Содержание
Валентность золота (Au), формулы и примеры
Общие сведения о валентности золота
Золото представляет собой металл желтого цвета с гранецентрированной кубической решеткой. Золото характеризуется исключительной пластичностью и превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 19,3 г/см3. Температура плавления 1064,4oС, кипения 2880oС.
Валентность золота в соединениях
Золото – семьдесят девятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в шестом периоде в IВ группе. В ядре атома золота содержится 79 протонов и 117 нейтронов (массовое число равно 197). В атоме золота есть шесть энергетических уровней, на которых находятся 79 электронов (рис. 1).
Рис. 1. Строение атома золота.
Электронная формула атома золота в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p64f145s25p65d106s1.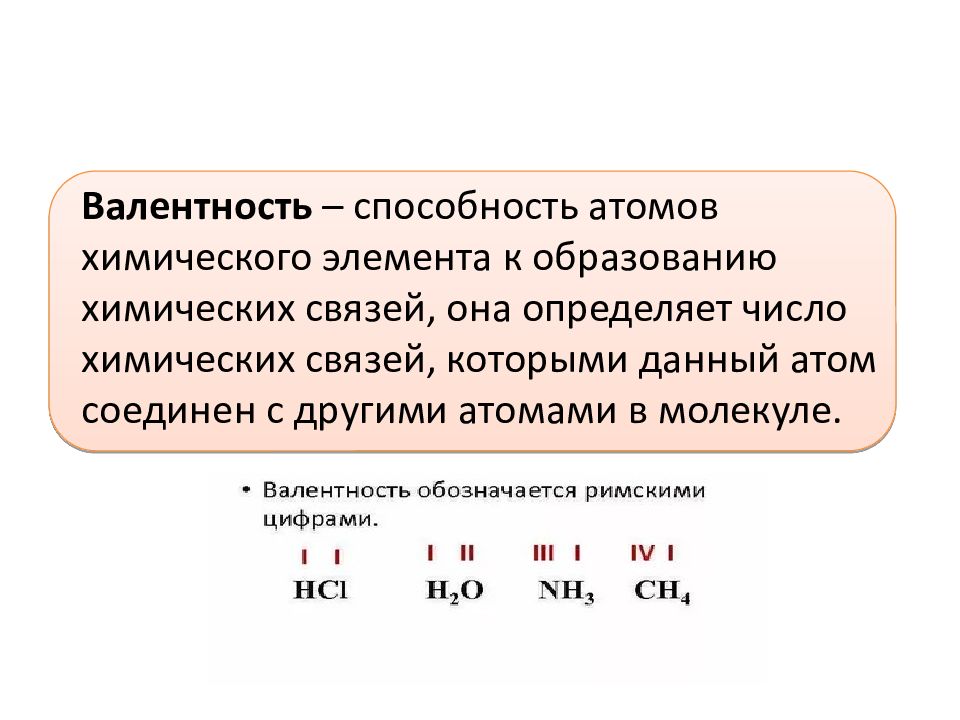
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие одного неспаренного электрона свидетельствует о том, что золото проявляет валентность I в своих соединениях (Au2O, AuNO3, AuCl, Au2S и т.д.).
Известно, что для золота также характерна валентность II (AuO, AuF2).
Примеры решения задач
|
Понравился сайт? Расскажи друзьям! |
| ||
Золото валентность — Справочник химика 21
Медь, серебро и золото несколько выпадают из общей для переходных металлов закономерности по своему электронному строению с валентной конфигурацией Они характеризуются более низкими температурами плавления и кипения, чем предшествующие им переходные элементы, и являются довольно мягкими металлами. Проявление таких свойств соответствует закономерной тенденции к ослаблению металлических связей, обнаруживаемой начиная с группы У1Б(Сг-Мо- У). Эта тенденция объясняется постепенным уменьшением числа неспаренных -электронов у атомов металлов второй половины переходных рядов. Медь, серебро и золото обладают очень большой электро- и теплопроводностью, поскольку их электронное строение обусловливает высокую подвижность 5-электронов. Эти металлы ковки, пластичны и инертны и могут находиться в природе в металлическом состоянии. Они встречаются довольно редко и поэтому имеют высокую стоимость, но все же распространены значительно больше, чем платиновые металлы. Относительно большая распространенность и возможность существования этих металлов в природе в несвязанном виде послужили причиной того, что они явились первыми металлами, с которыми познакомился чёловск и кошрые иН научился обрабатывать. По-видимому, первым металлом, который стали восстанавливать из его руды, была медь. Металлургия началась с открытия того, что сплав меди с оловом (естественно встречающаяся примесь) дает намного более твердый материал — бронзу.
Проявление таких свойств соответствует закономерной тенденции к ослаблению металлических связей, обнаруживаемой начиная с группы У1Б(Сг-Мо- У). Эта тенденция объясняется постепенным уменьшением числа неспаренных -электронов у атомов металлов второй половины переходных рядов. Медь, серебро и золото обладают очень большой электро- и теплопроводностью, поскольку их электронное строение обусловливает высокую подвижность 5-электронов. Эти металлы ковки, пластичны и инертны и могут находиться в природе в металлическом состоянии. Они встречаются довольно редко и поэтому имеют высокую стоимость, но все же распространены значительно больше, чем платиновые металлы. Относительно большая распространенность и возможность существования этих металлов в природе в несвязанном виде послужили причиной того, что они явились первыми металлами, с которыми познакомился чёловск и кошрые иН научился обрабатывать. По-видимому, первым металлом, который стали восстанавливать из его руды, была медь. Металлургия началась с открытия того, что сплав меди с оловом (естественно встречающаяся примесь) дает намного более твердый материал — бронзу. Медные предметы были найдены [c.446]
Медные предметы были найдены [c.446]
Химические свойства элементов. Атомы меди, серебра и золота могут проявлять более высокую степень окисления, чем атомы элементов главной подгруппы. Валентными электронами могут являться не только и5-электроны, но и (п — 1) ( -электроны, так как энергии (п— )с1- и и5-электронов близки. В соответствии с этим элементы подгруппы меди могут проявлять при определенных условиях степени окисления +1, — -2 и +3. Но наиболее характерны степени окисления для меди +1 и, особенно, +2, для серебра — -1, а для золота -(-3 и — -1. [c.232]
Медь, серебро и золото составляют IB группу периодической системы. На внешнем энергетическом уровне атомов этих элементов находится по одному s-электрону, что характеризует их как металлы. В то же время их предпоследний энергетический уровень, содержаш,ий 18 электронов, недостаточно устойчив. При возбуждении атомов во время реакции, вследствие недостаточной стабильности группировки d предпоследнего энергетического уровня, один из -электронов переходит в подуровень р внешнего энергетического уровня и число непарных (валентных) электронов достигает трех. В результате этого максимальное окислительное число элементов этой группы может достигнуть +3. [c.258]
В результате этого максимальное окислительное число элементов этой группы может достигнуть +3. [c.258]
Как видим, по мере увеличения числа валентных электронов растворимость металлов в серебре падает. В случае же растворения в серебре золота (один валентный электрон 5 ) электронная концентрация не изменяется, поэтому золото и серебро растворяются друг в друге неограниченно. [c.253]
Изучение многочисленных ме1 аллическнх сплавов показывает, что фазы А, В и АВ способны растворять в твердом состоянии переменные ко-Л1 чества компонентов. Такие однородные твердые вещества, состав которых может изменяться, называют твердыми растворами. Весьма характерно, что в то время как эвтектические составы Е и , отличаются тонкослоистым строением, областям выделения твердых растворов соответствует полная однородность структуры образцов иод микроскопом. Примерами систем, когда два вещества (А и В) смешиваются взаимно в самых различных соотношениях в твердый или жидкий однородный раствор, могут служить се-рсбро—золото, вода—спирт, бензол—толуол. Последовательным изменениям состава здесь отвечает непрерывность изменения соответствующих свойств. В системе Ае—Аи (рис. 1.4) атомы металлов по радиусам, энергиям связи, валентным возможностям близки друг к другу (хотя проявляются и раз- [c.21]
Последовательным изменениям состава здесь отвечает непрерывность изменения соответствующих свойств. В системе Ае—Аи (рис. 1.4) атомы металлов по радиусам, энергиям связи, валентным возможностям близки друг к другу (хотя проявляются и раз- [c.21]
Согласно этой теории, катализ происходит только при структурном и энергетическом соответствии катализируемых молекул данному катализатору. Теорией Баландина было предсказано, что реакции каталитического гидрирования бензола и дегидрирования циклогексана могут идти только на переходных металлах, имеющих гранецентрированную кубическую структуру или гексагональную структуру и притом атомные радиусы строго определенных размеров. При этих условиях шестичленные циклы образуют на октаэдрических гранях кристаллов металла шесть связей М— — С — С, валентный угол которых близок тетраэдрическому углу. Данным условиям удовлетворяют палладий, платина, иридий, родий, осмий и все они являются активными катализаторами гидрирования бензола и дегидрирования циклогексана. В то же время металлы, обладающие объемноцентрированной структурой, например тантал, вольфрам, даже при почти таких же размерах их атомных радиусов, как у платиновых металлов, а также металлы, имеющие такую же кристаллическую структуру, как платина, но иные размеры атомных радиусов, в частности серебро, золото, или не относящиеся к переходным элементам — медь, цинк,—все эти металлы не проявляют каталитической активности в вышеуказанных реакциях. Таким образом, структура поверхностных соединений бензола и циклогексана с платиновыми металлами была описана и доказана. Мало того, было, в сущности, установлено, что в условиях катализа подобные соединения легко и притом в точности воспроизводятся. Иначе катализ был бы невозможен. [c.59]
В то же время металлы, обладающие объемноцентрированной структурой, например тантал, вольфрам, даже при почти таких же размерах их атомных радиусов, как у платиновых металлов, а также металлы, имеющие такую же кристаллическую структуру, как платина, но иные размеры атомных радиусов, в частности серебро, золото, или не относящиеся к переходным элементам — медь, цинк,—все эти металлы не проявляют каталитической активности в вышеуказанных реакциях. Таким образом, структура поверхностных соединений бензола и циклогексана с платиновыми металлами была описана и доказана. Мало того, было, в сущности, установлено, что в условиях катализа подобные соединения легко и притом в точности воспроизводятся. Иначе катализ был бы невозможен. [c.59]
Активность этих элементов значительно ниже активности щелочных металлов. В соединениях они проявляют валентность, равную -[-1 медь проявляет дополнительную валентность, равную -[-2, а золото — валентность, равную +3. Это обусловлено особым расположением электронов в двух внешних слоях атома. [c.333]
[c.333]
Атомы кислорода соединяются не менее чем с двумя различными атомами. Так же ведут себя кальций, сера, магний и барий. У этих элементов валентность два, У азота, фосфора, алюминия и золота валентность три. Железо может иметь валентность два или три. В принципе вопрос о валентности оказался не столь простым, каким представлялось вначале, но даже такой простейший вариант этой теории позволил сделать важные выводы. [c.81]
Из приведенных выше значений потенциалов следует, что растворение золотого анода протекает с образованием ионов обеих валентностей, поэтому рассчитанный анодный выход золота по току (только с учетом Аи +) равен 125—140%. [c.319]
Введение в кристаллический кремний примесных атомов фосфора, имеющих по пять валентных электронов, также нарушает энергетическую однородность кристалла. В этих условиях каждый атом фосфора уже при сообщении ему энергии порядка 4,4 кДж/моль способен ионизироваться, перебрасывая один из своих электронов в зону проводимости и превращаясь в положительно заряженный ион. Аналогично ведут себя в кристаллах кремния и германия примесные атомы мышьяка, сурьмы и золота, обычно называемые донорными примесями. Для получения полупроводника с определенной концентрацией носителей (электронов или дырок) необходимо, чтобы количество собственных переносчиков тока в кристалле было примерно на два порядка ниже. [c.89]
Аналогично ведут себя в кристаллах кремния и германия примесные атомы мышьяка, сурьмы и золота, обычно называемые донорными примесями. Для получения полупроводника с определенной концентрацией носителей (электронов или дырок) необходимо, чтобы количество собственных переносчиков тока в кристалле было примерно на два порядка ниже. [c.89]
Назначение. Деактиваторы (инактиваторы, пассивато-ры) металлов — это присадки, подавляющие каталитическое действие металлов на окисление топлив. Деактиваторы, как правило, добавляют к топливу совместно с антиокислителями в концентрациях, в 5—10 раз меньших, чем антиокислитель. Они могут быть также компонентами двух- и трехкомпонентных присадок [1 — 11]. Установлено, что металлы переменной валентности являются сильными катализаторами окисления углеводородных топлив [1—5, II —17]. Металлы постоянно контактируют с топливами — в нефтезаводской, перекачивающей аппаратуре и в двигателях, входят в виде микропримесей в их состав. В топливных дистиллятах обнаружено присутствие алюминия, берилия, ванадия, висмута, железа, золота, кремния, калия, кальция, кобальта, меди, молибдена, натрия, никеля, олова рубидия, серебра, свинца, стронция, титана, цинка и др.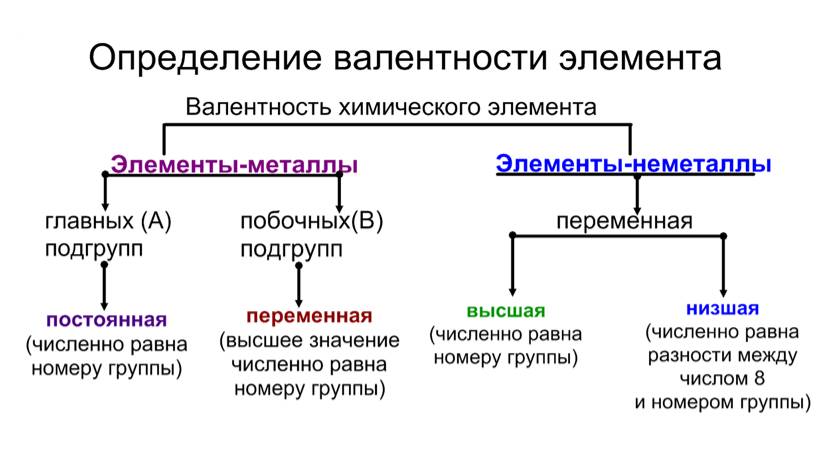 [18—21]. [c.122]
[18—21]. [c.122]
Учитывая, что атомный вес золота равен 197 у. е., вычислить валентность этого элемента в соединении состава 64,9% Аи и 35,1%С1. [c.8]
Учитывая, что атомная масса золота равна 197 уг. ед., вычислить валентность этого элемента в соединении состава 64,9% Au и 35,1% С1. [c.9]
В элементах побочных подгрупп изменение химических свойств в вертикальном направлении имеет свою специфику. В ПШ-под-группе от 8с к Ьа и Ас основные свойства элементов заметно усиливаются от амфотерных (у 5с) к ярко выраженным основным (Са— Ас), затем при достройке и /-подуровней при одном и том же числе слоев с элементами главных (А) подгрупп возрастает влияние увеличивающегося заряда ядра на валентные электроны. Это приводит к тому, что у элементов побочных подгрупп, в атомах которых завершается формирование внутренних слоев, может наблюдаться с увеличением Z возрастание ионизационных потенциалов, уменьшение химической активности, торможение нарастания радиусов атомов, ослабление основных свойств (например, в ряду Си — Ag— Аи).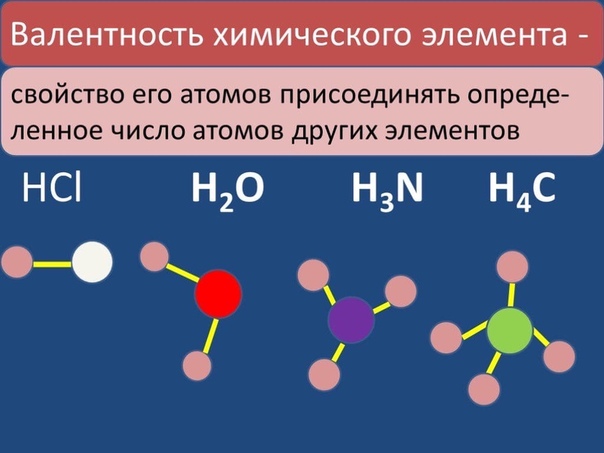 Химическая активность в этом ряду убывает с возрастанием порядкового номера, о чем свидетельствуют значения энергии Г иббса для бинарных соединений этих металлов. На золото сильное влияние оказывает лантаноидное сжатие. [c.92]
Химическая активность в этом ряду убывает с возрастанием порядкового номера, о чем свидетельствуют значения энергии Г иббса для бинарных соединений этих металлов. На золото сильное влияние оказывает лантаноидное сжатие. [c.92]
Для некоторых -элементов общее число валентных электронов наружного и соседнего с наружным квантовым уровнем не равно номеру группы. Так, медь, серебро и золото находятся в I группе, но они могут проявлять степень окисления не только + 1, но и — -2 и +3. Из элементов VIH группы только рутений и осмий проявляют высшую степень окисления — -8, у всех же других она меньше. Восстановительная активность -элементов в подгруппах возрастает снизу вверх (за исключением подгруппы скандия), [c.109]
Напишите электронные формулы атомов меди, серебра и золота. Какие валентности они могут проявлять Напишите электронные формулы ионов Сц +, Ag+ и Аи +. [c.350]
По физическим свойствам все металлы — твердые вещества (кроме ртути, которая при обычных условиях жидкая), они отличаются от неметаллов особым видом связи (металлическая связь).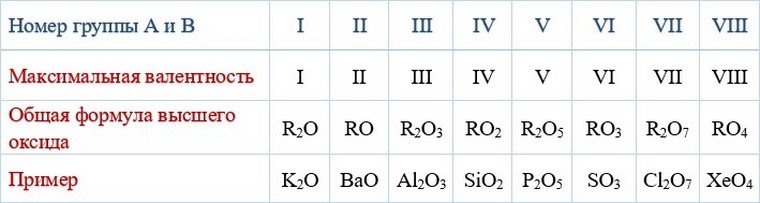 Валентные электроны слабо связаны с конкретным атомом и внутри каждого металла существует так называемый электронный газ. Поэтому все металлы обладают высокой электропроводностью (т. е. они — проводники в отличие от неметаллов-диэлектриков), особенно медь, серебро, золото, ртуть и алюминий высока и теплопроводность металлов. Отличительным свойством многих металлов является их пластичность (ковкость), вследствие чего они могут быть прокатаны в тонкие листы (фольгу) и вытянуты в проволоку (олово, алюминий и др.), однако встречаются и достаточно хрупкие металлы (цинк, сурьма, висмут). [c.157]
Валентные электроны слабо связаны с конкретным атомом и внутри каждого металла существует так называемый электронный газ. Поэтому все металлы обладают высокой электропроводностью (т. е. они — проводники в отличие от неметаллов-диэлектриков), особенно медь, серебро, золото, ртуть и алюминий высока и теплопроводность металлов. Отличительным свойством многих металлов является их пластичность (ковкость), вследствие чего они могут быть прокатаны в тонкие листы (фольгу) и вытянуты в проволоку (олово, алюминий и др.), однако встречаются и достаточно хрупкие металлы (цинк, сурьма, висмут). [c.157]
В вертикальных столбцах таблицы — группах располагаются элементы, обладающие одинаковой валентностью в высших солеобразующих оксидах (она указана римской цифрой). Каждая группа разделена на две подгруппы, одна из которых (главная) включает элементы малых периодов и четных рядов больших периодов, а другая (побочная) образована элементами нечетных рядов больших периодов. Различия между главными и побочными подгруппами ярко проявляются в крайних группах таблицы (исключая VIII).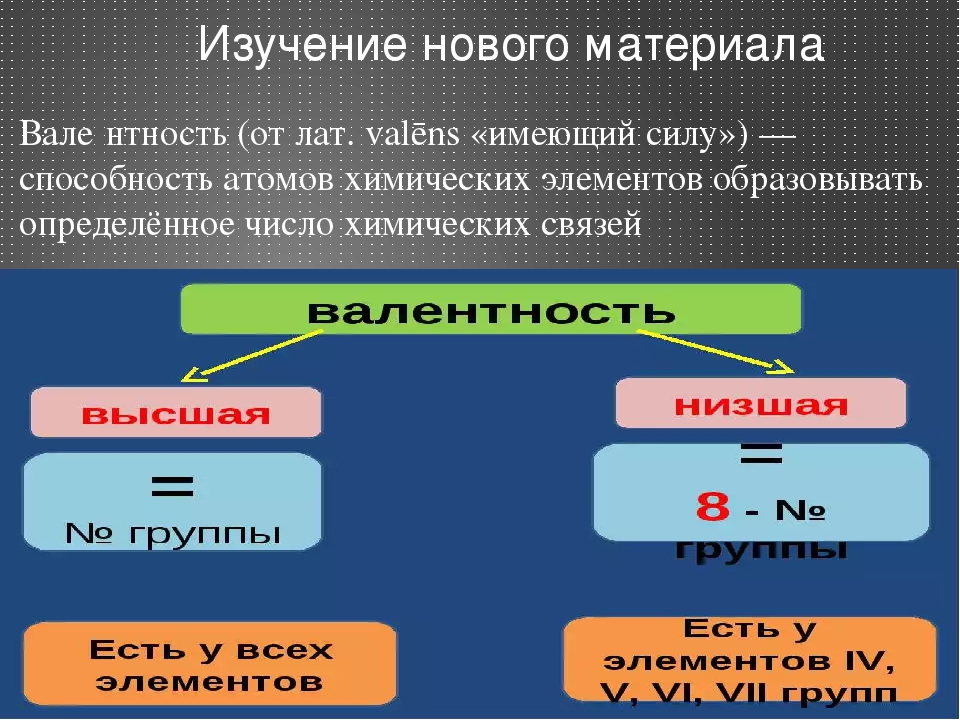 Так, главная подгруппа I группы включает очень активные щелочные металлы, энергично разлагающие воду, тогда как побочная подгруппа состоит из меди Си,серебра Ag и золота Аи, малоактивных в химическом отношении. В VII группе главную подгруппу составляют активные неметаллы фтор F, хлор С1, бром Вг, иод I и астат At, тогда как у элементов побочной подгруппы — марганца Мп, технеция Тс и рения Re — преобладают металлические свойства. VIII группа элементов, занимающая особое положение, состоит из девяти элементов, разделенных на три триады очень сходных друг с другом элементов, и подгруппы благородных газов. [c.22]
Так, главная подгруппа I группы включает очень активные щелочные металлы, энергично разлагающие воду, тогда как побочная подгруппа состоит из меди Си,серебра Ag и золота Аи, малоактивных в химическом отношении. В VII группе главную подгруппу составляют активные неметаллы фтор F, хлор С1, бром Вг, иод I и астат At, тогда как у элементов побочной подгруппы — марганца Мп, технеция Тс и рения Re — преобладают металлические свойства. VIII группа элементов, занимающая особое положение, состоит из девяти элементов, разделенных на три триады очень сходных друг с другом элементов, и подгруппы благородных газов. [c.22]
Кроме того, медь, серебро и золото образуют соединения, в которых они проявляют положительную валентность 2 и 3, которая отсутствует у щелочных металлов. [c.394]
Легкость отдачи валентного электрона падает от меди к золоту, т. е. с увеличением заряда ядра. [c.395]
Ионизационный потенциал падает от Си до Ag, а затем увеличивается у Аи, несмотря на то, что валентный электрон находится у атома золота дальше от ядра, чем у атома меди.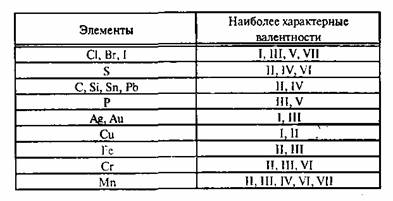 [c.395]
[c.395]
Б. В. Некрасов предложил делить все гидриды на пять групп солеобразные, переходные, металлообразные, полимерные и. летучие. Не вызывает никаких сомнений тот факт, что в периодической системе переход от гидридов одного типа (ионных или солеобразных) к другому (летучие ковалентные соединения) совершается постепенно, причем по мере приближения к концу периодов состав гидридов переходных металлов утрачивает определенность, гидриды делаются похожими на сплавы переменного состава. Когда внутренняя электронная оболочка атома заполнена, казалось бы, имеются условия для образования гидридов, сходных с гидридами щелочных или щелочноземельных металлов. Однако возможность перехода внутренних электронов в валентную оболочку придает гидридам таких элементов, как медь и цинк, характер, промежуточный между типичными ионными и ковалентными соединениями, а гидриды серебра и золота делает сходными с гидридами переходных металлов. [c.289]
Восстановление попов металла с помощью какого-нибудь другого низковалентного металлического иона, валентность которого прп атом возрастает. Примером этой реакции может служить реакция восстановления золота солью железа(П), например железным купоросом [c.16]
Примером этой реакции может служить реакция восстановления золота солью железа(П), например железным купоросом [c.16]
За последние годы большое экономическое значение приобрела проблема непосредственного окисления олефинов в карбонильные соединения с применением в качестве катализаторов солей металлов, имеющих переменную валентность золота, пла- [c.74]
Гидроксид золота (валентное состояние 3) обладает слабо кислотными свойствами. Как называется ее калиевая соль КАиОг [c.76]
Большое значение релятивистские эффекты имеют для элементов побочных подгрупп. Давно известно, что химические и физические свойства золота сильно отличаются от свойств меди и серебра. Часто такие отличия носят название аномалии Аи . Например, большинство координационных соединений Аи (I) имеет координационное число 2, в то время как Ag (I) и Си (I) имеют тенденцию к большим значениям. Золото имеет значение 1 значительно большее, чем серебро, и связано это с релятивистским сжатием бв-подоболочки. Это объясняет низкз ю восстановительную активность золота, а также существование аурид-иона Аи в таких соединениях, как СзАи или КЬАи. Серебро такие соединения уже не образует. Сжатие валентной 6в-А0 золота также увеличивает прочность и уменьшает длину его связей в соединениях. Вторая энергия ионизации золота Е 2 меньше, чем у серебра, что связано с релятивистским расширением 5 -подоболочки. Поэтому проявление в соединениях золота более высоких степеней окисления, чем у меди и серебра, связано с меньшими энергетическими затратами для участия в этом 5й-электронов. Желтый цвет золота связан с релятивизмом. Вследствие небольшого энергетического различия между сжатым [c.86]
Это объясняет низкз ю восстановительную активность золота, а также существование аурид-иона Аи в таких соединениях, как СзАи или КЬАи. Серебро такие соединения уже не образует. Сжатие валентной 6в-А0 золота также увеличивает прочность и уменьшает длину его связей в соединениях. Вторая энергия ионизации золота Е 2 меньше, чем у серебра, что связано с релятивистским расширением 5 -подоболочки. Поэтому проявление в соединениях золота более высоких степеней окисления, чем у меди и серебра, связано с меньшими энергетическими затратами для участия в этом 5й-электронов. Желтый цвет золота связан с релятивизмом. Вследствие небольшого энергетического различия между сжатым [c.86]
Одновременно и на катоде происходит разряд ионов обеих валентностей, Выход золота по току на катоде из расчета на Аи ниже — до 115%. Таким образом, скорость образования Au lJ количественно больше скорости его разряда, и одновалентное золото накапливается в электролите. Это способствует протеканию реакции, характерной для положительных металлов (Си, Аи) [c. 319]
319]
Измерения, произведенные при различных катодной и анодной плотностях тока в растворах 0,1-н. НАиСи и 1-н. НС1, длительно бывших в соприкосновении с порошком металлического золота, дают следующие валентности катодной и анодной реакций (табл. 60). [c.248]
Наименьшим электрическим сопротивлением обладают метаалы, атомы которых имеют в качестве валентных только внешние 5-электроны. (Атомы серебра, меди и золота вследствие проскока з-электронов имеют электронные конфигурации валентных оболочек атомов щелочных элементов пз ). В этих случаях в компактных металлах реализуется, как правило, металлическая связь. Появление неспаренных р- и -электронов приводит к увеличению доли направленных ковалентных связей, электропроводность у.меньшается. Атом железа на предвнешней электронной оболочке имеет неспаренные Зс/-электроны, которые также образуют ковалентные связи. Кроме этого, в кристалле металла, когда энергетические уровни атомов объединяются в энергетические зоны, Зс(-и 45-зоны пересекаются. Поэтому при определенном возбуждении -электроны могут перейти на молек лярные орбитали -зоны н, таким образом, количество носителей заряда может уменьшиться. Поэтому металлы -элементов с частично заполненной электронной -подоболочкой у атомов имеют несколько более высокое электрическое сопротивление, чем металлы непереходных элементов. [c.323]
Поэтому при определенном возбуждении -электроны могут перейти на молек лярные орбитали -зоны н, таким образом, количество носителей заряда может уменьшиться. Поэтому металлы -элементов с частично заполненной электронной -подоболочкой у атомов имеют несколько более высокое электрическое сопротивление, чем металлы непереходных элементов. [c.323]
При установлении между окисной пленкой и объемом кристалла электронного равновесия в рассматриваемой системе образуется общий уровень электрохимического потенциала электронов, который не может проходить выше зоны проводимости и ниже валентной зоны. Поэтому энергетические уровни окисной пленки, оказывающие наибольшее влияние на величину коэффициента поверхностной рекомбинации, должны находиться вблизи уровня на расстоянии, не превышающем ширины запрещенной зоны для данного кристалла (см. рис. 53 и 58). Считая, что гидратированная окисная пленка вместе с адсорбированными в ней частицами подобна водному раствору, и обращаясь к рис. 53, мы приходим к выводу, что наиболее эффективными центрами рекомбинации в окисной пленке являются атомы или ионы элементов, располагающихся в правой части ряда напряжений металлов или металлоидов (см. стр. 192). Такими элементами являются водород, медь, серебро, золото, а также кислород и сера. Напомним, что именно для ионов этих элементов характерна высокая скорость электронного обмена при контакте металла или полупроводника с электролитом. Поэтому дe aнный [c.210]
53, мы приходим к выводу, что наиболее эффективными центрами рекомбинации в окисной пленке являются атомы или ионы элементов, располагающихся в правой части ряда напряжений металлов или металлоидов (см. стр. 192). Такими элементами являются водород, медь, серебро, золото, а также кислород и сера. Напомним, что именно для ионов этих элементов характерна высокая скорость электронного обмена при контакте металла или полупроводника с электролитом. Поэтому дe aнный [c.210]
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ — соединения, кристаллическая решетка которых состоит из комплексных ионов, способных существовать самостоятельно в растворах. Комплексным называется ион, состоящий из атома металла или неметалла в определенном валентном состоянии, связанного с одним или несколькими способными к самостоятельному существованию мoлeкyлa ш или ионами. К- с. образуются в результате присоединения к данному иону (или атому) нейтральных молекул или ионов. К- с., в отличие от двойных солей, в растворах диссоциируют слабо.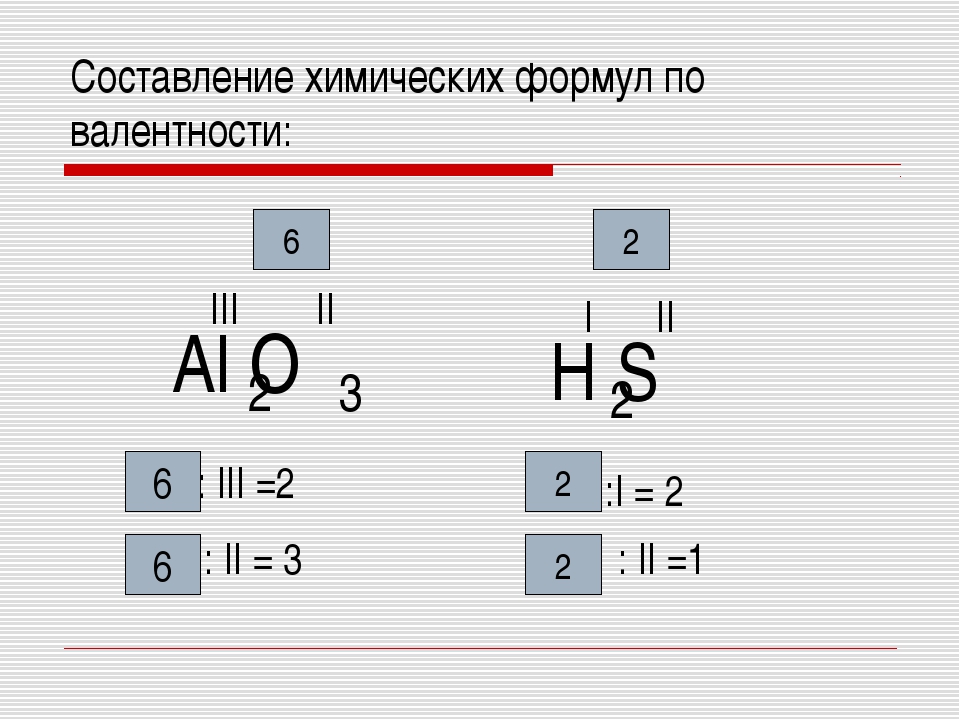 К- с. могут содержать комплексный анион (напр., Fe ( N)e) ), комплексный катион Ag (Nh4)2]+ или вообще К- с. могут не диссоциировать на ионы (напр., [Со (N0 )3 (ЫНз)з]). к. с. широко используются в аналитической химии, при получении золота, серебра, меди, металлов платиновой группы и др., для разделения лантаноидов и актиноидов. К К- с. относятся вещества, играющие важную роль в жизнедеятельности животных и. растений — гемоглобин, хлорофилл, энзимы и др. [c.132]
К- с. могут содержать комплексный анион (напр., Fe ( N)e) ), комплексный катион Ag (Nh4)2]+ или вообще К- с. могут не диссоциировать на ионы (напр., [Со (N0 )3 (ЫНз)з]). к. с. широко используются в аналитической химии, при получении золота, серебра, меди, металлов платиновой группы и др., для разделения лантаноидов и актиноидов. К К- с. относятся вещества, играющие важную роль в жизнедеятельности животных и. растений — гемоглобин, хлорофилл, энзимы и др. [c.132]
Согласно правилу Шульце-Гарди, при коагуляции золя электролитами коагулируюш,ий ион всегда имеет заряд, противоположный заряду коллоидной частицы порог коагуляции при этом тем меньше, чем выше валентность коагулирующего иона. Так, отрицательно заряженные золи золота и АзгЗз коагулируют под влиянием катиона положительно заряженные золи, подобно Ре(ОН)з, коагулируют под.действием аниона. [c.236]
В табл. 3.2 приведены электронные конфигурации и типы термов атомов элементов первых трех периодов из -элементов взяты платиновые металлы, медь, серебро и золото. Видно отчетливое периодическое повторение внешних (валентных) электронных конфигураций и типов термов атомов элементов. [c.70]
Видно отчетливое периодическое повторение внешних (валентных) электронных конфигураций и типов термов атомов элементов. [c.70]
К побочной подгруппе первой группы относятся медь (Си), серебро (Ай) и золото (Аи). Медь и ее аналоги являются предпо-слеДНими й-элеиентаШ, атомы которых содержат полностью заполненный электронами а -подуровень. Валентные электроны ( —распределены следующим образом [c.411]
Из приведенных схем видно, что у трехвалентного хрома, двух- и четырехвалентного марганца число валентных электронов меньше числа неспаренных электронов. Данное обстоятельство, а также некоторые другие особенности элементов побочных подгрупп в сильной степени усложняют вопрос о валентностях этих элементов. Объяснить так наглядно и просто валентности элементов побочных подгрупп даже в их простейших соединениях, как это было сделано для элементов главных подгрупп, не представляется возможным. В отличне от элементов главных подгрупп, для которых максимальная валентность равна номеру группы, для некоторых элементов побочных подгрупп могут наблюдаться валентности больше номера группы. Например, для находящихся в первой группе меди и золота наряду с валентностью единица характерна также валентность два и три соответственно. [c.78]
Например, для находящихся в первой группе меди и золота наряду с валентностью единица характерна также валентность два и три соответственно. [c.78]
На внешнем слое атомы элементов подгруппы меди, так же как и атомы щелочных металлов, содержат по одному электрону. В этом их сходство. Так, все элементы подгруппы меди, как правило, положительно одновалентны и не образуют отрицательно валентных ионов, как и щелочные металлы. Все они способны образовать окислы типа Э2О. Но по структуре второго снаружи электронного слоя атомы элементов подгруппы меди отличаются от атомов щелочных металлов. В то время- как у последних указанный слой содержит 8 электронов (см, таблицу в 2), атомы меди,-серебра и золота на предпоследнем слое содержат 18 электронов, причем этот слой еще не вполне стабилизирован и способен к отдаче электронов. Так, соединения двухвалентной меди более характерны и чаще образуются, чем соединения одновалентной меди. Так как атом меди на внешнем слое содержит один электрон, то положительно двухвалентный ион Си » может образоваться только путем отдачи одного электрона из второго снаружи слоя. Аналогично золото образует положительно одно-и трехвалентные ионы (ионы Аи и Аи» ). Соединения трехвалентного золота также более характерны и чаще образуются, чем соединения одновалентного золота. Атом золота на внешнем слое тоже содержит один электрон. Следовательно, положительно трехвалентный ион Аи» «» может образоваться путем добавочного выделения двух электронов из ближайшего внутреннего 18-элек-тронного слоя. [c.405]
Аналогично золото образует положительно одно-и трехвалентные ионы (ионы Аи и Аи» ). Соединения трехвалентного золота также более характерны и чаще образуются, чем соединения одновалентного золота. Атом золота на внешнем слое тоже содержит один электрон. Следовательно, положительно трехвалентный ион Аи» «» может образоваться путем добавочного выделения двух электронов из ближайшего внутреннего 18-элек-тронного слоя. [c.405]
Триады элементов VIII группы являются связующим звеном между четными и нечетными рядами больших периодов в таблице Менделеева. Упомянем в качестве примера триаду железа (Ре — Со — N1). Так, с одной стороны, железо очень сходно со своим левым соседом — марганцем. С другой стороны, налицо большое сходство между никелем и медью (оба характеризуются наиболее типичной валентностью +2, образуют аналогичные по составу и свойствам соединения их гидроокиси растворяются в избытке аммиака, давая при этом интенсивно окрашенные комплексные соединения и т. д.). Далее, по внешнему виду очень сходны палладий и серебро платина и золото — наиболее благородные металлы и т. д. [c.537]
д.). Далее, по внешнему виду очень сходны палладий и серебро платина и золото — наиболее благородные металлы и т. д. [c.537]
Возможно, это связано с тем, что в солянокислом растворе образуются комплексные соединения НАиСЦ и НАиС . При электролизе растворон солей металлов, содержащих ионы неоди-на ов ой валентности, катодные и анодные процессы проходят обычно с такими соотношениями скоростей, цри которых сохраняются рав новесия типа (ХП1, 6), (Х1П,7) и (XII, 8). Это значит, что в случае меди разряжаются н а, катоде и ионизируются на аноде главным образом ионы высшей валентности (Си2+). Наоборот, жел езо будет ра зряжаться на катоде и растворяться на аноде почти исключительно в виде двухвалентного, а золото посылает в растврр ианы Аи + н Аи+ почти в разных соотношениях в таком же близком соотношении ионы обоих видов восстанавливаются на -катоде. [c.373]
В периодической системе медь, серебро и золото относятся к -элементам их электронная оболочка, соседняя с наружной, состоит из 18 электронов, наружная же — из одного электрона. Они в соединениях могут проявлять валентность 1, Однако медь чаще всего встречается в соединениях в виде а золото в виде Аи . Это служит указанием на то, что не все электроны -подуровня одинаково прочно удерживаются на соседнем с на-)ужным слое и что они могут частично принимать участие в реакциях. 3 этого подуровня может теряться максимально два электрона (табл. 118). [c.395]
Они в соединениях могут проявлять валентность 1, Однако медь чаще всего встречается в соединениях в виде а золото в виде Аи . Это служит указанием на то, что не все электроны -подуровня одинаково прочно удерживаются на соседнем с на-)ужным слое и что они могут частично принимать участие в реакциях. 3 этого подуровня может теряться максимально два электрона (табл. 118). [c.395]
В своих соединениях золото проявляетц валентность 1 или 3. Все соединения золота термически малоустойчивы и сравнительно легко разрушаются, претерпевая внутримолекулярную реакцию окисления — восстановления. [c.410]
В случае же растворения в серебре золота (один валентный электрон—3 ) электронная концентрация ие изменится, поэтому Аи и А растворяются друг в друге неограниченно. Образованию твердых растворов благоирипятствуют близость химических свойств, атомных радиусов и. типа кристаллической структуры исходных веществ. Несоблюдение одного из этих условий приводит к тому, что твердые растворы между ко. мпонентами образуются лишь в ограниченных пределах концентраций или же не образуются вообще. О предельной растворимости ряда металлов в N1 можно судить по данным табл. 13. [c.77]
мпонентами образуются лишь в ограниченных пределах концентраций или же не образуются вообще. О предельной растворимости ряда металлов в N1 можно судить по данным табл. 13. [c.77]
Валентность золота
Валентность золота.
Валентность золота:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность золота равна I, II, III, V. Золото проявляет переменную валентность.
| Валентность золота в соединениях | |
| I | AuBr, Au2O |
| II | AuS, AuBr2 |
| III | Au2O3, Au2Br6 |
| V | Au2F10 |
Все свойства атома золота
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности
62
Страница не найдена | Кафедра физики твердого тела ПетрГУ
http://secretary.rid.go.th/
http://rtlabs.nitk.ac.in/
http://www.ei.ksue.edu.ua/
http://www.unajma.edu.pe/
http://www.drbrambedkarcollege.ac.in/
https://www.hsri.or.th/
http://www4.fe.usp.br/
https://www.cnba.uba.ar/
https://www.osgoode.yorku.ca
bak hocam 2yildir kullandigim siteye gelip kod ekliyorsun not yazip kodlarini siliyorum (insan olan utanir kusura bakma hocam diyip giderdi) kendine dusmanmi ariyorsun? belliki sen disli birine denk gelmemissin hayatin boyunca ama ben cok ugrastim cokta denk geldim bu sekilde tanimadigin birini tehtit etmen ya deli oldugunu gosterir yada tecrubesizligini sen bana isimi ogretecegine once baskalarina ait olan sitelere girmemeyi ogren ondan sonra bana isimi ogretirsin ben cok takintili bir adamim beni kotu bir insan olmaya zorlama rica ediyorum bak lutfen birbirimizi uzmeyelim emin ol bu site felan umrumdami saniyorsun? olay tamamen prensip meselesi sen benim yatakodama gelip beraber yatacagiz diyorsun oyle bir olay yok isine bak oldu 10 kisi daha cagir 500 kod eklesin herkes yorumbacklink isimi yapiyorsun? sacmalamissin daha fazla beni muatap etme kendinle yaptigin terbiyesizligin farkina var illa darbe yiyincemi aklin basina gelecek anlamiyorum ki o kadar yaziyorum ki birbirimize kotuluk yapmayalim kalp kirmayalim birbirimizi uzmeyelim sana daha once boyle notlar yazan bir linkci gordun mu Allah askina ben bazen goruyorum ana baci duymadigim kufurler yaziyor adamlar birbirine sen benim gibi bir insani uzuyorsun ama lutfen.. 8yildir ben kimseyle ortak site kullanmadim babam gelse onunlada kullanmam en hassas oldugum konudur bu bir daha kod eklememeni siddetle tavsiye ediyorum yoksa farkli seyler olur ve kendine nur topu gibi manyak bir dusman edinirsin bos yere bu polemigi uzatiyorsun haksiz olan sensin kod disinde birsey yazmak istersen yazabilirsin ama rica ediyorum isi inada bindirme senden ERDEMLİ DÜRÜST VE OLGUN bir davranis bekliyorum beni anladigini umuyorum ve tekrar inşAllah kod eklemeyecegini umuyorum olumlu olumsuz notunu buraya yazablirsin bende bir daha bu siteyi kullanmiyacagim sanada kullandirmam tabiki is site isi degil prensip isi.. ihtiyacin olabilir site sayin azdir bunlar dogal seyler ben gerekirse kendim eklerim senin kodlarini oyle bir durumda kendi kodlarimida silerim sadece senin olur ama o son not garip bir insan oldugunu dusunduruyor bana ve inan ugrasacak vaktim de kafamda yok kendine sardirma hepimiz ekmek davasindayiz senle isim yok benden sana kotulukte gelmez ama beni zorlama lutfen.. zaten kafamda bir dunya sorun var hayat acimasiz hayat zor benim derdim bana yetiyor butun ictenligim ve iyi niyetim ile sana bu notu yaziyorum bu kadar sozden sonra kod ekleyecegini sanmiyorum birde seninle ugrasmayayim guzel kardesim arkadasim lutfen rica ediyorum LUTFEN barış her zaman erdemli insanlarin isidir lutfen ayni olgunluk ile senden olumlu donusunu bekliyorum eger yazdiklarimda kalp kirici yada incitici birsey varsa lutfen kusura bakma 1-2defa kontrol ettim ama belki gozumden kacmis olabilir hakkini helal et ve en iyisi ikimiz icinde helallesip bu isi noktalamaktir inan kotu biri degilim selam ve sevgiyle..
«Валентность химических элементов» — химия, уроки
Тема: Валентность химических элементов.
Цель: Ознакомление с понятием «валентность». Определение валентности элементов по формулам их соединений.
задачи обучения: Ввести понятие о «валентности», «бинарное соединение», научить определять валентность по формулам соединений.
задачи воспитания: Воспитывать аккуратность, сосредоточенность, сознательное отношение к процессу обучения, чувство бережного отношения к каждой минуте рабочего времени.
задачи развития: Развивать познавательный интерес, интеллект, формировать положительное отношение к учению, развивать волю, стремление преодолевать познавательные затруднения, правильно оформлять записи в тетрадях, уметь работать с алгоритмами.
Тип урока: Урок усвоения новых знаний.
Методы: Словесный, наглядный, практический.
Оборудование: Таблица валентностей некоторых элементов.
Сабақ барысы / Ход урока
1. Орг. момент. Сообщение темы и целей урока, подготовка учащихся к восприятию новых знаний.
2. Проверка домашнего задания.
Цифровой диктант
Контроль за выполнением диктанта учащиеся осуществляют методом взаимопроверки.
Задание. Напротив правильных утверждений поставьте цифру 1, напротив неверных – 0.
1. Химический элемент – это определенный вид атомов.
2. В каждой клетке таблицы Д.И.Менделеева, помимо обозначения и названия элемента, записаны два числа: верхнее – относительная атомная масса элемента, нижнее – его порядковый номер.
3. Химический элемент галлий был назван так в честь Франции.
4. В таблице Д.И.Менделеева элементы располагаются, как правило, в порядке убывания их атомных масс.
5. Значения относительной атомной массы и массы атома, выраженной в а. е. м., никогда не совпадают численно.
6. Простыми называют вещества, состоящие из атомов одного элемента.
7. Индекс – это число, показывающее количество взятых частиц (атомов или молекул) вещества.
8. Массовая доля элемента показывает, какую часть (долю) составляет масса данного элемента от всей массы вещества.
9. Относительная молекулярная масса воды Н2О равна 20.
10. Массовая доля кальция в оксиде кальция СаО составляет 71%.
П р а в и л ь н ы е о т в е т ы: 1 – 1, 2 – 0, 3 – 1, 4 – 0, 5 – 0, 6 – 1, 7 – 0, 8 – 1, 9 – 0, 10 – 1.
3. Новый материал.
Валентность
Учитель. Валентность – это способность атомов присоединять к себе определенное число других атомов.
С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HF, NaCl). С атомом двухвалентного элемента соединяются два атома одновалентного (H2O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента.
Правила определения валентности элементов в соединениях
Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
Учитель. Как определить валентность элемента, исходя из таблицы Д.И.Менделеева?
У металлов, находящихся в группах а, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая (схема).
Высшая валентность равна номеру группы.
Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент.
Учитель. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
Валентность может быть постоянной (у элементов главных подгрупп таблицы Д.И.Менделеева) или переменной (у элементов побочных подгрупп в таблице), но с этим явлением вы познакомитесь чуть позже, а если интересуетесь, то почитайте учебник 9-го класса.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений. Для этого удобно воспользоваться следующей таблицей.
Таблица
Алгоритм составления формулы соединения Р и О
Последовательность действий | Составление формулы оксида фосфора |
1. Написать символы элементов | Р О |
2. Определить валентности элементов | V II |
3. Найти наименьшее общее кратное численных значений валентностей | 5•2 = 10 |
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов | 10 : 5 = 2, 10 : 2 = 5; P : О = 2 : 5 |
5. Записать индексы при символах элементов | Р2 О5 |
6. Формула соединения (оксида) | Р2О5 |
Учитель. Запомните еще два правила для составления химических формул соединений неметаллов между собой.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже. (Демонстрация таблицы Д.И.Менделеева.)
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
Самостоятельная работа
Текст работы заранее написан на доске. Двое учащихся решают задание на обратной стороне доски, остальные в тетрадях.
Задание 1. Проверьте, правильно ли написаны формулы следующих соединений: Na2S, KBr, Al2O3,
Mg3N2, MgO.
Задание 2. Напишите формулы соединений металлов с неметаллами: кальция с кислородом, алюминия с хлором, натрия с фосфором. Назовите эти соединения.
После выполнения работы ученики обмениваются тетрадями, происходит взаимопроверка. Учитель может выборочно проверить некоторые тетради, похвалить тех учащихся, которые справились быстрее всех и сделали меньше всего ошибок.
4. Закрепление.
1. Беседа с учащимися по вопросам
1) Что такое валентность?
2) Почему валентность иногда называют атомностью элемента?
3) Чему равны валентности водорода и кислорода?
4) Какие два значения валентности могут проявлять неметаллы?
5) Как определить низшую и высшую валентности неметаллов?
6) Как найти наименьшее общее кратное между численными значениями валентностей?
7) Могут ли атомы в соединении иметь свободные валентности?
8) Какой из двух неметаллов в химической формуле их соединения занимает 1-е место, а какой –2-е? Поясните на примере оксида NO2, используя таблицу Д.И.Менделеева.
1.Выполнение упражнения 3 стр. 34 у доски.
2. Выполнение упражнения 5 стр. 34 у доски.
5. Домашнее задание: § 11 учить, упр. 1,2 (устно), упр. 10 стр. 34 (письм.)
ГДЗ / ответы Химия 8 класc Кузнецова Н.Е. §13 Валентность химических элементов. Определение валентности в бинарных соединениях » Крутые решение для вас от GDZ.cool
ГДЗ / ответы Химия 8 класc Кузнецова Н.Е. §13 Валентность химических элементов. Определение валентности в бинарных соединениях
Во всех упражнениях красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1 Рассмотрите таблицу 7. Какие металлы обладают постоянной валентностью?
Металлы, располагающиеся в главных подгруппах I и ІІ групп, а также алюминий, располагающийся в главной подгруппе IІІ группы, проявляют постоянную валентность, равную номеру группы.
Какие элементы первой группы обладают переменной валентностью?
Медь (Cu), серебро (Ag) и золото (Au) обладают переменной валентностью.
Какую подгруппу они образуют?
Они образуют побочную подгруппу.
Задание 2 Используя таблицу 7, составьте формулы кислородсодержащих соединений известных вам элементов.
І группа: H2O, Li2O, Na2O, K2O, Rb2O, Cs2O
ІІ группа: BeO, MgO, CaO
ІІI группа: B2O3, Al2O3
ІV группа: CO2, SiO2, SnO2, PbO2
V группа: N2O5, P2O5, As2O5
VІ группа: SO3, SeO3, TeO3
VIІ группа: Cl2O7, Br2O7, I2O7
Объяснение: воспользуйтесь общими формулами высших оксидов, располагающиеся в нижней строке таблицы 7.
Задание 3 Определите валентность химических элементов по формулам их соединений: HgO, HBr, ZnS, MgF2, CuO, AlCl3.
Ответ: HgIIOII, HIBrI, ZnIISII, MgIIF2I, CuIIOII, AlIIICl3I
Объяснение.
Соединение HgO. Постоянное значение валентности киcлорода II. Вычисляем валентность всех атомов кислорода (1•2=2) и делим валентность всех атомов кислорода на число атомов ртути (2:1=2). Валентность ртути ― II
Соединение HBr. Постоянное значение валентности водорода I. Вычисляем валентность всех атомов водорода (1•1=1) и делим валентность всех атомов водорода на число атомов брома (1:1=1). Валентность брома ― I
Соединение ZnS. Высшее значение валентности цинка II. Вычисляем валентность всех атомов цинка (1•2=2) и делим валентность всех атомов цинка на число атомов серы (2:1=2). Валентность серы ― II
Соединение MgF2. Постоянное значение валентности алюминия III и фтора I
Соединение CuO. Постоянное значение валентности кислорода II. Вычисляем валентность всех атомов кислорода (1•2=2) и делим валентность всех атомов кислорода на число атомов меди (2:1=2). Валентность меди ― II
Соединение AlCl3. Постоянное значение валентности алюминия III. Вычисляем валентность всех атомов алюминия (1•3=3) и делим валентность всех атомов алюминия на число атомов хлора (3:3=1). Валентность хлора ― I
Задание 4 Определите валентность химических элементов в соединениях: Cl2O, NO, NO2, N2O3, SO2, SO3, Cl2O5.
Ответ: Cl2IOII, NIIOII, NIVO2II, N2IIIO3II, SIVO2II, SVIO3II, Cl2VO5II
Объяснение.
Соединение Сl2O. Постоянное значение валентности киcлорода II. Вычисляем валентность всех атомов кислорода (1•2=2) и делим валентность всех атомов кислорода на число атомов хлора (2:2=1). Валентность хлора ― I
Соединение NO. Постоянное значение валентности киcлорода II. Вычисляем валентность всех атомов кислорода (1•2=2) и делим валентность всех атомов кислорода на число атомов азота (2:1=2). Валентность азота ― II
Соединение NO2. Постоянное значение валентности киcлорода II. Вычисляем валентность всех атомов кислорода (2•2=4) и делим валентность всех атомов кислорода на число атомов азота (4:1=4). Валентность азота ― IV
Соединение N2O3. Постоянное значение валентности киcлорода II. Вычисляем валентность всех атомов кислорода (3•2=6) и делим валентность всех атомов кислорода на число атомов азота (6:2=3). Валентность азота ― III
Соединение SO2. Постоянное значение валентности киcлорода II. Вычисляем валентность всех атомов кислорода (2•2=4) и делим валентность всех атомов кислорода на число атомов cеры (4:1=4). Валентность серы ― IV
Соединение SO3. Постоянное значение валентности киcлорода II. Вычисляем валентность всех атомов кислорода (3•2=6) и делим валентность всех атомов кислорода на число атомов cеры (6:1=6). Валентность серы ― VI
Соединение Сl2O5. Постоянное значение валентности киcлорода II. Вычисляем валентность всех атомов кислорода (5•2=10) и делим валентность всех атомов кислорода на число атомов хлора (10:2=5). Валентность хлора ― V
Задание 5 Начертите графические формулы для молекул: аммиака NH3, воды H2O, сернистого газа SO2.
Определение валентности химических элементов. Составление формул двухэлементных (бинарных) соединений | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Тема:
Химическая связь
Пример. Сера содержится в VIa, а хлор — в VIIa группе. Значит, высшая валентность серы VI, а хлора — VII (рис. 12.2).
Значение валентности неметаллического элемента в соединении с водородом или металлическим элементом равно разности между числом VIII и номером соответствующей группы.
Пример. Азот содержится в Va группе. Следовательно, в соединениях с водородом и металлическими элементами он проявляет валентность III (VIII — V = III).
Применим приобретенные знания для составления формул двухэлементных (бинарных) соединений.
| Рис. 12.2. Определение валентности химических элементов по расположению в периодической системе химических элементов |
Задание. Составь формулу соединения фосфора с кислородом, в котором фосфор проявляет высшую валентность.
В формулах бинарных соединений символ металлического элемента записывают первым
Составлять химические формулы бинарных соединений нужно по определенному плану:
|
Последовательность действий
|
Выполнение действия
|
|
1. Запиши химические символы фосфора и кислорода.
|
PO
|
|
2. Помня, что кислород двухвалентный, обозначь в формуле его валентность римской цифрой над соответствующим символом.
|
II
PO
|
|
3. По периодической системе определи высшую валентность фосфора. Он находится в Va группе, значит его высшая валентность — V. Обозначь ее над символом фосфора.
|
V II
PO
|
|
4. Найди наименьшее общее кратное для значений валентности фосфора и кислорода. Наименьшее число, которое делится без остатка на валентности обоих элементов, — 10. Запиши его арабской цифрой сверху между значениями валентностей.
|
V 10 II
P O
|
|
5. Раздели наименьшее общее кратное на валентность фосфора (10 : V = 2). 2 — нижний индекс; запиши его арабскими цифрами возле символа фосфора справа.
|
V 10 II
P2 O
|
|
6. Раздели наименьшее общее кратное на валентность кислорода (10 : II = 5). 5 — нижний индекс; запиши его арабскими цифрами возле символа кислорода справа.
|
V 10 II
Р2 O5
|
|
7. Проверь правильность составления формулы соединения.
Суммарная валентность всех атомов одного элемента должна равняться суммарной валентности всех атомов другого элемента.
Умножь индексы на валентности соответствующих элементов и сравни полученные произведения: 2 • V = 10 и 5 • II = 10. Произведение индекса фосфора в формуле на его валентность равно про изведению индекса кислорода в формуле на его валентность. Следовательно, формула составлена правильно. Запиши ее.
|
Р2O5
|
Наши действия отображает схема (рис. 12.3):
| Рис. 12.3. Составление формулы соединения фосфора (V) с кислородом |
В формулах бинарных соединений символ кислорода записывают вторым, за исключением соединения с фтором
Определение валентности по формулам бинарных соединений. Зная как соотносятся суммарные валентности атомов каждого из химических элементов в бинарном соединении, можно определить валентность одного из элементов в бинарном соединении по известной валентности другого химического элемента.
Задание. Определи валентность серы в соединении, формула которого H2S.
|
Последовательность действий
|
Выполнение действия
|
|
1. Запиши химическую формулу вещества.
|
H2S
|
|
2. Помня, что водород одновалентен, обозначь в формуле его валентность римской цифрой над со ответствующим символом.
|
I
H2S
|
|
3. Найди суммарную валентность атомов водорода, умножив его валентность на индекс: I • 2 = 2. Запиши ее арабской цифрой сверху между символами элементов.
|
I 2
H2 S
|
|
4. Раздели суммарную валентность на количество атомов серы: 2 : Ь — II. Полученное частное и будет искомой валентностью серы. Запиши ее значение над соответствующим символом в фор муле соединения. Материал с сайта http://worldofschool.ru
|
I 2 II
H2 S
|
|
5. Проверь правильность определения валентности серы.
Суммарная валентность всех атомов одного элемента должна равняться суммарной валентности всех атомов другого элемента.
Умножь индексы на валентности соответствующих элементов и сравни полученные произведения: 2 • I = 2 и 1 • II = 2. Произведение индекса водорода в формуле на его валентность равно произведению индекса серы в формуле на ее валентность. Следовательно, валентность серы определена правильно.
|
I 2 II
H2 S
|
Запишем решение в виде схемы (рис. 12.4):
| Рис. 12.4. Определение валентности серы в соединении с водородом |
На этой странице материал по темам:
Составить элементы формулы от бора до фтора
Задачи на составление бинарных соединений
Составление формул двухэлементных соединений
Склади формулу бінарних сполук одно,дво,і тривалентних елементів
Як скласти формулу бінарної сполуки за валентністю конспект
Вопросы по этому материалу:
Составь формулы бинарных соединений азота кислорода, фтора с кальцием
Составь формулы бинарных соединений с кислородом в которых значения валентности лития, магния, бора, углерода максимальны.
Определи валентность атомов химических элементов по формулам соединений: PH
3, Au2O3, SiH4, Ag2O.
Составь формулы бинарных соединений одно-, двух— и трехвалентных металлических элементов с фтором.
Составь схемы определения валентности элементов по формулам бинарных соединений и решения обратной задачи для случаев, когда: а) значения валентностей химических элементов, которые входят в состав соединения, одинаковы; б) значение валентности одного элемента без остатка делится на значение валентности второго элемента в соединении; в) значения валентностей химических элементов, которые входят в состав соединения, не делятся друг на друга.
Как найти элементы электронной конфигурации для золота (Au)
Электронная конфигурация для золота : золото имеет символ «Au» и является одним из встречающихся в природе элементов с более высоким атомным номером. В чистом виде ЗОЛОТОЙ элемент представляет собой легкий, яркий, красновато-желтый, мягкий, плотный, пластичный и ковкий металл. Золото является переходным элементом и находится в группе 11 -й периодической таблицы.
Электронная конфигурация элемента определяется как количество электронов, находящихся на орбитах атома или молекул.
В случае золота в 6 оболочках атома золота присутствует 79 электронов. Число электронов на каждой орбите — 2, 8, 18, 32, 18 и 1. Электронная конфигурация Золота:
.
Химический элемент с атомным номером 79.
1с 2 2с 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 60005 10 6с 1 .
или
[Xe] 4f 14 5d 10 6s 1
Электронная конфигурация для золотого иона
Электронная конфигурация иона золота может быть представлена как количество электронов, присутствующих на орбите оболочки атома золота, и записывается как [Xe] 4f 14 5d 10 6s 1
Полная электронная конфигурация для золота
Полная электронная конфигурация для Золота может быть определена как:
1с 2 2с 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 60005 10 6с 1
Валентные электроны золота
На внешней оболочке золота присутствует только один электрон, поэтому количество валентных электронов, которые имеет золото, равно ОДИН.
Что такое электронная конфигурация золота
Электронная конфигурация — это распределение электронов атомов по орбитам. Для конфигурации с золотым электроном: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 6 5д 10 6с 1
Сколько валентных электронов в золоте
Количество валентных электронов — это количество электронов, которые присутствуют на самой внешней оболочке атома.Золото имеет 79 электронов и только один электрон на внешней оболочке, и оно образует одновалентные соединения. Итак, у золота всего 1 (один) валентный электрон.
, представляющие валентные электроны в символах Льюиса
Цель обучения
- Напомним формализм структуры Льюиса для представления валентных электронов
Ключевые моменты
- Электроны существуют вне ядра атома и находятся на основных энергетических уровнях, которые содержат только определенное количество электронов.
- Самый внешний главный энергетический уровень, содержащий электроны, называется валентным уровнем и содержит валентные электроны.
- Символы Льюиса — это диаграммы, которые показывают количество валентных электронов конкретного элемента с точками, которые представляют неподеленные пары.
- Символы Льюиса не визуализируют электроны на внутренних основных энергетических уровнях.
Условия
- основных энергетических уровня: Различные уровни, на которых могут находиться электроны и которые находятся на определенных расстояниях от ядра атома.Каждый уровень связан с определенным значением энергии электронов внутри него.
- валентный уровень (valence level) Самый внешний главный энергетический уровень, который является наиболее удаленным от ядра, которое все еще содержит электроны.
- валентных электронов: Электроны атомов, участвующие в образовании химических связей.
- Символы Льюиса Символы элементов с их числом валентных электронов, представленные точками
Символы Льюиса (также известные как точечные диаграммы Льюиса или электронные точечные диаграммы) представляют собой диаграммы, которые представляют валентные электроны атома.Структуры Льюиса (также известные как точечные структуры Льюиса или структуры с электронными точками) представляют собой диаграммы, которые представляют собой валентные электроны атомов внутри молекулы. Эти символы Льюиса и структуры Льюиса помогают визуализировать валентные электроны атомов и молекул, существуют ли они в виде неподеленных пар или внутри связей.
Основные уровни энергии
Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. Электростатическое притяжение между ними удерживает электроны «связанными» с ядром, поэтому они остаются на определенном расстоянии от него.Тщательные исследования показали, что не все электроны в атоме имеют одинаковое среднее положение или одинаковую энергию. Мы говорим, что электроны «находятся» на разных основных энергетических уровнях, и эти уровни существуют на разных радиусах от ядра и имеют правила относительно того, сколько электронов они могут вместить.
Основные энергетические уровни золота (Au) На рисунке показана организация электронов вокруг ядра атома золота (Au). Обратите внимание, что первый энергетический уровень (ближайший к ядру) может иметь только два электрона, в то время как большее количество электронов может «уместиться» в пределах данного уровня дальше.Количество электронов на каждом уровне указано в правом верхнем углу рисунка. Обратите внимание, что на внешнем уровне находится только один электрон.
Например, нейтральный атом золота (Au) содержит 79 протонов в своем ядре и 79 электронов. Первый основной энергетический уровень, ближайший к ядру, может содержать максимум два электрона. Второй главный энергетический уровень может иметь 8, третий — 18 и так далее, пока не будут распределены все 79 электронов.
Внешний главный энергетический уровень представляет большой интерес в химии, потому что электроны, которые он удерживает, находятся дальше всего от ядра и, следовательно, наиболее слабо удерживаются его силой притяжения; чем больше расстояние между двумя заряженными объектами, тем меньшую силу они оказывают друг на друга.Химическая реакционная способность всех различных элементов периодической таблицы зависит от количества электронов на последнем, наиболее удаленном уровне, называемом валентным уровнем или валентной оболочкой. В случае золота на валентном уровне имеется только один валентный электрон.
Октет валентных электронов
Атомы приобретают, теряют или делят электроны на своем валентном уровне, чтобы достичь большей стабильности или более низкого энергетического состояния. С этой точки зрения связи между атомами образуются так, что связанные атомы находятся в более низком энергетическом состоянии по сравнению с тем, когда они были сами по себе.Атомы могут достичь этого более стабильного состояния, имея валентный уровень, содержащий столько электронов, сколько он может удерживать. Для первого основного энергетического уровня наличие двух электронов на нем является наиболее стабильным расположением, в то время как для всех других уровней, кроме первого, восемь электронов необходимы для достижения наиболее стабильного состояния.
Символы Льюиса
В символе Льюиса для атома написан химический символ элемента (как указано в периодической таблице), а валентные электроны представлены в виде окружающих его точек.В этом обозначении показаны только электроны на валентном уровне. Например, символ углерода Льюиса изображает «C’, окруженный 4 валентными электронами, потому что углерод имеет электронную конфигурацию 1s 2 2s 2 2p 2 .
Символ Льюиса для углерода Каждый из четырех валентных электронов представлен точкой.
Электроны, не находящиеся на валентном уровне, не отображаются в символе Льюиса. Причина этого в том, что химическая реакционная способность атома элемента составляет исключительно , определяемое числом его валентных электронов, и , а не его внутренних электронов.Символы Льюиса для атомов объединяются для записи структур Льюиса для соединений или молекул со связями между атомами.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Теоретическое исследование валентных состояний в Au через соединения Au – F под высоким давлением
В дополнение к известным Au 3+ и Au 5+ недавно было показано, что Au, вероятно, обладает необычными валентными состояниями в сжатых соединениях Au – F.Однако наши симуляции показывают, что полимерный AuF 4 в основном состоянии демонстрирует неожиданную 6-кратную координацию, а не 4-кратную, что указывает на то, что крайне необходимо более полное понимание аномального Au 4+ . Чтобы полностью понять природу и происхождение аномальных валентных состояний в Au, мы тщательно исследовали структуры основного состояния соединений Au – F при высоких давлениях с использованием методов квантово-механических расчетов. Как следствие, мы идентифицируем несколько ранее неизвестных (стабильных) структур AuF 2 , AuF 3 и AuF 4 структур.Наши результаты расширяют известный полиморфизм соединений AuF n и предлагают фундаментальное понимание происхождения необычных валентных состояний в Au, которые преобладают при высоком давлении.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуй еще раз?
Trends in Electron Configuration Chemistry Tutorial
Пожалуйста, не блокируйте рекламу на этом веб-сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Тенденции изменения числа валентных электронов
Приведенная ниже таблица для основных элементов группы составлена так же, как Периодическая таблица элементов.
Электронная конфигурация в обозначениях оболочки дана для атома каждого из элементов.
Электроны в валентной оболочке (наивысший уровень энергии) выделены красным цветом.
Можете ли вы увидеть закономерность или тенденцию в электронной конфигурации атомов в каждой группе и в каждом периоде?
| символ конфигурация электронов в оболочках (электроны валентной оболочки, количество электронов на высшем энергетическом уровне, показано красным цветом ) | ||||||||
| Группа 1 (IA) | Группа 2 (IIA) | Группа 13 (IIIA) | Группа 14 (IVA) | Группа 15 (ВА) | Группа 16 (VIA) | Группа 17 (VIIA) | Группа 18 (VIIIA или 0) | |
|---|---|---|---|---|---|---|---|---|
| Li 2, 1 | Be 2, 2 | В 2, 3 | С 2, 4 | N 2, 5 | O 2, 6 | Ф. 2, 7 | Ne 2, 8 | |
| Na 2,8, 1 | мг 2,8, 2 | Al 2,8, 3 | Si 2,8, 4 | П 2,8, 5 | S 2,8, 6 | Класс 2,8, 7 | Ar 2,8, 8 | |
| К 2,8,8, 1 | Ca 2,8,8, 2 | Ga 2,8,18, 3 | Ge 2,8,18, 4 | As 2,8,18, 5 | SE 2,8,18, 6 | Br 2,8,18, 7 | Кр 2,8,18, 8 | |
| руб. 2,8,18,8, 1 | Sr 2,8,18,8, 2 | В 2,8,18,18, 3 | Sn 2,8,18,18, 4 | Сб 2,8,18,18, 5 | Te 2,8,18,18, 6 | I 2,8,18,18, 7 | Хе 2,8,18,18, 8 | |
| CS 2,8,18,18,8, 1 | Ba 2,8,18,18,8, 2 | Тл 2,8,18,32,18, 3 | Пб 2,8,18,32,18, 4 | Bi 2,8,18,32,18, 5 | Po 2,8,18,32,18, 6 | по адресу 2,8,18,32,18, 7 | Rn 2,8,18,32,18, 8 | |
| Fr 2,8,18,32,18,8, 1 | Ra 2,8,18,32,18,8, 2 | |||||||
| 1 валентный электрон | 2 валентных электронов | 3 валентных электронов | 4 валентных электронов | 5 валентных электронов | 6 валентных электронов | 7 валентных электронов | 8 валентных электронов (ИСКЛЮЧЕНИЕ Он имеет 2 валентных электрона) | |
Вы должны увидеть две модели или тенденции:
- Элементы одной группы имеют одинаковое количество электронов валентной оболочки.
Группа 1
(IA)2
(IIA)13
(IIIA)14
(IVA)15225
15
16
(VIA)17
(VIIA)18
(VIIIA или 0)Число валентных электронов 1 3 2 2 2 1 2 5 6 7 8 2 - Через период Периодической таблицы слева направо количество валентных электронов увеличивается. 2
Группа 1
(IA)2
(IIA)13
(IIIA)14
(IVA)15294
16
(VIA)17
(VIIA)18
(VIIIA или 0)Число валентных электронов 1 3 2 2 2 2 2 5 6 7 8 2 Тенденция: наименьшее количество валентных электронов
→ → → → → максимальное количество
валентных электронов
Тенденции энергии валентных электронов
В приведенной ниже таблице электронная конфигурация только валентных электронов дана с использованием подоболочки.
Можете ли вы найти закономерность или тенденцию в уровнях энергии, занимаемых валентными электронами?
| символ положение электронов валентной оболочки (уровень энергии валентных электронов показан красным цветом ) | |||||||||||
| Период | Группа 1 (IA) | Группа 2 IIA | Группа 13 (IIIA) | Группа 14 (IVA) | Группа 15 (ВА) | Группа 16 (VIA) | Группа 17 (VIIA) | Группа 18 (VIIIA или 0) | Уровень энергии валентных электронов | Тренд | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | He 1 с 2 | 1 (оболочка K) | Наименьшее потребление энергии ↓ | ||||||||
| 2 | Li 2 с 1 | Be 2 с 2 | B 2 с 2 2 с 1 | С 2 с 2 2 с 2 | N 2 с 2 2 с 3 | O 2 с 2 2 с 4 | Ф 2 с 2 2 с 5 | Ne 2 с 2 2 с 6 | 2 (L корпус) | ↓ | |
| 3 | Na 3 с 1 | мг 3 с 2 | Al 3 с 2 3 с 1 | Si 3 с 2 3 с 2 | P 3 с 2 3 с 3 | S 3 с 2 3 с 4 | Класс 3 с 2 3 с 5 | Ar 3 с 2 3 с 6 | 3 (корпус M) | ↓ | |
| 4 | К 4 с 1 | Ca 4 с 2 | Ga 4 с 2 4 с 1 | Ge 4 с 2 4 с 2 | As 4 с 2 4 p 3 | SE 4 с 2 4 с 4 | Br 4 с 2 4 с 5 | Kr 4 с 2 4 с 6 | 4 (корпус N) | ↓ | |
| 5 | руб 5 с 1 | Sr 5 s 2 | In 5 с 2 5 p 1 | Sn 5 с 2 5 с 2 | Сб 5 с 2 5 п 3 | Te 5 с 2 5 с 4 | I 5 с 2 5 с 5 | Xe 5 с 2 5 с 6 | 5 (оболочка O) | ↓ | |
| 6 | CS 6 с 1 | Ba 6 с 2 | Tl 6 с 2 6 с 1 | Pb 6 с 2 6 p 2 | Bi 6 с 2 6 с 3 | Po 6 с 2 6 с 4 | При 6 с 2 6 p 5 | Rn 6 с 2 6 p 6 | 6 (корпус P) | ↓ | |
| 7 | Fr 7 с 1 | Ra 7 с 2 | 7 (оболочка Q) | ↓ Наивысшая энергия | |||||||
Вы должны увидеть две модели или тенденции в уровнях энергии валентных электронов:
- Электроны валентной оболочки элементов в один и тот же период Периодической таблицы занимают один и тот же энергетический уровень:
Период Энергетический уровень
электронов валентностиОболочка валентности 1 1 K 2 2 L 3 4 4 N 5 5 O 6 6 P 7 9030
- По группе Периодической таблицы сверху вниз энергия валентных электронов увеличивается:
Уровень энергии
электронов валентности
в группеТренд 2 наименьшая энергия 3 ↓ ↓ 296
4 ↓ 6 ↓ 7 самая высокая энергия Электронная конфигурация
— Валентная оболочка для переходных металлов
Как вы можете видеть, есть три электронные подоболочки над очевидно инертным ядром Xe.5d-электроны, которые большую часть времени далеки от ядер из-за формы своих орбиталей, ощущают резкое увеличение эффективного заряда ядра через третий d-ряд. Например, для титана эффективный заряд d-электронов равен 4. Для золота он равен 11, так что электроны хорошо удерживаются.
Для s-электронов форма орбитали помещает очень значительную часть электронной плотности вблизи ядер. Это означает, что для тяжелых элементов (начиная с Ga) наблюдается так называемый «эффект пары инертных электронов»: по сравнению с p- и d-электронами, из-за формы s-орбитали, s-электроны гораздо меньше защищены от заряда ядер нижележащими слоями, что приводит к гораздо более прочной связи упомянутых электронов.В результате, Bi очень нестабилен в валентном состоянии +5, перброматы являются гораздо более сильным окислителем, чем перхлораты, но это не верно для броматов и хлоратов, а Ag, Au и Hg имеют очень прочно связанные s-электроны, что приводит к относительной инертности. указанных металлов.
Для Au и Ag, однако, сильно связанные s-электроны участвуют в чрезвычайно мощных (из-за относительно небольшого размера s-орбиталей) ss-взаимодействиях, в то время как для Hg возможны только относительно слабые sp- и dp-взаимодействия из-за заполненных d- и s-орбиталей. — подоболочки.Таким образом, металлический Ag и особенно Au в металлическом состоянии имеют s-электроны, участвующие в эффективных ковалентных взаимодействиях, что приводит к относительно инертной природе. Однако имейте в виду, что они далеко не инертны: Ag имеет высокое сродство к сере, и как Ag, так и Au растворяются в растворах цианида в присутствии кислорода, не говоря уже о таких агрессивных реагентах, как хлор и бром.
Тем не менее, Au, Ag и Cu имеют одну общую черту с элементами Ia (I основная подгруппа). Благодаря участию только сферических s-орбиталей в связывании атомов в металлическом состоянии все три металла обладают высокой пластичностью.Другие d-элементы имеют значительные связи d-d в металлических состояниях, а d-орбитали не являются сферически симметричными, что приводит к гораздо менее пластичному поведению.
Части Периодической таблицы
Когда элементы объединяются, чтобы сформировать соединения, есть два основных типа
соединение, которое может возникнуть. Ионные связи образуются, когда есть
передача электронов от одного вида к другому, производя
заряженные ионы, которые очень сильно притягиваются друг к другу электростатическим
взаимодействия и ковалентных связей , которые возникают, когда атомы
делятся электронами для производства нейтральных молекул.В целом
металл и неметаллы объединяются с образованием ионных соединений , а
неметаллы соединяются с другими неметаллами с образованием ковалентных соединений
(молекулы).Поскольку металлы в периодической таблице расположены левее, они
имеют низкую энергию ионизации
и низкое сродство к электрону,
поэтому они относительно легко теряют электроны и с трудом их приобретают.
Они также имеют относительно мало валентных электронов и могут образовывать ионы (и
тем самым удовлетворять правилу октетов) легче, теряя свою валентность
электроны с образованием положительно заряженных катионов .- Металлы основной группы обычно образуют такие же заряды, как и
их номер группы: то есть металлы Группы 1А, такие как
натрий и калий образуют заряд +1, металлы группы 2А, такие как
магний и кальций образуют 2+ зарядов, а металлы группы 3A, такие как
в виде алюминия образуют 3+ заряда. - Металлы, следующие за переходными металлами (в сторону
нижняя часть групп 4A и 5A) могут потерять либо их крайние s
и p электронов, образующих заряды, идентичные своим
номер группы, или они могут потерять всего p электронов, пока
сохраняя свои два s электронов, образуя заряды, которые являются
номер группы минус два.Другими словами, олово и свинец в Группе
4A может образовывать 4+ или 2+ зарядов, в то время как висмут в группе 5A может образовывать заряды 4+ или 2+.
формируют заряд 5+ или 3+. - Переходные металлы обычно способны образовывать 2+ заряда
теряя валентность s электронов, но также могут терять
электроны со своих d орбиталей с образованием других зарядов.
Большинство переходных металлов могут образовывать более одного возможного заряда.
в ионных соединениях.
Неметаллы находятся правее в таблице Менделеева и имеют
высокие энергии ионизации и
высокое сродство к электрону, поэтому
они относительно легко получают электроны и с трудом теряют их.
У них также есть большее количество валентных электронов, и они уже
близок к полному октету из восьми электронов. Неметаллы
набирать электроны, пока у них не будет того же количества электронов, что и у
ближайший благородный газ (группа 8А), образующий отрицательно заряженные анионы
которые имеют заряды, равные номеру группы минус восемь.Это,
неметаллы группы 7A образуют заряды 1, неметаллы группы 6A образуют 2-
заряды, а металлы группы 5А образуют 3- заряды. Группа 8А
элементы уже имеют восемь электронов в их валентных оболочках и имеют
малая тенденция к получению или потере электронов, и
образуют ионные или молекулярные соединения.Ионные соединения удерживаются вместе в регулярном массиве, называемом кристаллом .
решетка силами притяжения между противоположно заряженными
катионы и анионы.Эти силы притяжения очень сильны, и
поэтому большинство ионных соединений имеют очень высокие температуры плавления. (Для
Например, хлорид натрия, NaCl, плавится при 80 ° С, а оксид алюминия,
Al 2 O 3 , плавится при 2054 ° C.) Ионные соединения:
обычно твердые, жесткие и хрупкие. Ионные соединения не проводят
электричество, потому что ионы не могут двигаться в твердой фазе,
но ионные соединения могут проводить электричество, когда они растворяются в
вода.Когда неметаллы объединяются с другими неметаллами, они имеют тенденцию делиться
электроны в ковалентных связях вместо образования ионов, что приводит к
образование нейтральных молекул. (Имейте в виду, что поскольку водород
также неметалл, сочетание водорода с другим неметаллом
также будет образовывать ковалентную связь.) Молекулярные соединения могут быть
газы, жидкости или твердые вещества с низкой температурой плавления и включают широкий спектр
веществ. (См.
Галерея молекул для
Примеры.)Когда металлы соединяются друг с другом, обычно описывается соединение.
как металлическое соединение (вы уже догадались). В этом
модели, каждый атом металла отдает один или несколько своих валентных электронов
сделать электронное море , которое окружает все атомы, удерживая
вещества вместе за счет притяжения между катионами металлов и
отрицательно заряженные электроны. Поскольку электроны в электроне
море может свободно перемещаться, металлы очень легко проводят электричество, в отличие от
молекулы, где электроны более локализованы.Атомы металлов могут
проходят друг мимо друга легче, чем в ионных соединениях (которые
удерживаются в фиксированных положениях притяжениями между катионами и
анионы), позволяя металлу раскалывать листы или втягивать
провод. Можно легко комбинировать разные металлы, чтобы получить .
сплавы , физические свойства которых могут сильно отличаться от их
составляющие металлы. Сталь представляет собой сплав железа и углерода,
которое намного тверже самого железа; хром, ванадий, никель и
другие металлы также часто добавляют в железо для производства сталей различных
типы. Латунь представляет собой сплав меди и цинка, который используется
в сантехнике, электрических деталях и музыкальных инструментах.
Бронза — это сплав меди и олова, который намного тверже, чем
медь; когда бронза была открыта древними цивилизациями, она ознаменовала
значительный шаг вперед от использования менее прочных каменных орудий.Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
- По группе Периодической таблицы сверху вниз энергия валентных электронов увеличивается:
