Содержание
Азотная кислота слабая — Справочник химика 21
Азотная кислота, слабая. . . Азотная кислота, концентриро- с с с с с С [c.226]
ПРИЛОЖЕНИЕ 1 Азотная кислота (слабая) ОСТ 15374—39 [c.175]
Азотная кислота слабая…………ОСТ 15374—39 [c.269]
Ход определения. 50 г хлористого метилена взвесить с точностью до 0,01 г в фарфоровом тигле, высушенном до постоянной массы. Осторожно, не допуская кипения, упарить на водяной бане под тягой до прекращения выделения паров. Остаток медленно сжечь на электроплитке под тягой до прекращения выделения дыма, затем прокалить в муфельной печи при красном калении 1 мин. После этого растворить в 2 мл азотной кислоты, слабо нагревая на электроплитке или на кипящей водяной бане. [c.126]
В ледяной уксусной кислоте азотная кислота слабо ионизирована, но зато анилин ионизирован нацело. Заметно ионизированными основаниями являются мочевина и ацетамид, которые в жидком аммиаке функционируют как кислоты. [c.130]
Заметно ионизированными основаниями являются мочевина и ацетамид, которые в жидком аммиаке функционируют как кислоты. [c.130]
Аммиак широко применяется в народном хозяйстве страны. Большая часть его перерабатывается в азотную кислоту (слабая, концентрированная, особо чистая). [c.4]
Разлагает воду и растворяется в соляной, серной и азотной кислотах. Слабо растворим в плавиковой и фосфорной кислотах благодаря образованию иа поверхности металла защитных пленок фторидов и фосфатов. [c.561]
Однако равновесие сильно смещено влево, так что одна азотная кислота — слабый нитрующий агент. При добавлении концентрированной серной кислоты концентрация катиона NO2 сильно возрастает [c.428]
Крепкая азотная кислота Слабая азотная кислота Соляная кислота. Фенол. . . . Ацетальдегид Этиловая жидкость Аммиак жидкий Хлор жидкий Пропан жидкий Сера расплавленная Фосфор желтый Метанол. . . [c.41]
Азотная кислота слабая [c. 106]
106]
А Азотная кислота слабая по схеме [c.9]
А Азотная кислота слабая по схеме с абсорбцией [c.98]
Химическая активность. Галлий довольно устойчив на воздухе и окисляется только с поверхности. Он не разлагает воду и остается светлым при кипячении в ней. Азотная кислота слабо действует на галлий, о в соляной кислоте, растворе едкого кали, и водном аммиаке он растворяется, выделяя водород. Хлористые соединения галлия летучи, окислы и гидроокиси галлия аморфны. [c.228]
Азотной кислоты слабой [c.128]
Кислотостойкость. На асфальто-пековую массу действуют только концентрированная серная и азотная кислоты. Слабые кислоты и сильные щелочи практически не действуют, а слабые щелочи не действуют вовсе. Органические растворители на асфальто-пековую [c.91]
Селен. Соляная кислота не действует на элементарный селен. Разбавленная азотная кислота слабо растворяет загрязненный селен и почти не действует на селен высокой степени чистоты. Концентрированная азотная кислота на холоде быстро растворяет загрязненный селен, тогда как селен высокой степени чистоты (99,99%) растворяется в ней очень медленно. [c.16]
Концентрированная азотная кислота на холоде быстро растворяет загрязненный селен, тогда как селен высокой степени чистоты (99,99%) растворяется в ней очень медленно. [c.16]
Азотная кислота, слабая. . Азотная кислота, концентриро [c.226]
Атомный вес серебра 107,88. Серебро легко растворяется в азотной кислоте, слабо — в серной и практически нерастворимо в соляной кислоте и в щелочах. Анодное растворение серебра также легко происходит в цианистых солях с образованием растворимых комплексных соединений. Неустойчиво серебро и в растворах аммиака. Во всех химических соединениях оно одновалентно. С сероводородом в присутствии влаги и кислорода воздуха се- [c.4]
Большую часть аммиака перерабатывают в азотную кислоту (слабую, концентрированную, особо чистую), из которой получают азотнокислые соли — полупродукты, используемые для производства синтетпческих красителей, лекарственных веществ и многих продуктов органического синтеза. [c.5]
[c.5]
С серной, соляной и азотной кислотами слабой и средней концентрации они не взаимодействуют. При температуре кипения этих кислот наблюдается заметное взаимодействие. Количество растворившейся основной соли за один и тот же промежуток времени в указанных кислотах возрастает от калиевого алунита к водородному. По стойкости к неорганическим кислотам основные соли можно расположить в следующий ряд НгАвыше температуры кипения (автоклавные условия) все основные соли полностью растворяются в кислотах относительно небольших концентраций ( 10 %). В концентрированных кислотах все основные соли алюминия растворяются практически полностью. Обожженные при температуре дегидратации (450—550 °С), эти соли растворяются в неорганических кислотах также слабых и средних концентраций. [c.47]
Длительное время химики пытались, подобно нитрованию ароматического ядра, осуществить введение нитрогрупп в парафины или жирную цепь ароматических соединений, но эти попытки не имели успеха. Концентрированная азотная кислота и даже нитрующая смесь при низких температурах не оказывали никакого воздействия на насыщенные углеводороды, а при повышенных температурах окисляли их до углекислого газа и ос-моляли. Азотная кислота слабой концентрации не действовала на насыщенные углеводороды и нри высоких температурах. Синтезы жирных нитросоединений поэтому производились косвенными методами и приводили к низким выходам продуктов [c.387]
Концентрированная азотная кислота и даже нитрующая смесь при низких температурах не оказывали никакого воздействия на насыщенные углеводороды, а при повышенных температурах окисляли их до углекислого газа и ос-моляли. Азотная кислота слабой концентрации не действовала на насыщенные углеводороды и нри высоких температурах. Синтезы жирных нитросоединений поэтому производились косвенными методами и приводили к низким выходам продуктов [c.387]
С, с углеродом при нагревании — карбид АиСз. При температуре красного каления А. реагирует с СО и СО2, образуя карбид и оксид А. и углерод. А. устойчив к сильно разбавленной и концентрированной азотной кислоте, слабо растворяется в серной кислоте, энергичнее реагирует с соляной, не реагирует с фосфорной. Легко растворяется в щелочах, образуя алюминаты. См. также приложение. [c.207]
Такая обработка не годится,- однако, для соединений типа RHgX (где X — галоген, а К органический радикал) вследствие летучести галогенидов ртути. В этом случае рекомендуется следующий ход анализа. Навеску в 0,2—0,3 г пробы помещают в коническ]гю колбу емкостью 300 мл, прибавляют 40 мл ледяной уксусной кислоты, обрабатывают 2 мл брома и дают постоять 20 мин. Вставляют в горло колбы маленькую воронку с обрезанной трубкой, прибавляют 3 мл соляной кислоты и восстанавливают ртуть, прибавляя небольшими порциями цинковую пыль при температуре ниже 50° С. По исчезновении окраски брома прибавляют избыток цинковой пыли и дают раствору стоять 3 ч или, лучше, оставляют его на ночь. Затем прибавляют 0,5 г тонко измельченного силикагеля для удаления коллоидной ртути и декантируют при слабом отсасывании через тигель Гуча, в который предварительно укладывают довольно толстый слой асбеста, покрытый слоем тонко измельченного силикагеля. Осадок несколько раз промывают декантацией и затем переносят обратно в колбу или весь тигель, или же только слой асбеста с находящимся на нем осадком и обмывают тигель над колбой 20 мл разбавленной (1 1) азотной кислоты.
В этом случае рекомендуется следующий ход анализа. Навеску в 0,2—0,3 г пробы помещают в коническ]гю колбу емкостью 300 мл, прибавляют 40 мл ледяной уксусной кислоты, обрабатывают 2 мл брома и дают постоять 20 мин. Вставляют в горло колбы маленькую воронку с обрезанной трубкой, прибавляют 3 мл соляной кислоты и восстанавливают ртуть, прибавляя небольшими порциями цинковую пыль при температуре ниже 50° С. По исчезновении окраски брома прибавляют избыток цинковой пыли и дают раствору стоять 3 ч или, лучше, оставляют его на ночь. Затем прибавляют 0,5 г тонко измельченного силикагеля для удаления коллоидной ртути и декантируют при слабом отсасывании через тигель Гуча, в который предварительно укладывают довольно толстый слой асбеста, покрытый слоем тонко измельченного силикагеля. Осадок несколько раз промывают декантацией и затем переносят обратно в колбу или весь тигель, или же только слой асбеста с находящимся на нем осадком и обмывают тигель над колбой 20 мл разбавленной (1 1) азотной кислоты. По око15[чании реакции прибавляют, 10 мл азотной кислоты, слабо нагревают до растворения всей ртути и приливают концентрированный раствор перманганата до появления розовой окраски, не исчезающей в течение 5 мин. Удаляют избыток перманганата, прибавляя но каплям свежеприготовленный раствор сульфата железа (И), и далее ведут анализ, как описано на стр. 248. [c.245]
По око15[чании реакции прибавляют, 10 мл азотной кислоты, слабо нагревают до растворения всей ртути и приливают концентрированный раствор перманганата до появления розовой окраски, не исчезающей в течение 5 мин. Удаляют избыток перманганата, прибавляя но каплям свежеприготовленный раствор сульфата железа (И), и далее ведут анализ, как описано на стр. 248. [c.245]
В коррозионной камере в тумане 3-процентного раствора N301 при температуре 30° хорошие результаты показало комбинированное покрытие, состоящее из медного подслоя толщиной 30 мк и оловянноникелевого покрытия (толщиной 30 мк). Такие же образцы покрытий показали высокую коррозионную стойкость при испытании в тропической камере при периодическом нагревании до температуры 55° и. охлаждении до точки выпадения росы. Оловянноникелевое покрытие отличается стойкостью в разбавленных минеральных кислотах [52, 70]. Концентрированная азотная кислота слабо разрушает покрытие, но под воздействием концентрированных серной и соляной кислот оловянноникелевое покрытие разрушается [c. 171]
171]
Нитрат свинца не растворим в спирте и концентрированной азотной кислоте. Слабая азотная кислота и 90 %-ный спирт растворяют нитрат свинца лишь в незначительном количестве. В метиловом спирте растворяется 1,35% при 20,5°. Легко растворим в жидком аммиаке. Соль мало гирроскопична. [c.145]
Серебро легко растворяется в азотной кислоте, слабо в серной и практически нерастворимо в соляной кислоте и в щелочах. Легко также происходит анодное растворение серебра в цианистых растворах. Этот процесс часто применяется для его электрополировкн. Под действием сероводорода темнеет. Серебрение не предохраняет железа от коррозии в атмосферных условиях. Серебро легко полируется и в полированном состоянии обладает хорошей отражательной способностью. [c.159]
Концентрированная азотная кислота слабо взаимодействует с металлическим свинцом, так как защитная пленка из нитрата двухвалентного свинца мало растворяется в концентрированной азотной кис. иоте. [c.439]
иоте. [c.439]
Палладий — серебристо-белый металл с уд. весом 12,0 и температурой плэвления 1554° С. Электропроводность палладия почти в 7 раз ниже, чем серебра, i[o в отличие от серебра она неизменна в течение длительного времени, даже при нагревании до 300° С. При более высоких температурах поверхность металла покрывается коричневым налетом окислов. Гальванически осажденный палладий характеризуется высокой твердостью, уступающей лишь хромовым и родиевым покрытиям. Он обладает высокой способностью к насыщению водородом, атомный вес 106,7, в соединениях двухвалентен и четырехвалентен. Растворим в азотной кислоте, слабо в соляной кислоте и хорошо растворим в царской водке. Электрохимический эквивалент Pd = 1,99 г/а-ч и нормальный электродный потенциал равен +0,83 в. Металлический палладий марки Пд 99,7 или Пд 99,8 поставляется нашей промышленностью по ГОСТу 13462—68. Палладий легко паяется и стоимость его значительно меньше, чем у остальных металлов платиновой группы. Удельный расход его для покрытия электрических контактов при равных толщинах также существенно меньше, чем золота или платины, за счет меньшего удельного веса. Удельная электропроводность палладия 82 [c.82]
Удельный расход его для покрытия электрических контактов при равных толщинах также существенно меньше, чем золота или платины, за счет меньшего удельного веса. Удельная электропроводность палладия 82 [c.82]
|
1. |
Идентификация химической продукции
| |
|
1.1. |
Идентификация химической продукции | |
|
1.1.1. |
Техническое наименование: |
КИСЛОТА АЗОТНАЯ, NITRIC ACID |
|
1.1.2 |
Краткие рекомендации по применению (в т.ч. ограничения по применению): |
КИСЛОТА АЗОТНАЯ конценирированная марки А применяется в производстве изделий электронной и радиоэлектронной промышленности, в процессах нитрования органических соединений, в производстве взрывчатых веществ, при химической обработке металлов, в медицинской промышленности, в производстве пластмасс и для других целей.  КИСЛОТА АЗОТНАЯ концентрированная марки Б применяется для гальванических работ, в производстве химических реактивов, для растворения примесей промышленных продуктов, в процессах нитрования органических соединений, в производстве взрывчатых веществ и для других целей. КИСЛОТА АЗОТНАЯ концентрированная марки Б применяется для гальванических работ, в производстве химических реактивов, для растворения примесей промышленных продуктов, в процессах нитрования органических соединений, в производстве взрывчатых веществ и для других целей.
|
|
2. |
Идентификация опасности (опасностей)
| |
|
2.1 |
Степень опасности химической продукции в целом: |
Класс опасности (по ГОСТ 12.1.007-76) — 3. |
|
2.2. |
Гигиенические нормативы для продукции в целом в воздухе рабочей зоны: (ПДКр.з. или ОБУВ р.з.) |
2 мг/м3 (в пересчете на оксид азота) |
|
2.3. |
Сведения о маркировке (по ГОСТ 31340-13) | |
|
2.  3.1. 3.1.
|
Описание опасности: |
Символы: «Жидкость, выливающаяся из двух пробирок и поражающая металл и руку», «Сухое дерево и мертвая рыба», «Пламя над окружностью» (для концентрации 65% и более), Сигнальное слово: «Опасно». Характеристика опасности: Может вызвать коррозию металлов, При попадании на кожу и в глаза вызывает химические ожоги, При попадании в глаза вызывает необратимые последствия, Опасно для окружающей среды. Сильный окислитель, может вызвать возгорание или взрыв (для концентрации более 65%) |
|
3. |
Информация при перевозках (транспортировании)
| |
|
3.1 |
Номер ООН (UN): (в соответствии с рекомендациями ООН по перевозке опасных грузов (типовые правила), последнее издание) |
Номер ООН 2031 |
|
3.  2 2
|
Надлежащее отгрузочное наименование и/или транспортное наименование: |
Кислород газообразный технический, кислород газообразный медицинский. |
|
3.3 |
Виды применяемых транспортных средств: |
Перевозить всеми видами транспорта в соответствии с Правилами перевозки опасных грузов, действующими на данном виде транспорта. |
|
3.4 |
Классификация опасности груза: (по ГОСТ 19433 и рекомендациям ООН по перевозке опасных грузов) |
По ГОСТ 19433-88 — класс 8 + 5.1 (для концентрации 65% и более) классификационный шифр 8051 (концентрация более 70%), 8052 (концентрация не более 70%, не менее 65%), 8012 (концентрация менее 65%). По рекомендация ООН, СМГС, МПОГ — класс 8 + 5.  1 (для концентрации 65% и более), классификационный код СО1, С1 (для концентрации менее 65%) 1 (для концентрации 65% и более), классификационный код СО1, С1 (для концентрации менее 65%)
|
|
3.5 |
Транспортная маркировка: (манипуляционные знаки; основные, дополнительные и информационные надписи) |
Знак опасности в соответствии с ГОСТ 19433 по чертежу № 8, 5(для концентрации 65% и более). Транспортная маркировка по ГОСТ 14192 с нанесением манипуляционного знака «Спускать с горки осторожно» для вещества в стеклянной таре, «Герметичная упаковка», «Беречь от солнечных лучей», «Азотная кислота». |
|
3.6 |
Группа упаковки: (в соответствии с рекомендациями ООН по перевозке опасных грузов) |
I (для концентрации более 70%), II |
|
3.  7 7
|
Аварийные карточки: (при железнодорожных, морских и др. перевозках) |
|
|
При железнодорожных перевозках аварийная карточки № 802. | ||
|
3.8 |
Информация об опасности при меж-дународном грузовом сообщении: (по СМГС, ADR (ДОПОГ), RID (МПОГ), IMDG Code (ММОГ), ICAO/IАTA (ИКАО) и др., включая сведения об опасности для окружа-ющей среды, в т.ч. о «загрязнителях моря») |
Код опасности по СМГС: 885 — для концентрации более 70%, 85 — для концентрации не менее 65% и не более 70%, 80 — для концентрации менее 65%. |
|
4. 
|
Правила хранения химической продукции и обращения с ней при погрузочно-разгрузочных работах
| |
|
4.1 |
Меры безопасности при обращении с химической продукцией | |
|
4.1.1 |
Меры безопасности и коллективные средства защиты: (в т.ч. система мер пожаровзрывобезопасности) |
При работе с азотной кислотой необходимо пользоваться индивидуальными средствами защиты (респираторы, резиновые перчатки, защитные очки, спецодежда), а также соблюдать правила личной гигиены. Все рабочие помещения должны быть оборудованы общей приточно-вытяжной вентиляцией. Анализ азотной кислоты следует проводить в вытяжном шкафу лаборатории. Для химразведки и руководителю работ — ПДУ-3 (в течение 20 минут). Для аварийных бригад — изолирующий защитный костюм КИХ-5 в комплекте с изолирующим противогазом ИП-4М или дыхательным аппаратом АСВ-2.  Кислотостойкие перчатки, перчатки из дисперсии бутилкаучука, специальная обувь. При отсутствии указанных образцов: защитный общевойсковой костюм Л-1 или Л-2 в комплекте с промышленным противогазом и патроном А. При возгорании — огнезащитный костюм в комплекте с самоспасателем СПИ-20. Кислотостойкие перчатки, перчатки из дисперсии бутилкаучука, специальная обувь. При отсутствии указанных образцов: защитный общевойсковой костюм Л-1 или Л-2 в комплекте с промышленным противогазом и патроном А. При возгорании — огнезащитный костюм в комплекте с самоспасателем СПИ-20.
|
|
4.1.2 |
Меры по защите окружающей среды: |
Для изоляции паров использовать распыленную воду. Вещество откачать из понижений местности с соблюдением мер предосторожности. Место разлива изолировать песком, воздушно-механической пеной, промыть большим количеством воды, обваловать и не допускать попадания вещества в поверхностные воды, соприкосновения с материалами, загрязненными нефтепродуктами, маслами. Грунт после нейтрализации перекопать. Промытые водой поверхности подвижного состава, территории обработать моющими композициями, щелочным раствором (известковым молоком, раствором кальцинированной соды). 
|
|
4.1.3 |
Рекомендации по безопасному перемещению и перевозке: |
Инструкция по упаковке P001 IBC02 Положение по совместной упаковке MP15 Минимальные нормы покрытия 3/0-0-1-0 Транспортная категория 2 |
|
4.2 |
Правила хранения химической продукции | |
|
4.2.1 |
Условия и сроки безопасного хранения: (в т.ч. гарантийный срок хранения, срок годности) |
Хранить в стальных герметично закрытых бочках. |
|
4.2.2 |
Несовместимые при хранении вещества и материалы: |
Не допускается совместное хранение с органическими веществами, легковоспламеняющимися и горючими веществами, неорганическими веществами, имеющими окислительные свойства.  |
|
4.3 |
Меры безопасности и правила хранения в быту: |
Не применяется |
|
5. |
Рекомендации по удалению отходов (остатков)
| |
|
5.1 |
Меры безопасности при обращении с отходами, образующимися при применении, хранении, транспортировании и др. |
При обращении с отходами каждый работающий обязан строго соблюдать меры личной безопасности, для чего следует пользоваться индивидуальными средствами защиты (респиратор РУ-60 с патроном марки А; защитные очки, резиновые перчатки; защитные передники). |
|
5.2 |
Рекомендации по удалению отходов, образующихся при применении продукции в быту: |
В быту не применяется. |
Азотная кислота
от 01. 01.2017 года
01.2017 года
Настоящее пользовательское (лицензионное) соглашение (далее – «Соглашение»)
заключается между Обществом с ограниченной ответственностью «АЛЕКТА» (далее –
«Лицензиар»), и Пользователем (физическим лицом, выступающем в роли конечного
потребителя Продукта) совместно именуемые «Стороны».
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно
представляет собой публичную оферту и, после его принятия Вами, образует соглашение
между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в
тексте Соглашения.
Принимая настоящее Соглашение, Вы соглашаетесь с положениями, принципами, а
также соответствующими условиями лицензионного соглашения, изложенными ниже.
1. ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
1.1. Программный продукт — экземпляры программы для ЭВМ «ХиШник», состоящей
из Серверной части (свидетельство о государственной регистрации базы данных
№2014621526) и Клиентского приложения (свидетельство о государственной
регистрации программы для ЭВМ № 2014661592), права на использование которой
предоставляются в соответствии с настоящим Соглашением.
1.2. Серверная часть — часть Программного продукта, размещенная в сети Интернет и
используемая для хранения данных в базе данных Лицензиара под наименованием
«ХиШник» (далее также – «база данных»), а также для хранения, обработки,
передачи данных Пользователя между базой данных и клиентским приложением.
1.3. Клиентское приложение — часть Программного продукта, устанавливаемая на
компьютер Пользователя или на мобильное устройство Пользователя и
позволяющая получить доступ к базе данных Лицензиара, а также данным
Пользователя, хранящимся в памяти сервера Лицензиара.
1.4. Пользовательское (лицензионное) соглашение – текст настоящего Соглашения со
всеми дополнениями, изменениями, приложениями к нему, размещенный на сайте
Лицензиара и доступный в сети интернет по адресу: http://www.hishnik-school.ru
1. 5. Заключение Пользовательского (лицензионного) соглашения (акцепт
5. Заключение Пользовательского (лицензионного) соглашения (акцепт
публичной оферты) — полное и безоговорочное принятие условий настоящего
Соглашения Пользователем путем совершения Пользователем одного (или
нескольких) из следующих действий:
прохождение регистрации и (или) авторизации на Сайте Лицензиара в
установленном им порядке;
внесение платежа за предоставление права на использование Программного
продукта;
начало использования Пользователем Программного продукта в любой иной
форме.
1.6. Лицензиар — сторона в настоящем Соглашении, обладающая исключительным
правом на Программный продукт и предоставляющая по настоящему Соглашению
Пользователю право использования Программного продукта, в пределах и
способами, указанными в настоящем Соглашении.
1. 7. Пользователь — физическое лицо, которое устанавливает на компьютер или
7. Пользователь — физическое лицо, которое устанавливает на компьютер или
мобильное устройство Клиентское приложение и использует его.
1.8. Неисключительная лицензия — лицензионный договор, предусматривающий
предоставление права использования Программного продукта с сохранением за
Лицензиаром права заключения лицензионного договора с другими лицами.
1.9. Роль – набор функций, которые доступны в Программном продукте Пользователю.
Настоящим Соглашением предусмотрены следующие роли:
1.9.1. Администратор — сотрудник образовательного учреждения,
осуществляющий регистрацию и предоставление доступа к Программному
продукту Пользователям – участникам образовательного процесса в
образовательном учреждении.
1.9.2. Преподаватель – сотрудник образовательного учреждения, организующий
и осуществляющий образовательный процесс посредством использования
функций Программного продукта.
1.9.3. Репетитор – преподаватель, дающий частные уроки, может проводить как
индивидуальные, так и групповые занятия посредством использования
функций Системы вне рамок Образовательного учреждения.
1.9.4. Учащийся – обучающийся в Образовательном учреждении и (или) вне его,
получающий и проверяющий свои знания посредством Системы.
1.10. Профиль — запись в базе данных, содержащая идентифицирующие сведения о
Пользователе и его роли.
1.11. Демонстрационный режим – режим использования Программного продукта для
целей ознакомления с его функциональными возможностями.
1.12. Продуктивный режим – режим использования Программного продукта для целей
применения в образовательном процессе.
1.13. Регистрационный ключ — набор цифр и букв, посредством которого Пользователь
получает право использования Программного продукта в Продуктивном режиме с
полным доступом к Серверной части.
1.14. Логин – уникальный идентификатор Пользователя в базе данных.
1.15. Пароль – набор цифр и букв, посредством которого и совместно с Логином
Пользователь получает доступ в Клиентское приложение Программного продукта.
1.16. Интернет сайт Лицензиара — http://www.hishnik-school.ru.
1.17. Контент — все объекты, размещенные на Сайте и в Программном продукте, в том
числе элементы дизайна, текст, графические изображения, иллюстрации, видео,
скрипты, программы, музыка, звуки и другие объекты и их подборки.
2. ПРЕДМЕТ СОГЛАШЕНИЯ
2.1. Лицензиар предоставляет Пользователю право использования Программного
продукта «ХиШник» на условиях простой (неисключительной) лицензии в пределах
и способами, указанными в настоящем Соглашении, а Пользователь обязуется
уплатить Лицензиару вознаграждение за предоставление права использования
Программного продукта в соответствии с условиями настоящего Соглашения.
2.2. Лицензиар гарантирует, что он является правообладателем исключительных прав на
Программный продукт и имеет права на заключение Соглашения. Лицензиару в
настоящий момент в соответствии с тем знанием, которым он обладает, не известны
права третьих лиц, нарушаемые данным Соглашением.
2.3. Пользователь не вправе полностью или частично предоставлять (передавать) права
третьим лицам, полученные им по Соглашению, в том числе продавать,
тиражировать, копировать Программный продукт, предоставлять доступ третьим
лицам, отчуждать иным образом, в т.ч. безвозмездно, без получения на все
вышеперечисленные действия предварительного письменного согласия Лицензиара.
2.4. Соглашение предоставляет Пользователю право использования Программного
продукта с сохранением за Лицензиаром права выдачи лицензий другим лицам.
Пользователь может использовать экземпляр Программного продукта только в
пределах тех прав и теми способами, которые предусмотрены Соглашением.
Предоставляемое Пользователю Лицензиаром право на использование
Программного продукта действует в течение срока действия Соглашения.
2.5. Программный продукт «ХиШник», состоящий из Серверной части и Клиентского
приложения, представляет собой программу для ЭВМ, предназначенную для
осуществления образовательного процесса.
2.6. Право использования Программного продукта (неисключительная лицензия),
предоставляемое Пользователю в соответствии с настоящим Соглашением,
включает право на использование Программного продукта в двух режимах:
2.6.1. Демонстрационный режим, ограниченный правом установки на компьютер
или мобильное устройство, запуска, настройки Клиентского приложения и
ограниченного доступа к Серверной части, для целей ознакомления с
функциональными возможностями Программного продукта.
2.6.2. Продуктивный режим, ограниченный правом установки на компьютер или
мобильное устройство, запуска, настройки Клиентского приложения и
полного доступа к Серверной части, для целей применения Программного
продукта в образовательном процессе.
2.7. Право использования Программного продукта предоставляется:
2.7.1. В демонстрационном режиме — с момента установки Клиентского приложения
на компьютер или мобильное устройство.
2.7.2. В продуктивном режиме — с момента поступления денежных средств на счет
Лицензиара.
2.8. Права на использование Программного продукта считаются предоставленными
Пользователю:
2.8.1. В демонстрационном режиме — в момент установки Клиентского приложения
на компьютер или мобильное устройство.
2.8.2. В продуктивном режиме — в момент направления Пользователю на
электронную почту письма с регистрационным ключом.
2.9. Право использования Программного продукта предоставляется как на территории
Российской Федерации, так и на территории всех иных стран мира, если не
противоречит национальному законодательству этих стран.
2.10. Требования к компьютерам (оборудованию), необходимому для функционирования
Клиентского приложения размещены в сети Интернет на сайте Лицензиара.
3. СТОИМОСТЬ И ПОРЯДОК ОПЛАТЫ
3.1. Размер вознаграждения Лицензиара за предоставление Пользователю прав на
продуктивное использование Программного продукта размещен на Сайте
Лицензиара.
3.2. Вознаграждение Лицензиара за предоставление прав продуктивного использования
Программного продукта не облагаются НДС на основании подпункта 26 пункта 2
статьи 149 Налогового кодекса РФ.
3.3. Оплата предоставленных прав за продуктивное использование Программного
продукта по настоящему Соглашению производится Пользователем в форме
ежегодных платежей.
3.4. Способ оплаты по Соглашению: безналичное перечисление Пользователем
денежных средств в валюте Российской Федерации (рубль) на расчетный счет
Лицензиара способами, обозначенными на Сайте Лицензиара. При этом обязанность
Пользователя в части оплаты вознаграждения по Соглашению считается
исполненной со дня зачисления денежных средств банком на счет Лицензиара.
3.5. Лицензиар имеет право на одностороннее изменение условий и размера
вознаграждения по настоящему Соглашению. Актуальный размер вознаграждения
публикуется на Сайте Лицензиара.
4. СРОК ДЕЙСТВИЯ СОГЛАШЕНИЯ
4.1. Настоящее Соглашение вступает в силу с момента его заключения в соответствии с
п.2.7.
4.2. Срок предоставления права продуктивного использования Программного продукта в
соответствии с Соглашением составляет 1 (Один) год с момента авторизации
Пользователя посредством Регистрационного ключа. Соглашение считается
заключенным на тех же условиях на новый срок, равный 1 (Одному) году, при
условии осуществления Пользователем полной оплаты за продление права
продуктивного использования Программного продукта. Количество пролонгаций не
ограничивается.
4.3. Предоставление права демонстрационного использования Программного продукта
не ограничен по сроку.
4.4. Расторжение настоящего Соглашения возможно в соответствии с условиями,
указанным в действующем законодательстве РФ.
5. ПРАВА И ОБЯЗАННОСТИ СТОРОН
5.1. Пользователь обязуется:
5.1.1. Соблюдать права Лицензиара на Программный продукт и не использовать
Программный продукт иными способами кроме тех, что предусмотрены
настоящим Соглашением.
5.1.2. Не предпринимать попыток получения исходного кода Программного
продукта для дальнейшего его использования, а также не извлекать материалы
базы данных.
5.1.3. Своевременно уплачивать Лицензиару вознаграждение за предоставление
Пользователю права продуктивного использования Программного продукта в
порядке и сроки, установленные настоящим Соглашением.
5.1.4. Указывать достоверную информацию, в том числе свой адрес электронной
почты и иные данные, запрашиваемые Лицензиаром. При этом в случае
указания Пользователем недостоверной информации, все возможные риски,
которые могут возникнуть в связи с выполнением настоящего Соглашения,
Пользователь принимает на себя.
5.1.5. Строго придерживаться и не нарушать условий Соглашения, а также
обеспечить конфиденциальность коммерческой и технической информации
Лицензиара.
5.1.6. Не устанавливать Программный продукт на компьютерах (оборудованиях), не
соответствующих техническим требованиям для функционирования
Программного продукта.
5.1.7. Заботиться о том, чтобы права Лицензиара на Программный продукт не были
нарушены третьими лицами на территории действия настоящего Соглашения,
и обязан сообщить Лицензиару обо всех ставших ему известными
нарушениях.
5.2. Пользователь вправе:
5.2.1. Использовать Программный продукт только посредством установки (записи)
Клиентского приложения Программного продукта на компьютер или
мобильное устройство и его настройки для осуществления ознакомительного
или образовательного процесса с помощью базы данных.
5.2.2. Использовать Программный продукт для любых целей Пользователя, за
исключением ограничений, определенных Соглашением.
5.3. Лицензиар обязуется:
5.3.1. Обеспечить технические условия функционирования Серверной части и
Клиентского приложения для использования Программного продукта
Пользователем, в том числе обеспечить возможность получения и/или
предоставить дистрибутив (установочные файлы) Клиентского приложения, с
помощью которого осуществляется использование Программного продукта.
5.3.2. Защищать данные Пользователя, которые стали известны Лицензиару в связи
с исполнением Сторонами своих обязательств в соответствии с настоящим
Соглашением.
5.3.3. Уведомлять Пользователя о невозможности использования Программного
продукта в связи с выполнением сервисных работ не менее чем за 48 (Сорок
восемь) часов путем отправки сообщения на электронную почту, указанную
при регистрации.
5.3.4. Воздерживаться от каких-либо действий, способных затруднить
осуществление Пользователя предоставленного ему права использования
Программного продукта в установленных Соглашением пределах.
5.3.5. Предоставлять новые версии (обновления) Программного продукта путем их
размещения в сети Интернет на сайте Лицензиара либо в системе Google Play
с возможностью скачивания.
5.3.6. Информировать Пользователя о новых версиях (обновлениях) Программного
продукта, посредством направления уведомления на адрес электронной почты
Пользователя, указанный при регистрации и (или) авторизации на Сайте
Лицензиара.
5.3.7. Обеспечивать круглосуточный прием обращений в Службу поддержки по
адресу электронной почты: [email protected].
5.3.8. Осуществлять обработку поступивших обращений и консультации через
Службу поддержки, в период с 5:00 до 14:00 по московскому времени с
понедельника по пятницу, за исключением выходных и праздничных дней.
5.4. Лицензиар вправе:
5.4.1. Производить сервисные работы, которые могут повлечь перерывы в работе
Клиентского приложения.
5.4.2. В случае нарушения Пользователем условий (способов) использования прав
на Программный продукт в соответствии с настоящим Соглашением, лишить
Пользователя лицензии на использование прав на Программный продукт
путем закрытия доступа к Программному продукту.
5.4.3. Изменять в одностороннем порядке условия настоящего Соглашения в
установленном порядке.
5.4.4. Отказаться в одностороннем порядке от исполнения Соглашения в порядке,
предусмотренном применимым правом и/или настоящим Соглашением;
5.4.5. Осуществлять иные права, предусмотренные применимым правом, а также
настоящим Соглашением.
6. ПОРЯДОК ИСПОЛЬЗОВАНИЯ ПРОГРАММНОГО ПРОДУКТА
6.1. Пользователю для использования Программного продукта предлагается установить
(записать в память ЭВМ) и запустить Клиентское приложение Лицензиара,
экземпляр которого скачивается Пользователем самостоятельно одним из
следующих способов:
в сети Интернет на сайте Лицензиара;
в системе Google Play;
с флэш-накопителя, предоставленного Лицензиаром (опция).
6.2. После установки (записи в память ЭВМ) и запуска Клиентского приложения
Лицензиара Пользователю предоставляется право использования Программного
продукта в Демонстрационном режиме.
6.3. Для использования Программного продукта в Продуктивном режиме Пользователю
необходимо в Клиентском приложении ввести Регистрационный ключ, который
Лицензиар направляет Пользователю на адрес электронной почты, указанный на
Сайте Лицензиара в запросе на предоставление доступа. Пользователь
самостоятельно осуществляет использование Программного продукта путем запуска
и настройки Клиентского приложения.
6.4. Программный продукт предоставляется Пользователю по принципу «as is» («как
есть»), что подразумевает: Пользователю известны важнейшие функциональные
свойства продукта, в отношении которого предоставляются права на использование,
Пользователь несет риск соответствия Программного продукта его желаниям и
потребностям, а также риск соответствия условий и объема предоставляемых прав
своим желаниям и потребностям. Лицензиар не несет ответственность за какие-либо
убытки или ущерб, независимо от причин их возникновения (включая особый,
случайный или косвенный ущерб; убытки, связанные с недополученной прибылью,
прерыванием коммерческой или производственной деятельности, утратой деловой
информации, небрежностью, или какие-либо иные убытки), возникшие вследствие
использования или невозможности использования Программного продукта.
6.5. Программный продукт предназначен для личных, образовательных и иных не
связанных с осуществлением предпринимательской деятельности нужд физических
лиц. Использование Программного продукта в коммерческих целях не допускается.
7. ОТВЕТСТВЕННОСТЬ СТОРОН
7.1. За невыполнение или ненадлежащее выполнение обязательств по настоящему
Соглашению Стороны несут ответственность в соответствии с действующим
законодательством, если иное не установлено Соглашением.
7.2. Стороны освобождаются от ответственности за неисполнение (ненадлежащее
исполнение) Соглашения, если такое неисполнение (ненадлежащее исполнение)
явилось следствием действий обстоятельств непреодолимой силы, наступление
которых Стороны не могли предвидеть и предотвратить. Сторона, для которой
надлежащее исполнение обязательства стало невозможным ввиду действия
обстоятельств непреодолимой силы, обязана незамедлительно уведомить об этом
другую Сторону. Стороны вправе ссылаться на действия обстоятельств
непреодолимой силы лишь при условии, что они сделали все возможное в целях
предотвращения и/или минимизации негативных последствий действия указанных
обстоятельств.
7.3. Лицензиар не гарантирует абсолютную бесперебойность использования
Программного продукта и не дает гарантию того, что произведенные третьими
лицами программы для ЭВМ или любые другие средства, используемые при работе
Программного продукта, абсолютно защищены от компьютерных вирусов и других
вредоносных компонентов. Лицензиар обязуется осуществить все разумные меры
для защиты информации Пользователя и обеспечения бесперебойного
использования Программного продукта.
7.4. Пользователь самостоятельно отвечает за содержание информации, передаваемой им
или иным лицом по сети Интернет и хранимой в памяти сервера Лицензиара, в том
числе за ее достоверность и правомерность ее хранения и распространения.
7.5. В случае привлечения Лицензиара к ответственности или наложения на него
взыскания в связи с допущенными Пользователем нарушениями прав третьих лиц, а
равно установленных законодательством запретов или ограничений, Пользователь
обязан в полном объеме возместить убытки Лицензиара.
7.6. В случае нарушения Пользователем условий и ограничений настоящего
Соглашения, он является нарушителем исключительного права на Программный
продукт. За нарушение авторских прав на Программный продукт Пользователь несет
ответственность в соответствии с законодательством Российской Федерации.
7.7. Совокупная кумулятивная ответственность Лицензиара перед Пользователем в
отношении требований любого рода, возникающих из настоящего Соглашения, не
будет превышать сумму вознаграждения по данному Соглашению, фактически
выплаченного Пользователем за Программный продукт, в отношении которого
возникло требование, в течение 12 (двенадцати) месяцев, предшествующих
возникновению требования. Вышеуказанные ограничения ответственности
применяются даже в том случае, если с помощью вышеуказанного способа защиты
права не удается добиться его основной цели.
8. ПЕРСОНАЛЬНЫЕ ДАННЫЕ
8.1. Информация, предоставленная Пользователем является конфиденциальной.
8.2. Предоставляя свои персональные данные Лицензиару, Пользователь соглашается на
их обработку, как с использованием средств автоматизации, так и без использования
средств автоматизации, в частности сбор, хранение, передачу третьим лицам и
использование информации Лицензиаром в целях исполнения обязательств перед
Пользователем в соответствии с настоящим Соглашением; получения
Пользователем персонализированной рекламы; проверки, исследования и анализа
данных, позволяющих поддерживать и улучшать Программный продукт.
8.3. Лицензиар обязуется не разглашать полученную от Пользователя информацию. Не
считается нарушением предоставление Лицензиаром информации, в том числе
персональные данные Пользователя третьим лицам, действующим на основании
договора с Лицензиаром, в целях исполнения настоящего Соглашения.
8.4. Не считается нарушением обязательств по неразглашению информации
предоставленной Пользователем, в том числе персональные данные Пользователя, в
целях обеспечения соблюдения требований действующего законодательства
Российской Федерации (в том числе в целях предупреждения и/или пресечения
незаконных и/или противоправных действий Пользователей).
8.5. Пользователь не имеет права передавать свои Логин и Пароль третьим лицам.
8.6. Пользователь обязуется обеспечивать конфиденциальность своего Логина и Пароля
и несет ответственность за использование Логина и Пароля третьими лицами. Ни
при каких обстоятельствах Лицензиар не несет ответственность за использование
третьими лицами Логина и пароля Пользователя.
8.7. В случае несанкционированного доступа к логину и паролю и/или персональной
странице Пользователя, или распространения логина и пароля Пользователь обязан
незамедлительно сообщить об этом Лицензиару посредством заполнения формы
обратной связи, представленной на Сайте.
8.8. Лицензиар не несет ответственности за использование кем бы то ни было
общедоступных персональных данных Пользователей.
9. ИСКЛЮЧИТЕЛЬНЫЕ ПРАВА НА КОНТЕНТ
9.1. Все объекты, размещенные на Сайте и в Программном продукте, в том числе
элементы дизайна, текст, графические изображения, иллюстрации, видео, скрипты,
программы, музыка, звуки и другие объекты и их подборки (далее — Контент),
являются объектами исключительных прав Лицензиара, все права на эти объекты
защищены.
9.2. Кроме случаев, установленных настоящим Соглашением, а также действующим
законодательством Российской Федерации, Контент не может быть скопирован
(воспроизведен), переработан, распространен, отображен во фрейме, опубликован,
скачан, передан, продан или иным способом использован целиком или по частям без
предварительного разрешения правообладателя, кроме случаев, когда
правообладатель явным образом выразил свое согласие на свободное использование
Контента любым лицом.
9.3. Использование Пользователем Контента, доступ к которому получен исключительно
для личного некоммерческого использования, допускается при условии сохранения
всех знаков авторства или других уведомлений об авторстве, сохранения имени
автора в неизменном виде, сохранении произведения в неизменном виде.
9.4. Любое использование Контента, кроме разрешенного в настоящем Соглашении или
в случае явно выраженного согласия правообладателя на такое использование, без
предварительного письменного разрешения правообладателя, категорически
запрещено.
10. ПРОЧИЕ УСЛОВИЯ
10.1. Все споры и разногласия, возникающие в связи с исполнением и (или) толкованием
настоящего Соглашения, разрешаются Сторонами путем переговоров. При
невозможности урегулирования Сторонами возникших разногласий путем
переговоров, спор подлежит разрешению в арбитражном суде по месту нахождения
ответчика с обязательным соблюдением претензионного порядка урегулирования
споров и разногласий. Срок ответа на претензию 30 (тридцать) календарных дней с
момента ее поступления в письменной форме или в электронном виде.
10.2. Ни одно из положений настоящего Соглашения не является и не может
рассматриваться как передача (отчуждение) исключительных прав на
интеллектуальную собственность Лицензиара.
10.3. В случае поступления от Пользователя замечаний к Программному продукту,
предоставляемому в рамках настоящего Соглашения, такие замечания подлежат
рассмотрению Лицензиаром по его желанию и необязательны для учета.
10.4. Условия настоящего Соглашения распространяются на последующие версии
Программного продукта, которые являются его обновлениями. Заключения иных
соглашений в отношении обновлений Программного продукта не требуется.
10.5. Во всем ином, что не предусмотрено настоящим Соглашением, Стороны
руководствуются действующим законодательством РФ.
11. АДРЕС, РЕКВИЗИТЫ ЛИЦЕНЗИАРА
ООО «АЛЕКТА»
Юридический адрес: 630090, г. Новосибирск, Проспект академика Лаврентьева 2/2.
Почтовый адрес: 630090, г. Новосибирск, Проспект академика Лаврентьева 2/2.
ОГРН 1025403657135
ИНН 5408128408
КПП 540801001
ОКВЭД 72.19, 62.01, 62.02, 68.20.2;
ОКПО 26335100;
ОКАТО 50401384000;
ОКФС 16;
ОКОПФ 65.
E-mail: [email protected]
Кислоты
Серная кислота (h3SO4) сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях — тяжёлая маслянистая жидкость без цвета и запаха. Подробнее »
Азотная кислота (HNO3) — сильная одноосновная кислота.
Применение:
— в производстве минеральных удобрений;
— в производстве красителей и лекарств Подробнее »
Лимонная кислота (2-гидрокси-1,2,3-пропантрикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая) (C6H8O7) — слабая трёхосновная кислота. Подробнее »
Муравьиная кислота (систематическое наименование: метановая кислота) — первый представитель в ряду насыщенных одноосновных карбоновых кислот. Подробнее »
Олеиновая кислота (цис-9-октадеценовая кислота) СН3(СН2)7СН=СН(СН2)7СООН — мононенасыщенная жирная кислота. Является наиболее распространенной в природе ненасыщенной жирной кислотой. Подробнее »
Кислота ортофосфорная представляет собой желтоватую жидкость, имеет химическую формулу: h4PO4. Подробнее »
Соляная (хлороводоро́дная, хлористоводоро́дная) — HCl, раствор хлороводорода в воде; сильная одноосновная кислота. Бесцветная (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.), «дымящая» на воздухе, едкая жидкость. Подробнее »
Сульфаминовая кислота (моноамид серной кислоты, амидосерная кислота, серной кислоты моноамид) — кислота, формула которой Nh3SO2OH (также Nh3SO3H). Подробнее »
Уксусная кислота (этановая кислота) — органическое вещество с формулой Ch4COOH. Подробнее »
Фтористоводородная кислота (Плавиковая кислота) — HF, бесцветная жидкость. Подробнее »
Щавелевая кислота (этандиовая кислота) НООССООН — двухосновная предельная карбоновая кислота. Щавелевая кислота техническая представляет собой бесцветные кристаллы. Подробнее »
Борная кислота (ортоборная кислота) — слабая кислота, имеющая химическую формулу h4BO3, представляет собой мелкий кристаллический сыпучий порошок белого цвета. Подробнее »
Классификация и характерные химические свойства кислот.
Классификация кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные | двухосновные | трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH | H2SO4, H2SO3, H2CO3, H2SiO3 | H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
H2S, HCl, CH3COOH, HCOOH | H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
хорошо диссоциирующие (сильные) | малодиссоциирующие (слабые) |
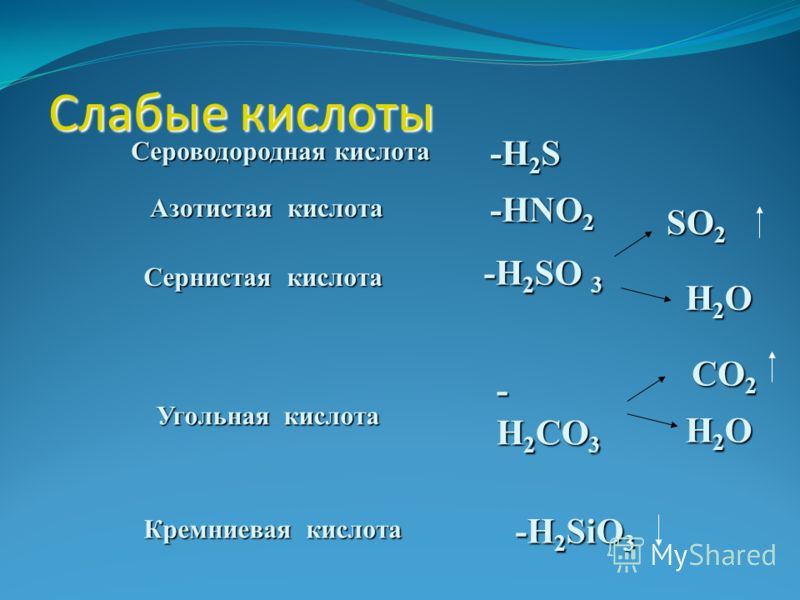
H2SO4, HCl, HBr, HI, HNO3, HClO4 | H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) | сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
практически все кислоты кроме HNO3 и H2SO4 (конц.) | HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка (), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H+ + Cl—
либо в таком: HCl → H+ + Cl—
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки . Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
H3PO4 H+ + H2PO4—
H2PO4— H+ + HPO42-
HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
H2SO4 + ZnO ZnSO4 + H2O
6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
2H2S + SO2 3S↓+ 2H2O
Азотная кислота
Азотная кислота – сильная кислота. Представляет собой бесцветную жидкость с резким запахом. В небольших количествах образуется при грозовых разрядах и присутствует в дождевой воде.
Под действием света она частично разлагается:
4HNO3 = 4NO2 + 2H2O + O2
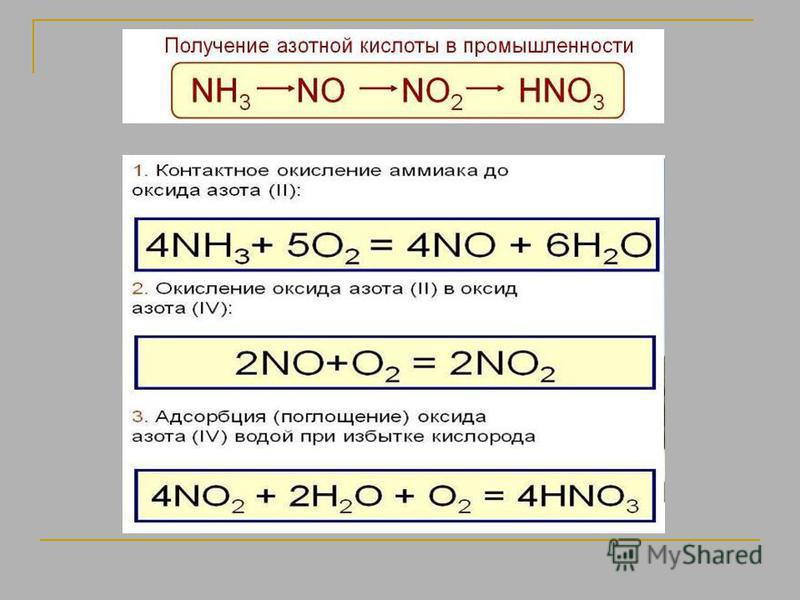
Азотную кислоту в промышленности получают в три стадии. На первой стадии происходит контактное окисление аммиака до оксида азота (П):
4NH3 + 5O2 = 4NO + 6H2O
На второй стадии происходит окисление оксида азота (П) до оксида азота (IV) кислородом воздуха:
2NO + O2 = 2NO2
На третьей стадии оксид азота (IV) поглощается водой в присутствии O2:
4NO2 + 2H2O + O2 = 4HNO3
В результате получается 60-62% -ная азотная кислота. В лаборатории её получают действием концентрированной азотной кислоты на нитраты при слабом нагревании:
NaNO3 + h3SO4 = NaHSO4 + HNO3
Молекула азотной кислоты имеет плоское строение. В ней имеется четыре связи с атомом азота:
Однако два атома кислорода равноценны, так как между ними четвёртая связь атома азота делится поровну, а перешедший от него электрон принадлежит им в равной степени. Таким образом, формулу азотной кислоты можно представить в виде:
Азотная кислота является одноосновной кислотой, образует только средние соли – нитраты. Азотная кислота проявляет все свойства кислот: реагирует с оксидами металлов, гидроксидами, солями:
2HNO3 + CuO = Cu(NO3)2 + H2O
2HNO3 + Ba(OH)2 = Ba(NO3)2 + 2H2O
2HNO3 + CaCO3 = Ca(NO3)2 + CO2 + H2O
Концентрированная азотная кислота реагирует со всеми металлами (кроме золота, платины, палладия) с образованием нитратов, оксида азота (+4). воды:
Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O
Формально концентрированная азотная кислота не реагирует с железом, алюминием, свинцом, оловом, но на их поверхности она образует оксидную плёнку, предохраняющую растворение общей массы металла:
2Al + 6HNO3 = Al2O3 + 6NO2 + 3H2O
В зависимости от степени разбавленности, азотная кислота образует следующие продукты реакции:
3Mg + 8HNO3 (30%) = 3Zn(NO3)2 + 2NO + 4H2O
4Mg + 10HNO3 (20%) = 4Zn(NO3)2 + N2O + 5H2O
Сильно разбавленная азотная кислота с активными металлами образует соединения азота (-3), по сути: аммиак, но вследствие избытка азотной кислоты он образует нитрат аммония:
4Ca + 10HNO3 = 4Ca(NO3)2 + Nh5NO3 + 3H2O
Активные металлы с сильно разбавленной кислотой на холоде могут образовывать азот:
5Zn + 12HNO3 = 5Zn(NO3)2 + N2 + 6H2O
Металлы: золото, платина, палладий реагируют с концентрированной азотной кислотой в присутствии концентрированной соляной кислоты:
Au + 3HCl + HNO3 = AuCl3 + NO + 2H2O
Азотная кислота, как сильный окислитель, окисляет простые вещества – неметаллы:
6HNO3 + S = H2SO4 + 6NO2 + 2H2O
2HNO3 + S = H2SO4 + 2NO
5HNO3 + P = H3PO4 + 5NO2 + H2O
Кремний окисляется азотной кислотой до оксида:
4HNO3 + 3Si = 3SiO2 + 4NO + 2H2O
В присутствии фтористоводородной кислоты азотная кислота растворяет кремний:
4HNO3 + 12HF + 3Si = 3SiF4 + 4NO + 8H2O
Азотная кислота способна окислять сильные кислоты:
HNO3 + 3HCl = Cl2 + NOCl + 2H2O
Азотная кислота способна окислять как слабые кислоты, так и сложные вещества:
6HNO3 + HJ = HJO3 + NO2 + 3H2O
FeS + 10HNO3 = Fe(NO3)2 + SO2 + 7NO2 + 5H2O
Соли азотной кислоты – нитраты хорошо растворимы в воде. Соли щелочных металлов и аммония называются селитрами. Нитраты обладают менее сильной окислительной активностью, однако в присутствии кислот могут растворять даже неактивные металлы:
3Cu + 2KNO3 + 4H2SO4 = 3CuSO4 + K2SO4 + 2NO + 4H2O
Нитраты в кислой среде окисляют соли металлов с меньшей валентностью до их солей с высшей валентностью:
3FeCl2 + KNO3 + 4HCl = 3FeCl3 + KCl + NO + 2H2O
Характерной особенностью нитратов является образование кислорода при их разложении. При этом продукты реакции могут быть различны и зависеть от положения металла в ряду активности. Нитраты первой группы (от лития до алюминия) разлагаются с образованием нитритов и кислорода:
2KNO3 = 2KNO2 + O2
Нитраты второй группы (от алюминия до меди) разлагаются с образованием оксида металла, кислорода и оксида азота (IV):
2Zn(NO3)2 = 2ZnO + 4NO2 + O2
Нитраты третьей группы (после меди) разлагаются на металл, кислород и оксид азота (IV):
Hg(NO3)2 = Hg + 2NO2 + O2
Нитрат аммония при разложении не образует кислород:
NH4NO3 = N2O+ 2H2O
Сама же азотная кислота разлагается по механизму нитратов второй группы:
4HNO3 = 4NO2 + 2H2O + O2
Если у Вас есть вопросы, приглашаю Вас на свои уроки химии. Записывайтесь в расписании на сайте.
Спасибо за внимание!
Ваш Владимир Смирнов.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Березниковский «Азот» выпустил рекордное количество азотной кислоты
Березниковский «Азот» выпустил рекордное количество азотной кислоты
Вконтакте
Google+
Березниковский «Азот» (входит в «Уралхим») в 2018 году выпустил 1,224 млн. тонн неконцентрированной азотной кислоты — рекордный объем за всю его историю.
Рекорд удалось поставить благодаря реализации инвестиционных проектов и слаженной работы коллектива.
За последние три года на производстве неконцентрированной азотной кислоты заменили важнейшие составляющие технологической цепочки – десять холодильников-конденсаторов. Вместо нержавеющих установлены титановые аппараты, которые в меньшей степени подвержены коррозии. В результате увеличился межремонтный пробег каждого агрегата.
Кроме того, на некоторых агрегатах были установлены частотные преобразователи для разгонных двигателей газотурбинных установок, что существенно сократило время запуска агрегатов, потребление электроэнергии оборудованием и уменьшило нагрузку на двигатели во время пусковых работ.
«Слабая азотная кислота — полуфабрикат для цехов, которые выпускают аммиачную селитру, нитрит нитратные соли, крепкую азотную кислоту. Так как сейчас высок спрос на аммиачную селитру, соответственно, вырос он и на азотную кислоту. Большая работа, проведенная в ходе реализации проектов капитальных вложений, помогла достичь рекордных показателей», — отметил начальник цеха №5 Евгений Стрельников.
Добавьте Fertilizer Daily в свои избранные источники
Понравилась статья?
Раз в неделю наши подписчики получают сводку актуальных новостей отрасли. Присоединяйтесь и вы!
ПРИМЕР РАССЫЛКИ
ПОДПИСАТЬСЯ НА РАССЫЛКУ
{«cookieName»:»wBounce»,»isAggressive»:false,»isSitewide»:true,»hesitation»:»300″,»openAnimation»:false,»exitAnimation»:false,»timer»:»»,»sensitivity»:»»,»cookieExpire»:»2920000″,»cookieDomain»:»»,»autoFire»:»»,»isAnalyticsEnabled»:false}
Список общих сильных и слабых кислот
Сильные и слабые кислоты важно знать как на уроках химии, так и для использования в лаборатории. Сильных кислот очень мало, поэтому один из самых простых способов отличить сильные кислоты от слабых — это запомнить краткий список сильных. Любая другая кислота считается слабой кислотой.
Ключевые выводы
- Сильные кислоты полностью диссоциируют на ионы в воде, тогда как слабые кислоты диссоциируют лишь частично.
- Существует всего несколько (7) сильных кислот, поэтому многие люди предпочитают запоминать их.Все остальные кислоты слабые.
- Сильные кислоты: соляная кислота, азотная кислота, серная кислота, бромистоводородная кислота, йодистоводородная кислота, хлорная кислота и хлорноватая кислота.
- Единственная слабая кислота, образующаяся в результате реакции между водородом и галогеном, — это фтористоводородная кислота (HF). Хотя технически фтористоводородная кислота является слабой кислотой, она чрезвычайно сильна и вызывает сильную коррозию.
Сильные кислоты
Сильные кислоты полностью диссоциируют на свои ионы в воде, давая один или несколько протонов (катионов водорода) на молекулу.Есть только 7 распространенных сильных кислот.
- HCl — соляная кислота
- HNO 3 — азотная кислота
- H 2 SO 4 — серная кислота ( HSO 4 — — слабая кислота)
- HBr — бромистоводородная кислота
- HI — иодистоводородная кислота
- HClO 4 — хлорная кислота
- HClO 3 — хлорная кислота
Примеры реакций ионизации включают:
HCl → H + + Cl —
HNO 3 → H + + NO 3 —
H 2 SO 4 → 2H + + SO 4 2-
Обратите внимание на образование положительно заряженных ионов водорода, а также на стрелку реакции, которая указывает только вправо.Весь реагент (кислота) ионизируется в продукт.
Слабые кислоты
Слабые кислоты не полностью диссоциируют на ионы в воде. Например, HF диссоциирует на ионы H + и F — в воде, но некоторое количество HF остается в растворе, поэтому это не сильная кислота. Слабых кислот намного больше, чем сильных. Большинство органических кислот являются слабыми кислотами. Вот неполный список, отсортированный от самого сильного до самого слабого.
- HO 2 C 2 O 2 H — щавелевая кислота
- H 2 SO 3 — сернистая кислота
- HSO 4 — — гидросульфат-ион
- H 3 PO 4 — фосфорная кислота
- HNO 2 — азотистая кислота
- HF — плавиковая кислота
- HCO 2 H — метановая кислота
- C 6 H 5 COOH — бензойная кислота
- CH 3 COOH — уксусная кислота
- HCOOH — муравьиная кислота
Слабые кислоты ионизируются неполностью.Примером реакции является диссоциация этановой кислоты в воде с образованием катионов гидроксония и анионов этаноата:
CH 3 COOH + H 2 O ⇆ H 3 O + + CH 3 COO —
Обратите внимание, что стрелка реакции в химическом уравнении указывает в обоих направлениях. Только около 1% этановой кислоты превращается в ионы, а остальное — этановая кислота. Реакция идет в обоих направлениях. Обратная реакция более благоприятна, чем прямая, поэтому ионы легко превращаются обратно в слабую кислоту и воду.
Различие сильных и слабых кислот
Вы можете использовать константу кислотного равновесия K a или pK a , чтобы определить, является ли кислота сильной или слабой. Сильные кислоты имеют высокие значения K и или маленькие значения pK и , слабые кислоты имеют очень маленькие значения K и или большие значения pK и .
Сильный и Слабый против. Концентрированный и разбавленный
Будьте осторожны, не путайте термины «сильный» и «слабый» с терминами «концентрированный» и «разбавленный».Концентрированная кислота — это кислота, которая содержит небольшое количество воды. Другими словами, кислота концентрированная. Разбавленная кислота — это кислотный раствор, содержащий много растворителя. Если у вас есть 12 M уксусная кислота, она концентрированная, но все же слабая кислота. Независимо от того, сколько воды вы удалите, это будет правдой. С другой стороны, 0,0005 M раствор HCl разбавленный, но все же сильный.
Strong Vs. Коррозийный
Вы можете пить разбавленную уксусную кислоту (кислота, содержащаяся в уксусе), но употребление серной кислоты той же концентрации может вызвать химический ожог.Причина в том, что серная кислота очень агрессивна, а уксусная кислота не так активна. Хотя кислоты имеют тенденцию к коррозии, самые сильные суперкислоты (карбораны) на самом деле не вызывают коррозии, и их можно держать в руке. Плавиковая кислота, хотя и является слабой кислотой, проходит через вашу руку и атакует ваши кости.
Источники
- Housecroft, C.E .; Шарп, А. Г. (2004). Неорганическая химия (2-е изд.). Прентис Холл. ISBN 978-0-13-039913-7.
- Портерфилд, Уильям У.(1984). Неорганическая химия. Эддисон-Уэсли. ISBN 0-201-05660-7.
- Трумаль, Александр; Губы, Лаури; и другие. (2016). «Кислотность сильных кислот в воде и диметилсульфоксиде». J. Phys. Chem. А . 120 (20): 3663–3669. DOI: 10.1021 / acs.jpca.6b02253
Слабые кислоты
Слабые кислоты
Почему кислоты слабые или сильные?
Каждая кислота реагирует с водой. Когда он теряет протон, он передает этот протон воде. Вода действует как основание, когда сольватирует протон.Конъюгированная кислота представляет собой протонированную воду и представлена как (H 3 O) + , (H 5 O 2 ) + , (H 2n O n ) + , или просто как H + (водн.). Основание конъюгата представляет собой кислоту без протона.
Сильная кислота полностью диссоциирует в воде, тогда как слабая кислота находится в равновесии со своим сопряженным основанием в воде. Давайте посмотрим на реакцию сильной кислоты, азотной кислоты или HNO 3 , и более слабой кислоты, азотистой кислоты или HNO 2 , в воде.
Азотная кислота является более сильной кислотой, чем азотистая кислота, потому что ее сопряженное основание более стабильно. Ион NO 3 — имеет избыточный отрицательный заряд, распределенный по 3 атомам кислорода, в то время как избыточный отрицательный заряд в NO 2 — распределен по 2 атомам кислорода.
Сопряженное основание более стабильно, когда отрицательный заряд находится на электроотрицательном элементе и когда заряд делокализован по нескольким атомам. Чем стабильнее конъюгат основания, тем сильнее кислота. Стабильное сопряженное основание не является основным. Очень сильная кислота имеет очень слабое сопряженное основание, а очень слабая кислота имеет очень сильное сопряженное основание.
Слабокислотное равновесие
Азотистая кислота находится в равновесии с протоном и сопряженным с ним основанием, NO 2 — . Поскольку концентрация воды постоянна, мы можем определить константу, равную произведению концентрации воды на константу равновесия. Эта константа K a составляет 10 -3.29 для HNO 2 .
Мы можем использовать K a для определения pH раствора азотистой кислоты. Например, давайте определим pH раствора, приготовленного из 0,01 моля HNO 2 в 1,0 л воды.
Часть кислоты распадется на H + и NO 2 — , но мы не знаем w = сколько. Мы назовем молярную концентрацию сольватированных протонов x, поэтому [H + ] = x. Это означает, что концентрация NO 2 — также должна быть x, потому что они образуются в равных количествах в результате диссоциации кислоты.Концентрация
Всегда можно решить относительно x, используя квадратное уравнение, но в большинстве случаев мы можем решить его, используя приближение. Если мы предположим, что степень диссоциации мала, то равновесная концентрация кислоты не сильно изменится по сравнению с исходной концентрацией. Затем мы можем использовать исходную концентрацию кислоты в выражении K a .
В данном случае приближение является хорошим, потому что мы получаем такое же значение pH, используя его, как и из квадратного уравнения.
Взаимодействие слабых кислот и сильных оснований
Сильные основания полностью реагируют со слабыми основаниями с образованием сопряженного основания слабой кислоты. Тогда будет равновесие между слабой кислотой и сопряженным с ней основанием в воде.
Например, давайте посмотрим на раствор, полученный при смешивании 0,010 моль HNO 2 и 0,004 моль NaOH в 1,0 л воды. Опять же, мы можем использовать приближение, чтобы решить эту проблему. Приближение справедливо, потому что степень диссоциации будет небольшой, когда уже присутствует некоторый продукт.
Слабые и сильные кислоты
Константы кислотной диссоциации ряда кислот приведены в таблицах. В таблице перечислены значения pKa. pK a = -log (K a )
Очень сильные кислоты, которые полностью диссоциируют в воде, различают путем изучения их кислотного равновесия диссоциации в неводных растворителях и pK a для воды. оценивается. Константы равновесия для более слабых кислот (pK a > 0) определяют из измерений pH растворов.
Назад
Компас
Индекс
Столы
Вступление
Следующий
Список общих сильных и слабых кислот
Существует 7 общих сильных кислот и много общих слабых кислот.
Сильные и слабые кислоты — ключевые понятия в химии. Сильные кислоты полностью диссоциируют на свои ионы в воде, тогда как слабые кислоты диссоциируют не полностью. Есть только несколько сильных кислот, но много слабых кислот.
Сильные кислоты
Сильные кислоты полностью диссоциируют в воде на свои ионы и производят один или несколько протонов или катионов водорода на одну молекулу.Минеральные или неорганические кислоты обычно являются сильными кислотами. Есть только 7 распространенных сильных кислот. Вот их названия и формулы:
- HCl — соляная кислота
- HNO 3 — азотная кислота
- H 2 SO 4 — серная кислота (примечание: HSO 4 — слабый кислота)
- HBr — бромистоводородная кислота
- HI — иодистоводородная кислота
- HClO 4 — хлорная кислота
- HClO 3 — хлорная кислота
Диссоциация сильной кислоты
Сильная кислота в воде полностью ионизируется если реакция диссоциации записана как химическая реакция, стрелка реакции указывает вправо:
- HCl → H + (водн.) + Cl — (водн.)
- HNO 3 → H + (водн. ) + NO 3 (водн.) —
- H 2 SO 4 → 2H + (водн.) + SO 4 2- (водн.)
Слабые кислоты
В то время как сильных кислот мало, есть много слабых кислот.Слабые кислоты не полностью диссоциируют в воде, приводя к равновесному состоянию, которое содержит слабую кислоту и ее ионы. Например, фтористоводородная кислота (HF) считается слабой кислотой, потому что некоторое количество HF остается в водном растворе в дополнение к ионам H + и F —. Вот неполный список распространенных слабых кислот, отсортированный от самой сильной к самой слабой:
- HO 2 C 2 O 2 H — щавелевая кислота
- H 2 SO 3 — сернистая кислота
- HSO 4 — — гидросульфат-ион
- H 3 PO 4 — фосфорная кислота
- HNO 2 — азотистая кислота
- HF — плавиковая кислота
- HCO 2 H — метановая кислота
- C 6 H 5 COOH — бензойная кислота
- CH 3 COOH — уксусная кислота
- HCOOH — муравьиная кислота
Слабая диссоциация кислоты
Слабые кислоты не полностью диссоциируют, образуя слабокислотное состояние, содержащее и его ионы.Итак, стрелка реакции указывает в обе стороны. Примером является диссоциация этановой кислоты, которая образует катион гидроксония и этаноат-анион:
CH 3 COOH + H 2 O ⇆ H 3 O + + CH 3 COO —
Сила кислоты (сильная и слабая кислоты)
Сила кислоты — это мера того, насколько быстро кислота теряет протон или катион водорода. Один моль сильной кислоты HA диссоциирует в воде с образованием одного моля H + и одного моля основания сопряженного кислоты A —.Напротив, один моль слабой кислоты дает менее одного моля каждого из катиона водорода и сопряженного основания, в то время как часть исходной кислоты остается. Двумя факторами, определяющими, насколько легко происходит депротонирование, являются размер атома и полярность связи H-A.
В общем, вы можете идентифицировать сильные и слабые кислоты на основе константы равновесия K a или pK a :
- Сильные кислоты имеют высокие значения K a .
- Сильные кислоты имеют низкие значения pK a .
- Слабые кислоты имеют малые значения K a .
- Слабые кислоты имеют большие значения pK a .
Концентрированный и разбавленный
Термины «сильный» и «слабый» — не то же самое, что и «концентрированный» и «разбавленный». Концентрированная кислота содержит очень мало воды. Разбавленная кислота содержит большой процент воды. Разбавленный раствор серной кислоты остается сильным кислотным раствором и может вызвать химический ожог. С другой стороны, 12 М уксусная кислота — это концентрированная слабая кислота (и все же опасная).Если вы разбавите уксусную кислоту достаточно, вы получите концентрацию уксуса, которую безопасно пить.
Сильное по сравнению с коррозионным
Большинство кислот очень агрессивны. Они могут окислять другие вещества и вызывать химические ожоги. Однако сила кислоты не является показателем ее коррозионной активности! Карборановые суперкислоты не вызывают коррозии и с ними можно безопасно обращаться. Между тем фтористоводородная кислота (слабая кислота) настолько агрессивна, что проникает через кожу и поражает кости.
Типы кислот
Три основных классификации кислот: кислоты Бренстеда – Лоури, кислоты Аррениуса и кислоты Льюиса:
- Кислоты Бренстеда – Лоури : кислоты Бренстеда – Лоури отдают протоны.В водном растворе донор протона образует катион гидроксония (H 3 O + ). Однако кислотно-основная теория Бренстеда – Лоури также допускает наличие кислот в растворителях, помимо воды.
- Аррениусовы кислоты : Аррениусовы кислоты являются донорами водорода. Кислоты Аррениуса диссоциируют в воде и отдают катион водорода (H + ) с образованием катиона гидроксония (H 3 O + ). Эти кислоты также характеризуются окрашиванием в красный лакмусовый цвет, кисловатым вкусом и реакцией с металлами и основаниями с образованием солей.
- Кислоты Льюиса : Кислоты Льюиса являются акцепторами электронных пар. Согласно этому определению кислоты, разновидность либо немедленно принимает электронные пары, либо отдает катион водорода или протон, а затем принимает электронную пару. Технически кислота Льюиса должна образовывать ковалентную связь с электронной парой. По этому определению кислоты Льюиса часто не являются кислотами Аррениуса или кислотами Бренстеда – Лоури. Например, HCl не является кислотой Льюиса.
Все три определения кислот имеют свое место в предсказании химических реакций и объяснении поведения.Обычными кислотами являются кислоты Бренстеда – Лоури или Аррениуса. Кислоты Льюиса (например, BF 3 ) конкретно обозначаются как «кислоты Льюиса».
Ссылки
- Ebbing, D.D .; Гаммон, С. Д. (2005). Общая химия (8-е изд.). Бостон, Массачусетс: Хоутон Миффлин. ISBN 0-618-51177-6.
- Lehninger, Albert L .; Нельсон, Дэвид Л .; Кокс, Майкл М. (январь 2005 г.). Принципы биохимии Ленингера . Макмиллан. ISBN 9780716743392.
- Петруччи Р.H., Harwood, R.S .; Селедка, Ф. (2002). Общая химия (8-е изд.) Прентис-Холл. ISBN 0-13-014329-4.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Семь сильных кислот
Если вы изучаете химию, вам, несомненно, нужно знать 7 сильных кислот. Прочтите это руководство, чтобы узнать, что такое 7 сильных кислот, почему они так важны и почему они не обязательно самые опасные кислоты, с которыми вы будете работать в лаборатории.
Что такое сильная кислота?
Когда кислота обозначается как сильная кислота, на самом деле это не имеет никакого отношения к тому, насколько она сильна или вызывает коррозию. «Сила» кислоты просто означает ее способность выделять ионы водорода в раствор. Сильные кислоты — это кислоты, которые полностью диссоциируют на ионы в воде. Это означает, что в растворе все их молекулы распадаются. Сильные кислоты дают по крайней мере один катион водорода (H + ) на молекулу. С другой стороны, слабые кислоты диссоциируют менее чем на 1%, что означает, что очень немногие их молекулы распадаются с высвобождением иона водорода.
Почему это важно? Это связано с химическими реакциями.Вот реакция ионизации сильной кислоты, соляной кислоты:
HCl → H + + Cl —
Обратите внимание на наличие в продукте иона водорода. Весь реагент (HCl) был ионизирован во время реакции. Также обратите внимание, что реакция идет только в одном направлении. После ионизации сильной кислоты реакция останавливается и необратима.
Вот реакция этановой кислоты, слабой кислоты:
CH 3 COOH + H 2 O ⇆ H 3 O + + CH 3 COO —
Обратите внимание, что стрелка реакции указывает в обоих направлениях.Это означает, что реакция протекает в обоих направлениях, чего нельзя сказать о сильных кислотах. Слабые кислоты лишь слегка диссоциируют, и их ионы водорода будут продолжать перемещаться между частью слабой кислоты и частью воды. Эта реакция обратима и многократно обратится, реформируя кислоту.
В следующем разделе мы перечислим все 7 сильных кислот, и мы рекомендуем вам запомнить их. Однако, если вы забыли, сильная или слабая кислота, вы также можете посмотреть на ее константу равновесия / константу диссоциации кислоты (K a ). Сильные кислоты будут иметь большие значения для K a , в то время как слабые кислоты будут иметь очень маленькие значения для K a .
Список сильных кислот
Есть только 7 сильных кислот; все остальные кислоты слабые. Они перечислены ниже по названию и химическому составу.
Название кислоты | Химический состав |
Хлорная кислота | HClO 3 |
Бромистоводородная кислота | HBr |
Кислота соляная | HCl |
Йодоводородная кислота | HI |
Азотная кислота | HNO 3 |
Хлорная кислота | HClO 4 |
Серная кислота | H 2 SO 4 |
Сильные кислоты и концентрированные кислоты
Важно понимать, что сильные / слабые кислоты — это не то же самое, что концентрированные / разбавленные кислоты.Эти термины часто используются неправильно и неправильно заменяют друг друга! Концентрация кислоты означает количество воды или растворителя в ней. Концентрированная кислота содержит небольшое количество воды, тогда как разбавленная кислота содержит большое количество воды. У вас может быть сильная разбавленная кислота, а также слабая концентрированная.
Не существует стандартной концентрации, определяющей, является ли вещество концентрированным или разбавленным, но, как правило, концентрированные кислоты будут иметь pH около 3, а разбавленные кислоты будут иметь pH ближе к 7.
Сильные кислоты против коррозионных кислот
То, что кислота сильная, не означает, что она вызывает коррозию. Коррозионная активность означает, насколько вещество повреждает поверхность, к которой прикасается. Живая ткань (например, кожа, глаза и т. Д.) Часто используется в качестве ориентира, поскольку люди хотят знать любые потенциальные риски веществ, с которыми они работают.
Некоторые химические вещества настолько агрессивны, что могут разъедать плоть и кости, но, опять же, сила кислоты не связана с тем, насколько она едкая.Эти два термина измеряют разные, не связанные между собой вещи. Некоторые сильные кислоты очень едкие, такие как соляная кислота (которая может разъедать нержавеющую сталь) и серная кислота (которая обычно используется в качестве очистителя канализации). Однако слабые кислоты также могут быть чрезвычайно едкими, например фтористоводородная кислота, которая может декальцинировать кости.
Когда едкие кислоты разбавляются, они часто будут иметь меньший коррозионный эффект из-за их низкой концентрации. В этом случае они могут действовать только как раздражитель и вызывать более легкие реакции, такие как зуд или покраснение кожи.
Кислоты, оксиды и основания могут вызывать коррозию. Слово «едкий натр» иногда используется как синоним коррозионного вещества, но оно может относиться только к сильным основаниям, но не к кислотам.
Резюме: список сильных кислот
Существует 7 сильных кислот: хлорная кислота, бромистоводородная кислота, соляная кислота, йодистоводородная кислота, азотная кислота, хлорная кислота и серная кислота. Однако принадлежность к списку сильных кислот не указывает на то, насколько они опасны или вредны.Сильные кислоты и основания — это просто те кислоты, которые полностью диссоциируют в воде.
Слабые кислоты (все остальные кислоты) диссоциируют лишь в небольшом количестве. Коррозионная активность кислоты — это мера того, насколько она разрушительна для таких поверхностей, как металл или кожа. Кислота может быть сильной, но довольно безопасной в обращении, если она имеет низкую коррозионную активность, но слабые кислоты также могут быть очень коррозионными, и с ними очень опасно работать, если не приняты надлежащие меры безопасности.
Что дальше?
Что такое динамическое равновесие и какое отношение оно имеет к ржавым автомобилям? Узнайте, прочитав наше полное руководство по динамическому равновесию.
Ищете другие определения и объяснения концепций молекулярной химии? Прочтите об электроотрицательности и гидратах здесь.
Не уверены, в чем разница между физическими и химическими изменениями? Ознакомьтесь с шестью подробными примерами физических и химических изменений, прочитав наше руководство.
Какие уроки естествознания наиболее важны в средней школе? Ознакомьтесь с нашим руководством, чтобы узнать все классы средней школы, которые вам следует посещать.
2.Сильные и слабые кислоты
Слабая кислота — это кислота, которая не полностью ионизируется при растворении в воде. Этановая кислота — типичная слабая кислота. Он реагирует с водой с образованием ионов гидроксония и этаноат-ионов, но обратная реакция более успешна, чем прямая. Ионы очень легко реагируют с преобразованием кислоты и воды.
В любой момент времени только около 1% молекул этановой кислоты преобразовались в ионы. Остальные остаются в виде простых молекул этановой кислоты. Большинство органических кислот слабые.- \ tag {5} \]
Константа диссоциации кислоты, К
а
Вы можете измерить положение равновесия, написав константу равновесия для реакции. Чем ниже значение константы, тем левее положение равновесия. Диссоциация (ионизация) кислоты является примером гомогенной реакции. Все присутствует в одной и той же фазе — в данном случае в растворе в воде. Поэтому вы можете написать простое выражение для константы равновесия K c .-]} {[HA] [H_2O]} \]
Однако, если вдуматься, в этом есть что-то странное.
Внизу выражения находится термин, обозначающий концентрацию воды в растворе. Это не проблема — за исключением того, что число будет очень большим по сравнению со всеми другими числами.
В 1 дм 3 раствора должно быть около 55 молей воды.
Если у вас была слабая кислота с концентрацией около 1 моль дм -3 , и только около 1% ее прореагировало с водой, количество молей воды упадет только примерно на 0.01. Другими словами, если кислота слабая, концентрация воды практически постоянна. В этом случае нет особого смысла включать его в выражение, как если бы это была переменная. Вместо этого определяется новая константа равновесия, которая не учитывает ее. Эта новая константа равновесия называется K a .
Вы можете найти выражение K a , написанное иначе, если будете работать с упрощенной версией равновесной реакции:
Может быть написано с государственными символами или без них.
Это фактически то же самое, что и предыдущее выражение для K a ! Помните, что, хотя мы часто пишем H + для ионов водорода в растворе, на самом деле мы говорим об ионах гидроксония. Эта вторая версия выражения K a не так точна, как первая.
Чтобы взять конкретный общий пример, равновесие диссоциации этановой кислоты правильно записывается как:
\ [CH_3COOH + H_2O \ rightleftharpoons CH_3COO ^ — + H_3O ^ + \ tag {7} \]
Выражение K a :
Если вы используете более простую версию равновесия.+ \ tag {8} \]
. . . выражение K a :
В таблице приведены некоторые значения K a для некоторых простых кислот:
| кислота | K a (моль дм -3 ) |
|---|---|
| плавиковая кислота | 5,6 x 10 -4 |
| метановая кислота | 1,6 x 10 -4 |
| этановая кислота | 1.7 х 10 -5 |
| сероводород | 8,9 x 10 -8 |
Это все слабые кислоты, потому что значения K a очень малы. Они перечислены в порядке уменьшения силы кислоты — значения K и становятся меньше по мере того, как вы спускаетесь по таблице. Однако, если вас не устраивают числа, это не сразу очевидно. Поскольку числа состоят из двух частей, слишком много, чтобы быстро подумать! Чтобы этого избежать, числа часто переводят в новую, более простую форму, называемую pK a .
Крепость кислот | Безграничная химия
Сильные кислоты
В воде сильные кислоты полностью диссоциируют на свободные протоны и сопряженное с ними основание.
Цели обучения
Расчет pH для растворов сильных кислот.
Ключевые выводы
Ключевые моменты
- Сильные кислоты могут катализировать химические реакции.
- Сильные кислоты определяются по их pKa. Кислота должна быть сильнее в водном растворе, чем ион гидроксония, поэтому ее pKa должен быть ниже, чем у иона гидроксония.Следовательно, сильные кислоты имеют pKa <-174.
- Сильные кислоты могут быть органическими или неорганическими.
- С сильными кислотами необходимо обращаться осторожно, поскольку они могут вызвать серьезные химические ожоги.
- Сильные кислоты необходимы для катализа некоторых реакций, включая синтез и гидролиз карбонильных соединений.
Ключевые термины
- карбонил : двухвалентная функциональная группа (-CO-), характерная для альдегидов, кетонов, карбоновых кислот, амидов, ангидридов карбоновых кислот, карбонилгалогенидов, сложных эфиров и других.
- сложный эфир : соединение, обычно образующееся при конденсации спирта и кислоты и удалении воды. он содержит функциональную группу углерод-кислородную двойную связь, соединенную через углерод с другим атомом кислорода
- гидролиз : химический процесс разложения; включает расщепление связи и добавление катиона водорода и аниона гидроксида воды
Определение сильных кислот
Сила кислоты означает легкость, с которой кислота теряет протон.- (\ text {aq}) [/ latex]
Точнее, кислота должна быть сильнее в водном растворе, чем ион гидроксония (H + ), поэтому сильные кислоты имеют pKa <-1,74. Примером является соляная кислота (HCl), pKa которой составляет -6,3. Обычно это означает, что в водном растворе при стандартной температуре и давлении концентрация ионов гидроксония равна концентрации сильной кислоты, введенной в раствор.
Ионизация кислот и оснований в воде : Сильная кислота полностью ионизируется в водном растворе, теряя один протон (H +).
Из-за полной диссоциации сильных кислот в водном растворе концентрация ионов гидроксония в воде равна общей концентрации (ионизированной и неионизированной) кислоты, введенной в раствор:
[H + ] = [A — ] = [HA] всего и pH = −log [H + ].
Сильные кислоты, как и сильные основания, при контакте с живыми тканями могут вызывать химические ожоги.
Примеры сильных кислот
Некоторые распространенные сильные кислоты (кислоты с pKa <-1) включают:
- Йодоводородная кислота (HI): pKa = -9.3
- Бромистоводородная кислота (HBr): pKa = -8,7
- Хлорная кислота (HClO 4) : pKa ≈ -8
- Соляная кислота (HCl): pKa = -6,3
- Серная кислота (H 2 SO 4 ): pKa1 ≈ -3 (только первая диссоциация)
- п-Толуолсульфоновая кислота: pKa = -2,8
- Азотная кислота (HNO 3 ): pKa ≈ -1,4
- Хлорная кислота (HClO 3 ): pKa ≈ 1,0
п-Толуолсульфоновая кислота : п-Толуолсульфоновая кислота является примером органической растворимой сильной кислоты с pKa, равным -2.8.
Сильный кислотный катализ
Сильные кислоты могут ускорять скорость некоторых реакций. Например, сильные кислоты могут ускорять синтез и гидролиз карбонильных соединений. С карбонильными соединениями, такими как сложные эфиры, синтез и гидролиз проходят через тетраэдрическое переходное состояние, где центральный углерод имеет кислород, спиртовую группу и исходную алкильную группу. Сильные кислоты протонируют карбонил, что делает кислород положительно заряженным, так что он может легко принимать электроны с двойной связью, когда спирт атакует карбонильный углерод; это делает возможным синтез и гидролиз сложного эфира.
Слабые кислоты
Слабая кислота только частично диссоциирует в растворе.
Цели обучения
Решает проблемы кислотно-щелочного равновесия для слабых кислот.
Ключевые выводы
Ключевые моменты
- Диссоциацию слабых кислот, которые являются наиболее популярным типом кислот, можно рассчитать математически и применить в экспериментальной работе.
- Если концентрация и K a слабой кислоты известны, можно рассчитать pH всего раствора.Точный метод расчета зависит от допущений и упрощений.
- Слабые кислоты и слабые основания необходимы для приготовления буферных растворов, которые имеют важное экспериментальное применение.
Ключевые термины
- конъюгированная кислота : вид, образующийся, когда основание принимает протон
- основание конъюгата : вид, созданный после передачи протона.
- слабая кислота : та, которая не полностью диссоциирует, отдавая только часть своих ионов водорода в раствор
Слабая кислота — это кислота, которая не полностью диссоциирует в растворе; это означает, что слабая кислота не отдает все свои ионы водорода (H + ) в растворе.Слабые кислоты имеют очень маленькие значения для K a (и, следовательно, более высокие значения для pK a ) по сравнению с сильными кислотами, которые имеют очень большие значения K a (и слегка отрицательные значения pK a ). — (\ text {aq}) [/ latex ]
, где HA представляет собой недиссоциированный вид, а A — представляет собой конъюгированное основание кислоты.-]} {[\ text {HA}]} [/ латекс]
Чем больше значение K a , тем более благоприятно образование H + , которое делает раствор более кислым; следовательно, высокое значение K и указывает на более низкий pH раствора. K a слабых кислот колеблется от 1,8 × 10 −16 до 55,5. Кислоты с K a менее 1,8 × 10 −16 являются более слабыми кислотами, чем вода.
Если кислоты полипротонные, каждый протон будет иметь уникальный K a .{-3}) = 2,4 [/ латекс]
Хотя это всего лишь слабая кислота, достаточно концентрированный раствор уксусной кислоты может быть довольно кислым.
Расчет процентной диссоциации
Процент диссоциации представляет собой силу кислоты и может быть рассчитан с использованием значения K , и pH раствора.
Цели обучения
Рассчитайте процент диссоциации слабых кислот по их значениям K a и заданной концентрации.
Ключевые выводы
Ключевые моменты
- Процент диссоциации обозначается как α (альфа) и представляет собой отношение концентрации диссоциированного иона водорода [H + ] к концентрации недиссоциированных частиц [HA].
- В отличие от K a процент диссоциации зависит от концентрации HA; разбавленные кислоты диссоциируют сильнее, чем концентрированные.
- Процент диссоциации зависит от концентрации как основания конъюгата, так и начальной концентрации кислоты; его можно рассчитать, если известны pH раствора и pKa кислоты.
Ключевые термины
- диссоциация : процесс, при котором соединения расщепляются на более мелкие составляющие молекулы, обычно обратимо.
- процент ионизации : доля кислоты, которая подвергается диссоциации
Мы уже обсуждали количественную оценку силы слабой кислоты, связывая ее с ее константой кислотного равновесия K a ; теперь мы сделаем это с точки зрения диссоциации кислоты % . Процент диссоциации обозначается греческой буквой альфа, α, и он может находиться в диапазоне от 0% <α <100%. Сильные кислоты имеют значение α, равное или почти 100%; для слабых кислот, однако, α может варьироваться в зависимости от силы кислоты.{-4}} {0,060} \ times 100 \% = 1,6 \% [/ латекс]
Как и следовало ожидать для слабой кислоты, процент диссоциации довольно невелик. Однако для некоторых слабых кислот процент диссоциации может быть выше — до 10% и более. Например, для задачи, связанной с процентом диссоциации 0,100 M хлоруксусной кислоты, мы не можем предполагать, что x является малым, и поэтому для решения проблемы используйте таблицу ICE.
Ka из процента диссоциации : В этом видео процент диссоциации кислоты значительный (11%), и поэтому мы не можем предположить, что x является небольшим.График ICE используется для расчета соответствующих концентраций.
