Содержание
Соляная кислота: влияние на экологию и здоровье человека. Справка
Получают соляную кислоту растворением в воде хлористого водорода, который синтезируют или непосредственно из водорода и хлора или получают действием серной кислоты на хлорид натрия.
Выпускаемая техническая соляная кислота имеет крепость не менее 31% HCl (синтетическая) и 27,5% HCl (из NaCI). Торговую кислоту называют концентрированной, если она содержит 24% и больше HCl, если содержание HCl меньше, то кислота называется разбавленной.
Соляную кислоту применяют для получения хлоридов различных металлов, органических полупродуктов и синтетических красителей, уксусной кислоты, активированного угля, различных клеев, гидролизного спирта, в гальванопластике. Ее применяют для травления металлов, для очистки различных сосудов, обсадных труб буровых скважин от карбонатов, окислов и др. осадков и загрязнений. В металлургии кислотой обрабатывают руды, в кожевенной промышленности – кожу перед дублением и крашением.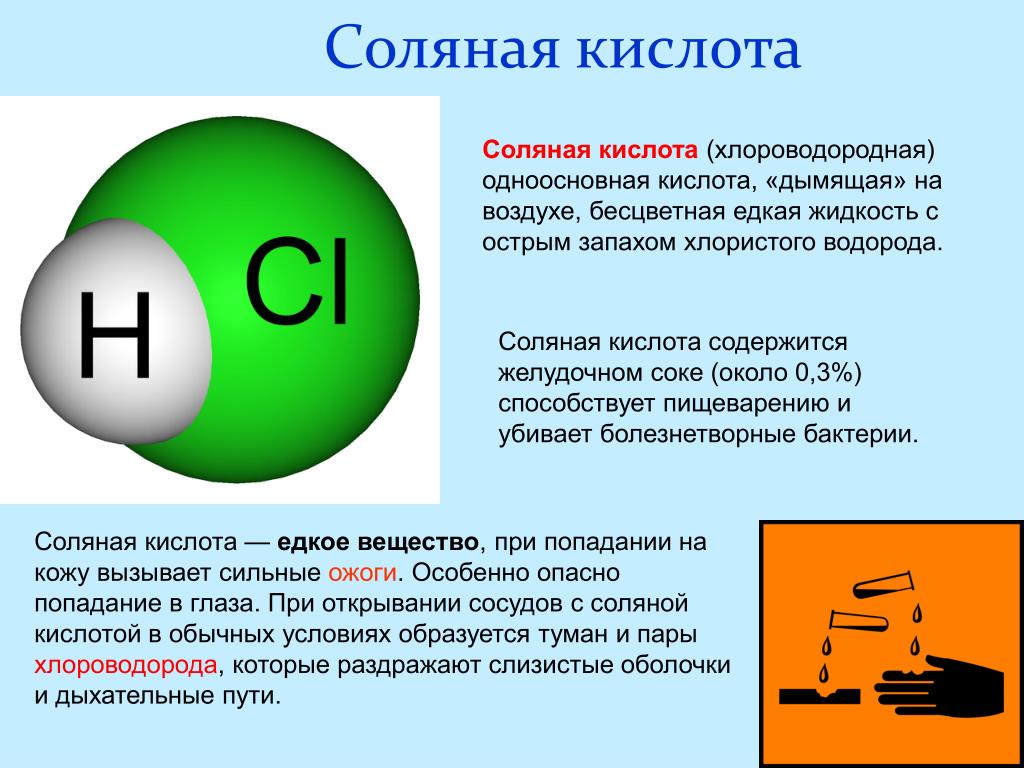 Соляную кислоту применяют в текстильной, пищевой промышленности, в медицине и т. д.
Соляную кислоту применяют в текстильной, пищевой промышленности, в медицине и т. д.
Соляная кислота играет важную роль в процессах пищеварения, она является составной частью желудочного сока. Разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Транспортируют соляную кислоту в стеклянных бутылях или гуммированных (покрытых слоем резины) металлических сосудах, а также в полиэтиленовой посуде.
Соляная кислота очень опасна для здоровья человека. При попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза.
При попадании соляной кислоты на кожные покрытия ее необходимо немедленно смыть обильной струей воды.
Очень опасны туман и пары хлороводорода, образующиеся при взаимодействии с воздухом концентрированной кислоты. Они раздражают слизистые оболочки и дыхательные пути. Длительная работа в атмосфере HCl вызывает катары дыхательных путей, разрушение зубов, помутнение роговицы глаз, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства.
Острое отравление сопровождается охриплостью голоса, удушьем, насморком, кашлем.
В случае утечки или разлива соляная кислота может нанести существенный ущерб окружающей среде. Во-первых, это приводит к выделению паров вещества в атмосферный воздух в количествах превышающих санитарно-гигиенические нормативы, что может повлечь отравление всего живого, а также появлению кислотных осадков, которые могут привести к изменению химических свойств почвы и воды.
Во-вторых, она может просочиться в грунтовые воды, в результате чего может произойти загрязнение внутренних вод.
Там, где вода в реках и озерах стала довольно кислой (рН менее 5) исчезает рыба. При нарушении трофических цепей сокращается число видов водных животных, водорослей и бактерий.
В городах кислотные осадки ускоряют процессы разрушения сооружений из мрамора и бетона, памятников и скульптур. При попадании на металлы соляная кислота вызывает их коррозию, а, реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
В случае разлива соляную кислоту смывают с поверхностей большим количеством воды или щелочного раствора, который нейтрализует кислоту.
Материал подготовлен на основе информации открытых источников
Области применения соляной кислоты
Когда мы слышим о соляной кислоте, возникает ассоциация с областью ее применения в химии или медицине. Но не все знают, что она присутствует в составе многих чистящих средств или спиртовой продукции в качестве добавки Е507. С ее помощью легко можно менять характеристики бетона или восстанавливать процесс пищеварения. Многие даже не догадываются насколько широко на сегодняшний день применение соляной кислоты. Разберем подробно ее полезные свойства в разных сферах деятельности.
- Промышленность. В металлургии соляная кислота необходима при процессе зачистки металла после лужения и пайки. В пищевой промышленности она используется как регулятор кислотности. Вы даже можете встретить ее в составе содовой.

- Домохозяйство. Как было сказано ранее, соляная кислота нужна для получения качественных и эффективных чистящих средств. Особое внимание обратите на то, что в этом случае необходимо соблюдать меры безопасности и работать с ней обязательно в резиновых перчатках. К сожалению, кислота наносит сильные ожоги на кожу.
- Медицина. Вы можете с помощью нее вылечить папилломы или улучшить пищеварение при пониженной кислотности.
- Строительство. Соляная кислота отлично очищает красный кирпич от грязи, а бетонная смесь благодаря ей повышает свою морозостойкость, становится более устойчивой к влаге и в разы быстрее застывает.
Применение данного раствора полезно в любой области, главное соблюдать правила безопасности во время ее использования.
Хранение и транспортировка
Все химикаты опасные для окружающей среды в чистом виде доставляются на объект в специализированных контейнерах, которые исключают утечку раствора. Люки и пробки обязательно должны быть герметичными, чтобы предотвратить контакт соляной кислоты с различными металлами.
Вы вряд ли встретите где-либо розничную закупку данного химиката, обычно его поставляют оптом. Купить качественную соляную кислоту, которая отвечает всем нормам и требованиям Вы можете в компании «Еврохиминвест». Клиентам предлагаются только выгодные условия сотрудничества. Компания работает без посредников, поэтому возможность брака или ошибок в заказе полностью исключена. Доставка осуществляется собственным автотранспортом с учетом класса опасности груза. Доверяйте серьезные дела надежным профессионалам, которые сделают свою работу максимально ответственно и аккуратно.
Интересные факты
- Желудок человека вырабатывает агрессивную соляную кислоту, которой под силу растворить бритвенное лезвие за неделю.
- Соляная кислота убивает болезнетворные бактерии, тем самым сохраняя наш организм в тонусе.
- Мы каждый день обновляем пострадавшую поверхность желудка от соляной кислоты в желудочном соке, даже не подозревая об этом.
- В человеке есть жидкость, а именно соляная кислота, которую запрещено проносить на борт самолета.
 К сожалению, мы не можем ее отделить, поэтому авиакомпании все же допускают людей к полету.
К сожалению, мы не можем ее отделить, поэтому авиакомпании все же допускают людей к полету.
Повторимся, что раствор хлористого водорода может нанести существенный вред организму и имеет второй класс опасности. Поэтому никогда не забывайте про защитные элементы одежды во избежание появлений ожогов на теле.
Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
Соляная кислота — неорганическое вещество, одноосновная кислота, одна из самых сильных кислот. Используются также другие названия: хлористый водород, кислота хлороводородная, кислота хлористоводородная.
Свойства
Кислота в чистом виде представляет собой жидкость без цвета и запаха. Техническая кислота обычно содержит примеси, которые придают ей слегка желтоватый оттенок. Соляную кислоту часто называют «дымящей», так как она выделяет пары хлороводорода, вступающие в реакцию с влагой воздуха и образующие кислотный туман.
Очень хорошо растворяется в воде. При комнатной температуре максимально возможное по массе содержание хлороводорода —38%. Кислота концентрации большей 24% считается концентрированной.
При комнатной температуре максимально возможное по массе содержание хлороводорода —38%. Кислота концентрации большей 24% считается концентрированной.
Хлористоводородная кислота активно вступает в реакции с металлами, оксидами, гидроксидами, образуя соли — хлориды. HCl взаимодействует с солями более слабых кислот; с сильными окислителями и аммиаком.
Для определения соляной кислоты или хлоридов используют реакцию с нитратом серебра AgNO3, в результате которой выпадает белый творожистый осадок.
Техника безопасности
Вещество очень едкое, разъедает кожу, органические материалы, металлы и их окислы. На воздухе выделяет пары хлороводорода, которые вызывают удушье, ожоги кожи, слизистой глаз и носа, повреждают органы дыхания, разрушают зубы. Соляная кислота относится к веществам 2 степени опасности (высокоопасным), ПДК реактива в воздухе составляет 0,005 мг/л. Работать с хлористым водородом можно только в фильтрующих противогазах и защитной одежде, включая резиновые перчатки, фартук, спецобувь.
При разливе кислоты ее смывают большим количеством воды или нейтрализуют щелочным растворами. Пострадавших от кислоты следует вынести из опасной зоны, промыть кожу и глаза водой или содовым раствором, вызвать врача.
Перевозить и хранить хим реактив допускается в стеклянной, пластиковой таре, а также в металлической таре, покрытой изнутри резиновым слоем. Тара должна герметично закрываться.
Получение
В промышленных масштабах соляную кислоту получают из газообразного хлороводорода (HCl). Сам хлороводород производится двумя основными способами:
— экзотермической реакцией хлора и водорода — таким образом получают реактив высокой чистоты, например, для пищевой промышленности и фармацевтики;
— из сопутствующих промышленных газов — кислота на основе такого HCl называется абгазной.
Это любопытно
Именно соляной кислоте природа «поручила» процесс расщепления пищи в организме. Концентрация кислоты в желудке составляет всего 0,4%, но этого оказывается достаточно, чтобы за неделю переварить бритвенное лезвие!
Кислота вырабатывается клетками самого желудка, который защищен от этой агрессивной субстанции слизистой оболочкой. Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Применение
— В медицине и фармацевтике — для восстановления кислотности желудочного сока при его недостаточности; при анемии для улучшения всасываемости железосодержащих лекарств.
— В пищепроме это пищевая добавка, регулятор кислотности Е507, а также ингредиент сельтерской (содовой) воды. Используется при изготовлении фруктозы, желатина, лимонной кислоты.
— В химической промышленности — основа для получения хлора, соды, глутамината натрия, хлоридов металлов, например, хлорида цинка, хлорида марганца, хлорида железа; синтеза хлорорганических веществ; катализатор в органических синтезах.
— Больше всего производимой в мире хлористоводородной кислоты расходуется в металлургии для очистки заготовок от окислов. Для этих целей применяется ингибированная техническая кислота, в состав которой введены специальные ингибиторы (замедлители) реакции, благодаря чему реактив растворяет окислы, но не сам металл. Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.
Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.
— Обрабатывают кожу перед дублением.
— В добывающей отрасли востребована для очистки буровых скважин от отложений, для обработки руд и горных пластов.
— В лабораторной практике хлористоводородная кислота используется как популярный реактив для аналитических исследований, для очистки сосудов от трудноудаляемых загрязнений.
— Применяется в каучуковой, целлюлозно-бумажной индустрии, в черной металлургии; для очистки котлов, труб, оборудования от сложных отложений, накипи, ржавчины; для очистки керамических и металлических изделий.
Соляная кислота — Её свойства, воздействие на человека
Соляная кислота – вещество неорганического происхождения. Относится к списку очень сильных кислот. Имеет несколько названий: хлористый водород, хлористоводородная кислота, хлористоводородная кислота.
Свойства Соляной кислоты
Хлористый водород в чистом виде является прозрачной жидкостью без запаха и оттенков. Но чаще всего используется техническая кислота. Она имеет примеси, поэтому обладает желтоватым оттенком. Хлористоводородная кислота, на открытом воздухе вступает в реакцию с воздухом. В процессе реакции от влаги воздуха и кислоты образуется туман.
Но чаще всего используется техническая кислота. Она имеет примеси, поэтому обладает желтоватым оттенком. Хлористоводородная кислота, на открытом воздухе вступает в реакцию с воздухом. В процессе реакции от влаги воздуха и кислоты образуется туман.
Соляная кислота отлично растворяется в воде. В основном используется кислота высокой концентрации от 36.6% до 24%. Хлористый водород замечательно вступает в реакции с различными веществами:
- Металлы.
- Оксиды.
- Гидрооксиды
- Более слабые кислоты
- Аммиак.
Чем опасна соляная кислота
Хлористоводородная кислота является крайне опасным веществом. Оно едкое, способно разъесть кожу человека, органические материалы, а также металлические предметы. При взаимодействии с воздухом выделяется ядовитый пар. Он может привести к удушью, ожогам слизистой и кожи, разрушает зубы. Соляная кислота имеет 2 класс опасности.
Работы с соляной кислотой необходимо производить с особой осторожностью. При не больших объемах используют защиту органов дыхания (противогазы) и защитную одежду:
При не больших объемах используют защиту органов дыхания (противогазы) и защитную одежду:
Ликвидацию аварий, при разливе соляной кислоты производят ее нейтрализацию большим количеством воды и раствором щелочей. Пострадавших от воздействия хлористого водорода сначала выводят из опасной зоны. Потом промывают кожу и глаза большим количеством воды и госпитализируют в мед учреждение для оказания помощи.
Перевозят соляную кислоту в пластмассовой или стеклянной таре. Большие объемы могут перевозить в металлической таре. Но металлические бочки или цистерны должны быть обработаны изнутри резиновым слоем. Вся тара должна быть герметично закрыта, чтобы избежать реакцию с воздухом.
Производство кислоты
На производстве соляная кислота получается из газообразного хлороводорода. Изначальное вещество хлороводород получается двумя способами:
- При взаимодействии хлора и водорода экзотермический способ – высокая чистота вещества
- Из сопутствующих газов при производстве других веществ – техническая кислота.

Применение
Соляная кислота используется во многих отраслях:
- Фарм. производство – препараты для восстановления кислотности желудочного сока.
- Пищевая промышленность – производство пищевых добавок (регулятор кислотности Е507), фруктозы, желатина, лимонной кислоты.
- Химическая промышленность – для получения хлора, хлорида металлов, соды.
- Металлургия – обработка металла перед пайкой, гальванированием.
- Лаборатории – в процессах исследований и для очистки инвентаря.
- В производстве каучука, бумаги – для очистки котлов, труб, керамических изделий.
Интересный факт
Соляная кислота содержится в желудке человека. Конечно, ее концентрация не высока всего 0.4%. НО такого количества достаточно для растворения лезвия бритвы за неделю! Желудок самостоятельно производит раствор соляной кислоты. Сам желудок защищен слизистой оболочкой. Слизистая ежедневно обновляется, чтобы заменить поврежденные участки. Кислота необходима для переваривания пищи и защиты организма от микробов.
Сегодня сложно обойтись без соляной кислоты. Она требуется во многих производственных процессах и медицине. В тоже время, это опасное химическое вещество. Оно требует соблюдения техники безопасности. В случае утечки, разлива соляной кислоты для устранения аварии и последствий требуется специальная одежда костюмы химзащиты. Наилучший выбор изолирующие и защитные костюмы серии Стрелец.
Соляная кислота желудочного сок — Справочник химика 21
Определите количество теплоты, выделяющейся в желудке человека при нейтрализации соляной кислоты желудочного сока 1 г гидрокарбоната натрия. [c.52]
При действии активного желудочного сока фибрин расщепляется до пептонов и жидкость приобретает способность давать биуретовую реакцию. После кипячения (разрушение фермента) или нейтрализации соляной кислоты желудочный сок теряет способность расщеплять фибрин, так как ни соляная кислота, ни пепсин порознь не производят расщепления белка. [c.186]
[c.186]
Роль соляной кислоты желудочного сока состоит в том, что она превращает один из ферментов желудочного сока — пепсин в активную форму. И, кроме того, она выполняет еще одну важную функцию — уничтожает проникающих в желудок патогенных и гнилостных бактерий. Поэтому соляная кислота является фармацевтическим препаратом. [c.64]
Кровь может попасть в желудочный сок в результате кровотечения. Это бывает при язве желудка, а также при кровотечениях из верхних дыхательных путей, носоглотки и пищевода. При сильном кровотечении желудочный сок окрашен в красный цвет. Под действием соляной кислоты желудочного сока гемоглобин крови постепенно превращается в солянокислый гемин коричневого цвета. Для обнаружения в желудочном соке малых количеств крови применяют известные нам гваяковую и бензидиновую реакции, основанные на пероксидазном действии гемоглобина (см. стр. 74). Для того чтобы исключить ошибки, связанные с попаданием в желудочный сок пероксидазы, сок перед реакцией на кровь кипятят. При этом пероксидаза разрушается, а гем сохраняет свои пероксидазные свойства. [c.266]
При этом пероксидаза разрушается, а гем сохраняет свои пероксидазные свойства. [c.266]
В процессе переваривания пищи в желудке большую р( играет соляная кислота желудочного сока. Соляная кислс во-первых, создает такую концентрацию водородных ионое желудке, при которой пепсин и гастриксин максимально актив во-вторых, она вызывает денатурацию и набухание белков и самым способствует их частичному расщеплению протеаза в-третьих, она способствует створаживанию. молока. [c.190]
После того как химус попадает в двенадцатиперстную кишку, прежде всего происходит нейтрализация попавшей в кишечник с пищей соляной кислоты желудочного сока бикарбонатами, содержащимися в панкреатическом и кишечном соках. Выделяющиеся при разложении бикарбонатов пузырьки углекислого газа способствуют хорошему перемешиванию пищевой кашицы с пищеварительными соками. Одновременно начинается эмульгирование жира. Наиболее мощное эмульгирующее действие на жиры оказывают соли желчных кислот, попадающие в двенадцатиперстную кишку с желчью в виде натриевых солей. Большая часть желчных кислот конъюгирована с глицином или таурином. По химической природе желчные кислоты являются производными холановой кислоты [c.364]
Большая часть желчных кислот конъюгирована с глицином или таурином. По химической природе желчные кислоты являются производными холановой кислоты [c.364]
Проделывают эту же реакцию, взяв вместо раствора соляной кислоты желудочный сок. В присутствии свободной соляной кислоты появляется красное окрашивание. [c.260]
Вместе с тем небезынтересно, что в живых организмах встречаются и неорганические вещества. Некоторые из этих соединений, например вода, хлорид натрия, калиевые соли и соляная кислота (желудочный сок), незаменимы для человека, животных и растений. [c.292]
При действии соляной кислоты желудочного сока фосфид цинка разрушается с образованием фосфористого водорода, который и обусловливает в основном токсичность этого препарата [c.276]
Соляная кислота желудочного сока уже не открывается в трупе. [c.32]
Количественное определение НС1 важно, чтобы судить, имеется ли в данном случае (например, в рвотных извержениях) введенная кислота, а не соляная кислота желудочного сока (0,1—0,2 / ). Последняя обыкновенно в содержимом желудка трупа уже нейтрализована. [c.177]
Последняя обыкновенно в содержимом желудка трупа уже нейтрализована. [c.177]
Анализ желудочного сока производят через 45 минут после пробного завтрака (35 г черствого белого хлеба и 400 мл воды). В желудочном содержимом соляная кислота желудочного сока разбавлена выпитой водой и частично (приблизительно на /з) связана с белками пробного завтрака. [c.183]
В кишечнике, наоборот, имеются весьма благоприятные условия для быстрого эмульгирования жиров. В двенадцатиперстной кишке прежде всего происходит нейтрализация соляной кислоты желудочного сока, попавшей в кишечник с пищей, бикарбонатами, содержащимися в панкреатическом и кишечном соках. Выделяющиеся при разложении бикарбонатов пузырьки углекислого газа способствуют хорошему перемешиванию пищевой кашицы с пищеварительными соками. Одновременно начинается эмульгирование жира в результате смешивания пищевой кашицы с различными веществами, способными играть роль эмульгаторов. [c. 293]
293]
Какова роль соляной кислоты желудочного сока в переваривании белков [c.214]
Действие пепсина. Важнейшим фактором превращения белков в желудке является протеолитический фермент — п е и с и н, содержащийся в желудочном соке. Клетки слизистой желудка выделяют пепсиноген, который под влиянием соляной кислоты желудочного сока превращается в активный протеолитический фермент пепсин. [c.312]
Оптимальная концентрация водородных ионов для пепсина отвечает pH ==1,5 — 2,5. Близкая к этим величинам концентрация Н-ионов и обеспечивается соляной кислотой желудочного сока. На высоте переваривания обычной пищи содержимое желудка имеет pH = 1,3—2,5. Высокая кислотность желудочного сока имеет существенное значение, так как при pH = 5 — 6 пепсин практически не действует на белки. [c.329]
Разнообразие неорганических кислот не так велико лишь фосфорная, угольная и соляная кислота (и отчасти кремниевая) встречаются в большинстве организмов как в виде солей, так и в свободном состоянии (например, соляная кислота желудочного сока).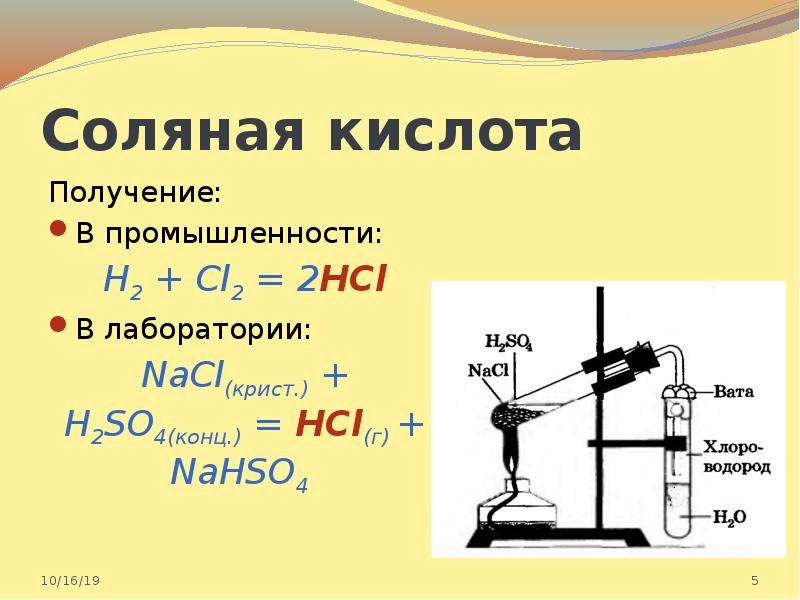 [c.42]
[c.42]
Организм развивается из одной клетки, но в развившемся организме находятся и действуют клетки совершенно разных назначений — разной специализации. Одни из них выполняют мышечную работу, другие передают нервные импульсы, функции третьих заключаются в выделении желчи (клетки печени), четвертые образуют соляную кислоту желудочного сока, а клетки сетчатки глаза воспринимают световые импульсы. Каждая клетка имеет, кроме общего оборудования (тоже всегда не вполне одинакового), еще специальное, отвечающее ее узкому назначению. Каким путем все это разнообразие возникло из единственной исходной клетки, трудно сказать. Мы не имеем возможности задерживаться на рассмотрении теорий дифференциации, а ограничимся описанием нескольких типов клеток. [c.171]
Токсическое действие фосфида цинка на грызунов обусловлено тем, что попадая в желудок животного и вступая в реакцию с соляной кислотой желудочного сока, он выделяет газ — фосфористый водород (РНз) [c. 176]
176]
Все карбонаты вызывают отрыжку ввиду выделения двуокиси углерода при реакции с соляной кислотой желудочного сока. [c.385]
Для нормального развития растительных и животных организмов наличие ничтожных количеств ионов галогенов совершенно необходимо. Например, ионы хлора необходимы для образования соляной кислоты желудочного сока, ионы йода — для нормального функционирования щитовидной железы, ионы фтора — для образования зубной эмали ионы брома —для правильного функционирования нервной системы. Поэтому в медицинской практике щироко применяются различные лекарственные средства, в состав которых входят галогены. [c.220]
Порошкообразный фосфористый цинк применяется в составе хлебной или зерновой приманки для отравления грызунов. Отравляющее действие его основано на выделении ядовитого фосфина при реакции с соляной кислотой желудочного сока [c.56]
Компонент соляной кислоты желудочного сока Входит в состав костей и зубов [c. 330]
330]
Водный раствор таннина (чай, кофе, настой черники) рекомендуют при отравлении тяжелыми металлами, а также алкалоидами. Под действием соляной кислоты желудочного сока таннин — сложное органическое соединение, входящее в состав чая, кофе, ягод черники, — превращается в галловую кислоту, которая дает малорастворимые соединения с тяжелыми металлами и связывает алкалоиды. [c.133]
Введение в качестве лекарственных препаратов — желе-за(П) хлорида или железа(П) сульфата ослабляет остроту заболевания. Для этих же целей используется мелкодисперсный порошок металлического железа (железо восстановленное, до 1 г на прием), который легко растворяется в соляной кислоте желудочного- сока. Поэтому действие этого препарата аналогично действию железа(П) хлорида. Однако более эффективны препараты, представляющие собой бионеорганические комплексы железа с сахарами, никотинамидом и другими органическими веществами. Такие комплексы хорошо всасываются в кровь, с чем и связана их фармакологическая эффективность. [c.283]
[c.283]
Соляная кислота желудочного сока необходима для перехода фермента пепсина в активную форму. Пепсин обеспечивает переваривание белков путем р g. Ю. Роль хлорид-ионов в переваривании гидролитического рас- белков [c.377]
Ионы натрия, калия и хлора еще участвуют в формировании нервного импульса и являются активаторами ряда ферментов. Хлор используется для образования соляной кислоты желудочного сока. [c.86]
Кроме соляной кислоты желудочный сок содержит сложные органические вещества-ферменты, обеспечивающие переваривание пищн.-Прил . ред. [c.296]
Вспомним теперь то, что было сказано о строении лекарственных веществ в самом начале, перед описанием первого опыта. Активной составной частью нашего препарата является метаналь (формальдегид)—вещество очень простого строения. Однако, вследствие негфиятного запаха и вкуса его нельзя принимать в качестве лекарства. Гексаметилентетрамин (уротропин), хотя он не имеет запаха и имеет сладковато-горький вкус, тоже не годится в качестве антисептика для мочевыводящих путей, так как при действии разбавленных кислот он легко отщепляет метаналь. (Давайте, докажем это опытным путем ) Принятый в качестве лекарства гексаметилентетрамин расщепляется уже в желудке соляной кислотой желудочного сока, а возникающий при этом метаналь присоединяется к содержащимся в желудке белкам и в результате преждевременно теряет свою активность. Поэтому гексаметилентетрамин путем соединения с ангидрометиленлимонной кислотой переводят в нерастворимую форму, которая разлагается лишь непосредственно в мочевых путях. Сам гексаметилентетрамин, а также его другие, растворимые в воде производные, часто употребляются как наружное средство для дезинфекции, а также против повышенной потливости. [c.261]
(Давайте, докажем это опытным путем ) Принятый в качестве лекарства гексаметилентетрамин расщепляется уже в желудке соляной кислотой желудочного сока, а возникающий при этом метаналь присоединяется к содержащимся в желудке белкам и в результате преждевременно теряет свою активность. Поэтому гексаметилентетрамин путем соединения с ангидрометиленлимонной кислотой переводят в нерастворимую форму, которая разлагается лишь непосредственно в мочевых путях. Сам гексаметилентетрамин, а также его другие, растворимые в воде производные, часто употребляются как наружное средство для дезинфекции, а также против повышенной потливости. [c.261]
Хотя ферменты слюны обладают высокой активностью, все же ротовой полости происходит далеко не полное расщепление ахмала до глюкозы из-за слишком короткого пребывания ЩИ во рту. Слюна обладает нейтральной реакцией, и это соот-тствует оптимальному действию птиалина и мальтозы. Содер-91ДИЙ соляную кислоту желудочный, сок прекращает действие рментов слюны в желудке, так как в кислой среде они теряют ою активность. Тем не менее ферменты птиалин и мальтоза тут некоторое время продолжать свое действие в желудке, кольку пищевой комок лишь постепенно пропитывается желу-» Ным соком. [c.189]
Тем не менее ферменты птиалин и мальтоза тут некоторое время продолжать свое действие в желудке, кольку пищевой комок лишь постепенно пропитывается желу-» Ным соком. [c.189]
Многие ферменты образуются тканями в недеятельном состояниив виде предшественников ферментов (проферментов, или зимогенов) и переходят в собственно ферменты под действием специальных активаторов. Так, И. П. Павловым было показано, что пепсиноген переходит в активный пепсин под действием соляной кислоты желудочного сока, поджелудочная липаза активируется желчью, а неактивный трипсиноген переходит в активный трипсин по]1>действием особого фермента [c.49]
Недостатком пенициллина является его химическая нестойкость. Он разрушается при нагревании, облучении, при воздействии на него щелочей, кислот, окислителей. Препараты пенициллина нельзя поэтому стерилизовать. Мало того, при приеме его через рот он разрушается соляной кислотой желудочного сока и пищеварительными ферментами.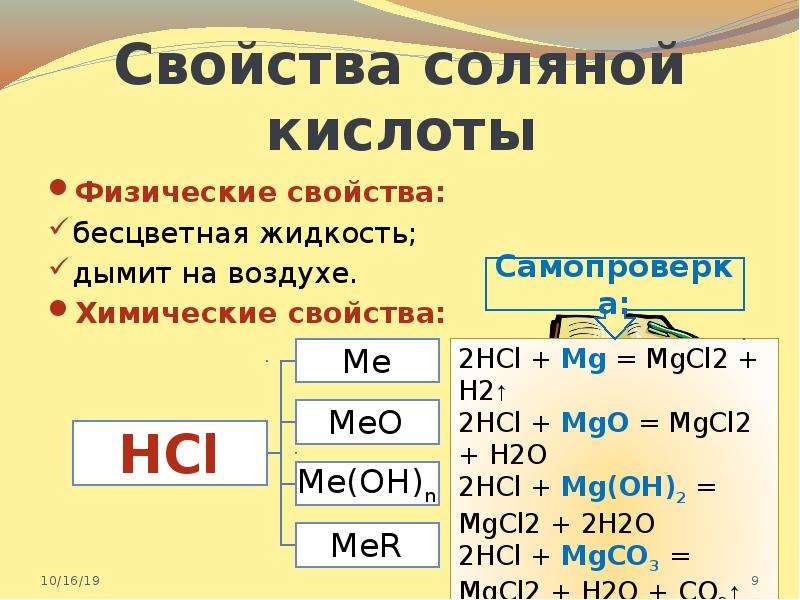 Пенициллин вводится поэтому, как правило, парэнтерально. [c.224]
Пенициллин вводится поэтому, как правило, парэнтерально. [c.224]
Ядохимикаты, применяемые в борьбе с грызунами, называются зооцидами. Фосфид цинка ZngPa получают воздействием паров фосфора на цинк при высокой температуре. Технический фосфид цинка представляет собой темно-серый порошок без запаха. Применяется он для приготовления отравленных приманок. В желудке грызуна фосфид под действием соляной кислоты желудочного сока разлагается с образованием ядовитого фосфористого водорода [c.111]
Ядохимикаты, применяемые в борьбе с грызунами, называют зооцидами. Фосфид цинка 2пзРг получают воздействием паров фосфора на цинк при высокой температуре. Применяется он для приготовления отравленных приманок. В желудке грызуна фосфид под действием соляной кислоты желудочного сока разлагается с образованием ядовитого фосфина [c.97]
Никодин обычно хорошо переносится. В некоторых случаях при застойных формах гепатита возможно усиление болей. При анацидных гастритах возможно усиление диспепсических явлений, для их предотвращения рекомендуется одновременный прием разведенной соляной кислоты, желудочного сока или ацидин-пепсина. [c.96]
При анацидных гастритах возможно усиление диспепсических явлений, для их предотвращения рекомендуется одновременный прием разведенной соляной кислоты, желудочного сока или ацидин-пепсина. [c.96]
Изучается применение ионитов для анализа желудочного сока. Сущность метода сводится к следующему больной принимает около 2 г порошка ионита, предварительно обработанного специально подобранным индикатором (хинин, метиленовый синий, ааокрасители и др.). Ионы соляной кислоты желудочного сока вытесняют из смолы соответствующее количество индикатора, который попадает через 2 часа в мочу и фиксируется в ней известными аналитическими методами. По количеству обнаруженного в моче индикатора устанавливают кислотность исследуемого желудочного OKBi [c.317]
Поскольку ионы бария и стронция обладают токсическим действием, их соединения практически не применяются в медицине. Исключение составляет барий сульфат, который не подвергается гидролизу и не растворяется в соляной кислоте желудочного сока, вследствие чего и отсутствует токсическое действие при приеме этого вещества внутрь. Применяют эту соль для рентгеновской диагностики заболеваний пищеварительного тракта в качестве контрастного вещества, так как BaSO сильно поглощает рентгеновские лучи. Но следует учитывать, что отдельные люди обладают повышенной чувствительностью к этому соединению. [c.250]
Применяют эту соль для рентгеновской диагностики заболеваний пищеварительного тракта в качестве контрастного вещества, так как BaSO сильно поглощает рентгеновские лучи. Но следует учитывать, что отдельные люди обладают повышенной чувствительностью к этому соединению. [c.250]
Соляная кислота в лаборатории — свойства, применение и правила работы
Физико-химические свойства
- Синонимы: cоляная кислота, хлористый водород, 7647-01-0, хлороводородная кислота, хлористо-водородная кислота.
- Категория: сильнокоррозионное вещество.
- Молекулярная формула: HCl или ClH.
- Молекулярная масса: 36,46 г/моль.
- Агрегатное состояние: жидкость.
- Цвет: прозрачная, бесцветная.
- Температура кипения: > 100 °C.
Соляная кислота была открыта арабским алхимиком Джабиром ибн Хайяном примерно в 800 году нашей эры, и на протяжении многих веков играла большую роль и широко использовалась в химической индустрии.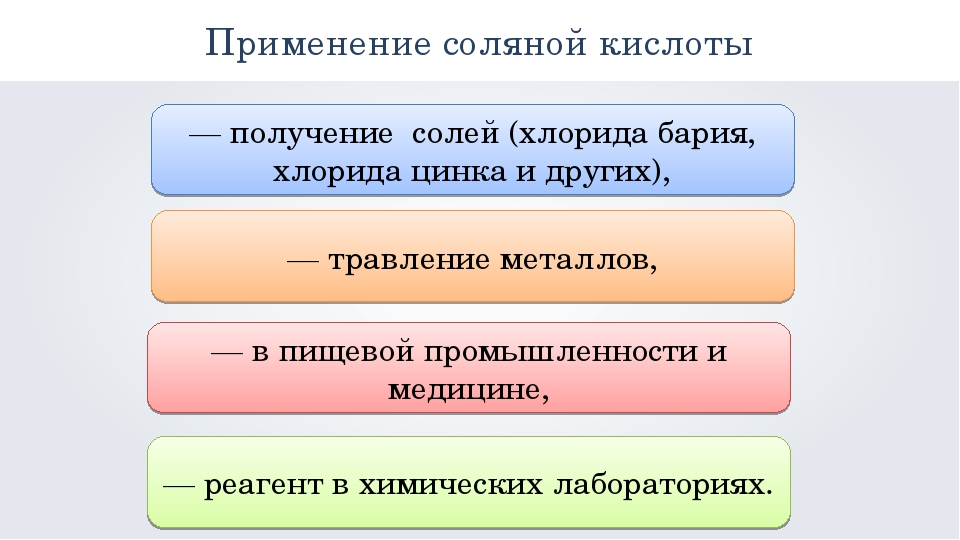
Соляная кислота растворима в воде и спирте и представляет собой прозрачную бесцветную жидкость с сильным резким запахом.
Растворы соляной кислоты могут варьироваться от 40% раствора до сильноразбавленных 1% и 0,1% растворов, хотя в типовых областях применения в промышленности используется 30-процентный «концентрат».
Области применения
Соляная кислота является важным и широко используемым химическим веществом.
В лабораториях соляная кислота применяется в качестве реагента в различных химических реакциях, а также при подготовке образцов для лабораторного анализа.
Наиболее часто соляная кислота используется при травлении стали, подкислении нефтяных скважин, производстве пищевых продуктов, производстве хлористого кальция и переработке руды.
Водный раствор соляной кислоты находит применение в самых разных областях промышленности и сферах деятельности человека.
К ним относятся извлечение полудрагоценных металлов из отработанных катализаторов, использование в качестве катализатора в синтезе веществ, использование в регенерации катализаторов, регулирование уровня рН, регенерация ионообменных смол, используемых в водоочистных сооружениях и электроэнергетике, нейтрализация щелочных продуктов или отходов, а также подкисление рассолов при производстве хлора и каустической соды.
Соляная кислота используется также во многих других промышленных производствах для получения органических химических веществ. Она может использоваться в производстве п-фенилендиамина, поликарбонатных смол, бисфенола А, поливинилхлоридных смол и этанола (из этилена).
В фармацевтической промышленности соляная кислота используется в качестве катализатора при синтезе веществ, для коррекции уровня рН, для деионизации воды и в качестве восстановителя (например, при производстве аскорбиновой кислоты и пара-аминобензойной кислоты).
Среди многих других областей применения соляной кислоты:
- Производство красителей и пигментов.
- Удаление шлама и накипи в промышленном оборудовании.
- Обеззоливание, дубление и покраска шкур в кожевенной промышленности.
- Производство лосьона для завивки волос.
- Карбонизация шерсти.
- Использование в качестве отбеливающего и красящего средства в текстильной промышленности.
- Очистка от песка и глины.
Потенциальные факторы риска
Соляная кислота — разъедающее вещество, которое может нанести вред при вдыхании, проглатывании или всасывании через кожу. Материал оказывает крайне разрушительное действие на ткани слизистых оболочек и верхних дыхательных путей. Вызывает сильные ожоги кожи и глаз.
Признаки и симптомы воздействия: жжение, кашель, свистящее дыхание, ларингит, одышка, спазм, воспаление и отек гортани, воспаление и отек бронхов, пневмония и отек легких.
Средства защиты
- Защита органов дыхания с помощью респираторов. Респираторы следует использовать только в следующих ситуациях:
✔ Респираторы должны использоваться как последнее средство защиты (то есть после принятия всех инженерно-технических и административных мер для контроля за ситуацией).
✔ В случае превышения допустимого уровня воздействия или при возникновении риска такого превышения.
✔ В соответствии с действующими правилами.
✔ Существует риск вредного воздействия по причине загрязнения атмосферы.
✔ В качестве СИЗ в случае ликвидации химического разлива.
Сотрудники лаборатории, использующие респираторные маски, должны быть обучены правилам обращения с средствами индивидуальной защиты. - Защита глаз с помощью защитных очков. При высоких концентрациях кислоты использование очков обязательно.
- Защита кожи и тела. Сотрудники лаборатории, работающие с химическими веществами, должны носить брюки в полный рост или их аналог, закрытую со всех сторон обувь и лабораторный халат.
- Соблюдение санитарно-гигиенических мероприятий: после работы с материалом тщательно вымойте руки.
Меры предосторожности для безопасного обращения с материалом
Избегайте попадания на кожу и в глаза. Избегайте вдыхания паров. Всегда работайте с химикатами внутри вытяжного шкафа. Если вам нужно развести соляную кислоту в лаборатории до определенной концентрации, всегда добавляйте кислоту в воду, а также используйте соответствующую воронку для переноса материала из контейнера в емкость.
Условия безопасного хранения
- Не храните в легковоспламеняющейся упаковке / совместно с ней; например, картон, пенополистирол, пластик и бумагу.
- Храните соляную кислоту вдали от аминов, щелочных металлов, металлов, перманганатов, например, перманганата калия, фтора, ацетилидов металлов, дисилицида гексалития.
- Храните контейнер с соляной кислотой в вертикальном положении и в сухом, хорошо проветриваемом месте. После открытия контейнера тщательно закройте его и храните в вертикальном положении во избежание утечки.
- Всегда храните соляную кислоту во вторичном контейнере. Лоток или ванна из налгена/полипропилена — это самый оптимальный вариант вторичной защитной оболочки.
Читайте подробный обзор по работе с кислотами в лаборатории.
Причина большинства заболеваний
ПРИЧИНА БОЛЬШИНСТВА ЗАБОЛЕВАНИЙ
От чего зависит состояние нашей иммунной системы?
Наличие или отсутствие дефицитных состояний — витаминов, белков, минералов и даже гормонов?
Наличие или отсутствие аутоиммуных заболеваний (НЯК, болезнь Крона, астма, псориаз, ревматоидный артрит, сахарный диабет 1 типа),
аллергий, дерматитов, нейродермитов, высыпаний на коже, акне?
Бактериальные инфекции (хеликтобактер, кандидоз, стафилококк и тд. )?
)?
Заболевания ЖКТ, сердечно-сосудистой, дыхательной и мочевыделительных систем?
К сожалению, людей без проблем в какой-либо области практически не встречается. В лучшем случае проблема носит скрытый характер. И основа здоровья — состояние ЖКТ. И первое с чего стоит начать — это нормализация его работы.
Большинство людей гастрит не считают чем-то серьезным и опасным.
А между тем:
— От качества обработки пищи в желудке зависит как она будет усвоена
— Отсюда берут начало различные формы желудочно-кишечных расстройств
— От концентрации соляной кислоты зависит уровень антибактериальной и противопаразитарной защиты
— Соляная кислота способствует переходу пищи из желудка в двенадцатиперстную кишку
— Участвует в регуляции секреции двенадцатиперстной кишки и поджелудочной железы⠀⠀
Делится гастрит на 2 основные категории — гиперацидные и гипоацидные.
Людей, у которых присутствует тот или иной тип отклонений очень много.
ГИПЕРАЦИДНЫЕ ГАСТРИТЫ — характерна повышенная кислотность.
• Слишком кислое содержимое желудка переходит из желудка в двенадцатиперстную кишку
• Спазм привратниковой части желудка, боль
• Спаз верхнего отдела тонкого кишечника
• Отток секретов печени и поджелудочной железы
• Пища не получает полноценной обработки желчью и соком поджелудочной железы,
• Кислота раздражает слизистую толстого кишечника
• Частые и обильные поносы
• Стенки толстого кишечника испытывают химический ожог
• Поносы сменяются запорами.
Симптомы гиперацидного гастрита:
— боли/дискомфорт в эпигастрии
— изжоги
— ощущение дискомфорта при длительных перерывах между приемами пищи
— неприязнь к кислому
— отрыжка кислым
— быстрый процесс пищеварения
ГИПОАЦИДНЫЕ ГАСТРИТЫ — характерна пониженная кислотность.
• Из-за отсутствия соляной кислоты нет антибактериального действия желудочного сока
• Не уничтожаются бактерии и микробы, попадая в кишечник
• Там они получают благоприятные условия для размножения
• Ослабляется перистальтика толстого кишечника
• Запор
• Процессы гниения и брожения
• Колиты, энтероколиты, геморрой
• Размножение гнилостной микрофлоры (кандида, стафилококк, хеликобактер и тд.)
• Возможно появление в дальнейшем различного рода опухолей, вплоть до злокачественных!!!
Симптомы гипоацидных гастритов:
— Отрыжка тухлым
— Запоры, геморрой
— Анемия, гиповитаминозы
— Вздутие, газообразование
— Сложно набрать вес
— Зависимость от соли
— Большое количество паразитов, патогенной микрофлоры, хеликобактер и тд.
Как бы это парадоксально не звучало, но какое бы у вас заболевание не было, они возникло неслучайно, под воздействием нескольких факторов: питания, стресса, воды. И начинать нужно прежде всего с питания и смены образа жизни и мышления. Диагностики и лечения ЖКТ.
________
Нужна помощь ведущих специалистов?
Запишитесь на прием по номеру 76-00-00 , 47-00-00
Имеются противопоказания. Необходимо проконсультироваться со специалистом.
Соляная кислота-HCl-кислота, многоразовая
Ноябрь 2003 г.
Соляная кислота. Ваш желудок естественным образом помогает переваривать обед. Он используется в промышленности для обработки стали, материала, который выбирают для подвесных мостов, легковых и грузовых автомобилей. Соляная кислота также используется в производстве батарей, фотовспышек и фейерверков. Его даже используют для обработки сахара и изготовления желатина. Соляная кислота, как и соединение хлора в прошлом месяце,
Соляная кислота, как и соединение хлора в прошлом месяце,
хлорид натрия — еще одно химическое вещество «рабочей лошадки», потому что оно невероятно полезно во многих отношениях.
В отличие от хлорида натрия, с соляной кислотой нелегко обращаться, и меры безопасности ОБЯЗАТЕЛЬНЫ! Эта кислота имеет резкий раздражающий запах и является очень едким веществом, то есть повреждает большинство предметов, к которым прикасается. Вам может быть интересно, как можно хранить такую реактивную жидкость, не повредив ее емкость. Металлические емкости для этой кислоты не подходят, но пластиковые емкости, например, из ПВХ (поливинилхлорида), выдерживают очень хорошо.
Это фотография операции травления стали, производимой Greer Steel Company в Дувре,
Огайо. При травлении стали раствор соляной кислоты используется для удаления ржавчины и
Шкала
для подготовки стальной поверхности к нанесению защитного покрытия. Обратите внимание на ржавый
Обратите внимание на ржавый
появление стальных валков на переднем плане и блестящих стальных валков, уже
«маринованный» на конвейерной ленте.Около соляной кислоты, производимой в
U.S. используется для травления стали. (Фото любезно предоставлено Greer Steel Company)
HCl представляет собой соединение хлористого водорода. Каждая молекула HCl состоит из водорода и хлора в соотношении один к одному. (См. Схему в левом верхнем углу страницы). При комнатной температуре HCl представляет собой бесцветный ядовитый газ. Растворите его в воде, и вы получите соляную кислоту.Для справки, кислоты — это вещества, выделяющие в воду ионы водорода. Чем больше ионов водорода выделяет кислота в воде, тем сильнее кислота (см. «Что такое ион?» Ниже). Если вы пришли к выводу из приведенного выше обсуждения, что HCl выделяет много ионов водорода в воду, вы правы!
Что такое ион?
Ион — это атом, который получил или потерял электроны. Электроны — это отрицательно заряженные субатомные частицы, которые уравновешивают положительно заряженные протоны в незаряженных (нейтральных) атомах.
Электроны — это отрицательно заряженные субатомные частицы, которые уравновешивают положительно заряженные протоны в незаряженных (нейтральных) атомах.
При растворении HCl в воде образуются ионы H и Cl. Водород теряет электрон (становится ионом с зарядом +1), а хлор приобретает электрон (становится ионом с зарядом -1).
Сильные кислоты, такие как HCl, выделяют в воду гораздо больше ионов водорода, чем слабые кислоты, такие как уксус или лимонный сок.
Дополнительные вопросы:
- Узнайте названия и химические формулы как минимум двух встречающихся в природе кислот.Что общего между химическими формулами кислот?
- Что подразумевается под pH кислоты? Как это связано с силой кислоты?
- Основания — это соединения, которые реагируют с кислотами с образованием воды и соли:
Кислота + Основание? Соль + вода.
Другими словами, кислоты и основания нейтрализуют друг друга. Напишите реакцию HCl с основным гидроксидом натрия (NaOH) и опишите своими словами, что происходит.(Намекать:
Напишите реакцию HCl с основным гидроксидом натрия (NaOH) и опишите своими словами, что происходит.(Намекать:
Хлорное соединение месяца октября играет роль в этой реакции!)
Идеи научных проектов:
- Как получается, что соляная кислота не разрушает внутреннюю оболочку желудка человека? Изучите причину, а также некоторые заболевания, связанные с «кислым желудком».
- Изучите методы, используемые для очистки случайных разливов кислот.Как принципы химии используются в этих операциях?
Чтобы просмотреть список предыдущих функций «Хлорное соединение месяца», щелкните
здесь.
соляная кислота | Соляная кислота
Использование и преимущества
Соляная кислота — сильная коррозионная кислота, которую можно использовать в промышленности для обработки стали, используемой в строительстве. Он используется в химической промышленности при крупномасштабном производстве винилхлорида, используемого для изготовления поливинилхлоридного (ПВХ) пластика, и является одним из химикатов, используемых для производства пенополиуретана и хлорида кальция.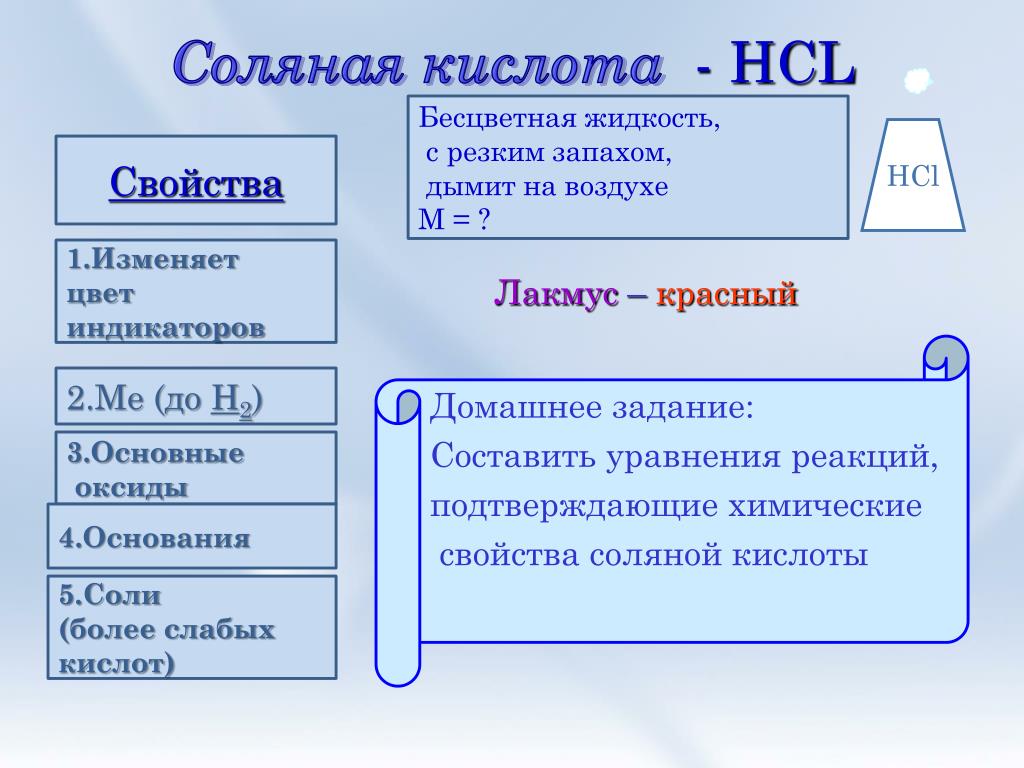
Соляная кислота также используется для производства многих других химикатов, а также в качестве дезинфицирующего средства и слизи, химического вещества, предотвращающего рост слизи в бумажной массе.
Другие распространенные конечные применения соляной кислоты включают бытовые чистящие средства, обслуживание бассейнов и производство продуктов питания.
Производство стали
Соляная кислота используется в операциях травления для удаления ржавчины и других примесей с углеродистой, легированной и нержавеющей стали, для подготовки стали к окончательному применению в строительных проектах, а также в таких продуктах, как кузова автомобилей и бытовая техника.Он также используется при травлении алюминия и очистке металлов.
Бытовые чистящие средства
Соляная кислота может входить в состав бытовых чистящих средств, таких как чистящие средства для унитазов, чистящие средства для плитки для ванных комнат и другие чистящие средства для фарфора, из-за ее коррозионных свойств, которые помогают очищать стойкие пятна.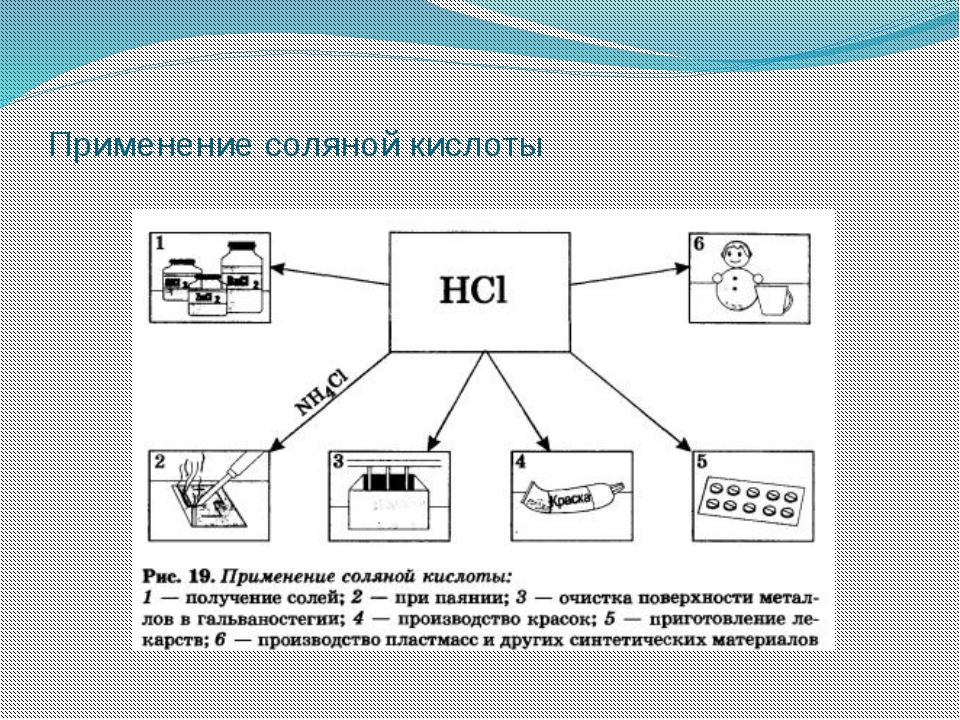
Очистка бассейна
Соляная кислота используется в качестве химиката для обработки плавательных бассейнов, чтобы поддерживать оптимальный pH в воде.
Производство и обработка пищевых продуктов
В пищевой промышленности соляная кислота используется для обработки различных пищевых продуктов, таких как кукурузные сиропы, используемые в безалкогольных напитках, печенье, крекерах, кетчупах и злаках.Соляная кислота также используется в качестве подкислителя в соусах, овощных соках и консервированных продуктах, чтобы улучшить вкус и уменьшить порчу.
Производство хлорида кальция
Когда соляная кислота смешивается или реагирует с известняком, образуется хлорид кальция, тип соли, используемый для удаления льда с дорог. Хлорид кальция также используется в производстве пищевых продуктов в качестве стабилизатора и укрепляющего агента, например, в выпечке, а также в качестве противомикробного средства.
Дополнительное использование
Соляная кислота используется в производстве батарей, фотовспышек и фейерверков. Он также используется при обработке кожи, строительстве, кислотной обработке нефтяных скважин и производстве желатиновых продуктов.
Он также используется при обработке кожи, строительстве, кислотной обработке нефтяных скважин и производстве желатиновых продуктов.
Соляная кислота — обзор
8.1.2.2 Коррозия в присутствии газообразных соединений хлора
Присутствие соляной кислоты или молекулярного хлора в газовой фазе значительно увеличивает скорость коррозии стали. Скорость, обнаруженная в установках для сжигания отходов, достигает 1000 нм / ч. Исследования [17] доказывают, что при отсутствии HCl образуется прочный прочный защитный слой.При концентрации 0,1% HCl на поверхности Fe 2 O 3 (гематит) образуются пузырьки, которые, тем не менее, не влияют на целостность защитной окалины. Однако концентрация HCl в дымовых газах 0,8% полностью нарушает целостность слоя гематита, а слой магнетита (Fe 3 O 4 ) становится неравномерным и пористым. Приблизительно 2% соляной кислоты в дымовых газах разрушают оба слоя. Когда рассматриваются окислительные условия, эти явления часто называют активным окислением, катализируемым присутствием хлора. Влияние летучих соединений хлора на высокотемпературную коррозию различных сплавов было предметом ряда исследований [6,11,12,14,19,23]. Результаты исследований однозначно указывают на то, что летучие соединения хлора разрушают защитный оксидный слой и тем самым разрушают саму металлическую поверхность. Анализируемые механизмы основаны в основном на исследованиях HCl, Cl 2 и паров NaCl.
Влияние летучих соединений хлора на высокотемпературную коррозию различных сплавов было предметом ряда исследований [6,11,12,14,19,23]. Результаты исследований однозначно указывают на то, что летучие соединения хлора разрушают защитный оксидный слой и тем самым разрушают саму металлическую поверхность. Анализируемые механизмы основаны в основном на исследованиях HCl, Cl 2 и паров NaCl.
Газовая коррозия металлов может быть вызвана некоторыми соединениями, содержащими хлор, но чаще всего HCl и в меньшей степени Cl 2 .Первый преобладает в условиях котла, поскольку дымовой газ содержит водяной пар. Однако Cl 2 может образовываться в восстановительных условиях путем термического разложения HCl [6].
Если сталь подвергается воздействию окислительной атмосферы, образуются стабильные оксиды, слой которых постепенно уменьшает диффузию кислорода к металлической поверхности. Таким образом, окисление происходит по так называемому параболическому закону (постепенное уменьшение интенсивности во времени).
Тем не менее, хлор демонстрирует способность проникать через защитный слой оксидов.Он диффундирует через слой, проходит через щели или поры слоя окалины, пока не достигнет поверхности металла, и вступает с ней в реакцию с образованием хлоридов. На границе окалины и металла очень низкий кислородный потенциал. Это соответствует низкому парциальному давлению O 2 , поскольку кислород расходуется на образование оксидов. Такие условия способствуют термической стабильности хлоридов FeCl 2 и CrCl 2 (рис. 8.1). Летучая HCl и Cl 2 реагируют с металлами с образованием хлоридов в соответствии с реакцией (8.9). Кроме того, металлы могут напрямую реагировать с HCl в соответствии с реакцией (8.10). Хлориды металлов демонстрируют высокие парциальные давления своих паров на границе окалина-поверхность металла, поэтому их постоянная сублимация возможна в соответствии с реакцией (8.11)
(8.9) M (s) + Cl2 (g) → MCl2 (s)
(8,10) M (т) + 2HCl (г) → MCl2 (г) + h3 (г)
(8,11) MCl2 (т) → MCl2 (г)
где M = Fe, Cr, Ni и ( s), (g) обозначают твердую и газообразную фазы соответственно.
Образующиеся таким образом летучие хлориды металлов могут диффундировать от металлической поверхности к слою окалины.Концентрация кислорода, возрастающая по мере удаления от металлической поверхности, способствует снижению термодинамической стабильности хлоридов и их окислению в твердые оксиды. Тем не менее оксиды, выделяемые из газовых фаз, образуют очень рыхлый слой осаждения, который не защищает трубы от коррозии. В этом случае хлорная коррозия протекает по линейному правилу — линейное увеличение во времени.
(8,12) 3MCl2 (г) + 2O2 (г) → M3O4 (т) + 3Cl2 (г)
(8,13) 2MCl2 (г) + (3/2) O2 (г) → M2O3 (т) + 2Cl2 (g)
В результате реакций (8.12) и (8.13), хлор выделяется и диффундирует в дымовой газ или возвращается к металлической поверхности и запускает следующий цикл. Графическое изображение этого механизма показано на рис. 8.2 [18]. Цикл постепенно перемещает материал с металлической поверхности в зону повышенной концентрации кислорода, а конечный расход хлоридов остается низким. Конечная реакция проходит в соответствии с:
Конечная реакция проходит в соответствии с:
Рисунок 8.2. Схема коррозии от летучих соединений хлора [18].
(8.14) 4M (s) + 3O2 (g) → 2M2O3 (s)
Было также обнаружено, что газообразные соединения хлора могут проникать по границам зерен стали, что называется межкристаллитной коррозией.
В восстановительной среде, где оксиды отсутствуют или нестабильны, хлориды металлов могут образовываться непосредственно на поверхности трубы в соответствии с формулой. (8.9). Скорость хлорной коррозии сильно (экспоненциально) зависит от температуры и теоретически [19] может возрасти примерно в 80 раз при повышении температуры с 300 до 450 ° C.В действительности такой сильной коррозии не наблюдается, поскольку хлоридная коррозия определяется не только кинетикой реакции, но и в большей степени диффузией газа через зазоры в отложениях и окалине. Поэтому свойства отложений могут иметь большее значение, чем градиенты температуры и парциального давления. Кроме того, скорость коррозии зависит от процесса испарения хлоридов металлов, который также является функцией температуры.
Вышеупомянутые процессы настолько сложны, что, несмотря на ряд исследований, нет единого подхода в их описании.Хлорная коррозия — это сложное взаимодействие реакций, которые регулируются кинетикой, диффузией и фазовым переходом, включая конденсацию, плавление, сублимацию и испарение. Согласно исх. Согласно [20] скорость коррозии определяется зависимостью между скоростью химической реакции и скоростью испарения образующихся хлоридов. При температуре дымовых газов ниже 500 ° C образуется защитный слой хлорида железа, скорость коррозии регулируется параболическим законом и со временем уменьшается. Для более высоких температур скорость коррозии сначала следует параболическому закону, а затем линейному правилу.Это происходит в результате повышения температуры, так как отложения хлоридов становятся более толстыми. Следовательно, достигается определенная толщина, при которой скорости осаждения и испарения находятся в равновесии, и осадок не растет. При температурах, превышающих 800 ° C, увеличения слоя хлоридов недостаточно для покрытия испарения, и скорость коррозии подчиняется линейному закону.
Усиление коррозии железа может быть вызвано образованием легкоплавкого хлорида железа FeCl 3 по реакции:
(8.15) FeCl2 + HCl + (1/4) O2 → FeCl3 + (1/2) h3O
В восстановительной атмосфере HCl может реагировать с CO и H 2 , поражая оксидный слой [9]:
(8.16) Fe2O3 + 2 HCl + CO → FeO + FeCl2 + h3O + CO2
(8.17) Fe3O4 + 2 HCl + CO → 2FeO + FeCl2 + h3O + CO2
Дополнительным источником разрушения, которое происходит при образовании твердых хлоридов, является механическое напряжение связано с увеличением объема FeCl 2 по сравнению с объемом железа.
HCl и Cl 2 из-за повреждения защитных слоев могут ускорить другие виды газовой коррозии, например.грамм. коррозия, вызванная серой.
Типичная картина коррозии газообразными соединениями хлора выглядит следующим образом: темный многослойный осадок оксидов, слабо приставший к трубке. Его толщина составляет около 0,1-0,3 мм. При удалении открывается тонкий коричневатый слой, который непосредственно прилипает к поверхности трубки. В конкретном случае испарителя слой отложений обычно тонкий, однако он может быть толще, если коррозия такого рода происходит на трубках пароперегревателя.
В конкретном случае испарителя слой отложений обычно тонкий, однако он может быть толще, если коррозия такого рода происходит на трубках пароперегревателя.
На основании лабораторных исследований, приведенных в работе.[21], можно сделать вывод, что быстрый рост оксидного слоя из-за воздействия хлора может также происходить, когда соединения хлора отсутствуют на металлической поверхности. Поэтому всегда следует учитывать воздействие хлора и хлоридов, если накипь на трубках отслоилась и отслоилась.
Как обычно используется соляная кислота в промышленности?
Соляная кислота или «HCL», или обычно известная как соляная кислота, используется в широком диапазоне промышленных и коммерческих применений.Людям, которые работают в отраслях, где используется это химическое вещество, важно понимать, как обычно используется соляная кислота, для каких целей она служит и что вам нужно знать, чтобы обращаться с ней безопасно и ответственно.
Соляная кислота — жидкая версия хлористого водорода, кислого газа. Это происходит естественным путем, а также производится в промышленных масштабах. Хотя HCL может быть агрессивной и опасной жидкостью, он естественным образом встречается в нашем организме. Это химическое вещество используется в нашей пищеварительной системе, регулируется слизистой оболочкой желудка, а также гормоном секретином.
Это происходит естественным путем, а также производится в промышленных масштабах. Хотя HCL может быть агрессивной и опасной жидкостью, он естественным образом встречается в нашем организме. Это химическое вещество используется в нашей пищеварительной системе, регулируется слизистой оболочкой желудка, а также гормоном секретином.
В жидкой форме HCL вызывает коррозию и имеет резкий раздражающий запах. Система идентификации опасностей Национальной ассоциации противопожарной защиты классифицирует промышленные вещества на основе различных факторов риска и оценивает каждую область риска от 0 до 4. Оценка 0 означает, что материал не представляет угрозы, тогда как все, что имеет рейтинг 4, означает опасность для жизни. Рейтинг HCL NFPA:
- Риск для здоровья: 3 (крайняя опасность)
- Воспламеняемость: 0 (при нормальных условиях не горит)
- Стабильность: 1 (обычно стабильна, но может стать нестабильной при повышенных температурах и давлениях)
Любой, кто взаимодействует с соляной кислотой, должен знать об этих факторах, потому что надлежащая защита и локализация жизненно важны. Имейте в виду, что надлежащие процедуры обращения с соляной кислотой варьируются от отрасли к отрасли, но всегда есть лучшие отраслевые практики, которым нужно следовать.
Имейте в виду, что надлежащие процедуры обращения с соляной кислотой варьируются от отрасли к отрасли, но всегда есть лучшие отраслевые практики, которым нужно следовать.
Итак, каковы способы использования HCL в различных отраслях промышленности?
HCL используется при производстве ПВХ
Поливинилхлорид (ПВХ) устойчив к коррозии соляной кислотой, что является одной из основных причин, почему ПВХ используется для многих аспектов локализации и транспортировки HCL. HCL можно использовать для производства органических соединений, которые затем используются для производства ПВХ.
Регулировка уровней PH
Подобно тому, как HCL регулирует уровень pH в нашем желудке, его также можно использовать для регулирования уровня pH в расходных материалах и лекарствах. Он может способствовать поддержанию баланса pH нашей питьевой воды, продуктов питания и фармацевтических препаратов.
Безопасность бассейна
Соляная кислота — одно из химических веществ, которые играют роль в поддержании безопасного уровня pH для пловцов в общественных и частных бассейнах.
Очистка соли
При добавлении к хлориду натрия HCL запускает процесс очистки, в результате которого получается безопасная, пригодная для использования поваренная соль.
Травильная сталь
Сталевары используют HCL для процесса травления, который удаляет ржавчину со стали как в рулонах, так и в листах.
Обработка кожи
Соляная кислота — одно из веществ, используемых в процессе дубления кожи. Кожевенные заводы используют HCL, чтобы остановить развитие бактерий и поддерживать надлежащий уровень pH кожи.
Регенерирующие иониты
Это важный шаг в обеспечении безопасности воды. По сути, HCL способствует удалению ионизированных частиц из воды.Любой, кто купил деионизированную воду, извлек выгоду из роли HCL в процессе ионного обмена.
Управление сточными водами
Помимо очистки питьевой воды, HCL используется для производства неорганических соединений, которые используются при обработке сточных вод.
Добыча нефти
HCL используется в процессе гидроразрыва пласта и во многих процессах добычи газа и нефти для подкисления скважины с целью удаления карбонатных коллекторов или известняков из породы или в сочетании с другими материалами для растворения кварца, песка и глины из горных пород.В скважину можно вводить другие добавки, чтобы кислота не разрушала стальные кожухи.
Пищевая промышленность использует
Некоторые добавки, используемые в пищевой промышленности, включают HCL в процесс разработки. К ним относятся фруктоза, лимонная кислота и гидролизованный растительный белок.
Этот список демонстрирует, что HCL можно использовать для широкого круга целей, которые большинство людей никогда бы не рассматривали. Многие из этих применений довольно безобидны, хотя сама соляная кислота звучит устрашающе.Самым важным является наличие надлежащих процедур для использования HCL в каждом из этих процессов.
Кислота соляная
2
Соляная кислота повышает активность катализатора
25 августа 2020 г. — Исследовательская группа разработала процесс синтеза, который резко увеличивает активность катализаторов обессеривания сырой нефти. Возможно, новый процесс можно использовать и для катализаторов…
— Исследовательская группа разработала процесс синтеза, который резко увеличивает активность катализаторов обессеривания сырой нефти. Возможно, новый процесс можно использовать и для катализаторов…
Секреты жуткой фотографической техники
30 октября 2019 г. — В 1960-х годах французский художник по имени Жан-Пьер Судр начал экспериментировать с малоизвестным фотографическим процессом XIX века, создавая драматические черно-белые фотографии с неземной вуалью …
Расшифровка механизма: как органические кислоты образуются в атмосфере
12 мая 2021 года — кислотность атмосферы все больше определяется углекислым газом и органическими кислотами, такими как муравьиная кислота.Второе из них влияет на рост облаков и pH дождевой воды. Но химическая …
Включение и выключение цвета пористого материала с помощью кислоты
8 февраля 2019 г. — Стабильный изменяющий цвет состав демонстрирует потенциал для электроники, датчиков и газа . ..
..
«Терминаторский» жидкий металл движется и растягивается в трехмерном пространстве
20 марта 2019 г. — Во франшизе блокбастера «Терминатор» злой робот трансформируется в различные человеческие формы и объекты и просачивается сквозь узкие отверстия благодаря своему «жидкому металлу»…
Пористые материалы проливают свет на очистку окружающей среды
5 июля 2018 г. — Ученые разработали стабильные монокристаллические пористые органические каркасы с водородными связями, которые являются термически и химически стойкими, имеют большую площадь поверхности и флуоресцентные свойства. …
LED-Ing the Way: чистый и удобный метод окисления пластиковых поверхностей для промышленности
11 июня 2019 г. — Исследовательская группа использовала диоксид хлора для окисления полипропилена.При облучении светодиодами радикалы ClO2 * атакуют метильные группы полипропилена, превращая их в карбоновую кислоту. C-H …
Предотвращение разрушения бетонных мостов
19 декабря 2018 г. — В новом исследовании изучается неблагоприятное воздействие адсорбции компонентов природного газа, обнаруженных в нашей окружающей среде, и смесей нескольких таких газов одним из материалов, из которых состоит …
— В новом исследовании изучается неблагоприятное воздействие адсорбции компонентов природного газа, обнаруженных в нашей окружающей среде, и смесей нескольких таких газов одним из материалов, из которых состоит …
Доставка грузов полимерами
Янв.22 февраля 2021 г. — Разлагаемые полимеры на биологической основе предлагают варианты химической переработки и могут быть инструментом для хранения и высвобождения полезных молекул. Ученые разработали класс полимеров на основе сахара, которые …
Реактор превращает парниковый газ в чистое жидкое топливо
3 сентября 2019 г. — Реактор электрокатализа, построенный в Университете Райса, перерабатывает диоксид углерода для производства чистых жидких топливных растворов с использованием электричества. Ученые, стоящие за изобретением, надеются, что оно станет…
Соляная кислота | Подкаст | Chemistry World
Мира Сентилингам
На этой неделе кислотное соединение, используемое на протяжении всей истории, в промышленности, а также в нашем организме. Вот Брайан Клегг:
Вот Брайан Клегг:
Брайан Клегг
Большинство из нас впервые сталкивается с трио сильных кислот — соляной, азотной и серной — когда заходит в химическую лабораторию в школе. Это не те вещества, которые вы найдете в кухонном шкафу дома.Тем не менее, я могу гарантировать, что одно из этих соединений было частью вашей жизни каждый день с самого детства. Потому что соляная кислота играет важную роль в вашем организме.
Эта сильнодействующая кислота, водный раствор хлористого водорода, известна давно. Ранние названия кислоты имеют довольно морской привкус, отражающий производство кислоты из поваренной соли. Алхимики назвали бы его «духи соли», в то время как его обычное название до появления современных конвенций было соляной кислотой, где «соляная кислота» была причудливым термином для соленой кислоты.Как сказал один Н. Грю в 1675 году, «Муриатик — это соленость, соединенная с некоторой остротой».
Неизвестно, когда именно была впервые получена соляная кислота. Алхимики были склонны создавать смеси, которые вполне могли содержать соляную кислоту, и некоторые предполагают, что Джабир ибн Хайян создал ее еще в девятом веке. В средневековье он наверняка использовался в царской водке, смеси соляной и азотной кислот. Мы действительно знаем, что в одном из газовых экспериментов Джозефа Пристли 1772 года был получен чистый газообразный хлористый водород, и что Хамфри Дэви успешно показал, что это соединение содержит водород и хлор в 1818 году.
Алхимики были склонны создавать смеси, которые вполне могли содержать соляную кислоту, и некоторые предполагают, что Джабир ибн Хайян создал ее еще в девятом веке. В средневековье он наверняка использовался в царской водке, смеси соляной и азотной кислот. Мы действительно знаем, что в одном из газовых экспериментов Джозефа Пристли 1772 года был получен чистый газообразный хлористый водород, и что Хамфри Дэви успешно показал, что это соединение содержит водород и хлор в 1818 году.
Мы склонны довольно свободно называть соляную кислоту HCl, но когда хлористый водород растворяется в воде, положительный ион водорода соединяется с водным H 2 O с образованием гидрокония (H 3 O + ), оставляя отрицательный хлорид-ион. Концентрированная соляная кислота составляет около 38% хлористого водорода.
Первоначально большая часть промышленного хлористого водорода представляла собой отходы, которые выбрасывались в воздух, но к середине девятнадцатого века уровень загрязнения больше не считался приемлемым. К счастью, к этому времени отработанный хлористый водород стал ценным для производства соляной кислоты. Хотя используемые процессы изменились, перейдя от побочного продукта производства карбоната натрия к производству, в основном, наряду с органическими соединениями, соляная кислота по-прежнему в основном представляет собой повторное использование отходов, мармита кислотного мира.
К счастью, к этому времени отработанный хлористый водород стал ценным для производства соляной кислоты. Хотя используемые процессы изменились, перейдя от побочного продукта производства карбоната натрия к производству, в основном, наряду с органическими соединениями, соляная кислота по-прежнему в основном представляет собой повторное использование отходов, мармита кислотного мира.
Большая часть промышленного производства соляной кислоты идет на травление и используется в различных химических производственных процессах.Рассматриваемое травление не связано с луком, а является способом удаления поверхностного обесцвечивания стали и других металлов.
В промышленных химических процессах соляная кислота используется для производства молекул, содержащих хлор, для пластмассовых изделий, таких как диохлорэтан и винилхлорид (используется для производства ПВХ). Поскольку большая часть мирового производства хлористого водорода происходит как побочный продукт других химических процессов, соляная кислота часто производится и потребляется на месте, эффективно рециркулируя в процессе, а не когда-либо становится отдельным коммерческим продуктом.
Хотя соляная кислота играет важную роль в пищевой промышленности, где она используется для контроля pH воды при производстве продуктов питания, она играет гораздо более фундаментальную роль, когда речь идет о потреблении пищи. Ваш желудок содержит значительное количество соляной кислоты и может иметь pH всего 1.
Часть роли этой мощной кислоты — предотвращение инфекции, но ее основная функция — пищеварение. Кислота атакует белки в процессе, известном как денатурирование, что заставляет их распадаться, что облегчает их расщепление ферментами для пищеварения.Возможно, наиболее знакомым примером денатурации является то, как белки яичного белка денатурируются при варке, превращаясь из прозрачной жидкости в непрозрачное твердое вещество. Здесь нарушение структуры приводит к образованию запутанной массы денатурированного белка, но в желудке результатом является выполнение первоначальной работы по разрушению, позволяющей ферментам, таким как пепсин, разделять белки на более мелкие фрагменты.
Ваш желудок защищен от содержащейся в нем кислоты толстым слоем слизи, а мощная мышца закрывает верхнюю часть желудка.Но задействованные механизмы иногда могут работать неправильно, в результате чего кислота попадает в пищевод, вызывая ощущение жжения при кислотном рефлюксе, или просто вызывает расстройство желудка.
Хотя сейчас существуют сложные лекарства, которые в первую очередь снижают выработку кислоты, многие из нас по-прежнему прибегают к простой неорганической химической реакции и глотают пару таблеток антацида при заболеваниях желудка. На рынке есть различные лекарства, но многие из них содержат карбонат кальция или магния, что приводит к простой реакции, которая нейтрализует кислоту с образованием хлорида, воды и углекислого газа.
Будь то очистка ржавого металла, производство ПВХ или расщепление белков, соляная кислота — это соединение, которое просто выполняет свою работу. Соляная кислота может быть причиной неудобных ночей, когда мы слишком много ели и страдаем от последствий избытка кислоты в желудке, но это более чем компенсируется ее повседневной ролью в превращении пищи в топливо.
Мира Сентилингам
И поскольку это топливо помогает нам прожить день, я уверен, что мы можем простить несколько бессонных ночей из-за несварения желудка.Это был научный писатель Брайан Клегг с химией, лежащей в основе широко используемого и, возможно, недооцененного соединения, соляной кислоты. Теперь, учитывая то, как мы все любим есть, на следующей неделе мы встретим соединение у источника всей этой пищи.
Дункан Макмиллан
Это правда, вероятно, недостаточно признанная, что мы обязаны своим существованием и сетью жизни, которая нас поддерживает, пище, произведенной светом. У подножия почти каждого древа жизни, от тундры до саванны до коралловых рифов и океанских желобов, всю тяжелую работу выполняет фотосинтезирующий организм.И молекула, которая заставляет это происходить, — хлорофилл.
Мира Сентилингам
И чтобы узнать, как именно хлорофилл использует свет для производства продуктов питания и как это соединение также вдохновляло известных художников на протяжении веков благодаря его использованию в определенном духе, присоединитесь к Динкану Макмиллану в презентации Chemistry in its element на следующей неделе. А пока спасибо за внимание. Я Мира Сентилингам.
А пока спасибо за внимание. Я Мира Сентилингам.
Промышленное использование и хранение соляной кислоты
Соляная кислота (HCl), также известная как соляная кислота, представляет собой бесцветную или слегка желтоватую жидкость, которая токсична и вызывает коррозию.Он используется во многих различных областях, включая производство хлоридов, очистку руды и производство металлов, таких как тантал и олово. Поскольку HCl является мощной кислотой, ее часто используют для нейтрализации основных систем нескольких различных типов.
Есть несколько мест, где HCl используется и встречается в промышленности, и ее конкретное использование может помочь определить потенциальные проблемы хранения.
Соляная кислота в природе
Интересно, что HCl можно найти в желудке человека.Он входит в состав желудочного сока и является важной частью нашей пищеварительной системы. Несмотря на то, что желудок наносит серьезный ущерб, от повреждений желудок защищен секрецией толстого слоя слизистой, а также гормоном секретином. В некоторых случаях люди могут страдать от несварения желудка или даже язвы желудка из-за того, что эта кислота не обрабатывается должным образом встроенными механизмами организма
В некоторых случаях люди могут страдать от несварения желудка или даже язвы желудка из-за того, что эта кислота не обрабатывается должным образом встроенными механизмами организма
Это не единственное место, где мы обнаружили, что он работает, он имеет множество применений в разных отраслях.
Для чего используется соляная кислота?
Вот 10 основных видов промышленного использования соляной кислоты:
- Производство органических соединений, таких как дихлорэтан и винилхлорид, которые используются для производства ПВХ (поливинилхлорида)
- Регулирование уровня pH в различных производственных процессах, включая производство питьевой воды, пищевых продуктов и фармацевтических препаратов
- Снижение pH или общей щелочности воды в плавательных бассейнах до оптимального уровня для пловцов.
- Соль поваренная очищающая
- Травление стали — удаление ржавчины и окалины со стального рулона или листа
- Обработка кожи в кожевенной промышленности
- Регенерирующие ионообменники
- Производство неорганических соединений, таких как железная кислота и хлоргидрат алюминия, для очистки воды
- Сопровождение добычи нефтяных скважин
- Обработка различных добавок, таких как фруктоза, лимонная кислота и гидролизованный растительный белок
Как эффективно хранить соляную кислоту?
Poly Processing предоставляет полную систему резервуаров для хранения химикатов для всех отраслей, упомянутых выше, и не только, а наши резервуары для хранения сертифицированы по стандарту NSF / ANSI 61. Это набор стандартов, относящихся к очистке воды, а также строгих требований к контролю оборудования, используемого для обработки воды и питьевой воды. Поскольку правильные методы хранения так важны, мы предлагаем различные системы резервуаров для хранения, которые наилучшим образом соответствуют вашим потребностям, в зависимости от того, где они хранятся и для чего они используются.
Это набор стандартов, относящихся к очистке воды, а также строгих требований к контролю оборудования, используемого для обработки воды и питьевой воды. Поскольку правильные методы хранения так важны, мы предлагаем различные системы резервуаров для хранения, которые наилучшим образом соответствуют вашим потребностям, в зависимости от того, где они хранятся и для чего они используются.
Важно убедиться, что ваше решение для хранения химикатов соответствует правильному набору стандартов для вашего конкретного применения. Poly Processing придерживается самых высоких стандартов, и мы — единственная компания, у которой есть полностью укомплектованный химический резервуар, сертифицированный по стандартам NSF / ANSI 61.
Поскольку HCl очень агрессивен, мы рекомендуем специальные меры безопасности для резервуаров. В случае разлива химикатов вторичная локализация имеет решающее значение для предотвращения повреждения оборудования или создания опасности для сотрудников. Система SAFE-Tank® — это резервуар внутри резервуара, который может содержать утечку, если основной резервуар для хранения химикатов окажется скомпрометирован.
