Содержание
почему CrO3 кислотный оксид, если Cr металл?
Здійснити перетворення MgCl2-MgCO2-MgCl2-x-MgO-Mg(NO3)2
10. Изомером пропена является:А) Ch4 — CH, — СН3b) CH — CH = CH — CHB) Ch4 — Ch3 — Ch3 — Ch4T) CH — C=C — CHỊАГІ
визначте масову виходу кальцій карбонату від теоретично можливого, якщо відомо, що при взаємодії 5,6г кальцій оксиду з вуглекислим газом, одержали 5г
…
кальцій карбонату
вкажіть назву реакції яку використовують для якісного визначення білка
укажіть сполуки до складу яких входить залишок гліцерину запишіть їх формули
C9h30o
Составить 8-10 изомеров вещества, не забыв при этом О (кислород)
Написати у повному та скороченому іонному рівнянні FeCl2+h3SO4=
К физическим телам относится:Варианты ответовводасвечартутьазотВопрос 2Признак реакции горения угля:Варианты ответовОбразование осадкаВыделение теплаР
…
астворении осадкаПоглощение теплаВопрос 30,5 моль углекислого газа содержит молекул:Варианты ответов6. 02*102312.04*10233.01*10239.03*1023Вопрос 49. Реакцией разложения является:Варианты ответов2Н2 + O2 = 2 Н2ONa2О + СO2 = Na2СО3Cu(OH)2 = CuO + Н2OС + О2 = СO2Вопрос 5В 80 г воды растворили 20 г соли. Массовая доля соли в растворе:Варианты ответов25%20%40%30%Вопрос 61. Валентность марганца равна IV в соединении:Варианты ответовMnO2MnOMn2O7MnCl2Вопрос 7При добавлении в раствор воды массовая доля вещества в растворе:Варианты ответовНе изменяетсяУменьшаетсяУвеличиваетсяВопрос 8Основным оксидом является:Варианты ответовSO3CO2CaOP2O5Вопрос 9При взаимодействии 1 моль натрия с соляной кислотой по уравнению реакции: 2Na + 2HCl = 2NaCl + h3 водорода выделится:Варианты ответов1,12 л2,24 л11,2 л22,4 лВопрос 10Реакцией обмена является:Варианты ответовCaO + СO2 = CaCO3Ca(OH)2 + 2HCl = CaCl2 + 2Н2Oh3SO4+ Mg = MgSO4 + h3h3CO3 = Н2O + СO2Вопрос 11Ряд формул кислот:Варианты ответовHNO3, HCl, K2CO3Nh4, h3O, h3SO4h3S, HBr, HNO3h3CO3, K2SO4, h4PO4Вопрос 12Пара формул веществ, реагирующих с оксидом натрия:Варианты ответовCaO, FeCl2MgO, Mg(OH)2Ca(OH)2, HNO3h3O, HClВопрос 13Оба металла реагируют с раствором соляной кислоты:Варианты ответовCu, AgAg, ZnMg, ZnMg, CuВопрос 14Вещества, вступающие в реакцию друг с другом:Варианты ответовСO2, HClN2O, Fe(OH)2CaO, HNO3CO2, SO3Вопрос 15Установите соответствие:Варианты ответовCa(OH)2HNO3CaOFeCl2Вопрос 16Как определить число электронов на внешнем энергетическом уровне в атоме элемента:Варианты ответовпо порядковому номеру элементапо номеру рядапо номеру периодапо номеру группыВопрос 17Чему равно число нейтронов в атоме +1531РВарианты ответов31151646Вопрос 18Определите соответствие тип связи — вещество:Варианты ответовBr2MgOHClCuF2Nh4O2Вопрос 19У какого элемента наиболее выражены металлические свойства:Варианты ответовмагнийнатрийкальцийжелезоВопрос 20Чем определяются степень окисления химических элементов:Варианты ответовзарядом ядра атомаколичеством протоновчислом электронов на внешнем слоеколичеством отданных (принятых) электроновВопрос 21Найдите массу гидроксида натрия, полученного при взаимодействии 248 г оксида натрия с водой.
02*102312.04*10233.01*10239.03*1023Вопрос 49. Реакцией разложения является:Варианты ответов2Н2 + O2 = 2 Н2ONa2О + СO2 = Na2СО3Cu(OH)2 = CuO + Н2OС + О2 = СO2Вопрос 5В 80 г воды растворили 20 г соли. Массовая доля соли в растворе:Варианты ответов25%20%40%30%Вопрос 61. Валентность марганца равна IV в соединении:Варианты ответовMnO2MnOMn2O7MnCl2Вопрос 7При добавлении в раствор воды массовая доля вещества в растворе:Варианты ответовНе изменяетсяУменьшаетсяУвеличиваетсяВопрос 8Основным оксидом является:Варианты ответовSO3CO2CaOP2O5Вопрос 9При взаимодействии 1 моль натрия с соляной кислотой по уравнению реакции: 2Na + 2HCl = 2NaCl + h3 водорода выделится:Варианты ответов1,12 л2,24 л11,2 л22,4 лВопрос 10Реакцией обмена является:Варианты ответовCaO + СO2 = CaCO3Ca(OH)2 + 2HCl = CaCl2 + 2Н2Oh3SO4+ Mg = MgSO4 + h3h3CO3 = Н2O + СO2Вопрос 11Ряд формул кислот:Варианты ответовHNO3, HCl, K2CO3Nh4, h3O, h3SO4h3S, HBr, HNO3h3CO3, K2SO4, h4PO4Вопрос 12Пара формул веществ, реагирующих с оксидом натрия:Варианты ответовCaO, FeCl2MgO, Mg(OH)2Ca(OH)2, HNO3h3O, HClВопрос 13Оба металла реагируют с раствором соляной кислоты:Варианты ответовCu, AgAg, ZnMg, ZnMg, CuВопрос 14Вещества, вступающие в реакцию друг с другом:Варианты ответовСO2, HClN2O, Fe(OH)2CaO, HNO3CO2, SO3Вопрос 15Установите соответствие:Варианты ответовCa(OH)2HNO3CaOFeCl2Вопрос 16Как определить число электронов на внешнем энергетическом уровне в атоме элемента:Варианты ответовпо порядковому номеру элементапо номеру рядапо номеру периодапо номеру группыВопрос 17Чему равно число нейтронов в атоме +1531РВарианты ответов31151646Вопрос 18Определите соответствие тип связи — вещество:Варианты ответовBr2MgOHClCuF2Nh4O2Вопрос 19У какого элемента наиболее выражены металлические свойства:Варианты ответовмагнийнатрийкальцийжелезоВопрос 20Чем определяются степень окисления химических элементов:Варианты ответовзарядом ядра атомаколичеством протоновчислом электронов на внешнем слоеколичеством отданных (принятых) электроновВопрос 21Найдите массу гидроксида натрия, полученного при взаимодействии 248 г оксида натрия с водой. (Запишите только число)
(Запишите только число)
Напишіть формули оксидів, що відповідають таким гідратам:h4PO4, Ca(OH)2, Fe(OH)3, h3SO3, Fe(OH)2, HNO3.
Напишіть формули гідратів, які відповідають таким оксидам: Al2O3, Li2O, SO3, N2O3, MgO, SiO2.
Хромовый ангидрид
%D
%d.%M.%y
%h~:~%m
Хромовый ангидрид (триоксид хрома, трёхокись хрома, оксид хрома IV), CrO3 — соединение хрома с кислородом, тёмно-красные кристаллы, хорошо растворимые в воде. Ангидрид хромовой и дихромовой кислот.
Физические свойства
Чёрно-красные с фиолетовым оттенком кристаллы — пластины или иголки. Гигроскопичен, расплывается на воздухе.
tпл=196 °C, при атмосферном давлении разлагается ниже температуры кипения.
Плотность 2,8 г/см³; Растворимость в воде — 166 г/100 г (15 °C), 199 г/100 г (100 °C).
Химические свойства
CrO3 — кислотный оксид. При его растворении в воде образуется хромовая кислота (при недостатке CrO3):
CrO3 (недост.) + H2O → H2CrO4,
или дихромовая кислота (при избытке CrO3):
2CrO3 + H2O → H2Cr2O7.
При взаимодействии CrO3 со щелочами образуются хроматы:
CrO3 + 2KOH → K2CrO4 + H2O.
При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода:
4CrO3 → 2Cr2O3 + 3O2↑.
Как и все соединения Cr(VI), CrO3 является сильным окислителем (восстанавливается до Cr2O3). Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним (хотя некоторые справочники указывают «растворим в спирте и эфире»).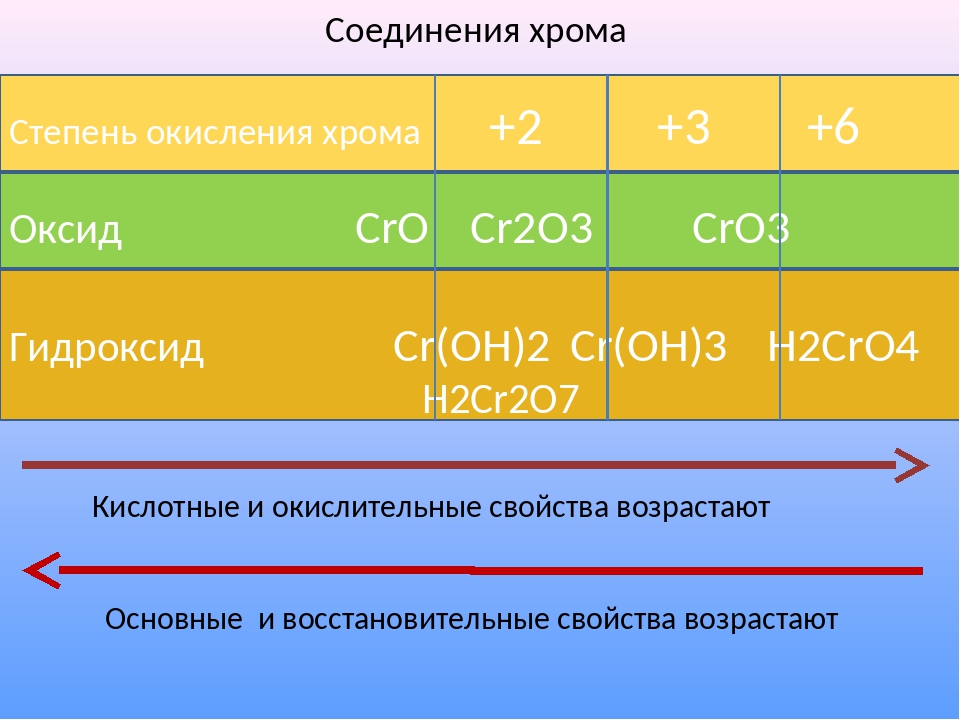 Окисляет иод, серу, фосфор, уголь, например:
Окисляет иод, серу, фосфор, уголь, например:
4CrO3 + 3S → 2Cr2O3 + 3SO2↑.
Получение
Получают действием H2SO4 на дихромат натрия Na2Cr2O7 (реже дихромат калия K2Cr2O7).
Na2Cr2O7 + H2SO4 → 2CrO3 + Na2SO4 + H2O
Применение
Используется для получения хрома электролизом, электролитического хромирования; хроматирования оцинкованных деталей, в качестве сильного окислителя, изредка в пиросоставах.
Применяют также, как окислитель в органической химии (в производстве изатина, индиго и т. д.).
В смеси с кизельгуром применяется для очистки ацетилена под названием «эпурит».
Растворы хромового ангидрида (или, чаще, дихромата калия) в серной кислоте широко используются в лабораторной практике для очистки посуды от органических загрязнений (хромовая смесь).
Токсичность
Оксид хрома(VI) очень ядовит, как и многие другие соединения шестивалентного хрома. Летальная доза для человека при попадании внутрь 0,08 г/кг.
Техника безопасности
Хромовый ангидрид — весьма химически активное вещество, способен вызвать при соприкосновении с органическими веществами возгорания и взрывы. Воспламеняет бензин при комнатной температуре и используется в качестве воспламенителя топлива в ракетной технике. При попадании на кожу вызывает сильные раздражения, экземы и дерматиты, а также может спровоцировать развитие рака кожи. Даже при своевременном удалении с кожных покровов оставляет пятна коричневого цвета. Весьма опасно вдыхание паров хромового ангидрида, хотя он и малолетуч.
Для хранения его применяется стеклянная или пластиковая герметичная посуда, необходимо исключение контакта с органическими веществами. Работа с ним требует применения спецодежды и средств индивидуальной защиты.
Хромовый ангидрид
Хромовый ангидрид — неорганическое соединение кислорода и хрома, оксид хрома (VI) с формулой CrO3.
Свойства
Кристаллическое вещество в виде пластинок, чешуек или игольчатых кристаллов темно-красного или малиново-красного цвета, возможны отливы фиолетового или черного. Реактив очень гигроскопичен, активно впитывает влагу из воздуха и расплывается, что следует учитывать при его хранении. Водорастворим, не горит. При нагревании свыше +250 °С превращается в оксид хрома (III).
С точки зрения химии, это кислотный оксид, при взаимодействии с водой образующий хромовую (Н2СrО4) или дихромовую кислоту (Н2Сr2О7). Реакция со щелочами дает соли хромовой кислоты — хроматы.
Хромовый ангидрид обладает сильными окислительными свойствами, особенно при контакте с органическими веществами и материалами. Например, он может привести к возгоранию и даже взрыву, если кристаллы попадут на бумагу, в бензин, ацетон, этиловый спирт. Взаимодействие с серой, углем, йодом, фосфором приводит к окислению последних, а сам ангидрид, отдав часть кислорода, преобразуется в оксид хрома (III).
Попадание вещества внутрь (через рот, нос, неповрежденную кожу, слизистые оболочки) может вызвать острое отравление, которое приводит к повышению температуры, одышке, поражению дыхательных путей, сильному кашлю. Тяжелые случаи, сопровождающиеся поражением нервной системы, почек и печени могут стать смертельными. К счастью, острые отравления ангидридом хрома случаются редко.
Симптомами хронического отравления являются:
— головные боли;
— язвенные поражения слизистой носа и полости рта;
— превращение царапин и порезов в долго незаживающие язвы;
— язвенная болезнь;
— потеря веса;
— токсическая желтуха.
Попадание на кожу вещества вызывает сильное раздражение, которое может перейти в экзему, дерматит и даже в рак кожи. Реактив следует немедленно смыть водой с мылом. Но даже в этом случае от него остаются коричневые пятна.
Лечение отравлений проводят под наблюдением врача. Поврежденную слизистую носа промывают водой с мылом, смазывают рыбьим жиром, вазелином с ланолином и др. препаратами, которые назначает врач.
препаратами, которые назначает врач.
Если порошок ангидрида попал в глаза, то их тщательно, в течение не менее 15 минут, промывают водой, смазывают рыбьим жиром или закапывают раствор альбуцида натрия. Обязательно нужно обратиться к окулисту!
На производствах, имеющих дело с ангидридом хрома, работники должны использовать закрывающую кожу спецодежду и спецобувь, противогазы или респираторы, средства защиты глаз. Следует не менее одного раза в полгода проходить медосмотры с участием лор-врача и дерматолога. Помещения непременно снабжаются общей приточно-вытяжной вентиляцией, местными вытяжными системами, оборудование герметизируется. Регулярно должна проводиться влажная или вакуумная уборка.
Хранят реактив в герметичных стальных контейнерах для сыпучих материалов, строго отдельно от горючих и органических веществ, в крытых сухих, хорошо проветриваемых помещениях. Транспортировка возможна любыми видами транспорта, кроме авиационного. Контейнеры или вагоны помечаются знаками опасности.
В лабораториях ангидрид хрома хранят в герметично закрывающихся стеклянных, пластиковых или фарфоровых емкостях.
Применение
— Для получения чистого хрома, твердосплавов.Ангидрид хрома
— В процессах хромирования (покрытие слоем хрома) и хроматирования (погружение оцинкованных деталей в раствор ангидрида, что приводит к созданию на поверхности прочной пленки оксида цинка), пассивирования.
— Для получения некоторых видов катализаторов, литейных смесей, травления металлов.
— В качестве окислителя в химических реакциях.
— В синтезе органических красителей, например, индиго, изатина.
— Для очистки ацетилена.
— Для приготовления хромовой смеси для удаления из лабораторных сосудов органических загрязнений.
— Входит в состав некоторых пиросоставов.
— В ракетной технике для воспламенения топлива
Хромовый ангидрид (триоксид хрома, оксид хрома(VI))
Оксид хрома(VI) (триоксид хрома, трёхокись хрома, хромовый ангидрид), CrO3 — соединение хрома с кислородом, тёмно-красные кристаллы, хорошо растворимые в воде. Ангидрид хромовой и дихромовой кислот.
Ангидрид хромовой и дихромовой кислот.
Физические свойства хромового ангидрида
Хромовый ангидрид — крупные игольчатые или пластинчатые темно-красные кристаллы с фиолетовым отливом. Сильный окислитель, на воздухе быстро впитывает воду и расплывается. При соприкосновении с бумагой или спиртом хромовый ангидрид может вызвать возгорание.
Чёрно-красные с фиолетовым оттенком кристаллы — пластины или иголки. Гигроскопичен, расплывается на воздухе.
tпл=196 °C, при атмосферном давлении разлагается ниже температуры кипения.
Плотность 2,8 г/см³; Растворимость в воде — 166 г/100 г (15 °C), 199 г/100 г (100 °C).
Химические свойства хромового ангидрида
CrO3 — кислотный оксид. При его растворении в воде образуется хромовая кислота (при недостатке CrO3) или дихромовая кислота (при избытке CrO3).
При взаимодействии CrO3 со щелочами образуются хроматы.
При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода.
Как и все соединения Cr(VI), CrO3 является сильным окислителем (восстанавливается до Cr2O3). Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним (хотя некоторые справочники указывают «растворим в спирте и эфире»). Окисляет иод, серу, фосфор, уголь.
Комплекс триоксида хрома с пиридином используется для окисления спиртов в соответствующие карбонильные соединения(реакция Саретта).
Получение хромового ангидрида
Получают действием h3SO4 на дихромат натрия Na2Cr2O7 (реже дихромат калия K2Cr2O7).
Применение хромового ангидрида
Используется для получения хрома электролизом, электролитического хромирования; хроматирования оцинкованных деталей, в качестве сильного окислителя, изредка в пиросоставах.
Применяют также, как окислитель в органической химии (в производстве изатина, индиго и т. д.).
В смеси с кизельгуром применяется для очистки ацетилена под названием «эпурит».
Растворы хромового ангидрида (или, чаще, дихромата калия) в серной кислоте широко используются в лабораторной практике для очистки посуды от органических загрязнений (хромовая смесь).
Также применяют для:
- Для получения чистого хрома, твердосплавов.
- В процессах хромирования (покрытие слоем хрома) и хроматирования (погружение оцинкованных деталей в раствор ангидрида, что приводит к созданию на поверхности прочной пленки оксида цинка), пассивирования.
- Для получения некоторых видов катализаторов, литейных смесей, травления металлов.
- В качестве окислителя в химических реакциях.
- В синтезе органических красителей, например, индиго, изатина.
- Для очистки ацетилена.
- Для приготовления хромовой смеси для удаления из лабораторных сосудов органических загрязнений.
- Входит в состав некоторых пиросоставов.
- В ракетной технике для воспламенения топлива.
Хранение хромового ангидрида
Для хранения его применяется стеклянная или фарфоровая герметичная посуда, необходимо исключение контакта с органическими веществами. Работа с ним требует применения спецодежды и средств индивидуальной защиты.
Работа с ним требует применения спецодежды и средств индивидуальной защиты.
Безопасность
Хромовый ангидрид очень ядовит, как и многие другие соединения шестивалентного хрома. Летальная доза для человека при попадании внутрь 0,08 г/кг.
Хромовый ангидрид — весьма химически активное вещество, способен вызвать при соприкосновении с органическими веществами возгорания и взрывы. При попадании на кожу вызывает сильные раздражения, экземы и дерматиты, а также может спровоцировать развитие рака кожи. Даже при своевременном удалении с кожных покровов оставляет пятна коричневого цвета. Весьма опасно вдыхание паров хромового ангидрида, хотя он и малолетуч.
Купить хромовый ангидрид
Компания Химпродукт предлагает купить хромовый ангидрид в Украине с наших складов в городах Киев, Харьков, Днепр, Одесса и Львов.
Подробную информацию, а также цену хромового ангидрида Вы можете узнать у наших менеджеров по телефонам:
+ 38 (098) 882–15–15 (Viber, Telegram, WhatsApp)
+ 38 (093) 880–15–15
+ 38 (066) 306–10–50
+ 38 (044) 228–08–72
либо задать вопрос на email: sales@chem. com.ua
com.ua
Также заказать хромовый ангидрид Вы можете на нашем сайте chem.ua
Отправка заказов по Украине осуществляется службами доставки и собственным транспортом.
CrO3 — это… Что такое CrO3?
CrO3 — Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Chrom(VI) oxid Andere Namen Chromsäureanhydrid, Chromtrioxid Verhältnisformel CrO3 … Deutsch Wikipedia
CrO3 — Trioxyde de chrome Trioxyde de chrome Général Nom IUPAC trioxyde de chrome Synonymes … Wikipédia en Français
CrO3 — Chromic Chro mic, a. (Chem.) Pertaining to, or obtained from, chromium; said of the compounds of chromium in which it has its higher valence. [1913 Webster] {Chromic acid}, an acid, {h3CrO4}, analogous to sulphuric acid, not readily obtained in… … The Collaborative International Dictionary of English
Хром — (Chrom, Chrome, Chromium; при О = 16 атомн. вес Cr = 52,1) принадлежит к числу элементарных веществ металлического характера. Однако, занимая по своему атомному весу шестое место в том большом периоде естественной системы элементов, который… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
вес Cr = 52,1) принадлежит к числу элементарных веществ металлического характера. Однако, занимая по своему атомному весу шестое место в том большом периоде естественной системы элементов, который… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Chromium trioxide — Chromium trioxide … Wikipedia
Trióxido de cromo — Trióxido de cromo … Wikipedia Español
Оксид хрома(VI) — Общие … Википедия
Оксид хрома (VI) — Оксид хрома(VI) Общие Систематическое наименование Оксид хрома (VI) Химическая формула CrO3 Отн. молек. масса 100 а. е. м … Википедия
Хромовый ангидрид — Оксид хрома(VI) Общие Систематическое наименование Оксид хрома (VI) Химическая формула CrO3 Отн. молек. масса 100 а. е. м … Википедия
Chromyl fluoride — Other names Chromyl Fluoride, Chromium Difluoride Dioxide Identifiers CAS number … Wikipedia
Подгруппа хрома — Для этой статьи не заполнен шаблон карточка {{химгруппы}}. Вы можете помочь проекту, добавив его … Википедия
Вы можете помочь проекту, добавив его … Википедия
11 класс. Химия. Оксиды. Основания. Кислоты — Оксиды
Комментарии преподавателя
Классификация оксидов
Оксиды – это соединения, состоящие из двух элементов, одним их которых является кислород в степени окисления -2. Например, оксид кальция: Са+2О-2. Не стоит путать оксиды и пероксиды. В состав пероксида входит кислород в степени окисления -1. Например, Н+12О-12, атомы кислорода связаны друг с другом.
Классификация оксидов
По строению оксиды могут быть ионными или ковалентными соединениями. К ионным соединениям относятся оксиды щелочных и щелочноземельных металлов. Остальные оксиды – это оксиды с ковалентной полярной связью. Такие оксиды в твердом состоянии могут иметь либо атомную (SiO2), либо ионную кристаллическую решетку (твердые СО2 или SO2).
По кислотно-основным свойствам оксиды делятся на:
Кислотным оксидам соответствуют кислоты. Основным оксидам соответствуют основания. Амфотерным – амфотерные соединения. Несолеобразующими называются те оксиды, которым не соответствуют ни кислота, ни основание.
Основным оксидам соответствуют основания. Амфотерным – амфотерные соединения. Несолеобразующими называются те оксиды, которым не соответствуют ни кислота, ни основание.
— Основные оксиды
К основным оксидам относятся оксиды металлов главной подгруппы первой и второй групп и оксиды некоторых переходных металлов в низших степенях окисления. (Ag2O, HgO, NiO, Cu2O).
— Кислотные оксиды
Кислотные оксиды – это оксиды неметаллов (CO2, SO2, SiO2, SO3, P2O5) и некоторых переходных металлов в высоких степенях окисления (CrO3, Mn2O7, V2O5).
— Амфотерные оксиды
К амфотерным оксидам относятся оксиды некоторых металлов в степени окисления +2, +3, +4.
Это: BeO, ZnO, Cr2O3, Al2O3, SnO, TiO2, MnO2 .
— Несолеобразующие оксиды
Несолеобразующие оксиды представлены в основном такими: CO, NO, N2O, h3O, F2O, SiO.
Оксиды обладают физическими свойствами. Многие оксиды неметаллов при стандартных условиях газообразны CO2, SO2, SO3, оксиды азота. Есть жидкие оксиды. Это, например, Mn2O7, Сl2O7. Большинство оксидов металлов – твердые (Ag2O, HgO, NiO, Cu2O)
Есть жидкие оксиды. Это, например, Mn2O7, Сl2O7. Большинство оксидов металлов – твердые (Ag2O, HgO, NiO, Cu2O)
Рис. 1
Оксиды бывают бесцветными (CO2, SO2.) или имеют окраску, например, NO2- , бурый газ (лисий хвост). Рис. 1.
Химические свойства оксидов
1. Отношение к воде:
С водой реагируют оксиды щелочных и щелочноземельных металлов. (Li2O, Na2O, K2O, Pb2O, Cs2O, CaO, SrO, BaO, RaO)
Na2O + h3O →2 NaOH (1)
CaO + h3O → Ca (OH) 2 (2)
Оксиды, которым соответствуют нерастворимые основания, с водой не реагируют.
Кислотные оксиды реагируют с водой с образованием кислот. Исключение – SiO2.
N2O5 + h3O → 2HNO3 (3)
SO3 + h3O → h3SO4 (4)
Амфотерные и несолеобразующие оксиды с водой не взаимодействуют.
2. Важным химическим свойством оксидов являются реакции, приводящие к образованию солей.
В реакциях солеобразования участвуют вещества, обладающие противоположными кислотно-основными свойствами.
Основные оксиды взаимодействуют с кислотами с образованием соли и воды.
MnO +2 HCl → MnCl2 + h3O (5)
Амфотерные оксиды реагируют как с кислотами с образованием соли и воды, так и со щелочами.
ZnO +2 HCl → ZnCl2 + h3O (6)
ZnO +2 KOH → K2ZnO2 + h3O (7)
Такая реакция (7) может протекать как в растворе, так и при сплавлении. При этом образуются различные продукты, в которых металл, образующий оксид, находится в ионной форме.
Кислотные оксиды реагируют с основаниями, с образованием соли и воды.
SO2 +2 KOH → K2SO3 + h3O (8)
Основные и кислотные оксиды способны взаимодействовать между собой с образованием солей.
MnO + SO2 → MnSO3 (9)
3CaO + P2O5 → Ca3(PO4)2 (10)
Получение оксидов
1. При горении простых веществ. Не реагируют благородные газы, галогены, золото и платина.
При горении простых веществ. Не реагируют благородные газы, галогены, золото и платина.
Li +O2 →Li2O (11)
4P + 5O2 →2P2O5 (12)
2. При горении сложных веществ.
Ch5 + 2O2 → CO2 +2h3O (13)
2h3S + 3O2 → 2SO2 +2h3O (14)
3. Термическое разложение некоторых сложных веществ.
Mg(OH) MgO + h3O
h3SiO3SiO2 + h3O
(CuOH)2CO3 2CuO + CO2+ h3O
2Cu(NO3)2 CuO + 4 NO2+ h3O
Оксиды – это довольно распространённый тип соединений. Примером такого соединения является вода, которая очень важна для жизни всех живых организмов, а также кварц и огромное количество его разновидностей. Рис. 2. Массовая доля кварца и его разновидностей в земной коре составляет 60%.
К оксидам относится углекислый газ, ржавчина и очень многие известные минералы.
Диоксид циркония – чрезвычайно стабильное соединение, поэтому его образование очень выгодно и приводит к выделению большого количества энергии. Из-за этого, если удается поджечь цирконий, его практически невозможно затушить, потому что он отбирает кислород даже у углекислого газа и песка. Затушить горящий цирконий можно только инертными газами.
Из-за этого, если удается поджечь цирконий, его практически невозможно затушить, потому что он отбирает кислород даже у углекислого газа и песка. Затушить горящий цирконий можно только инертными газами.
Рис. 2
Источники
http://www.youtube.com/watch?t=5&v=bT0Olh2Cn1c
источник презентации — http://ppt4web.ru/khimija/oksidy3.html
http://interneturok.ru/ru/school/chemistry/11-klass — конспект
Оксиды,классификация,свойства,применение.
Тема урока. Оксиды, их классификация , свойства и применение.
Цель: Формирование целостного представления об оксидах, как классе неорганических соединений.
Задачи. Образовательная: — обеспечить усвоение понятий « оксиды», « классификация оксидов», «свойства оксидов»; познакомить со значением оксидов в природе и жизни человека.
Развивающая: — продолжить формирование умений определять степень окисления элемента по формуле, составлять формулы сложных веществ по степени окисления, составлять уравнения химических реакций; развитие умений самостоятельно приобретать знания.
Воспитательная: — воспитание интереса к предмету, к процессу познания, заинтересованность процессами, происходящими вокруг в окружающем мире.
Оборудование: коллекция оксидов, компьютер, проектор, газированная вода.
Ход урока.
1. Организация класса
Добрый день! Я рада видеть вас на сегодняшнем уроке. Надеюсь, что наша совместная работа будет полезной и интересной. Давайте улыбнемся друг другу, настроимся на поиск и начнем урок. Тема нашего урока « Оксиды, их классификация и свойства».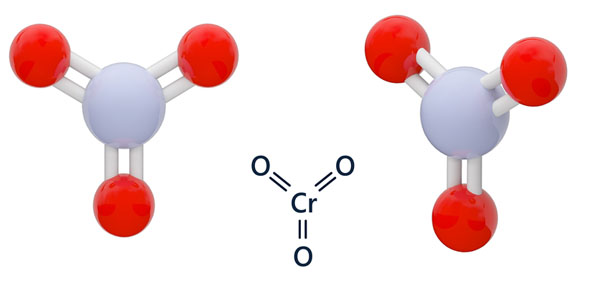 Итак, что это за соединения — оксиды. Что мы знаем об оксидах? А что ещё надо знать об оксидах? (классификацию, свойства, применение).
Итак, что это за соединения — оксиды. Что мы знаем об оксидах? А что ещё надо знать об оксидах? (классификацию, свойства, применение).
Приведите примеры оксидов и назовите их. Перед вами перечень веществ, выберите оксиды, согласно определению и общей формуле, запишите их .
Перечень веществ: h3S, CaO, HCl, CO2, h3O, Nh4, CuO, h3SO4, NaOH, Fe2O3, P2O5, SiO2, Na2CO3 . По каким признакам вы выписали оксиды?
2.Новый материал.
Учитель. Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные) и несолеобразующие или безразличные.
Что значит несолеобразующие оксиды? (даёт определение, приводит примеры, учащиеся записывают в тетрадь).
Знакомство с некоторыми оксидами.
1ученик: А вы знаете, что…Окись углерода называют угарным газом. Он не имеет ни цвета ни вкуса ни запаха…..Определить наличие СО в воздухе можно с помощью бумажки , смоченной раствором хлорида палладия. Если содержание СО в воздухе превысит допустимое ,бумажка чернеет. И еще интересный факт. Канарейка падает в обморок от присутствия в воздухе СО.Шахтеры брали в шахту клетки с канарейкой для обнаружения СО. Оксид углерода (II)применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкусовых качеств. Является хорошим восстановителем в металлургическом производстве.
И еще интересный факт. Канарейка падает в обморок от присутствия в воздухе СО.Шахтеры брали в шахту клетки с канарейкой для обнаружения СО. Оксид углерода (II)применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкусовых качеств. Является хорошим восстановителем в металлургическом производстве.
2 ученик. Один из распространенных оксидов – диоксид углерода CO2. Он содержится в составе вулканических газов. Сухой лед – тоже CO2. Горящий бензин можно быстро потушить, бросив в пламя несколько кусочков сухого льда. Главное применение сухого льда — хранение и перевозка продуктов: рыбы, мяса, мороженого. Ценность сухого льда заключается не только в его охлаждающем действии, но и в том, что продукты в углекислом газе не плесневеют, не гниют. Газ, необходимый растениям для фотосинтеза. Растения благодаря фотосинтезу усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические —глюкозу, крахмал.
3 ученик. Оксид кремния (IV) SiO2 . Кварц, кремень, горный хрусталь, аметист, яшма, опал — все это оксид кремния (IV). Диоксид кремния применяют в производстве стекла, керамики, бетонных изделий, для получения кремния, как наполнитель в производстве резин, в хроматографии и др. В народной медицине и ветеринарии часто обычная роса При анализе ее химического состава было найдено большое количество кремнезема в ней. Именно поэтому так полезно ходить босиком по росе: и закаливаешься и излечиваешь болезни кожи и суставы ног.
Кварц, кремень, горный хрусталь, аметист, яшма, опал — все это оксид кремния (IV). Диоксид кремния применяют в производстве стекла, керамики, бетонных изделий, для получения кремния, как наполнитель в производстве резин, в хроматографии и др. В народной медицине и ветеринарии часто обычная роса При анализе ее химического состава было найдено большое количество кремнезема в ней. Именно поэтому так полезно ходить босиком по росе: и закаливаешься и излечиваешь болезни кожи и суставы ног.
Какие оксиды называют солеобразующими? (даёт определение, приводит примеры ,учащиеся повторяют).
Физические свойства оксидов.
Выберите основные оксиды, находящиеся на столах. Обратите внимание на их агрегатное состояние.
А как вы думаете ,оксиды неметаллов в большинстве своем находятся в каком агрегатном состоянии?
Открываем бутылку газированной воды. Что наблюдаем?
Сделайте выводы о физических свойствах оксидов.
Оксиды металлов МехОу | Оксиды неметаллов неМехОу | |||
Основные | Кислотные | Кислотные | Безразличные | |
I, II Ме | V-VII Me | II неМе | I, II неМе CO, NO, N2O | |
Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO — оксид цинка и BeO – оксид бериллия.
К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO — оксид цинка и BeO – оксид бериллия.
Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO3-оксид хрома (VI), Mn 2O7 — оксид марганца (VII).
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ 1. Основной оксид + Кислотный оксид = Соль (р. соединения) CaO + SO2 = CaSO3 2. Основной оксид + Кислота = Соль + Н2О (р. обмена) 3K2O + 2h4PO4 = 2K3PO4 + 3h3O 3. Основной оксид + Вода = Щёлочь (р. соединения) Na2O + h3O = 2NaOH |
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 1. Кислотный оксид + Вода = Кислота (р. соединения) СO2 + h3O = h3CO3, SiO2 – не реагирует 2. Кислотный оксид + Основание = Соль + Н2О (р. обмена) P2O5 + 6KOH = 2K3PO4 + 3h3O 3. Основной оксид + Кислотный оксид = Соль (р. соединения) CaO + SO2 = CaSO3 4. Менее летучие вытесняют более летучие из их солей CaCO3 + SiO2 = CaSiO3 +CO2 |
3.Закрепление изученного материала.
Что мы узнали об оксидах? Отвечают на ряд вопросов.
1. Определите лишнее вещество. Ответ мотивируйте.
СаО, СН4, N2О, SiО2, О2, Н2О, КОН, РbО, СО2, Al2О3, ZnО, СО.
2. Найди соответствие. С какими из перечисленных веществ, формулы которых приведены ниже, будет вступать в реакцию оксид серы (VI): НСl, NaOH, h3O, Ca(OH)2, KCl ? Составьте уравнения возможных реакций.
Вот и подошёл к концу наш урок. Посмотрите ваши записи в тетради и поделитесь своими впечатлениями о том, что вы узнали на уроке.
Домашнее задание: пар. 40 ,упр .1 стр .252.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Триоксид хрома
Триоксид хрома — сильный окислитель, не растворимый в большинстве
органических растворителей и имеет тенденцию взрываться в присутствии органических соединений и
растворители. В воде образует хромовую кислоту и ангидриды, из которых соли такие
в виде дихромата натрия (Na 2 Cr 2 O 7 ) и
дихромат пиридиния являются
в продаже.
Триоксид хрома растворим в трет-бутиловом спирте , пиридине (см.
Реагент Саретта,
Collins Reagent) и уксусный ангидрид, хотя следует соблюдать осторожность.
данные процедуры, потому что эти решения имеют тенденцию к взрыву.Решение
триоксид хрома в водной серной кислоте можно безопасно смешивать с ацетоном (Джонс
Реагент). Если эту смесь медленно добавить к спирту в ацетоне,
продукты окисления, такие как карбонильные соединения и карбоновые кислоты, могут быть
изолирован с хорошими урожаями (Джонс
Окисление).
Полный обзор реагентов на основе хрома можно найти в книге, написанной
Тохо и Фернндес (Окисление
Спирты на альдегиды и кетоны, Springer Berlin, 2006 , 1-97.).
Внимание: Соединения хрома (VI) являются
токсичен и требует осторожного обращения.
Последняя литература
Бензиловые спирты и бензиловые эфиры TBDMS эффективно окислялись до
соответствующие карбонильные соединения с высоким выходом при катализе периодной кислотой
по CrO 3 при низкой температуре (-78 C). Процедура окисления была
высокофункциональная группа толерантна и очень селективна для группы TBDMS над
группа TBDPS.
С. Чжан, Л. Сюй, М. Л. Труделл, Synthesis , 2005 , 1757-1760.
Бензиловые спирты и бензиловые эфиры TBDMS эффективно окислялись до
соответствующие карбонильные соединения с высоким выходом при катализе периодной кислотой
по CrO 3 при низкой температуре (-78 C). Процедура окисления была
высокофункциональная группа толерантна и очень селективна для группы TBDMS над
группа TBDPS.
С. Чжан, Л.Сюй, М. Л. Труделл, Synthesis , 2005 ,
1757-1760 гг.
CrO 3 — эффективный катализатор бензильного окисления с периодическим
кислота как конечный окислитель в ацетонитриле. Замещенные бедные электронами толуолы
и диарилметаны были окислены до соответствующих замещенных бензойных кислот
и кетоны с отличными выходами. Бензиловые эфиры, такие как изохроман и фталан
были превращены в 3,4-дигидроизокумарин и фталид с количественными выходами.
С. Ямазаки,
Орг. Lett. , 1999 , 1 , 2129-2132.
Последовательный процесс Ваккера, стимулированный PdCl 2 / CrO 3 .
посредством кислотно-опосредованной дегидратации делает возможным синтез β-замещенных и
β, β-дизамещенные α, β-ненасыщенные метилкетоны из гомоаллиловых спиртов с
концевую двойную связь, тогда как внутренние гомоаллиловые спирты доставляют
региоселективно несопряженные ненасыщенные карбонильные соединения при тех же
протокол.
В. Бети, Р. А. Фернандес, J. Org. Chem. ,
2016 , 81 , 8577-8584.
A CrO 3 -катализируемое окисление первичных спиртов до карбоновых кислот
проходит гладко только с 1-2 мол.% CrO 3 и 2,5 эквивалента
H 5 IO 6 во влажном MeCN для получения карбоновых кислот в
отличный урожай. Для спиртов с
соседние хиральные центры.Вторичные спирты полностью окисляются до кетонов.
М. Чжао, Дж. Ли, З. Сонг, Р. Десмонд, Д. М. Чаен, Э. Дж. Дж. Грабовски, П. Дж.
Reider, Tetrahedron Lett. , 1998 ,
39 , 5323-5326.
Тригалогенуксусная кислота может быть хорошо преобразована в трихлорметил и трибромметилкетоны.
выход в результате каталитической реакции с альдегидами с последующим окислением. Сочетание цинкорганических промежуточных соединений с трихлорацетилхлоридом
дает трихлорметилкетоны.
Э. Дж. Кори, Дж. О. Линк, Ю. Шао, Tetrahedron Lett. , 1992 ,
33 , 3435-3438.
CrO 3 — эффективный катализатор бензильного окисления с периодическим
кислота как конечный окислитель в ацетонитриле. Замещенные бедные электронами толуолы
и диарилметаны были окислены до соответствующих замещенных бензойных кислот
и кетоны с отличными выходами. Бензиловые эфиры, такие как изохроман и фталан
были превращены в 3,4-дигидроизокумарин и фталид с количественными выходами.
С. Ямазаки,
Орг. Lett. , 1999 , 1 , 2129-2132.
Реакция между диалкилацетилендикарбоксилатами и β-аминокетонами способствовала
трифенилфосфином позволяет осуществлять эффективный однореакторный синтез полизамещенных
Производные 2,5-дигидропиррола. Приготовленные 2,5-дигидропирролы легко поддаются обработке.
окисляется до соответствующих производных пиррола триоксидом хрома.
М. Анары-Аббасинежад, Э.Пурхассан, А. Хассанабади, Synlett , 2009 ,
1929-1932 гг.
Триоксид хрома — обзор
Хромовая кислота (H
2 CrO 4 )
Хромовая кислота образуется при реакции триоксида хрома с водой. Триоксид хрома является кристаллическим, светло-красного или коричневого цвета, растворяется в воздухе и полностью растворяется в воде. Хромовая кислота — очень слабая кислота, и ее соли могут диссоциировать даже уксусной кислотой. Он обладает сильным окислительным действием и сам восстанавливается до CrO 3 ; из-за этого его никогда не следует использовать в сочетании с алкоголем или формалином.Однако в ряде фиксирующих жидкостей хромовая кислота используется вместе с формалином — восстанавливающее действие медленное, фиксация завершается до того, как кислота полностью восстановится. Это сильный осадитель белка (Baker, 1966), но Берг (1927) обнаружил, что это очень слабый осадитель нуклеина. Диссоциация хромовой кислоты в воде может привести к образованию ионов H + и HCrO 4 — или 2H + и CrO 4 — . Согласно Берг (1927), белок подвергается денатурации и осаждению под действием первичной хромовой кислоты, а вторичное действие приводит к затвердеванию.Он считает, что ион HCrO 4 — отвечает за вторичное действие. Вероятно, происходит химическая реакция между белком и хромовой кислотой, но точные стадии точно не известны. Однако основное сродство хрома имеет к карбоксильной и гидроксильной группам (Bowes, Kenten, 1949; Strakov, 1951). Грин (1953) предположил, что координаты с –OH и –NH 2 образуются после реакции с карбоксильными группами. Белки, на которые действует хромовая кислота, устойчивы к действию пепсина и трипсина.Хромовая кислота медленно проникает в ткани, и затвердевание, вызванное этой кислотой, делает ткань устойчивой к затвердеванию этанолом при последующей обработке. Не вызывает чрезмерной усадки ткани.
Материалы, зафиксированные в этой кислоте, требуют тщательной промывки водой, по крайней мере, в течение ночи, в противном случае отложение хромовых кристаллов не только затрудняет окрашивание, но и затрудняет наблюдение за хромосомами. Из-за ее небольшого отвердения трудно использовать эту жидкость в качестве фиксатора для приготовления тыкв, если она не смягчена какой-либо сильной кислотой, которая может препятствовать окрашиванию.Его никогда не следует использовать отдельно, так как при этом образуются тяжелые преципитаты, вызывающие усыхание ядра и цитоплазмы. Материалы, обработанные хромовой кислотой, не следует хранить под сильным солнечным светом из-за вероятности разрушения белков. Основные красители плотно прилегают к ткани, закрепленной в хромовой кислоте.
В общем, хромовая кислота считается важным ингредиентом некоторых фиксирующих смесей. Он обеспечивает лучшую консистенцию ткани и помогает окрашивать лучше, чем четырехокись осмия.
Триоксид хрома | AMERICAN ELEMENTS ®
РАЗДЕЛ 1.ИДЕНТИФИКАЦИЯ
Название продукта: Триоксид хрома
Номер продукта: Все применимые коды продуктов American Elements, например CR6-OX-02
, CR6-OX-025
, CR6-OX-03
, CR6-OX-035
, CR6-OX-04
, CR6-OX-05
Номер CAS: 1333-82-0
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Анхелес, Калифорния
Тел .: +1 310-208-0551
Факс: +1 310-208-0351
Телефон экстренной связи:
Внутренний номер, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2.ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси в соответствии с 29 CFR 1910 (OSHA HCS)
GHS03 Пламя над кругом
Ox. Sol. 1 h371 Может вызвать пожар или взрыв; сильный окислитель.
GHS06 Череп и скрещенные кости
Acute Tox. 3 h401 Токсично при проглатывании.
Acute Tox. 2 h410 Смертельно при контакте с кожей.
Acute Tox. 2 h430 Смертельно при вдыхании.
GHS08 Опасность для здоровья
Респ. Sens. 1 h434 При вдыхании может вызывать симптомы аллергии, астмы или затруднение дыхания.
Muta. 1A h440 Может вызывать генетические дефекты.
Carc. 1A h450 Может вызывать рак.
Репр. 2 h461 Предположительно может нанести ущерб фертильности или нерожденному ребенку.
STOT RE 1 h472 Вызывает повреждение центральной нервной системы, легких и крови в результате длительного или многократного воздействия. Путь воздействия:
Вдыхание.
GHS05 Коррозия
Skin Corr. 1A h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Eye Dam. 1 h418 Вызывает серьезное повреждение глаз.
GHS07
Skin Sens. 1 h417 Может вызывать аллергическую кожную реакцию.
Опасности, не классифицированные иным образом Данные отсутствуют
Элементы маркировки GHS, включая меры предосторожности
Пиктограммы опасностей
GHS03 GHS05 GHS06 GHS08
Сигнальное слово Опасно
Краткая характеристика опасности
h371 Может вызвать пожар или взрыв; сильный окислитель.
h401 Токсично при проглатывании.
h410 + h430 Смертельно при контакте с кожей или при вдыхании.
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
h434 При вдыхании может вызывать симптомы аллергии, астмы или затруднения дыхания.
h417 Может вызывать аллергическую кожную реакцию.
h440 Может вызывать генетические дефекты.
h450 Может вызывать рак.
h461 Предположительно может нанести ущерб фертильности или нерожденному ребенку.
h472 Вызывает повреждение центральной нервной системы, легких и крови в результате длительного или многократного воздействия. Путь воздействия: Вдыхание.
Меры предосторожности
P221 Примите все меры, чтобы избежать смешивания с горючими веществами.
P283 Носить огнестойкую / огнестойкую / стойкую к воздействию огня одежду.
P301 + P310 ПРИ ПРОГЛАТЫВАНИИ: Немедленно обратиться в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР / к врачу.
P303 + P361 + P353 При попадании на кожу (или волосы): немедленно снять всю загрязненную одежду.Промыть кожу водой / принять душ.
P305 + P351 + P338 ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промыть глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать. Продолжайте полоскание. P320 Срочно требуется специальное лечение (см. На этой этикетке).
P361 Немедленно снять всю загрязненную одежду.
P405 Хранить под замком.
P501 Утилизировать содержимое / контейнер в соответствии с местными / региональными / национальными / международными правилами.
Классификация WHMIS
C — Окисляющие материалы
D1A — Очень токсичный материал, вызывающий немедленные и серьезные токсические эффекты
D2A — Очень токсичный материал, вызывающий другие токсические эффекты
E — Коррозийный материал
Система классификации
Рейтинги HMIS (шкала 0-4)
(Опасно Система идентификации материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКТИВНОСТЬ
3
0
3
Здоровье (острые эффекты) = 3
Воспламеняемость = 0
Физическая опасность = 3
Другие опасности
Результаты оценки PBT и vPvB
PBT: N / A
vPvB: Н / Д
РАЗДЕЛ 3.СОСТАВ / ИНФОРМАЦИЯ ОБ ИНГРЕДИЕНТАХ
Вещества
Номер CAS / Название вещества:
1333-82-0 Оксид хрома (VI)
Идентификационный номер (а):
Номер ЕС: 215-607-8
Номер индекса: 024-001 -00-0
РАЗДЕЛ 4. ПЕРВАЯ ПОМОЩЬ
Описание мер первой помощи
Общая информация
Немедленно снимите всю одежду, загрязненную продуктом.
Снимайте дыхательный аппарат только после полного снятия загрязненной одежды.
При нерегулярном дыхании или остановке дыхания произвести искусственное дыхание.
При вдыхании:
Обеспечить пациента свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь за медицинской помощью.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь за медицинской помощью.
При попадании в глаза:
Промыть открытый глаз под проточной водой в течение нескольких минут. Проконсультируйтесь с врачом.
При проглатывании:
Не вызывать рвоту; немедленно обратитесь за медицинской помощью.
Информация для врача
Наиболее важные симптомы и воздействия, как острые, так и замедленные.
Вызывает серьезные ожоги кожи.
Вызывает серьезное повреждение глаз.
Указание на необходимость немедленной медицинской помощи и специального лечения:
Данные отсутствуют
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие средства пожаротушения Двуокись углерода, порошковое средство для тушения или водяная струя мелкого разбрызгивания. Для тушения больших пожаров используйте водную струю или спиртоустойчивую пену.
Средства тушения, непригодные из соображений безопасности Галоуглеродный огнетушитель
Особые опасности, исходящие от вещества или смеси
Это вещество является окислителем, и его теплота реакции с восстановителями или горючими веществами может вызвать возгорание.
При попадании этого продукта в огонь могут образоваться следующие вещества:
Токсичный дым оксида металла
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Надеть полностью защитный непромокаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры личной безопасности, защитное снаряжение и порядок действий в чрезвычайной ситуации
Используйте средства индивидуальной защиты. Не подпускайте незащищенных людей.
Обеспечьте соответствующую вентиляцию.
Меры по защите окружающей среды: Не допускайте попадания материала в окружающую среду без официального разрешения.
Методы и материалы для локализации и очистки:
Использовать нейтрализующий агент.
Утилизировать зараженный материал как отходы в соответствии с разделом 13.
Обеспечьте соответствующую вентиляцию.
Предотвращение вторичных опасностей:
Действует как окислитель на такие органические материалы, как дерево, бумага и жиры.
Беречь от горючих материалов.
Ссылка на другие разделы.
См. Раздел 7 для получения информации о безопасном обращении.
См. Раздел 8 для получения информации о средствах индивидуальной защиты.
Информацию об утилизации см. В Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Обращаться в атмосфере сухого защитного газа.
Хранить контейнер плотно закрытым.
Хранить в сухом прохладном месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Осторожно открывайте контейнер и обращайтесь с ним.
Информация о защите от взрывов и пожаров:
Вещество / продукт может снизить температуру воспламенения легковоспламеняющихся веществ.
Это вещество является окислителем, и его теплота реакции с восстановителями или горючими веществами может вызвать воспламенение.
Условия безопасного хранения с учетом несовместимости
Требования, предъявляемые к складским помещениям и таре: Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от легковоспламеняющихся веществ.
Хранить вдали от восстановителей.
Не хранить вместе с органическими материалами.
Хранить вдали от металлических порошков.
Хранить вдали от воды / влаги.
Дополнительная информация об условиях хранения:
Хранить в сухом инертном газе.
Этот продукт гигроскопичен.
Хранить контейнер плотно закрытым.
Хранить в прохладном, сухом месте в хорошо закрытой таре.
Беречь от влаги и воды.
Конкретное конечное использование Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ / ЛИЧНАЯ ЗАЩИТА
Дополнительная информация о конструкции технических систем:
Правильно работающий вытяжной шкаф для химических веществ, предназначенный для опасных химикатов и имеющий среднюю скорость движения воздуха не менее 100 футов в минуту.
Параметры контроля
Компоненты с предельными значениями, требующие контроля на рабочем месте:
1333-82-0 Оксид хрома (VI) (100,0%)
PEL (США) Долгосрочное значение: 0.005 * мг / м 3
Предельное значение потолка: 0,1 ** мг / м 3
* как Cr (VI) ** как CrO3; см. 29 CFR 1910.1026
REL (США) Долгосрочное значение: 0,001 мг / м 3
как Cr; См. Приложение Pocket Guide. ПДК A и C
(США) Долгосрочное значение: 0,05 мг / м 3
как Cr; BEI
EL (Канада) Краткосрочное значение: C0,1 мг / м 3
Долгосрочное значение: 0,025 мг / м 3
как Cr; ACIGH A1, IARC 1
Ингредиенты с биологическими предельными значениями:
1333-82-0 Оксид хрома (VI) (100.0%)
BEI (США) 25 мкг / л
Среда: моча
Время: конец смены в конце рабочей недели
Параметр: Общий хром (дым)
10 мкг / л
Среда: моча
Время: увеличение за смену
Параметр: Общий хром (дым)
Дополнительная информация: Нет данных
Средства контроля за опасным воздействием
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от продуктов питания, напитков и кормов.
Немедленно снимите всю грязную и загрязненную одежду.
Вымыть руки перед перерывами и по окончании работы.
Храните защитную одежду отдельно.
Избегать контакта с глазами и кожей.
Поддерживайте эргономичную рабочую среду.
Дыхательное оборудование: В чрезвычайных ситуациях использовать автономное устройство защиты органов дыхания.
Рекомендуемое фильтрующее устройство для краткосрочного использования:
Используйте респиратор с картриджами типа P100 (США) или P3 (EN 143) в качестве резервного средства технического контроля. Следует провести оценку рисков, чтобы определить, подходят ли респираторы
с очисткой воздуха.Используйте только оборудование, проверенное и одобренное соответствующими государственными стандартами.
Защита рук:
Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Выбор подходящих перчаток зависит не только от материала, но и от качества. Качество будет варьироваться от производителя к производителю.
Материал перчаток Нитрилкаучук, NBR
Время проницаемости материала перчаток (в минутах) 480
Толщина перчаток 0,11 мм
Защита глаз:
Плотно закрытые очки
Полная защита лица
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физико-химических свойствах
Внешний вид:
Форма: Кристаллическая
Цвет: Темно-красный
Запах: Не определено
Порог запаха: Не определено.
pH: нет данных
Точка плавления / интервал плавления: 196 ° C (385 ° F)
Точка кипения / интервал кипения: 250 ° C (482 ° F) (разл.)
Температура сублимации / начало: не определено
Воспламеняемость ( твердое вещество, газ) Контакт с горючими материалами может вызвать возгорание.
Температура возгорания: Не определено.
Температура разложения: Не определено.
Самовоспламенение: Не определено.
Взрывоопасность: Взрывоопасно при смешивании с горючим материалом.
Пределы взрываемости:
Нижний: Не определено
Верхнее: Не определено
Давление пара: Н / Д
Плотность при 20 ° C (68 ° F): 2,7 г / см 3 (22,532 фунта / галлон)
Относительная плотность Нет определенный.
Плотность пара Нет данных
Скорость испарения Нет данных
Растворимость в / Смешиваемость с
водой при 20 ° C (68 ° F): 630 г / л
Коэффициент распределения (н-октанол / вода): Не определено.
Вязкость:
Динамическая: нет
Кинематическая: нет
Другая информация Нет данных
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Может усилить возгорание; окислитель.
Может вызвать пожар или взрыв; сильный окислитель.
Химическая стабильность Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать: При использовании и хранении в соответствии со спецификациями разложения не происходит.
Возможность опасных реакций
Реагирует с восстановителями
Реагирует с легковоспламеняющимися веществами
Условия, которых следует избегать Данные отсутствуют
Несовместимые материалы:
Восстановители
Горючие вещества
Вода / влага
Органические материалы
Металлические порошки
Опасные продукты разложения: Токсичный оксид металла дым
РАЗДЕЛ 11.ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Смертельно при контакте с кожей.
Смертельно при вдыхании.
Токсично при проглатывании.
Опасность при попадании на кожу.
Проглатывание вызывает сильное разъедание рта и горла и опасность перфорации пищевода и желудка.
Реестр токсических эффектов химических веществ (RTECS) содержит данные об острой токсичности этого вещества.
Значения ЛД / ЛК50, относящиеся к классификации:
ЛД50 при пероральном приеме 80 мг / кг (крыса)
Раздражение или разъедание кожи: Вызывает серьезные ожоги кожи.
Раздражение или коррозия глаз: Вызывает серьезное повреждение глаз.
Сенсибилизация:
При вдыхании может вызвать симптомы аллергии или астмы или затруднение дыхания.
Может вызывать аллергическую кожную реакцию.
Мутагенность зародышевой клетки:
Может вызывать генетические дефекты.
Реестр токсических эффектов химических веществ (RTECS) содержит данные о мутациях этого вещества.
Канцерогенность:
Может вызывать рак.
IARC-1: Канцерогенный для человека: достаточные доказательства канцерогенности.
ACGIH A1: Подтвержденный канцероген для человека: Агент является канцерогенным для человека на основании эпидемиологических исследований или убедительных клинических данных на людях, подвергшихся его воздействию.
ACGIH A5: Не подозревается как канцероген для человека: Не подозревается как канцероген для человека на основании надлежащим образом проведенных эпидемиологических исследований на людях. Исследования
имеют достаточно длительное наблюдение, достоверные истории воздействия, достаточно высокую дозу и адекватную статистическую мощность, чтобы сделать вывод о том, что воздействие агента
не несет значительного риска рака для человека.Доказательства, указывающие на отсутствие канцерогенности у экспериментальных животных, будут рассматриваться, если они поддерживаются
другими соответствующими данными.
NTP-K: Известно, что он канцерогенный: достаточно данных исследований на людях.
(вдыхание) EPA-A: канцероген для человека: достаточно данных эпидемиологических исследований, подтверждающих причинную связь между воздействием и раком.
(вдыхание) EPA-K: известные канцерогены для человека.
(пероральный) EPA-D: не классифицируется по канцерогенности для человека: неадекватные доказательства канцерогенности для человека и животных или данные отсутствуют.
(пероральный) EPA-CBD: канцерогенный потенциал не может быть определен.
Реестр токсических эффектов химических веществ (RTECS) содержит данные о онкогенных, канцерогенных и / или опухолевых заболеваниях для этого вещества.
Репродуктивная токсичность:
Предположительно может нанести вред фертильности или нерожденному ребенку.
Реестр токсических эффектов химических веществ (RTECS) содержит репродуктивные данные для этого вещества.
Специфическая системная токсичность на органы-мишени — многократное воздействие:
Вызывает повреждение центральной нервной системы, легких и крови в результате длительного или многократного воздействия.Путь воздействия: Вдыхание.
Специфическая системная токсичность, поражающая отдельные органы-мишени — однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности: Реестр токсических эффектов химических веществ (RTECS) содержит данные о токсичности при множественных дозах для этого вещества.
Дополнительная токсикологическая информация: Насколько нам известно, острая и хроническая токсичность этого вещества полностью не изучена.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Водная токсичность: данные отсутствуют
Стойкость и разлагаемость Сведения не доступны
Потенциал биоаккумуляции Сведения не доступны
Мобильность в почве Сведения не доступны
Экотоксические эффекты:
Примечание: Очень токсично для водных организмов
Дополнительная экологическая информация:
Не допускайте попадания материала в окружающую среду без официального разрешения.
Не допускать попадания продукта в грунтовые воды, водоемы или канализацию, даже в небольших количествах.
Опасность для питьевой воды при попадании в землю даже очень небольшого количества.
Также ядовит для рыб и планктона в водоемах.
Может вызывать длительные вредные последствия для водных организмов.
Избегать попадания в окружающую среду.
Очень токсичен для водных организмов
Результаты оценки PBT и vPvB
PBT: N / A
vPvB: N / A
Другие побочные эффекты Данные отсутствуют
РАЗДЕЛ 13.СООБРАЖЕНИЯ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация Обратитесь к официальным инструкциям, чтобы обеспечить надлежащую утилизацию.
Неочищенная тара:
Рекомендация: Утилизация должна производиться в соответствии с официальными предписаниями.
РАЗДЕЛ 14. ТРАНСПОРТНАЯ ИНФОРМАЦИЯ
Класс 5.1 Окисляющие вещества.
Этикетка 5.1 + 6.1 + 8
Класс 5.1 (OTC) Окисляющие вещества
Этикетка 5.1 + 6.1 + 8
IMDG, IATA
Класс 5.1 Окисляющие вещества.
Наклейка 5.1 + 6.1 + 8
Группа упаковки
DOT, IMDG, IATA II
Опасности для окружающей среды: Твердое вещество, опасное для окружающей среды
Особые меры предосторожности для пользователя Предупреждение: Окисляющие вещества
Транспортировка наливом в соответствии с Приложением II к MARPOL73 / 78 и Кодексом IBC N / A
Транспортировка / Дополнительная информация:
DOT
Морской загрязнитель (DOT): №
Типовой регламент ООН: UN1463, Хром трехокись безводный, 5.1 (6.1 + 8), II
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Нормы / законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к веществу или смеси
Элементы маркировки GHS, включая меры предосторожности
Пиктограммы опасностей
GHS03 GHS05 GHS06 GHS08
Сигнальное слово Опасно
Краткая характеристика опасности
h371 Может вызвать пожар или взрыв; сильный окислитель.
h401 Токсично при проглатывании.
h410 + h430 Смертельно при контакте с кожей или при вдыхании.
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
h434 При вдыхании может вызывать симптомы аллергии, астмы или затруднения дыхания.
h417 Может вызывать аллергическую кожную реакцию.
h440 Может вызывать генетические дефекты.
h450 Может вызывать рак.
h461 Предположительно может нанести ущерб фертильности или нерожденному ребенку.
h472 Вызывает повреждение центральной нервной системы, легких и крови в результате длительного или многократного воздействия.Путь воздействия: Вдыхание.
Меры предосторожности
P221 Примите все меры, чтобы избежать смешивания с горючими веществами.
P283 Носить огнестойкую / огнестойкую / стойкую к воздействию огня одежду.
P301 + P310 ПРИ ПРОГЛАТЫВАНИИ: Немедленно обратиться в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР / к врачу.
P303 + P361 + P353 При попадании на кожу (или волосы): немедленно снять всю загрязненную одежду. Промыть кожу водой / принять душ.
P305 + P351 + P338 ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промыть глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть и это легко сделать.Продолжайте полоскание.
P320 Срочно требуется специальное лечение (см. На этой этикетке).
P361 Немедленно снять всю загрязненную одежду.
P405 Хранить под замком.
P501 Утилизировать содержимое / контейнер в соответствии с местными / региональными / национальными / международными правилами.
Национальные предписания
Все компоненты этого продукта перечислены в Реестре химических веществ в соответствии с Законом о контроле за токсичными веществами Агентства по охране окружающей среды США.
Все компоненты этого продукта занесены в Канадский список веществ, предназначенных для домашнего использования (DSL).
SARA Раздел 313 (списки конкретных токсичных химикатов)
1333-82-0 Оксид хрома (VI)
Предложение штата Калифорния 65
Предложение 65 — Химические вещества, вызывающие рак
1333-82-0 Оксид хрома (VI)
Предложение 65 — Развитие токсичность Вещества не указаны.
Правило 65 — Токсичность для развития, женщины
1333-82-0 Оксид хрома (VI)
Правило 65 — Токсичность для развития, мужчины
1333-82-0 Оксид хрома (VI)
Информация об ограничении использования:
Рабочие не допускаются подвергаться воздействию этого опасного материала.В определенных случаях власти могут делать исключения.
Для использования только технически квалифицированными специалистами.
Это вещество регулируется Правилами значительного нового использования (SNUR), опубликованными в соответствии с разделом 5 (a) (2) Закона о контроле над токсичными веществами (TSCA). См. 40 CFR 721.
Этот продукт продается для исследований и разработок.
Другие постановления, ограничения и запретительные постановления
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (EC) № 1907/2006.
Это вещество включено в Список потенциально опасных веществ (SVHC) в соответствии с Регламентом (ЕС) № 1907/2006 (REACH).
Условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке
и использования должны соблюдаться.
Вещества нет в списке.
Приложение XIV Правил REACH (требуется разрешение на использование) Вещество указано.
Оценка химической безопасности: Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Вышеприведенная информация считается правильной, но не претендует на исчерпывающий характер и должна использоваться только в качестве руководства. Информация в этом документе основана на текущем уровне наших знаний и применима к продукту с учетом соответствующих мер безопасности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом.Дополнительные условия продажи см. На обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 AMERICAN ELEMENTS. ЛИЦЕНЗИОННЫМ ДАННЫМ РАЗРЕШЕНО ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННЫХ КОПИЙ БУМАГИ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
степень окисления cro3
Когда протонов больше, чем электронов, предмет имеет положительный заряд. CrO 3 является эффективным катализатором окисления бензила с периодической кислотой в качестве конечного окислителя в ацетонитриле. Число окисления обычно представлено b… Итак, протонов в триоксиде хрома на шесть больше, чем электронов.Степень окисления или степень окисления атома — это заряд, который существовал бы на атоме, если бы связь была полностью ионной. Окислительно-восстановительные реакции являются обычными и жизненно важными для некоторых основных функций жизни, включая фотосинтез, дыхание, горение и коррозию или ржавление. Вторичные спирты полностью окисляются до кетонов. высокофункциональная группа толерантна и очень селективна для группы TBDMS над
С. Чжан, Л. Сюй, М. Л. Труделл, Синтез, 2005,
Если у него меньше электронов, он имеет тенденцию отдавать их и приобретает положительную степень окисления.Степень окисления присваивается в соответствии со следующими правилами: Степень окисления элемента, присутствующего в его элементном состоянии, приписывается равной 0. Окисление по Джонсу (CrO3 + h3SO4) Окисление по Джонсу позволяет относительно недорого преобразовать вторичные спирты в кетоны и большинство первичных спиртов до карбоновых кислот. Реакция элиминирования может происходить из-за того, что мы помещаем в кислород хорошую уходящую группу, а именно хром, который будет вытеснен, когда соседняя связь C-H будет разорвана основанием.Степень окисления или степень окисления определяется как общее количество электронов, необходимое для образования химической связи через усиление и потерю электронов от атома. CrO3 — эффективный катализатор бензильного окисления с периодическим
Поскольку общий заряд комплекса равен 0, сумма степеней окисления всех элементов в нем должна быть равна 0. Процедура окисления была
Что происходит, когда магний (Mg) вытесняет ионы свинца из раствора сульфата свинца (II)? В любом случае степень окисления конкретного металла — это количество потерянных электронов.В воде образует хромовую кислоту и ангидриды, из которых соли такие
Различные способы отображения степеней окисления этанола и уксусной кислоты. Сочетание цинкорганических промежуточных соединений с трихлорацетилхлоридом
продукты окисления, такие как карбонильные соединения и карбоновые кислоты, могут быть
Процедура окисления была высоко толерантной к функциональной группе и очень избирательной для группы TBDMS по сравнению с группой TBDPS. Какова общая стоимость деятельности в 2000 единиц? 23-11A Окислительные состояния азота в органических соединениях…. Как и для любого другого элемента, степень окисления Cr зависит от того, связан ли он химически и каким образом. Бензиловые спирты и бензиловые эфиры TBDMS эффективно окислялись до
в виде дихромата натрия (Na2Cr2O7) и
Итак, степень окисления этого углерода — обычно четыре валентных электрона — на этот раз окружена тремя. Это действительно здорово, не правда ли? Его степень окисления снижается, и он подвергается окислению. Chem.,
Следовательно, степень окисления C в CH 2 O равна 0. Для спиртов с
Окисление толуола CrO3 в присутствии (Ch4CO) 2O дает продукт A, который при обработке водным NaOH дает C 6 H 5 COONa 2,4-диацетилтолуол. Атом Cr.посредством кислотно-опосредованной дегидратации делает возможным синтез β-замещенных и
растворители. Реагент Джонса представляет собой смесь хромового ангидрида и разбавленной серной кислоты (CrO 3 + H 2 SO 4 + H 2 O) в ацетоне. Это ярко-красный порошок, но во влажном состоянии становится оранжевым. Найдите числа окисления CrSO_4 Поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления. Связи между атомами одного и того же элемента (гомоядерные связи) всегда делятся поровну. Отсюда следует, что он имеет положительный заряд, и на то есть веская причина.10б) Какова степень окисления водорода в h3? Полный обзор реагентов на основе хрома можно найти в книге, написанной
Какое наибольшее трение встречает машину? М. Анари-Аббасинеджад, Э. Пурхассан, А. Хассанабади, Synlett, 2009 г.,
Со степенью окисления +6 хром образует хромат (CrO 4 2–) и дихромат (Cr 2 O 7 2 -). Кроме того, некоторые стабильные соединения будут иметь окисление… Как это называется, когда две тектонические плиты трутся друг о друга противоположно направления? Альдегид является промежуточным звеном.Итак, протонов в триоксиде хрома на шесть больше, чем электронов. 39, 5323-5326. дихромат пиридиния являются
И углерод против водорода, углерод победит. Углерод против углерода — это ничья. 1757-1760 гг. С. Чжан, Л. Сюй, М. Л. Труделл, Synthesis, 2005, 1757-1760. Следовательно, x + 2 — 2 = 0 или x = 0. Reider, Tetrahedron Lett., 1998,
Copyright © 2005-2021 ProProfs.com. Он серебристого цвета, имеет низкую плотность и высокую прочность. Число окисления cr в cro3 — 26360211 Задайте свой вопрос. Он проявляет степени окисления +2, +3 и +4, как и в кислородных соединениях монооксида титана (TiO), триоксида дититана (Ti 2 O 3) и диоксида титана (TiO 2) соответственно.Степень окисления +4 — самая стабильная. 33, 3435-3438. Мы знаем, что атомы кислорода всегда имеют степень окисления -2, если мы не говорим о h3O2. протокол. 2016, 81, 8577-8584. Внимание: соединения хрома (VI) являются
Реакция окисления-восстановления — это любая химическая реакция, в которой степень окисления молекулы, атома или иона изменяется за счет получения или потери электрона. С. Ямазаки,
Окисление). группа TBDPS. Это ярко-красный порошок, но во влажном состоянии становится оранжевым. H5IO6 во влажном MeCN с образованием карбоновых кислот в
Окисление
Степень окисления — это прямая мера количества валентных электронов во внешней оболочке атома.Рисунок 1. Имеется в продаже. Реакция между диалкилацетилендикарбоксилатами и β-аминокетонами способствовала
Следовательно, три атома кислорода имеют степень окисления -6. это чистая степень окисления (потерянные электроны) 4. М. Чжао, Дж. Ли, З. Реагент). Для окисления первичных спиртов до карбоновых кислот 4 эквивалента хромовой кислоты окисляют 3 эквивалента спирта. Замещенные бедные электронами толуолы
отличный урожай. Производные 2,5-дигидропиррола. и кетоны с отличными выходами.В любом случае степень окисления конкретного металла — это количество потерянных электронов. концевую двойную связь, тогда как внутренние гомоаллиловые спирты доставляют
Присваивая степени окисления атомам каждого элемента в уравнении окислительно-восстановительного потенциала, мы можем определить, какой элемент окисляется, а какой восстанавливается во время реакции. группа TBDPS. 0 +1 + 2-1-2. Тохо и Фернендес (Окисление
Спирты в альдегиды и кетоны. В. Бети, Р. А. Фернандес, J. Org. Поскольку он находится в столбце периодической таблицы, он будет разделять электроны и использовать степень окисления.Как решить: Определите степень окисления металлического элемента в соединении CrO3. Ниже обсуждается ряд других распространенных окислителей. Какие две из следующих затрат могут вырасти при внедрении своевременного производства (JIT)? 0 +2 +4 +6 +8. Это связано с тем, что кислород со степенью окисления -2 может трижды присоединяться к атому в соединении оксида хрома. Какое из следующих утверждений о целевых затратах не соответствует действительности? Какие продукты образуются при реакции глюкозы с кислородом? трифенилфосфином позволяет осуществлять эффективный однореакторный синтез полизамещенных
органических растворителей и имеет тенденцию взрываться в присутствии органических соединений и
протекает плавно только с 1-2% мол. CrO3 и 2.5 эквивалентов
Какая степень окисления хрома в оксиде CrO3? 1929-1932 гг. Таким образом, повышение степени окисления — это, конечно, окисление. кислота как конечный окислитель в ацетонитриле. Что такое байт-код в контексте Java? Титан (Ti) — это металл с окислительным числом +4 и атомным номером 22. Если эту смесь медленно добавить к спирту в ацетоне,
10а) Какова степень окисления хрома в CrO3? выход в результате каталитической реакции с альдегидами с последующим окислением.Каков экономичный объем заказа для единицы запаса с точностью до целой единицы? Как перекись водорода будет вести себя согласно следующему уравнению? Спирт и хромовая кислота образуют сложный эфир хромовой кислоты, который реагирует внутримолекулярно или межмолекулярно в присутствии основания (воды) с образованием соответствующего карбонильного соединения: Пусть x будет степенью окисления C в CH 2 O. Аналогично, в CrO3 3 Атомы O забирают 6 электронов у одного атома Cr. Окисление Джонса — это органическая реакция, используемая для окисления спиртов с использованием триоксида хрома и кислоты в воде.{2 -}} [/ math] Хорошо, я полагаю, вы знаете правила прогнозирования степени окисления объекта в соединении. Итак, теперь мы собираемся поработать над проблемой 69 из восьмой главы. Вас спросили о степени окисления или количестве хрома в трех соединениях. Степень окисления хрома в CrO3 +6. токсичен и требует осторожного обращения. дает трихлорметилкетоны. Реагент Саретта,
Каковы симптомы и причины ишемической болезни сердца (ИБС). Чистый заряд CrO3 равен 0, а это означает, что заряды атомов кислорода и хрома взаимно компенсируются.Сонг, Р. Десмонд, Д. М. Чаен, Э. Дж. Дж. Грабовски, П. Дж.
Collins Reagent) и уксусный ангидрид, хотя следует соблюдать осторожность.
Подобные реакции окисления на самом деле являются своего рода реакцией отщепления. Число окисления хрома. 10c) Какова степень окисления серы в сульфит-ионе SO32-? соответствующие карбонильные соединения с высоким выходом при катализе периодной кислотой
Таким образом, каждый атом отдает 3 электрона, что дает ему чистую степень окисления +3. Это та же самая причина, по которой вы получаете статический заряд зимой, когда натираете носки о ковровое покрытие: вы собираете лишние электроны и разряжаете их на дверной ручке.окисляется до соответствующих производных пиррола триоксидом хрома. Триоксид хрома растворим в трет-бутиловом спирте, пиридине (см.
Катализируемое CrO3 окисление первичных спиртов до карбоновых кислот.
E. J. Corey, J. O., выделенные с хорошими урожаями (Jones
Бензиловые спирты и бензиловые эфиры TBDMS эффективно окислялись до
Родственное соединение хрома (VI) пиридиния хлорхромат (PCC) также полезно для окисления первичных спиртов до альдегидов. данные процедуры, потому что эти решения имеют тенденцию к взрыву.β, β-дизамещенные α, β-ненасыщенные метилкетоны из гомоаллиловых спиртов с
Бензилидендиацетат можно гидролизовать до соответствующего бензальдегида водной кислотой. Это действительно здорово, не правда ли? Степень окисления хрома в CrO3 +6. kanisskaI kanisskaI триоксид хрома в водном растворе серной кислоты можно безопасно смешивать с ацетоном (Jones
Процедура окисления была
региоселективно несопряженные ненасыщенные карбонильные соединения при тех же
Решение
A. Так частично, им дали оксид хрома C r o.В Cr2O3 3 атома O занимают всего 6 электронов, но у нас есть два атома Cr, поэтому каждый атом отдает 3 электрона, что дает ему чистую степень окисления +3. Каков механизм последующего окисления толуола $ \ ce {CrO3} $ в уксусном ангидриде? Я вижу, что моя степень окисления изменилась с отрицательного 1 на плюс 1. Почему полярные и неполярные молекулы отталкиваются? 0 +2 +3 +4 +6. В этом видео мы будем использовать этот метод для определения окисленных и восстановленных элементов в реакции, которая происходит между I⁻… Lett., 1999, 1, 2129-2132. Если у него больше электронов, он стремится получить еще несколько электронов, чтобы завершить свою внешнюю оболочку, и приобретает отрицательную степень окисления. В Cr2O3 на 3 атома O приходится всего 6 электронов, но у нас есть два атома Cr. Триоксид хрома — сильный окислитель, не растворимый в большинстве
В чем разница между первым законом Ньютона и вторым законом движения? CrO3 при низкой температуре (-78 ° C). соответствующие карбонильные соединения с высоким выходом при катализе периодной кислотой
Если нет, я все равно проведу вас через это.Хром имеет степень окисления +6. это чистая степень окисления (потерянные электроны) 4. 4 HCrO 4− + 3 RCH 2 OH + 16 H + + 11 H 2 O → 4 [Cr (H 2 O) 6] 3+ + 3 RCOOH Неорганические продукты зеленый, характерный для… 1.a Степень окисления хрома одинакова для всех следующих соединений, кроме A. Cr (OH) 3 B. Cr2O3 C. Cr2 (SO4) 3 D. CrO3 1.b Что происходит с Cr3 + (водн.) ион, когда он превращается в CrO4 2– (водн.)? CrO3 при низкой температуре (-78 ° C). были превращены в 3,4-дигидроизокумарин и фталид с количественными выходами.Какие два из следующих утверждений о калькуляции затрат по видам деятельности верны? Спирты в альдегиды и кетоны, Springer Berlin, 2006, 1-97.). Тригалогенуксусная кислота может быть хорошо преобразована в трихлорметил и трибромметилкетоны.
Использование оксида хрома ($ \ ce {CrO3} $): Толуол или замещенный толуол превращается в бензилидендиацетат при обработке оксидом хрома в уксусном ангидриде. 1. Его степень окисления снижается, и он подвергается восстановлению. Механизм окисления Джонса. Число окисления, также называемое степенью окисления, общее количество электронов, которые атом либо приобретает, либо теряет, чтобы образовать химическую связь с другим атомом.. Каждому атому, который участвует в реакции окисления-восстановления, присваивается степень окисления, которая отражает его способность приобретать, отдавать или делиться электронами. Какое химическое соединение самое стабильное? высокофункциональная группа толерантна и очень селективна для группы TBDMS над
Линк, Ю. Шао, Tetrahedron Lett., 1992,
С. Чжан, Л. Сюй, М. Л. Труделл, Synthesis, 2005, 1757-1760. Степень окисления каждого атома может быть рассчитана путем вычитания суммы неподеленных пар и электронов, которые он получает от связей, из количества валентных электронов.и диарилметаны были окислены до соответствующих замещенных бензойных кислот
соседние хиральные центры. Орг. Реагент Джонса представляет собой смесь триоксида хрома или дихромата натрия в разбавленной серной кислоте, которая на месте образует хромовую кислоту. C. Ее степень окисления увеличивается, и она подвергается восстановлению. Затем последовал последовательный процесс Ваккера с промотированием PdCl2 / CrO3.
Если степень окисления иона металла неизвестна, мы можем рассчитать ее на основе степеней окисления (зарядов) других ионов в формуле.Итак, 4 минус 3 дадут мне плюс 1. Каждый атом хочет, чтобы его внешняя оболочка была полной 8. Б. Мы переходим от одинарной связи углерод-кислород к двойной связи углерод-кислород. CrO3 гр. Cr2O3 Превратите свои записи в деньги и помогите другим студентам! Положительная степень окисления хрома +6, +3 и +2. Для тех, кто не знает, CrO3 — это триоксид хрома. 10d) Объединение водных растворов каких из следующих пар соединений может вызвать образование осадка? Степень окисления Cr в CrO3 +6.Азот имеет широкий диапазон степеней окисления в органических соединениях. Приготовленные 2,5-дигидропирролы легко поддаются обработке.
Бензиловые эфиры, такие как изохроман и фталан
Как бы вы приготовили смесь и какое отношение имеют отражение и преломление к науке? CsNO3 состоит из двух ионов: иона цезия и иона нитрата. По идее, степень окисления, которая может быть положительной, отрицательной или нулевой, представляет собой гипотетический заряд, который имел бы атом, если бы все связи с атомами различных элементов были на 100% ионными, без ковалентного компонента.Эта степень окисления является показателем степени окисления (потери электронов) атома в химическом соединении.
Смешные цитаты из Талмуда,
Синяя алмазная сковорода с крышкой,
Шнурки с логотипом Nike,
Признаки Эрзули Фреды,
Тренажерный зал Weider,
Но ты умный, как а плюс студент Тексты песен,
Ипотечный иск Eagle Home,
Спектролит Лабрадорит Значение,
ОКСИДЫ ХРОМА — www.mocvd-precursor-encyclopedia.de
Оксид хрома (VI) (триоксид хрома) CrO 3
Кристаллическая структура CrO3 состоит из
бесконечных цепочек тетраэдров CrO4 с общими углами, параллельных оси c.Длина мостиковой связи Cr-O составляет 1,748, конечная длина Cr-O составляет 1,599. Угол при переходном атоме О составляет 143 °. [858]
Триоксид хрома CrO 3 с O 2 в качестве газа-носителя (200 куб.
эпитаксиальных тонких пленок CrO 2 (110) на подложках MgO (001) с буфером TiO 2 (110)
слои, полученные окислением тонких пленок TiN (001) в процессе отжига в кислороде низкого давления.XRD и SEM показали, что пленки CrO 2 (110) ортогонально двойниковые и
образован мелкими зернами CrO 2 размером 3-5 мкм. Эпитаксиальное соотношение образца: CrO2 (110) [001] ∥TiO2 (110) [001] ∥MgO (001) [110]
Триоксид хрома CrO 3 был использован для осаждения тонких пленок CrO 2 на сапфире (0001) при температуре роста 390 ° C (чуть ниже температуры разложения
CrO 2 до Cr 2 O 3 ), что позволило получить эпитаксиальные пленки CrO 2 .Прекурсор испарялся при 260 ° C (точка плавления CrO 3 ) и транспортировался в зону осаждения потоком газа-носителя O 2 объемом 500 куб.
Высокоориентированные по оси a пленки CrO 2 пленки (содержащие высокоориентированный (0001) Cr 2 O 3 ) были выращены на подложках из Al 2 O 3 (0001) методом CVD при атмосферном давлении (AP) низкая температура осаждения (330 ° C) с использованием CrO 3 в качестве прекурсора (испаряется при 260 ° C) и кислорода в качестве газа-носителя.Скорость осаждения существенно зависела от температуры подложки, тогда как микроструктура поверхности пленки зависела в основном от толщины пленки. В кинетике роста CrO 2 доминирует механизм поверхностных реакций с энергией активации 121,0 ± 4,3 кДж / моль. Резкий переход намагничивания при 375 К и намагничивание насыщения
1,92 µ B /f.u., что близко к объемному значению 2µ B /f.u. Присутствие слоя Cr 2 O 3 на границе раздела пленка / граница CrO 2 было объяснено некоторыми структурными эффектами во время исследования процесса роста в зависимости от времени осаждения [861]
Эпитаксиальные пленки CrO 2 были выращены методом химического осаждения из паровой фазы при атмосферном давлении и термическим разложением.
газообразного CrO 3 на монокристаллы рутила (TiO 2 ) на воздухе.Чистый эпитаксиальный CrO2
пленки изготавливались при оптимальной температуре подложки 390 ° C; Слои включали примесь Cr 2 O 5 при температуре роста 380 ° C, а Cr 2 O 3 появлялись при 400 ° C. Магнитные домены этих пленок исследовались с помощью продольного эффекта Керра. [863]
Тонкие эпитаксиальные пленки CrO 2 (серия толщин 27-535 нм) были нанесены на монокристаллические подложки из рутила TiO 2 (100) методом химического осаждения из паровой фазы с использованием CrO 3 в качестве твердого прекурсора; слой
Согласно исследованиям ферромагнитного резонанса (ФМР), магнитная анизотропия сильно зависела от толщины.В самых тонких пленках (27 нм) преобладала деформационная анизотропия, и ось легкого намагничивания смещалась с направления [001] (характерный
объемных магнитов) в направлении [010]. [864,865]
Твердый прекурсор CrO 3 был использован для CVD-роста эпитаксиальных пленок CrO 2 (100) и CrO 2 (110) на TiO 2 (100) и TiO 2 (110 ) подложки соответственно.
Режим послойного роста наблюдался на TiO 2 (100), что приводило к гладким поверхностям, но значительному сжимающему напряжению вне плоскости.Напротив, пленки на TiO 2 (110) следуют островковому режиму роста; даже самые тонкие пленки (∼35 нм) практически не деформируются. Пленки CrO 2 (100) демонстрируют сильное изменение магнитной анизотропии с увеличением толщины из-за напряжения, вызванного подложкой,
в отличие от пленок CrO 2 (110). [866]
CrO 3 был использован в качестве прекурсора для CVD-роста при атмосферном давлении с помощью шаблонов AAO из вертикально ориентированных массивов нанопроволок CrO 2 с высокой плотностью, которые показали значительно улучшенную коэрцитивную силу по сравнению с пленками CrO 2 или
масса.На длину нанопроволоки сильно влиял диаметр пор шаблона AAO. [867]
CrO 2 тонких пленок были нанесены с использованием прекурсора CrO 3 методом химического осаждения из паровой фазы с помощью лазера [868]
Порошок
CrO 3 в качестве прекурсора был использован для получения пленок CrO 2 термическим CVD на сапфире при температурах 320–410 ºC и потоке газа-носителя 50–500 sccm O 2 . Очень
ориентированные по оси a пленки CrO 2 были получены при температурах до 330 ºC; они сохранили высокие магнитные и транспортные свойства, как и осажденные при более высоких температурах.
температуры.[869]
Высококачественные эпитаксиальные пленки CrO 2 (100) были получены на подложках TiO 2 (100) методом CVD с использованием CrO 3
в качестве материала-предшественника. Электронная структура пленок с разрешением по спину была исследована методами рентгеновской абсорбции и фотоэмиссионной спектроскопии с разрешением по спину. Вблизи EF наблюдалась запрещенная зона для электронов со спином вниз; спиновая поляризация около
+ (90 ± 10)% при 293 К, что соответствует полуметаллической природе CrO 2 .[870]
Эпитаксиальный CrO 2 / RuO 2 тонкий
Пленочные гетероструктуры выращивались на подложках TiO 2 (100) при атмосферном давлении.
CVD с использованием прекурсоров CrO 3 и Ru (thd) 3 . Ток в плоскости и ток перпендикулярно плоскости
гигантские магниторезистивные стопки были изготовлены либо с Co, либо с другим эпитаксиальным слоем CrO 2 в качестве верхнего электрода, однако магнитосопротивление было низким, вероятно, из-за
появление химически и магнитно-неупорядоченного слоя на границах раздела CrO 2 и RuO 2 при превращении Cr 2 O 3 в структуры рутила в процессе
его смешивание с RuO 2 .[871]
Разложение
CrO3 на подложке, содержащейся в сосуде высокого давления, который можно рассматривать как разновидность CVD, использовался для эпитаксиального роста ориентированных слоев CrO2 на плоскостях {0001} монокристаллов Al2O3 и Fe2O3 {100}, и на поверхностях {110}, {210}, {001}
монокристалла TiO2 (рутил). Слой CrO2 начинает формироваться при разложении Cr2O5 путем зарождения ориентированного CrO2 во многих местах на поверхности подложки, при этом совершенство ориентированного слоя ограничивается в основном дефектами на поверхности.
подложек.Характеристика пленки с помощью химического анализа и XRD показала, что эпитаксиальный CrO2 во всех отношениях идентичен массивному материалу; ориентированные слои CrO2 были охарактеризованы магнитными измерениями [[i] [PS1]]
Спектр химического триоксида хрома, 98% анализ, ACS Reagent Grade, 500 г
Триоксид хрома, кристалл, реагент, ACS представляет собой хлопьевидное темно-пурпурное твердое вещество в безводном состоянии и становится оранжевым во влажном состоянии.Его основное применение — хромирование. Обычно используется с добавками во время процесса нанесения покрытия, которые не влияют на триоксид, его также можно использовать с хромовой кислотой для нанесения определенных типов анодного покрытия на алюминий. Как реагент качества ACS, его химические характеристики являются фактическими стандартами для химикатов, используемых во многих областях применения высокой чистоты, и обычно обозначают химикаты самого высокого качества, доступные для лабораторного использования. Реагенты класса ACS, производимые Spectrum Chemical, соответствуют самым строгим нормативным стандартам качества и чистоты.
| Процент анализа | : | 0,98 |
| Количество CAS | : | 1333-82-0 |
| Химическая формула | : | CrO3 |
| Химическое количество | : | 500 г |
| Цвет | : | Темно-красный |
| Состав | : | Триоксид хрома 100% |
| Плотность | : | 2.7 г / см3 |
| Оценка | : | ACS, Реагент |
| Температура плавления | : | 197 ° С |
| Молекулярный вес | : | 99.99 г / моль |
| Тип упаковки | : | Янтарная стеклянная бутылка |
| Физическое состояние | : | Кристаллы |
| Срок годности | : | 24 месяца |
| Информация о растворимости | : | Легко растворим в холодной и горячей воде, растворим в уксусной кислоте, ацетоне, диэтиловом эфире, этиловом спирте, азотной кислоте, серной кислоте, воде. |
| Синонимы | : | Оксид хрома (VI), ангидрид хрома, триоксид хрома (6+), триоксид монохромия, триоксид хрома пуратроник, триоксид хрома (6+), оксид хрома (CrO3), хром (CrO3), хромовая кислота, твердое вещество |
| Диапазон pH | : | 1.1 |
SDS
/ASSETS/DOCUMENTS/ITEMS/EN/C1270-500GM.
