Типичные неорганические вещества (соли, кислоты, основания, оксиды) | Типичные органические вещества (углеводороды и их производные) |
| Связи между атомами – ионные или полярные ковалентные | Связи между атомами – ковалентные неполярные или слабополярные |
| Структура веществ – ионная или атомная; редко — молекулярная | Структура веществ – молекулярная |
| Число однородных атомов в молекуле редко превышает два-три | Часто содержат большое число однородных атомов (С, Н) |
| Связи между одинаковыми атомами являются редким исключением | Прочные ковалентные углерод-углеродные (С-С) связи – основа существования многочисленных ОВ |
| Как правило, низкомолекулярные вещества | Молекулярная масса варьирует в большом диапазоне, вплоть до очень высоких значений в десятки и сотни миллионов |
| Большинство твердых веществ имеют высокие температуры плавления и кипения; характерна термическая устойчивость | Сравнительно низкие температуры плавления и кипения; большинство веществ разрушаются при нагревании |
| Подавляющее большинство не обладают прочностью | Почти все легко сгорают на воздухе |
| Для многих веществ характерна растворимость в воде | Нерастворимы или плохо растворимы воде.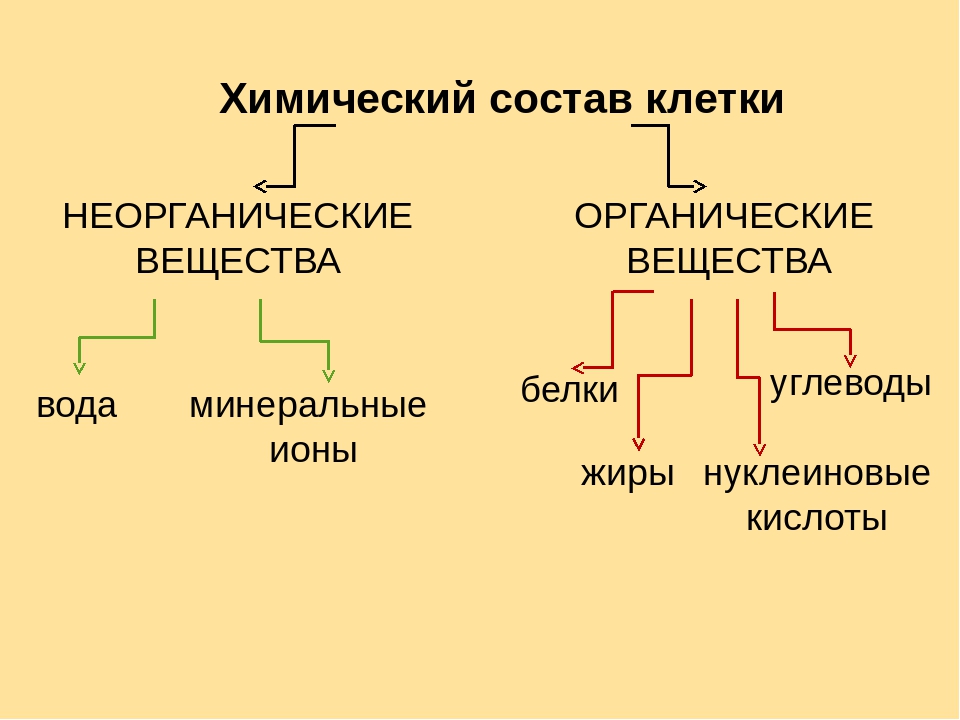 Хорошо растворяются в органических растворителях Хорошо растворяются в органических растворителях |
| В водных растворах и расплавах ведут себя как электролиты | В подавляющем большинстве не обладают электропроводностью |
| Взаимодействуют с другими веществами быстро, во многих случаях мгновенно и необратимо, с количественным выходом продуктов реакции | Химические реакции характеризуются невысокими скоростями, зачастую обратимы. Выход целевых продуктов, как правило, небольшой – вследствие обратимости и образования побочных продуктов |
| Образование полимерных соединений нехарактерно | Многие вещества способны к реакциям полимеризации и поликонденсации |
| Составляют основную массу неживой природы (литосферы, гидросферы, атмосферы) | Составляют основную массу живой природы — биосферы |
Урок 2. неорганические соединения клетки. углеводы и липиды.
 регулярные и нерегулярные биополимеры — Биология — 10 класс
регулярные и нерегулярные биополимеры — Биология — 10 класс
Химические вещества и их роль в живой природе
Органические вещества клетки. Углеводы. Липиды
Необходимо запомнить
ВАЖНО!
Живые системы – клетки, ткани, организмы – состоят из тех же химических элементов, что и объекты неживой природы, что свидетельствует о единстве и взаимосвязи живой и неживой материи. Но соотношение элементов в живом и неживом веществе существенно отличается.
Живые организмы имеют сходный химический состав (одни и те же химические элементы и вещества в близких количествах), что является доказательством родства всего живого на Земле.
К неорганическим соединениям относятся относительно простые соединения, которые встречаются и в неживой природе: вода, минеральные соли, ионы.
Органические соединения, основой строения которых являются атомы углерода, составляют отличительный признак живого. Из органических соединений всеобщее биологическое значение имеют белки, нуклеиновые кислоты, углеводы и липиды.
Из органических соединений всеобщее биологическое значение имеют белки, нуклеиновые кислоты, углеводы и липиды.
Особенности химической организации живой материи:
– 98 % элементного состава приходится на углерод, кислород, водород и азот;
– большое содержание воды;
– наличие органических веществ.
Углеводы – органические вещества с общей формулой Сn(Н2О)m.
Липиды – органические соединения с различной структурой, нерастворимые в воде, но растворимые в органических растворителях.
Общие функции углеводов и липидов: энергетическая, структурная, запасающая, защитная. Кроме того, липиды выполняют ещё терморегуляторную функцию и являются гормонами.
Группы химических элементов в клетке
Биологическая роль воды
Интересные факты
Регулярные и нерегулярные биополимеры
Урок 5.
 химический состав клетки — Биология — 5 класс
химический состав клетки — Биология — 5 класс
Биология, 5 класс
Урок 5. Химический состав клетки
Перечень вопросов, рассматриваемых на уроке:
- Урок посвящён изучению химического состава клетки.
Ключевые слова:
Клетка, химический состав, неорганические и органические вещества, вода, минеральные соли, белки, жиры, углеводы, нуклеиновые кислоты
Тезаурус:
Химический элемент – это атомы одного и того же вида.
Органические вещества – это вещества, которые входят в состав живых организмов и образуются только при их участии.
Неорганические вещества – это вещества, которые входят в состав неживой природы и могут образовываться без участия живых организмов.
Обязательная и дополнительная литература по теме
- Биология. 5–6 классы. Пасечник В. В., Суматохин С. В., Калинова Г. С. и др. / Под ред. Пасечника В. В. М.: Просвещение, 2019
- Биология.
 6 класс. Теремов А. В., Славина Н. В. М.: Бином, 2019.
6 класс. Теремов А. В., Славина Н. В. М.: Бином, 2019. - Биология. 5 класс. Мансурова С. Е., Рохлов В. С., Мишняева Е. Ю. М.: Бином, 2019.
- Биология. 5 класс. Суматохин С. В., Радионов В. Н. М.: Бином, 2014.
- Биология. 6 класс. Беркинблит М. Б., Глаголев С. М., Малеева Ю. В., Чуб В. В. М.: Бином, 2014.
- Биология. 6 класс. Трайтак Д. И., Трайтак Н. Д. М.: Мнемозина, 2012.
- Биология. 6 класс. Ловягин С. Н., Вахрушев А. А., Раутиан А. С. М.: Баласс, 2013.
Теоретический материал для самостоятельного изучения
Сейчас на Земле известно более ста химических элементов. Из их атомов состоят все вещества, встречающиеся на Земле. 80 химических элементов обнаружены в составе живых организмов. При этом четыре из них – углерод, водород, азот и кислород составляют около 98 % массы любого организма. Остальные химические элементы встречаются в живых организмах в малых количествах.
Клетки всех живых организмов состоят из одних и тех же химических элементов. Эти же элементы входят и в состав объектов неживой природы. Сходство состава указывает на общность живой и неживой природы.
Эти же элементы входят и в состав объектов неживой природы. Сходство состава указывает на общность живой и неживой природы.
На этом уроке вы узнаете, из каких химических элементов состоят клетки живых организмов, и какие изменения претерпевают эти химические соединения по мере роста и развития клеток.
В клетках живых организмов больше всего содержится таких химических элементов, как углерод, водород, кислород и азот. Вместе они составляют до 98 % массы клетки. Около 2 % массы клетки приходится на восемь элементов: калий, натрий, кальций, хлор, магний, железо, фосфор и серу. Остальные химические элементы содержатся в клетках в очень малых количествах.
Химические элементы, соединяясь между собой, образуют неорганические (вода и минеральные соли) и органические (белки, жиры, углеводы, нуклеиновые кислоты и др.) вещества.
Значение каждого из веществ, содержащегося в клетке уникально. Вода придаёт клетке упругость, определяет её форму, участвует в обмене веществ. Неорганические вещества используются для синтеза органических молекул. При недостатке минеральных веществ важнейшие процессы жизнедеятельности клеток нарушаются. Углеводы придают прочность клеточным оболочкам, а также служат запасающими веществами. Белки входят в состав разнообразных клеточных структур, регулируют процессы жизнедеятельности и тоже могут запасаться в клетках. Жиры откладываются в клетках. При расщеплении жиров освобождается необходимая живым организмам энергия. Нуклеиновые кислоты играют ведающую роль в сохранении наследственной информации.
Неорганические вещества используются для синтеза органических молекул. При недостатке минеральных веществ важнейшие процессы жизнедеятельности клеток нарушаются. Углеводы придают прочность клеточным оболочкам, а также служат запасающими веществами. Белки входят в состав разнообразных клеточных структур, регулируют процессы жизнедеятельности и тоже могут запасаться в клетках. Жиры откладываются в клетках. При расщеплении жиров освобождается необходимая живым организмам энергия. Нуклеиновые кислоты играют ведающую роль в сохранении наследственной информации.
Клетка – это миниатюрная природная лаборатория, в которой синтезируются и претерпевают изменения различные химические соединения. Сходство химического состава клеток разных организмов доказывает единство живой природы.
Разбор типового тренировочного задания:
Тип задания: Сортировка элементов по категориям
Текст вопроса: Расставьте названия веществ в таблицу:
Органические вещества | Неорганические вещества |
Варианты ответов:
Белки
Вода
Углеводы
Жиры
Кислород
Правильный вариант ответа:
Органические вещества | Неорганические вещества |
белки углеводы жиры | вода кислород |
Разбор типового контрольного задания
Тип задания: Выделение цветом
Текст вопроса: Выделите цветом вещества, входящие в состав живых организмов:
Варианты ответов:
- Вода
- Пластик
- Белки
- Жиры
- Нефть
- Углеводы
- ДНК и РНК
Правильный вариант ответа:
1) Вода
3) Белки
4) Жиры
6) Углеводы
7) ДНК и РНК
Сравнительная характеристика органических и неорганических веществ(таблица)
признаки
СРОЧНО ДАБ 50 БАЛЛОВ
Относительная молекулярная масса водородного соединения неметалла VIIA группы равна 81.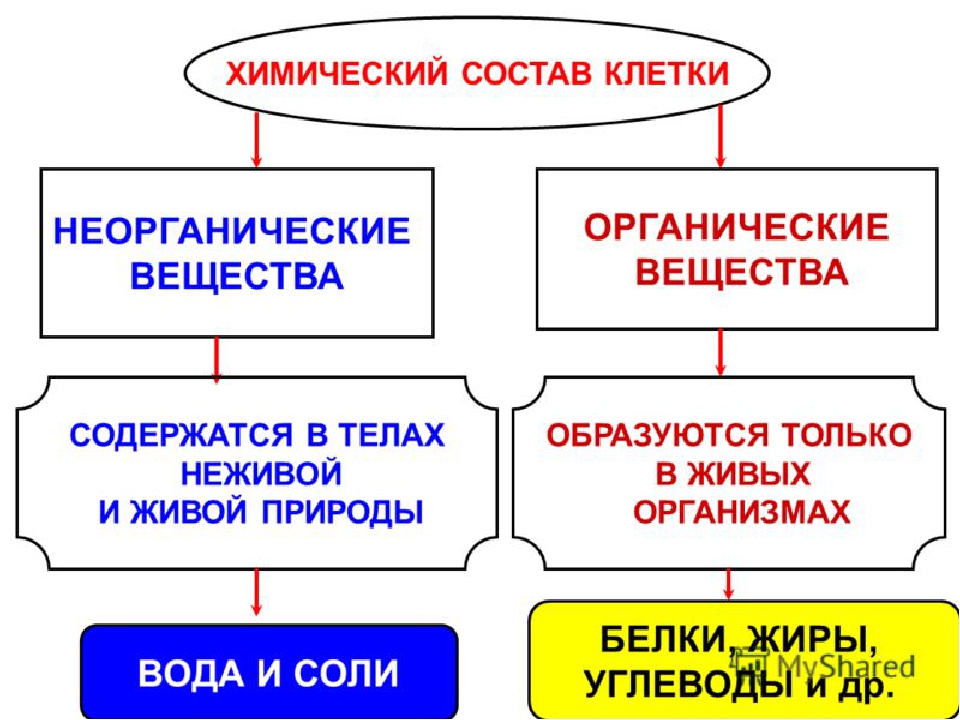 Какой неметалл входит в состав соединения
Какой неметалл входит в состав соединения
…
?
Запиши название элемента в именительном падеже.
Ответ:
.
Молекулярна масса сахарозы
ПОМОГИТЕ❤️❤️❤️❤️❤️❤️❤️❤️❤️❤️❤️❤️❤️
СРОЧНО ДАМ 60 БАЛЛОВ
4.Выбери вещества, вступающие в реакции с высшим оксидом химического элемента, в атоме которого три электронных слоя, а на внешне
…
м уровне находятся пять электронов:
h4PO4
Br2O3
h3O
Ca(OH)2
Rb2O
!Срочно! Дам максимум баллов
1.Относительная молекулярная масса водородного соединения неметалла VIIA группы равна 81. Какой неметалл входит в состав
…
соединения?
Запиши название элемента в именительном падеже.
2.Отметь ряд химических элементов, в котором последовательно увеличиваются металлические свойства простых веществ:
натрий, кальций, литий
бериллий, углерод, алюминий
натрий, цезий, франций
барий, кальций, бериллий
3.Выбери ряд высших оксидов, в котором последовательно ослабевают их основные свойства:
Li2O,Na2O,K2O
B2O3,CO2,BeO
Al2O3,B2O3,Ga2O3
K2O,Na2O,Li2O
!Срочно! Дам максимум баллов
1. Относительная молекулярная масса водородного соединения неметалла VIIA группы равна 81. Какой неметалл входит в состав
Относительная молекулярная масса водородного соединения неметалла VIIA группы равна 81. Какой неметалл входит в состав
…
соединения?
Запиши название элемента в именительном падеже.
2.Отметь ряд химических элементов, в котором последовательно увеличиваются металлические свойства простых веществ:
натрий, кальций, литий
бериллий, углерод, алюминий
натрий, цезий, франций
барий, кальций, бериллий
3.Выбери ряд высших оксидов, в котором последовательно ослабевают их основные свойства:
Li2O,Na2O,K2O
B2O3,CO2,BeO
Al2O3,B2O3,Ga2O3
K2O,Na2O,Li2O
4.Выбери вещества, вступающие в реакции с высшим оксидом химического элемента, в атоме которого три электронных слоя, а на внешнем уровне находятся пять электронов:
h4PO4
Br2O3
h3O
Ca(OH)2
Rb2O
Фреон-12 (дифлуородихлорометан) CF2Cl2 використовують у холодильниках як холодоагент. Його виготовляють згідно з наведеною схемою:
CCL + 2HF CF;Cl2 +
…
2HCI
Обчисліть масу фреону-12, яку можна одержати з 92,4 г карбон(IV) хлориду CCl..
Определите вид химической связи для следующих веществ: Cu, HCL, KCL, Na. Br, HBr , H 2 O, H 2, NH 3, Mg, N 2, Ca, H 2 S, O 2. v Составьте схему образо
Br, HBr , H 2 O, H 2, NH 3, Mg, N 2, Ca, H 2 S, O 2. v Составьте схему образо
…
вания любых двух видов связи из данных веществ.
Какой объём углекислого газа получится при сгорании 1м3 метана?
Получите оксид железа (III) разложением сложного вещества.
Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Сырье и продукты промышленности органических и неорганических веществ. Подробнейший справочник технолога. Физические, химические, тепловые и прочие свойства веществ.
| ||||||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | ||||||||||||
TehTab.ru Реклама, сотрудничество: [email protected] | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | |||||||||||
2.3.1. Неорганические вещества клетки
2.3. Химическая организация клетки
2.3.1. Неорганические вещества клетки
В состав клетки входит около 70 элементов Периодической системы элементов Менделеева, а 24 из них присутствуют во всех типах клеток. Все присутствующие в клетке элементы делятся, в зависимости от их содержания в клетке, на группы:
- макроэлементы – H, O, N, C,. Mg, Na, Ca, Fe, K, P, Cl, S;
- микроэлементы – В, Ni, Cu, Co, Zn, Mb и др.;
- ультрамикроэлементы – U, Ra, Au, Pb, Hg, Se и др.
Другой принцип классификации элементов:
- органогены (кислород, водород, углерод, азот),
- макроэлементы,
- микроэлементы.
В состав клетки входят молекулы неорганических и органических соединений.
Неорганические соединения клетки – вода и неорганические ионы.
Вода – важнейшее неорганическое вещество клетки. Все биохимические реакции происходят в водных растворах. Молекула воды имеет нелинейную пространственную структуру и обладает полярностью. Между отдельными молекулами воды образуются водородные связи, определяющие физические и химические свойства воды.
|
Физические свойства воды
|
Значение для биологических процессов
|
|
Высокая теплоемкость (из-за водородных связей между молекулами) и теплопроводность (из-за небольших размеров молекул)
|
Транспирация
|
|
Прозрачность в видимом участке спектра
|
Высокопродуктивные биоценозы прудов, озер, рек ( из-за возможности фотосинтеза на небольшой глубине)
|
|
Практически полная несжимаемость (из-за сил межмолекулярного сцепления)
|
Поддержание формы организмов: форма сочных органов растений, положение трав в пространстве, гидростатический скелет круглых червей, медуз, амниотическая жидкость поддерживает и защищает плод млекопитающих
|
|
Подвижность молекул (из-за слабости водородных связей)
|
Осмос: поступление воды из почвы; плазмолиз
|
|
Вязкость (водородные связи)
|
Смазывающие свойства: синовиальная жидкость в суставах, плевральная жидкость
|
|
Растворитель (полярность молекул)
|
Кровь, тканевая жидкость, лимфа, желудочный сок, слюна, у животных; клеточный сок у растений; водные организмы используют растворенный в воде кислород
|
|
Способность образовывать гидратационную оболочку вокруг макромолекул (из-за полярности молекул)
|
Дисперсионная среда в коллоидной системе цитоплазмы
|
|
Оптимальное для биологических систем значение сил поверхностного натяжения (из-за сил межмолекулярного сцепления)
|
Водные растворы – средство передвижения веществ в организме
|
|
Расширение при замерзании (из-за образования каждой молекулой максимального числа – 4 – водородных связей_
|
Лед легче воды, выполняет в водоемах функцию теплоизолятора
|
Неорганические ионы:
катионы K+, Na+, Ca2+ , Mg2+ и анионы Cl–, NO3- , PO4 2-, CO32-, НPO42-.
Разность между количеством катионов и анионов (Nа+, К+, Сl-) на поверхности и внутри клетки обеспечивает возникновение потенциала действия, что лежит в основе нервного и мышечного возбуждения.
Анионы фосфорной кислоты создают фосфатную буферную систему, поддерживающую рН внутриклеточной среды организма на уровне 6—9.
Угольная кислота и ее анионы создают бикарбонатную буферную систему и поддерживают рН внеклеточной среды (плазмы крови) на уровне 7—4.
Соединения азота служат источником минерального питания, синтеза белков, нуклеиновых кислот.
Атомы фосфора входят в состав нуклеиновых кислот, фосфолипидов, а также костей позвоночных, хитинового покрова членистоногих.
Ионы кальция входят в состав вещества костей; они также необходимы для осуществления мышечного сокращения, свертывания крови.
Таблица. Роль макроэлементов на клеточном и организменном уровне организации.
Таблица. Роль микроэлементов в жизни клетки, растительного и животного организмов.
Тематические задания
Часть А
А1. Полярностью воды обусловлена ее способность
1) проводить тепло
3) растворять хлорид натрия
2) поглощать тепло
4) растворять глицерин
А2. Больным рахитом детям необходимо давать препараты, содержащие
1) железо
2) калий
3) кальций
4) цинк
А3. Проведение нервного импульса обеспечивается ионами:
1) калия и натрия
2) фосфора и азота
3) железа и меди
4) кислорода и хлора
А4. Слабые связи между молекулами воды в ее жидкой фазе называются:
1) ковалентными
2) гидрофобными
3) водородными
4) гидрофильными
А5. В состав гемоглобина входит
1) фосфор
2) железо
3) сера
4) магний
А6. Выберите группу химических элементов, обязательно входящую в состав белков
1) Na, K, O, S
2) N, P, C, Cl
3) C, S, Fe, O
4) C, H, O, N
А7. Пациентам с гипофункцией щитовидной железы дают препараты, содержащие
1) йод
2) железо
3) фосфор
4) натрий
Часть В
В1. Выберите функции воды в клетке
1) энергетическая
2) ферментативная
3) транспортная
4) строительная
5) смазывающая
6) терморегуляционная
В2. Выберите только физические свойства воды
1) способность к диссоциации
2) гидролиз солей
3) плотность
4) теплопроводность
5) электропроводность
6) донорство электронов
Часть С
С1. Какие физические свойства воды определяют ее биологическое значение?
Тема 2.2. Химический состав клетки.
1. Дайте определения понятий.
Клетка – элементарная единица живого, обладающая всеми признаками организма: способностью к размножению, росту, обмену веществ и энергией с окружающей средой, раздражимостью, постоянством химического сотсава.
Макроэлементы – элементы, количество которых в клетке составляет до 0.001% от массы тела. Примеры – кислород, углерод, азот, фосфор, водород, сера, железо, натрий, кальций и др.
Микроэлементы – элементы, количество которых в клетке составляет от 0.001% до 0.000001% от массы тела. Примеры – бор, медь, кобальт, цинк, йод и др.
Ультрамикроэлементы – элементы, содержание которых в клетке не превышает 0.000001% от массы тела. Примеры – золото, ртуть, цезий, селен и др.
2. Составьте схему «Вещества клетки».
3. О чем говорит научный факт сходства элементарного химического состава живой и неживой природы?
Это указывает на общность живой и неживой природы.
Неорганические вещества. Роль воды и минеральных веществ в жизнедеятельности клетки.
1. Дайте определения понятий.
Неорганические вещества – это вода, минеральные соли, кислоты, анионы и катионы, присутствующие как в живых, так и в неживых организмах.
Вода – одно из самых распространенных неорганических веществ в природе, молекула которого состоит из двух атомов водорода и одного атом кислорода.
2. Нарисуйте схему «Строение воды».
3. Какие особенности строения молекул воды придают ей уникальные свойства, без которых невозможна жизнь?
Структура молекулы воды образована двумя атомами водорода и одним атомом кислорода, которые образуют диполь, то есть вода имеет две полярности «+»и»-«.Это способствует ее проницаемости через стенки мембраны, способностью растворять химические вещества. Кроме того, диполи воды связываются водородными связями друг с другом, что обеспечивает ее способность быть в различных агрегатных состояниях, а также — растворять или не растворять различные вещества.
4. Заполните таблицу «Роль воды и минеральных веществ в клетке».
5. Каково значение относительного постоянства внутренней среды клетки в обеспечении процессов ее жизнедеятельности?
Постоянство внутренней среды клетки называется гомеостазом. Нарушение гомеостаза влечёт к повреждению клетки или к её смерти, в клетке постоянно происходит пластический обмен и энергетический обмен, это две составляющие метаболизма, и нарушение этого процесса ведёт к повреждению или к гибели всего организма.
6. В чем состоит назначение буферных систем живых организмов и каков принцип их функционирования?
Буферные системы поддерживают определенное значение рН (показатель кислотности) среды в биологических жидкостях. Принцип функционирования заключается в том, что рН среды зависит от концентрации протонов в этой среде (Н+). Буферная система способна поглощать или отдавать протоны в зависимости от их поступления в среду извне или, напротив, удаления из среды, при этом рН не будет изменяться. Наличие буферных систем необходимо в живом организме, так как из-за изменения условий окружающей среды рН может сильно меняться, а большинство ферментов работает только при определенном значении рН.
Примеры буферных систем:
карбонатно-гидрокарбонатная (смесь Na2СО3 и NaHCO3)
фосфатная (смесь K2HPO4 и Kh3PO4).
Органические вещества. Роль углеводов, липидов и белков в жизнедеятельности клетки.
1. Дайте определения понятий.
Органические вещества – это вещества, в состав которых обязательно входит углерод; они входят в состав живых организмов и образуются только при их участии.
Белки – высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью.
Липиды – обширная группа природных органических соединений, включающая жиры и жироподобные вещества. Молекулы простых липидов состоят из спирта и жирных кислот, сложных — из спирта, высокомолекулярных жирных кислот и других компонентов.
Углеводы – это органические вещества, в своем составе имеющие карбонильную и несколько гидроксильных групп и иначе называемые сахарами.
2. Впишите в таблицу недостающую информацию «Строение и функции органических веществ клетки».
3. Что понимают под денатурацией белка?
Денатурация белка – это утрата белком своей природной структуры.
Нуклеиновые кислоты, АТФ и другие органические соединения клетки.
1. Дайте определения понятий.
Нуклеиновые кислоты – это биополимеры, состоящие из мономеров – нуклеотидов.
АТФ – это соединение, состоящее из азотистого основания аденина, углевода рибозы и трех остатков фосфорной кислоты.
Нуклеотид – это мономер нуклеиновой кислоты, который состоит из фосфатной группы, пятиуглеродного сахара (пентозы) и азотистого основания.
Макроэргическая связь – это связь между остатками фосфорной кислоты в АТФ.
Комплементарность – это пространственное взаимное соответствие нуклеотидов.
2. Докажите, что нуклеиновые кислоты являются биополимерами.
Нуклеиновые кислоты состоят из большого количества повторяющихся нуклеотидов и имеют массу 10.000 до нескольких миллионов углеродных единиц.
3. Охарактеризуйте особенности строения молекулы нуклеотида.
Нуклеотид представляет собой соединение из трех компонентов: остатка фосфорной кислоты, пятиуглеродного сахара (рибозы), и одного из азотистых соединений (аденин, гуанин, цитозин, тимин или урацил).
4. Какое строение имеет молекула ДНК?
ДНК – двойная спираль, состоящая из множества нуклеотидов, которые последовательно соединяются между собой за счет ковалентных связей между дезоксирибозой одного и остатком фосфорной кислоты другого нуклеотида. Азотистые основания, которые располагаются по одну сторону от остова одной цепи, связаны Н-связями с азотистыми основаниями второй цепи по принципу комплементарности.
5. Применив принцип комплементарности, постройте вторую цепочку ДНК.
Т-А-Т-Ц-А-Г-А-Ц-Ц-Т-А-Ц
А-Т-А-Г-Т-Ц-Т-Г-Г-А-Т-Г.
6. Каковы основные функции ДНК в клетке?
При помощи четырех типов нуклеотидов в ДНК записана вся важная информация в клетке об организме, которая передается последующим поколениям.
7. Чем молекула РНК отличается от молекулы ДНК?
РНК представляет собой одинарную цепь меньшего, чем ДНК, размера. В нуклеотидах находится сахар рибоза, а не дезоксирибоза, как в ДНК. Азотистым основанием, вместо тимина, является урацил.
8. Что общего в строении молекул ДНК и РНК?
И РНК, и ДНК являются биополимерами, состоящими из нуклеотидов. В нуклеотидах общим в строении является наличие остатка фосфорной кислоты и оснований аденина, гуанина, цитозина.
9. Заполните таблицу «Типы РНК и их функции в клетке».
10. Что такое АТФ? Какова его роль в клетке?
АТФ – аденозинтрифосфат, макроэргическое соединение. Его функции – универсальный хранитель и переносчик энергии в клетке.
11. Каково строение молекулы АТФ?
АТФ состоит из трех остатков фосфорной кислоты, рибозы и аденина.
12. Что представляют собой витамины? На какие две большие группы их разделяют?
Витамины – биологически активные органические соединения, играющие важную роль в процессах обмена веществ. Их разделяют на водорастворимые (С, В1, В2 и др.) и жирорастворимые (А, Е и др.).
13. Заполните таблицу «Витамины и их роль в организме человека».
Разница между органическими и неорганическими
Органические соединения содержат углерод, обычно связанный с водородом. Неорганические соединения либо не содержат углерода, либо связаны с кислородом, азотом или металлом.
Термины «органический» и «неорганический» в химии означают нечто иное, чем когда вы говорите о продуктах питания и других продуктах. Органические и неорганические соединения составляют основу органической химии и неорганической химии. Химики-органики изучают органические молекулы, их синтез и реакции между ними.Химики-неорганики изучают все другие типы веществ, включая соли, металлы и минералы.
Основное различие между этими двумя классами веществ состоит в том, что органические соединения всегда содержат элемент углерод, в то время как большинство неорганических соединений не имеют этого элемента. Поскольку существуют углеродсодержащие неорганические соединения, наличие углерода недостаточно для того, чтобы классифицировать соединение как органическое! За очень немногими исключениями, органические соединения содержат атомы углерода, связанные с атомами водорода, образуя связи C-H.Многие органические соединения также содержат атомы кислорода.
Примеры органических соединений
Соединения, образующиеся в живых организмах, представляют собой органические молекулы. Основные классы органических соединений — это углеводы, жиры, белки и нуклеиновые кислоты.
Примеры органических веществ:
- Сахароза (столовый сахар), C 12 H 22 O 11
- Метан, CH 4
- ДНК
- Бензол, C 6 H 6
- Этанол (зерновой спирт), C 2 H 6 O
- Уголь
- Волосы и ногти (кератиновый белок)
- Целлюлоза
- Масло
- Ферменты
Органические соединения без связей CH
Есть несколько органических соединений, содержащих углерод, но без связи CH.Примеры включают:
- Четыреххлористый углерод, CCl 4
- Мочевина, CO (NH 2 ) 2
Примеры неорганических соединений
Неорганические вещества включают все чистые элементы, соли, многие кислоты и основания, металлы и сплавы, а также минералы. Соединения, в которых неуглеродный атом образует химическую связь с водородом, являются неорганическими.
Примеры неорганических соединений включают:
- Хлорид натрия (поваренная соль) (NaCl)
- Латунь
- Стекло и кварц (SiO 2 )
- Соляная кислота (HCl)
- Серная кислота (H 2 ) SO 4 )
Неорганические молекулы, содержащие углерод
Некоторые неорганические соединения содержат углерод.К ним относятся оксиды, карбиды, некоторые карбонаты и некоторые цианиды. Примеры включают:
- Диоксид углерода (CO 2 )
- Цианиды (связь CN)
- Карбиды (например, карбид бора, B 4 C)
- Дисульфид углерода (CS 2 )
- Фосген (COCl 2 )
Обратите внимание, что цианистый водород HCN содержит как углерод, так и водород. Обычно его считают неорганическим соединением из-за связи между углеродом и азотом.Алмаз, графит и графен состоят из чистого углерода. Они неорганические.
Ни органические, ни неорганические
Чистые элементы не являются соединениями, поэтому они не являются ни органическими, ни неорганическими соединениями:
- Аргон (Ar)
- Серебро (Ag)
- Сера (S)
- Углерод (C)
Не все органические вещества происходят из жизни
Большинство органических соединений образуются в живых организмах, но молекулы могут образовываться посредством других процессов. Например, органические соединения, обнаруженные на Марсе или в туманности, не обязательно являются признаком внеземной жизни.Солнечное излучение может поставлять энергию, необходимую для преобразования неорганических соединений в органические.
Сравнение органических и неорганических соединений
Органические и неорганические соединения
Есть основные различия между органическими и неорганическими соединениями. Хотя оба типа соединений составляют основу химии, эти два типа довольно сильно различаются. Основное отличие заключается в наличии атома углерода; органические соединения будут содержать атом углерода (и часто атом водорода для образования углеводородов), в то время как почти все неорганические соединения не содержат ни одного из этих двух атомов.
Хотя большинство неорганических соединений не содержат углерода, некоторые из них содержат. Окись углерода и двуокись углерода, например, содержат атомы углерода, но их количество недостаточно велико для образования прочных связей с кислородом, присутствующим в молекуле. Из-за небольшого количества углерода и слабых связей, которые он образует, ученые давно классифицируют эти молекулы как неорганические, но это побудило некоторых представителей научного сообщества заявить о необходимости создания более совершенной системы классификации соединений.
Еще одно важное различие между органическими и неорганическими соединениями — это тип молекулы и ее связь с живыми существами. Органические соединения будут включать такие вещи, как нуклеиновые кислоты, содержащиеся в ДНК, липиды и жирные кислоты, обнаруженные в клетках живых организмов, белки и ферменты, необходимые для протекания клеточных процессов, и многое другое. Между тем неорганические соединения включают соли металлов и других элементарных соединений.
1. C 12 H 22 O 11 — Сахароза, более известная как сахар, который мы используем в домашних условиях, является важным органическим соединением, которое содержит не только углерод и водород, но и их в изобилии и в более высоких соотношениях. чем присутствующий кислород.
2. CH 4 — Это органическое соединение на основе углерода и водорода, также известное как метан, является широко известным продуктом жизнедеятельности живых существ.
3. C 55 H 72 O 5 N 4 Mg — Более известный среди исследователей как хлорофилл-а, этот компонент, обнаруженный в зеленых растениях, не только имеет высокое соотношение углерода и водорода, но также является главный фактор процесса фотосинтеза у растений.
4. (NH 4 ) 2 S — Несмотря на присутствие атомов водорода в этом соединении, отсутствие атома углерода и возникающие слабые связи, которые образуются между атомами, делают сульфид аммония неорганическим соединением.
5. CaCl 2 — Хлорид кальция — неорганическое соединение, имеющее множество применений, но отсутствие в нем атома углерода, атома водорода или обоих означает, что он классифицируется как неорганическое соединение.
Сравнение органических и неорганических соединений
Разница между органическими и неорганическими соединениями
Типы соединений
Объединение атомов различных элементов приводит к образованию соединений.В зависимости от типа притяжения, которое существует между атомами соединения, соединения подразделяются на четыре основные категории:
В ковалентных соединениях атомы разных элементов делятся своими электронами для достижения стабильности
В ионных соединениях атомы различных элементов связаны друг с другом за счет полной передачи своих электронов
Металлические соединения характеризуются ассоциацией различных металлических атомов сильными металлическими силами
В координационных ковалентных соединениях определенные комплексные ионы удерживаются вместе ковалентными и координационные связи
Все организмы в значительной степени состоят из органических молекул.
Органические молекулы, которые очень важны для нас, — это в основном углеводы, белки, липиды и т. Д.
Развитию органической химии около 200 лет. В конце семнадцатого века химики всего мира начали различать органические соединения, полученные из растений и животных, и неорганические молекулы, полученные из минеральных ресурсов.
Разница между органическими и неорганическими соединениями
В первые годы развития химии химики сделали много неудачных попыток синтезировать органические соединения в лабораторных условиях.После нескольких неудач все их усилия оказались тщетными, и они были вынуждены поверить в то, что органические соединения могут быть синтезированы с помощью особого механизма, который может происходить только внутри живых существ. Следовательно, в отличие от неорганических соединений, органические соединения не могут быть получены в лаборатории.
Синтез органических соединений
Открытие карбамида произвело революцию в области органической химии. Это открытие привело Кольбе в 1845 году к работе над получением уксусной кислоты в лаборатории, в то время как Хеннель успешно работал над получением этилового спирта, Бертло в 1856 году предпринял успешную попытку получения метана в лаборатории без использования каких-либо живых организмов.
Новая версия органической химии
После успешного синтеза различных органических соединений в лаборатории теория жизненной силы была полностью проигнорирована. Углубленное изучение органических соединений показало, что эти соединения в основном состоят из углерода. Изучение соединений углерода в основном известно как органическая химия.
Здесь следует отметить одну вещь: простое присутствие углерода в соединении не означает, что соединение является органическим.Например, CO2 содержит углерод, но является неорганическим соединением.
Углубленное понимание структуры органических соединений показывает, что все органические соединения состоят из углерода в качестве основного компонента, который также неизменно связан с водородом. Эти органические соединения, состоящие в основном из углерода и водорода, называются углеводородами.
Существует большое количество органических соединений, содержащих неорганические частицы, такие как азот, сера, фосфор и т. Д.Но эти соединения являются производными только углеводородов и, следовательно, считаются органическими соединениями.
Следовательно, органическая химия определяется как химия углеводородов и их производных.
Различия между органическими и неорганическими соединениями (таблица)
Органическое соединение | Неорганическое соединение 02 | ||||
Обычно не содержит углерода. | |||||
Природа соединений | Ковалентное соединение | Электровалентные / ионные / ковалентные соединения | |||
Точки плавления и кипения | Растворимость в воде | Нерастворимый | Растворимый | ||
Растворимый в органических растворителях | Растворимый | Нерастворимый 48 | Хорошие проводники | ||
Горючесть | Горючие | Негорючие | |||
Летучие |
| Летучая природа ile | |||
Связь | выставлен | Не выставлен | |||
Изомерия | выставлен | Большое количество органических соединений Поскольку мы знаем, что органические соединения состоят в основном из углерода и водорода, основные свойства углерода приводят к образованию такого большого количества соединений.
Три упомянутые выше причины ясно оправдывают присутствие большого количества органических соединений на Земле. С другой стороны, неорганические соединения естественным образом содержатся в минералах земной коры, поэтому их количество ограничено. Большинство неорганических соединений не проявляют четырехвалентности и катенации, и, следовательно, их количество ограничено. Типы органических соединений Поскольку мы знаем, что большинство органических соединений являются производными углеводородов, поэтому для изучения типов органических соединений давайте начнем с типов углеводородов. Эти два типа углеводородов в основном классифицируются на основе количества связей между присутствующими в них атомами углерода Насыщенные углеводороды Те органические соединения, которые имеют только одинарные связи между атомами углерода, известны как алканы. У них максимальное количество атомов водорода, связанных с атомами углерода. Общая формула соединений этого семейства — Cnh3n + 1, т.е. последовательные соединения алканов отличаются друг от друга по составу по группе -Ch3. Ненасыщенные углеводороды Те органические соединения, которые имеют недостаточное количество атомов водорода, подвергаются образованию двойной и тройной связи, чтобы удовлетворить их валентность, известны как ненасыщенные углеводороды. Общая формула семейства углеводородов с двойной связью — Cnh3n, тогда как семейство с тройной связью в Cnh3n-1. Семейство двойной связи известно как алкен, тогда как семейство тройной связи известно как алкин. Ненасыщенность приводит к нестабильности углеродного соединения.Его можно удалить с помощью процесса гидрирования, в котором молекулы водорода подают к углеродному соединению, содержащему двойную или тройную связь, в присутствии катализатора Ni / Pd для удаления ненасыщенности. Органические против. Неорганические молекулы | SciencingРазличие между органической и неорганической химией нетривиально. Курсы обучения в университетах по всему миру построены на основе различий. И даже среди тех, кто не имеет формального образования в области химии, есть несколько интуитивное ощущение разницы.Сахар, крахмал и масла состоят из органических молекул. Вода, аккумуляторная кислота и поваренная соль неорганические. (Не путайте это с определением органических продуктов; это другой вопрос, который включает больше сельскохозяйственных и политических различий.) Углерод••• xerviar / iStock / Getty Images Отличительной чертой органических молекул является что они содержат углерод. Раннее представление об органических молекулах по сравнению с неорганическими заключалось в том, что органические молекулы произошли исключительно от живых существ.Оказывается, существуют органические молекулы, которые происходят не из живых процессов, а из других источников. Итак, действительно становится, что ключевой особенностью органических молекул является присутствие углерода. Тем не менее, возможно, большинство известных органических молекул являются результатом жизненных процессов. Углеводороды••• Лука Франческо Джованни Бертолли / iStock / Getty Images Атомы углерода легко образуют химические связи с другими атомами углерода. Они также легко образуют химические связи с атомами водорода.Молекула, состоящая из атомов углерода и атомов водорода без участия других элементов, называется углеводородом. Углеводороды — очень распространенные и знакомые органические соединения. Бензин — это углеводород; также метан, этан, пропан и бутан. Функциональные группы••• Дино Аблакович / iStock / Getty Images Характерной чертой атома углерода является то, что он образует связи с другими атомами углерода, часто в цепочке или кольце. Находясь в этой конфигурации, углерод также будет химически связываться с атомами других элементов. Есть шесть элементов, с которыми углерод имеет особую ассоциацию. К ним относятся сам углерод, а также 1. водород; 2. кислород; 3. азот; 4. фосфор; и 5. сера. Различные комбинации этих элементов образуют так называемые функциональные группы в органической химии. В органических соединениях семь из этих функциональных групп. (Обратите внимание, что пять элементов сами по себе неорганические, но в сочетании с углеродом они становятся частью органической молекулы.) Функциональные группы придают характерные свойства некоторым хорошо знакомым органическим веществам. Один из них — алкоголь, который мы называем этанолом. Этанол — относительно простая органическая молекула, состоящая из двух атомов углерода, шести атомов водорода и одной так называемой гидроксильной функциональной группы. Сама по себе гидроксильная функциональная группа также относительно проста. Это просто атом кислорода и атом водорода. Как и во всей химии — органической или неорганической — добавление или вычитание всего одного атома может резко изменить свойства молекулы.Молекула этанола без гидроксильной функциональной группы, но только с атомом водорода на своем месте, не является этанолом, а представляет собой органическое соединение этан. Этан представляет собой пар, а не жидкость, при нормальных условиях и служит хладагентом. Другие функциональные группы включают так называемую карбоксильную группу, состоящую из атома углерода, двух атомов кислорода и атома водорода. Простая органическая молекула с одним атомом углерода и четырьмя атомами водорода — это органическое соединение метана или природного газа.Замена одного из атомов водорода в молекуле метана карбоксильной группой образует органическое соединение уксусную кислоту. Уксусная кислота придает уксусу привычный запах и вкус. Полярность••• FU / amanaimagesRF / amana images / Getty Images Молекула воды — неорганическая молекула — представляет собой молекулу, обладающую полярностью (магнитный заряд). Это связано с тем, что атом кислорода в молекуле воды имеет тенденцию иметь связанный с ним отрицательный заряд. Атомы водорода обычно имеют положительный заряд.Именно эти противоположности удерживают молекулу воды вместе как единое целое. Именно эти заряды делают молекулу воды так называемой полярной молекулой. На кислородной стороне молекулы воды имеется частичный отрицательный заряд; на каждой из водородных частей молекулы есть частичные положительные заряды. Органические молекулы, состоящие только из углерода и водорода (также известные как углеводороды), в отсутствие функциональных групп по существу неполярны. Известное наблюдение о том, что нефть и вода не смешиваются, объясняется именно этим несоответствием.Вода является полярной молекулой и может смешиваться с другими полярными молекулами и / или растворять их. Но масла химически неполярны, и существует отталкивание, которое сопротивляется смешиванию и растворению. Примеры••• AaronAmat / iStock / Getty Images Один из способов понять, что такое органические и неорганические молекулы — это несколько общих примеров. Вода и стол — неорганические соединения. Поваренная соль — это пример того, что называется ионным соединением. Натрий образует положительно заряженный ион (катион), а хлор образует отрицательно заряженный ион (анион).Эти электрические заряды удерживают молекулу хлорида натрия вместе. Хлорид натрия может быть важным соединением для живых существ, но поскольку он на самом деле не производится живыми существами и не содержит углерода, он является хорошим примером неорганической молекулы. Вода — еще один пример соединения, которое важно — на самом деле незаменимо — для живых существ, но само состоит из неорганических молекул. Он используется живыми существами, но не производится ими и не содержит углерода. 2.4 Неорганические соединения, необходимые для функционирования человека — анатомия и физиологияЦели обученияК концу этого раздела вы сможете:
Концепции, которые вы изучили до сих пор в этой главе, управляют всеми формами материи и будут работать в качестве основы как для геологии, так и для биологии.Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения бывают либо неорганическими, либо органическими.
В следующем разделе рассматриваются четыре группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе. Вода До 70 процентов веса взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько функций делают воду незаменимой для жизнедеятельности человека. Вода как смазка и амортизатор Вода является основным компонентом многих смазочных жидкостей организма.Подобно тому, как масло смазывает петли двери, вода в синовиальной жидкости смазывает работу суставов тела, а вода в плевральной жидкости помогает легким расширяться и отскакивать при дыхании. Водянистая жидкость помогает пище течь по пищеварительному тракту и обеспечивает отсутствие трения при движении соседних органов брюшной полости. Вода также защищает клетки и органы от физических травм, смягчая, например, мозг внутри черепа и защищая нежную нервную ткань глаз.Вода также смягчает развивающийся плод в утробе матери. Вода как теплоотвод Радиатор — это вещество или объект, который поглощает и рассеивает тепло, но не испытывает соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое в результате химических реакций, без значительного повышения температуры. Более того, когда температура окружающей среды стремительно растет, вода, хранящаяся в организме, помогает ему сохранять прохладу. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам под кожей и переносится в окружающую среду.В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к сердцевине тела. Вода как компонент жидких смесей Смесь — это комбинация двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если вы подумаете о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их в миске, очевидно, что они не связываются с образованием нового соединения.Воздух в помещении, которым вы дышите, представляет собой газовую смесь, содержащую три отдельных элемента — азот, кислород и аргон — и одно соединение — диоксид углерода. Есть три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента; это растворы, коллоиды и суспензии. Чтобы клетки тела выжили, они должны оставаться влажными в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом.Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределяются по всему раствору. Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным. Вода считается «универсальным растворителем», и поэтому считается, что жизнь не может существовать без воды. Вода, безусловно, является самым распространенным растворителем в организме; практически все химические реакции организма происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называют гидрофильными или «водолюбивыми».Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным. Неполярные молекулы, которые с трудом растворяются в воде, называются гидрофобными или «водобоязненными». Концентрации растворенных веществ В химии описаны различные смеси растворенных веществ и воды. Концентрация данного растворенного вещества — это количество частиц этого растворенного вещества в данном пространстве (кислород составляет около 21 процента атмосферного воздуха).В кровотоке человека концентрация глюкозы обычно измеряется в миллиграммах (мг) на децилитр (дл), а у здорового взрослого человека в среднем составляет около 100 мг / дл. Другой метод измерения концентрации растворенного вещества — его молярность, которая составляет моль (M) молекул на литр (L). Моль элемента — это его атомный вес, а моль соединения — это сумма атомных весов его компонентов, называемая молекулярной массой. Часто используемый пример — вычисление моля глюкозы по химической формуле C6h22O6.Согласно периодической таблице, атомный вес углерода (C) составляет 12,011 грамма (г), а в глюкозе шесть атомов углерода, что дает общий атомный вес 72,066 г. Проведя те же вычисления для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («грамм молекулярной массы» глюкозы). Когда вода добавляется для получения одного литра раствора, у вас есть один моль (1М) глюкозы. Это особенно полезно в химии из-за отношения родинок к «числу Авогадро». В моль любого раствора столько же частиц: 6.02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются в тысячных долях моля или миллимолях (мМ). Коллоид представляет собой смесь, которая чем-то похожа на тяжелый раствор. Частицы растворенного вещества состоят из крошечных сгустков молекул, достаточно больших, чтобы сделать жидкую смесь непрозрачной (поскольку частицы достаточно большие, чтобы рассеивать свет). Знакомые примеры коллоидов — молоко и сливки. В щитовидной железе гормон щитовидной железы хранится в виде густой белковой смеси, также называемой коллоидом. Суспензия представляет собой жидкую смесь, в которой более тяжелое вещество временно суспендировано в жидкости, но со временем оседает. Такое отделение частиц от суспензии называется седиментацией. Пример седиментации происходит в анализе крови, который устанавливает скорость седиментации или скорость седиментации. Тест измеряет, как быстро красные кровяные тельца в пробирке выделяются из водянистой части крови (известной как плазма) в течение определенного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но некоторые заболевания могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови. Роль воды в химических реакциях Два типа химических реакций включают образование или потребление воды: дегидратационный синтез и гидролиз.
Эти реакции обратимы и играют важную роль в химии органических соединений (о чем мы поговорим ниже). Рисунок 2.4.1 — Дегидратационный синтез и гидролиз: Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера).(а) При дегидратационном синтезе два мономера ковалентно связаны в реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды выделяется как побочный продукт во время реакций дегидратации. (b) При гидролизе ковалентная связь между двумя мономерами расщепляется путем присоединения атома водорода к одному и гидроксильной группы к другому, что требует участия одной молекулы воды. Соль Напомним, что соли образуются, когда ионы образуют ионные связи.В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой атом принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH — . Этот факт важен для отличия солей от кислот и оснований, обсуждаемых далее. Типичная соль NaCl полностью диссоциирует в воде (рисунок 2.4.2). Положительные и отрицательные области молекулы воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга.Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе. Это свойство имеет решающее значение для функции ионов при передаче нервных импульсов и стимулировании сокращения мышц. Рисунок 2.4.2 — Диссоциация хлорида натрия в воде: Обратите внимание, что кристаллы хлорида натрия диссоциируют не на молекулы NaCl, а на катионы Na + и анионы Cl —, каждый из которых полностью окружен молекулами воды. Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей. Кислоты и основания Кислоты и основания, как и соли, диссоциируют в воде на электролиты. Кислоты и основания могут сильно изменить свойства растворов, в которых они растворены. Кислоты Кислота — это вещество, которое выделяет ионы водорода (H + ) в растворе (Рисунок 2.4.3 a ). Поскольку у атома водорода есть только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот одиночный протон с большой вероятностью участвует в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая выделяется из клеток слизистой оболочки желудка, является сильной кислотой, поскольку она высвобождает весь свой H + в водянистую среду желудка.Эта сильная кислота помогает пищеварению и убивает микробы, попавшие в организм. Слабые кислоты не ионизируются полностью; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Пример слабой кислоты — уксус или уксусная кислота; он называется ацетатом после того, как отдает протон. Рис. 2.4.3 — Кислоты и основания: (a) В водном растворе кислота диссоциирует на ионы водорода (H + ) и анионы. Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + .(b) В водном растворе основание диссоциирует на гидроксильные ионы (OH — ) и катионы. Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию OH — . Основания Основание — это вещество, которое выделяет гидроксильные ионы (OH — ) в растворе, или вещество, которое принимает H +, уже присутствующий в растворе (см. Рисунок 2.4.3 b ). Ионы гидроксила (также известные как ионы гидроксида) или другие основные вещества объединяются с присутствующим H + с образованием молекулы воды, тем самым удаляя H + и снижая кислотность раствора.Сильные основания высвобождают большую часть или все свои гидроксильные ионы; слабые основания высвобождают только некоторые гидроксильные ионы или поглощают только несколько H + . Пища, смешанная с соляной кислотой из желудка, сожгла бы тонкий кишечник (следующий участок пищеварительного тракта после желудка), если бы не высвобождение бикарбоната (HCO 3 — ), слабого основания, которое привлекает Н + . Бикарбонат принимает часть протонов H +, тем самым снижая кислотность раствора. Концепция pH Относительную кислотность или щелочность раствора можно определить по его pH. pH раствора — это отрицательный десятичный логарифм концентрации ионов водорода (H + ) в растворе. Например, раствор с pH 4 имеет концентрацию H + , которая в десять раз больше, чем у раствора с pH 5. То есть раствор с pH 4 в десять раз более кислый, чем раствор с pH 5. Понятие pH станет более понятным, когда вы изучите шкалу pH, как показано на рисунке 2.4.4. Шкала состоит из серии приращений от 0 до 14.Раствор с pH 7 считается нейтральным — ни кислым, ни основным. Чистая вода имеет pH 7. Чем ниже число ниже 7, тем кислее раствор или тем выше концентрация H + . Концентрация ионов водорода при каждом значении pH в 10 раз отличается от следующего значения pH. Например, значение pH 4 соответствует концентрации протонов 10 –4 M или 0,0001M, а значение pH 5 соответствует концентрации протонов 10 –5 M или 0.00001M. Чем выше число выше 7, тем более щелочной (щелочной) раствор или тем ниже концентрация H + . Например, человеческая моча в десять раз кислотнее чистой воды, а HCl в 10 000 000 раз кислотнее воды. Рисунок 2.4.4 Шкала pH Буферы pH крови человека обычно находится в диапазоне от 7,35 до 7,45, хотя обычно его определяют как pH 7,4. При этом слегка щелочном pH кровь может снизить кислотность, возникающую из-за того, что двуокись углерода (CO 2 ) постоянно попадает в кровоток триллионами клеток тела.Гомеостатические механизмы (наряду с выдыханием CO 2 при дыхании) обычно поддерживают pH крови в этом узком диапазоне. Это очень важно, потому что колебания — либо слишком кислые, либо слишком щелочные — могут привести к опасным для жизни расстройствам. Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при pH примерно 7,4. Таким образом, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, которые в совокупности называются буферами, в жидкости организма.Буфер представляет собой раствор слабой кислоты и ее конъюгированного основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже небольшое снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действуя как слабое основание — будет связывать избыточные ионы водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода. Гомеостатический дисбаланс Избыточная кислотность кислот и оснований, крови и других жидкостей организма известна как ацидоз.Распространенными причинами ацидоза являются ситуации и нарушения, которые снижают эффективность дыхания, особенно способность человека полностью выдохнуть, что вызывает накопление CO 2 (и H + ) в кровотоке. Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, которые действуют как основания или способствуют выработке кислот. Например, при тяжелой диарее из организма может выводиться слишком много бикарбоната, в результате чего кислоты накапливаются в жидкостях организма.У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное заболевание, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз. Напротив, алкалоз — это состояние, при котором кровь и другие жидкости организма слишком щелочные (щелочные). Как и в случае ацидоза, основной причиной являются респираторные расстройства; однако при респираторном алкалозе уровни углекислого газа падают слишком низко.Заболевания легких, передозировка аспирином, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + . Метаболический алкалоз часто возникает в результате продолжительной сильной рвоты, которая вызывает потерю ионов водорода и хлорида (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся диуретики, которые заставляют организм терять ионы калия, а также антациды при приеме в чрезмерных количествах, например, при стойкой изжоге или язве. Обзор главы Неорганические соединения, необходимые для функционирования человека, включают воду, соли, кислоты и основания. Эти соединения неорганические; то есть они не содержат ни водорода, ни углерода. Вода — это смазка и подушка, теплоотвод, компонент жидких смесей, побочный продукт реакций синтеза дегидратации и реагент в реакциях гидролиза. Соли — это соединения, которые при растворении в воде диссоциируют на ионы, отличные от H + или OH — .Напротив, кислоты выделяют в растворе H + , делая его более кислым. Основания принимают H + , делая раствор более щелочным (едким). pH любого раствора — это его относительная концентрация H + . Раствор с pH 7 нейтрален. Растворы с pH ниже 7 являются кислотами, а растворы с pH выше 7 — основаниями. Изменение одной цифры на шкале pH (например, от 7 до 8) представляет десятикратное увеличение или уменьшение концентрации H + .У здорового взрослого человека pH крови колеблется от 7,35 до 7,45. Механизмы гомеостатического контроля, которые важны для поддержания крови в здоровом диапазоне pH, включают химические вещества, называемые буферами, слабые кислоты и слабые основания, высвобождаемые, когда pH крови или других жидкостей организма колеблется в любом направлении за пределами этого нормального диапазона. Контрольные вопросы Вопросы о критическом мышлении Уровень pH лимонного сока равен 2, а pH апельсинового сока равен 4.Какой из них более кислый и насколько? Что это значит? Лимонный сок в сто раз более кислый, чем апельсиновый сок. Это означает, что в лимонном соке концентрация ионов водорода в сто раз выше. Во время вечеринки Эли проигрывает пари и вынужден выпить бутылку лимонного сока. Вскоре после этого он начинает жаловаться на затрудненное дыхание, и его друзья отвозят его в местное отделение неотложной помощи. Там ему внутривенно вводят раствор бикарбоната.Почему? Лимонный сок, как и любая кислота, выделяет ионы водорода в растворе. Поскольку избыток H + попадает в пищеварительный тракт и всасывается в кровь, pH крови Эли падает ниже 7,35. Напомним, что бикарбонат — это буфер, слабое основание, которое принимает ионы водорода. Вводя бикарбонат внутривенно, врач отделения неотложной помощи помогает поднять pH крови Эли до нейтрального. Неорганические соединения, необходимые для функционирования человека — Анатомия и физиологияOpenStaxCollege Цели обученияК концу этого раздела вы сможете:
Концепции, которые вы изучили до сих пор в этой главе, управляют всеми формами материи и будут работать в качестве основы как для геологии, так и для биологии.Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения бывают либо неорганическими, либо органическими.
В следующем разделе рассматриваются три группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе. До 70 процентов веса взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько функций делают воду незаменимой для жизнедеятельности человека. Вода как смазка и подушкаВода является основным компонентом многих смазочных жидкостей организма.Подобно тому, как масло смазывает петли двери, вода в синовиальной жидкости смазывает работу суставов тела, а вода в плевральной жидкости помогает легким расширяться и отскакивать при дыхании. Водянистая жидкость помогает пище течь по пищеварительному тракту и обеспечивает отсутствие трения при движении соседних органов брюшной полости. Вода также защищает клетки и органы от физических травм, смягчая, например, мозг внутри черепа и защищая нежную нервную ткань глаз.Вода также смягчает развивающийся плод в утробе матери. Вода как теплоотводРадиатор — это вещество или объект, который поглощает и рассеивает тепло, но не испытывает соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое в результате химических реакций, без значительного повышения температуры. Более того, когда температура окружающей среды стремительно растет, вода, хранящаяся в организме, помогает ему сохранять прохладу. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам под кожей и переносится в окружающую среду.В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к сердцевине тела. Вода как компонент жидких смесейСмесь — это комбинация двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если вы подумаете о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их в миске, очевидно, что они не связываются с образованием нового соединения.Воздух в помещении, которым вы дышите, представляет собой газовую смесь, содержащую три отдельных элемента — азот, кислород и аргон — и одно соединение — диоксид углерода. Есть три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента. Это растворы, коллоиды и суспензии. Чтобы клетки тела выжили, они должны оставаться влажными в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом. Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределяются по всему раствору.Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Соотношение сахара и воды в левой части стакана будет таким же, как соотношение сахара и воды в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара к воде изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным. Вода считается «универсальным растворителем», и поэтому считается, что жизнь не может существовать без воды.Вода, безусловно, является самым распространенным растворителем в организме; практически все химические реакции организма происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называют гидрофильными или «водолюбивыми». Как уже было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным.Неполярные молекулы, которые с трудом растворяются в воде, называются гидрофобными или «водобоязненными». Концентрации растворенных веществВ химии описаны различные смеси растворенных веществ и воды. Концентрация данного растворенного вещества — это количество частиц этого растворенного вещества в данном пространстве (кислород составляет около 21 процента атмосферного воздуха). В кровотоке человека концентрация глюкозы обычно измеряется в миллиграммах (мг) на децилитр (дл), а у здорового взрослого человека в среднем составляет около 100 мг / дл.Другой метод измерения концентрации растворенного вещества — его молярность, которая составляет моль (M) молекул на литр (L). Моль элемента — это его атомный вес, а моль соединения — это сумма атомных весов его компонентов, называемая молекулярной массой. Часто используемый пример — вычисление моля глюкозы по химической формуле C 6 H 12 O 6 . Согласно периодической таблице, атомный вес углерода (C) составляет 12,011 грамма (г), а в глюкозе шесть атомов углерода, что дает общий атомный вес 72.066 г. Проведя те же вычисления для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («грамм молекулярной массы» глюкозы). Когда вода добавляется для получения одного литра раствора, у вас есть один моль (1М) глюкозы. Это особенно полезно в химии из-за отношения родинок к «числу Авогадро». В моль любого раствора такое же количество частиц: 6,02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются в тысячных долях моля или миллимолях (мМ). Коллоид — это смесь, которая чем-то похожа на тяжелый раствор. Частицы растворенного вещества состоят из крошечных сгустков молекул, достаточно больших, чтобы сделать жидкую смесь непрозрачной (поскольку частицы достаточно большие, чтобы рассеивать свет). Знакомые примеры коллоидов — молоко и сливки. В щитовидной железе гормон щитовидной железы хранится в виде густой белковой смеси, также называемой коллоидом. Суспензия — это жидкая смесь, в которой более тяжелое вещество временно взвешено в жидкости, но со временем оседает.Такое отделение частиц от суспензии называется седиментацией. Пример седиментации происходит в анализе крови, который устанавливает скорость седиментации или скорость седиментации. Тест измеряет, как быстро красные кровяные тельца в пробирке выделяются из водянистой части крови (известной как плазма) в течение определенного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но некоторые заболевания могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови. Роль воды в химических реакцияхДва типа химических реакций включают образование или потребление воды: дегидратационный синтез и гидролиз.
Эти реакции обратимы и играют важную роль в химии органических соединений (о чем мы поговорим ниже). Обезвоживание, синтез и гидролиз Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера).(а) При дегидратационном синтезе два мономера ковалентно связаны в реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды выделяется как побочный продукт во время реакций дегидратации. (b) При гидролизе ковалентная связь между двумя мономерами расщепляется путем присоединения атома водорода к одному и гидроксильной группы к другому, что требует участия одной молекулы воды. Напомним, что соли образуются, когда ионы образуют ионные связи.В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой атом принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH — . Этот факт важен для отличия солей от кислот и оснований, обсуждаемых далее. Типичная соль NaCl полностью диссоциирует в воде ([ссылка]). Положительные и отрицательные области молекулы воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга.Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе. Это свойство имеет решающее значение для функции ионов при передаче нервных импульсов и стимулировании сокращения мышц. Диссоциация хлорида натрия в воде Обратите внимание, что кристаллы хлорида натрия диссоциируют не на молекулы NaCl, а на катионы Na + и анионы Cl —, каждый из которых полностью окружен молекулами воды. Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей. Кислоты и основания, как и соли, диссоциируют в воде на электролиты. Кислоты и основания могут сильно изменить свойства растворов, в которых они растворены. КислотыКислота — это вещество, которое выделяет ионы водорода (H + ) в растворе ([ссылка] a ).Поскольку у атома водорода есть только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот одиночный протон с большой вероятностью участвует в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H + в растворе; то есть они полностью ионизируются. Соляная кислота (HCl), которая выделяется из клеток слизистой оболочки желудка, является сильной кислотой, поскольку она высвобождает весь свой H + в водянистую среду желудка. Эта сильная кислота помогает пищеварению и убивает микробы, попавшие в организм.Слабые кислоты не ионизируются полностью; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Пример слабой кислоты — уксус или уксусная кислота; он называется ацетатом после того, как отдает протон. Кислоты и основания (a) В водном растворе кислота диссоциирует на ионы водорода (H + ) и анионы. Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + . (b) В водном растворе основание диссоциирует на гидроксильные ионы (OH — ) и катионы.Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию OH — . БазыОснование — это вещество, которое выделяет гидроксильные ионы (OH — ) в растворе, или вещество, которое принимает H + , уже присутствующий в растворе (см. [Ссылка] b ). Ионы гидроксила (также известные как ионы гидроксида) или другие основные вещества объединяются с присутствующим H + с образованием молекулы воды, тем самым удаляя H + и снижая кислотность раствора.Сильные основания высвобождают большую часть или все свои гидроксильные ионы; слабые основания высвобождают только некоторые гидроксильные ионы или поглощают только несколько H + . Пища, смешанная с соляной кислотой из желудка, сожгла бы тонкий кишечник, следующую часть пищеварительного тракта после желудка, если бы не высвобождение бикарбоната (HCO 3 — ), слабого основания, которое привлекает H + . Бикарбонат принимает часть протонов H + , тем самым снижая кислотность раствора. Концепция pHОтносительную кислотность или щелочность раствора можно определить по его pH. PH раствора — это отрицательный десятичный логарифм концентрации ионов водорода (H + ) в растворе. Например, раствор с pH 4 имеет концентрацию H + , которая в десять раз больше, чем у раствора с pH 5. То есть раствор с pH 4 в десять раз более кислый, чем раствор с pH 5. Понятие pH станет более понятным, когда вы изучите шкалу pH, как показано в [ссылка].Шкала состоит из серии приращений от 0 до 14. Раствор с pH 7 считается нейтральным — ни кислым, ни основным. Чистая вода имеет pH 7. Чем ниже число ниже 7, тем кислее раствор или тем выше концентрация H + . Концентрация ионов водорода при каждом значении pH в 10 раз отличается от следующего значения pH. Например, значение pH 4 соответствует концентрации протонов 10 –4 M или 0,0001M, а значение pH 5 соответствует концентрации протонов 10 –5 M или 0.00001M. Чем выше число выше 7, тем более щелочной (щелочной) раствор или тем ниже концентрация H + . Например, человеческая моча в десять раз кислотнее чистой воды, а HCl в 10 000 000 раз кислотнее воды. Шкала pH БуферыpH крови человека обычно находится в диапазоне от 7,35 до 7,45, хотя обычно его определяют как pH 7,4. При этом слегка щелочном pH кровь может снизить кислотность, возникающую из-за того, что двуокись углерода (CO 2 ) постоянно попадает в кровоток триллионами клеток тела.Гомеостатические механизмы (наряду с выдыханием CO 2 при дыхании) обычно поддерживают pH крови в этом узком диапазоне. Это очень важно, потому что колебания — либо слишком кислые, либо слишком щелочные — могут привести к опасным для жизни расстройствам. Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при pH примерно 7,4. Таким образом, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, которые в совокупности называются буферами, в жидкости организма.Буфер представляет собой раствор слабой кислоты и сопряженного с ней основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже небольшое снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действуя как слабое основание — будет связывать избыточные ионы водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода. Гомеостатический дисбаланс Кислоты и основания Напротив, алкалоз — это состояние, при котором кровь и другие жидкости организма слишком щелочные (щелочные). Как и в случае ацидоза, основной причиной являются респираторные расстройства; однако при респираторном алкалозе уровни углекислого газа падают слишком низко.Заболевания легких, передозировка аспирином, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + . Метаболический алкалоз часто возникает в результате продолжительной сильной рвоты, которая вызывает потерю ионов водорода и хлорида (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся диуретики, которые заставляют организм терять ионы калия, а также антациды при приеме в чрезмерных количествах, например, при стойкой изжоге или язве. Неорганические соединения, необходимые для функционирования человека, включают воду, соли, кислоты и основания. Эти соединения неорганические; то есть они не содержат ни водорода, ни углерода. Вода — это смазка и подушка, теплоотвод, компонент жидких смесей, побочный продукт реакций синтеза дегидратации и реагент в реакциях гидролиза. Соли — это соединения, которые при растворении в воде диссоциируют на ионы, отличные от H + или OH — . Напротив, кислоты выделяют в растворе H + , делая его более кислым.Основания принимают H + , делая раствор более щелочным (едким). pH любого раствора — это его относительная концентрация H + . Раствор с pH 7 нейтрален. Растворы с pH ниже 7 являются кислотами, а растворы с pH выше 7 — основаниями. Изменение одной цифры на шкале pH (например, от 7 до 8) представляет десятикратное увеличение или уменьшение концентрации H + . У здорового взрослого человека pH крови колеблется от 7,35 до 7,45. Механизмы гомеостатического контроля, важные для поддержания крови в здоровом диапазоне pH, включают химические вещества, называемые буферами, слабые кислоты и слабые основания, высвобождаемые, когда pH крови или других жидкостей организма колеблется в любом направлении за пределами этого нормального диапазона. CH 4 — метан. Это соединение ________.
Что из следующего, вероятнее всего, будет равномерно распределено в воде в гомогенном растворе?
Дженни смешивает тесто для блинов, затем добавляет шоколадную стружку.Ожидая, когда приготовятся первые несколько блинов, она замечает, как шоколадная стружка опускается на дно прозрачной стеклянной миски. Тесто с шоколадной крошкой является примером ________.
Вещество распадается на K + и Cl — в растворе. Вещество a (n) ________.
Тай три года, и в результате «желудочного недуга» его рвало около 24 часов.Его pH крови 7,48. Что это значит?
pH лимонного сока составляет 2, а pH апельсинового сока — 4. Какой из них более кислый и насколько? Что это значит? Лимонный сок в сто раз более кислый, чем апельсиновый сок. Это означает, что в лимонном соке концентрация ионов водорода в сто раз выше. Во время вечеринки Эли проигрывает пари и вынужден выпить бутылку лимонного сока. Вскоре после этого он начинает жаловаться на затрудненное дыхание, и его друзья отвозят его в местное отделение неотложной помощи. Там ему внутривенно вводят раствор бикарбоната. Почему? Лимонный сок, как и любая кислота, выделяет ионы водорода в растворе. Когда избыток H + попадает в пищеварительный тракт и всасывается в кровь, pH крови Эли падает ниже 7,35. Напомним, что бикарбонат — это буфер, слабое основание, которое принимает ионы водорода.Вводя бикарбонат внутривенно, врач отделения неотложной помощи помогает поднять pH крови Эли до нейтрального. Глоссарий
Неорганическая химия — обзор2.1 ВведениеЕсли органическая химия определяется как химия углеводородных соединений и их производных, неорганическая химия может быть описана в очень общем виде как химия неуглеродных соединений или как химия всего остального . Сюда входят все остальные элементы периодической таблицы (рис. 2.1 и 2.2) и некоторые соединения углерода (например, оксид углерода (CO) и диоксид углерода (CO 2 )), которые играют важную роль во многих неорганических соединениях. .Таким образом, неорганическая химия — это подкатегория химии, связанная со свойствами и реакциями неорганических соединений, которая включает все химические соединения без цепей или колец атомов углерода, которые попадают в подкатегорию органических соединений. Рис. 2.1. Периодическая таблица элементов. Рис. 2.2. Периодическая таблица элементов, показывающая группы и периоды, включая элементы лантаноидов и актиниды. Общее различие между неорганическими соединениями и органическими соединениями заключается в том, что неорганические соединения являются результатом естественных процессов, не связанных с какой-либо формой жизни, или результатом экспериментов человека в лаборатории, тогда как органические соединения являются результатом деятельности живых существ .Однако следует соблюдать осторожность при использовании такого определения, поскольку органические соединения могут быть искусственно созданы в лаборатории. Другое определение относится к солевому свойству неорганических соединений, которое отсутствует в органических соединениях, но даже в этом случае это определение также неверно, поскольку органические кислоты (RCO 2 H) sacrosanct также могут образовывать соли. Существует также аргумент, что неорганические соединения не имеют углеродно-водородных связей, что характерно для органических соединений, но это также не совсем верно, поскольку перфторуглероды (соединения углерод-фтор, в которых все атомы водорода заменены атомами фтора). ) не имеют углеродно-водородных связей, но все же являются органическими соединениями.Другое часто упоминаемое отличие состоит в том, что неорганические соединения содержат атомы металлов, а органические — нет. Опять же, это неверно, поскольку металлоорганические соединения содержат атомы металлов. Таким образом, рекомендуется проявлять осторожность при принятии любого определения, которое призвано определить различия между неорганическими соединениями и органическими соединениями. Металлоорганическая химия , очень большая и быстро развивающаяся область, объединяет обе области, рассматривая соединения, содержащие прямые связи металл-углерод, и включает катализ многих химических реакций.Металлоорганические соединения содержат по крайней мере одну связь между атомом металла и атомом углерода. Они названы координационными соединениями в системе аддитивной номенклатуры. Название органического лиганда, связывающегося через один атом углерода, можно получить, рассматривая лиганд как анион или как нейтральную группу заместителя. Кроме того, биоинорганическая химия связывает биохимию и неорганическую химию, а поскольку химия окружающей среды включает изучение как неорганических, так и органических соединений, исследования этих различных подразделов химии являются важными областями знаний.Как можно себе представить, область неорганической химии чрезвычайно широка, предоставляя практически безграничные области для исследований. В самом широком (или общем) смысле неорганические химические вещества и соединения определяются тем, чем они не являются: (i) они не являются органическими по природе и (ii) чем-либо помимо биологических, углеводородных и других подобных углеродных химических веществ. может считаться неорганическим. С практической точки зрения, неорганические химические вещества — это вещества минерального происхождения, которые не содержат углерода в своей молекулярной структуре и обычно основаны на самых распространенных химических веществах на Земле: кислород, кремний, алюминий, железо, кальций, натрий, калий и магний. .Исключение составляют CO и CO 2 , а также производные минеральных карбонатов (CO 3 ) и производные бикарбонатов (HCO 3 ). Что касается экологических проблем, связанных с разливами или удалением неорганических химикатов, уже многое известно о влиянии молекулярной структуры на токсичность химических веществ для человека, гораздо меньше известно о влиянии молекулярной структуры на окружающую среду. стойкость химического вещества. Для экосистем, в которых существуют виды растений и фауны, стойкость любых химических веществ (неорганических и органических) является чрезвычайно важным критерием для прогнозирования потенциального вреда, поскольку неизбежно существуют некоторые виды, чувствительные к любым химическим веществам и любым стойким химическим веществам.Хотя некоторые химические вещества могут быть безвредными для ограниченного числа организмов, в конечном итоге они будут доставлены в ходе биогеохимических циклов к чувствительным видам в экосистеме. Таким образом, высокотоксичные, легко поддающиеся биологическому разложению вещества могут представлять гораздо меньшую проблему для окружающей среды, чем относительно безвредные стойкие химические вещества, которые вполне могут повредить важнейшие виды растений или фауны. Таким образом, изучение химического воздействия на окружающую среду можно разделить на две области исследования: (i) изучение уровней вещества, накапливающегося в воздухе, воде, почвах, включая отложения и биоту, и (ii) исследование воздействие химических веществ при достижении порогового уровня действия, особенно воздействия, производимые на биоту, которые представляют собой значительную неблагоприятную реакцию (т.д., кривая доза-реакция в окружающей среде). Чтобы предсказать тенденции уровней химического вещества, требуется гораздо больше информации о скорости закачки; поток и разделение между воздухом, водой, почвой и биотой; и потери в результате деградации, что дает начало концепции экологического баланса для экосистемы. Эти динамические явления регулируются физическими свойствами и химическими свойствами молекулярного загрязнителя. Механика жидкостей и метеорология могут в будущем предоставить концептуальные и технические инструменты для создания прогнозных моделей таких систем.Большая часть знаний о последствиях получена в результате исследований острой токсикологии и медицинских исследований различных (но не всех) организмов (включая людей), но поскольку воздействие на окружающую среду обычно связано с хроническим воздействием, все чаще проводятся исследования долгосрочного непрерывного воздействия до минутного воздействия. количества химического вещества. Хорошо известная сложность распознавания таких эффектов, когда они возникают в экосистеме, усугубляется тем фактом, что многие из эффектов неспецифичны и часто могут быть замаскированы аналогичными эффектами, возникающими в результате воздействия природных явлений, таких как голод, засуха и т. Д. (или более) нескольких метеорологических или катастрофических явлений.Даже если обнаружен подлинный эффект, необходимо найти кандидата в причинный агент и сопоставить его с этим эффектом. Этот процесс должен сопровождаться экспериментальными исследованиями (лабораторными исследованиями и / или полевыми исследованиями), которые вне всяких разумных сомнений связывают причинное неорганическое (ые) химическое (ые) (ые) (ые) (ые) (ые) (ые)) химическое (ые) (ые) (ые) (ые) (ые) (ыми) (ыми) ((ыми)) ((ыми) воздействием ((ыми) воздействием ((ями)), то на экосистему растений, то и фауны. Этого можно достичь только путем тщательного сбора и усвоения технических знаний неорганической химии, касающихся свойств и поведения неорганических химикатов. Однако нельзя ожидать, что инженер накопит столько же химических знаний, как профессиональный химик-неорганик — точно так же, как химик может стать брезгливым из-за необходимости владеть одной или несколькими инженерными дисциплинами. Но накопление достаточных знаний для (i) понимания поведения неорганических химикатов в окружающей среде с последующим (ii) умением делать разумные прогнозы (на основе свойств) поведения неорганических химикатов в окружающей среде.Неспособность признать взаимно интерактивные роли химика и инженера будет препятствовать и мешать разработке единой политики управления окружающей средой, которая будет применяться к устойчивости любой экосистемы или обширной экологической области (Глава 1). Таким образом, неорганические химические вещества находят применение во всех аспектах химической промышленности, включая катализаторы, пигменты, поверхностно-активные вещества, покрытия, медицину, топливо и сельское хозяйство. Продукты неорганических химических процессов используются в качестве (i) основных химикатов для промышленных процессов, включая кислоты, основания, соли, окислители, газы и галогены; (ii) химические добавки, которые включают пигменты, щелочные металлы и красители; и (iii) готовая продукция, в которую входят удобрения, стекло и строительные материалы. С промышленной точки зрения существует два основных класса неорганических химикатов: (i) щелочные химические вещества, включая кальцинированную соду, которая преимущественно представляет собой карбонат натрия (NaCO 3 ), едкий натр (NaOH) и жидкий хлор (Cl ). 2 ) и (ii) основные неорганические соединения, такие как фторид алюминия (AlF 3 ), карбид кальция (CaC 2 ), хлорат калия (KClO 3 ) и диоксид титана (TiO 2 ). Кроме того, хлорно-щелочная промышленность является важным компонентом мировой химической экономики.Основная реакция в промышленности — это реакция, в которой соленая вода (рассол — вода, содержащая хлорид натрия, NaCl) разлагается в процессе электролиза с образованием NaOH (гидроксид натрия, NaOH), газообразного хлора (Cl 2 ) и водорода. (H 2 ) газ: 2NaCl + 2h3O → Cl2 + h3 + 2NaOH Хлор образуется на положительном электроде (аноде), а водород (H 2 ) и гидроксид натрия образуются на отрицательном электроде ( катод). Эти три материала являются сырьем для производства отбеливателя (гипохлорит натрия, NaOCl) и множества других продуктов, включая кальцинированную соду (Na 2 CO 3 ). Наконец, неорганическая химия — это предмет, к которому не следует подходить с какой-либо степенью смятения или сомнений, поскольку предмет становится легче по мере того, как отдельный исследователь работает над ним. |

 Подробнейший справочник технолога. Физические, химические, тепловые и прочие свойства веществ. Доставляет. Внушает. Прёт непадецки 🙂
Подробнейший справочник технолога. Физические, химические, тепловые и прочие свойства веществ. Доставляет. Внушает. Прёт непадецки 🙂 2. Требования к качеству минерального сырья
2. Требования к качеству минерального сырья 1.3. Магнезиальные вяжущие вещества (табл. 4.3)
1.3. Магнезиальные вяжущие вещества (табл. 4.3) 4.18)
4.18) 5. Теплоизоляционные огнеупоры
5. Теплоизоляционные огнеупоры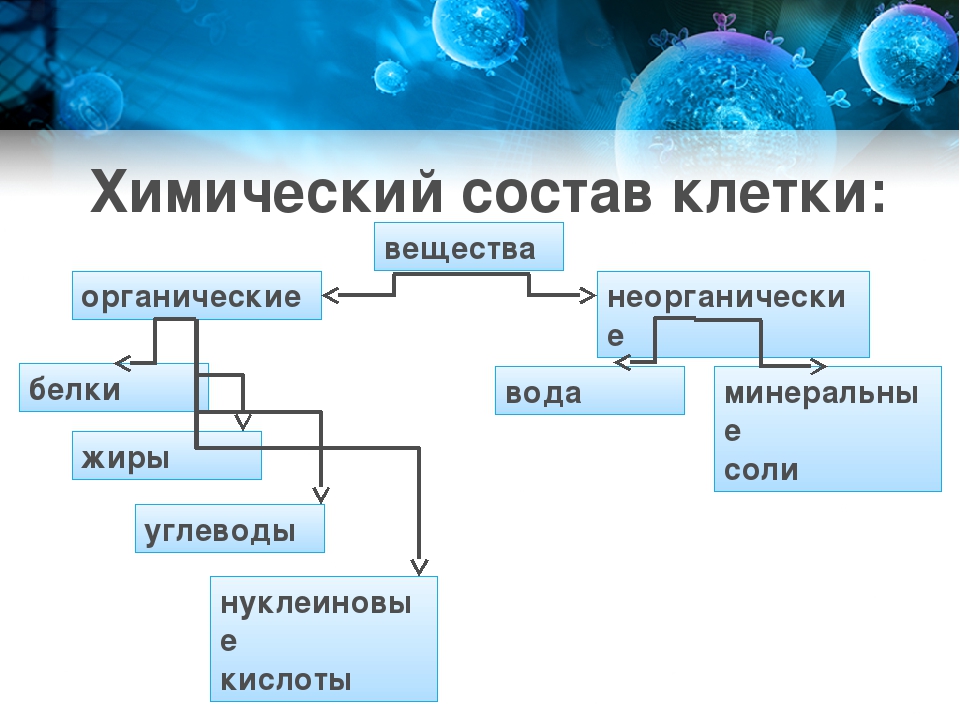 1.2. Вязкость стекол
1.2. Вязкость стекол 2.8. Стеклокристаллические материалы (ситаллы)
2.8. Стеклокристаллические материалы (ситаллы) 3. Добыча природных цеолитов
3. Добыча природных цеолитов 6.7. Адсорбционный метод внесения удобрений и микроэлементов в почву
6.7. Адсорбционный метод внесения удобрений и микроэлементов в почву 5. Угли
5. Угли
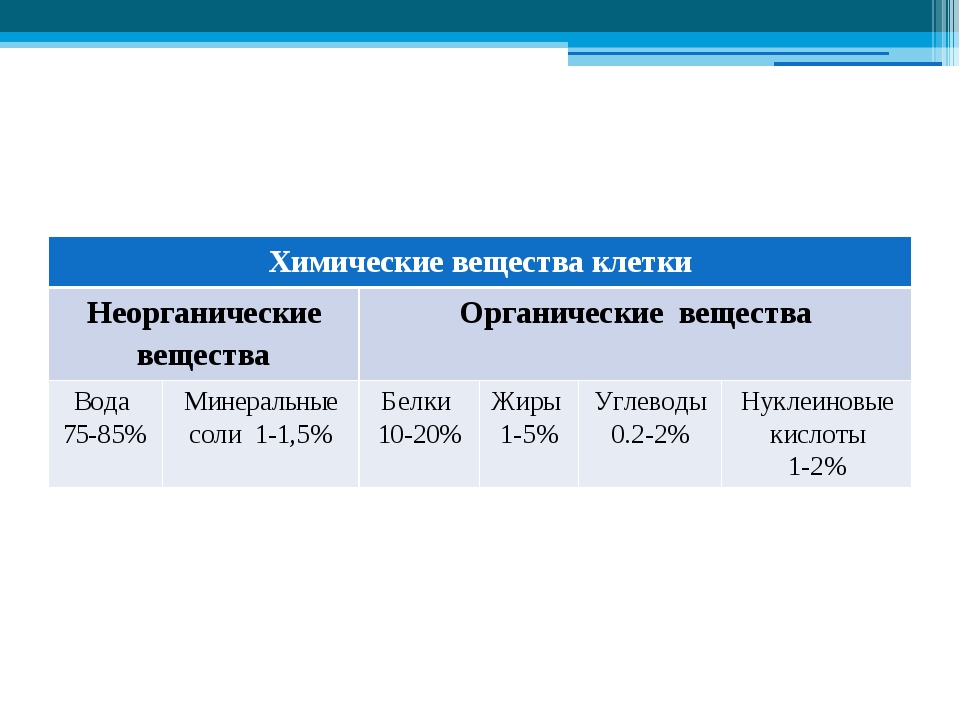 7.4. Битумы торфа
7.4. Битумы торфа 10. Технология переработки углей
10. Технология переработки углей
 11.1. Теоретические основы процесса
11.1. Теоретические основы процесса 3.3. Технология производства дробленных углеродных адсорбентов методом парогазовой активации
3.3. Технология производства дробленных углеродных адсорбентов методом парогазовой активации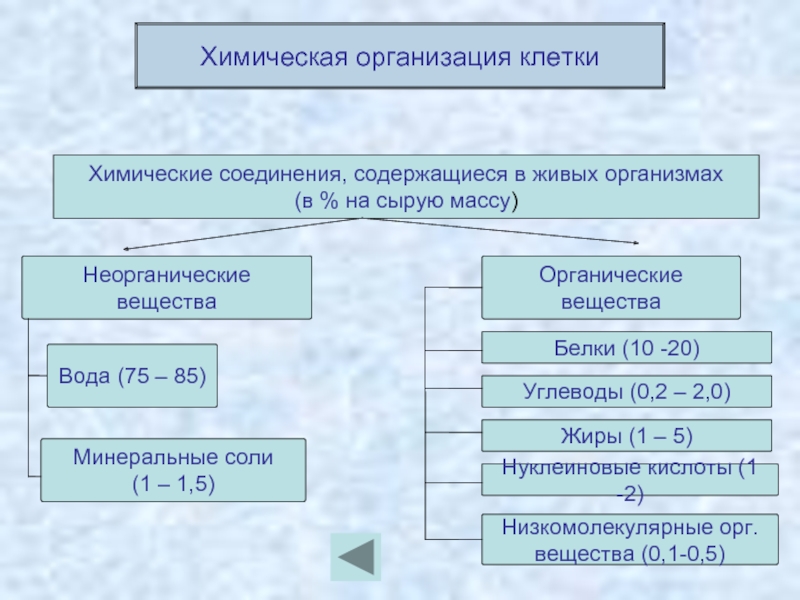 5. Регенерация сорбирующих материалов
5. Регенерация сорбирующих материалов
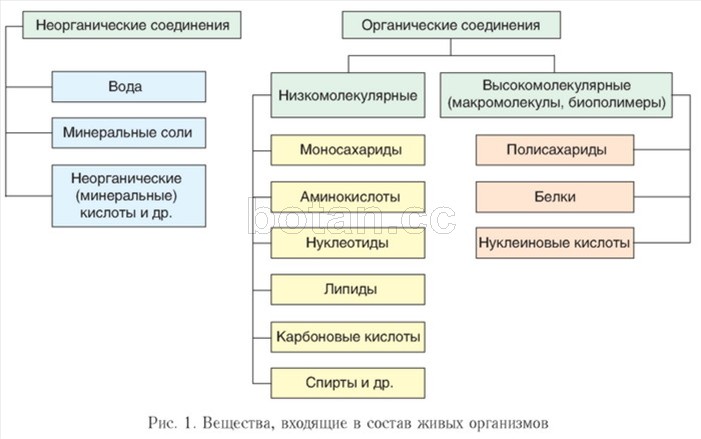 6.5. Высокоэффективные углеродные адсорбенты при совместном использовании нефте- и сланцепродуктов
6.5. Высокоэффективные углеродные адсорбенты при совместном использовании нефте- и сланцепродуктов 1.3. Осушка газов
1.3. Осушка газов