Updating… ć А 11 Основания и кислоты.pptm (374k) Татьяна Прокофьева, 3 мая 2012 г. ć ГИА Вопрос А11 Хим свойства кислот.pptm (187k) Татьяна Прокофьева, 3 мая 2012 г., 22:25 ć ГИА Ворпос А11 Хим свойства оснований.pptm (185k) Татьяна Прокофьева, 3 мая 2012 г., 22:25 |
Кислоты и основания • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Из нашего повседневного опыта мы знаем, что некоторые вещества обладают высококоррозионными свойствами. Например, если кислота из аккумулятора вашей машины попадет на одежду, она сразу же ее проест. Иногда мы используем аммиак и другие вещества для домашней уборки. Эти коррозионные вещества известны химикам как кислоты и основания. На поверхностном уровне их различить совсем не сложно. Кислоты кислые на вкус и окрашивают лакмусовую бумажку в красный цвет, щелочи же мыльные на ощупь и окрашивают лакмусовую бумажку в синий цвет. Однако химики редко довольствуются такого рода феноменологическими определениями. Они ищут ответ на вопрос «Что делает вещество кислотой или основанием на молекулярном уровне?». Вот уже больше века химики бьются над определением кислот и оснований.
Они ищут ответ на вопрос «Что делает вещество кислотой или основанием на молекулярном уровне?». Вот уже больше века химики бьются над определением кислот и оснований.
Первая попытка определить понятие кислоты восходит к 1778 году. Антуан Лавуазье смог объяснить, что именно происходит при горении, опровергнув бытовавшую до того теорию о флогистоне. Содержащийся в воздухе газ, который соединяется с веществами, когда они горят, он назвал кислородом — от греческого «производящий кислоту», поскольку он считал (как потом оказалось, ошибочно), что все кислоты содержат кислород.
Определение Аррениуса
Современный подход к этой проблеме впервые сформулировал шведский химик Сванте Аррениус (Svante Arrhenius, 1859–1927). Его определение, выдвинутое в 1877 году, было очень простым: если некоторое вещество при растворении в воде высвобождает ион водорода (то есть протон, Н+), значит это кислота. Если же при растворении в воде высвобождается гидроксид-ион (ОН–), то это основание. Согласно этому определению, аккумуляторная кислота, представляющая собой водный раствор серной кислоты (H2SO4), является кислотой, потому что атомы водорода серной кислоты в растворе становятся ионами водорода. Соответственно, гидроксид натрия (NaOH) является основанием, так как в воде он высвобождает гидроксид-ион. Это определение объясняет, почему кислоты и основания нейтрализуют друг друга. Когда гидроксид-ион встречается с ионом водорода, они соединяются с образованием H2O, обычной воды.
Между прочим, Аррениус активно участвовал в дискуссии о внеземном разуме (см. Парадокс Ферми). Он был сторонником теории панспермии — гипотезы о том, что жизнь с планеты на планету могут переносить микроорганизмы, перемещающиеся через космос, а значит, достаточно было жизни развиться лишь однажды, а не на каждой планете, где она есть. На смену этой гипотезе пришла теория направленной панспермии, в соответствии с которой где-то в Галактике существует цивилизация, которая рассылает зародыши жизни с целью заселения подходящих планет. Однако все эти теории только отодвигают решение проблемы происхождения жизни, потому что всё равно остается вопрос, как жизнь зародилась в самом первом месте.
Однако все эти теории только отодвигают решение проблемы происхождения жизни, потому что всё равно остается вопрос, как жизнь зародилась в самом первом месте.
Определение Брёнстеда—Лаури
Определение Аррениуса довольно точное, но область его применения ограниченна — оно годится только для водных растворов (веществ, растворенных в воде). Вот пример реакции, на которую не распространяется определение Аррениуса: если вы поместите рядом сосуды с соляной кислотой (HCl) и аммиаком (NH3), вы увидите белый дымок над сосудами. Пары аммиака и соляной кислоты смешиваются в воздухе над сосудами, и происходит химическая реакция
NH3 + HCl → NH4Cl,
в которой кислота и основание соединяются с образованием хлорида аммония. Поскольку в этой реакции не участвует вода, определение Аррениуса здесь просто неприменимо.
В 1923 году датский химик Йоханнес Николаус Брёнстед (Johannes Nicolaus Brønsted, 1879–1947) и британский химик Томас Мартин Лаури (Thomas Martin Lowry, 1874–1936) предложили новое определение. В соответствии с ним кислота представляет собой молекулу или ион, способные отдавать протон (то есть ион водорода, H+), а основание представляет собой молекулу или ион, способные принимать протон. Если рассматриваемая реакция протекает в водной среде, это определение по сути то же, что и определение, предложенное Аррениусом, однако оно распространяется также на реакции, протекающие в отсутствие воды, такие как образование хлорида аммония, описанное выше.
В соответствии с ним кислота представляет собой молекулу или ион, способные отдавать протон (то есть ион водорода, H+), а основание представляет собой молекулу или ион, способные принимать протон. Если рассматриваемая реакция протекает в водной среде, это определение по сути то же, что и определение, предложенное Аррениусом, однако оно распространяется также на реакции, протекающие в отсутствие воды, такие как образование хлорида аммония, описанное выше.
Определение Льюиса
Наконец, последнее обобщение сделало определение кислот и оснований не зависящим не только от присутствия воды, но и от образования протонов. Его выдвинул в 1923 году американский химик Гилберт Ньютон Льюис (Gilbert Newton Lewis, 1875–1946). Это определение основано на том, каким способом образуются химические связи в химических реакциях между кислотами и основаниями, а не на том, присоединяются или отдаются протоны. По Льюису, кислота — это химическое соединение, способное принимать электронную пару с последующим образованием ковалентной связи, а основание — это соединение, способное отдавать электронную пару.
Определение Льюиса включает в себя оба более ранних определения, а также объясняет те реакции, в которых не участвует водород. Например, когда диоксид серы реагирует с ионом кислорода с образованием серного ангидрида (эта реакция играет немаловажную роль в образовании кислотных дождей), ион кислорода отдает два электрона для образования ковалентной связи — иными словами, ведет себя как основание, в то время как диоксид серы принимает электроны и, следовательно, ведет себя как кислота. Эта реакция, протекающая без протона и без воды, подходит под определение Льюиса, но не подходит ни под одно из предшествующих определений.
Показатель pH: измерение кислотности
Для водных растворов широко используется система определения концентрации кислоты или основания, которая лучше всего может быть объяснена в терминах теории Брёнстеда—Лаури. В чистой воде в каждый момент времени какие-то молекулы H2O диссоциируют на ионы водорода (H+) и гидроксид-ионы (OH–), и одновременно с этим какие-то соседние ионы H+ и OH– соединяются с образованием молекул воды. Таким образом, в воде всегда присутствуют ионы водорода (протоны). Молярная концентрация (см. Закон Авогадро) водорода в чистой воде составляет 10–7 моль на литр. Это означает, что одна молекула H2O из каждых 10 миллионов находится в форме ионов.
Таким образом, в воде всегда присутствуют ионы водорода (протоны). Молярная концентрация (см. Закон Авогадро) водорода в чистой воде составляет 10–7 моль на литр. Это означает, что одна молекула H2O из каждых 10 миллионов находится в форме ионов.
Условились считать, что водородный показатель pH (сокр. от англ. «power of hydrogen» — «степень водорода») чистой воды равен 7 — это математический показатель степени из выражения 10–7, взятый с положительным знаком. Мы можем повысить концентрацию ионов водорода в воде, добавив кислоту. Например, если мы добавим в чистую воду соляную кислоту (HCl), концентрация ионов водорода возрастет. Если мы достигнем точки, в которой молярная концентрация составляет 10–1 моль на литр, мы получим примерное значение кислотности желудочного сока. pH этого раствора составит 1. Таким образом, pH ниже 7 характеризует кислоту, и чем меньше значение pH, тем сильнее кислота.
Подобным образом можно понизить концентрацию ионов водорода в чистой воде, добавив основание (ионы OH– основания будут реагировать с ионами H+ с образованием молекул воды). Так, у аммиака, применяемого в домашнем хозяйстве, молярная концентрация ионов водорода составляет всего 10–11 моль на литр, и, следовательно, pH равен 11. А поскольку pH больше 7, это основание.
Так, у аммиака, применяемого в домашнем хозяйстве, молярная концентрация ионов водорода составляет всего 10–11 моль на литр, и, следовательно, pH равен 11. А поскольку pH больше 7, это основание.
Реакции между кислотами и основаниям
Реакциями нейтрализации в водных растворах являются все реакции между кислотами и основаниями, одним из продуктов которых является вода. Сущность реакции нейтрализации заключается в переносе иона водорода (протона) от кислоты к основанию. Кислотноосновные реакции сопровождаются изменением концентрации ионов Н+. Определение последней играет важную роль в методах кислотно-основного титрования. На практике очень часто вместо концентрации ионов водорода [Н+1 используют водородный показатель pH = = — lg [Н+]. Объясняется это тем, что физико-химические методы позволяют непосредственно определить именно pH раствора. По изменению pH раствора следят за [c.93]
Реакция между кислотой и основанием с образованием соли и воды [c. 546]
546]
В 1949 г. Кольтгоф писал Несомненно, еще не сказано последнее слово относительно механизма кислотно-основной реакции. Пр крайней мере спорно, является ли первичной реакцией между основаниями и бренстедовскими кислотами прямой перенос протона. Первичная реакция между кислотами и основанием может состоять в образовании водородной связи. В основных растворителях с высокой диэлектрической проницаемостью кислота реагирует с растворителем — основанием с первичным образованием водородной связи. Вслед за этим происходит диссоциация с образованием сольватированного протона и основания, сопряженного с кислотой. Однако в растворителях с низкой диэлектрической проницаемостью кислота и основание могут реагировать с образованием устойчивого продукта присоединения через водородную связь. Даже в водной среде нередко имеют место реакции, связанные с образованием водородной связи. Таково, например, взаимодействие между водой и аммиаком. [c.300]
Можно легко показать, что константа равновесия К реакций между кислотой и основанием А1 + В2 констант сопряженных пар кислота — основание [c. 382]
382]
Следовательно, ограничения кислотно-основных реакций водной средой больше нет, и такие реакции возможны в любой среде и в отсутствии среды. При протонной трактовке область кислотноосновных реакций сильно расширяется, и соответственно исключаются многие недостатки, присущие теории Аррениуса. Согласно протонной теории, реакцию между кислотой и основанием можно рассматривать как борьбу за протон между двумя основаниями. При диссоциации H I как кислоты образующиеся ионы хлора являются основанием, так как они могут присоединить протоны. Такую кислотно-основную пару называют сопряженной парой, а ионы хлора — основанием, сопряженным с кислотой НС1. Чтобы кислота могла отдать протоны, необходимо присутствие основания, принимающего протоны. В случае простой ионизации кислоты роль основания играет растворитель. Например [c.329]
Любую соль можно рассматривать как продукт реакции между кислотой и основанием, Это действительно так, и подобные реакции называются реакциями нейтрализации. Они будут рассмотрены нами несколько позднее. Здесь мы только отметим две вещи. [c.127]
Они будут рассмотрены нами несколько позднее. Здесь мы только отметим две вещи. [c.127]
Кислотность или основность водных растворов солей объясняется протеканием в них реакции гидролиза. В широком понимании гидролиз — это любое взаимодействие веществ с водой более конкретно гидролиз можно определить как реакцию соли с водой, приводящую к образованию кислоты и основания. Таким образом, гидролиз —это процесс, обратный нейтрализации (реакции между кислотой и основанием с выделением воды), а константа гидролиза записывается выражением, обратным выражению константы равновесия нейтрализации. [c.310]
Шатенштейн и Измайлов (1949 г.) показали, что реакция между кислотами и основаниями на стадии диссоциации протекают значительно сложнее, чем это следует из теории Бренстеда. Сначала образуется молекулярное соединение за счет водородной связи между атомом водорода кислоты и электроотрицательным атомом основания, затем следуег ионизация и диссоциация [c. 206]
206]
Реакцию между кислотой и основанием протонная теория представляет схемой [c.244]
Наиболее распространенной реакцией карбанионов является их рекомбинация с положительно заряженными частицами, обычно с протоном, или с другой частицей, имеющей вакантную орбиталь на внешней оболочке (реакция между кислотой и основанием Льюиса) [c.239]
Вид кривых титрования зависит от предшествующих протолитических реакций между кислотой и основанием и водой, приводящих к появлению в растворах ионов Н3О+ и 0Н . [c.641]
В основе учебника лежит курс органической химии, излагаемый по классам. Взаимоотношения между классами органических соединений столь многообразны, что практически любая последовательность классов, избираемая авторами современных учебников, с одной стороны, может быть логично обоснована, а с другой — правомерно оспорена. Однако независимо от последовательности изучения химиц отдельных классов студент должен освоить прежде всего грамматику органической химии познакомиться с классификацией и номенклатурой органических соединений, получить начальные знания о пространственном и электронном строении соединений с ковалентной связью, о типах разрыва ковалентных связей и классификации органических реакций. Все эти знания читатель может получить в главе 1 учебника, где они изложены на примере простейших реакций между кислотами и основаниями. Кислотно-основные реакции избраны для этой цели неслучайно. Согласно современным представлениям о природе кислот и оснований, подавляюш ее большинство органических реакций включает кислотно-основные взаимодействия, по крайней мере в качестве отдельных стадий. [c.7]
Все эти знания читатель может получить в главе 1 учебника, где они изложены на примере простейших реакций между кислотами и основаниями. Кислотно-основные реакции избраны для этой цели неслучайно. Согласно современным представлениям о природе кислот и оснований, подавляюш ее большинство органических реакций включает кислотно-основные взаимодействия, по крайней мере в качестве отдельных стадий. [c.7]
При рассмотрении реакций между кислотами и основаниями в водных растворах воду (амфолит) можно не учитывать. Например, реакцию между НС1 и КОН можно представить как сумму двух протолитических реакций [c.45]
Обычно под нейтрализацией понимают реакцию между кислотой и основанием. Однако, если в той же реакции вместо кислоты использовать ее ангидрид, можно по-прежнему говорить о нейтрализации. [c.270]
Согласно наиболее общему определению, к солям относятся все продукты реакций между кислотами и основаниями, за исключением молекул растворителей, образующихся в тех случаях, когда реакция протекает в растворителе. Состав и свойства веществ, называемых солями, могут быть настолько разнообразны, что дать более точное всеобъемлющее определение этого класса соединений очень трудно. Однако некоторые соли, обладающие сходными свойствами, образуют группы, и изучение таких групп представляет немалый интерес. [c.254]
Состав и свойства веществ, называемых солями, могут быть настолько разнообразны, что дать более точное всеобъемлющее определение этого класса соединений очень трудно. Однако некоторые соли, обладающие сходными свойствами, образуют группы, и изучение таких групп представляет немалый интерес. [c.254]
Всякая реакция между кислотой и основанием протекает практически до полного завершения, так как продукт такой реакции Н2О является слабо диссоциированным веществом [c.280]
На основании этих параметров можно с удивительной точностью предсказывать энтальпии реакций между кислотой и основанием Льюиса ( 0,8 кДж-моль ) даже в тех случаях, [c.51]
Самая общая из всех теорий кислот и оснований предложена в 1939 г. М. И. Усановичем. Согласно этой теории кислотами называют вещества, способные отщеплять катионы, а также вещества, способные присоединять анионы или электроны. Основаниями называют вещества, отщепляющие анионы или электроны, а также присоединяющие катионы. Однако общий характер теории М. И. Усановича одновременно является и ее недостатком. В классы кислот и оснований попадают все химические вещества, и любая химическая реакция представляет собой реакцию между кислотами и основаниями. [c.42]
Однако общий характер теории М. И. Усановича одновременно является и ее недостатком. В классы кислот и оснований попадают все химические вещества, и любая химическая реакция представляет собой реакцию между кислотами и основаниями. [c.42]
Р. нейтрализации — реакция между кислотой и основанием, при которой компоненты реагируют друг с другом в стехиометрических эквивалентных количествах продуктами реакции нейтрализации являются соль и вода [c.257]
От чего зависят относительные скорости и направления органических реакций Это важнейший вопрос органической химии. Теоретические представления, отвечаюш ие на этот вопрос, называют концепциями реакционной способности. С основными концепциями реакционной способности органических соединений удобнее всего познакомиться при рассмотрении наиболее распространенных органических реакций — реакций между кислотами и основаниями. [c.91]
Реакция между кислотой и основанием не сводится только к переходу протона от кислоты к основанию. [c.580]
[c.580]
Впоследствии теория Бренстеда оказалась недостаточной, чтобы объяснить новые факты. В 40-х годах Дэвис, Измайлов и сотрудники [15] показали, что диссоциация кислот и оснований протекает значительно сложнее, чем это следует из теории Бренстеда. Переход протона, являющийся главным содержанием реакции между кислотой и основанием, в действительности представляет только конечную и не всегда обязательную стадию взаимодействия. Непременной же формой кислотно-основного взаимодействия, в том числе при катализе посредством как жидких, так и твердых кислот и оснований, является образование молекулярных соединений [c.18]
Из обычно используемых в анализе реакций сравнительно быстро протекают реакции соединения ионов (реакции между кислотой и основанием, образование комплексов, осаждение). Медленно протекающими чаще всего являются окислительновосстановительные и молекулярные реакции, включая многие реакции органических соединений. [c. 496]
496]
Так, многочисленные факты говорят о наличии кислотных и основных свойств у таких углеводородов, которые Бренстед относил к апротонным веществам, т. е. к соединениям, не способным участвовать в протолити-ческих реакциях. Кроме того, было показано, что реакции между кислотами и основаниями, на стадии диссоциации их в растворе, протекают значительно сложнее, чем это следует из теории Брепстедз. [c.22]
По теории Бренстеда — Лоури, кислотой является любое вещество, способное отдавать протон, а основанием — любое вещество, которое может присоединять протон. Тогда основное уравнение реакции между кислотой и основанием может быть записано следующим образом [c.318]
Как предположили, независимо друг от друга, Горди [4], Дэвис [5], Н. Д. Соколов [6] и Кольтгофф [7], первичной реакцией между кислотой и основанием следует считать образование с помощью водородных связей молекулярных соединений различного состава и полярности. Криоскопические [1, 8—10], спектральные [4, 11, 12] и диэлектрические [13] измерения подтвердили это предположение. Повышение силы кислоты и основания приводит к увеличению полярности возникающих между ними водородных связей, обусловливая возможность завершения кислотно-основного взаимодействия переходом протона [c.63]
Криоскопические [1, 8—10], спектральные [4, 11, 12] и диэлектрические [13] измерения подтвердили это предположение. Повышение силы кислоты и основания приводит к увеличению полярности возникающих между ними водородных связей, обусловливая возможность завершения кислотно-основного взаимодействия переходом протона [c.63]
Теория Усановича включает также реакции с электронным переносом и поэтому рассматривает окислительно-восстановительные реакции как частный случай реакций между кислотами и основаниями. Действительно, внутреннюю связь между реакциями этих типов можно увидеть при сравнении процесса нейтрализации основания кислотой и растворения металла сильной кислотой. Уравнения соответствующих реакций можно записать следующим образом [c.403]
Они использовали полученные Гризесом, Джансеном и Хейделом [2, с. 357] данные относительно каталитического действия хлорной кислоты на реакцию между водой и уксусным ангидридом и показали, что еслп к пробе, содержащей маленькие количества воды, например, к раствору ацетата натрия в уксусной кислоте прибавить небольшие количества уксусного ангидрида, то при титровании этого раствора безводной хлорной кислотой будут протекать две последовательные реакции 1) между основанием (ацетат) и кислотой (хлорная кислота) 2) между уксусным ангидридом и водой. Последняя реакция катализируется первым избытком хлорной кислоты, она имеет высокое значение АЯ и приводит к заметному изменению температуры. Начало нз. [енения температуры системы происходит в конце первой реакции — реакции между кислотой и основанием. Это было первым сообщением об использовании органического индикатора . Другие примеры детально обсуждаются ниже. [c.98]
Последняя реакция катализируется первым избытком хлорной кислоты, она имеет высокое значение АЯ и приводит к заметному изменению температуры. Начало нз. [енения температуры системы происходит в конце первой реакции — реакции между кислотой и основанием. Это было первым сообщением об использовании органического индикатора . Другие примеры детально обсуждаются ниже. [c.98]
Обсудите утверждение Кислота — донор протонов, основание — акцептор протонов. Следовательно, присоединение 1- Вг к пропену — реакция между кислотой и основанием . Рассмотрите механизм присоединения НВг к пропену. Какую стадию этого механизма можно считать кислотно-основным азаимодейстием [c.736]
В каких случаях дюлектрическая проницаемость сильно сказывается на реакции между кислотой и основанием, в каких случаях ее роль незначительна [c.204]
Для титриметрических определений широко используют реакции в растворах между кислотами и осцованиями.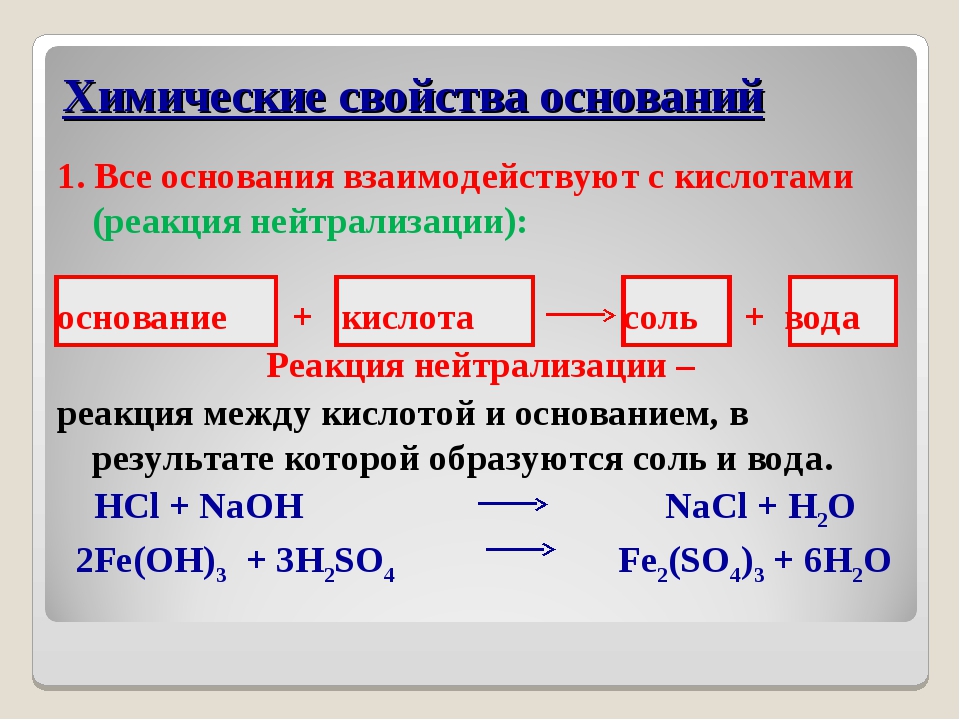 В классической химии реакцию между кислотой и основанием с образованием соли и воды называют реакцией нейтрализации и соответственно сам метод называют методом нейтрализации. Обратимся к хорошо известной реакции нейтрализации [c.257]
В классической химии реакцию между кислотой и основанием с образованием соли и воды называют реакцией нейтрализации и соответственно сам метод называют методом нейтрализации. Обратимся к хорошо известной реакции нейтрализации [c.257]
Большинство методик титрования в неводных растворах основано на реакции между кислотой и основанием. Способность растворителей к взаимодействию с используем1 ши реагентами затрудняет расширение возможностей метода титрования в неводных растворах за счет использования окислительно-восстановительных реакций. Однако можно привести один интересный пример реакции такого типа — определение воды при помощи реактива Фишера. Этот реактив представляет собой смесь иона и двуокиси серы в пиридине. Для выполнения определения образец, содержащий миллиграммовые количества воды, обычно растворяют или диспергируют в безводнЬм метаноле титрование реактивом Фишера проводят до тех пор, пока визуально или электрометрически не будет обнаружено присутствие свободного иода [c.335]
Классификация неорганических веществ, подготовка к ЕГЭ по химии
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли.
Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В
этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении
химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты
(в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются
исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными
оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3,
Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и
кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что
СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2,
SO3, P2O5, N2O3, NO2, N2O5, SiO2,
MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять
степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой,
так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)
Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования.
К таким оксидам относят:
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей.
Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов.
Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания
способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет.
Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH,
которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли
и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких
температурах вода испаряется, и комплексная соль образоваться не может)
Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации
кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию
с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз.
В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не
обманешь :)
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными
гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается
металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат
лития, дигидрофосфат и гидрофосфат натрия) - Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2)
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4]
(тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)
Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в
избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода),
то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Протонная теория кислот и оснований (общие сведения)
Протонная теория кислот и оснований (общие сведения)
теория объясняет кислотные и оснoвные свойства веществ происходящими между
ними процессами протолиза — обмена протонами. Это значит, что одно вещество (HA)
в функции кислоты (донора протонов) вступает в кислотно-оснoвное
взаимодействие с другим веществом B—, выполняющим функции основания
(акцептора протонов):
HA + B—
A— + HB
Продукты реакции — новое основание A—
и новая кислота HB (сопряженные с реагентами HA и B—
соответственно) также вступают в кислотно-основное взаимодействие между собой.
Это делает реакцию обратимой и приводит всю систему в состояние протолитического
равновесия.
реакцию автопротолиза. Например, для воды:H2O + H2O
OH— + H3O+
Состояние равновесия в этом случае
характеризуется ионным произведением воды KB:
KB
= [OH—] х [H3O+] = const = f(T)
При 25 оС KB = 1 . 10—14
и [OH—] = [H3O+] = 1 . 10—7
моль/л
[OH—] удобно выражать через водородный показатель рН и гидроксидный
показатель рОН:рН = —lg [H3O+] и pOH = —lg
[OH—]
При 25 оС в чистой воде рН = 7 и рОН = 7; рН +
рОН = 14 = const = f(T).
могут выполнять по отношению к ней функции кислоты или основания. Такие вещества
называют протолитами в водном растворе. Если протолит HA (молекула
или ион) — кислота, то обратимая реакция протолиза имеет вид:
HA
+ H2O
A— + H3O+ (1)
а состояние протолитического
равновесия (1) характеризуется константой кислотности KK:
KK = [A—] х [H3O+] / [HA]
= f(T)
Значение KK определяет силу
данной кислоты НА в водном растворе. Условно кислоты со значением KK
менее 1 . 10—1 называют слабыми, а со значением
KK более 1 . 10—1 — сильными.Если
протолит A— (молекула или ион) — основание, то обратимая реакция
протолиза имеет вид:
A— + H2O
HA + OH— (2)
а состояние протолитического равновесия (2) характеризуется
константой основности KO:
KO = {[HA] х
[OH—]} / [A—] = f(T)Значение KO
определяет силу данного основания А— в водном растворе. Условно основания
со значением KО менее 1 . 10—1
называют слабыми, а со значением KО более 1 .
10—1 — сильными.
кислота HA/основание A- (Кт/Ос) значения KK
и KO в водном растворе связаны соотношением: KK
х KO = KB = const = f(T).
Это соотношение справедливо и может быть использовано для практических расчетов
только в области разбавленных (от 0,0005 до 0,1 моль/л) водных растворов.
В водных растворах с концентрацией более 0,1 моль/л ионное произведение воды
KB начинает зависеть от количества растворенного вещества.
С разбавлением растворов равновесия протолитических реакций (1) и (2) существенно
сдвигаются вправо.
протолита co можно рассчитать его степень протолиза a
в данном растворе. Например, для кислоты HA используется формула:aHA
= [H3O+] / co
В области разбавленных
водных растворов значение KK для равновесия (1) связано со значениями
aHA уравнением закона разбавления Оствальда:KK
= a2HA х co / (1 — aHA)
что [H3O+] > [OH—] и при 25 оС [H3O+]
больше 1 . 10—7 моль/л; водородный показатель
рН для такого раствора меньше семи.
В водных растворах протолитов-оснований
среда щелочная. Это значит, что [OH—] > [H3O+]
и при 25 оС [OH—] больше 1 . 10—7
моль/л; гидроксидный показатель рОН для такого раствора меньше семи, а водородный
показатель рН для такого раствора больше семи. В водных растворах веществ-непротолитов
среда нейтральная. Как и в чистой воде: при 25 оС [H3O+]
= [OH—] = 1 . 10—7 моль/л, а рН = рОН
= 7. На практике водные растворы со средой, близкой к нейтральной, могут иметь
рН от 6 до 8.
Нижняя и верхняя границы измерения рН водных растворов отвечают
значениям рН = 1 и рН = 13 (рОН = 1), поскольку при рН < 1 и рН > 13 растворы
протолитов перестают быть разбавленными. Наоборот, в предельно разбавленных
растворах протолитов (при их бесконечно малой концентрации) значение
рН стремится к семи и определяется автопротолизом самой воды.
Кислоты и Основания
Определение Бронстеда-Лоури (1923) — Определение
кислот и оснований с участием ионов водорода и гидроксида соответственно
слишком ограничивает. Более широкое определение было предложено Бронстедом.
и Лоури в 1923 году. Главный эффект определения — увеличение
количество веществ, выступающих в роли оснований.
| Кислота | База | |
| Отдает ионы водорода | Принимает ионы водорода. | |
| HCl + | HOH —> | H 3 O + + Класс — |
| HOH + | NH 3 —> | NH 4 + + OH — |
Определение вещества как кислоты Бренстеда-Лоури
или базу можно сделать только наблюдая за реакцией.В случае
HOH это основание в первом случае и кислота в
второй случай.
Ссылка на звонок
анимация переноса иона аммония в воду — Джереми Харви,
Бристольский университет, Англия
См. Пример на рисунке слева:
Чтобы определить, является ли вещество кислотой или основанием, посчитайте
водороды в каждом веществе до и после реакции.Если количество атомов водорода уменьшилось, это вещество является
кислота (отдает ионы водорода). Если количество водородов
увеличено, что вещество является основой (принимает ионы водорода).
Эти определения обычно применяются к реагентам на
оставил.
Если смотреть в обратном порядке, новая кислота и основание могут
быть идентифицированным. Вещества в правой части уравнения
называются конъюгированной кислотой и конъюгированным основанием по сравнению с теми
налево.
Также обратите внимание, что исходная кислота превращается в сопряженное основание
после того, как реакция закончилась.
Кислоты и основания | Типы реакций
Что такое кислоты и основания? (ESBQV)
Бытовые кислоты и щелочи
Осмотрите свой дом и школу и найдите примеры кислот и оснований. Помните, что пища также может быть кислой или щелочной.
Составьте список всех найденных предметов. Как вы думаете, почему это кислоты или основания?
Некоторые распространенные кислоты и основания, а также их химические формулы показаны в Таблице 13.1.
Кислота | Формула | Основа | Формула |
Соляная кислота 900Cl \ | Гидроксид натрия | \ (\ text {NaOH} \) | |
Серная кислота | \ (\ text {H} _ {2} \ text {SO} _ {4} \) | Гидроксид калия | \ (\ text {KOH} \) |
Сернистая кислота | \ (\ text {H} _ {2} \ text {SO} _ {3} \) | Карбонат натрия | \ (\ text {Na} _ {2} \ text {CO} _ {3} \) |
Уксусная (этановая) кислота | \ (\ text {CH} _ {3} \ text {COOH} \) | Гидроксид кальция | \ (\ text {Ca} (\ t ext {OH}) _ {2} \) |
Угольная кислота | \ (\ text {H} _ {2} \ text {CO} _ {3} \) | Магний гидроксид | \ (\ text {Mg} (\ text {OH}) _ {2} \) |
Азотная кислота | \ (\ text {HNO} _ {3} \) | Аммиак | \ (\ text {NH} _ {3} \) |
Фосфорная кислота | \ (\ text {H} _ {3} \ text {PO} _ {4} \) | Бикарбонат натрия | \ (\ text {NaHCO} _ {3} \) |
Таблица 13.1:
Некоторые распространенные кислоты и основания и их химические формулы.
Большинство кислот обладают определенными характеристиками, и большинство оснований также обладают схожими характеристиками. Важно иметь определение кислот и оснований, чтобы их можно было правильно идентифицировать в реакциях.
Определение кислот и оснований (ESBQW)
Одно из первых замечаний о кислотах — это то, что они имеют кислый вкус. Было отмечено, что основы имеют мыльный вкус и горький вкус.{-} \) ионов и, следовательно, является основанием .
Обратите внимание, что мы пишем \ (\ stackrel {\ text {H} _ {2} \ text {O}} {\ longrightarrow} \), чтобы указать, что для диссоциации необходима вода.
Однако это определение может использоваться только для кислот и оснований в воде . Поскольку существует множество реакций, которые не происходят в воде, важно было дать более широкое определение кислот и оснований. {-} \ text {(aq)} \)
Чтобы решить, какое вещество является донором протонов, а какое — акцептором протонов, нам нужно посмотреть, что происходит с каждым реагентом.{+} \ text {(aq)} \)
Вода отдает протон и, следовательно, в этой реакции является кислотой . Аммиак принимает протон и, следовательно, является основанием .
Обратите внимание на эти примеры, как мы смотрели на общие элементы, чтобы разбить реакцию на две части. Итак, в первом примере мы проследили, что случилось с хлором, чтобы увидеть, является ли он частью кислоты или основания. Мы также проследили за азотом, чтобы увидеть, является ли он частью кислоты или основания.Вы также должны заметить, что в реакции с кислотой с правой стороны на один водород меньше, а в реакции с основанием — с дополнительным водородом с правой стороны.
Амфотерные вещества
В приведенных выше примерах \ (\ text {2} \) и \ (\ text {3} \) мы замечаем интересную вещь о воде. В примере \ (\ text {2} \) мы обнаруживаем, что вода действует как основание (она принимает протон). Однако в примере \ (\ text {3} \) мы видим, что вода действует как кислота (отдает протон)!
В зависимости от того, с какой водой реагирует, она может реагировать как основание или как кислота.Говорят, что вода амфотерная . Вода в этом отношении не уникальна, некоторые другие вещества также являются амфотерными.
- Амфотерный
Амфотерное вещество — это вещество, которое может вступать в реакцию как с кислотой, так и с основанием.
Когда мы смотрим только на кислоты и основания Бренстеда-Лоури, мы можем также говорить об амфипротических веществах, которые представляют собой особый тип амфотерных веществ.
- Амфипротический
Амфипротическое вещество — это вещество, которое может реагировать либо как донор протона (кислота Бренстеда-Лоури), либо как акцептор протона (основание Бренстеда-Лоури). {2 -} \ text {(aq)} + 2 \ text {H} _ {2} \ text {O (l)} \]
В этой главе мы в основном будем рассматривать монопротонные кислоты (кислоты, которые могут отдавать только один протон).Если вы видите в реакции полипротонную кислоту, запишите полученное уравнение реакции, в котором кислота отдает все свои протоны.
Примеры полипротонных кислот: \ (\ text {H} _ {2} \ text {SO} _ {4} \), \ (\ text {H} _ {2} \ text {SO} _ {3 } \), \ (\ text {H} _ {2} \ text {CO} _ {3} \) и \ (\ text {H} _ {3} \ text {PO} _ {4} \).
Практика Сиявула дает вам доступ к неограниченному количеству вопросов с ответами, которые помогут вам учиться. Тренируйтесь где угодно, когда угодно и на любом устройстве!
Зарегистрируйтесь, чтобы заняться сейчас
Кислоты и основания
Упражнение 13.{+} \ text {(aq)} \)
Отсюда мы видим, что кислота Бренстеда-Лоури — это \ (\ text {HNO} _ {3} \), а основание Бренстеда-Лоури — это \ (\ text {NH} _ {3} \).
\ (\ text {HBr (aq)} + \ text {KOH (aq)} \ rightarrow \ text {KBr (aq)} + \ text {H} _ {2} \ text {O (l)} \)
Разбиваем реакцию на две части:
\ (\ text {HBr (aq)} \ rightarrow \ text {KBr (aq)} \) и
\ (\ text {KOH (aq)} \ rightarrow \ text {H} _ {2} \ text {O (l)} \)
Отсюда мы видим, что кислота Бренстеда-Лоури — это \ (\ text {HBr} \), а основание Бренстеда-Лоури — это \ (\ text {KOH} \).{+} \) образуют сопряженную кислотно-основную пару.
Слово «сопряженный» означает «соединенный» или «связанный».
Мы можем представить это как:
Кислотно-основные пары конъюгата
Используя стандартные кислоты и основания из таблицы 13.1, выберите кислоту и основание из списка. Напишите химическое уравнение реакции этих двух соединений.
Теперь определите конъюгированные пары кислота-основание в выбранной вами реакции. Сравните свои результаты с результатами своих одноклассников.
Siyavula Practice дает вам доступ к неограниченному количеству вопросов с ответами, которые помогут вам в обучении.{+} \ text {(aq)} \)
Отсюда мы видим, что кислота Бренстеда-Лоури — это \ (\ text {H} _ {2} \ text {O} \), а база Бренстеда-Лоури — \ (\ text {NH} _ {3} \) .
Пометьте конъюгированные пары кислота-основание.
Объясните своими словами, что подразумевается под термином «сопряженная пара кислота-основание».
Конъюгированная пара кислота-основание представляет собой пару реагента и продукта, которые превращаются друг в друга за счет потери или усиления протона.Так, например, кислота теряет протон с образованием основания. Говорят, что кислота и полученное основание представляют собой пару сопряженных кислот и оснований.
Кислотно-основные реакции в органической химии — Master Organic Chemistry
Введение в кислотно-основные реакции в органической химии
Теперь, когда мы описали, как выяснить, где находятся электроны в молекуле, факторы, стабилизирующие отрицательный заряд и положительный заряд, и перейдя к формализму изогнутой стрелки для реакций, мы готовы приступить к более подробному рассмотрению некоторых ключевых реакций в органической химии.
Начнем с кислотно-основных реакций.
Содержание
- Четыре компонента каждой кислотно-основной реакции
- Что делает кислотно-щелочную реакцию благоприятной? (Подсказка: это связано со стабильностью конъюгированного основания)
- Кислотность молекулы напрямую связана со способностью конъюгированного основания стабилизировать отрицательный заряд
- Любой фактор, который стабилизирует конъюгированное основание, приведет к увеличению Кислотность
- Кислотно-основные реакции, которые идут от менее стабильной (т.е. Более основной) анион на более стабильный (т.е. менее основной) анион энергетически выгоден
1. Четыре компонента каждой кислотно-основной реакции в органической химии
В первом посте, который я сделал, вводя кислотно-основные реакции, я только что сказал, что первая задача бизнеса — просто выяснить, какие узы образуются, и какие узы разрываются, и распознать четыре компонента. Как это.
Это образец кислотно-основной реакции в органической химии: мы меняем водород между двумя атомами.На самом деле, поскольку водород не уносит с собой электронов, когда это происходит, технически мы меняем местами H + (протон). У нас есть названия для каждого из задействованных видов:
- Молекула, которая теряет H +, называется кислотой
- Молекула, которая получает H +, называется основанием
- После получения H + основание становится конъюгированной кислотой .
- После потери H + кислота становится конъюгированным основанием .
2.Что делает кислотно-щелочную реакцию благоприятной? (Подсказка: это связано со стабильностью конъюгированной основы)
Хотя это помогает нам распознать закономерность, на самом деле это не помогает нам ответить «почему?». Например, почему вышеупомянутая реакция протекает хорошо, а реакция ниже — нет? В конце концов, технически это тоже кислотно-основная реакция.
Теперь мы можем вернуться назад и приступить к рассмотрению этого важного вопроса.
Начнем с простых примеров. Вот четыре примера кислотно-основных реакций.Если вы раньше читали о стабильности отрицательного заряда, вы сможете оценить, какие из них будут более благоприятными, а какие — менее благоприятными. (Не стесняйтесь пока игнорировать стрелку, направленную назад)
3. Кислотность молекулы напрямую связана со способностью конъюгированной основы стабилизировать отрицательный заряд
Давайте посмотрим на это и подумаем:
- В каждой реакции молекула слева — это кислота, которая отдает протон воде (основанию), образуя h4O (+) [сопряженная кислота] и анион (сопряженное основание).
- Обратите внимание, как меняются заряды: в каждом случае конъюгат основания более отрицательный, чем кислота, а конъюгированная кислота более положительный, чем основание. Это всегда верно для кислотно-основных реакций.
- Поскольку здесь каждая реакция включает h3O и h4O (+), единственное различие между каждой реакцией заключается в идентичности кислоты и конъюгированного основания.
- При прочих равных, нейтральная молекула более стабильна, чем ее сопряженное основание (природа стремится минимизировать заряды).Различия в стабильности между нейтральными молекулами (слева) тривиальны по сравнению с разницей в стабильности между заряженными молекулами (справа).
- Следовательно, понимание факторов, которые стабилизируют отрицательный заряд, будет ключом к пониманию того, какие из них наиболее благоприятны, а какие наименее благоприятны.
Если вы вспомните факторы, которые стабилизировали отрицательный заряд, то, пройдя слева направо по периодической таблице, мы получили следующую тенденцию:
Из этих четырех видов фторид-ион (F-) является наиболее стабильным. Следовательно, из всех четырех видов, перечисленных в приведенных выше реакциях, мы должны ожидать, что H-F с наибольшей вероятностью откажется от своего протона с образованием сопряженного основания F (-). Другими словами, H-F — самый кислый.
Из этих четырех видов CH 3 (-) является наименее стабильным. Следовательно, из всех четырех перечисленных видов следует ожидать, что H-CH 3 с наименьшей вероятностью отдаст свой протон с образованием сопряженного основания, CH 3 (-). Другими словами, H-CH 3 наименее кислый.
4. Любой фактор, стабилизирующий основание конъюгата, приведет к увеличению кислотности
Давайте повторим это в другой форме. КИСЛОТНОСТЬ ВИДА НАПРЯМУЮ СВЯЗАНА С СТАБИЛЬНОСТЬЮ ЕГО СОЕДИНЕННОЙ БАЗЫ.
Простите за крик, но это важно! Я так взволнован, что вынужден кричать об этом.
СТАБИЛИЗАЦИЯ ОСНОВАНИЯ СОЕДИНЕНИЯ ПРИВЕДЕТ К ПОВЫШЕНИЮ КИСЛОТНОСТИ.
Чтобы хорошо провести время, вы можете вернуться к семи факторам, которые стабилизируют отрицательный заряд (заряд, электроотрицательность, поляризуемость, резонанс, индукционные эффекты, орбитали и ароматичность), и посмотреть на них через эту линзу. Каждая тенденция, которая приводит к стабилизации отрицательного заряда, будет иметь прямое влияние на кислотность. Более конкретно, стабилизация отрицательного заряда сделает кислотный конъюгат более кислым.
5. Кислотно-основные реакции, которые переходят от менее стабильного (т.е. более основного) аниона к более стабильному (т.е. менее основному) аниону, являются энергетически выгодными
Итак, для реакции на самом верху мы исходим из менее стабильный анион (H 2 N–) на более стабильный анион (F-).Это энергетически выгодно, как вода, текущая под гору. Итак, эта реакция продолжается.
Обратная реакция будет включать переход от более стабильного аниона (F-) к менее стабильному аниону (H 2 N-). Это энергетически невыгодный , и он не протекает удовлетворительно.
Конечно, на данный момент это все еще довольно расплывчато — на самом деле мы можем быть более точными в этом, как мы увидим.Однако в следующем посте мы рассмотрим те же самые реакции под несколько другим углом.
Следующее сообщение: Прогулки по кислотно-основным реакциям (2) — Основность
Идентификация кислот и оснований — Химия средней школы
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает одно
или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как
в виде
ChillingEffects.org.Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно
искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится
на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например, мы требуем
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105Или заполните форму ниже:
Глава 12 — Кислотно-щелочная химия
Введение
Термины кислота и основание использовались в течение нескольких сотен лет. Кислоты — вещества, имеющие кислый вкус, вызывающие коррозию и вступающие в реакцию с веществами, называемыми основаниями. Вещества, которые имели горький вкус, делали кожу скользкой при контакте и вступали в реакцию с кислотами, получили название оснований . Однако эти простые определения пришлось уточнить по мере того, как химические свойства кислот и оснований стали лучше пониматься.
Первое химическое определение кислот и оснований было сделано Сванте Аррениусом. Кислота Аррениуса — это вещество, которое производит ионы H 1+ при растворении в воде, а основание Аррениуса — это вещество, которое при растворении в воде производит ионы OH 1–.В этой теории кислота ионизирует в воде так же, как ионное вещество, и константа равновесия для реакции называется константой кислотной ионизации . Например, ионизация HCl аррениусовой кислоты в воде представлена следующим образом:
Нейтрализация — это реакция кислоты и основания с образованием воды и соли .
HCl + NaOH → H 2 O + NaCl
NaCl представляет собой соль .Обратите внимание, что катион соли происходит от основания, а анион — от кислоты.
Кислотно-основная теория Аррениуса очень ограничена, потому что ее определения ограничиваются поведением в воде. Следовательно, были разработаны более широкие определения для этих очень важных классов соединений. В этой главе мы исследуем теории кислотно-щелочной химии Льюиса и Бренстеда-Лоури. Теория Льюиса является самой широкой и обсуждается в первую очередь.
12,1 Кислоты и основания Льюиса
Введение
Самое широкое определение кислот и оснований дано Льюисом.По этому определению большое количество реакций можно отнести к кислотно-основным реакциям. В этом разделе мы вводим кислоты и основания Льюиса и используем изогнутые стрелки, чтобы показать механизм кислотно-основной реакции Льюиса. Эти темы будут снова использованы в главе 13 «Органическая химия».
Предварительные требования
Цели
•
Определите кислоту Льюиса и основание Льюиса.
•
Опишите кислотно-щелочную реакцию Льюиса.
•
Определите кислоты и основания Льюиса.
•
Объясните, как изогнутые стрелки используются, чтобы показать механизм кислотно-основной реакции Льюиса.
•
Различают перенос электрона и кислотно-щелочную реакцию Льюиса.
12.1-1. Определения
Кислотно-основная реакция Льюиса превращает неподеленную пару основания и пустую орбиталь кислоты в ковалентную связь.
•
Кислота Льюиса представляет собой вещество, имеющее пустую орбиталь, которое оно может использовать для разделения неподеленной пары для образования связи.
•
Основание Льюиса — это вещество, которое имеет неподеленную пару, которую оно может разделить ковалентной связью.
•
Кислотно-основная реакция Льюиса представляет собой преобразование неподеленной пары на основании и пустой орбитали кислоты в ковалентную связь между кислотой и основанием.
Продукт кислотно-основной реакции Льюиса представляет собой ковалентную связь между кислотой и основанием. Оба связывающих электрона исходят из основания, поэтому это координационная ковалентная связь. Изогнутая стрелка от неподеленной пары к атому с пустой орбиталью используется, чтобы показать, что неподеленная пара станет связующей парой между двумя атомами.
12.1-2. Кислоты и основания Льюиса
Базы Льюиса
•
База Льюиса должна содержать по крайней мере одну неподеленную пару электронов.
•
Все анионы являются основаниями Льюиса, но не все основания Льюиса являются анионами.
•
Неподеленная пара часто, но не всегда, расположена на атомах кислорода или азота.
•
Прочность основания увеличивается за счет электронной плотности.
Сила основания зависит от концентрации электронов в области неподеленной пары, чем больше плотность электронов, тем сильнее основание.Следовательно, сила базы зависит от групп вокруг одинокой пары. Например, рассмотрите относительные основные силы следующих элементов, которые являются основными из-за неподеленных пар на атоме кислорода.
CH 3 O 1−> HO 1− > ClO 1−
CH 3 O 1– является самым сильным основанием, потому что группа CH 3 толкает электронную плотность на атом кислорода. ClO 1– является самым слабым, поскольку электроотрицательный атом хлора удаляет электронную плотность из кислорода.В верхнем ряду рисунка 12.2 показаны некоторые основания Льюиса, которые являются молекулами. В каждом случае неподеленная пара находится на атоме азота или кислорода, что является обычным явлением для оснований Льюиса, которые являются молекулами. Анионы также являются основными по Льюису. Хлорид-анион является очень слабым основанием Льюиса, в то время как ион сероводорода (HS 1–) и ацетат-ион (C 2 H 3 O 2 1–) являются обычными слабыми основаниями Льюиса.
Кислоты Льюиса
Кислоты Льюиса зачастую труднее идентифицировать.Следующее должно помочь.
•
Кислота Льюиса должна быть способна приспособиться к дополнительной электронной области (новой связи), поэтому, если она подчиняется правилу октетов, кислотный атом Льюиса должен иметь менее четырех областей.
•
Атаке неподеленной пары способствует положительный заряд, поэтому кислотность Льюиса усиливается положительным зарядом.
•
Все катионы являются кислотами Льюиса, но не все кислоты Льюиса являются катионами.
Кислотные центры Льюиса на рисунке 12.3, каждый из которых содержит менее четырех электронных областей, показаны красным. AlCl 3 является электронодефицитным, потому что алюминий имеет только шесть валентных электронов. Молекулы с электронодефицитными атомами являются сильными кислотами Льюиса. SO 3 и CO 2 не являются электронодефицитными, но центральный атом в каждом из них имеет менее четырех электронных областей (три вокруг S и две вокруг C), поэтому они являются кислотами Льюиса. Их кислотность усиливается положительным формальным зарядом.Катионы, такие как Ag 1+ и H 1+ , которые имеют довольно низкоэнергетические пустые орбитали, также являются хорошими кислотами Льюиса.
12.1-3. Кислотность и основность по Льюису и орбитальная энергия
Связь между двумя атомами является ковалентной только тогда, когда взаимодействующие орбитали имеют схожие энергии, потому что большое энергетическое разделение благоприятствует ионным связям. Таким образом, образование координационной ковалентной связи в кислотно-основной реакции Льюиса облегчается, когда энергия пустой орбитали кислоты Льюиса близка к энергии неподеленной пары основания Льюиса.Энергии неподеленных пар обычно ниже, чем энергии пустых орбиталей, поэтому наиболее сильные взаимодействия происходят, когда энергия неподеленной пары высока для неподеленной пары, а энергия пустой орбитали низка для пустой орбитали. Например, рассмотрим случаи Na 1+ и Ag 1+ , как показано на рисунке. Энергия пустой орбитали Ag 1+ намного ниже, чем у Na 1+ ; т.е. энергия пустой орбитали Ag 1+ мала для пустой орбитали.Таким образом, пустая орбиталь на Ag 1+ достаточно близка к орбитали неподеленной пары на ионе Br 1–, так что связь Ag – Br является ковалентной. Однако энергия пустой орбитали на Na 1+ настолько высока, что связь Na – Br является ионной. Таким образом, Ag 1+ является достаточно сильной кислотой Льюиса, чтобы реагировать с ионом Br 1–, но кислотность Na 1+ настолько мала, что это не так. Действительно, Na 1+ является настолько слабой кислотой Льюиса (ее орбитали настолько высоки по энергии), что она не действует как кислота в водных растворах.В общем, H 1+ и катионы металлов с высоким эффективным ядерным зарядом (металлы, такие как Ag и Pb, которые расположены низко и справа от периодической таблицы) имеют пустые орбитали с относительно низкой энергией, поэтому они являются льюисовскими. кислые, но катионы металлов в левой части таблицы Менделеева являются настолько слабыми кислотами Льюиса, что их кислотность в большинстве случаев можно игнорировать. Делаем следующий вывод.
Сильные кислоты Льюиса имеют пустые орбитали с низкой энергией, а сильные основания Льюиса имеют неподеленные пары с высокой энергией.
12.1-4. Окислители и кислоты
И окислители, и кислоты Льюиса характеризуются пустыми валентными орбиталями с низкой энергией, в то время как восстановители и основания Льюиса имеют электроны с высокой энергией. Следовательно, многие кислоты Льюиса также являются окислителями, и многие основания Льюиса также являются восстановителями. Действительно, окислители и кислоты Льюиса часто определяют как акцепторы электронов, а восстановители и основания Льюиса — как доноры электронов. Возникает очевидный вопрос: «Что определяет, будут ли электроны переноситься или совместно использоваться, когда неподеленная пара входит в контакт с пустой орбиталью?» Как это часто бывает в нашем исследовании химии, ответ заключается в их относительной энергии: электроны делают все, что наиболее эффективно для увеличения своего электрического потенциала, чтобы снизить свою энергию.Если энергия пустой орбитали ниже, чем энергия неподеленной пары, электроны просто переходят от восстановителя к более положительному электрическому потенциалу окислителя в окислительно-восстановительной реакции. Однако, если пустая орбиталь имеет более высокую энергию, электроны понижают свою энергию, образуя ковалентную связь между кислотой и основанием, что увеличивает их электрический потенциал, подвергая их части ядерного заряда на кислоте. Пример H 1+ , который одновременно является окислителем и кислотой, рассмотрен на рисунке 12.5. Если H 1+ встречает атом цинка, он ведет себя как окислитель и принимает электроны с более высокой энергией от восстановителя цинка. Однако электроны не будут течь от иона Br 1– на орбиталь с более высокой энергией на H 1+ , поэтому неподеленная пара на ионе Br 1– снижает свою энергию, образуя ковалентную связь H – Br. Br 1– является основанием в присутствии H 1+ , но он является восстановителем в присутствии чего-то вроде Cl 2 , имеющего пустую орбиталь при более низкой энергии (2 Br 1– + Cl 2 → Br 2 + 2 Cl 1– ).
12.1-5. Изогнутые стрелки в кислотно-основных реакциях Льюиса
Изогнутые стрелки, указывающие от неподеленной пары к атому, указывают на то, что неподеленная пара преобразуется в связывающую пару, в то время как изогнутые стрелки, указывающие от связи к атому, используются, чтобы показать, что связующая пара преобразуется в неподеленную пару на атоме.
Изогнутые стрелки всегда начинаются с пары электронов и заканчиваются на атоме, но их значение зависит от того, является ли электронная пара неподеленной парой или парой связи.
Начало изогнутой стрелки Конец изогнутой стрелки Реагент Товар Эффект неподеленная пара на атоме B атом А Одинокая пара становится связью A – B. Соединительная пара A – B атом А Связь A – B становится неподеленной парой на атоме A. Таблица 12.1
Изогнутые стрелки будут широко использоваться в этой и следующей главах для объяснения механизмов кислотно-основных реакций Льюиса.
12.1-6. Примеры металлов в виде кислот Льюиса
Ионы Ag 1+ имеют относительно низкоэнергетические пустые орбитали, поэтому они являются хорошими кислотами Льюиса. Ионы Cl 1– имеют неподеленные пары, поэтому они являются основаниями Льюиса. На рисунке 12.6a изогнутая стрелка от Cl 1– до Ag 1+ используется для демонстрации превращения неподеленной пары на ионе Cl 1– в связь AgCl в этой кислотно-основной реакции Льюиса.Ионы серебра также реагируют с аммиаком. Обратите внимание, что красная неподеленная пара азота в каждом аммиаке превращается в красную связь Ag – N на рис. 12.6b.
На рисунке 12.6c атом алюминия AlCl 3 имеет только шесть валентных электронов и три электронные области, окружающие его, поэтому AlCl 3 является сильной кислотой Льюиса. Обратите внимание, что во время этой реакции Al переходит от трехэлектронных областей и гибридизации sp 2 к четырехэлектронным областям и sp 3 гибридизации.Изменение гибридизации с sp 2 на sp 3 приводит к изменению геометрии с тригональной плоскости на тетраэдрическую. Следующая анимация показывает изменение геометрии.
Делаем следующий вывод.
Число электронных групп вокруг кислотного атома Льюиса изменяется с образованием связи, которая изменяет геометрию и гибридизацию атома.
12.1-7. Изогнутые стрелки в механизме — пример
Кислотно-основная реакция Льюиса между SO 3 и H 2 O с образованием H 2 SO 4 является реакцией, которая является основной причиной кислотного дождя. Атом кислорода в молекуле воды содержит две неподеленные пары, поэтому вода является основанием Льюиса, в то время как атом серы в SO 3 имеет только три электронные области, что делает SO 3 кислотным по Льюису. Как показано на рис. 12.7a, неподеленная пара на атоме кислорода в воде совместно с атомом серы образует новую связь S – O.Одновременно пи-электроны в связи S = O превращаются в неподеленную пару на кислороде (изогнутая стрелка от связи к атому), и гибридизация атома серы идет от sp 2 к sp 3 . (от тригональной плоскости к тетраэдрической).
Полученная структура помещает положительный формальный заряд на атом кислорода, который устраняется переносом протона от этого атома кислорода к тому, который несет отрицательный формальный заряд. Перенос протона осуществляется двумя кислотно-основными реакциями с растворителем.В первом случае протон передается от атома кислорода с положительным формальным зарядом к молекуле растворителя (воде), как показано на рисунке 12.7b.
На заключительном этапе протон переносится от растворителя к атому кислорода с отрицательным формальным зарядом, как показано на рисунке 12.7c. H 3 O 1+ , полученный на этапе 2, и OH 1–, полученный на этом этапе, затем претерпят реакции переноса протона с образованием 2 H 2 O. Конечный продукт имеет правильную структуру серной кислоты. .
12.1-8. Сравнение окислительно-восстановительных и кислотно-основных реакций Льюиса
Электронная пара ведет себя как восстановитель, когда энергия пустой орбитали намного ниже, но как база Льюиса, когда энергия пустой орбитали выше.
Сравните определения реагентов, участвующих в кислотно-основных и окислительно-восстановительных реакциях Льюиса.
•
Восстановитель: вещество, которое может переносить электроны на другое вещество.Хорошие восстановители характеризуются электронами высокой энергии.
•
Основание Льюиса: вещество, которое может отдавать электронную пару ковалентной связи с другим веществом. Хорошие основания Льюиса характеризуются электронными парами высоких энергий.
•
Окислитель: вещество, которое может принимать электроны от другого вещества. Хорошие окислители характеризуются низкоэнергетическими пустыми орбиталями.
•
Кислота Льюиса: вещество, которое может принимать электронную пару на пустую орбиталь с образованием ковалентной связи.Хорошие кислоты Льюиса характеризуются низкоэнергетическими пустыми орбиталями.
Единственное различие между двумя типами реакций состоит в том, что одна из них передает, а другая разделяет электроны между двумя реагентами.
12,2 кислоты Бренстеда
Введение
Хотя определение Льюиса является самым широким, определение Бренстеда-Лоури (или просто Бренстеда) является наиболее часто используемым определением кислотно-основного в водных растворах. В этом разделе мы даем определение кислотам и основаниям Бренстеда и вводим кислотно-основные реакции Бренстеда.
Предварительные требования
•
10.5 Электролиты (различают сильные электролиты и неэлектролиты по способности их водных растворов проводить электричество.)
Цели
•
Напишите название кислоты по ее формуле или формулу по ее названию.
12.2-1. Brønsted Определение
Кислотно-основные реакции Бренстеда — это реакции переноса протона.
Кислота Бренстеда является донором протона, основание Бренстеда является акцептором протона, а кислотно-основная реакция Бренстеда представляет собой перенос протона от кислоты к основанию. Таким образом, электронная пара является точкой отсчета в теории Льюиса, а протон — точкой отсчета в теории Бренстеда.
Определение Бренстеда — это частный случай определения Льюиса. В каждом из них основание содержит неподеленную пару, которую оно разделяет с кислотой, образуя ковалентную связь.Любая база Бренстеда — это база Льюиса, и наоборот. Однако кислота Льюиса — это любой вид, который может принимать неподеленную пару, но акцептор неподеленной пары должен быть протоном в определении Бренстеда, а вещество, которое содержит протон, является кислотой Бренстеда.
12.2-2. Водные растворы кислот и оснований
[H 3 O 1+ ] определяет кислотность, а [OH 1– ] определяет основность водного раствора.
Согласно определению Бренстеда, кислоты переносят протон в воду, которая является слабым основанием Бренстеда, с образованием ионов гидроксония (H 3 O 1+ ).HX + H 2 O H 3 O 1+ + X 1−
Именно концентрация H 3 O 1+ определяет степень кислотности водного раствора. Таким образом, если указанная выше реакция с водой является обширной, концентрация H 3 O 1+ относительно высока, поскольку практически весь HX превращается в H 3 O 1+ . Такие кислоты являются сильными кислотами. Если его реакция с водой не является обширной, концентрация H 3 O 1+ относительно низка, так как только небольшая часть кислоты превращается в H 3 O 1+ , и такие кислоты называются слабые кислоты.Аналогичные соображения можно сделать и для баз. Концентрация гидроксид-иона определяет основность водного раствора. Таким образом, сильное основание , такое как КОН, является основанием, которое в значительной степени превращается в гидроксид-ионы в воде: КОН → K 1+ + OH 1–. Слабое основание , такое как фторид-ион, лишь незначительно реагирует с водой с образованием гидроксид-ионов: F 1− + H 2 O HF + OH 1−.
12.2-3. Кислоты и основания — электролиты
Сильные кислоты и основания — сильные электролиты, а слабые кислоты и основания — слабые электролиты.
Если HX является сильной кислотой, то он полностью превращается в ионы H 3 O 1+ и X 1– в воде. Присутствие этих ионов делает кислоту сильным электролитом. Однако, если HX не полностью реагирует с водой, образуются только небольшие концентрации ионов.В данном случае HX — это слабый электролит . Точно так же сильные основания — это сильные электролиты, а слабые основания — это слабые электролиты.
Напомним из раздела 10.5, что электричество проводится через раствор электролита, но не через раствор неэлектролита.1+ Ions in a 0.1 M of HX» cellpadding=»10″>
Лампочка не светится, значит, в растворе нет ионов.Тот факт, что HX не образует ионы в растворе, указывает на то, что HX не является электролитом . Водный раствор представлен как HX, чтобы показать, что молекулы не ионизируются в воде. Свет светится ярко, это означает, что концентрация ионов H 3 O 1+ в растворе относительно высока. Кислоты, которые полностью ионизируются в воде с образованием высоких концентраций ионов H 3 O 1+ , называются сильными кислотами .Водный раствор представлен как H 3 O 1+ + X 1–, чтобы показать, что молекулы полностью ионизируются в воде. Свет светит, значит, HX — электролит, но сила света намного меньше, чем у сильной кислоты. Тусклость света указывает на низкую концентрацию ионов H 3 O 1+ . Таким образом, только часть молекул HX в воде ионизируется. Кислоты, которые лишь частично ионизируются в воде, называются слабыми кислотами .Водный раствор обозначается как HX, потому что HX является преобладающим веществом в растворе. Таблица 12.2: Определение относительных концентраций H 3 O 1+ ионов в 0,1 M HX
12.2-4. Примеры
чистый H 2 O Вода — неэлектролит и обозначается как H 2 O. В воде есть ионы, но их концентрации очень малы. 0,10 M HNO 3 Азотная кислота — сильная кислота, и ее водный раствор представлен как H 3 O 1+ (H 1+ ) + NO 3 1– . Следующая реакция настолько обширна, что в растворе практически отсутствуют молекулы азотной кислоты. Напомним, что обширные реакции обозначены одиночными стрелками, как показано ниже. HNO 3 + H 2 O → H 3 O 1+ + NO 3 1–
0.10 M КОН КОН полностью ионизируется в воде и является сильным электролитом. Это сильное основание, потому что одним из производимых им ионов является ион OH 1–. Таким образом, водный КОН записывается как K 1+ + OH 1– . 0,10 M CH 3 OH CH 3 OH — неэлектролит. Это не кислота и не основание — это спирт (древесный спирт). Водный раствор метанола записывается как CH 3 OH . 0,10 M HNO 2 Лампочка тускло светится, значит, азотистая кислота является слабой кислотой, и ее водные растворы представлены как HNO 2 , а не как ион гидроксония и нитрит-ион, чтобы показать преобладающую форму. Следующая реакция не является обширной (реагирует только около 5% молекул HNO 2 ), поэтому используются двойные стрелки. HNO 2 + H 2 O H 3 O 1+ + NO 2 1–
0.10 M NH 3 Лампочка горит тускло, значит, NH 3 — слабый электролит. Около 1% молекул аммиака реагируют с водой с образованием ионов, поэтому водный раствор представлен как молекулы NH 3 , а не как ионы. В реакции используются двойные стрелки. NH 3 + H 2 O NH 4 1+ + OH 1–
Протон переносится из воды в аммиак, поэтому NH 3 является слабым основанием .
Таблица 12.3
12.2-5. Кислоты Бренстеда
Кислый протон должен быть связан с электроотрицательным атомом, которым является кислород в большинстве кислот, содержащих атом кислорода.
Чтобы HX был кислотным, связь H – X должна разорваться с образованием ионов H 1+ и X 1–, но это может произойти только в том случае, если это полярная связь. Таким образом, атом водорода должен быть ковалентно связан с сильно электроотрицательным атомом, чтобы быть кислотным.Существует большое количество соединений с атомами водорода, ковалентно связанными с атомами, которые не очень электроотрицательны, но эти соединения не являются кислотами Бренстеда. Наиболее распространенными примерами являются органические соединения, потому что связь C – H неполярна (C и H имеют очень похожие электроотрицательности). Например, связи C – H в CH 4 не образуют H 1+ при разрыве, поэтому CH 4 не может быть кислотой Бренстеда. Связь H – Cl очень полярна, поэтому разрыв связи H – Cl действительно приводит к образованию ионов H 1+ , что делает HCl кислотой Бренстеда.
Кислые протоны обычно записываются первыми в формуле кислот, чтобы указать, что они кислые.
Например, химические формулы гидросульфат-иона и хлорной кислоты записываются как HSO 4 1– и HClO 4 , чтобы продемонстрировать, что они являются кислотами, а формулы метана и аммиака записываются как CH 4 и NH 3 , чтобы указать, что они не содержат кислотных протонов.Однако такое написание формул может ввести в заблуждение, поскольку часто протон помещается рядом с атомом, с которым он не связан. Кислые протоны в HSO 4 1– и HClO 4 оба присоединены к атомам кислорода. Уксусная кислота обозначается как HC 2 H 3 O 2 , чтобы указать, что это кислота, которая имеет только один кислотный протон. Еще раз, кислый протон также связан с атомом кислорода, а не с углеродом, в то время как другие атомы водорода присоединены к углероду и не являются кислотными.Следовательно, уксусная кислота часто записывается как CH 3 COOH, что указывает на связь O – H и лучше отражает истинную структуру кислоты. Аналогично, H 2 SO 4 содержит две связи O – H, но не содержит
S – H-связи.12.2-6. Бинарные кислоты и оксикислоты
Бинарные кислоты
Бинарные кислоты имеют протон и только один другой элемент. HCl, HBr и HI — сильные кислоты, но HF — слабая кислота. Примечание: эти кислоты плюс NH 4 1+ , H 2 S и H – CN — единственные кислоты, с которыми мы имеем дело, не имеющие связей O – H.
•
Обратите внимание, что HCN не является бинарной кислотой, потому что он содержит атомы трех разных элементов. Однако HCN — это газ, и его название (цианистый водород) заканчивается на -ид, поэтому он рассматривается как бинарное соединение.
Оксокислоты
Большинство кислотных протонов связаны с атомом кислорода. Такие кислоты называются оксокислотами. Кислые протоны показаны синим цветом на рис. 12.12.
Обозначение кислот
12.2-7. Бинарные кислоты
Чистые соединения, образующие бинарные кислоты, названы в соответствии с правилами, изложенными в разделе 4.6, пока они не растворятся в воде. Например, HCl — это хлористый водород, а H 2 S — сероводород. Однако, когда эти вещества растворяются в воде, они образуют кислые растворы, которые названы следующим образом.
•
Замените водород на гидро.
•
Измените окончание -ide на -ic.
•
Добавьте слово кислота.
Формула Имя как чистое вещество Формула Название как водный раствор HF ( г ) фтороводород ВЧ ( водн., ) плавиковая кислота HCl ( г ) хлористый водород HCl ( водн., ) соляная кислота HI ( г ) иодистого водорода Hl ( водн. ) иодистоводородная кислота HCN ( г ) цианистый водород HCN ( водн. ) синильная кислота H 2 S ( г ) сероводород H 2 S ( водн. ) сероводородная кислота Таблица 12.4: Названия некоторых распространенных бинарных кислот
12.2-8. Многоатомные кислоты
Многоатомные кислоты являются производными многоатомных ионов и названы
•
изменение -ate окончания многоатомного иона на -ic или
•
изменение -ite окончания многоатомного иона на -ous и
•
добавление слова кислота.
Если кислота также является ионом, ее название не меняется.Например, ионы HPO 4 2– и H 2 PO 4 1– являются ионами моногидрофосфата и ионами дигидрофосфата соответственно. В более старом, но все еще распространенном методе ионы с кислотными протонами называются с использованием префикса «би» вместо слова «водород». Таким образом, HSO 4 1– представляет собой гидросульфат или бисульфат.
Ионная формула Имя иона Формула кислоты Название кислоты C 2 H 3 O 2 1– ацетат-ион HC 2 H 3 O 2 уксусная кислота SO 3 2– сульфит-ион H 2 SO 3 сернистая кислота SO 4 2– сульфат-ион H 2 SO 4 серная кислота НЕТ 2 1– нитрит-ион HNO 2 азотистая кислота НЕТ 3 1– нитрат-ион HNO 3 азотная кислота ClO 1– гипохлорит-ион HClO хлорноватистая кислота ClO 2 1– хлорит-ион HClO 2 хлористая кислота ClO 3 1– хлорат-ион HClO 3 хлорная кислота ClO 4 1– перхлорат-ион HClO 4 хлорная кислота PO 4 3– фосфат-ион H 3 PO 4 фосфорная кислота Таблица 12.1+ для NH 4 1+ .)
12.3 Кислотно-основные реакции Бренстеда
Введение
Все кислотно-основные реакции Бренстеда включают перенос одного протона от кислоты к основанию. В этом разделе мы увидим, как предсказать продукты кислотно-основной реакции Бренстеда.
Цели
•
Определите сопряженное основание кислоты.
•
Определите сопряженную кислоту основания.
•
Опишите кислотно-щелочную реакцию Бренстеда с точки зрения переноса протона.
12.3-1. Основание конъюгата
Конъюгированное основание кислоты образуется путем удаления одного и только одного протона из кислоты.
После того, как кислота теряет протон, она становится основанием, потому что вид, которым она становится, может вернуть протон.Потеря одного протона превращает кислоту в ее сопряженное основание . Важно понимать, что кислота и сопряженное с ней основание отличаются одним и только одним протоном . Все реакции Бренстеда включают перенос одного протона. Таким образом, кислота всегда превращается в сопряженное с ней основание в реакции Бренстеда.
Заряд сопряженного основания всегда на единицу ниже, чем заряд кислоты, поскольку кислота теряет H 1+ .
Упражнение 12.1+ для NH 4 1+ .)
12.3-2. Конъюгат кислоты
Конъюгированная кислота основания образуется путем добавления одного протона к основанию.
После того, как основание получает протон, оно становится кислотой, потому что частицы, которыми оно становится, могут отдавать протон обратно. Усиление одного протона превращает основание в его сопряженную кислоту . Все реакции Бренстеда включают перенос одного протона.).1+ для NH 4 1+ .)
12.3-3. Кислотно-основные реакции Бренстеда
Химическое уравнение кислотно-основной реакции Бренстеда состоит из двух сопряженных кислотно-основных пар и ничего больше.
Кислотно-основные реакции Бренстеда превращают реагирующую кислоту в сопряженное основание, а реагирующее основание — в сопряженную кислоту. Химическое уравнение кислотно-основной реакции Бренстеда состоит из двух сопряженных кислотно-основных пар и ничего больше.Рассмотрим следующую реакцию переноса протона: HCN + NH 3 → CN 1– + NH 4 1+ .
Перенос протона превращает реагирующую кислоту (HCN) в сопряженное основание (CN 1–) и реагирующее основание (NH 3 ) в сопряженную кислоту (NH 4 1+ ).
Продукты кислотно-щелочной реакции также являются кислотой и основанием, поэтому вещества справа в химическом уравнении также вступают в реакцию с образованием веществ слева: CN 1– + NH 4 1+ → HCN + NH 3 .В этой конкретной реакции вероятность того, что столкновение между кислотой и основанием приведет к кислотно-основной реакции, примерно одинакова в любом направлении. Тот факт, что обратная реакция важна, демонстрируется двойными стрелками в химическом уравнении: HCN + NH 3 CN 1– + NH 4 1+ .
12,4 Степень переноса протона
Введение
Не все кислоты и основания очень хорошо взаимодействуют друг с другом, и степень, в которой они действительно реагируют, называется степенью переноса протона .Если степень переноса протона велика, реакция обычно обозначается одной стрелкой, но если перенос не обширный, реакция обозначается двойными стрелками.
Предварительные требования
Цели
•
Напишите химическое уравнение реакции сильной кислоты, слабой кислоты или слабого основания с водой.
12.4-1. Сравнение концентраций кислотно-основного конъюгата
Чем слабее кислота, тем сильнее сопряженное с ней основание.
Сила кислоты связана с легкостью, с которой она отдает свой протон, чтобы стать сопряженным основанием, а сила основания связана с его способностью принимать протон, чтобы стать сопряженной кислотой. Если A 1– является сильным основанием , тогда он должен сильно связывать протон, когда он образует HA, а если его протон сильно связан, , тогда HA должна быть слабой кислотой . Мы пришли к выводу, что сила основания обратно пропорциональна силе его сопряженной кислоты, т.е.е. сильные кислоты имеют слабые сопряженные основания и наоборот .
Рассмотрим следующую кислотно-щелочную реакцию.
HA + B 1− A 1− + HB
Если HA является более сильной из двух кислот, то A 1– должно быть более слабым из двух оснований из-за обратной зависимости между силой сопряженной кислоты и основания. Это означает, что более сильная кислота всегда находится на той же стороне химического уравнения, что и более сильное основание . Точно так же более слабая кислота и основание также находятся на одной стороне
уравнение.Следовательно, в кислотно-основных реакциях Бренстеда есть только три возможных комбинации:1
более сильная кислота + более сильное основание → более слабое основание + более слабая кислота
2
реагируя и производя кислоты сопоставимой силы и реагируя и производя основания сопоставимой силы
3
более слабая кислота + более слабое основание → более сильное основание + более сильная кислота
12.4-2. Степень как функция относительной силы кислоты
Если реагирующая кислота является более сильной кислотой, то реагирующее основание является более сильным основанием, и реакция протекает широко.
•
Прямая реакция: более сильная кислота + более сильное основание обширно.
•
Обратная реакция: более слабая кислота + более слабое основание производит мало более сильной кислоты и основания.
•
Равновесие: почти исключительно более слабые кислота и основание, которые являются продуктами этого типа реакции.
•
Одиночная стрелка обычно используется для обозначения того, что в состоянии равновесия присутствует очень мало ограничивающего реагента.
Если силы кислот сравнимы, то концентрации веществ по обе стороны от равновесия сопоставимы.
•
Прямая реакция: умеренная кислота + умеренное основание дает умеренное количество продуктов.
•
Обратная реакция: умеренная кислота + умеренное основание дает умеренное количество реагентов.
•
Равновесие: умеренное количество всех видов.
•
Все виды присутствуют в значительных количествах в состоянии равновесия, поэтому реакция не является обширной, и следует использовать двойные стрелки.
Если реагирующая кислота намного слабее, чем полученная кислота, то образуется мало продукта.
•
Прямая реакция: более слабая кислота + более слабое основание производит мало более сильного основания и более сильной кислоты.
•
Обратная реакция: более сильная кислота + более сильное основание интенсивно реагируют с образованием более слабой кислоты и основания.
•
Равновесие: почти исключительно более слабые кислота и основание, которые являются реагентами в этом типе реакции.
•
Продукт мало, но образуется какой-то продукт, так как идет какая-то реакция, и при написании химического уравнения необходимо использовать двойные стрелки.
12.4-3. Упражнение по относительной кислотной силе
Упражнение 12.4:
Смешивают растворы, содержащие равные концентрации HA, A 1–, HB и B 1–.После реакции полученный раствор состоит почти из
исключительно HA и B 1– определяют относительную концентрацию кислоты и основания.12.4-4. Выражение константы равновесия
В равновесной смеси всегда преобладают более слабые кислота и основание.
Теперь мы исследуем равновесную смесь, которая получается в результате смешивания равных количеств HA и B 1– в зависимости от относительной силы кислоты HA и HB.Химическое уравнение: HA + B 1− A 1− + HB
Выражение константы равновесия: K =
HA >> HB;
К >> 1
Более сильная кислота Более сильная база Более слабое основание Более слабая кислота HA + B 1– → A 1– + HB В состоянии равновесия [A 1–] [HB] >> [HA] [B 1– ], поэтому K >> 1, что соответствует протяженной реакции.Примечание: A 1– — более слабое основание, а HB — более слабая кислота!
HA ~ HB;
К ~ 1
Кислота База База Кислота HA + B 1– A 1– + HB [A 1–] [HB] ~ [HA] [B 1– ] в равновесном состоянии, поэтому K ~ 1, когда вступающие в реакцию и образующиеся кислоты имеют одинаковую силу.
HA K
Более слабая кислота Более слабое основание Более сильная база Более сильная кислота HA + B 1– A 1– + HB В состоянии равновесия [HA] [B 1–] >> [A 1– ] [HB], поэтому K 1– является более слабым основанием.В каждом случае, когда силы кислоты сильно различаются, произведение равновесных концентраций более слабой кислоты и основания всегда намного больше, чем произведение концентраций более сильной кислоты и основания. То есть в равновесной смеси преобладают более слабые кислота и основание.
12.4-5. Одиночные и двойные стрелки
Одиночные стрелки иногда используются для обозначения обширной реакции. Условно предполагаем, что для таких реакций K > 1000.
Когда K >> 1, количество образующегося продукта можно определить без использования константы равновесия, поскольку равновесная концентрация по крайней мере одного из реагентов будет незначительной. Реакции этого типа часто обозначаются одиночными стрелками (→), а не двойными стрелками равновесия, чтобы подчеркнуть, что обратная реакция происходит лишь в незначительной степени.
Хотя значение K , при котором обратная реакция может быть проигнорирована, зависит от концентраций реагентов, в наших обсуждениях мы будем использовать значение ~ 1000.Таким образом, одну стрелку можно использовать для реакций, в которых
K> ~ 1000.
Если K, обратная реакция не может быть проигнорирована, и значение K должно использоваться при определении количества образующегося продукта. Уравнения для реакций этого типа следует писать двойными стрелками (), чтобы подчеркнуть важность обратной реакции. Пример каждого случая приведен в следующей таблице.
HF + ClO 1− → F 1− + HOCl
K = [F 1–] [HOCl] [HF] [OCl 1–] = 2 × 10 4
K >> 1 so, Реакция (или перенос протона) обширная.
Реагирующая кислота (HF) является намного более сильной кислотой, чем полученная кислота (HClO).
Равновесные концентрации F 1– и HClO намного больше, чем концентрации HF + OCl 1–.
Реакция часто пишется одной стрелкой.
HF + NO 2 1− F 1− + HNO 2 K = [F 1–] [HNO 2 ] [HF] [NO 2 1–] = 2
K ~ 1 так, Реакция не является экстенсивной ни в одном направлении.
Сила реагирующих и получаемых кислот сопоставимы.
Равновесные концентрации реагентов и продуктов близки.
Реакция написана двойными стрелками.
HCN + F 1− CN 1− + HF K Прямая реакция не является обширной, но обратная реакция обширна.
Реагирующая кислота (HCN) намного слабее, чем полученная кислота (HF).1+ для NH 4 1+ .)
HOCl + CN 1– OCl 1– + HCN K ~ 100
Кислотно-основные реакции с участием воды
12.4-7. Роль воды
Все остальные кислотно-основные реакции в этой главе протекают в воде, которая может действовать как кислота и основание. Таким образом, реакция с водой является важным аспектом кислотно-щелочной химии. Общая реакция кислоты и воды может быть представлена следующим образом.HA + H 2 O A 1− + H 3 O 1+
•
Сильные кислоты : Сильные кислоты интенсивно реагируют с водой. Чтобы реакция была обширной, ГК должна быть более сильной кислотой, чем H 3 O 1+ . Другими словами, любая кислота, более сильная, чем ион гидроксония, считается сильной кислотой.
•
Слабые кислоты : Слабые кислоты не сильно реагируют с водой.Таким образом, слабые кислоты являются более слабыми кислотами, чем ионы H 3 O 1+ .
12.4-8. Сильные кислоты в воде
Сильные кислоты представлены как H 3 O 1+ в кислотно-основных реакциях в воде.
Сильные кислоты — это кислоты, которые сильнее, чем H 3 O 1+ . Таким образом, их реакция с водой — это реакция, при которой реагирующая кислота сильнее, чем полученная кислота, т.е.е. реакция настолько обширна, что обычно записывается одной стрелкой. Обычными сильными кислотами являются HClO 4 , HCl, HBr, HI, HNO 3 и H 2 SO 4 . Ион гидроксония является самой сильной кислотой, которая может существовать в воде, потому что любая кислота, более сильная, чем гидроксоний, активно взаимодействует с водой с образованием иона гидроксония. Этот эффект известен как выравнивающий эффект , потому что сила сильных кислот уравновешена с силой иона гидроксония. Благодаря выравнивающему эффекту все сильные кислоты представлены H 3 O 1+ в кислотно-основных реакциях в воде.
Конъюгированные основания сильных кислот слишком слабы, чтобы реагировать как основания Бренстеда в водном растворе. Таким образом, ионы ClO 4 1–, Cl 1– , Br 1–, I 1– и NO 3 1– следует рассматривать как ионы-зрители в водном растворе Бренстеда. Кислотно-основные реакции . HSO 4 1– не реагирует в воде как основание Бренстеда, но может реагировать как слабая кислота.Соляная кислота, которая представляет собой водный раствор HCl, является сильной кислотой, но в растворе соляной кислоты практически отсутствуют молекулы HCl, поскольку указанная выше реакция настолько обширна. Ион гидроксония — сильная кислота, но хлорид-ион — настолько слабое основание Бренстеда, что им можно пренебречь в кислотно-основных реакциях Бренстеда. Следовательно, соляная кислота представлена как ионы H 3 O 1+ + Cl 1– в водных растворах.
12.4-9. Слабые кислоты в воде
Слабые кислоты представлены формулой кислоты, а не H 3 O 1+ в кислотно-основных реакциях.
Слабые кислоты — это кислоты более слабые, чем H 3 O 1+ . Таким образом, их реакция с водой — это реакция, в которой полученная кислота сильнее, чем реагирующая кислота, то есть следующая реакция не является обширной.
HA + H 2 O A 1− + H 3 O 1+
Обратная реакция между ионом гидроксония и сопряженным основанием слабой кислоты является экстенсивной реакцией, поэтому K Реакции обозначены двойными стрелками, чтобы подчеркнуть важность обратной реакции.Концентрация HA намного выше, чем у A 1– или H 3 O 1+ в растворе слабой кислоты. Следовательно, слабые кислоты представлены формулой кислоты, а не H 3 O 1+ в кислотно-основных реакциях. Пример плавиковой кислоты рассмотрен ниже.
Ион гидроксония является гораздо более сильной кислотой, чем HF, поэтому обратная реакция намного шире, чем прямая. Следовательно, ионы K 3O 1+ , поэтому раствор представлен HF, а не H 3 O 1+ .
12.4-10. Базы в воде
Все анионы являются основаниями, потому что анион всегда может принять протон.
Вода также используется в качестве эталонной кислоты при определении относительной силы оснований. Реакцию основания (A 1–, сопряженное основание HA) с водой можно представить следующим образом: A 1– + H 2 O HA + OH 1– .
•
Strong Bases : A 1– является сильным основанием, если указанная выше реакция является обширной, что имеет место, когда основание является более сильным основанием, чем гидроксид-ион.
•
Слабые основания : A 1– является более слабым основанием, чем гидроксид-ион, поэтому он не вступает в интенсивную реакцию с водой.
O 2– и NH 2 1– являются прочными основаниями. Однако OH 1– является самым сильным основанием, которое может существовать в воде, поскольку указанная выше реакция протекает широко, когда A 1– является сильным основанием. Гидроксиды металлов являются наиболее распространенными сильными основаниями. Все анионы являются основаниями, потому что анион всегда может принять протон.Однако некоторые основания являются молекулярными, и ниже рассматривается общий пример аммиака.
NH 3 + H 2 O NH 4 1+ + OH 1−
Вышеупомянутая реакция не является обширной в прямом направлении, что показано с помощью двойных стрелок, поскольку аммиак является слабым основанием. Только около 1% молекул NH 3 в типичном водном растворе реагирует с водой с образованием NH 4 1+ + OH 1–, поэтому водный раствор аммиака представлен как NH 3 .
12,5 Прочность кислот и щелочей
Введение
Мы теперь видели, что степень кислотно-щелочной реакции зависит от относительной силы реагирующих и образующихся кислот. В этом разделе мы покажем, как измеряется и заносится в таблицу относительная сила кислот.
Предварительные требования
Цели
•
Свяжите кислотную силу HA с прочностью связи H – A.
•
Объясните, почему сила кислоты HA также зависит от электроотрицательности A.
•
Предскажите более сильную из двух кислот с сопоставимой силой связи по электроотрицательности атома, с которым связан Н.
•
Оцените относительную силу ряда оксикислот (НОХ) на основе способности X снимать или отдавать электроны.
12,5-1. Сила сцепления
Знание относительной силы кислот реагирующих и образующихся кислот позволяет нам предсказать степень реакции, поэтому теперь мы исследуем факторы, которые определяют эти силы.Кислотная сила HA связана с легкостью разрыва связи H – A. Если связь H – A слабее, то HA легче отдает протон и является более сильной кислотой, но если связь сильнее, то она не отдает протон так легко и является более слабой кислотой. При прочих равных условиях можно сделать следующий вывод.
Если связь H – A сильная, то HA — слабая кислота.
Упражнение 12.1+ для NH 4 1+ .)
12.5-2. Разрыв связи
Энергии связи недостаточно для объяснения относительной силы кислоты, поскольку приведенные в таблице значения относятся к связям в газовой фазе, а не в растворе. Кроме того, связующая пара делится между связанными атомами, чтобы произвести атомы, а не ионы. Процесс энергии связи сравнивается с процессом растворения HF, HCl и CH 4 на рисунках 12.15a и 12.15b.
Обратите внимание, что связь H – C неполярна, поэтому она не может разорваться с образованием ионов, поэтому атомы водорода, присоединенные к углероду, не являются кислотными.Мы заключаем, что атом водорода должен быть присоединен к атому, который является более электроотрицательным, чем углерод, чтобы быть кислым .
12,5-3. Электроотрицательность
При разрыве связи H – A в кислотно-основной реакции образуются ионы, и образованию ионов способствует большая разница в электроотрицательности между связанными атомами. Таким образом, сила кислоты также увеличивается по мере увеличения электроотрицательности атома, с которым связан водород, .
Упражнение 12.7:
Вам даны следующие соединения и энергии связи с водородом.1+ для NH 4 1+ .)12,5-4. Сила оксокислоты
Оксокислоты — кислоты, в которых кислый водород присоединен к атому кислорода. Сила оксикислоты H – O – X зависит от прочности связи H – O. Все, что отнимает электронную плотность от связи Н – О, ослабляет связь и делает кислоту сильнее. Таким образом, сила кислоты увеличивается с увеличением электроотрицательности или степени окисления X.
•
Если X сильно электроотрицателен, он снимает электронную плотность связи O – H, что ослабляет связь и делает кислоту более сильной. Таким образом, H 2 SO 4 является более сильной кислотой, чем H 2 SeO 4 , потому что S более электроотрицательна, чем Se.
•
Способность X снимать электронную плотность с связи O – H также увеличивается с увеличением степени окисления. Таким образом, H 2 SO 4 является более сильной кислотой, чем H 2 SO 3 , потому что степень окисления S выше у H 2 SO 4 .
В таблице 12.7 мы рассматриваем четыре соединения с общим X – OH, где X = H, CH 3 , Cl и ClO. На атоме кислорода есть две неподеленные пары и протон, поэтому XOH может действовать как кислота или основание в зависимости от свойств X.
HOH H – O – H (вода) является одновременно очень слабой кислотой и очень слабым основанием. Фактически его кислотная и щелочная силы равны. HOCH 3 CH 3 групп являются электронодонорными, поэтому атом кислорода более богат электронами, чем в воде.Следовательно, CH 3 OH — лучшее основание, чем вода. В качестве альтернативы добавленная электронная плотность в связи O – H усиливает связь, что делает CH 3 OH более слабой кислотой, чем вода. HOCl Cl поглощает электроны и является более электроотрицательным, чем H. Удаление электронной плотности из OH имеет два эффекта: кислород не так богат электронами, поэтому HOCl является более слабым основанием, и связь O – H ослабляется, поэтому HOCl является более сильным кислота. Таким образом, HOCl — более сильная кислота и более слабое основание, чем вода. HOClO OClOH (HClO 2 ) — самая сильная кислота и самое слабое основание в этой группе. Это связано с тем, что дополнительный атом кислорода удаляет даже большую электронную плотность, чем одиночный Cl, поэтому он является более сильной кислотой, чем HOCl. В качестве альтернативы степень окисления Cl изменяется от +1 в HClO до +3 в HClO 2 . Увеличение степени окисления отнимает электронную плотность от ОН, что делает его более слабым основанием и более сильной кислотой. Таблица 12.7
12,5-5. Пример
Упражнение 12.8:
Используйте следующие правила, чтобы определить, является ли каждая из реакций обширной или нет.•
Обширные кислотно-основные реакции происходят, когда реагирующие кислота и основание намного сильнее, чем полученные кислота и основание.
•
Более сильная оксокислота — это та, у которой центральный атом является более электроотрицательным и / или находится в более высокой степени окисления.
12,6 Константа диссоциации кислоты,
K a
Введение
Степень кислотно-щелочной реакции зависит от силы реагирующих и образующихся кислот, а константы кислотной диссоциации кислот дают нам эти относительные силы.
Предварительные требования
Цели
•
Напишите выражение константы диссоциации кислоты для кислоты Аррениуса и химическое уравнение, к которому оно применяется.
•
Оцените относительную кислотную силу ряда аррениусовских кислот с учетом их констант кислотной диссоциации.
•
Напишите выражение константы диссоциации кислоты для кислоты Бренстеда и химическое уравнение, к которому оно применяется.
•
Оцените относительную кислотную силу ряда кислот Бренстеда с учетом их констант диссоциации кислоты.
•
Определите константу равновесия для кислотно-основной реакции по константам кислотной диссоциации реагирующих и образующихся кислот.
12.6-1. Определение Аррениуса
Кислоты Аррениуса ионизируются в воде, а не вступают с ней в реакцию. Следовательно, образуется H 1+ , а не H 3 O 1+ .
Кислота Аррениуса представляет собой вещество, которое содержит атомы H и образует H 1+ в воде, а основание Аррениуса представляет собой вещество, которое содержит ОН и производит ОН 1– в воде.Все кислоты и основания Аррениуса также являются кислотами и основаниями Бренстеда, но определение Бренстеда немного шире, поэтому не все кислоты и основания Бренстеда классифицируются как кислоты и основания Аррениуса. Например, NH 3 — это база Бронстеда, но не база Аррениуса.
Кислоты Аррениуса «ионизируются» в воде с образованием H 1+ , а не реагируют с ней с образованием H 3 O 1+ .
HA H 1+ + A 1−
Степень реакции определяется силой кислоты и измеряется константой равновесия, которая называется кислотной диссоциацией или константой кислотной ионизации и обозначается символом K a .
12.6-2. Brønsted
K a
Константа диссоциации кислоты, K a , является константой равновесия для реакции кислоты с водой.
Определение прочности кислоты по Бренстеду
Кислоты Бренстеда не диссоциируют в воде, они реагируют с ней, поэтому равновесная реакция становится HA + H 2 O H 3 O 1+ + A 1– .Константа равновесия реакции следующая.
Вода является растворителем и считается чистой жидкостью, поэтому она входит в выражение равновесия как 1 (единица). Обратите внимание, что это та же самая константа диссоциации ( K a ), что и для аррениусовских кислот, за исключением того, что H 3 O 1+ появляется вместо H 1+ , но H 3 O 1+ и H 1+ — это всего лишь два способа представления одного и того же вида в двух разных теориях.Важно помнить, что кислоты с большими значениями K a сильнее кислот с меньшими значениями K a , независимо от того, считается ли кислота кислотой Аррениуса или кислотой Бренстеда .
HCl — сильная кислота ( K a >> 1). В растворе 0,1 M HCl практически отсутствуют молекулы HCl. Обратной реакцией можно пренебречь при расчете концентрации H 3 O 1+ или Cl 1–, поскольку K a настолько велик.Следовательно, реакция обычно указывается одной стрелкой.
HCl + H 2 O → H 3 O 1+ + Cl 1− K a = = >> 1
HClO — слабая кислота. В растворе HClO 0,1 M [H 3 O 1+ ] = 10 –4 M . Обратная реакция важна при определении концентраций H 1+ и Cl 1–, поэтому двойные стрелки равновесия используются при написании уравнения K a .HClO + H 2 O H 3 O 1+ + ClO 1− K a = = 3,5 × 10 −8
H 2 SO 3 — слабая дипротонная (содержит два протона) кислота. В растворе 0,1 M H 2 SO 3 , [H 3 O 1+ ] = 0,04 M . Важность обратной реакции обозначена двойными стрелками. Обратите внимание, что только один протон удаляется в уравнении K a .Сопряженное основание H 2 SO 3 представляет собой HSO 3 1–, которое также является кислотой со своим собственным K a (1,0 × 10 –7 ).
H 2 SO 3 + H 2 O H 3 O 1+ + HSO 3 1− K a = = 1,5 × 10 −2
HS 1– — очень слабая кислота. В растворе 0,1 M HS 1–, [H 3 O 1+ ] = 10 –7 M .HS 1− + H 2 O H 3 O 1+ + S 2− K a = = 1,3 × 10 −13
Ион гидроксония — самая сильная кислота, которая может существовать в воде. HCl — более сильная кислота, но она не может существовать в воде, потому что она так интенсивно реагирует с водой.
H 3 O 1+ + H 2 O H 2 O + H 3 O 1+ K a = = 1
12.6-3. Определение
K для кислотно-основной реакции
Константа равновесия для кислотно-основной реакции равна константе кислотной диссоциации реагирующей кислоты, деленной на константу полученной кислоты.
Константа равновесия для любой кислотно-основной реакции может быть определена из значений K a реагирующих и образовавшихся кислот, как показано в уравнении 12.1.
(12,1)
K =
K a реагирующей кислоты K a полученной кислоты Константа равновесия, K
Напомним, что мы пользуемся общим правилом, согласно которому кислотно-основные реакции, в которых K > ~ 1000, настолько обширны, что обратную реакцию можно не учитывать в расчетах, и их можно записывать с помощью одинарных стрелок. Это означает, что реагирующая кислота должна быть примерно в 1000 раз сильнее, чем полученная кислота, если кислотно-основная реакция считается настолько обширной, что обратная реакция может быть проигнорирована в расчетах.
12.6-4. Определение
K Упражнение
Упражнение 12.9:
Используйте следующие значения K, , и , чтобы ответить на вопросы.Кислота К a ВЧ 7,2 × 10 –4 HNO 2 4,0 × 10 –4 NH 4 1+ 5.1+ для NH 4 1+ .) Достаточно ли обширны следующие реакции, чтобы их можно было обозначить одной стрелкой?
12,6-5. Прогнозирование интенсивности упражнения
Упражнение 12.10:
Используйте следующие значения K a , чтобы определить константу равновесия для реакции каждой из кислот с ClO 1– и указать, можно ли использовать одну стрелку для описания реакции.Кислота К a База ВЧ 7,2 × 10 –4 Ф. 1– H 2 S 1.0 × 10 –7 HS 1– HClO 3,5 × 10 –8 ClO 1– HCN 4.0 × 10 –10 CN 1– HS 1– 1,3 × 10 –13 S 2– 12.7 Решения слабых оснований
Введение
Вода также является кислотой, поэтому она может реагировать со слабыми основаниями с образованием гидроксид-иона и сопряженной кислоты слабого основания.
12.7-1. Большинство анионов являются слабыми основаниями
Слабые основания реагируют с водой с образованием гидроксид-иона и их сопряженной кислоты.
Рассмотрим реакцию слабого основания гипохлорит-иона с водой: ClO 1– + H 2 O ( l ) HClO ( водн. ) + OH 1– .
Реакция основания с водой разрывает связь O – H в воде в процессе, называемом гидролизом. Наиболее слабые основания обнаруживаются в виде солей, поэтому соли, такие как KClO, NaF, KCN и LiNO 2 , все образуют основные растворы в воде, поскольку их анионы реагируют с водой с образованием гидроксид-иона.
Таблица кислотных оснований 12,8
Введение
Кислотно-основные реакции являются обширными, когда реагирующая кислота сильнее, чем полученная кислота. Сила кислоты измеряется константами кислотной диссоциации кислот. Объединив эти два факта, мы теперь можем написать уравнения кислотно-основных реакций и определить, являются ли они обширными.
Цели
•
Прогнозируйте, будут ли кислотно-основные реакции обширными, основываясь на положениях кислоты и основания в кислотно-основной таблице.
•
Определите реагенты, которые будут использоваться в общем уравнении кислотно-основной реакции.
•
Используйте таблицу кислотных оснований, чтобы написать уравнения кислотно-основных реакций и определить константу равновесия для реакции.
•
Решите, какой вариант кислотно-щелочной реакции лучше представить: одинарной или двойной стрелкой.
12.8-1. Использование кислотно-щелочной таблицы Видео
12,8-2. Использование кислотно-щелочной таблицы для записи химических уравнений
12,8-3. Кислотно-щелочной стол
Кислотно-основные реакции являются обширными, когда реагирующая кислота сильнее, чем полученная кислота, и относительные силы кислоты могут быть выведены из констант диссоциации кислоты. Следовательно, таблицы кислот и их значения K a являются общими. Кислотно-основная таблица, используемая в тексте, включает кислоту, ее K a и ее сопряженное основание.Таким образом, в таблице можно найти как реагенты, так и продукты кислотно-щелочной реакции.
Кислотно-основная таблица, используемая в этом тексте, дана в ресурсе «Кислотно-основная таблица». Он перечисляет кислоты в левом столбце, их K и s в центральном столбце и их сопряженные основания в правом столбце. Сила кислоты уменьшается, а сила основания увеличивается по мере продвижения по таблице. При таком расположении самая сильная кислота (HClO 4 ) помещается в левый верхний угол, а самое сильное основание (ион O 2–) — в нижний правый угол.Поэтому примите во внимание следующее.
Кислотно-основные реакции являются обширными, когда реагирующая кислота превышает (сильнее) полученную кислоту, указанную в таблице.
Следующие примеры показывают, как относительные положения кислоты и основания позволяют предсказать, будет ли кислотно-основная реакция обширной.
HA является более сильной кислотой, чем HB, поэтому в кислотно-щелочной таблице она находится выше HB. B 1– является более сильным основанием, чем A 1–, поэтому он находится ниже A 1– в кислотно-щелочной таблице.Реакция более сильной кислоты (НА) с более сильным основанием (B 1–) благоприятна ( K > 1). Обратите внимание, что такое расположение гарантирует, что реагирующая кислота сильнее, чем полученная кислота. Если реагирующая кислота намного превышает реагирующее основание (или образовавшуюся кислоту), реакция настолько обширна, что ее можно записать одной стрелкой. Например,
HF + OH 1– → F 1– + H 2 O.
Реакция более слабой кислоты (HB) с более слабым основанием (A 1–) не является обширной.Обратите внимание, что реагирующая кислота ниже (слабее) полученной кислоты. Лишь небольшая часть кислоты превращается в сопряженное основание (B 1–), и только небольшая часть основания превращается в сопряженную кислоту (НА). Обратная реакция более сильной кислоты и основания важна для определения концентраций B 1– и HA, поэтому итоговое уравнение обычно записывается двойными стрелками. Например, HCN + F 1– CN 1– + HF.
12.8-4. Примеры кислотно-щелочной таблицы
Теперь мы используем кислотно-щелочную таблицу для написания химических уравнений кислотно-основных реакций, которые возникают при смешивании следующих растворов, и используем уравнение 12.1K =
K a реагирующей кислоты K a полученной кислоты для определения их констант равновесия. Мы используем относительные положения реагентов в таблице и константы равновесия, чтобы указать, являются ли реакции обширными.Помните, что сила кислоты увеличивается по мере роста таблицы, но сила основания увеличивается по мере продвижения по таблице. Просмотрите ресурс «Таблица кислотно-щелочного баланса».
В воду барботируют газообразный хлористый водород.
Относительные положения реагентов и их значения K a из таблицы в ресурсах приведены на рисунке 12.17a. Обратите внимание, что реагентом является хлористый водород, а не соляная кислота, поэтому реагирующей кислотой является HCl. Тогда реагирующей основой является вода. Продуктами реакции являются Cl 1–, сопряженное основание реагирующей кислоты, и H 3 O 1+ , сопряженная кислота реагирующего основания.Кислота находится выше основания, поэтому ожидаем благоприятной реакции. Обратите внимание, что значения K a сильных кислот даны просто как Уравнение 12.1K =
K a реагирующей кислоты K a произведенной кислоты , чтобы определить, что значение константы равновесия очень велико, поэтому следует использовать одну стрелку. Таким образом, растворение
HCl ( г )
в воде дает соляную кислоту, которая представляет собой раствор ионов гидроксония и хлорида.
Смешанные растворы синильной кислоты и нитрита калия.
Мы идентифицируем HCN как реагирующую кислоту, K 1+ как ион-наблюдатель и ион NO 2 1– как реагирующее основание. Реагенты и их значения K и , определенные из кислотно-щелочной таблицы, приведены на рисунке 12.17b. Реагирующая кислота находится ниже реагирующего основания, поэтому ожидается небольшой перенос протона. Используя уравнение 12.1K =
K a реагирующей кислоты K a полученной кислоты , мы определяем, что константа равновесия составляет всего 1,0 × 10 –6 , поэтому образуется очень мало продукта и двойные стрелки должны быть использованы в химическом уравнении.
К соляной кислоте добавляют раствор гипохлорита калия.
Мы идентифицируем ион K 1+ как ион-спектатор и ион ClO 1– как реагирующее основание.HCl выравнивается до H 3 O 1+ + Cl 1– в воде, поэтому H 3 O 1+ является реагирующей кислотой, а Cl 1– также является ионом-наблюдателем. Мы извлекаем реагирующие кислоту и основание из кислотно-щелочной таблицы, как показано на рисунке 12.17c. Кислота находится значительно выше основания, поэтому ожидается интенсивный перенос протона, и, используя уравнение 12.1K =
K a реагирующей кислоты K a полученной кислоты , мы определяем, что К = 2.9 × 10 7 . Таким образом, реакцию можно записать одной стрелкой.
Аммиак добавлен в воду.
Мы идентифицируем NH 3 как реагирующее основание и H 2 O как реагирующую кислоту. Относительные положения и значения K a реагентов, как указано в кислотно-щелочной таблице, показаны на рисунке 12.17d. Основание намного выше кислоты, поэтому ожидается небольшой перенос протона. Действительно, К = 1.8 × 10 –5 для реакции, поэтому для реакции этого слабого основания с водой следует использовать двойные стрелки.
Плавиковая кислота добавляется к раствору сероводорода калия.
HF — реагирующая кислота, а K 1+ — ион-наблюдатель. Ион HS 1– имеет протон и является анионом, поэтому он может вести себя как кислота или основание, но HF не будет реагировать с другой кислотой, поэтому HS 1– является реагирующим основанием в этой реакции. .Кислота находится выше основания, поэтому перенос является благоприятным с константой равновесия 7,2 × 10 3 , поэтому в итоговом уравнении можно использовать единственную стрелку, чтобы показать, что практически весь по крайней мере один из реагентов исчезает.
12,8-5. Идентификация реагентов
Идентификация реагирующих частиц — это первое, что вы должны сделать при написании чистого ионного уравнения для кислотно-основного уравнения. Помните следующее:
•
Сильные кислоты записываются как H 3 O 1+ , а слабые кислоты — как формула кислоты.
•
Большинство оснований и некоторые кислоты являются анионами, но обычно встречаются в виде солей. Однако в этих случаях катион обычно является ионом-наблюдателем. Таким образом, основанием в растворе KF является ион F 1–.
•
NH 4 1+ представляет собой кислоту, но обычно встречается в виде соли. Будьте осторожны с анионом, потому что анионы также являются основаниями. Если анион является сопряженным основанием сильной кислоты, он является ионом-наблюдателем в кислотно-основной реакции, в противном случае анион может быть реакционноспособным основанием.
•
Анионы с кислотными протонами, такие как HSO 3 — , являются амфипротонными. Они ведут себя как кислоты в присутствии оснований, но действуют как основания в присутствии кислот.
Упражнение 12.11:
Укажите, как реагирующие кислоты и основания будут представлены в чистых ионных уравнениях для кислотно-основных реакций, которые происходят при смешивании следующих растворов. См. Ресурс «Таблица кислотно-щелочного баланса».1+ для NH 4 1+ .)азотная кислота и сульфид калия
хлорид аммония и цианид натрия
карбонат натрия и плавиковая кислота
аммиак и хлорная кислота
12,8-6.).1+ для NH
4 1+ .)
12,9
p H и p K a
Введение
Концентрация ионов гидроксония является важным свойством водного раствора, но она может быть очень маленькой, поэтому ее часто задают на p-шкале, чтобы избежать записи показателей степени.
Цели
•
Напишите выражение для константы ионного произведения воды и укажите ее значение при 25 ° C.
•
Определите концентрацию иона гидроксония (или гидроксида) в водном растворе с учетом концентрации иона гидроксида (или гидроксония).
•
Определите p K a и определите относительную концентрацию кислоты на основе кислоты p K a .
12.9-1. Константа ионного продукта воды
Вода является одновременно очень слабой кислотой и очень слабым основанием, поэтому она может реагировать сама с собой.H 2 O + H 2 O H 3 O 1+ + OH 1−
Помните, что вода является растворителем и рассматривается как чистая жидкость, поэтому она входит в выражение равновесия как единица, чтобы получить следующее выражение константы равновесия.
(12,2)
K w = [H 3 O 1+ ] [OH 1−] = 1,0 × 10 −14
Ионный продукт воды
Константа равновесия для реакции называется константой продукта ионов воды и обозначается символом K w .Значение, указанное для константы равновесия, соответствует значению при 25 ° C. Уравнение 12.2 может использоваться для определения либо [H 3 O 1+ ], либо [OH 1–], если другое известно.
В чистой воде концентрации гидроксония и гидроксид-иона одинаковы, поскольку они производятся в соотношении 1: 1 из воды. Следовательно, в чистой воде при 25 ° C верно следующее.
(12,3)
[H 3 O 1+ ] = [OH 1−] = (K w ) 1/2 = 1.0 × 10 −7 M
Концентрации в чистой воде
Решения, для которых справедливо уравнение 12.3, называются нейтральными; растворы, в которых [H 3 O 1+ ]> [OH 1– ], называются кислотными; и растворы, в которых [H 3 O 1+ ] 1–] называются основными или щелочными.
12.9-2. pH
Концентрация ионов гидроксония является важной характеристикой раствора, но обычно это небольшое количество.Чтобы избежать использования экспонент при обсуждении концентраций ионов гидроксония, мы определяем pH .
Показатель степени [H 3 O 1+ ] обычно отрицательный, поэтому знак log [H 3 O 1+ ] обычно отрицательный. Отрицательный знак в уравнении 12.4 означает, что значение pH обычно положительное. Из-за отрицательного знака высокий pH означает низкую концентрацию ионов гидроксония, а низкий pH подразумевает высокую концентрацию ионов гидроксония.Уравнение 12.2
K w = [H 3 O 1+ ] [OH 1−] = 1.0 × 10 −14
может быть преобразовано следующим образом, чтобы показать, как концентрация ионов гидроксония и, следовательно, может быть определен pH основного раствора.
Уравнение 12.5 показывает, что растворы с высокими концентрациями гидроксид-ионов имеют низкие концентрации ионов гидроксония, поэтому высокий pH также подразумевает высокую концентрацию гидроксид-иона, а низкий pH подразумевает низкую концентрацию гидроксид-иона.Нейтральный раствор — это раствор, в котором
[H 3 O 1+ ] = [OH 1−] = 1,0 × 10 −7 M,
, поэтому pH нейтрального раствора определен как
. pH = −log (1,0 × 10 −7 ) = 7,0.
Концентрация иона гидроксония больше в кислом растворе, поэтому pH кислого раствора меньше 7,0. Концентрация иона гидроксония меньше в щелочном растворе, поэтому pH основного раствора больше 7,0. Эти выводы приведены в следующей таблице.
pH раствора Тип решения выше 7 базовый равно 7 нейтральный ниже 7 кислая Таблица 12.8: Тип раствора в зависимости от pH
12.9-3. Упражнение по концентрации ионов гидроксония
Упражнение 12.13:
Какова концентрация ионов гидроксония в следующих растворах? Используйте электронный формат для экспонент:1 × 10 –4 = 1e – 04.
12.9-4. pH упражнения
Упражнение 12.14:
Что такое pH, если [H 3 O 1+ ] = 1,3 × 10 –5 M ?
Каков pH 0,10 M HCl?
Каков pH раствора 0,022 M Ba (OH) 2 ? Подсказка: концентрация гидроксид-иона не
0,022 M .
12.9-5. п
К а
Высокое значение p K a означает слабую кислоту.
K a кислоты является обычно используемым свойством кислот, поскольку оно описывает силу кислоты, но его часто называют p K a , чтобы избежать использования отрицательных показателей степени при обсуждении сила кислоты.P K a кислоты является отрицательным логарифмом по основанию 10 от K a .
Кислоты с высоким значением p K a s являются слабыми кислотами из-за отрицательного знака в определении p K a . В следующей таблице перечислены некоторые кислоты, их K a s и их p K a s.
Кислота К a p K a ВЧ 7.2 × 10 –4 3,14 HOCl 3,5 × 10 –8 7,46 HCN 4,0 × 10 –10 9,40 Стол 12.9
Обратите внимание, что p K a увеличивается с уменьшением силы кислоты.
12.9-6. p
K a Упражнение
Упражнение 12.15:
Раствор 0,1 M какой из следующих кислот имеет более высокий pH?
12.9-7. Выбор раствора с помощью упражнения на более низкое значение pH
Упражнение 12.16:
Укажите раствор в каждой паре с более низким pH.
12.10 Упражнения и решения
Выберите ссылки, чтобы просмотреть либо упражнения в конце главы, либо решения нечетных упражнений.
15,2 Кислоты и основания Льюиса — химия
Цели обучения
К концу этого раздела вы сможете:
- Объясните модель кислотно-щелочной химии Льюиса
- Напишите уравнения образования аддуктов и комплексных ионов
- Выполнение расчетов равновесия с учетом констант формации
В 1923 г.N. Льюис предложил обобщенное определение кислотно-основного поведения, в котором кислоты и основания идентифицируются по их способности принимать или отдавать пару электронов и образовывать координированную ковалентную связь.
Координатная ковалентная связь (или дативная связь) возникает, когда один из атомов в связи обеспечивает оба связывающих электрона. Например, координационная ковалентная связь возникает, когда молекула воды соединяется с ионом водорода с образованием иона гидроксония. Координационная ковалентная связь также возникает, когда молекула аммиака соединяется с ионом водорода с образованием иона аммония.Оба этих уравнения показаны здесь.
Кислота Льюиса — это любая разновидность (молекула или ион), которая может принимать пару электронов, а основание Льюиса — это любая разновидность (молекула или ион), которая может отдавать пару электронов.
Кислотно-основная реакция Льюиса происходит, когда основание отдает пару электронов кислоте. Образуется кислотно-основной аддукт Льюиса , соединение, которое содержит координационную ковалентную связь между кислотой Льюиса и основанием Льюиса.Следующие уравнения иллюстрируют общее применение концепции Льюиса.
Атом бора в трифториде бора, BF 3 , имеет только шесть электронов в валентной оболочке. Из-за недостатка предпочтительного октета BF 3 является очень хорошей кислотой Льюиса и реагирует со многими основаниями Льюиса; фторид-ион является основанием Льюиса в этой реакции, отдавая одну из своих неподеленных пар:
В следующей реакции каждая из двух молекул аммиака, оснований Льюиса, отдает пару электронов иону серебра, кислоте Льюиса:
Оксиды неметаллов действуют как кислоты Льюиса и реагируют с ионами оксидов, основаниями Льюиса, с образованием оксианионов:
Многие кислотно-основные реакции Льюиса представляют собой реакции замещения, в которых одно основание Льюиса замещает другое основание Льюиса из кислотно-основного аддукта или в которых одна кислота Льюиса замещает другую кислоту Льюиса:
Последняя реакция замещения показывает, как реакция кислоты Бренстеда-Лоури с основанием вписывается в концепцию Льюиса. {\; \; +} [/ latex] .{\; \; 2 -} (водн.) [/ Латекс]
Комплексный ион состоит из центрального атома, обычно катиона переходного металла, окруженного ионами или молекулами, называемыми лигандами . Эти лиганды могут быть нейтральными молекулами, такими как H 2 O или NH 3 , или ионами, такими как CN — или OH —. Часто лиганды действуют как основания Льюиса, отдавая пару электронов центральному атому. Лиганды собираются вокруг центрального атома, создавая новый ион с зарядом, равным сумме зарядов, и, чаще всего, ион переходного металла.Это более сложное расположение является причиной того, что образующийся ион называется комплексным ионом . Сложный ион, образующийся в этих реакциях, невозможно предсказать; это должно быть определено экспериментально. Типы связей, образующихся в сложных ионах, называются координационными ковалентными связями, поскольку электроны лигандов делятся с центральным атомом. По этой причине комплексные ионы иногда называют координационными комплексами. Это будет более подробно изучено в следующих главах.
Константа равновесия для реакции компонентов комплексного иона с образованием комплексного иона в растворе называется константой образования ( K f ) (иногда называемой константой стабильности).2} [/ латекс]
Обратной константе образования является константа диссоциации ( K d ) , константа равновесия для разложения комплексного иона на его компоненты в растворе. В упражнениях этого раздела мы будем работать с константами диссоциации. В Приложении К и Таблице 2 приведены таблицы констант формации. В целом, чем больше константа образования, тем стабильнее комплекс; однако, как и в случае значений K sp , необходимо учитывать стехиометрию соединения.{3 -} [/ латекс]
7 × 10 19 Таблица 2. Общие комплексные ионы при уменьшении констант состава В качестве примера растворения путем образования комплексных ионов давайте рассмотрим, что происходит, когда мы добавляем водный раствор аммиака к смеси хлорида серебра и воды. 2} = 1.{\; \; +} (водн.) [/ латекс]
Мы записываем равновесие как реакцию образования, потому что в Приложении K перечислены константы образования сложных ионов. Перед установлением равновесия коэффициент реакции больше константы равновесия [ K f = 1,7 × 10 7 , и [латекс] Q = \ frac {0.10} {0 \; \ times \; 0} [/ латекс], он бесконечно велик], поэтому реакция смещается влево, чтобы достичь равновесия.
- Определите x и равновесные концентрации.{\; \; +}] = 0,10 \; — \; x = 0,10 \; — \; 0,0011 = 0,099 [/ латекс]
Концентрация свободного иона серебра в растворе составляет 0,0011 M .
- Проверить работу. Значение Q , вычисленное с использованием равновесных концентраций, равно K f в пределах ошибки, связанной со значащими цифрами в вычислении.
Проверьте свои знания
Рассчитайте концентрацию ионов серебра [Ag + ] в растворе, приготовленном путем растворения 1.00 г AgNO 3 и 10,0 г KCN в воде, достаточной для получения 1,00 л раствора. (Подсказка: поскольку Q < K f , предположим, что реакция идет до завершения, затем вычислите [Ag + ], произведенное диссоциацией комплекса.)г. Льюис предложил определение кислот и оснований, основанное на способности атома или молекулы принимать или отдавать электронные пары. Кислота Льюиса — это разновидность, которая может принимать электронную пару, тогда как основание Льюиса имеет электронную пару, доступную для передачи в кислоту Льюиса.Комплексные ионы являются примерами кислотно-основных аддуктов Льюиса. В сложном ионе у нас есть центральный атом, часто состоящий из катиона переходного металла, который действует как кислота Льюиса, и нескольких окружающих их нейтральных молекул или ионов, называемых лигандами, которые действуют как основания Льюиса. Сложные ионы образуются за счет обмена электронными парами с образованием координированных ковалентных связей. Равновесная реакция, которая происходит при образовании комплексного иона, имеет связанную с ней константу равновесия, называемую константой образования, K f .Это часто называют константой стабильности, поскольку она представляет стабильность комплексного иона. Образование комплексных ионов в растворе может сильно повлиять на растворимость соединения переходного металла.
Химия: упражнения в конце главы
- При каких обстоятельствах образец твердого AgCl полностью растворяется в чистой воде?
- Объясните, почему добавление NH 3 или HNO 3 к насыщенному раствору Ag 2 CO 3 в контакте с твердым Ag 2 CO 3 увеличивает растворимость твердого вещества.
- Рассчитайте концентрацию ионов кадмия [Cd 2+ ] в растворе, приготовленном путем смешивания 0,100 л 0,0100 M Cd (NO 3 ) 2 с 1,150 л 0,100 NH 3 ( водн. ).
- Объясните, почему добавление NH 3 или HNO 3 к насыщенному раствору Cu (OH) 2 в контакте с твердым Cu (OH) 2 увеличивает растворимость твердого вещества.
- Иногда равновесия для комплексных ионов описывают в терминах констант диссоциации, K d .{\; \; 3 -} [/ латекс].
- Рассчитайте массу иона цианида калия, которую необходимо добавить к 100 мл раствора для растворения 2,0 × 10 –2 моль цианида серебра AgCN.
- Рассчитайте минимальную концентрацию аммиака, необходимую в 1,0 л раствора для растворения 3,0 × 10 –3 моль бромида серебра.
- Рулон 35-мм черно-белой фотопленки перед проявлением содержит около 0,27 г неэкспонированного AgBr. Какая масса Na 2 S 2 O 3 · 5H 2 O (пентагидрат тиосульфата натрия или гипо) в 1.{\; \; 3 -} [/ латекс] ( K f = 4,7 × 10 13 )?
- Мы видели вводное определение кислоты: кислота — это соединение, которое вступает в реакцию с водой и увеличивает количество присутствующего иона гидроксония. В главе, посвященной кислотам и основаниям, мы видели еще два определения кислот: соединение, которое отдает протон (ион водорода, H + ) другому соединению, называется кислотой Бренстеда-Лоури, а кислота Льюиса — это любая разновидность. который может принять пару электронов.{\; \; -} [/ латекс] в насыщенном растворе AgCN?
- В разбавленном водном растворе HF действует как слабая кислота. Однако чистый жидкий HF (точка кипения = 19,5 ° C) является сильной кислотой. В жидком HF HNO 3 действует как основание и принимает протоны. Кислотность жидкого HF может быть увеличена путем добавления одного из нескольких неорганических фторидов, которые являются кислотами Льюиса и принимают ион F — (например, BF 3 или SbF 5 ). Напишите сбалансированные химические уравнения реакции чистой HNO 3 с чистым HF и чистого HF с BF 3 .
- Простейшей аминокислотой является глицин, H 2 NCH 2 CO 2 H. Общей чертой аминокислот является то, что они содержат функциональные группы: аминогруппу –NH 2 и карбоновую кислоту. группа, –CO 2 H. Аминокислота может функционировать как кислота или основание. Для глицина сила кислоты карбоксильной группы примерно такая же, как у уксусной кислоты, CH 3 CO 2 H, а сила основания аминогруппы немного больше, чем у аммиака, NH 3 .{\; \; -} [/ latex] группы.)
- Борная кислота, H 3 BO 3 , не является кислотой Бренстеда-Лоури, а является кислотой Льюиса.
(a) Напишите уравнение его реакции с водой.
(b) Предскажите форму образовавшегося аниона.
(c) Какая гибридизация бора соответствует предсказанной вами форме?
Глоссарий
- комплексный ион
- ион, состоящий из центрального атома переходного металла и окружающих молекул или ионов, называемых лигандами
- координатная ковалентная связь
- (также дативная связь) связь, образующаяся, когда один атом обеспечивает оба электрона в общей паре
- константа диссоциации
- ( K d ) константа равновесия для разложения комплексного иона на его компоненты в растворе
- постоянная формации
- ( K f ) (также константа устойчивости) константа равновесия для образования комплексного иона из его компонентов в растворе
- Кислота Льюиса
- любые частицы, которые могут принимать пару электронов и образовывать координационную ковалентную связь
- Кислотно-основной аддукт Льюиса
- соединение или ион, которые содержат координированную ковалентную связь между кислотой Льюиса и основанием Льюиса
- База Льюиса
- любые частицы, которые могут отдавать пару электронов и образовывать координационную ковалентную связь
- лиганд
- молекула или ион, которые окружают переходный металл и образуют комплексный ион; лиганды действуют как основания Льюиса
Решения
Ответы на упражнения в конце главы по химии
1.Когда количество твердого вещества настолько мало, что насыщенный раствор не образуется
3. 8 × 10 –5 M
5. 5 × 10 23
7.
[Cd 2+ ] = 9,5 × 10 –5 M ; [CN –] = 3,8 × 10 –4 M
9. [Co 3+ ] = 3,0 × 10 –6 M ; [NH 3 ] = 1,8 × 10 –5 M
11. 1.{+} [/ латекс]; (б) Электронная и молекулярная формы одинаковы — обе тетраэдрические. (c) Тетраэдрическая структура соответствует гибридизации sp 3 .
кислот и оснований (предыдущая версия) | Химия
Это более старая версия этого модуля. Доступна более новая версия модуля Acids and Bases I
На протяжении тысячелетий люди знали, что уксус, лимонный сок и многие другие продукты имеют кислый вкус. Однако только несколько сотен лет назад было обнаружено, почему эти вещества имеют кислый вкус — потому что все они являются кислотами.Термин «кислота» происходит от латинского термина acere , что означает «кислый». Хотя существует много разных определений кислот и оснований, в этом уроке мы познакомим вас с основами кислотно-щелочной химии.
В семнадцатом веке ирландский писатель и химик-любитель Роберт Бойль впервые назвал вещества кислотами или основаниями (он назвал основания щелочами ) в соответствии со следующими характеристиками:
Кислоты кислый на вкус, вызывают коррозию. Металлы меняют лакмус (краситель, извлекаемый из лишайников) на красный и становятся менее кислыми при смешивании с основаниями.
Основы кажутся скользкими, меняют лакмусовый оттенок и становятся менее щелочными при смешивании с кислотами.
Пока Бойль и другие пытались объяснить, почему кислоты и основания ведут себя
как они это делают, первое разумное определение кислот и оснований
не будет предложено до 200 лет спустя.В конце 1800-х годов шведский ученый Сванте Аррениус предположил, что вода может растворять многие соединения, разделяя их на отдельные ионы.Аррениус
предположил, что кислоты — это соединения, которые содержат водород и могут
раствориться в воде, чтобы высвободить ионы водорода в раствор.
Например, соляная кислота (HCl) растворяется в воде следующим образом:HCl H 2 O → H + ( водн. ) + Класс — ( водн. ) Аррениус определил основания как вещества, которые растворяются в воде, высвобождая гидроксид-ионы (ОН-) в раствор.Например, типичным основанием согласно определению Аррениуса является гидроксид натрия (NaOH):
NaOH H 2 O → Na + ( водн. ) + ОН — ( водн. ) Определение кислот и оснований Аррениуса объясняет ряд вещей.Теория Аррениуса объясняет, почему все кислоты имеют сходные свойства друг с другом (и, наоборот, почему все основания похожи): потому что все кислоты выделяют H + в раствор (а все основания выделяют OH — ). Определение Аррениуса также объясняет наблюдение Бойля о том, что кислоты и основания противодействуют друг другу. Идея о том, что основание может ослабить кислоту и наоборот, называется нейтрализацией.
Нейтрализация
Как видно из уравнений, кислоты выделяют H +
в раствор и основы выпуск OH — .Если бы мы смешали
кислота и основание вместе, ион H + будет объединяться с OH —
ион для образования молекулы H 2 O, или обычная вода:Реакция нейтрализации кислоты основанием всегда будет давать воду и соль, как показано ниже:
Кислота База Вода Соль HCl + NaOH → H 2 O + NaCl HBr + КОН → H 2 O + KBr Хотя Аррениус помог объяснить основы химии кислот и оснований, к сожалению, его теории имеют пределы.Например, определение Аррениуса не объясняет, почему некоторые вещества, такие как обычная пищевая сода (NaHCO 3 ), могут действовать как основание, даже если они не содержат гидроксид-ионы.
В 1923 году датский ученый Йоханнес Бронстед и англичанин Томас Лоури опубликовали независимые, но похожие статьи, уточняющие теорию Аррениуса. По словам Бренстеда, «… кислоты и основания — это вещества, способные соответственно отщеплять или поглощать ионы водорода.«Определение Брёнстеда-Лоури расширило аррениусовскую концепцию кислот и оснований.
Определение кислот Бренстеда-Лоури очень похоже на определение Аррениуса: любое вещество, которое может отдавать ион водорода, является кислотой (согласно определению Бренстеда, кислоты часто называют донорами протона , потому что ион H + , водород минус его электрон, является просто протоном.
Определение Бренстеда оснований , однако, сильно отличается от определения Аррениуса.Основание Бренстеда определяется как любое вещество, которое может принимать ион водорода. По сути, основание противоположно кислоте. NaOH и KOH, как мы видели выше, по-прежнему будут считаться основаниями, потому что они могут принимать H + из кислоты с образованием воды. Однако определение Бренстеда-Лоури также объясняет, почему вещества, не содержащие OH — , могут действовать как основания. Пищевая сода (NaHCO 3 ), например, действует как основание, принимая ион водорода из кислоты, как показано ниже:
Кислота База Соль HCl + NaHCO 3 → H 2 CO 3 + NaCl В этом примере образовавшаяся углекислота (H 2 CO 3 ) подвергается быстрому разложению до воды и газообразного диоксида углерода, и поэтому раствор пузырится, как газ CO 2 .
pH
Согласно определению Бренстеда-Лоури, как кислоты, так и основания связаны с концентрацией присутствующих ионов водорода. Кислоты увеличивают концентрацию ионов водорода, а основания уменьшают концентрацию ионов водорода (принимая их). Следовательно, кислотность , или основность , чего-либо, может быть измерена по концентрации ионов водорода.
В 1909 году датский биохимик Сёрен Соренсен изобрел шкалу pH для измерения кислотности. Шкала pH описывается формулой:
pH = -log [H + ] Примечание. Обычно для сокращения концентрации используются квадратные скобки, таким образом [H + ] = концентрация ионов водорода.При измерении pH [H + ] выражается в молях H + на литр раствора. Например, раствор с [H + ] = 1 x 10 -7 моль / литр имеет pH, равный 7 (более простой способ думать о pH — это то, что он равен экспоненте H + концентрация, игнорируя знак минус). Шкала pH находится в диапазоне от 0 до 14. Вещества с pH от 0 до менее 7 являются кислотами (pH и [H + ] обратно пропорциональны — более низкий pH означает более высокий [H + ]).Вещества с pH от 7 до 14 являются основаниями (более высокий pH означает более низкий [H + ]). Прямо посередине, при pH = 7, находятся нейтральные вещества, например, чистая вода. Взаимосвязь между [H + ] и pH показана в таблице ниже вместе с некоторыми типичными примерами кислот и оснований в повседневной жизни.
[H + ] pH Пример Кислоты 1 Х 10 0 0 HCl 1 х 10 -1 1 Желудочная кислота 1 х 10 -2 2 Лимонный сок 1 x 10 -3 3 Уксус 1 x 10 -4 4 Сода 1 x 10 -5 5 Дождевая вода 1 x 10 -6 6 Молоко Нейтраль 1 х 10 -7 7 Чистая вода Базы 1 х 10 -8 8 Яичные белки 1 x 10 -9 9 Сода пищевая 1 x 10 -10 10 Тумс ® антацид 1 x 10 -11 11 Аммиак 1 x 10 -12 12 Минеральная известь — Ca (OH) 2 1 x 10 -13 13 Драно ® 1 x 10 -14 14 NaOH Сводка
Поскольку кислоты и основания были впервые обозначены и описаны в 17 веке, их определение на протяжении веков уточнялось, чтобы отразить возросшее понимание их химических свойств.



 В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами. По летучести.
По летучести. 
 , 22:25
, 22:25