Содержание
Побочный эффект — Журнал «Сибирская нефть» — №132 (июнь 2016)
Сера — неизбежный побочный продукт переработки углеводородов, который может приносить как прибыль, так и проблемы в силу своей экологической небезопасности. На Московском нефтеперерабатывающем заводе эти проблемы были решены за счет модернизации установки производства серы, которая позитивно повлияла и на экономическую составляющую процесса
Сера — распространенный химический элемент и встречается во многих полезных ископаемых, в том числе в нефти и природном газе. При переработке углеводородного сырья сера становится побочным продуктом, от которого нужно каким-то образом избавляться, а в идеале сделать источником получения дополнительной прибыли. Осложняющий ситуацию фактор — неэкологичность этого вещества, требующая особых условий его хранения и транспортировки.
В масштабах мирового рынка объемы серы, производимые при переработке нефти и газа,приме рно равны и в общей сложности составляют около 65 %. Еще почти 30 % приходится на отходящие газы цветной металлургии. Небольшая оставшаяся доля — это непосредственная разработка месторождений серы и добыча пиритов*. В 2014 году в мире было произведено 56 млн тонн серы, при этом эксперты прогнозируют рост этого показателя к 2017–2018 годам за счет ввода в эксплуатацию новых крупных газовых месторождений в Средней Азии и на Ближнем Востоке.
Еще почти 30 % приходится на отходящие газы цветной металлургии. Небольшая оставшаяся доля — это непосредственная разработка месторождений серы и добыча пиритов*. В 2014 году в мире было произведено 56 млн тонн серы, при этом эксперты прогнозируют рост этого показателя к 2017–2018 годам за счет ввода в эксплуатацию новых крупных газовых месторождений в Средней Азии и на Ближнем Востоке.
Российский рынок серы можно считать значительно монополизированным: примерно 85 % сырья поставляется газоперерабатывающими предприятиями «Газпрома». Оставшаяся доля делится между «Норильским никелем» и нефтепереработкой. По данным Росстата, в 2015 году в России произведено примерно 6 млн тонн серы, что позволяет стране занимать десятую часть мирового рынка. Внутренний рынок профицитен: российские потребители (а это преимущественно производители удобрений) ежегодно закупают порядка 2–3 млн тонн серы, остальное идет на экспорт. При этом рынок потребителя также можно считать монопольным: около 80 % всей производимой в России жидкой серы закупают предприятия группы «ФосАгро», еще примерно 13 % отправляется другому производителю минудобрений — «ЕвроХиму». На экспорт идет только гранулированная и комовая сера (см. врез о видах серы).
На экспорт идет только гранулированная и комовая сера (см. врез о видах серы).
Виды товарной серы
Простая сера представляет собой светложелтое порошкообразное вещество. В природе сера может встречаться как в самородном кристаллическом виде, так и в различных соединениях, в том числе может присутствовать в природном газе и нефти. В настоящее время преимущественно выпускается три формы серы — комовая, жидкая и гранулированная. При выделении серы из газов получают жидкую (или расплавленную) серу. Ее хранят и транспортируют в обогреваемых резервуарах. Для потребителя транспорт жидкой серы более выгоден, чем ее плавление на месте. Достоинства жидкой серы — отсутствие потерь при транспортировке и хранении и высокая чистота. Недостатки — опасность возгорания, траты на обогрев цистерн.
При охлаждении жидкой серы получают комовую серу. Именно ее до начала 1970‑х годов преимущественно выпускали в СССР. Среди недостатков комовой серы: невысокое качество, потери на пыль и крошку при рыхлении и погрузке, опасность возгорания, низкая экологичность.
Гранулированную серу получают непосредственно из жидкой серы. Различные способы грануляции сводятся к разбиванию жидкости на отдельные капли с последующим их охлаждением и капсулированием.
Очевидно, что крупных потребителей интересует поставщик, способный полностью удовлетворить их спрос. «В этой ситуации небольшие производители, как правило, ищут покупателейсреди сос едних предприятий — это позволяет сэкономить на логистике и за счет этого повысить интерес к товару, — пояснил начальник управления нефтехимии и СУГ „Газпром нефти“ Захар Бондаренко. — Иногда сера, будучи побочным продуктом производства, и вовсе отдается за бесценок, лишь бы избавиться от небезопасного для хранения сырья».
Выбирая свою стратегию утилизации сероводорода, Московский нефтеперерабатывающий завод делал ставку на экологию, но смог учесть и финансовые интересы.
Без запаха и пыли
Реконструкция установки производства серы на МНПЗ стала частью проекта комплексной модернизации производства, направленной на улучшение экологических показателей завода. В 2014 году Московский НПЗ перешел на выпуск гранулированной серы — современного продукта, отвечающего самым строгим экологическим требованиям. В рамках реконструкции было обновлено оборудование установки, построен блок грануляции и блок доочистки отходящих газов.
В 2014 году Московский НПЗ перешел на выпуск гранулированной серы — современного продукта, отвечающего самым строгим экологическим требованиям. В рамках реконструкции было обновлено оборудование установки, построен блок грануляции и блок доочистки отходящих газов.
Значительные объемы сероводородосодержащих (кислых) газов на НПЗ получают в результате процесса каталитического крекинга, а также гидроочистки бензина и дизельного топлива от серы, изначально содержащейся в нефти. Сегодня эта проблема особенно актуальна: нефть становится все более сернистой, а экологические стандарты для топлива жестко ограничивают содержание этого элемента. Экологический класс «Евро-5», которому соответствует весь выпускаемый на МНПЗ бензин, подразумевает пятикратное снижение содержания серы в топливе по сравнению с «Евро-4», с 50 до 10 мг / кг.
Юрий Ерохин,
начальник управления охраны труда, промышленной безопасности и охраны окружающей среды МНПЗ
Для нефтеперерабатывающего производства установка получения серы — это в первую очередь воздухозащитный объект, позволяющий утилизировать сероводород без ущерба для окружающей среды.
После внедрения на МНПЗ современных технологий мы смогли полностью исключить выбросы сероводорода в атмосферу. Это не голословное утверждение. Нулевые выбросы подтверждаются и инструментальным контролем, который мы регулярно проводим в соответствии с законодательством силами независимой аккредитованной лаборатории. Фактически реконструкция установки получения серы позволила сократить объем выбросов на МНПЗ на 50 %. Это значимое достижение не только для завода, но для экологии всего региона. В то же время, перейдя на выпуск гранулированной серы и уйдя от производства комовой серы, мы смогли улучшить экологическую обстановку непосредственно на территории завода.
На установке получения серы сероводород сначала окисляют до диоксида серы, который затем при взаимодействии с тем же сероводородом в присутствии катализатора превращается в элементарную серу (процесс Клаусса). Однако, чтобы полностью утилизировать сероводород, надо не просто прогнать кислые газы через установку, но и произвести последующую дополнительную очистку. «В процессе модернизации установки мы поменяли 90 % оборудования, — рассказал куратор установки получения серы Владимир Суворкин. — Но одним из главных этапов проекта стало строительство блока доочистки отходящих газов. Новый блок доочистки позволяет минимизировать выбросы диоксида серы, а весь сероводород возвращать в технологический процесс. Таким образом, нам удалось увеличить степень извлечения серы более чем на 20 % — сейчас она достигает 90 %. При этом выбросы сероводорода полностью исключены».
«В процессе модернизации установки мы поменяли 90 % оборудования, — рассказал куратор установки получения серы Владимир Суворкин. — Но одним из главных этапов проекта стало строительство блока доочистки отходящих газов. Новый блок доочистки позволяет минимизировать выбросы диоксида серы, а весь сероводород возвращать в технологический процесс. Таким образом, нам удалось увеличить степень извлечения серы более чем на 20 % — сейчас она достигает 90 %. При этом выбросы сероводорода полностью исключены».
Другой важный экологический аспект — избавление от комовой серы — сыпучего материала, хранение которого неизбежно связано с образованием большого количества вредной пыли. Изначально установка производит жидкую серу, которую можно либо продать в жидком виде, либо охладить и превратить в комовую, либо гранулировать. «На старой установке существовали две серные ямы объемом 50 тонн каждая для хранения жидкой серы, — уточнил Владимир Суворкин. — Когда не было отгрузки жидкой серы, в ж / д или автоцистерны приходилось откачивать серу на склад и хранить уже в кристаллизованном комовом виде. С вводом нового узла (серной ямы) объемом 950 тонн от этой проблемы мы избавились». Часть жидкой серы сейчас продается одному из предприятий, расположенных в Московской области, остальное направляется на установку грануляции.
С вводом нового узла (серной ямы) объемом 950 тонн от этой проблемы мы избавились». Часть жидкой серы сейчас продается одному из предприятий, расположенных в Московской области, остальное направляется на установку грануляции.
Структура потребления серы в РФ
Товарная структура производства серы в РФ
в 2009-2015 гг., %
Структура рынка серы в РФ,
млн т.
В отличие от производства комовой серы, при грануляции практически не образуется пыли и запаха. Каждая гранула представляет собой полусферу размером от 2 до 5 мм и находится в полимерной оболочке, что предотвращает ее растворение. На выходе с конвейера готовая продукция фасуется в современную упаковку — герметичные мешки «биг-бэги». Такая упаковка полностью исключает контакт серы с окружающей средой.
На выходе с конвейера готовая продукция фасуется в современную упаковку — герметичные мешки «биг-бэги». Такая упаковка полностью исключает контакт серы с окружающей средой.
Транспортный узел
Конечно, грануляция серы — довольно сложный и затратный процесс, значительно увеличивающий себестоимость продукта. Избежать расходов на ввод в эксплуатацию дополнительного оборудования «Газпром нефть» могла бы при условии продажи на рынке всей производимой жидкой серы. Однако рассчитывать на это не приходится. Главная проблема российского рынка этого продукта на сегодня — дефицит цистерн, связанный с новым техрегламентом, обязывающим владельцев подвижного состава либо модернизировать устаревший подвижной состав, либо выводить его из эксплуатации. Владельцы цистерн предпочитают второй вариант, при этом вкладываться в производство новых цистерн никто не спешит. «В масштабах отечественного рынка серы МНПЗ — небольшой производитель, поэтому компании нет смысла тратиться на расширение собственного парка цистерн, — рассказал Захар Бондаренко. — Гораздо выгоднее оказалось гранулировать нереализованные остатки жидкой серы и продавать на внешние рынки, где всегда можно найти покупателя даже на небольшие объемы».
— Гораздо выгоднее оказалось гранулировать нереализованные остатки жидкой серы и продавать на внешние рынки, где всегда можно найти покупателя даже на небольшие объемы».
Установка получения серы
Модернизированная установка производства серы на Московском НПЗ включает в себя два блока получения серы, каждый из которых был реконструирован. Глубина извлечения серы на этих блоках достигает 96,6 %. Также установка снабжена блоком доочистки отходящих газов, что позволяет в конечном итоге извлекать 99,9 % серы. В новом узле отгрузки серы может одновременно храниться до 950 тонн жидкой серы, что полностью исключает необходимость производства и хранения комовой серы. Помимо этого, в эксплуатацию был введен блок грануляции серы. Проектная мощность установки по жидкой дегазированной сере с учетом работы блока очистки отходящих газов составляет 94 тыс. тонн в год, а проектная мощность блока грануляции жидкой серы — 84 тыс. тонн в год, что полностью покрывает существующие потребности предприятия по утилизации сероводородосодержащих газов.
тонн в год, что полностью покрывает существующие потребности предприятия по утилизации сероводородосодержащих газов.
Если для российских потребителей гранулированная сера оказывается слишком дорогим продуктом, для переработки которого к тому же требуется дополнительное оборудование, то на внешних рынках спрос на гранулированную серу стабильно высок. Сегодня гранулированная сера Московского НПЗ поставляется более чем в десяток стран, в том числе в страны Латинской Америки, Африки и Юго-Восточной Азии. «В настоящее время гранулированная сера на мировом рынке постепенно вытесняет прочие ее товарные формы благодаря более высокому качеству (отсутствию примесей и загрязнений) и удобству транспортировки, — пояснила руководитель отдела рынков химической продукции исследовательской группы „Инфомайн“ Ольга Волошина. — В то же время на внутреннем рынке традиционно используют в основном жидкую серу. В ближайшей перспективе эта ситуация вряд ли изменится, поскольку для перехода производств на использование гранулированной серы вместо жидкой необходимо их переоборудование, в том числе создание сероплавильных мощностей. Это потребует дополнительных затрат, на которые мало кто пойдет в условиях экономического кризиса».
Это потребует дополнительных затрат, на которые мало кто пойдет в условиях экономического кризиса».
Перспективы и возможности
Несмотря на текущую востребованность серы на внешних рынках, эксперты очень осторожны в прогнозах развития этого направления. Мировой рынок сильно зависим от крупнейших импортеров, в первую очередь Китая, который в 2015 году ввез порядка 10 млн тонн серы. Однако развитие собственного производства постепенно снижает заинтересованность китайцев в импорте. Нестабильна ситуация и с другими значительными игроками. В этой связи уже несколько лет подряд «Газпром», как крупнейший экспортер, говорит о необходимости искать альтернативные рынки сбыта серы внутри страны. Таким рынком могла бы стать сфера дорожного строительства при условии активного внедрения новых материалов — сероасфальта и серобетона. Сравнительные исследования этих материалов показывают целый ряд их преимуществ, в частности экологическую безопасность, износостойкость, теплоустойчивость, трещиностойкость, стойкость к колееобразованию. «Несмотря на создание опытных партий тротуарной плитки из серобетона, а также покрытие участков дорог сероасфальтом, массового промышленного производства этих строительных материалов пока налажено не было, — констатировала Ольга Волошина. — Разработчики объясняют это отсутствием нормативно-технической базы, регламентирующей требования к такого вида материалам, а также к технологиям устройства дорожного покрытия».
«Несмотря на создание опытных партий тротуарной плитки из серобетона, а также покрытие участков дорог сероасфальтом, массового промышленного производства этих строительных материалов пока налажено не было, — констатировала Ольга Волошина. — Разработчики объясняют это отсутствием нормативно-технической базы, регламентирующей требования к такого вида материалам, а также к технологиям устройства дорожного покрытия».
Пока в «Газпроме» ведется работа над долгосрочной целевой программой создания и развития в РФ подотрасли промышленности строительных и дорожно-строительных материалов на основе серного вяжущего. В свое время в компании говорили о целесообразности размещения производства таких материалов в регионах с высоким уровнем дорожного строительства и наличием сырья. Тогда в качестве потенциальной сырьевой и производственной базы назывался Московский НПЗ. Правда, пока таких проектов в «Газпром нефти» нет.
Что такое Сера — фото, описание, свойства минерала, происхождение, месторождения
Сера (с лат.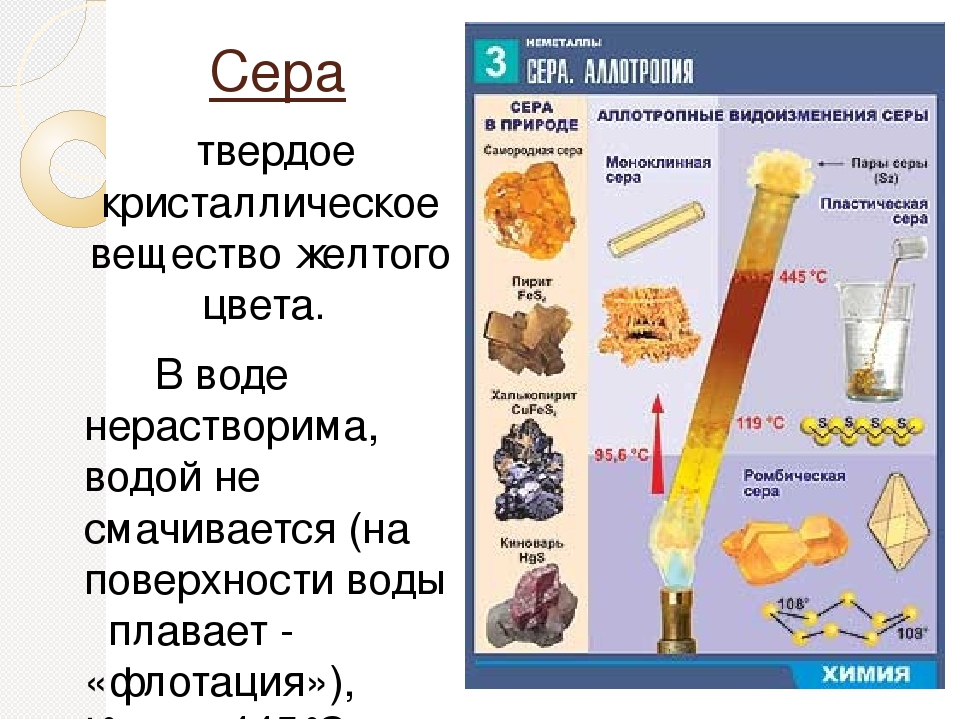 sērum «сыворотка») — минерал класса самородных элементов, неметалл. Латинское название связано с индоевропейским корнем swelp — «гореть». Химическая формула: S.
sērum «сыворотка») — минерал класса самородных элементов, неметалл. Латинское название связано с индоевропейским корнем swelp — «гореть». Химическая формула: S.
Физические свойства и фото серы
Сера в отличие от других самородных элементов имеет молекулярную решетку, что определяет ее низкую твердость (1,5-2,5), отсутствие спайности, хрупкость, неровный излом и обусловленный им жирный плеск; лишь на поверхности кристаллов наблюдается стеклянный блеск. Удельный вес 2,07 г/см3. Обладает плохой электропроводимостью, слабой теплопроводностью, невысокой температурой плавления (112,8°С) и воспламенения (248°С). Легко загорается от спички и горит голубым пламенем; при этом образуется сернистый газ, имеющий резкий удушливый запах. Цвет у самородной серы светло-жёлтый, соломенно-желтый, медово-желтый, зеленоватый; сера, содержащая органические вещества, приобретают бурую, серую, черную окраску. Вулканический сера ярко-желтая, оранжевая, зеленоватая. Местами обычно с желтоватым оттенком. Встречается минерал в виде сплошных плотных, натечных, землистых, порошковатых масс; также бывают наросшие кристаллы, желваки, налеты, корочки, включения и псевдоморфозы по органическим остаткам. Сингония ромбическая.
Встречается минерал в виде сплошных плотных, натечных, землистых, порошковатых масс; также бывают наросшие кристаллы, желваки, налеты, корочки, включения и псевдоморфозы по органическим остаткам. Сингония ромбическая.
Отличительные признаки: для самородной серы характерны: неметаллический блеск и то, что она загорается от спички и горит, выделяя сернистый газ, имеющий резкий удушливый запах. Наиболее характерным цветом для самородной серы является светло-желтый.
Разновидность:
Вулканит (селенистая сера). Оранжево-красного, красно-бурого цвета. Происхождение вулканическое.
- Моноклинная сера
- Кристаллическая сера
- Кристаллическая сера
- Селенистая сера — вулканит
Химические свойства серы
Загорается от спички и горит голубым пламенем, при этом образуется сернистый газ, имеющий резкий удушливый запах. Легко плавится (температура плавления 112,8° С). Температура воспламенения 248°С. Сера растворяется в сероуглероде.
Легко плавится (температура плавления 112,8° С). Температура воспламенения 248°С. Сера растворяется в сероуглероде.
Происхождение серы
Встречается самородная сера естественного и вулканического происхождений. Серобактерии живут в водных бассейнах, обогащенных сероводородом за счет разложения органических остатков, — на дне болот, лиманов, мелких морских заливов. Лиманы Черного моря и залив Сиваш являются примерами таких водоемов. Концентрация серы вулканического происхождения приурочена к жерлам вулканов и к пустотам вулканических пород. При вулканических извержениях выделяются различные соединения серы (H2S, SО2), которые окисляются в поверхностных условиях, что приводит к восстановлению ее; кроме того, сера возгоняется непосредственно из паров.
Иногда при вулканических процессах сера изливается в жидком виде. Это бывает тогда, когда сера, ранее осевшая на стенках кратеров, при повышении температуры расплавляется. Отлагается сера также из горячих водных растворов в результате распада сероводорода и сернистых соединений, выделяющихся в одну из поздних фаз вулканической деятельности. Эти явления сейчас наблюдаются около жерл гейзеров Йеллоустонского парка (США) и Исландии. Встречается совместно с гипсом, ангидритом, известняком, доломитом, каменной и калийной солями, глинами, битуминозными отложениями (нефть, озокерит, асфальт) и пиритом. Также встречается на стенках кратеров вулканов, в трещинах лав и туфов, окружающих жерла вулканов как действующих, так и потухших, вблизи серных минеральных источников.
Это бывает тогда, когда сера, ранее осевшая на стенках кратеров, при повышении температуры расплавляется. Отлагается сера также из горячих водных растворов в результате распада сероводорода и сернистых соединений, выделяющихся в одну из поздних фаз вулканической деятельности. Эти явления сейчас наблюдаются около жерл гейзеров Йеллоустонского парка (США) и Исландии. Встречается совместно с гипсом, ангидритом, известняком, доломитом, каменной и калийной солями, глинами, битуминозными отложениями (нефть, озокерит, асфальт) и пиритом. Также встречается на стенках кратеров вулканов, в трещинах лав и туфов, окружающих жерла вулканов как действующих, так и потухших, вблизи серных минеральных источников.
Спутники. Среди осадочных пород: гипс, ангидрит, кальцит, доломит, сидерит, каменная соль, сильвин, карналлит, опал, халцедон, битумы (асфальт, нефть, озокерит). В месторождениях, образовавшихся в результате окисления сульфидов, — главным образом пирит. Среди продуктов вулканического возгона: гипс, реальгар, аурипигмент.
Применение
Широко используется в химической промышленности. Три четверти добычи серы идет на изготовление серной кислоты. Применяется она также для борьбы с сельскохозяйственными вредителями, кроме того, в бумажной, резиновой промышленности (вулканизация каучука), в производстве пороха, спичек, в фармацевтике, стекольной, пищевой промышленности.
Месторождения серы
На территории Евразии все промышленные месторождения самородной серы поверхностного происхождения. Некоторые из них находятся в Туркмении, в Поволжье и др. Породы, содержащие серу, тянутся вдоль левого берега Волги от г. Самара полосой, имеющей ширину в несколько километров, до Казани. Вероятно, сера образовалась в лагунах в пермский период в результате биохимических процессов. Месторождения серы находятся в Раздоле (Львовская область, Прикарпатье), Яворовске (Украина) и в Урало-Эмбинском районе. На Урале (Челябинская обл.) встречается сера, образовавшаяся в результате окисления пирита. Сера вулканического происхождения имеется на Камчатке и Курильских островах. Основные запасы находятся в Ираке, США (штаты Луизиана и Юта), Мексике, Чили, Японии и Италии (о. Сицилия).
Основные запасы находятся в Ираке, США (штаты Луизиана и Юта), Мексике, Чили, Японии и Италии (о. Сицилия).
Сера. Химия серы и ее соединений
1. Положение серы в периодической системе химических элементов
2. Электронное строение атома серы
3. Физические свойства и нахождение в природе
4. Соединения серы
5. Способы получения
6. Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с галогенами
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6.1.5. Взаимодействие с водородом
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с окислителями
6.2.2. Взаимодействие с щелочами
Сероводород
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.
3.3. Восстановительные свойства
3.4. Взаимодействие с солями тяжелых металлов
Сульфиды
Способы получения сульфидов
Химические свойства сульфидов
Оксиды серы
1. Оксид серы (IV)
2. Оксид серы (VI)
Серная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация серной кислоты
3.2. Основные свойства серной кислоты
3.3. Взаимодействие с солями более слабых кислот
3.4. Разложение при нагревании
3.5. Взаимодействие с солями
3.6. Качественная реакция на сульфат-ионы
3.7. Окислительные свойства серной кислоты
Сернистая кислота
Соли серной кислоты – сульфаты
Сера
Положение в периодической системе химических элементов
Сера расположена в главной подгруппе VI группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д. И. Менделеева.
И. Менделеева.
Электронное строение серы
Электронная конфигурация серы в основном состоянии:
Атом серы содержит на внешнем энергетическом уровне 2 неспаренных электрона и две неподеленные электронные пары в основном энергетическом состоянии. Следовательно, атом серы может образовывать 2 связи по обменному механизму, как и кислород. Однако, в отличие от кислорода, за счет вакантной 3d орбитали атом серы может переходить в возбужденные энергетические состояния. Электронная конфигурация серы в первом возбужденном состоянии:
Электронная конфигурация серы во втором возбужденном состоянии:
Таким образом, максимальная валентность серы в соединениях равна VI (в отличие от кислорода). Также для серы характерна валентность — IV.
Степени окисления атома серы – от -2 до +4. Характерные степени окисления -2, 0, +4, +6.
Физические свойства и нахождение в природе
Сера образует различные простые вещества (аллотропные модификации).
Наиболее устойчивая модификация серы – ромбическая сера S8. Это хрупкое вещество желтого цвета.
Моноклинная сера – это аллотропная модификация серы, в которой атомы соединены в циклы в виде «короны». Это твердое вещество, состоящее из темно-желтых игл, устойчивое при температуре более 96оС, а при обычной температуре превращающееся в ромбическую серу.
Пласт
Тонны серобетона
13 марта 2014
Материал опубликован в № 1–2 корпоративного журнала «Газпром»
«Газпром» выходит на рынок строительных материалов
Что можно сделать из природного газа
Ценность и экономическая эффективность инноваций неизменно возрастают, когда благодаря их использованию удается одновременно решить сразу несколько задач. Таким примером является проект «Газпрома» по разработке и внедрению производства серного модифицированного вяжущего (СМВ), а также материалов и конструкций на его основе. Реализация этого проекта позволит «Газпрому» преодолеть производственные трудности, возникающие при добыче газа на высокосернистых месторождениях, параллельно обеспечив создание и развитие в России новой перспективной подотрасли, связанной с производством стройматериалов.
Сера в дорогах
Как добывают природный газ
О комплексном эффекте нового газпромовского инновационного проекта рассказал Председатель Правления компании Алексей Миллер на заседании Президиума Совета при Президенте России по модернизации экономики и инновационному развитию 17 мая 2013 года. Он пояснил, что «основным сдерживающим фактором увеличения добычи на Астраханском и Оренбургском месторождениях является значительное количество выделяемой из газа серы в условиях ограниченного спроса на нее на внешних рынках и на внутреннем рынке. В наших институтах разработаны технологии модификации асфальта на основе серы, которые позволяют увеличить прочность и пластичность асфальта, увеличить межремонтные сроки дорог до 5–7 лет со значительным экономическим эффектом для дорожного строительства… эта технология могла бы, на наш взгляд, дать тройной эффект. Во-первых, снизить экологическую нагрузку в Астрахани и Оренбурге, где накоплены очень большие объемы серы. Во-вторых, повысить рентабельность добычи газа на этих месторождениях. И, в-третьих, существенно улучшить качество дорог, особенно в регионах с резкими перепадами температуры, а также удешевить строительство дорог».
Метод модифицирования битума серой сам по себе не новый и получил первое промышленное использование еще 100 лет назад, однако масштабные работы в этом направлении в нашей стране и за рубежом начались только в 1970-е годы. В 1986 году в СССР была даже выпущена «Инструкция по применению добавок серы в горячих асфальтобетонных смесях». В связи с известными событиями дальнейшее развитие этих проектов в России застопорилось и до практического воплощения они не дошли, но эстафету подхватил «Газпром». В 1998 году «Газпром ВНИИГАЗ» начал исследования по использованию серы в дорожном строительстве, а впервые сероасфальтобетон был уложен в октябре — декабре 2002 года при ремонте дорожного покрытия моста в Крылатском. Работы проводились в экстремальных условиях (дождь, снег, минусовые температуры), а заключительная их часть — при температуре ниже минус 20 градусов, когда укладка обычного асфальтобетона фактически невозможна. В июне 2010 года сероасфальтобетон был положен на участке 50–51 км МКАД, на что потребовалось 558 т материала. Участок благополучно выдержал даже экстремальную летнюю жару. Таким образом, опытным путем было подтверждено качественное превосходство сероасфальта, который изготавливается путем добавления в битум СМВ, перед традиционным дорожным покрытием.
В настоящее время преимущество использования СМВ в дорожном строительстве сомнений не вызывает, и не случайно на упомянутом выше заседании Председатель Правительства РФ Дмитрий Медведев поручил Министерству транспорта проработать с «Газпромом» вопрос о реализации в регионах с разным температурным режимом ряда пилотных проектов строительства дорог из сероасфальтобетона.
Материал повышенной прочности
В то же время надо отметить, что при всех достоинствах сероасфальтобетона его производство даже в промышленных масштабах не решает ключевой для «Газпрома» проблемы — перепроизводства серы при добыче газа на Астраханском и Оренбургском месторождениях. Объемы «лишней» серы, то есть той, которую невозможно реализовать, достигают 2–3 млн т в год, а в случае роста добычи на обоих месторождениях эта цифра станет еще больше. И даже если весь асфальтобетон, производимый в России, будет наполнен СМВ, на его изготовление уйдет лишь около 100–200 тыс. т серы в год. Это обусловлено тем, что процент содержания самой серы в сероасфальтобетоне крайне невелик. Как показывают исследования, содержание 40% серы является границей ее положительного влияния на свойства серного битумного вяжущего (обычная дозировка — от 10 до 30%), при этом сама доля такого вяжущего в общей консистенции асфальтобетона составляет максимум 7% (обычно 5–6%).
Учитывая этот фактор, «Газпром» параллельно с производством сероасфальтобетона намерен заняться и выпуском серобетона для строительных целей в рамках единой программы «Создание и развитие подотрасли промышленности строительных и дорожно-строительных материалов на основе серного вяжущего». Разработчиком и исполнителем программы является ООО «Газпром сера» — оператор «Газпрома» по реализации этого вида продукции. Реализация программы также направлена на достижение комплексного эффекта, позволяющего решить и чисто газпромовские задачи, и многие проблемы отечественной стройиндустрии.
Такого рода перспективы связаны с особенностями производства и применения серобетона. Как уже отмечалось, доля 16-го элемента в сероасфальте невелика. Иное дело — серобетон. Здесь сера является главным структурообразующим материалом, основным вяжущим элементом, заменяющим цемент. Ее доля в вяжущем веществе составляет свыше 90%. В настоящее время в России производится порядка 60 млн т цемента. Если стройматериалы из серы закроют хотя бы 10% рынка, то в производство будет вовлечено свыше 5 млн т этого элемента, что позволит полностью справиться с проблемой имеющегося на сегодняшний день переизбытка серы и увеличить добычу газа на высокосернистых месторождения, причем не только газпромовских.
При этом для отечественной стройиндустрии плюсы также очевидны. Помимо увеличения физических объемов выпуска стройматериалов в условиях постоянно растущего спроса на них, использование серобетона в строительной отрасли существенно повысит надежность возводимых из него объектов. Основными преимуществами серобетона в сравнении с обычным являются: быстрый набор прочности, ее сохранение и более высокие прочностные характеристики (на сжатие и на изгиб), возможность этого материала эффективно работать на растяжение, высокая химическая (коррозийная) стойкость, стойкость в кислых и солевых средах и морозостойкость, в несколько раз превосходящая традиционный бетон. К этим характеристикам можно добавить низкую теплопроводность и низкое водопоглощение, водонепроницаемость, отвердение на морозе, возможность вторичной переработки, незначительную усадку и высокую адгезию (эффект сцепления поверхностей разнородных тел). Здесь, как и в случае с сероасфальтом, мы видим, что серобетон дает фору своему собрату из портландцемента (далее цемента) в отношении более высокой надежности сделанных из него конструкций, а также проведения самих работ. Обычный бетон нельзя класть на морозе (либо его надо специально разогревать), тогда как серобетон отвердевает при любой температуре в диапазоне от плюс 40 до минус 40.
Свойства серобетона являются следствием его внутренней структуры, которая довольно подробно изучена североамериканскими учеными. Сера без добавления наполнителя представляет собой вещество с гомогенной структурой, что означает плотное расположение молекул относительно друг друга. Присутствие наполнителя приводит к тому, что молекулы серы «скрепляют» молекулы наполнителя и заполняют внутренние пространства получаемого вещества таким образом, что пористость становится почти незаметной (даже под микроскопом).
Низкая пористость серобетона во многом обусловила сферы его применения. Это касается использования серобетона как основного материала для хранилищ отходов, коллекторов сточных вод, очистительных установок, свай, труб, канализационных лотков, различных сборных конструкций, словом, всех подземных инженерных коммуникаций, а также морских сооружений и плотин. Для газовой промышленности серобетон также может быть интересен, являясь идеальным материалом для строительства пригрузов (утяжелителей бетонных охватывающих, УБО) для газопроводов, дорожных плит и свай, которые используются при обустройстве месторождений, и т. д.
Стоит добавить, что серобетон удобен и в изготовлении. Любой, кому хотя бы раз приходилось делать строительный раствор, знает, что требуется три компонента: цемент, песок и вода. Для приготовления серобетона вода не нужна, да и песок можно использовать практически любой. Если в случае с цементом требуется песок, крупность которого должна быть 2,4, то для серобетона этот показатель может быть меньше 1. Иными словами, для серобетона годятся пылеватые пески, по сути дела барханные, а вот обычный бетон на таком песке развалится. Выходит, что качественные конструкции или сооружения можно производить на местных материалах.
Астрахань ждет ОПП
Однако необходимо отметить, что свойства серобетона в большей степени, нежели в случае с цементным бетоном, зависят от соблюдения технологического процесса и контроля качества входного сырья на всех этапах производства. В настоящее время строительные материалы на основе серы в нашей стране производятся небольшими фирмами, как правило, в кустарных условиях. Эти производства могут подпортить репутацию материалов на основе серы. В результате такого дилетантского подхода и отсутствия точного оборудования, способного регулировать нагрев смеси в пределах плюс-минус 1 градус, «кустарные» серобетоны могут, достигнув температуры 150 градусов, выделять сероводород и сернистый ангидрид — газы, которые обладают нервно-паралитическим действием и представляют угрозу для человека. Поэтому особую актуальность приобретает создание производств, которые могут выпускать большие объемы серобетона в строгом соответствии с технологическими стандартами.
Именно в этом направлении сейчас и двигается «Газпром сера». На первом этапе стоит задача создания функционального комплекса опытно-промышленного производства (ОПП). На его базе будут выполняться: разработка составов и производство СМВ, смесей серобетонов и сероасфальтов, отработка технологий производства материалов и конструкций на основе серы, проектирование и промышленные испытания конструкций, материалов, машин, оборудования. Сотрудниками предприятия в настоящее время осуществляются НИОКР и разработка нормативно-технической документации, касающейся производства новых видов продукции, а также планируется обучение специалистов, которые в дальнейшем будут задействованы в производстве материалов и конструкций из серы. Словом, это будет научно-исследовательский и образовательный центр, испытательный полигон и производственное предприятие в одном лице. По словам заместителя начальника Департамента маркетинга, переработки газа и жидких углеводородов ОАО «Газпром», генерального директора «Газпром сера» Марата Гараева, «ОПП предполагается оснастить новейшим оборудованием на основе экологически безвредных и безлюдных технологий. Основными видами выпускаемой и реализуемой продукции станут СМВ в гранулированном виде (сейчас разработчики ориентируются на объемы порядка 120 тыс. т в год, которые со временем могут быть увеличены), серобетонные и сероасфальтовые смеси, плиты для покрытия временных и постоянных дорог, сваи квадратного сечения с ненапрягаемой арматурой, охватывающие утяжелители газопроводов. Все виды конструкций будут изготавливаться строго в соответствии с ГОСТом».
К настоящему времени специалисты «Газпром серы» совместно с институтом «ЛЕННИИГИПРОХИМ» подготовили ТЭО, обоснование инвестиций и основные технические решения по каждому из производств. В ближайшее время должен пройти конкурс по выбору проектировщика предприятия. Проектирование и выход на площадку строительства должны быть завершены в текущем году, а ввод в эксплуатацию предприятия ожидается в 2016-м. Местом его дислокации намечена Астрахань, в перспективе предполагается появления таких предприятий и в Оренбурге.
Это будет следующий этап программы — развитие сети производителей серосодержащих материалов и изделий из них. На этой стадии потребуется государственная поддержка. Основная помощь, которую могли бы оказать органы власти, — это включение проекта по использованию серы в народном хозяйстве в федеральную целевую программу. Это позволит участникам программы привлекать кредиты на льготных условиях, а признание серосодержащих материалов инновационными даст возможность их производителям получить налоговые послабления. Эта тема была обсуждена на встрече генерального директора «Газпром сера» Марата Гараева и заместителя министра экономического развития РФ Андрея Клепача 21 августа 2013 года, по итогам которой в текущем году можно будет ожидать положительного результата.
Николай Хренков
Справка
Серное модифицированное вяжущее (СМВ) — это минеральное термопластическое вещество, изготовленное из технической серы и модификатора. Способ его получения включает в себя расплавление серы в среде двуокиси углерода, нагревание расплава до температуры 135–140 °С и добавление в него модификатора в виде ненасыщенных органических соединений (олефиновых углеводородов), в частности, дициклопентадиена, в пропорции 93–98% — сера, 2–7% — модификатор. Добавление модификаторов позволяет регулировать свойства серы — снижать температуру плавления, замедлять кристаллизацию, улучшать совместимость с наполнителями. В итоге полученное таким образом вещество становится прочным (не ломается, не рвется) и пластичным.
Серобетон — это композиционный строительный материал, в состав которого входит серное вяжущее, инертные заполнители и наполнители. Спектр применения инертных заполнителей и наполнителей широк. В этом качестве могут использоваться щебень, песок, гравий, металлургические шлаки и прочие породы, применяемые для традиционного бетона.
Серобетон начали активно исследовать в Северной Америке в 70-х годах ХХ века, когда было доказано, что серобетон и сероасфальт безопасны для окружающей среды. Позднее, уже в 1980–1990-х годах, с увеличением добычи углеводородов выросла и добыча серы как продукта, сопутствующего нефти и газу. Поиск новых методов использования серы стали вести крупные нефтяные и газовые компании. В результате появились новые разработки по производству и применению бетона и асфальта на основе серного вяжущего. Уже тогда были выявлены его преимущества по отношению к традиционному бетону на основе портландцемента. Позже экспериментально было установлено, что предпочтительно использование модифицированной серы.
Сравнительная характеристика свойств серного и портландцементного бетонов
| Наименование свойства (испытания) | Серобетон | Бетон |
|---|---|---|
| Влагостойкость | 1,0 | 0,8 |
| Химическая стойкость (к кислотам), % | 84 | 23 |
| Морозостойкость (при 100% влажности) | 300 | 50 |
| Истираемость, % | 3 | 17 |
| Прочность на сжатие, МПа | 55–65 | 15–25 |
| Прочность на изгиб, МПа | 10–15 | 6–9 |
| Прочность на растяжение, МПа | 5–7 | 3–4 |
| Время набора прочности | 3 часа | 28 суток |
Сера | справочник Пестициды.ru
Сера – макроэлемент
Физические и химические свойства
Молекулярная масса 32,06.
Сера – твердое вещество желтого цвета. Существуют кристаллические и аморфные разновидности. Практически нерастворима в воде, хорошо растворима в ряде органических растворителей; плохо растворима в спирте, хлороформе.
Механизм действия серного фунгицида (тиовита) на возбудителя мучнистой росы
Механизм действия серного фунгицида (тиовита) на возбудителя мучнистой росы
Использовано изображение:[6]
Действие на вредные организмы
Фунгицид
Для эффективной борьбы с болезнями нужно, чтобы применяемые препараты в течение длительного времени постепенно выделяли пары серы в достаточном для фунгицидного действия количестве. Этого можно достичь равномерным покрытием поверхности препаратом. Также препарат должен иметь хорошие удерживаемость и устойчивость.[6]
Большое влияние на активность препаратов серы оказывает температура воздуха. Сера эффективна лишь в узком спектре температур (18-28 °С). при температуре ниже 20 °С ее препараты слабо эффективны, а при температуре выше 35 °С повреждают листья. При температуре 16-18 °С применяют максимально допустимую норму препаратов серы.[2][7][9]
Механизм действия. Фунгицидность серы обусловлена продуктами ее восстановления или окисления, поскольку сама сера не активна. Препараты серы выделяют пары элементарной серы, проникающей в мицелий и споры гриба благодаря растворению в веществах клетки (возможно, в липидах). Сера является акцептором водорода и способствует нарушению нормального течения реакций гидрирования/дегидрирования.[6] Вещество в оболочке или внутри жизнеспособных спор превращается в сероводород, подавляющий ферменты дыхания – полифенолаксидазу и прочие.[11]Процесс образования сероводорода тесно связан и с прорастанием спор и жизнеспособностью гриба. Споры, которые потеряли способность к прорастанию, сероводород из серы образовывать не могут. Поэтому, синтез серодоворода можно рассмотреть как детоксикацию элементарной серы. Сероводород является фунгитоксичным. Элементарная сера связывая металлы, входящие в состав ферментов (цинк, медь, железо, марганец) образует сульфиды. Инактивация сероводородом ферментов и связывание металлов элементарной серой нарушает метаболизм гриба, вызывая его гибель.[6]
Предположительно, способность спор абсорбировать серу и детоксицировать ее с образованием водорода обуславливают специфичность действия препаратов серы. (изображение).
Акарицид и инсектицид
Акарицидная активность серы обусловлена ее возгонкой.
Ранее серу широко применяли для борьбы с вредителями запасов путем окуривания помещений при сжигании серы. Однако с появлением эффективных препаратов масштабы использования серы для фумигации диоксидом серы непрерывно сокращались,[8] и, в настоящее время, в сельском хозяйстве она в этом качестве не применяется.
Пестициды, содержащие
Сера
для сельского хозяйства:
для личных подсобных
хозяйств:
закончился срок регистрации:
Применение
Фитотоксичность. При температуре более 35 °С препараты серы повреждают растения (ожоги листьев, иногда их опадение), поэтому при более высоких температурах используют меньшую норму расхода.[2] Тыквенные культуры и некоторые сорта крыжовника имеют повышенную чувствительность к препаратам серы – у них возможны ломкость и огрубение листьев, их опадение, ожоги.[6]
Нельзя применять серу, когда растения страдают от засухи.[7][9][2]
Жидкие формы
В сельском хозяйстве. В 80-х годах сера и ее соединения были одними из наиболее важных неорганических пестицидов. В тонко измельченном состоянии или в виде коллоидных препаратов сера широко применяется для борьбы с растительноядными клещами и мучнисторосяными грибами.[7]
В сельском и личных подсобных хозяйствах фунгициды на основе серы применяются против возбудителей заболеваний винограда (оидиум), яблони, груши, айвы (мучнистая роса, парша, ржавчина), томатов и огурцов открытого и защищенного грунта, кабачков (мучнистая роса), крыжовника, смородины черной (американская мучнистая роса) розы открытого и защищенного грунта (мучнистая роса).[5]
Баковые смеси. Нельзя применять препараты на основе серы в течение 15 дней до и 15 дней после обработки растений минеральными маслами и с эмульсиями нефтяных масел. Можно применять совместно с большинством препаратов (кроме нефтяных и минеральных масел или содержащих в своем составе масла).[2]
Шашки
В личном приусадебном хозяйстве. Серные дымовые шашки применяются в личных подсобных хозяйствах (в пустых погребах, теплицах, парниках) для борьбы с возбудителями болезней, бактериальных инфекций, вредными насекомыми, клещами.[5]
Токсикологические данные | |
| ДСД (мг/кг массы тела человека) | (нт) |
| ПДК в почве (мг/кг) | 160,0 (общ.) |
| ПДК в воде водоемов (мг/дм3) | (нт) |
| ОДУ в воде водоемов (мг/дм3) | (нт) |
| ПДК в воздухе рабочей зоны (мг/м3) | 6,0 |
| ОБУВ в атмосферном воздухе (мг/м3) | 0,07 |
Токсикологические свойства и характеристики
Общее описание.
Полезные виды. Сера малотоксична для пчел, их изолируют на период обработки на дневное время. На полезных энтомофагов сера оказывает различное действие: для птеромалидов – не ядовита, для личинок златоглазок и перепончатокрылых семейства ихневмонид – слаботоксична, для хищных клещей – от слабой до высокой степени токсичности. Не влияет на подавление паразита оранжерейной белокрылки – энкарзии.[2]
Препарат малотоксичен для хищного клеща анистиса, но в концентрации 0,5% на черной смородине снижал его численность в 3-4 раза.[4] Подавляет Zetzelia maliна яблоне.[4]
Препараты серы слаботоксичны для Verticilium Lecanii. Не токсичен для спор и мицелия Trichoderma lignorum, Trichoderma viridaeи Trichoderma roseum.[4]
Теплокровные. Для человека и теплокровных животных сера малотоксична, однако отдельные ее препараты могут быть весьма токсичными.[9][2][1]
Симптомы отравления. При вдыхании пыли возможны тиопневмокониозы и другие заболевания легких, порошковая сера может вызвать экзему.[2][1]
Классы опасности. Препараты на основе серы относится ко второму классу опасности для человека.[5]
Таблица Токсикологические данные составлена в соответствии с ГН 1.2.3111-13.[3]
Получение
В 1936-40 годах было освоено получение и производство коллоидной серы, которую получали в качестве побочного продукта при очистке коксовых газов от сероводорода. После отмывки от солей роданистоводородной кислоты и фитоцидных соединений мышьяка серу начали использовать в качестве активного акарицида и фунгицида для борьбы с мучнистой росой огурцов.[10]
В послевоенный период на Роздольском горно-химическом комбинате было начато крупное промышленное производство смачивающегося порошка серы.[10]
Для получения порошка тонкого помола вещество размалывают на специальных мельницах-микронизаторах. Часто используют осажденную коллоидную серу (выделяемую при очистке коксовых и других газов, содержащих сероводород), которую отмывают водой от фитоцидных примесей, добавляют диспергатор (обычно сульфитный щелок) и подсушивают. В некоторых странах для нужд сельского хозяйства серу получают осаждением из водных растворов тиосульфата натрия (гипосульфита). Концентрированный раствор тиосульфата аккуратно подкисляют серной кислотой, выделившаяся сера подвергается очистке диализом от растворимых в воде солей. Это один из способов получения коллоидной серы высокой дисперсности, которая не осаждается из суспензии на протяжении многих месяцев.[7]
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Амиров Н.Х. Васильев В.В. Пестициды: безопасность и здоровье. Монография. Пенза: Издательство Пензенского государственного университета, 2005. – 248 с.
2.
Белов Д.А. Химические методы и средства защиты растений в лесном хозяйстве и озеленении: Учебное пособие для студентов. –М.: МГУЛ, 2003. – 128 с
3.
Гигиенические нормативы содержания пестицидов в объектах окружающей среды (перечень). Гигиенические нормативы ГН 1.2.3111-13  Скачать >>>
4.
Голышин Н. М. Фунгициды. — М.: Колос, 1993. -319 с.: ил.
5.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2012 год.
Министерство сельского хозяйства Российской Федерации
(Минсельхоз России)
6.
Зинченко В.А. Химическая защита растений: средства, технология и экологическая безопасность. – М.: Колос С, 2005. – 232 с.
7.
Мельников Н.Н, Аронова Н.И. Поведение синтетических пиретроидов в объектах окружающей среды. Агрохимия, 1987, Т.9
8.
Мельников Н.Н. Пестициды. Химия, технология и применение. — М.: Химия, 1987. 712 с.
9.
Мельников Н.Н., Новожилов К.В., Пылова Т.Н. Химические средства защиты растений (пестициды). Справочник. – М.: Химия, 1980. – 288 с.
10.
Ченкин А.Ф., Захаренко В.А. и др. Истории развития и проблемы защиты растений. Россельхозакадемия АЭИН, 1997;
Источники из сети интернет:
11.
http://www.mkperi.ru
Свернуть
Список всех источников
Опрыскивание | справочник Пестициды.ru
Проводится с помощью опрыскивателей различных типов: ручных, транспортных и авиационных (самолетов и вертолетов).[5]
Опрыскивание показано при борьбе с вредными насекомыми, клещами, микроорганизмами, сорной растительностью и болезнями.[1]
Размер капель
Размер капель – важный параметр качественного опрыскивания. Размер капель определяет количество рабочего состава, осевшего на обрабатываемую поверхность. Чем меньше размер капель, тем больше вероятность обтекания целевого объекта с потоками воздуха. Крупные капли отрываются от потока воздуха и падают на листья. На практике установлено, что оптимальный размер капель для попадания рабочего состава на обрабатываемый объект составляет 200–300 мкм при высокой скорости падения. Однако на практике при опрыскивании образуются капли разного размера.[6]
Малолитражное опрыскивание
Малолитражное опрыскивание
Использовано изображение:[8]
По количеству рабочей жидкости на 1 га и преобладающему размеру капель опрыскивание подразделяют на:
- Малолитражное крупнокапельное (обычное) опрыскивание. Норма расхода рабочей жидкости – 300–600 л для обработки полей и 800–2000 л для обработки древесных насаждений. (фото)
- Микролитражное среднекапельное (малообъемное) опрыскивание. Норма расхода для обработки полей – 100–250 л. Размер капель – 15–300 мкм. Применяется для обработки посевов гербицидами.
- Микролитражное мелкокапельное (микрообъемное). Норма расхода рабочей жидкости на полях – 25–100 л. Обработка древесных насаждений требует 50–200 л. Размер капель – 30–150 мкм.
- Утрамалообъемное (УМО). Опрыскивание концентрированными, не разбавленными водой эмульсиями пестицидов и масляными растворами. Норма расхода – 0,6–5 л. Размер капель может колебаться от 1 до 20 мкм.[1] Практически, ультрамалообъемное опрыскивание является аэрозольной обработкой.
Выбор размера капель зависит от класса пестицида и параметров его действия. Оптимальный расход рабочего раствора для пестицида указывается в регламентах его применения.
Готовые растворы пестицидов
Готовые растворы пестицидов
Использовано изображение:[9]
Препаративные формы для опрыскивания
В настоящее время разработаны препараты в виде большого числа различных препаративных форм, наиболее распространенными из которых являются концентраты эмульсий, концентраты суспензий и смачивающиеся порошки. Наиболее современными формами являются микрокапсулированные суспензии и водорастворимые гранулы.
Для опрыскивания в быту разработаны препаративные формы, которые не требуют приготовления – водные растворы. (фото)
Физико-химические свойства рабочих форм пестицидов
Дисперсные системы, используемые для опрыскивания, должны отвечать ряду требований к их физико-химическим свойствам, таким, как смачиваемость, растекаемость, прилипаемость, удерживаемость.
– способность сохранять необходимые свойства в течение времени употребления. Это свойство зависит от степени дисперсности, формы и удельной массы частиц и жидкости.
– непосредственный контакт яда и обрабатываемой поверхности без воздушного пространства на границе их соприкосновения. Поверхностные явления, наблюдающиеся на границе газообразной, твердой и жидких фаз, определяют степень смачиваемости и растекаемости. На обрабатываемой поверхности капли растворов ядохимикатов разбиваются на менее мелкие. Они растекаются по поверхности, смачивая ее. Величина степени смачивания зависит от натяжения рабочей жидкости.
– сила, с которой поверхностная пленка оказывает давление на жидкость. Оно измеряется как работа в эрг/см2 или дин/см. Вода обладает высоким поверхностным натяжением.
Наблюдается следующая зависимость между поверхностным натяжением и смачиваемостью: чем выше поверхностное натяжение, тем ниже смачиваемость.
При низкой смачиваемости капля жидкости имеет округлую форму с минимальной площадью поверхности для данного объема.
возникает, если сцепление между молекулами жидкости и твердого тела превышает сцепление молекул в самой жидкости. В таком состоянии поверхность хорошо смачивается (прилипает).
как обратное явление наблюдается при отсутствии сцепления молекул жидкости и молекул твердого тела, то есть при отсутствии смачиваемости.
Для увеличения смачиваемости к рабочим растворам добавляют разнообразные поверхностно-активные вещества (концентраты сульфитно-спиртовой барды, мыла и прочие). Они уменьшают поверхностное натяжение и усиливают смачиваемость.
жидкости – это способность жидкости при высыхании образовывать тонкую пленку частиц на поверхности листа. Чем тоньше пленка, тем лучше она удерживается поверхностью. В основе прилипаемости лежит способность адсорбции вещества на поверхности.[1]
Опрыскивание пестицидами
Опрыскивание пестицидами
Использовано изображение:[10]
Качество опрыскивания
За качеством опрыскивания необходимо вести строгий контроль. Основные показатели качества:
- Соблюдение установленной нормы расхода препарата.
- Соблюдение установленной нормы расхода рабочего раствора.
- Отсутствие перекрытий и огрехов.
- Густота покрытия обрабатываемой поверхности.
- Равномерность распределения рабочей жидкости по ширине захвата агрегата.[1] (фото)
Сроки проведения опрыскивания
Опрыскивания проводятся в оптимально выбранное время и сжатые сроки.
Выбор оптимального срока опрыскивания связан с оценкой состояния популяции и прогнозом появления чувствительной к пестицидам стадии развития вредоносного организма. Сжатые сроки обусловлены быстрым переходом вредных организмов в фазу наименьшей чувствительности к пестицидам.
Сроки проведения опрыскиваний лимитированы по времени, поскольку тесно связаны с развитием защищаемой культуры.
По отношению к возбудителям заболеваний, сроки опрыскивания зависят и от свойств выбранных пестицидов. При выборе контактных препаратов время опрыскивания выбирается так, чтобы споры либо личинки вредителей попадали на уже обработанную поверхность. При использовании системных препаратов опрыскивание более целесообразно при обнаружении первых признаков заболеваний.[1]
Опрыскивание вентиляторным опрыскивателем
Опрыскивание вентиляторным опрыскивателем
Правила опрыскивания сельскохозяйственных угодий:
- Опрыскивание проводят утром, с 8 до 11 часов, в безветренную погоду. Опрыскивание в жару приводит к ожогам растений.
- В дождливую погоду и по росе опрыскивание проводить нельзя, поскольку препараты смываются на землю.
- Опрыскивание химикатами во время цветения запрещено, поскольку приводит к уничтожению пчел. С той же целью необходимо перед опрыскиванием удалить всю цветущую сорную растительность.
- Во время опрыскивания рабочую жидкость необходимо периодически перемешивать (взбалтывать).[3]
Опрыскивание (влажная обработка) помещений
Применяется в практике борьбы с вредителями запасов на хлебоперерабатывающих предприятиях, а также для дезинсекции и дезинфекции объектов различного назначения: жилых помещений, пищевых производств и прочих.
Пестициды наносят на стены, столбы, полы, плинтуса, верхние и нижние проходные и непроходные галереи, каналы активной вентиляции, различные решетки, щиты в капельно-жидком состоянии в виде эмульсий, растворов и суспензий.
Помещения обрабатываются с целью уничтожения насекомых, клещей, вредных микроорганизмов, включая возбудителей различных болезней.[2]
Преимущества и недостатки опрыскивания
– малый расход препарата, низкая зависимость от потоков воздуха, равномерное покрытие препаратами обрабатываемых поверхностей, хорошая удерживаемость рабочего состава на обрабатываемой поверхности, возможность применения баковых смесей.[1] – сложность приготовления рабочих растворов, коррозия аппаратуры, большой расход жидкости.[1]
Машины и механизмы для опрыскивания
Опрыскивание проводят тракторными, автомобильными, авиационными, тачечными, ручными и другими видами опрыскивателей. Различают наземное и авиационное опрыскивание.
Наземное опрыскивание
– наиболее распространенный способ опрыскивания. Им обрабатывается до 80 % площадей. На сегодняшний день применяются опрыскиватели более 40 различных марок. Выполняются они в самоходных вариантах либо агрегатируются с колесными тракторами.
Наземное опрыскивание имеет ряд неоспоримых достоинств:
- Качественное распределение препаратов по обрабатываемой поверхности.
- Минимальный снос распыляющей жидкости.
Недостатки наземного опрыскивания:
- Невысокая производительность труда.
- Повышенное уплотнение почвы машинотракторными агрегатами.
- Невысокая маневренность агрегатов.
- Низкая сменная производительность.[6]
Для обработки пропашных культур применяют опрыскиватели штанговые серии ОП-2500 с шириной захвата 12, 18, 24 м. Они оснащены компьютерной системой поддержки нормы внесения рабочей жидкости, пневматической тормозной системой, миксером, мембранно-поршневым насосом.[3]
Кроме того, используют опрыскиватель прицепной штанговый ОПШ-15-01, опрыскиватель малообъемный штанговый ОП-2000-2-01, опрыскиватель малообъемный монтируемый штанговый ОМ-630-2, подкормщик-опрыскиватель ПОМ-630, опрыскиватель-подкормщик ОП-3200.[4]
Широкое распространение за рубежом и в РФ получают самоходные опрыскиватели – сельскохозяйственные машины, оснащенные всеми техническими средствами трактора, но предназначенные исключительно для опрыскивания сельскохозяйственных культур.
опрыскиватели вентиляторные серии ОВС с емкостью бака 600 и1500 л, оснащенные вентиляторными приставками типа «стандартная», «спрут», «колонна»,[3] а также опрыскиватель прицепной вентиляторный ОПВ-1200, опрыскиватель прицепной вентиляторный ОПВ-2000.[4]
Кроме того, на российском рынке представлены аналогичные опрыскиватели зарубежного производства. Работа такого опрыскивателя продемонстрирована на видео.
. Низкорослые деревья в лесных питомниках, на придомовых территориях, в парках, отдельно стоящие деревья обрабатывают различными наземными опрыскивателями. Наиболее популярными являются опрыскиватели вентиляторного типа.
В лесном, садовом и парковом хозяйствах активно используются опрыскиватель навесной универсальный ОН-400 (монтируется на тракторах Т-30, Т-54В), опрыскиватель вентиляторный садовый ОВС-А. [7]
опрыскиватели серии ОЗГ с емкостью бака от 60 до 1000 л, оснащенныемембранно-поршневыми насосами высокого давления (до 16, реже до 50 Атм) и 1–2 гидравлическими пистолетами.[3], а также для локальной дезинфекции используют ручные опрыскиватели. Ихассортимент очень широк. Такие опрыскиватели отличаются удобством эксплуатации и небольшими объемами рабочего раствора (1–20 литров).
Авиационное опрыскивание
Для опрыскивания применяются самолеты Ан-2 и Ан-2М, оборудованные специальной аппаратурой для опрыскивания или распыливания порошковидных химикатов.
В горной местности в отсутствие крупных аэродромов и в распутицу используются вертолеты Ми-1, Ми-2, Ка-26, «Авиатика».
При авиационном опрыскивании самолетами и вертолетами не всегда возможно достичь необходимого качества работы. Из-за большой высоты опрыскивания размер капель уменьшается со 100 до 50 мкм и происходит снос препаратов за пределы обрабатываемой зоны. При этом, в зависимости от размера, капли могут сноситься на расстояние до 20 км в сторону от самолета.
Повышению эффективности использования авиации способствует разработка конструкции авиационной опрыскивающей техники нового класса. Это мотодельтапланы, с их помощью посевы обрабатываются с высоты 1–3 м, тогда как самолеты и вертолеты не спускаются ниже 5–10 метров.[3]
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Ганиев М.М., Недорезков В.Д. Химические средства защиты растений. – М.: КолосС, 2006. – 248 с.
2.
Инструкция по борьбе с вредителями хлебных запасов. Часть 1. – М., 1992. – 120 с.
3.
Маркевич А.Е. Немировец Ю.Н. Справочник в вопросах и ответах по механизации и контролю качества применения пестицидов в сельском хозяйстве – Горки: учреждение образования «Могилевский государственный учебный центр подготовки, повышения квалификации, переподготовки кадров, консультирования и аграрной реформы», 2004. – 60 с.
4.
Мартыненко В.И.; Промоненков В.К.; Кукаленко С.С.; ВолодковичС.Д.; Каспаров В.А. Пестициды: Справочник. -М. : Агропромиздат, 1992 -368с.
5.
Попов С.Я. Основы химической защиты растений. Попов С.Я., Дорожкина Л.А., Калинин В.А./ Под ред. профессора С.Я Попова. — М.: Арт-Лион, 2003. — 208 с.
6.
Шкаликов В.А., Белошапкина О.О., Буркеев Д.Д. и др.; Защита растений от болезней. – 3-е изд., испр. и доп. – М.: КолосС, 2010. – 404 с., ил. – (Учебники и учеб.пособия для студентов высш. учеб. заведений)
7.
Щербакова Л.Н. Защита растений: учебное пособие для студентов учреждений среднего и профессионального образования./ Л.Н. Щербакова, Н.Н. Карпун. — М.: Издательский центр «Академия», 2008. — 272 с. [16] с. цв. вкл: ил.
Изображения (переработаны):
8.9.
Pesticides, by Gerald Holmes, Valent USA Corporation, Bugwood.org, по лицензии CC BY-NC
10.
Pesticides, by USDA Forest Service — Region 8 — Southern Archive, USDA Forest Service, по лицензии CC BY
Свернуть
Список всех источников
Акарицид | справочник Пестициды.ru
Акарициды – собирательное название средств защиты растений, состоящее из двух слов – acari – клещ и cide – сокращать (смысловой перевод – средства, сокращающие численность клещей).
История
Долгое время клещи оставались для земледельцев невидимыми врагами; повреждения культур, наносимые этими мелкими вредоносными организмами, не расценивалось как результат их деятельности. Предполагалось, что причиной гибели урожаев и растений были болезни и более заметные вредители, в первую очередь, насекомые. Тем не менее, со временем клещей наконец разглядели и стали рассматривать в качестве злостных вредителей растениеводства.
Недостаточная изученность биологии этих существ в древние времена и Средние века не позволяла найти достаточно действенного средства, которое могло бы помочь их уничтожить. В результате, с ними боролись только «симптоматическими» способами, например, обустройством дренажных систем на культивируемых участках, препятствующих застою воды и ухудшавших условия существования для влаголюбивых клещей. Применялись и неспецифические средства, действующие против многих вредителей, например, окуривание серой. Среди других старых средств можно назвать минеральные масла.
Клещи – объекты действия акарицидов
Клещи – объекты действия акарицидов
Использовано изображение:[11]
Революцией в борьбе не только с клещами, но и другими вредителями стало начало применения хлорорганических соединений. Когда в 40-х годах прошлого века был синтезирован ДДТ и другие ХОС, борьба с этими вредителями начала казаться перспективной.
Сам ДДТ оказался активен только против насекомых, так как клещи обладают природной устойчивостью к препарату. А вот родственный ему ГХЦГ (линдан, гексахлоран) был признан первым ХОС, активным против клещей. ГХЦГ проявляет кишечное и контактное действие, после всасывания влияет на нервную систему, вначале приводя к активации процессов возбуждения, а затем к параличу тела. К сожалению, средства на его основе губительны в отношении большого числа насекомых, в том числе и энтомофагов, поэтому с течением времени численность вредителей-клещей на обрабатываемых участках может даже возрастать из-за уменьшения числа их естественных врагов. К тому же, акарицидное влияние ГХЦГ оказалось достаточно слабым, так что средство сравнительно быстро вышло из обращения.[5][1]
Позже для борьбы с клещами стали использовать фосфорорганические соединения, также обладавшие и инсектицидным, и акарицидным действием. Самым первым из них был карбофос (малатион), который наболее широко используется до сих пор. Низкая фитотоксичность и широкий спектр действия (сосущие, грызущие насекомые, растительноядные клещи) сделали его весьма популярным среди других ФОС.[8]
Позже были выявлены токсичность и высокая опасность этих соединений, к тому же, у многих видов клещей выработалась устойчивость к препаратамэтой группы. Было отмечено, что, чем больше поколений дает вредитель за сезон, тем быстрее у него формируется резистентность к ФОС.[5] В связи с возделыванием культур интенсивного типа воспроизводства и ростом вредоносности клещей, возникла необходимость поиска особых средств, которые будут иметь другие механизмы действия и влиять только на этих вредителей. Это привело к появлению препаратов группы специфических акарицидов.[6]
Современные препараты данной группы делятся на три вида:
- Инсектоакарициды – эффективны против клещей и насекомых. В их числе можно рассматривать средства из группы фосфорорганических соединений, некоторых пиретроидов и препаратов неорганической серы.
- Специфические акарициды – соединения и смеси соединений, действующие только в отношении клещей (вернее, преимущественно в отношении них, так как большинство препаратов все же имеет некоторое влияние на ряд видов насекомых).[4][6] Среди специфических акарицидов существует немало средств, ассортимент которых с последние годы значительно пополнился и обновился. К ним относятся препараты, значительно отличающиеся друг от друга по химическому строению. Это вещества,содержащие:
- Акарофунгициды – средства для уничтожения клещей и патогенных грибов. Эта группа выделяется в отдельную только некоторыми специалистами.[2]
Все специфические акарициды являются средствами контактного действия, особенности механизмов патологического влияния на вредителей могут различаться.[6]
Существует ряд фумигантов, которые также могут использоваться против этой группы вредоносных организмов. К примеру, препараты на основе магния фосфида обладают акарицидным действием и используются для фумигации зерна от хлебных клещей.[3] При разложении фосфида магния выделяется газ фосфин, который и оказывает токсическое действие на насекомых и клещей. Фосфин – яд широкого спектра действия; он вызывает нарушение нервной регуляции функции органов, впоследствии парализуя нервную систему, а также обрывает биохимические превращения, инактивируя ряд ферментов.[7]
Для уничтожения клещей и других вредителей запасов ранее часто широко использовался бромистый метил, хотя сейчас его применение, фактически, стремится к нулю. При фумигации бромметил оказывает на вредителей нервно-паралитическое действие, он взаимодействует с ферментами, в составе которых имеются сульфгидрильные группы, и блокирует их, ингибируя процессы окисления и восстановления. Наиболее активен этот препарат в отношении яиц.[7][5]
Особенности специфических акарицидов и способы их применения
. Клещи наиболее чувствительны к обработкам сразу после выхода из яйца и на стадии личинок младших возрастов. Имаго и старшие личинки более устойчивы, поэтому планировать обработку следует на период активного развития клещей. Впрочем, многое зависит от выбора средства. Так, препараты Клофентезина повреждают летние яйца и личинки, акарицид на основе Фенпироксимата влияет на личинок и взрослых клещей, а препараты на основе Феназахина действует на клещейв любой стадии развития.[6]. Эффективность использования специфических акарицидов и число обработок зависят от того, насколько препарат стоек и как долго он удерживается на растениях.[6]. Наиболее долго действует Пропаргит его эффект длится до 15-20 суток и дольше. Токсичность некоторых (например, бромопропилата) оказывается достаточно высокой даже при низких температурах.[6]. Это очень важный фактор, от которого зависит защитное действие препарата. Если на растении содержится большое количество клещей, следует выбирать средства с высокой начальной токсичностью. В противном случае, низкотоксичные акарициды стоит использовать параллельно с ФОС или высокотоксичными препаратами (Пиридабен).
. Специфические акарициды выпускают в формах, предназначенных для многолитражного опрыскивания:
.
Как правило, препараты используются для защиты от вредителей ягодных и плодовых культур. Чтобы средства из группы специфических акарицидов оказали максимальный эффект, необходимо тщательно обрабатывать листья и стебли растений со всех сторон.Кратность обработок бывает различной. Например, бромопропилат используется однократно, срок ожидания составляет 45 дней до снятия урожая с яблони, смородины, винограда и других культур, опрыскиваемых акарицидами.[6]
Обработка ульев акарицидами
Обработка ульев акарицидами
1 – клещ varroa; 2 – нимфа пчелы, пораженная клещом; 3 – обработка ульев
Использовано изображение:[10][9][12]
Токсическое влияние акарицидов на насекомых и теплокровных
Даже среди специфических акарицидов есть те, которые способны оказывать действие не только на клещей, но и на насекомых, вредных и полезных. К примеру, Амитраз (не зарегистрирован на территории РФ) уничтожает совок, листоверток, плодожорок, тли и моли; в то же время, он оказывает токсическое влияние на пчел и энтомофагов. Это один из наиболее широко действующих препаратов, у других менее скромный спектр «побочного» влияния.
Что касается действия на теплокровных животных и человека, то одним из наименее вредных акарицидов можно назвать Клофентезин, он вызывает лишь слабое раздражение при попадании на конъюнктиву, а одним из самых опасных считается Пропаргит, который оказывает выраженное кумулятивное действие. Коэффициент кумуляции Неорона составляет 0,9 а Омайта – 1,03.[6]
Области применения акарицидов
Основной сферой применения акарицидов является их использование в растениеводстве. Помимо этого, они полезны и в других областях, требующих избавления от клещей – вредителей или паразитов. Например, ими обрабатывают ульи для лечения варроатоза у пчел, (фото) а также других подобных заболеваний, вызванных паразитическими клещами (против акарапидоза применяется тедион и т.д.).[5]
Для борьбы с заболеваниями людей и животных, передаваемых с укусами клещей (болезнь Лайма, клещевой боррелиоз, клещевой энцефалит) в эндемичных районах применяют обработку акарицидами лесопарковых зон.
Близкие статьи
Ссылки:
Заглавная статья: Пестициды
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Бегляров Г.А, Смирнова А.А. и др. Химическая и биологическая защита растений. М.: Колос, 1983. — 351 с.
2.
Белов Д.А. Химические методы и средства защиты растений в лесном хозяйстве и озеленении: Учебное пособие для студентов. –М.: МГУЛ, 2003. – 128 с
3.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2012 год.
Министерство сельского хозяйства Российской Федерации
(Минсельхоз России)
4.
Груздев Г. С., Дорожкина Л. А., Петриченко С. А. Защита зеленых насаждений в rородах. — М., Стройиздат, 1990. — 544с.
5.
Груздев Г.С. Химическая защита растений. Под редакцией Г.С. Груздева — 3-е изд., перераб. и доп. — М.: Агропромиздат, 1987. — 415 с.: ил.
6.
Зинченко В.А. Химическая защита растений: средства, технология и экологическая безопасность. – М.: Колос С, 2005. – 232 с.
7.
Попов С.Я. Основы химической защиты растений. Попов С.Я., Дорожкина Л.А., Калинин В.А./ Под ред. профессора С.Я Попова. — М.: Арт-Лион, 2003. — 208 с.
8.
Солдатенков А.Т. Пестициды и регуляторы роста: прикладная и органическая химия / А.Т. Солдатенков, Н.М. Колядина, А. Ле Туан. — М.: БИНОМ. Лаборатория знаний, 2012.-223 с.: ил. -(Библиотека классического университета).
Изображения (переработаны):
9.10.11.12.
Свернуть
Список всех источников
демонстраций — Сжигание в чистом кислороде
Демонстрационные выступления — Сжигание в чистом кислороде — Горящая сера
Горение в чистом кислороде,
Часть 3:
Горящая сера — огонь и сера
Сера легко воспламеняется только при нормальных атмосферных условиях, но в
чистый кислород, он горит очень красивым голубым пламенем. Продукция
сгорают диоксид серы и триоксид серы:
S (т) + O 2 (г) ——> SO 2 (г)
2S (т) + 3O 2 (г) ——>
2SO 3 (г)
Эти вещества реагируют с водой в воздухе с образованием серы и
серная кислота соответственно:
SO 2 (г) + H 2 O (г)
——> H 2 SO 3 (г) [сернистая кислота]
SO 3 (г) + H 2 O (г)
——> H 2 SO 4 (г) [серная кислота]
Это может быть продемонстрировано путем гашения горящей серы небольшим количеством
дистиллированной воды и добавлением соответствующего кислотно-основного индикатора, такого как
метиловый апельсин.
В следующей демонстрации небольшое количество серы помещается в
ложка для дефлаграции, нагретая на горелке Бунзена до тех пор, пока она не начнет гореть, а затем
опускают в банку с чистым кислородом. Затем сера вспыхивает, превращаясь в
более яркое голубое пламя, и со временем начинает выбрасывать пары диоксида серы
и триоксид.
Видеоклип:
НАСТОЯЩИЙ,
4.20
МБ
!!! Опасности !!!
Используйте длинную ложку для дефлаграции, чтобы удержать серу в кислородном баллоне.
Образуются пары диоксида серы и триоксида серы; эти пары должны
следует избегать, так как они будут гидролизоваться до серной и серной кислоты при воздействии
влага.
Процедуры
н / д
Список литературы
Джон Эмсли, Элементы, 3-е изд. Оксфорд, Clarendon Press,
1998, стр.148-149, 198-199.
Дэвид Л. Хейзерман, Исследование химических элементов и их
Соединения. Нью-Йорк: TAB Books, 1992, стр. 32-36, 65-69.
Sulphur — Science Learning Hub
Сера — это химический элемент. Его официальный символ — S, а его атомный номер — 16, что означает, что каждый атом серы имеет в своем ядре 16 протонов. Элементарная сера имеет бледно-желтый цвет. При комнатной температуре это мягкий порошок, который крошится при прикосновении.Элементарная сера не имеет запаха сама по себе, но когда она образует соединение — например, с водородом — она может вонять!
Отложения серы естественным образом находятся в вулканических областях, таких как Роторуа и Уайт-Айленд, а также в больших количествах глубоко под землей в Соединенных Штатах, Польше и Сицилии. По массе сера является пятым по распространенности элементом на Земле.
Черный порошок, сера и несколько вариантов написания
Сера — один из немногих элементов, который встречается в чистом виде, поэтому люди знали и использовали «чистую» элементарную серу очень давно.Записи показывают, что китайцы использовали серу в традиционной медицине более 2600 лет назад. К 7 веку нашей эры они научились смешивать серу с древесным углем и нитратом калия для создания черного пороха (пороха). Древние индийские, греческие и египетские культуры также использовали серу в лекарствах, для дезинфекции и отбеливания тканей.
Сера также упоминается в религиозных писаниях, возраст которых составляет 2600 лет. В английском переводе Библии сера называется «серой», чтобы описать разрушение (на которое способна вулканическая активность) и неприятный запах, связанный с соединениями серы.
Перенесемся на 2300 лет в 1777 год. После обширных экспериментов Антуан Лавуазье обнаружил, что не может расщепить серу на более простые вещества, поэтому он объявил ее элементом.
В последнее время споры велись не о химии, а о правописании. Первоначальный латинский термин был «sulpur». Со временем он стал «серой», а в 3 веке превратился в «серу». Английский язык сохранил написание «ph», в то время как другие языки использовали, например, «f» — zolfo в итальянском и schwefel в немецком.Международный союз теоретической и прикладной химии официально принял слово «сера» в 1990 году.
Сера, необходимая для жизни (и неприятный запах)
Сера присутствует во всех тканях живых растений и животных. Он составляет около 0,3% человеческого тела. Это компонент некоторых белков. Он также помогает нашему организму противостоять бактериям, способствует выработке инсулина и помогает поддерживать здоровье суставов, кожи, волос, ногтей и соединительных тканей.
Сбалансированная диета должна удовлетворять потребности организма в сере.Богатые белком продукты — яйца, мясо, птица, рыба, молочные и соевые продукты — являются хорошими источниками диетической серы. Брассика (брокколи и капуста), лук, чеснок и спаржа также являются источником диетической серы.
Когда организм переваривает богатую серой пищу, в качестве побочного продукта образуется сероводород. Это газ, от которого пердит пахнет тухлыми яйцами — и придает Роторуа его знаменитый запах.
Сера необходима для роста растений. Помимо того, что сера важна для некоторых растительных белков, она способствует развитию хлорофилла и фиксации азота в бобовых.Большая часть серы в почве поступает из органических веществ и выветрившихся горных пород. Мы используем удобрения, чтобы обогащать почву важными элементами.
С другой стороны, сера может остановить жизнь. Люди давно используют серу для борьбы с насекомыми, плесенью и бактериями. Высокие концентрации сероводорода (намного превышающие то, что вырабатывается в нашем кишечнике) могут вызвать паралич дыхания, что приведет к смерти. Это просто показывает, что все дело в дозе.
Прочие применения
Сера наиболее широко используется для производства серной кислоты для производства фосфатов для удобрений.Он также используется для упрочнения резины, чтобы сделать такие изделия, как шины, обувь и шланги, более долговечными.
Еще одно обычное применение серы — это спички. Многие спички состоят из хлората калия, серы, порошкового стекла и желатина (который удерживает все материалы на дереве). Проведение спичечной головки по поражающей поверхности вызывает трение и нагрев, а затем — пламя. Хлорат калия выделяет кислород, а сера соединяется с кислородом и поддерживает огонь. Деревянная спичка также служит источником топлива.Характерный запах горящей спички исходит от серы.
Природный газ, используемый для отопления и приготовления пищи, не имеет запаха, цвета и вкуса. Соединения серы добавляются в природный газ, поэтому мы можем обнаружить даже малейшую утечку. Скунсы также используют серу для защиты. Они используют спрей на основе серы, достаточно сильный, чтобы отпугнуть медведей. Он настолько сильный, что с подветренной стороны люди могут почувствовать запах брызг на расстоянии нескольких километров!
Связанное содержание
Узнайте больше о минералах.
В отношении здоровья человека сера является макроминералом. О витаминах и минералах, необходимых для здорового питания, читайте в статье Микронутриенты.
Полезные ссылки
Узнайте больше о сере на этих веб-сайтах:
Загрузите эту бесплатную электронную книгу Making Superphosphate . Он был написан для поддержки учебной программы по химии в средней школе и описывает химические процессы, участвующие в производстве суперфосфатных удобрений на заводе по производству удобрений Ravensdown в Данидине.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Твердость твердых веществ — шлифовальная сера
Твердость вещества зависит от природы и силы связей, которые связывают атомы, молекулы или ионы в кристаллической решетке. Твердые тела с трехмерной ковалентной сеткой, такие как алмаз и кремний, твердые и хрупкие, потому что связи, удерживающие кристалл вместе, довольно прочны. Поскольку прочность этих связей зависит от хорошего перекрытия валентных орбиталей, попытки деформировать твердые тела приведут к разрыву связей и разрушению кристалла, как это видно в случае кремния.Графит представляет собой твердое тело с двумерной ковалентной сеткой. Хотя связи внутри гексагональных слоев очень прочные, только слабые силы Лондона должны преодолеваться при скольжении слоев друг относительно друга; следовательно, графит — мягкий материал. Точно так же межмолекулярные силы, удерживающие вместе спиральные цепи селена, слабы, поэтому это вещество также мягкое. Как и большинство молекулярных веществ, сера и йод легко измельчаются.
В дисульфиде молибдена ковалентные связи между атомами молибдена и серы сильны, но атомы серы в соседних слоях связаны только слабыми силами Лондона.Таким образом, MoS 2 легко разрезать на очень тонкие листы.
Хотя атомы металла связаны морем делокализованных электронов, прочность связей широко варьируется, частично в зависимости от размера атомов металла и количества связывающих электронов. Таким образом, литий легко режется, свинец и олово могут сплющиваться при приложении давления, а магний, железо и цинк настолько твердые, что их нельзя измельчить с помощью ступки и пестика. Свинец и олово можно деформировать без разрушения, поскольку прочность металлических связей гораздо менее чувствительна к положению атомов, чем прочность ковалентных связей.Твердость металла не связана с его кристаллической структурой. Хотя литий мягкий, а железо твердое, оба металла имеют объемноцентрированную кубическую решетку. Также показана гранецентрированная кубическая (кубическая плотнейшая упаковка) элементарная ячейка свинца.
Химия кислорода и серы
Химия кислорода
и сера
Химия
Кислород
Кислород — самый распространенный элемент на этой планете. В
земная кора 46.6% кислорода по весу, океаны — 86%
кислород по весу, а атмосфера составляет 21% кислорода по объему. В
название кислород происходит от греческого слова oxys ,
«кислота» и gennan , чтобы образовать или
генерировать ». Таким образом, кислород буквально означает« кислота ».
бывшее «. Это имя было введено Лавуазье, который заметил
что соединения, богатые кислородом, такие как SO 2 и P 4 O 10 ,
растворяются в воде с образованием кислот.
Электронная конфигурация атома кислорода [He] 2 с 2
2 p 4 предполагает, что нейтральные атомы кислорода могут
получить октет валентных электронов, разделив две пары
электроны с образованием двойной связи O = O, как показано на рисунке
ниже.
Согласно этой структуре Льюиса, все электроны в
O 2 молекулы парные. Следовательно, соединение должно
быть диамагнитным он должен отталкиваться
магнитное поле. Экспериментально установлено, что O 2 парамагнитен
это
притягивается к магнитному полю. Это можно объяснить, если предположить
что есть два неспаренных электрона в * разрыхляющей связке
молекулярные орбитали молекулы O 2 .
| На этой фотографии видно, что жидкость O 2 настолько сильно притягивается магнитным полем, что преодолеть разрыв между полюсами подковообразного магнита. |
При температурах ниже -183 o C, O 2
конденсируется с образованием жидкости характерного голубого цвета
который возникает в результате поглощения света с длиной волны
630 нм.Это поглощение не наблюдается в газовой фазе и
относительно слабый даже в жидкости, потому что для этого требуется три
тела
сталкиваются две молекулы O 2 и фотон
одновременно, что является очень редким явлением даже в
жидкая фаза.
Химия
Озон
Молекула O 2 — не единственная элементарная форма
кислород. При наличии молнии или другого источника
искра, O 2 молекулы диссоциируют с образованием атомов кислорода.
| искра | |||
| O 2 ( г ) | 2 O ( г ) |
Эти атомы O могут реагировать с молекулами O 2 с образованием
озон, O 3 ,
| O 2 ( г ) | + | O ( г ) | O 3 ( г ) |
, структура Льюиса которого показана на рисунке
ниже.
Кислород (O 2 ) и озон (O 3 ) являются примерами.
из аллотропов (от греческого значения «в
другой способ «). По определению, аллотропы разные
формы элемента. Потому что у них разные структуры,
аллотропы обладают разными химическими и физическими свойствами (см.
Таблица ниже).
Свойства аллотропов кислорода
| Кислород (O 2 ) | Озон (O 3 ) | |||
| Точка плавления | -218.75 o С | -192,5 o С | ||
| Температура кипения | -182.96 o С | -110,5 o С | ||
| Плотность (при 20 o C) | 1,331 г / л | 1.998 г / л | ||
| Порядок облигаций O-O | 2 | 1,5 | ||
| Длина соединения O-O | 0,1207 нм | 0,1278 нм |
Озон — нестабильное соединение с резким резким запахом, которое
медленно разлагается до кислорода.
| 3 O 3 ( г ) | 3 O 2 ( г ) |
При низких концентрациях озон может быть относительно приятным.(В
характерный запах чистоты, связанный с летними грозами,
из-за образования небольших количеств O 3 .)
Воздействие O 3 при более высоких концентрациях приводит к
кашель, учащенное сердцебиение, боль в груди и общие
телесная боль. При концентрациях выше 1 ppm озон токсичен.
Одним из характерных свойств озона является его способность
поглощать излучение в ультрафиолетовой части спектра (
> 300 нм), тем самым обеспечивая фильтр, защищающий нас от
воздействие высокоэнергетического ультрафиолетового излучения солнца.Мы сможем понять важность этого фильтра, если подумаем о
что происходит, когда наша кожа поглощает солнечное излучение.
Электромагнитное излучение в инфракрасном, видимом и
низкоэнергетические участки ультрафиолетового спектра (<300 нм)
несет достаточно энергии, чтобы возбудить электрон в молекуле в
орбиталь с более высокой энергией. Этот электрон в конечном итоге возвращается в
орбитали, с которой он был возбужден, и энергия передается на
окружающие ткани в виде тепла.Любой, у кого есть
пострадавшие от солнечных ожогов могут оценить болезненные последствия
чрезмерного количества этого излучения.
Излучение в высокоэнергетической части ультрафиолета
спектр (300 нм) при поглощении оказывает другое действие.
Это излучение несет достаточно энергии, чтобы ионизировать атомы или
молекулы. Ионы, образующиеся в этих реакциях, имеют нечетное число
электронов и чрезвычайно реактивны. Они могут вызвать постоянное
повреждают клеточную ткань и вызывают процессы, которые в конечном итоге
привести к раку кожи.Относительно небольшое количество этого излучения
поэтому может оказывать сильное воздействие на живые ткани.
В 1974 г. Молина и Роуленд указали, что
хлорфторуглероды, такие как CFCl 3 и CF 2 Cl 2 ,
которые использовались в качестве хладагентов и пропеллентов в аэрозолях
банки начали накапливаться в атмосфере. в
стратосферы, на высотах от 10 до 50 км над земной
поверхности, хлорфторуглероды разлагаются с образованием атомов Cl и
оксиды хлора, такие как ClO, когда они поглощают солнечный свет.Атомы Cl
и молекулы ClO имеют нечетное количество электронов, как показано на
рисунок ниже.
В результате эти вещества необычно реакционноспособны. в
атмосфере, они реагируют с озоном или с атомами кислорода, которые
необходимы для образования озона.
| Класс | + | О 3 | ClO | + | О 2 | |
| ClO | + | O | Класс | + | О 2 |
Молина и Роуленд предположили, что эти вещества могут
в конечном итоге разрушить озоновый щит в стратосфере, с
опасные последствия для биологических систем, которые могут быть
подвергается повышенному воздействию ультрафиолетового излучения высокой энергии.
Кислород как
Окислитель
Фтор — единственный элемент, который более электроотрицателен, чем
кислород. В результате кислород приобретает электроны практически во всех
химические реакции. Каждая молекула O 2 должна получить четыре
электронов, чтобы удовлетворить октеты двух атомов кислорода без
обмен электронами, как показано на рисунке ниже.
Таким образом, кислород окисляет металлы с образованием солей, в которых
атомы кислорода формально присутствуют в виде ионов O 2-.Ржавчина
образуется, например, когда железо реагирует с кислородом в присутствии
воды, чтобы получить соль, формально содержащую Fe 3+
и ионов O 2-, в среднем три молекулы воды
координирован с каждым из ионов Fe 3+ в этом твердом теле.
| H 2 O | |||||
| 4 Fe ( s ) | + | 3 O 2 ( г ) | 2 Fe 2 O 3 ( s ) 3 H 2 O |
Кислород также окисляет неметаллы, такие как углерод, с образованием
ковалентные соединения, в которых кислород формально окисляется
количество -2.
| C ( с ) | + | O 2 ( г ) | CO 2 ( г ) |
Кислород — прекрасный пример окислителя
потому что он увеличивает степень окисления практически любого вещества
с которой он реагирует. В ходе своих реакций кислород
уменьшенный. Таким образом, вещества, с которыми он вступает в реакцию, снижают
Агенты .
Пероксиды
Требуется четыре электрона, чтобы восстановить молекулу O 2 до
пара ионов O 2-. Если реакция прекращается после O 2
молекула получила только два электрона, O 2 2-
ион, показанный на рисунке ниже.
У этого иона на два электрона больше, чем у нейтрального O 2
молекула, что означает, что атомы кислорода должны иметь только одну
одна пара связывающих электронов для достижения октета валентности
электроны.Ион O 2 2- называется пероксидом
ион, потому что соединения, содержащие этот ион, необычайно богаты
кислород. Это не просто оксиды, это (гипер) пероксиды.
Самый простой способ приготовить перекись — провести реакцию натрия или
металлический барий с кислородом.
| 2 Na ( с ) | + | O 2 ( г ) | Na 2 O 2 ( с ) | ||
| Ba ( s ) | + | O 2 ( г ) | BaO 2 ( с ) |
Когда эти пероксиды вступают в реакцию с сильной кислотой,
перекись водорода (H 2 O 2 ).
| BaO 2 ( с ) | + | 2 H + ( водн. ) | Ba 2+ ( водн. ) | + | H 2 O 2 ( водн. ) |
Структура Льюиса перекиси водорода содержит O-O
одинарная связь, как показано на рисунке ниже.
Теория VSEPR предсказывает, что геометрия вокруг каждого кислорода
атом в H 2 O 2 должен быть изогнут. Но это
теория не может предсказать, должны ли четыре атома находиться в
в той же плоскости или следует визуализировать молекулу лежащей
в двух пересекающихся плоскостях. Экспериментально определенная
Структура H 2 O 2 показана на рисунке
ниже.
Валентный угол H-O-O в этой молекуле лишь немного больше
чем угол между парой соседних 2 p атомных
орбитали на атоме кислорода, а угол между плоскостями
образующие молекулу немного больше тетраэдрической
угол.
Степень окисления атомов кислорода в перекиси водорода
равно -1. H 2 O 2 , следовательно, может действовать как
окислитель и захватить еще два электрона, чтобы сформировать пару
гидроксид-ионы, в которых кислород имеет степень окисления
-2.
| H 2 O 2 | + | 2 e — | 2 ОН — |
Или он может действовать как восстанавливающий агент и потерять пару
электроны с образованием молекулы O 2 .
| H 2 O 2 | О 2 | + | 2 ч + | + | 2 e — |
Реакции, в которых соединение одновременно подвергается обоим
окисление и восстановление называются диспропорционированием
Реакция . Продукты диспропорционирования H 2 O 2
кислород и вода.
| 2 H 2 O 2 ( водн. ) | O 2 ( г ) | + | 2 H 2 O ( л ) |
Диспропорционирование H 2 O 2 является
экзотермическая реакция.
| 2 H 2 O 2 ( водн. ) | O 2 ( г ) | + | 2 H 2 O ( л ) | H o = -94.6 кДж / моль H 2 O |
Эта реакция является относительно медленной, однако в отсутствие
катализатор, например пыль или металлическая поверхность. Основные виды использования
H 2 O 2 вращаются вокруг его окислительной способности.
Используется в разбавленных (3%) растворах как дезинфицирующее средство. В большем
концентрированные растворы (30%), используется как отбеливающий агент для
волосы, мех, кожа или древесная масса, из которой делают бумагу.В очень
концентрированные растворы, H 2 O 2 было использовано
в качестве ракетного топлива из-за легкости, с которой оно разлагается на
дать О 2 .
Методы
Подготовка O 2
Небольшие количества газа O 2 можно приготовить в
количество способов.
1. Разложив разбавленный раствор перекиси водорода с помощью
пыль или металлическая поверхность в качестве катализатора.
| 2 H 2 O 2 ( водн. ) | O 2 ( г ) | + | 2 H 2 O ( л ) |
2. Путем реакции перекиси водорода с сильным окислителем.
агент, такой как перманганат-ион, MnO 4 — .
| 5 H 2 O 2 ( водн. ) | + | 2 MnO 4 — ( водн. ) | + | 6 ч + ( водн. ) | 2 Mn 2+ ( водн. ) | + | 5 O 2 ( г ) | + | 8 H 2 O ( л ) |
3.Пропуская электрический ток через воду.
| электролизный | ||||
| 2 H 2 O ( л ) | 2 H 2 ( г ) | + | O 2 ( г ) |
4.При нагревании хлората калия (KClO 3 ) в
наличие катализатора до его разложения.
| MnO 2 | ||||
| 2 KClO 3 ( с ) | 2 KCl ( с ) | + | 3 O 2 ( г ) |
Химия
Сера
Поскольку содержание серы в периодической таблице находится непосредственно под кислородом,
эти элементы имеют похожие электронные конфигурации.Как результат,
сера образует множество соединений, являющихся аналогами кислородных соединений,
как показано в таблице ниже. Примеры в этой таблице показывают, как
префикс thio — может использоваться для обозначения соединений, в которых
сера заменяет атом кислорода. Тиоцианат (SCN — )
ион, например, является серосодержащим аналогом цианата
(OCN — ) ион.
Соединения кислорода и их серные аналоги
| Кислородные соединения | Соединения серы | |
| Na 2 O (оксид натрия) | Na 2 S (сульфид натрия) | |
| H 2 O (вода) | H 2 S (сероводород) | |
| O 3 (озон) | SO 2 (диоксид серы) | |
| CO 2 (диоксид углерода) | CS 2 (сероуглерод) | |
| OCN — (цианат) | SCN — (тиоцианат) | |
| OC (NH 2 ) 2 (мочевина) | SC (NH 2 ) 2 (тиомочевина) |
Существует четыре основных различия между химическим составом
сера и кислород.
1. Двойные связи O = O намного прочнее двойных связей S = S.
2. Одинарные связи S-S почти в два раза прочнее одинарных O-O.
облигации.
3. Сера ( EN = 2,58) гораздо менее электроотрицательна.
чем кислород ( EN = 3,44).
4. Сера может расширять свою валентную оболочку, удерживая более восьми
электроны, а кислород — нет.
Эти, казалось бы, незначительные различия имеют важные последствия.
для химии этих элементов.
Эффект
Различия в силе связей X-X и X = X
Радиус атома серы примерно на 60% больше, чем у атома серы.
атом кислорода.
В результате атомам серы труднее подойти близко
достаточно вместе, чтобы образовать узы. Таким образом, двойные связи S = S являются
намного слабее, чем двойные связи O = O.
Двойные связи между серой и атомами кислорода или углерода могут быть
содержится в таких соединениях, как SO 2 и CS 2 (см.
рисунок ниже).Но эти двойные связи намного слабее, чем
эквивалентные двойные связи с атомами кислорода в O 3 или CO 2 .
Энтальпия диссоциации связи для двойной связи C = S составляет 477
кДж / моль, например, тогда как энтальпия диссоциации связи для
Двойная связь C = O составляет 745 кДж / моль.
Элементарный кислород состоит из молекул O 2 , в которых
каждый атом завершает свой октет валентных электронов, разделяя два
пары электронов с одним соседним атомом.Потому что сера
не образует прочных двойных связей S = S, элементарная сера обычно
состоит из циклических молекул S 8 , в которых каждый атом
завершает свой октет, образуя одинарные связи с двумя соседними
атомов, как показано на рисунке ниже.
S 8 молекул могут упаковываться, образуя более одной
кристалл. Самая стабильная форма серы состоит из орторомбической
кристаллы молекул S 8 , которые часто встречаются вблизи
вулканы.Если эти кристаллы нагреть до плавления и
расплавленная сера затем охлаждается, аллотроп серы, состоящий из
моноклинных кристаллов молекул S 8 составляет
сформирован. Эти моноклинные кристаллы медленно трансформируются.
в более стабильную орторомбическую структуру за период
время.
Склонность элемента к образованию связей с самим собой называется цепью
(от латинского catena , «цепочка»). Так как
сера образует необычно прочные одинарные связи S-S, лучше при
катенации, чем любой элемент, кроме углерода.В результате
ромбические и моноклинные формы серы — не единственные
аллотропы элемента. Также существуют аллотропы серы, которые
различаются размером молекул, образующих кристалл. Циклический
молекулы, содержащие 6, 7, 8, 10 и 12 атомов серы, являются
известен.
Сера плавится при 119,25 o C с образованием желтой жидкости.
которая менее вязкая, чем вода. Если эту жидкость нагреть до 159 o ° C,
превращается в темно-красную жидкость, которую невозможно вылить из его
контейнер.Вязкость этой темно-красной жидкости в 2000 раз.
больше, чем у расплавленной серы, потому что циклический S 8
молекулы открываются и соединяются вместе, образуя длинные цепочки из
около 100 000 атомов серы.
Когда сера вступает в реакцию с активным металлом, она может образовывать
сульфид-ион, S 2-.
| 16 К ( с ) | + | S 8 ( S ) | 8 К 2 S ( s ) |
Однако это не единственный продукт, который можно получить.А
может быть произведено множество полисульфид-ионов с зарядом -2
которые различаются количеством атомов серы в цепи.
Эффект
Различия электроотрицательностей серы и кислорода
Поскольку сера гораздо менее электроотрицательна, чем кислород, она
с большей вероятностью образовывать соединения, в которых он имеет положительный
степень окисления (см. таблицу ниже).
Общие числа окисления для серы
| Окисление Число | Примеры | |
| -2 | Na 2 S, H 2 S | |
| -1 | Na 2 S 2 , H 2 S 2 | |
| 0 | S 8 | |
| +1 | S 2 Класс 2 | |
| +2 | S 2 O 3 2- | |
| +2 1 / 2 | S 4 O 6 2- | |
| +3 | S 2 O 4 2- | |
| +4 | SF 4 , SO 2 , H 2 SO 3 , СО 3 2- | |
| +5 | S 2 O 6 2- | |
| +6 | SF 6 , SO 3 , H 2 SO 4 , СО 4 2- |
Теоретически сера может реагировать с кислородом с образованием либо SO 2
или SO 3 , чьи структуры Льюиса приведены на рисунке
ниже.
| СО 2 | |
| СО 3 |
На практике при сжигании сернистых соединений образуется SO 2 ,
независимо от того, сжигается ли сера или соединение серы.
| S 8 ( S ) | + | 8 O 2 ( г ) | 8 SO 2 ( г ) | |||
| CS 2 ( л ) | + | 3 O 2 ( г ) | CO 2 ( г ) | + | 2 SO 2 ( г ) | |
| 3 FeS 2 ( с ) | + | 8 O 2 ( г ) | Fe 3 O 4 ( с ) | + | 6 SO 2 ( г ) |
Хотя образующийся в этих реакциях SO 2 должен
реагирует с O 2 с образованием SO 3 , скорость этого
реакция очень медленная.Скорость конверсии СО 2
в SO 3 можно значительно увеличить, добавив
соответствующий катализатор.
| В 2 О 5 / К 2 О | ||
| 2 SO 2 ( г ) | 2 SO 3 ( г ) |
Огромное количество SO 2 производится промышленностью
каждый год, а затем конвертируется в SO 3 , который можно использовать
для производства серной кислоты, H 2 SO 4 .Теоретически,
серную кислоту можно получить путем растворения газа SO 3 в
вода.
| SO 3 ( г ) | + | H 2 O ( л ) | H 2 SO 4 ( водн. ) |
На практике это неудобно. Вместо этого SO 3
абсорбируется 98% H 2 SO 4 , где он реагирует
с водой для образования дополнительных H 2 SO 4
молекулы.Затем при необходимости добавляют воду, чтобы
концентрация этого раствора от 96% до 98% H 2 SO 4
по весу.
Серная кислота на сегодняшний день является наиболее важным промышленным продуктом.
химический. Утверждалось даже, что существует прямое
соотношение между количеством серной кислоты в стране
потребляет и его уровень жизни. Более 50%
ежегодно производимая серная кислота используется для производства удобрений. В
остальное используется для изготовления бумаги, синтетических волокон и текстиля,
инсектициды, моющие средства, кормовые добавки, красители, лекарства,
антифриз, краски и эмали, линолеум, синтетический каучук,
печатные краски, целлофан, фотопленка, взрывчатые вещества,
автомобильные аккумуляторы и металлы, такие как магний, алюминий,
железо и сталь.
Серная кислота диссоциирует в воде с образованием HSO 4 —
ион, известный как гидросульфатный или бисульфатный ион.
| H 2 SO 4 ( водн. ) | H + ( водн. ) | + | HSO 4 — ( водн. ) |
10% этих ионов гидросульфата диссоциируют с образованием
SO 4 2-, или сульфат-ион.
| HSO 4 — ( водн. ) | H + ( водн. ) | + | SO 4 2- ( водн. ) |
При замене H + можно образовать различные соли.
ионы в серной кислоте с положительно заряженными ионами, такие как
Ионы Na + или K + .
| NaHSO 4 | = | гидросульфат натрия |
| Na 2 SO 4 | = | натрия сульфат |
Диоксид серы растворяется в воде с образованием серной кислоты.
| SO 2 ( г ) | + | H 2 O ( л ) | H 2 SO 3 ( водн. ) |
Сернистая кислота не так сильно диссоциирует в воде
как серную кислоту, но еще можно заменить H +
ионы в H 2 SO 3 с положительными ионами с образованием
соли.
| NaHSO 3 | = | гидросульфит натрия |
| Na 2 SO 3 | = | натрия сульфит |
Серная кислота и сернистая кислота являются примерами класса
соединений, известных как оксикислоты , потому что они
буквально кислоты, содержащие кислород. Потому что они отрицательные
ионы (или анионы), содержащие кислород, SO 3 2-
и ионы SO 4 2- известны как оксианионы .Льюисовские структуры некоторых оксидов серы, образующих
оксикислоты или оксианионы приведены в таблице ниже.
Один из этих оксианионов заслуживает особого упоминания. Этот ион,
который известен как ион тиосульфата, образуется в результате реакции
между серой и ионом сульфита (SO 3 2-).
| 8 SO 3 2- ( водн. ) | + | S 8 ( S ) | 8 S 2 O 3 2- ( водн. ) | |
Эффект
Различия в способности серы и кислорода расширять свои
Валанс Шелл
Электронные конфигурации кислорода и серы обычно
написано следующим образом.
| O | = | [He] 2 с 2 2 с 4 | |
| S | = | [Ne] 3 с 2 3 с 4 |
Хотя это обозначение показывает сходство между
конфигурации двух элементов, он скрывает важную
разница, которая позволяет сере расширять свою валентную оболочку, чтобы удерживать
более восьми электронов.
Кислород реагирует с фтором с образованием OF 2 .
| O 2 ( г ) | + | 2 ф. 2 ( г ) | 2 ИЗ 2 ( г ) |
Реакция останавливается на этом этапе, потому что кислород может удерживать только
восемь электронов в валентной оболочке, как показано на рисунке
ниже.
Сера реагирует с фтором с образованием SF 4 и SF 6 ,
показано на рисунке ниже, потому что сера может расширять свою валентность
оболочка для хранения 10 или даже 12 электронов.
| S 8 ( S ) | + | 16 F 2 ( г ) | 8 SF 4 ( г ) | |
| S 8 ( S ) | + | 24 F 2 ( г ) | 8 SF 6 ( г ) |
Основы диоксида серы | Загрязнение диоксидом серы (SO2)
Что такое SO
2 и как он попадает в воздух?
Что такое SO
2 ?
Национальные стандарты качества окружающего воздуха
Агентства по охране окружающей среды для SO 2 разработаны для защиты от воздействия всей группы оксидов серы (SO x ).SO 2 представляет собой компонент, вызывающий наибольшую озабоченность, и используется в качестве индикатора для большей группы газообразных оксидов серы (SO x ). Другие газообразные SOx (например, SO 3 ) обнаруживаются в атмосфере в концентрациях намного ниже, чем SO 2 .
Как правило, можно ожидать, что меры контроля, снижающие SO 2 , уменьшат воздействие на людей всех газообразных SO x . Это может иметь важное сопутствующее преимущество, заключающееся в уменьшении образования твердых примесей серы, таких как мелкие частицы сульфата.
Выбросы, которые приводят к высоким концентрациям SO 2 , как правило, также приводят к образованию других SO x . Самыми крупными источниками выбросов SO 2 являются сжигание ископаемого топлива на электростанциях и других промышленных объектах.
Как SO
2 попадает в воздух?
Самым крупным источником SO 2 в атмосфере является сжигание ископаемого топлива на электростанциях и других промышленных объектах. К меньшим источникам выбросов SO 2 относятся: промышленные процессы, такие как извлечение металла из руды; природные источники, такие как вулканы; а также локомотивы, корабли и другие транспортные средства и тяжелое оборудование, сжигающие топливо с высоким содержанием серы.
Начало страницы
Каковы вредные эффекты SO
2 ?
SO 2 может повлиять как на здоровье, так и на окружающую среду.
Какое воздействие на здоровье оказывает SO
2 ?
Кратковременное воздействие SO 2 может нанести вред дыхательной системе человека и затруднить дыхание. Люди, страдающие астмой, особенно дети, чувствительны к этим эффектам SO 2 .
SO 2 Выбросы, которые приводят к высоким концентрациям SO 2 в воздухе, обычно также приводят к образованию других оксидов серы (SO x ).SO x может реагировать с другими соединениями в атмосфере с образованием мелких частиц. Эти частицы способствуют загрязнению твердыми частицами (ТЧ). Мелкие частицы могут глубоко проникать в легкие и в достаточном количестве могут вызвать проблемы со здоровьем.
Какое воздействие на окружающую среду оказывает SO
2 и другие оксиды серы?
При высоких концентрациях газообразный SOx может нанести вред деревьям и растениям, повреждая листву и замедляя рост.
SO 2 и другие оксиды серы могут способствовать образованию кислотных дождей, которые могут нанести вред чувствительным экосистемам.
Видимость
SO 2 и другие оксиды серы могут реагировать с другими соединениями в атмосфере с образованием мелких частиц, которые уменьшают видимость (дымку) в некоторых частях Соединенных Штатов, включая многие из наших ценных национальных парков и дикой природы.
Осаждение частиц также может окрашивать и повреждать камень и другие материалы, включая культурно важные объекты, такие как статуи и памятники.
Начало страницы
Что делается для уменьшения загрязнения SO
2 ?
Национальные и региональные правила Агентства по охране окружающей среды по сокращению выбросов SO 2 и загрязнителей, образующих оксиды серы (SO x ), помогут правительствам штатов и местным органам власти соответствовать национальным стандартам качества воздуха Агентства.
EPA определяет районы, где качество воздуха не соответствует стандартам EPA SO 2 . Для этих территорий правительства штатов, местных властей и племен разрабатывают планы по сокращению количества SO 2 в воздухе.
Начало страницы
Выделение элементарной серы как вещества, ингибирующего рост, продуцируемого Legionella pneumophila
РЕЗЮМЕ
Добавление смолы HP-20 в среду могло усилить рост видов Legionella .Элементарная сера была выделена как вещество, ингибирующее саморазвитие, эндогенно продуцируемое Legionella pneumophila из метанольных экстрактов смол, используемых для культивирования бактерий. Элементарная сера проявляет сильную ингибирующую активность по отношению ко всем протестированным видам Legionella .
Legionella pneumophila , повсеместная грамотрицательная бактерия, обнаруженная в природных или искусственных водных системах. Его естественными хозяевами, вероятно, являются различные виды амеб. Если люди вдыхают аэрозольную воду из источников, загрязненных л.pneumophila , например, в градирнях или гидромассажных ваннах, бактерия может вторгаться и размножаться в альвеолярных макрофагах, вызывая тяжелую форму пневмонии, называемую болезнью легионеров (4, 9). Если пневмонию не лечить быстро антибиотиками, эффективными против бактерии, уровень смертности может приближаться к 30-40%. Поэтому контроль и регулирование заражения Legionella в некоторых водных системах очень важны.
L. pneumophila требует специальных сред для роста (7).Он не может сбраживать углеводы, но может использовать некоторые аминокислоты в качестве основных источников углерода и энергии. Железо (III) и l-цистеин являются питательными веществами, необходимыми для его роста. В дополнение к этим требованиям, добавление активированного угля в среду для выделения и культивирования L. pneumophila широко практикуется, поскольку такое добавление может значительно усилить рост бактерии. Считается, что одна из функций древесного угля заключается в каталитическом разложении активированного кислорода, образующегося во время культивирования (3).С другой стороны, активированный уголь обладает хорошими адсорбционными свойствами. Таким образом, можно легко предположить, что древесный уголь играет важную роль в абсорбции и детоксикации неизвестного токсичного вещества, которое может подавлять рост бактерий. Однако не было предпринято никаких попыток выяснить, присутствует ли ингибирующее рост вещество, адсорбированное на активированном угле. Если мы предположим, что это вещество эндогенно продуцируется бактерией как фактор ингибирования роста и имеет высокую специфичность в отношении роста Legionella , то такое вещество может быть очень полезным в качестве ведущего соединения при разработке эффективных лекарств для предотвращения Загрязнение водных систем легионеллой .Эта идея подтолкнула нас к изучению вещества. В наших предварительных экспериментах мы обнаружили, что активированный уголь можно заменить смолой Diaion HP-20 для культуры L. pneumophila и что метанольные экстракты смол Diaion HP-20, которые использовались для культивирования L. pneumophila , проявляют сильную ингибирующую активность по отношению к бактериям. Таким образом, мы попытались выделить действующее начало из экстрактов метанола и идентифицировали его как элементарную серу.
В этой статье мы описываем выделение элементарной серы, эндогенно продуцируемой L.pneumophila и его биологическая активность в качестве ингибитора роста бактерий.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы бактерий.
L. pneumophila серогруппа 1 GIFU9134, полученная из исходной культуры Департамента микробиологии Медицинской школы Университета Гифу, использовалась в этом исследовании. Этот штамм поддерживали на забуференной среде древесного угля и дрожжевого экстракта альфа (BCYEα) -агар (1) и пересевали ежемесячно. Суспензию клеток готовили из 2-дневной культуры и использовали в качестве инокулята. Legionella bozemanii серогруппы 1 GIFU9140, полученный из исходной культуры отделения микробиологии медицинского факультета Университета Гифу; L. pneumophila серогруппа 1 P4202, Legionella dumoffii P4201 и Pseudomonas putida SN2845, выделенные нами из воды градирен; и Staphylococcus aureus IAM1011, Micrococcus luteus IAM1056, Pseudomonas aeruginosa IAM1514, Escherichia coli IAM12119 и Micrococter aerogenes, gal и культура Micrococter aerogenes из Токийского научно-исследовательского центра были получены из запасов и культуры IAM1102 Токийского университета. используются в качестве тестовых микроорганизмов для измерения бактерицидной активности элементарной серы.
Динамика роста L. pneumophila . Клеточную суспензию (100 мкл; 10 5 КОЕ) L. pneumophila GIFU9134 инокулировали в колбу Сакагучи объемом 500 мл, содержащую 100 мл среды, обозначенной L. (0,1% α-кетоглутаровая кислота, 0,5% K 2 HPO 4 , 1,5% дрожжевой экстракт, 0,3% NaCl, 0,1% [6,3 мМ] l-цистеина гидрохлорид, 0,05% пирофосфат железа [pH 6,8]) с или без 5% Диаиона HP-20 (Mitsubishi Chemical Corp.). Колбу инкубировали при 37 ° C и встряхивали при 120 об / мин, и образцы культуральной жидкости получали с 24-часовыми интервалами в течение 7 дней.Количество жизнеспособных клеток в каждом образце подсчитывали на чашке с агаром BCYEα.
Производство ингибитора роста с помощью L. pneumophila . Клеточную суспензию L. pneumophila GIFU9134 инокулировали в колбу Сакагучи на 500 мл, содержащую 100 мл среды L с 5% диаиона HP-20, и культивировали при 37 ° C и встряхивали при 120 об / мин в течение 7 дней. Культуральный бульон (100 мл) помещали в колонку с ватным тампоном для отделения смол от бактериальных клеток. Таким образом, первый остался в столбце, а второй прошел через столбец.После промывания водой (50 мл) смолы экстрагировали метанолом (50 мл). Раствор в метаноле концентрировали в вакууме и фракционировали между этилацетатом (5 мл) и водой (5 мл). После концентрирования каждой фракции остаток (3,0 мг из этилацетатной фракции и 38,7 мг из водной фракции) использовали для анализа для измерения бактерицидной активности. Когда был приготовлен образец из среды L без культивирования бактерии, та же процедура была проделана без инокуляции бактерии.В этом случае 2,0 и 41,3 мг образцов были получены из этилацетатной и водной фракций соответственно.
Когда использовали среду без смол, бактерии культивировали в среде L без смол Diaion HP-20 в тех же условиях, упомянутых выше. После 7 дней культивирования культуральный бульон (100 мл) центрифугировали (6400 × г, , 30 мин) для получения культурального супернатанта, и к супернатанту добавляли смолы Diaion HP-20 (5 г). После инкубации смеси в течение 24 часов смолы были выделены и образцы для анализа (2.0 мг из этилацетатной фракции и 36,9 мг из водной фракции) получали из метанольных экстрактов смол в соответствии с той же процедурой, указанной выше.
Выделение элементарной серы Клетки L. pneumophila GIFU9134, сохраненные на скошенном агаре, высевали в колбу Эрленмейера на 500 мл, содержащую 100 мл среды L с 5% диаиона HP-20, культивировали при 37 ° C и встряхивали. при 120 об / мин в течение 2 суток. Эту культуру (25 мл) переносили в ту же среду (1000 мл), что и для основной культуры.Инкубацию проводили при 37 ° C со встряхиванием при 120 об / мин в течение 7 дней. Культуральный бульон (20 литров) помещали в колонку с ватной пробкой для отделения смол. После промывания водой (5 литров) колонку со смолами элюировали метанолом (3 литра). Раствор в метаноле концентрировали в вакууме с получением сырых экстрактов (8,5 г). Экстракты смешивали с деионизированной водой (500 мл), и смесь трижды экстрагировали 500 мл этилацетата. После упаривания этилацетатного раствора остаток (1.0 г) наносили на колонку с силикагелем (10 г; Silica gel 60 [Merck]). Колонку элюировали n -гексаном (100 мл), и фракцию n -гексана (12 мг) дополнительно очищали нормально-фазовой высокоэффективной жидкостной хроматографией (ВЭЖХ) (колонка, Senshu pak Pegasil Silica [ 4,6 на 250 мм]; подвижная фаза, n -гексан; скорость потока 2,0 мл / мин) для получения активного компонента (время удерживания 2,5 мин [3,5 мг]). В спектре активного компонента (положительный, без матрицы; Voyager DE-STR [Perkin-Elmer Biosystems]) в спектре активного компонента (положительный, без матрицы), ионов при m / z 160 (41), 192 (8), 224 (33), 256 (100) и 288 (72).Время удерживания активного компонента по данным ВЭЖХ с обращенной фазой (колонка, Capcell-Pak C 18 , 4,6 × 250 мм [Shiseido]; подвижная фаза, ацетонитрил; скорость потока 1,0 мин / мл) составляет 16,3 мин. Спектр МС и время удерживания подлинной элементарной серы были идентичны спектрам активного компонента.
Бактерицидная активность. Образцы растворяли в этаноле или диметилсульфоксиде в соответствующих концентрациях и раствор (10 мкл) смешивали с фосфатно-солевым буфером (990 мкл), содержащим клетки л.pneumophila GIFU9134 (10 4 КОЕ). После инкубации смеси при 37 ° C в течение 24 часов часть смеси (100 мкл) распределяли на чашке с агаром BCYEα, и образование колоний на чашке наблюдали через 6 дней инкубации при 37 ° C. Минимальная бактерицидная концентрация (МБК) была определена как самая низкая концентрация образца, при которой колонии на планшете не наблюдались.
РЕЗУЛЬТАТЫ
Культура L. pneumophila со смолами Diaion HP-20. Для исследования вещества, адсорбированного на активированном угле в культуральном бульоне объемом л.pneumophila необходимо отделить древесный уголь от бульона. Однако нелегко получить только частицы древесного угля из смеси древесного угля и бактериальных клеток, участвующих в бульоне. Поэтому мы протестировали использование смолы Diaion HP-20 вместо активированного угля для культивирования бактерии. Смола Diaion HP-20 представляет собой синтетический адсорбент из сшитого полистирола, и сферические частицы смолы диаметром 0,5 мм могут быть легко извлечены фильтрованием из культурального бульона без загрязнения бактериальных клеток.На рисунке 1 показана динамика роста L. pneumophila в среде со смолами Diaion HP-20 или без них. Когда бактерии культивировали со смолой HP-20, количество жизнеспособных клеток достигало максимума на 2 дня раньше, чем в случае, когда бактерии культивировали без смолы.
РИС. 1.
Динамика роста L. pneumophila , культивированного в среде с (○) или без (•) смол Diaion HP-20.
Производство ингибитора роста л.пневмофила. Затем мы исследовали, адсорбируют ли смолы Diaion HP-20 в среде для культуры L. pneumophila вещество, которое может влиять на рост самой бактерии. Чтобы выяснить, присутствует ли вещество, мы получили три образца смол Diaion HP-20 следующим образом. Сначала после 7 дней культивирования со средой, содержащей смолы Diaion HP-20, смолы извлекали из культуральной жидкости. Во-вторых, смолы Diaion HP-20 инкубировали в жидкой среде в течение 7 дней без инокуляции бактерий, и смолы извлекали.В-третьих, бактерии культивировали в среде без смол в течение 7 дней и к супернатанту культуры, полученному центрифугированием культуральной жидкости, добавляли смолы Diaion HP-20. После инкубации смол в супернатанте в течение 24 часов мы извлекли смолы. Каждый образец смол экстрагировали метанолом, экстракты метанола распределяли между этилацетатом и водой и измеряли бактерицидную активность каждого слоя в отношении самого L. pneumophila . В результате активность была обнаружена только во фракции органического слоя метанольных экстрактов, полученных из смол Diaion HP-20 первого эксперимента, т.е.е. смолы, извлеченные из культурального бульона после культивирования в среде со смолами Diaion HP-20. Анализ фракции показал, что активность с МБК составляет 25 мкг / мл.
Выделение и идентификация ингибитора роста. Затем мы попытались идентифицировать ингибитор роста, входящий в состав метанольных экстрактов смол Diaion HP-20, используемых для культивирования L. pneumophila . Процедура, использованная для выделения вещества, кратко изложена в таблице 1. Метанольные экстракты смол Diaion HP-20, выделенные из культуральной жидкости, распределяли между этилацетатом и водой.Затем этилацетатную фракцию наносили на колонку с силикагелем, и активное вещество элюировали с колонки n -гексаном. Фракцию n -гексана дополнительно очищали с помощью ВЭЖХ с нормальной фазой для получения активного начала.
ТАБЛИЦА 1.
Выделение ингибитора роста из смол Diaion HP-20 a , используемого для культивирования L. pneumophila
Не наблюдалось значимого сигнала в ядерно-магнитном резонансе 1 H и 13 C спектры, измеренные с помощью 3.5 мг образца при 500 и 125 МГц соответственно. Серия ионов, которые различались на 32 единицы массы, наблюдалась при m / z 160, 192, 224, 256 и 288 в спектре МС, а элементный анализ показал очень высокое (92,1%) содержание серы в образце. предполагая, что действующим веществом была элементарная сера. Действующее начало было окончательно идентифицировано как элементарная сера путем сравнения его времени удерживания на ВЭЖХ и биологической активности с таковыми у подлинной элементарной серы.
Антибактериальная активность элементарной серы.В таблице 2 показана бактерицидная активность элементарной серы против нескольких видов Legionella и других бактерий. Бактерицидную активность измеряли в буфере, содержащем клетки каждой бактерии и элементарную серу в серийных концентрациях. Все протестированных видов Legionella были уничтожены добавлением элементарной серы в низких концентрациях. Элементарная сера показала сильную активность в отношении Staphylococcus aureus и Enterobacter aerogenes , среди других протестированных бактерий.
ТАБЛИЦА 2.
Бактерицидная активность элементарной серы a
ОБСУЖДЕНИЕ
Известно, что добавление активированного угля в среду усиливает рост L. pneumophila. В этом исследовании мы сосредоточились на адсорбированном на древесном угле веществе, которое может подавлять рост бактерий. Поскольку активированный уголь трудно отделить от культурального бульона без загрязнения бактериальных клеток, мы разработали метод культивирования л.pneumophila со смолами Diaion HP-20 вместо активированного угля. Рост бактерии сильно ускорялся добавлением смол, и смолы можно было легко извлечь из культуральной жидкости. Кроме того, мы выделили элементарную серу в качестве ингибитора роста из метанольных экстрактов смол Diaion HP-20, используемых для культивирования L. pneumophila .
Тот факт, что метанольные экстракты смол Diaion HP-20 не проявляли активности по ингибированию роста в среде без культивирования бактерий, указывает на то, что элементарная сера не является составной частью среды.Следовательно, он продуцируется L. pneumophila эндогенно во время культивирования. Среда содержит 0,1% l-цистеина, но биосинтетическое происхождение элементарной серы в настоящее время неясно. Это производство элементарной серы бактерией наблюдалось в культуре со смолами Diaion HP-20, но не наблюдалось в культуре без смол, что позволяет предположить, что существуют различия не только в скорости роста, но и в части метаболизма между двумя условия культивирования. Известно, что некоторые бактерии производят элементарную серу.Накопление элементарной серы наблюдается в клетках Thiobacillus sp. (8), а элементарная сера известна как метаболит Streptomyces sp. (2, 6). Известно также, что элементарная сера обладает антибиотической активностью по отношению к некоторым бактериям (5).
Мы выделили 3,5 мг элементарной серы из смол Diaion HP-20, выделенных из 20 литров культурального бульона L. pneumophila . Судя по потере образца во время процедуры выделения (таблица 1) и бактерицидной активности элементарной серы (таблица 2), количество элементарной серы, продуцируемой бактерией, достаточно, чтобы подавить рост самой бактерии, если она присутствует в растворе.В настоящее время неясно, почему L. pneumophila продуцирует такое вещество, ингибирующее саморазвитие, или коррелирует ли потребность в l-цистеине для роста бактерии с производством элементарной серы. Однако наши результаты показали, что элементарная сера может быть хорошим кандидатом в качестве лекарственного средства для эффективного и недорогого предотвращения заражения Legionella в водных системах. В настоящее время ведется работа с использованием элементарной серы для предотвращения загрязнения гидромассажной ванны.
БЛАГОДАРНОСТИ
Эта работа была поддержана грантом на научные исследования (№ 12556016) Министерства образования, культуры, спорта, науки и технологий Японии.
СНОСКИ
- Получено 15 марта 2002 г.
- Принято 25 июля 2002 г.
- Авторские права © Американское общество микробиологии, 2002 г.
1981 г.Улучшенная полуселективная среда для изоляции Legionella pneumophila из зараженных клинических образцов и образцов окружающей среды. J. Clin. Microbiol.14 : 298-303. - 2.↵
Хаяси, Х., Н. Таруи и С. Мурао.
1985. Выделение и идентификация циклооктасеры, вещества, индуцирующего образование плодовых тел, продуцируемого Streptomyces albus TO447. Agric. Биол. Chem.49 : 101-105. - 3.↵
Hoffman, P.С., Л. Пайн и С. Белл.
1983. Производство супероксида и перекиси водорода в среде, используемой для культивирования Legionella pneumophila : каталитическое разложение древесным углем. Прил. Environ. Microbiol.45 : 784-791. - 4.↵
Horwitz, M.A., and S.C. Silverstein.
1980. Бактерия болезни легионеров ( Legionella pneumophila ) размножается внутриклеточно в моноцитах человека. J. Clin. Исследование 66 : 441-450. - 5.↵
Либенсон, Л., Ф. П. Хэдли, А. П. Макилрой, В. М. Ветцель и Р. Р. Меллон.
1953. Антибактериальный эффект элементарной серы. J. Infect. Дис.93 : 28-35. - 6.↵
Наканиши, С., С. Токи, Ю. Сайто, Э. Цукуда, К. Кавахара, К. Андо и Ю. Мацуда.
1995. Выделение ингибиторов киназы легкой цепи миозина из микроорганизмов: дегидроальтенузин, альтенузин, атровенетинон и циклооктасера.Biosci. Biotechnol. Biochem.59 : 1333-1335. - 7.↵
Пайн, Л., Дж. Р. Джордж, М. В. Ривз и В. К. Харрелл.
1979.
