Содержание
▶▷▶▷ схеме превращений s-2 s+4 соответствует уравнение
▶▷▶▷ схеме превращений s-2 s+4 соответствует уравнение
| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 29-04-2019 |
схеме превращений s-2 s 4 соответствует уравнение — Сокращенное ионное уравнение Cu2 S2- CuS соответствует znanijacomtask1189887 Cached Сокращенное ионное уравнение Cu2 S2- CuS соответствует схеме превращений 1) Cu S — CuS Какое вещество пропущено в цепочке превращений? Ca — Школьные znanijacomtask2163444 Cached Схеме превращений s-2 s0 соответствует уравнение В 2h3S O2 2h3O S Какой буквой обозначен фрагмент молекулярного уравнения химической реакции, соответствующий кратному ионному уравнению Тест (химия, 9 класс) по теме: Итоговая контрольная работа по nsportalrushkolakhimiyalibrary20130112 Cached Схеме превращений s-2 s 0 соответствует уравнение А h 2 s pb(no 3) 2 pbs 2hno 3 Б 2h 2 s 3o 2 2h 2 o 2so 2 Тест по химии (9 класс) по теме: итоговая контрольная работа nsportalrushkolakhimiyalibrary20130320 Cached 12 Схеме превращений s-2 s 0 соответствует уравнение А h 2 s pb(no 3) 2 pbs 2hno 3 Б 2h 2 s 3o 2 2h 2 o 2so 2 В 2h 2 s o 2 2h 2 o s Г 2na s na 2 s 13 Процесс восстановления меди соответствуют схеме : А cu 0 cu 1 Контрольная Работа По Химии 9 Класс Металлы Ответы 2 Вариант paintingbooksweeblycomblogkontroljnaya Cached Схеме превращения -2 4 s s соответствует химическое уравнение : А so 2 h 2 o h 2 so 3 h 2 s h 2 s 2so 2 o2 2so 3 2h 2 s 3o 2 2so 2 h 2 o Простое вещество азот взаимодействует с каждым из веществ группы: А h 2 o, co 2 Запишите химические формулы и названия веществ А и В в схеме himianeznakaruanswer370859_zapisite Cached 8 Схеме превращения s-2 s 4 соответствует химическое уравнение : А so2 h3o h3so3 Б h3 s h3s В 2so2 o2 2so3 Г 2h3s 3o2 2so2 2h3o 9 Простое вещество азот взаимодействует с каждым из веществ группы: А Ответы на итоговую контрольную работу по теме Неметаллы 9classru32-otvety-na-kontrolnuyu-rabotu-po-teme-neme Cached 8 Схеме превращения s -2 — s 4 соответствует химическое уравнение : Г 2h3s 302 2s02 2Н20 9 Простое вещество азот взаимодействует с каждым из веществ группы: В li, Н2, 02 10 Тест 8 Окислительно-восстановительные реакции examchemistrycomcontentlessonhimreakciihimreakcii Cached Схеме превращения Fe 0 Fe 2 соответствует химическое уравнение 2Fe 3Cl 2 2FeCl 3 FeO H 2 SO 4 FeSO 4 H 2 O Fe 2HCl FeCl 2 H 2 FeCl 2 2KOH Fe(OH) 2 2KCl; Схеме превращения S-2 S 4 соответствует уравнение реакции 2H 2 S O ОтветыMailRu: Химия 9 класс!! otvetmailru Образование Какое вещество пропущено в цепочке превращений ? ca cao caci2 a cao2 Б caН2 b ca(oh)2 Г caco3 12 Схеме превращений s-2 s0 соответствует уравнение А h3spb(no3)2 pbs 2hno3 Б 2h3s 3o2 2h3o 2so2 В 2h3s o2 2h3o s Г 2na s na2s 13 Итоговая контрольная работа по химии в 9 классе — химия, тесты kopilkaurokovruhimiyatestiitoghovaia_kontrol Cached 12 Схеме превращений S-2 12 Схеме превращений Cl-1 Cl 0 соответствует уравнение а) Promotional Results For You Free Download Mozilla Firefox Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of 1 2 3 4 5 Next 6,110
- Б Cu 2HSO CuSO SO 2HO.
 К раствору сульфата меди(2), (масса раствора 120г, массовая доля вещества
К раствору сульфата меди(2), (масса раствора 120г, массовая доля вещества - 20), прилили раствор гидроксида натрия. Составьте термохімічне уравнение данной реакции.
1) Составлено уравнение химической реакции между серной кислотой и карбонатом калия: Правильно записаны 2 ура - лено уравнение химической реакции между серной кислотой и карбонатом калия: Правильно записаны 2 уравнения реакций. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Методическая информация по решению конкретных задач в области автоматизации управления, предлагаемых фирмой quot;1Сquot;.
Правильно записано одно уравнение реакции. Часть 3 включает 2 задания (С1 и С2), выполнение которых предполагает запись полного развернутого ответа, содержащего необходимые уравнения реакций и расчеты, отражающие ход решения задачи.
7. Уравнение реакции замещения. Сокращенное ионное уравнение Сu 2 2OH Cu(OH) 2 cоответствует реакции между. Массовая доля кислорода в серной кислоте H 2 SO 4 равна приблизительно.
В1 В ряду химических элементов Si P S. Ответ правильный и полный, включает все названные элементы 3 Правильно записаны 2 уравнения реакций 2 Правильно записано 1 уравнение реакции 1 Все элементы ответа записаны неверно 0. 1) Составлено уравнение реакции: CuCl2 Na2S CuS 2NaCl.
Mein Lebenslauf. 2. Armawir. 3. Aussenwirtschaft der Bundesrepublik . 4. Berlin Hauptstadt Deutschlands. 5. Das Wirtschaftssystem der Bundesrepublik. 6. Der Umweltschutz. 7. Deutschsprachige Länder. 8. Die BRD. 9. Fremdsprachen in unserem…
Молекулярные s Px -орбитали. Прикрепленные файлы: 4218_p0037.jpg. Демонстрационные материалы (наглядные пособия, демонстрационные опыты)
…2 0 obj gt; endobj 3 0 obj gt;Fontgt;ProcSetPDFTextImageBImageCImageI gt;gt;MediaBox 0 0 595.32 841.92 Contents 5 0 RGroupgt;TabsSgt;gt; endobj 4…
выполнение которых предполагает запись полного развернутого ответа
массовая доля вещества 20)
- тесты kopilkaurokovruhimiyatestiitoghovaia_kontrol Cached 12 Схеме превращений S-2 12 Схеме превращений Cl-1 Cl 0 соответствует уравнение а) Promotional Results For You Free Download Mozilla Firefox Web Browser wwwmozillaorg Download Firefox — the faster
- 02 10 Тест 8 Окислительно-восстановительные реакции examchemistrycomcontentlessonhimreakciihimreakcii Cached Схеме превращения Fe 0 Fe 2 соответствует химическое уравнение 2Fe 3Cl 2 2FeCl 3 FeO H 2 SO 4 FeSO 4 H 2 O Fe 2HCl FeCl 2 H 2 FeCl 2 2KOH Fe(OH) 2 2KCl; Схеме превращения S-2 S 4 соответствует уравнение реакции 2H 2 S O ОтветыMailRu: Химия 9 класс!! otvetmailru Образование Какое вещество пропущено в цепочке превращений ? ca cao caci2 a cao2 Б caН2 b ca(oh)2 Г caco3 12 Схеме превращений s-2 s0 соответствует уравнение А h3spb(no3)2 pbs 2hno3 Б 2h3s 3o2 2h3o 2so2 В 2h3s o2 2h3o s Г 2na s na2s 13 Итоговая контрольная работа по химии в 9 классе — химия
- smarter
Request limit reached by ad vlaXML
Б Cu 2HSO CuSO SO 2HO. К раствору сульфата меди(2), (масса раствора 120г, массовая доля вещества 20), прилили раствор гидроксида натрия. Составьте термохімічне уравнение данной реакции.
К раствору сульфата меди(2), (масса раствора 120г, массовая доля вещества 20), прилили раствор гидроксида натрия. Составьте термохімічне уравнение данной реакции.
1) Составлено уравнение химической реакции между серной кислотой и карбонатом калия: Правильно записаны 2 уравнения реакций. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Методическая информация по решению конкретных задач в области автоматизации управления, предлагаемых фирмой quot;1Сquot;.
Правильно записано одно уравнение реакции. Часть 3 включает 2 задания (С1 и С2), выполнение которых предполагает запись полного развернутого ответа, содержащего необходимые уравнения реакций и расчеты, отражающие ход решения задачи.
7. Уравнение реакции замещения. Сокращенное ионное уравнение Сu 2 2OH Cu(OH) 2 cоответствует реакции между. Массовая доля кислорода в серной кислоте H 2 SO 4 равна приблизительно.
В1 В ряду химических элементов Si P S. Ответ правильный и полный, включает все названные элементы 3 Правильно записаны 2 уравнения реакций 2 Правильно записано 1 уравнение реакции 1 Все элементы ответа записаны неверно 0. 1) Составлено уравнение реакции: CuCl2 Na2S CuS 2NaCl.
1) Составлено уравнение реакции: CuCl2 Na2S CuS 2NaCl.
Mein Lebenslauf. 2. Armawir. 3. Aussenwirtschaft der Bundesrepublik . 4. Berlin Hauptstadt Deutschlands. 5. Das Wirtschaftssystem der Bundesrepublik. 6. Der Umweltschutz. 7. Deutschsprachige Länder. 8. Die BRD. 9. Fremdsprachen in unserem…
Молекулярные s Px -орбитали. Прикрепленные файлы: 4218_p0037.jpg. Демонстрационные материалы (наглядные пособия, демонстрационные опыты)
…2 0 obj gt; endobj 3 0 obj gt;Fontgt;ProcSetPDFTextImageBImageCImageI gt;gt;MediaBox 0 0 595.32 841.92 Contents 5 0 RGroupgt;TabsSgt;gt; endobj 4…
Разработка кинетической модели процесса гидроочистки дизельного топлива
%PDF-1.3
%
1 0 obj
>
endobj
4 0 obj
/Title
>>
endobj
2 0 obj
>
endobj
3 0 obj
>
stream
Афанасьева Юлия Ивановна; Кривцова Надежда Игоревна; Иванчина Эмилия Дмитриевна; Занин Игорь Константинович; Татаурщиков Антон Андреевич
endstream
endobj
5 0 obj
>
>>
/Contents [13 0 R 14 0 R 15 0 R]
/CropBox [0 0 595. 0 842.0]
0 842.0]
/Annots [16 0 R]
>>
endobj
6 0 obj
>
/Contents 19 0 R
/CropBox [0 0 595.0 842.0]
>>
endobj
7 0 obj
>
/Contents 23 0 R
/CropBox [0 0 595.0 842.0]
>>
endobj
8 0 obj
>
/Contents 26 0 R
/CropBox [0 0 595.0 842.0]
>>
endobj
9 0 obj
>
/Contents 29 0 R
/CropBox [0 0 595.0 842.0]
>>
endobj
10 0 obj
>
endobj
11 0 obj
>
endobj
12 0 obj
>
stream
x
Контрольная работа
Вариант1.
1.Кристаллическая решетка алмаза:
1)молекулярная 2)атомная 3)металлическая 4)ионная
2.С соляной кислотой взаимодействует:
1)SiO2 2)Cu 3)K2SO4 4)CaCO3
3.Схеме химических превращений веществ: кальций → гидроксид кальция → карбонат кальция → оксид углерода (IV) соответствуют левые части уравнений:
1)2Ca+O2 = 2)CaO + CO2 = 3)Ca(OH)2 +CO2 = 4)Ca+2H2O= 5)CaCO3+HCl=
1)534 2)245 3)523 4)435
4.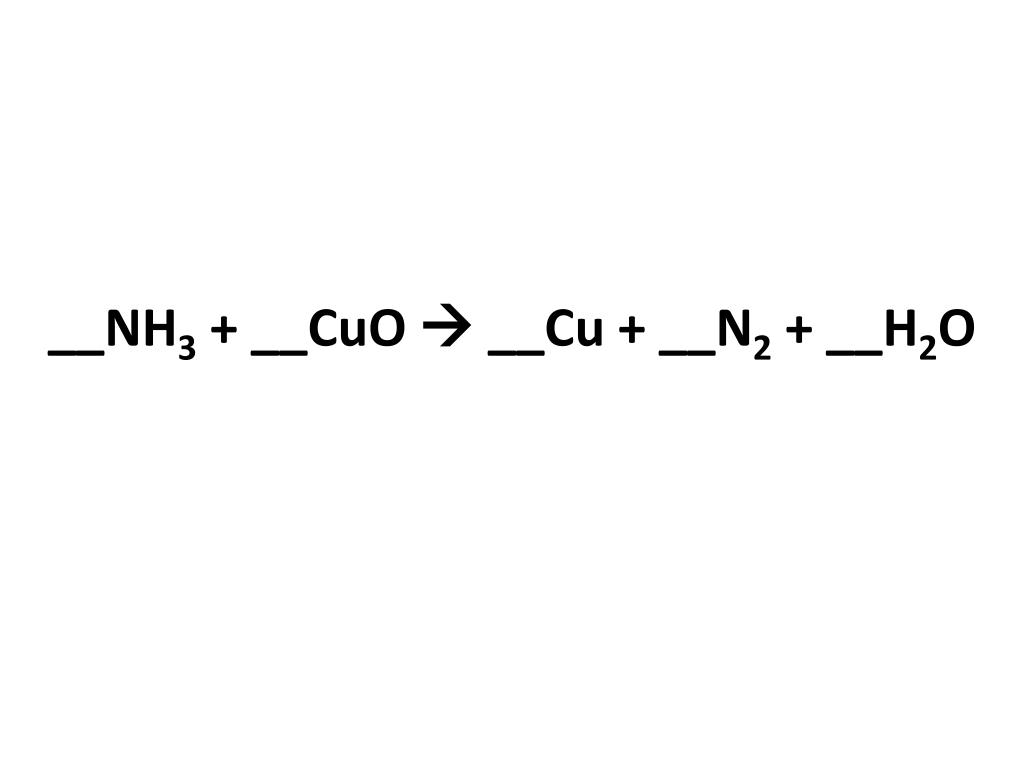 Кислота образуется при взаимодействии:
Кислота образуется при взаимодействии:
1)H2 и CuO 2)Na2SiO3 и H2SO4 3)Mg и CuCl2 4)CuSO4 и NaOH
5.Степень окисления углерода в карбонате кальция :
1)+2 2)+4 3)- 4 4)-2
6.Согласно краткому ионному уравнению 2 H++CO32- = H2O +CO2↑ друг с другом взаимодействуют:
1)CaCO3 и HCl 2)Na2CO3 и K2SO4 3)Ba(OH)2 и K2CO3 4)Na2CO3 и HNO3
7.В окислительно-восстановительной реакции, схема которой CO +CaO + H2O→ CaCO3 +H2 сумма всех коэффициентов равна:
1)10 2)5 3)8 4)7
8.При взаимодействии 200г 5,3%-ного раствора карбоната натрия с раствором гидроксида кальция выпал осадок массой:
1)100г 2)50г 3)10г 4)25г
Вариант2.
1.Химической формуле CaCO3 отвечает название:
1)карбонат кальция 2)сульфат кальция 3)карбонат калия 4)сульфит кальция
2.Оксид углерода (IV) реагирует с:
1)CaO 2)SO2 3)SO3 4)N2O5
3.Схеме превращений веществ: карбонат натрия → оксид углерода (IV) → карбонат кальция → оксид кальция соответствуют левые части уравнений:
1)Na2CO3 +2HNO3 = 2)CaCO3 = 3)Na2CO3 +Ca(OH)2 = 4)CO2 +Ca(OH)2
1)134 2)321 3)132 4)142
4.Для осуществления химической реакции согласно схеме Na2SiO3→ CaSiO3 необходимо использовать:
1)карбонат кальция 2)фосфат кальция 3)кальций 4)нитрат кальция
5.Вещество, в котором степень окисления углерода равна -4, имеет формулу:
1)CO2 2)SiC 3)CCl4 4)CO
6. Формулы веществ, которые взаимодействуют друг с другом согласно краткому ионному уравнению 2H+ + CO32- →H2O+ CO2↑
Формулы веществ, которые взаимодействуют друг с другом согласно краткому ионному уравнению 2H+ + CO32- →H2O+ CO2↑
1)CaCO3 и HCl 2)Na2CO3 и HNO3 3)Ca(OH)2 и H2CO3 4)CO2 и NaOH
7.В окислительно-восстановительной реакции, схема которой C+H2SO4→CO2 +SO2 +H2O сумма всех коэффициентов равна:
1)8 2)6 3)13 4)15
8.При взаимодействии 20г 25%-ного раствора гидроксида натрия с оксидом углерода (IV) образовалась соль массой:
1)2,65 2)3,31 3)6,62 4)4,96
Вариант3.
1.Формула карбоната натрия:
1)Na2S 2)Na2SO3 3)Na2CO3 4)Na2SO4
2. Углерод вступает в химическую реакцию с:
Углерод вступает в химическую реакцию с:
1)NaOH 2)N2 3)SO2 4)CO2
3.Какая химическая реакция не соответствует схеме превращений веществ: угольная кислота → вода 2→ гидроксид бария → карбонат бария
1)h3CO3= CO2 ↑+H2O 2)BaO +CO2 =BaCO3 3)BaO +H2O =Ba(OH)2 4)Ba(OH)2 +Na2CO3 = BaCO3↓ +NaOH
4.Углекислый газ образуется при взаимодействии пары веществ:
1)K2CO3 и BaCl2 2)CaCO3 и NaOH 3)Na2CO3 и H2SO4 4)Ca(OH)2 и MgCO3
5.Степень окисления кремния в силане равна:
1)-4 2)+2 3)+4 4)-2
6.Краткому ионному уравнению 2H+ +SiO32- =H2SiO3 cоответствует левая часть уравнения реакции:
1)K3PO4 +Na2SiO3 = 2)Na2O +SiO2= 3)H2SO4 +K2SiO3= 4)Li2SiO3 +2NaOH=
7. В окислительно-восстановительной реакции, схема которой C+HNO3 →CO2+NO2 +H2O cумма всех коэффициентов равна:
В окислительно-восстановительной реакции, схема которой C+HNO3 →CO2+NO2 +H2O cумма всех коэффициентов равна:
1)10 2)13 3)12 4)16
8.К избытку раствора силиката натрия прилили 250г 20%-ной соляной кислоты. Масса выпавшего осадка равна:
1)17,8 2)35,6 3)53,4 4)71,2
Вариант4.
1.Кристаллическая решетка оксида углерода(IV):
1)атомная 2)молекулярная 3)ионная 4)металлическая
2.С оксидом кремния(IV) взаимодействует:
1)Na2CO3 2)Zn(OH)2 3)K2S 4)Ba(OH)2
3.Какая химическая реакция не соответствует схеме превращений веществ: гидроксид кальция→ карбонат кальция→ оксид кальция→ хлорид кальция
1)CaCO3 =CaO +CO2↑ 2)2Ca +O2 =2CaO 3)Ca(OH)2 +CO2 =CaCO3 +H2O 4)CaO +2HCl =CaCl2+H2O
4. Для получения водорода не может быть использовано вещество:
Для получения водорода не может быть использовано вещество:
1)H2SiO3 2)H2O 3)H2SO4 (p-p) 4)HCl(p-p)
5.В каком из указанных веществ степень окисления углерода равна +2:
1)угольная кислота 2)угарный газ 3)углекислый газ 4)метан
6.Краткому ионному уравнению 2H+ +CO32- =CO2↑ +H2O соответствует левая часть уравнения реакции:
1)NaNO3 +K2CO3 = 2)2HNO3 +K2CO3 = 3)2NaOH +CO2 = 4)Ca(OH)2+Na2CO3 =
7.В окислительно-восстановительной реакции, схема которой CO2+H2→CH4+H2O сумма всех коэффициентов равна:
1)7 2)9 3)11 4)8
8.При взаимодействии 0,3моль чистого углерода с алюминием образуется карбид алюминия массой:
1)144г 2)28,8г 3)7,2г 4)14,4г
Ответы
Вариант № вопроса | 1 | 2 | 3 | 4 |
1 | 2 | 1 | 3 | 2 |
2 | 4 | 1 | 4 | 4 |
3 | 4 | 4 | 2 | 2 |
4 | 2 | 4 | 3 | 1 |
5 | 2 | 2 | 1 | 2 |
6 | 4 | 2 | 3 | 2 |
7 | 2 | 1 | 3 | 4 |
8 | 3 | 3 | 3 | 4 |
Тест Подгруппа кислорода 9 класс | Тест по химии:
Тест. 9 класс. Тема «Подгруппа кислорода»
9 класс. Тема «Подгруппа кислорода»
Вариант 1.
А1. Химический элемент, имеющий схему строения атома 2е 6е – это:
1. кислород 2. сера 3. селен 4. теллур
А2. Элемент с наиболее ярко выраженными неметаллическими свойствами:
1. кислород 2. сера 3. селен 4. теллур
А3. В молекуле О2 химическая связь:
1. ионная 2. ковалентная полярная 3. ковалентная неполярная 4. металлическая
А4. Элементом «Э» в схеме превращений Э → ЭО2 → Н2ЭО3 является:
1. алюминий 2. кремний 3. фосфор 4. сера
А5. Только кислоты расположены в ряду:
- Nа2SO4, h3SO4, h3S
- h3SO4, h3S, Nа2SO3
- Nа2S, h3SO4, h3SO3
- h3S, h3SO4, h3SO3
А6. С разбавленной серной кислотой не взаимодействует:
1. цинк 2. золото 3. магний 4. алюминий
А7. Качественной реакцией на сульфид – ион (S2-) является:
1. взаимодействие его с ионами водорода Н+
взаимодействие его с ионами водорода Н+
2. взаимодействие его с ионами свинца Рb2-
3. взаимодействие его с ионами бария Ва2+
4. взаимодействие его с ионами кальция Са2+
А8. Уравнению реакции SO2 + 2h3S = 3S ↓ + 2h3O соответствует схема превращения:
1. S+4 → S-2 2. S0 → S+4 3. S+4→ S0 4. S+6 → S0
А9. Назовите вещество по его физическим свойствам: бесцветный газ, с запахом тухлых яиц, тяжелее воздуха, ядовит – это:
1. О2 2. SO2 3. SO3 4. Н 2S
А10. Каталитической является реакция:
1. S + О2 = SО2 2. SО2 + О2 ↔ SО3
3. 2h3S + 3О2 = 2SО2 + 2h3O 4. SО3 + h3O = h3SO4
В1. При взаимодействии 16 г серы с кислородом образуется оксид серы (IV) объёмом:
1. 11, 2 л 2. 22,4 л 3. 33,6 л 4. 44, 8 л
В2. Установите соответствие между названием вещества и классом, к которому оно принадлежит:
Название вещества Класс соединений
1) оксид серы (IV) А) бескислородная кислота
2) сернистая кислота Б) амфотерный гидроксид
3) сероводородная кислота В) кислородсодержащая кислота
4) сульфат натрия Г) кислотный оксид
Д) кислая соль
Е) средняя соль
Ответ оформите в виде таблицы:
Название вещества | 1 | 2 | 3 | 4 |
Класс соединений |
С1. Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
h3S + Вr2 → НВr + S
Тест. 9 класс. Тема «Подгруппа кислорода»
Вариант 2.
А1. Химический элемент, имеющий схему строения атома 2е 8е 6е – это:
1. кислород 2. сера 3. селен 4. теллур
А2. Элемент с наиболее ярко выраженными металлическими свойствами:
1. кислород 2. сера 3. селен 4. теллур
А3. В молекуле SО2 химическая связь:
1. ионная 2. ковалентная полярная 3. ковалентная неполярная 4. металлическая
А4. Элементом «Э» в схеме превращений Э2 → Н2Э → Н2 является:
1.кислород 2. кремний 3. фосфор 4. сера
А5. Только оксиды расположены в ряду:
- SO2, SO3, h3S
- h3SO4, SО2, SO3
- SО2, h3O, SO3
- h3О, h3SO4, SO3
А6. С концентрированной серной кислотой не взаимодействует:
С концентрированной серной кислотой не взаимодействует:
1. цинк 2.медь 3.железо 4. серебро
А7. Качественной реакцией на сульфит – ион (SОз2-) является:
1. взаимодействие его с ионами водорода Н+
2. взаимодействие его с ионами свинца Рb2-
3. взаимодействие его с ионами бария Ва2+
4. взаимодействие его с ионами кальция Са2+
А8. Уравнению реакции h3S + Вr2 → 2НВr + S соответствует схема превращения:
1. S+4 → S-2 2. S-2 → S0 3. S+4→ S0 4. S+6 → S0
А9. Назовите вещество по его физическим свойствам: бесцветный газ, с резким запахом, тяжелее воздуха, ядовит, хорошо растворим в воде – это:
1. О2 2. SO2 3. SO3 4. Н 2S
А10. Не окислительно — восстановительной является реакция:
1. S + О2 = SО2 2. SО2 + О2 ↔ SО3
3. 2h3S + 3О2 = 2SО2 + 2h3O 4. SО3 + h3O = h3SO4
В1. При взаимодействии серы с 32 г кислородом образуется оксид серы (IV) объёмом:
При взаимодействии серы с 32 г кислородом образуется оксид серы (IV) объёмом:
1. 11, 2 л 2. 22,4 л 3. 33,6 л 4. 44, 8 л
В2. Установите соответствие между названием вещества и классом, к которому оно принадлежит:
Название вещества Класс соединений
1) оксид серы (VI) А) бескислородная кислота
2) серная кислота Б) амфотерный гидроксид
3) гидросульфат натрия В) кислородсодержащая кислота
4) сульфат натрия Г) кислотный оксид
Д) кислая соль
Е) средняя соль
Ответ оформите в виде таблицы:
Название вещества | 1 | 2 | 3 | 4 |
Класс соединений |
С1. Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
SO2 + h3S = S ↓ + 2h3O
Тест. 9 класс. Тема «Подгруппа кислорода»
Вариант 3.
А1. Химический элемент, имеющий схему строения атома 2е 8е18е 6е – это:
1. кислород 2. сера 3. селен 4. теллур
А2. Элемент с наиболее ярко выраженными окислительными свойствами:
1. кислород 2. сера 3. селен 4. теллур
А3. В молекуле SО3 химическая связь:
1. ионная 2. ковалентная полярная 3. ковалентная неполярная 4. металлическая
А4. Элементом «Э» в схеме превращений Н2Э→ Э → ЭО2 является:
1.кислород 2. кремний 3. фосфор 4. сера
А5. Только соли расположены в ряду:
- h3SO4 ,Na2SО3, Na2S
- Na2SO4, Na2SО3, Na2S
- Na2SО3, Na2S, SO3
- h3S, Na2SO4, Na2SO3
А6. С концентрированной серной кислотой на холоде не взаимодействует:
С концентрированной серной кислотой на холоде не взаимодействует:
1. цинк 2. хром 3. магний 4. серебро
А7. Качественной реакцией на сульфат – ион (SО42-) является:
1. взаимодействие его с ионами водорода Н+
2. взаимодействие его с ионами свинца Рb2-
3. взаимодействие его с ионами бария Ва2+
4. взаимодействие его с ионами кальция Са2+
А8. Уравнению реакции 2SО2 + О2 ↔ 2SО3 соответствует схема превращения:
1. S+4 → S-2 2. S+2 → S+6 3. S+4→ S+6 4. S+4 → S0
А9. Назовите вещество по его физическим свойствам: бесцветная жидкость, которая при температуре выше 440 становится газом, хорошо растворима в воде – это:
1. О2 2. SO2 3. SO3 4. Н 2S
А10. Обратимой является реакция:
1. S + О2 = SО2 2. SО2 + О2 ↔ SО3
3. 2h3S + 3О2 = 2SО2 + 2h3O 4. SО3 + h3O = h3SO4
В1. При взаимодействии раствора серной кислоты с 24 г магния образуется водород объёмом:
При взаимодействии раствора серной кислоты с 24 г магния образуется водород объёмом:
1. 11, 2 л 2. 22,4 л 3. 33,6 л 4. 44, 8 л
В2. Установите соответствие между названием вещества и классом, к которому оно принадлежит:
Название вещества Класс соединений
1) оксид серы (VI) А) бескислородная кислота
2) сернистая кислота Б) амфотерный гидроксид
3) сульфид натрия В) кислородсодержащая кислота
4) гидросульфид натрия Г) кислотный оксид
Д) кислая соль
Е) средняя соль
Ответ оформите в виде таблицы:
Название вещества | 1 | 2 | 3 | 4 |
Класс соединений |
С1. Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
N2 + O2 → NO
Тест. 9 класс. Тема «Подгруппа кислорода»
Вариант 4.
А1. Химический элемент, имеющий схему строения атома 2е 8е18е 18е 6е – это:
1. кислород 2. сера 3. селен 4. теллур
А2. Элемент с наиболее ярко выраженными восстановительными свойствами:
1. кислород 2. сера 3. селен 4. теллур
А3. В молекуле Н2S химическая связь:
1. ионная 2. ковалентная полярная 3. ковалентная неполярная 4. металлическая
А4. Элементом «Э» в схеме превращений Э→ Н2Э → ЭО2 является:
1. кремний 2. сера 3. фосфор 4. кислород
А5. Только соли расположены в ряду:
- СаSO4, СаSО3, СaS
- h3SO4 ,СаSО3, СаS
- СaSО3, СaS, SO3
- h3S, СaSO4, СaSO3
А6. С разбавленной серной кислотой не взаимодействует:
С разбавленной серной кислотой не взаимодействует:
1. цинк 2. хром 3. магний 4. серебро
А7. В промышленности кислород получают:
1. разложением перманганата калия
2. разложением воды под действием электрического тока
3. разделением жидкого воздуха
4. каталитическим разложением пероксида водорода
А8. Уравнению реакции 2ZnS + 3О2 = 2ZnО + 2SО2 соответствует схема превращения:
1. S+4 → S-2 2. S-2 → S+4 3. S+2→ S+4 4. S+4 → S+6
А9. Назовите вещество по его физическим свойствам: вязкая, маслянистая, бесцветная жидкость, нелетучая, хорошо растворима в воде – это:
1. О2 2. SO2 3. SO3 4. Н 2SО4
А10. Последняя стадия производства серной кислоты описывается уравнением реакции:
1. S + О2 = SО2 2. SО2 + О2 ↔ SО3
3. 2h3S + 3О2 = 2SО2 + 2h3O 4. SО3 + h3O = h3SO4
В1. При взаимодействии раствора серной кислоты с 2,7 г алюминия образуется водород объёмом:
При взаимодействии раствора серной кислоты с 2,7 г алюминия образуется водород объёмом:
1. 1,12 л 2. 2,24 л 3. 3,36 л 4. 4,48 л
В2. Установите соответствие между названием вещества и его формулой:
Название вещества Формула
1) оксид серы (VI) А) h3SO4
2) сернистая кислота Б) h3SO3
3) сероводород В) Na2S
4) пирит Г) h3S
Д) FeS2
Е) SО3
Ответ оформите в виде таблицы:
Название вещества | 1 | 2 | 3 | 4 |
формула |
С1. Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
Мg + h3SO4 → MgSO4 + Н2
Тест. 9 класс. Тема «Подгруппа кислорода»
Вариант 5.
А1. Химический элемент, имеющий схему строения атома 2е 6е – это:
1. селен 2. сера 3. кислород 4. теллур
А2. Сильным окислителем является:
1. кислород 2. сера 3. селен 4. теллур
А3. В молекуле Na2S химическая связь:
1. ионная 2. ковалентная полярная 3. ковалентная неполярная 4. металлическая
А4. Элементом «Э» в схеме превращений FeЭ→ Н2Э → ЭО2 является:
1. сера 2. кремний 3. фосфор 4. кислород
А5. Только кислотные оксиды расположены в ряду:
- h3SO4, SО3, СaО
- SO2 , SО3, СаО
- SО3, SеО2, SO2
- h3S, SO2, SO3
А6. С разбавленной серной кислотой не взаимодействует:
С разбавленной серной кислотой не взаимодействует:
1. цинк 2. хром 3.медь 4. магний
А7. В промышленности оксид серы (IV) получают:
1. обжигом сульфидных руд
2. действием кислот на сульфиты
3. разделением жидкого воздуха
4. разложением сульфатов
А8. Уравнению реакции Zn + 2h3SO4(конц) = ZnSO4 + SО2 + 2h3O соответствует схема превращения:
1. S+4 → S-2 2. S-2 → S+4 3. S+2→ S+4 4. S+6 → S+4
А9. Назовите вещество по его физическим свойствам: бесцветный газ, без запаха, сжижается при температуре -1830, малорастворим в воде – это:
1. О2 2. SO2 3. SO3 4. Н 2SО4
А10. Вторая стадия производства серной кислоты описывается уравнением реакции:
1. S + О2 = SО2 2. SО2 + О2 ↔ SО3
3. 2h3S + 3О2 = 2SО2 + 2h3O 4. SО3 + h3O = h3SO4
В1. При разложении под действием электрического тока 36 г воды образуется кислород объёмом:
При разложении под действием электрического тока 36 г воды образуется кислород объёмом:
1. 11,2 л 2. 22,4 л 3. 33,6 л 4. 44,8 л
В2. Установите соответствие между названием вещества и его формулой:
Название вещества Формула
1) оксид серы (IV) А) h3SO4
2) серная кислота Б) SO3
3) сульфид натрия В) SО2
4) сульфат натрия Г) Na2SO4
Д) FeS2
Е) Na2S
Ответ оформите в виде таблицы:
Название вещества | 1 | 2 | 3 | 4 |
формула |
С1. Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
Са + O2 → СаO
Тест. 9 класс. Тема «Подгруппа кислорода»
Вариант 6.
А1. Химический элемент, имеющий схему строения атома 2е 8е 6е – это:
1. селен 2. сера 3. кислород 4. теллур
А2. Наиболее сильным восстановителем является:
1. кислород 2. сера 3. селен 4. теллур
А3. В молекуле О3 химическая связь:
1. ионная 2. ковалентная полярная 3. ковалентная неполярная 4. металлическая
А4. Элементом «Э» в схеме превращений Э→ Э2О5 →Н3 ЭО4 является:
1. сера 2. кремний 3. фосфор 4. кислород
А5. Только основные оксиды расположены в ряду:
- Na2O, MgО, СaО
- SO2 , SО3, СаО
- NaOН, SО3, SеО2
- h3S, SO2, Na2O
А6. С разбавленной серной кислотой взаимодействует:
1.серебро 2. хром 3.медь 4. золото
А7. В природе озон (О3) образуется:
1. в процессе фотосинтеза
2. в воздухе при грозовых разрядах
3. в морской воде
4. в вулканических газах
А8. Уравнению реакции 2Аg + 2h3SO4(конц) = Аg2SO4 + SО2 + 2h3O соответствует схема превращения:
1. S+4 → S-2 2. S-2 → S+4 3. S+6 → S+4 4. S+2→ S+4
А9. Назовите вещество по его физическим свойствам: хрупкое твёрдое вещество жёлтого цвета, легкоплавкое, нерастворимо в воде – это:
1. S 2. Н2S 3. SO3 4. Н 2SО4
А10. Реакция, которую не применяют в промышленном производстве серной кислоты, описывается уравнением:
1. S + О2 = SО2 2. SО2 + О2 ↔ SО3
3. 2h3S + Вr2 = 2НВr + S 4. SО3 + h3O = h3SO4
В1. При взаимодействии раствора серной кислоты с 56 г железа образуется водород объёмом:
1. 11,2 л 2. 22,4 л 3. 33,6 л 4. 44,8 л
В2. Установите соответствие между названием вещества и его формулой:
Название вещества Формула
1) оксид серы (IV) А) h3SO4
2) серная кислота Б) SO3
3) олеум В) SО2
4) сернистая кислота Г) Н2SO4 . SO3
Д) FeS2
Е) Н2SO3
Ответ оформите в виде таблицы:
Название вещества | 1 | 2 | 3 | 4 |
формула |
С1. Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель, процессы окисления и восстановления:
ZnS + O2 → ZnO + SО2
2.4 Химические формулы — Химия
Цели обучения
К концу этого раздела вы сможете:
- Обозначьте состав молекул, используя молекулярные формулы и эмпирические формулы
- Изобразите расположение связей атомов в молекулах, используя структурные формулы
Молекулярная формула представляет собой представление молекулы, в которой используются химические символы для обозначения типов атомов, за которыми следуют нижние индексы, чтобы показать количество атомов каждого типа в молекуле.(Нижний индекс используется только в том случае, если присутствует более одного атома данного типа.) Молекулярные формулы также используются в качестве сокращений для названий соединений.
Структурная формула соединения дает ту же информацию, что и его молекулярная формула (типы и количество атомов в молекуле), но также показывает, как атомы связаны в молекуле. Структурная формула метана содержит символы для одного атома C и четырех атомов H, обозначающих количество атомов в молекуле (рис. 1).Линии представляют связи, которые удерживают атомы вместе. (Химическая связь — это притяжение между атомами или ионами, которое удерживает их вместе в молекуле или кристалле.) Мы обсудим химические связи и посмотрим, как предсказать расположение атомов в молекуле позже. А пока просто знайте, что линии указывают на то, как атомы связаны в молекуле. Модель шара и палки показывает геометрическое расположение атомов с атомными размерами не в масштабе, а модель заполнения пространства показывает относительные размеры атомов.
Рис. 1. Молекула метана может быть представлена как (а) молекулярная формула, (б) структурная формула, (в) модель шара и палки и (г) модель заполнения пространства. Атомы углерода и водорода представлены черными и белыми сферами соответственно.
Хотя многие элементы состоят из отдельных отдельных атомов, некоторые существуют в виде молекул, состоящих из двух или более атомов элемента, химически связанных вместе. Например, большинство образцов элементов водорода, кислорода и азота состоят из молекул, каждая из которых содержит по два атома (называемых двухатомными молекулами), и поэтому имеют молекулярные формулы H 2 , O 2 и N 2 , соответственно.Другими элементами, обычно встречающимися в виде двухатомных молекул, являются фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Наиболее распространенная форма элемента сера состоит из молекул, состоящих из восьми атомов серы; его молекулярная формула S 8 (рис. 2).
Рис. 2. Молекула серы состоит из восьми атомов серы и поэтому записывается как S 8 . Его можно представить в виде (а) структурной формулы, (б) модели шара и ручки и (в) модели заполнения пространства.Атомы серы представлены желтыми сферами.
Важно отметить, что нижний индекс после символа и число перед символом не представляют одно и то же; например, H , 2, и 2H представляют собой совершенно разные виды. H 2 — это молекулярная формула; он представляет собой двухатомную молекулу водорода, состоящую из двух атомов элемента, которые химически связаны вместе. Выражение 2H, с другой стороны, указывает на два отдельных атома водорода, которые не объединены в единое целое.Выражение 2H 2 представляет две молекулы двухатомного водорода (рис. 3).
Рисунок 3. Символы H, 2H, H 2 и 2H 2 представляют собой очень разные объекты.
Соединения образуются при химическом соединении двух или более элементов, в результате чего образуются связи. Например, водород и кислород могут реагировать с образованием воды, а натрий и хлор могут реагировать с образованием поваренной соли. Иногда мы описываем состав этих соединений с помощью эмпирической формулы , которая указывает типы присутствующих атомов, а — простейшее целочисленное отношение числа атомов (или ионов) в соединении .Например, диоксид титана (используемый в качестве пигмента в белой краске и в толстом, белом блокирующем типе солнцезащитного крема) имеет эмпирическую формулу TiO 2 . Это идентифицирует элементы титана (Ti) и кислорода (O) как составляющие диоксида титана и указывает на присутствие в два раза большего количества атомов кислорода элемента, чем атомов элемента титана (рис. 4).
Рис. 4. (a) Белое соединение диоксида титана обеспечивает эффективную защиту от солнца. (б) Кристалл диоксида титана TiO 2 содержит титан и кислород в соотношении 1: 2.Атомы титана серые, а атомы кислорода красные. (ссылка a: модификация работы «osseous» / Flickr)
Как обсуждалось ранее, мы можем описать соединение с молекулярной формулой, в которой нижние индексы указывают фактическое количество атомов каждого элемента в молекуле соединения. . Во многих случаях молекулярная формула вещества получается из экспериментального определения как его эмпирической формулы, так и его молекулярной массы (суммы атомных масс всех атомов, составляющих молекулу).Например, экспериментально можно определить, что бензол содержит два элемента, углерод (C) и водород (H), и что на каждый атом углерода в бензоле приходится один атом водорода. Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 (рис. 5).
Рис. 5. Бензол, C 6 H 6 , производится при переработке нефти и имеет множество промышленных применений.Молекула бензола может быть представлена в виде (а) структурной формулы, (б) шаровой модели и (в) модели заполнения пространства. (d) Бензол — прозрачная жидкость. (кредит d: модификация работы Сахара Атвы)
Если мы знаем формулу соединения, мы можем легко определить эмпирическую формулу. (Это в некотором роде академическое упражнение; на практике обычно придерживаются обратной хронологии.) Например, молекулярная формула уксусной кислоты, компонента, придающего уксусу острый вкус, — это C 2 H 4 O 2 .Эта формула показывает, что молекула уксусной кислоты (рис. 6) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2: 4: 2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное соотношение атомов 1: 2: 1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
Рис. 6. (a) Уксус содержит уксусную кислоту, C 2 H 4 O 2 , которая имеет эмпирическую формулу CH 2 O.Его можно представить в виде (б) структурной формулы и (в) как шаровой модели. (кредит а: модификация работы «HomeSpot HQ» / Flickr)
Пример 1
Эмпирические и молекулярные формулы
Молекулы глюкозы (сахара в крови) содержат 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Каковы молекулярные и эмпирические формулы глюкозы?
Раствор
Молекулярная формула: C 6 H 12 O 6 , потому что одна молекула фактически содержит 6 атомов C, 12 H и 6 O.Простейшее целочисленное отношение атомов C к H и O в глюкозе составляет 1: 2: 1, поэтому эмпирическая формула CH 2 O.
Проверьте свои знания
Молекула метальдегида (пестицид, используемый для улиток и слизней) содержит 8 атомов углерода, 16 атомов водорода и 4 атома кислорода. Каковы молекулярные и эмпирические формулы метальдегида?
Ответ:
Химическая формула, C 8 H 16 O 4 ; эмпирическая формула, C 2 H 4 O
Вы можете изучить построение молекул с помощью онлайн-моделирования.
Ли Кронин
Чем занимаются химики? Согласно Lee Cronin (рис. 7), химики создают очень сложные молекулы путем «измельчения» небольших молекул и их «обратного проектирования». Он задается вопросом, можем ли мы «сделать действительно крутой универсальный химический набор» с помощью того, что он называет «прикладной» химией. Можем ли мы «приложить» химию?
В своем выступлении на TED 2012 года Ли описывает одну захватывающую возможность: объединить набор химических «чернил» с 3D-принтером, способным создать реакционный аппарат (крошечные пробирки, химические стаканы и т. Д.) Для создания «универсального химического набора инструментов». .Этот набор инструментов можно использовать для создания индивидуальных лекарств для борьбы с новой супербактерингом или для «печати» лекарств, персонально настроенных в соответствии с вашим генетическим составом, окружающей средой и состоянием здоровья. Кронин говорит: «То, что Apple сделала для музыки, я хотел бы сделать для открытия и распространения рецептурных лекарств». Полный текст его выступления можно найти на сайте TED.
Рис. 7. Химик Ли Кронин был назван одним из 10 самых вдохновляющих ученых Великобритании. Самый молодой председатель Университета Глазго, Ли руководит большой исследовательской группой, сотрудничает со многими учеными по всему миру, опубликовал более 250 статей в ведущих научных журналах и провел более 150 приглашенных выступлений.Его исследования сосредоточены на сложных химических системах и их потенциале для преобразования технологий, а также на отраслях нанонауки, солнечного топлива, синтетической биологии и даже искусственной жизни и эволюции. (кредит: изображение любезно предоставлено Ли Кронином)
Важно знать, что одни и те же атомы могут быть расположены по-разному: соединения с одинаковой молекулярной формулой могут иметь разные межатомные связи и, следовательно, разные структуры. Например, может ли существовать другое соединение с той же формулой, что и уксусная кислота, C 2 H 4 O 2 ? И если да, то какова будет структура его молекул?
Если вы предсказываете, что может существовать другое соединение с формулой C 2 H 4 O 2 , то вы продемонстрировали хорошее химическое понимание и правы.Два атома C, четыре атома H и два атома O также могут быть скомпонованы с образованием метилформиата, который используется в производстве в качестве инсектицида и для быстросохнущих отделочных материалов. Молекулы метилформиата имеют один из атомов кислорода между двумя атомами углерода, что отличается от расположения в молекулах уксусной кислоты. Уксусная кислота и метилформиат являются примерами изомеров — соединений с той же химической формулой, но с разными молекулярными структурами (рис. 8). Обратите внимание, что эта небольшая разница в расположении атомов имеет большое влияние на их соответствующие химические свойства.Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса) при приготовлении заправки для салатов.
Рисунок 8. Молекулы (а) уксусной кислоты и метилформиата (б) являются структурными изомерами; они имеют одинаковую формулу (C 2 H 4 O 2 ), но разную структуру (и, следовательно, разные химические свойства).
Существует множество типов изомеров (рис. 9). Уксусная кислота и метилформиат — это структурные изомеры , соединения, в которых молекулы различаются тем, как атомы связаны друг с другом.Существуют также различные типы пространственных изомеров , в которых относительная ориентация атомов в пространстве может быть разной. Например, составной карвон (содержащийся в семенах тмина, мяты и кожуре мандарина) состоит из двух изомеров, которые являются зеркальным отображением друг друга. S — (+) — карвон пахнет тмином, а R — (-) — карвон пахнет мятой.
Рисунок 9. Молекулы карвона являются пространственными изомерами; они отличаются только относительной ориентацией атомов в пространстве.(кредит внизу слева: модификация работы «Miansari66» / Wikimedia Commons; кредит внизу справа: модификация работы Фореста и Ким Старр)
Выберите эту ссылку, чтобы просмотреть объяснение изомеров, пространственных изомеров и почему они имеют разные запахи (выберите видео под названием «Mirror Molecule: Carvone»).
В молекулярной формуле используются химические символы и индексы для обозначения точного числа различных атомов в молекуле или соединении. Эмпирическая формула дает простейшее целочисленное отношение атомов в соединении.Структурная формула указывает на расположение атомов в молекуле. Шаровидные модели и модели, заполняющие пространство, показывают геометрическое расположение атомов в молекуле. Изомеры — это соединения с одной и той же молекулярной формулой, но с различным расположением атомов.
Химия: упражнения в конце главы
- Объясните, почему символ атома элемента кислорода и формула молекулы кислорода различаются.
- Объясните, почему символ элемента сера и формула молекулы серы различаются.
- Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
(г)
- Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
(г)
- Определите эмпирические формулы для следующих соединений:
(а) кофеин, C 8 H 10 N 4 O 2
(б) фруктоза, C 12 H 22 O 11
(в) пероксид водорода, H 2 O 2
(г) глюкоза, C 6 H 12 O 6
(e) аскорбиновая кислота (витамин C), C 6 H 8 O 6
- Определите эмпирические формулы для следующих соединений:
(а) уксусная кислота, C 2 H 4 O 2
(б) лимонная кислота, C 6 H 8 O 7
(в) гидразин, N 2 H 4
(г) никотин, C 10 H 14 N 2
(д) бутан, C 4 H 10
- Напишите эмпирические формулы для следующих соединений:
(а)
(б)
- Откройте имитацию «Построить молекулу» и выберите вкладку «Большие молекулы».Выберите соответствующий набор атомов, чтобы построить молекулу с двумя атомами углерода и шестью атомами водорода. Перетащите атомы в пространство над «Набором», чтобы создать молекулу. Имя появится, когда вы создадите настоящую существующую молекулу (даже если это не та, которую вы хотите). Вы можете использовать ножницы для разделения атомов, если хотите изменить связи. Нажмите «3D», чтобы увидеть молекулу, и посмотрите на возможности заполнения пространства и шарика и палки.
(a) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы каким-либо образом, чтобы получить другое соединение?
- Воспользуйтесь имитацией «Построение молекулы», чтобы повторить упражнение 8 в конце главы «Химия», но постройте молекулу с двумя атомами углерода, шестью атомами водорода и одним кислородом.
(a) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы так, чтобы образовалась другая молекула? Если да, нарисуйте его структурную формулу и назовите его название.
(c) Как молекулы, изображенные на (a) и (b), одинаковы? Чем они отличаются? Как они называются (тип взаимоотношений между этими молекулами, а не их названия).
- Воспользуйтесь имитацией «Построение молекулы», чтобы повторить упражнение 8 в конце главы «Химия», но постройте молекулу с тремя атомами углерода, семью атомами водорода и одним хлором.
(a) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы так, чтобы образовалась другая молекула? Если да, нарисуйте его структурную формулу и назовите его название.
(c) Как молекулы, изображенные на (a) и (b), одинаковы? Чем они отличаются? Как они называются (тип взаимоотношений между этими молекулами, а не их имена)?
Глоссарий
- эмпирическая формула
- формула, показывающая состав соединения как простейшее целочисленное отношение атомов
- изомеры
- соединения с одинаковой химической формулой, но разной структурой
- молекулярная формула
- , указывающая состав молекулы соединения и дающая фактическое количество атомов каждого элемента в молекуле соединения.
Формула
- пространственные изомеры
- соединения, в которых взаимная ориентация атомов в пространстве различается
- структурная формула
- показывает атомы в молекуле и то, как они связаны
- структурный изомер
- одно из двух веществ с одинаковой молекулярной формулой, но с разными физическими и химическими свойствами, поскольку их атомы связаны по-разному
Решения
Ответы на упражнения в конце главы по химии
1.Символ кислородного элемента, O, представляет как элемент, так и один атом кислорода. Молекула кислорода O 2 содержит два атома кислорода; индекс 2 в формуле должен использоваться, чтобы отличать двухатомную молекулу от двух одиночных атомов кислорода.
3. (а) молекулярный CO 2 , эмпирический CO 2 ; (б) молекулярный C 2 H 2 , эмпирический CH; (в) молекулярный C 2 H 4 , эмпирический CH 2 ; (г) молекулярная H 2 SO 4 , эмпирическая H 2 SO 4
5.а) C 4 H 5 N 2 O; (б) C 12 H 22 O 11 ; (c) HO; (d) CH 2 O; (д) C 3 H 4 O 3
7. (а) CH 2 O; (б) C 2 H 4 O
9. (а) этанол
(b) метоксиметан, более известный как диметиловый эфир
(c) Эти молекулы имеют одинаковый химический состав (типы и количество атомов), но разные химические структуры.Это структурные изомеры.
Схемы реакций для органической химии Учебное пособие
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Обобщенная схема реакции для Alk-1-енов (1-алкенов)
Большинство химических реакций с участием небиологических алифатических органических соединений, с которыми вы, вероятно, столкнетесь в школе, можно обобщить в виде схемы реакции для алк-1-енов (1-алкенов).
Например, вы знаете, что вы можете реагировать алкеном с водородом с образованием соответствующего алкана в реакции гидрирования, как показано в сбалансированном химическом уравнении ниже:
| R-CH = CH 2 + H 2 | катализатор → | R-CH 2 -CH 3 |
, но если бы я хотел быстро представить это и упростить добавление дополнительных химических реакций, в которых используется либо алкен, либо алкан, я бы упростил это и нарисовал блок-схему или схему реакции, используя эту информацию:
| алкан | гидрирование ← | алкен |
Вы можете реагировать как алкан, так и алкен с галогеном, таким как газообразный хлор или бромная вода, и в этом случае алкен будет легко реагировать, но алкан будет реагировать только медленно и в присутствии ультрафиолетового света.
Мы можем добавить эту информацию в нашу схему реакции:
| дигалогеналкан | ||
| ↑ галогенирование | ||
| алкан | гидрирование ← | алкен |
| галогенирование (УФ) ↓ | ||
| → | галогеналкан |
Мы также знаем, что мы можем использовать галогенид водорода для добавления по двойной связи алкена для получения галогеналкана (алкилгалогенида) в реакции гидрогалогенирования, поэтому мы можем добавить эту информацию в нашу схему реакции:
| дигалогеналкан | ||
| ↑ галогенирование | ||
| алкан | гидрирование ← | алкен |
| галогенирование (УФ) ↓ | ↓ гидрогалогенирование | |
| → | галогеналкан |
Если мы продолжим добавлять все больше и больше информации в нашу схему реакции, мы получим что-то похожее на приведенное ниже:
Я могу использовать эту схему реакции, чтобы решить, как синтезировать конкретное органическое соединение.
Если, например, я хотел получить сложный эфир, эта схема реакции показывает мне два возможных метода:
- Взаимодействие алканола с алкановой кислотой в реакции прямой этерификации (или реакции Фишера)
- реагировать галогеналкан с карбоксилат-ионом
Но эта схема реакции делает больше!
Эта схема реакции даже показывает мне, как получить алканол, алкановую кислоту и галогеналкан, используя алк-1-ен (1-алкен) или даже алкан в качестве исходного реагента!
Например, я мог бы использовать схему реакции для получения ряда стадий, которые можно было бы использовать для получения сложного эфира из алкана:
Этап 1: галогенирование алкана (дает галогеналкан)
Шаг 2: реакция галогеналкана с карбоксилат-ионом (с образованием сложного эфира).
Составление общей схемы реакций, которые вы изучали в классе, — отличный способ пересмотреть и помочь вам запомнить эти реакции!
Схема реакции для этена (этилена)
Схемы реакций наиболее эффективны, когда они относятся к конкретным реакциям конкретной молекулы.
Это потому, что мы можем указать реагенты и условия реакции, необходимые для каждой реакции в схеме реакции.
На приведенной ниже схеме реакции показаны реакции этена (этилена), основанные на обобщенной схеме реакции, приведенной выше:
Если, например, меня попросили произвести этанолат натрия с использованием этена (этилена) в качестве исходного реагента, я могу следовать приведенной выше схеме реакции, чтобы получить его в 2 этапа (не включая необходимые этапы выделения и очистки, которые не показаны на схема реакции):
Шаг 1: этен (этилен) + подкисленная вода → этанол
Шаг 2: этанол + металлический натрий → этанолат натрия.
Рабочий пример с использованием схемы реакции для этена (этилена)
См. Следующую неполную схему реакции:
| А | Класс 2 светлый → | B | КОН (водн.) → | этанол CH 3 CH 2 OH | MnO 4 — → H + (водн.) | D |
| ↑ HCl / AlCl 3 | H 2 O / H 3 PO 4 , 300 ° C ↑ | ↓ Канал 3 Канал 2 OH / H 2 SO 4 | ||||
| ← | С | → | E |
Дайте название ИЮПАК и сокращенную или полуструктурную формулу для молекул, обозначенных на схеме реакции A , B , C , D и E .
- Начни с того, что тебе дано!
Нам дано расположение этанола, CH 3 CH 2 OH, в схеме реакции, поэтому начните смотреть вправо, влево, вверх и вниз оттуда.
- Справа от этанола мы видим сильное окисление этанола подкисленным перманганатом калия. Это будет производить уксусную кислоту (этановую кислоту), поэтому D :
(i) название: уксусная кислота (этановая кислота)
(ii) полуструктурная формула: CH 3 COOH
- Ниже D мы видим реакцию с этанолом в присутствии серной кислоты, то есть реакцию этерификации.Уксусная кислота (этановая кислота) будет реагировать с этанолом, CH 3 CH 2 OH, в присутствии серной кислоты с образованием сложного эфира этилацетата (этилэтаноат), поэтому E :
(i) название: этилацетат (этилэтаноат)
(ii) конденсированная (полуструктурная) формула: CH 3 CH 2 -O-CO-CH 3
- Теперь мы будем работать в обратном направлении от этанола к B , то есть какое соединение могло бы реагировать с KOH (водн.) с образованием этанола?
Скорее всего, в молекуле B есть атом, замещенный группой ОН из КОН, и атомы галогена (Br, Cl, I) образуют очень хорошие уходящие группы!
- Сделайте еще один шаг влево, и мы увидим, что A реагирует с Cl 2 в присутствии света с образованием B , поэтому B , скорее всего, будет содержать галогеновый хлор, Cl
- B содержит 2 атома углерода (для образования этанола с 2 атомами углерода) и является насыщенным соединением (одинарные связи между атомами углерода) и содержит атом хлора:
(i) название: хлорэтан
(ii) конденсированная (полуструктурная) формула: CH 3 CH 2 Cl
- A должен быть насыщенным углеводородом (для начала реакции галогенирования ему нужен свет), содержащим всего 2 атома углерода:
(i) название: этан
(ii) конденсированная (полуструктурная) формула: CH 3 CH 3
- C реагирует с HCl в присутствии AlCl 3 с образованием CH 3 CH 2 Cl ( B )
и C реагирует с водой в присутствии кислоты с образованием этанола, CH 3 CH 2 OH
C , скорее всего, будет этиленом (этеном), потому что эта молекула вступает в реакции присоединения с водой с образованием этанола и подвергается гидрогалогенированию с HCl, так что H и Cl присоединяются по двойной связи:(i) название: этилен (этен)
(ii) конденсированная (полуструктурная) формула: CH 2 = CH 2
Наша полная схема реакции теперь выглядит так, как показано ниже:
| A этан | Класс 2 светлый → | B хлорэтан | КОН (водн.) → | этанол CH 3 CH 2 OH | MnO 4 — → H + (водн.) | D уксусная кислота (этановая кислота) |
| ↑ HCl / AlCl 3 | H 2 O / H 3 PO 4 , 300 ° C ↑ | ↓ Канал 3 Канал 2 OH / H 2 SO 4 | ||||
| ← | C этилен (этен) | → | E этилацетат (этилэтаноат) |
Итак, мы идентифицировали все неизвестные соединения в схеме реакции:
A : этан, CH 3 CH 3
B : хлорэтан, CH 3 CH 2 Cl
C : этилен (этен), CH 2 = CH 2
D : уксусная кислота (этановая кислота), CH 3 COOH
E : этилацетат (этилэтаноат), CH 3 CH 2 -O-CO-CH 3
Зеленая химия | Английский | Зеленая химия
Модуль зеленой химии
Предлагаемое использование: Курс органической химии (как лекционный, так и лабораторный) во время обсуждения различных реакций (замещения, исключения, добавления, перегруппировки и т. Д.))
ЭКОНОМИКА АТОМА: МЕРЫ ЭФФЕКТИВНОСТИ РЕАКЦИИ
Майкл К. Канн, химический факультет Скрентонского университета
[email protected]
Процентная доходность
Хотя эффективность реакции можно измерить разными способами, наиболее распространенным способом является вычисление выхода (процентного выхода). Студентам часто требуется, особенно в лаборатории, определить теоретический выход на основе ограничивающего реагента, а затем рассчитать процентный выход на основе отношения фактический выход / теоретический выход х 100.В целом химики-органики считают выход 90% или выше отличным, а 20% или меньше — плохим.
Теоретический выход = (моль ограничивающего реагента) (стехиометрическое соотношение; желаемый продукт / ограничивающий реагент) (ММ желаемого продукта)
Процентный доход = (фактический / теоретический) X 100
Чтобы проиллюстрировать расчет процентного выхода (и измерение эффективности реакции), рассмотрим следующую реакцию нуклеофильного замещения, промотируемую кислотой.Типичная процедура 1 для этой реакции начинается с растворения
Уравнение 1a
1,33 г бромида натрия (2) в 1,5 мл воды с последующим добавлением 0,80 мл 1-бутанола (1) и 1,1 мл (2,0 г) концентрированной серной кислоты (3). Следующая таблица реагентов (таблица 1) и таблица желаемых продуктов (таблица 2) могут быть
.
Таблица 1 Реагенты Таблица
| Реагент | МВт | Вес Использованный (г) | Используемые моль | Теоретически Требуется моль | Плотность | Bp ( o ° C) |
| 1 C 4 H 9 OH | 74.12 | 0,80 | 0,0108 | 0,0108 | 0,810 | 118 |
| 2 NaBr | 102,91 | 1,33 | 0,0129 | 0,0108 | ||
| 3 H 2 SO 4 | 98,08 | 2,0 | 0,0200 | 0,0108 | 1,84 |
Таблица 2 Таблица желаемых продуктов
| Соединение | МВт | Теоретический выход (моль) | Теоретическая Урожайность (граммы) | Фактический выход (граммы) | % Доходность | Плотность | Bp ( o ° C) |
| 4 C 4 H 9 Br | 137.03 | 0,011 | 1,48 (100%) | 1,20 | 81 | 1,275 | 101,6 |
настройка. Разделение веса каждого используемого реагента на молекулярный вес реагента дает количество молей каждого используемого реагента. Из стехиометрии реакции (уравнение 1a) ясно, что для получения одного моля продукта (1-бромбутана) требуется один моль каждого реагента, а поскольку 1-бутанол (0,0108 моль) используется в наименьшем количестве, это ограничивающий реагент.Расчет (как показано ниже) теоретического выхода 1-бромбутана дает 1,48 г. Это означает, что использование
Теоретический выход = (моль ограничивающего реагента) (стехиометрическое соотношение; желаемый продукт / ограничивающий реагент) (молекулярная масса желаемого продукта)
= (моль 1-бутанола) (стехиометрическое соотношение; 1-бромбутан / 1-бутанол) ( MW 1-бромбутана)
= (0,0180 моль) (1 моль / 1 моль) (137,03 г / моль)
= 1.48 г
количества реагентов, максимальное количество (при условии 100% выхода) 1-бромбутана, которое может быть получено, составляет 1,48 г. Фактически ни одна реакция никогда не протекает со 100% выходом из-за таких факторов, как образование побочных продуктов, неполное превращение исходных материалов, потери при переработке реакционной смеси и потери при выделении и очистке желаемого продукта. Эта реакция обычно дает фактические выходы 1-1,2 г. Предполагая, что фактический выход составляет 1,20 г, расчет% выхода выглядит следующим образом.Таким образом, фактически выделен 81% теоретического выхода, что является очень приличным выходом, который понравился бы большинству химиков.
Процентный выход = (фактический / теоретический) X 100
= (1,20 г / 1,48 г) X 100 = 81%
Как указывалось ранее, большинство химиков традиционно измеряли эффективность реакции по процентному выходу, однако это лишь часть истории. Если учесть приведенную выше реакцию, то всего 4.Было использовано 13 г реагентов (0,8 г 1-бутанола, 1,33 г NaBr и 2,0 г H 2 SO 4 ), и что в лучшем случае эта реакция даст только 1,48 г желаемого продукта, вопрос Можно спросить: «Что происходит с основной массой реагентов (4,13 г -1,48 г = 2,7 г )?». Ответ заключается в том, что они попадают в побочные продукты (NaHSO 4 и H 2 O), которые могут быть нежелательными, неиспользованными, токсичными и / или не переработанными / повторно используемыми. С побочными продуктами часто обращаются как с отходами, и их необходимо утилизировать или обработать иным образом.В лучшем случае только 36% (1,48 г / 4,13 г х 100) массы реагентов попадают в желаемый продукт. Если фактический выход составляет 81%, то только 29% (0,81 X 0,36 X 100) массы реагентов фактически попадает в желаемый продукт!
Стремясь повысить осведомленность об атомах реагентов, которые включены в желаемый продукт, и об атомах, которые выбрасываются (превращаются в нежелательные продукты), Барри Трост разработал концепцию атомной экономики . 2 В 1998 году Трост был удостоен президентской премии Green Chemistry Challenge за концепцию атомной экономики.В свете концепции атомной экономии, указанное выше нуклеофильное замещение, промотируемое кислотой, должно быть пересмотрено. В уравнении 1b мы проиллюстрировали атомную экономию этой реакции, показывая все атомы реагентов, которые включены в желаемый продукт, зеленым цветом,
.
Уравнение 1b
, а потраченные впустую показаны коричневым цветом. Точно так же атомы желаемого продукта показаны зеленым, а атомы, составляющие нежелательные продукты, — коричневыми. В таблице 3 представлен другой взгляд на атомную экономию этой реакции.В столбцах 1 и 2 этой таблицы перечислены формулы и формулы веса (FW) реагентов. Зеленым цветом (столбцы 3 и 4) показаны атомы и веса атомов реагентов, которые включены в желаемый продукт (4), а коричневым цветом (столбцы 5 и 6) показаны атомы и веса атомов реагенты, которые попадают в нежелательные побочные продукты. Сосредоточившись на последней строке этой таблицы, можно увидеть, что из всех атомов реагентов (4C, 12H, 5O, 1Br, 1Na и 1S) только 4C, 9H и 1Br используются в желаемом продукте и основной части ( 3H, 5O, 1Na, 1S) выбрасываются как компоненты нежелательных продуктов.Это пример плохой атомной экономики! Логическим продолжением концепции атомной экономики Троста является вычисление
Таблица 3 Атомная экономика уравнения 1
| Реагенты Формула | Реагенты FW | Используемые атомы | Вес использованных атомов | Неиспользованные Атомы | Вес неиспользованных атомов |
| 1 C 4 H 9 OH | 74 | 4C, 9H | 57 | HO | 17 |
| 2 NaBr | 103 | Br | 80 | Na | 23 |
| 3 H 2 SO 4 | 98 | _____ | 0 | 2H, 4O, S | 98 |
| Всего 4C, 12H, 5O, BrNaS | 275 | 4С, 9Н, Br | 137 | 3H, 5O, Na, S | 138 |
процентная атомная экономика . 3 Это можно сделать, взяв отношение массы используемых атомов (137) к общей массе атомов всех реагентов (275) и умножив на 100. Как показано ниже, в этой реакции присутствует только 50% атомов экономия.
% Atom Economy = (FW используемых атомов / FW всех реагентов) X 100
= (137/275) X 100 = 50%
Таким образом, в лучшем случае (если реакция дает 100% выход), тогда только половина массы реагентов будет включена в желаемый продукт, а остальная часть будет потрачена на нежелательные побочные продукты.
ДОПОЛНИТЕЛЬНЫЙ МАТЕРИАЛ
В следующем дополнительном материале рассматриваются два новых термина, называемых «экспериментальная атомная экономика» , и « процентная доходность X экспериментальная атомная экономика». Эти два термина дополнительно поясняют эффективность реакции, однако этот материал может быть опущен. Чтобы пропустить дополнительный материал и вернуться к обсуждению атомной экономики и других экологических соображений, щелкните здесь.
В действительности, если реакцию проводить в соответствии с количествами, указанными в таблице 1, атомная экономия будет еще меньше. Это результат того факта, что в таблице 3 предполагалось, что стехиометрические количества каждого реагента (1: 1: 1), как указано в уравнении 1b, будут израсходованы в этой реакции. Фактически количества реагентов 1, 2 и 3, которые были использованы в реальной реакции, как показано в таблице 1, составляют 0,0108: 0,0129: 0,0200 = 1: 1,11: 1,85. Таблица 4 иллюстрирует термин, который мы создали для «экспериментальной» атомной экономики , , который основан на фактических количествах реагентов, использованных в эксперименте.Таблица 4 аналогична таблице 3 за исключением того, что
Таблица 4 Экспериментальная атомная экономия уравнения 1: на основе
фактических количеств использованных реагентов
| Реагенты Формула | Масса реагента (использовано FW X молей) | Используемые атомы | Вес используемых атомов (FW X моль) | Неиспользованные Атомы | Вес неиспользованных атомов (FW X моль) |
| 1 C 4 H 9 OH | 74.0 X 0,0108 = 0,80 | 4C, 9H | 57 X 0,0108 = 0,62 | HO | 17 X 0,0108 = 0,18 |
| 2 NaBr | 103 X 0,0129 = 1,33 | Br | 79,9X .0129 = 1,03 79,9X .0108 = 0,86 превышение 0,17 | Na | 23 X 0,0129 = 0,30 превышение 0,17 итого 0,47 |
| 3 H 2 SO 4 | 98 Х.0200 = 2,0 | _____ | 0,00 | 2H, 4O, S | 98,1 X 0,0200 = 1,96 |
| Всего 4C, 12H, 5O, BrNaS | 4,13 | 4С, 9Н, Br | 1,48 | 3H, 5O, Na, S | 2,61 |
учитывается избыток использованных реагентов. В этом случае используется избыток NaBr (реагент 2) (.0129 моль) по сравнению с 1-бутанолом (0,0108 моль), который является ограничивающим реагентом. Таким образом, в таблице 4 в четвертом столбце, где рассчитана масса фактически используемых реагентов, можно увидеть, что даже несмотря на то, что бром (из NaBr) используется в желаемом продукте, имеется избыток этого элемента и, следовательно, избыток необходимо добавить к неиспользованной массе реагентов. Термин, который мы придумали, называется Процент Экспериментальная атомная экономика , и теперь его можно вычислить.Процентная экспериментальная атомная экономия — это просто ожидаемая масса реагентов, которые используются в желаемом продукте (которая оказывается такой же, как теоретический выход), деленная на фактическую общую массу всех реагентов, используемых в эксперименте. В таблице 4 мы видим в столбце 4, строке 4, использованная масса составляет 1,48 г, а общая масса реагентов составляет 4,13 г (строка 4, столбец 2), таким образом, экспериментальная экономия атомов в% составляет (1,48 / 4,13 X 100) 36 %. Это, конечно, не что иное, как тот же расчет, который был
.
% Experimental Atom Economy = (масса реагентов, используемых в желаемом продукте / общая масса всех реагентов) X 100
= (теоретический выход / общая масса всех реагентов) X 100
= (1.48 г / 4,13 г) X 100 = 36%
, выполненный в начале обсуждения атомной экономии, и представляет собой максимальный% массы реагентов, которые могут быть включены в желаемый продукт. Хотя такой же вывод был получен до обсуждения концепции атомной экономии, полезно составить таблицу, такую как Таблица 4, чтобы можно было увидеть, какой (-е) реагент (-ы) приводит к плохой атомной экономии.
Вместо того, чтобы рассматривать процентный выход и (экспериментальную) атомную экономию отдельно, еще лучшим показателем эффективности реакции является рассмотрение их комбинации.Чтобы проиллюстрировать это, мы ввели термин процентная доходность X Экспериментальная атомная экономика (% PE . EAE) . Это рассчитывается следующим образом:
% Выход X Экспериментальная атомная экономия = (фактический выход / теоретический выход) X (масса реагентов, использованных в желаемом продукте
/ общая масса всех реагентов) X 100
% PE . EAE = (фактический выход / теоретический выход) X (теоретический выход / общая масса всех реагентов)
X 100
= (фактический выход / общая масса всех реагентов) X 100
= (1,20 г / 4,13 г) Х 100
= 29%
Обратите внимание, что в этом расчете теоретический выход исключает оставление отношения фактического выхода к общей массе всех реагентов X 100.Если снова предположить, что фактический выход составляет 1,20 г, и это разделить на 4,13 г (общая масса всех реагентов из таблицы 4), то процент выхода X экспериментальной атомной экономики составит всего 29% (ранее мы пришли к такому же выводу в гораздо менее формальный способ; см. первый абзац этого раздела). Это означает, что только 29% от общей массы всех реагентов фактически выделяется в желаемый продукт, а 71% теряется! Такое измерение эффективности реакции открывает совершенно новую перспективу.Хотя многие химики сочли бы выход 81% очень приемлемым, немногие сочли бы удовлетворительным выделение только 29% масс реагирующих атомов в желаемом продукте.
На этом завершается дополнительный материал
Прочие экологические соображения
Хотя учет как атомной экономии, так и% выхода дает гораздо лучшую меру эффективности реакции и ее приемлемости для окружающей среды, необходимо учитывать и другие факторы.Чтобы вызвать обсуждение экологической приемлемости реакции, целесообразно изучить некоторые из Двенадцати принципов зеленой химии (см. Ниже). Принципы 1 и 2 напрямую связаны с атомной экономией и доходностью.
ДВЕНАДЦАТЬ ПРИНЦИПОВ ЗЕЛЕНОЙ ХИМИИ 4
1. Лучше предотвратить образование отходов, чем обрабатывать или убирать отходы после их образования.
2. Синтетические методы должны быть разработаны таким образом, чтобы обеспечить максимальное включение
всех материалов, используемых в процессе, в конечный продукт.
3. Везде, где это практически возможно, синтетические методы должны быть разработаны таким образом, чтобы
использовать и генерировать вещества, которые обладают небольшой или нулевой токсичностью для здоровья человека и окружающей среды.
4. Химические продукты должны быть разработаны таким образом, чтобы сохранять эффективность функции
при одновременном снижении токсичности.
5. Использование вспомогательных веществ (например, растворителей, разделительных агентов и т.д.)
должно быть по возможности ненужным и безвредным при использовании
.
6. Потребности в энергии должны быть признаны из-за их воздействия на окружающую среду и
экономики и должны быть сведены к минимуму. Синтетические методы
следует проводить при температуре и давлении окружающей среды.
7. Сырье должно быть возобновляемым, а не истощающим
, когда это технически и экономически целесообразно.
8. Ненужной дериватизации (блокирующая группа, защита / снятие защиты,
временная модификация физических / химических процессов) следует
по возможности избегать.
9. Каталитические реагенты (насколько возможно селективные) превосходят стехиометрические реагенты
.
10. Химические продукты должны быть спроектированы таким образом, чтобы по окончании их функции
они не сохранялись в окружающей среде и не распадались на безвредные продукты разложения
.
11. Аналитические методологии нуждаются в дальнейшем развитии, чтобы обеспечить
оперативный мониторинг и контроль в реальном времени до образования
опасных веществ.
12. Вещества и форма вещества, используемого в химическом процессе
, должны выбираться таким образом, чтобы свести к минимуму вероятность химических аварий,
включая выбросы, взрывы и пожары.
Принципы 3 и 4 касаются токсичности всех веществ, используемых в реакции, включая реагенты и продукты. Из уравнения 1 ясно, что два атома водорода и один кислород, которые идут на образование воды, тратятся впустую. Однако, если в результате реакции образуется побочный продукт, вода является экологически безвредной (нетоксичной и не представляет проблем с утилизацией, если она чистая), как можно представить.Однако все продукты и реагенты должны быть оценены на их токсичность. Прекрасные примеры образования менее токсичных продуктов, обладающих такой же эффективностью, можно увидеть в новых пестицидах, разработанных Rohm and Haas для борьбы с насекомыми и морских обрастающих организмов. Каждый из этих новых образцов пестицидов был удостоен награды Presidential Green Chemistry Challenge.
Принцип № 5 требует рассмотрения вспомогательных веществ (растворителей, разделительных агентов, осушителей и т. Д.).), которые используются в реакциях и синтезах. Хотя вода используется в качестве растворителя (экологический плюс 5 ), в типичной экспериментальной процедуре 1 для выполнения уравнения 1 для обработки продукта (1-бромбутана) после дистилляции требуется 1 мл концентрированной серной кислоты, 1 мл 3M гидроксида натрия, безводного хлорида кальция, 1 мл этанола, 1 мл ацетона и 2 мл п-ксилола — все это для выделения только 1-1,2 г 1-бромбутана! Таким образом, очевидно, что количество отходов, образующихся из этих вспомогательных веществ, является значительным и превышает количество отходов (по крайней мере, с точки зрения массы), образующихся непосредственно в результате реакции.Во многих органических реакциях используются большие количества органических растворителей, которые часто бывают токсичными. Эти растворители часто попадают в воду, почву и воздух, что приводит к значительному загрязнению окружающей среды. Предпринимаются попытки заменить органические растворители водой, диоксидом углерода и ионными жидкостями комнатной температуры. Фактически, Джозеф ДеСимоун из Университета Северной Каролины был награжден Президентской премией Green Chemistry Challenge за свою работу по разработке поверхностно-активных веществ для жидкого и сверхкритического диоксида углерода .В результате усилий доктора ДеСимоуна для химической чистки одежды был разработан процесс с использованием жидкого углекислого газа. Этот процесс рециркулирует диоксид углерода, который получается как отходы от других химических процессов, и позволяет заменять перхлорэтилен, влияние которого на здоровье подвергается сомнению.
Принцип № 6 рассматривает энергетические потребности реакции. Предпочтительно проводить реакции при температуре и давлении окружающей среды, однако многие химические реакции требуют нагрева и / или охлаждения и давления, отличного от давления окружающей среды.Это требует использования некоторого источника энергии, и чаще всего этим источником энергии является ископаемое топливо. Для проведения реакции и выделения 1-бромбутана, образованного в уравнении 1, требуется кипячение с обратным холодильником и две дистилляции. Таким образом, энергетические потребности этой реакции значительны.
Большинство органических исходных материалов, таких как 1-бутанол в уравнении 1, в конечном итоге получают из сырой нефти, невозобновляемого (истощающего) ресурса. Принцип № 7 побуждает нас задуматься о том, можно ли получить эти исходные материалы из возобновляемых источников.Возобновляемые ресурсы обычно означают биологические материалы и материалы растительного происхождения (биомассу). Двуокись углерода и метан также обычно считаются возобновляемыми, поскольку они могут быть получены как естественными, так и синтетическими методами. Работа Дратса и Фроста из штата Мичиган, Марка Холтзаппла из Texas A&M и Biofine Corporation по созданию химического сырья из биомассы получила награды Presidential Green Chemistry Challenge.
Некоторые могут ошибочно относить реакцию, описанную в уравнении 1, к реакции, катализируемой кислотой, хотя на самом деле это реакция, промотированная кислотой.Это результат того факта, что серная кислота в этой реакции требуется в стехиометрических, а не каталитических количествах. Поскольку принцип № 9 указывает, что реагенты, используемые в каталитических количествах, предпочтительнее реагентов, используемых в стехиометрических количествах. Поскольку для потери каждой молекулы воды в этой реакции требуется один моль серной кислоты, то достаточно будет только стехиометрических количеств этого реагента. Однако, даже если используются стехиометрические количества, восстановление / рециркуляция / повторное использование нежелательных продуктов должно происходить всякий раз, когда это возможно.В последнее время были достигнуты значительные успехи в разработке реакций, которые ускоряются нетоксичными и восстанавливаемыми катализаторами. Биокаталитический процесс, открытый и разработанный Lilly Research Laboratories для производства потенциального противосудорожного препарата, получил награду Presidential Green Chemistry Challenge.
Во всех оставшихся обсуждениях эффективности реакции обсуждение будет ограничено атомной экономией, основанной на стехиометрии реакции. Когда кто-то сталкивается с этими реакциями в лаборатории, также может быть разумным рассчитать атомную экономию на основе количества используемых реагентов (экспериментальная атомная экономия).Кроме того, можно также рассмотреть такие вопросы, как токсичность, потребление энергии, использование вспомогательных веществ, каталитические реагенты по сравнению со стехиометрическими и возобновляемые по сравнению с невозобновляемым сырьем.
В приведенной выше реакции замещения (уравнение 1a) было обнаружено, что плохая атомная экономия является результатом того факта, что атомы уходящей группы (ОН), которая заменяется, противоиона (натрия) нашего нуклеофила (бромида) и вся серная кислота, которая требуется для этой реакции, тратится на образование нежелательных продуктов в этой реакции.В силу того факта, что реакции элиминирования требуют только потери атомов (при отсутствии получения) из реагента, это означает, что реакции элиминирования в целом даже хуже с точки зрения их атомной экономии, чем реакции замещения.
В качестве примера рассмотрим атомы следующей реакции элиминирования. Дегидрогалогенирование алкилгалогенидов, промотируемое основанием, является распространенным методом получения алкенов из алкилгалогенидов путем отщепления. В уравнении 2 образование метилпропена осуществляется реакцией 2-бром-2-метилпропана (7) с этоксидом натрия (8).В этой реакции атомы реагентов, которые включены в желаемый продукт (9), и атомы желаемого продукта показаны зеленым, в то время как неиспользованные атомы реагентов показаны коричневым цветом, как и атомы в нежелательных продуктах. реакции. Таблица 5 иллюстрирует атомную экономию этой реакции, и расчет% атомной экономии дает очень плохие 27%. Бедный атом
Уравнение 2
Таблица 5 Уравнение атомной экономики 2
| Реагенты Формула | Реагенты FW | Используемые атомы | Вес использованных атомов | Неиспользованные Атомы | Вес неиспользованных атомов |
| 7 C 4 H 9 Br | 137 | 4C, 8H | 56 | HBr | 81 |
| 8 C 2 H 5 ONa | 68 | ____ | 0 | 2C, 5H, O, Na | 68 |
| Всего 6C, 14H, O, Br, Na | 205 | 4C, 8H | 56 | 2C, 6H, O, Br, Na | 149 |
% Atom Economy = (FW используемых атомов / FW всех реагентов) X 100
= (56/205) X 100 = 27%
экономия является результатом не только потери HBr, но также потому, что это реакция, стимулированная основанием, и все атомы основания этоксида натрия обнаруживаются в нежелательных побочных продуктах.
Поскольку реакции присоединения обычно приводят к включению всех атомов реагентов в конечные желаемые продукты, реакции присоединения приводят к высокой атомной экономии. Таким образом, с точки зрения атомной экономии, реакции присоединения предпочтительнее с экологической точки зрения, чем реакции отщепления и замещения. В качестве примера рассмотрим следующее добавление бромистого водорода к метилпропену. В этом примере все атомы реагентов (9 и 11) показаны зеленым, поскольку все эти атомы используются в конечном желаемом продукте (7).Таблица экономии атомов (Таблица 6) и расчет 100% экономии атомов дополнительно подчеркивают превосходную атомную экономию этой реакции.
Уравнение 3
Таблица 6 Уравнение атомной экономики 3
| Реагенты Формула | Реагенты FW | Используемые атомы | Вес использованных атомов | Неиспользованные Атомы | Вес неиспользованных атомов |
| 9 C 4 H 8 | 56 | 4C, 8H | 56 | ____ | 0 |
| 11 HBr | 81 | HBr | 81 | ____ | 0 |
| Итого 4C, 9H, Br | 137 | 4C, 9H, Br | 137 | ____ | 0 |
% Atom Economy = (FW используемых атомов / FW всех реагентов) X 100
= (137/137) X 100 = 100%
Реакции перегруппировки включают реорганизацию атомов молекулы.Поскольку ни отщепление, ни добавление, ни замещение атомов не происходит, в молекуле, подвергающейся перегруппировке, атомная экономия реакций перегруппировки составляет 100%, и они являются экологически предпочтительными реакциями с точки зрения атомной экономии. Чтобы проиллюстрировать это, рассмотрим катализируемую кислотой перегруппировку 3,3-диметил-1-бутена (12) в 2,3-диметил-2-бутен (13). В этом случае все атомы реагента 12 показаны зеленым, поскольку все они включены в желаемый продукт 13.Как и в предыдущих примерах, можно создать таблицу атомной экономии и рассчитать процентную экономию. Хотя кислота (H + ), используемая в этой реакции, не включается в желаемый продукт, она используется только в каталитических количествах и поэтому обозначена черным (не зеленым или коричневым) и не учитывается в таблице атомной экономии или расчет атомной экономики. Как было предсказано выше для перегруппировок,% атомной экономии этой реакции составляет 100%.
Уравнение 4
Таблица 7 Уравнение атомной экономики 4
| Реагенты Формула | Реагенты FW | Используемые атомы | Вес использованных атомов | Неиспользованные Атомы | Вес неиспользованных атомов |
| 12 C 6 H 12 | 84 | 6C, 12H | 84 | ____ | 0 |
| Всего 6C, 12H | 84 | 6C, 12H | 84 | ____ | 0 |
% Atom Economy = (FW используемых атомов / FW всех реагентов) X 100
= (84/84) X 100 = 100%
Практически все органические реакции относятся к категории реакций замещения, присоединения, отщепления или перегруппировки.С точки зрения атомной экономии, реакции присоединения и перегруппировки являются предпочтительными с экологической точки зрения, за ними следуют реакции замещения, в то время как отщепления являются наименее предпочтительными с экологической точки зрения. Когда человек сталкивается с реакциями, при изучении химии следует рассматривать каждую реакцию не только с точки зрения выхода, но и с точки зрения атомной экономии реакции.
Концепция атомной экономики также может быть применена к синтезу. Чтобы определить атомную экономию синтеза, нужно просто определить, какие из атомов реагентов для всех стадий синтеза включены в желаемый конечный продукт.
Чтобы проиллюстрировать концепцию атомной экономии в синтезе, рассмотрим промышленный синтез этиленоксида (19). Оксид этилена является сырьем для синтеза этиленгликоля (используется в антифризах), этоксилатов (поверхностно-активных веществ), а также простых эфиров и полимеров гликоля (таких как ПЭТ). Приблизительно 8 800 миллионов фунтов этого соединения производятся в год во всем мире. Классический синтез (схема 1) этиленоксида (19) представляет собой двухстадийный синтез и известен как хлоргидриновый путь.Атомы атомов реагента, которые включены в конечный желаемый продукт (19), и атомы желаемого продукта равны
Схема 1 Путь хлоргидрина к этиленоксиду
зеленый, и те атомы, что показаны зеленым, в то время как атомы реагентов, которые попадают в нежелательные продукты (вместе с атомами нежелательных продуктов), показаны коричневым. Таблица 8 представляет собой таблицу экономии атомов для пути хлоргидрина к оксиду этилена и позволяет рассчитать низкую экономию атомов (23%) этого пути.
Таблица 8 Атомная экономика схемы 1, путь хлоргидрина к оксиду этилена
| Реагенты Формула | Реагенты FW | Используемые атомы | Вес использованных атомов | Неиспользованные Атомы | Вес неиспользованных атомов |
| 14 C 2 H 4 | 28 | 2C, 4H | 28 | _____ | 0 |
| 15 Класс 2 | 71 | _____ | 0 | 2Cl | 71 |
| 6 H 2 O | 18 | O | 16 | 2H | 2 |
| 18 Ca (OH) 2 | 72 | _____ | 0 | Са, 4Н, 2О | 72 |
| Всего 2C, 8H, 3O, Ca, 2Cl | 189 | 2C, 4H, O | 44 | 6H, 2O, Ca, 2Cl | 145 |
% Atom Economy = (FW используемых атомов / FW всех реагентов) X 100
= (44/189) X 100 = 23%
Разработан каталитический путь (схема 2) для получения окиси этилена из этилена.В этом одностадийном синтезе единственным другим реагентом, кроме этилена, является 1/2 моля кислорода. Как видно из схемы 2 и таблицы 9, все атомы реагента включены в желаемый конечный продукт, и, таким образом, этот синтез имеет 100% атомную экономию. 100% -ная атомная экономия для этой реакции неудивительна, поскольку это реакция присоединения, и, как было замечательно указано, реакции присоединения имеют 100% -ную атомную экономию.
Схема 2 Каталитический путь к оксиду этилена
Таблица 9 Атомная экономика схемы 2, каталитический путь к оксиду этилена
| Реагенты Формула | Реагенты FW | Используемые атомы | Вес использованных атомов | Неиспользованные Атомы | Вес неиспользованных атомов |
| 14 C 2 H 4 | 28 | 2C, 4H | 28 | _____ | 0 |
| 21 1/2 O 2 | 16 | O | 16 | _____ | 0 |
| Всего 2C, 4H, 1Ol | 44 | 2C, 4H, O | 44 | _____ | 0 |
% Atom Economy = (FW используемых атомов / FW всех реагентов) X 100
= (44/44) X 100 = 100%
The Boots Company Synthesis of Ibuprofen
Ибупрофен является активным ингредиентом ряда фирменных продуктов, включая Адвил, Мотрин и Нуприн.Ибупрофен действует как анальгетик (болеутоляющее), а также эффективен как нестероидный противовоспалительный препарат (НПВП). НПВП уменьшают воспаление от таких состояний, как артрит, остеоартрит и ревматизм. Ибупрофен упоминается как нестероидное противовоспалительное средство , поскольку ибупрофен не является членом семейства стероидных соединений.
Мировое производство ибупрофена превышает 30 миллионов фунтов в год. Компания Boots Company PLC из Ноттингема, Англия, впервые запатентовала синтез ибупрофена в 1960-х годах (U.S. Patent 3,385,886), и это служило основным методом синтеза в течение многих лет. Синтез ибупрофена Boot представляет собой шестистадийный синтез и показан на схеме 3. Как обычно, все
Схема 3 Ботинки Синтез ибупрофена
атома каждого реагента, которые включены в конечный желаемый продукт (ибупрофен), показаны зеленым, а те, которые попадают в нежелательные продукты, показаны коричневым. Таблица 10 иллюстрирует атомную экономию синтеза компании Boots Company и позволяет рассчитать процентную атомную экономию 40%.Как было указано выше, ежегодно производится около 30 миллионов фунтов ибупрофена. Если бы все мировые поставки ибупрофена производились с помощью процесса Boots, это привело бы к образованию около 35 миллионов фунтов отходов!
Таблица 10 Атомная экономика схемы 3, синтез ибупрофена компанией Boots Company
| Реагенты Формула | Реагенты FW | Используемые атомы | Вес использованных атомов | Неиспользованные Атомы | Вес неиспользованных атомов |
| 1 C 10 H 14 | 134 | 10C, 13H | 133 | H | 1 |
| 2 C 4 H 6 O 3 | 102 | 2C, 3H | 27 | 2C, 3H, 3O | 75 |
| 4 C 4 H 7 ClO 2 | 122.5 | C, H | 13 | 3C, 6H, Cl, 2O | 109,5 |
| 5 C 2 H 5 ONa | 68 | _____ | 0 | 2C, 5H, O, Na | 68 |
| 7 H 3 O | 19 | _____ | 0 | 3Н, О | 19 |
| 9 NH 3 O | 33 | _____ | 0 | 3H, N, O | 33 |
| 12 H 4 O 2 | 36 | H, 2O | 33 | 3H | 3 |
| Всего 20C, 42H, N, 10O, Cl, Na | 514.5 | Ибупрофен 13C, 18H, 2O | Ибупрофен 206 | Отходы 7C, 24H, N, 8O, Cl, Na | Отходы 308,5 |
% Atom Economy = (FW используемых атомов / FW всех реагентов) X 100
= (206 / 514,5) X 100 = 40%
В восьмидесятые годы ибупрофен был одобрен для использования без рецепта, и срок действия патента компании Boots Company истек.Признавая финансовые возможности, которые может предложить производство и продажа этого препарата, несколько компаний приступили к созданию предприятий и разработке новых методов приготовления ибупрофена. Корпорация Hoechst Celanese (Сомервилль, Нью-Джерси; теперь известная как Celanese Corporation) открыла новый трехступенчатый синтез ибупрофена. Вместе с компанией Boots они сформировали компанию BHC для подготовки (путем нового синтеза) и продажи ибупрофена. Синтез BHC Company показан на схеме 4, где используемые атомы показаны зеленым цветом, а неиспользованные атомы — коричневым.Атомная экономия дополнительно проиллюстрирована в Таблице 11, и расчет% атомной экономии дает 77%, что является значительным улучшением по сравнению с 40% из
.
Схема 4 Синтез ибупрофена компании BHC
Таблица 11 Атомная экономика схемы 4, синтез ибупрофена компании BHC
| Реагенты Формула | Реагенты FW | Используемые атомы | Вес использованных атомов | Неиспользованные Атомы | Вес неиспользованных атомов |
| 1 C 10 H 14 | 134 | 10C, 13H | 133 | H | 1 |
| 2 C 4 H 6 O 3 | 102 | 2С, 3Н, О | 43 | 2C, 3H, 2O | 59 |
| 4 выс. 2 | 2 | 2H | 2 | _____ | 0 |
| 6 CO | 28 | CO | 28 | _____ | 0 |
| Всего 15C, 22H, 4O | 266 | Ибупрофен 13C, 18H, 2O | 206 | Отходы 2C, 3H, 2O | 60 |
% Atom Economy = (FW используемых атомов / FW всех реагентов) X 100
= (206/266) X 100 = 77%
Boots Компания процесс.Атомная экономия процесса компании BHC подскакивает до> 99%, если учесть, что уксусная кислота, полученная на этапе 1, восстанавливается и используется.
Процесс компании BHC не только предлагает резкое улучшение атомной экономики, но и предлагает другие экологические преимущества. К ним относятся трехступенчатый каталитический процесс по сравнению с шестиступенчатым процессом Boots Company, который требует дополнительных реагентов в стехиометрических количествах. Например, первая стадия каждого процесса дает один и тот же продукт (3) из одних и тех же реагентов (1 и 2).Однако в процессе компании Boots Company используется трихлорид алюминия в стехиометрических количествах (не учтенных в таблице 10), в то время как в процессе компании BHC используется HF в каталитических количествах, который повторно восстанавливается и повторно используется. Трихлорид алюминия производит большие количества гидрата трихлорида алюминия в качестве побочного продукта, который обычно вывозится на свалки. Никелевые и палладиевые катализаторы, используемые на этапах 2 и 3 процесса BHC Company, также восстанавливаются и используются повторно.
Поскольку процесс компании BHC состоит всего из трех этапов (vs.шесть шагов для процесса компании Boots), и он имеет значительно улучшенную атомную экономию, он не только приводит к резкому сокращению производимых отходов, но также позволяет увеличить производительность (больше ибупрофена за меньшее время и с меньшим количеством оборудования). Эти факторы приводят к экономической выгоде для компании в результате того, что требуется меньше денег для обработки образующихся отходов и меньше капитальных затрат для производства того же количества ибупрофена. Таким образом, не только выигрывает окружающая среда, но и повышается прибыль компании, и в результате более экологичного процесса могут быть достигнуты хорошие связи с общественностью.
За разработку этого синтеза ибупрофена компания BHC выиграла престижную президентскую премию «Green Chemistry Challenge» в 1997 году, а в 1993 году она также получила известную награду Kirpatrick Chemical Engineering Achievement Award 6 . Премия Кирпатрика вручается каждые два года. Chemical Engineering и отмечает выдающиеся усилия группы в разработке и коммерциализации технологических процессов.
Экономия атома и экспериментальная экономия атома выходят за рамки расчета выхода реакции и предлагают второй способ измерения эффективности реакции с учетом использованных и неиспользованных атомов реагентов.Процентная экономия атомов и процентная экспериментальная атомная экономия дают возможность количественно оценить атомную экономию и позволяют количественно сравнивать атомную экономию одной реакции (или синтеза) с другой. Возможно, лучшим показателем эффективности реакции является учет как атомной экономии, так и выхода путем расчета процентного выхода X экспериментальной атомной экономии (PE , EAE). Конечно, при оценке экологической пригодности реакции (или синтеза) следует учитывать не только эффективность реакции, но также (как обсуждалось выше) другие факторы, такие как токсичность, использование вспомогательных веществ, потребность в энергии, происхождение сырья и каталитический vs.стехиометрические реагенты.
1. Определите следующие термины
a) атомная экономия
b)% атомная экономия
c)% доходность
d)% экспериментальная атомная экономия
c)% PE . EAE
2. Какие термины в вопросе 1 имеют значение только для экспериментальных результатов? Какой экспериментальный результат
необходим для того, чтобы эти термины имели смысл?
3. Рассмотрите следующие реакции.
a) Обозначьте каждую реакцию как замену, удаление, добавление или перегруппировку.
б) Перепишите каждую реакцию, убедившись, что она сбалансирована. Покажите все атомы реагента, которые включены в
желаемый продукт, и атомы желаемого продукта зеленым цветом, а все остальные атомы коричневым.
c) Составьте таблицу атомной экономии, аналогичную таблице 3, для каждой реакции.
d) Рассчитайте% атомной экономии для каждой реакции.
4. Как указано в ссылке 3, Роджер Шелдон разработал термин, очень похожий на% атомной экономии, названный% использования атома
.% Использования атомов можно рассчитать по следующему уравнению.
% Использование атома = (МВт желаемого продукта / МВт всех продуктов) X 100
а) Сравните и сопоставьте это с экономией в% атома.
б) С помощью информации, представленной на схемах 3 и 4, можете ли вы рассчитать процент использования атомов для этих синтезов? Объясните свой ответ
.
c) Какая концепция, которую вы изучили на первокурснике по химии, уравнивает фактические проценты, рассчитанные для% использования атома%
и% атомной экономии (в большинстве случаев).Докажите это, вычислив процент использования атомов для
каждой из реакций в вопросе 3 и сравнив свои результаты с процентной экономией атомов, которую вы рассчитали в вопросе 3.
5. Рассмотрим следующий двухстадийный синтез 2-пентина.
а) Перепишите синтез, убедившись, что каждая реакция сбалансирована. Покажите все атомы реагентов, которые включены
в желаемый продукт, и атомы желаемого продукта зеленым, а все остальные атомы коричневым.
c) Составьте таблицу атомной экономии для этого синтеза, аналогичную таблице 7.
d) Рассчитайте% атомной экономии этого синтеза.
e) Рассчитайте процент использования атомов в этом синтезе.
.
6. Ваш инструктор направит вас на эксперимент из вашего текущего лабораторного учебника. Относительно этой лаборатории:
a) Напишите сбалансированное уравнение, показывающее атомы реагентов, которые включены в желаемый продукт, и
атомов желаемого продукта зеленым цветом, а все остальные атомы коричневым цветом.
б) Постройте таблицу атомной экономии, аналогичную Таблице 3.
в) Рассчитайте% атомной экономии.
d) Постройте таблицу экспериментальной атомной экономии, аналогичную Таблице 4.
e) Рассчитайте экспериментальную атомную экономию.
f) Предположим, что эта реакция дает выход 80%. Рассчитайте% PE . EAE.
г) Каковы энергетические потребности этой реакции?
з) Используются ли в этой реакции вспомогательные вещества?
i) Какие реагенты используются в стехиометрических количествах?
j) Какие реагенты используются в каталитических количествах?
7.Поставка механизма для этапа 1 синтеза ибупрофена компании BHC. Катализируется ли эта стадия кислотой или промотируется кислотой?
8. Третий синтез ибупрофена, называемый этильным синтезом, показан ниже.
a) Перепишите синтез, указав все атомы реагентов, которые включены в желаемый продукт, и атомы
желаемого продукта зеленым, а все остальные атомы коричневым.
c) Составьте таблицу атомной экономии для этого синтеза, аналогичную таблице 7.
d) Рассчитайте% атомной экономии этого синтеза.
.
1. Уильямсон, Кеннет Л., Макромасштабные и микромасштабные органические эксперименты, 2-е изд., Д. К. Хит и Ко., 1994, 247-252.
2. Трост, Барри М., Атомная экономика — поиск синтетической эффективности. Наука 1991 , 254 , 1471-1477.
3. Cann, Michael C .; Коннелли, Марк Э. Реальные случаи в зеленой химии ; ACS, Вашингтон, 2000. Роджер Шелдон из Делфтского университета разработал очень похожую концепцию, называемую процентным использованием атомов.Шелдон, Роджер А. Органический синтез — прошлое, настоящее и будущее. Chem. Ind. (Лондон) , 1992, (декабрь), 903-906.
4. Анастас, Пол Т. и Уорнер, Джон К. Грин Теория и практика химии, Oxford University Press, Нью-Йорк, 1998.
5. Предпринимаются значительные усилия по сокращению использования органических соединений в качестве растворителей для реакций. и замену их водой или, что еще лучше, вообще без растворителя.
6. Вестхаймер Т. Премия достается БХК. Chem.Eng . 1993 , (декабрь), 84-95.
Return to Green Module for Organic Chemistry Home
Производное азирина — обзор
1.02.1 Введение
Азиридины и азирины — простейшие из гетероциклических кольцевых систем, содержащих азот, содержащих всего два атома углерода и один азот. Азиридины являются полностью насыщенным примером этой гетероциклической кольцевой системы, в то время как азирины содержат одинарную двойную связь. Могут быть образованы два типа азирина: 1 H -азирин и 2 H -азирин.При такой простоте структуры азиридины сочетают в себе уникальное сочетание реакционной способности и стабильности. Эта смесь реакционной способности и стабильности делает азиридины и азирины особенно полезными для синтеза более сложных азотсодержащих молекул. Включение дополнительного кольца, аннелированного с азиридиновым кольцом (т.е. азиридина с конденсированным кольцом), увеличивает как реакционную способность, так и сложность этой системы
Производные азиридинов с конденсированным кольцом можно разделить на две общие категории в зависимости от положения азота по отношению к кольцевому кольцу.Мы будем использовать терминологию типа I или exo для описания азиридинов с конденсированным кольцом, в которых азиридина является экзоциклическим по отношению к конденсированному кольцу. Мы будем называть азиридины, в которых азот находится в положении плацдарма, типом II или эндо . Азирины с конденсированными кольцами являются довольно редкими, и известны примеры только 2 H -азиринов с конденсированными кольцами. Хотя эти бициклические кольцевые системы часто идентифицируются как азиридин с конденсированным кольцом или азирин, они также идентифицируются по их систематическому названию бициклического кольца.Например, азиридин типа II, где n = 1, обычно идентифицируется как 1-азабицикло [3.1.0] гексан.
Существует множество методов синтеза азиридинов и азиринов. Точно так же существует множество реакций, которым подвергаются азиридины и азирины. Многие из этих реакций в равной степени применимы как к моноциклическим (Глава 1.01), так и к производным с конденсированным кольцом. В этой главе основное внимание уделяется реакциям и методам синтеза, которые являются уникальными для производных азиридинов и азиринов с конденсированным кольцом.В предыдущей главе этой серии <1996CHEC-II (1A) 61> была освещена литература по азиридинам и азиринам с конденсированными кольцами вплоть до 1996 года. С тех пор появилось большое количество обзоров по синтезу и взаимодействию азиридинов и азиринов (как моноциклических, так и моноциклических). и производные с конденсированным кольцом) были опубликованы <2004PHC (16) 54, 2006ACR194, 2005ARB103, 2005COR657, 2003MI206, 2004CSY275, 2004T2701, 2003PHC (15) 75, 2003ALD57, 2003ALD39, 2003CRV2905, 2002PHC (14) 52, 2002OPSR247 2001PHC (13) 52, 2001TCC93, 2000S1347, 2000PHC (12) 57, 2000COR727, 1999PHC (11) 66, 1998PHC (10) 49, 1997PHC (9) 43, 1997CRV2341, 1997RCC (4) 59, 1997TA1693, 1996CRV3303, 1996PHC ( 8) 44>.
9.E: Химическая кинетика (упражнения) — Chemistry LibreTexts
9.1
Напишите скорость реакции через скорость исчезновения реагента и скорость образования продуктов:
- \ (NO _ {(g)} + O_ {3 (g)} \ rightarrow NO_ {2 (g)} + O_ {2 (g)} \)
- \ (2C_2H_ {6 (g)} + 7O_ {2 (g)} \ rightarrow 4 CO_ {2 (g)} + 6 H_2O _ {(aq)} \)
- \ (H_ {2 (g)} + I_ {2 (g)} \ rightarrow 2HI _ {(g)} \)
- \ (4OH _ {(g)} + H_2S _ {(g)} \ rightarrow SO_ {2 (g)} + 2H_2O _ {(aq)} + H_ {2 (g)} \)
S9.1
- \ (\ text {скорость реакции} = \ dfrac {-∆ [NO]} {∆t} = \ dfrac {-∆ [O_3]} {∆t} = \ dfrac {∆ [NO_2]} {∆ t} = \ dfrac {∆ [O_2]} {∆t} \)
- \ (\ text {скорость реакции} = \ dfrac {-∆ [C_2H_6]} {2∆t} = \ dfrac {-∆ [O_2]} {7∆t} = \ dfrac {∆ [CO_2]} { 4∆t} = \ dfrac {∆ [H_2O]} {6∆t} \)
- \ (\ text {скорость реакции} = \ dfrac {-∆ [H_2]} {∆t} = \ dfrac {-∆ [I_2]} {∆t} = \ dfrac {∆ [HI]} {2∆ t} \)
- \ (\ text {скорость реакции} = \ dfrac {-∆ [OH]} {4∆t} = \ dfrac {-∆ [H_2S]} {∆t} = \ dfrac {∆ [SO_2]} {∆ t} = \ dfrac {∆ [H_2O]} {∆t} = \ dfrac {∆ [H_2]} {∆t} \)
Q9.2
Определите значение константы скорости элементарной реакции:
\ [I_ {2 (g)} + H_ {2 (g)} \ rightarrow 2HI _ {(aq)} \]
с учетом того, что, когда [Br 2 ] составляет 0,15 М, а [H 2 ] составляет 0,2 М, скорость реакции составляет 0,005 М с -1 при 298 К.
S9.2
скорость реакции = k [Br 2 ] [H 2 ]
0,005 Ms -1 = k (0,15M) 2 (0,2M)
к = 1.11 М -1 с -1
9,3
Учитывая скорость реакции третьего порядка:
\ [A + B + C \ стрелка вправо P \]
составляет 0,05 Мс -1
Если [A] = 0,05 M, [B] = 0,01 M и [C] = 0,25 M. Что такое константа скорости третьего порядка?
S9.3
скорость реакции = k [A] [B] [C]
0,05 мс -1 = k (0,05 м) (0,01 м) (0,25 м)
k = 0,05 Ms -1 / (0,05) (0,01) (0,25) M 3
k = 400M -2 с -1
Q9.2 \]
Константа скорости реакции второго порядка, k, равна M -1 мин -1 или M -1 с -1
Q9.4
Рассчитайте долю начального количества A, которая будет израсходована через 60 с. Учитывая реакцию ниже, которая оказывается первым порядком по A и \ (t_ {1/2} = 40 \; s \)
\ [A \ стрелка вправо B + C \]
S9.4
с \ (t_ {1/2} = 40 \; s \]
Остаток фракции А через 60 с:
Дробь будет израсходована через 60 секунд:
Q9.5
При условии, что реакция первого порядка завершается на 90% за 30 минут при 298 К. Рассчитайте константу скорости.
9,6
Предположим, что период полураспада радиоактивного изотопа первого порядка занимает около 1 года (365 дней). Сколько времени потребуется радиоактивности этого изотопа, чтобы распасться на 60%?
S9.6
60% потеряно
100% — 60% = 40% осталось
40% = 0,4
Q9.{-0,045 * 5} \]
\ [n_ {A} = 0,032 \]
Q9.7b
Вы забыли выполнить лабораторное задание накануне и понимаете, что у вас есть всего 5 часов, чтобы снизить исходную концентрацию реагента на 90%. Вы знаете, что период полураспада составляет 2 часа, и, прежде чем встать с постели, вы задаетесь вопросом, сможете ли вы вообще закончить лабораторию вовремя. Предполагая, что у вас есть реагент первого порядка, будет ли 5 часов достаточно времени, чтобы ваше соединение уменьшилось на 90%?
S9.7b
Во-первых, вам нужно определить период полураспада вашего соединения.{_ {o}}} = — kt \]
У нас нет начальной и конечной концентрации, но это нормально.
Предполагая, что начальная концентрация составляет 100 г, мы можем предположить, что конечная концентрация составляет 10 г, потому что она будет уменьшена на 90%, как указано в задаче.
\ [ln \ dfrac {[10]} {[100]} = — kt \]
\ [\ dfrac {ln [0,1]} {- 0,3465} = t = 6,65 \; часов \]
Так что 5 часов будет явно недостаточно для восстановления соединения
Q9.8a
Предположим, вы имеете дело с реагентом первого порядка.{-1} \]
Q9.9a
Наблюдается реакция \ [A \ rightarrow B \]. Вы не знаете стехиометрию реагентов или продуктов, но заметите, что когда вы увеличиваете начальную концентрацию A с 0,4 M до 0,8 M, период полураспада уменьшался с 10 минут до 5 минут. Определите порядок реакции и константу скорости.
S9.9a
Реакция, период полураспада которой изменяется при изменении концентрации реагента, является реакцией второго порядка.
\ [t_ {1/2} = \ dfrac {1} {k [A] _ {o}} \]
\ [k = \ dfrac {1} {[A] _ {0} t_ {1/2}} \]
\ [k = \ dfrac {1} {(0.{-1} \]
Q9.9b
Вы заметили, что начальная концентрация не влияет на период полураспада. Исходя только из этой информации, что вы можете определить о порядке реагента?
S9.9b
Из этой информации можно определить, что это будет реагент первого порядка. Концентрация реагентов первого порядка не влияет на скорость или период полураспада реагента. Это видно по формуле. t _ {\ frac {1} {2}} = \ frac {0,693} {k} Эта формула не учитывает начальную концентрацию реагента.
Q9.10a
Рассчитайте порядок реакции и константу скорости разложения цитобутана до этилена по уравнению
.
\ [C _4 H_ {8 г)} \ rightarrow 2C_ 2 H_ { 4 (г)} \]
и температура 215 0 ° C, постоянный объем, давление 200, 158, 124, 98, 77,5, 61 мм рт.
S9.10a
Q9.10b
Учитывая следующие данные о концентрации [A] за период времени, решите, представляют ли данные первый или второй порядок.Решите относительно K. Показать графики.
S9.10b
Данные лучше всего подходят для графика второго порядка.
Уравнение реакции второго порядка:
1 / [A] = kt + 1 / [A 0 ]
При решении для K уравнение преобразуется в:
1 / [A] — 1 / [A 0 ] = k
т
Введите указанные числа:
1 / [. 3] — 1 / [5] = k
(0-54)
.025 = к
Один, также можно получить наклон графика и k = 0,025
Q9.11a
Если продолжительность жизни соединения составляет 15,6 дня. Какое значение k? Сколько времени потребуется, чтобы разложиться до 10%. Используйте реакцию первого порядка.
S9.11a
Уравнение периода полураспада реакции первого порядка:
\ [t_½ = \ dfrac {\ ln (2)} {k} \]
Если мы подключим предоставленную информацию:
\ [15.6 дней = \ dfrac {\ ln (2)} {k} \]
\ [k = 4.{-1} \]
Второе необходимое уравнение — это реакция первого порядка:
ln ([A] / [A 0 ]) = -kt 1/2
так, ln ([A] / [A 0 ]) =. 1
t = -1 / k x ln ([A] / [A 0 ])
t = -1 / (4,4 x 10 -2 день -1 ) x (0,1)
t = 52 дня
12) В реакции 2А -> продукты второго порядка конечная концентрация составляет 0,28 М. Какова начальная концентрация, если k = 0,32M -1 с -1 и время равно 5 секундам.
Решение:
Уравнение реакции второго порядка:
1 / [A] = kt + 1 / [A 0 ]
Заполнение предоставленной информации:
1 / [. 28M] =. 32M -1 с -1 (5) + 1 / [A 0 ]
1 / [A 0 ] = 1,97
[A 0 ] = 0,50 млн
9.11b
Рассчитайте период полураспада соединения, если 90% данного образца соединения разложилось за 30 минут.
S9.-к * 1800
ln [10% / 90%] / 1800 = k = 3,95E-4
t1 / 2 = ln (2) / k
t1 / 2 = 0,693 / 3,95E-4 = 1754 с
1754 с * 1 мин / 60 с = 29 мин
9.12
Заданная константа скорости реакции второго порядка
\ [2 NO_ {2 (g)} \ rightarrow 2NO _ {(g)} + O_ {2 (g)} \]
составляет 1,08 M -1 с -1 при 600 0 C. Найдите время, которое потребуется для концентрации NO 2 с 1,24 M до 0,56 M?
S9.12
1 / [A] — 1 / [A] 0 = kt
t = 1 / k (1 / [A] — 1 / [A] 0 )
= (1 / 1,08 M -1 с -1 ) (1 / 0,56 — 1 / 1,24) = 7,2 с
Q9.13a
Какой порядок полураспада реакции не зависит от начальной концентрации?
S9.13a
Первый порядок, потому что уравнение периода полураспада для первого порядка составляет
т 1/2 = лн (2) / к, у него нет [A 0 ]
Q9.13b
Разложение N2) первого порядка. При 365 0 ° C t1 / 2 составляет 1,79 x 10 3 мин. при начальном давлении 1,05 атм. Рассчитайте полное давление.
S9.13b
\ [\ begin {align} P & = P_ {N_2O} + P_ {N_2} + P_ {O_2} \\ & = 0,525 + 0,525 +0,2625 = 1,31 \; атм \ end {align} \]
Q9.14a
Интегрированный закон скорости реакции нулевого порядка A → B равен [A] t = [A] 0 — kt
а) скектч следующие участки:
Оценка
(i) vs.[A]
(ii) [A] по сравнению с
t
S9.14a
ставка =
тыс.
Скорость
не зависит от [A]
(ii) [A] по сравнению с
t
[A] т = [A] 0 — узлы
б) Выведите выражение для периода полураспада реакции.
При t = t 1/2 , [A] = [A] 0 /2 так, [A] 0 /2 = [A] 0 — узлы 1/2
т 1/2 = 1/2 к [A} 0
c) Рассчитайте период полураспада, когда закон интегрированной скорости больше не действует (то есть, когда [A] = 0)
[A] т = 0 = [A] 0 — узлы
t 1/2 = 1/2 k [A} 0 ⇒ k = 1/2 t 1/2 [A} 0
Следовательно, чтобы израсходовать все реагенты, требуется
т = [A} 0 / k = [A] 0 /2 так, [A] 0 / (1 / (2t 1/2 )) [A] 0 = 2t 1/2
Закон интегрированной скорости
больше не действует после 2 периодов полураспада
Q9.{-kt} \]
б)
\ [t_ {1/2} = \ dfrac {\ ln 2} {k} \]
\ [10 часов = \ dfrac {\ ln2} {k} \]
\ [k = \ dfrac {\ ln2} {10 часов} \ times \ dfrac {1hour} {60min} \ times \ dfrac {1min} {60secs} \]
\ [k = \]
Q9.15a
В ядерной промышленности рабочие используют практическое правило, согласно которому реакционная способность любого образца будет относительно безвредной после 10 периодов полураспада. Рассчитайте долю радиоактивного образца, которая остается после этого периода времени (подсказка: радиоактивный распад подчиняется кинетике первого порядка)
S9.15а
[A] = [A] o e -kt
т 1/2 = ln2 / k
[A] = (100) e — (1) (10) = 0,00454
%, остающееся после 10 периодов полураспада
Q9.15b
Во время школьной экскурсии, чтобы применить то, что вы узнали на уроке физической химии, вы и ваш класс отправились на атомную электростанцию. Директор завода г-н Сетсо проводит для класса экскурсию по предприятию. Когда класс достигает комнаты симуляции, ему предлагается симуляция краха, но только если класс может ответить на его вопросы, он сможет испытать это на себе.{-k \, 30лет} \]
\ [\ ln [0.004] = — k \, 30лет \]
\ [k = \ dfrac {-30} {\ ln [0.004]} \]
\ [k = \]
Q9.16a
Многие реакции с участием гетерогенного катализа имеют нулевой порядок; то есть ставка = k. Примером может служить разложение фосфина (\ (\ ce {Ph4} \)) над вольфрамом (W):
\ [\ ce {4Ph4 (g) → P4 (g) + 6h3 (g)} \]
Скорость этой реакции не зависит от [PH 3 ], пока давление фосфина достаточно высокое (> = 1 атм).Объяснять.
S9.16a
При достаточном pH 3 все каталитические центры на поверхности вольфрама заняты. Дальнейшее увеличение количества фосфина не может повлиять на реакцию, и скорость не зависит от [PH 3 ].
9,16б
Вы с Джилл только что пошли на семинар по кинетике ферментов. Однако Джилл не понимает, почему при высоких концентрациях субстратов порядок реакции нулевой. Пожалуйста, объясните Джилл понятным для всех способом.
S9.16b
При высоких концентрациях субстратов все ферменты работают с максимальной скоростью. Как только фермент преобразует один субстрат в свой продукт, другой субстрат попадает в активный центр. Следовательно, скорость работы фермента постоянна, и это определение реакции нулевого порядка.
Q9.41a
Смесь соединений M и N с периодом полураспада 40 и 17 минут соответственно. Они разлагаются по кинетике первого порядка.Если их концентрации изначально равны, как долго концентрация N будет вдвое меньше, чем M?
S9.41a
[I] — начальная концентрация M и N
-> t = 30,1 мин.
Q9.41b
Соединения A и B распадаются по кинетике первого порядка. Период полураспада A составляет 20 минут, а период полураспада B — 48 минут. Если контейнер изначально содержит равные концентрации соединений A и B, через какое время концентрация B будет вдвое больше, чем A?
S9.41b
1. Запишите математическими терминами информацию, содержащуюся в задаче, и то, что проблема требует.
\ [t_ {1/2, A} = 20,0 мин \]
\ [t_ {1/2, B} = 48,0 мин \]
\ [[A] _0 = [B] _0 \]
A и B распадаются по первому порядку, поэтому
\ [- \ dfrac {d [A]} {dt} = k_A [A] \]
\ [- \ dfrac {d [B]} {dt} = k_B [B] \]
(Примечание: константы скорости для A и B не равны, поэтому укажите, что есть что, с помощью нижних индексов.{- \ dfrac {ln2} {t_ {1/2, B}} t} \]
Возьмите натуральное бревно с обеих сторон:
\ [- \ dfrac {t} {t_ {1/2, B}} ln2 = \ left (1 — \ dfrac {t} {t_ {1/2, A}} \ right) ln2 \]
\ [t = \ dfrac {1} {\ dfrac {1} {t_ {1/2, A}} — \ dfrac {1} {t_ {1/2, B}}} \]
5. Подставьте значения периодов полураспада
\ [t = \ dfrac {1} {\ dfrac {1} {20,0 мин} — \ dfrac {1} {48,0 мин}} = 34,2 \ мин \]
Ответ: 34,2 минуты
Q9.42a
В термодинамике Q3 и химической кинетике Q9 используется термин «обратимый».Как вы понимаете этот термин? (в этих двух главах он имеет то же значение)
S9.42a
На самом деле, это слово используется для описания «обратимой» реакции, в которой в кинетике могут происходить как прямые, так и обратные реакции. В термодинамике «обратимый» используется для описания процесса, который находится в равновесии на пути от начального к конечному состояниям.
Q9.42b
Если реакция пришла к термодинамическому равновесию, можем ли мы сказать что-нибудь конкретное о кинетике системы?
S9.42b
Равновесие возникает, когда все реагенты и продукты потребляются с той же скоростью, что и создаются. Возьмем простой пример:
\ [A \ underset {k _ {- 1}} {\ overset {k_1} {\ rightleftharpoons}} B \]
Когда система находится в состоянии равновесия,
\ [\ dfrac {d [A]} {dt} = \ dfrac {d [B]} {dt} = 0 \]
\ [k _ {- 1} [A] = k_1 [B] \]
\ [\ dfrac {k _ {- 1}} {k_1} = \ dfrac {[B]} {[A]} \]
\ [K_ {eq} = \ dfrac {k _ {- 1}} {k_1} \]
Q9.43а
Рекомбинация атомов брома в органическом растворителе, таком как тетрафлорид углерода, рассматривается как процесс, контролируемый диффузией
\ [Br + Br \ rightarrow Br_2 \]
у нас вязкость CF 4 составляет 9,80 x 10 -4 Нсм -2 при 30 o C, какова скорость рекомбинации при 30 o C?
S9.43a
Q9.43b
Вычислить константу скорости контролируемой диффузией реакции
\ [2 I \ стрелка вправо I_2 \]
в дихлорметане при 15 ° C, который имеет вязкость 0.{-1} \]
9,52
Японцы, выжившие после взрыва атомной бомбы, подверглись опасности радиации. У одного человека уровень йода-131 составил 9,7 мкС. Вычислите количество атомов I-131, которому соответствует эта радиоактивность.
S9.52
Сначала преобразуйте скорость в мКи с -1
1 мКи = 1,10X10 -3 Ки
1 Ci = 3,7 X 10 10 с -1
Ставка (\ (r \) может быть получена как таковая
\ [r = (9.(-1)) (0,600 м) (0,10 м)
скорость = 2,28e-4 м / с
9,55
Определите закон скорости для следующей реакции:
\ [N_2O_2 + H_2 \ стрелка вправо H_2O + N_2O \]
Кроме того, определите, какое из следующих действий изменит значение \ (k \)?
- Повышение давления \ (N_2O_2 \)
- Увеличение объема контейнера
- Повышение температуры
- Добавление катализатора в контейнер.-1, рассчитайте скорость образования СО2.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.Синтез и химические свойства 3-фосфонокумаринов и 1,2-бензоксафосфоринов как предшественников биоактивных соединений
Присутствие сопряженной π-системы в лактоновом кольце 2-оксо-2 H -1-производных бензопирана 1 подразумевает их участие в реакциях нуклеофильного присоединения (). Различные факторы, такие как заместители в лактоновом кольце, сила используемого нуклеофила, растворитель и т.д., влияют на скорость реакции, тип и выходы полученных продуктов.В литературе есть много примеров, представляющих структуру кумарина как превосходного акцептора Михаэля [42,47,48,49], дающего аддукты типа B в качестве основного продукта ().
2.2.1. Реакции с нуклеофильными реагентами
Химические свойства диэтил 2-оксо- 2H -1-бензопиран-3-фосфонат ( 1a ), диэтил-3,4-дигидро-2-оксо- 2H -1-бензопиран- 3-фосфонат ( 19 ), 2-оксо- 2H -1-бензопиран-3-фосфоновая кислота ( 5 ) и диэтил 7-N, N-диэтиламино-2-оксо- 2H -1- бензопиран-3-фосфонат ( 1j ,) был объектом экспериментальных и теоретических исследований параметров реактивности, в которых электрофильность центра в системе кумарина различалась атомным электростатическим потенциалом и энергиями связи XPS, тогда как электронная локализация была исследована на основе атомного Фукуи. индексы [50].Рассчитанные электронные структуры характеризуются большим отрицательным зарядом на атоме C-3, тогда как заряд атома C-4 имеет значения, близкие к нулю. Полученные энергии связи 2p для P-атомов описывают идентичное локальное окружение кумаринов. Напротив, в 7-диэтиламино-замещенном соединении энергия была низкой, вероятно, из-за взаимодействия между N- и P-заместителями, проявляющегося как более высокая электроотрицательность при P-атоме. Расчетные атомные электростатические потенциалы также показали, что электрофильность реакционных центров в системе кумарина увеличивается в присутствии фосфоновой группы, особенно в кумарин-3-фосфоновой кислоте 5 .Электронодонорная группа в C-7 увеличивала электрофильность углерода C-7, но в то же время атомы C-3 и O-2 из лактонового кольца увеличивали их нуклеофильность.
Структуры фосфорсодержащих кумаринов, являющиеся объектом теоретических исследований.
В результате фосфорсодержащие атомы С-3 кумаринов в этих химических структурах были определены как мягкие центры. Действительно, индексы Фукуи показали повышенные значения для C-3, особенно когда фосфорильная и диэтилфосфорильная группы связаны, и характеризовали центр как твердый.Фактически, фосфорсодержащие заместители не влияли на локализацию электронов на атоме C-3, как акцептирующие группы, но были больше всего похожи на атом водорода из-за аналогичной электроотрицательности атомов H и P. Индексы атомов углерода характеризуют атомы C-3 как твердые центры по сравнению с C-2. Кроме того, исследуемые параметры предполагали реакционную способность в лактоновом кольце, что объясняло более низкую нуклеофильность атома О-2 по сравнению с С-3 и, кроме того, участие в реакциях 1,2-присоединения с нуклеофилами.
2.2.2. Реакции с гидридами
Было изучено химическое поведение диэтил 2-оксо- 2H -1-бензопиран-3-фосфоната ( 1a ) в реакциях гидрирования / ацилирования в различных условиях [51] и высокой региоселективности для C- продукт ацилирования 20 . Два пути реакции, представленные на схеме 23, демонстрируют преимущество реакций в одной емкости по сравнению с многоступенчатыми способами. Первый путь, показанный как метод А, включает депротонирование 3,4-дигидроаддукта 19 NaH или DMAP и образование енолят-иона, который реагирует с ангидридом с образованием ацилированного продукта 20a .Однако урожайность была довольно неудовлетворительной — 31 или 38%. Второй подход, метод B, представляет собой реакцию в одном реакторе с генерируемым in situ енолят-ионом с последующим его захватом серией ангидридов, давая ожидаемые продукты 20a — d с более высокими выходами (схема 23).
Выходы продуктов 20a — d сильно зависели от растворителя — пиридина — и катализатора — DMPA — используемых в процессе. При оптимизации условий реакции соотношение ангидридов и DMAP варьировалось от 3: 1 до 3: 2.2. Уксусный, пропионовый и масляный ангидриды давали C-ацилированные продукты с выходом 90%, 65% и 72% через 2,5 часа при -4 ° C. Для объемных ацилирующих реагентов, таких как iso -пропилангидрид, проведение реакции при комнатной температуре увеличивает выход 20d с 47 до 72%. Стерические затруднения между вновь включенной ацильной группой и фосфорильной группой в положении C-3 определяют результат реакции.
Также были выделены продукты последующего ацилирования 21 или дальнейшего гидрирования 22 и 23 , ().Преобладающее присутствие дигидроаддукта 19 , когда реакцию проводили в ТГФ, подтвердило важность использованного растворителя, и дальнейшее гидрирование 19 привело к образованию производных 22 и 23 .
Продукты, выделенные в результате реакции ацилирования.
2.2.3. Реакции с металлоорганическими реагентами
О первой реакции 3-диэтилфосфонокумарина 1a с реактивом Гриньяра сообщили Bestmann и Lehnen [22].Продукт 24 был выделен в результате реакции присоединения типа Михаэля (схема 24). Хотя реакция протекала как стереоспецифическое цис -добавление к двойной связи C 3 = C 4 и продукт охарактеризован методом рентгеновской спектроскопии, в статье не приводятся выходы от проведенных реакций.
О продуктивном исследовании возможности применения 3-диалкилфосфонокумаринов 1q — t в качестве ключевых промежуточных продуктов для образования α-метилен-δ-лактонов сообщили Janecki и его сотрудники [23,24,25,52] .Такие соединения, как α-алкилиден-γ-лактоны, α-алкилиден-δ-лактоны и их аналоги с лактамным кольцом, проявляют фармакологические свойства и, в частности, сильную противораковую активность. Большинство синтезированных δ-лактонов были протестированы на клеточных линиях лейкемии человека NALM-6 и HL-60, а также на клетках рака груди MCF-7 и рака толстой кишки HT-29.
Для получения фосфорсодержащих аддуктов олефинирования Хорнера – Уодсворта – Эммонса α- (диэтоксифосфорил) -δ-лактоны 25 получали 1,4-конъюгированным присоединением металлоорганических соединений к замещенным 3-диэтилфосфонокумаринам 1q — т в присутствии каталитического количества CuI (схема 25).Реакции протекают полностью диастереоселективным образом, в то время как время превращения сильно зависит от заместителей в бензольном кольце. Например, когда взаимодействие осуществляли с 1 час (Y = 8-OMe) с использованием MeMgI в качестве нуклеофила, время реакции составляло 2,5 часа, а выход 25 составлял 73%. Однако, когда те же условия применялись для кумарина 1e (Y = 7-OMe), время его превращения составляло 48 часов, и продукт присоединения был получен с выходом 69%.В целом, при использовании изо -пропила и n -бутилмагнийгалогенида выходы находились в диапазоне от 51 до 93%, тогда как для метилмагнийгалогенида результаты находились в диапазоне от 68 до 85%. Интересно, что структуры выделенных соединений были охарактеризованы как транс, -β-замещенные изомеры.
Фундаментальные исследования по синтезу соединений 25 представили Николова и др. [53]. В этом исследовании ультразвуковые волны использовались в качестве промотора реакции — метод B, схема 25.Метод обработки ультразвуком обеспечивает необычный механизм для создания высокоэнергетической химии из-за необычайных температур и давления, создаваемых схлопыванием кавитационных пузырьков, в то время как он может ускорять органические реакции с участием процессов, опосредованных металлами, из-за активации поверхности металла и уменьшения размера частиц. , производя модифицированные металлические поверхности и одновременно ускоряя образование металлоорганических реагентов. Реакция между 3-диэтилфосфонокумарином 1a и магнийорганическим соединением завершалась присоединением по типу Майкла, и наблюдали образование транс -изомеров продуктов 25 .Способы инициирования реакции — термический или ультразвуковой — были дополнительно исследованы, и была указана взаимосвязь между выходами и временем реакции, а также применяемый метод.
Таблица 3
Сравнение результатов реакции 1a с магнийорганическими реагентами при термическом и ультразвуковом инициировании.
Заместитель R 1 Обратный поток US Время реакции
[мин]Выход
[%]Время реакции [мин] [Выход] Et 50 64 10 89 n -Pr 60 77 30 94 0r
94 69 50 74 PhCH 2 125 38 90 53 CH 2 COO т -B2038 30
95 Основным недостатком термического инициирования была недостаточная воспроизводимость полученных результатов.Это препятствие удалось преодолеть с помощью ультразвукового метода. Данные однозначно показывают влияние обработки ультразвуком на уменьшение времени реакции до 10-40 мин и увеличение выхода целевых молекул. Исследуемая реакция была уточнена с полной региоселективностью для 4-замещенных 3,4-дигидрофосфонокумаринов 25 .
Сравнение между методом A и методом B показало заметно более короткое время реакции для реакций, обработанных ультразвуком, и отсутствие требований, связанных с использованием определенного катализатора, инертной атмосферы и большого избытка используемых реактивов Гриньяра.
При применении метода В к реактивам Реформатского был получен продукт типа 25 [53] . Однако при ультразвуковом облучении с использованием различных цинкорганических соединений димерные системы 26 были получены с высокими выходами [54] (схема 26).
Очевидно, что процессы на схеме 26 характеризуются двумя различными механизмами. При образовании соединения 25 реакция классифицируется как присоединение C-нуклеофилов по типу Майкла к электронодефицитным системам.Однако образование продукта 26 нельзя объяснить реакцией присоединения Михаэля. Таким образом, Nikolova et al. исследовали механизм процесса и сделали предположение об образовании радикального интермедиата и последующем взаимодействии между инициированными радикалами (схема 27).
В ходе исследования механизма реакции авторы попытались синтезировать гетеродимеры, комбинируя кумариновые системы с различной реакционной способностью. Однако подходы не увенчались успехом, и предполагалось, что условия реакции благоприятствуют только процессу гомодимеризации, тогда как используемый растворитель играет главную роль в пути реакции.Продукты 26 были выделены и охарактеризованы как структуры мезо -формы на основании аналитических данных, полученных с помощью рентгеновской и ЯМР-спектроскопии.
Применение 4-замещенных 3-диэтилфосфонокумаринов 1u — ad (Схема 28) в качестве акцептора Михаэля другого подхода к исследованию региоселективности реакции и возможности включения второго алкильного заместителя в δ-лактоны 27 [26,27]. Исследование было проведено с серией магнийорганических реагентов (этил-, iso -пропил-, n -бутил-, циклогексилмагнийхлориды, аллилмагниййодид и бензилмагнийбромид) 4,4-дизамещенный 3-диэтоксифосфорил-3,4- дигидро-2 H -хроман-2-оны 27 были выделены с выходами от умеренных до хороших в смеси изомеров транс, — и цис, -.Только в трех случаях было обнаружено, что продукт представляет собой единственный транс-изомер .
2.2.4. Трехкомпонентные реакции диэтил-2-оксо-2
H -1-бензопиран-3-фосфоната ( 1a ) с соединениями, несущими карбонильную и аминогруппу
Реакции присоединения конъюгата к 3-диэтилфосфонокумарину 1a с использованием асимметричного нестабилизированного азомета. илиды были исследованы Мошкиным и соавт. [55,56]. Разработанный подход к синтезу продуктов 28 и 29 использовал в качестве исходного материала образованный in situ илид, производный от циклогексанона и N-метилглицина (схема 29).По структуре соединения 29 напоминают скелет антагонистов адренорецепторов и являются хорошими предшественниками новых фармацевтических агентов для лечения гиперплазии простаты.
Реакцию можно проиллюстрировать как 1,3-диполярное циклоприсоединение к 3-диэтилфосфонокумарину 1a , поэтому продукт 29 был ожидаемым аддуктом. Неожиданно также был образован пирролидон 28 .
Из-за стерических затруднений, дезактивация катионного центра и потеря диполярных свойств азометиновой структуры 30 наблюдали начальное добавление Михаэля с последующей внутримолекулярной циклизацией, приводящей к образованию гетероциклического соединения 28 (Схема 30).Участие циклогексанона в образовании пирролидона 28 было идентифицировано дополнительными реакциями. Без присутствия циклогексанона взаимодействие не наблюдалось, поэтому он играл главную роль в образовании 28 в качестве катализатора описанной реакции домино.
Когда используемое карбонильное соединение было заменено на параформальдегид (схема 31, реакция (1)), и реакция была проведена в бензоле с азеотропным удалением воды, Мошкин и его сотрудники наблюдали образование производного бензопиранопирролидина 31 .Конформация лактонового кольца в образующемся продукте подтвердила синхронность реакции нестабилизированных азометин-илидов с 3-диэтилфосфонокумарином 1a , приводящим к слиянию цис в новой структуре пирролидина.
Дальнейшее исследование 1,3-диполярного циклоприсоединения илида, производного от пролина и формальдегида, с использованием диэтил 2-оксо-2 H -1-бензопиран-3-фосфоната 1a в качестве улавливающего диполярофила, привело к образование пирролизидинов 32 в качестве основного продукта (схема 31, реакция (2), n = 1), второстепенного диастереомера 33 и присутствие других изомеров 34 и 35 было определено с помощью 1 H- и 31 P-ЯМР-спектроскопия.
Различная селективность процесса циклизации наблюдалась, когда в реакционную смесь вводилась пипеколиновая кислота (схема 31, реакция (2), n = 2). Увеличение продукта эндо -циклоприсоединения 35 может быть связано с размером и гибкостью циклической части азометин-илида и отсутствием стерических препятствий в переходном состоянии.
Большое количество пирролизидинов наблюдалось при использовании бензальдегида в качестве карбонильного компонента, и только два изомера были выделены и охарактеризованы как основные продукты 36 и 37 (схема 31, реакция (3)).
Фосфорилированные азагетероциклы были синтезированы [57] трехкомпонентным взаимодействием 3-диэтилфосфонокумарина 1a с ацетоном, циклопентаноном или циклогексаноном и бензиламином. Эти соединения являются перспективными предшественниками для получения полициклических δ-лактамов, обладающих потенциальной биологической активностью.
Реакция 3-диэтилфосфонокумарина 1a с бензиламином и ацетоном протекала при комнатной температуре в течение одного дня, и целевой продукт 38 был выделен в виде отдельного диастереомера с выходом 87% (схема 32).Структуру и абсолютную конфигурацию продукта определяли методом рентгеновской кристаллографии монокристаллов.
Интересно, что только один продукт наблюдался, когда 3-диэтилфосфонокумарин 1a взаимодействовал с циклопентаноном и бензиламином при комнатной температуре в бензоле в качестве растворителя. Выделенный продукт 39 был идентифицирован как изомер бензоксазоцина с относительной конфигурацией H-C (10), H-C (9) — транс и H-C (9), H-C (9a) — цис . С помощью рентгеноструктурного анализа была определена конфигурация 3aR *, 9R *, 9aR *, 10R * (схема 32).
Следует отметить, что реакция 1a с бензиламином и циклогексаноном не была стереоселективной, как ранее упомянутые реакции и смесь четырех изомеров 40 : 41 : 42 : 43 в соотношении 1: 0,25: 0,25: 0,1 были изолированы.
Авторы использовали энантиомерно чистые ( R ) — и ( S ) -фениламины в качестве реагентов для определения абсолютного стереохимического хода реакций.Однако даже при таком подходе однозначного определения относительной конфигурации стереогенных центров C-9 и C-9a в 39 — 43 не удалось. Когда аддукты были преобразованы в соответствующие им α-метилен-δ-лактамы, конфигурация была выделена.
Реакции с CH-кислотными соединениями
CH-кислотные соединения также использовали в качестве нуклеофилов в реакциях сопряженного присоединения с 3-диэтилфосфонокумарином 1a и его производными.Например, Janecki et al. [52] применили натриевую соль нитрометана в качестве альтернативного реагента в реакции присоединения типа Михаэля с получением кумарина 1a . Реакция протекала с конверсией исходного материала 58%, и продукт 44 был выделен в виде единственного диастереомера с псевдоаксиальным расположением фосфорильных и нитрогрупп (схема 33, метод A).
Взаимодействие кумарина 1a и нитрометана с использованием различных оснований (KF, Et 3 N, C 5 H 11 N) в протонном растворителе (EtOH) привело к образованию соединений 45 и 46 (схема 33, метод Б) [58].Продукт 45 был выделен с общим выходом 74% в виде смеси двух транс-изомеров в соотношении 1: 1,25 при использовании фторида калия в качестве основания. Трансформация включала 1,4-сопряженное присоединение нитрометана к активированной двойной связи в кумарине 1a и последующую атаку молекулы растворителя на карбонильную группу лактонового кольца. Однако при использовании пиперидина или пропиламина дополнительный продукт 1-гидрокси-4- (2′-гидроксифенил) -2,5-диоксопирролидин-3-илфосфонат ( 46 ) был выделен в виде единственного изомера.Механизм образования 46 , показанный на схеме 34, был результатом катализируемой основанием таутомерной трансформации аддукта типа Михаэля 44 с последующей перегруппировкой Nef-реакции.
Последующий протокол синтеза, метод C, схема 33, проиллюстрировал реакцию конъюгата с нитрометаном в условиях свободного растворителя. Результаты подчеркнули влияние оснований на путь реакции и соотношение продуктов. Первичный амин приводил к продукту 47 , тогда как вторичные амины способствовали образованию 46 и 47 .Соединение 46 было выделено как единственный продукт с очень хорошими выходами, когда в реакции использовали триэтиламин. Продукт присоединения типа Михаэля 44 все еще оставался основным продуктом в присутствии фторида калия в виде транс- -изомера .
Диастереоселективное добавление енолизируемых кетонов по Михаэлю к 3-диэтилфосфонокумарину 1a , 1c и 1h , промотированному 1,5,7-триазабицикло [4.4.0] дека-5-еном (TBD), проводили в следующая работа Krawczyk et al.[59,60] (Схема 35). Из-за равновесия процесса реакции проводили в присутствии избытка использованного кетона и основания TBD. Электроноакцепторные и электронодонорные заместители одинаково влияют на 3-диэтилфосфонокумарины 1c и 1h и способствуют их высокой реакционной способности.
Кетоны, такие как ацетон, циклопенатанон и 1-инданон, показали высокую стереоселективность в отношении продуктов присоединения 48 , 49 , 51 .В случае циклогексанона была получена смесь неидентифицированных фосфорсодержащих продуктов, и использование карбоната цезия (Cs 2 CO 3 ) решило проблему, давая 50 с очень хорошими выходами.
Все α-фосфоно-δ-лактонные продукты 48 — 51 были выделены в виде смеси C 3 -C 4 цис — и транс -изомеров с преимущественным образованием транс -продукт.Синклинальное переходное состояние могло образовываться, когда процесс осуществлялся с прохиральными кетонами. В описанном случае Re-face енолята приближается к Re-face 3-диэтилфосфонокумарина (), что приводит к образованию единственного диастереомера C 4 -C 2 — syn (Схема 35).
Предлагаемое формирование синклинального переходного состояния.
В тандемных реакциях Майкла с межмолекулярными соединениями Хорнера-Уодсворта-Эммонса с участием 3-диэтилфосфонокумарина 1a и его замещенных аналогов 1c и 1h (схема 36) было получено альтернативное CH-кислотное соединение, 2,5-гександион. применяется [61].Проведенные реакции катализируются стехиометрическим количеством TBD при комнатной температуре. Гашение процесса привело к образованию изомера транс продукта 52 и соответствующей гидроксикислоты 53 в почти эквимолярных количествах. Образование продукта 53 происходило в результате последующего гидролиза, катализируемого присутствием TBD образовавшегося бензолактонового аддукта. Применяли модифицированные условия с использованием протонного растворителя (MeOH), чтобы способствовать образованию 53 в качестве единственного продукта.Однако продукты типа 53 были выделены в виде их метил транс -циклопентенкарбоксилатных производных.
Затем дионовая система была заменена на циклогексан-1,3-дион [62]. Наблюдались продукты 54 (Схема 36), которые позже использовались в качестве аддуктов в последующем процессе переэтерификации-циклодегидратации домино, который приводил к образованию метил 2 — (диэтоксифосфорил) -2- (1-оксо-2,3,4,9-тетрагидро-1 H -ксантен-9-ил) ацетаты. Продукты , 54, были выделены в виде отдельных диастереомеров с анти -расположением объемных групп.
Функционализацию структуры индола проводили конъюгированным присоединением замещенных индолов к 3-диэтилфосфонокумаринам 1a , 1c , 1h и 1bl [63]. Реакцию проводили в присутствии TBD в CH 2 Cl 2 при комнатной температуре, и продукты 55 были выделены в виде смеси цис — и транс -диастереомеров, применяемые условия благоприятствовали образованию трансдуктов trans .
