Содержание
Скорость — любая химическая реакция
Скорость — любая химическая реакция
Cтраница 2
Скорость почти любой химической реакции в значительной степени зависит от температуры и давления.
[16]
Рассмотрим возможное изменение скорости любой химической реакции в переменном электрическом или электромагнитном поле.
[18]
От каких факторов зависит скорость любой химической реакции. Какие дополнительные факторы влияют на скорость гетерогенных реакций.
[19]
По закону действующих масс скорость любой химической реакции в гомогенной ( однородной) смеси пропорциональна произведению концентраций реагирующих веществ.
[20]
На основании закона действующих масс скорость любой химической реакции может быть выражена следующим образом.
[21]
Скорость разложения NaHCO3, как и скорость любой химической реакции, зависит от температуры. Повышение температуры положительно сказывается как на сдвиге равновесия в нужную нам сторону, так и на скорости реакции.
[22]
Закон действующих масс. Закон, согласно которому скорость любой химической реакции пропорциональна произведению активностей ( или концентраций) реагирующих веществ.
[23]
Следует иметь в виду, что константа скорости любой химической реакции, даже элементарного акта ( например, колебательного возбуждения), является сложной величиной, характеризующей данную молекулу. Она получается в результате усреднения по всем равновесным поступательным, вращательным и колебательным состояниям соударяющихся молекул. Легко понять, что в процессе протекания химической реакции заселенность различных уровней отличается от той, которая имела бы место при истинном равновесии.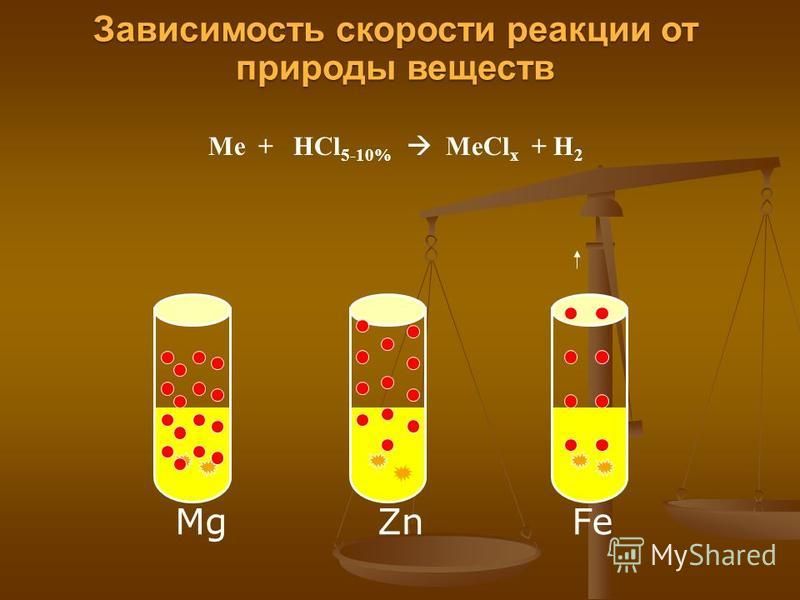 Поэтому константы скорости могут изменяться по мере протекания реакции и, таким образом, должны отличаться от равновесных констант скорости.
Поэтому константы скорости могут изменяться по мере протекания реакции и, таким образом, должны отличаться от равновесных констант скорости.
[24]
Из уравнений ( 95) — ( 95а) следует, что скорость любой химической реакции зависит от величины ее константы и от концентрации реагирующих веществ, а следовательно, для реакции, протекающей в газовой фазе, — и от давления.
[25]
Из уравнений ( 110) — ( 112-в) следует, что скорость любой химической реакции зависит от величины ее константы и от концентрации реагирующих веществ, а следовательно, для реакций, протекающих в газовой фазе, — и от давления.
[26]
Фундаментом химической кинетики является закон действия масс, при идеальном соблюдении которого в разбавленных растворах скорость любой химической реакции пропорциональна произведению — концентраций веществ действительно участвующих в реакции. Она не зависит ни от концентраций других веществ, ни от наличия или отсутствия других реакций. Если вещество может реагировать само с собой, то, согласно этому закону, скорость реакции будет пропорциональна квадрату, кубу или даже более высоким степеням концентрации такого вещества. В частности, прямая и обратная реакции обратимого процесса являются независимыми, а суммарная скорость обратимой реакции равна разности скоростей прямой и обратной реакции.
Она не зависит ни от концентраций других веществ, ни от наличия или отсутствия других реакций. Если вещество может реагировать само с собой, то, согласно этому закону, скорость реакции будет пропорциональна квадрату, кубу или даже более высоким степеням концентрации такого вещества. В частности, прямая и обратная реакции обратимого процесса являются независимыми, а суммарная скорость обратимой реакции равна разности скоростей прямой и обратной реакции.
[27]
Для определения скорости и направления реакции основным фактором является энергия активации. Скорость любой химической реакции зависит от числа столкновений реагирующих молекул в единицу времени, но если бы все столкновения сопровождались взаимодействием, то реакции протекали бы в очень короткие отрезки времени.
[28]
При изучении гомогенных реакций в растворах такое выражение обычно весьма удобно, чем и объясняются его возникновение и распространенность.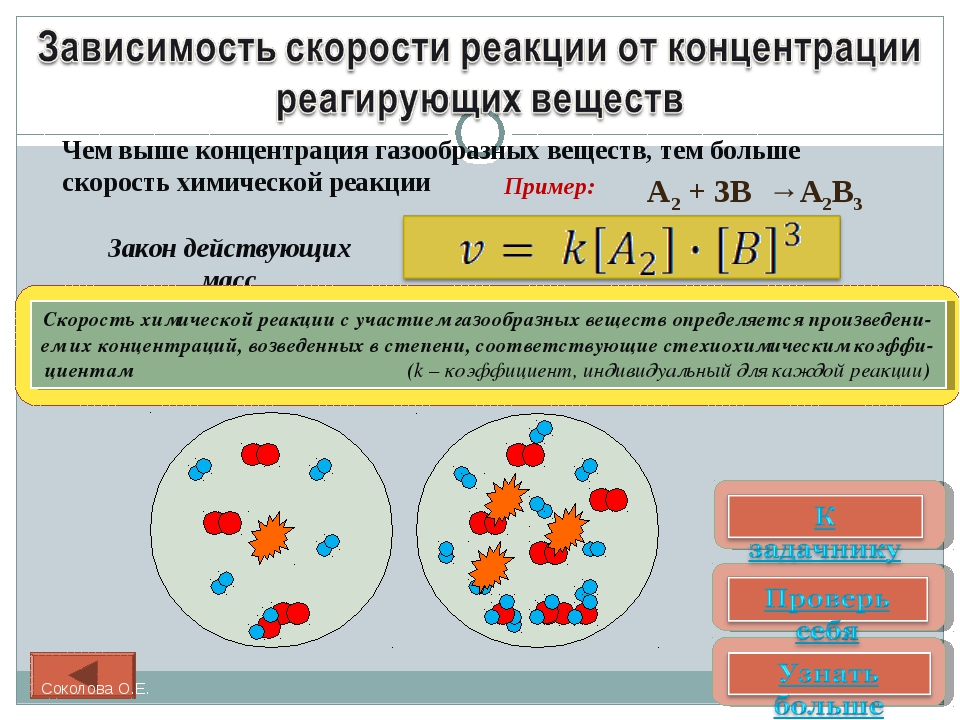 Однако изменение концентрации не может быть принято в качестве величины, пригодной для измерения скорости любой химической реакции.
Однако изменение концентрации не может быть принято в качестве величины, пригодной для измерения скорости любой химической реакции.
[29]
Давление не влияет на скорость мономолекулярных реакций, поскольку каждая молекула в них реагирует самостоятельно. Для бимолекулярных реакций повышение давления увеличивает возможность столкновения реагирующих молекул и поэтому увеличивает скорость реакции. Большинство реакций углеводородов нефти характеризуется небольшими скоростями. Поэтому достижение равновесных концентраций конечных продуктов в ряде случаев затруднено. Скорость любой химической реакции увеличивается с повышением температуры, причем для большинства реакций при повышении температуры на 10 она увеличивается в 2 — 4 раза.
[30]
Страницы:
1
2
3
Химические реакции скорость — Справочник химика 21
Факторы, влияющие на скорость химической реакции. Скорость химической реакции зависит от ряда условий. Рассмотрим важнейшие из них. [c.131]
Скорость химической реакции зависит от ряда условий. Рассмотрим важнейшие из них. [c.131]
Когда скорость диффузии намного меньше скорости химической реакции, скорость процесса равна скорости диффузии. Эту макрокинетическую область протекания реакции называют внешнедиффузионной областью. Константа скорости диффузии очень слабо зависит от температуры и весьма заметно — от линейной скорости потока газа. Поэтому изменением указанных условий эксперимента можно вызвать переход из одной макрокинетической области в другую. В частности, переходу во внешнедиффузионную область благоприятствуют высокие температуры и малые линейные скорости газового потока. [c.73]
Первый член уравнения, dQ T, представляет собой прирост энтропии за счет теплообмена между системой и ее окружением, а второй член уравнения, А( Х/Г, — прирост энтропии вследствие химической реакции. Скорость прироста энтропии в хилшческой реакции, отнесенная к единице объема системы, равна [c. 60]
60]
В общем случае кроме турбулентности газового потока в ГТД факторами, лимитирующими скорость и полноту сгорания топлива в камере сгорания, могут быть скорость химической реакции, скорость смешения паров топлива с воздухом и скорость испарения капель распыленного топлива. [c.167]
В случае десорбции мы имеем дело с реакциями, в ходе которых растворенный газ образуется, а не потребляется. Используя применительно к десорбции те же аргументы, что и при обсуждении проблем абсорбции (см. раздел VI-1-3), можно показать, что при достаточно высокой скорости химической реакции скорость десорбции оказывается существенно выше, чем она была бы при отсутствии реакции, а масса жидкости будет находиться в равновесии. Если условия равновесия в массе жидкости не обеспечиваются, то скорость процесса выражается уравнением (Х1,1) для физической десорбции. [c.265]
Химическая кинетика представляет собой учение о скоростях химических реакций, о факторах, определяющих эти скорости, а также о механизме химических реакций. Скорость химической реакции служит важнейшей количественной характеристикой химического взаимодействия. [c.8]
Скорость химической реакции служит важнейшей количественной характеристикой химического взаимодействия. [c.8]
Как указал Б. Н. Степаненко, не подлежит сомнению, что в химических реакциях скорости и даже сама возможность протекания многих реакций зависят от конформационных отношений [57]. Рассмотрим конформации открытых ациклических форм глюкозы и галактозы [58]. [c.88]
Основопологающим в химической кинетике является понятие о скорости химических реакций. Скорость химической 15сакции зависит от многих факторов, но важнейшими являются природа реагируюгцих веществ, концентрация, температура, давление и действие катализаторов. При постоянной температуре скорость реакции прямо пропорциональна концентрации реагирующих веществ. Данное количественное соотношение известно как закон действующих масс. Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа. Если процесс протекает только в одном направлении, то его называют необратимым.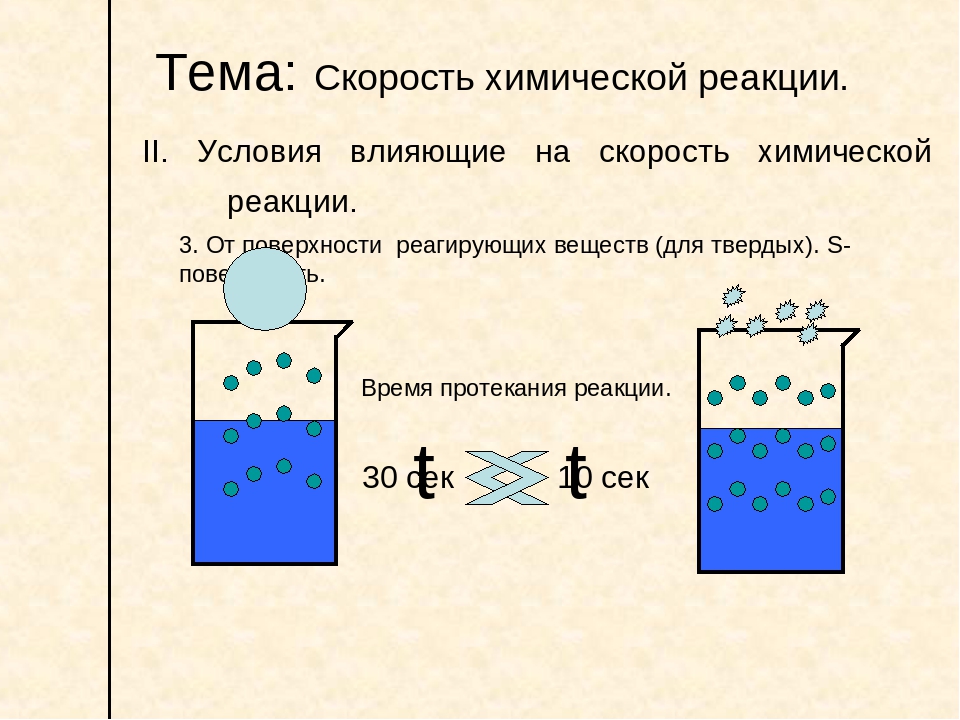 Процессы, протекающие в двух противоположных направлениях, называют обратимыми. Когда в обратимом процессе скорости прямой и обратной реакций становятся равными, то в системе устанавливается динамическое равновесие. Смещение химического равновесия осуществляется в соответствии с принципом Ле Шателье. [c.102]
Процессы, протекающие в двух противоположных направлениях, называют обратимыми. Когда в обратимом процессе скорости прямой и обратной реакций становятся равными, то в системе устанавливается динамическое равновесие. Смещение химического равновесия осуществляется в соответствии с принципом Ле Шателье. [c.102]
Аналогично в мембранах со сплошной матрицей возможно сопряжение диффузионных потоков двух компонентов газовой смеси при высокой растворимости газов в мембране или их сильном межмолекулярном взаимодействии. При векторно-скалярном сопряжении процессов диффузии и химической реакции скорость второго процесса не имеет пространственной фиксации, но знак сопряжения обеспечивается векторной природой перекрестного коэффициента 12. [c.20]
Для диффузионных процессов в мембранах это положение соблюдается достаточно строго для химических реакций скорость превращения /а = Уг можно считать линейной функцией [c.26]
Далее изучают кинетику химических реакций, скорости процессов массо- и теплопередачи, кинетику фазовых переходов в условиях, близких к условиям эксплуатации объекта, и составляют соответствующие элементарные функциональные операторы. Эти элементарные процессы обычно являются основными источниками нелинейностей результирующего функционального оператора (хи-тческие реакции порядка, отличного от нуля и единицы, нелинейные равновесные соотношения, экспоненциальная зависимость кинетических констант от температуры и т. п.). [c.200]
Эти элементарные процессы обычно являются основными источниками нелинейностей результирующего функционального оператора (хи-тческие реакции порядка, отличного от нуля и единицы, нелинейные равновесные соотношения, экспоненциальная зависимость кинетических констант от температуры и т. п.). [c.200]
Для двусторонней реакции, с учетом положения о независимости протекания химических реакций, скорость может быть выражена как разность скоростей прямой и обратной реакций [c.533]
В которой реагенты и А , взаимодействуя, дают продукты А, и A4, которые, в свою очередь взаимодействуя между собой, превращаются в исходные реагенты Ai и А . По принципу независимости протекания химических реакций скорость прямой и обратной реакций выразим по основному закону кинетики, рассматривая каждую реакцию как простую одностороннюю реакцию второго порядка [c.543]
Скорость химической реакции Скорость молекулярной диффузии [c.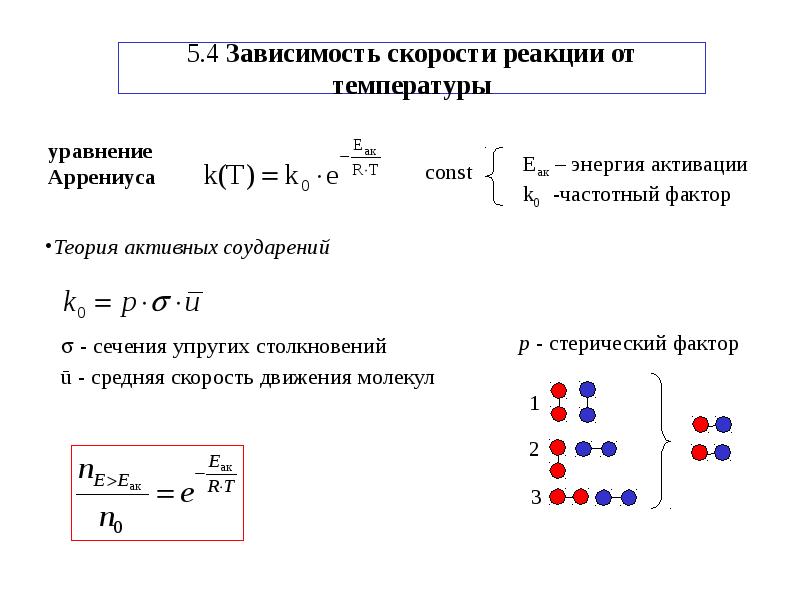 51]
51]
Химической кинетикой называется учение о скоростях химических реакций. Скорость химической реакции характеризуется количеством вещества, вступившим в реакцию в единицу времени. [c.32]
Определение эффективных коэффициентов диффузии проводится следующим образом. По одну сторону диафрагмы подается газообразный реагент, скорость диффузии которого нужно измерить. Можно также использовать смесь этого реагента с инертным газом. По другую сторону диафрагмы подается чистый инертный газ. Давление газов по обе стороны диафрагмы должно быть полностью уравнено. Реагент, продиффундировавший из право й части сосуда в левую, захватывается током газа, и концентрация реагента в выходящем из камеры потоке определяется аналитически. Одновременно для контроля измеряется количество реагента, выходящего из правой части сосуда. В отсутствие химической реакции скорость диффузии реагента в установившихся условиях, очевидно, равна количеству реагента, вымываемому из левой части сосуда в единицу времени. В соответствии с этим эффективный коэффициент диффузии может быть вычислен по формуле [c.366]
В соответствии с этим эффективный коэффициент диффузии может быть вычислен по формуле [c.366]
В случае очень медленных химических реакций преобладает химическое сопротивление. Такой режим называют химическим. Для быстрых химических реакций скорость процесса может определять диффузионное сопротивление. В этом случае говорят [c.144]
В случае диффузии компонента через слой толщиною йх, в котором тоже происходит химическая реакция, скорость диффузии на входе в этот слой по уравнению (У11-7) равна [c.566]
Аналогичные соотношения наблюдаются и при химических реакциях, скорость которых подчиняется уравнению первого порядка. Гомогенные химические реакции, протекающие строго в соответствии с уравнением скорости первого порядка, встречаются не часто. К ним относятся в первую очередь реакции разложения, например дегидрирование этана до этилена [c.155]
Каждую химическую реакцию можно характеризовать с двух точек зрения термодинамической и кинетической. С точки зрения термодинамики реакция характеризуется состоянием равновесия, когда в системе при данной температуре и постоянстве других внешних условий устанавливаются неизменные во времени равновесные концентрации участников реакции. Кинетика характеризует скорость протекания химической реакции, скорость ее приближения к состоянию равновесия. Большинство реакций аналитической химии протекает в растворе с большой скоростью и быстро приходит к состоянию химического равновесия. [c.22]
С точки зрения термодинамики реакция характеризуется состоянием равновесия, когда в системе при данной температуре и постоянстве других внешних условий устанавливаются неизменные во времени равновесные концентрации участников реакции. Кинетика характеризует скорость протекания химической реакции, скорость ее приближения к состоянию равновесия. Большинство реакций аналитической химии протекает в растворе с большой скоростью и быстро приходит к состоянию химического равновесия. [c.22]
В сложных химических реакциях скорость образования конечных продуктов реакции часто зависит от скорости лишь одной, наиболее медленно протекающей элементарной реакции. Такая реакция называется. лимитирующей. [c.187]
Необратимые процессы принято подразделять на скалярные, векторные и тензорные соответственно тому, какое поле прихо дится использовать для описания процесса скалярное, вектор ное или поле тензора второго ранга. К группе скалярных про цессов относятся, например, химические реакции (скорость ре акции в каждой точке характеризуется скалярной величиной) Векторными процессами являются, в частности, теплопровод ность, диффузия (с ними связаны поля вектора потока тепла и вектора диффузии). Наконец, к тензорным процессам можно отнести вязкие течения. Следует отметить, что классификация процессов по их тензорным свойствам не формальна, а физически связана с содержанием принципа Кюри (см. разд. П1.5). [c.129]
Наконец, к тензорным процессам можно отнести вязкие течения. Следует отметить, что классификация процессов по их тензорным свойствам не формальна, а физически связана с содержанием принципа Кюри (см. разд. П1.5). [c.129]
Скорость химической реакции. Скорость химической реакции — число элементарных актов реакции, происходящих в единицу времени, в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций) раздела фаз. Элементарный акт реакции состоит в таком соударении и дальнейшем взаимодействии молекул, таком перераспределении электронной плотности, образовании новых и разрыве старых химических связей, когда образуются новые по составу и строению вещества. [c.188]
Скорость химической реакции. Скорость химической реакции может быть количественно выражена изменением концентрации реагирующих веществ в единицу времени. При этом концентрацию обычно выражают числом молей вещества на единицу объема реакционной системы (обычно на 1 л). [c.130]
[c.130]
Основной закон кинетики гомогенных химических реакций скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Так, для реакции [c.129]
По мере протекания химических реакций скорость их обычно уменьшается, так как исходные вещества расходуются и их концентрация снижается (рис. 33). Константа же скорости независимо от изменения концентрации остается постоянной. [c.84]
Основополагающим в химической кинетике является понятие о скорости химических реакций. Скорость химической реакции зависит от многих факторов, но важнейшими являются природа реагирующих веществ, концентрация, температура, давление и действие катализаторов. При постоянной температуре скорость реакции прямо пропорциональна концентрации реагирующих веществ. Данное количественное соотношение известно как закон действующих масс. [c.90]
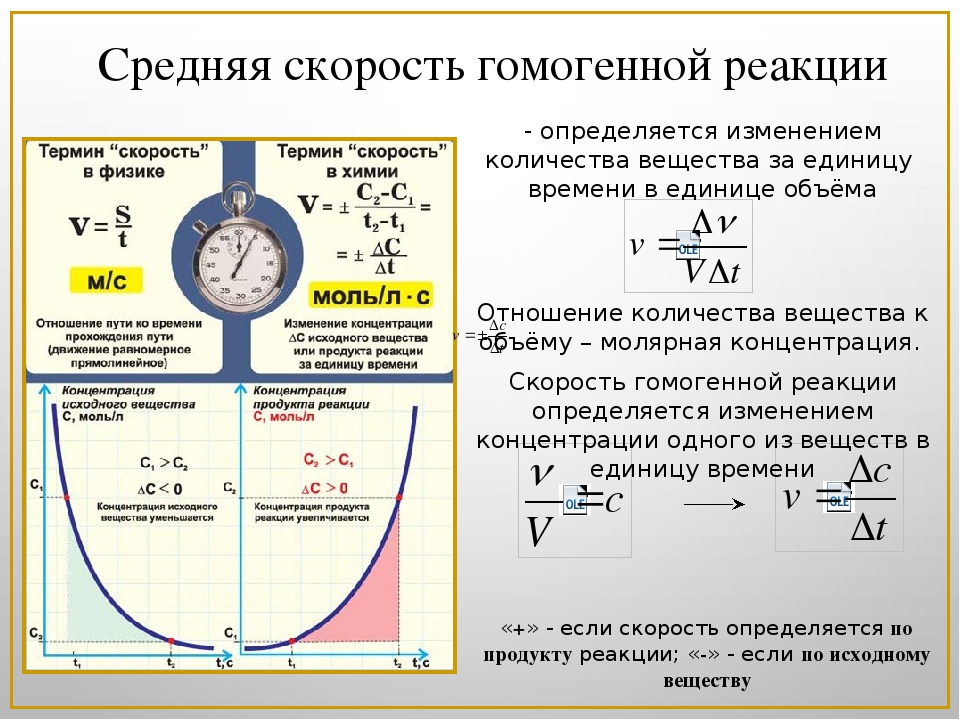
Химическая реакция — процесс превращения одного (одних) вещества в другое (другие). Скорость химической реакции — скорость процесса превращения. Эту скорость естественно определять количеством превращенного (исчезнувшего или образовавшегося) вещества. Поэтому скоростью химической реакции называется количество изменяющегося в реакции вещества в единице реакционного пространства за единицу времени. При этом количество вещества выражается в молях, время в секундах, а единицей реакционного пространства в гомогенных системах, т. е. в случае, когда все реагенты находятся в одной фазе (жидкой, газообразной или твердой), считается единица объема — литр (тогда размерность скорости реакции [c.197]
Скорость химической реакции — скорость процесса превращения. Эту скорость естественно определять количеством превращенного (исчезнувшего или образовавшегося) вещества. Поэтому скоростью химической реакции называется количество изменяющегося в реакции вещества в единице реакционного пространства за единицу времени. При этом количество вещества выражается в молях, время в секундах, а единицей реакционного пространства в гомогенных системах, т. е. в случае, когда все реагенты находятся в одной фазе (жидкой, газообразной или твердой), считается единица объема — литр (тогда размерность скорости реакции [c.197]
В данной главе в приближении диффузионного пограничного слоя (большие числа Пекле) исследуется ноле концентрации в окрестности движущейся частицы при протекании на ее поверхности химической реакции, скорость которой произвольным образом зависит от концентрации диффундирующего вещества. Получена зависимость полного диффузионного потока на поверхность частицы от скорости химической реакции и числа Пекле. Исследованы режимы протекания реакции на поверхностях сферической частицы, капли и кругового цилиндра в поступательном стоксовом потоке. Установлена приближенная формула, позволяющая с хорошей точностью определять число Шервуда при любой кинетике реакции во всем диапазоне значений константы скорости химической реакции и числа Пекле. [c.171]
Исследованы режимы протекания реакции на поверхностях сферической частицы, капли и кругового цилиндра в поступательном стоксовом потоке. Установлена приближенная формула, позволяющая с хорошей точностью определять число Шервуда при любой кинетике реакции во всем диапазоне значений константы скорости химической реакции и числа Пекле. [c.171]
Исходным и основополагающим понятием в химической кинетике является понятие о скорости химических реакций. Скорость химической реакции — это количество элементарных актов взаимодействия в единицу времени. Так как при взаимодействии изменяются концентрации реагирующих веществ, скорость реакции обычно измеряют изменением концентрации реагентов или продуктов реакции в единицу времени. При этом нет необходимости следить за изменением концентрации всех веществ, участвующих в реакции, поскольку стехиометрическое уравнение ее устанавливает соотношение между концентрациями реагентов. [c.213]
Здесь Сю, р1 — концентрация и плотность вводимого в аппарат вещества С1 —весовой расход вещества Сь с 1),С2 1),. … .., Сп(0 (0] — скорость химической реакции (скорость расходования вещества С1). [c.271]
… .., Сп(0 (0] — скорость химической реакции (скорость расходования вещества С1). [c.271]
При протекании в рассматриваемом объеме только одной химической реакции, скорость которой характеризуется величиной WA, скорость изменения объема реагирующей смеси с точностью до постоянного множителя, определяемого стехиометрией реакции, равна скорости образования реагента А в этом объеме. Например, для реакции [c.75]
Обобщая результаты предыдущих разделов, рассмотрим перенос тепла и компонентов к теплопроводящей реагирующей сферической частице в потоке несжимаемого газа при протекании на ее поверхности неизотермической химической реакции, скорость которой произвольным образом зависит от температуры и концентраций реагирующих компонентов. По-прежнему предполагается, что концентрации реагентов достаточно малы, так что реакция не влияет на параметры потока и частицы не учитывается также влияние термо- и бародиффузии и т. п. Ограничимся здесь стоксовым приближением для поля скоростей. [c.241]
[c.241]
В случае изотермической 1 = 0) поверхностной химической реакции, скорость которой определяется функцией Е (г), для числа Шервуда из (4.19) получаем уравнение [c.248]
Другой вопрос касается использования среднего диаметра пузыря в системах, где протекает химическая реакция. Скорость последней (на единицу объема пузыря) в зависимости от диаметра пузыря устанавливали с помощью уравнения (VII,118) на основе метода и допущений Кунии и Левеншпиля . Кроме того, расчетом выявлено, что реакция в основном происходит в зоне об- лако — гидродинамический след, а не в непрерывной фазе. Ниже [c.319]
Предложенные до сих пор интерполяционные формулы относились к случаю диффузионного режима реакции на поверхности твердых частиц, капель и пузырей. Рассмотрим теперь более общий случай гетерогенной химической реакции, скорость которой конечна и произвольным образом зависит от температуры и концентрации. Основные предположения и математическая формулировка соответ- [c. 271]
271]
Лангмюр еще в 1916 г. при кинетическом обосновании правила фаз показал сложность кинетических механизмов, приводящих к многофазной системе, удовлетворяющей условиям термодинамического равновесия [105]. В соответствии с реальным механизмом топо-химических реакций, скорость перехода фаз в катализаторе может определяться как скоростью появления зародышей новой фазы, так и скоростью диффузии атомов в кристаллической решетке и скоростью перестройки последней. Для окисных ванадиевых катализаторов, например, переход V2O4 VjOj протекает по диффузионному механизму [106]. [c.51]
Для гетерогенных химических реакций скорость процесса можно представить следующими отношениями [c.277]
Температура влияет на кинетику процессов переноса и химических реакций, скорость которых возрастает экспоненциально, в соответствии с уравнением Аррениуса [8]. В реальных условиях образование продуктов коррозии происходит с одновременным изменением агрессивности среды. [c.20]
[c.20]
Пример IV- . В аппарат, содержащийраствора с концентрацией С , подается со скоростью второй раствор с концентрацией Сх. Скорость вытекания смеси из аппарата составляет R i. Содержимое сосуда интенсивно перемешивается, так что концентрция одинакова во всем реакционном объеме и равна концентрации на выходеаиз реактора. В растворе протекает химическая реакция, скорость которой опи сывается уравнением [c.117]
Результаты алкилирования в значительной мере определяются физическими факторами, так как лимитирующей стадией процесса является скорость транспортирования реагирующих веществ к поверхностн раздела фаз, где протекают основные химические реакции. Скорость транспортирования реагирующих веществ зависит от интенсивности перемешивания эмульсии кислота—углеводороды, соотношения изобутан олефины на входе в реактор и времени их пребывания в реакционной зоне, концентрации химически инертных соединений в углеводородной фазе, объемного соотношения кислотной и углеводородной фаз. Качество применяемого сырья, состав кислоты и температура реакции оказывают существенное влияние как на скорость транспортирования, так и на скорость химических превращений. [c.168]
Качество применяемого сырья, состав кислоты и температура реакции оказывают существенное влияние как на скорость транспортирования, так и на скорость химических превращений. [c.168]
Однако химические реакции, скорость которых выражается такой простой зависимостью через концентрации, очень редки. В главах VIII и IX будет показано, что эти реакции (так называемые простые, или одностадийные, реакции) являются скорее исключением, чем правилом. Поэтому кинетический вывод закона действуюищх масс некорректен. Покажем, что уравнение (III.1.7) позволяет непосредственно и строго доказать справедливость этого закона. Для доказательства сначала ограничимся случаем, когда все реагирующие вещества, записанные и слева, и справа в уравнении реакции, являются в условиях реакции идеальными газами. Такие реакции называются идеально газовыми гомогенными реакциями. Напишем снова уравнение реакции. При этом, чтобы подчеркнуть, что система находится в равновесии, будем вместо знака равенства пользоваться символом Если же в системе самопроизвольно протекает реакция, например слева направо, то следует пользоваться символом Итак, [c. 88]
88]
Переход системы из одного состояния н другое, в том числе и химическая реакция, всегда протекает во времени и измеряется скоростью химической реакции. Скорость химической реакции показывает число химических взаимодействий в единице объема или на единице плоп1,ади поверхности за единицу времени. Измеряется скорость реакции и изv1eнeннeм концентрации С реагирующего вещества в единицу времени [c.134]
Одной из основных задач химической кинетики является расчет скорости химических реакций. Скорость сложной реакции может быть рассчитана, если известны составляющие ее элементарные стадии, кинетические уравнения, описывающие эти стадии и численные значения констант скорости стадий. Поэтому определение кинетических уравнений и констант скорости эле.м.ентарных реакций является важнейшей задачей теории элементарных химических процессов. [c.86]
Это уравнение показывает, на какую глубину проникает вещество во вторую фазу при диффузии, сопровождающейся химической реакцией. Мерой глубины зоны или фронта реакции может служить расстояние на котором концентрация падает в е раз по сравнению с Со, г. е. Ь= У01к. Отсюда видно, что глубина фронта реакции зависит от соотношения между коэффициентом диффузии и скоростью химической реакции. Скорость процесса в целом определяется величиной потока Я через единицу поверхности, т.е. в точках, где х=0, П=0 дС/дх)х=.о. Дифференцируя уравнение (ХП.40), находим [c.266]
Мерой глубины зоны или фронта реакции может служить расстояние на котором концентрация падает в е раз по сравнению с Со, г. е. Ь= У01к. Отсюда видно, что глубина фронта реакции зависит от соотношения между коэффициентом диффузии и скоростью химической реакции. Скорость процесса в целом определяется величиной потока Я через единицу поверхности, т.е. в точках, где х=0, П=0 дС/дх)х=.о. Дифференцируя уравнение (ХП.40), находим [c.266]
Общая химия (1984) — [
c.213
,
c.215
,
c.221
,
c.224
]
Общая химия в формулах, определениях, схемах (1996) — [
c.102
]
Общая химия в формулах, определениях, схемах (0) — [
c.102
,
c.402
]
Общая химия в формулах, определениях, схемах (1985) — [
c. 102
102
,
c.402
]
Общая химия в формулах, определениях, схемах (0) — [
c.102
,
c.402
]
Неорганическая химия (1974) — [
c.111
]
Неорганическая химия Издание 2 (1976) — [
c.154
]
Общая химия 1982 (1982) — [
c.170
]
Общая химия Издание 18 (1976) — [
c.166
]
Общая химия Издание 22 (1982) — [
c.170
]
Физическая и коллоидная химия (1964) — [
c.214
]
Физическая и коллоидная химия Учебное пособие для вузов (1976) — [
c.99
]
Физическая и коллоидная химия (1960) — [
c. 170
170
,
c.171
]
Основы общей химии Том 2 Издание 3 (1973) — [
c.122
]
Теплопередача Издание 3 (1975) — [
c.352
]
A. площади соприкосновения реагирующих веществ B. давления D.
В 50 мл 0.1048 Н р-ра FeSO4 сод-я 0.1048*0.05 = 0.00524 моль экв-в FeSO4;по з. экв-в, в р-ию с 0.0945*0.02 = 0.00189 моль экв-в KMnO4 вст-о 0.00189 моль экв-в FeSO4;т.о. с KClO3 прор-о 0.00524-0.00189 = 0.00335 моль экв-в FeSO4;в р-ии с FeSO4, независимо от среды, KClO3 восст-я до KCl (1 форм-я единица KClO3 прин-т 6 элек-в), поэтому его М экв. = 122.5*(1/6) = 20.4167 г/моль;масса KClO3 = 20.4167*0.00335 = 0.0684 г.
1)нет
2)да
3)нет
4)да
5)нет
HF -фтороводородная кислота
HCI -соляная кислота (хлороводородная)
HBr — бромоводородная кислота
HI-йодоводородная кислота
Горение метана
CH₄ + 2O₂ = CO₂ + 2H₂O
пиролиз метана с последующим охлаждением продуктов пиролиза для предотвращения разложения ацетилена
2CH₄ = C₂H₂ + 3H₂
гидрирование ацетилена
H₂ + C₂H₂ = C₂H₄
гидратация этилена в присутствии серной кислоты
C₂H₄ + H₂O = C₂H₅OH
реакция этанола с уксусной кислотой в присутствии серной кислоты с образованием сложного эфира — этилацетата
C₂H₅OH + CH₃COOH = CH₃COOC₂H₅ + H₂O
СuO +CO -> Cu + CO2
Cu+Cl2-> CuCl2
2CuCl2+2KI ->I2↓ + 2KCl + 2CuCl
CuCl2+2AgNO3 -> 2AgCl↓ + Cu(NO3)2
Новости школы -Подготовка к ЕГЭ по химии.
 Часть А-4
Часть А-4
Классификация химических реакций.
Скорость химической реакции
Обязательный минимум знаний
Схема 5
Классификация химических реакций
Схема 6
Классификация реакций в органической химии
гидрирования (+ Н2)
галогенирования (+ Г2)
гидрогалогенирования (+ НГ)
· Реакции присоединения
гидратации (+Н2О)
полимеризации
дегидрирования ( — Н2)
дегалогенирования (- Г2)
дегидрогалогенирования ( — НГ)
· Реакции отщепления
дегидратации ( — Н2О)
деполимеризации
· Реакции замещения
· Реакции изомеризации
Частные случаи органических реакций:
· этерификации (кислота + спирт ↔ сложный эфир + вода) и обратный процесс – гидролиз (щелочной гидролиз – омыление),
· поликонденсации (образуются полимер и низкомолекулярный продукт, часто вода)
· ОВР
Технологические процессы, часто отождествляемые с типом химической реакции:
· пиролиз (разложение органического вещества без доступа воздуха)
· крекинг (разрыв углеродной цепи под действием высокой температуры)
· конверсия (разложение органического вещества под действием перегретого водяного пара)
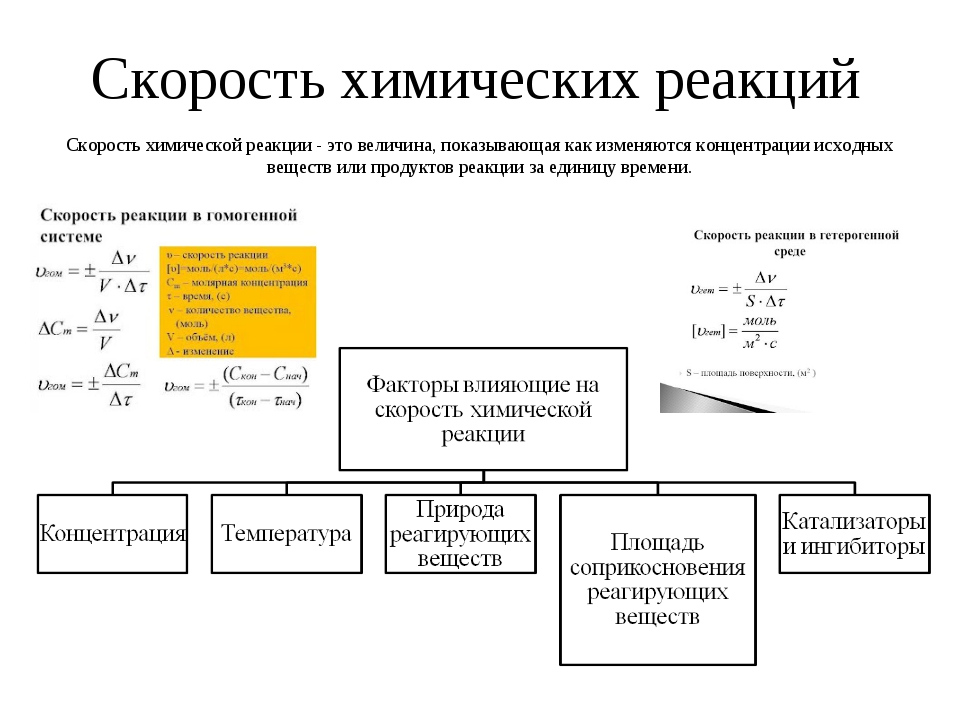
Скорость химической реакции
Скорость химической реакции – изменение концентрации реагирующих веществ в единицу времени:
Δ С
v = —————— (моль/л∙с)
Δ t
Таблица 5
Факторы, влияющие на скорость химической реакции
Примечание.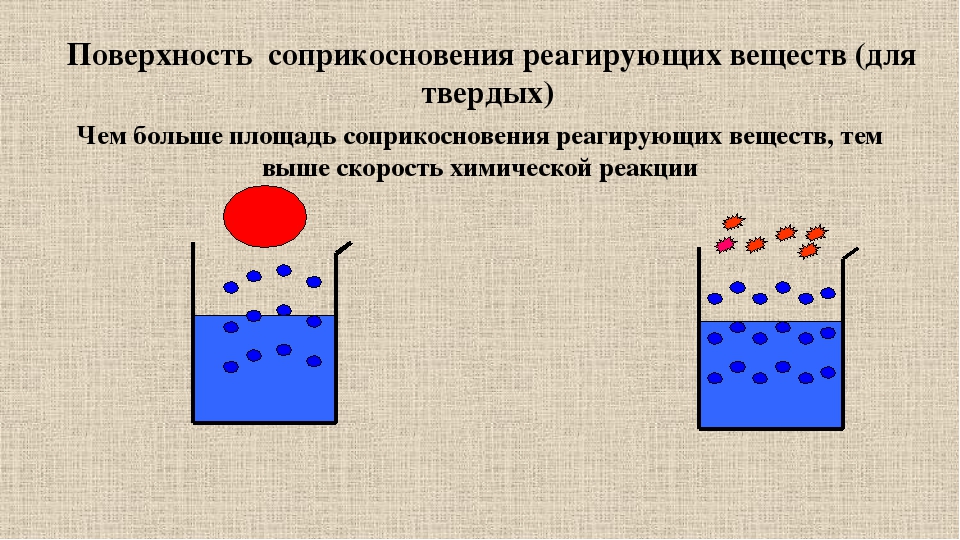 Для гетерогенных реакций скорость реакции зависит и от площади поверхности соприкосновения реагирующих веществ (для ее увеличения твердые вещества измельчают, используют «кипящий слой» и др.)
Для гетерогенных реакций скорость реакции зависит и от площади поверхности соприкосновения реагирующих веществ (для ее увеличения твердые вещества измельчают, используют «кипящий слой» и др.)
Катализаторы:
· изменяют скорость химической реакции или направление ее протекания,
· по окончании реакции остаются неизмененными качественно и количественно,
· не смещают химическое равновесие (в равной мере изменяют скорость как прямой, так и обратной реакций).
Биологические катализаторы белковой природы называются ферментами (энзимами).
Примеры тестовых заданий и
рекомендации к их выполнению
1. Взаимодействием растворов сульфата калия и хлорида бария относится к реакциям
1) замещения 2) нейтрализации 3) ионного обмена 4) соединения
Так как исходные вещества являются электролитами, то определить верный ответ несложно. Ответ 3.
Ответ 3.
2. Взаимодействие кислоты и щелочи относится к реакциям
1) соединения, окислительно-восстановительным
2) обмена, нейтрализации
3) обмена, этерификации
4) обмена, эндотермическим
Сразу исключается ответ 1. Следовательно, взаимодействие кислоты и щелочи, как двух сложных веществ, относится к реакциям обмена. Остальные ответы можно даже не анализировать в целях экономии времени. Ответ 2.
3. Взаимодействие между глицерином и высшими карбоновыми кислотами относится к реакциям
1) изомеризации
2) дегидратации
3) нейтрализации
4) этерификации
Сразу исключается ответ 1, так как в условии даны два исходных вещества. Реакция дегидратации (отщепления воды) по этой же причине не удовлетворяет требованиям задания. Реакция нейтрализации – реакция между сильной кислотой и щелочью – ни одно, ни второе исходные вещества не являются таковыми. Ответ 4.
Ответ 4.
4. Соляная кислота вступает в реакцию замещения с
1) гидроксидом меди (II)
2) медью
3) оксидом железа (II)
4) железом
Элементарные сведения о реакции замещения как реакции простого и сложного веществ позволят исключить из числа возможных ответы 1 и 3, т.к. в них предложены сложные вещества. Ответ 2 неверен по своей химической сути – медь в ряду напряжений металлов находится после водорода. Ответ 4.
5. Реакцией замещения является взаимодействие
1) метана с бромом
2) этилена с бромом
3) ацетилена с кислородом
4) пропилена с водой
Для алканов (предельных углеводородов), родоначальником которых является метан, наиболее характерны реакции замещения с галогенами. Верный ответ – 1. Остальные ответы можно не рассматривать. Ответ 1.
6. В неорганической химии к окислительно-восстановительным реакциям относятся
В неорганической химии к окислительно-восстановительным реакциям относятся
1) реакции обмена
2) реакции гидролиза
3) реакции замещения
4) реакции нейтрализации
Реакции обмена не относятся к окислительно-восстановительным, следовательно, условию задания не отвечают задания 1, 2 и 4. Ответ 3.
7. К окислительно-восстановительным реакциям не относятся
1) реакции горения
2) реакции соединения с участием простых веществ
3) реакции разложения с участием простых веществ
4) реакции обмена
Реакции обмена не относятся к окислительно-восстановительным. Остальные ответы можно не анализировать. Ответ 4.
8. К реакциям с участием воды не относятся
1) реакции гидролиза
2) реакции гидрирования
3) реакции гидратации
4) реакции этерификации
Реакции гидролиза – это разложение веществ водой. Реакции гидрирования – присоединение водорода – это и будет верный ответ. Остальные ответы можно не анализировать. Ответ 2
Реакции гидрирования – присоединение водорода – это и будет верный ответ. Остальные ответы можно не анализировать. Ответ 2
9. К экзотермическим реакциям не относится взаимодействие
1) оксида натрия с водой
2) фосфора с кислородом
3) оксида фосфора с водой
4) азота с кислородом
Все указанные в ответах реакции относятся к реакциям соединения, которые, как правило, являются экзотермическими реакциями, т.е. протекают с выделением теплоты. Одно из немногих исключений – взаимодействие азота с кислородом. Ответ 4.
10. К эндотермическим процессам относится
1) гашение извести
2) обжиг известняка
3) нейтрализация фосфорной кислоты известковым молоком
4) помутнение известковой воды
Очень сложное задание, требующее знаний тривиальных названий веществ и процессов, связанных с химией кальция. Гашением извести называется взаимодействие оксида кальция (негашеной извести) с водой. Известковым молоком называется взвесь гидроксида кальция в воде. Известковой водой называется раствор гидроксида кальция в воде. Реакции с участием этих соединений – экзотермические. Ответ 2.
Гашением извести называется взаимодействие оксида кальция (негашеной извести) с водой. Известковым молоком называется взвесь гидроксида кальция в воде. Известковой водой называется раствор гидроксида кальция в воде. Реакции с участием этих соединений – экзотермические. Ответ 2.
К этому ответу можно прийти гораздо проще. Достаточно знать, что практически все реакции разложения относятся к эндотермическим, т.е. протекают с поглощением теплоты. Обжиг известняка – разложение карбоната кальция.
11. Верны ли следующие суждения применительно к реакции синтеза аммиака?
А) Это реакция соединения, гомогенная, каталитическая
Б) Это реакция окислительно-восстановительная, обратимая, экзотермическая
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Верный ответ – 3. К такому выводу позволяет прийти запись уравнения реакции:
kat
N2 + 3H2 ↔ 2NH3 + Q
12. Верны ли следующие суждения применительно к способам получения сульфата цинка?
Верны ли следующие суждения применительно к способам получения сульфата цинка?
А) Сульфат цинка можно получить реакциями замещения и обмена
Б) Сульфат цинка можно получить реакциями разложения и соединения
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
На школьном уровне экзаменующемуся будет несложно прийти к выводу о возможности получения сульфата цинка реакцией замещения (например, взаимодействием цинка и разбавленной серной кислоты), а также реакцией обмена (например, взаимодействием оксида, гидроксида или карбоната цинка и серной кислоты). Можно получить сульфат цинка и реакцией соединения оксида цинка с оксидом серы (VI). А вот получить такую соль реакцией разложения почти невозможно. Ответ – 1.
13. Химические свойства этилена не характеризуются реакциями
1) полимеризации
2) гидратации
3) поликонденсации
4) гидрирования
Этилен, как непредельное соединение вступает в реакции присоединения, а потому ответы 1,2 и 4 – не отвечают условию задания. Ответ 3.
Ответ 3.
14. Для фенола не характерны реакции
1) поликонденсации
2) замещения
3) галогенирования
4) гидролиза
Знание свойств фенола позволяет выбрать верный ответ: фенол не гидролизуется. Ответ 4.
15. Реакцией соединения и окислительно-восстановительной является взаимодействие между
1) хлором и водородом
2) хлором и водой
3) фтором и водой
4) хлороводородом и аммиаком
Получение сложного вещества из простых и отвечает условию задания. Остальные ответы можно не рассматривать в целях экономии времени. Ответ 1.
16. К реакциям замещения и соединения относятся соответственно взаимодействия
1) оксид алюминия + соляная кислота и оксид железа (III) + алюминий
2) алюминий + хлорид меди (II) и алюминий + хлор
3) гидроксид алюминия + серная кислота и алюминий + кислород
4) сульфат алюминия + хлорид бария и алюминий + иод
Так как по условию задания первой в верном ответе должна быть реакция замещения (взаимодействие простого и сложного веществ), то определить верный ответ не составит труда. Это ответ – 2. Остальные ответы можно не анализировать. Ответ 2.
Это ответ – 2. Остальные ответы можно не анализировать. Ответ 2.
17. К реакциям обмена и замещения соответственно относятся взаимодействия
1) азотной кислоты с оксидом меди (II) и гидроксида кальция с оксидом углерода (IV)
2) этина с бромом и серной кислоты с оксидом магния
3) соляной кислоты с гидроксидом железа (III) и метана с хлором
4) фенола с натрием и с гидроксидом натрия
Достаточно сложное задание, так как требует знаний не только классификации химических реакций, но и номенклатуры органических и неорганический соединений. Однако его можно выполнить быстро на основании логики и знания о том, что реакция замещения – это, как правило, взаимодействие простого и сложного веществ. Эта реакция по условию задания должна быть предложена в условиях ответа второй. Ответ 3.
18. С наибольшей скоростью с водородом реагирует
1) фтор 2) хлор 3) бром 4) иод
Активность галогенов и их окислительные свойства уменьшаются в подгруппе сверху вниз. Ответ 1.
Ответ 1.
19. С наименьшей скоростью с водой реагирует
1) литий 2) натрий 3) калий 4) цезий
Активность щелочных металлов и их восстановительные свойства усиливаются в подгруппе сверху вниз. Ответ 1.
20. С наибольшей скоростью при комнатной температуре протекает реакция между
1) кислородом и водородом
2) железом и раствором серной кислоты
3) этиловым спиртом и натрием
4) растворами сульфата меди (II) и гидроксидом калия
В растворах электролитов реакции ионного обмена протекают почти мгновенно. Ответ 4.
21. Скорость химической реакции между цинком (в гранулах) и раствором серной кислоты не зависит от
1) концентрации серной кислоты
2) размера гранул цинка
3) давления
4) температуры
Скорость реакции зависит от концентрации веществ, температуры. Скорость гетерогенной реакции зависит от поверхности соприкосновения веществ (в данном случае размеров гранул цинка). Поскольку взаимодействие протекает не в газовой фазе, а на границе раздела жидкость — твердое вещество, давление не оказывает влияния на скорость химической реакции. Ответ 3.
Скорость гетерогенной реакции зависит от поверхности соприкосновения веществ (в данном случае размеров гранул цинка). Поскольку взаимодействие протекает не в газовой фазе, а на границе раздела жидкость — твердое вещество, давление не оказывает влияния на скорость химической реакции. Ответ 3.
22. Одинаковые кусочки магния взаимодействуют с наибольшей скоростью с соляной кислотой, если
1) разбавить кислоту
2) увеличить концентрацию кислоты
3) увеличить давление
4) уменьшить температуру
Увеличение концентрации вещества в растворе увеличивает скорость протекания химической реакции. Ответ 2.
23. Для увеличения скорости химической реакции
Fe (тв.) + 2H+ (р-р) = Fe2+ (р-р) + H2 (г)
необходимо
1) увеличить концентрацию ионов железа
2) добавить несколько кусочков железа
3) уменьшить температуру
4) увеличить концентрацию кислоты
Скорость реакции зависит от концентрации реагирующих веществ. Ответ 4.
Ответ 4.
24. На скорость химической реакции между цинком и раствором сульфата меди (II) не оказывает влияния увеличение
1) площади соприкосновения реагирующих веществ
2) температуры
3) концентрации раствора сульфата меди (II)
4) давления
Очевидный ответ 4.
25. С увеличением давления возрастает скорость реакции между
1) растворами нитрата серебра и хлорида натрия
2) цинком и соляной кислотой
3) водородом и кислородом
4) этиловым спиртом и натрием
Давление существенно влияет на скорость гомогенной реакции, протекающей в газовой фазе. Ответ 3.
26. Для увеличения скорости химической реакции разложения аммиака на водород и азот необходимо
1) увеличить концентрацию водорода
2) уменьшить температуру
3) увеличить температуру
4) уменьшить концентрацию аммиака
Так как реакция разложения аммиака – это экзотермический процесс, повышение температуры способствует его протеканию. Ответ 3.
Ответ 3.
27. Применение технологии «кипящего слоя» на производстве способствует увеличению скорости промышленных процессов потому, что
1) увеличивается концентрация реагирующих веществ
2) увеличивается поверхность соприкосновения реагирующих веществ
3) возрастает энергия активации процесса
4) возрастают масса и объем реагирующих веществ
«Кипящий слой» — технологический прием, позволяющий увеличить поверхность соприкосновения реагирующих веществ путем измельчения твердого сырья с последующим пропусканием через него газа или паров жидкости, в результате чего создается иллюзия кипения. Ответ 2.
28. Верны ли следующие суждения о катализаторах?
А) Это вещества, которые изменяют скорость химической реакции и расходуются при этом
Б) Это вещества, которые изменяют скорость химической реакции и ее направление
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Так как катализаторы по завершению каталитической реакции не меняются качественно и количественно, то суждение А не верно. Ответ 2.
Ответ 2.
29. Верны ли следующие суждения о ферментах?
А) Это биологические катализаторы белковой природы
Б) Это биологические катализаторы, которые «работают» в узком интервале температур и pH среды, обладают высокой эффективностью и селективностью
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Для некоторых экзаменующихся небольшое затруднения вызовут термины «рН среды» и «селективность». Первый характеризует «работу» фермента в определенном значении кислотно-основных свойств среды, а второй – избирательное действие на конкретное вещество или группу сходных веществ. Ответ 3.
30. Верны ли следующие суждения о скорости химической реакции?
А) Это изменение концентрации реагирующих веществ
Б) Это изменение количества вещества реагента в единицу времени
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Наиболее близко к истинному суждение А, но не содержит такой важнейшей характеристики скорости химической реакции, как отношение изменения концентрации реагирующих веществ ко времени, за которое оно произошло. Ответ 4.
Ответ 4.
Задания для самостоятельной работы
1. Взаимодействие алюминия с оксидом хрома (III) – это реакция
1) замещения 2) присоединения 3) разложения 4) обмена
2. Внутримолекулярная дегидратация спиртов – это реакция
1) замещения 2) присоединения 3) отщепления 4) изомеризации
3. При сливании растворов иодида калия и нитрата свинца (II) протекает реакция
1) замещения 2) присоединения 3) разложения 4) обмена
4. Хлор вступает в реакцию замещения с
1) хлоридом железа (II)
2) бромидом калия
3) оксидом углерода (II)
4) гидроксидом натрия
5. Не является окислительно-восстановительной реакция, схема которой
1) (CuOH)2CO3 ® CuO + H2O + CO2↑
2) KMnO4 ® K2MnO4 + O2↑ + MnO2
3) KClO3 ® KCl + O2↑
4) NH4NO3 ® N2O + H2O
6. К гомогенным реакциям относится
К гомогенным реакциям относится
1) обжиг сульфида меди (II)
2) алюминотермия
3) взаимодействие цинка с соляной кислотой
4) хлорирование метана
7. Окислительно-восстановительная реакция лежит в основе получения
1) сульфата аммония из аммиака и серной кислоты
2) кислорода разложением пероксида водорода
3) оксида бария разложением карбоната бария
4) гидроксида кальция из оксида кальция
8. Химическое взаимодействие отсутствует при получении
1) бензина каталитическим крекингом
2) кислорода фракционной перегонкой воздуха
3) синтез-газа конверсией метана
4) аммиака из азото-водородной смеси.
9. Эндотермическим процессом является
1) нейтрализация серной кислоты гидроксидом натрия
2) горение серы
3) разложение гидроксида кальция
4) взаимодействие алюминия с бромом
10. С уменьшением относительной молекулярной массы органического вещества протекает реакция
1) дегидрирования этана
2) изомеризации н-бутана
3) гидрирования бутаналя
4) хлорирования метана
11. С увеличением относительной молекулярной массы органического вещества протекает реакция
С увеличением относительной молекулярной массы органического вещества протекает реакция
1) гидролиза этилового эфира уксусной кислоты
2) дегидрирования этана
3) окисления пропанола-1 до пропаналя
4) гидратации ацетилена
12. К реакциям обмена относится взаимодействие между
1) оксидом меди (II) и соляной кислотой
2) оксидом натрия и водой
3) оксидом углерода (IV) и магнием
4) оксидом серы (VI) и оксидом цинка
13. К реакциям замещения не относится взаимодействие между хлором и
1) метаном
2) этиленом
3) этаном
4) уксусной кислотой
14. В реакцию соединения вступят вещества, формулы которых
1) СO и FeO
2) CO2 и Mg
3) CO и Сl2
4) СО и CuO
15. Окислительно-восстановительной является реакция, схема которой
1) CuO + H2SO4 ® CuSO4 + H2O
2) FeO + HNO3 ® Fe (NO3)3 + NO + H2O
3) NaHSO4 + NaOH ® Na2SO4 + H2O
4) NH4HCO3 ® NH3 + CO2 + H2O
16. Реакцией горения нельзя назвать процесс, уравнение которого
Реакцией горения нельзя назвать процесс, уравнение которого
1) S + O2 = SO2
2) C + O2 = CO2
3) N2 + О2 = 2 NO
4) 4 P + 5 O2 = 2 P2O5
17. С наибольшей скоростью с водой реагирует
1) калий 2) литий 3) кальций 4) железо
18. С наименьшей скоростью с водородом реагирует
1) фтор 2) хлор 3) бром 4) иод
19. С наибольшей скоростью при комнатной температуре протекает реакция между
1) водородом и азотом
2) уксусной кислотой и этиловым спиртом
3) цинком и соляной кислотой
4) растворами нитрата серебра и хлорида натрия
20. Скорость реакции разложения пероксида водорода увеличится при
1) разбавлении раствора
2) увеличении давления
3) внесении катализатора
4) охлаждении раствора
21. Увеличение давления повысит скорость реакции между
Увеличение давления повысит скорость реакции между
1) Mg и H2SO4
2) N2 и Н2
3) KI (р-р) и AgNO3 (р-р)
4) СаСО3 и HCl (р-р)
22. С наибольшей скоростью протекает реакция между водным раствором гидроксида натрия и
1) соляной кислотой
2) алюминием
3) хлорэтаном
4) оксидом кремния (IV)
23. Увеличение концентрации кислорода увеличит скорость реакции, схема которой
1) H2O2 ® H2O + O2
2) NO + O2 ® NO2
3) KClO3 ® KCl + O2
4) KMnO4 ® K2MnO4 + MnO2 + O2
24. Давление не влияет на скорость реакции между
1) H2 и Br2 2) CO2 и С 3) Fe и S 4) СО и О2
25. К каталитическим реакциям относится получение
1) хлороводорода из хлора и водорода
2) фосфора из фосфата кальция
3) хрома алюминотермией
4) аммиака из азота и водорода
26. Увеличение температуры
1) увеличивает скорость любой реакции
2) уменьшает скорость любой реакции
3) увеличивает скорость только эндотермических реакций
4) не влияет на скорость реакции
27. Скорость реакции увеличивается при
1) повышении концентрации реагирующих веществ
2) повышении концентрации продуктов реакции
3) понижении температуры
4) понижении давления
28. Соли двухвалентной ртути используются в качестве катализатора реакции
1) окисления спиртов
2) гидрировния аренов
3) гидратации ацетилена
4) тримеризации ацетилена
29. Для увеличения скорости реакции синтеза аммиака из азота и водорода нужно:
1) понизить температуру
2) уменьшить давление
3) увеличить концентрацию аммиака
4) увеличить давление
30. Ингибитор – это вещество,
1) ускоряющее химическую реакцию
2) замедляющее химическую реакцию
3) усиливающее действие катализатора
4) нейтрализующее каталитические яды
03 Октябрь 2011, 20458 просмотров.
Комментарии
На конкретных примерах укажите основные факторы, влияющие на скорость химических реакций.
1) Скорость реакции зависит от природы реагирующих веществ.
Металлы реагируют с соляной кислотой с различной скоро- стью: магний реагирует быстрее железа, а медь не реагирует вовсе (за скоростью реакции легко следить по выделению пузырьков водорода).
Галогены реагируют с водородом с различной скоростью, например хлор быстрее йода:
2) Для веществ в растворенном состоянии и газов скорость реакции зависит от концентрации реагирующих веществ.
Оксид азота (II) реагирует с чистым кислородом быстрее, чем с воздухом, в котором кислорода около 20% (за изменением скорости реакции легко наблюдать, так как исходные вещества бесцветны, а оксид азота (IV) окрашен в коричневый цвет).
3) Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ.
Чем сильнее измельчено твердое вещество, тем больше его поверхность. Уголь в виде больших кусков сгорает в печи медленнее, чем измельченный:
Железные опилки реагируют с раствором сульфата меди быстрее, чем железная пластинка такой же массы:
4) При повышении температуры на каждые 10°С скорость большинства реакций увеличивается в 2–4 раза.
Железо при обычной температуре реагирует с хлором очень медленно, при высокой же температуре протекает бурная реакция (железо горит в хлоре):
Водород восстанавливает оксиды металлов при нагревании, при комнатной температуре эта реакция не идет.
5) Скорость реакции зависит от присутствия некоторых веществ (катализаторов и ингибиторов).
Реакция синтеза аммиака из азота и водорода протекает только в присутствии катализаторов (железа со специальными добавками):
Реакция окисления аммиака также протекает только в присутствии катализатора (платины):
1. С наибольшей скоростью протекает химическая реакция: 1) Al + H+ → 2) Al3+ + OH- → 3) Al + I2 → 4) Al2O3 + NaOH → 2. Площадь поверхности соприкосновения реагирующих веществ не влияет на скорость химической реакции между: 1) Zn и HCl 2) FeS2 и O2 3) N2 и h3 4) CuO и Al 3. В меньшей степени изменение давления скажется на скорости реакции: 1) Fe + 2HCl(г) → FeCl2 + h3 3) Fe + h3O(г) → FeO + h3 2) 2h3 + O2 → 2h3O 4) Fe + 2HCl(р-р) → FeCl2 + h3 4. Скорость химической реакции 2NO2(г) = 2NO(г) +O2(г) не зависит от изменения 1) концентрации диоксида азота 3) концентрации кислорода 2) давления в системе 4) температуры 5. Для увеличения скорости химической реакции Mg(тв) + 2H+ → Mg2+ + h3(г) необходимо 1) добавить несколько кусочков магния 2) увеличить концентрацию ионов водорода 3) уменьшить температуру 4) увеличить концентрацию ионов магния 6. Скорость химической реакции CuO + 2H+ = Cu2+ + 2h3O не зависит от: 1) степени измельчения оксида меди(II) 2) температуры 3) концентрации ионов меди 4) концентрации ионов водорода 7. С наименьшей скоростью протекает реакция между 1) Fe и О2 2) CaCO3 и HCl(р-р) 3) Na и О2 4) Na2SO4(р-р) и BaCl2(р-р) 8. Не зависит от давления скорость взаимодействия веществ 1) h3(г) и I2(г) 2) Nh4 и HCl(г) 3) Zn(OH)2 и h3SO4 4) Na(ж) и Cl2(г) 9. Скорость прямой реакции 2NO(г) + O2 (г) = 2NO2(г) + Q , протекающей в замкнутой системе, возрастает при: 1) уменьшении концентрации NO2 2) добавлении оксида азота (IV) 3) увеличении температуры 4) разбавлении газовой смеси азотом
1) уменьшение температуры 2) изменение площади платинового катализатора 3) увеличение концентрации аммиака 4) уменьшение давления 20. Скорость реакции не зависит от давления для веществ 1) Cu и HNO3(разб) 2) h3(г) и Cl2(г) 3) SO2(г) и О2(г) 4) С(кр) и О2(г)
21. Скорость прямой реакции 2SO2(г) + O2 (г) = 2SO3(г) + Q снизится при 1) отравлении катализатора 2) уменьшении концентрации SO3 3) увеличении температуры 4) изменении твердого катализатора – V2O5 22. Для уменьшения скорости химической реакции необходимо 1) увеличить концентрацию реагирующих веществ 2) ввести в систему катализатор 3) повысить температуру 4) понизить температуру 23. При обычных условиях с наибольшей скоростью протекает реакция 1) 2Ba + O2 = 2BaO 2) Ba2+ + CO32- = BaCO3 3) Ba + 2H+ = Ba2+ + h3 4) Ba + S = BaS 24. С наибольшей скоростью протекает реакция 1) нейтрализации 2) горения серы в воздухе 3) растворения магния в кислороде 4) восстановления оксида меди(II) водородом 25. При обычных условиях с наименьшей скоростью происходит взаимодействие между 1) Fe и О2 2) Mg и HCl (10%-ный р-р) 3) Cu и О2 4) Zn и HCl (10%-ный р-р)
26. С наибольшей скоростью происходит 1) коррозия металлов на воздухе 2) брожение глюкозы 3) реакция нейтрализации 4) взаимодействия водорода с бромом 27. Для увеличения скорости химической реакции FeO + CO → Fe + CO2 + 17 кДж необходимо 1) увеличить концентрацию CO2 2) уменьшить концентрацию CO2 3) уменьшить температуру 4) увеличить степень измельчения FeO 36. Скорость химической реакции между цинком и кислотой зависит от: 1) понижения давления 2) природы кислоты 3) повышения давления 4) присутствия индикатора 37. С наибольшей скоростью при комнатной температуре протекает реакция взаимодействия: 1) углерода с кислородом 2) железа с раствором уксусной кислоты 3) железа с соляной кислотой 4) растворов гидроксида натрия и серной кислоты 38. Для увеличения скорости химической реакции 2CuS(тв) + 3O2(г) = 2CuO(тв) + 2SO2(г) + 2920 кДж необходимо: 1) увеличить концентрацию SO2 2) уменьшить концентрацию SO2 3) уменьшить температуру 4) увеличить степень измельчения СuS 39.Увеличение температуры поведения реакции: 1) не влияет на ее скорость, так как теплота не может быть участником превращения веществ 2) увеличивает скорость реакции, так как увеличивается число эффективных соударений молекул 3) уменьшает скорость реакции, так как увеличивается число упругих соударений молекул 4) не влияет на скорость реакции, так как в равной мере увеличивается число эффективных и упругих соударений молекул 40. С большей скоростью идет взаимодействие соляной кислоты с: 1) Cu 2) Fe 3) Mg 4) Zn 41. Скорость химической реакции горения угля в кислороде уменьшается при: 1) увеличении концентрации кислорода 2) повышении температуры 3) понижении температуры 4) повышении давления 42. Катализатор AlCl3 увеличивает скорость: 1) любой химической реакции между органическими веществами 2) некоторых химических реакций между органическими веществами 3) любой химической реакции между неорганическими веществами 4) некоторых реакций между неорганическими веществами 52. Для увеличения скорости реакции 2СО + О2 = 2 СО2 + Q необходимо: 1) увеличить концентрацию СО 2) уменьшить концентрацию О2 3) понизить давление 4) понизить температуру 53. Оцените справедливость суждений: А. При нагревании скорость многих химических реакций уменьшается. Б. Катализатор – это вещество, которое увеличивает скорость химической реакции, но само в ней не участвует. 1) Верно только А; 2) верно только Б; 3) верны оба суждения 4) оба суждения неверны. 54. На скорость реакции между уксусной кислотой и этанолом не влияет: 1) катализатор 2) температура проведения реакции 3) концентрация исходных веществ 4) давление 55. С наибольшей скоростью с водородом реагирует 1) Cl2 2) F2 3) S 4) С 56. Скорость реакции водорода с азотом увеличится при: 1) понижении температуры 2) понижении давления 3) разбавлении смеси воздухом 4) использовании катализатора 57. Скорость реакции угарного газа с кислородом уменьшится при: 1) понижении температуры 3) повышении концентрации кислорода 2) повышении давления 4) понижении концентрации углекислого газа 58. Скорость реакции оксида серы(IV) с кислородом увеличится при: 1) понижении температуры 2). понижении давления 2) разбавлении смеси азотом 4) использовании катализатора 59. Скорость реакции горения метана уменьшится при: 1) понижении температуры 3) повышении концентрации кислорода 2) повышении давления 4) понижении концентрации углекислого газа
60. Скорость реакции оксида углерода(II) с водородом увеличится при: 1) понижении температуры 2).повышении давления 3) разбавлении смеси азотом 4) понижении концентрации СН3ОН 69. Из приведенных утверждений: А. При увеличении температуры на каждые 100 скорость химической реакции увеличится в 2 – 4 раза. Б. По мере протекания реакции ее скорость уменьшается. 1) верно только А; 2) верно только Б 3) верно А и Б; 4) оба суждения неверны 70. Для увеличения скорости выделения углекислого газа при действии соляной кислоты на мрамор нужно 1) разбавить кислоту; 2) измельчить мрамор 3) добавить индикатор; 4) проводить реакцию в атмосфере инертного газа 71. Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, — это 1) нейтрализация серной кислоты раствором гидроксида натрия; 2) горение водорода в кислороде; 3) взаимодействие растворов хлорида меди и гидроксида калия; 4) горение алюминия в кислороде | 10. Повышение давления не повлияет на скорость реакции 1) FeO(кр) и Н2(г) 2) 2SO2(г) и O2(г) 3) Н2(г) и I2(г) 4) СaCO3(кр) и HCl(ж) 11. Скорость обратной реакции Nh5Cl (кр) = Nh4(г) + HCl(г) – Q , протекающей в замкнутом сосуде, возрастает при 1) добавлении кристаллов соли 2) понижении температуры 3) повышении концентрации HCl 4) удалении аммиака 12. Скорость реакции не зависит от давления для веществ: 1) h3(г) и Fe2O3(кр) 2) СО(г) и Н2О(г) 3) СаО и HNO3(разб) 4) N2(г) и О2(г) 13. Скорость прямой реакции Ca(HCO3)2(р-р) = CaCO3(кр) + СО2(г) + Н2О(ж) — Q , протекающей в замкнутой системе, возрастает при 1) уменьшении концентрации СО2 2) увеличении концентрации СО2 3) уменьшении температуры 4) увеличении температуры 14. Скорость реакции не зависит от давления для веществ: 1) С(кр) и О2(г) 2) CaO(кр) и С(кр) 3) Nh4(г) и HCl(г) 4) S (кр) и Н2(г) 15. Скорость прямой реакции N2(г) + 3h3(г) = 2Nh4(г) + Q возрастает при 1) увеличении температуры 2) увеличении концентрации аммиака 3) уменьшении температуры 4) уменьшении концентрации аммиака 16. Скорость реакции не зависит от давления для веществ: 1) Н2(г) и О2(г) 2) Na и Н2О 3) h3(г) и WO3 4) h3O и СО2(г) 17. Скорость прямой реакции О2(г) + 2SO2(г) = 2SO3(г) + Q возрастает при 1) увеличении температуры 2) увеличении концентрации оксида серы(VI) 3) уменьшении температуры 4) уменьшении концентрации оксида серы(VI) 18. Скорость реакции не зависит от давления для веществ 1) С(кр) и СО2(г) 2) h3(г) и Br2(г) 3) NO(г) и O2(г) 4) Hg и HNO3(разб) 19. На скорость прямой реакции N2(г) + 3h3(г) ======= 2Nh4(г) + Q существенно не повлияет 28. Для увеличения скорости химической реакции Zn + 2H+ → Zn2+ + h3 + 154 кДж необходимо 1) уменьшить концентрацию ионов цинка 2) увеличить концентрацию ионов водорода 3) уменьшить температуру 4) увеличить концентрацию ионов цинка 29. Для увеличения скорости химической реакции Zn(тв) + 2HСl9г) → ZnСl2(тв) + h3(г) + 231 кДж необходимо 1) увеличить концентрацию водорода 2) увеличить количество цинка 3) уменьшить температуру 4) увеличить концентрацию хлороводорода 30. При повышении температуры на 200 скорость реакции, температурный коэффициент которой равен 3, возрастает в 1) 2 раза 2) 3 раза 3) 8 раз 4) 9 раз 31. При обычных условиях с наибольшей скоростью происходит взаимодействие между 1) N2 и О2 2)Fe и S 3) C2H5OH и О2 4) Na2CO3 и HCl 32. Скорость химической реакции характеризует: 1) изменение количеств веществ за единицу времени в единице объема или единице площади 2) время, за которое заканчивается химическая реакция 3) число структурных единиц вещества, вступивших в химическую реакцию 4) движение молекул или ионов реагирующих веществ относительно друг друга 33. Скорость химической реакции между медью и азотной кислотой зависит от: 1) массы меди 2) объема кислоты 3) концентрации кислоты 4) объема колбы 34. При увеличении температуры на 300С скорость реакции возрастает в 8 раз. Чему равен температурный коэффициент реакции? 1) 8 2) 2 3) 3 4) 4 35. Для увеличения скорости химической реакции Мg + 2H+ → Mg2+ + h3 + 462 кДж необходимо 1) уменьшить концентрацию ионов водорода 2) увеличить концентрацию ионов водорода 3) понизить температуру 4) повысить давление 43. Скорость прямой реакции N2 + 3h3 → 2Nh4 + Q возрастает при: 1) увеличении концентрации азота 2) уменьшении концентрации азота 3) увеличении концентрации аммиака 4) уменьшении концентрации аммиака 44. Какой из факторов не оказывает влияния на скорость химической реакции в растворах? 1) концентрация веществ 2) использование катализатора 3) использование индикатора 4) объем реакционного сосуда 45. Во сколько раз увеличивается скорость химической реакции при повышении температуры на 200С, если температурный коэффициент 3? 1) в3 раза 2) в 6 раз 3) в 9 раз 4) в 90 раз 46. Скорость химической реакции между металлом и серой не зависит от: 1) температуры 2) площади поверхности соприкосновения веществ 3) давления 4) природы металла 47. Реакция, протекающая на границе раздела двух фаз, называется: 1) гетерогенной 2) окислительно-восстановительной 3) гомогенной 4) каталитической 48. Взаимодействие какой пары веществ будет протекать с большей скоростью, если известно, что концентрация растворов кислот во всех случаях одинакова? 1) Pb и HCl 2) Fe и HCl 3) Zn и HCl 4) Mg и HCl 49. С наименьшей скоростью протекает реакция между: 1) железным гвоздем и 4%-ным раствором CuSO4 2) железной стружкой и 4%-ным раствором CuSO4 3) железным гвоздем и 10%-ным раствором CuSO4 4) железной стружкой и 10%-ным раствором CuSO4 50. Во сколько раз изменится скорость реакции 2А + В = 2С, если концентрацию вещества А уменьшить в 2 раза? 1) увеличится в 4 раза 2) уменьшится в 2 раза 3) уменьшится в 4 раза 4) увеличится в 2 раза 51. Как повлияет на скорость реакции CaO + CO2 = CaCO3 увеличение давления в 3 раза? 1) скорость увеличится в 3 раза 2) скорость уменьшится в 9 раз 3) скорость уменьшится в 3 раза 4) скорость не изменится 61. Катализатор требуется для проведения реакции 1) бромирования гексана 2) нейтрализации уксусной кислоты 3) бромировании фенола 4) этерификации уксусной кислоты 62. Для увеличения скорости взаимодействия железа с соляной кислотой следует 1) добавить ингибитор; 2) понизить температуру 3) повысить давление; 4) увеличить концентрацию HCl 63. Давление влияет на скорость реакции между 1) гидроксидом цинка и азотной кислотой; 2) цинком и серной кислотой; 3) аммиаком и кислородом; 4) серой и алюминием 64. Реакцию, уравнение которой FeO + 2H+ = Fe2+ + h3O + Q можно ускорить, если 1) повысить давление; 2) понизить давление 3) повысить температуру; 4) понизить температуру 65. Скорость реакции Zn + h3SO4 = ZnSO4 + h3 + Q понизится при 1) повышении температуры; 2) понижении давления 3) повышении давления; 4) разбавлении раствора кислоты 66. Скорость реакции 2А + В = А2В при уменьшении концентрации вещества А в 2 раза 1) понизится в 2 раза; 2) повысится в 4 раза 3) понизится в 4 раза; 4) не изменится 67. Оцените справедливость суждений: А. Катализатор увеличивает скорость реакции, но не вызывает смещение химического равновесия. Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции. 1) верно только А; 2) верно только Б 3) верны оба суждения; 4) оба суждения неверны 68. Скорость реакции N2 + 3h3 = 2Nh4 + Q увеличится при: 1) понижении температуры; 2) понижении концентрации Nh4 3) разбавлении смеси аргоном; 4) использовании катализатора Ответы на вопросы
|
2. Факторы, влияющие на скорость химической реакции. Физическая химия: конспект лекций
2. Факторы, влияющие на скорость химической реакции
Для гомогенных, гетерогенных реакций:
1) концентрация реагирующих веществ;
2) температура;
3) катализатор;
4) ингибитор.
Только для гетерогенных:
1) скорость подвода реагирующих веществ к поверхности раздела фаз;
2) площадь поверхности.
Главный фактор – природа реагирующих веществ – характер связи между атомами в молекулах реагентов.
Пример:
NO2 – оксид азота (IV) – лисий хвост, СО – угарный газ, монооксид углерода.
Если их окислить кислородом, то в первом случае реакция пойдет мгновенно, стоит приоткрыть пробку сосуда, во втором случае реакция растянута во времени.
Концентрация реагирующих веществ будет рассмотрена ниже.
Пример:
Голубая опалесценция свидетельствует о моменте выпадения серы, чем выше концентрация, тем скорость выше.
Рис. 10
Чем больше концентрации Na2S2O3, тем меньше времени идет реакция. На графике (рис. 10) изображена прямо пропорциональная зависимость. Количественная зависимость скорости реакции от концент-рации реагирующих веществ выражается ЗДМ (законом действующих масс), который гласит: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Итак, основным законом кинетики является установленный опытным путем закон: скорость реакции пропорциональна концентрации реагирующих веществ, пример: (т.е. для реакции)
Для этой реакции Н2 + J2 = 2НJ – скорость можно выразить через изменение концентрации любого из веществ. Если реакция протекает слева направо, то концентрация Н2 и J2 будет уменьшаться, концентрация НJ – увеличиваться по ходу реакции. Для мгновенной скорости реакций можно записать выражение:
квадратными скобками обозначается концентрация.
Физический смысл k– молекулы находятся в непрерывном движении, сталкиваются, разлетаются, ударяются о стенки сосуда. Для того, чтобы произошла химическая реакция образования НJ, молекулам Н2 и J2 надо столкнуться. Число же таких столкновений будет тем больше, чем больше молекул H2 и J2 содержится в объеме, т. е. тем больше будут величины [Н2] и [J2]. Но молекулы движутся с разными скоростями, и суммарная кинетическая энергия двух сталкивающихся молекул будет различной. Если столкнутся самые быстрые молекулы Н2 и J2, энергия их может быть такой большой, что молекулы разобьются на атомы йода и водорода, разлетающиеся и взаимодействующие затем с другими молекулами Н2 + J2?2H+2J, далее будет H + J2?HJ + J. Если энергия сталкивающихся молекул меньше, но достаточно велика для ослабления связей H – H и J – J, произойдет реакция образования йодоводорода:
У большинства же сталкивающихся молекул энергия меньше необходимой для ослабления связей в Н2 и J2. Такие молекулы «тихо» столкнутся и также «тихо» разойдутся, оставшись тем, чем они были, Н2 и J2. Таким образом, не все, а лишь часть столкновений приводит к химической реакции. Коэффициент пропорциональности (k) показывает число результативных, приводящих к реакции соударений при концентрациях [Н2] = [J2] = 1моль. Величина k– const скорости. Как же скорость может быть постоянной? Да, скоростью равномерного прямолинейного движения называют постоянную векторную величину, равную отношению перемещения тела за любой промежуток времени к значению этого промежутка. Но молекулы движутся хаотически, тогда как же может быть скорость – const? Но постоянная скорость может быть только при постоянной температуре. С ростом температуры увеличивается доля быстрых молекул, столкновения которых приводят к реакции, т. е. увеличивается константа скорости. Но увеличение константы скорости не безгранично. При какой-то температуре энергия молекул станет столь большой, что практически все соударения реагентов будут результативными. При столкновении двух быстрых молекул будет происходить обратная реакция.
Настанет такой момент, когда скорости образования 2НJ из Н2 и J2 и разложения будут равны, но это уже химическое равновесие. Зависимость скорости реакции от концентрации реагирующих веществ можно проследить, пользуясь традиционной реакцией взаимодействия раствора тиосульфата натрия с раствором серной кислоты.
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3, (1)
H2S2O3 = S?+H2O+SO2?. (2)
Реакция (1) протекает практически мгновенно. Скорость реакции (2) зависит при постоянной температуре от концентрации реагирующего вещества H2S2O3. Именно эту реакцию мы наблюдали – в этом случае скорость измеряется временем от начала сливания растворов до появления опалесценции. В статье Л. М. Кузнецовой описана реакция взаимодействия тиосульфата натрия с соляной кислотой. Она пишет, что при сливании растворов происходит опалесценция (помутнение). Но данное утверждение Л. М. Кузнецовой ошибочно так как опалесценция и помутнение – это разные вещи. Опалесценция (от опал и латинского escentia – суффикс, означающий слабое действие) – рассеяние света мутными средами, обусловленное их оптической неоднородностью. Рассеяние света – отклонение световых лучей, распространяющихся в среде во все стороны от первоначального направления. Коллоидные частицы способны рассеивать свет (эффект Тиндаля – Фарадея) – этим объясняется опалесценция, легкая мутноватость коллоидного раствора. При проведении этого опыта надо учитывать голубую опалесценцию, а затем коагуляцию коллоидной суспензии серы. Одинаковую плотность суспензии отмечают по видимому исчезновению какого-либо рисунка (например, сетки на дне стаканчика), наблюдаемого сверху через слой раствора. Время отсчитывают по секундомеру с момента сливания.
Растворы Na2S2O3 x 5H2O и H2SO4.
Первый готовят путем растворения 7,5 г соли в 100 мл H2O, что соответствует 0,3 М концентрации. Для приготовления раствора H2SO4 той же концентрации отмерить надо 1,8 мл H2SO4(к), ? = = 1,84 г/см3 и растворить ее в 120 мл H2O. Приготовленный раствор Na2S2O3 разлить в три стакана: в первый – 60 мл, во второй – 30 мл, в третий – 10 мл. Во второй стакан добавить 30 мл H2O дистиллированной, а в третий – 50 мл. Таким образом, во всех трех стаканах окажется по 60 мл жидкости, но в первом концентрация соли условно = 1, во втором – Ѕ, а в третьем – 1/6. После того, как будут подготовлены растворы, в первый стакан с раствором соли прилейте 60 мл раствора H2SO4 и включите секундомер, и т. д. Учитывая, что скорость реакции падает с разбавлением раствора Na2S2O3, ее можно определить как величину, обратно пропорциональную времени v = 1/? и построить график, отложив на оси абсцисс концентрацию, а на оси ординат – скорость реакции. Из этого вывод – скорость реакции зависит от концентрации веществ. Полученные данные занесены в таблицу 3. Можно этот опыт выполнить с помощью бюреток, но это требует от выполняющего большой практики, потому что график бывает неправильным.
Таблица 3
Скорость и время реакции
Подтверждается закон Гульдберга-Вааге – профессора химии Гульдерга и молодого ученого Вааге).
Рассмотрим следующий фактор – температуру.
При увеличении температуры скорость большинства химических реакций повышается. Эта зависимость описана правилом Вант-Гоффа: «При повышении температуры на каждые 10 °C скорость химических реакций увеличивается в 2 – 4 раза».
где ? – температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °C;
v1 – скорость реакции при температуре t1;
v2 – скорость реакции при температуре t2.
Например, реакция при 50 °С протекает за две минуты, за сколько времени закончится процесс при 70 °С, если температурный коэффициент ?= 2?
Решение:
t1 = 120 с = 2 мин; t1 = 50 °С; t2 = 70 °С.
Даже небольшое повышение температуры вызывает резкое увеличение скорости реакции активных соударений молекулы. Согласно теории активации, в процессе участвуют только те молекулы, энергия которых больше средней энергии молекул на определенную величину. Эта избыточная энергия – энергия активации. Физический смысл ее – это та энергия, которая необходима для активного столкновения молекул (перестройки орбиталей). Число активных частиц, а следовательно, скорость реакции возрастает с температурой по экспоненциальному закону, согласно уравнению Аррениуса, отражающему зависимость константы скорости от температуры
где А – коэффициент пропорциональности Аррениуса;
k– постоянная Больцмана;
ЕА – энергия активации;
R – газовая постоянная;
Т– температура.
Катализатор – вещество, ускоряющее скорость реакции, которое само при этом не расходуется.
Катализ – явление изменения скорости реакции в присутствии катализатора. Различают гомогенный и гетерогенный катализ. Гомогенный – если реагенты и катализатор находятся в одном агрегатном состоянии. Гетерогенный – если реагенты и катализатор в различных агрегатных состояниях. Про катализ см. отдельно (дальше).
Ингибитор – вещество, замедляющее скорость реакции.
Следующий фактор – площадь поверхности. Чем больше поверхность реагирующего вещества, тем больше скорость. Рассмотрим на примере влияние степени дисперсности на скорость реакции.
CaCO3 – мрамор. Плиточный мрамор опустим в соляную кислоту HCl, подождем пять минут, он растворится полностью.
Порошкообразный мрамор – с ним проделаем ту же процедуру, он растворился через тридцать секунд.
Уравнение обоих процессов одинаково.
CaCO3(тв) + HCl(г) = CaCl2(тв) + H2O(ж) + CO2(г) ?.
Итак, при добавлении порошкообразного мрамора время меньше, чем при добавлении плиточного мрамора, при одинаковой массе.
С увеличением поверхности раздела фаз скорость гетерогенных реакций увеличивается.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
факторов, влияющих на скорость реакций — вводная химия — 1-е канадское издание
Джесси А. Ки
Цели обучения
- Для понимания теории столкновений.
- Чтобы понять четыре основных фактора, влияющих на скорость реакции.
Кинетика реакций — это исследование скорости химических реакций, причем скорости реакции могут сильно варьироваться в большом диапазоне временных масштабов.Некоторые реакции могут протекать со взрывоопасной скоростью, например, взрыв фейерверка (рис. 17.1 «Фейерверк ночью над рекой»), в то время как другие могут происходить с медленной скоростью в течение многих лет, например, ржавление колючей проволоки, подвергшейся воздействию элементов (рис. 17.2 » Ржавая колючая проволока »).
Рисунок 17.1. Ночной салют над рекой
Химическая реакция в фейерверке происходит со взрывной скоростью.
Рисунок 17.2. Ржавая колючая проволока
Ржавчина колючей проволоки происходит в течение многих лет.
Теория столкновений
Чтобы понять кинетику химических реакций и факторы, влияющие на кинетику, мы должны сначала изучить, что происходит во время реакции на молекулярном уровне. Согласно теории столкновения реактивности, реакции происходят, когда молекулы реагента «эффективно сталкиваются». Чтобы произошло «эффективное столкновение», молекулы реагента должны быть правильно ориентированы в пространстве, чтобы облегчить разрыв и образование связей и перегруппировку атомов, которая приводит к образованию молекул продукта (Рисунок 17.3 «Визуализации столкновений»).
Рисунок 17.3. Визуализации столкновений
Эта визуализация показывает неэффективное и эффективное столкновение, основанное на ориентации молекул.
Во время столкновения молекул молекулы также должны обладать минимальным количеством кинетической энергии, чтобы произошло эффективное столкновение. Эта энергия варьируется для каждой реакции и известна как энергия активации ( E a ) (Рисунок 17.4 «Потенциальная энергия и энергия активации»).Следовательно, скорость реакции зависит от энергии активации; более высокая энергия активации означает, что меньшее количество молекул будет иметь достаточно энергии для эффективного столкновения.
Рисунок 17.4. Потенциальная энергия и энергия активации
Эта диаграмма потенциальной энергии показывает энергию активации гипотетической реакции.
Факторы, влияющие на рейтинг
Есть четыре основных фактора, которые могут повлиять на скорость химической реакции:
1. Концентрация реагента. Увеличение концентрации одного или нескольких реагентов часто увеличивает скорость реакции. Это происходит потому, что более высокая концентрация реагента приведет к большему количеству столкновений этого реагента за определенный период времени.
2. Физическое состояние реагентов и площадь поверхности. Если молекулы реагента существуют в разных фазах, как в гетерогенной смеси, скорость реакции будет ограничена площадью поверхности фаз, которые находятся в контакте. Например, если твердый металлический реагент и газовый реагент смешиваются, только молекулы, присутствующие на поверхности металла, могут сталкиваться с молекулами газа.Следовательно, увеличение площади поверхности металла за счет его расплющивания или разрезания на множество частей увеличит скорость его реакции.
3. Температура . Повышение температуры обычно увеличивает скорость реакции. Повышение температуры приведет к увеличению средней кинетической энергии молекул реагента. Следовательно, большая часть молекул будет иметь минимальную энергию, необходимую для эффективного столкновения (рис. 17.5 «Температура и скорость реакции»).
Рисунок.17.5 Температура и скорость реакции
Влияние температуры на распределение кинетической энергии молекул в образце
4. Наличие катализатора . Катализатор представляет собой вещество, которое ускоряет реакцию, участвуя в ней, но не потребляется. Катализаторы обеспечивают альтернативный путь реакции для получения продуктов. Они имеют решающее значение для многих биохимических реакций. Они будут рассмотрены далее в разделе «Катализ».
Ключевые выводы
- Реакции происходят, когда две молекулы реагента эффективно сталкиваются, каждая из которых имеет минимальную энергию и правильную ориентацию.
- Концентрация реагента, физическое состояние реагентов, площадь поверхности, температура и присутствие катализатора — четыре основных фактора, влияющих на скорость реакции.
12.2 Факторы, влияющие на скорость реакции — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Опишите влияние химической природы, физического состояния, температуры, концентрации и катализа на скорость реакции
Скорость, с которой расходуются реагенты и образуются продукты в ходе химических реакций, сильно различается.В этом разделе будут изучены пять факторов, обычно влияющих на скорость химических реакций: химическая природа реагирующих веществ, состояние разделения (один большой кусок по сравнению с множеством мелких частиц) реагентов, температура реагентов, концентрация реагентов. реагенты и наличие катализатора.
Химическая природа реагирующих веществ
Скорость реакции зависит от природы участвующих веществ. Реакции, которые кажутся похожими, могут иметь разную скорость в одних и тех же условиях, в зависимости от идентичности реагентов.Например, когда небольшие кусочки металлов, железа и натрия, подвергаются воздействию воздуха, натрий полностью реагирует с воздухом в течение ночи, в то время как железо почти не затрагивается. Активные металлы кальций и натрий реагируют с водой с образованием газообразного водорода и основания. И все же кальций реагирует с умеренной скоростью, тогда как натрий реагирует так быстро, что реакция становится почти взрывоопасной.
Физические состояния реагентов
Химическая реакция между двумя или более веществами требует тесного контакта между реагентами.Когда реагенты находятся в разных физических состояниях или фазах (твердое, жидкое, газообразное, растворенное), реакция происходит только на границе раздела фаз. Рассмотрим гетерогенную реакцию между твердой фазой и жидкой или газообразной фазой. По сравнению со скоростью реакции для крупных твердых частиц скорость для более мелких частиц будет больше, потому что площадь поверхности, контактирующая с другой фазой реагента, больше. Например, крупные куски железа медленнее реагируют с кислотами, чем с мелкодисперсным порошком железа (Рисунок 12.6). Большие куски дерева тлеют, более мелкие — быстро, а опилки горит взрывом.
Рисунок 12.6 (a) Порошок железа быстро реагирует с разбавленной соляной кислотой и образует пузырьки газообразного водорода: 2Fe ( s ) + 6HCl ( водн. ) ⟶⟶ 2FeCl 3 ( водн. ) + 3H 2 ( г ). (б) Железный гвоздь реагирует медленнее, потому что площадь поверхности, подверженная воздействию кислоты, намного меньше.
Ссылка на обучение
Посмотрите это видео, чтобы увидеть реакцию цезия с водой в замедленном режиме и обсудить, как состояние реагентов и размер частиц влияют на скорость реакции.
Температура реагентов
Химические реакции обычно происходят быстрее при более высоких температурах. Еда может быстро испортиться, если оставить ее на кухонном столе. Однако более низкая температура внутри холодильника замедляет этот процесс, так что одни и те же продукты остаются свежими в течение нескольких дней. Газовые горелки, горячие плиты и духовки часто используются в лаборатории для увеличения скорости реакций, которые протекают медленно при обычных температурах. Для многих химических процессов скорость реакции увеличивается примерно вдвое при повышении температуры на 10 ° C.
Концентрации реагентов
Скорость многих реакций зависит от концентраций реагентов. Скорости обычно увеличиваются, когда увеличивается концентрация одного или нескольких реагентов. Например, карбонат кальция (CaCO 3 ) портится в результате его реакции с загрязняющим диоксидом серы. Скорость этой реакции зависит от количества диоксида серы в воздухе (рис. 12.7). Кислый оксид, диоксид серы, соединяется с водяным паром в воздухе с образованием серной кислоты в следующей реакции:
SO2 (г) + h3O (г) h3SO3 (водн.) SO2 (г) + h3O (г) ⟶h3SO3 (водн.)
Карбонат кальция реагирует с серной кислотой следующим образом:
CaCO3 (т.) + H3SO3 (водн.) ⟶CaSO3 (водн.) + CO2 (г) + h3O (л) CaCO3 (т.) + H3SO3 (водн.) ⟶CaSO3 (водн.) + CO2 (г) + h3O (л)
В загрязненной атмосфере с высокой концентрацией диоксида серы карбонат кальция разрушается быстрее, чем в менее загрязненном воздухе.Точно так же фосфор сгорает намного быстрее в атмосфере чистого кислорода, чем в воздухе, который составляет всего около 20% кислорода.
Рис. 12.7 Статуи, сделанные из карбонатных соединений, таких как известняк и мрамор, обычно медленно выветриваются с течением времени из-за воздействия воды, а также теплового расширения и сжатия. Однако такие загрязнители, как диоксид серы, могут ускорить выветривание. По мере увеличения концентрации загрязнителей воздуха разрушение известняка происходит быстрее. (кредит: Джеймс П. Фишер III)
Ссылка на обучение
Фосфор быстро горит на воздухе, но он будет гореть еще быстрее, если концентрация кислорода будет выше.Посмотрите это видео, чтобы увидеть пример.
Наличие катализатора
Относительно разбавленные водные растворы перекиси водорода, H 2 O 2 , обычно используются в качестве местных антисептиков. Перекись водорода разлагается с образованием воды и газообразного кислорода в соответствии с уравнением:
.
2h3O2 (водный) ⟶2h3O (l) + O2 (g) 2h3O2 (водный) ⟶2h3O (l) + O2 (g)
В типичных условиях это разложение происходит очень медленно. Однако когда разбавленный раствор H 2 O 2 (водный) наливается на открытую рану, реакция происходит быстро, и раствор пенится из-за сильного выделения газообразного кислорода.Это резкое различие вызвано наличием веществ в открытых тканях раны, которые ускоряют процесс разложения. Вещества, которые увеличивают скорость реакции, называются катализаторами, и эта тема более подробно рассматривается далее в этой главе.
Ссылка на обучение
Химические реакции происходят, когда молекулы сталкиваются друг с другом и претерпевают химическое превращение. Прежде чем физически провести реакцию в лаборатории, ученые могут использовать симуляции молекулярного моделирования, чтобы предсказать, как параметры, обсуждаемые ранее, повлияют на скорость реакции.Используйте интерактивный интерфейс PhET Reactions & Rates, чтобы изучить, как температура, концентрация и природа реагентов влияют на скорость реакции.
Факторы, влияющие на скорость реакции
Цели обучения
- Для понимания теории столкновений.
- Чтобы понять четыре основных фактора, влияющих на скорость реакции.
Кинетика реакций — это исследование скорости химических реакций, причем скорости реакции могут сильно варьироваться в большом диапазоне временных масштабов.Некоторые реакции могут протекать со взрывоопасной скоростью, например, взрыв фейерверка (рис. 17.1 «Фейерверк ночью над рекой»), в то время как другие могут происходить с медленной скоростью в течение многих лет, например, ржавление колючей проволоки, подвергшейся воздействию элементов (рис. 17.2 » Ржавая колючая проволока »).
Рисунок 17.1. Ночной салют над рекой
Химическая реакция в фейерверке происходит со взрывной скоростью.
Рисунок 17.2. Ржавая колючая проволока
Ржавчина колючей проволоки происходит в течение многих лет.
Теория столкновений
Чтобы понять кинетику химических реакций и факторы, влияющие на кинетику, мы должны сначала изучить, что происходит во время реакции на молекулярном уровне. Согласно теории столкновения реактивности, реакции происходят, когда молекулы реагента «эффективно сталкиваются». Чтобы произошло «эффективное столкновение», молекулы реагента должны быть правильно ориентированы в пространстве, чтобы облегчить разрыв и образование связей и перегруппировку атомов, которая приводит к образованию молекул продукта (Рисунок 17.3 «Визуализации столкновений»).
Рисунок 17.3. Визуализации столкновений
Эта визуализация показывает неэффективное и эффективное столкновение, основанное на ориентации молекул.
Во время столкновения молекул молекулы также должны обладать минимальным количеством кинетической энергии, чтобы произошло эффективное столкновение. Эта энергия варьируется для каждой реакции и известна как энергия активации ( E a ) (Рисунок 17.4 «Потенциальная энергия и энергия активации»).Следовательно, скорость реакции зависит от энергии активации; более высокая энергия активации означает, что меньшее количество молекул будет иметь достаточно энергии для эффективного столкновения.
Рисунок 17.4. Потенциальная энергия и энергия активации
Эта диаграмма потенциальной энергии показывает энергию активации гипотетической реакции.
Факторы, влияющие на рейтинг
Есть четыре основных фактора, которые могут повлиять на скорость химической реакции:
1. Концентрация реагента. Увеличение концентрации одного или нескольких реагентов часто увеличивает скорость реакции. Это происходит потому, что более высокая концентрация реагента приведет к большему количеству столкновений этого реагента за определенный период времени.
2. Физическое состояние реагентов и площадь поверхности. Если молекулы реагента существуют в разных фазах, как в гетерогенной смеси, скорость реакции будет ограничена площадью поверхности фаз, которые находятся в контакте.Например, если твердый металлический реагент и газовый реагент смешиваются, только молекулы, присутствующие на поверхности металла, могут сталкиваться с молекулами газа. Следовательно, увеличение площади поверхности металла за счет его расплющивания или разрезания на множество частей увеличит скорость его реакции.
3. Температура . Повышение температуры обычно увеличивает скорость реакции. Повышение температуры приведет к увеличению средней кинетической энергии молекул реагента.Следовательно, большая часть молекул будет иметь минимальную энергию, необходимую для эффективного столкновения (рис. 17.5 «Температура и скорость реакции»).
Рисунок. 17.5 Температура и скорость реакции
Влияние температуры на распределение кинетической энергии молекул в образце
4. Наличие катализатора . Катализатор представляет собой вещество, которое ускоряет реакцию, участвуя в ней, но не потребляется. Катализаторы обеспечивают альтернативный путь реакции для получения продуктов.Они имеют решающее значение для многих биохимических реакций. Они будут рассмотрены далее в разделе «Катализ».
Ключевые выводы
- Реакции происходят, когда две молекулы реагента эффективно сталкиваются, каждая из которых имеет минимальную энергию и правильную ориентацию.
- Концентрация реагента, физическое состояние реагентов, площадь поверхности, температура и присутствие катализатора — четыре основных фактора, влияющих на скорость реакции.
8.3: Факторы, влияющие на скорость реакции (кинетика)
Цели обучения
- Опишите влияние химической природы, физического состояния, температуры, концентрации и катализа на скорость реакции
Скорость, с которой расходуются реагенты и образуются продукты в ходе химических реакций, сильно различается. Мы можем выделить пять факторов, которые влияют на скорость химических реакций: химическая природа реагирующих веществ, состояние разделения (один большой кусок по сравнению с множеством мелких частиц) реагентов, температура реагентов, концентрация реагентов, и наличие катализатора.
Химическая природа реагирующих веществ
Скорость реакции зависит от природы участвующих веществ. Реакции, которые кажутся похожими, могут иметь разную скорость в одних и тех же условиях, в зависимости от идентичности реагентов. Например, когда небольшие кусочки металлов, железа и натрия, подвергаются воздействию воздуха, натрий полностью реагирует с воздухом в течение ночи, в то время как железо почти не затрагивается. Активные металлы кальций и натрий реагируют с водой с образованием газообразного водорода и основания.И все же кальций реагирует с умеренной скоростью, тогда как натрий реагирует так быстро, что реакция становится почти взрывоопасной.
Состояние подразделения реагентов
За исключением веществ в газообразном состоянии или в растворе, реакции происходят на границе или границе раздела двух фаз. Следовательно, скорость реакции между двумя фазами в значительной степени зависит от поверхностного контакта между ними. Мелкодисперсное твердое вещество имеет большую площадь поверхности, доступную для реакции, чем один большой кусок того же вещества.Таким образом, жидкость будет быстрее реагировать с мелкодисперсным твердым веществом, чем с большим куском того же твердого вещества. Например, большие куски железа медленно реагируют с кислотами; мелкодисперсное железо реагирует намного быстрее (Рисунок \ (\ PageIndex {1} \)). Большие куски дерева тлеют, более мелкие — быстро, а опилки горит взрывом.
Рисунок \ (\ PageIndex {1} \): (a) Порошок железа быстро реагирует с разбавленной соляной кислотой и образует пузырьки газообразного водорода, потому что порошок имеет большую общую площадь: 2Fe (s) + 6HCl (водн.) ⟶ 2FeCl3 (водн. ) + 3х3 (г).(поверхностьb) Железный гвоздь реагирует медленнее.
Видео \ (\ PageIndex {1} \) : Замедленная реакция цезия с водой и обсуждение того, как состояние реагентов и размер частиц влияют на скорость реакции.
Температура реагентов
Химические реакции обычно происходят быстрее при более высоких температурах. Еда может быстро испортиться, если оставить ее на кухонном столе. Однако более низкая температура внутри холодильника замедляет этот процесс, так что одни и те же продукты остаются свежими в течение нескольких дней.Мы используем горелку или электрическую плиту в лаборатории, чтобы увеличить скорость реакций, которые медленно протекают при обычных температурах. Во многих случаях повышение температуры всего на 10 ° C примерно вдвое увеличивает скорость реакции в гомогенной системе.
Концентрации реагентов
Скорость многих реакций зависит от концентраций реагентов. Скорости обычно увеличиваются, когда увеличивается концентрация одного или нескольких реагентов. Например, карбонат кальция (\ (\ mathrm {CaCO_3} \)) портится в результате его реакции с загрязняющим диоксидом серы.Скорость этой реакции зависит от количества диоксида серы в воздухе (Рисунок \ (\ PageIndex {2} \)). В качестве кислого оксида диоксид серы соединяется с водяным паром в воздухе с образованием серной кислоты в следующей реакции:
\ [\ ce {SO} _ {2 (g)} + \ ce {H_2O} _ {(g)} ⟶ \ ce {H_2SO} _ {3 (водн.)} \ Label {12.3.1} \]
Карбонат кальция реагирует с серной кислотой следующим образом:
\ [\ ce {CaCO} _ {3 (s)} + \ ce {H_2SO} _ {3 (водн.)} ⟶ \ ce {CaSO} _ {3 (водн.)} + \ Ce {CO} _ {2 (g)} + \ ce {H_2O} _ {(l)} \ label {12.3.2} \]
В загрязненной атмосфере с высокой концентрацией диоксида серы карбонат кальция разрушается быстрее, чем в менее загрязненном воздухе. Точно так же фосфор сгорает намного быстрее в атмосфере чистого кислорода, чем в воздухе, который составляет всего около 20% кислорода.
Рисунок \ (\ PageIndex {2} \): Статуи, сделанные из карбонатных соединений, таких как известняк и мрамор, обычно медленно выветриваются с течением времени из-за воздействия воды, а также теплового расширения и сжатия. Однако такие загрязнители, как диоксид серы, могут ускорить выветривание.По мере увеличения концентрации загрязнителей воздуха разрушение известняка происходит быстрее. (Источник: Джеймс П. Фишер III).
Видео \ (\ PageIndex {2} \) : Фосфор быстро горит на воздухе, но он будет гореть еще быстрее, если концентрация кислорода в нем выше.
Наличие катализатора
Растворы перекиси водорода пенится при наливании на открытую рану, поскольку вещества в открытых тканях действуют как катализаторы, увеличивая скорость разложения перекиси водорода.Однако в отсутствие этих катализаторов (например, во флаконе в аптечке) полное разложение может занять месяцы. Катализатор — это вещество, которое увеличивает скорость химической реакции за счет снижения энергии активации, но при этом оно не расходуется на реакцию. Энергия активации — это минимальное количество энергии, необходимое для протекания химической реакции в прямом направлении. Катализатор увеличивает скорость реакции, предоставляя альтернативный путь или механизм реакции (рисунок \ (\ PageIndex {3} \)).Катализ будет обсуждаться более подробно позже в этой главе, поскольку он относится к механизмам реакций.
Рисунок \ (\ PageIndex {3} \): присутствие катализатора увеличивает скорость реакции за счет снижения ее энергии активации.
Химические реакции происходят, когда молекулы сталкиваются друг с другом и претерпевают химическое превращение. Прежде чем физически провести реакцию в лаборатории, ученые могут использовать симуляции молекулярного моделирования, чтобы предсказать, как параметры, обсуждаемые ранее, повлияют на скорость реакции.Используйте интерактивный интерфейс PhET Reactions & Rates, чтобы изучить, как температура, концентрация и природа реагентов влияют на скорость реакции.
Авторы и авторство
Сводка
На скорость химической реакции влияют несколько параметров. Реакции, включающие две фазы, протекают быстрее, чем больше площадь контакта поверхности. Если температура или концентрация реагента увеличиваются, скорость данной реакции обычно также увеличивается.Катализатор может увеличить скорость реакции, предоставляя альтернативный путь, который вызывает снижение энергии активации реакции.
Глоссарий
- катализатор
- Вещество, которое увеличивает скорость реакции, но само по себе не расходуется на реакцию
Авторы и авторство
Факторы, влияющие на скорость химической реакции
Полезно иметь возможность предсказать, повлияет ли действие на скорость протекания химической реакции.На скорость химической реакции могут влиять несколько факторов.
Как правило, фактор, увеличивающий количество столкновений между частицами, увеличивает скорость реакции, а фактор, уменьшающий количество столкновений между частицами, снижает скорость химической реакции.
Концентрация реагентов
Более высокая концентрация реагентов приводит к более эффективным столкновениям в единицу времени, что приводит к увеличению скорости реакции (за исключением реакций нулевого порядка.) Точно так же более высокая концентрация продуктов обычно связана с более низкой скоростью реакции.
Используйте парциальное давление реагентов в газообразном состоянии как меру их концентрации.
Температура
Обычно повышение температуры сопровождается увеличением скорости реакции. Температура — это мера кинетической энергии системы, поэтому более высокая температура подразумевает более высокую среднюю кинетическую энергию молекул и большее количество столкновений в единицу времени.
Общее правило для большинства (не всех) химических реакций состоит в том, что скорость, с которой протекает реакция, будет примерно удваиваться на каждые 10 градусов Цельсия повышения температуры. Как только температура достигнет определенной точки, некоторые химические соединения могут измениться (например, денатурировать белки), и химическая реакция замедлится или остановится.
Среда или состояние вещества
Скорость химической реакции зависит от среды, в которой происходит реакция.Может иметь значение, является ли среда водной или органической; полярные или неполярные; или жидкое, твердое или газообразное.
Реакции с участием жидкостей и особенно твердых веществ зависят от доступной площади поверхности. Для твердых веществ форма и размер реагентов имеют большое значение для скорости реакции.
Наличие катализаторов и конкурентов
Катализаторы (например, ферменты) снижают энергию активации химической реакции и увеличивают скорость химической реакции, не расходясь в процессе.
Катализаторы работают, увеличивая частоту столкновений между реагентами, изменяя ориентацию реагентов так, чтобы больше столкновений было эффективным, уменьшая внутримолекулярные связи внутри молекул реагентов или передавая электронную плотность реагентам. Присутствие катализатора помогает реакции быстрее прийти к равновесию.
Помимо катализаторов, на реакцию могут влиять другие химические вещества. Количество ионов водорода (pH водных растворов) может изменять скорость реакции.Другие химические вещества могут конкурировать за реагент или изменять ориентацию, связывание, электронную плотность и т. Д., Тем самым снижая скорость реакции.
Давление
Повышение давления реакции увеличивает вероятность взаимодействия реагентов друг с другом, тем самым увеличивая скорость реакции. Как и следовало ожидать, этот фактор важен для реакций с участием газов, а не для жидкостей и твердых тел.
Смешивание
Смешивание реагентов увеличивает их способность к взаимодействию, тем самым увеличивая скорость химической реакции.
Сводка факторов
В таблице ниже приведены основные факторы, влияющие на скорость реакции. Обычно существует максимальный эффект, после которого изменение фактора не будет иметь никакого эффекта или замедлит реакцию. Например, повышение температуры выше определенной точки может денатурировать реагенты или вызвать их совершенно иную химическую реакцию.
| Фактор | Влияние на скорость реакции |
| температура | повышение температуры увеличивает скорость реакции |
| давление | увеличение давления увеличивает скорость реакции |
| концентрация | в растворе, увеличение количества реагентов увеличивает скорость реакции |
| состояние вещества | газы реагируют легче, чем жидкости, которые реагируют легче, чем твердые вещества |
| катализаторы | катализатор снижает энергию активации, увеличивая скорость реакции |
| смешивание | смешивание реагентов улучшает скорость реакции |
факторов, влияющих на скорость реакции
14.1 Факторы, влияющие на скорость реакции
Цель обучения
- Чтобы понять факторы, влияющие на скорость реакции.
Хотя сбалансированное химическое уравнение реакции описывает количественные отношения между количествами присутствующих реагентов и количествами продуктов, которые могут быть образованы, оно не дает нам информации о том, будет ли протекать данная реакция и как быстро она будет происходить. Эта информация получается путем изучения химической кинетики реакции, которая зависит от различных факторов: концентрации реагентов, температуры, физического состояния и площади поверхности реагентов, а также свойств растворителя и катализатора, если таковые присутствуют.Изучая кинетику реакции, химики понимают, как контролировать условия реакции для достижения желаемого результата.
Эффекты концентрации
Два вещества не могут вступить в реакцию друг с другом, если составляющие их частицы (молекулы, атомы или ионы) не вступят в контакт. Если контакта нет, скорость реакции будет равна нулю. И наоборот, чем больше частиц реагента сталкивается в единицу времени, тем чаще между ними может происходить реакция.Следовательно, скорость реакции обычно увеличивается с увеличением концентрации реагентов. Одним из примеров этого эффекта является реакция сахарозы (столового сахара) с серной кислотой, которая показана на рисунке 14.1 «Влияние концентрации на скорость реакции».
Рисунок 14.1 Влияние концентрации на скорость реакции
Смешивание сахарозы с разбавленной серной кислотой в стакане (а, справа) дает простой раствор. Смешивание того же количества сахарозы с концентрированной серной кислотой (a, слева) приводит к драматической реакции (b), которая в конечном итоге приводит к образованию столбика черного пористого графита (c) и интенсивного запаха горящего сахара.
Температурные эффекты
В главе 10 «Газы» вы узнали, что повышение температуры системы увеличивает среднюю кинетическую энергию составляющих ее частиц. По мере увеличения средней кинетической энергии частицы движутся быстрее, поэтому они чаще сталкиваются в единицу времени и обладают большей энергией при столкновении. Оба эти фактора увеличивают скорость реакции. Следовательно, скорость реакции практически всех реакций увеличивается с повышением температуры.И наоборот, скорость практически всех реакций уменьшается с понижением температуры. Например, охлаждение замедляет рост бактерий в пищевых продуктах за счет снижения скорости биохимических реакций, которые позволяют бактериям воспроизводиться. На рисунке 14.2 «Влияние температуры на скорость реакции» показано, как температура влияет на свет, излучаемый двумя хемилюминесцентными световыми стержнями.
Рисунок 14.2 Влияние температуры на скорость реакции
При высокой температуре реакция, которая дает свет в хемилюминесцентной световой палке, происходит быстрее, производя больше фотонов света в единицу времени.Следовательно, в горячей воде (слева) свет светится ярче, чем в ледяной воде (справа).
В системах, где возможно более одной реакции, одни и те же реагенты могут давать разные продукты в разных условиях реакции. Например, в присутствии разбавленной серной кислоты и при температуре около 100 ° C этанол превращается в диэтиловый эфир:
Уравнение 14.1
2Ch4Ch3OH → h3SO4Ch4Ch3OCh3Ch4 + h3O
Однако при 180 ° C происходит совершенно другая реакция, в результате которой образуется этилен в качестве основного продукта:
Уравнение 14.2
Ch4Ch3OH → h3SO4C2h5 + h3O
Эффекты фазы и площади поверхности
Когда два реагента находятся в одной и той же жидкой фазе, их частицы сталкиваются чаще, чем когда один или оба реагента являются твердыми веществами (или когда они находятся в разных жидкостях, которые не смешиваются). Если реагенты равномерно диспергированы в одном гомогенном растворе, то, как мы только что видели, количество столкновений в единицу времени зависит от концентрации и температуры.Однако, если реакция гетерогенная, реагенты находятся в двух разных фазах, и столкновения между реагентами могут происходить только на границах раздела фаз. Количество столкновений между реагентами в единицу времени существенно снижается по сравнению с гомогенным случаем, а, следовательно, и скорость реакции. Скорость гетерогенной реакции зависит от площади поверхности более конденсированной фазы.
Автомобильные двигатели используют эффекты площади поверхности для увеличения скорости реакции.Бензин впрыскивается в каждый цилиндр, где он воспламеняется при воспламенении от искры свечи зажигания. Бензин впрыскивается в виде микроскопических капель, потому что в этой форме он имеет гораздо большую площадь поверхности и может гореть намного быстрее, чем если бы его подавали в цилиндр в виде потока. Точно так же куча мелко измельченной муки горит медленно (или не горит совсем), но распыление мелко измельченной муки в пламя вызывает бурную реакцию (рис. 14.3 «Влияние площади поверхности на скорость реакции»).Подобные явления частично ответственны за взрывы пыли, которые иногда разрушают элеваторы или угольные шахты.
Рисунок 14.3 Влияние площади поверхности на скорость реакции
Куча муки обжигается только пламенем (справа), но когда ту же муку распыляют в пламя, она быстро горит (слева).
Эффекты растворителя
Природа растворителя также может влиять на скорость реакции растворенных частиц.Например, раствор ацетата натрия реагирует с метилиодидом в реакции обмена с образованием метилацетата и иодида натрия.
Уравнение 14.3
CH 3 CO 2 Na (раствор) + CH 3 I (л) → CH 3 CO 2 CH 3 (раствор) + NaI (раствор)
Эта реакция протекает в 10 миллионов раз быстрее в органическом растворителе диметилформамиде [DMF; (CH 3 ) 2 NCHO], чем в метаноле (CH 3 OH).Хотя оба являются органическими растворителями с аналогичной диэлектрической проницаемостью (36,7 для ДМФА против 32,6 для метанола), метанол способен образовывать водородные связи с ионами ацетата, тогда как ДМФА — нет. Водородная связь снижает реакционную способность атомов кислорода в ацетат-ионе.
Вязкость растворителя также важна для определения скорости реакции. В высоковязких растворителях растворенные частицы диффундируют намного медленнее, чем в менее вязких растворителях, и могут сталкиваться реже в единицу времени.Таким образом, скорость большинства реакций быстро снижается с увеличением вязкости растворителя.
Эффекты катализатора
В главе 3 «Химические реакции» вы узнали, что катализатор — это вещество, которое участвует в химической реакции и увеличивает скорость реакции, не претерпевая самого чистого химического изменения. Рассмотрим, например, разложение перекиси водорода в присутствии и в отсутствие различных катализаторов (Рисунок 14.4 «Влияние катализаторов на скорость реакции»).Поскольку большинство катализаторов обладают высокой селективностью, они часто определяют продукт реакции, ускоряя только одну из нескольких возможных реакций, которые могут произойти.
Рисунок 14.4 Влияние катализаторов на скорость реакции
Раствор перекиси водорода (H 2 O 2 ) разлагается в воде так медленно, что изменение не заметно (слева). Иодид-ион действует как катализатор разложения H 2 O 2 с образованием газообразного кислорода.Раствор становится коричневым из-за реакции H 2 O 2 с I — , в результате чего образуются небольшие количества I 3 — (в центре). Фермент каталаза примерно в 3 миллиардов раз более эффективен, чем йодид в качестве катализатора. Даже в присутствии очень небольшого количества фермента разложение идет интенсивно (справа).
Большинство химических веществ, производимых в промышленности, образуются в результате каталитических реакций. Последние оценки показывают, что около 30% валового национального продукта США и других промышленно развитых стран прямо или косвенно зависит от использования катализаторов.
Сводка
Факторы, которые влияют на скорость химических реакций, включают концентрацию реагентов, температуру, физическое состояние реагентов и их дисперсию, растворитель и присутствие катализатора.
Ключевые вынос
- Скорость реакции зависит от концентраций реагентов, температуры реакции, фазы и площади поверхности реагентов, растворителя и присутствия или отсутствия катализатора.
Концептуальные проблемы
Какую информацию вы можете получить, изучая химическую кинетику реакции? Предоставляет ли сбалансированное химическое уравнение ту же информацию? Почему или почему нет?
Если вам было поручено определить, следует ли проводить конкретную реакцию на промышленном объекте, почему изучение химической кинетики реакции было бы для вас важным?
Какова взаимосвязь между каждым из следующих факторов и скоростью реакции: концентрацией реагента, температурой реакции, физическими свойствами реагентов, физическими и химическими свойствами растворителя и присутствием катализатора?
Суспензия — это смесь мелкодисперсного твердого вещества с жидкостью, в которой она плохо растворима.Когда вы готовите реакцию, вы замечаете, что один из ваших реагентов образует с растворителем суспензию, а не раствор. Как это повлияет на скорость реакции? Какие шаги вы можете предпринять, чтобы попытаться решить проблему?
Почему скорость практически всех реакций увеличивается с повышением температуры? Если бы вы приготовили стакан сладкого чая со льдом по старинке, добавив сахар и кубики льда в стакан горячего чая, что бы вы добавили в первую очередь?
В типичных лабораторных условиях реакция проводится в вытяжном шкафу с циркуляцией воздуха, обеспечиваемой наружным воздухом.Студент заметил, что реакция, которая дала высокий выход продукта зимой, давала низкий выход того же продукта летом, даже несмотря на то, что его методика не изменилась, а используемые реагенты и концентрации были идентичными. Каково правдоподобное объяснение разной урожайности?
Очень активная область химических исследований включает разработку солюбилизированных катализаторов, которые не становятся неактивными в процессе реакции.Ожидается, что такие катализаторы значительно увеличивают скорости реакции по сравнению с тем же ходом реакции в присутствии гетерогенного катализатора. В чем причина ожидания увеличения относительной скорости?
Вода имеет диэлектрическую проницаемость более чем в два раза выше, чем у метанола (80,1 для H 2 O и 33,0 для CH 3 OH). Какой растворитель вы бы выбрали для реакции замещения между ионным соединением и полярным реагентом, оба из которых растворимы в метаноле или воде? Почему?
ответов
Kinetics дает информацию о скорости реакции и механизме реакции; сбалансированное химическое уравнение дает только стехиометрию реакции.
Скорость реакции обычно увеличивается с увеличением концентрации реагента, повышением температуры и добавлением катализатора. Физические свойства, такие как высокая растворимость, также увеличивают скорость реакции. Полярность растворителя может увеличивать или уменьшать скорость реакции, но увеличение вязкости растворителя обычно снижает скорость реакции.
Повышение температуры увеличивает среднюю кинетическую энергию молекул и ионов, заставляя их сталкиваться чаще и с большей энергией, что увеличивает скорость реакции. Сначала растворите сахар в горячем чае, а затем добавьте лед.
Температурная зависимость | Протокол
Химическая кинетика
Скорость реакции — это скорость, с которой происходит химическая реакция.Скорость реакции определяется как изменение концентрации компонента в реакции во времени. Скорость реакции зависит от нескольких факторов, включая концентрацию реагентов и температуру, при которой проводится реакция. Каждый реагент влияет на скорость реакции определенным фактором. Эта связь определяется законом скорости реакции.
Закон о тарифах
Закон скорости — это уравнение, которое описывает взаимосвязь между концентрацией реагентов, A и B, и порядком их реакции, m и n.Константа скорости k связывает концентрации и порядки реагентов со скоростью реакции. Это зависит от реакции как от температуры, при которой происходит реакция.
r = k [A] m [B] n для aA + bB → cC
Уравнение Аррениуса
Уравнение Аррениуса связывает константу скорости реакции с энергией активации химической реакции. Энергия активации определяется как количество энергии, необходимое для протекания химической реакции.Если реакция не удовлетворяет этой потребности в энергии активации, реакция не будет продолжаться.
Отрицательная экспоненциальная зависимость между k и температурой указывает на то, что с увеличением температуры значение k также увеличивается. Поскольку константа скорости может быть определена экспериментально в широком диапазоне температур, энергия активации может быть рассчитана с использованием уравнения Аррениуса. После натурального логарифма обеих частей уравнение Аррениуса переписывается как линейное уравнение.
График зависимости ln k от 1 / T дает прямую линию с наклоном, равным -E a / R, и пересечением по оси y ln A. Поскольку постоянная идеального газа R известна, E a можно определить графически, используя серию значений k при различных температурах.
Катализаторы и энергия активации
Некоторые химические реакции имеют достаточно большую энергию активации, что заставляет реакцию протекать медленно или вообще. Реакция разложения перекиси водорода на кислород и воду происходит самопроизвольно, но с невероятно медленной скоростью.Один из способов преодоления этого начального барьера — подача энергии в виде тепла. Однако это не всегда идеально, поскольку чрезмерное нагревание может повлиять на стабильность продуктов или реагентов или может способствовать побочным реакциям.
Энергия активации химических реакций может быть изменена с помощью катализаторов. Катализатор снижает энергию активации химической реакции, но не расходуется на нее.
