Содержание
Щелочи: понятие, свойства и применение
Щелочи — это водорастворимые сильные основания. В настоящее время в химии принята теория Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В соответствии с этой теорией, кислоты — это вещества, способные отщеплять протон, а основания — отдавать электронную пару OH−. Можно сказать, что под основаниями понимают соединения, которые при диссоциации в воде образуют только анионы вида OH−. Если совсем просто, то щелочами называют соединения, состоящие из металла и гидроксид-иона OH−.
К щелочам принято относить гидроксиды щелочных и щелочно-земельных металлов.
Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами.
Правильное химическое название щелочей — гидроксид (гидроокись), например, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые сложились исторически. Ввиду того, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их называют едкими: например, едкий натр, едкий барий.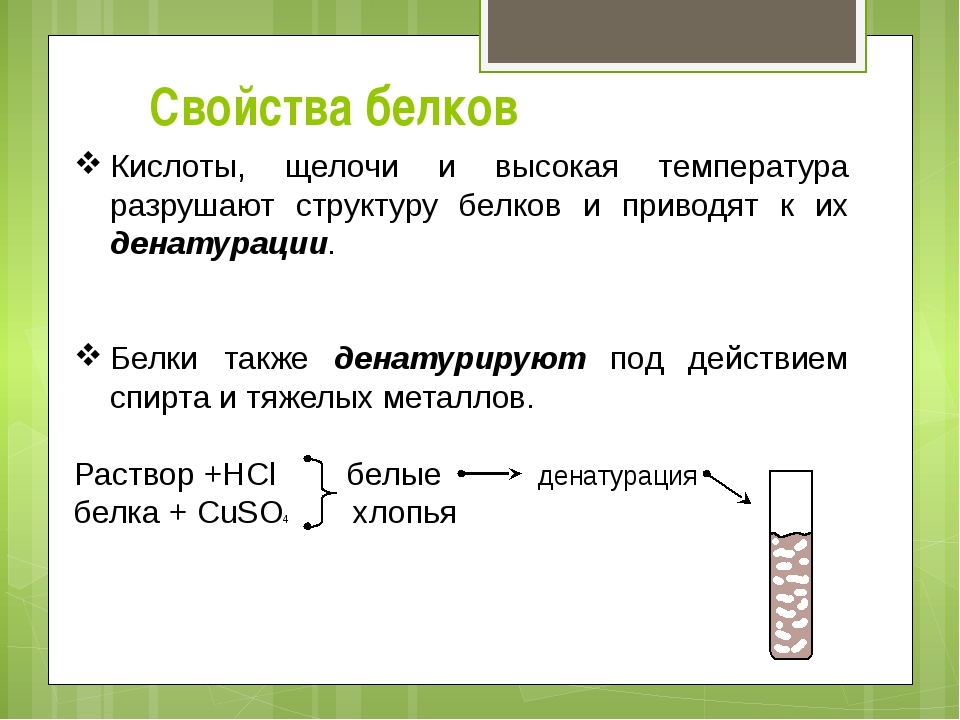 Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).
Щелочи — активные химические реагенты, поглощающие из воздуха не только водяные пары, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота. Поэтому хранить гидроксиды следует в герметичной таре или, например, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку. В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.
Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
В магазине «ПраймКемикалсГрупп» вы найдете самые востребованные щелочи по выгодным ценам.
Едкий натр
Самая популярная и востребованная в мире щелочь.
Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали
Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия
Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция
Популярная щелочь с очень широким спектром применения, которую в быту знают под названием «гашеная известь». Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Гидроокись лития
Востребованное соединение в химпроме как сырье; в стекольной, керамической, радиотехнической индустрии; для производства смазочных материалов, электролитов; для поглощения вредных газов.
Гидроокись бария
Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
В аналитической химии применяются фиксаналы щелочей, которые можно купить у нас:
— стандарт-титр Натрий гидроокись (Натрий гидроксид) 0,1 H
— стандарт-титр Калий гидроокись (Калий гидроксид) 0,1 Н
Щелочь – свойства и применение в мыловарении
Думаю, Вам уже известно, что мыло – это продукт реакции щелочи и животных жиров или масел. Мы позиционируем мыло ручной работы как 100% натуральное, но, как это возможно, учитывая, что изготавливаем мы его с использованием «химической» щелочи?
Те, кто знаком с историей мыловарения, слышали, что раньше мыло получали, смешивая животные или растительные жиры со щелоком, в свою очередь полученным из золы. В таком случае вопрос снимается, но неужели и в наши дни щелочь делают из древесной золы?
В таком случае вопрос снимается, но неужели и в наши дни щелочь делают из древесной золы?
Нет, но оказывается, что сырье для производства щелочей не менее натурально. Гидроокись калия получают из хлорида калия, который встречается в природе в виде минералов, а натрия гидроокись изготавливается путем электролиза хорошо нам знакомой поваренной соли (хлорида натрия).
Итак, несмотря на то, что в его составе присутствует щелочь, мыло с нуля действительно натуральный продукт. Однако у многих начинающих мыловаров все равно остаются вопросы о щелочи. Какую именно использовать? Чем они различаются? Что за странные аббревиатуры ХЧ и ЧДА?
Давайте попробуем вместе разобраться.
Не так давно ко мне на мастер-класс случайно попали две девочки-школьницы. И они задали вопрос, который, если честно, на некоторое время поставил меня в тупик: «А что же такое щелочь?».
Конечно, мы все можем прочитать в Википедии, что к щелочам относятся хорошо растворимые в воде гидроксиды щелочных и щелочноземельных металлов, но я попробую сформулировать более простое, пусть и не совсем научное определение:
Щелочи – это очень едкие вещества, обладающие высокой реакционной способностью.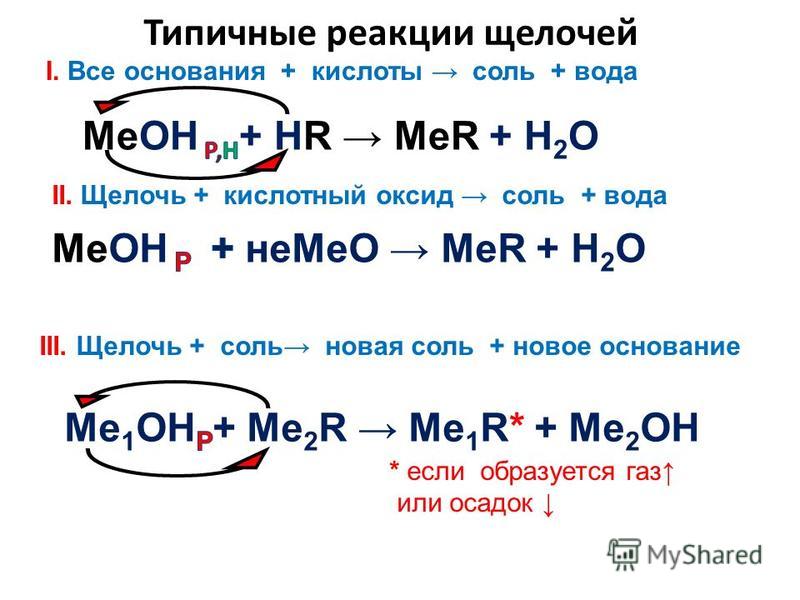 Положите в концентрированный щелочной раствор шерстяные нитки, немного подождите и перемешайте – они растворятся! При взаимодействии со щелочью разрушаются многие вещества. Мыловарам иногда это бывает на руку, например, в щелочном растворе погибают все бактерии, но, с другой стороны, большая часть добавок также теряет свои полезные свойства.
Положите в концентрированный щелочной раствор шерстяные нитки, немного подождите и перемешайте – они растворятся! При взаимодействии со щелочью разрушаются многие вещества. Мыловарам иногда это бывает на руку, например, в щелочном растворе погибают все бактерии, но, с другой стороны, большая часть добавок также теряет свои полезные свойства.
Есть довольно много разных щелочей, но нас с Вами будут интересовать только две из них: КОН и NaOH.
КОН также называют гидроокисью калия, каустическим поташем, едким кали. Химическое «имя» NaOH – натрий гидроокись, кроме этого он также известен как едкий натр или каустическая сода.
Многие химические вещества, получаемые в промышленности, содержат примеси и бывают разной степени очистки. Для создания мыла с нуля щелочи могут быть двух степеней очистки: химически чистыми (ХЧ) и чистыми для анализа (ЧДА). КОН чаще всего встречается ХЧ, гидроокись натрия купить можно обоих видов. Если у Вас есть выбор, то рекомендую взять ХЧ, в ней крупинки одинакового размера, их будет проще растворить. Внешне такая щелочь похожа на сахар. В ЧДА встречаются как более крупные кусочки, так и совсем мелкая пыль.
Из КОН делают жидкое мыло. Его особенность заключается в том, что оно не усыхает со временем, кроме этого КОН используется для изготовления «калийной пасты», которая лежит в основе рецептов «бельди» и скрабов.
В свою очередь, для твердого мыла используется гидроокись натрия.
Купить щелочь сейчас не составляет труда, но не спешите сразу варить мыло, сначала как следует изучите теоретические основы, в том числе обязательно ознакомьтесь с техникой безопасности при работе со щелочью.
Я знаю многих мыловаров, которые делают исключительно мыло из основы, так как боятся работать со щелочью. Мыло с нуля, конечно, далеко не самое безопасное хобби, но, хорошо изучив теорию и купив необходимые средства защиты, Вы сведете все риски к нулю.
Успехов Вам в мылотворчестве!
автор: Наталия Вербена
У нас вы можете купить:
Обновлено: 23 апреля 2019
Это интересно:
Понравилось? Поделись с друзьями:
Щёлочи — РЕАХИМПРИБОР
Щёлочи
Щёлочи — гидроксиды щелочных, щёлочноземельных металлов и некоторых других элементов, например, таллия.
К щелочам относятся хорошо растворимые в воде основания.
При диссоциации щёлочи образуют анионы OH− и катион металла.
К щелочам относятся гидроксиды металлов подгрупп Iа и IIа (начиная с кальция) периодической системы, например NaOH (едкий натр), KOH (едкий калий), Ba(OH)2 (едкий барий).
В качестве исключения можно отнести к щелочам гидроксид одновалентного таллия TlOH, который хорошо растворим в воде и является сильным основанием.
Едкие щёлочи — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH и цезия CsOH. Название «едкая щёлочь» обусловлено свойством разъедать кожу и слизистые оболочки, вызывая сильные ожоги, бумагу и другие органические вещества.
Из-за очень большой химической активности щёлочных металлов едкие щёлочи долгое время не удавалось разложить и они потому считались простыми веществами.
Физические свойства Щелочи:
Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твёрдые, белые, очень гигроскопичные вещества. Щёлочи — сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением.
Щёлочи — сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением.
Сила основания и растворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Самые сильные щёлочи — гидроксид цезия (поскольку из-за очень малого периода полураспада гидроксид франция не получен в макроскопических количествах) в группе Ia и гидроксид радия в группе IIa. Кроме того, едкие щёлочи растворимы в этаноле и метаноле.
Химические свойства Щелочи:
Щёлочи проявляют основные свойства.
В твёрдом состоянии все щёлочи поглощают h3O из воздуха, а также CO2 (также и в состоянии раствора) из воздуха, постепенно превращаясь в карбонаты.
Щёлочи, как основания, взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации).
Это одно из самых важных химических свойств щелочей.
Щёлочь + Кислота → Соль + Вода
Щёлочи взаимодействуют с кислотными оксидами с образованием соли и воды:
Щёлочь + Кислотный оксид → Соль + Вода
Щёлочи широко применяются в различных производствах и медицине; также для дезинфекции прудов в рыбоводстве и как удобрение, в качестве электролита для щелочных аккумуляторов.
Водные растворы щелочей изменяют окраску индикаторов.
Метиловый фиолетовый — Зелёный
Крезоловый красный — Жёлтый
Метиловый фиолетовый — Синий
Тимоловый синий — Жёлтый
Тропеолин — Жёлтый
Метиловый фиолетовый — Фиолетовый
(Ди)метиловый жёлтый — Жёлтый
Бромфеноловый синий — Сине-фиолетовый
Конго красный — Синий
Метиловый оранжевый — Оранжево — жёлтый
Бромкрезоловый зелёный — Синий
Бромкрезоловый синий — Синий
Лакмоид — Синий
Метиловый красный — Жёлтый
Хлорфеноловый красный — Красный
Лакмус (азолитмин) — Синий
Бромкрезоловый пурпурный — Ярко-красный
Бромтимоловый синий — Синий
Нейтральный красный — Янтарно-жёлтый
Феноловый красный — Ярко-красный
Крезоловый красный — Тёмно-красный
α-Нафтолфталеин — Синий
Тимоловый синий — Синий
Фенолфталеин — Малиново-красный
Тимолфталеин — Синий
Ализариновый жёлтый — Коричнево-жёлтый
Нильский голубой — Красный
Диазофиолетовый — Фиолетовый
Индигокармин — Жёлтый
Epsilon Blue — Тёмно-фиолетовый
Хромовый Тёмно синий — Синий
«Основания.
 Физические и химические свойства щелочей , их получение».
Физические и химические свойства щелочей , их получение».
Урок «Основания. Физические и химические свойства щелочей ,
их получение.»
Задачи урока: -систематизировать смысл названий и состав сложных веществ;
-сформировать знания учащихся о составе оснований, валентности гидроксогруппы, физических и химических свойств щелочей, их получении;
-развивать умения учащихся сравнивать вещества выделять общие черты в составе и свойствах оснований.
Цели урока: -развитие умений характеризовать состав оснований по формулам и отличать их от других сложных веществ;
-отработка правильности составления и записи уравнений химических реакций, в том числе реакции нейтрализации;
-формирование навыков аккуратной работы с химическими веществами согласно правилам ТБ.
Оборудование и реактивы: на каждой парте NaOH сухой в пробирке, стакан с дистиллированной водой, лакмус, фенолфталеин, метилоранж, стеклянные палочки.
Ход урока:
Эпиграфом к уроку я хотела бы привести слова: «Все предметы бессмертной природы лишены смысла, пока их не познали смертные и не возлюбили земной любовью.» С. Цвейг (2 слайд)
Актуализация ранее полученных знаний – беседа по вопросам с презентации:
— Что такое гидроксиды и как их классифицируют?
— С помощью чего можно распознать кислоту и основание?
(наглядная демонстрация – слайды 5 и 6)
-Как определить кислоту по составу?
-Чему равна валентность кислотного остатка?
(наглядная демонстрация – слайд 9)
— С чем взаимодействует кислота и какого типа эти реакции?
2. Самостоятельная работа с самопроверкой: (слайд 11 и 12) ((
Выберите из списка вещества, взаимодействующие с кислотами и напишите уравнения реакций с НСl, укажите тип реакции.
Al, SO3, ZnO, C, HBr, h3O
Выберите из списка вещества, взаимодействующие с кислотами и напишите уравнения реакций с Н2SO4, укажите тип реакции.
MgO, h3O, P, Zn, SO2, HCl
Объяснение новой темы:
— Приведите примеры оснований?
— Что общего в этих формулах?
(наглядная демонстрация – слайд 14,16,17)
Учащиеся делают выводы, что общее – это атомы металлов и группа -ОН. Учитель вводит понятие гидроксильной группы и её валентности, дают вместе определениие основаниям.
ОСНОВАНИЯ — это сложные вещества, в состав которых входят атомы металлов, связанные с одной или несколькими гидроксильными группами ОН- . (слайд 17)
Общая формула оснований — Me (OH)n (слайд 18)
— Как можно классифицировать основания?
(находят в таблице растворимости и делят по растворимости, классифицируют с примерами) (слайд 20)
Основания нерастворимые
растворимые
Рассматривают и записывают физические свойства оснований ( слайды 21-23)
Химические свойства изучают, выполняя лабораторные опыты. В выданную пробирку с сухой щелочью учащиеся наливают воду, размешивают стеклянной палочкой, убеждаются, что щелочи хорошо растворимы в воде, затем разливают ещё в две пробирки и в каждую из трёх пробирок добавляют по очереди индикаторы, записывают наблюдаемые изменения, затем добавляют кислоту. Видят реакцию с изменением цвета индикатора. Вводится понятие реакции нейтрализации, записывают уравнение реакции с кислотой, с кислотными оксидами.
В выданную пробирку с сухой щелочью учащиеся наливают воду, размешивают стеклянной палочкой, убеждаются, что щелочи хорошо растворимы в воде, затем разливают ещё в две пробирки и в каждую из трёх пробирок добавляют по очереди индикаторы, записывают наблюдаемые изменения, затем добавляют кислоту. Видят реакцию с изменением цвета индикатора. Вводится понятие реакции нейтрализации, записывают уравнение реакции с кислотой, с кислотными оксидами.
Реакция нейтрализации – это взаимодействие между кислотами с образованием соли и воды и основаниями. (слайды 25)
Изучаются способы получения оснований с записью уравнений реакций:
1. активный металл с водой
2Na + 2H 2O = 2NaOH + h3
2. основный оксид с водой
CaO + h3O = Ca(OH)2
3. соль с щелочью
CuCl2 + 2KOH = Cu(OH)2 + 2KCl (слайд 26)
Рефлексия изученного на уроке материала — дополнение подходящими по смыслу словами в стихах: (слайды 27)
Очень страшные подчас
Разъедают кожу рук
И их ………. зовут.
зовут.
Осторожность соблюдаем
И состав знаком нам ваш
Из ……….. и ……….
Значит …………. звать тебя
А найти нам вас нам помогут
……………….. цвета.
…………………. кличут их тут.
Получить такой мы можем
Если щелочь с …………. сложим.
С ……….. средой они дружат
играя.
И основание плюс кислота
………….. окажется,значит,
среда.
Полный вариант:
Очень страшные подчас
Разъедают кожу рук
И их едкими зовут
Осторожность соблюдаем
И состав знаком нам ваш
Из металлов и ОН
Значит щелочь звать тебя
А найти нам вас нам помогут
Индикаторов цвета.
Нерастворимыми кличут их
тут.
Получить такой мы можем
Если щелочь с солью сложим.
щелочная
С кислотной средой они
дружат играя.
И основание плюс кислота
Нейтральной окажется,
значит, среда.
Домашнее задание: § 18 (стр.
 91-94) воп. 3, 5(а,б)
91-94) воп. 3, 5(а,б)
Свойства щелочей с точки зрения ТЭД
Урок «Свойства щелочей с точки зрения ТЭД»
Казанцева Евгения Андреевна
учитель химии МОУ школы №12
г.о. Жуковский Московской области
Что такое щелочи?
- Щелочи — растворимые в воде основания.
- Щелочи – это электролиты, диссоциирующие в водных растворах на катионы металла и гидроксид- анионы.
Химические свойства щелочей:
1). Изменяют цвет индикаторов, так как в водных растворах диссоциируют на ионы :
NaOH→
NaOH→ Na⁺ + OH⁻
Ca(OH)₂ →
Ca(OH)₂ → Ca²⁺ + 2OH⁻
Лакмус→синий
Фенолфталеин→малиновый
Метилоранж→желтый
2).Взаимодействуют с кислотами
NaOH + H₃PO₄ →
3NaOH + H₃PO₄ → Na₃ PO₄ + 3H₂O
3Na⁺+ 3OH⁻ + 3H⁺ + PO₄³⁻→ 3Na⁺+ PO₄³⁻+ 3H₂O
OH⁻ + H⁺ → H₂O
Реакции между кислотами и основаниями с образованием соли и воды называются реакциями нейтрализации.
3).Щелочи взаимодействуют с кислотными оксидами:
Ca(OH)₂ + N₂O₅ →
Ca(OH)₂ + N₂O₅ → Ca(NO₃)₂ + H₂O
Ca²⁺ + 2OH⁻+ N₂O₅ → Ca²⁺ + 2NO₃⁻ + H₂O
2OH⁻+ N₂O₅ → 2NO₃⁻ + H₂O
Взаимодействие известковой воды с углекислым газом – качественная реакция на углекислый газ
Ca(OH)₂ + СO₂ →
Ca(OH)₂ + СO₂ → CaСO₃↓ + H₂O
Ca²⁺ + 2OH⁻+ СO₂ → CaСO₃↓ + H₂O
4). Щелочи взаимодействуют с растворимыми солями, если образуется осадок:
KOH + Fe₂(SO₄)₃ →
6KOH + Fe₂(SO₄)₃ →2Fe(OH)₃ ↓+ 3K₂SO₄
6K⁺ + 6OH⁻ + 2Fe³⁺ + 3SO₄²⁻→2Fe(OH)₃ ↓+ 6K⁺ + 3SO₄²⁻
6OH⁻ + 2Fe³⁺ →2Fe(OH)₃ ↓
3OH⁻ + Fe³⁺ →Fe(OH)₃ ↓
Вывод:
общие свойства щелочей обусловлены присутствием в их растворах гидроксид- анионов ОН⁻.
Нейтрализация щелочи, щелочных вод и стоков
Завод водоочистного оборудования ООО «ПЗГО» приветствует всех на странице своего официального сайта, посвященной такой теме как нейтрализация щелочи, щелочных стоков и вод в промышленном масштабе.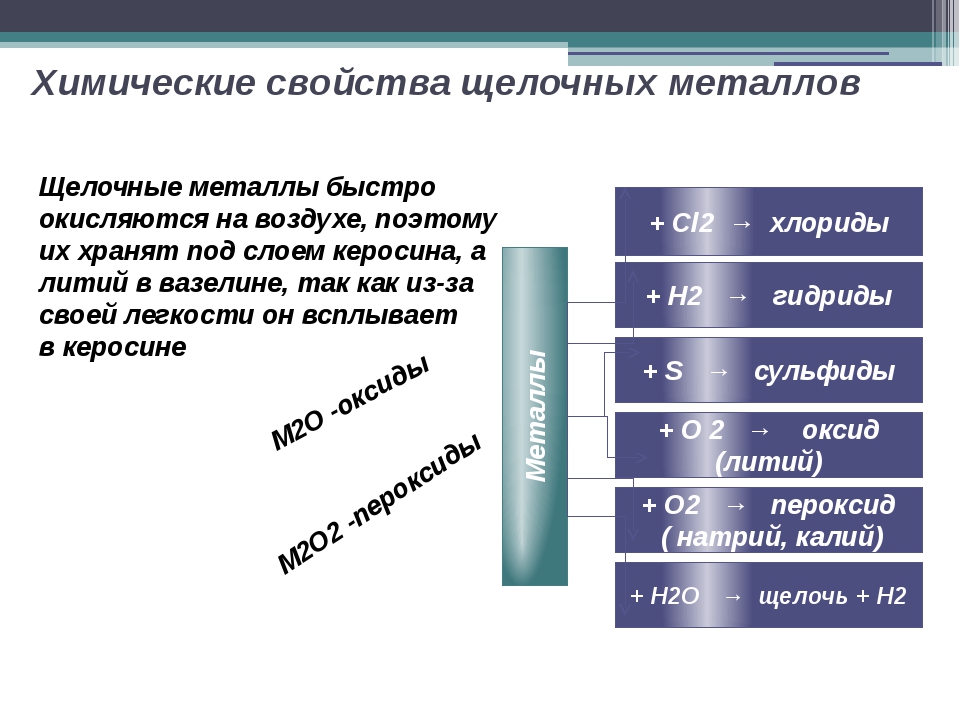
Прежде чем перейти к теоретической части вопроса, хотелось бы обратить Ваше внимание на наши собственные недорогие, компактные и высокоэффективные очистные станции модельного ряда «ШВ», изготавливаемые по уникальным патентам и собственным многолетним наработкам.
Строго учитываем все аспекты Заказа: объем, агрессивность и концентрацию очищаемой среды, пространственное размещение станций, а также экономическую подоплеку Вашего производственного предприятия.
Для запроса цены или обсуждения тонкостей Вашего Заказа на систему очистки щелочных или кислых стоков, пожалуйста, контактируйте с Клиентским отделом ООО «ПЗГО» любым удобным способом или воспользуйтесь кнопкой ниже, и мы свяжемся с Вами в течение 1 часа рабочего дня.
Осведомиться о стоимости или заказать проектирование
Химические и физические свойства щелочей и их растворов
Щелочи, с химической точки зрения, представляют собой гидроксиды щелочных и щелочноземельных металлов (группы в периодической таблице – Ia и IIa). К таким металлам относятся натрий (образует каустическую соду), калий (едкое кали), барий (едкий барий), бериллий, стронций, унбинилий, литий, цезий, франций. Все щелочные растворы проявляют основные свойства, но не наоборот.
К таким металлам относятся натрий (образует каустическую соду), калий (едкое кали), барий (едкий барий), бериллий, стронций, унбинилий, литий, цезий, франций. Все щелочные растворы проявляют основные свойства, но не наоборот.
Одним из самых важных химических свойств оснований является активное вступление в реакцию с кислотами – реакция нейтрализации, ведущая к ассоциативному образованию солей и воды. Эта особенность широко используется при проектировании оборудования для нейтрализации промышленных выбросов.
Последствия, вызванные индустриальными стоками
Самая агрессивная щелочь – гидроксид цезия. Этот гидроксид более чем в 10 раз сильнее гидроокиси натрия или калия. Используется, в основном, лабораторно, но иногда – в качестве присадки для аккумуляторных электролитов.
Физически, эти соединения – твёрдые белые порошки (кристаллы), имеющие предельный коэффициент гигроскопичности, интенсивно поглощающие из воздуха воду, углекислый газ, а также другие газы и жидкости. Имеют высокий показатель растворимости в воде, что также берется в расчет при проектировании станций очистки стоков.
Имеют высокий показатель растворимости в воде, что также берется в расчет при проектировании станций очистки стоков.
Кристалы едкого натра
Гигроскопичностью и экстремальной биологической опасностью алкалинов продиктованы крайне осторожные меры обращения с этими соединениями: щелочные ожоги кожи и дыхательных путей в значительной мере превосходят повреждения, полученные при равных обстоятельствах от кислоты.
В случае попадания гидроокиси на кожу, следует немедленно обезвредить ее разбавленным столовым уксусом – в крайнем случае – водой – и сразу обратиться к врачу.
Щелочные сливы предприятий
В очистке или нейтрализации стоков основного свойства нуждаются множественные производственные и обрабатывающие предприятия, а также лаборатории – независимые или прикрепленные к тому или иному предприятию. Рассмотрим основные направления.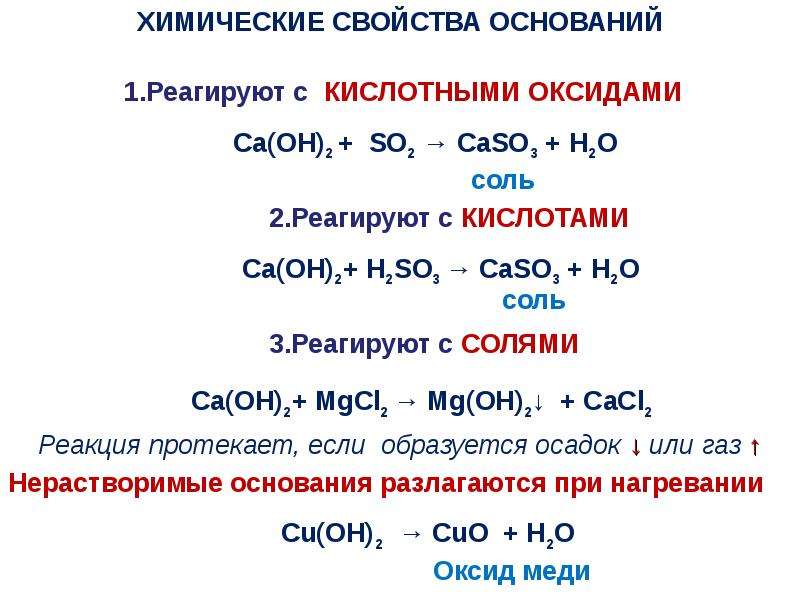
-
Участки с установленным газоочистным оборудованием реагентного типа (скрубберы, абсорберы, газопромыватели). Аппараты мокрой газоочистки нередко имеют в виде побочного продукта слабые щелочные шламы, прямой слив которых в канализацию – в силу различных причин – нежелателен или запрещен.
- Гальванические цеха, процессы хромирования, никелирования, оцинкования. Жидкости со свойствами оснований используются в качестве электролита в гальванических ваннах.
-
Производство удобрений в аграрной промышленности.
- В нефтегазовой отрасли используется для подготовки высокосернистой нефти. Закачивают щелок и при нефтедобыче для увеличения отдачи нефтяных пластов.
-
Молочные, мясные хозяйства.
- Изготовление моющих средств, мыловарение.
-
Производство искусственных тканей, например, шелка.
- Фабрики строительных смесей: портланд-цемент, гипс, известь, алебастр.

-
Биологическая стерилизация прудов и других водоемов промышленного назначения.
- Широко применение и в химии, медицине, фармацевтике.
Стоит заметить, что проблемой утилизации сточных сливов обеспокоены не только те компании, которые используют сами щелочи, но, как правило, и те, в чьих технологических циклах участвуют калий, натрий, магний, кальций, стронций, барий, бериллий, литий, цезий.
Методы и способы нейтрализации щелочи
Основным водоочистным методом в промышленности является нейтрализация щелочи кислотой. Наш завод предлагает к расчету, изготовлению и продаже установки, реализующие нижеследующий метод очистки.
Реакция с кислотой
В основной бак установки заливается щелочной раствор. Система автоматически детектирует его концентрацию и через насос-дозатор подает в реактор необходимое количество кислого раствора, (состав которого зависит от очищаемой среды: азотная, серная, соляная и другие кислоты).
Принципиальная схема станции нейтрализации стоков. 1, 2 – резервуары для реагентов, 3 – главный бак-реактор, 4 – усреднитель (отстойник)
После это включается механическая мешалка, работа которой способствует более продолжительному контакту реагентов и более полному протеканию реакции. Параллельно с этим, в режиме онлайн, pH-датчиками идет сверка текущих показаний с заданными параметрами.
По достижении требуемого уровня pH мешалка выключается и включается центробежный насос, который сливает прореагировавший раствор в канализационную магистраль. Объем бака и реагента прямо зависит от потребностей Заказчика. Помимо прочего, установка может быть оснащена дополнительными емкостями для буферного хранения агентов, очищаемых или очищенных жидкостных масс.
Комплекс водоподготовки для промышленных сливов предприятий
Очистка щелочи углекислым газом
Второй по распространенности метод алкалиновой нейтрализации – насыщение раствора углекислотой – в жидком или газообразном состоянии.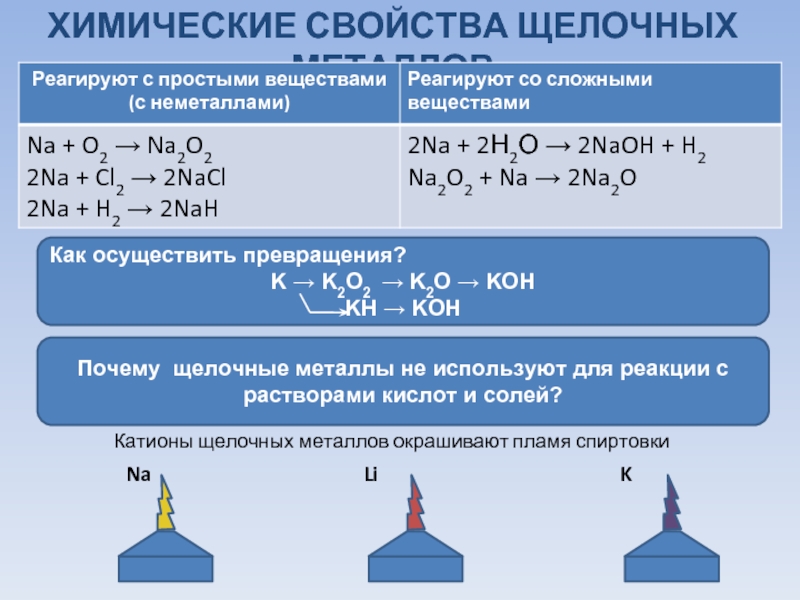
Углекислотная установка водоочистки: основными элементами здесь являются бак-нейтрализатор и баллоны с CO2
В принципе, если взглянуть на этот подход более детально, то можно увидеть, что он также задействует технологию кислотного очищения: подающийся в сток углекислый газ, взаимодействуя с водой, «на лету» образует слабую угольную кислоту – именно она и нейтрализует щелочь.
Озонирование
В дополнение к двум вышеперечисленным методам стоит добавить озонирование – самый сложный и трудозатратный вариант нейтрализации щелочи. Чаще всего озонирование применяется для биологической ректификации воды и только там, где это действительно оправдано: уничтожение опасных микробов, бактерий, плесени, грибков, очищение стоков от нефтепродуктов, цианидов, ароматических углеводородов. Вдобавок, озонаторы имеют немалую стоимость, а ядовитость озона – I класс опасности – представляет опасность и для человека.
Индустриальные озонаторы
Ограниченно озонирование воды для достижения требуемого уровня pH применяется в рыбных хозяйствах (фермах), а также в больших аквариумах, океанариумах.
Кстати, трехатомный кислород (озон) в естественной среде существует всего от нескольких до нескольких десятков минут, после чего распадается на O2 с отрицательным изменением энтальпии ΔH (экзотермическая реакция).
Сводная таблица эффективности методов нейтрализации щелочи
| Способ | Плюсы | Особенности |
| Кислотный |
Рейтинг ☆☆☆☆☆
| Требуется периодическое обслуживание системы. |
| Универсальность, высокая эффективность и производительность, низкая стоимость установок, компактность, простота размещения, мобильность, широкий выбор кислых реагентов для достижения максимальной эффективности очищения любых щелочных стоков. Низкие эксплуатационные траты. | ||
| CO2 |
Рейтинг ☆☆☆
| Требуется дополнительное оборудование для хранения газообразной или твердой углекислоты. Относительно высокая сложность систем водоочистки. Относительно высокая сложность систем водоочистки. |
| Исключение возможности перенасыщения кислотой и смещения показателя pH в красную зону шкалы. | ||
| Озонирование |
Рейтинг ☆☆
| Требуется тщательный контроль установок в силу высокой опасности озона. Реакции идут с большим выходом тепла, может потребоваться теплоотвод. |
| Высокая степень тонкой очистки, которая также включает в себя биологическое уничтожение вредных микроорганизмов. |
Заказ, покупка, доставка и монтаж установок щелочной нейтрализации
По любым вопросам, касающимся индивидуального проектирования, изготовления и недорогого приобретения современных и эффективных промышленных систем очистки стоков, пожалуйста, контактируйте с нашим заводом удобным Вам способом.
Осуществим быструю и аккуратную доставку оборудования по России, СНГ или странам Зарубежья. При необходимости проведем профессиональный монтаж или шефмонтаж «под ключ».
При необходимости проведем профессиональный монтаж или шефмонтаж «под ключ».
Полный комплект документации: схемы, чертежи, паспорта, сертификаты. Гарантия на станции и выполненные работы.
Урок №45. Химические свойства оснований. Реакция нейтрализации. Окраска индикаторов в щелочной и нейтральной средах. Применение оснований
ФИЗИЧЕСКИЕ
СВОЙСТВА
Большинство оснований – твёрдые вещества с различной
растворимостью в воде.
Гидроксид кальция (известковая вода)
Гидроксид кальция (известковое молоко)
Гидроксид кальция (кристаллический)
Гидроксид натрия (кристаллический)
ХИМИЧЕСКИЕ
СВОЙСТВА ЩЕЛОЧЕЙ
1). Изменяют окраску
индикаторов
Название индикатора | Нейтральная среда(OH=H) | Щелочная среда (OH>H) |
Лакмус | Фиолетовый | Синий |
Фенолфталеин | Бесцветный | Малиновый |
Метилоранж | Оранжевый | Жёлтый |
Универсальная | Оранжевая | Синяя |
Рис. Из коллекции ЦОР
Из коллекции ЦОР
Действие щелочей на индикаторы
Распознавание растворов щёлочи, воды, кислоты при помощи индикатора
2) Взаимодействие с
кислотными оксидами
Щёлочь + Кислотный |
—реакция обмена
2KOH + CO2 = K2CO3 +
H2O
Ca(OH)2 + CO2 = CaCO3
+ H2O
3) Взаимодействие с
кислотами
—реакция обмена
(нейтрализация)
Ca(OH)2 + 2HNO3 = Ca(NO3)2
+ 2H2O
Тренажёр «Реакция нейтрализации»
Видео «Реакция нейтрализации»
4) С растворами солей,
если в результате образуется осадок
Соль (раствор) + |
-реакция
обмена
FeCI3
+ 3NaOH
= Fe(OH)3↓ + 3NaCl
ХИМИЧЕСКИЕ
СВОЙСТВА НЕРАСТВОРИМЫХ ОСНОВАНИЙ
1) С кислотами
— реакция обмена
Нерастворимое основание + Кислота = Соль + |
2) Разлагаются при
нагревании
Нерастворимое основание = MxOy + |
—реакция разложения
Cu(OH)2 = CuO + H2O или 2Fe(OH)3 = Fe2O3
+3H2O
Внимание!
Валентность металла в оксиде и соответствующем гидроксиде одинаковая.
Применение оснований
Основания используются
при производстве моющих средств, мыла, шампуней. Именно щелочная среда создает
эффект мылкости, растворяет жир и смывает грязь. При побелке потолков, стен и
стволов деревьев по весне используют гашеную известь, которая тоже является основанием.
На основе нерастворимых в воде оснований изготавливают малярные и
художественные краски. Щелочные батарейки мы используем как источник питания. И
наконец, нашатырный спирт и ржавчина тоже являются основаниями.
NaOH – едкий натр,
каустическая сода
Легкоплавкие (tпл = 320
°С) белые гигроскопичные кристаллы и поэтому расплывающиеся в воздухе; хорошо
растворимы в воде. Раствор мылкий на ощупь и является опасной едкой жидкостью,
так как разъедает кожу, ткани, бумагу и другие материалы.
NaOH – один из важнейших продуктов химической промышленности. В больших
количествах требуется для очистки нефтепродуктов, широко применяется в
мыловаренной, бумажной, текстильной и других отраслях промышленности, а также
для производства искусственного волокна.
КОН – едкое кали,
каустический поташ
Белые гигроскопичные
кристаллы, хорошо растворимы в воде. Раствор мылкий на ощупь и является опасной
едкой жидкостью. Свойства КОН аналогичны свойствам NaOH, но применяется
гидроксид калия гораздо реже ввиду его более высокой стоимости.
Применяют его в качестве добавки при производстве мыла, тугоплавкого стекла.
Са(ОН)2 –
гашеная известь, белильная известь
Рыхлый белый порошок, малорастворимый
в воде. Получается при взаимодействии негашёной извести СаО с водой. Этот
процесс называют гашением. Прозрачный раствор называется «известковой водой»,
суспензия – «известковым молоком». Известковая вода применяется для
распознавания углекислого газа, она мутнеет при пропускании СO2.
Гидроксид кальция применяют в строительстве при кладке и штукатурке стен, для
побелки деревьев, для получения хлорной извести – дезинфицирующего средства.
Ba(OH)2 —
едкий барит
Белые гигроскопичные
кристаллы. Насыщенный водный раствор гидроксида бария называется баритовой
водой. Гидроксид бария применяют в виде баритовой воды как реактив на SO42- (сульфат)
и СО32- (карбонат) ионы, для очистки растительных масел и
животных жиров, как компонент смазок, для удаления сульфат-ионов из
промышленных растворов.
NH4OH⇄NH3*H2O –
аммиачная вода, едкий аммоний, едкий аммиак
Представляет собой
водный раствор аммиака, в которых он преимущественно в форме гидроксида аммония
NH4+.
Аммиачная вода применяется для получения азотных удобрений, в производстве
соды, красителей. Слабый (обычно 10%) раствор – нашатырный спирт, который
широко применяется в медицине.
Тренажёр «Свойства гидроксида натрия»
Видео «Химические свойства оснований»
металлов | Безграничная химия
Щелочные металлы
Щелочные металлы — это химические элементы из s-блока периодической таблицы. Они обладают гомологичными физическими и химическими свойствами.
Цели обучения
Вспомните периодические тенденции, наблюдаемые в щелочных металлах.
Основные выводы
Ключевые моменты
- Щелочные металлы — это группа химических элементов из s-блока периодической таблицы со схожими свойствами: они кажутся серебристыми, и их можно разрезать пластиковым ножом.
- Щелочные металлы обладают высокой реакционной способностью при стандартной температуре и давлении и легко теряют свой внешний электрон с образованием катионов с зарядом +1.
- Все обнаруженные щелочные металлы встречаются в природе.
- Большинство щелочных металлов находят множество различных применений, таких как атомные часы рубидия и цезия, натриевые лампы и поваренная соль.
Ключевые термины
- щелок : Сильный едкий щелочной раствор солей калия или натрия, полученный выщелачиванием древесной золы.Он широко используется в производстве мыла, а также в биодизеле.
- щелочной металл : Любой из мягких, легких, химически активных металлов 1-й группы периодической таблицы Менделеева; литий, натрий, калий, рубидий, цезий и франций.
- атомные часы цезия : основной стандарт частоты, в котором электронные переходы между двумя сверхтонкими основными состояниями атомов цезия-133 используются для управления выходной частотой.
Щелочные металлы — это группа химических элементов в периодической таблице со следующими физическими и химическими свойствами:
- блестящий
- мягкий
- серебристый
- высокая реактивность при стандартной температуре и давлении
- легко теряют свой крайний электрон, образуя катионы с зарядом +1
Все они легко режутся пластиковым ножом благодаря своей мягкости, а их блестящая поверхность быстро тускнеет на воздухе из-за окисления.Из-за их высокой реакционной способности щелочные металлы должны храниться под маслом, чтобы предотвратить реакцию с воздухом. В современной номенклатуре ИЮПАК щелочные металлы включают элементы группы 1, за исключением водорода. Все щелочные металлы реагируют с водой, причем более тяжелые щелочные металлы реагируют более энергично, чем более легкие.
Щелочные металлы : Литий хранится в масле из-за его высокой реакционной способности.
Периодические тенденции щелочных металлов
Щелочные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).Эта группа находится в s-блоке периодической таблицы, поскольку у всех щелочных металлов крайний электрон находится на s-орбитали. Щелочные металлы представляют собой лучший пример групповых тенденций в свойствах в периодической таблице с элементами, демонстрирующими аналогичные свойства. Например, при движении вниз по таблице все известные щелочные металлы показывают:
- увеличение атомного радиуса,
- уменьшение электроотрицательности
- повышение реактивности
- понижение температуры плавления и кипения
Как правило, их плотность увеличивается при движении вниз по столу, за исключением калия, который менее плотен, чем натрий.
Реакции щелочных металлов
Щелочные металлы бурно реагируют с водой, галогенами и кислотами. В результате реакции выделяется удивительное количество тепла и света. В химическом уравнении щелочные металлы представлены буквой M. Вот несколько примеров уравнений реакции:
- Щелочные металлы реагируют с кислородом с образованием оксидов, которые имеют более тусклый вид и более низкую реакционную способность. Оксиды гораздо менее химически активны, чем чистые металлы.
[латекс] 4 {\ text {M}} _ {(\ text {s})} + {\ text {O}} _ {2 (\ text {g})} \ rightarrow 2 {\ text {M }} _ {2} \ text {O} [/ latex]
- Оксиды бурно реагируют с водой с образованием гидроксида.Образующиеся гидроксиды этих элементов полностью диссоциируют в воде с образованием некоторых из самых сильных из известных оснований. Гидроксид натрия (NaOH), также называемый щелочью, представляет собой промышленную основу.
[латекс] {\ text {M}} _ {2} \ text {O} _ {(\ text {s})} + \ text {H} _ {2} {\ text {O}} \ rightarrow 2 \ text {MOH} _ {(\ text {aq})} [/ latex]
- Чистый щелочной металл также может напрямую реагировать с водой. В этом случае металл представляет собой основной ангидрид. Выделяется газообразный водород, который легко воспламеняется.
[латекс] 2 {\ text {M}} _ {(\ text {s})} +2 {\ text {H}} _ {2} \ text {O} \ rightarrow 2 \ text {MOH} _ {(\ text {aq})} + {\ text {H}} _ {2 (\ text {g})} [/ latex]
- Воздействие галогена на щелочной металл вызовет чрезвычайно экзотермическую реакцию, в результате которой образуется ионная соль. Почти каждая соль щелочного металла хорошо растворяется в воде. Они образуют проводящие растворы, что доказывает их ионную природу.
[латекс] 2 {\ text {M}} _ {(\ text {s})} + {\ text {Cl}} _ {2 (\ text {g})} \ rightarrow 2 \ text {MCl} _ {(\ text {s})} [/ латекс]
Встречи в природе
Все обнаруженные щелочные металлы встречаются в природе.Были проведены эксперименты, чтобы попытаться синтезировать унунениум (Uue), который, вероятно, станет следующим членом группы, если попытка окажется успешной. Предполагается, что следующим щелочным металлом после унунения будет негэкспентиум (Uhp), элемент, который еще не получил даже попыток синтеза из-за его чрезвычайно высокого атомного номера.
Применение щелочных металлов
Большинство щелочных металлов находят множество различных применений. Двумя наиболее известными применениями чистых элементов являются атомные часы рубидия и цезия, из которых атомные часы цезия являются наиболее точным представлением времени, известным по состоянию на 2012 год.Обычно соединения натрия используются в натриевых лампах, излучающих очень эффективный свет. С другой стороны, поваренная соль или хлорид натрия использовались с древних времен.
Щелочноземельные металлы
Щелочноземельные металлы — это химические элементы в s-блоке периодической таблицы с очень похожими физическими и химическими свойствами.
Цели обучения
Предскажите степень окисления щелочноземельного металла.
Основные выводы
Ключевые моменты
- Щелочноземельные металлы — это блестящие, серебристо-белые металлы, обладающие некоторой реакционной способностью при стандартной температуре и давлении.
- Все щелочноземельные металлы легко теряют два своих внешних электрона с образованием катионов с зарядом 2+.
- Все щелочноземельные металлы, кроме магния и стронция, содержат по крайней мере один радиоизотоп природного происхождения.
- Магний и кальций присутствуют повсеместно и необходимы всем известным живым организмам.
Ключевые термины
- Щелочноземельные металлы : Группа химических элементов в периодической таблице со схожими свойствами: блестящие, серебристо-белые, несколько реактивные при стандартной температуре и давлении.Они легко теряют два своих крайних электрона с образованием катионов с зарядом +2.
Свойства щелочноземельных металлов
Щелочноземельные металлы (бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra)) представляют собой группу химических элементов в s-блоке таблица Менделеева с очень похожими свойствами:
- блестящий
- серебристо-белый
- металлы с высокой реакционной способностью при стандартной температуре и давлении
- легко теряют два своих крайних электрона с образованием катионов с зарядом 2+
- низкой плотности
- низкая температура плавления
- низкая температура кипения
Щелочноземельные металлы включают элементы 2 группы.Все обнаруженные щелочноземельные металлы встречаются в природе.
Реакции щелочноземельных металлов
Все щелочноземельные металлы имеют два электрона в валентной оболочке, поэтому они теряют два электрона, образуя катионы с зарядом 2+. Большая часть химии наблюдалась только у первых пяти членов группы; химический состав радия не изучен из-за его радиоактивности.
С химической точки зрения все щелочные металлы реагируют с галогенами с образованием ионных галогенидов щелочноземельных металлов.Все щелочноземельные металлы, кроме бериллия, также реагируют с водой с образованием сильнощелочных гидроксидов, с которыми следует обращаться с большой осторожностью. Более тяжелые щелочноземельные металлы реагируют более энергично, чем более легкие.
Щелочные металлы имеют вторые по величине первые энергии ионизации в соответствующие периоды таблицы Менделеева. Это происходит из-за их низких эффективных ядерных зарядов и способности достичь полной конфигурации внешней оболочки, потеряв всего два электрона. Вторая энергия ионизации всех щелочных металлов также несколько мала.
Бериллий — исключение. Он не реагирует с водой или паром, а его галогениды ковалентны. Все соединения, в состав которых входит бериллий, имеют ковалентную связь. Даже фторид бериллия, который является наиболее ионным соединением бериллия, имеет низкую температуру плавления и низкую электропроводность при плавлении.
Вот список некоторых обычных реакций щелочноземельных металлов, где E = элементы, которые действуют как восстановители:
- Металлы восстанавливают галогены с образованием ионных галогенидов: [латекс] \ text {E} _ {(\ text {s})} + \ text {X} _ {2} \ rightarrow \ text {EX} _ {2 ( \ text {s})} [/ latex] где X = F, Cl, Br или I
- Металлы восстанавливают O2 с образованием оксидов:
[латекс] 2 \ text {E} _ {(\ text {s})} + \ text {O} _ {2} \ rightarrow 2 \ text {EO} _ {(\ text {s})} [ / латекс]
- Более крупные металлы реагируют с водой с образованием газообразного водорода: [латекс] \ text {E} _ {(\ text {s})} +2 \ text {H} _ {2} \ text {O} _ {( \ text {l})} \ rightarrow \ text {E} _ {(\ text {aq})} ^ {2+} +2 \ text {OH} _ {(\ text {aq})} ^ {-} + \ text {H} _ {2 (\ text {g})} [/ latex], где E = Ca, Sr или Ba
- Металлы претерпевают реакции трансметаллирования с обменом лигандов: [латекс] \ text {Ae} + \ text {Hg} {\ {\ text {N} (\ text {SiMe} _ {3}) _ {2} \} _ {2}} \ rightarrow [\ text {Ae} \ {{\ text {N} (\ text {SiMe} _ {3}) _ {2} \} _ {2}} (\ text {THF}) _ {2}] [/ latex], где Ae = Ca, Sr или Ba.
Соединения щелочноземельных металлов
- Галогениды алкилмагния (RMgX, где R = углеводородная группа и X = галоген) используются для синтеза органических соединений. Вот пример: [латекс] 3 \ text {RMgCl} + \ text {SnCl} _ {4} \ rightarrow 3 \ text {MgCl} _ {2} + \ text {R} _ {3} \ text {SnCl} [/ латекс]
- Оксид магния (MgO) используется в качестве материала для преломления печного кирпича и изоляции проводов (температура плавления 2852 ° C).
- Карбонат кальция (CaCO 3 ) в основном используется в строительной промышленности и для производства известняка, мрамора, мела и кораллов.
Радиоактивность
Все щелочноземельные металлы, за исключением магния и стронция, содержат по крайней мере один радиоизотоп природного происхождения: бериллий-7, бериллий-10 и кальций-41 являются радиоизотопами в следовых количествах. Кальций-48 и барий-130 имеют очень длительный период полураспада и поэтому встречаются в природе. Все изотопы радия радиоактивны.
Встречи в природе
Изумруд — это встречающееся в природе соединение бериллия. В земной коре содержится большое количество кальция и магния, которые составляют несколько важных породообразующих минералов, таких как доломит (долостон) и кальцит (известняк).Остальные нерадиоактивные члены группы присутствуют только в меньших количествах. Месторождения каждого из этих минералов разрабатываются для извлечения элементов для дальнейшего использования. Радий с максимальным периодом полураспада 1601 год присутствует в природе только тогда, когда он пополняется цепочкой распада в результате радиоактивного распада более тяжелых элементов.
Изумруд : Изумруд — разновидность берилла, минерала, содержащего щелочноземельный металл бериллий. Бериллий встречается в природе только в сочетании с другими элементами в минералах.
Биологическая роль и токсичность щелочноземельных металлов
Магний и кальций необходимы всем известным живым организмам. Они задействованы более чем в одной роли. Например, насосы ионов магния или кальция играют роль в некоторых клеточных процессах. Магний действует как активный центр некоторых ферментов, а соли кальция играют структурную роль в костях.
Стронций играет важную роль в морской водной жизни, особенно в твердых кораллах, которые используют стронций для создания своих экзоскелетов.Стронций и барий находят применение в медицине. Например, «бариевая мука» используется в радиографической визуализации, а соединения стронция используются в некоторых зубных пастах.
Однако бериллий и радий токсичны. Низкая растворимость бериллия в воде означает, что он редко доступен для биологических систем. Его роль в живых организмах неизвестна, и, когда они встречаются, он обычно очень токсичен. Радий имеет низкую доступность и очень радиоактивен, что делает его токсичным для жизни.
Алюминий
Алюминий — мягкий серебристый металл из группы бора периодической таблицы.
Цели обучения
Опишите свойства алюминия.
Основные выводы
Ключевые моменты
- Алюминий — мягкий, легкий и ковкий серебристый металл, не растворяющийся в воде.
- В подавляющем большинстве соединений алюминий имеет степень окисления 3+, но известны соединения со степенью окисления +1 и +2.
- Алюминий содержит много известных изотопов, массовые числа которых находятся в диапазоне от 21 до 42.
- Алюминий является наиболее широко используемым цветным металлом и в основном легированным, что улучшает его механические свойства.
Ключевые термины
- алюминий : металлический химический элемент (обозначение Al) с атомным номером 13.
- пассивирование : относится к материалу, который становится «пассивным», то есть меньше подвержен влиянию факторов окружающей среды, таких как воздух или вода.
Физические свойства алюминия
Алюминий это:
- относительно мягкий
- прочный
- легкий
- пластичный
- податливый
- Внешний вид от серебристого до тускло-серого
- не растворяется в воде при нормальных условиях
- немагнитный
- плохо воспламеняется
- способный быть сверхпроводником
Химические свойства
Алюминий устойчив к коррозии из-за явления пассивации.Тонкий поверхностный слой оксида алюминия образуется, когда металл подвергается воздействию воздуха. Этот оксидный слой защищает находящийся под поверхностью алюминий от дальнейшего окисления. Как и многие другие металлы, алюминий также может окисляться водой с образованием водорода и тепла:
[латекс] 2 \ text {Al} \ quad + \ quad 3 {\ text {H}} _ {2} \ text {O} \ quad \ longrightarrow \ quad {\ text {Al}} _ {2} { \ text {O}} _ {3} +3 {\ text {H}} _ {2} [/ latex]
Хотя алюминий очень легко окисляется, можно удалить оксидный слой с образца без его немедленного риформинга.Самый простой и безопасный способ — подключить батарею к образцу и провести электролиз либо в инертной атмосфере (например, газообразный аргон), либо в условиях вакуума.
Подавляющее большинство соединений алюминия имеют степень окисления 3+. Координационное число алюминия может варьироваться, но обычно Al 3+ является тетра- или гексакоординированным. Это означает, что у него будет 4 или 6 лигандов.
Галогениды алюминия: использование в качестве кислот Льюиса
Алюминий — очень реактивный металл, который легко вступает в реакцию с трехвалентными соединениями продукта.Его галогениды (AlF 3 , AlCl 3 , AlBr 3 и AlI 3 ) являются общими примерами. Трехвалентный алюминий является электронодефицитным и поэтому исключительно полезен в качестве кислоты Льюиса, особенно в органическом синтезе.
Гидриды алюминия и алюминийорганические соединения
Существует множество соединений эмпирической формулы AlR 3 и AlR 1,5 Cl 1,5 . Эти разновидности обычно имеют тетраэдрические центры Al. С большими органическими группами триорганоалюминий существует в виде трехкоординированных мономеров, таких как триизобутилалюминий.
Важным гидридом алюминия является алюмогидрид лития (LiAlH 4 ), который используется в качестве восстановителя в органической химии. Его можно производить из гидрида лития и трихлорида алюминия:
[латекс] 4 \ text {LiH} \ quad + \ quad \ text {Al} {\ text {Cl}} _ {3} \ quad \ longrightarrow \ quad \ text {LiAl} {\ text {H}} _ {4} \ quad + \ quad 3 \ text {LiCl} [/ латекс]
Алюминий общего назначения
Алюминий — наиболее широко используемый цветной металл. Алюминий почти всегда легирован, что заметно улучшает его механические свойства, особенно при отпуске.Например, обычная алюминиевая фольга и банки для напитков представляют собой сплавы с содержанием алюминия от 92% до 99%. Некоторые из многих применений металлического алюминия находятся в:
- Транспортировка в листах, трубах, отливках и т. Д.
- Упаковка (жестяная банка, фольга и др.)
- Строительство (окна, двери, сайдинг, строительная проволока и т. Д.)
- Широкий ассортимент предметов домашнего обихода, от кухонной утвари до бейсбольных бит и часов
- Столбы уличного освещения, мачты парусных судов, прогулочные столбы и т. Д.
- Наружные оболочки бытовой электроники, а также корпуса для оборудования (например, фотоаппаратуры)
- Линии электропередачи для распределения электроэнергии
- Алюминий особой чистоты, используемый в электронике и компакт-дисках
- Радиаторы для электронных устройств, таких как транзисторы и процессоры
- Материал подложки из ламината с металлическим сердечником, плакированного медью, используемого в светодиодном освещении высокой яркости
- Алюминий порошковый, используемый в красках и пиротехнике
- Множество стран, включая Францию, Италию, Польшу, Финляндию, Румынию, Израиль и бывшую Югославию, выпустили монеты, отчеканенные из алюминия или алюминиево-медных сплавов
Использование алюминия при транспортировке : Austin «A40 Sports» в алюминиевом корпусе (ок.1951).
Физико-химические свойства щелочей | Мини-химия
Физические свойства щелочей
Щелочи обладают следующими свойствами:
- Щелочи имеют горький вкус и на ощупь скользкие, мыльные.
- Щелочные растворы имеют значение pH больше 7. (Подробнее о значении pH в следующей подтеме)
- Щелочные растворы окрашиваются в красный цвет лакмусовой бумаги в синий цвет.
Химические свойства щелочей
Существует четыре основных реакции щелочей:
- Реакция нейтрализации
- Реакция с солью аммония
- Осаждение гидроксидов металлов
- Реакция с металлами
Реакция нейтрализации
Когда щелочь реагирует с кислотой, реакция называется реакцией нейтрализации .{+} \ rightarrow \ text {H} _ {2} \ text {O} $
Пример реакций нейтрализации:
- Оксид цинка и соляная кислота: $ \ text {ZnO} (\ text {s}) + 2 \ text {HCl} (\ text {aq}) \ rightarrow \ text {ZnCl} _ {2} (\ text { aq}) + \ text {H} _ {2} \ text {O} (\ text {l}) $
- Гидроксид натрия и серная кислота: $ 2 \ text {NaOH} (\ text {aq}) + \ text {H} _ {2} \ text {SO} _ {4} (\ text {aq}) \ rightarrow \ text {Na} _ {2} \ text {SO} _ {4} (\ text {aq}) + 2 \ text {H} _ {2} \ text {O} (\ text {l}) $
Реакция с солями аммиака
При нагревании смеси щелочи и соли аммония выделяется газообразный аммиак.{+} \ rightarrow \ text {NH} _ {3} + \ text {H} _ {2} \ text {O} $$
Пример такой реакции:
- Хлорид аммония и гидроксид натрия: $ \ text {NH} _ {4} \ text {Cl} (\ text {s}) + \ text {NaOH} (\ text {s}) \ rightarrow \ text {NaCl} (\ text {s}) + \ text {NH} _ {3} (\ text {g}) + \ text {H} _ {2} \ text {O} (\ text {l}) $
- аммоний сульфат и гидроксид кальция: $ (\ text {NH} _ {4}) _ {2} \ text {SO} _ {4} (\ text {s}) + \ text {Ca} (\ text {OH} _ {2}) (\ text {s}) \ rightarrow \ text {CaSO} _ {4} (\ text {s}) + 2 \ text {NH} _ {3} (\ text {g}) + 2 \ text {H} _ {2} \ text {O} (\ text {l}) $
Осаждение гидроксидов металлов
Растворы щелочей используются для осаждения нерастворимых гидроксидов металлов из растворов их солей.{-} (\ text {aq}) \ rightarrow \ text {Mg} (\ text {OH}) _ {2} (\ text {s}) $
Образуется белый осадок гидроксида магния.
Взаимодействие с металлами
Щелочи обычно не вступают в реакцию с металлами.
Сильные щелочи, такие как гидроксид натрия, реагируют с алюминием с образованием водорода.
$$ 2 \ text {Al} (\ text {s}) + 6 \ text {NaOH} (\ text {aq}) + 6 \ text {H} _ {2} \ text {O} (\ text {l }) \ rightarrow 2 \ text {Na} _ {3} \ text {Al} (\ text {OH}) _ {6} (\ text {s}) + 3 \ text {H} _ {2} (\ текст {g}) $$
Физические свойства щелочных металлов — Группа 1 — щелочные металлы — Edexcel — Редакция GCSE Chemistry (Single Science) — Edexcel
Группа 1 содержит элементы, помещенные в вертикальный столбец в дальнем левом углу периодической таблицы.Элементы группы 1 называются щелочными металлами.
Группа 1 находится в левой части таблицы Менделеева.
Щелочные металлы обладают схожими физическими и химическими свойствами.
Физические свойства
Щелочные металлы:
- мягкие (их можно разрезать ножом)
- имеют относительно низкие температуры плавления
Щелочные металлы также имеют низкую плотность. Они достаточно низкие, чтобы первые три (литий, натрий и калий) плавали на воде.
Пример
В таблице указаны температуры плавления пяти щелочных металлов. Используйте эту информацию, чтобы описать, как изменяется точка плавления в группе 1.
| Элемент | Точка плавления |
|---|---|
| Литий, Li | 180 ° C |
| Натрий, Na | 98 ° C |
| Калий, K | 63 ° C |
| Рубидий | 39 ° C |
| Цезий, Cs | 28 ° C |
Понижение группы 1, точка плавления .
- Вопрос
Используйте информацию в таблице и диаграмме, чтобы предсказать точку плавления франция, Fr. Поясните свой ответ.
- Показать ответ
Температура плавления франция будет около 23-27 ° C. Это связано с тем, что франций ниже цезия в периодической таблице, поэтому он должен иметь более низкую температуру плавления, а разница в температурах плавления уменьшается при переходе от одного элемента к другому.
Группа 1: Свойства щелочных металлов
На этой странице обсуждаются тенденции изменения некоторых атомных и физических свойств элементов группы 1 — лития, натрия, калия, рубидия и цезия.В разделах ниже рассматриваются тенденции изменения атомного радиуса, энергии первой ионизации, электроотрицательности, точек плавления и кипения и плотности.
Тенденции в атомном радиусе
На диаграмме ниже показано увеличение атомного радиуса вниз по группе.
Радиус атома определяется двумя факторами:
- Количество слоев электронов вокруг ядра
- Притяжение внешних электронов к ядру
Сравните электронные конфигурации лития и натрия:
- Li: 1s 2 2s 1
- Na: 1s 2 2s 2 2p 6 3s 1
В каждом элементе внешний электрон испытывает чистый заряд +1 от ядра. — \]
График, показывающий первые энергии ионизации атомов Группы 1, показан выше.Обратите внимание, что энергия первой ионизации уменьшается по группе. Энергия ионизации определяется тремя факторами:
- заряд на ядре,
- величина экранирования внутренними электронами,
- расстояние между внешними электронами и ядром.
Внизу группы увеличение заряда ядра в точности компенсируется увеличением количества внутренних электронов. Как упоминалось ранее, в каждом из элементов Группы 1 самые удаленные электроны испытывают суммарный заряд +1 от центра.Однако расстояние между ядром и внешними электронами увеличивается вниз по группе; электроны становится легче удалить, а энергия ионизации падает.
Тенденции электроотрицательности
Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Обычно его измеряют по шкале Полинга, по которой наиболее электроотрицательному элементу (фтору) присваивается электроотрицательность 4,0 (таблица A2).
График, показывающий электроотрицательность элементов Группы 1, показан выше.Каждый из этих элементов имеет очень низкую электроотрицательность по сравнению с фтором, и электроотрицательность уменьшается от лития к цезию.
Изобразите связь между атомом натрия и атомом хлора. Связь можно считать ковалентной, состоящей из пары общих электронов. Электронная пара будет притягиваться к атому хлора, потому что ядро хлора содержит намного больше протонов, чем ядро натрия. Это показано на рисунке ниже:
Электронная пара настолько близка к хлору, что происходит эффективный перенос электрона от атома натрия к атому хлора — атомы ионизируются.Это сильное притяжение ядра хлора объясняет, почему хлор гораздо более электроотрицателен, чем натрий.
Теперь сравните это со связью литий-хлор. Чистое натяжение с каждого конца связи такое же, как и раньше, но атом лития меньше атома натрия. Это означает, что электронная пара будет сильнее притягиваться к чистому заряду +1 на литиевом конце и, следовательно, ближе к нему.
В некоторых соединениях лития часто присутствует степень ковалентной связи, которой нет в остальной части группы.Например, йодид лития растворяется в органических растворителях; это типичное свойство ковалентных соединений. Атом йода настолько велик, что притяжение ядра йода к паре электронов относительно невелико, и полностью ионная связь не образуется.
Обобщение тенденции вниз по группе
По мере того, как атомы металла увеличиваются в размерах, любая пара связывающих электронов удаляется от ядра металла и, следовательно, менее сильно к нему притягивается. Это соответствует снижению электроотрицательности в группе 1.За исключением некоторых соединений лития, каждый из элементов группы 1 образует соединения, которые можно считать ионными. Каждый из них настолько слабо электроотрицателен, что в связи группы 1 с галогеном мы предполагаем, что электронная пара на более электроотрицательном атоме притягивается так близко к этому атому, что образуются ионы.
Тенденции температуры плавления и кипения
На рисунке выше показаны точки плавления и кипения элементов группы 1. И температура плавления, и температура кипения снижаются по группе.
Когда любой из металлов группы 1 плавится, металлическая связь ослабляется настолько, что атомы могут двигаться более свободно, и полностью разрывается при достижении точки кипения. Уменьшение точек плавления и кипения отражает уменьшение прочности каждой металлической связи.
Атомы в металле удерживаются вместе притяжением ядер к электронам, которые делокализованы по всей массе металла. По мере увеличения размера атомов расстояние между ядрами и этими делокализованными электронами увеличивается; следовательно, аттракционы падают.Атомы легче разделяются, образуя жидкость, а затем газ. Как обсуждалось ранее, каждый атом демонстрирует чистую тягу от ядер +1. Повышенный заряд ядра в нижней части группы компенсируется дополнительными уровнями экранирования электронов. Как и раньше, тенденция определяется расстоянием между ядром и связывающими электронами.
Тенденции плотности
Плотность элементов Группы 1 увеличивается вниз по группе (за исключением колебания в сторону понижения для калия).Эта тенденция показана на рисунке ниже:
Металлы этой серии относительно легкие — литий, натрий и калий менее плотны, чем вода (менее 1 г / см -3 ). Трудно дать простое объяснение этой тенденции, потому что плотность зависит от двух факторов, оба из которых меняются в зависимости от группы. Атомы упакованы одинаково, поэтому учитываются два фактора: сколько атомов может быть упаковано в данном объеме, и масса отдельных атомов.Упакованное количество зависит от объемов отдельных атомов; эти объемы, в свою очередь, зависят от их атомного радиуса.
Атомный радиус увеличивается вниз по группе, поэтому объем атомов также увеличивается. Таким образом, в заданный объем может быть помещено меньше атомов натрия, чем атомов лития. Однако по мере того, как атомы становятся больше, их масса увеличивается. Данное количество атомов натрия будет весить больше, чем такое же количество атомов лития. Следовательно, 1 см 3 натрия содержит меньше атомов, чем тот же объем лития, но каждый атом весит больше.Для определения плотности требуются математические расчеты.
Щелочные металлические элементы: свойства, характеристики и реакции — стенограмма видео и урока
Свойства и характеристики
Щелочные металлы серебристые, мягкие и не очень плотные. Их легко разрезать ножом для масла, а цезий даже может плавиться в ладони. Они имеют низкие температуры плавления и невероятно реакционны — настолько реактивны, что их необходимо хранить в специальных растворах или контейнерах, чтобы предотвратить непреднамеренную реакцию.Отчасти щелочные металлы обладают такой реакционной способностью, потому что в их внешнем электронном слое находится один электрон. Как и многие другие металлы, щелочные металлы не хотят ничего, кроме электронных структур, подобных их знаменитым стабильным и инертным собратьям, благородным газам.
Чтобы удалить этот крайний электрон из щелочного металла, требуется очень мало энергии. Таким образом, щелочные металлы легко теряют свой внешний электрон и превращаются в ион +1. Это случается так часто, что редко можно найти образец щелочного металла со всеми его электронами; большинство щелочных металлов присутствуют в их ионной +1 форме.
Энергия, необходимая для удаления электрона из элемента, называется первой энергией ионизации . Щелочные металлы имеют самую низкую энергию первой ионизации из всех элементов. Фактически, по мере того, как вы спускаетесь по столбцу 1A, энергия первой ионизации становится все ниже и ниже, что делает цезий наиболее легко ионизируемым элементом в периодической таблице.
Реакции
Реакции со щелочными металлами — одни из самых захватывающих и самых опасных. Вообще говоря, чем легче удалить электрон, тем более энергичной будет реакция.Легкость удаления электрона из щелочного металла приводит к фантастическому высвобождению энергии.
Этот принцип хорошо демонстрируется в реакции щелочного металла с водой. Ниже представлена общая форма щелочного металла (обозначена буквой M) с водой и химическая реакция металлического калия, реагирующего с водой. Щелочной металл, добавляемый в воду, образует газообразный водород, ионы щелочных металлов и ионы гидроксида.
Записанная химическая реакция намного менее захватывающая, чем реальная реакция.Когда калий реагирует с водой, он производит газообразный водород, ионы калия и ионы гидроксида. Во время реакции произведенный водород может стать достаточно горячим, чтобы воспламениться, образуя пламя. Натрий, калий, рубидий и цезий имеют такие низкие температуры плавления, что тепло от реакции заставляет их плавиться, увеличивая площадь поверхности контакта с водой и величину реакции.
Щелочные металлы реагируют с неметаллами с образованием ионных соединений. В этих типах реакций щелочной металл отдает свой внешний электрон неметаллу, который жадно поглощает электроны.Подобные реакции, в которых элемент обменивается электроном на другой, называется окислительно-восстановительной реакцией или окислительно-восстановительной реакцией . Они очень распространены между щелочными металлами и неметаллами. В результате химической реакции металлического натрия с газообразным хлором образуется хлорид натрия.
Щелочные металлы часто встречаются в природе, но редко в чистом виде. Их обычно можно найти в ионных соединениях или просто в виде ионов. Наши тела загружены ионами натрия и калия; они играют важную роль в клеточных функциях.Натрий часто используется в электрических лампочках, и во многих городах до сих пор используются натриевые уличные фонари, которые можно отличить по их оранжево-желтому свечению. Ионы лития используются для того, чтобы аккумуляторы стали популярными в портативной электронике.
Краткое содержание урока
Щелочные металлы имеют один электрон во внешнем слое и находятся в столбце 1A периодической таблицы. Обычно встречаются в виде ионных соединений или ионов, они легко отдают свой электрон другим элементам. Это часто вызывает окислительно-восстановительных реакций с неметаллами, которые довольно драматичны, включая воспламеняющийся газообразный водород.
- Найдено в столбце 1А периодической таблицы Менделеева
- Имеют один электрон во внешнем слое электронов
- Легко ионизируемый
- Серебристый, мягкий, неплотный
- Низкая температура плавления
- Невероятно реактивный
Результаты обучения
После того, как вы закончите, вы должны уметь:
- Назвать щелочные металлы и идентифицировать их в периодической таблице
- Обсудите общие свойства щелочных металлов
- Объясните, что такое окислительно-восстановительные реакции.
Свойства щелочных металлов
Эта таблица Менделеева выделена для определения группы элементов щелочных металлов.(Тодд Хелменстайн)
Щелочные металлы — это элементы, расположенные в группе IA периодической таблицы (первый столбец). Ключевой характеристикой этих элементов является то, что все они имеют по одному электрону на внешней электронной оболочке. Этот одиночный электрон слабо связан, что делает его набором реактивных металлических элементов.
Список щелочных металлов
Обратите внимание, что элемент, отсутствующий в большинстве списков щелочных металлов, — это водород. Водород — это щелочной металл , если он находится в металлическом состоянии.При обычных температурах и давлениях водород встречается в виде газа и обладает свойствами неметалла.
Свойства щелочного металла
Как и другие щелочные металлы, рубидий — блестящий металл серебристого цвета. Чистый элемент вступает в реакцию с воздухом или водой, поэтому его хранят в герметичном контейнере.
Одинокие электроны внешней оболочки приводят к тому, что элементы щелочного металла имеют несколько общих свойств:
- Один внешний электрон легко теряется, образуя одновалентный (1+) катион (например, Na + ).
- Щелочные металлы обычно менее плотны, чем другие металлы.
- Атомы щелочных металлов имеют самые большие атомные радиусы элементов в свои периоды.
- Щелочные металлы — элементы с высокой реакционной способностью. В частности, они легко реагируют с галогенами и другими неметаллами. Чистые металлы реагируют с кислородом воздуха и с водой. По мере продвижения по группе реактивность увеличивается. Кусок металлического натрия в воде загорится; кусок металлического цезия в воде взорвется.
- Атомы имеют низкую энергию ионизации.
- Атомы щелочных металлов имеют низкие значения электроотрицательности.
- В отличие от большинства металлов щелочные металлы обычно мягкие и имеют низкие температуры плавления. Металлический натрий можно разрезать ножом для масла. Температура плавления цезия достаточно низкая, он плавится от тепла ваших рук или в теплой комнате.
- Как и другие металлы, щелочные металлы имеют тенденцию быть блестящими и металлическими на вид, а также являются хорошими проводниками электричества и тепла.
Физико-химические свойства элементов 1 группы
Физико-химические свойства элементов 1 группы
Элементы группы 1: щелочные металлы
Элементами Группы 1 являются:
Эти элементы известны как щелочных металлов.
Физические свойства элементов группы 1
1. В таблице показаны некоторые свойства элементов группы 1.
| Элемент | Число протонов | Число нуклонов | Плотность (г · см -3 ) | Твердость (по Бринеллю) | Температура плавления (° C) | Температура кипения (° C) | Атомный радиус (нм) | Электро негатив |
| Литий | 3 | 7 | 0.53 | 0,06 | 181 | 1347 | 0,15 | 1,0 |
| Натрий | 11 | 23 | 0,97 | 0,07 | 98 | 886 | 0,19 | 0,9 |
| Калий | 19 | 39 | 0,86 | 0,04 | 64 | 774 | 0,23 | 0,8 |
| Рубидий | 37 | 85 | 1.53 | 0,03 | 39 | 688 | 0,25 | 0,8 |
| Цезий | 55 | 133 | 1,87 | 0,02 | 28 | 678 | 0,26 | 0,7 |
| Франций | 87 | 223 | 2,40 | ? | 27 | 677 | 0,29 | 0,7 |
2. Общие физические свойства элементов 1 группы:
- Щелочные металлы — это твердые частицы серого цвета с блестящими серебристыми поверхностями при свежей резке.
- Эти поверхности тускнеют, находятся на воздухе.
- Это потому, что щелочные металлы очень реактивны. Они быстро реагируют с кислородом и водяным паром в воздухе при воздействии.
- Щелочные металлы — это мягких твердых частиц, и легко поддаются резке.
- Щелочные металлы имеют низкую плотность по сравнению с тяжелыми металлами, такими как железо и медь.
- Щелочные металлы являются хорошими проводниками тепла, и электричества.
- Щелочные металлы имеют низкоплавких и точек кипения по сравнению с тяжелыми металлами, такими как медь и железо.
В таблице сравниваются точки плавления и кипения калия (щелочного металла) и меди (тяжелого металла).
| Элемент | Калий | Медь |
| Температура плавления (° C) | 64 | 1083 |
| Температура кипения (° C) | 774 | 2567 |
3.Тенденция изменения физических свойств
Физические свойства элементов изменяются постепенно, , когда опускаются вниз по группе 1 , как показано в Таблице.
| Элементы группы 1 | Тенденция изменения физических свойств | |||
| Атомный радиус (размер атома) щелочных металлов постепенно увеличивается на вниз по группе. Причина: | Хотя щелочные металлы имеют низкие плотности, плотности постепенно увеличиваются на вниз по группе. Например: Металлическая связь означает химическую связь, которая удерживает атомы вместе в металле. | Хотя щелочные металлы имеют низких температур плавления и кипения, температуры плавления и кипения постепенно снижаются, вниз по группе. Причина: | Щелочные металлы становятся мягче по группе. | |
Люди тоже спрашивают
Химический Свойства элементов 1 группы
1. В таблице показано расположение электронов щелочных металлов.
| Элемент | Расположение электронов |
| Литий | 2,1 |
| Натрий | 2.8,1 |
| Калий | 2.8.8.1 |
| Рубидий | 2.8.18.8.1 |
| Цезий | 2.8.18.18.8.1 |
| Франций | 2.8.18.32.18.8.1 |
2. Похожие химические свойства
- Все щелочные металлы обладают схожими химическими свойствами.
- Это потому, что все атомы щелочных металлов имеют один валентный электрон.
3. Реакционная способность
Щелочные металлы очень реактивны.
Хотя щелочные металлы обладают схожими химическими свойствами, они различаются на по реакционной способности .
Реактивность щелочных металлов увеличивается при понижении Группа 1.
Реакционная способность щелочного металла измеряется тем, насколько легко его атом теряет свой одиночный валентный электрон для достижения стабильного расположения электронов благородных газов (дуплет или октетное расположение электронов).
легче атом щелочного металла высвобождает свой одиночный валентный электрон, более реактивный является щелочным металлом.
Пояснение:
Повышение реакционной способности щелочных металлов до группы 1 можно объяснить следующим образом.
- Все щелочные металлы имеют один валентный электрон.
- Каждый атом щелочного металла будет выделять один валентный электрон во время химической реакции для достижения стабильного дуплета или октета электронного расположения.Таким образом, образуется ион с зарядом +1.
- При понижении группы 1 размер атома щелочных металлов увеличивается на .
- Электрон с одной валентностью становится на дальше от ядра на и экранируется на , на больше внутренних оболочек, содержащих электроны.
- Это означает, что эффективный ядерный заряд , ощущаемый одиночным валентным электроном , уменьшается на при спуске по группе.
- Это приводит к тому, что силы притяжения между ядром и одиночным валентным электроном становятся слабее, поэтому одиночный валентный электрон на слабее притягивается, ядром.
- Следовательно, электрон с одной валентностью может быть легче высвобожден, при спуске по группе.
- В результате реакционная способность щелочных металлов увеличивается на по группе.
4. В качестве восстановителей
- Восстановители являются хорошими донорами электронов в химических реакциях.
- Щелочные металлы являются хорошими восстановителями , потому что одновалентных электронов в атоме каждого щелочного металла можно легко высвободить, чтобы достичь стабильного расположения электронов в благородном газе (хороший донор электронов).
- Прочность щелочных металлов в качестве восстановителей увеличивается при понижении Группа 1.
- Это потому, что одновалентных электронов щелочных металлов становится намного легче высвобождаться при спуске по группе.
5. Электроположительность
- (a) Определение:
Электроположительность элемента — это мера способности атома отдавать электроны с образованием положительного иона.- Щелочные металлы очень электроположительны.
- Это связано с тем, что атом каждого щелочного металла может легко высвободить свой одиночный валентный электрон с образованием положительного иона.
- Однако электроположительность щелочных металлов увеличивается на при понижении группы 1.
Это можно объяснить следующим образом:
- Размер атома щелочных металлов увеличивается на от лития до франция.
- Одновалентный электрон в самой внешней занятой оболочке становится дальше от ядра и экранируется большим количеством внутренних оболочек, содержащих электроны.
- Итак, силы притяжения между ядром и одиночным валентным электроном становятся слабее при спуске вниз по Группе 1.
- Это приводит к тому, что одновалентный электрон освобождается легче при спуске в группу 1.
- В результате электроположительность щелочных металлов увеличивается на при понижении группы.
6. Элементы группы 1 проявляют схожих химических свойств в их реакциях с
- вода для выделения газообразного водорода и образования гидроксида металла.
- кислород для получения оксидов металлов.
- хлор для производства хлорида металла.
- бром для производства бромида металла.
7. Предсказать свойства рубидия, цезия и франция
- Рубидий, цезий и франций находятся на уровне ниже калия в группе 1 Периодической таблицы.
- Следовательно, ожидается, что рубидий, цезий и франций будут реагировать с водой, кислородом, хлором или бромом аналогично, , как калий, но эти реакции на более энергичны (более реакционны), чем , чем калий.
- Например:
8. Растворимость солей щелочных металлов
- Карбонатные, нитратные, хлоридные, сульфатные, бромидные и йодидные соли щелочных металлов представляют собой твердые вещества белого цвета .
- Эти соли растворимы в воде. Они растворяются в воде с образованием бесцветных растворов.
9. Техника безопасности при обращении с элементами 1-й группы
- Щелочные металлы очень реактивны.
- Щелочные металлы при воздействии на них могут реагировать с кислородом и водяным паром в воздухе.
- Следовательно, щелочные металлы, такие как литий, натрий и калий, должны храниться в парафиновом масле, тогда как рубидий и цезий хранятся в герметичных стеклянных пробирках. Это необходимо для предотвращения их реакции с кислородом и водяным паром в воздухе.
- При обращении с щелочными металлами необходимо соблюдать следующие правила техники безопасности .
- Не держите высокореактивные щелочные металлы голыми руками.
- Надевайте защитные очки и перчатки во время эксперимента.
Химические свойства элементов группы 1 Эксперимент 1
Цель: Изучить химические свойства металлов 1-й группы в их реакциях с водой и кислородом.
Постановка задачи: Как металлы группы 1 реагируют с водой и кислородом?
А. Реакции щелочных металлов с водой
Гипотеза: При понижении группы 1 щелочные металлы становятся более активными в своих реакциях с водой.
Переменные:
(a) Управляемая переменная: различные типы щелочных металлов
(b) Реагирующая переменная: реакционная способность щелочных металлов
(c) Контролируемые переменные: вода, размер щелочных металлов
Оперативное определение: Щелочной металл который более энергично и быстро реагирует с водой, является более химически активным металлом. Материалы: Небольшие кусочки лития, натрия и калия, дистиллированная вода, красная лакмусовая бумага и фильтровальная бумага.
Аппарат: Поилки для воды, небольшой нож и щипцы.
Мера безопасности:
Не прикасайтесь к чрезвычайно реактивным щелочным металлам голыми руками.
Всегда надевайте защитные очки и перчатки.
Процедура:
A. Небольшой кусок лития вырезается с помощью ножа.
- Масло с поверхности лития удаляют, раскатывая его по куску фильтровальной бумаги.
- Затем литий медленно помещают на поверхность воды в поилке с помощью пинцета, как показано на рисунке.
- Все происходящие изменения записываются.
- Когда реакция останавливается, образовавшийся раствор проверяют с помощью красной лакмусовой бумаги.
- Шаги с 1 по 5 повторяются с использованием натрия и калия соответственно для замены лития.
Наблюдения:
| Щелочной металл | Наблюдение |
| Литий | Литий медленно перемещается по поверхности воды с мягким шипением.Образуется бесцветный раствор , который становится красной лакмусовой бумажкой синей . |
| Натрий | Натрий плавится, превращаясь в небольшую сферу, быстро перемещается и беспорядочно по поверхности воды с шипением. Образуется бесцветный раствор , который превращает красную лакмусовую бумажку в синюю . |
| Калий | Калий плавится, образуя небольшую сферу, горит лиловым пламенем , перемещается очень быстро и беспорядочно по поверхности воды с «шипением» и «хлопком».Образуется бесцветный раствор , который превращает красную лакмусовую бумажку в синюю . |
Обсуждение:
- Щелочные металлы шипят и толкают по поверхности воды, как судно на воздушной подушке. Это из-за выделения газообразного водорода , когда они реагируют с водой.
- Реакция взаимодействия лития, натрия и калия и воды с образованием бесцветного газа («шипящий» звук) и щелочного раствора (гидроксид металла), который окрашивает красную лакмусовую бумажку в синий цвет. Следовательно, литий, натрий и калий обладают схожими химическими свойствами.
- Наблюдения также показывают, что реакционная способность щелочных металлов в их реакциях с водой увеличивается на при переходе литий → натрий → калий.
- Реакция взаимодействия щелочных металлов и воды с образованием раствора гидроксида металла (щелочной раствор) и газообразного водорода.
Б. Реакции щелочных металлов с кислородом
Гипотеза: При понижении группы 1 щелочные металлы становятся более активными в своих реакциях с кислородом.
Переменные:
(a) Управляемая переменная: различные типы щелочных металлов
(b) Реагирующая переменная: реакционная способность щелочных металлов
(c) Контролируемые переменные: газообразный кислород, размер щелочных металлов
Оперативное определение: Щелочной металл Металл, который горит быстрее и сильнее в газообразном кислороде, является более химически активным металлом.
Материалы: Небольшие кусочки лития, натрия и калия, фильтровальная бумага, красная лакмусовая бумажка и три газовых баллона, заполненных
газообразным кислородом.
Аппарат: Щипцы, ложка для газового баллона, небольшой нож и горелка Бунзена.
Процедура:
- Небольшой кусочек лития вырезается ножом.
- Масло с поверхности лития удаляют, взбалтывая его на куске фильтровальной бумаги.
- Затем литий нагревают в газовой ложке до тех пор, пока он не начнет гореть.
- Ложка для газового баллона с горящим литием затем быстро опускается в газовый баллон, наполненный газообразным кислородом, как показано на рисунке.
- Происходящие изменения записываются.
- Когда реакция остановится, в газовый сосуд наливают 10 см3 дистиллированной воды и хорошо встряхивают.
- Образованный раствор затем проверяют с помощью кусочка красной лакмусовой бумаги.
- Шаги с 1 по 7 повторяются с использованием натрия и калия соответственно для замены лития.
Наблюдения:
| Щелочной металл | Наблюдение |
| Литий | Литий горит медленно красным пламенем и выделяет белые пары, которые превращаются в белое твердое вещество при охлаждении до комнатной температуры.Белое твердое вещество растворяется в воде с образованием бесцветного раствора . Этот раствор превращает красную лакмусовую бумажку в синий цвет. |
| Натрий | Натрий горит быстро и ярко с желтым пламенем и выделяет белые пары, которые превращаются в белое твердое вещество при охлаждении до комнатной температуры. Белое твердое вещество растворяется в воде с образованием бесцветного раствора . Этот раствор превращает красную лакмусовую бумажку в синий цвет. |
| Калий | Калий горит очень быстро и ярко с лиловым пламенем и выделяет белые пары, которые превращаются в белое твердое вещество при охлаждении до комнатной температуры. Белое твердое вещество растворяется в воде с образованием бесцветного раствора . Этот раствор превращает красную лакмусовую бумажку в синий цвет. |
Обсуждение:
- Литий, натрий и калий сгорают в газообразном кислороде соответственно с образованием белых паров , которые затем превращаются в белое твердое вещество (оксид металла). Белое твердое вещество растворяется в воде с образованием щелочного раствора (гидроксид металла). Следовательно, можно сделать вывод, что эти щелочные металлы обладают схожими химическими свойствами.
- Из яркости пламени и скорости горения можно сделать вывод, что реакционная способность щелочных металлов в их реакциях с газообразным кислородом увеличивается на при переходе литий → натрий → калий.
- Все щелочные металлы реагируют с газообразным кислородом при нагревании с образованием белых твердых оксидов металлов.
- Образовавшиеся белые твердые оксиды металлов растворяются в воде с образованием щелочных растворов гидроксидов металлов.
Заключение:
Щелочные металлы проявляют аналогичные химические свойства в их реакциях с водой или газообразным кислородом. Реакционная способность щелочных металлов увеличивается на вниз по группе 1. Следовательно, предложенная гипотеза может быть принята.
Химические свойства элементов группы 1 Эксперимент 2
Цель: Изучить химические свойства металлов 1 группы в их реакциях с хлором и бромом.
Постановка задачи: Как металлы группы 1 реагируют с хлором и бромом?
Гипотеза: При понижении группы 1 щелочные металлы становятся более активными в своих реакциях с хлором или бромом.
Переменные:
(a) Управляемая переменная: различные типы щелочных металлов
(b) Реагирующая переменная: реакционная способность щелочных металлов
(c) Контролируемые переменные: хлор и бром, размер щелочных металлов
Оперативное определение: An Щелочной металл, который более энергично и быстро реагирует с хлором или газообразным бромом, является более химически активным металлом.
Материалы: Небольшие кусочки лития, натрия и калия, фильтровальная бумага, три газовых баллона, заполненных газообразным хлором, и три газовых баллона, заполненных парами брома.
Аппарат: Горелка Бунзена, щипцы, ложка для газового баллона и небольшой нож.
Меры безопасности:
Газообразный хлор и пары брома ядовиты. При работе с этими галогенами надевайте перчатки и защитные очки.
Процедура:
- Небольшой кусочек лития вырезается ножом.
- Масло с поверхности лития удаляют, раскатывая его по куску фильтровальной бумаги.
- Затем литий нагревают в газовой ложке до тех пор, пока он не начнет гореть.
- Ложка для газового баллона с горящим литием затем быстро опускается в газовый баллон, наполненный газообразным хлором, как показано на рисунке.
- Происходящие изменения записываются.
- Шаги с 1 по 5 повторяются с использованием натрия и калия соответственно для замены лития.
- Шаги с 1 по 6 повторяются с использованием паров брома для замены газообразного хлора.
Наблюдения:
| Щелочной металл | Наблюдение | |
| Хлор газ | Пары брома | |
| Литий | Литий горит медленно красным пламенем и выделяет белых паров , которые в конце реакции превращаются в белое твердое вещество . | Литий горит медленно красным пламенем и выделяет белых паров , которые в конце реакции превращаются в белое твердое вещество .Красновато-коричневый пар брома обесцвечен на . |
| Натрий | Натрий горит быстро и ярко желтым пламенем и выделяет белых паров , которые в конце реакции превращаются в белое твердое вещество . | Натрий горит быстро и ярко с желтым пламенем и выделяет белых паров , которые в конце реакции превращаются в белое твердое вещество .Красновато-коричневый пар брома обесцвечен на . |
| Калий | Калий горит очень быстро и ярко сиреневым пламенем и выделяет белых паров , которые в конце реакции превращаются в белое твердое вещество . | Калий очень быстро горит и ярко сиреневым пламенем и выделяет белых паров , которые в конце реакции превращаются в белое твердое вещество .Красновато-коричневый пар брома обесцвечен на . |
Обсуждение:
- Литий, натрий и калий проявляют схожие химические свойства в их реакциях с газообразным хлором или парами брома . Это потому, что все эти щелочные металлы имеют один валентный электрон.
- Из яркости пламени и скорости горения можно сделать вывод, что реакционная способность щелочных металлов в их реакциях с хлором или бромом увеличивается на при переходе литий → натрий → калий.
- Все щелочные металлы реагируют с газообразным хлором при нагревании с образованием белых твердых хлоридов металлов.
- Щелочные металлы реагируют с парами броррина при нагревании с образованием белых твердых бромидов металлов.
Заключение:
Щелочные металлы проявляют сходные химические свойства в их реакциях с газообразным хлором или парами брома. Реакционная способность щелочных металлов увеличивается на вниз по группе 1.Следовательно, предложенная гипотеза может быть принята.
.
