Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Горение и взрывы. Окисление и восстановление. / / Важнейшие восстановители и окислители (коротко и подробно) Поделиться:
Подробный перечень окислителей — таблица. Окислители.
Подробный перечень восстановителей — таблица. Восстановители.
| Поиск в инженерном справочнике DPVA. Введите свой запрос:
Поиск в инженерном справочнике DPVA. Введите свой запрос: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www. dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса.Free xml sitemap generator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблицы восстановителей — Справочник химика 21
Другими словами каждый из окислителей с большим окислительным потенциалом способен окислять все выше стоящие в таблице восстановители с меньшими потенциалами. И наоборот каждый из восстановителей с меньшим окислительным потенциалом может восстанавливать все нижестоящие окислители с большими потенциалами. [c.240]
Величины стандартных потенциалов различных пар, имеющих значение в количественном анализе, приведены в табл. 20. В первой й третьей графах этой таблицы даны формулы отдельных компонентов различных пар, эти компоненты расположены в порядке уменьшения соответствующих им стандартных потенциалов (четвертая графа). Во второй графе указано число электронов (м), получаемых окислителем (первая графа) при превращении его соответствующий восстановитель (третья графа). [c.347]
[c.347]
Возрастание величин стандартных потенциалов соответствует увеличению силы окислителей и уменьшению силы восстановителей, поэтому самые сильные окислители помещены в начале первой графы, й наиболее сильные восстановители — в конце третьей графы таблицы стандартных потенциалов. Например, сильнейшим из всех окислителей является фтор, которому соответствует наибольшая величина (+2,87 в). К числу весьма сильных окислителей принадлежат также МпО в кислой среде ( = +1,51 в). СггО/ [c.347]
Рассматриваемое правило дает возможность, пользуясь таблицей стандартных потенциалов, предвидеть направление течения различных окислительно-восстановительных реакций, выбирать подходящие окислители и восстановители и решать ряд других важных для аналитической практики вопросов. [c.350]
Положение пары 12/21″ примерно в середине таблицы окислительных потенциалов (см. табл. 20) показывает, что а) существует ряд восстановителей, способных окисляться свободным иодом (таковы все восстановители, расположенные в третьей графе таблицы ниже пары Ь/З , т. е. имеющие способных восстанавливаться «-ионами (таковы все окислители, расположенные в первой графе таблицы выше пары 12/21», имеющие Е > +0,54 в). [c.396]
е. имеющие способных восстанавливаться «-ионами (таковы все окислители, расположенные в первой графе таблицы выше пары 12/21», имеющие Е > +0,54 в). [c.396]
В таблице 18 представлены значения стандартных электродных потенциалов некоторых металлов. Символом Ме /Ме обозначен металл Ме, погруженный в раствор его соли. Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак — , а знаком + отмечены стандартные потенциалы электродов, являющихся окислителями. [c.80]
Подберите, используя данные таблицы 4 (см. приложение), наиболее эффективные окислители, восстановители и среду для проведения процессов [c.104]
Для этого необходимо составить электронные уравнения, указав предположительно восстановитель и окислитель, и выписать из таблиц их потенциалы [c.129]
Какой из галогеноводородов является наиболее сильным восстановителем Какой — наиболее слабым Пользуясь таблицей электродных потенциа- [c. 130]
130]
Вы могли заметить, что некоторые молекулы, атомы или ионы оказались в обеих таблицах. Это значит, что они могут быть как окислителями, так и восстановителями в зависимости от условий протекания реакции. Все они содержат какой-либо элемент в промежуточной (обычно неустойчивой) степени окисления, которая может быть повышена или понижена. [c.92]
Преподаватель скажет Вам, какой опыт следует выполнить. Например, № 4—5—6 будет означать, что в качестве восстановителя следует воспользоваться (5-я строка) сероводородной водой (или раствором сульфида натрия) и изучить действие (6-й столбец) дихромат-иона в щелочной среде. Студенты получают различные задания (номера опытов), а после их выполнения обмениваются результатами и заполняют таблицу. [c.290]
ЦИИ в полуячейке, тем больше термодинамическая вероятность протекания такой реакции. Если э. д. с. выражается как окислительный потенциал, можно также сказать, что более положительные потенциалы соответствуют лучшим восстановителям, а более отрицательные потенциалы — лучшим окислителям вещества с потенциалами, большими чем потенциал водорода, лучшие восстановители, нежели водород, а вещества с потенциалами, меньшими потенциала водорода, являются лучшими окислителями, чем ион водорода. Стандартные потенциалы, заимствованные из книги , приведены в табл. 8-1. Наиболее положительные потенциалы и, следовательно, отвечающие нм лучшие восстановители в стандартном состоянии расположены в начале таблицы. [c.311]
Стандартные потенциалы, заимствованные из книги , приведены в табл. 8-1. Наиболее положительные потенциалы и, следовательно, отвечающие нм лучшие восстановители в стандартном состоянии расположены в начале таблицы. [c.311]
По учебникам или таблице окислительно-восстановитель-ных потенциалов выяснить отношение бора и алюминия к воде, кислороду, кислотам и щелочам. [c.264]
Пользуясь таблицей электродных потенциалов и схемой, представленной на рис. 7, в следующих цепях указать электрод-окислитель и электрод-восстановитель [c.152]
В периодах, если двигаться по таблице слева направо, восстановительные свойства атомов падают. Наиболее сильный восстановитель в каждом периоде — это щелочной металл, наиболее слабый — галоген. [c.95]
Так как реакции окисления — восстановления могут протекать в заданном направлении при положительном значении э. д. с., то любой восстановитель, помещенный в левой колонке таблицы, может быть окислен любым окислителем, помещенным в третьей колонке, но расположенным ниже по отношению к первому. Чем дальше друг от друга расположены восстановитель и окислитель, тем больше значение э. д. с. и тем легче осуществляется реакция окисления — восстановления. [c.209]
с., то любой восстановитель, помещенный в левой колонке таблицы, может быть окислен любым окислителем, помещенным в третьей колонке, но расположенным ниже по отношению к первому. Чем дальше друг от друга расположены восстановитель и окислитель, тем больше значение э. д. с. и тем легче осуществляется реакция окисления — восстановления. [c.209]
При пользовании таблицей следует иметь в виду, что нормальные потенциалы восстановителя или окислителя зависят от среды, в которой ими пользуются. Приведем значения для озона, которым можно окислять в различных средах [c.209]
Сильнейшим из всех окислителей является свободный фтор. Величина Ео =+2,87 в. К наиболее сильным восстановителям относятся щелочные и щелочноземельные металлы. Зная окислительно-восстановительные потенциалы, можно предвидеть, в какую сторону пойдет ОВР. Чем дальше друг от друга расположены восстановитель и окислитель, тем больше значение э. д. с. и тем легче осуществляется ОВР. При пользовании таблицей следует иметь в виду, что нормальные потенциалы восстановителя и окислителя зависят от среды, в которой ими пользуются, и от концентрации. [c.30]
При пользовании таблицей следует иметь в виду, что нормальные потенциалы восстановителя и окислителя зависят от среды, в которой ими пользуются, и от концентрации. [c.30]
Каждые ион или молекула, находящиеся перед знаком равенства в уравнении электродного процесса таблицы потенциалов и имеющие большую положительную или менее отрицательную величину потенциала, могут быть. .. (окислителем, восстановителем) по отношению к таким же веще-ствам, имеющим меньшее положительное пли большее отрицательное значение потенциала. [c.130]
Найдите в таблице стандартных потенциалов самый сильный окислитель и самый сильный восстановитель. Выпишите электродные реакции и отвечающие им потенциалы. [c.132]
Анализ табл. 24 подтверждает, что элементы, для которых стандартный потенциал электрода отрицателен, являются более сильными восстановителями, чем водород (случай цинка), а элементы, для которых стандартный потенциал электрода положителен,— -более слабыми восстановителями, чем водород (случай меди). Вообще восстанавливающая способность элементов возрастает снизу вверх в таблице. [c.296]
Вообще восстанавливающая способность элементов возрастает снизу вверх в таблице. [c.296]
С помощью этой таблицы можно также определить стандартный потенциал окислительно-восстановительной реакции с участием того или иного элемента, например элемента Со/Со +//Ад» /Ад. Кобальт — более сильный восстановитель, чем серебро, так как в таблице он расположен над ним следовательно, кобальт отдает электроны. Приведем уравнения реакций окисления и восстановления, протекающих самопроизвольно [c.296]
В качестве примера рассмотрены возможные состояния хлора и их роль в окислительно-восстановительных процессах — табл. 9.1. Как видно из данных таблицы, ион С1 может быть только восстановителем, а все остальные состояния атома хлора, свободного и в различных своих кислородных соединениях, являются окислителями, причем по мере повышения степени окисления активность их как окислителей возрастает. [c.227]
В периодической таблице углерод расположен почти на границе между металлами и неметаллами. Поэтому он электроотрицателен, т. е. выступает в качестве окислителя в соединениях с металлами, и электроположителен, т. е. выступает в качестве восстановителя в соединениях с неметаллами, расположенными правее и ниже его в периодической таблице, в том числе с кислородом (см. табл. 10 ). [c.91]
Поэтому он электроотрицателен, т. е. выступает в качестве окислителя в соединениях с металлами, и электроположителен, т. е. выступает в качестве восстановителя в соединениях с неметаллами, расположенными правее и ниже его в периодической таблице, в том числе с кислородом (см. табл. 10 ). [c.91]
Заметим также, что каждый окислитель может окислять только стоящие выихг его [в первой графе таблицы) восстановители с меньшими окислительными потенциалами, и наоборот каждый восстлнэвитгль можгт восстанавливать только стоящие ниже его (з третьей графе таблицы) окислители с большими потенциа -лами. [c.358]
Пирометаллургаей называется способ получения металла из руд, основанный на их нагревании, например, в печах, продуваемых воздухом. Этот способ используется в двух из трех восстановительных процессов, приведенных в таблице. Нагрев при этом происходит либо на воздухе (обжиг), либо в присутствии восстановителя. Обычно используются уголь (кокс) или моноксид углерода, поскольку они недороги и доступны. Если оба этих вещества не годятся, в качестве восстановителя можно использовать более активный металл. Пирометаллургия — наиболее важный и старейший способ получения металлов из руд. [c.153]
Если оба этих вещества не годятся, в качестве восстановителя можно использовать более активный металл. Пирометаллургия — наиболее важный и старейший способ получения металлов из руд. [c.153]
Наличие окислителей и восстановителей обнаруживается по иамененню окраски рас-твсра с помощью приведенных н таблице реактивов. В скобках указаны ионы, которые с данными реактивами реагируют медленно. [c.35]
Пользуясь таблицей окислнтельно-восстановитель-ных потенциалов, предложить реагенты для окисления [c.44]
КМпО +5К 80з + ЗН 80 = 2Мп80, + бК ЗО + ЗН,0 Ниже приведена таблица, в которой указаны наиболее часто встречающиеся окислители и восстановители и полуреакции. Обратите внимание на влияние среды в этих процессах. [c.143]
В соответствии со сказанным, самыми сильными восстановителями являются элементы, находящиеся в начале каждого периода и в конце I главной подгруппы (элементы цезий 55Сз, франций ваРг)- Их атомы имеют самые низкие значения энергии ионизации. Самыми сильными окислителями являются элементы, располагающиеся в правом верхнем углу таблицы периодической системы (фтор, кислород, хлор). Атомы этих элементов обладают наивысшими значениями сродства к электрону. [c.85]
Самыми сильными окислителями являются элементы, располагающиеся в правом верхнем углу таблицы периодической системы (фтор, кислород, хлор). Атомы этих элементов обладают наивысшими значениями сродства к электрону. [c.85]
В табл. 3 собраны различные окислители и восстановители, действие которых на ионы Ре + и Ре + следует проверить опытным путем. Перенесите таблицу в лабораторный журнал и сразу же отметьте прочерками те реакции, которые заведомо проходить не могут (окислитель типа КМПО4 с Ре + и т. п.). [c.297]
С помощью периодической системы Д. И. Менделеева и таблицы окислительно-восстановительиых потенциалов показать, какие атомы и молекулы будут окислять сероводород и селеноводо-род. [c.244]
В таблице приведен ряд напряжений окислителей и восстановителей. При этом окислительная активность различных окисленных форм по мере уменьшения алгебраической величины редокси-потенциалов убывает (их способность действовать в качестве акцептора электронов уменьшается сверху вниз). Электронодонор-ная же способность восстановленных форм сверху вниз возрастает. Так, Мп04 -ион Е°= + 1,52 в) как окислитель действует энергичнее, чем ЫОз—ион (Я°= +0,96 в). С другой стороны, 82 -ион Е° = —1,51 в) более энергичный восстановитель, чем Нг ( =0). Следовательно, об окислительной активности окисленной формы иона или атома и о способности данной восстановительной формы быть восстановителем можно судить по относительному расположению этих форм в ряде напряжений. [c.163]
Электронодонор-ная же способность восстановленных форм сверху вниз возрастает. Так, Мп04 -ион Е°= + 1,52 в) как окислитель действует энергичнее, чем ЫОз—ион (Я°= +0,96 в). С другой стороны, 82 -ион Е° = —1,51 в) более энергичный восстановитель, чем Нг ( =0). Следовательно, об окислительной активности окисленной формы иона или атома и о способности данной восстановительной формы быть восстановителем можно судить по относительному расположению этих форм в ряде напряжений. [c.163]
Длина первого периода таблицы Менделеева — два элемента, так как при главном квантовом числе п= электронные облака имеют шаровую симметрию и в пределах такогс облака по законам квантовой механики могут находиться только два электрона. В разных вариантах таблицы Менделеева водород помещают или в первой группе, или в седьмой группе, а в некоторых вариантах этот элемент занимает вообще особое место. При этом линиями показывают сходство водорода как со щелочными металлами, так и с галогенами. Действительно, подобно галогенам водород может быть окислителем, а подобно щелочным металлам — восстановителем. [c.38]
Действительно, подобно галогенам водород может быть окислителем, а подобно щелочным металлам — восстановителем. [c.38]
Известно, что гальванический элемент работает при условии, когда разно ть потенциалов является положительной величиной. Окислительно-восстановительная реакция может протекать в выбранном направлении при том же условии, т. е. если разность окислительно-восстановительных потенциалов имеет полож1ительное значение, и, следовательно, э. д. с. положительна. Так, например, пусть требуется определить, в какую сторону пойдет реакция между диоксидом свинца (РЬОа) и иодидом калия ) в кислой среде, если концентрация веществ равна 1 г-ион/л. По таблице окислительно-восстановительных потенциалов находим стандартные потенциалы ЕдЛ г/21 =0,54 в и Ео РЬ02/РЬ -+- =1,68 в. Поскольку второй потенциал больше первого, окислителем будет диоксид свинца, а восстановителем иодид ионы Л э. д. с.= 1,68—0,54=1,14 в. Значит, реакция возможна, т. е. 3. д. с. является положительной величиной. [c.34]
[c.34]
Задание С1 на ЕГЭ по химии. Особенности, советы, рекомендации.
Автор статьи — профессиональный репетитор О. В. Овчинникова.
Часть С на ЕГЭ по химии начинается с задания С1, которое предполагает составление окислительно-восстановительной реакции (содержащей уже часть реагентов и продуктов). Оно сформулировано таким образом:
С1. Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель.
Часто абитуриенты считают, что уж это задание не требует особой подготовки. Однако оно содержит подводные камни, которые мешают получить за него полный балл. Давайте разберёмся, на что обратить внимание.
Теоретические сведения.
Перманганат калия как окислитель.
Дихромат и хромат как окислители.
Повышение степеней окисления хрома и марганца.
Азотная кислота с металлами.

— не выделяется водород, образуются продукты восстановления азота.
Серная кислота с металлами.
— разбавленная серная кислота реагирует как обычная минеральная кислота с металлами левее в ряду напряжений, при этом выделяется водород;
— при реакции с металлами концентрированной серной кислоты не выделяется водород, образуются продукты восстановления серы.
Диспропорционирование.
Реакции диспропорционирования — это реакции, в которых один и тот же элемент является и окислителем, и восстановителем, одновременно и повышая, и понижая свою степень окисления:
Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).
| Сера + щёлочь 2 соли, сульфид и сульфит металла (реакция идёт при кипячении) | и |
| Фосфор + щелочь фосфин и соль гипофосфит (реакция идёт при кипячении) | и |
| Хлор, бром, иод + вода (без нагревания) 2 кислоты, Хлор, бром, иод + щелочь (без нагревания) 2 соли, и и вода | и |
| Бром, иод + вода (при нагревании) 2 кислоты, Хлор, бром, иод + щелочь (при нагревании) 2 соли, и и вода | и |
Диспропорционирование оксида азота (IV) и солей.

Ты нашел то, что искал? Поделись с друзьями!
Активность металлов и неметаллов.
Для анализа активности металлов используют либо электрохимический ряд напряжений металлов, либо их положение в Периодической таблице. Чем активнее металл, тем легче он будет отдавать электроны и тем более хорошим восстановителем он будет в окислительно-восстановительных реакциях.
Электрохимический ряд напряжений металлов.
| Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au |
Активность неметаллов так же можно определить по их положению в таблице Менделеева.
Запомните! Азот — более активный неметалл, чем хлор!
Более активный неметалл будет окислителем, а менее активный будет довольствоваться ролью восстановителя, если они реагируют друг с другом.
Ряд электроотрицательности неметаллов:
| увеличение электроотрицательности |
Особенности поведения некоторых окислителей и восстановителей.
а) кислородсодержащие соли и кислоты хлора в реакциях с восстановителями обычно переходят в хлориды:
б) если в реакции участвуют вещества, в которых один и тот же элемент имеет отрицательную и положительную степени окисления — они встречаются в нулевой степени окисления (выделяется простое вещество).
Необходимые навыки.
- Расстановка степеней окисления.
Необходимо помнить, что степень окисления — это гипотетический заряд атома (т.е. условный, мнимый), но он должен не выходить за рамки здравого смысла. Он может быть целым, дробным или равным нулю.
Задание 1: Расставьте степени окисления в веществах: - Расстановка степеней окисления в органических веществах.
Помните, что нас интересуют степени окисления только тех атомов углерода, которые меняют своё окружение в процессе ОВР, при этом общий заряд атома углерода и его неуглеродного окружения принимается за 0. - Не забывайте задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает, и во что они переходят? Чтобы не получалось, что электроны прилетают из ниоткуда или улетают в никуда.
Пример:В этой реакции надо увидеть, что иодид калия может являться только восстановителем, поэтому нитрит калия будет принимать электроны, понижая свою степень окисления.
Причём в этих условиях (разбавленный раствор) азот переходит из в ближайшую степень окисления . - Составление электронного баланса сложнее, если формульная единица вещества содержит несколько атомов окислителя или восстановителя.
В этом случае это необходимо учитывать в полуреакции, рассчитывая число электронов.
Самая частая проблема — с дихроматом калия , когда он в роли окислителя переходит в :Эти же двойки нельзя забыть при уравнивании, ведь они указывают число атомов данного вида в уравнении.
Задание 4: Какой коэффициент в уравнении реакции будет стоять перед магнием?
- Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция.
Это можно сделать либо про продуктам восстановления марганца и хрома, либо по типу соединений, которые получились в правой части реакции: например, если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая. Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты.
Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты.
Задание 5: Определите среду и вещества в каждой реакции: - Помните, что вода — вольный путешественник, она может как участвовать в реакции, так и образовываться.
Задание 6: В какой стороне реакции окажется вода? Bо что перейдёт цинк?Задание 7: Мягкое и жесткое окисление алкенов.
Допишите и уравняйте реакции, предварительно расставив степени окисления в органических молекулах:(хол. р-р.)
(водн.р-р) - Иногда какой-либо продукт реакции можно определить, только составив электронный баланс и поняв, каких частиц у нас больше:
Задание 8: Какие продукты ещё получатся? Допишите и уравняйте реакцию: - Во что переходят реагенты в реакции?
Если ответ на этот вопрос не дают выученные нами схемы, то нужно проанализировать, какие в реакции окислитель и восстановитель — сильные или не очень?
Если окислитель средней силы, вряд ли он может окислить, например, серу из в , обычно окисление идёт только до .
И наоборот, если — сильный восстановитель и может восстановить серу из до , то — только до .
Задание 9: Во что перейдёт сера? Допишите и уравняйте реакции:(конц.)
- Проверьте, чтобы в реакции был и окислитель, и восстановитель.
Задание 10: Сколько ещё продуктов в этой реакции, и каких? - Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Задание 11: Кто из этих галогенов окислитель, а кто восстановитель? - Если же один из реагентов — типичный окислитель или восстановитель — тогда второй будет «выполнять его волю», либо отдавая электроны окислителю, либо принимая у восстановителя.
Пероксид водорода — вещество с двойственной природой, в роли окислителя (которая ему более характерна) переходит в воду, а в роли восстановителя — переходит в свободный газообразный кислород.

Задание 12: Какую роль выполняет пероксид водорода в каждой реакции?
Последовательность расстановки коэффициентов в уравнении.
Сначала проставьте коэффициенты, полученные из электронного баланса.
Помните, что удваивать или сокращать их можно только вместе. Если какое-либо вещество выступает и в роли среды, и в роли окислителя (восстановителя) — его надо будет уравнивать позднее, когда почти все коэффициенты расставлены.
Предпоследним уравнивается водород, а по кислороду мы только проверяем!
- Задание 13: Допишите и уравняйте:
Не спешите, пересчитывая атомы кислорода! Не забывайте умножать, а не складывать индексы и коэффициенты.
Число атомов кислорода в левой и правой части должно сойтись!
Если этого не произошло (при условии, что вы их считаете правильно), значит, где-то ошибка.
Возможные ошибки.

- Расстановка степеней окисления: проверяйте каждое вещество внимательно.
Часто ошибаются в следующих случаях:Задание 14: Допишите и уравняйте:
Задание 15: Допишите и уравняйте:
- Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот.
Пример: в реакции свободный хлор часто теряется. Получается, что электроны к марганцу прилетели из космоса… - Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.Задание 16: Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:
Ответы и решения к заданиям с пояснениями.

Задание 1:
Задание 2:
Задание 3:
Так как в молекуле дихромата 2 атома хрома, то и электронов они отдают в 2 раза больше — т.е. 6.
Задание 4:
Так как в молекуле два атома азота, эту двойку надо учесть в электронном балансе — т.е. перед магнием должен быть коэффициент .
Задание 5:
Задание 6:
Так как цинк — амфотерный металл, в щелочном растворе он образует гидроксокомплекс. В результате расстановки коэффициентов обнаруживается, что вода должна присутствовать в левой части реакции:
Задание 7:
Задание 8:
В процессе составления баланса мы видим, что на 2 иона приходится 3 сульфат-иона. Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
Задание 9:
(перманганат не очень сильный окислитель в растворе; обратите внимание, что вода переходит в процессе уравнивания вправо!)
(конц.)
(концентрированная азотная кислота очень сильный окислитель)
Задание 10:
Не забудьте, что марганец принимает электроны, при этом хлор их должен отдать.
Хлор выделяется в виде простого вещества.
Задание 11:
Чем выше в подгруппе неметалл, тем более он активный окислитель, т.е. хлор в этой реакции будет окислителем. Йод переходит в наиболее устойчивую для него положительную степень окисления , образуя йодноватую кислоту.
Задание 12:
(пероксид — окислитель, т.к. восстановитель — )
(пероксид — восстановитель, т.к. окислитель — перманганат калия)
(пероксид — окислитель, т. к. роль восстановителя более характерна для нитрита калия, который стремится перейти в нитрат)
к. роль восстановителя более характерна для нитрита калия, который стремится перейти в нитрат)
Задание 13:
Задание 14:
Задание 15:
Задание 16:
Читаем дальше: Задача С2 на ЕГЭ по химии.
Задачи на сплавы и смеси на ЕГЭ по химии.
Задача С5 на ЕГЭ по химии. Определение формул органических веществ.
Таблица «Окислители и восстановители в неорганической химии»
НАИБОЛЕЕ ЧАСТО ПРИМЕНЯЕМЫЕ ВОССТАНОВИТЕЛИ И ОКИСЛИТЕЛИ
И ПРОДУКТЫ РЕАКЦИИ
ОКИСЛИТЕЛИ ВОССТАНОВИТЕЛИ
Сl2
0 = НСl
Вг2 = НВг
I2
HClO = HCl–
KClO3 = KCl–
0 = Н I
ГАЛОГЕНЫ И ИХ СОЕДИНЕНИЯ
НI– = I2
НВг = Br 2
0
НСl– = Cl2
0
СОЕДИНЕНИЯ СЕРЫ
h3SO4 >h3S–2 h3S–2 >S0
h3SO4 > S0 Na2SO3 >Na2SO4
Na2SO3 > S0 S0 >SO2
СОЕДИНЕНИЯ АЗОТА
HNO3 NO2 Nh4 > N2
0
HNO3 NO KNO2 > KNO3
(c KI, Zn)
(KBr, Cu)
(c Cu)
(c Zn)
(c Cu)
HNO3 NO
HNO3 N2O, Nh4
разбавл. (c Zn)
(c Zn)
разбавл.
KNO2 > NO
(в кислой среде)
СОЕДИНЕНИЯ МАРГАНЦА
KMnO4 > MnSO4 KMnO4 >MnO2
(в кислой среде – разб. h3SO4)
KMnO4 > MnO2
(в нейтральной среде)
KMnO4 > K2MnO4
(в сильнощелочной среде КОН)
MnO2 > MnSO4
(в кислой среде – разб. h3SO4)
K2Cr2O7 > Cr2(SO4)3 CrCl3 >K2CrO4
(в кислой среде – H SO) (в щелочной среде – КОН)
СОЕДИНЕНИЯ ХРОМА
СОЕДИНЕНИЯ СВИНЦА
PbO2 >Pb(NO3)2
(в кислой среде)
SnCl4 >SnCl2 SnCl2 > SnCl4
FeCl3 > FeCl2 FeCl2 > FeCl3
СОЕДИНЕНИЯ ОЛОВА
СОЕДИНЕНИЯ ЖЕЛЕЗА
СОЕДИНЕНИЯ МЫШЬЯКА
Al0 + OH– > (Al(OH)4) –
h3O2 + H+ = h3O h3O2 > O2
As2S3 > h4AsO4 + h3SO4 + NO
(в кислой среде – НNO3)
P0 + h3O > h4PO4
Zn0 + OH– > (Zn(OH)4)2–
РАСПРОСТРАНЕННЫЕ КИСЛОРОДСОЖЕРЖАЩИЕ КИСЛОТЫ
И КИСЛОТНЫЕ ОСТАТКИ
КИСЛОТЫ КИСЛОТНЫЙ ОСТАТОК
h3CO3 – УГОЛЬНАЯ СО3
НClO – ХЛОРНОВАТИСТАЯ ClO ГИПОХЛОРИД
2 – КАРБОНАТ
НClO2 – ХЛОРИСТАЯ ClO2
НClO3 – ХЛОРНОВАТАЯ ClO3
ХЛОРИТ
ХЛОРАТ
НClO4 – ХЛОРНАЯ ClO ПЕРХЛОРАТ
Н2CrO4 – ХРОМОВАЯ CrO4
2 ХРОМАТ
Н2Cr2O7 – ДИХРОМОВАЯ Cr2O7
НMnO4 – МАРГАНЦЕВАЯ MnO4
2 ДИХРОМАТ
ПЕРМАНГАНАТ
MnO4
2 МАНГАНАТ
HNO2 – АЗОТИСТАЯ NO2
НИТРИТ
HNO3 – АЗОТНАЯ NO3
HPO3 – МЕТАФОСФОРНАЯ PO3
НИТРАТ
МЕТАФОСФАТ
h4PO4 – ОРТОФОСФОРНАЯ PO4
3– ОРТОФОСФАТ
НPO4
2– ГИДРООРТОФОСФАТ
Н4Р2О7 – ДИФОСФОРНАЯ
SO2 *nh3O – ПОЛИГИДРАТ ДИОКСИДА СЕРЫ SO3
2 СУЛЬФИТ
(сернистая кислота)
HSO3
ГИДРОСУЛЬФИТ
Н2PO4
Р2О7
– ДИГИДРООРТОФОСФАТ
4 ДИФОСФАТ
h3SO4 – CЕРНАЯ SO4
2– CУЛЬФАТ
НSO4
Н2S2O7 – ДИСЕРНАЯ S2O7
h3SiO3 МЕТАКРЕМНИЕВАЯ SiO3
h5SiO4 – ОРТОКРЕМНИЕВАЯ SiO4
– ГИДРОCУЛЬФАТ
2– ДИСУЛЬФАТ
2 МЕТАСИЛИКАТ
4– ОРТОСИЛИКАТ
HCl – СОЛЯНАЯ Cl ХЛОРИД
HI – ИОДИСТОВОДОРОДНАЯ
I– ИОДИД
HBr – БРОМИСТОВОДОРОДНАЯ
HF – ПЛАВИКОВАЯ
HS – СЕРОВОДОРОДНАЯ
Br БРОМИД
F– ФТОРИД
S– СУЛЬФИД
HS– ГИДРОСУЛЬФИД
11kl. 5
5
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ЭЛЕМЕНТОВ
1А 2А 3А 4А 5А 6А 7А
H
2,10
Li Be B C N O F
0,97 1,47 2,01 2,50 3,07 3,5 4,1
Na Mg Al Si P S Cl
0,93 1,23 1,47 2,25 2,32 2,6
2,83
K Ca Ga Ge As Se Br
0,91 1,04 1,82 2,02 2,11 2,48
2,74
Rb Sr In Sn Sb Te I
0,98 0,99 1,49 1,72 1,82 2,02
2,21
Cs Ba Tl Pb Bi Po
At
0,86 0,97 1,44 1,55 1,67 1,76
1,90
ЭЛЕКТРОХИМИЧЕСИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Стрелка отвечает уменьшению восстановительной способности атомов
металлов или увеличению окислительной способности их катионов.
Li Rb К Cs Ва Sr Na Mg Be A l Mn Cr Zn Fe Cd Co N i Sn Pb (H 2) Bi Cu Hg Ag
Pt Au
>
Li Rb К Cs Ва Sr Na Mg Be A l Mn Cr Zn Fe Cd Co N i Sn Pb (H 2) Bi Cu Hg Ag
Pt Au
J–, Br –, S 2–, Cl –, OH –, SO 4
кислоты
>
АКТИВНОСТЬ УМЕНЬШАЕТСЯ
2– … другие кислородсодержащие
На выполнение работы даётся 2 часа (120мин)
А1 . Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
Вариант 1 3)+2
4 ) 4
l + Q; 2) N2 + O2
2↔ NO Q; 4) С2Н2(г) 2С + Н
↔
2 Q
2)НВг
3)Р4
4)СаС12
1)+4 2)2
А2. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) 0,N,C,B 2) Cl,S,P,Si 3) C,Si,Ge,Sn 4) B,C,0,F
A3 К основным гидроксидам относится каждое из двух веществ:
1) Fe(OH)3 и Сu(ОН)2 2)Fe(OH), и Сг(ОН)2 3) Fe(OH)2 и Са(ОН)2 4) Fe(OH)3 и Сг(ОН)3
А4. При обычных условиях из двухатомных молекул состоят
При обычных условиях из двухатомных молекул состоят
1) гелий и аргон 2) азот и неон 3) сера и фосфор 4) водород и кислород
А5 Ковалентная полярная связь характерна для
1)КС1
А6. Степень окисления + 3 азот проявляет в каждом из двух соединений:
1) HNO2 и NН3 2) Nh5C1 и N2O3 3) NaNО2 и NF3 4) HN03 и N2
А7. Кристаллическая решетка хлорида кальция
1) металлическая 2) молекулярная 3) ионная 4) атомная
А8.Амфотерным оксидом является
1) оксид серы (IV) 2) оксид алюминия 3) оксид лития 4) оксид фосфора (V)
А9.Алюминий не вытесняет водород из
1) HI 2) СН3СООН 3) h3SО4(paзб) 4) h3SО4(конц)
А10.Способны взаимодействовать между собой
1) SiО2 и Н2О 2) СО2 и h3SO4 3) СО2 и Са(ОН)2 4) Na2О и Са(ОН)2
All. Гидроксид кальция реагирует с каждым из двух веществ
1)НСl и СО2 2) HNО3 и MgO 3) НС1 и КОН 4)ВаСl2 и NаОН
А12. Нитрат алюминия в растворе взаимодействует с
1)КС1 2)Fe(NO3)2 3)MgCl2 4) Са(ОН)2
А13. В цепочке превращений
Nh4 + X = NH 4CI Nh5C1 + NaOH = Y
веществами X и Y соответственно являются
1) хлор и аммиак 2) хлороводород и аммиак 3) хлороводород и хлорная кислота 4) соляная кислота и азот
А14. Пентен1 и гексен1 являются
Пентен1 и гексен1 являются
1) одним и тем же веществом
3) геометрическими изомерами 4)
гомологами
А15. Этанол не взаимодействует с
1) Na 2) NaOH 3) CuO 4) HCl
A16. Гидратацией алкина может быть
получен
1) формальдегид 2) ацетильдегид 3) пропионовый альдегид 4) масляный альдегид
А17. Бензол реагирует с
1) бромной водой 2) хлороводородом 3) этанолом 4) азотной кислотой
А18. С перманганатом калия в растворе взаимодействуют
1) пропин, пропен, пропан
2)этан, этен, ацетилен
А19 . Реакцией обмена является взаимодействие
1) оксида кальция с азотной кислотой 2) угарного газа с
кислородом
3) этилена с водородом
магнием
А20. Для увеличения скорости химической реакции
2СО+О2 = 2СО + Q необходимо 1) увеличить концентрацию оксида углерода (II)
2) уменьшить концентрацию кислорода 3) понизить давление 4) понизить температуру
А21.Химическое равновесие сместится в одну сторону при повышении давления и понижении
температуры в системе:
1) N2 +3Н2 2↔ NН3 + Q;
А22 2 моль ионов образуется при полной диссоциации 1 моль
1)К3РO4
4) NaCl
А23 . Какое молекулярное уравнение соответствует сокращенному ионному уравнению H+ + ОН– = h3O
Какое молекулярное уравнение соответствует сокращенному ионному уравнению H+ + ОН– = h3O
1) ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl 2) h3SO4 + Cu(OH)2 = CuSO4 +
2h3O 3)NaOH + HNO3 = NaNO3 + h3O 4)h3SO4 + Ba(OH)2 = BaSO4 +2h3O
A24 Лакмус краснеет в растворе соли
1) FeSO4 2)KNO3 3)NaCl 4)Na2CO3
3) 2бутин, 2бутен, 1,3бутадиен
4) этин, 1пентен, пентан
2) структурными изомерами
4) соляной кислоты с
3) Н2 + Сl2 2НС↔
2)Na2S
3)К2СO А25 В результате реакции, термохимическое уравнение которой
2КСlО3(тв) = 2КС1(ТВ) + 3O2(г) + 91 кДж,
выделилось 182 кДж теплоты. Масса образовавшегося при этом кислорода равна
1)96 г. 2) 192 г 3)288 г 4) 576 г
В1 Установить соответствие между названием вещества и классом (группой) неорганических соединений к
которому оно принадлежит.
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС (ГРУППА) СОЕДИНЕНИЙ
А) оксид хрома (III) 1) основание
Б) гидросульфат натрия 2) основная соль
В) бромид магния 3) основный оксид
Г) оксид марганца (VII) 4) средняя соль
5) кислая соль
6) кислотный оксид
7) амфотерный оксид
8) амфотерный гидроксид
В2 Установите соответствие между формулами веществ и степенями окисления марганца
Формула вещества Степень окисления
А) MnSO 4 1) +1
Б) Mn 2O 7 2) +2
Б) K 2MnO 4 3) +4
Г) MnO 2 4) +6
5) +7
6) +8
нейтрали
окислен
этерификации
поликонденсации
ВЗ Пропен взаимодействует
1 ) натрием 2) бромной водой 3) метаном 4 ) бромоводородом 5) гидроксидом натрия
6) водой в присутствии катализатора
В4 Для предельных одноатомных спиртов характерны реакции
1)
2)
3)
зации
4)
ия
5)
6)
В5 Этиламин взаимодействует с: 1 ) пропаном 2 ) водой 3) азотной кислотой 4 ) толуолом
5) кислородом 6 ) этаном
В6 К 200 г 8% раствора хлорида натрия добавили 50 г воды. Массовая доля соли в
Массовая доля соли в
образовавшемся растворе равна _%
В7 Объём воздуха, необходимый для полного сгорания 5,4 л этана, равен _л.
С1 Используя метод электронного баланса, составьте уравнение реакции:
HClO 3 + SO 2 + H 2O = HCl + …
Определите окислитель и восстановитель.
Часть1 (каждый правильный ответ) – 1 балл
Часть 2 B1 B52 балла, В6,В7по1 баллу
Часть 3 C1 – 3 балла, С2 4балла, СЗ2 балла
дегидратации
гидратации
Качественная характеристика окислительно-восстановительных реакций
Среди химических реакций, в том числе и в природе, окислительно-восстановительные реакции являются самыми распространенными. К их числу относятся, например, фотосинтез, обмен веществ, биологические процессы, а также сжигание топлива, получение металлов и многие другие реакции.
Окислительно-восстановительные реакции издавна успешно использовались человечеством в различных целях, но сама электронная теория окислительно-восстановительных процессов появилась совсем недавно – в начале XX века.
Для того чтобы перейти к современной теории окисления-восстановления, необходимо ввести несколько понятий – это валентность, степень окисления и строение электронных оболочек атомов. Изучая такие разделы, как Периодический закон Д.И. Менделеева, основы строения атомов элементов и химическая связь и строение молекул, мы уже сталкивались с этими понятиями. Далее, рассмотрим их подробнее.
Валентность
Валентность – понятие сложное, которое возникло вместе с понятием химической связи и определяется, как свойство атомов присоединять или замещать определенное число атомов другого элемента, т.е. это способность атомов образовывать химические связи в соединениях.
Первоначально валентность определяли по водороду (его валентность принимали равной 1) или кислороду (валентность равна 2).
Позднее стали различать положительную и отрицательную валентность. Количественно, положительная валентность характеризуется количеством отданных атомом электронов, а отрицательная валентность – числом электронов, которые необходимо присоединить атому для реализации правила октета (т.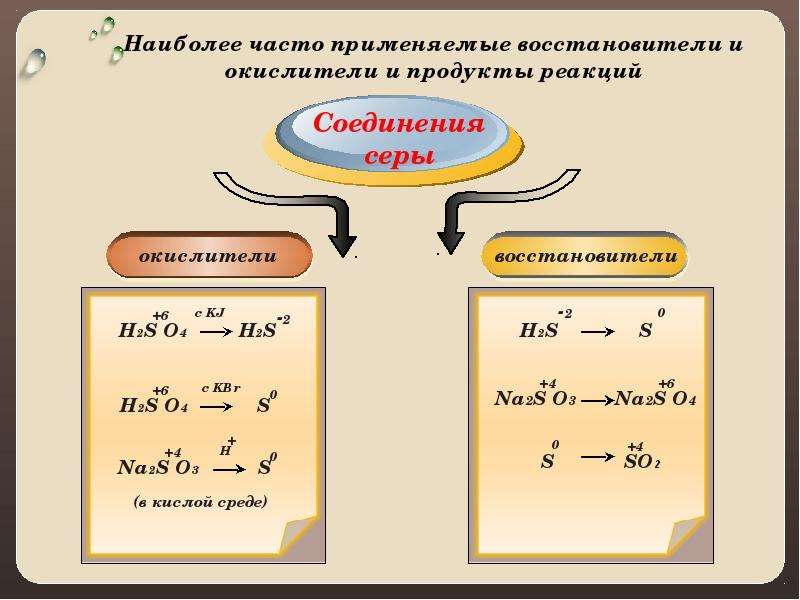 е. завершения внешнего энергетического уровня).
е. завершения внешнего энергетического уровня).
Позднее понятие валентности, стало сочетать в себе также и природу химических связей, возникающих между атомами в их соединении.
Как правило, высшая валентность элементов соответствует номеру группы в периодической системе.
Но, как и во всех правилах, есть исключения:
например, медь и золото находятся в первой группе периодической системы и их валентность должна быть равна номеру группы, т.е. 1, но в действительности же высшая валентность меди равна 2, а золота 3.
Степень окисления
Степень окисления иногда называют окислительным числом, электрохимической валентностью или состоянием окисления и является понятием условным.
Так, при вычислении степени окисления предполагается допущение, что молекулу составляют только ионы, хотя большинство соединений вовсе не являются ионными.
Количественно степень окисления атомов элемента в соединении определяется числом присоединенных к атому или смещенных от атома электронов.
Таким образом, при отсутствии смещения электронов степень окисления будет нулевая, при смещении электронов в сторону данного атома – отрицательная, при смещении от данного атома – положительная.
Как определить степень окисления атомов
Определяя степень окисления атомов необходимо следовать следующим правилам:
- В молекулах простых веществ и металлов степень окисления атомов равна 0.
- Водород почти во всех соединениях имеет степень окисления равную +1 (и только в гидридах активных металлов равную -1).
- Для атомов кислорода в его соединениях типична степень окисления -2 (исключения: OF2 и пероксиды металлов, степень окисления кислорода соответственно равна +2 и -1).

- Постоянную степень окисления имеют также атомы щелочных (+1) и щелочноземельных (+2) металлов, а также фтора (-1)
- В простых ионных соединениях, степень окисления равна по величине и знаку его электрическому заряду.
- Для ковалентного соединения, более электроотрицательный атом имеет степень окисления со знаком «-», а менее электроотрицательный – со знаком «+».
- Для комплексных соединений указывают степень окисления центрального атома.
- Сумма степеней окисления атомов в молекуле равна нулю.
Например, определим степень окисления селена Se в соединении H2SeO3
Так, степень окисления водорода равна +1, кислорода -2, а сумма всех степеней окисления равна 0, составим выражение, учитывая число атомов в соединении H2+SeхO3-2:
(+1)2+х+(-2)3=0, откуда
х=+4,
т. е. H2+Se+4O3-2
е. H2+Se+4O3-2
Окислитель и восстановитель
Зная какую величину имеет степень окисления элемента в соединении возможно предсказать его химические свойства и реакционную активность по отношению к другим соединениям, а также является ли данное соединение восстановителем или окислителем. Эти понятия в полной мере раскрываются в теории окисления-восстановления:
- Окисление – это процесс потери электронов атомом, ионом или молекулой, что приводит к повышению степени окисления.
Al0 -3e— = Al+3;
2O-2 -4e— = O20;
2Cl— -2e— = Cl20
- Восстановление – это процесс при котором атом, ион или молекула приобретают электроны, что приводит к понижению степени окисления.

Ca+2 +2e— = Ca0;
2H+ +2e— =H20
- Окислители – соединения, принимающие электроны в ходе химической реакции, а восстановители – отдающие электроны соединения. Восстановители во время реакции окисляются, а окислители – восстанавливаются.
- Сущность окислительно-восстановительных реакций – перемещение электронов (или смещение электронных пар) от одних веществ к другим, сопровождающихся изменением степеней окисления атомов или ионов. В таких реакциях один элемент не может окислиться без восстановления другого, т.к. передача электронов всегда вызывает и окисление и восстановление. Таким образом, общее число электронов, отнимаемое при окислении у одного элемента, совпадает с числом электронов, получаемых другим элементом при восстановлении.
Как определить является атом окислителем или восстановителем
- Так, если элементы в соединениях находятся в своих высших степенях окисления, то они будут проявлять только окислительные свойства, в связи с тем, что отдавать электроны они уже больше не могут.

- Напротив, если элементы в соединениях находятся в своих низших степенях окисления, то они проявляют только восстановительные свойства, т.к. присоединять электроны они больше не могут.
- Атомы элементов в промежуточной степени окисления, в зависимости от условий протекания реакции, могут быть как окислителями, так и восстановителями.
Приведем пример окислительно-восстановительные свойства серы:
Сера в своей высшей степени окисления +6 в соединении H2SO4, может проявлять только окислительные свойства, в соединении H2S – сера находится в своей низшей степени окисления -2 и будет проявлять только восстановительные свойства, а в соединении H2SO3 находясь в промежуточной степени окисления +4, сера может быть как окислителем, так и восстановителем.
На основании значений степеней окисления элементов можно предсказать вероятность реакции между веществами.
Понятно, что если оба элемента в своих соединениях находятся в высших или низших степенях окисления, то реакция между ними невозможна.
Реакция возможна, если одно из соединений может проявлять окислительные свойства, а другое – восстановительные.
Например, в HI и H2S как йод, так и сера находятся в своих низших степенях окисления (-1 и -2) и могут быть только восстановителями, следовательно, реагировать друг с другом не будут.
Зато они прекрасно будут взаимодействовать с H2SO4, для которой характерны восстановительные свойства, т.к. сера здесь находится в своей высшей степени окисления.
Важнейшие восстановители и окислители
Важнейшие восстановители и окислители представлены в следующей таблице.
Восстановители | |
Общая схема окисления восстановителя: M — ne → Mn+ | |
Нейтральные атомы | Все металлы, а также водород и углерод. Наиболее сильные восстановители – щелочные и щелочно-земельные металлы, а также лантаноиды и актиноиды. Слабые восстановители – благородные металлы – Au, Ag, Pt, Ir, Os, Pd, Ru, Rh. В главных подгруппах периодической системы восстановительная способность нейтральных атомов, растет с увеличением порядкового номера. |
Отрицательно заряженные ионы неметаллов | Отрицательно заряженные ионы являются сильными восстановителями, в связи с тем, что они могут отдавать как избыточные электроны, так и свои внешние электроны. Восстановительная способность, при одинаковом заряде, растет с увеличением радиуса атома. Например, I— более сильный восстановитель, чем Br— и Cl—. Восстановителями также могут быть S2-, Se2-, Te2— и другие. |
Положительно заряженные ионы металлов низшей степени окисления | Ионы металлов низшей степени окисления могут проявлять восстановительные свойства, если для них характерны состояния с более высокой степенью окисления. Например, Sn2+-2e— → Sn4+ Cr2+-e— → Cr3+ Cu+-e— → Cu2+ |
Сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления | Сложные или комплексные ионы, а также молекулы могут проявлять восстановительные свойства, если входящие в их состав атомы, находятся в промежуточной степени окисления. Например, SO32-, NO2—, AsO33-, [Fe(CN)6]4-, SO2, CO, NO и другие. |
Важнейшие восстановители в технике и лабораторной практике | Углерод (С), Оксид углерода (II) (СO2), Железо (Fe), Цинк (Zn), Алюминий (Al), Олово (Sn), Сернистая кислота (H2SO3), Сульфит (Na2SO3) и бисульфит натрия (Na2HSO3), Сульфид натрия (Na2S), Тиосульфат натрия (Na2S2O3), Водород (H2), Электрический ток |
Окислители | |
Общая схема восстановления окислителя Э + ne- → Эn- | |
Нейтральные атомы | Окислителями являются атомы р – элементов. Типичные неметаллы – фтор (F), кислород (O2), хлор (Cl2). Самые сильные окислители – галогены и кислород. В главных подгруппах 7, 6, 5 и 4 групп сверху вниз окислительная активность атомов понижается |
Положительно заряженные ионы металлов | Все положительно заряженные ионы металлов в разной степени проявляют окислительные свойства. Из них наиболее сильные окислители – это ионы в высокой степени окисления, например, Sn4+, Fe3+, Cu2+. Ионы благородных металлов даже в низкой степени окисления являются сильными окислителями. |
Сложные ионы и молекулы, содержащие атомы металла в состоянии высшей степени окисления | Типичными окислителями являются вещества, в состав которых входят атомы металла в состоянии наивысшей степени окисления. Например, KMnO4, K2Cr2O7, K2CrO4, HAuCl4. |
Сложные ионы и молекулы, содержащие атомы неметалла в состоянии положительной степени окисления | В основном это кислородсодержащие кислоты, а также соответствующие им оксиды и соли. Например, SO3, H2SO4, HClO, HClO3, NaOBr и другие. В ряду H2SO4 → H2SeO4 → H6TeO6 окислительная активность возрастает от серной к теллуровой кислоте. В ряду HClO — HClO2 — HClO3 — HClO4 HBrO — HBrO3 — HBrO4 HIO — HIO3 — HIO4, H5IO6 окислительная активность увеличивается справа налево, а усиление кислотных свойств происходит слева направо. |
Важнейшие восстановители в технике и лабораторной практике | Кислород (O2), Озон (O3), Перманганат калия (KMnO4), Хромовая (HCrO4) и Двухромовая кислоты (H2Cr2O7), Азотная кислота (HNO3), Азотистая кислота (HNO2), Серная кислота (конц) (H2SO4), Пероксид водорода (H2O2), Электрический ток, Хлорноватая кислота (HClO3), Диоксид марганца (MnO2), Диоксид свинца (PbO2), Хлорная известь (Ca(OCl)2), Растворы гипохлоритов калия (KOCl) и натрия (NaOCl), Гипобромид калия (KOBr), Гексацианоферрат (III) калия (K3[Fe(CN)6]. |
9.2. Восстановители и окислители
Для протекания химической ОВР необходимо
присутствие атомов, молекул или ионов,
взаимно противоположных по способности
отдавать или присоединять электроны.
Окислительно-восстановительные
свойства элементов зависят от их
положения в периодической системе
элементов Д. И. Менделеева и от их степени
окисления в составе веществ.
В периодах системы Д. И. Менделеева с
повышением порядкового номера элемента
восстановительные свойства простых
веществ понижаются, а окислительные
возрастают и становятся максимальными
у галогенов. Так, в 3-м периоде натрий –
самый активный восстановитель , а хлор-
самый активный окислитель. Объясняется
это строением атомов элементов (раздел
2.13).
В
подгруппах периодической системы Д.
И. Менделеева с повышением порядкового
номера элемента, т.е. сверху вниз,
возрастают восстановительные свойства
простых веществ, а окислительные —
убывают.
Так, в главной подгруппе VI
группы кислород – окислитель, сера
проявляет слабые окислительные свойства,
а теллур в некоторых реакциях уже
является восстановителем. Это объясняется
возрастанием сверху вниз числа
энергетических уровней атомов, их радиус
становится больше и, следовательно,
внешние электроны слабее удерживаются.
Атомы металлов присоединять электроны
не могут, они обладают только
восстановительными свойствами, поэтому
металлы часто называют элементами —
восстановителями. Атомы типичных
металлических элементов содержат на
внешнем уровне главным образом по 1-3
электрона. К ним относятся всеs-элементы, кроме водорода и гелия, всеd- иf–
элементы и часть р–элементов (Al,Ga,In,Tl).
Исключение: атомы оловаSn,
свинцаPbна внешнем уровне
имеют четыре электрона, атомы сурьмыSb, висмутаBi– пять, атомы полонияPo– шесть, но из-за большого атомного
радиуса обладают восстановительными,
металлическими свойствами.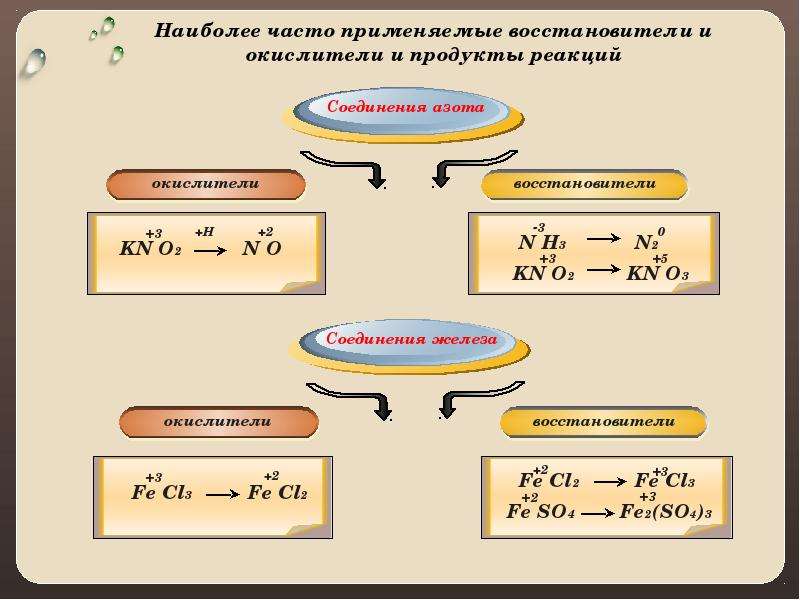
Для неметаллов более характерно
присоединение электронов, поэтому часто
неметаллы называют элементами –
окислителями. Атомы неметаллических
элементов содержат на внешнем уровне
4-7 электронов, как правило.Наиболее
активно присоединяют электроны атомы
фтора, который имеет саму высокую
электроотрицательность, является самым
сильным окислителем и в реакциях не
отдаёт электронов. За ним по величине
электроотрицательности и, следовательно,
по окислительной способности идёт
кислород, атомы которого могут отдавать
электроны только атомам фтора. Другие
неметаллы могут не только принимать,
но и отдавать электроны, а значит,
проявляют не только окислительные, но
и восстановительные свойства. Последние,
однако, у них выражены много слабее, чем
окислительные. Все зависит от того, с
каким веществом вступает в реакцию
данный неметалл. Если это восстановитель,
то атом неметалла проявляет окислительные
свойства. Например, сера является
окислителем в реакции взаимодействия
с железом; при взаимодействии с кислородом,
наоборот, сера проявляет свойства
восстановителя:
Fe
+ S = FeS S +O2
= SO2
Fe
— 2ē = Fe+2
S — 4ē = S+4
S
+ 2ē = S-2 O2
+ 4ē = 2O-2
Наиболее ярко восстановительные и
окислительные свойства выражены у
атомов элементов «крайних» групп
периодической системы – щелочных
металлов и галогенов. Лучшие восстановители
Лучшие восстановители
– щелочные металлы и наиболее активный
из них — франций. Лучшие окислители –
галогены и наиболее активный из них
фтор. По мере приближения к середине
периодической системы, к 4 группе, как
восстановительные, так и окислительные
свойства атомов становятся менее ярко
выраженными.
Элементы
в составе соединений, находящиеся в
высшей степени окисления, могут в ОВР
выступать только в качестве
окислителей, степень
окисления элемента может в этом случае
только понижаться. Соответственно
молекулы, ионы, содержащие атомы элементов
(металлов и неметаллов) в высшей степени
окисления, также являются окислителями.
+7
-2 +6 -2 +5 -2 +4 -2
Например,
MnO4—,
Cr2O72-,
NO3—,
CO2
и др.
Элементарные
ионы металлов (Na+, Ca2+,
Fe3+,
Сu2+,
и т. д.) в высшей степени окисления могут
д.) в высшей степени окисления могут
обладать только окислительными
свойствами, которые тем сильнее выражены,
чем меньше активность металла. Катионы
щелочных и щелочно-земельных металлов
почти не проявляют окислительных
свойств. Напротив, ионы малоактивных
металлов в высшей степени окисления
(Ag+,
Au3+,
и т.д.) – окислители.
Элементы
в составе соединений, находящиеся в
низшей степени окисления, могут быть,
наоборот, только
восстановителями; здесь
степень окисления может только
повышаться. Элементарные анионы проявляют
только восстановительные свойства.
Например, СI, Br,
I,
S2-,
теряя в процессе реакции электроны,
окисляются, соответственно, в свободный
хлор, бром, йод, серу. Чем активнее
неметаллы как окислители, тем менее
активны их элементарные анионы как
восстановители. Так, в ряду СI, Br,
I,
восстановительная способность возрастает.
Ионы металлов в низшей степени окисления
Mn2+, Fe2+,
Сu+,
Sn2+
также могут проявлять восстановительные
свойства.
Если
же элемент находится в промежуточной
степени окисления, то его атомы могут,
в зависимости от условий, как принимать,
так и отдавать электроны. В первом
случае степень окисления элемента
будет понижаться, во втором – повышаться.
Поэтому соединения,
содержащие элементы в промежуточных
степенях окисления, обладают
окислительно-восстановительной
двойственностью – способностью вступать
в реакции как с окислителями, так и
восстановителями.
Например, азотистая кислота HNO2
и ее соли, где степень окисления азота
равна (+3), вступают в реакции как с
сильными окислителями, так и с сильными
восстановителями. В качестве примеров
окислительно-восстановительной
двойственности азотистой кислоты и ее
солей можно привести реакции:
5
KNO2
+ 2 KMnO4
+ 3H2SO4
= 5 KNO3
+ 2 MnSO4
+ K2
SO4
+
3H2O
2HNO2
+ H2S
= 2NO
+ S
+ 2H2O
Наиболее часто применяемые восстановители
и окислители приведены в табл.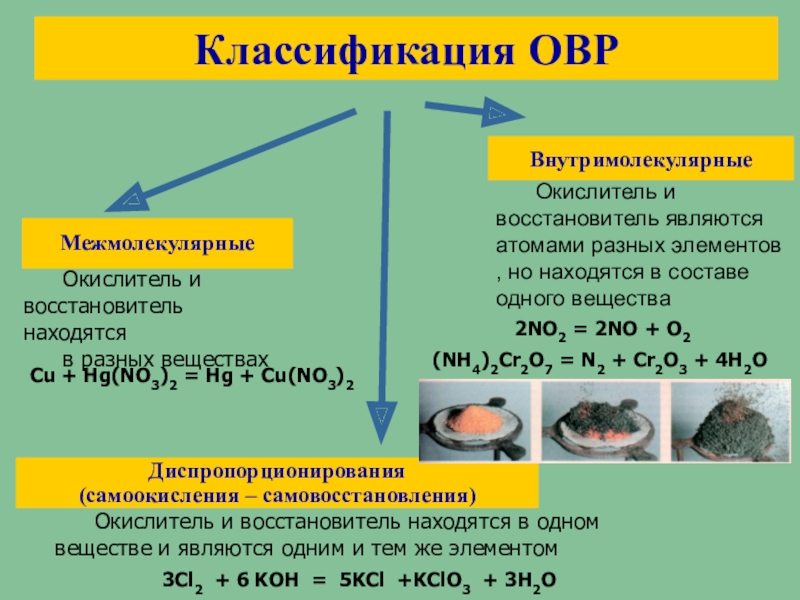 9.1.
9.1.
Таблица 9.1
Важнейшие окислители и восстановители — ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦІЇ.ЕЛЕКТРОЛІЗ
Часть И. ОБЩАЯ
ХИМИЯ
Раздел 7.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦІЇ.ЕЛЕКТРОЛІЗ
§
7.2. Важнейшие окислители и восстановители
Восстановители и окислители могут быть как
простыми веществами, то есть такими, которые состоят из одного элемента, так и
сложными.
Согласно их места в периодической
системе элементов атомы большинства металлов содержат на внешнем энергетическом
уровне 1-2 электрона. Поэтому в химических реакциях они отдают валентные электроны,
то есть окисляющиеся. Металлы проявляют восстановительные свойства.
В
периодах с увеличением порядкового номера элемента восстановительные свойства простых
веществ понижаются, а окислительные — возрастают и становятся максимальными у галогенов.
Например, в III периоде
натрий — самый активный в периоде восстановитель, а хлор — самый активный в периоде
окислитель.
У элементов главных подгрупп с
повышением порядкового номера усиливаются восстановительные свойства и ослабляются
окислительные. Лучшие восстановители-щелочные металлы, а самые активные из них — Fr
и Cs. Лучшие окислители — галогены.
Элементы главных подгрупп IV — VII групп (неметаллы) могут как отдавать, так и
присоединять электроны и проявлять восстановительные и окислительные свойства.
Таблица
7.1. Важнейшие восстановители и окислители
|
Восстановитель
|
Окислитель
|
|
Металлы,
|
Галогены
Перманганат
|
|
Йодоводнева
|
Дихромат
|
|
Хлорид
|
Кислород O2, озон О3, пероксид
Сульфатная
|
|
Нітритна
Фосфітна
|
Оксид
|
|
Альдегиды,
|
Хлорид
|
|
Катод под
|
Царская
|
Исключением является фтора. Он выявляет только
Он выявляет только
окислительные свойства, так как имеет наибольшую относительную электроотрицательности (см.
табл. 2.2).
Элементы побочных подгрупп (парных рядов
больших периодов) имеют металлический характер, поскольку на внешнем
энергетическом уровне их атомов содержатся 1-2 электроны. Поэтому их простые вещества
являются восстановителями. Следовательно, в отличие от простых веществ — металлов, которые выступают в
роли восстановителей, простые вещества — неметаллы проявляют себя и как окислители, и
как восстановители.
Окислительные или восстановительные свойства
сложных веществ зависят от степени окисления атома данного элемента.
+7
+4
+2
Например, КМnВ4, МnО2, MnSO4. В первой соединении марганец имеет
максимальную степень окисления и не может его больше повышать. Он может
только присоединять электроны, а значит, КМnO4 может быть только окисником. В
В
третий соединении в мангану самый низкий степень окисления — она может быть только
восстановителем. Во второй соединении марганец имеет промежуточную степень окисления (+4), а
поэтому она может быть и восстановителем, и окисником; все зависит от условий течения
реакции и веществ, с которыми будет взаимодействовать МnО2. Сложные анионы, содержащие атомы
с высокой степенью окисления, также являются окислителями.
+5
+7 +6 +5
+7
Например,
NO—3,
МnО—4,
Сr2О2-7,
СlO—4,
СlВ—4
т.д. Окислительные свойства обуславливает атом с высокой степенью окисления, а целый
анион, например не Мn+7, а весь анион МnO4-. Элементарные анионы проявляют только
восстановительные свойства. Например, F—, Сl— , r—, l—, S2- и др.
Важнейшие восстановители и окислители
представлены в табл. 7.1.
7.1.
Окисление и восстановление
Если один реагент в реакции удаляет кислород, вносит водород или вносит электроны, он считается восстановителем. Конечно, при этом он окисляется. Поскольку окисление и восстановление являются симметричными процессами, всегда протекающими вместе, в реакции всегда присутствует окислитель и восстановитель. Поскольку оба присутствуют всегда, зачем возиться с этой терминологией?
Если желаемой целью является восстановление какого-либо вещества, то полезно найти агент, который легко осуществит восстановление.Газообразный водород — очень полезный восстановитель, широко используемый для выделения чистых металлов восстановлением. Например, металлическая медь может быть получена восстановлением по реакции
CuO + H 2 -> Cu + H 2 O
Тот факт, что водород окисляется в процессе, является случайным — водород выполнил очень ценную задачу в качестве восстановителя.
Важные задачи решаются с помощью восстановителей в качестве проявителей фотографий и антиоксидантов. А в фотосинтезе восстановители выполняют задачу, необходимую для нашего выживания.
А в фотосинтезе восстановители выполняют задачу, необходимую для нашего выживания.
Об относительной силе восстановителей можно судить по их стандартным электродным потенциалам. Самые сильные восстановители указаны в стандартной таблице электродов.
| Катод (восстановление) Полуреакция | Стандартный потенциал E ° (вольт) |
| Li + (вод.) + E — -> Li (s) | -3.04 |
| K + (водн.) + E — -> K (s) | -2,92 |
| Ca 2+ (водн.) + 2e — -> Ca (s) | -2,76 |
| Na + (водн.) + E — -> Na (s) | -2,71 |
| Mg 2+ (водн.) + 2e — -> Mg (т) | -2,38 |
Литий, имеющий наибольшее отрицательное значение электродного потенциала, является сильнейшим восстановителем. По соглашению, стандартные электродные потенциалы — это потенциалы восстановления или тенденции к снижению. Согласно этому соглашению, самые сильные восстановители будут иметь большой отрицательный потенциал.
По соглашению, стандартные электродные потенциалы — это потенциалы восстановления или тенденции к снижению. Согласно этому соглашению, самые сильные восстановители будут иметь большой отрицательный потенциал.
Электрохимия — От чего зависит сила восстановителей и окислителей?
Поскольку соединения могут быть окислителями, такими как пермангенат калия (KMnO 4 ) и восстановителями LiH 4 , то, что делает соединение окислителем или восстановителем, — это таблицы окисления и восстановления.Поскольку окисление — это испускание электронов, а восстановление — это принятие электронов, как соотношение плюс и минус, если у вас есть таблица окисления, вы можете превратить ее в таблицу восстановления, перевернув таблицу, изменив знаки и перевернув уравнения . В любом случае, таблицы восстановления являются более стандартными, где самые сильные окислители имеют наиболее положительный / наибольший стандартный потенциал восстановления , а самые сильные восстановители имеют наибольший отрицательный / наименьший стандартный восстановительный потенциал .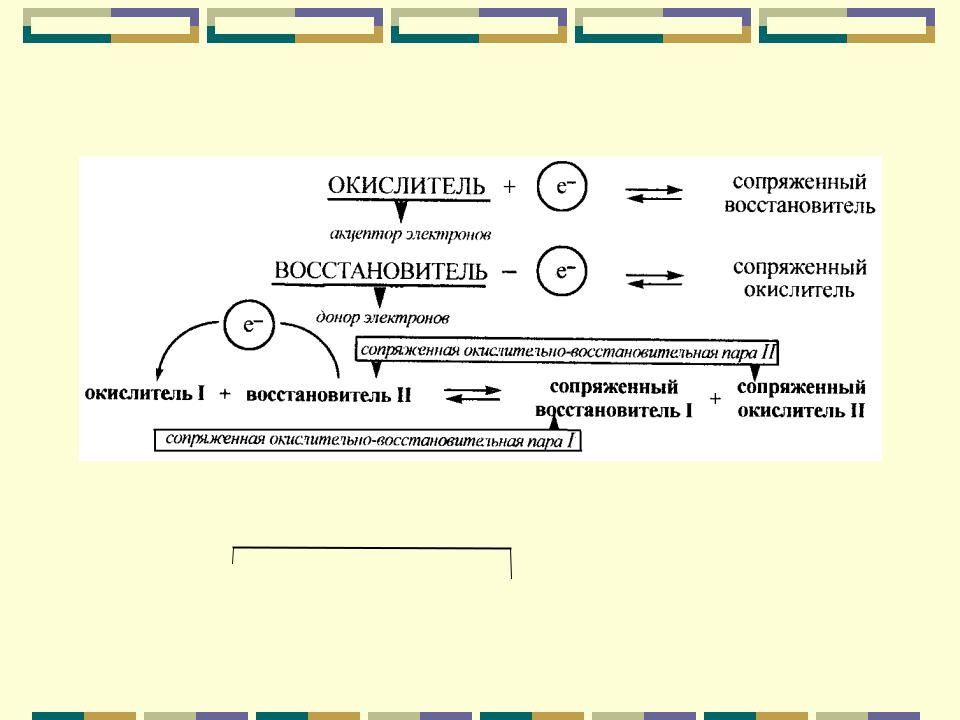 {-} (aq)} $ $ \ ce {M = Li, Na, K, Rb, Cs} $
{-} (aq)} $ $ \ ce {M = Li, Na, K, Rb, Cs} $
.
Цезий реагирует более бурно (во взрывной реакции, которая происходит, когда газообразный водород воспламеняется от тепла сильно экзотермической реакции), чем все металлы над ним, потому что он является более сильным восстановителем, восстанавливающим агентом, который окисляется больше, чем металлы над ним. потому что он имеет самую низкую энергию ионизации из-за экранирования, поскольку множество электронных оболочек вокруг ядра цезия уменьшают притяжение положительно заряженного ядра на электроны из-за электронов в электронных оболочках, отталкивающих валентные электроны дальше от ядра за счет как заряд отталкивания.Энергия ионизации — это просто измерение тепловой энергии, необходимой для того, чтобы атом потерял электрон в газовой фазе.
Это имеет смысл, но есть аномалии, которые следует учитывать, не следуя электрохимической серии экспериментов и просто пытаясь рационализировать такие вещи, как энергия ионизации, электроотрицательность и т.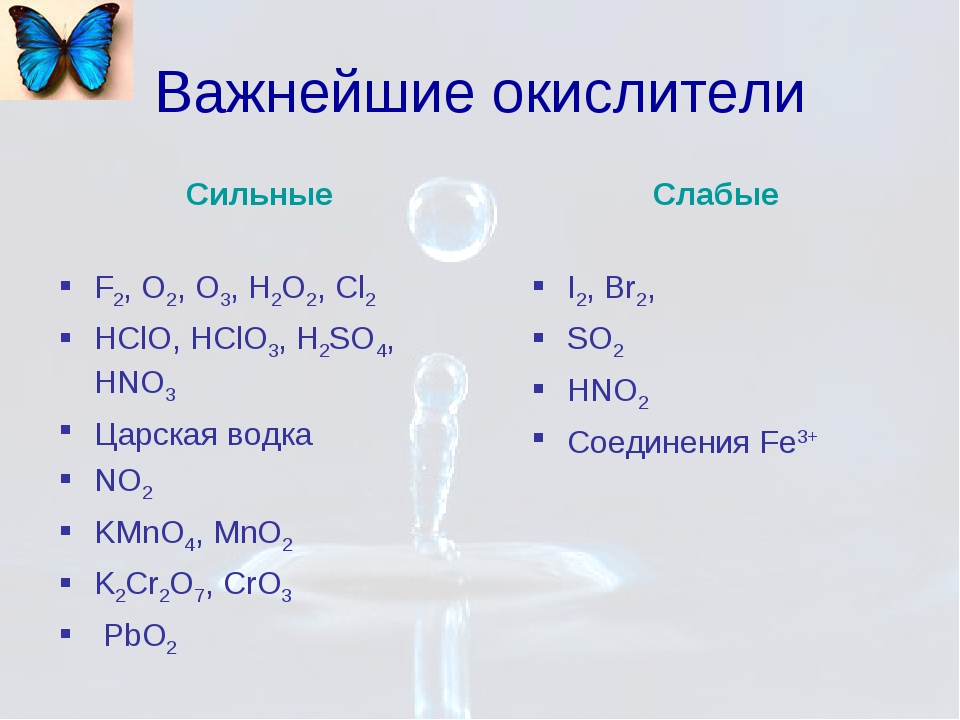 Д., С которых я начал свой ответ. Причина, по которой вы можете обнаружить аномалии, заключается в том, что потенциалы восстановления в напряжениях элементов рассчитываются в водном растворе, в то время как энергии ионизации рассчитываются в газовой фазе, хотя многие окислительно-восстановительные реакции происходят в жидких растворах, одна из разностей потенциалов является невозможностью при рассмотрении энергий ионизации следует учитывать энтальпию сольватации.Кроме того, электроотрицательные свойства Полинга можно вычислить, пропустив некоторые уравнения через элементы, учитывающие физику энергий ионизации, поэтому энергии ионизации и электроотрицательные свойства дают вам аналогичную перспективу.
Д., С которых я начал свой ответ. Причина, по которой вы можете обнаружить аномалии, заключается в том, что потенциалы восстановления в напряжениях элементов рассчитываются в водном растворе, в то время как энергии ионизации рассчитываются в газовой фазе, хотя многие окислительно-восстановительные реакции происходят в жидких растворах, одна из разностей потенциалов является невозможностью при рассмотрении энергий ионизации следует учитывать энтальпию сольватации.Кроме того, электроотрицательные свойства Полинга можно вычислить, пропустив некоторые уравнения через элементы, учитывающие физику энергий ионизации, поэтому энергии ионизации и электроотрицательные свойства дают вам аналогичную перспективу.
Глава 20 Раздел 4
Глава 20 Раздел 4
Когда мы обсуждали гальванические элементы, вы, возможно, задавались вопросом, почему электроны самопроизвольно проходят через внешнюю цепь. Например, в ячейке, показанной на рис. 20.5, что заставляет электроны покидать Zn-анод, проходить через внешнюю цепь и попадать на медный катод? В этом разделе мы исследуем «движущую силу» гальванического элемента, который проталкивает электроны через внешнюю цепь.
В простом смысле, мы можем сравнить поток электронов, вызванный гальванической ячейкой, с потоком воды в водопаде (рис. 20.7). Вода спонтанно течет через водопад из-за разницы в потенциальной энергии между вершиной водопада и потоком внизу. Аналогичным образом электроны текут от анода гальванического элемента к катоду из-за разницы в потенциальной энергии. Потенциальная энергия электронов на аноде выше, чем на катоде, и они самопроизвольно перетекают по внешней цепи от анода к катоду.
Разница в потенциальной энергии на электрический заряд (разность потенциалов ) между двумя электродами измеряется в вольтах. Один вольт (В) — это разность потенциалов, необходимая для передачи 1 Дж энергии заряду в 1 кулон (Кл):
Разность потенциалов между двумя электродами гальванического элемента обеспечивает движущую силу, которая толкает электроны через внешнюю цепь. Поэтому мы называем эту разность потенциалов электродвижущей силой («вызывающей движение электронов») силой или ЭДС . ЭДС ячейки, обозначенная E ячейка , называется потенциалом ячейки . Поскольку элемент E измеряется в вольтах, мы часто называем его напряжением элемента . Для любой клеточной реакции, которая протекает спонтанно, например, в гальванической ячейке, потенциал клетки будет положительным.
ЭДС ячейки, обозначенная E ячейка , называется потенциалом ячейки . Поскольку элемент E измеряется в вольтах, мы часто называем его напряжением элемента . Для любой клеточной реакции, которая протекает спонтанно, например, в гальванической ячейке, потенциал клетки будет положительным.
ЭДС конкретного гальванического элемента зависит от конкретных реакций, которые происходят на катоде и аноде, от концентраций реагентов и продуктов, а также от температуры, которая, как мы полагаем, составляет 25 ° C, если не указано иное.В этом разделе мы сосредоточимся на элементах, которые работают при 25 ° C в стандартных условиях . Напомним из Раздела 19.5, что стандартные условия включают 1 M концентраций реагентов и продуктов в растворе и давление 1 атм для тех, которые являются газами (Таблица 19.3). В стандартных условиях ЭДС называется стандартной ЭДС или стандартным потенциалом ячейки и обозначается E ° ячейкой . Для гальванического элемента Zn / Cu на рисунке 20.5, например, стандартный потенциал ячейки при 25 ° C составляет 1,10 В:
Для гальванического элемента Zn / Cu на рисунке 20.5, например, стандартный потенциал ячейки при 25 ° C составляет 1,10 В:
Напомним, что верхний индекс ° обозначает стандартные условия. (Для получения дополнительной информации см. Раздел 5.7)
Стандартные восстановительные возможности
Потенциал гальванического элемента зависит от конкретных задействованных катодных и анодных полуэлементов. В принципе, мы могли бы свести в таблицу стандартные потенциалы ячейки для всех возможных комбинаций катод / анод. Однако нет необходимости браться за эту трудную задачу.Скорее, мы можем присвоить стандартный потенциал каждой отдельной полуячейке, а затем использовать эти потенциалы полуячейки для определения E ° ячейки .
Потенциал ячейки — это разность потенциалов двух электродов, один из которых связан с катодом, а другой — с анодом. По соглашению, потенциал, связанный с каждым электродом, выбирается как потенциал восстановления, происходящего на этом электроде. Таким образом, стандартные электродные потенциалы приведены в таблице для реакций восстановления; это стандартных восстановительных потенциалов , обозначенные E ° красный .Потенциал ячейки, E ° , ячейка , определяется стандартным восстановительным потенциалом катодной реакции, E ° красный (катод), минус стандартный восстановительный потенциал анодной реакции, E ° красный (анод):
Таким образом, стандартные электродные потенциалы приведены в таблице для реакций восстановления; это стандартных восстановительных потенциалов , обозначенные E ° красный .Потенциал ячейки, E ° , ячейка , определяется стандартным восстановительным потенциалом катодной реакции, E ° красный (катод), минус стандартный восстановительный потенциал анодной реакции, E ° красный (анод):
[20,8]
Вскоре мы обсудим уравнение 20.8 более подробно.
Поскольку каждый гальванический элемент состоит из двух полуэлементов, невозможно напрямую измерить стандартный восстановительный потенциал полуреакции.Однако, если мы приписываем стандартный восстановительный потенциал определенной эталонной полуреакции, мы можем затем определить стандартные восстановительные потенциалы других полуреакций относительно этого эталона. Эталонная полуреакция — это восстановление H + ( водн.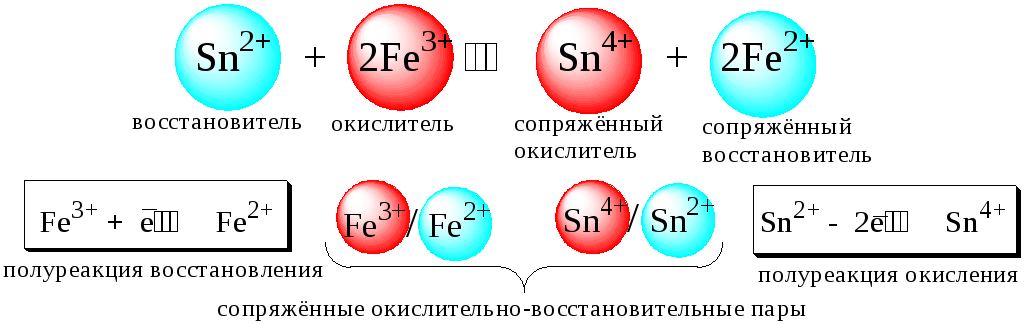 ) до H 2 ( г ) в стандартных условиях, которому приписан стандартный потенциал восстановления ровно 0 В:
) до H 2 ( г ) в стандартных условиях, которому приписан стандартный потенциал восстановления ровно 0 В:
[20,9]
Электрод, предназначенный для производства этой полуреакции, называется стандартным водородным электродом (SHE).SHE состоит из платиновой проволоки, соединенной с куском платиновой фольги, покрытой мелкодисперсной платиной, которая служит инертной поверхностью для реакции. Электрод заключен в стеклянную трубку, чтобы газообразный водород мог пузыриться над платиной, а раствор содержит H + ( водн. ) при стандартных (1 M ) условиях.
На рисунке 20.8 показан гальванический элемент с использованием SHE и стандартного электрода Zn 2 + / Zn. Спонтанная реакция показана на рисунке 20.1, а именно окисление Zn и восстановление H + :
РИСУНОК 20.8 Гальванический элемент с использованием стандартного водородного электрода.
Мы делаем два важных наблюдения об этой ячейке: (1) электрод Zn 2 + / Zn является анодом, а SHE — катодом, и (2) напряжение ячейки составляет 0,76 В. При использовании определенного стандартного уменьшения потенциал H + ( E ° красный = 0) и уравнение 20.8, мы можем определить стандартный потенциал восстановления для полуреакции Zn 2 + / Zn:
Таким образом, стандартный потенциал снижения -0.76 В можно отнести к восстановлению Zn 2 + до Zn:
Обратите внимание, что мы записываем реакцию как восстановление, хотя она «протекает в обратном направлении», как окисление, в ячейке на рис. 20.8; всякий раз, когда мы приписываем потенциал полуреакции, мы записываем реакцию как сокращение.
Стандартные потенциалы восстановления для других полуреакций могут быть установлены из потенциалов других клеток аналогично тому, как это используется для полуреакции Zn 2 + / Zn.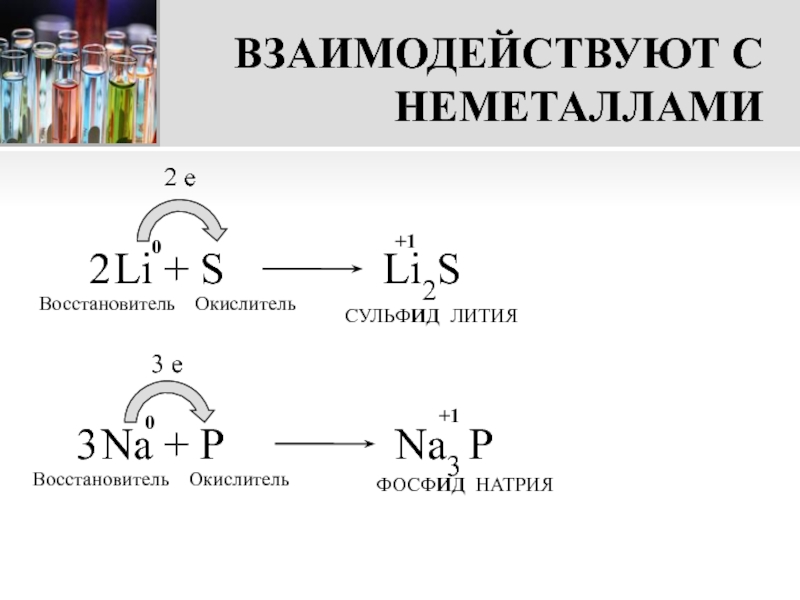 В таблице 20.1 перечислены некоторые стандартные восстановительные потенциалы; более полный список можно найти в Приложении E. Эти стандартные восстановительные потенциалы, часто называемые потенциалами полуэлемента , можно объединить для расчета ЭДС большого разнообразия гальванических элементов.
В таблице 20.1 перечислены некоторые стандартные восстановительные потенциалы; более полный список можно найти в Приложении E. Эти стандартные восстановительные потенциалы, часто называемые потенциалами полуэлемента , можно объединить для расчета ЭДС большого разнообразия гальванических элементов.
Поскольку электрический потенциал измеряет потенциальную энергию на электрический заряд, стандартные восстановительные потенциалы являются интенсивными свойствами. Таким образом, изменение стехиометрического коэффициента в полуреакции не влияет на значение стандартного восстановительного потенциала. Например, E ° красный для восстановления 2 моль Zn 2 + то же самое, что и для восстановления 1 моль Zn 2 + :
Пример упражнения 20.5
Для гальванической ячейки Zn-Cu 2 + , показанной на рисунке 20.5, ячейка E ° = 1,10 В и Zn-электрод является анодом. Учитывая, что стандартный потенциал восстановления Zn 2 + составляет -0.76 В, рассчитайте E ° красный для восстановления Cu 2 + до Cu:
Учитывая, что стандартный потенциал восстановления Zn 2 + составляет -0.76 В, рассчитайте E ° красный для восстановления Cu 2 + до Cu:
РЕШЕНИЕ Мы используем уравнение 20.8 и предоставленную нам информацию:
Обратите внимание, что этот стандартный потенциал снижения является одним из перечисленных в Таблице 20.1.
Практическое упражнение
Гальванический элемент основан на следующих полуреакциях:
Стандартная ЭДС для этой ячейки равна 1.46 В. Используя данные в таблице 20.1, рассчитайте E ° красный для уменьшения In 3 + до In + . Ответ: +0,40 В
Пример упражнения 20.6
Используя стандартные восстановительные потенциалы, перечисленные в таблице 20.1, рассчитайте стандартную ЭДС для клеточной реакции, описанной в примере упражнения 20. 4:
4:
РЕШЕНИЕ Нашим первым шагом в решении этой проблемы является определение полуреакций, которые происходят на катоде и аноде:
В таблице 20.1 видно, что стандартный потенциал восстановления для восстановления Cr 2 O 7 2 — до Cr 3 + составляет 1,33 В, а стандартный потенциал восстановления для восстановления I 2 до I — составляет 0,54 В. Мы используем эти значения в уравнении 20.8:
Хотя полуреакция йодида на аноде должна быть умножена на 3, чтобы получить сбалансированное уравнение реакции, значение E ° красный равно , а не , умноженному на 3.Как мы уже отмечали, стандартный восстановительный потенциал — это интенсивное свойство; он не зависит от конкретных стехиометрических коэффициентов.
Потенциал ячейки 0,79 В является положительным числом. Как отмечалось ранее, для работы гальванический элемент должен иметь положительную ЭДС.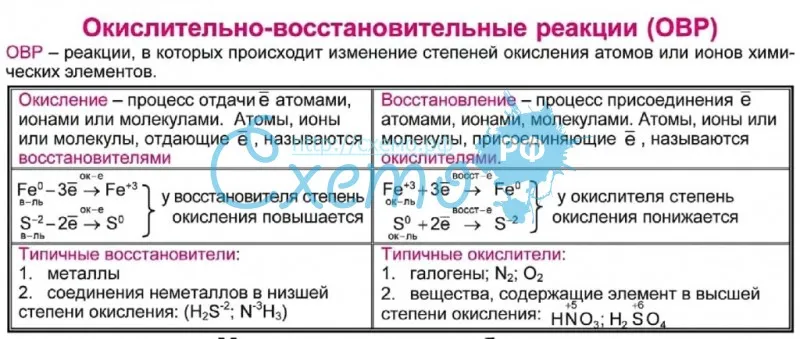
Практическое упражнение
Используя данные в Таблице 20.1, рассчитайте стандартную ЭДС для ячейки, которая использует следующую общую реакцию ячейки:
Ответ: 2.20 В
Теперь мы можем более подробно обсудить уравнение 20.8. Стандартные потенциалы понижения служат мерой движущей силы для того, чтобы произошло снижение: чем больше положительное значение E ° красный , тем больше движущая сила для уменьшения. Чтобы элемент работал самопроизвольно, реакция на катоде должна иметь более положительное значение E ° красный , чем реакция на аноде; большая движущая сила катодной полуреакции может быть использована, чтобы заставить анодную реакцию происходить в обратном направлении, как окисление.Разница между стандартными потенциалами восстановления двух реакций — это «избыточная» движущая сила, которую можно использовать для проталкивания электронов через внешнюю цепь. Таким образом, потенциал ячейки, E ° ячейка , представляет собой разность между стандартным восстановительным потенциалом катодной реакции E ° красный (катод) и потенциалом анодной реакции E ° . красный (анод). Эта взаимосвязь графически проиллюстрирована на рисунке 20.9, на котором стандартные потенциалы восстановления показаны на шкале с более положительными значениями E ° красный выше по шкале (как в таблице 20.1). В любом гальваническом элементе катодная реакция будет той, которая выше по шкале, а разница между потенциалами будет потенциалом ячейки.
красный (анод). Эта взаимосвязь графически проиллюстрирована на рисунке 20.9, на котором стандартные потенциалы восстановления показаны на шкале с более положительными значениями E ° красный выше по шкале (как в таблице 20.1). В любом гальваническом элементе катодная реакция будет той, которая выше по шкале, а разница между потенциалами будет потенциалом ячейки.
РИСУНОК 20.9 Стандартный потенциал гальванического элемента измеряет разность стандартных восстановительных потенциалов катодной и анодной реакций: E ° ячейка = E ° красный (катод) — E ° красный (анод).В гальваническом элементе катодная реакция всегда имеет более положительное (или менее отрицательное) значение для E ° красный .
Пример упражнения 20.7
Гальванический элемент основан на следующих двух стандартных полуреакциях:
Используя данные в Приложении E, определите (a), , полуреакции, которые происходят на катоде и аноде, и (b), — стандартный потенциал ячейки.
РЕШЕНИЕ (a) В Приложении E мы видим, что E ° красный (Cd 2 + / Cd) = -0.403 В и E ° красный (Sn 2 + / Sn) = -0,136 В. Стандартный потенциал восстановления для Sn 2 + более положительный (менее отрицательный), чем для Cd 2 + ; следовательно, восстановление Sn 2 + выше в масштабе рисунка 20.9, и это реакция, которая происходит на катоде:
(b) Потенциал ячейки определяется уравнением 20.8:
Обратите внимание, что неважно, что значения E ° красный обеих полуреакций отрицательны; отрицательные значения просто указывают на сравнение этих сокращений с контрольной реакцией, восстановление H + ( водн. ).Потенциал элемента положительный, как и должно быть у гальванического элемента.
Практическое упражнение
Гальванический элемент основан на полуячейке Co 2 + / Co и полуячейке AgCl / Ag.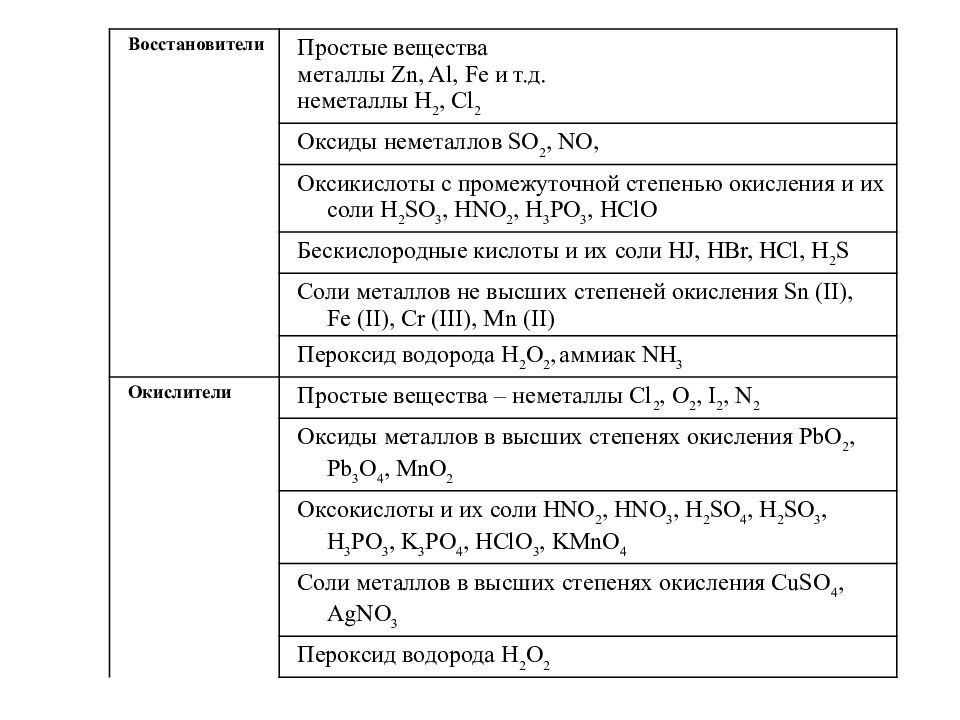 (а) Какая реакция происходит на аноде? (б) Каков стандартный потенциал ячейки?
(а) Какая реакция происходит на аноде? (б) Каков стандартный потенциал ячейки?
Ответы: (a) Co Co 2 + + 2e — ; (б) 1,13 В
Окисляющие и восстанавливающие агенты
До сих пор мы использовали табулирование стандартных восстановительных потенциалов в качестве инструмента для исследования гальванических элементов.Мы также можем использовать значения E ° красный как ценную помощь в понимании химии водных реакций. Вспомните, например, реакцию между Zn ( s ) и Cu 2 + ( водн. ), показанную на рисунке 20.3. Эта общая реакция такая же, как и реакция, лежащая в основе гальванической ячейки Zn / Cu на рисунке 20.4:
Металлический цинк окисляется, и Cu 2 + ( водн. ) восстанавливается в этой реакции. Однако, поскольку эти вещества находятся в прямом контакте, мы не производим полезные электрические работы; прямой контакт приводит, по сути, к «короткому замыканию» ячейки. Тем не менее, движущая сила реакции на рисунке 20.3 такая же, как на рисунке 20.4: потому что значение E ° красный для восстановления Cu 2 + (0,34 В) более положительно, чем значение E ° красный Значение для восстановления Zn 2 + (-0,76 В), восстановление Cu 2 + ( водн. ) Zn ( s ) является спонтанным процесс. (Можно также сделать аналогичное утверждение, что окисление Zn ( s ) Cu 2 + ( водн. ) является спонтанным процессом.)
Тем не менее, движущая сила реакции на рисунке 20.3 такая же, как на рисунке 20.4: потому что значение E ° красный для восстановления Cu 2 + (0,34 В) более положительно, чем значение E ° красный Значение для восстановления Zn 2 + (-0,76 В), восстановление Cu 2 + ( водн. ) Zn ( s ) является спонтанным процесс. (Можно также сделать аналогичное утверждение, что окисление Zn ( s ) Cu 2 + ( водн. ) является спонтанным процессом.)
Мы можем обобщить взаимосвязь между значением E ° красный и спонтанностью окислительно-восстановительных реакций: Чем положительнее значение E ° красный для полуреакции, тем больше склонность реагента к полуреакция должна быть восстановлена и, следовательно, окислена другая разновидность. Изучение полуреакций в таблице 20.1 показывает, что F 2 является наиболее легко восстанавливаемым веществом и, следовательно, самым сильным окислителем из списка:
Среди наиболее часто используемых окислителей — галогены, O 2 , и оксианионы, такие как MnO 4 — , Cr 2 O 7 2 — и NO 3 — , центральные атомы которого имеют высокую положительную степень окисления. Обратите внимание в Таблице 20.1, что все эти виды претерпевают редукцию с большими положительными значениями E ° красный .
Обратите внимание в Таблице 20.1, что все эти виды претерпевают редукцию с большими положительными значениями E ° красный .
Ион лития, Li + , представляет собой наиболее сложный для восстановления вид и поэтому является самым плохим окислителем:
Тот факт, что Li + так трудно восстановить, говорит нам о том, что обратная реакция, окисление Li ( s ) до Li + ( водн. ), является очень благоприятной реакцией. Металлический литий имеет большую тенденцию передавать электроны другим частицам; это самый сильный восстановитель среди веществ, перечисленных в Таблице 20.1. Обычно используемые восстановители включают H 2 и активные металлы, такие как щелочные металлы и щелочноземельные металлы. Другие металлы, которые имеют отрицательные значения E ° красный для восстановления соответствующего катиона — например, Zn и Fe, — также часто используются в качестве восстановителей. Растворы восстановителей трудно хранить в течение длительного времени из-за повсеместного присутствия O 2 , хорошего окислителя. Например, растворы проявителя, используемые в фотографии, являются мягкими восстановителями; у них есть только ограниченный срок хранения, потому что они легко окисляются O 2 из воздуха.
Растворы восстановителей трудно хранить в течение длительного времени из-за повсеместного присутствия O 2 , хорошего окислителя. Например, растворы проявителя, используемые в фотографии, являются мягкими восстановителями; у них есть только ограниченный срок хранения, потому что они легко окисляются O 2 из воздуха.
Мы видим, что список значений E ° красный обеспечивает упорядочение способности веществ действовать как окислители или восстановители. Эта взаимосвязь представлена на рисунке 20.10. Вещества, являющиеся сильными окислителями, восстанавливаются до веществ, являющихся слабыми восстановителями, и наоборот. Эта обратная зависимость между окисляющей и восстанавливающей силой аналогична обратной зависимости между силой кислот и оснований (рис. 16.7).
РИСУНОК 20.10 Стандартные потенциалы восстановления, E ° красный , перечисленные в таблице 20.1, связаны со склонностью веществ служить окислителями или восстановителями. Виды на левой стороне полуреакций могут действовать как окислители, а вещества на правой стороне полуреакций могут выступать в качестве восстановителей. По мере того, как E ° красный становится более положительным, окислительная сила компонента слева увеличивается. По мере того, как E ° красный становится более отрицательным, восстанавливающая сила вида справа увеличивается.
Виды на левой стороне полуреакций могут действовать как окислители, а вещества на правой стороне полуреакций могут выступать в качестве восстановителей. По мере того, как E ° красный становится более положительным, окислительная сила компонента слева увеличивается. По мере того, как E ° красный становится более отрицательным, восстанавливающая сила вида справа увеличивается.
Чтобы помочь вам вспомнить взаимосвязь между силой окислителя и восстановителя, вспомните очень экзотермическую реакцию между металлическим натрием и газообразным хлором с образованием хлорида натрия (рис. 8.2). В этой реакции Cl 2 ( г, ) восстанавливается (он служит сильным окислителем), а Na ( s ) окисляется (он служит сильным восстановителем). Продукты этой реакции — ионы Na + и Cl — — являются очень слабыми окислителями и восстановителями соответственно.
Пример упражнения 20.8
Какой из следующих видов в Таблице 20. 1 является наиболее сильным окислителем: NO 3 — ( водн. ), Ag + ( водн. ), Cr 2 O 7 2 — ( водн. )?
1 является наиболее сильным окислителем: NO 3 — ( водн. ), Ag + ( водн. ), Cr 2 O 7 2 — ( водн. )?
РЕШЕНИЕ Самым сильным окислителем будет вещество, которое имеет наибольшую тенденцию к восстановлению, что мы можем оценить, сравнив значения E ° красный из Таблицы 20.1:
Поскольку стандартный восстановительный потенциал Cr 2 O 7 2 – является наиболее положительным, Cr 2 O 7 2 – является самым сильным окислителем из трех.
Практическое упражнение
Используя таблицу 20.1, определите, какой из следующих видов является самым сильным восстановителем: I — ( водн. ), Fe ( s ), Mn 2 + ( водн. ). Ответ: Fe ( s )
реакция окисления-восстановления | Определение, примеры и факты
Основные классификации
Большинство окислительно-восстановительных (окислительно-восстановительных) процессов включают перенос атомов кислорода, атомов водорода или электронов, причем все три процесса имеют две важные характеристики: (1) они связаны, т. Е. , в любой реакции окисления происходит обратное восстановление, и (2) они включают характерное чистое химическое изменение — i.е., атом или электрон переходит от одной единицы вещества к другой. И взаимность, и чистое изменение проиллюстрированы ниже на примерах трех наиболее распространенных типов окислительно-восстановительных реакций.
Е. , в любой реакции окисления происходит обратное восстановление, и (2) они включают характерное чистое химическое изменение — i.е., атом или электрон переходит от одной единицы вещества к другой. И взаимность, и чистое изменение проиллюстрированы ниже на примерах трех наиболее распространенных типов окислительно-восстановительных реакций.
Углерод реагирует с оксидом ртути (II) (соединение, в котором ртуть имеет связывающую способность, выраженную как +2; см. Ниже Изменение состояния окисления) с образованием диоксида углерода и металлической ртути. Эту реакцию можно записать в виде уравнения:
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчас
Углерод, получая кислород, окисляется; оксид ртути (II), теряя кислород, подвергается дополнительному восстановлению; а чистым изменением является перенос двух атомов кислорода от звеньев оксида ртути (II) к атому углерода.
Атомы водорода переходят от гидразина, соединения азота и водорода, к кислороду в следующей реакции:
Гидразин, теряя водород, окисляется до молекулярного азота, а кислород, получая водород, восстанавливается до воды.
Металлический цинк и ион меди (II) реагируют в водном растворе, образуя металлическую медь и водный (обозначенный как водный) ион цинка в соответствии с уравнением
При переносе двух своих электронов металлический цинк окисляется , превращаясь в водный ион цинка, в то время как ион меди (II), приобретая электроны, восстанавливается до металлической меди. Чистое изменение — это перенос двух электронов, потерянных цинком и приобретенных медью.
Из-за их взаимодополняемости процессы окисления и восстановления вместе называются окислительно-восстановительными реакциями.Реагент, вызывающий окисление, называется окислителем, и сам этот реагент восстанавливается восстановителем. В приведенных выше примерах оксид ртути (II), кислород и ион меди (II) являются окислителями, а углерод, гидразин и цинк — восстановителями.
Стандартные понижающие потенциалы | Безграничная химия
Стандартные понижающие потенциалы
Стандартные восстановительные потенциалы обеспечивают систематическое измерение тенденции к снижению различных молекул.
Цели обучения
Напомним, что положительный потенциал восстановления указывает на термодинамически благоприятную реакцию по сравнению с восстановлением протона до водорода
Основные выводы
Ключевые моменты
- Восстановительный потенциал измеряет тенденцию молекулы к сокращению за счет поглощения новых электронов.
- Стандартный восстановительный потенциал — это восстановительный потенциал молекулы при определенных стандартных условиях.
- Стандартные восстановительные потенциалы могут быть полезны при определении направленности реакции.
- Восстановительный потенциал данного вещества может считаться отрицательным по отношению к окислительному потенциалу.
Ключевые термины
- уменьшить : добавить электроны / водород или удалить кислород.
- стандартный водородный электрод : окислительно-восстановительный электрод, который составляет основу термодинамической шкалы окислительно-восстановительных потенциалов; используется в качестве стандарта, по которому измеряются другие электроды.
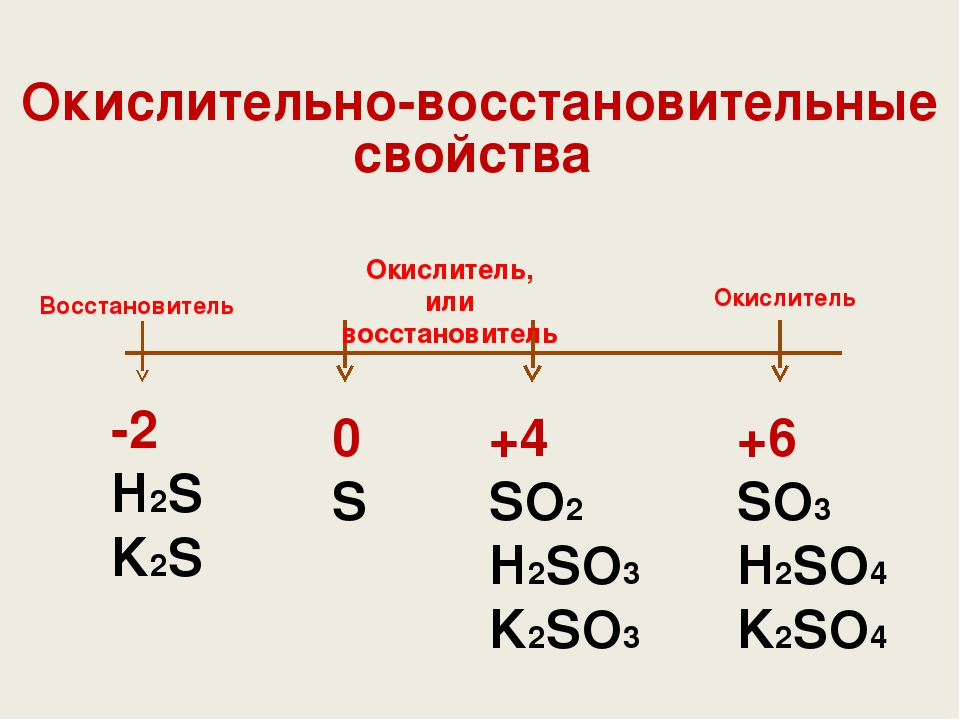
Понижающий потенциал
Восстановительный потенциал (также известный как окислительно-восстановительный потенциал, окислительно-восстановительный потенциал или E h ) измеряет склонность химического вещества приобретать электроны и тем самым уменьшаться.Потенциал восстановления измеряется в вольтах (В) или милливольтах (мВ). У каждого вида есть свой собственный восстановительный потенциал. Чем более положительный потенциал, тем больше у вида сродство к электронам или тем сильнее вид сокращается.
Окисление-восстановление в гальваническом элементе : В этом гальваническом элементе цинк восстанавливает катионы меди. В результате образуются катионы цинка и нейтральная металлическая медь.
Стандартный потенциал восстановления (E 0 ) измеряется при стандартных условиях:
- 25 ° С
- Концентрация 1 M для каждого иона, участвующего в реакции
- Парциальное давление 1 атм для каждого газа, участвующего в реакции
- Металлы в чистом виде
Стандартный понижающий потенциал
Стандартный восстановительный потенциал определяется относительно электрода сравнения стандартного водородного электрода (SHE), которому произвольно задан потенциал, равный 0. 00 вольт. Значения, указанные ниже в скобках, представляют собой стандартные потенциалы восстановления для полуреакций, измеренные при 25 ° C, 1 атмосфере и pH 7 в водном растворе.
00 вольт. Значения, указанные ниже в скобках, представляют собой стандартные потенциалы восстановления для полуреакций, измеренные при 25 ° C, 1 атмосфере и pH 7 в водном растворе.
- CH 3 COOH + 2H + + 2e — → CH 3 CHO + H 2 O (-0,58)
- 2H + + 2 e — → H 2 (0,0)
- O 2 + 2H + + 2e — → H 2 O 2 (+0.7)
- O 2 + 4H + + 4e — → 2H 2 O (+1.64)
Так как потенциал восстановления измеряет внутреннюю тенденцию к восстановлению вида, сравнение стандартного потенциала восстановления для двух процессов может быть полезным для определения того, как будет протекать реакция.
Исторически многие страны, включая США и Канаду, использовали в своих расчетах стандартные потенциалы окисления, а не восстановительные. Это просто отрицательные значения стандартных восстановительных потенциалов, поэтому на практике это несложно. Однако, поскольку они также могут называться «окислительно-восстановительными потенциалами», IUPAC предпочитает термины «потенциалы восстановления» и «потенциалы окисления». Их можно явно различить, используя символ E 0 r для восстановления и E 0 o для окисления.
Однако, поскольку они также могут называться «окислительно-восстановительными потенциалами», IUPAC предпочитает термины «потенциалы восстановления» и «потенциалы окисления». Их можно явно различить, используя символ E 0 r для восстановления и E 0 o для окисления.
Прогнозирование спонтанного направления окислительно-восстановительной реакции
Направление окислительно-восстановительной реакции зависит от относительной силы окислителей и восстановителей в растворе.
Цели обучения
Предсказать направление потока электронов в окислительно-восстановительной реакции с учетом восстановительных потенциалов двух полуреакций
Основные выводы
Ключевые моменты
- Иногда направление окислительно-восстановительной реакции можно определить путем оценки относительной силы восстановителей и окислителей.
- В ситуациях, когда электрохимический ряд недостаточен для точного определения направления окислительно-восстановительной реакции, можно использовать стандартный электродный потенциал E o .

- Отрицательное значение потенциала клетки указывает на восстанавливающую среду, а положительное значение указывает на окислительную среду.
Ключевые термины
- стандартный потенциал электрода : потенциал электрода, измеренный в стандартных условиях (298 K, 1 атм и 1 M).
Прогнозирование полуреакций окислительно-восстановительного потенциала
Обычно направление окислительно-восстановительной реакции зависит от относительной силы окислителей и восстановителей в растворе.В простых ситуациях электрохимический ряд может быть очень полезен для определения направления реакции.
Электрохимический ряд : Чтобы предсказать, будут ли два реагента участвовать в спонтанной окислительно-восстановительной реакции, важно знать, какое место они занимают в электрохимическом ряду.
В представленной таблице наиболее легко восстанавливаемым элементом является Li, а наиболее легко окисляемым — железо. Это означает, что Li будет записан как полуреакция восстановления по сравнению с любым другим элементом в этой таблице.С другой стороны, Fe будет записан как полуреакция окисления по сравнению с любым другим элементом в этой таблице.
Это означает, что Li будет записан как полуреакция восстановления по сравнению с любым другим элементом в этой таблице.С другой стороны, Fe будет записан как полуреакция окисления по сравнению с любым другим элементом в этой таблице.
Некоторые реакции нельзя «наблюдать» таким образом. Эти реакции требуют более математического метода определения направления. Чтобы понять это, важно учитывать стандартный электродный потенциал, который является мерой движущей силы реакции. Знак стандартного потенциала электрода указывает, в каком направлении должна протекать реакция, чтобы достичь равновесия.\ text {o} = 0,00 \ V [/ латекс]
E o = 0,76 В
Положительное значение E o указывает на то, что при STP эта реакция должна идти вправо, чтобы достичь равновесия. Другими словами, положительное значение E o указывает на то, что реакция имеет константы равновесия, которые благоприятствуют продуктам.
Что происходит со стандартным потенциалом электрода, когда реакция записывается в обратном направлении? Ни относительная сила окислителя или восстановителя, ни величина потенциала не изменятся.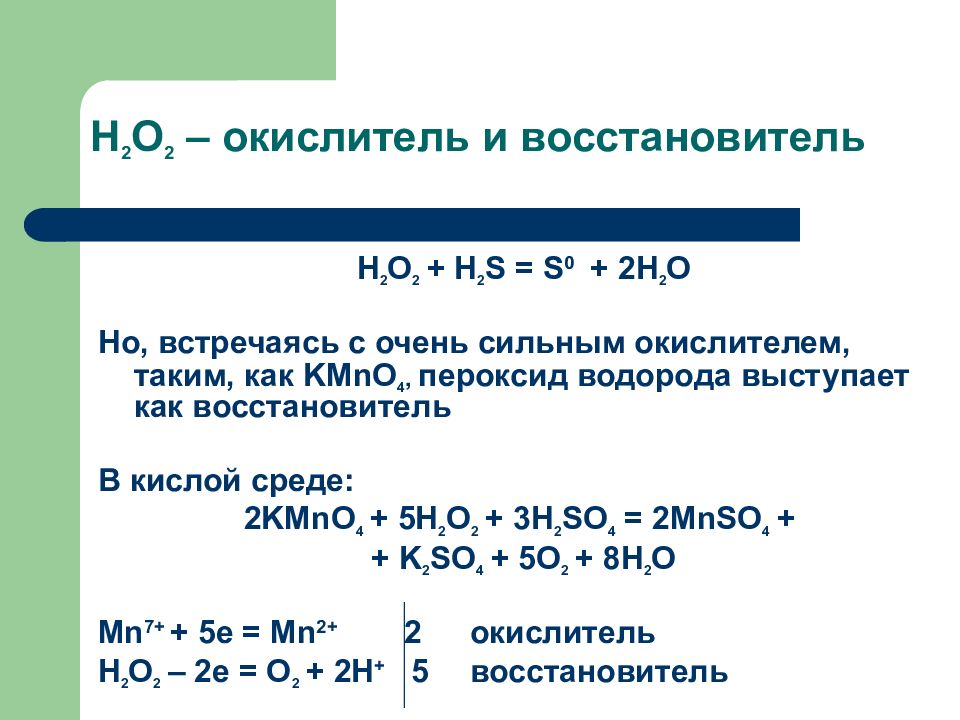 \ text {o} = -0,76 \ text {V} [/ latex]), потенциал ячейки меняется на противоположный.
\ text {o} = -0,76 \ text {V} [/ latex]), потенциал ячейки меняется на противоположный.
Относительные реакционные способности различных полуреакций можно сравнивать, чтобы предсказать направление потока электронов. Уравнения полуреакции можно объединить, если обратиться к окислению таким образом, чтобы нейтрализовать электроны.
Прогнозирование растворения металла в кислоте
Металл растворим в кислоте, если он вытесняет H 2 из раствора, что определяется стандартным восстановительным потенциалом металла.
Цели обучения
Предсказать, будет ли металл растворяться в кислоте, учитывая его восстановительный потенциал
Основные выводы
Ключевые моменты
- Некоторые металлы обладают более сильной «замещающей» способностью, чем другие, что указывает на их большую вероятность снижения.
- Хотя H 2 не является металлом, его все же можно «заменить» некоторыми сильно восстанавливающими металлами.

- Тенденция металла «вытеснять» газообразный водород из кислого раствора определяет его растворимость; если металл не может вытеснить водород, он не будет окисляться и останется нерастворимым.
- Вы можете определить, будет ли металл растворяться в кислоте, сравнив стандартный восстановительный потенциал металла с потенциалом газообразного водорода.
Ключевые термины
- уменьшить : добавить электроны / водород или удалить кислород.
- окислить : Увеличить валентность (положительный заряд) элемента за счет удаления электронов.
Деятельность металлов
Некоторые металлы можно считать более «активными», чем другие, в том смысле, что более активный металл может заменить менее активный из раствора его соли.{2+} + \ text {Cu} (\ text {s}) [/ latex]
Здесь цинк более активен, чем медь, потому что он может заменять медь в растворе. Если погрузить кусок металлического цинка в раствор медного купороса, поверхность цинка быстро покроется слоем мелкодисперсной меди. Синий цвет раствора уменьшается по мере замещения иона меди (II).
Синий цвет раствора уменьшается по мере замещения иона меди (II).
Подобные сравнения других металлов позволили расположить их в порядке увеличения их электронодонирующей или понижающей мощности.Эта последовательность известна как электродвижущая или активная серия металлов.
- Уровень активности 1 (высший): Li, K, Ca, Na
- Уровень активности 2: Mg, Al, Mn, Zn, Fe
- Уровень активности 3: Ni, Sn, Pb
- Уровень активности 4 (самый низкий): Cu, Ag, Pt, Au
Серия действий
Ряд активности долгое время использовался для предсказания направления окислительно-восстановительных реакций. Рассмотрим, например, упомянутое выше окисление меди металлическим цинком.{2+} + \ text {Cu} (\ text {s}) [/ latex]
Старомодный способ выразить это — сказать, что «цинк заменит медь из раствора».
Обратите внимание, что в таблице также учтена замена водорода (H 2 ). Хотя H 2 не является металлом, его все же можно «заменить» некоторыми сильно восстанавливающими металлами. Тенденция металла «заменять» газообразный водород из кислого раствора будет определять его растворимость в этом растворе.
Тенденция металла «заменять» газообразный водород из кислого раствора будет определять его растворимость в этом растворе.
Редукционные потенциалы
Каждая полуячейка связана с разностью потенциалов, величина которой зависит от природы конкретной электродной реакции и от концентраций растворенных веществ.- \ rightarrow \ text {Zn} (\ text {s}) [/ latex]
В ячейке Zn (s) | Zn 2+ (водн.) || Cu 2+ (водн.) | Cu (s), цинк появляется слева, указывая на то, что он окисляется, а не восстанавливается. По этой причине разность потенциалов, вносимая левой полуячейкой, имеет знак, противоположный ее обычному восстановительному потенциалу полуячейки. Эти значения можно определить с помощью стандартных восстановительных потенциалов, которые часто можно найти. Используя стандартные восстановительные потенциалы реакции, можно определить, насколько вероятно, что данный металл будет принимать или отдавать электроны.\ text {o} = 0,00 \ V [/ латекс]
Сложение двух полуреакций дает общее уравнение и положительное значение для E 0 . Это означает, что реакция происходит самопроизвольно, и Zn растворяется в HCl.
Это означает, что реакция происходит самопроизвольно, и Zn растворяется в HCl.
Термодинамика окислительно-восстановительных реакций
Термодинамика окислительно-восстановительных реакций может быть определена с использованием их стандартных восстановительных потенциалов и уравнения Нернста.
Цели обучения
Перевести между константой равновесия / коэффициентом реакции, стандартным восстановительным потенциалом и изменением свободной энергии Гиббса для данной окислительно-восстановительной реакции
Основные выводы
Ключевые моменты
- Окислительно-восстановительные реакции — это реакции, при которых электроны переносятся между частицами.
- Уравнение Нернста позволяет рассчитать восстановительный потенциал окислительно-восстановительной реакции в «нестандартных» условиях.
- Когда система находится в равновесии, уравнение Нернста можно упростить и записать в терминах константы равновесия K, которая, в свою очередь, позволяет вывести уравнение для определения изменения свободной энергии Гиббса ([латекс] \ Delta \ text {G} [/ latex]) реакции.

Ключевые термины
- Свободная энергия Гиббса : термодинамический потенциал, который измеряет «полезную» или инициирующую процесс работу, получаемую от термодинамической системы при постоянной температуре и давлении.
- стандартный потенциал восстановления : Восстановительный потенциал реакции, измеренный в стандартных условиях: 25 ° C, концентрация 1 M для каждого участвующего иона, парциальное давление 1 атм для каждого газа и металлы в чистом состоянии.
Понижающий потенциал
Для расчета термодинамических величин, таких как изменение свободной энергии Гиббса [латекс] \ Delta \ text {G} [/ latex] для общей окислительно-восстановительной реакции, необходимо использовать уравнение, называемое уравнением Нернста.Вальтер Нернст был немецким химиком и физиком, который в начале 20 века разработал уравнение, связывающее восстановительный потенциал, температуру, концентрацию и количество переносимых электронов.
Вальтер Нернст : Портрет Вальтера Нернста.
Уравнение Нернста позволяет рассчитать восстановительный потенциал при любой температуре и концентрации реагентов и продуктов; стандартный реакционный потенциал должен быть измерен при 298К и 1М для каждого раствора.0 [/ латекс]
В этом уравнении:
- [latex] \ Delta \ text {G} [/ latex] — изменение свободной энергии
- n — количество молей
- E 0 — стандартный потенциал
- F — постоянная Фарадея
Электрохимия Obj B Solutions
Электрохимия
Obj B Solutions
P107
1.анод:
электрод с окислением
катод:
где происходит редукция
2. The
катод (+), но его (-) заряженный раствор
притягивает (+) ионы, известные как катионы, потому что, как
происходит восстановление, положительные ионы расходуются, а (-) ионы из
раствор накапливается.
3. б. Cr = анод
Au
= катод
г.
электроны
перетекают из Cr в Au, где они собираются Au +3
г.
Au +3
+ 3e Au
Кр Кр +3 +
3e
4. а. правда
г. ложь
г. ложь
г. правда
5. а. Оно упало бы до нуля.
г. Он также упал бы до нуля.
г. Конечно.Mg все равно получит
окисленный Al +3 .
п 111
1. а. восстановители сами
окисленный. Со стороны реакции окисляется Cu, а не
Fe +2 . Итак, да, Cu — более сильный восстановитель, чем Fe +2 .
г. В большинстве случаев нейтральные металлы
улучшенные восстановители. Но не с золотом! Со стороны реакции,
это Fe +2
окисляется, а не Au.Итак, да, Fe +2 это
более сильный восстановитель, чем Au.
г. Приветствуется обратная реакция. Это должно быть очевидно из того, что мы утверждали в (а)
и (б). Если не очевидно, вас отвлекают Брюинз.
господство Дома. Вы также можете проверить E
значения.
г. Самый сильный окислитель — это
тот, который лучше всего удаляет электроны. Итак, ответ — Au +3 .
Другой
способ убедить себя: Au +3 + 3e
-> Au E = +1.50 В. Это значение E
больше, чем что-либо из вашей таблицы, кроме фтора. Так что из вашего
таблица, только фтор является лучшим окислителем, чем Au +3 .
2. а. Ли
г. Ли. Если Cs
чем сильнее, произойдет обратная реакция. Также Ли -> Ли +1 +
1e (E = 3,04 В:
наибольшее значение)
г. 3Li + Al +3 -> 3 Li +1
+ Al
г. Ал +3 есть
голоднее по электронам, чем Li +1 .
3 .. Когда вам говорят, что A + D +2
реагировать, затем A + D +2 -> A +2 + D. Это означает, что D +2 является
Это означает, что D +2 является
лучше при снижении, чем A +2 . Если применить это к каждой реакции,
вы понимаете, что D +2 > B +2 > E +2 > C +2
4. Cr + Al +3 реакции нет, поэтому Al
лучше, чем Cr при потере электронов
мг + Al +3
реакция, поэтому Mg лучше, чем Al, теряет электроны
Ni +2 + Al реакция, поэтому Al
лучше, чем Ni при потере электронов
Ni + Cr +3 реакции нет, поэтому Cr
лучше, чем Ni при потере электронов
Итак, от лучшего к худшему при потере электронов (лучший восстановитель) мы имеем
Mg> Al> Cr> Ni
5.Для ответа на вопрос вам необходимо увидеть из таблицы
потенциалы восстановления, что Cu +2 является лучшим окислителем, чем Cr +3 .
Итак, если вам интересно, следует ли хранить раствор, содержащий Cr +3 (из Cr (NO 3 ) 3 )) в меди,
вам действительно интересно, произойдет ли следующее:
Cr +3 + Cu -> Cu +2 + Cr
Но этого не произойдет, потому что Cu +2 побеждает. Итак, ответ таков: да, ученый должен хранить раствор в
Итак, ответ таков: да, ученый должен хранить раствор в
медный контейнер, так как ничего не будет
случилось с этим.
6. Ag +
+ 1e Ag
E = 0,80 В
Zn
Zn +2 + 2e E = 0,76 В
выдают в сумме 1,56 В, больше, чем любая другая комбинация.
К сожалению, они не указали это как один из вариантов. Итак, ответ — B
7.Используйте Cr +2
+ 2e Cr E = -0,91 В
Пб +2
+ 2e Pb E = -0,13 В,
Так
вам нужно перевернуть первый, чтобы получить положительное общее значение E.
Cr Cr +2
+ 2e E = +0,91
V
Pb +2 + 2e Pb E = -0,13 В
Всего: Cr + Pb +2 Cr +2
+ Pb E
= 0,78 В
1.анод: Cr Cr +2
+ 2e
2. Пб
3. Пб +2
4. Cr
+ Pb +2 Cr +2 + Pb
5. E
= 0,78 В
Красный
Буклет 5-52
3. Из таблиц:
Au +3 + 3e -> Au E = + 1,50 В
Al +3 + 3e -> Al E = — 1.66 В
Обратное 2-е уравнение: Al Al +3 + 3e E = 1,66
V
Au +3
+ 3e Au E = + 1,50 В
Всего: Al
+ Au +3 Al +3 + Au E = 3,16 В
4. Из таблиц: Cu +2 + 2e Cu E = 0,34 В
Кр +2
+ 2e Cr E = -0,91 В
Обратное 2-е уравнение: CrCr +2 + 2e E = 0.91V
Cu +2
+ 2e Cu E = 0,34 В
В целом: Cr + Cu +2 Cr +2 + Cu
Окисление
реакция: Cr -> Cr +2 + 2e
Сокращение
реакция: Cu +2 + 2e -> Cu
нетто
реакция: Cr + Cu +2 -> Cr +2 + Cu
Увеличение
по массе: Cu
Уменьшение
по массе: Cr (потому что превращается в Cr +2 )
Ячейка
напряжение: E = 1.25
V
5. а. E = 0,16 В спонтанный (
означает, что реакция будет происходить так, как написано)
г. E = -0,34 В не самопроизвольно (подразумевается, что реакция будет протекать только в
противоположное направление)
г. E = -1,24 В не самопроизвольно
г. E = -0,02 В не самопроизвольно
6. Pb +2
+ 2e -> Pb E = -0,13 В
X -> X +2 + 2e E = — x (отрицательный, потому что я реверсирую
уравнение для нейтрализации электронов)
— х + -0.13 = 0,15
x = -0,28 В (понижающий потенциал)
Найдите -0,28 В в таблице и
соответствует Ко.
Но что, если вы предположите, что
следующий?
Пб
-> Pb +2 + 2e E =
+ 0,13 В
X +2 + 2e -> X E = x
х + 0,13 = 0,15
x = 0,02 В, но ничего нет в
наша таблица с E = 0,02
V, поэтому они имеют в виду первую возможность.
Уравновешивание окислительно-восстановительных реакций и определение окислителей и восстановителей — научный класс [Видео 2021]
| Имя | Окислительное число | Изменение электронов |
|---|---|---|
| Окисление | увеличивается | электронов потеряно |
| Редукция | убавляется | электронов |
| Окислитель | убавляется | электронов |
| Восстановитель | увеличивается | электронов потеряно |
Балансировка окислительно-восстановительной реакции
Балансировка окислительно-восстановительной реакции может быть немного сложной.Вы можете использовать шаги, которые вы использовали ранее, чтобы сбалансировать другие уравнения, чтобы начать, но тогда вы должны принять во внимание ключевые ионы и степени окисления. Вот список шагов, которые помогут сбалансировать уравнение окислительно-восстановительного потенциала.
- Определите реагенты и продукты.
- Напишите несбалансированное уравнение в ионной форме и исключите любые ионы-наблюдатели.
- Присвойте каждому атому степень окисления и укажите каждый атом, который меняет свою степень окисления. Игнорируйте любой атом, который не меняется.
- Напишите и уравновесите полуреакции.
- Разделите уравнение на половинки реакций.
- Сбалансируйте атомы, кроме водорода и кислорода.
- Уравновесить атомы кислорода, добавив молекулы воды.
- Уравновесите атомы водорода, добавив ион гидроксония для каждого атома водорода и добавив равное количество молекул воды к другой части уравнения.
- Уравновесите заряд, добавив электроны, если необходимо.
- Уравняйте электроны и объедините полуреакции.
Примеры
Уравновесить уравнение реакции сероводорода в воздухе с образованием диоксида серы и воды.
h3 S + O2 = SO2 + h3 O
1. Определите реагенты и продукты и присвойте степени окисления.
2. Запишите и уравновесите полуреакции.
Обратите внимание, что сера меняется с степени окисления -2 на степень окисления +4, поэтому ей пришлось потерять шесть электронов.-2 + (-4) = -6.
Кислород меняется с нулевой степени окисления до -2, получая два электрона. 0 + (-2) = -2. Поскольку свободные атомы кислорода перемещаются парами, фактическое количество получаемых электронов составляет -4.
3. Две половинные реакции необходимо уравновесить, чтобы количество электронов, потерянных серой, было равно количеству электронов, полученному кислородом.
Итак, из этих полуреакций вы знаете, что 2 должна идти впереди h3 S, а 3 должна идти впереди O2 на стороне реакции.Что касается продукта, шесть атомов кислорода, необходимых для баланса, делятся между SO2 и h3O.
Окончательное уравнение:
2h3 S + 3O2 = 2SO2 + 2h3 O
Вот еще один пример. Сбалансируйте окислительно-восстановительную реакцию между диоксидом марганца и соляной кислотой, которая образует воду, хлорид марганца (II) и газообразный хлор.
MnO2 + HCl = h3 O + MnCl2 + Cl2
1. Определите реагенты и продукты и присвойте им степени окисления.
2.Запишите и уравновесите полуреакции.
Обратите внимание, что Mn4 + восстанавливается до Mn2 +, а Cl- окисляется до Cl.
Водород и кислород являются наблюдателями, поэтому не включайте их на этом этапе.
Полуреакции:
Два электрона приобретены и два электрона потеряны, поэтому эта часть уравновешена. Все уравнение выглядит так.
MnO2 + 2HCl = h3 O + MnCl2 + Cl2
Однако двойная проверка дает нам два атома кислорода в левой части уравнения и только один в правой.Все уравнение должно быть сбалансировано. Для этого добавьте 4 перед реагирующей HCl и 2 перед продуктом h3 O.
Окончательное сбалансированное уравнение принимает следующий вид:
MnO2 + 4HCl = 2h3 O + MnCl2 + Cl2
Сила агентов
Чем активнее элемент, тем больше вероятность того, что он будет терять электроны и быть восстановителем.Чем крепче и сильнее атом удерживает свои электроны, тем слабее он как восстанавливающий агент. Фтор, например, обожает свои электроны и никогда не хочет их отпускать, поэтому он является слабым восстановителем. С другой стороны, это очень сильный окислитель, потому что он легко и с радостью приобретает электроны.
Краткое содержание урока
Окислительно-восстановительная реакция — это реакция, в которой одно вещество отдает электрон, а другое вещество — этот электрон. Окислитель — это вещество, которое вызывает окисление в другом веществе.Восстановитель — это то, что вызывает восстановление другого вещества. Если степень окисления продукта выше, чем у реагента, то вещество теряет электроны и оно окисляется. Если степень окисления меньше, значит, оно приобрело электроны, и вещество восстановилось. Вещество, которое восстанавливается в результате реакции, является окислителем, поскольку оно приобретает электроны. Вещество, которое окисляется в реакции, является восстановителем, потому что оно теряет электроны.
Уравновешивание окислительно-восстановительных реакций выполняется в три этапа:
- Идентификация продуктов и реагентов.
- Напишите и уравновесите полууравнения.
- Уравняйте электроны и объедините полуреакции.
Результат урока
После просмотра видео студенты должны уметь:
- Объяснять, что такое окислительно-восстановительная реакция
- Определите окислитель и восстановитель
- Продемонстрируйте и напишите сбалансированное уравнение окислительно-восстановительного потенциала
.

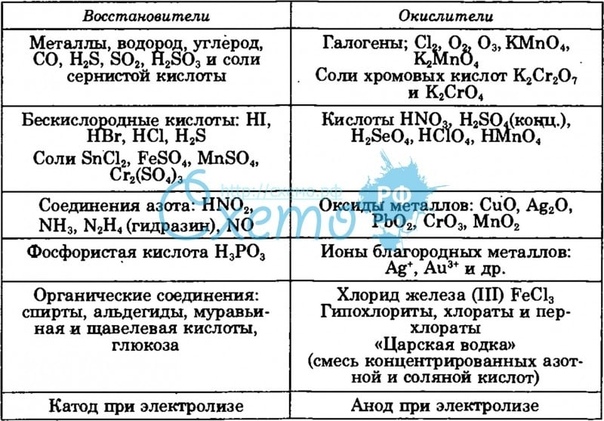

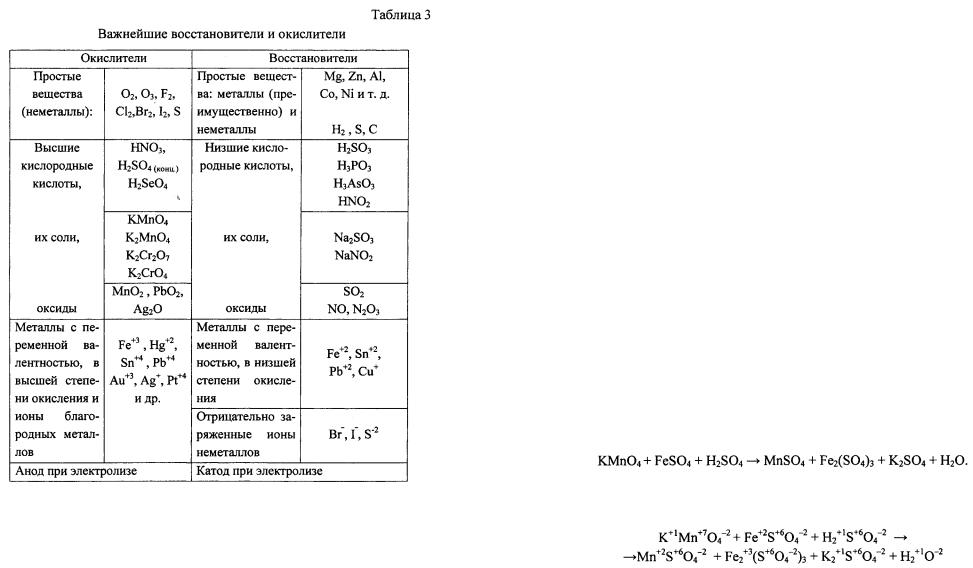
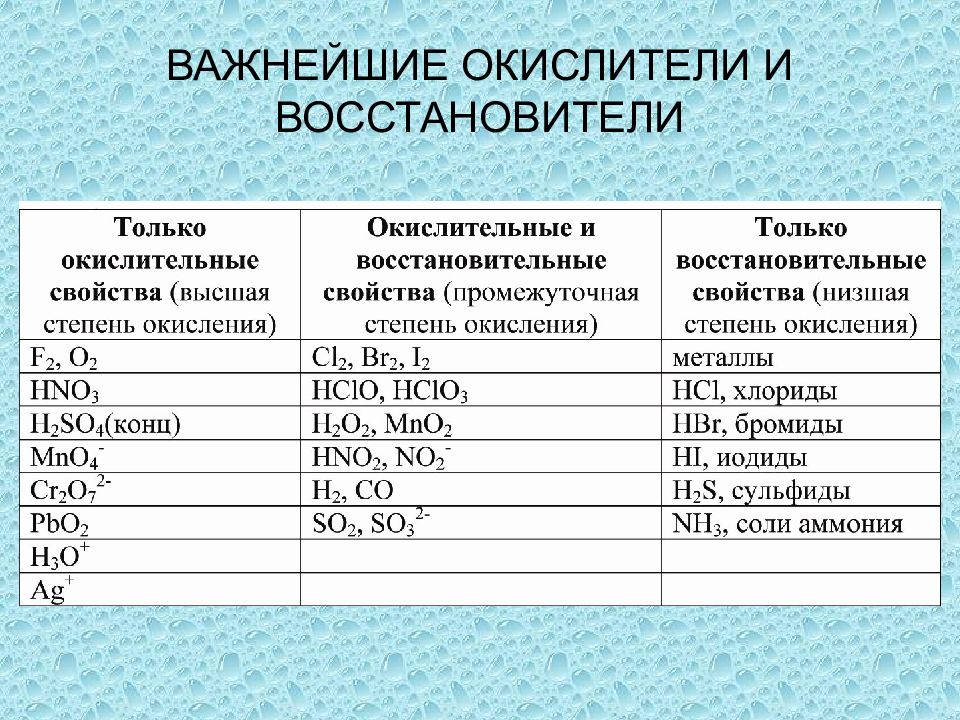


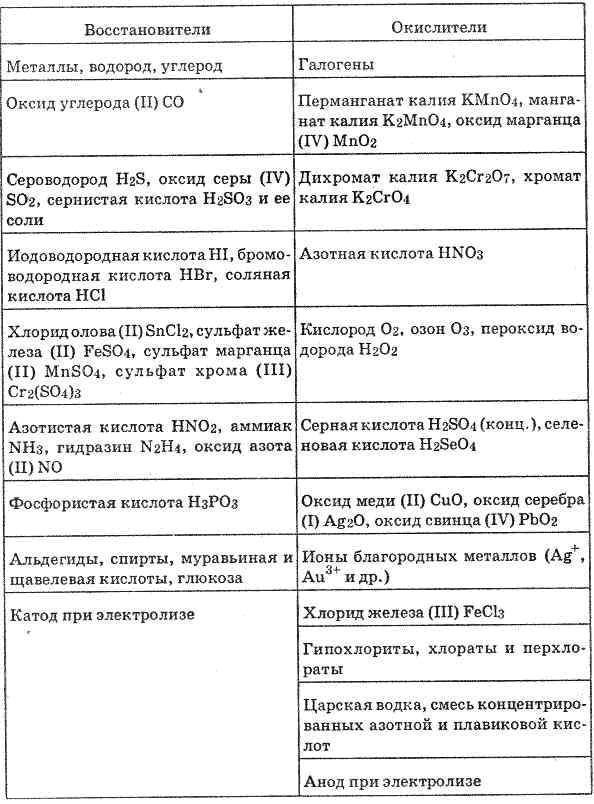
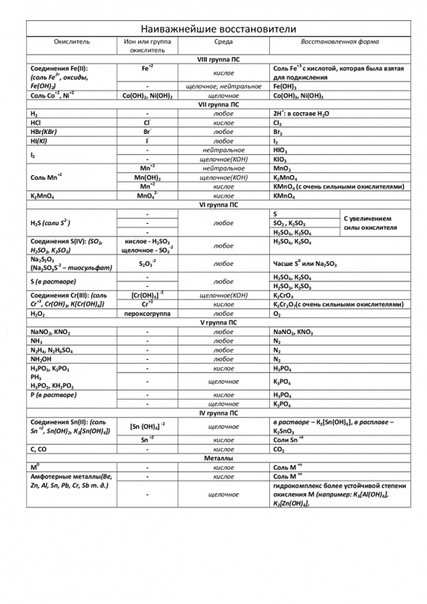


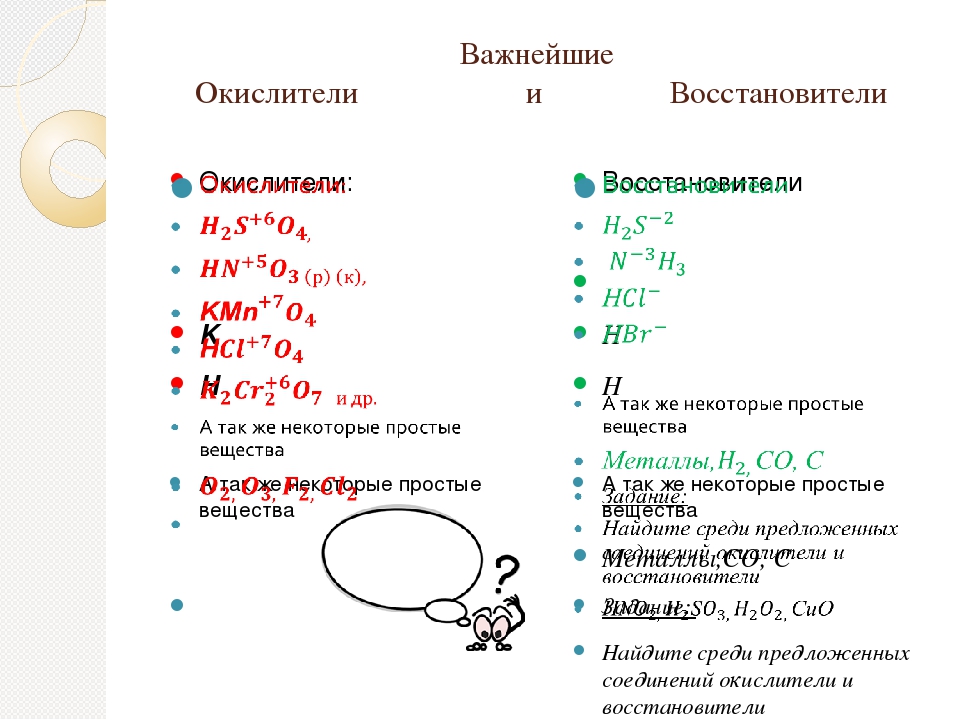



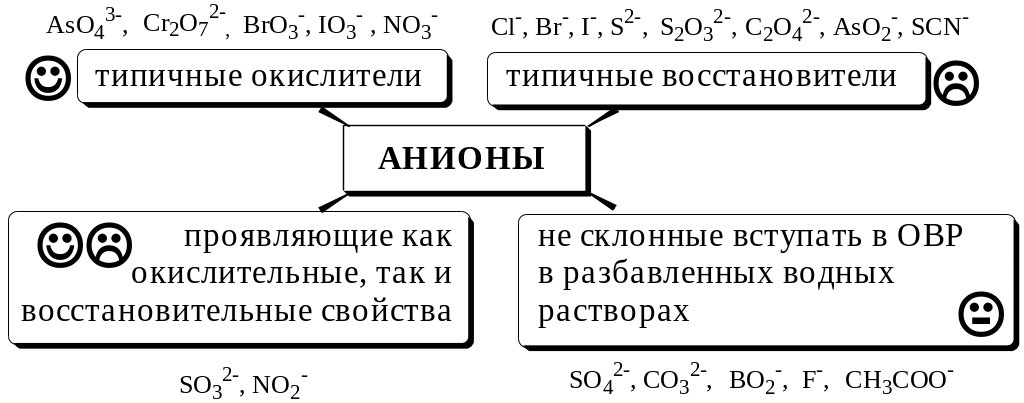



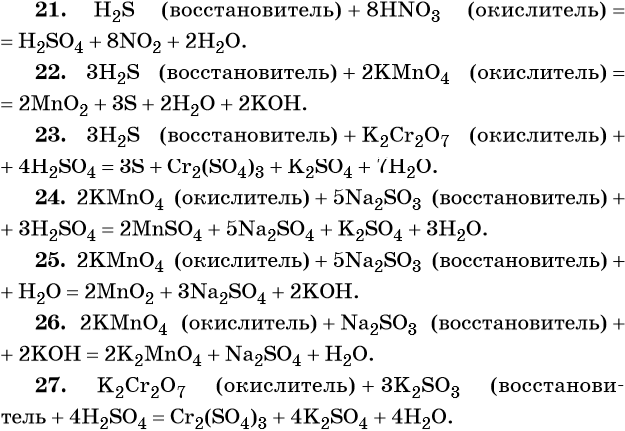
 ),
),