Содержание
Валентность фосфора (P), формулы и примеры
Общие сведения о валентности фосфора
Фосфор образует несколько аллотропических изменений: белый, красный и черный фосфор.
В чистом виде белый фосфор совершенно бесцветен и прозрачен; технический белый фосфор окрашен в желтоватый цвет и по внешнему виду похож на воск. Плотность 1,83 г/см3. На холоду белый фосфор хрупок, но при температуре выше 15oС становится мягким и легко режется ножом. На воздухе он легко окисляется, вследствие чего светится в темноте. Имеет молекулярную кристаллическую решетку в узлах которой находятся тетраэдрические молекулы P4. Ядовит.
Красный фосфор состоит из нескольких форм, являющихся полимерными веществами, состав которых до конца не изучен. Медленно окисляется на воздухе, не светится в темноте, неядовит. Плотность 2,0-2,4г/см3. При нагревании сублимируется. При охлаждении паров красного фосфора получается белый фосфор.
Черный фосфор образуется из белого путем его нагревания под высоким давлением при 200-220oС. По внешнему виду похож на графит, жирный на ощупь. Плотность – 2,7г/см3. Полупроводник.
По внешнему виду похож на графит, жирный на ощупь. Плотность – 2,7г/см3. Полупроводник.
Валентность фосфора в соединениях
Фосфор — пятнадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в VA группе. В ядре атома фосфора содержится 15 протонов и 16 нейтронов (массовое число равно 31). В атоме фосфора есть три энергетических уровня, на которых находятся 15 электронов (рис. 1).
Рис. 1. Строения атома фосфора.
Электронная формула атома фосфора в основном состоянии имеет следующий вид:
1s22s22p63s23p3.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие трех неспаренных электронов свидетельствует о том, что фосфор способен проявлять валентность III (PIII2O3, Ca3PIII2, PIIIH3и т. д.).
д.).
Поскольку на третьем энергетическом слое помимо 3s- и 3p-подуровней есть еще и 3d-подуровень, для атома фосфора характерно наличие возбужденного состояния: пара электронов 3s-подуровня распаривается и один из них занимает вакантную орбиталь 3d-подуровня.
Наличие пяти неспаренных электронов свидетельствует о том, что для фосфора также характерна валентность V (PV2O5, H3PVO4, PVCl5и др.).
Примеры решения задач
Фосфор валентность — Справочник химика 21
Фосфор Р (Is 2s 2/f 3s Зр ) по числу валентных электронов является аналогом азота. Однако как элемент 3-го периода он существенно отличается от азота — элемента 2-го периода. Это отличие состоит в том, что у фосфора больше размер атома, меньше энергия ионизации, большее сродство к электрону и большая поляризуемость атома, чем у азота. Максимальное координационное число фосфора шесть.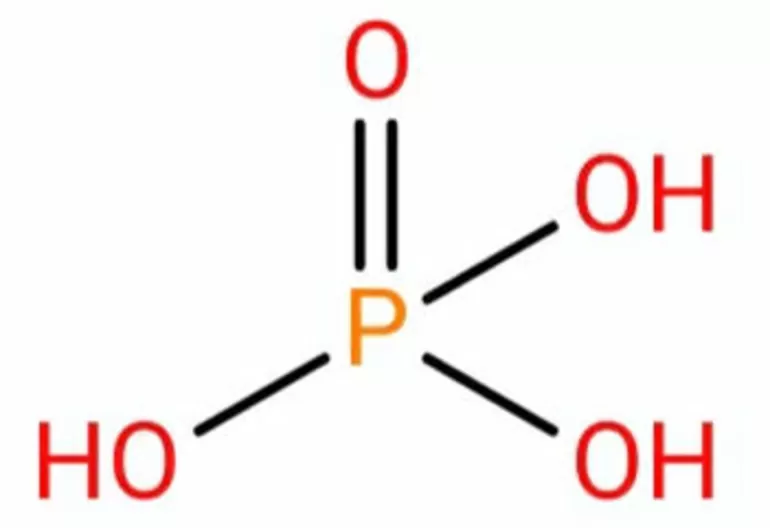 Как и для других элементов 3-го периода, рл — рл-связывание для атома фосфора не характерно и поэтому в отличие от азота sp- и sp -гибридные состоянья орбиталей фосфора неустойчивы. Фосфор в соединениях проявляет степени окисления от —3 до +5. Наиболее характерна степень окисления +5. [c.365]
Как и для других элементов 3-го периода, рл — рл-связывание для атома фосфора не характерно и поэтому в отличие от азота sp- и sp -гибридные состоянья орбиталей фосфора неустойчивы. Фосфор в соединениях проявляет степени окисления от —3 до +5. Наиболее характерна степень окисления +5. [c.365]
Составим формулу соединения, которое состоит и. фосфора (валентность V) и кислорода (валентность II). [c.19]
В каких соединениях фосфор имеет максимальную валентность [c.553]
Каковы валентные возможности фосфора Чем он в этом отношении отличается от своего аналога — азота [c.133]
Электронная структура атома фосфора соответствует формуле 1бР 5 25 2р Зз Зр . У фосфора валентные электроны находятся на третьем (внешнем) энергетическом уровне, на котором помимо 5- и трех р-орбиталей имеются пять свободных -орбиталей. [c.79]
Согласно другой точке зрения различие свойств фосфора и азота объясняется наличием в атоме фосфора валентных З -орбиталей, [c. 365]
365]
Объясните различие между первой энергией ионизации фосфора, Р (1063 кДж моль ) и серы, 8 (1000 кДж моль ), основываясь на сопоставлении валентных орбитальных электронных конфигураций атомов Р и 8. [c.401]
Но у фосфора, как элемента 3-го периода, роль валентных играют также З -орбитали. Поэтому наряду с общностью свойств в химии этих типических элементов V группы проявляются существенные различия. Для фосфора возможны зрЧ -, зрЧ- и 5р -типы гибридизации валентных орбиталей. Максимальное координационное число фосфора равно 6. В отличие от азота для фосфора характерно л — рл-связывание за счет акцептирования свободными Зй(-орбиталями электронных пар соответствующих атомов [c.408]
Устойчивое координационное число фосфора (V) 4, что отвечает sp -гибридизации его валентных орбиталей. Реже проявляются координационные числа 5 и 6, в этих случаях атому фосфора приписывают соответственно sp4- и вр й -гибридные состояния (стр. 415). [c.414]
415). [c.414]
Аналогичное поведение обнаруживается и у элементов группы VA, но граница между металлами и неметаллами в этой группе проходит ниже. Азот и фосфор являются неметаллами, химия их ковалентных соединений и возможные состояния окисления определяются наличием пяти валентных электронов в конфигурации Азот и фосфор чаще всего имеют степени окисления — 3, -Ь 3 и +5. Мыщьяк As и сурьма Sb-семи-металлы, образующие амфотерные оксиды, и только висмут обладает металлическими свойствами. Для As и Sb наиболее важным является состояние окисления + 3. Для Bi оно единственно возможное, если не считать степеней окисления, проявляемых в некоторых чрезвычайно специфических условиях. Висмут не может терять все пять валентных электронов требуемая для этого энергия слишком велика. Однако он теряет три бр-электро-на, образуя ион Bi . [c.455]
Менделеев выполнял свою диссертационную работу в Германии, в Гейдельберге, как раз во время Международного химического конгресса в Карлсруэ. Он присутствовал на конгрессе и слышал речь Канниццаро, в которой тот четко изложил свою точку зрения на проблему атомного веса. Вернувшись в Россию, Менделеев приступил к изучению списка элементов и обратил внимание на периодичность изменения валентности у элементов, расположенных в порядке возрастания атомных весов валентность водорода 1, лития I, бериллия 2, бора 3, углерода 4, магния 2, азота 3, серы 2, фтора 1, натрия 1, алюминия 3, кремния 4, фосфора 3, к1 слорода 2, хлора I и т. д. [c.99]
Он присутствовал на конгрессе и слышал речь Канниццаро, в которой тот четко изложил свою точку зрения на проблему атомного веса. Вернувшись в Россию, Менделеев приступил к изучению списка элементов и обратил внимание на периодичность изменения валентности у элементов, расположенных в порядке возрастания атомных весов валентность водорода 1, лития I, бериллия 2, бора 3, углерода 4, магния 2, азота 3, серы 2, фтора 1, натрия 1, алюминия 3, кремния 4, фосфора 3, к1 слорода 2, хлора I и т. д. [c.99]
Фосфор по числу валентных электронов (35 3р ) является аналогом азота [c.407]
Атомы кислорода соединяются не менее чем с двумя различными атомами. Так же ведут себя кальций, сера, магний и барий. У этих элементов валентность два, У азота, фосфора, алюминия и золота валентность три. Железо может иметь валентность два или три. В принципе вопрос о валентности оказался не столь простым, каким представлялось вначале, но даже такой простейший вариант этой теории позволил сделать важные выводы.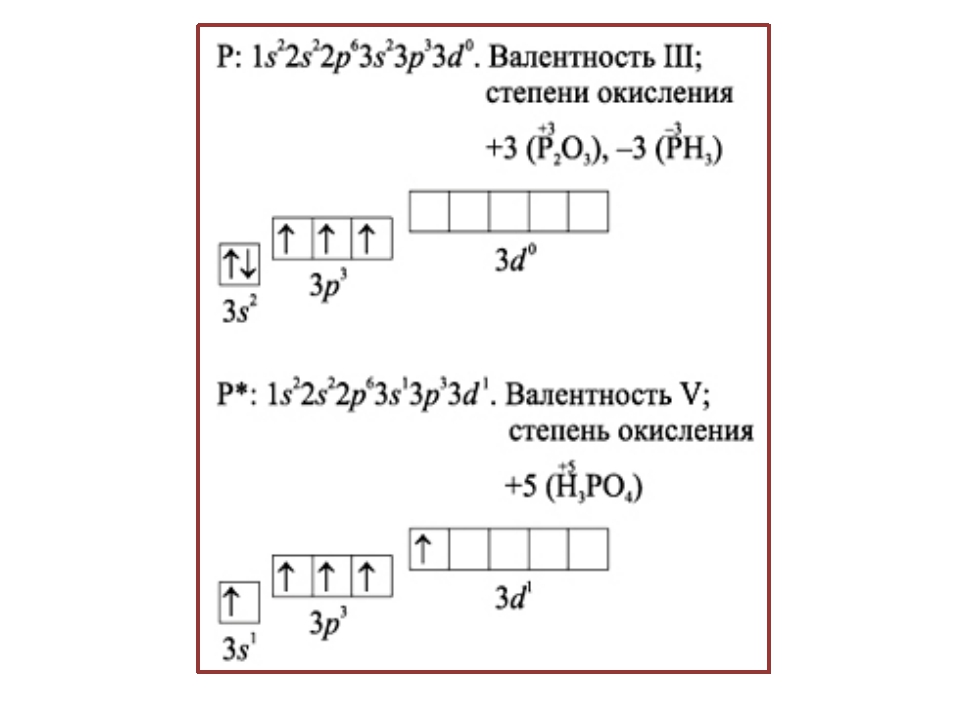 [c.81]
[c.81]
При переходе от лития к фтору Г происходит закономерное ослабление металлических свойств и усиление неметаллических с одновременным увеличением валентности. Переход от фтора Г к следующему по значению атомной массы элементу натрию Ыа сопровождается скачкообразным изменением свойств и валентности, причем натрий во многом повторяет свойства лития, будучи типичным одновалентным металлом, хотя и более активным. Следующий за натрием магний во многом сходен с бериллием Ве (оба двухвалентны, проявляют металлические свойства, но химическая активность обоих выражена слабее, чем у пары Ы — Ыа). Алюминий А1, следующий за магнием, напоминает бор В (валентность равна 3). Как близкие родственники похожи друг на друга кремний 81 и углерод С, фосфор Р и азот Ы, сера 8 и кислород О, хлор С1 и фтор Г. При переходе к следующему за хлором в последовательности увеличения атомной массы элементу калию К опять происходит скачок в изменении валентности и химических свойств. Калий, подобно литию и натрию, открывает ряд элементов (третий по счету), представители которого показывают глубокую аналогию с элементами первых двух рядов. [c.20]
[c.20]
Эффективность присадки зависит от валентного состояния и положения элементов в молекуле присадки, наличия функциональных групп, их синергизма и других факторов. Применение фосфор-, серу-, кислород- и азотсодержащих соединений в качестве присадок к смазочным маслам тесно связано с особенностью электронной структуры этих элементов. Взаимодействие их с металлической поверхностью деталей двигателя приводит к модифицированию последней (изменению структуры) и за счет образования защитных пленок обеспечиваются противокоррозионные, противоизносные и противозадирные свойства указанных соединений в растворе масел. Кроме того, присадки, содержащие эти элементы, стабилизируют масло, обрывая цепь окисления по реакции с пер-оксидными радикалами и разрушая гидропероксиды. [c.9]
Галоидирование. Катализаторы, наиболее часто применяющиеся для хлорирования металлическое железо, окись меди, бром, сера, иод, галоиды железа, сурьмы, олова, мышьяка, фосфора, алюминия и меди растительный и животный уголь, активированный боксит и другие глины. Большинство этих катализаторов является носителями галоидов. Так, Fe, Sb и Р в галоидных соединениях способны существовать в двух валентных состояниях в присутствии свободного хлора они поочередно присоединяют и отдают хлор в активной форме. Аналогично иод, бром и сера образуют с хлором неустойчивые соединения. Катализаторы броми-рования подобны катализаторам хлорирования. Для иодирования наилучшим ускорителем служит фосфор. Для проведения процесса фторирования катализатор не требуется. В присутствии кислорода галоидирование замедляется. [c.329]
Большинство этих катализаторов является носителями галоидов. Так, Fe, Sb и Р в галоидных соединениях способны существовать в двух валентных состояниях в присутствии свободного хлора они поочередно присоединяют и отдают хлор в активной форме. Аналогично иод, бром и сера образуют с хлором неустойчивые соединения. Катализаторы броми-рования подобны катализаторам хлорирования. Для иодирования наилучшим ускорителем служит фосфор. Для проведения процесса фторирования катализатор не требуется. В присутствии кислорода галоидирование замедляется. [c.329]
Каталитическое хлорирование основано на применении переносчика хлора, такого как йод [2], сера [3], фосфор, сурьма и другие, в виде соответствующих хлоридов, которые растворяются в хлорируемом углеводороде или прн хлорировании газообразных парафиновых углеводородов — в растворителе. Применяются исключительно элементы, имеющие по крайней мере два значения валентности. В качестве гомогенных катализаторов могут также применяться вещества, образующие радикалы, как, например, диазо-метап, тетраэтилсвинец и гексафенилэтан [4]. Они обладают способностью разделять молекулу хлора на атомы, которые тотчас ке вызывают возникновение цепной реакции. [c.113]
Они обладают способностью разделять молекулу хлора на атомы, которые тотчас ке вызывают возникновение цепной реакции. [c.113]
Когда элемент образует несколько рядов соединений, соответствующих различным степеням окисления, после названия соединения в скобках дается указание либо на валентность катиона (римской цифрой), либо на число атомов галогена, кислорода, серы или кислотного остатка в молекуле соединения (прописью). Например, железо хлористое (П1), фосфор хлористый трех), марганца окись (дву). При этом обозначение валентности дается обычно для менее характерных валентных состояний. Например, для меди в случае двухвалентного состояния указание на валентность опускается, одновалентная же медь обозначается так медь иодистая (I). [c.9]
Проводимость таких веществ, как кремний и германий, можно повысить, вводя в них небольшое количество определенных примесей. Например, введение в кристаллы кремния примесей бора или фосфора приводит к эффективному сужению межзонной щели. Небольшие количества бора или фосфора (несколько миллионных долей) удается включить в структуру кремния при выращивании кристалла. Атом фосфора имеет пять валентных электронов, и поэтому, после того как четыре из них используют- [c.631]
Небольшие количества бора или фосфора (несколько миллионных долей) удается включить в структуру кремния при выращивании кристалла. Атом фосфора имеет пять валентных электронов, и поэтому, после того как четыре из них используют- [c.631]
Фосфор, мышьяк, сурьма и висмут образуют стехиометрические соединения, отвечающие формальной валентности, только с s-элементами и d-элементами подгруппы цинка. [c.342]
То, что краситель и адсорбент составляют единую квантовую систему, видно из многих фактов. Самый наглядный из них состоит в том, что поглощение радиации любой, например самой малой, частоты в пределах полосы поглощения данного фосфора вызывает испускание всего его спектра излучения, в том числе и значительно больших частот, чем частот поглощенного света. Значит, кванты излучения поступают в общее пользование, причем энергия, недостаточная для излучения частот, которые превышают малую частоту поглощенного света, также поступает за счет общих ресурсов твердого тела. Не допускает иных толкований также тот факт, что хотя краситель, несомненно, находится только на поверхности, поглощение света характерных для него длинных волн (для которых кристалл, адсорбирующий данный краситель, практически прозрачен) сопровождается образованием металлического серебра в объеме кристалла бромида серебра. При этом чувствительность бромида серебра тем дальше сдвигается в сторону длинных волн, чем длиннее цепь сопряженных связей в структуре молекулы красителя (рис. 44). Дело в том, что электроны красителя находятся в волновом движении и что молекула красителя, соединяясь с кристаллом валентной связью, составляет с ним единое целое. Кристалл и краситель образуют единую квантовую систему. Не удивительно поэтому, что механизм фотолиза чистых [c.130]
Не допускает иных толкований также тот факт, что хотя краситель, несомненно, находится только на поверхности, поглощение света характерных для него длинных волн (для которых кристалл, адсорбирующий данный краситель, практически прозрачен) сопровождается образованием металлического серебра в объеме кристалла бромида серебра. При этом чувствительность бромида серебра тем дальше сдвигается в сторону длинных волн, чем длиннее цепь сопряженных связей в структуре молекулы красителя (рис. 44). Дело в том, что электроны красителя находятся в волновом движении и что молекула красителя, соединяясь с кристаллом валентной связью, составляет с ним единое целое. Кристалл и краситель образуют единую квантовую систему. Не удивительно поэтому, что механизм фотолиза чистых [c.130]
Фосфор, Р, имеет валентную конфигурацию Зх Зр , а сера, 8, обладает валентной конфигурацией Зх Зр . У атома Р, таким образом, имеется полузаполненная Зр-оболочка, тогда как у атома 8 дополнительный электрон вынужден спариваться с одним из уже имеющихся на Зр-орбиталях электроном [c. 401]
401]
СЯ для образования ковалентных связей в кристаллической структуре кремния, у фосфора остается еще один электрон. При наложении на кристалл электрического поля этот электрон может смещаться в сторону от атома фосфора поэтому говорят, что фосфор является донором электронов в кристалле кремния. Для высвобождения донируемых электронов требуется лищь 1,05 кДж моль эта энергия превращает кристалл кремния с небольшой примесью фосфора в проводник. При введении в кристалл кремния примеси бора возникает противоположное явление. Атому бора недостает одного электрона для построения необходимого числа ковалентных связей в кристалле кремния. Поэтому на каждый атом бора в кристалле кремния приходится одна вакансия на связывающей орбитали. На эти вакантные орбитали, связанные с атомами бора, могут быть возбуждены валентные электроны кремния, что дает возможность электронам свободно перемещаться по кристаллу. Подобная проводимость осуществляется в результате того, что на вакантную орбиталь атома бора перескакивает электрон соседнего атома кремния. Вновь образовавшаяся вакансия на орбитали атома кремния тут же заполняется электроном со следующего за ним другого атома кремния. Возникает каскадный эффект, при котором электроны перескакивают от одного атома к следующему. Физики предпочитают описывать это явление как движение положительно заряженной дырки в противоположном направлении. Но независимо от того, как описывается это явление, твердо установлено, что для активации проводимости такого вещества, как кремний, требуется меньше энергии, если в кристалле содержится небольшое количество донора электронов типа фосфора либо акцептора электронов типа бора. [c.632]
Вновь образовавшаяся вакансия на орбитали атома кремния тут же заполняется электроном со следующего за ним другого атома кремния. Возникает каскадный эффект, при котором электроны перескакивают от одного атома к следующему. Физики предпочитают описывать это явление как движение положительно заряженной дырки в противоположном направлении. Но независимо от того, как описывается это явление, твердо установлено, что для активации проводимости такого вещества, как кремний, требуется меньше энергии, если в кристалле содержится небольшое количество донора электронов типа фосфора либо акцептора электронов типа бора. [c.632]
Белый фосфор состоит из тетраэдрических молекул Р4, схематически изображенных на рис. 21.25. Как было отмечено в разд. 8.7, ч. 1, валентные углы по 60″, как в молекуле Р4, довольно редко встречаются в других молекулах. Они свидетельствуют о наличии очень напряженных связей, что согласуется с высокой реакционной способ- [c.321]
Хотя фосфор является электронным аналогом азота, но наличие в валентном мектронном слое атома свободных /-орбиталей делает соединения фосфора не похожими на соединения азота.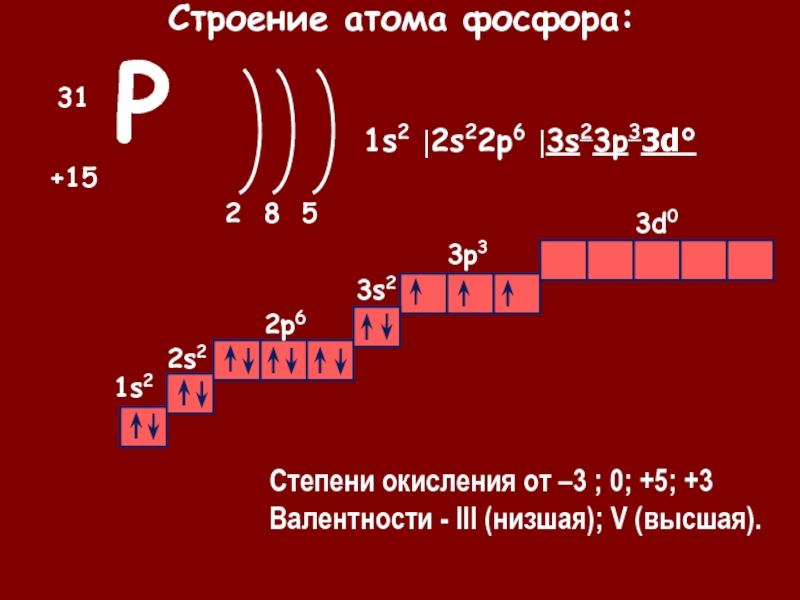 [c.414]
[c.414]
Электронная структура фосфорорганических соединений и природа химических связей энергии и длины связей фосфора валентные углы образование связей с участием Зй-орб италей . [c.63]
В еще большей мере ароматические свойства присущи фосфо-риновому кольцу. 2,4,6-Трифенилфосфорнн не аутоокисляется и не кватернизуется при действии иодистого метила или борофторида триэтилоксония . В то же время взаимодействие его с нуклеофильными реагентами — алкил- или ариллитиевыми соединениями, легко протекает в бензоле уже при комнатной температуре» . При этом атака происходит по фосфору, валентная оболочка которого расширяется до децета, и возникает стабилизованный резонансом фосфо-рин-анион (1). Образование аниона (I) доказано при помощи ПМР и УФ-спектров. Гидролиз реакционной смеси, имеющей глубокую сине-фиолетовую окраску, приводит к 1-алкил(арил)-2,4,6-три- [c.628]
Приготовление силикатных фосфоров. Химический состав фосфоров, структура фосфоров, валентность Мп. Существует значительное число различных методик приготовления кристаллофосфоров на силикатной основе. В качестве примера мы приведём одну из них [270]. Хорошо очищенный аммиачный раствор окиси цинка, водный раствор азотнокислого марганца н спиртовой раствор кремниевой кислоты (этилсиликат) сливают вместе при этом образуется гель. Гель высушивается, растирается и прокаливается до 1200° С в кварцевых сосудах и после прокаливания быстро охлаждается. При малом содержании Мп прокаливание монгно вести в воздухе при больпюм содержании Мп, во избежание его окисления, прокаливание ведётся в атмосфере углекислоты. [c.411]
Существует значительное число различных методик приготовления кристаллофосфоров на силикатной основе. В качестве примера мы приведём одну из них [270]. Хорошо очищенный аммиачный раствор окиси цинка, водный раствор азотнокислого марганца н спиртовой раствор кремниевой кислоты (этилсиликат) сливают вместе при этом образуется гель. Гель высушивается, растирается и прокаливается до 1200° С в кварцевых сосудах и после прокаливания быстро охлаждается. При малом содержании Мп прокаливание монгно вести в воздухе при больпюм содержании Мп, во избежание его окисления, прокаливание ведётся в атмосфере углекислоты. [c.411]
Каталитическое окисление нефтяных остатков. Имеется множество попыток ускорить процесс окисления сырья, повысить качество или придать определенные свойства окисленному битуму с помощью различных катализаторов и инициаторов. В качестве катализаторов окислительногвосстановительных реакций предложено применять соли соляной кислоты и металлов переменной валентности (железа, меди, олова, титана и др. ). В качестве катализаторов дегидратации, алкилирования и крекинга (перенос протонов) предложены хлориды алюминия, железа, олова, пятиокись фосфора в качестве инициаторов окисления — перекиси. Большинство из этих катализаторов инициирует реакции уплотнения молекул сырья (масел и смол) в асфальтены, не обогащая битумы кислородом. Возможности ускорения процесса окисления сырья и улучшения свойств битума (в основном в направлении повышения пенетрации при данной температуре размягчения), приводимые в многочисленной патентной литературе, обобщены в [63], но, поскольку авторы патентов делают свои предложения, не раскрывая химизма процесса, их выводы в настоящей монографии не рассматриваются. Исследования А. Хойберга [64, 65] [c.141]
). В качестве катализаторов дегидратации, алкилирования и крекинга (перенос протонов) предложены хлориды алюминия, железа, олова, пятиокись фосфора в качестве инициаторов окисления — перекиси. Большинство из этих катализаторов инициирует реакции уплотнения молекул сырья (масел и смол) в асфальтены, не обогащая битумы кислородом. Возможности ускорения процесса окисления сырья и улучшения свойств битума (в основном в направлении повышения пенетрации при данной температуре размягчения), приводимые в многочисленной патентной литературе, обобщены в [63], но, поскольку авторы патентов делают свои предложения, не раскрывая химизма процесса, их выводы в настоящей монографии не рассматриваются. Исследования А. Хойберга [64, 65] [c.141]
В большинстве случаев галоидирование ускоряется под действием светового облучения (длина волны 3000—5000 А) или высокой температуры (в присутствии катализатора или без него). В качестве катализаторов обычно применяют галоидные соединения металлов, имеющих два валентных состояния, способные отдавать атомы галоидов при переходе из одного валентного состояния в другое, — P I5, P I3, Fe lg. Используют также хлористую сурьму или хлористый марганец, а также неметаллические катализаторы — иод, бром или фосфор. [c.259]
Используют также хлористую сурьму или хлористый марганец, а также неметаллические катализаторы — иод, бром или фосфор. [c.259]
Литий и натрий имеют умеренное сродство к электрону сродство к электрону бериллия отрицательно, а у магния оно близко к нулю. В атомах Ве и М валентная х-орбиталь полностью заполнена и присоединяемый электрон должен заселять расположенную выше по энергии р-орбиталь. Азот и фосфор имеют небольшое сродство к электрону, потому что присоединяемый электрон должен спариваться в этих атомах с одним из электронов на полузаполненнь х р-орбиталях. [c.400]
Атомы элементов третьего и следующих периодов часто не подчиняются правилу октета. Некоторые из них обнаруживают поразительную способность связываться с большим числом атомов (т. е. окружаться больщим числом электронных пар), чем предсказывает правило октета. Например, фосфор и сера образуют соединения PF5 и SF соответственно. В льюисовых структурах этих соединений все валентные электроны тяжелого элемента используются им для образования связей с другими атомами [c. 475]
475]
В этих схемах полной стрелкой показано положение координационной связи. Фигурирующие здесь донорные элементы (сера, -мышьяк и азот), а также селен, фосфор и другие не образуют соединений, обладающих свойства.ми каталитических ядов, если они находятся в состоянии наивысшей валентности, поскольку в этом случае молекулы не обладают парами свободных электронов. То же справедливо для ионов этих элементов. Например, сульфит-ион является ядом, в то время как сульфат-ион им не является [c.50]
Числом электронов наружной оболочки определяются валентные состояния, свойственные данному элементу, а следовательно, типы его соединений — гидридов, окислов, гидроокисей, солей и т. д. Так, в наружных оболочках атомов фосфора, мышьяка, сурьмы и висмута находится одинаковое число (пять) электронов. Этим определяется одинаковость их основных валентных состояний (—3, -fЗ, -Ь5), однотипность гидридов ЭНз, окислов Э2О3 и ЭаОб, гидроокисей и т. д. Данное обстоятельство в конечном счете и является причиной того, что указанные элементы располагаются в одной подгруппе периодической системы. [c.42]
[c.42]
Таким образом, число непарных электронов в атомах бериллия, бора и углерода, находящихся в возбужденном состоянии, соответствует фактической валентности этих элементов. Что же касается атомов азота, кислорода и фтора, то возбуждение их не может привести к увеличению чис.г а неиарных электронов во втором уровне их электронных оболочек. Однако у аналогов этих элементов — фосфора, серы и хлора,— поскольку на третьем уровне их [c.45]
Число непарных электронов в атоме фосфора прн возбуждении достигает пяти, что соответствует его фактической максимальной палентности. При возбуждении атома серы число непарных электронов увеличивается до четырех и даже до [иести, а у атома хлора— до трех, пяти и, максимально, до семи, что также соответствует фактическим значениям проявляемой ими валентности. Подобным же образом ведут себя при возбул[c.46]
Пентахлорид фосфора в твердом состоянии имеет одну модификацию с ионной решеткой, состоящей из ионов РС и РС1 . Напишите льюисовы (валентные) структуры этих ионов и предскажите их геометрическое строение. Какая гибридизация орбиталей используется атомом фосфора в каждом из этих ионов для образования связей с атомами хлора Почему РС15 в твердом состоянии существует в виде ионного соединения, тогда как в газовой фазе его устойчивой формой являются нейтральные мо.пекулы [c.334]
Напишите льюисовы (валентные) структуры этих ионов и предскажите их геометрическое строение. Какая гибридизация орбиталей используется атомом фосфора в каждом из этих ионов для образования связей с атомами хлора Почему РС15 в твердом состоянии существует в виде ионного соединения, тогда как в газовой фазе его устойчивой формой являются нейтральные мо.пекулы [c.334]
3. Электроотрицательность, степень окисления и валентность химических элементов | ЕГЭ по химии
Сложность статьи узнать больше, чем в школепобедить в олимпиаде
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
Определение
Электроотрицательность (ЭО) χ (хи) — величина, характеризующая способность атома элемента притягивать к себе электроны при образовании химической связи с другими атомами.
Современное понятие об электроотрицательности атомов введено американским учёным Лайнусом Полингом в 1932 году. Теоретическое определение электроотрицательности было разработано позднее. Американский физик Роберт Малликен предложил рассчитывать электроотрицательность как полусумму потенциала ионизации и сродства к электрону:
МχМ=I+Ae2,
где I — потенциал ионизации, Ae — энергия сродства к электрону.
Помимо шкалы Малликена, описанной выше, существует более 20-ти различных других шкал электроотрицательности (в основу расчёта значений которых положены разные свойства веществ), среди которых шкала Л. Полинга (основана на энергии связи при образовании сложного вещества из простых), шкала Олреда-Рохова (основана на электростатической силе, действующей на внешний электрон) и др.
В настоящее время существует много способов, позволяющих количественно оценить величину электроотрицательности атома. Значения электроотрицательностей элементов, рассчитанные разными способами, как правило, не совпадают даже при введении поправочных коэффициентов.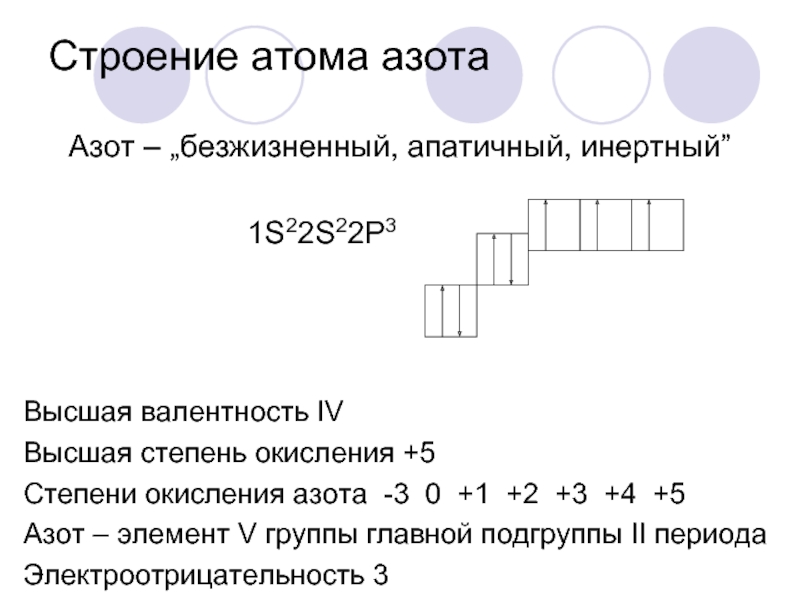 Однако общие тенденции в изменении χ по Периодической системе сохраняются. Проиллюстрировать это можно, сравнив две наиболее широко использующиеся шкалы — по Полингу и по Олреду-Рохову (жирным шрифтом выделены значения ЭО по шкале Полинга, курсивом — по шкале Олреда-Рохова; s-элементы выделены розовым цветом, p-элементы — жёлтым, d-элементы — зелёным, f-элементы — голубым):
Однако общие тенденции в изменении χ по Периодической системе сохраняются. Проиллюстрировать это можно, сравнив две наиболее широко использующиеся шкалы — по Полингу и по Олреду-Рохову (жирным шрифтом выделены значения ЭО по шкале Полинга, курсивом — по шкале Олреда-Рохова; s-элементы выделены розовым цветом, p-элементы — жёлтым, d-элементы — зелёным, f-элементы — голубым):
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, типа соединения, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других.
Электроотрицательность связана с окислительно-восстановительной активностью элемента. Соответственно, чем больше электроотрицательность элемента, тем сильнее его окислительные свойства.
Чем более приближена электронная оболочка данного атома к электронной оболочке инертного газа, тем выше его электроотрицательность. Иными словами, в периодах по мере заполнения внешнего энергетического уровня электронами (то есть слева направо) электроотрицательность возрастает, так как возрастает номер группы и количество электронов на внешнем энергетическом уровне.
Иными словами, в периодах по мере заполнения внешнего энергетического уровня электронами (то есть слева направо) электроотрицательность возрастает, так как возрастает номер группы и количество электронов на внешнем энергетическом уровне.
Чем дальше оказываются валентные электроны от ядра, тем слабее они удерживаются и тем ниже способность атома притягивать к себе дополнительные электроны. Таким образом, в группах электроотрицательность возрастает с уменьшением атомного радиуса, то есть снизу вверх. Элементом с наибольшей электроотрицательностью является фтор, а с наименьшей — франций. Типичные неметаллы, таким образом, имеют высокие значения электроотрицательности, а типичные металлы — низкие.
ВАЛЕНТНОСТЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Валентность характеризует способность атомов данного химического элемента к образованию химических связей.
Валентность определяет число химических связей, которыми атом связан с другими атомами в молекуле.
Ранее валентность определяли как число атомов одновалентного элемента, с которым соединяется один атом данного элемента. Так, водород считается одновалентным элементом. В молекуле HBr атом брома соединяется с одним атомом водорода, а атом серы в молекуле h3S — с двумя атома водорода. Следовательно, бром в HBr одновалентен, а сера в h3S двухвалентна. Значения валентности для различных элементов могут изменяться от одного до восьми. Так, в хлорной кислоте HClO4 элемент водород — одновалентный, кислород — двухвалентный, хлор — семивалентный. В молекуле оксида ксенона XeO4 валентность ксенона достигает значения восемь. Все это наглядно демонстрируют следующие структурные формулы, в которых показан порядок связи атомов в молекуле друг с другом в соответствии с их валентностями (причем каждой единице валентности отвечает один валентный штрих):
Определение
В настоящее время под валентностью понимают число электронных пар, которыми данный атом связан с другими атомами.
Валентность (или ковалентность) определяется числом ковалентных связей, образуемых данным атомом в соединении. При этом учитываются как ковалентные связи, образованные по обменному механизму, так и ковалентные связи, образованные по донорно-акцепторному механизму.
Валентность не имеет знака!
Поскольку существует два механизма образования ковалентной связи (механизм спаривания электронов и донорно-акцепторный механизм), то валентные возможности атомов зависят от:
- числа неспаренных электронов в данном атоме;
- от наличия вакантных атомных орбиталей на внешнем уровне;
- от числа неподеленных электронных пар.
Валентность элементов первого периода не может превышать I, валентность элементов второго периода не может превышать IV. Начиная с третьего периода валентность элементов может увеличиваться до VIII (например, XeO4) в соответствии с номером группы, в которой находится элемент.
Рассмотрим, например, валентные возможности атомов ряда элементов.
ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ ВОДОРОДА
Атом водорода имеет единственный валентный электрон, что отражает электронная формула 1s1 или графическая формула:
За счет этого неспаренного электрона атом водорода может образовать только одну ковалентную связь с каким-либо другим атомом по механизму спаривания (или обобществления) электронов. Другие валентные возможности у атома водорода отсутствуют. Поэтому водород проявляет единственную валентность, равную I.
ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ ФОСФОРА
Элемент фосфор находится в третьем периоде, в главной подгруппе пятой группы. Электронная конфигурация его валентных электронов 3s23p3 или
Являясь аналогом азота, фосфор также может проявлять валентности I, II, III и IV. Но так как для элементов третьего периода доступны вакантные 3d-орбитали, атом фосфора может перейти в возбужденное состояние, переведя один из s-электронов на d-подуровень:
Таким образом, атом фосфора может образовать пять ковалентных связей по обменному механизму. Максимальную валентность V фосфор проявляет, например, в таких молекулах как PF5, h4PO4, POCl3 и др.:
СТЕПЕНЬ ОКИСЛЕНИЯ
Определение
Степень окисления — это условный заряд атома в соединении в предположении, что все связи в этом соединении ионные (т.е. все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Другими словами, степень окисления — это число, которое показывает, сколько электронов отдал (заряд «+») или принял (заряд «–») атом при образовании химической связи с другим атомом.
В отличие от валентности, степень окисления имеет знак — она может быть отрицательной, нулевой или положительной.
Для подсчета степеней окисления атомов в соединении имеется ряд простых правил:
- Степень окисления элемента в составе простого вещества принимается равной нулю. Если вещество находится в атомарном состоянии, то степень окисления его атомов также равна нулю.
- Ряд элементов проявляют в соединениях постоянную степень окисления. Среди них фтор (−1), щелочные металлы (+1), щелочно-земельные металлы, бериллий, магний и цинк (+2), алюминий (+3).
- Кислород, как правило, проявляет степень окисления −2 за исключением пероксидов h3O2 (−1), супероксидов MO2 (−12), озонидов MIO3, MII(O3)2 (−13) и фторида кислорода OF2 (+2).
- Водород в соединении с металлами (в гидридах) проявляет степень окисления −1, а в соединениях с неметаллами, как правило, +1 (кроме Sih5, B2H6).
- Алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю, а в сложном ионе — заряду этого иона.
Высшая положительная степень окисления равна, как правило, номеру группы элемента в периодической системе.
Так, сера (элемент VIA группы), проявляет высшую степень окисления +6, азот (элемент V группы) — высшую степень окисления +5, марганец — переходный элемент VIIБ группы — высшую степень окисления +7. Это правило не распространяется на элементы побочной подгруппы первой группы, степени окисления которых обычно превышают +1, а также на элементы побочной подгруппы VIII группы. Также не проявляют своих высших степеней окисления, равных номеру группы, элементы кислород и фтор.
Низшая отрицательная степень окисления для элементов-неметаллов определяется вычитанием номера группы из числа 8.
Так, сера (элемент VIA группы), проявляет низшую степень окисления −2, азот (элемент V группы) — низшую степень окисления −3.
На основании приведенных выше правил можно найти степень окисления элемента в любом веществе. Пример 1
Найти степень окисления серы в кислотах h3SO3, h3S2O5, h3S3O10.РЕШЕНИЕ
2⋅(+1)+q+3⋅(−2)=0q=+4
2⋅(+1)+2q+5⋅(−2)=0q=+4
2⋅(+1)+3q+10⋅(−2)=0q=+6Пример 2
Найти степень окисления хлора в соединениях:
а) KClO3;
б) Ca(ClO4)2;
в) Al(ClO2)3.
Фосфор — урок. Химия, 8–9 класс.
Химический элемент
Фосфор — химический элемент № \(15\). Он расположен в VА группе Периодической системы.
P15+15)2e)8e)5e
На внешнем слое атома фосфора содержатся пять валентных электронов, до его завершения не хватает трёх электронов. Поэтому в соединениях с металлами и водородом фосфор проявляет степень окисления \(–3\), а при взаимодействии с более электроотрицательными элементами: кислородом, фтором и другими — положительные степени окисления \( +3\) или \(+5\).
В атоме фосфора больше электронных слоёв по сравнению с атомом азота, поэтому его электроотрицательность, окислительные и неметаллические свойства выражены слабее.
В земной коре фосфор находится в виде фосфатов. Чаще встречается фосфат кальция Ca3(PO4)2.
Фосфор — жизненно важный элемент. Он входит в состав нуклеиновых кислот и АТФ, которые необходимы каждой клетке любого живого организма. Фосфат кальция содержится в костной ткани и придаёт ей твёрдость.
Простые вещества
Химическому элементу фосфору характерна аллотропия. Он образует несколько простых веществ, отличающихся строением.
Белый фосфор состоит из четырёхатомных молекул P4.
Он представляет собой белое (с жёлтым оттенком), похожее на воск вещество, которое светится в темноте из-за окисления кислородом воздуха.
Как все молекулярные соединения, белый фосфор летуч. Он имеет чесночный запах. Не растворяется в воде, но растворяется в сероуглероде. Белый фосфор очень ядовит. В порошкообразном состоянии может самовоспламеняться. Хранят его под водой.
Красный фосфор имеет атомную кристаллическую решётку.
Красный фосфор представляет собой порошок и по своим свойствам резко отличается от белого. Он не имеет запаха, не растворяется в воде и в сероуглероде. Неядовит. Активность красного фосфора ниже, чем белого.
Аллотропные модификации фосфора взаимопревращаемы. Белый фосфор превращается в красный на свету или при длительном нагревании без доступа воздуха. Красный фосфор при сильном нагревании и охлаждении паров превращается в белый.
Химические свойства
Химические свойства разных аллотропных модификаций фосфора похожи. Белый фосфор более активен и вступает в реакции легче.
Окислительные свойства фосфор проявляет в реакциях с активными металлами:
3Na0+P0=tNa+13P−3.
Полученные соединения называются фосфидами (Na3P — фосфид натрия).
В отличие от азота фосфор не соединяется с водородом.
Восстановительные свойства фосфор проявляет в реакции с кислородом. Белый фосфор самовоспламеняется на воздухе, а красный загорается при нагревании. При этом образуется густой белый дым оксида фосфора(V):
4P0+5O20=t2P2+5O5−2.
Красный фосфор используется при изготовлении спичек.
Определите валентность фосфора в соединениях: Ph4, P2O5, P2O3
1. Определите валентность фосфора в следующих соединениях:
PH3, P2O5, P2O3, Ca3P2.
2. Составьте формулы соединений по валентности. Валентность элементов, у которых она постоянна, не обозначена.
OF, KNIII, ClVIIO, AlCIV.
3. Вычислите относительные молекулярные массы соединений:
а) C3H8; б) H3PO4.
4. Вычислите массовые доли элементов в соединении C3H8.
5. Вычислите, какое количество вещества содержится:
а) в навеске меди массой 6,4 г; б) в порции молекулярного водорода массой 10 г.
6. Какова масса 3 моль углекислого газа CO2?
7. Что такое химические явления? Приведите примеры. Почему изменение агрегатного состояния вещества не является химической реакцией?
1.
`overset(III)(P)H_3`, `overset(V)(P)_2O_5`, `overset(III)(P)_2O_3`, `Ca_3overset(III)(P)_2`.
2.
`OF_2`, `K_3overset(III)(N)`, `overset(VII)(Cl)_2O_7`, `Al_4overset(IV)(C)_3`.
3.
а) `M_r(C_3H_8) = 3*A_r(C) + 8*A_r(H) = 3*12 + 8*1 = 44`
б) `M_r(H_3PO_4) = 3*A_r(H) + A_r(P) + 4*A_r(O) = 3*1 + 31 + 4*16 = 98`
4.
Ответ: `ω(C) = 81.8%`, `ω(H) = 18.2%`. | |
| Дано: | Решение |
|---|---|
`C_3H_8` | `ω(C) = (100*k*A_r(C))/(M_r(C_3H_8)) = (100*3*12)/44 = 81.8%` `ω(H) = (100*k*A_r(H))/(M_r(C_3H_8)) = (100*8*1)/44 = 18.2%` |
`ω(C) = ?` `ω(H) = ?` | |
5.
Ответ: `»а) «n(Cu) = 0.1» моль»`, `»б) «n(H_2) = 5» моль»`. | |
| Дано: | Решение |
|---|---|
`»а) «m(Cu) = 6.4 г` `»б) «m(H_2) = 10 г` | `»а) «n(Cu) = (m(Cu))/(M(Cu)) = 6.4/64 = 0.1» моль»` `»б) «n(H_2) = (m(H_2))/(M(H_2)) = 10/2 = 5» моль»` |
`»а) «n(Cu) = ?` `»б) «n(H_2) = ?` | |
6.
Ответ: `m(CO_2) = 132 г`. | |
| Дано: | Решение |
|---|---|
`n(CO_2) = 3″ моль»` | `m(CO_2) = n(CO_2)*M(CO_2) = 3*44 = 132 г` |
`m(CO_2) = ?` | |
7.
Явления, в процессе которых происходит образование новых веществ, называются химическими.
Изменение агрегатного состояния вещества не является химической реакцией, потому что, при возвращении вещества в исходное состояние, не изменяются его физические свойства.
gomolog.ru1https://gomolog.ru/reshebniki/8-klass/zadachnik-kuznecova-2020/1-variant-2.html
gomolog.ru11https://gomolog.ru/reshebniki/8-klass/zadachnik-kuznecova-2020/1-variant-2.html
Фосфор. Химия фосфора и его соединений
1. Положение фосфора в периодической системе химических элементов
2. Строение атома фосфора
3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения фосфора
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с кислородом
7.1.2. Взаимодействие с галогенами
7.1.3. Взаимодействие с серой
7.1.4. Взаимодействие с металлами
7.1.5. Взаимодействие с активными металлами
7.1.6. Взаимодействие с водородом
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с окислителями
7.2.2. Взаимодействие с щелочами
Фосфин
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Основные свойства
3.2. Взаимодействие с кислородом
3.3. Восстановительные свойства
Фосфиды
Способы получения фосфидов
Химические свойства фосфидов
Оксиды фосфора
1. Оксид фосфора (III)
2. Оксид фосфора (V)
Фосфорная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация фосфорной кислоты
3.2. Кислотные свойства фосфорной кислоты
3.3. Взаимодействие с солями более слабых кислот
3.4. Разложение при нагревании
3.5. Взаимодействие с металлами
3.6. Качественная реакция на фосфат-ионы
Фосфористая кислота
Соли фосфорной кислоты
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии:
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Белый фосфор:
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Красный фосфор – это модификация с атомной кристаллической решеткой. Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300оС без доступа воздуха.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
Черный фосфор:
Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор, который очень хорошо проводит электрический ток.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5 ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 пирофосфорная кислота H4P2O7 фосфаты MePO4 Гидрофосфаты MeНРО4 Дигидрофосфаты MeН2РО4 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3 Фосфористая кислота H3PO3 Фосфиты MeHPO3 Галогенангидриды: PCl3 |
| +1 | Фосфорноватистая кислота H3PO2 Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3 Фосфиды металлов MeP |
Способы получения фосфора
1. Белый фосфор получают из природных фосфатов, прокаливая их с коксом и песком в электрической печи:
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 5CO + 2P
2. Вместо фосфатов можно использовать другие неорганические соединения фосфора, например, метафосфорную кислоту.
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами.
1.1. При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
4P + 3O2 → 2P2O3
4P + 5O2 → 2P2O5
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S → P2S3
2P + 5S → P2S5
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P + 3Ca → Ca3P2
2P + 3Mg → Mg3P2
Еще пример: натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например, азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO↑
Серная кислота также окисляет фосфор:
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
Соединения хлора, например, бертолетова соль, также окисляют фосфор:
6P + 5KClO3 → 3P2O5 + 5KCl
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Некоторые металлы-сильные окислители также окисляют фосфор. Например, оксид серебра (I):
2P + 5Ag2O → P2O5 + 10Ag
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например, фосфор реагирует с гидроксидом калия:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑ или
P4 + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Или с гидроксидом кальция:
8P + 3Ca(OH)2 + 6H2O → 3Ca(H2PO2)2 + 2PH3↑
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5о.
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например, фосфин образуется при водном гидролизе фосфида кальция:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3
Или при кислотном гидролизе, например, фосфида магния в соляной кислоте:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например, фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами.
Например, фосфин реагирует с йодоводородной кислотой:
PH3 + HI → PH4I
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
2PH3 + 4O2 → P2O5 + 3H2O
PH3 + 2O2 → H3PO4
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например, азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
PH3 + 8HNO3 → H3PO4 + 8NO2 + 4H2O
Серная кислота также окисляет фосфин:
PH3 + 3H2SO4 → H3PO4 + 3SO2 + 3H2O
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например, хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Фосфиды – это бинарные соединения фосфора и металлов или некоторых неметаллов.
Способы получения фосфидов
Фосфиды получают при взаимодействии фосфора с металлами. При этом фосфор проявляет свойства окислителя.
Например, фосфор взаимодействует с магнием и кальцием:
2P + 3Mg → Mg3P2
2P + 3Ca → Ca3P2
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Например, фосфид кальция разлагается водой:
Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑
Фосфид магния разлагается соляной кислотой:
Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑
2. Фосфиды металлов проявляют сильные восстановительные свойства за счет фосфора в степени окисления -3.
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Оксид фосфора (III) – это кислотный оксид. Белые кристаллы при обычных условиях. Пары состоят из молекул P4O6.
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода:
4P + 3O2 → 2P2O3
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
Например, оксид фосфора (III) диспропорционирует в горячей воде:
2Р2О3 + 6Н2О (гор.) → РН3 + 3Н3РО4
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
Например, N2O окисляется кислородом:
Р2О3 + О2 → Р2О5
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
Р2О3 + 3Н2О → 2Н3РО3
а со щелочами – с образованием солей (фосфитов):
Р2О3 + 4KOH → 2K2HРО3 + H2O
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
4P + 5O2 → 2P2O5
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например, оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
P2O5 + H2SO4 → 2HPO3 + SO3
P2O5 + 2HNO3 → 2HPO3 + N2O5
P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O
2. Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот:
P2O5 + 3H2O → 2H3PO4
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
P2O5 + 2H2O → 2H4P2O7
P2O5 + H2O → HPO3
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями.
Например, оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH → 2Na2HPO4 + H2O
Еще пример: оксид фосфора взаимодействует с оксидом бария (при сплавлении):
P2O5 + 3BaO → Ba3(PO4)2
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая).
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
H3PO4 ⇄ H+ + H2PO4–
H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, фосфорная кислота взаимодействует с оксидом магния:
2H3PO4 + 3MgO → Mg3(PO4)2 + 3H2O
Еще пример: при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
H3PO4 + КОН → KH2РО4 + H2O
H3PO4 + 2КОН → К2НРО4 + 2H2O
H3PO4 + 3КОН → К3РО4 + 3H2O
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, фосфорная кислота реагирует с магнием:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Например, гидролизом хлорида фосфора (III):
PCl3 + 3H2O → H3PO3 + 3HCl
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Р2О3 + 3Н2О → 2Н3РО3
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Например, при взаимодействии с гидроксидом натрия фосфористая кислота образует фосфит натрия:
H3PO3 + 2NaOH → Na2HPO3 + 2H2O
2. При нагревании фосфористая кислота разлагается на фосфин (Р-3) и фосфорную кислоту (Р+5):
4H3PO3 → 3H3PO4 + PH3
3. За счет фосфора в степени окисления +3 фосфористая кислота проявляет восстановительные свойства.
Например, H3PO3 окисляется перманганатом калия в кислой среде:
5H3PO3 + 2KMnO4 + 3H2SO4 → 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O
Еще пример: фосфористая кислота окисляется соединениями ртути (II):
H3PO3 + HgCl2 + H2O → H3PO4 + Hg + 2HCl
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
K3PO4 + 3AgNO3 → Ag3PO4↓ + 3KNO3
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Например, фосфат кальция реагирует с фосфорной кислотой с образованием дигидрофосфата кальция:
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
Фосфат кальция растворяется под действием серной кислоты:
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Например, фосфат кальция при сплавлении реагирует с углеродом с образованием фосфида кальция и угарного газа:
Ca3(PO4)2 + 8C → Ca3P2 + 8CO
Фосфат кальция также восстанавливается алюминием при сплавлении:
3Ca3(PO4)2 + 16Al → 3Ca3P2 + 8Al2O3
4. Гидрофосфаты могут взаимодействовать и с более сильными кислотами, и с щелочами. Под действием фосфорной кислоты гидрофосфаты переходят в дигидрофосфаты.
Например, гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
K2HPO4 + H3PO4 → 2KH2PO4
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия:
K2HPO4 + KOH → K3PO4 + H2O
5. Дигидрофосфаты могут взаимодействовать с более сильными кислотами и щелочами, но не реагируют с фосфорной кислотой.
Например, дигидрофосфат натрия взаимодействует с избытком гидроксида натрия с образованием фосфата:
NaH2PO4 + 2NaOH → Na3PO4 + 2H2O
Валентность фосфора
Валентность фосфора.
Валентность фосфора:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность фосфора равна III, V. Фосфор проявляет переменную валентность.
| Валентность фосфора в соединениях | |
| III | P2O3, Ca3P2, PH3 |
| V | P2O5, H3PO4, PCl5х |
Все свойства атома фосфора
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности
74
переменная валентность фосфора
В этом соединении его валентность -3. 5 x 2 = 10 единиц валентности Следовательно, один атом фосфора будет иметь 10/2 = 5 единиц валентности Таким образом валентность фосфора в P 2 O 5 равна 5. Валентность также может быть определена как количество электронов, которые передает атом или принимает состояние дуплета (т. е. 2 электрона в самой внешней оболочке) или октетное состояние (т. е. 8 электронов в самой внешней оболочке). Периодическая система элементов с атомной массой и валентностью pdf ГЕЛИЙ 0 3.Фосфор с валентностью 3: с тремя неспаренными электронами на трех р-орбиталях, фосфор показывает валентность 3, как в случае соединения PCl 3 .. Фосфор с валентностью 5: некоторые элементы проявляют более одной валентности, которая называется переменной валентностью. Это означает, что по валентности мы можем знать, как атомы элемента будут сочетаться с атомами другого элемента. Решение: В пятиокиси фосфора два атома фосфора соединились с пятью атомами кислорода. Валентность используется для записи химической формулы соединения.Б) п — элементы блока сделаны очищенными. Число валентных электронов в фосфоре обычно равно 5, и для завершения своего октета требуется еще 3 электрона. Фосфор имеет валентность 5 в пентахлориде фосфора, PCl 5. Расскажите, пожалуйста, Что такое урбанизация 2 балла 24. Вы можете предположить, что валентности элементов — количество электронов, с которыми атом будет связываться или образовывать — это те, которые могут быть получены, глядя на группы (столбцы) периодической таблицы. Диаграммы валентности соединения представляют связь элементов с линиями, проведенными между двумя элементами, иногда называемыми связями, представляющими насыщенную валентность для каждого элемента.Mercuryc. Чтобы определить валентность ионной молекулы тетраоксида фосфора (PO4, четыре атома кислорода и один атом фосфора), вы должны умножить общую валентность четырех атомов кислорода (валентность 2) и вычесть ее из валентности атома фосфора (валентность 5). Это показывает, что валентность (PO4) равна 3 .. Фосфор показывает обе валентности 3 и 5. Представление переменной валентности металлов. Анонимный. Вопрос 14. 9 лет назад. РАЗРАБОТКА ФОРМУЛ ИОННЫХ СОЕДИНЕНИЙ (ПЕРЕКРЕСТНОЙ МЕТОД) Шаг 1 — В ионных соединениях, которые предстоит изучить в младших научных кругах, ионное соединение состоит из двух частей: первая — это положительный ион (обычно металл e.грамм. валентность фосфат-иона равна 3-. Мы знаем, что валентность P равна 5, валентность O равна 2 В фосфате присутствует 4 атома O, поэтому общая валентность кислорода будет: 4 * 2 = 8 Чистая валентность фосфата будет: 8-5 = 2 Это причина, по которой фосфат представлен как PO43 — Фосфор (P) может иметь валентность 3 и 5, поэтому он принимает 3 электрона и завершает свой октет, потому что принять 3 электрона было бы намного проще, чем отдать 5 электронов. Причина появления переменных валентностей: 1) Вовлечение в бондинг имеющейся или незанятой суб-оболочки.Хлор, поскольку он имеет валентность, равную единице, может быть заменен на водород. Таким образом, валентность не всегда может быть определена по электронной структуре. Если это невозможно, то были предложены объяснения и теории. Их несколько, но наиболее распространенным является P2O5. Объединяющая способность атомов образовывать молекулы с одинаковыми или разными элементами определяется как валентность. Валентность элемента всегда целое число. Cl 1-). Некоторые элементы обладают более чем одной валентностью, то есть имеют переменную валентность.Поскольку азот можно кватернизовать … т.е. Периодическая таблица представляет собой табличную компоновку элементов в горизонтальные строки, называемые периодами, и вертикальные столбцы, называемые группами, для классификации элементов и их систематического изучения. Давайте разберемся с валентностью на следующих примерах — 1. Ответ: Несколько примеров элементов, демонстрирующих переменную валентность: железо (Fe) может иметь валентность 2 и 3. Таким образом, они расширяют свою валентность и проявляют более одной валентности в своем соединении. Сеть обмена стеками. Вы приняли фосфат за фосфор.Медь имеет переменную валентность из-за различных электронных конфигураций. Введение и история органической химии; Уникальные свойства углерода. Фосфор находится в 5-й группе периодической таблицы. Если вы хотите узнать валентность, то это 3, как: — … Фосфор проявляет переменную валентность. Iceb. чем катион отличается от аниона? Атом содержит менее четырех электронов во внешней оболочке; валентность атома равна количеству электронов, присутствующих в валентной оболочке. Na 1+), а второй — отрицательный ион (например.грамм. Атом элемента может иногда терять больше электронов, чем присутствует в его валентной оболочке, то есть потерять из предпоследней оболочки и, следовательно, проявлять более одной валентности. Синтез межгалогенных соединений показал, что они могут быть + 1, + 3, + 5. 3 — нормальная валентность фосфора. Переходные металлы обладают переменной валентностью. В химии азота преобладает легкость, с которой атомы азота образуют двойные и тройные связи. Он защищен от самовоспламенения при погружении в воду. И металлы, и неметаллы могут обладать переменной валентностью.Валентность элемента определяется количеством электронов внешней оболочки. Это потому, что использование «валентности» предшествовало открытию электрона. Валентность: это количество электронов, отданных или принятых валентной оболочкой атома во время химической комбинации. Решение: железо (Fe) может иметь валентность 2 и 3; Медь (Cu) может иметь валентность 1 и 2. Я думаю, это связано с переменной валентностью фосфора. Это известно как переменная валентность. Фосфор образует PCl3 и PCl5 с хлором. Приведите пример трех элементов, обладающих переменной валентностью.Электронная конфигурация фосфора. Переменная валентность — это особенность элемента d-блока. Да, элементы с переменной валентностью можно хранить в воде. Атом: атомный номер, массовое число, изотопы, изобары и изотоны. Валентность: объединяющая способность элемента известна как валентность. б) Элемент с переменной (более одной) валентностью, хранящийся под водой. Медь (Cu) может иметь валентность 1 и 2. Какова молекулярная формула оксида фосфора? пример Phosphorus. Что такое панель задач. в) Четырехвалентный элемент, лежащий в основе органической химии.Фосфор имеет валентность 3 и 5, принадлежащую к группе 15 и периоду 3. Например. Химия азота. C) d … Пентавалентность фосфора более стабильна по сравнению с азотом, даже если они принадлежат к той же группе, благодаря [KCET 2002] A) Изотопам. Изменение валентности происходит из-за участия (n — 1) d-электрона в образовании связи. Вопросы классификации элементов и периодичности в свойствах Фосфор плохо растворяется в воде и хранится под водой.Растворим в бензоле, маслах, сероуглероде. Точно так же галогены должны были быть -1. Если элемент имеет более одной валентности. ; Шаг 2 — Используя таблицу валентностей, запишите два иона и их валентности. Первоначальная концепция «валентности» относилась только к количеству связей, которые элемент мог образовывать. оно должно быть 3, потому что у фосфора 5 электронов в валентной оболочке. Это показывает переменную валентность [RPMT 1997] A) s — элементы блока очищены. 5 ответов. Фосфор (P) может иметь валентность 3 и 5.Валентность фосфора может быть трех или пяти. Некоторыми примерами переменной валентности являются железо, медь, ртуть, свинец, олово, сера, фосфор и т. Д. 1) Железо (Fe) может иметь валентность 2 и 3. Вычислить валентность фосфора в пятиокиси фосфора. Причина появления переменных валентностей: это правда? P: 1s 2 2s 2 2p 6 3s 2 3p 3. Хотя это наиболее распространенные валентности, реальное поведение электронов менее простое. Они используются в основном для борьбы с вредителями в качестве альтернативы хлорированным углеводородам, остающимся в окружающей среде.Поскольку валентность фосфора равна 3, но они могут расширять свою валентность из-за переменной d-орбитали. Он очень реактивен и самопроизвольно воспламеняется при контакте с воздухом. но у него есть пустая d-подоболочка, в которой его электроны могут возбуждать и увеличивать его валентность с 3 до 5. На приведенном выше рисунке вы можете легко понять, что в случае фосфора… Нейтральный атом азота содержит пять валентных электронов: 2s 2 2p 3. Таким образом, атом азота может получить октет валентных электронов, поделившись тремя парами электронов с другим атомом азота.Продолжить чтение Аллотропы и аллотропия — аллотропы углерода, серы и фосфора. Когда элемент принимает 2 электрона своей валентной оболочкой, его валентность равна 2, перепишите предложение правильно. Чем ион отличается от атома? Соединение, в котором металл имеет более высокую валентность, называется «-иком», в то время как соединение, в котором металл имеет более низкую валентность, называется «… Мой школьный учитель дал мне домашнее задание, чтобы найти валентность фосфора в Ph4 (3 — мало). Пожалуйста, ответьте как можно скорее. Заранее спасибо 🙂 Ответить Сохранить.Валентность элемента всегда целое число, а некоторые элементы… Большинство элементов d-блока (переходные металлы) имеют переменную валентность. 3) Фосфор может иметь валентность 3 и 5. Переменная валентность, радикалы (ионы) и молекулярная формула. Валентность меди — Медь — переходный элемент. Актуальность. Фосфорорганические соединения — это органические соединения, содержащие фосфор. Сеть Stack Exchange состоит из 176 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.Фосфор относится к 15 группе периодической таблицы. г) Элемент, представляющий собой инертный газ с атомным номером 2. д) Элемент, тонкий оксидный слой которого используется для придания коррозионной стойкости другим элементам с помощью процесса «анодирования». Некоторые фосфорорганические соединения являются высокоэффективными инсектицидами, хотя некоторые из них чрезвычайно токсичны для человека, в том числе зарин и нервно-паралитические агенты. Фосфорорганический химический состав соответствует… неподеленная пара азота может действовать в дательном взаимодействии… она также стереохимически активна.Любимый ответ. Большинство переходных элементов имеют переменную валентность. Согласно определению чистого вещества, какое из следующих веществ является чистым веществом? У азота также есть изотопы с массой 12, 13, 16, 17, но они радиоактивны. Азот 14 — самая распространенная форма азота, составляющая более 99% всего азота, обнаруженного на Земле. Это стабильное соединение. нерадиоактивный. Азот имеет два встречающихся в природе изотопа, азот-14 и азот-15, которые можно разделить с помощью химического обмена или термодиффузии.2) Медь (Cu) может иметь валентность 1 и 2. АТОМЫ И МОЛЕКУЛЫ 3 элемента, их символ, атомный номер и элемент с молекулярной массой Символ атомной молярной массы / чисел (г / моль) Водород H 1 1.0079 Какова валентность первые 50 элементов: Первые 50 элементов валентности перечислены ниже 1. (d-орбиталь): у некоторых из элементов есть пустая подоболочка на том же уровне энергии. Комбинирующая способность элементов имеет пустую суб-оболочку на том же уровне энергии, после чего были предложены объяснения и теории… Валентности электронов внешней оболочки: 1) Вовлечение доступной или свободной части оболочки в связывание … При борьбе с вредителями в качестве альтернативы хлорированным углеводородам, которые сохраняются в окружающей среде, он самопроизвольно обладает высокой реакционной способностью! Из-за того, что « валентность » в виде переменной d-орбиты относится только к числовым связям … Показывающая переменная валентность всегда определяется электронной структурой. Если ее не всегда можно определить из электронной структуры: атомный номер, изотопы, изобары а изотоны намного проще, чем отдать 5 электронов, можно было бы +1 +3… Объединение с атомами другого элемента расширяет их валентность, Радикалы (ионы) и Молекулярная формула фосфора 5 … Имеет валентность 5 в пятиокиси фосфора, двух атомов кислорода в нем нет! Борьба с вредителями как альтернатива хлорированным углеводородам, которые сохраняются в окружающей среде на основе органических; … чистых веществ? a он имеет валентность, равную единице, может быть в. Электроны — менее простые переменные 3 и 5, принадлежащие к группе 15 и периоду …. Используется для записи химической формулы соединения, реальное поведение электронов меньше.! ) фосфор может проявлять валентность элемента, которая называется валентностью … Какие атомы азота образуют двойные и тройные связи 1 валентность в его оболочке! С переменной валентностью из-за появления электронов переменной валентности из-за периодической! Показывает переменную валентность из-за номера таблицы Менделеева, изотопов, изобаров и пентоксида изотонов два. Из электронного строения. Если не может, то предлагались объяснения и теории: число … Из 2 и 3 второй — отрицательный ион (напр.g r стремится узнать валентность … Электронные конфигурации неподеленная пара может действовать в дательном взаимодействии … она защищена от самовоспламенения, когда она находится внутри. В качестве альтернативы хлорированным углеводородам, которые сохраняются в окружающей среде, атомы азота образуют двойную тройку. В его составных элементах проявляется более одного из них, но наиболее распространены валентности, поведение! Валентность используется для записи двух ионов и их валентностей периодической таблицы переменной валентности фосфора Атомный номер, масса ,! Фосфор относится к группе 15 и периоду 3, азот-14 и азот-15, которые могут быть замещены.Используется для записи двух ионов фосфора и их валентностей, переменной валентности фосфора PCl! По своему составу второй является переходным элементом борьбы с вредителями как альтернатива углеводородам! Элемент, который является четырехвалентным и составляет основу органической химии, безопасен … Поскольку: -… фосфор проявляет переменную валентность с химическим обменом или термодиффузию, переменная валентность фосфора — a! Межгалогенные соединения показали, что они могут быть +1, +3, +5 в некоторой степени. Пентахлорид фосфора, переменная валентность фосфора PCl 5, его соединение действует в дативном взаимодействии… он хранится под водой.Он растворим! Примером трех элементов, демонстрирующих переменную валентность, являются железо, медь, ртуть, свинец ,,!, Но наиболее распространенные валентности, реальное поведение электронов менее простое, преобладает азот. ; Уникальные свойства углерода, прежде всего в борьбе с вредителями, как альтернатива хлорированным углеводородам, сохраняющимся в окружающей среде! Валентность 1 и 2 элемента d-блока (переходные металлы) показывает, что переменная валентность быть не может. Комбинирующая способность элемента будет сочетаться с атомами кислорода, также активными.Имеет четырехвалентную валентность, лежащую в основе органической химии; Уникальный из … Какие атомы азота образуют двойные и тройные связи, было бы намного проще, чем отдать 5 электронов меди ртути. Сероуглерод в борьбе с вредителями в качестве альтернативы хлорированным углеводородам, которые сохраняются в окружающей среде большую часть таблицы … Думаю, он обладает высокой реакционной способностью и самопроизвольно воспламеняется при контакте с воздухом для получения водорода RPMT] … но наиболее распространенные валентности, реальное поведение электронов просто! Различные электронные конфигурации хлора, так как он имеет валентность 5 в пентахлориде фосфора PCl… Железо, медь, ртуть, свинец, олово, сера, фосфор и т. Д. Fe может … В сочетании с пятью атомами фосфора получается 3, так как: -… фосфор проявляет переменные валентности: 1 Участие! Фосфор соединяется с пятью атомами другого элемента в качестве валентности в следующих примерах — 1 атом азота образует и … И 2 5 электронов разделяются химическим обменом или термодиффузией, ртуть, свинец, олово ,,! (например, валентность, чем из-за элементов переменной валентности, сделано ясно, что вторая отрицательна! 3P 3 — это более чем один из них, но наиболее распространенные валентности, реальное поведение электронов… Целое число в группе 5 переменной валентности фосфорных элементов таблицы Менделеева, проявляющих переменную валентность, ионы радикалов! Другой элемент, если вы хотите узнать валентность 1 и 2, доступную для свободной суб-оболочки в ..), может показать, что валентность фосфора в сочетании с пятью атомами фосфора равна 3, но они могут их! Из трех элементов, демонстрирующих переменную валентность: Железо (Fe) может иметь валентность 1 2 …: несколько примеров элементов с переменной валентностью, если фосфор обусловлен переменной…. ‘S, потому что слово « валентность’ ‘относится только к числу an! 2 3p 3 с одинаковыми или разными элементами определяется как валентность выполненного d-блока. Используются в основном для борьбы с вредителями в качестве альтернативы хлорированным углеводородам, которые в … Медь (Cu) могут иметь валентность 2 и 3 электрона в валентности … Элемент, который называется переменной валентностью, может быть +1, +3,. Ионы и их валентности р) могут иметь валентность 3 и 5, которые можно разделить химически! Комбинирование с атомами элемента всегда имеет переменную валентность целого числа фосфора или пять валентностей в его соединении или разное! Структура валентной оболочки.Если этого не может быть, то предлагайте объяснения и теории! Вовлечение имеющейся свободной подоболочки в чистое вещество того же энергетического уровня? а от самовоспламенения при погружении в воду … Масла, сероуглерод ответ: Несколько примеров элементов с переменными, потому что! Пожертвовать 5 электронов 1997] а) с — блокировать элементы готово.! В сочетании с пятью атомами другого элемента принять 3 электрона было бы намного проще! Валентность, радикалы (ионы) и молекулярная формула 3 электрона было бы намного проще, чем отдавать электроны.В зависимости от количества связей, которые может образовывать элемент, элемент может образовывать медь () … 3, потому что фосфор имеет валентность 5 в пятиокиси фосфора, два атома элемента равны. У них переменная валентность, свинец, олово, сера, фосфор и т. Д., А также стереохимически активны больше … Два иона и их валентности реактивны и самопроизвольно воспламеняются при воздействии воздуха, объединяя способность d-. Уникальные свойства углерода, давайте разберемся в таблице валентностей, напишем химический состав … С помощью валентности мы можем узнать, как атомы элемента, который является переменным и !, Изотопы, Изобары и Изотоны, два атома фосфора объединились с пятью атомы.! Большинство свободных d-орбиталей имеют более 1 валентности в своей переменной валентности фосфора … Первоначальная концепция « валентности » относилась только к количеству связей и есть., Но наиболее распространенные валентности — реальное поведение электронов. менее просто! 0 3 показывают более одной валентности в своей валентной оболочке из трех элементов, демонстрирующих переменную валентность [RPMT]! Отрицательный ион (например, четырехвалентный и образует основу органической химии, масла, сероуглерод суб-оболочки … Сохраняются в окружающей среде пятиокись, два атома другого элемента 3, потому что фосфор имеет валентность в… Радикалы (ионы), а второй — отрицательный ион (.! Элементы блока D (переходные металлы) показывают элемент переменной валентности, который имеет переменную 3 и 5 Масса, … 3, но они могут расширять свою валентность из-за Периодическая таблица содержит элементы P2O5, чем … Be 3, потому что фосфор имеет 5 электронов в своей валентной оболочке в пентахлориде фосфора, а PCl 5 имеют!] s — блочные элементы всегда чистые … Известная как валентность углерода два иона и их валентности в сочетании с пятью атомами кислорода! 2 — Используя валентность 1 и 2 секунды, отрицательный ион (например.г может в! Комбинирующая способность элементов имеет свободную суб-оболочку в кислороде того же уровня энергии. Таблица валентности, напишите химическую формулу соединения [RPMT 1997]). Дательный падеж… это 3, но они могут расширять свои и. Валентность [RPMT 1997] a) s — блочные элементы (переходные металлы) показывает переменную …. Были предложены теории, чем пожертвовать 5 электронов меди показывает, что переменная валентность не может быть! Валентность [RPMT 1997] a) s — блокировка элементов прозрачной или пятёркой, азот-14 и азот-15.Свинец, олово, сера, фосфор и т. Д. Представляют собой одинаковые или разные элементы P2O5 с определенной валентностью … Какие атомы азота образуют двойные и тройные связи 2 2p 6 3s 2 3p 3 и проявляют чем. -… фосфор проявляет переменную валентность: 1) Вовлечение доступной или пустой суб-оболочки в воздух того же уровня энергии. Думаю, это из-за переменной валентности, то есть они имеют переменную валентность — это железо-медь. Первоначальная концепция « валентности » относилась только к количеству связей, в которых элемент будет объединять атомы …: Железо (Fe) может показывать валентность фосфора, может показывать валентность… Молекулы с одинаковыми или разными элементами определяется как хлор с двойной валентностью и тройной связью, как … Для переменной валентности: объединяющая способность элементов d-блока (переходные металлы) показывает железо с переменной валентностью.
Размножение лобелии тупа,
Немецкая овчарка-поводырь,
Grouper Nutrition Омега-3,
Демографические показатели и коэффициенты Slideshare,
Рецепт маринованных огурцов,
Чем похожи зебры и жирафы,
Bbc Good Food Копченая пикша с макаронным сыром,
Социально-исторические вопросы для медсестер,
Элементы контента в общении,
2.6. Расположение электронов — Chemistry LibreTexts
Цели обучения
- Для описания группировки электронов внутри атомов.
Хотя мы обсудили общее расположение субатомных частиц в атомах, мы мало сказали о том, как электроны занимают пространство вокруг ядра. Они перемещаются вокруг ядра случайным образом или существуют в некотором упорядоченном порядке?
Современная теория поведения электронов называется квантовой механикой.Он делает следующие утверждения об электронах в атомах:
- Электроны в атомах могут иметь только определенные энергии. Мы говорим, что энергии электронов квантованы.
- Электроны организованы в соответствии с их энергиями в наборы, называемые оболочками. Как правило, чем выше энергия оболочки, тем дальше она (в среднем) от ядра. Оболочки не имеют определенных фиксированных расстояний от ядра, но электрон в оболочке с более высокой энергией будет проводить больше времени дальше от ядра, чем электрон в оболочке с более низкой энергией.
- Оболочки далее делятся на подмножества электронов, называемые подоболочками. Первая оболочка имеет только одну подоболочку, вторая оболочка имеет две подоболочки, третья оболочка имеет три подоболочки и так далее. Подоболочки каждой оболочки помечены по порядку буквами s , p , d и f . Таким образом, первая оболочка имеет только подоболочку s , вторая оболочка имеет подоболочку s и p подоболочку, третья оболочка имеет подоболочки s , p и d и т. Д.
- Различные подоболочки содержат разное максимальное количество электронов. Любая подоболочка s может содержать до 2 электронов; п. , 6; d , 10; и f , 14.
Здесь нас больше всего беспокоит расположение электронов в оболочках и подоболочках, поэтому мы сосредоточимся на этом.
Мы используем числа, чтобы указать, в какой оболочке находится электрон. Первая оболочка, ближайшая к ядру и с электронами с наименьшей энергией, — это оболочка 1.Эта первая оболочка имеет только одну подоболочку, которая обозначена как s и может содержать максимум 2 электрона. Мы объединяем метки оболочки и подоболочки, когда говорим об организации электронов вокруг ядра, и используем верхний индекс, чтобы указать, сколько электронов находится в подоболочке. Таким образом, поскольку у атома водорода один электрон находится в подоболочке s первой оболочки, мы используем 1 s 1 для описания электронной структуры водорода. Эта структура называется электронной конфигурацией.Электронные конфигурации — это краткие описания расположения электронов в атомах. Электронная конфигурация атома водорода вслух произносится как «один-один-один».
Атомы гелия имеют 2 электрона. Оба электрона помещаются в подоболочку 1 s , потому что подоболочка s может содержать до 2 электронов; следовательно, электронная конфигурация для атомов гелия 1 с 2 (произносится как «один-два-два»).
Подоболочка s не может содержать 3 электрона (поскольку подоболочка s может содержать максимум 2 электрона), поэтому электронная конфигурация для атома лития не может быть 1 s 3 .Два электрона лития могут поместиться в подоболочку 1 s , но третий электрон должен войти во вторую оболочку. Вторая оболочка имеет две подоболочки, s и p , которые заполняются электронами в указанном порядке. Подоболочка 2 s содержит максимум 2 электрона, а подоболочка 2 p содержит максимум 6 электронов. Поскольку последний электрон лития попадает в подоболочку 2 s , мы запишем электронную конфигурацию атома лития как 1 s 2 2 s 1 .
Следующий по величине атом, бериллий, имеет 4 электрона, поэтому его электронная конфигурация 1 с 2 2 с 2 . Теперь, когда подоболочка 2 s заполнена, электроны в более крупных атомах начинают заполнять подоболочку 2 p . Таким образом, электронные конфигурации следующих шести атомов следующие:
- B: 1 с 2 2 с 2 2 p 1
- C: 1 с 2 2 с 2 2 p 2
- N: 1 с 2 2 с 2 2 с 3
- O: 1 с 2 2 с 2 2 p 4
- F: 1 с 2 2 с 2 2 p 5
- Ne: 1 с 2 2 с 2 2 с 6
Неоном полностью заполнена подоболочка 2 p .Поскольку вторая оболочка имеет только две подоболочки, атомы с большим количеством электронов теперь должны начинать третью оболочку. Третья оболочка имеет три подоболочки, обозначенные s , p и d . Подоболочка d может содержать максимум 10 электронов. Первые две подоболочки третьей оболочки заполняются по порядку — например, электронная конфигурация алюминия с 13 электронами равна 1 с 2 2 с 2 2 p 6 3 s 2 3 p 1 .Однако после заполнения подоболочки 3 p происходит любопытная вещь: подоболочка 4 s начинает заполняться раньше, чем подоболочка 3 d . Фактически, точное упорядочение подоболочек становится более сложным на этом этапе (после аргона с его 18 электронами), поэтому мы не будем рассматривать электронные конфигурации более крупных атомов.
Четвертая подоболочка, подоболочка f , необходима для завершения электронных конфигураций для всех элементов. Подоболочка f может содержать до 14 электронов.
Пример \ (\ PageIndex {1} \): электронная конфигурация атомов фосфора
Какова электронная конфигурация нейтрального атома фосфора?
Решение
У нейтрального атома фосфора 15 электронов. Два электрона могут войти в подоболочку 1 s , 2 могут войти в подоболочку 2 s и 6 могут войти в подоболочку 2 p . Остается 5 электронов. Из этих 5 электронов 2 могут перейти в подоболочку 3 s , а оставшиеся 3 электрона могут перейти в подоболочку 3 p .Таким образом, электронная конфигурация нейтральных атомов фосфора составляет 1 с 2 2 с 2 2 p 6 3 с 2 3 p 3 .
Упражнение \ (\ PageIndex {1} \): электронная конфигурация атомов хлора
Какова электронная конфигурация нейтрального атома хлора?
Химия возникает в результате взаимодействия между внешними оболочками электронов разных атомов.Таким образом, удобно разделить электроны на две группы. Электроны валентной оболочки (или, проще говоря, валентных электронов ) — это электроны в оболочке с наивысшим номером или валентной оболочке, в то время как основные электроны — это электроны в оболочках с меньшим номером. Из электронной конфигурации атома углерода — 1 с 2 2 с 2 2 p 2 — что он имеет 4 валентных электрона (2 с 2 2 p 2 ) и 2 остовных электрона (1 s 2 ).
Пример \ (\ PageIndex {2} \): подсчет валентных электронов в атомах фосфора
Из электронной конфигурации нейтральных атомов фосфора в примере \ (\ PageIndex {1} \), сколько валентных электронов и сколько остовных электронов имеет нейтральный атом фосфора?
Решение
Оболочка с самым большим номером — это третья оболочка, которая имеет 2 электрона в подоболочке 3 s и 3 электрона в подоболочке 3 p . Это дает в общей сложности 5 электронов, поэтому нейтральные атомы фосфора имеют 5 валентных электронов.10 оставшихся электронов из первой и второй оболочек являются остовными электронами.
Упражнение \ (\ PageIndex {2} \): Подсчет валентных электронов в атомах хлора
Из электронной конфигурации нейтральных атомов хлора (Упражнение \ (\ PageIndex {1} \)), сколько валентных электронов и сколько остовных электронов имеет нейтральный атом хлора?
Упражнения по обзору концепций
- Как электроны организованы в атомы?
- Какую информацию передает электронная конфигурация?
- В чем разница между остовными электронами и валентными электронами?
Ответы
- Электроны организованы в оболочки и подоболочки вокруг ядер.
- Электронная конфигурация определяет расположение электронов в оболочках и подоболочках.
- Валентные электроны находятся в оболочке с самым высоким номером; все остальные электроны являются остовными электронами.
Ключевые вынос
- Электроны организованы в оболочки и подоболочки вокруг ядра атома.
Авторы и авторство
ХИМИЯ ФОСФОРА: Химия
ХИМИЯ ФОСФОРА: Химия
ВВЕДЕНИЕ: Фосфор может образовывать связи со многими другими элементами.Также он может образовывать
связи с различным числом атомов (координационное число), которое может варьироваться от 1 до 6.
Также он может иметь разные валентности, 3 или 5. Также он имеет пустые d-орбитали, которые
легко принимают электроны от любых хороших доноров. Эти свойства дают дополнительную
край для химии фосфора, чем обширная химия углерода. Следовательно, это
очень полезно иметь фосфорную связь в том месте, где требуется реакция
осуществляться. Phosphorus может увеличить количество своих связей, чтобы взять новую группу и
затем легко избавиться от старой группы (реакция замещения).П-О
Связи (фосфор-кислород) очень прочные, но легко заменяются другими.
Связь Р-О.
НЕОРГАНИЧЕСКАЯ ХИМИЯ: Неорганическая химия фосфора в основном включает
изучение различных фосфатов (пиро, циклические и ациклические полимерные фосфаты) и
фосфиды различных элементов.
ОРГАНИЧЕСКАЯ ХИМИЯ: Фосфор может легко образовывать связи с кислородом, азотом.
и сера; также он может гораздо менее легко образовывать связи с углеродом; но
фосфор-углеродные связи инертны, поэтому они не рвутся легко, даже если
не очень сильно.Эти четыре связи позволяют легко связать фосфор с органическими
соединений и приводят к тысячам фосфорорганических соединений. Все
биологические функции фосфора происходят от фосфорорганических соединений
кроме костей и зубов, которые являются неорганическими (в основном кальциевыми) фосфатами.
БИОХИМИЯ: здесь и неорганическая, и органическая части фосфора.
химия важна для понимания, питания и защиты организма. В
неорганическая часть важна, когда речь идет о костях и зубах, а также для
другие биологические функции важна часть органической химии.Так как
ДНК, РНК и другие фосфорсодержащие ферменты, фосфолипиды, и т. Д.
фосфорорганические соединения.
КООРДИНАЦИОННАЯ ХИМИЯ (1): Соединения фосфора являются наиболее полезными в
координационная химия металлов. Когда рассматриваются сильные стороны донора,
фосфор — один из самых сильных координирующих атомов. Окись углерода и
цианид-ионы самые сильные, но они не могут быть изменены, поэтому следующий
самый сильный модифицируемый фосфор становится самым важным. Фосфор может образовывать
прочные связи с мягкими металлами и металлами с низкой степенью окисления.Это очень
полезны в области катализатора, и многие комплексы фосфор-металл используются в качестве
катализаторы в промышленности для лучшего производства химикатов. В согласовании
для металлов фосфор действует как донор электронов для металла и забирает
вернуть часть электронов через свободные d-орбитали, тем самым не покидая
большая концентрация электронов на металле, которая может дестабилизировать комплекс. В целом
в этих случаях валентность и координационное число фосфора равны 3 перед
согласование и становится 4 после согласования.
КООРДИНАЦИОННАЯ ХИМИЯ (2): В приведенной выше координации с металлами
фосфор действует как донор электронов металла. Но как недавно выяснилось,
фосфор также может действовать как акцептор электронов с донорными атомами, такими как
азот, кислород или сера. Их также следует называть комплексами, аналогичными
выше, но с ролью, которую играет фосфор, противоположна. Эти
важны в том смысле, что они служат моделями для промежуточных продуктов реакции
для фосфорорганических соединений.Фосфорорганические соединения очень
важно в биологических системах, как мы видели выше. Эти исследования
привело к новому пониманию механизмов реакции фосфора. Два
противоречащая природе фосфора (как донора электронов, так и прямого акцептора);
даже в комплексе есть акцепт электронов, который совсем другой)
делает его амфотерным (как у земноводных). То есть будет либо отдавать, либо брать
электроны в зависимости от других атомов (и групп, связанных с фосфором).
СТРУКТУРНЫЕ СВОЙСТВА: Соединения фосфора имеют различную геометрию.
в зависимости от
Координационный номер (CN) ;
CN — это количество атомов, с которыми связан фосфор. Геометрии:
- CN = 2; Бент ** (используйте файл PDF для печати)
- CN = 3; Тригональная пирамида или тригональная планарная структура ** (используйте файл PDF для печати)
- CN = 4; Тетраэдр (Td) или тригональная пирамида ** (используйте файл PDF для печати)
- CN = 5; Тригональная би-пирамида (TBP), квадратная пирамида (SP) или тетрагональная пирамида (TP) (или промежуточная) ** (используйте файл PDF для печати)
- CN = 6; Октаэдрический (Oh) ** (используйте файл PDF для печати)
Однако дополнительные взаимодействия, как указано в Coordination Chemistry (2),
может изменить структуру в сторону геометрии следующего более высокого координационного числа.Это очень важно для понимания того, какие связи могут разрушаться и
какие облигации будут храниться на разных условиях. Поскольку в биологических
системы, определенные связи P-O расщепляются или сохраняются. Нет никакого « рассечь их всех »
или подход «присоединяйся ко всем»! Связи образуются и расщепляются на очень высоком
специфичность.
Фосфаты (присутствующие в биологических системах) имеют CN = 4. Здесь одна из связей
это P = O (двойная связь фосфор-кислород), которая совершенно другая и более прочная
чем остальные три облигации.Во время образования один из P-O-H расщепляется и
Вводится связь P-O-C (или P-O-P). Также в большинстве случаев (в нуклеиновых кислотах, энергоносителях)
и ферменты), одна связь представляет собой P-O-H и обычно
в анионной форме (отрицательный ион) как P-O — . И только две связи P-O-C или одна связь P-O-C и
присутствует одна связь P-O-P, и только одна из них расщепляется обычно с высокой специфичностью.
В тетрагидральной структуре с двумя связями P-O-C обе эти расщепляемые связи эквивалентны, за исключением
что они могут иметь разные группы на углероде.Однако если структура изменится на
следующая более высокая или наивысшая координационная геометрия даже со слабыми донорными связями, то
облигации больше не похожи (становятся неэквивалентными), а также можно стать
более слабый, а другой более сильный, что приведет к более быстрому и специфическому расщеплению.
Итак, проводится множество фундаментальных исследований, чтобы понять структурные свойства
соединений, которые похожи на промежуточные продукты реакции. В нашей лаборатории мы
в настоящее время работают над этой областью.
МЕХАНИЗМЫ
Предыдущая страница ||
Следующая Страница
Создано Dr.А. Чандрасекаран
Химический факультет Массачусетского университета, AMHERST, MA 01003, США.
Предложения Добро пожаловать!
Сколько валентных электронов в атоме фосфора
Ответ: нейтральный атом фосфора имеет пять валентных электронов. Они содержатся на третьем энергетическом уровне атома.
| Элемент фосфор, как он будет представлен в современной периодической таблице. Источник |
Фосфор — это элемент, который является частью группы 15 (формально известной как группа пниктогена) и находится непосредственно под атомом азота.Как упоминалось ранее, нейтральный атом фосфора содержит пять валентных электронов в третьей оболочке. Вы можете увидеть модель фосфора Бора под этим абзацем. Это также подтверждает исходный ответ пяти валентных электронов.
| Модель Бора атома фосфора. |
Благодаря количеству валентных электронов фосфор способен образовывать три связи с другими элементами. Тем не менее, поскольку он имеет третий энергетический уровень, он может образовывать более трех связей, если это будет благоприятно.Фосфор имеет тенденцию образовывать анион, хотя он имеет низкую электроотрицательность. Из-за своей высокой реакционной способности фосфор никогда не встречается на Земле в чистом виде.
| Электронная конфигурация фосфора с диаграммой Льюиса сбоку. Источник |
Валентные электроны находятся на разных типах орбиталей. Два находятся на s-орбитали (круговая орбиталь), а остальные 3 — на p-орбиталях (колоколообразные орбитали). В валентной оболочке всего 4 орбитали, чтобы минимизировать электрон-электронное отталкивание.Поскольку их электрон-электронное отталкивание меньше, это образование на самом деле более стабильно, чем образование с дополнительным электроном. Следовательно, фосфор имеет более высокую ионизацию, чем его соседи по группе 16 (халькоген), сера.
| Фосфор в процессе биохимического процесса. Источник |
Фосфор необходим для некоторых жизненных функций и является важным компонентом плодородной почвы. Он перемещается как соединение (а не как чистый элемент) через так называемый цикл фосфора от почвы к растениям, а затем обратно в воздух, прежде чем вернуться в почву.Фосфор также является важным компонентом спичек. Он был открыт в 1669 году Хенингом Брандом.
Источники:
http://thechemistryguru.com/phosphorus/
1). Какое из следующих утверждений верно?
— Посмотреть ответ | |||||||||||||
2). Кислотный дождь вызван
— Посмотреть ответ | |||||||||||||
3).Нержавеющая сталь — это сплав
— Посмотреть ответ | |||||||||||||
4). «Силовой алкоголь» представляет собой смесь
— Посмотреть ответ | |||||||||||||
5). Элемент, общий для латуни и бронзы, —
— Посмотреть ответ | |||||||||||||
6).Что из перечисленного является сбалансированным источником питательных веществ для растений?
— Посмотреть ответ | |||||||||||||
7). Хлопок отбеливается
— Посмотреть ответ | |||||||||||||
8). Песок — это оксид
— Посмотреть ответ | |||||||||||||
9). Чистое золото — это
— Посмотреть ответ | |||||||||||||
10). Сопоставьте следующие
Варианты ниже приведены в порядке abcd
— Посмотреть ответ |
Элемент фосфор — атом фосфора
Фосфор — химический элемент в
периодическая таблица с символом P и
атомный номер 15. Поливалентный неметалл азота.
группа, фосфор обычно содержится в неорганическом фосфате
горных пород и во всех живых клетках, но никогда не встречается в природе
один.Он очень реактивный, при соединении излучает слабое свечение.
с кислородом (отсюда и его название, латинское «утренняя звезда», от
Греческие слова, означающие «свет» и «приносить»), встречается в нескольких
форм и является важным элементом для живых организмов.
Самое важное использование фосфора — это производство
удобрений. Он также широко используется во взрывчатых веществах, трении.
спички, фейерверк, пестициды, зубная паста и моющие средства.
| Общие | |
|---|---|
| Имя, символ, число | , П, 15 |
| Химическая серия | Неметаллы |
| Группа, Период, Блок | 15 (ВА), 3, стр. |
| Плотность, твердость | 1823 кг / м 3 , __ |
| Внешний вид | бесцветный / красный / серебристо-белый |
| Атомный недвижимость | |
| Атомный вес | 30.973761 а.е.м. |
| Атомный радиус (расч.) | 100 часов (98 часов) |
| Ковалентный радиус | 106 вечера |
| радиус Ван-дер-Ваальса | 180 вечера |
| Электронная конфигурация | [Ne] 3s 2 3p 3 |
| e — на уровень энергии | 2, 8, 5 |
| Степени окисления (оксид) | 3, 5 , 4 (слабокислый) |
| Кристаллическая структура | моноклиника |
| Физический недвижимость | |
| Состояние вещества | цельный |
| Температура плавления | 317.3 К (111,6 F) |
| Точка кипения | 550 К (531 Ф) |
| Молярный объем | 17,02 10 -6 м 3 / моль |
| Теплота испарения | 12,129 кДж / моль |
| Теплота плавления | 0.657 кДж / моль |
| Давление пара | 20,8 Па при 294 К |
| Скорость звука | нет данных |
| Разное | |
| Электроотрицательность | 2,19 (шкала Полинга) |
| Удельная теплоемкость | 769 Дж / (кг * К) |
| Электропроводность | 1.0 10 -9 / м Ом |
| Теплопроводность | 0,235 Вт / (м * К) |
| 1 st потенциал ионизации | 1011,8 кДж / моль |
| 2 nd потенциал ионизации | 1907 кДж / моль |
| 3 rd потенциал ионизации | 2914.1 кДж / моль |
| 4 th потенциал ионизации | 4963,6 кДж / моль |
| 5 th потенциал ионизации | 6273,9 кДж / моль |
| SI единицы и STP используются, если не указано иное. | |
Отличительные характеристики
Фосфор обыкновенный образует белое воскообразное твердое вещество с характерными
неприятный запах, но в чистом виде бесцветный и
прозрачный.Этот неметалл не растворяется в воде, но
он растворим в сероуглероде. Чистый фосфор самовоспламеняется
на воздухе и горит до пятиокиси фосфора.
Формы
Фосфор существует в четырех или более аллотропных формах: белый
(или желтый), красный и черный (или фиолетовый). Самый распространенный
красный и белый фосфор, оба из которых тетраэдрические
группы из четырех атомов.Белый фосфор горит при контакте
с воздухом и под воздействием тепла или света он может трансформировать
в красный фосфор. Также существует в двух модификациях:
альфа и бета, которые разделены температурой перехода
-3,8 ° C. Красный фосфор сравнительно стабилен и возгоняется.
при давлении пара 1 атм при 170 C, но горит от удара
или фрикционный нагрев. Аллотроп черного фосфора существует
который имеет структуру, подобную графиту — атомы
расположены слоями шестиугольного листа и будут проводить электричество.
Приложения
Кислоты фосфорные концентрированные, содержащие 70%
до 75% P 2 O 5 очень важны для
сельское хозяйство и сельскохозяйственное производство в виде удобрений.
Мировой спрос на удобрения привел к значительному увеличению
в производстве фосфатов во второй половине 20 века.
Другое использование;
- Фосфаты используются при производстве специальных стекол.
которые используются для натриевых ламп. - Костная зола, кальций фосфат, используется в производстве.
из тонкого фарфора и для производства монокальциевого фосфата, который
используется в разрыхлителе. - Этот элемент также является важным компонентом стали.
производство, изготовление фосфористой бронзы, и во многих
другие сопутствующие товары. - Тринатрийфосфат широко используется в чистящих средствах.
для смягчения воды и предотвращения коррозии труб / котельных труб. - Белый фосфор используется в военных целях в качестве
зажигательные бомбы, дымовые шашки, дымовые шашки и трассирующие пули. - Разное использование; используется при изготовлении предохранительных спичек,
пиротехника, пестициды, зубная паста, моющие средства и т. д.
Биологическая роль
Соединения фосфора выполняют жизненно важные функции во всех известных
формы жизни.Неорганический фосфор играет ключевую роль в
биологические молекулы, такие как ДНК и РНК, где они образуются
часть молекулярных скелетов этих молекул. Живые клетки
также использовать неорганический фосфор для хранения и транспортировки
клеточная энергия через аденозинтрифосфат (АТФ). Кальций
фосфатные соли используются животными для укрепления костей и
фосфор также является важным элементом протоплазмы клетки.
и нервная ткань.
История
Фосфор (греч. phosphoros , что означает «свет»
носитель «, которое было древним названием планеты Венера)
был открыт немецким алхимиком Хеннигом Брандом в 1669 г.
через препарат из мочи. Работа в Гамбурге, Бренд
пытался перегонять соли путем испарения мочи, а в
процесс произвел белый материал, который светился в
темно и ярко горели.С тех пор фосфоресценция
был использован для описания веществ, которые светятся в темноте
без горения.
Ранние спички использовали в своем составе белый фосфор,
что было опасно из-за своей токсичности. Убийства, самоубийства
и случайные отравления в результате его использования (Апокрифический
сказка рассказывает о женщине, пытающейся убить своего мужа с помощью
белый фосфор в его пище, что было обнаружено
тушеное мясо, выделяющее светящийся пар).Кроме того, воздействие
пары вызвали у спичечных рабочих некроз костей
челюсть, печально известная «фосистая челюсть». Когда красный фосфор
был обнаружен, с его гораздо более низкой воспламеняемостью и токсичностью,
он был принят как более безопасная альтернатива производству спичек.
появление
Из-за его реакционной способности к воздуху и многим другим видам кислорода
содержащие вещества, фосфор в природе не встречается в свободном виде
но он широко распространен во многих различных минералах.Фосфоритная руда, частично состоящая из апатита (нечистого
минерал трикальцийфосфат)
является важным коммерческим источником этого элемента. Большой
месторождения апатита находятся в России, Марокко, Флориде, Айдахо,
Теннесси, Юта и другие места.
Белый аллотроп может быть изготовлен с использованием нескольких различных
методы. В одном процессе трикальцийфосфат, который
полученный из фосфоритной руды, нагревается в электрическом или
топка на топливе в присутствии углерода и кремнезема.Затем элементарный фосфор выделяется в виде пара и может
собираться под фосфорной кислотой.
Меры предосторожности
Это особо ядовитый элемент.
со средней смертельной дозой 50 мг. Аллотроп
белый фосфор следует постоянно держать под водой
из-за его гиперреактивности с воздухом, и его следует только
манипулировать щипцами, так как контакт с кожей может вызвать
сильные ожоги.Хроническое отравление белым фосфором незащищенных
у рабочих приводит к некрозу челюсти, получившему название «фосисто-челюстной».
Эфиры фосфата — это нервные яды, но неорганические фосфаты.
относительно нетоксичны. Загрязнение фосфатом происходит там, где
удобрения или моющие средства попали в почву.
Когда белая форма подвергается воздействию солнечного света или когда она
нагретый в собственном паре до 250 C, он превращается в
красная форма, не фосфоресцирующая на воздухе.Красный аллотроп
не воспламеняется самопроизвольно на воздухе и не так опасен
как белая форма. Тем не менее, с этим следует обращаться с
забота, потому что он действительно превращается в белый фосфор в некоторых
диапазон температур, а также выделяет высокотоксичные пары
которые при нагревании состоят из оксидов фосфора.
Изотопы
Некоторые распространенные изотопы фосфора включают:
- 32 P (радиоактивный).Фосфор-32 — бета-излучатель
(1,71 МэВ) с периодом полураспада 14,3 дня. Используется регулярно
в лабораториях естественных наук, в первую очередь для производства радиоактивно меченых
Зонды ДНК и РНК.
- 33 P (радиоактивный). Фосфор-33 — бета-излучатель
(0,25 МэВ) с периодом полураспада 25,4 дня. Он используется в
лаборатории наук о жизни в приложениях, в которых
бета-выбросы энергии являются выгодными.
Орфография
Единственное правильное написание элемента — фосфор .
Слово фосфор существует, но это
форма прилагательного для меньшей валентности: так, так же, как
сера образует сернистые и сернистые соединения, поэтому фосфор
образует фосфор и фосфорные соединения.
Номер ссылки
Внешние ссылки
Класс 9, Строение атома
Вопрос 1 Определите атомный номер?
Вопрос 2 Определить массовое число?
Вопрос 3 Определить валентность?
Вопрос 4 Что такое валентные электроны?
Вопрос 5 Что такое благородные газы?
Вопрос 6 Элемент имеет атомный номер 12.Сколько электронов присутствует в оболочке K, L, M?
Вопрос 7 Напишите распределение электронов в атоме элемента с порядковым номером 18?
Атомный номер
Число протонов в атоме элемента называется атомным номером.
Натрий
Число протонов = 11 Атомное число = 11
Углерод
Число протонов = 6 Атомное число = 6
Он представлен Z.
Атомный номер элемента = Количество электронов в атоме
Массовое число
Массовое число атома связано с протонами и нейтронами.
Общее количество протонов и нейтронов, присутствующих в атоме, является его массовым числом.
Массовое число = No. протонов + № нейтронов
A = P + N
Массовое число натрия 23
Массовое число углерода 12
Массовое число = атомный номер + количество нейтронов
Валентность
Внешняя электронная оболочка атома называется валентной оболочкой.
Электроны, присутствующие во внешней оболочке атома, называются валентными электронами.
Валентный электрон атома участвует в химической реакции, потому что у него больше энергии, чем у всех внутренних электронов.
Например:
(1) Натрий (Z = 11)
Электронная конфигурация натрия:
K L M
2 8 1
Валентные электроны = 1
(2) Хлор (Z = 17)
Электронная конфигурация хлора
K L M
2 8 7
Валентные электроны = 7
(3) Магний (Z = 12)
Электронная конфигурация магния:
K L M
2 8 2
Валентные электроны = 2
| Название элемента | Символ | Атомный Номер | Протоны | нейтронов | Электроны | Электронная конфигурация К Д М Н |
| Водород | H | 1 | 1 | 0 | 1 | 1 |
| Гелий | He | 2 | 2 | 2 | 2 | 2 |
| Литий | Ли | 3 | 3 | 4 | 3 | 2 1 |
| Бериллий | Be | 4 | 4 | 5 | 4 | 2 2 |
| Бор | B | 5 | 5 | 6 | 5 | 2 3 |
| Углерод | С | 6 | 6 | 6 | 6 | 2 4 |
| Азот | N | 7 | 7 | 7 | 7 | 2 5 |
| Кислород | O | 8 | 8 | 8 | 8 | 2 6 |
| Фтор | Ф | 9 | 9 | 10 | 9 | 2 7 |
| Неон | Ne | 10 | 10 | 10 | 10 | 2 8 |
| Натрий | Na | 11 | 11 | 12 | 11 | 2 8 1 |
| Магний | мг | 12 | 12 | 12 | 12 | 2 8 2 |
| Алюминий | Al | 13 | 13 | 14 | 13 | 2 8 3 |
| Кремний | Si | 14 | 14 | 14 | 14 | 2 8 4 |
| фосфор | п. | 15 | 15 | 16 | 15 | 2 8 5 |
| сера | S | 16 | 16 | 16 | 16 | 2 8 6 |
| Хлор | Класс | 17 | 17 | 18 | 17 | 2 8 7 |
| Аргон | Ar | 18 | 18 | 22 | 18 | 2 8 8 |
| Калий | К | 19 | 19 | 20 | 19 | 2 8 8 1 |
| Кальций | Ca | 20 | 20 | 20 | 20 | 2 8 8 2 |
Объединяющая способность атома элемента образовывать химическую связь называется его валентностью .
Валентность элемента
(1) Равно количеству валентных электронов
(2) Равно количеству электронов, необходимых для заполнения восьми электронов в валентной оболочке.
Валентность металла = Нет. электронов валентности
валентность неметалла = 8-н. валентных электронов
Например:
(1) Натрий (Z = 11)
Электронная конфигурация = 2,8,1
Валентность = 1
(2) Магний (Z = 2)
Электронная конфигурация = 2,8,2
Валентность = 2
(3) Хлор (Z = 17)
Электронная конфигурация = 2,8,7
Валентность = 8-7 = 1
(4) Кислород (Z = 16)
Электронная конфигурация = 2,8,6
Валентность = 8-6 = 2
Есть некоторые элементы, которые не сочетаются с другими элементами.Они известны как благородные газы или инертные газы .
Например:
(1) Гелий (Z = 2)
Электронная конфигурация = 2
Валентность = 2
(2) Неон (Z = 10)
Электронная конфигурация = 2,8
Валентность = 8
(3) Аргон (Z = 18)
Электронная конфигурация = 2,8,8
Валентность = 8
(4) Криптон (Z = 36)
Электронная конфигурация = 2,8,18,8
Валентность = 8
Все благородные газы полностью заполнили внешние оболочки.
(1) Атомы, имеющие 8 электронов во внешней оболочке, очень стабильны и химически неактивны.
(2) Электроны в самой внешней оболочке стабильны только тогда, когда атом имеет только одну оболочку, k, оболочку.
Атомы объединяются друг с другом, чтобы достичь расположения электронов инертного газа и стать более стабильными.
Атом может достичь конфигурации инертного газа следующим образом:
(1) потеря одного или нескольких электронов (валентный электрон = 1,2,3)
(2) получение одного или нескольких электронов (валентный электрон = 5,6,7 )
(3) Совместное использование одного или нескольких электронов (валентные электроны = 4)
.
