Содержание
Валентность — это… Что такое Валентность?
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
История возникновения понятия «валентность»
Этимологию термина валентность возможно отследить начиная с 1425 года, когда его начали использовать в научных текстах в значении «экстракт», «препарат». Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz).[1] В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества.[2]
Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт.[3]. Наблюдая способность к насыщению разных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкленд ввёл понятие о «соединительной силе», положив этим основание учению о валентности. Хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития.
Хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 г. он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН4. Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора — фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес. В 1858 г. взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории» Арчибальд Скотт Купер.
Уже три года спустя, в сентябре 1861 г. А. М. Бутлеров внёс в теорию валентности важнейшие дополнения. Он провёл чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство «связывается и переходит в новую форму». Бутлеров ввёл представление о полноте использования сил сродства и о «напряжении сродства», то есть энергетической неэквивалентности связей, которая обусловлена взаимным влиянием атомов в молекуле. В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Теория Бутлерова позволила дать объяснение многим экспериментальным фактам, касавшимся изомерии органических соединений и их реакционной способности.
В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Теория Бутлерова позволила дать объяснение многим экспериментальным фактам, касавшимся изомерии органических соединений и их реакционной способности.
Огромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х гг. появились первые молекулярные модели. Уже в 1864 г. А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 г. А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 г. в учебнике Кекуле появились рисунки стереохимических моделей, в которых атом углерода имел тетраэдрическую конфигурацию.
Современные представления о валентности
С момента возникновения теории химической связи понятие «валентность» претерпело существенную эволюцию. В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.
В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.
Резонансная модель образования ковалентных связей в молекуле HNO3
В основном, под валентностью химических элементов понимается способность свободных его атомов к образованию определённого числа ковалентных связей. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей, предложенной в 1927 году В. Гайтлером и Ф. Лондоном в 1927 г. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами[4]. При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4— и NH4+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4— и NH4+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
Структурная формула молекулы этана
В ряде случаев, с валентностью отождествляются такие характеристики молекулярной системы как степень окисления элемента, эффективный заряд на атоме, координационное число атома и т. д. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу[5]. Например, в изоэлектронных молекулах азота N2, монооксида углерода CO и цианид-ионе CN— реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления элементов равна, соответственно, 0, +2, −2, +2 и −3. В молекуле этана (см. рис.) углерод четырёхвалентен, как и в большинстве органических соединений, тогда как степень окисления формально равна −3.
Особенно это справедливо для молекул с делокализованными химическими связями, например в азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4. Известное из многих школьных учебников правило — «Максимальная валентность элемента численно равна номеру группы в Периодической таблице» — относится исключительно к степени окисления. Понятия «постоянной валентности» и «переменной валентности» также преимущественно относятся к степени окисления.
Семиполярные и донорно-акцепторные (дативные) связи по своей сути являются «двойными» связями, поскольку при их образовании происходят оба процесса: перенос электрона (образование ионной связи) и обобществление электронов (образование ковалентной связи).
Понятие валентности нельзя использовать и в очень многих случаях, когда невозможно применить модель двухэлектронных двухцентровых связей[6]. Представления о валентности не применимы к описанию кластерным соединениям, бороводородам, карборанам, π-комплексам, соединениям благородных газов и многим другим. Например, катионы щелочных металлов в комплексах с краун-эфирами проявляют валентность, намного превышающую их степень окисления.
Например, катионы щелочных металлов в комплексах с краун-эфирами проявляют валентность, намного превышающую их степень окисления.
Некорректным будет использование валентности для описания соединений ионной, кристаллической природы. Так в кристалле хлорида натрия NaCl у каждого иона Na+ или Cl— — центра элементарной ячейки — реальное число соседних ионов координационное число равно 6, а степень окисления — +1 и −1 соответственно. Локализованных же электронных пар вовсе нет.
В современной химии активно используется метод молекулярных орбиталей, в котором отсутствуют какие-либо аналоги понятия валентности атома. Между тем, понятие кратности химической связи наиболее близко к характеристике числа образуемых связей. Отождествление единичной связи с двухэлектронной молекулярной орбиталью возможно лишь в предельном, локализованном случае[5]. В квантовой химии аналога понятия валентности как характеристики атома в молекуле не существует, а используемое понятие спин-валентности относится к изолированному атому[7].
См. также
Примечания
- ↑ Valence — Online Etymology Dictionary.
- ↑ Partington J.R. A Short History of Chemistry. — Dover Publications, Inc, 1989. — ISBN 0-486-65977-1
- ↑ Frankland E. On a New Series of Organic Bodies Containing Metals. // Phil. Trans. 1852. Vol. 142. P. 417—444.
- ↑ Неорганическая химия / Б. Д. Степин, А. А. Цветков ; Под ред. Б. Д. Степина. — М.: Высш. шк., 1994. — С. 71—72
- ↑ 1 2 Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126
- ↑ Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. стр.19.
- ↑ Татевский В. М. Квантовая механика и теория строения молекул. М.: Изд-во МГУ, 1965. Глава 3.
Ссылки
Литература
- Л. Паулинг Природа химической связи.
 М., Л.: Гос. НТИ хим. литературы, 1947.
М., Л.: Гос. НТИ хим. литературы, 1947. - Картмелл, Фоулс. Валентность и строение молекул. М.: Химия, 1979. 360 с.]
- Коулсон Ч. Валентность. М.: Мир, 1965.
- Маррел Дж., Кеттл С., Теддер Дж. Теория валентности. Пер. с англ. М.: Мир. 1968.
- Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. 248с.
- Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — С. 126.
Валентность. Как найти валентность. Элементы с постоянной валентностью
Валентность — это способность атома данного элемента образовывать определенное количество химических связей.
Образно говоря, валентность — это число «рук», которыми атом цепляется за другие атомы. Естественно, никаких «рук» у атомов нет; их роль играют т. н. валентные электроны.
Можно сказать иначе: валентность — это способность атома данного элемента присоединять определенное число других атомов.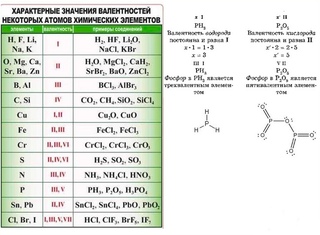
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
| Элементы | Постоянная валентность |
| щелочные металлы (Li, Na, K, Rb , Cs, Fr) | I |
| металлы II группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| алюминий (Al) | III |
| кислород (О) | II |
| фтор (F) | I |
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Важно запомнить несколько исключений: максимальная (и единственная) валентность фтора равна I (а не VII), кислорода — II (а не VI), азота — IV (способность азота проявлять валентность V — популярный миф, который встречается даже в некоторых школьных учебниках).
Валентность и степень окисления — это не тождественные понятия.
Эти понятия достаточно близки, но не следует их путать! Степень окисления имеет знак (+ или -), валентность — нет; степень окисления элемента в веществе может быть равна нулю, валентность равна нулю лишь в случае, если мы имеем дело с изолированным атомом; численное значение степени окисления может НЕ совпадать с валентностью. Например, валентность азота в N2 равна III, а степень окисления = 0.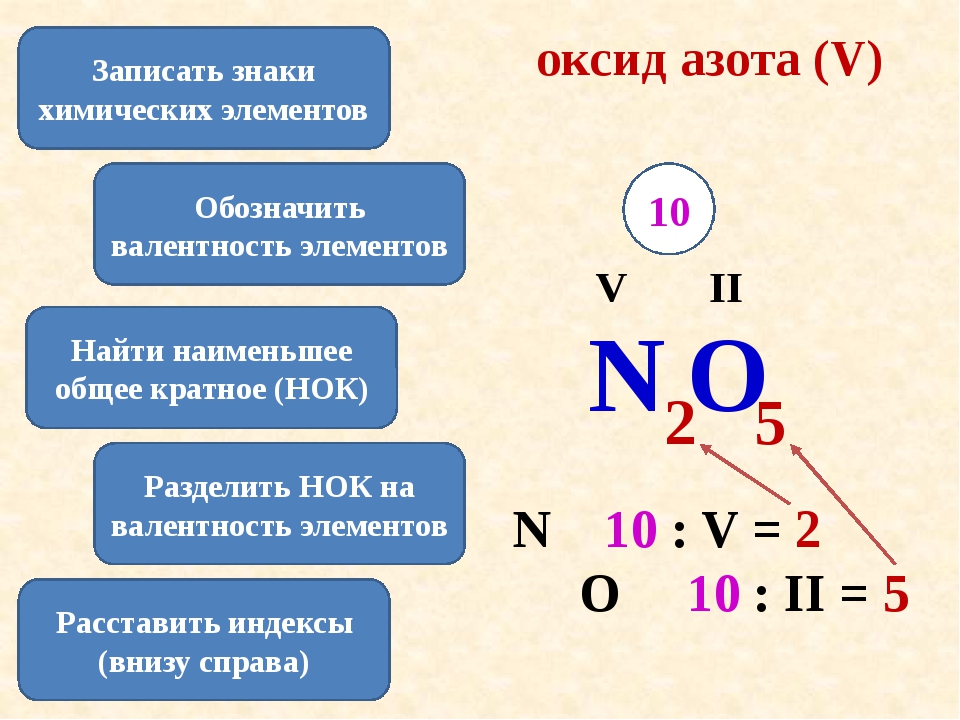 Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Валентность углерода в муравьиной кислоте = IV, а степень окисления = +2.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Делается это весьма просто. Запомните формальное правило: произведение числа атомов первого элемента в молекуле на его валентность должно быть равно аналогичному произведению для второго элемента.
В соединении AxBy: валентность (А) • x = валентность (В) • y
Пример 1. Найти валентности всех элементов в соединении NH3.
Решение. Валентность водорода нам известна — она постоянна и равна I. Умножаем валентность Н на число атомов водорода в молекуле аммиака: 1 • 3 = 3. Следовательно, для азота произведение 1 (число атомов N) на X (валентность азота) также должно быть равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
Пример 2. Найти валентности всех элементов в молекуле Cl2O5.
Решение. У кислорода валентность постоянна (II), в молекуле данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора = Х. Составляем уравнение: 5 • 2 = 2 • Х. Очевидно, что Х = 5. Ответ: Cl(V), O(II).
Пример 3. Найти валентность хлора в молекуле SCl2, если известно, что валентность серы равна II.
Решение. Если бы авторы задачи не сообщили нам валентность серы, решить ее было бы невозможно. И S, и Cl — элементы с переменной валентностью. С учетом дополнительной информации, решение строится по схеме примеров 1 и 2. Ответ: Cl(I).
Зная валентности двух элементов, можно составить формулу бинарного соединения.
В примерах 1 — 3 мы по формуле определяли валентность, попробуем теперь проделать обратную процедуру.
Пример 4. Составьте формулу соединения кальция с водородом.
Решение. Валентности кальция и водорода известны — II и I соответственно. Пусть формула искомого соединения — CaxHy. Вновь составляем известное уравнение: 2 • x = 1 • у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH2.
Вновь составляем известное уравнение: 2 • x = 1 • у. В качестве одного из решений этого уравнения можно взять x = 1, y = 2. Ответ: CaH2.
«А почему именно CaH2? — спросите вы. — Ведь варианты Ca2H4 и Ca4H8 и даже Ca10H20 не противоречат нашему правилу!»
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
«Значит, соединения типа N2O4 или C6H6 невозможны? — спросите вы. — Следует заменить эти формулы на NO2 и CH?»
Нет, возможны. Более того, N2O4 и NO2 — это совершенно разные вещества. А вот формула СН вообще не соответствует никакому реальному устойчивому веществу (в отличие от С6Н6).
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Пример 5. Составьте формулу соединения серы с фтором, если известно, что валентность серы равна шести.
Решение. Пусть формула соединения — SxFy. Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем уравнение: 6 • x = 1 • y. Несложно понять, что наименьшие возможные значения переменных — это 1 и 6. Ответ: SF6.
Вот, собственно, и все основные моменты.
А теперь проверьте себя! Предлагаю пройти небольшой тест по теме «Валентность».
Хотите узнать, почему «классическое» определение валентности часто не «работает»? Почему валентность железа в FeO не равна двум? Почему для описания комплексных веществ используется понятие «координационное число»?
Смотрите продолжение этой статьи →
Урок 2. валентность и валентные возможности атомов — Химия — 11 класс
Химия, 11 класс
Урок № 2. Валентность и валентные возможности атомов
Перечень вопросов, рассматриваемых в теме: всё в нашем мире состоит из атомов. Каждый атом — это очень упорядоченная система, имеющая определенную электронную конфигурацию, свои значения валентностей и степеней окисления. Валентность определяется числом химических связей, которые образует атом химического элемента в соединении. Степень окисления, в отличие от валентности, может быть нулевой и характеризуется знаком. Валентные возможности зависят от количества неспаренных электронов, неподелённых электронных пар и вакантных орбиталей внешнего электронного уровня. Благодаря такому понятию как «электроотрицательность» можно определять тип химической связи в соединениях, которая может быть ионной, а также ковалентной полярной и неполярной.
Каждый атом — это очень упорядоченная система, имеющая определенную электронную конфигурацию, свои значения валентностей и степеней окисления. Валентность определяется числом химических связей, которые образует атом химического элемента в соединении. Степень окисления, в отличие от валентности, может быть нулевой и характеризуется знаком. Валентные возможности зависят от количества неспаренных электронов, неподелённых электронных пар и вакантных орбиталей внешнего электронного уровня. Благодаря такому понятию как «электроотрицательность» можно определять тип химической связи в соединениях, которая может быть ионной, а также ковалентной полярной и неполярной.
Ключевые слова: валентность; валентные возможности; электроотрицательность; степень окисления; графическая электронная формула; периодическая таблица.
Глоссарий
Валентность – это способность атома химического элемента образовывать определенное число химических связей с другими атомами.
Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов.
Ковалентная связь — химическая связь, в которой у двух атомов имеется общая пара электронов.
Орбиталь – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
Периодический закон: Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Степень окисления – это условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, то есть все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Электрон — стабильная отрицательно заряженная элементарная частица.
Электронно-графическая формула для отдельных атомов химических элементов – это расположение всех его электронов на орбиталях.
Электроотрицательность – это суммарная характеристика способности атома данного элемента отдавать или присоединять электроны атомов других элементов.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Формулировка периодического закона: «свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Четыре основные периодические закономерности:
- Правило октета: все элементы стремятся потерять, либо приобрести электрон, для того, чтобы иметь конфигурацию ближайшего по периодической таблице благородного газа, то есть восьмиэлектронную конфигурацию. Благородные газы являются самыми стабильными элементами, в следствие заполненности их внешних s- и p-орбиталей.
- Энергия ионизации – количество энергии, которое необходимо затратить для отрыва электрона атома. Элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести. По правилу октета чем правее элемент расположен в таблице Менделеева, тем больше нужно затратить энергии на отрыв его электрона, это же справедливо и для энергии ионизации: она увеличивается слева направо. Энергия ионизации уменьшается в группе при движении вниз, потому что на низких энергетических уровнях электроны способны отталкивать электроны высоких энергетических уровней. Это явление названо эффектом экранирования.

- Сродство к электрону – если вещество находится в газообразном состоянии, то при приобретении его атомом дополнительного электрона, его энергия изменяется. При движении по группе вниз сродство к электрону становится менее отрицательным.
- Электроотрицательность — мера того, как сильно атом притягивает к себе электроны другого атома, который связан с ним. Электроотрицательность увеличивается при движении в таблице снизу вверх и слева направо. Благородные газы не имеют электроотрицательности.
Водородная связь – специфическая химическая связь между электроотрицательным атомом (например, кислородом, азотом или фтором) и атомом водорода. Данный вид связи может быть как межмолекулярным, так и внутримолекулярным. Возникновение водородной связи связано с тем, что у атома водорода очень маленький радиус. Благодаря этому при смещении или отдаче единственного электрона водород приобретает положительный заряд, который в свою очередь, действует на те атомы в молекуле, которые обладают высокой электроотрицательностью.
Особенностью данного вида связи является ее высокая прочность, а также широкая распространённость, главным образом в органических соединениях, например в спиртах, фенолах, альдегидах и карбоновых кислотах. Именно за счет нее образуется вторичная структура белков. В качестве неорганических веществ, молекулы которых образуют водородную связь, можно отметить следующие: вода, фтороводород, синильная кислота. В настоящее время водородную связь рассматривают как частный случай ковалентной.
Металлическая связь — связь между положительными ионами металлов в металлической решетке, осуществляемая за счет притяжения электронов, которые расположены относительно свободно в кристалле металла. Атомы металлов имеют небольшое число валентных электронов, что объясняется их положением в таблице Менделеева. Из-за слабой связи электронов с ядрами, они могут легко отрываться от них. В результате в кристаллической решетке металла появляются свободные электроны и положительно заряженные ионы, поэтому электроны обладают большой свободой перемещения внутри кристалла металла.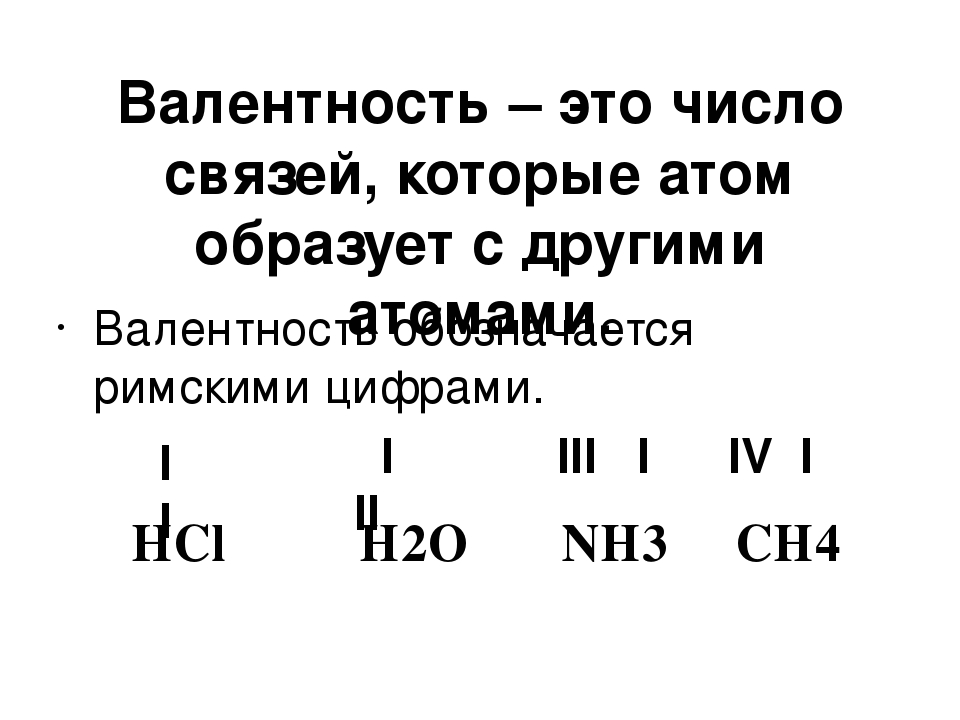 Энергия металлической связи в 3-4 раза меньше, чем энергия ковалентной связи. Данным видом связи обладают все твердые вещества, кроме ртути, например: натрий, железо, медь и различные сплавы.
Энергия металлической связи в 3-4 раза меньше, чем энергия ковалентной связи. Данным видом связи обладают все твердые вещества, кроме ртути, например: натрий, железо, медь и различные сплавы.
Ван-дер-Ваальсова связь — силы межмолекулярного и межатомного взаимодействий, энергия которых составляет 10—20 кДж/моль. Такие связи названы в честь голландского физика Яна Дидерика Ван-дер-Ваальса. Экспериментально было определено, что молекулы, в которых внешние оболочки всех атомов заполнены (молекулы азота N2, хлора Cl2, аммиака NH3 , атомы инертных газов — He, Ne и т.д) также связываются друг с другом и образуют слабые межмолекулярные связи. Вандерваальсово взаимодействие состоит из трёх слабых электромагнитных взаимодействий:
- Ориентационные силы, диполь-дипольное притяжение – связь между молекулами, которые являются постоянными диполями.
- Дисперсионное притяжение, обусловлено взаимодействием между мгновенным и наведённым диполем.

- Индукционное притяжение (поляризационное притяжение). Взаимодействие между постоянным диполем и наведённым (индуцированным).
В основе данного типа связи также лежат кулоновские силы, которые заключаются во взаимодействии между электронами и ядрами двух молекул: на определенном расстоянии между молекулами силы отталкивания/притяжения уравновешивают друг друга, в результате чего образуется устойчивая система.
Возбужденное состояние атома — энергетически нестабильное состояние, в которое атом переходит при получении энергии. Возбужденные состояния атомов образуются при переходе электронов (одного или нескольких) с занятых орбиталей на свободные. Меньше энергии затрачивается при переходе электрона между внешними оболочками, а больше – при переходе с внутренней оболочки на внешнюю.
Возбужденным атом пребывает недолго: при отдаче полученной энергии атом возвращается в основное состояние. Переходы между различными состояниями атомов и молекул могут происходить с испусканием электромагнитного излучения, либо с обменом энергией между молекулами и атомами. Вероятности переходов атомов между возбужденным/основным состоянием и расчет энергии при этом изучает спектроскопия.
Вероятности переходов атомов между возбужденным/основным состоянием и расчет энергии при этом изучает спектроскопия.
Эффективный заряд атома, характеризуется разностью между числом электронов свободного атома и числом электронов принадлежащих данному атому в химическом соединении. Для оценки эффективного заряда атома применяют модель, где величины представляют как функции точечных неполяризуемых зарядов, которые локализованы на атомах. У двухатомной молекулы рассматривают дипольный момент как произведение эффективного заряда атома на межатомное расстояние.
Диполь — совокупность двух равных по величине разноименных точечных зарядов q, расположенных на некотором расстоянии друг от друга, которое мало по сравнению с расстоянием до рассматриваемой точки поля.
Постоянный диполь – совокупность периодически быстро меняющихся по направлению и величине мгновенных микродиполей.
Наведенный диполь – диполь, который возникает под действием внешнего электрического поля.
Примеры и разбор решения задач тренировочного модуля
- Пример задачи. Определите валентность S в соединении H2SO4; определите валентность N в соединении HNO2; определите валентность F в соединении C2H2F2.
Решение. Валентность кислорода всегда равна 2. Валентность водорода равна 1. Для нахождения валентности серы, необходимо валентность кислорода умножить на ее индекс: 2*4=8, затем валентность водорода умножить на его индекс: 1*2 = 2. Теперь нужно вычесть полученные значения: 8-2 = 6 и разделить его на индекс серы: 6/1 = 6. Валентность серы в соединении 6.
Аналогично в варианте: валентность N в соединении HNO2 : (2*2-1*1)/1=3.
Валентность F в C2H2F2: валентность фтора всегда = 1, поэтому ответ 1.
- Пример задачи. Используя шкалу ЭО, соотнесите соединение и тип его химической связи.
Соединения: BeF2, O2, PCl5.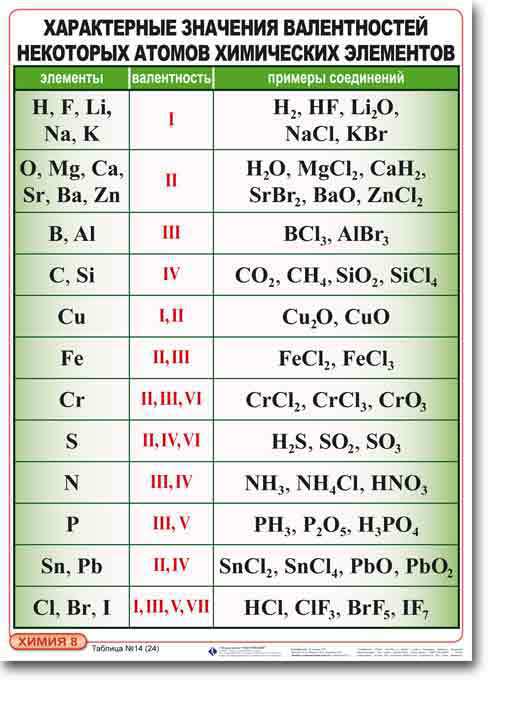
Типы химической связи: ионная, ковалентная неполярная, ковалентная полярная.
Решение. С помощью шкалы электроотрицательности найдем разность значений (∆х) для элементов:
BeF2 : 4,0 – 1,5 = 2,5
O2 : 3,5 – 3,5 = 0
PCl5 : 3,0 – 2,1 = 0,9
По правилам если ∆х < 2,0, то связь ковалентная полярная, если ∆х > 2,0, то связь ионная, если
∆х = 0, то связь ковалентная неполярная, таким образом, верный ответ:
BeF2 – ионная связь, O2 – ковалентная неполярная связь, PCl5 – ковалентная полярная связь.
Валентность. Степень окисления химических элементов
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).

- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.
- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2.
- h3 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)h5(-), B2(+3)H6(-), B(+3)h4(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)h3(-).

- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например h3(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.

- Низшая степень окисления = +№ группы – 8.
- Промежуточная степень окисления = +№ группы – 2.
Пример
Фосфор (P)
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.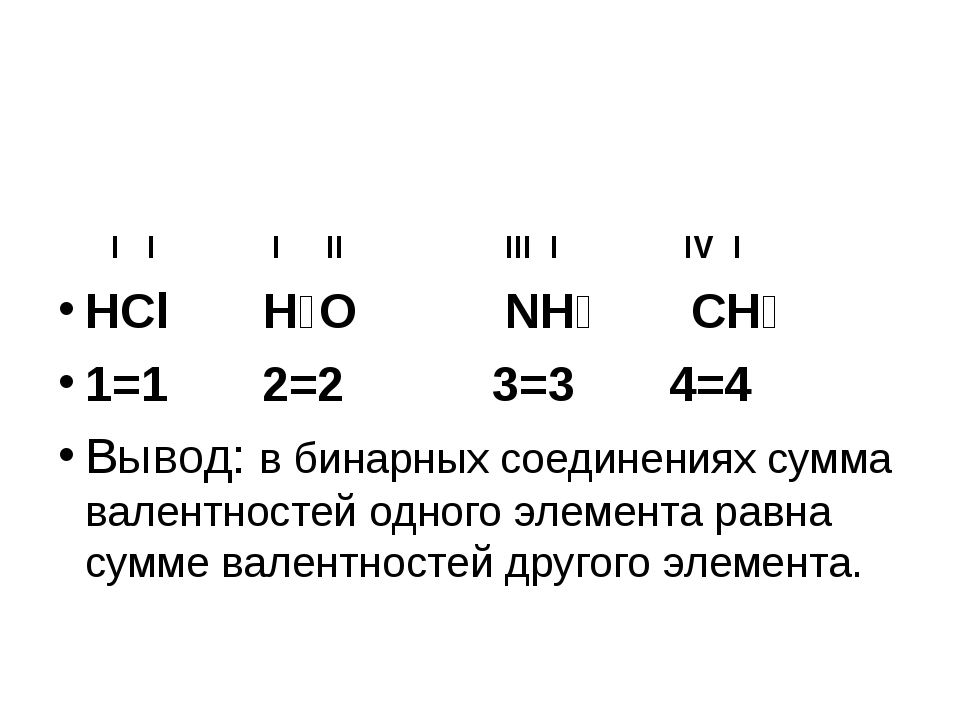
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0.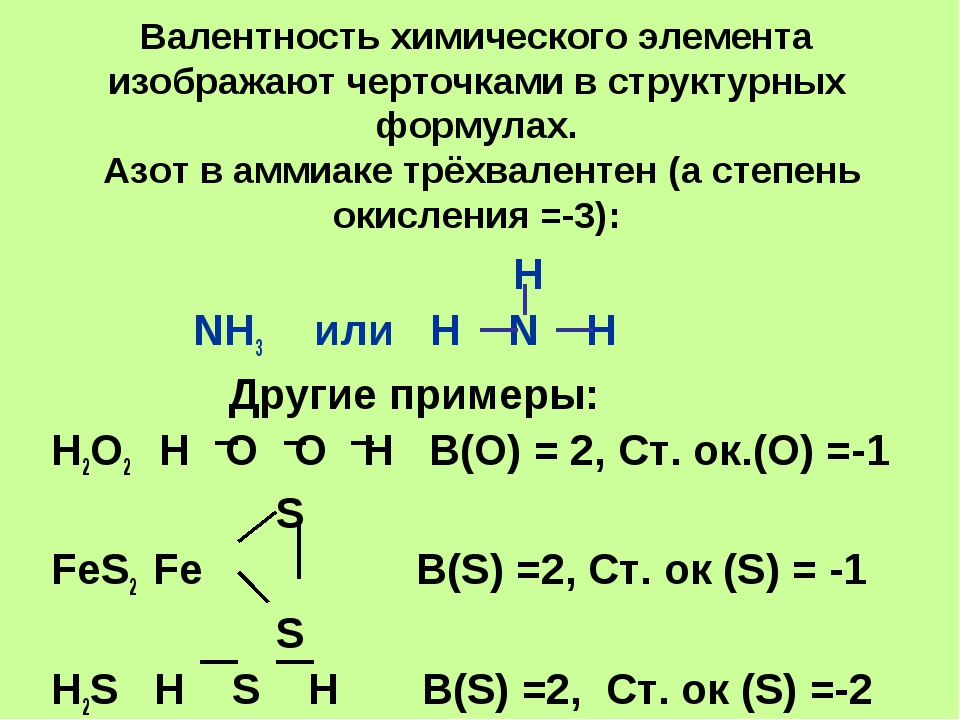 Отсюда х = +6.
Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)
Урок 6.
 Валентность – HIMI4KA
Валентность – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем.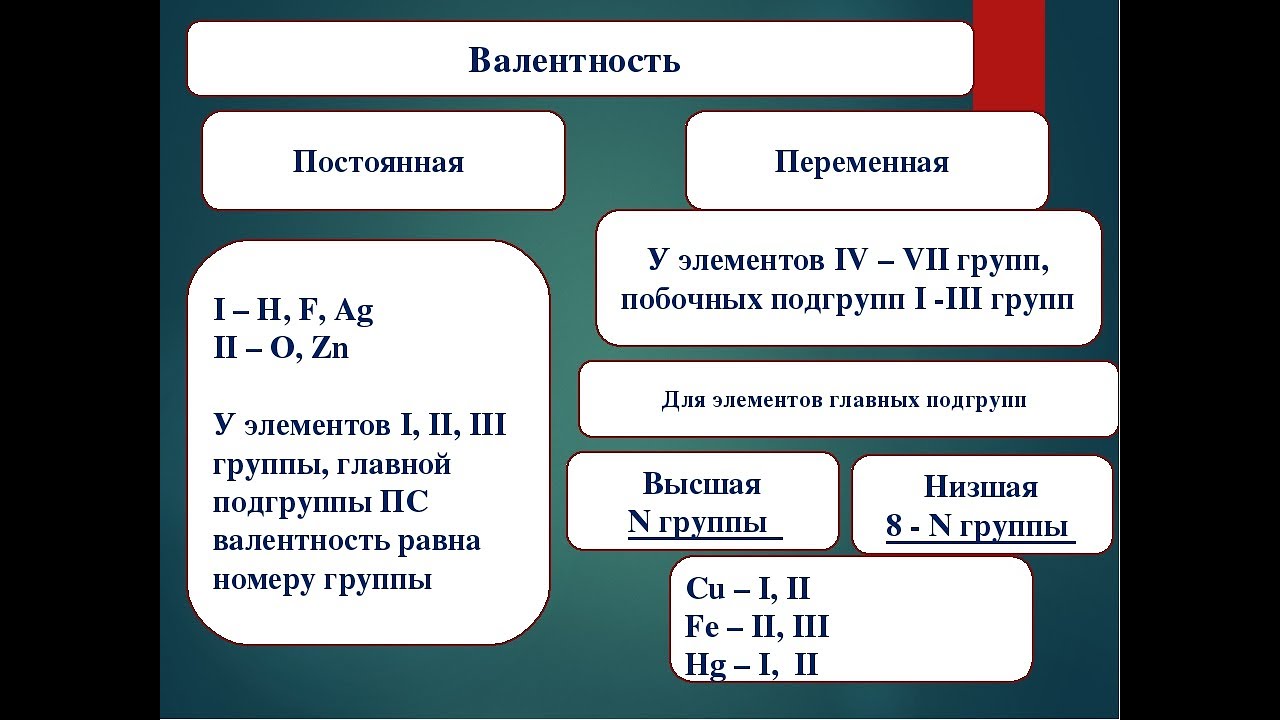 Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.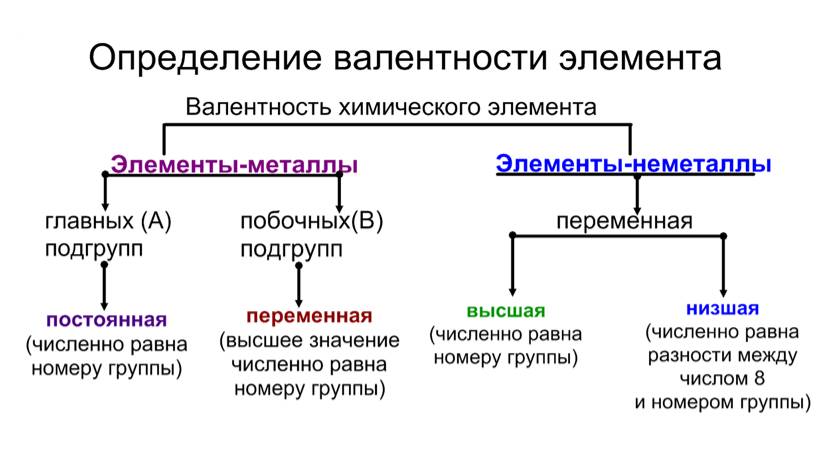
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х·1 = II·2, откуда х = IV.
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II, так как х·1 = II·1, откуда х = II:
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV, а азота — III.
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 (IV·III).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Валентность | CHEMEGE.RU
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Ковалентные связи могут образовываться по обменному и донорно-акцепторному механизмам.
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.
Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):
Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
Большинство элементов характеризуются высшей, низшей или промежуточной валентностью в соединениях.
Для большинства элементов высшая валентность, как правило, равна номеру группы, низшая валентность определяется по формуле: 8 — № группы. Промежуточная валентность – это число между низшей и высшей валентностями.
Например, высшая валентность хлора равна VII, низшая валентность хлора равна I, промежуточные валентности — III, V.
Обратите внимание! Степень окисления и валентность — это не одно и то же. Хотя иногда степени окисления совпадают с валентностями. Стпень окисления — это условный заряд атома, он может быть и положительным и отрицательным. А вот образовать отрицательное число связей атом никак не может.
Например, валентность (число связей) атома кислорода в молекуле O2 равна II, а вот степень окисления атома кислорода равна 0.
Большинство элементов проявляют переменную валентность в соединениях, но некоторые элементы проявляют постоянную валентность. Их необходимо запомнить:
| Элемент | Валентность |
| Фтор F | I |
| Кислород О | II |
| Металлы IA группы (Li, Na, K, Rb, Cs, Fr) | I |
| Металлы IIA группы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| Алюминий Al | III |
Как определить валентность атома в соединении?
Рассмотрим валентные возможности атомов второго периода. В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
Итак, не внешнем энергетическом уровне лития 1 неспаренный электрон: 1s22s1.
+3Li 1s2 2s1
Следовательно, литий может образовывать одну связь и валентность лития I.
У бериллия на внешнем энергетическом уровне 2 электрона: 1s22s2.
+4Be 1s2 2s2
В возбужденном состоянии возможен переход электронов внешнего энергетического уровня с одного подуровня на другой: 1s22s12p1.
+4Be* 1s2 2s1 2p1
Таким образом, на внешнем энергетическом уровне бериллия в возбужденном энергетическом состоянии есть 2 неспаренных электрона и две вакантные электронные орбитали. Следовательно, бериллий может образовать 2 связи по обменному механизму, т. е. валентность бериллия равна номеру группы и равна II.
е. валентность бериллия равна номеру группы и равна II.
Например, в хлориде бериллия валентность бериллия равна II:
Электронная конфигурация атома бора в основном состоянии +5B 1s22s22p1:
+5B 1s2 2s2 2p1
В возбужденном состоянии: +5B* 1s22s12p2.
+5B 1s2 2s1 2p2
Следовательно, бор может образовывать 3 связи по обменному механизму (за счет неспаренных электронов). Валентность бора в соединениях — III.
Например, в трихлориде бора BCl3 валентность бора равна III.
Однако, при этом у бора остается еще одна вакантная электронная орбиталь. Следовательно, бор может выступать, как акцептор электронной пары.
У атома углерода в возбужденном состоянии на внешнем энергетическом уровне 4 неспаренных электрона: 1s22s12p3, следовательно, максимальная валентность углерода равна IV (как правило, в органических соединениях у углерода именно такая валентность). В основном состоянии у атома углерода 2 неспаренных электрона, и валентность II. Однако посмотрим внимательно: у атома углерода в основном состоянии не внешнем энергетическом уровне есть незанятая (вакантная) электронная орбиталь. Следовательно, он может образовывать еще одну связь — по донорно-акцепторному механизму. Таким образом, в некоторых случаях углерод может образовывать три связи (например, молекула угарного газа CO, строение которой мы рассмотрим позднее).
В основном состоянии у атома углерода 2 неспаренных электрона, и валентность II. Однако посмотрим внимательно: у атома углерода в основном состоянии не внешнем энергетическом уровне есть незанятая (вакантная) электронная орбиталь. Следовательно, он может образовывать еще одну связь — по донорно-акцепторному механизму. Таким образом, в некоторых случаях углерод может образовывать три связи (например, молекула угарного газа CO, строение которой мы рассмотрим позднее).
Валентные возможности атома азота определяются также строением его внешнего энергетического уровня. В основном состоянии электронная формула азота: +7N 1s22s22p3.
За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность азота в соединениях — IV.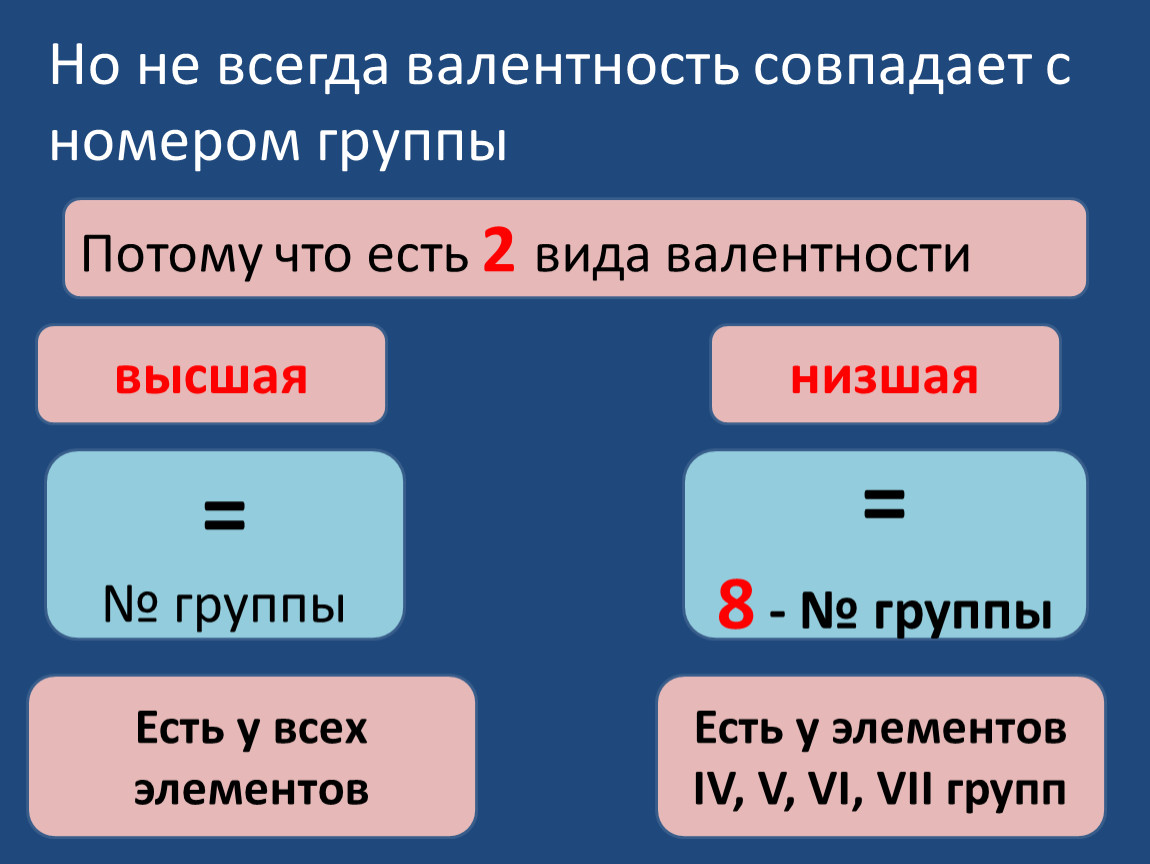 На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
Как определить валентность химических элементов в соединениях по таблице Менделеева (атома, кислотного остатка): по формуле, видеоурок
Валентность – термин, обозначающий способность атомов химических элементов вступать в соединения с атомами других элементов. С латыни это слово можно перевести как «способность» или «сила». Понятие «валентность» в химии одно из основных. Его ученые начали использовать еще до того, как определили строение атома. Зная, как определить валентность, они смогли описать природу химических связей.
При детальном изучении предложенной химической формулы можно отметить, что количество атомов у одного и того же элемента в разных веществах может отличаться. Возникает вопрос о том, как же определить индекс хим. эл-нта и не ошибиться в написании формулы. Сделать это будет просто, если перед этим познакомиться с таким понятием как «валентность».
Возникает вопрос о том, как же определить индекс хим. эл-нта и не ошибиться в написании формулы. Сделать это будет просто, если перед этим познакомиться с таким понятием как «валентность».
Основные сведения
Валентность (V) – это возможность атомов различных химических элементов образовывать связи между собой. Другими словами можно сказать, что это способность атома (мельчайшей частицы) присоединить к себе определенное количество других атомов.
[stop]Это не всегда постоянное число для одного и того же элемента. В разных соединениях последний может обладать различными значениями.[/stop]
Понятие «валентность» было введено еще до того времени, как ученые смогли наконец изучить строение атома (что произошло в 1853 году). В частности, поэтому оно пережило некоторые изменения.
Начало теории, которая объясняет наличие таких связей, изначально положил Франкленд. Но в то время его идеи о присутствии в природе «связывающей силы» не были приняты и распространены среди ученых. Важная, можно сказать, что даже решающая роль в дальнейшем развитии теории принадлежала Кекуле. Но он называл эту способность атомов создавать связи основностью. Также был уверен в том, что это неизменная способность каждой разновидности атомов. Несколько позже теория была дополнена. Свою лепту в ее формирование внес ученый Бутлеров. Постепенно на основе теории химики получили возможность изображать молекулы, что помогло им в изучении строения различных веществ, присутствующих в природе.
В дальнейшем же теория развивалась благодаря тому, что Менделеев представил широкой общественности свое научное открытие — учение о периодическом изменении свойств элементов.
Если посмотреть на валентность с точки зрения электронной теории, то можно определить, что она напрямую связана с количеством внешних электронов атома. Основываясь на этом, ученые под «валентностью» стали подразумевать то число электронных пар, которыми он может быть связан с другими атомами. Данное положение позволило в дальнейшем им определить и описать природу химической связи. Суть ее в том, что пара микрочастиц определенного вещества делит между собой тоже пару валентных электронов.
Химикам 19 века все же удавалось определять валентность еще тогда, когда они не подозревали о существовании такой мельчайшей частицы, как атом. Это было непросто. Определение проводилось с опорой на химический анализ.
С помощью химического анализа ученым удавалось определить точный состав химического соединения – сколько мельчайших частиц различных элементов присутствует в 1 молекуле. Такой способ достаточно сложен. Химикам необходимо было сначала определить точную массу каждого из эл-тов в образце вещества без примесей.
У данной методики были и свои недостатки. Например, определить V эл-нта возможно было только в простом соединении с одновалентным гидридом или двухвалентным оксидом. Это говорит о том, что такой способ определить V допустимо применять только к простым веществам. Для кислот он не подходит. Его можно применить к ним, но в таком случае получится определить только V кислотных остатков.
Валентность и электронная теория
Опираясь на электронную теорию можно сказать, что V мельчайших частиц можно определить на основании числа непарных электронов, которые принимают непосредственное участие в процессе образования электронных пар с электронами других таких же частиц.
Стоит отметить, что в образовании химических связей задействованы только те электроны, которые располагаются на внешней оболочке атома. Поэтому можно определить, что максимальная V равна числу электронов во внешней оболочке. Понятие валентность и ее определение связано с Периодическим законом, который открыл Менделеев.
Определение по таблице Д. И. Менделеева
Чтобы определить V по таблице Менделеева необходимо знать, что такое группы и подгруппы периодической таблицы. Это вертикальные столбцы, которые делят все эл-нты по определенному признаку. В зависимости от признака, выделяют подразделения. Этими столбцами эл-нты делятся на тяжелые и легкие, а также подгруппы — галогены, инертные газы и тому подобное.
Итак, чтобы определить V нужно руководствоваться двумя правилами:
- Высшая V (ВВ) элемента равна номеру его группы.
- Низшая V (НВ) находится как разница между числом 8 и номером группы, в которой расположен данный элемент.
Пример определения: фосфор проявляет ВВ – P2O5 и НВ (8-5)=3– PF3.
Таблица Менделеева (нажмите для увеличения)
Стоит также отметить несколько основных характеристик и особенностей, которые стоит учитывать переде тем, как определить этот показатель:
- V водорода всегда I – H2O, HNO3, H3PO4.
- Кислорода всегда равна II – CO2, SO3.
- У металлов, которые расположены в главной подгруппе, этот показатель всегда равен номеру группы – Al2O3, NaOH, KH.
- Для неметаллов чаще всего проявляются только две V– высшая и низшая.
Также существуют эл-нты, у которых может быть 3 или 4 разных значений этого показателя. К ним относятся хлор, бор, йод, хром, сера и другие. Например, хлор обладает показателями I, III, V, VII – HCl, ClF3,ClF5,HClO4 соответственно.
Определение по формуле
Чтобы определить по формуле можно воспользоваться несколькими правилами:
- Если известна валентность (V) одного из эл-нтов в двойном соединении: допустим, есть соединение углерода и кислорода СО2, при этом мы знаем, что V кислорода всегда равна II, тогда для определения можем воспользоваться таким правилом: произведение числа атомов на его V одного эл-нта должно равняться произведению числа атомов другого эл-нта на его V. Таким образом, V углерода можно определить так – 2×2 (в молекуле 2 атома кислорода с V= 2), то есть она будет равняться 4. Рассмотрим еще несколько примеров, как определить валентность: P2O5 – тут V фосфора = (5*2)/2 = 5. HCl – V хлора будет равна I, так как в этой молекуле 1 атом водорода, и V= 1.
- Если известна V нескольких эл-нтов, которые составляют группу, определить можно так: в молекуле гидроксида натрия NaOH V кислорода равняется II, а V водорода – I, таким образом группа -OH обладает одной свободной валентностью, так как кислород присоединил только один атом водорода и еще одна связь свободна. К ней и присоединится натрий. Можно сделать вывод, что натрий – одновалентный элемент.
Разница между степенью окисления и валентностью
Очень важно понимать принципиальную разницу между этими понятиями. Степень окисления – это условный электрический заряд, которым обладает ядро, в то время как валентность – это количество связей, которые оно может установить.
Рассмотрим подробнее, что такое степень окисления. Согласно современной теории о строении атома, ядро состоит из положительно заряженных протонов и нейтронов без заряда, а вокруг него находятся электроны с отрицательным зарядом, которые уравновешивают заряд ядра и делают его электрически нейтральным.
В случае, если атом устанавливает связь с другим элементом, он отдает или принимает электроны, то есть выходит из состоянии баланса и начинает обладать электрическим зарядом. При этом если он отдает электрон, он становится положительно заряженным, а если принимает – отрицательным.
[warning]В соединении хлора и водорода HCl водород отдает один электрон и приобретает заряд +1, а хлор принимает электрон и становится отрицательным -1. В сложных соединениях, HNO3 и H2SO4, степени окисления будут такими – H+1N+5O3-2 и H2+1S +6O4-2.[/warning]
Сравнивая два этих определения, можно сделать вывод, что они часто совпадают: V водорода +1 и V I, степень окисления кислорода -2 и V II, но очень важно помнить, что это правило выполняется не всегда!
В органическом соединении углерода под названием формальдегид и формулой HCOH у углерода степень окисления 0, но он обладает V, равной 4. В перекиси водорода H2O2 у кислорода степень окисления +1, но V остается равной 2. Поэтому не следует отождествлять два этих понятия, так как в ряде случаев это может привести к ошибке при определении.
Валентности распространенных элементов
Водород
Встречается во многих соединениях и можно определить, что его V=1. Это связано со строением его внешней электронной орбитали, на которой у водорода находится 1 электрон.
На первом уровне может находиться не более двух электронов одновременно, таким образом, водород может либо отдать свой электрон и образовать связь (электронная оболочка останется пустой), либо принять 1 электрон, также образовав новую связь (в таком случае его электронная оболочка полностью заполнится).
Пример: H2O – 2 атома водорода с V=1 связаны с двухвалентным кислородом; HCl – одновалентные хлор и водород; HCN – синильная кислота, где водород также проявляет V, равную 1.
Углерод
Углерод может обладать либо V II, либо IV. Связано это со строением внешнего электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V будет II. То есть 2 электрона установили 2 новые связи, например, соединение CO – угарный газ, где и кислород, и водород двухвалентные. Однако бывают ситуации, когда один электрон с первого уровня переходит на второй, тогда у углерода образуется 4 свободных электрона, которые могут образовывать связи: СО2, НСООН, Н2СО3.
Фосфор
Может обладать валентностью III и V. Как и в предыдущих случаях, связанно это со строением внешнего электронного уровня, на котором у него располагается 3 электрона, то есть возможность образовать 3 связи, но, как и углерод, у него возможен переход 1 электрона с s-орбитали на d-орбиталь, тогда неспаренных электронов станет 5, а значит. Например: РН3, Р2О5, Н3РО4.
Цинк
Цинк может обладать только валентностью, которая равна номеру его группы, то есть 2. Во всех своих соединениях валентность цинка равна II и не зависит от типа элемента и вида связи с ним. Пример: ZnCl2, ZnO, ZnH2, ZnSO4.
Видео по теме: Определение валентности химических элементов:
Видео по теме: Изучение валентности по периодической таблице Менделеева:
О том, как определить валентность, школьникам рассказывают на уроках химии в 8 классе. У многих именно эта тема вызывает значительные трудности. Но на самом деле, если разобраться в понятии, подробно ознакомиться с периодической таблицей Менделеева и немного потренироваться с формулами, то можно определить этот показатель без особого труда.
Статья по теме: Основной закон Гесса и следствия из него.
Определение валентности по Merriam-Webster
ва · ланс
| \ ˈVā-lən (t) s
\
1
: степень объединяющей способности элемента, показанная числом атомных весов одновалентного элемента (такого как водород), с которым атомный вес элемента будет сочетаться или для которого он может быть заменен или которым он может сравниваться
2а
: относительная способность объединяться, реагировать или взаимодействовать (как с антигенами или биологическим субстратом)
б
[частично из валентности в химии, частично заимствовано из позднелатинского валентия «сила, емкость» существительное, производное от латинского валент-, валентное , настоящее причастие валент «иметь силу, быть здоровым» — больше в орудии]
: степень привлекательности отдельного человека, деятельности или объекта в качестве поведенческой цели.
относительная сила валентностей успеха и неудачи — Леон Фестингер
Валенсия
| \ va-ˈläⁿs
\
Коммуна на юго-востоке Франции к югу от Лиона Население 63405
Определение валентности в словаре.com
[vey-luhns] SHOW IPA
/ ˈveɪ ləns / PHONETIC RESPELLING
существительное
Также va · len · cy [vey-luhn-see] / ˈveɪ lən si / .Chemistry.
- качество, определяющее количество атомов или групп, с которыми любой отдельный атом или группа будет химически соединяться.
- относительная объединяющая способность атома или группы по сравнению со стандартным атомом водорода. Хлорид-ион Cl– с валентностью, равной единице, обладает способностью объединяться с одним атомом водорода или его эквивалентом, как в HCl или NaCl.
Иммунология. количество детерминант на молекулу антигена.
способность одного человека или вещи реагировать или влиять на другого каким-то особым образом, например, посредством привлечения или содействия функции или деятельности.
ВОПРОСЫ
ПРОЙДИТЕ ДВОЙНОЙ ВИКТОРИН ПО КОНТРОНИМАМ
Посмотрите в обе стороны, прежде чем проходить этот тест на контронимы или слова, которые могут иметь противоположные значения.
Вопрос 1 из 7
Правильно выберите предложение, в котором используется слово «рента».
Происхождение валентности
Впервые зарегистрировано в 1865–1870 годах; от латинского valentia «сила, ценность», эквивалент причастия настоящего valent- (основа valēns) «быть сильным» + -ia суффикс существительного; см. -ence
СЛОВА, КОТОРЫЕ МОГУТ ПУТИТЬСЯ С валентностью
валентностью, валентностью
Слова, близкие к валентности
Валдоста, валентность, прощание, прощальное слово, валентность, валентность, валентная зона, валентная зона-зона проводимости, валентный электрон, валентные электроны, Валенсия
Определение для валентность (2 из 2)
Валентность
[va-lahns] SHOW IPA
/ vaˈlɑ̃s / PHONETIC RESPELLING
существительное
город и столица Дром на юго-востоке Франции.
Dictionary.com Несокращенный
На основе Несокращенного словаря Random House, © Random House, Inc., 2021
Слова, относящиеся к валентности
манера поведения, поведения, осанки, осанки, поведения, манеры, уравновешенности, присутствия, власти, отношения
Интернет для валентности
.expandable-content {display: none;}. Css-12x6sdt.expandable.content-extended> .expandable-content {display: block;}]]>
Валенсия не использовала его вначале Август, когда он хорошо уладил дела за горой и назначил там надзирателей.’
Валенс послала женщину, замаскированную под нищего, чтобы проследить позицию; но Брюс увидел уловку, и шпион признался.
Англичанин уступил, и, несмотря на все его усилия, Валенс был изгнан с поля боя.
СМОТРЕТЬ БОЛЬШЕ ПРИМЕРОВ СМОТРЕТЬ МЕНЬШЕ ПРИМЕРОВ
Изучить Dictionary.com
li {-webkit-flex-based: 49%; — ms-flex-предпочтительный-размер: 49%; гибкая основа : 49%;} @ экран только мультимедиа и (max-width: 769px) {.css-2jtp0r> li {-webkit-flex-базис: 49%; — ms-flex-предпочтительный-размер: 49%; гибкий-базис: 49%;}} @ media only screen and (max-width: 480px) { .css-2jtp0r> li {-webkit-flex-базис: 100%; — ms-flex-предпочтительный-размер: 100%; гибкий-базис: 100%;}}]]>
Определения валентности в Британском словаре (1 из 2)
существительное хим
другое название (особенно в США и Канаде) для валентности
феномен образования химических связей
Британский словарь определения валентности (2 из 2)
существительное
город на юго-востоке Франции, на Река Рона.Pop: 64 260 (1999)
Словарь английского языка Коллинза — полное и несокращенное цифровое издание 2012 г.
© William Collins Sons & Co. Ltd. 1979, 1986 © HarperCollins
Издатели 1998, 2000, 2003, 2005, 2006, 2007, 2009, 2012
Медицинские определения валентности
n.
Объединяющая способность атома или радикала, которая определяется количеством электронов, которые он потеряет, добавит или поделится при взаимодействии с другими атомами.
Положительное или отрицательное целое число, используемое для представления этой емкости.
Количество компонентов молекулы антигена, с которыми может связываться молекула антитела.
Привлечение или отвращение, которое человек испытывает к определенному объекту или событию.
Медицинский словарь American Heritage® Stedman’s
Авторские права © 2002, 2001, 1995 компании Houghton Mifflin. Опубликовано компанией Houghton Mifflin.
Научные определения валентности
Целое число, которое представляет способность атома или группы атомов объединяться с другими атомами или группами атомов.Валентность определяется количеством электронов, которые атом может потерять, добавить или разделить. Валентность атома положительна, если для образования связи используются его собственные электроны, или отрицательна, если используются электроны другого атома. Например, атом углерода может делить четыре своих электрона с другими атомами и, следовательно, имеет валентность +4. Атом натрия может получать электрон от другого атома и поэтому имеет валентность -1. (В этой книге различие между положительной и отрицательной валентностями игнорируется, если оно не имеет отношения к делу.Валентность атома обычно указывает, сколько химических связей он способен образовывать с другими атомами. Также называется валентным числом степень окисления
The American Heritage® Science Dictionary
Авторские права © 2011. Издано издательством Houghton Mifflin Harcourt Publishing Company. Все права защищены.
Культурные определения валентности
Новый словарь культурной грамотности, третье издание
Авторские права © 2005 издательской компании Houghton Mifflin Harcourt. Опубликовано Houghton Mifflin Harcourt Publishing Company.Все права защищены.
Прочие — это Readingli {-webkit-flex-base: 100%; — ms-flex-предпочтительный размер: 100%; flex-base: 100%;} @ media only screen и (max-width: 769px) {. Css -1uttx60> li {-webkit-flex-базис: 100%; — ms-flex-предпочтительный-размер: 100%; гибкий-базис: 100%;}} @ экран только мультимедиа и (max-width: 480px) {. css-1uttx60> li {-webkit-flex-базис: 100%; — ms-flex-предпочтительный-размер: 100%; гибкий-базис: 100%;}}]]>
Валентность (психология) | Психология вики
Оценка |
Биопсихология |
Сравнительный |
Познавательная |
Развивающий |
Язык |
Индивидуальные различия |
Личность |
Философия |
Социальные |
Методы |
Статистика |
Клиническая |
Образовательная |
Промышленное |
Профессиональные товары |
Мировая психология |
Когнитивная психология:
Внимание ·
Принимать решение ·
Обучение ·
Суждение ·
Объем памяти ·
Мотивация ·
Восприятие ·
Рассуждение ·
Мышление —
Познавательные процессы
Познание —
Контур
Индекс
Валентность , как она используется в психологии, особенно при обсуждении эмоций, означает внутреннюю привлекательность (положительная валентность) или отвращение (отрицательная валентность) события, объекта или ситуации. [1] Однако этот термин также используется для характеристики и классификации определенных эмоций. Например, эмоции, обычно называемые «отрицательными», такие как гнев и страх, имеют «отрицательную валентность». У радости есть «положительная валентность». Положительно валентные эмоции вызываются положительно валентными событиями, объектами или ситуациями. Этот термин также используется для обозначения гедонистического тона чувств, аффекта, определенного поведения (например, приближения и избегания), достижения или недостижения цели, а также соответствия или нарушения норм.Амбивалентность можно рассматривать как конфликт между положительными и отрицательными носителями валентности. [ необходима цитата ]
Теоретики, использующие подход, основанный на валентности к изучению аффектов, суждений и выбора, утверждают, что эмоции с одинаковой валентностью (т. Е. Гнев и страх или гордость и удивление) оказывают аналогичное влияние на суждения и выбор . Например, согласно этой теории, отрицательно валентные эмоции гнева и страха могут привести к более негативным суждениям. [2]
Термин вошел в английское употребление в психологии с переводом с немецкого в 1935 году работ Курта Левина.У амбивалентности более давняя история. [ необходима ссылка ]
Валентность — это один из критериев, используемых в некоторых определениях эмоций. Возможное отсутствие валентности приводится как причина для исключения удивления, рассматриваемого как реакция испуга, из списка эмоций, хотя некоторые могут включить его.
Валентности можно присвоить номер и рассматривать ее так, как если бы она была измерена, но достоверность измерения, основанного на субъективном отчете, вызывает сомнения. Измерения, основанные на наблюдениях за мимикой с использованием Системы кодирования действий лица и микровыражений (см. Пол Экман), или на современной функциональной визуализации мозга, могут преодолеть это возражение.
- ↑ Нико Х. Фрижда, Эмоции. Кембридж (Великобритания): Издательство Кембриджского университета, 1986. стр. 207
- ↑ Лернер, Дженнифер, Дахер Келтнер (2000). За пределами валентности: к модели эмоционально-специфических влияний на суждение и выбор. Познание и эмоции 14 (4): 473–493.
Определение валентности в химии
Валентность — это обычно количество электронов, необходимое для заполнения внешней оболочки атома.Поскольку существуют исключения, более общее определение валентности — это количество электронов, с которыми данный атом обычно связывается, или количество связей, образующихся у атома. (Подумайте о железе, которое может иметь валентность 2 или валентность 3.)
Формальное определение валентности ИЮПАК — это максимальное количество одновалентных атомов, которые могут объединяться с атомом. Обычно определение основывается на максимальном количестве атомов водорода или хлора. Обратите внимание, что IUPAC определяет только одно значение валентности (максимум), в то время как известно, что атомы способны отображать более одной валентности.Например, медь обычно имеет валентность 1 или 2.
Пример
Нейтральный атом углерода имеет 6 электронов с конфигурацией электронной оболочки 1s 2 2s 2 2p 2 . Углерод имеет валентность 4, поскольку 4 электрона могут заполнять 2p-орбиталь.
Общие валентности
Атомы элементов в основной группе периодической таблицы могут иметь валентность от 1 до 7 (поскольку 8 — это полный октет).
- Группа 1 (I) — Обычно отображается валентность 1. Пример: Na в NaCl
- Группа 2 (II) — Типичная валентность 2. Пример: Mg в MgCl 2
- Группа 13 (III) — Обычная валентность 3. Пример: Al в AlCl 3
- Группа 14 (IV) — Обычная валентность равна 4. Пример: C в CO (двойная связь) или CH 4 (одинарные связи)
- Группа 15 (V) — Обычные валентности 3 и 5. Примеры: N в NH 3 и P в PCl 5
- Группа 16 (VI) — Типичные валентности 2 и 6.Пример: O в H 2 O
- Группа 17 (VII) — Обычные валентности 1 и 7. Примеры: Cl в HCl
Валентность в зависимости от состояния окисления
Есть две проблемы с «валентностью». Во-первых, определение неоднозначное. Во-вторых, это просто целое число без знака, указывающего на то, получит ли атом электрон или потеряет свой крайний (е) электрон (ы). Например, валентность и водорода, и хлора равна 1, но водород обычно теряет свой электрон, чтобы стать H + , а хлор обычно получает дополнительный электрон, чтобы стать Cl —.
Степень окисления — лучший индикатор электронного состояния атома, потому что она имеет как величину, так и знак. Кроме того, понятно, что атомы элемента могут иметь разные степени окисления в зависимости от условий. Знак положительный для электроположительных атомов и отрицательный для электроотрицательных атомов. Наиболее распространенная степень окисления водорода +8. Наиболее распространенная степень окисления хлора -1.
Краткая история
Слово «валентность» было описано в 1425 году от латинского слова valentia , что означает сила или способность.Концепция валентности была разработана во второй половине 19 века для объяснения химической связи и молекулярной структуры. Теория химических валентностей была предложена в статье Эдварда Франкленда 1852 года.
определение валентности от The Free Dictionary
Город на юго-востоке Франции на реке Рона к югу от Лиона. Основанный во времена Римской империи, он был захвачен вестготами в 413 году нашей эры, а арабы ок. 730.
п. пл. val·lenc · es также val·len · cies 1. Химия
а. Объединяющая способность атома или группы атомов, определяемая количеством электронов, которые он может потерять, добавить или разделить, когда он вступает в реакцию с другими атомами или группами. Также называется степенью окисления .
г. Целое число, используемое для представления этой емкости, которая может быть положительной или отрицательной в зависимости от того, потеряны или получены электроны, соответственно: валентности меди равны +1 и +2.
2. Количество сайтов связывания молекулы, такой как антитело или антиген.
3. Количество различных антигенов, содержащихся в вакцине, соответствующее количеству патогенов, против которых она активна.
4. Психология Степень влечения или отвращения, которые человек испытывает к определенному объекту или событию.
5. Лингвистика Количество и тип аргументов, с которыми лексический элемент, особенно глагол, может объединяться для создания синтаксически правильного предложения, часто вместе с описанием категорий этих составляющих.Непереходные глаголы (появляются , приходят ) имеют валентность, равную единице — подлежащее; несколько переходных глаголов ( рисовать, касаться), два — подлежащее и прямое дополнение; другие переходные глаголы ( спрашивают, дают ), три — подлежащее, прямое и косвенное.
6. Способность чего-то объединять, реагировать или взаимодействовать с чем-то еще: «Я не утверждаю, что знаю о романах гораздо больше, чем их написание, но я не могу представить себе ни одного набора в дышащем мире, в котором отсутствует любой моральной валентности »(Роберт Стоун).
Словарь английского языка American Heritage®, пятое издание. Авторские права © 2016 Издательская компания Houghton Mifflin Harcourt. Опубликовано Houghton Mifflin Harcourt Publishing Company. Все права защищены.
Что означает валентность — Определение валентности
Примеры использования слова «valence».
Это верность говорящей женщины, ибо Sier Валенс уже сказал, что он отказался от своих клятв ради этой женщины, и она не отрицает этого.
Ничего не назревает, и если что-нибудь и произойдет, то Аддис-де- Валенсия не будет в центре этого.
Вместе со своим опекуном Аддис де Валенс , научившим его видеть небольшие улики, оставленные людьми на лошади или пешком, он возглавил небольшой отряд, который их поймал.
Побывав на каком-то другом евангельском служении в Гренобле, они возобновили свое путешествие, провели собрания в Валенсии и окрестностях, пересекли Рону и вошли в Ардеш.
Он назывался Deep Electromotive Valence Induration Lithospherimal процесс.
Валенсия и граф Рандан, полномочные представители от Франции, подписали в Эдинбурге договор с Сесилом и доктором
Вы имеете в виду тех хулиганов, которых боссы Ле Рейни, вроде Дегреса, которому было приказано арестовать моего советника Коснака, епископа Валенсии ?
Закон газов, закон объединения объемов, нулевой закон, концепция валентности , , законы массовых действий и другие, не поддающиеся подсчету.
Он усилил гарнизоны в Карлайле и Бервике и назначил Генри Перси командующим на западе, а Эймер де Валенс , граф Пембрук — на востоке.
Валенс , когда он с трудом взобрался на свой стрих и поехал за ними.
Главный бинаризм, вокруг которого вращаются все остальные термины, и единственный, который регулярно меняет валентностей , — это гомосексуальность против гетеросексуальности.
Большую часть предыдущего дня он провел за чтением всех описей и аналогичных документов, которые были представлены фонду французским госпиталем, Sier Valence Rainaut.
Мы проехали пятнадцать столбов без остановки и переночевали по адресу , Валенсия, .
Ранее, во время правления Валанса Третьего, Королевство Островов контролировало немногим больше, чем портовые сборы и рыболовство в пределах улова Орнифала, но даже для этого небольшого досягаемости требовались суда надзора.
Гамлет, потому что эмиссары короля Валенсия сказали ей, что она дочь графини Теры, убитой во время беспорядков в Каркозе семнадцатью годами ранее.
валентность — Викисловарь
Английский [править]
Этимология 1 [править]
В значении «выдержка, подготовка» от латинского valentia («сила, емкость») (1425). Нынешнее значение слова «объединяющая способность (атома)» происходит от немецкого Valenz (1884 г.), от того же латинского слова.Лингвистическое определение было сформировано по аналогии с его использованием в химии. Значение «одномерная ценность», используемое в психологии, также происходит от немецкого Valenz (1935).
Произношение [править]
Существительное [править]
валентность ( счетных и несчетных , множественных валентностей )
- (химия, медицина, устаревшее) Выписка; препарат, в настоящее время особенно эффективный против определенного числа штаммов возбудителя.
- (химия) Объединяющая способность атома, радикала или функциональной группы, определяемая количеством электронов, которые они теряют, приобретают или разделяют при объединении с другими атомами и т. Д. [С 1884 г.]
- Синоним: валентность
- (химия) Число сайтов связывания молекулы, такой как антитело или антиген.
- (лингвистика) Количество аргументов, которые может иметь глагол, включая его подлежащее, в диапазоне от нуля (например, «идет дождь») до трех (например, «он дает ей цветок») или меньше. обычно четыре.
- Синоним: валентность
Количество связей, которые имеет глагол, составляет то, что мы назовем валентностью глагола.
- (особенно психология) Одномерное значение, присвоенное объекту, ситуации или состоянию, которое обычно может быть положительным или отрицательным. [с 1935 г.]
гнев и страх отрицательны валентность
- (социология) Ценность.
Альтернативные формы [править]
Производные термины [править]
Связанные термины [править]
Переводы [править]
химия: комбайны
химия: количество сайтов связывания в молекуле
лингвистика: количество аргументов, которые может иметь глагол
психология: одномерное значение, присвоенное объекту, ситуации или состоянию
- Приведенные ниже переводы необходимо проверить и вставить выше в соответствующие таблицы переводов, удалив все цифры.Числа не обязательно совпадают с числами в определениях. См. Инструкции в Викисловаре: Макет статьи § Переводы.
Проверяемые переводы
Этимология 2 [править]
Эта этимология неполная. Вы можете помочь Викисловарю, подробно остановившись на происхождении этого термина.
Произношение [править]
Существительное [править]
валентность ( множественное число валентности )
- Альтернативное написание слова valance
Дополнительная литература [править]
Анаграммы [править]
Произношение [править]
Существительное [править]
валентность f
- (химия) валентность, валентность
- Синоним: mocenství
- (лингвистика) валентность, валентность
Производные термины [править]
Связанные термины [править]
Дополнительная литература [править]
- валентность в Příruční slovník jazyka českého , 1935–1957
- валентность в Slovník spisovného jazyka českého , 1960–1971, 1989
- валентность в Akademický slovník cizích slov , 1995, at prirucka.ujc.cas.cz
Этимология [править]
Обратное формирование из моновалентности . И т. Д.
Произношение [править]
Существительное [править]
валентность f ( множественное число валентности )
- (химия) валентность
- (лингвистика) валентность
См. Также [править]
Дополнительная литература [править]
Анаграммы [править]
.
