Содержание
Что такое валентность металлов
таблица или схема постоянной валентности в соединениях и как ее определить по формулам в 8 классе
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0.
Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Валентность химических элементов (Таблица)
Как можно определить валентность в соединениях:
- Валентность водорода (H) постоянна всегда 1. Отсюда в соединении h4O валентность O равна 2.
- Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
- Высшая валентность всегда равна № группы.
- Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.

- У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
- У неметаллов обычно две валентности: высшая и низшая.
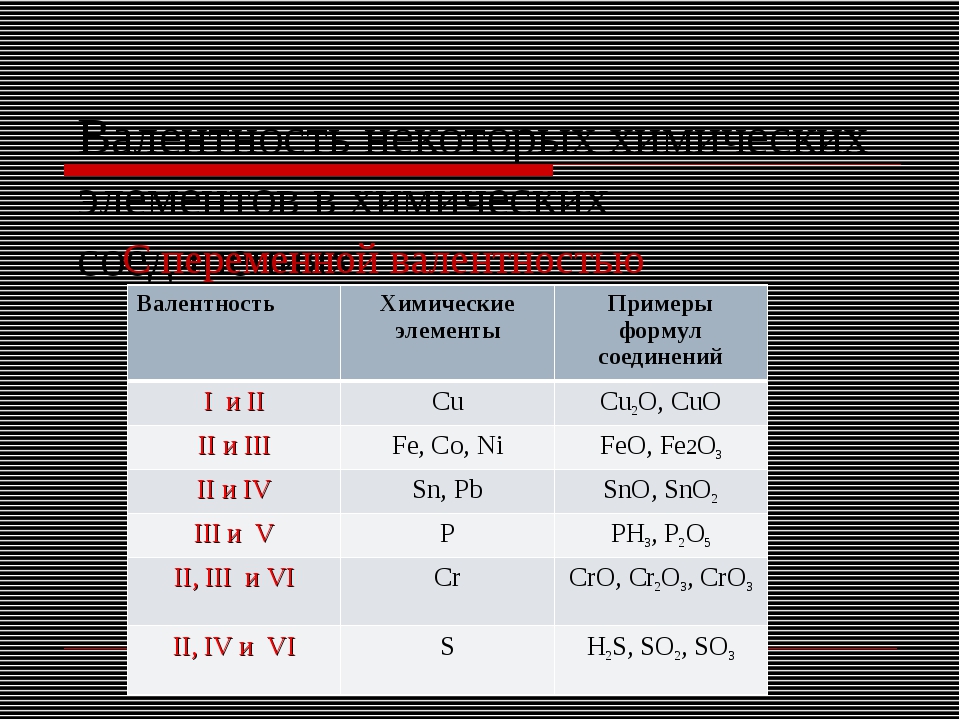
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
| Атомный № | Химический элемент | Символ | Валентность химических элементов | Примеры соединений |
| 1 | Водород / Hydrogen | H | I | HF |
| 2 | Гелий / Helium | He | отсутствует | — |
| 3 | Литий / Lithium | Li | I | Li2O |
| 4 | Бериллий / Beryllium | Be | II | Beh4 |
| 5 | Бор / Boron | B | III | BCl3 |
| 6 | Углерод / Carbon | C | IV, II | CO2, Ch5 |
| 7 | Азот / Nitrogen | N | III, IV | Nh5 |
| 8 | Кислород / Oxygen | O | II | h4O, BaO |
| 9 | Фтор / Fluorine | F | I | HF |
| 10 | Неон / Neon | Ne | отсутствует | — |
| 11 | Натрий / Sodium | Na | I | Na2O |
| 12 | Магний / Magnesium | Mg | II | MgCl2 |
| 13 | Алюминий / Aluminum | Al | III | Al2O3 |
| 14 | Кремний / Silicon | Si | IV | SiO2, SiCl4 |
| 15 | Фосфор / Phosphorus | P | III, V | Ph5, P2O5 |
| 16 | Сера / Sulfur | S | VI, IV, II | h4S, SO3 |
| 17 | Хлор / Chlorine | Cl | I, III, V, VII | HCl, ClF3 |
| 18 | Аргон / Argon | Ar | отсутствует | — |
| 19 | Калий / Potassium | K | I | KBr |
| 20 | Кальций / Calcium | Ca | II | Cah4 |
| 21 | Скандий / Scandium | Sc | III | Sc2S3 |
| 22 |
Титан / Titanium | Ti | II, III, IV | Ti2O3, Tih5 |
| 23 | Ванадий / Vanadium | V | II, III, IV, V | VF5, V2O3 |
| 24 | Хром / Chromium | Cr | II, III, VI | CrCl2, CrO3 |
| 25 | Марганец / Manganese | Mn | II, III, IV, VI, VII | Mn2O7, Mn2(SO4)3 |
| 26 | Железо / Iron | Fe | II, III | FeSO4, FeBr3 |
| 27 | Кобальт / Cobalt | Co | II, III | CoI2, Co2S3 |
| 28 | Никель / Nickel | Ni | II, III, IV | NiS, Ni(CO)4 |
| 29 | Медь / Copper | Сu | I, II | CuS, Cu2O |
| 30 | Цинк / Zinc | Zn | II | ZnCl2 |
| 31 | Галлий / Gallium | Ga | III | Ga(OH)3 |
| 32 | Германий / Germanium | Ge | II, IV | GeBr4, Ge(OH)2 |
| 33 | Мышьяк / Arsenic | As | III, V | As2S5, h5AsO4 |
| 34 | Селен / Selenium | Se | II, IV, VI, | h4SeO3 |
| 35 | Бром / Bromine | Br | I, III, V, VII | HBrO3 |
| 36 | Криптон / Krypton | Kr | VI, IV, II | KrF2, BaKrO4 |
| 37 | Рубидий / Rubidium | Rb | I | RbH |
| 38 | Стронций / Strontium | Sr | II | SrSO4 |
| 39 | Иттрий / Yttrium | Y | III | Y2O3 |
| 40 | Цирконий / Zirconium | Zr | II, III, IV | ZrI4, ZrCl2 |
| 41 | Ниобий / Niobium | Nb | I, II, III, IV, V | NbBr5 |
| 42 | Молибден / Molybdenum | Mo | II, III, IV, V, VI | Mo2O5, MoF6 |
| 43 | Технеций / Technetium | Tc | I — VII | Tc2S7 |
| 44 | Рутений / Ruthenium | Ru | II — VIII | RuO4, RuF5, RuBr3 |
| 45 | Родий / Rhodium | Rh | I, II, III, IV, V | RhS, RhF3 |
| 46 | Палладий / Palladium | Pd | I, II, III, IV | Pd2S, PdS2 |
| 47 | Серебро / Silver | Ag | I, II, III | AgO, AgF2, AgNO3 |
| 48 | Кадмий / Cadmium | Cd | II | CdCl2 |
| 49 | Индий / Indium | In | III | In2O3 |
| 50 | Олово / Tin | Sn | II, IV | SnBr4, SnF2 |
| 51 | Сурьма / Antimony | Sb | III, IV, V | SbF5, Sbh5 |
| 52 | Теллур / Tellurium | Te | VI, IV, II | Teh4, H6TeO6 |
| 53 | Иод / Iodine | I | I, III, V, VII | HIO3, HI |
| 54 | Ксенон / Xenon | Xe | II, IV, VI, VIII | XeF6, XeO4, XeF2 |
| 55 | Цезий / Cesium | Cs | I | CsCl |
| 56 | Барий / Barium | Ba | II | Ba(OH)2 |
| 57 | Лантан / Lanthanum | La | III | Lah5 |
| 58 | Церий / Cerium | Ce | III, IV | CeO2 , CeF3 |
| 59 | Празеодим / Praseodymium | Pr | III, IV | PrF4, PrO2 |
| 60 | Неодим / Neodymium | Nd | III | Nd2O3 |
| 61 | Прометий / Promethium | Pm | III | Pm2O3 |
| 62 | Самарий / Samarium | Sm | II, III | SmO |
| 63 | Европий / Europium | Eu | II, III | EuSO4 |
| 64 | Гадолиний / Gadolinium | Gd | III | GdCl3 |
| 65 | Тербий / Terbium | Tb | III, IV | TbF4, TbCl3 |
| 66 | Диспрозий / Dysprosium | Dy | III | Dy2O3 |
| 67 | Гольмий / Holmium | Ho | III | Ho2O3 |
| 68 | Эрбий / Erbium | Er | III | Er2O3 |
| 69 | Тулий / Thulium | Tm | II, III | Tm2O3 |
| 70 | Иттербий / Ytterbium | Yb | II, III | YO |
| 71 | Лютеций / Lutetium | Lu | III | LuF3 |
| 72 | Гафний / Hafnium | Hf | II, III, IV | HfBr3, HfCl4 |
| 73 | Тантал / Tantalum | Ta | I — V | TaCl5, TaBr2, TaCl4 |
| 74 | Вольфрам / Tungsten | W | II — VI | WBr6, Na2WO4 |
| 75 | Рений / Rhenium | Re | I — VII | Re2S7, Re2O5 |
| 76 | Осмий / Osmium | Os | II — VI, VIII | OsF8, OsI2, Os2O3 |
| 77 | Иридий / Iridium | Ir | I — VI | IrS3, IrF4 |
| 78 | Платина / Platinum | Pt | I, II, III, IV, V | Pt(SO4)3, PtBr4 |
| 79 | Золото / Gold | Au | I, II, III | AuH, Au2O3, Au2Cl6 |
| 80 | Ртуть / Mercury | Hg | II | HgF2, HgBr2 |
| 81 | Талий / Thallium | Tl | I, III | TlCl3, TlF |
| 82 | Свинец / Lead | Pb | II, IV | PbS, Pbh5 |
| 83 | Висмут / Bismuth | Bi | III, V | BiF5, Bi2S3 |
| 84 | Полоний / Polonium | Po | VI, IV, II | PoCl4, PoO3 |
| 85 | Астат / Astatine | At | нет данных | — |
| 86 | Радон / Radon | Rn | отсутствует | — |
| 87 | Франций / Francium | Fr | I | — |
| 88 | Радий / Radium | Ra | II | RaBr2 |
| 89 | Актиний / Actinium | Ac | III | AcCl3 |
| 90 | Торий / Thorium | Th | II, III, IV | ThO2, ThF4 |
| 91 | Проактиний / Protactinium | Pa | IV, V | PaCl5, PaF4 |
| 92 | Уран / Uranium | U | III, IV | UF4, UO3 |
| 93 | Нептуний | Np | III — VI | NpF6, NpCl4 |
| 94 | Плутоний | Pu | II, III, IV | PuO2, PuF3, PuF4 |
| 95 | Америций | Am | III — VI | AmF3, AmO2 |
| 96 | Кюрий | Cm | III, IV | CmO2, Cm2O3 |
| 97 | Берклий | Bk | III, IV | BkF3, BkO2 |
| 98 | Калифорний | Cf | II, III, IV | Cf2O3 |
| 99 | Эйнштейний | Es | II, III | EsF3 |
| 100 | Фермий | Fm | II, III | — |
| 101 | Менделевий | Md | II, III | — |
| 102 | Нобелий | No | II, III | — |
| 103 | Лоуренсий | Lr | III | — |
| Номер | Элемент | Символ | Валентность химических элементов | Пример |
Источник: https://infotables. ru/khimiya/1071-valentnost-khimicheskikh-elementov
ru/khimiya/1071-valentnost-khimicheskikh-elementov
Электроотрицательность. Степень окисления и валентность химических элементов
Электроотрицательность — способность атома какого-либо химического элемента в соединении оттягивать на себя электроны связанных с ним атомов других химических элементов.
Электроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
- График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
- При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
- Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т. е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Как рассчитать степень окисления элемента в соединении?
Степень окисления химических элементов в простых веществах всегда равна нулю.
Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю.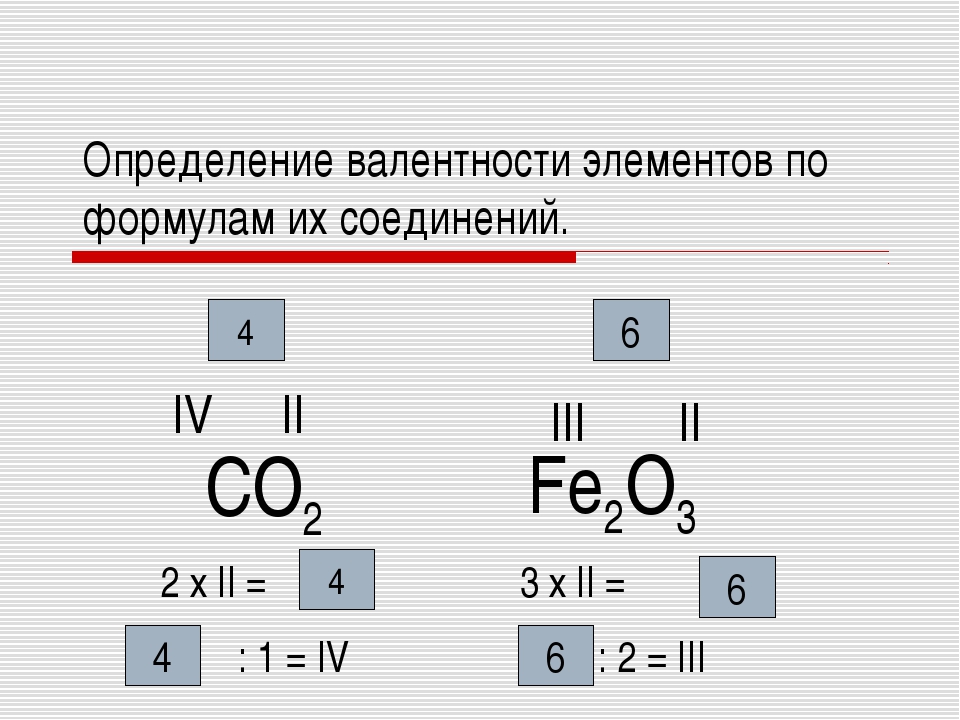 Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
- низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Валентность
Валентность — число химических связей, которые образует атом элемента в химическом соединении.
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
- неспаренных электронов
- неподеленных электронных пар на орбиталях валентных уровней
- пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня.
Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.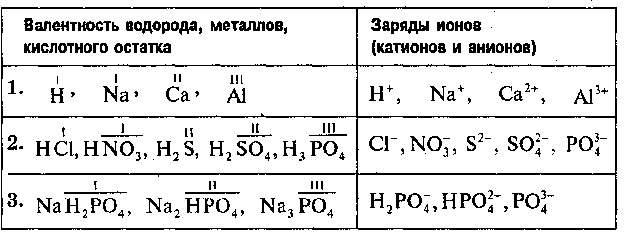
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II.
Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей.
По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных ( ) орбиталей валентного уровня.
Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Резюмируя информацию по валентным возможностям атома углерода:
- Для углерода возможны валентности II, III, IV
- Наиболее распространенная валентность углерода в соединениях IV
- В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Валентные возможности атома азота
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (Nh5), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Действительно, валентность, равная трём, наблюдается в молекулах аммиака (Nh5), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар.
Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор( ) предоставляет ее другому атому с вакантной ( ) орбиталью валентного уровня (акцептору). Т.е.
для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии.
Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей.
Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
Резюмируя информацию по валентным возможностям атома азота:
- Для азота возможны валентности I, II, III и IV
- Валентности V у азота не бывает!
- В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления +5 (!).

- В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония Nh5+, азотная кислота и д.р).
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/jelektrootricatelnost-stepen-okislenija-valentnost
Simple English Wikipedia, бесплатная энциклопедия
Некоторые химические элементы называются металлами . Они являются большинством элементов периодической таблицы. Эти элементы обычно обладают следующими свойствами:
- Они могут проводить электричество и тепло.
- Их легко сформировать.
- У них блестящий вид.
- Они имеют высокую температуру плавления.
Большинство металлов остаются твердыми при комнатной температуре, но это не обязательно.Ртуть жидкая. Сплавы — это смеси, в которых хотя бы одна часть смеси представляет собой металл. Примеры металлов: алюминий, медь, железо, олово, золото, свинец, серебро, титан, уран и цинк. Хорошо известные сплавы включают бронзу и сталь.
Хорошо известные сплавы включают бронзу и сталь.
Изучение металлов называется металлургией.
Признаки сходства металлов (свойства металлов) [изменить | изменить источник]
Большинство металлов твердые, блестящие, они кажутся тяжелыми и плавятся только при очень высоких температурах.Куски металла издают звон колокольчика при ударе чего-то тяжелого (они звонкие). Тепло и электричество могут легко проходить через металл (он проводящий). Кусок металла можно разбить на тонкий лист (он ковкий) или растянуть на тонкую проволоку (он пластичный). Металл трудно разорвать (у него высокая прочность на разрыв) или разбить (у него высокая прочность на сжатие). Если надавить на длинный тонкий кусок металла, он согнется, а не сломается (он эластичный). За исключением цезия, меди и золота, металлы имеют нейтральный серебристый цвет.
Не все металлы обладают этими свойствами. Ртуть, например, жидкая при комнатной температуре, свинец очень мягкий, а тепло и электричество не проходят через железо так, как через медь.
Мост в России металлический, вероятно, железный или стальной.
Металлы очень полезны людям. Их используют для изготовления инструментов, потому что они могут быть прочными и легко поддающимися обработке. Из железа и стали строили мосты, здания или корабли.
Некоторые металлы используются для изготовления таких предметов, как монеты, потому что они твердые и не изнашиваются быстро.Например, медь (блестящая и красного цвета), алюминий (блестящая и белая), золото (желтая и блестящая), а также серебро и никель (также белые и блестящие).
Некоторые металлы, например сталь, можно делать острыми и оставаться острыми, поэтому их можно использовать для изготовления ножей, топоров или бритв.
Редкие металлы с высокой стоимостью, такие как золото, серебро и платина, часто используются для изготовления ювелирных изделий. Металлы также используются для изготовления крепежа и шурупов. Кастрюли, используемые для приготовления пищи, могут быть сделаны из меди, алюминия, стали или железа. Свинец очень тяжелый и плотный, и его можно использовать в качестве балласта на лодках, чтобы не допустить их опрокидывания или защитить людей от ионизирующего излучения.
Свинец очень тяжелый и плотный, и его можно использовать в качестве балласта на лодках, чтобы не допустить их опрокидывания или защитить людей от ионизирующего излучения.
Многие изделия, сделанные из металлов, на самом деле могут быть сделаны из смесей по крайней мере одного металла с другими металлами или с неметаллами. Эти смеси называются сплавами. Некоторые распространенные сплавы:
Люди впервые начали делать вещи из металла более 9000 лет назад, когда они обнаружили, как получать медь из [] руды. Затем они научились делать более твердый сплав — бронзу, добавляя к ней олово.Около 3000 лет назад они открыли железо. Добавляя небольшое количество углерода в железо, они обнаружили, что из них можно получить особенно полезный сплав — сталь.
В химии металл — это слово, обозначающее группу химических элементов, обладающих определенными свойствами. Атомы металла легко теряют электрон и становятся положительными ионами или катионами. Таким образом, металлы не похожи на два других вида элементов — неметаллы и металлоиды. Большинство элементов периодической таблицы — металлы.
Большинство элементов периодической таблицы — металлы.
В периодической таблице мы можем провести зигзагообразную линию от элемента бора (символ B) до элемента полония (символ Po). Элементы, через которые проходит эта линия, — это металлоиды. Элементы, расположенные выше и справа от этой линии, являются неметаллами. Остальные элементы — это металлы.
Большинство свойств металлов обусловлено тем, что атомы в металле не очень крепко удерживают свои электроны. Каждый атом отделен от других тонким слоем валентных электронов.
Однако некоторые металлы отличаются. Примером может служить металлический натрий. Он мягкий, плавится при низкой температуре и настолько легкий, что плавает на воде. Однако людям не следует пробовать это, потому что еще одно свойство натрия состоит в том, что он взрывается при соприкосновении с водой.
Большинство металлов химически стабильны и не вступают в реакцию легко, но некоторые реагируют. Реактивными являются щелочные металлы, такие как натрий (символ Na) и щелочноземельные металлы, такие как кальций (символ Ca).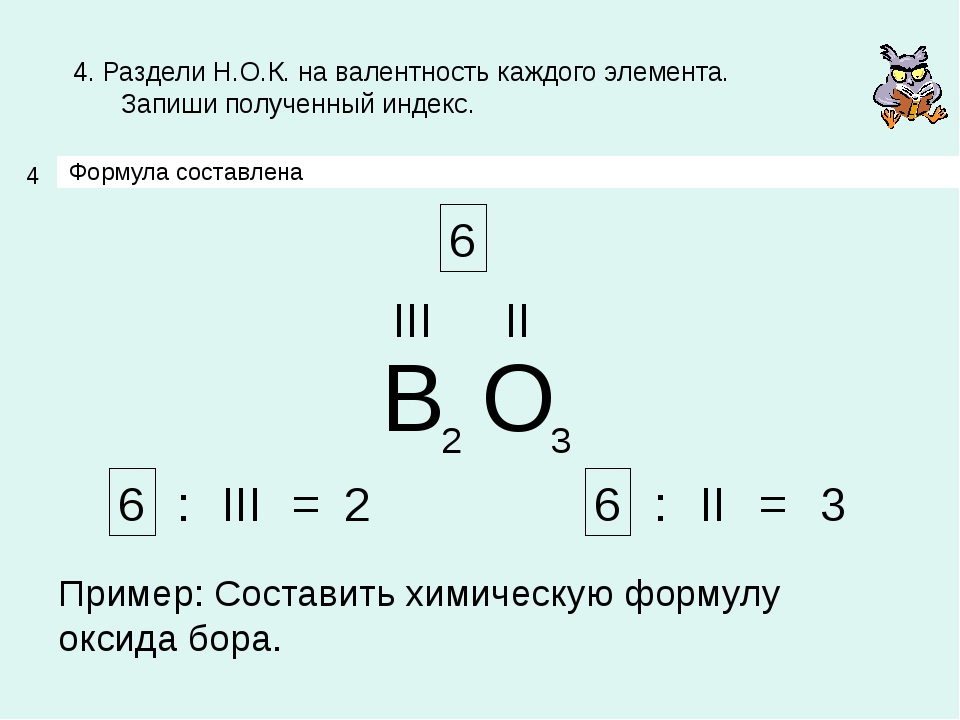 Когда металлы действительно вступают в реакцию, они часто реагируют с кислородом.Оксиды металлов являются основными. Оксиды неметаллов кислые.
Когда металлы действительно вступают в реакцию, они часто реагируют с кислородом.Оксиды металлов являются основными. Оксиды неметаллов кислые.
Соединения, в которых атомы металлов соединены с другими атомами, образуя молекулы, вероятно, являются наиболее распространенными веществами на Земле. Например, поваренная соль — это соединение натрия.
Кусок чистой меди, найденной как самородная медь
Считается, что использование металлов отличает людей от животных. Прежде чем использовать металлы, люди делали инструменты из камня, дерева и костей животных. Сейчас это называется каменным веком.
Никто не знает, когда был найден и использован первый металл. Вероятно, это была так называемая самородная медь, которую иногда находят большими кусками на земле. Люди научились делать из него медные инструменты и другие вещи, хотя для металла он довольно мягкий. Они научились плавке, чтобы получать медь из обычных руд. Когда медь плавили на огне, люди научились делать сплав под названием бронза, который намного тверже и прочнее меди. Из бронзы делали ножи и оружие.Это время в истории человечества примерно после 3300 г. до н.э. часто называют бронзовым веком, то есть временем бронзовых инструментов и оружия.
Из бронзы делали ножи и оружие.Это время в истории человечества примерно после 3300 г. до н.э. часто называют бронзовым веком, то есть временем бронзовых инструментов и оружия.
Примерно в 1200 году до нашей эры некоторые люди научились делать железные орудия труда и оружие. Они были даже тверже и прочнее бронзы, и это было преимуществом на войне. Время железных инструментов и оружия теперь называется железным веком. . Металлы были очень важны в истории человечества и цивилизации. Железо и сталь сыграли важную роль в создании машин. Золото и серебро использовались в качестве денег, чтобы люди могли торговать, то есть обмениваться товарами и услугами на большие расстояния.
В астрономии металл — это любой элемент, кроме водорода или гелия. Это потому, что эти два элемента (а иногда и литий) — единственные, которые образуются вне звезд. В небе спектрометр может видеть признаки металлов и показывать астроному металлы в звезде.
В организме человека некоторые металлы являются незаменимыми питательными веществами, такими как железо, кобальт и цинк. Некоторые металлы могут быть безвредными, например рутений, серебро и индий. Некоторые металлы могут быть токсичными в больших количествах. Другие металлы, такие как кадмий, ртуть и свинец, очень ядовиты.Источники отравления металлами включают горнодобывающую промышленность, хвостохранилища, промышленные отходы, сельскохозяйственные стоки, профессиональные воздействия, краски и обработанную древесину.
.
валентных электронов — химия | Сократик
Химия
Наука
- Анатомия и физиология
- Астрономия
- Астрофизика
- Биология
- Химия
- науки о Земле
- Наука об окружающей среде
.
| НОМЕР | СИМВОЛ | ЭЛЕМЕНТ | ВАЛЕНЦИЯ | ||||||||||||
| 1 | |||||||||||||||
| 2 | He | Гелий | 0 | ||||||||||||
| 3 | Li | Литий | 1 , -1 | ||||||||||||
| 5 | B | Бор | 3 , 2, 1 | ||||||||||||
| 6 | C | Углерод | 4 , 3, 2, 1, -1, -2, -4 | ||||||||||||
| 7 | N | Азот | 5 , 4, 3, 2, 1, 0, -1, -2, -3 | ||||||||||||
| 8 | O | 2, 1, 0, -1, -2 | |||||||||||||
| 9 | F | Фтор | 0, -1 | ||||||||||||
| 10 | Ne | Neon | |||||||||||||
| 11 | Na | Натрий | 1 , -1 | ||||||||||||
| 12 | Mg | Магний | 2 |
| 14 | Si | Кремний | 4 , 3, 2, 1, -1, -2, -4 | ||||||||||||
| 15 | P | Фосфор | 5 , 4, 3 , 2, 1, 0, -1, -2, -3 |
| ||||||||||||
| 16 | S | Сера | 6 , 5, 4, 3, 2, 1, 0, -1, -2 | ||||||||||||
| 17 | Класс | Хлор | 6, 5, 4, 3, 2, 1, 0, -1 , -2 | ||||||||||||
| 18 | Ar | Аргон | 0 | ||||||||||||
| 19 | K | Калий | 1 , -1 | ||||||||||||
| 20 | Ca | Кальций | 2 | ||||||||||||
| 21 | Sc | Скандий | |||||||||||||
| Ti | Титан | 4 , 3, 2, 0, -1, -2 | |||||||||||||
| 23 | V | Ванадий | 5, 4, 3 , 2, 1, 0 , -1, -2 | ||||||||||||
| 24 | Cr | Хром | 6 , 5, 4, 3 , 2 , 1, 0, -1, -2, -3, -4 | ||||||||||||
| 25 | Mn | Марганец | 7 , 6, 5, 4 , 3, 2 , 1 , 0, -1, -2, -3 | ||||||||||||
| 26 | Fe | Железо | 6, 5, 4, 3 , 2 , 1, 0, -1, -2 | ||||||||||||
| 27 | Co | Кобальт | 5, 4, 3 , 2 , 1, 0, -1 | ||||||||||||
| 28 | Ni | Никель | 6, 4, 3, 2 , 1, 0, -1 | ||||||||||||
| 29 | Cu | Медь | 4, 3, 2 , 1 , 0 | ||||||||||||
| 30 | Zn | Цинк | |||||||||||||
| 31 | Ga | Галлий | 3 , 2, 1 | ||||||||||||
| 32 | Ge | Германий | 4 , 3, 2, 1 | As | Мышьяк | 5 , 3 , 2, -3 | |||||||||
| 34 | Se | S elenium | 6, 4 , 2, 1, -2 | ||||||||||||
| 35 | Br | Бром | 7, 5, 4, 3, 1, 0, -1 | ||||||||||||
| 36 | Kr | Криптон | 2, 0 | ||||||||||||
| 37 | Rb | Рубидий | 1 , -1 | ||||||||||||
| 38 | |||||||||||||||
| 38 | |||||||||||||||
| 39 | Y | Иттрий | 3 , 2 | ||||||||||||
| 40 | Zr | Цирконий | 4 , 3, 2, 1, 0, -2 | Nb | Ниобий | 5 , 4, 3, 2, 1, 0, -1, -3 | |||||||||
| 42 | Mo | Молибден | 6 , 5, 4 , 3 , 2, 1, 0, -1, -2 | ||||||||||||
| 43 | Tc | Технеций | 7 , 6, 5, 4 , 3, 2, 1, 0, -1, -3 | ||||||||||||
| 44 | Ru | Рутений | 8, 7, 6, 5, 4 , 3 , 2, 1, 0, -2 | ||||||||||||
| 45 | Rh | Родий | 6, 5, 4, 3 , 2, 1, 0, -1 | ||||||||||||
| 46 | Pd | Палладий | 4 , 2 , 0 | ||||||||||||
| 47 | Ag | Серебро | 3, 2, 1 , 0 | ||||||||||||
| Кадмий | 2 , 1 | ||||||||||||||
| 49 | In | Индий | 3 , 2, 1 | ||||||||||||
| 50 | Sn | олово | |||||||||||||
| 51 | Сб | Сурьма | 5, 3 , -3 | ||||||||||||
| 52 | Te | Теллур | 6, 5, 4 , 2, 1, -2 | ||||||||||||
| 53 | I | Йод | 7, 5 , 3, 1, 0, -1 | ||||||||||||
| 54 | Xe | Ксенон | 8, 6, 4, 3, 2, 0 | ||||||||||||
| 55 | Cs | Цезий | |||||||||||||
| 56 | Ba | Барий | 2 | ||||||||||||
| 57 | La | Лантан | 3 , 2 | ||||||||||||
| 59 | Pr | Празеодим | 4, 3 , 2 | ||||||||||||
| 60 | Nd | Неодим | 4, | ||||||||||||
| P рометий | 3 | ||||||||||||||
| 62 | Sm | Самарий | 3 , 2 | ||||||||||||
| 63 | Eu | Europium | 30007| 30007 | 30007 | | Гадолиний | 3 , 2, 1 |
| |||||||
| 65 | Tb | Тербий | 4, 3 , 1 | ||||||||||||
| 66 | Dy | , 2 | |||||||||||||
| 67 | Ho | Гольмий | 3 , 2 | ||||||||||||
| 68 | Er | Эрбий | 3 | 3 , 2 | |||||||||||
| 70 | Yb | Иттербий | 3 , 2 | ||||||||||||
| 71 | Lu | 3 | |||||||||||||
| 72 | Hf | Гафний | 4 , 3, 2, 1 | ||||||||||||
| 73 | Ta | ||||||||||||||
| 74 | W | Вольфрам | 6 , 5, 4 , 3, 2, 1, 0, -1, -2, -4 | ||||||||||||
| 75 | Re | Рений | 7, 6, 5 , 4 , 3 , 2, 1, 0, -1, -3 | ||||||||||||
| 76 | Os | Осмий | 8, 7, 6, 5, 4 , 3, 2, 1, 0, -2 | ||||||||||||
| 77 | Ir | Iridium | 6, 5, 4 , 3 , 2, 1, 0, -1 | ||||||||||||
| 78 | Pt | Платина | 6, 5, 4 , 2 , 0 | ||||||||||||
| 79 | Au | Золото 9 0007 | 7, 5, 3 , 2, 1, 0, -1 | ||||||||||||
| 80 | Hg | Меркурий | 2 , 1 | ||||||||||||
| 81 | 3 , 1 | ||||||||||||||
| 82 | Pb | Свинец | 4, 2 | ||||||||||||
| 83 | Bi | Висмут | 3 | ||||||||||||
| 84 | Po | Полоний | 6, 4 , 2, -2 | ||||||||||||
| 85 | Ат | Астатин | 7, 5, 3, 1, -1 | ||||||||||||
| 86 | Rn | Радон | 2, 0 | ||||||||||||
| 87 | Fr | Франций | 1 | ||||||||||||
| 88 | |||||||||||||||
| 89 | Ac | Актиний | 3 | ||||||||||||
| 90 | Th | Торий | 4 , 3, 2 | ||||||||||||
| 92 | U | Уран | 6 , 5, 4, 3, 2 | ||||||||||||
| 93 | Np | Нептуний 70007 | |||||||||||||
| 94 | Pu | Плутоний | 7 , 6, 5, 4 , 3, 2 | ||||||||||||
| 95 | Am | Америций | |||||||||||||
| 96 | См | Кюрий | 6 , 5 , 4, 3 , 2 | ||||||||||||
| 97 | Bk Беркелиум | 4,900 05 3 , 2 | |||||||||||||
| 98 | Cf | Калифорний | 5 , 4, 3 , 2 | ||||||||||||
| 99 | Es | Einsteinium | |||||||||||||
| 100 | Fm | Фермий | 4 , 3 , 2 | ||||||||||||
| 101 | Md | Менделевий | | , 2 | № | Нобелиум | 3, 2 | 103 | Lr | Лоуренсий | 3 , 2 |
| ||||
| 105 | Db | Дубний | 5 , 4 | ||||||||||||
| 106 | Sg | Seaborgium | 6 , 5 , 4 | ||||||||||||
| 107 | Bh | Bohrium | 7 , 6 , 5 9117 , 9117 000 900| 108 | Hs | Калий | 8 , 7 , 4 , 3 , 2 |
| ||||||||
| 109 | Mt | 9114 | |||||||||||||
| 110 | Ds | Дармштадтиум | 6 , 5 , 4 , 31179 31179 | ||||||||||||
| 111 | Rg | Roentgenium | 3 , -1 | ||||||||||||
| 112 | Cn | Copernicium | 2911 80, 1 | ||||||||||||
| 113 | Nh | Nihonium | 1 | ||||||||||||
| 114 | Fl | Flerovium | 2 30007 | ||||||||||||
| 116 | Lv | Livermorium | 4 , 2 | ||||||||||||
| 117 | Ts | Оганессон | 8 , 6 , 4 , 2 |
.
Валентных электронов — Характеристики и определение валентных электронов
- БЕСПЛАТНАЯ ЗАПИСЬ КЛАСС
- КОНКУРСНЫЕ ЭКЗАМЕНА
- BNAT
- Классы
- Класс 1–3
- Класс 4-5
- Класс 6-10
- Класс 110003 CBSE
- Книги NCERT
- Книги NCERT для класса 5
- Книги NCERT, класс 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- NCERT Книги для класса 11
- NCERT Книги для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
9plar
- Книги NCERT
- RS Aggarwal
- RS Aggarwal Решения класса 12
- RS Aggarwal Class 11 Solutions
- RS Aggarwal Решения класса 10
- Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- RD Sharma
- RD Sharma Class 6 Решения
- RD Sharma Class 7 Решения
- Решения RD Sharma класса 8
- Решения RD Sharma класса 9
- Решения RD Sharma класса 10
- Решения RD Sharma класса 11
- Решения RD Sharma Class 12
- PHYSICS
- Механика
- Оптика
- Термодинамика
- Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Статистика
- Числа
- Числа Пифагора Тр Игонометрические функции
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Разделение фракций
- Microology
- FORMULAS
- Математические формулы
- Алгебраные формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- 000
- 000 Калькуляторы по химии
- 000
- 000
- 000 Образцы документов для класса 6
- Образцы документов CBSE для класса 7
- Образцы документов CBSE для класса 8
- Образцы документов CBSE для класса 9
- Образцы документов CBSE для класса 10
- Образцы документов CBSE для класса 1 1
- Образцы документов CBSE для класса 12
0003000
- Вопросники предыдущего года CBSE
- Вопросники предыдущего года CBSE, класс 10
- Вопросники предыдущего года CBSE, класс 12
- HC Verma Solutions
- HC Verma Solutions Класс 11 Физика
- Решения HC Verma Физика класса 12
- Решения Лакмира Сингха
- Решения Лакмира Сингха класса 9
- Решения Лахмира Сингха класса 10
- Решения Лакмира Сингха класса 8
9000 Класс
9000BSE 9000 Примечания3 2 6 Примечания CBSE
Примечания
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке 8 класса CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Дополнительные вопросы по науке
- CBSE Вопросы
- CBSE Class 10 Дополнительные вопросы по математике
- CBSE Class 10 Science Extra questions
- Class 3
- Class 4
- Class 5
- Class 6
- Class 7
- Class 8 Класс 9
- Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для класса 11 по физике
- Решения NCERT для класса 11 Химия
- Решения NCERT для биологии класса 11
- Решение NCERT s Для класса 11 по математике
- NCERT Solutions Class 11 Accountancy
- NCERT Solutions Class 11 Business Studies
- NCERT Solutions Class 11 Economics
- NCERT Solutions Class 11 Statistics
- NCERT Solutions Class 11 Commerce
- NCERT Solutions for Class 12
- Решения NCERT для физики класса 12
- Решения NCERT для химии класса 12
- Решения NCERT для биологии класса 12
- Решения NCERT для математики класса 12
- Решения NCERT, класс 12, бухгалтерия
- Решения NCERT, класс 12, бизнес-исследования
- NCERT Solutions Class 12 Economics
- NCERT Solutions Class 12 Accountancy Part 1
- NCERT Solutions Class 12 Accountancy Part 2
- NCERT Solutions Class 12 Micro-Economics
- NCERT Solutions Class 12 Commerce
- NCERT Solutions Class 12 Macro-Economics
- NCERT Solut Ионы Для класса 4
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для класса 5
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для класса 6
- Решения NCERT для математики класса 6
- Решения NCERT для науки класса 6
- Решения NCERT для класса 6 по социальным наукам
- Решения NCERT для класса 6 Английский язык
- Решения NCERT для класса 7
- Решения NCERT для математики класса 7
- Решения NCERT для науки класса 7
- Решения NCERT для социальных наук класса 7
- Решения NCERT для класса 7 Английский язык
- Решения NCERT для класса 8
- Решения NCERT для математики класса 8
- Решения NCERT для науки 8 класса
- Решения NCERT для социальных наук 8 класса ce
- Решения NCERT для класса 8 Английский
- Решения NCERT для класса 9
- Решения NCERT для класса 9 по социальным наукам
- Решения NCERT для математики класса 9
- Решения NCERT для математики класса 9 Глава 1
- Решения NCERT для математики класса 9, глава 2
- для математики класса 9, глава 3
- Решения NCERT для математики класса 9, глава 4
- Решения NCERT для математики класса 9, глава 5
- для математики класса 9, глава 6
- Решения NCERT для математики класса 9 Глава 7
- для математики класса 9 Глава 8
- Решения NCERT для математики класса 9 Глава 9
- Решения NCERT для математики класса 9 Глава 10
- для математики класса 9 Глава 11
- NCERT для математики класса 9 Глава 12
- для математики класса 9 Глава 13
- NCER Т
Решения NCERT
Решения NCERT
Решения NCERT
Решения NCERT
Решения
Решения NCERT
.
Валентность металлов — Справочник химика 21
Эквивалентную массу вещества вычисляют, исходя из его мольной массы. Эквивалентная масса кислоты равна ее мольной массе, деленной на основность кислоты. Эквивалентная масса основания равна его мольной массе, деленной на валентность металла, образующего основание. Эквивалентная масса [c.44]
Чпсло атомов металла валентность металла [c.8]
Если ион металла может находиться в различных состояниях окисления, их обозначают римскими цифрами, записываемыми после названия элемента. Кроме того, с этой же целью употребляется и старая номенклатура с указанием валентности металла. Например [c.32]
Многоосновные кислоты, а также основания двух- и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда. Например, диссоциация угольной кислоты происходит в две ступени [c.237]
В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда. Например, диссоциация угольной кислоты происходит в две ступени [c.237]
Чтобы определить, какой металл взят, необходимо знать его валентность. Значит, в условие задачи следует ввести эту величину. Предположим, что валентность металла 2, тогда атомная масса его равна 20 2 = 40 у. ед., а значит, искомый металл — кальций. [c.108]
Молярную массу эквивалентов вещест.ва вычисляют, исходя из его молярной массы. Молярная масса эквивалентов кислоты равна ее молярной массе, деленной на основность кислоты. Молярная масса эквивалентов основания равна его молярной массе, деленной на валентность металла, образующего основание. Молярная масса эквивалентов соли равна ее молярной массе, деленной на произведение валентности металла на число его атомов в молекуле. [c.35]
Конденсированные арены образуют твердые комплексы и с хлоридом сурьмы(III) в среде хлороформа или четыреххлористого углерода [140], с трифторметансульфонатом одновалентной меди [141] или серебра [142]. Для выделения моноциклических аренов в виде твердых комплексов предложены соединения типа М(А1Х4)п, где М = Си, Ag, 5п, РЬ и другие металлы X = С1, Вг п — валентность металла [143]. [c.72]
Для выделения моноциклических аренов в виде твердых комплексов предложены соединения типа М(А1Х4)п, где М = Си, Ag, 5п, РЬ и другие металлы X = С1, Вг п — валентность металла [143]. [c.72]
СОЛИ равна ее мольной массе, деленной на произведение валентности металла иа число его атомов в молекуле. [c.45]
Германиды во многом напоминают силиды металлов, проявляя свойства интерметаллических соединений. Только немногие германиды особенно активных металлов разлагаются водой или разбавленными кислотами. Большинство лгерманидов, характеризующихся составом, ие соответствующим обычным валентностям металлов, отлича.ются твердостью, тугоплавкостью и химической инертностью, Германиды переходных металлов имеют металлический блеск и довольно высокую электрическую проводимость. [c.364]
Все эти результаты доказывают, что образование гидрокарбонилов не является обязательным при изомеризации, как это предполагали некоторые исследователи [45].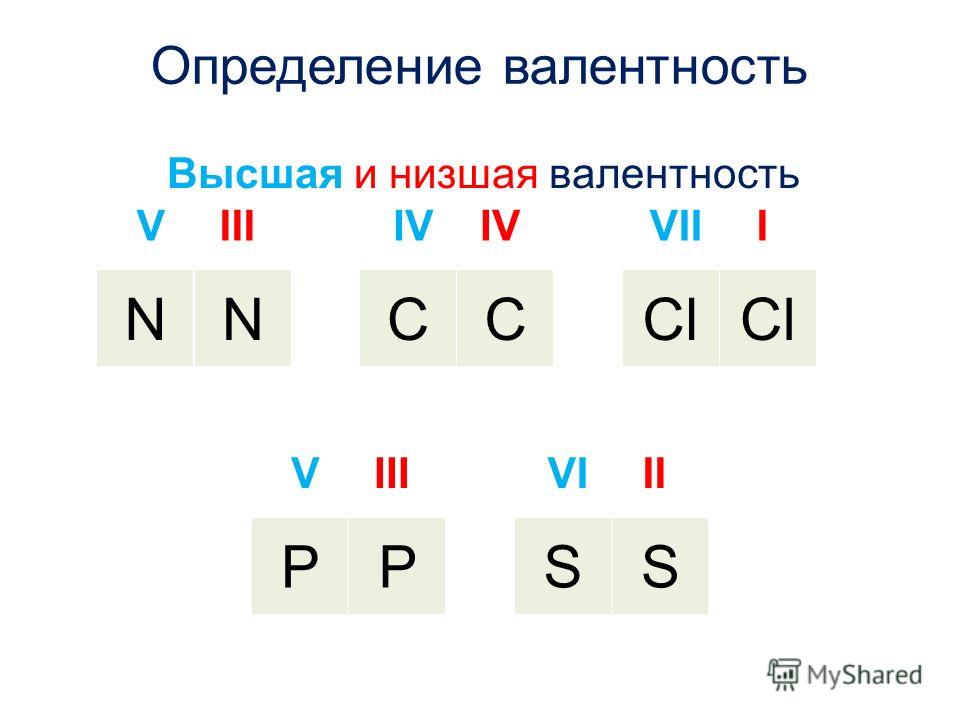 Поскольку карбонилы металлов можно рассматривать как я-аллильные комплексы нуль-валентного металла и для их активирования требуется подвод тепловой энергии или энергии квантов, то очевидно, что при этом происходит диссоциация одной из связей Ме—С. [c.110]
Поскольку карбонилы металлов можно рассматривать как я-аллильные комплексы нуль-валентного металла и для их активирования требуется подвод тепловой энергии или энергии квантов, то очевидно, что при этом происходит диссоциация одной из связей Ме—С. [c.110]
М — масса грамм-молекулы окисла т — число атомов металла в молекуле окисла п — валентность металла 5 — площадь [c.61]
Механизм действия ацетатов при окислении ацетальдегида в уксусную кислоту заключается, вероятно, в чередующейся переме не валентности металлов, что обеспечивает перенос кислорода [c.206]
Для определеэквивалента основания молекулярный вес его (М) следует разделить на валентность металла (или число гидроксильных групп). Эквивалент, например, едкого кали равен 56, так как молекулярный вес его 56, а валентность калия 1 эквивалент гидроокиси алюминия А1(0Н)з составляет 1/3 от ее молекулярного веса и т. д. [c.62]
Применение указанных методов оценки скорости коррозии иногда затруднительно.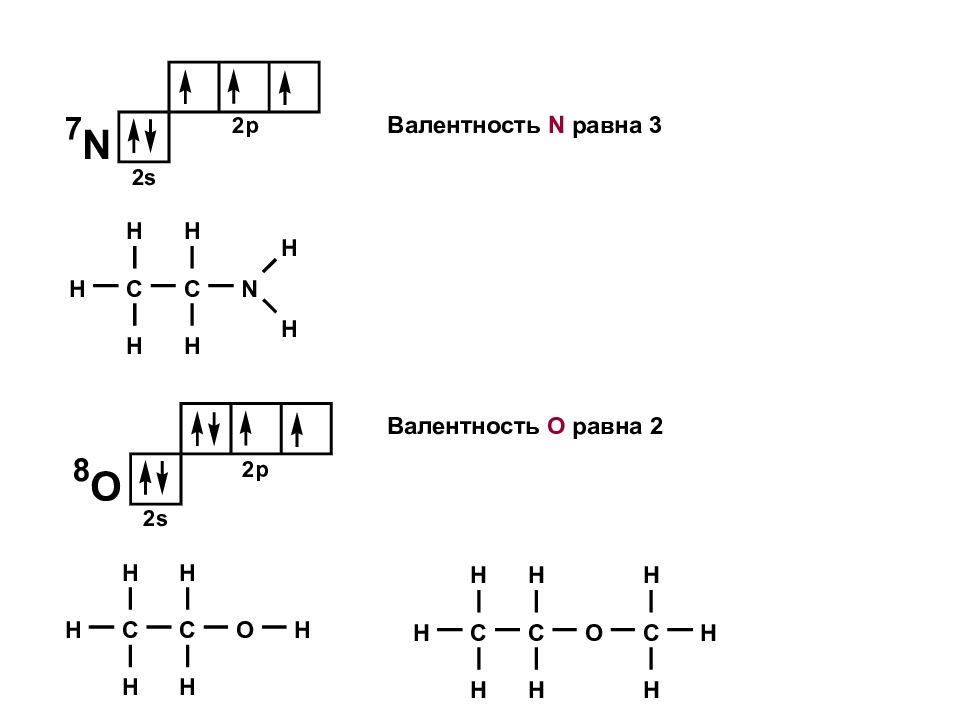 Например, для массового показателя необходимо знать валентность металла г. Но в продуктах коррозии (при протекании ее в воде или атмосфере) одновременно содержатся ионы двух- и трехвалентного железа, как правило, в разных соотношениях. Подоб- [c.13]
Например, для массового показателя необходимо знать валентность металла г. Но в продуктах коррозии (при протекании ее в воде или атмосфере) одновременно содержатся ионы двух- и трехвалентного железа, как правило, в разных соотношениях. Подоб- [c.13]
В силу этих причин положительная валентность металлов главных пбдгрупп, как правило, равна номеру группы, а металлы побочных подгрупп периодической системы обычно обладают переменной положительной валентностью, причем высшее ее значение совпадает с номером группы. Отрицательная валентность для металлов вообще не характерна. [c.111]
Тогда в состав 1 моля соли входит 3 г-иона (0,012 0,04) 504 . Формула соли N63(504)0, так как металлы в 6-валентном состоянии солей типа Ме(504)я не образуют. Валентность металла 3. [c.137]
Обозначим грамм-атомную массу первого металла через А, а его содержание в смеси через х г. Тогда грамм-атомная масса второго металла ЗА и его содержание (5,4—2. Учитывая валентность металлов, можно записать [c.181]
Основания классифицируют по их растворимости в воде и по их силе. По растворимости основания делятся на растворимые, или щелочи, и на нерастворимые. Важнейшие щелочи — это гидроксид натрия NaOH, гидроксид калия КОН м гидроксид кальция Са(0Н)2. По силе основания делятся на сильные и слабые ( 84). К сильным основаниям относятся все и1,елочи, кроме гидроксида аммония. Согласно международной поменклатуре, соединения, содержащие в своем составе гидроксогруппы, па.зывают г ид роке идам и. В случае металлов переменной валентности в скобках указывают валентность металла в данном основании. Так, Са(ОН)2—гидроксид кальция, Ре(ОН)2—гидроксид железа(П), Ре(ОН)з— гидроксид железа(III), [c.41]
Хлорид металла содержит 67,2% хлора. Атомный вес металла 52. Определите валентность металла в этом соединении. [c.138]
Пример. К какому классу соединений относятся СаО и РЬО.2 Одинакова ли валентность металлов в этих соединениях [c.140]
Услопные обозначения М — металл Э — элемент п — валентность металла. [c.910]
О с и о в а II и я состоят из металла п одновалентных гидроксо-групп ОН, число которых равно валентности металла. Примерами оснований могут служить гидроксид натрия NaOH и гидроксид [c.41]
Второй метод получения полипропилена с высоким молекулярным весом предложен Дж. Натта. Он установил, что в присутствии смеси металлалкилов (металлы 11 и III г )упп) и галогенидов металлов переменной валентности (металлы IV, V и VI групп) происходит полимеризация пропилена с образованием высокомолекулярного полимера. Компоненты катализатора образуют нерастворимый комплекс, на поверхности которого протекает анионная полимеризация пропилена. Получ емый полимер имеет стереорегулярную структуру. В качестве каталитического комплекса применяют смеси 1лкилалюминия (например, триэтил-или трипропилалюминия) и треххлористого титаня. Триэтилалю-мипий применяют в виде раствора в гептане (молярность раствора [c.200]
В зависимости от pH сред1з1 гидратированные ионы поливалентных металлов образуют комплексы за счет донорных гетеро-атомных групп — азота, серы, кислорода. Например, образование комплексов с поливалентными катионами титана, циркония, молибдена идет при рН3-4 то есть процесс комплексообразования нужно учитывать уже при рН>3. При рН>5 заметны процессы образования гидрокомплексов металлов, которые сопровождаются гидролизом солей. [c.47]
Эквивалент соли находят делением молекулярного веса соли на общее чр сло единиц валентности металла (или на общее число единиц валентности кислотного остатка) в молекуле соли. Например, эквивалент сернокислого алю,. и-ния 57, так как молекулярный вес Л]2(304)з 344, валентность алюминия 3, а общее число единиц вйлентност. г алюминия 6 (342 6 = 57), [c.62]
Кроме кислых и средних солей, существуют основные соли. Они образуются, когда кислота взаимодействует с избытком основания. При этом не все гидроксогруипы основания замещаются кислотными остатками. Валентность такой группы (металл с гидроксо-груп-пой) определяют, вычитая из валентности металла в соответствующем гидроксиде число незамещенных гидроксогрупп. Таким образом, основные соли, кроме атомов металла и кислотных остатков, содержат гидроксо1-руппы ОН. Название основных солей, как правило, образуется из названия средней соли добавлением слова основной . [c.14]
Влияние соединений металлов переменной валентности на делигнификацию древесины в щелочной среде Текст научной статьи по специальности «Химические науки»
УДК 676.014
ВЛИЯНИЕ СОЕДИНЕНИЙ МЕТАЛЛОВ ПЕРЕМЕННОЙ ВАЛЕНТНОСТИ НА ДЕЛИГНИФИКАЦИЮ ДРЕВЕСИНЫ В ЩЕЛОЧНОЙ СРЕДЕ
© И.П. Дейнеко , Ле Куанг Зиен
Санкт-Петербургская государственная лесотехническая академия, Институтский пер., 5, Санкт-Петербург, 194021 (Россия)
E-mail: [email protected]
Изучено влияние расхода сульфатов металлов переменной валентности (Fe2+, Fe3+, Cu2+, Mn2+, Ni2+, Co2+, Ce4+) на натронную варку древесины. Установлено, что ускорение делигнификации ионами металлов переменной валентности в щелочной среде осуществляется посредством образования и реакций растворимых каталитически активных комплексов с продуктами деструкции компонентов древесины.
Введение
Соединения металлов переменной валентности широко используются в качестве катализаторов в различных химических процессах [1], что связано с их способностью к обратимому переносу электронов. Поскольку при щелочной варке целлюлозы важную роль играют окислительно-восстановительные реакции [2, 3] можно предположить, что соединения переходных металлов будут оказывать определенное влияние на процесс делигнификации древесины. Действительно, имеются данные, что добавление к варочному раствору небольших количеств (0,05% от массы древесины) солей марганца, меди и никеля в виде ацетатов приводит к ускорению делигнификации и к стабилизации полисахаридов как при натронной, так и при сульфатной варках [4]. Увеличение расхода соли меди до 0,5%, а для соли никеля до 5,0% оказывает противоположный эффект — в этом случае происходит сильное замедление варочного процесса [5]. Использование же в качестве добавки ацетата железа замедляет делигнификацию даже при небольших расходах соли [5]. Эти данные представляют несомненный интерес, однако для выяснения характера и степени влияния ионов различных металлов на делигнификацию, а также установления типа протекающих с компонентами древесины реакций необходимы более углубленные исследования.
В данной работе изучено влияние расхода сульфатов металлов переменной валентности (Fe2+, Fe3+, Cu2+, Mn2+, Ni2+, Co2+, Ce4+) на натронную варку древесины и предпринята попытка выяснить причины каталитического действия соединений названных катионов при делигнификации древесины в щелочной среде.
Экспериментальная часть
Все эксперименты были проведены с использованием еловой древесины возраста около 100 лет, заготовленной в Сестрорецком лесопарке Ленинградской области весной 2003 г. Приготовление щепы осуществлялось ручным способом.
Содержание неорганических макро- и микроэлементов в образцах древесины определено методом атомно-эмиссионной спектрометрии с индукционной аргоновой плазмой на атомно-эмиссионном спектрометре ICAP 61E TRACE фирмы Thermo Jarrell Ash, USA. Анализ выполнен в Центре исследования качества воды ГУП «Водоканал» (Санкт-Петербург). Подготовка пробы для анализа осуществлялась следующим образом. Навеску опилок массой 1,0 г помещали в термостойкую колбу объемом 100 мл, заливали
* Автор, с которым следует вести переписку.
опилки 20 мл концентрированной азотной кислоты, закрывали колбу часовым стеклом и оставляли на ночь. Затем колбу помещали на электрическую плиту и выдерживали в течение i ч при медленном нагреве, упаривая пробу до половины объема, после чего осторожно приливали к ней 2 мл 33%-ного пероксида водорода. Далее пробу упаривали до состояния «влажных солей», охлаждали и добавляли к массе 2 мл концентрированной азотной кислоты, 20 мл дистиллированной воды и «выщелачивали» соли на электрической плитке. Охлажденный раствор переносили в мерную колбу объемом i00 мл и доводили до метки дистиллированной водой. Параллельно делали «холостой опыт» для проверки чистоты реактивов. В качестве градуировочных растворов использовали Государственные стандартные образцы водных растворов элементов.
Для варок использовалась щепа размерами: длина 25-35 мм, ширина 3-5 мм, толщина 2-5 мм. Щепу подсушивали до воздушно сухого состояния и хранили в закрытом полиэтиленовом мешке. Для анализа химического состава использовали опилки (0,25-0,50 мм), в которых было определено [7] содержание эфирорастворимых веществ (i,3%) и лигнина (27,7%).
Варку проводили в автоклавах из кислотоупорной стали емкостью 350 мл, обогреваемых в глицериновой бане. В автоклавы загружали щепу в количестве 20-30 г, жидкостный модуль составлял 7; расход гидроксида натрия в расчете на абсолютно сухую древесину (а.с.д.) был взят 30%. Одновременно проводили серию варок в четырех автоклавах, один из которых представлял собой контрольный опыт (натронная варка без добавок). После загрузки щепы, за 60 мин до начала опыта (варки), в автоклавы заливали воду (при использовании добавок их растворяли в дистиллированной воде), затем через 30 мин вводили гидроксид натрия в виде 25%-ного раствора. Автоклавы с содержимым погружали в баню по достижении там необходимой температуры. Подъем температуры от i40 до 170оС составлял 90 мин, варка в изотермическом режиме — 90 мин.
Промывку и сортирование целлюлозы осуществляли на лабораторных ситах с диаметром отверстий 0,5 и 0,i мм.O; Ce(SO4)2.
Обсуждение результатов
Древесина в небольших количествах содержит ионы металлов переменной валентности, которые могут оказывать определенное влияние на варку. Имеются сведения, что после удаления в мягких условиях основной части ионов металлов обработкой кислотой или хелатирующим реагентом (DTPA — диэтилентриа-минпентауксусная кислота) скорость делигнификации древесины при сульфатной варке повышается [В]. Эти данные указывают на суммарное ингибирующее действие соединений металлов, присутствующих в древесине.
Анализ элементного состава исследуемого образца (табл. i) свидетельствует о присутствии в еловой древесине большой группы переходных металлов; в наибольшей концентрации в ксилеме содержатся марганец и железо.
Таблица i. Элементный состав еловой древесины
Элемент мг/100 г а.с.д ммоль/Ю0г а.с.д.
Ag 0,046 0,0004
Cd 0,009 0,000В
Cr 0,062 0,00i2
Co 0,009 0,0001
Cu 0,i7 0,0026
Fe i,95 0,0349
Mn 3,9 0,0709
Ni 0,045 0,004
Ce 0,0007 0,00003
Изучение влияния солей железа на натронную варку показало, что при низких расходах ионов (0,5-i,0 ммоль на i00 г а.с.д.) и окисленная, и восстановленная формы железа оказывали заметное ускоряющее действие на варку (табл. 2), т. е. наблюдался катализ делигнификации. Однако при концентрации катионов более 2,0 ммоль на i00 г а.с.д. положительный каталитический эффект переходил в отрицательный.
Как и соли железа, сульфаты никеля, кобальта и церия оказывали на варку ускоряющее действие (табл. 3). Однако влияние отдельных ионов металлов на скорость процесса имело некоторые особенности. Так, в противоположность ионам железа и никеля ингибирующее действие ионов кобальта и церия при повышении их концентрации в растворе до 6,0 и 9,0 ммоль/л соответственно практически не проявилось, хотя степень делигнификации с увеличением расхода соли немного снизилась. Очень сильное ингибирование процесса наблюдалось при повышенной концентрации ионов никеля.
В противоположность рассмотренным результатам внесение в варочный раствор сульфатов меди и марганца практически не оказало влияния на скорость делигнификации (табл. 4). Однако в присутствии соли марганца наблюдалось небольшое увеличение выхода древесного остатка.
Полученные результаты показывают, что изученные сульфаты металлов, кроме сульфатов меди и марганца, оказывают каталитическое действие на делигнификацию древесины при натронной варке; однако с увеличением расхода солей их каталитическое действие переходит в ингибирование. При этом ионы переходных металлов, за исключением ионов марганца, проявляют каталитическое действие лишь в реакциях с лигнином, не оказывая какого-либо существенного влияния на полисахаридный комплекс, что следует из данных по выходу древесного остатка (см. табл. 2-4).
Поскольку в щелочной среде соли переходных металлов гидролизуются до малорастворимых гидроксидов [9] их влияние на варочный процесс, очевидно, связано с образованием координационных соединений, в которых лигандами являются компоненты древесины или продукты их деструкции. Образовавшиеся комплексы, по-видимому, обладают достаточно высокой растворимостью в щелочном растворе и поэтому могут вступать во взаимодействие с реакционными центрами лигнина.
Таблица 2. Влияние сульфатов железа на щелочную варку еловой щепы
Соль — FeSO4 Fe2(SO4)3
Расход соли, % от массы а.с.д. — 0,i4 0,28 0,56 0,2 0,4 0,8
Концентрация Fen+ в растворе, ммоль/л — 0,75 i,5 3,0 i,5 3,0 6,0
Молярный расход Fen+, ммоль на i00 г а.с.д. — 0,5 i,0 2,0 i,0 2,0 4,0
Общий выход, % от а.с.д., в том числе 49,0±0,6 48,i 49,8 52,7 48,i 49,2 53,3
целлюлозы, % от а.с.д. 44,9±i,5 47,8 47,5 44,8 47,5 46,0 38,8
непровара, % от а.с.д. 3,B±i,5 0,3 2,3 7,9 0,6 3,2 i4,5
Содержание лигнина в целлюлозе, % ii,0±0,6 9,i i0,0 i2,6 9,6 i0,8 ii,8
Таблица 3. Влияние сульфатов никеля, церия и кобальта на щелочную варку еловой щепы
Соль — NiSO4 Ce2(SO4)2 CoSO4
Расход соли, % от массы а.с.д. — 0,28 1,12 0,33 1,98 0,28 0,56 1,12
Концентрация Mn+ в растворе, ммоль/л — 1,5 6,0 1,5 9,0 1,5 3,0 6,0
Молярный расход Mn+, ммоль на 100г а.с.д. — 1,0 4,0 1,0 6,0 1,0 2,0 4,0
Общий выход, % от а.с.д., в том числе 49,0±0,6 48,9 52,9 48,6 51,0 47,4 48,3 49,6
целлюлозы, % от а.с.д. 44,9±1,5 44,3 36,3 47,3 43,3 46,6 43,9 47,6
непровара, % от а.с.д. 3,8±1,5 4,6 16,6 1,3 7,7 0,8 4,4 1,8
Содержание лигнина в целлюлозе, % 11,0±0,6 10,2 13,1 10,0 10,9 9,1 10,3 11,1
Таблица 4. Влияние сульфатов меди и марганца на щелочную варку еловой щепы
Соль — CuSO4 MnSO4
Расход соли, % от массы а.с.д. — 0,25 0,50 1,00 0,27 1,08
Концентрация соли в варочном растворе, ммоль/л — 1,5 3,0 6,0 1,5 6,0
Молярный расход соли, ммоль на 100 г а.с.д. — 1,0 2,0 4,0 0,97 3,88
Выход древесного остатка, % от а.с.д. 49,0±0,6 49,6 49,6 50,0 51,3 50,3
Выход целлюлозы, % от а.с.д. 44,9±1,5 46,7 45,3 45,7 44,9 46,1
Выход непровара, % от а.с.д. 3,8±1,5 2,9 4,3 4,3 6,4 4,2
Содержание лигнина в целлюлозе, % 11,0±0,6 11,5 11,2 11,8 11,3 10,7
Каталитическое действие ионов металлов в малых концентрациях, а также тот факт, что ускорение процесса наблюдается в присутствии как окисленной (Fe2+, Co2+, Ni2+), так и восстановленной (Fe3+, Ce4+) форм металлов, свидетельствует о том, что катализ делигнификации осуществляется в результате протекания окислительно-восстановительных реакций. L- + Men+.
Образовавшиеся радикальные частицы могут далее претерпевать различные превращения, которые способны оказывать то или иное влияние на процесс делигнификации. По одному из них радикал подвергается распаду, что обеспечивает деструкцию макромолекулы лигнина. Другое же направление представляет собой рекомбинацию первичных и/или вторичных радикалов с образованием конденсированных структур. Очевидно, что при низком расходе соли концентрация радикальных центров будет невысока и их превращения в большей мере будут осуществляться по первому направлению. С увеличением расхода соединений металлов переменной валентности концентрация радикалов будет возрастать, что увеличит вероятность их встречи и рекомбинации.
Данное объяснение дает определенный ответ на выявленный сложный характер действия ионов металлов на делигнификацию.
Обращает на себя внимание тот факт, что добавление в варочный раствор сульфатов и ацетатов металлов приводит к различающимся результатам. Так, в частности, как показано в работе [4], использование ацетатов меди и особенно марганца оказывало отчетливо выраженное каталитическое действие на делиг-нификацию. Введение же в варочный раствор ионов названных металлов в виде сульфатов, как следует из наших результатов, не повлияло на скорость варки. С другой стороны, добавление к раствору ацетата железа замедляет варку [5], а сульфаты как окисленной, так и восстановленной форм железа катализируют щелочной сольволиз лигнина (см. табл. 2).
Объяснить это можно тем, что в комплексообразовании участвуют как компоненты древесины, так и кислотные остатки, присутствующие в добавляемых солях. Очевидно, что в варочном растворе в присутствии древесины ионы металлов образуют разнолигандные комплексы, суммарное влияние которых и определяет окислительно-восстановительные свойства комплекса [10, 11].
Факт образования комплексов металлов с компонентами древесины хорошо известен. Однако для проявления каталитического действия образующиеся комплексы должны быть хорошо растворимы в щелочной среде и иметь относительно небольшие размеры, позволяющие им подходить к реакционным центрам лигнина. Можно предположить, что в качестве лигандов для таких комплексов будут пригодны низкомолекулярные соединения, как присутствующие в древесине, так и образующиеся при деструкции высокомолекулярных компонентов. Наиболее вероятно образование комплексов металлов со следующими соединениями:
— пирокатехин [10] и его производные, образующиеся при деметоксилировании лигнина [12];
— уроновые кислоты [13], образующиеся при щелочном гидролизе гемицеллюлоз и пектиновых веществ [14];
— аминокислоты [11], образующиеся при щелочном гидролизе полипептидов [15].
Изучение растворимости сульфатов металлов в присутствии некоторых органических соединений, способных к комплексообразованию, показало, что при определенном расходе органического лиганда происходит растворение солей в щелочной среде (табл. 5).
Таблица 5. Минимальное количество органических соединений (ммоль на 1,0 ммоль Меп+),
обеспечивающее растворимость сернокислых солей металлов в щелочной среде (1М №ОН)
Соединение FeSO4 Fe2(SO4)3 CuSO4 NiSO4 MnSO4 CoSO4 Ce(SO4)2
Пирокатехин 1,0 0,5 0,5 1,0 2,0 2,0 1,0
Галактуроновая кислота 4,0 1,0 0,03 4,0 4,0 0,5 2,0
Аргинин 8,0 3,5 0,12 — — — —
Аспарагин 8,0 4,0 1,0 — — — —
Лизин 8,0 4,0 0,5 — — — —
(-) — образование осадков происходило даже при большом расходе модельных соединений
Различия в расходе лигандов, обеспечивающих растворение солей металлов, свидетельствуют о существенных отличиях в строении образующихся растворимых комплексов. В случае ионов меди для предотвращения образования осадка, требуется менее 1 моля лиганда на 1 моль соли. Низкий расход лиганда в данном случае можно объяснить образованием многоядерных, а также разнолигандных комплексов с участием сульфат-, гидроксид-анионов и органических лигандов. Катионы других металлов, в зависимости от строения лиганда, образуют как однородно-, так и разнолигандные комплексы. Соли железа приобретают растворимость в присутствии аминокислот лишь при большом расходе лигандов, превышающем координационное число этих катионов [16], особенно если учесть, что названные лиганды могут занимать более одного координационного места. Данный факт свидетельствует о том, что для обеспечения растворимости в щелочной среде необходимо участие аминокислот в формировании не только внутренней, но и внешней координационной сферы [17].
Переход ионов металлов из свободного состояния в координационное приводит к изменению их реакционной способности, что связано с перераспределением электронной плотности. Поэтому изучение влияния природы лигандов на каталитическую активность комплекса при щелочной делигнификации представляет значительный интерес.
Для выяснения каталитического эффекта комплексов нами были проведены варки еловой щепы в присутствии сульфатных солей меди и железа с добавлением в раствор вышерассмотренных органических соединений.
Использование пирокатехина в качестве лиганда не оказало какого-либо влияния на варку.
В отличие от пирокатехина, при совместном введении галактуроновой кислоты и сульфата меди наблюдалось ускорение делигнификации, сопровождающееся снижением выхода древесного остатка (табл. 6).
В противоположность медному комплексу ионы железа (III) в присутствии галактуроновой кислоты оказали ингибирующее действие на варку по сравнению с варкой, проведенной с сульфатом железа в отсутствие галактуроновой кислоты. Однако по сравнению с натронной варкой степень делигнификации снизилась незначительно. В то же самое время выход древесного остатка в присутствии комплекса заметно выше, что свидетельствует о стабилизации полисахаридной части древесины.
Результаты щелочных варок с аминокислотами показали, что каталитическая активность образующихся комплексов существенно зависит от строения лиганда и природы используемого катиона (табл. 7).
При варке с ионами меди ускорение делигнификации происходило в присутствии аспарагина и лизина. В случае ионов железа (II), наряду с аспарагином и лизином, увеличение степени делигнификации по сравнению с натронной варкой происходило и при добавлении также серина и метионина. Однако эффект от суммарного введения ионов железа (II) и аминокислот был на том же уровне, что и эффект, получаемый от введения только сульфата железа. В данном случае трудно сделать вывод об образовании каталитически активных комплексов, так как ускорение процесса могло происходить в результате действия более устойчивого комплекса железа с другими соединениями, образующимися из компонентов древесины и переходящими в варочный раствор.
Таблица 6. Влияние галактуроновой кислоты на щелочную варку еловой щепы в присутствии сернокислых солей меди и железа
Соль — — CuSO4 Fe2(SO4)3
Расход соли, % от массы а.с.д. (ммоль/л) — — 0,25 (1,5) 0,25 (1,5) 0,40 (1,5) 0,40 (1,5)
Расход галактуроновой кислоты, % от — 0,38 (3,0) — 0,38 (3,0) — 0,38 (3,0)
массы а.с.д. (ммоль/л) Общий выход, % от а.с.д., в том числе: 49,0±0,6 48,9 49,6 47,9 48,1 51,6
целлюлозы, % от а.с.д. 44,9±1,5 45,7 46,7 45,4 47,5 41,1
непровара, % от а.с.д. 3,8±1,5 3,2 2,9 2,5 0,6 10,5
Содержание лигнина в целлюлозе, % 11,0±0,6 10,4 11,5 9,7 9,6 11,9
Таблица 7. Влияние аминокислот на щелочную варку еловой щепы в присутствии сульфатов меди и железа.
Соль, % от массы а.с.д. (ммоль/л) Расход аминокислоты, ммоль/л Общий выход, % от а.с.д. Выход целлюлозы, % от а.с.д. Выход непрова-ра, % от а.с.д. Содержание лигнина в целлюлозе, %
— — 49,0±0,6 44,9±1,5 3,8±1,5 11,0±0,6
CuSO4 — 49,1 46,8 2,3 10,7
0,25 (1,0) Аспарагин 3,0 49,0 45,9 3,1 9,7
L-Лизин 3,0 48,6 47,4 1,2 9,2
Аргинин 3,0 50,5 46,2 4,3 10,6
FeSO4 — 49,8 47,5 2,3 10,0
0,27 (1,0) Аспарагин 3,0 47,5 46,5 1,0 9,9
L-Лизин 3,0 49,9 44,1 5,9 10,4
L-Треонин 3,0 51,2 43,8 7,4 11,2
L-Метионин 3,0 47,5 46,2 1,3 10,5
DL-Серин 3,0 47,7 45,9 1,8 10,3
Таким образом, рассмотренные данные, в частности, положительное влияние на варку ионов меди в присутствии галактуроновой кислоты и аминокислот, а также ингибирование процесса при совместном введении ионов железа (III) с галактуроновой кислотой, устраняющее положительное влияние, оказываемое на систему введением только сульфата железа, свидетельствует о принципиальной возможности конструирования каталитических систем на основе комплексов металлов переменной валентности.
Список литературы
1. Химическая энциклопедия: в 5 т. Т. 2. / Редкол.: И. Л. Кнунянц (гл. ред.) и др. М., 1990. 671 с.
2. Азаров В.И., Буров А.В., Оболенская А.В. Химия древесины и синтетических полимеров. СПб., 1999. 628 с.
3. Никитин В.М. Теоретические основы делигнификации. М., 1981. 296 с.
4. Карпунин И.И., Музыченко М.П. О влиянии добавки катализаторов и органических веществ при щелочной варке древесины // Химическая переработка древесного и недревесного сырья: межвузовский сборник научных трудов. Л., 1989. С. 87-91.
5. Капуцкий Ф.Н., Карпунин И.И. Исследование влияния некоторых солей металлов переменной валентности при щелочной делигнификации древесины // Журнал прикладной химии. 1980, Т. LIII. №5. С. 1135-1139.
6. Химия древесины / Под ред. Б.Л. Браунинга. М., 1967. 415 с.
7. Оболенская А.В., Ельницкая З.П., Леонович А.А. Лабораторные работы по химии древесины и целлюлозы. М., 1991. 320 с.
8. Kangas H., Robertsen L., Vuorinen T. The effect of transition metal ions on the kraft pulping process // Paperi ja puu. 2002. V. 84. №7. P. 473-477.
9. Суворов А.В., Никольский А.Б. Общая химия. СПб., 1997. 624 с.
10. Лукачина В.В. Лиганд-лигандное взаимодействие и устойчивость разнолигандных комплексов. Киев, 1988. 184 с.
11. Манорик П.А. Разнолигандные биокоординационные соединения металлов в химии, биологии, медицине. Киев, 1991. 272 с.
12. Браунс Ф.Э., Браунс Д.А. Химия лигнина, М., 1964. 864 с.
13. Gyurcsik B., Nagy L. Carbohydrates as ligands: coordination equilibria and structure of the metal complexes // Coordination Chemistry Reviews. 2000. V. 203. P. 81-149.
14. Гемицеллюлозы / М.С.Дудкин, В.С.Громов, Н.А.Ведерников, Р.Г.Каткевич, Н.К.Черно. Рига, 1991. 488 с.
15. Фенгел Д., Вегенер Г. Древесина (химия, ультраструктура, реакции). М., 1988. 512 с.
16. Кукушкин Ю.Н. Химия координационных соединений. М., 1985. 455 с.
17. Миронов В.Е., Исаев П.Д. Введение в химию внешнесферных комплексных соединений металлов в растворах. Красноярск, 1986. 312 с.
Поступило в редакцию б мая 200б г.
Электроотрицательность. Степень окисления и валентность химических элементов / Справочник :: Бингоскул
Электроотрицательность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
- В периодической системе химических элементов (ПСХЭ) ЭО в периоде увеличивается слева направо и уменьшается в главной подгруппе.
- ЭО связана с окислительно-восстановительными свойствами элементов, поэтому типичные неметаллы характеризуются высокой ЭО, а металлы – низкой. Самая высокая ЭО у фтора, потому что он самый сильный окислитель.
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
Степень окисления (СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
При определении СО следует руководствоваться следующими правилами:
- Сумма СО в химическом соединении всегда равна нулю, так как молекулы электронейтральны; в сложном ионе соответствует заряду иона.
- СО всех простых веществ соответствует нулю;
- Высшая положительная СО определяется по номеру группы; низшая отрицательная равна восемь минус номер группы;
- Элементы с наибольшей ЭО имеют отрицательную СО, с наименьшей – положительную;
- Постоянную СО имеют фтор (-1), щелочные металлы (+1), щелочноземельные, а также бериллий, магний, цинк (+2), алюминий (+3). У кислорода СО равна -2, исключение пероксиды (+2). У водорода +1, исключение соединения с металлами (гидриды) -1.
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
- Найдем и проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х». — H+13 PX O-24
- Используя эти значения составим и решим уравнение с одной неизвестной. (+1) * 3 + (x) * 1 + (-2) * 4 = 0 Следовательно, x=5 или +5. Таким образом, СО у фосфора +5.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
- Проставим известные СО элементов – алюминий и кислород, у азота примем СО за «x». Al+3 (NxO-23)3
- Составим и решим уравнение — (+3) * 1 + 3x + 9 * (-2) = 0. В итоге получаем x=+5, то есть СО у азота в соединении +5.
Валентность. Валентные возможности атомов
Валентность — это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Валентность обозначается римскими цифрами и указывается над химическим элементом справа вверху и не имеет знака (+ или -). Может быть постоянной или переменной.
Для определения валентности применяются определенные правила:
- У металлов главных подгрупп валентность всегда постоянная и определяется по номеру группы.
- У металлов побочных подгрупп и неметаллов валентность переменная. Высшая валентность = номеру группы, а низшая = 8 — номер группы.
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
- Количеством неспаренных электронов;
- Наличием свободных орбиталей;
- Наличием неподеленных пар электронов.
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Атом С способен присоединять и отдавать электроны с образованием ковалентных связей. Валентные возможности углерода очень широкие, он может принимать значение степени окисления от +4 до -4.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
Таким образом, сера способна проявлять валентности II, IV, VI.
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.
Смотри также:
§ 16. Валентность. Определение валентности по формулам соединений
1. Что такое валентность химических элементов? Поясните, почему валентность водорода принята за единицу?
Валентностью называют свойство атома химического элемента присоединять или замещать определенное число атомов другого химического элемента.
Валентность водорода принята за единицу потому, что атом водорода не может присоединять или замещать более одного атома другого химического элемента.
2. При взаимодействии магния с водой один атом магния замещает два атома водорода в молекуле воды. Какова валентность магния?
Тут все просто: водород всегда одновалентен. Атом магния замещает 2 атома водорода. Значит, валентность магния равна 2.
Mg + H2O = MgO + H2↑
3. Выпишите элементы, имеющие постоянную валентность, равную I: Na, Cu, S, K, H, Cl.
В предыдущих параграфах вы уже сталкивались с соединениями таких элементов, как Cu и S, и должны знать, что их валентность отлична от I. А вот на каком основании автор вписал сюда Cl, мне непонятно. Но валентность хлора может сильно отличаться (от I до VII).
Ответ: Na, K, H
4. Выпишите элементы, имеющие постоянную валентность, равную II: Ca, Na, O, S, Ba, Fe.
Про Na мы узнали из предыдущего задания. Про S и Fe вы уже должны знать, благодаря оксидам железа FeO и Fe2O3.
Ответ: Ca, O, Ba.
5. Определите валентность металлов в следующих оксидах: CuO, Cu2O, Na2O, Al2O3, FeO, Fe2O3.
Как было сказано в параграфе, «валентность элементов определяют также по кислороду, который обычно двухвалентен», а еще «число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента».
Надеюсь, это не вызвало сложности. Для примера рассмотрим Al2O3: здесь 3 атома кислорода с валентностью II. Значит общее число единиц валентности кислорода равно 6. Атомов алюминия у нас 2. Значит валентность алюминия = число единиц валентности кислорода (6) / число атомов алюминия (2) = 3.
Валентность металлов в оксидах: CuO — II, Cu2O — I, Na2O — I, Al2O3 — III, FeO — II, Fe2O3 — III.
Тестовые задания
1. Формула одного из оксидов фосфора P2O5. Валентность фосфора в этом соединении равна:
1) 2; 2) 3; 3) 4; 4) 5.
Смотрите решение предыдущего задания.
2*5 / 2 = 5
Ответ: 4)
2. Установите соответствие между химической формулой соединения и валентностью серы в этом соединении.
| 1) SO3 | А. II |
| 2) H2S | Б. IV |
| 3) SO2 | В. VI |
Ответы: 1) — В; 2) — А; 3) — Б.
Валентность — металл — Большая Энциклопедия Нефти и Газа, статья, страница 1
Валентность — металл
Cтраница 1
Валентность металлов имеет значение не только для стабильности их комплексов, но и для избирательного сродства к отдельным функциональным группам белков, в том числе энзимных.
[1]
Валентность металла и валентность кислотного остатка указаны над символами римскими цифрами.
[2]
Валентность металлов имеет значение не только для стабильности их комплексов, но и для избирательного сродства к отдельным функциональным группам белков, в том числе энзимных.
[3]
Валентность металла обозначают соответствующей цифрой в скобках справа от его названия.
[4]
Характерной валентностью металлов актинидной группы является трехвалентное состояние. Соединения трехвалентных актинидов, начиная с урана, обнаружены даже в водном растворе, а для элементов с порядковым номером больше 94 трехвалентное состояние является наиболее устойчивым или единственно возможным состоянием.
[5]
Зная валентность металлов, составьте формулы окислов калия, натрия, серебра, алюминия, хрома, железа, меди, магния, кальция и цинка.
[6]
Определить валентность металла и заменить водород кислоты металлом, после чего проверить, чтобы число положитель-ных зарядов металла и число отрицательных зарядов кислотных остатков было одинаково.
[7]
Почему валентности металлов по кислороду и по водороду выража-йтся одними и теми же числами.
[8]
Одинакова ли валентность металлов в этих соединениях.
[9]
С повышением валентности металла электропроводность хлоридов уменьшается; для повышения электропроводности таких расплавов к ним добавляют хлориды щелочных металлов. Данные по вязкости и плотности в системе NaF — A1F3 ( гл. XI) говорят, например, о наличии криолита, как химического соединения не только в твердом ( о чем говорит диаграмма плавкости), айв жидком состоянии.
[10]
С возрастанием валентности металлов с переменной валентностью свойства их гидратов окислов изменяются так же, как в периодах периодической системы: от основных через амфотер-ные к кислотным.
[11]
В зависимости от валентности металла, а также от аниона, от комбинации их в соединении, степень диссоциации может быть различной. Более полно диссоциируют соли одновалентных катионов и анионов, слабее — соли, образованные двухвалентными металлами с одновалентными анионами или одновалентными металлами с двухвалентными анионами. Меньше всего диссоциированы соли, в которых двухвалентны и катионы, и анионы Ч Соли слабых кислот и оснований частично распадаются на слабо ионизированные кислоты и основания. При этом гидраты выпадают, находясь в течение какого-то времени в коллоидном состоянии ( ср.
[12]
В зависимости от валентности металла и групп, занимающих пятое и шестое места в координационной сфере, металлопорфирины отличаются по свойствам и, в частности, по величине каталитической активности. В настоящее время не имеется общей номенклатуры не только для металлопорфиринов вообще, но даже для комплексных соединений железа. Обычно называют порфириновый комплекс железа, содержащий двухвалентное железо, гемом, или феррогемом. Это вещество способно присоединять различные азотсодержащие основания, например пиридин, первичные амины, а также имидазол. Все эти соединения объединяются под названием гемохромоге-ны. Образование соединений этого типа происходит при фиксации тема на белках. В частности, фиксация может осуществляться за счет имида-зольных остатков, которые имеются в молекулах белков. Если металлопорфириновое соединение железа содержит трехвалентное железо и свободная валентность использована для присоединения гидроксила, то получается вещество, называемое гематином; если же свободная валентность занята атомом хлора, то образуется гемин. Соответствующее соединение с азотистыми основаниями в этом случае называют парагематинами.
[13]
В зависимости от валентности металла, а также от аниона, от комбинации их в соединении, степень диссоциации может быть различной. Более полно диссоциируют соли одновалентных катионов и анионов, слабее — соли, образованные двухвалентными металлами с одновалентными анионами или одновалентными металлами с двухвалентными анионами. Меньше всего диссоциированы соли, в которых двухвалентны и катионы, и анионы Ч Соли слабых кислот и оснований частично распадаются на слабо ионизированные кислоты и основания. При этом гидраты выпадают, находясь в течение какого-то времени в коллоидном состоянии ( ср.
[14]
Во многих нитридах видимая валентность металла совместима с ее обычными значениями, в других же случаях сама простейшая формула указывает на сложность молекулярной структуры.
[15]
Страницы:
1
2
3
4
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Блок 1b — Аннотации — Правило октетов
В разделе 3.2 было введено понятие валентных электронов . Это электроны, находящиеся на самом высоком занятом энергетическом уровне или оболочке атома элемента. В наших обсуждениях мы сосредоточимся на элементах первых двух столбцов в левой части таблицы Менделеева и последних шести столбцов в правой части таблицы. Вместе эти элементы называются основной группой или репрезентативными элементами .На рис. 3.6 в работе Раймонда используются структуры электронных точек Льюиса, чтобы показать количество валентных электронов в некоторых типичных элементах. Обратите внимание, что количество валентных электронов, которые имеет каждый элемент, равно его номеру группы, , например. , элементы в группе IA имеют один валентный электрон (одна точка), элементы в группе IIA имеют два валентных электрона (2 точки), и т. Д.
Оказывается, в наличии восьми электронов на валентной оболочке есть что-то особенное. Это самая стабильная ситуация для атома. Элементы, которые имеют это число в чистых нейтральных формах, относятся к группе VIIIA.Эти элементы, как группа, называются инертными газами . Все инертные газы имеют 8 валентных электронов, за исключением гелия, который имеет 2. Это связано с тем, что первый энергетический уровень может содержать только 2 электрона, тогда как другие энергетические уровни могут содержать 8 или более электронов. (Каждый энергетический уровень может содержать до 2 n электронов, где n — уровень энергии; см. Раздел 3.2 и Таблицу 3.4 в Raymond). Даже если уровень энергии может содержать более 8 электронов, наиболее стабильное число — 8.Инертные газы называются инертными, потому что они очень инертны по отношению к себе и другим элементам. Это отражает их высокую стабильность. Все остальные элементы периодической таблицы хотели бы быть подобны инертному газу с точки зрения количества электронов, находящихся в их валентной оболочке. Химию можно рассматривать как следствие того, что все элементы периодической таблицы пытаются достичь того же количества валентных электронов, что и один из инертных газов. Они делают это, реагируя друг с другом , чтобы получить, потерять или поделиться электронами.так что каждый атом имеет 8 электронов в валентной оболочке . Это утверждение так называемого правила октетов .
Периодическая таблица Менделеева отражает эту ситуацию. Первоначально элементы располагались в периодической таблице слева направо в соответствии с их атомными номерами и в столбцы в соответствии с их химическими и физическими свойствами. Например, крайняя правая колонка содержит химически инертные газы. На рис. 3.8 в Raymond показаны типичные элементы:
Периодическая таблица также дает подсказки об электронной структуре элемента. Если сфокусироваться на представительных элементах, строки сообщают вам, какой уровень энергии содержит валентные электроны: строка 1 — это уровень n = 1, строка 2 — уровень n = 2, и т.Столбцы указывают для нейтральной формы элемента, сколько валентных электронов находится в валентной оболочке: первый столбец (группа IA) содержит 1 валентный электрон, второй столбец (группа IIA) содержит 2 валентных электрона, и т. Д. . , а последний столбец (группа VIIIA) содержит 8 валентных электронов.
Правило октетов может использоваться для предсказания заряда одноатомных ионов , которые образуются из репрезентативных элементов. Это показано на рисунке 3.8. Один из способов получить 8 электронов в валентной оболочке атома — это потерять или получить электроны.Элементы в левой части таблицы Менделеева имеют тенденцию терять электроны, это металлы , , в то время как элементы в правой части таблицы Менделеева имеют тенденцию получать электроны, это неметаллы . Когда металлы и неметаллы объединяются, металлы отдают свои валентные электроны неметаллам, так что каждый в конечном итоге имеет 8 электронов на внешнем уровне энергии. При этом металлы образуют положительные ионы (катионы), а неметаллы образуют отрицательные ионы (анионы).На рис. 3.8 показаны точечные структуры электронов Льюиса для обычных ионов, образованных типичными элементами. Неметаллы, расположенные в правой части периодической таблицы, имеют каждый , получивший электронов, равное их заряду, и, как показано точечными структурами Льюиса, каждый имеет 8 электронов в своей валентной оболочке. Металлы, расположенные в левой части периодической таблицы, имеют каждый потерянных электронов, равное их заряду (теперь положительному), и, как показано точечными структурами Льюиса, у каждого из них осталось 0 электронов в своей валентности. оболочка! Следствием этого является то, что на следующем более низком энергетическом уровне, который сейчас является самым высоким занятым энергетическим уровнем, будет 8 электронов (см. Таблицу 3.4 в Раймонде).
Атомы и ионы с одинаковым числом электронов называются изоэлектронными . Li + — это изоэлектронный с He (2 электрона), что показано красными прямоугольниками на рисунке 3.8; N 3-, O 2- , F —, Na + , Mg 2+ и Al 3+ — все изоэлектронные с Ne (10 электронов), и это показано розовые прямоугольники на рис. 3.8; и P 3-, S 2-, Cl —, K + и Ca 2+ являются изоэлектронными с Ar (18 электронов), и это показано синими прямоугольниками на рисунке 3.8. Применение правила октетов предсказывает, что именно ионы должны образоваться из репрезентативных элементов.
Углерод (C) и кремний (Si) относятся к Группе IVA. (См. Рис. 3.2 Раймонда, который также показан выше.) Элементы этой группы имеют 4 валентных электрона. Эти элементы могут получить или потерять 4 электрона, чтобы стать одноатомным ионом, изоэлектронным с инертным газом. Однако из-за высокого заряда, который может возникнуть, либо C 4+ , либо C 4- для углерода и Si 4+ или Si 4- для кремния, это маловероятно.Вот почему они не показаны в столбце Group IVA на Рисунке 3.8, показанном выше. Мы увидим, что углерод использует другую стратегию для соблюдения правила октетов.
Правило октетов не работает для предсказания зарядов на ионах переходных металлов . Переходные металлы расположены в периодической таблице в десяти столбцах между столбцами IIA и IIIA для репрезентативных элементов, а группы обозначены от IB до VIIIB. Это показано на Рисунке 2.6 Raymond:
.
Переходные металлы обычно производят ионы с зарядами 1+, 2+, 3+ и иногда 4+, и, в отличие от типичных элементов, многие переходные металлы могут иметь более одного зарядового состояния.Важным примером в биохимии является железо (Fe), которое обычно находится в состоянии Fe 2+ или Fe 3+ . Определенные белки, называемые белками переноса электронов, транспортируют электроны, имея цикл связанных ионов железа между состояниями Fe 2+ и Fe 3+ .
ПЕРЕМЕННАЯ СТОИМОСТЬ | Химик
Некоторые элементы существуют в более чем одной степени окисления и, таким образом, обладают переменной валентностью. Например, переходные металлы демонстрируют широкий диапазон валентных состояний, например.г., Fe2 +, Fe3 +; Cr2 +, Cr3 + Co2 +, CO3 + (чаще), Co4 + и Co5 + (реже) и т. Д. Аналогично, нормальные металлы, например, Pb2 + и Pb4 +; Sn2 + и Sn4 + также демонстрируют переменную валентность. Некоторые неметаллы также обнаруживают более одного валентного состояния, например, P3 + и P5 +.
Переменная валентность может быть вызвана разными причинами и будет обсуждаться здесь соответственно.
В переходных элементах (элементах, в которых d-орбитали находятся в процессе завершения) переменная валентность обусловлена частично заполненными «d» -орбиталями, состоянием гибридизации и типом реагентов (обычно называемых лигандами).Такие элементы могут включать различное количество электронов в образовании соединения и иметь переменную валентность. Стабильность конкретного валентного состояния также будет зависеть от природы реагирующих частиц и количества присутствующих d-электронов.
Железо (Fe) обычно имеет валентные состояния Fe2 + и Fe3 +. Атомный номер Fe равен 26, а его электронная конфигурация будет следующей: 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
Потеря двух электронов с 4s-орбиталей не оставит после себя конфигурации инертного газа.Следовательно, существует больше шансов, что электроны вырвутся наружу. Поскольку орбитали «cl» будут более стабильными, когда они заполнены наполовину (с конфигурацией d5), потеря одного электрона с 3d-орбитали вместе с двумя электронами с 4s-орбиталей дала бы более стабильное состояние иона. Следовательно, железо в состоянии Fe3 + будет более стабильным. Покажем валентную оболочку, имеющую 3d-орбитали, и расположим электроны в соответствии с теорией валентных связей (см. Главу 4). Чтобы получить следующую конфигурацию инертного газа, потребуется больше электронов, которые поставляются реагирующими частицами (основаниями Льюиса или лигандами), и, таким образом, ионы стабилизируются.В основном вода будет действовать как основание Льюиса, и по этой причине большинство солей переходных металлов существуют в стабильном состоянии в виде гидратированных частиц.
Элементы лантаноидов и актинидов демонстрируют переменную валентность из-за участия «f» -орбиталей.
Некоторые из элементов блока «1» демонстрируют переменную валентность из-за участия «инертной пары» электронов. «Инертная пара» электронов присутствует на «s» орбиталях и не участвует в химических реакциях в преобладающих условиях.В таких условиях только p-орбитали будут участвовать в образовании связи. Однако, если «инертная пара» электронов, присутствующих на «s» -орбиталях, приводится в действие для участия в образовании связи, будет наблюдаться увеличение валентного состояния на две единицы. Именно благодаря «инертной паре» электронов разница в валентных состояниях таких элементов всегда составляет две единицы.
Хотя эффект инертной пары весьма заметен для соединений двухвалентного олова, четырехвалентное олово более стабильно из двух.Следовательно, двухвалентное олово легко превращается в четырехвалентное состояние, и, таким образом, первый ион является восстановителем.
Sn (II) — 2e- Sn (IV)
Блочные элементы «13», которые имеют свободные орбитали «cl», доступные в их электронной конфигурации, также демонстрируют переменную валентность за счет использования этих орбиталей в дополнение к соответствующим орбиталям «s» и «ps». Таким образом, участие вакантных cr-орбиталей будет отвечать за изменение валентного состояния таких элементов. Рассмотрим первых двух членов V группы, а именно азот и фосфор.Нет никаких шансов для присутствия и участия «cr» орбиталей в азоте, на что указывает его электронная конфигурация (1s2 2s2 2p3), т.е. во второй оболочке нет «ar-орбиталей».
Атомы и химия
Валентные электроны
Атомы имеют тенденцию быть химически стабильными, когда каждая электронная оболочка пуста или полна. Частично заполненные оболочки нестабильны. Говоря антропоморфными терминами, атомы немного навязчивы и навязчивы в отношении своих электронных оболочек.Никому не нужна частично заполненная оболочка! Раздражают частично заполненные снаряды. Таким образом, атомы любят торговаться друг с другом, разрабатывать сделки по обмену электронами или обмену ими, чтобы все могли быть счастливы.
Щелкните здесь, чтобы открыть периодическую таблицу в новом окне.
Электроны, населяющие частично заполненную оболочку, называются валентными электронами . Валентные электроны участвуют в образовании химических связей между атомами, поэтому химикам полезно знать, сколько валентных электронов имеет каждый тип атома.Чтобы определить количество валентных электронов в атоме любого типа, найдите элемент в периодической таблице и посчитайте в строке слева, как показано в примерах ниже. (Это работает для всех элементов, кроме благородных газов, которые не имеют частично заполненных оболочек и, следовательно, валентных электронов.)
Сколько валентных электронов у атома кислорода? Кислород — шестой элемент во втором ряду. Поскольку это шестой элемент в своем ряду, он имеет шесть валентных электронов. (Обратите внимание, что ряд столбцов пропускается при подсчете во второй строке, потому что в этих столбцах нет элементов для этой строки.)
Сколько валентных электронов у натрия? Натрий — первый элемент в третьем ряду. Поскольку это первый элемент в своем ряду, у него всего один валентный электрон.
Сколько валентных электронов у неона? Никто. Это благородный газ, поэтому он не имеет частично заполненных оболочек и, следовательно, валентных электронов.
Атомы водорода и щелочных металлов, перечисленных в первом столбце периодической таблицы, имеют по одному валентному электрону. Эти элементы стремятся отдать валентный электрон в химической реакции.Возьмем, к примеру, литий. Чтобы избежать позора частично заполненной оболочки, литий мог либо отдать свой валентный электрон (тем самым опустошив свою вторую оболочку), либо собрать еще семь (чтобы заполнить ту оболочку, которая может вместить восемь). Что ж, вам не нужно быть атомом лития, чтобы знать, что отдать один электрон намного проще, чем просить своих друзей о семи из них! Точно так же элемент кальций (второй элемент в четвертом ряду) мог либо отдать свои два валентных электрона, чтобы опустошить свою четвертую оболочку, либо собрать еще шестнадцать, чтобы заполнить эту оболочку.Разумеется, отдать два намного проще, чем собрать шестнадцать, поэтому кальций сильно предпочитает отдавать свои два валентных электрона. С другой стороны, элементам с правой стороны периодической таблицы, таким как кислород и фтор, легче заполнить свои оболочки (добавив один или два дополнительных электрона), чем избавиться от множества валентных электронов.
Таким образом, элементы с левой стороны периодической таблицы ( металлов ) имеют тенденцию отдавать валентные электроны, а элементы с правой стороны ( неметаллы ) имеют тенденцию собирать их.Исключение составляет крайний правый столбец. Эти элементы, называемые благородными газами , счастливы именно так. Гелий, например, имеет полностью заполненную внутреннюю оболочку, а все остальные его оболочки совершенно пусты. Аналогично с неоном. Его первые две оболочки полны, а остальные пустые. Гелий, неон и другие благородные газы любят это так: никаких частично заполненных оболочек! Таким образом, благородные газы вообще не вступают в химические реакции. Дворяне редко соизволят пообщаться с простолюдином!
Также стоит отметить, что элементы в нижнем левом и верхнем правом углах периодической таблицы, как правило, имеют более высокую реакционную способность (опять же, за исключением благородных газов).Элемент франций (в нижнем левом углу) является наиболее химически активным металлом; фтор (в правом верхнем углу) — наиболее реактивный неметалл. Чтобы понять, почему это так, рассмотрим следующее. Электроны притягиваются к ядру, но отталкиваются друг от друга. Чем больше электронов в атоме, тем меньше разницы в силе притяжения ядра. Хотя в ядре франция много положительно заряженных протонов, в нем также много электронов. Таким образом, с точки зрения любого отдельного электрона остальная часть атома кажется почти нейтральной: она лишь немного привлекательна.Более того, электроны с более высокими энергиями могут легче избежать притяжения ядра и уйти. Валентный электрон франция застрял на очень высокоэнергетической оболочке. Он не может упасть в нижние снаряды, потому что эти снаряды уже полны! Этот печальный, одинокий валентный электрон очень хочет сбежать.
У фтора, напротив, остается только одно пустое место во второй оболочке. Фтор стремится заполнить это место, чтобы он мог чувствовать себя самодовольным и самодовольным, как его ближайший сосед неон.А с точки зрения блуждающего электрона вторая оболочка атома фтора — довольно привлекательное место для жизни. Счета за энергию дешевы (для достижения второй оболочки требуется относительно мало энергии), а других электронов вокруг не так уж много. Какой электрон не захотел бы там уйти на пенсию?
| A | B |
|---|---|
| периодическая таблица | расположение элементов в столбцах на основе набора свойств, повторяющихся от строки к строке |
| период | Каждая строка в таблице элементов |
| группа | Каждый столбец в периодической таблице |
| Периодический закон | Свойства элементов повторяются предсказуемым образом, когда атомные числа |
| единица атомной массы | определяется как одна двенадцатая массы атома углерода-12 |
| металлы | элементы, которые хорошо проводят электрический ток и тепло |
| переходные металлы | элементы, которые образуют мост между элементами на левой и правой сторонах стол |
| неметаллы | элементы, плохо проводящие тепло и электрический ток |
| металлоиды | элементы со свойствами, которые находятся между свойствами металлов и неметаллов |
| валентный электрон | электрон, который находится на самом высоком занятом энергетическом уровне атома |
| щелочные металлы | металлы, имеющие один валентный электрон и чрезвычайно реакционноспособны |
| щелочноземельные металлы | металлы, имеющие два валентных электрона |
| галогены | элементы с семью валентными электронами все неметаллы |
| благородные газы | бесцветные и без запаха |
| Антуан Лавуазье | сгруппировал известные элементы по категориям, которые он назвал металлами, неметаллами, газами и землей |
| современная периодическая таблица | элементы расположены по возрастанию атомного номера |
| Периодическая таблица Менделеева | элемент расположены путем увеличения атомной массы |
| периоды слева направо | элементы становятся менее металлическими и более неметаллическими по своим свойствам |
| элементы в группе имеют аналогичные свойства | , потому что они имеют одинаковое количество валентных электронов |
| реакционная способность щелочного металла | увеличивается сверху вниз группы |
| Группа 1 | щелочные металлы |
| Семейство бора | Металлы с тремя валентными электронами |
| Группа 2 | щелочноземельные металлы |
| Семейство углерода | Группа с четырьмя валансными электронами, неметаллом 2 металлоидами и 2 металлами |
| Группа 3 | Семейство бора |
| Группа 4 | семейство углерода |
| Семейство азота | Группа с пятью валентные электроны, 2 неметалла, 2 металла ids и 1 металл |
| Группа 5 | Семейство азота |
| Семейство кислорода | Группа с шестью валентными электронами 3 неметалла 2 металлоида |
| Группа 6 | Семейство кислорода |
| Группа 7 | |
| Группа 8 | благородные газы |
| Добрейнер | идентифицировала группы из 3 элементов со схожими свойствами |
| Группа Добринера из 3 элементов | Триада |
| Newlands | свойства элементов повторяются каждые 8 элементы |
| свойства элементов повторяются каждые 8 элементов | Закон октав |
Образование ионов переходных металлов | Химия для неосновных
- Опишите образование ионов переходных металлов.
Как переходные металлы образуют ионы?
Переходные металлы — интересная и сложная группа элементов. У них есть запутанные закономерности распределения электронов, которые не всегда соответствуют правилам электронного заполнения. Предсказать, как они будут образовывать ионы, также не всегда очевидно.
Ионы переходных металлов
Переходные металлы принадлежат блоку d , что означает, что подуровень электронов d находится в процессе заполнения до десяти электронов.Многие переходные металлы не могут потерять достаточно электронов, чтобы достичь электронной конфигурации благородного газа. Кроме того, большинство переходных металлов способны принимать ионы с разными зарядами. Железо, которое образует ионы Fe 2+ или Fe 3+ , теряет электроны, как показано ниже.
Согласно процессу Ауфбау, электроны заполняют подуровень 4 s перед тем, как начать заполнять подуровень 3 d . Однако в процессе образования катионов переходных металлов в первую очередь удаляются самые внешние – электронов.Поскольку большинство переходных металлов имеют два валентных электрона, заряд 2+ является очень обычным для их ионов. Так обстоит дело с железом выше. Наполовину заполненный подуровень d ( d 5 ) особенно стабилен, что является результатом потери атомом железа третьего электрона.
Рисунок 8.5
A. Ржавчина представляет собой сложное сочетание оксидов железа (III), в том числе оксида железа (III), Fe 2 O 3 .B. Сульфат железа (II), FeSO 4 , с древних времен известен как зеленый купорос и веками использовался при производстве чернил.
Некоторые переходные металлы, у которых относительно мало d электронов, могут иметь электронную конфигурацию благородного газа. Скандий является примером.
Другие могут иметь конфигурации с полным подуровнем d , такие как цинк и медь.
Полученная выше конфигурация с 18 электронами на внешнем основном энергетическом уровне упоминается как электронная конфигурация псевдо благородного газа .Это придает особую стабильность ионам Zn 2+ и Cu + .
Сводка
- Образование ионов переходных металлов сложнее, чем образование простых катионов.
- Ионы переходных металлов часто включают перегруппировки как d , так и s электронов.
Практика
Ответьте на вопрос по ссылке ниже:
http://www.dynamicscience.com.au/tester/solutions/chemistry/atomic%20structure/transitionmetalsionformation.htm
Обзор
Вопросы
- В какой блок попадают переходные металлы?
- Какой подуровень заполняется первым?
- Какой подуровень теряет электроны первым?
- Что такое конфигурация электронов псевдо-благородного газа?
- электронная конфигурация псевдо благородного газа: 18 электронов на крайнем главном энергетическом уровне.
- переходный металл: Металлы, подуровни которых заполняются до десяти электронов.
Металлическое склеивание | Химия для неосновных
- Определите металлическую связку.
- Опишите свойства металлов.
Почему металлы ведут себя именно так?
На изображении выше изображена медная пластина, изготовленная в 1893 году. Посуда имеет множество сложных украшений, и этот предмет очень полезен. Что бы произошло, если бы мы решили, что хлорид меди (I) был таким же хорошим материалом (ну, в нем есть медь).CuCl превратился бы в порошок, когда мы его растолкали, чтобы придать ему форму. Металлы ведут себя уникальным образом. Связывание, которое происходит в металле, отвечает за его отличительные свойства: блеск, пластичность, пластичность и отличную проводимость.
Металлическая облигация
Чистые металлы — это твердые кристаллические вещества, но в отличие от ионных соединений каждая точка кристаллической решетки занята одним и тем же атомом. Электроны на внешних энергетических уровнях металла подвижны и способны перемещаться от одного атома металла к другому.Это означает, что металл более правильно рассматривать как массив положительных ионов, окруженный морем подвижных валентных электронов. Электроны, которые могут свободно перемещаться по пустым орбиталям металлического кристалла, называются делокализованными электронами (см. рисунок ниже). Металлическая связь — это притяжение неподвижных катионов металла к окружающим мобильным электронам.
Рисунок 8.16
В металле неподвижные катионы металла окружены морем подвижных валентных электронов, которые не связаны ни с одним катионом.
Свойства металлов
Модель металлической связи объясняет физические свойства металлов. Металлы очень хорошо проводят электричество и тепло благодаря свободному течению электронов. Когда электроны входят в один конец куска металла, равное количество электронов выходит наружу из другого конца. Когда свет падает на поверхность металла, его электроны поглощают небольшое количество энергии и возбуждаются на одну из его многочисленных пустых орбиталей. Электроны немедленно падают на более низкие энергетические уровни и излучают свет.Этот процесс обеспечивает высокий блеск металла .
Рисунок 8.17
Американский платиновый орел — официальная слитковая платиновая монета Соединенных Штатов, впервые отчеканенная в 1997 году. Блеск металла обусловлен металлическими связями.
Напомним, что ионные соединения очень хрупкие. Приложение силы приводит к тому, что одноименно заряженные ионы в кристалле подходят слишком близко друг к другу, что приводит к разрушению кристалла.Когда к металлу прикладывается сила, свободно текущие электроны могут проскользнуть между неподвижными катионами и предотвратить их соприкосновение. Представьте себе шарикоподшипники, покрытые маслом, скользящие друг по другу. В результате металлы очень пластичные, и пластичные, . Из них можно придать форму, свернуть в тонкие листы или натянуть на тонкую проволоку.
Сводка
- Металлическая связка отвечает за свойства металлов.
- Металлы хорошо проводят электричество и тепло.
- Металлы пластичны и пластичны.
- Металлы имеют блеск.
Практика
Вопросы
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://www.chemguide.co.uk/atoms/bonding/metallic.html
- Что происходит с валентными электронами в металлах?
- Что удерживает вместе атомы металла?
- Что происходит с металлической связкой при плавлении металла?
- Что происходит с металлической связкой, когда металл закипает?
Обзор
Вопросы
- Что такое делокализованный электрон?
- Почему металлы хорошо проводят электричество и тепло?
- Почему металлы имеют блеск?
- делокализованных электронов: Электроны, которые могут свободно перемещаться по пустым орбиталям металлического кристалла.
