Содержание
Понятие электроотрицательности — урок. Химия, 8–9 класс.
Все известные химические элементы можно разделить на металлы и неметаллы.
Металлы — элементы, атомы которых способны отдавать электроны.
Неметаллы — элементы, атомы которых могут принимать электроны.
При взаимодействии металла с неметаллом атом первого теряет электроны, а атом второго их присоединяет.
А что происходит, если взаимодействуют атомы двух неметаллов?
Сравним атомы серы и кислорода:
O8 +8 2e, 6e;
S16 +16 2e, 8e, 6e.
Радиус атома серы больше, валентные электроны слабее связаны с ядром. При образовании связи произойдёт сдвиг электронов от серы к кислороду.
Сравним атомы углерода и кислорода:
O8 +8 2e, 6e;
C6 +6 2е, 4е.
Заряд ядра атома кислорода больше, и притягивать к себе электроны он будет сильнее.
Значит, атомы разных неметаллов притягивают к себе электроны неодинаково.
Способность атомов элементов оттягивать к себе общие электронные пары в химических соединениях называется электроотрицательностью (ЭО).
Так как общие электронные пары образуются валентными электронами, то можно сказать, что электроотрицательность — это способность атома притягивать к себе валентные электроны от других атомов.
Обрати внимание!
Чем больше электроотрицательность, тем сильнее у элемента выражены неметаллические свойства.
Шкала относительной электроотрицательности Полинга
Абсолютные значения ЭО — неудобные для работы числа. Поэтому обычно используют относительную электроотрицательность по шкале Полинга. За единицу в ней принята ЭО лития.
По шкале Полинга наиболее электроотрицательным среди элементов, способных образовывать соединения, является фтор, а наименее электроотрицательным — франций. ЭО франция равна \(0,7\), а ЭО фтора — \(4\). ЭО остальных элементов изменяются в пределах от \(0,7\) до \(4\).
ЭО франция равна \(0,7\), а ЭО фтора — \(4\). ЭО остальных элементов изменяются в пределах от \(0,7\) до \(4\).
Как правило, неметаллы имеют ЭО больше двух. У металлов значение ЭО меньше двух. Некоторые элементы (B,Si,Ge,As,Te) со значениями электроотрицательности, близкими к \(2\), способны проявлять промежуточные свойства.
Элементы с высокой и низкой электроотрицательностью считаются активными. С высокой — активные неметаллы, с низкой — активные металлы. У первых ЭО близка к \(3\)–\(4\), у вторых — к \(1\).
Изменение электроотрицательности в Периодической системе
С увеличением порядкового номера элементов ЭО изменяется периодически.
В периоде она растёт слева направо при накоплении электронов на внешнем слое.
В группе она убывает сверху вниз при увеличении числа электронных слоёв и увеличении атомных радиусов.
Наибольшей ЭО в каждом периоде обладают самые маленькие атомы с семью внешними электронами — атомы галогенов (инертные газы соединений не образуют).
Наименьшая ЭО в периоде у самого большого атома с одним внешним электроном — атома щелочного металла.
Обрати внимание!
Значения электроотрицательности элементов позволяют определить:
— заряды атомов в соединении;
— сдвиг электронов при образовании химической связи.
Установим, как происходит сдвиг электронов при взаимодействии атомов хлора и серы, cеры и кислорода.
Пример:
хлор и сера расположены в третьем периоде. Электроотрицательность по периоду возрастает слева направо. ЭО хлора больше ЭО серы, значит, электроны будут сдвинуты от серы к хлору. Заряд атома серы будет положительным, а хлора — отрицательным:
Sδ+→Clδ−.
Проверим вывод по шкале Полинга. Электроотрицательность хлора равна \(3\), а электроотрицательность серы — \(2,5\). Хлор более электроотрицательный.
Пример:
кислород и сера расположены в шестой А группе. Электроотрицательность по группе сверху вниз уменьшается.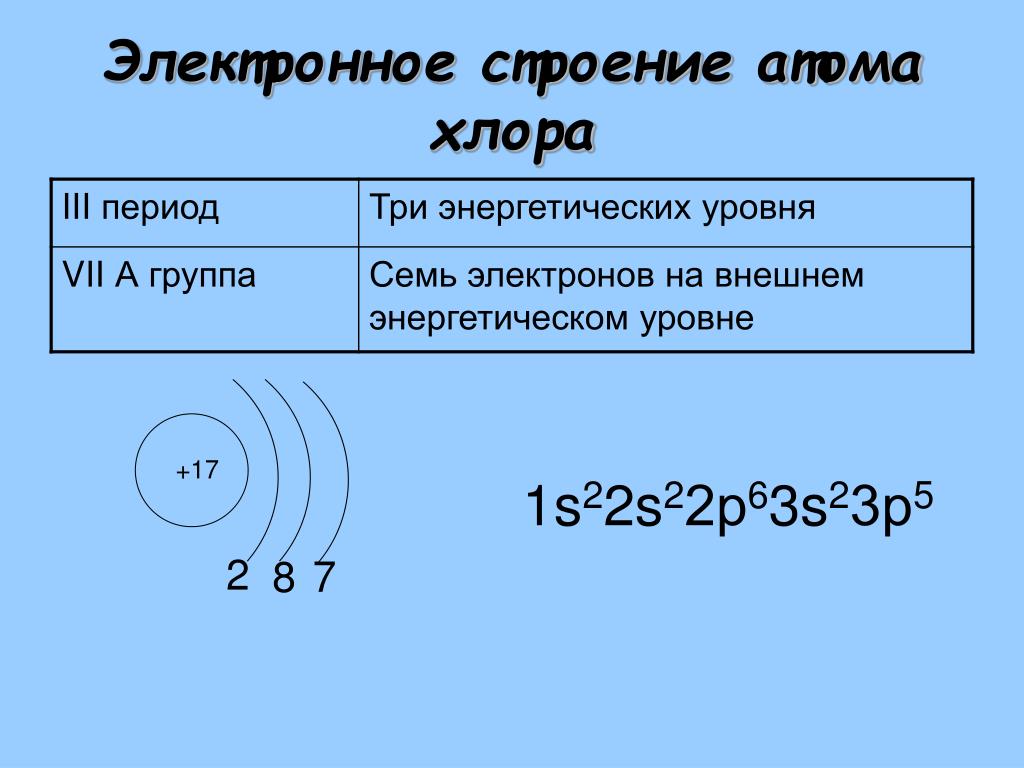 ЭО кислорода больше ЭО серы, значит, электроны будут сдвинуты от серы к кислороду. Атом серы имеет положительный заряд, а кислорода — отрицательный:
ЭО кислорода больше ЭО серы, значит, электроны будут сдвинуты от серы к кислороду. Атом серы имеет положительный заряд, а кислорода — отрицательный:
Sδ+→Oδ−.
По шкале Полинга электроотрицательность кислорода равна \(3,5\), а электроотрицательность серы — \(2,5\). Более электроотрицательный — кислород.
При сравнении ЭО элементов часто используют ряд электроотрицательности, расположив элементы в порядке убывания её значения:
F,O,N,Cl,Br,S,C,P,H,Si,Mg,Li,Na.
Особенности фармакокинетики антисмысловых олигонуклеотидных препаратов | Хаитов
Введение
Фармакокинетические свойства антисмысловых олигонуклеотидов (АСО) становятся наиболее понятными при рассмотрении их физических и химических свойств. Такие параметры как заряд, молекулярная масса и амфипатическая природа фосфотиоатных АСО оказывают заметное влияние на их фармакокинетику. Особенно значимое влияние на фармакокинетические свойства АСО оказывает химическая структура, в частности фосфотиоатная группа и 2′-метоксиэтил (МОЭ).
Всасывание, распределение, метаболизм, и выведение фосфотиоатных олигодеоксинуклеотидов (ОДН) первого поколения были тщательно изучены на лабораторных животных и в клинических исследованиях [1, 16, 18, 19, 20, 23, 28, 37, 38, 39, 40, 58]. Особенности фармакокинетики препаратов фосфотиоатных АСО заключаются в следующем: введённые парентерально фосфотиоатные ОДН быстро оказываются в плазме крови, где они связываются с гидрофильными участками белков плазмы и таким образом избегают гломерулярной фильтрации. Эти гидрофильные участки отличны от других гидрофильных участков, с которыми связываются липофильные препараты, и, таким образом, конкуренция за связывание с белками плазмы для АСО невелика. Кинетика в плазме характеризуется короткой фазой распределения (порядка нескольких часов), а затем наступает фаза выведения препарата с периодом его полувыведения, составляющим дни или недели. Начальная фаза распределения обязательно включает связывание АСО с белками и распределение этих комплексов по тканям печени, почек, лимфатических узлов, костного мозга и селезёнки, которые являются местами наиболее активного связывания и накопления АСО. Совершенно очевидно, что фаза выведения АСО вследствие начального связывания с белками, определяется начальным этапом его распределения. Вследствие возможного насыщения белков, площадь под фармакокинетической кривой (AUC) увеличивается с увеличением дозы, так как АСО уже не связываются с белками после их насыщения, а попадают в свободном виде в кровоток. После связывания АСО попадают в клетки по градиенту концентрации из внеклеточного пространства через клеточную мембрану во внутриклеточное пространство, вероятно, с помощью белка-переносчика. АСО в клетках связываются с доступными мишенями, но главным образом АСО в клетках, вероятнее всего, связываются с внутриклеточными белками. В клетке убиквитарные нуклеазы, но не ферменты цитохрома P450, метаболизируют препараты АСО. Поскольку ферменты цитохрома P450 обычно метаболизируют низкомолекулярные препараты, АСО не конкурируют в метаболических процессах с обычными низкомолекулярными соединениями, снижая риск развития лекарственных взаимодействий.
Совершенно очевидно, что фаза выведения АСО вследствие начального связывания с белками, определяется начальным этапом его распределения. Вследствие возможного насыщения белков, площадь под фармакокинетической кривой (AUC) увеличивается с увеличением дозы, так как АСО уже не связываются с белками после их насыщения, а попадают в свободном виде в кровоток. После связывания АСО попадают в клетки по градиенту концентрации из внеклеточного пространства через клеточную мембрану во внутриклеточное пространство, вероятно, с помощью белка-переносчика. АСО в клетках связываются с доступными мишенями, но главным образом АСО в клетках, вероятнее всего, связываются с внутриклеточными белками. В клетке убиквитарные нуклеазы, но не ферменты цитохрома P450, метаболизируют препараты АСО. Поскольку ферменты цитохрома P450 обычно метаболизируют низкомолекулярные препараты, АСО не конкурируют в метаболических процессах с обычными низкомолекулярными соединениями, снижая риск развития лекарственных взаимодействий. Выведение АСО с мочой в конечном счёте является результатом метаболизма в тканях и установления равновесия метаболитов и нативного вещества вне тканей и в системном кровотоке. Эти процессы у лабораторных животных и человека очень сходны, в силу чего не удаётся выявить межвидовую корреляцию между лабораторными животными и человеком.
Выведение АСО с мочой в конечном счёте является результатом метаболизма в тканях и установления равновесия метаболитов и нативного вещества вне тканей и в системном кровотоке. Эти процессы у лабораторных животных и человека очень сходны, в силу чего не удаётся выявить межвидовую корреляцию между лабораторными животными и человеком.
В настоящее время конфигурация «второго поколения» АСО, чьей особенностью являются МОЭ группы в положении 2′- нуклеотидов на 3′- и 5′-концах наиболее широко используется в клинических исследованиях. Эта конфигурация представляет собой более совершенную структуру по сравнению с немодифицированными фосфотиоатными ОДН, являющимися антисмысловыми препаратами первого поколения. Это обусловлено её повышенной эффективностью, уменьшенной токсичностью и повышенным периодом полувыведения. Многие факторы, связанные с переходом от первого ко второму поколению АСО, имеют непосредственное отношение к улучшению их фармакокинетики.
Особенности химического строения АСО
Фосфотиоатный скелет
Самые ранние попытки создать препараты с антисмысловой активностью были связаны с использованием немодифицированной ДНК, которая, к сожалению, была очень восприимчива к разрушению нуклеазой. Как оказалось, убиквитарные нуклеазы расщепляют фосфодиэстеразные связи нативной ДНК, в результате чего период полувыведения немодифицированных АСО составлял минуты. Такая быстрая деградация была основной особенностью фармакокинетического профиля немодифицированных антисмысловых ДНК. Изменение фосфодиэфирного скелета ДНК на фосфотиоатный резко изменило фармакокинетический профиль АСО. В этих препаратах фосфотиоатная структура заменяет в фосфодиэфирных связях один атом серы на один немостиковый атом кислорода. Такая структура повышает устойчивость АСО к нуклеазам и, как следствие, улучшает их кинетические свойства.
Как оказалось, убиквитарные нуклеазы расщепляют фосфодиэстеразные связи нативной ДНК, в результате чего период полувыведения немодифицированных АСО составлял минуты. Такая быстрая деградация была основной особенностью фармакокинетического профиля немодифицированных антисмысловых ДНК. Изменение фосфодиэфирного скелета ДНК на фосфотиоатный резко изменило фармакокинетический профиль АСО. В этих препаратах фосфотиоатная структура заменяет в фосфодиэфирных связях один атом серы на один немостиковый атом кислорода. Такая структура повышает устойчивость АСО к нуклеазам и, как следствие, улучшает их кинетические свойства.
Фосфотиоатная хиральность
Как показали исследования, тиатион диэфирного скелета АСО не только повышает его устойчивость к нуклеазам, но и способствует возникновению хиральности, то есть возможности существования стереоизомеров, по каждой фосфотиоатной связи, что приводит к тому, что в любой 20-mer АСО существуют 219 Sp или Rp стереоизомеров [14, 15]. Комбинация резистентности к нуклеазам и повышение связывания с белками сильно влияет на фармакокинетику АСО. Повышение стабильности фосфотиоатных АСО приводит к тому, что период полувыведения препарата из плазмы увеличивается до 30-60 минут в сравнении с периодом полувыведения фосфодиэфирных АСО, составляющим 1-2 минуты.
Комбинация резистентности к нуклеазам и повышение связывания с белками сильно влияет на фармакокинетику АСО. Повышение стабильности фосфотиоатных АСО приводит к тому, что период полувыведения препарата из плазмы увеличивается до 30-60 минут в сравнении с периодом полувыведения фосфодиэфирных АСО, составляющим 1-2 минуты.
Устойчивость к нуклеазам и хиральность из-за замены фосфодиэфирных на фосфотиоатные связи заслуживают обсуждения, потому что физические свойства связанные с этой структурной особенностью важны как для первого-, так и для второго поколений АСО. Устойчивость к нуклеазам фосфотиоатных АСО возникает из-за близости серы на немостиковом кислороде в активном участке экзонуклеазы к иону металла. Эта близость может вызывать смещение иона металла из активного участка. Данный эффект был продемонстрирован на модели 3’–5′ экзонуклеазы ДНК-полимеразы. Рентгеновские кристаллографические данные подтверждают эту гипотезу о смещении иона металла. Очевидные различия в чувствительности стереоизомеров к экзонуклеазной активности ДНК-полимеразы согласуются с предложенной конформацией фосфотиоатных стереоизомеров ОДН в активном участке. Вполне вероятно, что хиральность фосфоротиоатных связей может помешать другим нуклеазам таким же образом, то есть смещением иона металла, хотя различные экзонуклеазы могут показать различные предпочтения связей Rp и Sp в зависимости от природы активного центра фермента.
Вполне вероятно, что хиральность фосфоротиоатных связей может помешать другим нуклеазам таким же образом, то есть смещением иона металла, хотя различные экзонуклеазы могут показать различные предпочтения связей Rp и Sp в зависимости от природы активного центра фермента.
В альтернативе, сера может просто занимать место кислорода в диэфирных связях. Различия в способности серы брать на себя отрицательный заряд, по сравнению с кислородом, позволяют прогнозировать изменения активного центра. Это изменение, скорее всего, происходит из-за гидролиза фосфодиэфирных связей, и может осуществляться через формирование переходного пятивалентного фосфора с двумя отрицательно заряженными атомами кислорода. Замена одного из экваториальных атомов кислорода серой будет иметь отрицательные последствия на активность ферментов: (1) снижается связывание воды, которая стабилизирует местный отрицательный заряд на атомах, что приводит к трудностям для получения второго отрицательного заряда серы; и (2) снижение связывания Mg2+ с серой. Существует доказательство для последнего эффекта в исследованиях уровня расщепления рибозимами диастереомерных фосфотиоатных включений, когда добавление Mg2+ ингибирует расщепляющие эффекты фосфоротиоатных рибозимов [51]. Кроме того, было показано, что существует некоторое снижение активности нуклеаз на участках скелета, находящихся дальше от фосфотиоатных связей, что даёт возможность предположить передачу эффекта хиральности [54]. Этот феномен лучше всего объясняется изменениями в расположении молекул воды вокруг фосфотиоатного скелета по сравнению с фосфодиэфирным [60].
Существует доказательство для последнего эффекта в исследованиях уровня расщепления рибозимами диастереомерных фосфотиоатных включений, когда добавление Mg2+ ингибирует расщепляющие эффекты фосфоротиоатных рибозимов [51]. Кроме того, было показано, что существует некоторое снижение активности нуклеаз на участках скелета, находящихся дальше от фосфотиоатных связей, что даёт возможность предположить передачу эффекта хиральности [54]. Этот феномен лучше всего объясняется изменениями в расположении молекул воды вокруг фосфотиоатного скелета по сравнению с фосфодиэфирным [60].
Стереоспецифические воздействия на активность нуклеаз заметно влияют на фармакокинетику фосфоротиоатных АСО и это наиболее наглядно проявляется в скорости метаболизма фосфоротиоатных АСО первого поколения в плазме крови. Скорость полного выведения АСО из плазмы уменьшается, предполагая замедление метаболизма. Эти изменения в скорости не могут быть объяснены исходя только из кинетики первого порядка, но их можно объяснить различиями в восприимчивости связей Rp и Sp.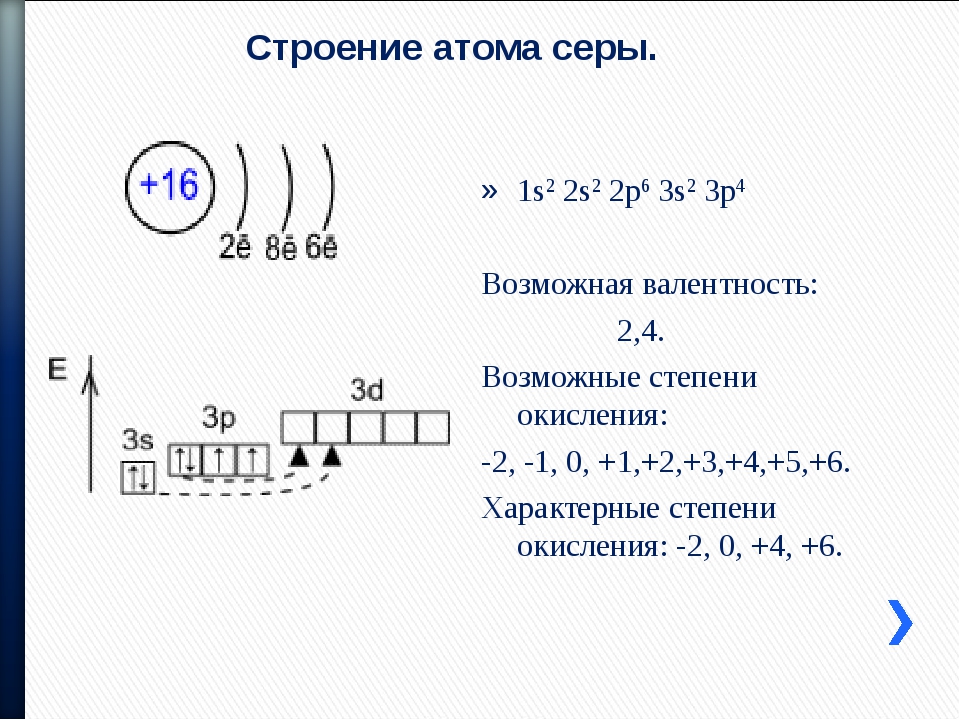
Стереоспецифические различия в экзонуклеазной активности для АСО второго поколения менее важны. Это обусловлено тем, что АСО второго поколения имеют 2′-модификации на 3′- и 5′-концах, которые предотвращают их расщепление экзонуклеазой. С помощью эндонуклеазы, выделенной из возбудителя Serratia marcescens, были изучены эффекты хиральности фосфоротиоатнных связей [35]. Сайт воздействия эндонуклеазы так же, как экзонуклеазы – это один из немостиковых кислородов для гидролиза фосфодиэфирных связей. В диастереомере сера локализуется в непосредственной близости от Mg2+, вследствие чего уменьшается активность фермента, в то время как в диастереомере Rp – нет. Поскольку эндонуклеаза Serratia имеет значительные сходства с некоторыми эндонуклеазами млекопитающих, следует предположить, что этот механизм может быть широко применим. Каким образом стереохимические особенности фосфоротиоатных связей влияют на действие других эндонуклеаз – не известно. Однако если предположить, что реакция развивается по схеме, аналогичной эндонуклеазе Serratia, можно думать, что активный участок будет содержать ион металла (вероятно, Mg2+) и сера будет влиять на действие нуклеаз, когда она будет ориентирована на ион металла.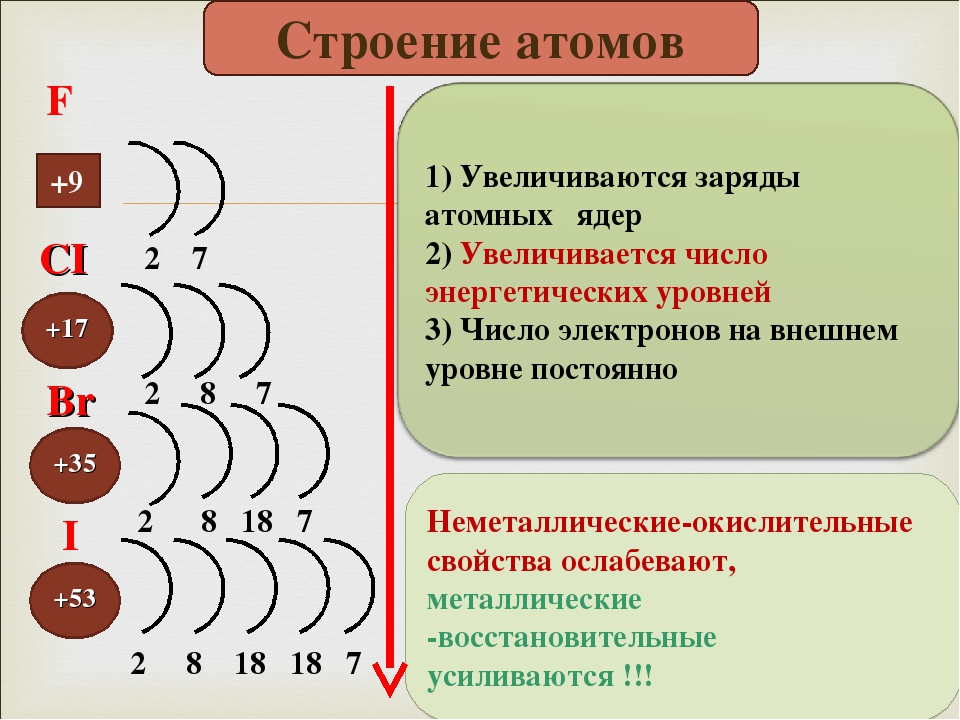 Если эндонуклеазы чувствительны к хиральности, это могло бы иметь важные последствия для развития проблемы создания эффективных препаратов второго поколения. Как и влияние хиральности на препараты первого поколения, так и хиральное воздействие на метаболизм препаратов второго поколения может привести к замедлению их метаболизма. Так, например, можно предположить, что быстро метаболизирующиеся стереоизомеры будут выборочно разрушаться, оставляя функционирующими только медленно метаболизирующиеся изомеры.
Если эндонуклеазы чувствительны к хиральности, это могло бы иметь важные последствия для развития проблемы создания эффективных препаратов второго поколения. Как и влияние хиральности на препараты первого поколения, так и хиральное воздействие на метаболизм препаратов второго поколения может привести к замедлению их метаболизма. Так, например, можно предположить, что быстро метаболизирующиеся стереоизомеры будут выборочно разрушаться, оставляя функционирующими только медленно метаболизирующиеся изомеры.
Связывание АСО с белками
Было установлено, что в сравнении с АСО с фосфодиэфирным скелетом, на фармакокинетику фосфотиоатных структур оказывает существенное влияние их связывание с белками. Химической основой повышения связывания с белками является повышенная липофильность фосфотиоатных связей по сравнению с фосфодиэфирными. Поскольку молекулярные взаимодействия с водой определяются формой и функцией макромолекул в водном растворе [60], то даже небольшие изменения в липофильности скелета по всей длине АСО могут иметь последствия для взаимодействия олигомера с водой и макромолекулами, такими как белки.
В первом приближении, фосфотиоатные ОДН связываются с клеточными белками более беспорядочно, чем фосфодиэфирные ОДН [5, 6]. Почему фосфотиоатные АСО лучше связываются с белками до конца не выяснено. Возможные объяснения предполагают повышение липофильности и комплексообразование с ионами металлов.
Важность связывания с белками плазмы для фармакологии, фармакокинетики и токсикологии фосфотиоатных АСО (как первого, так и второго поколений) сложно переоценить. На микромолярном уровне концентраций более чем 90% фосфотиоатных ОДН связываются в плазме. Есть особые отличия в проценте и силе связывания с белками, так же как качественные отличия в связывании АСО с особыми белками у разных видов. Связывание фосфотиоатных АСО с циркулирующими белками удерживает эти соединения от фильтрации в почечных клубочках и выведения с мочой. В случае насыщения, например при введении большой дозы АСО, выведение с мочой АСО полной длины усиливается. Вследствие видовых различий, насыщение у различных видов определяется разными концентрациями АСО. Например, белки плазмы мышей имеют меньшее сродство к АСО, по сравнению с таковыми крыс или человека. Поэтому эффект насыщения процесса связывания АСО с белками плазмы у мышей происходит при более низких концентрациях, по сравнению с другими видами. Видовые различия в связывании плазмы с белками являются существенным фактором отличия в межвидовой фармакокинетике.
Например, белки плазмы мышей имеют меньшее сродство к АСО, по сравнению с таковыми крыс или человека. Поэтому эффект насыщения процесса связывания АСО с белками плазмы у мышей происходит при более низких концентрациях, по сравнению с другими видами. Видовые различия в связывании плазмы с белками являются существенным фактором отличия в межвидовой фармакокинетике.
Устойчивость к нуклеазам и связывание с белками, которые характерны для АСО с фосфотиоатными связями, изменяют и фармакокинетику терапии с применением АСО. Дополнительные химические структуры, характерные для второго поколения создаваемых препаратов, вносят и другие изменения в их фармакокинетику.
Метоксиэтильные производные АСО
АСО второго поколения были разработаны для улучшения некоторых характеристик ОДН первого поколения. Так фосфотиоатные структуры, добавленные к группам МОЭ в позиции 2′, повышают их устойчивость к нуклеазам и изменяют эффективность связывания с белками.
Устойчивость МОЭ к нуклеазам
Было показано, что структура МОЭ влияет на устойчивость АСО к нуклеазам. В то время как фосфотиоатные структуры уменьшают активность экзонуклеазы, структура в позиции 2′ практически исключает экзонуклеазную активность. Устойчивость к нуклеазам может быть результатом (1) замещения в позиции 2′ водорода на МОЭ, (2) стерических эффектов МОЭ или (3) образования жёсткой водной оболочки вокруг скелета АСО [57]. Какими бы не были причины устойчивости к нуклеазам, наличие группы МОЭ делает измененные в позиции 2′ АСО практически невосприимчивыми к воздействию циркулирующих и к большинству клеточных нуклеаз. Центральный участок скелета АСО, состоящий из деоксифосфотиоатов, далеко не так устойчив к опосредованным нуклеазой расщеплениям. Различия АСО первого и второго поколений в участках, подверженных метаболизму, определяют и различия метаболических моделей.
В то время как фосфотиоатные структуры уменьшают активность экзонуклеазы, структура в позиции 2′ практически исключает экзонуклеазную активность. Устойчивость к нуклеазам может быть результатом (1) замещения в позиции 2′ водорода на МОЭ, (2) стерических эффектов МОЭ или (3) образования жёсткой водной оболочки вокруг скелета АСО [57]. Какими бы не были причины устойчивости к нуклеазам, наличие группы МОЭ делает измененные в позиции 2′ АСО практически невосприимчивыми к воздействию циркулирующих и к большинству клеточных нуклеаз. Центральный участок скелета АСО, состоящий из деоксифосфотиоатов, далеко не так устойчив к опосредованным нуклеазой расщеплениям. Различия АСО первого и второго поколений в участках, подверженных метаболизму, определяют и различия метаболических моделей.
При оценке моделей метаболизма с помощью капиллярного гель-электрофореза (КГЭ) или путём жидкостной хроматографии/масс спектрометрии (ЖХ/МС), не было обнаружено метаболитов, которые были бы короче на один нуклеотид.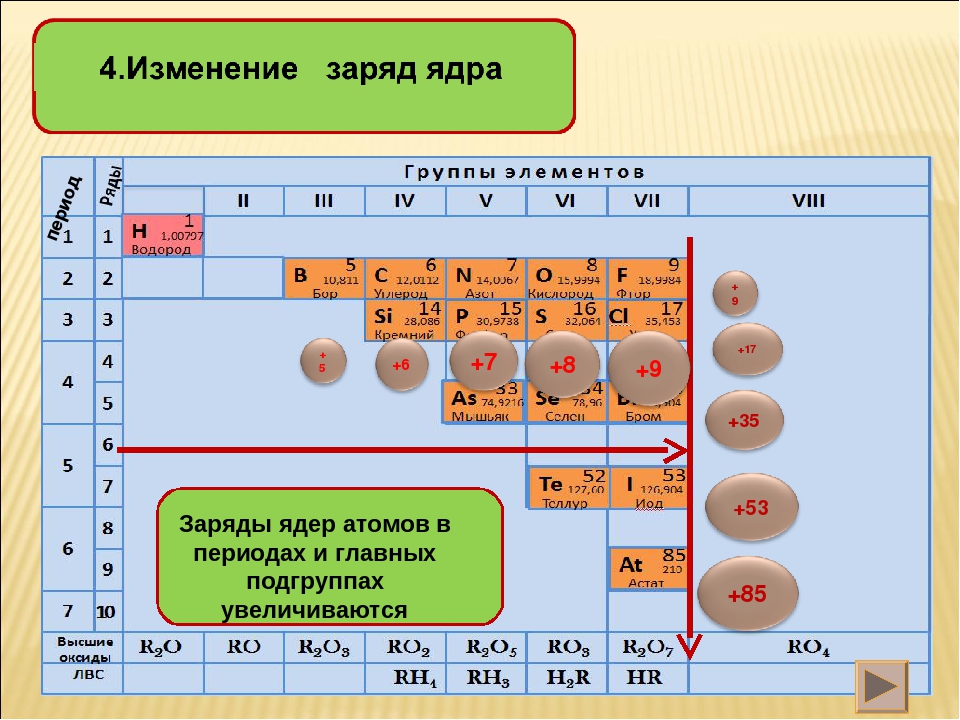 Больше всего было обнаружено метаболитов, расщеплённых в дезокси участке (предположительно эндонуклеазами), дальнейший путь метаболизма заключается в уменьшении размеров продуктов расщепления. Устойчивость к экзонуклеазам и медленный метаболизм под влиянием действующих эндонуклеаз приводит к образованию соединений, характеризующихся большим периодом полувыведения.
Больше всего было обнаружено метаболитов, расщеплённых в дезокси участке (предположительно эндонуклеазами), дальнейший путь метаболизма заключается в уменьшении размеров продуктов расщепления. Устойчивость к экзонуклеазам и медленный метаболизм под влиянием действующих эндонуклеаз приводит к образованию соединений, характеризующихся большим периодом полувыведения.
Связывание МОЭ с белками
Экспериментальными исследованиями доказано, что фосфотиоатные АСО со структурами 2′-МОЭ имеют меньшее сродство к белкам плазмы, в сравнении с немодифицированными фосфотиоатными АСО. Например, при добавлении пяти структур МОЭ к 3′-концам фосфотиоатных ОДН первого поколения, константы диссоциации для альбуминов повышаются от примерно 18 до примерно 40 мкM. При этом, в полностью замещённой МОЭ структуре АСО только слегка снижается сродство к белкам плазмы [17, 22]. Почему увеличение количества структур МОЭ в олигонуклеотиде не влияет на дальнейшее уменьшение сродства к белкам плазмы не ясно, но может быть это связано с особенностями вторичной структуры АСО.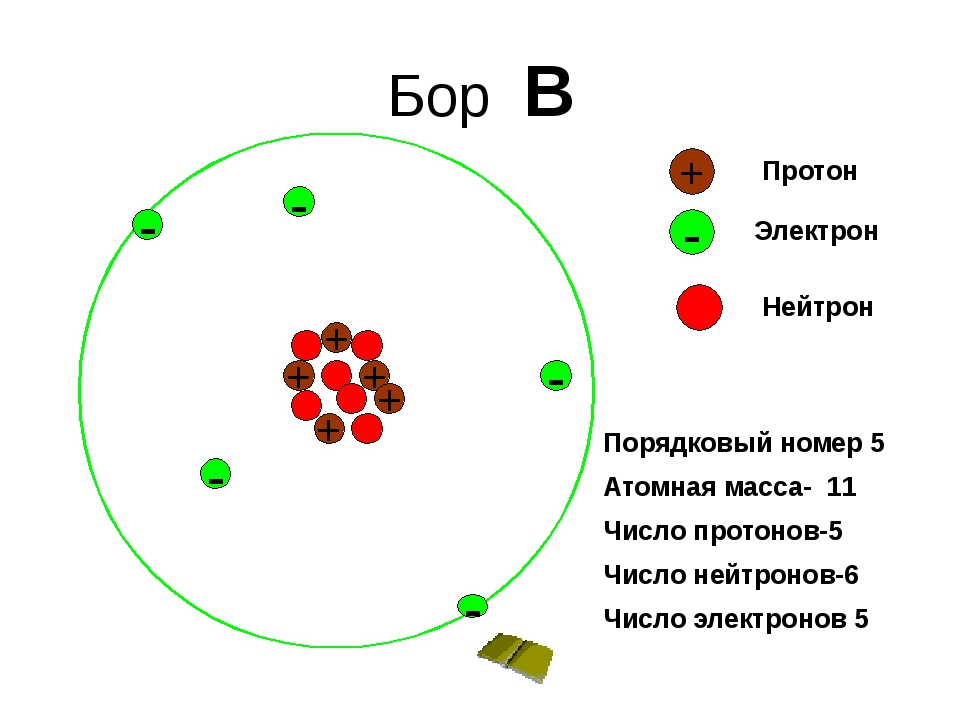
Уменьшение сродства к белкам, связанное со структурами МОЭ, можно обосновать некоторыми физическими свойствами. Вероятно наиболее значительным физическим фактором, который отличает модифицированные МОЭ АСО от немодифицированных – это наличие молекулярной оболочки воды, которая возникает из-за боковой цепи МОЭ [57]. Заместители МОЭ в углеводородном скелете «хелатируют» молекулы воды (и, возможно, ионы металлов), образуя водную оболочку, и уменьшая потенциальный контакт между «липкими» молекулами серы и плазменными или клеточными белками. Степень связывания АСО с белками обратно коррелирует с их выведением с мочой. Введение фосфотиоатных связей и заместителей 2′-МОЭ изменяет связывание с белками и в результате изменяет свойства АСО.
Всасывание, распределение, метаболизм и выведение АСО
Всасывание
Парентеральный путь введения АСО
Исследованиями установлено, что вследствие молекулярной массы (около 7000 Д) и отрицательных зарядов АСО, всасывание этих препаратов из ЖКТ ограничено. Именно поэтому, обычно применяется парентеральный путь их введения. Подкожные, внутривенные инфузии или интравитриальные инъекции используется для введения препаратов первого поколения. Меньшая провоспалительная активность АСО второго поколения делает их более подходящими для подкожного введения. Фармакокинетика этих препаратов в плазме при подкожных инъекциях и внутривенных инфузиях сравнима. Исследования на лабораторных животных показывают, что, в конечном счёте, распределение АСО так же сопоставимо по различным органам, за исключением места введения и лимфатических узлов.
Именно поэтому, обычно применяется парентеральный путь их введения. Подкожные, внутривенные инфузии или интравитриальные инъекции используется для введения препаратов первого поколения. Меньшая провоспалительная активность АСО второго поколения делает их более подходящими для подкожного введения. Фармакокинетика этих препаратов в плазме при подкожных инъекциях и внутривенных инфузиях сравнима. Исследования на лабораторных животных показывают, что, в конечном счёте, распределение АСО так же сопоставимо по различным органам, за исключением места введения и лимфатических узлов.
После подкожного введения, АСО как первого, так и второго поколения всасываются быстро из места введения в системный кровоток. В клинических исследованиях после подкожного введения АСО второго поколения время достижения максимальной концентрации (Tmax), находится в пределах от 1,5 до 4,7 часа в диапазоне доз от 25 до 200 мг при постоянном объёме 1 мл [50]. Биодоступность подкожной дозы лежит в пределах от 36 до 82% от введенной дозы.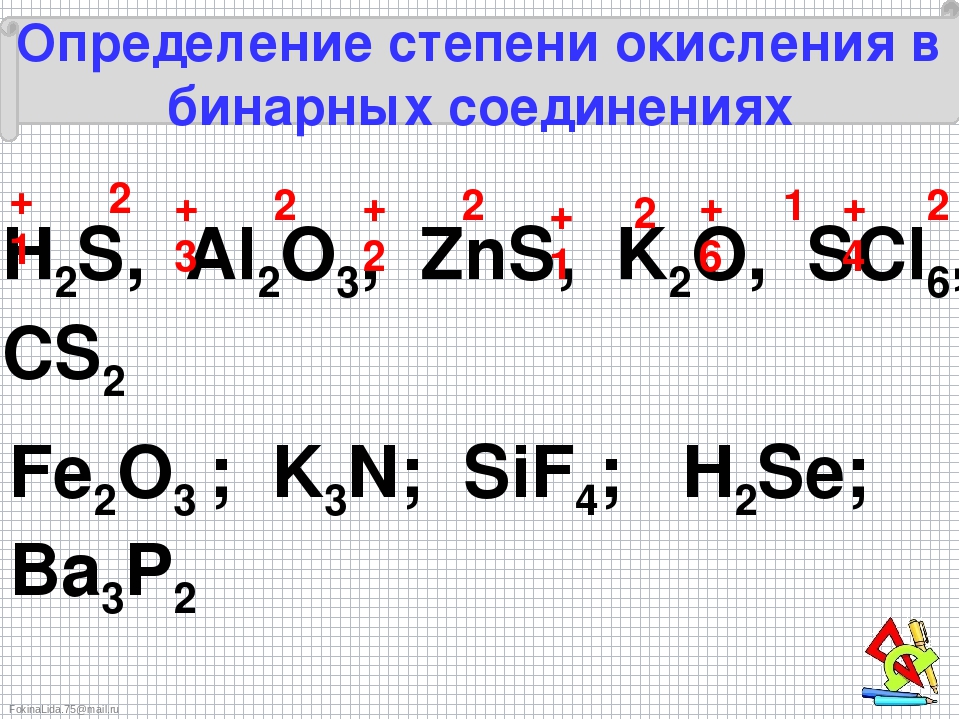 Доклинические [48] и клинические исследования [50] предполагают, что биодоступность АСО повышается в зависимости от концентрации.
Доклинические [48] и клинические исследования [50] предполагают, что биодоступность АСО повышается в зависимости от концентрации.
Кинетика АСО в месте введения может повлиять на местный ответ, также как на их системную кинетику и на распределение. Уменьшение концентрации АСО в месте введения гипотетически уменьшает местный ответ на инъекцию. Одним из подходов к снижению концентрации АСО в месте введения является разведение раствора и, как следствие, повышение площади поверхности всасывания из подкожного депо. Теоретически, разведение растворов и большая площадь поверхности всасывания должны уменьшить местную концентрацию и снизить местные реакции. Этих же эффектов можно было бы ожидать и при повышении системного всасывания. Поэтому изменения дозы и объёма можно рассматривать как потенциальные переменные величины. Однако даже на сегодняшний день подкожные инъекции с низкими объёмами и относительно высокими концентрациями демонстрируют высокую биодоступность применяемого материала.
Местное введение АСО
Изучение различных приёмов введения АСО демонстрирует, что их аэрозольные формы, ректальное введение и интравитриальные инъекции используются как средства местного введения. Для лечения лёгочных заболеваний возможно создавать относительно высокие концентрации АСО в лёгких используя аэрозоли [56].
Кинетика ОДН первого поколения была изучена на мышах. Установлено, что кинетика таких препаратов дозозависима, клиренс – лёгочный с периодом полувыведения около 2 часов. В отличие от этого, исследования модифицированных МОЭ АСО второго поколения, показывают, что период их полувыведения составляет более 4 дней. Так же как и для другого местного лечения, преимущество ингаляций заключается в возможности создать высокие местные концентрации в тканях, которые обычно не накапливают применяемых веществ. В лёгких АСО обычно не накапливаются после парентерального введения. Местное введение так же редко вызывает системные эффекты. Например, при введении АСО обезьянам в дозе 0,1 мг/кг с помощью ингаляций (по три дозы в течение 1 недели) концентрация препарата в лёгких составляла примерно 1 мкг/г. Но у этих же обезьян, концентрация в печени и почках составила примерно 5% от концентрации в лёгких, свидетельствуя о существенно меньшем системном эффекте [65, 66].
Но у этих же обезьян, концентрация в печени и почках составила примерно 5% от концентрации в лёгких, свидетельствуя о существенно меньшем системном эффекте [65, 66].
Данные литературы свидетельствуют о том, что ректальное введение АСО с успехом используется для лечения язвенных колитов. В отличие от ингаляций, где могут использоваться небольшие количества вводимого вещества, применяемая для лечения клизма может содержать до 240 мг вещества (alicaforsen) первого поколения. В данном случае эпителий прямой кишки подвергается воздействию вводимого вещества, однако из-за плохой проницаемости сильно заряженных ОДН, наблюдается минимальное всасывание препарата, как и общий системный эффект. Расчёты показывают, что концентрация АСО в эпителии кишечника через 12 часов после введения составляет 20 мкг/г. Биодоступность у человека лежит в пределах от 0,03 до 2,14% и максимальная концентрация АСО, определяемая в плазме, составляет только 0,126 мкг/мл [44]. Отсутствие значительного системного всасывания и высокая местная концентрация лечебного препарата положительно сказываются на лечении.
Проведено исследование интравитреальных инъекций препаратов АСО как первого, так и второго поколений. В данном случае вещества вводятся в глаз в очень маленьких количествах. Вследствие изоляции места введения, системные эффекты препарата снижаются в ещё большей степени. В глазу, в стекловидное тело и сетчатку АСО поступают с разной скоростью: в стекловидное тело быстрее по сравнению с сетчаткой. И местный метаболизм, и диффузия из глаза способствуют выведению препарата. Как уже отмечалось, из-за небольших количеств системный эффект вводимого препарата оказывается минимальным. Однако, при этом механизм системного распределения сходен с большинством других препаратов.
Энтеральное введение АСО
Отмеченная стабильность АСО второго поколения к нуклеазам обеспечивает стабильность препарата в кишечнике, что делает возможным его дальнейшее всасывание. Тем не менее, размер молекулы и заряды АСО ограничивают всасывание препарата. После всасывания из кишечника, кинетика АСО подобна таковой при его парентеральном введении. Хотя печень является одним из главных мест накопления АСО, эффект первого прохождения через печень не является важным фактором, влияющим на кинетику препарата АСО [44, 55].
Распределение АСО в организме
Роль перфузионного и тканевого сродства
Распределение АСО и других препаратов зависит от проницаемости, интенсивности кровоснабжения, связывания с белками плазмы, тканей и клеток. Показано, что распределение в тканях фосфотиоатных АСО первого и второго поколения с их множественными отрицательными зарядами и их связыванием с белками в наименьшей степени зависит от кровоснабжения, и гораздо более зависит от факторов, влияющих на их транспорт внутрь клетки.
Внутреннее распределение из плазмы в ткани относительно быстрое, период полувыведения составляет 30-90 минут после в/в введения. Период полувыведения АСО после подкожного введения больше, чем после в/в. Это отличие происходит из-за времени, необходимого для всасывания, а не из-за других отличий фармакокинетики [21, 24, 37, 48].
Изучение кинетики препаратов первого и второго поколения отметило её небольшие отличия. Большая стабильность к нуклеазам АСО второго поколения компенсируется меньшим их связыванием с белками. Наряду с этим, фармакокинетические профили препаратов 1-го и 2-го поколения сходны или почти неотличимы, если сумму нативного АСО и его метаболитов (общие АСО) первого поколения сравнивать с интактным препаратом второго поколения (ISIS 13650). В противном случае, более быстрое разрушение АСО экзонуклеазами укорачивало бы период полувыведения препаратов первого поколения в сравнении со вторыми. Распределение препаратов обоих поколений дозозависимо [48].
Как отмечалось выше, после всасывания из места инъекции или кишечника АСО связываются с белками плазмы. Два белка плазмы, которые точно связываются с фосфотиоатными АСО – это альбумин и альфа-2-макроглобулин. Другой распространённый белок, кислый гликопротеин не связывает АСО [59]. Связывание с белками очень важно для распределения АСО в ткани-мишени. Химические структуры, уменьшающие связывание приводят к заметному снижению концентрации препарата в тканях, повышают степень его фильтрации через почечные клубочки и выведения с мочой. Это явление можно наблюдать при использовании АСО с диэфирными связями в скелете препарата или при наличии структуры МОЭ. Уменьшение сродства диэфиров и МОЭ-структур (или и то, и то) к белкам позволяет более свободно циркулировать АСО в кровотоке, приводя к интенсификации его выведения с мочой [24, 26].
Во всех исследованиях с парентерально введенными АСО первого и второго поколения, мы не наблюдали линейного клиренса АСО из плазмы. Клиренс уменьшался с увеличением дозы препарата, и, следовательно, его биодоступность была большей, чем можно было предположить исходя из введённой дозы [27, 28, 36, 46, 48, 50, 64]. Поскольку начальный клиренс обусловлен распределением АСО в тканях и при этом наблюдалось поглощение препарата тканями, можно предположить возможность их насыщения АСО. Изучение процесса насыщения в результате введений АСО может проводиться с использованием фагоцитов печени. Когда связывание АСО с клетками Купфера достигнет насыщения, начнётся уменьшение сродства. Последующее введение АСО мышам улучшает распределение АСО по не фагоцитарным клеткам печени, и в результате улучшается фармакологическая активность в гепатоцитах в сравнении с контролем. И, наоборот, при концентрации в плазме ниже 1 мкг/мл АСО активнее связываются с клетками Купфера, и меньше накапливаются в гепатоцитах.
Исследование процесса связывания АСО с белками плазмы показало, что этот эффект сопровождается быстрым распределением комплекса в тканях по поверхности клеток. Хотя точные механизмы клеточного связывания не установлены, можно предположить, что АСО связываются с белками плазмы или с клеточными белками, пока есть свободные участки связывания. Затем связанные АСО распределяются по градиенту концентрации через клеточную мембрану путём обмена внеклеточного белка на внутриклеточный.
Таким образом, движущей силой попадания АСО в клетки является градиент концентраций. Было описано челночное движение АСО между цитоплазмой и ядром [33, 34, 43]. В целом, является очевидным, что связывание с белками облегчает движение АСО через барьеры, которые обычно тормозят движение гидрофильных сильно заряженных молекул. Данный челночный механизм движения через мембраны остаётся гипотезой для АСО, но ранее он был описан для металлоорганических соединений [52]. Транспорт АСО из внеклеточного матрикса во внутриклеточное пространство был визуализирован на печени мышей при помощи иммуногистохимических методов [9] и на почках крыс с помощью витальной микроскопии с флуоресцентной меткой для АСО второго поколения (S. Henry, B. Molitoris).
Идентичность белков, контролирующих транспорт АСО из внеклеточного во внутриклеточное пространство не известна, однако считается, что связывание комплекса белок-АСО с клеткой осуществляется при помощи фагоцитарного рецептора [4]. Поскольку высоким сродством к АСО обладают фагоциты, такие как клетки Купфера, тканевые макрофаги и клетки проксимальных канальцев, можно думать о возможности нахождения таких рецепторов на их клеточной поверхности [9].
Тем не менее, клеточное распределение и фармакодинамика АСО у трансгенных мышей, лишённых фагоцитарного рецептора SR-A I/II не отличались от таковых показателей контрольных сингенных животных [7]. Таким образом, этот рецептор, известный как «рецептор для уборки мусора» (Scavenger receptor), по-видимому, не ответственен за поглощение комплекса печенью и почками. Роль других акцепторных структур, участвующих в процессах эндоцитоза комплекса АСО-белок, не изучена.
Мембранные белки, функционирующие как переносчики, присутствуют во всех организмах [25]. Основными переносчиками лекарственных средств являются: ABC (ATP-binding cassette transporters) и SLC (solute carrier family). Известно, что скорость переноса веществ через биологические мембраны с помощью процессов, опосредованных транспортёрами, характеризуется насыщаемостью. Описано несколько членов семейства SLC с известными функциями, в основном для переноса нуклеозидов, нуклеозид-сахаров и фосфат-сахаров. Есть мнение, что будущие исследования, скорее всего, будут касаться процессов межмембранного транспорта АСО.
Ясно, что помимо указанных выше отличий в накоплении создаваемых конструкций разными органами и тканями и зависимости клиренса и распределения таких соединений от их дозы, на распределение АСО в тканях оказывают влияние транспортные системы, особенности кровотока особей, возможное время нахождения препарата в организме и, наконец, насыщаемость тканей АСО. Несмотря на существенную роль указанных факторов в процессах тканевого распределения АСО, считается, что начальное связывание АСО с поверхностью клетки является одним из определяющих факторов в анализируемых механизмах. Такое заключение основывается на том, что печень и почки являются начальными участками связывания АСО с некоторым дополнительным накоплением в первые 24 часа после введения АСО [47]. При изучении параметров распределения АСО в печени и почках показано фракционное повышение концентрации препарата в органах в течение первых 24 часов. Это происходит в период клеточного и субклеточного перераспределения АСО [29], но предположительно, первичные органы распределения должны накапливать больше вещества с течением времени [45, 46, 48] из-за большего сродства этих органов к АСО. Белки, ответственные за это сродство могут содержать гепариноподобные участки связывания ламинина и фибриногена, и фактор роста фибробластов (FGF, Fibroblast growth factor) [2, 3, 30, 42]. Раннее взаимодействие АСО с клеткой может быть обусловлено связыванием этих белков, но природа этих белков, как отмечалось выше, изучена мало.
Рассматривая значимость сочетания специфических участков связывания АСО с клетками в распределении препарата в организме, следует отметить и такой важный фактор, как различное кровоснабжение разных органов, возможность которого влиять на различное распределение фосфотиоатных АСО очевидна. По данным разных авторов, работа с десятками серий веществ как первого, так и второго поколений свидетельствует об их сходном распределении, и заметно подобном распределении у особей различных видов. Почки, печень, лимфатические узлы, селезёнка и костный мозг – это органы, накапливающие самое большое количество АСО и их метаболитов. То, что лёгкие и сердце не накапливают АСО, свидетельствует о том, что для объяснения выраженного накопления АСО в печени и почках недостаточно только одного объяснения об их хорошем кровоснабжении. Например, участки с наилучшим кровообращением в почках – это клубочки, а они не являются участками, содержащими большее количество АСО. Напротив, в проксимальных канальцах кровообращение менее активно. Однако клетки проксимальных канальцев характеризуются большим количеством активно фагоцитирующих клеток, накапливают свободные АСО, а так же АСО, связанные с белками, которые обычно реабсорбируются в проксимальных канальцах [49]. В результате почечная кора и эпителий проксимальных канальцев содержат самую высокую концентрацию фосфотиоатных АСО, как первого, так и второго поколения.
Следует отметить также, что кровоснабжение (мл/г ткани) печени составляет примерно 20% от почечного. 4-5-кратные различия в перфузии между почками и печенью не приводят к 4-5-кратным различиям в концентрации АСО в этих органах. Окончатые капилляры увеличивают площадь соприкосновения АСО с кровотоком и, следовательно, это может компенсировать недостаточную перфузию печени относительно почек.
Связывание АСО с белками плазмы при распределении
Хотя насыщение клеток АСО в конечном счёте влияет на их распределение в органах, связывание АСО с белками плазмы может изменять распределение в почках и печени в различных сериях. Существуют посерийные различия в связывании с белками. При снижении связывания АСО с белками плазмы происходит уменьшение их накопления в печени и повышение их накопления в почках. И, наоборот, при более высоком связывании, концентрация АСО в свободном виде в кровотоке будет находиться в меньшем количестве, меньше накапливаться в почках и больше в других органах. Существует обратная зависимость между степенью связывания АСО с белком и накоплением их в почках крыс и обезьян после повторяющегося внутривенного и подкожного введения.
Связывание с белками может быть использовано как критерий выбора АСО для клинических исследований. К настоящему времени, определение связывания с белками – это эмпирический процесс без возможности предсказать, какая серия будет связываться с белками больше или меньше.
Распределение АСО по другим органам
Независимо от последовательности распределения фосфотиоатных АСО первого и второго поколения, наблюдается характерная картина локализации этих препаратов в почках и печени, а также в селезёнке и лимфатических узлах, кости и в цитоплазме адипоцитов [10-12]. Накопление АСО в лимфоидной ткани можно объяснить отчасти фагоцитарной активностью гистиоцитов и других мононуклеарных клеток. Возможно, визуализировать АСО в фаголизосомах гистиоцитов и тканях макрофагов при помощи гематоксилинового окрашивания. Показано, что АСО подвергаются эндоцитозу, локализуются в эндосомах и сохраняются в пределах этих структур. Концентрация АСО в фаголизосомах часто такова, что её возможно определить методом окрашивания гематоксилином (почти как ядерную ДНК). АСО в фаголизосомах вероятно составляет большую часть АСО, накопленных в селезёнке и лимфоидных органах. Кроме того, фагоцитарно активные клетки костей и костного мозга накапливают АСО в этих тканях, что подтверждается наличием базофильных гранул в их клетках.
Мышцы (как скелетные, так и сердечные) не содержат значительного количества АСО. Тем не менее, внимательное изучение мышц с использованием иммуногистохимических или авторадиографических методов показывает содержание АСО в фаголизосомах макрофагов стромы мышц и это накопление может частично отразиться и на измерении концентрации АСО в мышцах и сердце.
Накопление АСО в цитоплазме адипоцитов значимо с терапевтической точки зрения. Особенно потому, что в отличие от большинства накапливаемых в адипоцитах веществ, АСО гидрофильны. Иммуногистохимические методы ясно показывают, что АСО находятся в цитоплазматической фракции адипоцитов, при этом АСО почти нет в жировой вакуоли. Интенсивность окрашивания указывает на значительное накопление вещества в цитоплазме. Например, у обезьян после 13 недель лечения препаратом ISIS 113715 в дозе 10 мг/кг/неделя концентрация в печени составила 301 ± 88,1 мкг/г, но только 37,3 ± 14,4 мкг/г в жировой ткани у тех же животных.
Учитывая, что нежировой компонент составляет 10% от общей жировой массы, коррекция концентрации АСО с учётом этого показателя свидетельствует о сопоставимости его концентрации с таковой в печени. Значительные концентрации АСО в адипоцитах показывают, что их можно использовать для лечения генетических заболеваний клеток этого типа: источников гормонов и цитокинов. Так, установлено, что фармакологически активные концентрации АСО регистрируются в адипоцитах мышей при введении препарата ISIS 113715 в дозе 25 мг/кг дважды в неделю и снижают экспрессию гена-мишени PTP-1B как в печени, так и в адипоцитах [68]. Аналогичные наблюдения были сделаны у обезьян, получавших АСО ISIS 113715. Поскольку биопсию подкожного жира можно провести в клинических условиях и так как активные АСО накапливаются в жире, то можно использовать жир для биопсии и непосредственного измерения фармакологических эффектов (снижение мРНК) и тканевой концентрации препарата в тканях человека.
Фосфотиоатные АСО распределяются и в другие ткани. Иммуногистохимические исследования показывают, что эндотелиальные клетки накапливают АСО в концентрациях, значительных для уменьшения уровня мРНК, делая их потенциальной мишенью для фармакологического воздействия [9, 4]. В некоторых тканях их концентрации не достаточно велики для фармакологического эффекта. Например, зрелые лимфоциты не накапливают АСО, а антисмысловая активность проявляется T-клетками ограниченно.
Костные клетки, особенно фагоцитарно активные остеобласты, могут накапливать АСО и этот эффект может быть использован в терапевтических целях. Кроме того, клетки островков поджелудочной железы также накапливают АСО. АСО как первого, так и второго поколения являются сильно заряженными гидрофильными молекулами, которые не проникают через гемато-энцефалический или гемато-тестикулярный барьеры. Однако, как и в мышцах, в интерстициальном участке яичек локализуются макрофаги, содержащие обнаруживаемые АСО. Яичники не отделены барьером, вследствие этого АСО можно количественно измерить в яичниках и визуализировать иммуногистохимическими методами в строме.
Ограниченное распределение АСО из плазмы крови в клетки мозга и кардиомиоциты делает эти ткани маловероятными мишенями антисмыслового вмешательства, несмотря на то, что селективное ингибирование или экспрессия некоторых белков ионных каналов в головном мозге и мышцах могут быть терапевтически полезны. Тем не менее, ограниченное распределение АСО в этих тканях можно рассматривать как преимущество. Отсутствие значительных концентраций АСО в мозге и сердце уменьшает риск поражения центральной нервной системы (ЦНС) и снижает проявление нежелательных сердечных эффектов. Как отмечалось ранее, прямое введение в структуры ЦНС, в частности, в головной мозг, с помощью интратекальной, внутрижелудочковой инфузии или инъекции вызывает распределение АСО в пределах центральной нервной системы и может быть полезно терапевтически [8, 32].
При беременности плод достаточно хорошо защищен от воздействия антисмысловых препаратов. Изучение трансплацентарной кинетики АСО не выявило его накопления в плоде, отмечен низкий уровень АСО у грызунов в плаценте [13, 31, 53]. Эти результаты были последовательно воспроизведены при исследовании тератогенности различных АСО второго поколения на мышах, крысах и кроликах. Плацента, несмотря на высокую перфузию, не является органом с высоким накоплением АСО [31, 53, 62].
В целом, представленные факты показывают, что распределение АСО является одним из ключевых факторов, который определяет выраженность активности АСО. Отличия в распределении АСО, как представляется, связаны в значительной степени с тропностью тканей для этих препаратов и, в меньшей степени, с перфузией.
Метаболизм
Антисмысловые препараты первого и второго поколения метаболизируются нуклеазами, а не системами оксидаз типа цитохрома P450, с помощью которого метаболизируются обычные липофильные низкомолекулярные препараты. АСО не являются ни субстратом изоферментов цитохрома P450, и не индуцируют или ингибируют его активность в клинически значимых концентрациях. Опосредованное экзонуклеазами расщепление АСО, которое является основным путём метаболизма и клиренса фосфотиоатных ОДН первого поколения, вторично для АСО второго поколения. Ограничивают экзонуклеазную активность два фрагмента: один МОЭ на 3′-конце и другой МОЭ на 5′-конце.
Ферменты, ответственные за метаболизм АСО
Специфические ферменты, метаболизирующие АСО второго поколения не известны. Нуклеазы являются повсеместно распределёнными и есть возможность определить расщеплённые метаболиты АСО в большинстве тканей. Печеночный и почечный гомогенаты – оба способны метаболизировать АСО второго поколения in vitro без добавления экзогенных источников энергии, таких как никотинамидадениндинуклеотидфосфат (NADPH) или аденозин-5-трифосфат (АТФ). Начальное расщепление приводит к образованию двух продуктов, каждый из которых характеризуется защищённым MOE концом 5′ и 3′. Эти метаболиты не связываются с белками, и, таким образом, выводятся из тканей. Поскольку метаболиты удаляются быстрее, чем они образуются, накопление метаболитов в тканях практически не происходит. Таким образом, не представляется возможным использовать определение количества метаболитов в ткани, как индекса метаболизма АСО в тканях.
Поскольку скорость выведения АСО из тканей зависит от их метаболизма, то различия в метаболизме АСО в различных тканях могут быть оценены на основе периода полувыведения этих препаратов из характеризуемых тканей. На основе данных для четырёх АСО второго поколения, заключено, что поведение членов этого класса сходно, однако прослеживаются небольшие различия в периоде их полувыведения из печени и почек обезьян, получавших препарат в течение 4-13 недель. Показано, что период полувыведения препаратов АСО ISIS 104838 и 112989 из печени и почек весьма сходен. Эти данные дают возможность предположить, что для некоторых серий АСО не существует значительных различий в скорости метаболизма в различных органах. Однако различия в тканевом периоде полувыведения выявлены для препаратов ISIS 107248, 113715, а также 301012. Обнаруженные различия в скорости метаболизма препаратов АСО в печени и почках показывают, что в разных тканях могут быть различия в скорости метаболизма, или имеет место более сложная кинетика для некоторых серий препарата, или полученные результаты просто отражают небольшое количество образцов, взятых в течение ограниченного времени.
Детальное исследование процесса выведения АСО второго поколения показывает наличие разных темпов их выведения из различных типов клеток печени [63, 67]. Поскольку некоторые типы клеток, такие как клетки проксимальных канальцев коркового слоя почки, как правило, содержат АСО в фаголизосомах, этот тип поглощения, вероятно, определяет различия в метаболических скоростях препарата в разных тканях. Кроме того, вполне вероятно, что специфические последовательности в строении скелета АСО могут характеризоваться различной чувствительностью к расщеплению эндонуклеазами.
Бактериальные экзонуклеазы проявляют высокую степень специфичности к последовательности нуклеотидов в скелете АСО предположительно для защиты от вирусов. Большая часть активности нуклеаз в клетках млекопитающих связана с механизмами транскрипции и репарации ДНК, и, таким образом, видовая специфичность млекопитающих может отличаться от таковых бактериальных эндонуклеаз. Не известно, одинаково ли ответственны за катаболизм этих синтетических АСО процессы репликации и действие ферментов, связанных с явлением репарации. При высоких концентрациях оцДНК [61], АСО могут эффективно конкурировать с природным субстратом. Множество ферментов семейства нуклеаз способны катаболизировать АСО. Определение специфических ферментов, участвующих в метаболизме АСО не критично для развития антисмысловых препаратов, но, более глубокое понимание метаболических путей будет полезно для развития новых технологий.
Метаболиты АСО
Различия в метаболизме АСО первого и второго поколений весьма очевидны при сравнении метаболического профиля с КГЭ. Когда образцы ткани или мочи анализируются в детекторе LC/MS, характер метаболических процессов становится более ясным [24]. Как правило, фосфоротиоатные ОДН первого поколения метаболизируются в каскад метаболитов АСО, каждый из которых отличается на один нуклеотид в результате однонуклеотидных расщеплений экзонуклеазой. Так, после введения 20-mer, то есть состоящего из 20 нуклеотидов, ОДН первого поколения плазма и ткани содержат семейства последовательно сокращенных АСО, начиная с 19-mer и далее вплоть до короткого АСО.
Исходное расщепление в метаболизме АСО второго поколения, опосредованное
эндонуклеазами, приводит к образованию двух АСО, один с 3′-концом MOЭ и другой с 5′-концом MOЭ. Расщепление продуктов с незащищёнными концами, может проводиться либо 5′-экзонуклеазой или 3′-экзонуклеазой. Результаты комбинированной эндо- и экзонуклеазной активности – это каскад цепочечно сокращённых продуктов расщепления, многие, если не все, из которых могут быть выявлены в моче, собранной у обследуемых животных или людей. Моча животных, принимавших препарат, или пациентов, лечившихся АСО второго поколения, может содержать метаболиты, которые варьируются от двух возможных 15-mer до двух возможных MOЭ 5-mer и множественных комбинаций каждого из промежуточных метаболитов [24].
Метаболиты короче, чем длина концов MOЭ будут присутствовать в тканях, если концы MOЭ сами являются субстратами для нуклеаз. Эти метаболиты обычно не определяются при масс-спектральном анализе, что наводит на мысль, что как правило, нет мононуклеотидов MOЭ, выделяющихся в процессе метаболизма. Тем не менее, некоторые исключения из этого обобщения имеют место. Для ограниченного числа последовательностей нуклеотидов, наблюдаются однонуклеотидные обрезки АСО второго поколения в тканях и плазме – либо КГЭ или LC/MS: метаболиты, по-видимому, были результатом экзонуклеазного расщепления. Эти метаболиты могут наблюдаться в начальном распределении. Предполагается, что они быстро появляются в плазме крови. MOЭ-мононуклеотиды, которые образуются в процессе метаболизма, не являются субстратами для фосфорилирования, и таким образом, вряд ли будут включены в нуклеотидтрифосфаты и, в конечном счёте, в эндогенные нуклеотиды. MOЭ-мононуклеотиды не ингибируют ферменты, ответственные за синтез ДНК. Таким образом, MOЭ-мононуклеотиды, если они образовались, не должны встраиваться в эндогенные нуклеотиды.
Центральная часть дезоксинуклеотидов АСО второго поколения подлежит экзонуклеазному расщеплению, что приводит к высвобождению одного нуклеотида. Монодезоксинуклеотиды, которые получаются путём экзонуклеазного расщепления, идентичны эндогенным нуклеотидам, за исключением тиофосфатной группы, которая может теоретически присутствовать. Тем не менее, тиофосфатная группа лабильна к окислению и к утрате серы, что делает группу концевого фосфата идентичной эндогенным нуклеотидам. Поэтому, в отличие от MOЭ-мононуклеотидов, любой высвобождённый дезоксинуклеотид будет естественно включён во внутриклеточное депо эндогенных нуклеотидов. Нуклеотиды, которые сохраняют тиофосфатные группы, будут субстратами для добавления одной или двух фосфатных групп, в результате чего получаются смешанные тиофосфатные ди- или трифосфаты нуклеотида. Фосфорилирование возможно, но присутствие альфа тиофосфата делает реакции термодинамически неблагоприятными [41].
Заключение
Очевидна актуальность исследования фармакокинетики данных и схожих с описанными препаратов, а так же создание моделей на различных видов животных для полного понимания процессов протекающих в организме после приема препаратов. В России так же ведутся исследования подобных препаратов.
1. Adjei A.A., Dy G.K., Erlichman C. et al. A phase I trial of ISIS 2503, an antisense inhibitor of H-ras, in combination with gemcitabine in patients with advanced cancer. // Clin. Cancer Res. 2003. Vol. 9, №1. P. 115.
2. Benimetskaya L., Loike J.D., Loike G. et al. Mac-1 (CD11b/CD18) is an ODN-binding protein. // Nat. Med. 1997. Vol. 3, №4. P. 414.
3. Benimetskaya L., Tonkinson J.L., Koziolkiewicz M. et al. Binding of phosphorothioate ODNs to basic fibroblast growth factor, recombinant soluble CD4, laminin and fibronectin in P-chirality independent. // Nucl. Acids Res. 1995. Vol. 23, №21. P. 4239.
4. Bijsterbosch M.K., Manoharan M., Rump E.T. et al. In vitro fate of phosphorothioate antisense ODNs: predominant uptake by scavenger receptors on endothelial cells. // Nucl. Acids Res. 1997. Vol. 25, №16. P. 3290.
5. Bijsterbosch M.K., Rump E.T., De Vrueh R.L. et al. Modulation of plasma protein binding and in vitro liver cell uptake of phosphorothioate ODNs by cholesterol conjugation. // Nucl. Acids Res. 2000. Vol. 28, № 14. P. 2717.
6. Brown D.A., Kang S.H., Gryaznov S.M. et al. Effect of phosphorothioate modification of ODNs on specific protein binding. // J. Biol. Chem. 1994. Vol. 269, №43. Р. 26801.
7. Butler M., Crooke R.M., Graham M.J. et al. Phosphorothioate ODNs distribute similarly in class A scavenger receptor knockout and wild-type mice. // J. Pharmacol. Exp. Ther. 2000. Vol. 292, №2. P. 489.
8. Butler M., Hayes C.S., Chappell A., Murray S.F., Yaksh T.L., Hua X.Y. Spinal distribution and metabolism of 2_-O-(2-methoxyethyl)-modified ASOs after intrathecal administration in rats. // Neuroscience. 2005. Vol. 131, №3. P. 705.
9. Butler M., Stecker K., Bennett C.F. Cellular distribution of phosphorothioate ODNs in normal rodent tissues. // Lab. Invest. 1997. Vol. 77, №4. P. 379.
10. Cossum P.A., Sasmor H., Dellinger D. et al. Disposition of the 14C-labeled phosphorothioate ASO ISIS 2105 after intravenous administration to rats. // J. Pharmacol. Exp. Ther. 1993. Vol. 267, №3. P. 1181.
11. Cossum P.A., Troung L., Owens S.R. et al. Pharmacokinetics of a 14C-labeled phosphorothioate ASO, ISIS 2105, after intradermal administration to rats. // J. Pharmacol. Exp. Ther. 1994. Vol. 269, №1. P. 89.
12. Crooke S.T., Graham M.J., Zuckerman J.E. et al. Pharmacokinetic properties of several novel ASO analogs in mice. // J. Pharmacol. Exp. Ther. 1996. Vol. 277, №2. P. 923.
13. Driver S.E., Robinson G.S., Flanagan J., Shen W., Smith L.E.H., Thomas D.W., Roberts P.C. ASO-based inhibition of embryonic gene expression. // Nat. Biotechnol. 1999. Vol. 17. P. 1184.
14. Eckstein F. Phosphorothioate ODNs: what is their origin and what is unique about them? //Antisense Nucl. Acid Drug Dev. 2000. Vol. 10, №2. Р. 117.
15. Gaus H.J., Owens S.R., Winniman M., Cooper S., Cummins L.L. On-line HPLC electrospray mass spectrometry of phosphorothioate ASO metabolites. // Anal. Chem. 1997. Vol. 69, №3. P. 313.
16. Geary R.S. Current assessment of PK/PD relationships for antisense therapeutics. // World Congress of Pharmacy and Pharmaceutical Sciences, Nice, France, 2002.
17. Geary R.S., Bradley J.D., Watanabe T. et al. Lack of pharmacokinetic interaction for ISIS 113715, a 2_-O-methoxyethyl modified antisense oligonucleotide targeting protein tyrosine phosphatase 1B messenger RNA, with oral antidiabetic compounds metformin, glipizide or rosiglitazone. // Clin. Pharmacokinet. 2006. Vol. 45, №8. P. 789.
18. Geary R.S., Leeds J.M., Fitchett J. et al. Pharmacokinetics and metabolism in mice of a phosphorothioate ASO antisense inhibitor of C-raf-1 kinase expression.// Drug Metab. Dispos. 1997. Vol. 25, №11. Р. 1272.
19. Geary R.S., Leeds J.M., Henry S.P., Monteith D.K., Levin A.A. Antisense oligonucleotide inhibitors for the treatment of cancer: 1. Pharmacokinetic properties of phosphorothioate ODNs. // Anticancer Drug Des. 1997. Vol. 12, №5. Р. 383.
20. Geary R.S., Leeds J.M., Shanahan W. et al. Sequence independent plasma and tissue pharmacokinetics for 3 antisense phosphorothioate ASOs: mouse to man. // in American Association of Pharmaceutical Scientists, Pharm. Research, Plenum Press, Seattle, Washington. 1996. Р. S.
21. Geary R.S., Teng C.L., Truong L. et al. First pass hepatic extraction of a partially modified chimeric antisense oligonucleotides in Beagle dogs. // in Annual Meeting of the American Association of Pharmaceutical Scientists, Indianapolis, IN, 2000. P. 216.
22. Geary R.S., Ushiro-Watanabe T., Truong L et al. Pharmacokinetic properties of 2_-O-(2-methoxyethyl)-modified ASO analogs in rats. // J. Pharmacol. Exp. Ther. 2001. Vol. 296, №3. Р. 890.
23. Geary R.S., Yu R.Z., Levin A.A. Pharmacokinetics of phosphorothioate antisense ODNs. // Curr. Opin. Invest. Drugs. 2001. Vol. 2, №4. Р. 562.
24. Geary R.S., Yu R.Z., Watanabe T. et al. Pharmacokinetics of a tumor necrosis factor-alpha phosphorothioate 2_-O-(2-methoxyethyl) modified antisense oligonucleotides: comparison across species. // Drug Metab. Dispos. 2003. Vol. 31, №11. P. 1419.
25. Giacomini K.M., Sugiyama Y. Membrane transporters and drug response, in Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 11th ed., Brunton, L.L., ed., McGraw-Hill, New York, 2006. P. 41.
26. Gleave M., Chi K.N. Knock-down of the cytoprotective gene, clusterin, to enhance hormone and chemosensitivity in prostate and other cancers. // Ann. NY Acad. Sci. 2005. Vol.1058. P. 1.
27. Gleave M., Miyake H. Use of antisense oligonucleotides targeting the cytoprotective gene, clusterin, to enhance androgen- and chemo-sensitivity in prostate cancer. // World J. Urol. 23. 2005. №1. P. 38.
28. Glover J.M., Leeds J.M., Mant T.G. et al. Phase I safety and pharmacokinetic profile of an intercellular adhesion molecule-1 antisense ODN (ISIS 2302). // J. Pharmacol. Exp. Ther. 1997. Vol. 282, №3. Р. 1173.
29. Graham M.J., Crooke S.T., Monteith D.K. et al. In vitro distribution and metabolism of a phosphorothioate ASOwithin rat liver after intravenous administration. // J. Pharmacol. Exp. Ther. 1998. Vol. 286, №1. P. 447.
30. Guvakova M.A., Yakubov L.A., Vlodavsky I., Tonkinson J.L., Stein C.A. Phosphorothioate ODNs bind to basic fibroblast growth factor, inhibit its binding to cell surface receptors, and remove it from low affinity binding sites on extracellular matrix. // J. Biol. Chem. 1995. Vol. 270. P.2620.
31. Henry S.P., Denny K.H., Templin M.V., Yu R.Z., Levin A.A. Effects of human and murine antisense oligonucleotide inhibitors of ICAM-1 on reproductive performance, fetal development, and post-natal development in mice. // Birth Defects Res. B Dev. Reprod. Toxicol. 2004. Vol. 71, №6. P. 359.
32. Hua X.Y., Moore A., Malkmus S. et al. Inhibition of spinal protein kinase C alpha expression by an antisense oligonucleotide attenuates morphine infusion-induced tolerance. // Neuroscience. 2002. Vol. 113, №1. P. 99.
33. Jackson J.K., Gleave M.E., Gleave J., Burt H.M. The inhibition of angiogenesis by antisense oligonucleotides to clusterin. // Angiogenesis. 2005. Vol. 8, №3. P. 229.
34. Kastelein J.J.P., Wedel M.K., Baker B.F. et al. Potent reduction of apolipoprotein B and Low-density lipoprotein cholesterol by short-term administration of an antisense inhibitor of apolipoprotein B. // Circulation. 2006. Vol. 114, №16. P. 1729.
35. Koziolkiewicz M., Krakoviak A., Kwinkowski M., Boczkowska M., Stec W.J. Stereodifferntiation — the effect of P chirality of oligo(nucleoside phosphorothioates) on the activity of bacterial RNase H. // Nucl. Acids Res. 1995. Vol.23, №24. Р. 5000.
36. Leeds J.M., Geary R.S. Pharmacokinetic properties of phosphorothioate ASOs in humans, in Antisense Research and Applications, 1st ed., Crooke, S. T., ed., Springer, Heidelberg, 1998. P. 217.
37. Leeds J.M., Henry S.P., Geary R.S., Burckin T.A., Levin A.A. Comparison of the pharmacokinetics of subcutaneous and intravenous administration of a phosphorothioate oligodeoxynucleotide in cynomolgus monkeys. // Antisense Nucl. Acid Drug Dev. 2000. Vol.10, №6. Р. 435.
38. Levin A.A. A review of issues in the pharmacokinetics and toxicology of phosphorothioate antisense oligonucleotides. // Biochim. Biophys. Acta. 1999. Vol.1489, №1. Р. 69.
39. Levin A.A., Geary R.S., Leeds J.M. et al. The pharmacokinetics and toxicity of phosphorothioate ASOs, in Biotechnology and Safety Assessment, 2nd ed., Thomas, J. A., ed., Taylor & Francis, Philadelphia, PA, 1998. Р. 151.
40. Levin A.A., Henry S.P., Bennett C.F. et al. Preclinical development of antisense therapeutics, in Novel Therapeutics from Modern Biotechnology: From Laboratory to Human Testing, 1st ed., Oxender D.L. and Post L.E., eds., Springer-Verlag, Heidelberg, Germany, 1998. Р. 131.
41. Levin A.A., Henry S.P., Monteith D., Templin M. Toxicity of antisense oligonucleotides. // in Antisense Drug Technology, Crooke, S. T., ed., Marcel Dekker, New York, 2001. P. 201.
42. Loke S.L., Stein C.A., Zhang X.H. et al. Characterization of ASO transport into living cells. // Proc. Natl. Acad. Sci. USA. 1989. Vol. 86. P. 3474.
43. Lorenz P., Misteli T., Baker B.F., Bennett C.F., Spector D.L. Nucleocytoplasmic shuttling: a novel in vitro property of antisense phosphorothioate ODNs. // Nucl. Acids Res. 2000. Vol. 28, №2. P. 582.
44. Miner P.B., Geary R.S., Matson J. et al. Bioavailability and therapeutic activity of alicaforsen (ISIS 2302) administered as a rectal retention enema to subjects with active ulcerative colitis. // Ailment Pharmacol. Ther. 2006. Vol. 23, №10. Р. 1427.
45. Mou T.C., Gray D.M. The high binding affinity of phosphorothioate-modified oligomers for Ff gene 5 protein is moderated by the addition of C-5 propyne or 2_-O-methyl modifications. // Nucl. Acids Res. 2002. Vol. 30, №3. Р. 749.
46. Nicklin P.L., Craig S.J., Phillips J.A. Pharmacokinetic properties of phosphorothioates in animals—absorption, distribution, metabolism and elimination, in Antisense Research and Applications, 1st ed., Crooke, S. T., ed., Springer, Berlin, 1998. P. 141.
47. Peng B., Andrews J., Nestorov I. et al. Tissue distribution and physiologically based pharmacokinetics of antisense phosphorothioate ASO ISIS 1082 in rat. // Antisense Nucl. Acid Drug Dev. 2001. Vol. 11, №1. P. 15.
48. Phillips J.A., Craig S.J., Bayley D. et al. Pharmacokinetics, metabolism and elimination of a 20-mer phosphorothioate ODN (CGP 69846A) after intravenous and subcutaneous administration. // Biochem. Pharmacol. 1997. Vol. 54, №6. Р. 657.
49. Sawai K., Mahato R.I., Oka Y., Takakura Y., Hashida M. Disposition of ASOs in isolated perfused rat kidney: involvement of scavenger receptors in their renal uptake. // J. Pharmacol. Exp. Ther. 1996. Vol. 279, №1. P. 284.
50. Sewell L.K., Geary R.S., Baker B.F. et al. Phase I trial of ISIS 104838, a 2_-methoxyethyl modified antisense oligonucleotides targeting tumor necrosis factor-alpha. // J. Pharmacol. Exp. Ther. 2002. Vol. 303, №3. Р. 1334.
51. Slim G., Gait M.J. Configurationally defined phosphorothioate-containing oligoribonucleotides in the study of the mechanism of cleavage of hammerhead ribozymes. // Nucl. Acids Res. 1991. Vol. 19, №6. Р. 1183.
52. Snyder R.M., Mirabelli C.K., Crooke S.T. Cellular association, intracellular distribution, and efflux of auranofin via sequential ligand exchange reactions. // Biochem. Pharmacol. 1986. Vol. 35, №6. P. 923.
53. Soucy N.V., Riley J.P., Templin M.V. et al. Maternal and fetal distribution of a phosphorothioate ASO in rats after intravenous infusion. // Birth Defects Res. B Dev. Reprod. Toxicol. 2006. Vol. 77, №1. P. 22.
54. Spitzer S., Eckstein F. Inhibition of deoxyribonucleases by phosphorothioate groups in oligodeoxyribonucleotides. // Nucl. Acids Res. 1988. Vol. 16, №24. Р. 11691.
55. Stavchansky S., Geary R.S., Cho M. Pharmacokinetics and hepatic first pass effect of an antisense oligonucleotide (ISIS 2302) in rats. // in Annual Meeting of the American Association of Pharmaceutical Scientists, Indianapolis, IN, 2000. P. 216.
56. Templin M.V., Levin A.A., Graham M.J. et al. Pharmacokinetic and toxicity profile of a phosphorothioate ASO following inhalation delivery to lung in mice. // Antisense Nucl. Acid Drug Dev. 2000. Vol. 10, №5. Р. 359.
57. Teplova M., Minasov G., Tereshko V. et al. Crystal structure and improved antisense properties of 2_-O-(2-methoxyethyl)-RNA. // Nat. Struct. Biol. 1999. Vol.6, №6. Р.535.
58. Villalona-Calero M.A., Ritch P., Figueroa J.A. et al. A phase I/II study of LY900003, an antisense inhibitor of protein kinase C-alpha, in combination with cisplatin and gemcitabine in patients with advanced non-small cell lung cancer. // Clin. Cancer Res. 2004. Vol. 10, №18 Pt 1. P. 6086.
59. Watanabe T.A., Geary R.S., Levin A.A. Plasma protein binding of an antisense oligonucleotide targeting human ICAM-1 (ISIS 2302). // ASOs. 2006. Vol. 16, №2. P. 169.
60. White A.P., Reeves K.K., Snyder E. et al. Hydration of single-stranded phosphodiester and phosphorothioate oligodeoxyribonucleotides. // Nucl. Acids Res. 1996. Vol. 24, №16. Р. 3261.
61. Wilson D.M. 3rd, Ape1 abasic endonuclease activity is regulated by magnesium and potassium concentrations and is robust on alternative DNA structures. // J. Mol. Biol. 2005. Vol. 345, №5. P. 1003.
62. Yu D., Kandimalla E.R., Roskey A. et al. Stereo-enriched phosphorothioate ODNs: synthesis, biophysical and biological properties. // Bioorg. Med. Chem. 2000. Vol.8, №1. Р. 275.
63. Yu R.Z., Baer B., Chappel A. et al. Development of an ultrasensitive noncompetitive hybridization-ligation enzyme-linked immunosorbent assay for the determination of phosphorothioate ODN in plasma. // Anal. Biochem. 2002. Vol. 304, №1. P. 19.
64. Yu R.Z., Geary R.S., Leeds J.M. et al. Comparison of pharmacokinetics and tissue disposition of an antisense phosphorothioate ASO targeting human Ha-ras mRNA in mouse and monkey. // J. Pharm. Sci. 2001. Vol. 90, №2. P. 182.
65. Yu R.Z., Geary R.S., Levin A.A. Application of novel quantitative bioanalytical methods for pharmacokinetic and pharmacokinetic/ pharmacodynamic assessments of antisense oligonucleotides. // Curr. Opin. Drug Discov. Dev. 2004. Vol. 7, №2. Р. 195.
66. Yu R.Z., Kim T.W., Hong A. et al. Cross species pharmacokinetic comparison from mouse to man of a second generation antisense oligonucleotide ISIS 301012, targeting human apolipoprotein B-100. // Drug Metab. Dispos. 2007. Vol. 35. P. 460.
67. Yu R.Z., Zhang H., Geary R.S. et al. Pharmacokinetics and pharmacodynamics of an antisense phosphorothioate ASO targeting Fas mRNA in mice. // J. Pharmacol. Exp. Ther. 2001. Vol. 296, №2. P. 388.
68. Zinker B.A., Rondinone C.M., Trevillyan J.M. et al. PTP1B antisense oligonucleotide lowers PTP1B protein, normalizes blood glucose, and improves insulin sensitivity in diabetic mice. // Proc. Natl. Acad. Sci. USA. 2002. Vol. 99, №17. P. 1137.
В РХТУ придуман способ безопасной переработки серы – Наука – Коммерсантъ
Сера — необходимый компонент при производстве резины, косметики, лекарств, дезинфицирующих средств, удобрений. В природе она часто встречается в виде кольцевидной структуры из восьми атомов. Чтобы ее использовать для изготовления продукции, кольцо атомов необходимо раскрыть, что сейчас чаще всего делают при помощи нагрева и последующего охлаждения. Ученые РХТУ им. Д. И. Менделеева предложили более экологичный и экономичный способ, показав, что кольца серы можно раскрывать за счет реакций с ионными жидкостями. В перспективе этот метод можно использовать для переработки серных отвалов на предприятиях.
Все известные сегодня способы, которыми кольцо атомов самородной серы можно превратить в цепочку, энергозатратны. В самом распространенном из них минерал нагревают до температуры 160–200 градусов, а затем опускают в холодную воду. При нагреве серное кольцо раскрывается, и его мономеры полимеризуются в цепочку, после чего сера приобретает способность образовывать новые соединения с другими веществами. К примеру, именно в таком раскрытом виде ее используют в процессе вулканизации натурального или синтетического каучуков для изготовления резины. В промышленности на такие процессы уходит значительное количество энергии: для производства одной тонны полимерной серы нужно примерно 10 куб. м природного газа.
Кроме того, при нагреве выделяется токсичный сероводород.
Разработка альтернативных способов раскрытия серного кольца связана с поиском нуклеофильных или электрофильных соединений-активаторов, способных образовывать связи с кольцевой восьмиатомной молекулой серы. В последнее время появляется все больше работ, где ученые подбирают новые реагенты для раскрытия серного кольца без нагрева. Химики из РХТУ им. Д. И. Менделеева предложили использовать в этом процессе ионные жидкости — расплавы солей при температурах ниже 100 градусов Цельсия, состоящие исключительно из ионов. Ионные жидкости изучают в науке несколько десятилетий, с ними связывают будущее зеленой химии — без токсичных растворителей. Химические свойства ионных жидкостей исследованы еще недостаточно, а для раскрытия серного кольца их никогда не применяли.
«Предположение, что ионные жидкости могут вступать в реакцию с элементной серой, у нас возникло, когда мы изучали их химию,— рассказывает один из авторов работы, сотрудник РХТУ Ефрем Кривобородов.— Это полярные соединения с локализованными в некоторых случаях зарядами, и в зависимости от структуры анионов или катионов возможно проявление их нуклеофильных свойств по отношению к определенным веществам. Отсюда и предположение о возможной реакции серы и ионной жидкости. Получилось, что, интегрировав знания по химии серы и химии ионных жидкостей, мы получили совершенно новые результаты, ранее не описанные».
Базовые принципы зеленой химии предполагают учет энергетических затрат и их влияние на окружающую среду, синтез при температуре, близкой к комнатной, а также использование безопасных растворителей. Эксперименты с ионными жидкостями и элементарной серой как раз проходили при комнатной температуре без дополнительного подвода энергии. Серу сначала растворяли в бензоле, затем в этот раствор добавляли ионную жидкость (в одном случае брали фосфониевую ионную жидкость, в другом — имидазолиевую) и перемешивали компоненты на магнитной мешалке. Вещества вступали во взаимодействие в результате нуклеофильного присоединения отрицательно заряженных анионов ионной жидкости к цепочке атомов серы, и раскрывалось серное кольцо. Продукт — полимерную серу — в растворе идентифицировали с помощью метода ядерно-магнитного резонанса.
«Этого оказалось достаточно, чтобы охарактеризовать состав продукта и подтвердить предположение о механизме реакции. Также мы еще провели теоретические вычисления (квантово-химические расчеты), которые подтвердили наши предположения. В дальнейших исследованиях будем варьировать концентрации реагентов для определения кинетики реакции»,— поясняет Ефрем Кривобородов.
По подсчетам исследователей, предложенный способ синтеза значительно сокращает энергозатраты на получение высокомолекулярных серосодержащих соединений. Теперь на основе этого метода авторы планируют разработать методики синтеза органических полимеров, отвечающие принципам зеленой химии. Также эксперимент с серой позволил глубже исследовать фундаментальные свойства ионных жидкостей, в частности их способность вступать в реакцию с другими простыми веществами и устойчивость под воздействием излучения высоких энергий.
Кроме того, новая технология может быть востребована в производстве для безопасной переработки элементной серы в отвалах, которые скапливаются сотнями тысяч тонн на предприятиях очистки нефти и природного газа, загрязняя окружающую среду.
РХТУ им. Д. И. Менделеева — опорный университет химической отрасли России, работа которого направлена не только на получение новых знаний, но и на внедрение их в промышленность. Исследование проведено сотрудниками и студентами кафедр ЮНЕСКО «Зеленая химия для устойчивого развития» и биоматериалов при финансовой поддержке РХТУ им. Д. И. Менделеева в рамках научного проекта №2020-040.
Использованы материалы статьи Ionic liquids: green solvents and reactive compounds? Reaction of tri-n-butylmethylphosphonium dimethylphosphate with elemental sulfur; Natalia Tarasova, Efrem Krivoborodov, Alexey Zanin, Yaroslav Mezhuev; журнал Pure and Applied Chemistry; сентябрь 2020 г.
Первую ксерокопию сделал Карлсон — Парламентская газета
Уроженец Сиэтла изобретатель Честер Карлсон впервые в истории сделал ксерокопию 81 год назад, 22 октября 1938 года. За своё изобретение он впоследствии получил от компании «Ксерокс» 150 миллионов долларов.
После окончания Калифорнийского технологического института Честер Карлсон в поисках работы отправился в Нью-Йорк, где устроился в патентный отдел фирмы «Мэллори», занимавшейся электроникой. Во время работы, когда нужной копии патента не оказалось под рукой, Карлсон задумался о том, чтобы придумать какой-нибудь быстрый и дешевый способ копирования бумаг. Он начал изучать техническую литературу в Нью-Йоркской публичной библиотеке. Внимание Карлсона привлекло описание экспериментов одного венгерского ученого с веществами, которые меняют свои электрические свойства под действием света.
Первая ксерокопия была сделана на цинковой пластинке, покрытой слоем серы. На ней был создан статический заряд, затем пластинку облучили через стекло с нанесенной на него надписью, и надпись появилась на слое серы. В последующие годы метод Карлсона доводили до совершенства, а в 1947 году компания «Халоид» из города Рочестера приступила к разработке копировальной техники на основе изобретения.
Читайте также:
• День 22 октября в истории
• Молнию изобрёл шведский эмигрант
• Кто изобрел «Тетрис»
В 1949 году в продаже появилась первая модель копировального аппарата. Технологию копирования назвали «ксерографией» — от греческих слова «ксерос» («сухой») и «графе» (пишу). Компания-производитель аппарата после объединения с британской фирмой «Рэнк Организейшн» в 1955 году стала называться «Рэнк Ксерокс», а потом — просто «Ксерокс». Настоящий успех пришел к фирме в 1959 году с выходом модели ксерокса, которая стала очень популярной и позволила компании заработать сотни миллионов долларов. Изобретатель ксерографии Честер Карлсон получил от «Ксерокса» 150 миллионов долларов, из которых 100 миллионов потратил на благотворительность.
Степень окисления в химии — определение и формулы
Условную величину в соединении, где атом элемента приобретает заряд, принимая или наоборот делясь электронами с остальными элементами, именуют степенью окисления.
В случаях, где элемент делится электроном, степень окисления становится положительной, при принятии частицы – отрицательной, так как электрон имеет отрицательный заряд.
Электроотрицательные элементы притягивают к себе электроны. Валентность атома влияет на рассматриваемую условную величину.
Для примера возьмём Н – самый первый элемент в таблице Менделеева, он имеет всего одну отрицательную частицу. В соединениях с неметаллами (например – H2O, H2S, HCl и т. д.), элементы с высокой электроотрицательностью тянут к себе электрон водорода, вследствие чего степень равняется единице. С металлами (KOH, CA(OH)2, NaOH и др.) всё происходит иначе. Так как электроотрицательность водорода выше в сравнении с ними, то ему свойственно притягивать электроны, и степень окисления равняется -1.
Нулю степень окисления атомов может равняться только в простых веществах, а в химических соединениях она постоянная или переменная.
Вследствие того, что металлам не свойственна высокая электроотрицательность, степень их окисления в формулах не может являться отрицательной. В отличие от них, неметаллам свойственна и положительная, и отрицательная величины.
Что необходимо для вычисления степени окисления
Общее количество атомных степеней, находящихся в составе молекулы, постоянно равняется нулю, это связано с тем, что молекула вещества электронейтральна. Эта особенность позволяет узнавать степень окисления атомов, высчитывая значения по известной формуле соединения.
В качестве примера рассмотрим серу: у S степень окисления бывает только -2, +4 и +6. Для того чтобы узнать степень окисления S в H2SO4, требуется составить и решить уравнение.
В формуле электроотрицательность Н будет равна +1 (элементы, чья электроотрицательность выше притягивают электрон водорода к себе, поэтому степень не отрицательна), а у кислорода она зачастую равняется -2. Электроотрицательность элементов можно посмотреть в специальной таблице.
Неизвестную величину обозначим у: H+12SуО-24.
Учитывая стехиометрические индексы, S: 2(+1) +у+4(-2) =0.
В результате получается, что у равен 6, следовательно, неизвестная величина в рассматриваемой формуле равна +6.
Ионные жидкости помогают разорвать кольцо атомов серы
Ученые Российского химико-технологического университета им. Д. И. Менделеева преобразовали природную серу в пригодную для применения форму, используя реакции с ионными жидкостями. Об их работе рассказала пресс-служба университета.
В природе cера обычно встречается в виде кольцевидной структуры из восьми атомов (S8). Чтобы использовать ее в промышленности, кольцо атомов необходимо раскрыть. Обычно делают при помощи нагрева и последующего охлаждения. При нагреве серное кольцо раскрывается и его мономеры полимеризуются в цепочку, после чего сера приобретает способность образовывать новые соединения с другими веществами. Существующие методы преобразования природной серы в полимерную модификацию очень энергозатратны. Для производства одной тонны полимерной серы нужно примерно десять кубометров природного газа. Кроме того, при ее нагреве выделяется токсичный сероводород. Разработка альтернативных способов раскрытия серного кольца связана с поиском соединений-активаторов, способных образовывать связи с молекулами серы, желательно без нагрева.
Химики из РХТУ впервые предложили использовать в этом процессе ионные жидкости (ИЖ) — расплавы солей при температурах ниже 100 °С, состоящие исключительно из ионов. «Предположение, что ИЖ могут вступать в реакцию с элементной серой, у нас возникло, когда мы изучали их химию, — рассказывает один из авторов работы, сотрудник РХТУ Ефрем Кривобородов. — Это полярные соединения с локализованными в некоторых случаях зарядами, и в зависимости от структуры анионов или катионов возможно проявление их нуклеофильных свойств по отношению к определенным веществам. Отсюда и предположение о механизме возможной реакции серы и ионной жидкости. Получилось, что, интегрировав знания по химии серы и химии ИЖ, мы получили совершенно новые результаты, ранее не описанные».
Эксперименты с ИЖ и серой проходили при комнатной температуре без дополнительного подвода энергии. Серу сначала растворяли в бензоле, затем в этот раствор добавляли ионную жидкость (фосфониевую или имидазолиевую) и перемешивали компоненты на магнитной мешалке. Вещества вступали во взаимодействие в результате нуклеофильного присоединения отрицательно заряженных анионов ионной жидкости к цепочке атомов серы, при этом раскрывалось серное кольцо. Полимерную серу в растворе идентифицировали с помощью метода ядерно-магнитного резонанса.
По подсчетам исследователей, предложенный способ синтеза значительно сокращает энергозатраты на получение высокомолекулярных серосодержащих соединений. Теперь на основе этого метода авторы планируют разработать методики синтеза органических полимеров, отвечающие принципам зеленой химии. Кроме того, новая технология может быть востребована в производстве для безопасной переработки элементной серы в отвалах, которые скапливаются сотнями тысяч тонн на предприятиях очистки нефти и природного газа, загрязняя окружающую среду.
Результаты работы опубликованы в журнале Pure and Applied Chemistry.
(PDF) «Серый кардинал» живой природы Е.В.Терёшина
/92 «Дельфис» № 3 (87)/2016
эволюционирует живое, – электрохимиче-
ский потенциал, то есть сила, приводящая
в движение заряды. Электроны движутся
от донора (восстановителя) к акцептору
(окислителю). Следом за электронами идут
протоны. Так создаются два направленных
потока положительно и отрицательно заря-
женных элементарных частиц – электронов
и протонов. Для всех биосистем, аэробных
и анаэробных, гетеротрофных и аутотроф-
ных, существует единая схема сопряжения
электрон-транспортных схем с движени-
ем протонов. Мембрана разделяет эти по-
токи, создавая разницу в знаке зарядов,
располагающихся по обе её стороны. Про-
тоны, движущиеся благодаря электрохими-
ческому потенциалу в сторону электронов,
передают энергию на синтез АТФ (адено-
зинтрифосфата) – соединения, играющего
исключительно важную роль в обмене энер-
гии и вещества в организме. В АТФ энергия
запасается в виде фосфатных связей, удер-
живаемых ионом магния.
Абсолютным донором электронов и про-
тонов служит атом водорода, который содер-
жит один протон и один электрон: он как бы
раздваивается на две противоположности,
способные к взаимодействию. Природны-
ми источниками водородных электронов и
протонов могут быть как его молекула, так и
восстановленные соединения (содержащие
водород). Абсолютному донору противо-
стоит абсолютный акцептор – окислители,
способные только принимать электроны,
например, атомы кислорода, хлора, фтора.
Дорога от донора к акцептору часто ока-
зывается извилистой, разделённой на мно-
жество этапов. Движение по нисходящему
электрохимическому потенциалу идёт слов-
но по лестнице: каждая ступенька – порция
энергии. Преодолеть её и достигнуть цели
помогают переносчики. Они обладают
свойствами «гермафродитов», так как могут
одновременно и принимать, и отдавать пе-
реносимую субстанцию. Живой природой
задействованы из косной материи такие
«гермафродиты», как атомы углерода, азо-
та и серы, а также некоторые переходные
металлы. Азот и сера имеют переменную ва-
лентность и проявляют широкий диапазон
степеней окисления. У азота они варьируют
от -3 до +5, у серы от -2 до +6, что создаёт
целый спектр соединений оксидов с абсо-
лютным акцептором – кислородом. Углерод
имеет лишь две устойчивые степени окисле-
ния: -4 и +4, однако он может соединяться
с кислородом как двойной (углекислый газ
CO2), так и тройной (угарный газ CO) свя-
зями; с водородом он образует четыре связи
(2-3-4). Соединения азота, серы и углерода с
водородом имеют форму тетраэдров и вы-
страиваются в ряд: Оh3 (вода) – Nh4 (амми-
ак) – Ch5 (метан) (2-3-4). Сероводород (h3S)
подобен воде (Н2О), но длина связи с водо-
родом у кислорода (0,096 нм) меньше, чем у
серы (0,133 нм), аналогично – и угол между
связями (91,1° – вода, 104° – сероводород), а
поэтому в тетраэдры пары его молекул (как
это имеет место для воды) не соединяются.
Водородными связями в квазикристалличе-
ские структуры могут объединиться лишь
молекулы аммиака и воды, но не сероводо-
рода и метана.
Свойства «гермафродитов» проявляют
также переходные металлы, у которых за-
полняются d- и f-электронные орбитали. В
Периодической таблице химических эле-
ментов Д.И.Менделеева они выстроены в
четыре длинных горизонтальных ряда. Жи-
вой природой востребованы восемь элемен-
тов из декады первого ряда: ванадий, хром,
марганец, железо, кобальт, никель, цинк и
медь, а также два элемента 6-й группы: по-
мимо кобальта ещё молибден и вольфрам.
Кстати, в этой же группе с переходными
металлами соседствуют по вертикали кисло-
род, сера и селен.
Все перечисленные металлы образуют со-
единения с серой – сульфиды, обладающие
гексагональной структурой упаковок моле-
кул в кристалле. Такая упаковка энергети-
чески наиболее выгодна и с максимальной
плотностью, практически без зазоров по-
крывает пространство. Кислород с металла-
ми подобных упаковок не образует. Сера как
бы производит отбор элементов для созда-
ния «фабрики», где будет строиться живое
вещество. Все эти металлы, кроме железа,
мало распространены в земной коре, и веро-
ятность их собирания в одной биосистеме
крайне незначительна. Тем не менее, самые
первые и фундаментальные построения
энергетической и синтетической структуры
живого без них невозможны. Ими насыще-
но и наше тело. Как они попадают в клетки?
Вероятно, благодаря собирающим их бакте-
риям. Или, может быть, как-то ещё? Подо-
зреваем, что без серы здесь не обошлось!
ИЗ МАГМЫ И ПЕПЛА
Какой была Земля до зарождения жизни?
К этому времени, насколько мы знаем, уже
сформировались её ядро, мантия и кора.
Вещество планеты неоднородно, оно раз-
деляется на тяжёлые и лёгкие компоненты,
газы и минералы, что заставляет его пере-
мешиваться, оттесняя лёгкие соединения к
периферии, а тяжёлые – собирая в центре,
в ядре. Расположенная между ядром и корой
мантия остаётся подвижной. Главными ком-
понентами мантийных флюидов являют-
ся газы Н2, СО, СН4, СО2, Н2S и пары´ воды.
Предполагают, что метан (СН4) вулканиче-
ских испарений мог быть продуктом геохи-
мического восстановления угарного газа СО
1.17: Ионы — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
Без заголовков
Как обсуждалось в предыдущем разделе, количество протонов в атоме определяет, к какому элементу принадлежит атом.Если число протонов изменяется (как вы увидите в блоке 2, это может произойти во время ядерных реакций), идентичность атома меняется. В нейтральном атоме количество протонов и электронов равно друг другу. Однако количество электронов в атоме может измениться. Если число электронов изменится по сравнению с числом в нейтральном атоме, полученная частица будет заряжена. Почему? Рассмотрим следующие примеры.
Элемент | Протоны | Электронов | Чистая плата | Частица | Символ |
Атом калия | 19 | 19 | 0 | Нейтральный атом | К |
Ион калия | 19 | 18 | +1 | Катион | К + |
Атом серы | 16 | 16 | 0 | Нейтральный атом | S |
Ион серы | 16 | 18 | -2 | Анион | S 2 — |
Протоны — это положительно заряженные частицы, а количество протонов определяется атомным номером элемента.Поскольку электрон имеет ту же величину заряда, что и протон, но противоположный знак (электроны отрицательны), для того, чтобы атом был нейтральным, чтобы не иметь чистого заряда, количество протонов и электронов равны друг другу. Однако, если электронов меньше, чем протонов, как в случае иона калия, итоговый заряд будет положительным, поскольку положительных протонов на один больше, чем отрицательных электронов [(+19) + (−18) = +1]. Положительные ионы — это катионов . Когда электронов больше, чем протонов, как в случае с ионом серы, суммарный заряд отрицательный [(+16) + (−18) = −2].Отрицательные ионы — это анионы .
Заполните следующую таблицу и подумайте, как бы вы объяснили свои ответы, если бы вы учили этому понятию коллегу.
Элемент | Протоны | Электронов | Чистая плата | Частица | Символ |
Атом стронция | 0 | Sr | |||
Ион стронция | +2 | Катион | |||
Атом брома | Нейтральный атом | ||||
Ион брома | рублей – |
Таблица общих зарядов химических элементов
Это таблица наиболее распространенных зарядов атомов химических элементов.Вы можете использовать эту диаграмму, чтобы предсказать, может ли атом связываться с другим атомом. Заряд атома связан с его валентными электронами или степенью окисления. Атом элемента наиболее стабилен, когда его внешняя электронная оболочка полностью или наполовину заполнена. Наиболее распространенные заряды основаны на максимальной стабильности атома. Однако возможны и другие сборы.
Например, водород иногда имеет заряд ноль или (реже) -1. Хотя атомы благородных газов почти всегда несут нулевой заряд, эти элементы действительно образуют соединения, что означает, что они могут приобретать или терять электроны и нести заряд.
Таблица общих начислений за элемент
Номер | Элемент | Заряд |
|---|---|---|
| 1 | водород | 1+ |
| 2 | гелий | 0 |
| 3 | литий | 1+ |
| 4 | бериллий | 2+ |
| 5 | бор | 3-, 3+ |
| 6 | углерод | 4+ |
| 7 | азот | 3- |
| 8 | кислород | 2- |
| 9 | фтор | 1- |
| 10 | неон | 0 |
| 11 | натрия | 1+ |
| 12 | магний | 2+ |
| 13 | алюминий | 3+ |
| 14 | кремний | 4+, 4- |
| 15 | фосфор | 5+, 3+, 3- |
| 16 | сера | 2-, 2+, 4+, 6+ |
| 17 | хлор | 1- |
| 18 | аргон | 0 |
| 19 | калий | 1+ |
| 20 | кальций | 2+ |
| 21 | скандий | 3+ |
| 22 | титан | 4+, 3+ |
| 23 | ванадий | 2+, 3+, 4+, 5+ |
| 24 | хром | 2+, 3+, 6+ |
| 25 | марганец | 2+, 4+, 7+ |
| 26 | утюг | 2+, 3+ |
| 27 | кобальт | 2+, 3+ |
| 28 | никель | 2+ |
| 29 | медь | 1+, 2+ |
| 30 | цинк | 2+ |
| 31 | галлий | 3+ |
| 32 | германий | 4-, 2+, 4+ |
| 33 | мышьяк | 3-, 3+, 5+ |
| 34 | селен | 2-, 4+, 6+ |
| 35 | бром | 1-, 1+, 5+ |
| 36 | криптон | 0 |
| 37 | рубидий | 1+ |
| 38 | стронций | 2+ |
| 39 | иттрий | 3+ |
| 40 | цирконий | 4+ |
| 41 | ниобий | 3+, 5+ |
| 42 | молибден | 3+, 6+ |
| 43 | технеций | 6+ |
| 44 | рутений | 3+, 4+, 8+ |
| 45 | родий | 4+ |
| 46 | палладий | 2+, 4+ |
| 47 | серебро | 1+ |
| 48 | кадмий | 2+ |
| 49 | индий | 3+ |
| 50 | банка | 2+, 4+ |
| 51 | сурьма | 3-, 3+, 5+ |
| 52 | теллур | 2-, 4+, 6+ |
| 53 | йод | 1- |
| 54 | ксенон | 0 |
| 55 | цезий | 1+ |
| 56 | барий | 2+ |
| 57 | лантан | 3+ |
| 58 | церий | 3+, 4+ |
| 59 | празеодим | 3+ |
| 60 | неодим | 3+, 4+ |
| 61 | прометий | 3+ |
| 62 | самарий | 3+ |
| 63 | европий | 3+ |
| 64 | гадолиний | 3+ |
| 65 | тербий | 3+, 4+ |
| 66 | диспрозий | 3+ |
| 67 | гольмий | 3+ |
| 68 | эрбий | 3+ |
| 69 | тулий | 3+ |
| 70 | иттербий | 3+ |
| 71 | лютеций | 3+ |
| 72 | гафний | 4+ |
| 73 | тантал | 5+ |
| 74 | вольфрам | 6+ |
| 75 | рений | 2+, 4+, 6+, 7+ |
| 76 | осмий | 3+, 4+, 6+, 8+ |
| 77 | иридий | 3+, 4+, 6+ |
| 78 | платина | 2+, 4+, 6+ |
| 79 | золото | 1+, 2+, 3+ |
| 80 | ртуть | 1+, 2+ |
| 81 | таллий | 1+, 3+ |
| 82 | свинец | 2+, 4+ |
| 83 | висмут | 3+ |
| 84 | полоний | 2+, 4+ |
| 85 | астатин | ? |
| 86 | радон | 0 |
| 87 | франций | ? |
| 88 | радий | 2+ |
| 89 | актиний | 3+ |
| 90 | торий | 4+ |
| 91 | протактиний | 5+ |
| 92 | уран | 3+, 4+, 6+ |
Периодическая таблица в KnowledgeDoor
Ссылки (Щелкните рядом со значением выше, чтобы увидеть полную информацию о цитировании этой записи)
Олбрайт, Томас А., и Джереми К. Бёрдетт. Проблемы теории молекулярных орбиталей. Нью-Йорк: Oxford University Press, 1992.
Аллен, Леланд К. «Электроотрицательность — это средняя энергия одного электрона валентной оболочки в свободных атомах в основном состоянии». Журнал Американского химического общества, том 111, номер 25, 1989 г., стр. 9003–9014. doi: 10.1021 /
Аллен, Леланд К. «Электроотрицательность — это средняя одноэлектронная энергия электронов валентной оболочки в свободных атомах в основном состоянии.»Журнал Американского химического общества, том 111, номер 25, 1989 г., стр. 9003–9014. Doi: 10.1021 /
Allred, AL» Значения электроотрицательности по термохимическим данным. «Журнал неорганической и ядерной химии, том 17 , number 3-4, 1961, pp. 215–221. doi: 10.1016 /
Allred, AL, and EG Rochow. «Шкала электроотрицательности, основанная на электростатической силе». Журнал неорганической и ядерной химии, том 5, номер 4, 1958 г., стр.264–268. DOI: 10.1016 /
Андерс, Эдвард и Николас Гревесс. «Изобилие элементов: метеоритное и солнечное». Geochimica et Cosmochimica Acta, том 53, номер 1, 1989 г., стр. 197–214. DOI: 10.1016 /
-X
Андерсен Т., Х. К. Хауген и Х. Хотоп. «Энергии связи в атомных
Отрицательные ионы: III. «Journal of Physical and Chemical Reference Data, том 28, номер 6, 1999 г., стр. 1511–1533.
Ball, David W.»Элементная этимология: что в имени?» Журнал химического образования, том 62, номер 9, 1985 г., стр. 787–788. DOI: 10.1021 /
Бацанов, С.С. «Ван-дер-Ваальсовые радиусы элементов». Неорганические материалы, том 37, номер 9, 2001 г., стр. 871–885. См. Реферат
Bearden, J. A., and A. F. Burr. «Переоценка рентгеновских уровней атомной энергии». Обзоры современной физики, том 39, номер 1, 1967, стр. 125–142. DOI: 10.1103 /
Бонди, А.«Объемы и радиусы Ван дер Ваальса». Журнал физической химии, том 68, номер 3, 1964 г., стр. 441–451. DOI: 10.1021 /
Боуэн, Х. Дж. М. Экологическая химия элементов. Лондон: Academic Press, Inc., 1979.
Бойд, Рассел Дж. И Кеннет Э. Эджкомб. «Атомные и групповые электроотрицательности из распределений электронной плотности молекул». Журнал Американского химического общества, том 110, номер 13, 1988 г., стр. 4182–4186. DOI: 10.1021 /
Братч, Стивен Г.«Пересмотренные значения электроотрицательности Малликена: I. Расчет и преобразование в единицы Полинга». Журнал химического образования, том 65, номер 1, 1988 г., стр. 34–41. DOI: 10.1021 /
Cardarelli, François. Справочник по материалам: Краткий настольный справочник, 2-е издание. Лондон: Springer – Verlag, 2008.
Кардона, М. и Л. Лей, редакторы. Фотоэмиссия в
Твердые тела I: общие принципы. Берлин: Springer-Verlag, 1978.
Чейз, Малкольм В., редактор. Монография JPCRD No.9: Термохимические таблицы NIST-JANAF (Часть I и Часть II). Вудбери, штат Нью-Йорк: Американское химическое общество и Американский институт физики,
1998.
Clementi, E., and D. L. Raimondi. «Константы атомарного экранирования из функций SCF». Журнал химической физики, том 38, номер 11, 1963 г., стр. 2686–2689. DOI: 10.1063 /
Коэн, Э. Ричард, Дэвид Р. Лид и Джордж Л. Тригг, редакторы. Настольный справочник по физике AlP, 3-е издание. Нью-Йорк: Springer-Verlag New York, Inc., 2003.
Коннелли, Нил Г., Туре Дамхус, Ричард М. Хартсхорн и Алан Т. Хаттон. Номенклатура неорганической химии: Рекомендации ИЮПАК 2005. Кембридж: RSC Publishing, 2005.
Кордеро, Беатрис, Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес, Хорхе Эчеверриа, Эдуард Кремадес, Флавиа Барраган и Сантьяго Альварес. «Ковалентные радиусы еще раз». Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. DOI: 10.1039 /
Кросвелл, Кен. Алхимия Небес.Нью-Йорк: Anchor Books, 1995.
де Подеста, Майкл. Понимание свойств материи, 2-е издание. Лондон: Тейлор и Фрэнсис, 2002.
Донохью, Джерри. Структуры элементов,
2-е издание. Малабар, Флорида: издательство Robert E. Krieger Publishing Company, 1974.
Dronskowski, Richard. Вычислительная химия твердотельных материалов. Вайнхайм, Германия: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
Эббинг, Даррелл Д. и Стивен Д. Гаммон.Общая химия, 8-е издание. Бостон, Массачусетс: Компания Houghton Mifflin, 2005.
Эмсли, Джон. Строительные блоки природы: руководство от А до Я
элементы. Оксфорд: Издательство Оксфордского университета, 2003.
Эмсли, Джон. Элементы, 3-е издание. Oxford: Oxford University Press, 1998.
Файерстоун, Ричард Б. Таблица изотопов, 8-е издание, том 2. Под редакцией Вирджинии С. Ширли с помощниками редакторов Корал М. Баглин, С. Ю. Фрэнк Чу и Джин Зипкин. Нью-Йорк: John Wiley & Sons, Inc., 1996.
Galasso, Francis S. Структура и свойства
Неорганические твердые вещества. Oxford: Pergamon Press, 1970.
Ghosh, Dulal C., and Kartick Gupta. «Новая шкала электроотрицательности 54 элементов периодической таблицы, основанная на поляризуемости атомов». Журнал теоретической и вычислительной химии, том 5, номер 4, 2006 г., стр. 895–911. DOI: 10.1142 /
Гринвуд, Н. Н. и А. Эрншоу. Химия элементов, 2-е издание. Оксфорд: Баттерворт-Хайнеманн, 1997.
Грегорянц, Евгений, Виктор В. Стружкин, Рассел Дж. Хемли, Михаил И. Еремец, Хо-гванг Мао и Юрий А. Тимофеев. «Сверхпроводимость в халькогенах вплоть до многомегабарного давления». Физический обзор B,
том 65, номер 6, 2002 г., стр. 064504–1–064504–6. DOI: 10.1103 /
Гвин Уильямс. Энергии связи электронов. http: //
Ho, C.Ю., Р. У. Пауэлл и П. Э. Лили. «Тепловой
Электропроводность элементов: всесторонний обзор. «Журнал физических и химических справочных данных, том 3, приложение 1, 1974 г., стр. С I – 1 по I – 796.
Хорват, А. Л.» Критическая температура элементов и периодическая система . »Журнал химического образования, том 50, номер 5,
1973, стр. 335–336. DOI: 10.1021 /
Хухи, Джеймс Э., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: принципы структуры и реакционной способности, 4-е издание.Нью-Йорк: издательство HarperCollins College Publishers, 1993.
.
Международная организация труда (МОТ). Международная карта химической безопасности для серы. http: //
Международная организация труда (МОТ). Международная карта химической безопасности для серы.http: //
Джессбергер, Эльмар К., Александр Христофоридис и Йохен Киссель. «Аспекты основного элементного состава пыли Галлея». Природа, том 332, номер 21, 1988 г., стр. 691–695. DOI: 10.1038 /
Кауфман, Виктор и В.К. Мартин. «Длины волн и уровень энергии
Классификация спектров серы (от SI до S XVI). «Journal of Physical and Chemical Reference Data», том 22, номер 2, 1993, стр. 279–375.
Киттель, Чарльз. Введение в физику твердого тела, 8-е издание . Хобокен, Нью-Джерси: John Wiley & Sons, Inc, 2005.
Краузе, М. О. «Атомные радиационные и безызлучательные выходы для K- и L-оболочек». Справочный журнал физических и химических данных, том 8, номер 2, 1979 г., стр. 307–327.
Ли, Вай-Ки, Гун-Ду Чжоу и Томас Мак. Расширенная структурная неорганическая химия. Oxford: Oxford University Press, 2008.
Liboff, Ричард Л. Введение в квантовую механику, 3-е издание. Ридинг, Массачусетс: Addison Wesley Longman, Inc., 1998.
Лиде, Дэвид Р., редактор. CRC Справочник по химии и физике, 88-е издание. Бока-Ратон, Флорида: Taylor & Francis Group, 2008.
Манн, Джозеф Б., Терри Л. Мик и Леланд К. Аллен. «Конфигурация
Энергии основных элементов группы.»Журнал Американского химического общества, том 122, номер 12, 2000 г., стр. 2780–2783. Doi: 10.1021 /
Мануэль, О., редактор. Происхождение элементов в Солнце
Система: последствия наблюдений после 1957 г. Нью-Йорк: Kluwer Academic Publishers, 2000.
Мартин, У. К. «Электронная структура элементов». Европейский физический журнал C — Частицы и поля, том 15, номер 1–4, 2000 г., стр. 78–79. DOI: 10.1007 /
McDonough, W.F. «Композиционная модель ядра Земли». стр. 547–568 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Oxford: Elsevier Ltd., 2005.
Mechtly, Eugene A. «Свойства материалов». pp. 4–1–4–33 в Справочных данных для инженеров: радио, электроника, компьютер и связь. Мак Э. Ван
Валкенбург, отредактированный Венди М. Миддлтон. Уоберн, Массачусетс: Баттерворт-Хайнеманн, 2002. DOI: 10.1016 /
Мисслер, Гэри Л.и Дональд А. Тарр. Неорганическая химия, 3-е издание. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл,
2004.
Нэгл, Джеффри К. «Атомная поляризуемость и электроотрицательность». Журнал Американского химического общества, том 112, номер 12, 1990 г., стр. 4741–4747. DOI: 10.1021 /
Национальный институт охраны труда и здоровья (NIOSH). Международная карта химической безопасности для серы. http: //
Национальный институт охраны труда и здоровья (NIOSH). Международная карта химической безопасности для серы. http: //
Национальный институт охраны труда и здоровья (NIOSH). Регистр токсического действия химических веществ на серу. http: //
Николас, Дж. В. и Д. Р. Уайт. «Температура». С. 8–41 в Измерение термодинамических свойств одиночных фаз. Под редакцией А. Р. Х. Гудвина, В. А. Уэйкхема и К. Н. Марша. Амстердам: Elsevier Science, 2003.
Орем, У. Х. и Р. Б. Финкельман. «Угледобыча и геохимия». стр. 191–222 в отложениях, диагенез,
и осадочные породы. Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005.
Oxtoby, David W., Х. П. Гиллис и Алан Кэмпион. Принципы современной химии, 6-е издание. Бельмонт, Калифорния: Томсон Брукс / Коул, 2008.
Палм, Х. и Хью Сент-К. О’Нил. «Космохимические оценки состава мантии». стр. 1–38 в «Мантия и ядро». Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Полинг, Линус. Природа химической связи, 3-е издание. Итака, Нью-Йорк: издательство Корнельского университета, 1960.
Пирсон, Ральф Г. «Абсолютная электроотрицательность и твердость: применение к неорганической химии.»Неорганическая химия, том 27, номер 4, 1988 г., стр. 734–740. Doi: 10.1021 /
Пекка Пюйккё. Самосогласованный, ковалентные радиусы 2009 года». Http: //
Pyykkö, Pekka, and Michiko Atsumi. «Ковалентные радиусы молекулярных двойных связей для элементов Li-E112». Химия — Европейский журнал , том 15, номер 46, 2009 г., стр. 12770–12779. doi: 10.1002 /
2
Pyykkö, Pekka и Michiko Atsumi. «Молекулярные ковалентные радиусы одинарной связи для элементов 1-118». Химия — Европейский журнал, том 15, номер 1, 2009 г., стр. 186–197. doi: 10.1002 /
Pyykkö, Pekka, Sebastian Riedel и Michael Patzschke. «Ковалентные радиусы с тройной связью». Химия — Европейский журнал, том 11, номер 12, 2005 г., стр. 3511–3520. DOI: 10.1002 /
Рорер, Грегори С. Структура и связь в кристаллических материалах.Кембридж: Cambridge University Press, 2001.
Самсонов Г.В., редактор. Справочник по физико-химическим свойствам элементов. Нью-Йорк: Plenum Publishing Corporation, 1968.
Сандерсон Р. Т. Простые неорганические вещества.
Малабар, Флорида: Robert E. Krieger Publishing Co., Inc., 1989.
Сандерсон, Р. Т. «Принципы электроотрицательности: Часть I. Общая природа». Журнал химического образования, том 65, номер 2, 1988 г., стр. 112–118. DOI: 10.1021 /
Сандерсон, Р.Т. Полярная ковалентность. Нью-Йорк: Academic Press, Inc., 1983.
Sansonetti, J. E., and W. C. Martin. «Справочник по основным данным атомной спектроскопии». Журнал физических и
Справочные данные по химии, том 34, номер 4, 2005 г., стр. 1559–2259. DOI: 10.1063 /
Научная группа Thermodata Europe (SGTE). Чистые вещества: Часть 1 — Элементы и соединения от AgBr до Ba3N2. Под редакцией И.
Уртадо и Д. Нойшютц. Берлин: Springer-Verlag, 1999. doi: 10.1007 /
Шеннон, Р.D. «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах». Acta Crystallographica Раздел A, том 32, номер 5, 1976 г., стр. 751–767. DOI: 10.1107 /
Силби, Роберт Дж., Роберт А. Олберти и Мунги Г. Бавенди. Физическая химия, 4-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005.
Сингман, Чарльз Н. «Атомный объем и аллотропия элементов». Журнал химического образования, том 61, номер 2, 1984 г., стр.137–142. DOI: 10.1021 /
Слейтер, Дж. К. «Атомные радиусы в кристаллах». Журнал
Химическая физика, том 41, номер 10, 1964, стр. 3199–3204. doi: 10.1063 /
Смит, Дерек В. «Электроотрицательность в двух измерениях: переоценка и разрешение парадокса Пирсона-Полинга». Журнал химии
Образование, том 67, номер 11, 1990 г., стр. 911–914. DOI: 10.1021 /
Смит, Дерек В. Неорганические вещества: прелюдия к изучению описательной неорганической химии.Кембридж: Кембриджский университет
Press, 1990.
Speight, Стандартные таблицы и формулы Джеймса Г. Перри для инженеров-химиков. Нью-Йорк: McGraw-Hill Companies, Inc., 2003.
Steudel, Ralf и Bodo Eckert. «Аллотропы твердой серы». стр. 1–79 в Элементарная сера и соединения с высоким содержанием серы I. Под редакцией Ральфа Штуделя. Берлин: Springer – Verlag, 2003. doi: 10.1007 /
Министерство транспорта США (DOT), Транспорт Канады (TC), Секретариат транспорта и коммуникаций Мексики (SCT) и Centro de Información Química para Emergencias ( CIQUIME).2008 Чрезвычайная ситуация
Руководство по реагированию.
Вайнштейн, Борис К., Владимир М. Фридкин, Владимир Л. Инденбом. Структура кристаллов, 2-е издание. Современная кристаллография 2. Под ред. Б. К. Вайнштейна, А. А. Чернова, Л. А. Шувалова. Берлин: Springer-Verlag, 1995.
Фойгт, Х. Х., редактор. Ландольт – Бёрнштейн — Астрономия и астрофизика VI группы. Берлин: Springer – Verlag, 1993.
.
Waber, J. T. и Don T. Cromer. «Радиусы орбит атомов и ионов». Журнал химической физики, том 42, номер 12, 1965 г., стр.4116–4123. DOI: 10.1063 /
Уолдрон, Кимберли А., Эрин М. Ферингер, Эми Э. Стриб, Дженнифер Э.
Троски и Джошуа Дж. Пирсон. «Проценты скрининга на основе эффективного ядерного заряда Слейтера как универсальный инструмент для обучения периодическим тенденциям». Журнал химического образования, том 78, номер 5, 2001 г., стр. 635–639. DOI: 10.1021 /
Визер, Майкл Э. и Тайлер Б. Коплен. «Атомный вес элементов 2009 (Технический отчет IUPAC).«Чистая и прикладная химия, том 83, номер 2, 2011 г., стр. 359–396. Doi: 10.1351 /
Yaws, Карл Л.« Плотность жидкости в элементах ». Химическая инженерия, том 114, номер 12, 2007 г., стр. 44–46.
Yaws, Карл Л. Справочник по физическим свойствам углеводородов и химикатов Yaws. Хьюстон, Техас: Gulf Publishing Company, 2005.
Янг, К. Ф. и Х. П. Р. Фредерикс. «Составление статической диэлектрической проницаемости неорганических твердых тел.»Журнал физико-химических справочных данных, том 2, номер 2, 1973 г., стр. 313–409.
Зефиров Ю. В.» Сравнительный анализ систем ван-дер-ваальсовых радиусов. «Кристаллографические отчеты, том 42, номер 1, 1997, pp. 111–116.
2.3: Формальные заряды — Chemistry LibreTexts
Определение формального заряда на атоме
Формальный заряд сравнивает количество электронов вокруг «нейтрального атома» (атома не в молекуле) с количеством электронов вокруг атома в молекуле.Формальный заряд назначается атому в молекуле, если предполагается, что электроны во всех химических связях одинаково распределяются между атомами, независимо от относительной электроотрицательности. Для расчета формальных зарядов мы относим электроны в молекуле к отдельным атомам в соответствии со следующими правилами:
- Несвязывающие электроны присваиваются атому, на котором они расположены.
- Связующие электроны делятся поровну между двумя связанными атомами, поэтому по одному электрону от каждой связи идет к каждому атому.
Формальный заряд каждого атома в молекуле можно рассчитать с помощью следующего уравнения:
Формальный заряд = (количество валентных электронов в свободном атоме) — (количество электронов неподеленной пары) — (1/2 количество электронов пары связей) Уравнение. 2.3.1
Чтобы проиллюстрировать этот метод, давайте вычислим формальный заряд атомов в аммиаке (NH 3 ), чья структура Льюиса выглядит следующим образом:
Нейтральный атом азота имеет пять валентных электронов (он находится в группе 15).Согласно структуре Льюиса, атом азота в аммиаке имеет одну неподеленную пару и три связи с атомами водорода. Подставляя в уравнение 2.3.1, получаем
Формальный заряд N = (5 валентных e-) — (2 одиночных пары e-) — (1/2 x 6 пар связей e-) = 0
Нейтральный атом водорода имеет один валентный электрон. Каждый атом водорода в молекуле не имеет несвязывающих электронов и не имеет одной связи. Используя уравнение 2.3.1 для расчета формального заряда водорода, получаем
Формальный заряд H = (1 валентность e-) — (0 одиночная пара e-) — (1/2 x 2 пары связей e-) = 0
Сумма формальных зарядов каждого атома должна быть равна общему заряду молекулы или иона.В этом примере азот и каждый водород имеют формальный нулевой заряд. В сумме общий заряд равен нулю, что соответствует общему нейтральному заряду молекулы NH 3 .
Обычно структура с наиболее формальными нулевыми зарядами на атомах является более стабильной структурой Льюиса. В случаях, когда ДОЛЖНЫ быть положительные или отрицательные формальные заряды на различных атомах, наиболее стабильные структуры обычно имеют отрицательные формальные заряды на более электроотрицательных атомах и положительные формальные заряды на менее электроотрицательных атомах.Следующий пример дополнительно демонстрирует, как рассчитать формальные заряды для многоатомных ионов.
Пример 2.3.1
Рассчитайте формальные заряды каждого атома в ионе NH 4 + .
Дано: химических веществ
Запрошено: официальных обвинений
Стратегия:
Укажите количество валентных электронов в каждом атоме иона NH 4 + . Используйте электронную структуру Льюиса NH 4 + , чтобы определить количество связывающих и несвязывающих электронов, связанных с каждым атомом, а затем используйте уравнение 2.3.1 для расчета формального заряда каждого атома.
Раствор:
Электронная структура Льюиса для иона NH 4 + выглядит следующим образом:
Атом азота в аммонии имеет ноль несвязывающих электронов и 4 связи. Таким образом, используя уравнение 2.3.1, формальный заряд атома азота равен
.
Формальный заряд N = (5 валентность e-) — (0 одиночная пара e-) — (1/2 x 8 пара связей e-) = 1+
формальный платеж (N) = 5− (0 + 82) = 0
Каждый атом водорода в имеет одну связь и ноль несвязывающих электронов.Таким образом, формальный заряд каждого атома водорода составляет
Формальный заряд H = (1 валентность e-) — (0 одиночная пара e-) — (1/2 x 2 пары связей e-) = 0
формальный платеж (H) = 1− (0 + 22) = 0
Таким образом, формальные заряды на атомах в ионе NH 4 + равны
Суммирование формальных зарядов на атомах должно дать нам общий заряд молекулы или иона. В этом случае сумма формальных зарядов равна 0 + 1 + 0 + 0 + 0 = 1+, что совпадает с общим зарядом многоатомного иона аммония.
Упражнение \ (\ PageIndex {1} \)
Запишите формальные заряды всех атомов в BH 4 — .
- Ответ
.
Определение заряда атомов в органических структурах
Рассмотренный выше метод расчета для определения формальных зарядов на атомах является важной отправной точкой для начинающего химика-органика и хорошо работает при работе с небольшими структурами.Но этот метод становится неоправданно трудоемким при работе с более крупными конструкциями. Было бы чрезвычайно утомительно определять формальные заряды на каждом атоме в 2′-дезоксицитидине (одном из четырех нуклеозидных строительных блоков, составляющих ДНК) с помощью уравнения 2.3.1. По мере того, как вы приобретете больше опыта с органическими структурами, вы сможете быстро взглянуть на этот тип сложной структуры и определить заряды на каждом атоме.
2′-дезоксицитидин
Вам необходимо развить способность быстро и эффективно рисовать большие конструкции и определять формальные расходы.К счастью, это требует лишь некоторой практики в распознавании общих шаблонов связи.
Органическая химия имеет дело только с небольшой частью таблицы Менделеева, настолько, что становится удобно распознавать формы связи этих атомов. На рисунке ниже показаны наиболее важные формы склеивания. Они будут подробно рассмотрены ниже. Важно отметить, что большинство атомов в молекуле нейтральны. Обратите особое внимание на нейтральные формы элементов ниже, потому что именно так они будут выглядеть большую часть времени.
Рисунок \ (\ PageIndex {1} \): Структуры обычных органических атомов и ионов.
Карбон
Углерод, важнейший элемент для химиков-органиков. В структурах метана, метанола, этана, этена и этина есть четыре связи с атомом углерода. И каждый атом углерода имеет формальный нулевой заряд. Другими словами, углерод четырехвалентный , что означает, что он обычно образует четыре связи.
Углерод обычно образует четыре связки
Углерод четырехвалентен в большинстве органических молекул, но есть исключения.Далее в этой главе и по всей книге приведены примеры органических ионов, называемых «карбокатионами» и «карбанионами», в которых атом углерода имеет положительный или отрицательный формальный заряд, соответственно. Карбокатионы возникают, когда углерод имеет только три связи и не имеет неподеленных пар электронов. Карбокатионы имеют только 3 валентных электрона и формальный заряд 1+. Карбанионы возникают, когда атом углерода имеет три связи плюс одну неподеленную пару электронов. Карбанионы имеют 5 валентных электронов и формальный заряд 1−.
| карбокатион: 3 связи и отсутствие неподеленной пары | карбанион: 3 связи и одна неподеленная пара | углеродный радикал: 3 связи и один неспаренный электрон |
Две другие возможности — это углеродные радикалы и карбены, оба из которых имеют нулевой формальный заряд. Углеродный радикал , , , имеет три связи и один неспаренный электрон.Углеродные радикалы имеют 4 валентных электрона и нулевой формальный заряд. Карбены представляют собой высокореакционные частицы, в которых атом углерода имеет две связи и одну неподеленную пару электронов, что дает ему формальный нулевой заряд. Хотя карбены встречаются редко, вы встретите их в разделе 8.10 «Добавление карбенов к алкенам».
Вы, безусловно, должны использовать методы, которым вы научились, чтобы проверить правильность этих формальных сборов для примеров, приведенных выше. Что еще более важно, вам нужно будет, прежде чем вы значительно продвинетесь в своем изучении органической химии, просто распознать эти закономерности (и схемы, описанные ниже для других атомов) и уметь определять атомы углерода, несущие положительные и отрицательные формальные заряды, с помощью быстрого осмотр.
Водород
Обычный образец связи для водорода прост: атомы водорода в органических молекулах обычно имеют только одну связь, без неспаренных электронов и формальный заряд, равный нулю. Исключениями из этого правила являются протон H + , ион гидрида H — и водородный радикал H . . Протон представляет собой водород без связей и неподеленных пар и с формальным зарядом 1+. Ион гидрида представляет собой водород без связей, с парой электронов и формальным зарядом 1−.Радикал водорода — это атом водорода без связей, с одним неспаренным электроном и формальным зарядом 0. Однако, поскольку эта книга концентрируется на органической химии применительно к живым существам, мы не увидим «голых» протонов. и гидриды как таковые, поскольку они слишком реакционноспособны, чтобы присутствовать в такой форме в водном растворе. Тем не менее, идея о протоне будет очень важна, когда мы будем обсуждать кислотно-щелочную химию, а идея о гидрид-ионе станет очень важной намного позже в книге, когда мы будем обсуждать органические реакции окисления и восстановления.Однако, как правило, все атомы водорода в органических молекулах имеют одну связь и не имеют формального заряда.
Нейтральный водород: одна связь, без неподеленной пары
Кислород
Обычно кислород имеет нулевой формальный заряд, когда атом кислорода имеет 2 связи и 2 неподеленные пары. Другие конфигурации — кислород с 1 связью и 3 неподеленными парами, который имеет формальный заряд 1−, и кислород с 3 связями и 1 неподеленной парой, который имеет формальный заряд 1+.Все три образца кислорода соответствуют правилу октетов.
| нейтральный кислород: 2 связи и 2 неподеленные пары | отрицательный кислород: 1 связка и 3 неподеленные пары | положительный кислород: 3 связи и одна неподеленная пара |
Если он имеет две связи и две неподеленные пары, как в воде, он будет иметь нулевой формальный заряд. Если он имеет одну связь и три неподеленные пары, как в гидроксид-ионе, он будет иметь формальный заряд 1−.Если он имеет три связи и одну неподеленную пару, как в ионе гидроксония, он будет иметь формальный заряд 1+.
Кислород также может существовать в виде радикала, например, когда атом кислорода имеет одну связь, две неподеленные пары и один неспаренный (свободный радикал) электрон, что дает ему формальный нулевой заряд. Однако пока сконцентрируйтесь на трех основных примерах нерадикальных веществ, поскольку они составляют большинство кислородсодержащих молекул, с которыми вы столкнетесь в органической химии.
Азот
Азот имеет два основных типа связывания, каждый из которых соответствует правилу октетов:
| нейтральный азот: 3 связи и 1 неподеленная пара | положительный азот: 4 связи | отрицательный азот: 2 связи и 2 неподеленные пары |
Если у азота есть три связи и неподеленная пара, он имеет формальный заряд, равный нулю.Если у него четыре связи (и нет ни одной единственной пары), формальный заряд равен 1+. В довольно необычной схеме связывания отрицательно заряженный азот имеет две связи и две неподеленные пары.
Фосфор и сера
Два элемента третьего ряда обычно встречаются в биологических органических молекулах: фосфор и сера. Хотя оба этих элемента имеют другие схемы связывания, которые имеют отношение к лабораторной химии, в биологическом контексте сера почти всегда следует той же схеме связывания / формального заряда, что и кислород, в то время как фосфор присутствует в форме фосфат-иона (PO 4 3-), где он имеет пять связей (почти всегда с кислородом), отсутствие неподеленных пар и формальный нулевой заряд.Помните, что элементы в третьей строке периодической таблицы имеют d орбиталей в своей валентной оболочке, а также s и p орбитали, и, таким образом, не связаны правилом октетов.
Галогены
Галогены (фтор, хлор, бром и йод) очень важны в лабораторной и медицинской органической химии, но менее распространены в встречающихся в природе органических молекулах. Галогены в органических соединениях обычно видны с одной связью, тремя неподеленными парами и формальным нулевым зарядом.Иногда, особенно в случае брома, мы можем встретить реакционноспособные частицы, в которых галоген имеет две связи (обычно в трехчленном кольце), две неподеленные пары и формальный заряд 1+.
Общие нейтральные схемы соединения для галогенов
Общий положительный образец соединения для галогенов
Эти правила, если их усвоить и усвоить, так что вам даже не нужно о них думать, они позволят вам довольно быстро рисовать большие органические структуры с формальными затратами.
После того, как вы научились рисовать структуры Льюиса, не всегда нужно рисовать неподеленные пары на гетероатомах, так как вы можете предположить, что надлежащее количество электронов присутствует вокруг каждого атома, чтобы соответствовать указанному формальному заряду (или его отсутствию). . Однако иногда рисуются одиночные пары, если это помогает сделать объяснение более ясным.
Упражнение \ (\ PageIndex {2} \)
Укажите атом с ненейтральным зарядом в следующем атоме:
- Ответ
CO
2
1.C менее электроотрицателен, чем O, поэтому это центральный атом.
2. C имеет 4 валентных электрона, и каждый O имеет 6 валентных электронов, всего 16 валентных электронов.
3. Размещение одной электронной пары между C и каждым O дает O – C – O, с оставшимися 12 электронами.
4. Разделение оставшихся электронов между атомами O дает три неподеленных пары на каждом атоме:
Эта структура имеет октет электронов вокруг каждого атома O, но только 4 электрона вокруг атома C.
5. У центрального атома не осталось электронов.
6. Чтобы дать атому углерода октет электронов, мы можем преобразовать две неподеленные пары на атомах кислорода в связывающие электронные пары. Однако есть два способа сделать это. Мы можем взять по одной электронной паре от каждого кислорода, чтобы сформировать симметричную структуру, или взять обе электронные пары от одного атома кислорода, чтобы получить асимметричную структуру:
Обе электронные структуры Льюиса дают всем трем атомам октет.Как нам выбрать между этими двумя возможностями? Формальные заряды для двух электронных структур Льюиса CO 2 следующие:
Обе структуры Льюиса имеют чистый формальный заряд, равный нулю, но структура справа имеет заряд 1+ на более электроотрицательном атоме (O). Таким образом, предполагается, что симметричная структура Льюиса слева будет более стабильной, и фактически это структура, наблюдаемая экспериментально. Однако помните, что формальные заряды , а не представляют собой фактические заряды на атомах в молекуле или ионе.Они используются просто как бухгалтерский метод для предсказания наиболее стабильной структуры Льюиса для соединения.
Примечание
Структура Льюиса с набором формальных зарядов, близких к нулю, обычно наиболее устойчива.
Пример 2.3.2
Ион тиоцианата (SCN — ), который используется в печати и в качестве ингибитора коррозии против кислых газов, имеет по крайней мере две возможные электронные структуры Льюиса. Нарисуйте две возможные структуры, назначьте формальные заряды всем атомам в обоих и решите, какое расположение электронов является предпочтительным.
Дано: химических веществ
Запрошено: Электронные структуры Льюиса, формальные заряды и предпочтительное расположение
Стратегия:
A Используйте пошаговую процедуру, чтобы записать две вероятные электронные структуры Льюиса для SCN — .
B Вычислите формальный заряд каждого атома, используя уравнение 2.3.1.
C Предскажите, какая структура предпочтительна, основываясь на формальном заряде каждого атома и его электроотрицательности по отношению к другим присутствующим атомам.
Раствор:
A Возможные структуры Льюиса для иона SCN — следующие:
B Мы должны вычислить формальные заряды на каждом атоме, чтобы определить более стабильную структуру. Если мы начнем с углерода, мы заметим, что атом углерода в каждой из этих структур разделяет четыре пары связей, число связей типично для углерода, поэтому он имеет формальный заряд, равный нулю. Продолжая рассмотрение серы, мы наблюдаем, что в (а) атом серы имеет одну общую пару связей, три неподеленных пары и в общей сложности шесть валентных электронов.Таким образом, формальный заряд атома серы равен 6 — (6 + 2/2) = 1−. В (b) атом серы имеет формальный заряд 0. В (c) атом серы имеет формальный заряд 1+. Продолжая рассмотрение азота, мы наблюдаем, что в (а) атом азота разделяет три пары связей, имеет одну неподеленную пару и всего 5 валентных электронов. Таким образом, формальный заряд атома азота равен 5 — (2 + 6/2) = 0. В (b) атом азота имеет формальный заряд 1−. В (c) атом азота имеет формальный заряд 2−.
C Какая структура предпочтительна? Структура (b) является предпочтительной, потому что отрицательный заряд находится на более электроотрицательном атоме (N), и она имеет более низкие формальные заряды на каждом атоме по сравнению со структурой (c): 0, 1– по сравнению с 1+, 2–.
Упражнение \ (\ PageIndex {2} \)
Соли, содержащие фульминат-ион (CNO — ), используются во взрывных детонаторах. Изобразите три электронные структуры Льюиса для CNO – и используйте формальные заряды, чтобы предсказать, какая из них более стабильна.(Примечание: N — центральный атом.)
- Ответ
Вторая структура считается наиболее стабильной.
Обращение переноса заряда между платиной и углеродным носителем, легированным серой, для электрокаталитического выделения водорода.
Таустер, С. Дж., Фунг, С. С. и Гартен, Р. Л. Сильные взаимодействия металла с носителем. Благородные металлы 8 группы, нанесенные на диоксид титана. Дж.Являюсь. Chem. Soc. 100 , 170–175 (1978).
CAS
Статья
Google Scholar
Tang, H. et al. Сильное взаимодействие металл – носитель между наночастицами золота и неоксидами. J. Am. Chem. Soc. 138 , 56–59 (2016).
CAS
PubMed
Статья
Google Scholar
Tang, H., et al. Классические сильные взаимодействия металл – носитель между наночастицами золота и диоксидом титана. Sci. Adv . 3 , e1700231 (2017).
ADS
PubMed
PubMed Central
Статья
CAS
Google Scholar
Bruix, A. et al. Новый тип сильного взаимодействия металл-носитель и получение H 2 посредством превращения воды на катализаторах Pt / CeO 2 (111) и Pt / CeO x / TiO 2 (110). J. Am. Chem. Soc. 134 , 8968–8974 (2012).
CAS
PubMed
Статья
Google Scholar
Кэмпбелл, К. Т. Электронные возмущения. Нац. Chem. 4 , 597 (2012).
CAS
PubMed
Статья
Google Scholar
Вайсилов Г.Н. и др. Поддерживающая наноструктура увеличивает перенос кислорода к каталитически активным наночастицам платины. Нац. Матер. 10 , 310 (2011).
ADS
CAS
PubMed
Статья
Google Scholar
Лыхач Ю. и др. Подсчет электронов на нанесенных наночастицах. Нац. Матер. 15 , 284 (2015).
ADS
PubMed
Статья
CAS
Google Scholar
Graciani, J. et al. Высокоактивные катализаторы медь-цериевый и медно-церий-диоксид титана для синтеза метанола из CO 2 . Наука 345 , 546–550 (2014).
ADS
CAS
PubMed
Статья
Google Scholar
Сааведра Дж., Доан Х. А., Перселл К. Дж., Грабов Л. С. и Чендлер Б. Д. Критическая роль воды на границе раздела золото-диоксид титана в каталитическом окислении CO. Наука 345 , 1599–1602 (2014).
ADS
CAS
PubMed
Статья
Google Scholar
Lin, L. et al. Низкотемпературное производство водорода из воды и метанола с использованием катализаторов Pt / α-MoC. Природа 544 , 80–83 (2017).
ADS
CAS
PubMed
Статья
PubMed Central
Google Scholar
Фармер, Дж. А. и Кэмпбелл, К. Т. Ceria поддерживает более мелкие частицы металлического катализатора за счет прочного связывания металлической подложки. Наука 329 , 933–936 (2010).
ADS
CAS
PubMed
Статья
PubMed Central
Google Scholar
Jackson, C. et al. Взаимодействие электронного металла с носителем увеличивало активность восстановления кислорода и стабильность платины, нанесенной на карбид бора. Нац. Commun. 8 , 15802 (2017).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Zhu, W. et al. Усмирение межфазных электронных свойств наночастиц платины на нанолистах нитрида бора с большим количеством вакансий для усиленного катализа. Нац. Commun. 8 , 15291 (2017).
ADS
PubMed
PubMed Central
Статья
Google Scholar
Li, S. et al. Настройка селективности каталитического гидрирования диоксида углерода по сравнению с катализаторами из иридия / оксида церия с сильным взаимодействием металл-носитель. Angew. Chem. Int. Эд. 129 , 10901–10905 (2017).
Артикул
Google Scholar
Джермано, Л. Д., Марангони, В. С., Могили, Н. В. В., Сейшас, Л., Маронезе, К. М. Ультрамалые (<2 нм) наноструктуры Au @ Pt: настройка электронных состояний поверхности для электрокатализа. ACS Appl. Матер. Интерфейсы 11 , 5661–5667 (2019).
CAS
PubMed
Статья
Google Scholar
Галлер Г. Л. и Ресаско Д. Е. Взаимодействие металла с носителем: металлы VIII группы и восстанавливаемые оксиды.in Достижения катализа , Vol. 36 (ред. Eley, D.D., Pines, H. & Weisz, P.B.) 173–235 (Academic Press, 1989).
Hu, P. et al. Электронные взаимодействия металл – носитель в одноатомных катализаторах. Angew. Chem. Int. Эд. 53 , 3418–3421 (2014).
CAS
Статья
Google Scholar
Murata, K. et al. Взаимодействие металл-носитель относительно гранулометрического влияния Pd / Al2O3 на горение метана. Angew. Chem. Int. Эд. 56 , 15993–15997 (2017).
CAS
Статья
Google Scholar
Rao, R.G. et al. Распределение межфазного заряда в палладиевых катализаторах на углеродной основе. Нац. Commun. 8 , 340 (2017).
ADS
PubMed
PubMed Central
Статья
CAS
Google Scholar
Дрессельхаус, М.С. и Томас, И. Л. Альтернативные энергетические технологии. Природа 414 , 332 (2001).
ADS
CAS
Статья
Google Scholar
Тернер, Дж. А. Устойчивое производство водорода. Наука 305 , 972–974 (2004).
ADS
CAS
PubMed
Статья
PubMed Central
Google Scholar
Вальтер, М.G. et al. Солнечные вододелительные элементы. Chem. Ред. 110 , 6446–6473 (2010).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Юлианелли, А., Лигуори, С., Уилкокс, Дж. И Базиль, А. Достижения в области парового риформинга метана для производства водорода с помощью технологии мембранных реакторов: обзор. Катал. Ред. 58 , 1–35 (2016).
CAS
Статья
Google Scholar
Liang, H.-W. и другие. Молекулярные центры металл – Nx в пористом углероде для электрокаталитического выделения водорода. Нац. Commun. 6 , 7992 (2015).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Fei, H. et al. Атомарный кобальт на легированном азотом графене для генерации водорода. Нац. Commun. 6 , 8668 (2015).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Zhang, J. et al. Одиночные атомы платины, иммобилизованные на MXene как эффективный катализатор реакции выделения водорода. Нац. Катал. 1 , 985–992 (2018).
CAS
Статья
Google Scholar
Tiwari, J. N. et al. Многокомпонентный электрокатализатор со сверхнизким содержанием Pt и высокой активностью выделения водорода. Нац. Энергетика 3 , 773–782 (2018).
ADS
CAS
Статья
Google Scholar
Zhang, H. et al. Динамическое притяжение ограниченных решеткой атомов платины в мезопористую углеродную матрицу для реакции выделения водорода. Sci. Adv . 4 , eaao6657 (2018).
ADS
PubMed
PubMed Central
Статья
CAS
Google Scholar
Cheng, N. et al. Одноатомный и кластерный катализ реакции выделения водорода платины. Нац. Commun. 7 , 13638 (2016).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Wu, Z.-Y. и другие. Карбонизация малых органических молекул с помощью переходных металлов в сторону функциональных углеродных материалов. Sci. Adv . 4 , eaat0778 (2018).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Ян, М.и другие. Каталитически активные виды Au-O (OH) (x), стабилизированные ионами щелочных металлов на цеолитах и мезопористых оксидах. Наука 346 , 1498–1501 (2014).
ADS
CAS
PubMed
Статья
Google Scholar
Wei, H. S. et al. Одноатомные и псевдоодноатомные катализаторы платины на основе FeO x для хемоселективного гидрирования функционализированных нитроаренов. Нац. Commun. 5 , 5634 (2014).
ADS
CAS
PubMed
Статья
Google Scholar
Choi, C.H. et al. Настройка селективности электрохимических реакций атомно-дисперсным платиновым катализатором. Нац. Commun. 7 , 10922 (2016).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Wertheim, G. K., DiCenzo, S. B. & Youngquist, S.E. Единичный заряд на поддерживаемых кластерах золота в окончательном фотоэмиссионном состоянии. Phys. Rev. Lett. 51 , 2310–2313 (1983).
ADS
CAS
Статья
Google Scholar
Кумар В. и Кавазо Ю. Дж. П. Р. Б. Эволюция атомной и электронной структуры кластеров Pt: планарный, слоистый, пирамидальный, каркасный, кубический и октаэдрический рост. Phys. Ред. B 77 , 205418 (2008).
ADS
Статья
CAS
Google Scholar
Zheng, Y., Jiao, Y., Jaroniec, M. & Qiao, S.Z. Развитие электрохимии реакции выделения водорода путем объединения эксперимента и теории. Angew. Chem. Int. Эд. 54 , 52–65 (2015).
CAS
Статья
Google Scholar
Wei, H. et al. Фотохимическое восстановление со льдом для синтеза металлов с атомной дисперсией путем подавления роста нанокристаллов. Нац. Commun. 8 , 1490 (2017).
ADS
PubMed
PubMed Central
Статья
CAS
Google Scholar
Чжан, Л., Хан, Л., Лю, Х., Лю, X. и Луо, Дж. Синтез одиночных атомов платины с циклическим потенциалом для эффективного выделения водорода в нейтральных средах. Angew. Chem. Int. Эд. 56 , 13694–13698 (2017).
CAS
Статья
Google Scholar
Инь, X.-P. и другие. Разработка координационной среды одноатомной платины, закрепленной на графдине, для оптимизации электрокаталитического выделения водорода. Angew. Chem. Int. Эд. 57 , 9382–9386 (2018).
CAS
Статья
Google Scholar
Qu, Y. et al. Стратегия термического излучения для синтеза атомно-дисперсных центров металла Pt из объемного металла Pt. J. Am. Chem. Soc. 141 , 4505–4509 (2019).
CAS
PubMed
Статья
Google Scholar
Ye, S. et al. Высокостабильные одиночные атомные центры Pt, закрепленные на графене с анилиновой стопкой для реакции выделения водорода. Energy Environ. Sci. 12 , 1000–1007 (2019).
CAS
Статья
Google Scholar
Kwon, H.C. et al. Окись углерода как промотор атомно-дисперсного платинового катализатора в реакции электрохимического выделения водорода. J. Am. Chem. Soc. 140 , 16198–16205 (2018).
CAS
PubMed
Статья
Google Scholar
Mahmood, J. et al. Эффективный и универсальный по pH катализатор на основе рутения для реакции выделения водорода. Нац. Nanotechnol. 12 , 441–446 (2017).
ADS
CAS
PubMed
Статья
Google Scholar
Равель, Б. и Ньювилл, М. АФИНА, АРТЕМИДА, ГЕФЕСТ: анализ данных для рентгеновской абсорбционной спектроскопии с использованием IFEFFIT. J. Synchrot. Radiat. 12 , 537–541 (2005).
CAS
Статья
Google Scholar
Крессе, Г. и Фуртмюллер, Дж. Эффективные итерационные схемы для ab initio расчетов полной энергии с использованием базисного набора плоских волн. Phys. Ред. B 54 , 11169–11186 (1996).
ADS
CAS
Статья
Google Scholar
Кресс, Г. и Жубер, Д. От ультрамягких псевдопотенциалов до метода расширенных волн проектора. Phys. Ред. B 59 , 1758–1775 (1999).
ADS
CAS
Статья
Google Scholar
Perdew, J. P., Burke, K. & Ernzerhof, M. Обобщенное приближение градиента стало проще. Phys. Rev. Lett. 77 , 3865–3868 (1996).
ADS
CAS
PubMed
Google Scholar
Blöchl, P.E. Метод расширенных волн для проектора. Phys. Ред. B 50 , 17953–17979 (1994).
ADS
Google Scholar
Grimme, S., Antony, J., Ehrlich, S. & Krieg, H. Последовательная и точная неэмпирическая параметризация поправки на функциональную дисперсию плотности (DFT-D) для 94 элементов H-Pu. J. Chem. Phys. 132 , 154104 (2010).
ADS
PubMed
Статья
CAS
Google Scholar
Монкхорст, Х. Дж. И Пак, Дж. Д. Особые моменты для интеграции зоны Бриллюэна. Phys. Ред. B 13 , 5188–5192 (1976).
ADS
MathSciNet
Статья
Google Scholar
Qu, Y. et al. Сверхвысокая электрокаталитическая активность наноцветов VS2 для эффективной реакции выделения водорода. J. Mater. Chem. A 5 , 15080–15086 (2017).
CAS
Статья
Google Scholar
Hinnemann, B. et al. Биомиметическое выделение водорода: наночастицы MoS2 как катализатор выделения водорода. J. Am. Chem. Soc. 127 , 5308–5309 (2005).
CAS
PubMed
Статья
PubMed Central
Google Scholar
Пан, Х. Реакция выделения водорода с усиленным напряжением на монослое дисульфида ванадия. Nanoscale Res. Lett. 11 , 113 (2016).
ADS
PubMed
PubMed Central
Статья
CAS
Google Scholar
Qu, Y., Pan, H., Kwok, C. T. & Wang, Z. Влияние легирования на реакцию выделения водорода из монослоя дисульфида ванадия. Nanoscale Res. Lett. 10 , 480 (2015).
ADS
PubMed
PubMed Central
Статья
CAS
Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
