Содержание
Урок №17-18. Закон сохранения массы веществ. Химические уравнения
Закон
сохранения массы веществ
Проблемный вопрос: изменится ли масса реагирующих
веществ по сравнению с массой продуктов реакции?
Чтобы ответить на данный вопрос наблюдайте за следующими видео-экспериментами:
Горение свечи в замкнутом сосуде
Сохранение массы веществ в реакциях
Вывод: Масса веществ до и после реакции не изменилась.
Формулировка закона сохранения массы: масса веществ,
вступивших в реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения этот закон
объясняется тем, что при химических реакциях общее количество атомов не
изменяется, а происходит лишь их перегруппировка.
Закон сохранения массы
веществ является основным законом химии, все расчеты по химическим реакциям
производятся на его основе. Именно с открытием этого закона связывают
возникновение современной химии как точной науки.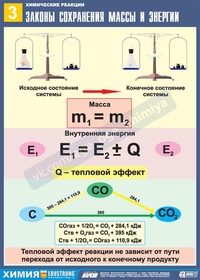
Закон сохранения массы был теоретически открыт в 1748
году и экспериментально подтверждён в 1756 году русским ученым М.В.
Ломоносовым.
Французский учёный Антуан Лавуазье в 1789 году
окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов,
так и Лавуазье пользовались в своих экспериментах очень точными весами. Они
нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали
исходные вещества и продукты реакции.
Химические
уравнения
Закон сохранения массы веществ
применяется при составлении уравнений химических реакций.
Химическое уравнение – это условная запись химической
реакции посредством химических формул и коэффициентов.
Посмотрим видео — эксперимент: Нагревание смеси
железа и серы.
В результате химического взаимодействия серы и железа
получено вещество – сульфид железа (II) – оно отличается от исходной
смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно
Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно
их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических
реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции
называются продуктами.
Запишем протекающую реакцию в виде уравнения
химической реакции:
Fe + S = FeS
Алгоритм
составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия |
1. В левой P + O2 → |
2. В правой части (после стрелки) пишем
P + O2 → P2O5
|
3. Согласно закону сохранения массы веществ
4P + 5O2
|
РАБОТА С ТРЕНАЖЁРАМИ
Тренажёр №1
Тренажёр №2
Тренажёр №3
Тренажёр №4
Тренажёр №5
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1.
Преобразуйте следующие схемы в уравнения химических реакций расставив
необходимые коэффициенты и заменив стрелки на знак равенства:
Zn + O2 → ZnO
Fe + Cl2→ FeCl3
Mg + HCl → MgCl2 + H2
Al(OH)3 → Al2O3 + H2O
HNO3→ H2O+NO2+O2
CaO+H2O→ Ca(OH)2
H2+Cl2→ HCl
KClO3→ KClO4+KCl
Fe(OH)2+H2O+O2→ Fe(OH)3
KBr+Cl2→ KCl+Br2
№2.
Используя алгоритм составления уравнений химических реакций, составьте
уравнения реакций взаимодействия между следующими парами веществ:
1) Na и O2
2) Na и Cl2
3) Al и S
Формулировка закона сохранения массы — урок. Химия, 8–9 класс.
Закон сохранения массы веществ в химических реакциях был сформулирован на основе работ по прокаливанию металлов.
В XVII в. английский учёный Р. Бойль проводил опыты по прокаливанию свинца. После окончания опытов он взвешивал полученные продукты и сравнивал их массу с массой исходного металла. Масса окалины всегда была больше массы свинца.
Русский учёный М. В. Ломоносов повторил опыты Р. Бойля. Но металлы он прокаливал в запаянных стеклянных сосудах — ретортах. Взвешивание сосудов до и после реакции показало, что их масса остаётся неизменной.
В \(1748\) г. М. В. Ломоносов сделал вывод: «Все перемены, в натуре случающиеся, суть такого состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому. Так ежели где убудет материи, то умножится в другом месте».
Так ежели где убудет материи, то умножится в другом месте».
В \(1789\) г. французскому химику А. Лавуазье удалось объяснить причину разных результатов взвешивания веществ в открытых и закрытых сосудах. Он доказал, что образование окалины происходит за счёт присоединения к металлу кислорода, содержащегося в воздухе.
Так был открыт М. В. Ломоносовым и экспериментально подтверждён А. Лавуазье закон сохранения массы.
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
При химических реакциях атомы не исчезают и не появляются. Продукты реакции образуются из атомов, содержащихся в исходных веществах. Поэтому масса и остаётся неизменной.
Пример:
реакция горения природного газа (метана):
метан \(+\) кислород \(=\) углекислый газ \(+\) вода.
Исходные вещества — метан Ch5 и кислород O2:
Продукты реакции — углекислый газ CO2 и вода h3O:
В молекулах исходных веществ и в молекулах продуктов реакции содержатся атомы углерода, водорода и кислорода. Их число не меняется, поэтому и масса веществ остаётся неизменной.
масса метана \(+\) масса кислорода \(=\) масса углекислого газа \(+\) масса воды,
m(Ch5)+m(O2)=m(CO2)+m(h3O).
Закон сохранения массы вещества — Справочник химика 21
Закон сохранения массы веществ (М. В. Ломоносов, 1748) масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции. [c.4]
Для решения большинства химических задач ключевым этапом является расчет по уравнению химической реакции. Сам процесс расчета может проводиться несколькими незначительно отличающимися друг от друга способами, но принципы, позволяющие производить подобные действия, остаются одинаковыми для всех случаев. В основе расчетов по уравнениям химических реакций лежит закон сохранения массы вещества при химических превращениях. Современную формулировку зтого закона можно представить следующим образом [c.249]
Сам процесс расчета может проводиться несколькими незначительно отличающимися друг от друга способами, но принципы, позволяющие производить подобные действия, остаются одинаковыми для всех случаев. В основе расчетов по уравнениям химических реакций лежит закон сохранения массы вещества при химических превращениях. Современную формулировку зтого закона можно представить следующим образом [c.249]
Теоретическую основу аналитической химии составляют фундаментальные законы естествознания, такие, как периодический закон Д. И. Менделеева, законы сохранения массы вещества и [c.5]
Закон сохранения массы вещества. Расстановка коэффициентов в уравнениях химических реакций. Расчеты по уравнениям химических реакций [c.249]
По закону сохранения массы вещества, вес веществ, вступивших в реакцию, равен весу полученных веществ. Чтобы этот закон выполнялся, в уравнении реакции нужно расставить коэффициенты [c. 16]
16]
Стехиометрия основывается на стехиометрических законах сохранения массы веществ, постоянства состава, эквивалентов, кратных отношений, объемных отношений, Авогадро. [c.10]
Закон сохранения массы веществ, находящихся в реакторе и участвующих в химических реакциях, приводит к совокупности уравнений материального баланса. Каждое из.них представляет собой дифференциальное уравнение, определяющее скорость изменения концентрации какого-либо реагента. [c.16]
В основе ядерных реакций, как и химических процессов, лежит закон сохранения массы вещества и энергии. [c.71]
Материальный баланс печного процесса — это количественное выражение равенства массы поступивших в нее веществ и получающихся при этом продуктов и отходов. Основой материального баланса является закон сохранения массы вещества. [c.137]
М. Б. Ломоносов (1711 — 1765) впервые стал систематически применять весы при изучении химических реакций. Б 1756 г. он экспериментально установил один из основных законов природы — закон сохранения массы вещества, составивший основу количественного анализа и имеющий огромное значение для всей науки. М. В. Ломоносов разработал многие приемы химического анализа и исследования, не потерявшие значения до наших дней [c.8]
Б 1756 г. он экспериментально установил один из основных законов природы — закон сохранения массы вещества, составивший основу количественного анализа и имеющий огромное значение для всей науки. М. В. Ломоносов разработал многие приемы химического анализа и исследования, не потерявшие значения до наших дней [c.8]
Основой материального баланса являются законы сохранения массы вещества и стехиометрических соотношений. [c.5]
Материальный баланс составляют по уравнению основной суммарной реакции с учетом побочных реакций согласно закону сохранения массы вещества. Общая масса всех поступающих [c.5]
Закон сохранения массы вещества в химических реакциях подвергался многочисленным проверкам и не было экспериментально обнаружено отклонений от него. Укажите в самых общих чертах пути повышения точности (уменьшения погрешности) эксперимента. [c.13]
Закон сохранения массы вещества позволяет оценивать количества продуктов реакции по количествам исходных веществ и [c. 249]
249]
Покажите справедливость закона сохранения массы веществ М. В. Ломоносова на следующих явлениях а) при взаимодействии цинка с соляной кислотой масса образующегося хлорида цинка меньше массы цинка и кислоты, вступивших в реакцию [c.11]
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ [c.23]
ХИМИЧЕСКИЕ УРАВНЕНИЯ — запись химических реакции с помощью химических формул и численных коэффициентов в соответствии с законом сохранения массы вещества при химических превращениях. X. у. лежат в основе расчетов, связанных с данной реакцией. [c.274]
Открытие закона сохранения массы вещества и энергии. [c.15]
Для формирования химии как науки исключительно важное значение имело открытие закона сохранения массы вещества и энергии (движения). [c.15]
Открытие закона сохранения массы вещества и энергии Работы М. В. Ломоносова и А.-Л. Лавуазье…….. [c.429]
Закон сохранения массы вещества. Впервые его высказал М. В. Ломоносов в письме к Эйлеру от 5 июня 1748 г., опубликованном на русском языке в 1760 г. Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому… Это определение, за исключением архаичности языка, не устарело. [c.13]
Впервые его высказал М. В. Ломоносов в письме к Эйлеру от 5 июня 1748 г., опубликованном на русском языке в 1760 г. Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому… Это определение, за исключением архаичности языка, не устарело. [c.13]
Для составления уравнения окислительно-восстановительной реакции необходимо прежде всего знать химические формулы исходных и получающихся веществ. Исходные вещества мы знаем, а продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. В левой и правой частях уравнения реакции должно быть одинаковое число одних и тех же атомов. Следовательно, правильно записанная реакция является выражением закона сохранения массы вещества. Согласно закону эквивалентов вещества всегда соединяются между собой или замешают друг друга в определенных весовых соотношениях, соответствующих их эквивалентам. [c.115]
Закон сохранения массы веществ при химических реакциях Ломоносов рассматривал как одно из проявлений всеобщего закона сохранения материи и движения. [c.25]
[c.25]
П р и м е р 2. В условии задачи указано, что при взаимодействии натрия с водой образовался 12%-ный раствор щелочи. В этом случае закон сохранения массы веществ удобно выразить уравнением [c.8]
Рассмотренное уравнение удовлетворяет законам сохранения массы вещества и зарядов, поэтому стрелку (—) можно заменить знаком равенства и в полном ионно-молекулярном виде уравнение реакции будет иметь вид [c.47]
Закон сохранения массы вещества. Применяя количественные методы исследования химических реакций, М. В. Ломоносов установил, что при химических превращениях общий вес вещества остается неизменным. На основании своих опытов он сформулировал закон сохранения массы веш,еств [c.25]
С точки зрения атомно-молекулярной теории закон сохранения массы веществ объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит только их перегруппировка. А так как атомы имеют постоянную массу, то это и приводит к закону сохранения массы веществ. [c.25]
[c.25]
Закон постоянства состава. Закон сохранения массы веществ послужил основой для изучения количественного состава различных веществ, и к началу [c.26]
Подобные уравнения составляются на основе закона сохранения массы веществ и показывают количественные соотношения веществ, участвующих в химической реакции, В том случае, если указывается, какое количество молей веществ участвует в реакции и какое количество энергии при этом выделяется (поглощается), говорят о термохимических уравнениях реакций (см. гл. V). [c.167]
Огромной заслугой Ломоносова перед наукой было то, что он первый количественно обосновал основной закон химических превращений— закон сохранения массы вещества. Его опыты с накаливанием металлов в запаянных сосудах дали экспериментальное доказательство правильности материалистического представления о неуничтожаемости вещества. Уже тогда Ломоносов подошел к обобщенному определению принципа сохранения материи и движения, получившего ныне всестороннее доказательство и признание как всеобщего закона природы. Впервые Ломоносов сформулировал этот закон в 1748 г. в письме к Л. Эйлеру и опубликовал его в 1756 г. Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупигся к [c.13]
Впервые Ломоносов сформулировал этот закон в 1748 г. в письме к Л. Эйлеру и опубликовал его в 1756 г. Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупигся к [c.13]
Пример 1. Пусть необходимо в общем виде записать в математической форме закон сохранения массы веществ для реакции [c.7]
ПОНЯТНО, что ДЛЯ каждой отдельной реакции в уравнении, отражающем закон сохранения массы веществ, будут фигурировать другие величины. Однако даже для одной и той же реакции этот закон -можно выразить видоизмененными уравнениями, описывающими зависимость между величинами, которые, например, заданы в условии задачи. [c.7]
Оно, как и предыдущие, отражает закон сохранения массы веществ для данной реакции. [c.8]
Следует помнить, что каждое химическое уравнение не только-несет информацию о качественном составе веществ, принимающих участие в реакции, но и отражает закон сохранения массы веществ, и дает представление о количественных отношениях масс веществ, формулы которых записаны б уравнении для каждой реакции масса вещ еств, вступающих в реакцию, равна массе веществ, образующихся в результате ее. [c.25]
[c.25]
Искомая величина X —масса воды, образовавшейся в результате реакции. На основании закона сохранения массы веществ сумма масс оксидов металлов и серной кислоты, вступивших в реак-дию, равна сумме масс сульфатов металлов и воды, образовавшихся, в результате реакции. Обозначив массу серной кислоты /Пн,со запишем [c.26]
Согласно этому закону, масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате ее. Обозначив массы веществ, вступивших в реакцию и образовавшихся в результате ее, соответственно mNa, tnufi и mNaon, гпн,, запишем алгебраическое уравнение, отражающее закон сохранения массы веществ для данной реакции [c.7]
Решение. Искомая величина X — объем 8%-ного раствора серной кислоты. Уравнение составим на основании закона сохранения массы веществ масса серной кислоты в X л 8%-ного раствора равна массе кислоты в 0,6 л 0,1 М раствора. [c.70]
Материальный баланс составляется на основании закона сохранения массы вещества, согласно которому во всякой замкнутой системе масса веществ, встуинвии х в реакцию, равна массе веществ, получившихся в результате реакции. Материальный баланс технологического процесса — это масса веществ, поступивших на технологическую операцию (приход), равная массе веществ, полученных в ее результате (расход) [c.62]
Материальный баланс технологического процесса — это масса веществ, поступивших на технологическую операцию (приход), равная массе веществ, полученных в ее результате (расход) [c.62]
ЧТО выражает закон сохранения массы веществ в химических реакциях (1). Однако мы не будем требовать существования положительного решения системы (10), благодаря чему аналогично (7)—(9) можно рассматривать классы задач, подобные приведенному примеру 1. Обозначим через А матрицу, строками которой являются все лпнейно независимые решения системы (10), т. е. [c.106]
М. В. Ломоносов первым из ученых (в 1748 г.) сформулировал закон сохранения массы вещества при химической реакции. Q писал … все перСхМены, в., натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимается, столько присовокупится к другому . Этот закон в современной формулировке гласит Масса веществ, вступивших в реакцию, всегда равна массе веществ, образовавшихся в результате реакции. [c.3]
[c.3]
В исходной молекуле кислорода содержится 2 атома кислорода. В одной молекуле продукта реакции — воды -только один аюм О. Таким образом, если провзаимодействовала одна молекула О , то, чтобы выполнялся закон сохранения массы вещества, должно образоваться 2 молекулы воды. В двух молекулах воды содержится 4 атома водорода. А в исходных молекулах водорода — по два атома в молекуле. Значит, для получения двух молекул воды необходимы две молекулы li . Таким образом схему реакции можно превратить в уравнение [c.250]
Возникновение физической хнмии как самостоятельной науки относится к середине XVIII в. Первый в мире курс физической химии был создан М. В. Ломоносовым (1752—1754). На основе своих физико-химических исследований М. В. Ломоносов пришел к принципиально новому определению химии как науки о свойствах тел, исходя из того, что все изменения в природе связаны с движением материи. Он первым обосновал основной закон сохранения массы вещества и пришел к определению принципа сохранения материи и движения, получившего признание как всеобщий закон природы. [c.6]
[c.6]
Исследования М. В. Ломоносова позволили ему сформулировать основной закон природы — закон сохранения массы вещества (1758) Все перемены, в натуре случающиееся, такого суть состояния, что сколько чего у одного тела отнимается, столько же присоединяется к другому. Так, ежели где убудет несколько материи, то умножится в другом месте… Сей всеобщий естественный закон простирается и в самые правила движения… [c.15]
Получено оно следующим образом. При взаимодействии цинка с соляной кислотой образуется хлорид цинка (Zn b) и выделяется свободный водород. Но поскольку в левой части уравнения в молекуле соляной кислоты содержится только один атом водорода и один атом хлора, то, согласно закону сохранения массы вещества, в реакцию должны вступить две молекулы соляной кислоты. [c.19]
Урок 7. закон сохранения массы веществ. химические уравнения.коэффициенты в уравнениях реакций. типы химических реакций — Химия — 8 класс
Конспект
Закон сохранения массы веществ. Химические уравнения. Коэффициенты в уравнениях реакций
Химические уравнения. Коэффициенты в уравнениях реакций
В 1748 году Михаил Васильевич Ломоносов в письме к выдающемуся математику Леонарду Эйлеру написал следующее: «Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому…». Так Михаил Васильевич сформулировал один из результатов своих опытов по прокаливанию металлов, который стал известен как закон сохранения массы веществ. Суть опытов сводилась к следующему: Ломоносов взвешивал металлы в запаянных ретортах, затем прокаливал содержимое реторты, а потом взвешивал опять. В результате проделанного опыта масса не изменялась. В 1774 году французский химик Антуан Лавуазье, независимо от М.В. Ломоносова, повторил опыты по прокаливанию металлов, на основании которых также сделал вывод о том, что в процессе химической реакции масса веществ не изменяется.
В настоящее время закон сохранения массы формулируется так: «масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ».
Химическая реакция – это процесс превращения одних веществ в другие. А каждое вещество имеет свой состав, который можно записать при помощи химической формулы. Это значит, что и химическую реакцию можно записать при помощи условных обозначений.
Химическая реакция между магнием и серой протекает очень бурно. Как же можно записать эту химическую реакцию? В ней магний взаимодействует с серой. Продуктом этой реакции является сульфид магния, вещество, которое состоит из магния и серы. Валентности магния и серы в этом веществе одинаковы: Mg + S = MgS. Магний и сера в этой реакции будут исходными веществами, а сульфид магния – продуктом реакции.
Рассмотрим реакцию между магнием и кислородом. Продукт реакции – оксид магния: Mg + O2 → MgO. Обратите внимание на знак, разделяющий исходные вещества и продукты реакции. Если масса веществ в ходе химической реакции не изменяется, то неизменным является и состав атомов, которые входят в исходные вещества и продукты реакции. А у нас число атомов кислорода в исходных веществах и в продуктах реакции различны. Чтобы прошла эта реакция, молекула кислорода должна вступить в реакцию с двумя атомами магния: 2Mg + O2 = 2MgO. Вот теперь у нас получилось уравнение химической реакции.
Чтобы прошла эта реакция, молекула кислорода должна вступить в реакцию с двумя атомами магния: 2Mg + O2 = 2MgO. Вот теперь у нас получилось уравнение химической реакции.
Уравнение химической реакции – условная запись химической реакции посредством математических знаков, химических формул и коэффициентов. Уравнение химической реакции показывает сущность химической реакции с позиции атомно-молекулярной теории, т.е. в левой и правой части уравнения должно быть одинаковое число атомов. Для характеристики количественных соотношений между массами вещество вступивших в реакцию и продуктами реакции используют коэффициенты.
Рассмотрим процесс составления уравнения реакции на примере взаимодействия фосфора с кислородом.
1. Запишем исходные вещества P + O2
2. Составим продукт реакции исходя из валентностей элементов P + O2 → P2O5
3. Определим коэффициенты перед веществами, содержащими кислород. Чтобы число атомов кислорода стало одинаковым, поставим перед молекулой кислорода коэффициент 5, а перед оксидом фосфора 2, таким образом, число атомов кислорода в левой и правой частях уравнения стало одинаковым: P + 5O2 → 2P2O5
4. Коэффициент перед формулой относится к атомам всех химических элементов в веществе. Поэтому в правой части уравнения стало 4 атома фосфора. Для того, чтобы число атомов фосфора было равным, поставим коэффициент 4 перед фосфором в исходном веществе: 4P + 5O2 = 2P2O5
Коэффициент перед формулой относится к атомам всех химических элементов в веществе. Поэтому в правой части уравнения стало 4 атома фосфора. Для того, чтобы число атомов фосфора было равным, поставим коэффициент 4 перед фосфором в исходном веществе: 4P + 5O2 = 2P2O5
Теперь у нас получилось уравнение химической реакции взаимодействия фосфора с кислородом с образованием оксида фосфора (V).
Справочный материал:
• Закон сохранения массы веществ – масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
• Уравнение химической реакции – условная запись химической реакции посредством математических знаков, химических формул и коэффициентов.
• Уравнение химической реакции показывает сущность химической реакции с позиции атомно-молекулярной теории.
• Коэффициенты в уравнении химических реакций (стехиометрические коэффициенты) – цифры, стоящие перед химическими формулами, характеризуют количественные соотношения между массами вещество вступивших в реакцию и продуктами реакции.
• Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
Закон сохранения массы и эненргии
После доказательства существования атомов и молекул важнейшим открытием атомно-молекулярной теории стал закон сохранения массы, который был сформулирован в виде философской концепции великим русским ученым Михаилом Васильевичем Ломоносовым (1711-1765) в 1748 г. и подтвержден экспериментально им самим в 1756 г. и независимо от него французским химиком А.Л.Лавуазье в 1789 г.
Масса всех веществ, вступающих в химическую реакцию, равна массе всех продуктов реакции.
Опыты по сжиганию веществ, которые проводились до Ломоносова, наводили на мысль о том, что масса веществ в процессе реакции не сохраняется. При нагревании на воздухе ртуть превращалась в красную окалину, масса которой была больше массы металла. Масса золы, образующейся при сгорании дерева, напротив, всегда меньше массы исходного вещества.
Ломоносов провел простой опыт, который показал, что горение металла есть реакция присоединения, а увеличение массы металла происходит за счет присоединения части воздуха. Он прокаливал металлы в запаянном стеклянном сосуде и обнаружил, что масса сосуда не изменялась, хотя химическая реакция происходила. После того, как сосуд был вскрыт, туда устремлялся воздух, и масса сосуда увеличивалась. Таким образом, при аккуратном измерении массы всех участников реакции выясняется, что масса веществ при химической реакции сохраняется. Закон сохранения массы имел огромное значение для атомно-молекулярной теории. Он подтвердил, что атомы являются неделимыми и при химических реакциях не изменяются. Молекулы при реакции обмениваются атомами, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Закон сохранения массы является частным случаем общего закона природы – закона сохранения энергии, который утверждает, что энергия изолированной системы постоянна. Энергия – это мера движения и взаимодействия различных видов материи. При любых процессах в изолированной системе энергия не производится и не уничтожается, она может только переходить из одной формы в другую.
Одной из форм энергии является так называемая энергия покоя, которая связана с массой соотношением Эйнштейна
Е0 = m0•с2,
где с – скорость света в вакууме (с = 3•108 м/с). Это соотношение показывает, что масса может переходить в энергию и наоборот. Именно это и происходит во всех ядерных реакциях, и поэтому закон сохранения массы в ядерных процессах нарушается. Однако, закон сохранения энергии остается справедливым и в этом случае, если учитывать энергию покоя.
В химических реакциях изменение массы, вызванное выделением или поглощением энергия, очень мало. Типичный тепловой эффект химической реакции по порядку величины равен 100 кДж/моль. Посчитаем, как при этом изменяется масса:
∆m = ∆E/с2 = 105 / (3•108)2 ~ 10-12 кг/моль = 10-9г/моль.
Закон сохранения массы, масса продуктов реакции равна массе веществ вступивших в реакцию
Купить рН-метры, pH meters в Санкт-Петербурге
В каталоге товаров/продукции представлены рН-метры —
pH метры Россия, карманные рН-метры, портативные рН-метры, стационарные рН-метры, рН-метры для пищевой промышленности, категории: pH meter made in Russia, pocket pH meters, portable pH meters, stationary pH meters, pH meters for food industry, ; портативные, стационарные лабораторные модели измерителей водородного показателя (показателя pH), компактные карманные приборы рН-метры, автономные портативные рН-метры для оперативного определения кислотности или щелочности среды, лабораторные модели стационарные измерители водородного показателя (показателя pH), ,
pH метры Россия
Подробнее…
Купить pH метры производства Россия — pH meter made in Russia в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить портативные, стационарные pH метры Россия в Санкт-Петербурге по выгодной цене. компактные модели рН-метров, приборов для измерения водородного показателя.
карманные рН-метры
Подробнее…
Купить карманные рН-метры — pocket pH meters в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Легкие и удобные устройства предназначены для оперативного определения кислотности или щелочности среды / определения уровня pH среды в полевых условиях, когда использование более громоздких лабораторных «портативных рН-метров»; «стационарных рН-метров» приборов зат…
рН-метры для пищевой промышленности
Подробнее…
Приборы для анализа пищевых продуктов — купить рН-метры для пищевой промышленности — pH meters for food industry в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93.
Универсальные измерительные приборы контроля качества продуктов питания применяются в различных лабораториях и производстве.
Купить прибор в Санкт-Петербурге по выгодной цене. рН-метры. В каталоге ХИМСНАБ-СПБ представлены…
Купить электроды для измерения pH, анализаторы pH-электроды для рН-метров
Выносные электроды предназначеных для проведения измерений в лабораторных и полевых измерений рН, определения окислительно-восстановительного потенциала, удельной электрической проводимости и температуры воды, водных растворов. Анализаторы состоят из измерительного преобразователя и комбинированных датчиков (первичных преобразователей), обеспечивающих измерение параметров водной среды. Измерительные приборы отличает высокая производительность и точность осуществляемых измерений.
Купить электроды и датчики, electrodes and sensors в Санкт-Петербурге
В каталоге товаров/продукции представлены электроды и датчики —
Ион-селективные электроды, pH-электроды, электроды для измерения pH, датчики ОВП, редокс-электроды, датчики проводимости, датчики температуры, кислородные датчики, электроды вспомогательные (сравнения), категории: Ion-selective electrodes, pH-electrodes, sensors ORP, conductivity sensors, temperature sensors, oxygen sensors, the auxiliary electrode (comparison), ; Ион-селективные электроды, pH-электрод, датчики ph, электрод ph метра, электроды для измерения ph, измерительный электрод ph, рН-метрический электрод, измерение значения концентрации ионов водорода, определение концентрации ионов водорода, электроды датчики ОВП, редокс-электроды, измерение окислительно-восстановительного потенциала, многодиапазонные зонды и электроды, электроды датчики проводимости, электрод сенсор датчик температуры, электрод сенсор датчик кислородный, специальные лабораторные и промышленные электроды сравнения, электроды вспомогательные,
Ион-селективные электроды
Подробнее…
Купить Ион-селективные электроды — Ion-selective electrodes в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить Ион-селективный электрод в Санкт-Петербурге по выгодной цене.
Проведение лабораторных ионометрических исследований, ионометрический анализ образцов требует наличия анализаторов и специализированного лабораторного оборудования: ионоселективного электрода, вспомогательного…
pH-электроды, электроды для измерения pH
Подробнее…
Купить pH-электроды (pH-electrodes) лабораторные измерительные устройства, анализаторы жидкости, растворов, воды и водных сред используемые для получения точных и воспроизводимых показаний приборов, опредлеление кислотности или щелочности выраженной в виде pH. В комании ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93 можно приобрести рН-электроды для рН-метров, анализаторов воды предназначе…
датчики ОВП, редокс-электроды
Подробнее…
Индикаторные элементы для проведения измерения окислительно-восстановительных потенциалов. В обратимых окислительно-восстановительных системах позволяют проводить определение концентрации компонентов. Специализированные электроды и датчики ОВП, редокс-электроды имеют особые электрохимические характеристики для потенциометрических измерений, регистрации ОВП растворов. Измерительное оборудован…
датчики проводимости
Подробнее…
Купить многодиапазонные датчики проводимости — conductivity sensors для кондуктометров использующих выносной (сменный) электрод в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить датчик проводимости в Санкт-Петербурге по выгодной цене. Специализированные электроды и датчики, electrodes and sensors с подключаемым кабелем используемые для определения проводимости и солесодержания в вод…
кислородные датчики
Подробнее…
Купить кислородные датчики — oxygen sensors для стационарных и портативных оксиметров в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Модели стандартных полярографических датчиков растворенного кислорода применяемых в настольных и портативных приборах. Отдельные модели датчиков кислорода состоят из платинового катода, серебряного анода и фторопластовой мембраны. Конструкции датчика делаю…
электроды вспомогательные (сравнения)
Подробнее…
Купить электроды вспомогательные (сравнения) — auxiliary electrode (comparison) в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Лабораторный вспомогательный или опорный электрод, заполненный концентрированным раствором КСl — электролит является вторым по значимости элементом измерительного прибора «рН-метра» . Данный тип электрода позволяет создать опорную точку, относитель…
индикаторная бумага в ПОЛОСКАХ или индикаторная бумага в КАТУШКАХ. Подобрать по диапазону pH: 0 — 6 рН; 1 — 12 рН; 4,5 — 10 рН; 7 — 14 рН; 1 — 11 рН; 5,5 — 9 рН; 1 — 14 рН; 0 — 14 рН; 0 — 12 рН, также в каталоге ХИМСНАБ-СПБ
лабораторного оборудования и приборов, раздела измерительные приборы можно приобрести приборы для измерения водородного показателя pH:
«рН-метры»;
«карманные рН-метры»;
«портативные рН-метры»;
«стационарные рН-метры» и
«pH-электроды»
Оставьте заявку ON-LINE или позвоните. Менеджер компании ответит на ваши вопросы.
Широкий ассортимент
В каталоге компании более 4000 наименований продукции в 200 товарных категориях: химические реактивы, лаб. оборудование и посуда, аксессуары и принадлежности для лабораторий, различные виды удобрений, химическое сырьеи многе другое. Можно подобрать продукцию воспользовавшись фильтром характеристик.
Проверенные поставщики
Компания реализует товары и продукцию только от проверенных поставщиков гарантирующих качестно продукции.
Консультация по продукции
Менеджеры компании проконсультируют вас по ассортименту реализуемой продукции, звоните в рабочее время
Доставка
География потребителей выходит за пределы России, компания «Химснаб-СПБ» осуществляет доставку приобретаемых товаров и продукции по Санкт-Петербургу, Ленинрадской обл, России и странам СНГ.
Индивидуальный подход
Строим свое сотрудничество с клиентом с учетом всех пожеланий клиента.
Гибкий и индивидуальный подход к каждому клиенту, ориентированность на долгосрочные партнерские отношения, строгое соблюдение оговоренных сроков и предоставления документов заказчику являются неоспоримыми преимуществами компании «Химснаб-СПБ». Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Малотоннажная химия
Реализация продукции малотоннажной химии: продукция химической и нефтехимической промышленности. Малотоннажная химия дает возможность на скромном оборудовании и в небольших объемах производить дорогостоящие модификаторы, пластификаторы, ингибиторы и другие микродобавки, способные наделять конечный продукт новыми свойствами
Комплексное снабжение, оснащение
Компания Химснаб-СПБ имеет многолетний опыт работы на рынке химической продукции и лабораторного оборудования. Компания тесно сотрудничает со многими промышленными и производственными организациями и имеет возможность осуществлять комплексное снабжение и оснащение предприятии различных отраслений промышленности необходимым оборудованием и расходными материалами.
Предствленная информация на страницах данного интернет-сайта и в каталоге продукции носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса РФ. Для получения подробной информации о наличии и стоимости указанных товаров и (или) услуг,обращайтесь к менеджерам отдела продаж: форма обратной связи, e-mail, телефон.
Реализация продукции для сельского хозяйства, химической, строительной, нефтегазовой, металлургической, текстильной, кожевенной, и других отраслей промышленности.
Урок химии по теме «Закон сохранения массы веществ. Химические уравнения»
Цель урока:ознакомить с количественной стороной химических процессов, узнать о научном подвиге М.В. Ломоносова, получить представление о химических уравнениях, научиться писать их.
Задачи:
1. Образовательные: Экспериментально доказать закон сохранения массы веществ. На основе этого закона сформировать понятие о материальном балансе химических реакций и научить расставлять коэффициенты в уравнениях реакций.
2. Развивающие: содействовать развитию у учащихся исследовательских умений в процессе выполнения и наблюдения эксперимента, углубление знаний.
3. Воспитательные: поддерживать интерес к изучению химии, воспитывать сотрудничество, способствовать развитию грамотной химической речи, учить анализировать.
Основные понятия. Закон сохранения массы веществ, химическое уравнение, коэффициент.
Тип урока. Изучение нового материала.
Методы обучения. Частично-поисковый, исследовательский, репродуктивный.
Формы деятельности. Общеклассная, групповая, индивидуальная.
Ожидаемый результат:
- Знать формулировку закона сохранения массы веществ, его значение, понимать смысл уравнений химических реакций, значение коэффициентов в химических уравнениях;
- Уметь применять закон сохранения массы веществ при написании уравнений, расставлять коэффициенты в уравнениях, проводить опыты.
Демонстрации. Опыты, подтверждающие закон сохранения массы веществ: взаимодействие сульфата натрия и хлорида бария в закрытом сосуде, мрамора и соляной кислоты.
Оборудование и реактивы. Мультимедиапроектор, компьютер, экран, диск Школа Кирилла и Мефодия «Уроки химии 8-9 кл.», карточки с заданиями, пробирки, пластмассовые штативы, стаканы, весы, растворы хлорида бария, сульфата натрия, соляной кислоты, мрамор.
Ход урока.
I. Орг. Момент.
Ознакомление с целями, задачами и планом урока.
План урока.
- Самостоятельная работа.
- Открытие закона (1756г.), (видеозапись), Современная формулировка закона.
- Объяснение опыта с горением свечи.
- Лабораторный опыт.
- Значение закона.
- Химическое уравнение. Знаки, используемые в химическом уравнении. (видеозапись)
- Алгоритм расстановки коэффициентов. Коэффициент.
- Закрепление.
- Вывод.
- Домашнее задание: § 14, 15, упражнение 1-4 (стр.42).
II. Проверка знаний полученных на предыдущих уроках.
1. Самостоятельная работа.
Учитель: Проверим свои знания и умения составлять химические формулы, определять валентности элементов. Выполним самостоятельную работу по вариантам на карточках с заданиями. На экране задания для самостоятельной работы (приложение № 1)
Учитель: Правильность выполнения заданий проверим по ответам на экране (приложение № 2).
III. Изучение нового материала.
2. Постановка проблемы: Будет ли масса веществ, полученных после реакции, равна массе веществ, вступивших в реакцию?
Учитель: Вспомним, что представляют собой химические реакции с точки зрения атомно-молекулярного учения? Что происходит с веществами во время химических реакций? Из чего состоят вещества?
Вывод: Во время химических реакций атомы сохраняются, значит и масса веществ, вступающих в реакцию должна быть равна массе веществ, полученных после реакции. В течение тысячелетий люди верили в то, что вещество может бесследно исчезать и появляться из ничего. Это житейское наблюдение подтвердил и такой известный ученый как Р. Бойль. На экране видеоматериал (диск «Уроки химии Кирилла и Мефодия. 8-9 классы» урок 5 «Закон сохранения массы веществ» 2004г.).
В 1756г. М.В. Ломоносов доказал закон сохранения массы веществ: «Все перемены в Натуре случающиеся такого суть состояния, что, сколько чего у одного тела отнимается, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте; сколько часов кто положит на бдение, столько же сну отнимет…».
В настоящее время этот закон формулируется так: масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
3. Объяснение, совместное с учащимися обсуждение.
Учитель: Объясните известный опыт: сжигание свечи, уравновешенной на весах. Чаша весов со свечой поднимается вверх. Можно ли утверждать, что закон сохранения массы веществ по мере сгорания парафиновой свечи нарушен?
Как усовершенствовать этот опыт, чтобы доказать правильность закона? Чем объяснить поднятие чашки со сгораемой свечой на весах? Можно ли сказать, что парафиновая свеча исчезает бесследно, уничтожается?
Ученик: Свеча сгорела, продукты реакции улетучились, смешались с воздухом. Установить поглотители продуктов реакции.
Вывод: Таким образом, если учесть массу парафиновой свечи, кислорода воздуха (это исходные вещества) и массу продуктов реакции (углекислый газ и пары воды), то окажется, что масса веществ, взятых для реакции, точно равна массе веществ, получившихся после реакции. А значит, реакция горения подчиняется закону сохранения массы веществ.
4. Организация лабораторной работы и объяснение ее результатов.
Проведем лабораторный опыт. Задания на карточках и на экране (приложение № 3).
Вывод: в первом опыте все продукты остались в стаканчике, а во втором – образовался газ, который улетучился.
Уменьшение массы веществ после реакции возможно только в том случае, если один из продуктов её не замечен и не измерен, чаще всего такими веществами являются пары и газы.
5. Значение закона.
Закон М.В. Ломоносова имеет большое значение: помогает правильно понимать окружающий мир: ничто в природе не может возникнуть из ничего и не может исчезнуть бесследно. Этот закон является основой для составления уравнений химических реакций.
6. Работа над термином «химические уравнения».
Химическое уравнение – это условная запись химических реакций с помощью химических знаков и формул.
На экране знаки, используемые в химическом уравнении. (диск «Уроки химии Кирилла и Мефодия. 8-9 классы» урок 5 «Закон сохранения массы веществ» 2004г.)
7. Работа над термином «коэффициент» и алгоритмом расстановки коэффициентов.
Алгоритм расстановки коэффициентов в уравнениях химических реакций на примере реакции горения красного фосфора. (приложение №4)
Коэффициент – это цифра, которая ставится перед химической формулой.
Учитель: Расставим коэффициенты в химической реакции между натрием и хлороводородом. В начале записываем схему реакции:
Na + HCl → NaCl + H2 ↑
Чтобы схема стала уравнением мы должны уравнять число атомов каждого элемента в левой и правой частях уравнения. Для этого используем коэффициенты – цифры, которые ставятся впереди химических формул.
Сравним число атомов каждого элемента в левых и правых частях схемы. Число атомов Na одинаковое (1), коэффициенты здесь не нужны. Число атомов водорода в правой части в 2 раза больше чем в левой, перед формулой HCl ставим коэффициент – 2. В 2-х молекулах HCl содержится 2 атома Cl, а в правой части только 1 атом Cl, ставим коэффициент – 2 перед формулой NaCl, теперь нарушилось равенство в числе атомов Na, чтобы восстановить его нужно поставить коэффициент – 2 перед химическим знаком Na. Теперь закон сохранения массы веществ выполняется.
2Na + 2HCl → 2NaCl + H2 ↑
8. Закрепление.
Для закрепления полученных знаний выполним самостоятельную работу. Расставим коэффициенты в приведенных схемах:
Ba + O2 → BaO
H2 + O2 → H2O
Al + Br2 → AlBr3
H2O → H2 + O2
9. Подведение итогов.
Решение проблемы, поставленной в начале урока.
10. Домашнее задание § 14, 15 упражнения 1-4 по учебнику «Химия – 8» (авторы Г.Е. Рудзитис, Ф.Г. Фельдман).
Закон сохранения массы
Цель обучения
- Определить закон сохранения массы
Ключевые моменты
- Закон сохранения массы гласит, что масса в изолированной системе не создается и не разрушается химическими реакциями или физическими превращениями.
- Согласно закону сохранения массы, масса продуктов химической реакции должна равняться массе реагентов.
- Закон сохранения массы полезен для ряда вычислений и может использоваться для определения неизвестных масс, например количества газа, потребляемого или производимого во время реакции.
Условия
- реагент Любой из участников, присутствующий в начале химической реакции. Кроме того, молекула до того, как претерпит химическое изменение.
- закон сохранения массы Закон, который гласит, что масса не может быть создана или разрушена; он просто переставлен.
- продукт Химическое вещество, образовавшееся в результате химической реакции.
История закона сохранения массы
Древние греки впервые предложили идею о постоянстве общего количества материи во Вселенной. Однако Антуан Лавуазье описал закон сохранения массы (или принцип сохранения массы / материи) как фундаментальный принцип физики в 1789 году.
Антуан Лавуазье Портрет Антуана Лавуазье, ученого, которому приписывают открытие закона сохранения массы.
Этот закон гласит, что, несмотря на химические реакции или физические превращения, масса сохраняется, то есть она не может быть создана или уничтожена в изолированной системе. Другими словами, в химической реакции масса продуктов всегда будет равна массе реагентов.
Закон сохранения массы-энергии
Этот закон был позже изменен Эйнштейном в законе сохранения массы-энергии, который описывает тот факт, что полная масса и энергия в системе остаются постоянными.Эта поправка включает тот факт, что масса и энергия могут быть преобразованы друг в друга. Однако закон сохранения массы остается полезным понятием в химии, поскольку энергия, производимая или потребляемая в типичной химической реакции, составляет ничтожное количество массы.
Таким образом, мы можем визуализировать химические реакции как перегруппировку атомов и связей, в то время как количество атомов, участвующих в реакции, остается неизменным. Это предположение позволяет нам представить химическую реакцию в виде сбалансированного уравнения, в котором количество молей любого элемента, участвующего в ней, одинаково с обеих сторон уравнения.Дополнительное полезное применение этого закона — определение масс газообразных реагентов и продуктов. Если суммы твердых или жидких реагентов и продуктов известны, любую оставшуюся массу можно отнести к газу.
Сохранение атомов — YouTube В этом видео рассказывается, как атомы сохраняются в химической реакции.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
5.2: Закон сохранения материи
В науке закон — это общее утверждение, объясняющее большое количество наблюдений. Прежде чем быть принятым, закон должен быть многократно подтвержден при различных условиях. Поэтому законы считаются высшей формой научного знания и, как правило, считаются неприкосновенными. Научные законы составляют основу научного знания. Один научный закон, который обеспечивает основу для понимания химии, — это закон сохранения материи.Он гласит, что в любой данной системе, которая закрыта для переноса материи (внутрь и наружу), количество вещества в системе остается постоянным. Кратко выразить этот закон можно, сказав, что количество вещества в системе сохраняется .
С развитием более точных представлений об элементах, соединениях и смесях ученые начали исследовать, как и почему вещества реагируют. Французский химик А. Лавуазье заложил основы научных исследований материи, описав, что вещества реагируют по определенным законам.{\ text {Oxygen}}} _ {\ text {7,4 г}} \]
Другой способ сказать это: «В химической реакции материя не создается и не разрушается». Закон сохранения массы также известен как «закон неразрушимости материи».
Пример \ (\ PageIndex {1} \)
Если нагревание 10 граммов \ (\ ce {CaCO3} \) дает 4,4 г \ (\ ce {CO2} \) и 5,6 г \ (\ ce {CaO} \), покажите, что эти наблюдения согласуются с закон сохранения массы.
Образец карбоната кальция (CaCO 3 ).(Общественное достояние; Walkerma).
Решение
- Масса реагентов, \ (\ ce {CaCO3} \): \ (10 \, г \)
- Масса продуктов, \ (\ ce {CO2} \) и \ (\ ce {CaO} \): \ (4.4 \, g + 5.6 \, g = 10 \, g \).
Поскольку масса реагентов = массе продуктов, наблюдения согласуются с законом сохранения массы.
Что это значит для химии? При любом химическом изменении одно или несколько исходных веществ превращаются в другое вещество или вещества.И начальное, и конечное вещества состоят из атомов, потому что вся материя состоит из атомов. Согласно закону сохранения материи, материя не создается и не разрушается, поэтому после химического изменения у нас должно быть такое же количество и вид атомов , которые присутствовали до химического изменения.
Может показаться, что горение разрушает материю, но такое же количество или масса материи все еще существует после костра, как и раньше. На рис. 5.1.1 показано, что когда дерево горит, оно соединяется с кислородом и превращается не только в золу, но также в углекислый газ и водяной пар.Газы уносятся в воздух, оставляя после себя только пепел. Предположим, мы измерили массу древесины до того, как она сгорела, и массу золы после того, как она сгорела. Также предположим, что мы смогли измерить кислород, используемый огнем, и газы, выделяемые огнем. Что бы мы нашли? Общая масса вещества после пожара будет равна общей массе вещества до пожара.
Рисунок 5.1.1: Сжигание — это химический процесс. Пламя возникает в результате сгорания топлива.Изображения использованы с разрешения (CC BY-SA 2.5; Einar Helland Berger для огня и пепла).
Упражнение \ (\ PageIndex {1} \)
- Каков закон сохранения материи?
- Как закон сохранения вещества применим к химии?
- Ответ:
Закон сохранения материи гласит, что в любой данной системе, которая закрыта для переноса материи, количество вещества в системе остается постоянным
- Ответ б:
Закон сохранения вещества гласит, что в химических реакциях общая масса продуктов должна равняться общей массе реагентов.
3.7: Сохранение массы — Нового нет
- Последнее обновление
- Сохранить как PDF
- Закон сохранения массы
- Резюме
- Вклады и атрибуция
Может показаться, что горение разрушает материю, но такое же количество или масса материи все еще существует после костра, как и раньше.Посмотрите на рисунок \ (\ PageIndex {1} \) ниже. Он показывает, что когда дерево горит, оно соединяется с кислородом и превращается не только в золу, но также в углекислый газ и водяной пар. Газы уносятся в воздух, оставляя после себя только пепел. Предположим, вы измерили массу древесины до того, как она сгорела, и массу золы после того, как она сгорела. Также предположим, что вы смогли измерить кислород, используемый огнем, и газы, выделяемые огнем. Что бы вы нашли? Общая масса вещества после пожара будет равна общей массе вещества до пожара.
Рисунок \ (\ PageIndex {1} \): Горение — это химический процесс. Пламя возникает в результате сгорания топлива. (CC BY-SA 2.5; Эйнар Хелланд Бергер за огонь и Вальтер Зигмунд за пепел).
Закон сохранения массы
Закон сохранения массы был создан в 1789 году французским химиком Антуаном Лавуазье. Закон сохранения массы гласит, что материя не может быть создана или разрушена в результате химической реакции. Например, когда горит древесина, масса сажи, золы и газов равна исходной массе древесного угля и кислорода, когда они впервые прореагировали.Таким образом, масса продукта равна массе реагента. Реагент — это химическая реакция двух или более элементов с образованием нового вещества, а продукт — это вещество, которое образуется в результате химической реакции (Видео \ (\ PageIndex {1} \)). Материя и соответствующая ей масса не могут быть созданы или разрушены, но могут изменить форму на другие вещества, такие как жидкости, газы и твердые тела.
Видео \ (\ PageIndex {1} \): Это красивая небольшая демонстрация, показывающая сохранение массы в действии.
Если вы станете свидетелем сгорания дотла 300-килограммового дерева, после сожжения останется только пепел, и все они вместе весят 10 кг. Это может заставить вас задуматься, куда делись остальные 290 кг. Недостающие 290 кг были выброшены в атмосферу в виде дыма, поэтому единственное, что вы можете увидеть, — это 10 кг золы. Если вы знаете закон сохранения массы, то вы знаете, что остальные 290 кг должны куда-то уйти, потому что они должны равняться массе дерева до того, как оно сгорело.
Пример \ (\ PageIndex {1} \)
Если отопление 10.0 граммов карбоната кальция (CaCO 3 ) дает 4,4 г диоксида углерода (CO 2 ) и 5,6 г оксида кальция (CaO), что показывает, что эти наблюдения согласуются с законом сохранения массы.
Решение
\ [\ begin {align *} \ text {Масса реагентов} & = \ text {Масса продуктов} \\ [4pt] 10.0 \, \ text {g of} \ ce {CaCO3} & = 4.4 \ , \ text {g of} \ ce {CO2} + 5.6 \, \ text {g of} \ ce {CaO} \\ [4pt] 10.0 \, \ text {g of реагент} & = 10.0 \, \ text {g of products} \ end {align *} \]
Поскольку масса реагента равна массе продуктов, наблюдения согласуются с законом сохранения массы.
Упражнение \ (\ PageIndex {1} \)
Гидроксид калия (\ (\ ce {KOH} \)) легко реагирует с диоксидом углерода (\ (\ ce {CO2} \)) с образованием карбоната калия (\ (\ ce {K2CO3} \)) и воды (\ ( \ ce {h3O} \)). Сколько граммов карбоната калия получается, если 224,4 г \ (\ ce {KOH} \) вступает в реакцию с 88?0 г \ (\ ce {CO2} \)? В результате реакции также образуется 36,0 г воды.
- Ответ
- 276,4 г карбоната калия
Закон также применим как к химическим, так и к физическим изменениям. Например, если у вас есть кубик льда, который плавится в жидкость, и вы нагреваете эту жидкость, она превращается в газ. Кажется, что он исчез, но все еще там.
Сводка
- Горение и другие изменения материи не разрушают материю.
- Масса вещества всегда одна и та же до и после изменений.
- Закон сохранения массы гласит, что материя не может быть создана или уничтожена.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
2 простых примера закона сохранения массы
Химия — важный предмет, который вам обязательно нужно знать, если вы планируете изучать химию или другую специальность в колледже. Вам следует знать закон сохранения массы. Что это? А как его используют в химии?
Продолжайте читать, чтобы узнать, что такое закон сохранения массы и как он появился. Мы также дадим вам некоторые примеры закона сохранения массы, чтобы помочь вам лучше понять концепцию.
Что такое закон сохранения массы?
Во-первых, что такое закон сохранения массы? Этот закон гласит, что в закрытой системе материю нельзя ни создать, ни уничтожить — она может только изменить форму.
Другими словами, количество или масса вещества в изолированной системе будет всегда постоянным независимо от любых химических реакций или физических изменений, которые имеют место. (Обратите внимание, что изолированная или закрытая система — это система, которая не взаимодействует с окружающей средой.)
Этот закон важен в химии, особенно при объединении различных материалов и проверке реакций между ними.
В химии закон сохранения массы гласит, что масса продуктов (химических веществ, созданных в результате химической реакции) всегда будет равна массе реагентов (веществ, производящих химическую реакцию).
Думайте об этом как о балансировании алгебраического уравнения. Обе стороны вокруг знака равенства могут выглядеть по-разному (например, 6 a + 2 b = 20), но они все равно представляют одинаковое общее количество. Это похоже на то, как масса должна быть постоянной для всей материи в замкнутой системе — даже если эта материя меняет форму!
Но как работает закон сохранения массы?
Когда вещество подвергается химической реакции, вы можете предположить, что часть или даже вся присутствующая материя исчезает, но на самом деле это просто меняет форму.
Подумайте, когда жидкость превращается в газ. Вы могли подумать, что вещество (в данном случае жидкость) просто исчезло. Но если бы вы действительно измерили газ , вы бы обнаружили, что начальная масса жидкости на самом деле не изменилась. Это означает, что вещество, которое сейчас является газом, по-прежнему имеет ту же массу, что и когда оно было жидкостью (да, у газа тоже есть масса!).
Какова история закона сохранения массы?
Хотя многие люди, включая древних греков, заложили научную основу, необходимую для открытия закона сохранения массы, именно Французский химик Антуан Лавуазье (1743-1794) чаще всего считается его первооткрывателем.По этой же причине закон иногда называют законом Лавуазье.
Лавуазье выглядит гордым своим открытием.
В конце 1700-х годов Лавуазье экспериментально доказал, что общая масса , а не изменяется в химической реакции, что привело его к выводу, что материя всегда сохраняется в химической реакции.
Эксперименты Лавуазье стали первым случаем, когда кто-то четко проверил идею сохранения материи, измерив массы материалов как до, так и после того, как они подверглись химической реакции.
В конечном счете, открытие закона сохранения массы имело огромное значение для области химии, потому что доказало, что материя не просто исчезает (как казалось), а скорее меняет форму в другое вещество с такой же массой.
Каковы некоторые законы сохранения массовых примеров?
Закон сохранения массы Примеры полезны для визуализации и понимания этой важной научной концепции. Вот два примера, которые помогут проиллюстрировать, как работает этот закон.
Пример 1: Костер / Костер
Один из распространенных примеров, с которыми вы столкнетесь, — это изображение костра или костра.
Представьте себе: вы с друзьями собрали несколько палочек и зажгли их спичкой. После пары жареных зефиров и песен у костра вы понимаете, что костер, который вы построили, полностью сгорел. Все, что у вас осталось, — это небольшая кучка пепла и немного дыма.
Ваш первоначальный инстинкт может заключаться в предположении, что часть первоначальной массы костра от палочек каким-то образом исчезла.Но на самом деле это не так — оно просто трансформировалось!
В этом сценарии, когда палки сгорели, они вместе с кислородом воздуха превратились не только в золу, но также в углекислый газ и водяной пар. В результате, если бы мы измерили общую массу деревянных палочек и кислорода до того, как подожгли палочки, мы бы обнаружили, что эта масса равна массе золы, углекислого газа и водяного пара вместе взятых. .
Пример 2: Горящая свеча
Аналогичным примером закона сохранения массы является изображение горящей свечи.
Для этого примера представьте себе обычную свечу с воском и фитилем. Однако как только свеча полностью сгорит, вы увидите, что воска определенно намного меньше, чем было до того, как вы ее зажгли. Это означает, что часть воска (не весь, как вы, вероятно, заметили со свечами, которые вы зажгли в реальной жизни!) Превратилась в газов, — а именно, водяной пар и углекислый газ.
Как показал предыдущий пример с костром, неважно (и, следовательно, не масса) теряется в процессе горения.
Резюме: Что такое закон сохранения массы?
Закон сохранения массы — это научный закон, популяризированный и систематизированный французским химиком 18 века Антуаном Лавуазье.
Согласно закону, в изолированной системе материя не может быть создана или уничтожена, а только изменена. Это означает, что общая масса всех веществ до химической реакции будет равна общей массе всех веществ после химической реакции.Проще говоря, материя (и, следовательно, масса) всегда сохраняется, даже если вещество меняет химическую или физическую форму.
Знание этого научного закона важно для изучения химии, поэтому, если вы планируете заняться этой областью, вы обязательно захотите понять, что такое закон сохранения массы!
Что дальше?
Есть ли у вас еще какие-нибудь научные темы? Тогда вам повезло! Наши руководства научат вас множеству полезных тем, от того, как переводить градусы Цельсия в градусы Фаренгейта, до определения плотности воды и того, как уравновесить химические уравнения.
Нужна помощь в определении стилистических приемов в книге, которую вы читаете на уроке английского? Позвольте нашему исчерпывающему списку самых важных литературных приемов помочь вам!
Закон сохранения материи
Это «Закон сохранения материи», раздел 5.1 из книги Введение в химию: общую, органическую и биологическую (v. 1.0). Чтобы узнать об этом подробнее (включая лицензирование), щелкните здесь.
Эта книга находится под лицензией Creative Commons by-NC-sa 3.0 лицензия. См. Лицензию для получения дополнительных сведений, но в основном это означает, что вы можете делиться этой книгой, если указываете автора (но см. Ниже), не зарабатываете на ней деньги и делаете ее доступной для всех на тех же условиях.
Этот контент был доступен по состоянию на 29 декабря 2012 года, а затем его загрузил Энди Шмитц, чтобы сохранить доступность этой книги.
Обычно здесь указываются автор и издатель.Однако издатель попросил удалить обычную атрибуцию Creative Commons для исходного издателя, авторов, названия и URI книги. Кроме того, по просьбе издателя их имя было удалено в некоторых местах. Более подробная информация доступна на странице авторства этого проекта.
Для получения дополнительной информации об источнике этой книги или о том, почему она доступна бесплатно, посетите домашнюю страницу проекта. Здесь вы можете просмотреть или загрузить дополнительные книги.Чтобы загрузить файл .zip, содержащий эту книгу, для использования в автономном режиме, просто щелкните здесь.
Эта книга вам помогла? Подумайте о том, чтобы передать это:
Creative Commons поддерживает свободную культуру от музыки до образования. Их лицензии помогли сделать эту книгу доступной вам.
DonorsChoose.org помогает таким людям, как вы, помогать учителям финансировать их школьные проекты, от художественных принадлежностей до книг и калькуляторов.
5.1 Закон сохранения материи
Цели обучения
- Правильно определите закон применительно к науке.
- Укажите закон сохранения материи.
В науке закон Общее утверждение, объясняющее большое количество наблюдений. это общее утверждение, объясняющее большое количество наблюдений. Прежде чем быть принятым, закон должен быть многократно подтвержден при различных условиях.Поэтому законы считаются высшей формой научного знания и, как правило, считаются неприкосновенными. Научные законы составляют основу научного знания.
Один научный закон, который обеспечивает основу для понимания химии, — это закон сохранения материи. В любой данной системе, которая закрыта для переноса материи (внутрь и наружу), количество вещества в системе остается постоянным .. Он гласит, что в любой данной системе, которая закрыта для передачи материи (внутрь и наружу), количество вещества в системе остается постоянным.Кратко выразить этот закон можно, сказав, что количество вещества в системе сохраняется .
Что это значит для химии? При любом химическом изменении одно или несколько исходных веществ превращаются в другое вещество или вещества. И начальное, и конечное вещества состоят из атомов, потому что вся материя состоит из атомов. Согласно закону сохранения материи, материя не создается и не разрушается, поэтому после химического изменения у нас должно быть такое же количество и тип атомов, что и до химического изменения.
Прежде чем рассматривать явные примеры закона сохранения материи, нам нужно изучить метод, который используют химики для представления химических изменений.
Упражнения по обзору концепции
Каков закон сохранения материи?
Как закон сохранения вещества применим к химии?
ответов
Закон сохранения материи гласит, что в любой данной системе, которая закрыта для переноса материи, количество вещества в системе остается постоянным
Закон сохранения вещества гласит, что в химических реакциях общая масса продуктов должна равняться общей массе реагентов.
Ключевые вынос
- Количество вещества в закрытой системе сохраняется.
Упражнения
Выразите закон сохранения материи своими словами.
Объясните, почему концепция сохранения материи считается научным законом.
Ответ
Материя не может быть создана или уничтожена.
Смоделируйте закон сохранения массы с помощью уравнений
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает одно
или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как
в виде
ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно
искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится
на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например, мы требуем
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Химический факультет Университета штата Флорида
Химический факультет Университета штата Флорида
Антуан Лавуазье | Введение / Предпосылки Антуан Лавуазье (1743–1794), отец современной химии, был первым, кто соблюдал закон сохранения массы.Этот закон гласит, что количество материи во Вселенной постоянно. Это означает, что атомы нельзя ни создать, ни разрушить. Довольно круто, да? Именно благодаря закону сохранения массы мы можем писать сбалансированные химические реакции. Это позволяет прогнозировать массы реагентов и продуктов, участвующих в химической реакции. |
Ключевые понятия
Фундаментальный химический закон — это закон сохранения массы (который также известен как закон сохранения вещества ).Этот закон гласит, что масса не может быть создана или уничтожена; или другими словами, общая масса материалов, присутствующих после химической реакции, будет такой же, как общая масса до реакции. Масса — это всего лишь мера количества материала в объекте. Единица СИ (предпочтительная метрическая единица для использования в научных измерениях) для массы — это килограмм (кг), что равно примерно 2,2 фунта (фунта). Масса может быть легко преобразована в моль , что является просто еще одной единицей количества в химии.Поскольку массу можно математически преобразовать в массу, закон сохранения массы также можно назвать законом сохранения молей (общее количество молей на одной стороне уравнения должно быть равно общему количеству молей на другой стороне уравнения). уравнение). Следовательно, этот закон позволяет уравновесить уравнения. Попробуем уравновесить следующие реакции.
| Несимметричный Сбалансированный | HCl + Mg (OH) 2 → MgCl 2 + H 2 O 2HCl + Mg (OH) 2 → MgCl 2 + 2H 2 O |
| Несимметричный Сбалансированный | C 2 H 6 + O 2 → CO 2 + H 2 O щелкните, чтобы открыть |
Теперь применим закон сохранения массы к уравнению химической реакции.
| Пример 1: Некоторое количество оксида калия (K 2 O) помещали в 9 г воды и получали 112 г гидроксида калия (КОН). Какая масса прореагировала оксида калия? | |
| Напишите уравнение слова | Оксид калия + вода → гидроксид калия |
| Поместите массы данного вещества под уравнением | ??? + 9г → 112г |
| Применить закон сохранения массы | ? + 9г = 112г |
| Найдите недостающую массу | 112г — 9г =? ? = 103 г |
| Ответ: 103 г оксида калия прореагировало с водой. | |
| Пример 2: При нагревании 245 г хлората калия хлорат калия распадается на 149 г хлорида калия и некоторое количество газообразного кислорода. Узнайте массу образовавшегося газообразного кислорода. | |
| Напишите уравнение слова | Хлорат калия → хлорид калия + кислород |
| Поместите массы данного вещества под уравнением | 245г → 149г + ??? |
| Применить закон сохранения массы | 245г = 149г +? |
| Найдите недостающую массу | 245г — 149г =? ? |
| Ответ: щелкните, чтобы открыть | |
| Пример 3: При добавлении 12 граммов NaOH к 16 граммах HCl образуется 7 граммов H 2 O и некоторое количество NaCl. .Найдите массу образовавшегося NaCl. | |
| Напишите уравнение | NaOH + HCl → H 2 O + NaCl |
| Поместите массы данного вещества под уравнением | 12г + 16г → 7г + ??? |
| Применить закон сохранения массы | 12г + 16г = 7г +? |
| Найдите недостающую массу | 28г — 7г =? |
| Ответ: щелкните, чтобы открыть | |
Глоссарий
Атом = мельчайшая частица элемента, которая может существовать отдельно или в комбинации.
Моль = базовая единица количества чистого вещества в Международной системе единиц, которая содержит такое же количество элементарных единиц, как и атомов ровно в 12 граммах изотопа углерода 12.
Единица СИ = Международные единицы системы — это единицы, согласованные международным сообществом для использования в публикациях и исследовательских документах, чтобы каждый мог их понять.

 Между реагентами ставим знак «+»,
Между реагентами ставим знак «+», Наименьшее кратное для атомов натрия –10:
Наименьшее кратное для атомов натрия –10: