Содержание
Что такое молярный объём | Решаем химию: вопросы и ответы
Молекулы вступают в реакцию в определённых соотношениях, и это описывают химические реакции. Например, из этого уравнения
2Н2 + О2 = 2Н2О
видно, что в реакции приняли участие 2 молекулы водорода и 1 молекула кислорода, образовав при этом 2 молекулы воды. Но молекула так малы, что увидеть их невозможно, и уж тем более нельзя взять их в руки. Поэтому в учебнике химии и появляется понятие моль – количество вещества, в котором содержится число Авогадро частиц (6,02*10 в двадцать третьей степени). Рядом с этим понятием стоит другое – молярная масса, то есть масса 1 моля частиц. Молярная масса совпадает с атомной или молекулярной, рассчитывается по таблице Менделеева и выражается в граммах на моль (г/моль).
Фото: pixabay.com
Но мы прекрасно знаем, что не все вещества в обычных условиях находятся в твёрдом или жидком состоянии. Например, кислород, азот, хлор, неон – это газы. Резонно спросить: а как же их взвешивать? На этот случай химии для 8 класса припасено ещё одно понятие – молярный объём.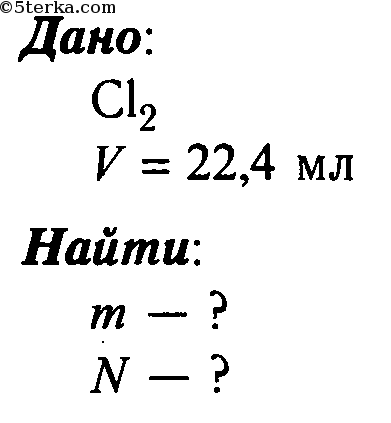
Что такое молярный объём
Тут следует запомнить, что в обычных условиях 1 моль любого газа занимает одинаковый объём. То есть молярный объём – это объём 1 моля любого газа. Сейчас советую на всякий случай вспомнить, что в 1 моле любого вещества (в том числе газа) содержится число Авогадро частиц. Старайтесь не забывать об этом факте.
Теперь надо обязательно упомянуть следующее. Все знают, что при изменении температуры и давления объём газов меняется. Так вот чтобы все расчёты вести правильно, то есть в одинаковых условиях, говорят о нормальных условиях: температуре 0 градусов Цельсия и давлении в 1 атмосферу (или 101,3 кПа). Это нужно просто запомнить:
нормальные условия в химии: температура – 0 градусов Цельсия, давление – 1 атм.
Экспериментально было доказано, что в нормальные условиях 1 моль любого газа занимает объем 22,4 литра.
То есть молярный объём любого газа в н.у. составляет 22,4 л/моль.
И это число тоже нужно запомнить! Оно даже важнее, чем сами нормальные условия, потому используется это число в решениях по химии намного чаще, чем н. у. (нормальные условия).
у. (нормальные условия).
Как найти молярный объём
Очень просто. Если молярную массу для каждого вещества нужно рассчитывать по таблице Менделеева, то
молярный объём для всех газов одинаков.
Пример 1.
Молярная масса воды Н2О 18 г/моль (2*1+16, всё берем из периодической таблицы), молярная масса оксида кальция СаО 56 г/моль (40+16), молярная масса серной кислоты Н2SO4 98 г/моль (2*1+32+4*16).
Зато в нормальных условиях молярный объём кислорода О2 22,4 л/моль, молярный объём фтора P2 22,4 л/моль, молярный объём ксенона 22,4 г/моль. Приятно, не правда ли?
Другое дело, если речь идёт о химических реакциях. Но для начала просто потренируемся с цифрами.
Пример 2.
Определите объём, который занимают 10 моль кислорода в н.у.
Решение:
Молярный объём кислорода 22,4 л/моль, то есть 1 моль занимает 22,4 л. Следовательно, 10 моль будут занимать в 10 раз больше 22,4*10=224 литра. Это и есть ответ: 10 моль кислорода займут объём 224 литра.
Пример 3.
Известно, что неон в н.у. занял объём 5,6 литра. В каком количестве взят неон (в молях)?
Решение:
1 моль занимает объём 22,4 литра, а вот неизвестное число моль заняло объём 5,6 литра. Можно составить пропорцию:
1 моль — 22,4 литра
Х моль — 5,6 литра
Отсюда Х=1*5,6/22,4=0,25. Значит ответ такой: неон взяли в количестве 0,25 моль.
Пример 4.
Это уже расчёт по химической реакции, поэтому будьте внимательны. Итак, хлор прореагировал с водородом с образованием хлорида водорода:
Н2 + Cl2 = 2HCl
Для реакции взяли 11,2 литра водорода. Сколько понадобилось хлора (н.у.)?
Решение:
Посмотрим, сколько нам дано водорода по условию задачи. 1 моль водорода занимает объём 22,4 литра. Но у нас всего 11,2 литра водорода, то есть Х моль. Составим пропорцию:
1 моль – 22,4 литра
Х моль – 11,2 литра
Отсюда Х=1*11,2/22,4=0,5 моль водорода. Значит, по условию задачи у нас водорода 0,5 моль.
Из уравнения химической реакции Н2 + Cl2 = 2HCl видно, что нам нужно по 1 молю водорода и хлора (об этом говорят коэффициенты в уравнении). То есть, 1 моль водорода реагирует с 1 молем хлора. Но нам дали всего 0,5 моль водорода, сколько нам нужно хлора? Составим ещё одну пропорцию:
То есть, 1 моль водорода реагирует с 1 молем хлора. Но нам дали всего 0,5 моль водорода, сколько нам нужно хлора? Составим ещё одну пропорцию:
1 моль водорода реагирует с 1 молем хлора
0,5 моль водорода реагирует с Х молями хлора.
Отсюда получаем: Х=0,5*1/1=0,5 моль. Таким образом, нам нужно 0,5 моль хлора. А это количество занимает объём 22,4*0,5=11,2 литра.
Ответ: понадобилось 11,2 литра хлора.
В следующий раз мы научимся делать расчёты по реакциям, в которых участвуют и твёрдые вещества, и газы, то есть одновременно будем использовать молярную массу и молярный объём.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Урок №40. Закон Авогадро. Молярный объем газов
Амедео Авогадро
Закон
Авогадро: в равных объёмах различных газов
при одинаковых условиях (температуре и давлении) содержится одинаковое число
молекул. (1811 г, итальянский учёный Амедео Авогадро)
(1811 г, итальянский учёный Амедео Авогадро)
Cледствия
из закона Авогадро:
1
следствие:
Одинаковое
число молекул различных газов при одинаковых условиях занимает одинаковый
объём.
Так,
6,02 ∙ 1023 молекул (1 моль) любого газа и любой смеси газов при
(н.у.) занимает объём равный 22,4
л.
Такой
объём называется молярным объёмом
и обозначается Vm
Молярный
объём – это постоянная величина для веществ – газов при нормальных условиях
(н.у.):
Vm = 22,4 л/моль н.у. – это p = 1амт (101325 Па) t = 0 ˚C (273 К)
|
Взаимосвязь молярной массы,
молярного объёма, числа Авогадро и количества вещества:
υ
= V
/ Vm
= N
/ Na
= m
/ M
M = ρVm
Задача
№1
Образец: Какой объем
занимает 0,2 моль N2 при н. у.?
у.?
Дано: Vm= 22, 4л/моль ν (N2) = 0,2 моль | Решение: ν (N2) = V(N2 ) / Vm , следовательно
V = 0,2 моль · 22,4 л / моль = 4,48
Ответ:
|
Найти: V — ? |
Задачи для самостоятельного
решения
Решите
задачи по приведённому образцу:
1. Какой объем занимают
5 моль О2 при н.у.?
2. Какой объем занимают
2,5 моль Н2 при н.у.?
Задача
№2
Образец: Какое
количество вещества содержит водород объемом 33,6 л при н.у.?
Дано: Vm= 22, 4л/моль V (H2) = 33,6 л | Решение: ν
Ответ:
|
Найти: ν |
Задачи для самостоятельного
решения
Решите
задачи по приведённому образцу:
1. Какое количество
вещества содержит кислород объемом 0,224 л при н.у.?
2. Какое количество
вещества содержит углекислый газ объемом 4,48 л при н.у.?
Задача
№3
Образец: Какой объем
займут 56 г. газа СО при н.у.?
Дано: Vm= 22, 4л/моль m (CO) = 56 г | Решение: ν (CO) = V(CO) / Vm
V
Неизвестное ν =
M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль ν
V = 44,8 л
Ответ:
|
Найти: V — ? |
Задачи для самостоятельного
решения
Решите
задачи по приведённому образцу:
1. Какой объем займут 8 г. газа О2
Какой объем займут 8 г. газа О2
при н.у.?
2. Какой объем займут 64 г. газа SО2
при н.у.?
Задача
№4
Образец: В каком
объеме содержится 3·1023 молекул водорода Н2 при н.у.?
Дано: Vm= 22, 4л/моль N = 3·1023 Na = 6,02 ·1023 моль-1 | Решение: ν (Н2) = V(Н2)
V
Неизвестное ν =
V
Ответ:
|
Найти: V — ? |
Задачи для самостоятельного
решения
Решите
задачи по приведённому образцу:
1. В каком объеме
В каком объеме
содержится 12,04 ·1023 молекул углекислого газа — СО2 при н.у.?
2. В каком объеме
содержится 3,01·1023 молекул кислорода — О2 при н.у.?
Решите
задачи для закрепления:
1ЛП 28-22-4 л (ГОСТ 9818-85) по стандарту: ГОСТ 9818-85
Лестничные площадки плоские 1ЛП 28-22-4 л (ГОСТ 9818-85) важный элемент в строительстве лестничных конструкций. Железобетон — универсальный строительный материал, который сочетает в себе работу бетона и стали. Лестничные изделия изготавливаются по действующим Стандартам, и должны иметь высокие эксплуатационные характеристики. Благодаря высокой прочности, надежности и долговечности их применение допускается в гражданских строениях.
Лестничные площадки 1ЛП 28-22-4 л (ГОСТ 9818-85) – это специальные плоские платформы, изготавливаются по установленным размерам и применяются для обустройства лестничных клеток в зданиях различного назначения.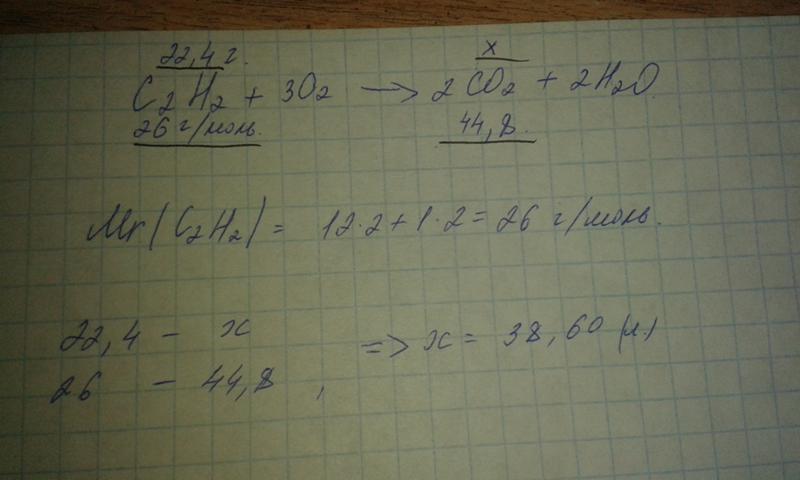 Данные конструктивные элементы располагаются на разных уровнях перпендикулярно между собой. Прямоугольные элементы имеют в своей конструкции специальные выемки, которые используются для стыковки лестничного марша определенной толщины (это 1050 и 1200 мм.). Высокая безопасность – определяющая характеристика, по которой выбираются ЖБИ-изделия для гражданского строительства.
Данные конструктивные элементы располагаются на разных уровнях перпендикулярно между собой. Прямоугольные элементы имеют в своей конструкции специальные выемки, которые используются для стыковки лестничного марша определенной толщины (это 1050 и 1200 мм.). Высокая безопасность – определяющая характеристика, по которой выбираются ЖБИ-изделия для гражданского строительства.
1.Варианты написания маркировки.
Маркирование плоских площадок 1ЛП 28-22-4 л (ГОСТ 9818-85) производится согласно ГОСТ 9818-85 и включает в основное обозначение тип изделия, размеры и предел вертикальной нагрузки. Условные буквенно-цифровые знаки могут быть записаны следующими вариантами:
1. 1ЛП 28-22-4;
2. 1ЛП 28-22-4 к;
3. 1ЛП 28-22-4 л;
4. 1ЛП 28-22-4 лк;
5. 1ЛП 28-22-4 лш;
6. 1ЛП 28-22-4 ш.
1ЛП 28-22-4 ш.
2.Основная сфера применения.
Сфера использования данных изделий достаточно широка. Плоские площадки 1ЛП 28-22-4 л (ГОСТ 9818-85) применяют для обустройства лестничных конструкций жилых, общественных и промышленных зданий с этажами высотой до 2,8 метра. Строения могут быть возведены из любого строительного материала: кирпич, блоки, панели и прочие. Площадки данного типа монтируются как внизу, так и вверху лестничного марша, также при помощи этих элементов производится разделение лестницы на ходовые зоны или части, например, при изменении направления движения вверх. Это также делается для повышения безопасности. Через каждые 18 ступеней должна быть обустроена переходная площадка, далее – новый марш. 1ЛП 28-22-4 л (ГОСТ 9818-85) применяется для лестничных маршей плоских тип ЛМ (данные марши не имеют фризовых ступеней). Размеры должны соответствовать площадке.
1ЛП 28-22-4 л (ГОСТ 9818-85) применяются в зданиях с высокой пропускной способностью. Благодаря значительной несущей способности готовое сооружение выдерживает значительные деформирующие усилия, а также статические, динамические и ударные нагрузки – не менее 3,5 кПа., поэтому широкое применение площадок данного вида имеет полностью экономическое и практическое обоснование.
Благодаря значительной несущей способности готовое сооружение выдерживает значительные деформирующие усилия, а также статические, динамические и ударные нагрузки – не менее 3,5 кПа., поэтому широкое применение площадок данного вида имеет полностью экономическое и практическое обоснование.
3.Обозначение маркировки 1ЛП 28-22-4 л (ГОСТ 9818-85) .
Обозначают плоские площадки согласно ГОСТ 9818-85, и указывают цифробуквенной комбинацией тип изделия и основные размеры. Рассмотрим маркировку 1ЛП 28-22-4 л (ГОСТ 9818-85) , где соответственно указаны:
1. 1 – группа рельефа изделия, плоская;
2. ЛП – лестничная площадка;
3. 28 – длина платформы, указывается в дц.;
4. 22 – ширина, дц.;
5. 4 – вертикальная унифицированная нагрузка, в кПа;
6. л — левое исполнение.
7. Дополнительными буквами указывают тип поверхности – «ш»-шлифованная, «м»-мозаичная, «г»-глянцевая, «к» — облицованная керамической плиткой.
Знаки наносят на боковую грань черной краской, также указываются дата производства изделия и его масса.
Укажем ряд параметров, по которым можно охарактеризовать лестничные площадки тип ЛП:
1. Длина – 2800 ;
2. Ширина – 2200 ;
3. Высота – 320 ;
4. Масса – 3030 ;
5. Геометрический объем – 1,9712 ;
6. Объем бетона на одно изделие – 1,212 .
4.Материалы для изготовления и их характеристики.
Основной материал для изготовления – бетон тяжелых марок или керамзитобетон (с использованием пористых заполнителей). Пористые материалы применяются для снижения массы изделия. Технология изготовления ЛП – вибропрессование. За счет высокого уплотнения смеси изделие обладает высокой механической прочностью и долговечностью. Марка бетона по прочности должна соответствовать пределам М200.
Пористые материалы применяются для снижения массы изделия. Технология изготовления ЛП – вибропрессование. За счет высокого уплотнения смеси изделие обладает высокой механической прочностью и долговечностью. Марка бетона по прочности должна соответствовать пределам М200.
Все плоские площадки тип 1ЛП 28-22-4 л (ГОСТ 9818-85) подвергают армированию. Это выполняется для получения более высокой прочности и для повышения общей несущей способности. Для стального каркаса тип КР5 используют стальную проволоку унифицированного диаметра из стали класса A-III и Вр-1. В тело платформы дополнительно закладывают монтажные петли тип П1 — 4 шт. Металлические детали подвергают антикоррозионной обработке.
5.Транспортировка и хранение.
Транспортирование площадок 1ЛП 28-22-4 л (ГОСТ 9818-85) производится спецтранспортом. Укладывают площадки горизонтально, прокладывая каждый слой деревянными элементами, также все изделия должны быть надежно закреплены. Хранение осуществляется в штабелях высотой не более 2,5 м.
Хранение осуществляется в штабелях высотой не более 2,5 м.
Уважаемые покупатели! Сайт носит информационный характер.
Указанные на сайте информация не являются публичной офертой (ст.435 ГК РФ).
Стоимость и наличие товара просьба уточнять в офисе продаж или по телефону 8 (800) 500-22-52
Кастрюля средняя с крышкой Gredil 22,4 л (012365)
Кастрюля средняя с крышкой Gredil 22,4 л (012365) — профессиональная серия кухонного инвентаря для HoReCa из нержавеющей стали от польского производителя Stalgast. Кастрюли совместимы со всеми видами плит. Разрешается использование в посудомоечном оборудовании. Кастрюли с нержавеющей стали марки Gredil предназначены для самых требовательных поваров, для которых наиболее важным является качество и долговечность продукции. Технология многослойного дна, используемая в кастрюлях Gredil, обеспечивает хорошую и равномерную теплопроводность , благодаря чему блюда, приготовленные в кастрюлях Gredil, не горят и отлично нагреваются. Кроме того, использование сэндвич- дна гарантирует устойчивость к коррозии благодаря чему кастрюли прослужат долгие годы. Чтобы обеспечить исключительный комфорт использования, кастрюли Gredil оснащены не нагревающимися многоточечными сварными ручками. В дополнение к исключительному комфорту — усиленный верхний край и не нагревающиеся ручки которые обеспечивают безопасность при переноске даже полных кастрюль.
Кроме того, использование сэндвич- дна гарантирует устойчивость к коррозии благодаря чему кастрюли прослужат долгие годы. Чтобы обеспечить исключительный комфорт использования, кастрюли Gredil оснащены не нагревающимися многоточечными сварными ручками. В дополнение к исключительному комфорту — усиленный верхний край и не нагревающиеся ручки которые обеспечивают безопасность при переноске даже полных кастрюль.
| Кастрюли | |
| Тип | Средние кастрюли |
| Объём | 22,4 л |
| Диаметр | 360 мм |
| Высота | 220 мм |
| Крышка | Из нержавеющей стали |
| Материал | Нержавеющая сталь |
| Антипригарное покрытие | Нет |
| Совместимость с источниками тепла | Все виды плит |
| Можно мыть в посудомоечной машине | Да |
| Производитель | Stalgast |
| Страна-производитель | Польша |
Кастрюля 22 см, 4,2 л Amore со стеклянной крышкой и белыми ручками, индукция
Коллекция Amore — это грация в каждом изгибе! Ее плавные формы и гармоничные детали вдохновят Вас готовить лучшие блюда для Ваших любимых.
Кастрюля изготовлена из высококачественной нержавеющей стали 18/10, обладающей высокими антикоррозийными свойствами. Жаропрочные ручки выполнены из эко-пластика со вставками белого перламутрового цвета. Термостойкая крышка из закаленного стекла, оснащена отверстием для отвода пара. Многослойное капсульное дно, произведенное по специальной технологии, гарантирует аккумуляцию тепла в течение долгого времени и равномерное распределение тепла по стенкам кастрюли. Толщина дна — 0,5 см, толщина стенок 0,7 мм. Мерная шкала на внутренней поверхности кастрюли поможет определить объем приготовляемых блюд. Комбинированная обработка материалов придает уникальность дизайну кастрюли: поверхность снаружи глянцевая, а внутри кастрюля матовая.
Подходит для всех типов плит: газовых, электрических, керамических, галогеновых, индукционных. Можно мыть в посудомоечной машине.
| Высота | 11,5 см |
| Диаметр | 22 см |
| Коллекция | Amore |
| Объем | 4,2 л |
| Материал | высококачественная нержавеющая сталь |
| Основной цвет | стальной |
| Технология | прочное трехслойное капсульное дно |
| Внутреннее покрытие | матовая сатиновая поверхность |
| Внешнее покрытие | блестящая глянцевая поверхность |
Масло холодильное Sunisso SL 22 (4л)
Код товара:081013
Масла класса Suniso SL — это синтетические смазочные масла из сложных эфиров совместимы c R-134а, R-404, R-407c,R-410a,R-507 и R-509a/b и др. Не содержит спирт.
Не содержит спирт.
Масла класса Suniso SL — это синтетические смазочные масла из сложных эфиров, произведены на основе отборных полиолэстерных базовых компонентов и присадок, обеспечивающих отличную смазывающую способность, стабильность и защиту от коррозии. Эти смазочные материалы совместимы с альтернативными хладагентами, такими, как R134a, при экстремально низких температурах.
Смазочные масла Suniso SL разработаны специально для использования в холодильных системах и системах кондиционирования воздуха, заряженных альтернативными хладагентами, не разрушающими озоновый слой.
Масла Suniso SL совместимы с альтернативными хладагентами, такими, как R-134а и большинством других хладагентов, не содержащих хлора (R-404, R-407c, R-410a, R-507 и R-509a/b и другими), даже при экстремально низких температурах.
Обеспечивает отличные смазочные свойства, стабильность и защиту от коррозии. Не содержит спирт.
Компания «SUNOCO» является основным поставщиком рефрижераторных масел для «Carrier International Corporation» — одним из ведущих производителей охлаждающих систем.
SL22 | SL32 | SL46 | SL68 | SL100 | SL150 | SL220 | |
| плотность при 15 оС | 0.99 | 0.98 | 0.97 | 0.96 | 0.96 | 0.99 | 1.01 |
| вязкость при 40 оС / сСт | 22 | 32 | 47.2 | 70.1 | 100 | 150 | 220 |
| индекс вязкости | 127 | 125 | 120 | 109 | 106 | 103 | 100 |
| вязкость при 100 оС / сСт | 4,6 | 5,8 | 7,2 | 9,1 | 11,3 | 15,5 | 20,8 |
| точка воспламенения оС | 232 | 235 | 235 | 252 | 254 | 264 | 264 |
| точка застывания оС | -48 | -48 | -44 | -36 | -36 | -33 | -30 |
Двигатель CHAMPION G140VK/1 (4 л.
 с., d=22,2 мм) с вертикальным валом по цене 0 руб — отзывы, характеристики, фото
с., d=22,2 мм) с вертикальным валом по цене 0 руб — отзывы, характеристики, фото
Характеристики двигателя
Модель двигателя:
G140VK/1
Тип двигателя:
4-тактный, одноцилиндровый
Мощность двигателя, л/с (кВт):
2,9/4 (кВт/л.с.)
Расположение вала:
Вертикальный
Тип вала:
Цилиндрический под шпонку
Диаметр вала, мм:
22,2 мм
Длина вала, мм:
61,9 мм
Объем двигателя, см³:
139 см3
Частота вращения вала двигателя, об/мин:
3000 об/мин
Рабочий объём двигателя, л:
139 см3
Система охлаждения:
Принудительное воздушное
Система запуска:
Ручной стартер
Обороты холостого хода, об/мин:
1550 об/мин
Топливо:
Бензин
Объем топливного бака, л:
1 л
Расход топлива, л/ч:
395 г/кВт•ч)/(л/ч)
Ёмкость масляного картера, л:
0,55 л
Габаритные размеры и вес
Масса, кг:
8,7 кг
Страна происхождения
Страна происхождения:
Китай
Молярный объем при 0 ° C и 1 атм 22 4 л Моль 2 — газовая фаза
При стандартной температуре и давлении один моль любого газа занимает объем 22,4 л.
Стехиометрия — количественное исследование относительных количеств реагентов и продуктов в химических реакциях; стехиометрия газа включает химические реакции, в которых образуются газы. Стехиометрия основана на законе сохранения массы, означающем, что масса реагентов должна быть равна массе продуктов.Это предположение можно использовать для определения неизвестных количеств реагентов или продуктов.
Стехиометрические вычисления с участием газов позволяют нам переводить между массой, числом молей и, что наиболее важно, объемом газов. Следующее соотношение делает это возможным:
1 моль любого газа при стандартной температуре и давлении (273 К и 1 атм) занимает объем 22,4 л.
Хотя указанное выше соотношение является приблизительным, оно является относительно хорошим приближением для STP и может надежно использоваться в расчетах.
Например:
Практические вопросы
Ханская академия
Хлорфторуглероды и окружающая среда
Официальная подготовка MCAT (AAMC)
Пакет вопросов по химии, вопрос 54
Пакет вопросов по химии Отрывок 15, вопрос 83
Ключевые точки
• При стандартной температуре и давлении (STP) 1 моль любого газа будет занимать объем 22. 4 л.
4 л.
• Закон идеального газа, наряду со сбалансированным химическим уравнением, может использоваться для определения количества (по объему или массе) газа, потребляемого или производимого в химической реакции.
Ключевые термины
Стандартные температура и давление (STP) : 273 K и 1 атм
стехиометрия : исследование и расчет количественных (измеримых) соотношений реагентов и продуктов в химических реакциях (химические уравнения)
Какой молярный объем газов — 22.4 л / моль
Одним из наиболее практических результатов закона Авогадро является молярный объем газов Vm, который составляет примерно: Vm = 22,4 дм3 / моль. Теплотехника
Закон Авогадро
Закон Авогадро является одним из законов о газе. В начале XIX века итальянский ученый Лоренцо Романо Амедео Карло Авогадро изучал взаимосвязь между объемом и количеством вещества присутствующего газа. Результаты определенных экспериментов с газами привели его к формулировке хорошо известного закона Авогадро .В нем говорится, что при одинаковых условиях температуры и давления равные объемы разных газов содержат одинаковое количество молекул, или:
Результаты определенных экспериментов с газами привели его к формулировке хорошо известного закона Авогадро .В нем говорится, что при одинаковых условиях температуры и давления равные объемы разных газов содержат одинаковое количество молекул, или:
Для фиксированной массы идеального газа при постоянном давлении и температуре объем и количество газа прямо пропорциональны.
Вы можете выразить это математически как:
В ∝ n
или
В = постоянное. n
, где nR / V является постоянным и:
- n — количество вещества в молях
- V — объем газа
константа равна RT / p, где p — абсолютное давление газа, T — абсолютная температура и R — идеальная или универсальная газовая постоянная, равная произведению постоянная Больцмана и постоянная Авогадро.
Молярный объем газов
Одним из наиболее практических результатов этого закона является молярный объем газа , V м , что составляет примерно:
V м = 22,4 дм 3 / моль
Это означает, что при стандартной температуре (273,15 K, 0 ° C) и стандартном атмосферном давлении (101,325 кПа) молярный объем одинаков для всех идеальных газов.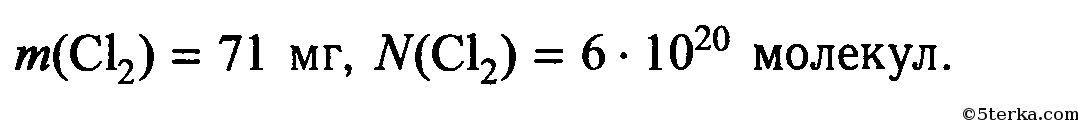 Обратите внимание, что это сделано в предположении идеального газа. Это значение сильно зависит от давления и температуры.Например:
Обратите внимание, что это сделано в предположении идеального газа. Это значение сильно зависит от давления и температуры.Например:
- для 273,15 К (0 ° C) и 100,00 кПа молярный объем идеального газа составляет 22,71 дм 3 моль -1 .
- для 298,15 К (25 ° C) и 100,00 кПа молярный объем идеального газа составляет 24,79 дм 3 моль -1 .
Ссылки:
Физика реактора и теплогидравлика:
- Дж. Р. Ламарш, Введение в теорию ядерных реакторов, 2-е изд., Addison-Wesley, Reading, MA (1983).
- Дж.Р. Ламарш, А. Дж. Баратта, Введение в ядерную инженерию, 3-е изд., Прентис-Холл, 2001, ISBN: 0-201-82498-1.
- В. М. Стейси, Физика ядерных реакторов, John Wiley & Sons, 2001, ISBN: 0-471-39127-1.
- Glasstone, Сесонске. Nuclear Reactor Engineering: Reactor Systems Engineering, Springer; 4-е издание, 1994 г., ISBN: 978-0412985317
- Тодреас Нил Э., Казими Муджид С.
 Ядерные системы, том I: теплогидравлические основы, второе издание. CRC Press; 2 издание, 2012 г., ISBN: 978-0415802871
Ядерные системы, том I: теплогидравлические основы, второе издание. CRC Press; 2 издание, 2012 г., ISBN: 978-0415802871 - Зохури Б., МакДэниел П. Термодинамика в системах атомных электростанций. Springer; 2015, ISBN: 978-3-319-13419-2
- Моран Михал Дж., Шапиро Ховард Н. Основы инженерной термодинамики, пятое издание, John Wiley & Sons, 2006, ISBN: 978-0-470-03037-0
- Кляйнштройер К. Современная гидродинамика. Springer, 2010 г., ISBN 978-1-4020-8670-0.
- Министерство энергетики США, ТЕРМОДИНАМИКА, ТЕПЛООБМЕН И ПОТОК ЖИДКОСТИ. Справочник по основам DOE, том 1, 2 и 3. Июнь 1992 г.
Надеемся, эта статья, Молярный объем газов — 22.4 л / моль , поможет вам. Если это так, даст нам на боковой панели. Основная цель этого сайта — помочь общественности узнать интересную и важную информацию о теплотехнике.
Объемный моляр. Молярная объемная доза газа nas CNTP
O объемная молярная соответствует ao volume ocupado por 1 mol de qualquer gás perfeito nas mesmas condições de temperatura e pressão.
Geralmente, рассматриваемый как CNTP (Condições Normais de Temperatura e Pressão), em que a pressão é igual a 1 atm e a temperatura é de 0º C (temperatura de fusão do gelo).Como se trata de gas, é обязательно учитывать температуру termodinâmica, ou seja, na escala kelvin, em que 0º C é igual a 273 K .
Nas CNTP, ocupado por qualquer gás é de 22,4 L.
Mas como se chegou a esse valor?
Vamos usar a Equação de Estado dos Gases Perfeitos (Equação de Clapeyron) para calcular o volume ocupado por 1 mol:
с. V = п. Р . Т
В = н. Р . Т
П
Lembre-se de que R — это постоянный универсальный газовый фильтр, который не содержит CNTP, давление 0,082 атм.L. моль -1 . К -1 .
Substituindo os valores na equação acima, temos:
V = (1 моль). (0,082 атм. Л. Моль -1 ). (273 К)
(0,082 атм. Л. Моль -1 ). (273 К)
1 атм
V = 22 386 л
Esse valor pode ser arredondado para 22,4 L . Портанто, также как и объем, занимаемый по 1 моль, гас на CNTP. Этот объем соответствует кубическому объему, приблизительно равному 28,19 см.
Объем ocupado por 1 mol de qualquer gás
Sabemos que o volume que o gás ocupa Independence da sua natureza, pois, conorme mostra a lei de Avogadro, volume iguais, de quaisquer gas, nas mesmas condições de temperatura e pressão, apresentam a mesma quantidade de matéja em mol, ou se месма Quantidade де Moléculas ou átomos. Sabemos que 1 mol de qualquer substância semper contém 6,02. 10 23 átomos ou moléculas (Константе де Авогадро).
Portanto, 1 mol de qualquer gás semper apresenta o mesmo volume, porque semper detém a mesma quantidade de moléculas ou átomos.Além disso, a distância entre eles é tão grande que o tamanho dos átomos não interfere no volume final do gás.
Agora, в качестве condições form as CATP (Condições Ambientais de Temperatura e Pressão), o объемный молярный проход и ser 25 л .
Важные конхесер эссас рэлэсэс порк муитос калькулос эстеквиометрикос е калькулос собр о студо душ газы envolvem essas informações. Veja dois exemplos:
* Пример использования газов:
“(FEI-SP) Nas condições normais de pressão e temperatura (CNTP), o объем, потребляемый по 10 г моноксида углерода (CO), де: (Dados: C = 12 u, O = 16 u, молярный объем = 22,4 л)
Нет паре агора… Tem mais depois da publicidade;)
а) 6,0 л
б) 8,0 л
в) 9,0 л
г) 10 л
e) 12 л »
Решение:
Молярная масса (CO) = 12 + 16 = 28 г / моль.
1 моль CO —— 28 г ———— 22,4 л
28 г —— 22,4 л
10 г —— V
V = 10. 22,4
22,4
28
В = 8 л → Альтернатива «b»
Outra forma de resolver essa questão seria através da equação de Clapeyron:
Dados nas CNTP:
P = 1 атм;
Т = 273 К;
м = 10 г;
R = 0,082 атм.L. моль -1
V =?
Basta aplicar na equação de Clapeyron:
С. V = п. Р . Т
(п = м / м)
С. V = м . Р . Т
M
V = м. Р . Т
М. П
В = (10 г). (0,082 атм. Л. Моль -1 ). (273 К)
(28 г. моль -1 ). (1 атм)
В ~ 8,0 л
* Пример выполнения упражнений по эстетике:
«Рассчитать количество воды N 2 (г) + 3 H 2 (г) → 2 NH 3 (г) , рассчитать количество литров NH 3 (г) N 2 (г) . Рассмотрим больше газов как CNTP ».
Рассмотрим больше газов как CNTP ».
Решение:
N 2 (г) + 3 H 2 (г) → 2 NH 3 (г)
↓ ↓
1 моль продуц 2 моль
22,4 л ——— 22,4 л. 2
3 л ————- В
В = 3. 44,8 л
22,4 л
V = 6 л.
Объем молярных доз газов. Объемный молярный e hipótese de Avogadro
No ano de 1811, o químico italiano Amedeo Avogadro (1776-1856) propôs uma explicação para a relação que havia entre o número de moléculas dos gases e o volume por eles ocupado.Segundo a Hipótese de Avogadro or Princípio de Avogadro , томов, которые используются для газовых смесей, которые находятся в состоянии температуры и давления, в настоящее время или в открытом состоянии.
Иссо сигнификата независимой природы да гас е ду таманхо дас суас молекулас, о том, что эле окупара сера пропорциональ ао нумеро де молекулас, це ха не фраско……………………………………… ……………………………. Por exemplo, se temos dois frascos, um Contendo gás hidrogênio (H 2 ) eo outro Contendo dióxido de Carbono (CO 2 ), sendo o volume dos dois igual, isso quer dizer que existe a mesma quantidos do molis фраскос.
Esse fato acontece porque o tamanho das moléculas gasosas é considerado desprezível em compareção com a distância entre elas.
Assim, при условии соблюдения Condições Normais de Temperatura e Pressão (CNTP), при давлении с температурой 1 атм. При температуре 273 K (0ºC), темп. será de 22,4 L. Esse valor соответствует молярным объемным дозам газов .
Нет паре агора… Tem mais depois da publicidade;)
Рассматривается как Condições Ambientais de Temperatura e Pressão (CATP), em que a pressão também é de aproximadamente 1 atm, mas a temperatura é de 298 K (25 ºC), o volume molar passa a ser 25 L.
Portanto, se temos 1 mol de gás hidrogênio e 1 mol de gás carbônico em dois recipientes separados, podemos closedir que ambos estão ocupando o volume de 22,4 L nas CNTP. O número de moléculas deles também é o mesmo, teno em vista que 1 mol de qualquer gás é semper 6,0.10 23 (номер Авогадро).
A diferença estará somente na massa, pois a quantidade e o tipo de átomo em cada molécula são Diferentes. Отсутствует 1 моль H 2 , общая масса 2 г, концентрация 1 моль CO 2, темпа 44 г.
Амедео Авогадро (1776-1856)
Publicado por:
Дженнифер Роша Варгас Фогача
Объемный моляр — Manual da Química
Объемный молярный объем, равный температуре и давлению, в литрах, 1 моль качества материала, не превышающего нормальную температуру и давление (CNTP).
Amadeo Avogadro contribuiu com o conhecimento do volume molar , definedando em seus estudos a seguinte lei : quando temos sizes iguais, de dois ou mais gas, semper haverá a mesma quantidade de moléculia (denominada de molar) seja de átomos.Temos, por exemplo, um mol de moléculas de CO 2 e um mol de átomos no caso de um gás nobre.
A lei de Avogadro é aplicada apenas se o gás, ou os газы, estiver em condições normais de temperatura e pressão (CNTP), ou seja:
Давление = 1 атм.
Температура = 0 o C или 273K
Постоянная дозировка газов (R) = 0,082
Молекулярное число = 1 моль
Baseados nesses dados e conhecendo a equação de Clapeyron, демонстрация abaixo:
P. V = n.R.T
V = n.R.T
1.V = 1.0 082.273
V = 22 386 л
Temos condição determinar o молярный объем . O espaço ocupado por um mol de um gás é igual a 22,386 L ou, simplesmente, 22,4 L. Assim, as seguintes relações podem ser utilizadas:
1 mol de moléculas ———- 6, 02.10 23 moléculas ——— ocupam um volume de 22,4 L
1 mol de átomos ———- 6,02.10 23 átomos —— —ocupam um volume de 22,4 L
A seguir, vê poderá ter uma noção de como o volume molar é cobrado nosercios:
Exemplo 1 — (Faap-SP) Nas condições normais de temperatura давление, качественный объем, окупадо пор 35,5 г хлористого газа (Cl 2 )? Дадо: Cl = 35,5 ед.
Não pare agora … Tem mais depois da publicidade;)
a) 9,85 L
b) 11,2 L resposta correta
c) 13,4 L
d) 18,2 L
e) 22,4 L
О упражнении с индикатором и массой до gás cloro utilizada (35,5 г) и вопросе об объеме que ela ocupará. Assim, basta seguir as seguintes etapas:
Assim, basta seguir as seguintes etapas:
Nesse caso, basta multiplicar a massa atômica pelo número de átomos de cloro na fórmula молекулярная:
M = 2.35,5
M = 71 г / моль
Em seguir uma regra de três utilizando massa e молярный объем :
1 моль Cl 2 ——— 71 г ——— 22,4 л
35,5 г- ——— x
71.x = 35,5,22,4
71x = 795,2
x = 795,2
71
x = 11,2 л
Пример 2 — (UFF) Альтернативное соответствие с объемом, потребляемым 0,25 моль карбонового газа (CO 2 ) при нормальных условиях температуры и давления (CNTP) :
a) 0,25 л
b) 0,50 л
c) 5,60 л resposta correta
d) 11,2 л
e) 22,4 л
Oerciseio indica Quantidade de gás carbônico utilizada (0,25 моль) и вопрос o volume que ela ocupará.Assim, basta montar uma regra de três utilizando моль e молярный объем :
1 моль CO 2 ——— 22,4 л
0,25 моль —— — x
1x = 0,25,22,4
x = 5,6 л
Um mol de differentes gas ocupa semper o volume molar de 22,4 л
Por
Диого Лопес Диас
O que é mol? — Brasil Escola
Mol é uma unidade de medida utilizada para express a quantidade de matéria microscópica, como átomos e moléculas. É um termo que provém do latim mol , que means quantidade, e foi proposto pela primeira vez em 1896 pelo químico Wilhem Ostwald. Porém, foi Amedeo Avogadro que sugeriu, em 1811, que a mesma quantidade de matérias differentes apresentaria a mesma quantidade de moléculas, o que foi chamado de Constante de Avogadro.
É um termo que provém do latim mol , que means quantidade, e foi proposto pela primeira vez em 1896 pelo químico Wilhem Ostwald. Porém, foi Amedeo Avogadro que sugeriu, em 1811, que a mesma quantidade de matérias differentes apresentaria a mesma quantidade de moléculas, o que foi chamado de Constante de Avogadro.
Apenas no século XX, após os estudos do químico Frances Jean Baptiste Perrin, é que os cientistas consguiramterminar qual é a quantidade de matéria presente em um mol, que é:
6,02.10 23 энтиды
Partir desse conhecimento, для возможного определения квантидада em um mol de qualquer matéria ou component do átomo (como elétrons, protons e nêutrons). Veja os casos a seguir:
1 mol de feijão = 6,02.10 23 grãos de feijão
1 mol de celulares = 6,02,10 23 aparelhos celulares
1 моль реала = 6,02.10 23 реалов
Utilizações gerais da unidade mol
O termo mol pode ser utilizado para qualquer matéria ou component dela, mas é mais comumente utilizado no estudo de quantidades relacionadas com átomos, moléculas e components atômicos.
a) Para elemento químico
Semper que estivermos trabalhando com elemento químico (Conceunto de átomos isótopos), deveremos utilizar a seguinte expressão:
1 моль элемента = 6,02.10 23 átomos deste elemento
Пример: Elemento Cobre (Cu)
Se tivermos um mol de cobre, teremos, então, 6,02.10 23 átomos de cobre.
b) Para moléculas
Semper que estivermos trabalhando com uma substância poliatômica (formada pela interção de dois ou mais átomos), que é um grupo de moléculas iguais, deveremos utilizar a seguinte expressão:
1 моль de qualquer substância = 6,02.10 23 moléculas
Пример: Агуа (H 2 O)
Se tivermos um mol de água, teremos 6,02.10 23 moléculas de água.
Relações com a unidade mol
Como a unidade mol é utilizada para expressar quantidade de matéria (e matéria é tudo o que ocupa um volume eOSSui massa), podemos relacionar o mol de qualquer matéria com sua massa, assim como podemosterminar o volume (desde que a matéria esteja no estado gasoso) que uma matéria ocupa a partir do mol.
Mapa Mental: Mol
Para baixar o mapa mental, clique aqui!
a) Relação entre mol e massa
Связь между массой, зависимой от массы атома (encontrada na Tabela Periódica), элемента или массы молекулярной массы. Quando relacionadas com o mol, tanto a massa atômica quanto a massa молекулярная são trabalhadas na unidade grama, como nos exemplos a seguir:
Não parera… Tem mais depois da publicidade;)
Пример 1: Elemento cobre (massa atômica 63,5 u)
Sabe-se que um mol de cobre apresenta 6,02.10 23 atomos de cobre e que a massa do elemento é 63,5 u, assim sendo, em:
1 mol de cobre —— 6,02.10 23 atomos de cobre —- песа 63,5 г
Пример 2: Substância H 2 O (молекулярная масса 18 ед.)
Sabe-se que um mol de água apresenta 6,02.10 23 moléculas de água e que a massa da molécula é de 18 u, assim sendo, em:
1 моль H 2 O —— 6,02.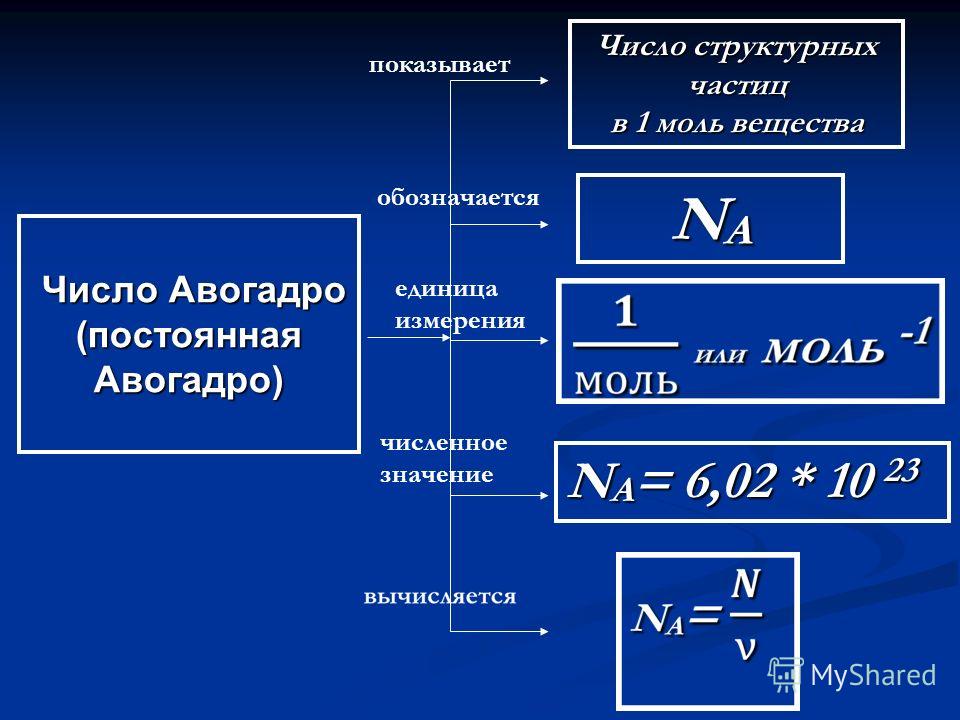 10 23 moléculas de H 2 O —- pesa 18 г
10 23 moléculas de H 2 O —- pesa 18 г
б) Relação entre mol e volume
Quando a matéria está no estado gasoso, podemosterminar o espaço ocupado por qualquer quantidade molar dela. Isso é posível porque uma mesma quantidade em mol da matéria gasosa semper ocupa o mesmo espaço, que é de 22,4 L.
1 моль de matéria gasosa ——- окупа 22,4 л
Пример 1: Elemento argônio (massa atômica 40 u)
Sabe-se que um mol de argônio apresenta 6,02.10 23 atomos de argônio e que a massa do elemento é 40 u, assim sendo, em:
1 mol de argônio —— 6,02.10 23 átomos de argônio —— окупа 22,4 л —— pesa 40g
Пример 2: Амония (молекулярная масса 17 ед.)
Sabe-se que um mol de amônia apresenta 6,02.10 23 moléculas da substância amônia e que a massa da molécula é de 17 u, assim sendo, em:
1 моль NH 3 —— 6,02,10 23 молекулы NH 3 —- окупа 22,4 л —— песа 17 г
c) Образец энвольвендо моля
Partir do mol, podemos calcular a massa, o volume, o número de átomos e o número de moléculas de qualquer substância. Veja um exemplo:
Veja um exemplo:
Образец: (FCC-BA) Масса молочной массы ácido acético, CH 3 COOH, é: (Dado: молекулярная масса до ácido acético = 60 ед.)
а) 1,0.10 -21 г
б) 1,0. 10 -22 г
в) 1,0. 10 -23 г
г) 1,0. 10 -24 г
д) 1,0. 10 -25 г
Resolução: A substância ácido acético Possui Fórmula CH 3 COOH и молекулярная масса 60 ед. Assim, podemos relacionar esses dados com a unidade mol da seguinte maneira:
1 моль CH 3 COOH —— 6,02,10 23 молекулы CH 3 COOH —— pesa 60 г
Paraterminar a massa de uma única molécula em gramas, basta montar uma regra de três a partir da expressão proposta acima, como manifestrado a seguir:
1 моль CH 3 COOH —— 6,02.10 23 молекулы CH 3 COOH —— 60 г
1 молекула CH 3 COOH —— x
60,1 = 6,02,10 23 . x
x
х = 60
6,02,10 23
X = 9,966,10 -23
оу, арредондандо:
X = 10,10 -23 или X = 1,10 -22
Por Me. Диого Лопес Диас
Artículos — Elbibliote.com
Эль объемный моляр (ВМ). Ejercicios.
Mediante Experimentos se ha confirmado que el volumen que ocupa cualquier gas, indiferentemente de su naturaleza o composicin, en condiciones normales de presin y temperatura (CNPT o CN), es de 22, 4 литра пор мол де sustancia, siendo las con температура 0C (273 K) и предварительная температура 1 атм (760 мм рт. ст.). Este volumen es denominado volumen molar (VM).
Dado que en un mol de molculas de cualquier sustancia en estado gaseoso hay 6,02.10 23 molculas, quiere decir entonces que esa cantidad de molculas est presente en un volumen de 22,4 L.
Непрерывный процесс, связанный с различными ситуациями, проблематичными для всех случаев образования молей, молярной массы тела или начального объема объема тела, а также молярной части объема тела (VM).
Se recuerda que pueden utilizarse las frmulas de masa molar, nmero de moles y nmero de Avogadro siempre y cuando se haga el righto anlisis del проблема, Sus соответствует аналогам и despejes de frmulas:
1.Calcular el volumen inicial (Vo) que ocupa 3,23. 10 22 molculas de gas metano (CH 4 ).
- El primer paso para realizar un problem es escribir of datos:
- Анализ проблемы, настройка 6,02.10 23 molculas ocupan un volumen de 22,4 L en CNTP, porlo que al realizar una regla de tres (a) o sustituir en las frmulas (b) queda:
N = 3,23. 10 22 molculas de CH 4 ; L = 6,02. 10 23 мол. / Моль; VM = 22,4 л / моль; Vo =?
2.Calcular la cantidad de sustancia en moles de molculas de cloro diatmico, contenidos en 4,35 L de Cl 2 CNTP.
- El primer paso es escribir of datos:
- Al analizar el проблема, se tiene que un mol de sustancia ocupa un volumen de 22,4 L en CNTP, porlo que al realizar una regla de tres (a) o sustituir en la frmula (b) queda:
Vo = 4,35 L de Cl 2 ; VM = 22,4 л / моль; п =?
3.

 у.
у.