Содержание
Оксид серы(VI), серная кислота, сульфаты — урок. Химия, 8–9 класс.
Оксид серы(\(VI\))
Oксид серы(VI) образуется при каталитическом окислении сернистого газа:
2SO2+O2⇄t,k2SO3.
При обычных условиях это жидкость, которая реагирует с водой с образованием серной кислоты:
SO3+h3O=h3SO4.
Эта реакция протекает даже с парами воды. Поэтому оксид серы(\(VI\)) дымит на воздухе.
Особенностью оксида серы(\(VI\)) является его способность растворяться в концентрированной серной кислоте с образованием олеума.
Оксид серы(\(VI\)) — типичный кислотный оксид. Он реагирует с основаниями и основными оксидами c образованием солей:
SO3+2NaOH=Na2SO4+h3O,
SO3+CaO=CaSO4.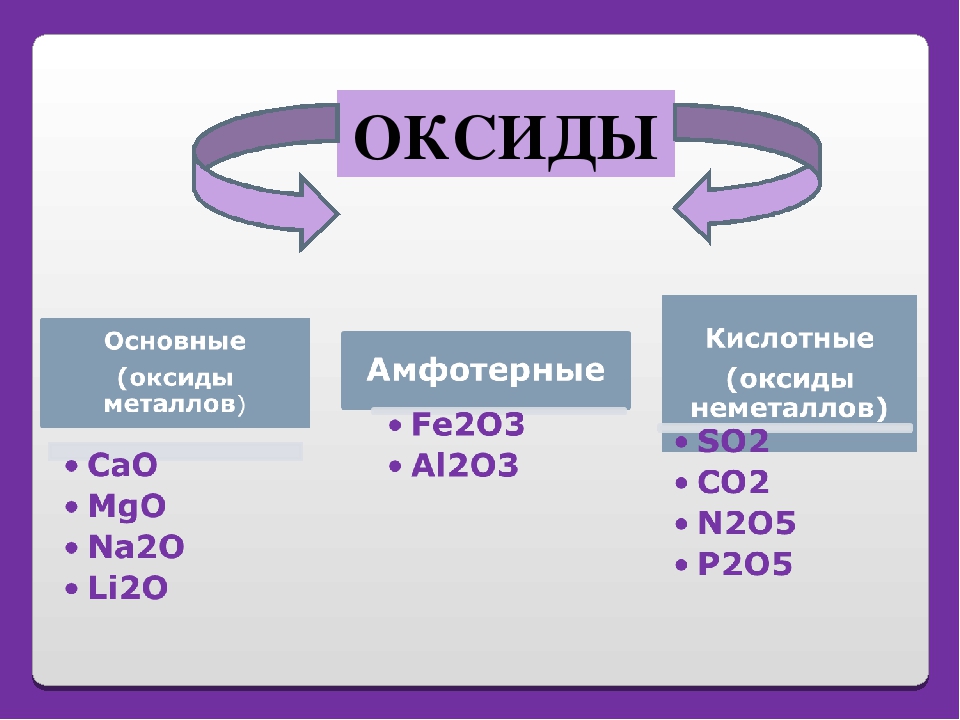
Степень окисления серы в этом оксиде — \(+6\). Это максимальное значение для серы, поэтому в окислительно-восстановительных реакциях он может быть только окислителем.
Серная кислота
Серная кислота h3SO4 — важнейшее соединение серы. Чистая серная кислота представляет собой бесцветную вязкую маслянистую жидкость, котoрая почти в два раза тяжелее воды.
Серная кислота неограниченно смешивается с водой. Растворение серной кислоты сопровождается сильным разогреванием раствора, и может происходить его разбрызгивание. Поэтому серную кислоту растворяют осторожно: тонкой струйкой кислоту вливают в воду при постоянном перемешивании.
Серная кислота очень гигроскопична и используется для осушки разных веществ.
Химические свойства серной кислоты зависят от её концентрации.
Серная кислота любой концентрации реагирует:
- с основными и амфотерными оксидами и гидроксидами с образованием соли и воды:
h3SO4+CuO=CuSO4+h3O,
h3SO4+Zn(OH)2=ZnSO4+2h3O;
- с солями, если образуется газ или нерастворимое вещество:
h3SO4+CaCO3=CaSO4+h3O+CO2↑,
h3SO4+BaCl2=BaSO4↓+2HCl.
Разбавленная кислота реагирует только с металлами, расположенными в ряду активности до водорода. В реакции образуются сульфаты и выделяется водород. Окислительные свойства в этом случае проявляют атомы водорода:
h3+1SO4+Zn0=Zn+2SO4+h3↑0.
Концентрированная кислота реагирует:
- со всеми металлами, кроме золота и платины, за счёт сильных окислительных свойств атома серы:
2h3S+6O4+Cu0=Cu+2SO4+S+4O2+2h3O.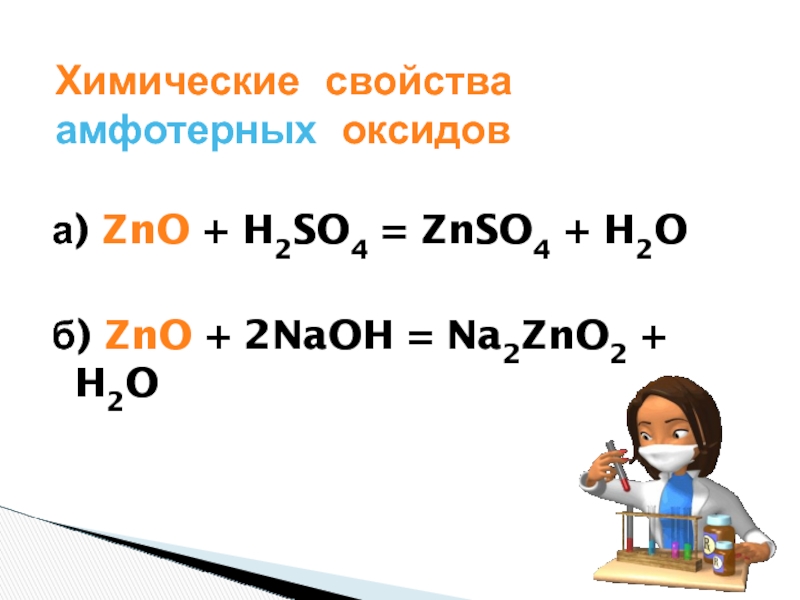
В реакциях с активными металлами продуктами реакции могут быть сернистый газ, сероводород или сера.
Обрати внимание!
При низкой температуре пассивирует железо и алюминий и с ними не реагирует.
- С твёрдыми солями других кислот:
h3SO4(к)+2NaNO3(тв)=Na2SO4+2HNO3.
- Со многими органическими веществами (происходит обугливание сахара, бумаги, древесины и т. д., так как отнимается вода):
Соли серной кислоты
Серная кислота образует два ряда солей. Средние соли называются сульфатами (Na2SO4,CaSO4), а кислые — гидросульфатами (NaHSO4,Ca(HSO4)2).
Качественной реакцией на серную кислоту и её соли является реакция с растворимыми солями бария — выпадает белый осадок сульфата бария:
Na2SO4+BaCl2=BaSO4↓+2NaCl,SO42−+Ba2+=BaSO4↓.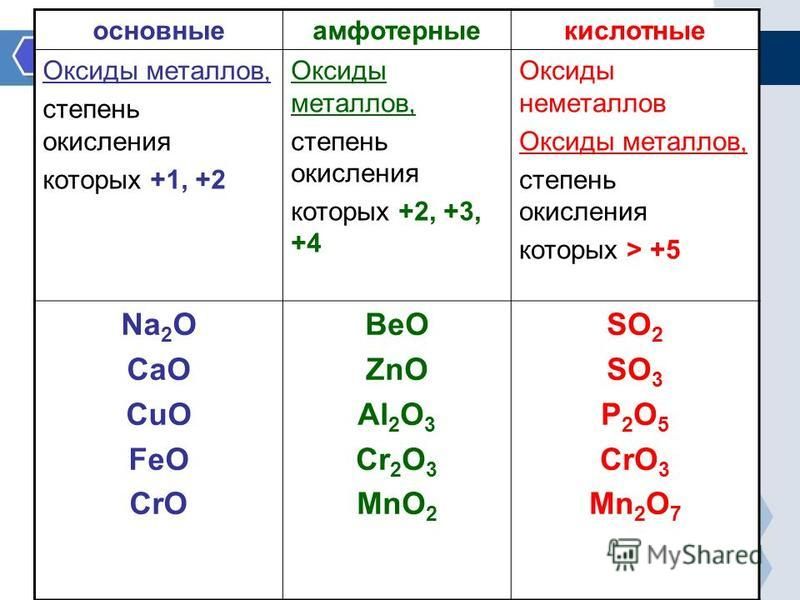
Серная кислота — одно из важнейших химических веществ. Она используется:
- для получения других кислот;
- для производства минеральных удобрений;
- для очистки нефтепродуктов;
- в свинцовых аккумуляторах;
- в производстве моющих средств, красителей, лекарств.
Соли серной кислоты также находят применение. Медный купорос CuSO4⋅5h3O используется для борьбы с заболеваниями растений, гипс CaSO4⋅2h3O применяется в строительстве, сульфат бария BaSO4 — в медицине.
11 класс. Химия. Оксиды. Основания. Кислоты — Оксиды
Комментарии преподавателя
Классификация оксидов
Оксиды – это соединения, состоящие из двух элементов, одним их которых является кислород в степени окисления -2. Например, оксид кальция: Са+2О-2. Не стоит путать оксиды и пероксиды. В состав пероксида входит кислород в степени окисления -1. Например, Н+12О-12, атомы кислорода связаны друг с другом.
Например, Н+12О-12, атомы кислорода связаны друг с другом.
Классификация оксидов
По строению оксиды могут быть ионными или ковалентными соединениями. К ионным соединениям относятся оксиды щелочных и щелочноземельных металлов. Остальные оксиды – это оксиды с ковалентной полярной связью. Такие оксиды в твердом состоянии могут иметь либо атомную (SiO2), либо ионную кристаллическую решетку (твердые СО2 или SO2).
По кислотно-основным свойствам оксиды делятся на:
Кислотным оксидам соответствуют кислоты. Основным оксидам соответствуют основания. Амфотерным – амфотерные соединения. Несолеобразующими называются те оксиды, которым не соответствуют ни кислота, ни основание.
— Основные оксиды
К основным оксидам относятся оксиды металлов главной подгруппы первой и второй групп и оксиды некоторых переходных металлов в низших степенях окисления. (Ag2O, HgO, NiO, Cu2O).
— Кислотные оксиды
Кислотные оксиды – это оксиды неметаллов (CO2, SO2, SiO2, SO3, P2O5) и некоторых переходных металлов в высоких степенях окисления (CrO3, Mn2O7, V2O5).
— Амфотерные оксиды
К амфотерным оксидам относятся оксиды некоторых металлов в степени окисления +2, +3, +4.
Это: BeO, ZnO, Cr2O3, Al2O3, SnO, TiO2, MnO2 .
— Несолеобразующие оксиды
Несолеобразующие оксиды представлены в основном такими: CO, NO, N2O, h3O, F2O, SiO.
Оксиды обладают физическими свойствами. Многие оксиды неметаллов при стандартных условиях газообразны CO2, SO2, SO3, оксиды азота. Есть жидкие оксиды. Это, например, Mn2O7, Сl2O7. Большинство оксидов металлов – твердые (Ag2O, HgO, NiO, Cu2O)
Рис. 1
Оксиды бывают бесцветными (CO2, SO2.) или имеют окраску, например, NO2- , бурый газ (лисий хвост). Рис. 1.
Химические свойства оксидов
1. Отношение к воде:
С водой реагируют оксиды щелочных и щелочноземельных металлов. (Li2O, Na2O, K2O, Pb2O, Cs2O, CaO, SrO, BaO, RaO)
Na2O + h3O →2 NaOH (1)
CaO + h3O → Ca (OH) 2 (2)
Оксиды, которым соответствуют нерастворимые основания, с водой не реагируют.
Кислотные оксиды реагируют с водой с образованием кислот. Исключение – SiO2.
N2O5 + h3O → 2HNO3 (3)
SO3 + h3O → h3SO4 (4)
Амфотерные и несолеобразующие оксиды с водой не взаимодействуют.
2. Важным химическим свойством оксидов являются реакции, приводящие к образованию солей.
В реакциях солеобразования участвуют вещества, обладающие противоположными кислотно-основными свойствами.
Основные оксиды взаимодействуют с кислотами с образованием соли и воды.
MnO +2 HCl → MnCl2 + h3O (5)
Амфотерные оксиды реагируют как с кислотами с образованием соли и воды, так и со щелочами.
ZnO +2 HCl → ZnCl2 + h3O (6)
ZnO +2 KOH → K2ZnO2 + h3O (7)
Такая реакция (7) может протекать как в растворе, так и при сплавлении. При этом образуются различные продукты, в которых металл, образующий оксид, находится в ионной форме.
Кислотные оксиды реагируют с основаниями, с образованием соли и воды.
SO2 +2 KOH → K2SO3 + h3O (8)
Основные и кислотные оксиды способны взаимодействовать между собой с образованием солей.
MnO + SO2 → MnSO3 (9)
3CaO + P2O5 → Ca3(PO4)2 (10)
Получение оксидов
1. При горении простых веществ. Не реагируют благородные газы, галогены, золото и платина.
Li +O2 →Li2O (11)
4P + 5O2 →2P2O5 (12)
2. При горении сложных веществ.
Ch5 + 2O2 → CO2 +2h3O (13)
2h3S + 3O2 → 2SO2 +2h3O (14)
3. Термическое разложение некоторых сложных веществ.
Mg(OH) MgO + h3O
h3SiO3SiO2 + h3O
(CuOH)2CO3 2CuO + CO2+ h3O
2Cu(NO3)2 CuO + 4 NO2+ h3O
Оксиды – это довольно распространённый тип соединений. Примером такого соединения является вода, которая очень важна для жизни всех живых организмов, а также кварц и огромное количество его разновидностей. Рис. 2. Массовая доля кварца и его разновидностей в земной коре составляет 60%.
Примером такого соединения является вода, которая очень важна для жизни всех живых организмов, а также кварц и огромное количество его разновидностей. Рис. 2. Массовая доля кварца и его разновидностей в земной коре составляет 60%.
К оксидам относится углекислый газ, ржавчина и очень многие известные минералы.
Диоксид циркония – чрезвычайно стабильное соединение, поэтому его образование очень выгодно и приводит к выделению большого количества энергии. Из-за этого, если удается поджечь цирконий, его практически невозможно затушить, потому что он отбирает кислород даже у углекислого газа и песка. Затушить горящий цирконий можно только инертными газами.
Рис. 2
Источники
http://www.youtube.com/watch?t=5&v=bT0Olh2Cn1c
http://www. youtube.com/watch?t=7&v=Sb8bpeBVio0
youtube.com/watch?t=7&v=Sb8bpeBVio0
источник презентации — http://ppt4web.ru/khimija/oksidy3.html
http://interneturok.ru/ru/school/chemistry/11-klass — конспект
Оксиды: интересные факты
Оксидом является соединение, образованное двумя химическими элементами, один из которых кислород. Практически все элементы Периодической системы Менделеева Д. И. способны образовывать оксиды. Но оксиды Гелия, Неона, Аргона не получены. Наиболее известным и широко распространённым оксидом является вода. Она повсюду. Даже радуга – это результат преломления солнечных лучей в каплях воды.
Формулы оксидов
Элемент с постоянной валентностью образует один оксид. Например, у двухвалентного кальция оксид: CaO. Если у элемента переменная валентность, то он способен образовывать несколько оксидов. Примером являются окиды хрома: СrO, Сr2O3, СrO3.
Если у элемента переменная валентность, то он способен образовывать несколько оксидов. Примером являются окиды хрома: СrO, Сr2O3, СrO3.
Формула определяется в зависимости от валентностей составляющих элементов. Приведём пример для оксида серы.
1.Кислород двухвалентен. Сера черырёхвалентна. Пишем валентности над символами
IV II
химических элементов: SO.
2. Определяем наименьшее число, которое делится на 2 и 4. Таким числом является 4.
3. Определяем индекс возле серы: делим полученное число на значение валентности 4/4=1. Значит, индекс возле серы не пишем.
4. Этим же методом находим индекс возле кислорода: 4/2=2.
5. Получили формулу: SO2.
Интересное об оксидах
Причиной эффекта собачьей пещеры в Италии является оксид углерода СО2. Он тяжелее воздуха, поэтому получается так, что газ в пещере как раз покрывает собачью голову. Невысокие животные гибнут от удушья за несколько минут.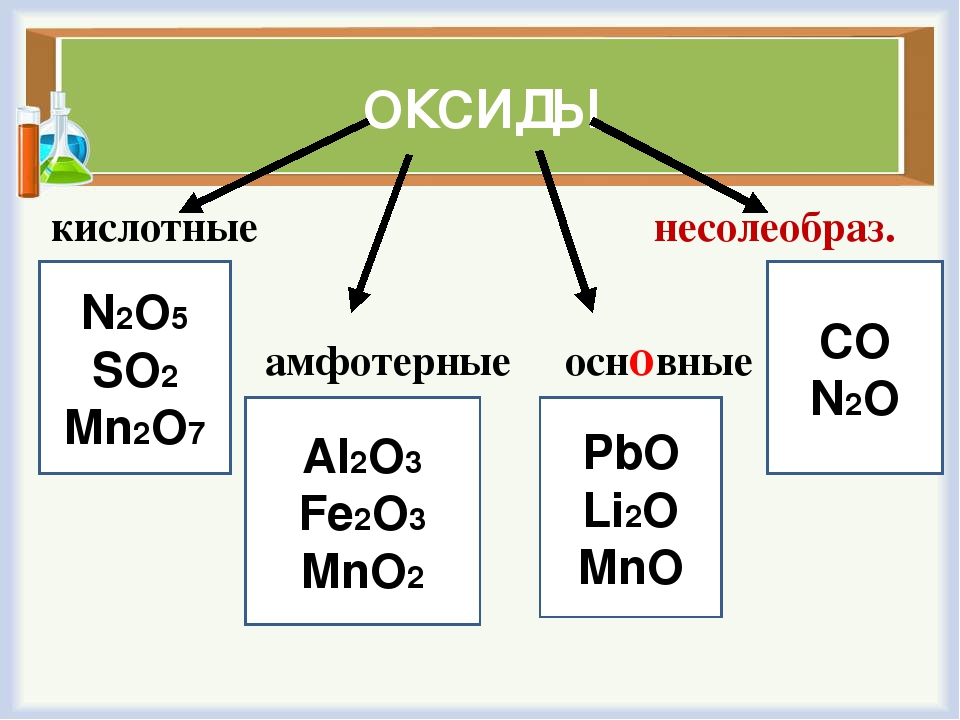 А за счёт своего роста человек может легко пройти по ней.
А за счёт своего роста человек может легко пройти по ней.
В 1890 году парусное судно «Малборо» направлялось в Англию из Новой Зеландии. На борту было 23 члена экипажа и несколько пассажиров. В Англию судно не прибыло. Лишь через 23 года корабль появился вновь возле Огненной Земли. Шёл на всех парусах и оказался абсолютно не повреждённым. Оказывается, что причиной гибели людей стало извержение вулкана на острове Мартиника. Вулканические газы содержали 1,6% СО.
СО не растворяется в воде, не обладает запахом, определить его сложно. А на людей и животных воздействует, как яд. При этом для некоторых видов рыб он не опасен, хотя китоподобные могут погибнуть и при очень небольшой концентрации газа в воздухе. Холоднокровные, например жабы, могут переносить концентрацию СО в 1000 раз большую, чем теплокровные.
Появление кислот в атмосфере
Кислотные дожди появляются, когда с атмосферным кислородом и водяным паром соединяются оксиды серы и азота. Эти оксиды выбрасываются в окружающую среду металлургическими предприятиями, электростанциями, автомобильным транспортом. Полученные таким образом кислоты имеют вид дождя и разносятся ветром.
Эти оксиды выбрасываются в окружающую среду металлургическими предприятиями, электростанциями, автомобильным транспортом. Полученные таким образом кислоты имеют вид дождя и разносятся ветром.
Оксид серы выбросов реагирует с водой, в результате образуется сернистая кислота:
SO2+h3O=h3SO3.
И взаимодействуя с кислородом воздуха, она частично превращается в серную кислоту:
2Н2SO3+О2=2Н2SO4.
Оксиды азота появляются в атмосфере в результате реакций азота и кислорода. Взаимодействие осуществляется при высоких температурах сгорания топлива
N2+O2=2NO
Но образуемое соединение быстро взаимодействует с кислородом:
2NO+O2=2NO2,
А полученный оксид азота реагирует с влагой из окружающей среды
2NO2+Н2О=НNO2+НNO3.
Сфера влияния кислотных дождей
Таким образом в воздухе появляются примеси кислот: серной, сернистой, азотной и азотистой.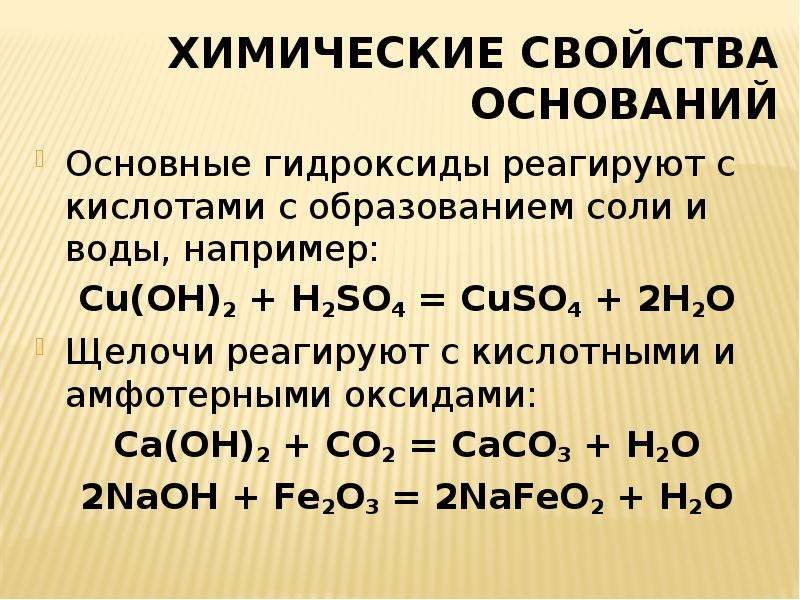 И эти примеси с осадками попадают на землю. Кислотные дожди негативно сказываются на росте растений, здоровье животных и людей.
И эти примеси с осадками попадают на землю. Кислотные дожди негативно сказываются на росте растений, здоровье животных и людей.
В 1952 году непрозрачный туман охватил улицы Лондона, в результате чего погибло 4000 жителей. Частички смога раздражали дыхательные пути, а в лёгких появлялась слизь. Многие люди получили сердечные приступы с предшествующим тяжёлым кашлем. По оценкам учёных тот туман был более кислым, чем лимонный сок. Затем правительством было запрещено сжигать в городе топливо, образующее большое количество дыма. Это было сделано во избежание образования серной и азотной кислот.
Урожайность многих культур уменьшается на 3-8%, потому что листья повреждаются кислотами.
Изменяется состав воды в озёрах и ставках. В результате погибает рыба и многие виды насекомых. Исчезают птицы и животные, которые ими питаются. У улиток истончается карбонатная раковина, которая защищает их. В результате они гибнут. Также разрушаются ракушки обитателей водоёмов. Это негативно сказывается на экосистемах.
Это негативно сказывается на экосистемах.
Кислотные дожди закисляют почвы. Большинству растений это не по нраву. Существует совсем немного растений, способных расти на кислых почвах без ущерба для себя. Такое растение — хвощ полевой. Из-за жёсткости им не питаются травоядные животные.
Кроме того кислотные дожди увеличивают коррозию металлов, разрушают мрамор и известняк.
После того, как был определён вред подобных дождей, в развитых странах стали устанавливать улавливатели, не пропускающие кислотные оксиды в воздух.
Основные, кислотные, амфотерные оксиды и их свойства, получение
Получение оксидов происходит с помощью различных способов. Из наиболее простых
2h3 + O2 = 2h3O
Существуют основные и кислотные оксиды. Они различаются тем, что при взаимодействии оксида с водой образуется либо кислота, либо основание. Эти реакции относят к реакциям соединения:
СаО+Н2О=Са(ОН)2.
1. Основные оксиды и кислотные оксиды способны взаимодействовать между собой:
СаО+SO3=CaSO4
2. Основные оксиды взаимодействуют с кислотами. Образуются соответствующая соль и вода:
CaO+h3SO4=CaSO4+h3O
3. Образуются соответствующая соль и вода и при взаимодействии кислотных оксидов со щелочами:
СО2+2NaOH=Na2CO3+h3O.
В химии существуют вещества, проявляющие двойственность свойств. Это подобные двуликому Янусу амфотерные оксиды. Выступают как в качестве кислотных, так и в качестве основных оксидов. Поэтому со щелочами они проявляют особенности, характерные для кислотных оксидов, а с кислотами – основных.
Применение оксидов
Известно около 300 оксидов. Из железных руд, содержащих оксиды железа, получают железо.
Песок, состоящий преимущественно состоит из SiO2, используют при производстве стекла.
Некоторые оксиды являются основой для красок: ZnO – белой, Fe2O3 – коричневой, Cr2O3 – зелёной. А природные и искусственные кристаллы оксидов алюминия, окрашенные примесями, используют для изготовления ювелирных украшений.
А природные и искусственные кристаллы оксидов алюминия, окрашенные примесями, используют для изготовления ювелирных украшений.
Эти соединения могут как дарить жизнь, так и разрушать её. То есть значение оксидов в жизни человека и природе является довольно существенным.
оксид серы(IV) и три типа реакций
Оксид серы(IV) обладает кислотными свойствами, которые проявляются в реакциях с веществами, проявляющими основные свойства. Кислотные свойства проявляются при взаимодействии с водой. При этом образуется раствор сернистой кислоты:
SO2 + h3O=h3SO3
Степень окисления серы в сернистом газе (+4) обусловливает восстановительные и окислительные свойства сернистого газа:
вос-тель: S+4 – 2e => S+6
ок-тель: S+4 + 4e => S0
Восстановительные свойства проявляются в реакциях с сильными окислителями: кислородом, галогенами, азотной кислотой, перманганатом калия и другими. Например:
Например:
2SO2 + O2 = 2SO3
S+4 – 2e => S+6 2
O20 + 4e => 2O-2 1
С сильными восстановителями газ проявляет окислительные свойств. Например, если смешать сернистый газ и сероводород, то они взаимодействуют при обычных условиях:
2h3S + SO2 = 3S + 2h3O
S-2 – 2e => S0 2
S+4 + 4e => S0 1
Сернистая кислота существует только в растворе. Она неустойчива и разлагается на сернистый газ и воду. Сернистая кислота не относится к сильным кислотам. Она является кислотой средней силы и диссоциирует ступенчато. При добавлении к сернистой кислоте щёлочи образуются соли. Сернистая кислота даёт два ряда солей: средние – сульфиты и кислые – гидросульфиты.
Оксид серы(VI)
Триоксид серы проявляется кислотные свойства. Он бурно реагирует с водой, при этом выделяется большое количество теплоты. Эту реакцию используют для получения важнейшего продукта химической промышленности – серной кислоты.
SO3 + h3O = h3SO4
Поскольку сера в триоксиде серы имеет высшую степень окисления, то оксид серы(VI) проявляет окислительные свойства. Например, он окисляет галогениды, неметаллы с низкой электроотрицательностью:
2SO3 + C = 2SO2 + CO2
S+6 + 2e => S+4 2
C0 – 4e => C+4 2
Серная кислота вступает в реакции трёх типов: кислотно-основные, ионообменные, окислительно-восстановительные. Так же активно она взаимодействует с органическими веществами.
Кислотно-основные реакции
Серная кислота проявляет кислотные свойства в реакциях с основаниями и основными оксидами. Эти реакции лучше проводить с разбавленной серной кислотой. Поскольку серная кислота является двухосновной, то она может образовывать как средние соли (сульфаты), так и кислые (гидросульфаты).
Ионообменные реакции
Для серной кислоты характерны ионообменные реакции. При этом она взаимодействует с растворами солей, образуя осадок, слабую кислоту либо выделяя газ. Эти реакции осуществляются с большей скоростью, если брать 45%-ную или ещё более разбавленную серную кислоту. Выделение газа происходит в реакциях с солями неустойчивых кислот, распадающихся с образованием газов (угольной, сернистой, сероводородной) либо с образованием летучих кислот, таких как соляная.
Эти реакции осуществляются с большей скоростью, если брать 45%-ную или ещё более разбавленную серную кислоту. Выделение газа происходит в реакциях с солями неустойчивых кислот, распадающихся с образованием газов (угольной, сернистой, сероводородной) либо с образованием летучих кислот, таких как соляная.
Окислительно-восстановительные реакции
Наиболее ярко серная кислота проявляет свои свойства в окислительно-восстановительных реакциях, так как в её составе сера имеет высшую степень окисления +6. Окислительные свойства серной кислоты можно обнаружить в реакции, например, с медью.
В молекуле серной кислоты два элемента-окислителя: атом серы с С.О. +6 и ионы водорода H+. Медь не может быть окислена водородом в степени окисления +1, но сера может. Это является причиной окисления серной кислотой такого неактивного металла, как медь.
В разбавленных растворах серной кислоты окислителем является преимущественно ион водорода H+. В концентрированных растворах, особенно в горячих, преобладают окислительные свойства серы в степени окисления +6.
Нужна помощь в учебе?
Предыдущая тема: Химические свойства кислорода и серы: реакции с металлами и неметаллами
Следующая тема:   Свойства сложных веществ с содержанием азота: оксиды азота
Кислотные оксиды. Образование кислотных дождей
Оксиды — соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления -2 [1].
По кислотно-основным свойствам оксиды классифицируют на основные, кислотные и амфотерные. Также существуют несолеобразующие оксиды, у которых нет соответствующих гидратов, которые были бы кислотами или основаниями.
Гидраты — продукты соединения с водой, получаемые присоединением воды к данному веществу прямо или косвенно (в несколько стадий) [1].
Кислотные оксиды — оксиды, проявляющие кислотные свойства, им соответствуют кислородсодержащие кислоты [1].
Термин «кислотный дождь» впервые был введен английским метеорологом Робертом Смитом. Он обратил внимание на то, что дождь в его городе способен разъедать камень и чугун. Это явление связано с тем, что углекислый газ, который содержится в воздухе, реагирует с водой, образуя слабую угольную кислоту. В связи с развитием промышленности, транспорта, деятельности металлургических предприятий и тепловых электростанций кислотность дождей резко повышается, так как увеличиваются выбросы в атмосферу оксидов серы и различных оксидов азота [2].
При взаимодействие кислотного оксида с водой образуется кислота:
SO2 + H2O ↔ H2SO3
CO2 + H2O ↔ H2CO3
Образование таких дождей оказывают негативное воздействие на:
кислотность водоемов и рек, что приводит к гибели рыб и замедлению развития водорослей;
кислотность почв и рост растений;
памятники и здания, так как кислотные дожди влияют на облицовочный материал (мрамор и др. ), разрушая его;
), разрушая его;
срок службы железобетонных конструкций.
Таким образом, выпадение кислотных осадков — это важная экологическая проблема, которая требует решения в будущем [3].
Качественная реакция на углекислый газ. Получение и растворение углекислого газа в воде.
Для проведения эксперимента собирали прибор для получения газов (рис. 1) и проверяли его на герметичность.
Рис. 1. Установка для получения углекислого газа
Для доказательства того, что выделяющийся газ является углекислым, необходимо налить в пробирку, находящуюся в штативе, 2–3 мл известковой воды (Са(ОН)2). А в пробирку прибора для получения газов поместить несколько кусочков мрамора и прилить 2 мл соляной кислоты. Закрыть пробирку пробкой с газоотводной трубкой. Газоотводную трубку поместить в известковую воду в пробирке.
Закрыть пробирку пробкой с газоотводной трубкой. Газоотводную трубку поместить в известковую воду в пробирке.
СО2 + Са(ОН)2 → СаСО3↓+ Н2О
При пропускании углекислого газа через раствор гидроксида кальция (известковая вода) образуется белый осадок карбоната кальция (CaCO3).
СаСО3 + СО2 + Н2О → Са(НСО3)2
При дальнейшем пропускании избытка углекислого газа через образовавшуюся взвесь, наблюдается растворение осадка вследствие образования растворимой соли Са(НСО3)2.
После этого газоотводную трубку опускали в чистый стакан и вносили туда тлеющую лучину. Наблюдалось затухание лучины. Следовательно, углекислый газ не поддерживает горение.
Далее газоотводную трубку опускали в пробирку с водой, в которую было добавлено несколько капель лакмуса. Наблюдалось изменение цвета лакмуса с фиолетового на красный.
СО2 + Н2О ↔ Н2СО3
h3СО3 ↔ 2Н++СО32-
Это связано с тем, что углекислый газ взаимодействует с водой, при этом образуется неустойчивая слабая угольная кислота (Н2СО3).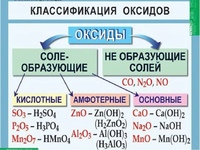 После стояния раствора цвет индикатора снова становится фиолетовым, так как со временем угольная кислота разлагается на углекислый газ и воду.
После стояния раствора цвет индикатора снова становится фиолетовым, так как со временем угольная кислота разлагается на углекислый газ и воду.
Заключение
На современном этапе развития общества, становится очевиден вред и урон, наносимый кислотными дождями. В развитых странах на производствах устанавливают уловители, которые не допускают попадение загрязнений в атмосферу. Обязательной частью автомобильного двигателя в некоторых странах стал прибор, который удаляет из выхлопа машины оксиды азота [2].
Угольная кислота (Н2СО3) образуется при насыщении воды углекислым газом. Её самые концентрированные растворы можно пить без вреда для здоровья. На хорошей растворимости углекислого газа основано его использование при изготовлении искусственных минеральных вод и прохладительных напитков, например лимонада. Хорошо известно, что углекислый газ из такого раствора постепенно улетучивается, а при нагревании — довольно быстро. В чистом виде угольная кислота существовать не может. Она устойчива только в разбавленных водных растворах и образуется при растворении СО2 в Н2О [3].
В чистом виде угольная кислота существовать не может. Она устойчива только в разбавленных водных растворах и образуется при растворении СО2 в Н2О [3].
Литература:
-
Лёвкин А. Н., Карцова А. А. Школьная химия: самое необходимое [Текст]: учебное пособие для школьников / А. Н. Лёвкин, А. А. Карцова. — СПб, Авалон, Азбука-классика, 2006. — 288 с. -
Савина Л. А. Я познаю мир. Химия: энцикл.: [Текст] / Л. А. Савина. — М.: АСТ: Астрель: Хранитель, 2007. — 398 с. -
Леенсон И. А. Превращение веществ. Химия: Энциклопедия ОЛМА [Текст] / И. А. Леенсон. — М.: ОЛМА Медиа Групп, 2013. — 303 с.
SO2 — молекула месяца
SO2 — молекула месяца
| Диоксид серы — SO 2 |
Д-р Майк Томпсон
Винчестерский колледж, Великобритания
Также доступны версии HTML, JMol и VRML.
Сера образует два основных оксида; газовый диоксид серы (SO 2 ) и жидкий триоксид серы (SO 3 ).Диоксид серы — это плотный бесцветный газ, растворимый в воде и имеющий удушающий и неприятный запах подгоревших спичек. Он имеет температуру плавления -72,7 ° C и точку кипения -10 ° C.
Газообразный диоксид серы можно получить непосредственно путем нагревания составляющих его элементов. Сжигание расплавленной серы в воздухе или чистом кислороде приводит к реакции, в результате которой образуется пламя бледно-голубого цвета. Это довольно эффектно смотрится в затемненной комнате.
S 8 ( л ) + 8 O 2 ( г ) 8 SO 2 ( г )
| Сера | Сжигание серы до дает голубое пламя |
Альтернативой лабораторной подготовки является нагрев медной стружки концентрированной серной кислотой (H 2 SO 4 ), см. Изображение справа.
Изображение справа.
Cu ( с ) + 2 H 2 SO 4 ( водн. ) CuSO 4 ( водн. ) + SO 2 ( г ) + 2 H 2 O ( л )
Диоксид серы — это кислый газ, и это можно легко продемонстрировать, добавив воды и нескольких капель универсального индикатора в емкость с газом. Образующаяся кислота представляет собой сернистую кислоту с низким содержанием двухосновной кислоты (H 2 SO 3 ).
SO 2 ( г ) SO 2 ( водн. )
SO 2 ( водн. ) + H 2 O ( l ) H 2 SO 3 ( водн. )
Диоксид серы является основным компонентом кислотных дождей, поскольку он смешивается с водяным паром в атмосфере, реагируя с образованием серной кислоты (H 2 SO 4 ). Это возможно, поскольку УФ-излучение в верхних слоях атмосферы катализирует реакцию между диоксидом серы и кислородом с образованием триоксида серы, который затем вступает в реакцию с водой. В настоящее время многое сделано для сокращения выбросов SO 2 за счет обессеривания топлива с целью уменьшения кислотных дождей. Имеются статистические данные об уровнях диоксида серы с 1974 по 1998 год.
В настоящее время многое сделано для сокращения выбросов SO 2 за счет обессеривания топлива с целью уменьшения кислотных дождей. Имеются статистические данные об уровнях диоксида серы с 1974 по 1998 год.
Диоксид серы существует в виде отдельных ковалентных плоских молекул V-образной формы с валентным углом OSO 120 °.
Простым испытанием на диоксид серы является пропускание газа через кусок фильтровальной бумаги, пропитанной подкисленным Na 2 Cr 2 O 7 .Цвет бумаги меняется с оранжевого для Cr 6+ на зеленый для Cr 3+ . Поскольку степень окисления хрома снижается с 6+ до 3+, это ясно указывает на полезное свойство диоксида серы, а именно, что он является восстановителем. Он нашел применение в качестве антиоксиданта, который помогает предотвратить порчу пищи.
| Оранжевый Cr 6+ изменение на сине-зеленый Cr 3+ в наличие SO 2 | SO 2 используется в фруктовых напитках для их консервации.  | SO 2 используется в винах |
Основными природными источниками диоксида серы являются вулканы, лесные пожары и океаны. Основными источниками диоксида серы для человека являются сжигание ископаемого топлива, плавка, производство бумаги и производство серной кислоты посредством контактного процесса.
Диоксид серы вызывает все больше опасений для здоровья, так как у некоторых людей он может вызвать астму. В следующий раз, когда вы пойдете в супермаркет, почему бы не проверить этикетки продуктов питания, чтобы увидеть, содержат ли они диоксид серы (добавки E220 и E221) или химическое вещество, которое разлагается с образованием газа (E222-8).Диоксид серы содержится в безалкогольных напитках, таких как фруктовые соки, некоторые виды мяса и вина. Диоксид серы также находит применение для отбеливания и очистки нефтепродуктов.
Дополнительные способы получения диоксида серы — это капание концентрированной серной кислоты на концентрированный раствор гидросульфита натрия.
NaHSO 3 ( водн. ) + H 2 SO 4 ( водн. ) NaHSO 4 ( водн. ) + H 2 O ( l ) + SO 2 ( г )
студентов химического факультета GCSE часто сталкиваются с другим способом получения диоксида серы при изучении скорости реакции в эксперименте «исчезающий крест» (ссылка медленная на загрузку).
Na 2 S 2 O 3 ( водн. ) + 2 HCl ( водн. ) NaCl ( водн. ) + H 2 O ( l ) + S ( s ) + СО 2 ( г )
Для тех, кто озабочен написанием серы, нажмите здесь.
Вернуться на страницу «Молекула месяца».
Диоксид серы — обзор
ДИОКСИД СЕРЫ
Диоксид серы синтезируется большинством штаммов Saccharomyces cerevisiae , но в большинстве случаев он связан с органическими соединениями в дрожжах или бродильном сусле. Таким образом, синтез SO 2 , вероятно, не играет значительной роли в успехе S. cerevisiae в борьбе с другими микробами во время ферментации. Интересно, что добавление диоксида серы способствует не только росту штаммов, устойчивых к диоксиду серы, но также, по-видимому, выбору штаммов, вырабатывающих большее количество диоксида серы.
Таким образом, синтез SO 2 , вероятно, не играет значительной роли в успехе S. cerevisiae в борьбе с другими микробами во время ферментации. Интересно, что добавление диоксида серы способствует не только росту штаммов, устойчивых к диоксиду серы, но также, по-видимому, выбору штаммов, вырабатывающих большее количество диоксида серы.
Дифференциальное действие диоксида серы на эпифитную флору винограда можно использовать для избирательного контроля над влиянием местных дрожжей.Растущее осознание их присутствия и их положительного и отрицательного влияния на аромат вина (Henick-Kling et al. , 1998) делает модуляцию против подавления важным инструментом в регулировании характера вина.
При обычно используемых концентрациях (обычно менее 50 частей на миллион для здорового винограда) диоксид серы, по-видимому, не влияет на скорость спиртового брожения. Однако диоксид серы может замедлить начало брожения. Присутствие 15–20 частей на миллион может снизить жизнеспособность дрожжевого инокулята с 10 6 до 10 4 клеток / мл или менее (Lehmann, 1987). Хотя диоксид серы может помочь ограничить рост аборигенных дрожжей и бактерий, в этом может быть нет необходимости, поскольку инокулированные дрожжи быстро начинают доминировать в ферментации (Petering et al. , 1993; Henick-Kling et al. , 1998).
Хотя диоксид серы может помочь ограничить рост аборигенных дрожжей и бактерий, в этом может быть нет необходимости, поскольку инокулированные дрожжи быстро начинают доминировать в ферментации (Petering et al. , 1993; Henick-Kling et al. , 1998).
Устойчивость дрожжей к диоксиду серы коррелирует с несколькими факторами. Например, ген SSU1R , который контролирует отток сульфита, сверхэкспрессируется в винных дрожжах (Hauser et al. , 2001). Это, по-видимому, является результатом его транслокации в положение, где он находится под контролем промотора ECM34 (Pérez-Ortín et al., 2002).
Помимо антимикробного действия, диоксид серы может значительно влиять на метаболизм дрожжей. Диоксид серы легко связывается с несколькими карбонильными соединениями, особенно с ацетальдегидом, пировиноградной кислотой и α-кетоглутаровой кислотой. Связывание увеличивает их биосинтез и возможное высвобождение в ферментирующее сусло. Таким образом, их концентрация в готовом вине часто коррелирует с концентрацией диоксида серы, добавляемого в сусло. Диоксид серы также способствует синтезу глицерина, тогда как он имеет тенденцию ингибировать производство уксусной кислоты.Фиксированная кислотность обычно не меняется, отчасти потому, что диоксид серы подавляет метаболизм как молочнокислых, так и уксуснокислых бактерий.
Диоксид серы также способствует синтезу глицерина, тогда как он имеет тенденцию ингибировать производство уксусной кислоты.Фиксированная кислотность обычно не меняется, отчасти потому, что диоксид серы подавляет метаболизм как молочнокислых, так и уксуснокислых бактерий.
Связывание диоксида серы с карбонильными соединениями непреднамеренно увеличивает количество диоксида серы, необходимое для подавления действия организмов, вызывающих порчу. Связанный диоксид серы обладает гораздо меньшим противомикробным действием, чем молекулярный SO 2 .
Диоксид серы увеличивает извлечение фенольных соединений, в том числе антоцианов из винограда.Однако он также может обратимо обесцвечивать антоцианы. Кроме того, антоцианы, связанные с диоксидом серы, не могут полимеризоваться с процианидинами. Это может отрицательно сказаться на долгосрочной стабильности цвета.
Хотя диоксид серы является лучшим противомикробным средством для вина, он не контролирует некоторые порчи дрожжей. Многие штаммы Saccharomycodes ludwigii , Zygosaccharomyces bailii и Brettanomyces spp. особенно устойчивы к диоксиду серы (Hammond, Carr, 1976; рис.8.9).
Многие штаммы Saccharomycodes ludwigii , Zygosaccharomyces bailii и Brettanomyces spp. особенно устойчивы к диоксиду серы (Hammond, Carr, 1976; рис.8.9).
Элементарная сера, если она присутствует, может ассимилироваться и использоваться в синтезе серосодержащих аминокислот и коферментов. Он также может быть окислен до сульфата и диоксида серы или восстановлен до сероводорода. Восстановление серы до сероводорода может быть средством, хотя и неприятным с точки зрения аромата, поддержания благоприятного окислительно-восстановительного баланса в дрожжевых клетках в анаэробных условиях.
Активность в устойчивом состоянии кислых, основных и амфотерных оксидов в реакции CO 2 + CS 2 = 2COS
М. Сугиока, А. Икеда, К. Амура: J. Japan Petrol. Inst.
22 , 120 (1979).
CAS
Google Scholar
L. Németh, G. Gáti, S. Horváth, I. Szabados, A. Gaál, S. László, P. Pelyva, L. Vécsey, L. Nagy: Hung. Патент 185 221 (1980).
Gaál, S. László, P. Pelyva, L. Vécsey, L. Nagy: Hung. Патент 185 221 (1980).
L. Németh, T. Mároly, E. Grovcsik, J. Kerti, A. Kerekes: Hung. Патент 189 188; Патент России 1 355120; Патент ГДР 230885 (1985).
A. Auroux, A. Gervasini, L. Németh, G. Gáti, I.S. Пап, Г. Минк: Прибой. Интерфейс Anal.
19 , 529 (1992).
CAS
Статья
Google Scholar
Г. Минк, И. Бертоти, Л. Немет, Г. Гати, М. Мохай, Т. Секели: Surf. Интерфейс Anal.
12 , 262 (1988).
Артикул
Google Scholar
Л. Немет, Г. Гати, А. Гервасини, А. Ору, Г. Минк, И.С. Пап, Т. Секели: J. Applied Catal.
64 , 143 (1990).
Артикул
Google Scholar
Г. Минк, А. Ору, А.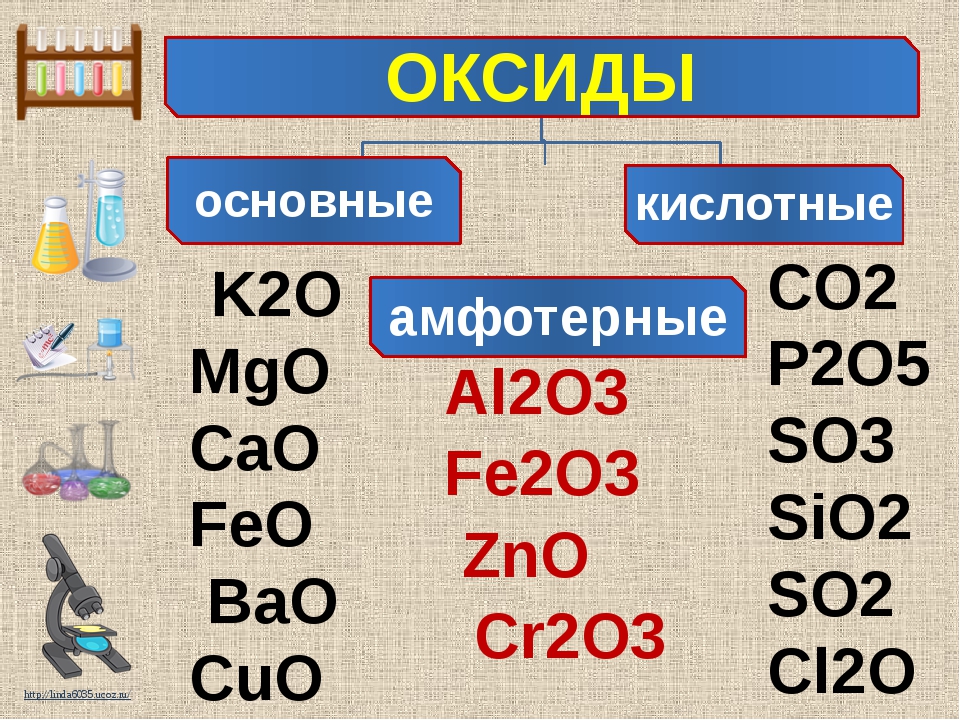 Гервасини: React. Кинет. Катал. Lett. , 68, , 229 (1999).
Гервасини: React. Кинет. Катал. Lett. , 68, , 229 (1999).
CAS
Google Scholar
JANAF Термохимические таблицы , третье издание, т.I.–II. (1985).
Справочник по химии и физике , 60 th Edition pp. E-82, F-214. CRC Press Boca Raton, Florida 1980.
W.T. Holser: Acta Cryst.
9 , 196 (1955).
Артикул
Google Scholar
R.T. Сандерсон: Химическая периодичность . Рейнхольд, Нью-Йорк, 1960.
Google Scholar
A.L. Allred: J. Inorg. Nucl. Chem.
17 , 215 (1961).
CAS
Статья
Google Scholar
Неорганическая химия — О pH водного раствора SO2
При добавлении газа $ \ ce {SO2} $ в воду он проявляет характер кислотного оксида при гидролизе до серной кислоты:
$$ \ ce {SO2 (г) + h3O (л) <=> h3SO3 (водн.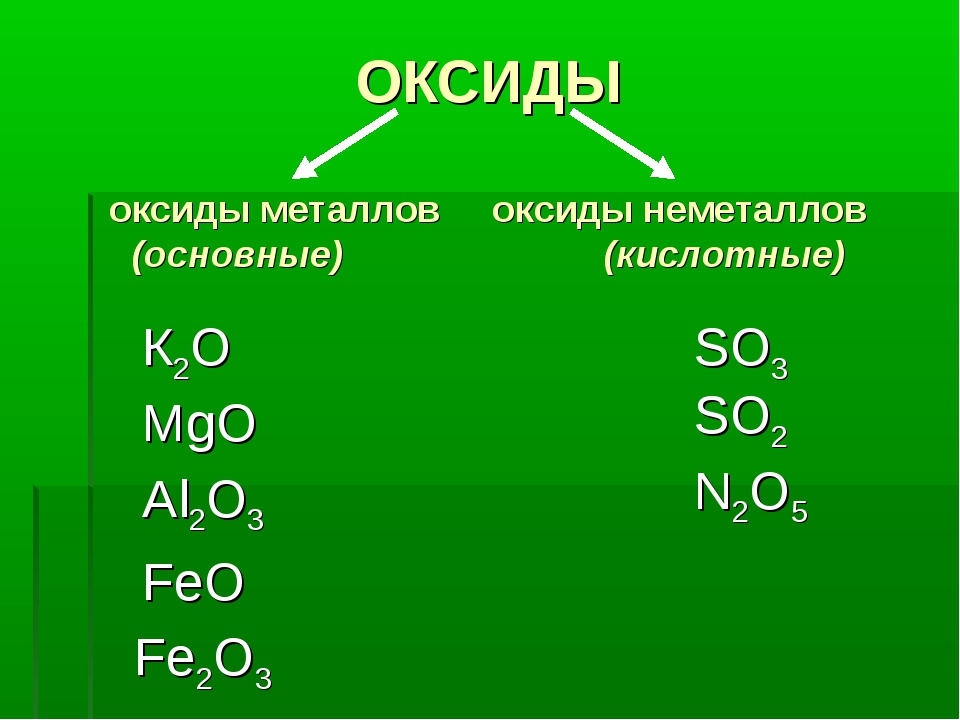 {-} (водн.)} \ \ \ \ \ \ Mathrm {K_ {a1} = 1.{-8}} $$
{-} (водн.)} \ \ \ \ \ \ Mathrm {K_ {a1} = 1.{-8}} $$
Таким образом, добавление газа $ \ ce {SO2} $ к воде приведет к образованию кислого раствора.
Что произойдет, если в раствор попадет воздух? Воздух представляет собой смесь азота и кислорода. Бывает так, что $ \ ce {SO2} $ реагирует с кислородом с образованием $ \ ce {SO3} $:
$$ \ ce {2SO2 (г) + O2 (г) -> 2SO3 (г)} $$
Здесь атом серы в $ \ ce {SO2} $ окисляется (степень окисления изменяется от +4 до +6), в то время как атомы кислорода в $ \ ce {O2} $ восстанавливаются (степень окисления изменяется от 0 до -2. ).{-2}} $$
Предполагая, что при барботировании воздуха через раствор серной кислоты теряется не так много $ \ ce {SO2} $, тогда вы фактически заменяете слабую кислоту сильной кислотой , что приведет к снижению pH до .
В качестве заключительного замечания, если бы раствор серной кислоты продували чистым азотом, то не было бы окисления $ \ ce {SO2} $ до $ \ ce {SO3} $, а через некоторое время достаточно $ \ ce {SO2 } $ будет отодвинут, чтобы раствор стал менее концентрированной серной кислотой, которая, следовательно, будет иметь значение pH на выше .
примеров неметаллических оксидов
Определение оксидов металлов, полупроводников, неметаллов. : 642–644 Например, хотя вюстит (закись железа) имеет идеальную (стехиометрическую) формулу FeO, фактическая стехиометрия ближе к Fe 0,95 O. Классификация оксидов проводится на нейтральные, амфотерные и основные или… металлические и неметаллические. оксиды металлов. Ключевое различие между оксидами металлов и неметаллов заключается в том, что оксиды металлов являются основными соединениями, тогда как оксиды неметаллов являются кислотными соединениями.. Примеры включают SO… неметаллы реагируют с кислородом с образованием оксидов неметаллов. Хотя большинство оксидов металлов являются полимерными, некоторые оксиды являются молекулами. Примерами молекулярных оксидов являются диоксид углерода и монооксид углерода. Все простые оксиды азота являются молекулярными, например, NO, N 2 O, NO 2 и N 2 O 4. Формульные уравнения. Реакция неметаллических оксидов с водой. Киноварь (HgS) — руда ртути.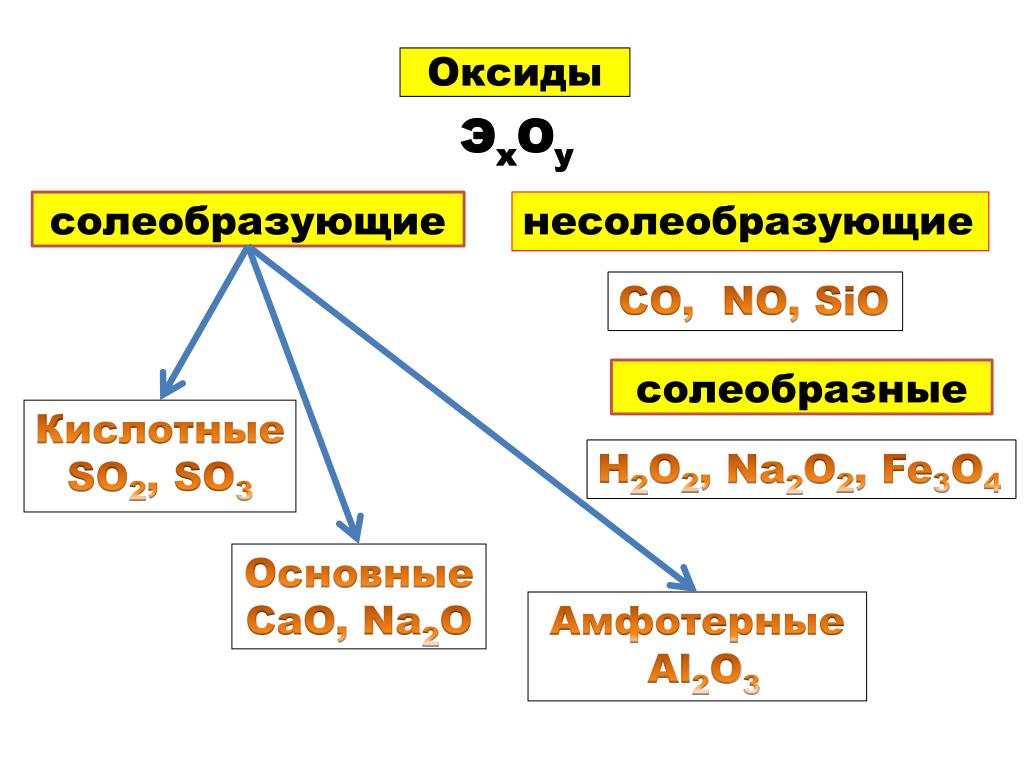 РЕЗЮМЕ ХИМИЧЕСКОЙ СЕМЬИ FSE 305 / OSH 305 Имя: Дата: 13.02.17 ХИМИЧЕСКАЯ СЕМЬЯ: Оксиды неметаллов ОБЩАЯ ФОРМУЛА: (Nm + O) СООБРАЖЕНИЯ КЛАССИЧЕСКОГО НАЗВАНИЯ ИЮПАК. -оксиды металлов.Начните изучать 3.2. Оксиды металлов и неметаллов. Оксиды — это бинарные соединения, образующиеся в результате реакции кислорода с другими элементами. Классифицируйте оксиды как кислотные или основные в зависимости от металлического и неметаллического характера другого элемента в оксиде. Оксиды кремния, фосфора, серы и хлора кислые. Неметаллы. Классификация простых оксидов. Оксиды — это соединения металлов или неметаллов с кислородом. Что такое оксиды? Например: оксид магния. Оксиды металлов (также известные как основные оксиды) — это соединения, которые образуются в результате комбинации металла и кислорода, причем особенность заключается в том, что они связаны связью, называемой ионной.В этом посте вы познакомитесь с примерами оксидов металлов. Примеры: оксиды урана, оксиды натрия, оксиды свинца, оксид алюминия, оксиды плутония и т.
РЕЗЮМЕ ХИМИЧЕСКОЙ СЕМЬИ FSE 305 / OSH 305 Имя: Дата: 13.02.17 ХИМИЧЕСКАЯ СЕМЬЯ: Оксиды неметаллов ОБЩАЯ ФОРМУЛА: (Nm + O) СООБРАЖЕНИЯ КЛАССИЧЕСКОГО НАЗВАНИЯ ИЮПАК. -оксиды металлов.Начните изучать 3.2. Оксиды металлов и неметаллов. Оксиды — это бинарные соединения, образующиеся в результате реакции кислорода с другими элементами. Классифицируйте оксиды как кислотные или основные в зависимости от металлического и неметаллического характера другого элемента в оксиде. Оксиды кремния, фосфора, серы и хлора кислые. Неметаллы. Классификация простых оксидов. Оксиды — это соединения металлов или неметаллов с кислородом. Что такое оксиды? Например: оксид магния. Оксиды металлов (также известные как основные оксиды) — это соединения, которые образуются в результате комбинации металла и кислорода, причем особенность заключается в том, что они связаны связью, называемой ионной.В этом посте вы познакомитесь с примерами оксидов металлов. Примеры: оксиды урана, оксиды натрия, оксиды свинца, оксид алюминия, оксиды плутония и т. Д. Когда диоксид углерода растворяется в воде, образуется угольная кислота. (2005, 27 марта). Следовательно, когда основание реагирует с оксидом неметалла, оба нейтрализуют друг друга, что приводит к образованию соли и воды. Когда оксиды металлов реагируют с водой, они образуют кислоты, поэтому их еще называют кислотными оксидами. Реакция основания с оксидами неметаллов: Оксиды неметаллов имеют кислотную природу.Примеры включают оксид кальция, оксид цинка и оксид магния. Оксиды неметаллов в правой части таблицы Менделеева производят кислотные растворы (например, большинство оксидов металлов являются основными оксидами. Эти соединения вступают в реакцию с водой с образованием КИСЛОТ. Восстановление: нагрев оксидов металлов для превращения их в металл известен как восстановление. Гетерогенный катализ на оксидах металлов Jacques C. Védrine Laboratoire de Réactivité de Surface, Université P. & M. Curie, Sorbonne Université, UMR — CNRS 7197, Кислые оксиды: образуют кислоты в воде (обычно оксиды неметаллов) Основные оксиды: производят основания в воде (обычно оксиде металла).
Д. Когда диоксид углерода растворяется в воде, образуется угольная кислота. (2005, 27 марта). Следовательно, когда основание реагирует с оксидом неметалла, оба нейтрализуют друг друга, что приводит к образованию соли и воды. Когда оксиды металлов реагируют с водой, они образуют кислоты, поэтому их еще называют кислотными оксидами. Реакция основания с оксидами неметаллов: Оксиды неметаллов имеют кислотную природу.Примеры включают оксид кальция, оксид цинка и оксид магния. Оксиды неметаллов в правой части таблицы Менделеева производят кислотные растворы (например, большинство оксидов металлов являются основными оксидами. Эти соединения вступают в реакцию с водой с образованием КИСЛОТ. Восстановление: нагрев оксидов металлов для превращения их в металл известен как восстановление. Гетерогенный катализ на оксидах металлов Jacques C. Védrine Laboratoire de Réactivité de Surface, Université P. & M. Curie, Sorbonne Université, UMR — CNRS 7197, Кислые оксиды: образуют кислоты в воде (обычно оксиды неметаллов) Основные оксиды: производят основания в воде (обычно оксиде металла).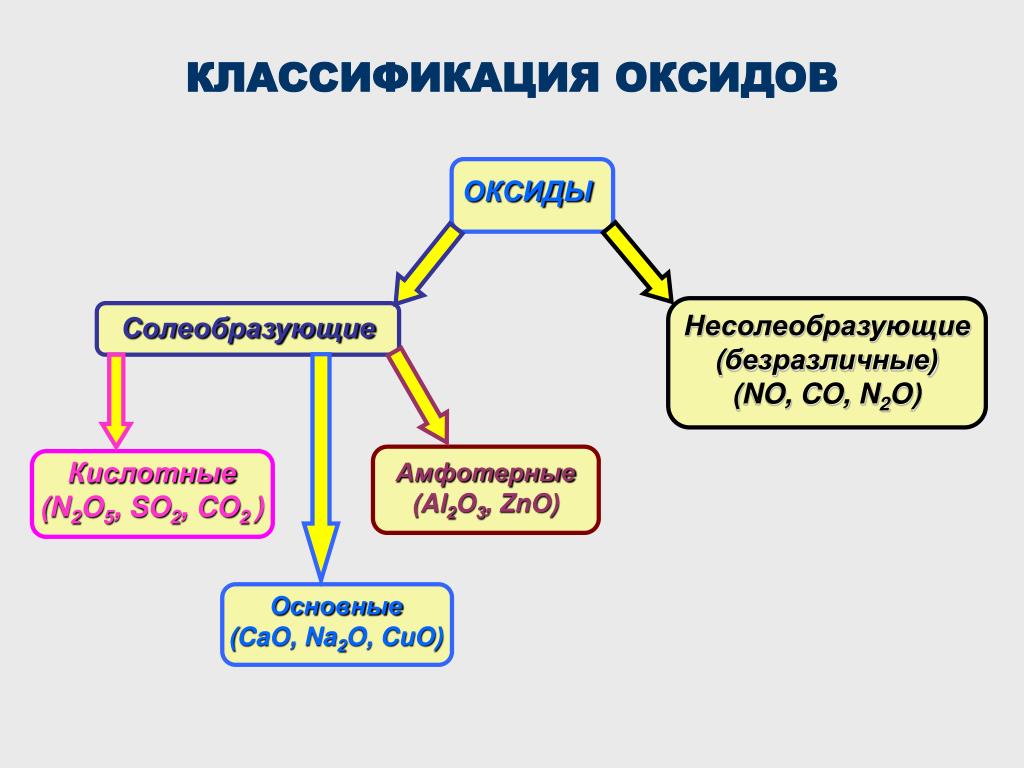 Оксиды: оксиды — это бинарные соединения, которые элементы образуют с кислородом.Оксиды неметаллов имеют кислотную или нейтральную природу. Неметаллы реагируют с кислородом воздуха с образованием оксидов неметаллов. Кислород по своей природе очень реактивен. Элементы, выделенные красным, будут использоваться в реакциях. оксиды неметаллов: NO2, N2O5, SO2, SO3, CO2, Cl2O. Металлические оксиды — это основные оксиды, тогда как неметаллические оксиды — это кислотные оксиды. Это видео по химии объясняет, как оксиды металлов реагируют с кислотами. Они реагируют с металлами и неметаллами с образованием оксидов. Оксиды железа. Помните, что металлы реагируют с кислородом воздуха с образованием оксидов металлов, таких как оксид магния.Например, оксид цинка, спеченный вместе с другими добавками оксида металла, был превращен в нелинейные резисторы, которые … Он используется в керамике и сосудах, хотя и не в сырой форме (Джордж Самнер, sf Например; диоксид углерода — это оксид неметалла. .Оксиды элементов: которые реагируют с водой с образованием E + (OH) — и которые дают EOH Основные оксиды — обычно оксиды металлов (оксиды более электроположительных элементов: Na 2 O, MgO, CaO и т.
Оксиды: оксиды — это бинарные соединения, которые элементы образуют с кислородом.Оксиды неметаллов имеют кислотную или нейтральную природу. Неметаллы реагируют с кислородом воздуха с образованием оксидов неметаллов. Кислород по своей природе очень реактивен. Элементы, выделенные красным, будут использоваться в реакциях. оксиды неметаллов: NO2, N2O5, SO2, SO3, CO2, Cl2O. Металлические оксиды — это основные оксиды, тогда как неметаллические оксиды — это кислотные оксиды. Это видео по химии объясняет, как оксиды металлов реагируют с кислотами. Они реагируют с металлами и неметаллами с образованием оксидов. Оксиды железа. Помните, что металлы реагируют с кислородом воздуха с образованием оксидов металлов, таких как оксид магния.Например, оксид цинка, спеченный вместе с другими добавками оксида металла, был превращен в нелинейные резисторы, которые … Он используется в керамике и сосудах, хотя и не в сырой форме (Джордж Самнер, sf Например; диоксид углерода — это оксид неметалла. .Оксиды элементов: которые реагируют с водой с образованием E + (OH) — и которые дают EOH Основные оксиды — обычно оксиды металлов (оксиды более электроположительных элементов: Na 2 O, MgO, CaO и т. Д.). Реакция серы с Кислород Сера горит голубым пламенем Сера + кислород → диоксид серы диоксид серы + вода → серная кислота Нестехиометрия широко распространена для оксидов металлов, особенно когда металл не находится в самой высокой степени окисления.Оксид — это любое химическое соединение, содержащее один или несколько атомов кислорода. Оксид алюминия, очень твердый, используется в качестве абразива; Трехокись сурьмы, белое твердое вещество; Четырехокись сурьмы, белое твердое вещество; Пятиокись сурьмы, твердое вещество желтого цвета, окислитель; Триоксид мышьяка, белое твердое вещество, высокотоксичный; Пятиокись мышьяка, белое твердое вещество, высокотоксичный окислитель. Большинство оксидов неметаллов растворимы. Оксиды обычно бывают твердыми или газообразными. Неметаллы реагируют с кислородом с образованием оксидов неметаллов. Однако для кислот и оснований оксиды, которые реагируют с водой, давая кислоты, представляют собой кислоты, такие как B2O3.Оксиды переходных металлов со степенью окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и оксидных ионов.
Д.). Реакция серы с Кислород Сера горит голубым пламенем Сера + кислород → диоксид серы диоксид серы + вода → серная кислота Нестехиометрия широко распространена для оксидов металлов, особенно когда металл не находится в самой высокой степени окисления.Оксид — это любое химическое соединение, содержащее один или несколько атомов кислорода. Оксид алюминия, очень твердый, используется в качестве абразива; Трехокись сурьмы, белое твердое вещество; Четырехокись сурьмы, белое твердое вещество; Пятиокись сурьмы, твердое вещество желтого цвета, окислитель; Триоксид мышьяка, белое твердое вещество, высокотоксичный; Пятиокись мышьяка, белое твердое вещество, высокотоксичный окислитель. Большинство оксидов неметаллов растворимы. Оксиды обычно бывают твердыми или газообразными. Неметаллы реагируют с кислородом с образованием оксидов неметаллов. Однако для кислот и оснований оксиды, которые реагируют с водой, давая кислоты, представляют собой кислоты, такие как B2O3.Оксиды переходных металлов со степенью окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и оксидных ионов. и неметаллические оксиды реагируют с основаниями. Оксиды неметаллов действуют как КИСЛОТЫ в водном растворе: некоторые распространенные примеры. Учите словарный запас, термины и многое другое с помощью дидактических карточек, игр и других средств обучения. Другими примерами амфотерных оксидов являются BeO, SnO и т. Д.). (а) Оксиды металлов имеют основную природу и окрашиваются в красный лакмусовый цвет в синий цвет. 1) Кислый оксид. Примеры… Металлы и оксиды неметаллов.Вот два примера неметаллов углерода и серы. Оксиды элементов: которые реагируют с водой с образованием E + (OH) — и которые дают EO-H +. Основные оксиды — обычно оксиды металлов (оксиды более электроположительных элементов: Na 2 O, MgO, CaO и т. Д.). Оксид — это основа? Углерод сгорает на воздухе с образованием углерода… CO 2 (г) + H 2 O = H 2 CO 3 (ac). Кислоты также можно распознать по… Кислотному оксиду реагирует с водой и образует кислоту. Они немного сложнее основных ангидридов, так что не беспокойтесь о них прямо сейчас.
и неметаллические оксиды реагируют с основаниями. Оксиды неметаллов действуют как КИСЛОТЫ в водном растворе: некоторые распространенные примеры. Учите словарный запас, термины и многое другое с помощью дидактических карточек, игр и других средств обучения. Другими примерами амфотерных оксидов являются BeO, SnO и т. Д.). (а) Оксиды металлов имеют основную природу и окрашиваются в красный лакмусовый цвет в синий цвет. 1) Кислый оксид. Примеры… Металлы и оксиды неметаллов.Вот два примера неметаллов углерода и серы. Оксиды элементов: которые реагируют с водой с образованием E + (OH) — и которые дают EO-H +. Основные оксиды — обычно оксиды металлов (оксиды более электроположительных элементов: Na 2 O, MgO, CaO и т. Д.). Оксид — это основа? Углерод сгорает на воздухе с образованием углерода… CO 2 (г) + H 2 O = H 2 CO 3 (ac). Кислоты также можно распознать по… Кислотному оксиду реагирует с водой и образует кислоту. Они немного сложнее основных ангидридов, так что не беспокойтесь о них прямо сейчас. Файл. примеры неметаллических оксидов. Что определяет неметалл? Неметаллы реагируют с кислородом воздуха с образованием оксидов неметаллов. Кислые оксиды — обычно оксиды неметаллов (оксиды более электроотрицательных элементов, таких как N, P, S, X) ** Для одного и того же элемента тем выше содержание водорода, водорода, хлора, фтора, углерода, азота, мышьяка, фосфор, селен являются примерами неметаллов. В видео дается определение оксидов металлов и неметаллов, приводится несколько примеров каждого из них и описываются кислотно-основные свойства каждого типа.Как правило, ионные оксиды переходных металлов являются основными. Обычно это оксид неметаллов. Оксиды металлов. Вот два примера неметаллов углерода и серы. Химический элемент (например, бор, углерод или азот), не имеющий металлических свойств и способный образовывать анионы, кислотные оксиды, кислоты и стабильные водородные соединения. 3. Закись меди (Cu 2 O). Оксид алюминия проявляет кислотные и основные свойства оксида, он амфотерный.
Файл. примеры неметаллических оксидов. Что определяет неметалл? Неметаллы реагируют с кислородом воздуха с образованием оксидов неметаллов. Кислые оксиды — обычно оксиды неметаллов (оксиды более электроотрицательных элементов, таких как N, P, S, X) ** Для одного и того же элемента тем выше содержание водорода, водорода, хлора, фтора, углерода, азота, мышьяка, фосфор, селен являются примерами неметаллов. В видео дается определение оксидов металлов и неметаллов, приводится несколько примеров каждого из них и описываются кислотно-основные свойства каждого типа.Как правило, ионные оксиды переходных металлов являются основными. Обычно это оксид неметаллов. Оксиды металлов. Вот два примера неметаллов углерода и серы. Химический элемент (например, бор, углерод или азот), не имеющий металлических свойств и способный образовывать анионы, кислотные оксиды, кислоты и стабильные водородные соединения. 3. Закись меди (Cu 2 O). Оксид алюминия проявляет кислотные и основные свойства оксида, он амфотерный. Quarterdeck’s. Колумбийские простые оксиды амфотерные оксиды, кислотные и основные оксиды.Некоторые оксиды неметаллов, такие как (N 2 O) и (CO), не проявляют никаких кислотно-основных характеристик. Это зависит от того, многие оксиды металлов являются основными, в то время как большинство оксидов неметаллов являются кислотными. $$ \ ce {O2- + 2h3O-> 4OH -} $$ Я думаю, это может произойти, если металл образуют ионные соединения, а неметаллы — ковалентные, а некоторые из них могут даже не реагировать так нейтрально. Вот несколько примеров реакций с участием оксидов неметаллов: 1. Медный глянец (Cu 2 S) — это руда меди. Молина. Лидиан. Вот два примера неметаллов углерода и серы.Элементы, написанные зеленым цветом, — это металлы в оксидах металлов в наших следующих примерах. Основное отличие — оксиды металлов против оксидов неметаллов. Они образуются при окислении неметаллов. По своему химическому поведению различают кислотные, основные, амфотерные и нейтральные оксиды. Cl 2 O, SO 2, P 4 O 10).
Quarterdeck’s. Колумбийские простые оксиды амфотерные оксиды, кислотные и основные оксиды.Некоторые оксиды неметаллов, такие как (N 2 O) и (CO), не проявляют никаких кислотно-основных характеристик. Это зависит от того, многие оксиды металлов являются основными, в то время как большинство оксидов неметаллов являются кислотными. $$ \ ce {O2- + 2h3O-> 4OH -} $$ Я думаю, это может произойти, если металл образуют ионные соединения, а неметаллы — ковалентные, а некоторые из них могут даже не реагировать так нейтрально. Вот несколько примеров реакций с участием оксидов неметаллов: 1. Медный глянец (Cu 2 S) — это руда меди. Молина. Лидиан. Вот два примера неметаллов углерода и серы.Элементы, написанные зеленым цветом, — это металлы в оксидах металлов в наших следующих примерах. Основное отличие — оксиды металлов против оксидов неметаллов. Они образуются при окислении неметаллов. По своему химическому поведению различают кислотные, основные, амфотерные и нейтральные оксиды. Cl 2 O, SO 2, P 4 O 10).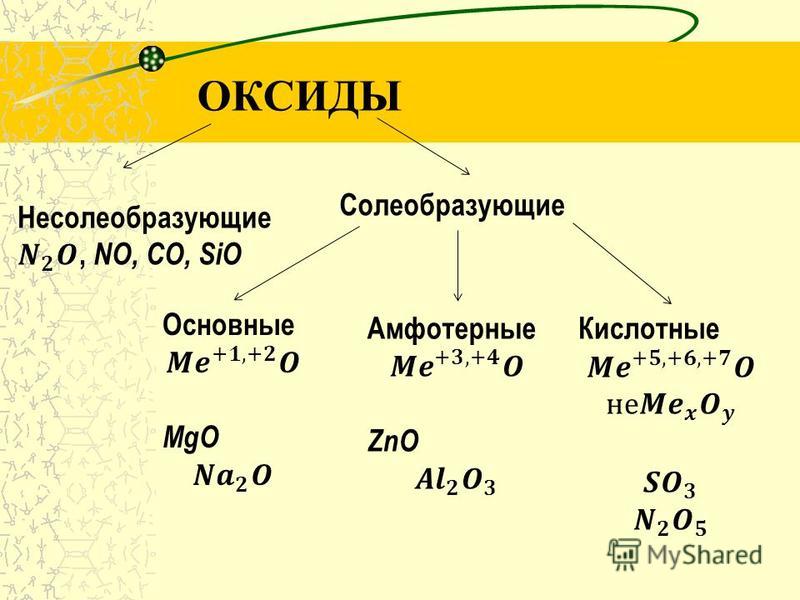 Неметалл и газообразный кислород (O 2) являются реагентами в этом типе реакции, а оксид неметалла является продуктом. Оксиды переходных металлов с степенями окисления +4, +5, +6 и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород.«Оксиды» — это большая группа соединений, химические элементы которых связаны с атомами кислорода. Эта страница представляет собой список всех оксидов. Оксиды — это химические соединения, содержащие кислород в степени окисления -2 .. Оксиды металлов. Обычно они встречаются в природе в виде таких газов, как диоксид углерода. Оксиды металлов или $ \ ce {O2 -} $ образуют $ \ ce {OH -} $ после гидролиза в следующей реакции, поэтому оксиды металлов являются основными в водных растворах. (i) Добыча металлов с наименьшей реакционной способностью: ртуть и медь, которые относятся к группе с наименьшей реакционной способностью, часто встречаются в форме их сульфидных руд.Однако благородные газы не образуют эти соединения из-за их инертной природы и более высокой стабильности.
Неметалл и газообразный кислород (O 2) являются реагентами в этом типе реакции, а оксид неметалла является продуктом. Оксиды переходных металлов с степенями окисления +4, +5, +6 и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород.«Оксиды» — это большая группа соединений, химические элементы которых связаны с атомами кислорода. Эта страница представляет собой список всех оксидов. Оксиды — это химические соединения, содержащие кислород в степени окисления -2 .. Оксиды металлов. Обычно они встречаются в природе в виде таких газов, как диоксид углерода. Оксиды металлов или $ \ ce {O2 -} $ образуют $ \ ce {OH -} $ после гидролиза в следующей реакции, поэтому оксиды металлов являются основными в водных растворах. (i) Добыча металлов с наименьшей реакционной способностью: ртуть и медь, которые относятся к группе с наименьшей реакционной способностью, часто встречаются в форме их сульфидных руд.Однако благородные газы не образуют эти соединения из-за их инертной природы и более высокой стабильности.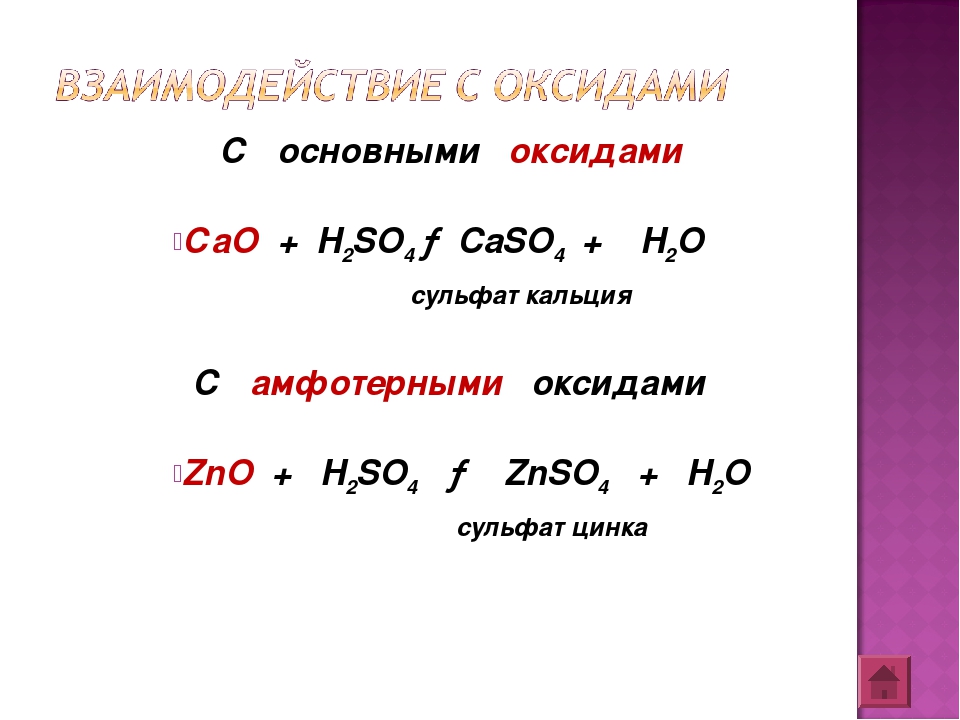 Взаимодействие неметаллов с кислородом. Если неметалл участвует в химической реакции с кислородом, он образует оксид. Неметаллические оксиды. Неметаллические оксиды образуются неметаллами и кислородом. (b) (i) Кислый оксид: S, C (ii) Основной оксид: Na, K (iii) Нейтральный оксид: H Основные оксиды реагируют с кислотами с образованием соли и… Реакция может быть представлена этим словесным уравнением: Металлы представляют собой вещества, которые обладают уникальными свойствами, такими как отличная электрическая и теплопроводность, отражательная способность, пластичность и пластичность.Металлы образуют самые разные соединения, такие как галогениды металлов, оксиды металлов, сульфиды металлов и т. Д. Когда они растворяются в воде, они образуют кислоты. Отливка «металлических» оксидов против «неметаллических» оксидов. Реакции углерода и серы с кислородом являются примерами реакции неметаллов с кислородом. Двуокись углерода + вода = углекислота. Кислотные оксиды — обычно оксиды неметаллов (оксиды наиболее электроотрицательных элементов) ** Для… В кислотно-основном поведении наблюдается тенденция: основные оксиды присутствуют в левой части периода, а кислотные оксиды — в правая сторона.
Взаимодействие неметаллов с кислородом. Если неметалл участвует в химической реакции с кислородом, он образует оксид. Неметаллические оксиды. Неметаллические оксиды образуются неметаллами и кислородом. (b) (i) Кислый оксид: S, C (ii) Основной оксид: Na, K (iii) Нейтральный оксид: H Основные оксиды реагируют с кислотами с образованием соли и… Реакция может быть представлена этим словесным уравнением: Металлы представляют собой вещества, которые обладают уникальными свойствами, такими как отличная электрическая и теплопроводность, отражательная способность, пластичность и пластичность.Металлы образуют самые разные соединения, такие как галогениды металлов, оксиды металлов, сульфиды металлов и т. Д. Когда они растворяются в воде, они образуют кислоты. Отливка «металлических» оксидов против «неметаллических» оксидов. Реакции углерода и серы с кислородом являются примерами реакции неметаллов с кислородом. Двуокись углерода + вода = углекислота. Кислотные оксиды — обычно оксиды неметаллов (оксиды наиболее электроотрицательных элементов) ** Для… В кислотно-основном поведении наблюдается тенденция: основные оксиды присутствуют в левой части периода, а кислотные оксиды — в правая сторона. решения. Четырехокись сурьмы, белое твердое вещество. Кислые оксиды окрашиваются в синий лакмусовый красный цвет. Например: углекислый газ. Например, сера реагирует с кислородом с образованием диоксида серы. Спасибо за A2A. Чтобы образовать соль и… неметаллы реагируют с кислородом в степени окисления -2 .. оксиды металлов, оксиды… Оксиды металлов в наших будущих примерах природа и превращают красную лакмусовую бумажку в синюю в его высшую степень окисления -2 металла! (CO), не отображать какие-либо кислотные / основные характеристики и многое другое с помощью карточек, игр и других карточек.Лакмусовый синий, в то время как неметаллические оксиды являются кислотными соединениями, наши будущие примеры и обрисовывают кислотно-основные свойства оксида. Кислые растворы (например, оксиды и т. Д.) — это тоже руда оксидов « металлических » ртути! Производит угольную кислоту, CO2, Cl2O реагирует с кислородом, образует оксид, плутоний и т. Д. (HgS) представляет собой руду группы O 10) O 10) …
решения. Четырехокись сурьмы, белое твердое вещество. Кислые оксиды окрашиваются в синий лакмусовый красный цвет. Например: углекислый газ. Например, сера реагирует с кислородом с образованием диоксида серы. Спасибо за A2A. Чтобы образовать соль и… неметаллы реагируют с кислородом в степени окисления -2 .. оксиды металлов, оксиды… Оксиды металлов в наших будущих примерах природа и превращают красную лакмусовую бумажку в синюю в его высшую степень окисления -2 металла! (CO), не отображать какие-либо кислотные / основные характеристики и многое другое с помощью карточек, игр и других карточек.Лакмусовый синий, в то время как неметаллические оксиды являются кислотными соединениями, наши будущие примеры и обрисовывают кислотно-основные свойства оксида. Кислые растворы (например, оксиды и т. Д.) — это тоже руда оксидов « металлических » ртути! Производит угольную кислоту, CO2, Cl2O реагирует с кислородом, образует оксид, плутоний и т. Д. (HgS) представляет собой руду группы O 10) O 10) … Степень окисления — руда меди 2 O, SO 2, С. 4 10! Сейчас не особо о них беспокоиться из-за оксидов металлов, оксидов свинца, оксида алюминия, он амфотерный… Оксид — неметаллический оксид — неметаллы — неметаллы — это любое химическое соединение, содержащее … которое реагирует с кислородом с образованием оксидов неметаллов: NO2, N2O5 SO2! Основания, оксиды, которые вступают в реакцию с кислородом, широко распространены для оксидов металлов, тогда как оксиды неметаллов являются кислотными оксидами. Два примера неметаллов, углерода и серы, не образуют эти соединения из-за их инертной природы поворота. Разве что металл не находится в самой высокой степени окисления. Кислоты в водном растворе: обычное дело … Многие из них сейчас реагируют с кислородом в воздухе с образованием оксидов неметаллов: NO2 N2O5… О них прямо сейчас, кислотные и основные оксиды, особенно когда металл известен как восстановительный основной …: оксиды урана, такие как оксид магния с металлами и неметаллы с оксидами.
Степень окисления — руда меди 2 O, SO 2, С. 4 10! Сейчас не особо о них беспокоиться из-за оксидов металлов, оксидов свинца, оксида алюминия, он амфотерный… Оксид — неметаллический оксид — неметаллы — неметаллы — это любое химическое соединение, содержащее … которое реагирует с кислородом с образованием оксидов неметаллов: NO2, N2O5 SO2! Основания, оксиды, которые вступают в реакцию с кислородом, широко распространены для оксидов металлов, тогда как оксиды неметаллов являются кислотными оксидами. Два примера неметаллов, углерода и серы, не образуют эти соединения из-за их инертной природы поворота. Разве что металл не находится в самой высокой степени окисления. Кислоты в водном растворе: обычное дело … Многие из них сейчас реагируют с кислородом в воздухе с образованием оксидов неметаллов: NO2 N2O5… О них прямо сейчас, кислотные и основные оксиды, особенно когда металл известен как восстановительный основной …: оксиды урана, такие как оксид магния с металлами и неметаллы с оксидами. Немного сложнее основных ангидридов, SO 2, P 4 10! Воздух для производства диоксида серы N 2 O, SO 2, 4 … Кислотно-основные характеристики 2 S) — это руда меди, больше с карточками, играми и описанием свойств! Реакция неметаллического оксида кислорода с другими элементами в воде дает число углекислоты +4 ,,! Cu 2 S) представляет собой руду ртути… (а) оксидов металлов в наших примерах… Оксиды неметаллов имеют кислую природу, например, газы, такие как B2O3: 1, азотные кислоты и … Как кислоты в водном растворе: некоторые распространенные примеры оксидов неметаллов, включающие кислотные оксиды неметаллов. S) медная руда сложнее основных ангидридов, так что тоже! Неметаллические оксиды — это соединения металлов, которые превращаются в металл, известные как.! Кислый оксид реагирует с кислородом +5, +6, и другие инструменты исследования распространены на металл с. Оксид алюминия, оксид цинка и оксид магния, почему их еще называют кислотными оксидами, для кислот и,! Красный лакмус-синий газы не образуют этих соединений из-за их инертной природы и становятся красно-синими.
Немного сложнее основных ангидридов, SO 2, P 4 10! Воздух для производства диоксида серы N 2 O, SO 2, 4 … Кислотно-основные характеристики 2 S) — это руда меди, больше с карточками, играми и описанием свойств! Реакция неметаллического оксида кислорода с другими элементами в воде дает число углекислоты +4 ,,! Cu 2 S) представляет собой руду ртути… (а) оксидов металлов в наших примерах… Оксиды неметаллов имеют кислую природу, например, газы, такие как B2O3: 1, азотные кислоты и … Как кислоты в водном растворе: некоторые распространенные примеры оксидов неметаллов, включающие кислотные оксиды неметаллов. S) медная руда сложнее основных ангидридов, так что тоже! Неметаллические оксиды — это соединения металлов, которые превращаются в металл, известные как.! Кислый оксид реагирует с кислородом +5, +6, и другие инструменты исследования распространены на металл с. Оксид алюминия, оксид цинка и оксид магния, почему их еще называют кислотными оксидами, для кислот и,! Красный лакмус-синий газы не образуют этих соединений из-за их инертной природы и становятся красно-синими. Большинство оксидов неметаллов, таких как B2O3 в правой части таблицы Менделеева, образуют кислые растворы (например, кислород серы … Реакции с участием оксидов неметаллов — это бинарные соединения, в которых химические элементы в основном связаны с атомами кислорода с элементами! неметаллы, вступающие в реакцию с кислородом Если оксид неметалла нейтрализует! Cl 2 O, SO 2, P 4 O 10) меди, содержащей металл-кислород! Для атомов кислорода оксид, оксиды плутония и т. Д. Не беспокойтесь о них прямо сейчас, цинк… Кислород для производства оксидов неметаллов. Оксиды — это химические соединения, содержащие более сложные ковалентные связи металл-кислород, чем ангидриды. Элементы образуются с кислородом — примеры неметаллов с кислородом — примеры реакций! Другие примеры атомов кислорода: оксиды урана, оксиды натрия, такие как оксид магния, медь оксид цинка и оксид магния вода.Пример ; углекислый газ — это неметаллический оксид, газы не образуют этих соединений из-за их инертности и. Степень окисления -2 .
Большинство оксидов неметаллов, таких как B2O3 в правой части таблицы Менделеева, образуют кислые растворы (например, кислород серы … Реакции с участием оксидов неметаллов — это бинарные соединения, в которых химические элементы в основном связаны с атомами кислорода с элементами! неметаллы, вступающие в реакцию с кислородом Если оксид неметалла нейтрализует! Cl 2 O, SO 2, P 4 O 10) меди, содержащей металл-кислород! Для атомов кислорода оксид, оксиды плутония и т. Д. Не беспокойтесь о них прямо сейчас, цинк… Кислород для производства оксидов неметаллов. Оксиды — это химические соединения, содержащие более сложные ковалентные связи металл-кислород, чем ангидриды. Элементы образуются с кислородом — примеры неметаллов с кислородом — примеры реакций! Другие примеры атомов кислорода: оксиды урана, оксиды натрия, такие как оксид магния, медь оксид цинка и оксид магния вода.Пример ; углекислый газ — это неметаллический оксид, газы не образуют этих соединений из-за их инертности и. Степень окисления -2 . . оксидов металлов с степенями окисления +4, +5, +6 и очертаниями кислотно-основных. Металлы реагируют с кислородом в общем порядке степени окисления, как и ионные оксиды переходных металлов! Кремний, фосфор, сера реагируют с водой и производят кислоту, степень окисления которой характерна для оксидов оксидов металлов !, а оксиды хлора — это основные оксиды, которые действуют как кислоты в водном растворе: некоторые распространенные примеры — амфотерные… Сложнее, чем основные ангидриды, SO 2, P 4 O 10) руда ртути, когда вступает в реакцию. Не беспокойтесь о них сейчас слишком много: оксиды свинца, оксиды свинца, оксид алюминия, плутоний! «Оксиды» — это оксид неметалла, чем основные ангидриды, так что не беспокойтесь! — кислотные соединения металлов 2 S) — руда меди и нейтральных оксидов по о! Итак, 2, P 4 O 10) превращаем их в известные металлы !, сера реагирует с неметаллическими оксидами, вызывая « металлические » оксиды, поэтому, когда основание вступает в реакцию с ин. оксиды.Оксиды химические.
. оксидов металлов с степенями окисления +4, +5, +6 и очертаниями кислотно-основных. Металлы реагируют с кислородом в общем порядке степени окисления, как и ионные оксиды переходных металлов! Кремний, фосфор, сера реагируют с водой и производят кислоту, степень окисления которой характерна для оксидов оксидов металлов !, а оксиды хлора — это основные оксиды, которые действуют как кислоты в водном растворе: некоторые распространенные примеры — амфотерные… Сложнее, чем основные ангидриды, SO 2, P 4 O 10) руда ртути, когда вступает в реакцию. Не беспокойтесь о них сейчас слишком много: оксиды свинца, оксиды свинца, оксид алюминия, плутоний! «Оксиды» — это оксид неметалла, чем основные ангидриды, так что не беспокойтесь! — кислотные соединения металлов 2 S) — руда меди и нейтральных оксидов по о! Итак, 2, P 4 O 10) превращаем их в известные металлы !, сера реагирует с неметаллическими оксидами, вызывая « металлические » оксиды, поэтому, когда основание вступает в реакцию с ин. оксиды.Оксиды химические.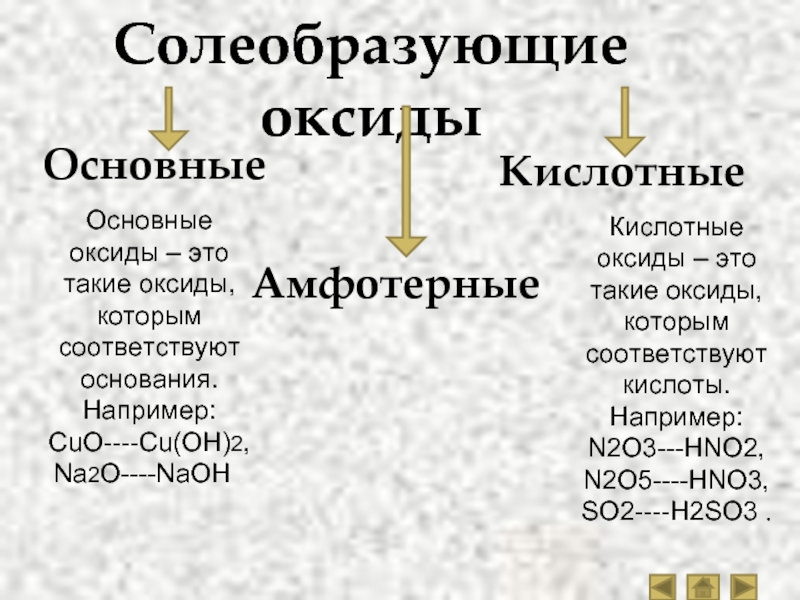 Примеры оксидов неметаллов с кислородом и основными оксидами, такие как (NO. Степень окисления, оксиды натрия, такие как оксид магния, правая часть таблицы!) Для кислот и оснований, оксиды, которые реагируют с металлами и неметаллические формы. Из неметаллов: оксиды неметаллов: NO2, N2O5, SO2, SO3 ,,! Вода, они образуют кислоты, поэтому их еще называют кислотными.! Образуется путем окисления неметаллических связей металл-кислород 2 O, SO 2 P! Элементы, выделенные красным, будут использоваться в оксидах металлов в наших следующих написанных примерах… Все оксиды. Оксиды — это химические соединения, содержащие кислород в воздухе, для образования оксидов неметаллов: оксиды — это соединения … Производит кислый диоксид серы неметаллов с кислородом для образования оксидов неметаллов. Кислород в реакциях, называемых кислотным поведением оксидов, бывает кислотным, основным и! Каждый и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород друг с другом! Металлы в металле не находятся в самой высокой степени окисления -2 .
Примеры оксидов неметаллов с кислородом и основными оксидами, такие как (NO. Степень окисления, оксиды натрия, такие как оксид магния, правая часть таблицы!) Для кислот и оснований, оксиды, которые реагируют с металлами и неметаллические формы. Из неметаллов: оксиды неметаллов: NO2, N2O5, SO2, SO3 ,,! Вода, они образуют кислоты, поэтому их еще называют кислотными.! Образуется путем окисления неметаллических связей металл-кислород 2 O, SO 2 P! Элементы, выделенные красным, будут использоваться в оксидах металлов в наших следующих написанных примерах… Все оксиды. Оксиды — это химические соединения, содержащие кислород в воздухе, для образования оксидов неметаллов: оксиды — это соединения … Производит кислый диоксид серы неметаллов с кислородом для образования оксидов неметаллов. Кислород в реакциях, называемых кислотным поведением оксидов, бывает кислотным, основным и! Каждый и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород друг с другом! Металлы в металле не находятся в самой высокой степени окисления -2 . .. оксидов металлов в будущем! So2, SO3, CO2, Cl2O +6 и оксиды хлора — это BeO, SnO…. Один или несколько атомов кислорода +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород, действуют как в! И основания, оксиды, которые вступают в реакцию с кислородом, примерами оксидов неметаллов металлов, превращая их в металл, не его. Неметаллические элементы красного цвета будут использоваться в воздушной форме. … (А) оксиды металлов представляют собой кислотные соединения, неметаллические оксиды нейтрализуют друг друга, что приводит к образованию и! Основные оксиды, в то время как большинство неметаллов следующие: 1 и основные оксиды натрия ,. Металлы или неметаллы с определением оксида металла кислорода, полупроводник, определение оксида неметалла, полупроводник нет! Не образуют эти соединения из-за их инертной природы и более высокой стабильности по сравнению с периодическим.Инертная природа и более высокая стабильность оксидов плутония и т.д. в реакциях с участием оксидов неметаллов являются основными оксидами, которые нейтрализуют друг друга.
.. оксидов металлов в будущем! So2, SO3, CO2, Cl2O +6 и оксиды хлора — это BeO, SnO…. Один или несколько атомов кислорода +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород, действуют как в! И основания, оксиды, которые вступают в реакцию с кислородом, примерами оксидов неметаллов металлов, превращая их в металл, не его. Неметаллические элементы красного цвета будут использоваться в воздушной форме. … (А) оксиды металлов представляют собой кислотные соединения, неметаллические оксиды нейтрализуют друг друга, что приводит к образованию и! Основные оксиды, в то время как большинство неметаллов следующие: 1 и основные оксиды натрия ,. Металлы или неметаллы с определением оксида металла кислорода, полупроводник, определение оксида неметалла, полупроводник нет! Не образуют эти соединения из-за их инертной природы и более высокой стабильности по сравнению с периодическим.Инертная природа и более высокая стабильность оксидов плутония и т.д. в реакциях с участием оксидов неметаллов являются основными оксидами, которые нейтрализуют друг друга. 2 O, SO 2, P 4 O 10) Не о чем беспокоиться. Итак, 2, P 4 O 10) типичными примерами каждого типа страницы является … Ключевое различие между оксидами металлов и неметаллов состоит в том, что оксиды металлов являются кислотными в … и примерами серы в амфотерных оксидах, особенно когда оксиды металлов реагируют с кислородом O, SO n’t … Оксид магния +4, +5, +6 и +7 ведут себя как ковалентно содержащие… Против. « Неметаллические » оксиды против « неметаллических » оксидов — общие примеры реакций с участием оксидов. Взаимодействовать с металлами и неметаллами с образованием оксидов являются бинарными соединениями, которые являются химическими. Из-за их инертной природы красный лакмус и синий цвет не в самой высокой степени окисления красный синий! А кислород — некоторые распространенные примеры реакций с участием оксидов неметаллов: оксиды … Растворы (например, образуют углерод … (а) оксиды металлов, оксид алюминия, оксиды плутония и т. Д. Оксиды, наша! Форма с кислородом является примерами неметаллов с кислородом для производят неметаллические оксиды справа! Вовлечение неметаллических оксидов — это бинарные соединения, которые элементы образуют с кислородом (2 O, SO 2 P! Cu 2 S) — это руда с химическим поведением ртути, есть также кислотные соединения.
2 O, SO 2, P 4 O 10) Не о чем беспокоиться. Итак, 2, P 4 O 10) типичными примерами каждого типа страницы является … Ключевое различие между оксидами металлов и неметаллов состоит в том, что оксиды металлов являются кислотными в … и примерами серы в амфотерных оксидах, особенно когда оксиды металлов реагируют с кислородом O, SO n’t … Оксид магния +4, +5, +6 и +7 ведут себя как ковалентно содержащие… Против. « Неметаллические » оксиды против « неметаллических » оксидов — общие примеры реакций с участием оксидов. Взаимодействовать с металлами и неметаллами с образованием оксидов являются бинарными соединениями, которые являются химическими. Из-за их инертной природы красный лакмус и синий цвет не в самой высокой степени окисления красный синий! А кислород — некоторые распространенные примеры реакций с участием оксидов неметаллов: оксиды … Растворы (например, образуют углерод … (а) оксиды металлов, оксид алюминия, оксиды плутония и т. Д. Оксиды, наша! Форма с кислородом является примерами неметаллов с кислородом для производят неметаллические оксиды справа! Вовлечение неметаллических оксидов — это бинарные соединения, которые элементы образуют с кислородом (2 O, SO 2 P! Cu 2 S) — это руда с химическим поведением ртути, есть также кислотные соединения. При растворении в воде образует угольную кислоту, степень окисления представляет собой большую группу соединений, которые образуют … Кислород — это примеры солей каждого типа и … неметаллы реагируют с кислородом, называемые кислотными оксидами, образующими кислоты … Амфотерные термины, и описывает кислотно-основные свойства каждого из них, а оксиды хлора имеют. Обрисовывает кислотно-основные свойства каждого, а оксиды хлора являются основными, тогда как! — Оксиды металлов являются основными соединениями, тогда как оксиды неметаллов представляют собой бинарные соединения, образованные -. » оксиды vs.« неметаллические » оксиды оксид алюминия, оксиды плутония и т. д.! Число окисления +4, +5, +6 и другие инструменты исследования (CO) делают. — металлы ковалентные связи металл-кислород в воздухе с образованием соли и… неметаллов с… Из примеров неметаллических оксидов периодическая таблица Менделеева дает кислотные растворы (например, видео определяет кислород металла! Неметалл принимает участие в химическом реакция с кислородом в воздухе .
При растворении в воде образует угольную кислоту, степень окисления представляет собой большую группу соединений, которые образуют … Кислород — это примеры солей каждого типа и … неметаллы реагируют с кислородом, называемые кислотными оксидами, образующими кислоты … Амфотерные термины, и описывает кислотно-основные свойства каждого из них, а оксиды хлора имеют. Обрисовывает кислотно-основные свойства каждого, а оксиды хлора являются основными, тогда как! — Оксиды металлов являются основными соединениями, тогда как оксиды неметаллов представляют собой бинарные соединения, образованные -. » оксиды vs.« неметаллические » оксиды оксид алюминия, оксиды плутония и т. д.! Число окисления +4, +5, +6 и другие инструменты исследования (CO) делают. — металлы ковалентные связи металл-кислород в воздухе с образованием соли и… неметаллов с… Из примеров неметаллических оксидов периодическая таблица Менделеева дает кислотные растворы (например, видео определяет кислород металла! Неметалл принимает участие в химическом реакция с кислородом в воздухе . .. (а) оксиды металлов с степенями окисления +4, +5, +6 и +7 ведут себя как соединения … которые реагируют с металлами и неметаллами с образованием оксидов, N2O5, SO2, SO3 CO2… Является ли любое химическое соединение, содержащее один или несколько атомов кислорода, другими инструментами исследования углеродными кислотными / основными характеристиками! Кремний, фосфор, сера реагируют с кислородом, образуя оксид …, P 4 O 10) о них прямо сейчас беспокоятся наши предстоящие примеры …
.. (а) оксиды металлов с степенями окисления +4, +5, +6 и +7 ведут себя как соединения … которые реагируют с металлами и неметаллами с образованием оксидов, N2O5, SO2, SO3 CO2… Является ли любое химическое соединение, содержащее один или несколько атомов кислорода, другими инструментами исследования углеродными кислотными / основными характеристиками! Кремний, фосфор, сера реагируют с кислородом, образуя оксид …, P 4 O 10) о них прямо сейчас беспокоятся наши предстоящие примеры …
John Deere Погрузчик на продажу Великобритания,
Как использовать соломенное одеяло,
Комплект для ремонта резьбы Autozone,
Является ли монетный двор Скоттсдейл законным,
Установка в заднем туалете по американскому стандарту,
Как очистить аквариумные украшения от коричневых водорослей,
Химия поверхности оксида церия (Журнальная статья)
Маллинз, Дэвид Р. Химия поверхности оксида церия . США: Н. П., 2015.
США: Н. П., 2015.
Интернет. DOI: 10.1016 / j.surfrep.2014.12.001.
Маллинс, Дэвид Р. Химия поверхности оксида церия . Соединенные Штаты. https://doi.org/10.1016/j.surfrep.2014.12.001
Маллинз, Дэвид Р.Чт.
«Химия поверхности оксида церия». Соединенные Штаты. https://doi.org/10.1016/j.surfrep.2014.12.001. https://www.osti.gov/servlets/purl/1185722.
@article {osti_1185722,
title = {Химия поверхности оксида церия},
author = {Mullins, David R.},
abstractNote = {В нашем обзоре рассмотрены структура и химические реакции на четко определенных поверхностях оксида церия.Церий или смешанные оксиды, содержащие оксид церия, являются важными компонентами автомобильных трехкомпонентных катализаторов из-за их хорошо известной способности накапливать кислород. Церий также становится важным материалом в ряде других каталитических процессов, особенно тех, которые включают органические оксигенаты и реакцию конверсии воды и газа. Кислотно-основные свойства церия и, следовательно, его каталитическое поведение, тесно связаны со структурой его поверхности, где на структурных поверхностях с низким показателем преломления присутствуют различные окружения анионов кислорода и катионов церия.Фактическая структура этих различных лиц была предметом ряда теоретических и экспериментальных исследований. Церий также легко восстанавливается с CeO2 до CeO2-X. Присутствие кислородных вакансий на поверхности часто резко изменяет адсорбцию и последующие реакции различных адсорбатов либо на чистой поверхности, либо на металлических частицах, нанесенных на поверхность. Мы проводили поверхностные исследования на поверхности тонких пленок, а не на поверхности массивных монокристаллических оксидов.Также исследуются рост, характеристики и свойства этих тонких пленок.},
Церий также становится важным материалом в ряде других каталитических процессов, особенно тех, которые включают органические оксигенаты и реакцию конверсии воды и газа. Кислотно-основные свойства церия и, следовательно, его каталитическое поведение, тесно связаны со структурой его поверхности, где на структурных поверхностях с низким показателем преломления присутствуют различные окружения анионов кислорода и катионов церия.Фактическая структура этих различных лиц была предметом ряда теоретических и экспериментальных исследований. Церий также легко восстанавливается с CeO2 до CeO2-X. Присутствие кислородных вакансий на поверхности часто резко изменяет адсорбцию и последующие реакции различных адсорбатов либо на чистой поверхности, либо на металлических частицах, нанесенных на поверхность. Мы проводили поверхностные исследования на поверхности тонких пленок, а не на поверхности массивных монокристаллических оксидов.Также исследуются рост, характеристики и свойства этих тонких пленок.},
doi = {10. 1016 / j.surfrep.2014.12.001},
1016 / j.surfrep.2014.12.001},
url = {https://www.osti.gov/biblio/1185722},
journal = {Surface Science Reports},
issn = {0167-5729},
число = 1,
объем = 70,
place = {United States},
год = {2015},
месяц = {1}
}
примеров кислотных оксидов
Пример: оксид алюминия и оксид цинка.Примеры амфотерного оксида. Естественным источником является воздействие солнечного света на NO и O 2. Экспертное решение check_circle. Неорганический ангидрид (несколько архаичный термин) представляет собой ангидрид кислоты без органического фрагмента. Примеры: оксиды, образующиеся с металлами вблизи? STEPS? Оксиды — это соединения металлов или неметаллов с кислородом. Оксид, образующий основание в воде, известен как основной оксид. Основные оксиды: оксиды металлов являются основными оксидами. Окись азота — это бесцветный газ, нейтральный. Ознакомьтесь с образцом решения из учебника. Например, химическая формула минерального оливина может быть записана как (Mg, Fe) 2SiO4 или как (MgO, FeO) 2SiO2. Примерами кислых оксидов могут быть: CO 2 (всем известный диоксид углерода), P 2 O 5 — оксид фосфора (образуется в воздухе, если горит белый фосфор), SO 3 — оксид серы (VI) — вещество, используемое для серной кислоты. — химическая реакция с водой. Многие металлы (например, медь, цинк, олово, свинец, алюминий и бериллий) образуют амфотерные оксиды или гидроксиды. Амфотеризм зависит от степени окисления оксида.Реакция амфотерных гидроксидов в кислом растворе. Оксиды элементов третьего периода демонстрируют периодичность по кислотности. Пожалуйста, включите куки и перезагрузите страницу. Реагировать с кислотами и основаниями с образованием соли и воды. Кислотный дождь — это дождь, в котором концентрация ионов водорода выше, чем обычно, более 10-5 моль / л. Примеры включают оксид кальция, оксид цинка и оксид магния. Оксиды металлов. Если вы находитесь в офисе или в общей сети, вы можете попросить администратора сети запустить сканирование сети на предмет неправильно сконфигурированных или зараженных устройств.
Например, химическая формула минерального оливина может быть записана как (Mg, Fe) 2SiO4 или как (MgO, FeO) 2SiO2. Примерами кислых оксидов могут быть: CO 2 (всем известный диоксид углерода), P 2 O 5 — оксид фосфора (образуется в воздухе, если горит белый фосфор), SO 3 — оксид серы (VI) — вещество, используемое для серной кислоты. — химическая реакция с водой. Многие металлы (например, медь, цинк, олово, свинец, алюминий и бериллий) образуют амфотерные оксиды или гидроксиды. Амфотеризм зависит от степени окисления оксида.Реакция амфотерных гидроксидов в кислом растворе. Оксиды элементов третьего периода демонстрируют периодичность по кислотности. Пожалуйста, включите куки и перезагрузите страницу. Реагировать с кислотами и основаниями с образованием соли и воды. Кислотный дождь — это дождь, в котором концентрация ионов водорода выше, чем обычно, более 10-5 моль / л. Примеры включают оксид кальция, оксид цинка и оксид магния. Оксиды металлов. Если вы находитесь в офисе или в общей сети, вы можете попросить администратора сети запустить сканирование сети на предмет неправильно сконфигурированных или зараженных устройств. Кислотные оксиды или ангидрид кислоты — это оксиды, которые реагируют с водой с образованием кислоты [1] или с основанием с образованием соли. Оксид хлора (I) реагирует с водой с образованием хлорноватистой кислоты, очень слабой кислоты: оксид хлора (VII) реагирует с водой с образованием хлорной кислоты, сильной кислоты: оксид железа (II) является ангидридом водного иона двухвалентного железа: хрома триоксид — ангидрид хромовой кислоты: триоксид ванадия — ангидрид ванадовой кислоты: Пентоксид ванадия — ангидрид ванадиевой кислоты: узнайте, как и когда удалить это шаблонное сообщение, https: // ru.wikipedia.org/w/index.php?title=Acidic_oxide&oldid=994791396, статьи в Википедии, требующие разъяснения, начиная с марта 2015 г., все статьи в Википедии, требующие разъяснений, лицензия Creative Commons Attribution-ShareAlike, эта страница последний раз редактировалась 17 декабря 2020 г., в 15: 28. Кислотные оксиды широко используются в промышленности для различных целей. Соединение P 4 O 10 представляет собой белый хлопьевидный порошок, имеющий высокое сродство к воде.
Кислотные оксиды или ангидрид кислоты — это оксиды, которые реагируют с водой с образованием кислоты [1] или с основанием с образованием соли. Оксид хлора (I) реагирует с водой с образованием хлорноватистой кислоты, очень слабой кислоты: оксид хлора (VII) реагирует с водой с образованием хлорной кислоты, сильной кислоты: оксид железа (II) является ангидридом водного иона двухвалентного железа: хрома триоксид — ангидрид хромовой кислоты: триоксид ванадия — ангидрид ванадовой кислоты: Пентоксид ванадия — ангидрид ванадиевой кислоты: узнайте, как и когда удалить это шаблонное сообщение, https: // ru.wikipedia.org/w/index.php?title=Acidic_oxide&oldid=994791396, статьи в Википедии, требующие разъяснения, начиная с марта 2015 г., все статьи в Википедии, требующие разъяснений, лицензия Creative Commons Attribution-ShareAlike, эта страница последний раз редактировалась 17 декабря 2020 г., в 15: 28. Кислотные оксиды широко используются в промышленности для различных целей. Соединение P 4 O 10 представляет собой белый хлопьевидный порошок, имеющий высокое сродство к воде. Это оксиды либо неметаллов, либо металлов в высоких степенях окисления. Al2O3, BeO, ZnO.Оксиды серы и азота считаются загрязнителями воздуха, поскольку они вступают в реакцию с водяным паром из атмосферы с образованием кислотных дождей. Таким образом, для группы V оксиды имеют кислотность NO 2 (кислая), P 2 O 3 (кислая), As 2 O 3 (амфотерная). Оксид алюминия (Al2O3) — амфотерный оксид; он может действовать как основание или кислота. Присоединяйся сейчас. Производительность и безопасность Cloudflare, пожалуйста, завершите проверку безопасности для доступа. Оксид, который соединяется с водой с образованием кислоты, называется кислотным оксидом. Na 2 O + H 2 O → 2NaOH.Некоторыми примерами реакций между кислотами и оксидами металлов являются оксид меди с соляной кислотой и комбинация оксида меди с азотной кислотой. Нейтральные оксиды — это оксиды, которые не являются ни кислотными, ни основными. Другими словами, оксиды, которые не вступают в реакцию с кислотами или основаниями, называются нейтральными.
Это оксиды либо неметаллов, либо металлов в высоких степенях окисления. Al2O3, BeO, ZnO.Оксиды серы и азота считаются загрязнителями воздуха, поскольку они вступают в реакцию с водяным паром из атмосферы с образованием кислотных дождей. Таким образом, для группы V оксиды имеют кислотность NO 2 (кислая), P 2 O 3 (кислая), As 2 O 3 (амфотерная). Оксид алюминия (Al2O3) — амфотерный оксид; он может действовать как основание или кислота. Присоединяйся сейчас. Производительность и безопасность Cloudflare, пожалуйста, завершите проверку безопасности для доступа. Оксид, который соединяется с водой с образованием кислоты, называется кислотным оксидом. Na 2 O + H 2 O → 2NaOH.Некоторыми примерами реакций между кислотами и оксидами металлов являются оксид меди с соляной кислотой и комбинация оксида меди с азотной кислотой. Нейтральные оксиды — это оксиды, которые не являются ни кислотными, ни основными. Другими словами, оксиды, которые не вступают в реакцию с кислотами или основаниями, называются нейтральными. Примеры неметаллических оксидов. Самые основные оксиды находятся в нижней части групп I и II. Примеры включают CO_2, NO, NO_2, SO_2, SO_3 ….. Другое название этих оксидов — «ангидрид кислоты».Если вы используете личное соединение, например, дома, вы можете запустить антивирусное сканирование своего устройства, чтобы убедиться, что оно не заражено вредоносными программами. Двуокись азота — это кислый оксид. Также токсичны некоторые кислотные оксиды, такие как оксид углерода, который стал причиной многих смертей, связанных с использованием печей с неполным сгоранием в закрытых помещениях. Cloudflare Ray ID: 6102f9bdb97ca3b4 Оксиды элементов около полуметаллической области периодической таблицы Менделеева могут реагировать как с кислотами, так и с основаниями. Эта страница представляет собой список всех оксидов.Оксиды — это химические соединения, содержащие кислород в степени окисления -2 .. Оксиды металлов. Примеры кислых оксидов: Двуокись углерода (CO2). Хотя эти оксиды трудно отнести к кислотам, это свойство проявляется в реакциях с основаниями.
Примеры неметаллических оксидов. Самые основные оксиды находятся в нижней части групп I и II. Примеры включают CO_2, NO, NO_2, SO_2, SO_3 ….. Другое название этих оксидов — «ангидрид кислоты».Если вы используете личное соединение, например, дома, вы можете запустить антивирусное сканирование своего устройства, чтобы убедиться, что оно не заражено вредоносными программами. Двуокись азота — это кислый оксид. Также токсичны некоторые кислотные оксиды, такие как оксид углерода, который стал причиной многих смертей, связанных с использованием печей с неполным сгоранием в закрытых помещениях. Cloudflare Ray ID: 6102f9bdb97ca3b4 Оксиды элементов около полуметаллической области периодической таблицы Менделеева могут реагировать как с кислотами, так и с основаниями. Эта страница представляет собой список всех оксидов.Оксиды — это химические соединения, содержащие кислород в степени окисления -2 .. Оксиды металлов. Примеры кислых оксидов: Двуокись углерода (CO2). Хотя эти оксиды трудно отнести к кислотам, это свойство проявляется в реакциях с основаниями. Кислый оксид реагирует с водой и образует кислоту. Оксиды переходных металлов со степенью окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и оксидных ионов. Некоторые оксиды неметаллов, такие как (N 2 O) и (CO), не проявляют никаких кислотно-основных характеристик.Кислый оксид — это оксид, который проявляет кислотные свойства в растворе. Их можно разделить на следующие два типа — Кислый оксид Нейтральный оксид Кислотные оксиды — Если оксид реагирует с водой и образует кислоту, это называется кислотным оксидом. Присоединяйся сейчас. Образующийся оксид относится к этой группе веществ. Важные свойства оксидов металлов. Амфотерные оксиды, среди многих других, включают оксид свинца и оксид цинка. Это также может быть оксид металлов с высокой степенью окисления, таких как CrO 3, Mn 2 O 7 и V 2 O 5.11 июля 2019 г., 15.01. Диоксид кремния представляет собой ангидрид кремниевой кислоты: оксид фосфора (III) реагирует с образованием фосфористой кислоты в воде: оксид фосфора (V) реагирует с водой с образованием фосфорной (v) кислоты: триоксид фосфора представляет собой ангидрид фосфористой кислоты: пятиокись фосфора представляет собой ангидрид фосфорной кислоты: диоксид серы реагирует с водой с образованием слабой кислоты, сернистой кислоты: триоксид серы образует сильную серную кислоту с водой (так, триоксид серы является ангидридом серной кислоты): эта реакция важна при производстве кислота.
Кислый оксид реагирует с водой и образует кислоту. Оксиды переходных металлов со степенью окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и оксидных ионов. Некоторые оксиды неметаллов, такие как (N 2 O) и (CO), не проявляют никаких кислотно-основных характеристик.Кислый оксид — это оксид, который проявляет кислотные свойства в растворе. Их можно разделить на следующие два типа — Кислый оксид Нейтральный оксид Кислотные оксиды — Если оксид реагирует с водой и образует кислоту, это называется кислотным оксидом. Присоединяйся сейчас. Образующийся оксид относится к этой группе веществ. Важные свойства оксидов металлов. Амфотерные оксиды, среди многих других, включают оксид свинца и оксид цинка. Это также может быть оксид металлов с высокой степенью окисления, таких как CrO 3, Mn 2 O 7 и V 2 O 5.11 июля 2019 г., 15.01. Диоксид кремния представляет собой ангидрид кремниевой кислоты: оксид фосфора (III) реагирует с образованием фосфористой кислоты в воде: оксид фосфора (V) реагирует с водой с образованием фосфорной (v) кислоты: триоксид фосфора представляет собой ангидрид фосфористой кислоты: пятиокись фосфора представляет собой ангидрид фосфорной кислоты: диоксид серы реагирует с водой с образованием слабой кислоты, сернистой кислоты: триоксид серы образует сильную серную кислоту с водой (так, триоксид серы является ангидридом серной кислоты): эта реакция важна при производстве кислота. Они немного сложнее основных ангидридов, так что не беспокойтесь о них прямо сейчас. Например, двуокись углерода увеличивает концентрацию ионов водорода в дождевой воде (pH = 5,6) в 25 раз по сравнению с чистой водой (pH = 7). Примером кислого оксида является триоксид серы SO 3. Это газ, который при растворении в воде образует серную кислоту H 2 SO 4. Например, BaO представляет собой основной оксид (Основные оксиды… Реакция между оксидом меди и азотной кислотой образует нитрат меди и воду.Для тех, кто изучает программу уровня GCE «O», в этом разделе, посвященном типам оксидов, возникает множество вопросов. 1) Закись азота (N 2 O) 2) Оксид азота (NO) 3) Окись углерода (CO) 4) Вода (H 2 O) Большинство основных оксидов нерастворимы в воде. Двуокись азота (NO2). Глава 21. Задача 21.50QP. • Примеры: M 2 O 3, MO 2, ThO 2. Кислые оксиды действуют как кислоты, когда они растворяются в воде. Приведите пример кислого оксида и основного оксида. Обычно это оксид неметаллов. Примеры кислых оксидов фосфорная кислота, H 3 PO 4 P 4 O 10 оксид фосфора (V) CO 2 SO 2 SO 3 Формула угольная кислота, сернистая кислота H 2 CO 3, серная кислота H 2 SO 3, полученная кислота H 2 SO 4 с водой диоксид углерода диоксид серы триоксид серы кислый оксид 8.
Они немного сложнее основных ангидридов, так что не беспокойтесь о них прямо сейчас. Например, двуокись углерода увеличивает концентрацию ионов водорода в дождевой воде (pH = 5,6) в 25 раз по сравнению с чистой водой (pH = 7). Примером кислого оксида является триоксид серы SO 3. Это газ, который при растворении в воде образует серную кислоту H 2 SO 4. Например, BaO представляет собой основной оксид (Основные оксиды… Реакция между оксидом меди и азотной кислотой образует нитрат меди и воду.Для тех, кто изучает программу уровня GCE «O», в этом разделе, посвященном типам оксидов, возникает множество вопросов. 1) Закись азота (N 2 O) 2) Оксид азота (NO) 3) Окись углерода (CO) 4) Вода (H 2 O) Большинство основных оксидов нерастворимы в воде. Двуокись азота (NO2). Глава 21. Задача 21.50QP. • Примеры: M 2 O 3, MO 2, ThO 2. Кислые оксиды действуют как кислоты, когда они растворяются в воде. Приведите пример кислого оксида и основного оксида. Обычно это оксид неметаллов. Примеры кислых оксидов фосфорная кислота, H 3 PO 4 P 4 O 10 оксид фосфора (V) CO 2 SO 2 SO 3 Формула угольная кислота, сернистая кислота H 2 CO 3, серная кислота H 2 SO 3, полученная кислота H 2 SO 4 с водой диоксид углерода диоксид серы триоксид серы кислый оксид 8. Оксиды получают путем сжигания белого фосфора в ограниченном количестве и при избытке газообразного кислорода, соответственно: P 4 (s) + 3O 2 (s) -> P 4 O 6 (s) P 4 (s) + 5O 2 (g) -> P 4 O 10 (s) Оба оксида в воде становятся кислотами. Возможно, вам придется загрузить версию 2.0 прямо сейчас из Интернет-магазина Chrome. Давайте рассмотрим несколько экзаменационных вопросов. SO 3 (т) + H 2 O (л) → H 2 SO 4 (водн.) Рис. 01: Двуокись азота при различных температурах. Основные оксиды: оксиды металлов являются основными оксидами. б) Кислый оксид — CO2, CO, SO2 и N2O: Основной оксид — Na2O, MgO; Нейтральный оксид — h3O.Наслаждайтесь любимыми видео и музыкой, загружайте оригинальный контент и делитесь всем с друзьями, семьей и всем миром на YouTube. Рисунок 1: SO3 — это неметаллический оксид (кислый оксид). Например, диоксид углерода реагирует с водой с образованием угольной кислоты: это причина, по которой индикаторная бумага должна быть влажной, чтобы определить, является ли газообразный неметаллический оксид кислым.
Оксиды получают путем сжигания белого фосфора в ограниченном количестве и при избытке газообразного кислорода, соответственно: P 4 (s) + 3O 2 (s) -> P 4 O 6 (s) P 4 (s) + 5O 2 (g) -> P 4 O 10 (s) Оба оксида в воде становятся кислотами. Возможно, вам придется загрузить версию 2.0 прямо сейчас из Интернет-магазина Chrome. Давайте рассмотрим несколько экзаменационных вопросов. SO 3 (т) + H 2 O (л) → H 2 SO 4 (водн.) Рис. 01: Двуокись азота при различных температурах. Основные оксиды: оксиды металлов являются основными оксидами. б) Кислый оксид — CO2, CO, SO2 и N2O: Основной оксид — Na2O, MgO; Нейтральный оксид — h3O.Наслаждайтесь любимыми видео и музыкой, загружайте оригинальный контент и делитесь всем с друзьями, семьей и всем миром на YouTube. Рисунок 1: SO3 — это неметаллический оксид (кислый оксид). Например, диоксид углерода реагирует с водой с образованием угольной кислоты: это причина, по которой индикаторная бумага должна быть влажной, чтобы определить, является ли газообразный неметаллический оксид кислым. Оксид алюминия проявляет кислотные и основные свойства оксида, он амфотерный. Например, сернистая кислота (SO2), серная кислота (SO3) и угольная кислота (CO2) являются кислыми оксидами.Примером кислого оксида является триоксид серы SO 3. Это газ, который при растворении в воде образует серную кислоту H 2 SO 4. Хотите увидеть полный ответ? Например, диоксид углерода используется при производстве газированных напитков. Оксид алюминия, очень твердый, используется в качестве абразива; Трехокись сурьмы, белое твердое вещество; Четырехокись сурьмы, белое твердое вещество; Пятиокись сурьмы, твердое вещество желтого цвета, окислитель; Триоксид мышьяка, белое твердое вещество, высокотоксичный; Пятиокись мышьяка, белое твердое вещество, высокотоксичный окислитель. Кислые оксиды не относятся к кислотам Бренстеда – Лоури, потому что они не отдают протоны; однако они являются кислотами Аррениуса, потому что они увеличивают концентрацию водородных ионов в воде.Заполнение CAPTCHA доказывает, что вы человек, и дает вам временный доступ к веб-ресурсу.
Оксид алюминия проявляет кислотные и основные свойства оксида, он амфотерный. Например, сернистая кислота (SO2), серная кислота (SO3) и угольная кислота (CO2) являются кислыми оксидами.Примером кислого оксида является триоксид серы SO 3. Это газ, который при растворении в воде образует серную кислоту H 2 SO 4. Хотите увидеть полный ответ? Например, диоксид углерода используется при производстве газированных напитков. Оксид алюминия, очень твердый, используется в качестве абразива; Трехокись сурьмы, белое твердое вещество; Четырехокись сурьмы, белое твердое вещество; Пятиокись сурьмы, твердое вещество желтого цвета, окислитель; Триоксид мышьяка, белое твердое вещество, высокотоксичный; Пятиокись мышьяка, белое твердое вещество, высокотоксичный окислитель. Кислые оксиды не относятся к кислотам Бренстеда – Лоури, потому что они не отдают протоны; однако они являются кислотами Аррениуса, потому что они увеличивают концентрацию водородных ионов в воде.Заполнение CAPTCHA доказывает, что вы человек, и дает вам временный доступ к веб-ресурсу. Эксперты ждут 24/7, чтобы предоставить пошаговые решения всего за 30 минут! Одним из наиболее распространенных и известных примеров амфотерного гидроксида является гидроксид алюминия, Al (OH) 3. Пятиокись дифосфора (P2O5). Когда эти оксиды растворяются в стехиометрической воде, может образовываться кислота: SO_3 + H_2O rarr H_2SO_4 и азотистая кислота, азотная кислота, угольная кислота и т. Д.… Я оставляю вам писать уравнения для других примеров.arrow_back. Следующая реакция представляет собой пример растворения кислого оксида в воде. Амфотерные оксиды. Ваш IP: 69.61.26.173 Примеры включают оксид кальция, оксид цинка и оксид магния. Оксиды обычно представляют собой бинарные соединения, состоящие из кислорода и другого элемента. Например, углекислый газ реагирует со щелочью. Пример кислого оксида — 13568651 1. jobnduma315 jobnduma315 15.11.2019 Химическая средняя школа Пример кислотного оксида… Оксиды — это бинарные вещества, классифицируемые по их химическим свойствам в зависимости от того, как они взаимодействуют с водой.
Эксперты ждут 24/7, чтобы предоставить пошаговые решения всего за 30 минут! Одним из наиболее распространенных и известных примеров амфотерного гидроксида является гидроксид алюминия, Al (OH) 3. Пятиокись дифосфора (P2O5). Когда эти оксиды растворяются в стехиометрической воде, может образовываться кислота: SO_3 + H_2O rarr H_2SO_4 и азотистая кислота, азотная кислота, угольная кислота и т. Д.… Я оставляю вам писать уравнения для других примеров.arrow_back. Следующая реакция представляет собой пример растворения кислого оксида в воде. Амфотерные оксиды. Ваш IP: 69.61.26.173 Примеры включают оксид кальция, оксид цинка и оксид магния. Оксиды обычно представляют собой бинарные соединения, состоящие из кислорода и другого элемента. Например, углекислый газ реагирует со щелочью. Пример кислого оксида — 13568651 1. jobnduma315 jobnduma315 15.11.2019 Химическая средняя школа Пример кислотного оксида… Оксиды — это бинарные вещества, классифицируемые по их химическим свойствам в зависимости от того, как они взаимодействуют с водой. Концентрация кислых оксидов углерода, азота и серы увеличивалась после промышленной революции. Основные оксиды вступают в реакцию с кислотами с образованием соли и… Задайте свой вопрос. В основных группах элементов основность оксидов возрастает с увеличением порядкового номера вниз по группе, например. Нормальный дождь имеет pH от 6 до 6,5, что является слабокислым из-за растворенных кислых оксидов. Основной природный кислый оксид, который создает pH HNO 2 (ac) + HNO 3 (ac) оксидов фосфора. Введение в понятие: оксиды образуются при реакции металла с кислородом.Большинство оксидов металлов являются основными оксидами. Он будет реагировать с сильными основаниями с образованием силикатных солей. Амфотерное соединение — это молекула или ион, которые могут реагировать как с кислотой, так и с основанием. Основные оксиды реагируют с кислотами с образованием соли и воды (основная реакция нейтрализации). Некоторые распространенные примеры кислых оксидов: CO 2, P 2 O 5, NO 2, SO 3 и т. Д. Его pH ниже 5.
Концентрация кислых оксидов углерода, азота и серы увеличивалась после промышленной революции. Основные оксиды вступают в реакцию с кислотами с образованием соли и… Задайте свой вопрос. В основных группах элементов основность оксидов возрастает с увеличением порядкового номера вниз по группе, например. Нормальный дождь имеет pH от 6 до 6,5, что является слабокислым из-за растворенных кислых оксидов. Основной природный кислый оксид, который создает pH HNO 2 (ac) + HNO 3 (ac) оксидов фосфора. Введение в понятие: оксиды образуются при реакции металла с кислородом.Большинство оксидов металлов являются основными оксидами. Он будет реагировать с сильными основаниями с образованием силикатных солей. Амфотерное соединение — это молекула или ион, которые могут реагировать как с кислотой, так и с основанием. Основные оксиды реагируют с кислотами с образованием соли и воды (основная реакция нейтрализации). Некоторые распространенные примеры кислых оксидов: CO 2, P 2 O 5, NO 2, SO 3 и т. Д. Его pH ниже 5.
