| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Урок №13.
 Массовая доля химического элемента в соединении
Массовая доля химического элемента в соединении
Массовая для элемента в данном
веществе (w) – отношение
относительной атомной массы данного элемента, умноженной на число его атомов в
молекуле к относительной молекулярной массе вещества.
w(элемента) |
где
w – массовая доля элемента в
веществе,
n– индекс в
химической формуле,
Ar–
относительная атомная масса,
Mr–
относительная молекулярная масса вещества.
Массовые
доли выражают в процентах или в долях:
w(элемента)
= 20% или 0,2.
АЛГОРИТМ РЕШЕНИЯ
Вычислите массовые доли элементов в фосфорной кислоте,
имеющей простейшую химическую формулу H3PO4, с точностью
до сотых.
Дано: Фосфорная H3PO4 | Решение: 1. Ar(H)=1 2. Вычисляем относительную молекулярную массу соединения Mr(H3PO4) 3. Вычисляем массовые доли элементов по формуле: w(элемента) = (n· Ar(элемента) w(H) = n(H)·Ar(H)·100% / w(P) = n(P)·Ar(P)·100% / w(O) = n(O)·Ar(O)·100% / Проверка Сумма значений массовых долей всех элементов должна Подставляем значения, 3,06% + 31,63% + 65,31% = 100% Таким образом, массовые доли элементов в фосфорной |
Найти: w%(H) w%(P) w%(O) | Ответ: w(H) = 3,06% w(P) = 31,63% w(O) = 65,31% |
РАБОТА С ТРЕНАЖЁРАМИ
Тренажёр 1
Тренажёр 2
Химический «калькулятор» (вычисление относительных молекулярных масс)
Друзья! Я, конечно, уверен, что вы сможете вычислить относительную молекулярную массу любого соединения и без помощи данного калькулятора. Для этого нужно лишь иметь под рукой таблицу Менделеева.
Напомню, что в данной таблице рядом с символом элемента и его порядковым номером всегда указывается относительная атомная масса (Ar). Например, атомная масса углерода приближенно равна 12, Ar(O) = 16, Ar(Pb) = 207. Внимание: атомная масса хлора округляется до 35,5!
Из атомов складываются молекулы, а из относительных атомных масс — относительные молекулярные массы (Mr).
Пример 1. Молекула H2S состоит из 3 атомов: двух атомов водорода и одного атома серы. Отн. молек. масса сероводорода = 2Ar(H) + Ar(S) = 2 + 32 = 34.
Пример 2. Молекула H3PO4 состоит из 8 атомов: трех атомов водорода, одного атома фосфора и четырех атомов кислорода. Mr(H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3 + 31 + 64 = 98.
Вот, собственно, и вся «наука»! Осталось лишь напомнить, что молярная масса вещества (в г/моль) ЧИСЛЕННО равна его относительной молекулярной массе. Например, в задаче 2 мы вычислили Mr фосфорной кислоты (98). Молярная масса этого вещества = 98 г/моль. M(Cl2) = 71 г/моль, M(NO2) = 46 г/моль и т. д.
Если вы решаете задачу, в которой необходимо вычислять молярные массы многих соединений, да еще каждое из них состоит из большого числа атомов, «ручной» расчет Мr становится утомительным. Вот здесь и можно воспользоваться данным калькулятором. Все элементарно: в левой колонке выбираем символ соответствующего элемента, в правой — количество атомов данного элемента в молекуле.
Например, если вам нужно вычислить Mr(HClO4), в первой строке выберите Н и 1, во второй — Cl и 1, в третьей — O и 4. Остальные строки оставьте без изменений. Нажимаем кнопку «Вычислить» и получаем результат — 100,5. Это и есть относительная молекулярная масса хлорной кислоты.
Урок 5. закон постоянства состава веществ. химические формулы. относительная атомная и молекулярная массы. массовая доля химического элемента в соединении — Химия — 8 класс
Закон постоянства состава. Относительная атомная и молекулярная массы. Массовая доля элемента
Атомы, как и молекулы обладают своей массой и размером. Массы атомов очень малы и определить ее путём точных измерений очень трудно, а в XVIII веке было невозможно. Большая заслуга в измерении атомных масс химических элементов принадлежит Джону Дальтону и Йенсу Якобу Берцелиусу, которые первыми попытались определить относительную атомную массу химических элементов.
В настоящее время для измерения массы атомов в качестве эталона принята масса одной двенадцатой части массы атома углерода. Массы атомов измеряют в атомных единицах массы. Такую массу называют относительной атомной массой, её условное обозначение взято от двух английских слов: A – atoms, r – relative (Ar). Значения относительных атомных масс можно узнать по периодической системе химических элементов: Ar (O) = 16. Эта запись означает, что относительная атомная масса кислорода равна 16. При вычислениях обычно используют округлённые значения. Относительную атомную массу хлора округлять до целого числа не принято: Ar (Cl) = 35,5.
Для того чтобы узнать массу молекулы необходимо знать ее состав. Вопрос определения качественного и количественного состава вещества являлся очень важным для дальнейшего развития химии как науки. На рубеже XVIII–XIX веков не было приборов, которые бы точно определяли атомы каких элементов входят в состав вещества, в каких соотношениях. Всё это можно было установить только косвенным путём. Французский химик Жозеф Луи Пруст сформулировал закон постоянства состава веществ: «каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав». Этот закон дал возможность описывать состав веществ при помощи уже известных символов – знаков химических элементов.
Французский химик Жозеф Луи Пруст сформулировал закон постоянства состава веществ: «каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав». Этот закон дал возможность описывать состав веществ при помощи уже известных символов – знаков химических элементов.
Известно, что в молекуле воды на два атома водорода приходится один атом кислорода: h3O. Химическая формула воды читается «аш-два-о». В серной кислоте на два атома водорода приходится один атом серы и четыре атома кислорода: h3SO4. Химическая формула серной кислоты читается «аш-два-эс-о-четыре». Условную запись состава вещества называют химической формулой. Знаки химических элементов указывают на качественный состав вещества, а индексы – на количественный состав вещества. Если нужно записать несколько молекул вещества, то используют коэффициенты. Тогда 3 молекулы воды можно записать так: 3h3O.
Зная состав вещества, легко определить и относительную массу молекулы. Она обозначается Mr и рассчитывается как сумма масс всех атомов в молекуле. Рассчитаем, чему равна относительная молекулярная масса водорода. Молекула водорода состоит из двух атомов, поэтому химическая формула водорода h3. Относительная молекулярная масса водорода нам известна, поэтому: Mr (h3) = 2 * Ar (H) = 2 * 1 = 2
Она обозначается Mr и рассчитывается как сумма масс всех атомов в молекуле. Рассчитаем, чему равна относительная молекулярная масса водорода. Молекула водорода состоит из двух атомов, поэтому химическая формула водорода h3. Относительная молекулярная масса водорода нам известна, поэтому: Mr (h3) = 2 * Ar (H) = 2 * 1 = 2
Так же можно рассчитать и относительную молекулярную массу любой молекулы. Например, молекулы сахара: Mr (C12h32O11) = 12 * Ar (C) + 22 * Ar (H) + 11 * Ar (O) = 12 * 12 + 22 * 1 + 11 * 16 = 342
Ещё одной важной количественной характеристикой вещества является массовая доля химического элемента, т.е. отношения массы всех атомов данного химического элемента к массе вещества. Обозначается массовая доля греческой буквой омега – ω, вычисляется по формуле:
Например, в молекуле сероводорода массовая доля водорода составляет 5,9 %, а серы 94,1 %. Как определить состав сероводорода?
По условию задачи в ста атомных единицах массы (аем) 5,9 атомных единиц массы водорода и 94,1 атомная единица массы серы. Для того чтобы определить соотношения количества атомов водорода и серы в 100 единицах аем сероводорода, разделим значение аем каждого химического элемента на величину его относительной атомной массы.
Для того чтобы определить соотношения количества атомов водорода и серы в 100 единицах аем сероводорода, разделим значение аем каждого химического элемента на величину его относительной атомной массы.
Получившиеся величины необходимо привести к целочисленным значениям. Сделаем это, разделив оба числа на меньшее из них.
Эти числа принимаются в качестве индексов в простейшей формуле данного вещества.
x = 2; y = 1
Ответ: формула сероводорода h3S.
Справочный материал:
• Закон постоянства состава: «Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав» (в начале 20 века было установлено существование веществ с переменным составом)
• Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
• Индекс – в химической формуле показывает число атомов данного химического элемента в молекуле данного вещества.
• Химический знак (символ) – условное обозначение химического элемента.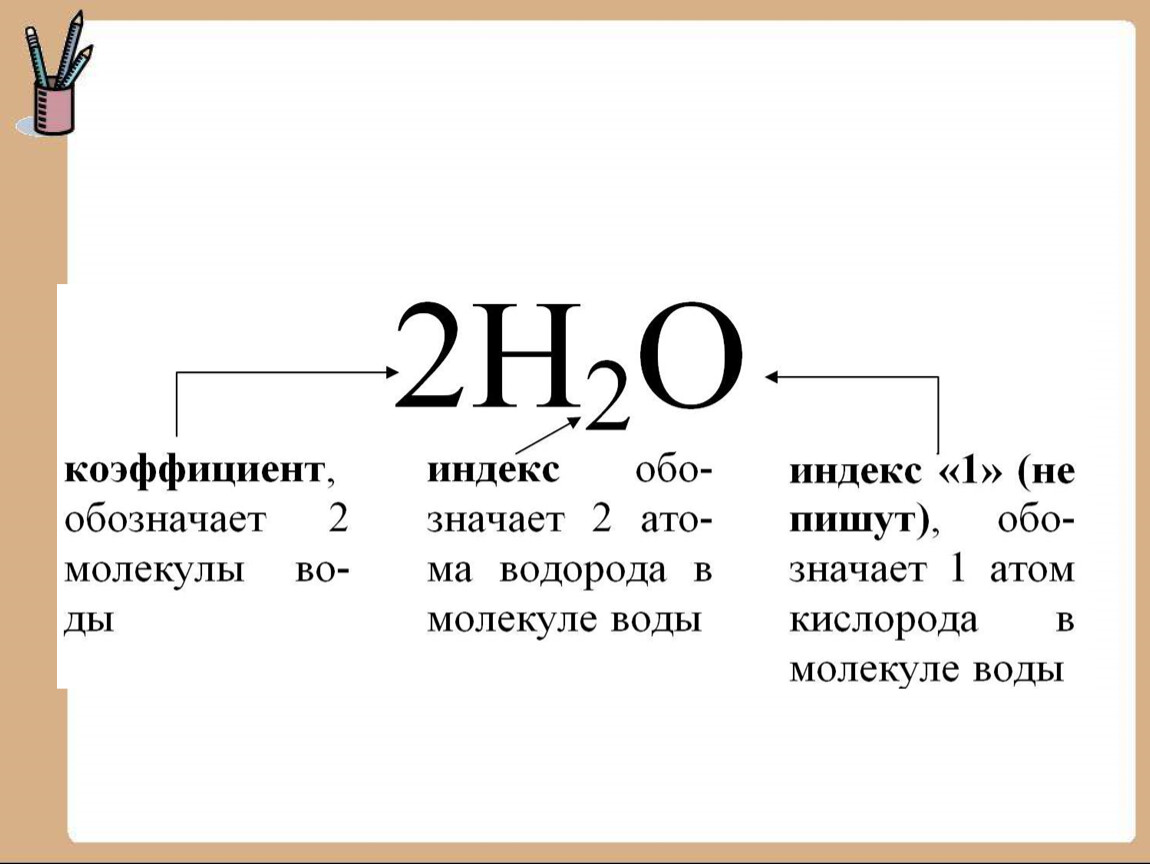 Первая буква (заглавная) его латинского названия. Иногда добавляется вторая буква – одна из последующих, обязательно строчная.
Первая буква (заглавная) его латинского названия. Иногда добавляется вторая буква – одна из последующих, обязательно строчная.
• Относительная атомная масса – это величина, которая показывает, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода. Условное обозначение Ar.
• Относительная молекулярная масса – это величина, которая показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Условное обозначение Mr.
• Массовая доля химического элемента в веществе – это отношение массы атомов определённого химического элемента к массе вещества. Представляет собой количественную характеристику вещества. Обозначается ω [омега].
Вычисление массовой доли элемента или вещества
Как вычислить массовую долю элемента в веществе
Массовая доля элемента ω(Э) % — это отношение массы данного элемента m (Э) во взятой молекуле вещества к молекулярной массе этого вещества Mr (в-ва).
Массовую долю элемента выражают в долях от единицы или в процентах:
ω(Э) = m (Э) / Мr(в-ва) (1)
ω% (Э) = m(Э) · 100%/Мr(в-ва)
Сумма массовых долей всех элементов вещества равна 1 или 100%.
Как правило, для расчетов массовой доли элемента берут порцию вещества, равную молярной массе вещества, тогда масса данного элемента в этой порции равна его молярной массе, умноженной на число атомов данного элемента в молекуле.
Так, для вещества АxВy в долях от единицы:
ω(A) = Ar(Э) · Х / Мr(в-ва) (2)
Из пропорции (2) выведем расчетную формулу для определения индексов (х, y) в химической формуле вещества, если известны массовые доли обоих элементов и молярная масса вещества:
Х = ω%(A) · Mr(в-ва) / Аr(Э) · 100% (3)
Разделив ω% (A) на ω% (В) , т.е. преобразовав формулу (2), получим:
ω(A) / ω(В) = Х · Ar(А) / У · Ar(В) (4)
Расчетную формулу (4) можно преобразовать следующим образом:
Х : У = ω%(A) / Ar(А) : ω%(В) / Ar(В) = X(А) : У(В) (5)
Расчетные формулы (3) и (5) используют для определения формулы вещества.
Если известны число атомов в молекуле вещества для одного из элементов и его массовая доля, можно определить молярную массу вещества:
Mr(в-ва) = Ar(Э) · Х / W(A)
Примеры решения задач на вычисление массовых долей химических элементов в сложном веществе
Пример 1. Определите массовые доли химических элементов в серной кислоте H2SO4 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу серной кислоты:
Mr (H2SO4) = 1 · 2 + 32 + 16 · 4 = 98
2. Вычисляем массовые доли элементов.
Для этого численное значение массы элемента (с учетом индекса) делят на молярную массу вещества:
Учитывая это и обозначая массовую долю элемента буквой ω, вычисления массовых долей проводят так:
ω(Н) = 2 : 98 = 0,0204, или 2,04%;
ω(S) = 32 : 98 = 0,3265, или 32,65%;
ω(О) = 64 : 98 =0,6531, или 65,31%
Пример 2. Определите массовые доли химических элементов в оксиде алюминия Al2O3 и выразите их в процентах._14-1200x800.jpg)
1. Вычисляем относительную молекулярную массу оксида алюминия:
Mr( Al2O3) = 27 · 2 + 16 · 3 = 102
2. Вычисляем массовые доли элементов:
ω(Al) = 54 : 102 = 0,53 = 53%
ω(O) = 48 : 102 = 0,47 = 47%
Как вычислить массовую долю вещества в кристаллогидрате
Массовая доля вещества — отношение массы данного вещества в системе к массе всей системы, т.е. ω(Х) = m(Х) / m,
где ω(X) — массовая доля вещества Х,
m(X) — масса вещества Х,
m — масса всей системы
Массовая доля — безразмерная величина. Её выражают в долях от единицы или в процентах.
Пример 1. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
Молярная масса BaCl2·2H2O составляет:
М(BaCl2·2H2O) = 137+ 2 · 35,5 + 2 · 18 = 244 г/моль
Из формулы BaCl2·2H2O следует, что 1 моль дигидрата хлорида бария содержит 2 моль H2O. Отсюда можно определить массу воды, содержащейся в BaCl2·2H2O:
Отсюда можно определить массу воды, содержащейся в BaCl2·2H2O:
m(h3O) = 2 · 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
ω(H2O) = m(H2O)/m(BaCl2 · 2H2O) = 36 / 244 = 0,1475 = 14,75%.
Пример 2. Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Дано: m(Ag )=5,4 г m = 25 г | Решение Определяем количество вещества серебра, находящегося в аргентите: n(Ag ) = m(Ag) / M(Ag) = 5,4 / 108 = 0,05 моль. Из формулы Ag2S следует, что количество вещества аргентита в два раза меньше количества вещества серебра. Определяем количество вещества аргентита: n(Ag2S) = 0,5 · n(Ag) = 0,5 · 0,05 = 0,025 моль Рассчитываем массу аргентита: m(Ag2S) = n(Ag2S) · М(Ag2S) = 0,025 · 248 = 6,2 г . Теперь определяем массовую долю аргентита в образце горной породы, массой 25 г. ω(Ag2S) = m(Ag2S) / m = 6,2/25 = 0,248 = 24,8%. |
Найти: ω(Ag2S) = ? |
Вместо обычных учебников: виртуальная реальность в образовании
В скором времени технологии VR и AR станут полноценным образовательным инструментом наряду с учебниками, ведь для сегодняшнего поколения школьников этот формат подачи информации становится более интересен и понятен, считают специалисты
Эпидемия коронавируса привлекла внимание людей, вынужденных оставаться дома, к онлайн-образованию и интерактивным инструментам, способным сделать обучение более наглядным, в частности VR/AR-технологиям. В России виртуальная и дополненная реальность уже активно внедряется в детском образовании как важный элемент нацпроектов «Образование» и «Цифровая экономика». Портал «Будущее России. Национальные проекты», оператором которого является ТАСС, узнал у экспертов, ожидает ли российские школы тотальная виртуализация и что государство должно для этого сделать.
В России виртуальная и дополненная реальность уже активно внедряется в детском образовании как важный элемент нацпроектов «Образование» и «Цифровая экономика». Портал «Будущее России. Национальные проекты», оператором которого является ТАСС, узнал у экспертов, ожидает ли российские школы тотальная виртуализация и что государство должно для этого сделать.
Фото: Sk.ru.
Стоит узнать друг друга лучше
Отечественный рынок VR/AR-решений в детском образовании необходимо разделять на проекты в сфере дополнительных и развивающих занятий и решения, претендующие на внедрение в учебные программы на всероссийском уровне, говорит руководитель направления «Виртуальная и дополненная реальность, технологии геймификации» кластера информационных технологий фонда «Сколково» Алексей Каленчук.
Первое направление, по его мнению, сейчас выглядит «более ярким и цветущим». Дело в том, что в сфере дополнительного образования гораздо меньше регуляторных барьеров, мешающих внедрению новых решений, поясняет Каленчук. Кроме того, такие необязательные учебные продукты должны «продавать себя сами», то есть понравиться и ребенку, и родителям. А в-третьих, спрос на различные развивающие занятия, тем более связанные с новыми технологиями, достаточно высок. «Отчасти эта причина побудила не только частные компании, но и государственные детские технопарки (например, сеть «Кванториум») создавать целые программы обучения работы VR/AR на федеральном и региональном уровнях», — считает Каленчук.
Кроме того, такие необязательные учебные продукты должны «продавать себя сами», то есть понравиться и ребенку, и родителям. А в-третьих, спрос на различные развивающие занятия, тем более связанные с новыми технологиями, достаточно высок. «Отчасти эта причина побудила не только частные компании, но и государственные детские технопарки (например, сеть «Кванториум») создавать целые программы обучения работы VR/AR на федеральном и региональном уровнях», — считает Каленчук.
Что касается рынка VR/AR-решений в общенациональной системе детского образования, то он, по словам экспертов, находится в стадии становления и развития. Реализуются пилотные проекты, в том числе с участием медицинских специалистов, которые должны оценить эффект от таких учебных инструментов, найти подходящий сценарий для их масштабирования, исследовать возможные области применения и т.д.
«Постепенно у рынка формируется понимание того, как именно нужно использовать данные технологии в образовании, чтобы раскрыть их преимущества и получить максимальный результат как с точки зрения повышения качества обучения, так и с точки зрения экономической эффективности», — отметил президент НТС VIVE по России, СНГ, странам Балтии и Израилю Андрей Кормильцев.
Так, Центр Национальной технологической инициативы (НТИ) на базе Дальневосточного федерального университета (ДВФУ) по направлению «Нейротехнологии, технологии виртуальной и дополненной реальности» в 2019 году провел большое исследование имеющихся на российском рынке образовательных решений с VR/AR-технологией, рассказала порталу директор по коммуникациям центра Екатерина Филатова. Был создан методологический совет для формирования единого подхода к обучению. В 2020 году продолжается внедрение в отечественных школах VR/AR-решений, а по итогам их использования запланированы большие исследования.
По мнению гендиректора «Ментал Тех» и креативного директора VRTech Артема Коновалова, для массового внедрения VR в этой сфере необходимо разработать методологию переноса школьной программы в виртуальную реальность. То есть, она должна стать полноценной частью образовательного процесса, а не просто игрушкой. Кроме того, школы должны иметь специальное оборудование и VR-классы.
Вероятно, нынешний бум онлайн-обучения, вызванный режимом самоизоляции из-за эпидемии коронавируса, даст существенный толчок развитию образовательных VR/AR-решений. По словам Филатовой, в этом году они пока не так широкого используются в удаленных школьных уроках, однако спрос на интерактивные образовательные инструменты сейчас существенно возрос. Действительно, такие дисциплины, как физика, химия, ОБЖ и история просто созданы для виртуальной реальности: учителю намного удобнее объяснять материал, а ученикам интереснее его усваивать.
По словам Филатовой, в этом году они пока не так широкого используются в удаленных школьных уроках, однако спрос на интерактивные образовательные инструменты сейчас существенно возрос. Действительно, такие дисциплины, как физика, химия, ОБЖ и история просто созданы для виртуальной реальности: учителю намного удобнее объяснять материал, а ученикам интереснее его усваивать.
«С текущим запросом на дистанционное обучение спрос на VR в образовании может увеличиться», — согласен и директор по взаимодействию с вузами Mail.ru Group Сергей Марданов.
Зачем и почему
Пока инструменты VR/AR довольно молодые и не способны заменить традиционное образование, но уже сегодня они могут качественно дополнить образование, сделать его более практико-ориентированным, интересным и доступным. Эксперты из ДВФУ, которые разработали дорожную карту развития VR в России, отмечают, что внедрение этих инструментов не только разнообразит опыт школьников, но и позволит существенно повысить доступность качественного образования. Однако пока готовых образовательных проектов с VR в России не очень много, так как инвестировать в эту отрасль начали относительно недавно, а разработка, тестирование и внедрение продукта занимают значительное время, говорит Кормильцев.
Однако пока готовых образовательных проектов с VR в России не очень много, так как инвестировать в эту отрасль начали относительно недавно, а разработка, тестирование и внедрение продукта занимают значительное время, говорит Кормильцев.
По его словам, сейчас наиболее популярными решениями в образовании являются программно-аппаратные комплексы, позволяющие создавать и «посещать» виртуальные экскурсии, просматривать различные видео в формате 360 градусов. Постепенно на рынке появляются и более сложные решения с большим уровнем интерактивности, которые позволяют провести лабораторные работы по физике и химии в безопасной виртуальной среде или же осознать размеры Вселенной и увидеть созвездия на уроках астрономии.
В 2019 году Центр НТИ на базе ДВФУ совместно с VR/AR-компаниями Modum Lab и STEM Games провели один из первых в России экспериментов, доказывающих эффективность применения VR в образовании.
«Мы готовили к ОГЭ по физике школьников из Москвы и Владивостока при помощи VR и сравнили результаты их и тех сверстников из параллели, кто готовился к экзамену традиционными методами», — рассказывает президент Modum Lab Дмитрий Кириллов.
Оказалось, что результаты тех, кто занимался с помощью VR, в среднем на 13% выше.
В свою очередь, Кормильцев отмечает, что результаты последних исследований использования VR в обучении показали рост концентрации внимания учащихся на 20% при росте переключаемости и восприятия информации на 15%.
При этом одно из существенных преимуществ VR заключается в том, что внутри шлема сложно что-то списать. «Мечта любого экзаменатора», — добавляет Коновалов.
Психологически готовы
Президент Modum Lab отмечает, что 2019 год стал переломным для развития VR/AR в российском детском образовании. Именно в прошлом году правительство наиболее активно заговорило о необходимости перевода образования на цифровые рельсы, перспективе внедрения виртуальной и дополненной реальности в школах и вузах. Тогда стало известно, что в рамках нацпроекта «Образование» 2 тыс. сельских школ в 50 регионах России в 2019/20 учебном году получат в том числе VR-оборудование для создания специальных классов.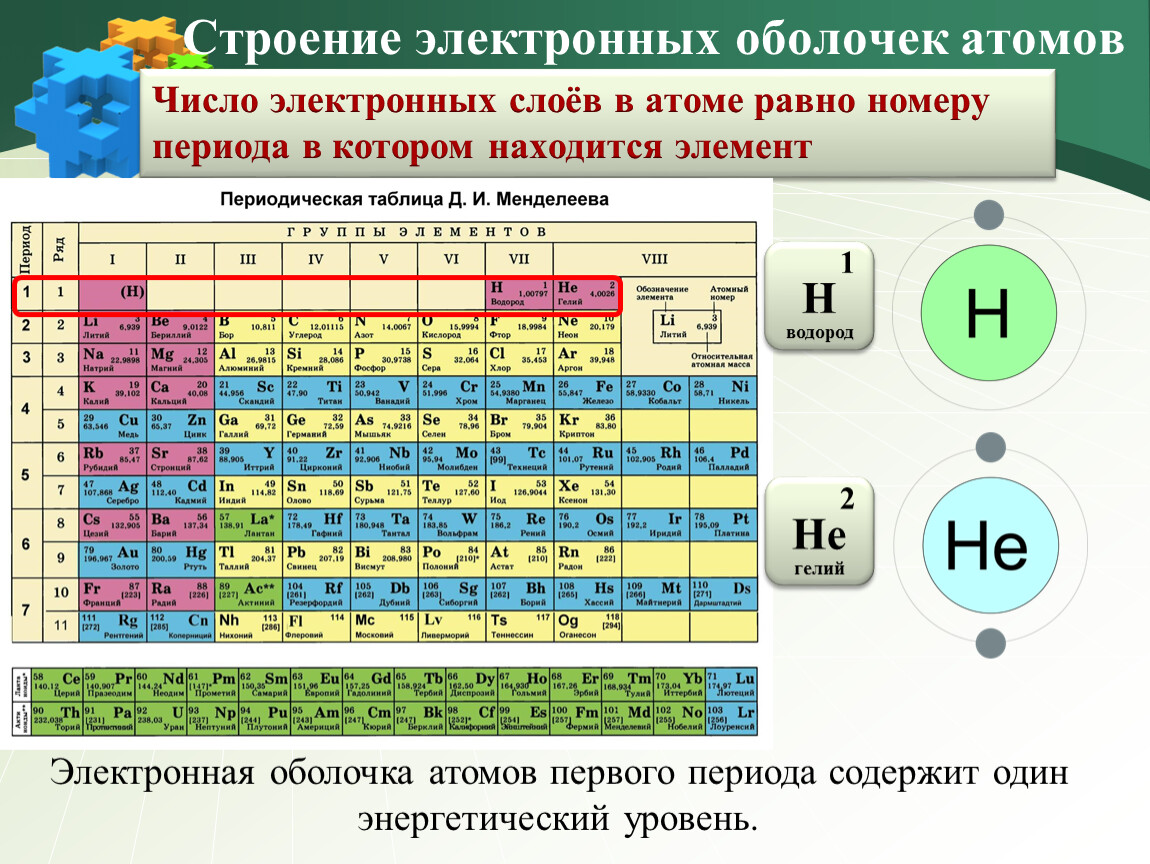 Планируется, что к 2024 году в российских школах будет порядка 16 тыс. VR-классов. Внедрение технологий виртуальной и дополненной реальности в образовательный процесс предусмотрено и нацпроектом «Цифровая экономика».
Планируется, что к 2024 году в российских школах будет порядка 16 тыс. VR-классов. Внедрение технологий виртуальной и дополненной реальности в образовательный процесс предусмотрено и нацпроектом «Цифровая экономика».
«В России сложилось устойчивое понимание необходимости модернизации образования: повышается цифровая грамотность населения, и часто современным детям бывает недостаточно изучать картинки в учебнике и читать скучную теорию», — считает Кириллов.
По его оценке, во многих российских образовательных учреждениях достаточно благоприятная обстановка для внедрения технологичных решений. Например, Кириллов отмечает высокую оснащенность школ оборудованием, позволяющим использовать AR-технологии: интерактивными панелями, планшетами и компьютерами. Постепенно в некоторых школах появляются и VR-шлемы. «С этим, правда, сложнее, так как оборудование дорогостоящее», — добавляет эксперт.
По его мнению, власти видят запрос на цифровизацию со стороны учеников и школ и реагируют на него. Например, в 2019 году Московский центр качества образования закупил у российских разработчиков несколько проектов по разным школьным предметам, в частности по английскому языку, для дальнейшего их масштабирования в столичных школах. Появляются похожие проекты и в регионах. Например, на Дальнем Востоке цифровизацией образования, изучением VR/AR-технологий и их внедрением активно занимается ДВФУ. Кроме того, в рамках госпрограмм VR внедряется и в дополнительное образование: в сети детских технопарков «Кванториум», технологических кружках, на IT-полигонах в школах.
Например, в 2019 году Московский центр качества образования закупил у российских разработчиков несколько проектов по разным школьным предметам, в частности по английскому языку, для дальнейшего их масштабирования в столичных школах. Появляются похожие проекты и в регионах. Например, на Дальнем Востоке цифровизацией образования, изучением VR/AR-технологий и их внедрением активно занимается ДВФУ. Кроме того, в рамках госпрограмм VR внедряется и в дополнительное образование: в сети детских технопарков «Кванториум», технологических кружках, на IT-полигонах в школах.
«Заинтересованность государства и отдельных образовательных структур видна и по активности на тендерных площадках. Еще два года назад запросов на разработку VR/AR-проектов для детей практически не было, а сегодня их десятки», — говорит президент Modum Lab.
Одновременно появляются и специальные образовательные программы для учителей, которые будут работать с новыми технологиями. Кириллов убежден, что VR/AR-технологии достаточно просты в использовании: овладеть VR-шлемом может любой ребенок или взрослый, и учителей их применение пугает довольно редко. Но все же, по опыту эксперта, в Москве и Санкт-Петербурге учителя лучше знакомы с новыми технологиями, нежели в регионах, где пока недостаточно просветительской работы. И здесь, как и в случае с закупкой VR-оборудования, основная проблема заключается в недостаточном финансировании образовательных учреждений.
Но все же, по опыту эксперта, в Москве и Санкт-Петербурге учителя лучше знакомы с новыми технологиями, нежели в регионах, где пока недостаточно просветительской работы. И здесь, как и в случае с закупкой VR-оборудования, основная проблема заключается в недостаточном финансировании образовательных учреждений.
Эксперты уверены, что для развития VR в образовании необходимо создать платформу по управлению контентом. По мнению Кормильцева, взрывным решением, которое могло бы резко увеличить использование технологии виртуальной реальности в образовании, может стать продукт, позволяющий учителям самостоятельно создавать уроки и пользоваться базой уроков, разработанной другими преподавателями. «Мы уверены, что, как только такой инструмент будет внедрен, количество контента резко вырастет и использование шлемов виртуальной реальности станет еще более полезным», — убежден Кормильцев.
Экскурсия по мозгу и уроки ОБЖ
По оценке Центра НТИ ДВФУ, в России сейчас более 15 компаний, разрабатывающих образовательные AR/VR-решения для школ и колледжей.
Например, Modum Lab в 2019 году запустила новое направление Modum Education, в рамках которого специализируется на разработке технологичных решений для школ и университетов. За год был реализовано несколько проектов, в частности в сотрудничестве с HP Inc. в московской школе № 1296 открыт высокотехнологичный образовательный класс с виртуальной реальностью для изучения биологии и физики.
Компания — участница «Сколково» Luden.io еще в начале 2015 года выпустила приложение InMind VR, где в игровой форме можно было путешествовать по мозгу и лечить нейроны, говорит Каленчук.
Другое интересное решение, по мнению Каленчука, представил разработчик VR Concept. Оно позволяет в рамках VR-платформы изучать архитектуру, машиностроение и иные сложные инженерные объекты, в том числе в удаленном и многопользовательском формате обучения.
Компания Rubius совместно с командой ученых и студентов Томского государственного университета создала прототип платформы для сборки образовательных модулей с использованием VR/AR. Пилотный проект предназначен для преподавателей ОБЖ.
Пилотный проект предназначен для преподавателей ОБЖ.
Компания MEL Science развивает продукт MEL Chemistry VR. Он представляет собой систему занятий по химии длительностью от трех до семи минут, где с помощью VR визуализируется сложный материал. Это можно интегрировать в обычный школьный урок.
Издательство цифрового контента «Физикон» в 2018 году выиграло грант Фонда содействия инновациям и получило средства на разработку образовательной среды для проведения в школах занятий с использованием технологий VR/AR. На финальном этапе проекта, который запланирован на 2020 год, будут разработаны трехмерные модели и тематические комплекты для уроков по физике, истории, естествознанию, географии и биологии.
Ученые Государственного университета управления совместно с Британской высшей школой дизайна разрабатывают метод, позволяющий более точно подбирать для школьников сферу профориентации с учетом оценки их реакции на ситуации, созданные при помощи VR. Предполагается, что система будет оценивать не только скорость реакции, но и эмоции ребенка, а также показатели работы мозга. По итогам такого анализа она подскажет, в каких сферах навыки подростка окажутся востребованы больше всего.
По итогам такого анализа она подскажет, в каких сферах навыки подростка окажутся востребованы больше всего.
Проект, направленный на профориентацию, есть и у Mail.ru Group. По словам директора компании по взаимодействию с вузами, совместно с департаментом образования Москвы создана VR-экскурсия по московскому офису Mail.ru Group, в рамках которой можно узнать о востребованных IT-профессиях. «Сейчас мы рассматриваем развитие подобных решений для удаленного присутствия школьников в офисе», — добавляет Марданов.
Виртуализация образования
В среднесрочной перспективе российский рынок VR/AR-решений в образовании будет расти вслед за удешевлением инфраструктуры и повышением спроса, уверен Марданов.
«В глобальном контексте образовательный сегмент решений VR за ближайшие пять лет имеет все шансы вырасти в семь-десять раз», — добавляет Каленчук.
По его словам, на горизонте трех-пяти лет можно будет наблюдать миграцию наиболее эффективных VR/AR-решений из развлекательной сферы и корпоративного обучения в обязательную образовательную программу школ и активный рост числа VR-классов.
Помимо распространения технологий VR/AR непосредственно в образовательных учреждениях вполне вероятен взрывной рост их домашнего применения, добавляет Кормильцев. «Ситуация с коронавирусом заставила всех по-новому оценить возможности удаленной работы, обучения и общения. VR/AR-решения дают возможность дистанционного обучения со значительно более высоким уровнем погружения, что повышает эффективность обучения и делает технологию востребованной», — поясняет он.
Со своей стороны государство для развития этого направления, по мнению экспертов, должно совместно с экспертным сообществом разработать регуляторную базу, экономически стимулировать отечественных разработчиков программного обеспечения для детского образования, сформировать стратегию страны в целом и заниматься активной популяризацией AR/VR-технологий. Кроме того, запуск «цифровых песочниц» и fast track (различные экосистемы для ускоренного развития стартапов, в том числе запускаемые крупным бизнесом) для образовательных решений в AR/VR позволит, по словам Каленчука, существенно (до десяти раз) повысить выживаемость образовательных стартапов.
Эксперты также сходятся во мнении, что отечественное детское образование является сложным, но перспективным сегментом для развертывания AR/VR-проектов. «У России есть все шансы стать мировым лидером в сфере виртуального образования», — резюмирует Артем Коновалов.
Дополненная реальность (AR): технологии, устройства, финансовые перспективы
Технологии дополненной реальности появились относительно недавно, терминология еще не устоялась, подробно об этом говорится в статье «Дополненная, виртуальная и прочие реальности». Википедия дает следующие определения.
Дополненная реальность (augmented reality, AR) — результат введения в поле восприятия любых сенсорных данных с целью дополнения сведений об окружении и улучшения восприятия информации.
Термин «дополненная реальность» предположительно был предложен исследователем корпорации Boeing Томом Коделом (Tom Caudell) в 1990 году.
Существует несколько других определений дополненной реальности. В частности, исследователь Рональд Азума (Ronald Azuma) в 1997 году определил её как систему, которая:
В частности, исследователь Рональд Азума (Ronald Azuma) в 1997 году определил её как систему, которая:
1) совмещает виртуальное и реальное;
2) взаимодействует в реальном времени;
3) работает в 3D.
В концепции Пола Милграма (Paul Milgram) и Фумио Киширо (Fumio Kishino) дополненная реальность является частью смешанной реальности, которую также называют гибридная реальность (hybrid reality).
Эта концепция была предложена еще в 1994 году. Но, начиная с 2016 года, компания Microsoft начала активно использовать термин «смешанная реальность» для продвижения на рынке своего продукта HoloLens. И теперь некоторые эксперты (и поставщики оборудования) подразделяют термины следующим образом:
Дополненная реальность (AR) — проецирование любой цифровой информации (изображения, видео, текст, графика и т.д.) поверх экрана любых устройств. В результате реальный мир дополняется искусственными элементами и новой информацией. Может быть реализована с помощью приложений для обычных смартфонов и планшетов, очков дополненной реальности, стационарных экранов, проекционных устройств и других технологий.
Может быть реализована с помощью приложений для обычных смартфонов и планшетов, очков дополненной реальности, стационарных экранов, проекционных устройств и других технологий.
Смешанная реальность (MR) — проецирование трехмерных виртуальных объектов или голограмм на физическое пространство. Позволяет перемещаться вокруг виртуального объекта, осматривать его со всех сторон и, при необходимости, внутри. Требует, как правило, специального оборудования (очков или шлемов).
Именно этими определениями мы и будем руководствоваться в этой статье; речь в ней пойдет в основном о дополненной реальности.
Как работает технология AR
Общая схема создания дополненной реальности во всех случаях такова: камера устройства AR снимает изображение реального объекта; программное обеспечение (ПО) устройства проводит идентификацию полученного изображения, выбирает или вычисляет соответствующее изображению визуальное дополнение, объединяет реальное изображение с его дополнением и выводит итоговое изображение на устройство визуализации.
Несколько подробнее технологию создания дополненной реальности мы рассмотрим на примере использования ее для диагностики промышленного оборудования или управления им.
Для работы с AR на производстве используется смартфон, планшет или смарт-очки с видеокамерой и соответствующим ПО. Если объектив видеокамеры направлен на объект (единицу оборудования), ПО распознает его или по заблаговременно установленному маркеру, или после анализа формы объекта.
Распознав объект, ПО подключается к трехмерному цифровому двойнику объекта, размещенному на сервере предприятия или в облаке.
Затем устройство AR загружает необходимую информацию и накладывает ее на изображение объекта. В результате сотрудник предприятия видит на экране (или через очки) отчасти физическую реальность, отчасти цифровую. При этом оператор, управляющий данной единицей оборудования, и техник-ремонтник, глядя на один объект, будут видеть разную дополненную реальность, в соответствии с выполняемыми функциями. Ремонтник может видеть данные о наработке или, допустим, рабочей температуре того или иного узла обслуживаемого оборудования. Оператору устройство AR может помогать управлять объектом — посредством сенсорного экрана, голосом или жестами. При движении сотрудника размер и ориентация дисплея AR автоматически корректируются, ненужная информация исчезает, а новая появляется.
Ремонтник может видеть данные о наработке или, допустим, рабочей температуре того или иного узла обслуживаемого оборудования. Оператору устройство AR может помогать управлять объектом — посредством сенсорного экрана, голосом или жестами. При движении сотрудника размер и ориентация дисплея AR автоматически корректируются, ненужная информация исчезает, а новая появляется.
Трехмерная цифровая модель создается либо при помощи САПР (обычно еще на этапе разработки объекта), либо путем оцифровки данной единицы оборудования. Этот цифровой двойник собирает информацию о состоянии объекта, получаемую от него самого, из информационных систем и из внешних источников. С его помощью ПО дополненной реальности масштабирует и точно размещает на изображении объекта или вокруг него актуальные данные.2
Пример использования AR в решении SmartEAM компании IT-Enterprise на предприятии ИНТЕРПАЙП СТАЛЬ
Устройства, реализующие AR
Устройства, способные создавать дополненную реальность, можно разделить на следующие группы.
Мобильные устройства. К ним относятся планшеты, смартфоны, очки и, в перспективе, линзы дополненной реальности.
На планшеты и смартфоны должно быть установлено специализированное ПО. Например, на смартфоны и планшеты можно устанавливать браузеры дополненной реальности, такие как Wikitude, Layar, Blippar, или специальные приложения (в частности, City Lens для Windows Phone). Эти браузеры могут показывать ближайшие к месту нахождения пользователя достопримечательности, магазины, кафе, пункты проката, пункты обслуживания и т.п., а также выполнять другие полезные функции.3
Очки дополненной реальности — это отдельное полноценное устройство, разработанное непосредственно для работы с AR. Они, в большинстве своем, умеют проецировать голограммы и информацию в реальное пространство, но не привязывают их к физическим объектам. Фактически это просто экран перед глазами. Наиболее известны очки Google Glass (в 2018 г. обычным пользователям были доступны версии 2. 0 и 3.0, компаниям — версия 2017-го года, Google Glass Enterprise Edition). С ними конкурируют Vuzix Blade, Epson Moverio, Sony SmartEyeglass. По сравнению с Google Glass эти и другие очки дополненной реальности дешевле и доступнее — обычные пользователи могут купить их на официальных сайтах.
0 и 3.0, компаниям — версия 2017-го года, Google Glass Enterprise Edition). С ними конкурируют Vuzix Blade, Epson Moverio, Sony SmartEyeglass. По сравнению с Google Glass эти и другие очки дополненной реальности дешевле и доступнее — обычные пользователи могут купить их на официальных сайтах.
А вот очки Microsoft HoloLens, Magic Leap One и Meta 2 — это уже очки смешанной реальности, т.е. они позволяют работать с виртуальными объектами, привязанными к реальному миру.4
Линзы для дополненной реальности пока еще остаются технологией будущего. Разработчики стремятся превратить линзы в прозрачный экран, содержащий систему управления, миниатюрную камеру, антенну, светодиоды и другие оптоэлектронные компоненты. В частности, компания Samsung уже подала патент на «умные» контактные линзы, работы в этом направлении ведет и компания Google. Но на рынок подобные устройства выйдут не ранее чем 5–10 лет.5
Стационарные устройства. Это может быть телевизор, экран компьютера, игровой компьютер типа Kinect. На экран телевизора выводится уже дополненное изображение (особенно часто это бывает во время трансляции футбольных и хоккейных матчей), пример для компьютера — карты Google в режиме «Satellite», когда на спутниковый снимок накладываются названия улиц и достопримечательностей. Иногда используются широкоформатные экраны, а также проекционные системы, способные накладывать изображения не только на экраны, но и на любые поверхности.
На экран телевизора выводится уже дополненное изображение (особенно часто это бывает во время трансляции футбольных и хоккейных матчей), пример для компьютера — карты Google в режиме «Satellite», когда на спутниковый снимок накладываются названия улиц и достопримечательностей. Иногда используются широкоформатные экраны, а также проекционные системы, способные накладывать изображения не только на экраны, но и на любые поверхности.
Специальные средства. К ним относятся, например, специализированные шлемы военных пилотов. На стекло шлема выводится необходимая пилоту важная информация, и он может воспринимать ее, не переводя взгляд на приборную панель, экономя тем самым драгоценные секунды. Многие подобные системы позволяют осуществлять целеуказание путём поворота головы или движением глазных яблок пилота. Шлем пилота истребителя пятого поколения F-35 использует настолько современные технологии, что пилот может видеть даже сквозь непрозрачный корпус самолёта. Это самый дорогой шлем в мире — его стоимость превышает 400 тыс. долл. А британские инженеры разработали для военных пилотов шлем с уже встроенной системой ночного видения.6
долл. А британские инженеры разработали для военных пилотов шлем с уже встроенной системой ночного видения.6
На защитном стекле «умного мотошлема» может отображаться скорость мотоцикла, маршрут, текстовые сообщения и многое другое. Похожую технологию используют и для отображения информации на лобовом стекле автомобиля.7
Дополненная реальность в промышленности
Компания Boeing на протяжении последних 20 лет искала систему, способную сократить время на производство кабельных жгутов и устранение ошибок при их изготовлении. Бортовые системы самолетов содержат множество компонентов, связанных между собой проводами и кабелями. Их общая длина в самолёте Боинг-747, например, составляет 250 километров.8 Укладка и соединение проводов производится по специальному шаблону, после чего их скрепляют в жгуты, а на концы кабелей устанавливают разъемы. Такая работа занимает длительное время и чревата ошибками. В начале 2014 г. компания внедрила решение дополненной реальности на платформе очков Google Glass. За счет внедрения технологии AR удалось сократить время производства на 25% и снизить количество ошибок на 50%.9
За счет внедрения технологии AR удалось сократить время производства на 25% и снизить количество ошибок на 50%.9
Компания Lockheed Martin использует технологии дополненной реальности при сборке самолета F-35. В качестве основной платформы используются AR-очки Epson Moverio BT-200, оборудованные датчиками движения и глубины. Когда техник монтирует на шасси деталь тормоза, в очках он видит все данные о том, где и в каком порядке нужно проводить сборку и подсоединять кабели. По данным компании NGRAIN, внедрившей эту систему, программное обеспечение позволяет инженерам работать быстрее на 30% и с точностью до 96%.10 (Стоит отметить, что компания Lockheed Martin с успехом использует также и технологию VR, подробнее об этом говорится в статье «Виртуальная реальность».)
Концерн Fiat Chrysler Automobiles (FCA) применил в своей работе проекционную AR-систему OPS Solutions. Теперь на каждом этапе сборочного процесса рабочие получают наглядную информацию о своем следующем шаге.
Машиностроительное предприятие AGCO (США) в 2015 г. оснастило участки большими дисплеями, на которые выводился трехмерный состав изделий и полный комплект документации, необходимый для быстрой и качественной сборки изделий (тракторов и другой сельскохозяйственной техники). В 2017 г. предприятие перешло на использование очков Google Glass, благодаря чему контроль качества ускорился на 20%.
Портативные виртуальные визуализаторы PVAITV и MibiPV, разработанные специально для инженеров и IT-специалистов, позволяют сканировать оборудование и выявлять ошибки/поломки, которые необходимо устранить. Программа указывает, где находится поврежденный разъем или выдернутый шнур.11
Рабочие General Electric при сборке ветряных турбин на заводе во Флориде связываются с экспертами через очки дополненной реальности, показывают собираемое оборудование в поле зрения и получают ответы на вопросы от специалистов, конструировавших турбины, с помощью тех же очков. Анализ показывает рост производительности на 34% по сравнению с использованием предыдущих технологий сборки оборудования. 12
12
Помимо все более активного применения в промышленности дополненная реальность используется в компьютерных играх, маркетинге (в частности, в уличном маркетинге, когда большой экран с AR выставляется в людном месте), в моде, социальных сетях, медицине и хирургии, туризме, в прессе, музейном деле — и список примеров применения AR постоянно пополняется.13
Финансовые перспективы (AR как J-технология)
По данным консалтинговой фирмы Digi-Capital, в 2017 году инвесторы в США вложили в VR- и AR-стартапы свыше $3 млрд. В итоге рынок значительно превзошел прогнозы. Но вместе с тем рынок VR/AR весьма нестабилен и «разогревается» разовыми крупными сделками, а инвестируют в него в основном венчурные инвесторы. При этом значительный объем средств инвесторов приходится на долю стартапа Magic Leap. За несколько лет проект суперсекретных очков дополненной реальности получил свыше $2 млрд. от компаний Google, Alibaba, Qualcomm и саудовских фондов. В чем причина такой щедрости? Основатель компании Рони Абовитц после ряда исследований пришел к выводу, что мозг использует далеко не все данные, поступающие в него через зрительную систему. Поэтому для новой технологии можно использовать не всё световое поле, а лишь избранные биты информации, которые будут правильно интерпретироваться зрительной корой. И тогда можно избавиться от дисплеев и полагаться непосредственно на глаза пользователей. Так что инвесторы знали, во что вкладывают деньги. Разработка длилась в течение 7 лет, заказы на первые образцы для разработчиков ценой 2295 долл. начали принимать в августе 2018 г.14
Поэтому для новой технологии можно использовать не всё световое поле, а лишь избранные биты информации, которые будут правильно интерпретироваться зрительной корой. И тогда можно избавиться от дисплеев и полагаться непосредственно на глаза пользователей. Так что инвесторы знали, во что вкладывают деньги. Разработка длилась в течение 7 лет, заказы на первые образцы для разработчиков ценой 2295 долл. начали принимать в августе 2018 г.14
Что касается рынка в целом, то он также пока нестабилен. Так, если в июле 2017 г. аналитики компании IDC полагали, что мировой объем продаж товаров и услуг, связанных с технологиями дополненной и виртуальной реальности (AR/VR), с 11,4 млрд. долл. в 2017 году вырастет почти до 215 млрд. долл. в 2021 году и в среднем объем рынка будет ежегодно расти на 113,2%,15 то в 2018 г. их оценки изменились. По новым прогнозам, с 2017-го по 2022 годы мировой рынок технологий дополненной (AR) и виртуальной (VR) реальности будет расти в среднем на 71,6% в год. Итого — 106 млрд. долл. в 2022 г., а не 215 млрд. долл. в 2021 г.16
Итого — 106 млрд. долл. в 2022 г., а не 215 млрд. долл. в 2021 г.16
Аналитики компании Digi-Capital дают несколько иные оценки: к 2020 году стоимость рынка VR составит $30 миллиардов, а AR — $90 миллиардов. Однако Джесси Шелл, генеральный директор Schell Games и профессор Университета Карнеги-Меллон, считает, что это «крайне неверный прогноз». Он полагает, что рынок будет развиваться очень медленно. А значит, стартапам стоит учесть, что суровые времена затянутся на более длительный период, чем планировалось. Шелл считает, что к 2025 году доля прибыли AR составит 15% от дохода рынка VR, то есть примерно $1,1–$3,3 млрд. Рынок дополненной реальности по-прежнему будет небольшим, и его ждут трудности. По словам Шелла, пройдет еще много лет, прежде чем технологии разовьются настолько, чтобы создать очки дополненной реальности, которые не отличались бы от обычных очков.17
Однако Тим Кук, генеральный директор компании Apple, неоднократно заявлял, что AR на данный момент является самой перспективной технологией. По его словам, дополненная реальность — настолько же грандиозная идея, как и создание смартфона. Периодически в сети появляются сведения о работе Apple над очками дополненной реальности, предполагаемая дата выпуска — конец 2019 г.18
По его словам, дополненная реальность — настолько же грандиозная идея, как и создание смартфона. Периодически в сети появляются сведения о работе Apple над очками дополненной реальности, предполагаемая дата выпуска — конец 2019 г.18
Павел Биленко, основатель инженерного центра ТЕКНЕР, считает, что AR — одна из J-технологий с ускоренной диффузией. Скорость диффузии технологий — это время, за которое технологии начинают активно использоваться большинством потребителей. За последние 110 лет скорость диффузии потребительских технологий стремительно росла, и сейчас кривая развития некоторых из них по форме напоминает букву J, т.е. технология за считанные годы после рождения становится ключевым конкурентным преимуществом компании.
Еще один немаловажный факт, говорящий о безусловной перспективности AR — оздание в 2015 году альянса Augmented Reality for Enterprise Alliance (AREA). В этот альянс входят такие крупные компании, как Bosch и Boeing. Цель альянса — бесплатный (для американского рынка) и открытый обмен лучшими практиками, извлеченными уроками и технологическими ресурсами, которые будут помогать предприятиям эффективно внедрять AR. 19 11-го апреля 2017 года объявлено о разработке участниками этого альянса ключевых отраслевых руководящих документов. Документы разрабатывались при содействии UI Labs, Lockheed Martin, Caterpillar и Procter & Gamble.
19 11-го апреля 2017 года объявлено о разработке участниками этого альянса ключевых отраслевых руководящих документов. Документы разрабатывались при содействии UI Labs, Lockheed Martin, Caterpillar и Procter & Gamble.
Ссылки:
1. https://lenta.ru/articles/2017/07/07/ar/
2. https://hbr-russia.ru/innovatsii/tekhnologii/a24121
3. https://i-look.net/news/augmented-reality-browsers.html
4. https://www.unipage.net/ru/p/google_glass_3
5. http://controlengrussia.com/innovatsii/dopolnennaya-real-nost/ar/
6. https://www.prosoft.ru/cms/f/466284.pdf
7. http://tofar.ru/kak-rabotaet-ar.php
8. http://krasvozduh.ru/zavod-boing/
9. https://gigazine.net/gsc_news/en/20160715-boeing-google-glass
10. https://www.popularmechanics.com/flight/a13967/lockheed-martin-augmented-reality-f-35/
11. https://ar-conf.ru/ru/news/razvitie-dopolnennoy-realnosti-v-aviakosmicheskoy-otrasli-34872
12. http://www.forbes.ru/tehnologii/344377-zhizn-v-forme-j-riski-i-vozmozhnosti-uskoreniya-diffuzii-tehnologiy
13. https://augmentedreality.by/example/
https://augmentedreality.by/example/
14. https://adindex.ru/publication/opinion/media/2018/07/9/172599.phtml
15. https://www.cio.ru/articles/050917-Kak-podgotovit-predpriyatiya-k-prihodu-virtualnoy-dopolnennoy-i-smeshannoy-realnosti
16. https://www.osp.ru/news/2018/06/13034605/
17. https://rb.ru/story/vr-ar-2025/
18. https://lenta.ru/articles/2017/07/07/ar/
19. http://www.forbes.ru/tehnologii/344377-zhizn-v-forme-j-riski-i-vozmozhnosti-uskoreniya-diffuzii-tehnologiy
Как найти относительную массу
Относительная масса — важное понятие в химии. Он существует, чтобы упростить процесс определения массы атома или молекулы. В абсолютных единицах массы протонов и нейтронов составляют порядка 10 — 27 килограммов, что составляет одну миллиардную миллиардную долю миллиардной доли килограмма, а масса электронов еще меньше — около 10 — 30 килограмма, примерно в тысячу раз меньше, чем протон или нейтрон.С этим было бы трудно справиться в практических ситуациях, поэтому ученые определяют относительную атомную массу атома углерода как 12 и рассчитывают все остальное на этой основе.
TL; DR (слишком долго; не читал)
Найдите относительную массу любого атома, прибавив количество протонов к количеству нейтронов. Водород имеет относительную атомную массу 1, а углерод-12 имеет относительную атомную массу 12.
Изотопы одного и того же элемента имеют разное количество нейтронов, поэтому вам нужно рассчитывать для одного конкретного изотопа.Периодические таблицы показывают относительную атомную массу как нижнее число для элемента, но при этом учитываются любые изотопы.
Найдите относительные молекулярные массы, сложив вклад каждого элемента. Используйте химическую формулу, чтобы найти, сколько из каждого атома включено, умножьте их относительные атомные массы на количество атомов каждого присутствующего, а затем сложите их все, чтобы найти результат.
Что такое относительная масса?
Относительная масса — это масса атома или молекулы относительно массы 1/12 атома углерода-12.Согласно этой схеме нейтральный атом водорода имеет массу 1. Вы можете думать об этом, как если бы каждый протон или нейтрон считали за 1 и игнорировали массы электронов, потому что они настолько малы по сравнению с ними. Таким образом, формула для относительной атомной массы проста:
Относительная атомная масса = количество протонов + количество нейтронов
Однако, поскольку ученые установили атом углерода-12 в качестве «стандартного атома», техническое определение таково:
Относительная атомная масса = масса атома ÷ (1/12 массы атома углерода-12)
Относительная атомная масса элемента
Элементы — это атомы основных строительных блоков, созданные в результате Большого взрыва или в результате звезды, и они представлены в периодической таблице.Относительная атомная масса — это нижнее число в периодической таблице (верхнее число — это атомный номер, который подсчитывает количество протонов). Вы можете прочитать это число прямо из упрощенных периодических таблиц для многих элементов.
Однако технически точные периодические таблицы учитывают существование различных изотопов, и указанные в них относительные атомные массы не являются целыми числами. Изотопы — это версии одного и того же элемента с разным количеством нейтронов.
Вы всегда можете найти относительную массу элемента, добавив количество протонов к количеству нейтронов для конкретного изотопа рассматриваемого элемента.Например, атом углерода-12 имеет 6 протонов и 6 нейтронов, поэтому его относительная атомная масса равна 12. Обратите внимание, что когда указан изотоп атома, число после названия элемента является относительной атомной массой. Итак, уран-238 имеет относительную массу 238.
Периодическая таблица и изотопы
Относительные атомные массы в периодической таблице включают вклад различных изотопов путем получения средневзвешенного значения масс различных изотопов на основе их содержания.Хлор, например, имеет два изотопа: хлор-35 и хлор-37. Три четверти хлора, встречающегося в природе, — это хлор-35, а оставшаяся четверть — хлор-37. Формула, используемая для относительных масс в периодической таблице:
Относительная атомная масса = (масса изотопа 1 × содержание изотопа 1 + масса изотопа 2 × содержание изотопа 2 +…) ÷ 100
Итак, для хлора это :
Относительная атомная масса = (35 × 75 + 37 × 25) ÷ 100
= (2,625 + 925) ÷ 100 = 35.5
Для хлора относительная атомная масса в периодической таблице показывает 35,5 в соответствии с этим вычислением.
Относительная молекулярная масса
Просто сложите относительные массы составляющих элементов, чтобы найти относительную массу молекулы. Это легко сделать, если вы знаете относительные атомные массы рассматриваемых элементов. Например, вода имеет химическую формулу H 2 O, поэтому есть два атома водорода и один атом кислорода.
Рассчитайте относительную молекулярную массу, умножив относительную атомную массу каждого атома на количество этих атомов в молекуле, а затем сложив результаты.Это выглядит так:
Относительная молекулярная масса = (количество атомов элемента 1 × относительная масса элемента 1) + (количество атомов элемента 2 × относительная масса элемента 2) +…
Для H 2 O, элемент 1 — водород с относительной атомной массой 1, а элемент 2 — кислород с относительной атомной массой 16, поэтому:
Относительная молекулярная масса = (2 × 1) + (1 × 16) = 2 + 16 = 18
Для H 2 SO 4 элемент 1 — водород (H), элемент 2 — сера (S с относительной массой = 32), а элемент 3 — кислород (O), поэтому тот же расчет дает:
Относительная молекулярная масса H 2 SO 4 = (количество атомов H × относительная масса H) + (количество атомов S × относительная масса S) + (количество атомов O × относительная масса of O)
= (2 × 1) + (1 × 32) + (4 × 16)
Вы можете использовать тот же подход для любой молекулы.
Относительная масса по формуле — Расчеты для всех учащихся — Edexcel — GCSE Combined Science Revision — Edexcel
Атомы имеют очень небольшую массу, поэтому вместо их фактических масс в килограммах используются их относительные атомные массы. Относительная атомная масса элемента, обозначенная как A r , определяется как относительная масса его атомов по сравнению с массой конкретного атома углерода (углерода-12). Значения A r для элементов часто указываются в периодической таблице.Обратите внимание, поскольку A r является мерой относительной массы атомов, она не имеет единиц.
Относительные атомные массы элементов являются мерой пропорциональности. Например, A r для углерода равно 12, а A r для магния равно 24. Это означает, что атомы магния в два раза превышают массу атомов углерода.
Расчет относительной массы по формуле
Относительная формула массы имеет символ M r .Чтобы вычислить M r для вещества:
- вычислите, сколько атомов каждого элемента находится в химической формуле
- сложите вместе значения A r для всех атомов каждого элемента
Например, формула для диоксида углерода: CO 2 . Он имеет один атом углерода ( A r = 12) и два атома кислорода ( A r = 16):
M r CO 2 = 12 + 16 + 16 = 44
Его также можно вычислить следующим образом:
N r CO 2 = (1 × 12) + (2 × 16) = 12 + 32 = 44
Как A r Значения , M r значения также не имеют единиц измерения.
Относительные формулы масс ионных соединений
Ионные соединения, такие как хлорид натрия, не существуют в виде молекул. Однако их относительные формульные массы рассчитываются таким же образом. Используемые формулы являются их эмпирическими формулами.
- Вопрос
Рассчитайте относительную формульную массу, M r , гидроксида кальция, Ca (OH) 2 .
- Показать ответ
( A r из Ca = 40, A r из O = 16, A r из H = 1)
M r = 40 + (2 × 16) + (2 × 1)
= 40 + 32 + 2
= 74
Его также можно вычислить следующим образом:
M r = 40 + 2 × ( 16 + 1)
= 40 + 34 = 74
Относительная формула массы — Вычисления в химии — AQA — Объединенная научная редакция GCSE — AQA Trilogy
Атомы имеют очень маленькую массу, поэтому используются их относительные атомные массы.Относительная атомная масса элемента, символ A r , представляет собой относительную массу его атомов по сравнению с массой атома углерода-12. Значения A r для элементов приведены в периодической таблице. Поскольку A r является мерой относительной массы, у нее нет единиц измерения.
Дополнительные сведения о вычислении относительной атомной массы см. В Руководстве по изучению атомной структуры.
Расчет относительной массы по формуле
Относительная масса по формуле вещества, состоящего из молекул, представляет собой сумму относительных атомных масс атомов в числах, указанных в формуле.
Относительная формула массы обозначена символом M r . Чтобы вычислить M r для вещества:
- вычислите, сколько атомов каждого элемента содержится в химической формуле
- сложите вместе значения A r для всех атомов каждого присутствующего элемента.
Например, формула для диоксида углерода CO 2 . Он состоит из одного атома углерода ( A r = 12) и двух атомов кислорода ( A r = 16):
M r CO 2 = 12 + 16 + 16 = 44
Его также можно вычислить следующим образом:
M r CO 2 = (1 × 12) + (2 × 16) = 12 + 32 = 44
Как A r значения, M r значения — это просто числа.У них нет единиц, потому что это относительных масс.
Относительные формулы масс ионных соединений
Ионные соединения, такие как хлорид натрия, не существуют в виде молекул. Однако их относительные формулы массы вычисляются таким же образом, исходя из чисел, указанных в формуле.
Рабочий пример
- Вопрос
Рассчитайте относительную формульную массу, M r , гидроксида кальция, Ca (OH) 2 .
( A r из Ca = 40, A r из O = 16, A r из H = 1)
- Показать ответ
M r = 40 + (2 × 16) + (2 × 1)
= 40 + 32 + 2
= 74
Его также можно вычислить следующим образом:
M r = 40 + 2 × ( 16 + 1)
40 + 34 = 74
- Вопрос
Рассчитайте относительную формульную массу, M r , нитрата магния, Mg (NO 3 ) 2 .
( A r из Mg = 24, A r из N = 14, A r из O = 16)
- Показать ответ
M r = 24 + (2 × 14) + (2 × 3 × 16)
= 24 + 28 + 96
= 148
Его также можно вычислить следующим образом:
M r = 24 + 2 × [14 + (16 × 3)]
= 24 + 124
= 148
1.Объясняя и как рассчитать относительную атомную массу RAM или A r
. ВЕРХ СТРАНИЦЫ
(б) Примеры расчета относительной атомной массы
(c) Примеры только для студентов химии продвинутого уровня A Как рассчитать относительную атомную массу с точным относительным На основе данных современных высокоточных масс-спектрометров (a) Очень точный расчет относительной атомной массы Родственник определяется как точная масса одного изотопа
Если бы мы переделали расчет
См. Также Масс-спектрометр и изотопный анализ б) Можно сделать обратное Это включает в себя немного Бор A r Относительная атомная масса
так естественный бор (г. ВЕРХ СТРАНИЦЫ Примечания к редакции о том, как На других страницах Атомная структура и Тесты для самооценки относительной атомной массы введите ответ
ПРИЛОЖЕНИЕ 1.Типичная таблица Менделеева, используемая на предвузовских экзаменах Выше представлена типичная таблица Менделеева, используемая в спецификациях по науке и химии GCSE в и я «обычно» использовал эти значения в своих расчетах на примере, чтобы охватить большинство Примечания к редакции о том, как ВЕРХ СТРАНИЦЫ Примечания: (i) Список относительной атомной массы находится в (ii) Относительные атомные массы указаны с точностью до второго знака после запятой. (iii) Трансурановые элементы были исключены, поскольку (iv) * радиоактивный, массовое число наиболее стабильного изотопа
Примечания к редакции о том, как ВЕРХ СТРАНИЦЫ ДРУГИЕ РАСЧЕТНЫЕ СТРАНИЦЫ
Ключевые слова и фразы: Какова относительная атомная масса ВЕРХ СТРАНИЦЫ
как сделать относительную атомную массу ВЕРХ СТРАНИЦЫ |
2.Как рассчитать относительную Как рассчитать относительную молекулярную массу? RMM Как рассчитать относительную формулу массы? RFM Есть ли разница между RMM и RFM? Имеет ли значение, является ли соединение ионным или Относительная молекулярная масса / относительная формула массы Если сложить индивидуальные атомные массы всех атомов в формуле, вы рассчитали Атомные массы например для ионных соединений, например NaCl = 23 + 35,5 58,5) или молекулярный например M r из N 2 = 28 из (2 x 14) или соединения e.грамм. и более примеров расчета относительной формулы В сбалансированном уравнении химических символов общее количество Если честно, термин относительная формула массы может использоваться с любыми Сокращение M r может использоваться для
Тогда как относительный атомный ВНИМАНИЕ: Примеры Как рассчитать относительную молекулярную массу = Как Молекулярная / формульная масса = всего Остерегайтесь скоб, например (ОН) 2
Тесты для самооценки по относительной формуле массы или относительной массы ВИКТОРИНА по расчету Выше представлена типичная таблица Менделеева, используемая в спецификациях по науке и химии GCSE в и я «обычно» использовал эти значения в своих расчетах на примере, чтобы охватить большинство
ВИКТОРИНА по расчету ДРУГИЕ РАСЧЕТНЫЕ СТРАНИЦЫ
расчет относительной формулы расчета массы |
2.3. Расчет атомных масс — Chemistry LibreTexts
The Mole
Идентичность вещества определяется не только типами атомов или ионов, которые оно содержит, но и количеством каждого типа атома или иона. Например, вода H 2 O и пероксид водорода H 2 O 2 похожи в том, что их соответствующие молекулы состоят из атомов водорода и кислорода. Однако, поскольку молекула перекиси водорода содержит два атома кислорода, в отличие от молекулы воды, которая имеет только один, эти два вещества обладают очень разными свойствами.Сегодня у нас есть сложные инструменты, которые позволяют напрямую измерять эти определяющие микроскопические признаки; однако те же характеристики были первоначально получены при измерении макроскопических свойств (масс и объемов объемных количеств вещества) с использованием относительно простых инструментов (весов и мерной посуды). Этот экспериментальный подход потребовал введения новой единицы количества веществ, моль , которая остается незаменимой в современной химической науке.
Моль — это единица измерения, аналогичная знакомым единицам, таким как пара, дюжина, брутто и т. Д. Она обеспечивает конкретную меру , число атомов или молекул в массивном образце вещества. Моль определяется как количество вещества, содержащего такое же количество дискретных элементов (таких как атомы, молекулы и ионы), что и количество атомов в образце чистого 12 C весом ровно 12 г. Одним из латинских значений слова «моль» является «большая масса» или «большой объем», что согласуется с его использованием в качестве названия этой единицы.{23} / \ ce {mol} \).
Видео \ (\ PageIndex {3} \) : Что такое число Авогадро?
В соответствии с определением единицы количества, 1 моль любого элемента содержит такое же количество атомов, как 1 моль любого другого элемента. Однако массы 1 моля разных элементов различаются, поскольку массы отдельных атомов сильно различаются. Молярная масса элемента (или соединения) — это масса в граммах 1 моля этого вещества, свойство, выраженное в граммах на моль (г / моль) (рисунок \ (\ PageIndex {3} \)).{23} \) атомы —1,00 моль атомов. Слева направо (верхний ряд): 65,4 г цинка, 12,0 г углерода, 24,3 г магния и 63,5 г меди. Слева направо (нижний ряд): 32,1 г серы, 28,1 г кремния, 207 г свинца и 118,7 г олова. (кредит: модификация работы Марка Отта).
Поскольку определения моля и атомной единицы массы основаны на одном и том же эталонном веществе, 12 C, молярная масса любого вещества численно эквивалентна его атомному или формульному весу в а.е.м.Согласно определению а.е.м., один атом углерода 12 весит 12 а.е.м. (его атомная масса составляет 12 а.е.м.). Первое определение моля заключалось в том, что моль составлял 12 г 12 C, содержащий 1 моль 12 атомов C (его молярная масса составляет 12 г / моль). Это соотношение сохраняется для всех элементов, поскольку их атомные массы измеряются относительно атомных масс эталонного вещества, равного 12 C. Расширяя этот принцип, молярная масса соединения в граммах также численно эквивалентна его формульной массе в а.е.м. (Рисунок \ (\ PageIndex {4} \)).{23} \) молекулы или формульные единицы — 1,00 моль соединения или элемента. По часовой стрелке сверху слева: 130,2 г C 8 H 17 OH (1-октанол, формульная масса 130,2 а.е.м.), 454,4 г HgI 2 (иодид ртути (II), формульная масса 454,4 а.е.м.) , 32,0 г CH 3 OH (метанол, формульная масса 32,0 а.е.м.) и 256,5 г S 8 (сера, формульная масса 256,5 а.е.м.). (кредит: Сахар Атва).
| Элемент | Средняя атомная масса (а.е.м.) | Молярная масса (г / моль) | Атомов / моль |
|---|---|---|---|
| С | 12.{23} \) |
Хотя атомная масса и молярная масса численно эквивалентны, имейте в виду, что они сильно различаются по масштабу, о чем свидетельствует огромная разница в величинах соответствующих единиц (а.е.м. по сравнению с г). Чтобы оценить размеры крота, рассмотрите небольшую каплю воды весом около 0,03 г (см. Рисунок \ (\ PageIndex {5} \)). Хотя это составляет лишь крошечную долю 1 моля воды (~ 18 г), он содержит больше молекул воды, чем можно ясно представить.Если бы молекулы были равномерно распределены среди примерно семи миллиардов людей на Земле, каждый человек получил бы более 100 миллиардов молекул.
Рисунок \ (\ PageIndex {5} \) : Количество молекул в одной капле воды примерно в 100 миллиардов раз больше, чем количество людей на Земле. (кредит: «tanakawho» / Wikimedia commons)
Видео \ (\ PageIndex {4} \) : Моль используется в химии для обозначения \ (6.{23} \) чего-то, но может быть трудно представить себе такое большое количество. Посмотрите это видео, а затем ответьте на следующие вопросы «Подумайте». Узнайте больше о кроте, просмотрев информацию в разделе «Копай глубже».
Атомная масса | Безграничная химия
Средняя атомная масса
Средняя атомная масса элемента — это сумма масс его изотопов, умноженная на их естественное содержание.
Цели обучения
Вычислить среднюю атомную массу элемента с учетом его изотопов и их естественного содержания
Основные выводы
Ключевые моменты
- Элемент может иметь разное количество нейтронов в ядре, но всегда имеет одинаковое количество протонов.Варианты элемента с разными нейтронами имеют разные массы и называются изотопами.
- Средняя атомная масса элемента рассчитывается путем суммирования масс изотопов элемента, каждый из которых умножается на его естественное содержание на Земле.
- При вычислении массы элементов или соединений всегда используйте среднюю атомную массу, которую можно найти в периодической таблице.
Ключевые термины
- массовое число : общее количество протонов и нейтронов в атомном ядре.
- естественное изобилие : изотоп, естественным образом встречающийся на планете.
- средняя атомная масса : масса, рассчитанная путем суммирования масс изотопов элемента, каждый из которых умножен на его естественное содержание на Земле.
Атомный номер элемента определяет идентичность элемента и означает количество протонов в ядре одного атома. Например, элемент водород (самый легкий элемент) всегда будет иметь в своем ядре один протон.В ядре элемента гелия всегда будет два протона.
Изотопы
Однако атомы одного и того же элемента могут иметь разное количество нейтронов в своем ядре. Например, существуют стабильные атомы гелия, которые содержат один или два нейтрона, но оба атома имеют два протона. Эти разные типы атомов гелия имеют разные массы (3 или 4 атомные единицы массы), и их называют изотопами. Для любого данного изотопа сумма количества протонов и нейтронов в ядре называется массовым числом.Это потому, что каждый протон и каждый нейтрон весят одну атомную единицу массы (а.е.м.). Сложив вместе количество протонов и нейтронов и умножив на 1 а.е.м., вы можете вычислить массу атома. Все элементы существуют как набор изотопов. Слово «изотоп» происходит от греческих «isos» (что означает «тот же») и «topes» (что означает «место»), потому что элементы могут занимать одно и то же место в периодической таблице, но при этом различны в субатомном строении.
Атом лития : Стилизованный атом лития-7: 3 протона (красный), 4 нейтрона (черный) и 3 электрона (синий).(У лития также есть другой, более редкий изотоп, содержащий всего 2 нейтрона.)
Расчет средней атомной массы
Средняя атомная масса элемента — это сумма масс его изотопов, каждый из которых умножен на его естественное содержание (десятичная дробь, связанная с процентом атомов этого элемента, принадлежащих к данному изотопу).
Средняя атомная масса = f 1 M 1 + f 2 M 2 +… + f n M n где f — доля, представляющая естественное содержание изотопа, а M — масса количество (вес) изотопа.
Среднюю атомную массу элемента можно найти в периодической таблице, обычно под символом элемента. Когда доступны данные о естественном содержании различных изотопов элемента, вычислить среднюю атомную массу просто.
- Для гелия на каждый миллион изотопов гелия-4 приходится примерно один изотоп гелия-3; поэтому средняя атомная масса очень близка к 4 а.е.м. (4,002602 а.е.м.).
- Хлор состоит из двух основных изотопов, один из которых содержит 18 нейтронов (75.77 процентов атомов природного хлора) и один с 20 нейтронами (24,23 процента атомов природного хлора). Атомный номер хлора 17 (в его ядре 17 протонов).
Чтобы вычислить среднюю массу, сначала преобразуйте проценты в доли (разделите их на 100). Затем вычислите массовые числа. Изотоп хлора с 18 нейтронами имеет распространенность 0,7577 и массовое число 35 а.е.м. Чтобы вычислить среднюю атомную массу, умножьте долю на массовое число для каждого изотопа, а затем сложите их вместе.
Средняя атомная масса хлора = (0,7577 [латекс] \ cdot [/ latex] 35 а.е.м.) + (0,2423 [латекс] \ cdot [/ латекс] 37 а.е.м.) = 35,48 а.е.м.
Другой пример — вычисление атомной массы бора (B), который имеет два изотопа: B-10 с естественным содержанием 19,9% и B-11 с содержанием 80,1%. Следовательно,
Средняя атомная масса бора = (0,199 [латекс] \ cdot [/ latex] 10 а.е.м.) + (0,801 [латекс] \ cdot [/ латекс] 11 а.е.м.) = 10,80 а.е.м.
Всякий раз, когда мы проводим массовые вычисления с участием элементов или соединений (комбинаций элементов), мы всегда используем средние атомные массы.
Масс-спектрометрия для измерения массы
Масс-спектрометрия — это мощный метод определения характеристик, позволяющий определять элементы, изотопы и соединения на основе отношения массы к заряду.
Цели обучения
Определите основное применение масс-спектрометра
Основные выводы
Ключевые моменты
- Масс-спектрометры работают с образцами в газообразном состоянии.
- Газообразные образцы ионизируются источником ионов, который добавляет или удаляет заряженные частицы (электроны или ионы).Примеры источников ионов включают индуктивно связанную плазму и электронный удар.
- Масс-анализаторы разделяют ионизированные образцы в соответствии с их отношением массы к заряду. Времяпролетный и квадрупольный — примеры масс-анализаторов.
- Массу частицы можно очень точно рассчитать на основе таких параметров, как время, необходимое для прохождения определенного расстояния, или угол ее перемещения.
- Масс-спектрометры настолько точны, что могут определять типы элементов в соединениях или измерять разницу между массами разных изотопов одного и того же атома.
Ключевые термины
- ионизация : любой процесс, который приводит к диссоциации нейтрального атома или молекулы на заряженные частицы (ионы).
- плазма : состояние вещества, состоящего из частично ионизированного газа, обычно при высоких температурах.
- Отношение массы к заряду : лучший способ разделения ионов в масс-спектрометре. Это число рассчитывается путем деления веса иона на его заряд.
Масс-спектрометрия (МС) — это мощный метод, позволяющий идентифицировать широкий спектр химических соединений.Он используется для определения массы частицы, элементного состава образца и химической структуры более крупных молекул.
Масс-спектрометры разделяют соединения на основе свойства, известного как отношение массы к заряду: масса атома, деленная на его заряд. Сначала образец ионизируется. Ионизация — это процесс преобразования атома или молекулы в ион путем добавления или удаления заряженных частиц, таких как электроны или ионы. Как только образец ионизируется, он проходит через какое-либо электрическое или магнитное поле.Массу частицы можно рассчитать на основе таких параметров, как время, необходимое для прохождения определенного расстояния, или угол ее перемещения.
Схема масс-спектрометра : Образец загружается в масс-спектрометр, где он подвергается испарению и ионизации. Компоненты образца ионизируются одним из множества методов, например с помощью ионизирующей нити. Ионы разделяются при анализе магнитными полями. Они разделены в соответствии с их отношением массы к заряду.Ионы обнаруживаются, как правило, количественным методом, например коллектором Фарадея. Ионный сигнал преобразуется в масс-спектр.
Состав приборов для масс-спектрометрии (МС)
Приборы
MS состоят из двух основных компонентов:
- Источник ионов, который может преобразовывать молекулы пробы в ионы
- Масс-анализатор, сортирующий ионы по массе с помощью электромагнитных полей
Существует множество методов ионизации и обнаружения соединений.
Ионизирующие соединения
Пламя индуктивно связанной плазмы (ICP) : Изображение пламени ICP через зеленое стекло сварщика.
Источник ионов — это часть масс-спектрометра, которая ионизирует соединение. В зависимости от информации, требуемой от масс-спектрометрического анализа, могут использоваться различные методы ионизации. Например, наиболее распространенным источником ионов для анализа элементов является индуктивно-связанная плазма (ICP). В ICP «пламя» плазменного газа с температурой 10 000 градусов Цельсия используется для распыления молекул пробы и отделения внешних электронов от этих атомов.
Плазма обычно создается из газообразного аргона. Плазменный газ в целом электрически нейтрален, но значительное количество его атомов ионизируется высокой температурой.
Электронный удар (ЭУ) — еще один метод генерации ионов. В EI образец нагревается до тех пор, пока не станет газом. Затем он проходит через пучок электронов. Этот высокоэнергетический пучок удаляет электроны из молекул образца, оставляя после себя положительно заряженные радикалы.
Масс-анализаторы
Масс-анализаторы разделяют ионы в соответствии с их отношением массы к заряду.Есть много типов масс-анализаторов. У каждого есть свои сильные и слабые стороны, в том числе:
- насколько точно они могут измерить подобное отношение массы к заряду
- диапазон масс и концентраций проб, которые они могут измерить.
Например, анализатор времени пролета (TOF) использует электрическое поле для ускорения ионов с помощью того же потенциала, а затем измеряет время, необходимое им для достижения детектора. Поскольку все частицы имеют одинаковый заряд, их скорости зависят только от их массы, и более легкие ионы первыми достигнут детектора.
Времяпролетный масс-анализатор : Схема времяпролетного масс-анализатора (TOF).
Другой тип детектора — квадрупольный. Здесь ионы проходят через четыре параллельных стержня, которые прикладывают переменное электрическое напряжение. На изменение поля ионы реагируют сложными путями. В зависимости от приложенного напряжения через анализатор будут проходить только ионы с определенным отношением массы к заряду. Все остальные ионы будут потеряны при столкновении со стержнями.
Использование масс-спектрометра для измерения массы
Вот как масс-спектрометр проанализирует образец хлорида натрия (поваренной соли).
- В ионном источнике образец испаряется (превращается в газ) и ионизируется до ионов натрия (Na + ) и хлорида (Cl — ).
- Атомы и ионы натрия имеют только один изотоп и массу около 23 а.е.м.
- Атомы и ионы хлоридов состоят из двух изотопов с массой примерно 35 а.е.м. (при естественном содержании около 75 процентов) и примерно 37 а.е.м. (при естественном содержании около 25 процентов).
- В состав масс-анализатора спектрометра входят электрические и магнитные поля, которые воздействуют на ионы, проходящие через эти поля. Угол, под которым ион движется через поля, зависит от его отношения массы к заряду: более легкие ионы меняют направление больше, чем более тяжелые.
- Потоки отсортированных ионов проходят от анализатора к детектору, который регистрирует относительное содержание каждого типа ионов. Эта информация используется для определения химического состава исходного образца (т.е. что в образце присутствуют и натрий, и хлор), а также его изотопный состав (отношение хлора-35 к хлору-37).

 Из Периодической таблицы имени Д.И.Менделеева
Из Периодической таблицы имени Д.И.Менделеева
