Первая страница статьи Открытое 100 лет назад Э.Резерфордом 1. 1911 г. Резерфорд открывает атомное | |
| 1 – источник α-частиц, 3 – золотая фольга, 5 – микроскоп для наблюдения сцинтилляций, 7 – сцинтиллятор ZnS | |
Г.
Гейгер и Э. Марсден увидели, что при прохождении через тонкую фольгу
из золота большинство α-частиц,
как и ожидалось, пролетает без отклонения, но неожиданно было
обнаружено, что часть α-частиц
отклоняется на очень большие углы. Некоторые α-частицы
рассеивались даже в обратном направлении. Расчеты напряженности
электрического поля атомов в моделях Томсона и Резерфорда показывают
существенное различие этих моделей. Напряжённость поля положительного
заряда распределенного по поверхности атома в случае модели Томсона
~1013 В/м.
В модели Резерфорда положительный заряд, находящийся в центре атома в
области
R < 10-12
см создаёт напряженности поля на 8 порядков больше. Только такое
Только такое
сильное электрического поле массивного заряженного тела может
отклонить
α-частицы
на большие углы, в то время как в слабом электрическом поле модели
Томсона это было невозможно.
Э.
Резерфорд, 1911 г. «Хорошо
известно, что
α—
и
β-частицы
при столкновении с атомами вещества испытывают отклонение от
прямолинейного пути. Это рассеяние гораздо более заметно у
β-частиц
нежели у
α-частиц,
т.к. они обладают значительно меньшими импульсами и энергиями.
Поэтому нет сомнения в том, что столь быстро движущиеся частицы
проникают сквозь атомы, встречающиеся на их пути, и что наблюдаемые
отклонения обусловлены сильным электрическим полем, действующим
внутри атомной системы. Обычно предполагалось, что рассеяние пучка α—
или
β-лучей
при прохождении через тонкую пластинку вещества есть результат
многочисленных малых рассеяний при прохождении атомов вещества.
Однако наблюдения проведенные Гейгером и Марсденом показали, что
некоторое количество α-частиц
при однократном столкновении испытывают отклонение на угол больше
90°. Простой расчет показывает, что в атоме должно существовать
Простой расчет показывает, что в атоме должно существовать
сильное электрическое поле, чтобы при однократном столкновении
создавалось столь большое отклонение».
1911 г. Э.
Резерфорд. Атомное ядро
| α + 197Au → α + 197Au | Эрнест Резерфорд (1891-1937) |
Исходя из планетарной модели атома,
Резерфорд вывел формулу описывающую рассеяние α-частиц
на тонкой фольге из золота, согласующуюся с результатами Гейгера и
Марсдена. Резерфорд предполагал, что α-частицы
и атомные ядра с которыми они взаимодействуют можно рассматривать как
точечные массы и заряды и что между положительно заряженными ядрами и α-частицами
действуют только электростатические силы отталкивания и что ядро
настолько тяжелое по сравнению с α-частицей
, что оно не смещается в процессе взаимодействия. Электроны вращаются
Электроны вращаются
вокруг атомного ядра на характерных атомных масштабах ~10-8 см
и из-за малой массы не влияют на рассеяние α-частиц.
Вначале
Резерфорд получил зависимость угла рассеяния
θ
α-частицы
с энергией
E
от величины прицельного параметра
b
столкновения с точечным массивным ядром.
b − прицельный параметр − минимальное расстояние
на которое α-частица
подошла бы к ядру, если бы между ними не действовали силы
отталкивания, θ
− угол рассеяния α-частицы,
Z1e
− электрический заряд α-частицы,
Z2e
− электрический заряд ядра.
Затем Резерфорд рассчитал, какая доля пучка
α-частиц
с энергией
E
рассеивается на угол
θ
в зависимости от заряда ядра
Z2e
и заряда α-частицы
Z1e.
Так исходя из классических законов Ньютона и Кулона была получена
знаменитая формула рассеяния Резерфорда. Основным при получении
формулы было предположение, что в атоме находится массивный
положительно заряженный центр, размеры которого
R < 10-12
см.
Э. Резерфорд,
1911 г.: «Наиболее
простым является предположение, что атом имеет центральный заряд,
распределенный по очень малому объему, и что большие однократные
отклонения обусловлены центральным зарядом в целом, а не его
составными частями. В то же время экспериментальные данные
недостаточно точны, чтобы можно было отрицать возможности
существования небольшой части положительного заряда в виде спутников,
находящихся на некотором расстоянии от центра … Следует
отметить, что найденное приближенное значение центрального заряда
атома золота (100e)
примерно совпадает с тем значением, который имел бы атом золота,
состоящий из 49 атомов гелия, несущих каждый заряд 2e.
Быть может, это лишь совпадение, но оно весьма заманчиво с точки
зрения испускания радиоактивным веществом атомов гелия, несущих две
единицы заряда».
Дж.
Дж. Томсон и Э. Резерфорд
Э. Резерфорд, 1921 г.:
«Представление о нуклеарном строении атома первоначально
возникло из попыток объяснить рассеяние α-частиц на большие
углы при прохождении через тонкие слои материи. Так как α частицы
Так как α частицы
обладают большою массою и большою скоростью, то эти значительные
отклонения были в высшей степени замечательны; они указывали на
существование весьма интенсивных электрически! или магнитных полей
внутри атомов. Чтобы объяснить эти результаты, необходимо было
предположить, что атом состоит из заряженного массивного ядра, весьма
малых размеров по сравнению с обычно принятой величиной диаметра
атома. Это положительно заряженное ядро содержит большую часть массы
атома и окружено на некотором расстоянии известным образом
распределенными отрицательными электронами; число которых равняется
общему положительному заряду ядра. При таких условиях вблизи ядра
должно существовать весьма интенсивное электрическое поле и
α-частицы, при встрече с отдельным атомом проходя вблизи от
ядра, отклоняются на значительные углы. Допуская, что электрические
силы изменяются обратно пропорционально квадрату расстояния в
области, прилегающей к ядру, автор получил соотношение, связывающее
число α-частиц, рассеянных на некоторый угол с зарядом ядра и
энергией α-частицы.
Вопрос о том, является ли атомное число
элемента действительной мерой его нуклеарного заряда, настолько
важен, что для разрешения его должны быть применены все возможные
методы. В настоящее время в кавендишевской лаборатории ведется
несколько исследований с целью проверки точности этого соотношения.
Два наиболее прямых метода основаны на изучения рассеяния быстрых α-
и β-лучей. Первый метод применяется Chadwick’oм,
пользующимся новыми приемами; последний – Crowthar’oм.
Результаты, полученные до сих пор
Chadwick’oм,
вполне подтверждают тождество атомного числа с нуклеарным зарядом в
пределах возможной точности эксперимента, которая у Chadwick’a
составляет около 1%».
Несмотря на то, что комбинация двух
протонов и двух нейтронов исключительно устойчивое образование, в
настоящее время считается, что α-частицы
не входит в состав ядра в качестве самостоятельного структурного
образования. В случае α-радиоактивных
элементов энергия связи α-частицы
больше, чем энергия которую необходимо затратить на то, чтобы по
отдельности удалить из ядра два протона и два нейтрона, поэтому α-частица
может быть испущена из ядра, хотя она не присутствует в ядре как
самостоятельное образование.
Предположение Резерфорда о том, что атомное
ядро может состоять из какого-то количества атомов гелия или о
положительно заряженных спутниках ядра, было вполне естественным
объяснением открытой им α радиоактивности.
Представления о том, что частицы могут рождаться в результате
различных взаимодействий, в это время еще не существовало.
Открытие атомного ядра Э. Резерфордом в
1911 г. и последующее изучение ядерных явлений радикально изменило
наше представление об окружающем мире. Обогатило науку новыми
концепциями, явилось началом исследования субатомной структуры
материи.
Опыт Резерфорда • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Атом состоит из компактного и массивного положительно заряженного ядра и отрицательно заряженных легких электронов вокруг него.
Эрнест Резерфорд — уникальный ученый в том плане, что свои главные открытия он сделал уже после получения Нобелевской премии. В 1911 году ему удался эксперимент, который не только позволил ученым заглянуть вглубь атома и получить представление о его строении, но и стал образцом изящества и глубины замысла.
В 1911 году ему удался эксперимент, который не только позволил ученым заглянуть вглубь атома и получить представление о его строении, но и стал образцом изящества и глубины замысла.
Используя естественный источник радиоактивного излучения, Резерфорд построил пушку, дававшую направленный и сфокусированный поток частиц. Пушка представляла собой свинцовый ящик с узкой прорезью, внутрь которого был помещен радиоактивный материал. Благодаря этому частицы (в данном случае альфа-частицы, состоящие из двух протонов и двух нейтронов), испускаемые радиоактивным веществом во всех направлениях, кроме одного, поглощались свинцовым экраном, и лишь через прорезь вылетал направленный пучок альфа-частиц. Далее на пути пучка стояло еще несколько свинцовых экранов с узкими прорезями, отсекавших частицы, отклоняющиеся от строго заданного направления. В результате к мишени подлетал идеально сфокусированный пучок альфа-частиц, а сама мишень представляла собой тончайший лист золотой фольги. В нее-то и ударял альфа-луч.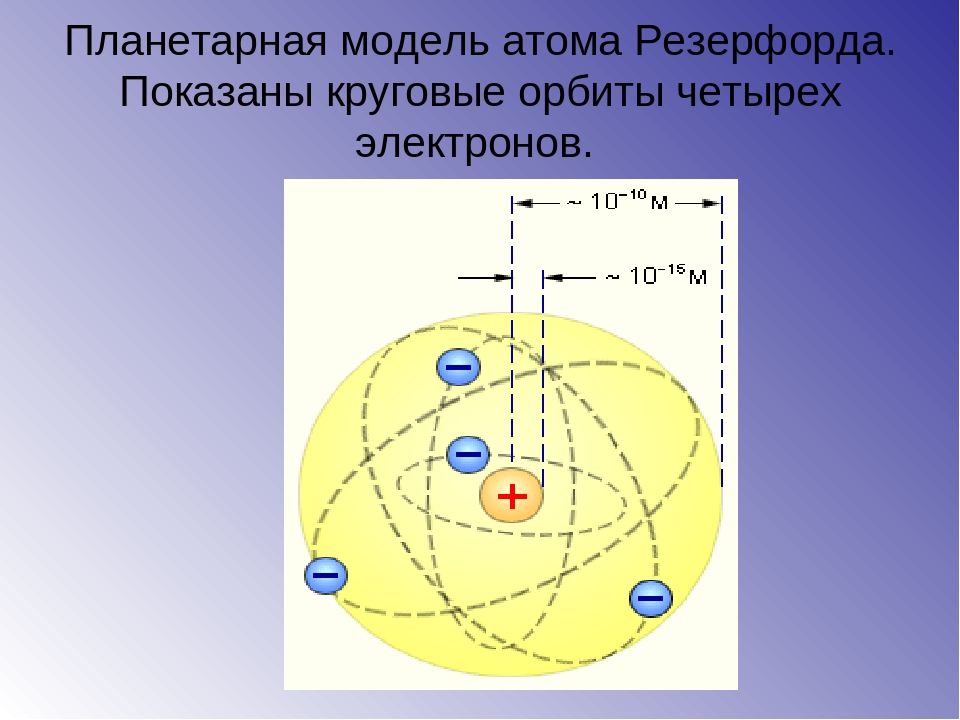 После столкновения с атомами фольги альфа-частицы продолжали свой путь и попадали на люминесцентный экран, установленный позади мишени, на котором при попадании на него альфа-частиц регистрировались вспышки. По ним экспериментатор мог судить, в каком количестве и насколько альфа-частицы отклоняются от направления прямолинейного движения в результате столкновений с атомами фольги.
После столкновения с атомами фольги альфа-частицы продолжали свой путь и попадали на люминесцентный экран, установленный позади мишени, на котором при попадании на него альфа-частиц регистрировались вспышки. По ним экспериментатор мог судить, в каком количестве и насколько альфа-частицы отклоняются от направления прямолинейного движения в результате столкновений с атомами фольги.
Эксперименты подобного рода проводились и раньше. Основная их идея состояла в том, чтобы по углам отклонения частиц накопить достаточно информации, по которой можно было бы сказать что-либо определенное о строении атома. В начале ХХ века ученые уже знали, что атом содержит отрицательно заряженные электроны. Однако преобладало представление, что атом представляет собой что-то похожее на положительно заряженную тонкую сетку, заполненную отрицательно заряженными электронами-изюминами, — модель так и называлась «модель сетки с изюмом». По результатам подобных опытов ученым удалось узнать некоторые свойства атомов — в частности, оценить порядок их геометрических размеров.
Резерфорд, однако, заметил, что никто из его предшественников даже не пробовал проверить экспериментально, не отклоняются ли некоторые альфа-частицы под очень большими углами. Модель сетки с изюмом просто не допускала существования в атоме столь плотных и тяжелых элементов структуры, что они могли бы отклонять быстрые альфа-частицы на значительные углы, поэтому никто и не озабочивался тем, чтобы проверить такую возможность. Резерфорд попросил одного из своих студентов переоборудовать установку таким образом, чтобы можно было наблюдать рассеяние альфа-частиц под большими углами отклонения, — просто для очистки совести, чтобы окончательно исключить такую возможность. В качестве детектора использовался экран с покрытием из сульфида натрия — материала, дающего флуоресцентную вспышку при попадании в него альфа-частицы. Каково же было удивление не только студента, непосредственно проводившего эксперимент, но и самого Резерфорда, когда выяснилось, что некоторые частицы отклоняются на углы вплоть до 180°!
В рамках устоявшейся модели атома полученный результат не мог быть истолкован: в сетке с изюмом попросту нет ничего такого, что могло бы отразить мощную, быструю и тяжелую альфа-частицу. Резерфорд вынужден был заключить, что в атоме большая часть массы сосредоточена в невероятно плотном веществе, расположенном в центре атома. А вся остальная часть атома оказывалась на много порядков менее плотной, нежели это представлялось раньше. Из поведения рассеянных альфа-частиц вытекало также, что в этих сверхплотных центрах атома, которые Резерфорд назвал ядрами, сосредоточен также и весь положительный электрический заряд атома, поскольку только силами электрического отталкивания может быть обусловлено рассеяние частиц под углами больше 90°.
Резерфорд вынужден был заключить, что в атоме большая часть массы сосредоточена в невероятно плотном веществе, расположенном в центре атома. А вся остальная часть атома оказывалась на много порядков менее плотной, нежели это представлялось раньше. Из поведения рассеянных альфа-частиц вытекало также, что в этих сверхплотных центрах атома, которые Резерфорд назвал ядрами, сосредоточен также и весь положительный электрический заряд атома, поскольку только силами электрического отталкивания может быть обусловлено рассеяние частиц под углами больше 90°.
Годы спустя Резерфорд любил приводить по поводу своего открытия такую аналогию. В одной южноафриканской стране таможню предупредили, что в страну собираются провезти крупную партию контрабандного оружия для повстанцев, и оружие будет спрятано в тюках хлопка. И вот перед таможенником после разгрузки оказывается целый склад, забитый тюками с хлопком. Как ему определить, в каких именно тюках спрятаны винтовки? Таможенник решил задачу просто: он стал стрелять по тюкам, и, если пули рикошетили от какого-либо тюка, он по этому признаку и выявлял тюки с контрабандным оружием. Так и Резерфорд, увидев, как альфа-частицы рикошетируют от золотой фольги, понял, что внутри атома скрыта гораздо более плотная структура, чем предполагалось.
Так и Резерфорд, увидев, как альфа-частицы рикошетируют от золотой фольги, понял, что внутри атома скрыта гораздо более плотная структура, чем предполагалось.
Картина атома, нарисованная Резерфордом по результатам опыта, нам сегодня хорошо знакома. Атом состоит из сверхплотного, компактного ядра, несущего на себе положительный заряд, и отрицательно заряженных легких электронов вокруг него. Позже ученые подвели под эту картину надежную теоретическую базу (см. Атом Бора), но началось всё с простого эксперимента с маленьким образцом радиоактивного материала и куском золотой фольги.
См. также:
Строение атома. Модель томпсона. Опыты Резерфорда. Планетарная модель
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: планетарная модель атома.
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
Первую модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный Нобелевской премии за открытие электрона). В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом».
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1).
Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Опыты Резерфорда
Верна ли модель Томсона? Как в действительности распределены положительные и отрицательные заряды внутри атома? Чтобы ответить на эти вопросы, нужен был эксперимент, позволяющий проникнуть внутрь атома. Ученик Томсона, знаменитый английский физик Эрнест Резерфорд предложил с этой целью бомбардировать атом высокоэнергетичными ?-частицами и смотреть, как они будут отклоняться положительным зарядом атома.
Что такое -частицы? Потоки этих частиц — так называемые «альфа-лучи» — были обнаружены при радиоактивном распаде некоторых элементов (например, радия). В результате тщательных исследований, проведённых опять-таки Резерфордом, было установлено, что каждая -частица имеет положительный заряд, равный по модулю удвоенному заряду электрона, и массу, превышающую массу электрона примерно в раз. То есть, -частица оказалась полностью ионизованным (лишённым электронов) атомом гелия.
То есть, -частица оказалась полностью ионизованным (лишённым электронов) атомом гелия.
Резерфорд говорил об -частицах как об ионах гелия; сейчас мы знаем, что это ядра гелия.
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
Энергия -частиц очень велика — достаточно сказать, что скорость их вылета из радиоактивного образца составляет примерно скорости света. Поэтому интересно было выяснить, на какие углы будут отклоняться столь мощные «снаряды» при рассеянии на отдельных атомах, а точнее — на их положительных зарядах.
Пучок -частиц направлялся на тончайшую золотую фольгу. Как гласит история, Резерфорд не сомневался в том, что углы отклонения должны быть весьма малы: имея столь огромную энергию, -частицы должны проходить сквозь фольгу как нож сквозь масло. Только «для очистки совести», на всякий случай, он попросил учеников посмотреть, не возникает ли рассеяния -частиц на большие углы.
Каково же было всеобщее удивление, когда такие частицы обнаружились! Да, как и следовало ожидать, подавляющая доля -частиц отклонялась несущественно. Но совсем небольшая их часть (примерно одна частица из нескольких тысяч) отклонялась на угол, больший (рис. 2).
Рис. 2. Рассеяние -частиц на атомах
Эти отклонения казались совершенно невероятными. По словам Резерфорда, дело выглядело так, словно артиллерийский снаряд налетел на кусок бумаги и от удара повернул назад.
А «бумагой» в образном сравнении Резерфорда служил атом, устроенный согласно модели Томсона. Действительно, допустим, что положительный заряд атома «размазан» по всему атому, то есть шару радиусом см. Этот положительный заряд создаёт электрическое поле, тормозящее и отклоняющее -частицы. Вблизи атома потенциал данного поля:
Расчёты, однако, показывают, что такое поле оказывается слишком слабым — его тормозящего действия никак не хватит для того, чтобы остановить -частицу и отбросить её назад!
Таким образом, наличие -частиц, отброшенных фольгой, опровергло модель Томсона. Что же было предложено взамен?
Что же было предложено взамен?
Планетарная модель атома
Чтобы отбросить -частицу, положительный заряд атома должен создавать куда более сильное электрическое поле, чем то, которое получается в модели Томсона. А чтобы создать такое поле, положительный заряд должен быть сосредоточен в области, гораздо меньшей размера атома.
Размер этой области можно вычислить. Если положительный заряд занимает область размером , то вблизи заряда создаётся электрическое поле с потенциалом
Зная кинетическую энергию -частицы, можно найти величину тормозящего потенциала , а затем и размер положительно заряженной области. Вычисления, проведённые Резерфордом, дали следующий результат:
см.
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3).
Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!
Вот таким удивительным объектом оказался атом. Однако планетарная модель атома, объяснив результаты опытов Резерфорда по рассеянию -частиц, оказалась лишь первым шагом на пути к пониманию внутриатомных процессов. А именно, планетарная модель приводила к одному серьёзному противоречию, и преодоление этого противоречия Нильсом Бором положило начало физике атома. Читаем следующий листок!
Однако планетарная модель атома, объяснив результаты опытов Резерфорда по рассеянию -частиц, оказалась лишь первым шагом на пути к пониманию внутриатомных процессов. А именно, планетарная модель приводила к одному серьёзному противоречию, и преодоление этого противоречия Нильсом Бором положило начало физике атома. Читаем следующий листок!
Человек, заглянувший в глубь атома — Энергетика и промышленность России — № 8 (36) август 2003 года — WWW.EPRUSSIA.RU
Газета «Энергетика и промышленность России» | № 8 (36) август 2003 года
Английский физик Эрнест Резерфорд родился в Новой Зеландии, неподалеку от г. Нельсона. Он был одним из 12 детей колесного мастера и строительного рабочего Джеймса Резерфорда, шотландца по происхождению, и Марты (Томпсон) Резерфорд, школьной учительницы из Англии. Сначала Резерфорд посещал начальную и среднюю местные школы, а затем стал стипендиатом Нельсон-колледжа, частной высшей школы, где проявил себя талантливым студентом, особенно по математике. Благодаря успехам в учебе он получил еще одну стипендию, которая позволила ему поступить в Кентербери-колледж в Крайстчерче, одном из крупнейших городов Новой Зеландии.
Благодаря успехам в учебе он получил еще одну стипендию, которая позволила ему поступить в Кентербери-колледж в Крайстчерче, одном из крупнейших городов Новой Зеландии.
Благодаря своим необыкновенным способностям к науке молодой ученый был удостоен стипендии Кембриджского университета в Англии, где он занимался в Кавендишской лаборатории, одном из ведущих мировых центров научных исследований.
В 1898 г. Резерфорд принял место профессора Макгиллского университета в Монреале (Канада), где начал серию важных экспериментов, касающихся радиоактивного излучения элемента урана. Вскоре он открыл два вида этого излучения: испускание альфа-лучей, проникающих только на короткое расстояние, и бета-лучей, которые проникают на значительно большее расстояние. Затем Р. обнаружил, что радиоактивный торий испускает газообразный радиоактивный продукт, который он назвал «эманация» (испускание)
Дальнейшие исследования показали, что два других радиоактивных элемента — радий и актиний — также производят эманацию. На основании этих и других открытий Р. пришел к двум важным для понимания природы радиации выводам: все известные радиоактивные элементы испускают альфа- и бета-лучи, и, что еще более важно, радиоактивность любого радиоактивного элемента через определенный конкретный период времени уменьшается. Эти выводы дали основание предполагать, что все радиоактивные элементы принадлежат к одному семейству атомов и что в основу их классификации можно положить период уменьшения их радиоактивности.
На основании этих и других открытий Р. пришел к двум важным для понимания природы радиации выводам: все известные радиоактивные элементы испускают альфа- и бета-лучи, и, что еще более важно, радиоактивность любого радиоактивного элемента через определенный конкретный период времени уменьшается. Эти выводы дали основание предполагать, что все радиоактивные элементы принадлежат к одному семейству атомов и что в основу их классификации можно положить период уменьшения их радиоактивности.
Резерфорд провел дальнейшие эксперименты для получения результатов, которые подтвердили выстраиваемую им теорию. В 1903 г. он доказал, что альфа-частицы несут положительный заряд. Поскольку эти частицы обладают измеримой массой, «выбрасывание» их из атома имеет решающее значение для превращения одного радиоактивного элемента в другой. Созданная теория позволила ученому также предсказать, с какой скоростью различные радиоактивные элементы будут превращаться в то, что он называл дочерним материалом. Ученый был убежден, что альфа-частицы неотличимы от ядра атома гелия. Подтверждение этому было получено, когда Содди, работавший тогда с английским химиком Уильямом Рамзаем, открыл, что эманация радия содержит гелий, предполагаемую альфа-частицу.
Ученый был убежден, что альфа-частицы неотличимы от ядра атома гелия. Подтверждение этому было получено, когда Содди, работавший тогда с английским химиком Уильямом Рамзаем, открыл, что эманация радия содержит гелий, предполагаемую альфа-частицу.
В 1908 г. Резерфорду была присуждена Нобелевская премия по химии «за проведенные им исследования в области распада элементов в химии радиоактивных веществ». В своей вступительной речи от имени Шведской королевской академии наук К.Б. Хассельберг указал на связь между работой, проведенной ученым, и работами Томсона, Анри Беккереля, Пьера и Мари Кюри. «Открытия привели к потрясающему выводу: химический элемент… способен превращаться в другие элементы», — сказал Хассельберг.
После получения Нобелевской премии Резерфорд занялся изучением явления, которое наблюдалось при бомбардировке пластинки тонкой золотой фольги альфа-частицами, излучаемыми таким радиоактивным элементом, как уран. Оказалось, что с помощью угла отражения альфа-частиц можно изучать структуру устойчивых элементов, из которых состоит пластинка. Согласно принятым тогда представлениям, модель атома была подобна пудингу с изюмом: положительные и отрицательные заряды были равномерно распределены внутри атома и, следовательно, не могли в значительной мере изменять направление движения альфа-частиц. Pезерфорд, однако, заметил, что определенные альфа-частицы отклонялись от ожидаемого направления в значительно большей степени, чем это допускалось теорией. Работая с Эрнестом Марсденом, студентом Манчестерского университета, ученый подтвердил, что довольно большое число альфа-частиц отклоняется дальше, чем ожидалось, причем некоторые под углом более чем 90 градусов.
Согласно принятым тогда представлениям, модель атома была подобна пудингу с изюмом: положительные и отрицательные заряды были равномерно распределены внутри атома и, следовательно, не могли в значительной мере изменять направление движения альфа-частиц. Pезерфорд, однако, заметил, что определенные альфа-частицы отклонялись от ожидаемого направления в значительно большей степени, чем это допускалось теорией. Работая с Эрнестом Марсденом, студентом Манчестерского университета, ученый подтвердил, что довольно большое число альфа-частиц отклоняется дальше, чем ожидалось, причем некоторые под углом более чем 90 градусов.
Размышляя над этим явлением, Резерфорд в 1911 г. предложил новую модель атома. Согласно его теории, которая сегодня стала общепринятой, положительно заряженные частицы сосредоточены в тяжелом центре атома, а отрицательно заряженные (электроны) находятся на орбите ядра, на довольно большом расстоянии от него. Эта модель, подобно крошечной модели Солнечной системы, подразумевает, что атомы состоят главным образом из пустого пространства. Широкое признание теорий Р. началось с 1913 г., когда к работе ученого в Манчестерском университете подключился датский физик Нильс Бор. Бор показал, что в терминах предлагаемой Резерфордом структуры могут быть объяснены общеизвестные физические свойства атома водорода, а также атомов нескольких более тяжелых элементов.
Когда разразилась Первая мировая война, Резерфорд был назначен членом гражданского комитета Управления изобретений и исследований британского Адмиралтейства и изучал проблему определения местонахождения подводных лодок с помощью акустики. После войны он вернулся в манчестерскую лабораторию и в 1919 г. сделал еще одно фундаментальное открытие. Изучая структуру атомов водорода с помощью бомбардировки их альфа-частицами, обладающими высокой скоростью, он заметил на своем детекторе сигнал, который можно было объяснить как результат того, что ядро атома водорода пришло в движение вследствие столкновения с альфа-частицей. Однако точно такой же сигнал появлялся и когда ученый заменил атомы водорода атомами азота. Резерфорд объяснил причину этого явления тем, что бомбардировка вызывает распад устойчивого атома. Т.е. в процессе, аналогичном естественно происходящему распаду, который вызывается радиацией, альфа-частица выбивает единственный протон (ядро атома водорода) из устойчивого при нормальных условиях ядра атома азота и придает ему чудовищную скорость. Еще одно свидетельство в пользу такого толкования этого явления было получено в 1934 г., когда Фредерик Жолио и Ирен Жолио-Кюри открыли искусственную радиоактивность.
В 1919 г. Резерфорд перешел в Кембриджский университет, став преемником Томсона в качестве профессора экспериментальной физики и директора Кавендишской лаборатории, а в 1921-м занял должность профессора естественных наук в Королевском институте в Лондоне. В 1930 г. Р. был назначен председателем правительственного консультативного совета Управления научных и промышленных исследований. Находясь на вершине своей карьеры, ученый привлекал к работе в своей лаборатории в Кембридже много талантливых молодых физиков, в том числе. П. М. Блэкетта, Джона Кокрофта, Джеймса Чедвика и Эрнеста Уолтона. Несмотря на то что у самого Резерфорда оставалось из-за этого меньше времени на активную исследовательскую работу, его глубокая заинтересованность в проводимых исследованиях и четкое руководство помогали поддерживать высокий уровень работ, осуществляемых в его лаборатории. Ученики и коллеги вспоминали об ученом как о милом, добром человеке. Наряду с присущим ему как теоретику даром предвидения Резерфорд обладал практической жилкой. Именно благодаря ей он был всегда точен в объяснении наблюдаемых явлений, какими бы необычными они на первый взгляд ни казались.
Обеспокоенный политикой, проводимой нацистским правительством Адольфа Гитлера, Резерфорд в 1933 г. стал президентом Академического совета помощи, который был создан для оказания содействия тем, кто бежал из Германии.
В 1900 г., во время краткой поездки в Новую Зеландию, Резерфорд женился на Мэри Ньютон, которая родила ему дочь. Почти до конца жизни он отличался крепким здоровьем и умер в Кембридже в 1937 г. после непродолжительной болезни. Ученый похоронен в Вестминстерском аббатстве неподалеку от могил Исаака Ньютона и Чарльза Дарвина.
В числе полученных им наград медаль Румфорда (1904) и медаль Копли (1922) Лондонского Королевского общества, а также британский орден «За заслуги» (1925). В 1931 г. ученому был пожалован титул пэра. Резерфорд был удостоен почетных степеней Новозеландского, Кембриджского, Висконсинского, Пенсильванского и Макгиллского университетов. Он являлся членом-корреспондентом Геттингенского Королевского общества, а также членом Новозеландского философского института, Американского философского общества, Академии наук Сент-Луи, Лондонского Королевского общества и Британской ассоциации содействия развитию науки.
Резерфорд и планетарный атом. История лазера
Резерфорд и планетарный атом
Эрнст Резерфорд (1871—1937) родился в маленьком городке Южного острова Новой Зеландии в семье выходца из Шотландии. Его мать была школьной учительницей и великолепно играла на рояле, что было необычным в Новой Зеландии того времени. Его отец, энергичный и умелый фермер, организовал выгодный бизнес по производству веревок и канатов. Многочисленная семья молодого Эрнста жила вдали от больших городов на семейной ферме.
В 10 лет Эрнст прочел популярную книгу по физике и, как это случалось с другими физиками в подобных случаях, был увлечен ею. После школы второй ступени и колледжа, где он был первым на экзаменах по английскому языку, латыни, истории, математике, физике и химии, в 1889 г. получил стипендию университета Новой Зеландии. Там он получил ученую степень, представив диссертацию по магнетизму железа, получаемого при высокочастотных электрических разрядах. В 1894 г. он выиграл стипендию, которая позволяла ему продолжить занятия в Англии. История гласит, что он получил эту новость во время выкапывания картошки и воскликнул: «Это последняя картошка, которую я выкапываю в моей жизни»; после чего одолжил деньги на билет и отправился в 1895 г. в Кембридж, куда был принят студентом-исследователем в знаменитую Кавендишскую лабораторию, возглавляемую Дж. Дж. Томсоном, открывателем электрона.
Как раз до этого Кембриджский университет решил больше сосредоточиться на экспериментальных исследованиях, открывая лаборатории и для студентов из других университетах, среди которых первым был Резерфорд. Он быстро стал известен среди других соучеников, один из которых писал: «У нас здесь появился кролик от Антиподов, и он копает очень глубоко».
В Кембридже Резерфорд продолжил свои исследования магнетизма и получил интересные результаты по передаче и детектированию электромагнитных волн. Затем, после открытия (в 1895 г.) В. Рентгеном рентгеновских лучей, Резерфорд, с энтузиазмом и энергией, которые были отличительными чертами его характера, присоединился к Томсону в его исследованиях рентгеновских лучей, а позднее (1896 г.) радиоактивности. В эту область он внес фундаментальные вклады, работая сначала в Кембридже, а после 1898 г. в Монреале (Канада), где он был назначен профессором физики в университете МакГилла. Он выдвинул идею, что радиоактивность заключается в разрушении первоначальных атомов с превращением их в другие элементы. С помощью этой теории дезинтеграции он раскрыл природу явлений радиоактивности. Эта теория получила полное подтверждение экспериментами, которые он выполнил вместе с молодым сотрудником, химиком Фредериком Содди (1877-1956), который получил Нобелевскую премию по химии в 1921 г. «за его вклад в наши знания химии радиоактивных веществ и его исследования происхождения и природы изотопов». Эти эксперименты включали изучение природы излучений, испускаемых радиоактивными веществами, которые открыл Резерфорд и обозначил их как альфа- и бета-лучи (ядра гелия — альфа, электроны — бета). В 1907 г. Резерфорд возвратился в Великобританию в качестве профессора физики в Манчестере (занял эту позицию после Артура Шустера). В следующем году он получил Нобелевскую премию по химии «за его исследования по дезинтеграции элементов и химию радиоактивных веществ». Наконец, в 1911 г. в результате изучения рассеяния альфа-частиц в твердотельных мишенях он предложил планетарную интерпретацию атома. В 1919 г. он объявил о первом искусственном развале атомного ядра и занял после Дж. Дж. Томсона пост директора Кавендишской лаборатории. В 1914 г. он был возведен в рыцарское звание, в 1932 г. удостоился титула Барона Резерфорда Нельсона. В 1925— 1930 гг. он был президентом Королевского общества.
Когда он неожиданно умер от ущемления грыжи, его прах был похоронен в Вестминстерском Аббатстве, к востоку от захоронения Ньютона и рядом с лордом Кельвином, в присутствии короля и представителей правительства.
Резерфорд, который считается выдающейся фигурой в развитии физики, был человеком вулканической энергии, огромного энтузиазма, исключительной работоспособности и твердого здравого смысла. Один из его сотрудников сказал, что он является человеком «не симпатичным, но просто великим». Фальшивая скромность была неведома ему.
Рис. 16. Рисунок атома Резерфорда. Пример в отношении водорода. Электрон (отрицательный заряд) вращается вокруг ядра (положительный заряд) подобно вращению Земли вокруг Солнца
В 1911 г. он постулировал модель атома, в которой было, наконец, дано правильное распределение отрицательных (электронов) и положительных зарядов. С помощью эксперимента, который стал классическим в истории физики, он продемонстрировал, что сильная концентрация положительного заряда помещается в центральной области каждого атома, в которой также сосредоточена большая часть массы атома. Эта центральная часть, которая по размерам, по крайней мере, в 100 000 раз меньше, чем весь атом, и в настоящее время обозначается как атомное ядро. Отрицательный заряд, которым окружается ядро, образуется электронами, которые вращаются вокруг ядра под действием сил электрического взаимодействия. Поскольку атом в целом электрически нейтрален, общий заряд электронов, вращающихся вокруг ядра, должен быть равен положительному заряду ядра (рис. 16).
Атомы различных элементов содержат разное число электронов, вращающихся вокруг ядра. К этому заключению пришли последовательно, отталкиваясь от открытия Менделеевым: химические элементы можно расположить в последовательности с прогрессивно увеличивающимися атомными весами в таблице Менделеева так, что элементы со сходными химическими свойствами располагаются в одной определенной колонке. Позднее (1913 г.) английский физик Генри Г. Дж. Мозли (1887-1915), который погиб молодым в Галлиполи во время Первой мировой войны, выполнил серию экспериментов по рассеянию атомами рентгеновских лучей. Эти эксперименты позволили ему определить число электронов, которые содержит атом. Он показал, что перемещение одного элемента до другого соседнего в таблице Менделеева получается путем добавления электрона. Таким образом, было установлено, что число электронов в атоме конечно и много меньше, чем воображали. Водород является простейшим атомом с одним электроном, гелий имеет два, и т.д. вплоть до самого тяжелого элемента — урана, известного в то время, который содержит 92 электрона (сегодня искусственно создают атомы с числом электронов до 118).
Мы можем сказать, что эта модель атома подобна системе планет, вращающихся вокруг Солнца под действием сил всемирного тяготения, с важным отличием, которым нельзя пренебрегать. Электроны, которые вращаются вокруг ядра, несут электрический заряд и поэтому должны, согласно законам электромагнетизма Максвелла, испускать электромагнитные волны подобно антенне радиовещательной станции. Но поскольку эти «атомные антенны» много меньше, электромагнитные волны, испускаемые атомами, в миллиарды раз меньше тех, что испускаются обычной антенной. Эти волны лежат в видимом диапазоне, и их испускание делает тела светящимися.
Таким образом, согласно модели Резерфорда, электроны, которые вращаются вокруг ядра, должны испускать световые волны, и поскольку эти волны несут энергию, электроны будут терять свою кинетическую энергию из-за испускания ими излучения. Легко рассчитать, что если это так, то все электроны атома полностью потеряют свою кинетическую энергию за пренебрежимо малую долю секунды и должны упасть на поверхность ядра.
Однако наблюдения показывают, что это не так, и атомные электроны бесконечно долго вращаются вокруг ядра на относительно большом расстоянии от них. Вдобавок к этому противоречию с фундаментальной природой атома, имеется ряд других несоответствий между теоретическими предсказаниями и экспериментальными результатами. Например, опыт говорит, что атомы излучают свет только определенных цветов или длин волн (спектральные линии, которые обсуждались в главе 2), в то время как движение электрона в модели Резерфорда должно приводить к излучению всех цветов (т.е. всех длин волн).
Опыты Резерфорда по рассеянию альфа-частиц — урок. Физика, 9 класс.
Эксперимент по рассеиванию альфа-частиц
Открытие электрона, рентгеновского излучения и явления радиоактивности свидетельствовало о том, что представление об атоме как неделимой частице являлось неверным. К концу \(XIX\) века стало понятно, что атом должен иметь сложное строение. Большой вклад в изучение строения атома внёс физик-экспериментатор Эрнест Резерфорд.
Эрнест Резерфорд
В \(1904\) году Резерфорд начал свои эксперименты по бомбардировке альфа-частицами тонких металлических пластин (золотых и платиновых) для изучения структуры атомов, из которых состоят пластины.
Альфа-частица — ионизированный атом гелия.
Альфа-частица — это массивная (масса альфа-частицы в несколько тысяч раз больше, чем масса электрона) положительно заряженная частица. Заряд альфа-частицы в два раза больше элементарного заряда.
Схематично установка Резерфорда изображена на рисунке ниже.
В толстостенном свинцовом футляре (\(1\)) находится радиоактивное вещество (\(2\)), излучающее поток альфа-частиц. Через небольшое отверстие (\(3\)) поток альфа-частиц направляется на тонкую золотую фольгу (\(4\)) (толщиной порядка \(0,1\) мк). За фольгой располагается экран, покрытый сернистым цинком (\(5\)). При столкновении альфа-частицы на экране наблюдается вспышка.
Согласно модели строения атома по Томпсону, альфа-частицы должны столкнуться с большими плотными атомами и разлететься под разными углами. Однако опыт показал, что большинство альфа-частиц пролетают беспрепятственно через пластинку металла (\(6\)). И только небольшая часть всех альфа-частиц изменяет направление движения, отклоняясь на небольшие углы (\(7\)). А некоторые частицы и вовсе отлетают от фольги в обратном направлении (\(8\)).
Результаты опыта были удивительными. Только в \(1911\) году Резерфорд смог объяснить результаты опытов, предложив новую модель строения атома.
Ядерная модель строения атома
Так как большинство альфа-частиц свободно проходило через фольгу, это означало, что практически всё пространство, через которое проходит поток альфа-частиц, — это пустота. Где же тогда «спрятана» вся масса атома? Резерфорд предположил, что практически вся масса атома сосредоточена в очень маленьком объёме — ядре атома. Было очевидно, что ядро должно быть положительно заряжено. Когда альфа-частица пролетает достаточно близко от такого ядра, то из-за Кулоновских сил отталкивания происходит отклонение от первоначального направления движения частицы. А при столкновении с ядром частица отскакивает в обратном направлении. По расчётам Резерфорда, ядро атома должно было иметь размер примерно в \(3000\) раз меньший, чем атом. Остальное пространство атома должны занимать электроны.
Планетарная модель строения атома
Итак, стало понятно, что «пудинговая модель строения атома» неверна. На основе экспериментальных данных была предложена новая модель строения атома, которая получила название «планетарная модель строения атома».
Обрати внимание!
Согласно модели Резерфорда, атом состоит из очень маленького положительно заряженного ядра, размер которого в тысячи раз меньше самого атома, и электронов, которые вращаются вокруг ядра по круговым орбитам.
Модель очень напоминала модель строения Солнечной системы, где вокруг массивного Солнца по круговым орбитам вращаются планеты.
Таким образом, на основе планетарной модели можно было объяснить результаты опытов по рассеянию альфа-частиц. Однако объяснить стабильность атомов не удавалось. Движение электрона в атоме происходит с ускорением. В соответствии с классической электродинамикой это движение должно было сопровождаться излучением электромагнитных волн, в результате чего энергия электрона в атоме непрерывно уменьшалась бы. Электрон стал бы приближаться к ядру по спирали и должен был бы очень скоро упасть на него. Однако атомы стабильны. Следовательно, планетарная модель противоречила законам классической физики.
Ремесленник большой науки
Резерфорд был, по-видимому, последним представителем той эпохи в истории науки, когда ученый собственноручно создавал приборы для своих открытий. Сегодня, когда мы тратим миллиарды на megascience, поражает воображение, насколько простыми средствами вел Резерфорд штурм атомного мира, и делал это успешно. Он задавал природе прямые вопросы, и почему-то именно ему она с готовностью отвечала; правда, столь просто формулировать сложные вопросы мог только Резерфорд — казалось, он заранее знал ответ.
Его экспериментальные схемы легко объяснить школьнику, они могут показаться даже прямолинейными и безыскусными, ремесленными, что ли (его дед был шотландским колесным мастером, а отец — новозеландским фермером). Один из любимых учеников Резерфорда Петр Капица дал ему кличку «крокодил» — по всей вероятности, намекая на образ упрямого животного, которое никогда не поворачивает назад.
Изображение крокодила на стене Кавендишской лаборатории
Wikipedia
Новозеландский кролик
Резерфорд со времен своего новозеландского детства испытывал страсть ко всяческим механизмам: с упоением разбирал и собирал часы, строил с отцом водяные мельницы, а на втором курсе Кентерберийского университета воспроизвел прибор Герца для генерации электромагнитных волн. Примерно в это время его посетила странная, ни на чем не основанная идея, что все атомы состоят из одних и тех же элементарных составляющих, и он сделал об этом студенческий доклад, но был освистан. На самом деле Резерфорд воспроизвел давнюю гипотезу Уильяма Праута, что любой атом можно представить как соединение определенного количества одних и тех же элементарных атомов, которая была опровергнута более точным измерением атомных весов (об изотопах тогда еще не было известно). Но скепсис товарищей по учебе и преподавателей нимало не смутил Резерфорда — он решил, что докажет это экспериментально, а для этого нужно было попасть в место, где творится современная наука. Как ни странно, случай представился по окончании университета, когда он начал работать сельским учителем. Однажды, копая картошку после уроков с нерадивыми фермерскими детьми, Резерфорд узнал, что ему присудили премию для посещения физической столицы империи — Кембриджа.
Резерфорд отправился в Англию не с пустыми руками — в его чемодане помещался приемник радиоволн собственной конструкции, который сразу произвел впечатление на директора знаменитой Кавендишской лаборатории Дж. Дж. Томсона
В Англию Резерфорд отправился не с пустыми руками — в его чемодане помещался приемник радиоволн собственной конструкции, который сразу произвел впечатление и на директора знаменитой Кавендишской лаборатории Дж. Дж. Томсона, стоящего тогда на пороге открытия электрона, и на других коллег. Вскоре он блестяще подтвердил свою репутацию, установив устойчивую радиосвязь между Кавендишской лабораторией и расположенной в трех километрах от нее обсерваторией Кембриджского университета. Известна фраза, которую произнес по поводу появления Резерфорда в университете один кембриджский профессор: «К нам приехал новозеландский кролик из страны антиподов, и роет он глубоко».
Занятия радиосвязью Резерфорд прекратил после триумфа Маркони (о Попове широкая западная публика тогда ничего не знала). Дж. Дж. Томсон предложил заняться ионизацией газов только что открытыми рентгеновскими лучами, и Резерфорд согласился, дотошно изучив это явление. Сам Томсон как раз сделал эпохальное открытие, доказав, что катодные лучи — это поток частиц, переносящих элементарный отрицательный заряд, электронов. Он предположил, что атом представляет собой что-то вроде пудинга с изюмом — внутри положительно заряженной сферы помещено столько электронов, чтобы суммарный заряд всей системы был равен нулю. Что-то Резерфорду в этой схеме не понравилось, скорее всего ее умозрительность, — для окончательного ответа нужен был инструмент, позволяющий проникнуть внутрь атома, но тот продолжал казаться стабильным и непроницаемым.
Что-то Резерфорду в этой схеме не понравилось, скорее всего ее умозрительность — для окончательного ответа нужен был инструмент, позволяющий проникнуть внутрь атома, но атом продолжал казаться стабильным и непроницаемым
Неожиданный импульс поискам Резерфорда придало известие, пришедшее с другой стороны Ла-Манша: в Париже Анри Беккерель обнаружил неизвестное доселе излучение, испускаемое солями урана (сегодня это явление называется радиоактивностью). Французский физик сначала подумал, что имеет дело с рентгеновскими лучами, — это подтверждалось тем, что излучение солей урана тоже оказалось ионизирующим. Но Резерфорд «встал в охотничью стойку» и после серии опытов доказал, что радиоактивность состоит из потока разнозаряженных частиц — альфа и бета; позже к ним добавили гамма-излучение, которому Резерфорд поначалу не уделил должного внимания. Он доказал, что β-излучение — это поток открытых Томсоном электронов, а вот с положительно заряженными и более тяжелыми α-частицами все обстояло сложнее, и именно к ним исследователь проявил наибольший интерес, разглядев в них тот самый инструмент, с помощью которого можно проникнуть внутрь атома. Позже историки науки констатировали, что это была хоть и гениальная, но мало на чем основанная догадка.
Альфа-частицы — это ядра гелия
Проводя опыты по отклонению α-частиц в сильном магнитном поле, Резерфорд установил, что они несут положительный заряд и движутся со скоростью 2,5 × 109 сантиметров в секунду (примерно 1/10 скорости света). Был проведен удивительно простой и прямо ведущий к цели эксперимент.
Фѐдор Кедров Эрнест Резерфорд (Рождение ядерной физики). М., «Знание», 1980
Прибор, построенный Резерфордом (рис. 1), состоял из электроскопа (1), сделанного из полоски золотой фольги и помещенного над двадцатью металлическими пластинками (3), вертикально установленными в эбонитовом ящике. Щели между пластинками составляют всего один миллиметр; благодаря таким узким щелям α-частицы, испускаемые радиоактивным излучателем — радиевой солью (4), расположенным под пластинками на дне ящика, проходят в камеру электроскопа параллельным пучком. Через прибор по входной трубке (2) пропускается водород, который увлекает с собой накапливающийся в приборе радон. Водород вместе с радоном удаляется через выходную трубку (5). Благодаря непрерывному удалению радона увеличивается пробег α-частиц. Прикладывая сильное магнитное поле, направленное параллельно плоскостям пластинок (3), можно было почти полностью прекратить в камере электроскопа ионизацию, вызываемую электрическим зарядом α-частиц, то есть листочки электроскопа опадали. Именно так Резерфорд показал, что α-частицы — это быстродвижущиеся электрически заряженные частицы с большой энергией. Затем Резерфорд соединял пластинки (3) поочередно с противоположными полюсами электрической батареи. Теперь, закрывая щели между пластинками и наблюдая различную скорость происходящего при этом прекращения ионизации и направление, по которому происходит отклонение α-частиц, исследователь определил их скорость. Резерфорд определил и отношение заряда α-частиц к их массе; это указывало на то, что α-частицы, по-видимому, представляют собой дважды ионизованные атомы гелия.
Чтобы окончательно доказать, что он имеет дело с ядрами гелия, Резерфорд провел еще один простой и решающий эксперимент, поставив шах и мат скептикам.
Чтобы окончательно доказать, что он имеет дело с ядрами гелия, Резерфорд провел еще один простой и решающий эксперимент, поставив шах и мат скептикам
Запаянная стеклянная трубка (2) наполнена газом радоном (рис. 2). Толщина стенок этой трубки всего 0,01 миллиметра. Они достаточно тонкие, чтобы α-частицы, испускаемые радоном, могли проходить через них в трубку (3). Перед опытом из трубки (3) тщательно откачивался воздух. Однако через несколько дней после начала опыта, то есть наполнения трубки (2) радоном, исследователи обнаруживали в трубке (3) накопление какого-то газа. С помощью поднятия ртутного столбика газ сжимался в отростке (1), через который пропускался электрический ток. При этом наблюдались характерные желтые линии спектра гелия. В разрядной трубке действительно был гелий.
Планетарная модель ядра
Установив, что α-частицы — это ионизированные атомы гелия, Резерфорд решил бомбардировать ими различные вещества и посмотреть, что получится. Направляя пучок α-частиц на металлическую пластинку, Резерфорд решил проверить, а нет ли таких, что отражаются от нее. Вообще, это была странная идея — положительно заряженные частицы не должны были рассеиваться на пудингообразных нейтральных атомах Томсона, однако небольшая часть их отклонялась назад, как будто столкнулась с положительным ядром.
Фѐдор Кедров Эрнест Резерфорд (Рождение ядерной физики). М., «Знание», 1980
Идея этого примитивного эксперимента почему-то никому, кроме Резерфорда, в голову не пришла; между тем именно этот эксперимент доказал, что в центре атома находится небольшое положительное ядро и именно на нем рассеиваются α-частицы. Дальше Резерфорд предложил заменить «пудинг» своего учителя на атом, по структуре напоминающий Солнечную систему: положительно заряженное массивное ядро-солнце в центре и отрицательные электроны-планеты, вращающиеся вокруг него. С точки зрения классической электродинамики такая модель атома бессмысленна — вращающиеся по круговым орбитам электроны будут непрерывно излучать энергию, пока не упадут на ядро. Но Резерфорд был уверен в своей правоте — ведь простой эксперимент доказывал это. Понадобилось время, чтобы ученик Резерфорда Нильс Бор обосновал планетарную модель атома с помощью квантовой механики и все признали правоту и выдающуюся интуицию Резерфорда.
Далее были выдающиеся работы по трансмутации элементов, открытие учеником Резерфорда Джеймсом Чедвиком предсказанного учителем нейтрона и окончательное понимание того, что атомные ядра всех веществ состоят из одних и тех же элементов — протонов и нейтронов. Неудачное юношеское выступление Резерфорда было с блеском реабилитировано.
Резерфорд предложил заменить «пудинг» своего учителя на атом, по структуре напоминающий Солнечную систему: положительно заряженное массивное ядро-солнце в центре и отрицательные электроны-планеты, вращающиеся вокруг него
Но Резерфорд продолжал стремиться внутрь ядра, ломая его. Для этого были необходимы большие энергии, и он предложил своим ученикам построить первый в истории ускоритель частиц. До БАКа ему было далеко, и опять-таки удивляет безыскусность, ремесленничество этого пионерского проекта под руководством Резерфорда. Вот как вспоминает о создании этой прорывной установки Джон Кокрофт: «Мы сделали две колонки из стеклянных цилиндров от бензинового насоса, скрепили их между собой пластилином и откачали из них воздух, добившись очень большого разрежения. Одна из колонок давала весьма высокое напряжение, порядка 200 тысяч или 500 тысяч вольт. Вторая колонка служила нам в качестве атомной пушки. По ней двигались наши снаряды из атомов водорода, разгоняемые высоким напряжением, получаемым на второй колонке».
Надо сказать, что этот простой и четкий экспериментальный подход к решению самых приземленных задач Резерфорду довелось применять не раз. Например, он защитил одного предпринимателя, построившего электростанцию, от жителей близлежащих домов. Жители утверждали, что вибрация угрожает разрушением жилых строений. Резерфорд быстро придумал что-то вроде сейсмографа, который показал: если просто ходить туда-сюда по комнате, это дает большую амплитуду колебаний, чем турбины электростанции, запущенные на полную мощность, — и вопрос был снят. А во время Первой мировой войны физик оказал неоценимую услугу британскому ВМФ, соорудив пьезоэлектрический прибор, с большой точностью детектирующий акустические сигналы немецких подводных лодок.
Во время Первой мировой войны физик оказал неоценимую услугу британскому ВМФ, соорудив пьезоэлектрический прибор, с большой точностью детектирующий акустические сигналы немецких подводных лодок
Простота и оригинальность решений в прикладной области несли в себе черты того же исследовательского стиля Резерфорда, которым отмечены его великие фундаментальные открытия, заложившие основу современных представлений о строении вещества. Новозеландский кролик, кембриджский крокодил, потомок колесного мастера — этот человек сочетал какое-то звериное знание природы с умением смастерить из подручных средств выдающийся прибор, решающий самую сложную задачу.
модель Резерфорда | Определение и факты
Модель Резерфорда , также называемая атомной моделью Резерфорда, ядерным атомом или планетарной моделью атома , описание структуры атомов, предложенное (1911) физиком из Новой Зеландии Эрнестом Резерфордом. Модель описывала атом как крошечное плотное положительно заряженное ядро, называемое ядром, в котором сосредоточена почти вся масса, вокруг которого на некотором расстоянии циркулирует свет, отрицательные составляющие, называемые электронами, подобно планетам, вращающимся вокруг Солнца. .
Модель атома Резерфорда
Физик Эрнест Резерфорд представил атом как миниатюрную солнечную систему с электронами, вращающимися вокруг массивного ядра, и в основном как пустое пространство, причем ядро занимает лишь очень небольшую часть атома. Нейтрон не был открыт, когда Резерфорд предложил свою модель, в которой ядро состояло только из протонов.
Encyclopædia Britannica, Inc.
Популярные вопросы
Какая модель атома предложена Эрнестом Резерфордом?
У атома, по описанию Эрнеста Резерфорда, есть крошечное массивное ядро, называемое ядром.Ядро имеет положительный заряд. Электроны — это частицы с отрицательным зарядом. Электроны вращаются вокруг ядра. Пустое пространство между ядром и электронами занимает большую часть объема атома.
Что такое эксперимент Резерфорда с золотой фольгой?
В кусок золотой фольги попали альфа-частицы, имеющие положительный заряд. Большинство альфа-частиц прошли сквозь него. Это показало, что атомы золота в основном были пустым пространством. У некоторых частиц траектория искривилась под большими углами.Некоторые даже отскочили назад. Это могло произойти только в том случае, если бы внутри атома была небольшая тяжелая область положительного заряда.
Каковы были результаты эксперимента Резерфорда?
Предыдущая модель атома, модель атома Томсона или модель «сливового пудинга», в которой отрицательно заряженные электроны были подобны сливам в положительно заряженном пудинге атома, была опровергнута. Модель атома Резерфорда опиралась на классическую физику. Модель атома Бора, основанная на квантовой механике, построена на модели Резерфорда для объяснения орбит электронов.
Что правильно и неправильно в атомной модели Эрнеста Резерфорда?
Модель атома Резерфорда была верна в том, что атом в основном представляет собой пустое пространство. Большая часть массы находится в ядре, и ядро заряжено положительно. Вдали от ядра находятся отрицательно заряженные электроны. Но модель атома Резерфорда использовала классическую физику, а не квантовую механику. Это означало, что электрон, вращающийся вокруг ядра, испускал электромагнитное излучение. Электрон потеряет энергию и упадет в ядро.В модели Бора, использующей квантовую теорию, электроны существуют только на определенных орбитах и могут перемещаться между этими орбитами
Какое влияние оказала теория Эрнеста Резерфорда?
Эксперимент с золотой фольгой показал, что атом состоит из небольшого массивного положительно заряженного ядра с отрицательно заряженными электронами, находящимися на большом расстоянии от центра. Нильс Бор основывался на модели Резерфорда, чтобы создать свою собственную. В модели Бора орбиты электронов объяснялись квантовой механикой.
Ядро было постулировано как маленькое и плотное, чтобы объяснить рассеяние альфа-частиц на тонкой золотой фольге, как это наблюдалось в серии экспериментов, проведенных студентом Эрнестом Марсденом под руководством Резерфорда и немецкого физика Ганса Гейгера в 1909 году. источник, испускающий альфа-частицы (т.е. положительно заряженные частицы, идентичные ядру атома гелия и в 7000 раз более массивные, чем электроны), был заключен в защитный свинцовый экран. Излучение фокусировалось в узкий пучок после прохождения через щель в свинцовом экране.Перед щелью помещали тонкий срез золотой фольги, а экран, покрытый сульфидом цинка для придания ему флуоресценции, служил счетчиком для обнаружения альфа-частиц. Когда каждая альфа-частица попадала на флуоресцентный экран, он производил вспышку света, называемую сцинтилляцией, которую можно было увидеть в обзорный микроскоп, прикрепленный к задней части экрана. Сам экран был подвижным, что позволяло Резерфорду и его коллегам определять, отклоняются ли какие-либо альфа-частицы золотой фольгой.
Эксперимент Резерфорда с золотой фольгой
В 1909 году Резерфорд опроверг сэра Дж. Дж. Томсоновская модель атома как равномерно распределенного вещества. Поскольку лишь очень немногие из альфа-частиц в его луче рассеивались под большими углами после удара о золотую фольгу, в то время как большинство из них проходило полностью, Резерфорд знал, что масса атома золота должна быть сконцентрирована в крошечном плотном ядре.
Encyclopædia Britannica, Inc.
Большинство альфа-частиц проходят прямо через золотую фольгу, что означает, что атомы в основном состоят из открытого пространства.Некоторые альфа-частицы слегка отклонялись, что свидетельствовало о взаимодействии с другими положительно заряженными частицами внутри атома. Еще другие альфа-частицы были рассеяны под большими углами, а очень немногие даже отскочили обратно к источнику. (Позднее Резерфорд сказал знаменитую фразу: «Это было почти так же невероятно, как если бы вы выстрелили 15-дюймовым снарядом по куску папиросной бумаги, а он вернулся и попал в вас».) Только положительно заряженная и относительно тяжелая частица-мишень, такая как предполагаемое ядро, могло объяснить такое сильное отталкивание.Отрицательные электроны, которые электрически уравновешивают положительный заряд ядра, считались движущимися по круговым орбитам вокруг ядра. Электростатическую силу притяжения между электронами и ядром сравнивали с гравитационной силой притяжения между вращающимися планетами и Солнцем. Большая часть этого планетарного атома была открытым космосом и не оказывала сопротивления прохождению альфа-частиц.
Модель Резерфорда вытеснила атомную модель «сливового пудинга» английского физика сэра Дж.Дж. Томсона, в котором электроны были погружены в положительно заряженный атом, как сливы в пудинге. Основанная полностью на классической физике, сама модель Резерфорда через несколько лет была заменена атомной моделью Бора, которая включала некоторую раннюю квантовую теорию.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Редакторы Encyclopaedia Britannica. Последней редакцией и обновлением этой статьи был Эрик Грегерсен, старший редактор.
Узнайте больше в этих связанных статьях Britannica:
Атомная модель Резерфорда | Химия для неосновных специалистов
Цели обучения
- Опишите эксперимент Резерфорда с золотой фольгой.
- Опишите ядерную модель атома.
Сколько места занимают кирпичи?
Когда мы смотрим на окружающий мир, он выглядит довольно солидно. Мы ударяемся рукой о стену, и рука останавливается — она (обычно) не проходит сквозь стену. Мы думаем о материи как о занимающем пространство. Но в материи много пустого места. На самом деле большая часть материи — это пустого места.
Эксперимент с золотой фольгой
В 1911 году Резерфорд и его коллеги Ханс Гейгер и Эрнест Марсден инициировали серию новаторских экспериментов, которые полностью изменили принятую модель атома.Они бомбардировали очень тонкие листы золотой фольги быстро движущимися альфа-частицами . Альфа-частицы, тип естественных радиоактивных частиц, представляют собой положительно заряженные частицы с массой, примерно в четыре раза превышающей массу атома водорода.
Рис. 1. (A) Экспериментальная установка для эксперимента Резерфорда с золотой фольгой: радиоактивный элемент, испускавший альфа-частицы, был направлен на тонкий лист золотой фольги, окруженный экраном, который позволял обнаруживать отклоненные частицы.(B) Согласно модели сливового пудинга (вверху) все альфа-частицы должны были пройти через золотую фольгу с небольшим отклонением или без него. Резерфорд обнаружил, что небольшой процент альфа-частиц отклоняется на большие углы, что можно объяснить атомом с очень маленьким плотным положительно заряженным ядром в центре (внизу).
Согласно принятой атомной модели, в которой масса и заряд атома равномерно распределены по всему атому, ученые ожидали, что все альфа-частицы пройдут через золотую фольгу с небольшим отклонением или вообще без него.Удивительно, но хотя большинство альфа-частиц действительно не отклонялось, очень небольшой процент (примерно 1 из 8000 частиц) отскакивал от золотой фольги под очень большими углами. Некоторых даже перенаправили обратно к источнику. Никакие предварительные знания не подготовили их к этому открытию. В известной цитате Резерфорд воскликнул, что это было «как если бы вы выстрелили 15-дюймовым [артиллерийским] снарядом по куску папиросной бумаги, а он вернулся и попал в вас».
Резерфорду нужно было предложить совершенно новую модель атома, чтобы объяснить свои результаты.Поскольку подавляющее большинство альфа-частиц прошло через золото, он рассудил, что большая часть атома представляет собой пустое пространство. Напротив, сильно отклоненные частицы должны были испытать чрезвычайно мощную силу внутри атома. Он пришел к выводу, что весь положительный заряд и большая часть массы атома должны быть сосредоточены в очень маленьком пространстве внутри атома, которое он назвал ядром. Ядро — крошечное плотное центральное ядро атома, состоящее из протонов и нейтронов.
Атомная модель Резерфорда стала известна как ядерная модель . В ядерном атоме протоны и нейтроны, составляющие почти всю массу атома, расположены в ядре в центре атома. Электроны распределены вокруг ядра и занимают большую часть объема атома. Стоит подчеркнуть, насколько маленькое ядро по сравнению с остальной частью атома. Если бы мы могли взорвать атом до размеров большого профессионального футбольного стадиона, ядро было бы размером с шарик.
Модель Резерфорда оказалась важным шагом на пути к полному пониманию атома. Однако он не полностью рассматривал природу электронов и то, как они занимали огромное пространство вокруг ядра. Только несколько лет спустя было достигнуто полное понимание электрона. Это оказалось ключом к пониманию химических свойств элементов.
Посмотрите видео, объясняющее эксперимент с золотой фольгой:
Сводка
- Бомбардировка золотой фольги альфа-частицами показала, что некоторые частицы отклоняются.
- Ядерная модель атома состоит из небольшой и плотной положительно заряженной внутренней части, окруженной облаком электронов.
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://www.icbse.com/topics/rutherfords-model-atom
- Какой толщины была золотая фольга?
- Какой альфа-источник он использовал?
- Сколько было отклонено назад?
- В чем заключался один недостаток теории Резерфорда?
Обзор
- Когда Резерфорд и его коллеги провели свое исследование?
- Что такое альфа-частица?
- Как Резерфорд объяснил наблюдение, что большинство альфа-частиц проходят прямо через золотую фольгу?
- Что он сказал об отклоненных частицах?
- Опишите ядерную модель Резерфорда.
Глоссарий
- альфа-частица: Тип естественной радиоактивной частицы, положительно заряженные частицы с массой примерно в четыре раза больше массы атома водорода.
- Ядерная модель : Ядерная модель атома состоит из небольшой и плотной положительно заряженной внутренней части, окруженной облаком электронов.
История открытия ядра | Разделы | Американский институт физики
Резерфорд в Манчестере, 1907–1919 гг.
Эрнест Резерфорд открыл ядро атома в 1911 году.Мы читаем об этом в учебниках и в популярных произведениях. Но что означает это заявление? Географическое открытие обычно означает, что человек видит место впервые. Но может ли открытие быть таким же для царства, скрытого от глаз? В этом смысле нельзя увидеть атом. Это намекает на то, что, возможно, история открытия ядра была более сложной. История, развернувшаяся в лаборатории Резерфорда в Манчестерском университете, вращалась вокруг реальных людей. Это было связано с разочарованиями и победами.Это было связано с тяжелым трудом, недоумением и вдохновением.
Когда Резерфорд стал профессором Манчестера в 1907 году, он нашел современные лаборатории как для преподавания, так и для исследований. По настоянию его предшественника Артура Шустера было собрано более 40 000 фунтов стерлингов для финансирования программы по физике. Для сравнения: щедрая зарплата Резерфорда составляла 1600 фунтов стерлингов в год. Предоставлено: Из книги: Физические лаборатории Манчестерского университета: отчет о 25-летней работе Манчестерского университета, Манчестер: в University Press, 1906.AIP Эмилио Сегре Визуальные архивы, Коллекция хрупких книг.
Резерфорд прибыл в Манчестер летом 1907 года, за несколько месяцев до начала семестра в университете. Его назвали профессором физики Лэнгуорти, преемником Артура Шустера (1851–1934), который вышел на пенсию в возрасте 56 лет, чтобы нанять Резерфорда. Шустер построил современный физический корпус, нанял Ханса Гейгера, доктора философии. (1882–1945) благодаря своим экспериментальным способностям и обеспечил новую должность в математической физике, чтобы завершить полную физическую программу.Резерфорд вошел в центр мира физики. Исследователи приходили к нему десятками.
Прослушать голосовой фрагмент
Для прослушивания этого аудиоклипа необходимо установить Flash Player.
Я нашел квартиру Резерфорда очень занятой, усердно работающей. Но очень грязное место. А именно, Манчестер очень туманный, туманный и дымный. И, конечно же, везде дым, везде дым. Теперь в лаборатории Резерфорда использовали электроскоп.Вы должны построить его самостоятельно из коробок с какао, сусального золота и изоляции серы. А электроскоп заряжаешь сургучом, которым натираешь брюки. Так что это была очень примитивная техника. Но, конечно же, микроскоп для чтения электроскопа. Теперь микроскоп был закреплен, и тогда нельзя было его трогать. И, конечно, вы не должны были его чистить. Так проходили годы без чистки аппаратов. Но не считая недостатков, это была прекрасная лаборатория, хорошие комнаты, и там работало много людей — способных людей…. Я очень хорошо помню Мозли, с которым мы были в очень дружеских отношениях. О его творчестве я расскажу позже. И Чарльз Дарвин был там. Он читал лекции по теоретической физике. И Рассел, который позже приехал в Оксфорд. Итальянец Росси проделал спектроскопическую работу. Он показал, что ионий и натрий имеют одинаковый спектр. А потом был Гейгер. Он был помощником. А также помощник по имени Маковер, который умер с тех пор. Гейгер и Маковер вместе издали книгу. А также парень Робинсон, который работал над бета-лучами.Грей, новозеландский мужчина. Марсден, приехавший из Австралии. Фаяны, приехавшие из Германии. И Болтвуд был там какое-то время. Он приехал из Йеля. Резерфорд пригласил его в надежде, что Болтвуд, великий химик, очистит ионий, но он потерпел неудачу, как и многие другие.
Резерфорд прибыл, имея в виду множество исследовательских вопросов. Он не закончил разгадывать загадки распадающихся семейств тория, радия и т. Д., Но он передал большую часть этой работы Болтвуду, Хану и Содди. Болтвуд и Хан оба работали с Резерфордом в Манчестере, Болтвуд в 1909–1910 годах и Хан в 1907–1908 годах.Резерфорд постепенно обращал свое внимание гораздо больше на сами лучи α (альфа), β (бета) и γ (гамма) и на то, что они могут раскрыть об атоме. То есть он оставил радиохимию другим и обратился к физике.
Резерфорд всегда собирал вокруг себя группу талантливых молодых исследователей. На этой групповой фотографии 1910 года — Эрнест Марсден и Ханс Гейгер. Спереди и в центре — профессора Шустер и Резерфорд, а в центре сзади — Уильям Кей, талантливый и услужливый управляющий лабораторией.Предоставлено: Дж. Б. Биркс, изд., Резерфорд в Манчестере, (Лондон: Heywood & Co., 1962), напротив стр. 38.
В раннюю команду Резерфорда в Манчестере входили Гейгер и Уильям Кей (1879–1961), младший лаборант с 1894 года. Резерфорд повысил Кея до стюарда лаборатории в 1908 году, чтобы управлять лабораторным оборудованием и помогать ему в его исследованиях. В 1957 году Кей вспомнил свою молодость с Резерфордом в интервью. Язык необычный, но описание максимально приближено к подходу Резерфорда.Спрашивал Сэмюэл Девонс (1914–2006), который был одним из последних учеников Резерфорда в 1930-х годах.
[Девонс] «Когда вы были здесь [в Манчестере], в то время … Резерфорд действительно делал какие-нибудь аппараты сам?»
[Кей] «Нет, нет, нет, нет. Раньше я настраивал почти весь его аппарат. Знаете, когда он делал свою работу, знаете, чаще всего он мне рассказывал, и мы проводили грубый эксперимент, повторно … »
[Д.] «Он набросал то, что хотел?»
[K.] «Ну, он сказал бы вам, что хотел, грубо, понимаете, но он позволил вам сделать то, что вы хотите, понимаете, он сказал вам, что он собирался сделать, Понимаете, это было очень хорошо. Он дает вам ……… он многому вас научил, и вы знали, что делать, а чего не делать. А затем мы проводили грубый эксперимент и получали одну или две кривые, которые вы видите, а затем сразу же переключали их на кого-то другого, чтобы он проделал настоящую работу, и вот как он делал свое…….. напал на эти мелочи, понимаете.
[D.] «Он сам опробовал их первым?»
[K.] «Он сам проводил грубый эксперимент над мелочами, понимаете, а затем передавал его кому-нибудь …» (цитируется по Hughes, стр. 104)
Ганс Гейгер был главным партнером Резерфорда в исследованиях альфа-лучей с 1907 по 1913 год. Вместе они разработали несколько способов обнаружения альфа-лучей. Они доказали, что альфа-лучи — это дважды ионизированные ядра гелия.Ca. 1908. Предоставлено: AIP Эмилио Сегре Visual Archives, Physics Today Collection.
Резерфорд и Ганс Гейгер тесно работали в 1907 и 1908 годах над обнаружением и измерением α частиц. Если бы они использовали α частицы для зондирования атома, им нужно было сначала узнать больше об этих частицах и их поведении. Резерфорд попытался подсчитать α частицы, но безуспешно.
Год спустя в Манчестере ему и Гейгеру удалось двумя методами наблюдать α частицы.Первый метод заключался в сцинтилляции, возбуждаемой α частицами на тонком слое сульфида цинка. Они наблюдали их через микроскоп и подсчитывали сцинтилляции при разных углах рассеяния. Они также разработали «электрометр», который мог продемонстрировать прохождение отдельной частицы α большой аудитории. Инструмент, который превратился в «счетчик Гейгера», имел частично откачанный металлический цилиндр с проволокой в центре. Они приложили напряжение между цилиндром и проводом, достаточно высокое, чтобы вызвать искру.Они пропустили α частицы через тонкое слюдяное окно, где эти частицы сталкивались с газами, образуя ионы газа. Затем они столкнулись с другими молекулами и образовали больше ионов и так далее. Каждая частица α образовывала каскад ионов, которые частично разряжали цилиндр и указывали на прохождение частицы α . Гейгер и Резерфорд опубликовали несколько статей в 1908 и 1909 годах об этих методах и их использовании.
Резерфорд написал Генри Бамстеду (1870–1920), американскому физику, 11 июля 1908 г .:
Гейгер — хороший человек и работал как раб.Я никогда не смог бы найти время для тяжелой работы, пока мы не наладили бы дела в хорошем стиле. Наконец-то все прошло хорошо, но черт рассыпается. Наша трубка работала как шарм, и мы могли легко получить дальность хода до 50 мм. для каждой частицы. … Гейгер — демон, который подсчитывает мерцания, и может считать с интервалами в течение всей ночи, не нарушая своего хладнокровия. Я чертовски энергично удалился через две минуты. (Цит. У Евы, стр. 180.)
Хотя Резерфорд подозревал еще в 1906 году, что α частицы были атомами гелия, лишенными своих электронов, он потребовал строгих доказательств.Одного эксперимента было недостаточно. Одного детектора было недостаточно. Он хотел больше доказательств. Для этого Резерфорд хотел «больших напряжений» и больших электромагнитов, чтобы отклонить α частиц, но этот метод еще не созрел. Стюард лаборатории Уильям Кей напомнил в цитируемом интервью устной истории, что Резерфорд в 1908 году настаивал на необходимости сильных электрических и магнитных полей для более точного измерения заряда и массы частиц α и β :
И вот кем он был все время.Это то, что он получил в Кембридже [после 1919 года], чего у нас здесь не было, понимаете, потому что у нас не было денег. (Хьюз, «Уильям Кей», 2008 г., стр. 109–110.)
Кей сказал, что Резерфорду нужен большой магнит с водяным охлаждением, но он «уронил его, как горячий пирог», когда узнал его стоимость. Так что ему требовалась новая линия атаки. Новая линия была очень простой, химическая процедура смешивалась с физикой. Для этой работы Резерфорд нанял Томаса Ройдса (1884–1955), который получил диплом с отличием по физике в 1906 году.Они собрали α частицы в герметичную стеклянную трубку, сжали их и пропустили через нее электрическую искру. Они изучили излучаемый свет с помощью спектроскопа и обнаружили, что он идентичен спектру гелия. Через несколько месяцев Резерфорд был удостоен Нобелевской премии по химии «за исследования распада элементов и химии радиоактивных веществ». (Нобелевская цитата) Резерфорд и Ройдс установили идентичность и основные свойства α частиц.Затем Резерфорд обратил свое внимание на их использование для исследования атома.
Осенью 1908 г. началась важная серия исследований. Гейгер пропускал лучи из α частиц через золотую и другие металлические фольги, используя новые методы обнаружения, чтобы измерить, насколько эти лучи рассеиваются атомами в фольге. Гейгер подумал, что Эрнест Марсден (1889–1970), 19-летний студент с отличием по физике, был готов помочь в этих экспериментах, и предложил это Резерфорду.Поскольку Резерфорд часто подталкивал студентов третьего курса к исследованиям, говоря, что это лучший способ изучить физику, он с готовностью согласился.
Этот набросок из статьи Гейгера и Марсдена 1909 года показывает коническую стеклянную трубку, полную «излучения радия» (радона), закрытую в точке B тонкой пластиной из слюды. Это был их источник альфа ( α ) частиц. S представляет собой экран из сульфида цинка, который мерцает при ударе частицей α . P представлял собой свинцовый экран, который блокировал перемещение любых частиц α непосредственно на экран из сульфида цинка.RR представлял собой фольгу (или фольгу) из различных металлов (включая золото), которая «диффузно отражала» падающие α частицы. Гейгер и Марсден наблюдали образовавшиеся сцинтилляции с помощью микроскопа M. Авторы и права: Х. Гейгер и Э. Марсден, «О диффузном отражении α -частиц», Proceedings of the Royal Society , 1909, 82: 495–500.
Гейгер и Марсден начали с малоугловой дисперсии и попробовали фольгу различной толщины, пытаясь найти математические соотношения между дисперсией и толщиной фольги или числом пройденных атомов.Позже Марсден вспоминал, что Резерфорд сказал ему во время этих экспериментов: «Посмотри, сможешь ли ты получить какой-нибудь эффект, когда альфа-частицы отражаются непосредственно от металлической поверхности». (Сообщено Марсденом в Birks, 1962, стр. 8). Марсден сомневался, что Резерфорд ожидал обратного рассеяния α частиц, но, как писал Марсден,
… это было одно из тех «предчувствий», что, возможно, может наблюдаться какой-то эффект, и что в любом случае соседнюю территорию с землей Тома Тиддлера можно будет исследовать с помощью разведки.Резерфорд всегда был готов встретить неожиданное и использовать его там, где это было выгодно, но он также знал, когда остановиться на таких экскурсиях. (Биркс, 1962, с. 8)
Это был игривый подход Резерфорда в действии. Его ученики и другие люди опробовали его идеи, многие из которых зашли в тупик. Однако эта идея искать обратное рассеяние α частиц оправдала себя. Резерфорд писал:
Эксперимент, направляемый дисциплинированным воображением отдельного человека или, что еще лучше, группы людей с различным умственным мировоззрением, способен достичь результатов, которые далеко превосходят только воображение величайшего философа.(Цит. По Eve, 1939, Frontmatter)
Спустя некоторое время, в 1908 или 1909 году, Марсден сообщил о своих результатах Резерфорду. Резерфорд вспоминал об этом несколько иначе:
Я помню … позже Гейгер пришел ко мне в большом волнении и сказал: «Мы смогли получить некоторые из α -частиц, летящих назад …» Это было самое невероятное событие, которое когда-либо происходило. меня в моей жизни. Это было почти невероятно, как если бы вы выстрелили 15-дюймовым снарядом по куску папиросной бумаги, а он вернулся и попал в вас.( Резерфорд , 1938, стр. 68)
Человеческая память подвержена ошибкам. Говорил ли Марсден или Гейгер Резерфорду, эффект был одинаковым. Резерфорд сказал, что они должны подготовить публикацию об этом исследовании, которое они представили в мае 1909 года. Более того, это заставило Резерфорда задуматься о том, что в конечном итоге, почти два года спустя, он опубликовал как теорию атома.
Чем занимался Резерфорд остаток 1909 года и весь 1910 год? Во-первых, его близкий друг Болтвуд был в Манчестере в течение учебного года, работая с Резерфордом над продуктами радиоактивного распада радия.Он также рассматривал более ранние идеи об атомной структуре и говорил о них. Что наиболее важно, он систематически разбирал явление рассеяния α частиц и тестировал каждую деталь. Резерфорд не сразу придумал свою смелую идею — ядерный атом, но пришел к ней постепенно, рассматривая проблему со всех сторон.
Осенью 1910 года он привез Марсдена обратно в Манчестер, чтобы завершить тщательную экспериментальную проверку своих идей с помощью Гейгера. Они повторно установили уровни выбросов и диапазоны α частиц радиоактивными источниками, а также повторно изучили свой статистический анализ.Резерфорд попытался согласовать результаты рассеяния с различными моделями атомов, особенно с моделью Дж. Дж. Томсона, в котором положительное электричество считалось распределенным равномерно по всей сфере атома.
Страница ранних, недатированных (1910 или 1911) черновых заметок Резерфорда. Первые несколько строк гласили: «Теория строения атома. Предположим, что атом состоит из + заряда ne в центре & — заряда, поскольку электрон распределен по сфере радиуса r». Затем он обрисовал в общих чертах идеи о вычислении силы отклонения заряженной частицы, проходящей близко к этому заряженному центру.Предоставлено: Дж. Б. Биркс, изд., Резерфорд в Манчестере, (Лондон: Heywood & Co., 1962), стр. 70.
В какой-то момент зимой 1910–1911 годов Резерфорд разработал основную идею атома с «заряженным центром». Как отметили Гейгер и Марсден в своей статье 1909 года:
Если принять во внимание высокую скорость и массу α -частицы, кажется удивительным, что некоторые из α -частиц, как показывает эксперимент, могут быть повернуты в пределах слоя 6 x 10 -5. см.золота на угол 90 ° и даже больше. Чтобы произвести аналогичный эффект с помощью магнитного поля, потребуется огромное поле в 109 абсолютных единиц. (Биркс, стр.179)
Резерфорд в своей статье в мае 1911 г. пришел к выводу, что такое замечательное отклонение пути массивной заряженной частицы может быть достигнуто только в том случае, если большая часть массы, скажем, атома золота и большая часть его заряда будут сосредоточены в очень маленьком центральном элементе. тело. Примечание: на тот момент в 1911 году Резерфорд не называл это ядром.«
Послушайте, как Чедвик расскажет о первом публичном заявлении Резерфорда
Для прослушивания этого аудиоклипа необходимо установить Flash Player.
Первое публичное заявление о ядерной теории Резерфорда было сделано на собрании Манчестерского литературно-философского общества, и он пригласил нас, молодых людей, пойти на собрание. Он сказал, что хочет сказать несколько интересных вещей и подумал, что мы хотели бы их услышать.В то время мы не знали, о чем это было. Конечно, Гейгер и Марсден знали, что знали пожилые люди в лаборатории, потому что они уже проводили эксперименты. Фактически, Резерфорд никогда не упоминал об этом публично, если они не сделали того, что было достаточным для того, чтобы иметь решающее значение. И, конечно же, Дарвин знал об этом намного раньше. Но это должно было быть в начале 1911 года, и мы пошли на собрание, и он рассказал нам. И тогда он упомянул, что были некоторые экспериментальные доказательства, полученные Гейгером и Марсденом.Насколько я помню, он не сказал больше о результатах, кроме того, что они были решающими. И, как я уже говорил, он никогда бы не сделал публичного заявления такого рода, если бы у него не было веских доказательств. И это одна из характеристик, которая пронизывает все работы Резерфорда, особенно все его работы до конца манчестерского периода. Если вы посмотрите на некоторые из его работ в первые дни — я называю МакГилла первые дни — он был вполне убежден, что альфа-частицы были атомами гелия, но он никогда не говорил этого в этих словах.Он всегда говорил, что это либо атомы гелия, либо молекулы водорода, или, возможно, он мог сказать что-то еще в этом роде. Для него было весьма характерно то, что он никогда не говорил, что это так, если бы у него не было экспериментальных доказательств этого, которые действительно его удовлетворили.
Фактически, Резерфорд был чрезвычайно осторожен, делая выводы об этом центральном заряде: «Простой расчет показывает, что атом должен быть центром сильного электрического поля, чтобы вызвать такое большое отклонение при одном столкновении.»(Биркс, стр. 183). Он быстро и примерно пришел к выводу, что несколько количественных соотношений должны быть верными, если эта основная теория верна. Во-первых, количество рассеянных под заданным углом α частиц должно быть пропорционально толщине фольги. Во-вторых, это число должно быть пропорционально квадрату заряда ядра. Наконец, она должна быть обратно пропорциональна четвертой степени скорости частицы α . Эти три идеи составили экспериментальную программу Гейгера и Марсдена на следующий год.
Послушайте, как Чедвик говорит об интересе Резерфорда к исследованиям
Для прослушивания этого аудиоклипа необходимо установить Flash Player.
Резерфорд тогда почти полностью интересовался исследованиями. Он очень мало преподавал в Макгилле. Он был профессором-исследователем. Я предполагаю, что он читал какие-то лекции, но их было бы очень мало. И его интерес, естественно, был в исследовательской сфере. Он действительно читал несколько лекций, но элементарных лекций — такого рода вещи, которые вы ожидаете от человека, должны знать до того, как он приедет в университет.Это были лекции для инженеров. Они были хулиганами, и Резерфорд мог держать их под контролем. Возможно, в отделе был только один человек, который мог бы это сделать, и ему (Резерфорду?) Они понравились, потому что он смог показать им очень интересные эксперименты, которые можно проводить на начальных курсах.
Мне часто говорили, что Резерфорд был плохим лектором. Никогда не слышал такой ерунды. Совершенно верно, что иногда он бывал немного скучным, немного запутанным, но это было только в очень редких случаях.Были и другие случаи, когда он действительно был наиболее возбуждающим. Он вызвал огромный энтузиазм.
Резерфорд допускал возможность отрицательного заряженного центра. Сегодня это звучит странно, так что же сделало это разумным? Во-первых, она не сильно отличалась от модели Томсона. Во-вторых, поскольку Резерфорд знал, что α частицы несут двойной заряд +, он подумал, что это может действовать так же, как Солнце на комету, движущуюся рядом с ним.Он будет направлять частицу α назад и назад к ее источнику. Он также рассмотрел почти забытую модель, предложенную японским физиком Хантаро Нагаока (1865–1950) — модель Сатурна. Нагаока и Резерфорд контактировали в 1910 и 1911 годах, и Резерфорд упомянул модель Нагаоки о «центральной притягивающей массе, окруженной кольцами вращающихся электронов» (Биркс, стр. 203). Конечным результатом этой критической статьи Резерфорда, однако, стало заявление Резерфорда о том, что независимо от того, был ли атом диском или сферой и действительно был ли центральный заряд положительным или отрицательным, не повлияет на расчеты.Резерфорд всегда старался не требовать большего, чем его результаты могли подтвердить.
В теперь известной работе Резерфорда от мая 1911 года о рассеянии альфа-частиц золотой фольгой он включил этот набросок гиперболического пути частицы. Авторы и права: Э. Резерфорд, «Рассеяние α и β частиц веществом и структура материи», Philosophical Magazine , 1911, 21: 669–688.
Резерфорд действительно видел возможные проверки природы центрального заряда. По его словам, поглощение β частиц должно отличаться с отрицательным центром и положительным.Положительный центр объясняет огромную скорость, которую α частицы достигают во время излучения радиоактивных элементов. Но это были только намеки.
Эта схема представляет собой усовершенствованные эксперименты 1912–1913 годов, проведенные Гейгером и Марсденом. R был источником альфа-частиц, E — золотой фольгой, а M — микроскопом, вращающимся вокруг вертикальной оси с центром на золотой фольге. Альфа-частицы от источника проходили через диафрагму D, рассеивались фольгой и наблюдались в виде сцинтилляций на экране S.Гейгер и Марсден наблюдали углы рассеяния частиц, вращая сборку экрана микроскопа. Авторы и права: Х. Гейгер и Э. Марсден, «Законы отклонения α частиц на большие углы», Philosophical Magazine , 1913, 25: 604–623.
Гейгер и Марсден действительно систематически работали над проверяемыми выводами гипотезы о центральном заряде Резерфорда. Первая крупная публикация их результатов была на немецком языке в журнале Proceedings Венской академии наук ( Sitzungberichte der Wiener Akademie der Wissenschaften) в 1912 году.За этой 30-страничной версией в 1913 году последовала версия на английском языке в Philosophical Magazine: «Законы отклонения частиц α под большими углами». Английская версия является наиболее известной. Небольшие различия между ними привели одного историка к предположению, что Резерфорд принял решение в пользу положительно заряженного центра к августу 1912 года (Trenn, 1974). Другие члены команды Резерфорда, особенно Чарльз Гальтон Дарвин (1887–1962), H.G.J. Мозли (1887–1915) и Нильс Бор (1885–1962) сыграли важную роль в окончательном создании ядерного атома Резерфорда.
Молодой Генри Дж. Дж. Мозли, в лаборатории Баллиола-Тринити, Оксфорд, ок. 1910. Позже в том же году Мозли начал исследования в манчестерской лаборатории Резерфорда. Его блестящая карьера была прервана во время Первой мировой войны. Авторы и права: Оксфордский университет, Музей истории науки, любезно предоставлено AIP Emilio Segrè Visual Archives, Physics Today, Collection.
«Великая война» полностью нарушила работу манчестерского департамента Резерфорда. Бор вернулся в Данию. Марсден принял профессуру в Новой Зеландии.Мозли погиб в битве при Галлиполи. Джеймс Чедвик (1891–1974), который работал с Гейгером в Техническом университете Берлина, когда разразилась война, провел несколько лет в лагере для военнопленных Рухлебен. Другие студенты тоже ушли на войну, и Резерфорд посвятил много энергии мобилизации науки для военных действий и, в частности, противолодочным методам.
Нильс Бор впервые работал с Резерфордом в здании
в Манчестере в 1912 году. На этой фотографии изображены молодые Нильс и Маргрет Бор, ок.1914 г., когда Бор сменил Чарльза Гальтона Дарвина в качестве читателя Шустера по математической физике в Манчестере. Предоставлено: AIP Визуальный архив Эмилио Сегре, коллекция Маргрета Бор.
На этом отвлеченном фоне Резерфорд и его лаборант Уильям Кей в 1917 году начали исследовать прохождение α частиц через водород, азот и другие газы. Когда закончилась Великая война, Эрнест Марсден ненадолго помог с утомительными сцинтилляционными наблюдениями, которые дали ключ к разгадке природы ядра.Резерфорд сообщил о предварительных результатах этих обширных экспериментов в 1919 году. Резерфорд поместил источник радия C (висмут-214) в герметичный латунный контейнер, приспособленный так, чтобы положение источника могло быть изменено и чтобы можно было вводить различные газы или по желанию создавался вакуум. Частицы α пересекли внутреннюю часть контейнера, прошли через щель, покрытую серебряной пластиной или другим материалом, и попали на экран из сульфида цинка, где в затемненном помещении наблюдали сцинтилляцию.Когда газообразный водород был введен в контейнер и были приняты меры для поглощения α частиц до того, как они попадут на экран, сцинтилляции все еще наблюдались. Резерфорд утверждал, что, проходя через газообразный водород, частицы α иногда сталкивались с ядрами водорода. Как писал Резерфорд, это произвело «быстрые атомы водорода», которые в основном проецировались вперед в направлении первоначального движения частиц α .
Во время этих экспериментов Резерфорд имел в виду несколько тонких вопросов, в основном связанных с природой ядра.Он попросил своего коллегу Дарвина проанализировать эти столкновения на основе «простой теории» упругих столкновений между точечными ядрами, отталкиваемыми по закону обратных квадратов, при этом α частицы несут заряд, в 2 раза превышающий заряд электрона (и противоположного знака). ) и ядра водорода 1 раз. Дарвин обнаружил, что все α частицы, приближающиеся в пределах 2,4х10 -13 см, будут производить «быстрый атом водорода». Однако эта простая теория предсказывала гораздо меньше ускоренных атомов водорода, чем наблюдалось в экспериментах.
Резерфорд отверг объяснения этой дисперсии, основанные на различных зарядах частиц или иных законах, чем законы обратных квадратов. Скорее, он пришел к выводу, что для расстояний порядка диаметра электрона «структура ядра гелия больше не может рассматриваться как точка…». Он утверждал, что ядро гелия ( α частица) имеет сложную структуру из четырех ядер водорода плюс двух отрицательно заряженных электронов. (Мы бы сказали, что он состоит из двух протонов.Резерфорд пришел к выводу, что деформация сложных ядер во время столкновений была более вероятным объяснением, поскольку изменение сил между ядрами сложным образом изменяется при близком сближении.
Принимая во внимание сильные силы, возникающие при таких столкновениях, неудивительно, если бы ядро гелия распалось. Никаких доказательств такого распада … не наблюдалось, что указывает на то, что ядро гелия должно быть очень стабильной структурой.
Мы должны помнить, что Резерфорд не мог напрямую наблюдать структуру ядра, поэтому его выводы были предварительными.Тем не менее он открыто рассматривал возможности сложного ядра, способного к деформации и даже к возможному распаду. Эти мысли сформировали этот напряженный период экспериментальных исследований.
3.4: Эксперимент Резерфорда — Ядерная модель атома
Электрон был открыт Дж. Дж. Дж. Томсоном в 1897 году. Было также известно о существовании протонов и нейтральном заряде атомов. Поскольку нетронутый атом не имел суммарного заряда, а электрон и протон имели противоположные заряды, следующим шагом после открытия субатомных частиц было выяснить, как эти частицы расположены в атоме.Это сложная задача из-за невероятно малых размеров атома. Поэтому ученые решили разработать модель того, как, по их мнению, мог выглядеть атом. Целью каждой модели атома было точное представление всех экспериментальных данных об атомах самым простым из возможных способов.
После открытия электрона Дж. Дж. Томсон разработал так называемую модель « сливовый пудинг » (рис. \ (\ PageIndex {1} \) ) в 1904 году.Сливовый пудинг — английский десерт, похожий на черничный кекс. В модели атома из сливового пудинга Томсона электроны были заключены в однородную сферу положительного заряда, как черника, застрявшая в булочке. Положительное вещество считалось желеобразным или густым супом. Электроны были несколько подвижными. По мере того, как они приближались к внешней части атома, положительный заряд в этой области был больше, чем у соседних отрицательных зарядов, и электрон оттягивался больше к центральной части атома.
Рисунок \ (\ PageIndex {1} \) Модель «сливового пудинга».
Однако эта модель атома вскоре уступила место новой модели, разработанной новозеландцем Эрнестом Резерфордом (1871-1937) примерно пятью годами позже. Томсон при жизни получил множество наград, включая Нобелевскую премию по физике в 1906 году и рыцарское звание в 1908 году.
Атомы и золото
В 1911 году Резерфорд и его коллеги Ханс Гейгер и Эрнест Марсден инициировали серию новаторских экспериментов, которые полностью изменили принятую модель атома.Они засыпали очень тонкие листы золотой фольги быстро движущимися альфа-частицами.
Рисунок \ (\ PageIndex {2} \) (A) Экспериментальная установка для эксперимента Резерфорда с золотой фольгой: радиоактивный элемент, испускавший альфа-частицы, был направлен на тонкий лист золотой фольги, окруженный экраном. что позволило бы обнаруживать отклоненные частицы. (B) Согласно модели сливового пудинга (вверху) все альфа-частицы должны были пройти через золотую фольгу с небольшим отклонением или без него.Резерфорд обнаружил, что небольшой процент альфа-частиц отклоняется на большие углы, что можно объяснить атомом с очень маленьким плотным положительно заряженным ядром в центре (внизу).
Согласно принятой атомной модели, в которой масса и заряд атома равномерно распределены по всему атому, ученые ожидали, что все альфа-частицы пройдут через золотую фольгу с небольшим отклонением или вообще без отклонения. Удивительно, но, как показано на рисунке \ (\ PageIndex {2} \) (, хотя большинство альфа-частиц действительно не отклонялись, очень небольшой процент (примерно 1 из 8000 частиц) отскакивал от золотой фольги. под очень большими углами.Некоторых даже перенаправили обратно к источнику. Никакие предварительные знания не подготовили их к этому открытию. В известной цитате Резерфорд воскликнул, что это было «как если бы вы выстрелили 15-дюймовым [артиллерийским] снарядом по куску ткани, а он вернулся и попал в вас».
Резерфорду нужно было предложить совершенно новую модель атома, чтобы объяснить свои результаты. Поскольку подавляющее большинство альфа-частиц прошло через золото, он рассудил, что большая часть атома представляет собой пустое пространство.Напротив, сильно отклоненные частицы должны были испытать чрезвычайно мощную силу внутри атома. Он пришел к выводу, что весь положительный заряд и большая часть массы атома должны быть сосредоточены в очень маленьком пространстве внутри атома, которое он назвал ядром. Ядро — крошечное плотное центральное ядро атома, состоящее из протонов и нейтронов.
Атомная модель Резерфорда стала известна как ядерная модель .В ядерном атоме протоны и нейтроны, составляющие почти всю массу атома, расположены в ядре в центре атома. Электроны распределены вокруг ядра и занимают большую часть объема атома. Стоит подчеркнуть, насколько маленькое ядро по сравнению с остальной частью атома. Если бы мы могли взорвать атом до размеров большого профессионального футбольного стадиона, ядро было бы размером с шарик.
Модель Резерфорда оказалась важным шагом на пути к полному пониманию атома.Однако он не полностью рассматривал природу электронов и то, как они занимали огромное пространство вокруг ядра. За это и другие открытия Резерфорд был удостоен Нобелевской премии по химии в 1908 году. К сожалению, Резерфорд предпочел бы получить Нобелевскую премию по физике, потому что считал физику выше химии. По его мнению, «Вся наука — это либо физика, либо коллекционирование марок».
Модель атома Резерфорда
: определение и схема — видео и стенограмма урока
Открытие атома
Атом был впервые задуман греческим философом Демокритом примерно в 400 г. до н. Э.Эта концепция была утеряна в темные века Европы до 1803 года, когда британский ученый Джон Далтон предположил, что все состоит из очень крошечных неделимых частиц, называемых атомами.
Простая модель атома Дальтона существовала до 1897 года, когда другой британский физик, Дж. Дж. Томсон обнаружил, что атомы содержат крошечные отрицательно заряженные частицы, называемые электронами. С 1897 по 1909 годы ученые думали, что атомы состоят из электронов, равномерно распределенных по положительно заряженной матрице.J.J. Модель Томсона была известна как модель сливового пудинга .
Модель атома Дальтона изображает крошечную твердую неделимую сферу. Модель сливового пудинга Томсона показывает электроны (зеленые кружки), распределенные в положительно заряженной матрице.
Разработка модели Резерфорда
В 1909 году Резерфорд провел свой знаменитый эксперимент с золотой фольгой . В эксперименте Резерфорд и его коллега Ханс Гейгер бомбардировали кусок золотой фольги положительно заряженными альфа-частицами, ожидая, что они пройдут прямо через фольгу.Вместо этого многие альфа-частицы отрикошетили от фольги, предполагая, что эти частицы сталкиваются с чем-то положительным. Они назвали эту положительную силу ядром . Модель Резерфорда была создана на основе этих новых данных.
На этой диаграмме показаны ожидаемые и фактические результаты эксперимента с золотой фольгой. На диаграмме слева показаны частицы, проходящие через положительно заряженную матрицу модели сливового пудинга.На диаграмме справа показаны частицы, рикошетирующие от ядра в центре атома.
Проблемы с моделью Резерфорда
Спустя годы после того, как Резерфорд открыл ядро, химики и физики элементарных частиц обнаружили, что поведение электронов намного сложнее, чем это изображено в модели Резерфорда. Электроны не двигались по заданному пути, их скорости были непостоянными, а их расположение вокруг ядра могло меняться в зависимости от того, сколько энергии они имели.Было некорректно изображать электроны движущимися по прямым путям. Вместо этого физики начали представлять их в виде электронного облака, которое могло предполагать, где электроны могут быть в любой момент времени. Модель электронного облака — это текущая модель атома.
Исследования электронов и ядра показали, что размеры этих частиц были значительно меньше, чем показывает модель Резерфорда. Таким образом, в более новых моделях ядро представлялось очень маленькой массой, а электроны — практически ничем.Исследования также показали, что ядро содержит небольшие положительно заряженные частицы, называемые протонами, и небольшие нейтрально заряженные частицы, называемые нейтронами.
Краткое содержание урока
Модель Резерфорда показывает, что атом — это в основном пустое пространство, а электроны вращаются вокруг фиксированного, положительно заряженного ядра по заданным предсказуемым траекториям. До Резерфорда популярной моделью атома была модель сливового пудинга , популяризированная J.J. Thomson , в котором электроны считались равномерно распределенными по положительно заряженной матрице.
Модель Резерфорда была создана после его знаменитого эксперимента, в котором он бомбардировал золотую фольгу положительно заряженными альфа-частицами. Вместо того, чтобы пройти прямо сквозь них, некоторые из частиц отрикошетили, предполагая, что эти частицы столкнулись с чем-то положительным. Он назвал эту положительную силу «ядром». В конце концов было обнаружено, что эта модель неточно отражает поведение электронов или размеры частиц. Модель Резерфорда — одна из самых популярных моделей атома, хотя она считалась точной только с 1909 по 1913 год.
Известные термины
- Ядро : Ядро — это центр атома, вокруг которого вращаются электроны.
- Plum Pudding Модель : Эта модель была дорезерфордовской, согласно которой электроны равномерно распределялись через положительно заряженную матрицу.
- Модель Резерфорда : Последняя модель атома представляет атом в основном как пространство с электронами, вращающимися вокруг неподвижного ядра.
Результаты обучения
Тщательно просмотрите содержание этого урока, чтобы:
- Охарактеризовать модель атома Резерфорда
- Изучите историю различных моделей атома
- Выделите проблемы, связанные с моделью Резерфорда
Эрнест Резерфорд | Институт истории науки
Эрнест Резерфорд постулировал ядерную структуру атома, открыл альфа- и бета-лучи и предложил законы радиоактивного распада.Он получил Нобелевскую премию по химии в 1908 году.
Серия открытий
Непревзойденный экспериментатор Резерфорд (1871–1937) сделал замечательную серию открытий в области радиоактивности и ядерной физики. Он открыл альфа- и бета-лучи, изложил законы радиоактивного распада и идентифицировал альфа-частицы как ядра гелия. Наиболее важно то, что он постулировал ядерную структуру атома: эксперименты, проведенные в лаборатории Резерфорда, показали, что когда альфа-частицы попадают в атомы газа, некоторые из них сильно отклоняются, что подразумевает плотную, положительно заряженную центральную область, содержащую большую часть атомной массы.
Образование и ранняя карьера
Родился на ферме в Новой Зеландии, четвертый из 12 детей, Резерфорд получил степень в Университете Новой Зеландии и начал обучать непослушных школьников. Он был освобожден от этой задачи благодаря стипендии в Кембриджском университете, где он стал первым аспирантом Дж. Дж. Томсона в Кавендишской лаборатории. Там он начал экспериментировать с передачей радиоволн, присоединился к продолжающемуся исследованию Томсоном проводимости электричества через газы, а затем обратился к области радиоактивности, только что открытой Анри Беккерелем, Пьером и Мари Кюри.
Творческое партнерство
На протяжении всей своей карьеры Резерфорд проявлял способность творчески работать с единомышленниками, некоторые из которых уже работали в учреждениях, в которые он был назначен, а других он привлекал в качестве докторантов или аспирантов. В университете Макгилла в Монреале, на его первом назначении, он работал с Фредериком Содди над радиоактивным распадом. В Манчестерском университете он сотрудничал с Хансом Гейгером (известным счетчиком Гейгера), Нильсом Бором (чья модель атомной структуры пришла на смену модели Резерфорда) и Х.Дж. Дж. Мозли (получивший экспериментальное доказательство атомных чисел). Во время Первой мировой войны эта манчестерская исследовательская группа была в значительной степени рассредоточена, и Резерфорд занялся решением проблем, связанных с обнаружением подводных лодок. После войны он сменил Дж. Дж. Томсона на посту профессора Кавендиша в Кембридже и снова собрал энергичную исследовательскую группу, включая Джеймса Чедвика, первооткрывателя нейтрона.
с отличием
Как и Томсон, Резерфорд получил множество наград. Он получил Нобелевскую премию по химии за 1908 г .; он стал рыцарем, а затем и пэром в Палате лордов.Для высшей чести он был похоронен в Вестминстерском аббатстве.
Информация, содержащаяся в этой биографии, последний раз обновлялась 15 декабря 2017 г.
| Резерфорд и Бор описывают атомную структуру 1913 Фото: заметки Нильса Бора о его новой атомной теории. В 1911 году Нильс Бор получил докторскую степень в Дании, защитив диссертацию по электронной теории металлов.Сразу после этого он отправился в Англию, чтобы учиться у Дж. Дж. Томсон, который открыл электрон в 1897 году. Большинство физиков в первые годы двадцатого века были поглощены электроном — такое новое и захватывающее открытие. Мало кто уделял много внимания работам Макса Планка или Альберта Эйнштейна. Томсона не слишком интересовали эти новые идеи, но Бор был непредвзято. Вскоре Бор отправился навестить Эрнеста Резерфорда (бывшего ученика Томсона) в другой части Англии, где Резерфорд сделал совершенно новое открытие об атоме. Находка Резерфорда произошла в результате очень странного опыта. Все в то время представляли атом как «сливовый пудинг». То есть, он был примерно одинаковой консистенции, с отрицательно заряженными электронами, разбросанными в нем, как изюм в пудинге. В рамках эксперимента с рентгеновскими лучами в 1909 году Резерфорд стрелял лучом альфа-частиц (или альфа-лучей, испускаемых радиоактивным элементом радием) на лист золотой фольги толщиной всего 1/3000 дюйма и отслеживая пути частиц.Большая часть частиц прошла сквозь фольгу, чего можно было бы ожидать, если бы атомы в золоте были похожи на сливовый пудинг. Но время от времени частица отскакивала назад, как будто она ударилась о что-то твердое. Проследив множество частиц и изучив закономерности, Резерфорд пришел к выводу, что атом должен иметь почти всю свою массу и положительный заряд в центральном ядре, примерно в 10 000 раз меньшем, чем сам атом. Весь отрицательный заряд удерживался в электронах, которые должны вращаться вокруг плотного ядра, как планеты вокруг Солнца. В 1912 году Бор присоединился к Резерфорду. Он понял, что модель Резерфорда не совсем верна. По всем правилам классической физики он должен быть очень нестабильным. Во-первых, вращающиеся электроны должны испускать энергию и, в конечном итоге, по спирали опускаться в ядро, заставляя атом коллапсировать. Или электроны могут быть сбиты с места, если мимо проходит заряженная частица. Бор обратился к квантовой теории Планка, чтобы объяснить стабильность большинства атомов. Он обнаружил, что отношение энергии электронов к частоте их орбит вокруг ядра равно постоянной Планка (отношение энергии света к его частоте волны, или приблизительно 6.626 х 10 -23 ). Бор предложил революционную идею о том, что электроны «прыгают» между энергетическими уровнями (орбитами) квантовым образом, то есть никогда не находятся в промежуточном состоянии. Таким образом, когда атом поглощает или испускает энергию (например, свет или тепло), электрон перескакивает на более высокие или более низкие орбиты. Бор опубликовал эти идеи в 1913 году, что вызвало неоднозначную реакцию. Многие люди до сих пор не приняли идею квантов или обнаружили другие недостатки в теории, потому что Бор основывал ее на очень простых атомах.Но имелись веские доказательства его правоты: электроны в его модели выстраивались в соответствии с регулярными структурами (спектральными сериями) света, излучаемого настоящими атомами водорода. Теория Бора, согласно которой электроны существуют на заданных орбитах вокруг ядра, была ключом к периодическому повторению свойств элементов. |

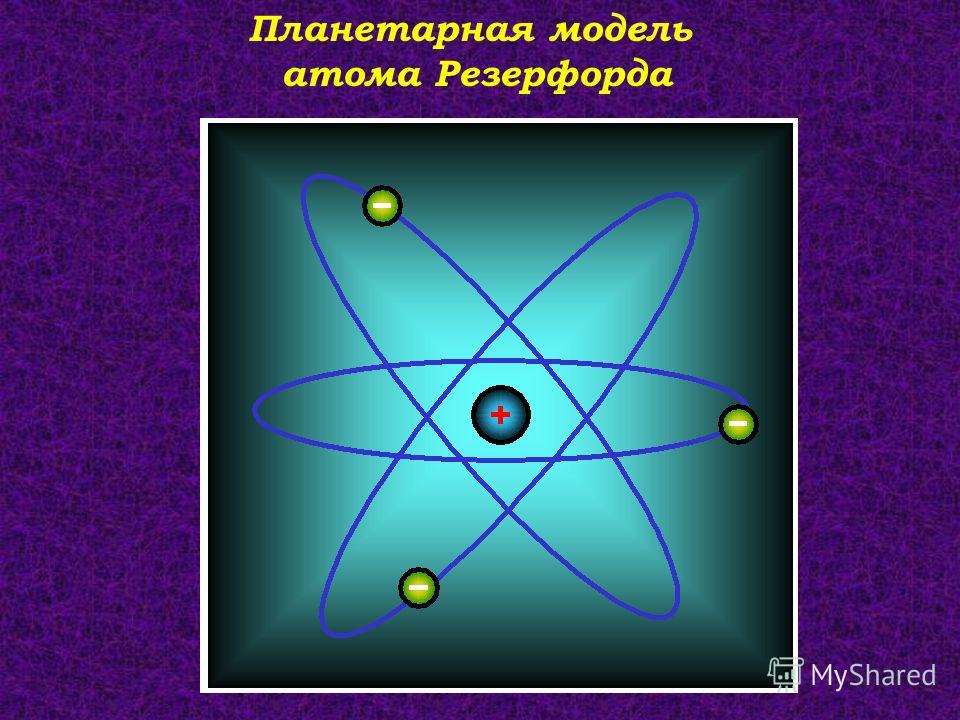

 В соответствии
В соответствии
