3. Строение атома Н.
nλ = 2πrn, Разным разрешённым орбитам n соответствуют n = 1, 2, 3… Э. Резерфорд, 1914 г.: Электрический заряд атомного ядра в Размеры атома составляют несколько Химические свойства атомов, Z + N = A. Атомные ядра обладают магнитными моментами, где mp – масса протона. где me – масса электрона. Магнитные момента атомов в тысячи раз больше магнитных моментов Таблица 1 Характеристики протона, нейтрона и | |||
| Характеристика | Протон | Нейтрон | Электрон |
|---|---|---|---|
| Масса mс2, МэВ | 938. 272 272 | 939.565 | 0.511 |
| Электрический заряд (в единицах элементарного заряда) | +1 | 0 | -1 |
| Спин J (в единицах ћ) | 1/2 | 1/2 | 1/2 |
| Чётность | +1 | +1 | +1 |
| Статистика | Ферми-Дирака | ||
| Магнитный момент (для нуклонов – в ядерных магнетонах, для электрона – в магнетонах Бора) | +2.79 | –1.91 | +1.001 |
| Время жизни | > 1032 лет | 885.7±0.8 с | > 4. 6·1026 лет 6·1026 лет |
| Тип распада | стабилен | n → p + e− + | стабилен |
Протон, нейтрон и электрон являются фермионами, имеют спин
J = 1/2 и
подчиняются принципу Паули. Нейтрон имеет массу на 1.3 МэВ больше, чем протон,
поэтому в свободном состоянии он распадается на протон p,
электрон e− и
электронное антинейтрино
Теория строения атома – Сергей Кравчук – Блог – Сноб
Благодаря существованию у человека хорошего вкуса он имеет возможность подсознательного интуитивного принятия верных решений в повседневной деятельности. Стремление к элегантности в науке всегда делало её более совершенной.
Основным источником сведений о строении мельчайших частиц материи, в частности химических частиц (атомов, молекул, ионов), является экспериментальное исследование их свойств. После обобщения экспериментальных данных создавались теории строения этих частиц, содержащих определенную совокупность представлений и постулатов. Любая такая теория ограничена, так как описывает определенную совокупность экспериментальных фактов, возможно очень большую, но часто где-то оказывается предел её возможностей и за этой чертой без дальнейшего ее развития теория становится непригодной и тормозит дальнейшее развитие науки.
После обобщения экспериментальных данных создавались теории строения этих частиц, содержащих определенную совокупность представлений и постулатов. Любая такая теория ограничена, так как описывает определенную совокупность экспериментальных фактов, возможно очень большую, но часто где-то оказывается предел её возможностей и за этой чертой без дальнейшего ее развития теория становится непригодной и тормозит дальнейшее развитие науки.
Был период бурного развития науки конца XIX столетия и первой половины XX века, когда почти ежегодно делались фундаментальные открытия, которые в течение следующего года воплощались в практику, например, в 1895 году состоялось открытие Рентгеном Х-лучей, которые уже в 1896 году начали использоваться в практической медицине, и в том же 1896 году Беккерель открыл явление радиоактивности солей урана. По сравнению с теми годами, сейчас положение вещей в фундаментальной науке можно назвать периодом застоя, когда развитие техники осуществляется только за счет обычного совершенствования технологий, в частности наращивания объема памяти компьютеров, смартфонов, запасов энергии аккумуляторов и тому подобное. Это можно объяснить только тем, что либо уже все открыто, либо предыдущие фундаментальные теории исчерпали себя, являются неверными и уже тормозят развитие науки. Поэтому необходимо создавать новые теории, которые лучше объясняли бы известные экспериментальные данные и создавали возможности для движения фундаментальной науки вперед.
Это можно объяснить только тем, что либо уже все открыто, либо предыдущие фундаментальные теории исчерпали себя, являются неверными и уже тормозят развитие науки. Поэтому необходимо создавать новые теории, которые лучше объясняли бы известные экспериментальные данные и создавали возможности для движения фундаментальной науки вперед.
По моему мнению, сейчас между классической, проверенной временем, теорией химического строения и современной квантовой механикой содержится значительный разрыв, обусловленный ложным пониманием физической сути поведения электрона в атоме. Слишком много в квантовой механике нерешенных вопросов, которые непонятны не только школьникам, но и их учителям и академикам. Среди них: что заставляет электрон двигаться по вытянутой гантелеобразной р-орбите (как написано в школьных учебниках), траектория которой проходит через ядро, почему электрон при этом не падает на ядро и не излучает во время своего углового ускорения по такой орбите свет? При этом отсутствуют доказательства существования такой формы электронной орбиты, иначе говоря, такие орбиты никто не видел.
Сейчас возможно получение правильных квантовых количественных расчетов только для простейшего атома водорода, но ни для одного другого многоэлектронного атома. При этом отсутствует корреляция между теоретическим и экспериментальным орбитальным магнитным спином. Невозможно объяснить, почему ядро, имеющее собственный спин, стабильно находится на своем месте в центре совокупности гантелеобразных электронных орбиталей. Когда спрашиваешь об этом физика, он обычно отвечает, что это представление о гантелеобразную электронную орбиту не имеет физического смысла и является условным, и достаточно только математического описания поведения электрона в атоме.
Планетарная модель строения атома была предложена Резерфордом в 1911г. Позже от нее отказались из-за невозможности объяснения движения электрона по кругу без излучения. Сейчас физики не представляют себе строение атома, а просто описывают его математически сложным трехмерным дифференциальным уравнением Шредингера. Но даже для атома водорода решение этого уравнения не совсем верно из-за элементарных функций. Для атомов, имеющих два и более электронов, уравнение Шредингера не может быть решено даже численным образом.
Для атомов, имеющих два и более электронов, уравнение Шредингера не может быть решено даже численным образом.
Не верится, что строение атома невозможно себе представить. По моему, всё возможно себе представить, и если эта воображаемая модель будет правильная, то все формулы и расчеты будут сходиться. Из базовых принципов строения атома совсем не вытекает, почему именно 2 элемента содержатся в I-м периоде периодической системы элементов, восемь во II-м и III-м периодах, восемнадцать в IV-м и V-м периодах, тридцать два в VI-м периоде. Почему происходит такая характерная периодическая смена радиусов атомов и их первых потенциалов ионизации? И почему вообще существует периодическая система элементов. Напротив, существование различных типов химических связей, магнитных свойств веществ, сверхпроводимости объясняется введением надуманных и искусственных понятий типа sp-гибридизации. Такие искусственные объяснения и неочевидные предположения, которые затрудняют общую картину, обычно используются в случаях, когда возникают проблемы в основном алгоритме определенного явления или проблемы. Непонятно также, почему валентность равна 8, а также почему все физико-математические расчеты поведения электронов в атоме, более сложном, чем атома водорода, являются неточными. Поэтому не удается создать точный магнитно-резонансный томограф, настроенный на атомы других важных биологических элементов, кроме атома водорода, например на атом углерода, азота или кислорода. И для уточненного описания поведения электрона в многоэлектронных атомах ученые вынуждены подгонять формулы, вводя какие-то дополнительные коэффициенты, используются приближенные методы, в частности теории возмущений.
Непонятно также, почему валентность равна 8, а также почему все физико-математические расчеты поведения электронов в атоме, более сложном, чем атома водорода, являются неточными. Поэтому не удается создать точный магнитно-резонансный томограф, настроенный на атомы других важных биологических элементов, кроме атома водорода, например на атом углерода, азота или кислорода. И для уточненного описания поведения электрона в многоэлектронных атомах ученые вынуждены подгонять формулы, вводя какие-то дополнительные коэффициенты, используются приближенные методы, в частности теории возмущений.
Все становится проще и понятнее без дополнительных вводных, если принять базовым простое положение. Единственное состояние электрона в атоме — это движение по кругу, и все. Нет никаких гантелей р-орбиталей и p-электронов, как и нет последующих d-, f-, g-состояний электрона, и d-, f-, g-орбит. Просто из таких колец, по которым движутся электроны и построены все атомные орбиты. По моему мнению, первым исследователям, которые описывали поведение электрона в атоме, просто не хватило пространственного воображения для построения кольцевой модели атома, поэтому они вынуждены были ввести искусственные понятия и идеи гантелеобразных орбит.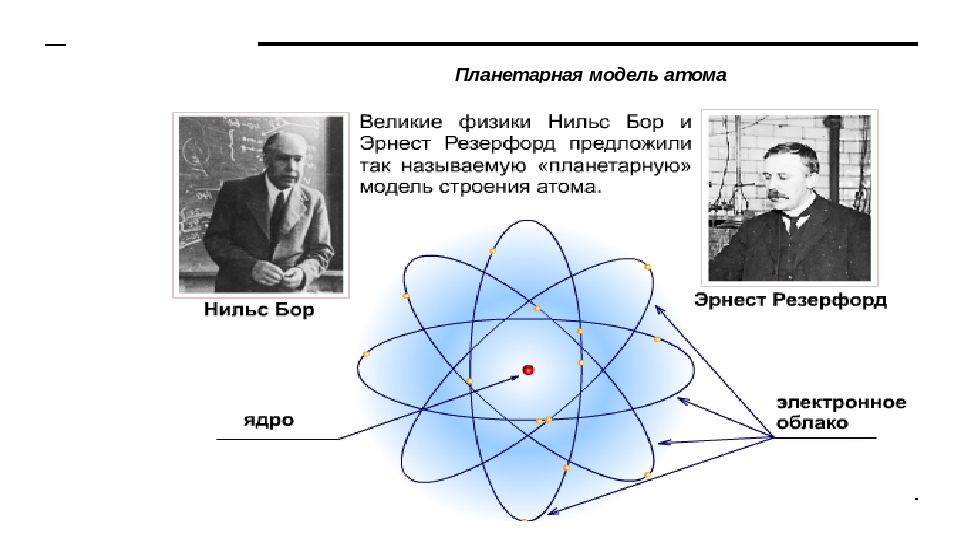 Позже эти идеи корифеев закрепились и после того как они попали в учебники по физике их никто не решался опровергать.
Позже эти идеи корифеев закрепились и после того как они попали в учебники по физике их никто не решался опровергать.
На самом деле, в атоме водорода содержит только одно электронное кольцо, что является простым и верным решением, с которым никто не спорит, потому что оно согласуется со всеми расчетами и современными представлениями об s-электроне. Этот единственный электрон вращается по кругу вокруг ядра, которое находится в центре этого круга. Это кольцо может свободно вращаться вокруг ядра, образуя сферу. В атоме гелия первый электронный уровень дополняется вторым, который представляет собой параллельно расположено кольцо с противоположным первому направлением движения электрона. Противоположное направление движений второго необходимо для компенсации магнитного момента, возникающего во время движения первого электрона.
В атомах второго периода периодической системы элементов первый уровень электронов занимает более близкую к ядру систему из двух s-колец, а все последующие по мере увеличения заряда ядра занимают стабильную 8-кольцевую конструкцию, которая может свободно вращаться вокруг ядра — центра симметрии. Кольца переходят друг в друга, поэтому направление движений электронов в соседних кольцах противоположный, а в местах их соединения совпадает и сливается в общий поток. На орбите вокруг ядра, таким образом, существует 4 парных расположенных друг против друга кольца, в которых поток электронов однонаправленный.
Кольца переходят друг в друга, поэтому направление движений электронов в соседних кольцах противоположный, а в местах их соединения совпадает и сливается в общий поток. На орбите вокруг ядра, таким образом, существует 4 парных расположенных друг против друга кольца, в которых поток электронов однонаправленный.
Конфигурация магнитных полей в данном случае такова, что происходит взаимосогласование движения электронов именно по этим траекториям, а ядро оказывается в своеобразной магнитной ловушке. При смещении ядра из центра этой системы в одну сторону увеличения силы магнитного поля с этой стороны возвращает ядро в прежнее положение в центр системы. Атомные орбиты электронов центральносимметричные. Таким образом, во 2-3-х периодах в конструкции орбиты можно расположить только 8 центральносимметричных связанных друг с другом колец, в 4-5 периодах — 18 колец, 6-7 периодах — 32 кольца. Поэтому все элементы можно расположить в периодической системе по изменением своих химических характеристик. После полного заполнения 8 колец начинается заполнение именно 18 колец, а не любого другого количества. Другие варианты невозможны. Другое количество колец не может стать взаимосвязанным и создать симметричную сферическую конструкцию с таким расчетом, чтобы электрон, двигаясь по всей области орбиты и переходя с одного кольца на другое, сохранял постоянное направление движений при возвращении на то же самое кольцо. Так логично и просто можно объяснить наличие именно такой периодической системы элементов.
После полного заполнения 8 колец начинается заполнение именно 18 колец, а не любого другого количества. Другие варианты невозможны. Другое количество колец не может стать взаимосвязанным и создать симметричную сферическую конструкцию с таким расчетом, чтобы электрон, двигаясь по всей области орбиты и переходя с одного кольца на другое, сохранял постоянное направление движений при возвращении на то же самое кольцо. Так логично и просто можно объяснить наличие именно такой периодической системы элементов.
Подобные кольцеобразные модели рисовали и американский архитектор К.Снельсон в 1963 году, и позднее были сконструированы объемные модели в образовательных целях российским педагогом Д.Кожевниковым. Однако они не связывали и не связывают расположение этих колец с потоками электронов, поэтому 32-электронная орбита у них смоделирована неправильно. Траектория движения электрона по периметру всего уровня 8-, 18- и 32-электронных орбит выглядит волнообразной, и, учитывая корпускулярно-волновой дуализм частиц микромира, этот процесс можно описать термином «стоячая волна».
При наличии на орбите одного электрона только он движется по всем кольцам, переходя из одного кольца на другое. При расположении на орбите нескольких электронов, их может расположиться не более одного электрона на одно кольцо. БОльшая вероятность или расположение нескольких электронов в каком-либо из восьми колец уровня обусловлена необходимостью постоянного сохранения максимально полной компенсации момента атома и симметрии электромагнитных моментов, которая происходит в такой конструкции автоматически. Заполнение электронами всего уровня орбиты создает для каждого отдельного электрона возможность длительного времени пребывания в идеальных для себя условиях кругового движения в пределах одного кольца без всяких флуктуаций, тогда химические свойства атома становятся инертными.
Второй 8-електронний уровень образуется на определенном расстоянии от первого. Радиус атома при этом увеличивается. Кольца обоих уровней располагаются друг против друга, но направление движения электронов в них противоположный, что обеспечивает полную магнитную компенсацию атома.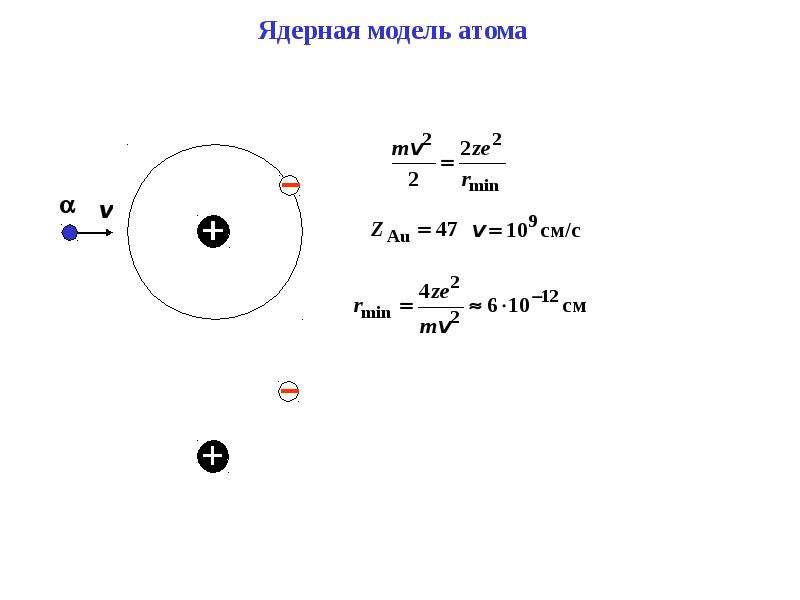
Следующий уровень является 18-электронным, далее следует 32-электронный. Вторичной структурной единицей этих 18-и 32-электронных конструкций есть большие кольца, построенные из шести одноэлектронных колец. Ближние к ядру электроны имеют бОльшую энергию, или скорость движения, чтобы не упасть на ядро, так как находятся между положительно заряженным ядром и отрицательно заряженными электронами внешних орбит. Переход электрона с близкой к удаленной от ядра орбите сопровождается потерей им энергии и излучением кванта света — фотона.
Осознавая такое строение электронных оболочек атома легко объясняется и предусматриваются характерные свойства элементарных и сложных химических частиц — атомов, молекул и ионов. Понятно, что в пределах периода (горизонтальная строчка периодической системы элементов) атомный радиус уменьшается слева направо, т.к. возрастает заряд ядра. Рассмотрим теперь периодическое увеличение радиусов атомов первой группы (вертикальный столбик) периодической системы элементов (первый вертикальный столбик): водород — литий — натрий — калий — рубидий — цезий — франций (0,05 — 0,155 — 0,189 — 0,236 — 0,248 — 0,268 — 0,290нм). Оно свидетельствует о том, радиус 8-электронного атома лития приблизительно в 3 раза больше 1-электронного атома водорода (можете сравнить отношение одного кольца ко всей 8-кольцевой модели конструкции даже визуально). Кроме того, восемь электронов в атомах 2-го и 3-го периодов увеличивают радиус атома больше (на 0,034нм) чем 18 электронов в атомах 4-го и 5-го периодов (на 0,012нм), что невозможно объяснить иначе, чем рассмотрев соотношение размеров колец в 8 — 18 — 32 — кольцевых конструкциях к радиусу всей сферы атома – около 1,7 — 2,5 — 4,2. Ближе по значениям друг к другу стоят размеры колец 8 и 18 — кольцевых конструкций. Этим размерам соответствует как энергия электронов, так и расстояние от орбиты к ядру.
Оно свидетельствует о том, радиус 8-электронного атома лития приблизительно в 3 раза больше 1-электронного атома водорода (можете сравнить отношение одного кольца ко всей 8-кольцевой модели конструкции даже визуально). Кроме того, восемь электронов в атомах 2-го и 3-го периодов увеличивают радиус атома больше (на 0,034нм) чем 18 электронов в атомах 4-го и 5-го периодов (на 0,012нм), что невозможно объяснить иначе, чем рассмотрев соотношение размеров колец в 8 — 18 — 32 — кольцевых конструкциях к радиусу всей сферы атома – около 1,7 — 2,5 — 4,2. Ближе по значениям друг к другу стоят размеры колец 8 и 18 — кольцевых конструкций. Этим размерам соответствует как энергия электронов, так и расстояние от орбиты к ядру.
При невозможности построения в рамках 8-кольцевой орбиты симметричной и компенсированной по всем показателям конструкции с незаполненными полностью 8 кольцами, один или несколько электронов становятся слабо локализованными в определенном кольце. Тогда может происходить конформация в 6-кольцевую не спаренную модель, объясняющую аномально низкие первые потенциалы ионизации газообразных атомов бора и кислорода в ряду их роста во втором периоде к подобным потенциалам атомов в других периодах.
В отличие от атомов молекулы всегда создают спаренные кольцевые электронные орбиты. Этим можно объяснить, что в природе преобладают молекулы, а не атомы. Недостаточная заполненность электронами энергетических уровней единичного атома побуждает его к объединению с другими атомами для взаимного достижения идеальной электронной конфигурации. При этом одно из электронных кольцо атома встраивается в кольцо 8-кольцевого уровня другого атома. Так возникают химические реакции.
Так называемая водородная связь, которая существует между молекулами, в составе которых есть атомы водорода и атомы элемента второго периода (углерод, азот, кислород), является по сути магнитной связью на определенном расстоянии между молекулами — между кольцами с некомпенсированным магнитным моментом. Энергию водородной связи (20-30 кДж/моль) можно рассчитать между определенными молекулами, как энергию магнитного поля, учитывая радиус кольца, скорость движения электрона (силу электрического тока) и расстояние между электронными кольцами молекул. Отсутствие водородной связи между молекулами h3S, h3Sе, h3Те, в отличие от h3О, объясняется компенсацией магнитного поля внешнего 8-кольцевого уровня внутренним 8-кольцевым уровнем, в котором движение электронов по кольцам имеет противоположное направление. Благодаря наличию этой магнитной водородной связи вода обладает уникальными физико-химическими свойствами, что обусловило появление и существование жизни на Земле. 8-валентность тяжелых химических элементов объясняется доминированием основных магнитных четырех осей, порождаемое 8-электронной орбитой и поддерживается благодаря такому уникальному геометрическому строению 18-и 32-электронных орбит. Внешние 18- и 32-электронные орбиты будто нанизываются на эти 4 основные магнитные оси внутренних орбит.
Отсутствие водородной связи между молекулами h3S, h3Sе, h3Те, в отличие от h3О, объясняется компенсацией магнитного поля внешнего 8-кольцевого уровня внутренним 8-кольцевым уровнем, в котором движение электронов по кольцам имеет противоположное направление. Благодаря наличию этой магнитной водородной связи вода обладает уникальными физико-химическими свойствами, что обусловило появление и существование жизни на Земле. 8-валентность тяжелых химических элементов объясняется доминированием основных магнитных четырех осей, порождаемое 8-электронной орбитой и поддерживается благодаря такому уникальному геометрическому строению 18-и 32-электронных орбит. Внешние 18- и 32-электронные орбиты будто нанизываются на эти 4 основные магнитные оси внутренних орбит.
Учитывая направление движения электронов по кольцам 8-кольцевой модели атома углерода можно объяснить наличие противоположных кольцевых потоков совместных электронов над и под круговой молекулой бензола (если ее представить в горизонтальной плоскости), что придает молекуле дополнительную устойчивость именно в кольцеобразном варианте строения.
В свою очередь, спаривание больших электронных колец приводит к образованию пуриновыми и пиримидиновыми основаниями, которые являются производными бензола, спиральной молекулы нуклеиновой кислоты ДНК или РНК. Можно утверждать, что природа стала живой, то есть самовоспроизводимой, благодаря энергии, содержащейся в атоме. Молекула ДНК по сути концентрирует и направляет в определенных направлениях электронные потоки, она может создавать различные комбинации электромагнитных полей. Поэтому она может легко конформироваться для активизации определенных своих участков, выходящих наружу, а другие участки при этом скрываются внутри и становятся неактивными. Вероятно, что ДНК клеток под суммарным воздействием электромагнитных полей других ДНК постоянно конформируется в процессе роста зародыша и плода человека. Таким образом, каждая ДНК в клетке, как в голограмме несет информацию обо всем организме.
Учитывая такую модель строения атома легче объяснить отсутствие излучения, которое должно возникать при круговом ускорении.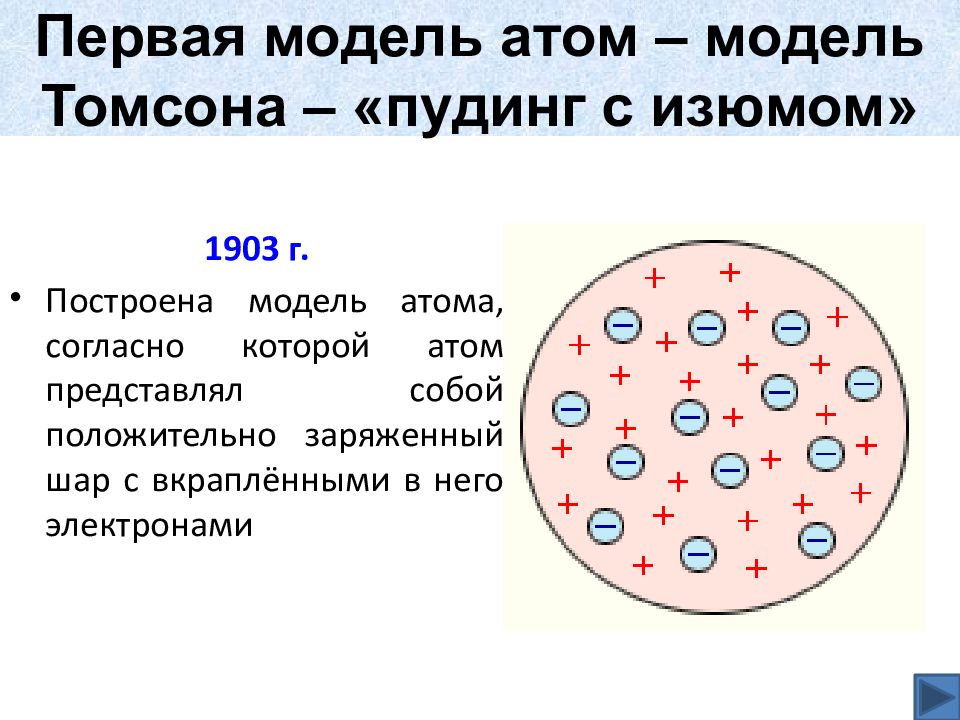 Физически, с одной стороны, это можно объяснить взаимным гашением возникающих электромагнитных волн от электронов соседних колец, по которым электроны вращаются в разных фазах. С другой стороны, постоянное возвращение электрона при движении по кругу на то же место в течение сколь угодно долгого времени не должно вызывать никаких изменений как снаружи так и внутри такой системы, в том числе излучения. Равномерное поступательное движение электрона по прямой является частным случаем кругового движения с радиусом, приближенным к бесконечности. В такой воображаемом путешествии электрона во Вселенной при отсутствии внешнего воздействия, электрон должен вернуться в исходную точку траектории. Разница между приведенными примерами — прямолинейным движением Вселенной и круговым по орбите атома, состоит только в энергии электрона, которая прямо пропорциональна скорости его движения и обратно пропорциональна радиусу круговой орбиты. Из приведенного примера также напрашивается вывод, что Вселенная не является бесконечной, т.
Физически, с одной стороны, это можно объяснить взаимным гашением возникающих электромагнитных волн от электронов соседних колец, по которым электроны вращаются в разных фазах. С другой стороны, постоянное возвращение электрона при движении по кругу на то же место в течение сколь угодно долгого времени не должно вызывать никаких изменений как снаружи так и внутри такой системы, в том числе излучения. Равномерное поступательное движение электрона по прямой является частным случаем кругового движения с радиусом, приближенным к бесконечности. В такой воображаемом путешествии электрона во Вселенной при отсутствии внешнего воздействия, электрон должен вернуться в исходную точку траектории. Разница между приведенными примерами — прямолинейным движением Вселенной и круговым по орбите атома, состоит только в энергии электрона, которая прямо пропорциональна скорости его движения и обратно пропорциональна радиусу круговой орбиты. Из приведенного примера также напрашивается вывод, что Вселенная не является бесконечной, т. к. постоянное движение в одну сторону со временем неизменно приводит нас в начальную точку движения.
к. постоянное движение в одну сторону со временем неизменно приводит нас в начальную точку движения.
Урок 24. строение атома. опыты резерфорда — Физика — 11 класс
Физика, 11 класс
Урок №24. Строение атома. Опыты Резерфорда
На уроке рассматриваются: понятия атомное ядро, опыты Резерфорда, планетарная модель строения атома; сравниваются модели атома Томсона и Резерфорда, даны некоторые сведения о фактах, подтверждающих сложное строение атома, о работах учёных по созданию модели строения атома.
Атомное ядро — тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
Размеры ядра: диаметр порядка 10-12—10-13 см (у разных ядер диаметры различны).
Размер атома: примерно 10-8 см, т. е. от 10 до 100 тысяч раз превышает размеры ядра.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряжённое ядро, в котором сосредоточена почти вся масса атома, электроны движутся по орбитам вокруг ядра, заряд ядра, как и число электронов в атоме, равен порядковому номеру элемента в периодической системе Д. И.Менделеева.
И.Менделеева.
Ядро атома водорода названо протоном и рассматривается как элементарная частица.
Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Частота излучений атома водорода составляет ряд серий: серия Бальмера, серия Лаймана, серия Пашена и другие, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний.
Обязательная литература по теме урока:
- Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика.11 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 279 – 283.
- Степанова Г.Н. (сост.) Сборник задач по физике для 10-11 классов общеобразовательных учреждений.5-е изд., доп. — М.: «Просвещение», 1999 — С. 221-222
- Анциферов Л.И., Физика: электродинамика и квантовая физика. 11кл. Учебник для общеобразовательных учреждений. – М.: Мнемозина, 2001. – С. 270-274.
- Рымкевич А.
 П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. — С. 155 – 156.
П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. — С. 155 – 156. - Кикоин А. К. За пределы таблицы //Квант. — 1991. — № 1. — С. 38,39,42-44
Основное содержание урока
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
Идеи электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом — электроны и они являются частью атомов.
По мысли Томсона, положительный заряд занимает весь объём атома и распределён он в этом сферическом объёме равномерно. У более сложных атомов в положительно заряжённом шаре есть несколько электронов, так что атом подобен кексу, в котором роль изюма играют электроны. Распространённый термин этой модели — «Пудинг с изюмом» или «Булочка с изюмом».
Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица
Масса покоя электрона me = 9,1·10-31кг;
— отношение заряда электрона к его массе.
Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.
В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов, колебания которых и являются причиной испускания атомных спектров, по аналогии с теорией устойчивости колец Сатурна.
Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.
30.08.1871 г. – 19.10.1937 г.
Эрнест Резерфорд
Британский физик новозеландского происхождения
Лауреат Нобелевской премии по химии 1908 года
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.
Эти частицы возникают при распаде, например, радия и некоторых других радиоактивных элементов. Сами же α-частицы – это ионизированные атомы гелия, положительный заряд гелия в два раза больше заряда электрона +2He. Этими частицами Резерфорд бомбардировал атомы тяжёлых элементов (золото, медь и др.). Если бы электроны были равномерно распределены по всему объёму атома (по модели атома Томсона), электроны не могли бы заметно изменять траекторию α –частиц, так как размеры и масса электронов в 8000 раз меньше массы α-частиц. Точно так же камушек в несколько десятков граммов при столкновении с автомобилем не может изменить его скорость.
Изменение направления движения α-частиц может вызвать только массивная часть атома, при этом положительно заряжённая. Весь прибор размещался в сосуде, из которого был откачан воздух. Радиоактивный препарат, помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок α -частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеяния α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать в микроскоп.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами. Сотрудники Резерфорда вели счёт α-частиц, попадающих в регистрирующее устройство при отклонении их на от первоначального направления на определённый угол φ (фи). Данные из серии опытов, за определённый период времени, приведены в таблице:
Угол отклонения α-частиц φ, ° | 15 | 60 | 105 | 150 | 180 |
Число частиц N | 132000 | 477 | 70 | 33 | 1-3 |
Отсюда можно сделать вывод: такое поведение α-частиц возможно только в том случае, если они упруго взаимодействуют с массивным положительно заряжённым телом малых по сравнению с атомом размеров.
Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц, он сам не верил в положительный результат. Он сравнил такой эффект с 15-дюймовым снарядом, как если бы его выстрелили в кусок тонкой бумаги, а снаряд возвратился бы и нанёс обратный удар.
Резерфорд понял, что α-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к мысли о существовании атомного ядра.
Подсчитывая число α-частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра. Оказалось, что ядро имеет диаметр порядка 10-12—10-13 см (у разных ядер диаметры различны). Размер же самого атома 10-8 см, то есть от 10 до 100 тысяч раз превышает размеры ядра. Впоследствии удалось определить и заряд ядра.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Число внутриатомных электронов, как и заряд ядра, равны порядковому номеру элемента в периодической системе Д. И. Менделеева.
Электроны движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.
Такой характер движения электронов определяется действием кулоновских сил притяжения со стороны ядра.
Закон Кулона:
qα — заряд α-частицы;
q — положительный заряд атома;
r — его радиус;
— коэффициент пропорциональности.
Ядро атома водорода имеет положительный заряд, который по модулю равен заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Размер атома водорода — это радиус орбиты его электрона
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением. Ускоренно движущийся заряд должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Электроны должны приближаться к ядру, подобно тому как спутник приближается к Земле при торможении в верхних слоях атмосферы. Атом должен прекратить свое существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны
В начале XX века было уже известно, что вещество излучает свет конкретных длин волн в определенных, очень узких спектральных интервалах — спектральных линиях, все линии имеют конечную длину.
Линейчатые спектры дают все вещества в газообразном атомарном (но не молекулярном состоянии). Классическим примером линейчатого спектра является спектр атома водорода.
Швейцарский физик и математикИоганн Якоб Бальмер определил, что в видимой части спектра атома водорода имеются четыре линии, соответствующие длинам волн: λ1 = 434 нм; λ2 = 486 нм; λ3 = 410 нм; λ4 = 656 нм
Частота излучений атома водорода составляет ряд серий, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний, переходов электрона с верхних энергетических уровней на нижние уровни.
На рисунке можно увидеть переходы электрона на другой энергетический уровень, частоты излучения которого находятся в видимой области спектра.
Серию уровней назвали в честь швейцарского учителя Иоганна Бальмера, который ещё в 1885 году основываясь на результатах экспериментов вывел формулу для определения частот видимой части спектра водорода:
где Z – число протонов в атоме или порядковый номер в периодической таблице Менделеева;
n и m (целое число – 1, 2, 3, 4, 5, и так далее) — энергетические уровни, где m > n.
В этой формуле v — не частота, которая измеряется в с-1, а волновое число, которое равно обратному значению длины волны 1/λ и которое измеряется в м-1.
R — это постоянная Ридберга (для данного вещества), которая определена из спектральных данных, учитывая, что скорость распространения видимого излучения составляет:
Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома. Отсюда следует, что к таким явлениям законы классической физики неприменимы. Все выводы об устойчивости атома и спектре, которые излучает атом будут подтверждены Нильсом Бором в 1913 году.
Рассмотрим задачи тренировочного блока урока.
1. Формула Бальмера – Ридберга для водорода приводится в виде:
Коэффициент RH носит название постоянной Ридберга для водорода и его можно вычислить из данной формулы. Полученный результат равен _______·107 м-1, если известно, что при переходе атома водорода из четвёртого энергетического состояния во второе происходит излучение с длиной волны 486,13 нм.
Дано:
m = 4
n = 2
RH — ?
Решение:
Постоянная Ридберга для водорода:
Выведем постоянную Ридберга RH из формулы Бальмера – Ридберга:
Подставим известные значения в формулу:
Ответ:
2. Рассчитайте на какое наименьшее расстояние α-частица может приблизиться к ядру атома золота, двигаясь по прямой, проходящей через центр ядра. Масса α-частицы, её заряд, скорость движения и заряд ядра золота приведены в таблице:
Масса α-частицы, кг | Заряд α-частицы, Кл | Скорость движения α-частицы, м/с | Заряд ядра золота, Кл | Расстояние сближения, м |
6,6·10-27 | 3,2·10-19 | 1,9·107 | 1,3·10-17 | ? |
По закону сохранения энергии максимальная кинетическая энергия α-частицы будет равна максимальной потенциальной энергии взаимодействия частицы с ядром атома золота:
Потенциальная энергия кулоновского взаимодействия зарядов.
Для определения наименьшего расстояния между α-частицей и ядра атома золота используем формулу взаимодействия заряжённых частиц — закон Кулона:
— коэффициент пропорциональности.
Чтобы определить силу взаимодействия зарядов на кратчайшем расстоянии, запишем II закон Ньютона, устанавливающий зависимость силы от ускорения, для движения тела движущегося по окружности с центростремительным ускорением:
Приравняем выражения для силы взаимодействия двух точечных зарядов:
Отсюда выразим расстояние сближения двух зарядов, считая его радиусом от центра ядра золота до точки сближения с α-частицей:
Подставим числовые значения в полученную формулу:
Ответ:
Масса α-частицы, кг | Заряд α-частицы, Кл | Скорость движения α-частицы, м/с | Заряд ядра золота, Кл | Расстояние сближения, м |
6,6·10-27 | 3,2·10-19 | 1,9·107 | 1,3·10-17 | 3,1·10-14 |
28 февраля 1913 г. Нильс Бор представил новую модель атома
Нильс Бор впервые показал, что электрон делает квантовые скачки по орбитам в атоме, и это изменило наше понимание микромира
Модель атома Бора пришла на смену планетарной модели атома
Эрнеста Резерфорда.
108 лет назад датский физик-теоретик Нильс
Бор предложил свою теорию строения атома, где
электроны не подчиняются законам классической физики. В
боровской модели атома электроны могут находиться только на
разрешенных орбитах и способны мгновенно перескакивать между
орбитами при поглощении и испускании фотонов (совершать
квантовые скачки).
Ранее, летом 1912 года, ученый прислал своему
наставнику Эрнесту Резерфорду черновик статьи,
посвященной проблеме устойчивости атома. По сути, Нильс Бор
впервые смог объяснить, почему электроны не падают на ядро атома:
когда электроны движутся с ускорением по
строго стационарным орбитам, они не
излучают электромагнитных волн, а значит, не теряют
энергию и не сходят с орбиты. Чтобы найти радиусы
устойчивых орбит, пришлось обращаться к новой на тот момент,
квантовой теории Макса Планка.
Справка.
Состояние атома, в котором все электроны находятся на
стационарных орбитах с наименьшей возможной энергией,
называется основным, а все другие состояния —
возбужденными. Стационарным состояниям соответствуют определенные
стационарные орбиты, по которым движутся электроны.
Бором были сформулированы квантовые постулаты, которые резко
расходились с классической механикой и классической
электродинамикой, однако успешно позволяли описать простейший
атом водорода. Нильс Бор впервые показал, что электрон
делает квантовые скачки по орбитам в атоме, и это изменило наше
понимание микромира.
Кроме того, Бор ввел понятие об атомном номере, понял, что такое
изотопы, высказал и осмыслил закон радиоактивного смещения. Он
также внес огромный вклад в понимание некоторых процессов,
происходящих внутри тяжелых атомных ядер, что имело решающее
значение для начала исследований, приведших к освобождению
ядерной энергии. (© «Нильс Бор. Жизнь и творчество», изд-во
«Наука», 1967 г.).
Фото: из презентации физика-теоретика Д.И. Казакова.
Согласно теории Бора, электрон вращается вокруг атома по строго стационарным орбитам. Бор ввел понятие квантового соотношения между радиусом орбиты и скоростью электрона.
«Исходным пунктом атомной теории Бора является признание того
факта, что модель атома Резерфорда вместе с классической физикой
не могут объяснить той устойчивости, которой, как мы знаем из
нашего повседневного опыта, обладают атомы. <…> Исходя из
нового положения Бора о существовании атома только в
стационарных состояниях, теперь можно было описать эти
состояния без какой-либо ссылки на такие классические
представления, как электронные орбиты», — писали о вкладе
Бора в развитие физики Х. Меллер и М. Пиль.
Теория датского физика объяснила не только стабильность атомов,
но и линейчатый характер спектров — еще
один важнейший вопрос физики того времени.
Орбитальная модель атома Бора, позже
усовершенствованная Арнольдом Зоммерфельдом, стала
итогом старой квантовой теории.
Рождение новой квантовой теории состоялось в
1925-1926 годах и связано оно было с учеником Нильса Бора —
Вернером Гейзенбергом (и его матричной механикой), а также с
Эрвином Шредингером и Полем Дираком.
«Решающим моментом в атомной модели Резерфорда было то, что она
со всей ясностью показала, что устойчивость атомов нельзя
объяснить на основе классической физики и что квантовый
постулат — единственно возможный выход из острой дилеммы, и
эта острота несоответствия заставила меня абсолютно поверить в
правильность квантового постулата», — говорил сам Нильс
Бор.
В июле 1913 года в одном из старейших научных журналов
Великобритании — Philosophical Magazine — вышла
знаменитая статья Бора,
посвященная строению атомов и молекул. Эта публикация имела
фундаментальное значение для развития теоретической физики.
Атомная физика | Открытые видеолекции учебных курсов МГУ
Курс лекций «Атомная физика» читается для студентов третьего курса физического факультета МГУ имени М. В. Ломоносова в 5 семестре.
В курсе лекций в доступной форме излагаются основные понятия физики атома. В первой части курса внимание уделяется основам физики микромира, и истории становления атомной физики как самостоятельной дисциплины. Важное место в курсе занимает изучение основ квантовой механики, вводятся её основные понятия, операторы, волновая функция, стационарные и нестационарные состояния, излагаются основы квантовомеханической теории возмущений. Рассматриваются такие вопросы как частица в потенциальной яме, частица в центральном поле, операторы рождения и уничтожения, атом водорода.
Вторая часть курса посвящена исследованию спектральных свойств атомов и молекул, теории взаимодействия квантовой системы с излучением, рассмотрению атома в поле внешних сил.
Список всех тем лекций
Лекция 1. Масштабы в атомной физике. Строение атома..
Предмет и порядки величин в атомной физике
Экспериментальные свидетельства недостаточности классического описания, приведшие к появлению квантовой физики
Гравитоны
Сильное взаимодействие
Электромагнитное взаимодействие
Слабое взаимодействие
Элементарные частицы, взаимодействия и физические теории
Строение атома
Порядки физических величин в атомной физике
Представления о материи в классической механике
Стабильность и размер атомов
Модель атома Томсона
Модель атома Резерфорда
Постулаты Бора
Спектральные серии атома водорода
Опыт Франка и Герца
Гипотеза де-Бройля
Лекция 2. Введение в квантовую механику. Операторы..
Водородоподобные атомы
Противоречия теории Бора
Постулаты квантовой механики
Собственные функции и собственные значения операторов квантовой механики
Лекция 3. Понятие волновой функции. Стационарные состояния..
Среднее значение оператора энергии
Физический смысл амплитуды вероятности
Волновая функция в координатном и импульсном представлении
Соотношение неопределенностей
Свойства коммутатора двух операторов
Соотношением Робертсона — Шрёдингера
Нестационарное уравнение Шрёдингера
Частица в бесконечной прямоугольной яме
Осцилляционная теорема
Лекция 4. Нестационарные состояния. Эволюция волновых пакетов..
Нестационарное уравнение Шрёдингера
Энергия n-го состояния
Средняя энергия и координата для нестационарных состояний
Суперпозиция двух нижних состояний электрона в прямоугольной яме
Производная от средней энергии, импульса и координаты
Теорема Эренфеста
Оператор четности
Лекция 5. Частица в потенциальной яме. Гармонический осциллятор..
Поведение волновой функции во времени
Демонстрация эволюции волновой функции во времени (на примере прямоугольно ямы)
Исследование периодичности волновой функции
Задача о прямоугольной яме конечной глубины
Гармонический осциллятор
Формула Родригеса
Стационарные состояния
Операторный метод решения задачи о гармоническом осцилляторе
Лекция 6. Операторы рождения и уничтожения. Частица в трёхмерном потенциале..
Операторный метод решения задачи о гармоническом осцилляторе
Вычисление средних операторным методом
Описание процесса квантования электромагнитного поля
Принцип соответствия для гармонического осциллятора
Нестационарные состояния гармонического осциллятора
Частицы в трехмерном потенциале
Квантовая точка
Атом водорода
Лекция 7. Частица в центральном поле. Атом водорода..
Атом водорода
Оператор момента импульса
Уравнение Шредингера в сферических координатах
Лекция 8. Орбитальный, спиновый и полный моменты атомов. Теория возмущений..
Волновые функции электронов в атоме водорода
Гиромагнитное соотношение
Расщепление энергетических уровней в неоднородном магнитном поле
Спин электрона
Компьютерная модель эксперимента Штерна-Герлаха
Полный момент импульса электрона
Введение в теорию возмущений
Лекция 9. Спин-орбитальное взаимодействие. Тонкая структура атома..
Введение в теорию возмущений
Релятивистское приближение
Спин-орбитальное взаимодействие
Формула Дирака
Лекция 10. Многоэлектронные системы. Водородоподобные атомы..
Формула Дирака
Тонкая структура линий водорода
Сверхтонкая структура линий водорода
История развития теории о спин-орбитальном взаимодействии
Простейшие многоэлектронные системы
Спектры водородоподобных атомов
Лекция 11. Многоэлектронные атомы. Термы..
Многоэлектронные атомы
Принцип тождественности
Термы
Лекция 12. Спонтанные и вынужденные переходы. Правила отбора..
Термы
Взаимодействие атома с электромагнитным полем
Спонтанное и вынужденное излучение атомов
Правила отбора
Серия Лаймана
Серия Бальмера
Правила отбора для многоэлектронных атомов
Лекция 13. Взаимодействие атома с квантовым электромагнитным полем..
Взаимодействие атома с электромагнитным полем
Разложение поля на осцилляторы
Взаимодействие атома с квантовым электромагнитным полем
Спонтанное и вынужденное излучение атомов
Лэмбовский сдвиг
Аномальный магнитный момент электрона
Тонкая структура рентгеновских спектров
Эффект Пашена-Бака
Лекция 14. Физика молекул и молекулярных ионов..
Ион молекулы водорода
Волновые функции молекулярного иона водорода
Роль обменной энергии при образовании молекулы водорода
Ионная связь
Валентность
Металлическая связь
Ядерная подсистема молекулы
Потенциал Морзе
Структура энергетических уровней молекулы
Строение атома — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e— | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям — орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии: в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 и -1/2.
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов n-го периода заполнены предыдущие n-1 электронные уровни.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов. Распределим эти электроны в соответствии с (●), не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона — 3s2. Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
— фосфор – пятнадцатый элемент, распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3. Итого получаем1s22s22p63s23p3.
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий — элемент пятого периода, следовательно, первые четыре энергетических уровня полностью заполнены — 1s22s22p63s23p64s23d104p6.Заполнение пятого уровня начинается с 5s2. Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.
В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2—
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Ты нашел то, что искал? Поделись с друзьями!
Нильс Бор думал не только о строении атома — о строении мира
Свои первые труды по квантовой механике будущий лауреат Нобелевской премии Лев Ландау опубликовал, ещё будучи сотрудником Ленинградского университета, однако особое влияние на его формирование как советского учёного произвело участие в деятельности Копенгагенского института теоретической физики, который возглавлял выдающийся датский физик-теоретик Нильс Бор.
Он родился седьмого октября 1885 года. Если мать Эллен была душой и сердцем семьи, то отец Христиан, профессор физиологии Копенгагенского университета, — её интеллектуальным средоточием. Его коллеги и друзья составляли цвет датской науки начала девятнадцатого века. Родительское воспитание дало плоды: в школе Нильс стал лучшим учеником по физике и математике. Затем с лёгкостью поступил в престижный вуз и удивлял преподавателей способностью глубоко и самостоятельно мыслить. Там, где другие сокурсники находили только одно решение задачи, Нильс отыскивал несколько вариантов.
Ещё студентом Нильс участвовал в конкурсе по теме «Использование вибрации струи для определения поверхностного натяжения жидкостей». В результате серьёзной работы получил золотую медаль Датского королевского общества. После окончания университета успешно защитил диссертацию, посвящённую физическим свойствам металлов, и получил степень магистра. Чтобы расширить свои знания, отправился осенью 1911 года на стажировку в Кембридж — научный центр Англии, к знаменитому профессору Джозефу Джону Томсону, который считался ревностным приверженцем классической физики.
При первой встрече с ним двадцатишестилетний Бор вместо своей диссертации положил на стол учёного его же статью с отмеченными в тексте ошибками, на которые указал автору со словами: «Не правда ли, сэр Джозеф, как важно, что ошибки обнаружены!» Через несколько лет лауреат Нобелевской премии Пётр Капица услышал другую версию случившегося. По ней молодой датчанин, нетвёрдый в английском, просто сказал: «Сэр Джозеф, вот тут вы написали глупость!»
На ежегодном застолье учёных Кавендишской лаборатории, ставшей научной меккой для физиков-исследователей разных стран, в том числе СССР, Бор встретился с её руководителем, выдающимся английским теоретиком в области физики Эрнестом Резерфордом и решил работать с ним. Но этот ответственный поступок необходимо было согласовать с Томсоном, который не мог до конца понять образ мыслей Бора, но и не хотел, видимо, ему мешать, поэтому без колебаний дал своё согласие.
Переехав в Манчестер, Бор занялся в лаборатории Резерфорда созданием новой теории квантовой модели атома, которая основывалась тогда на двух постулатах, противоречивших законам классической физики. Бору удалось устранить эти противоречия, в результате появилась квантовая теория планетарного атома. За эти исследования, а также за заслуги в изучении атомного излучения Бор был удостоен в 1922 году Нобелевской премии.
Фото: pixabay.com
Ставший учёным с мировым именем, он много сделал для развития науки в Дании. Благодаря ему Копенгаген превратился в центр теоретической физики, в котором был создан институт, сыгравший большую роль для широкого общения деятелей науки из разных стран. Сам Бор, будучи административным и научным руководителем института, сумел создать в нём свой стиль работы, построенный на уважении, дружбе, полной свободе слова и мысли. Его всегда окружали молодые учёные-исследователи, среди которых был швейцарец Вольфганг Паули. Он поступил к Бору ассистентом и внёс важные дополнения к его теории планетарного атома, что открыло новое направление в физике, названное квантовой механикой.
Первые десятилетия ХХ века были временем бурных открытий в области атомной физики, для развития которой много сделал и Бор. В 1938 году на Всемирном конгрессе антропологии и этнографии он выступил с докладом, направленным против расовой теории нацистов. Немецкая делегация покинула тогда зал, а учёный был внесён в список непримиримых противников третьего рейха. Его пребывание в оккупированной фашистами Дании стало опасным: в начале сентября 1943 года Бора вывезли в люке самолёта в Англию, а оттуда вскоре он перебрался в США, где велась работа над созданием атомной бомбы. То, что она стала угрозой человечеству, подтвердили американские бомбардировки японских городов Хиросимы и Нагасаки в августе 1945 года. Сразу же после этого жестокого акта Бор опубликовал в английской газете «Таймс» статью, в которой популярно объяснил, что сделать мир безопасным от оружия массового уничтожения могут только честный диалог и желание решать все вопросы, связанные с его производством и применением, при равноправном сотрудничестве учёных и правительств всех стран. По его мнению, самый большой фактор риска при использовании ядерной энергии — это человек.
Вернувшись в Копенгаген, Нильс Бор был избран президентом Датской академии наук, ему была присуждена престижная международная премия «Атом для мира», в его честь правительство страны учредило золотую медаль, на одной стороне которой был изображён профиль учёного, а на другой — модель атома с надписью вокруг неё: «Противоположности суть дополнения». Физик-теоретик и общественный деятель, член более двадцати иностранных академий наук, в том числе АН СССР, Нильс Бор дважды приезжал в нашу страну, побывал в Москве, Ленинграде, Дубне, познакомился с научно-исследовательскими институтами, читал лекции перед учёными и студентами. В 1963 году исполнилось полвека его теории атома, а за год до этой даты великого учёного не стало.
Структура атома — Химия LibreTexts
Атом состоит из положительно заряженного ядра, окруженного одной или несколькими отрицательно заряженными частицами, называемыми электронами. Положительные заряды равны отрицательным зарядам, поэтому у атома нет общего заряда; он электрически нейтрален. Большая часть массы атома находится в его ядре; масса электрона составляет всего 1/1836 массы самого легкого ядра, массы водорода. Хотя ядро тяжелое, оно довольно мало по сравнению с общим размером атома.
Радиус типичного атома составляет от 1 до 2,5 ангстрем (Å), тогда как радиус ядра составляет примерно 10 -5 Å. Если бы атом был увеличен до размеров Земли, его ядро было бы всего 200 футов в диаметре и могло бы легко находиться внутри небольшого футбольного стадиона. Ядро атома содержит протоны и нейтроны. Протоны и нейтроны имеют примерно равные массы, но различаются по заряду. Нейтрон не имеет заряда, тогда как протон имеет положительный заряд, который точно уравновешивает отрицательный заряд электрона.В таблице \ (\ PageIndex {1} \) перечислены заряды этих трех фундаментальных частиц и даны их массы, выраженные в атомных единицах массы.
| Частица | Заряд | Масса (а.е.м.) |
|---|---|---|
| Электроны | -1 | 0,000549 |
| Протоны | +1 | 1.00782 |
| Нейтроны | 0 | 1,00867 |
Атомная единица массы (а.е.м.) определяется как ровно одна двенадцатая массы атома углерода, который имеет шесть протонов и шесть нейтронов в своем ядре. В этой шкале протоны и нейтроны имеют массы, близкие, но не точно, к 1 ед. Каждая (6,022 x 10 23 ед. В 1 грамме. количество может быть вычислено обсуждается ниже).Число протонов в ядре атома известно как атомный номер Z. Оно равно количеству электронов вокруг ядра, потому что атом электрически нейтрален. Массовое число атома равно общему количеству тяжелых частиц: протонов и нейтронов.
Когда два атома находятся достаточно близко, чтобы химически соединиться — чтобы образовать химические связи друг с другом, — каждый атом в первую очередь «видит» самые удаленные электроны другого атома. Эти внешние электроны, следовательно, являются наиболее важными факторами в химическом поведении атомов.Нейтроны в ядре мало влияют на химическое поведение, а протоны важны только потому, что они определяют, сколько электронов окружает ядро в нейтральном атоме.
Все атомы с одинаковым атомным номером ведут себя примерно одинаково химически и классифицируются как один и тот же химический элемент. Каждый элемент имеет собственное имя и одно- или двухбуквенный символ (обычно производный от английского или латинского названия элемента). Например, символ углерода — C, а символ кальция — Ca.Символ натрия — Na — первые две буквы его латинского (и немецкого) названия, natrium , , чтобы отличить его от азота, N и серы, S.
.
Пример \ (\ PageIndex {1} \): Бром
Какой атомный символ у брома и каков его атомный номер? Почему символ брома не является просто первой буквой его названия? Какой еще элемент вытесняет символ B? (См. Периодическую таблицу)
Решение
атомный номер брома 35, его обозначение — Br; B — символ бора
.
Авторы и авторство
- Дикерсон, Ричард Э.и Грей, Гарри Б. и Хейт, Гилберт П. (1979) Химические принципы.
Атомная теория | физика | Britannica
Атомная теория , древнее философское предположение о том, что все вещи можно объяснить бесчисленными комбинациями твердых, маленьких, неделимых частиц (называемых атомами) различных размеров, но из одного и того же основного материала; или современная научная теория материи, согласно которой химические элементы, которые объединяются, чтобы сформировать большое разнообразие веществ, состоят из скоплений подобных субъединиц (атомов), обладающих ядерной и электронной субструктурой, характерной для каждого элемента.Древняя атомная теория была предложена в V веке до нашей эры греческими философами Левкиппом и Демокритом и возрождена в I веке до нашей эры римским философом и поэтом Лукрецием. Современная атомная теория, которая постоянно совершенствовалась, начала процветать в начале XIX века благодаря работам английского химика Джона Далтона. Эксперименты британского физика Эрнеста Резерфорда в начале 20-го века по рассеянию альфа-частиц на тонкой золотой фольге установили, что атомная модель атома Резерфорда состоит из центрального положительно заряженного ядра, содержащего почти всю массу и окруженного атомом. облако отрицательно заряженных планетоподобных электронов.
Британская викторина
Викторина «Все о физике»
Кто был первым ученым, проведшим эксперимент по управляемой цепной ядерной реакции? Какая единица измерения для циклов в секунду? Проверьте свою физическую хватку с помощью этой викторины.
С появлением квантовой механики и уравнения Шредингера в 1920-х годах теория атома стала точной математической наукой.Австрийский физик Эрвин Шредингер разработал уравнение в частных производных для квантовой динамики атомных электронов, включая электростатическое отталкивание всех отрицательно заряженных электронов друг от друга и их притяжение к положительно заряженному ядру. Уравнение может быть решено точно для атома, содержащего только один электрон (водород), и очень близкие приближения могут быть найдены для атомов, содержащих два или три электрона (гелий и литий). В той степени, в которой уравнение Шредингера может быть решено для более сложных случаев, атомная теория способна предсказывать из первых принципов свойства всех атомов и их взаимодействия.Появление в последнее время высокоскоростных суперкомпьютеров для решения уравнения Шредингера сделало возможным точный расчет свойств атомов и молекул с все большим числом электронов. Точное согласие с экспериментом достигается, если также включены небольшие поправки, обусловленные эффектами специальной теории относительности и квантовой электродинамики.
История атома — теории и модели — сложный процент
Нажмите для увеличения
Вся материя состоит из атомов.Это то, что мы сейчас принимаем как данность, и одна из вещей, которую вы изучаете еще в начале уроков химии в средней или средней школе. Несмотря на это, наши представления о том, что такое атом , на удивление недавние: всего сто лет назад ученые все еще обсуждали, как именно выглядит атом. На этом графике показаны ключевые модели, предложенные для атома, и то, как они менялись с течением времени.
Хотя наша графика началась в 1800-х годах, идея атомов появилась задолго до этого.Фактически, мы должны вернуться в Древнюю Грецию, чтобы найти его происхождение. Слово «атом» на самом деле происходит от древнегреческого и примерно переводится как «неделимый». Древнегреческую теорию приписывают нескольким различным ученым, но чаще всего ее приписывают Демокриту (460–370 до н.э.) и его наставнику Левкиппу. Хотя их представления об атомах были рудиментарными по сравнению с нашими сегодняшними представлениями, они изложили идею о том, что все состоит из атомов, невидимых и неделимых сфер материи бесконечного типа и числа.
Эти ученые представляли атомы различной формы в зависимости от типа атома. Они представляли атомы железа как имеющие крючки, скрепляющие их вместе, объясняя, почему железо остается твердым при комнатной температуре. Атомы воды были гладкими и скользкими, что объясняло, почему вода при комнатной температуре была жидкостью и ее можно было переливать. Хотя теперь мы знаем, что это не так, их идеи легли в основу будущих атомных моделей.
Однако нужно было долго ждать, прежде чем эти основы были заложены.Только в 1803 году английский химик Джон Далтон начал разрабатывать более научное определение атома. Он опирался на идеи древних греков, описывая атомы как маленькие твердые сферы, которые неделимы, и что атомы данного элемента идентичны друг другу. Последнее утверждение в значительной степени остается верным, за исключением изотопов различных элементов, которые различаются по количеству нейтронов. Однако, поскольку нейтрон не будет открыт до 1932 года, мы, вероятно, можем простить Далтону эту оплошность.Он также выдвинул теории о том, как атомы объединяются, чтобы образовать соединения, а также придумал первый набор химических символов для известных элементов.
Изложение теории атома Дальтоном было началом, но по-прежнему мало что рассказало нам о природе самих атомов. Последовало еще одно, более короткое затишье, когда наши познания в атомах не сильно продвинулись. Были некоторые попытки определить, как могут выглядеть атомы, такие как предположение лорда Кельвина о том, что они могут иметь вихревую структуру, но только на рубеже 20-го века прогресс в выяснении атомной структуры действительно начал проявляться. подбирать.
Первый прорыв произошел в конце 1800-х годов, когда английский физик Джозеф Джон (Дж. Дж.) Томсон обнаружил, что атом не так неделим, как утверждалось ранее. Он провел эксперименты с использованием катодных лучей, образующихся в разрядной трубке, и обнаружил, что лучи притягиваются положительно заряженными металлическими пластинами, но отталкиваются отрицательно заряженными. Из этого он сделал вывод, что лучи должны быть заряжены отрицательно.
Измерив заряд частиц в лучах, он смог сделать вывод, что они в две тысячи раз легче водорода, и, изменив металл, из которого сделан катод, он смог сказать, что эти частицы присутствуют во многих типах атомов. .Он открыл электрон (хотя и называл его «корпускулой») и показал, что атомы не неделимы, а имеют более мелкие составные части. Это открытие принесло ему Нобелевскую премию 1906 года.
В 1904 году он выдвинул свою модель атома, основанную на своих открытиях. Названная «моделью сливового пудинга» (хотя и не самим Томсоном), она представляла атом как сферу с положительным зарядом, с электронами, разбросанными повсюду, как сливы в пудинге. Ученые начали вглядываться во внутренности атома, но модель Томсона не продержалась долго — и именно один из его учеников предоставил доказательства, чтобы передать ее в историю.
Эрнест Резерфорд был физиком из Новой Зеландии, учился в Кембриджском университете под руководством Томсона. Это была его более поздняя работа в Манчестерском университете, которая позволила глубже проникнуть в суть атома. Эта работа появилась после того, как он уже получил Нобелевскую премию в 1908 году за свои исследования в области химии радиоактивных веществ.
Резерфорд разработал эксперимент по исследованию атомной структуры, который включал стрельбу положительно заряженными альфа-частицами в тонкий лист золотой фольги.Альфа-частицы были настолько малы, что могли проходить через золотую фольгу, и, согласно модели Томсона, которая показывала, что положительный заряд рассеивается по всему атому, они должны проходить с небольшим отклонением или без него. Проведя этот эксперимент, он надеялся подтвердить модель Томсона, но в итоге сделал прямо противоположное.
Во время эксперимента большая часть альфа-частиц действительно прошла через фольгу с небольшим отклонением или без него. Однако очень небольшое количество частиц отклонялось от своего первоначального пути на очень большие углы.Это было совершенно неожиданно; как заметил сам Резерфорд: «Это было почти так же невероятно, как если бы вы выстрелили 15-дюймовым снарядом по куску папиросной бумаги, а он вернулся и попал в вас». Единственное возможное объяснение заключалось в том, что положительный заряд не распространялся по всему атому, а концентрировался в небольшом плотном центре: ядре. Большая часть остального атома была просто пустым пространством.
Открытие ядра Резерфордом означало, что модель атома нуждалась в переосмыслении. Он предложил модель, в которой электроны вращаются вокруг положительно заряженного ядра.Хотя это было усовершенствованием модели Томсона, оно не объясняло, что удерживает электроны на орбите, а не просто по спирали в ядре.
Входит Нильс Бор. Бор был датским физиком, который попытался решить проблемы с помощью модели Резерфорда. Он понял, что классическая физика не может должным образом объяснить, что происходит на атомном уровне; вместо этого он обратился к квантовой теории, чтобы попытаться объяснить расположение электронов. Его модель постулировала существование энергетических уровней или оболочек электронов.Электроны можно было найти только на этих определенных энергетических уровнях; Другими словами, их энергия была квантована и не могла иметь никакого значения. Электроны могли перемещаться между этими энергетическими уровнями (называемыми Бором «стационарными состояниями»), но должны были делать это путем поглощения или испускания энергии.
Предложение Бора о стабильных уровнях энергии решало проблему спиралевидного движения электронов в ядро до некоторой степени, но не полностью. Точные причины немного сложнее, чем мы собираемся здесь обсуждать, потому что мы попадаем в сложный мир квантовой механики; и как сказал сам Бор: «Если квантовая механика вас не сильно шокировала, значит, вы ее еще не поняли».Другими словами, это становится немного странным.
Модель
Бора не решает всех проблем с атомной моделью. Он хорошо работал с атомами водорода, но не мог объяснить наблюдения более тяжелых элементов. Это также нарушает принцип неопределенности Гейзенберга, один из краеугольных камней квантовой механики, согласно которому мы не можем знать точное положение и импульса электрона. Тем не менее, этот принцип был постулирован лишь через несколько лет после того, как Бор предложил свою модель. Несмотря на все это, модель атома Бора, вероятно, по-прежнему является той моделью атома, с которой вы наиболее знакомы, поскольку зачастую она впервые появляется на курсах химии в средней или средней школе.Он все еще имеет свое применение; это очень удобно для объяснения химической связи и реакционной способности некоторых групп элементов на простом уровне.
Во всяком случае, модель все же требовала доработки. В этот момент многие ученые исследовали и пытались разработать квантовую модель атома. Главным из них был австрийский физик Эрвин Шредингер, о котором вы, наверное, слышали раньше (он парень с кошкой и ящиком). В 1926 году Шредингер предположил, что электроны, движущиеся по фиксированным орбитам или оболочкам, ведут себя как волны.Это кажется немного странным, но вы, вероятно, уже помните, что свет может вести себя и как волна, и как частица (так называемая дуальность волна-частица), и, оказывается, электроны тоже.
Шредингер решил серию математических уравнений, чтобы создать модель распределения электронов в атоме. Его модель показывает ядро, окруженное облаками электронной плотности. Эти облака — облака вероятности; хотя мы не знаем точно, где находятся электроны , мы знаем, что они, скорее всего, могут быть обнаружены в данных областях космоса.Эти области пространства называют электронными орбиталями. Возможно, понятно, почему уроки химии в старших классах не соответствуют этой модели, хотя сегодня это общепринятая модель, потому что на то, чтобы разобраться, нужно немного больше времени!
Schrödinger’s не было последним словом об атоме. В 1932 году английский физик Джеймс Чедвик (ученик Эрнеста Резерфорда) открыл существование нейтрона, завершив нашу картину субатомных частиц, составляющих атом.На этом история не заканчивается; С тех пор физики обнаружили, что протоны и нейтроны, составляющие ядро, сами делятся на частицы, называемые кварками, но это выходит за рамки этой статьи! Во всяком случае, атом дает нам отличный пример того, как научные модели могут меняться со временем, и показывает, как новые свидетельства могут привести к новым моделям.
Понравились этот пост и рисунок? Подумайте о поддержке сложного процента на Patreon и получайте предварительные просмотры предстоящих публикаций и многое другое!
Изображение в этой статье находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 Международная лицензия. См. Рекомендации по использованию содержания сайта.
Ссылки и дополнительная литература
Атомная теория
3.1 Атомная теория
Цели обучения
- Изложите современную атомную теорию.
- Узнайте, как устроены атомы.
Наименьшая часть элемента, которая поддерживает идентичность этого элемента, называется атомом. Наименьшая часть элемента, которая поддерживает идентичность этого элемента.. Отдельные атомы чрезвычайно малы. Чтобы построить линию длиной 1 см, потребуется около пятидесяти миллионов атомов подряд. Точка в конце печатного предложения состоит из нескольких миллионов атомов. Атомы настолько малы, что трудно поверить, что вся материя состоит из атомов, но это так.
Представление о том, что атомы играют фундаментальную роль в химии, формализовано современной атомной теорией. Представление о том, что атомы играют фундаментальную роль в химии, впервые высказано английским ученым Джоном Далтоном в 1808 году.Состоит из трех частей:
- Вся материя состоит из атомов.
- Атомы одного и того же элемента одинаковы; атомы разных элементов разные.
- Атомы объединяются в целочисленных отношениях с образованием соединений.
Эти концепции составляют основу химии.
Хотя слово атом происходит от греческого слова, означающего «неделимый», теперь мы понимаем, что сами атомы состоят из более мелких частей, называемых субатомными частицами .Первым был обнаружен электрон — крошечная субатомная частица с отрицательным зарядом, крошечная субатомная частица с отрицательным зарядом. Его часто обозначают как e — , с правым надстрочным индексом, показывающим отрицательный заряд. Позже были обнаружены две более крупные частицы. Протон — субатомная частица с положительным зарядом. представляет собой более массивную (но все же крошечную) субатомную частицу с положительным зарядом, представленную как p + . Нейтрон: субатомная частица без заряда.представляет собой субатомную частицу с массой примерно такой же, как у протона, но без заряда. Он представлен как n или n 0 . Теперь мы знаем, что все атомы всех элементов состоят из электронов, протонов и (за одним исключением) нейтронов. Таблица 3.1 «Свойства трех субатомных частиц» суммирует свойства этих трех субатомных частиц.
Таблица 3.1 Свойства трех субатомных частиц
| Имя | Символ | Масса (прибл.; кг) | Заряд |
|---|---|---|---|
| Протон | п. + | 1,6 × 10 −27 | 1+ |
| нейтрон | п, н 0 | 1,6 × 10 −27 | нет |
| Электрон | e – | 9.1 × 10 −31 | 1− |
Как эти частицы расположены в атомах? Они не расположены случайным образом. Эксперименты Эрнеста Резерфорда в Англии в 1910-х годах указали на ядерную модель — модель атома, в котором протоны и нейтроны находятся в центральном ядре, а электроны находятся на орбите вокруг ядра. атома. Относительно массивные протоны и нейтроны собираются в центре атома, в области, называемой ядром, центром атома, содержащим протоны и нейтроны.атома (множественные ядер ). Электроны находятся вне ядра и проводят время, вращаясь в космосе вокруг ядра. (См. Рисунок 3.1 «Структура атома».)
Рисунок 3.1 Структура атома
В центре атома есть протоны и нейтроны, образующие ядро, а электроны вращаются вокруг ядра.
Современная атомная теория утверждает, что атомы одного элемента одинаковы, а атомы разных элементов различны.Что отличает атомы разных элементов? Фундаментальной характеристикой, которой обладают все атомы одного и того же элемента, является число протонов . Все атомы водорода имеют в ядре один и только один протон; все атомы железа имеют в ядре 26 протонов. Это число протонов настолько важно для идентичности атома, что его называют атомным номером — числом протонов в атоме. элемента. Таким образом, атомный номер водорода равен 1, а атомный номер железа 26.Каждый элемент имеет свой характерный атомный номер.
Однако атомы одного и того же элемента могут иметь разное количество нейтронов. Атомы одного и того же элемента (то есть атомы с одинаковым числом протонов) с разным числом нейтронов называются изотопами. Атомы одного и того же элемента, которые имеют разное количество нейтронов. Большинство природных элементов существуют в виде изотопов. Например, большинство атомов водорода имеют в своем ядре единственный протон. Однако небольшое количество (примерно один из миллиона) атомов водорода имеет в своих ядрах протон и нейтрон.Этот конкретный изотоп водорода называется дейтерий. Очень редкая форма водорода имеет в ядре один протон и два нейтрона; этот изотоп водорода называется тритием. Сумма количества протонов и нейтронов в ядре называется массовым числом. Сумма количества протонов и нейтронов в ядре. изотопа.
У нейтральных атомов такое же количество электронов, как и у протонов, поэтому их общий заряд равен нулю. Однако, как мы увидим позже, так будет не всегда.
Пример 1
- Наиболее распространенные атомы углерода имеют шесть протонов и шесть нейтронов в своих ядрах. Каковы атомный номер и массовое число этих атомов углерода?
- Изотоп урана имеет атомный номер 92 и массовое число 235. Каково количество протонов и нейтронов в ядре этого атома?
Решение
- Если в ядре атома углерода шесть протонов, его атомный номер равен 6.Если у него также есть шесть нейтронов в ядре, то массовое число равно 6 + 6, или 12.
- Если атомный номер урана 92, то это количество протонов в ядре. Поскольку массовое число равно 235, то количество нейтронов в ядре равно 235 — 92, или 143.
Проверьте себя
Число протонов в ядре атома олова — 50, а число нейтронов в ядре — 68. Каковы атомный номер и массовое число этого изотопа?
Ответ
Атомный номер = 50, массовое число = 118
Обращаясь к атому, мы просто используем название элемента: термин натрий относится как к элементу, так и к атому натрия.Но постоянно использовать имя элемента может быть неудобно. Вместо этого химия определяет символ для каждого элемента. Атомарный символ — одно- или двухбуквенное представление имени элемента. представляет собой одно- или двухбуквенное сокращение названия элемента. По соглашению первая буква символа элемента всегда заглавная, а вторая буква (если есть) — строчная. Таким образом, символ водорода — H, символ натрия — Na, а символ никеля — Ni. Большинство символов происходит от английского названия элемента, хотя некоторые символы происходят от латинского названия элемента.(Символ натрия Na происходит от его латинского названия natrium .) В таблице 3.2 «Названия и символы общих элементов» перечислены некоторые общие элементы и их символы. Вам следует запомнить символы в Таблице 3.2 «Имена и символы общих элементов», так как именно так мы будем представлять элементы в химии.
Таблица 3.2 Названия и символы общих элементов
| Имя элемента | Символ | Имя элемента | Символ | |
|---|---|---|---|---|
| Алюминий | Al | Меркурий | рт. Ст. | |
| Аргон | Ar | молибден | Пн | |
| мышьяк | As | Неон | Ne | |
| Барий | Ba | Никель | Ni | |
| Бериллий | Be | Азот | N | |
| висмут | Bi | Кислород | O | |
| Бор | B | Палладий | Pd | |
| Бром | руб. | фосфор | -П, | |
| Кальций | Ca | Платина | Pt | |
| Углерод | С | Калий | К | |
| Хлор | класс | Радий | Ra | |
| Хром | Cr | Радон | Rn | |
| Кобальт | Co | Рубидий | руб. | |
| Медь | Cu | Скандий | SC | |
| фтор | F | Селен | SE | |
| Галлий | Ga | Кремний | Si | |
| Германий | Ge | Серебро | Ag | |
| Золото | Au | Натрий | Na | |
| Гелий | He | Стронций | Sr | |
| Водород | H | сера | S | |
| Йод | I | Тантал | Ta | |
| Иридий | Ir | Олово | Sn | |
| Утюг | Fe | Титан | Ti | |
| Криптон | Кр | Вольфрам | Вт | |
| Свинец | Пб | Уран | U | |
| Литий | Li | Ксенон | Xe | |
| Магний | мг | цинк | Zn | |
| Марганец | Mn | Цирконий | Zr |
Элементы сгруппированы вместе в специальной таблице, называемой периодической таблицей — диаграммой всех элементов.. Простая периодическая таблица показана на рисунке 3.2 «Простая периодическая таблица», а более обширная представлена в главе 17 «Приложение: Периодическая таблица элементов». Элементы в периодической таблице перечислены в порядке возрастания атомного номера. Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы рассмотрим организацию электронов в атомах (см. Главу 8 «Электронная структура»). Одно немедленное использование таблицы Менделеева помогает нам идентифицировать металлы и неметаллы.Неметаллы находятся в верхнем правом углу таблицы Менделеева, на одной стороне жирной линии, разделяющей правую часть таблицы. Все остальные элементы — металлы.
Рисунок 3.2 Простая периодическая таблица
Есть простой способ представить изотопы с помощью атомных символов. Используем конструкцию
XZA
, где X — символ элемента, A — массовое число, а Z — атомный номер. Таким образом, для изотопа углерода, который имеет 6 протонов и 6 нейтронов, символ
.
C612
, где C — символ элемента, 6 — атомный номер, а 12 — массовое число.
Пример 2
- Какой символ у изотопа урана с атомным номером 92 и массовым числом 235?
- Сколько протонов и нейтронов в F2656e?
Решение
- Обозначение этого изотопа — U92235.
- В этом атоме железа 26 протонов и 56 — 26 = 30 нейтронов.
Проверьте себя
Сколько протонов в N1123a?
Ответ
11 протонов
Также принято указывать массовое число после названия элемента, чтобы указать на конкретный изотоп. Углерод-12 представляет собой изотоп углерода с 6 протонами и 6 нейтронами, а уран-238 представляет собой изотоп урана с 146 нейтронами.
Основные выводы
- Химия основана на современной атомной теории, которая утверждает, что вся материя состоит из атомов.
- Сами атомы состоят из протонов, нейтронов и электронов.
- Каждый элемент имеет свой атомный номер, равный количеству протонов в его ядре.
- Изотопы элемента содержат разное количество нейтронов.
- Элементы представлены атомным символом.
- Периодическая таблица — это таблица, в которой упорядочены все элементы.
Упражнения
Перечислите три утверждения, из которых состоит современная атомная теория.
Объясните, как устроены атомы.
Что больше, протон или электрон?
Что больше, нейтрон или электрон?
Каковы заряды каждой из трех субатомных частиц?
Где находится большая часть массы атома?
Нарисуйте схему атома бора, в ядре которого находятся пять протонов и шесть нейтронов.
Нарисуйте схему атома гелия, в ядре которого есть два протона и два нейтрона.
Определите атомный номер . Какой порядковый номер у атома бора?
Какой атомный номер у гелия?
Определите изотоп и приведите пример.
В чем разница между дейтерием и тритием?
Какая пара представляет собой изотопы?
- h34e и h33e
- F2656e и M2556n
- S1428i и P1531
Какая пара представляет собой изотопы?
- C2040a и K1940
- F2656e и F2658e
- U92238 и U92235
Укажите полные обозначения каждого атома, включая атомный номер и массовое число.
- атом кислорода с 8 протонами и 8 нейтронами
- Атом калия с 19 протонами и 20 нейтронами
- Атом лития с 3 протонами и 4 нейтронами
Укажите полные обозначения каждого атома, включая атомный номер и массовое число.
- Атом магния с 12 протонами и 12 нейтронами
- Атом магния с 12 протонами и 13 нейтронами
- Атом ксенона с 54 протонами и 77 нейтронами
Америций-241 — изотоп, используемый в детекторах дыма.Каков полный символ этого изотопа?
Углерод-14 — изотоп, используемый для проведения радиоактивных испытаний на датирование ранее живого материала. Каков полный символ этого изотопа?
Укажите атомарные символы для каждого элемента.
- натрия
- аргон
- азот
- радон
Укажите атомарные символы для каждого элемента.
- серебро
- золото
- ртуть
- йод
Дайте название элементу.
- Si
- Mn
- Fe
- Cr
Дайте название элементу.
- Ф
- Класс
- рублей
- I
ответов
Вся материя состоит из атомов; атомы одного и того же элемента одинаковы, а атомы разных элементов различны; атомы объединяются в целочисленных отношениях с образованием соединений.
Протон больше электрона.
протон: 1+; электрон: 1-; нейтрон: 0
Атомный номер — это количество протонов в ядре.Бор имеет атомный номер пять.
Изотопы — это атомы одного и того же элемента, но с разным числом нейтронов. h21 и h22 являются примерами.
- изотопов
- Неизотопы
- Неизотопы
- кремний
- марганец
- утюг
- хром
Список атомных теорий
Атомная теория развивалась с древних времен.Ученые взяли гипотезу греческих ученых и основали ее на своих различных открытиях и теориях относительно атома, происходящих от греческого слова «atomos», что означает неделимый. С тех пор научное сообщество обнаружило, что эти частицы делятся на субчастицы, называемые протонами, нейтронами и электронами. Тем не менее название «атом» прижилось.
Древнегреческие верования
Левкипп и Демокрит были первыми, кто высказал свое предположение в пятом веке до нашей эры.C., что вся материя состоит из крошечных единиц, называемых атомами. Два философа считали, что это твердые частицы без внутренней структуры, которые бывают разных форм и размеров. Согласно этой теории, нематериальные качества, такие как вкус и цвет, состоят из атомов. Однако Аристотель категорически противился этой идее, и научное сообщество веками не уделяло ей серьезного внимания.
Теория Дальтона
В 1808 году английский химик Джон Далтон развил греческое понятие атомов.Он постулировал, что материя состоит из атомов, которые представляют собой небольшие неделимые частицы. Он также предположил, что, хотя все атомы одного элемента идентичны, они полностью отличаются от атомов, составляющих другие элементы.
J.J. Теория Томсона
Английский физик Джозеф Дж. Томсон предложил теорию «сливового пудинга» делимого атома в 1904 году, после открытия электронов в 1897 году. Его модель постулировала, что атомы состоят из большой положительно заряженной сферы, усеянной отрицательно заряженными электронами (он назвал их «тельцами») как фрукты в сливовом пудинге.Далее он предположил, что заряд положительной сферы равен отрицательному заряду электронов. Сегодня мы называем положительно заряженные частицы протонами, а отрицательные — электронами.
Гипотеза Резерфорда
Британский физик Эрнест Резерфорд предложил ядерную модель атома, в которой ядро существует, в 1911 году. Он также обнаружил активность в этой части, а именно движение протонов и электронов в центральной части атома. Далее он предположил, что количество протонов в атоме равно количеству электронов.Он также предположил, что существует больше нейтральных частиц. Они стали известны как нейтроны.
Теория Бора
Датский физик Нильс Бор предложил в 1913 году планетарную модель, в которой электроны вращаются вокруг ядра так же, как планеты вращаются вокруг Солнца. Пока электроны находятся на орбите, они обладают тем, что Бор назвал «постоянной энергией». Когда эти частицы поглощают энергию и переходят на более высокую орбиту, теория Бора называет их «возбужденными» электронами. Когда электроны возвращаются на свою первоначальную орбиту, они испускают эту энергию в виде электромагнитного излучения.
Эйнштейн, Гейзенберг и квантовая механика
На основе десятилетий кропотливых исследований тысяч ученых современная атомная теория основывается на работе, проделанной в 1930-х годах Альбертом Эйнштейном, Вернером Гейзенбергом и другими. Как и в предыдущих теориях, атом состоит из центрального тяжелого ядра, окруженного множеством электронов. В отличие от более ранних теорий, которые рассматривали электроны, протоны и другие крошечные частицы как определенные твердые «глыбы», современная квантовая теория рассматривает их как статистические «облака»; как ни странно, вы можете точно измерить их скорость или их местоположение, но не то и другое одновременно.Вместо того, чтобы вести себя как планеты, вращающиеся по правильным эллиптическим траекториям, они вращаются в нечетких облаках различной формы. Атомы становятся менее похожими на твердые и точные бильярдные шары и больше похожи на упругие круглые губки. И несмотря на то, что они «твердое вещество», они могут проявлять волнообразные свойства, такие как длина волны и интерференционные картины.
Quark Theory
По мере того, как ученые рассматривали атомы с помощью все более мощных инструментов, они обнаружили, что протоны и нейтроны, составляющие ядро, в свою очередь, состоят из еще более мелких частиц.В 1960-х физики Мюррей Гелл-Манн и Джордж Цвейг назвали эти частицы «кварками», позаимствовав слово из романа Джеймса Джойса. Кварки бывают таких разновидностей, как «верхний», «нижний», «верхний» и «нижний». Протоны и нейтроны образуются из пучков по три кварка в каждом: «вверх», «вниз», «вверх» и «вниз», «вверх» и «вниз» соответственно.
Теория атома
Теория атома
Атомная теория :
Древний философ Гераклит утверждал, что все находится в состоянии
потока.Ничто не ускользает от каких-то изменений (невозможно войти в
та же река). С другой стороны, Парменид утверждал, что все то, что
это так, чтобы оно не могло стать тем, чем не является (изменение невозможно, потому что
субстанция должна пройти через ничто, чтобы стать чем-то другим,
что является логическим противоречием). Таким образом, изменение несовместимо с тем, чтобы быть таким
что только постоянные аспекты Вселенной могут считаться реальными.
Гениальный побег был предложен в V веке до нашей эры.C. Демокрита. Он
выдвинул гипотезу, что вся материя состоит из крошечных неразрушимых единиц, называемых
атомы. Сами атомы остаются неизменными, но перемещаются в пространстве, чтобы
комбинировать различными способами, чтобы сформировать все макроскопические объекты. Ранний атомный
теория утверждала, что характеристики объекта определяются
форма его атомов. Так, например, сладкое делают из гладких
атомы, горькие вещи состоят из острых атомов.
Таким образом согласовываются постоянство и поток, и поле атомной
родилась физика.Хотя идеи Демокрита заключались в том, чтобы решить
философская дилемма, тот факт, что в основе лежит некая элементарная
вещество для Вселенной является основным двигателем в современной физике,
поиск последней субатомной частицы.
В начале 1800-х годов Джон Далтон определил, что каждое химическое вещество
элемент состоит из уникального типа атома, и что атомы различаются
своими массами. Он разработал систему химических символов и, имея
выяснил относительный вес атомов, сложил их в таблицу.В
Кроме того, он сформулировал теорию о том, что химическая комбинация
различные элементы встречаются в простых числовых соотношениях по весу, что привело
к развитию законов определенной и множественной пропорции.
Затем он определил, что соединения состоят из молекул, и что
молекулы состоят из атомов в определенных пропорциях. Таким образом, атомы
определяют состав вещества, и соединения могут быть разбиты на
их отдельные элементы.
Первые оценки размеров атомов и числа атомов на
Единичный объем произведен Джозефом Лошмидтом в 1865 году.Используя идеи
кинетической теории, идея о том, что свойства газа обусловлены
движения атомов, составляющих его, Лошмидт вычислил среднее свободное
путь атома на основе скоростей диффузии. Его результатом было то, что есть
6.022×10 23 атомов на 12 граммов углерода.
И что типичный диаметр атома составляет 10 -8 сантиметров.
К 19 веку было установлено, что атомы связываются вместе.
образовывать вещества с помощью электромагнитных сил. Эти атомы
очень малы, а материя — это в основном пустое пространство, но «чувствует»
твердые, потому что атомы вашей руки отталкиваются
электромагнитные силы между вашими атомами и атомами объектов
(как стол).
Дело :
Материя существует в четырех состояниях: твердом, жидком, газовом и плазменном. Плазма
встречаются только в коронах и ядрах звезд. Состояние материи
определяется силой связей между атомами, из которых состоит материя.
Таким образом, пропорционально температуре или количеству энергии, содержащейся в
причина.
Переход от одного состояния вещества к другому называется фазой
переход. Например, лед (твердая вода) превращается (тает) в жидкую воду.
по мере добавления энергии.Продолжайте добавлять энергию, и вода превращается в пар.
(газообразная вода) затем при температуре в несколько миллионов градусов распадается на
составляющие атомы.
Ключевым моментом, который следует отметить в теории атома, является взаимосвязь между
макроскопический мир (нас) и микроскопический мир атомов. Например,
макроскопический мир имеет дело с такими понятиями, как температура и давление
описать материю. Микроскопический мир атомной теории имеет дело с
кинетическое движение атомов для объяснения макроскопических величин.
Как мы узнаем, что атомы существуют? Броуновский
движение
В атомной теории температура объясняется как движение атомов
(быстрее = горячее). Давление объясняется как передача импульса
те движущиеся атомы на стенках контейнера (более быстрые атомы =
более высокая температура = больший импульс / удары = более высокое давление).
Закон об идеальном газе :
Макроскопические свойства вещества регулируются законом идеального газа
химия.
Идеальный газ — это газ, который по своему физическому поведению соответствует
В частности, идеализированное соотношение между давлением, объемом и температурой.Закон идеального газа гласит, что для определенного количества газа продукт
объема (V) и давления (P) пропорционально абсолютной
температура (T) и количество или плотность частиц (n); т.е. в
форма уравнения PV = nkT, в которой k — постоянная (называемая постоянной Больцмана). Такое соотношение для
вещество называется его уравнением состояния и достаточно для описания
его грубое поведение.
Идеальный газ
моделирование
Распространение
Схема PV
Хотя ни один газ не описывается в точности указанным выше законом, поведение реальных
газы довольно точно описываются законом идеального газа при достаточно высоких
температуры и низкого давления (например, давление воздуха на уровне моря), когда
относительно большие расстояния между молекулами и их высокие скорости преодолевают любые
взаимодействие.Газ не подчиняется уравнению, когда условия таковы, что
газ или любой из составляющих газов в смеси близок к своей тройной
точка.
Закон идеального газа может быть получен из кинетической теории газов и основан на
предположения, что (1) газ состоит из большого количества молекул, которые
находятся в беспорядочном движении и подчиняются детерминированным законам движения Ньютона; (2)
объем молекул пренебрежимо мал по сравнению с объемом, занимаемым
газ; и (3) никакие силы не действуют на молекулы, кроме как во время упругого
столкновения незначительной продолжительности.
Термодинамика :
Изучение взаимосвязи между теплом, работой, температурой и энергией,
охватывающая общее поведение физической системы, называется термодинамикой. Есть
четыре закона термодинамики, все из которых связаны с энергией и ее эволюцией от
система в систему.
Нулевой закон термодинамики состоит в том, что две системы находятся в тепловом
равновесие с третьей системой, они должны быть в тепловом равновесии с
друг с другом. Этот закон помогает определить понятие температуры и определяет
Известный факт, что все системы стремятся достичь равновесия.Государства или
системы, не находящиеся в равновесии, вынуждены и требуют объяснения, такого как
формы жизни.
Первый закон термодинамики часто называют законом
сохранение энергии (на самом деле масса-энергия), потому что оно, по сути, говорит
что когда система подвергается процессу, сумма всей энергии
передается через границу системы — либо в виде тепла, либо в виде работы —
равно чистому изменению энергии системы. Например, если вы
выполнять физическую работу с системой (например, размешать немного воды), некоторые из
энергия идет в движение, остальное идет на повышение температуры
система.
Второй закон термодинамики гласит, что в замкнутой системе энтропия увеличивается. Машины ржавеют, мертвые деревья
распад, обрушение зданий; все это примеры энтропии в
действие, спонтанное движение от порядка к беспорядку.
Классическая или ньютоновская физика неполна, потому что не включает
необратимые процессы, связанные с увеличением энтропии.
Энтропия всей Вселенной всегда увеличивалась со временем. Мы
просто локальное пятно с низкой энтропией, и наша судьба связана с
непрекращающийся беспорядок в нашем мире => звезды сгорят,
цивилизации умрут от недостатка власти.
Таким образом, приближение к равновесию — необратимый процесс. В
стремление к равновесию настолько фундаментально для физики, что второе
закон, вероятно, является наиболее универсальным регулятором естественной деятельности, известным
наука.
Понятие температуры входит в термодинамику как точное
математическая величина, связывающая тепло с энтропией. Взаимодействие этих
три величины дополнительно ограничиваются третьим законом
термодинамика, которая имеет дело с абсолютным нулем температуры и ее
теоретическая недостижимость.
Абсолютный ноль (приблизительно -273 ° C) соответствует состоянию в
при котором система достигла своего самого низкого энергетического состояния. Третий закон гласит
что по мере приближения к этой минимальной температуре дальнейшая экстракция
энергия становится все труднее и труднее.
Атом Резерфорда :
Эрнест Резерфорд считается отцом ядерной физики. Действительно, это
можно сказать, что Резерфорд изобрел сам язык для описания
теоретические представления об атоме и явлении радиоактивности.Названные и охарактеризованные им частицы включают альфа-частицу, бета.
частица и протон. Резерфорд опроверг модель атома Томсона в 1911 году.
с его известным экспериментом с золотой фольгой, в котором он продемонстрировал, что
атом имеет крошечное массивное ядро.
Его результаты лучше всего можно объяснить с помощью модели атома как крошечного, плотного,
положительно заряженное ядро, называемое ядром, в котором почти вся масса равна
концентрированный, вокруг которого свет, отрицательные составляющие, вызванные
электроны циркулируют на некотором расстоянии, как планеты, вращающиеся вокруг
солнце.
Атомную модель Резерфорда также называют
ядерный атом, или планетарная модель атома.
Теория атома
На развитие теории структуры и поведения атомов потребовалось более двух тысячелетий — от абстрактных размышлений древнегреческих философов до высокотехнологичных экспериментов современных ученых. Однако до научной революции и развития научных методов, начиная с 16 века, идеи об атоме были в основном спекулятивными.Только в самом конце XIX века технологии стали достаточно продвинутыми, чтобы позволить ученым взглянуть на составные части атома: электрон, ядро, протон и нейтрон.
Greek Origins
Считается, что идея о том, что вся материя состоит из крошечных неделимых частиц или атомов, возникла у греческого философа Левкиппа Милетского и его ученика Демокрита из Абдеры в V веке до нашей эры. (Слово атом происходит от греческого слова atomos , что означает «неделимый».?) Эти мыслители считали, что помимо того, что атомы слишком малы, чтобы их можно было увидеть, неизменяемы и неразрушимы, они также являются полностью твердыми, без внутренней структуры и имеют бесконечное разнообразие форм и размеров, что объясняет различные виды материи. Считалось, что цвет, вкус и другие нематериальные качества состоят из атомов.
Хотя идея атома была поддержана некоторыми более поздними греческими философами, она подверглась яростным нападкам со стороны других, включая Аристотеля, который выступал против существования таких частиц.В средние века в Европе римско-католические богословы находились под сильным влиянием идей Аристотеля, поэтому атомная философия в значительной степени отвергалась на протяжении веков. Однако греческая концепция атома сохранилась как в работах Аристотеля (его аргументы против), так и в другом классическом труде римского автора Лукреция, De rerum natura («О природе вещей»), который был заново открыт в Европа в начале эпохи Возрождения.
Современное развитие
Считается, что современная атомная теория началась с Джона Далтона, английского химика и метеоролога, который в 1808 году опубликовал книгу об атмосфере и поведении газов под названием Новая система химической философии. Теория атомов Дальтона основывалась на четырех основных идеях: химические элементы состоят из атомов; атомы элемента были одинаковыми по весу; атомы разных элементов имели разный вес; и атомы объединяются только в небольших целочисленных соотношениях, таких как 1: 1, 1: 2, 2: 1, 2: 3, с образованием соединений.
Не все эти идеи были новыми; греки уже представили идею, что элементы состоят из атомов и что атомы разных элементов имеют разные физические свойства.Особый вклад Дальтона, который отличал его работу от того, что было сделано ранее, заключался в его методе фактического определения атомного веса. В эссе, опубликованном в 1805 году, Дальтон включил список атомных весов для 21 элемента. Дальтон был также первым, кто предложил стандартные символы для элементов.
Субатомная структура
Работа Дальтона была в основном посвящена химии атомов (как они объединяются в новые соединения), а не физической внутренней структуре атомов, хотя он никогда не отрицал возможность наличия у атомов субструктуры.Современные теории о физической структуре атомов возникли только в 1897 году, когда Дж. Дж. Томсон открыл электрон.
Фактически, Томсон обнаружил, что катодные лучи представляют собой потоки отрицательно заряженных частиц с массой примерно в 1000 раз меньше, чем атом водорода. Он утверждал, что эти частицы, которые он назвал «корпускулами», были вещи, из которых были сделаны атомы. Термин «электрон» до открытия Томсона — несколькими годами ранее ирландский физик Дж. Дж.Стони предположил, что электричество состоит из отрицательных частиц, называемых «электронами». и ученые приняли это слово для обозначения всего, что имеет электрический заряд. Однако Томсон, физик из Кембриджского университета, был первым, кто предположил, что эти частицы являются строительным блоком атома.
Томсон также пытался показать, как электроны расположены в атоме. Поскольку было известно, что атомы электрически нейтральны, Томсон предложил (1904 г.) модель, в которой атом представлял собой положительно заряженную сферу, усеянную отрицательно заряженными электронами.Это называлось «сливовый пудинг». Модель, поскольку электроны в атоме напоминали изюм в сливовом пудинге. Эта модель долго не просуществовала. В 1911 году эксперименты Эрнеста Резерфорда с альфа-лучами привели его к описанию атома как маленького тяжелого ядра с электронами на орбите вокруг него. Эта ядерная модель атома стала основой той, которая принята до сих пор.
Бор и за их пределами
В 1913 году датский физик Нильс Бор, который учился под руководством Томсона и Резерфорда, дополнительно уточнил ядерную модель, предположив, что электроны движутся только в ограниченных последовательных орбитальных оболочках и что внешние орбиты с более высокой энергией определены химические свойства различных элементов.Более того, Бор смог объяснить спектральные линии различных элементов, предположив, что, когда электроны прыгали с более высоких орбит на более низкие, они излучали энергию в виде света. В 1920-х годах теория Бора стала основой квантовой механики, которая более подробно объяснила сложную структуру и поведение атомов.
Протоны и нейтроны
С момента открытия Томсоном электрона в 1897 году ученые поняли, что атом должен содержать положительный заряд, чтобы уравновесить отрицательный заряд электронов.В 1919 году в качестве побочного продукта своих экспериментов по расщеплению атомных ядер Резерфорд открыл протон, который составляет ядро атома водорода. Протон несет единственный положительный электрический заряд, и каждое атомное ядро содержит один или несколько протонов. Хотя Резерфорд предположил существование нейтральной субатомной частицы, нейтрона, в 1920 году, фактическое открытие было сделано английским физиком Джеймсом Чедвиком, бывшим учеником Резерфорда, в 1932 году.

 Бор, 1913 г.:
Бор, 1913 г.: Обратно, освещение атома
Обратно, освещение атома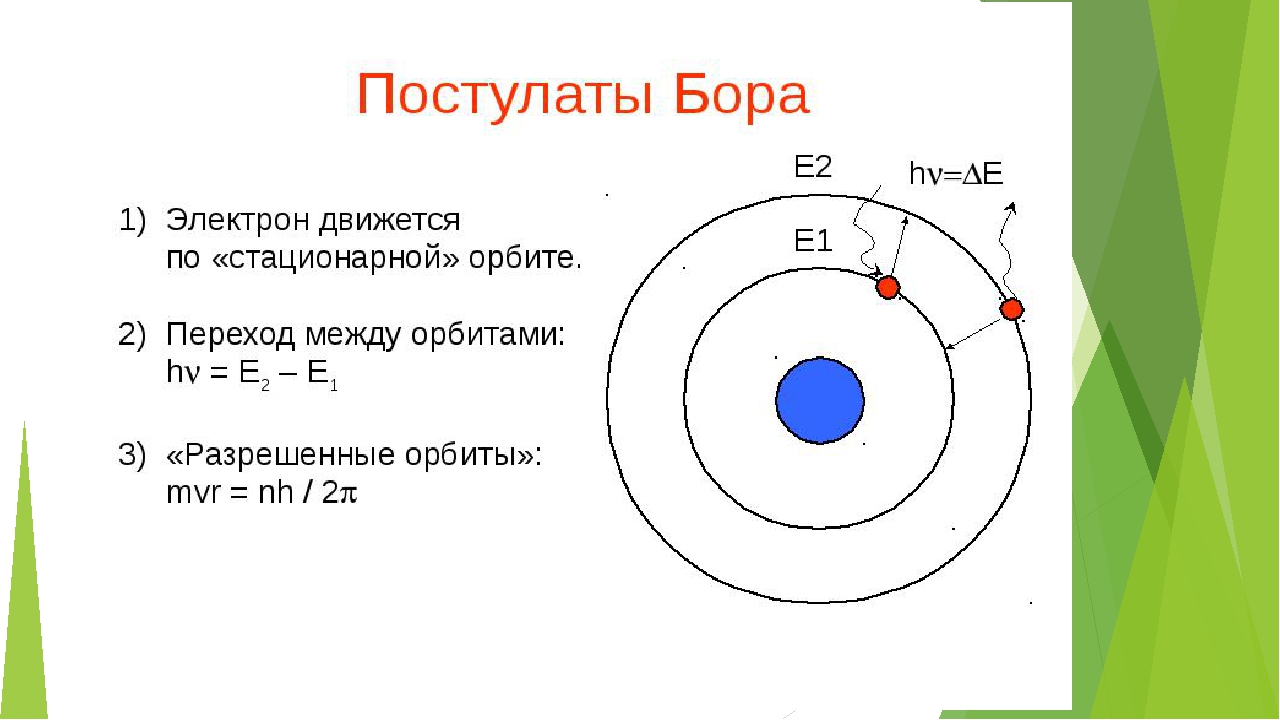 Это приводит к интересному предположению,
Это приводит к интересному предположению, Э. Резерфорд впервые использовал ядерные реакции под действием
Э. Резерфорд впервые использовал ядерные реакции под действием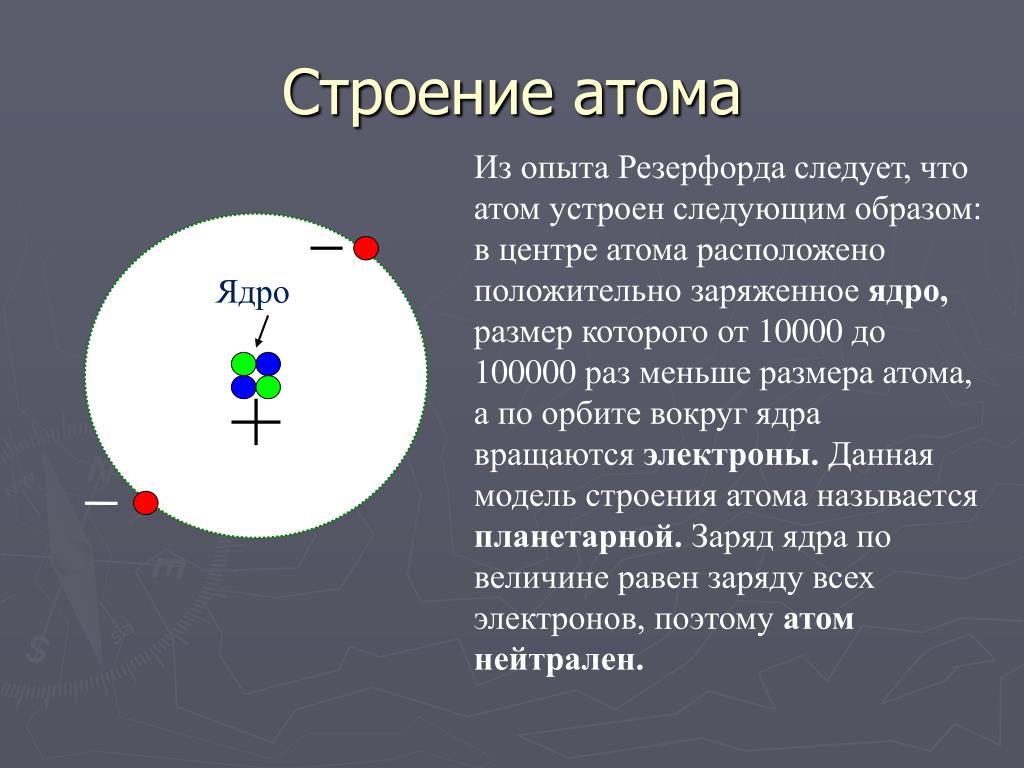 П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. — С. 155 – 156.
П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. — С. 155 – 156.