Содержание
Типы кристаллических решёток — урок. Химия, 8–9 класс.
Большинство твёрдых веществ имеет кристаллическое строение, которое характеризуется строго определённым расположением частиц.
Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой.
Точки, в которых размещены частицы кристалла, называют узлами решётки. В узлах воображаемой решётки могут находиться атомы, ионы или молекулы.
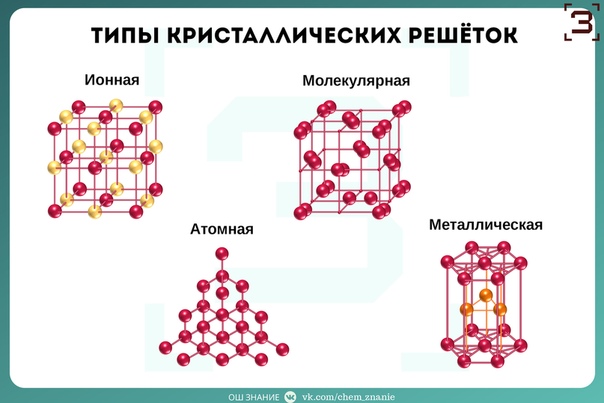
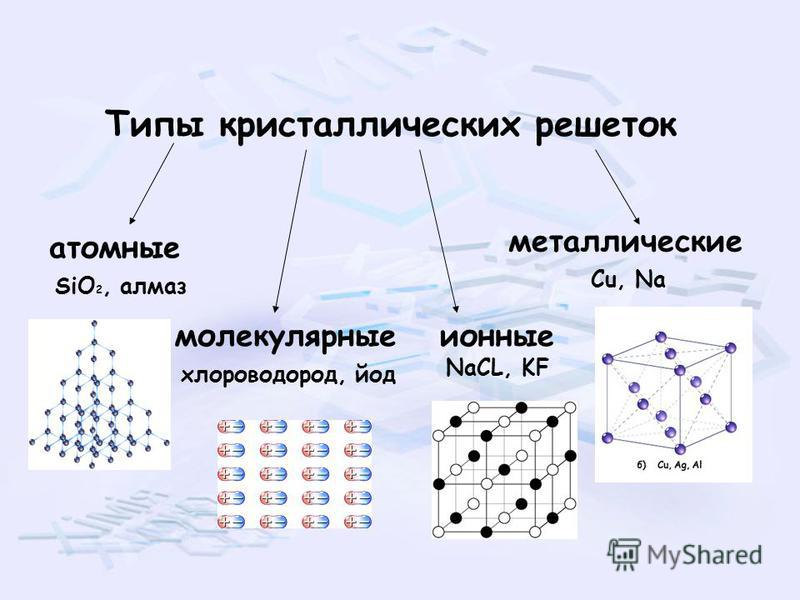
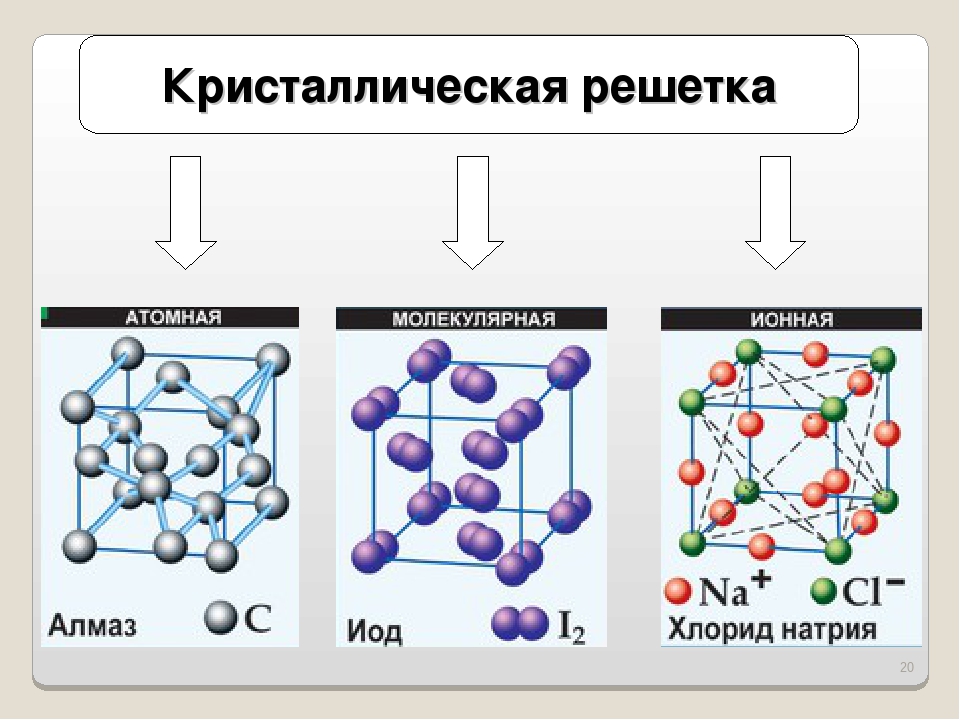
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную, металлическую, атомную и молекулярную.
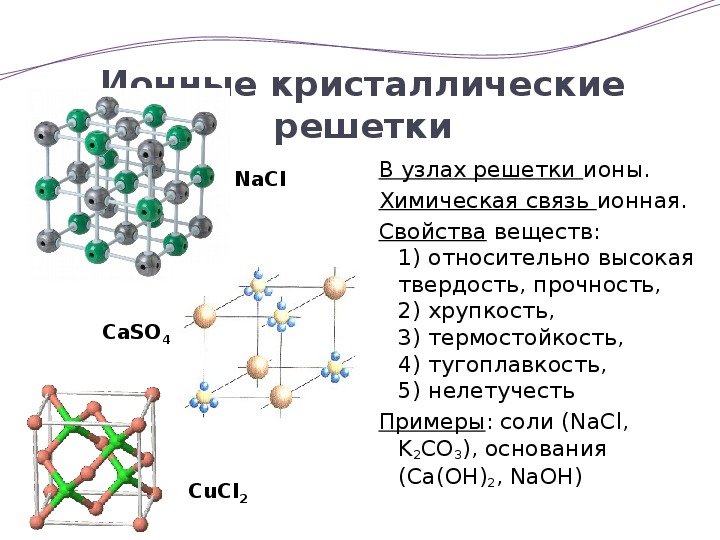
Ионными называют решётки, в узлах которых находятся ионы.
Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
Ионные кристаллические решётки имеют соли, щёлочи, оксиды активных металлов.
Ионы могут быть простые или сложные. Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na+ и хлора Cl−, а в узлах решётки сульфата калия чередуются простые ионы калия K+ и сложные сульфат-ионы SO42−.
Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые, тугоплавкие, нелетучие. Такие вещества хорошо растворяются в воде.
Рис. \(1\). Кристаллическая решётка хлорида натрия
Рис. \(2\). Кристаллы хлорида натрия
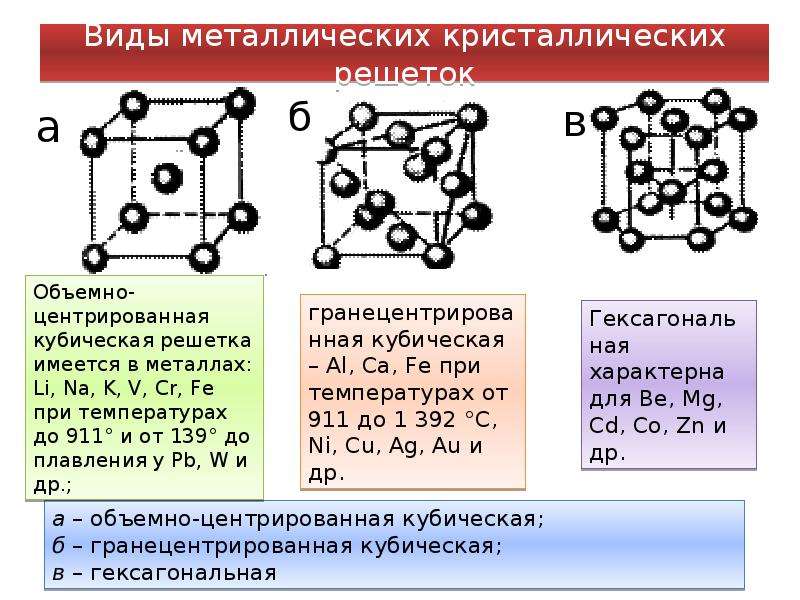
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Такие кристаллические решётки характерны для простых веществ металлов и сплавов.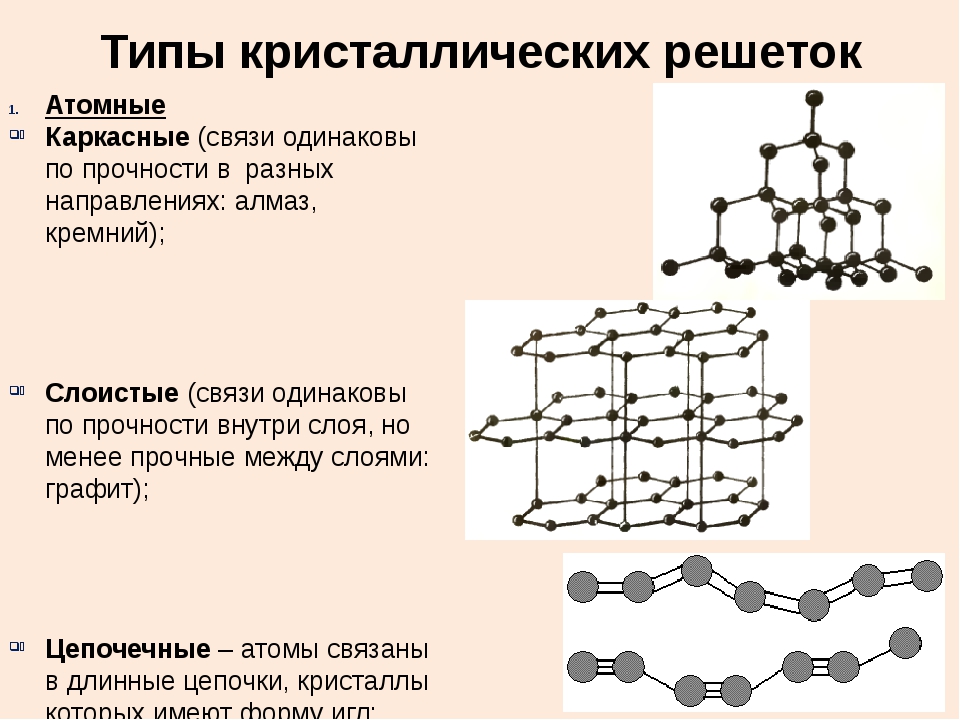
Температуры плавления металлов могут быть разными (от \(–37\) °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск, ковкость, пластичность, хорошо проводят электрический ток и тепло.
Рис. \(3\). Металлическая кристаллическая решётка
Рис. \(4\). Изделие из металла
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит, кремний, бор и германий, а также сложные вещества, например, карборунд SiC и кремнезём, кварц, горный хрусталь, песок, в состав которых входит оксид кремния(\(IV\)) SiO2.
Таким веществам характерны высокая прочность и твёрдость. Так, алмаз является самым твёрдым природным веществом.
У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения. Например, температура плавления кремнезёма — \(1728\) °С, а у графита она выше — \(4000\) °С.
Например, температура плавления кремнезёма — \(1728\) °С, а у графита она выше — \(4000\) °С.
Атомные кристаллы практически нерастворимы.
Рис. \(5\). Кристаллическая решётка алмаза
Рис. \(6\). Алмаз
Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость, низкие температуры плавления и кипения.
Многие молекулярные вещества при комнатной температуре представляют собой жидкости и газы.
Такие вещества летучи. Например, кристаллические иод и твёрдый оксид углерода(\(IV\)) («сухой лёд») испаряются, не переходя в жидкое состояние.
Некоторые молекулярные вещества имеют запах.
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами (He,Ne,Ar,Kr,Xe,Rn), а также неметаллы с двух- и многоатомными молекулами (h3,O2,N2,Cl2,I2,O3,P4,S8).
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд, иод, твёрдые аммиак, кислоты, оксиды большинства неметаллов. Большинство органических соединений тоже представляют собой молекулярные кристаллы (нафталин, сахар, глюкоза).
Рис. \(7\). Кристаллическая решётка иода
Рис. \(8\). Иод
Если известно строение вещества, то можно предсказать его свойства.
Попробуем определить, каковы примерно температуры плавления у фторида натрия, фтороводорода и фтора.
У фторида натрия — ионная кристаллическая решётка. Значит, его температура плавления будет высокой.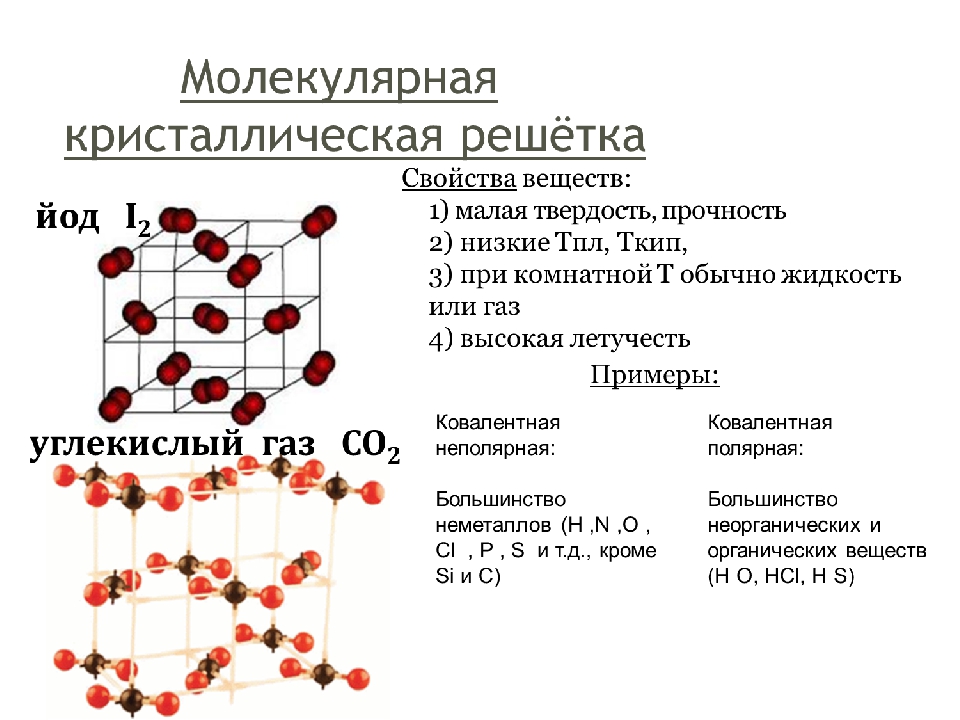 Фтороводород и фтор имеют молекулярные кристаллические решётки. Поэтому их температуры плавления будут невысокими. Молекулы фтороводорода полярные, а фтора — неполярные. Значит, межмолекулярное взаимодействие у фтороводорода будет сильнее, и его температура плавления будет выше по сравнению со фтором.
Фтороводород и фтор имеют молекулярные кристаллические решётки. Поэтому их температуры плавления будут невысокими. Молекулы фтороводорода полярные, а фтора — неполярные. Значит, межмолекулярное взаимодействие у фтороводорода будет сильнее, и его температура плавления будет выше по сравнению со фтором.
Экспериментальные данные подтверждают эти предположения: температуры плавления NaF, HF и F2 составляют соответственно \(995\) °С, \(–83\) °С, \(–220\) °С.
Источники:
Рис. 1.Кристаллическая решётка хлорида натрия https://upload.wikimedia.org/wikipedia/commons/e/e9/Sodium-chloride-3D-ionic.png
Рис. 2. Кристаллы хлорида натрия https://cdn.pixabay.com/photo/2015/09/24/17/08/crystal-955935_960_720.jpg
Рис. 4. Изделие из металла https://cdn.pixabay.com/photo/2013/07/12/17/22/database-152091_960_720.png
Рис. 6. Алмаз https://cdn.pixabay.com/photo/2014/10/24/08/09/diamond-500872_960_720.jpg
Рис. 8. Иод https://upload.wikimedia.org/wikipedia/commons/7/7c/Iod_kristall.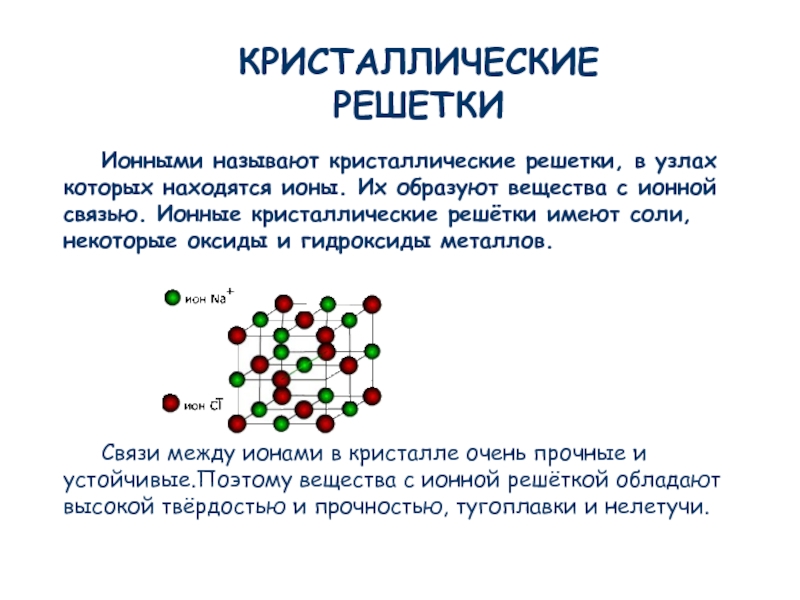 jpg
jpg
Урок 4. строение кристаллов. кристаллические решётки. причины многообразия веществ — Химия — 11 класс
Химия, 11 класс
Урок № 4. Строение кристаллов. Кристаллические решётки. Причина многообразия веществ
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению кристаллического состояния вещества, зависимости свойств веществ от типов кристаллических решеток. Объясняются причины многообразия веществ, такие как изотопия элементов, аллотропия, изомерия, гомология. Дается понятие химического синтеза.
Глоссарий
Аллотропия – существование нескольких простых веществ, образованных одним и тем же химическим элементом.
Атомная кристаллическая решётка – регулярная структура твёрдого вещества, в узловых точках которой находятся атомы химического элемента.
Гомология – явление наличия в природе органических соединений, имеющих одинаковое строение и химические свойства, но отличающихся на некоторое целое число групп СН2— состав.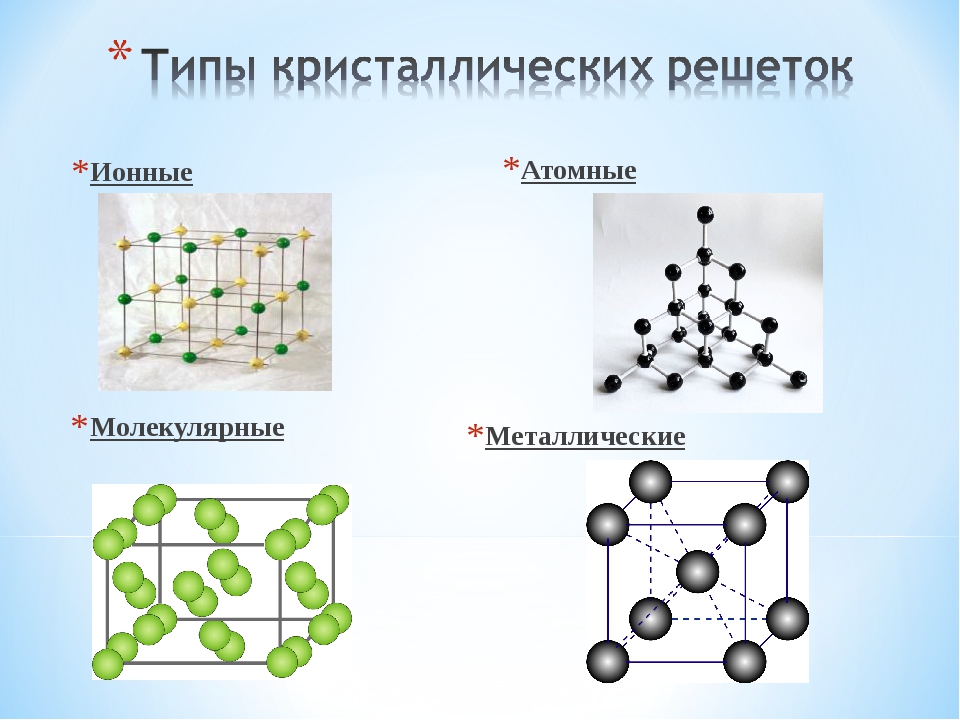
Изомерия – явления наличия нескольких веществ, имеющих один и тот же состав, но отличающихся по порядку соединения атомов.
Ионная кристаллическая решетка – регулярная структура твёрдого вещества, в узлах которой расположены положительно и отрицательно заряженные ионы.
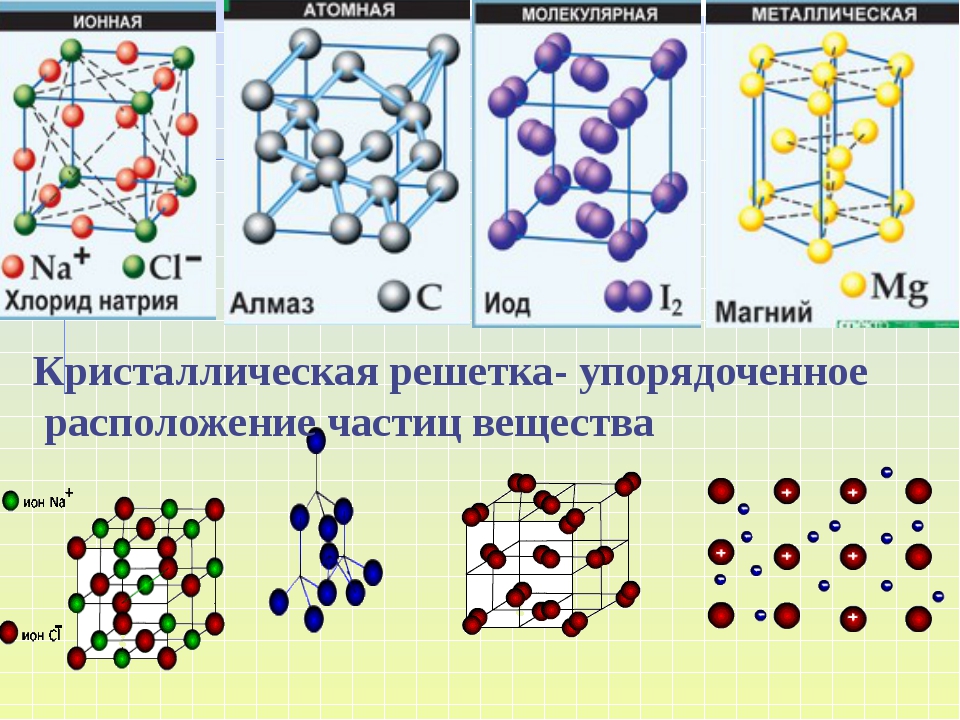
Кристаллическая решетка – особая структура твёрдого вещества, в которой частицы вещества расположены в строго определенном порядке.
Кристаллы – твёрдые вещества, имеющие форму правильных многогранников, образованных в результате многократного регулярного повторения расположения составляющих вещество частиц.
Металлическая кристаллическая решетка – регулярная структура твёрдого вещества, в узлах которой расположены ионы металла.
Молекулярная кристаллическая решетка – регулярная структура твёрдого вещества, в узлах которой находятся молекулы вещества.
Полиморфизм – способность твёрдого вещества образовывать различные кристаллические структуры, состоящие из одних и тех же частиц.
Полиморфные модификации – разные кристаллические структуры, которые образованы частицами одного и того же вещества.
Химический синтез – процесс искусственного создания новых веществ физическими и химическими методами.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.
 edu.ru/ (дата обращения: 01.06.2018).
edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Строение кристаллов и типы кристаллических решеток
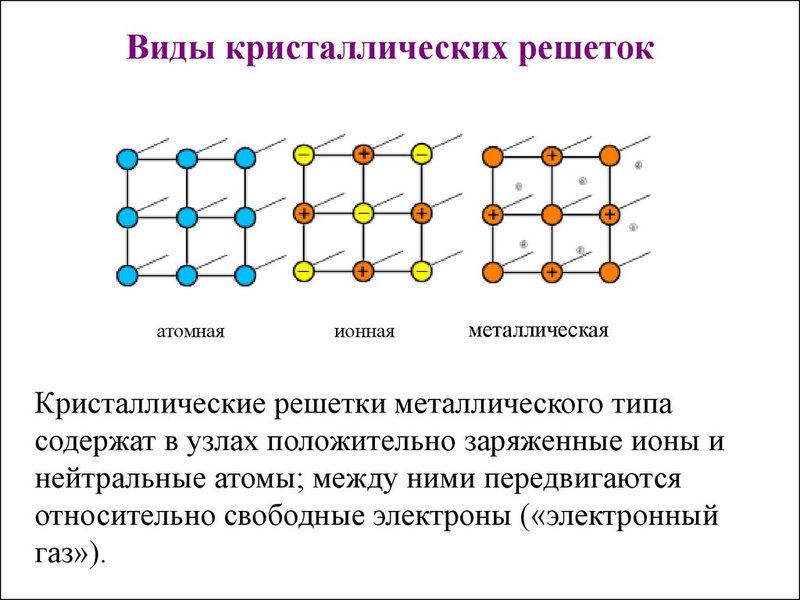
Кристаллами называются твёрдые вещества, частицы которых образуют трёхмерную периодическую пространственную структуру, называемую кристаллической решёткой. Грани кристаллов представляют собой правильные многоугольники. Свойства кристаллических тел различны. Например, алмаз обладает максимальной твёрдостью, а графит можно сломать руками, хотя эти вещества состоят атомов углерода. Свойства веществ зависят от типа кристаллической решетки. Различают четыре типа кристаллических решёток: атомную, ионную, молекулярную и металлическую.
Зависимость свойств веществ от типа кристаллической решетки
В узлах атомной кристаллической решётки расположены атомы, соединённые ковалентной связью. Примерами веществ, имеющих атомную кристаллическую решетку, являются алмаз, кремний, германий, бор. Вещества, имеющие атомную кристаллическую решетку, характеризуются высокой температурой плавления, большой твёрдостью.
В узлах ионной кристаллической решётки находятся положительные и отрицательные ионы, связь между ними ионная. Ионную кристаллическую решетку имеют соли, щёлочи и оксиды типичных металлов. Для веществ с ионной кристаллической решеткой характерны высокие температуры плавления, твёрдость, плотность, хорошая электропроводность.
В узлах молекулярной кристаллической решетки находятся молекулы, которые удерживаются за счет межмолекулярных вандервальсовых сил. Примером веществ с молекулярной кристаллической решеткой являются лёд, йод, нафталин, углекислый газ. Межмолекулярные связи значительно слабее ковалентных и ионных, поэтому для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления, невысокая твёрдость, возможность возгонки (переход из твёрдого состояния в газообразное, минуя жидкое).
Для металлов характерна металлическая кристаллическая решётка, в узлах которой расположены положительно заряженные ионы металлов, а между ними свободно перемещаются валентные электроны (так называемый электронный газ).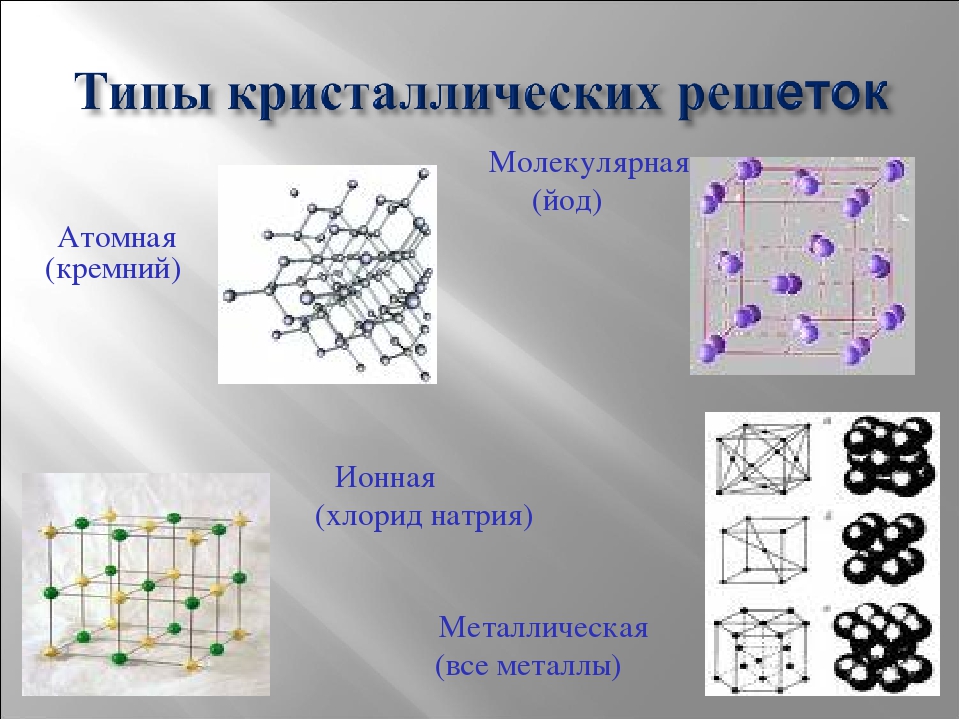 Для веществ с металлической кристаллической решеткой характерны механическая прочность, плавкость, ковкость, хорошая тепло- и электропроводность, металлический блеск.
Для веществ с металлической кристаллической решеткой характерны механическая прочность, плавкость, ковкость, хорошая тепло- и электропроводность, металлический блеск.
Свойства кристаллических тел определяются не только характером связи между частицами, но и их взаимным расположением относительно друг друга. В кристаллах алмаза все атомы углерода связаны ковалентными неполярными связями и находятся на одинаковом расстоянии друг от друга, образуя тетраэдры. В кристаллах графита каждые шесть атомов углерода связаны ковалентными неполярными связями, а между собой такие плоские шестиугольники связаны слабыми межмолекулярными связями.
Причины многообразия веществ
Не только углерод может образовывать разные вещества в зависимости от типа кристаллической решётки. Известно несколько веществ, образованных фосфором (белый, красный, чёрный и металлический фосфор). Сера может существовать в виде трёх модификаций (ромбическая, моноклинная и пластическая). Явление существования нескольких простых веществ, образованных одним и тем же элементом, называется аллотропией (полиморфизмом), а сами простые вещества – аллотропными (полиморфными) модификациями.
Существование изотопов – атомов одного и того же химического элемента, имеющих разные массовые числа — ещё одна причина огромного многообразия веществ.
Изучая органическую химию, вы узнали о существовании изомеров – молекул, имеющих одинаковый состав, но разную последовательность атомов и их расположение в пространстве. Изомеры встречаются не только среди органических соединений, например, изомером карбамида является цианат аммония.
Причиной разнообразия органических соединений является и гомология – существование ряда соединений, имеющих одинаковое строение и химические свойства, но отличающихся друг от друга на целое число групп СН2-.
118 известных на сегодняшний день химических элементов образуют миллионы различных веществ, но человек искусственным путём создает новые вещества с нужными ему свойствами. Создание человеком новых веществ получило название химического синтеза.
Таким образом, явления аллотропии (полиморфизма), изомерии, изотопии, гомологии, химический синтез новых соединений являются причинами многообразия веществ.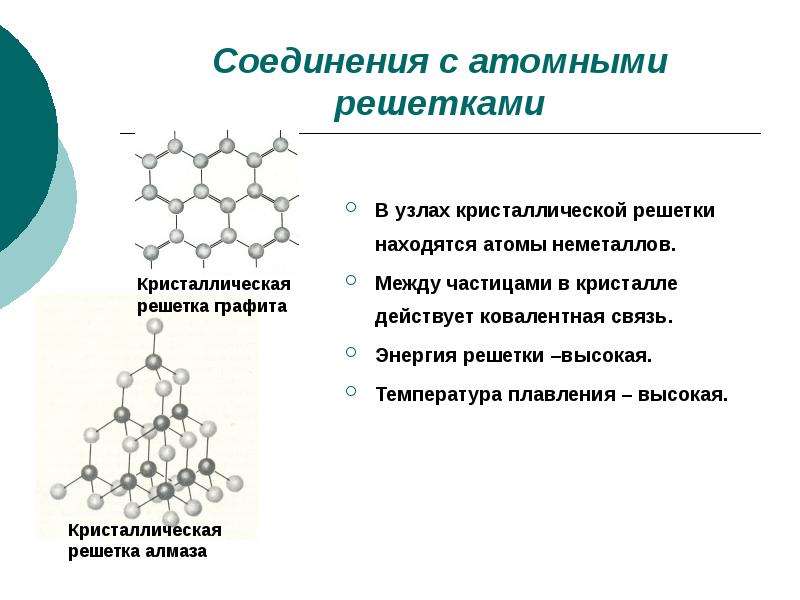
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Расчет количества молекул в кристалле
Условие задачи: Молекула белого фосфора состоит из четырех атомов этого элемента. Сколько молекул белого фосфора содержится в кристалле фосфора массой 2,48 г? Ответ запишите в виде числа, приведенного к стандартному виду.
Шаг первый: найдём молярную массу молекулы белого фосфора Р4. Относительная атомная масса фосфора равна 31 а.е.м., молярная масса Р4 равна 4·31 = 124 (г/моль).
Шаг второй: найдём количество молей белого фосфора в кристалле массой 2,48 г. Для этого разделим массу кристалла на молярную массу Р4:
2,48 : 124 = 0,02 (моль).
Шаг третий: найдём количество молекул, содержащееся в 0,02 моль белого фосфора. Для этого число моль умножим на число Авогадро:
0,02·6,02·1023 = 1,2·1022 (молекул).
Ответ: 1,2·1022.
2. Расчёт числа атомов в молекуле фуллерена
Условие задачи: Одной из аллотропных модификаций углерода, применяемых в электронике, является фуллерен.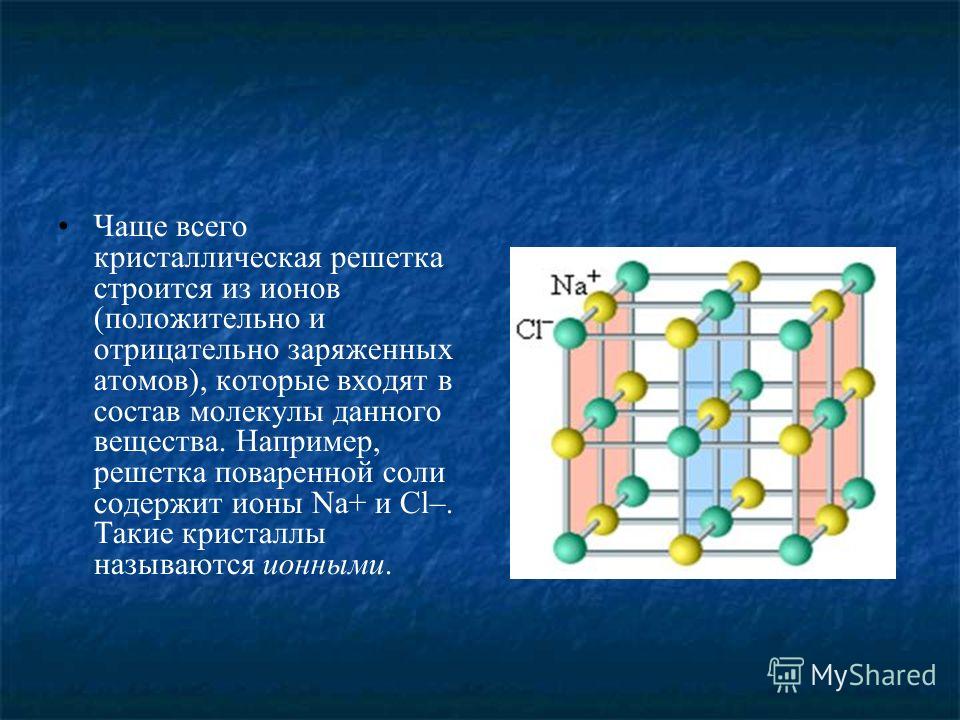 0,5 моль фуллерена имеют массу 360 г. Сколько атомов углерода входит в состав одной молекулы фуллерена?
0,5 моль фуллерена имеют массу 360 г. Сколько атомов углерода входит в состав одной молекулы фуллерена?
Шаг первый: найдём молярную массу фуллерена.
Для этого массу имеющегося образца разделим на количество молей:
360 : 0,5 = 720 (г/моль).
Шаг второй: найдём количество атомов углерода в 1 моль фуллерена. Для этого молярную массу фуллерена разделим на массу 1 моль атомов углерода. 1 моль атомов углерода имеет массу 12 г.
720 : 12 = 60 (атомов).
Ответ: 60.
Сборка тестов по химии по теме «Строение вещества»
Чтобы поделиться, нажимайте
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Также вы можете ознакомиться со всеми тестами ЦТ по химии перейдя по ссылке http://www.yoursystemeducation.com/ct/ или всеми заданиями ЕГЭ по химии перейдя по ссылке http://www.yoursystemeducation.com/realnoe-ege/
- Немолекулярное строение имеет: 1) фуллерен, 2) алмаз, 3) вода, 4) углекислый газ.
- Немолекулярное строение имеет: 1) железо, 2) водород, 3) кислород, 4) угарный газ.
- Ионную кристаллическую решетку имеет: 1) бромид калия, 2) бром, 3) калий, 4) бромоводород.
- Молекулярную кристаллическую решетку имеет: 1) литий, 2) оксид натрия, 3) красный фосфор, 4) белый фосфор.
- Молекулярную кристаллическую решетку имеет: 1) фторид серы (VI), 2) сульфид натрия, 3) графит, 4) натрий.
- Молекулярное строение имеет: 1) йод, 2) йодид калия, 3) гидроксид калия, 4) гидроксид алюминия.

- Немолекулярное строение имеет: 1) йод, 2) хлорид йода, 3) гидроксид калия, 4) уксусная кислота.
- Немолекулярное строение имеет: 1) цинк, 2) муравьиная кислота, 3) фтороводород, 4) кислород.
- Молекулярную кристаллическую решетку в твердом состоянии имеет: 1) иодид бария, 2) гидроксид бария, 3) барий, 4) йод.
- Ионную кристаллическую решетку имеет: 1) фтор, 2) фтороводород, 3) гидрид натрия, 4) хлорид титана(IV).

- Молекулярное строение имеет: 1) оксид кремния(IV), 2) нитрат бария, 3) хлорид натрия, 4) оксид углерода(II).
- Молекулярную кристаллическую решетку имеют: 1) H2O, CuO, 2) CuO, K2S, 3) K2S, H2SO4, 4) H2SO4, O2.
- Атомную кристаллическую решетку имеет: 1) графит, 2) железо, 3) карбонат кальция, 4) азотная кислота.
- Ионную кристаллическую решетку имеет: 1) фторид кальция, 2) оксид кремния, 3) алмаз, 4) медь.
- Вещество, имеющее низкую температуру плавления, возгоняющееся при нагревании, неэлектропроводное – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную.
- Твердое, хрупкое вещество, расплав которого проводит электрический ток – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную
- Вещество, имеющее высокую электропроводность, ковкое, пластичное, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную.
- Тугоплавкое хрупкое вещество, нерастворимое в воде, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную
- Атом является структурной единицей в кристаллической решетке: 1) фосфорной кислоты, 2) белого фосфора, 3) кремнезема, 4) хлорида аммония.
- В кристалле вольфрама частицы связаны металлической связью, поэтому вольфрам: 1) тугоплавок, 2) химически стоек, 3) электропроводен, 4) имеет высокую плотность.
- Ионный тип кристаллической решетки характерен для: 1) кислот, 2) металлов, 3) неметаллов, 4) солей.
- Из молекул состоит каждое из веществ: 1) поваренная соль и кислород, 2) оксид магния и хлороводород, 3) вода и хлор, 4) алмаз и сода.
- Атомную кристаллическую решетку имеет каждое из веществ: 1) алмаз и графит, 2) аммиак и йод, 3) озон и кислород, 4) вода и мел.
- Ионную кристаллическую решетку имеет каждое из веществ: 1) серная кислота и оксид углерода(IV), 2) гидроксид натрия и хлорид калия, 3) карбонат кальция и хлороводород, 4) оксид кремния и гидроксид меди(II).

- Верны ли следующие суждения о типах кристаллических решеток веществ в твердом состоянии? А) этанол имеет ионную кристаллическую решетку. Б) йод имеет молекулярную кристаллическую решетку. 1) верно только А, 2) верно только Б, 3) верны оба суждения, 4) оба суждения неверны.
- Какие свойства характерны для вещества с атомной кристаллической решеткой? 1) нерастворимость в воде и тугоплавкость, 2) хрупкость и легкоплавкость, 3) растворимость в воде и летучесть, 4) хорошая тепло- и электропроводность.
- В твердых веществах молекулярного строения химическая связь: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная
- В твердых веществах атомного строения химическая связь между атомами: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная
- Некоторое вещество тугоплавко и не проводит электрический ток ни в твердом виде, ни в расплаве.
 Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. - Некоторое вещество тугоплавко и не проводит электрический ток в твердом виде, но его водный раствор обладает электрической проводимостью. Какую кристаллическую решетку имеет это вещество? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
- Выберите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку: 1) С (графит), 2) SiO2, 3) SiC, 4) CO2
- Выберите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) SiO2, 2) SiH4, 3) O2, 4) Na.
- Выберите вещество, которое в твердом состоянии имеет ионную кристаллическую решетку: 1) N2O5, 2) HNO3, 3) NH4NO3, 4) NH3.

- Какое свойство характерно для веществ с атомной кристаллической решеткой? 1) высокая плотность, 2) тугоплавкость, 3) хорошая растворимость в воде, 4) электропроводность.
- Один и тот же тип решетки в кристаллическом состоянии имеют: 1) хлор и водород, 2) вода и алюминий, 3) поваренная соль и серная кислота, 4) кремнезем и гидроксид натрия.
- Запахом обладают вещества, имеющие кристаллическую решетку: 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
- Молекулярную решетку в кристаллическом состоянии имеет: 1) хлорид натрия, 2) хлор, 3) натрий, 4) гидроксид натрия.
- Хлорид-ионы отсутствую в кристаллах: 1) хлорида натрия, 2) хлорида кальция, 3) хлорида фосфора(V), 4) хлорида цезия.

- Ионную кристаллическую решетку в кристаллическом состоянии имеет: 1) бром, 2) вода, 3) серная кислота, 4) карбонат натрия.
- Металлическую кристаллическую решетку имеет: 1) NH3, 2) AlCl3, 3) Cu3Al, 4) CuO.
- Один и тот же тип решетки в кристаллическом состоянии имеют вода и: 1) железо, 2) углекислый газ, 3) поваренная соль, 4) алмаз.
- Легкоплавкое кристаллическое вещество хорошо растворимо в этаноле и не проводит электрический ток ни в расплаве, ни в растворе. Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
- Тугоплавкое кристаллическое вещество нерастворимо в воде и хорошо проводит теплоту и электрический ток.
 Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. - Тот же тип кристаллической решетки, что и у сульфата натрия, имеет: 1) красный фосфор, 2) хлороводород, 3) серная кислота, 4) сульфид бария.
- Тот же тип кристаллической решетки, что и у натрия, имеет: 1) хлорид цинка, 2) сульфат натрия, 3) карбонат натрия, 4) золото.
- Тот же тип кристаллической решетки, что и у кислорода, имеет: 1) бром, 2) оксид натрия, 3) поваренная соль, 4) калий.
- Один и тот же тип решетки в кристаллическом состоянии имеют: 1) фтор и фторид натрия, 2) хлор и хлорид калия, 3) хлорид натрия и гидроксид калия, 4) оксид хлора(VII) и гидроксид калия.
- Оксид алюминия в кристаллическом состоянии имеет тот же тип кристаллической решетки, что и: 1) алюминий, 2) кислород, 3) фтор, 4) фторид алюминия.
- Ванилин представляет собой легкоплавкое кристаллическое вещество с характерным запахом. Какой тип кристаллической решетки он имеет? 1) атомный, 2) молекулярный, 3) ионный, 4) металлический.
- Атомную решетку в кристаллическом состоянии имеет: 1) азот, 2) аммиак, 3) карбид кремния, 4) платина.
- Один и тот же тип решетки в кристаллическом состоянии имеют: 1) натрий и хлорид натрия, 2) сульфат бария и барий, 3) сульфат бария и серная кислота, 4) серная кислота и оксид серы(VI).

- Для твердых веществ с молекулярной кристаллической решеткой характерна высокая: 1) плотность, 2) температура плавления, 3) летучесть, 4) энергия связи между молекулами.
- Для твердых веществ с металлической кристаллической решеткой характерна низкая: 1) теплопроводность, 2) плотность, 3) летучесть при комнатной температуре, 4) электропроводность.
- Для твердых веществ с ионной кристаллической решеткой характерна низкая: 1) температура плавления, 2) энергия связи между ионами, 3) растворимость в воде, 4) летучесть.
- Твердое вещество с ионной кристаллической решеткой расплавили.
 Полученная жидкость: 1) имеет высокую плотность, 2) быстро испаряется, 3) неприятно пахнет, 4) проводит электрический ток.
Полученная жидкость: 1) имеет высокую плотность, 2) быстро испаряется, 3) неприятно пахнет, 4) проводит электрический ток. - Атомную кристаллическую решетку не образует: 1) кремний, 2) германий, 3) алюминий, 4) углерод.
- Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, не электропроводно, то его кристаллическая решетка: 1) молекулярная, 2) атомная, 3) ионная, 4) металлическая.
- Понятие «молекула» не применимо по отношению к структурной единице вещества: 1) хлороформа, 2) кислорода, 3) алмаза, 4) озона.
- Атомная кристаллическая решетка характерна для: 1) алюминия и карбида алюминия, 2) серы и йода, 3) оксида кремния и хлорида натрия, 4) алмаза и бора.
- Вещества, имеющие молекулярную кристаллическую решетку, как правило: 1) тугоплавкие и хорошо растворимые в воде, 2) легкоплавкие и летучие, 3) твердые и электропроводные, 4) теплопроводные и пластичные.
Ответы приведены в конце страницы.
А вот некоторые задания ЦТ и ЕГЭ с видео-объяснением:
А18 ЦТ 2010. Укажите названия веществ, в молекулах которых содержатся кратные связи и все атомы лежат в одной плоскости: а) стирол; б) фенилацетилен; в) сероводород; г) бутин-1:
- б, г
- а, г
- а, б
- б, в
А19 ЦТ 2010. Укажите название вещества, которое в твёрдом состоянии имеет атомную кристаллическую решётку:
- серная кислота
- оксид кремния (IV)
- алюминий
- водород
Досрочный ЕГЭ 2018. Из предложенного перечня веществ выберите два вещества, в которых присутствует ковалентная неполярная химическая связь.
1) этан;
2) азотная кислота;
3) гидроксид бария;
4) хлор;
5) аммиак;
Запишите в поле ответа номера выбранных веществ.
Также вы можете ознакомиться со всеми тестами ЦТ по химии перейдя по ссылке http://www. yoursystemeducation.com/ct/ или всеми заданиями ЕГЭ по химии перейдя по ссылке http://www.yoursystemeducation.com/realnoe-ege/
yoursystemeducation.com/ct/ или всеми заданиями ЕГЭ по химии перейдя по ссылке http://www.yoursystemeducation.com/realnoe-ege/
Ответы:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 2 | 1 | 1 | 4 | 1 | 1 | 3 | 1 | 4 | 3 | 4 | 4 | 1 | 1 | 3 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 1 | 2 | 4 | 3 | 3 | 4 | 3 | 1 | 2 | 2 | 1 | 4 | 1 | 1 | 3 |
| 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 |
| 4 | 1 | 3 | 2 | 1 | 2 | 2 | 3 | 4 | 3 | 2 | 2 | 4 | 4 | 4 |
| 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
| 1 | 3 | 4 | 2 | 3 | 4 | 3 | 3 | 4 | 4 | 3 | 3 | 3 | 4 | 2 |
А также вы можете проделать большое число заданий на эту тему с подробными видео-объяснениями в отдельном разделе «Химическая связь и строение вещества»
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
структур кристаллической решетки металлов
структура кристаллической решетки металлов
ПРОСТОЙ КУБИЧЕСКИЙ МЕТАЛЛ
В металле все атомы идентичны, и большинство из них имеют сферическую форму (
склеивание не зависит от направления).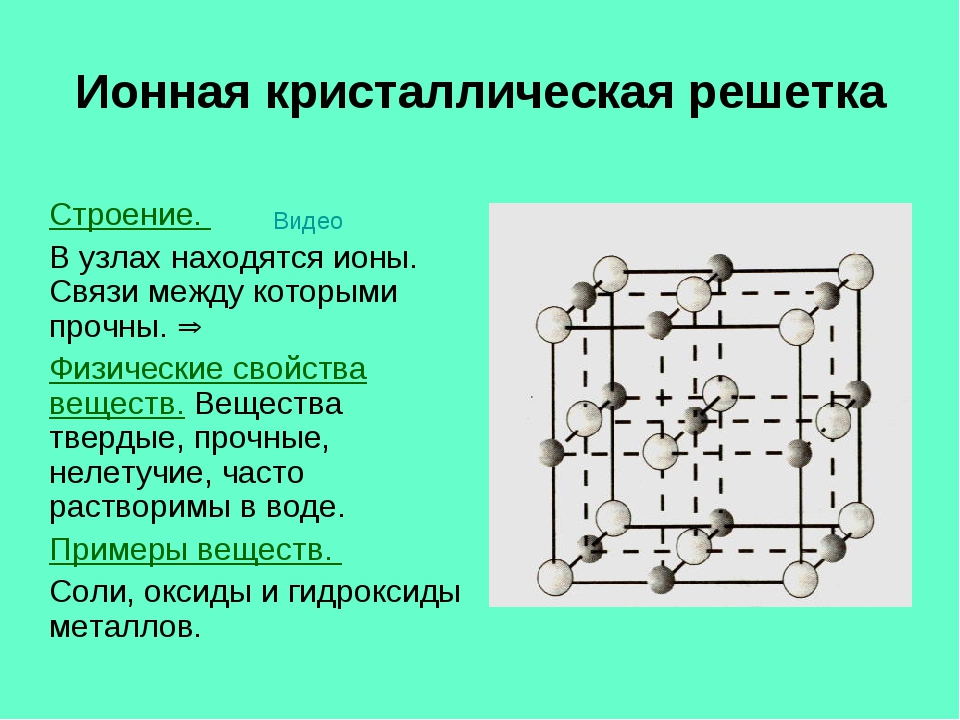 Таким образом, металлы имеют тенденцию принимать относительно
Таким образом, металлы имеют тенденцию принимать относительно
простые конструкции. Самый простой:
Простые кубики (sc)
Вот два способа нарисовать элементарную ячейку для простой кубической структуры.В элементарной ячейке слева атомы в углах обрезаны, потому что
только часть (в данном случае 1/8) принадлежит этой ячейке. Остаток от
атом принадлежит соседним ячейкам, как показано на рисунке ниже.
Нажмите на левую элементарную ячейку вверху, чтобы просмотреть фильм о ее вращении.
Здесь мы видим две элементарные ячейки, уложенные стопкой в решетку.
Обратите внимание, что в каждом случае обнаруживается одна и та же общая структура.
Фильм ниже даст вам почувствовать общую решетку
шаблон.
Щелкните изображение, чтобы просмотреть его.
Мы можем думать об этой решетке как о слоях квадратных упакованных сфер. В
В
слои сложены так, чтобы каждая сфера находилась прямо над сферой в
слой ниже.
Хотя мы показали пространство между сферами, это только для
«открыть» структуру для просмотра. В настоящем кристалле сферы соприкасаются
как показано в элементарной ячейке и решетке ниже.
Таким образом, длина края ячейки в 2 раза больше радиуса сферы.
Нажмите на элементарную ячейку и решетку выше, чтобы увидеть, как они вращаются.
В 3-D эффективность упаковки определяется по формуле:
П.E. = (объем сфер) / (объем ячейки)
Для простой кубической решетки это:
P.E. = (1 / 8×8) (4/3 pi r 3 ) / (2r) 3 =
пи / 6 = 52,35%.
Это низкое значение неудивительно. Помните, что двумерная квадратная решетка
неэффективно использует пространство. Простая кубическая решетка является ее трехмерным аналогом, а
также содержит много пустого места.
Обратим внимание на пустые места в решетке. Каждый
Каждый
В центре элементарной ячейки находится одно крупное междоузлие (47,65%
громкость). 8 атомов касаются этого пространства, поэтому
межузельное координационное число — 8, а его геометрия
является кубическим (у куба 8 углов).
Поскольку каждая элементарная ячейка содержит (8 x 1/8 =) 1 атом и 1 междоузлие
сайта, количество атомов и междоузлий одинаковое.
Изучите структуру ниже, которая показывает расположение любого
одиночный атом в простой кубической решетке; обратите внимание, что каждый атом имеет
6 соседей, поэтому атомная координация
номер — 6.Координационная геометрия
октаэдр (у октаэдра 6 углов).
Октаэдрическая координация атома. An
октаэдр.
Поскольку как координационное число, так и эффективность упаковки низкие,
простая кубическая решетка неэффективно использует пространство. Очень мало примеров простых
кубические решетки известны (альфа-полоний — один из немногих известных простых
кубические решетки).
Ниже мы снова видим сечение простой кубической решетки в виде
«действительно» есть — атомы соприкасаются друг с другом. Обратите внимание на каналы
формируется путем совмещения межстраничных объявлений. Эти пустые места могут позволить
другие маленькие атомы входят в кристалл.
Щелкните изображение ниже, чтобы увидеть решетку.
Щелкните здесь, чтобы перейти к
следующая страница.
Структура кристаллов
Кристаллические решетки
Единичные ячейки
От элементарной ячейки к решетке
От решетки к элементарной ячейке
Стехиометрия
Упаковка и геометрия
Простой
Кубические металлы
Плотно упакованные конструкции
Центрированный по центру тела кубический
Хлорид цезия
Хлорид натрия
Оксид рения
Оксид ниобия
Если не указано иное, все изображения, фильмы
и VRML являются собственностью и авторским правом
по
Др.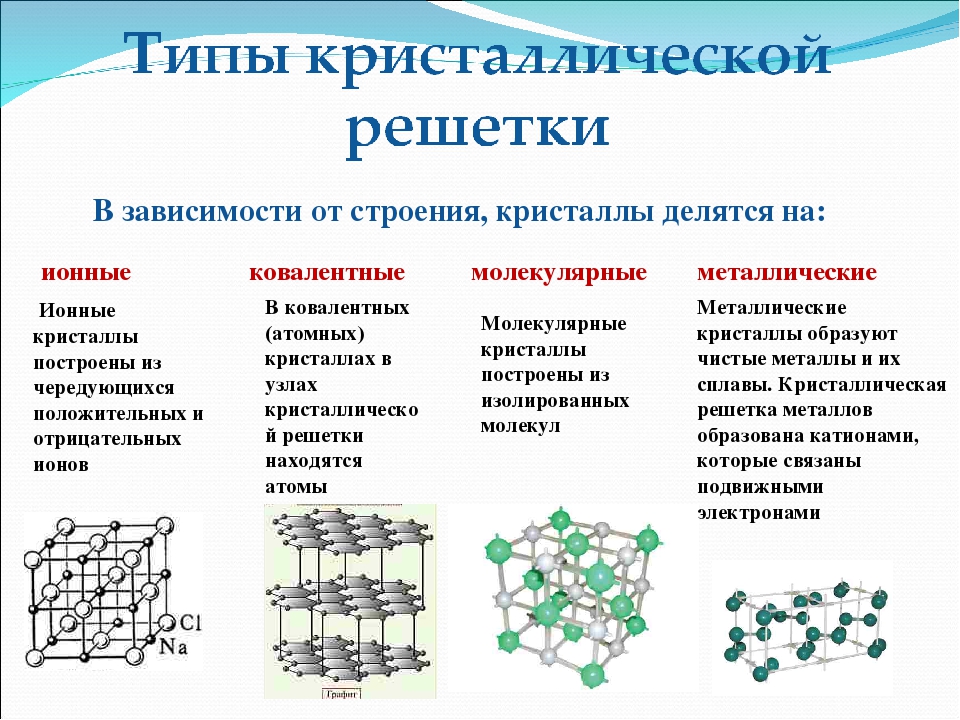 Барбара Л. Саулс и доктор Фредерик С. Саулс
Барбара Л. Саулс и доктор Фредерик С. Саулс
1998.
Свяжитесь с владельцами для получения индивидуального разрешения
использовать. [email protected]
NaCl
NaCl представляет собой кристаллическую структуру с гранецентрированной кубической решеткой Браве и двумя атомами в основе.
Кристаллическая структура: NaCl
Решетка Браве: гранецентрированная кубическая
Космическая группа: 225 (F м -3 м), Strukturbericht: B1, символ Пирсона: cF8
Группа точек: m3m (O h ) шесть двукратных оборотов, четыре трехкратных поворота, три четырехкратных поворота, девять зеркальных плоскостей, инверсия
Постоянная решетки: $ a = 0.{\ circ}.
\ конец {уравнение} \]
Примитивные векторы решетки равны,
$ \ vec {a} _1 = \ frac {a} {2} \ hat {x} + \ frac {a} {2} \ hat {y} $,
$ \ vec {a} _2 = \ frac {a} {2} \ hat {x} + \ frac {a} {2} \ hat {z} $,
$ \ vec {a} _3 = \ frac {a} {2} \ hat {y} + \ frac {a} {2} \ hat {z} $.
В основе два атома. В дробных координатах условной единицы положения двух атомов равны
.
$ \ vec {B} _1 = (0,0,0) $,
$ \ vec {B} _2 = (0,5,0,0) $.
Пространственная группа: 225 (F м -3 м)
192 операции симметрии:
1 x, y, z тождество 2 z, y, -x ось C4 3 ось y, x, -z C2 4 x, z, -y ось C4 5 z, x, -y 3-стержневая ось | центр инверсии в 0 0 0 6 y, z, -x 3-стержневая ось | центр инверсии в 0 0 0 7 x, y, -z зеркальная плоскость 8 ось z, -y, x C2 9 ось y, -x, z C4 10 x, -z, y ось C4 11 z, -x, y 3-стержневая ось | центр инверсии в 0 0 0 12 y, -z, x 3-стержневая ось | центр инверсии в 0 0 0 13 x, -y, z плоскость зеркала 14 -z, y, x ось C4 15 -y, x, z ось C4 16 -x, z, y ось C2 17 -z, x, y 3-стержневая ось | центр инверсии в 0 0 0 18 -y, z, x 3-стержневая ось | центр инверсии в 0 0 0 19 -x, y, z зеркальная плоскость 20 -z, -y, -x ось C2 21 -y, -x, -z ось C2 22 -x, -z, -y ось C2 23 -z, -x, -y 3-стержневая ось | центр инверсии в 0 0 0 24 -y, -z, -x 3-стержневая ось | центр инверсии в 0 0 0 25 -x, -y, -z Ci: 0 0 0 26 -z, -y, x 4-стержневая ось | центр инверсии в 0 0 0 27 -y, -x, z зеркальная плоскость 28 -x, -z, y 4-стержневая ось | центр инверсии в 0 0 0 29 -z, -x, y ось C3 30 -y, -z, x ось C3 31 -x, -y, z ось C2 32 -z, y, -x плоскость зеркала 33 -y, x, -z 4-стержневая ось | центр инверсии в 0 0 0 34 -x, z, -y Ось с четырьмя стержнями | центр инверсии в 0 0 0 35 -z, x, -y ось C3 36 -y, z, -x ось C3 37 -x, y, -z ось C2 38 z, -y, -x 4-стержневая ось | центр инверсии в 0 0 0 39 y, -x, -z ось с четырьмя стержнями | центр инверсии в 0 0 0 40 x, -z, -y зеркальная плоскость 41 z, -x, -y ось C3 42 y, -z, -x ось C3 43 x, -y, -z ось C2 44 z, y, x зеркальная плоскость 45 y, x, z зеркальная плоскость 46 x, z, y зеркальная плоскость 47 ось z, x, y C3 48 ось y, z, x C3 49 z, y + 1/2, -x + 1/2 4-кратная винтовая ось | смещение: 0 1/2 0 50 y, x + 1/2, -z + 1/2 2-кратная ось винта | смещение: 1/4 1/4 0 51 x, z + 1/2, -y + 1/2 ось C4 52 z, x + 1/2, -y + 1/2 3-стержневая ось | центр инверсии в 0 1/2 0 53 y, z + 1/2, -x + 1/2 3-стержневая ось | центр инверсии в 1/2 1/2 0 54 x, y + 1/2, -z + 1/2 b-glide plane | перевод: 0 1/2 0 55 z, -y + 1/2, x + 1/2 2-кратная винтовая ось | перенос: 1/4 0 1/4 56 y, -x + 1/2, z + 1/2 4-кратная винтовая ось | перенос: 0 0 1/2 57 x, -z + 1/2, y + 1/2 ось C4 58 z, -x + 1/2, y + 1/2 3-стержневая ось | центр инверсии в 1/2 0 1/2 59 y, -z + 1/2, x + 1/2 3-стержневая ось | центр инверсии в 0 0 1/2 60 x, -y + 1/2, z + 1/2 c-glide plane | перевод: 0 0 1/2 61 -z, y + 1/2, x + 1/2 4-кратная винтовая ось | перенос: 0 1/2 0 62 -y, x + 1/2, z + 1/2 4-кратная винтовая ось | перенос: 0 0 1/2 63 -x, z + 1/2, y + 1/2 2-кратная ось винта | смещение: 0 1/2 1/2 64 -z, x + 1/2, y + 1/2 3-стержневая ось | центр инверсии в -1/2 0 1/2 65 -y, z + 1/2, x + 1/2 3-стержневая ось | центр инверсии в -1/2 1/2 0 66 -x, y + 1/2, z + 1/2 n-glide plane | перевод: 0 1/2 1/2 67 -z, -y + 1/2, -x + 1/2 2-кратная винтовая ось | перенос: -1/4 0 1/4 68 -y, -x + 1/2, -z + 1/2 2-кратная винтовая ось | перенос: -1/4 1/4 0 69 -x, -z + 1/2, -y + 1/2 ось C2 70 -z, -x + 1/2, -y + 1/2 3-стержневая ось | центр инверсии в 0 1/2 0 71 -y, -z + 1/2, -x + 1/2 3-стержневая ось | центр инверсии в 0 0 1/2 72 -x, -y + 1/2, -z + 1/2 Ci: 0 1/4 1/4 73 -z, -y + 1/2, x + 1/2 4-стержневая ось | центр инверсии в -1/4 1/4 1/4 74 -y, -x + 1/2, z + 1/2 g-glide plane | перевод: -1/4 1/4 1/2 75 -x, -z + 1/2, y + 1/2 4-стержневая ось | центр инверсии в 0 0 1/2 76 -z, -x + 1/2, y + 1/2 3-кратная ось винта | смещение: -1/3 1/3 1/3 77 -y, -z + 1/2, x + 1/2 ось C3 78 -x, -y + 1/2, z + 1/2 2-кратная винтовая ось | смещение: 0 0 1/2 79 -z, y + 1/2, -x + 1/2 g-glide plane | перевод: -1/4 1/2 1/4 80 -y, x + 1/2, -z + 1/2 4-стержневая ось | центр инверсии в -1/4 1/4 1/4 81 -x, z + 1/2, -y + 1/2 4-стержневая ось | центр инверсии в 0 1/2 0 82 -z, x + 1/2, -y + 1/2 ось C3 83 -y, z + 1/2, -x + 1/2 3-кратная винтовая ось | смещение: -1/3 1/3 1/3 84 -x, y + 1/2, -z + 1/2 2-кратная ось винта | смещение: 0 1/2 0 85 z, -y + 1/2, -x + 1/2 4-стержневая ось | центр инверсии при 1/4 1/4 1/4 86 y, -x + 1/2, -z + 1/2 4-стержневая ось | центр инверсии при 1/4 1/4 1/4 87 x, -z + 1/2, -y + 1/2 зеркальная плоскость 88 z, -x + 1/2, -y + 1/2 ось C3 89 y, -z + 1/2, -x + 1/2 ось C3 90 x, -y + 1/2, -z + 1/2 ось C2 91 z, y + 1/2, x + 1/2 g-плоскость скольжения | перевод: 1/4 1/2 1/4 92 y, x + 1/2, z + 1/2 g-плоскость скольжения | перевод: 1/4 1/4 1/2 93 x, z + 1/2, y + 1/2 плоскость скольжения n | смещение: 0 1/2 1/2 94 z, x + 1/2, y + 1/2 3-кратная ось винта | смещение: 1/3 1/3 1/3 95 y, z + 1/2, x + 1/2 3-кратная ось винта | смещение: 1/3 1/3 1/3 96 x, y + 1/2, z + 1/2 перевод: 0 1/2 1/2 97 z + 1/2, y, -x + 1/2 ось C4 98 y + 1/2, x, -z + 1/2 2-кратная ось винта | смещение: 1/4 1/4 0 99 x + 1/2, z, -y + 1/2 4-кратная винтовая ось | смещение: 1/2 0 0 100 z + 1/2, x, -y + 1/2 3-стержневая ось | центр инверсии в 1/2 1/2 0 101 y + 1/2, z, -x + 1/2 3-стержневая ось | центр инверсии в 1/2 0 0 102 x + 1/2, y, -z + 1/2 a-glide plane | перевод: 1/2 0 0 103 z + 1/2, -y, x + 1/2 2-кратная винтовая ось | смещение: 1/2 0 1/2 104 y + 1/2, -x, z + 1/2 4-кратная винтовая ось | перенос: 0 0 1/2 105 x + 1/2, -z, y + 1/2 4-кратная ось винта | смещение: 1/2 0 0 106 z + 1/2, -x, y + 1/2 3-стержневая ось | центр инверсии в 1/2 -1/2 0 107 y + 1/2, -z, x + 1/2 3-стержневая ось | центр инверсии в 0-1/2 1/2 108 x + 1/2, -y, z + 1/2 n-glide plane | перевод: 1/2 0 1/2 109 -z + 1/2, y, x + 1/2 ось C4 110 -y + 1/2, x, z + 1/2 4-кратная винтовая ось | перенос: 0 0 1/2 111 -x + 1/2, z, y + 1/2 2-кратная ось винта | смещение: 0 1/4 1/4 112 -z + 1/2, x, y + 1/2 3-стержневая ось | центр инверсии в 0 0 1/2 113 -y + 1/2, z, x + 1/2 3-стержневая ось | центр инверсии в 0 1/2 1/2 114 -x + 1/2, y, z + 1/2 c-glide plane | перевод: 0 0 1/2 115 -z + 1/2, -y, -x + 1/2 ось C2 116 -y + 1/2, -x, -z + 1/2 2-кратная винтовая ось | смещение: 1/4 -1/4 0 117 -x + 1/2, -z, -y + 1/2 2-кратная винтовая ось | смещение: 0 -1/4 1/4 118 -z + 1/2, -x, -y + 1/2 3-стержневая ось | центр инверсии в 0 0 1/2 119 -y + 1/2, -z, -x + 1/2 3-стержневая ось | центр инверсии в 1/2 0 0 120 -x + 1/2, -y, -z + 1/2 Ci: 1/4 0 1/4 121 -z + 1/2, -y, x + 1/2 4-стержневая ось | центр инверсии в 0 0 1/2 122 -y + 1/2, -x, z + 1/2 g-glide plane | перевод: 1/4 -1/4 1/2 123 -x + 1/2, -z, y + 1/2 4-стержневая ось | центр инверсии в 1/4 -1/4 1/4 124 -z + 1/2, -x, y + 1/2 ось C3 125 -y + 1/2, -z, x + 1/2 3-кратная ось винта | смещение: 1/3 -1/3 1/3 126 -x + 1/2, -y, z + 1/2 2-кратная ось винта | смещение: 0 0 1/2 127 -z + 1/2, y, -x + 1/2 зеркальная плоскость 128 -y + 1/2, x, -z + 1/2 4-стержневая ось | центр инверсии при 1/4 1/4 1/4 129 -x + 1/2, z, -y + 1/2 4-стержневая ось | центр инверсии на 1/4 1/4 1/4 130 -z + 1/2, x, -y + 1/2 ось C3 131 -y + 1/2, z, -x + 1/2 ось C3 132 -x + 1/2, y, -z + 1/2 ось C2 133 z + 1/2, -y, -x + 1/2 4-стержневая ось | центр инверсии в 1/2 0 0 134 y + 1/2, -x, -z + 1/2 4-стержневая ось | центр инверсии в 1/4 - 1/4 1/4 135 x + 1/2, -z, -y + 1/2 g-glide plane | перевод: 1/2 -1/4 1/4 136 z + 1/2, -x, -y + 1/2 3-кратная ось винта | смещение: 1/3 -1/3 1/3 137 y + 1/2, -z, -x + 1/2 ось C3 138 x + 1/2, -y, -z + 1/2 2-кратная винтовая ось | перенос: 1/2 0 0 139 z + 1/2, y, x + 1/2 n-glide plane | перевод: 1/2 0 1/2 140 y + 1/2, x, z + 1/2 g-glide plane | перевод: 1/4 1/4 1/2 141 x + 1/2, z, y + 1/2 g-glide plane | перевод: 1/2 1/4 1/4 142 z + 1/2, x, y + 1/2 ось 3-кратного винта | смещение: 1/3 1/3 1/3 143 y + 1/2, z, x + 1/2 3-кратная ось винта | смещение: 1/3 1/3 1/3 144 x + 1/2, y, z + 1/2 перевод: 1/2 0 1/2 145 z + 1/2, y + 1/2, -x 4-кратная ось винта | смещение: 0 1/2 0 146 y + 1/2, x + 1/2, -z 2-кратная винтовая ось | перенос: 1/2 1/2 0 147 x + 1/2, z + 1/2, -y 4-кратная винтовая ось | перенос: 1/2 0 0 148 z + 1/2, x + 1/2, -y 3-стержневая ось | центр инверсии в 0 1/2 -1/2 149 y + 1/2, z + 1/2, -x 3-стержневая ось | центр инверсии в 1/2 0 -1/2 150 x + 1/2, y + 1/2, -z n-glide plane | перевод: 1/2 1/2 0 151 z + 1/2, -y + 1/2, x 2-кратная винтовая ось | перенос: 1/4 0 1/4 152 y + 1/2, -x + 1/2, z ось C4 153 x + 1/2, -z + 1/2, y 4-кратная винтовая ось | перенос: 1/2 0 0 154 z + 1/2, -x + 1/2, ось y с 3 стержнями | центр инверсии в 1/2 0 0 155 y + 1/2, -z + 1/2, x 3-стержневая ось | центр инверсии в 1/2 0 1/2 156 x + 1/2, -y + 1/2, z a-glide plane | перевод: 1/2 0 0 157 -z + 1/2, y + 1/2, x 4-кратная ось винта | перенос: 0 1/2 0 158 -y + 1/2, x + 1/2, z ось C4 159 -x + 1/2, z + 1/2, y 2-кратная винтовая ось | смещение: 0 1/4 1/4 160 -z + 1/2, x + 1/2, y 3-стержневая ось | центр инверсии в 0 1/2 1/2 161 -y + 1/2, z + 1/2, x 3-стержневая ось | центр инверсии в 0 1/2 0 162 -x + 1/2, y + 1/2, z b-плоскость скольжения | перевод: 0 1/2 0 163 -z + 1/2, -y + 1/2, -x 2-кратная винтовая ось | смещение: 1/4 0 -1/4 164 -y + 1/2, -x + 1/2, -z ось C2 165 -x + 1/2, -z + 1/2, -y 2-кратная ось винта | смещение: 0 1/4 -1/4 166 -z + 1/2, -x + 1/2, -y 3-стержневая ось | центр инверсии в 1/2 0 0 167 -y + 1/2, -z + 1/2, -x 3-стержневая ось | центр инверсии в 0 1/2 0 168 -x + 1/2, -y + 1/2, -z Ci: 1/4 1/4 0 169 -z + 1/2, -y + 1/2, x 4-стержневая ось | центр инверсии при 1/4 1/4 1/4 170 -y + 1/2, -x + 1/2, z плоскость зеркала 171 -x + 1/2, -z + 1/2, y 4-стержневая ось | центр инверсии при 1/4 1/4 1/4 172 -z + 1/2, -x + 1/2, y C3 ось 173 -y + 1/2, -z + 1/2, x C3 ось 174 -x + 1/2, -y + 1/2, z C2 ось 175 -z + 1/2, y + 1/2, -x g-glide plane | перевод: 1/4 1/2 -1/4 176 -y + 1/2, x + 1/2, -z 4-стержневая ось | центр инверсии в 0 1/2 0 177 -x + 1/2, z + 1/2, -y 4-стержневая ось | центр инверсии при 1/4 1/4 -1/4 178 -z + 1/2, x + 1/2, -y 3-кратная ось винта | смещение: 1/3 1/3 -1/3 179 -y + 1/2, z + 1/2, -x ось C3 180 -x + 1/2, y + 1/2, -z 2-кратная ось винта | смещение: 0 1/2 0 181 z + 1/2, -y + 1/2, -x 4-стержневая ось | центр инверсии в 1/4 1/4 -1/4 182 y + 1/2, -x + 1/2, -z 4-стержневая ось | центр инверсии в 1/2 0 0 183 x + 1/2, -z + 1/2, -y g-glide plane | перевод: 1/2 1/4 -1/4 184 z + 1/2, -x + 1/2, -y ось C3 185 y + 1/2, -z + 1/2, -x 3-кратная ось винта | смещение: 1/3 1/3 -1/3 186 x + 1/2, -y + 1/2, -z 2-кратная винтовая ось | перенос: 1/2 0 0 187 z + 1/2, y + 1/2, x g-плоскость скольжения | перевод: 1/4 1/2 1/4 188 y + 1/2, x + 1/2, z n-плоскость скольжения | перевод: 1/2 1/2 0 189 x + 1/2, z + 1/2, y g-плоскость скольжения | перевод: 1/2 1/4 1/4 190 z + 1/2, x + 1/2, y 3-кратная ось винта | смещение: 1/3 1/3 1/3 191 y + 1/2, z + 1/2, x 3-кратная ось винта | смещение: 1/3 1/3 1/3 192 x + 1/2, y + 1/2, перевод z: 1/2 1/2 0
Расположение атомов в кристаллических твердых телах
Поскольку кристаллическое твердое тело состоит из повторяющихся структур своих компонентов в трех измерениях (кристаллическая решетка ), мы можем представить весь кристалл, нарисовав структуру мельчайших идентичных единиц, которые: будучи сложенными вместе, сформируйте кристалл. Эта базовая повторяющаяся единица называется элементарной ячейкой. Наименьшая повторяющаяся ячейка кристаллической решетки. Например, элементарная ячейка листа идентичных почтовых марок представляет собой одну марку, а элементарная ячейка стопки кирпичей — это один кирпич. В этом разделе мы описываем расположение атомов в различных элементарных ячейках.
Эта базовая повторяющаяся единица называется элементарной ячейкой. Наименьшая повторяющаяся ячейка кристаллической решетки. Например, элементарная ячейка листа идентичных почтовых марок представляет собой одну марку, а элементарная ячейка стопки кирпичей — это один кирпич. В этом разделе мы описываем расположение атомов в различных элементарных ячейках.
Единичные ячейки проще всего визуализировать в двух измерениях. Во многих случаях для представления данной структуры можно использовать более одной элементарной ячейки, как показано на рисунке Эшера в открытии главы и для двумерной кристаллической решетки на рисунке 12.2 «Элементарные ячейки в двух измерениях». Обычно выбирается наименьшая элементарная ячейка, полностью описывающая порядок. Единственное требование к действительной элементарной ячейке состоит в том, что повторение ее в пространстве должно давать правильную решетку. Таким образом, элементарная ячейка в части (d) на рисунке 12.2 «Элементарные ячейки в двух измерениях» не является правильным выбором, потому что повторение ее в пространстве не дает желаемой решетки (есть треугольные отверстия).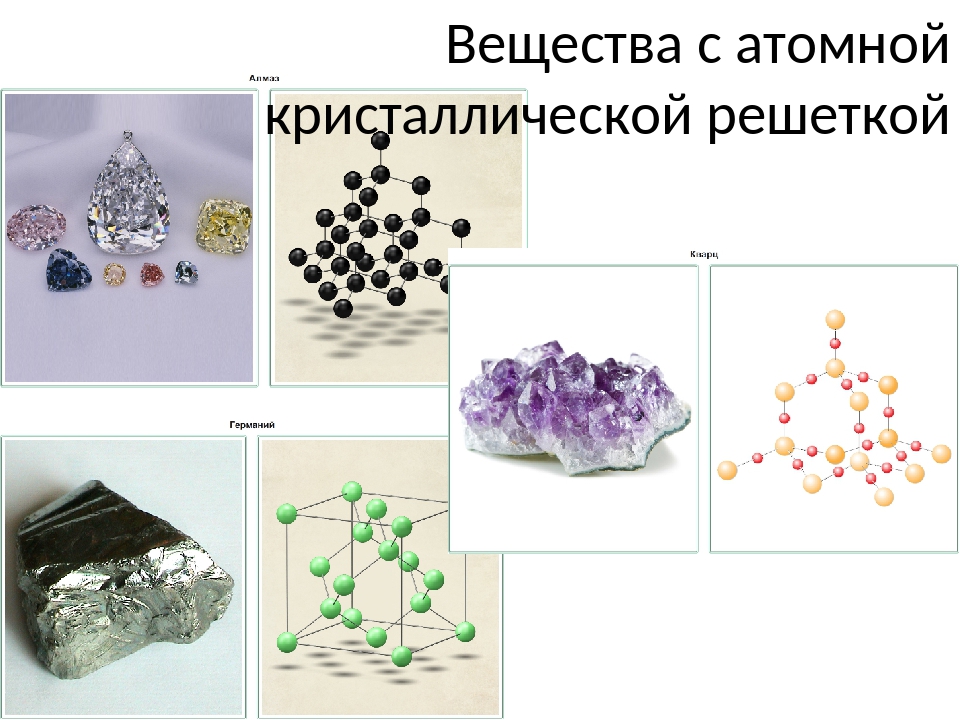 Концепция элементарных ячеек расширена до трехмерной решетки на схематическом чертеже на рисунке 12.3 «Элементарные ячейки в трех измерениях».
Концепция элементарных ячеек расширена до трехмерной решетки на схематическом чертеже на рисунке 12.3 «Элементарные ячейки в трех измерениях».
Единичная ячейка
Существует семь принципиально различных типов элементарных ячеек, которые различаются относительной длиной ребер и углами между ними (рис. 12.4 «Общие характеристики семи основных элементарных ячеек»). Каждая элементарная ячейка имеет шесть сторон, каждая из которых представляет собой параллелограмм. Мы сосредотачиваемся в первую очередь на кубических элементарных ячейках, у которых все стороны имеют одинаковую длину и все углы равны 90 °, но концепции, которые мы вводим, также применимы к веществам, элементарные ячейки которых не являются кубическими.
Рисунок 12.4 Общие характеристики семи основных элементарных ячеек
Длины краев элементарных ячеек обозначены как a , b и c , а углы определены следующим образом: α, угол между b и c ; β, угол между a и c ; и γ, угол между a и b .
Если кубическая элементарная ячейка состоит из восьми компонентных атомов, молекул или ионов, расположенных в углах куба, то она называется простой кубической элементарной кубической ячейкой, которая состоит из восьми компонентных атомов, молекул или ионов, расположенных в углах куба. куб.(часть (а) на рисунке 12.5 «Три вида кубической элементарной ячейки»). Если элементарная ячейка также содержит идентичный компонент в центре куба, то это объемно-центрированная кубическая (ОЦК) кубическая элементарная ячейка с восемью составляющими атомами, молекулами или ионами, расположенными в углах куба, плюс идентичный компонент. в центре куба. (часть (b) на рисунке 12.5 «Три вида кубической элементарной ячейки»). Если в центре каждой грани есть компоненты в дополнение к компонентам в углах куба, то элементарная ячейка является гранецентрированной кубической (ГЦК). Кубическая элементарная ячейка с восемью компонентными атомами, молекулами или ионами, расположенными в углах.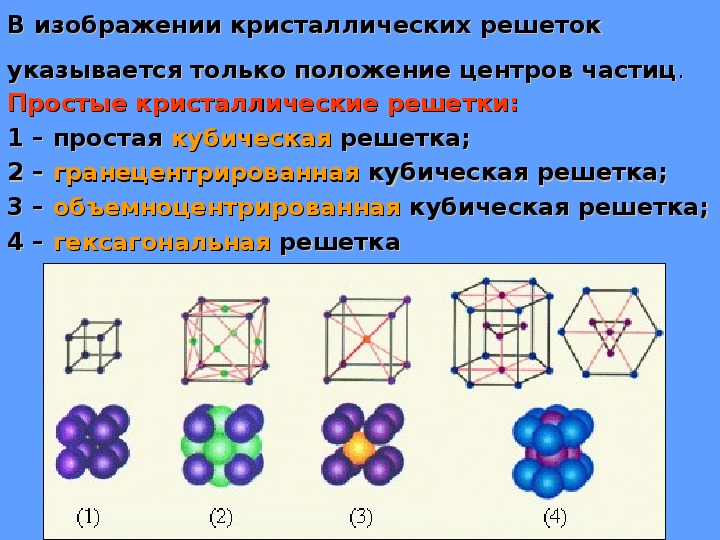 куба плюс идентичный компонент в центре каждой грани куба.(часть (c) на рисунке 12.5 «Три вида кубической элементарной ячейки»).
куба плюс идентичный компонент в центре каждой грани куба.(часть (c) на рисунке 12.5 «Три вида кубической элементарной ячейки»).
Рисунок 12.5 Три вида кубической элементарной ячейки
Для трех типов кубических элементарных ячеек, простой кубической (a), объемно-центрированной кубической (b) и гранецентрированной кубической (c), есть три представления для каждой: модель шара и ручки, пространство -заполнение модели в разрезе, которая показывает часть каждого атома, которая находится внутри элементарной ячейки, и совокупность нескольких элементарных ячеек.
Как показано на Рисунке 12.5 «Три вида кубической элементарной ячейки» твердое тело состоит из большого количества элементарных ячеек, расположенных в трех измерениях. Поэтому любое интенсивное свойство объемного материала, такое как его плотность, также должно быть связано с его элементарной ячейкой. Поскольку плотность — это масса вещества на единицу объема, мы можем вычислить плотность объемного материала из плотности одной элементарной ячейки.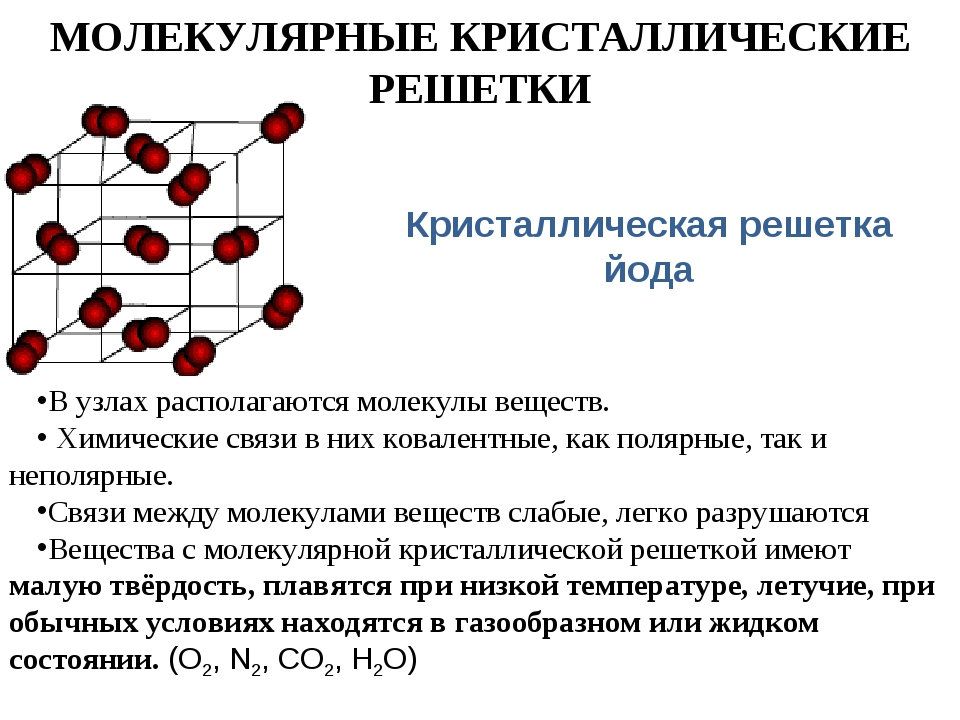 Для этого нам нужно знать размер элементарной ячейки (чтобы получить ее объем), молярную массу ее компонентов и количество компонентов в элементарной ячейке.Однако, когда мы считаем атомы или ионы в элементарной ячейке, те, которые лежат на грани, ребре или угле, вносят вклад в более чем одну элементарную ячейку, как показано на рисунке 12.5 «Три вида кубической элементарной ячейки». Например, атом, который находится на поверхности элементарной ячейки, является общим для двух соседних элементарных ячеек и поэтому считается как 12 атомов на элементарную ячейку. Точно так же атом, который находится на краю элементарной ячейки, является общим для четырех соседних элементарных ячеек, поэтому он дает 14 атомов в каждую. Атом в углу элементарной ячейки является общим для всех восьми соседних элементарных ячеек, и поэтому вклад в каждую из них составляет 18 атомов.Напротив, атомы, которые полностью лежат в элементарной ячейке, например атом в центре объемно-центрированной кубической элементарной ячейки, принадлежат только этой элементарной ячейке.
Для этого нам нужно знать размер элементарной ячейки (чтобы получить ее объем), молярную массу ее компонентов и количество компонентов в элементарной ячейке.Однако, когда мы считаем атомы или ионы в элементарной ячейке, те, которые лежат на грани, ребре или угле, вносят вклад в более чем одну элементарную ячейку, как показано на рисунке 12.5 «Три вида кубической элементарной ячейки». Например, атом, который находится на поверхности элементарной ячейки, является общим для двух соседних элементарных ячеек и поэтому считается как 12 атомов на элементарную ячейку. Точно так же атом, который находится на краю элементарной ячейки, является общим для четырех соседних элементарных ячеек, поэтому он дает 14 атомов в каждую. Атом в углу элементарной ячейки является общим для всех восьми соседних элементарных ячеек, и поэтому вклад в каждую из них составляет 18 атомов.Напротив, атомы, которые полностью лежат в элементарной ячейке, например атом в центре объемно-центрированной кубической элементарной ячейки, принадлежат только этой элементарной ячейке.
Обратите внимание на узор
Для всех элементарных ячеек, кроме гексагональной, атомы на гранях вносят 12 атомов в каждую элементарную ячейку, атомы на краях вносят вклад в каждую элементарную ячейку по 14 атомов, а атомы в углах вносят вклад в 18 атомов в каждую элементарную ячейку.
Пример 1
Металлическое золото имеет гранецентрированную кубическую элементарную ячейку (часть (c) на Рисунке 12.5 «Три вида кубической элементарной ячейки»). Сколько атомов Au в каждой элементарной ячейке?
Дано: элементарная ячейка
Запрошено: количество атомов в элементарной ячейке
Стратегия:
Используя рисунок 12.5 «Три вида элементарной кубической ячейки», определите положения атомов Au в гранецентрированной кубической элементарной ячейке, а затем определите, какой вклад вносит каждый атом Au в элементарную ячейку.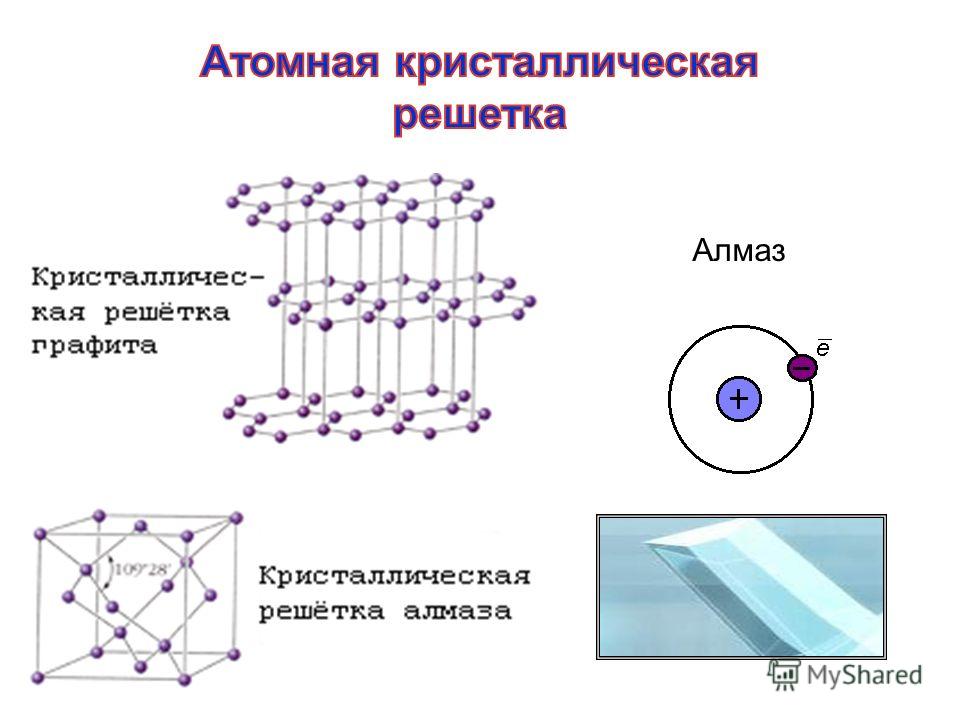 Сложите вклады всех атомов Au, чтобы получить общее количество атомов Au в элементарной ячейке.
Сложите вклады всех атомов Au, чтобы получить общее количество атомов Au в элементарной ячейке.
Решение:
Как показано на рис. 12.5 «Три вида элементарной кубической ячейки», гранецентрированная кубическая элементарная ячейка имеет восемь атомов в углах куба и шесть атомов на гранях. Поскольку атомы на грани являются общими для двух элементарных ячеек, каждая считается как 12 атомов на элементарную ячейку, что дает 6 × 12 = 3 атома Au на элементарную ячейку.Атомы в углу разделяются на восемь элементарных ячеек и, следовательно, дают только 18 атомов на элементарную ячейку, что дает 8 × 18 = 1 атом Au на элементарную ячейку. Таким образом, общее количество атомов Au в каждой элементарной ячейке составляет 3 + 1 = 4.
Упражнение
Металлическое железо имеет объемно-центрированную кубическую элементарную ячейку (часть (b) на рисунке 12.5 «Три вида кубической элементарной ячейки»). Сколько атомов Fe в каждой элементарной ячейке?
Сколько атомов Fe в каждой элементарной ячейке?
Ответ: два
Теперь, когда мы знаем, как считать атомы в элементарных ячейках, мы можем использовать элементарные ячейки для расчета плотности простых соединений.Обратите внимание, однако, что мы предполагаем, что твердое тело состоит из идеального регулярного массива элементарных ячеек, тогда как реальные вещества содержат примеси и дефекты, которые влияют на многие из их объемных свойств, включая плотность. Следовательно, результаты наших расчетов будут близки, но не обязательно идентичны экспериментально полученным значениям.
Пример 2
Рассчитайте плотность металлического железа, имеющего объемно-центрированную кубическую элементарную ячейку (часть (b) на рисунке 12.5 «Три вида кубической элементарной ячейки») с длиной ребра 286,6 пм.
Дано: элементарная ячейка и длина ребра
Запрошено: плотность
Стратегия:
A Определите количество атомов железа в элементарной ячейке.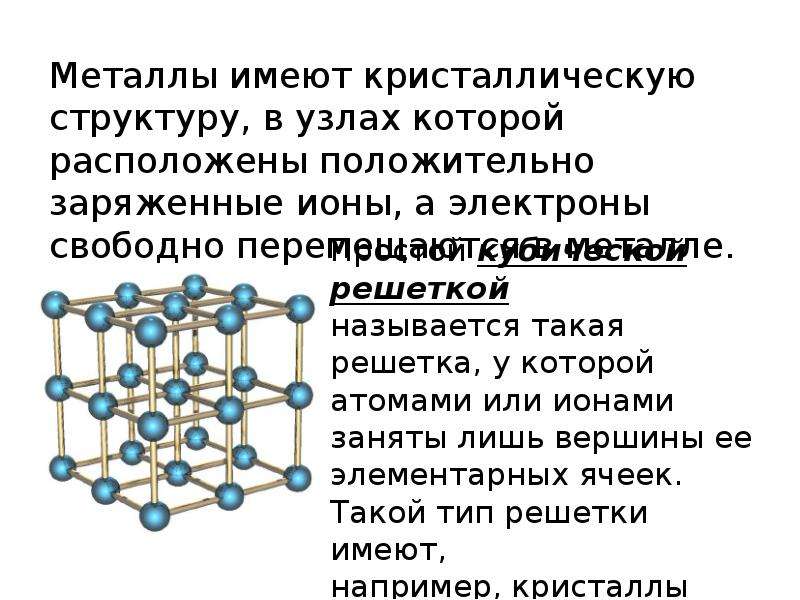
B Рассчитайте массу атомов железа в элементарной ячейке, используя молярную массу и число Авогадро.Затем разделите массу на объем клетки.
Решение:
A Из примера 1 мы знаем, что каждая элементарная ячейка металлического железа содержит два атома Fe.
B Молярная масса железа 55,85 г / моль. Поскольку плотность — это масса на единицу объема, нам нужно вычислить массу атомов железа в элементарной ячейке из молярной массы и числа Авогадро, а затем разделить массу на объем ячейки (обязательно используйте подходящие единицы, чтобы получить плотность в г / см 3 ):
масса Fe = (2 атома Fe) (1 моль6.022 × 1023 атомов) (55,85 гмоль) = 1,855 × 10–22 г объем = [(286,6 пм) (10–12 м / мин) (102 см3)] 3 = 2,354 × 10–23 см3 плотность = 1,855 × 10–22 г 2,354 × 10−23 см3 = 7,880 г / см3
Этот результат хорошо согласуется с экспериментальным значением 7,874 г / см, приведенным в таблице.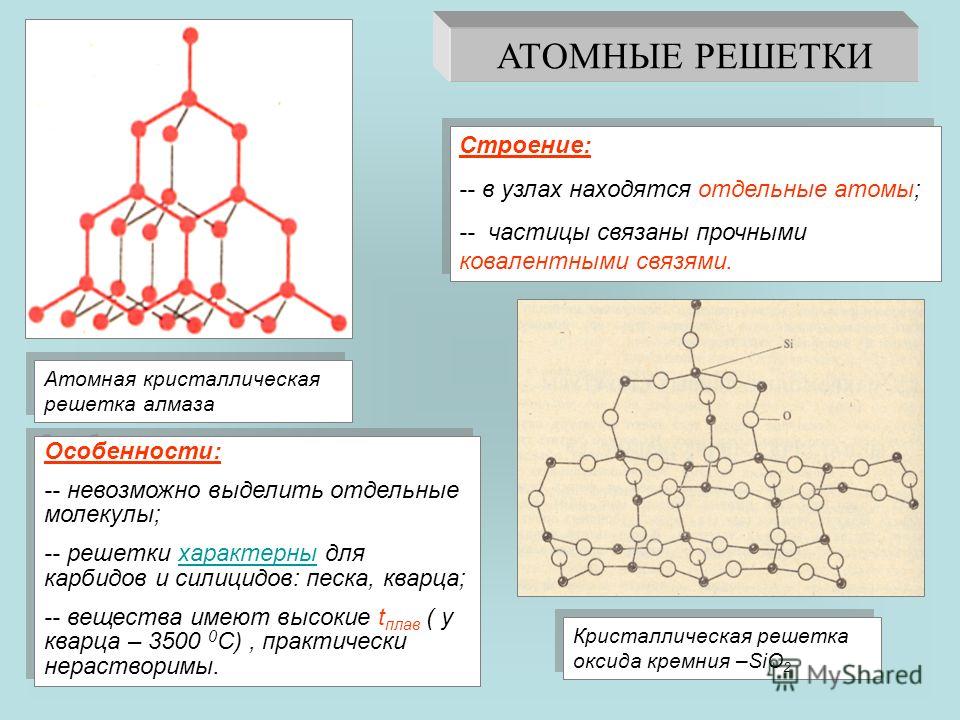 3 .
3 .
Упражнение
Рассчитайте плотность золота, имеющего гранецентрированную кубическую элементарную ячейку (часть (c) на рисунке 12.5 «Три вида элементарной кубической ячейки») с длиной ребра 407,8 мкм.
Ответ: 19.29 г / см 3
Упаковка сфер
Наше обсуждение трехмерных структур твердых тел рассматривало только те вещества, в которых все компоненты идентичны. Как мы увидим, такие вещества можно рассматривать как состоящие из идентичных сфер, упакованных вместе в пространстве; способ упаковки компонентов приводит к получению различных элементарных ячеек. Большинство веществ со структурой этого типа — металлы.
Простая кубическая структура
Расположение атомов в твердом теле, имеющем простую кубическую элементарную ячейку, показано в части (а) на рисунке 12.5 «Три вида кубической элементарной ячейки».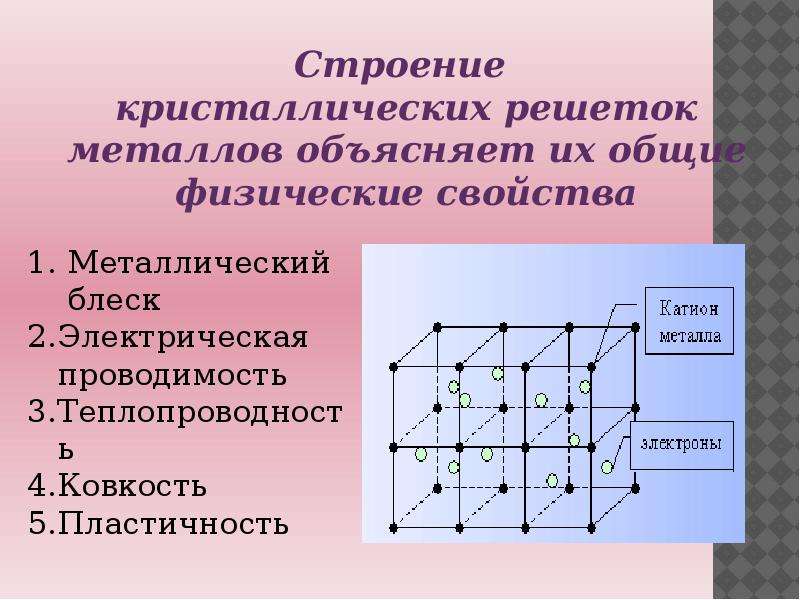 Каждый атом в решетке имеет только шесть ближайших соседей в октаэдрическом расположении. Следовательно, простая кубическая решетка — неэффективный способ упаковать атомы вместе в пространстве: только 52% всего пространства заполнено атомами. Единственный элемент, который кристаллизуется в простой кубической элементарной ячейке, — это полоний. Однако простые кубические элементарные ячейки распространены среди бинарных ионных соединений, где каждый катион окружен шестью анионами и наоборот.
Каждый атом в решетке имеет только шесть ближайших соседей в октаэдрическом расположении. Следовательно, простая кубическая решетка — неэффективный способ упаковать атомы вместе в пространстве: только 52% всего пространства заполнено атомами. Единственный элемент, который кристаллизуется в простой кубической элементарной ячейке, — это полоний. Однако простые кубические элементарные ячейки распространены среди бинарных ионных соединений, где каждый катион окружен шестью анионами и наоборот.
Расположение атомов в простой кубической элементарной ячейке. Каждый атом в решетке имеет шесть ближайших соседей в октаэдрическом расположении.
Телоцентрированная кубическая структура
Объемно-центрированная кубическая элементарная ячейка является более эффективным способом упаковки сфер вместе и гораздо более распространена среди чистых элементов. Каждый атом имеет восемь ближайших соседей в элементарной ячейке, а атомы занимают 68% объема.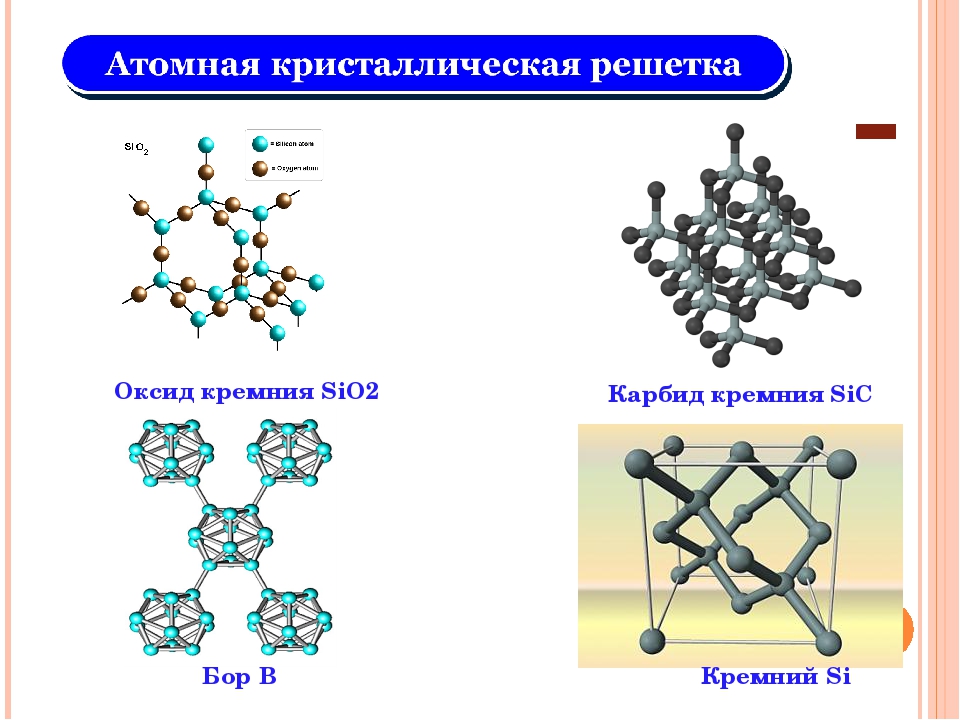 Как показано в части (b) на рисунке 12.5 «Три вида кубической элементарной ячейки», объемно-центрированная кубическая структура состоит из одного слоя сфер, контактирующих друг с другом и выровненных так, что их центры находятся в углах квадратный; второй слой сфер занимает квадратные «дыры» над сферами в первом слое.Третий слой сфер занимает квадратные отверстия, образованные вторым слоем, так что каждое из них находится непосредственно над сферой в первом слое и так далее. Все щелочные металлы, барий, радий и некоторые переходные металлы имеют объемно-центрированную кубическую структуру.
Как показано в части (b) на рисунке 12.5 «Три вида кубической элементарной ячейки», объемно-центрированная кубическая структура состоит из одного слоя сфер, контактирующих друг с другом и выровненных так, что их центры находятся в углах квадратный; второй слой сфер занимает квадратные «дыры» над сферами в первом слое.Третий слой сфер занимает квадратные отверстия, образованные вторым слоем, так что каждое из них находится непосредственно над сферой в первом слое и так далее. Все щелочные металлы, барий, радий и некоторые переходные металлы имеют объемно-центрированную кубическую структуру.
Плотноупакованные шестиугольные и кубические плотноупакованные конструкции
Самый эффективный способ упаковки сфер — это плотная упаковка, которая имеет два варианта. Один слой плотно упакованных сфер показан в части (а) на рисунке 12.6 «Плотно упакованные слои сфер». Каждая сфера окружена шестью другими в той же плоскости, образуя шестиугольное расположение. Над любым набором из семи сфер находятся шесть углублений, расположенных в шестиугольнике. В принципе, все шесть узлов одинаковы, и любой из них может быть занят атомом следующего слоя. На самом деле, однако, эти шесть сайтов можно разделить на два набора, помеченных B и C в части (a) на рисунке 12.6 «Плотно упакованные слои сфер». Сайты B и C отличаются, потому что как только мы помещаем сферу в позицию B, мы больше не можем разместить сферу ни в одной из трех позиций C, смежных с A, и наоборот.
Над любым набором из семи сфер находятся шесть углублений, расположенных в шестиугольнике. В принципе, все шесть узлов одинаковы, и любой из них может быть занят атомом следующего слоя. На самом деле, однако, эти шесть сайтов можно разделить на два набора, помеченных B и C в части (a) на рисунке 12.6 «Плотно упакованные слои сфер». Сайты B и C отличаются, потому что как только мы помещаем сферу в позицию B, мы больше не можем разместить сферу ни в одной из трех позиций C, смежных с A, и наоборот.
Рисунок 12.6 Слои плотно упакованных сфер
(a) В этом единственном слое плотно упакованных сфер каждая сфера окружена шестью другими в шестиугольном расположении. (b) Размещение атома в позиции B запрещает размещение атома в позиции в любых соседних положениях C и приводит к тому, что все атомы во втором слое занимают позиции B. (c) Размещение атомов в третьем слое над атомами в положениях A в первом слое дает гексагональную плотноупакованную структуру. Размещение атомов третьего слоя над позициями C дает кубическую плотноупакованную структуру.
Размещение атомов третьего слоя над позициями C дает кубическую плотноупакованную структуру.
Если мы поместим второй слой сфер в позиции B в части (a) на Рисунке 12.6 «Слои плотно упакованных сфер», мы получим двухслойную структуру, показанную в части (b) на Рисунке 12.6 «Плотно упакованные. Слои сфер ». Теперь есть две альтернативы для размещения первого атома третьего слоя: мы можем разместить его непосредственно над одним из атомов в первом слое (позиция A) или в одной из позиций C, соответствующих позициям, которые мы сделали не , используйте для атомов в первом или втором слоях (часть (c) на Рисунке 12.6 «Плотноупакованные слои сфер»). Если мы выберем первое расположение и повторим узор в последующих слоях, положения атомов будут чередоваться от слоя к слою в узоре ABABAB…, в результате чего получится гексагональная структура с плотной упаковкой (ГПУ). Один из двух вариантов расположения атомов с плотной упаковкой. — наиболее эффективный способ упаковки сфер в решетку — в котором позиции атомов чередуются от слоя к слою в шаблоне ABABAB….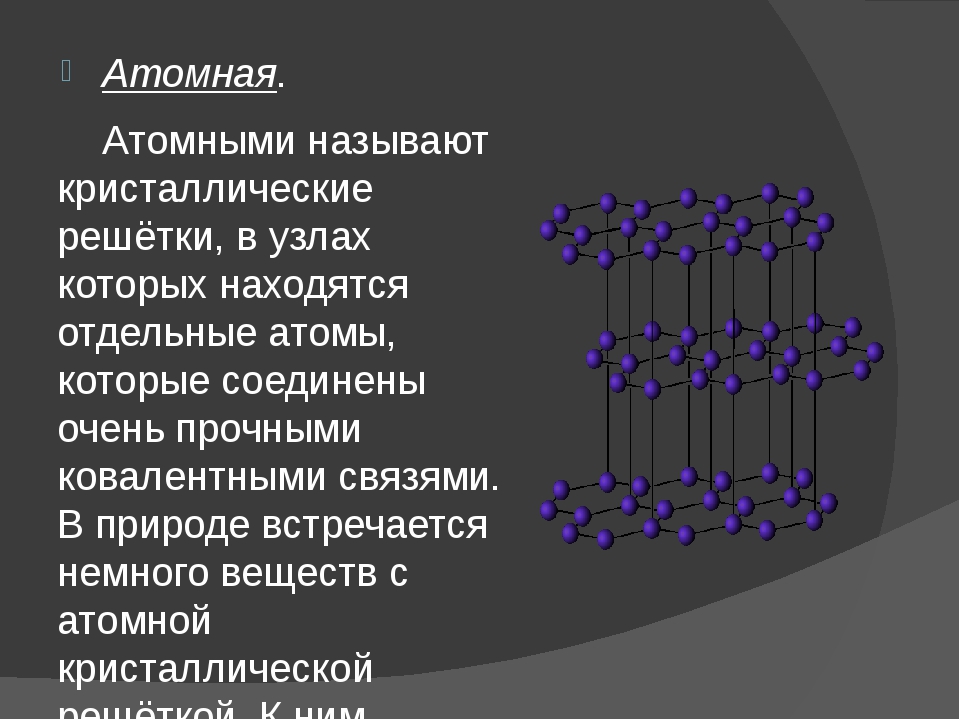 (часть (a) на Рисунке 12.7 «Плотно упакованные структуры: hcp и ccp»).Если мы выберем второе расположение и будем повторять узор до бесконечности, позиции атомов будут чередоваться как ABCABC…, давая кубическую плотноупакованную структуру (ccp). Один из двух вариантов расположения плотной упаковки — наиболее эффективный способ упаковки сфер в решетка, в которой позиции атомов меняются от слоя к слою по схеме ABCABC…. (часть (b) на рисунке 12.7 «Плотно упакованные структуры: hcp и ccp»). Поскольку структура ccp содержит гексагонально упакованные слои, она не выглядит особенно кубической.Однако, как показано в части (b) на рисунке 12.7 «Плотноупакованные структуры: ГПУ и ЦПУ», простое вращение структуры показывает ее кубическую природу, которая идентична структуре ГЦК. Структуры hcp и ccp различаются только способом наложения слоев. Обе структуры имеют общую эффективность упаковки 74%, и в обеих каждый атом имеет 12 ближайших соседей (6 в одной плоскости плюс 3 в каждой из плоскостей непосредственно выше и ниже).
(часть (a) на Рисунке 12.7 «Плотно упакованные структуры: hcp и ccp»).Если мы выберем второе расположение и будем повторять узор до бесконечности, позиции атомов будут чередоваться как ABCABC…, давая кубическую плотноупакованную структуру (ccp). Один из двух вариантов расположения плотной упаковки — наиболее эффективный способ упаковки сфер в решетка, в которой позиции атомов меняются от слоя к слою по схеме ABCABC…. (часть (b) на рисунке 12.7 «Плотно упакованные структуры: hcp и ccp»). Поскольку структура ccp содержит гексагонально упакованные слои, она не выглядит особенно кубической.Однако, как показано в части (b) на рисунке 12.7 «Плотноупакованные структуры: ГПУ и ЦПУ», простое вращение структуры показывает ее кубическую природу, которая идентична структуре ГЦК. Структуры hcp и ccp различаются только способом наложения слоев. Обе структуры имеют общую эффективность упаковки 74%, и в обеих каждый атом имеет 12 ближайших соседей (6 в одной плоскости плюс 3 в каждой из плоскостей непосредственно выше и ниже).
Рисунок 12.7 Плотно упакованные структуры: hcp и ccp
На иллюстрациях (а) показан вид в разобранном виде, вид сбоку и вид сверху конструкции ГПУ.Простая шестиугольная элементарная ячейка обрисована в общих чертах на виде сбоку и сверху. Обратите внимание на сходство с гексагональной элементарной ячейкой, показанной на рисунке 12.4 «Общие характеристики семи основных элементарных ячеек». Структура ccp на (b) показана в разобранном виде, на виде сбоку и в повернутом виде. Повернутое изображение подчеркивает ГЦК-природу элементарной ячейки (выделено). Линия, соединяющая атомы в первом и четвертом слоях структуры ccp, является диагональю тела куба.
Таблица 12.1 «Свойства обычных структур металлов» сравнивает эффективность упаковки и количество ближайших соседей для различных кубических структур и структур с плотной упаковкой; число ближайших соседей называется координационным числом. Число ближайших соседей в твердой структуре. Большинство металлов имеют ГПУ-, ГПУ- или ОЦК-структуры, хотя некоторые металлы демонстрируют как ГПУ-, так и ГПУ-структуры, в зависимости от температуры и давления.
Большинство металлов имеют ГПУ-, ГПУ- или ОЦК-структуры, хотя некоторые металлы демонстрируют как ГПУ-, так и ГПУ-структуры, в зависимости от температуры и давления.
Таблица 12.1 Свойства обычных структур металлов
| Структура | Процент пространства, занятого атомами | Координационный номер |
|---|---|---|
| простая кубическая | 52 | 6 |
| объемно-центрированная кубическая | 68 | 8 |
| шестигранник плотно упакованный | 74 | 12 |
| кубический плотноупакованный (идентичен гранецентрированному кубу) | 74 | 12 |
Сводка
Наименьшей повторяющейся единицей кристаллической решетки является элементарная ячейка .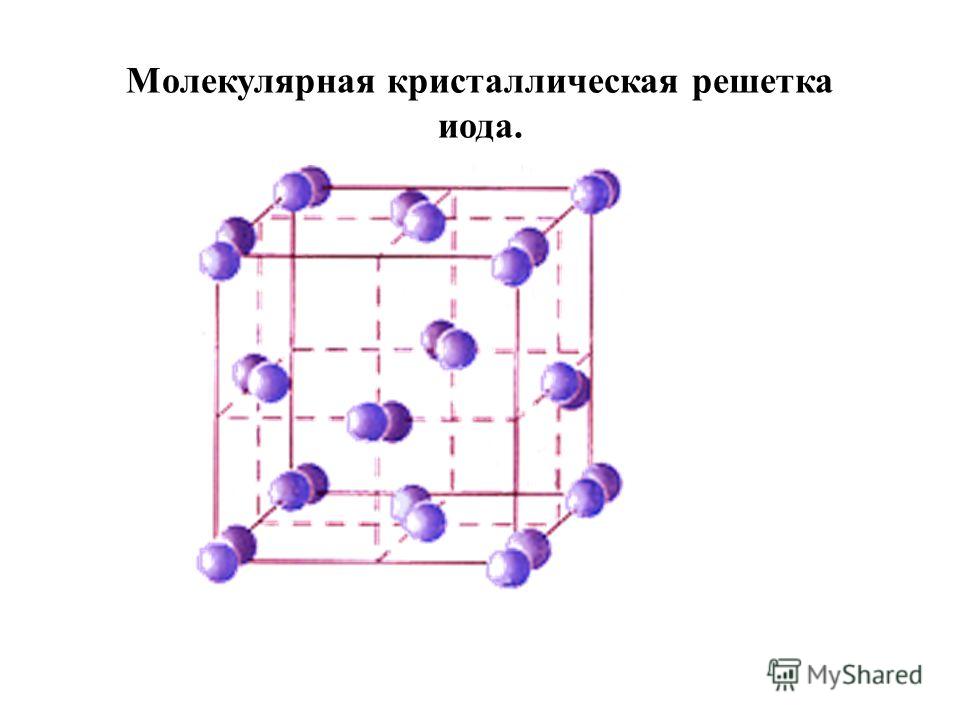 Простая кубическая элементарная ячейка содержит только восемь атомов, молекул или ионов в углах куба. Объемно-центрированная кубическая (ОЦК) элементарная ячейка содержит один дополнительный компонент в центре куба. Гранецентрированная кубическая (ГЦК) элементарная ячейка содержит компонент в центре каждой грани в дополнение к компонентам в углах куба. Простые кубические и ОЦК-схемы заполняют атомами только 52% и 68% доступного пространства соответственно. Гексагональная плотноупакованная (ГПУ) структура имеет повторяющееся расположение ABABAB…, а кубическая плотноупакованная (ccp) структура имеет повторяющийся узор ABCABC…; последняя идентична ГЦК решетке.Компоновки ГПУ и ЦПУ заполняют 74% доступного пространства и имеют координационное число , равное , равное 12 для каждого атома в решетке, т.е. число ближайших соседей. Простая кубическая и ОЦК-решетки имеют координационные числа 6 и 8 соответственно.
Простая кубическая элементарная ячейка содержит только восемь атомов, молекул или ионов в углах куба. Объемно-центрированная кубическая (ОЦК) элементарная ячейка содержит один дополнительный компонент в центре куба. Гранецентрированная кубическая (ГЦК) элементарная ячейка содержит компонент в центре каждой грани в дополнение к компонентам в углах куба. Простые кубические и ОЦК-схемы заполняют атомами только 52% и 68% доступного пространства соответственно. Гексагональная плотноупакованная (ГПУ) структура имеет повторяющееся расположение ABABAB…, а кубическая плотноупакованная (ccp) структура имеет повторяющийся узор ABCABC…; последняя идентична ГЦК решетке.Компоновки ГПУ и ЦПУ заполняют 74% доступного пространства и имеют координационное число , равное , равное 12 для каждого атома в решетке, т.е. число ближайших соседей. Простая кубическая и ОЦК-решетки имеют координационные числа 6 и 8 соответственно.
Key Takeaway
- Кристаллическое твердое тело может быть представлено его элементарной ячейкой, которая представляет собой наименьшую идентичную единицу, которая, будучи сложена вместе, дает характерную трехмерную структуру.
Концептуальные проблемы
Почему допустимо представлять структуру кристаллического твердого тела структурой его элементарной ячейки? Каковы наиболее важные ограничения при выборе элементарной ячейки?
Все структуры элементарных ячеек имеют шесть сторон.Могут ли кристаллы твердого тела иметь более шести сторон? Поясните свой ответ.
Объясните, как интенсивные свойства материала отражаются в элементарной ячейке. Все ли свойства объемного материала такие же, как у его элементарной ячейки? Поясните свой ответ.
Экспериментально измеренная плотность сыпучего материала на немного выше, чем ожидалось, исходя из структуры чистого материала.Предложите два объяснения этому наблюдению.
Экспериментально определенная плотность материала на ниже, чем ожидалось, на , исходя из расположения атомов в элементарной ячейке, формулы массы и размера атомов. Какой вывод (а) вы можете сделать о материале?
Только один элемент (полоний) кристаллизуется с простой кубической элементарной ячейкой.Почему полоний — единственный пример элемента с такой структурой?
Что означает термин «координационное число » в структуре твердого тела? Как координационное число зависит от структуры металла?
Расположите три типа кубических элементарных ячеек в порядке увеличения эффективности упаковки.В чем разница в эффективности упаковки между структурой ГПУ и структурой ЦПУ?
Структура многих металлов зависит от давления и температуры. Какая структура — ОЦК или ГПУ — более вероятна в данном металле при очень высоких давлениях? Объясните свои рассуждения.
Металл имеет две кристаллические фазы.Температура перехода , температура, при которой одна фаза превращается в другую, составляет 95 ° C при 1 атм и 135 ° C при 1000 атм. Нарисуйте фазовую диаграмму этого вещества. Известно, что металл имеет либо структуру ccp, либо простую кубическую структуру. Обозначьте регионы на диаграмме соответствующим образом и обоснуйте свой выбор для структуры каждой фазы.
Числовые задачи
Металлический родий имеет элементарную ячейку ГЦК.Сколько атомов родия содержит каждая элементарная ячейка?
Хром имеет структуру с двумя атомами на элементарную ячейку. Является ли структура этого металла простой кубической, ОЦК, ГЦК или ГПУ?
Плотность никеля 8,908 г / см 3 .Если металлический радиус никеля составляет 125 мкм, какова структура металлического никеля?
Плотность вольфрама 19,3 г / см 3 . Если металлический радиус вольфрама равен 139 пм, какова структура металлического вольфрама?
Элемент имеет плотность 10.25 г / см 3 и радиус металла 136,3 мкм. Металл кристаллизуется в ОЦК решетке. Определите элемент.
Образец инертного металла массой 21,64 г помещают в колбу, содержащую 12,00 мл воды; конечный объем 13,81 мл. Если длина края элементарной ячейки составляет 387 мкм, а радиус металла — 137 мкм, определите устройство упаковки и идентифицируйте элемент.
Установлено, что образец щелочного металла с ОЦК-ячейкой имеет массу 1.000 г и объем 1.0298 см. 3 . Когда металл вступает в реакцию с избытком воды, в результате реакции образуется 539,29 мл газообразного водорода при 0,980 атм и температуре 23 ° C. Определите металл, определите размеры элементарной ячейки и укажите приблизительный размер атома в пикометрах.
Установлено, что образец щелочноземельного металла с элементарной ячейкой с ОЦК имеет массу 5.000 г и объем 1,392 см. 3 . Для полной реакции с газообразным хлором требуется 848,3 мл газообразного хлора при 1,050 атм и 25 ° C. Определите металл, определите размеры элементарной ячейки и укажите приблизительный размер атома в пикометрах.
Литий кристаллизуется в ОЦК-структуре с длиной ребра 3.509 Å. Рассчитайте его плотность. Каков приблизительный металлический радиус лития в пикометрах?
Ванадий используется при производстве нержавеющей ванадиевой стали. Он образует кристаллы с ОЦК с плотностью 6,11 г / см 3 при 18,7 ° C. Какова длина края элементарной ячейки? Каков приблизительный металлический радиус ванадия в пикометрах?
Простая кубическая ячейка содержит один атом металла с металлическим радиусом 100 мкм.
- Определите объем атома (ов), содержащихся в одной элементарной ячейке [объем сферы = (43) πr3].
- Какова длина одного края элементарной ячейки? (Подсказка: между атомами нет пустого пространства.)
- Рассчитайте объем элементарной ячейки.
- Определите эффективность упаковки для этой конструкции.
- Используйте шаги из задачи 11, чтобы вычислить эффективность упаковки для элементарной ячейки ОЦК с металлическим радиусом 1.00 Å.
ответов
натрий, край элементарной ячейки = 428 мкм, r = 185 мкм
д = 0.5335 г / см 3 , r = 151,9 пм
Ионная решеткаУпаковка для кристалловВ ионном твердом теле ионы упакованы вместе в повторяющийся массив, называемый кристаллической решеткой.Концепция кристаллической упаковки предполагает, что ионы представляют собой твердые сферы. Самая простая конфигурация — это когда сферы в основании упакованы бок о бок. Последовательный В этом расположении каждый атом Альтернативное уплотнение может быть получено путем размещения второго слоя Это более компактное устройство, чем Другая конструкция имеет базовый слой сфер, расположенных в шестиугольной форме в В этом устройстве отверстия между сферами меньше, чем в кубическом устройстве. При размещении Каждая сфера имеет координационное число двенадцать. Если третий слой сфер вместо размещения над отверстием второго Каждая сфера имеет координационное число двенадцать. Единичные ячейкиПростейшее расположение сфер, которое воспроизведет весь кристалл Ионная решеткаВ большинстве ионных соединений анионы намного больше, чем катионы, и это Основные понятия:
Расположение упаковки ионного соединения определяется сравнительными размерами ионов.Рассмотрим решетку, в которой анионы образуют кубический массив. На диаграмме ниже показаны четыре сферы, представляющие некоторые анионы Если катион слишком велик, чтобы обеспечить оптимальное соотношение 0,414, анионы будут разделены.
Можно предсказать координационное число для солей, не соответствующих ни одному из перечисленных типов.
Правила устойчивости решеток и растворимостиСравним энергии решеток трех солей одинаковой стехиометрии 1: 1.
Для этих солей энергии решетки будут разными, потому что разные структуры имеют Если вы сравните общую энергию гидратации катионов и анионов в каждой из этих солей, Таким образом, основная причина того, что некислые катионы и неосновные анионы образуют нерастворимые соли, заключается в том, что оба иона имеют большие размеры (схожие по размеру), Причина того, что кислотные катионы и неосновные анионы образуют растворимые соли, заключается в том, что ионы сильно различаются по размеру, что дает более низкие энергии решетки. Трудность предсказания растворимости солей слабощелочных анионов, таких как сульфат большие, -2-заряженные (слабоосновные) анионы, такие как сульфат, лучше всего осаждаются большими, -зарядными (слабокислыми) катионами (такими как барий). Более мелкие, слабоосновные анионы, такие как NO 2 — и ClO 2 — , не имеют терминов -TDS и DH, работающих на нерастворимость. Соли этих анионов обычно растворимы. |
Структура простых тел
Структура простых тел
Возвращаться
к расписанию занятий
Структуры простых тел
При рассмотрении металлических
или ионных твердых тел атомы и ионы рассматриваются как твердые сферы.В
металлов, упаковка часто приводит к наибольшей пространственной эффективности, с
атомы металлов потеряли свои валентные электроны. Валентные электроны
могут свободно перемещаться по конструкции, что приводит к высокому электрическому
проводимость и высокая пластичность металлических твердых тел. Ионные твердые тела
рассматриваются как устройства, в которых катионы соприкасаются с анионами,
и анионы касаются катионов. Кристалл держится вместе
в значительной степени кулоновскими силами притяжения между противоположно заряженными ионами.
Элементарные ячейки и кристаллические структуры
Кристаллы состоят из
повторяющиеся асимметричные единицы, которые могут быть атомами, ионами или молекулами.
Пространственная решетка — это узор, образованный точками, которые представляют
повторяющиеся структурные единицы. Элементарная ячейка кристалла
представляет собой воображаемую область с параллельными сторонами, из которой весь кристалл может
быть застроенным. Большинство кристаллов имеет несколько областей, которые могут служить
элементарная ячейка, как правило, самая маленькая элементарная ячейка, которая демонстрирует наибольшую
симметрия выбрана.Если повторить в трех измерениях, весь кристалл
воссоздан.
Металлические твердые тела,
отсутствие направленных связей, часто упаковывается с наибольшей эффективностью, принимая
плотно упакованная структура . У каждого атома металла есть 12 ближайших соседей
(CN = 12), а 74% объема элементарной ячейки занято атомной
сферы. Плотная упаковка может происходить по-разному.
Атом металла на плоскости будет окружен 6 ближайшими соседями.
Выше и ниже плоскости расположены «шапки», состоящие из треугольника из 3-х атомов.
который входит в углубления, образованные центральным атомом металла и его шестью соседями.
Колпачки могут быть выровнены друг с другом (шаблон ABA) или расположены в шахматном порядке.
(узор ABC). Есть также металлические кристаллы с неправильным рисунком,
и некоторые, которые повторяются после многих (нескольких сотен) слоев.
Результаты паттерна ABA
в гексагональной плотноупакованной элементарной ячейке, изображенной выше (а). Азбука
узор приводит к гранецентрированному кубическому расположению, также называемому кубическим
плотно упакованная конструкция, как на фото (б).Любая структура содержит
небольшие отверстия, составляющие 26% объема кристалла. Есть
два типа отверстий. Октаэдрические отверстия с координационным числом
из 6, лежат внутри двух смещенных треугольных плоскостей атомов. Восьмигранный
отверстия гранецентрированного куба (или кубической плотноупакованной элементарной ячейки) показаны
ниже.
Октаэдрические отверстия
(оранжевым цветом) находятся по краям и в центре элементарной ячейки.
Проще всего увидеть октаэдрическую симметрию отверстия в центре
куб, как изображены все 6 ближайших соседей.Для n атомов
в плотноупакованной структуре n октаэдрических отверстий. Размер
октаэдрической дыры будет зависеть от размера атомов, которые
плотно упакованный. Ионные твердые тела и сплавы часто рассматриваются как плотноупакованные
расположение большего металла или иона, с меньшим атомом или ионом, занимающим
дыры.
Тетраэдрические отверстия
образованы плоским треугольником атомов с атомом, покрывающим углубление
в центре. полученное отверстие имеет координационное число 4
в четырехгранном расположении.В гранецентрированной кубической элементарной ячейке
четырехгранные отверстия можно рассматривать как находящиеся за каждым углом.
Тетраэдрические отверстия
маленькие светлые кружочки в углах внутреннего куба.
Есть два типа четырехгранных отверстий (желтые и белые), обозначающие
две разные ориентации. Для кристалла из n атомов в плотноупакованном
расположение, имеется 2n четырехгранных отверстий.
Возврат
к расписанию занятий
Радиусы октаэдра и тетраэдра
Отверстия
Размер восьмигранника
отверстие или тетраэдрическое отверстие в плотноупакованном расположении будет зависеть от
размер иона, который плотно упакован.Предполагая, что больший ион
(обычно анион) плотно упакован, октаэдрические отверстия будут иметь радиус
0,414 радиуса большего иона. Тетраэдрические отверстия
будет иметь радиус в 0,225 раза больше радиуса большего иона. В
сплавов, оба металла находятся в элементарной форме, а их атомные радиусы и
должны быть рассмотрены. Атомные радиусы металлов получены в чистом металле.
как 1/2 расстояния между ядрами соседних атомов металла.
Однако это расстояние зависит от координационного числа и зависит от координационного числа.
число из 12 металлов с наибольшим межъядерным расстоянием.
В следующей таблице показано изменение атомных радиусов в зависимости от координации.
номер.
Координация №
относительный радиус
12
1,00
8
0,97
6
0,96
4
0.88
Для сравнения атомных радиусов все
исправлено с учетом вышеуказанных факторов до координационного числа 12, даже
если их типичная кристаллическая структура имеет более низкое координационное число.
Эти радиусы иногда называют радиусами Гольдшмидта .
Ионные твердые тела
Множество ионных структур
можно рассматривать как плотную упаковку более крупного иона (обычно
анион), с катионами, занимающими октаэдрические или тетраэдрические отверстия
и искажение структуры, так что анионы больше не соприкасаются друг с другом.
Например, структуру каменной соли NaCl можно рассматривать как:
а) как центрированный по граням
кубический массив анионов, с катионами, занимающими октаэдрические отверстия
(в центре каждого куба и на каждом краю) или
б) как грань центрированная
массив катионов с анионами, занимающими все октаэдрические отверстия
В любом
описание, каждый ион имеет координационное число 6, с элементарной ячейкой
содержащие равное количество катионов и анионов (соль 1: 1).
Другой кристалл 1: 1
структурой для ионных твердых тел является структура CsCl, с ионами хлорида в
углы куба и ион цезия в центре (или кубическое отверстие).
Строение также можно рассматривать в обратном направлении, с ионами цезия
по углам и хлорид в центре. Эта структура возникает
в солях 1: 1, в которых ионы примерно одинаковы по размеру. Оба иона
иметь координационное число 8.
Третье строение
для солей 1: 1 — структура цинковой обманки или спалерита.Анионы
находятся в гранецентрированном массиве с катионами в половине тетраэдрических отверстий.
Поскольку у каждого иона есть четыре ближайших соседа,
в этой структуре координационное число 4.
Соли с соотношением 1: 2 (или
2: 1) стехиометрия иногда показывает структуру флюорита (или антифторита).
Структура флюорита, наблюдаемая во фториде кальция, содержит ионы кальция.
в гранецентрированном кубическом массиве с ионами фтора в все (8)
четырехгранных отверстий.Ионы фтора имеют координационное число
4, а ионы кальция имеют координационное число 8. Другой
вид этой структуры — это простое кубическое расположение анионов,
с катионами, занимающими половину кубических дырок.
Антифтористый состав
часто встречается в солях с общей формулой M 2 X, например
как оксид калия. Анионы находятся в гранецентрированном кубическом расположении,
с катионами во всех тетраэдрических отверстиях.
Возврат
к расписанию занятий
Авторские права © 1998
Беверли Дж. Волисер и Стивен Ф. Телло, Массачусетс Лоуэлл. Вы можете свободно
отредактируйте эти страницы для использования в некоммерческих образовательных учреждениях.
Пожалуйста, разместите это уведомление об авторских правах на всех страницах.
Кремниевая решетка
Кремниевая решетка
3.1 Силиконовая решетка
Индексы Миллера, обозначенные как h, k и l, являются символическим векторным представлением для
ориентация атомных плоскостей и направлений в кристаллической решетке.Определение трех
решетки векторов, образующих оси решетки, любая плоскость кристалла будет пересекать оси
в трех разных точках. Индексы Миллера получаются обратным
перехваченных ценностей. По соглашению отрицательные индексы записываются
с полосой над индексами. Принятая номенклатура соответствует описанию
ниже [139].
- Направление обозначается [hkl],
- эквивалентные направления обозначены
, - плоскость с нормальным вектором [hkl] представлена как (hkl), и
- эквивалентные плоскости обозначены {hkl}.
Кристаллическая структура кремния классифицируется как структура алмаза [139],
и, таким образом, имеет два атома в примитивной ячейке. Германий и углерод являются
другие примеры решетки со структурой алмаза. Напротив, III-V
полупроводники (GaAs, AlAs, InAs, InP и др.) относятся к типу цинковой обманки. Кристалл
Решетку кремния можно представить в виде двух проникающих гранецентрированных кубических решеток
(ГЦК) со стороной куба a = 0,543 нм, как показано на рисунке 3.1. Структура
визуализируется как тетраэдр с четырьмя вершинами первой ГЦК решетки в точке (0,0,0),
(a / 2,0,0), (0, a / 2,0) и (0,0, a / 2) и дополнительный атом добавлен в центр
этого тетраэдра.Дополнительный атом смещается на (,,) с
относительно исходной ГЦК-решетки. Одна элементарная ячейка кремния состоит из восьми
атомов, где их распределение со ссылкой на рисунок 3.1 описывается как
ниже.
- Каждый из восьми атомов (A ′ , относящихся к первой ГЦК решетке) на
углы распределяются между каждой ячейкой, таким образом считается эквивалентным один атом
внутри ячейки (серого цвета), - каждый из шести атомов (A ‘) на гранях разделяется между двумя ячейками, таким образом
считая еще три атома внутри оболочки (красного цвета), и - четыре атома (A ′ ′ , относящиеся ко второй ГЦК решетке) полностью покоятся
внутри ячейки (синего цвета).
Рисунок 3.1: Изображен эскиз кристаллической решетки алмаза. Цвета серый
и красный цвет представляет атомы A ‘, а синий цвет представляет атомы A ‘ ‘. Для кремния
оба атома идентичны.
.
