Содержание
Азотная кислота, подготовка к ЕГЭ по химии
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары
желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной
кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.
Получение
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
NH3 + O2 → (кат. Pt) NO + H2O
NO + O2 → NO2
NO2 + H2O + O2 → HNO3
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
KNO3 + H2SO4(конц. ) → KHSO4 + HNO3↑
) → KHSO4 + HNO3↑
Химические свойства
- Кислотные свойства
- Термическое разложение
- Реакции с неметаллами
- Реакции с металлами
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии
выпадения осадка, выделения газа или образования слабого электролита.
CaO + HNO3 → Ca(NO3)2 + H2O
HNO3 + NaOH → NaNO3 + H2O
Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑
При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в
темном месте.
HNO3 → (hv) NO2 + H2O + O2
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2,
если разбавленная — до NO.
HNO3(конц.) + C → CO2 + H2O + NO2
HNO3(конц.) + S → H2SO4 + NO2 + H2O
HNO3(разб.) + S → H2SO4 + NO + H2O
HNO3(конц.) + P → H3PO4 + NO2 + H2O
В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой
На какой
именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием
нитрата и преимущественно NO2.
Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
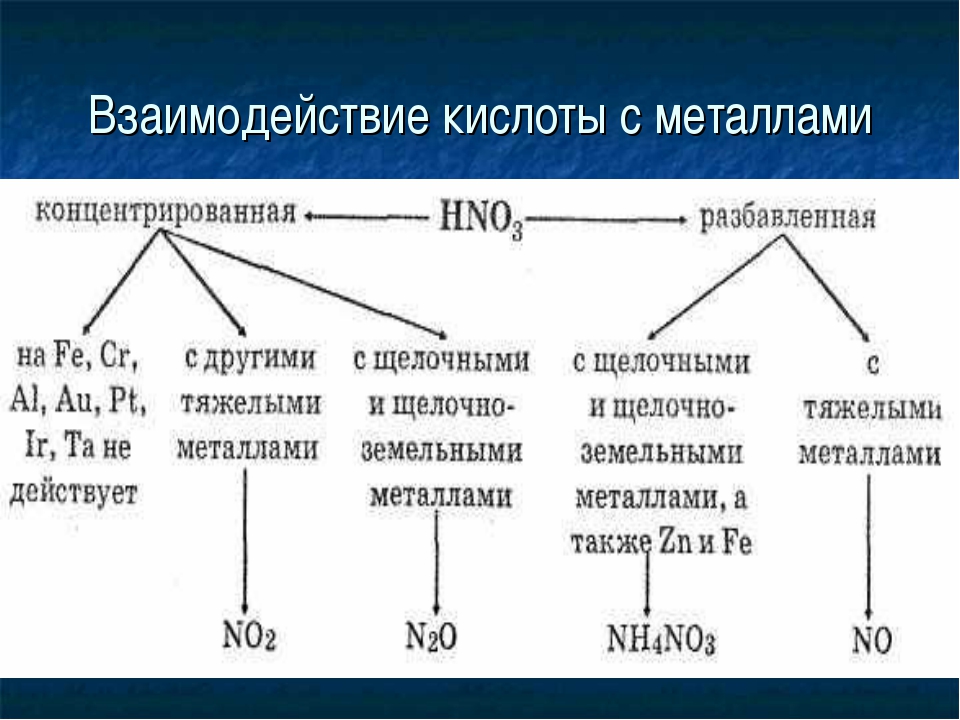
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2,
NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка
с азотной кислотой в различных концентрациях.
Zn + HNO3(70% — конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% — ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% — разб.) → Zn(NO3)2 + N2O + H2O
Zn + HNO3(10% — оч. разб.) → Zn(NO3)2 + N2 + H2O
Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит
Это происходит
за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так
как оксидная пленка на поверхности металлов разрушается.
Al + HNO3 → (t) Al(NO3)3 + NO2 + H2O
Соли азотной кислоты — нитраты NO
3—
Получение
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
Fe + HNO3(разб.) → Fe(NO3)2 + NH4NO3 + H2O
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.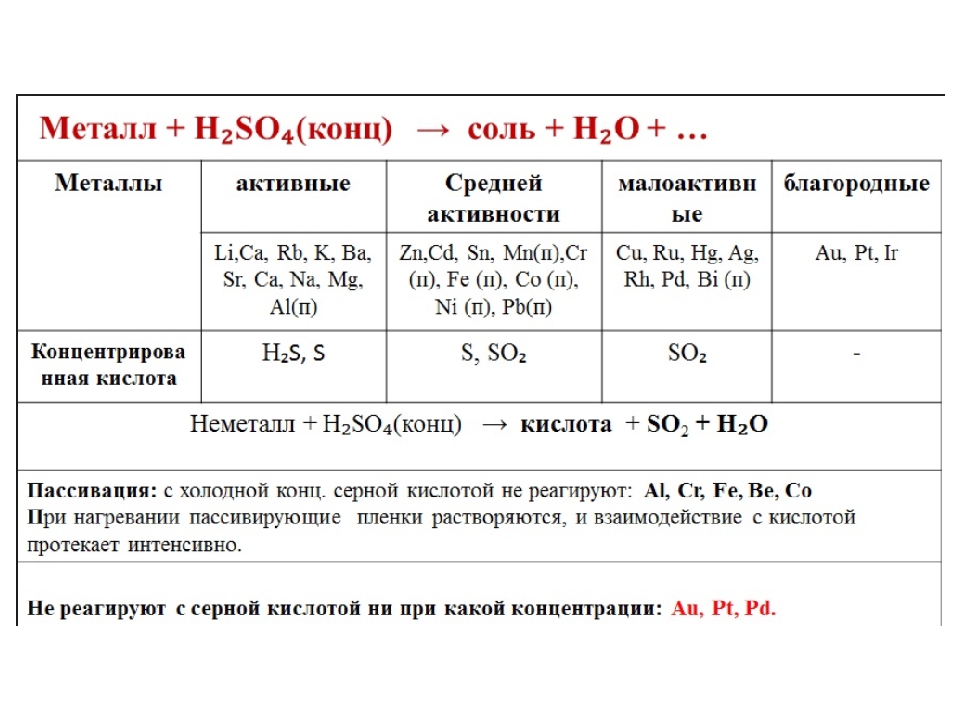
MgO + HNO3 → Mg(NO3)2 + H2O
Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O
Нитрат аммония получают реакция аммиака с азотной кислотой.
NH3 + HNO3 → NH4NO3
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная
кислота — до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + NH4NO3 + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
Химические свойства
- Реакции с металлами, основаниями и кислотами
- Разложение нитратов
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате
Соли реагируют с основаниями и кислотами, если в результате
реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
AgNO3 + KCl → AgCl↓ + KNO3
Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.
Pb(NO3)2 → (t) PbO + NO2 + O2
NaNO3 → (t) NaNO2 + O2
Cu(NO3)2 → (t) CuO + NO2 + O2
PtNO3 → (t) Pt + NO2 + O2
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью.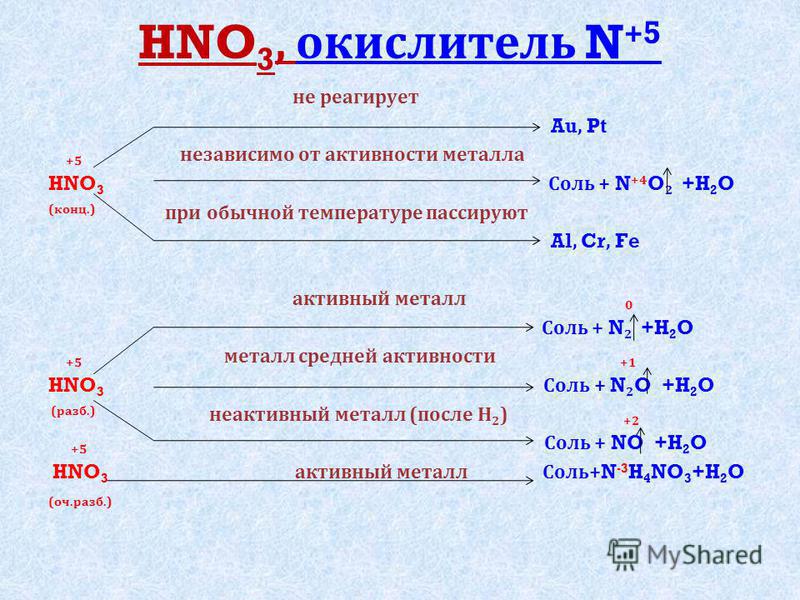 Копирование, распространение
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Азотная кислота — строение и химические свойства » HimEge.ru
Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде.
tкип. = 83ºC.. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет:
4HNO3 = 4NO2 + 2H2O + O2.
Азотная кислота ядовита.
В растворе — сильная кислота; нейтрализуется щелочами, гидратом аммиака, реагирует с основными оксидами и гидроксидами, солями слабых кислот. Сильный окислитель; реагирует с металлами, неметаллами, типичными восстановителями. Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th, U; не реагирует с Au, Ir, Pt, Rh, Та, W, Zr. Не разрушает диоксид кремния. Смесь концентрированных HNO3 и HCl («царская водка») обладает сильным окислительным действием (превосходит чистую HNO3), переводит в раствор золото и платину. Еще более активна смесь концентрированных HNO3 и HF.
Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th, U; не реагирует с Au, Ir, Pt, Rh, Та, W, Zr. Не разрушает диоксид кремния. Смесь концентрированных HNO3 и HCl («царская водка») обладает сильным окислительным действием (превосходит чистую HNO3), переводит в раствор золото и платину. Еще более активна смесь концентрированных HNO3 и HF.
Mr = 63, 01; d = 1, 503(25); tпл = -41, 6 oC; tкип +82,6 oC (разл.).
1. Типичные свойства кислот:
1) Взаимодействует с основными и амфотерными оксидами:
2HNO3 + CuO = Cu(NO3)2 + H2O
6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O
2) С основаниями, амфотерными гидроксидами:
HNO3 + NaOH = NaNO3 + H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O
3) Вытесняет слабые кислоты из их солей:
2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2
2HNO3 + Na2SiO3 = H2SiO3 ↓+ 2NaNO3
2.
 Специфические свойства азотной кислоты как окислителя
Специфические свойства азотной кислоты как окислителя
1) Взаимодействие азотной кислоты с металлами
В качестве окислителя выступает азот в степени окисления +5, а не водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода. Глубина восстановления нитрат-иона зависит от концентрации кислоты и от положения металла в электрохимическом ряду напряжений металлов. Возможные продукты взаимодействия металлов с азотной кислотой приведены в таблице ниже. Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты.
4 HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + 2 N+4O2 + 2 H2O
N+5 + 1e → N+4 2 окислитель, пр-с восстановления
Cu0 – 2e → Cu+2 1 восстановитель, пр-с окисления
8 HN+5O3(разб. ) + 3 Cu0 = 3 Cu+2(NO3)2 + 2 N+2O + 4 H2O
) + 3 Cu0 = 3 Cu+2(NO3)2 + 2 N+2O + 4 H2O
N+5 + 3e → N+2 2 окислитель, пр-с восстановления
Cu0 – 2e → Cu+2 3 восстановитель, пр-с окисления
2) Проявляет окислительные свойства при взаимодействии с неметаллами:
S + 6HNO3(конц) = H2SO4 + 6NO2 + 2H2O;
B + 3HNO3 = H3BO3 + 3NO2;
3P + 5HNO3 + 2H2O = 5NO + 3H3PO4.
3) Азотная кислота окисляет сложные вещества:
6HI + 2HNO3 = 3I2 + 2NO + 4H2O;
FeS + 12HNO3 = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O.
4) Ксантопротеиновая реакция:
Азотная кислота окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук – «ксантопротеиновая реакция»).
Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляют концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака (в щелочной среде) окраска переходит в оранжевую. Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка.
5) Окислительные свойства «царской водки»:
Смесь концентрированных азотной и соляной кислот в объемном соотношении 1 : 3 обладает еще большей окислительной активностью, они могут растворять даже золото и платину:
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O;
4HNO3 + 18HCl + Pt = 3H2[PtCl6] + 4NO + 8H2O
4HNO3 = 4NO2 + 2H2O + O2 (комн., на свету).
HNO3 + H2O = NO3– + H3O+.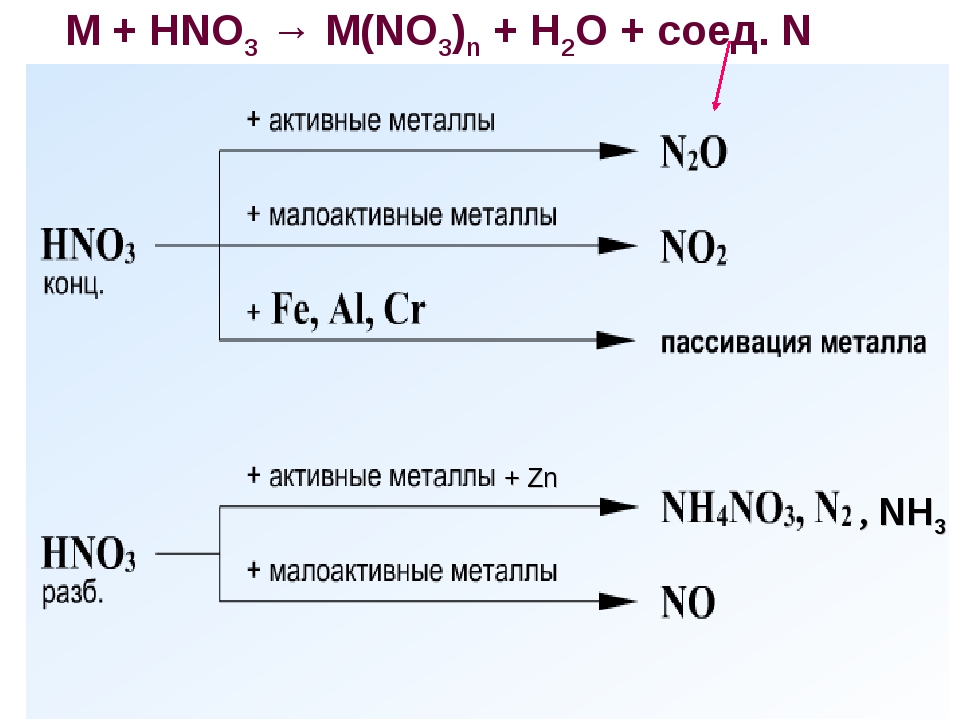
HNO3 (разб.) + NaOH = NaNO3 + H2O ,
HNO3 (разб.) + NH3 · H2O = NH4NO3 + H2O.
2HNO3 (2-3%-я) + 8H0(Zn, разб. H2SO4) = NH4NO3 + 3H2O,
2HNO3 (5%-я) + 8H0(Mg, разб. H2SO4) = N2O ↑ + 5H2O,
HNO3 (30%-я) + 3H0(Zn, разб. H2SO4) = NO2↑ H2O,
HNO3 (60%-я) + 2H0(Zn, разб. H2SO4) = HNO2 + H2O. (кат Pd)
2HNO3 (конц.) +Ag = AgNO3 + NO2 ↑ + H2O.
8HNO3 (разб.) + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
10HNO3 (разб.) + 4Mg = 4Mg(NO3)2 +N2O↑ + 5H2O (примесь H2)
12HNO3 (разб. ) + 5Sn —t—5Sn(NO3)2 + N2 ↑ + 6H2O (примесь NO)
) + 5Sn —t—5Sn(NO3)2 + N2 ↑ + 6H2O (примесь NO)
30HNO3 (оч. разб.) + 8Al = 8Al(NO3)3 + 3 NH4NO3 + 9H2O (примесь H2)
12HNO3 (оч. разб.) + 5Fe = 5Fe(NO3)2 + N2 ↑ + 6H2O (0-10 oC),
4HNO3 (разб.) + Fe = Fe(NO3)3 + NO↑ + 2H2O.
4HNO3 (конц., гор.) + Hg = Hg(NO3)2 + 2NO2 ↑ + 2H2O,
8HNO3(разб., хол) + 6Hg = 3Hg2(NO3)2 + 2NO ↑ + 4H2O.
6HNO3 (конц.) + S = H2SO4 + 6NO2 ↑ + 2H2O (кип.),
2HNO3 (конц.) + 6HCl(конц.) = 2NO↑ + 3Cl2↑ + 4H2O (100-150 oC).
HNO3 (конц. ) + 4HCl(конц.) + Au = H[AuCl4] + NO↑ + 2H2O.
) + 4HCl(конц.) + Au = H[AuCl4] + NO↑ + 2H2O.
4HNO3 (конц.) + 18HCl(конц.) + 3Pt = 3H2[PtCl6] + 4NO↑ + 8H2O
4HNO3 (конц.) + 18HF(конц.) + 3Si = 3H2[SiF6] + 4NO↑ + 8H2O.
4HNO3 (дымящ.) + P4O10 = 2N2O5 + 4HPO3 (в атмосфере O2+O3)
Урок «Азотная кислота, состав, строение молекулы, физические и химические свойства, получение»
Тип урока: Урок передачи и приобретения новых знаний и умений.
Цели: Повторить и закрепить знания об общих химических свойствах кислот; изучить строение молекулы азотной кислоты, физические и специфические химические свойства азотной кислоты – взаимодействие ее с металлами; познакомить учащихся с промышленным и лабораторным способами получения чистой азотной кислоты.
В результате урока необходимо знать:
- Состав и строение молекулы азотной кислоты; число ковалентных связей, образуемых атомом азота и степень окисления азота в молекуле азотной кислоты.
- Общие химические свойства азотной кислоты: взаимодействие с индикаторами (лакмусом и метилоранжем), с основными и амфотерными оксидами, основаниями, с солями более слабых и более летучих кислот.
- Специфические химические свойства азотной кислоты: взаимодействие ее с металлами.
- Лабораторный и промышленный способы получения азотной кислоты.
Необходимо уметь:
- Составлять уравнения химических реакций с позиции теории электролитической диссоциации.
- Составлять уравнения реакций взаимодействия концентрированной и разбавленной кислоты с металлами с использованием метода электронного баланса.
Методы и методические приемы:
- Беседа.
- Самостоятельная работа учащихся по составлению уравнений химических реакций азотной кислоты с металлами.
- Лабораторная работа по изучению общих химических свойств азотной кислоты;
- Составление опорного конспекта.
- Творческая работа: сообщение учащегося о получении азотной кислоты.
- Демонстрация опытов: взаимодействие разбавленной и концентрированной азотной кислоты с медью.
- Демонстрация слайдов с помощью мультимедиа проектора.
- Взаимопроверка и взаимооценка результатов самостоятельной работы.
Оборудование и реактивы:
На столах учащихся: растворы азотной кислоты HNO3 (20 – 25 %), индикаторы лакмус и метилоранж, раствор гидроксида натрия NaOH, раствор сульфата меди (II) CuSO4, раствор сульфата железа (II) FeSO4, оксид меди (II) CuO, оксид алюминия Al2O3, раствор карбоната натрия Na2CO3, пробирки, пробиркодержатели.
На столе учителя: концентрированная азотная кислота HNO3 (60 – 65 %), разбавленная азотная кислота HNO3 (30 %), штатив с пробирками, медная проволока (кусочки), газоотводная трубка, кристаллизатор с водой, пробиркодержатель, мультимедийная установка (компьютер, проектор, экран).
План урока:
План урока написан на доске и отпечатан для составления опорного конспекта на столах учащихся (Приложение 1)
Ход урока:
I Повторение.
Учитель: На прошлых уроках мы изучили некоторые соединения азота. Давайте вспомним их.
Ученик: Это аммиак, соли аммония, оксиды азота.
Учитель: Какие оксиды азота являются кислотными?
Ученик: Оксид азота (III) N2O3 – азотистый ангидрид и оксид азота (V) N2O5 – азотный ангидрид, ему соответствует азотная кислота HNO3.
Учитель: Каков качественный и количественный состав азотной кислоты?
Учитель пишет на доске формулу азотной кислоты и просит ученика расставить степени окисления
Ученик: Молекула состоит из трех химических элементов: H, N, O – из одного атома водорода, одного атома азота и трех атомов кислорода.
II Состав и строение HNO3
Учитель: Как же образуется молекула азотной кислоты?
Учитель показывает презентацию об азотной кислоте (Приложение 2 – презентация, Приложение 3 – текст пояснения к презентации)
III Физические свойства:
Учитель: Теперь переходим к изучению физических свойств азотной кислоты.
Учащиеся составляют краткое описание физических свойств азотной кислоты.
Учитель на демонстрационном столе показывает, что представляет собой концентрированная азотная кислота HNO (60 – 65 %) — бесцветная жидкость, «дымящаяся на воздухе», с едким запахом. Концентрированная 100 % — ая HNO3 иногда окрашена в желтоватый цвет, т.к. она летучая и нестойкая, и при комнатной температуре разлагается с выделением оксида азота (IV) или «бурого» газа, именно поэтому ее хранят в бутылках из темного стекла.
Учитель на доске пишет уравнение химической реакции разложения азотной кислоты:
Учитель: Азотная кислота гигроскопична, смешивается с водой в любых отношениях. В водных растворах – сильный электролит, при температуре – 41,6 0С затвердевает. На практике применяется 65 % азотная кислота, она не дымит, в отличие от 100 % — ой.
IV Химические свойства
Учитель: Переходим к следующему этапу урока. Азотная кислота – сильный электролит. Следовательно, ей будут присущи все общие свойства кислот. С какими веществами реагируют кислоты?
Ученик: С индикаторами, с основными и амфотерными оксидами, с основаниями, с солями более слабых и летучих кислот, с металлами.
Учитель: Перед вами общие свойства кислот.
Включается мультимедийная установка. Учитель показывает презентацию об общих химических свойствах кислот (Приложение 4).
Учитель: Проведем экспериментальный этап урока. Ваша задача – провести химические реакции, подтверждающие химические свойства кислот, на примере азотной кислоты. Работать будете группами по 4 человека. На партах лежат инструкции к лабораторным опытам (Приложение 5). В тетрадях надо составить уравнения химических реакций в молекулярном и ионном виде.
Далее учитель проверяет технику безопасности выполнения лабораторных опытов. Вызывает учеников к доске записывать уравнения реакций.
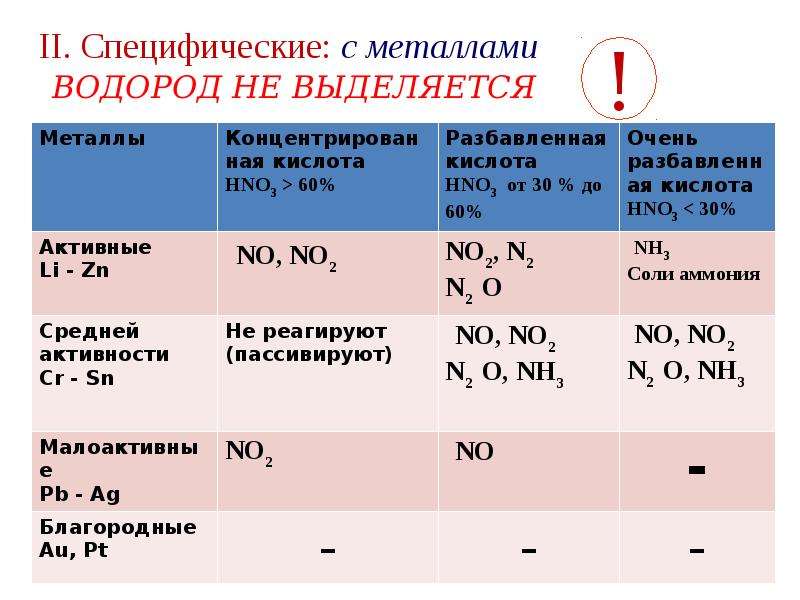
Учитель: Переходим к специфическим химическим свойствам азотной кислоты. Следует отметить, что азотная кислота, и разбавленная, и концентрированная, при взаимодействии с металлами не выделяет водород, а может выделять различные соединения азота – от аммиака до оксида азота (IV).
Включается мультимедийная установка. Учитель показывает презентацию о возможных продуктах восстановления азотной кислоты (Приложение 6).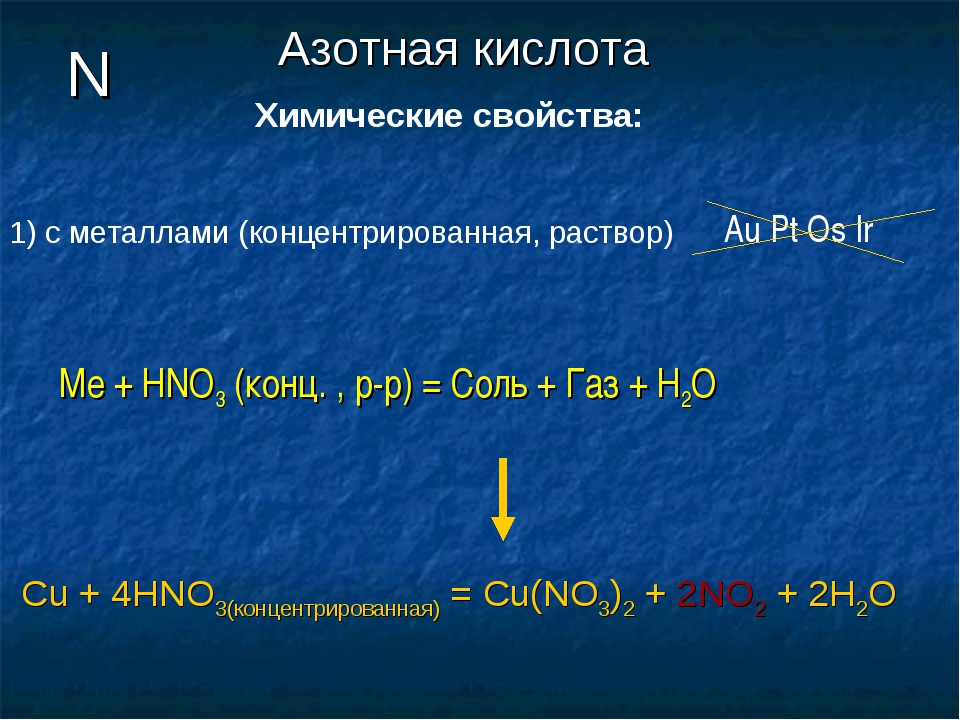
Учитель: Посмотрим на схему. У каждого на столах лежат схемы восстановления азотной кислоты (разбавленной и концентрированной) металлами (Приложение 7).
Далее учитель демонстрирует опыты:
- Взаимодействие разбавленной азотной кислоты с медью. Собирание оксида азота (II) над водой.
- Взаимодействие концентрированной азотной кислоты с медью. Получение оксида азота (IV).
На доске записывает уравнения реакций:
Учитель: На основе опытов можно сделать выводы:
- Раствор азотной кислоты реагирует не только с металлами, стоящими в электрохимическом ряду напряжений металлов до водорода, но и с металлами, стоящими после водорода.
- В реакции с разбавленной HNO3 окислителем металлов является не ион водорода H+, а ион NO3-, у которого окислительные свойства сильнее.

- Концентрированная азотная кислота также реагирует с металлами, стоящими в электрохимическом ряду напряжений металлов правее водорода. Окислителем металлов в данном случае являются молекулы HNO3 за счет предельно окисленного атома азота .
- В окислительно-восстановительных реакциях с металлами азотная кислота выступает как сильный окислитель за счет атомов . Поэтому водород не выделяется, продуктами реакции являются соединения азота с более низкой степенью окисления, чем +5, а также соль и вода.
Учитель: Пользуясь схемами восстановления концентрированной и разбавленной азотной кислоты металлами, а также учебником на стр. 127, перейдем к самостоятельной работе по вариантам (Приложение 8). Каждый выполняет свой вариант. Вам предложены карточки – задания. Время работы 5-7 минут.
Включается мультимедийная установка. Учитель показывает правильные варианты ответов (Приложение 9). Учащиеся проверяют правильность выполнения задания.
Учащиеся проверяют правильность выполнения задания.
V Получение азотной кислоты HNO3
Ученик: (сообщение) В лаборатории азотную кислоту получают взаимодействием калийной или натриевой селитры с концентрированной серной кислотой при нагревании или без нагревания:
В промышленности азотную кислоту получают каталитическим окислением аммиака, синтезированного из азота воздуха:
Ученик показывает схему получения азотной кислоты (Приложение 10), а учащиеся записывают уравнения реакций в тетрадь.
VI Заключение
Учитель: На сегодняшнем уроке мы познакомились с составом и строением азотной кислоты. Повторили и закрепили общие свойства кислот на примере азотной кислоты, закрепили свои знания по теории ТЭД, теории строения атома и химической связи. Изучили специфические свойства азотной кислоты, а именно взаимодействие ее с металлами.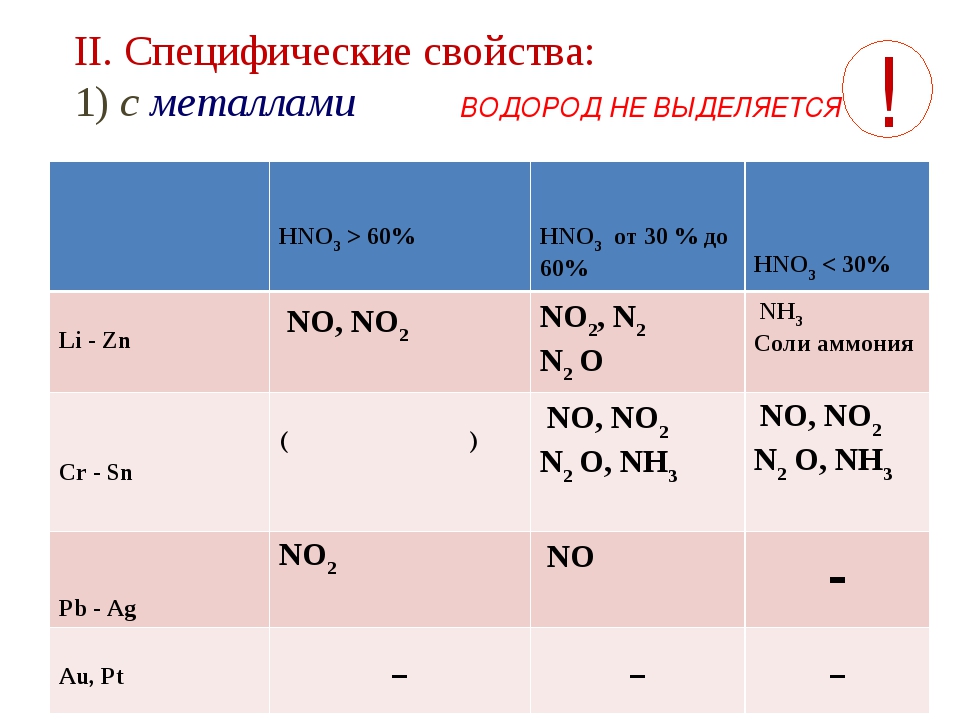 Познакомились со способами получения азотной кислоты.
Познакомились со способами получения азотной кислоты.
Далее подводятся итоги, выставляются оценки. Учитель задает домашнее задание по учебнику, задачнику и конспекту.
Д/з: § 33, упр. 4 на стр. 128 учебника;
задачи: 4 – 35, 4 – 41 задачник;
выучить конспект.
Список литературы
- Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: учебник для 9 класса общеобразовательных учреждений. – М.: Вентана – Граф, 2004.
- Энциклопедия для детей. Химия. – М.: Аванта, 2000.
- Максименко О.О. Химия. Пособие для поступающих в вузы. – М.: Эксмо, 2003.
- Полосин В.С., Прокопенко В.Г. Практикум по методике преподавания химии. Учебное пособие. – М.: Просвещение, 1989.
- Мартыненко Б.В. Химия: Кислоты и основания. – М.: Просвещение, 2000.
Взаимодействие азотной кислоты металлами и неметаллами
Взаимодействие азотной кислоты с металлами и неметаллами [c. 115]
115]
Взаимодействие кислот окислителей с металлами и неметаллами. 1. В пробирку с газоотводной трубкой поместите медные стружки и прилейте 2—3 мл концентрированной азотной кислоты, слегка подогрейте. Выделяющийся бурый газ поглощается водой. Обнаружьте в образовав- [c.57]
И и к е л ь не окисляется на воздухе и легко растворяется только в разбавленной азотной кислоте. Химическая стойкость никеля обусловлена его склонностью к пассивированию, связанному с образованием на поверхности металла защитной оксидной пленки.С кислородом он начинает взаимодействовать только при 500°С. И лишь в измельченном состоянии при нагревании N1 реагирует с галогенами, серой и другими неметаллами. С большинством из них он, как и многие -элементы, образует соединения переменного состава (в том числе и металлоподобные). Из соединений никеля практическое значение имеют главным образом те, в которых никель имеет степень окисления +2. Оксид N 0 и гидроксид Ы1(0Н)2 в воде не растворяются, но легко растворяются в кислотах и растворах аммиака. Взаимодействия идут с образованием комплексных ионов [c.297]
Взаимодействия идут с образованием комплексных ионов [c.297]
По уравнению (1) процесс восстановления протекает при взаимодействии концентрированной азотной кислоты с металлами, электродные потенциалы которых положительны, например Си, Ag, Hg. При взаимодействии же с неметаллами или с металлами, электродные потенциалы которых отрицательны, но по абсолютной величине невелики, концентрированная азотная кислота восстанавливается по уравнению (2). [c.218]
Вследствие довольно высокой активности марганец легко окисляется при нагревании, в особенности в порошкообразном состоянии, кислородом, серой, галогенами. Компактный металл на воздухе устойчив. Так как покрывается оксидной пленкой, которая препятствует дальнейшему окислению металла. Еще более устойчивая пленка образуется при действии на Мп холодной азотной кислоты. Технеций и рений вступают в химическое взаимодействие с неметаллами при достаточно 620 [c. 620]
620]
Общая характеристика элементов главной подгруппы V группы периодической системы. Азот. Строение атома, строение молекулы, степени окисления. Круговорот азота в природе. Получение, физические и химические свойства азота. Аммиак, строение молекулы, получение, физические и химические свойства. Восстановительные свойства аммиака. Аммиачная вода. Соли аммония, их получение. Термическое разложение солей аммония. Оксиды азота, их получение и основные химические свойства. Азотистая кислота. Окислительно-восстановительные свойства соединений азота со степенью окисления +3. Азотная кислота, ее получение и химические свойства. Окислительные свойства азотной кислоты в реакциях взаимодействия с металлами и неметаллами. Царская водка. Соли азотной кислоты, их термическое разложение. Азотные удобрения. Фосфор, строение атома, степени окисления. Аллотропия. Физические и химические свойства. Фосфин. Фосфиды, их гидролиз. Оксиды фосфора (III) и (V), их получение, свойства. Ортофосфор-ная кислота, ее получение. Одно-, двух- и трехзамещен-ные фосфаты. Их растворимость и гидролиз. Метафос-форная кислота, ее общая характеристика. Фосфорные удобрения. [c.7]
Одно-, двух- и трехзамещен-ные фосфаты. Их растворимость и гидролиз. Метафос-форная кислота, ее общая характеристика. Фосфорные удобрения. [c.7]
Концентрированная серная кислота растворяет марганец только при нагревании с выделением двуокиси серы. В азотной кислоте марганец растворяется, восстанавливая ее до окиси или закиси азота. Порошкообразный марганец взаимодействует при нагревании с многими неметаллами. С металлами образует сплавы. [c.171]
Азотная кислота — сильная и характеризуется ярко выраженными окислительными свойствами. В продажу обычно поступает 65%-ная ННОз плотностью 1400 кг/м . С водой азотная кислота смешивается в любых соотношениях. Животные и растительные ткани при действии на них азотной кислоты очень быстро разрушаются. Даже небольшое количество разбавленной азотной кислоты оставляет желтые пятна на коже. Концентрированная азотная кислота взаимодействует с многими неметаллами сера окисляется ею до серной кислоты при кипячении, уголь —до углекислого газа. Тлеющая лучинка, внесенная в пары азотной кислоты, воспламеняется скипидар, влитый в концентрированную азотную кислоту, загорается синий раствор индиго обесцвечивается. Концентрированная азотная кислота не действует на золото и платину. Железо, алюминий и некоторые другие металлы пассивируются концентрированной азотной кислотой, так как на их поверхности возникает плотная защитная пленка оксидов, нерастворимая в кислотах. Это свойство азотной кислоты позволяет хранить и транспортировать ее в стальных цистернах. [c.304]
Тлеющая лучинка, внесенная в пары азотной кислоты, воспламеняется скипидар, влитый в концентрированную азотную кислоту, загорается синий раствор индиго обесцвечивается. Концентрированная азотная кислота не действует на золото и платину. Железо, алюминий и некоторые другие металлы пассивируются концентрированной азотной кислотой, так как на их поверхности возникает плотная защитная пленка оксидов, нерастворимая в кислотах. Это свойство азотной кислоты позволяет хранить и транспортировать ее в стальных цистернах. [c.304]
Некоторая соль А, полученная при взаимодействии металла с неметаллом, полностью окислилась при длительном кипячении с концентрированной азотной кислотой. При этом была получена кристаллическая соль В белого цвета, слабо растворимая только в концентрированной серной кислоте. Продуктом реакции соли А с кипящей концентрированной соляной кислотой является вещество С, которое выпадает из охлажденного и достаточно разбавленного раствора в виде белых кристаллов. Каждое из трех соединений содержит металл в одной и той же степени окисления. [c.140]
Каждое из трех соединений содержит металл в одной и той же степени окисления. [c.140]
Азотная кислота является сильным окислителем, поэтому ее реакции с металлами значительно отличаются от реакций металлов с соляной и разбавленной серной кислотами практически никогда не наблюдается выделения водорода. Благодаря окислительным свойствам азотная кислота взаимодействует и с неметаллами. [c.169]
Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительновосстановительные реакции, идуш 1е с участием HNO3, протекают сложно. [c.439]
Азотная кислота обладает сильно выраженными окислительными свойствами. Она разрушает животные и растительные ткани, окисляет почти все металлы и неметаллы. Образование тех или иных продуктов взаимодействия зависит от концентрации НЫОз, активности простого вещества и температуры (стр. 264). На рис. 183 показано влияние концентрации НЫОз на характер образующихся продуктов ее восстановления при взаимодействии с железом. Достаточно разбавленная кислота в основном восстанавливается до ЫН4ЫО3 с повышением ее концентрации становится более характерным образование ЫО концентрированная НЫОз восстанавливается до ЫОа- [c.400]
Достаточно разбавленная кислота в основном восстанавливается до ЫН4ЫО3 с повышением ее концентрации становится более характерным образование ЫО концентрированная НЫОз восстанавливается до ЫОа- [c.400]
При обычных условиях простое вещество бор — твердое вещество ( = 2075 °С). Кристс1ллическое строение бора особенное. Оно не является характерным ни для Me uraTOB, ни для неметаллов. В нем реализуется большее число связей (>4), природа которых не является ни типично металлической, ни обычной ковалентно L Кристалл бора состоит из икосаэдров — правильных двадцати-вершинами. При обычных температурах бор весьма инертен, мпературах он становится аюгивным, взаимодействует с кисло-ми, серой, азотом, углеродом, водородом и многими металлами, нно реагирует с такими сильными окислителями, как фтор, го-фованная азотная кислота и царская водка. Аморфный бор по-ряется при кипячении в концентрированной щелочи [c.59]
Концентрированная азотная кислота взаимодействует со многими неметаллами сера окисляется ею до Н2504 при кипячении, уголь — до СО2. Тлеющая лучинка, внесенная в пары азотной кислоты, воспламеняется скипидар, влитый в концентрированную НЫОз, загорается синий раствор индиго обесцвечивается. Концентрированная НМОз не действует на золото и платину. Железо, алюминий и некоторые другие металлы пассивируются концентрированной азотной кислотой, так как на их поверхности возникает плотная защитная.пленка оксидов, нерастворимая в кислотах. Это свойство азотной,кислоты позволяет хранить и транспортировать ее в стальных цистернах. [c.322]
Тлеющая лучинка, внесенная в пары азотной кислоты, воспламеняется скипидар, влитый в концентрированную НЫОз, загорается синий раствор индиго обесцвечивается. Концентрированная НМОз не действует на золото и платину. Железо, алюминий и некоторые другие металлы пассивируются концентрированной азотной кислотой, так как на их поверхности возникает плотная защитная.пленка оксидов, нерастворимая в кислотах. Это свойство азотной,кислоты позволяет хранить и транспортировать ее в стальных цистернах. [c.322]
Азотная кислота HNO3— бесцветная жидкость с резким запахом, гигроскопична, кипит при 84 °С, хорошо растворима в воде. Разбавленная А. к. проявляет все свойства одноосновных кислот. Концентрированная (96—98 %) HNO3 красно-бурого цвета от присутствия в ней NOa-Ha свету и при нагревании HNO, разлагается на N0-2, О2 и HjO. Концентрированная А. к.— один из самых сильных окислителей, реагирует почти со всеми металлами (за исключением золота, платины, иридия, родия) с образованием нитратов, при этом выделяются оксиды азота. Алюминий, железо и хром легко взаимодействуют с разбавленной А. к., но практически не реагируют с концентрированной кислотой вследствие образования на поверхности защитного тонкого слоя оксида металла. А. к. взаимодействуют со многими неметаллами, а также оргащтческими соединениями. В промышленности А. к. получают из аммиака. А. к. применяется в производстве азотных удобрений, взрывчатых веществ, лекарств, красителей, пластических масс, искусственных волокон, как окислитель в реактивных двигателях и др. [c.8]
Алюминий, железо и хром легко взаимодействуют с разбавленной А. к., но практически не реагируют с концентрированной кислотой вследствие образования на поверхности защитного тонкого слоя оксида металла. А. к. взаимодействуют со многими неметаллами, а также оргащтческими соединениями. В промышленности А. к. получают из аммиака. А. к. применяется в производстве азотных удобрений, взрывчатых веществ, лекарств, красителей, пластических масс, искусственных волокон, как окислитель в реактивных двигателях и др. [c.8]
Алюминий получают в больших количествах из боксита АЬОз йНгО (л=1—3). Боксит очищают растворением в водном растворе NaOH и переосаждают в виде А1(0Н)з с помощью СОг. Дегидратированный продукт растворяют в расплаве криолита и проводят электролиз при 800—1000°С. Алюминий — прочный твердый белый металл. Он очень электроположителен, но тем не менее устойчив по отношению к коррозии, так как на его поверхности образуется пр10чная плотная защитная оксидная пленка. Толстые оксидные пленки часто наносят на алюминий электролитически. Этот процесс называют анодированием. Свеженанесенные пленки можно окрасить пигментами. Алюминий растворим в разбавленных кислотах, но пассивируется концентрированной азотной кислотой. Если же разрушить защитную оксидную пленку механически или амальгамированием, то происходит энергичное взаимодействие даже с водой. Металлический алюминий легко взаимодействует с горячей водной натриевой щелочью, галогенами и различными неметаллами. [c.295]
Толстые оксидные пленки часто наносят на алюминий электролитически. Этот процесс называют анодированием. Свеженанесенные пленки можно окрасить пигментами. Алюминий растворим в разбавленных кислотах, но пассивируется концентрированной азотной кислотой. Если же разрушить защитную оксидную пленку механически или амальгамированием, то происходит энергичное взаимодействие даже с водой. Металлический алюминий легко взаимодействует с горячей водной натриевой щелочью, галогенами и различными неметаллами. [c.295]
Разбавленная же с металлами, стоящими в ряду напряжений после водорода, восстанавливается до N0, а расположенные до водорода превращают ее в N0, N2O, N2 или Nh5+. Чем более разбавлен раствор кислоты и активнее металл, тем глубже протекает процесс восстановления. Взаимодействуя с неметаллами (S, Р и др.) азотная кислота обычно восстанавливается до N0, а с переходными элементами до N0 и NO2 одновременно. С соляной кислотой HNO3 образует очень сильный окислитель — хлористый нитрозил [c.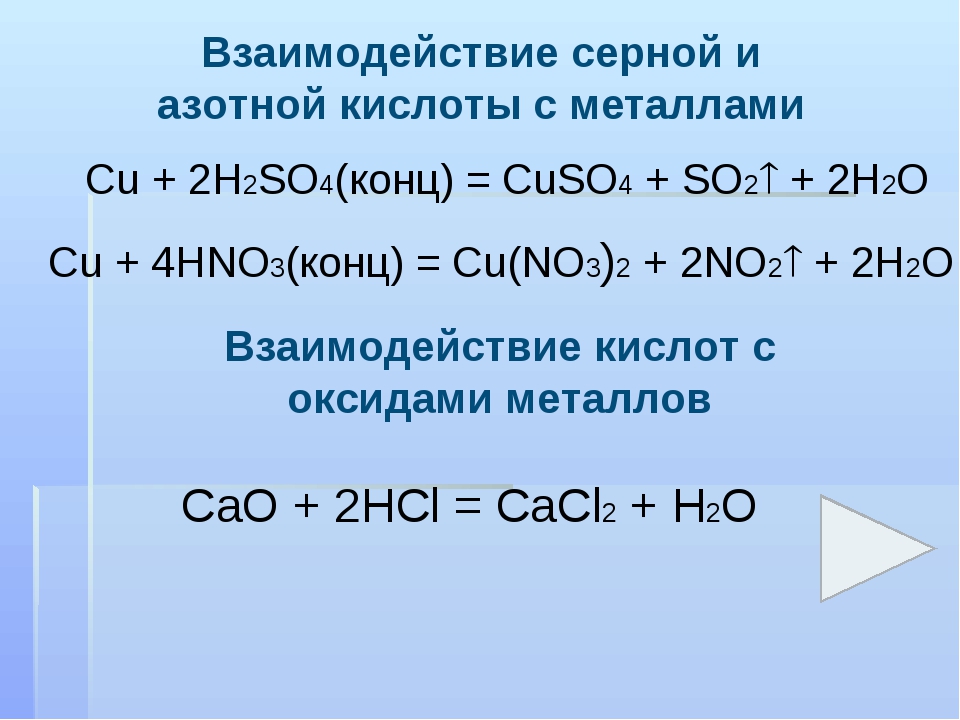 227]
227]
Рассматриваемые металлы тугоплавки и высокостойки к химическим воздействиям лишь при высокой температуре, когда разрушается защитная оксидная пленка, они взаимодействуют с кислородом, углеродом, галогенами и другими неметаллами. Оксидная защитная пленка настолько устойчива, что металлы не поддаются действию кислот, ванадий окисляется лишь азотной кислотой. С водными растворами щелочей не реагируют. В расплавленных щелочах разрушается оксидная пленка, имеющая кислотный характер [c.246]
Азотная кислота обладает сильно выраженными окислительными свойствами. Она окисляет почти все металлы и неметаллы. Образование тех или иных продуктов взаимодействия зависит от концентрации HNO3 и активности простого вещества (стр. 218). HNO3 разрушает животные и растительные ткани. [c.371]
Висмут — типичный металл, сурьма, занимая промежуточное положение в подгруппе между Р, Аз и 81, проявляет свойства как металла, так и неметалла. Постепенная металлизация ог Р к В обусловлена ростом атомного радиуса и снижением энергии ионизации. В ряду Р— 5Ь—В1 восстановительная способность элементов увеличивается. В ряду напряжения рассматриваемые элементы стоят после водорода, поэтому они взаимодействуют только с кислотами — окислителями. Усиление металличности в ряду Р — 5Ь — Ш проявляется и в их реакциях вза-имодействия с азотной кислотой [c.172]
Постепенная металлизация ог Р к В обусловлена ростом атомного радиуса и снижением энергии ионизации. В ряду Р— 5Ь—В1 восстановительная способность элементов увеличивается. В ряду напряжения рассматриваемые элементы стоят после водорода, поэтому они взаимодействуют только с кислотами — окислителями. Усиление металличности в ряду Р — 5Ь — Ш проявляется и в их реакциях вза-имодействия с азотной кислотой [c.172]
В чистом виде марганец — серебристо-белый, твердый, хрупкий металл, по внешности похожий на железо. На воздухе покрывается тонкой окисной пленкой, придающей металлу красноватый оттенок. Пленка предохраняет металл от окисления даже при нагревании его. Разведенные соляная и серная кислоты взаимодействуют с марганцем с выделением водорода и образованием солей двухвалентного марганца (МпС12, Мп504). Азотная и концентрированная серная кислоты, окисляя металл, дают соли, содержащие марганец различных степеней положительной валентности его. При нагревании марганец разлагает воду и реагирует со многими металлами и неметаллами. [c.530]
[c.530]
C чем взаимодействует азотная кислота HNO3. ПОМОГИТЕ!!!!!!!!!
1) Взаимодействие с металлами:
Особенностью данных реакций является то, что в них когда не выделяется водород, а металл в зависимости от активности окисляется с выделением NO или NO2. Выделение газа также зависит от концентрации кислоты.
Концентрированная азотная кислота(>60%) окисляет металлы с выделением NO2. При обычных условиях концентрированная азотная кислота не реагирует с Fe, Al и Cr, металлы пассивируются, т.е. на данных металлах образуется тонкая оксидная пленка, которая затрудняет протекание реакции. Однако при повышение температуры данные реакции возможны.
Fe+ 6HNO3 = Fe(NO3)3+3NO2+3h3O
Ag+2HNO3 = AgNO3+NO2+h3O
Азотная кислота с концентрацией меньше 60% окисляет металлы с выделением NO.
3Mg+8HNO3 = 3Mg(NO3)2+2NO+4h3O
Очень разбавленная азотная кислота реагирует с металлами с выделением Nh5NO3
4Zn+10HNO3 = 4Zn(NO3)2+Nh5NO3+3h3O
2) Взаимодействие с оксидами:
Азотная кислота реагирует со всеми основными и амфотерными оксидами с образованием соли и воды
CuO+2HNO3 = Cu(NO3)2+h3O
Al2O3+6HNO3 = 2Al(NO3)3+3h3O
3) Взаимодействие с основаниями:
Азотная кислота являясь минеральной кислотой реагирует со всеми основаниями.
Fe(OH)3+3HNO3 = Fe(NO3)3+3h3O
Nh4∙h3O+HNO3 = h3O+Nh5NO3
В реакциях с аммиаком образует соли аммония:
Nh4+HNO3 = Nh5NO3
Азотная кислота обладает специфическими свойствами, которые присущи только ей.
1) Разложение при повышение температуры:
4HNO3 = 4NO2+O2+2h3O
Данная реакция является обратимой.
2) Окисление неметаллов:
4HNO3(к)+C = CO2+2h3O+4NO2
5HNO3(к)+P = h4PO4+5NO2+h3O
5HNO3(р)+P = h4PO4+5NO+2h3O
Данные реакции протекают при повышении температуры.
3) Окисление сложных веществ:
FeS+10HNO3(к) = Fe(NO3)3+SO2+7NO2+5h3O
FeO+4HNO3(к) = Fe(NO3)3+NO2+2h3O
Азотная кислота — Кислородные соединения азота и фосфора — Подгруппа азота и фосфора — Неорганическая химия
10 января 2007
Азотная кислота HNO3 в чистом виде – бесцветная жидкость с резким удушливым запахом. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет:
4НNО3 = 4NО2 + 2Н2О + О2.
Азотная кислота принадлежит к числу наиболее сильных кислот и для нее характерны все реакции, в которые вступают кислоты, – с основаниями, основными оксидами и т.д.
Специфическим же свойством азотной кислоты является ее ярко выраженная окислительная способность. Сущность окисления различных веществ азотной кислотой заключается в том, что ион NО3 , имеющий в своем составе азот в степени окисления +5, в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) может принимать от одного до восьми электронов. Восстановление аниона NО3– в связи с этим может протекать до различных веществ:
NO3– + 2H+ + 1e → NO2 + H2O, (1)
NO3– + 4H+ + 3e → NO + 2H2O, (2)
2NO3– + 10H+ + 8e → N2O + 5H2O, (3)
2NO3– + 12H+ + 10e → N2 + 6H2O, (4)
NO3– + 10H+ + 8e → NH4+ + 3H2O. (5)
(5)
При прочих равных условиях образование тех или иных продуктов восстановления азотной кислоты зависит от концентрации. Азотная кислота обладает окислительной способностью при любой концентрации, при этом, однако, чем концентрированнее НNО3, тем менее глубоко она восстанавливается.
С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме (1) с выделением NО2; если НNО3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2)-(5), в зависимости от степени разбавления.
Азотная кислота взаимодействует со всеми металлами, за исключением Аu, Рt, W. Концентрированная НNО3 не взаимодействует при обычных условиях также с Fе, Аl и Сr, которые она пассивирует, однако при очень сильном нагревании НNО3 взаимодействует и с этими металлами.
Большинство неметаллов и сложных веществ восстанавливают HNO3, как правило, до NO (реже до NО2):
ЗР + НNО3 + 2Н2О = 3Н3РО4 + NО,
S + 2НNО3 = Н2SО4 + 2NО,
3C + 4НNО3 = 3СО2 + 4NО + 2Н2О,
ZnS + 8НNО3(конц) = ZnSО4 + 8NО2 + 4Н2O,
6НCl + 2НNO3(конц) = 3Сl2 + 2NО + 4Н2О. (6) .
(6) .
С помощью концентрированной Н/>NО3 можно растворить даже золото. Для этого нужно взять смесь из одного объема концентрированной НNО3 и трех объемов концентрированной соляной кислоты (такую смесь называют царской водкой):
Аu + НNО3 + 4НСl = Н[АuСl4] + NO + 2Н2О.
Действие царской водки объясняется тем, что концентрированная НNО3 окисляет НСl по реакции (6) до свободного хлора, который в момент выделения является очень сильным окислителем. Поэтому при растворении металлов в царской водке получаются не соли азотной кислоты, а соответствующие хлориды.
Урок 15. азотная кислота. строение молекулы. свойства разбавленной и концентрированной азотной кислоты. соли азотной кислоты. азотные удобрения. — Химия — 9 класс
Конспект
Азотная кислота имеет формулу HNO3. Азотная кислота – бесцветная дымящая жидкость с резким запахом.
Азотная кислота – бесцветная дымящая жидкость с резким запахом.
В водных растворах диссоциирует. Разбавленная азотная кислота обладает всеми типичными свойствами кислот.
Концентрированная и разбавленная азотная кислота являются сильными окислителями, поэтому по-особому реагируют с металлами. При взаимодействии разбавленной азотной кислоты с активными металлами (стоящими в ряду напряжений до цинка) преимущественно образуются аммиак (или соль аммония), нитрат металла и вода. Степень окисления азота при этом понижается с +5 до -3. При взаимодействии разбавленной азотной кислоты с другими металлами преимущественно образуются оксид азота два, нитрат металла и вода. Степень окисления азота при этом понижается с +5 до +2. Также, в некоторых случаях может образовываться азот. Например, при взаимодействии магния с разбавленной азотной кислотой образуются: нитрат магния, аммиак и вода, а при взаимодействии меди с разбавленной азотной кислотой образуются: нитрат меди (II), моноксид азота и вода.
Получают азотную кислоту в три стадии:
1. Каталитическое окисление аммиака
2. Окисление моноксида азота в диоксид
3. Растворение диоксида азота в воде с одновременным окислением кислородом
Соли азотной кислоты – нитраты – твердые, кристаллические вещества.
Помимо общих свойств солей обладают специфическим свойством – способностью разлагаться при нагревании. Продукты разложения зависят от металла, входящего в состав соли.
Некоторые соли азотной кислоты называют селитрами, например, нитрат натрия – натриевая селитра. Многие селитры используются в качестве азотсодержащих удобрений для повышения урожайности сельхозхозяйственных культур.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Составление уравнений и расчет электродвижущей силы окислительно-восстановительной реакции
Реакции металлов в азотной кислоте: написание уравнений и расчет
Электродвижущая сила окислительно-восстановительной реакции
Альгирдас Сульциус *
Кафедра физической и неорганической химии, Каунасский технологический университет пл. 19, Каунас LT-50270, Литва
*
SS Дополнительная информация
РЕЗЮМЕ: В этом письме редактору дается комментарий к статье «Запись реакций металлов с азотной кислотой: мнемонический прибор
для студентов начального курса химии».
КЛЮЧЕВЫЕ СЛОВА: высшая школа / вводная химия, неорганическая химия, мнемоника / механическое обучение, кислоты / основания, металлы,
окисление / восстановление, реакции
Я с интересом прочитал подготовленное сообщение Михаила
Курушкина, опубликованное в этом журнале.
1
В этом сообщении
,
1
были изучены только два фактора, влияющие на состав продуктов реакции
: а именно: (i) активность металла
и (ii) концентрация кислоты.Кинетика реакции металлов в азотной кислоте
и, возможно, возможность образования различных газообразных продуктов реакции
(N2O, N2, NO, NO2, NH
3,
2
и
h3,
3
) также зависят от формы металла; например, кусок тонкой проволоки или порошка
. В окислительно-восстановительных реакциях металлов с кислотой
изменяется концентрация кислоты и температура. Следует учесть, что скорость реакции
также определяется трудностью образования газовой фазы и растворимостью
газа (N2, N
2O, NO, NO2, NH
3 незначительно растворим в воде)
в растворе кислоты.Для целеустремленных студентов-химиков
важно не только написать уравнения реакций металлов с
азотной кислотой различной концентрации, но и рассчитать их электродвижущую силу (ЭДС)
, указав наиболее «термодинамические».
4
реакции, и используйте полученное значение для выбора
преобладающего газообразного продукта.
В сообщении
1
кадмий был выбран в качестве отправной точки
: все металлы выше Cd в типичном ряду активности (Eo
= −0.40 В) считаются реактивными; все металлы ниже и
, включая Cd, считаются менее химически активными. В данной работе
металлов разделены на две группы на основе значения
их стандартного потенциала Eo
5,6
в типичном ряду активности:
химически активных
металлов с Eo> 0 и менее Кислота азотная
также была разделена на три группы: очень разбавленная кислота
с концентрацией менее 5%, разбавленная кислота с концентрацией 5-
20% и концентрированная кислота 60-70%.
Ниже предлагаются две мнемонические схемы (рис. 1), аналогичные
правилу левой руки Флеминга и правилу правой руки
7
.
Мнемонические схемы имеют один (рисунок 1A) или два
(рисунок 1B) входов и пять выходов для каждого пальца; газообразные продукты
перечислены по часовой стрелке в сторону увеличения степени окисления азота
. Согласно литературным данным
8,9
,
N2O образуется в реакциях Fe и Al в разбавленной азотной кислоте;
, следовательно, этот газ также показан на рисунке 1А.Когда Mn и
Mg реагируют с 10-20% HNO3, газовая смесь (h3, N
2,
N2O, NO), содержащая примерно 80% h3,
8
образует
(см. Дополнительная информация.)
Чтобы определить наиболее «термодинамически благоприятную» реакцию
4
, необходимо рассчитать ЭДС Eo всех возможных
реакций. Следовательно, записываются уравнения возможных окислительно-восстановительных реакций
, как показано в примере для металлического Ni:
+ ⎯ → ⎯⎯⎯ + Ni (s) 2HNO (водн.) Ni (NO) (водн.) H (г)
разбавленный
3322
(a)
Дата публикации: 17 сентября 2015 г.
Рисунок 1.Предлагаемые мнемонические схемы указывают на восстановление продукта
в азотной кислоте. (A) Левая схема для химически активных металлов в разбавленной азотной кислоте
; (B) правая схема для менее химически активных металлов в разбавленной и концентрированной азотной кислоте
и для химически активных металлов в концентрированной азотной кислоте
.
Письмо
pubs.acs.org/jchemeduc
© 2015 American Chemical Society и
Division of Chemical Education, Inc. 1971 DOI: 10.1021 / acs.jchemed.5b00328
J. Chem. Educ. 2015, 92, 1971−1972
Азотная кислота — обзор
2.29.3.3 Растворы азотной кислоты
Растворы азотной кислоты используются при переработке ядерного топлива за счет способности урана и плутония образовывать нитратные комплексы, растворяющиеся в нуклеофильных растворителях. такой как три- n -бутилфосфат. Нержавеющие стали, в основном аустенитные марки, обычно используются при строительстве перерабатывающих заводов и являются либо пассивными, либо подвержены межкристаллитной коррозии (что приводит к опаданию зерна и, следовательно, к общим потерям, а не к растрескиванию), в зависимости от окислительной способности раствора, которая является сильно увеличивается при высоких температурах (> 70 ° C) и в присутствии некоторых растворенных веществ, которые действуют как окислители.Более подробное описание дается в другом месте (см. Глава 2.24 , Коррозия в азотной кислоте ).
Радиолиз водной азотной кислоты и нейтральных нитратных растворов дает нитрит-ион в качестве основного растворенного продукта 30 вместе с различными количествами перекиси водорода, в зависимости от кислотности, поскольку азотистая кислота окисляется перекисью водорода ( по крайней мере, при комнатной температуре; в горячих растворах азотной кислоты перекись водорода разлагается с образованием газов NO x , что свидетельствует о восстановлении нитрат-иона, то есть обращении окислительно-восстановительной пары).Схемы реакций сложны, включают в себя различные связанные химические реакции, а также радиолитические реакции, и выходы сильно зависят от ЛПЭ излучения. 30
Присутствие азотистой кислоты в значительных концентрациях значительно изменяет коррозионное поведение азотной кислоты, причем общий эффект зависит от обстоятельств. В чистых водных растворах азотной кислоты азотистая кислота катализирует восстановление нитратов и, следовательно, действует, повышая потенциал коррозии нержавеющей стали, немного увеличивая ее скорость коррозии, если температура достаточно высока для поддержки межкристаллитной коррозии, даже если окислительно-восстановительный потенциал раствор падает, так как азотистая кислота является менее окисляющей, чем азотная кислота (см. Рисунок 12 в Глава 2.24 , Коррозия в азотной кислоте ). В более сложных растворах, содержащих определенные растворенные частицы, такие как Cr (VI) и Ce (IV), эффект производства азотистой кислоты может быть значительным, резко снижая скорость коррозии, если происходит полное восстановление до Cr (III) и Ce (III). , так как потенциал коррозии снова становится пассивным. 31 В таких растворах потенциал коррозии и, следовательно, достигаемая скорость коррозии зависят от общего окислительно-восстановительного баланса; преобладает ли окисление кислотой или восстановление под действием облучения, зависит от концентрации и температуры азотной кислоты, увеличение любой из которых способствует окислению, и мощности дозы облучения, увеличение которой способствует снижению.
Поскольку на коррозионную стойкость металлов, таких как цирконий и тантал, не влияют окисляющие вещества в растворе, эффект радиолиза не проявляется. О влиянии радиолиза на коррозионную стойкость титана не сообщалось, хотя можно было бы ожидать отрицательного эффекта, если бы для поддержания пассивности полагались на окисляющие ионы, а не на растворенные ионы титана (см. Глава 2.24 , Коррозия в Азотная кислота ).
Реакции с азотной кислотой | HNO3
Азотная кислота — сильная кислота и реагирует
по-разному как окислитель,
окисляющая кислота и многое другое с элементами и соединениями.
Его реакции зависят от концентрации раствора азотной кислоты. вы увидите много реакций
HNO 3 в этом руководстве.
Вы должны быть осторожны при использовании азотной кислоты, потому что это очень
опасная кислота, потому что она может нанести вред людям.
Типы реакций с азотной кислотой
- может реагировать как кислота — выделять газообразный водород
- может реагировать как окисляющая кислота — нитрат-ион восстанавливается до
соединения с более низкой степенью окисления - реагирует с металлами, неметаллами
Какие реакции азотной кислоты можно показать, объясните на атомной шкале азота, кислорода и водорода.
Как кислота,
Из-за выделения в воду ионов H + азотная кислота проявляет кислотные свойства и имеет низкие значения pH.
в водных растворах. Таким образом, азотная кислота может выделять газообразный водород вместе с металлами. Но из-за окисляющей кислоты
По характеристикам, эта типичная реакция кислота-металл может отличаться от других реакций кислота-металл.
В следующих разделах вы узнаете об этих реакциях азотной кислоты.
2H + + 2e → H 2
В качестве окислителя
Азот находится в степени окисления +5 в азотной кислоте, поэтому атом азота может восстанавливаться до более низких степеней окисления и вести себя как
окислитель.
Cu + HNO 3 → Cu (NO 3 ) 2 + NO 2 + H 2 O
ИЛИ
Cu + HNO 3 → Cu (NO 3 ) 2 + NO + H 2 O
Поведение в качестве окислителя будет зависеть от концентрации азотной кислоты.(В зависимости от концентрации дайте разные
продукты)
Азотная кислота — неорганическое соединение. Но он также реагирует с
органические соединения.
Металлы и реакция разбавленной азотной кислоты
Разбавленная азотная кислота действует как обычная кислота, когда реагирует с химически активными металлами, такими как натрий, магний, цинк и другие. Но азотная
кислота ведет себя иначе (как окисляющая кислота) с менее химически активными металлами, такими как медь, серебро.
Реакция магния и азотной кислоты
Разбавленная азотная кислота реагирует с магнием с образованием нитрата магния и газообразного водорода.
Mg + HNO
3 → Mg (NO 3 ) 2 + H 2
Как разбавленная, так и концентрированная азотная кислота может действовать как окисляющая кислота.
Дегидратация азотной кислоты
Обезвоживание — это удаление воды, простое объяснение.Пятиокись азота (N 2 O 5 ) представляет собой ангидрид азотной кислоты,
из которого его можно приготовить дегидратацией азотной кислоты при низких температурах.
Степень окисления азота защищена в этой реакции.
Реакция серы и горячей концентрированной азотной кислоты
Сера окисляется до серной кислоты (H 2 SO 4 ), а азотная кислота восстанавливается до диоксида азота (NO 2 ).
Эта реакция является примером окислительной способности азотной кислоты.
Степень окисления серы увеличивается с 0 до +6, а азота уменьшается с +5 до +4. Двуокись азота — это газ коричневого цвета, который вы можете видеть
из реакционной смеси выделяется газ коричневого цвета. Сера представляет собой твердое вещество желто-белого цвета.
Сульфиды и азотная кислота
Сульфид-ион
окисляются до
сульфат-ион концентрированной азотной кислотой. Азотная кислота восстанавливается до оксида азота (NO).
Реакция сульфида цинка и азотной кислоты
Сульфид-ион окисляется до сульфат-иона.Таким образом, белый осадок ZnS исчезает, когда реакция завершается, потому что ZnSO 4
растворим в воде.
Царская водка
Смесь, содержащая один объем концентрированной азотной кислоты и три объема концентрированной соляной кислоты , является
известная как царская водка. В царской водке растворяются даже золото и платина.
Реакция меди и азотной кислоты
С медью разбавленная азотная кислота и концентрированная азотная кислота действуют как окисляющая кислота .
В зависимости от концентрации азотной кислоты приведены разные продукты. Если используется разбавленный азот , дается оксид азота (NO).
При концентрации азотной кислоты концентрированной дается диоксид азота (NO 2 ). Медь окисляется до меди (II) как в разбавленном, так и в разбавленном виде.
концентрированная азотная кислота и раствор синего цвета будут даны в обоих случаях.
Cu + разбавленная HNO
3 кислота
Медь окисляется до степени окисления медь +2, а азотная кислота восстанавливается до оксида азота.
Cu + концентрированная HNO
3 кислота
Медь окисляется до степени окисления медь +2, а азотная кислота восстанавливается до диоксида азота (NO 2 ).
Реакция металлического серебра и разбавленной азотной кислоты
Серебро реагирует с разбавленной азотной кислотой с образованием
нитрат серебра (AgNO 3 ), диоксид азота (NO 2 ) и вода в качестве продуктов.
Ag + HNO 3 → AgNO 3 + NO 2 + H 2 O
Реакция олова и азотной кислоты
Олово (Sn) и разбавленная азотная кислота реагируют с образованием Sn (NO 3 ) 2 , NH 4 NO 3 и воды.Вот олово
окислен до степени окисления +2. Нитрат олова растворим в воде.
Реакция свинца и азотной кислоты
Свинец (Pb) и разбавленная азотная кислота реагируют с образованием нитрата свинца (Pb (NO 3 ) 2 ),
№ 2 и вода. Вот свинец
окислен до степени окисления +2. Нитрат свинца растворим в воде.
Реакция горячей концентрированной азотной кислоты и углерода
Углерод (C) и горячая концентрированная азотная кислота реагируют с образованием диоксида углерода (CO 2 ), диоксида азота (NO 2 ).
и вода.Здесь углерод окисляется до степени окисления +4, а степень окисления азота изменяется с +5 на +4.
Реакция азотной кислоты и фосфора
Фосфор реагирует с азотной кислотой с образованием фосфорной кислоты (H 3 PO 4 ), NO 2 и H 2 O.
Это окислительно-восстановительная реакция. Степень окисления атома фосфора увеличена от 0 до +5.
Реакция азотной кислоты и металлического серебра
Серебро реагирует с азотной кислотой с образованием нитрата серебра (AgNO 3 ), NO 2 и H 2 O.Серебро окисляется до
+1 степень окисления.
HNO
3 реакция с водой
HNO 3 кислота полностью диссоциирует в воде и высвобождает ион гидроксония (H 3 O + ) в воде с образованием водного раствора сильной кислоты.
Реакция азотной кислоты и сероводорода
Сера и оксид азота (NO) образуются в результате реакции сероводорода и оксида азота. В присутствии
избыток азотной кислоты, сера может быть
окисляется до диоксида серы, кроме того.
Разложение азотной кислоты
В лаборатории иногда можно увидеть коричневый цвет в бутылках с азотной кислотой.
Азотная кислота разлагается до диоксида азота, газообразного кислорода и воды, когда раствор кислоты HNO 3 нагревается или подвергается воздействию солнечного света.
Вопросы
Задайте свои вопросы по химии и найдите ответы
Почему железо растворяется в HCL лучше, чем HNO3
Согласно некоторым веб-ресурсам в Интернете, они говорят, что использование кислоты HNO 3 может производить газ оксида азота (NO).Газообразный оксид азота можно легко превратить в газообразный диоксид азота. Двуокись азота — токсичный газ. Это происходит потому, что азотная кислота является окисляющей кислотой. Но HCl не является окисляющей кислотой. Таким образом, при взаимодействии железа с HCl кислотой не образуется токсичный газ.
Можете ли вы объяснить реакции, проявляемые азотной кислотой, степенями окисления?
Азот — азот в степени окисления +5. Это максимальная степень окисления азота. Таким образом, атом азота может быть восстановлен до более низких степеней окисления.
Кислород — кислород имеет степень окисления -2 и может быть окислен до более высокой степени окисления.
Водород — Водород имеет степень окисления +1. Таким образом, его можно свести к газообразному водороду.
Чем реакции с азотной кислотой отличаются от реакций с серной кислотой?
Разбавленная азотная кислота может действовать как окисляющая кислота. Но разбавленная серная кислота не проявляет свойств окисляющей кислоты.
Является ли HNO
3 реакциями особенными для менее реакционноспособных металлов, таких как серебро, медь?
Когда HNO 3 реагирует с серебром или медью, атом азота азотной кислоты восстанавливается до оксида азота (NO) или
диоксид азота.
