Содержание
Бинарные соединения – оксиды. Химия. 8 класс. Конспект урока
УМК «Химия. 8 класс» О. С. Габриеляна.
Тип урока: изучение нового материала
Цели:
Образовательные: сформировать понятие «оксид».
Развивающие:
- развивать умение анализировать химические объекты, давать определение понятиям.
- развивать умение проводить самостоятельный поиск химической информации с использованием различных источников.
Воспитывающие: способствовать экологическому воспитанию учащихся, используя приобретенные знания на уроке для оценки влияния химического загрязнения окружающей среды на организм человека и другие объекты.
Задачи (шаги, с помощью которых достигаются цели урока):
- продолжить формирование умения составлять формулы веществ, используя степень окисления, названия веществ.

- закрепить знания химической номенклатуры для бинарных соединений
- показать значение оксидов в природе и жизни человека.
Ход урока
I. Организационный момент
Приветствие учащихся, готовность к уроку.
II. Актуализация знаний, проверка домашнего задания
Самостоятельная работа (10 минут) – 6 вариантов.
Расставить степени окисления в соединениях:
- 1 вариант: Na; K2O; Fe; CaCO3; AlCl3;
- 2 вариант: Li3N; BaSO4; Zn; H2CO3; NH3;
- 3 вариант: OF2; CuSO4; NaOH; O2; SO3;
- 4 вариант: KH; KOH; BaH2; H2O; O3;
- 5 вариант: Cl2O7, KClO , Na2S, MgO, Cu2O, N2;
- 6 вариант: Al2S3, NaH, KNO3, Al, NF3.

III. Новая тема
Демонстрирую: стакан с водой, стакан с песком, образец яшмы, колбу с углекислым газом.
– Что объединяет все эти вещества? (Учащиеся высказывают предположения).
Итак, тема урока: «Оксиды».
На доске написаны формулы оксидов:
CaO
Fe2O3
Na2O
CO2
Учитель предлагает проанализировать эти формулы.
- Найдите что общего во всех этих веществах.
- Простые или сложные?
- Из скольких химических элементов состоят?
- Какой химический элемент входит в состав каждого оксида?
- Составьте общую формулу оксидов.
В ходе анализа справа от формул учитель делает краткую запись на доске, а учащиеся в тетради:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- Дайте определение оксидам (сложные вещества, состоящие из 2 химических элементов, один из которых – кислород).
На доске написаны формулы веществ:
O2, H2SO4, CuO, N2O5, H2O2.
- Какие из предложенных веществ можно отнести к оксидам?
Учащиеся выбирают формулы оксидов, мотивируя свой выбор.
- Можно ли отнести к оксидам H2O2?Чем отличается оно от оксидов?
Учащиеся дают более точное определение оксидам. (Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород со степенью окисления –2). Учащиеся записывают определение в тетрадь.
Номенклатура оксидов:
- Основа латинского названия кислорода + суффикс -ид: оксигениум: окси + ид = оксид.
- Русское название элемента с положительной степенью окисления (“+”) в родительном падеже.
- (Римская цифра переменной степени окисления.)
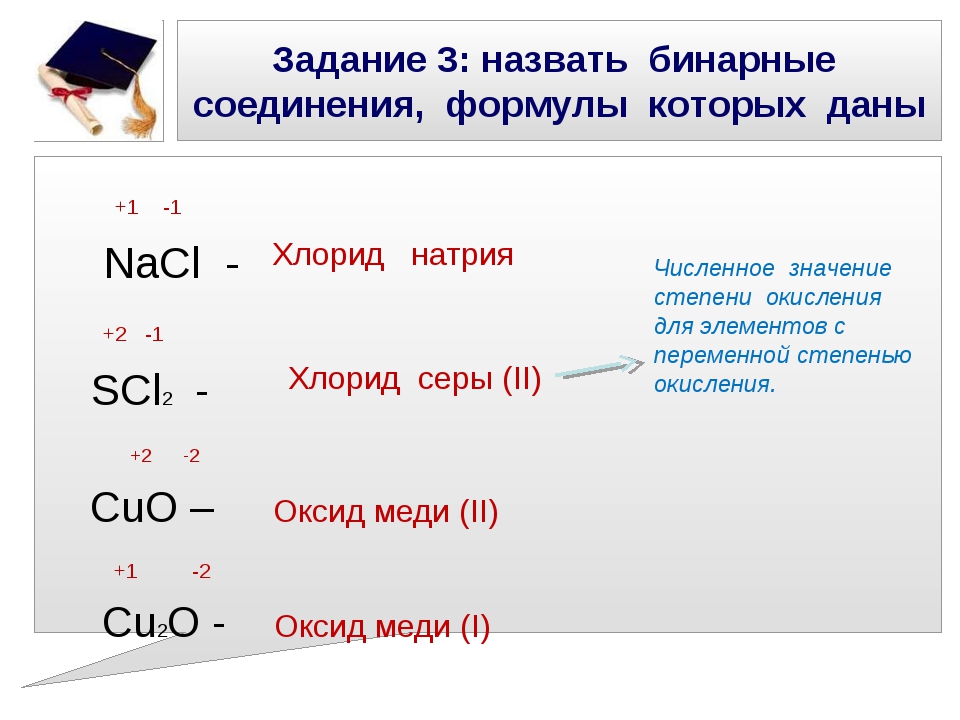
Пример: Al+32O-23 – оксид алюминия; Cu+2O–2 – оксид меди (II).
Учащиеся записывают алгоритм в тетрадь.
- Многие оксиды встречаются в природе в виде полезных ископаемых, они находятся в окружающем нас воздухе, образуются в результате деятельности человека. Сейчас вы познакомитесь с образцами оксидов.
Н2О – вода — оксид водорода.
Al2О3 – оксид алюминия – глинозём.
SiO2 – Кварц, кремнезём, речной песок, яшма – оксид кремния.
СаО – оксид кальция – негашеная известь.
MnO2 – оксид марганца (IV) – пиролюзит.
MgO – оксид магния – жженая магнезия.
Fe2O3 – оксид железа (III) – красный железняк (гематит).
Те оксиды, с которыми вы познакомились используются человеком в строительстве, для производства металлов, стекла, как поделочные материалы.
IV. Первичное закрепление знаний
Составьте формулы названных в тексте оксидов (одно название оксида – 1 ученик у доски, остальные в тетрадях).
В земной коре – литосфере – находится оксид алюминия ________ (глина), оксид кремния (IV) _____ (песок), оксид железа (III) ______ (содержится в красном железняке). Водная оболочка Земли – гидросфера – оксид водорода _____. В воздухе есть оксид углерода (IV) ______ (углекислый газ). В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу: оксид углерода (II) _____ (угарный газ), оксид серы (IV) ______ (сернистый газ), оксид азота (II) ____ и оксид азота (IV) ______.
Ответ: оксид алюминия – Al2O3, оксид кремния – SiO2, оксид железа (III) – Fe2O3, оксид водорода – Н2О, оксид углерода (IV) – СО2, оксид серы (IV) – SO2, оксид азота (II) – NO, оксид азота (IV) – NO2.
V. Подведение итогов
Мы сегодня научились находить формулы оксидов среди других веществ, называть оксиды и составлять формулы по названиям. Познакомились с отдельными представителями оксидов.
Познакомились с отдельными представителями оксидов.
VI. Домашнее задание
§ 18 упр. 1.
Урок химии в 8 классе «Бинарные соединения»
Муниципальное бюджетное образовательное учреждение
основная общеобразовательная школа №6
урок химии в 8 классе
Важнейшие классы бинарных соединений.
Оксиды и водородные соединения
Подготовила и провела
учитель химии Щетинина И.В
Цель: познакомиться с важнейшими классами бинарных соединений –оксидами и водородными соединениями.
Задачи урока:
Образовательная: сформировать первоначальные знания об оксидах и водородных соединениях, показать значение важнейших представителей в природе и жизни человека;
Развивающая: развивать умение классифицировать оксиды, давать им химические названия, определять степени окисления по формуле, выводить формулы бинарных соединений по степеням окисления элементов;
Воспитательная: умение осуществлять самостоятельную деятельность на уроке,
умения адекватной самооценки и самоконтроля. Воспитывать культуру умственного труда, развивать коммуникативные качества.
Воспитывать культуру умственного труда, развивать коммуникативные качества.
Метапредметные и личностные результаты:
Регулятивные УУД
1. Сформировать умение самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности (формулировка вопроса урока)
2. Сформировать умение в диалоге с учителем совершенствовать самостоятельно выработанные критерии оценки.
Познавательные УУД
1. Сформировать умение владеть смысловым чтением
2. Сформировать умение преобразовывать информацию из одного вида в другой (текст
в таблицу и пр.).
3. Анализировать, сравнивать, классифицировать и обобщать.
Коммуникативные УУД
1. Сформировать умение самостоятельно организовывать учебное взаимодействие в паре.
2. Отстаивая свою точку зрения, приводить аргументы, подтверждая их фактами.
Личностные УУД
Постепенно выстраивать собственное целостное мировоззрение.
2. Осознавать потребность и готовность к самообразованию, в том числе и в рамках самостоятельной деятельности вне школы.
3. Сформировать умение оценивать жизненные ситуации с точки зрения безопасного образа жизни и сохранения здоровья.
компьютер, проектор, газированная вода, минеральная вода, образцы оксидов, нашатырный спирт, соляная кислота, презентация
Учебник по химии 8 класс, О.С. Габриелян.
Тип урока: комбинированный урок (с использованием презентации).
Формы урока: Фронтальная, индивидуальная, парная
Ход урока
Организация начала урока
Включение в деловой ритм. Подготовка класса к работе.
Подготовка к активной учебной деятельности
Какую тему мы начали изучать? («Соединения химических элементов»)
NH3, CaО, KН, FeO, Н2S, Cl2O7, Н2О, NO2, СH4, СaH2, HCl
Перед вами на слайде формулы. Что у них общего? (все они состоят из 2-х элементов)
Что у них общего? (все они состоят из 2-х элементов)
Да, такие соединения называют бинарными.
Вставьте пропущенные слова и сформулируйте определение бинарных соединений
Бинарные соединения – это … вещества, состоящие из … химических элементов
Попробуйте классифицировать все эти вещества на 2 группы. (Выполняют работу)
Сегодня на уроке мы познакомимся с важнейшими классами бинарных соединений.
Учитель: Давайте сформулируем тему урока.
Важнейшие классы бинарных соединений. Оксиды и водородные соединения. Предположите, какие задачи мы должны сегодня решить.
— познакомиться с представителями оксидов и водородных соединений, с физическими свойствами веществ, их значением и для человека;
— показать огромное значение их в природе и в жизни человека;
Изучение нового материала
Учитель: Одним из классов бинарных соединений являются оксиды
Задание 1.Среди перечисленных веществ найдите оксиды:
CaBr2, MgO, P2O5, Na2S, KF, Li2O, OF2, SO3
Почему вы объединили эти соединения в одну группу?
— В состав всех этих соединений входит кислород.
Оксиды –это сложные вещества, состоящие из двух химических элементов, один из которых -кислород в степени окисления -2. Название оксидов состоит из двух слов первое оксид, второе – название химического элемента в родительном падеже, далее указывается в скобках валентность элемента, если она переменна.
Оксиды – широко распространенный в природе класс неорганических соединений. Познакомимся с некоторыми оксидами. К оксидам относиться песок (диоксид кремния с небольшим количеством примесей), глина (оксид алюминия с небольшим количеством примесей, углекислый газ (диоксид углерода), большинство руд металлов содержат оксиды железа красный железняк (Fe2O3), магнетит (Fe3O4)
Оксиды отличаются по агрегатному состоянию: твердые, жидкие, газы.
Ребята, вы знаете, что такое
ГИППОПОТАМОМОНСТРОСЕСКВИППЕДАЛИОФОБИЯ – это страх пред длинными словами или речью.
Какие виды фобии вам известны? (клаустро-, нео-, аэро-,) хемофобия – боязнь химии._17-1200x800.jpg) Это пристальное разглядывание этикеток на продуктах питания Е-360 на баночке с майонезом, разговоры о нитратах в овощах и т.п.
Это пристальное разглядывание этикеток на продуктах питания Е-360 на баночке с майонезом, разговоры о нитратах в овощах и т.п.
В химии много таких слов, и их не надо бояться, потому что они порой означают самые простые вещи.
На слайде слово ДИГИДРОГЕНМОНООКСИД О каком веществе идет речь?
«…, у тебя нет ни запаха, ни вкуса, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое» Антуан де Сент Экзюпери
Учитель: у вас на цветных карточках текст. Прочитав его, вы должны ответить на вопрос: о каком веществе идет речь? ВОДА. И подсказка на слайде. Вода – самое удивительное, самое распространённое вещество на Земле. Сегодня на уроке мы уделим этому веществу большое внимание.
Самостоятельная работа в группах
Сейчас я предлагаю вам поработать в группах.
Работа с учебником: стр. 91-95. Заполните недостающую строчку в таблице, прочитав соответственную информацию в учебнике
Учащиеся в парах работают с текстом учебника, рассматривают образцы оксидов и заполняют таблицу «Важнейшие оксиды в природе и жизни человека”
По ходу заполнения таблицы учитель комментирует и добавляет информацию
Важнейшие оксиды в природе и жизни человека
Названия
Формула
Физические свойства
Применение
Оксид водорода, вода
Н2О
Бесцветная жидкость
Потребление воды человеком: слив воды в туалете, умывание,
стирка, мытье посуды, полив, приготовление пищи, напитков
Оксид углерода
(IV) углекислый газ
СО2
Бесцветный газ
Сухой лед для хранения
мороженого, приготовление
газированных напитков, тушение пожаров
Оксид
алюминия
Al2O3
Твердый, белый
Образует минералы –
рубин, сапфир, корунд, основную массу особых глин –бокситов
Оксид кремния (IV)
SiO2
Твердый
Образует кварц, кварцевый песок,
горный хрусталь, кремнезем, аметист, агат
Оксид кальция,
негашеная известь
CaO
Белое тугоплавкое
Образует гашеную известь, в строительстве для получения вяжущих материалов.
Вода – самое удивительное и самое распространенное, самое необходимое вещество на Земном шаре. Каковы же запасы воды на Земле? (карта). Суша занимает ¼ поверхности Земли, и ¾ — вода. Это воды морей и рек, озер и океанов. 20% суши – льды. Это ледники гор, арктические и антарктические шапки планеты.
Вода является важнейшим ресурсом для поддержания жизни и источником всего живого на Земле, но её неравномерное распределение на континентах не раз становилось причиной кризисов и социальных катастроф. Дефицит пресной питьевой воды в мире знаком человечеству с древнейших времён, и с последнего десятилетия двадцатого века он постоянно рассматривается как одна из глобальных проблем современности. При этом, по мере роста населения нашей планеты, значительно увеличивались масштабы водопотребления, и, соответственно, вододефицита, что впоследствии стало приводить к ухудшающимся условиям жизни и замедлило экономическое развитие стран, испытывающих дефицит.
Углекислый газ. Объёмная доля его в атмосфере – 0.03%. содержание его непостоянно. В городах, особенно вблизи заводов его больше, чем в селах. И в разное время года содержание СО2 неодинаково. Как вы думаете почему?
Объёмная доля его в атмосфере – 0.03%. содержание его непостоянно. В городах, особенно вблизи заводов его больше, чем в селах. И в разное время года содержание СО2 неодинаково. Как вы думаете почему?
Углекислый газ образуется при дыхании живых организмов, сгорании топлива, гниении органических веществ. Он входит в состав вулканических газов, содержится в минеральных водах. Так, в Грузии есть источник Боржоми, в г. Кисловодск – Нарзан, в Липецке тоже есть источник, богатый углекислым газом.
Углекислый газ необходим для поддержания жизни как планеты, так и отдельно взятого организма. СО2 влияет на климат, являясь своеобразным одеялом. Без него невозможен метаболизм: с углекислым газом из организма выходят продукты обмена. А ещё это незаменимый компонент любимых всеми газированных напитков. Именно углекислый газ создаёт игривые пузырьки, щекочущие в носу. При этом для здорового человека он абсолютно безопасен.
Свойства углекислого газа
Лабораторная работа. Получение и определение углекислого газа.
Получение и определение углекислого газа.
Напоминаю вам о технике безопасности. У вас на столах стоят стаканчики с кусочками мрамора. При добавлении к нему раствора соляной кислоты образуется углекислый. Газ, который, как известно не поддерживает горения. Поэтому тлеющая лучина, которую вы внесете в стаканчик потухнет.
Это свойство СО2 используется при тушении пожаров.
При увеличении давления до 60 атм. Углекислый газ превращается в бесцветную жидкость, при испарении которой часть его превращается в снегообразную массу – т.н. «сухой лед».
Видео
Ответьте, есть ли на Земле проблемы, связанные с углекислым газом?
В настоящее время проблема парникового эффекта является одним из наиболее глобальных экологических вопросов, стоящих перед человечеством. Суть этого явления состоит в том, что солнечное тепло остается у поверхности нашей планеты в виде оранжерейных газов. Главной причиной парникового эффекта является попадание в атмосферу промышленных газов, один из которых – углекислый.
Оксид кальция (негашеная известь) – белое тугоплавкое вещество, которое энергично взаимодействует с водой (показываю опыт в литровой банке). При добавлении к оксиду кальция воды начинается бурная реакция с выделением большого количества теплоты. Раствор так сильно разогревается, что начинает кипеть. Поэтому называется этот процесс гашение. В результате образуется гашеная известь, из которой делают строительные материалы, обладающие вяжущими свойствами.
Оксид кремния и оксид алюминия образуют основную массу земной коры – литосферу. Эти оксиды входят в состав многих минералов. Из диоксида кремния состоит кварц, горный хрусталь – разновидность кварца, кварцевый песок. Из оксида алюминия состоят драгоценные камни, например, корунд и особая разновидность глин – бокситы.
Можно рассказать об оксиде хрома три, оксиде цинка.
Водородные соединения в природе и жизни человека
Сообщения учащихся: «Сероводород», «Аммиак», «Хлороводород»
Составьте и заполните таблицу “Водородные соединения”
Сероводород
Н2S
Газ с резким
неприятным запахом, немного растворим в воде
Получение сероводородной
кислоты
Хлороводород
НСl
Бесцветный газ,
тяжелее воздуха,
растворим в воде
Образует соляную
кислоту. В желудочном соке (барьер для
В желудочном соке (барьер для
микробов)
Аммиак
Nh4
Бесцветный газ,
резкий запах, легче
воздуха, растворим в
воде
Для получения нашатырного
спирта (в медицине), удобрений
Гидрид натрия
NaH
Бесцветный, твердый,
нелетучий, тугоплавкий
Получение водорода, осушитель газов и жидкостей
Гидрид кальция
Cah3
Белый, твердый, нелетучий,
тугоплавкий
Очистка железа от магнетита
Физкультминутка
Закрепление знаний
Впишите вместо пропусков формулы
1 вариант.
В земной коре -литосфере находится оксид алюминия ______ (глина),
оксид кремния ________ (песок),
оксид железа(III) _______ (красный железняк).
Впишите вместо пропусков формулы
2 вариант.
В результате хозяйственной деятельности человека образуются вещества загрязняющие атмосферу: оксид углерода(II) _________ (угарный газ),
оксид серы(IV) _______ , оксид азота(IV) _________ .
Если останется время можно выполнить в РТ №2 стр.80
Внимание, черный ящик!! Вопрос:
ЧТО ПРОДАЕТСЯ ПОД ХИМИЧЕСКИМ НАЗВАНИЕМ: ОКСИД ВОДОРОДА c ОКСИДОМ УГЛЕРОДА (IV)?
Домашнее задание §19
Составить кроссворд из 7 слов по теме урока и оформить на отдельном листе
Рефлексия
Итоги урока
Объявляются оценки за урок отвечавшим ученикам, выражается благодарность всем за работу на уроке
Сероводород (H2S )– бесцветный газ с запахом тухлых яиц. Он хорошо растворяется в воде. Сероводород – очень ядовитый газ, который неблагоприятно действует на нервную систему.
Сероводород встречается в вулканических газах, а также в воде некоторых минеральных источников – Пятигорска и Мацесты (на Кавказе), Любеня-Великого (Львовская область) и др. Природные сероводородные воды используются для лечения.
Сероводород всегда образуется при гниении остатков растительных и животных организмов и разложении других органических веществ, в которые входит сера. Поэтому неприятный запах сероводорода распространяется от выгребных ям, сточных вод и особенно от тухлых яиц. Но в больших количествах в природе сероводород не накапливается, потому что он легко окисляется кислородом воздуха и разлагается.
Поэтому неприятный запах сероводорода распространяется от выгребных ям, сточных вод и особенно от тухлых яиц. Но в больших количествах в природе сероводород не накапливается, потому что он легко окисляется кислородом воздуха и разлагается.
Сероводород применяют для получения серной кислоты, её солей элементной серы.
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
Хлороводород — НСl Бесцветный газ, тяжелее воздуха, хорошо растворим в воде 1V воды на 500V НСl-соляная кислота, которая находясь в желудке создает «барьер» микробам. Водный раствор широко используется для получения очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамата натрия, соды.
Аммиак (NH3) – неорганическая соединение, бесцветный газ с резким удушливым запахом, легче воздуха, хорошо растворим в воде.
Используют преимущественно для производства азотных удобрений, взрывчатых веществ и азотной кислоты. Жидкий аммиак используется в холодильных установках. Водный раствора аммиака (нашатырный спирт) применяется в медицине. Аммиак — один из важнейших продуктов современной химической промышленности. Как восстановитель используется в красках для волос.
Нашатырный спирт дают понюхать, когда человек находится в предобморочном состоянии, т. е. когда он еще в сознании и присутствует защитная реакция (он «отпрянет» от ваты с нашатырем). При настоящем обмороке сознание отсутствует и вы можете невольно вызвать у него ожог слизистых.
Механизм действия. Вдыхание паров нашатырного спирта вызывает мощное неприятное раздражение нервных рецепторов слизистых оболочек верхних дыхательных путей. Это, в свою очередь, способно почти мгновенно пробудить человека во время естественного сна и привести его в чувство при внезапной потере сознания при обмороке. Однако подобное «оживляющее» действие препарата проявляется не всегда, а только при условии сохранения рефлекторной проводимости (грубо говоря, нервной проводимости) от слизистой поверхности верхних дыхательных путей к головному мозгу, а также при способности мозга ожить в ответ на получение им такого нервного сигнала. Итак, в случаях, когда рефлекторное возбуждение головного мозга со стороны верхних дыхательных путей невозможно, «оживлять» человека посредством нашатыря бессмысленно.
Итак, в случаях, когда рефлекторное возбуждение головного мозга со стороны верхних дыхательных путей невозможно, «оживлять» человека посредством нашатыря бессмысленно.
«Бинарные соединения». УМК О.С. Габриелян, 8-й класс
Тип урока: комбинированный урок
Оборудование:
периодическая таблица химических элементов
Д.И. Менделеева;
карточки с алгоритмом “Составление формул”
(одна на парту) приложение № 1;
компьютер и мультимедийный проектор,
презентация приложение № 2.
Цель: знакомство с понятием “бинарные
соединения”, формирование принципа
номенклатуры бинарных соединений, определение
понятий: оксид, сульфид, гидрид, галогенид,
нитрид.
Задачи.
Предметные:
— создать условия для формирования понятия
“бинарные соединения”, виды бинарных
соединений: “оксиды”, “сульфиды”, нитриды”,
“карбиды”, “гидриды”; химической грамотности в
составлении формул веществ, использования
приобретённых знаний в практической
деятельности и повседневной жизни человека.
Метапредметные:
— содействовать в формировании умения работать
с информацией, преобразовывать информацию из
Периодической таблицы Д.И. Менделеева в данные
для составления формул;
— анализировать, сравнивать и выявлять сходства
и различия;
— выстраивать устные и письменные
высказывания;
— развивать коммуникативные способности
учащихся (умение вести диалог и монолог, слушать
высказывания других учеников).
Личностные:
создать условия для формирования культуры
умственного труда, адекватной самооценки
деятельности.
Планируемые результаты обучения.
Личностные:
Участие в формировании критически и адекватно
мыслящей личности, способной сформулировать
свою точку зрения.
Метапредметные:
Создание условий для анализа и сравнения
информации, содержащей химические формулы,
способствование умению формулировать
высказывания, устанавливать
причинно-следственные связи “степень окисления
– состав вещества”, формулировать выводы.
Предметные:
Формирование понятий “бинарные соединения”,
“оксиды”, “сульфиды”, нитриды”, “карбиды”,
“гидриды”; развитие навыка составления формул
по степени окисления.
Методические рекомендации:
При проведении урока, возможно, выдавать жетоны
за верные ответы. Тогда при подведении итогов
урока и выставлении отметок использовать другую
градацию (если выдавать жетоны и за все устные
ответы и все письменные задания). Слайд №9 можно
скрыть, но если ученики затрудняются в устных
названиях веществ можно содержимое обсудить еще
раз. (Это материал из предыдущего урока)
Характеристика этапов урока
| Этапы урока | Деятельность | |
| Учителя | Учеников | |
| Организационный этап | Приветствие учеников. | Приветствие учителя. |
| Актуализация знаний | Формулировка задания для
анализа содержимого слайда №2. (Формулы бинарных соединений) Проанализируйте формулы веществ и
Эти вещества и являются предметом для изучения. | Проводят анализ формул и находят
общий признак. Состоят из двух элементов
|
| Постановка цели и задач
урока. Мотивация учебной деятельности учащихся | Формулировка задания для
постановки цели. Используя материал прошлого
| Формулируют тему урока “Бинарные
соединения” (запись в тетрадь).  — Состав,
Задачи: научиться записывать формулы веществ и
|
| Слайд № 3. Задание: “Дайте
| Проводят анализ формул и находят
общий признак. Это бинарные соединения, один
(Предполагаемый ответ учеников) | |
| Эти соединения называются
оксиды. | Самостоятельно формулируют
определение оксидов. (Запись определения оксидов) | |
| Задание: “Сравните формулы
оксидов и найдите различие в составе”. Мотивируйте свой ответ ? — На какие группы
Прочитайте формулы, дайте название веществам.
? – Какое слово повторяется при названии
(Оксид)
Учитель поясняет принцип построения названий
Латинский корень + ИД (чего?) русское название
| Сравнивают состав и делают
вывод: Представлены оксиды, образованные металлами и неметаллами. Запись в тетрадях:
Классификация оксидов по составу: оксиды
(Слайд № 4)
Читают формулы, дают название.
Самостоятельно формулируют принцип в названии
| |
| Первичное усвоение новых знаний. | Задание: “Составить формулы
водорода и следующих металлов лития, магния, алюминия” Самопроверка “ Формулы на слайде 5”
Для тех, кто ошибся взять “Алгоритм
Все, кто составил верно формулы, ставят на полях
| Составление формул и запись в
тетрадь: LiH, MgH2, AlH3 Самостоятельная
|
| Первичная проверка понимания | Задание: “Составить формулу
бинарного соединения водорода и азота” (см. приложение №1) Самопроверка “Слайд № 5”
Все, кто составил верно формулу, поставить на
| Решить проблему: “Какой элемент
записать на первом месте: азот или водород”. Верный
Самостоятельная проверка и выставление баллов
|
| Первичное закрепление | Задание: “Составить формулы
бинарных соединений водорода и следующих элементов: углерода, серы, хлора” Все, кто
Самопроверка “Слайд № 5” | Запись формул: H4C, H2S,
HCl Самостоятельная проверка и выставление
|
| Задание: “Найти общее в формулах
водородных соединений, найти отличие” | Классифицируют водородные
соединения по степени окисления водорода на: гидриды и летучие водородные соединения | |
| Задание “Найти общее в формулах
бинарных соединений” Слайд № 6
Слайд №7, 8 | Фронтальная устная работа Запись
| |
| Контроль усвоения, обсуждение
допущенных ошибок и их коррекция | Задание: “Составить формулы
веществ по степени окисления”.  Слайд № 10
Проверять каждую формулу отдельно.
За каждую верно составленную формулу – 1
Максимальное количество баллов за задание — 10 | Составляют формулы и
осуществляют самопроверку. Слайд №10 |
| Информация о домашнем задании,
инструктаж по его выполнения | 1) Выучить номенклатуру бинарных
соединений 2) § 18 | Запись в дневник |
| Рефлексия (подведение итогов
занятия) | Выставление отметок за урок за
устные ответы и комментирование. Ознакомление
Максимальное количество баллов – 17 (за каждую
17-15 баллов – отметка 5
14-12 баллов – отметка 4
11-9 баллов – отметка 3 | Подсчет баллов на полях и
выставление отметок |
Список литературы
1. Программа курса химии для 8-11 классов
Программа курса химии для 8-11 классов
общеобразовательных учреждений, 8-е издание,
стереотипное, М: Дрофа. 2011.
2. Учебник. О.С.Габриелян, Химия. 8 класс. — М.:
“Дрофа”, 2012.
3. Габриелян О.С., Воскобойникова Н П., Яшукова А.
В. Настольная книга учителя. Химия. 8 кл.:
Методическое пособие. — М.: Дрофа, 2007.
4. Габриелян О С., Смирнова Т. В. Изучаем химию в 8
кл.: Дидактические материалы. — М.: Блик плюс, 2004.
5. Габриелян О.С., Яшукова А.В. Рабочая тетрадь. 8
кл. К учебнику О.С. Габриеляна “Химия. 8.” — М.:
Дрофа, 2005-2012.
Приложение 1
Приложение 2
|
№ этапа
|
Работа учителя
|
Работа ученика
|
|
Мотивационный этап
| ||
|
Организационный момент (1 мин)
|
Приветствие учащихся.
|
|
|
Опрос учащихся по ранее изученному материалу (актуализация опорных знаний) (1-2 мин)
|
Учитель: На прошлом уроке мы с вами познакомились с бинарными соединениями. Давайте вспомним, что это же такое (слайд 1)
|
Ученик дает определение бинарных соединений. Бинарные соединения – это сложные вещества, состоящие из двух химических элементов.
|
|
Этап целеполагания, постановка задач урока (4-5мин)
|
Учитель: Посмотрите внимательно на формулы следующих бинарных соединений: CO, CaO, CO2, Na2O, SO2, SO3 (слайд 2). Что общего вы заметили в этих соединениях? К какому классу соединений они относятся?
Учитель: Посмотрите теперь внимательно на формулы следующих бинарных соединений: NaH, HCl, CaH2 (слайд 3).
(водородные соединения)
Учитель: Давайте сформулируем тему нашего сегодняшнего занятия.
Учитель: Запишем тему урока «Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения» (слайд 4)
Учитель: Давайте теперь сформулируем цель нашего сегодняшнего занятия (слайд 5)
Учитель: у каждого из вас на столе есть «лестница успеха» из 5 ступеней, отметьте галочкой ту ступень, на которой вы сейчас находитесь по данной теме (слайд 6)
|
Учащиеся делают предположение, что это формулы сложных веществ, состоят из двух элементов, один элемент – кислород, степень окисление кислорода -2. (оксиды)
Учащиеся делают предположение, что это формулы сложных веществ, состоят из двух элементов, один элемент – водород.
Учащиеся формулируют тему урока: «оксиды и водородные соединения»
Записывают тему в тетрадь.
Учащиеся: познакомиться с важнейшими бинарными соединениями – оксидами и летучими водородными соединениями, научится по формуле называть вещества, составлять формулы веществ по названию.
Ученики работают с «лестницей успеха»
|
|
Операционный этап
| ||
|
Этап усвоения новых знаний (5 мин)
|
Учитель: мы выделили главные признаки оксидов, давайте запишем это определение в тетрадь.
Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород со степенью окисления -2 (слайд 7)
Вернемся к ряду оксидов (слайд 8). Учитель: Посмотрите внимательно на оксиды, как вы думаете на какие 2 группы и по какому признаку можно разделить эти оксиды?
Учитель: Давайте попробуем назвать эти вещества (слайд 9):
Оксид + элемент(а)
Учитель: у нас получились 2 оксида углерода и 2 оксида серы.
Если элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой.
Учитель: Вернемся теперь к ряду водородных соединений (слайд 10). Посмотрите внимательно на водородные соединения, как вы думаете на какие 2 группы и по какому признаку можно разделить эти водородные соединения.
Учитель: водородные соединения металлов называют – гидриды.
Давайте попробуем назвать эти вещества (слайд 11):
НеМе + водород = летучее водородное соединение
Активный Ме + водород = гидрид.
|
Ученики записывают определение в тетрадь.
Учащиеся отвечают, что можно разделить на 2 группы — оксиды металлов и неметаллов.
Учащиеся совместно с учителем дают названия веществ:
CO – оксид углерода (II),
CaO – оксид кальция
CO2 – оксид углерода (IV),
Na2O – оксид натрия,
SO2 – оксид серы (IV)
SO3 – оксид серы (VI)
Учащиеся отмечают, что в этих оксидах элементы проявляют разную степень окисления.
Учащиеся отвечают, что можно разделить на 2 группы – водородные соединения металлов и неметаллов.
Учащиеся дают названия веществ:
NaH — гидрид натрия
HCl – хлороводород
CaH2 – гидрид кальция
|
|
Этап закрепления новых знаний (13 мин)
|
Учитель: мы с вами узнали, что бывают оксиды металлов и оксиды неметаллов, а водородные соединения можно разделить на летучие водородные соединения и гидриды. Чтобы рассмотреть сходства и различия этих соединений мы заполним с вами общую таблицу (слайд 12) (приложение 1), для этого поработаем в группах (слайд 13). Каждая группа получает пакет с заданием и выполняет свое задание. Группа №1 работает с оксидами металлов, группа №2 работает с оксидами неметаллов, группа №3 работает с гидридами металлов и группа №4 работает с летучими водородными соединениями.
|
Учащиеся в группе получают пакет с заданием, распределяют задания между собой и приступают к выполнению заданий.
|
|
Игровая пауза
(2 мин)
|
Учитель: работа в группах закончена, вы наверно устали и теперь перед тем, как мы начнем проверять вашу работу, я предлагаю вам сделать небольшую разминку. Встаньте, выпрямите спину, возьмите в правую руку розовую карточку, а в левую желтую карточку. Когда на экране появляется формула оксида, поднимаем вверх розовую карточку, если появляется формула водородного соединения, то поднимаем вверх желтую карточку.
|
Учащиеся выполняют разминку.
|
|
Этап первичной проверки понимания нового материала (10 мин)
|
Учитель: теперь давайте проверим работу, которую вы выполняли в группах.
|
Один ученик от группы показывает и комментирует полученный результат. Остальные учащиеся по мере представления информации заполняют общую таблицу
|
|
Этап повторения пройденного материала (3 мин)
|
Учитель: сегодня на уроке мы изучили бинарные соединения, как они называются? Что общего вы заметили в этих соединениях и в чем их различия? Вы наверно заметили, что на столе у меня лежат разные предметы и вещества. В состав всех этих веществ входят разные оксиды (учитель показывает вещества и предметы и рассказывает об их практическом применении)
|
Учащиеся отвечают, что сегодня мы изучили оксиды и водородные соединения. Оксиды состоят из 2-х элементов один из которых кислород, а в водородных соединениях обязательно есть водород.
|
|
Этап обобщения и систематизации новых знаний (2-3 мин).
|
Учитель: теперь проверим, как вы усвоили тему сегодняшнего урока. Для этого каждому из вас предстоит выполнить небольшой тест (приложение 2)
|
Учащиеся выполняют тест.
|
|
Аналитический этап
| ||
|
Этап рефлексии (2-3 мин)
|
Учитель вносит 2 колбы.
Учитель: я предлагаю вам закончить предложения. В одной колбе находятся вопросы, в другой номер группы. Сейчас по очереди вы будете вытаскивать из первой колбы вопрос, а из второй – номер группы, которая будет отвечать на этот вопрос. Затем капитан группы, которая ответила на вопрос, вытаскивает из колбы следующий вопрос и задает его уже другой группе, и так далее.
Учитель: а теперь вернемся к нашей «лестнице успеха». Отметьте на этой лестнице ту ступень, на которой вы сейчас находитесь по данной теме (слайд 15). Поднимите руки, кто поднялся выше, теперь кто остался на том же уровне, кто опустился ниже.
|
Группы по очереди отвечают на вопросы.
|
|
Этап комментирования домашнего задания (1-2 мин)
|
Учитель: сегодня мы с вами изучили важнейшие классы бинарных соединений – оксиды и летучие водородные соединения. Дома вы выполните следующее задание (слайд 16)
1 уровень — прочитать §18 и выполните упр. № 1 п.;
2 уровень — §18, упр. 1 п. + расставить в соединениях с.о.;
3 уровень — §18, упр. 1 письменно + расставить в соединениях с.о. + упр. 3 п..
|
Учащиеся записывают домашнее задание.
|
Формулы бинарных соединений в химии
Определение и формулы бинарных соединений
Их названия образуются от латинского корня названия более электроотрицательного элемента с окончанием –ид и русского названия менее электроотрицательного элемента в родительном падеже, причем в формулах бинарных соединений первым записывается символ менее электроотрицательного элемента. Например, Ag2O – оксид серебра (I), OF2 – фторид кислорода, KBr – бромид калия, Mg3N2 – нитрид магния, CaC2 – карбид кальция (однако названия водородных соединений неметаллов, обладающих свойствами кислот, образуются по правилам, принятым для кислот).
Например, Ag2O – оксид серебра (I), OF2 – фторид кислорода, KBr – бромид калия, Mg3N2 – нитрид магния, CaC2 – карбид кальция (однако названия водородных соединений неметаллов, обладающих свойствами кислот, образуются по правилам, принятым для кислот).
Если менее электроотрицательный элемент может находиться в разных окислительных состояниях, то после его названия в скобках указывают римскими цифрами степень его окисленности. Так, Cu2O – оксид меди (I), CuO – оксид меди (II), CO – оксид углерода (II), CO2 – оксид углерода (IV), SF6 – фторид серы (VI). Можно также вместо степени окисленности указывать с помощью греческих числительных приставок (моно, ди, три, тетра, пента, гекса и т.д.) число атомов более электроотрицательного элемента в формуле соединения: CO–монооксид углерода, CO2 – диоксид углерода, SF6 – гексафторид серы.
Для того, чтобы составить формулу бинарного соединения необходимо соблюдать следующую последовательность действий (рассмотрим подробно на примере оксида железа (III)):
- Изображаем химические знаки элементов, входящих в состав оксида
FeO
- Проставляем над знаком каждого элемента валентность римской цифрой:
FeIIIOII
- Находим наименьшее общее кратное чисел единиц валентностей (II × III) = 6
- Делим наименьшее общее кратное на число единиц валентности каждого элемента в отдельности (полученные частные и будут индексами в формуле)
6 : 2 = 3;
6 : 3 = 2;
Fe2O3.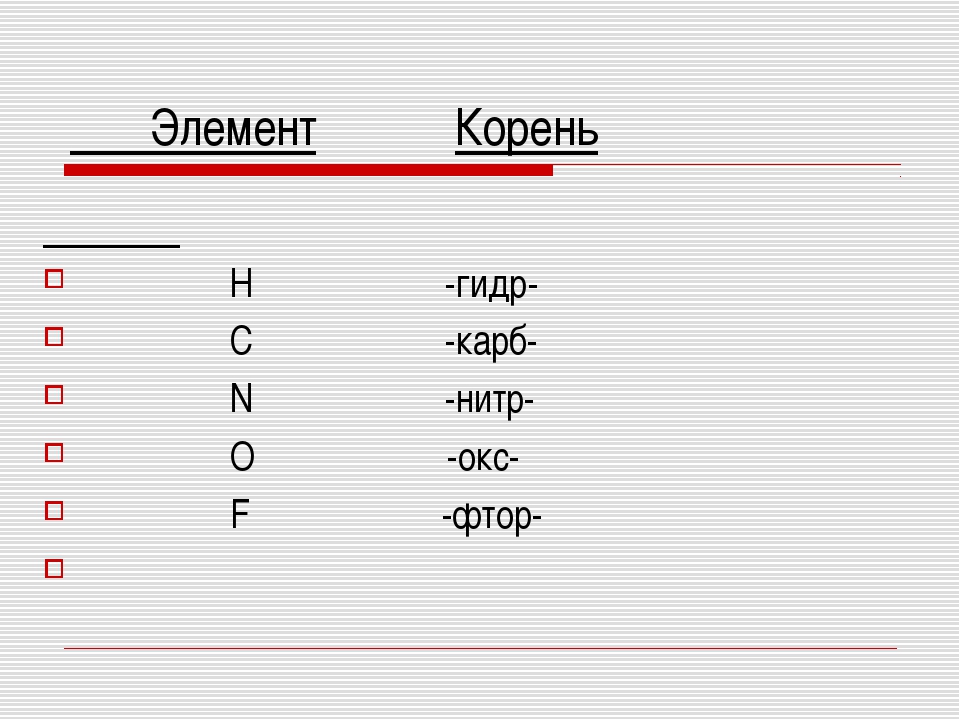
Примеры решения задач
|
Понравился сайт? Расскажи друзьям! |
| ||
| Класс | Название урока | Ссылка на учебные материалы |
| 8 | Предмет химии. Тела и вещества. Основные методы познания. Вводный инструктаж по технике безопасности | https://resh.edu.ru/subject/lesson/1521/main/ |
| 8 | Чистые вещества и смеси. Способы разделения смесей | https://resh. edu.ru/subject/lesson/1522/main/ edu.ru/subject/lesson/1522/main/ |
| 8 | Физические и химические явления | https://resh.edu.ru/subject/lesson/1485/main/ |
| 8 | Атом. Молекула | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Химический элемент. Знаки химических элементов | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Простые и сложные вещества | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Валентность. Составление химических формул бинарных соединений | https://resh.edu.ru/subject/lesson/1520/main/ |
| 8 | Химические уравнения. Коэффициенты. Закон сохранения массы веществ | https://resh.edu.ru/subject/lesson/1519/main/ |
| 8 | Вычисления по химическим уравнениям количества и массы вещества по количеству вещества, массе реагентов или продуктов реакции | https://resh.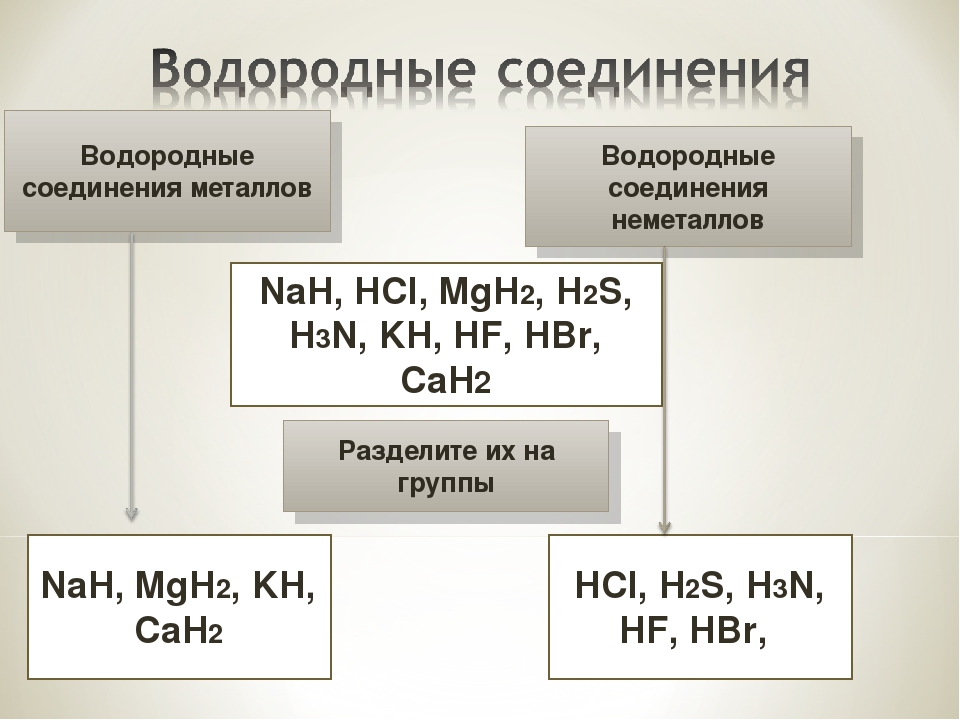 edu.ru/subject/lesson/2448/main/ edu.ru/subject/lesson/2448/main/ |
| 8 | Обобщение и систематизация знаний по теме «Первоначальные химические понятия» | https://resh.edu.ru/subject/lesson/2448/main/ |
| 8 | Кислород – химический элемент и простое вещество. Озон. Состав воздуха | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Физические и химические свойства кислорода | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Получение и применение кислорода | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Озон. Аллотропия кислорода. Состав воздуха. Горение | https://resh.edu.ru/subject/lesson/2446/main/ |
| 8 | Водород – химический элемент и простое вещество. Физические и химические свойства водорода | https://resh.edu.ru/subject/lesson/3119/main/ |
| 8 | Получение и применение водорода | https://resh. edu.ru/subject/lesson/3119/main/ edu.ru/subject/lesson/3119/main/ |
| 8 | Объёмные отношения газов при химических реакциях | https://resh.edu.ru/subject/lesson/2731/main/ |
| 8 | Вода в природе. Круговорот воды в природе. Физические свойства воды | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Химические свойства воды. Взаимодействие с металлами | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Химические свойства воды. Взаимодействие воды с оксидами металлов | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Растворы. Растворимость веществ в воде. Массовая доля растворённого вещества в растворе | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Расчёт массовой доли растворённого вещества в растворе | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Оксиды. Классификация. Номенклатура Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2445/main/ |
| 8 | Амфотерные оксиды и гидроксиды | https://resh.edu.ru/subject/lesson/2684/main/ |
| 8 | Физические и химические свойства оксидов | https://resh.edu.ru/subject/lesson/2444/main/ |
| 8 | Получение и применение оксидов | https://resh.edu.ru/subject/lesson/2444/main/ |
| 8 | Основания. Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2442/main/ |
| 8 | Получение и применение оснований | https://resh.edu.ru/subject/lesson/2442/main/ |
| 8 | Кислоты. Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2055/main/ |
| 8 | Физические и химические свойства кислот. Индикаторы. Изменение окраски индикаторов в различных средах | https://resh. edu.ru/subject/lesson/3120/main/ edu.ru/subject/lesson/3120/main/ |
| 8 | Получение и применение кислот | https://resh.edu.ru/subject/lesson/3120/main/ |
| 8 | Соли. Классификация. Номенклатура. Получение и применение солей | https://resh.edu.ru/subject/lesson/2054/main/ |
| 8 | Физические и химические свойства солей | https://resh.edu.ru/subject/lesson/2441/main/ |
| 8 | Генетическая связь между классами неорганических соединений | https://resh.edu.ru/subject/lesson/2440/main/ |
| 8 | Строение атома: ядро, энергетический уровень |
https://resh.edu.ru/subject/lesson/2051/main/
https://mosobr.tv/release/7883
|
| 8 | Состав ядра атома: протоны, нейтроны. Изотопы | https://resh.edu.ru/subject/lesson/2051/main/ |
| 8 | Периодический закон Д. И. Менделеева. Периодическая система химических элементов Д. И. Менделеева И. Менделеева. Периодическая система химических элементов Д. И. Менделеева | https://resh.edu.ru/subject/lesson/2050/main/ |
| 8 | Физический смысл атомного (порядкового) номера химического элемента, номера группы и периода периодической системы | https://resh.edu.ru/subject/lesson/2050/main/ |
| 8 | Закономерности изменения свойств атомов химических элементов и их соединений на основе положения в периодической системе Д. И. Менделеева и строения атома | https://resh.edu.ru/subject/lesson/2049/main/ |
| 8 | Электроотрицательность атомов химических элементов | https://resh.edu.ru/subject/lesson/2439/main/ |
| 8 | Ковалентная химическая связь: неполярная и полярная. Ионная связь | https://resh.edu.ru/subject/lesson/2048/main/ |
| 8 | Металлическая связь. Понятие о водородной связи и её влиянии на физические свойства веществ на примере воды | https://resh. edu.ru/subject/lesson/2438/main/ edu.ru/subject/lesson/2438/main/ |
| 8 | Валентность и степень окисления. Правила определения степеней окисления | https://resh.edu.ru/subject/lesson/3121/main/ |
| 8 | Окислительно-восстановительные реакции | https://resh.edu.ru/subject/lesson/3122/main/ |
| 8 | Повторение и обобщение по теме «Строение атома. Строение вещества. Химическая связь» | https://resh.edu.ru/subject/lesson/3093/main/ |
| 8 | Химические формулы. Индексы. Закон постоянства состава вещества | https://interneturok.ru/lesson/chemistry/8-klass/bpervonachalnye-himicheskie-predstavleniyab/himicheskaya-formula-veschestva?seconds=0 |
| 8 | Относительная атомная и молекулярная массы. Массовая доля химического элемента в соединении |
Относительная+атомная+и+молекулярная+массы
|
| 8 | Вычисление массовой доли химического элемента по формуле соединения | Вычисление+массовой+доли+химического+элемента |
| 8 | Моль – единица количества вещества. Молярная масса Молярная масса | Моль+-+единица+количества+вещества.+Молярная+масса |
| 8 | Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях | Тепловой+эффект+химических+реакций.+Понятие+об +экзо-+и+эндотермических+реакциях |
| 8 | Физические и химические свойства оснований | Физические+и+химические+свойства+оснований |
| 9 | Окислительно-восстановительные реакции. Реакции соединения, разложения, замещения и обмена с точки зрения окисления и восстановления | https://resh.edu.ru/subject/lesson/2104/main/ |
| 9 | Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях | https://resh.edu.ru/subject/lesson/2437/main/ |
| 9 | Скорость химических реакций. Первоначальные представления о катализе | https://resh.edu.ru/subject/lesson/2102/main/ |
| 9 | Обратимые и необратимые реакции. Понятие о химическом равновесии Понятие о химическом равновесии | https://resh.edu.ru/subject/lesson/2103/main/ |
| 9 | Сущность процесса электролитической диссоциации. Диссоциация кислот, оснований и солей. Слабые и сильные электролиты. Степень диссоциации | https://resh.edu.ru/subject/lesson/1518/main/ |
| 9 | Реакции ионного обмена и условия их протекания | https://resh.edu.ru/subject/lesson/1603/main/ |
| 9 | Гидролиз солей | https://resh.edu.ru/subject/lesson/3123/main/ |
| 9 | Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях | https://resh.edu.ru/subject/lesson/1606/main/ |
| 9 | Обобщение и систематизация знаний по теме «Химические реакции» | https://resh.edu.ru/subject/lesson/2101/main/ |
| 9 | Общая характеристика элементов VIIA группы. Галогены в природе. Физические свойства галогенов Галогены в природе. Физические свойства галогенов | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Химические свойства и применение галогенов | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Хлороводород. Соляная кислота и её соли | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Общая характеристика элементов VIA группы. Сера в природе. Физические и химические свойства серы | https://resh.edu.ru/subject/lesson/2434/main/ |
| 9 | Сероводород. Сульфиды | https://resh.edu.ru/subject/lesson/2434/main/ |
| 9 | Оксиды серы (IV). Сернистая кислота и её соли | https://resh.edu.ru/subject/lesson/2076/main/ |
| 9 | Оксиды серы (VI). Серная кислота и её соли | https://resh.edu.ru/subject/lesson/2077/main/ |
| 9 | Общая характеристика элементов VA группы. Азот в природе. Физические и химические свойства азота | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Аммиак: строение молекулы, физические и химические свойства | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Аммиак: химические свойства, получение, применение | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Соли аммония | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Азотная кислота и её соли | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Фосфор. Оксид фосфора (V) | https://resh.edu.ru/subject/lesson/2073/main/ |
| 9 | Фосфорная кислота и её соли | https://resh.edu.ru/subject/lesson/2073/main/ |
| 9 | Характеристика элементов IVA группы. Углерод и кремний в природе. Физические и химические свойства углерода. Аллотропия углерода | https://resh.edu.ru/subject/lesson/2072/main/ |
| 9 | Оксиды углерода | https://resh.edu.ru/subject/lesson/2071/main/ |
| 9 | Угольная кислота и её соли | https://resh.edu.ru/subject/lesson/2070/main/ |
| 9 | Кремний и его соединения | https://resh.edu.ru/subject/lesson/2069/main/ |
| 9 | Обобщение и систематизация знаний по теме «Неметаллы IV и V групп и их соединения» | https://resh.edu.ru/subject/lesson/2068/main/ |
| 9 | Положение металлов в Периодической системе химических элементов Д. И. Менделеева. Общие физические свойства металлов |
https://resh.edu.ru/subject/lesson/1607/main/
https://mosobr.tv/release/7942
|
| 9 | Общие химические свойства металлов |
https://resh.edu.ru/subject/lesson/1607/main/
https://mosobr.tv/release/7974
|
| 9 | Получение и применение металлов | https://resh.edu.ru/subject/lesson/1607/main/ |
| 9 | Положение щелочных и щелочноземельных металлов в Периодической таблице химических элементов Д. И. Менделеева и строение их атомов. Свойства | https://resh.edu.ru/subject/lesson/1602/main/ |
| 9 | Соединения щелочных и щелочноземельных металлов | https://resh.edu.ru/subject/lesson/3124/main/ |
| 9 | Положение алюминия в Периодической таблице химических элементов Д. И. Менделеева и строение атома. Физические и химические свойства алюминия | https://resh.edu.ru/subject/lesson/1604/main/ |
| 9 | Соединения алюминия | https://resh.edu.ru/subject/lesson/1604/main/ |
| 9 | Положение железа в Периодической таблице химических элементов Д. И. Менделеева и строение атома. Нахождение в природе. Физические и химические свойства железа | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Соединения железа и их свойства | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Получение и применение соединений железа | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Обобщение и систематизация знаний по теме «Металлы и их соединения» | https://resh.edu.ru/subject/lesson/2067/main/ |
| 9 | Углеводороды | https://resh.edu.ru/subject/lesson/1608/main/ |
| 9 | Спирты: метанол, этанол, глицерин | https://resh.edu.ru/subject/lesson/2066/main/ |
| 9 | Карбоновые кислоты: уксусная, стеариновая, олеиновая, аминоуксусная кислоты | https://resh.edu.ru/subject/lesson/2065/main/ |
| 9 | Биологически важные вещества: жиры, углеводы, белки | https://resh.edu.ru/subject/lesson/1609/main/ |
| 9 | Полимеры | https://resh.edu.ru/subject/lesson/2435/main/ |
| 9 | Обобщающий урок по теме «Важнейшие органические соединения» | https://resh.edu.ru/subject/lesson/2064/main/ |
| 9 | Степень окисления атомов и её определение в соединениях | Степень+окисления+атомов+и+её+определение+в+соединениях |
| 9 | Положение неметаллов в Периодической системе химических элементов Д. И. Менделеева | https://www.youtube.com/watch?v=ohFd4lJ9RcE&feature=emb_logo |
| 9 | Химические свойства металлов. Взаимодействие металлов с неметаллами | https://www.youtube.com/watch?v=qgzo40bfL1o |
| 9 | Оксиды азота | https://www.youtube.com/watch?time_continue=130&v=JmbTPhygCdk&feature=emb_logo |
| 9 | Общие химические свойства металлов | https://www.youtube.com/watch?time_continue=217&v=3O_1UupZ71E&feature=emb_logo |
| 9 | Получение и применение металлов | https://www.youtube.com/watch?time_continue=347&v=ZmgAo8Q3jFI&feature=emb_logo |
| 9 | Природные источники углеводородов: природный газ, нефть, уголь | https://www.youtube.com/watch?time_continue=206&v=O9e6ORyASjI&feature=emb_logo |
| 9 | Свойства металлов, неметаллов и их соединений. Генетическая связь между классами неорганических соединений | Свойства+металлов+неметаллов+и+их+соединений |
| 9 | Вычисления по химическим уравнениям количества, объёма, массы вещества по количеству, объёму, массе реагентов или продуктов реакции | https://www.youtube.com/watch?time_continue=8&v=nwIVA6XBq5w&feature=emb_logo |
5. Бинарные соединения. Ионная связь
А. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ…
Оксиды А. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ… Определение валентности… Определение типа оксида… Взаимодействие оксидов… 3 Б. КОНТРОЛЬНЫЕ ЗАДАНИЯ… 5 ЧАСТЬ A… 5 ЧАСТЬ B… 6 ЧАСТЬ C… 11 ЧАСТЬ D… 1
Подробнее
Пояснительная записка
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля. Данная рабочая
Подробнее
Билеты по химии 6 класс
Билеты по химии 6 класс Билет 1 1. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости
Подробнее
ХИМИЯ МЕТАЛЛОВ
ХИМИЯ МЕТАЛЛОВ 1. Какая из электронных формул отражает строение атома натрия: 1. 1s 2 2s 2 2p 6 3s 1 ; 2. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 ; 3. 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ; 4. 1s 2 2s 1. 2. Какие
Подробнее
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОР. МОСКВЫ
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОР. МОСКВЫ Федеральное государственное автономное образовательное учреждение высшего профессионального образования «НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ «МИСиС»
Подробнее
Инструкция по выполнению работы
Тренировочная работа 1 по ХИМИИ Химия. 11 класс. Вариант 1 m00090 2 Инструкция по выполнению работы Район. Город (населенный пункт). Школа. Класс Фамилия. Имя. Отчество 24 октября 2012 года 11 класс Вариант
Подробнее
Варианты контрольных работ по «Химии»
Варианты контрольных работ по «Химии» Задание к контрольной работе составлено в 4 вариантах. Студент должен выполнить работу по варианту, номер которого соответствует начальной букве фамилии. Вариант 1
Подробнее
Часть 3 С3. Часть 3 С4
ШИФР Часть 1 Часть 2 С1 С2 С3 С4 С5 С6 Итоговый балл (из 100 баллов) Вступительная работа для поступающих в 10 ФХ и ХБ классы Часть 1 Обведите номер одного правильного ответа кружком. При правильном ответе
Подробнее
ID_589 1/6 neznaika.pro
Вариант 1 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
Подробнее
1) IV 2) V 3) VI 4) VII
2 1. В ряду: Na Mg Al Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3) уменьшается высшая степень окисления элементов 4) ослабевают металлические
Подробнее
Важнейшие окислители и восстановители
Важнейшие окислители и восстановители Весьма важным является определение самой возможности протекания ОВР, а также установление продуктов реакции. В связи с этим следует отметить, что направление протекания
Подробнее
ID_590 1/7 neznaika.pro
Вариант 2 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа. 1 Химический элемент, в атомах которого распределение электронов по слоям: 2,
Подробнее
Контрольные работы по химии 8 класс
Итоговая контрольная работа по химии 8 класс Вариант подготовила Субханова Г. Р. Вариант 1 В задания 1-12 выберите только один правильный ответ. 1. Только простые вещества содержатся в наборе: 1) C, O
Подробнее
Диагностическая работа 1 по ХИМИИ
Район Город (населенный пункт) Школа Класс Фамилия Имя Отчество Диагностическая работа 1 по ХИМИИ 21 ноября 2011 года 9 класс Вариант 1 Химия. 9 класс. Вариант 1 2 Инструкция по выполнению работы На выполнение
Подробнее
Бинарные соединения — Введение, список, наименование, примеры и часто задаваемые вопросы
Каждый должен иметь базовые знания о соединениях и других химических веществах; это для нашей безопасности. Многие химические вещества, которые мы видим ежедневно, довольно реактивны, и с ними нужно обращаться осторожно. Изучение химии учит, какие химические соединения использовать без вреда, а какие нужно хранить вдали от детей. В этой статье вы узнаете, что такое бинарное соединение, а также список бинарных ионных соединений.Поначалу эти слова могут показаться вам чушью, но вскоре вы начнете узнавать их в своей повседневной жизни. Так почему бы не начать узнавать о них прямо сейчас ?!
Прежде чем мы продолжим, нам нужно поговорить о том, почему бинарные соединения и почему они так важны в области химии. Бинарные соединения — это соединения, которые содержат ровно два вида различных элементов. Слово Binary происходит от слова Bi, что означает два. С другой стороны, эти соединения демонстрируют сильные химические связи, такие как металлические, ионные и ковалентные.
Список бинарных ионных соединений
Важность бинарных соединений поднялась на совершенно новый уровень после открытия ионных соединений. Большинство ионных соединений, которые есть в нашей периодической таблице, представляют собой двухэлементные соединения, в которых одно из соединений является металлом, а другое — неметаллом. В дополнение к этому бинарные ионные соединения начинаются с двух соединений, но они могут стать чрезвычайно сложными с точки зрения свойств и могут образовывать многоатомные ионные соединения.
Ниже приведен список бинарных ионных соединений, который поможет вам понять, где и как используются эти соединения.
NaCl, где Na⁺ положительный, а Cl⁻ отрицательный, образует хлорид натрия.
Li₃N, здесь Li положительно, а N₋₃ отрицательно, эта формула используется для определения нитрида лития.
Оксид магния можно записать как MgO, где Mg₂₊ положительный, а O₂₋O-2 отрицательный.
Это некоторые из ваших соединений, которые входят в список бинарных ионных соединений.
Разница между бинарными кислотами и бинарными соединениями
Многие студенты не понимают, когда в вопросе им предлагается назвать бинарные кислоты.Во-первых, нам нужно прояснить определение бинарных кислот; Что ж, будет намного проще, если мы возьмем пример. Давайте посмотрим на три соединения, в основном на водородоводородную кислоту, плавиковую кислоту и бромистоводородную кислоту. Теперь вы заметили одну вещь.
Все соединения имеют один общий элемент — атом водорода. Тем не менее, с другой стороны, все остальные три соединения неметаллы, это йод, фтор и бром, что делает их бинарными кислотами. Эти кислоты содержат один водородный элемент и неметаллический элемент.Все три соединения, которые мы написали в примере, связаны вместе, водородный элемент из неметалла.
Другое различие между бинарными кислотами и бинарными соединениями состоит в том, что сила бинарных кислот зависит от связи между атомом водорода и другим заданным элементом. Чем слабее связь; тем сильнее будет кислота.
Каждая бинарная кислота, имеющаяся у нас в химии, начинается с префикса «hydro», за которым следует название других элементов, а в постфиксе мы добавляем «-ic».Таким образом, если вы представляете собой бинарную кислоту из двух данных элементов, водорода и хлора, тогда вы назовете эту кислоту как гидро + хлористая кислота.
Присвоение имен бинарным соединениям
Теперь мы знаем, что такое бинарное соединение, и можем определить, является ли данное соединение бинарным или нет, но другая проблема химии — это название соединения. Итак, здесь мы собираемся показать вам, как назвать бинарное соединение. Есть некоторые моменты, которые вам нужно знать, прежде чем вы начнете называть бинарные соединения.
(изображение будет загружено в ближайшее время)
Сначала идет катион, а затем анион в порядке, необходимом для бинарных соединений.
Если вы используете катион с фиксированной степенью окисления, вы можете взять его название прямо из таблицы Менделеева.
Название аниона появляется от корня имени элемента с добавлением суффикса «-ide».
Примеры бинарных соединений
Теперь давайте попробуем дать названия бинарным соединениям, используя несколько примеров. Все примеры, которые мы собираемся показать, состоят только из одного заряда, и он включает в себя как катион, так и анион в данной формуле.
Пример: 1 Напишите имя данной формулы KCl
Первая часть имени будет происходить от первого элемента в данной формуле.Здесь у нас есть «K», который является химическим символом калия.
Постфикс — это корень первого имени второго символа, то есть «Cl», а имя элемента — Chloride.
Теперь добавьте постфикс после получения root от второго символа добавьте «-ide», и вы получите свое полное имя.
В результате мы получили KCl = хлорид калия.
4.5: Формулы и названия бинарных ионных соединений
Узнав еще несколько деталей о названиях отдельных ионов, вы будете в шаге от того, как давать названия ионным соединениям.В этом разделе начинается формальное изучение номенклатуры, систематического наименования химических соединений.
Именование ионов
Название одноатомного катиона — это просто название элемента, за которым следует слово ion . Таким образом, Na + — ион натрия, Al 3 + — ион алюминия, Ca 2 + — ион кальция и так далее.
Мы видели, что некоторые элементы теряют разное количество электронов, производя ионы с разным зарядом (Рисунок 4.4.1). Железо, например, может образовывать два катиона, каждый из которых в сочетании с одним и тем же анионом образует разные соединения с уникальными физическими и химическими свойствами. Таким образом, нам нужно другое имя для каждого иона железа, чтобы отличить Fe 2 + от Fe 3 + . Та же проблема возникает и для других ионов с более чем одним возможным зарядом.
Есть два способа провести это различие. В более простом и современном подходе, называемом Stock system (Table \ (\ PageIndex {1} \)), положительный заряд иона обозначается римской цифрой в скобках после имени элемента, за которой следует слово ion.Таким образом, Fe 2 + называется ионом железа (II), а Fe 3 + называется ионом железа (III). Эта система используется только для элементов, которые образуют более одного общего положительного иона. Мы не называем ион Na + ионом натрия (I), потому что (I) не нужен. Натрий образует только ион 1+, поэтому нет никакой двусмысленности в названии иона натрия .
| Элемент | Шток | Заряд | Современное название (складская система) | Общее название |
|---|---|---|---|---|
| железо | ферр- | 2+ | ион железа (II) | Ион железа |
| 3+ | ион железа (III) | ион трехвалентного железа | ||
| медь | купр- | 1+ | ион меди (I) | ион меди |
| 2+ | ион меди (II) | ион меди | ||
| банка | станн- | 2+ | ион олова (II) | Ион олова |
| 4+ | ион олова (IV) | ион олова | ||
| свинец | отвес- | 2+ | ион свинца (II) | свинцовый ион |
| 4+ | ион свинца (IV) | свинцово-ионный | ||
| хром | хром- | 2+ | ион хрома (II) | хром-ион |
| 3+ | ион хрома (III) | хром-ион | ||
| золото | авр- | 1+ | ион золота (I) | золотистый ион |
| 3+ | ион золота (III) | ауриновый ион |
Вторая система, называемая общей системой , не является традиционной, но все еще широко распространена и используется в науках о здоровье.Эта система учитывает, что многие металлы имеют два общих катиона. В общей системе используются два суффикса (- ic и — ous ), которые добавляются к основанию имени элемента. Суффикс -ic представляет больший из двух катионных зарядов, а суффикс -ous представляет меньший. Во многих случаях основа имени элемента происходит от латинского имени элемента. В таблице \ (\ PageIndex {1} \) перечислены элементы, использующие общую систему, вместе с соответствующими именами катионов.
| Ион | Имя |
|---|---|
| ф — | фторид-ион |
| Класс — | хлорид-ион |
| Br — | бромид-ион |
| Я — | иодид-ион |
| O 2− | оксид-ион |
| S 2− | сульфид-ион |
| П 3− | фосфид-ион |
| N 3− | нитрид-ион |
Название одноатомного аниона состоит из основы названия элемента, суффикса — ide , а затем слова ion .Таким образом, как мы уже видели, Cl — представляет собой «хлор-» + «-ид-ион» или хлорид-ион. Аналогично, O 2- представляет собой ион оксида, Se 2- представляет собой ион селенида и так далее. В таблице \ (\ PageIndex {2} \) перечислены имена некоторых обычных одноатомных ионов.
Пример \ (\ PageIndex {1} \)
Назовите каждый ион.
- Ca 2 +
- S 2−
- Cu +
Решение
- ион кальция
- сульфид-ион
- ион меди (I) или ион меди
Упражнение \ (\ PageIndex {1} \)
Назовите каждый ион.
- Fe 2 +
- Fe 3 +
- Ba 2 +
- Ответ:
- ион железа (II)
- Ответ б:
- ион железа (III)
- Ответ c:
- ион бария
Пример \ (\ PageIndex {2} \)
Напишите формулу для каждого иона.
- бромид-ион
- ион меди
- ион магния
Решение
- Br —
- Cu 2 +
- мг 2 +
Упражнение \ (\ PageIndex {2} \)
Напишите формулу для каждого иона.
- фторид-ион
- ион олова
- ион калия
- Ответ:
- Ф —
- Ответ б:
- Sn 2+
- Ответ c:
- К +
Химическая номенклатура | Химия: Первые атомы
Цели обучения
К концу этого раздела вы сможете:
- Получение названий общих типов неорганических соединений с использованием систематического подхода
Номенклатура , набор правил именования вещей, важна в науке и во многих других ситуациях.Этот модуль описывает подход, который используется для обозначения простых ионных и молекулярных соединений, таких как NaCl, CaCO 3 и N 2 O 4 . Самыми простыми из них являются бинарные соединения , содержащие только два элемента, но мы также рассмотрим, как назвать ионные соединения, содержащие многоатомные ионы, и один конкретный, очень важный класс соединений, известный как кислоты (последующие главы этого текста остановимся на этих соединениях более подробно).Мы ограничим наше внимание здесь неорганическими соединениями, соединениями, которые состоят в основном из элементов, отличных от углерода, и будем следовать рекомендациям по номенклатуре, предложенным IUPAC. Правила для органических соединений, в которых углерод является основным элементом, будут рассмотрены в следующей главе, посвященной органической химии.
Ионные соединения
Чтобы назвать неорганическое соединение, нам нужно рассмотреть ответы на несколько вопросов. Во-первых, это соединение ионное или молекулярное? Если соединение является ионным, образует ли металл ионы только одного типа (фиксированный заряд) или более одного типа (переменный заряд)? Ионы одноатомные или многоатомные? Если соединение молекулярное, содержит ли он водород? Если да, то есть ли в нем кислород? На основании полученных нами ответов мы помещаем соединение в соответствующую категорию и затем называем его соответствующим образом.
Соединения, содержащие только одноатомные ионы
Название бинарного соединения, содержащего одноатомные ионы, состоит из названия катиона (название металла), за которым следует название аниона (название неметаллического элемента с окончанием, замененным суффиксом — ide ) . Некоторые примеры приведены в таблице 1.
| Таблица 1. Названия некоторых ионных соединений | |
|---|---|
| NaCl, хлорид натрия | Na 2 O, оксид натрия |
| KBr, бромид калия | CdS, сульфид кадмия |
| CaI 2 , йодид кальция | Mg 3 N 2 , нитрид магния |
| CsF, фторид цезия | Ca 3 P 2 , фосфид кальция |
| LiCl, хлорид лития | Al 4 C 3 , карбид алюминия |
Соединения, содержащие многоатомные ионы
Соединения, содержащие многоатомные ионы, называются аналогично соединениям, содержащим только одноатомные ионы, за исключением того, что нет необходимости менять окончание на — ide , поскольку суффикс уже присутствует в имени аниона.Примеры приведены в таблице 2.
| Таблица 2. Названия некоторых многоатомных ионных соединений | ||
|---|---|---|
| KC 2 H 3 O 2 , ацетат калия | (NH 4 ) Cl, хлорид аммония | |
| NaHCO 3 , бикарбонат натрия | CaSO 4 , сульфат кальция | |
| Al 2 (CO 3 ) 3 , карбонат алюминия | Mg 3 (PO 4 ) 2 , фосфат магния | |
Ионных соединений в ваших шкафах
Каждый день вы встречаете и употребляете большое количество ионных соединений.Некоторые из этих соединений, где они находятся и для чего они используются, перечислены в Таблице 3. Посмотрите на этикетку или список ингредиентов на различных продуктах, которые вы используете в течение следующих нескольких дней, и посмотрите, не встретите ли вы какие-либо из них. те, что в этой таблице, или найдите другие ионные соединения, которые теперь вы можете назвать или записать в виде формулы.
| Таблица 3. Повседневные ионные соединения | |
|---|---|
| Ионное соединение | Использовать |
| NaCl, хлорид натрия | соль поваренная обыкновенная |
| KI, йодид калия | добавлен в «йодированную» соль для здоровья щитовидной железы |
| NaF, фторид натрия | ингредиент зубной пасты |
| NaHCO 3 , бикарбонат натрия | сода пищевая; используется в кулинарии (и как антацид) |
| Na 2 CO 3 , карбонат натрия | сода стиральная; используется в чистящих средствах |
| NaOCl, гипохлорит натрия | действующее вещество бытового отбеливателя |
| CaCO 3 карбонат кальция | ингредиент антацидов |
| Mg (OH) 2 , гидроксид магния | ингредиент антацидов |
| Al (OH) 3 , гидроксид алюминия | ингредиент антацидов |
| NaOH, гидроксид натрия | щелочь; используется как очиститель канализации |
| K 3 PO 4 , фосфат калия | пищевая добавка (многоцелевого назначения) |
| MgSO 4 , сульфат магния | добавлено в очищенную воду |
| Na 2 HPO 4 , гидрофосфат натрия | агент против слеживания; используется в порошковых продуктах |
| Na 2 SO 3 , сульфит натрия | консервант |
Соединения, содержащие ион металла с переменным зарядом
Большинство переходных металлов могут образовывать два или более катионов с разными зарядами.Соединения этих металлов с неметаллами называются тем же способом, что и соединения первой категории, за исключением того, что заряд иона металла указывается римской цифрой в скобках после названия металла. Заряд иона металла определяется из формулы соединения и заряда аниона. Например, рассмотрим бинарные ионные соединения железа и хлора. Железо обычно имеет заряд 2+ или 3+ (см. Молекулярные и ионные соединения), и две соответствующие формулы соединений — FeCl 2 и FeCl 3 .Самое простое название, «хлорид железа», в этом случае будет неоднозначным, поскольку оно не делает различий между этими двумя соединениями. В подобных случаях заряд иона металла указывается римской цифрой в скобках сразу после названия металла. Эти два соединения однозначно называются хлоридом железа (II) и хлоридом железа (III) соответственно. Другие примеры представлены в таблице 4.
| Таблица 4. Названия некоторых ионных соединений переходных металлов | |
|---|---|
| Ионное соединение переходного металла | Имя |
| FeCl 3 | хлорид железа (II) |
| Hg 2 O | оксид ртути (I) |
| HgO | оксид ртути (II) |
| Cu 3 (PO 4 ) 2 | фосфат меди (II) |
В устаревшей номенклатуре использовались суффиксы — ic и — ous для обозначения металлов с более высоким и более низким зарядом соответственно: Хлорид железа (III), FeCl 3 , ранее назывался хлоридом железа, и хлорид железа (II), FeCl 2 , был известен как хлорид железа.Хотя научное сообщество в значительной степени отказалось от этого соглашения об именах, оно по-прежнему используется в некоторых сегментах промышленности. {2 -} [/ latex]), а составы должны быть нейтральными.Поскольку общее количество положительных зарядов в каждом соединении должно равняться общему количеству отрицательных зарядов, положительные ионы должны быть Fe 3+ , Cu 2+ , Ga 3+ , Cr 4+ и Ti 3+ . Эти заряды используются в названиях ионов металлов:
- сульфид железа (III)
- селенид меди (II)
- нитрид галлия (III)
- хлорид хрома (III)
- сульфат титана (III)
Проверьте свои знания
Напишите формулы следующих ионных соединений:
- фосфид хрома (III)
- сульфид ртути (II)
- фосфат марганца (II)
- оксид меди (I)
- фторид хрома (VI)
Показать ответ
- CrP
- HgS
- Mn 3 (PO 4 ) 2
- Cu 2 O
- CrF 6
Эрин Брокович и загрязнение хромом
В начале 1990-х годов служащая юриста Эрин Брокович (рис. 1) обнаружила высокий уровень серьезных заболеваний в маленьком городке Хинкли, штат Калифорния.Ее расследование в конечном итоге связывало болезни с загрязненными Cr (VI) грунтовыми водами, используемыми Pacific Gas & Electric (PG&E) для борьбы с коррозией в близлежащем газопроводе. Как показано в фильме « Эрин Брокович » (за который Джулия Робертс получила «Оскар»), Эрин и адвокат Эдвард Масри подали в суд на PG&E за загрязнение воды возле Хинкли в 1993 году. Соглашение, которое они выиграли в 1996 году — 333 миллиона долларов — было самой крупной суммой за всю историю. присужден по иску прямого действия в США в то время.
Рис. 1. (a) Эрин Брокович обнаружила, что Cr (IV), используемый PG&E, загрязнил систему водоснабжения Хинкли, Калифорния. (b) Ион Cr (VI) часто присутствует в воде в виде многоатомных ионов, хромата CrO 4 2− (слева) и дихромата Cr 2 O 7 2− (справа) .
Соединения хрома широко используются в промышленности, например, для хромирования, изготовления красителей, в качестве консервантов и для предотвращения коррозии воды в градирне, как это произошло в районе Хинкли.В окружающей среде хром существует в основном в форме Cr (III) или Cr (VI). Cr (III), компонент многих витаминов и пищевых добавок, образует соединения, которые плохо растворяются в воде и обладают низкой токсичностью. Но Cr (VI) гораздо более токсичен и образует соединения, которые достаточно растворимы в воде. Воздействие малых количеств Cr (VI) может привести к повреждению дыхательной, желудочно-кишечной и иммунной систем, а также почек, печени, крови и кожи.
Несмотря на усилия по очистке, загрязнение подземных вод Cr (VI) остается проблемой в Хинкли и других местах по всему миру.Исследование, проведенное Рабочей группой по окружающей среде в 2010 году, показало, что из 35 протестированных городов США в 31 из них уровень Cr (VI) в водопроводной воде выше, чем цель общественного здравоохранения в 0,02 частей на миллиард, установленная Калифорнийским агентством по охране окружающей среды.
Молекулярные (ковалентные) соединения
Характеристики связывания неорганических молекулярных соединений отличаются от ионных соединений, и они также названы с использованием другой системы. Заряды катионов и анионов определяют их соотношения в ионных соединениях, поэтому указание названий ионов дает достаточно информации для определения химических формул.Однако, поскольку ковалентное связывание позволяет значительно варьировать соотношения комбинаций атомов в молекуле, названия молекулярных соединений должны явно идентифицировать эти соотношения.
Соединения, состоящие из двух элементов
Когда два неметаллических элемента образуют молекулярное соединение, часто возможны несколько комбинационных соотношений. Например, углерод и кислород могут образовывать соединения CO и CO 2 . Поскольку это разные вещества с разными свойствами, они не могут иметь одно и то же название (их нельзя одновременно называть оксидом углерода).Чтобы справиться с этой ситуацией, мы используем метод наименования, который в некоторой степени похож на тот, который используется для ионных соединений, но с добавлением префиксов для указания количества атомов каждого элемента. Название более металлического элемента (тот, что левее и / или внизу периодической таблицы) идет первым, за ним следует название более неметаллического элемента (тот, который правее и / или вверху) с его окончанием. изменен на суффикс — ide . Номера атомов каждого элемента обозначены греческими префиксами, показанными в таблице 5.
| Таблица 5. Префиксы номенклатуры | ||||
|---|---|---|---|---|
| Номер | Префикс | Число | Префикс | |
| 1 (иногда опускается) | моно- | 6 | гекса- | |
| 2 | di- | 7 | гепта- | |
| 3 | три- | 8 | окта- | |
| 4 | тетра- | 9 | нона- | |
| 5 | пента- | 10 | дека- | |
Когда присутствует только один атом первого элемента, префикс моно — обычно удаляется из этой части.Таким образом, CO называется монооксидом углерода, а CO 2 называется диоксидом углерода. Когда две гласные находятся рядом, обычно опускается и в греческом префиксе. Некоторые другие примеры показаны в Таблице 6.
| Таблица 6. Названия некоторых молекулярных соединений, состоящих из двух элементов | ||||
|---|---|---|---|---|
| Соединение | Имя | Соединение | Имя | |
| SO 2 | диоксид серы | BCl 3 | треххлористый бор | |
| СО 3 | триоксид серы | SF 6 | гексафторид серы | |
| НЕТ 2 | диоксид азота | ПФ 5 | пентафторид фосфора | |
| N 2 O 4 | тетроксид диазота | П 4 О 10 | декаоксид тетрафосфора | |
| N 2 O 5 | пятиокись азота | IF 7 | гептафторид йода | |
Есть несколько распространенных имен, с которыми вы столкнетесь, продолжая изучать химию.Например, хотя NO часто называют оксидом азота, его собственное название — монооксид азота. Аналогичным образом, N 2 O известен как закись азота, хотя в наших правилах указано название «окись азота». (А H 2 O обычно называют водой, а не монооксидом дигидрогена.) Вы должны запоминать общеупотребительные названия соединений, когда вы с ними встречаетесь.
Пример 2:
Обозначение ковалентных соединений
Назовите следующие ковалентные соединения:
- SF 6
- N 2 O 3
- Класс 2 O 7
- П 4 О 6
Показать ответ
Поскольку эти соединения состоят исключительно из неметаллов, мы используем префиксы для обозначения количества атомов каждого элемента:
- гексафторид серы
- диоксид азота
- гептоксид дихлора
- гексоксид тетрафосфора
Проверьте свои знания
Напишите формулы следующих соединений:
- пентахлорид фосфора
- окись азота
- гептафторид йода
- четыреххлористый углерод
На веб-сайте Chemiste можно практиковаться в именовании химических соединений и написании химических формул.Вы можете выбирать бинарные, многоатомные и ионные соединения с переменным зарядом, а также молекулярные соединения.
Бинарные кислоты
Некоторые соединения, содержащие водород, являются членами важного класса веществ, известных как кислоты. Химия этих соединений более подробно рассматривается в последующих главах этого текста, но пока достаточно отметить, что многие кислоты выделяют ионы водорода H + при растворении в воде. Чтобы обозначить это отличное химическое свойство, смеси воды с кислотой дается название, производное от названия соединения.Если соединение представляет собой бинарную кислоту (состоящую из водорода и еще одного неметаллического элемента):
- Слово «водород» заменено на префикс hydro-
- Имя другого неметаллического элемента изменено добавлением суффикса — ic
- Слово «кислота» добавлено вторым словом
Например, когда газ HCl (хлористый водород) растворяется в воде, раствор называется соляной кислотой . Несколько других примеров этой номенклатуры показаны в Таблице 7.
| Таблица 7. Названия некоторых простых кислот | |
|---|---|
| Название газа | Название кислоты |
| HF ( г ), фтороводород | HF ( водн. ), плавиковая кислота |
| HCl ( г ), хлористый водород | HCl ( водн. ), соляная кислота |
| HBr ( г ), бромистый водород | HBr ( водн. ), бромистоводородная кислота |
| HI ( г ), йодистый водород | HI ( водн. ), иодистоводородная кислота |
| H 2 S ( г ), сероводород | H 2 S ( водн. ), сероводородная кислота |
Оксикислоты
Многие соединения, содержащие три или более элементов (например, органические соединения или координационные соединения), подпадают под специальные правила номенклатуры, которые вы узнаете позже.Тем не менее, мы кратко обсудим важные соединения, известные как оксикислоты , , соединения, которые содержат водород, кислород и, по крайней мере, еще один элемент и связаны таким образом, чтобы придать соединению кислотные свойства (вы узнаете подробности об этом в следующей главе). Типичные оксикислоты состоят из водорода в сочетании с многоатомным кислородсодержащим ионом. Назвать оксикислоты:
- Опустить «водород»
- Начните с корневого имени аниона
- Заменить — съел на — ic , или — ite на — ous
- Добавить «кислота»
Например, рассмотрим H 2 CO 3 (который вы можете назвать «гидрокарбонатом»).Чтобы назвать это правильно, слово «водород» опущено; — ate карбоната заменить на — ic ; и добавляется кислота, поэтому ее называют угольной кислотой. Другие примеры приведены в таблице 8. Есть некоторые исключения из общего метода присвоения имен (например, H 2 SO 4 называется серной кислотой, а не серной кислотой, а H 2 SO 3 сернистой, а не серной кислотой. сернистый, кислотный).
| Таблица 8. Названия общих оксикислот | ||
|---|---|---|
| Формула | Имя аниона | Название кислоты |
| HC 2 H 3 O 2 | ацетат | уксусная кислота |
| HNO 3 | нитрат | азотная кислота |
| HNO 2 | нитрит | азотистая кислота |
| HClO 4 | перхлорат | хлорная кислота |
| H 2 CO 3 | карбонат | угольная кислота |
| H 2 SO 4 | сульфат | серная кислота |
| H 2 SO 3 | сульфит | сернистая кислота |
| H 3 PO 4 | фосфат | фосфорная кислота |
Ключевые концепции и резюме
Химики используют правила номенклатуры, чтобы четко обозначать соединения.Ионные и молекулярные соединения называются разными способами. Бинарные ионные соединения обычно состоят из металла и неметалла. Сначала пишется название металла, затем идет название неметалла с измененным окончанием на — ide . Например, K 2 O называют оксидом калия. Если металл может образовывать ионы с разными зарядами, римская цифра в скобках следует за названием металла, чтобы указать его заряд. Таким образом, FeCl 2 — хлорид железа (II), а FeCl 3 — хлорид железа (III).
Некоторые соединения содержат многоатомные ионы; названия обычных многоатомных ионов следует запомнить. Молекулярные соединения могут образовывать соединения с различным соотношением их элементов, поэтому префиксы используются для указания числа атомов каждого элемента в молекуле соединения. Примеры включают SF 6 , гексафторид серы и N 2 O 4 , четырехокись азота. Кислоты — важный класс соединений, содержащих водород и имеющих особые правила номенклатуры.Бинарные кислоты названы с использованием префикса hydro- , суффикса — ide заменяется на — ic и добавляется «кислота»; HCl — это соляная кислота. Оксикислоты названы изменением конца аниона на — ic и добавлением «кислоты»; H 2 CO 3 угольная кислота.
Упражнения
- Назовите следующие соединения:
- CsCl
- BaO
- К 2 S
- BeCl 2
- HBr
- AlF 3
- Назовите следующие соединения:
- NaF
- Rb 2 O
- BCl 3
- H 2 SE
- П 4 О 6
- ICl 3
- Напишите формулы следующих соединений:
- бромид рубидия
- селенид магния
- оксид натрия
- кальция хлорид
- фтороводород
- фосфид галлия
- бромид алюминия
- сульфат аммония
- Напишите формулы следующих соединений:
- карбонат лития
- перхлорат натрия
- гидроксид бария
- карбонат аммония
- серная кислота
- ацетат кальция
- фосфат магния
- натрия сульфит
- Напишите формулы следующих соединений:
- диоксид хлора
- тетраоксид диазота
- фосфид калия
- сульфид серебра (I)
- нитрид алюминия
- диоксид кремния
- Напишите формулы следующих соединений:
- хлорид бария
- нитрид магния
- диоксид серы
- трихлорид азота
- диоксид азота
- хлорид олова (IV)
- Каждое из следующих соединений содержит металл, который может иметь более одного ионного заряда.Назовите эти соединения:
- Cr 2 O 3
- FeCl 2
- CrO 3
- TiCl 4
- CoO
- МоС 2
- Каждое из следующих соединений содержит металл, который может иметь более одного ионного заряда. Назовите эти соединения:
- NiCO 3
- МоО 3
- Co (НЕТ 3 ) 2
- В 2 О 5
- MnO 2
- Fe 2 O 3
- Следующие ионные соединения встречаются в обычных бытовых товарах.Напишите формулы для каждого соединения:
- фосфат калия
- сульфат меди (II)
- кальция хлорид
- диоксид титана
- аммиачная селитра
- бисульфат натрия (обычное название гидросульфата натрия)
- Следующие ионные соединения встречаются в обычных бытовых товарах. Назовите каждое из соединений:
- Ca (H 2 PO 4 ) 2
- FeSO 4
- CaCO 3
- MgO
- NaNO 2
- КИ
- Как называются по ИЮПАК следующие соединения?
- диоксид марганца
- хлорид ртути (Hg 2 Cl 2 )
- нитрат железа [Fe (NO 3 ) 3 ]
- тетрахлорид титана
- бромид меди (CuBr 2 )
Показать выбранные ответы
1.(а) хлорид цезия; (б) оксид бария; (c) сульфид калия; (d) хлорид бериллия; (e) бромистый водород; (е) фторид алюминия
3. (а) RbBr; (б) MgSe; (c) Na 2 O; (d) CaCl 2 ; е) HF; (f) GaP; g) AlBr 3 ; (в) (NH 4 ) 2 SO 4
5. (а) ClO 2 ; (б) N 2 O 4 ; (c) K 3 P; d) Ag 2 S; (e) AlN; (е) SiO 2
7. (а) оксид хрома (III); (б) хлорид железа (II); (c) оксид хрома (VI); (d) хлорид титана (IV); (e) оксид кобальта (II); (f) сульфид молибдена (IV)
9.а) K 3 PO 4 ; (б) CuSO 4 ; (c) CaCl 2 ; (d) TiO 2 ; e) NH 4 NO 3 ; (е) NaHSO 4
11. (а) оксид марганца (IV); (б) хлорид ртути (I); (c) нитрат железа (III); (d) хлорид титана (IV); (e) бромид меди (II)
Глоссарий
бинарная кислота: соединение, которое содержит водород и еще один элемент, связанные таким образом, что придает соединению кислотные свойства (способность выделять ионы H + при растворении в воде)
бинарное соединение: соединение, содержащее два разных элемента.
номенклатура: Система правил наименования объектов интереса
оксикислота: соединение, которое содержит водород, кислород и еще один элемент, связанный таким образом, что придает соединению кислотные свойства (способность выделять ионы H + при растворении в воде)
химическое соединение | Определение, примеры и типы
Химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
молекула метана
Метан, в котором четыре атома водорода связаны с одним атомом углерода, является примером основного химического соединения. На структуру химических соединений влияют сложные факторы, такие как валентные углы и длина связи.
Encyclopædia Britannica, Inc.
Британская викторина
Основы химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
Вся материя во Вселенной состоит из атомов более 100 различных химических элементов, которые встречаются как в чистом виде, так и в сочетании в химических соединениях. Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы углерода отличаются от атомов железа, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени.Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно. Символ железа — Fe, от оригинального латинского названия ferrum . Фундаментальный принцип химической науки состоит в том, что атомы различных элементов могут объединяться друг с другом, образуя химические соединения. Например, метан, который образован из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит различные молекулы CH 4 .Формула соединения, например, CH 4 , указывает типы присутствующих атомов с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не записывается).
молекула воды
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Одиночный атом кислорода содержит шесть электронов в своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется.
Encyclopædia Britannica, Inc.
Исследуйте магнитоподобную ионную связь, образующуюся при передаче электронов от одного атома к другому
Ионы — атомы с положительным или отрицательным суммарным зарядом — связываются вместе, образуя ионные соединения.
Encyclopædia Britannica, Inc. См. Все видео для этой статьи
Посмотрите, как работают молекулярные связи, когда два атома водорода соединяются с атомом серы, образуя сероводород
Молекулярные соединения образуются при образовании молекул, таких как молекулы метана или воды , соединяйтесь вместе, деля электроны.
Encyclopædia Britannica, Inc. См. Все видео по этой статье
Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O. Хлорид натрия — это химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионов хлора с отрицательным зарядом (Cl — ).( См. Ниже Тенденции в химических свойствах элементов, где обсуждается процесс превращения незаряженных атомов в ионы [т.е. частицы с положительным или отрицательным суммарным зарядом].) Вышеупомянутые вещества служат примером двух основных типов химических веществ. соединения: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. С другой стороны, хлорид натрия содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются в тысячи слов, атомы элементов могут объединяться различными способами, образуя бесчисленное множество соединений. .На самом деле известны миллионы химических соединений, и еще многие миллионы возможны, но еще не открыты и не синтезированы. Большинство веществ, встречающихся в природе, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества могут быть разделены на составляющие их соединения физическими методами, которые не изменяют способ агрегирования атомов в соединениях. Соединения можно разбить на составные элементы путем химических изменений.Химическое изменение (то есть химическая реакция) — это изменение, при котором изменяется организация атомов. Пример химической реакции — горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в способе связывания атомов углерода, водорода и кислорода. в соединениях.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Химические соединения обладают поразительным набором характеристик. При обычных температурах и давлениях некоторые из них являются твердыми телами, некоторые — жидкостями, а некоторые — газами. Цвета различных составных частей совпадают с цветами радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.Чтобы понять это огромное разнообразие, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также подразделяются на органические и неорганические. Органические соединения ( см. Ниже. Органические соединения), названные так потому, что многие из них были первоначально изолированы от живых организмов, обычно содержат цепи или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений.Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. Ниже Неорганические соединения).
ртуть (Hg)
Ртуть (химический символ: Hg) — единственный металлический элемент, который находится в жидком состоянии при комнатной температуре.
© marcel / Fotolia
В рамках широкой классификации органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат ионы O 2- или атомы кислорода, гидриды содержат ионы H — или атомы водорода, сульфиды содержат ионы S 2- и так далее.Подклассы органических соединений включают спирты (содержащие группу ―OH), карбоновые кислоты (характеризующиеся группой COOH), амины (содержащие группу NH 2 ) и так далее.
Различные способности различных атомов объединяться с образованием соединений лучше всего можно понять с помощью периодической таблицы. Периодическая таблица Менделеева была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития науки химии было замечено, что элементы можно сгруппировать в соответствии с их химической реакционной способностью.Элементы с подобными свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. По мере раскрытия деталей атомной структуры стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента ( см. Атом ). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его внешней оболочке. Такие электроны называются валентными электронами.
Таблица Менделеева
Периодическая таблица элементов.
Encyclopædia Britannica, Inc.
Например, атомы элементов в группе 1 периодической таблицы все имеют один валентный электрон, атомы элементов в группе 2 имеют два валентных электрона и так далее, до группы 18 , элементы которого содержат восемь валентных электронов. Самое простое и самое важное правило для предсказания того, как атомы образуют соединения, состоит в том, что атомы имеют тенденцию объединяться таким образом, чтобы они могли либо опустошить свою валентную оболочку, либо завершить ее (т.е., заполните его), в большинстве случаев всего с восемью электронами. Элементы в левой части таблицы Менделеева имеют тенденцию терять свои валентные электроны в химических реакциях. Натрий (в Группе 1), например, имеет тенденцию терять свой одинокий валентный электрон с образованием иона с зарядом +1. Каждый атом натрия имеет 11 электронов ( e — ), каждый с зарядом -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e —.Калий, расположенный непосредственно под натрием в группе 1, также образует +1 ион (K + ) в своих реакциях, как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы имеют тенденцию вступать в реакции, так что они получают (или разделяют) достаточно электронов, чтобы заполнить свою валентную оболочку. Например, кислород в группе 16 имеет шесть валентных электронов и, следовательно, нуждается в двух дополнительных электронах, чтобы завершить его внешнюю оболочку. Кислород достигает этой договоренности, реагируя с элементами, которые могут терять или делиться электронами.Например, атом кислорода может реагировать с атомом магния (Mg) (в Группе 2), принимая два валентных электрона магния, образуя ионы Mg 2+ и O 2-. (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2-.) Получающийся в результате Mg 2+ и O 2- затем объединяют в соотношении 1: 1 с получением ионного соединения MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, он не имеет чистого заряда, поскольку содержит равное количество ионов Mg 2+ и O 2-.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксид кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы в данной группе имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное разделение элементов — на металлы, которые составляют большинство элементов, и неметаллы.Типичными физическими свойствами металлов являются блестящий внешний вид, пластичность (способность растираться в тонкий лист), пластичность (способность вытягиваться в проволоку), а также эффективная теплопроводность и электрическая проводимость. Самым важным химическим свойством металлов является тенденция отдавать электроны с образованием положительных ионов. Например, медь (Cu) — типичный металл. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко превращаться в изделия различной формы, такие как трубы для систем водоснабжения.Медь содержится во многих ионных соединениях в форме иона Cu + или Cu 2+ .
Металлические элементы находятся слева и в центре таблицы Менделеева. Металлы групп 1 и 2 называются типичными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Неметаллы, которых относительно мало, находятся в верхнем правом углу таблицы Менделеева, за исключением водорода, единственного неметаллического члена Группы 1.У неметаллов отсутствуют физические свойства, характерные для металлов. В химических реакциях с металлами неметаллы приобретают электроны с образованием отрицательных ионов. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор — это типичный неметалл. При обычных температурах элементарный хлор содержит молекулы Cl 2 и реагирует с другими неметаллами с образованием таких молекул, как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl — .
Разделение элементов на металлы и неметаллы является приблизительным. Некоторые элементы вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
Именование ионных соединений: простые бинарные соединения, соединения переходных металлов и многоатомные ионные соединения — видео и стенограмма урока
Переходный металл — это металл, который может использовать внутреннюю оболочку перед использованием внешней оболочки для соединения.Это элементы в середине периодической таблицы, такие как цинк, железо и медь. Назвать многоатомные ионные соединения, содержащие переходные металлы, также довольно просто. Он следует тем же правилам именования, что и простые бинарные соединения, но с добавлением дополнительного правила. Таким образом, вы по-прежнему называете сначала катион, а затем анион с добавлением суффикса -ide в конце.
Новое правило состоит в том, что переходные металлы образуют более одного иона, поэтому это необходимо учитывать при наименовании.Мы делаем это, используя римские цифры, чтобы обозначить, какой это ион. Римская цифра будет соответствовать заряду иона. Например, Fe2 + — это железо (II). Fe3 + — железо (III).
Когда с этими металлами образуются соединения, необходимо учитывать различные ионы. Если бы я сказал вам, что соединение было хлоридом железа, это не дало бы вам всей истории. Вы не узнаете, было ли это железо (II) или железо (III), что означает, что вы не знаете, сколько атомов хлора находится в соединении для связи с железом, поскольку для железа (II) потребуется два хлора. и три для железа (III).Если бы я вместо этого сказал вам, что это соединение было хлоридом железа (II), вы бы знали, что это Fe2 +, а это значит, что с ним связаны два атома хлора. Формула будет FeCl2. Если бы я сказал, что это хлорид железа (III), формула была бы FeCl3.
Обозначение многоатомных ионных соединений
Многоатомное ионное соединение представляет собой соединение, состоящее из многоатомного иона, состоящего из двух или более атомов, связанных вместе, и металла. Назвать многоатомные ионы сложнее, но выполнимо.Сначала назовите катион, который является просто названием элемента. Затем назовите анион. Это становится еще сложнее.
Давайте сначала поговорим о многоатомном ионном соединении, содержащем кислород. Если многоатомный анион содержит кислород, он называется оксианионом. Если он может образовывать более одной формы оксианиона, он получает суффикс -ate или -ite . Есть несколько распространенных оксианионов, которые запоминает большинство людей.
| Оксианион | Кол-во форм |
|---|---|
| ClO | 4 |
| НЕТ | 2 |
| СО | 2 |
Если оксианион может образовывать только два разных вида оксианионов, имя иона с большим числом атомов оканчивается на -ate, а меньшее число атомов оканчивается на -ite.
Например:
NO2 — нитрит, с окончанием -ite
NO3 — нитрат, с окончанием -ate
SO3 2- сульфит, с окончанием -ite
SO4 2- сульфат, с окончанием -ate
Если ион образует четыре различных типа оксианионов, то они получают префикс вместе с суффиксом. Ион первого и наименьшего размера получает в качестве префикса гипо-. Ион наибольшего размера получает в качестве префикса на .
Это выглядит так.
ClO- гипохлорит. Он имеет префикс гипо- и суффикс -ite, потому что он самый маленький.
ClO2 — хлорит только с суффиксом -ite.
ClO3 — хлорат с суффиксом только -ат
ClO4 — перхлорат. Он имеет префикс per- и суффикс -ate, потому что он самый большой.
Обратите внимание, что у них есть имя центрального элемента плюс суффикс или префикс.
Итак, чтобы быстро понять, если в анионе есть кислород, это оксианион.Если существует только две формы оксианиона, он получает суффикс -ite для меньшего иона и -ate для большего иона. Размер в данном случае относится к заряду иона. Если существует четыре версии оксианиона, он будет иметь следующий размер по размеру:
Hypo- and -ite для самой маленькой
Only -ite для второй
Only -ate для третьей
Per- и -для самого большого
Теперь давайте посмотрим на многоатомный анион, который получил ионы водорода H + -.Они называются путем добавления водорода (если он добавил один водород) или дигидрогена (если он добавил два атома водорода) перед названием аниона.
HCO3 — гидрокарбонат
HSO4 — гидросульфат
h3 PO4 — дигидрофосфат
Пример:
KClO3. Катион K, который представляет собой калий. Анион — это ClO3, который представляет собой оксианион, который, как вы видели ранее, был назван хлоратом. Итак, название этого многоатомного иона — хлорат калия.
Резюме урока
В этом уроке было рассмотрено многое. Вы узнали, что называть простые бинарные ионные соединения легко. Сначала назовите катион именем элемента, затем назовите анион и добавьте в конец -ide .
Назвать ионные соединения переходными металлами тоже не сложно. Они названы как бинарные соединения, в которых сначала катион, затем анион с добавленным к нему -идом, но вы должны учитывать вариации ионов металлов. Вы делаете это, добавляя римские цифры в скобки к катиону.Итак, FeCl2 — хлорид железа (II).
Назвать многоатомные ионные соединения сложно, и существует несколько правил в зависимости от различных задействованных ионов. Когда задействован ион водорода, соединение начинается либо с водорода, либо с дигидрогена, в зависимости от того, задействованы один или два иона. Если кислород является одним из анионов, то это оксианион. Если есть только две формы оксианиона, он получает суффикс -ite для меньшего иона и -ate для большего иона.Если существует четыре версии оксианиона, самая маленькая получает префикс hypo- и суффикс -ite. Следующий по величине индекс получает суффикс -ite. Третий получает суффикс -ate. Четвертый и самый большой оксианион получает префикс per- и суффикс -ate.
Результат обучения
После этого урока вы сможете называть простые бинарные ионные соединения, ионные соединения с переходными металлами и многоатомные ионные соединения.
Что такое бинарное соединение? — Определение и примеры — Видео и стенограмма урока
Что такое бинарное соединение?
В химии бинарное соединение — это нечто, состоящее ровно из двух элементов.Элемент — это тип вещества, которое невозможно разделить на более простые вещества химическими методами. Любой из этих квадратов в периодической таблице элементов представляет собой элемент. Несколько примеров химических элементов — водород, кислород и железо. Это означает, что бинарное соединение будет состоять из двух разных химических элементов.
В бинарном соединении может быть только один каждый элемент. Мы видим это с хлоридом натрия (солью) NaCl, который содержит один натрий (Na) и один хлор (Cl).Тем не менее, мы видим некоторые бинарные соединения, которые могут содержать более одного элемента каждого элемента, например, закись азота N2O , которая имеет два азота (N) и один кислород (O). N2O также называют веселящим газом, и вы, вероятно, столкнетесь с ним, если вам когда-нибудь придется сходить к стоматологу, чтобы удалить зубы мудрости. Бинарные соединения, от кислот до солей, всегда рядом.
Примеры бинарных соединений
Давайте совершим небольшое путешествие, чтобы увидеть некоторые реальные примеры бинарных соединений.Сначала пойдем искупаться в ближайшей реке. Вы увидите h3O абсолютно везде. Что такое h3O? Это вода. Это бинарное соединение? Ну, он содержит два разных химических элемента: водород и кислород. Таким образом, это бинарное соединение.
Река оказалась слишком холодной, чтобы в ней было удобно купаться, но мы можем промыть золото. На самом деле, вам действительно повезет, и вы заметите немного золота на своей сковороде! Является ли золото или Au бинарным соединением? Нет, золото — это всего лишь один химический элемент (Au).
Поскольку в наши дни мы действительно не можем много купить за золото, мы решаем уйти и пойти к торговцу золотом, чтобы обменять его на немного денег. По пути мы проезжаем мимо фермы, где чувствуем резкий запах. Это аммиак или Nh4 , который используется в удобрениях. Это бинарное соединение? Да, он содержит два элемента, азот и водород.
Пытаясь избавиться от этого ужасного запаха, мы, к сожалению, проезжаем мимо фабрики, где действительно сильно пахнет тухлыми яйцами.Это сероводород или h3S . К настоящему времени мы знаем, что это явно бинарное соединение, поскольку оно состоит из двух элементов — водорода и серы.
Наконец-то мы добрались до торговца золотом. Он выглядит очень подозрительным и вместо того, чтобы дать нам денег на золото, он предлагает нам цианистый водород или HCN , который является действительно ядовитым соединением. Он говорит нам, что на черном рынке он продается дороже, чем его вес в золоте. Нам все равно, и мы немедленно убегаем оттуда.Это бинарное соединение? Ну, он состоит из водорода, углерода и азота, что в сумме составляет три химических элемента. Это означает, что это не может быть бинарное соединение, поскольку бинарные соединения состоят из двух разных химических элементов.
Резюме урока
Это было близкое. Вместо того, чтобы испытывать удачу, давайте подведем итоги. Вы, вероятно, уже хорошо представляете, что такое бинарные соединения, а что нет. Еще раз, бинарное соединение представляет собой вещество, состоящее ровно из двух различных элементов , которые являются веществами, которые нельзя упростить химическими средствами.
Примеры бинарных соединений включают h3O, h3S и Nh4. Примеры веществ, не являющихся химическими соединениями , включают Au, Fe, O, HCN и HNO3. Бинарные соединения — это вещества, состоящие ровно из двух элементов; Ни больше ни меньше.
2.6 Молекулярные и ионные соединения — химия
Цели обучения
К концу этого раздела вы сможете:
- Определите ионные и молекулярные (ковалентные) соединения
- Предсказать тип соединения, образованного из элементов, на основе их расположения в периодической таблице.
- Определите формулы простых ионных соединений
В обычных химических реакциях ядро каждого атома (и, следовательно, идентичность элемента) остается неизменным.Однако электроны могут быть добавлены к атомам путем передачи от других атомов, потеряны при передаче другим атомам или совместно с другими атомами. Передача и обмен электронами между атомами определяют химию элементов. Во время образования некоторых соединений атомы приобретают или теряют электроны и образуют электрически заряженные частицы, называемые ионами (рис. 1).
Рис. 1. (a) Атом натрия (Na) имеет равное количество протонов и электронов (11) и не заряжен. (b) Катион натрия (Na + ) потерял электрон, поэтому он имеет на один протон (11) больше, чем электронов (10), что дает ему общий положительный заряд, обозначенный надстрочным знаком плюс.
Вы можете использовать периодическую таблицу, чтобы предсказать, образует ли атом анион или катион, и вы часто можете предсказать заряд образовавшегося иона. Атомы многих металлов основной группы теряют достаточно электронов, чтобы у них осталось то же количество электронов, что и у атома предыдущего благородного газа. Например, атом щелочного металла (группа 1) теряет один электрон и образует катион с зарядом 1+; щелочноземельный металл (группа 2) теряет два электрона и образует катион с зарядом 2+ и так далее.Например, нейтральный атом кальция с 20 протонами и 20 электронами легко теряет два электрона. В результате получается катион с 20 протонами, 18 электронами и зарядом 2+. Он имеет такое же количество электронов, что и атомы предшествующего благородного газа, аргона, и обозначается как Ca 2+ . Название иона металла совпадает с названием атома металла, из которого он образуется, поэтому Ca 2+ называют ионом кальция.
Когда атомы неметаллических элементов образуют ионы, они обычно получают достаточно электронов, чтобы дать им такое же количество электронов, как у атома следующего благородного газа в периодической таблице.Атомы группы 17 получают один электрон и образуют анионы с зарядом 1−; атомы группы 16 получают два электрона и образуют ионы с зарядом 2− и так далее. Например, нейтральный атом брома с 35 протонами и 35 электронами может получить один электрон, чтобы обеспечить ему 36 электронов. В результате получается анион с 35 протонами, 36 электронами и зарядом 1−. Он имеет такое же количество электронов, что и атомы следующего благородного газа, криптона, и обозначается Br — . (Обсуждение теории, подтверждающей предпочтительный статус числа электронов благородных газов, отраженное в этих правилах прогнозирования образования ионов, приводится в следующей главе этого текста.)
Обратите внимание на полезность периодической таблицы в предсказании вероятного образования и заряда ионов (рис. 2). Двигаясь слева направо по периодической таблице, элементы основной группы имеют тенденцию образовывать катионы с зарядом, равным номеру группы. То есть элементы группы 1 образуют ионы 1+; элементы группы 2 образуют 2+ иона и т. д. Двигаясь справа налево в периодической таблице, элементы часто образуют анионы с отрицательным зарядом, равным количеству групп, перемещенных влево от благородных газов.Например, элементы группы 17 (одна группа слева от благородных газов) образуют ионы 1−; элементы группы 16 (две группы слева) образуют ионы 2− и так далее. Эту тенденцию можно использовать в качестве ориентира во многих случаях, но ее предсказательная ценность уменьшается по мере приближения к центру таблицы Менделеева. Фактически, переходные металлы и некоторые другие металлы часто имеют переменные заряды, которые нельзя предсказать по их расположению в таблице. Например, медь может образовывать ионы с зарядом 1+ или 2+, а железо может образовывать ионы с зарядом 2+ или 3+.
Рис. 2. Некоторые элементы демонстрируют правильную структуру ионного заряда, когда они образуют ионы.
Пример 1
Состав ионов
Ион, содержащийся в некоторых соединениях, используемых в качестве антиперспирантов, содержит 13 протонов и 10 электронов. Что это за символ?
Решение
Поскольку количество протонов остается неизменным, когда атом образует ион, атомный номер элемента должен быть 13. Зная это, мы можем использовать периодическую таблицу для идентификации элемента как Al (алюминий).Атом Al потерял три электрона и, таким образом, имеет на три положительных заряда (13) больше, чем электронов (10). Это катион алюминия Al 3+ .
Проверьте свои знания
Дайте символ и название иона с 34 протонами и 36 электронами.
Ответ:
Se 2−, селенид-ион
Пример 2
Образование ионов
Магний и азот реагируют с образованием ионного соединения. Предскажите, что образует анион, который образует катион, и заряды каждого иона.Напишите символ для каждого иона и назовите их.
Решение
Положение магния в периодической таблице (группа 2) говорит нам, что это металл. Металлы образуют положительные ионы (катионы). Атом магния должен потерять два электрона, чтобы иметь такое же количество электронов, как у атома предыдущего благородного газа, неона. Таким образом, атом магния образует катион с двумя электронами меньше, чем протонов, и с зарядом 2+. Символ для иона — Mg 2+ , и он называется ионом магния.
Позиция азота в периодической таблице (группа 15) показывает, что это неметалл. Неметаллы образуют отрицательные ионы (анионы). Атом азота должен получить три электрона, чтобы иметь такое же количество электронов, как и атом следующего благородного газа, неона. Таким образом, атом азота образует анион с тремя электронами больше, чем протонов, и зарядом 3−. Символ для иона — N 3-, и он называется нитрид-ионом.
Проверьте свои знания
Алюминий и углерод вступают в реакцию с образованием ионного соединения.Предскажите, что образует анион, который образует катион, и заряды каждого иона. Напишите символ для каждого иона и назовите их.
Ответ:
Al образует катион с зарядом 3+: Al 3+ , ион алюминия. Углерод образует анион с зарядом 4−: C 4−, карбид-ион.
Ионы, которые мы обсуждали до сих пор, называются одноатомными ионами , то есть они являются ионами, образованными только из одного атома. Мы также находим много многоатомных ионов .Эти ионы, которые действуют как дискретные единицы, представляют собой электрически заряженные молекулы (группа связанных атомов с общим зарядом). Некоторые из наиболее важных многоатомных ионов перечислены в Таблице 6. Оксианионы — это многоатомные ионы, которые содержат один или несколько атомов кислорода. На этом этапе изучения химии вы должны запомнить названия, формулы и заряды наиболее распространенных многоатомных ионов. Поскольку вы будете использовать их неоднократно, они скоро станут вам знакомы.
Обратите внимание, что существует система именования некоторых многоатомных ионов; -ate и -ite — суффиксы, обозначающие многоатомные ионы, содержащие больше или меньше атомов кислорода. Per- (сокращение от «гипер») и hypo- (что означает «ниже») — это префиксы, означающие больше атомов кислорода, чем -ate , и меньше атомов кислорода, чем -ite , соответственно. Например, перхлорат — это ClO 4 — , хлорат — это ClO 3 — , хлорит — это ClO 2 — и гипохлорит — ClO — .К сожалению, количество атомов кислорода, соответствующее данному суффиксу или префиксу, не согласуется; например, нитрат — это NO 3 —, а сульфат — это SO 4 2-. Более подробно это будет рассмотрено в следующем модуле по номенклатуре.
Природа сил притяжения, которые удерживают атомы или ионы вместе внутри соединения, является основой для классификации химической связи. Когда электроны переносятся и образуются ионы, образуются ионных связей и .Ионные связи — это электростатические силы притяжения, то есть силы притяжения, испытываемые между объектами с противоположным электрическим зарядом (в данном случае катионами и анионами). Когда электроны «делятся» и образуются молекулы, получается ковалентных связей и . Ковалентные связи — это силы притяжения между положительно заряженными ядрами связанных атомов и одной или несколькими парами электронов, расположенными между атомами. Соединения классифицируются как ионные или молекулярные (ковалентные) на основе имеющихся в них связей.
Когда элемент, состоящий из атомов, которые легко теряют электроны (металл), реагирует с элементом, состоящим из атомов, которые легко приобретают электроны (неметалл), обычно происходит перенос электронов с образованием ионов. Соединение, образованное этим переносом, стабилизируется электростатическим притяжением (ионными связями) между ионами противоположного заряда, присутствующими в соединении. Например, когда каждый атом натрия в образце металлического натрия (группа 1) отдает один электрон для образования катиона натрия, Na + , и каждый атом хлора в образце газообразного хлора (группа 17) принимает один электрон на образуют хлорид-анион, Cl — , полученное соединение, NaCl, состоит из ионов натрия и ионов хлора в соотношении один ион Na + на каждый ион Cl — .Точно так же каждый атом кальция (группа 2) может отдать два электрона и передать по одному каждому из двух атомов хлора с образованием CaCl 2 , который состоит из ионов Ca 2+ и Cl — в соотношении один Иона Ca 2+ на два иона Cl — .
Соединение, содержащее ионы и удерживаемое ионными связями, называется ионным соединением . Таблица Менделеева может помочь нам распознать многие соединения, которые являются ионными: когда металл объединяется с одним или несколькими неметаллами, соединение обычно является ионным.Это руководство хорошо подходит для прогнозирования образования ионных соединений для большинства соединений, которые обычно встречаются во вводном курсе химии. Однако это не всегда так (например, хлорид алюминия AlCl 3 не является ионным).
Вы часто можете распознать ионные соединения по их свойствам. Ионные соединения — это твердые вещества, которые обычно плавятся при высоких температурах и кипят при еще более высоких температурах. Например, хлорид натрия плавится при 801 ° C и кипит при 1413 ° C.(Для сравнения, вода с молекулярным соединением плавится при 0 ° C и закипает при 100 ° C.) В твердой форме ионное соединение не является электропроводным, потому что его ионы не могут течь («электричество» — это поток заряженных частиц. ). Однако в расплавленном состоянии он может проводить электричество, потому что его ионы могут свободно перемещаться через жидкость (рис. 3).
Рис. 3. Хлорид натрия плавится при 801 ° C и в расплавленном состоянии проводит электричество. (кредит: модификация работы Марка Блейзера и Мэтта Эванса)
Посмотрите это видео, чтобы увидеть, как смесь солей плавится и проводит электричество.
В каждом ионном соединении общее количество положительных зарядов катионов равно общему количеству отрицательных зарядов анионов. Таким образом, ионные соединения в целом электрически нейтральны, даже если они содержат положительные и отрицательные ионы. Мы можем использовать это наблюдение, чтобы помочь нам написать формулу ионного соединения. Формула ионного соединения должна иметь такое соотношение ионов, чтобы количество положительных и отрицательных зарядов было равным.
Пример 3
Предсказание формулы ионного соединения
Драгоценный камень сапфир (рис. 4) в основном представляет собой соединение алюминия и кислорода, которое содержит катионы алюминия, Al 3+ , и анионы кислорода, O 2-.Какая формула этого соединения?
Рис. 4. Хотя чистый оксид алюминия бесцветен, следовые количества железа и титана придают синему сапфиру характерный цвет. (кредит: модификация работы Станислава Дороненко)
Раствор
Поскольку ионное соединение должно быть электрически нейтральным, оно должно иметь одинаковое количество положительных и отрицательных зарядов. Два иона алюминия, каждый с зарядом 3+, дадут нам шесть положительных зарядов, а три оксидных иона, каждый с зарядом 2−, дадут нам шесть отрицательных зарядов.Формула будет следующей: Al 2 O 3 .
Проверьте свои знания
Предскажите формулу ионного соединения, образованного катионом натрия Na + и сульфидным анионом S 2-.
Многие ионные соединения содержат многоатомные ионы (таблица 6) в виде катиона, аниона или того и другого. Как и простые ионные соединения, эти соединения также должны быть электрически нейтральными, поэтому их формулы можно предсказать, рассматривая многоатомные ионы как дискретные единицы.Мы используем круглые скобки в формуле, чтобы указать группу атомов, которые ведут себя как единое целое. Например, формула фосфата кальция, одного из минералов в наших костях, — Ca 3 (PO 4 ) 2 . Эта формула показывает, что есть три иона кальция (Ca 2+ ) на каждые две фосфатные (PO 4 3-) группы. Группы PO 4 3− представляют собой дискретные единицы, каждая из которых состоит из одного атома фосфора и четырех атомов кислорода и имеет общий заряд 3−.Соединение электрически нейтрально, и его формула показывает общее количество трех атомов Ca, двух P и восьми атомов O.
Пример 4
Предсказание формулы соединения с многоатомным анионом
Разрыхлитель содержит дигидрофосфат кальция, ионное соединение, состоящее из ионов Ca 2+ и H 2 PO 4 — . Какая формула этого соединения?
Раствор
Положительный и отрицательный заряды должны уравновешиваться, и это ионное соединение должно быть электрически нейтральным.Таким образом, у нас должны быть два отрицательных заряда, чтобы сбалансировать заряд 2+ иона кальция. Для этого требуется соотношение одного иона Ca 2+ к двум ионам H 2 PO 4 —. Мы обозначаем это, заключив формулу для иона дигидрофосфата в скобки и добавив нижний индекс 2. Формула: Ca (H 2 PO 4 ) 2 .
Проверьте свои знания
Предскажите формулу ионного соединения, образованного между ионом лития и ионом пероксида, O 2 2- (Подсказка: используйте периодическую таблицу, чтобы предсказать знак и заряд иона лития. .)
Поскольку ионное соединение не состоит из отдельных дискретных молекул, его нельзя правильно обозначить с помощью молекулярной формулы . Вместо этого ионные соединения должны быть обозначены формулой, указывающей относительные числа и входящих в его состав ионов. Для соединений, содержащих только одноатомные ионы (например, NaCl), и для многих соединений, содержащих многоатомные ионы (например, CaSO 4 ), эти формулы являются всего лишь эмпирическими формулами, введенными ранее в этой главе.Однако формулы для некоторых ионных соединений, содержащих многоатомные ионы, не являются эмпирическими формулами. Например, ионное соединение оксалат натрия состоит из ионов Na + и C 2 O 4 2-, объединенных в соотношении 2: 1, и его формула записывается как Na 2 C 2 О 4 . Нижние индексы в этой формуле не являются наименьшими из возможных целых чисел, так как каждое из них можно разделить на 2, чтобы получить эмпирическую формулу NaCO 2 .Однако это не общепринятая формула оксалата натрия, поскольку она неточно представляет многоатомный анион соединения, C 2 O 4 2-.
Многие соединения не содержат ионов, а состоят исключительно из дискретных нейтральных молекул. Эти молекулярных соединений (ковалентные соединения) образуются, когда атомы делятся, а не передают (приобретают или теряют) электроны. Ковалентное связывание — важное и обширное понятие в химии, и оно будет подробно рассмотрено в одной из последующих глав этого текста.Мы часто можем идентифицировать молекулярные соединения на основе их физических свойств. В нормальных условиях молекулярные соединения часто существуют в виде газов, низкокипящих жидкостей и легкоплавких твердых веществ, хотя существует много важных исключений.
В то время как ионные соединения обычно образуются при соединении металла и неметалла, ковалентные соединения обычно образуются при соединении неметаллов. Таким образом, таблица Менделеева может помочь нам распознать многие ковалентные соединения. Хотя мы можем использовать положения элементов соединения в периодической таблице, чтобы предсказать, является ли оно ионным или ковалентным на данном этапе нашего изучения химии, вы должны знать, что это очень упрощенный подход, который не учитывает ряд факторов. интересные исключения.Между ионными и молекулярными соединениями существуют оттенки серого, о которых вы узнаете позже.
Пример 5
Предсказание типа связи в соединениях
Предскажите, являются ли следующие соединения ионными или молекулярными:
(a) KI, соединение, используемое в качестве источника йода в поваренной соли
(b) H 2 O 2 , отбеливатель и дезинфицирующее средство перекись водорода
(c) CHCl 3 , анестезирующий хлороформ
(d) Li 2 CO 3 , источник лития в антидепрессантах
Раствор
(а) Калий (группа 1) — металл, а йод (группа 17) — неметалл; KI предположительно будет ионным.
(b) Водород (группа 1) — неметалл, а кислород (группа 16) — неметалл; H 2 O 2 предсказывается как молекулярный.
(c) Углерод (группа 14) — неметалл, водород (группа 1) — неметалл, а хлор (группа 17) — неметалл; Предполагается, что CHCl 3 будет молекулярным.
(d) Литий (группа 1) — металл, а карбонат — многоатомный ион; Предполагается, что Li 2 CO 3 будет ионным.
Проверьте свои знания
Используя таблицу Менделеева, предскажите, являются ли следующие соединения ионными или ковалентными:
(а) SO 2
(б) CaF 2
(с) № 2 H 4
(d) Al 2 (SO 4 ) 3
Ответ:
(а) молекулярный; (б) ионный; (в) молекулярный; (г) ионный
Металлы (особенно в группах 1 и 2) имеют тенденцию терять количество электронов, которое оставило бы их с тем же количеством электронов, что и в предыдущем благородном газе в периодической таблице.Таким образом образуется положительно заряженный ион. Точно так же неметаллы (особенно в группах 16 и 17 и, в меньшей степени, в группе 15) могут получить количество электронов, необходимое для обеспечения атомов таким же количеством электронов, как и в следующем благородном газе в периодической таблице. . Таким образом, неметаллы имеют тенденцию образовывать отрицательные ионы. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы — анионами. Ионы могут быть одноатомными (содержащими только один атом) или многоатомными (содержащими более одного атома).
Соединения, содержащие ионы, называются ионными соединениями. Ионные соединения обычно образуются из металлов и неметаллов. Соединения, которые не содержат ионов, а вместо этого состоят из атомов, прочно связанных в молекулы (незаряженные группы атомов, которые ведут себя как единое целое), называются ковалентными соединениями. Ковалентные соединения обычно образуются из двух неметаллов.
Химия: Упражнения к концу главы
- Используя периодическую таблицу, предскажите, являются ли следующие хлориды ионными или ковалентными: KCl, NCl 3 , ICl, MgCl 2 , PCl 5 и CCl 4 .
- Используя периодическую таблицу, предскажите, являются ли следующие хлориды ионными или ковалентными: SiCl 4 , PCl 3 , CaCl 2 , CsCl, CuCl 2 и CrCl 3 .
- Для каждого из следующих соединений укажите, является ли оно ионным или ковалентным. Если он ионный, напишите символы для участвующих ионов:
(а) NF 3
(б) BaO,
(c) (NH 4 ) 2 CO 3
(d) Sr (H 2 PO 4 ) 2
(e) IBr
(е) Na 2 O
- Для каждого из следующих соединений укажите, является ли оно ионным или ковалентным, и, если оно ионное, напишите символы для соответствующих ионов:
(а) KClO 4
(б) MgC 2 H 3 O 2
(в) H 2 S
(г) Ag 2 S
(e) N 2 Класс 4
(f) Co (NO 3 ) 2
- Для каждой из следующих пар ионов напишите символ формулы соединения, которое они будут образовывать:
(а) Ca 2+ , S 2−
(б) NH 4 + , SO 4 2−
(в) Al 3+ , Br —
(г) Na + , HPO 4 2−
(e) Mg 2+ , PO 4 3−
- Для каждой из следующих пар ионов напишите символ формулы соединения, которое они будут образовывать:
(а) К + , О 2−
(б) NH 4 +, PO 4 3−
(в) Al 3+ , O 2−
(г) Na + , CO 3 2−
(e) Ba 2+ , PO 4 3−
Глоссарий
- ковалентная связь
- сила притяжения между ядрами атомов молекулы и парами электронов между атомами
- ковалентное соединение
- (также молекулярное соединение), состоящее из молекул, образованных атомами двух или более различных элементов
- ионная связь
- электростатические силы притяжения между противоположно заряженными ионами ионного соединения
- ионное соединение
- Соединение, состоящее из катионов и анионов, объединенных в соотношении с образованием электрически нейтрального вещества
- молекулярное соединение
- (также ковалентное соединение), состоящее из молекул, образованных атомами двух или более различных элементов
- одноатомный ион
- ион, состоящий из одного атома
- оксианион
- многоатомный анион, состоящий из центрального атома, связанного с атомами кислорода
- многоатомный ион
- ион, состоящий более чем из одного атома
Решения
Ответы на упражнения в конце главы по химии
1.Ионный: KCl, MgCl 2 ; Ковалент: NCl 3 , ICl, PCl 5 , CCl 4
3. (а) ковалентный; (б) ионный, Ba 2+ , O 2-; (в) ионный, NH 4 + , CO 3 2-; (г) ионный, Sr 2+ , H 2 PO 4 —; (д) ковалентный; (е) ионная, Na + , O 2−
5. (а) CaS; b) (NH 4 ) 2 SO 4 ; c) AlBr 3 ; (d) Na 2 HPO 4 ; (e) Mg 3 (PO 4 ) 2
.



 Сложные вещества.
Сложные вещества.
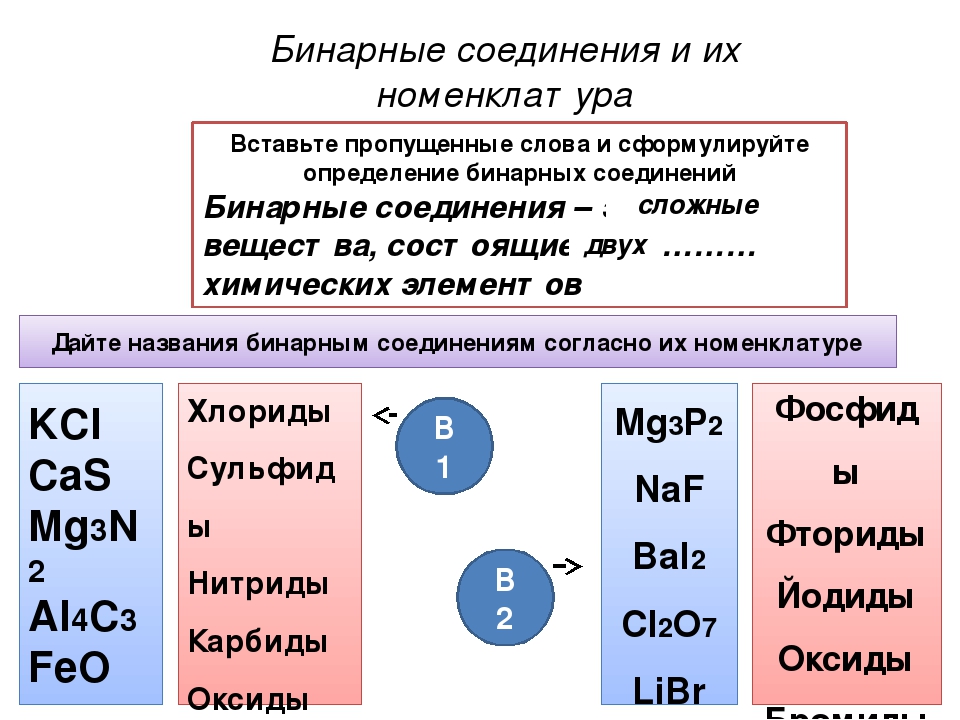



 Что общего вы заметили в этих соединениях?
Что общего вы заметили в этих соединениях?
 Как же их отличить? Давайте расставим степень окисления в этих оксидах.
Как же их отличить? Давайте расставим степень окисления в этих оксидах.
 В группе распределите задания между собой и приступайте к их выполнению. Продуктом вашей работы должна быть заполненная таблица. Как только вы заполните таблицу в группе, сохраните ее на USB-флеш-накопитель.
В группе распределите задания между собой и приступайте к их выполнению. Продуктом вашей работы должна быть заполненная таблица. Как только вы заполните таблицу в группе, сохраните ее на USB-флеш-накопитель. Для этого от каждой группы пригласим по очереди к доске одного представителя, который представит нам полученный результат. (слайд 14)
Для этого от каждой группы пригласим по очереди к доске одного представителя, который представит нам полученный результат. (слайд 14) Различаются вещества физическими свойствами и областью их применения.
Различаются вещества физическими свойствами и областью их применения.