Содержание
Гомологи и изомеры
Гомологи и изомеры
Учитель химии Шорохова Яна Александровна
МЕТАН
Молекулярная формула СН 4
( качественный
и количественный состав)
Структурная формула
( формула строения)
Явление гомологии
А теперь посмотрите (таблица 1) на примеры молекулярных и структурных формул других углеводородов, похожих по строению на метан, но с большим числом атомов углерода. Обратите внимание, что атом углерода образует 4 связи, обозначенные черточками (он четырехвалентен ), а атом водорода – одну связь (он одновалентен ).
Название углеводорода
Молекулярная формула
Структурная формула
Метан
СН 4
Этан
полная
Пропан
С 2 Н 6
свернутая (сокращенная)
Бутан
СН 4
С 3 Н 8
С 4 Н 10
Н 3 С – СН 3
Н 3 С – СН 2 – СН 3
Н 3 С – СН 2 – СН 2 – СН 3
- Какие вещества называют гомологами?
Метан, этан, пропан, бутан называют гомологами (от греч. homologos – подобный).
homologos – подобный).
- Гомологи – это органические вещества, сходные по строению, но отличающиеся по составу на одну или несколько групп –СН 2 –. СН 2 – гомологическая разность
Рис. 1. Гомологи
- Гомологи имеют сходные химические свойства и более или менее закономерно изменяющиеся физические свойства, что облегчает изучение огромного количества органических соединений. Явление гомологии было обнаружено французским химиком Ш. Жераром в XIX в.
Посмотрите на рис. 1 и ответьте на вопрос: Что вам напоминают эти конструкции из кубиков? Попробуйте собрать из оставшихся кубиков еще одну конструкцию, продолжающую начатый ряд.
Явление изомерии
В органической химии существует еще одно интересное явление – изомерия . В 30-е годы XIX в. шведский ученый Й. Я. Берцелиус назвал изомерами вещества, имеющие одинаковый состав, но разные свойства. Позднее, благодаря трудам великого русского химика А.М. Бутлерова, было установлено, что изомеры имеют разный порядок соединения атомов, т.е. разное строение.
Позднее, благодаря трудам великого русского химика А.М. Бутлерова, было установлено, что изомеры имеют разный порядок соединения атомов, т.е. разное строение.
Изомеры – это вещества, имеющие одинаковый состав молекул (молекулярную формулу) и разное строение, а потому и разные свойства.
Изомеры (греч. isos – равный, meros — часть)
Явление изомерии
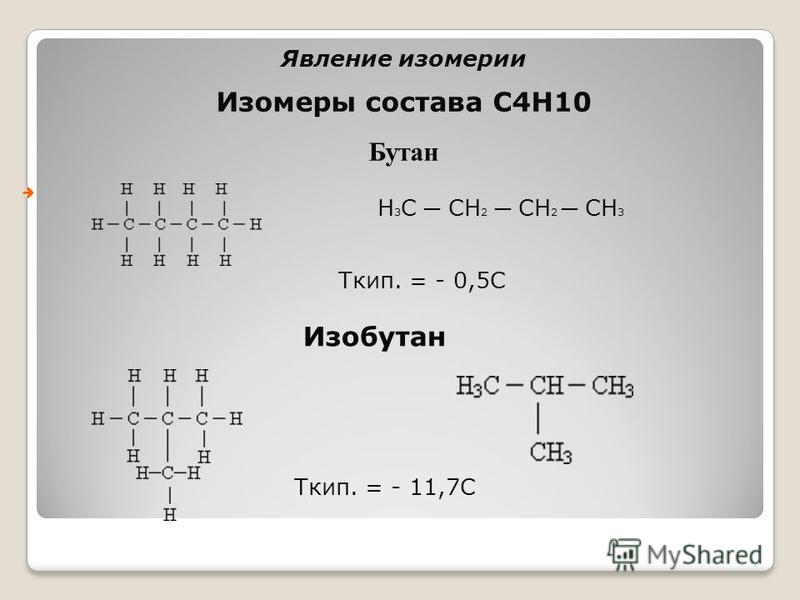
Изомеры состава С4Н10
Бутан
Н 3 С ─ СН 2 ─ СН 2 ─ СН 3
Ткип. = — 0,5С
Изобутан
Ткип. = — 11,7С
Основные типы изомерии
структурная
пространственная
Самоконтроль
Сравните 2 ключевых понятия органической химии, заполнив таблицу 2.
Гомологи и изомеры
Таблица 2.
Понятия
Состав
Гомологи
Строение
Изомеры
Свойства
Тест «Гомологи и изомеры»
Для пентана СН 3 ─ СН 2 ─ СН 2 ─ СН 2 ─ СН 3 среди перечисленных ниже предложенных веществ найдите:
1) Формулу гомолога
2) Формулу изомера
Гомологи и изомеры | Презентация к уроку (химия, 10 класс) по теме:
Слайд 1
Гомологи и изомеры Разработала: Учитель химии МБОУ СОШ №1 с. Александров – гай Белова Светлана Сергеевна
Александров – гай Белова Светлана Сергеевна
Слайд 2
МЕТАН Молекулярная формула СН 4 ( качественный и количественный состав) Структурная формула ( формула строения)
Слайд 3
Явление гомологии А теперь посмотрите (таблица 1) на примеры молекулярных и структурных формул других углеводородов, похожих по строению на метан, но с большим числом атомов углерода. Обратите внимание, что атом углерода образует 4 связи, обозначенные черточками (он четырехвалентен ), а атом водорода – одну связь (он одновалентен ).
Слайд 4
Название углеводорода Молекулярная формула Структурная формула полная свернутая (сокращенная) Метан СН 4 СН 4 Этан С 2 Н 6 Н 3 С – СН 3 Пропан С 3 Н 8 Н 3 С – СН 2 – СН 3 Бутан С 4 Н 10 Н 3 С – СН 2 – СН 2 – СН 3
Слайд 5
Какие вещества называют гомологами? Метан , этан, пропан, бутан называют гомологами (от греч. homologos – подобный). Гомологи – это органические вещества, сходные по строению, но отличающиеся по составу на одну или несколько групп –СН 2 –. СН 2 – гомологическая разность
СН 2 – гомологическая разность
Слайд 6
Рис . 1. Гомологи Гомологи имеют сходные химические свойства и более или менее закономерно изменяющиеся физические свойства, что облегчает изучение огромного количества органических соединений. Явление гомологии было обнаружено французским химиком Ш. Жераром в XIX в. Посмотрите на рис. 1 и ответьте на вопрос: Что вам напоминают эти конструкции из кубиков? Попробуйте собрать из оставшихся кубиков еще одну конструкцию, продолжающую начатый ряд.
Слайд 7
Явление изомерии В органической химии существует еще одно интересное явление – изомерия . В 30-е годы XIX в. шведский ученый Й. Я. Берцелиус назвал изомерами вещества, имеющие одинаковый состав, но разные свойства. Позднее, благодаря трудам великого русского химика А.М. Бутлерова, было установлено, что изомеры имеют разный порядок соединения атомов, т.е. разное строение. Изомеры – это вещества, имеющие одинаковый состав молекул (молекулярную формулу) и разное строение, а потому и разные свойства. Изомеры (греч. isos – равный, meros — часть)
Изомеры (греч. isos – равный, meros — часть)
Слайд 8
Явление изомерии Изомеры состава С4Н10 Бутан Н 3 С ─ СН 2 ─ СН 2 ─ СН 3 Изобутан Ткип . = — 11,7С Ткип . = — 0,5С
Слайд 9
Самоконтроль Сравните 2 ключевых понятия органической химии, заполнив таблицу 2. Гомологи и изомеры Таблица 2. Понятия Состав Строение Свойства Гомологи Изомеры
Слайд 10
Тест «Гомологи и изомеры» Для пентана СН 3 ─ СН 2 ─ СН 2 ─ СН 2 ─ СН 3 среди перечисленных ниже предложенных веществ найдите: 1 ) Формулу гомолога 2) Формулу изомера
Задачи к разделу изомерия и номенклатура органических соединений
Здесь представлены типовые задачи к разделу изомерия и номенклатура органических соединений.
1.Для вещества, имеющего строение CH
3 – CH (СН3) – CH3, составьте формулы одного изомера и двух гомологов. Дайте всем веществам названия по систематической номенклатуре.
Показать решение »
Изомеры – вещества, обладающие одинаковой молекулярной формулой, но имеющие различное строение и, вследствие этого, различные химические и физические свойства.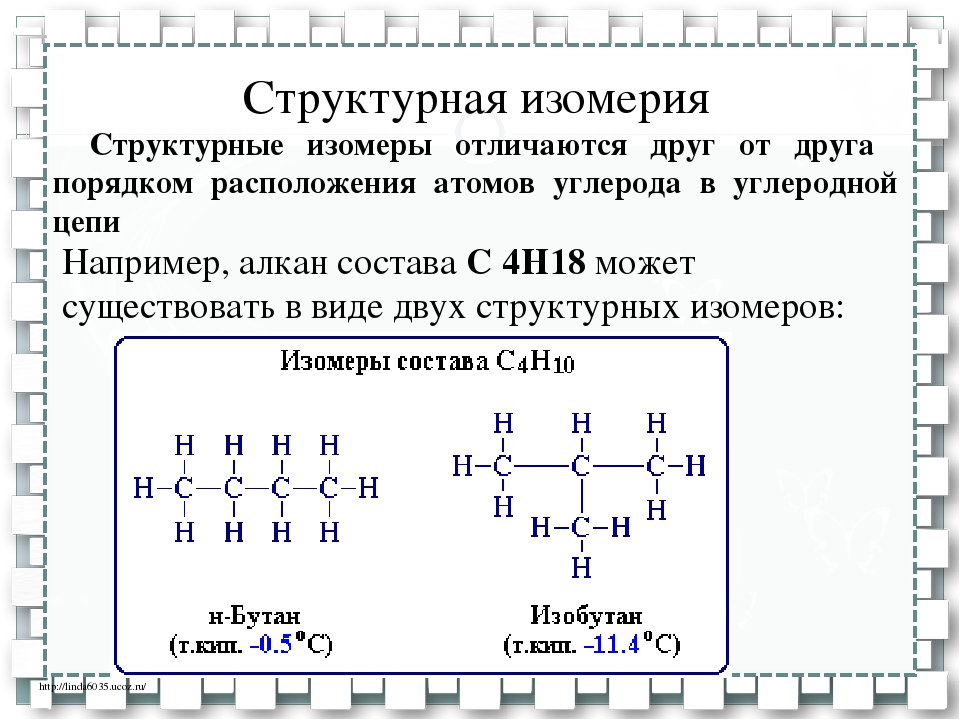
Гомологи – вещества, принадлежащие одному гомологическому ряду. Имеют схожее однотипное строение, и каждый последующий член гомологического ряда отличается от предыдущего на – СН2 группу.
2. Для вещества, имеющего строение CH
3 – CH(СН3)– CH2 – CH(СН3) – CH3, составьте формулы одного изомера и двух гомологов. Дайте всем веществам названия по систематической номенклатуре.
Показать решение »
Изомеры – вещества, обладающие одинаковой молекулярной формулой, но имеющие различное строение и, вследствие этого, различные химические и физические свойства.
Гомологи – вещества, принадлежащие одному гомологическому ряду. Имеют схожее однотипное строение, и каждый последующий член гомологического ряда отличается от предыдущего на – СН2 группу.
3.Выведите формулы альдегидов и кетонов, изомерных валериановому альдегиду С
5Н10О, и назовите их по рациональной и систематической номенклатурам.
Показать решение »
4.Напишите проекционные формулы всех возможных стереомеров следующих соединений: 1,2-дибромпропана; 3,4-дибром-3,4-диметилгексана; 2,4-дибромпентана; 2-бром-З-хлорбутана.
Показать решение »
5.Укажите, будет ли сохранена оптическая активность, если втор-бутилкарбинол: а)окислить в соответствующую карбоновую кислоту; б) превратить в эфир уксусной кислоты; в) превратить в йодистый алкил и последний восстановить до углеводорода?
Показать решение »
Среди органических соединений есть оптически активные вещества, обладающие способностью вращать плоскость поляризации света.Такие вещества существуют в виде двух изомеров (оптических антиподов), вращающих плоскость поляризации в противоположные стороны. Пространственные формы оптических антиподов не совпадают и их совмещение невозможно. Оптическая изомерия возможно только для молекул, имеющих асимметрический атом углерода (т.е. атом углерода, связанный с четырьмя различными заместителями).
Все продукты реакций, кроме, 2-метилбутана, будут проявлять оптическую активность, связанную с наличием в молекуле асимметрического атома углерода (*С)
6.Напишите графические формул пяти изомерных аминов, содержащих бензольное ядро, состава C
7H9N. Назовите их.
Показать решение »
7.Напишите графические формулы изомерных ароматических кислот состава С
8Н8О2. Назовите эти соединения.
Показать решение »
8.Напишите графические формулы первичных, вторичных и третичных спиртов состава C
6H13OH. Назовите их по номенклатуре ИЮПАК.
Показать решение »
9.Сколько изомерных гомологов бензола может отвечать формуле C
9H12? Напишите структурные формулы изомеров и назовите их.
Показать решение »
К вопросу о формировании понятий «гомологи» и «изомеры»
Начальный этап изучения курса органической химии требует формирования его основополагающих понятий «гомологи» и «изомеры», с которыми обучающиеся не встречались ранее, хотя явление изометрии достаточно распространено и среди неорганических веществ. В связи с этим изучение классов органических соединений целесообразно начинать с составления и анализа содержания систематизирующих таблиц для соответствующих гомологических рядов, что позволит заложить основу знаний, обеспечить дальнейшее осмысленное восприятие учебного материала курса. Приведу конкретные примеры.
В связи с этим изучение классов органических соединений целесообразно начинать с составления и анализа содержания систематизирующих таблиц для соответствующих гомологических рядов, что позволит заложить основу знаний, обеспечить дальнейшее осмысленное восприятие учебного материала курса. Приведу конкретные примеры.
Фрагмент таблицы для гомологического ряда алкенов CnH2n
| n | Состав молекулы | Структурный изомер | Структурный изомер | Структурный изомер |
2 | С2Н4 | СН2=СН2 |
|
|
3 | С3Н6 | СН2=СН-СН3 |
|
|
4 | С4Н8 | СН2=СН-СН2СН3 | СН3-СН=СН-СН3 | СН2=С(СН3)-СН3 |
5 | С5Н10 | СН2=СН-СН2СН2СН3 | СН3-СН=СН-СН2-СН3 | СН2=С(СН3)СН2СН3 |
6 | С6Н12 | СН2=СН-(СН2)3СН3 | СН3СН=СН(СН2)2СН3 | СН2=С(СН3)(СН2)2СН3 |
В горизонтальных фрагментах таблицы приведены формулы структурных изомеров соответствующих составов, начиная с n=4, например гекс-1-ен, гекс-2-ен, 2-метилпент-1-ен. Анализ особенностей их строения позволяет обучающимся с достаточной долей самостоятельности сделать вывод о том, какие именно изменения в строении молекул привели к возникновению приведенных изомеров. Из табличных данных следует, что для алкенов возможна структурная изомерия на основании изменения положения кратной связи, так называемая «позиционная» изомерия (при этом последовательность соединения атомов углерода в молекуле может не меняться), а так же изомерия углеродного скелета при неизменном положении кратной связи. Очевидно, что возможно одновременное сочетание того и другого варианта изменений в строении молекулы. Вертикальные фрагменты приведенной таблицы содержат структурные формулы так называемых ближайших гомологов, иначе говоря более сходных и близких друг к другу с точки зрения строения молекул. Вводя более узкое (по сравнению с понятием «гомологи») понятие ближайших гомологов обязательно следует подчеркнуть, что используемая характеристика «ближайшие» ни в коем случае не должна расцениваться как синоним характеристики «соседние», то есть следующие в таблице друг за другом и отличающиеся по составу только на одну метиленовую группу СН2.
Анализ особенностей их строения позволяет обучающимся с достаточной долей самостоятельности сделать вывод о том, какие именно изменения в строении молекул привели к возникновению приведенных изомеров. Из табличных данных следует, что для алкенов возможна структурная изомерия на основании изменения положения кратной связи, так называемая «позиционная» изомерия (при этом последовательность соединения атомов углерода в молекуле может не меняться), а так же изомерия углеродного скелета при неизменном положении кратной связи. Очевидно, что возможно одновременное сочетание того и другого варианта изменений в строении молекулы. Вертикальные фрагменты приведенной таблицы содержат структурные формулы так называемых ближайших гомологов, иначе говоря более сходных и близких друг к другу с точки зрения строения молекул. Вводя более узкое (по сравнению с понятием «гомологи») понятие ближайших гомологов обязательно следует подчеркнуть, что используемая характеристика «ближайшие» ни в коем случае не должна расцениваться как синоним характеристики «соседние», то есть следующие в таблице друг за другом и отличающиеся по составу только на одну метиленовую группу СН2. Ближайшие гомологи не обязательно должны являться соседями по гомологическому ряду, и наоборот, соседние гомологи не всегда будут ближайшими по отношению друг к другу. Например, бут-1-ен и гекс-1-ен по отношению друг к другу являются гомологами ближайшими на основании одинакового положения кратной связи в их молекулах и линейного строения углеродной цепи, но при этом они не являются соседями по гомологическому ряду. И наоборот, бут-1-ен и пент-2-ен, являясь соседями по гомологическому ряду, ближайшими гомологами по отношению друг к другу не являются. В связи с разным положением кратной связи они будут обычными гомологами. Таким образом, в данной таблице обычные гомологи записаны по диагонали. Аналогичные таблицы составляются для гомологических рядов других классов органических соединений.
Ближайшие гомологи не обязательно должны являться соседями по гомологическому ряду, и наоборот, соседние гомологи не всегда будут ближайшими по отношению друг к другу. Например, бут-1-ен и гекс-1-ен по отношению друг к другу являются гомологами ближайшими на основании одинакового положения кратной связи в их молекулах и линейного строения углеродной цепи, но при этом они не являются соседями по гомологическому ряду. И наоборот, бут-1-ен и пент-2-ен, являясь соседями по гомологическому ряду, ближайшими гомологами по отношению друг к другу не являются. В связи с разным положением кратной связи они будут обычными гомологами. Таким образом, в данной таблице обычные гомологи записаны по диагонали. Аналогичные таблицы составляются для гомологических рядов других классов органических соединений.
Фрагмент таблицы для гомологического ряда предельных одноатомных спиртов CnH2n+2O
| n | Состав молекулы | Структурный изомер | Структурный изомер | Структурный изомер |
1 | СН4О | СН3-ОН |
|
|
2 | С2Н6О | СН3-СН2-ОН |
|
|
3 | С3Н8О | СН3-СН2-СН2-ОН | СН3-СН(ОН)-СН3 |
|
4 | С4Н10О | СН3-СН2-СН2-СН2-ОН | СН3СН(ОН)СН2СН3 | СН3СН(СН3)СН2-ОН |
5 | С5Н12О | СН3-(СН2)3-СН2-ОН | СН3СН(ОН)(СН2)2СН3 | СН3СН(СН3)(СН2)2ОН |
Как и в предыдущей таблице, составленной для гомологического ряда алкенов, в горизонтальных фрагментах этой таблицы приведены формулы структурных изомеров, например бутан-1-ол, бутан-2-ол, 2-метилпропан-1-ол. В вертикальных фрагментах расположились ближайшие гомологи, например пропан-2-ол, бутан-2-ол и пентан-2-ол, относящиеся к типу вторичных спиртов. При этом, будучи ближайшими, пропан-2-ол и пентан-2-ол не являются соседями по гомологическому ряду. В других столбцах таблицы так же оказались ближайшие по отношению друг к другу гомологи. На основе анализа общности их строения целесообразно одновременно проклассифицировать предельные одноатомные спирты на три типа: первичные, вторичные и третичные. Обычные гомологи расположились в разных столбцах таблицы по диагонали, например бутан-1-ол и пентан-2-ол. При этом являясь соседними в гомологическом ряду, они не будут ближайшими.
В вертикальных фрагментах расположились ближайшие гомологи, например пропан-2-ол, бутан-2-ол и пентан-2-ол, относящиеся к типу вторичных спиртов. При этом, будучи ближайшими, пропан-2-ол и пентан-2-ол не являются соседями по гомологическому ряду. В других столбцах таблицы так же оказались ближайшие по отношению друг к другу гомологи. На основе анализа общности их строения целесообразно одновременно проклассифицировать предельные одноатомные спирты на три типа: первичные, вторичные и третичные. Обычные гомологи расположились в разных столбцах таблицы по диагонали, например бутан-1-ол и пентан-2-ол. При этом являясь соседними в гомологическом ряду, они не будут ближайшими.
Фрагмент таблицы для гомологического ряда алифатических аминов CnH2n+3N
| n | Состав молекулы | Структурный изомер | Структурный изомер | Структурный изомер |
1 | СН5N | СН3-NH2 |
|
|
2 | C2H7N | CH3-CH2-NH2 | (CH3)2NH |
|
3 | C3H9N | CH3—CH2-CH2-NH2 | CH3-NH-CH2-CH3 | (CH3)3N |
Как и в предыдущих случаях в строчках приведенной таблицы записаны формулы структурных изомеров, а в столбцах — формулы ближайших гомологов. При этом в столбце первичных аминов в качестве изомера состава С3Н9N присутствует формула пропиламина, а не изопропиламина, несмотря на то, что он тоже является первичным. По своему строению молекула пропиламина наиболее близка к молекуле этиламина, так как и в том, и в другом случае аминогруппа связана с первичным атомом углерода. Содержание таблицы так же позволяет выявить типы аминов, одновременно сравнив подход к их определению с подходом к определению типов спиртов. При одинаковом строении углеводородного радикала, присутствующего в молекуле, амины и спирты могут принадлежать к разным типам. Например, изопропиламин и изопропиловый спирт (пропан-2-ол) содержат в своих молекулах одинаковый углеводородный радикал – изопропил, но при этом являются представителями разных типов своих классов: первичного и вторичного соответственно. Содержание подобного рода таблиц позволяет наглядно проиллюстрировать явление структурной изомерии, сформировать понятия «гомолог» и «ближайший гомолог».
При этом в столбце первичных аминов в качестве изомера состава С3Н9N присутствует формула пропиламина, а не изопропиламина, несмотря на то, что он тоже является первичным. По своему строению молекула пропиламина наиболее близка к молекуле этиламина, так как и в том, и в другом случае аминогруппа связана с первичным атомом углерода. Содержание таблицы так же позволяет выявить типы аминов, одновременно сравнив подход к их определению с подходом к определению типов спиртов. При одинаковом строении углеводородного радикала, присутствующего в молекуле, амины и спирты могут принадлежать к разным типам. Например, изопропиламин и изопропиловый спирт (пропан-2-ол) содержат в своих молекулах одинаковый углеводородный радикал – изопропил, но при этом являются представителями разных типов своих классов: первичного и вторичного соответственно. Содержание подобного рода таблиц позволяет наглядно проиллюстрировать явление структурной изомерии, сформировать понятия «гомолог» и «ближайший гомолог».
Систематическая работа обучающихся с одинаково структурированными таблицами, составленными для гомологических рядов разных классов органических соединений, помогает сформировать представление об общности химических явлений, освоить некоторые фундаментальные понятия органической химии, закрепить приобретенные знания, развить самостоятельность и логику химического мышления. Все это составит прочную основу для дальнейшего успешного изучения предмета.
§ 8. Гомологи и изомеры алканов
1.
Условие:
Какие вещества называют гомологами? Приведите примеры.
Решение:
Советы:
Ряд органических соединений, образованный гомологами, называют гомологическим рядом.
2.
Условие:
Напишите формулы и назовите радикалы, которые можно вывести из первых шести предельных углеводородов.
Решение:
Советы:
Если мысленно вычесть из формул алканов по одному атому водорода, то получаются формулы групп атомов с неспаренными электронами, которые называют радикалами.
3.
Условие:
Составьте сокращённые структурные формулы всех возможных изомеров гексана и назовите эти изомеры.
Решение:
Советы:
Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства
4.
Условие:
Приведите названия предельных углеводородов, которые имеют следующие формулы:
Решение:
Советы:
1. Выбрать самую длинную непрерывную углеродную цепь с максимальным числом ответвлений.
2. Пронумеровать углеродные атомы главной цепи
а) нумерацию начинают, с того конца, ближе к которому расположен заместитель
б) если заместители разные и находятся на равном удалении, нумерация с того конца, где заместитель проще
в) если заместители одинаковые и находятся на равном удалении, нумеруют с более разветвленного конца.
3. При составлении названия вначале указывается цифрами положение заместителей (ответвление), затем указав количество заместителей (2 – ди, 3 – три, 4 – тетра) пишут название углеводорода главной цепи.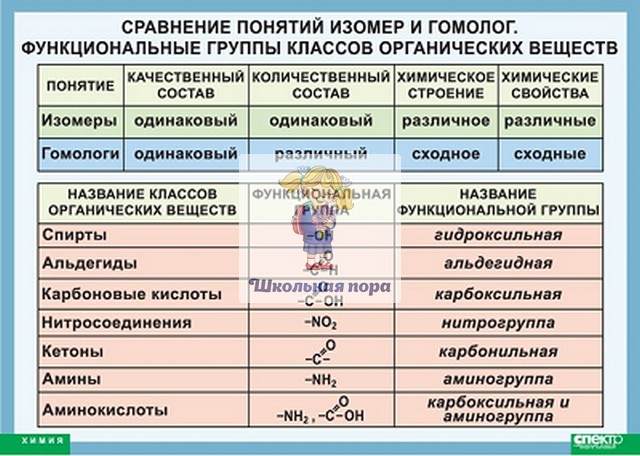
5.
Условие:
Изобразите формулу 2,2,4-триметилпентана
Решение:
Советы:
Задание выполняем в соответствии с правилами составления формул алканов.
6.
Условие:
Какой объём воздуха (н.у.) потребуется, чтобы сжечь 50 куб.м газа, содержащего 90% метана, 5% этана, 3% оксида углерода (IV) и 2% азота?
Решение:
Из всех компонентов газа горят только метан и этан.
Вычислим объем метана и этана:
V(Ch5)=w(Ch5)×Vгаза=0,9×50 м3=45 м3V(C2H6)=w(C2H6)×Vгаза=0,05×50 м3=2,5 м3
Для решения воспользуемся следствием из закона Авогадро.
По уравнению реакции (1) для сжигания 1 моль метана необходимо 2 моль кислорода. Пусть для сжигания 45 м3 метана нужно х м3 кислорода. Составим пропорцию:
По уравнению реакции (2) для сжигания 2 моль этана необходимо 7 моль кислорода. Пусть для сжигания 2,5 м3 этана нужно у м3 кислорода. Составим пропорцию:
Таким образом, для сжигания газа необходимо 90+8,75 = 98,75 м3 кислорода. В воздухе содержится примерно 21% кислорода по объему, или 0,21. Вычислим объем воздуха, необходимый для сжигания газа:
В воздухе содержится примерно 21% кислорода по объему, или 0,21. Вычислим объем воздуха, необходимый для сжигания газа:
Vвоздух=V(O2)/w(O2)=98,75 м3/0,21=470,24 м3
ОТВЕТ: необходимо 470,2 м3 воздуха.
Советы:
Следствие из закона Авогадро: объемные соотношения газов равны их мольным соотношениям.
7.
Условие:
Углеводород содержит 81,82% углерода. Масса 1 л этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода, составьте его структурную формулу и назовите его.
Решение:
Найдем количество вещества неизвестного углеводорода:
Вычислим молярную массу углеводорода:
Масса 1 моль углеводорода равна 44 г. Вычислим массу углерода, содержащегося в 1 моль углеводорода:
В 1 моль углеводорода содержится 36 г углерода и 44-36 = 8 г водорода. Молярная масса углерода равна 12, а водорода 1, то есть в 1 моль углеводорода содержится 36/12 = 3 моль углерода и 8 моль водорода.
Формула углеводорода C3H8, это пропан. Структурная формула: СН3-СН2-СН3
Структурная формула: СН3-СН2-СН3
Советы:
Молярный объём для всех газов при н.у. равен 22,4 л/моль
8.
Условие:
При сжигании 8,6 г углеводорода получили 26,4 г оксида углерода (IV) и 12,6 г воды. Найдите молекулярную формулу этого углеводорода, если его плотность по отношению к воздуху равна 2,966. Напишите структурные формулы всех изомеров углеводорода и назовите их.
Решение:
Советы:
Количество вещества атомов углерода в углеводороде равняется количеству вещества молекул углекислого газа. Количнствл вещества атомов водорода в 2 раза больше, чем количество вещества молекул воды, так как в молекуде воды 2 атома водорода.
Тестовые задания
Условие:
- Гомологом метана является углеводород: 1) C2h5, 2) C6H6, 3) C3H8, 4) C2h3
- Изомерами являются: 1) этан и бутан, 2) 2-метилпропан и бутан, 3) метан и этан, 4) пропан и бутан
- Углеводород, стуктурная формула которого
называют: 1) 2-метибутаном, 2) 2-этилпропаном, 3) 1,2 — диметилпропаном, 4) 3-метилбутаном
Решение:
1 — 3)
2 — 2)
3 — 1)
Советы:
Гомологи – это вещества близкие по строению и свойствам, которые отличаются на одну или несколько групп – СН2.
Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства.
Гомология и изомерия. Подробное описание. Примеры. Гомологи. Изомеры
Для изучения гомологии и изомерии необходимо знать Теорию А.М. Бутлерова:
- Атомы в молекулах соединены друг с другом согласно их валентности, порядок распределения связей в молекуле называется химическим строением.
- Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
- Свойства веществ зависят не только от их состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
- Атомы в молекулах оказывают влияние друг на друга и это влияние приводит к химическим изменениям поведения атома.
- Определить состав и строение химического вещества можно по продуктам химических превращений.
Гомологи — это соединения, которые сходны по строению и химическим свойствам, но отличаются по составу молекул на одну или несколько групп CH2, которая называется гомологичной разницей.
Гомологи образуют гомологичные ряды. Гомологический ряд — это ряд соединений, сходных по своему строению и химическим свойствам, которые отличаются друг от друга по составу молекул на одну или несколько гомологичных разниц CH2.
Изомерия- это явление существования веществ, имеющих одинаковый качественный и количественный состав, но различное строение и разные свойства.
В основе изомерии, как показал автор Теории, лежит различие в строении молекул, имеющих одинаковый набор атомов.
РАЗЛИЧАЮТ НЕСКОЛЬКО ВИДОВ ИЗОМЕРИИ:
Структурные изомеры— соединения одинакового состава, отличающиеся химическим строением.
Пространственная изомерия (стереоизомерия) обусловлена различным пространственным расположением атомов при одинаковом порядке их связывания.
Различают две формы.
1. Геометричекая (цис-, транс-изомерия)
малеиновая кислота фумаровая кислота
Наиболее устойчивы транс-изомеры, поэтому в природе они наиболее распространены.
цис-форма транс-форма
Цис-форма – 2 заместителя расположены по одну сторону плоскости двойной связи.
Транс-форма – 2 заместителя расположены по разные стороны плоскости двойной связи.
гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах.
Органическая химия — раздел химии, в котором изучают соединения углерода, их строение, свойства, взаимопревращения.
Само название дисциплины — «органическая химия» — возникло достаточно давно. Причина его кроется в том, что большинство соединений углерода, с которыми сталкивались исследователи на начальном этапе становления химической науки, имели растительное или животное происхождение. Тем не менее, в порядке исключения, отдельные соединения углерода относят к неорганическим. Так, например, неорганическими веществами принято считать оксиды углерода, угольную кислоту, карбонаты, гидрокарбонаты, циановодород и некоторые другие.
Тем не менее, в порядке исключения, отдельные соединения углерода относят к неорганическим. Так, например, неорганическими веществами принято считать оксиды углерода, угольную кислоту, карбонаты, гидрокарбонаты, циановодород и некоторые другие.
В настоящее время известно чуть менее 30-ти миллионов разнообразных органических веществ и этот список непрерывно пополняется. Такое огромное число органических соединений связано, прежде всего, со следующими специфическими свойствами углерода:
1) атомы углерода могут соединяться друг с другом в цепи произвольной длины;
2) возможно не только последовательное (линейное) соединение атомов углерода между собой, но также разветвленное и даже циклическое;
3) возможны разные виды связей между атомами углерода, а именно одинарные, двойные и тройные. При этом валентность углерода в органических соединениях всегда равна четырем.
Помимо этого, большому разнообразию органических соединений способствует также и то, что атомы углерода способны образовывать связи и с атомами многих других химических элементов, например, водородом, кислородом, азотом, фосфором, серой, галогенами. При этом водород, кислород и азот встречаются наиболее часто.
При этом водород, кислород и азот встречаются наиболее часто.
Следует отметить, что довольно долго органическая химия представляла для ученых «темный лес». Какое-то время в науке даже была популярна теория витализма, согласно которой органические вещества не могут быть получены «искусственным» способом, т.е. вне живой материи. Однако теория витализма просуществовала не очень долго, ввиду того что одно за одним обнаруживались вещества, синтез которых возможен вне живых организмов.
У исследователей вызывало недоумение то, что многие органические вещества имеют одинаковый качественный и количественный состав, однако часто обладают совершенно непохожими друг на друга физическими и химическими свойствами. Так, например, диметиловый эфир и этиловый спирт имеют абсолютно одинаковый элементный состав, однако диметиловый эфир в обычных условиях представляет собой газ, а этиловый спирт – жидкость. Кроме того, диметиловый эфир с натрием не реагирует, а этиловый спирт взаимодействует с ним, выделяя газообразный водород.
Исследователями XIX века было выдвинуто множество предположений касательно того, как все-таки устроены органические вещества. Существенно важные предположения были выдвинуты немецким ученым Ф.А.Кекуле, который первый высказал идею о том, что атомы разных химических элементов имеют конкретные значения валентностей, а атомы углерода в органических соединениях четырехвалентны и способны объединяться друг с другом, образуя цепи. Позднее, отталкиваясь от предположений Кекуле, российский ученый Александр Михайлович Бутлеров разработал теорию строения органических соединений, которая не потеряла свою актуальность и в наше время. Рассмотрим основные положения этой теории:
1) все атомы в молекулах органических веществ соединены друг с другом в определенной последовательности в соответствии с их валентностью. Атомы углерода имеют постоянную валентность, равную четырем, и могут образовывать друг с другом цепи различного строения;
2) физические и химические свойства любого органического вещества зависят не только от состава его молекул, но также и от порядка соединения атомов в этой молекуле между собой;
3) отдельные атомы, а также группы атомов в молекуле оказывают влияние друг на друга. Такое взаимное влияние отражается в физических и химических свойствах соединений;
Такое взаимное влияние отражается в физических и химических свойствах соединений;
4) исследуя физические и химические свойства органического соединения можно установить его строение. Верно также обратное – зная строение молекулы того или иного вещества, можно спрогнозировать его свойства.
Аналогично тому, как периодический закон Д.И.Менделева стал научным фундаментом неорганической химии, теория строения органических веществ А.М. Бутлерова фактически стала отправной точкой в становлении органической химии как науки. Следует отметить, что после создания теории строения Бутлерова органическая химия начала свое развитие очень быстрыми темпами.
Изомерия и гомология
Согласно второму положению теории Бутлерова, свойства органических веществ зависят не только от качественного и количественного состава молекул, но и от порядка соединения атомов в этих молекулах между собой.
В связи с этим, среди органических веществ широко распространено такое явление как изомерия.
Изомерия – явление, когда разные вещества имеют абсолютно одинаковый состав молекул, т.е. одинаковую молекулярную формулу.
Очень часто изомеры сильно отличаются по физическим и химическим свойствам. Например:
Типы изомерии
Структурная изомерия
а) Изомерия углеродного скелета
б) Изомерия положения:
кратной связи
заместителей:
функциональных групп:
в) Межклассовая изомерия:
Межклассовая изомерия имеет место, когда соединения, являющиеся изомерами, относятся к разным классам органических соединений.
Пространственная изомерия
Пространственная изомерия — явление, когда разные вещества при одинаковом порядке присоединения атомов друг к другу отличаются друг от друга фиксировано-различным положением атомов или групп атомов в пространстве.
Существует два типа пространственной изомерии – геометрическая и оптическая. Задания на оптическую изомерию на ЕГЭ не встречаются, поэтому рассмотрим только геометрическую.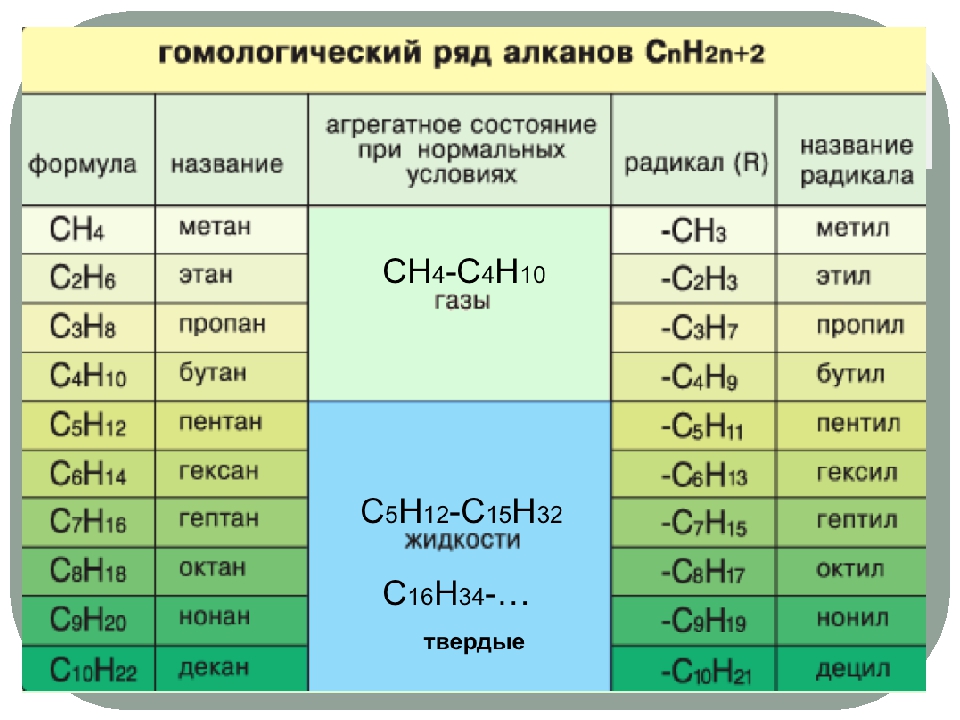
Если в молекуле какого-либо соединения есть двойная C=C связь или цикл, иногда в таких случаях возможно явление геометрической или цис-транс-изомерии.
Например, такой вид изомерии возможен для бутена-2. Смысл ее заключается в том, что двойная связь между атомами углерода фактически имеет плоское строение, а заместители при этих атомах углерода могут фиксированно располагаться либо над, либо под этой плоскостью:
Когда одинаковые заместители находятся по одну сторону плоскости говорят, что это цис-изомер, а когда по разные — транс-изомер.
На в виде структурных формул цис- и транс-изомеры (на примере бутена-2) изображают следующим образом:
Отметим, что геометрическая изомерия невозможна в случае, если хотя бы у одного атома углерода при двойной связи будет два одинаковых заместителя. Так, например, цис-транс-изомерия невозможна для пропена:
Пропен не имеет цис-транс-изомеров, так как при одном из атомов углерода при двойной связи два идентичных «заместителя» (атомы водорода)
Как можно видеть из иллюстрации выше, если поменять местами метильный радикал и атом водорода, находящиеся при втором углеродном атоме, по разные стороны плоскости, мы получим ту же самую молекулу, на которую просто посмотрели с другой стороны.
Влияние атомов и групп атомов друг на друга в молекулах органических соединений
Понятие о химической структуре как о последовательности связанных друг с другом атомов было существенно расширено с появлением электронной теории. С позиций данной теории можно объяснить, каким образом атомы и группы атомов в молекуле оказывают влияние друг на друга.
Различают два возможных способа влияния одних участков молекулы на другие:
1) Индуктивный эффект
2) Мезомерный эффект
Индуктивный эффект
Для демонстрации данного явления возьмем для примера молекулу 1-хлорпропана (CH3CH2CH2Cl). Связь между атомами углерода и хлора является полярной, поскольку хлор имеет намного более высокую электроотрицательность по сравнению с углеродом. В результате смещения электронной плотности от атома углерода к атому хлора на атоме углерода формируется частичный положительный заряд (δ+), а на атоме хлора — частичный отрицательный (δ-):
Смещение электронной плотности от одного атома к другому часто обозначают стрелкой, направленной к более электроотрицательному атому:
Однако, интересным является такой момент, что, кроме смещения электронной плотности от первого атома углерода к атому хлора, также имеет место смещение, но в несколько меньшей степени от второго атома углерода к первому, а также от третьего ко второму:
Такое смещение электронной плотности по цепи σ-связей называют индуктивным эффектом (I). Данный эффект затухает по мере удаления от влияющей группы и уже практически не проявляется после 3 σ-связей.
В случае, когда атом или группа атомов обладают большей электроотрицательностью по сравнению с атомами углерода, говорят, что такие заместители обладают отрицательным индуктивным эффектом (-I). Таким образом, в рассмотренном выше примере отрицательным индуктивным эффектом обладает атом хлора. Кроме хлора, отрицательным индуктивным эффектом обладают следующие заместители:
–F, –Cl, –Br, –I, –OH, –NH2, –CN, –NO2, –COH, –COOH
Если электроотрицательность атома или группы атомов меньше электроотрицательности атома углерода, фактически происходит передача электронной плотности от таких заместителей к углеродным атомам. В таком случае говорят, что заместитель обладает положительным индуктивным эффектом (+I) (является электронодонорным).
Так, заместителями с +I-эффектом являются предельные углеводородные радикалы. При этом выраженность +I-эффекта возрастает с удлинением углеводородного радикала:
–CH3, –C2H5, –C3H7, –C4H9
Следует отметить, что атомы углерода, находящиеся в разных валентных состояниях, обладают также и разной электроотрицательностью. Атомы углерода в состоянии sp-гибридизации имеют большую электроотрицательность по сравнению с атомами углерода в состоянии sp2-гибридизации, которые, в свою очередь, более электроотрицательны, чем атомы углерода в состоянии sp3-гибридизации.
Мезомерный эффект (М), или эффект сопряжения, — влияние заместителя, передаваемое по системе сопряженных π-связей.
Знак мезомерного эффекта определяется по тому же принципу, что и знак индуктивного эффекта. Если заместитель увеличивает электронную плотность в сопряженной системе, он обладает положительным мезомерным эффектом (+М) и является электронодонорным. Положительным мезомерным эффектом обладают двойные углерод-углеродные связи, заместители, содержащие неподеленную электронную пару: -NH2, -OН, галогены.
Отрицательным мезомерным эффектом (–М) обладают заместители, оттягивающие электронную плотность от сопряженной системы, при этом электронная плотность в системе уменьшается.
Отрицательным мезомерным эффектом обладают группы:
–NO2, –COOH, –SO3H, -COH, >C=O
За счет перераспределения электронной плотности за счет мезомерного и индуктивного эффектов в молекуле на некоторых атомах появляются частичные положительные или отрицательные заряды, что имеет отражение в химических свойствах вещества.
Графически мезомерный эффект показывают изогнутой стрелкой, которая начинается в центре электронной плотности и завершается там, куда смещается электронная плотность. Так, например, в молекуле хлористого винила мезомерный эффект возникает при сопряжении неподеленной электронной пары атома хлора, с электронами π-связи между углеродными атомами. Таким образом, в результате этого на атоме хлора появляется частичный положительный заряд, а обладающее подвижностью π-электронное облако под воздействием электронной пары смещается в сторону крайнего атома углерода, на котором возникает вследствие этого частичный отрицательный заряд:
Если в молекуле имеются чередующиеся одинарные и двойные связи, то говорят, что молекула содержит сопряженную π-электронную систему. Интересным свойством такой системы является то, что мезомерный эффект в ней не затухает.
Все о гомологе и изомере! — ChemSimplified
Наряду с знанием основных функциональных групп, которые присутствуют в органических соединениях, высока вероятность того, что вы столкнетесь с этими двумя концепциями: гомологичный ряд и изомерия. Гомологический ряд (для краткости гомолог) подобен семье, состоящей из братьев и сестер, обладающих одинаковыми / похожими чертами. Например, самый основной гомологический ряд состоит из неразветвленного алкана. Ознакомьтесь со списком первых 10 братьев и сестер ниже.
Заметили, что их структура выглядит примерно так же? Единственная разница между одним родным братом и другим — это дополнительный CH 2 .Это одна из характеристик, определяющих гомолог. Кроме того, гомологи имеют одну и ту же функциональную группу и общую формулу (C n H 2n + 2 в нашем случае неразветвленного алкана).
Так как их структура настолько схожа, что они имеют довольно похожие физические свойства, такие как точка кипения, точка плавления, физические состояния, плотность и т. Д. Проверьте их точку кипения и физическое состояние:
Очень похоже, не правда ли? т это? Можно с уверенностью сказать, что температура кипения обычно повышается примерно на 20-30 ° C для каждого дополнительного углерода в гомологичном ряду.Вы сможете наблюдать некоторую тенденцию, когда дело касается физических свойств гомологов. Это похоже на то, как если бы вы замечали, что у всех братьев и сестер в семье вьющиеся волосы, а с возрастом они становятся длиннее. Таким образом, у младшего брата и сестры самые короткие вьющиеся волосы, а у старшего брата самые длинные вьющиеся волосы. (Не стреляйте в меня, если у вас есть знания в области генетики. Я просто пытаюсь придумать аналогию, чтобы помочь понять смысл.) [Если у вас есть лучшая аналогия, я весь в глазах, напишите это в комментариях ниже.;-)]
Гомологи также имеют сходные химические свойства. Например, алканы сжигаются с кислородом с образованием диоксида углерода и воды. Однако по мере увеличения размера алкана горение становится все труднее. Тем не менее, существует тенденция их химической реакции с кислородом. Другой пример — поскольку алканы являются неполярными молекулами, они обычно не реагируют с ионными соединениями. Это все равно, что сказать: братья и сестры обычно не любят сладкое, поэтому большинство из них избегают конфет, печенья, тортов или чего-нибудь сладкого.Младший может однажды съесть конфету в синюю луну, но старшие не станут даже подходить к сладостям. Безумно правда? Кто не любит сладкое? Я отвлекся, во всяком случае, вы меня уловили.
Все эти разговоры о гомологах и их характеристиках резюмируются здесь:
Хорошо, если у вас есть гомолог. Тогда как насчет изомера? Я могу суммировать их в двух пунктах:
Конечно, на этом (базовом химическом) уровне изомеры, о которых мы говорим, относятся к конституциональному изомеру.Не беспокойтесь об этом, если вы никогда о них не слышали. Но, если вам интересно, вы можете узнать больше о том, как можно классифицировать изомеры и где подходит конституционный изомер. Чтобы определить изомеры, вам необходимо иметь возможность подсчитать количество атомов, присутствующих для каждого элемента в соединении. а также сможете увидеть, подключены ли они по-разному. Если вам нужно напомнить о подсчете атомов, вы можете прочитать об этом здесь.
Если вам хочется посмотреть, как я прохожу через каждую из точек, определяющих гомолог и изомер, вы можете посмотреть это здесь:
Итак, в любом случае, что, если вам нужно классифицировать данный набор соединений на гомолог или изомер , или это одно и то же соединение или нет? Не волнуйся, я тебя прикрыл.Просто используйте эту простую блок-схему, и вы сможете классифицироваться как босс!
Посмотрите, как я прохожу по блок-схеме здесь:
Готовы проверить свои навыки? Каждое упражнение сосредоточено на 1 наборе соединений и состоит из 5 вопросов. Щелкни прочь!
Структурная изомерия в органических молекулах
На этой странице объясняется, что такое структурная изомерия, и рассматриваются некоторые из различных способов возникновения структурных изомеров.
Что такое структурная изомерия?
Изомеры — это молекулы, которые имеют одинаковую молекулярную формулу, но имеют другое расположение атомов в пространстве.Это исключает любые другие устройства, которые возникают просто из-за вращения молекулы как целого или вращения вокруг определенных связей. Например, обе следующие молекулы являются одной и той же молекулой. Они не изомеры. Оба бутана.
Существует также бесконечное количество других возможных способов, которыми эта молекула может скручиваться. Вокруг всех одинарных углерод-углеродных связей происходит полностью свободное вращение. Если бы перед вами была модель молекулы, вам пришлось бы разобрать ее на части и перестроить, если вы хотите сделать изомер этой молекулы.Если вы можете создать явно другую молекулу, просто вращая одинарные связи, это не будет отличаться — это все та же молекула.
При структурной изомерии атомы располагаются совершенно в другом порядке. В этом легче убедиться на конкретных примерах. Далее рассматриваются некоторые способы возникновения структурных изомеров. Названия различных форм структурной изомерии, вероятно, не имеют большого значения, но вы должны знать о различных возможностях, когда приступаете к рисованию изомеров.
Цепная изомерия
Эти изомеры возникают из-за возможности разветвления в углеродных цепях. Например, есть два изомера бутана, \ (C_4H_ {10} \). В одном из них атомы углерода образуют «прямую цепь», а в другом — разветвленную.
Будьте осторожны, чтобы не нарисовать «ложные» изомеры, которые являются просто скрученными версиями исходной молекулы. Например, эта структура представляет собой версию бутана с прямой цепью, вращающуюся вокруг центральной углерод-углеродной связи.
Это легко увидеть на модели. Это пример, который мы уже использовали в верхней части этой страницы.
Пример 1. Цепные изомеры в пентане
Пентан, C 5 H 12 , имеет три цепных изомера. Если вы думаете, что можете найти какие-то другие, это просто искаженные версии приведенных ниже. Если сомневаетесь, сделайте несколько моделей.
Позиционная изомерия
При позиционной изомерии основной углеродный скелет остается неизменным, но важные группы перемещаются по нему.
Пример 2: Позиционные изомеры в C 5 H 12
Например, есть два структурных изомера с молекулярной формулой C3H7Br. В одном из них атом брома находится на конце цепи, а в другом — в середине.
Если вы создали модель, вы не сможете повернуть одну молекулу, чтобы превратить ее в другую. Вам придется отломать бром от конца и снова прикрепить его посередине.В то же время вам придется переместить водород из середины в конец.
Другой подобный пример встречается в спиртах, таких как \ (C_4H_9OH \)
Это единственные две возможности, при условии, что вы придерживаетесь четырехуглеродной цепи, но нет причин, по которым вы должны это делать. Вы легко можете получить смесь изомерии цепи и изомерии положения — вы не ограничены ни одним, ни другим.
Итак, два других изомера бутанола:
Вы также можете получить изомеры положения на бензольных кольцах.Рассмотрим молекулярную формулу \ (C_7H_7Cl \). В зависимости от положения атома хлора вы можете получить четыре разных изомера. В одном случае он присоединен к атому углерода боковой группы, а затем есть три других возможных положения, которые он может иметь вокруг кольца — рядом с группой \ (CH_3 \), следующее за ним — с группой \ (CH_3 \ ) или напротив группы \ (CH_3 \).
Изомерия функциональных групп
В этом разнообразии структурной изомерии изомеры содержат разные функциональные группы, то есть они принадлежат к разным семействам соединений (разным гомологическим рядам).
Пример 3: Изомеры в C 3 H 6 O
Молекулярная формула \ (C_3H_6O \) может представлять собой пропаналь (альдегид) или пропанон (кетон).
Есть и другие возможности для этой же молекулярной формулы — например, у вас может быть двойная связь углерод-углерод (алкен) и группа -ОН (спирт) в одной и той же молекуле.
Другой распространенный пример иллюстрируется молекулярной формулой \ (C_3H_6O_2 \).Среди нескольких структурных изомеров этого — пропановая кислота (карбоновая кислота) и метилэтаноат (сложный эфир).
Структурные изомеры: определение и примеры — класс стандартизированных испытаний [видео 2021 года]
Изомеры цепи
Изомеры цепи состоят из двух или более атомов углерода или других соединений с одинаковой молекулярной формулой, но с различным расположением атомов или разветвлений. Представьте себе удаление одного углеродного соединения и его присоединений из цепи и присоединение их к другому углеродному соединению внутри цепи.
Например, пентан, имеющий молекулярную формулу C5 h22, имеет три различных изомера цепи. На следующей иллюстрации вы увидите, что пентан и изопентан являются изомерами цепи друг друга.
Когда мы меняем группу Ch4 пентана, которая обведена красным кружком, на атом водорода в углеродной цепи, мы получим цепной изомер: изопентан.
Ниже приводится пример неопентана, другого цепного изомера пентана.
Неопентан образуется в результате обмена Ch4 слева на атом H, который обведен красным, а также другой группы Ch4 справа на атом H, обведенный синим. Переключая группы водорода и Ch4 в пентановой цепи, мы меняем способ связи атомов друг с другом. Здесь мы видим все три цепных изомера пентана.
Изомеры цепи относятся не только к углеродным группам в цепи, но также и к различным атомам, которые могут присутствовать в цепи.Давайте посмотрим на 2-бромбутан, который имеет бромную (Br) группу в цепи.
Изменяя способ присоединения атомов углерода, водорода и брома к цепи, мы можем получить следующие цепные изомеры 1-бромбутана.
Изомеры функциональных групп
Молекулы классифицируются по их функциональным группам или группам атомов или связей с уникальными химическими и физическими качествами.Давайте посмотрим на некоторые функциональные группы, где R и R ‘- боковые группы, состоящие из углерода, водорода и / или других элементов. Например, если к молекуле присоединена функциональная группа CH = O (карбонил), то эта молекула классифицируется как альдегид. Если к молекуле присоединена функциональная группа -ОН (гидроксил), то эта молекула классифицируется как спирт.
Изомеры функциональных групп имеют одинаковую молекулярную формулу, но разные функциональные группы в цепи.Например, этиловый спирт и диметиловый эфир имеют одинаковую химическую формулу, но разные функциональные группы, которые обведены синим кружком.
Этиловый спирт имеет гидроксильную группу (R-OH) и группу диметилового эфира (R-O-R ‘). Другие примеры изомеров функциональных групп включают ацетон, который представляет собой кетон, и пропаналь, альдегид. Они оба имеют одинаковую химическую формулу, но их функциональные группы разные.
Позиционные изомеры
Вернемся к одной из наших структурных блоков и добавим флаг.Каждый раз, когда мы пересматриваем нашу структуру, мы оставляем расположение блоков нетронутым и меняем только флаг. Позиционные изомеры похожи в том, что все остается неизменным, кроме положения важной функциональной группы, в данном случае флага. Позиционные изомеры имеют одинаковый углеродный скелет, но только функциональная группа или заместитель, которым является любой атом или группа атомов, меняет положение.
На следующем изображении показаны позиционные изомеры аминофенола.
Здесь положение заместителя -Nh3 в кольце изменяется. Пропилбромид и изопропилбромид также являются изомерами положения с тремя атомами углерода в углеродной цепи. Каждое ребро цепи представляет собой один атом углерода, который остается неизменным; единственное, что меняется, — это положение брома в цепи.
Итоги урока
Давайте рассмотрим. Структурные изомеры имеют одинаковую молекулярную формулу, но разное расположение атомов.Существует три типа структурных изомеров: изомеры цепей, изомеры функциональных групп и изомеры положения. Изомеры цепей имеют одинаковую молекулярную формулу, но разное расположение или разветвления. Изомеры функциональных групп имеют одинаковую формулу, но разные функциональные группы. Эти функциональные группы состоят из различных групп атомов, которые расположены определенным образом и придают молекуле ее уникальные характеристики. Позиционные изомеры имеют одинаковое количество атомов углерода в цепи, но расположение заместителя, которым может быть атом или функциональная группа, отличается в цепи.
Структурные изомеры — ключевые термины и их значения
- Структурные изомеры : имеют одинаковую молекулярную формулу, но разное расположение атомов
- Изомеры цепей : имеют одинаковую молекулярную формулу, но содержат разное расположение / разветвления
- Изомеры функциональных групп : имеют одинаковую формулу, но разные функциональные группы
- Функциональные группы : состоят из различных групп атомов, расположенных определенным образом; они придают молекуле ее уникальные характеристики
- Позиционные изомеры : имеют одинаковое количество атомов углерода в цепи, но расположение заместителя в цепи отличается
Результаты обучения
К тому времени, когда вы закончите этот урок, вы расширите свои способности до:
- Предоставьте описание структурных изомеров
- Укажите три типа изомеров
- Сравнить изомеры функциональных групп с изомерами положения
Изомерия функциональных групп | Творческая химия
Что это?
Функциональная изомерия возникает, когда вещества имеют одинаковую молекулярную формулу, но разные функциональные группы.Это означает, что функциональные изомеры принадлежат к разным гомологическим рядам. Вы не встретите их на экзамене GCSE Chemistry, но вы встретите их на A Level.
Существует три изомера функциональных групп, о которых вам необходимо знать:
- спирты и простые эфиры
- альдегиды и кетоны
- кислоты карбоновые и сложные эфиры
Что здесь?
Вы можете увидеть модели:
- этанол и метоксиметан — изомеры функциональных групп C 2 H 6 O
- пропаналь и пропанон — изомеры функциональной группы C 3 H 6 O
- пропановая кислота и метилэтаноат — изомеры функциональных групп C 3 H 6 O 2
Это типичные молекулы, которые встречаются на A Level.Вы должны быть готовы идентифицировать изомеры функциональных групп для таких простых органических соединений, а также должны уметь давать им имена.
Дважды нажмите, чтобы остановить и перезапустить каждую анимацию.
×
этанол
Канал
3 Канал 2 ОН
метоксиметан
CH
3 OCH 3
Спирты и эфиры
Функциональной группой в спиртах является гидроксильная группа -ОН.
Функциональная группа в простых эфирах — R 1 –O – R 2 . Символы R 1 и R 2 представляют структуру остальной части молекулы:
- они могут быть одинаковыми или разными
- , если один из них представляет собой атом водорода, соединение содержит гидроксильную группу и не является эфиром.
R 1 и R 2 представляют собой метильные группы, -CH 3 в метоксиметане.
пропанал
Канал
3 Канал 2 Канал
пропанон
CH
3 COCH 3
Альдегиды и кетоны
Альдегиды и кетоны имеют карбонильную группу C = O.Эта функциональная группа может находиться на разных позициях:
- в альдегидах он присоединен к одному или двум атомам водорода.
- в кетонах он присоединен к двум атомам углерода.
пропановая кислота
Канал
3 Канал 2 Канал
метилэтаноат
КАНАЛ
3 КУХНЯ 3
Карбоновые кислоты и сложные эфиры
Имеют разные функциональные группы:
- карбоновые кислоты имеют карбоксильную группу -COOH
- сложные эфиры имеют функциональную группу R 1 COOR 2
Символы R 1 и R 2 представляют структуру остальной части молекулы:
- они могут быть одинаковыми или разными
- , если один из них представляет собой атом водорода, соединение содержит карбоксильную группу и не является сложным эфиром.
R 1 и R 2 представляют собой метильные группы -CH 3 в метилэтаноате.
Глава 7 — Алканы и галогенированные углеводороды — Химия
Глава 7: Алканы и галогенированные углеводороды
Этот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
Вступительное эссе
7.1 Распознавание органических структур
7.2 Введение в алканы
Алканы с прямой цепью
Алканы с разветвленной цепью
Циклоалканы
Классификация углеродных связей
7.3 Свойства алканов
Точки плавления и кипения
Растворимость
Свойства алканов и опасность для окружающей среды: внимательный взгляд
7.4 Химическая реакционная способность алканов
Реакции горения
Реакции галогенирования (Тип замещения)
Алканы для крекинга
7.5 Краткое содержание главы
7.6 Упражнения в конце главы
7.7 Ссылки
Вступительное эссе
Углеводороды — это простейшие органические соединения, но они обладают интересными физиологическими эффектами.Эти эффекты зависят от размера молекул углеводородов и от того, на каком участке тела или в теле они применяются. Алканы с низкой молярной массой — от 1 до примерно 10 или около того атомов углерода — представляют собой газы или легкие жидкости, которые действуют как анестетики. Вдыхание («нюхание») этих углеводородов в бензине или аэрозольных пропеллентах из-за их опьяняющего действия является серьезной проблемой для здоровья, которая может привести к повреждению печени, почек или мозга или к немедленной смерти от удушья из-за отсутствия кислорода. Канистры под давлением с пропаном и бутаном, оба из которых предназначены для использования в качестве топлива, используются как ингалянты.
Рисунок 7.1. Диапазон продуктов на нефтяной основе, которыми можно злоупотреблять в качестве ингалянтов . Автор фото: Лэнс Капрал. Мэтью К. Хакер
Проглоченные жидкие алканы в желудке не причиняют большого вреда. Однако в легких они вызывают «химическую» пневмонию, растворяя жироподобные молекулы клеточных мембран в крошечных воздушных мешочках (альвеолах). Легкие перестают выводить жидкость, как при пневмонии, вызванной бактериями или вирусами. Людей, которые проглотили бензин или другие смеси жидких алканов, не следует вызывать рвоту, поскольку это увеличивает вероятность попадания алканов в легкие.(Противоядия от отравления бензином в домашних условиях не существует; позвоните в токсикологический центр.)
Жидкие алканы, содержащие примерно 5–16 атомов углерода на молекулу, смывают натуральные кожные кожные масла и вызывают высыхание и растрескивание кожи, в то время как более тяжелые жидкие алканы (содержащие примерно 17 или более атомов углерода на молекулу) действуют как смягчающие вещества (смягчители кожи). В качестве защитной пленки можно использовать такие смеси алканов, как минеральное масло и вазелин. Вода и водные растворы, такие как моча, не растворяют такую пленку, что объясняет, почему вазелин защищает нежную кожу ребенка от опрелостей.
В этой главе мы исследуем алканы, соединения, содержащие только два элемента, углерод и водород, и имеющие только одинарные связи. Мы также будем исследовать алканы, в структуру которых входят галогены. Напомним, что галогены являются элементами семейства 7A периодической таблицы Менделеева и содержат репрезентативные элементы, такие как хлор, фтор, йод и бром. Есть несколько других видов углеводородов, различающихся типом связи между атомами углерода и свойствами, возникающими в результате этой связи.В главе 8 мы рассмотрим углеводороды с двойными связями, с тройными связями и с особым видом связи, называемым ароматичностью . Затем в главе 9 мы изучим некоторые соединения, которые считаются производными от углеводородов, путем замены одного или нескольких атомов водорода кислородсодержащей группой. Глава 10 посвящена органическим кислотам и основаниям.
(Вернуться к началу)
7.1 Распознавание органических структур
Цель обучения
- Чтобы уметь распознавать состав и свойства, типичные для органических и неорганических соединений.
Ученые 18-го и начала 19-го веков изучали соединения, полученные из растений и животных, и назвали их органическими , поскольку они были изолированы от «организованных» (живых) систем. Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были помечены как неорганические . В течение многих лет ученые считали, что органические соединения могут производиться только живыми организмами, потому что они обладают жизненной силой, присущей только живым системам.Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Велер синтезировал мочевину из неорганических исходных материалов. Он прореагировал цианатом серебра (AgOCN) и хлоридом аммония (NH 4 Cl), ожидая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
AgOCN + NH 4 Cl → AgCl + NH 4 OCN
Вместо этого он обнаружил, что продукт представляет собой мочевину (NH 2 CONH 2 ), хорошо известное органическое вещество, легко выделяемое из мочи.Этот результат привел к серии экспериментов, в которых из неорганических исходных материалов были получены самые разные органические соединения. Теория жизненной силы постепенно исчезла, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Сегодня органическая химия была реклассифицирована как изучение соединений, содержащих углерод, а неорганическая химия — это изучение химии всех других элементов. Может показаться странным, что мы разделяем химию на две ветви — одну, которая рассматривает соединения только одного элемента, и другую, которая охватывает более 100 оставшихся элементов.Однако такое разделение кажется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.
Примечание
Слово органический имеет разные значения. Органические удобрения, такие как коровий навоз, являются органическими в первоначальном смысле; он получен из живых организмов. Органические продукты — это, как правило, продукты, выращенные без синтетических пестицидов и удобрений. Органическая химия — это химия соединений углерода.Углерод уникален среди других элементов тем, что его атомы могут образовывать стабильные ковалентные связи друг с другом и с атомами других элементов во множестве вариаций. Полученные молекулы могут содержать от одного до миллионов атомов углерода.
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах между органическими и неорганическими молекулами. Тем не менее, полезно сравнить типичных членов каждого класса, как показано в таблице 7.1 (Однако имейте в виду, что для каждой категории в этой таблице есть исключения.) Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, в таблице 7.1 также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органическое соединение гексан (C 6 H 14 ), растворитель, который используется для экстракции соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в таблице 7.1.
Таблица 7.1 Общие контрастные свойства и примеры органических и неорганических соединений
Упражнения по обзору концепции: нажмите, чтобы ответить на вопросы
Ключевые вынос
- Органическая химия — это изучение соединений углерода, почти все из которых также содержат атомы водорода.
Дополнительная практика
Классифицируйте каждое соединение как органическое или неорганическое.
- С 6 В 10
- CoCl 2
- С 12 В 22 О 11
Классифицируйте каждое соединение как органическое или неорганическое.
- CH 3 NH 2
- NaNH 2
- Cu (NH 3 ) 6 Класс 2
Какой член каждой пары имеет более высокую температуру плавления?
- CH 3 OH и NaOH
- CH 3 Cl и KCl
Какой член каждой пары имеет более высокую температуру плавления?
- C 2 H 6 и CoCl 2
- CH 4 и LiH
Ответы на нечетные вопросы:
- органические
- неорганическое
- органический
(Вернуться к началу)
7.2 Введение в алканы
Алканы — это органические соединения, которые полностью состоят из одинарных атомов углерода и водорода и лишены каких-либо других функциональных групп. Алканы имеют общую формулу C n H 2n +2 и могут быть подразделены на следующие три группы: линейные алканы с прямой цепью, разветвленные алканы и циклоалканы (рис. 7.2). Алканы также представляют собой насыщенных углеводородов, , то есть все атомы углерода «насыщены» атомами водорода и не содержат никаких углерод-углеродных двойных или тройных связей.Алканы — это простейшие и наименее химически активные углеводородные соединения, содержащие только углерод и водород. Они имеют большое коммерческое значение, поскольку являются основным компонентом бензина и смазочных масел и широко используются в органической химии; хотя роль чистых алканов (таких как гексаны) делегируется в основном растворителям. Отличительной чертой алкана, отличающей его от других соединений, которые также содержат исключительно углерод и водород, является отсутствие ненасыщенности.Другими словами, он не содержит двойных или тройных связей, которые обладают высокой реакционной способностью в органической химии. Хотя они не полностью лишены реакционной способности, их отсутствие реакционной способности в большинстве лабораторных условий делает их относительно неинтересным, но очень важным компонентом органической химии. Как вы узнаете позже, энергия, заключенная в углерод-углеродной связи и углерод-водородной связи, довольно высока, и их быстрое окисление производит большое количество тепла, обычно в форме огня.
Рисунок 7.2. Примеры алканов
Алканы с прямой цепью
Алканы с прямой цепью, метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) представляют собой начало ряда соединений, в которых любые два члены в последовательности отличаются одним атомом углерода и двумя атомами водорода, а именно единицей CH 2 (рис. 7.3)
Рисунок 7.3 Три простейших алкана
Первые 10 членов этой серии приведены в таблице 7.2. Обратите внимание, что по мере увеличения длины углеродной цепи количество возможных различных структурных изомеров также увеличивается.
Таблица 7.2 Первые 10 алканов с прямой цепью
Начиная с пропана (C 3 H 8) и далее, вы заметите, что единственное различие между углеводородами с более длинной цепью заключается в добавлении единиц CH 2 по мере продвижения вверх по ряду (рис.7.4). Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа CH 2 ), называется гомологической серией и может быть определено математически. Члены такой серии называли гомологами . В органической химии гомологи обладают свойствами, которые изменяются закономерно и предсказуемо. Таким образом, принцип гомологии обеспечивает организацию органической химии во многом так же, как периодическая таблица дает организацию неорганической химии.Вместо ошеломляющего множества отдельных углеродных соединений мы можем изучить несколько членов гомологического ряда и из них вывести некоторые свойства других соединений в этом ряду.
Рисунок 7.4 Члены гомологической серии
Обратите внимание, что на рис. 7.4 каждая следующая формула включает на один атом углерода и на два атома водорода больше, чем предыдущая формула. Принцип гомологии позволяет нам написать общую формулу для алканов: C n H 2 n + 2 .Используя эту формулу, мы можем написать молекулярную формулу для любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Упражнения по обзору концепции
В гомологическом ряду алканов, какова молекулярная формула члена чуть выше C 8 H 18 ?
Используйте общую формулу алканов, чтобы написать молекулярную формулу алкана с 12 атомами углерода.
Алканы с разветвленной цепью
Мы можем записать структуру бутана (C 4 H 10 ), разместив четыре атома углерода в ряд,
–C – C – C – C–
, а затем добавив достаточно атомов водорода, чтобы каждый атом углерода получил четыре связи:
Составной бутан имеет такую структуру, но есть другой способ соединить вместе 4 атома углерода и 10 атомов водорода. Поместите 3 атома углерода в ряд, а затем ответвите четвертый атом от среднего атома углерода:
Теперь мы добавляем достаточно атомов водорода, чтобы у каждого углерода четыре связи.
Существует углеводород, который соответствует этой структуре, что означает, что два разных соединения имеют одинаковую молекулярную формулу (C 4 H 10 ), но разное расположение атомов в пространстве. Напомним, что соединения, имеющие ту же молекулярную формулу, но другое расположение в пространстве, называются структурными изомерами . Структурные изомеры обладают разными химическими и физическими свойствами. На рис. 7.5 показана модель шара и стержня для бутана с прямой цепью и разветвленного изомера изобутана.
Рис. 7.5 Бутан и изобутан. Шариковые модели этих двух соединений показывают, что они являются изомерами; оба имеют молекулярную формулу C 4 H 10 .
Обратите внимание, что C 4 H 10 изображен с изогнутой цепью на рисунке 7.5. Цепь из четырех атомов углерода может быть изогнута по-разному, поскольку группы могут свободно вращаться вокруг связей C – C. Однако это вращение не меняет идентичности соединения.Важно понимать, что изгиб цепи , а не не изменяет идентичность соединения; все следующие элементы представляют собой одно и то же соединение:
Формула изобутана показывает непрерывную цепочку только из трех атомов углерода, с четвертым присоединенным как ответвление от среднего атома углерода непрерывной цепи.
В отличие от C 4 H 10 , соединения метана (CH 4 ), этана (C 2 H 6 ) и пропана (C 3 H 8 ) не существуют в изомерных формы, потому что существует только один способ расположить атомы в каждой формуле так, чтобы каждый атом углерода имел четыре связи.
Примечание
Непрерывную (неразветвленную) цепочку атомов углерода часто называют прямой цепью , хотя тетраэдрическое расположение каждого углерода придает ей зигзагообразную форму. Алканы с прямой цепью иногда называют нормальными алканами , и их названия получают с префиксом n -. Например, бутан называется n -бутан.
Упражнения по обзору концепции
В алканах может быть двухуглеродная ветвь от второго углеродного атома четырехуглеродной цепи? Объяснять.
Студента просят написать структурные формулы для двух разных углеводородов, имеющих молекулярную формулу C 5 H 12 . Она пишет одну формулу со всеми пятью атомами углерода в горизонтальной линии, а другую с четырьмя атомами углерода в линию, с группой CH 3 , идущей вниз от первого, присоединенной к третьему атому углерода. Представляют ли эти структурные формулы разные молекулярные формулы? Объясните, почему да или почему нет.
Ответы
Нет; ветвь будет самой длинной непрерывной цепочкой из пяти атомов углерода.
Нет; оба представляют собой пятиуглеродные непрерывные цепи.
Ключевые вынос
- Алканы с четырьмя или более атомами углерода могут существовать в изомерных формах.
Упражнения
Кратко опишите важные различия между алканом с прямой цепью и алканом с разветвленной цепью.
Изобразите структурные изомеры следующих алканов.
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
Канал 3 Канал 2 Канал 2 Канал 3 и
Канал 3 Канал 2 Канал 2 Канал 2 Канал 3 и
Ответы
Алканы с прямой цепью и алканы с разветвленной цепью имеют разные свойства, а также разную структуру.
Дополнительная практика
Напишите сжатую структурную формулу для каждой структурной формулы.
Конденсированная структурная формула для изогексана может быть записана как (CH 3 ) 2 CHCH 2 CH 2 CH 3 . Нарисуйте формулу линейного угла для изогексана.
Нарисуйте формулу линейного угла для соединения CH 3 CH 2 CH (CH 3 ) CH 2 CH 2 CH 3 .
Приведите структурную формулу соединения, представленного этой формулой линейного угла:
(Вернуться к началу)
Циклоалканы
Циклоалканы очень важны в компонентах продуктов питания, фармацевтических препаратов и многого другого.Однако, чтобы использовать циклоалканы в таких приложениях, мы должны знать эффекты, функции, свойства и структуру циклоалканов. Циклоалканы — это алканы, имеющие форму кольца; следовательно, для названия этих алканов используется префикс цикло . Стабильные циклоалканы не могут быть образованы с углеродными цепями любой длины. Напомним, что в алканах углерод принимает тетраэдрическую геометрию, в которой углы между связями составляют 109,5 °.
Источник: Википедия
Для образования некоторых циклоалканов угол между связями должен отклоняться от этого идеального угла, эффект известен как угловая деформация .Кроме того, некоторые атомы водорода могут оказаться ближе друг к другу, чем это желательно (затмиться), этот эффект называется деформацией кручения . Эти дестабилизирующие эффекты, угловая деформация и деформация кручения известны вместе как кольцевая деформация . Циклоалканы меньшего размера, циклопропан и циклобутан, имеют особенно высокие кольцевые деформации, поскольку их валентные углы существенно отклоняются от 109,5 °, а их атомы водорода затмевают друг друга. Таким образом, обе эти кольцевые конформации крайне неблагоприятны и нестабильны.Циклопентан — более стабильная молекула с небольшой степенью деформации кольца, в то время как циклогексан способен принять идеальную геометрию циклоалкана, в которой все углы составляют идеальные 109,5 ° и никакие водороды не затмеваются; у него вообще нет кольцевой деформации. Циклоалканы большего размера, чем циклогексан, имеют кольцевую деформацию и не так часто встречаются в органической химии. На рисунке 7.6 представлены примеры циклоалкановых структур.
Рисунок 7.6. Типичные циклоалкановые структуры. Указаны средние валентные углы и энергия деформации.
Для вашего здоровья: Циклопропан как анестетик
Циклопропан с температурой кипения -33 ° C представляет собой газ при комнатной температуре. Это также мощный анестетик быстрого действия с небольшим количеством нежелательных побочных эффектов в организме. Однако он больше не используется в хирургии, поскольку образует взрывоопасные смеси с воздухом почти во всех концентрациях.
(Вернуться к началу)
Классификация углеродных связей
Атомов углерода, участвующих в химических связях внутри молекулы, можно классифицировать на основе количества образующихся углерод-углеродных связей.
- первичный атом углерода : один сосед углерода
- вторичный атом углерода : два соседних атома углерода
- третичный атом углерода : три соседних атома углерода
- четвертичный атом углерода : четыре соседних атома углерода
Число соседних атомов углерода у атома углерода может помочь определить реакционную способность этого положения углерода. Таким образом, важно уметь распознать, является ли атом углерода первичным, вторичным, третичным или четвертичным по своей структуре (рис.7.7).
Рисунок 7.7. Классификация атомов углерода на первичные, вторичные, третичные или четвертичные. В приведенных выше молекулах центральный углерод оценивается по количеству атомов углерода, которые непосредственно связаны с центральным углеродом. Первичный углерод связан с одним углеродом, вторичный углерод связан с двумя атомами углерода, третичный углерод связан с тремя атомами углерода, а четвертичный углерод связан с четырьмя атомами углерода.
В любой данной молекуле можно классифицировать каждый атом углерода (рис.7.8).
Рисунок 7.8. Классификация атомов углерода в молекуле
(Вернуться к началу)
7.3 Свойства алканов
Алканы — это простейшее семейство углеводородов — соединений, содержащих углерод и водород только с углеродно-водородными связями и одинарными углерод-углеродными связями. Алканы не очень реактивны и обладают небольшой биологической активностью; все алканы не имеют цвета и запаха.Поскольку алканы обладают относительно предсказуемыми физическими свойствами и подвергаются относительно небольшому количеству химических реакций, кроме горения, они служат основой для сравнения свойств многих других семейств органических соединений. Давайте сначала рассмотрим их физические свойства.
В таблице 7.3 описаны некоторые свойства некоторых из первых 10 алканов с прямой цепью. Почти все алканы имеют плотность менее 1,0 г / мл и поэтому менее плотны, чем вода (плотность H 2 O равна 1.00 г / мл при 20 ° C).
Таблица 7.3 Физические свойства некоторых алканов
Если присмотреться: плотность газа и опасность возгорания
Таблица 7.3 показывает, что первые четыре члена алканового ряда являются газами при обычных температурах. Природный газ состоит в основном из метана, плотность которого составляет около 0,67 г / л. Плотность воздуха около 1,29 г / л. Поскольку природный газ менее плотен, чем воздух, он поднимается вверх.Когда утечка природного газа обнаружена и перекрыта в помещении, газ можно удалить, открыв верхнее окно. С другой стороны, баллонный газ может быть пропаном (плотность 1,88 г / л) или бутаном (смесь бутана и изобутана; плотность около 2,5 г / л). Оба намного тяжелее воздуха (плотность 1,2 г / л). Если баллонный газ попадает в здание, он собирается у пола. Это представляет гораздо более серьезную опасность возгорания, чем утечка природного газа, потому что избавить помещение от более тяжелого газа труднее.
(Вернуться к началу)
Точки плавления и кипения
И точки плавления, и точки кипения алканов являются характеристиками межмолекулярных сил, обнаруживаемых между молекулами. Разница в электроотрицательности углерода и водорода (2,1 — 1,9 = 0,2) мала; следовательно, связь C-H неполярна, а это означает, что единственными притяжениями между одной молекулой и ее соседями будут силы лондонской дисперсии.Эти силы будут очень малы для такой молекулы, как метан, но будут увеличиваться по мере увеличения размера молекул. Следовательно, температуры плавления и кипения алканов увеличиваются с увеличением размера молекулы из-за увеличения лондонских дисперсионных сил. (т.е. межмолекулярные силы сильнее в более крупных углеводородах, поэтому требуется больше энергии, чтобы вызвать фазовые изменения). На рис. 7.9 показаны тенденции плавления и кипения первых 16 углеводородов. Обратите внимание, что первые четыре алкана являются газами при комнатной температуре, а твердые частицы не начинают появляться примерно до C 17 H 36 .
Рисунок 7.9. Точки плавления и кипения алканов с прямой цепью
По материалам: Techstepp
Что касается изомеров, то чем более разветвлена цепь, тем ниже температура кипения. Лондонские дисперсионные силы меньше для более коротких молекул и действуют только на очень коротких расстояниях между одной молекулой и ее соседями. Коротким объемным молекулам (со значительным количеством разветвлений) труднее располагаться близко друг к другу (компактным) по сравнению с длинными тонкими молекулами.Циклоалканы похожи на алканы по своим общим физическим свойствам, но имеют более высокие температуры кипения, плавления и плотности, чем алканы. Это происходит из-за более сильных сил Лондона, потому что форма кольца обеспечивает большую площадь контакта.
(Вернуться к началу)
Растворимость
Алканы (как нормальные, так и циклоалканы) практически нерастворимы в воде, но растворяются в органических растворителях. Жидкие алканы являются хорошими растворителями для многих других ковалентных соединений.Когда молекулярное вещество растворяется в воде, должно происходить следующее:
- нарушение межмолекулярных сил внутри вещества. В случае алканов это лондонские дисперсионные силы.
- нарушение межмолекулярных сил в воде, так что вещество может поместиться между молекулами воды. В воде основным межмолекулярным притяжением являются водородные связи.
Для разрушения любого из этих аттракционов требуется энергия, хотя количество энергии, необходимое для разрушения лондонских дисперсионных сил в соединении, таком как метан, относительно незначительно; это не относится к водородным связям в воде.Напомним, что водородные связи намного прочнее.
Чтобы упростить, вещество будет растворяться, если выделяется достаточно энергии при образовании новых связей между веществом и водой, чтобы восполнить энергию, необходимую для разрушения первоначального притяжения. Единственное новое притяжение между алканом и молекулами воды — это лондонские дисперсионные силы. Эти силы не позволяют высвободить достаточное количество энергии для компенсации энергии, необходимой для разрыва водородных связей в воде.Следовательно, алкан не растворяется, как показано на рисунке 7.10.
Рисунок 7.10. Углеводороды с длинной цепью нерастворимы в воде. Ни насыщенные, ни ненасыщенные углеводороды в этом подсолнечном масле не обладают достаточно сильными межмолекулярными силами, чтобы разрушить водородные связи между молекулами воды. Таким образом, масло не растворяется в воде и образует пузырьки масла на поверхности границы раздела вода / масло.В этом случае масло менее плотное, чем вода, и будет плавать поверх слоя воды.
Растворимость в органических растворителях
В большинстве органических растворителей основными силами притяжения между молекулами растворителя являются дисперсионные силы Лондона. Следовательно, когда алкан растворяется в органическом растворителе, дисперсионные силы Лондона нарушаются и заменяются новыми дисперсионными силами Лондона между смесью. Эти два процесса более или менее энергетически нейтрализуют друг друга; таким образом, нет барьера для растворимости.
(Вернуться к началу)
Свойства алканов и опасность для окружающей среды: более внимательный взгляд
Из-за растворимости и плотности алканов разливы нефти в океане или других водоемах могут иметь разрушительные экологические последствия. Нефть не может растворяться или смешиваться с водой, и поскольку она менее плотная, чем вода, она плавает на поверхности воды, образуя нефтяное пятно, как показано на рисунке 7.11. Поскольку нефтяное пятно остается на поверхности воды, организмы, наиболее подверженные воздействию нефтяных пятен, — это организмы, обитающие на поверхности океана или вблизи береговой линии, включая каланов и морских птиц.Химические составляющие масла токсичны при проглатывании, вдыхании, раздражении кожи и глаз.
Рисунок 7.11 Разливы нефти. Нефть покрывает поверхность воды в Мексиканском заливе после того, как нефтяная вышка Deepwater Horizon затонула в результате взрыва. Утечка была на милю ниже поверхности, что затрудняло оценку размера разлива. Один литр масла может создать пятно размером 2,5 гектара (6,3 акра). Этот и аналогичные разливы служат напоминанием о том, что углеводороды и вода не смешиваются.
Источник: Фото любезно предоставлено NASA Goddard / MODIS Rapid Response Team.
Упражнения по обзору концепции
Не обращаясь к таблице, сделайте прогноз, у которого температура кипения выше — гексан или додекан. Объяснять.
Если к 100 мл воды в химическом стакане добавить 25 мл гексана, чего из следующего вы ожидаете? Объяснять.
- Гексан растворяется в воде.
- Гексан не растворяется в воде и плавает сверху.
- Гексан не растворяется в воде и опускается на дно емкости.
Ответы
додекан в связи с его большей молярной массой
б; гексан не растворим в воде и менее плотен, чем вода.
Ключевые вынос
- Алканы — это неполярные соединения, низкокипящие и нерастворимые в воде.
Упражнения
Не обращаясь к таблице или другой справочной информации, спрогнозируйте, какой член каждой пары имеет более высокую точку кипения.
- пентан или бутан
- гептан или нонан
Для какого члена каждой пары гексан является хорошим растворителем?
- пентан или вода
- хлорид натрия или соевое масло
(Вернуться к началу)
7.4 Химическая реакционная способность алканов
Алканы содержат сильные одинарные углерод-углеродные связи и сильные углерод-водородные связи. Обе эти связи неполярны. Следовательно, в молекуле нет части, несущей сколько-нибудь значительный положительный или отрицательный заряд, который требуется для притяжения к ней других ионных и полярных молекул. Поэтому алканы обычно не реагируют с ионными соединениями, такими как большинство лабораторных кислот, оснований, окислителей или восстановителей.Рассмотрим, например, бутан:
Ни положительные, ни отрицательные ионы не притягиваются к неполярной молекуле. Фактически, алканы подвергаются так мало реакциям, что их иногда называют парафинами , от латинского parum affinis , что означает «слабое сродство».
В результате алканы обладают очень низкой реакционной способностью и подвергаются только трем основным типам реакций, включая следующие:
- Реакции горения — сжечь их — уничтожить всю молекулу;
- Реакции галогенирования (тип замещения) — реагируют с некоторыми галогенами, разрывая углерод-водородные связи;
- Реакции крекинга — используют тепло и / или катализатор для крекинга алканов, разрыва углерод-углеродных связей.
Реакции горения
Сжигание соединений углерода, особенно углеводородов, было наиболее важным источником тепловой энергии для человеческих цивилизаций на протяжении всей истории человечества. Практическое значение этой реакции нельзя отрицать, но массивные и неконтролируемые химические изменения, происходящие при горении, затрудняют установление механистических путей. Используя в качестве примера горение пропана, мы видим из следующего уравнения, что каждая ковалентная связь в реагентах была разорвана, и в продуктах образовался совершенно новый набор ковалентных связей.Никакая другая обычная реакция не включает в себя столь глубоких и всепроникающих изменений, а механизм горения настолько сложен, что химики только начинают исследовать и понимать некоторые из его элементарных особенностей.
CH 3 CH 2 CH 3 + 5O 2 → 3CO 2 + 4H 2 O + тепло
Обратите внимание, что в реакции, приведенной выше, соединения в левой части стрелки называются субстратами или реагентами , а соединения в правой части стрелки являются продуктами реакции .Энергия, чаще всего выделяющаяся в виде тепла, может быть либо субстратом, либо продуктом реакции, в зависимости от вовлеченных соединений. Также обратите внимание, что ни один из атомов не теряется в рамках данного химического уравнения. Закон сохранения массы гласит, что материю нельзя ни создать, ни уничтожить. Таким образом, уравнение должно быть сбалансировано и иметь такое же количество атомов в левой части уравнения, что и в правой. Напомним, что коэффициенты уравнения определяют, сколько молей соединения присутствует, и что, если коэффициент не показан, по умолчанию он равен единице.Например, приведенное выше уравнение будет читаться так: 1 моль пропана (CH 3 CH 2 CH 3 ) реагирует с 5 молями кислорода (O 2 ) с образованием 3 моль диоксида углерода (CO 2 ) и 4 моля воды (H 2 O) и выделяется тепло.
Химические связи также содержат потенциальную энергию. Если вы думаете о природе связи, она удерживается энергией притяжения. Чтобы разорвать связи на стороне реагента уравнения, требуется энергия, в то время как образование связей на стороне продукта высвободит энергию.Если энергия, выделяемая при образовании связи, выше, чем энергия, необходимая для диссоциации связи, энергия будет высвобождаться в результате реакции. Эта энергия обычно измеряется как теплота реакции, которая называется энтальпией .
Важны два момента относительно этой реакции:
- Поскольку все ковалентные связи в молекулах реагентов разорваны, количество тепла, выделяемого в этой реакции, связано с прочностью этих связей (и, конечно, прочностью связей, образующихся в продуктах).Эти температуры могут быть оценены с использованием энергии диссоциации / образования связи (энергия, необходимая для разрыва связи на стороне реагента уравнения и энергия, высвобождаемая при образовании связи на стороне продукта уравнения).
- Стехиометрия реагентов также важна. Если подается недостаточное количество кислорода, некоторые продукты будут состоять из менее окисленного газообразного монооксида углерода (CO).
Например, если бы присутствовало только 4 моля кислорода, при сгорании одного моля пропана образовался бы только 1 моль диоксида углерода и 2 моля монооксида углерода.
CH 3 CH 2 CH 3 + 4O 2 → CO 2 + 2CO + 4H 2 O + тепло
Энергия связи
Атомы соединяются вместе, образуя соединения, потому что при этом они достигают более низких энергий, чем они обладают как отдельные атомы. Количество энергии, равное разнице между энергиями связанных атомов и энергиями отделенных атомов, обычно выделяется в виде тепла.То есть связанные атомы имеют более низкую энергию, чем отдельные атомы как отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию.
Когда происходит химическая реакция, молекулярные связи разрываются и образуются другие связи, в результате чего образуются другие молекулы. Например, связи двух молекул воды разрываются с образованием водорода и кислорода.
2H 2 O → 2H 2 + O 2
Для разрыва связи всегда требуется энергия, известная как энергия связи .Хотя концепция может показаться простой, энергия связи служит очень важной цели при описании структуры и характеристик молекулы. Его можно использовать для определения наиболее подходящей точечной структуры Льюиса при наличии нескольких точечных структур Льюиса.
Ключевые выводы:
- Для разрыва связи всегда требуется энергия.
- Энергия всегда высвобождается при заключении облигации.
Хотя каждая молекула имеет свою характерную энергию связи, возможны некоторые обобщения.Например, хотя точное значение энергии связи C – H зависит от конкретной молекулы, все связи C – H имеют примерно одинаковую энергию связи, поскольку все они являются связями C – H. Для разрыва 1 моля связи C – H требуется примерно 100 ккал энергии, поэтому мы говорим об энергии связи C – H как примерно 100 ккал / моль. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а связь C = C имеет энергию связи около 145 ккал / моль. Мы можем вычислить более общую энергию связи, найдя среднее значение энергии связи конкретной связи в разных молекулах, чтобы получить среднюю энергию связи.В таблице 7.2 представлен список средних значений энергии связи для обычных органических связей. Помните, что энергия может быть измерена в ккал или кДж, а коэффициент преобразования между ними составляет: 4,184 кДж = 1 ккал
| Одинарные облигации | Множественные облигации | ||||||
|---|---|---|---|---|---|---|---|
| H — H | 432 | N — H | 391 | I — I | 149 | С = С | 614 |
| H — F | 565 | N — N | 160 | I — Класс | 208 | C ≡ C | 839 |
| H — Класс | 427 | N — F | 272 | I — Br | 175 | O = O | 495 |
| H — Br | 363 | N — Cl | 200 | C = O * | 745 | ||
| H — I | 295 | N — Br | 243 | S — H | 347 | C ≡ O | 1072 |
| N — O | 201 | S — F | 327 | N = O | 607 | ||
| C — H | 413 | O — H | 467 | S — Класс | 253 | N = N | 418 |
| С — С | 347 | O — O | 146 | S — Br | 218 | N 90 N | 941 |
| C — N | 305 | O — F | 190 | S – S | 266 | C ≡ N | 891 |
| С — О | 358 | O — Cl | 203 | C = N | 615 | ||
| C — F | 485 | O — I | 234 | Si — Si | 340 | ||
| C — Класс | 339 | Si — H | 393 | ||||
| C — Br | 276 | F — F | 154 | Si — C | 360 | ||
| C — I | 240 | F-Cl | 253 | Si — O | 452 | ||
| C — S | 259 | F — Br | 237 | ||||
| Cl — Cl | 239 | ||||||
| Cl — Br | 218 | ||||||
| руб. — | 193 | ||||||
* C = O в (CO 2 ) = 799 | |||||||
Когда связь прочная, энергия связи выше, потому что для разрыва прочной связи требуется больше энергии.Это коррелирует с порядком и длиной облигации. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем выше энергия связи из-за повышенного электрического притяжения. Как правило, чем короче длина связи, тем больше энергия связи.
Разрыв и образование связи
Когда происходит химическая реакция, атомы в реагентах меняют свои химические связи, образуя продукты. Новое расположение связей не имеет такой же полной энергии, как связи в реагентах.Следовательно, когда происходят химические реакции, всегда будет сопутствующее изменение энергии . Изменение энергии реакции или теплота реакции называется энтальпией . Он представлен математическим символом ΔH и рассчитывается как разность энергии, необходимой для разрыва связей реагентов, за вычетом энергии, высвобождаемой при образовании связей в продуктах.
ΔH = Энергия реагентов — Энергия продуктов
Рисунок 7.12: Энтальпия реакции. (верхняя реакция) Экзотермические реакции. При экзотермической химической реакции выделяется энергия, поскольку реагенты превращаются в продукты. (низшая реакция) Эндотермические реакции. При эндотермической химической реакции энергия поглощается, поскольку реагенты превращаются в продукты.
В некоторых реакциях энергия образующихся продуктов ниже энергии реагентов. Таким образом, в ходе реакции избыточная энергия, выделяемая при образовании продукта, будет передаваться в окружающую среду.Такие реакции являются экзотермическими и могут быть представлены диаграммой уровней энергии на рис. 7.12 (верхний). В большинстве случаев энергия выделяется в виде тепла (хотя некоторые реакции выделяют энергию в виде света). В химических реакциях, где продукты имеют более высокую энергию, чем реагенты, реагенты должны поглощать энергию из окружающей среды, чтобы иметь возможность вступать в реакцию. Эти реакции являются эндотермическими и могут быть представлены в виде диаграмм уровней энергии, подобных рисунку 7.12 (внизу).
Экзотермические и эндотермические реакции можно рассматривать как имеющие энергию либо как «продукт» реакции, либо как «реагент», соответственно.Экзотермические реакции высвобождают энергию, поэтому энергия — это продукт. Эндотермические реакции требуют энергии, поэтому энергия — это реагент.
Экзотермические реакции будут иметь отрицательную общую энтальпию, а эндотермические реакции будут иметь положительную общую энтальпию.
ΔH = Энергия реагентов — Энергия продуктов
Энергия реакции может быть обработана стехиометрически внутри реакции точно так же, как любое из соединений внутри реакции.При сжигании метана, CH 4 , каждый сожженный моль выделяет 824 кДж энергии. Таким образом, легко подсчитать, сколько энергии выделяется при сжигании любого количества CH 4 . Мы также можем легко подсчитать, сколько CO 2 образуется на каждый моль сожженного CH 4 , поскольку на каждый моль сожженного CH 4 образуется один моль CO 2 .
(Вернуться к началу)
Полное сгорание (при наличии достаточного количества кислорода) любого углеводорода дает диоксида углерода (CO 2 ) и воды (H 2 O) .Очень важно, чтобы вы могли написать правильно сбалансированные уравнения для этих реакций, потому что они часто возникают как часть термохимических расчетов. Некоторые проще, чем другие. Например, для алканов алканы с четным числом атомов углерода немного сложнее, чем с нечетным числом!
Пример 1: Сжигание пропана
Например, с пропаном (C 3 H 8 ) вы можете сбалансировать углерод и водород, когда вы записываете уравнение.Ваш первый черновик будет:
C 3 H 8 +? O 2 → 3CO 2 + 4H 2 O
Подсчет кислорода приводит непосредственно к окончательной версии:
C 3 H 8 + 5O 2 → 3CO 2 + 4H 2 O
Пример 2: Сжигание бутана
С бутаном (C 4 H 10 ) вы снова можете сбалансировать углерод и водород, записывая уравнение.
C 4 H 10 +? O 2 → 4CO 2 + 5H 2 O
Подсчет кислорода приводит к небольшой проблеме — 13 справа. Наличие нечетного числа атомов кислорода на стороне продукта делает невозможным баланс с четным числом на стороне реагента. В подобных случаях начните пытаться сбалансировать уравнение, изменив кофактор перед алканом на 2. Затем повторно сбалансируйте углерод и водород на стороне продукта.В этом случае кислородное число должно быть положительным, и теперь вы сможете уравновесить уравнение.
2C 4 H 10 + 13O 2 → 8CO 2 + 10H 2 O
Углеводороды становится труднее воспламенять по мере того, как молекулы становятся больше. Это связано с тем, что более крупные молекулы не так легко испаряются — реакция будет намного лучше, если кислород и углеводород хорошо смешаны как газы. Если жидкость не очень летучая, только молекулы на поверхности могут реагировать с кислородом.Более крупные молекулы имеют большее притяжение Ван-дер-Ваальса, что затрудняет им отрыв от своих соседей и превращение в газ.
При полном сгорании все углеводороды будут гореть синим пламенем. Однако сгорание имеет тенденцию быть менее полным по мере увеличения числа атомов углерода в молекулах. Это означает, что чем больше углеводород, тем больше вероятность получить желтое дымное пламя.
Неполное сгорание
Неполное сгорание (при недостаточном количестве кислорода) может привести к образованию углерода или окиси углерода.Проще говоря, водород в углеводороде получает первый шанс у кислорода образовать воду в продукте, а углерод получает все, что осталось! Когда образуется только углерод, присутствие светящихся углеродных частиц в пламени делает его желтым, и черный углерод часто виден в дыме. Если некоторое количество кислорода может взаимодействовать с углеродом, но недостаточно для образования диоксида углерода (CO 2 ), то оксид углерода (CO) образуется в виде бесцветного ядовитого газа.
Почему окись углерода ядовита: кислород переносится по крови гемоглобином, белком, содержащимся в красных кровяных тельцах.Углекислый газ также связывается с гемоглобином. Гемоглобин переносит кислород из легких в каждую клетку вашего тела, где он отбрасывает кислород, улавливает углекислый газ и переносит его обратно в легкие. Затем гемоглобин будет заменять углекислый газ на кислород в воздухе, которым вы вдыхаете. Когда вы выдыхаете, вы выделяете углекислый газ. Окись углерода также может связываться с гемоглобином. Разница в том, что окись углерода связывается необратимо (или очень сильно), что делает эту конкретную молекулу гемоглобина бесполезной для переноса кислорода.Если вы вдохнете достаточно угарного газа, вы умрете от внутренней формы удушья!
Теплота сгорания
Теплота сгорания, ΔH c , определяется как общая энергия, выделяемая в виде тепла, когда вещество подвергается полному сгоранию с кислородом при определенных стандартных условиях. Он рассчитывается так же, как рассчитывается энтальпия, однако он специфичен для набора стандартных условий. Теплота сгорания является полезной величиной, поскольку она является постоянной величиной для типа сжигаемого материала и может использоваться для сравнения эффективности и полезности различных источников топлива, наиболее часто используемых в обществе (нефть, бензин, природный газ, дизельное топливо, уголь). , дерево, водород, этанол и т. д.).В Соединенных Штатах номинальные значения нагрева обычно указываются в британских тепловых единицах (БТЕ) на фунт материала. Обычное преобразование в метрические единицы:
БТЕ / фунт = (кДж / кг) * 2,326
Теплота сгорания, ΔHc, значения обычных источников топлива и связанные с ними выбросы CO2 указаны в таблице 7.5
Таблица 7.5 Профиль теплоты сгорания и выбросов CO2 для обычных видов топлива
По материалам: EPA — (2014) и Wikipedia — Heat of Combustion
Нефть (от греческого: petra: «порода» + oleum : «нефть») — это встречающаяся в природе жидкость от желтого до черного цвета, обнаруживаемая в геологических формациях под поверхностью Земли, которая обычно перерабатывается в различные типы. топлива.Он состоит в основном из алканов, циклоалканов и алкенов различной длины и некоторых дополнительных второстепенных органических соединений. Алканы с пятью или более атомами углерода являются жидкостями и встречаются как обычные компоненты нефти (также называемой сырой нефтью ). Многие циклоалканы также содержатся в нефтепродуктах, включая бензин, керосин, дизельное топливо, моторное масло и многие другие тяжелые масла. С другой стороны, природный газ состоит преимущественно из метана (CH 4 ), но также содержит этан (C 2 H 6 ), пропан (C 3 H 8 ) и бутан ( C 4 H 10 ).Природный газ также содержит следовые количества азота, диоксида углерода (CO 2 ) и сероводорода (H 2 S).
Компоненты нефти разделяются по размеру с помощью метода, называемого фракционной перегонкой. Полученные образцы включают бензин с содержанием алканов от пяти до десяти атомов углерода и керосин со смесью алканов с длиной углерода от десяти до семнадцати. Алканы с более длинными углеродными цепями содержатся в дизельном топливе, мазуте, вазелине, парафиновом воске, моторных маслах, а самые длинные цепи используются в асфальте.Подсчитано, что в мире ежедневно используется около 95 миллионов баррелей нефти! По оценкам Агентства по охране окружающей среды, каждый баррель нефти производит 0,43 метрических тонны CO 2 . Обратите внимание, что метрическая тонна эквивалентна 1000 кг. Это означает, что 40 850 000 метрических тонн CO 2 или 40 850 000 000 кг CO 2 выбрасываются в атмосферу каждый день только в результате потребления масла! Это почти 15 миллиардов метрических тонн CO 2 в год! Этот расчет включает только потребление сырой нефти, а не других распространенных источников топлива, таких как природный газ, уголь, древесина, и возобновляемых источников энергии, таких как этанол и биодизель.
Вверх для обсуждения:
В Орегоне, по оценкам, в зимние месяцы для обогрева среднего дома с хорошей изоляцией требуется около 40 БТЕ в час на квадратный фут. Если бы у вас был дом площадью 2000 квадратных футов, сколько БТЕ вам потребовалось бы для обогрева собственного дома в течение 1 месяца? (предположим, 31 день в месяце). Если бы у вас был выбор отопления дома природным газом, углем (бурый уголь) или дровами, сколько кг каждого из этих видов топлива потребовалось бы для обогрева вашего дома в течение одного месяца? Сколько СО2 будет производиться каждым видом топлива каждый зимний месяц?
(Вернуться к началу)
Реакции галогенирования (Тип замещения)
В присутствии тепла или света алканы могут реагировать с галогенами с образованием алкилгалогенидов (или галогеналканов). Этот тип реакции называется реакцией замещения , потому что атом галогена занимает место (или замещает) один из атомов водорода в структуре алкана. Следует отметить, что не все галогены одинаково реагируют с алканами.
- Реакция между алканами и фтором: Эта реакция взрывоопасна даже на холоде и в темноте, и вы склонны получать углерод и фтороводород, а не желаемую реакцию замещения.Это не представляет особого интереса для химиков-органиков, поскольку реакция может быть очень опасной и не дает желаемого продукта. Например, желаемым продуктом может быть алкилфторид:
.
Канал 4 + Факс 2 → Канал 3 Факс + HF
Но реакция идет так быстро, что результат:
Канал 4 + 2F 2 → C + 4HF
- Реакция между алканами и йодом: Йод никак не реагирует с алканами — по крайней мере, в нормальных лабораторных условиях.Так что и эта реакция бесполезна.
- Реакции между алканами и хлором или бромом: В темноте реакции не происходит, но при наличии света и тепла в результате реакции образуются желаемые алкилгалогениды. Таким образом, мы сосредоточим наше обсуждение на реакциях галогенирования с хлором и бромом.
Реакция метана и хлора
В присутствии пламени реакции очень похожи на реакцию с фтором — образуется смесь углерода и галогенида водорода.При переходе от фтора к хлору к брому интенсивность реакции значительно снижается. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, которые происходят при комнатной температуре. Мы рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.
В реакции замещения атом водорода в метане заменяется атомом хлора. Это может происходить несколько раз, пока не будут заменены все атомы водорода.В конечном итоге, чем дольше протекает реакция, тем больше атомов водорода замещается в алкане. Таким образом, вы получаете смесь хлорметана (CH 3 Cl), дихлорметана (CH 2 Cl 2 ), трихлорметана (CHCl 3 ) и тетрахлорметана (CCl 4 ).
Исходная смесь бесцветного газа (CH 4 ) и зеленого газа (Cl 2 ) будет производить пары хлористого водорода (HCl) и туман органических жидкостей (смесь хлорированного метана).Все органические продукты являются жидкими при комнатной температуре, за исключением хлорметана (CH 3 Cl), который представляет собой газ.
Эта реакция замещения является примером радикальной реакции, когда только один электрон переносится за раз. Тепло или свет инициируют реакцию, разрывая связь между двумя атомами Cl в ионе хлорида. Это образует два радикала . Радикал — это атом, молекула или ион, имеющий неспаренные валентные электроны.Таким образом, они очень нестабильны и реактивны. На диаграмме ниже первая стадия реакции галогенирования показана ниже. Это называется инициацией .
Реакция инициирования
Как только радикал инициирован, он атакует алкан, в данном случае метан (CH 4 ), и создает новый углеродный радикал. Эта стадия реакции называется распространением , поскольку один вид радикала создает или распространяет другой радикал.
Реакция распространения
Конечной стадией радикальной реакции является реакция обрыва , которая гасит присутствующие радикалы. Для реакции метан-хлор это образование хлорметана (CH 3 Cl).
Реакция завершения
Таким образом, радикальные реакции протекают в три стадии:
- Инициирование — , когда радикалы образуются, как правило, под действием тепла, света или другого каталитического процесса.
- Распространение — , где одна разновидность радикала взаимодействует с другой молекулой с образованием другой разновидности радикала.
- Обрыв — , когда две радикальные группы взаимодействуют и гасят радикальную реакцию, образуя стабильный продукт.
(Вернуться к началу)
Алканы большего размера и хлор
Как видно на примере метана, если вы галогенируете более крупные алканы, вы снова получите смесь продуктов замещения, но стоит просто кратко взглянуть на то, что произойдет, если будет замещен только один из атомов водорода (монозамещение) — просто чтобы показать что не всегда все так просто, как кажется! Например, с пропаном можно получить один из двух изомеров:
Если бы случай был единственным фактором, вы ожидали бы получить в три раза больше изомера с хлором на конце.Есть 6 атомов водорода, которые можно заменить на концевых атомах углерода, по сравнению только с 2 атомами в середине. Фактически, вы получаете примерно одинаковое количество каждого из двух изомеров. Если вы используете бром вместо хлора, большая часть продукта находится там, где бром присоединен к центральному атому углерода. Почему это происходит?
Это связано со стабильностью промежуточного углеродного радикала, образующегося во время реакции. Углероды, у которых больше углеродных соседей, легче теряют водород и образуют промежуточный углеродный радикал.Соседние атомы углерода, будучи крупнее соседних атомов водорода, могут помочь стабилизировать образование радикала углерода. Таким образом, в реакции галогенирования третичные атомы углерода будут наиболее реакционноспособными положениями, за ними следуют вторичные атомы углерода и, наконец, первичные атомы углерода. Четвертичные атомы углерода не реагируют, поскольку они не имеют доступных атомов водорода, которые можно было бы заменить галогеном.
Реакции галогенирования с циклоалканами
Реакции циклоалканов обычно такие же, как и реакции алканов, с заменой атомов водорода в циклической кольцевой структуре атомом галогена.Например, в присутствии УФ-света циклопропан будет вступать в реакции замещения хлором или бромом, как и нециклический алкан.
Однако небольшие кольцевые структуры, особенно циклопропан, также способны реагировать в темноте. В отсутствие УФ-света циклопропан может вступать в реакции присоединения, в которых кольцо разрывается. Например, с бромом циклопропан дает следующее линейное соединение.
Это все еще может происходить в присутствии УФ-света, но вы также получите смесь реакций замещения.Кольцо сломано, потому что циклопропан сильно страдает от деформации кольца. Напомним, что валентные углы в кольце составляют 60 °, а не нормальное значение около 109,5 °, когда углерод образует четыре одинарные связи.
Упражнения по обзору концепции
Почему алканы иногда называют парафинами?
Какой галоген наиболее легко реагирует с алканами? Которая реагирует наименее охотно?
Ответы
Алканы не вступают в реакцию со многими обычными химическими веществами.Иногда их называют парафинами, от латинского parum affinis , что означает «слабое сродство».
проще всего: F 2 ; наименее охотно: I 2
Широкий спектр интересных и часто полезных соединений имеет один или несколько атомов галогена на молекулу. Например, метан (CH 4 ) может реагировать с хлором (Cl 2 ), заменяя один, два, три или все четыре атома водорода атомами Cl. Несколько галогенированных продуктов, полученных из метана и этана (CH 3 CH 3 ), перечислены в таблице 7.6 вместе с некоторыми из их использования.
Таблица 7.6: Некоторые галогенированные углеводороды
Для вашего здоровья: галогенированные углеводороды
Когда-то широко использовавшиеся в потребительских товарах, многие хлорированные углеводороды считаются канцерогенами (веществами, вызывающими рак), а также, как известно, вызывают серьезные повреждения печени. Примером может служить четыреххлористый углерод (CCl 4 ), который когда-то использовался в качестве растворителя для химической чистки и в огнетушителях, но больше не рекомендуется для любого использования.Даже в небольших количествах его пары могут вызвать серьезное заболевание при продолжительном воздействии. Более того, он реагирует с водой при высоких температурах с образованием смертоносного фосгена (COCl 2 ), что делает использование CCl 4 в огнетушителях особенно опасным.
Этилхлорид, напротив, используется в качестве наружного местного анестетика. При нанесении на кожу он быстро испаряется, охлаждая пораженный участок, делая его нечувствительным к боли. Его также можно использовать в качестве экстренной общей анестезии.
Бромсодержащие соединения широко используются в огнетушителях и в качестве антипиренов для одежды и других материалов. Поскольку они тоже токсичны и оказывают неблагоприятное воздействие на окружающую среду, ученые занимаются разработкой более безопасных заменителей для них, как и для многих других галогенированных соединений.
Для вашего здоровья: хлорфторуглероды и озоновый слой
Алканы, замещенные атомами фтора (F) и хлора (Cl), используются в качестве диспергирующих газов в аэрозольных баллончиках, в качестве вспенивающих агентов для пластмасс и в качестве хладагентов.Два наиболее известных из этих хлорфторуглеродов (ХФУ) перечислены в таблице 7.6.
Хлорфторуглероды способствуют парниковому эффекту в нижних слоях атмосферы. Они также диффундируют в стратосферу, где разрушаются ультрафиолетовым (УФ) излучением, высвобождая атомы Cl. Они, в свою очередь, разрушают молекулы озона (O 3 ), которые защищают Землю от вредного УФ-излучения. Действия по всему миру привели к сокращению использования ХФУ и родственных соединений. ХФУ и другие озоноразрушающие соединения, содержащие Cl или бром (Br), заменяются более безвредными веществами.Одной альтернативой являются гидрофторуглероды (ГФУ), такие как CH 2 FCF 3 , которые не содержат Cl или Br для образования радикалов. Другой — гидрохлорфторуглероды (ГХФУ), такие как CHCl 2 CF 3 . Молекулы ГХФУ легче распадаются в тропосфере, и меньшее количество молекул, разрушающих озон, достигает стратосферы.
Рисунок 7.13. Разрушение озонового слоя в верхних слоях атмосферы. Озон в верхних слоях атмосферы защищает поверхность Земли от ультрафиолетового излучения солнца, которое может вызывать рак кожи у людей, а также вредно для других животных и некоторых растений.Озоновые «дыры» в верхних слоях атмосферы (серые, розовые и пурпурные области в центре) представляют собой большие области значительного разрушения озонового слоя. Они встречаются в основном над Антарктидой с конца августа до начала октября и заполняют их примерно в середине ноября. Истощение озонового слоя также отмечено в арктических регионах. Самая большая озоновая дыра из когда-либо наблюдавшихся произошла 24 сентября 2006 года.
Алканы крекинга
Что такое треск? Крекингом называют разбиение больших молекул углеводородов на более мелкие и полезные части.Это достигается за счет использования высоких давлений и температур без катализатора или более низких температур и давлений в присутствии катализатора . Катализатор — это вещество, которое увеличивает скорость химической реакции без каких-либо постоянных химических изменений.
Источником крупных молекул углеводорода часто является фракция нафты или фракция газойля, образующаяся при фракционной перегонке сырой нефти (нефти).Эти фракции получают в процессе перегонки в виде жидкостей, но повторно испаряются в газовую фазу перед крекингом. В взломщике не происходит ни одной уникальной реакции. Молекулы углеводородов распадаются довольно случайным образом с образованием смесей более мелких углеводородов, некоторые из которых имеют двойные связи углерод-углерод. Одна возможная реакция с участием углеводорода C 15 H 32 может быть:
C 15 H 32 → 2C 2 H 4 + C 3 H 6 + C 8 H 18
Или, более ясно показывая, что происходит с различными атомами и связями:
Это только один из способов расщепления данной конкретной молекулы.Обратите внимание, что помимо получения более мелких алканов, реакция крекинга также может давать алкены с двойными связями. В этом случае алкены — этен (C 2 H 4 ) и пропен (C 3 H 6 ) — являются важными материалами для изготовления пластмасс или производства других органических химикатов. Октан — одна из молекул бензина (бензина).
Присмотревшись: алкановая основа свойств других соединений
Понимание физических свойств алканов важно в том смысле, что нефть и природный газ, а также многие производные из них продукты — бензин, газ в баллонах, растворители, пластмассы и др. — состоят в основном из алканов.Это понимание также важно, потому что оно является основой для описания свойств других семейств органических и биологических соединений. Например, большая часть структур липидов состоит из неполярных алкильных групп. Липиды включают пищевые жиры и жироподобные соединения, называемые фосфолипидами и сфинголипидами, которые служат структурными компонентами живых тканей. Эти соединения имеют как полярные, так и неполярные группы, что позволяет им ликвидировать разрыв между водорастворимой и водонерастворимой фазами.Эта характеристика важна для избирательной проницаемости клеточных мембран.
Рисунок 7.13 Сравнение липидов и алканов. Трипальмитин (а), типичная молекула жира, имеет длинные углеводородные цепи, типичные для большинства липидов. Сравните эти цепи с гексадеканом (b), алканом с 16 атомами углерода.
(Вернуться к началу)
7.5 Краткое содержание главы
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения следующих жирным шрифтом терминов в резюме и спросить себя, как они соотносятся с темами в главе.
Органическая химия — это химия углеродных соединений, а неорганическая химия — химия всех других элементов. Атомы углерода могут образовывать стабильные ковалентные связи с другими атомами углерода и с атомами других элементов, и это свойство позволяет образовывать десятки миллионов органических соединений. Углеводороды содержат только атомы водорода и углерода.
Углеводороды, в которых каждый атом углерода связан с четырьмя другими атомами, называются алканами или насыщенными углеводородами .Они имеют общую формулу C n H 2 n + 2 . Любой данный алкан отличается от следующего в серии единицей CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором, называется гомологической серией .
Атомы углерода в алканах могут образовывать прямые или разветвленные цепи. Два или более соединений, имеющих одинаковую молекулярную формулу, но разные структурные формулы, представляют собой изомеров друг друга.У трех мельчайших алканов нет изомерных форм; начиная с C 4 H 10 , все другие алканы имеют изомерные формы.
Циклоалканы — это углеводороды, молекулы которых представляют собой замкнутые кольца, а не прямые или разветвленные цепи. Циклический углеводород представляет собой углеводород с кольцом из атомов углерода.
Напомним, что структурная формула показывает все атомы углерода и водорода и то, как они связаны друг с другом. Конденсированная структурная формула показывает атомы водорода рядом с атомами углерода, к которым они присоединены.Формула линейного угла — это формула, в которой атомы углерода подразумеваются в углах и на концах линий. Подразумевается, что каждый атом углерода присоединен к достаточному количеству атомов водорода, чтобы дать каждому атому углерода четыре связи
Физические свойства алканов отражают тот факт, что молекулы алканов неполярны. Алканы нерастворимы в воде и менее плотны, чем вода.
Алканы обычно не реагируют с лабораторными кислотами, основаниями, окислителями и восстановителями.Они действительно горят (претерпевают реакций горения, ).
Алканы реагируют с галогенами, замещая атомы водорода одним или несколькими атомами галогена с образованием галогенированных углеводородов. Эта реакция называется галогенированием . Алкилгалогенид (галогеналкан) представляет собой соединение, полученное в результате замены атома водорода алкана на атом галогена.
Алканы большего размера можно разделить на алканы и алкены меньшего размера с использованием высокой температуры или катализаторов.Эти реакции называются реакциями крекинга .
(Вернуться к началу)
7.6 Упражнения в конце главы
Вы нашли банку без этикетки, содержащую твердое вещество, плавящееся при 48 ° C. Он легко воспламеняется и легко горит. Вещество не растворяется в воде и плавает на поверхности. Вещество может быть органическим или неорганическим?
В чем опасность проглатывания жидкого алкана?
- Различают более легкие и тяжелые жидкие алканы с точки зрения их воздействия на кожу.
Ниже приводится формула линии для алкана. Нарисуйте уплотненную структуру.
Напишите уравнения полного сгорания каждого соединения.
- бутан, C 4 H 10 (обычная жидкость для зажигалок)
- , C 8 H 18 (типичный углеводород в бензине).
Октан
Плотность пробы бензина 0,690 г / мл. На основе полного сгорания октана рассчитайте количество в граммах диоксида углерода (CO 2 ) и воды (H 2 O), образовавшихся на галлон (3.78 л) бензина при использовании в автомобиле.
Изобразите структуры четырех из девяти изомерных гексанов (C 7 H 16 ).
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
Рассмотрите приведенные здесь формулы линейного угла и ответьте на вопросы.
- Какая пара формул представляет изомеры? Нарисуйте каждую конструкцию.
- Какая формула представляет собой галогенид алкила? Напишите его сокращенную структурную формулу.
- Какая формула представляет собой циклический алкан?
- Это молекулярная формула соединения, представленного (i)?
(Вернуться к началу)
7.7 Ссылки
Текст этой главы был адаптирован из ресурсов Creative Commons, перечисленных ниже, если в тексте не указано иное.
- Органическая химия (2016) Libretexts, U.C. Дэвис, под лицензией: Creative Commons Attribution-Noncommercial-Share Alike 3.0 Лицензия США. Доступно по адресу: https://chem.libretexts.org/Core/Organic_Chemistry
- Ингалянт. (2017, 12 февраля). В Википедия, Бесплатная энциклопедия . Получено 01:21, 13 февраля 2017 г., с https://en.wikipedia.org/w/index.php?title=Inhalant&oldid=765135147
- Аноним. (2012) Введение в химию: общие, органические и биологические (V1.0). Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
- Физическая и теоретическая химия (2017) Libretexts, U.C. Дэвис, под лицензией: Creative Commons Attribution-Noncommercial-Share Alike 3.0 Лицензия США. Доступно по адресу: https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies.
- Нефть. (2017, 14 февраля). В Википедия, Бесплатная энциклопедия . Получено 06:29, 16 февраля 2017 г., с https://en.wikipedia.org/w/index.php?title=Petroleum&oldid=765440823
- Болл Д. У., Хилл Дж. У. и Скотт Р. Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
.
.
Что такое изомерия? — A Plus Topper
Что такое изомерия?
Что такое изомер и пример?
Изомерия
- Изомерия — это явление, при котором две или более молекул имеют одинаковую молекулярную формулу.
- Эти молекулы имеют одинаковое количество и типы атомов. Они отличаются только расположением атомов.Это молекулы, которые имеют разную структуру. Эти молекулы получили название изомеров.
- Изомеры — это молекулы с одинаковой молекулярной формулой, но с разными структурными формулами.
- Изомеры имеют разные физические свойства.
- Изомеры из одного гомологического ряда имеют одинаковую функциональную группу. Следовательно, они имеют одинаковые химические свойства.
Как нарисовать изомеры алканов?
Изомерия в алканах
- Изомерия в алканах начинается с молекул, содержащих более трех атомов углерода.Метан, этан и пропан не имеют изомеров.
- Изомеры алканов различаются только расположением атомов, давая молекул с прямой цепью и молекул с разветвленной цепью .
Например, бутан, C 4 H 10 , имеет два изомера, показанные ниже.
Используйте следующие шаги, чтобы помочь вам составить структурные формулы изомеров алканов.
- Шаг 1: Используйте общее количество атомов углерода, указанное в молекулярной формуле, чтобы нарисовать все возможные углеродные скелеты с прямой и разветвленной цепью.Это достигается изменением количества атомов углерода в прямых и разветвленных цепях.
- Шаг 2: Для каждого углеродного скелета разместите одинарные связи вокруг каждого атома углерода, чтобы каждый атом углерода имел четыре связи.
- Шаг 3: Завершите структуру, поместив по одному атому водорода на каждую из одинарных связей.
Пример изомерии алканов:
Изобразите все изомеры C 5 H 12 .
Решение:
- Шаг 1: Нарисуйте все возможные углеродные скелеты.
- Шаг 2: Поместите одинарные связи вокруг каждого атома углерода. Убедитесь, что каждый атом углерода имеет четыре связи.
- Шаг 3: Поместите атом водорода в каждую из одинарных связей.
Люди тоже спрашивают
Как нарисовать изомеры алкенов?
Изомерия в алкенах
- Алкены также проявляют изомерию. Однако изомерия в алкенах связана с
(a) разветвлением углеродной цепи
(b) различным расположением двойной связи - Этен и пропен не проявляют изомерию.
- Изомерия в алкенах начинается с молекул, содержащих более трех атомов углерода. Например, бутен C 4 H 8 имеет три изомера, а пентен C 5 H 10 имеет пять изомеров.
Используйте следующие шаги, чтобы построить структурные формулы изомеров алкенов.
- Шаг 1: Используйте общее количество атомов углерода, указанное в молекулярной формуле, чтобы нарисовать все возможные углеродные скелеты с прямой и разветвленной цепью.Это достигается изменением количества атомов углерода в прямых и разветвленных цепях.
- Шаг 2: Для каждого углеродного скелета разместите двойную связь в разных местах.
- Шаг 3: Поместите одинарные связи вокруг каждого атома углерода, чтобы каждый атом углерода имел четыре связи.
- Шаг 4: Завершите структуру, поместив по одному атому водорода на каждую из одинарных связей.
Пример изомерии алканов:
Изобразите все изомеры C 4 H 8 .
Раствор:
Как назвать изомеры с помощью IUPAC?
Обозначение изомеров
- Изомеры алканов и алкенов также названы в соответствии с правилами IUPAC. Название разветвленного алкана или разветвленного алкена состоит из трех составных частей:
- Корневая и конечная части названия ИЮПАК получены таким же образом, как и при наименовании алканов и алкенов с прямой цепью.
- Для алканов или алкенов с разветвленной цепью префиксы используются для определения идентичности, количества и расположения этих разветвлений или боковых цепей.
- Эти ответвления формально известны как алкильные группы.
- Алкильная группа представляет собой алкан, из которого удален один атом водорода.
- Алкильные группы имеют общую формулу C n H 2n + 1 где n = 1, 2, 3,…
- Алкильные группы именуются путем исключения -ана из названия соответствующего алкана и его замены на -ил. Ниже показаны два примера.
Пример наименования изомеров алканов:
Назовите алкан, имеющий структуру, показанную ниже.
Раствор:
- Шаг 1: Найдите самую длинную непрерывную углеродную цепь в молекуле.
- Шаг 2: Дайте имя этой самой длинной цепочке.
Примечание. Атомы углерода в самой длинной непрерывной цепи не обязательно должны располагаться на прямой линии.
- Шаг 3: Пронумеруйте атомы углерода в этой самой длинной цепи, начиная с конца, ближайшего к разветвлениям (алкильным группам).
Для этого алклана используется нумерация справа налево.
- Шаг 4: Найдите и назовите присоединенные алкильные группы. Положение каждой алкильной группы определяется номером атома углерода, к которому она присоединена в цепи.
Примечание: Если две или более алкильных групп одного типа присоединены к одной цепи, количество алкильных групп указывается префиксами ди- (2), три- (3), тетра- (4), и так далее. Кроме того, расположение каждой идентичной группы должно быть указано числом.
- Шаг 5: Завершите название молекулы, объединив три составляющие части вместе.Напишите имя одним словом. Используйте дефисы для разделения чисел и слов и запятые для разделения чисел.
Название молекулы:
В таблице приведены названия и структурные формулы изомеров алканов.
Пример наименования изомеров алкенов:
Назовите алкен, приведенный ниже.
Раствор:
- Шаг 1: Найдите самую длинную непрерывную углеродную цепь, содержащую двойную связь.
- Шаг 2: Дайте имя этой самой длинной цепочке.
- Шаг 3: Пронумеруйте атомы углерода в этой самой длинной цепи, начиная с конца, ближайшего к двойной связи, и , а не , ближе к первой алкильной группе. Это гарантирует, что атомы углерода, соединенные двойной связью, будут иметь как можно более низкие номера.
- Шаг 4: Найдите двойную связь по номеру первого атома углерода в двойной связи. Этот номер ставится перед фамилией.
Примечание. Положение двойной связи необходимо указывать только для цепочек из четырех или более атомов углерода. - Шаг 5: Найдите присоединенную алкильную группу и назовите ее.
- Шаг 6: Завершите название молекулы, объединив три составляющие части вместе. Напишите имя одним словом.
Название молекулы: 3-метилбут-1-ен
В таблице приведены названия и структурные формулы изомеров алкенов.
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
