Содержание
Валентность хрома (Cr), формулы и примеры
Общие сведения о валентности хрома
Хром в виде простого вещества – серовато-белый блестящий металл. Имеет структуру объемно-центрированной кубической решетки.Плотность – 7,2 г/см3. Температуры плавления и кипения равны 1890oС и 2680oС, соответственно.
Валентность хрома в соединениях
Хром находится в четвертом периоде в VIB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 24. В ядре атома хрома содержится 24 протона и 28 нейтронов (массовое число равно 52). В атоме хрома есть четыре энергетических уровня, на которых находятся 24 электрона (рис. 1).
Рис. 1. Строения атома хрома.
Электронная формула атома хрома в основном состоянии имеет следующий вид:
1s22s22p63s23p63d54s1.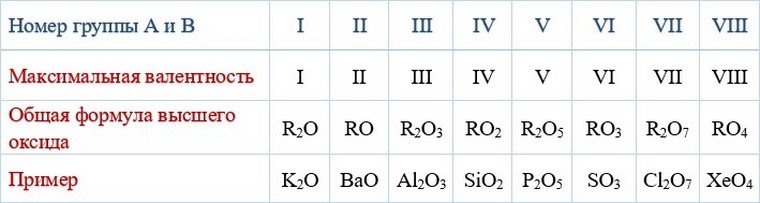
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие шести неспаренных электронов свидетельствует о том, что хром в своих соединениях может проявлять валентность IV (CrVIO3, CrVICl6, CrIVO2Cl6, K2CrVI2O7 и т.д.).
Известно, что для хрома также характерны валентности II (CrIIO, CrII(OH)2, CrIICl2) и III(CrIII2O3, CrIII(OH)3, KCrIIIO2, CrIIICl3).
Примеры решения задач
|
Понравился сайт? Расскажи друзьям! |
| ||
Хром высшей валентности — Справочник химика 21
Если процесс восстановления протекает на катоде с малым перенапряжением выделения водорода, первая стадия процесса не должна определять кинетику суммарного процесса, а потенциал катода можно считать близким к равновесному. В этом случае строение двойного электрического слоя и адсорбция поверхностноактивных веществ не будут сказываться на кинетике процесса, и определять закономерности последней будет замедленность химической стадии восстановления органического вещества атомарным водородом. Если же процесс протекает на катоде с высоким перенапряжением выделения водорода, определять кинетику восстановления будет замедленность первой электрохимической стадии, и кинетические закономерности восстановления не будут отличаться от наблюдаемых для перенапряжения выделения водорода на этом металле. Плотность тока в этом случае не будет существенно зависеть от концентрации органического вещества в электролите. Подобные кинетические закономерности наблюдаются также при использовании, так называемых, переносчиков водорода, каталитических добавок ионов металлов переменной валентности, таких как титан, ванадий, хром, церий и т. д. Подобные добавки применяют в тех случаях, когда электродный процесс восстановления органического соединения требует значительно большего перенапряжения, чем восстановление иона металла переменной валентности, например в то время как восстановление органического вещества происходит без затруднений в растворе под действием который окисляется до Естественно, что кинетика суммарного процесса восстановления органического соединения в этом случае будет определяться замедленностью процесса восстановления ионов металла переменной валентности.
В этом случае строение двойного электрического слоя и адсорбция поверхностноактивных веществ не будут сказываться на кинетике процесса, и определять закономерности последней будет замедленность химической стадии восстановления органического вещества атомарным водородом. Если же процесс протекает на катоде с высоким перенапряжением выделения водорода, определять кинетику восстановления будет замедленность первой электрохимической стадии, и кинетические закономерности восстановления не будут отличаться от наблюдаемых для перенапряжения выделения водорода на этом металле. Плотность тока в этом случае не будет существенно зависеть от концентрации органического вещества в электролите. Подобные кинетические закономерности наблюдаются также при использовании, так называемых, переносчиков водорода, каталитических добавок ионов металлов переменной валентности, таких как титан, ванадий, хром, церий и т. д. Подобные добавки применяют в тех случаях, когда электродный процесс восстановления органического соединения требует значительно большего перенапряжения, чем восстановление иона металла переменной валентности, например в то время как восстановление органического вещества происходит без затруднений в растворе под действием который окисляется до Естественно, что кинетика суммарного процесса восстановления органического соединения в этом случае будет определяться замедленностью процесса восстановления ионов металла переменной валентности. [c.445]
[c.445]
Низкий выход хрома по току и высокая валентность соединений хрома, из которых производится выделение его на катоде, определяют медленность наращивания хрома на детали. [c.14]
Изучен процесс озонирования в присутствии добавок, служащих донорами электронов (солей мета.ллов переменной валентности, галоидных соединений, аммиака и др.). Применение добавок дает возможность получать ароматические оксипроизводные, хиноны, карбоновые кислоты, перекисные соединения, нитрилы и другие соединения с высокой избирательностью. Показано, что получение того или иного продукта зависит от скорости взаимодействия озона с добавкой. Приведены константы скорости. Описан синергетический эффект, наблюдаемый при использовании в качестве катализатора смеси солей хрома и марганца. Предложена схема процессов, объясняющая полученные результаты, согласно которой озонолиз ароматических соединений предотвращается быстрыми реакциями озона с добавками. [c.330]
[c.330]
Обработка катализатора водородом приводит к восстановлению ионов хрома высокой валентности в ионы Сг +, которые, как хорошо известно, не являются активными центрами полимеризации. Поэтому (Сг +04) — промежуточный продукт восстановления — по-видимому, не образуется и увеличение каталитической активности не наблюдается. [c.183]
Если активацию проводить при высоких температурах (600—700°С), то за счет разложения хрома высших валентностей до трехокиси хрома получается малоактивный катализатор. [c.86]
Часто транспассивное состояние связывается с гем, что пленка фазового окисла, пассивирующего электрод, окисляется до соединений, хорошо растворимых в воде и отвечающих более высокой валентности металла. Например, СггОз или СгОг, на хроме окисляется до СгОз, образующей СггО в кислых растворах или СгО » в щелочных [69]. Подобное же объяснение дается для железа (образование РеО ), никеля (образование КЮа) и других металлов. [c.249]
[c.249]
NO r ПОН способствует первичной пассивации ЭП-220, по при более положительных значениях потенциала анодное растворение происходит через поры пленки вследствие растворения оксидов никеля и хрома более высокой валентности. [c.65]
Феррохром — сплав железа с большим содержанием хрома — получают восстановлением хромита углеродом в электропечах. Его используют при производстве легированных сталей. Сплавы хрома имеют очень важное значение, (причем особое место занимают его сплавы с железом специальные стали). Хромовые стали отличаются высокой твердостью, вяз(костью и прочностью. Их свойства -можно связать с высокой металлической валентностью хрома (VI) и взаимодействием между разнородными атомами, что, как правило, приводит к получению сплавов, отличающихся более высокой твердостью и вязкостью, чем исходные металлы. Хромовые стали идут на изготовление брони, ра(кет, сейфов и пр. Обычная нержавеющая сталь содержит 14—18% хрома и, как правило, 8 /о никеля. [c.576]
[c.576]
Полимеризация этилена при высоком давлении (100—350 МПа,, или 1000—3500 кгс/см ) протекает при 200—300°С в расплаве в присутствии инициаторов (кислорода, органических перекисей). Полиэтилен низкого давления получают полимеризацией этилена под давлением 0,2—0,5 МПа (2—5 кгс/см ) и температуре 50— 80 °С в присутствии комплексных металлоорганических катализаторов (триэтилалюминия, диэтилалюминийхлорида и триизобутил-алюминия). Полиэтилен среднего давления получают полимеризацией этилена в растворителе при давлении 3,5—4,0 МПа (35— 40 кгс/см ) и температуре 130—170 °С в присутствии окислов металлов переменной валентности, являющихся катализаторами (окислы хрома, молибдена, ванадия). В качестве растворителей применяют бензин, ксилол, циклогексан и др. [c.104]
Следует отметить, как это было указано ранее в гл. IV, что при высоких концентрациях азотной кислоты хромоиикелевые стали подвержены так называемому явлению перепассивации , прн котором пассивные пленки теряют свои защитные свойства вследствие иерехода хрома в окислы высшей валентности, неустойчивые в высококонцентрированной кислоте. [c.227]
[c.227]
Интересно отметить, что хром в металлическом состоянии имеет металлическую валентность 6, соответствующую степени окисления + 6, характерной для хроматов и бихроматов, а не более низкой степени окисления -ЬЗ, характерной для солей хрома металлы марганец,, железо, кобальт и никель тоже имеют металлическую валентность 6, хотя почти все эти элементы образуют соединения со степенями окисления + 2 и -ЬЗ. Ценные физические свойства переходных металлов обусловлены высокой металлической валентностью этих элементов. [c.494]
Окислительный потенциал системы Се Се + в серной кислоте равняется 1,44 в. Такой высокий окислительный потенциал позволяет применять соли церия в качестве окислителя так же широко, как применяют растворы бихромата, ванадата и перманганата. Четырехвалентный церий в окислительных реакциях имеет ряд преимуществ по сравнению с перманганатом и бихроматом. При восстановлении перманганата и бихромата образуются нестойкие вещества, в которых ионы марганца и хрома имеют промежуточные состояния валентности и косвенно могут изменять направление реакции. [c.43]
[c.43]
В присутствии неорганических анионов, обладающих окислительными свойствами, появляются иногда в растворах, а также в защитных пленках, ионы низшей валентности (например, Сг ). Последнее как будто противоречит тому, что было сказано выше о невозможности восстановления на железе в нейтральных средах ионов хромата или бихромата на самом же деле здесь никакого противоречия нет. В начальный момент соприкосновения железа с электролитом происходит восстановление некоторого количества анионов хромата (реакция идет с очень малой скоростью) однако как только на поверхности железа образуется пленка из гидратов окиси хрома и железа, дальнейшее восстановление ионов хромата прекращается из-за высокого перенапряжения процесса. [c.57]
Изучение катализаторов в нестационарном состоянии позволило установить прямую связь между валентностью катионов окислов и селективностью в окислении углеводородов. Это открывает возможности предсказания поведения химических соединений определенного состава в качестве катализаторов окисления углеводородов. Так, например, повышение содержания ионов хрома высокой валентности в СГ2О3 приводит к увеличению каталитической активности в реакции полного горения пропилена. Если допустить, что характер зависимости каталитических свойств от изменения валент- [c.264]
Так, например, повышение содержания ионов хрома высокой валентности в СГ2О3 приводит к увеличению каталитической активности в реакции полного горения пропилена. Если допустить, что характер зависимости каталитических свойств от изменения валент- [c.264]
Направления дальнейших исследований. Обширный класс интерметаллических соединений, особенно очень стабильных Бруеровских соединений, представляет интерес для широкого применения в катализе, особенно в области получения синтетического топлива. Так, появляется возможность приготовления нанесенных интерметаллов, которые имеют необычно высокую термическую и химическую стойкость, комбинацией металлов группы УП1 с титаном, стронцием, гафнием, ванадием, ниобием, таллием, хромом, молибденом и вольфрамом. Из-за очень сильных взаимодействий, возникающих при образовании данных соединений, ожидается, что спекание будет существенно уменьшено. Такие сильные взаимодействия, по-видимому, модифицируют электронные и каталитические свойства металла группы УП1. В некоторых случаях это может приводить к ухудшению каталитических свойств. Например, для 2гР1з интенсивное изъятие электронов атомами циркония делает платину заметно истощенной по электронам, а поэтому менее металлической, чем платина нулевой валентности. Такое чрезмерное взаимодействие можно уменьшить или регулировать использованием в качестве второго элемента металла, расположенного -справа или слева от циркония (например, молибдена). [c.139]
В некоторых случаях это может приводить к ухудшению каталитических свойств. Например, для 2гР1з интенсивное изъятие электронов атомами циркония делает платину заметно истощенной по электронам, а поэтому менее металлической, чем платина нулевой валентности. Такое чрезмерное взаимодействие можно уменьшить или регулировать использованием в качестве второго элемента металла, расположенного -справа или слева от циркония (например, молибдена). [c.139]
Подобно хрому, молибден и вольфрам проявляют переменную валентность, но, в отличие от хрома, устойчивыми у ннх являются соединения, отвечающие их высшей валентности +6. Их окислы МоОз и ШОз вследствие высокой валентности металла являются ангидридами. Им отвечают в качестве гидратов кислоты Н2М0О4 — молибденовая и НгШО — вольфрамовая. [c.153]
Весовой метод основан на отделении осадка молибдена с а-бен-зоиноксимом Комплекс осаждают из холодного раствора серной кислоты (1 20), но допускаются и большие концентрации кислоты (1 4). Для предотвращения восстановления пятивалентного молибдена в раствор добавляют небольшой избыток брома. Для полного перевода хрома и ванадия соответственно в трех- и четырехвалентное состояние в раствор добавляют также соль Мора, так как эти элементы в более высоких валентных состояниях мешают анализу. [c.64]
Для предотвращения восстановления пятивалентного молибдена в раствор добавляют небольшой избыток брома. Для полного перевода хрома и ванадия соответственно в трех- и четырехвалентное состояние в раствор добавляют также соль Мора, так как эти элементы в более высоких валентных состояниях мешают анализу. [c.64]
Некоторые минералы, включающие металлы, которые окисляются до более высокого валентного состояния, можно разложить сплавлением со щелочными окислительными расплавами (смесь Na2 03+ KNO3 или более агрессивно действующая Na202). Таковы, например, некоторые минералы из хрома, ванадия, молибдена, которые в этих условиях переходят соответственно в хроматы, ванадаты, молибдаты. Сплавление в этом случае также проводят в железных или никелевых тиглях. [c.448]
Молибден и вольфрам относятся к шестой группе периодической системы и входят в подгруппу хрома. Атомньш вес молибдена 95,95, заряд ядра 42. Атомный вес вольфрама 183,82, заряд ядра 74 находясь в пятом периоде, т. е. во втором большом периоде, молибден и вольфрам имеют следующее расположение электронов 2, 8, 18 13, 1 и 2, 8, 18, 32,12, 2 соответственно. Вследствие такого расположения электронов молибден и вольфрам обладают переменной валентностью, причем наиболее устойчивой оказывается валентность 4 и 6 при валентности 6 атомы обоих элементов освобождаются от одного электрона с наружной оболочки и пяти электронов со второй, приобретая вследствие этого структуру атома инертного газа криптона. Благодаря высокой валентности молибден и вольфрам входят в большинство соединений в виде кислородсодержащего аниона ШоОГ и [c.48]
е. во втором большом периоде, молибден и вольфрам имеют следующее расположение электронов 2, 8, 18 13, 1 и 2, 8, 18, 32,12, 2 соответственно. Вследствие такого расположения электронов молибден и вольфрам обладают переменной валентностью, причем наиболее устойчивой оказывается валентность 4 и 6 при валентности 6 атомы обоих элементов освобождаются от одного электрона с наружной оболочки и пяти электронов со второй, приобретая вследствие этого структуру атома инертного газа криптона. Благодаря высокой валентности молибден и вольфрам входят в большинство соединений в виде кислородсодержащего аниона ШоОГ и [c.48]
В пассивном состоянии окисление самого металла протекает с очень малой скоростью, если ее отнести к общей поверхности электрода, но не прекращается совершенно. Ни фазовый окисел, ни адсорбционный слой кислорода не изолируют полностью поверхность металла от раствора. Поэтому в отдельных местах поверхности, не фиксированных точно, а, вероятно, перемежающихся, может продолжаться растворение металла при высоком положительном потенциале.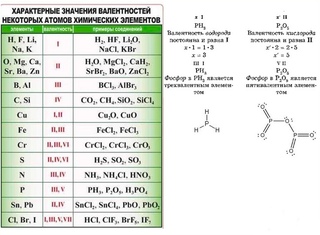 Если металл может существовать в нескольких степенях окисления, то более высокому положительному потенциалу часто отвечает образование ионов более высокой валентности. Так, например, железо может переходить в раствор не в виде двухвалентных ионов (как обычно), а в виде трехвалентных хром может образовывать анионы Сг04 или СГ2О7, в зависимости от pH раствора, и т. д. [c.586]
Если металл может существовать в нескольких степенях окисления, то более высокому положительному потенциалу часто отвечает образование ионов более высокой валентности. Так, например, железо может переходить в раствор не в виде двухвалентных ионов (как обычно), а в виде трехвалентных хром может образовывать анионы Сг04 или СГ2О7, в зависимости от pH раствора, и т. д. [c.586]
Исследование А. Т. Ваграмяна и Д. Н. Усачева и показало, что в случае злектроосаждения хрома процесс осложняется наличием пленки на поверхности электрода. Согласно развитому в работе представлению [39], восстановление ионов хрома происходит не из ионов раствора, а непосредственно из продуктов пленки, образующейся в процессе электролиза на поверхности катода. В состав этой пленки входят хромат-ионы и продукты их неполного восстановления, кроме того,— некоторое количество чужеродных анионов, без которых выделения металла не происходит. Д. Н. Усачевым и А. Т. Ваграмяном было предположено, что металлы, которые входят в пленку в виде сложных анионов и являются ее составной частью, могут разряжаться наряду с ионами хрома. Исследование показало, что действительно при введении в раствор хромовой кислоты марганца в виде КМПО4 на катоде осаждается сплав марганец —хром, содержащий при определенных условиях электролиза (температура, плотность тока, концентрация) 15% Мп и 85% Сг. При изменении условий электролиза состав сплава меняется. Следует отметить, что при введении в хромовый электролит марганца не в виде аниона, а в виде катиона М.п + на катоде осаждается лишь хром, а марганец в осадке не обнаруживается. Это совершенно необычное, аномальное явление для электрохимии, когда в одинаковых условиях электролиза ион более высокой валентности восстанавливается до металла, а более низкой — не восстанавливается. [c.194]
Исследование показало, что действительно при введении в раствор хромовой кислоты марганца в виде КМПО4 на катоде осаждается сплав марганец —хром, содержащий при определенных условиях электролиза (температура, плотность тока, концентрация) 15% Мп и 85% Сг. При изменении условий электролиза состав сплава меняется. Следует отметить, что при введении в хромовый электролит марганца не в виде аниона, а в виде катиона М.п + на катоде осаждается лишь хром, а марганец в осадке не обнаруживается. Это совершенно необычное, аномальное явление для электрохимии, когда в одинаковых условиях электролиза ион более высокой валентности восстанавливается до металла, а более низкой — не восстанавливается. [c.194]
Все известные до сих пор катализаторы для дегидрирования н-бутана и других парафиновых углеводородов состоят в основном из окислов хрома на окиси алюминия. Характерным свойством алю-мохромовых катализаторов является их высокая чувствительность к отравляющему действию воды. Активность алюмохромовых катализаторов связана с содержанием в них окислов хрома высшей валентности (например, СгОз). [c.118]
Активность алюмохромовых катализаторов связана с содержанием в них окислов хрома высшей валентности (например, СгОз). [c.118]
У металлов, которые образуют несколько окислов, пассивирующим свойством обладает, как правило, только один из них. Например, у хрома и железа пленка, состоящая из МеаОд, малорастворима, неактивна и очень компактна. В случае анодного окисления при потенциале выше Е образуются соединения с более высокой валентностью, которые могут быть значительно более растворимы. У хрома окисление хромистых соединений пассивной пленки до растворимых хромовокислых происходит уже при потенциале 1,2 в, тогда как выделение кислорода в кислых растворах начинается при 1,6 в. У железа Е выше Ео , так что кислород выделяется, не нарушая пассивной пленки. Она разрушается при более высоких потенциалах. Подобно хрому ведет себя и молибден. Оба эти металла содержатся в нержавеющих сталях как составные элементы снлава и являются причиной усиления их коррозии в транспассивном состоянии [52]. [c.15]
[c.15]
О происходяш,ем восстановлении катализатора под действием этилена свидетельствует резкое уменьшение в нем содержания Ст в начале полимеризации, на что указывают данные анализа и изменение окраски катализатора. Так, например, в активированном воздухом катализаторе иодометрически определенное содержание Сг составляло 1,96 вес. %, а через 3 мин. после начала реакции полимеризации оно равнялось 0,22 вес.%. По-ви-димому, для проявления катализатором полимеризуюш ей способности необходимо, чтобы это восстановление остановилось на промежуточном валентном состоянии, а не шло глубоко, до образования окисла трехвалентного хрома, который, как известно, не ведет полимеризацию [4, 5, 18, 26]. Поэтому суш ествование температурного предела, до которого катализатор активен (—180°), по-видимому, связано с тем, что при более высоких температурах происходит глубокое восстановление хрома (до Сг ). В литературе имеются высказывания о том, что каталитическая активность в реакции полимеризации связана с окислами хрома промежуточных валентностей [17—19]. Косси и Ван-Рейн [24] восстанавливали в мягких условиях образцы окиснохромового катализатора и снимали их спектры электронного парамагнитного резонанса (ЭПР). Наблюдаемые узкую и широкую линии они приписывают соединениям Сг и. Эти авторы высказывают предположение, что такие ионы хрома и являются активными центрами в реакции полимеризации. Подтверждение в пользу образования иона пятивалентного хрома дается в работе В. Б. Казанского и Ю. И. Печерской [25]. Авторы работы показали, что узкая линия поглош,ения в спектрах электронного парамагнитного резонанса, снятых на неполностью восстановленных алюмохромовых катализаторах (СгОз на А12О3), обусловлена поверхностной фазой соединения Сг . Полученные нами предварительные результаты исследования наших катализаторов методом электронного парамагнитного резонанса сводятся к следующему. [c.162]
Косси и Ван-Рейн [24] восстанавливали в мягких условиях образцы окиснохромового катализатора и снимали их спектры электронного парамагнитного резонанса (ЭПР). Наблюдаемые узкую и широкую линии они приписывают соединениям Сг и. Эти авторы высказывают предположение, что такие ионы хрома и являются активными центрами в реакции полимеризации. Подтверждение в пользу образования иона пятивалентного хрома дается в работе В. Б. Казанского и Ю. И. Печерской [25]. Авторы работы показали, что узкая линия поглош,ения в спектрах электронного парамагнитного резонанса, снятых на неполностью восстановленных алюмохромовых катализаторах (СгОз на А12О3), обусловлена поверхностной фазой соединения Сг . Полученные нами предварительные результаты исследования наших катализаторов методом электронного парамагнитного резонанса сводятся к следующему. [c.162]
Оксиды лантана и калия усиливают гетероциклизующие, дегидрирующие и ослабляют крекирующие, коксообразующие свойства алюмохромового катализатора. Введение оксида калия также приводит к повышению стабильности катализатора. Стационарно работающий катализатор содержит ионы хрома низшей валентности [58, 61]. Но и в присутствии модифицированного алюмохромокалиевого катализатора выход тиофена из бутана и Н28 невелик — не превышает 30-40 %. Гетероциклизацию -бутана ведут при большой концентрации сероводорода, который обладает высокой коррозионной активностью. Уменьшение этого нежелательного воздействия достигается [62] проведением каталшического процесса с небольшой концентрацией сероводорода, но в присутствии элементарной серы. При взаимодействии вьщеляющегося в процессе водорода с серой образуется сероводород, вступающий в реакцию гетероциклизации -бутана в тиофен. [c.177]
Введение оксида калия также приводит к повышению стабильности катализатора. Стационарно работающий катализатор содержит ионы хрома низшей валентности [58, 61]. Но и в присутствии модифицированного алюмохромокалиевого катализатора выход тиофена из бутана и Н28 невелик — не превышает 30-40 %. Гетероциклизацию -бутана ведут при большой концентрации сероводорода, который обладает высокой коррозионной активностью. Уменьшение этого нежелательного воздействия достигается [62] проведением каталшического процесса с небольшой концентрацией сероводорода, но в присутствии элементарной серы. При взаимодействии вьщеляющегося в процессе водорода с серой образуется сероводород, вступающий в реакцию гетероциклизации -бутана в тиофен. [c.177]
По мере накопления экспериментального материала выяснилось, что высокие давления вызывают зачастую уникальные изменения в веществах, которые никаким другими способами достигнуты быть не могут. Это может проявляться в переходе электрона с одной орбитали на другую (церий, цезий), переходе вещества из диэлектрика в состояние с металлической проводимостью (фосфор, оксиды железа, никеля, хрома), переходе вещества из. модификации с малой плотностью в модификацию с большой, в изменении валентности, получении совершенно новых соединений и т. д. Все эти явления крайне интересны, и далеко не всем им в настоящее время дано убедительное объяснение. Давление существенно влияет и на кинетику различных процессов. Многочисленные примеры показывают, как действует давленпе на с.чорость реакций различных порядков и какие выводы можно сделать па основании исследования таких процессов. Действие давления на сложные химические реакции редко удается объяснить до конца, ибо очень трудно выделить в суммарном эффекте, где давление проявило себя как действующее на равновесие процесса, а где — на его кинетику. Особо следует указать на давление, влияющее на скорость пространственно-затруд-ненных реакций. [c.6]
модификации с малой плотностью в модификацию с большой, в изменении валентности, получении совершенно новых соединений и т. д. Все эти явления крайне интересны, и далеко не всем им в настоящее время дано убедительное объяснение. Давление существенно влияет и на кинетику различных процессов. Многочисленные примеры показывают, как действует давленпе на с.чорость реакций различных порядков и какие выводы можно сделать па основании исследования таких процессов. Действие давления на сложные химические реакции редко удается объяснить до конца, ибо очень трудно выделить в суммарном эффекте, где давление проявило себя как действующее на равновесие процесса, а где — на его кинетику. Особо следует указать на давление, влияющее на скорость пространственно-затруд-ненных реакций. [c.6]
Если общее содержание хрома в катализаторе высоко, то доля Сг + будет низкой. Однако активной является лишь та часть Сг +, которая взаимодействует с поверхностью носителя именно этот Сг + участвует i образовании АЦ.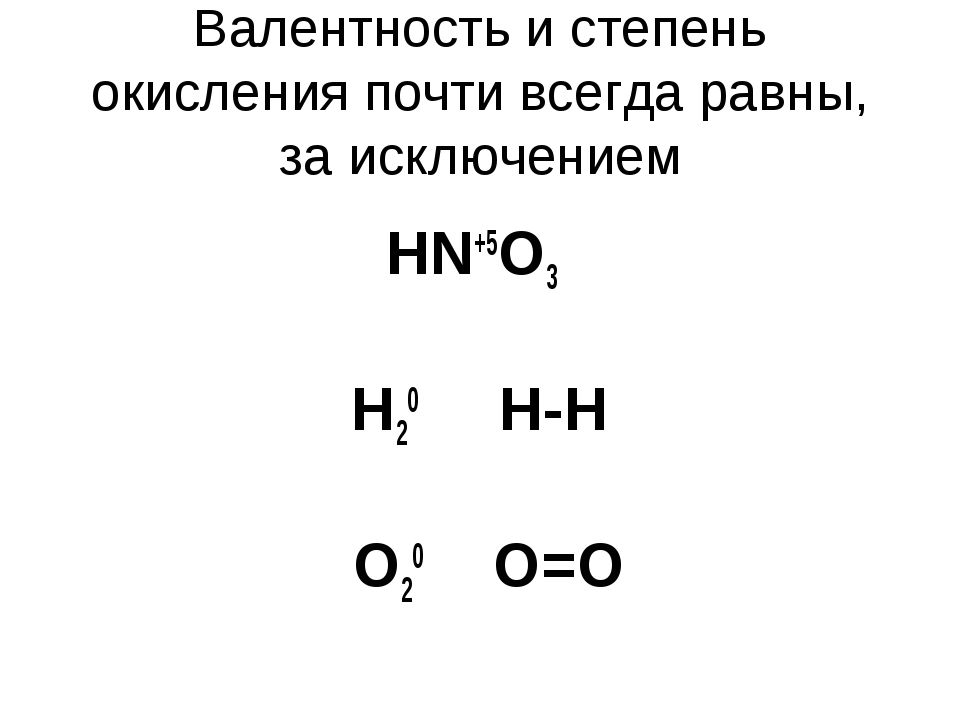 Остальная часть 6-валентного хроыг при активации с удалением влаги (при высоких температурах в токе сухого воздуха) превращается в неактивную фазу СГ2О3. [c.42]
Остальная часть 6-валентного хроыг при активации с удалением влаги (при высоких температурах в токе сухого воздуха) превращается в неактивную фазу СГ2О3. [c.42]
Все три элемента близки по химическим свойствам. Это относится, в частности, к поливалентности, способности образовывать изополи-и гетерополисоединения, проявлению как металлических, так и неметаллических свойств.Основные свойства окислов усиливаются от хрома к вольфраму. Хромовая кислота Н2СГО4 более сильная, чем вольфрамовая. Устойчивость соединений с низшей валентностью растет от вольфрама к хрому. Соединения Мо(У) более устойчивы, чем (V). Соединения Сг(П1) — ярко выраженные ионные соединения. Соединения (У) и Мо(У) почти не имеют ионного характера. Об этом, в частности, говорит их высокая летучесть. Молибден и вольфрам намного более способны образовывать изополи- и гетерополисоединения, чем хром. [c.159]
Хром находится в 6-й группе, в его электронной оболочке на два электрона больше, чем у титана. В основном состоянии атом хрома содержит две полузаполненные оболочки [Аг]3( 4з с шестью неспаренными электронами. Благодаря наличию шести валентных электронов и не очень высокой электроотрицательности хрома (1,6) химия его очень богата и разнообразна он проявляет все степени окисления от -2 до -Ьб. Как и в случае титана, самые низкие степени окисления (-2, -1,0 и -Ы) проявляются только в комплексных соединениях с л-акцепторными лигандами, например в карбониле Сг(СО)в. Наиболее характерна для хрома степень окисления -ЬЗ и, соответственно, электронная конфигурация иона В природе хром встречается в основном в виде соединений Сг(Ш), например хромистого железняка ГеО СГ2О3, правда на Урале встречается красная свинцовая руда РЬСгО , в которой хром находится в степени окисления -Ьб, характеризуюш ейся выраженными окислительными свойствами. [c.347]
В основном состоянии атом хрома содержит две полузаполненные оболочки [Аг]3( 4з с шестью неспаренными электронами. Благодаря наличию шести валентных электронов и не очень высокой электроотрицательности хрома (1,6) химия его очень богата и разнообразна он проявляет все степени окисления от -2 до -Ьб. Как и в случае титана, самые низкие степени окисления (-2, -1,0 и -Ы) проявляются только в комплексных соединениях с л-акцепторными лигандами, например в карбониле Сг(СО)в. Наиболее характерна для хрома степень окисления -ЬЗ и, соответственно, электронная конфигурация иона В природе хром встречается в основном в виде соединений Сг(Ш), например хромистого железняка ГеО СГ2О3, правда на Урале встречается красная свинцовая руда РЬСгО , в которой хром находится в степени окисления -Ьб, характеризуюш ейся выраженными окислительными свойствами. [c.347]
При адсорбции этана и пропана на молибдате хрома при 200-300 °С образуются поверхностные формы, характеризующиеся полосами поглощения 1390, 1450 и 1550 см .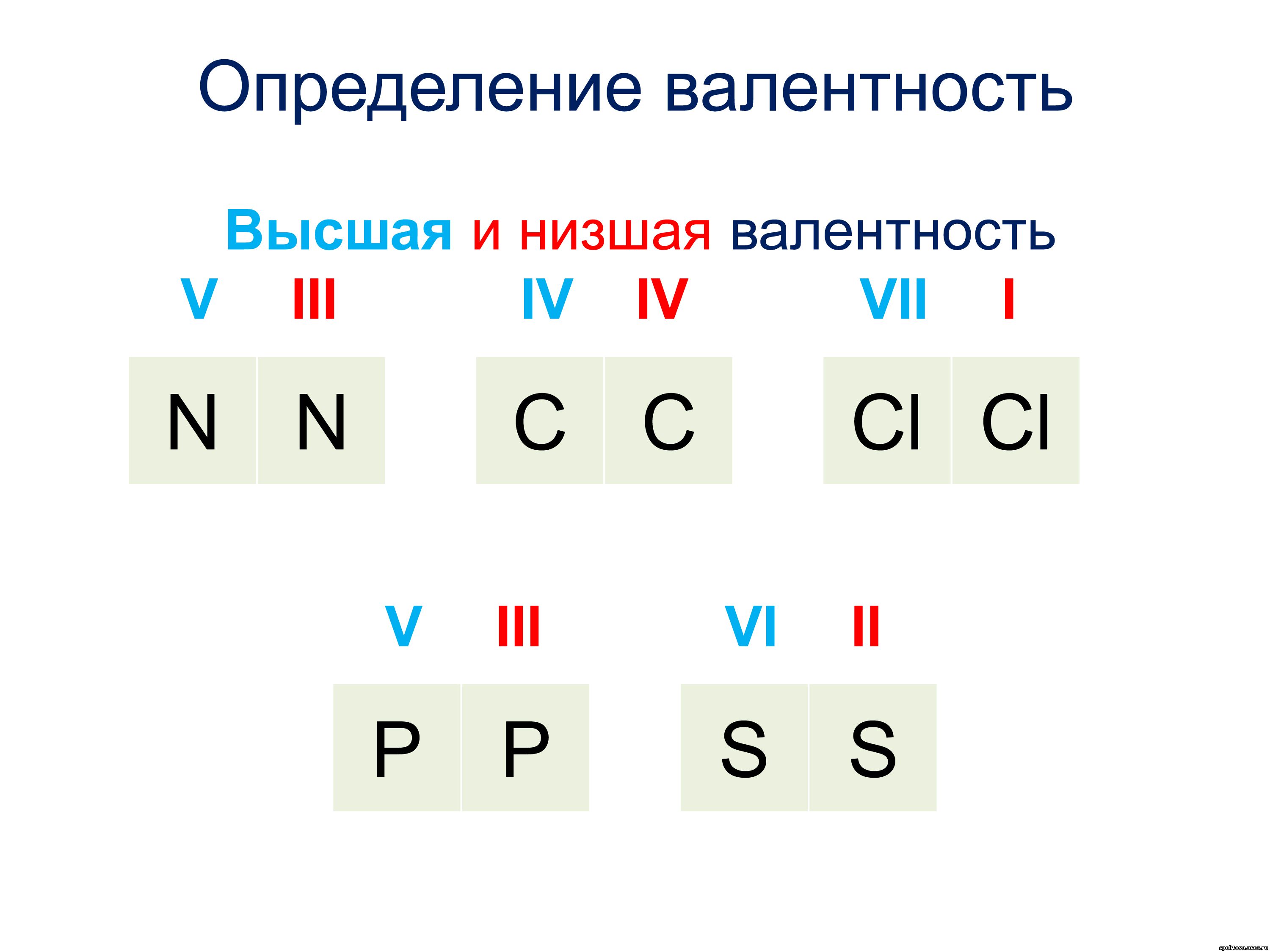 Их интерпретируют как валентные колебания групп формиатных и кар-боксилатных поверхностных структур [97]. Они на молибдате хрома имеют достаточно высокую термостабильность, и полная их десорбция наблюдается лищь при температуре вьшхе 400 °С. [c.90]
Их интерпретируют как валентные колебания групп формиатных и кар-боксилатных поверхностных структур [97]. Они на молибдате хрома имеют достаточно высокую термостабильность, и полная их десорбция наблюдается лищь при температуре вьшхе 400 °С. [c.90]
НИЗШИМ валентным состояниям данного элемента. Однако в тех случаях, когда имеет место внутренняя конверсия у-лучей захвата, следствием ее может — явиться возникновение у атомов высокого положительного заряда, что соответствует процессу окисления. Так, при облучении гидратированных солей трехвалентного хрома до 10% радиоактивного хрома находится в шестивалентном состоянии, а при облучении хлорида четырехвалентного рения наблюдается образование иона перрената КеОГ [39]. [c.26]
Сила адсорбции представляет собой электростатическое притяжение между положительно заряженной внутренней частью иона и электронами металла или его окисла. Имеются основания считать, что в анионах типа МО » валентные электроны распределяются между центральным атомом и атомами кислорода по-разному. В хромат-ионе, например, некоторые из электронов хрома, по всей вероятности, оттянуты от него и перешли к кислороду (электровалентная связь). Поэтому центр иона должен обнаруживать высокий положительный заряд. Благодаря этому заряду хромат-ион, адсорбированный поверхностью металла или окисной пленкой, может вытягивать свободные электроны с поверхности металла. Это будет до некоторой степени ограничивать подвижность электронов и задерживать коррозию. Следует, однако, заметить, что выполненные нами совместно с Ларькиным квантовохимические расчеты показали, что связь хромат-ионов с железом осуществляется не центральным атомом хрома, а посредством кислородных атомов (подробно см. ниже). [c.68]
В хромат-ионе, например, некоторые из электронов хрома, по всей вероятности, оттянуты от него и перешли к кислороду (электровалентная связь). Поэтому центр иона должен обнаруживать высокий положительный заряд. Благодаря этому заряду хромат-ион, адсорбированный поверхностью металла или окисной пленкой, может вытягивать свободные электроны с поверхности металла. Это будет до некоторой степени ограничивать подвижность электронов и задерживать коррозию. Следует, однако, заметить, что выполненные нами совместно с Ларькиным квантовохимические расчеты показали, что связь хромат-ионов с железом осуществляется не центральным атомом хрома, а посредством кислородных атомов (подробно см. ниже). [c.68]
Задания №4 с решениями
Разберем задания №4 из вариантов ОГЭ за 2016 год.
Перед решением заданий советуем повторить тему «Валентность и степень окисления».
Задания с решениями.
Задание №1.
Валентность неметаллов последовательно увеличивается в ряду водородных соединений, формулы которых:
1. HF → Ch5 → h3O → Nh4
2. Sih5 → Ash4 → h3S → HCl
3. HF → h3O → Nh4 → Ch5
4. Sih5 → h3S → Ash4 → HCl
Объяснение: расставим по порядке во всех вариантах ответа валентности неметаллов:
1. HF (I)→ Ch5(IV) → h3O(II) → Nh4(III)
2. Sih5(IV) → Ash4(III) → h3S(II) → HCl(I)
3. HF(I) → h3O(II) → Nh4(III) → Ch5(IV)
4. Sih5(IV) → h3S(II) → Ash4(III) → HCl(I)
Правильный ответ — 3.
Задание №2.
В веществах, формулы которых: CrO3, CrCl2, Cr(OH)3, хром проявляет степени окисления, соответственно равные:
1. +6, +2, +3
2. +6, +3, +2
3. +3, +2, +3
4. +3, +2, +6
Объяснение: определим у хрома степени окисления в данных соединениях: +6, +2, +3. Правильный ответ — 1.
Правильный ответ — 1.
Задание №3.
Азот проявляет одинаковую степень окисления в каждом из двух веществ, формулы которых:
1. N2O5 и LiNO3
2. Li3N и NO2
3. NO2 и HNO2
4. Nh4 и N2O3
Объяснение: определим степени окисления азота в каждой паре соединений:
1. +5 и +5
2. -3 и +4
3. +4 и +3
4. -3 и +3
Правильный ответ — 1.
Задание №4.
В порядке уменьшения валентности в водородных соединениях элементы расположены в ряду:
1. Si → P → S → Cl
2. F → N → C → O
3. Cl → S → P → Si
4. O → S → Se → Te
Объяснение: напишем соответствующие водородные соединения с соответствующими валентностями для каждого ряда:
1. Sih5(IV) → Ph4(III) → h3S(II) → HCl(I)
2. HF(I) → Nh4(III) → Ch5(IV) → h3O(II)
3. HCl(I) → h3S(II) → Ph4(III) → Sih5(IV)
4. h3O(II) → h3S(II) → h3Se(II) → h3Te(II)
Правильный ответ — 1.
Задание №5.
Отрицательная степень окисления химических элементов численно равна:
1. номеру группы в периодической системе
2. Числу электронов, недостающих до завершения внешнего электронного слоя
3. Числу электронных слоев в атоме
4. Номеру периода, в котором находится элемент в периодической системе
Объяснение: электроны — отрицательные частицы, поэтому отрицательная степень окисления обозначает количество электронов, добранных до завершения уровня. Правильный ответ — 2.
(соответственно, положительная степень окисления обозначает недостаток электронов)
Задание №6.
Валентность хрома равна шести в веществе, формула которого:
1. Cr(OH)3 2. Cr2O3 3. h3CrO4 4. CrO
Объяснение: определим валентность хрома в каждом веществе:
1. Cr(OH)3 — III 2. Cr2O3 — III 3. h3CrO4 — VI 4. CrO — II
Правильный ответ — 3.
Задание №7.
Атомы серы и углерода имеют одинаковую степень окисления в соединениях
1. h3S и Ch5
2. h3SO3 и CO
3. SO2 и h3CO3
4. Na2S и Al3C4
Объяснение: определим в каждой паре степени окисления серы и углерода:
1. +2 и -4
2. +4 и +2
3. +4 и +4
4. -2 и -4
Правильный ответ — 3.
Задание №8.
В порядке уменьшения валентности в высших оксидах элементы расположены в ряду:
1. Cl → S → P → Si
2. Si → P → S → Cl
3. N → Si → C → B
4. Na → K → Li → Cs
Объяснение: запишем формулы высших оксидов с соответствующими валентностями для каждого ряда элементов:
1. Cl2О7(VII) → SО3(VI)→ P2О5(V) → SiО2(IV)
Правильный ответ — 1.
Задание №9.
В каком соединении марганец имеет наибольшую степень окисления?
1. KMnO4 2. MnSO4 3. K2MnO4 4. MnO2
Объяснение: определит степень окисления марганца в каждом соединении:
1. KMnO4 — +7 2. MnSO4 — +2 3. K2MnO4 — +6 4. MnO2 — +4
Правильный ответ — 1.
Задание №10.
Высшую степень окисления углерод имеет в соединении:
1. С алюминием
2. С кальцием
3. С хлором
4. С железом
Объяснение: запишем соответствующие соединения углерода со степенями окисления:
1. Al4C3 (-4)
2. CaC2 (-4)
3. CCl (+4)
4. Fe3C (-2)
Правильный ответ — 3.
Автор решения: Лунькова Е.Ю.
Задания для самостоятельной работы.
1. Нулевое значение степени окисления имеют все элементы в веществах, формулы которых:
1. SO2, h3S, h3
2. N2, Nh4, HNO3
3. HBr, Br2, NaBr
4. h3, Br, N2
2. Вещество, в котором степень окисления фосфора равна -3, имеет формулу:
1. P2O5 2. P2O3 3. PCl3 4. Ca3P2
3. Степень окисления железа в соединениях, формулы которых Fe2O3 и Fe(OH)2, соответственно равна:
1. +3 и +3 2. +2 и +2 3. +3 и +2 4. +2 и +3
4. В соединениях, формула которого CaCO3, степень окисления углерода равна:
1. +2 2. -4 3. -2 4. +4
5. В соединениях, формула которого HClO3, степень окисления хлора равна:
1. +5 2. +3 3. +1 4. +7
6. В соединениях, формула которого h4PO4, степень окисления фосфора равна
1. +3 2. +5 3. +2 4. +1
7. Валентность углерода в соединениях, формулы которых СН4 и СО2, соответственно равна:
1. II и IV 2. II и II 3. IV и II 4. IV и IV
8. В соединении, формула которого Н2О2, степень окисления кислорода равна:
1. -2 2. -1 3. +2 4. +1
9. В соединении, формула которого Fe3O4, степень окисления железа равна:
1. +2, +3 2. +2 3. +3 4. +4
10. В перечне KClO3, Cl2, HF, KI, F2, CBr4, AgBr, число формул веществ, в которых галогены имеют нулевую степень окисления, равно
1. Одному 2. Двум 3. Трем 4. Четырем
Предоставленные задания были взяты из сборника для подготовки к ОГЭ по химии авторов: Корощенко А.С. и Купцовой А.А.
Тест на валентность и степени окисления химических элементов.
Задание №1
Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную –4.
- 1. Na
- 2. K
- 3. Si
- 4. Mg
- 5. C
Решение
Задание №2
Из числа указанных в ряду элементов выберите два элемента с наибольшей электроотрицательностью.
- 1. Ba
- 2. Al
- 3. N
- 4. Cl
- 5. Ca
Решение
Задание №3
Из числа указанных в ряду элементов выберите два элемента, проявляющие в сложных соединениях как положительные, так и отрицательные степени окисления.
- 1. Cl
- 2. K
- 3. Br
- 4. F
- 5. Ca
Решение
Задание №4
Из числа указанных в ряду элементов выберите два элемента, которые образуют водородные соединения состава ЭН3.
- 1. Cl
- 2. N
- 3. C
- 4. Be
- 5. P
Решение
Задание №5
Из числа указанных в ряду элементов выберите два элемента, проявляющих в сложных веществах только положительные степени окисления.
- 1. Cl
- 2. F
- 3. Br
- 4. Cu
- 5. Fe
Решение
Задание №6
Из числа указанных в ряду элементов выберите два элемента, проявляющих в сложных соединениях как положительные, так и отрицательные степени окисления.
- 1. He
- 2. P
- 3. Al
- 4. Cl
- 5. Li
Решение
Задание №7
Из числа указанных в ряду элементов выберите два элемента, проявляющих в оксидах степени окисления как +2, так и +3.
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Решение
Задание №8
Из указанных в ряду химических элементов выберите два элемента, проявляющих в сложных веществах постоянную валентность, равную I
- 1. Cs
- 2. C
- 3. Al
- 4. Rb
- 5. Ca
Решение
Задание №9
Из указанных в ряду химических элементов выберите два элемента, являющихся металлами и способных проявлять в соединениях степень окисления +3.
- 1. Cu
- 2. N
- 3. P
- 4. Cr
- 5. Fe
Решение
Задание №10
Из указанных в ряду химических элементов выберите два элемента, простые вещества которых образованы двухатомными молекулами.
- 1. Al
- 2. Mg
- 3. Br
- 4. F
- 5. Na
Решение
Задание №11
Из указанных в ряду химических элементов выберите два элемента, образующие между собой соединение и проявляющие в них одинаковую валентность.
- 1. Ne
- 2. He
- 3. Na
- 4. F
- 5. O
Решение
Задание №12
Из указанных в ряду химических элементов выберите два элемента, проявляющих в соединениях постоянную степень окисления.
- 1. Cr
- 2. Zn
- 3. F
- 4. S
- 5. Fe
Решение
Задание №13
Из указанных в ряду химических элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5. N
Решение
Задание №14
Из указанных в ряду химических элементов выберите два элемента, которые в соединениях проявляют только положительные степени окисления.
- 1. P
- 2. Cu
- 3. Zn
- 4. Si
- 5. Cl
Решение
Задание №15
Из указанных в ряду химических элементов выберите два элемента, высшая степень окисления которых равна +6.
- 1. Na
- 2. S
- 3. Se
- 4. K
- 5. O
Решение
Задание №16
Из указанных в ряду химических элементов выберите два элемента, которые могут проявлять степень окисления +6.
- 1. Cr
- 2. C
- 3. Ge
- 4. Fe
- 5. Pb
Решение
Задание №17
Из указанных в ряду химических элементов выберите два элемента, которые проявляют в сложных веществах постоянные степени окисления.
- 1. N
- 2. Li
- 3. H
- 4. F
- 5. O
Решение
Задание №18
Из указанных в ряду химических элементов выберите два элемента, расположенные в одном периоде, высшая степень окисления которых равна +6.
- 1. P
- 2. Se
- 3. Si
- 4. Cr
- 5. S
Решение
Задание №19
Из указанных в ряду химических элементов выберите два элемента, способные проявлять валентность, равную V.
- 1. Na
- 2. B
- 3. Al
- 4. As
- 5. P
Решение
Задание №20
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в высших оксидах равна +6.
- 1. Al
- 2. S
- 3. Cr
- 4. P
- 5. Si
Решение
Задание №21
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять валентность I.
- 1. Na
- 2. Cl
- 3. Si
- 4. Mn
- 5. Cr
Решение
Задание №22
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5. N
Решение
Задание №23
Из числа указанных в ряду элементов выберите два элемента, которые проявляют в оксидах степень окисления как +2, так и +3.
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Решение
Задание №24
Из числа указанных в ряду элементов выберите два элемента, которые в соединении с кислородом проявляют степень окисления +4.
- 1. S
- 2. Na
- 3. Al
- 4. Si
- 5. Mg
Решение
Задание №25
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в оксидах может принимать значение +3.
- 1. P
- 2. C
- 3. Si
- 4. Cr
- 5. S
Решение
Задание №26
Из числа указанных в ряду элементов выберите два элемента, которые не проявляют положительной степени окисления.
- 1. C
- 2. N
- 3. F
- 4. Be
- 5. Ne
Решение
Задание №27
Из указанных в ряду элементов выберите два элемента, которые не проявляют валентности, равной номеру группы.
- 1. Mg
- 2. P
- 3. N
- 4. O
- 5. Ti
Решение
Задание №28
Из указанных в ряду элементов выберите два элемента, которые в соединениях не проявляют отрицательной степени окисления.
- 1. P
- 2. Cu
- 3. B
- 4. Mg
- 5. Si
Решение
Задание №29
Из указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
- 1. Na
- 2. Al
- 3. Br
- 4. Cu
- 5. Se
Решение
Задание №30
Из указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
- 1. Sr
- 2. Br
- 3. Rb
- 4. As
- 5. Se
Решение
Задание №31
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять валентность I.
- 1. S
- 2. Cu
- 3. Cl
- 4. Si
- 5. Mg
Решение
Задание №32
Из указанных в ряду элементов выберите два элемента, которые в соединениях проявляют степень окисления +6.
- 1. Fe
- 2. Mg
- 3. S
- 4. P
- 5. Cu
Решение
Задание №33
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +4.
- 1. Sc
- 2. F
- 3. N
- 4. C
- 5. Ca
Решение
Задание №34
Из указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
- 1. Cs
- 2. Be
- 3. B
- 4. Cr
- 5. N
Решение
Задание №35
Из предложенного перечня химических элементов выберите два таких, которые проявляют постоянную степень окисления в сложных веществах:
- 1. H
- 2. Cu
- 3. Cs
- 4. Zn
- 5. Cl
Решение
Задание №36
Из предложенного перечня химических элементов выберите два таких, которые проявляют постоянную степень окисления в сложных веществах:
- 1. Sr
- 2. O
- 3. Cr
- 4. Al
- 5. Cl
Решение
Задание №37
Из предложенного перечня химических элементов выберите два таких, которые проявляют постоянную степень окисления в сложных веществах:
- 1. Zn
- 2. H
- 3. C
- 4. Rb
- 5. Cu
Решение
Задание №38
Из предложенного перечня химических элементов выберите два таких, которые проявляют постоянную степень окисления в сложных веществах:
- 1. Cl
- 2. Mn
- 3. O
- 4. Be
- 5. Mg
Решение
Задание №39
Из предложенного перечня химических элементов выберите два таких, которые проявляют постоянную степень окисления в сложных веществах:
- 1. Fe
- 2. F
- 3. P
- 4. H
- 5. Na
Решение
Задание №40
Из предложенного перечня химических элементов выберите два таких, которые могут проявлять в сложных веществах степени окисления, равные +2 и +3:
- 1. Ca
- 2. N
- 3. Al
- 4. Fe
- 5. Cu
Решение
Задание №41
Из предложенного перечня химических элементов выберите два таких, которые могут проявлять в сложных веществах степени окисления в сложных веществах равные +2 и +3:
- 1. Cr
- 2. Li
- 3. F
- 4. Cu
- 5. Fe
Решение
Задание №42
Из предложенного перечня химических элементов выберите два таких, высшая степень окисления которых не равна номеру группы:
- 1. H
- 2. Fe
- 3. O
- 4. Mn
- 5. Cl
Решение
Задание №43
Из предложенного перечня химических элементов выберите два таких, высшая степень окисления которых не равна номеру группы:
- 1. N
- 2. Br
- 3. Cu
- 4. K
- 5. Fe
Решение
Задание №44
Из предложенного перечня химических элементов выберите два таких, высшая степень окисления которых не равна номеру группы:
- 1. F
- 2. Cl
- 3. Mn
- 4. Zn
- 5. Cu
Решение
Задание №45
Из предложенного перечня химических элементов выберите два таких, высшая валентность которых не равна номеру группы:
- 1. H
- 2. N
- 3. O
- 4. Mn
- 5. Cl
Решение
Задание №46
Из предложенного перечня химических элементов выберите два таких, высшая валентность которых не равна номеру группы:
- 1. Br
- 2. F
- 3. P
- 4. N
- 5. Zn
Решение
Задание №47
Из предложенного перечня химических элементов выберите два таких, высшая валентность которых не равна номеру группы:
- 1. Cu
- 2. Sr
- 3. As
- 4. Rb
- 5. N
Решение
Задание №48
Из предложенного перечня химических элементов выберите два таких, которые не способны проявлять отрицательные степени окисления в соединениях:
- 1. Br
- 2. H
- 3. Se
- 4. Ca
- 5. Mn
Решение
Задание №49
Из предложенного перечня химических элементов выберите два таких, которые не способны проявлять отрицательную степень окисления в соединениях:
- 1. Cr
- 2. Sr
- 3. H
- 4. Si
- 5. P
Решение
Задание №50
Из предложенного перечня химических элементов выберите два таких, которые не способны проявлять отрицательную степень окисления в соединениях:
- 1. Si
- 2. F
- 3. Fe
- 4. P
- 5. K
Решение
Задание №51
Из предложенного перечня химических элементов выберите два таких, которые способны проявлять в соединениях только валентность равную II:
- 1. Ca
- 2. Rb
- 3. Cu
- 4. S
- 5. Sr
Решение
Задание №52
Из предложенного перечня химических элементов выберите два таких, которые способны проявлять в соединениях степень окисления, равную +6:
- 1. P
- 2. О
- 3. Cr
- 4. Se
- 5. Cs
Решение
Задание №53
Из предложенного перечня химических элементов выберите два таких, которые образуют водородные соединения вида h3Э:
- 1. Аl
- 2. Se
- 3. Br
- 4. P
- 5. O
Решение
Задание №54
Из предложенного перечня химических элементов выберите два таких, которые в водородных соединениях проявляют валентность равную III:
- 1. Si
- 2. P
- 3. Al
- 4. C
- 5. Xe
Решение
Задание №55
Из предложенного перечня химических элементов выберите два таких, которые в водородных соединениях проявляют валентность равную II:
- 1. F
- 2. K
- 3. Ca
- 4. Te
- 5. P
Решение
Задание №56
Из предложенного перечня химических элементов выберите два таких, которые могут проявлять степень окисления +4:
- 1. N
- 2. O
- 3. P
- 4. Si
- 5. Be
Решение
Задание №57
Из предложенного перечня химических элементов выберите два таких, которые могут проявлять степень окисления +6:
- 1. S
- 2. Fe
- 3. C
- 4. Sc
- 5. As
Решение
Задание №58
Из предложенного перечня химических элементов выберите два таких, которые могут проявлять степени окисления +3 и +5 в оксидах:
- 1. Al
- 2. P
- 3. S
- 4. N
- 5. B
Решение
Задание №59
Из предложенного перечня химических элементов выберите два таких, для которых не характерна постоянная степень окисления:
- 1. N
- 2. Al
- 3. Fe
- 4. Be
- 5. Cs
Решение
Задание №60
Из предложенного перечня химических элементов выберите два таких, для которых не характерна постоянная степень окисления:
- 1. Mg
- 2. F
- 3. Cu
- 4. P
- 5. Sr
Решение
Задание №61
Из предложенного перечня химических элементов выберите два таких, для которых не характерна постоянная степень окисления:
- 1. Al
- 2. F
- 3. Ba
- 4. Cr
- 5. Mn
Решение
Задание №62
Из предложенного перечня химических элементов выберите два таких, для которых возможна степень окисления +4:
- 1. Al
- 2. F
- 3. Rb
- 4. N
- 5. Pb
Решение
Задание №63
Из предложенного перечня химических элементов выберите два таких, для которых высшая степень окисления равна +2:
- 1. Cu
- 2. F
- 3. O
- 4. He
- 5. Al
Решение
Задание №64
Из предложенного перечня химических элементов выберите два таких, для которых высшая степень окисления равна +3:
- 1. Cu
- 2. Ga
- 3. O
- 4. H
- 5. Al
Решение
Задание №65
Из предложенного перечня химических элементов выберите два таких, для которых низшая степень окисления равна -1:
- 1. N
- 2. H
- 3. I
- 4. Se
- 5. Cs
Решение
Задание №66
Из предложенного перечня химических элементов выберите два таких, которые в соответствующих водородных соединениях проявляют валентность, равную IV:
- 1. N
- 2. C
- 3. Ge
- 4. P
- 5. Al
Решение
Задание №67
Из предложенного перечня химических элементов выберите два таких, которые не могут проявлять отрицательную степень окисления в соединениях:
- 1. Se
- 2. F
- 3. Si
- 4. Sr
- 5. Cr
Решение
Задание №68
Из предложенного перечня химических элементов выберите два таких, которые в водородных соединениях проявляют валентность, равную II:
- 1. S
- 2. I
- 3. Ba
- 4. Al
- 5. Br
Решение
Задание №69
Из предложенного перечня химических элементов выберите два таких, которые не могут проявлять отрицательные степени окисления в сложных веществах:
- 1. F
- 2. H
- 3. Mn
- 4. Rb
- 5. Si
Решение
Задание №70
Из предложенного перечня химических элементов выберите два таких, высшая степень окисления которых не совпадает с номером группы:
- 1. O
- 2. Te
- 3. Cu
- 4. Cr
- 5. Mn
Решение
Задание №71
Из предложенного перечня химических элементов выберите два таких, высшая валентность которых не равна номеру группы:
- 1. N
- 2. P
- 3. Cr
- 4. Cu
- 5. Mn
Решение
Задание №72
Из предложенного перечня химических элементов выберите два таких, для которых высшая степень окисления равна +2:
- 1. O
- 2. F
- 3. Ba
- 4. H
- 5. Fr
Решение
Задание №73
Из предложенного перечня химических элементов выберите два таких, которые не могут проявлять отрицательную степень окисления в соединениях:
- 1. Sc
- 2. P
- 3. H
- 4. Cs
- 5. O
Решение
Задание №74
Из числа указанных в ряду элементов выберите два элемента, проявляющие в сложных соединениях как положительные, так и отрицательные степени окисления.
- 1. O
- 2. K
- 3. Si
- 4. F
- 5. Ba
Решение
Задание №75
Из числа указанных в ряду элементов выберите два таких, низшая степень окисления которых равна –4.
- 1. С
- 2. K
- 3. Si
- 4. Ti
- 5. N
Решение
Задание №76
Из предложенного перечня химических элементов выберите два таких, низшая степень окисления которых равна -2:
- 1. Sr
- 2. Se
- 3. Cl
- 4. Ba
- 5. S
Решение
Задание №77
Из предложенного перечня d-элементов выберите два таких, высшая степень окисления не совпадает с номером группы:
- 1. Cr
- 2. Mn
- 3. Cu
- 4. Zn
- 5. Fe
Решение
Задание №78
Из предложенного перечня химических элементов выберите два таких, низшую степень окисления которых нельзя рассчитать по формуле: № группы — 8
- 1. Si
- 2. Mn
- 3. Cr
- 4. N
- 5. P
Решение
Задание №79
Из предложенного перечня химических элементов выберите два таких, низшие степени окисления которых не могут принимать отрицательных значений:
- 1. H
- 2. Mn
- 3. O
- 4. Zn
- 5. Si
Решение
Задание №80
Из предложенного перечня химических элементов выберите два таких, высшая степень окисления которых равна +2:
- 1. O
- 2. Cu
- 3. Fe
- 4. Cr
- 5. S
Решение
Задание №81
Из предложенного перечня химических элементов выберите два таких, которые в водородных соединениях проявляют валентность, равную III:
- 1. Ca
- 2. P
- 3. Al
- 4. Xe
- 5. Rb
Решение
Задание №82
Из предложенного перечня химических элементов выберите два таких, которые не проявляют постоянную степень окисления в сложных веществах:
- 1. H
- 2. F
- 3. O
- 4. Ca
- 5. Cs
Решение
Задание №83
Из предложенного перечня химических элементов выберите два таких, степень окисления которых в оксидах может принимать значение, равное +4:
- 1. P
- 2. N
- 3. Fe
- 4. Mn
- 5. Ca
Решение
Задание №84
Из предложенного перечня химических элементов выберите два таких, низшую степень окисления которых нельзя рассчитать по формуле: № группы — 8
- 1. C
- 2. Cl
- 3. Cu
- 4. N
- 5. Al
Решение
Задание №85
Из предложенного перечня химических элементов выберите два таких, которые не способны проявлять отрицательную степень окисления в соединениях:
- 1. Cr
- 2. Sr
- 3. H
- 4. Si
- 5. P
Решение
Задание №86
Из предложенного перечня химических элементов выберите два таких, которые не способны проявлять валентность, равную V:
- 1. N
- 2. P
- 3. As
- 4. Cl
- 5. O
Решение
Задание №87
Из предложенного перечня химических элементов выберите два таких, низшую степень окисления которых нельзя рассчитать по формуле: № группы — 8
- 1. H
- 2. Br
- 3. Si
- 4. N
- 5. Mn
Решение
Задание №88
Из предложенного перечня химических элементов выберите два таких, в водородных соединениях которых водород проявляет отрицательную степень окисления:
- 1. N
- 2. Al
- 3. P
- 4. Sr
- 5. Se
Решение
Задание №89
Из предложенного перечня химических элементов выберите два таких, которые способны проявлять степени окисления +1, +3 и +5 в сложных веществах:
- 1. N
- 2. Al
- 3. Cl
- 4. Si
- 5. C
Решение
Задание №90
Из предложенного перечня ионов выберите такие, в которых степень окисления серы равна +6:
- 1. SO32-
- 2. SO42-
- 3. HS—
- 4. HSO3—
- 5. HSO4—
Решение
Задание №91
Установите соответствие между формулой частицы и степенью окисления серы в ней:
| Формула частицы | СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ |
A) SO32- Б) KHSO4 В) S2O72- | 1) -3 2) -2 3) -1 4) +1 5) +2 6) +3 7) +4 8) +5 9) +6 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №92
Установите соответствие между формулой частицы и степенью окисления хлора в ней:
| ФОРМУЛА ЧАСТИЦЫ | СТЕПЕНЬ ОКИСЛЕНИЯ ХЛОРА |
A) ClO3— Б) HClO4 В) Ca(ClO)2 | 1) -2 2) -1 3) +1 4) +2 5) +3 6) +4 7) +5 8) +6 9) +7 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №93
Установите соответствие между формулой частицы и степенью окисления хрома в ней:
| ФОРМУЛА ЧАСТИЦЫ | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА |
A) Cr2O72- Б) CrO42- В) Cr2O3 | 1) -2 2) -1 3) +1 4) +2 5) +3 6) +4 7) +5 8) +6 9) +7 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №94
Установите соответствие между формулой частицы и степенью окисления фосфора в ней:
| ФОРМУЛА ЧАСТИЦЫ | СТЕПЕНЬ ОКИСЛЕНИЯ ФОСФОРА |
A) Ca(H2PO4)2 Б) H2PO2— В) PH3 | 1) -4 2) -3 3) -2 4) -1 5) +1 6) +2 7) +3 8) +4 9) +5 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №95
Установите соответствие между формулой частицы и степенью окисления азота в ней:
| ФОРМУЛА ЧАСТИЦЫ | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА |
1) N2H4 2) NH2OH 3) (NH4)2HPO4 | 1) -4 2) -3 3) -2 4) -1 5) +1 6) +2 7) +3 8) +4 9) +5 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №96
Установите соответствие между формулой частицы и степенью окисления хрома в ней:
| ФОРМУЛА ЧАСТИЦЫ | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА |
А) (NH4)2Cr2O7 Б) Н2Cr2O7 В) K2CrO4 | 1) -1 2) 0 3) +1 4) +2 5) +3 6) +4 7) +5 8) +6 9) +7 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №97
Установите соответствие между формулой частицы и степенью окисления азота в ней:
| ФОРМУЛА ЧАСТИЦЫ | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА |
А) NH4+ Б) (NH4)2HPO4 В) NH4MnO4 | 1) -4 2) -3 3) -2 4) -1 5) 0 6) +1 7) +2 8) +3 9) +4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №98
Установите соответствие между формулой частицы и степенью окисления кислорода в ней:
| ФОРМУЛА ЧАСТИЦЫ | СТЕПЕНЬ ОКИСЛЕНИЯ КИСЛОРОДА |
А) Na2O2 Б) OF2 В) O22- | 1) -4 2) -3 3) -2 4) -1 5) 0 6) +1 7) +2 8) +3 9) +4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №99
Установите соответствие между формулой частицы и степенью окисления кислорода в ней:
| ФОРМУЛА ЧАСТИЦЫ | СТЕПЕНЬ ОКИСЛЕНИЯ КИСЛОРОДА |
А) SO32- Б) OH— В) H2O2 | 1) -4 2) -3 3) -2 4) -1 5) 0 6) +1 7) +2 8) +3 9) +4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Высшую валентность азот проявляет в оксиде
.
Содержание верного ответа и указания по оцениванию (допускаются другие формулировки ответа, не искажающие его смысла)
Часть А – 1 балл 23-21 балл – «5»
Часть В – 1- 2 балла 20-16 баллов – «4»
15- 12 баллов – «3»
Список литературы:
- Габриелян О.С., Химия. 8 класс. Дрофа. 2010г
Рудзитис Г.Е. Химия 8 класс. М.: «Просвещение», 2010г.
ТЕСТ
№2(1). Молекулы и атомы. Простые и сложные
вещества. Знаки химических элементов.
Относительные атомная и молекулярная
массы. Химические формулы.
Часть
А
Современную химическую символику
разработал
1) Д.И.Менделеев 3) Й. Берцелиус
2) А. Лавуазье 4) А. Авогадро
2. Химический элемент – это
1) определенный вид атомов
2) вещество, которое нельзя разложить
на более простые вещества
3) атомы с одинаковой массой
4) вещество, которое при химическом
превращении всегда увеличивает свой
вес.
3. Относительная атомная масса химического
элемента – это
1) масса его атома
2) масса его атома, выраженная в а.е.м.
3) отношение массы атома к 1/12 массы
атома углерода
4) масса его атома, выраженная в
граммах
4. Простое вещество образовано
1) одинаковыми молекулами
2) атомами одного химического элемента
3) молекулами, состоящими из одного
атома
4) простыми молекулами
5. Молекулярные массы Fe 3 O 4 ,
H 3 PO 4 ,
N 2 равны соответственно
6. Массовая доля железа в соединении
Fe 2 O 3
равна
7. Массовые доли элементов в соединении
железа с серой равны соответственно
46,67% и 53,33%. Формула соединения
4) Fe 2 (SO 4) 3
Часть Б
8. Вставьте пропущенные в высказывании
слова: «_________________________ — это
мельчайшие химически неделимые
частицы, из которых состоят молекулы».
9. Установите соответствие между названием
вещества и его типом. Ответ запишите
в виде последовательности букв и
цифр, например, А1, Б2 и т.п.
1) вода А –
простые вещества
2) кислород Б –
сложные вещества
10. Распределите на группы – металлы (А)
и неметаллы (Б) – химические элементы:
Ответ запишите в виде последовательности
букв и цифр, например, А123, Б456.
ТЕСТ №2(2). Молекулы и атомы. Простые и
сложные вещества. Знаки химических
элементов. Относительные атомная и
молекулярная массы. Химические формулы
Часть А
Д.Дальтону
Д.И. Менделееву
Аристотелю
атомы одного химического элемента
атомы одного химического элемента,
отличающиеся по массеатомы одного химического элемента,
одинаковые по массеатомы одного химического элемента,
одинаковые по размеру
Заслуга введения в науку понятия о
химическом элементе принадлежит
Изотопы — это
Приведенное в таблице химических
элементов Д.И.Менделеева значение
относительной атомной массы химического
элемента – это
состоит из двух атомов
содержит мало атомов
содержит одинаковые атомы
состоит из атомов одного химического
элементаМассовая доля марганца в соединении
Mn 2 О 7 равнаМассовые доли фосфора и хлора в соединении
равны соответственно 14,87% и 85,13%. Формула
соединения
относительная атомная масса его самого
тяжелого изотопа
относительная атомная масса его самого
легкого изотопа
относительная атомная масса его самого
распространенного в природе изотопа
средняя атомная масса всех изотопов,
с учетом распространенности их в
природе
Азот (N 2) является
простым веществом, так как его молекула
Относительные молекулярные массы HNO 3 ,
P 2 O 5 ,
O 3 равны соответственно
Часть Б
Вставьте пропущенные в высказывании
слова: «__________________________ — это
атомы одного вида».
Установите соответствие между названием
вещества и его типом. Ответ запишите в
1) сера А
– простые вещества
2) кислород Б
– сложные вещества
10. Распределите на группы – металлы
(А) и неметаллы (Б) – химические элементы:
ТЕСТ №3(1). Валентность химических
элементов. Составление формул по
валентности. Химические уравнения. Типы
химических реакций.
Часть А
Валентность серы, азота и углерода в
их водородных соединениях (H 2 S,
NH 3 , CH 4)
соответственно равны
2. Символы химических элементов, образующих
простые вещества-металлы, записаны
под номером
3.Валентность серы в соединениях Na 2 S,
SO 3 , CS 2
равны соответственно
4.Формулы бинарных соединений кальция
с азотом и алюминия с серой соответственно
записаны под номером
Al 2 S 3 ,
Ca 3 N 2
Ca 3 N 2 ,
Al 2 S 3
Ca(NO 3) 2 ,
Al 2 S 3
Ca 3 N 2 ,
Al 2 (SO 4) 3
5.Сумма коэффициентов в уравнении реакции
Na +H 2 O
→ NaOH + H 2
равна
6. Закончите уравнение реакции (коэффициенты
указаны): Fe + CuCl 2
= … + FeCl 2
образовавшегося из 5,6 г железа и 3,2 г
серы.
Часть Б
8. Вставьте пропущенные в высказывании
слова: «Масса веществ, вступивших в
химическую реакцию ____________________ массе
образовавшихся веществ».
Установите соответствие между левой
и правой частью уравнения реакции.
Ответ запишите в виде последовательности
букв и цифр, например, А1, Б2 и т.п.
4Al + 3O 2
= А.
Al 2 O3
+ 3H 2 O
2Al(OH) 3
= Б.
2AlCl 3
+ 3H 2 O
Al 2 O 3
+ 6HCl = В. 2Al 2 O 3
Распределите на группы химические
реакции – соединения (А) и замещения
(Б):
4Fe + 3O 2
= 2Fe 2 O 3
Hg(NO 3) 2
+ Cu = Cu(NO 3) 2
+ HG
S + O 2
= SO 2 ,
Zn + 2HCl = ZnCl 2
+ H 2
N 2
+ O 2
= 2NO
2Al(OH) 3
= Al 2 O 3
+ 3H 2 O
Ответ запишите в виде последовательности
букв и цифр, например А123, Б456.
ТЕСТ №3(2). Валентность химических
элементов. Составление формул по
валентности. Химические уравнения. Типы
химических реакций.
Часть А
Валентность кальция, натрия и алюминия
в их соединениях с кислородом – CaO,
Na 2 O,
Al 2 O 3
– соответственно равна
1) I, II, III 3) II, I, III
2) III, II, I 4) II, III, I
2. Символы химических элементов, образующих
простые вещества–металлы, записаны
под номером
3. Валентность азота в соединениях Na 3 N,
NO, NF 3
соответственно равна
1) I, II, III 3) III, I, III
2) III, II, III 4) I, II, I
4. Формулы бинарных соединений магния
с азотом и кальция с серой соответственно
записаны под номером
1) CaS, Mg 3 N 2
3) Mg(NO 3) 2 ,
CaS
2) Mg 3 N 2 ,
CaSO 4
4) Mg 3 N 2 ,
CaS
5. Сумма коэффициентов в уравнении
реакции FeCl 2 + Cl 2
→ FeCl 3 равна
6. Закончите уравнение реакции
(коэффициенты указаны): Mg
+ 2… = H 2
+ MgCl 2
7. Используя закон сохранения массы,
определите массу сульфида железа(II),
образовавшегося из 56 г железа и 32
г серы.
Часть Б
8. Вставьте пропущенные в высказывании
слова: «_________________________ называют
условное изображение хода химической
реакции посредством знаков и формул».
9.Установите соответствие между левой
и правой частями уравнения реакции.
Ответ запишите в виде последовательности
букв и цифр, например, А1, Б2 и т.п.
1) 4Fe +3O 2 =
А.
Fe 2 O 3
+ 3H 2 O
2) 2Fe(OH) 3
= Б.
2FeCl 3
+ 3H 2 O
3) Fe 2 O 3
+ 6HCl = В.
2Fe 2 O 3
10. Распределите на группы химические
реакции – разложения (А) и замещения
(Б):
1) 4Fe + 3O 2
= 2Fe 2 O 3
2) Hg(NO 3) 2
+ Cu = Cu(NO 3) 2
+ Hg
3) 4HNO 3
= 4NO 2
+ O 2
+2H 2 O
4) Zn + 2HCl = ZnCl 2
+ H 2
5) CaCO 3
= CaO + CO 2
6) Al(OH) 3
= Al 2 O 3
+ 3H 2 O
Ответ запишите в виде последовательности
букв и цифр, например А123, Б456.
ТЕСТ №4 (1). Молярная масса. Вычисления
по уравнениям химических реакций
Часть А
Молярная масса соединения CuSO 4
∙ 5H 2 O
(г/моль)Чему равно количество вещества (моль),
содержащееся в оксиде серы(VI)
массой 12г?При взаимодействии раствора, содержащего
гидроксид натрия NaOH
массой 4 г, с раствором хлорида меди(II)
Сu(OH) 2
и хлорид натрия NaCl. Чему
равна масса (г) оксида? (Ответ дайте в
виде целого числа.)Чему равна масса (г) хлорида железа(III),
полученного при реакции железа массой
16,8 г с хлором?Чему равна масса (г) оксида железа Fe 3 O 4 ,
образующегося при горении на воздухе
железа массой 11,2 г?Масса осадка сульфата бария BaSO 4 ,
образовавшегося при смешивании
растворов, содержащих сульфат натрия
Na 2 SO 4
массой 1,42 г и хлорид бария BaCl 2
массой 2,8г, равнаЧему равна масса соли хлорида алюминия
AlCl 3 (г), образовавшейся
в результате реакции гидроксида алюминия
Al(OH) 3
массой 23,4 г и соляной кислоты HCl,
содержащей 35 г хлороводорода?
Чему равно число молекул воды, содержащихся
в порции вещества массой 3,6 г?
Часть Б
Вычислите массу оксида железа(III),
образующегося при взаимодействии 22,4
г железа с 10 г кислорода. Ответ приведите
в виде целого числа.При горении метана (CH 4)
на воздухе образуются углекислый газ
и вода. Вычислите массу воздуха,
требуемого для горения 16 г метана, если
массовая доля кислорода в воздухе
составляет 28,6 %.
ТЕСТ №4 (2). Молярная масса. Вычисления
по уравнениям химических реакций.
Часть А
Молярная масса соединения CaSO 4
∙ 2H 2 O
(г/моль)Масса образца серы 19,2 г. Чему равно
количество вещества серы (моль)?Чему равна масса (г) карбоната натрия
Na 2 CO 3
количеством вещества 0,25 моль?При взаимодействии раствора, содержащего
гидроксид натрия NaOH
массой 8 г, с раствором нитрата меди(II)
Cu(NO 3) 2
образовался осадок гидроксида
меди(II) Cu(OH) 2
и нитрат натрия (NaNO 3).
Чему равна масса (г) гидроксида меди(II)?
(Ответ дайте в виде целого числа.)Чему равна масса серы (г), вступившей в
реакцию с алюминием массой 2,7 г?Чему равна масса гидроксида железа(III)
(г), растворившегося в серной кислоте
H 2 SO 4 ,
массой 9,8 г? Схема реакции: Fe(OH) 3
+ H 2 SO 4
→ Fe 2 (SO 4) 3
+ H 2 O.
(Ответ дайте в виде целого числа).
Чему равно число атомов фосфора,
содержащихся в образце фосфора массой
155 г?
8. Чему равна масса осадка сульфата
бария BaSO 4 (г),
образовавшегося при смешивании
растворов, содержащих сульфат
натрия Na 2 SO 4
массой 1,6 г и хлорид бария BaCl 2
массой 2,08 г?
Часть Б
9. Вычислите массу оксида меди(II),
образующегося при взаимодействии 27 г
алюминия с
25 г кислорода. Ответ приведите в виде
целого числа.
При горении метана (СН 4) образуются
углекислый газ и вода. Вычислите массу
воздуха, требующегося для сжигания 32
г метана, если массовая доля кислорода
в воздухе равна 28,7%.
Тест итогового (тематического) контроля
ТЕСТ № 1(1). Обобщение и контроль знаний
по теме « Первоначальные химические
понятия»
Часть А
воспользоваться лупой и пинцетом
добавить к смеси воду, затем профильтровать
пропустить смесь через сито
добавить к смеси воду, затем профильтровать
и упарить фильтратдистиллированная вода, алюминий, воздух
почва, морская вода, духи
медь, железо, свинец
сталь, бронза, мельхиор
скисание молока и горение свечи
таяние льда и испарение воды
замерзание воды и гниение остатков
свечение электролампы и образование
облаковPH 3 ,
P 4 ,
O 3NH 3 ,
N 2 ,
N 2 OH 2 O,
Cl 2 ,
HClтрех атомов азота и одного атома
водородаодного атома азота и трех атомов
водородаодного атома азота и одного атома
водородатрех атомов азота и трех атомов водорода
Для разделения смеси порошков мела и
поваренной соли следует
Перечень чистых веществ помещен под
номером
Формулы только простых веществ
Молекула аммиака состоит из
Сумма коэффициентов в уравнении реакции
фосфора (Р) с избытком кислорода (О 2)
Массовая доля цинка в хлориде цинка
равна
Валентность хрома в соединении Cr 2 O 3
равна
Часть Б
А. Атомы – это мельчайшие химически
неделимые частицы, из которых состоят
молекулы.
Б. При физических явлениях молекулы
вещества сохраняются, а при химических
– разрушаются.
1) верны оба высказывания
2) верно высказывание А, высказывание Б
неверно
3) верно высказывание Б, высказывание А
неверно
4) оба высказывания неверны
10. Установите соответствие между
уравнением реакции и его типом. Ответ
запишите в
виде последовательности букв и
цифр, например, А1, Б2 и т.п.
Fe 2 O 3
+ 6HCl = 2FeCl 3
+ 3H 2 O
А. Замещение
Fe + 2HCl =
FeCl 2 + H 2
Б. Соединение
4Fe + 3O 2
= 2Fe 2 O 3
В. Разложение
2Fe(OH) 3
= Fe 2 O 3
+ 3H 2 O
Г. Обмен
ТЕСТ №1 (2). Обобщение и контроль знаний
по теме «Первоначальные химические
понятия»
Часть А
фильтрования
декантации
перегонки
сахар, железо, воздух
почва, морская вода, духи
медь, бронза, свинец
сталь, кислород, мельхиор
обугливание сахара и засахаривание
вареньяобразование инея и образование облаков
скисание молока и выделение газа из
бутылки лимонадаобразование газа при смешивании соды
с уксусом и почернение серебряных
изделийS 8 ,
P 4 ,
NH 3NaOH, KOH, HNO 3
одного атома серы и одного атома
кислородаодного атома серы и трех атомов кислорода
одного атома серы и двух атомов кислорода
двух атомов серы и одного атома кислорода
Валентность хрома в соединении CrO 3
равнаМассовая доля кальция в нитриде кальция
равна
Смесь порошков серы и железа можно
разделить при помощи
Перечень смесей помещен под номером
Только химические явления описаны под
номером
Формулы только простых веществ объединены
под номером
Молекула оксида серы(IV)
состоит из
Сумма коэффициентов в уравнении реакции
алюминия с кислородом (О 2) равна
Часть Б
Выскажите мнение по поводу суждений:
А. Молекулы веществ находятся в непрерывном
движении. Скорость движения
молекул зависит от температуры.
Б. При физических явлениях молекулы
вещества разрушаются, а при химических
—
сохраняются.
верны оба высказывания
верно высказывание А, высказывание Б
неверно
верно высказывание Б, высказывание А
неверно
оба высказывания неверны
Установите соответствие между уравнением
реакции и его типом. Ответ запишите в
виде последовательности букв и цифр,
например, А1, Б2 и т.п.
Al 2 O 3
+ 6HCl = 2AlCl 3
+ 3H 2 O
А. Замещение
2Al + 6HCl =
2AlCl 3 +3H 2
Б. Соединение
4Al + 3O 2
= 2Al 2 O 3
В. Разложение
2Al(OH) 3
= Al 2 O 3
+ 3H 2 O
Г. Обмен
Хром и его соединения
Открытый урок по теме: «Хром и его соединения»
Подготовила и провела учитель
МОУ Поназыревской СОШ
Пинегина О.С.
Урок «Хром и его соединения» – это третий урок по теме «Металлы побочных подгрупп», изучается в 11 классе (профильный уровень). Данный урок очень насыщен теоретическим материалом и экспериментом.
Элементы содержания: хром: особенности строения атома, физические и химические свойства, получение и применение. Оксиды и гидроксиды хрома, зависимость их от свойств, от степени окисления элемента. Важнейшие соли хрома. Комплексные соединения хрома.
Цели образования
Обучающая: актуализировать и закрепить знания учащихся по теме, отработать умения составлять уравнения реакций с участием соединений хрома, продолжить работу по развитию находить основные, узловые вопросы в материале, анализировать, обобщать, делать выводы, применение теоретических знаний для объяснения результатов проведенных опытов.
Развивающая: развивать
-учебно-информационные навыки: умение извлекать информацию из устного сообщения, справочных таблиц, наблюдаемых процессов;
-учебно-логические: умение анализировать данные, выявлять сущность наблюдаемых процессов, обобщать и делать выводы, формулировать определения понятий;
-учебно-организационные: организовывать самостоятельную деятельность, совершенствовать навыки самооценки знаний и умений.
Воспитательная: привитие интереса к изучаемому предмету, к самоорганизации и культуре труда, формировать умение вести диалог, дискутировать, выслушивать друг друга, формировать понимание развития своего интеллекта как ценностной характеристики современной личности.
Тип урока: урок совершенствования знаний, умений и навыков
Вид урока: урок -практикум
Наглядные пособия: таблицы “Периодическая система Д.И.Менделеева”, “Электрохимический ряд напряжений металлов”, “Растворимость соединений”, методическое пособие “Окислительно-восстановительные реакции”, учебники;
Оборудование к уроку:
-Оборудование и реактивы для демонстрационного эксперимента
-На столах учащихся оборудование и реактивы для лабораторных опытов.
-Распечатанные задания в формате ЕГЭ.
-Инструкция для проведения лабораторных опытов.
-Информационный лист
Педагогическая технология: технология практико-ориентированного подхода в обучении
Методы:
-проблемно — поисковый,
-объяснительно-иллюстративный
-дифференцированная и индивидуальная самостоятельная работа учащихся в группах,
-работа с учебной и дополнительной литературой,
-исследовательский
Форма организации учебной деятельности: дифференцированно — групповая.
Средства обучения: литература
учебная:1) Габриелян О.С. Химия. 11. – М.:Дрофа, 2014г.
дополнительная: 1)Глинка Н.Л. Общая химия: Учебное пособие для вузов.- Л.,:Химия, 1984г.
2)Лидин Р.А. Справочник по общей и неорганической химии.- М,: Просвещение.
3)Хомченко В.М. Химия: учебник.-М.: Высшая школа, 1982г.
4)Третьяков Ю.Д. Химия: Справ. Материалы :Кн. для учащихся.-М.:Просвещение.
Оборудование и реактивы: Реактивы: бихромат аммония (Nh5)2Cr2O7, раствор хлорида хрома (III) CrCl3, раствор бихромата калия K2Cr2O7, раствор сульфита натрия Na2SO3, раствор нитрата бария Ba(NO3)2, разбавленный раствор соляной кислоты HCl, разбавленный раствор серной кислоты h3SO4, раствор гидроксида натрия NaOH (ω = 30%),раствор хромата калия K2CrO4, раствор нитрата серебра АgNO3.
Посуда и оборудование: фарфоровая чашка, шпатель, спиртовка, штатив для пробирок, пробирки, стеклянная палочка, колбы
Ход урока:
Учитель: Ребята какую тему мы с Вами проходим? А что это такое металлы? Элементы металлы? Простые вещества металлы?
Учитель:
Конкурс «Вопрос – ответ» один учащийся работает у доски
Задание разделите металлы на две группы:
1группа – металлы главных подгрупп— алюминий, кальций, магний, калий , натрий,
2 группа – металлы побочных подгрупп: железо, медь, цинк, серебро
В какой металл упаковывают еду для космонавтов и конфеты для сладкоежек? (алюминий)
На долю этого металла приходится более 1,5% от массы тела человека. 98% его содержится в костях скелета. Однако, он не только делает наши кости крепче, но и способствует работе нервной системы. Здоровый человек должен получать в день 1,5 г его. Что это за металл? (кальций)
Этот металл входит в состав гипса, который используется в медицине для наложения неподвижных гипсовых повязок и в зубоврачебной технике для получения слепков полости рта. О каком металле идет речь? (кальций)
Горькая или английская соль, в состав которой входит этот металл, используется в медицине в качестве слабительного, содержится в морской воде и придает ей горький вкус? (магний)
Академик А.Е.Ферсман писал, что при отсутствии этого металла «… на улицах стоял бы ужас разрушения: ни рельсов, ни вагонов, и автомобилей, камни мостовой превращаются в труху, растения начинают чахнуть. Впрочем, человек бы этого не заметил, т.к., лишившись 3г этого металла, он бы моментально умер» Что это за металл? (Железо. Без железа не может происходить образование гемоглобина и миоглобина – красных кровяных телец и мышечного пигмента)
Я не менее красивый металл, чем золото. Мой род очень древний, ему примерно 7 тысяч лет. С моей помощью 5 тыс. лет назад соорудили 147 метровую пирамиду Хеопса. Из меня изготовили щит герою Троянской войны Ахиллу. Я очень музыкальный металл, у меня прекрасный голос. Я умею исцелять, без меня у человека развивается малокровие, слабость. Кто я? (медь)
При недостатке этого металла нарушается обмен веществ у растений и животных, снижается интенсивность фотосинтеза растений, а это ведет к понижению содержания крахмала и сахара в зерне и корнеплодах. Поэтому его соли широко используются в сельском хозяйстве в качестве удобрений. Что это за металл?
( калий)
Этот элемент является основным ионом внутриклеточной среды. Его концентрация в крови во много раз меньше чем внутри клеток. Этот факт является очень важным для нормального функционирования клеток организма. (Калий)
Этот металл входит в состав физиологического раствора и питьевой соды, которые широко используются в медицине. ( натрий)
Этот элемент является самым распространенным ионом плазмы – жидкой части крови. На долю этого элемента приходится основная доля в создании осмотического давления плазмы. (Натрий)
Этот элемент входит в состав многих ферментов, оказывает стимулирующее действие на процесс полового созревания, образования костей, распада жировой ткани. (Цинк)
Этот металл может исцелять. Если хранить воду в сосудах, изготовленных из этого металла, или просто в контакте с изделиями, то мельчайшие частички этого металла переходят в раствор и убивают микроорганизмы и бактерии. Такая вода долго не портится и не «зацветает». О каком металле идет речь? (Серебро)
Учитель: Историческая справка: В 1766 году петербургский профессор химии И.Г.Леман описал новый минерал, найденный на Урале на Березовском руднике, в 15 километрах от Екатеринбурга. Обрабатывая камень соляной кислотой, Леман получил изумрудно-зеленый раствор, а в образовавшемся белом осадке обнаружил свинец. Спустя несколько лет, в 1770 году, Березовские рудники описал академик П.С.Паллас. «Березовские копи, — писал он, — состоят из четырех рудников, которые разрабатываются с 1752 года. В них наряду с золотом добываются серебро и свинцовые руды, а также находят замечательный красный свинцовый минерал, который не был обнаружен больше ни в одном другом руднике России. Эта свинцовая руда бывает разного цвета (иногда похожего на цвет киновари), тяжелая и полупрозрачная… Иногда маленькие неправильные пирамидки этого минерала бывают вкраплены в кварц подобно маленьким рубинам. При размельчении в порошок она дает красивую желтую краску…». Минерал был назван «сибирским красным свинцом». Впоследствии за ним закрепилось название «крокоит».
Образец этого минерала был в конце XVIII века привезен Палласом в Париж. Крокоитом заинтересовался известный французский химик Луи Никола Воклен. В 1796 году он подверг минерал химическому анализу. «Все образцы этого вещества, которые имеются в нескольких минералогических кабинетах Европы, — писал Воклен в своем отчете, — были получены из этого (Березовского) золотого рудника. Раньше рудник был очень богат этим минералом, однако говорят, что несколько лет назад запасы минерала в руднике истощились и теперь этот минерал покупают на вес золота, в особенности, если он желтый. Образцы минерала, не имеющие правильных очертаний или расколотые на кусочки, годятся для использования их в живописи, где они ценятся за свою желто-оранжевую окраску, не изменяющуюся на воздухе… Красивый красный цвет, прозрачность и кристаллическая форма сибирского красного минерала заставила минералогов заинтересоваться его природой и местом, где он был найден; большой удельный вес и сопутствующая ему свинцовая руда, естественно, заставляли предполагать о наличии свинца в этом минерале…»
В 1797 году Воклен повторил анализ. Растертый в порошок крокоит он поместил в раствор углекислого калия и прокипятил. В результате опыта ученый получил углекислый свинец и желтый раствор, в котором содержалась калиевая соль неизвестной тогда кислоты. При добавлении к раствору ртутной соли образовывался красный осадок, после реакции со свинцовой солью появлялся желтый осадок, а введение хлористого олова окрашивало раствор в зеленый цвет. После осаждения соляной кислотой свинца Воклен выпарил фильтрат, а выделившиеся красные кристаллы (это был оксид шестивалентного хрома) смешал с углем, поместил в графитовый тигель и нагрел до высокой температуры. Когда опыт был закончен, ученый обнаружил в тигле множество серых сросшихся металлических иголок, весивших в 3 раза меньше, чем исходное вещество. Так впервые был выделен новый элемент.
Учитель: Ребята какой элемент был получен Вокленом?
Учитель: Тема нашего урока: «Хром и его соединения»
Учитель: Почему элемент назвали хромом?
Один из друзей Воклена предложил ему назвать элемент хромом (по-гречески «хрома» — окраска) из-за яркого разнообразного цвета его соединений. Сначала Воклену не понравилось предложенное название, поскольку открытый им металл имел скромную серую окраску и как будто не оправдывал своего имени. Но друзья все же сумели уговорить Воклена и, после того как французская Академия наук по всей форме зарегистрировала его открытие, химики всего мира внесли слово «хром» в списки известных науке элементов. (Итог на доске)
Учитель: Ребята назовите особенности строения его атома? (Итог на доске)
Учитель: Какими химическими свойствами обладает хром? (Итог на доске)
Учитель: Есть некоторые особенности или индивидуальности. (Итог на доске) Запись в тетради.
Учитель: Подводя итог первой части урока о хроме можно сказать так:
Он тверд, тяжел и тугоплавок
И сталь прекрасную дает,
А от его больших добавок
Ржаветь она перестает.
Его валентность (нет сомненья)
Бывает шесть лишь иногда
А у его соединений
Окраска разная всегда.
Учитель: Соединения хрома называют «минеральный хамелеон» Почему? Как Вы думаете? И так ли это? В этом разобраться нам поможет практическая часть урока.
Учитель: Ребята! У вас на столах «Инструктивные карточки» , в которых описан порядок проведения опытов.
2. Повторение правил техники безопасности.
Верно-неверно (задание ЕГЭ)
Работу с легковоспламеняющимися растворителями следует проводить вдали от огня; верно
Если кислота попадает на кожу, ее необходимо сразу нейтрализовать большим количеством щелочи; неверно
Соли свинца и хрома очень ядовиты; верно
Лакмус можно использовать для обнаружения, как кислот, так и щелочей; верно
В лаборатории можно трогать вещества руками; неверно
Соли натрия и калия окрашивают пламя горелки соответственно в жёлтый и фиолетовый цвета; верно
Особо осторожно необходимо работать с растворами кислот и щелочей; верно
Выполнять задания строго по инструкции. верно
«Инструктивные карточки»- практическая часть.
Опыт №1. Получение оксида хрома (III).
Приборы и реактивы: ложечка для сжигания веществ; спиртовка; спички; бихромат аммония (Nh5)2Cr2O7 (измельченный).
Выполнение опыта. Лист бумаги, на который ставлю спиртовку. Тонко измельченный бихромат аммония насыпаю в ложечку для сжигания веществ. Нагреть на пламени спиртовки. Начинается разложение бихромата, которое протекает с выделением тепла и постепенно захватывает все большие и большие количества соли. В конце реакция идет все более бурно — появляются искры, пламя, летит рыхлый и легкий пепел — типичное извержение вулкана в миниатюре. Образовалось большое количество рыхлого темно-зеленого вещества.
Вывод: оксид хрома (III) Cr 2O3 получается путем нагревания бихромата аммония: (Nh5)2Cr2O7=Cr2O3+N2+4h3O
Опыт №2. Исследование свойств оксида хрома (III)
Приборы и реактивы: пробирка; вода h3O; оксид хрома (III) Cr2O3; серная кислота
Выполнение опыта. Добавляю полученный зеленый порошок оксида хрома (III) сначала в пробирку с водой Cr2O3 + 3h3O = 2Cr(OH)3 затем в пробирку с серной кислотой
Cr2O3 + 3h3SO4 = Cr2(SO4)3 + 3h3O
Наблюдаю растворение оксида в обоих пробирках.
Вывод: Оксид хрома растворяется в воде и в кислотах.
Опыт №3.Окислительные свойства солей хрома (VI)
Приборы и реактивы: раствор бихромата калия K2Cr2O7; раствор сульфита натрия Na2SO3; серная кислота h3SO4.
Выполнение опыта. К раствору K2Cr2O7, подкисленному серной кислотой, добавляю раствор Na2SO4. Наблюдаю изменения окраски. Оранжевый раствор стал зелено- фиолетовым.
Вывод: В кислой среде хром восстанавливается сульфитом натрия от хрома (VI) до хрома (III): K2Cr2O7 + 3Na2SO3 + 4h3SO4 = K2SO4 + Cr2(SO4)3 + 3Na2SO4 + 4h3O
Опыт №4. Переход хромата в бихромат и обратно
Приборы и реактивы: раствор хромата калия K2CrO4, раствор бихромата калия K2Cr2O7, серная кислота, гидроксид натрия.
Выполнение опыта: К раствору бихромата калия добавляю щелочь, в результате происходит изменение окраски раствора из оранжевого в желтый. K2Cr2O7 + 4NaOH = 2Na2CrO4 + 2KOH + h3O. К раствору хромата калия добавляю серную кислоту, в результате происходит изменение окраски раствора из желтого в оранжевый. 2K2CrO4 + h3SO4 = K2Cr2O7 + K2SO4 + h3O
Вывод: В кислой среде хроматы неустойчивы, ион CrO42- желтого цвета превращается в ион Cr2O72- оранжевого цвета, а в щелочной среде эта реакция протекает в обратном направлении 2CrO42- + 2H+ кислая сред஬щелочная среда Cr2O72- + h3O.
Опыт №5. Получение малорастворимых солей хромовых кислот
Приборы и реактивы: раствор хромата калия K2CrO4, раствор бихромата калия K2Cr2O7, раствор нитрата серебра AgNO3.
Выполнение опыта. Наливаю в одну пробирку раствор хромата калия, в другую — раствор бихромата калия, и добавляю в обе пробирки раствор нитрата серебра, в обоих случаях наблюдаю образование красно-бурого осадка.
K2CrO4 + 2AgNO3= Ag2CrO4¯ + 2KNO3
K2Cr2O7 + AgNO3 = Ag2CrO4¯+ KNO3
Вывод: Растворимые соли хрома при взаимодействии с нитратом серебра образуют нерастворимый осадок
Опыт №7. Получение гидроксида хрома
Приборы и реактивы: раствор соли хрома (III) CrCl3, едкий натр (гидроксид натрия) NaOH. Выполнение опыта. В пробирку с раствором хлорида хрома (III) по каплям добавляю раствор едкого натра до образования серо-зеленого осадка.
Вывод: Гидроксид хрома Cr(OH)3 получается при действии на соль трехвалентного хрома щелочью: CrCl3 + 3NaOH = Cr(OH)3¯ + 3NaCl
Учитель: Ребята с какими цветами соединений хрома мы встретились в практической части урока?
От чего зависит изменение цвета? У кого в природе происходит аналогичное явление?
ХАМЕЛЕОН
Учитель: Ребята! Какое биологическое значение хрома?
Биологическая роль.
Хром обнаруживается в растительных и животных организмах. В организме взрослого человека содержится примерно 6 г Сr (0,1%).
Металлический хром нетоксичен, а соединения Сr(III) и Сr(VI) опасны для здоровья. Они вызывают раздражение кожи, что приводит к дерматитам.
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В конце 1950-х гг. два исследователя, Шварц и Мерц, сообщили, что у крыс, которые были на рационе, дефицитном по хрому, развивалась непереносимость сахара; при добавлении же хрома в рацион их состояние нормализовалось. Это было первым подтверждением, что хром необходим животным для нормальной жизни. С тех пор исследователи поняли, что хром играет такую же роль и для здоровья человека
3. Подведение итогов урока.
Тесты для контроля и самопроверки знаний (5 мин)
Проверочная работа в формате ЕГЭ (Дифференцированная)
Часть А (вариант1)
1.Катион хрома Cr3+ образуется при диссоциации
1)Cr2O3 2)CrCl2 3)Cr(OH)2 4)Cr(NO3)3
2.Продуктом, образующимся при нагревании дихромата аммония, является
1)CrO3 2)N2 3)Nh4 4)CrN
3.Соединения состава Na2ЭО4 образует каждый из двух элементов:
1)хром и фосфор 2)сера и хром 3)азот и селен 4)сера и хлор
4.С основаниями не реагирует
1)Cl2O5 2)SiO2 3)SO3 4)CrO
5.Оксид хрома (VI) взаимодействует с каждым из двух веществ:
1)оксидом кремния и углекислым газом
2)водой и углекислым газом
3)водой и гидроксидом натрия
4)кислородом и водородом
Часть В
1.Установите соответствие между формулой вещества и степенью окисления хрома.
Формула веществ Степень окисления
А)NaCrO2 1)+7
Б)h3Cr2O7 2)+6
В)BaCrO4 3)+4
Г)CrSO4 4)+3
5)+2
2.Установите соответствие между исходными веществами и основным продуктом их взаимодействия.
Формулы веществ Продукт взаимодействия
А)Cr+Cl2 1)CrCl2
Б)Cr+HCl 2)CrCl3
В)CrO3+HCl 3)CrCl4
Г)K2Cr2O7+HCl 4)CrCl6
Часть С
1.Используя метод электронного баланса, составьте уравнение реакции
K2Cr2O7+K2SO3+h3SO4=Cr2(SO4)3+…+…
Определите окислитель и восстановитель.
Часть А (вариант2)
1.Наиболее низкую степень окисления хром проявляет в соединении
1)K2Cr2O7 2)Na[Cr(h3O)F4] 3)Cr2O3 4)Cr(OH)2
2.В атоме хрома число свободных 3d-орбиталей равно
1)1 2)2 3)3 4)0
3. С гидроксидом хрома (II) не взаимодействует
1) соляная кислота 2) кислород 3)гидроксид калия 4) серная кислота
4.Верны ли следующие суждения о хроме и его соединениях?
А. Степень окисления хрома в высшем оксиде равна +3.
Б. Хроматы и дихроматы – сильные окислители
1)верно только А 2)верно только Б 3)верны оба суждения 4)оба суждения неверны
5.При взаимодействии свежеприготовленного осадка гидроксида хрома(III) с избытком раствора щелочи образуется:
1)средняя соль 2)основная соль 3)двойная соль 4)комплексная соль
Часть В
1.Установите соответствие между схемой изменения степени окисления элемента и уравнениям реакции, в которой это изменение происходит.
Изменение степени Уравнение реакции
окисления
А)Cr+3-Cr0 1)2Cr+6h3SO4(конц)=Cr2(SO4)3+3SO2+6h3O
Б)Cr+6-Cr0 2)2CrO3+3h3S(р-р)=2Cr(OH)3+3S
В)Cr0-Cr+3 3)K2Cr2O7+4Al=2Cr+Al2O3+2KAlO2
Г)Cr+6-Cr+3 4)Cr2O3+3Ca=2Cr+3CaO
5)2K2CrO4+2HCl=K2Cr2O7+2KCl+h3O
2.Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции.
Формулы веществ Признак реакции
А)Cr(OH)3+HCl 1)образование осадка
Б)Сr(OH)3+NaOH 2)растворение осадка
В)K2Cr2O7+KOH 3)изменение окраски раствора
Г)K2CrO4+h3SO4 4)изменение окраски осадка
5)видимых признаков реакции нет
Часть С
1.Используя метод электронного баланса, составьте уравнение реакции
K2Cr2O7+K2SO3+h3SO4=Cr2(SO4)3+…+…
Определите окислитель и восстановитель.
Оценка: 10-11- «5» 7-9 -«4» 4– 6 -«3» менее 4- «2»
Ответы
Задание | Вариант1 | Вариант2 |
А1 1б | 4 | 4 |
А2 1б | 2 | 4 |
А3 1б | 2 | 3 |
А4 1б | 4 | 2 |
А5 1б | 3 | 4 |
В1 2б | 3225 | 4312 |
В2 2б | 2122 | 2233 |
С1 K2Cr2O7+3K2SO3+4h3SO4=Cr2(SO4)3+4K2SO4+4h3О 2б
Сера в степени окисления +4 является восстановителем, а хром +6 –окислителем
S – 2e- S+6 6 3
Cr+6+6e-Cr+3 2 1
Взаимопроверка.
4. Рефлексия(выводы) Отдельно каждой группе предлагается сделать вывод по теме урока, выбрать одно предложений и закончить его:
сегодня мы узнали…
было трудно…
мы поняли, что…
мы научились…
мы смогли…
было интересно узнать, что…
нас удивило…
нам захотелось…
5. Домашнее задание.
Приложение 1
«Инструктивные карточки»- практическая часть.
Опыт №1. Получение оксида хрома (III).
Приборы и реактивы: ложечка для сжигания веществ; спиртовка; спички; бихромат аммония (Nh5)2Cr2O7 (измельченный).
Выполнение опыта. Лист бумаги, на который ставлю спиртовку. Тонко измельченный бихромат аммония насыпаю в ложечку для сжигания веществ. Нагреть на пламени спиртовки. Начинается разложение бихромата, которое протекает с выделением тепла и постепенно захватывает все большие и большие количества соли. В конце реакция идет все более бурно — появляются искры, пламя, летит рыхлый и легкий пепел — типичное извержение вулкана в миниатюре. Образовалось большое количество рыхлого темно-зеленого вещества.
Вывод: оксид хрома (III) Cr 2O3 получается путем нагревания бихромата аммония:
Опыт №2. Исследование свойств оксида хрома (III)
Приборы и реактивы: пробирка; вода h3O; оксид хрома (III) Cr2O3; серная кислота
Выполнение опыта. Добавляю полученный зеленый порошок оксида хрома (III) сначала в пробирку с водой , затем в пробирку с серной кислотой
Наблюдаю растворение оксида в обоих пробирках.
Вывод: Оксид хрома растворяется в воде и в кислотах.
Опыт №3.Окислительные свойства солей хрома (VI)
Приборы и реактивы: раствор бихромата калия K2Cr2O7; раствор сульфита натрия Na2SO3; серная кислота h3SO4.
Выполнение опыта. К раствору K2Cr2O7, подкисленному серной кислотой, добавляю раствор Na2SO4. Наблюдаю изменения окраски. Оранжевый раствор стал зелено- фиолетовым.
Вывод: В кислой среде хром восстанавливается сульфитом натрия от хрома (VI) до хрома (III):
Опыт №4. Переход хромата в бихромат и обратно
Приборы и реактивы: раствор хромата калия K2CrO4, раствор бихромата калия K2Cr2O7, серная кислота, гидроксид натрия.
Выполнение опыта: К раствору бихромата калия добавляю щелочь, в результате происходит изменение окраски раствора из оранжевого в желтый. К раствору хромата калия добавляю серную кислоту, в результате происходит изменение окраски раствора из желтого в оранжевый.
Вывод: В кислой среде хроматы неустойчивы, ион CrO42- желтого цвета превращается в ион Cr2O72- оранжевого цвета, а в щелочной среде эта реакция протекает в обратном направлении 2CrO42- + 2H+ кислая сред஬щелочная среда Cr2O72- + h3O.
Опыт №5. Получение малорастворимых солей хромовых кислот
Приборы и реактивы: раствор хромата калия K2CrO4, раствор бихромата калия K2Cr2O7, раствор нитрата серебра AgNO3.
Выполнение опыта. Наливаю в одну пробирку раствор хромата калия, в другую — раствор бихромата калия, и добавляю в обе пробирки раствор нитрата серебра, в обоих случаях наблюдаю образование красно-бурого осадка.
K2CrO4 + 2AgNO3= Ag2CrO4¯ + 2KNO3
K2Cr2O7 + AgNO3 = Ag2CrO4¯+ KNO3
Вывод: Растворимые соли хрома при взаимодействии с нитратом серебра образуют нерастворимый осадок
Опыт №7. Получение гидроксида хрома
Приборы и реактивы: раствор соли хрома (III) CrCl3, едкий натр (гидроксид натрия) NaOH. Выполнение опыта. В пробирку с раствором хлорида хрома (III) по каплям добавляю раствор едкого натра до образования серо-зеленого осадка.
Вывод: Гидроксид хрома Cr(OH)3 получается при действии на соль трехвалентного хрома щелочью.
Таблица степеней окисления химических элементов. Возможные степени окисления химических элементов. Стандартные, высшие, низшие, редкие степени окисления, исключения. Максимальная степень окисления и минимальная степень окисления.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2 #:
#ul (uarr color (white) (darr)) #
# — «7,46 эВ» ##ul (цвет uarr (белый) (дарр)) «» ul (цвет uarr (белый) (дарр)) «» ul (цвет uarr (белый) (дарр)) «» ul (цвет uarr (белый) (дарр) )) «» ul (uarr color (white) (darr)) #
# «» «» «» «» «» «-» 10,75 эВ «#
Если другие веб-сайты говорят вам, что электронная конфигурация иная, они неверны, потому что все учебники, которые я когда-либо читал за 4 года обучения в колледже, говорят мне # 3d ^ 5 4s ^ 1 #.Уровни энергии были получены из этого приложения.
Имеются явные доказательства того, что орбитали хрома должны удерживать электроны №12 # для образования связей в этом соединении:
(Вы можете насчитать шесть связей и одно взаимодействие на атом хрома.)
Итак, для связи в этом соединении необходимо использовать орбитали # 6 #. Валентные орбитали равны для удерживающих валентных электронов , а валентные электроны используются для связи .
Если хром может связываться таким образом, то всегда должен обладать способностью связываться таким образом, поэтому не имело бы смысла, если бы он мог использовать все валентные электроны №6 # в одном соединении, а , но не , мог бы иметь возможность связываться таким образом. Другой.
Следовательно, его валентные электроны должны включать электроны на # 3d # орбиталях, что дает нам # 1 + 5 = bb (6) # total.
валентных электронов хрома
Например, атомный номер хрома 24, это означает, что он содержит 24 протона. Сэмми. Его электронная конфигурация: 1s2 2s2 2p6 3s2 3p6 4s1 3d5. Это также количество электронов, которые участвуют в образовании связи с… В степени окисления +4 хром потерял 4 электрона, что означает, что хлорид хрома (IV) будет иметь химическое соединение.Используйте Периодическую таблицу элементов, чтобы определить, какой из этих элементов, скорее всего, имеет аналогичную температуру плавления. Переходный металл — это любой из различных химических элементов, которые имеют валентные электроны (электроны, которые могут участвовать в образовании химической связи) в двух оболочках вместо одной. Например, железо может иметь валентность +2 или +3, а хром может иметь валентность +2, +3 или +6. Следовательно, если есть 4 электрона или 9 электронов на d-орбитали, он переместит один электрон с s-орбитали ниже себя, чтобы заполнить дополнительное пространство.Результат 2-8-13-1. 5, 5 в. 2, 0 дн. 5, 2 эл. 2, 4 Согласно Льюису, ковалентное связывание приводит к октетам за счет разделения электронов, а ионное связывание приводит к октетам за счет передачи электронов от одного атома к другому. Таким образом, он имеет 6 валентных электронов. «II» означает, что он имеет 2 валентных электрона. Хром имеет 24 протона и 24 электрона. Поиск валентных электронов для всех элементов, кроме переходных металлов. Структура Льюиса № 3 является наиболее стабильной из-за меньшего разделения зарядов, даже несмотря на то, что атом Cr не подчиняется правилу октетов.Также известно, что когда атом нейтрален, то количество протонов в нем равно количеству электронов. Атомный номер хрома 24, что означает, что в нем 24 электрона. На последней орбите находится шесть электронов. В 1916 году Гилберт Н. Льюис объяснил валентность и химическую связь в терминах тенденции атомов (основной группы) к достижению стабильного октета из 8 электронов валентной оболочки. Шесть валентных электронов хрома — это 4s2 и 3d4. Атомная масса хрома 52. C 2 H 6 O C 2 H 4 O + 2 H + 0 +2.Металлургическая, химическая и огнеупорная промышленность являются основными потребителями хрома. Количество валентных электронов в элементе — это количество электронов во внешней оболочке. Чтобы иметь более стабильный наполовину заполненный d-подуровень, электрон перемещается с 4s на пустую орбиталь в 3d, давая пять неспаренных электронов в 3d и 1 неспаренный электрон в 4s. Название: Хром Символ: Cr Атомный номер: 24 Атомная масса: 51,9961 а.е.м. Точка плавления: 1857,0 ° C (2130,15 K, 3374,6 ° F) Точка кипения: 2672.0 ° C (2945,15 K, 4841,6 ° F) Количество протонов / электронов: 24 Количество нейтронов: 28 Классификация: переходный металл Кристаллическая структура: кубическая плотность при 293 K: 7,19 г / см 3 Цвет: серый Атомная структура Хром (Cr) представляет собой серебряный металл, имеющий атомный номер 24 в периодической таблице. Валентная ионизация электронов. Динамика хрома с помощью … Параметры анизотропии, связанные с уходящими электронами, также значительно изменяются в зависимости от энергии и квантового числа полного углового момента, что предполагает прямое и / или косвенное изменение…. хрома определяется по следующей энергии. Электроотрицательность хрома: χ = 1,66. Для №1 я вижу, что F имеет семь валентных электронов. За соответствующий тест начисляется 1 балл. «Электрон в одной из внешних оболочек атома, который участвует в образовании химических связей». Атомный вес хрома составляет 51,9961 атомных единиц массы или граммов на моль. Конфигурации диких электронов также означают, что у вас есть хорошие шансы на различные валентные числа. Электроны имеют определенную форму распределения (или конфигурацию) в каждом атоме, даже в хроме.(5) (наполовину заполненные 4 и 3d… * Пожалуйста, выберите более одного элемента для сравнения. Таким образом, Хром сначала потеряет свой 1-й электрон и ад-электрон, образуя Cr2 +, который стабилен только в отсутствие воздуха. Многие переходы Металлы могут иметь разное количество валентных электронов. Конечно, их 6 …? Хром является переходным металлом с d-блоком, поэтому валентные электроны удаляются из подоболочки s, прежде чем они будут удалены из подоболочки d. Кстати, химия хрома аналогична химии серы, 3s2 3p4.имеется 6 валентных электронов. В случае Хрома электронная конфигурация сокращенно [Ar] 3d5 4s1. Это таблица наиболее распространенных зарядов атомов химических элементов. Потому что C 2S — это обычное соединение, обнаруживаемое в шламе и шлаке, образующемся при плавлении отходов, и результаты поиска валентных электронов в Sigma-Aldrich. Да! Хром находится в группе 6 Периодической таблицы; т.е. хром имеет шесть валентных электронов. Например, железо может иметь валентность +2 или +3, а хром может иметь валентность … Атом Cr может вмещать более 8 валентных электронов — элементы над строкой 2 периодической таблицы могут вмещать более 8 электронов.Краткое изложение определения ионных зарядов и валентных электронов. D. Углерод образует и то, и другое… Для № 2 F имеет только один валентный электрон; У O всего два. а. ионы хрома с высокой валентностью от Cr4 + до Cr6 + спонтанно включаются в C 2S при отжиге на воздухе. … C. Углерод имеет четыре валентных электрона, что позволяет образовывать множественные связи. Дополнительные уроки: http://www.educreations.com/yt/2649908/?ref=ytd Хром имеет несколько валентностей, и это связано с тем, что он имеет три степени окисления: +6, +3 и +2.Хром существует в трех общих стабильных валентных состояниях: хром (0), (III) и (VI). Хром отличается очень высокой температурой плавления. Некоторые из них трудно запомнить (или предсказать), так какова электронная конфигурация атома Cr? Вы можете использовать эту диаграмму, чтобы предсказать, может ли атом связываться с другим атомом. Заряд атома связан с его валентными электронами или степенью окисления. Атом элемента наиболее стабилен, когда его внешняя электронная оболочка полностью заполнена или наполовину заполненный.Чем выше соответствующее число электроотрицательности, тем больше элемент или соединение притягивает электроны… Сравнить продукты: Выберите до 4 продуктов. Медь и хром имеют один валентный электрон (они являются исключением), потому что у них есть один 4s-электрон. Соответственно, валентные электроны напрямую влияют на поведение элементов в химической реакции. Cr (III) является важным диетическим питательным веществом. Полная электронная конфигурация иона хрома (III) — 1s22s22p63s23p64s03d3. Итак, количество нейтронов, присутствующих в хроме, рассчитывается следующим образом.Решение для хрома имеет _ валентные электроны и _ требуется? У каждого О есть 3 пары электронов. Калий, хром и медь — единственные элементы четвертого периода, у которых есть один электрон во внешней оболочке. Его дефицит в организме связан с диабетом, бесплодием и сердечно-сосудистыми заболеваниями. A. Хром (Cr) B. Стронций (Sr) c. Криптон (Kr) D. Франций (Fr) Сумма формальных зарядов должна равняться нулю для соединения или заряда на ионе. Валентность можно определить по-разному.Валентность — это объединяющая способность элемента или количество электронов, присутствующих на самой внешней орбите элемента. Таким образом, мы можем вычислить ее по количеству электронов, присутствующих на самой внешней орбите. Хлор — это элемент 17 с электронной конфигурацией [Ne] 3s2 3p5, с 7 валентными электронами. В этом случае наиболее энергетически устойчивой структурой не является та, в которой орбитали заполнены наполовину. Электроны в оболочках 3d54s1 образуют валентные электроны, поскольку пять электронов в оболочке 3d участвуют в образовании химической связи.Два 4s-электрона находятся в наивысшем главном квантовом числе n = 4, поэтому они являются валентными электронами. анион: Cl03. Валентные электроны (группа перехода № 6, [Ar] 4s13d5) [1s2 2s2 2p6 3s2 3p6] 4s 1 3d 5. Изучение валентных электронов для определения реакционной способности. Дополнительные бесплатные уроки на: http://www.khanacademy.org/video ? v = 1TZA171yxY4 Cr (VI) канцерогенен. Вольфрам имеет точно такое же количество внешних электронов, что и хром, но его внешняя структура 5d 4 6s 2, а НЕ 5d 5 6s 1. Хром образует электроположительные ионы, теряя электроны во время образования ионных соединений.5 {/ экв}. Вы не можете делать такие обобщения! Член Героя; Сообщений: 702; Re: На рисунке структуры Льюиса для дихромат-иона, сколько валентных электронов составляет хром. У Ne нет. Это переходный металл, расположенный в 6-й группе периодической таблицы. Только два определяют валентные электроны: «Электроны во внешней оболочке атома, определяющие химические свойства». Некоторые элементы, такие как переходные металлы, имеют электронные конфигурации, в которых электроны из их внутренних оболочек также могут использоваться в качестве валентных электронов; эти элементы могут иметь несколько различных степеней окисления.Эти ионы хрома с высокой валентностью занимают позиции Si4 + в тетраэдрической координации. Хром является исключением из принципа Ауфбау (который говорит нам, как электроны добавляются к орбиталям). Давайте рассмотрим случай электронно-точечных структур Льюиса триоксида хрома CrO 3. Хром является важным питательным веществом, необходимым для нормального метаболизма сахара и жиров, и работает, в первую очередь, за счет усиления действия инсулина. Он входит в состав нескольких пищевых добавок и витаминов. химическая формула — CrO 3.Два ряда непосредственно под хромом в Периодической таблице — это вольфрам. Но, черт возьми, теперь у меня есть еще один ответ: сколько валентных электронов у хрома. Каждый квадрат периодической таблицы содержит буквенный символ элемента, напечатанный непосредственно под атомным номером элемента. Хром находится в группе 6 Периодической таблицы; то есть в целом на электроотрицательность атома влияет как его атомный номер, так и расстояние, на котором его валентные электроны находятся от заряженного ядра.6, 4 стр. и еще один:
2020 валентные электроны хрома
Хром | Введение в химию
Цель обучения
- Вспомните антиферромагнитные свойства элементарного хрома.
Ключевые моменты
- Состояния окисления +3 и +6 чаще всего наблюдаются в соединениях хрома, тогда как состояния +1, +4 и +5 встречаются редко.
- Хром отличается своими магнитными свойствами: это единственное твердое тело, которое демонстрирует антиферромагнитное упорядочение при комнатной температуре (и ниже).
- Соединения хрома (VI) являются мощными окислителями при низком или нейтральном pH.
Условия
- лиганд Ион, молекула или функциональная группа, которая связывается с другим химическим соединением с образованием более крупного комплекса.
- антиферромагнетизм Проявляет антиферромагнетизм — явление, подобное ферромагнетизму, при котором магнитные домены выстраиваются в регулярную структуру, но соседние электронные спины направлены в противоположных направлениях.
- Хром Хром — это химический элемент, который имеет символ Cr и атомный номер 24.
- амфотерный, имеющий характеристики кислоты и основания и способный реагировать как то и другое; амфипротический.
Свойства хрома
Хром — стально-серый, блестящий, твердый металл, который требует полировки и имеет высокую температуру плавления. Он также не имеет запаха и податлив. В больших количествах и в различных формах хром может быть токсичным и канцерогенным. Наиболее ярким примером токсичного хрома является шестивалентный хром (Cr (VI)). Заброшенные предприятия по производству хрома часто требуют экологической очистки.
Хром отличается своими магнитными свойствами: это единственное твердое тело, которое демонстрирует антиферромагнитное упорядочение при комнатной температуре (и ниже). При температуре выше 38 ° C он переходит в парамагнитное состояние. Хром является членом переходных металлов в Группе 6. Хром имеет электронную конфигурацию 4s 1 3d 5 из-за более низкой энергии высокоспиновой конфигурации.
Степени окисления хрома
Хром демонстрирует широкий диапазон возможных состояний окисления, где состояние +3 является наиболее стабильным с энергетической точки зрения.Состояния +3 и +6 чаще всего наблюдаются в соединениях хрома, тогда как состояния +1, +4 и +5 встречаются редко.
Cr
3+ Соединения
Известно большое количество соединений хрома (III). Ион Cr 3+ имеет такой же радиус (63 мкм), что и ион Al 3+ (радиус 50 мкм), поэтому они могут заменять друг друга в некоторых соединениях, таких как хромовые квасцы и квасцы. Когда следовое количество Cr 3+ заменяет Al 3+ в корунде (оксид алюминия (Al 2 O 3 )), образуется красный рубин.Ионы хрома (III) имеют тенденцию к образованию октаэдрических комплексов. Цвет этих комплексов определяется лигандами, прикрепленными к центру Cr.
Гидроксид хрома (III) (Cr (OH) 3 ) является амфотерным, растворяется в кислых растворах с образованием [Cr (H 2 O) 6 ] 3+ и в основных растворах с образованием [Cr ( ОН) 6 ] 3- . Он обезвоживается путем нагревания с образованием зеленого оксида хрома (III) (Cr 2 O 3 ), который представляет собой стабильный оксид с кристаллической структурой, идентичной структуре корунда.{2 -} + {H} _ {2} O [/ latex]
Таким образом, доминирующая разновидность определяется по закону действия масс pH раствора. Изменение равновесия видно по изменению цвета от желтого (хромат) до оранжевого (дихромат), например, когда кислота добавляется к нейтральному раствору хромата калия. При еще более низких значениях pH возможна дальнейшая конденсация до более сложных оксианионов хрома. И хромат, и дихромат-анионы являются сильными окисляющими реагентами при низком pH.
Оксид хрома (VI) Оксид хрома (VI) имеет красный цвет и является мощным окислителем.
Другие состояния окисления хрома
Степень окисления +5 реализуется только в немногих соединениях, но является промежуточным звеном во многих реакциях, включающих окисление хроматом. Единственным бинарным соединением является летучий фторид хрома (V) (CrF 5 ). Соединения хрома (IV) (в степени окисления +4) встречаются несколько чаще, чем соединения хрома (V). Тетрагалогениды CrF 4 , CrCl 4 и CrBr 4 могут быть получены обработкой тригалогенидов (CrX 3 ) соответствующим галогеном при повышенных температурах.
Известно много соединений хрома (II), включая водостойкий хлорид хрома (II) (CrCl 2 ). Полученный ярко-синий раствор стабилен только при нейтральном pH. Большинство соединений хрома (I) получают окислением богатых электронами октаэдрических комплексов Cr. Как подтверждено дифракцией рентгеновских лучей, также была описана пятичастная связь Cr-Cr (длина 183,51 (4) мкм).
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
WebElements Periodic Table »Хром» Свойства свободных атомов
Атомы хрома имеют 24 электрона, а структура оболочки — 2.8.13.1.
Электронная конфигурация основного состояния газообразного нейтрального хрома в основном состоянии равна [ Ar ]. 3d 5 . 4s 1 , а символ термина — это 7 S 3 .
Схематическая электронная конфигурация хрома.
Оболочечная структура Косселя хрома.
Атомный спектр
Представление атомного спектра хрома.
Энергия ионизации и сродство к электрону
Сродство к электрону хрома составляет 64,3 кДж / моль ‑1 . Энергии ионизации хрома приведены ниже.
Энергии ионизации хрома.
Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды «Клементи-Раймонди», Z eff .Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1с | 23,4138 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 16,98 | 2п | 20,08 | ||||
| 3с | 12,37 | 3 пол. | 11,47 | 3d | 9,76 | ||
| 4с | 5,13 | 4p | (нет данных) | 4д | (нет данных) | 4f | (нет данных) |
| 5s | (нет данных) | 5p | (нет данных) | 5д | (нет данных) | ||
| 6s | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 5989 [1] |
| L I | 2s | 696 [3] |
L II| 9024 583,8 [3] | | |
| L III | 2p 3/2 | 574,1 [3] |
| M I | 3s | 74.1 [3] |
| M II | 3 полюса 1/2 | 42,2 [3] |
| M III | 3 полюса 3/2 | 42,2 [3] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: Общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, «Энергии связи на уровне ядра в металлах», J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
хрома | Использование, свойства и факты
Хром (Cr) , химический элемент 6-й группы (VIb) периодической таблицы, твердый стально-серый металл, который требует полировки и используется в сплавах для повышения прочности и коррозионной стойкости. Хром был открыт (1797) французским химиком Николя-Луи Вокленом и год спустя выделен как металл; он был назван в честь его разноцветных соединений.Зеленый цвет изумруда, змеевика, хромовой слюды и красный цвет рубина обусловлены небольшим количеством хрома. Название элемента хром (от греческого chrōmos , «цвет») означает ярко выраженную и разнообразную окраску соединений хрома.
хром
Свойства хрома.
Британская энциклопедия, Inc.
Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов.Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 24 |
|---|---|
| атомный вес | 51,9961 |
| точка плавления | 1,890 ° C (3,434 ° F) |
| удельный вес | 7.20 (28 ° C) |
| степени окисления | +2, +3, +6 |
| электронная конфигурация | [Ar] 3 d 5 4 s 1 |
Встречаемость, использование и свойства
Хром — элемент, который содержится в относительно большом количестве в земной коре; свободный металл никогда не встречается в природе. Большинство руд состоит из минерала хромита, идеальная формула которого — FeCr 2 O 4 . Он широко распространен в естественных отложениях, обычно загрязненных кислородом, магнием, алюминием и кремнеземом; содержание хрома в них колеблется от 42 до 56 процентов.Одно из основных применений хрома — это сплавы черных металлов, для которых чистый металл не требуется. Соответственно, хромит часто восстанавливают углеродом в печи, получая сплав феррохром, который содержит железо и хром в соотношении атомов приблизительно от 1 до 2.
Для получения чистого хрома хромит сначала обрабатывают расплавленной щелочью и кислородом, превращая весь хром превращается в хромат щелочного металла, последний растворяется в воде и в конечном итоге осаждается в виде дихромата натрия, Na 2 Cr 2 O 7 .Затем дихромат восстанавливают углеродом до полуторного оксида хрома, Cr 2 O 3 , и этот оксид, в свою очередь, восстанавливают алюминием с получением металлического хрома.
Хром добавляют к железу и никелю в форме феррохрома для получения сплавов, которые отличаются высокой стойкостью к коррозии и окислению. Используется в небольших количествах, хром твердеет. Нержавеющие стали — это сплавы хрома и железа, в которых содержание хрома колеблется от 10 до 26 процентов.Хромовые сплавы используются для производства таких продуктов, как маслопроводы, отделка автомобилей и столовые приборы. Хромит используется как огнеупор и как сырье для производства хромовых химикатов.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Металл белый, твердый, блестящий и хрупкий, чрезвычайно устойчив к обычным коррозионным реагентам; это сопротивление объясняет его широкое использование в качестве гальванического защитного покрытия. При повышенных температурах хром соединяется непосредственно с галогенами или с серой, кремнием, бором, азотом, углеродом или кислородом.(Для дополнительной обработки металлического хрома и его производства см. Обработка хрома .)
Природный хром состоит из смеси четырех стабильных изотопов: хрома-52 (83,76 процента), хрома-53 (9,55 процента), хрома-50. (4,31 процента) и хром-54 (2,38 процента). Металл парамагнитен (слабо притягивается к магниту). Он существует в двух формах: объемно-центрированной кубической (альфа) и гексагональной плотноупакованной (бета). При комнатной температуре хром медленно растворяется в соляной и разбавленной серной кислотах.Некоторые окислители образуют тонкий слой инертного оксида на металле, что делает его пассивным также для разбавленных минеральных кислот, таких как серная, азотная или холодная царская водка. При обычных температурах металл не реагирует на морскую воду, влажный или сухой воздух.
Крупнейшие производители хрома включают ЮАР, Индию, Казахстан и Турцию.
Основные соединения
Наиболее частыми степенями окисления хрома являются +6, +3 и +2. Однако известно несколько стабильных соединений в состояниях +5, +4 и +1.
В степени окисления +6 наиболее важными частицами, образованными хромом, являются хромат CrO 4 2- и дихромат Cr 2 O 7 2- ионы. Эти ионы составляют основу ряда промышленно важных солей. Среди них хромат натрия Na 2 CrO 4 и дихромат натрия Na 2 Cr 2 O 7 , которые используются при дублении кожи, при обработке поверхности металлов и в качестве катализаторов в различных промышленных предприятиях. процессы.
Хром образует несколько коммерчески ценных кислородных соединений, наиболее важным из которых является оксид хрома, обычно называемый триоксидом хрома или хромовой кислотой, CrO 3 , в котором хром находится в степени окисления +6. Оранжево-красное кристаллическое вещество хромовая кислота постепенно разжижается при воздействии влажного воздуха. Обычно его получают обработкой дихромата натрия серной кислотой. Хромовая кислота используется в основном для хромирования, но также используется в качестве красителя в керамике.Это мощный окислитель, который может бурно реагировать с некоторыми органическими материалами, но такие растворы часто используются путем контролируемого окисления в органическом синтезе.
Другим важным кислородным соединением является оксид хрома, также известный как полуторный оксид хрома или оксид хрома, Cr 2 O 3 , в котором хром находится в степени окисления +3. Его получают прокаливанием бихромата натрия в присутствии углерода или серы. Оксид хрома представляет собой зеленый порошок и широко используется в качестве пигмента; его гидратная форма, известная как зеленый цвет Гинье, используется, когда требуется химическая и термостойкость.
Эрик Грегерсен
Узнайте больше в этих связанных статьях Britannica:
обработка хрома
Хром переработка, подготовка руды для использования в различных продуктах. Хром (Cr) — блестящий, твердый, тугоплавкий металл, плавящийся при 1857 ° C (3375 ° F) и кипящий при 2672 ° C (4842 ° F).В чистом виде он устойчив к обычной коррозии, поэтому применяется в качестве гальванического защитного…
Азия: ферросплавы
азиатских стран с запасами хрома включают Турцию, Филиппины, Индию, Иран и Пакистан; Запасы также находятся на северо-западе Казахстана.Марганец находится в изобилии, с большими запасами в Закавказье, Средней Азии, Сибири и Индии; Китайские резервы также значительны. Южный Китай имеет исключительно большие месторождения вольфрама. Вольфрам…
Южная Африка: ресурсы и энергия
… крупнейший производитель платины и хрома, которые добываются в таких центрах, как Рустенбург и Стилпорт на северо-востоке, и становятся все более значимыми с экономической точки зрения.Обширные месторождения минералов платиновой группы и хрома расположены в основном к северу от Претории. Провинция Северный Кейп содержит большинство крупных месторождений…
Сколько валентных электронов у хрома?
Единицы измерения температуры: преобразование между градусами Кельвина и Цельсия
Вы когда-нибудь задумывались, какова минимально возможная температура? В этом уроке вы узнаете, что измеряет температуру.Вы также познакомитесь со шкалой Кельвина (абсолютной шкалой) и узнаете, как она соотносится со шкалой Цельсия.
Что такое валентные электроны? — Урок для детей
Электроны валентности похожи на указания в наборе Lego.В этом уроке мы узнаем, что такое валентные электроны и почему ученым нужно знать количество валентных электронов в атоме.
Телескопы и электромагнитный спектр
Этот урок научит вас, какие формы света могут достигать земли, а какие нет, и как мы преодолеваем эту проблему.Мы рассмотрим концепцию видения, а также то, почему мы отправляем телескопы в космос.
Работа и мощность во вращательном движении
Посмотрев этот урок, вы сможете объяснить, что такое работа и мощность в контексте вращательного движения, и использовать уравнения для решения задач, связанных с вращательной работой и мощностью.После этого будет проведена короткая викторина.
Электронные конфигурации на s, p и d орбиталях
Вас смущают длинные списки, которые начинаются с единиц и, кажется, продолжаются бесконечно? Не волнуйтесь, этот урок электронной конфигурации поможет вам быстро понять, как описать размещение электронов.
Урок
Elements для детей: определение и факты
Золото. Кислород. Вести. Дармштадтиум.Вы, возможно, никогда не слышали о дармштадтиуме, хотите верьте, хотите нет, но у него есть что-то общее с золотом, кислородом и свинцом. Все четыре слова — это названия элементов. Готовимся узнать все об элементах!
Валентные электроны и уровни энергии атомов элементов
Таблица Менделеева содержит огромное количество информации.Этот урок объяснит, как использовать его для быстрого определения наиболее полезной информации о наиболее важных электронах. Мы сосредоточим наше обсуждение на валентных электронах и уровнях энергии.
Изотопы и средняя атомная масса
Когда вы выпиваете стакан воды, вы на самом деле пьете смесь тяжелой и легкой воды.Какая разница? Это вредно? Это видео объяснит разницу между двумя типами воды и подробно расскажет о значении различных изотопов элементов.
Точка эквивалентности: определение и расчет
Этот урок объясняет термин «точка эквивалентности» в химии.Мы рассмотрим несколько примеров распространенных стратегий решения проблем, связанных с вычислением точки эквивалентности, и укажем на распространенные ошибки.
Правило октетов и структуры атомов Льюиса
Изучите правило октетов и его применение к уровням энергии электронов.Определите валентные электроны и узнайте, как их определять, глядя на таблицу Менделеева. Также узнайте, какое отношение они имеют к правилу октетов. Узнайте, как нарисовать диаграмму Льюиса атома, и поймите, как она дает ключи к разгадке химической связи.
Химические связи I: ковалентные
Мама всегда говорила, что делиться заботой.В этом уроке будет изучено, как электроны влияют на химическую реакционную способность атомов и, в частности, на преимущества совместного использования электронов.
Электронные конфигурации на уровнях атомной энергии
Этот урок объяснит, что делают электроны внутри атома.Настройтесь, чтобы узнать, как мы указываем, где они расположены, и как это описание местоположения поможет нам предсказать свойства элемента.
Возможно, вы знакомы с ролью электронов в электрических устройствах, но знаете ли вы, что электроны также определяют химическую реакционную способность всего, что вас окружает?
Химические связи III: полярный ковалент
Вы не знаете, как определить, какую связь образуют два атома? Этот урок поможет вам понять разницу между полярными и неполярными ковалентными связями, а также как предсказать, как два атома будут взаимодействовать.
Теплопередача и изменение фаз
Посмотрев этот урок, вы сможете объяснить, что такое теплопередача, и описать различные фазовые изменения, которые могут возникнуть в результате теплопередачи, с точки зрения положения молекул.Вы также сможете дать названия этим фазовым изменениям. После этого будет проведена короткая викторина.
Ионные связи: определения и примеры
Знаете ли вы, что когда атомы слипаются, образуя молекулы, они приобретают и теряют электроны, делая их заряженными отрицательно или положительно? В этом уроке вы узнаете, как катионы и анионы образуют один тип химической связи, называемый ионной связью.
учащихся с ограниченными интеллектуальными возможностями
У студентов с ограниченными интеллектуальными возможностями есть уникальные особенности и особые потребности.В этом уроке определяется и объясняется концепция умственной отсталости и рассматривается, как эти ученики могут по-разному взаимодействовать и учиться в классе.
Нитрит: определение, структура и формула
Знаете ли вы, что нитраты из таких источников, как удобрения, могут попадать в наш организм и превращаться в нитриты? Узнайте, что такое нитрит, включая его структуру и формулу.
Информация об элементе хрома
Cr: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История хрома
Элемент Хром был открыт Луи Николя Воклен в году
1797 г. во Франции
.
Хром
получил свое название от греческого слова chroma, означающего «цвет».
Присутствие хрома: изобилие в природе и вокруг нас
В таблице ниже показано содержание хрома во Вселенной, Солнце, метеоритах,
Земная кора, океаны и человеческое тело.
Кристаллическая структура хрома
Твердотельная структура хрома — телесно-центрированная кубическая.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в
три
пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки
края
Константы решетки ( a , b и c )
и углы между ними. Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений (
x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства хрома
Атомы хрома имеют 24 электрона и
структура электронной оболочки [2, 8, 13, 1] с символом атомного члена (квантовые числа) 7 S 3 .
Оболочечная структура хрома — количество электронов на энергию
уровень
| n | с | п. | д | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | M | 2 | 6 | 5 | |
| 4 | N | 1 |
Основное состояние электронной конфигурации хрома — нейтраль
Атом хрома
Электронная конфигурация нейтрального атома хрома в основном состоянии
[Ar] 3d5 4s1.Часть конфигурации хрома, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3d5 4s1, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального хрома
Полная электронная конфигурация основного состояния для атома хрома, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d5 4с1
Атомная структура хрома
Атомный радиус хрома — 166 пм, а его ковалентный радиус — 127 пм.
Атомный спектр хрома
Химические свойства хрома:
Энергии ионизации хрома и сродство к электрону
Сродство к электрону хрома составляет 64,3 кДж / моль.
Энергия ионизации хрома
Энергии ионизации хрома
см. В таблице ниже.
| Число энергии ионизации | Энтальпия — кДж / моль |
|---|---|
| 1 | 652.9 |
| 2 | 1590,6 |
| 3 | 2987 |
| 4 | 4743 |
| 5 | 6702 |
| 6 | 8744,9 |
| 7 | 15455 |
| 8 | 17820 |
| 9 | 20190 |
| 10 | 23580 |
| 11 | 26130 |
| 12 | 28750 |
| 13 | 34230 |
| 14 | 37066 |
| 15 | 97510 |
| 16 | 1.058 × 105 |
| 17 | 1,143 × 105 |
| 18 | 1,253 × 105 |
| 19 | 1,347 × 105 |
| 20 | 1.443 × 105 |
| 21 | 1,577 × 105 |
Физические свойства хрома
Физические свойства хрома указаны в таблице ниже.
| Плотность | 7.14 г / см3 |
| Молярный объем | 7.28236694678 см3 |
Упругие свойства
Твердость хрома — Испытания для измерения твердости элемента
Электрические свойства хрома
Хром — проводник электричества. Ссылаться на
Таблица
ниже электрические свойства хрома
Теплопроводность и теплопроводность хрома
Магнитные свойства хрома
Оптические свойства хрома
Акустические свойства хрома
Термические свойства хрома — энтальпии и
термодинамика
Термические свойства хрома
см. В таблице ниже.
Энтальпия хрома
Изотопы хрома — ядерные свойства хрома
Изотопы родия.Встречающийся в природе хром имеет
4 стабильный изотоп —
50Cr, 52Cr, 53Cr, 54Cr.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 42Cr | ||||
| 43Cr | ||||
| 44Cr | ||||
| 45Cr | ||||
| 46Cr | ||||
| 47Cr | ||||
| 48Cr | ||||
| 49Cr | ||||
| 50Cr | 4.345% | Стабильный | N / A | |
| 51Cr | ||||
| 52Cr | 83.789% | Стабильный | N / A | |
| 53Cr | 9.501% | Стабильный | N / A | |
| 54Cr | 2.365% | Стабильный | N / A | |
| 55Cr | ||||
| 56Cr | ||||
| 57Cr | ||||
| 58 Cr | ||||
| 59 Cr | ||||
| 60Cr | ||||
| 61Cr | ||||
| 62Cr | ||||
| 63Cr | ||||
| 64Cr | ||||
| 65Cr | ||||
| 66Cr | ||||
| 67Cr |
Нормативно-правовое регулирование и здравоохранение — Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
.
