Содержание
Чистые вещества и смеси. Химия. 8 класс. Разработка урока
Цели
- Обучающая: рассмотреть понятия «Чистое вещество, смеси», научить определять основные отличия смеси и индивидуальных веществ, обозначить понятия «дисперсная система, эмульсия, суспензия, аэрозоль», научить разделять смеси путем фильтрования.
- Развивающая: формировать аналитические навыки, умение обобщать и делать вывод, развивать креативность и творчество.
- Воспитательная: воспитывать научное мировоззрение, умение работать в паре и группе, самостоятельно трудиться, умение рефлексии; прививать культуру химического эксперимента.
Тип урока: комбинированный.
Оборудование: презентация, ПК, проектор, колонки, видео опыты, комплект на парту: лабораторное оборудование (пробирки, стаканы, фильтр, воронка, штатив, стеклянные палочки), молоко, соляная кислота, смесь песка и соли, вода, зубная паста на предметном стекле.
Предварительная работа: задать на дом найти определения (золь, гель, эмульсия, суспензия, аэрозоль) в сети Интернет и в словаре. Подготовить сообщения о составе молока, чугуна, губной помады, воздуха. Мозговой штурм: задача с кувшином (слайд 5).
Ход урока
1. Организационный момент
2. Актуализация знаний
Притча. В 1660 году королевское научное общество Англии пришел король Карл Второй с вопросом: «Почему ведро с водой весит 10 фунтов, рыба весит 4 фунта, а ведро с рыбой тоже 10 фунтов?». Ученые стали предполагать, что это сила вытеснения плавательного пузыря рыбы и т.д….
А что скажете вы?
Но один ученый сказал: «Позволь, король, не поверить тебе и провести опыт самостоятельно».
Вывод… (Что скажут обучающиеся?)
Истинные химики доверяют только собственно проведенным экспериментам…
3. Проверка домашнего задания
1. Выдать раздаточный материал – таблички. Распределить сложные вещества по классам. Индивидуально для сильных – назвать вещества.
Выдать раздаточный материал – таблички. Распределить сложные вещества по классам. Индивидуально для сильных – назвать вещества.
Время: 2 минуты, собрать для проверки.
|
|
| ||
|
|
|
| |
|
|
|
| |
Акцентировать внимание на общих формулах веществ.
|
|
|
|
|
|
|
|
2. Фронтальная проверка прочтения домашнего параграфа 22.
Какие состояния есть у твердого вещества, какие кристаллические решетки (слайд 4).
Как вы считаете, а у глины — …..PNG)
Постановка проблемы
3. Мозговой штурм – задача, которая была домой. Что можно было хранить (или что делать?) в таком кувшине, на дне которого закрывающееся отверстие? Слайд 5.
4. Лабораторный опыт – разделение молока (прилить несколько капель соляной кислоты). Что наблюдается? Так для чего кувшин? Вывод – кувшин для сепарации молока (отделение сливок).
4. Изучение нового материала
1. Запишем тему урока «Чистые вещества и смеси».
Послушаем стихотворение Сергея Есенина «ВОСХОД СОЛНЦА»
Загорелась зорька красная
В небе темно-голубом,
Полоса явилася ясная
В своем блеске золотом.
Лучи солнышка высоко
Отразили в небе свет.
И рассыпались далеко
От них новые в ответ.
Лучи ярко-золотые
Осветили землю вдруг.
Небеса уж голубые
Расстилаются вокруг.
Если бы все вещества были чистыми, то мы не могли бы любоваться голубым небом, розовым рассветом, багряным закатом… (слайд 7)
Постановка целей и задач. Как вы думаете, что мы будем делать на уроке?
Сегодня на уроке мы с вами определим, что такое смесь и индивидуальной вещество, научимся различать смеси и чистые вещества, разделим смесь путем фильтрования.
2. Лабораторный опыт «Соль и песок, зубная паста».
Что вы видите в стакане? Это одно вещество?… А на предметном стекле – зубная паста – это одно вещество?…. (Вывод – смеси не всегда можно определить визуально). Почему?
Почему?
3. Работа с учебником (с. 121). Какие бывают смеси?
(Однородные и неоднородные, мелкие и крупные, Ж, Т, Г).
4. Домашним заданием было посмотреть в Интернете определения понятий: гель, золь, эмульсия, суспензия, аэрозоль. Зачитаем эти определения по тетради.
5. Работа в тетради – заполнить таблицу, слайд 15. Расставить определения на пересечении фаз растворителя и растворенного вещества (дисперсионная фаза и среда).
6. Проверка заполнения таблицы.
7. Что вы знаете об этих веществах – домашняя работа (сообщения по темам: воздух, чугун, губная помада, молоко).
8. Видео опыт «Соль и вода». Какой метод применили в опыте?
9. Работа в группах: кто предложит больше способов разделения смесей? Слайд 20.
10. Видео опыт «Взаимодействие железа и серы». Чем отличается чистое вещество и смесь? Всегда можно отличить чистое вещество и тонкую смесь (молоко, зубную пасту)?
11. Понятия чистые вещества, их значение, применение.
Понятия чистые вещества, их значение, применение.
12. Лабораторный опыт. Разделение смеси песка и соли фильтрованием.
На столах: смесь песка и соли, вода, воронка и готовый фильтр, стаканы, палочка.
ТБ, смешали с водой, профильтровали – выводы.
5. Итоги урока, оценивание, домашнее задание
Домашнее задание: параграф 22, найти определения: сепарация, дистилляция, возгонка, перегонка, хроматография.
Оценивание: все получат отметки за самостоятельные работы, оценить активных за домашнее задание.
Рефлексия. Учитель. Притча про строителей храма. У строителей храма спрашивали: чем они занимались? Первый строитель ответил: «Я клал кирпичи…». Второй: «Я выполнял свое дело». Третий: «Я строил ХРАМ!». Какое настроение у вас после урока – что получилось, что было сложным, почему не получились задания, как можно делать лучше, каковы наши успехи… и т.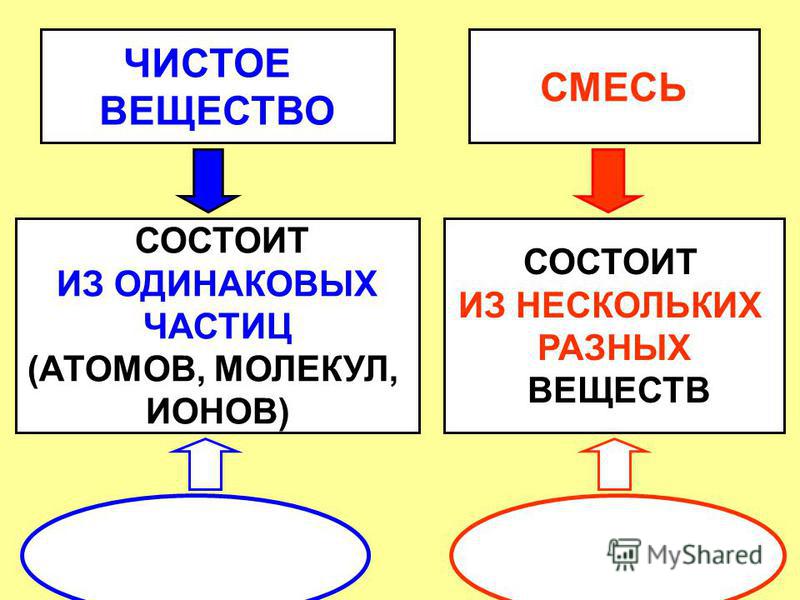 д.
д.
На доске презентация со смайликами, отражающими настроение урока и ученика (злость, грусть, скука, агрессия, радость)
6. Закрепление
Давайте подумаем, а как могут применять методы химического анализа люди различных профессий? (врач, криминалист, искусствовед).
Литература:
- Учебник по химии, 8 класс, автор О.С. Габриелян.
- Сайт АЛХИМИК (Аликберовой).
Чистые вещества и смеси ~ С химией по жизни
Дорогие мои восьмиклассники!
Чистое вещество имеет определенный постоянный состав или структуру (соль, сахар).
В жизни редко встречаются чистые вещества, чаще — смеси веществ. Воздух – это смесь азота, кислорода и других газов, морская вода – смесь воды и растворенных солей.
Смеси — это физические сочетания чистых веществ, не имеющие определенного или чистого состава.
Примером смеси может служить обыкновенный чай (напиток), который многие самостоятельно готовят и пьют по утрам. Кто-то любит крепкий чай (большое кол-во заварки), кто-то любит сладкий чай (большое кол-во сахара)… Как видим, смесь под названием «чай» всегда получается немного разной, хотя и состоит из одних и тех же компонентов. Однако, следует отметить, что каждый компонент смеси сохраняет набор своих характеристик, поэтому, разные вещества можно выделить из смеси.
Кто-то любит крепкий чай (большое кол-во заварки), кто-то любит сладкий чай (большое кол-во сахара)… Как видим, смесь под названием «чай» всегда получается немного разной, хотя и состоит из одних и тех же компонентов. Однако, следует отметить, что каждый компонент смеси сохраняет набор своих характеристик, поэтому, разные вещества можно выделить из смеси.
| Роберт Бойль |
Индивидуальное чистое вещество обладает определённым набором свойств (постоянными физическими свойствами). Только чистая дистиллированная вода имеет tпл = 0 °С, tкип= 100 °С, не имеет вкуса. Морская вода замерзает при более низкой, а закипает при более высокой температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более низкой, а закипает при более высокой температуре, чем вода Балтийского моря. Почему? Дело в том, что в морской воде содержатся другие вещества, например растворенные соли, т.е. она представляет собой смесь различных веществ, состав которой меняется в широких пределах, свойства же смеси не являются постоянными.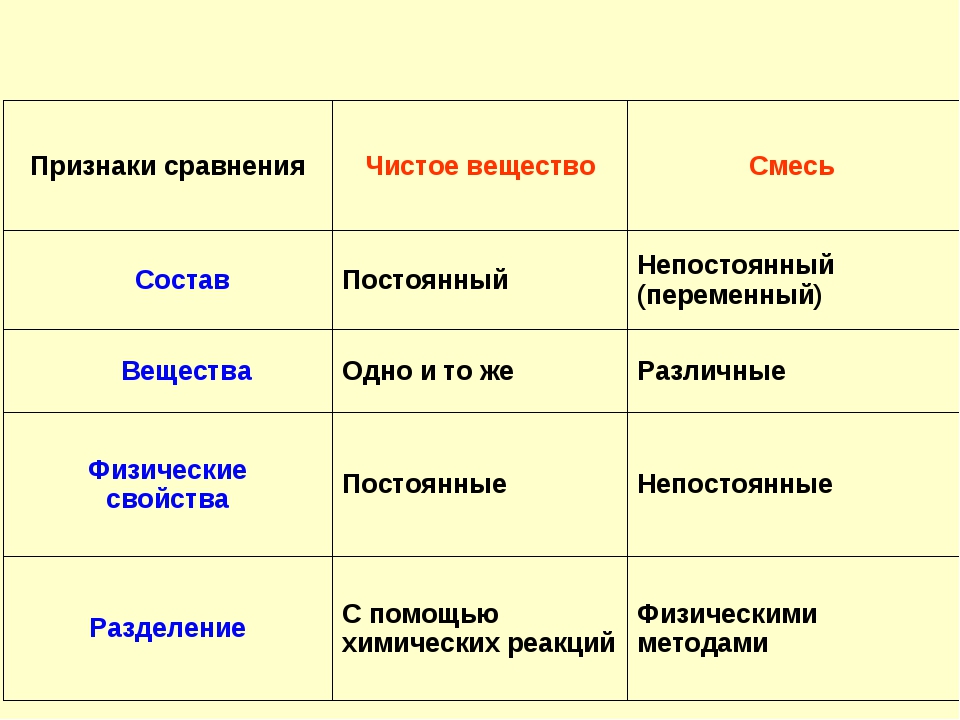 Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов».
Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов».
В результате изучения темы «Чистые вещества и смеси», необходимо:
— иметь представление о
чистых веществах и смесях: однородных и неоднородных; свойствах чистых веществ и
смесей, их составе;
Для лучшего усвоения материала, рекомендую:
1. Посмотреть видеоурок;
Другие видеоуроки по школьной программе смотрите на InternetUrok.ru
2. познакомиться с данными таблицы;
3. изучить классификацию смесей;
4. выполнить интерактивное задание «Смеси»;
5. выполнить интерактивное задание «Смеси в природе»;
6. выполнить интерактивное задание «Смеси в сельском хозяйстве»;
7. повторить п. 23, выполнить № 1-3, с.124
Желаю удачи!
Похожие материалы:
Чистые вещества и смеси
В
жизни мы часто имеем дело со смесями, а не с чистыми веществами. Даже не вся
Даже не вся
вода является чистым веществом, а представляет собой смесь. Только вода,
лишенная примесей или содержащая их мало, является чистым веществом. Такую воду
называют дистиллированной. В большинстве своем – вода – это смесь
растворенных в ней солей, минералов и других веществ, т.е. является смесью.
Смеси
делят на две группы: однородные смеси, в которых даже с
помощью микроскопа нельзя отличить частицы веществ. К однородным смесям
относятся растворы спирта, сахара.
Неоднородные
смеси, в которых даже невооруженным глазом или с помощью
микроскопа можно различить вещества, входящие в состав смеси. К неоднородным смесям
относятся смесь воды с мелом, воды с песком.
Смеси
бывают: твердыми, жидкими и газообразными. Например, твердые
смеси – это стекло, сплавы (мельхиор, чугун, гранит).
Твёрдые
смеси
Жидкие
– это клеточный сок, молоко, минеральная вода, кровь.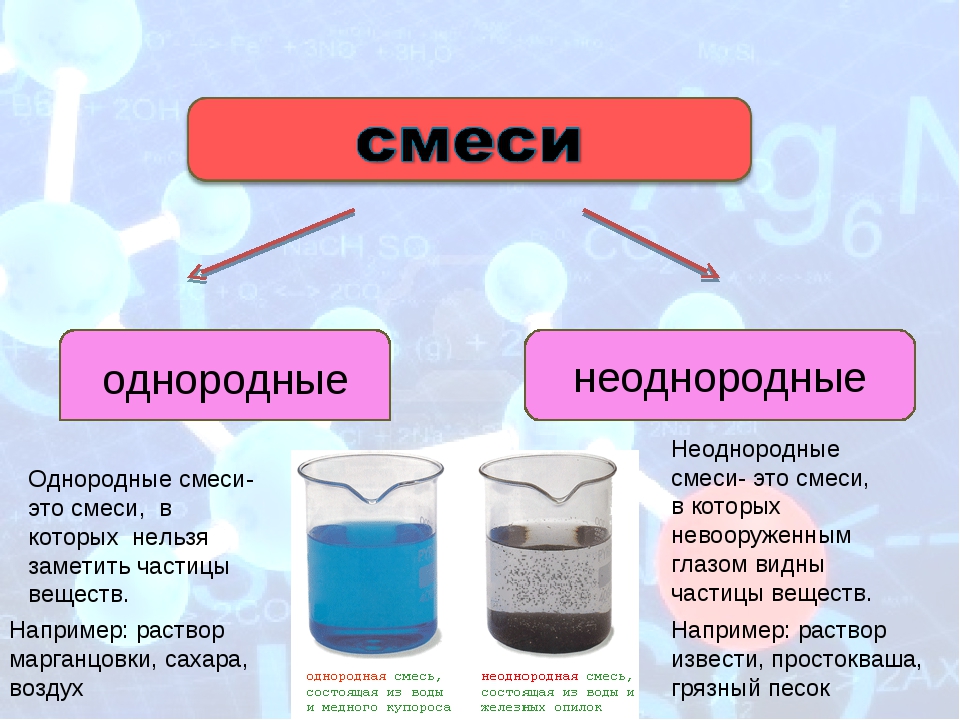
Жидкие
смеси
А
газообразные – это воздух, пропан-бутановая смесь.
Смеси,
в отличие от чистых веществ, имеют иные свойства. Так,
чистая вода замерзает при температуре 0 0С, а если растворить в ней
соль, то температура замерзания значительно понижается. Этим свойством
пользуются работники коммунальных служб, когда в период гололедицы посыпают
дороги технической поваренной солью или другими реагентами. Чистое железо не
ржавеет на воздухе, а железный гвоздь, из-за содержания в нем примесей,
ржавеет.
Из
смеси можно выделить составляющие ее компоненты.
Существуют различные способы разделения смесей.
Одним
из способов разделения неоднородной смеси является отстаивание. Этот
способ основан на различной плотности веществ. Этим способом можно
разделить смесь железных и древесных опилок, смешав смесь с водой и дав
ей отстояться. Железные опилки опустятся вниз, а древесные всплывут наверх и их
Железные опилки опустятся вниз, а древесные всплывут наверх и их
можно слить вместе с водой. Этим способом можно воспользоваться при разделении смеси
воды и мела или воды и глины. Мел и глина в этом случае опустятся вниз, а
воду можно осторожно слить.
Отстаиванием
можно разделить и жидкости. Например, смесь растительного масла и воды,
бензина и воды, нефти и воды. Эти жидкости быстро расслаиваются, поэтому их
разделяют с помощью делительной воронки или колонки.
Разделение
сливок от молока производят с помощью центрифугирования.
Другим
методом является фильтрование, которое основано на различной
пропускной способности фильтра по отношению к компонентам смеси. С помощью
этого метода отделяют твердые примеси от жидкости. В химической
лаборатории используют бумажные фильтры. Таким методом можно разделить смесь
песка и поваренной соли. Эту смесь сначала растворяют в воде, затем
пропускают через бумажный фильтр. Песок остается на фильтровальной бумаге, а
Песок остается на фильтровальной бумаге, а
раствор поваренной соли – фильтрат, проходит через фильтр. В
промышленности жидкости фильтруют через специальные материалы –
различные ткани. Для очистки концентрированного раствора щелочи используют
стекловату.
Разделение
смеси магнитом основано на различии магнитных свойств
веществ. Если смешать железные опилки с серой на бумаге и накрыть еще сверху
листом бумаги, а затем поднести магнит, то железные опилки притянутся магнитом,
а сера нет.
Однородную
смесь можно разделить на компоненты с помощью метода выпаривания. Он основан
на различной температуре кипения веществ смеси. Этим методом можно разделить
поваренную соль и воду. Для этого, в фарфоровую чашку наливают раствор соли
и кипятят. Вода испаряется, а частицы соли остаются в чашке.
Иногда
применяют способ упаривания, когда вода частично испаряется, получается
концентрированный раствор, при охлаждении которого растворенное вещество
выделяется в виде кристаллов.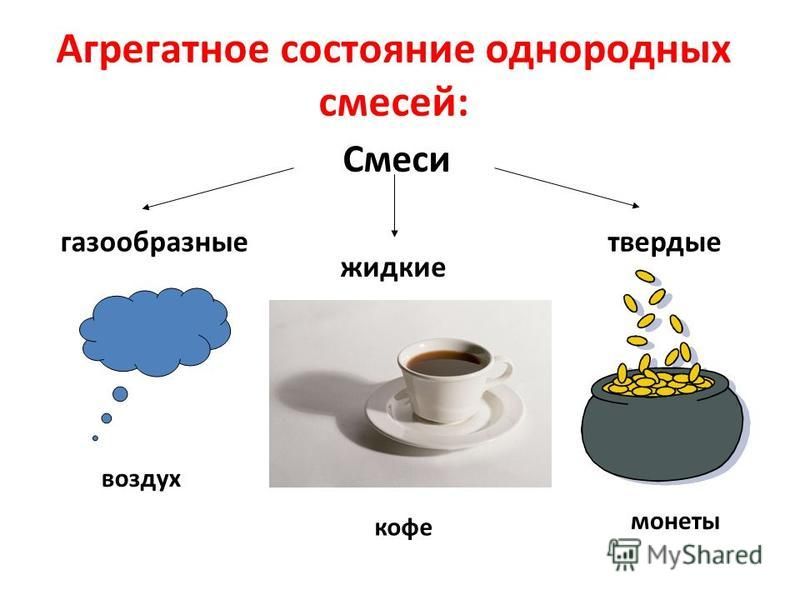 Этот способ называется кристаллизацией,
Этот способ называется кристаллизацией,
при этом, вещество получается в чистом виде, а примеси остаются в растворе.
Для
получения дистиллированной воды используют метод дистилляции, который
тоже основан на различии температур кипения компонентов в смеси.
Состав
смесей определяют с помощью химического анализа. Например, в металлургии
при производстве стали, обязательно берут ее пробы для определения содержания
углерода. Контроль за состоянием окружающей среды немыслим без определения
концентрации примесей в воздухе и воде. Химический анализ горных пород и руд
используется при разведке полезных ископаемых.
Знаменитый
Шерлок Холмс раскрыл свои преступления во многих случаях только благодаря
результатам химического анализа. Без химического анализа просто не обойтись в
криминалистике, археологии, медицине и искусствоведении. Без химического анализа
не обходятся и космические исследования Марса, Венеры, Луны.
С
помощью методов химического анализа получают очень чистые вещества,
в которых содержание примесей не превышает одной стотысячной и даже одной
миллионной доли процента. Такие, особо чистые вещества, необходимы в атомной
энергетике, полупроводниковой промышленности, волоконной оптике и др. областях.
С
простейшими методами очистки веществ вы уже знакомы.
Например, для очистки природной воды используют уголь, обожженную глину. Вода,
проходя через эти пористые вещества, избавляется от различных примесей. Для
очистки большого количества воды, используют смесь песка и гравия. Кроме этого,
для обеззараживания воды используют метод хлорирования.
Урок химии в 8 классе на тему: «Чистые вещества и смеси»
План-конспект урока в 8 классе по теме:
«Чистые вещества и смеси. Способы разделения смесей»
Подготовлено учителем химии МБОУ Лицея №15
Заводского района г. Саратова
Саратова
Сафаровой М.А.
Тема урока: Чистые вещества и смеси. Способы разделения.
Тип урока: урок изучения нового материала
УМК: Рудзитис Г.Е., Фельдман Ф.Г. Химия. 8 класс, М.: Просвещение, 2015
Цели: Создание условий для формирования у учащегося представления о чистых веществах и видах смесей, а так же способах разделения смесей.
Планируемые результаты:
Предметные умения: рассмотреть понятия: чистое вещество, смесь, научить определять основные отличия чистых веществ и смесей, обучить основным принципам разделения смесей;
Личностные УУД: формирование ответственного отношения к обучению, готовность к саморазвитию, самообразованию;
Регулятивные УУД: формировать аналитические навыки, умение обобщать и делать выводы, развивать креативность и творческие способности;
Познавательные УУД: воспитывать научное мировоззрение, прививать культуру химического эксперимента, строить логические цепочки, устанавливать причинно-следственные связи;
Коммуникативные УУД: умение работать в паре и группе, самостоятельно принимать решения.
Тип урока: комбинированный.
Оборудование: презентация, ПК, проектор, комплект на парту: лабораторное оборудование (пробирки, стаканы, делительная воронка, фильтр, штатив, стеклянные палочки, бумага для хроматографии, пипетки), вещества и смеси: молоко, гранит, раствор соляной кислоты, зубная паста на предметном стекле, смесь воды и песка, смесь серы и железных опилок.
Ход урока:
Организационный момент. Постановка целей и задач урока.
Учитель приветствует обучающихся.
Класс делится на 4-6 групп. Каждая группа получает индивидуальное задание – разделить смесь, применив знания, полученные на уроке.
2. Постановка целей и задач
Цитата урока: И.В.Петрянов:»Разве вода — это только та бесцветная жидкость, что налита в стакан? Океан, покрывающий почти всю нашу планету, всю нашу чудесную Землю, в котором миллионы лет назад зародилась жизнь, — это вода. Тучи, облака, туманы, несущие влагу всему живому на земной поверхности, — это ведь тоже вода.
Тучи, облака, туманы, несущие влагу всему живому на земной поверхности, — это ведь тоже вода.
Установочный вопрос: о какой «воде» идет речь? Возможные вопросы: Какая вода бывает? Чем отличается друг от друга? Почему?
Вопросы для формулирования темы урока: 1) дайте определение понятию «вещество»? 2) Какие физические характеристики веществ вы знаете? 3) На столе перед вами представлены различные вещества (гранит, молоко, дистиллированная вода, карбонат кальция, раствор соляной кислоты, смесь серы и железных опилок). Разделите их на две группы. По какому принципу вы их разделили? 4) Как определить чистое перед вами вещество или смесь?
Ученики предполагают возможные варианты ответа. Предполагают возможную тему урока.
3. Актуализация знаний
Формулировка понятий чистое вещество и смесь. Очень многие вещества, с которыми мы сталкиваемся в быту, представляют собой, на самом деле смеси. Так, воздух, которым мы дышим — это смесь, состоящая из азота, кислорода, углекислого газа и других компонентов. Морская вода, включает в себя большое количество неорганических солей, растворенные газы, гумусовые вещества. В дыме сигареты можно обнаружить до 30000 различных компонентов, в том числе токсичных, вызывающих хронические заболевания и раковые опухоли.
Так, воздух, которым мы дышим — это смесь, состоящая из азота, кислорода, углекислого газа и других компонентов. Морская вода, включает в себя большое количество неорганических солей, растворенные газы, гумусовые вещества. В дыме сигареты можно обнаружить до 30000 различных компонентов, в том числе токсичных, вызывающих хронические заболевания и раковые опухоли.
Сравнение физико-химических свойств дистиллированной и морской воды показывает, что дистиллированная воды имеет постоянную температуру кипения 100оС, температуру плавления 0оС, не имеет вкуса и запаха. Морская вода имеет горько-соленый вкус, обладает более высокой температурой кипения и плавления, к тому же эти характеристики меняются при длительном кипячении морской воды. Физические характеристики морской воды из различных источников тоже заметно отличаются. Почему? Дело в том, что в морской воде содержится большое количество компонентов, содержание которых для различных источников будет различно, что ведет к изменению свойств. Заполняем таблицу: сравнение свойств смеси и чистого вещества.
Заполняем таблицу: сравнение свойств смеси и чистого вещества.
Свойство | Чистое вещество | Смесь |
В природе невозможно встретить абсолютно чистое вещество. Чистые вещества получают искусственно, которые по степени чистоты разделяют на несколько классов: чистое вещество, чистое для анализа, химически чистое, особо чистое вещества, которые применяют в аналитической практике, в квантовой технике, производстве нанооборудования.
Записываем понятие однородной и неоднородной смеси.
Как можно разделить смеси на индивидуальные компоненты? Различие каких физических свойств мы можем использовать для разделения?
Обзор основных способов разделения однородных и неоднородных смесей, принципов, на которых основаны методы разделения на основе презентации. (Слайды интерактивной презентации). Ученикам предлагается провести следующие лабораторные опыты: разделение смеси железа и серы, песка и воды, пасты фломастеров.
(Слайды интерактивной презентации). Ученикам предлагается провести следующие лабораторные опыты: разделение смеси железа и серы, песка и воды, пасты фломастеров.
Итак, смеси веществ в зависимости от физических свойств компонентов смеси, можно разделить отстаиванием, фильтрование, экстракцией, дистилляцией, кристаллизацией, хромотографическими методами и т.д.
3. Первичное усвоение и закрепление новых знаний. Разбираем проблемные ситуации каждой группы:
1) ребята пошли в поход. Маша варила суп, но коробка с солью у нее выпала, соль рассыпалась. Предложите способ разделения смеси песка и соли.
2) в автосервисе отработанное масло содержит примеси неорганических солей, растворимых в воде. Предложите способ разделения данной смеси.
3) отходы фабрики содержат мелкогранулированные отходы пластика, железные опилки, пыль (песок). Предложите способ разделения данной смеси.
Ребята составляют алгоритм разделения данных смесей и проводят экспериментальное разделение данной смеси.
4. Подведение итогов урока. Рефлексия. Составление синквейна.
Запись домашнего задания.
Домашнее задание. Параграф 4 (Учебник Рудзитиса), ответить на вопросы 1-4 стр 17, тестовые задания 1-5 стр.18
ДОМАШНИЙ эксперимент: вырастить кристаллик поваренной соли по методике. Приготовить раствор поваренной соли: в горячей воде (200 мл) растворить 5 столовых ложек соли. Раствор профильтровать через марлю. Полученный фильтрат перелить в чистый стаканчик, в который опустить нитку с привязанным кристалликом соли. Оставить на несколько дней. Все наблюдения записывать в лабораторный журнал.
Рефлексия. Составление синквейна на тему: смеси и чистое вещество.
Технологическая карта урока «Чистые вещества и смеси»
Технология проведения урока (этап урока, его цель) | Деятельность учителя | Деятельность ученика | Формируемые УУД |
Орг. | Приветствует учащихся, создает позитивный эмоциональный фон, предлагает деление на группы | Приветствуют учителя, делятся на группы | Личностные: проявлять желание к процессу обучения, Регулятивные: готовность воспринимать новую информацию |
Постановка цели и задач урока. | Создание проблемной ситуации (стихотворение) Мотивация учебной деятельности Учитель мотивирует к учебной деятельности (предъявляет смесь), просит разделить представленные вещества на группы) и дать объяснение своим действиям с точки зрения | Ученики перечисляют возможные примеры «воды». Отвечают на возможные вопросы. Разделяют вещества по и смеси по разным группам. Учащиеся приходят к определению темы: Чистые вещества и смеси. Формулируют цель и задачи урока. | Личностные –разивать познавательный интерес к уроку; мотивация Познавательные-уметь высказывать личное мнение в устной форме – ставить проблему, решать поставленные задачи Регулятивные – планировать реализацию учебной цели, прогнозировать темуурока Коммуникативные — вступать в учебный диалог с учителем и учащимися; учебное сотрудничество с учителем и учащимися а |
Актуализация знаний | Беседа. Учитель актуализирует материал по теме. Предлагает заполнить таблицу сравнения свойств чистых веществ и смесей. Актуализация основных понятий, относящихся к теме урока. Просмотр презентации с характеристикой основных способов разделения смеси. Организация самостоятельной работы по разделению конкретной смеси. Повторение правил самостоятельной работы с лабораторным оборудованием и реактивами. | Дополняют и конспектируют учебный материал. Просматривают презентацию, задают вопросы, приводят примеры. Анализируют задание для самостоятельной работы. Повторяют правила техники безопасности. Выполняют практическую работу по разделению смеси, пользуясь текстом учебника. Докладывают результаты работы, исправляют ошибки, оценивают работу одноклассников. | Личностные: выражать положительное отношение к процессу обучения, сотрудничества с одноклассниками и учителем.; Познавательные: Определить основные понятия; Выбрать наиболее эффективные пути решения задачи, сделать обсуждение собственных результатов и доложить их. Регулятивные – Использовать конкретную информацию и личные знания, оценивать групповую работу; Коммуникативные — Уметь строить необходимое взаимодействие с членами группы для выполнения задач , вступать в диалог, участвовать в коллективном обсуждении проблем.
|
Первичное усвоение новых знаний и проверка их усвоения | Введение нового материала. Учитель предлагает для каждой группы собственное задание: предложить алгоритм разделения полученных смесей. Динамическая пауза!!! Организуется работа по выполнению практического задания Определяются способы разделения смеси | Учащиеся предлагают алгоритм способа разделения смеси Проводят работу по разделению смеси. Работают в группе. Сравнивают свою работу с работой одноклассников. Предлагают альтернативные способы разделения смесей для других групп. Участвуют в дискуссии и оценке работы класса. | Личностные: Осуществлять мотивацию к обучению, оценивать собственную деятельность, развивать собственные навыки и умения Познавательные — Уметь анализировать и систематизировать материал; формулирование проблемы и самостоятельное создание способов решения творческого и поискового характера. Регулятивные: Самостоятельно анализировать условия достижения цели, планировать необходимые действия самостоятельно, оценивать правильность выполнения действия и вносить необходимые коррективы как в конце действия, так и по ходу его реализации. Коммуникативные: уметь участвовать в коллективном обсуждении проблем, четко выражать свои мысли в соответствии с задачами и условиями коммуникации. |
Подведение итогов урока. Рефлексия | Повторение опорных понятий урока, составление выборки невыясненных вопросов (при их наличи). Инструктаж по выполнению домашнего задания. Запись в дневник. Организует самооценку учащимися своих знаний, уровня усвоения новых знаний и эмоционального состояния от урока. | Проговаривают основные понятия урока, составляют выборку невыясненных вопросов. Записывают домашнее задание в дневник Выражают собственное мнение о работе и полученном результате. Обобщают результаты своей деятельности по достижению цели. Выражают эмоциональное состояние от урока в виде синквейна. | Регулятивные — планировать необходимые действия самостоятельно. Осознание качества и уровня усвоения Познавательные: рефлексия, контроль Личностные — отношение обучающихся к уроку, мотивация Коммуникативные — учитывать разные мнения, формулировать собственное мнение и позицию, аргументировать ее с позициями партнеров в сотрудничестве при выборе общего решения в совместной деятельности. |
Приложение 1
Инструктивная карта
Лабораторный опыт №1 «Разделение модельных смесей»
А) разделение смеси серы и железа
Рассмотрите цвет серы и железа
Возьмите небольшие порции каждого вещества
а) испытайте магнитом б) опустите в пробирку с водой, проверьте растворимость
Смешайте серу с железом
Отметьте, изменился ли цвет компонентов в смеси, растворимость, магнитные свойства
Сделайте вывод (сохраняют ли компоненты свои свойства в смеси?)
Б) разделение смеси воды и песка
1. Возьмите небольшую порцию песка и опустите в стаканчик с водой
Возьмите небольшую порцию песка и опустите в стаканчик с водой
2. Размешайте смесь стеклянной палочкой
3. Отметьте изменения, происходящие в стакане
4. Аккуратно, по стеклянной палочке вылейте содержимое стаканчика через воронку с бумажным фильтром
5. Сделайте вывод о возможности разделения смеси песка и воды
В) разделение смеси пасты двух фломастеров
1. Возьмите кусочек фильтровальной бумаги с нанесенной на ней точкой двумя фломастерами.
2. Положите бумагу на предметное стекло
3. С помощью пипетки нанесите каплю воды строго на пятно
4. Опишите наблюдения, сделайте вывод о способах разеления такой смеси.
Лабораторный опыт №2 «Разделение смесей»
Цель: научиться находить и осуществлять рациональные способы выделения веществ из смесей на основе знаний о физических свойствах их компонентов
Ход работы
1. Получите групповое задание, рассмотрите выданную вам смесь (образец №)
Получите групповое задание, рассмотрите выданную вам смесь (образец №)
2. Отметьте физические свойства компонентов смеси (растворимость, плотность и др.)
3. Определите тип смеси (гомогенная или гетерогенная)
4. Предложите способ ее разделения, используя имеющееся лабораторное оборудование. (При затруднении смотрите учебник параграф 4 )
5. Проведите практическое разделение смеси, запишите все действия и наблюдения в лабораторный журнал.
6. Подумайте, какие еще смеси можно разделить таким же способом, приведите примеры
7. Доложите о результатах работы одноклассникам
Нам была предложена (гомогенная – гетерогенная) смесь… образец №. Мы разделили ее …(название способа), используя следующее лабораторное оборудование … Способ основан на различной … (физические свойства) компонентов смеси. Таким же способом можно разделить смесь…
Презентация «Смеси»
PPT / 7 Мб
Чистые вещества и смеси веществ
Купить неорганические реактивы, inorganic chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены неорганические реактивы —
категории: ;
Купить органические соединения, реактивы, organic chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены органические соединения, реактивы —
реактивы Карла Фишера для волюметрии, реактивы HYDRANAL, органические растворители, органические кислоты, органические соли и соединения, категории: reagents for Karl Fischer volumetry, other reagents HYDRANAL, organic solvents, organic acids, organic salts and compounds, ; , , , , органические соединения, органические соли,
реактивы Карла Фишера для волюметрии
Подробнее.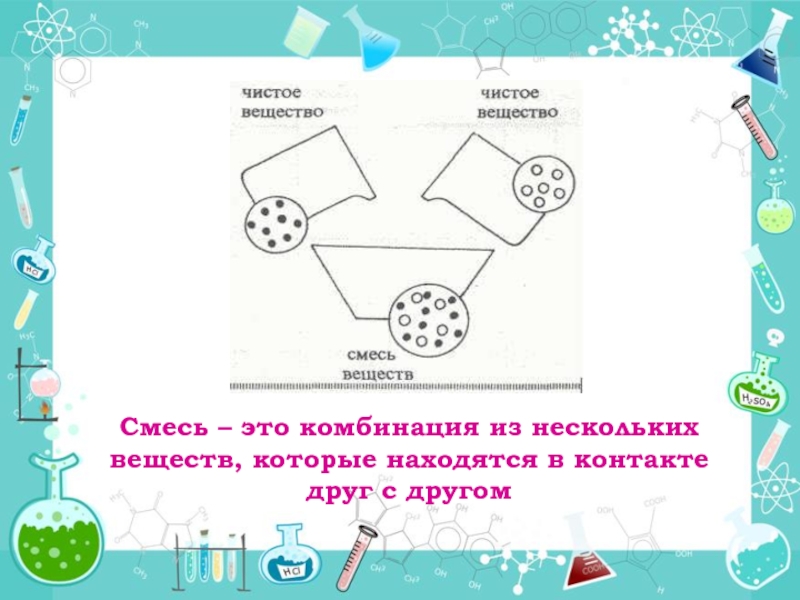 ..
..
Купить реактивы карла фишера для волюметрии — reagents for Karl Fischer volumetry в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Использование реактивов Гидранал позволяет определить воду в составе химических реактивов, пищевых продуктов, фармацевтическихпрепаратов. Содержание воды влияет на множество химических и физических параметров выпускаемой продукции. Реактивы Карла Фишера произв…
органические растворители
Подробнее…
Купить органические растворители (organic solvents) в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить органический растворитель в Санкт-Петербурге по выгодной цене. Компания ХИМСНАБ-СПБ предлагает следующую фасовку растворителей: п/э или стеклянная бутылка 1 литр; п/э канистра 10 литров; п/э канистра 5 литров; стеклянный флакон 1 литр, бочка, и бочка, 250 кг. Реактивы и растворители. ..
..
органические кислоты
Подробнее…
Купить органические кислоты — organic acids в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Органические вещества, проявляющие кислотные свойства (кислоты их кислые соли и средние соли содержатся во многих товарах. Благодаря наличию свободных кислот и кислых солей многие продукты и их водные вытяжки обладают кислой реакцией.
К ним относятся карбоновые кислоты, содержа…
Купить химические реактивы, chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены химические реактивы —
вода, неорганические реактивы, органические соединения, реактивы, растворы, особо чистые вещества, категории: water, inorganic chemicals, organic chemicals, solutions, highly purified substances, ; дистиллированная вода, вода (УФ-ВЭЖХ) для аналитики, бидистиллированная вода, вода для молекулярной биологии, , , , ,
неорганические реактивы
Подробнее.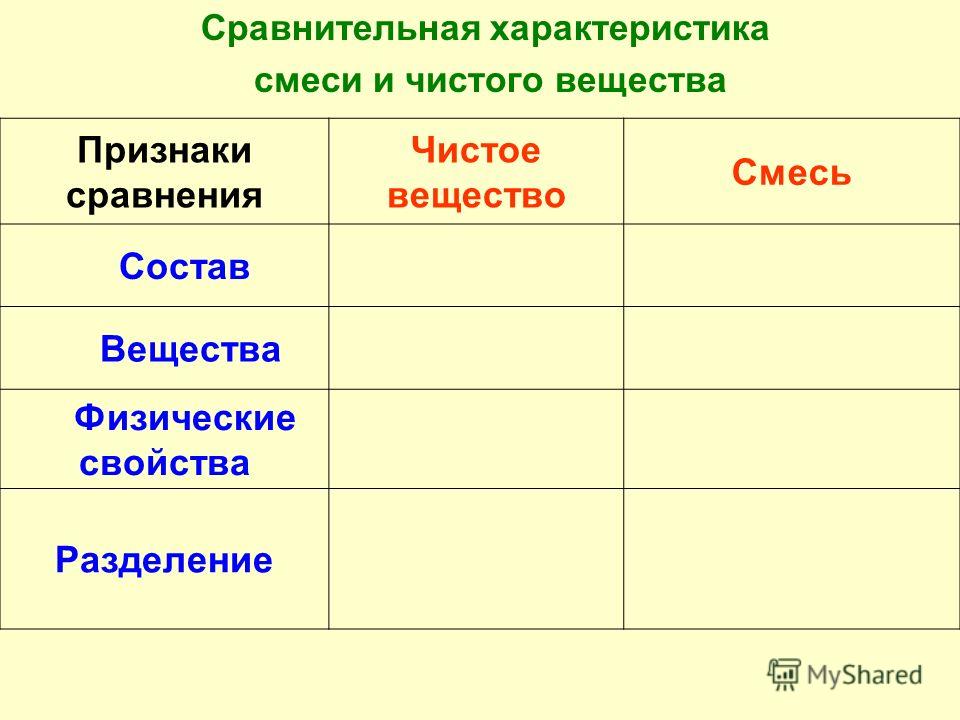 ..
..
Купить неорганические реактивы — inorganic chemicals в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93.
Неорганическое соединение, как правило, представляет собой химическое соединение, которое не имеет связей СН , то есть соединение, которое не является органическим соединением
Химические соединения, реагенты и реактивы находят свое применение в различных областях: научные-исследов…
органические соединения, реактивы
Подробнее…
Купить органические реактивы — organic chemicals в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить органический реактив в Санкт-Петербурге по выгодной цене. химические реактивы химические реактивы химические реактивы хим. реактивы продукцию chemicals химические реактивы, chemicals вода, неорганические реактивы, органические реактивы, растворы, особо чистые вещества особо чистые веще. ..
..
растворы
Подробнее…
Купить растворы — solutions в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. В каталоге ХИМСНАБ-СПБ представлен большой выбор готовых специальных растворов различного назначения: буферные растворы, растворы для заполнения, очистки и хранения электродов, стандартные растворы для кондуктометров, реактивы карла фишера для кулонометрии.
Купить раствор в Санкт-Петербурге по выгодной цене: …
особо чистые вещества
Подробнее…
Купить особо чистые вещества (ультрачистые вещества) в Санкт-Петербурге, в компании Химснаб-СПБ, телефон +7-812-337-18-93. В высокочистых веществах содержатся примесей в незначительном количестве, что они не влияют на основные специфические свойства веществ. Свойства особо чистых веществ используют для создания новых приборов, устройств и технологических процессов. Они находят применени…
Свойства особо чистых веществ используют для создания новых приборов, устройств и технологических процессов. Они находят применени…
Оставьте заявку ON-LINE или позвоните. Менеджер компании ответит на ваши вопросы.
Широкий ассортимент
В каталоге компании более 4000 наименований продукции в 200 товарных категориях: химические реактивы, лаб. оборудование и посуда, аксессуары и принадлежности для лабораторий, различные виды удобрений, химическое сырьеи многе другое. Можно подобрать продукцию воспользовавшись фильтром характеристик.
Проверенные поставщики
Компания реализует товары и продукцию только от проверенных поставщиков гарантирующих качестно продукции.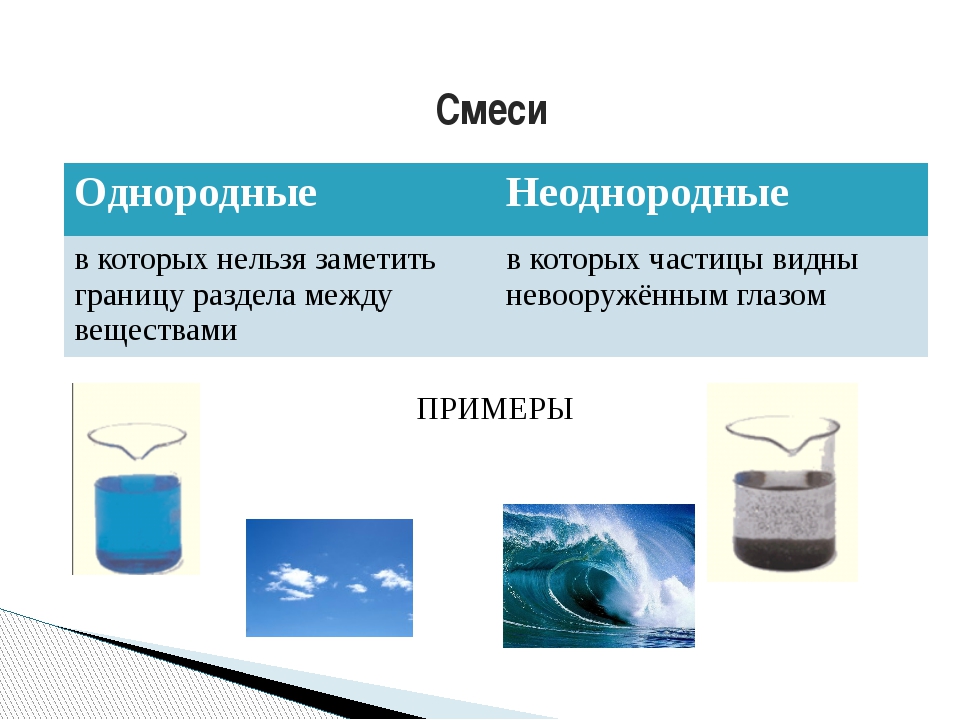
Консультация по продукции
Менеджеры компании проконсультируют вас по ассортименту реализуемой продукции, звоните в рабочее время
Доставка
География потребителей выходит за пределы России, компания «Химснаб-СПБ» осуществляет доставку приобретаемых товаров и продукции по Санкт-Петербургу, Ленинрадской обл, России и странам СНГ.
Индивидуальный подход
Строим свое сотрудничество с клиентом с учетом всех пожеланий клиента.
Гибкий и индивидуальный подход к каждому клиенту, ориентированность на долгосрочные партнерские отношения, строгое соблюдение оговоренных сроков и предоставления документов заказчику являются неоспоримыми преимуществами компании «Химснаб-СПБ». Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Малотоннажная химия
Реализация продукции малотоннажной химии: продукция химической и нефтехимической промышленности. Малотоннажная химия дает возможность на скромном оборудовании и в небольших объемах производить дорогостоящие модификаторы, пластификаторы, ингибиторы и другие микродобавки, способные наделять конечный продукт новыми свойствами
Комплексное снабжение, оснащение
Компания Химснаб-СПБ имеет многолетний опыт работы на рынке химической продукции и лабораторного оборудования. Компания тесно сотрудничает со многими промышленными и производственными организациями и имеет возможность осуществлять комплексное снабжение и оснащение предприятии различных отраслений промышленности необходимым оборудованием и расходными материалами.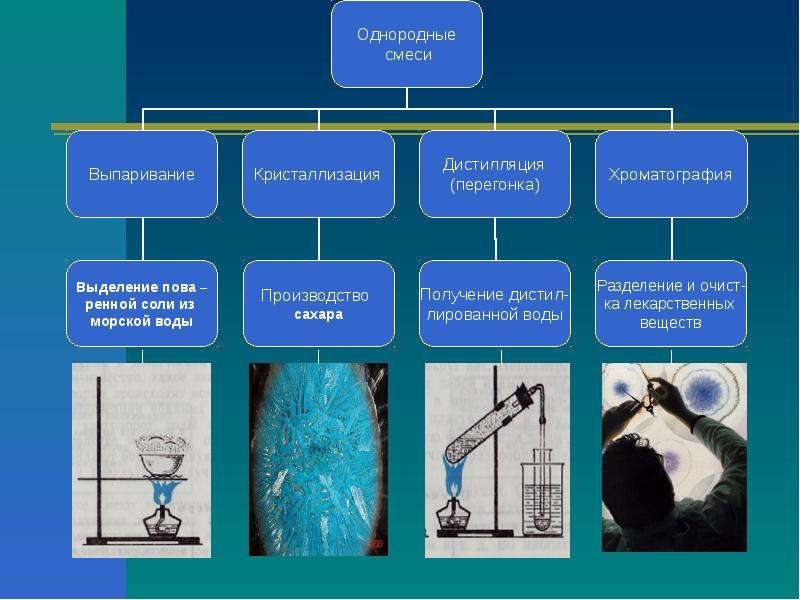
Предствленная информация на страницах данного интернет-сайта и в каталоге продукции носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса РФ. Для получения подробной информации о наличии и стоимости указанных товаров и (или) услуг,обращайтесь к менеджерам отдела продаж: форма обратной связи, e-mail, телефон.
Реализация продукции для сельского хозяйства, химической, строительной, нефтегазовой, металлургической, текстильной, кожевенной, и других отраслей промышленности.
Урок №3. Чистые вещества и смеси. Способы разделения смесей
I. Новый материал
Большинство предметов, которые нас окружают, состоят не из одного вещества, а представляют собой смеси нескольких веществ. Так, рассматривая гранит, легко заметить в нем три составные части- розовые зерна полевого шпата, прозрачные кристаллики кварца и темные блестящие чешуйки слюды. Это пример неоднородной смеси. Мрамор , в противоположность граниту, однороден — это чистое вещество [1] Мы вдыхает воздух,
Это пример неоднородной смеси. Мрамор , в противоположность граниту, однороден — это чистое вещество [1] Мы вдыхает воздух,
а это смесь газов (азота, кислорода и других), выдыхаем углекислый
газ. Умываемся водой — это еще одно вещество, самое распространенное
на Земле. Кофе, чай, кока-кола и другие напитки представляют собой водные растворы многих соединений. Чернила состоят из мельчайших частичек краски, плавающих в воде. Пьём молоко — смесь воды с мельчайшими капельками
молочного жира, и не только: здесь еще есть молочный белок казеин,
минеральные соли, витамины и даже сахар, но не тот, с которым
пьют чай, а особый, молочный — лактоза. Едим яблоки, которые состоят из
целого набора химических веществ — здесь и сахар, и яблочная кислота,
и витамины… Когда прожеванные кусочки яблока попадают в желудок, на
них начинают действовать пищеварительные соки человека, которые помогают
усваивать все вкусные и полезные вещества не только яблока, но и любой другой
пищи. Мы не только живем среди химических веществ, но и сами из
Мы не только живем среди химических веществ, но и сами из
них состоим. Каждый человек — его кожа, мышцы, кровь, зубы, кости, волосы
построены из химических веществ, как дом из кирпичей. Азот, кислород, сахар,
витамины – вещества природного, естественного происхождения. Стекло, резина,
сталь – это тоже вещества, точнее, материалы (смеси веществ). Бумага представляет собой материал, в котором волокна целлюлозы, переплетенные между собой и обработанные клеем, прочно удерживают тонко измельченный мел, тальк, наполнители. Пластмасса, керамика, стекло и резина — искусственного происхождения, в природе их не было. Разработкой новых материалов и изучением их свойств занимается дисциплина — материаловедение. Совершенно
чистые вещества в природе не встречаются или встречаются очень редко.
Отличие чистых веществ от смеси.
Индивидуальное чистое вещество обладает определённым
набором характеризующих свойств (постоянными физическими свойствами).
Чистые вещества, в отличие от большинства смесей, плавятся и кипят при определенной температуре. [ 1]
Только
чистая дистиллированная вода имеет tпл = 0 °С, tкип= 100 °С, не имеет вкуса.
Морская же вода замерзает при более низкой, а закипает при более высокой
температуре, вкус у нее горько-соленый, потому как в ней растворены различные соли.
Вода Черного моря замерзает при более
низкой, а закипает при более высокой температуре, чем вода Балтийского моря.
Потому как в морской воде содержатся разные вещества (растворенные соли), состав которых меняется в широких пределах, свойства же смеси не являются постоянными.
«Смесь – целостная система, состоящая из разнородных компонентов».
Сравнительная характеристика смеси и чистого вещества
Признаки сравнения | Чистое вещество | Смесь |
Состав | Постоянный | Непостоянный |
Вещества | Одно и то же | Различные |
Физические свойства | Постоянные | Непостоянные |
Изменение энергии при образовании | Происходит | Не происходит |
Разделение | С помощью химических реакций | Физическими методами |
Смеси отличаются друг от друга по внешнему виду.
Классификация смесей показана в таблице:
Приведём
примеры суспензий (речной песок + вода), эмульсий (растительное масло + вода) и
растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий +
медь или никель + медь).
В суспензиях видны частицы твердого вещества, в эмульсиях – капельки
жидкости, такие смеси называются неоднородными (гетерогенными), а в растворах
компоненты не различимы, они являются однородными (гомогенными) смесями.
Среди смесей можно выделить жидкие, твердые, газообразные. Например, воздух- газообразная смесь, Стекло, сталь, бронза, латунь — твердые смеси. Клеточный сок, молоко, минеральная вода — жидкие.
Способы разделения смесей
В природе
вещества существуют в виде смесей. Для лабораторных исследований, промышленных
производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки
веществ применяются различные способы разделения смесей
Применение дистиллированной воды
Эти способы основаны на различиях в физических свойствах компонентов
смеси.
Рассмотрим способы разделения гетерогенных и гомогенных смесей.
Пример смеси | Способ |
Суспензия – смесь речного песка с водой | Отстаивание Применяют для разделения неоднородной смеси двух нерастворимых веществ, обладающих различной плотностью. Раньше так выделяли крупинки золота из измельченной золотоносной породы. Золотоносный песок помещали на наклонный желоб, по которому пускали струю воды. Поток воды подхватывал и уносил пустую породу, а тяжелые крупинки золота оседали на дне желоба. Отстаиванием разделяют также смеси двух не смешивающихся жидкостей (эмульсию), например воды и бензина, отделить нефть или растительное масло от В |
Смесь песка и поваренной соли в воде | Фильтрование Позволяет очистить жидкость от нерастворимых в ней веществ. Этот способ заключается в пропускании смеси через пористую (фильтровальную) бумагу. Фильтровальная бумага, в отличии от обычной, не содержит клеящих веществ, поэтому легко впитывает и пропускает жидкость, позволяет отделять от раствора частицы размером больше 0,01 мм. Так можно разделить гетерогенную смесь поваренной соли и речного В промышленности в качестве фильтров часто используют ткани. Например, на маслобойных заводах измельченные семена подсолнечника завертывают в плотную суконную ткань и сжимают между стальными плитами. Растительное масло проходит через ткань, а внутри нее остается твердая масса -жмых. [3] Способ |
Смесь порошка железа и серы | Действие Порошок железа притягивался магнитом, а порошок серы Несмачивающийся порошок серы всплывал на поверхность |
Раствор соли в воде – гомогенная смесь | Выпаривание или используют для выделения твердых веществ из растворов. Эту операцию проводят, нагревая раствор в фарфоровой чашке. Вода испаряется, а в фарфоровой чашке остаются При выпаривании воды из озер Эльтон и Баскунчак получают Если вещество, например сахар, Иногда требуется Если же разделять смесь спирта и воды, то первым Разделение однородных смесей |
Особым методом разделения компонентов, основанным на
различной поглощаемости их определенным веществом, является хроматография.
Дома вы можете проделать следующий опыт. Подвесьте
полоску из фильтровальной бумаги над сосудом с красными чернилами, погружая в
них лишь конец полоски. Раствор впитывается бумагой и поднимается по ней. Но
граница подъема краски отстает от границы подъема воды. Так происходит
разделение двух веществ: воды и красящего вещества в чернилах.
С помощью хроматографии русский ботаник М. С. Цвет
впервые выделил хлорофилл из зеленых частей растений. В промышленности и
лабораториях вместо фильтровальной бумаги для хроматографии используют крахмал,
уголь, известняк, оксид алюминия. А всегда ли требуются вещества с одинаковой
степенью очистки?
Для различных целей необходимы вещества с различной
степенью очистки. Воду для приготовления пищи достаточно отстоять для удаления
примесей и хлора, используемого для ее обеззараживания. Воду для питья нужно
предварительно прокипятить. А в химических лабораториях для приготовления
растворов и проведения опытов, в медицине необходима дистиллированная вода,
максимально очищенная от растворенных в ней веществ. Особо чистые вещества,
Особо чистые вещества,
содержание примесей в которых не превышает одной миллионной процента,
применяются в электронике, в полупроводниковой, ядерной технике и других точных
отраслях промышленности.
II. Задания для закрепления
1) САМОПРОВЕРКА:
Тренажёр №1. Чистые вещества и смеси
Тренажёр №2. Смеси
Тренажёр №3. Смеси в природе
Тренажёр №4. Смеси в сельском хозяйстве
2) Решите задачу:
Дана смесь соли, речного песка и древесных стружек. Предложите способ разделения этой смеси.
3) Из предложенного перечня выпишите в один столбик чистые вещества, а в другой смеси:
Спирт, молоко, морская вода, углекислый газ, минеральная вода, парафин, почва.
4) Из приведенного списка выпишите отдельно чистые вещества, однородные смеси и неоднородные смеси:
Поваренная соль, раствор поваренной соли в воде, кровь, вода, сода, крахмал, золото, цемент, зубная паста.
Используемые источники:
1 В.В. Еремин, А.А. Дроздов, Н.Е. Кузьменко, В.В. Лунин Химия 8
2 http://him.1september.ru/article.php?ID=200602306
3 О.С. Габриелян Химия 8 М., Дрофа, 2008
Чистые вещества и смеси | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Тема:
Химические вещества и элементы
Бывают индивидуальные вещества и смеси. А любой реальный объект — это комбинация нескольких (часто многих) веществ. Даже вещество, которое принято считать чистым, содержит определенные примеси. Химические реактивы, например, классифицируют по степени чистоты. Содержание основного вещества в так называемых чистых реактивах превышает 98%. «Чистые для анализа» реактивы содержат примесей не более 1%. А в «особо чистых» реактивах доля примесей составляет менее 0,00001%.
Одно из важнейших заданий современной химии — получение сверхчистых веществ. Ведь без них невозможно развитие высоких технологий, в частности микроэлектроники.
В луче света ты можешь даже невооруженным глазом увидеть множество пылинок:
Вот посмотри: всякий раз, когда солнечный свет проникает В наши жилища и мрак прорезает своими лучами, Множество маленьких тел в пустоте ты увидишь; мелькая, Мечутся взад и вперед в лучистом сиянии света… Тит Лукреций Кар. О природе вещей / Перевод Ф.А. Петровского
| Рис. 4.5. Так выглядят частицы пыли при увеличении |
А так частички пыли выглядят при увеличении (рис. 4.5). Обрати внимание на их форму и размер. Очевидно, что необходимо использовать как традиционные, так и новейшие средства для уменьшения содержания пыли в воздухе.
| Рис. 4.6. «Чистая комната» |
Выполнять некоторые высокоточные технологические операции возможно только в так называемых чистых комнатах (рис. 4.6). «Чистая комната» — это сооружение, в котором регулируется содержание частичек пыли и поддерживается специфический микроклимат. В воздухе объемом один литр должно содержаться не более 2—4 частичек пыли.
В отличие от индивидуальных веществ, смеси можно физическими методами разделить на составные части.
Некоторые способы разделения смесей известны из повседневной жизни. Например — молочный сепаратор, с помощью которого из молока изготавливают сливки и масло.
Немало производственных процессов также связано с разделением смесей. Материал с сайта http://worldofschool.ru
Вода в озере Кунигунда (Закарпатье) в несколько раз соленее морской. Если после купания в этом водоеме постоять на солнце, кожа быстро покроется слоем соли.
| Рис. 4.8. Схема дистилляции (перегонки) морской воды. Способ разделения смеси |
На этой странице материал по темам:
Смесь чем отличается от вещества конспект краткий
Лукреций кар о природе вещей краткое содержание
Краткий конспект на тему чистые вещества и смеси
Реферат вещества и смеси
Чистые вещества и смеси реферат
Вопросы по этому материалу:
Какие газы входят в состав воздуха?
Является ли воздух однородной смесью?
Чистые вещества и смеси — Элементы, соединения и смеси — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
Значение чистого
Слово «чистый» используется в химии иначе, чем его повседневное значение. Например, в магазинах продаются картонные коробки с маркировкой «чистый» апельсиновый сок. Этикетка означает, что содержимое представляет собой апельсиновый сок без добавления каких-либо других веществ. Однако сок не является чистым в химическом смысле, потому что он содержит разные вещества, смешанные вместе.В химии:
- чистое вещество состоит только из одного элемента или одного соединения
- смесь состоит из двух или более разных веществ, химически не связанных между собой
Компоненты смеси могут быть разделены без химических реакций
Смеси и соединения
Водород и кислород являются газами. Вместе, как смесь, водород и кислород могут вступать в реакцию и образовывать воду. Вода — это соединение водорода и кислорода. Есть важные различия между свойствами смеси и соединения.
В этой таблице столбец «Смесь» относится к газам водорода и кислорода, а столбец «Соединение» относится к воде.
| Смесь | Соединение | |
|---|---|---|
| Состав | Переменный состав — можно изменять относительные количества двух газов. | Постоянный состав — вода всегда содержит одинаковое соотношение водорода и кислорода. Это соотношение отражено в химической формуле соединения — H 2 O. |
| Зарегистрирован или нет? | Водород и кислород не соединяются. | Водород и кислород соединились, чтобы сформировать новое вещество — воду. |
| Свойства | Сохраняет свойства используемых веществ. Эта смесь находится в газовом состоянии. | Свойства отличаются от свойств содержащихся в нем элементов. Это соединение представляет собой жидкость. |
| Разделение | Вещества в смеси могут быть разделены. | Нельзя разделить, но можно получить с помощью химических реакций. |
Различия между чистыми веществами и смесями
Чистые вещества имеют высокую температуру плавления , но смеси плавятся в широком диапазоне температур. Эту разницу легче всего увидеть, если измерить температуру горячей жидкости, когда она охлаждается и замерзает. На графике показана кривая охлаждения для образца соединения, называемого салолом.
Температура остается неизменной, пока чистое вещество меняет состояние.
Горизонтальная часть графика показывает, что салол имеет резкую температуру плавления, поэтому он чистый.Загрязненный салол (смесь салола и других веществ) при замерзании вызывает постепенное понижение в диапазоне температур.
3.05: Чистые вещества и смеси
Задача обучения
- Различают чистые вещества и смеси
- Определять смеси как однородные или неоднородные
Чистые вещества
Когда мы говорим о чистом веществе , мы говорим о чем-то, что содержит только один вид материи.Это может быть либо один элемент, либо одно соединение, но каждый образец этого вещества, который вы исследуете, должен содержать в точности одно и то же с фиксированным, определенным набором свойств.
| Чистое вещество | Элемент или соединение? | Состоит из: |
|---|---|---|
| Свинец (Pb) | элемент | атомов свинца |
| Газообразный кислород (O 2 ) | элемент | молекул кислорода * |
| Вода (H 2 O) | соединение | молекул воды |
| Аммиак (NH 3 ) | соединение | молекул аммиака |
* Примечание: чистый газообразный кислород состоит из молекул, но по-прежнему считается элементом, а не соединением, поскольку молекулы состоят из элементов одного типа.Соединения состоят из одного или нескольких элементов.
Смеси
Если мы берем два или более чистых вещества и смешиваем их вместе, мы называем это смесью . Смеси всегда можно снова разделить на составляющие чистые вещества, потому что связывание между атомами составляющих веществ не происходит в смеси. В то время как соединение может иметь свойства, сильно отличающиеся от свойств составляющих его элементов, в смесях вещества сохраняют свои индивидуальные свойства.Например, натрий — мягкий блестящий металл, а хлор — едкий зеленый газ. Эти два элемента могут объединяться с образованием соединения, хлорида натрия (поваренная соль), которое представляет собой белое кристаллическое твердое вещество, имеющее — ни свойств натрия или хлора. Если, однако, вы смешали поваренную соль с молотым перцем, вы все равно могли бы видеть отдельные зерна каждого из них, и, если бы вы были терпеливы, вы могли бы взять пинцет и осторожно разделить их обратно на чистую соль и чистый перец. .
Гетерогенная смесь
Гетерогенная смесь представляет собой смесь, состав которой неоднороден по всей смеси. Овощной суп — это неоднородная смесь. Любая данная ложка супа будет содержать различное количество различных овощей и других компонентов супа.
Гомогенная смесь / раствор
Гомогенная смесь представляет собой комбинацию двух или более веществ, которые настолько тщательно перемешаны, что смесь ведет себя как единое вещество.Еще одно слово для обозначения однородной смеси — раствор. Таким образом, комбинация соли и стальной ваты представляет собой неоднородную смесь, поскольку легко увидеть, какие частицы вещества представляют собой кристаллы соли, а какие — стальную вату. С другой стороны, если вы возьмете кристаллы соли и растворите их в воде, очень трудно определить наличие более одного вещества, просто взглянув, даже если вы используете мощный микроскоп. Соль, растворенная в воде, представляет собой гомогенную смесь или раствор (Рисунок \ (\ PageIndex {3} \)).
Рисунок \ (\ PageIndex {3} \): Типы смесей © Thinkstock Слева комбинация двух веществ представляет собой гетерогенную смесь, поскольку частицы двух компонентов выглядят по-разному. Справа кристаллы соли растворились в воде настолько тонко, что вы не можете сказать, присутствует ли соль. Гомогенная смесь выглядит как единое вещество.
Пример \ (\ PageIndex {3} \)
Определите следующие комбинации как гетерогенные смеси или гомогенные смеси.
- газированная вода (углекислый газ растворен в воде.)
- Смесь металлической стружки железа и порошка серы (и железо, и сера являются элементами.)
Рисунок \ (\ PageIndex {4} \): Смесь железной стружки и порошка серы ( Asoult, смесь Fe-S 03, CC BY 4.0)
Решение
- Поскольку диоксид углерода растворен в воде, мы можем сделать вывод из поведения кристаллов соли, растворенных в воде, что диоксид углерода, растворенный в воде, является (также) гомогенной смесью.
- Если предположить, что железо и сера просто смешаны вместе, должно быть легко увидеть, что такое железо, а что такое сера, так что это неоднородная смесь.
Упражнение \ (\ PageIndex {3} \)
Являются ли следующие комбинации гомогенными смесями или гетерогенными смесями?
- человеческое тело
- амальгама, комбинация некоторых других металлов, растворенных в небольшом количестве ртути
Ответы
- гетерогенная смесь
- однородная смесь
Категоризация материалов
Рисунок \ (\ PageIndex {1} \): Взаимосвязь между типами веществ и методами, используемыми для разделения смесей
Обычная поваренная соль называется хлоридом натрия.Его считают веществом , потому что оно имеет однородный и определенный состав. Все образцы хлорида натрия химически идентичны. Вода также является чистым веществом. Соль легко растворяется в воде, но соленую воду нельзя классифицировать как вещество, поскольку ее состав может варьироваться. Вы можете растворить небольшое или большое количество соли в определенном количестве воды. Смесь представляет собой физическую смесь двух или более компонентов, каждый из которых сохраняет свою индивидуальность и свойства в смеси .Только форма соли изменяется, когда она растворяется в воде. Он сохраняет свой состав и свойства.
Этап
Фаза — это любая часть образца, имеющая однородный состав и свойства. По определению, чистое вещество или гомогенная смесь состоит из одной фазы. Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а образуют два отдельных слоя. Каждый из слоев называется фазой.
Пример \ (\ PageIndex {1} \)
Обозначьте каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- фильтрованный чай
- свежевыжатый апельсиновый сок
- компакт-диск
- оксид алюминия, белый порошок с соотношением атомов алюминия и кислорода 2: 3
- селен
Дано : химическое вещество
Запрошено : его классификация
Стратегия:
- Определите, является ли вещество химически чистым.Если оно чистое, это либо элемент, либо соединение. Если вещество можно разделить на элементы, это соединение.
- Если вещество не является химически чистым, это либо гетерогенная смесь, либо гомогенная смесь. Если его состав однороден во всем, это однородная смесь.
Решение:
- A) Чай представляет собой раствор соединений в воде, поэтому он не является химически чистым. Обычно его отделяют от чайных листьев фильтрацией.
B) Поскольку состав раствора однороден повсюду, это однородная смесь . - A) Апельсиновый сок содержит твердые частицы (мякоть), а также жидкость; он не является химически чистым.
B) Апельсиновый сок, потому что его состав неоднороден, представляет собой гетерогенную смесь . - A) Компакт-диск — это твердый материал, содержащий более одного элемента, с видимыми по краю участками разного состава.Следовательно, компакт-диск не является химически чистым.
B) Области разного состава указывают на то, что компакт-диск представляет собой гетерогенную смесь. - A) Оксид алюминия представляет собой простое химически чистое соединение .
- A) Селен — один из известных элементов .
Упражнение \ (\ PageIndex {1} \)
Обозначьте каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- белое вино
- ртуть
- заправка для салата в стиле ранчо
- сахар столовый (сахароза)
- Ответ a:
- гомогенная смесь (раствор)
- Ответ b:
- элемент
- Ответ c:
- гетерогенная смесь
- Ответ d:
- соединение
Пример \ (\ PageIndex {2} \)
Как химик классифицирует каждый образец материи?
- морская вода
- почва
- вода
- кислород
РЕШЕНИЕ
- Соленая вода действует как единое целое, даже если содержит два вещества — соль и воду.Морская вода — это однородная смесь или раствор.
- Почва состоит из небольших кусочков различных материалов, поэтому представляет собой неоднородную смесь.
- Вода — это вещество; более конкретно, поскольку вода состоит из водорода и кислорода, она представляет собой соединение.
- Кислород, вещество, это элемент.
Упражнение \ (\ PageIndex {2} \)
Как химик классифицирует каждый образец материи?
- кофе
- водород
- яйцо
- Ответ a:
- однородная смесь (раствор), предположим, это фильтрованный кофе
- Ответ b:
- элемент
- Ответ c:
- гетерогенная смесь.
Сводка
Вещество можно разделить на две большие категории: чистые вещества и смеси. Чистое вещество — это форма вещества, имеющая постоянный состав и постоянные свойства во всем образце. Смеси представляют собой физические комбинации двух или более элементов и / или соединений. Смеси можно разделить на однородные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения — это вещества, состоящие из более чем одного типа атомов.Элементы — это простейшие вещества, состоящие только из одного типа атомов.
Ключевые выводы
- Чистые вещества состоят из одного элемента или соединений.
- Комбинации различных веществ называются смесями.
- Гомогенные смеси — это смеси двух или более соединений (или элементов), которые не визуально отличимы друг от друга.
- Гетерогенные смеси — это смеси двух или более соединений (или элементов), которые визуально отличимы друг от друга.
научных игр о чистых веществах | Легенды обучения
В этой серии игр ваши ученики узнают о свойствах чистых веществ и о том, что отличает их от других веществ. Цель обучения Pure Substances — основанная на NGSS и государственных стандартах — обеспечивает повышение вовлеченности учащихся и академической успеваемости в вашем классе, как показали исследования.
Прокрутите вниз, чтобы ознакомиться с играми с этой целью обучения и концепциями, которые они воплощают в жизнь.
Охваченные концепции
Вещества, состоящие из одного типа атомов или молекул, называются чистыми веществами. Они отличаются от смесей, которые представляют собой комбинацию нескольких типов атомов или молекул, которые химически не соединены.
Некоторые чистые вещества встречаются в природе, например, вода, кислород и сахар. Другие, например нейлон, являются синтетическими.
Чистые вещества обладают различными химическими и физическими свойствами, одинаковыми для каждого образца вещества.К ним относятся плотность, цвет, запах, растворимость, состояние вещества при комнатной температуре и многое другое.
Мы можем наблюдать и измерять эти свойства с помощью различных научных инструментов, таких как термометры, весы, горелки, магниты, градуированные цилиндры, другие химические вещества и многое другое.
Предварительный просмотр каждой игры в обучающей цели приведен ниже.
Вы можете получить доступ ко всем играм Legends of Learning бесплатно, навсегда, с учетной записью учителя. Бесплатная учетная запись учителя также позволяет создавать плейлисты с играми и заданиями для учащихся и отслеживать успеваемость в классе.Зарегистрируйтесь сегодня бесплатно!
Теги:
чистое вещество, химическое вещество, состояние вещества, соединение, смесь, гетерогенный, гомогенный, раствор, масса, вес, атом, молекула, частица, элемент
В чем разница между чистыми веществами и смесями?
Чистое вещество состоит только из этого вещества и не может быть разделено на какие-либо другие вещества.Смесь можно разделить на два или более чистых вещества. В то время как чистые вещества имеют четко определенные физические и химические свойства, смеси имеют разные свойства в зависимости от пропорций чистых веществ в каждой смеси и от места в смеси.
Чистые вещества могут быть элементами, состоящими исключительно из одного вида атомов, или они могут быть соединениями, состоящими из молекул, включающих два или более элементов. Смеси могут быть однородными или неоднородными в зависимости от того, насколько хорошо смешаны компоненты.Однородные смеси имеют одинаковый вид и характеристики во всей смеси. Гетерогенные смеси более грубые с обнаруживаемыми вариациями внешнего вида и свойств в различных частях смеси
TL; DR (слишком долго; не читал)
Чистые вещества состоят из одного вида материалов с одинаковыми свойствами, а смеси состоят из двух или более чистых веществ, каждое из которых имеет разные свойства. В результате чистые вещества нельзя разделить на другие материалы, но различные свойства компонентов смесей можно использовать для разделения их на чистые вещества.
Элементы и соединения
Элементы всегда являются чистыми веществами, в то время как соединения представляют собой химические комбинации двух или более элементов, которые также могут быть чистыми. В реальном мире такие вещества, как элементы и соединения, редко бывают чистыми, потому что они обычно загрязнены их контейнерами, окружающей средой или их производством. Теоретически чистый означает без обнаруживаемых примесей. Обычно возможно очистить элементы и соединения до этого стандарта, хотя часто это требует больших усилий.
Соединения состоят из более чем одного чистого вещества, и они отличаются от смесей тем, что их невозможно разделить без химической реакции. Смеси можно разделить с помощью физических процессов, но они не будут разделять соединения.
Если элемент или соединение существует в двух состояниях одновременно, это может быть чистое вещество и смесь одновременно. Например, чистая вода с чистым колотым льдом остается чистым веществом, но это также смесь двух состояний чистого вещества.В виде смеси лед можно отделить от воды физическими средствами, такими как вычерпывание фрагментов льда.
Гомогенные и гетерогенные смеси
Смеси содержат более одного типа атомов или молекул и могут быть разделены с помощью физических методов. В гомогенных смесях частицы смеси настолько мелкие, что кажется, будто смесь состоит из одного и того же материала. Для гетерогенных смесей частицы поддаются обнаружению, и свойства смеси различаются в зависимости от того, какая часть смеси исследуется.
Растворы представляют собой типичные гомогенные смеси. Например, раствор соли в воде представляет собой гомогенную смесь, потому что воду и соль можно разделить дистилляцией с получением чистой воды и кристаллической соли. Воздух представляет собой смесь, состоящую в основном из азота и кислорода. Газы можно разделить, охлаждая и сжижая воздух, а затем выпаривая азот, который имеет более низкую температуру кипения, а затем кислород, который кипит при более высокой температуре, чем азот.
Гетерогенные смеси могут быть чем угодно, от хлопьев для завтрака до песка или заправки для салатов.Многие распространенные материалы представляют собой гетерогенные смеси, которые часто можно легко разделить путем фильтрации, механического отделения или использования таких свойств, как вес или магнетизм. Ключевой характеристикой гетерогенных смесей является то, что их свойства варьируются от точки к точке, и это изменение может использоваться для их разделения.
Для любого неизвестного вещества тщательный осмотр обычно показывает, является ли материал неоднородной смесью. Если это не так, это может быть однородная смесь или чистое вещество.Нагревание или охлаждение приведет к тому, что материал либо отделится, поскольку компоненты смеси закипят, либо затвердеют при разных температурах, либо все чистое вещество будет кипеть или замерзать в отдельных точках.
The Central Science, Chapter 1, Section 2
Chemistry: The Central Science, Chapter 1, Section 2
Давайте начнем изучение химии с изучения некоторых фундаментальных способов классификации и описания материи. Два основных способа классификации вещества — в соответствии с его физическим состоянием, как газ, жидкость или твердое тело, и в соответствии с его составом, как элемент, соединение или смесь.
Состояния Материи
Образец вещества может быть газом, жидкостью или твердым телом. Эти три формы материи называются состояниями материи . Состояния вещества различаются некоторыми простыми наблюдаемыми свойствами. Газ (также известный как пар ) не имеет фиксированного объема или формы; скорее, он соответствует объему и форме своего контейнера. Газ можно сжать, чтобы он занимал меньший объем, или он может расшириться, чтобы занять больший объем.Жидкость имеет определенный объем независимо от емкости, но не имеет определенной формы. Он принимает форму той части контейнера, которую занимает. solid имеет как определенную форму, так и определенный объем; это жестко. Ни жидкости, ни твердые тела не могут быть сжаты до сколько-нибудь заметной степени.
Свойства состояний можно понять на молекулярном уровне (рис. 1.4). В газе молекулы далеко друг от друга и движутся с большой скоростью, неоднократно сталкиваясь друг с другом и со стенками контейнера.В жидкости молекулы более плотно упакованы вместе, но все же движутся быстро, позволяя им скользить друг по другу; таким образом, жидкости легко переливаются. В твердом теле молекулы крепко удерживаются вместе, обычно в определенном порядке, в котором молекулы могут лишь слегка покачиваться в своих фиксированных положениях. Таким образом, твердые тела имеют жесткую форму.
Рис. 1.4 Три физических состояния воды являются общими и знакомыми нам: водяной пар, жидкая вода и лед.Мы не видим водяного пара. Когда мы смотрим на пар или облака, мы видим крошечные капельки жидкой воды, рассеянные в атмосфере. Молекулярные изображения на этом рисунке показывают, что молекулы в твердом теле расположены более упорядоченно, чем в жидкости. Молекулы в газе намного дальше друг от друга, чем в жидкости или твердом теле.
Чистые вещества и смеси
Большинство форм материи, с которыми мы сталкиваемся, например, воздух, которым мы дышим (газ), бензин для автомобилей (жидкость) и тротуар, по которому мы идем (твердое тело), не являются химически чистыми.Однако мы можем разделить или разделить эти виды материи на разные чистые вещества. Чистое вещество (обычно называемое просто веществом ) — это вещество, которое имеет фиксированный состав и различные свойства. Например, вода и обычная поваренная соль (хлорид натрия), основные компоненты морской воды, являются чистыми веществами.
Мы можем классифицировать вещества как элементы или соединения. Элементы — это вещества, которые нельзя разложить на более простые вещества.Каждый элемент состоит только из одного вида атомов [Рис. 1.5 (a и b)]. Соединения , напротив, состоят из двух или более элементов и, таким образом, содержат атомы двух или более типов [Рис. 1.5 (c)].
Рисунок 1.5 Каждый элемент содержит уникальный вид атома. Элементы могут состоять из отдельных атомов, как в (а), или молекул, как в (б). Соединения содержат два или более разных атома, соединенных или связанных вместе, как в (c). Смесь содержит отдельные единицы своих компонентов, показанные на (d) как атомы и молекулы.
Большая часть вещества, с которым мы сталкиваемся, состоит из смесей различных веществ. Смеси — это комбинации двух или более веществ, в которых каждое вещество сохраняет свою химическую идентичность и, следовательно, свои свойства [Рисунок 1.5 (d)]. В то время как чистые вещества имеют фиксированный состав, состав смесей может варьироваться. Например, чашка подслащенного кофе может содержать либо немного сахара, либо много. Вещества, составляющие смесь (например, сахар и вода), называются компонентами смеси.
Некоторые смеси, такие как песок, камни и древесина, не имеют одинакового состава, свойств и внешнего вида во всей смеси. Такие смеси гетерогенные [Рисунок 1.6 (а)]. Смеси, однородные по всей поверхности, составляют 90–150 однородных смесей. Воздух представляет собой однородную смесь газообразных веществ азота, кислорода и меньшего количества других веществ. Азот в воздухе обладает всеми свойствами чистого азота, потому что и чистое вещество, и смесь содержат одни и те же молекулы азота.Соль, сахар и многие другие вещества растворяются в воде с образованием гомогенных смесей [Рис. 1.6 (b)]. Гомогенные смеси также называют растворами . Воздух — газообразный раствор; бензин — жидкий раствор; латунь — твердый раствор.
Рисунок 1.7 обобщает классификацию веществ на смеси, соединения и элементы. Различие между физическими и химическими изменениями рассматривается в разделе 1.3.
Рисунок 1.7 Схема классификации материи. На химическом уровне все вещества в конечном итоге классифицируются как элементы или соединения.
Разделение смесей
Поскольку каждый компонент смеси сохраняет свои свойства, мы можем разделить смесь на ее компоненты, воспользовавшись различиями в их свойствах. Например, неоднородную смесь железных и золотых опилок можно индивидуально отсортировать по цвету на железо и золото.Более разумным подходом было бы использовать магнит, чтобы притягивать железные опилки, оставляя золотые позади. Мы также можем воспользоваться важным химическим различием между этими двумя металлами: многие кислоты растворяют железо, но не растворяют золото. Таким образом, если мы поместим нашу смесь в подходящую кислоту, железо растворится, а золото останется. Затем эти два элемента можно разделить фильтрацией , процедурой, показанной на Рисунке 1.8. Нам пришлось бы использовать другие химические реакции, о которых мы узнаем позже, чтобы преобразовать растворенное железо обратно в металл.
Подобным образом мы можем разделить гомогенные смеси на составляющие. Например, вода имеет гораздо более низкую температуру кипения, чем поваренная соль; больше летучих. Если кипятить раствор соли и воды, более летучая вода испаряется, а соль остается. Водяной пар снова переходит в жидкую форму на стенках конденсатора (рис. 1.9). Этот процесс называется дистилляцией .
Рисунок 1.9 Простое устройство для разделения раствора хлорида натрия (соленой воды) на компоненты. Кипячение раствора испаряет воду, которая конденсируется, затем собирается в приемной колбе. После того, как вся вода выкипела, в колбе для кипячения остается чистый хлорид натрия.
Различная способность веществ прилипать к поверхностям различных твердых тел, таких как бумага и крахмал, также может использоваться для разделения смесей. Это основа хроматографии (буквально «запись цветов»), техники, которая может дать прекрасные и впечатляющие результаты.Пример хроматографического разделения чернил показан на рисунке 1.10.
Элементы
В настоящее время известно 112 элементов. (В 1999 году ученые впервые сообщили о производстве и обнаружении элементов 114, 116 и 118, поэтому это число, вероятно, изменится!) Эти элементы широко различаются по своему содержанию, как показано на рисунке 1.11. Например, более 90 процентов земной коры состоит всего из пяти элементов: кислорода, кремния, алюминия, железа и кальция.Напротив, всего три элемента (кислород, углерод и водород) составляют более 90 процентов массы человеческого тела.
Рис. 1.11 Элементы в процентах по массе в (а) земной коре (включая океаны и атмосферу) и (б) в теле человека.
Некоторые из наиболее известных элементов перечислены в Таблице 1.2 вместе с химическими сокращениями — или химическими символами — которые мы используем для их обозначения. Все известные элементы и их символы перечислены на лицевой стороне внутренней обложки текста.Таблица, в которой символы каждого элемента заключены в рамку, называется периодической таблицей . В периодической таблице элементы расположены в вертикальных столбцах, так что тесно связанные элементы сгруппированы вместе. Мы опишем этот важный инструмент более подробно в разделе 2.4.
Обратите внимание, что символ для каждого элемента состоит из одной или двух букв, причем первая буква заглавная. Эти символы часто являются производными от английского названия элемента (первый и второй столбцы в таблице 1.2), но иногда они происходят от иностранного имени (третий столбец). Вам нужно будет знать эти символы и выучить другие по мере того, как мы встречаемся с ними в тексте.
Соединения
Большинство элементов могут взаимодействовать с другими элементами с образованием соединений. Например, газообразный водород сгорает в газообразном кислороде с образованием воды. И наоборот, можно разложить воду на составляющие ее элементы, пропустив через воду электрический ток, как показано на рисунке 1.12. Как видно из таблицы 1.3, свойства воды не имеют ничего общего со свойствами составляющих ее элементов. Кроме того, состав воды не меняется. Чистая вода, независимо от ее источника, состоит из 11 процентов водорода и 89 процентов кислорода по массе. Этот макроскопический состав воды соответствует ее молекулярному составу, который состоит из двух атомов водорода в сочетании с одним атомом кислорода.
Рис. 1.12 Разложение воды на водород и кислород при пропускании через нее постоянного электрического тока.
Наблюдение, что элементный состав чистого соединения всегда один и тот же, известно как закон постоянного состава (или закон определенных пропорций ). Впервые он был предложен французским химиком Жозефом Луи Прустом (1754-1826) примерно в 1800 году. Хотя этот закон известен уже почти 200 лет, среди некоторых людей сохраняется общее убеждение, что существует фундаментальное различие между соединениями, полученными в лаборатории. и соответствующие соединения, встречающиеся в природе.Однако чистое соединение имеет одинаковый состав и свойства независимо от его источника. И химики, и природа должны использовать одни и те же элементы и действовать в соответствии с одними и теми же законами природы. Когда два материала различаются по составу и свойствам, мы знаем, что они состоят из разных соединений или различаются по чистоте.
Чистые вещества и смеси | Хорошая наука
Цель обучения
В этом уроке мы узнаем, как материя классифицируется на основе ее макроскопических и микроскопических свойств.
Результаты обучения
По окончании этого урока вы сможете:
- Определите материю и объясните, как она состоит из частиц.
- Различают чистое вещество и смесь.
- Различают однородную смесь и гетерогенную смесь.
- Объясните, как можно наблюдать материю на макроскопическом и микроскопическом уровне.
- Различают растворы, коллоиды и грубые смеси.
(Изображение: Devanath, Pixabay)
Краткое содержание урока
- Материя — это все, что занимает пространство и имеет массу.
- Вещество можно разделить на чистые вещества и смеси.
- Чистые вещества состоят из частиц одного типа и не могут быть физически разделены на другие вещества.
- Смеси состоят из более чем одного типа частиц и могут быть физически разделены на другие вещества.
- Смеси можно разделить на однородные и гетерогенные.
- Гомогенные смеси состоят из одной фазы и имеют однородный состав.
- Гетерогенные смеси состоят из двух или более фаз и не имеют однородного состава.
- Растворы — это смеси, однородные на макроскопическом и микроскопическом уровне.
- Грубые смеси — это смеси, неоднородные на макроскопическом и микроскопическом уровне.
- Коллоиды — это смеси, гомогенные на макроскопическом уровне, но гетерогенные на микроскопическом уровне.
- Коллоиды можно отличить от растворов, поскольку они непрозрачны, тогда как растворы прозрачны; коллоиды также могут превращаться в разные фазы, тогда как растворы — нет.
Щелкните изображение, чтобы просмотреть таблицу для этого урока.
Щелкните изображение, чтобы просмотреть практический эксперимент для этого урока.
Щелкните изображение, чтобы просмотреть Учебное пособие по химии для 7-го класса (версия PDF).
Щелкните изображение, чтобы просмотреть Учебное пособие по химии для 7-го класса (версия для печати).
Щелкните изображение, чтобы просмотреть заметки об уроке химии для 7-го класса.
Является ли соединение чистым веществом? Labmate Online
В научном контексте «чистый» означает один тип материала.Якобы соединения содержат более одного типа материалов. Однако и соединения, и элементы считаются чистыми веществами. Чистые соединения создаются, когда элементы постоянно соединяются, образуя одно вещество. Например, когда элементы ртути и кислорода соединяются и происходит химическая реакция, образуется оксид ртути (II). После образования оксида ртути (II) невозможно отделить друг от друга ртуть и кислород, использованные при его создании.
С другой стороны, смеси считаются нечистыми веществами.Смесь образуется, когда вещества соединяются, но химической реакции не происходит. В общем, смесь может быть разделена на ее исходные компоненты, а чистое соединение — нет.
Конечно, есть несколько исключений из приведенного выше определения. Силикатные минералы, например, не имеют химически связанных формул. Впоследствии силикатные минералы стали называть «нестехиометрическими соединениями». Эти нестехиометрические соединения образуют земную кору.
Чем отличаются чистые соединения, смеси и элементы?
Чистые соединения и элементы отличаются от смесей одним ключевым моментом: вещества в чистом соединении удерживаются вместе химическими связями.Эти химические связи нельзя разорвать. Поскольку они содержат только одно вещество, элементы не могут быть разложены обычными химическими методами, такими как нагревание.
Смесь может содержать ряд чистых соединений, которые можно отделить друг от друга обычными химическими методами. В статье «От сырой смеси к чистому соединению — упрощенная автоматическая очистка» более подробно обсуждается процесс очистки.
Как образуются чистые соединения?
Химические соединения — это чистые вещества, содержащие два или более химических элемента.Химические соединения обладают уникальной структурой; они скрепляются определенным образом химическими связями. Различные типы химических связей включают ионные связи (которые находятся в солях), металлические связи (которые находятся в металлах) и ковалентные связи (которые находятся в молекулярных соединениях).
Химические связи образуются и разрушаются в ходе химических реакций. Когда реактивные элементы вступают в контакт друг с другом, они объединяются — иногда довольно драматично — в соединение.Во время химической реакции две или более химических молекул взаимодействуют и изменяются. Возьмем, к примеру, стальной мусорный бак: когда железо в мусорном ведре взаимодействует с кислородом в атмосфере, происходит химическая реакция и образуется вещество, которое мы называем «ржавчиной».
В контексте химической реакции процесс начинается с реагентов и заканчивается продуктами (часто новыми химическими соединениями). Разложение, кислотно-основное действие и синтез — три примера различных типов химической реакции.

 момент
момент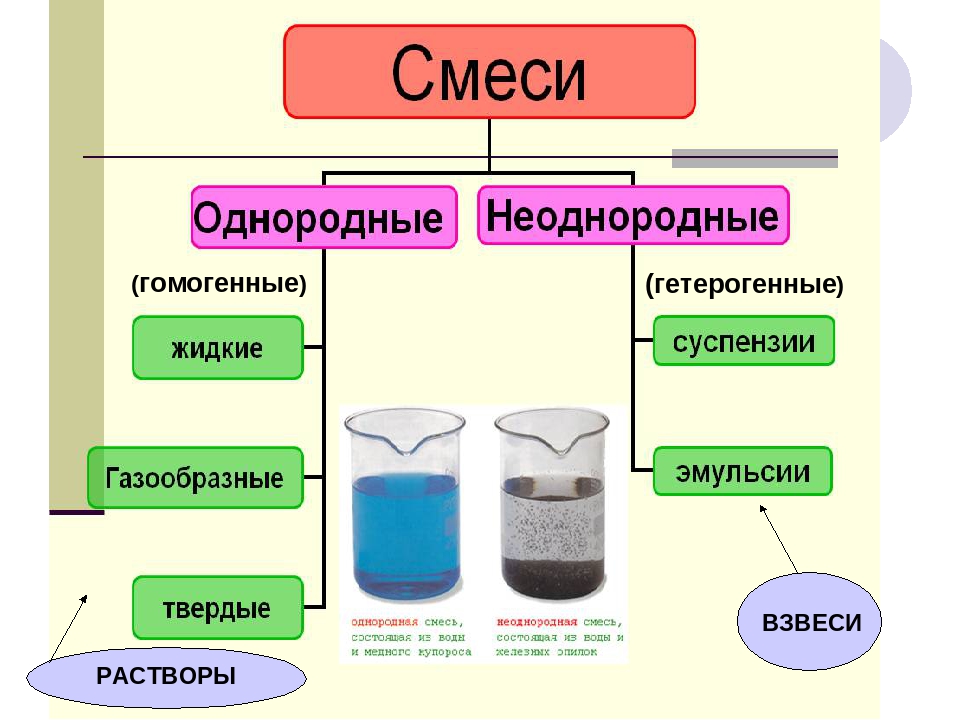




 В лаборатории это можно сделать с помощью делительной воронки. Нефть
В лаборатории это можно сделать с помощью делительной воронки. Нефть В качестве фильтров можно в домашних условиях использовать различные пористые
В качестве фильтров можно в домашних условиях использовать различные пористые
