Содержание
Хром
|
Хром / Chromium (Cr) | |
|---|---|
|
Атомный номер |
24 |
|
Внешний вид простого вещества |
твёрдый металл голубовато-белого цвета |
|
Свойства атома | |
|
Атомная масса (молярная масса) |
51,9961 а. е. м. (г/моль) |
|
Радиус атома |
130 пм |
|
Энергия ионизации (первый электрон) |
652,4 (6,76) кДж/моль (эВ) |
|
Электронная конфигурация |
[Ar] 3d5 4s1 |
|
Химические свойства | |
|
Ковалентный радиус |
118 пм |
|
Радиус иона |
(+6e)52 (+3e)63 пм |
|
Электроотрицательность (по Полингу) |
1,66 |
|
Электродный потенциал |
-0. 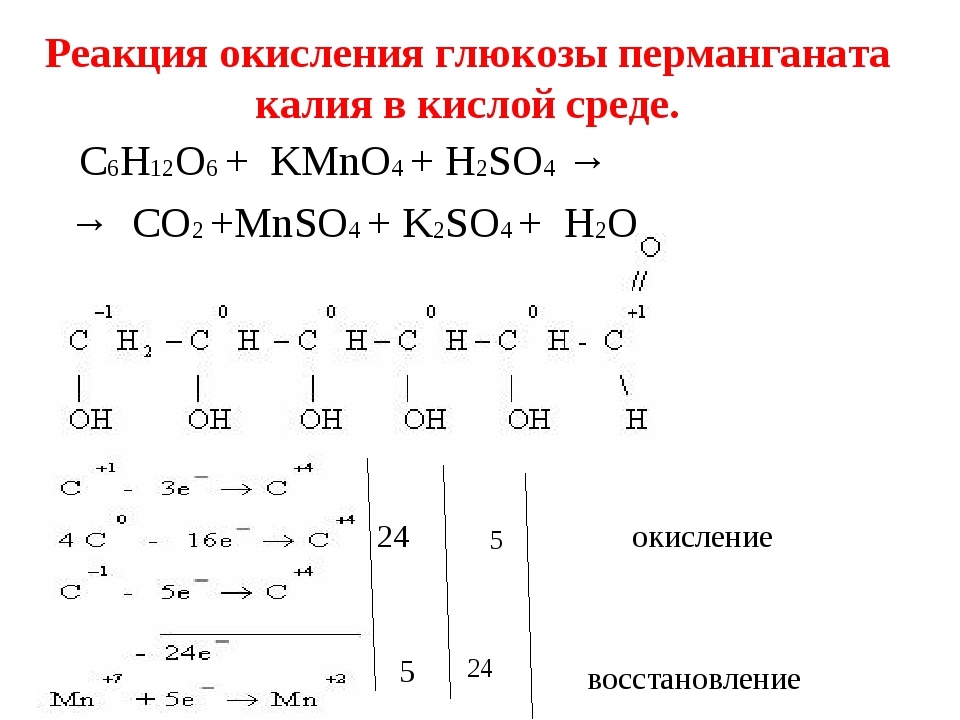 74 74 |
|
Степени окисления |
6, 3, 2, 0 |
|
Термодинамические свойства простого вещества | |
|
Плотность |
7,18 г/см³ |
|
Молярная теплоёмкость |
23,3 Дж/(K·моль) |
|
Теплопроводность |
93,9 Вт/(м·K) |
|
Температура плавления |
2130 K |
|
Теплота плавления |
21 кДж/моль |
|
Температура кипения |
2945 K |
|
Теплота испарения |
342 кДж/моль |
|
Молярный объём |
7,23 см³/моль |
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
кубическая объёмноцентрированая |
|
Параметры решётки |
2,885 Å |
|
Отношение c/a |
— |
|
Температура Дебая |
460 K |
|
Cr |
24 |
|
51,9961 | |
|
[Ar]3d54s1 | |
|
Хром | |
Хром —элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 24. Обозначается символом Cr (Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
И. Менделеева, атомный номер 24. Обозначается символом Cr (Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
История
Схема атома хрома
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего Воклен получил карбид хрома).
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Добыча
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 млн. т (или 1 место в мире)
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Из него получают феррохром восстановлением в электропечах коксом (углеродом):
-
FeO · Cr2O3 + 4C → Fe + 2Cr + 4CO↑
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата углём:
-
Na2Cr2O7 + 2C → Cr2O3 + Na2CO3 + CO↑
5) с помощью алюминотермии получают металлический хром:
-
Cr2O3+ 2Al → Al2O3 + 2Cr + 130 ккал
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
При этом на катодах совершаются в основном 3 процесса:
-
восстановление шестивалентного хрома до трехвалентного с переходом его в раствор; -
разряд ионов водорода с выделением газообразного водорода; -
разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
-
Cr2O72− + 14Н+ + 12е− = 2Cr + 7H2O
Физические и химические свойства
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
Хром является самым твердым металлом (твердость по шкале Мооса 8.5).
Устойчив на воздухе. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами. Сплавляя Cr2O3 со щелочами получают хромиты:
Сплавляя Cr2O3 со щелочами получают хромиты:
-
Cr2O3 + 2NaOH → 2NaCrO2 + H2O.
Непрокаленный оксид хрома(III) легко растворяется в щелочных растворах и в кислотах:
-
Cr2O3 + 6HCl → 2CrCl3 + 3Н2О.
При термическом разложении карбонила хрома Cr(СО)6 получают красный основной оксид хрома(II) CrO. Коричневый или желтый гидроксид Cr(OH)2 со слабоосновными свойствами осаждается при добавлении щелочей к растворам солей хрома(II).
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
При взаимодействии концентрированной серной кислоты с растворами дихроматов образуются красные или фиолетово-красные кристаллы оксида хрома(VI) CrO3. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие.
Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие.
Известны галогениды, соответствующие разным степеням окисления хрома. Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2 и тригалогениды CrF3, CrCl3, CrBr3 и CrI3. Однако, в отличие от аналогичных соединений алюминия и железа, трихлорид CrCl3 и трибромид CrBr3 хрома нелетучи.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах. Известен гексафторид хрома CrF6.
Получены и охарактеризованы оксигалогениды хрома CrO2F2 и CrO2Cl2.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
В растворах наиболее устойчивы соединения хрома(III). В этой степени окисления хрому соответствуют как катионная форма, так и анионные формы, например, существующий в щелочной среде анион [Cr(OH)6]3−.
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
-
2Na3[Cr(OH)6] + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O.
Хрому(VI) отвечает ряд существующих только в водных растворах кислот: хромовая H2CrO4, дихромовая H2Cr2O7, трихромовая H3Cr3O10 и другие, которые образуют соли — хроматы, дихроматы, трихроматы и т. д.
В зависимости от кислотности среды анионы этих кислот легко превращаются друг в друга. Например, при подкислении жёлтого раствора хромата калия K2CrO4 образуется оранжевый дихромат калия K2Cr2O7:
-
2K2CrO4 + 2HCl → K2Cr2O7 + 2KCl + Н2О.
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат калия K2CrO4:
-
K2Cr2O7 + 2KOH → 2K2CrO4 + Н2О.
При добавлении к жёлтому раствору, содержащему хромат-ионы, раствора соли бария выпадает жёлтый осадок хромата бария BaCrO4:
-
Ba2+ + CrO42- → BaCrO4↓.
Соединения хрома(VI) — сильные окислители, например:
-
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O.
Применение
Хром важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Металлический хром практически нетоксичен, но металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м³.
Соединения хрома
Хромтау
Подгруппа хрома
Подгруппа хрома — побочная подгруппа VI группы
Свойства элементов подгруппы хрома
|
Атомный
|
Название
|
Электронная
|
r
|
t°пл.
|
t°кип.
|
ЭО
|
Атомный
|
Степень
|
|
24
| Хром Cr | [Ar] 3d54s1 |
7,2
|
1857
|
2672
|
1,56
|
0,125
|
+1,+2,+3,
|
|
42
| Молибден Mo | [Kr] 4d55s1 |
10,2
|
2610
|
2560
|
1,3
|
0,135
|
+1,+2,+3,
|
|
74
| Вольфрам W | [Xe] 4f145d46s2 |
19,3
|
3410
|
5660
|
1,4
|
0,141
|
+1,+2,+3,
|
Физические свойства
Блестящие, сероватого цвета металлы. С увеличением атомного номера растут температуры плавления и кипения.
С увеличением атомного номера растут температуры плавления и кипения.
Вольфрам — самый тугоплавкий из известных металлов.
Химические свойства
В ряду Cr – Mo – W химическая активность падает.
С увеличением степени окисления элементов у их оксидов и гидроксидов законо-мерно происходит ослабление основных свойств и усиление кислотных. Высшим оксидам RO3 соответствуют кислоты h3RO4.
В том же направлении происходит усиление окислительных свойств соединений.
Хром и его соединения
Получение
1. Алюминотермия: Cr2O3 + 2Al ® Al2O3 + 2Cr
2. Восстановлением оксидов оксидом углерода (II).
3. Электролизом водных растворов соединений хрома.
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 –t°® 2Cr2O3
2Cr + 3Cl2 –t°® 2CrCl3
2Cr + N2 –t°® 2CrN
2Cr + 3S –t°® Cr2S3
В раскалённом состоянии реагирует с парами воды:
2Cr + 3h3O « Cr2O3 + 3h3
Хром растворяется в разбавленных сильных кислотах (HCl, h3SO4)
В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl ® CrCl2 + h3
2Cr + 6HCl + O2 ® 2CrCl3 + 2h3O + h3
Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
Соединения двухвалентного хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl ® CrCl2 + 2h3O
Соединения хрома (II) — сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl ® 2CrCl3 + h3
4Cr(OH)2 + O2 + 2h3O ® 4Cr(OH)3
Соединения трёхвалентного хрома
Оксид хрома (III) Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH)3 –t°® Cr2O3 + 3h3O
4K2Cr2O7 –t°® 2Cr2O3 + 4K2CrO4 + 3O2
(Nh5)2Cr2O7 –t°® Cr2O3 + N2+ 4h3O
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + 2NaOH ® 2NaCrO2 + h3O
Cr2O3 + Na2CO3 ® 2NaCrO2 + CO2
Cr2O3 + 6KHSO4 ® Cr2(SO4)3 + 3K2SO4 + 3h3O
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
2Cr2O3 + 4KOH + KClO3 ® 2K2Cr2O7(дихромат калия) + KCl + 2h3O
Гидроксид хрома (III) Cr(OH)3 — нерастворимое в воде вещество зелёного цвета.
Cr2(SO4)3 + 6NaOH ® 2Cr(OH)3¯ + 3Na2SO4
Обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3h3SO4 ® Cr2(SO4)3 + 6h3O
Cr(OH)3 + KOH ® K[Cr(OH)4]
(или, упрощая, Cr(OH)3 + KOH ® KCrO2(хромат калия) + 2h3O)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr+3Cl3 ® 2Cr+2Cl2 + ZnCl2
2Cr+3Cl3 + 16NaOH + 3Br2 ® 6NaBr + 6NaCl + 8h3O + 2Na2Cr+6O4
Соединения шестивалентного хрома
Оксид хрома (VI) CrO3 — ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и h3SO4(конц.).
K2CrO4 + h3SO4 ® CrO3 + K2SO4 + h3O
K2Cr2O7 + h3SO4 ® 2CrO3 + K2SO4 + h3O
CrO3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH ® K2CrO4 + h3O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + h3SO4 ® K2Cr2O7 + K2SO4 + h3O
В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH ® 2K2CrO4 + h3O
кислая среда
2CrO42- + 2H+
¬––––––––––––
––––––––––––®
Cr2O72- + h3O
щелочная среда
Все соединения хрома (VI) — сильные окислители.
4CrO3 + 3S ® 3SO2 + 2Cr2O3
keepslide.com — СОЕДИНЕНИЯ ХРОМА
Составитель: И.Н…. | Facebook
СОЕДИНЕНИЯ ХРОМА
Составитель: И.Н. Пиялкина, учитель химии МБОУ СОШ №37 города Белово
Соединения хрома
Соединения хрома(II)
Соединения хрома(III)
Соединения хрома(VI)
CrO –основный оксидCr(OH)2-основание
CrO3-кислотный оксидh3CrO4-хромоваяh3Cr2O7-дихромовая кислоты
Cr2O3-амфотерный оксидCr(OH)3-амфотерный гидроксид
CrO
Оксид хрома (II) – кристаллы черного цвета,имеет основный характер
При осторожном нагревании гидроксида хрома (II) в отсутствии кислорода получают оксид хрома (II). Составьте уравнение реакции.
Cr(OH)2 = CrO + h3O
3CrO = Cr + Cr2O3
При более высоких температурах оксид хрома (II) диспропорционирует:
700°
Соединения хрома (II)
Оксида хрома (II) реагирует с соляной и серной кислотами. Рассмотрите реакции с точки зрения ТЭД.
CrO + h3SO4 = CrSO4 + h3O
CrO + 2H+ + Cl– = Cr2+ + 2Cl– + h3O
CrO + 2H+ = Cr2+ + h3O
CrO + 2HCl = CrCl2 + h3O
CrO + 2H+ + SO42– = Cr2+ + SO42– + h3O
CrO + 2H+ = Cr2+ + h3O
Оксид хрома (II) – сильный восстановитель. Кислородом воздуха окисляется до оксида хрома (III)
Кислородом воздуха окисляется до оксида хрома (III)
Cr+2O + O20 > Cr2+3O3–2
Cr+2 – 1e > Cr+3 4O20 + 4e > 2O–2 1
4CrO + O2 = 2Cr2O3
CrO (за счет Cr+2) – восстановитель, процесс окисления O2 – окислитель, процесс восстановления
Cr(OH)2
Гидроксид хрома (II)
Гидроксид хрома (II) получают в виде желтого осадка действием растворов щелочей на соли хрома (II) без доступа воздуха.
CrCl2 + 2NaOH = Cr(OH)2 v + 2NaCl
Cr2+ + 2Cl– +2Na+ +2OH– = Cr(OH)2 v+ 2Na+ +2Cl–
Cr2+ + 2OH– = Cr(OH)2 v
Гидроксид хрома (II) обладает основными свойствами
Cr(OН)2 + 2HCl = CrCl2 + 2h3O
Cr(OН)2 + 2H+ + 2Cl– = Cr2+ + 2Cl– + 2h3O
Cr(OН)2 + 2H+ = Cr2+ + 2h3O
Гидроксид хрома (II) – сильный восстановительКислородом воздуха окисляется до гидроксида хрома (III)
Cr+2(ОН)2+ O20 + Н2О > Cr+3(O –2Н)3
Cr+2 – 1e > Cr+3 4O20 + 4e > 2O–2 1
4Cr(OН)2 + O2 + 2Н2О = 4Cr(OН)3
Cr(OН)2 (за счет Cr+2) –восстановитель, процесс окисления O2 – окислитель, процесс восстановления
Соли хрома (II)
Водные растворы солей хрома (II) получают без доступа воздуха растворением металлического хрома в разбавленных кислотах в атмосфере водорода или восстановлением цинкомв кислой среде солей трехвалентного хрома.
В лабораторных условиях термическим разложением дихромата аммония:
(Nh5)2Cr2O7 = Cr2O3 + N2 + 2h3O
В промышленности восстановлением дихромата калия коксом или серой:
K2Cr2O7 + 3C = 2Cr2O3 + 2K2CO3 + CO2
K2Cr2O7 + S = 2Cr2O3 + K2SO4
t°
t°
t°
Соединения хрома (III)
Оксид хрома (III) обладает амфотерными свойствами При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение реакции оксида хрома (III) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЭД.
Cr2O3 + 6HCl = 2CrCl3 + 3h3O
Cr2O3 + 6H+ + 6Cl– = 2Cr3+ + 6Cl– + 3h3O
Cr2O3 + 6H+ = 2Cr3+ + 3h3O
При сплавлении оксида хрома (III) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуютсяхромиты:
Сr2O3 + Ba(OH)2 = Ba(CrO2)2 + h3O
Сr2O3 + Na2CO3 = 2NaCrO2 + CO2
t°
t°
Оксид хрома (III) нерастворим в воде.
В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель и переходит в хромат:
Cr2O3 + KOH + KMnO4 > K2CrO4 + MnO2 + h3O
Рассмотрите эти реакции как окислительно-восстановительныеРасставьте коэффициенты.
Cr2O3 + KOH +Сa(ClO)2 > K2CrO4 + CaCl2 + h3O
Cr2O3 + O2 + Na2CO3 > Na2CrO4 + CO2
Cr2O3 + KClO3 + Na2CO3 > Na2CrO4 + KCl + CO2
Cr2O3+NaNO3 + Na2CO3>Na2CrO4 +NaNO2 + CO2
Оксид хрома (III) – катализатор В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида азота, который в избытке кислорода окисляется до бурого диоксида азота.
Каталитическое окисление этанола Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома (III) Реакция окисления спирта протекает с выделением энергии. Продукт реакции окисления спирта — уксусный альдегид.
Cr2O3, t°
2СН3–СН2–ОН +О2 2СН3 – С = О +2h3O
H
Гидроксид хрома (III)
Cr(OH)3
Получают гидроксид хрома (III) действиемрастворов щелочей или аммиака на растворы солей хрома (III).
Составьте уравнение реакции получения Cr(OH)3 действием раствора аммиака на хлорид хрома (III):
CrCl3 + 3(Nh4·h3O) = Cr(OH)3 + 3Nh5Cl
Лабораторный опыт № 1
К раствору хлорида хрома (III) прилейте раствор аммиака. Что наблюдаете?
Что наблюдаете?
Лабораторный опыт № 2
Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте раствор соляной кислоты, а к другой – щелочь. Что происходит? Какими свойствами обладает гидроксид хрома (III)?
Cr(OH)3
CrCl3
Na3[Cr(OH)6]
NaOH
HCl
+h3SO4
+NaOH
Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте серной кислоты, а к другой – щелочь. Что происходит?
Гидроксид хрома (III) обладает амфотерными свойствами.При взаимодействии с кислотами образуются соли хрома (III):Составьте уравнение реакции гидроксида хрома (III) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЭД.
Cr(OH)3 + 3HCl = CrCl3 + 3h3O
Cr(OH)3 + 3H+ + 3Cl– = Cr3+ + 3Cl– + 3h3O
Cr(OH)3 + 3H+ = Cr3+ + 3h3O
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Cr(OH)3 + 3Na+ + 3OH– = 3Na+ + [Cr(OH)6]3–
Cr(OH)3 + 3OH– = [Cr(OH)6]3–
2Cr(OH)3 = Cr2O3 + 3h3O
t°
Гидроксид хрома (III) растворяется в щелочах
При нагревании гидроксид хрома (III) разлагается:
гексагидроксохромат (III) натрия (изумрудно-зеленый)
Соли хрома (III)
Бывают двух видов: CrCl3 — хроматы (III) и хромиты NaCrO2 или гидроксокомплексы Na3[Cr(OH)6]СВОЙСТВА:1. Хроматы (III) в щелочной среде образуют гидроксид хрома(III), который сразу растворяется , образуя гидроксокомплексы.
Хроматы (III) в щелочной среде образуют гидроксид хрома(III), который сразу растворяется , образуя гидроксокомплексы.
CrCl3 + 3KOH (нед.) > Cr(OН)3 + 3KCl
CrCl3 + 6KOH (изб.) > К3[Cr(OH)6] + 3KCl
2. Хромиты устойчивы в щелочной среде, в кислой разрушаются:
NaCrO2 + HCl (нед.) + h3O = Cr(OH)3 + NaCl
NaCrO2 + 4HCl (изб.) = CrCl3 + NaCl + 2h3O
с угольной кислотой
Na3[Cr(OH)6] + 3CO2 = Cr(OH)3 + 3NaHCO3
Соли хрома (III)
3. Взаимный гидролиз: при смешивании солей хрома (III) с растворами сульфидов, сульфитов, карбонатов происходит выпадение осадка гидроксида хрома (III) и выделение газа
Cr2S3 + 6h3O = 2Cr(OH)3 + 3h3S
В водных растворах катион Cr3+ встречается только в виде гидратированного иона [Cr(h3O)6] 3+, которыйпридает раствору сине-фиолетовый цвет.
2CrCl3+3Na2S + 6h3O > 2Cr(OН)3+3Н2S +3NaCl
4. В растворе подвергаются полному гидролизу:
Сульфат хрома (III) образует двойные соли – хромовые квасцыИз смешанного раствора сульфата хрома (III) и сульфата калия кристаллизуется двойная соль – KCr(SO4)2·12h3O сине-фиолетового цвета. .
.
При нагревании выше 250 °C разлагается:
Оксид хрома (VI) CrO3 — хромовый ангидрид, представляет собой темно-красные игольчатые кристаллы.
Соединения хрома (VI)
CrO3 — кислотный оксид
С избытком воды образуется хромовая кислота h3CrO4
CrO3 + Н2O = Н2CrO4
При большой концентрации CrO3 образуется дихромовая кислота Н2Cr2О7
2CrO3 + Н2O = Н2Cr2O7
которая при разбавлении переходит в хромовую кислоту:
Н2Cr2О7 + Н2О = 2Н2CrO4
При растворении в воде образует кислоты.
Эти кислоты – неустойчивые. Существуют только в растворе. Между ними в растворе устанавливается равновесие
2Н2CrO4 — Н2Cr2O7 + Н2O
При взаимодействии CrO3 со щелочами образуются хроматы
CrO3 + 2KOH > K2CrO4 + h3O.
CrO3 является сильным окислителем Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним.
4CrO3 + C2H5OH > 2CO2 + 2Cr2O3+ 3h3O
Если поместить оксид хрома на фарфоровую пластинку и капнуть на него несколько капель ацетона,то через несколько секунд ацетон загорается. При этом оксид хрома (VI) восстанавливается до оксида хрома (III), а ацетон окисляется до углекислого газа и воды.
Окисление ацетона хромовым ангидридом (видео)
16CrO3 +3Ch4– С – Ch4 > 9CO2 + 8Cr2O3 + 9h3O
О
Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7
Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов CrO3; хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет
хроматы – соли хромовой кислоты устойчивы в щелочной среде, при подкислении переходят в оранжевыедихроматы, соли двухромовой кислоты. Реакция обратима, поэтому при добавлении щелочи желтая окраска хромата восстанавливается.
2CrO42– + 2H+ — Cr2O72– + h3O
хроматы
дихроматы
соли
ОН–
Н+
Лабораторный опыт № 3
К раствору дихромата калия добавьте гидроксид калия. Как изменилась окраска? Чем это вызвано? К полученному раствору добавьте серной кислоты до восстановления желтой окраски.
Напишите уравнения реакций.
2K2CrO4 + h3SO4(разб.) = K2Cr2O7 +K2SO4+h3O
K2Cr2O7 + 2KOH = 2K2CrO4 + h3O
2K2CrO4 +2HCl(разб.)= K2Cr2O7 + 2KCl + h3O
2K2CrO4 + h3O + CO2 = K2Cr2O7 + KHCO3
Взаимопревращение хроматов и дихроматов Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7, Хромат калия K2CrO4 и дихромат калия K2Cr2O7 – соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым.2K2CrO4 + h3SO4 = K2Cr2O7 + K2SO4 + h3O В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы. K2Cr2O7 + 2KOH = 2K2CrO4 + h3O
K2Cr2O7 + 2KOH = 2K2CrO4 + h3O
Соединения хрома (VI) – сильные окислители
Cr2O72–
Cr3+
Cr(OH)3
[Cr(OH)6]3–
H+
h3O
OH–
Cr2O72– + 14H+ + 6e > 2Cr3+ + 7h3O
Cr2O72– + 7Н2О + 6e > 2[Cr(OH)6]3– + 2ОН–
Окислительные свойства дихроматов Дихроматы, например дихромат калия K2Cr2O7 – сильные окислители. Под действием восстановителей дихроматы в кислой среде переходят в соли хрома (III). Примером такой реакции может служить окисление сульфита натрия раствором дихромата калия в кислой среде. К раствору дихромата калия добавляем серную кислоту и раствор сульфита натрия.K2Cr2O7+3Na2SO3+4h3SO4=Cr2(SO4)3+3Na2SO4+K2SO4+ 4h3O Оранжевая окраска, характерная для дихроматов, переходит в зеленую. Образовался раствор сульфата хрома (III) зеленого цвета. Соли хрома — ярко окрашены, именно поэтому элемент получил такое название: «хром», что в переводе с греческого означает «цвет, краска».
опыт
1. Zn + K2Cr2O7 +h3SO4 > ZnSO4 + Cr2(SO4)3 +K2SO4 +h3O
2. K2Cr2O7 + h3S +h3SO4 > S + Cr2(SO4)3+K2SO4+h3O
K2Cr2O7 + h3S +h3SO4 > S + Cr2(SO4)3+K2SO4+h3O
3. K2Cr2O7 + h3O2 + h3SO4 >O2 + Cr2(SO4)3 + K2SO4 +h3O
4. K2Cr2O7 + h3O + h3S > S + Cr(OH)3 + KOH
5. K2Cr2O7 + h3O + K2S > S + K3[Cr(OH)6] + KOH
Дихроматы проявляют окислительные свойства не только в растворах, но и в твердом виде:
K2Cr2O7 + S > K2SO4 + Cr2O3
K2Cr2O7 + С > K2СO3 + СО + Cr2O3
K2Cr2O7 + Al > Cr + KAlO2 + Al2O3
Рассмотрите эти реакции как окислительно-восстановительныеРасставьте коэффициенты.
K2Cr2O7 + KOH + (Nh5)2S > S + K3[Cr(OH)6] + Nh4
Дихромат калия (хромпик) широко применяется как окислитель органических соединений:
3С2H5OH + K2Cr2O7 + 4h3SO4 Ch4– CHO + Cr2(SO4)3 + K2SO4 + 7h3O
3С3H7OH + K2Cr2O7 + 4h3SO4 3Ch4– C–Ch4 + Cr2(SO4)3 + K2SO4 + 7h3O ¦ O
Хроматы щелочных металлов плавятся без разложения, а дихроматы при высокой температуре превращаются в хроматы. Дихромат аммония разлагается при нагревании:
Дихромат аммония разлагается при нагревании:
(Nh5)2Cr2O7 Cr2O3 + N2 + 4h3O
180°C
В ряду гидроксидов хрома различных степеней окисления Cr(ОН)2 — Cr(ОН)3 — Н2CrО4 закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловлено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства. Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения хрома (III). Соединения хрома(VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
Степень окисления хромa +2 +3 +6
Оксид CrO Cr2O3 CrO3
Гидроксид Cr(OH)2 Cr(OH)3 h3CrO4 h3Cr2O7
Кислотные и окислительные свойства возрастают
Основные и восстановительные свойства возрастают
Соединения хрома
Домашнее задание:Выполнить ОВР!
Используем презентацию «ОВР по теме «ХРОМ»
СПАСИБО ЗА РАБОТУ!
Начала химии. Современный курс для поступающих в ВУЗы. – М.: 1Федеративная Книготорговая Компания.Химия. Подготовка к ЕГЭ: учебно-методическое пособие / Под ред. В.Н. Доронькина. – Ростов н/Дону: ЛегионХимия. Пособие для поступающих в вузы /О.О. Максименко. – М. : Филол. о-во СЛОВО: Изд-во ЭксмоИнтернет-ресурсы (картинки, видеофрагменты: 1) Единая образовательная коллекция цифровых ресурсов. Химия. Неорганическая химия. Металлы побочных подгрупп. Хром. Видеопыты. http://school-collection.edu.ru/2) Образовательная коллекция Химия для всех XXI Химические опыты со взрывами и без
Поурочный план на тему металлдардын тор өзгерістері
1. Назовите процесс отдачи электронов. A) Окисление B) Разложение C) Восстановление D) Окисление-восстановление
2. Даны реакции, которые могут протекать во время грозы. Выберите вариант процесса, протекающего в молекулах.
24
N2 NO O3 A окисление окисление окисление B окисление окисление восстановление C восстановление восстановление окисление D восстановление восстановление восстановление
3. Выберите утверждения, соотвествующие процессу окисления.
Утверждение 1 Возрастает степень окисления 2 Возрастает количество водорода, уменьшается количество кислорода; 3 Возрастает количество кислорода, уменьшается количество водорода;
Ответ:
4. Процесс ОВР представлен уравнением: K2Cr2O7 + KI + h3SO4 = Cr2(SO4)3 + K2SO4 + I2 + h3O (а) Определите степени окисления элементов в реагентах и продуктах: ______________________________________________________________________________
(b) Определите в составе реагентов вещества, выполняющие роль:
Окислителя ______________________________________________________________________________ Восстановителя________________________________________________________________
(c) Составьте с помощью электронного баланса уравнение: процесса окисления методом полуреакции ______________________________________________________________________________
восстановления методом полуреакции. ______________________________________________________________________________
(d) Составьте полное сбалансированное уравнение реакции, спользуя электронный баланс. ______________________________________________________________________________
(e) Дайте определение окислительно-восстановительному процессу с точки зрения отдачи и присоединения электронов: ______________________________________________________________________________ ______________________________________________________________________________
25
5. Схема демонстрирует цикл оксида хрома (II) CrO.
(а) Заполните таблицу:
№ Схема процесса Название А В Сr+2 -4𝑒̅ → Сr+6 Окисление С D
(b) Укажите, в каком из процессов оксид хрома (II) CrO выполняет роль окислителя.
(с) В оксиде хрома (ІІІ) хром проявляет промежуточную степень окисления, поэтому способен проявлять как восстановительные, так и окислительные свойства. Cr2O3 + 2Na2CO3 + 3NaNO3 𝑡𝑜 → 2Na2CrO4 + 3NaNO2 + 2CO2
(і) Запишите формулы веществ Окислитель в процессе:_________________ Восстановитель в процессе: _____________
(іі) Определите реакции, демонстрирующие восстановительные и окислительные свойства оксида хрома (III): A. Cr2O3 + 6HCl → 2CrCl3 + 3h3O B. Cr2O3 + 2Al → Al2O3 + 3Cr C. Cr2O3 + KClO3 + 2K2CO3 → 2K2CrO4 + KCl + 2CO2 D. Cr2O3 + 2KOH → 2KCrO2 + h3O
Суммативное оценивание за раздел
9.2А «Окислительно-восстановительные реакции»
Цель обучения 9.2.2.3 Знать и уметь использовать правила нахождения степеней окисления 9.2.2.4 Понимать, что процессы окисления и восстановления взаимосвязаны и протекают одновременно 9.2.2.5 Понимать окислительно-восстановительные реакции как реакции, протекающие с изменением степеней окисления 9.2.2.6 Понимать окисление, как процесс отдачи электронов, а восстановление – принятие электронов 9.2.2.7 Расставлять коэффициенты методом электронного баланса в уравнениях окислительно-восстановительных реакций
Критерий оценивания Обучающийся Классифицирует процессы окисления и восстановления с точки зрения отдачи и присоединения электронов Устанавливает значение окисления и восстановления как встречно параллельные процессы Определяет степени окисления элементов в составе реагентов и продуктов Составляет электронный баланс методом полуреакций и балансирует суммарное уравнение окислительно- восстановительного процесса Определяет окислительные возможности соединения
Уровень мыслительных навыков
Знание и понимание Применение
Время выполнения
20 минут
Задания
1. Назовите процесс отдачи электронов. A) Окисление B) Разложение C) Восстановление D) Окисление-восстановление
2. Даны реакции, которые могут протекать во время грозы. Выберите вариант процесса, протекающего в молекулах.
24
N2 NO O3
A окисление окисление окисление
B окисление окисление восстановление
C восстановление восстановление окисление
D восстановление восстановление восстановление
3. Выберите утверждения, соотвествующие процессу окисления.
Утверждение
1 Возрастает степень окисления
2 Возрастает количество водорода, уменьшается количество кислорода;
3 Возрастает количество кислорода, уменьшается количество водорода;
Ответ:
4. Процесс ОВР представлен уравнением: K2Cr2O7 + KI + h3SO4 = Cr2(SO4)3 + K2SO4 + I2 + h3O (а) Определите степени окисления элементов в реагентах и продуктах: ______________________________________________________________________________
(b) Определите в составе реагентов вещества, выполняющие роль:
Окислителя ______________________________________________________________________________ Восстановителя________________________________________________________________
(c) Составьте с помощью электронного баланса уравнение: процесса окисления методом полуреакции ______________________________________________________________________________
восстановления методом полуреакции. ______________________________________________________________________________
(d) Составьте полное сбалансированное уравнение реакции, спользуя электронный баланс. ______________________________________________________________________________
(e) Дайте определение окислительно-восстановительному процессу с точки зрения отдачи и присоединения электронов: ______________________________________________________________________________ ______________________________________________________________________________
25
5. Схема демонстрирует цикл оксида хрома (II) CrO.
(а) Заполните таблицу:
№ Схема процесса Название А В Сr+2 -4𝑒̅ → Сr+6 Окисление С D
(b) Укажите, в каком из процессов оксид хрома (II) CrO выполняет роль окислителя.
(с) В оксиде хрома (ІІІ) хром проявляет промежуточную степень окисления, поэтому способен проявлять как восстановительные, так и окислительные свойства. Cr2O3 + 2Na2CO3 + 3NaNO3 𝑡𝑜 → 2Na2CrO4 + 3NaNO2 + 2CO2
(і) Запишите формулы веществ Окислитель в процессе:_________________ Восстановитель в процессе: _____________
(іі) Определите реакции, демонстрирующие восстановительные и окислительные свойства оксида хрома (III): A. Cr2O3 + 6HCl → 2CrCl3 + 3h3O B. Cr2O3 + 2Al → Al2O3 + 3Cr C. Cr2O3 + KClO3 + 2K2CO3 → 2K2CrO4 + KCl + 2CO2 D. Cr2O3 + 2KOH → 2KCrO2 + h3O
Оксид хрома (III) – катализатор В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида азота, который в избытке кислорода окисляется до бурого диоксида азота.
Чтобы посмотреть презентацию с картинками, оформлением и слайдами, скачайте ее файл и откройте в PowerPoint на своем компьютере.
Текстовое содержимое слайдов презентации:
СОЕДИНЕНИЯ ХРОМА Составитель: И.Н. Пиялкина, учитель химии МБОУ СОШ №37 города Белово Соединения хрома Соединения хрома(II) Соединения хрома(III) Соединения хрома(VI) CrO –основный оксидCr(OH)2-основание CrO3-кислотный оксидh3CrO4-хромоваяh3Cr2O7-дихромовая кислоты Cr2O3-амфотерный оксидCr(OH)3-амфотерный гидроксид CrO Оксид хрома (II) – кристаллы черного цвета,имеет основный характер При осторожном нагревании гидроксида хрома (II) в отсутствии кислорода получают оксид хрома (II). Составьте уравнение реакции. Cr(OH)2 = CrO + h3O 3CrO = Cr + Cr2O3 При более высоких температурах оксид хрома (II) диспропорционирует: Соединения хрома (II) Оксида хрома (II) реагирует с соляной и серной кислотами. Рассмотрите реакции с точки зрения ТЭД. CrO + h3SO4 = CrSO4 + h3O CrO + 2H+ + Cl– = Cr2+ + 2Cl– + h3O CrO + 2H+ = Cr2+ + h3O CrO + 2HCl = CrCl2 + h3O CrO + 2H+ + SO42– = Cr2+ + SO42– + h3O CrO + 2H+ = Cr2+ + h3O Оксид хрома (II) – сильный восстановитель.Кислородом воздуха окисляется до оксида хрома (III) Cr+2O + O20 → Cr2+3O3–2 Cr+2 – 1e → Cr+3 4O20 + 4e → 2O–2 1 4CrO + O2 = 2Cr2O3 CrO (за счет Cr+2) – восстановитель, процесс окисления O2 – окислитель, процесс восстановления Cr(OH)2 Гидроксид хрома (II) Гидроксид хрома (II) получают в виде желтого осадка действием растворов щелочей на соли хрома (II) без доступа воздуха. CrCl2 + 2NaOH = Cr(OH)2 ↓ + 2NaCl Cr2+ + 2Cl– +2Na+ +2OH– = Cr(OH)2 ↓+ 2Na+ +2Cl– Cr2+ + 2OH– = Cr(OH)2 ↓ Гидроксид хрома (II) обладает основными свойствами Cr(OН)2 + 2HCl = CrCl2 + 2h3O Cr(OН)2 + 2H+ + 2Cl– = Cr2+ + 2Cl– + 2h3O Cr(OН)2 + 2H+ = Cr2+ + 2h3O Гидроксид хрома (II) – сильный восстановительКислородом воздуха окисляется до гидроксида хрома (III) Cr+2(ОН)2+ O20 + Н2О → Cr+3(O –2Н)3 Cr+2 – 1e → Cr+3 4O20 + 4e → 2O–2 1 4Cr(OН)2 + O2 + 2Н2О = 4Cr(OН)3 Cr(OН)2 (за счет Cr+2) –восстановитель, процесс окисления O2 – окислитель, процесс восстановления Соли хрома (II) Водные растворы солей хрома (II) получают без доступа воздуха растворением металлического хрома в разбавленных кислотах в атмосфере водорода или восстановлением цинкомв кислой среде солей трехвалентного хрома. В лабораторных условиях термическим разложением дихромата аммония: (Nh5)2Cr2O7 = Cr2O3 + N2 + 2h3O В промышленности восстановлением дихромата калия коксом или серой: K2Cr2O7 + 3C = 2Cr2O3 + 2K2CO3 + CO2 K2Cr2O7 + S = 2Cr2O3 + K2SO4 Соединения хрома (III) Оксид хрома (III) обладает амфотерными свойствами При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение реакции оксида хрома (III) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЭД. Cr2O3 + 6HCl = 2CrCl3 + 3h3O Cr2O3 + 6H+ + 6Cl– = 2Cr3+ + 6Cl– + 3h3O Cr2O3 + 6H+ = 2Cr3+ + 3h3O При сплавлении оксида хрома (III) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуютсяхромиты: Сr2O3 + Ba(OH)2 = Ba(CrO2)2 + h3O Сr2O3 + Na2CO3 = 2NaCrO2 + CO2 Оксид хрома (III) нерастворим в воде. В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель и переходит в хромат: Cr2O3 + KOH + KMnO4 → K2CrO4 + MnO2 + h3O Рассмотрите эти реакции как окислительно-восстановительныеРасставьте коэффициенты. Cr2O3 + KOH +Сa(ClO)2 → K2CrO4 + CaCl2 + h3O Cr2O3 + O2 + Na2CO3 → Na2CrO4 + CO2 Cr2O3 + KClO3 + Na2CO3 → Na2CrO4 + KCl + CO2 Cr2O3+NaNO3 + Na2CO3→Na2CrO4 +NaNO2 + CO2 Оксид хрома (III) – катализатор В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида азота, который в избытке кислорода окисляется до бурого диоксида азота. Каталитическое окисление этанола Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома (III) Реакция окисления спирта протекает с выделением энергии. Продукт реакции окисления спирта — уксусный альдегид. 2СН3–СН2–ОН +О2 2СН3 – С ═ О +2h3O H Гидроксид хрома (III) Cr(OH)3 Получают гидроксид хрома (III) действиемрастворов щелочей или аммиака на растворы солей хрома (III). Составьте уравнение реакции получения Cr(OH)3 действием раствора аммиака на хлорид хрома (III): Лабораторный опыт № 1 К раствору хлорида хрома (III) прилейте раствор аммиака. Что наблюдаете? Лабораторный опыт № 2 Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте раствор соляной кислоты, а к другой – щелочь. Что происходит? Какими свойствами обладает гидроксид хрома (III)? Cr(OH)3 CrCl3 Na3[Cr(OH)6] NaOH HCl +h3SO4 +NaOH Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте серной кислоты, а к другой – щелочь. Что происходит? Гидроксид хрома (III) обладает амфотерными свойствами.При взаимодействии с кислотами образуются соли хрома (III):Составьте уравнение реакции гидроксида хрома (III) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЭД. Cr(OH)3 + 3HCl = CrCl3 + 3h3O Cr(OH)3 + 3H+ + 3Cl– = Cr3+ + 3Cl– + 3h3O Cr(OH)3 + 3H+ = Cr3+ + 3h3O Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Cr(OH)3 + 3Na+ + 3OH– = 3Na+ + [Cr(OH)6]3– Cr(OH)3 + 3OH– = [Cr(OH)6]3– 2Cr(OH)3 = Cr2O3 + 3h3O Гидроксид хрома (III) растворяется в щелочах При нагревании гидроксид хрома (III) разлагается: гексагидроксохромат (III) натрия (изумрудно-зеленый) Соли хрома (III) Бывают двух видов: CrCl3 — хроматы (III) и хромиты NaCrO2 или гидроксокомплексы Na3[Cr(OH)6]СВОЙСТВА:1. Хроматы (III) в щелочной среде образуют гидроксид хрома(III), который сразу растворяется , образуя гидроксокомплексы. CrCl3 + 3KOH (нед.) → Cr(OН)3 + 3KCl CrCl3 + 6KOH (изб.) → К3[Cr(OH)6] + 3KCl 2. Хромиты устойчивы в щелочной среде, в кислой разрушаются: NaCrO2 + HCl (нед.) + h3O = Cr(OH)3 + NaCl NaCrO2 + 4HCl (изб.) = CrCl3 + NaCl + 2h3O с угольной кислотой Na3[Cr(OH)6] + 3CO2 = Cr(OH)3 + 3NaHCO3 Соли хрома (III) 3. Взаимный гидролиз: при смешивании солей хрома (III) с растворами сульфидов, сульфитов, карбонатов происходит выпадение осадка гидроксида хрома (III) и выделение газа Cr2S3 + 6h3O = 2Cr(OH)3 + 3h3S В водных растворах катион Cr3+ встречается только в виде гидратированного иона [Cr(h3O)6] 3+, которыйпридает раствору сине-фиолетовый цвет. 2CrCl3+3Na2S + 6h3O → 2Cr(OН)3+3Н2S +3NaCl 4. В растворе подвергаются полному гидролизу: Сульфат хрома (III) образует двойные соли – хромовые квасцыИз смешанного раствора сульфата хрома (III) и сульфата калия кристаллизуется двойная соль – KCr(SO4)2·12h3O сине-фиолетового цвета. Применяются в качестве дубящего вещества при изготовлении эмульсий, а также в дубящих растворах и дубящих фиксажах. Соединения хрома (III) могут проявлять как окислительные так и восстановительные свойства. Рассмотрите эти реакции как окислительно-восстановительныеРасставьте коэффициенты. Назовите окислитель и восстановитель. K3[Cr(OH)6] +Br2 +KOH → K2CrO4+ KBr + h3O CrCl3 + h3O2 + KOH → K2CrO4 +KCl + h3O KCrO2 +PbO2 + KOH → K2CrO4 +K2PbO2 + h3O Cr2(SO4)3 +Cl2 +NaOH → Na2CrO4 +NaCl +h3O +Na2SO4 CrCl3 + Zn →CrCl2 + ZnCl2 Получают CrO3 действием избытка концентрированной серной кислоты на насыщенный водный раствор дихромата натрия: Na2Cr2O7 + 2h3SO4 = 2CrO3 + 2NaHSO4 + h3O Оксид хрома (VI) очень ядовит. 4CrO3 → 2Cr2O3 + 3O2↑. При нагревании выше 250 °C разлагается: Оксид хрома (VI) CrO3 — хромовый ангидрид, представляет собой темно-красные игольчатые кристаллы. Соединения хрома (VI) CrO3 — кислотный оксид С избытком воды образуется хромовая кислота h3CrO4 CrO3 + Н2O = Н2CrO4 При большой концентрации CrO3 образуется дихромовая кислота Н2Cr2О7 2CrO3 + Н2O = Н2Cr2O7 которая при разбавлении переходит в хромовую кислоту: Н2Cr2О7 + Н2О = 2Н2CrO4 При растворении в воде образует кислоты. Эти кислоты – неустойчивые. Существуют только в растворе. Между ними в растворе устанавливается равновесие 2Н2CrO4 ↔ Н2Cr2O7 + Н2O При взаимодействии CrO3 со щелочами образуются хроматы CrO3 + 2KOH → K2CrO4 + h3O. CrO3 является сильным окислителем Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним. Окисляет йод, серу, фосфор, уголь. 4CrO3 + 3S = 2Cr2O3 + 3SO2↑ 4CrO3 + C2H5OH → 2CO2 + 2Cr2O3+ 3h3O Если поместить оксид хрома на фарфоровую пластинку и капнуть на него несколько капель ацетона,то через несколько секунд ацетон загорается. При этом оксид хрома (VI) восстанавливается до оксида хрома (III), а ацетон окисляется до углекислого газа и воды. Окисление ацетона хромовым ангидридом (видео) 16CrO3 +3Ch4– С – Ch4 → 9CO2 + 8Cr2O3 + 9h3O О Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7 Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов CrO3; хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет хроматы – соли хромовой кислоты устойчивы в щелочной среде, при подкислении переходят в оранжевыедихроматы, соли двухромовой кислоты. Реакция обратима, поэтому при добавлении щелочи желтая окраска хромата восстанавливается. 2CrO42– + 2H+ ↔ Cr2O72– + h3O хроматы дихроматы соли ОН– Н+ Лабораторный опыт № 3 К раствору дихромата калия добавьте гидроксид калия. Как изменилась окраска? Чем это вызвано? К полученному раствору добавьте серной кислоты до восстановления желтой окраски. Напишите уравнения реакций. 2K2CrO4 + h3SO4(разб.) = K2Cr2O7 +K2SO4+h3O K2Cr2O7 + 2KOH = 2K2CrO4 + h3O 2K2CrO4 +2HCl(разб.)= K2Cr2O7 + 2KCl + h3O 2K2CrO4 + h3O + CO2 = K2Cr2O7 + KHCO3 Взаимопревращение хроматов и дихроматов Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7, Хромат калия K2CrO4 и дихромат калия K2Cr2O7 – соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым.2K2CrO4 + h3SO4 = K2Cr2O7 + K2SO4 + h3O В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы.K2Cr2O7 + 2KOH = 2K2CrO4 + h3O Соединения хрома (VI) – сильные окислители Cr2O72– Cr3+ Cr(OH)3 [Cr(OH)6]3– H+ h3O OH– Cr2O72– + 14H+ + 6e → 2Cr3+ + 7h3O Cr2O72– + 7Н2О + 6e → 2[Cr(OH)6]3– + 2ОН– Окислительные свойства дихроматов Дихроматы, например дихромат калия K2Cr2O7 – сильные окислители. Под действием восстановителей дихроматы в кислой среде переходят в соли хрома (III). Примером такой реакции может служить окисление сульфита натрия раствором дихромата калия в кислой среде. К раствору дихромата калия добавляем серную кислоту и раствор сульфита натрия.K2Cr2O7+3Na2SO3+4h3SO4=Cr2(SO4)3+3Na2SO4+K2SO4+ 4h3O Оранжевая окраска, характерная для дихроматов, переходит в зеленую. Образовался раствор сульфата хрома (III) зеленого цвета. Соли хрома — ярко окрашены, именно поэтому элемент получил такое название: «хром», что в переводе с греческого означает «цвет, краска». опыт 1. Zn + K2Cr2O7 +h3SO4 → ZnSO4 + Cr2(SO4)3 +K2SO4 +h3O 2. K2Cr2O7 + h3S +h3SO4 → S + Cr2(SO4)3+K2SO4+h3O 3. K2Cr2O7 + h3O2 + h3SO4 →O2 + Cr2(SO4)3 + K2SO4 +h3O 4. K2Cr2O7 + h3O + h3S → S + Cr(OH)3 + KOH 5. K2Cr2O7 + h3O + K2S → S + K3[Cr(OH)6] + KOH Дихроматы проявляют окислительные свойства не только в растворах, но и в твердом виде: K2Cr2O7 + S → K2SO4 + Cr2O3 K2Cr2O7 + С → K2СO3 + СО + Cr2O3 K2Cr2O7 + Al → Cr + KAlO2 + Al2O3 Рассмотрите эти реакции как окислительно-восстановительныеРасставьте коэффициенты. K2Cr2O7 + KOH + (Nh5)2S → S + K3[Cr(OH)6] + Nh4 Дихромат калия (хромпик) широко применяется как окислитель органических соединений: 3С2H5OH + K2Cr2O7 + 4h3SO4 Ch4– CHO + Cr2(SO4)3 + K2SO4 + 7h3O 3С3H7OH + K2Cr2O7 + 4h3SO4 3Ch4– C–Ch4 + Cr2(SO4)3 + K2SO4 + 7h3O ║ O Хроматы щелочных металлов плавятся без разложения, а дихроматы при высокой температуре превращаются в хроматы. Дихромат аммония разлагается при нагревании: (Nh5)2Cr2O7 Cr2O3 + N2 + 4h3O В ряду гидроксидов хрома различных степеней окисления Cr(ОН)2 — Cr(ОН)3 — Н2CrО4 закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловлено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства. Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения хрома (III). Соединения хрома(VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями проявлять восстановительные свойства, превращаясь в соединения хрома (VI). Степень окисления хромa +2 +3 +6 Оксид CrO Cr2O3 CrO3 Гидроксид Cr(OH)2 Cr(OH)3 h3CrO4 h3Cr2O7 Кислотные и окислительные свойства возрастают Основные и восстановительные свойства возрастают Соединения хрома Домашнее задание:Выполнить ОВР! Используем презентацию «ОВР по теме «ХРОМ» СПАСИБО ЗА РАБОТУ! Начала химии. Современный курс для поступающих в ВУЗы. – М.: 1Федеративная Книготорговая Компания.Химия. Подготовка к ЕГЭ: учебно-методическое пособие / Под ред. В.Н. Доронькина. – Ростов н/Дону: ЛегионХимия. Пособие для поступающих в вузы /О.О. Максименко. – М. : Филол. о-во СЛОВО: Изд-во ЭксмоИнтернет-ресурсы (картинки, видеофрагменты: 1) Единая образовательная коллекция цифровых ресурсов. Химия. Неорганическая химия. Металлы побочных подгрупп. Хром. Видеопыты. http://school-collection.edu.ru/2) Образовательная коллекция Химия для всех XXI Химические опыты со взрывами и без
Приложенные файлы
- 5870191
Размер файла: 3 MB Загрузок: 0
Хром
История
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего, Воклен получил карбид хрома).
Нахождение в природе
Хром является довольно распространённым элементом в земной коре (0,012 % по массе). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении, Бразилии, на Филиппинах.
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире).
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- V2O5 до 0,2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.
Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
- Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
- 4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
- Na2Cr27 + 2C → Cr2O3 + Na2CO3 + CO
5) с помощью алюминотермии получают металлический хром:
- Cr2O3 + 2Al → Al2O3 + 2Cr + 130kcal
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
- Cr2O72− + 14H+ + 12e− → 2Cr + 7H2O
Физические свойства
В свободном виде — голубовато-белый металл с кубической объёмноцентрированной решёткой, a = 0,28845 нм. Ниже температуры 38 °C является антиферромагнетиком, выше переходит в парамагнитное состояние (точка Нееля).
Хром имеет твёрдость по шкале Мооса 5, один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Изотопы
Основная статья: Изотопы хрома
Природный хром состоит из четырех стабильных изотопов (50Cr (изотопная распространённость 4,345 %), 52Cr (83.789 %), 53Cr (9.501 %), 54Cr (2.365 %)).
Химические свойства
Характерные степени окисления
Для хрома характерны степени окисления +2, +3 и +6 (см. табл.). Практически все соединения хрома окрашены.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Cr(OH)2 (жёлтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зелёный) | Амфотерный | Cr3+ (зелёные или лиловые соли) [Cr(OH)4]− (зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | H2CrO4 H2Cr2O7 | Кислотный | CrO42− (хроматы, желтые) Cr2O72− (дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Диаграмма Пурбе для хрома
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
- [H]
- 2Cr3+ → Zn,HCl 2Cr2+
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr3+ существует в виде аквакомплексов [Cr(H2O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
- Cr3+ + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4+
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
- Cr3+ + 3OH− → Cr(OH)3↓
- Cr(OH)3 + 3OH− → [Cr(OH)6]3−
Сплавляя Cr2O3 со щелочами, получают хромиты:
- Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
- Cr2O3 + 6HCl → 2CrCl3 + 3H2O
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
- 2Na3[Cr(OH)6] + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
- 2Cr2O3 + 8NaOH + 3O2 → 4Na2CrO4 + 4H2O
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
- 2CrO42− + 2H+ → Cr2O72− + H2O
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
- Cr2O72− + 2OH− → 2CrO42− + H2O
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
- H2CrnO3n+1 → H2O + nCrO3
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
- Ba2+ + CrO42− → BaCrO4↓
- 2Ba2+ + Cr2O72− + H2O → 2BaCrO4↓ + 2H+
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
- K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего монопероксида хрома(VI) CrO5 (CrO(O2)2), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты.
Пример соединения хрома (VI): Оксид хрома (VI)
Соединения хрома в степени окисления +6 особо токсичны. Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома. Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Шестивалентный хром является признанным канцерогеном при вдыхании. На многих рабочих местах сотрудники подвержены воздействию шестивалентного хрома, например, при гальваническом хромировании или сварке нержавеющих сталей. В Европейском союзе использование шестивалентного хрома существенно ограничено директивой RoHS.
Шестивалентный хром транспортируется в клетки человеческого организма с помощью сульфатного транспортного механизма благодаря своей близости к сульфатам по структуре и заряду. Трёхвалентный хром, более часто встречающийся, не транспортируется в клетки.
Внутри клетки Cr(VI) восстанавливается до метастабильного пятивалентного хрома (Cr(V)), затем до трехвалентного хрома (Cr(III)). Трехвалентный хром, присоединяясь к протеинам, создает гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.
Продукты шестивалентного хрома являются генотоксичными канцерогенами. Хроническое вдыхание соединений шестивалентного хрома увеличивает риск заболеваний носоглотки, риск рака лёгких. (Лёгкие особенно уязвимы из-за большого количества мелких капилляров). Видимо, механизм генотоксичности запускается пяти- и трёхвалентным хромом.
В США предельно допустимая концентрация шестивалентного хрома в воздухе составляет 5 мкг/м³ (0,005 мг/м³). В России предельно допустимая концентрация хрома (VI) существенно ниже — 1,5 мкг/м³ (0,0015 мг/м³).
Одним из общепризнанных методов избежания шестивалентного хрома является переход от технологий гальванического хромирования к газотермическому и вакуумному напылению.
Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.
Хром и его соединения — презентация онлайн
ХРОМ и его соединения
I. Исторические сведения
II. Хром – химический элемент:
1.Положение хрома в периодической системе
химических элементов Д.И.Менделеева
2. Строение атома.
3. Нахождение в природе
III.Хром – простое вещество
1. Состав. Физические свойства.
2. Получение.
3. Химические свойства
4. Биологическая роль и физиологическое
действие.
5. Применение
IV. Соединения хрома
В 1766 году в окрестностях
Екатеринбурга был
обнаружен минерал,
который получил название
«сибирский красный
свинец», PbCrO4.
Современное название —
крокоит.
В 1797 французский химик Л. Н. Воклен открыл в сибирской
красной свинцовой руде новый элемент хром и в 1798 году
получил его в свободном состоянии.
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска —
из-за разнообразия окраски своих соединений.
Французский химик Луи Николя
Воклен родился в Сент-Андред’Эберто (Нормандия).
Совместно с А. Ф. Фуркруа
выяснил (1799) химическую
природу мочевины. Совместно с
П. Ж. Робике открыл (1806)
первую аминокислоту аспарагин.
Открыл также пектин и яблочную
кислоту, выделил камфорную и
хинную кислоты.
Внёс существенный вклад в
развитие анализа минералов.
Создал школу химиков.
Опубликовал одно из первых в
мире руководств по химическому
анализу – «Введение в
аналитическую химию» (1799).
Положение хрома в ПСХЭ Д.И. Менделеева. Строение атома.
порядковый номер период
Cr
металл
+24
24
4
группа
VIB
1s2 2s22p6 3s23p6 3d 5 4s1
2 8
13 1
валентные электроны
Cr0 ─ 2e → Cr+2
Cr0 ─ 3e → Cr+3
Cr0 ─ 6e → Cr+6
Нахождение хрома в природе
Хром является довольно распространённым элементом
(0,02 масс. долей, %). Основные соединения хрома —
хромистый железняк (хромит) FeO·Cr2O3. Вторым по
значимости минералом является крокоит PbCrO4.
хромит
крокоит
Физические свойства
В свободном виде — голубовато- белый
металл.
Хром (с примесями) является одним из
самых твердых металлов.
Очень чистый хром достаточно хорошо
поддаётся механической обработке,
пластичен.
Устойчив на воздухе. При 2000 °C сгорает с
образованием зелёного оксида хрома (III)
Cr2O3.
Плотность 7,19 г/см3;
t плавления 1890°С;
t кипения
2480°С.
Получение
Из хромистого железняка Fe(CrO2)2
(хромита железа) получают
феррохром восстановлением в
электропечах коксом (углеродом):
FeO· Cr2O3 + 4C → Fe + 2Cr + 4CO↑
Феррохром — сплав железа и хрома
(около 60% ),
основные примеси – углерод (до5%)
кремний (до 8%), сера (до 0,05 %),
фосфор (до 0,05 %).
Феррохром применяют для
производства легированных
сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия
(кальцинированная сода) на воздухе:
4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2↑
2) растворяют хромат натрия и отделяют его от оксида
железа;
3) переводят хромат в дихромат, подкисляя раствор и
выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата
углём:
Na2Cr2O7
+ 2C → Cr2O3 + Na2CO3 + CO↑
5) с помощью алюминотермии получают металлический хром:
Cr2O3 + 2Al → Al2O3 + 2Cr + 130 ккал
С помощью электролиза получают электролитический хром
из раствора хромового ангидрида в воде, содержащего
добавку серной кислоты. При этом на катодах совершаются
в основном 3 процесса:
1) восстановление шестивалентного хрома до
трехвалентного с переходом его в раствор;
2) разряд ионов водорода с выделением газообразного
водорода;
3) разряд ионов, содержащих шестивалентный хром с
осаждением металлического хрома;
Cr2O72− + 14Н+ + 12е− = 2Cr + 7h3O
Химические свойства
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn,
+
Fe Co,Sn,Pb, h3,Cu,Hg,Ag,Au
О2 + неметаллы
+
+
+
Cr
Cr
h3O
растворы HCl, h3SO4
h3SO4 (конц.), HNO3
растворы солей
+
щелочные расплавы окислителей
+
При комнатной температуре хром химически мало активен
из-за образования на его поверхности тонкой прочной
оксидной пленки.
При нагревании оксидная пленка хрома разрушается, и он
реагирует практически со всеми неметаллами, например:
кислородом, галогенами, азотом, серой.
Составьте уравнения реакций
хрома с перечисленными неметаллами.
Рассмотрите данные реакции как
окислительно-восстановительные.
4 Cr0 + 3 O20 = 2 Cr2+3O3–2
Cr0 – 3e → Cr+3
4
O20 + 4e → 2O–2 3
Cr0 – восстановитель, процесс окисления
O20 – окислитель, процесс восстановления
2 Cr0 + 3 Br20 = 2 Cr+3Br3–1
Cr0 – 3e → Cr+3
2
Br20 + 2e → 2Br–1 3
Cr0 – восстановитель, процесс окисления
Br20 – окислитель, процесс восстановления
2 Cr0 + N20 = 2Cr+3N–3
Cr0 – 3e → Cr+3 2
N20 + 6e → 2N–3 1
Cr0 – восстановитель, процесс окисления
N20 – окислитель, процесс восстановления
2 Cr0 + 3 S0 = Cr2+3S3–2
Cr0 – 3e → Cr+3 2
S0 + 2e → S–2
3
Cr0 – восстановитель, процесс окисления
S0 – окислитель, процесс восстановления
В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3h3O = Cr2O3 + 3h3
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn,
Cr
Fe Co,Sn,Pb, h3,Cu,Hg,Ag,Au
В ряду напряжений хром находится левее водорода и поэтому
в отсутствии воздуха может вытеснять водород из растворов
соляной и серной кислот, образуя соли хрома (II).
Составьте уравнения реакций хрома c растворами соляной
и серной кислот.
Рассмотрите данные реакции как окислительновосстановительные.
Cr0 + 2 H+1Cl = Cr+2Cl2 + h30
Cr0 – 2e → Cr+2
1
2H+ + 2e → h30
1
Cr0 – восстановитель, процесс окисления
HCl (за счет Н+1) – окислитель, процесс восстановления
Cr0 +
h3+1SO4 = Cr+2SO4 + h30
Cr0 – 2e → Cr+2
2H+ + 2e → h30
1
1
Cr0 – восстановитель, процесс окисления
h3SO4(за счет Н+1) – окислитель,
процесс восстановления
В присутствии кислорода
хром реагирует с растворами
кислот c образованием
солей хрома (III)
4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O
Концентрированные серная и азотная
кислоты на холоду пассивируют хром
При сильном нагревании кислоты
pастворяют хром с образованием
cолей хрома (III)
Cr + h3SO4 → Cr2(SO4)3 + SO2 + h3O
Cr + HNO3 → Cr(NO3)3 + NO2 + h3O
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
Cr0 + h3S+6O4 → Cr2+3(SO4)3 + S+4O2 + h3O
Cr0 – 3e → Cr+3
S+6 + 2e → S+4
2
3
2Cr + 6h3SO4 = Cr2(SO4)3 + 3SO2 + 6h3O
Cr0 – восстановитель, процесс окисления
h3SO4 (за счет S+6) – окислитель, процесс восстановления
Cr0 + HN+5O3 → Cr+3(NO3)3 + N+4O2 + h3O
Cr0 – 3e → Cr+3
N+5 + 1e → N+4
1
3
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3h3O
Cr0 – восстановитель, процесс окисления
HNO3 (за счет N+5) – окислитель, процесс восстановления
Хром способен вытеснять многие металлы, например
медь, олово, серебро и другие, из растворов их солей:
Составьте уравнение реакции хрома c раствором сульфата
меди (II). Рассмотрите данную реакцию как окислительновосстановительную.
Cr0 + Cu+2SO4 → Cr+2SO4 + Cu0
Cr0 – 2e → Cr+2 1
Cu+2+ 2e → Cu0 1
Cr + CuSO4 = CrSO4 + Cu
Cr0 – восстановитель, процесс окисления
CuSO4 (за счет Cu+2) – окислитель, процесс
восстановления
Растворы щелочей на хром практически не действуют.
Хром реагирует с щелочными расплавами окислителей.
В качестве окислителей используют нитраты натрия, калия,
хлорат калия и другие окислители.
При взаимодействии с щелочными расплавами окислителей
хром образует соли анионного типа, в которых проявляет
высшую степень окисления.
Cr + KClO3 + KOH
сплавление
K2CrO4 + KCl + h3O
Рассмотрите эту реакцию как окислительно-восстановительную
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
Cr0 + KCl+5O3 + KOH → K2Cr+6O4 + KCl–1 + h3O
Cr0 – 3e → Cr+3
Cl+5 + 6e → Cl–
1
2
Cr + KClO3 + 2KOH = K2CrO4 + KCl + h3O
Cr0 – восстановитель, процесс окисление
KClO3 (за счет Cl+5) – окислитель, процесс восстановление
Хром — постоянная составная часть
растительных и животных организмов. В
крови содержится от 0,012 до 0,0035 %
хрома. Хром имеет большое значение в
метаболизме углеводов и жиров, а
также участвует в процессе синтеза
инсулина. Важнейшая его
биологическая роль состоит в регуляции
углеводного обмена и уровня глюкозы в
крови Элемент способствует
нормальному формированию и росту
детского организма. Снижение
содержания хрома в пище и крови
приводит к уменьшению скорости роста,
увеличению холестерина в крови.
Хром важный компонент во многих легированных сталях.
Используется в качестве износоустойчивых и красивых
гальванических покрытий (хромирование)
Хром применяется для производства сплавов:
хром-30 и хром-90, незаменимых для производства сопел
мощных плазмотронов и в авиакосмической промышленности.
Соединения хрома
Соединения хрома (II)
оксид
гидроксид
соли
Соединения хрома (III)
оксид
гидроксид
соли
Соединения хрома (VI)
оксид
гидроксид
соли
Соединения хрома (II)
CrO
Оксид хрома (II) – кристаллы черного цвета,
имеет
основный характер
При осторожном нагревании
гидроксида хрома (II) в отсутствии
кислорода получают оксид хрома (II).
Составьте уравнение реакции.
Cr(OH)2 = CrO + h3O
При более высоких температурах оксид хрома (II)
диспропорционирует:
700°
3CrO = Cr + Cr2O3
Составьте уравнение реакции оксида хрома (II) с соляной и
серной кислотами. Рассмотрите реакции с точки зрения ТЕД.
CrO + 2HCl = CrCl2 + h3O
CrO + 2H+ + Cl– = Cr2+ + 2Cl– + h3O
CrO + 2H+ = Cr2+ + h3O
CrO + h3SO4 = CrSO4 + h3O
CrO + 2H+ + SO42– = Cr2+ + SO42– + h3O
CrO + 2H+ = Cr2+ + h3O
Оксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до оксида
хрома (III)
Составьте уравнение реакции.
Рассмотрите данную реакцию
как окислительно-восстановительную.
Cr+2O + O20 → Cr2+3O3–2
Cr+2 – 1e → Cr+3
O20 + 4e → 2O–2
4
1
4CrO + O2 = 2Cr2O3
CrO (за счет Cr+2) – восстановитель, процесс окисления
O2 – окислитель, процесс восстановления
Гидроксид хрома (II)
Cr(OH)2
Гидроксид хрома (II) получают в виде желтого осадка
действием растворов щелочей на соли хрома (II) без доступа
воздуха.
Составьте уравнение реакции получения гидроксида
хрома (II) действием гидроксида натрия на хлорид хрома (II).
Рассмотрите реакцию с точки зрения ТЕД.
CrCl2 + 2NaOH = Cr(OH)2 ↓ + 2NaCl
Cr2+ + 2Cl– + 2Na+ + 2OH– = Cr(OH)2 ↓ + 2Na+ + 2Cl–
Cr2+ + 2OH– = Cr(OH)2 ↓
Гидроксид хрома (II) обладает основными
свойствами.
Составьте уравнение реакции гидроксида хрома (II) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД
Cr(OН)2 + 2HCl = CrCl2 + 2h3O
Cr(OН)2 + 2H+ + 2Cl– = Cr2+ + 2Cl– + 2h3O
Cr(OН)2 + 2H+ = Cr2+ + 2h3O
Гидроксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до гидроксида хрома (III)
Составьте уравнение реакции. Рассмотрите данную реакцию
как окислительно-восстановительную.
Cr+2(ОН)2+ O20 + Н2О → Cr+3(O –2Н)3
Cr+2 – 1e → Cr+3
O20 + 4e → 2O–2
4
1
4Cr(OН)2 + O2 + 2Н2О = 4Cr(OН)3
Cr(OН)2 (за счет Cr+2) –восстановитель, процесс окисления
O2 – окислитель, процесс восстановления
Соли хрома (II)
Водные растворы солей хрома (II) получают без доступа
воздуха растворением металлического хрома в разбавленных
кислотах в атмосфере водорода или восстановлением цинком
в кислой среде солей трехвалентного хрома.
Безводные соли хрома (II) белого цвета, а водные растворы и
кристаллогидраты — синего цвета.
Соединения хрома (II) – сильные восстановители. Легко
окисляются. Именно поэтому очень трудно получать и хранить
соединения двухвалентного хрома.
Реагируют с концентрированными серной и азотной
кислотами:
CrCl2 + O2 + HCl → CrCl3 + h3O
CrCl2 + h3SO4 → Cr2(SO4)3 + SO2↑ + HCl↑ + h3O
CrCl2 + HNO3 → Cr(NO3)3 + NO2↑ + HCl↑ + h3O
Рассмотрите эти реакции как окислительновосстановительные. Расставьте коэффициенты..
Cr+2Cl2 + O20 + HCl → Cr+3Cl3 + h3O–2
Cr+2 – 1e → Cr+3
O20 + 4e → 2O–2
4
1
4CrCl2 + O2 + 4HCl = 4CrCl3 + 2h3O
Cr+2Cl2 + HN+5O3 (к) →Cr+3(NO3)3 + N+4O2↑ + HCl↑ + h3O
Cr+2 – 1e → Cr+3
N+5 + 1e → N+4
1
1
CrCl2 + 4HNO3(конц) = Cr(NO3)3 + NO2↑ + 2HCl↑ + h3O
Cr+2Cl2 + h3S+6O4(к.) →Cr2+3(SO4)3 + S+4O2↑ + HCl↑ + h3O
Cr+2 – 1e → Cr+3
S+6 + 2e → S+4
2
1
2CrCl2 + 4h3SO4(конц) = Cr2(SO4)3 + SO2↑ + 4HCl↑ +2h3O
Соединения хрома (III)
Cr2O3
Оксид хрома () – тугоплавкий порошок темно-зеленого цвета.
Получение.
В лабораторных условиях термическим разложением
дихромата аммония:
t°
(Nh5)2Cr2O7 = Cr2O3 + N2 + 2h3O
В промышленности восстановлением дихромата калия
коксом или серой:
t°
K2Cr2O7 + 3C = 2Cr2O3 + 2K2CO3 + CO2
t°
K2Cr2O7 + S = 2Cr2O3 + K2SO4
Оксид хрома (III) обладает амфотерными свойствами
При взаимодействии с кислотами образуются соли хрома (III):
Составьте уравнение реакции оксида хрома (III) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД.
Cr2O3 + 6HCl = 2CrCl3 + 3h3O
Cr2O3 + 6H+ + 6Cl– = 2Cr3+ + 6Cl– + 3h3O
Cr2O3 + 6H+ = 2Cr3+ + 3h3O
При сплавлении оксида хрома (III) с оксидами,
гидроксидами и карбонатами щелочных и
щелочноземельных металлов образуются
хроматы (III) (хромиты):
t°
Сr2O3 + Ba(OH)2 = Ba(CrO2)2 + h3O
t°
Сr2O3 + Na2CO3 = 2NaCrO2 + CO2
Оксид хрома (III) нерастворим в воде.
В окислительно-восстановительных реакциях оксид хрома (III)
ведет себя как восстановитель:
Cr2O3 + KOH + KMnO4 → K2CrO4 + MnO2 + h3O
Cr2O3 + KOH + Сa(ClO)2 → K2CrO4 + CaCl2 + h3O
Cr2O3 + O2 + Na2CO3 → Na2CrO4 + CO2
Cr2O3 + KClO3 + Na2CO3 → Na2CrO4 + KCl + CO2
Cr2O3 + NaNO3 + Na2CO3 → Na2CrO4 + NaNO2 + CO2
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Cr2+3O3 + KOH + KMn+7O4 → K2Cr+6O4 + Mn+4O2 + h3O
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
Mn+7 + 3e → Mn+4
2 восстановление, окислитель
Cr2O3 + 2KOH + 2KMnO4 = 2K2CrO4 + 2MnO2 + h3O
Cr2+3O3 + KOH + Сa(Cl+1O)2 → K2Cr+6O4 + CaCl2–1 + h3O
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
Cl+1 + 2e → Cl–1
3 восстановление, окислитель
Cr2O3 + 4KOH + 3Сa(ClO)2 = 2K2CrO4 + 3CaCl2 + 2h3O
Cr2+3O3 + O20 + Na2CO3 → Na2Cr+6O4 + CO2–2
2Cr+3 – 6e → 2Cr+6 2 окисление, восстановитель
O20 + 4e → O–2
3 восстановление, окислитель
Cr2O3 + 3O2 + 4Na2CO3 = 2Na2CrO4 + 4CO2
Cr2+3O3 + KCl+5O3 + Na2CO3 → Na2Cr+6O4 + KCl–1 + CO2
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
Cl+5 + 6e → Cl–1
1 восстановление, окислитель
Cr2O3 + KClO3
+ 2Na2CO3 = 2Na2CrO4 + KCl
+ 2CO2
Cr2+3O3 + NaN+5O3 + Na2CO3 → Na2Cr+6O4 + NaN+3O2 + CO2
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
N+5 + 2e → N+3
3 восстановление, окислитель
Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
Оксид хрома (III) – катализатор
В присутствии оксида хрома (III)
аммиак окисляется кислородом воздуха до
монооксида азота, который в избытке
кислорода окисляется до бурого диоксида
азота.
Каталитическое окисление этанола
Окисление этилового спирта
кислородом воздуха происходит
очень легко в присутствии оксида
хрома (III)
Реакция окисления спирта протекает
с выделением энергии. Продукт
реакции окисления спирта уксусный альдегид.
2СН3–СН2–ОН + О2
Cr2O3, t°
2СН3 – С ═ О + 2h3O
H
Гидроксид хрома (III)
Cr(OH)3
Получают гидроксид хрома (III) действием
растворов щелочей или аммиака на растворы
солей хрома (III).
Лабораторный опыт № 1
К раствору хлорида хрома (III) прилейте раствор
аммиака. Что наблюдаете?
Составьте уравнение реакции получения
Cr(OH)3 действием раствора аммиака на
хлорид хрома (III):
CrCl3 + 3(Nh4·h3O) = Cr(OH)3 + 3Nh5Cl
Лабораторный опыт № 2
Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте раствор соляной кислоты, а к другой –
щелочь. Что происходит?
Какими свойствами обладает гидроксид хрома (III)?
HCl
CrCl3
NaOH
Cr(OH)3
Na3[Cr(OH)6]
Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте серной кислоты, а к другой – щелочь.
Что происходит?
+h3SO4
+NaOH
Гидроксид хрома (III) обладает амфотерными свойствами.
При взаимодействии с кислотами образуются соли хрома (III):
Составьте уравнение реакции гидроксида хрома (III) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД.
Cr(OH)3 + 3HCl = CrCl3 + 3h3O
Cr(OH)3 + 3H+ + 3Cl– = Cr3+ + 3Cl– + 3h3O
Cr(OH)3 + 3H+ = Cr3+ + 3h3O
Гидроксид хрома (III) растворяется в щелочах
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
гексагидроксохромат (III) натрия
(изумрудно-зеленый)
Cr(OH)3 + 3Na+ + 3OH– = 3Na+ + [Cr(OH)6]3–
Cr(OH)3 + 3OH– = [Cr(OH)6]3–
При нагревании гидроксид хрома (III) разлагается:
t°
2Cr(OH)3 = Cr2O3 + 3h3O
Соли хрома (III)
Хроматы (III) устойчивы в щелочной среде. Они легко
реагируют с кислотами:
недостаток кислоты:
NaCrO2 + HCl + h3O = Cr(OH)3 + NaCl
избыток кислоты:
NaCrO2 + 4HCl = CrCl3 + NaCl + 2h3O
с угольной кислотой
Na3[Cr(OH)6] + 3CO2 = Cr(OH)3 + 3NaHCO3
В растворе подвергаются полному гидролизу:
Cr2S3 + 6h3O = 2Cr(OH)3 + 3h3S
В водных растворах катион Cr3+ встречается только
в виде гидратированного иона [Cr(h3O)6] 3+, который
придает раствору сине-фиолетовый цвет.
Сульфат хрома (III) образует двойные соли – хромовые квасцы.
Из смешанного раствора сульфата хрома (III) и сульфата калия
кристаллизуется двойная соль
сине-фиолетового цвета.
–
KCr(SO4)2·12h3O
Применяются в качестве дубящего вещества при
изготовлении эмульсий, а также в дубящих растворах
и дубящих фиксажах.
Соединения хрома (III) могут проявлять как окислительные
так и восстановительные свойства.
K3[Cr(OH)6] + Br2 + KOH → K2CrO4 + KBr + h3O
CrCl3 + Zn → CrCl2 + ZnCl2
KCrO2 + PbO2 + KOH → K2CrO4 + K2PbO2 + h3O
CrCl3 + h3O2 + KOH → K2CrO4 + KCl + h3O
Cr2(SO4)3 + Cl2 + NaOH → Na2CrO4 + NaCl + h3O + Na2SO4
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
K3[Cr+3(OH)6] + Br20 + KOH → K2Cr+6O4 + KBr– + h3O
Cr+3 – 3e → Cr+6 2 окисление, восстановитель
Br20 + 2e → 2Br–1 3 восстановление, окислитель
2K3[Cr(OH)6] + 3Br2 + 4KOH = 2K2CrO4 + 6KBr + 8h3O
Cr+3Cl3 + Zn0 → Cr+2Cl2 + Zn+2Cl2
Cr+3 + 1e → Cr+2
Zn0 – 2e → Zn+2
2
1
восстановление, окислитель
окисление, восстановитель
2CrCl3 + Zn = 2CrCl2 + ZnCl2
KCr+3O2 + Pb+4O2 + KOH → K2Cr+6O4 + K2Pb+2O2 + h3O
Cr+3 – 3e → Cr+6
Pb+4 + 2e → Pb–2
2
3
окисление, восстановитель
восстановление, окислитель
2KCrO2 + 3PbO2 + 8KOH = 2K2CrO4 + 3K2PbO2 + 4h3O
Cr+3Cl3 + h3O2–1 + KOH → K2Cr+6O4 + KCl + h3O–2
Cr+3 – 3e → Cr+6 2
2O–1 + 2e → 2O–2 3
окисление, восстановитель
восстановление, окислитель
2CrCl3 + 3h3O2 + 10KOH = 2K2CrO4 + 6KCl + 8h3O
Cr2+3(SO4)3 + Cl20 + NaOH → Na2Cr+6O4 + NaCl– + h3O + Na2SO4
Cr+3 – 3e → Cr+6
Cl20 + 2e → 2Cl–1
2
3
окисление, восстановитель
восстановление, окислитель
Cr2(SO4)3 +3Cl2 +16NaOH = 2Na2CrO4 + 6NaCl + 8h3O +3Na2SO4
Оксид хрома (VI) CrO3 — хромовый ангидрид,
представляет собой темно-красные
игольчатые кристаллы.
Получают CrO3 действием избытка
концентрированной серной кислоты
на насыщенный водный раствор
дихромата натрия:
Na2Cr2O7 + 2h3SO4 = 2CrO3 + 2NaHSO4 + h3O
При нагревании выше 250 °C разлагается:
4CrO3 → 2Cr2O3 + 3O2↑.
Оксид хрома (VI) очень ядовит.
CrO3 — кислотный оксид.
При растворении в воде образует кислоты.
С избытком воды образуется хромовая
кислота h3CrO4
CrO3 + Н2O = Н2CrO4
При большой концентрации CrO3 образуется дихромовая
кислота
Н2Cr2О7
2CrO3 + Н2O = Н2Cr2O7
которая при разбавлении переходит в хромовую кислоту:
Н2Cr2О7 + Н2О = 2Н2CrO4
Эти кислоты – неустойчивые. Существуют только в растворе.
Между ними в растворе устанавливается равновесие
2Н2CrO4 ↔ Н2Cr2O7 + Н2O
При взаимодействии CrO3 со щелочами образуются хроматы
CrO3 + 2KOH → K2CrO4 + h3O.
CrO3 является сильным окислителем
Например этанол, ацетон и многие другие органические
вещества самовоспламеняются или даже взрываются при
контакте с ним.
CrO3 + C2H5OH → CO2 + Cr2O3 + h3O
C2H5OH + 3h3O – 12e → 2CO2 + 12H+
2CrO3 + 6H+ + 6e → Cr2O3 + 3h3O
1
2
C2H5OH + 3h3O + 4CrO3 + 12H+ = 2CO2 + 12H+ + 2Cr2O3 + 6h3O
4CrO3 + C2H5OH → 2CO2 + 2Cr2O3 + 3h3O
Окисляет йод, серу, фосфор, уголь.
4CrO3 + 3S = 2Cr2O3 + 3SO2↑.
Окисление ацетона хромовым ангидридом.
Если поместить оксид хрома на
фарфоровую пластинку и
капнуть на него несколько
капель ацетона,то через
несколько секунд ацетон
загорается. При этом оксид
хрома (VI) восстанавливается
до оксида хрома (III), а ацетон
окисляется до углекислого газа
и воды.
16CrO3 + 3Ch4– С – Ch4 → 9CO2 + 8Cr2O3 + 9h3O
О
Оксиду хрома (VI) соответствуют две кислоты –
хромовая Н2CrO4 и дихромовая Н2Cr2O7
Хромовая кислота —
кристаллическое вещество
красного цвета; выделена
в свободном состоянии
при охлаждении
насыщенных водных
растворов CrO3; хромовая
кислота — электролит
средней силы.
Изополихромовые кислоты
существуют в водных
растворах, окрашенных в
красный цвет
соли
хроматы – соли хромовой кислоты
устойчивы в щелочной среде, при
подкислении переходят в оранжевые
дихроматы, соли двухромовой
кислоты. Реакция обратима, поэтому
при добавлении щелочи желтая
окраска хромата восстанавливается.
2CrO42– + 2H+ ↔ Cr2O72– + h3O
хроматы
Н+
ОН–
дихроматы
Лабораторный опыт № 3
К раствору дихромата калия добавьте гидроксид калия.
Как изменилась окраска? Чем это вызвано?
К полученному раствору добавьте
серной кислоты до восстановления
желтой окраски.
Напишите уравнения реакций.
2K2CrO4 + h3SO4(разб.) = K2Cr2O7 + K2SO4 + h3O
2K2CrO4 + 2HCl(разб.) = K2Cr2O7 + 2KCl + h3O
2K2CrO4 + h3O + CO2 = K2Cr2O7 + KHCO3
K2Cr2O7 + 2KOH = 2K2CrO4 + h3O
Взаимопревращение хроматов и дихроматов
Оксиду хрома (VI) соответствуют две кислоты –
хромовая Н2CrO4 и дихромовая Н2Cr2O7, Хромат калия
K2CrO4 и дихромат калия K2Cr2O7 – соли этих кислот.
Хроматы – желтого цвета, дихроматы – оранжевого. В
кислой среде хромат-ион превращается в дихромат-ион. В
присутствии щелочи дихроматы снова становятся
хроматами. Хромат калия превращаем в дихромат,
добавляя кислоту. Желтый раствор становится оранжевым.
2K2CrO4 + h3SO4 = K2Cr2O7 + K2SO4 + h3O
В стакан с дихроматом калия добавляем щелочь, оранжевый
раствор становится желтым – дихроматы превращаются в
хроматы.
K2Cr2O7 + 2KOH = 2K2CrO4 + h3O
Соединения хрома (VI) –
сильные окислители
H+
Cr3+
Cr2O72– + 14H+ + 6e → 2Cr3+ + 7h3O
2–
Cr2O7
h3O
OH–
Cr(OH)3
[Cr(OH)6
3–
]
Cr2O72– + 7Н2О + 6e → 2[Cr(OH)6]3– + 2ОН–
Окислительные свойства дихроматов
Дихроматы, например дихромат калия K2Cr2O7 – сильные
окислители. Под действием восстановителей дихроматы в
кислой среде переходят в соли хрома (III). Примером такой
реакции может служить окисление сульфита натрия
раствором дихромата калия в кислой среде. К раствору
дихромата калия добавляем серную кислоту и раствор
сульфита натрия.
K2Cr2O7 +3Na2SO3+4h3SO4 =Cr2(SO4)3 + 3Na2SO4+ K2SO4 + 4h3O
Оранжевая окраска, характерная для дихроматов, переходит в
зеленую. Образовался раствор сульфата хрома (III) зеленого
цвета. Соли хрома — ярко окрашены, именно поэтому элемент
получил такое название: «хром», что в переводе с греческого
означает «цвет, краска».
опыт
Zn + K2Cr2O7 + h3SO4 → ZnSO4 + Cr2(SO4)3 + K2SO4 +h3O
K2Cr2O7 + h3S + h3SO4 → S + Cr2(SO4)3 + K2SO4 +h3O
K2Cr2O7 + h3O2 + h3SO4 → O2 + Cr2(SO4)3 + K2SO4 +h3O
K2Cr2O7 + h3O + h3S → S + Cr(OH)3 + KOH
K2Cr2O7 + h3O + K2S → S + K3[Cr(OH)6] + KOH
K2Cr2O7 + KOH + (Nh5)2S → S + K3[Cr(OH)6] + Nh4
Дихроматы проявляют окислительные свойства не только в
растворах, но и в твердом виде:
K2Cr2O7 + S → K2SO4 + Cr2O3
K2Cr2O7 + С → K2СO3 + СО + Cr2O3
K2Cr2O7 + Al → Cr + KAlO2 + Al2O3
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Zn0 + K2Cr2+6O7 + h3SO4 → Zn+2SO4 + Cr2+3(SO4)3 + K2SO4 +h3O
Cr+6 + 3e → Cr+3
Zn0 – 2e → Zn+2
2
3
восстановление, окислитель
окисление, восстановитель
3Zn + K2Cr2O7 + 7h3SO4 = 3ZnSO4 + Cr2(SO4)3 + K2SO4 + 7h3O
K2Cr2+6O7 + h3S–2 + h3SO4 → S0 + Cr2+3(SO4)3 + K2SO4 + h3O
Cr+6 + 3e → Cr+3
S–2 – 2e → S0
2
3
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + 3h3S + 4h3SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7h3O
K2Cr2+6O7 + h3O2–1 + h3SO4 → O20 + Cr2+3(SO4)3 + K2SO4 +h3O
Cr+6 + 3e → Cr+3
2O–1 – 2e → O20
2 восстановление, окислитель
3 окисление, восстановитель
K2Cr2O7 + 3h3O2 + 4h3SO4 = 3O2 + Cr2(SO4)3 + K2SO4 + 7h3O
K2Cr2+6O7 + h3O + h3S–2 → S0 + Cr+3(OH)3 + KOH
2Cr+6 + 6e → 2Cr+3 1
S–2 – 2e → S0
3
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + h3O + 3h3S = 3S + 2Cr(OH)3 + 2KOH
K2Cr2+6O7 + h3O + K2S–2 → S0 + K3[Cr+3 (OH)6] + KOH
2Cr+6 + 6e → 2Cr+3 1 восстановление, окислитель
S–2 – 2e → S0
3 окисление, восстановитель
K2Cr2O7 + 7h3O + 3K2S = 3S + 2K3[Cr(OH)6] + 2KOH
K2Cr2+6O7 + KOH +h3O + (Nh5)2S–2 → S0 + K3[Cr+3(OH)6] + Nh4
2Cr+6 + 6e → 2Cr+ 1 восстановление, окислитель
S–2 – 2e → S0
3 окисление, восстановитель
K2Cr2O7 + 4KOH + h3O + 3(Nh5)2S = 3S + 2K3[Cr(OH)6] + 6Nh4
K2Cr2+6O7 + S0 → K2S+6O4 + Cr2+3O3
Cr+6 + 3e → Cr+3 2
S0 – 6e → S+6
1
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + S = K2SO4 + Cr2O3
K2Cr2+6O7 + С0 → K2С+4O3 + С+2О + Cr2+3O3
Cr+6 + 3e → Cr+3
С0 – 4e → С+4
С0 – 2e → С+2
3
4
2
2
1
1
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + 2С = K2СO3 + СО + Cr2O3
K2Cr2+6O7 + Al0 → Cr0 + KAlO2 + Al2+3O3
2Cr+6 + 6e → 2Cr+3 1 восстановление, окислитель
Al0 – 3e → Al+3
2 окисление, восстановитель
K2Cr2O7 + 4Al = 2Cr + 2KAlO2 + Al2O3
Дихромат калия (хромпик) широко применяется как окислитель
органических соединений:
3С2H5OH + K2Cr2O7 + 4h3SO4
Ch4– CHO + Cr2(SO4)3 + K2SO4 + 7h3O
3С3H7OH + K2Cr2O7 + 4h3SO4
3Ch4– C–Ch4 + Cr2(SO4)3 + K2SO4 + 7h3O
║
O
Хроматы щелочных металлов плавятся без разложения, а
дихроматы при высокой температуре превращаются в хроматы
Дихромат аммония разлагается при нагревании:
(Nh5)2Cr2O7
180°C
Cr2O3 + N2 + 4h3O
В ряду гидроксидов хрома различных степеней окисления
Cr(ОН)2 — Cr(ОН)3 — Н2CrО4
закономерно происходит ослабление основных свойств и
усиление кислотных. Такое изменение свойств обусловлено
увеличением степени окисления и уменьшением ионных
радиусов хрома. В этом же ряду последовательно
усиливаются окислительные свойства.
Соединения Cr (II) — сильные восстановители, легко
окисляются, превращаясь в соединения хрома (III).
Соединения хрома(VI) — сильные окислители, легко
восстанавливаются в соединения хрома (III).
Соединения хрома (III), могут при взаимодействии с
сильными восстановителями проявлять окислительные
свойства, переходя в соединения хрома (II), а при
взаимодействии с сильными окислителями проявлять
восстановительные свойства, превращаясь в соединения
хрома (VI).
Соединения хрома
Степень окисления хромa
Оксид
Гидроксид
+2
CrO
+3
+6
Cr2O3
CrO3
Cr(OH)2 Cr(OH)3 h3CrO4
h3Cr2O7
Кислотные и окислительные свойства возрастают
Основные и восстановительные свойства возрастают
Начала химии. Современный курс для поступающих в
ВУЗы. – М.: 1Федеративная Книготорговая Компания.
Химия. Подготовка к ЕГЭ: учебно-методическое пособие /
Под ред. В.Н. Доронькина. – Ростов н/Дону: Легион
Химия. Пособие для поступающих в вузы /О.О.
Максименко. – М. : Филол. о-во СЛОВО: Изд-во Эксмо
Интернет-ресурсы (картинки, видеофрагменты: 1) Единая
образовательная коллекция цифровых ресурсов. Химия.
Неорганическая химия. Металлы побочных подгрупп. Хром.
Видеопыты. http://school-collection.edu.ru/
2) Образовательная коллекция
Химия для всех XXI
Химические опыты со взрывами и без
http://ppt4web.ru/khimija/khrom1.html
75. Техника безопасности при работе с соединениями хрома
ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С
СОЕДИНЕНИЯМИ ХРОМА
При работе с препаратами хрома не
допускать их попадания на кожу и внутрь
организма.
Соединения хрома высших степеней
окисления оказывают раздражающее и
сжигающее действие на слизистые оболочки
и кожу. В трещинах кожного покрова или
порезах оксид хрома (VI) СгО3 и дихроматы
способны вызывать долго не заживающие
язвы.
Дихроматы более опасны, чем хроматы.
Менее опасны соединения хрома со
степенью окисления +3, однако
установлено, что пыль оксида хрома (III)
Cr2O3, которая образуется при разложении
дихромата аммония (Nh5)2Cr2О7 и
алюмотермии оксидов хрома, взывает
раздражение и способна в конечном счете
привести к тяжелейшим заболеваниям
легких.
77. Лабораторный практикум
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Опыт 1. Получение и свойства хроматов и дихроматов
Смещение равновесия между хромат(VI)- и дихромат(VI)- ионами.
К раствору
прилейте 2 моль/л раствор серной кислоты, а к раствору
K2Cr2O7 – 2 моль/л раствор КOH.
Запишите наблюдения. Напишите в ионном виде уравнение реакции,
объясняющее изменение окраски растворов.
2K2CrO4 + h3SO4 ……….
K2Cr2O7 + 2KOH ………..
Окислительные свойства соединений хрома (VI). К раствору дихромата
калия, подкисленному 2 моль/л раствором серной кислоты, прилейте раздельно в
2-х пробирках растворы NaNO2 и Na2S. Запишите наблюдения.
Напишите и уравняйте уравнения реакций ионно электронным методом:
K2Cr2O7+ NaNO2 +h3SO4
K2Cr2O7+h3SO4+Na2S
K2Cr2O7+h3SO4+С2Н5ОН
Оксид хрома — обзор
8.1.2 Фазовые равновесия с оксидом хрома
В системе Cr 2 O 3 -Al 2 O 3 оксид хрома не образует промежуточных фаз с оксидом алюминия, учитывая что область непрерывных твердых растворов существует ниже линии солидуса, по крайней мере, выше 1500 К. При более низких температурах твердый раствор имеет тенденцию распадаться на два изоморфных раствора с высоким содержанием хрома и оксидом алюминия. Область сосуществования этих двух растворов составляет примерно от 15% до 25% до 50-70 мол.% Cr 2 O 3 , но точное положение границы раздела фаз остается предметом обсуждения.
Надежные данные о фазовых равновесиях в системе хрома-кремнезем и присутствии металлического хрома в контакте с силикатными расплавами важны для оптимизации шлаковых режимов восстановительных процессов при производстве хромовых ферросплавов. Эти данные представляют большой теоретический и практический интерес для производства хромсодержащих сталей и окислительного обезуглероживания высокоуглеродистого феррохрома в конвертерах.В условиях высокого окислительного потенциала газовой фазы и отсутствия металлического хромсодержащего расплава кремнезем не реагирует с Cr 2 O 3 .
В восстановительных условиях (низкий окислительный потенциал газовой фазы и присутствие металлического хрома) взаимодействие кремнезема с оксидом хрома (Cr 2 O 3 ) сопровождается восстановлением Cr 3+ → Cr 2+ с последующим образованием силикатного расплава «CrO» -SiO 2 .Здесь гипотетическая фазовая диаграмма (рис. 8.10) показывает, где оксид «CrO» используется вместо Cr 2 O 3 . Как показано для системы Cr-O, в чисто кислой (богатой кремнеземом) среде соотношение Cr 3+ / Cr 2+ существенно снижается, что приводит к тому, что форма Cr 2+ находится в равновесии с кремнеземом. -богатые таеты. Поскольку CrO не является независимой стабильной фазой при нормальных условиях, он описывается составом Cr 2 O 3 + Cr в областях, обедненных кремнеземом.На рисунке 8.10 также показана область существования силиката хрома Cr 2 SiO 4 . Хотя это приблизительное описание, оно объясняет некоторые технологические методы, используемые при производстве хромистых ферросплавов и сталей.
РИСУНОК 8.10. Фазовая диаграмма «CrO» -SiO 2 .
В отличие от кремнезема кальций как основной оксид смещает равновесие в сторону более высоких валентностей хрома в присутствии кислорода. CaO образует хромит кальция (CaCr 2 O 4 ) с Cr 2 O 3 при высоких температурах в богатой хромом области (рис.8.11). Этот хромит нестабилен при более низких температурах, и о его составе также сообщалось как (Ca 2 Cr 3 ) Cr 10 O 20 , то есть в виде смешанного хромита кальция и хрома (Decterov and Pelton, 1997 ). При увеличении содержания CaO соотношение Cr 6+ / Cr 3+ увеличивается и образуется хромат кальция CaCrO 4 . Далее были идентифицированы еще два комплексных соединения (хромит-хроматы кальция) состава 9CaO · 4CrO 3 · Cr 2 O 3 и 3CaO · 2CrO 3 · Cr 2 O 3 .Было также предложено рассматривать эту диаграмму как часть тройного равновесия CaO-Cr 2 O 3 -CrO 3 (Kaiser et al., 1992; Lyakishev, Gasik, 1998). Например, Кайзер и др. (1992) определили составы Ca 5 (CrO 4 ) 3 O как стабильные на воздухе между 776 ° и 959 ° C, Ca 3 (CrO 4 ) 2 между 882 ° и 1253 ° C и Ca 5 (CrO 4 ) 3 между 1140 ° C и 1297 ° C, но нестабилен в восстановительных условиях.
РИСУНОК 8.11. Фазовая диаграмма CaO-Cr 2 O 3 .
Существенное снижение температуры ликвидуса (<1775 ° C) в диапазоне составов (от 30% до 60% Cr 2 O 3 ) используется для переработки кальциево-хромистых расплавов при производстве низкоуглеродистого FeCr путем смешивание расплавов FeSiCr и CaO-Cr 2 O 3 .
Помимо равновесия оксида хрома с CaO и SiO 2 , система Cr 2 O 3 -MgO является одной из наиболее важных систем в производстве ферросплавов и сталей.В этой системе образуется только одно соединение (магниевая шпинель MgCr 2 O 4 ), но MgO имеет широкий диапазон растворимости, снижающейся с понижением температуры (рис. 8.12). Сообщалось также, что хромит магния имеет некоторый диапазон гомогенности.
РИСУНОК 8.12. Фазовая диаграмма MgO-Cr 2 O 3 при P O 2 = 0,2 атм.
Бинарные системы с Cr 2 O 3 , рассмотренные ранее, явно не проявляются как таковые в процессах производства ферросплавов, но они формируют основу для тройных и более сложных комбинаций.Наиболее важные из них кратко представлены в этой главе.
В тройной системе Cr 2 O 3 -Al 2 O 3 -SiO 2 , большая область твердых растворов корунда, а также узкое длинное поле муллита (3Al 2 O 3 · 2SiO 2 ) (Лякишев и Гасик, 1998). Жидкий состав тройной эвтектики имеет 6% мас. Al 2 O 3 и 1% мас. Cr 2 O 3 .В конце концов, здесь не возникает равновесия тройных соединений. Из-за взаимной растворимости оксида алюминия и оксида хрома (фаза корунда) оксид алюминия, возможно, не влияет на соотношение Cr 2+ / Cr 3+ в такой степени, как диоксид кремния.
Напротив, в тройной системе Cr 2 O 3 -CaO-SiO 2 присутствует тройное соединение 3CaO · Cr 2 O 3 · 3SiO 2 , что соответствует природный минерал уваровит (Ca 3 Cr 2 Si 3 O 12 ), относящийся к группе гранатов.Если хром присутствует в окисленном состоянии 3+ (кислородный потенциал в газовой фазе достаточно высок), жидкая фаза имеет разрыв для смешивания двух жидкостей: почти чистого кремнезема и богатого кремнеземом расплава с 27% мас. CaO и ~ 1% мас. Cr 2 O 3 .
Однако, как было отмечено для бинарных систем, уровень кислородного потенциала, присутствие металлического хрома и основность шлака (соотношение CaO / SiO 2 ) оказывают сильное влияние на степень окисления хрома, которая может измениться с + От 2 («CrO») до +6 (CrO 3 ).Экспериментальные исследования (Villiers and Muan, 1992; Xiao and Holappa, 1993) подтвердили, что для реальных условий более правильное равновесие ликвидуса и твердых веществ может быть достигнуто, если эта система рассматривается как четвертичная: CaO-CrO-Cr 2 O 3 -SiO 2 .
Для системы Cr 2 O 3 -MgO-SiO 2 не сообщалось о тройных соединениях, но был обнаружен большой разрыв в смешиваемости. Основными фазами в этой системе являются по существу хромия, MgO и MgCr 2 O 4 , примыкающие к двойной Cr 2 O 3 -SiO 2 .
Замена различных оксидов по-разному влияет на активность хрома (Xiao and Holappa, 1993). Как и следовало ожидать, замещение СаО в шлаках на MgO снижает активность оксидов хрома, но не оказывает существенного влияния на соотношение Cr 2+ / Cr 3+ . Незначительные добавки оксида алюминия увеличивают активность оксидов хрома, тогда как более высокие количества не вызывают такого эффекта. Это показывает, что шлаки обработки феррохрома могут вести себя по-разному, если их состав изменяется в процессе.
Практическая задача 14
Практическая задача 14
Практическая задача 14
Определить степень окисления хрома в неизвестном
соль, если электролиз расплавленной пробы этой соли за 1,50
часов при токе 10,0 А наносит 9,71 грамма хрома
металл на катоде.
Решение
Начнем, как и раньше, с подсчета количества молей
электроны, прошедшие через ячейку во время электролиза.
Так как нам неизвестно сбалансированное уравнение реакции при
катод в этой ячейке, не кажется очевидным, как мы
собираюсь использовать эту информацию. Поэтому мы записываем это
появиться на видном месте и вернуться к исходному
постановка вопроса, чтобы посмотреть, что еще можно сделать.
Задача сообщает нам массу хрома, отложившегося в
катод. К настоящему времени должно быть очевидно, что нам нужно преобразовать
эту информацию в количество молей металлического хрома
сгенерировано.
Теперь мы знаем количество произведенных молей металлического хрома и
количество электронов, необходимое для производства этого металла.
Поэтому мы могли бы посмотреть на отношения между родинками
электронов, потребляемых в этой реакции, и молей хрома
произведено.
Три моля электронов расходуются на каждый моль
хром металлический произведен. Единственный способ объяснить это —
Предположим, что результирующая реакция на катоде включает уменьшение
Ионы Cr 3+ в металлический хром.
| Катод (-): | Cr 3+ + 3 e — Cr |
Таким образом, степень окисления хрома в неизвестной соли
должно быть +3.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Степени окисления переходных металлов
Степень окисления элемента связана с количеством электронов, которые атом теряет, получает или использует при соединении с другим атомом в соединениях.Он также определяет способность атома окислять (терять электроны) или восстанавливать (приобретать электроны) другие атомы или частицы. Почти все переходные металлы имеют несколько потенциальных степеней окисления.
Введение
Для заполнения атомных орбиталей требуется определенное количество электронов. S-блок состоит из элементов I и II групп, щелочных и щелочноземельных металлов (к этому блоку относятся натрий и кальций). Группы с XIII по XVIII состоят из p-блока, который содержит неметаллы, галогены и благородные газы (общие элементы — углерод, азот, кислород, фтор и хлор).Переходные металлы находятся в d-блоке между группами III и XII. Если следующая таблица кажется странной или если ориентация неясна, просмотрите раздел об атомных орбиталях.
| с Орбитальная | p Орбитали | d Орбитали |
|---|---|---|
| 1 орбиталь, 2 электрона | 3 орбитали: p x , p y , p z ; 6 электронов | 5 орбиталей: d x 2 -y 2 , d z 2 , d xy , d yz , d xz ; 10 электронов |
| Орбиталь с наибольшей энергией для данного квантового числа n | Вырожденные с s-орбиталью квантового числа n + 1 |
Главное, что нужно помнить об электронной конфигурации, — это то, что наиболее стабильная конфигурация благородного газа идеальна для любого атома.Формирование связей — способ приблизиться к этой конфигурации. В частности, переходные металлы образуют более мягкие связи с анионами, катионами и нейтральными комплексами по сравнению с другими элементами. Это связано с тем, что d-орбиталь довольно размыта (в большей степени f-орбиталь серий лантанидов и актинидов).
Конфигурации нейтрального атома электронов
Счет по периодической таблице — простой способ определить, какие электроны существуют на каких орбиталях. Как упоминалось ранее, подсчитывая протоны (атомный номер), вы можете определить количество электронов в нейтральном атоме.Блочная организация ускоряет этот процесс. Если вы не уверены в этой системе счета и в заполнении электронных орбиталей, см. Раздел о конфигурации электронов.
Например, если бы мы были заинтересованы в определении электронной организации Ванадий (атомный номер 23), мы бы начали с водорода и пошли вниз по Периодической таблице).
1s (H, He), 2s (Li, Be), 2p (B, C, N, O, F, Ne), 3s (Na, Mg), 3p (Al, Si, P, S, Cl, Ar ), 4s (K, Ca), 3d (Sc, Ti, V).
Рисунок \ (\ PageIndex {1} \): Периодическая таблица (общественное достояние; PubChem)
Ссылка на периодическую таблицу ниже подтверждает эту организацию. У нас есть три элемента на трехмерной орбите. Поэтому мы пишем в порядке заполнения орбиталей.
1с 2 2с 2 2p 6 3s 2 3p 6 4s 2 3d 3
или
[Ar] 4s 2 3d 3 .
Конфигурации нейтральных атомов переходных металлов четвертого периода приведены в Таблице \ (\ PageIndex {2} \).
| SC | Ti | В | Cr | Mn | Fe | Co | Ni | Cu | Zn |
|---|---|---|---|---|---|---|---|---|---|
| [Ar] 4s 2 3d 1 | [Ar] 4s 2 3d 2 | [Ar] 4s 2 3d 3 | [Ar] 4s 2 3d 4 | [Ar] 4s 2 3d 5 | [Ar] 4s 2 3d 6 | [Ar] 4s 2 3d 7 | [Ar] 4s 2 3d 8 | [Ar] 4s 2 3d 9 | [Ar] 4s 2 3d 10 |
| [Ar] 4s 1 3d 5 | [Ar] 4s 1 3d 10 |
Хром и медь кажутся аномальными.Кратко посмотрите, где элемент , хром (атомный номер 24) находится в Периодической таблице (рисунок \ (\ PageIndex {1} \)). Электронная конфигурация хрома — не [Ar] 4s 2 3d 4 , а [Ar] 4s 1 3d 5 . Это связано с тем, что наполовину заполненное трехмерное многообразие (с одним 4s-электроном) более стабильно, чем частично заполненное d-многообразие (и заполненное 4s-многообразие). Вы заметите из Таблицы \ (\ PageIndex {2} \), что медь демонстрирует подобное явление, хотя и с полностью заполненным d-многообразием.
Состояния окисления ионов переходных металлов
Когда мы рассматриваем ионы, мы складываем или вычитаем отрицательные заряды атома. Учет атомных орбиталей при назначении степеней окисления помогает понять, что переходные металлы представляют собой особый случай, но не исключение из этого удобного метода. Атому, который принимает электрон для достижения более стабильной конфигурации, присваивается степень окисления -1. Пожертвование электрона тогда +1. Когда переходный металл теряет электроны, он имеет тенденцию терять свои s-орбитальные электроны раньше, чем любой из своих d-орбитальных электронов.Для более подробного обсуждения формы этих соединений см. Образование координационных комплексов.
Пример \ (\ PageIndex {1} \)
Запишите электронные конфигурации:
- нейтральное железо,
- ионов железа (II) и
- ион железа (III).
- Ответ
Атомный номер железа 26, поэтому в составе 26 протонов.
- Fe: [Ar] 4s 2 3d 6
- Fe 2 + : [Ar] 3d 6
- Fe 3 + : [Ar] 3d 5
- Обратите внимание, что s-орбитальные электроны теряются , сначала , затем d-орбитальные электроны.
Пример \ (\ PageIndex {2} \)
Определите более стабильную конфигурацию между следующей парой:
- [Kr] 5s 2 4d 6 по сравнению с [Kr] 5s 1 4d 7
- Ag 1 + по сравнению с Ag 2 +
- Ответ
- Это описание рутения. Есть только один электрон 5s.
- Однократно окисленное серебро ([Kr] 4d 10 ) более стабильно, чем дважды — ([Kr] 4d 9 ).
Состояния множественного окисления
Большинство переходных металлов имеют несколько степеней окисления, поскольку для переходных металлов относительно легко потерять электрон (ы) по сравнению с щелочными металлами и щелочноземельными металлами. Щелочные металлы имеют один электрон на своей валентной s-орбитали, а их ионы почти всегда имеют степень окисления +1 (из-за потери одного электрона). Точно так же щелочноземельные металлы имеют два электрона на s-орбиталях валентности, что приводит к образованию ионов со степенью окисления +2 (от потери обоих).Однако переходные металлы более сложны и демонстрируют диапазон наблюдаемых состояний окисления, главным образом из-за удаления d-орбитальных электронов. В следующей таблице описаны наиболее распространенные степени окисления элементов периода 3.
Скандий — один из двух элементов в первом периоде переходного металла, который имеет только одну степень окисления (цинк — другой, со степенью окисления +2). Все остальные элементы имеют по крайней мере две разные степени окисления. Марганец, который находится в середине периода, имеет наибольшее количество степеней окисления и, действительно, самую высокую степень окисления за весь период, поскольку он имеет пять неспаренных электронов (см. Таблицу ниже).
Чтобы помнить о стабильности более высоких степеней окисления переходных металлов, важно знать тенденцию: стабильность более высоких степеней окисления постепенно увеличивается вниз по группе. Например, в группе 6 (хром) Cr наиболее стабилен в степени окисления +3, а это означает, что вы не найдете много стабильных форм Cr в степенях окисления +4 и +5. Напротив, существует множество стабильных форм молибдена (Mo) и вольфрама (W) в степенях окисления +4 и +5.
Пример \ (\ PageIndex {3} \)
Что делает цинк стабильным, как Zn 2 + ? Что делает скандий стабильным как Sc 3 + ?
- Ответ
Цинк имеет нейтральную конфигурацию [Ar] 4s 2 3d 10 .Потеря 2 электронов не изменяет полную d-орбиталь. Нейтральный скандий записывается как [Ar] 4s 2 3d 1 . Потеря 3 электронов переводит конфигурацию в благородное состояние с валентностью 3p 6 .
Пример \ (\ PageIndex {4} \)
Почему железо почти всегда Fe 2 + или Fe 3 + ?
- Ответ
Железо записывается как [Ar] 4s 2 3d 6 .Потеря 2 электронов с s-орбитального (3d 6 ) или 2 s- и 1 d-орбитального (3d 5 ) электрона представляет собой довольно стабильные состояния окисления.
Пример \ (\ PageIndex {5} \)
Напишите оксиды марганца в нескольких различных степенях окисления. Какие из них возможны и / или разумны?
- Ответ
Хотя Mn +2 является наиболее стабильным ионом марганца, d-орбиталь может быть удалена от 0 до 7 электронов.Следовательно, соединения марганца варьируются от Mn (0) до Mn (s) , Mn (II) как MnO, Mn (II, III) как Mn 3 O 4 , Mn (IV) как MnO 2 , или диоксид марганца, Mn (VII) в перманганат-ионе MnO 4 — и т. д.
Состояние окисления переходных металлов в соединениях
Если дано ионное соединение, такое как \ (\ ce {AgCl} \), вы можете легко определить степень окисления переходного металла. В этом случае вас попросят определить степень окисления серебра (Ag).Поскольку мы знаем, что хлор (Cl) находится в группе галогенов периодической таблицы, мы знаем, что он имеет заряд -1, или просто Cl —. Вдобавок, увидев, что нет общего заряда для \ (\ ce {AgCl} \) (который определяется при взгляде на верхний правый угол соединения, то есть AgCl # , где # представляет собой общий заряд соединение), можно сделать вывод, что серебро (\ (\ ce {Ag} \)) имеет степень окисления +1. Это дает нам Ag + и Cl —, в которых положительный и отрицательный заряд компенсируют друг друга, в результате чего получается общий нейтральный заряд; поэтому +1 подтверждается как степень окисления серебра (Ag).{-}} \)). Поскольку есть два брома каждый с зарядом -1. Кроме того, мы знаем, что \ (\ ce {CoBr2} \) имеет общий нейтральный заряд, поэтому мы можем сделать вывод, что катион (кобальт), \ (\ ce {Co} \) должен иметь степень окисления +2 до нейтрализовать заряд -2 от двух анионов брома.
Пример \ (\ PageIndex {7} \)
Какова степень окисления цинка в \ (\ ce {ZnCO3} \). (Примечание: анион \ (\ ce {CO3} \) имеет зарядовое состояние -2)
- Ответ
Зная, что \ (\ ce {CO3} \) имеет заряд -2, и зная, что общий заряд этого соединения нейтрален, мы можем заключить, что цинк имеет степень окисления +2.{-}} \).
Этот пример также показывает, что атомы марганца могут иметь степень окисления +7, которая является наивысшей возможной степенью окисления для переходных металлов четвертого периода.
Марганец: пример из практики
Марганец широко изучается, поскольку он является важным восстановителем в химическом анализе, а также изучается в биохимии для катализа и в металлургии для обогащения сплавов. В растениях марганец требуется в следовых количествах; более сильные дозы начинают вступать в реакцию с ферментами и подавлять некоторые клеточные функции.Благодаря гибкости марганца в отношении многих степеней окисления, он становится хорошим примером для описания общих тенденций и концепций, лежащих в основе электронных конфигураций.
Рисунок \ (\ PageIndex {2} \): (слева) грубый фрагмент блестящего серебристого металла (CC BY-SA 3.0; Томихандорф через Википедию) (справа). В некоторых наскальных рисунках Ласко используются пигменты на основе марганца. (Public Domain; Prof saxx через Wikipedia)
Считается, что электронные конфигурации неспаренных электронов являются парамагнитными , и реагируют на близость магнитов.{0} \ nonumber \]
Поскольку все 3p-орбитали парные, этот комплекс диамагнитен.
Сводка
Состояния окисления переходных металлов подчиняются общим правилам для большинства других ионов, за исключением того факта, что d-орбиталь вырождена с s-орбиталью большего квантового числа. Переходные металлы достигают стабильности, располагая свои электроны соответствующим образом и окисляясь, или они теряют электроны в пользу других атомов и ионов. Эти образующиеся катионы участвуют в образовании координационных комплексов или синтезе других соединений.
Вопросы
Определите степень окисления переходных металлов, содержащихся в этих нейтральных соединениях. Примечание: переходный металл подчеркнут в следующих соединениях.
(A) Медь (I) Хлорид: Cu Cl (B) Медь (II) Нитрат: Cu (NO 3 ) 2 (C) Золото (V) Фторид: Au F 5 (D) Железо (II) Оксид: Fe O (E) Железо (III) Оксид: Fe 2 O 3 (F) Свинец (II) Хлорид: Pb Cl 2 (G) Свинец (II) Нитрат: Pb (NO 3 ) 2 (H) Марганец (II) Хлорид: Mn Класс 2 (I) Триоксид молибдена : Mo O 3 (J) Никель (II) Гидроксид: Ni (OH) 2 (K) Платина (IV) Хлорид: Pt Cl 4 (L) Серебро Сульфид: Ag 2 S (M) Вольфрам (VI) Фторид: W F 6 (N) Ванадий (III) Нитрид: V N (O) Цирконий Гидроксид: Zr (OH) 4 - Определите степень окисления переходного металла для общего ненейтрального соединения: манганат ( Mn O 4 2 — )
- Почему переходные металлы имеют большее количество степеней окисления, чем металлы основной группы (т.е.е. щелочные металлы и щелочноземельные металлы)?
- Какой переходный металл имеет наибольшее количество степеней окисления?
- Почему количество степеней окисления переходных металлов увеличивается в середине группы?
- Какие два переходных металла имеют только одну степень окисления?
Список литературы
- Окстоби Д., Гиллис Х. П., Кэмпион А. Принципы современной химии, 6 th ed. Томсон Брукс / Коул, Бельмонт.2008; 313-318.
- Audi A, Sherwood, P. Рентгеновские фотоэлектронные спектроскопические исследования в валентной зоне марганца и его оксидов, интерпретированные расчетами кластерной и зонной структуры ; Серфинг. Интерфейс Анал .; 2002; 33; 274-282.
- Рини С., Квик-Урибе С., Смит Д. Состояние окисления марганца и его значение для токсичности. Chem. Res. Toxicol .; 2002; 15; 1119-1126.
- Справочник CRC, 88 th ed. Sct. 1, Prt. 1 Электронная конфигурация и энергия ионизации нейтральных атомов в основном состоянии ; 13-14.
- Справочник CRC, 88 th ed. Sct. 4, пр. 1 Температуры плавления, кипения, тройных и критических точек элементов ; 133-134.
Авторы и авторство
- Марго Крейтман (UCD), Джослин Вуд, Лиза Чу (UCD)
Степень окисления +2 Cr, включенного в кристаллическую решетку UO 2
Расчетный UO, легированный хромом
2
Чтобы выполнить вычисления DFT + U , мы сначала вывели параметр Hubbard U для элементы d и f в рассматриваемых соединениях (оксиды Cr и U, см. рис.1 для расчетной структуры UO 2 ). Расчетное значение параметра Хаббарда U для Cr в Cr 2 O 3 (то есть Cr 3+ ) составляет 4,0 эВ, что согласуется с тем, которое использовалось в предыдущих исследованиях хромсодержащих систем (~ 3,5 эВ, например, ссылки 6,18,19,20,21 ). Для Cr 2+ мы использовали значение 6.5 эВ, полученное нами для CrO. То же значение, которое мы получили для Cr 2+ в UO 2 , и мы заметили, что полученный параметр Хаббарда U сильно зависит от степени окисления Cr, но слабо зависит от локального окружения Cr.Поэтому мы решили использовать зависящие от степени окисления значения, полученные для оксидов Cr, во всех расчетах UO 2 , легированного Cr. Для UO 2 мы использовали 1,7 эВ, полученное для UO 2 Беридзе и Ковальски 22 , что также является типичным для U 4+ видов 15,22,23 . Подробная информация и обсуждение параметра решетки, ширины запрещенной зоны и спектральных сигнатур, связанных с рентгеновскими лучами, полученных для UO 2 , а также других оксидов урана с применением применяемой вычислительной методологии, представлены в предыдущих исследованиях 15,22 .
Рис. 1: Структура вычисленной суперячейки UO 2 .
Стрелки указывают расчетное поперечное расположение антиферромагнитных спинов 1k, которое было обнаружено Пеггом и др. 52 в качестве предпочтительной магнитной структуры в UO 2 и принятой в наших исследованиях.
Первоначально мы вычислили два наиболее вероятных случая легированного хромом UO 2 , а именно: (1) катионный обмен с образованием частиц U 5+ и (2) катионный обмен двух соседних центров с образование O-вакансии на мостиковом участке кислорода, присоединенном к атомам Cr, как было предложено Guo et al. 11 . Обе конфигурации визуализированы на рис. 2 и помечены как 1Cr и 2Cr + 1Ov соответственно. После интерпретации измерений XANES Riglet-Martial et al. 4 , в обоих случаях мы изначально предполагали образование разновидностей Cr 3+ . В случае (1) мы предположили баланс заряда за счет образования одного U 5+ на один атом Cr. Кроме того, для случая (1) мы попытались вычислить системы с частицами Cr 2+ и Cr 4+ , обеспечив начальное заполнение d -орбиталей Cr (4, 3 и 2 9 1066 d электронов для Cr 2+ , Cr 3+ и Cr 4+ соответственно).Удивительно, но во всех расчетах полученная электронная конфигурация всегда была конфигурацией Cr 2+ (т.е. четыре электрона) с зарядом, уравновешенным образованием частиц U 5+ . Например, в случае (2) с образованием двух разновидностей Cr 2+ мы получили пару U 5+ .
Рис. 2: Вычисленные суперячейки, представляющие различные рассматриваемые конфигурации включения Cr.
В случаях 1Cr + 1Ov (a) и 2Cr + 2Ov (a) Cr смещается в сторону пустого междоузельного участка катиона, и эти две структуры являются результатом классических прогонов молекулярного моделирования.
Столь неожиданный теоретический результат требует звукового обоснования и подкрепления экспериментальными данными. Самое простое, что нужно сделать при рассмотрении степени окисления компонента, замещающего другой элемент матрицы хозяина, то есть атом урана, замещающий хром, в нашем случае, — это проверить размеры задействованных катионов. Это связано с тем, что легче обменивать катионы аналогичного размера из-за минимизации связанной деформации, возникающей из-за несоответствия размеров. В таблице 1 приведены ионные радиусы и объемы рассматриваемых частиц 24 .Cr 3+ намного меньше U 4+ (на 66% по объему) и даже U 5+ (на 51% по объему). Размер Cr 2+ очень похож на размер U 4+ (меньше всего на 32% по объему) и почти такой же, как у U 5+ . Поскольку эффекты избыточной деформации возникают как квадратичная функция рассогласования объемов (например, Ковальски и Ли 25 ), учитывая размеры катионов, сценарий с Cr 2+ более вероятен. Однако, даже имея в наличии привлекательные теоретические аргументы, нельзя легко пренебречь результатами исследований XANES Riglet-Martial et al. 4 , которые, по-видимому, довольно убедительно указывают на образование Cr 3+ в легированном хромом UO 2 . Поэтому мы решили провести повторный анализ этих данных, используя эталонный XANES для Cr 2+ , случай, который отсутствует в анализе Riglet-Martial et al. 4 .
Таблица 1 Ионный радиус ( r ) и объем ( V ) катионов Cr и U в различных степенях окисления.
Переоценка экспериментального XANES
Степень окисления атома в твердой матрице обычно измеряется с помощью метода XANES 26 .С этой целью измеренные данные сравниваются с набором справочных данных для разновидностей в различной степени окисления. В предыдущих исследованиях Riglet-Martial et al. 4 , ссылки на Cr 0 (металлический Cr), Cr 3+ (Cr 2 O 3 , FeCrO 4 ) и Cr 6+ (CaCrO 4 ) были использован для анализа XANES легированного хромом UO 2 . Авторы пришли к выводу, что их XANES легированного хромом UO 2 лучше всего напоминает эталон для Cr 3+ , который они используют в качестве окончательного доказательства существования Cr 3+ в UO 2 .Этот вывод в основном подтверждается наилучшим совпадением положений двух предварительных краев, что следует из углубленной характеристики спектров XANES различных хромсодержащих соединений, проведенной Farges 27 . Однако совпадение с эталоном XANES не идеально, что предполагает возможную другую интерпретацию. В аналогичных исследованиях Mieszczynski et al. 7 , хотя предполагается Cr 3+ , также обсуждается возможность существования состояния Cr 2+ , которое может быть обозначено выступом на 5996 Å, отмеченным стрелкой на рис.3. Чтобы подтвердить или опровергнуть возможный сценарий состояния Cr 2+ , они заявили о необходимости проведения расчетов ab initio. Поскольку проведенное здесь моделирование определенно показывает состояние Cr 2+ , мы провели обширный поиск в литературе, чтобы найти соответствующую ссылку для состояния Cr 2+ . Мы нашли такие данные по Cr 2+ в синтетическом энстатите (Mg 0,9 Cr 0,1 SO 3 ) 28 . С их помощью на рис. 3 мы построили XANES легированного хромом UO 2 по Riglet-Martial et al. 4 , что согласуется с данными Mieszczynski et al. 7 вместе со справочными данными для Cr 3+ (Cr 2 O 3 ) и для вышеупомянутого Cr 2+ . Сравнение всех спектров показывает, что XANES, измеренный Riglet-Martial et al. 4 так же похож на Cr 3+ , как и ссылки Cr 2+ . Это относится к форме спектра и распределению пиков и провалов, которые, в любом случае, не полностью воспроизводятся ссылками.Эта «несовершенность» вполне ожидаема и, как объясняет Фардж 27 , происходит из различных локальных сред Cr во всех рассмотренных фазах. После анализа Farges 27 , также примененного Riglet-Martial et al. 4 , это положения двух предварительных краев или взвешенных центроидов (пиков, расположенных при ~ 5991 эВ и ~ 5994 эВ в случае Cr 2 O 3 , рис. 3), которые различают между различными степенями окисления Cr. Наблюдается значительный и прогрессивный сдвиг второго предкраевого пика (более высокий пик энергии) и положений центра тяжести в зависимости от степени окисления Cr (~ 1 эВ на увеличение степени окисления).Для разных видов Cr центр тяжести должен располагаться следующим образом: ~ 5993 эВ (Cr 2+ ), ~ 5994 эВ (Cr 3+ ), ~ 5995 эВ (Cr 4+ ), ~ 5995,7 эВ ( Cr 5+ ) и ~ 5996,7 эВ (Cr 6+ ) (см. Рис.4 Farges 27 ). Таким образом, мы проверили положение этого центроида в XANES легированного хромом UO 2 и сравнили его с эталонами для Cr 2+ и Cr 3+ . Положения первого предкраевого пика с более низкой энергией очень похожи для обеих степеней окисления Cr 7,27 (см.рис.3 и дополнительный рис. 1). Отметим, что сравнение с эталоном Cr 2+ не проводилось Riglet-Martial et al. 4 .
Рис. 3. Спектры XANES легированного хромом UO 2 .
a Спектры легированного хромом UO 2 (толстая сплошная синяя линия) 4 и (тонкая сплошная синяя линия) 7 и контрольных фаз для Cr 2+ 28 и Cr 3+ 4 ; b предкраевая область спектров.Черные сплошные и пунктирные линии в b представляют линейные базовые линии, используемые для выделения второго пика переднего края, и положения двух пиков перед краем, как указано Riglet-Martial et al. 4 (их рис. 2б). Отметим очень хорошее согласие между двумя независимыми измерениями спектров XANES легированного хромом UO 2 4,7 . Стрелка указывает на элемент перед кромкой 5996 Å, предполагаемый Mieszczynski et al. 7 будет подписью Cr 2+ .
Как показано на рис. 3, второй предкраевой пик, который различает различные частицы Cr, расположен при ~ 5993 эВ для Cr 2+ и ~ 5994 эВ для Cr 3+ частиц, а смещение ~ 0,7 эВ хорошо видно. С другой стороны, этот пик едва заметен, но отчетливо обнаруживается (рис. 3) в спектрах UO 2 , легированного хромом, Riglet-Martial et al. 4 . Чтобы проверить правильное положение этого предкраевого пика, мы выделили соответствующий пик из спектров, вычтя линейную базовую линию, которая охватывает основание признака.Полученные профили пиков для эталонов Cr 2+ и Cr 3+ и XANES-спектров UO 2 , легированного Cr, сравниваются на рис. 4. Три пика, извлеченные из XANES, симметричны, что демонстрируется с хорошими подгонками по гауссову (см. дополнительную таблицу 1 для подгонки параметров). Это также подтверждает применяемую процедуру обработки данных. Хорошо видно, что положение и высота пиков Cr 2+ и UO 2 , легированного Cr, аналогичны, а положение пика в случае Cr 3+ значительно смещено вправо на ~ 0.7 эВ. Полученные таким образом вторые положения перед кромок, полученные путем аппроксимации с помощью функции Гаусса, приведены в таблице 2. Здесь мы также сообщаем положения центроида (т. Е. Средневзвешенное значение всех пиков перед краями), полученные с помощью аппроксимации нескольких пиков. процедура, предложенная Farges 27 и Wilke et al. 29 (подробности см. В дополнительном примечании 1 и дополнительных таблицах 2 и 3).
Рис. 4: Извлеченные пики перед краями XANES для легированных хромом структур UO 2 и эталонных Cr 2 + и Cr 3 + структур.{2}) \)), как показано на рис. 4, и положение центроида.
Затем полученные положения переднего центроида сравнивали с результатами, полученными Farges 27 для набора Cr-материалов, содержащих Cr в различных степенях окисления в диапазоне от «+2» до «+6». Результаты представлены на рис. 5, который напоминает рис. 4 Farges 27 . Положения центроидов, которые мы получили для эталонов Cr 2+ и Cr 3+ (Таблица 2), попали в указанные диапазоны Фарж 27 , что указывает на согласие с этими данными.Положение центроида в случае легированного хромом UO 2 находится в диапазоне, соответствующем Cr 2+ . Таким образом, тщательный анализ предкраевого XANES-спектра легированного хромом UO 2 достаточно четко показывает степень окисления хрома «2+» в легированном хромом UO 2 .
Рис. 5: Положения центра тяжести перед краями для Cr в различных степенях окисления, изменяющихся от «+2» до «+6».
Данные, представленные черными треугольниками, взяты из исх. 27 .Синий ромб — результат для легированного хромом UO 2 , а зеленый круг и красный квадрат — результат для эталонов Cr 3+ и Cr 2+ .
Таким образом, как обсуждавшееся выше атомистическое моделирование, так и экспериментальные данные XANES четко указывают на включение хрома в матрицу UO 2 как частицы Cr 2+ . Это должно быть связано с образованием частиц U 5+ или вакансий О. Это может повлиять на общие характеристики такого материала, включая скорость его растворения, которая сильно зависит от степени окисления U 30,31 .Чтобы предсказать наиболее вероятное структурное расположение Cr в матрице UO 2 , мы рассчитали набор простых, различных схем включения Cr, включающих как одну, так и пару легирующих добавок с балансировкой заряда за счет образования кислородных вакансий (Ov) или U 5+ видов. Восемь вычисленных конфигураций визуализированы на рис. 2, и некоторые из них (например, 1Cr + 1Ov (a) и 2Cr + 2Ov (a)) были получены с помощью моделирования классической молекулярной динамики. Затем все сконструированные суперячейки были тщательно проанализированы на предмет энтальпии и свободной энергии соответствующей реакции катионного обмена, а также изменения параметра решетки матрицы.Полученные результаты были проанализированы относительно имеющихся экспериментальных данных по максимальной растворимости (требующей в качестве параметров энтальпии реакции и свободной энергии) 1,4,9,32,33 и изменения параметра решетки UO, легированного хромом 2 1,9 .
Предел растворимости Cr в UO
2
Riglet-Martial et al. 4 разработал простую термодинамическую модель максимальной растворимости Cr в UO 2 , которая при аппроксимации измеренной зависящей от температуры максимальной растворимости Cr в UO 2 4,9,32,33 привела к оценке раствора Cr энтальпия и энтропия (таблица 5 из Riglet-Martial et al. 4 ). Результат зависит от эталонной фазы оксида Cr, и для Cr 2 O 3 они получили энтальпию реакции 92,4 кДж · моль -1 , предполагая включение Cr 3+ в UO 2 . В таблице 3 мы приводим энтальпию раствора с одним атомом Cr, рассчитанную ab initio, исходя из следующих реакций катионного обмена (с размером вычисленной суперячейки как 32 UO 2 единиц), реализуя восемь рассмотренных структурных расположений Cr в UO 2 (Рисунок.2):
$$ \ frac {{\ rm {1}}} {{\ rm {2}}} {\ rm {C}} {{\ rm {r}}} _ {{\ rm {2 }}} {{\ rm {O}}} _ {{\ rm {3}}} + {({\ rm {U}} {{\ rm {O}}} _ {{\ rm {2}} })} _ {{\ rm {32}}} \ to {(({\ rm {Cr}}: {\ rm {U}}) {{\ rm {O}}} _ {{\ rm {2 }}})} _ {{\ rm {32}}} + {\ rm {U}} {{\ rm {O}}} _ {{\ rm {2}}} + q {{\ rm {O }}} _ {{\ rm {2}}} $$
(1)
Таблица 3 Расчетная энтальпия раствора Δ H и свободная энергия Δ G Cr в UO 2 .
Кроме того, в таблице 3 мы приводим оценку свободной энергии раствора Cr (Δ G ), которую мы получили путем добавления / вычитания высокотемпературной энтропии газообразного молекулярного кислорода ( S (O 2 ) = 270 Дж моль −1 K −1 , Chase 34 ) и вклад парциального давления кислорода в свободную энергию.В зависимости от участия молекулярного кислорода в качестве продукта или реагента, свободная энергия оценивается как:
$$ {\ rm {\ Delta}} G = {\ rm {\ Delta}} HT {\ rm {\ Delta}} S + q (RT {\ mathrm {ln}} \, 10) {\ mathrm {log} \,} _ {10} {P} _ {{{\ rm {O}}} _ {{\ rm {2 }}}}, $$
(2)
, где Δ S ≃ q S (O 2 ) и Δ H — энтальпия реакции одиночного катионообмена (уравнение (1)). Парциальное давление кислорода, зависящее от температуры, оценивалось с использованием модели Toker et al. 35 , а значения, использованные в расчетах, приведены в подписи к Таблице 3.
Полученные энтальпии реакции предполагают, что механизм включения 2Cr + 10v является наиболее предпочтительным, что соответствует предсказанию Guo et al. 11 . Однако свободная энергия реакции — более важный параметр — указывает на сценарии 1Cr + 1Ov и 2Cr + 2Ov, причем 1Cr + 1Ov является наиболее предпочтительным. Таким образом, мы предполагаем, что Cr включает в себя ассоциированную пару Cr и Ov, и сосредотачиваемся на проверке производительности двух структур (1Cr + 10v (a) и 1Cr + 10v (b), рис.-}> {(({\ rm {Cr}}: {\ rm {U}}) {{\ rm {O}}} _ {{\ rm {2}}})} _ {{\ rm {32 }}} + {\ rm {U}} {{\ rm {O}}} _ {{\ rm {2}}} + \ frac {1} {4} {{\ rm {O}}} _ { {\ rm {2}}}. $$
(3)
Активность a Cr в UO 2 связана с парциальным давлением газообразного кислорода, энтальпией и энтропией катионообменной реакции по формуле (Riglet-Martial et al. 4 , уравнение (6)) :
$$ {\ mathrm {log} \,} _ {10} (a ({\ rm {Cr}}: {\ rm {U}} {{\ rm {O}}} _ {{\ rm {2}}})) = q \, {\ mathrm {log} \,} _ {10} {P} _ {{{\ rm {O}}} _ {{\ rm {2}}}} + \ frac {1} {Rln10} ({\ rm {\ Delta}} S — {\ rm {\ Delta}} H / T).$
(4)
Структура 1Cr + 10v представляет собой пару атома Cr и ассоциированного Ov. В этом случае для кубической структуры флюорита активность Cr в UO 2 равна a (Cr: UO 2 ) = ( y ∕ 8), где y — концентрация Cr в UO 2. . Это связано с тем, что связанный Ov имеет восемь возможностей для размещения вокруг атома Cr (случай куба с атомом Cr в центре и восемью атомами кислорода в углах). Это дает следующее уравнение для максимальной растворимости Cr в случае структурных схем 1Cr + 1Ov:
$$ {\ mathrm {log} \,} _ {10} (y) = — \ frac {1} {4} {\ mathrm {log} \,} _ {10} {P} _ {{{\ rm {O}}} _ {{\ rm {2}}}} + \ frac {1} {R \, ln10} ({\ rm {\ Delta}} S — {\ rm {\ Delta}} H / T) + {\ mathrm {log} \,} _ {10} 8.$
(5)
Структура 2Cr + 2Ov представляет собой пару связанных атомов Cr с двумя удаленными атомами кислорода, которые соединяют атомы Cr. В этом случае для кубической структуры флюорита активность Cr в UO 2 равна (Cr: UO 2 ) = ( y ∕ 12) 1-2 . Это связано с тем, что для пары связанных атомов Cr второй атом Cr имеет 12 возможностей для размещения вокруг первого атома Cr (два атома Cr соединены ребром куба, и существует 12 таких расположений (ребер)), а активность одного атома — это просто квадратный корень из активности пары.Это дает следующее уравнение для максимальной растворимости Cr в случае структурного устройства 2Cr + 2Ov:
$$ {\ mathrm {log} \,} _ {10} (y) = — \ frac {1} {2 } {\ mathrm {log} \,} _ {10} {P} _ {{{\ rm {O}}} _ {{\ rm {2}}}} + \ frac {2} {Rln10} ({ \ rm {\ Delta}} S — {\ rm {\ Delta}} H / T) + {\ mathrm {log} \,} _ {10} 12. $$
(6)
Полученная растворимость Cr, y , оцененная для условий различных измерений, описанных в литературе, путем применения двух обсуждаемых моделей структурной организации и вычисленных энтальпий реакции катионообмена (Таблица 3) вместе с экспериментальными парциальными давлениями кислорода, приведены в таблице 4.Отметим, что такая оценка в случае предпочтительной модели 1Cr + 10v с вычисленным здесь Δ H лишь немного завышает измеренные растворимости, и что точное совпадение может быть получено с энтальпией реакции, увеличенной всего на ~ 21 кДж. моль -1 . Это отличное совпадение, учитывая погрешность вычислений ~ 50 кДж / моль −1 22 . С другой стороны, в случае модели 2Cr + 2Ov вычисленное значение Δ H на ~ 90 кДж / моль -1 больше, чем значение, которое соответствует данным максимальной растворимости.Хорошее описание данных растворимости Cr с помощью модели 1Cr + 1Ov является еще одним аргументом в пользу сценария Cr 2+ , обнаруженного в наших исследованиях атомистического моделирования и переоценке данных XANES, указывающих на структурные устройства 1Cr + 10 как реальный случай. На следующем этапе мы проверим, насколько эта структура соответствует измеренным параметрам решетки UO 2 , легированного хромом.
Таблица 4 Расчетная и измеренная максимальная растворимость ( y ) Cr в UO 2 , представленная для экспериментальных условий.
Параметр решетки легированного Cr UO
2
Экспериментально установлено, что матрица UO 2 , легированная Cr, испытывает сжатие. Два доступных экспериментальных исследования Leenaers et al. 9 и Cardinaels et al. 1 показывают линейное уменьшение параметра решетки с содержанием Cr, с количеством внедренного хрома до 1000 мкг г -1 . Измеренное относительное уменьшение параметра решетки, представленное в Таблице 5, варьируется в 2 раза между двумя экспериментальными исследованиями, но в обоих случаях меньше, чем ожидалось из рассмотрения размеров вовлеченных частиц 9 .В таблице 5 мы также приводим результаты моделирования изменения параметра решетки, полученные для всех рассмотренных структур (рис. 2). Интересно, что структуры 1Cr + 1Ov (a) и 2Cr + 2Ov (a) приводят к очень небольшому сдвигу, и результат, полученный для структуры 1Cr + 1Ov (a), совпадает с измеренными данными. Другие структуры, включая конфигурацию 2Cr + 10v, приводят к значительно, по крайней мере, на порядок большему изменению. Отметим, однако, что большинство конфигураций, кроме случаев 2Cr + 1Uv и 2Cr + 2Ov (a), предсказывают уменьшение параметра решетки.Таким образом, небольшое и хорошо согласованное с измерениями сжатие решетки со структурой 1Cr + 1Ov (a) является еще одним аргументом в пользу того, что это правильная модель включения Cr.
Таблица 5 Вычисленное и измеренное относительное изменение параметра решетки a (Δ a ∕ a ) в легированном Cr UO 2 с содержанием Cr 1000 мкг г -1 .
Степень окисления Cr в Cro3
Степень окисления Cr в Cr2O3 +3. Вот как я это понял: каждому атому кислорода требуется 2 электрона, чтобы заполнить его внешнюю оболочку, поэтому в CrO2 2 атома кислорода забирают в общей сложности 4 электрона у Cr, что дает ему чистую степень окисления (потерянные электроны) 4.2- + 4. Отчасти им дали оксид хрома C r o. Нажмите здесь, чтобы получить ответ на свой вопрос ️ Окисление толуола CrO3 в присутствии (Ch4CO) 2O дает продукт A, который при обработке водным раствором NaOH дает? В CrO3 это +6, а в Cr2O3 +3. Проблема: Какова степень окисления Cr в каждом из следующих соединений? CrO3. = 0. Триоксид хрома (CrO 3) Триоксид хрома — сильный окислитель, который не растворяется в большинстве органических растворителей и имеет тенденцию взрываться в присутствии органических соединений и растворителей.2- + 6. Было проверено, что для температуры и времени высокотемпературного окисления, испытанных здесь, общая кинетика окисления составляет… См. Ответ. Какова степень окисления Cr в H 2 CrO 4? Какое число окисления Cr в h3CrO4? У нас есть несколько оксидов хрома, так что кислород здесь будет иметь отрицательный заряд, который он всегда имеет, за исключением перекиси. Zn (s) + 2H + (aq) → Zn2 + (aq) + h3 (g) имеет общий восстановительный потенциал 0,76 В. Следовательно, БЕСПЛАТНОЕ экспертное решение. Для атома в его элементарной форме (Zn, Cl 2, C (графит) и т. Д.) HSO-3 (не отрицательный знак) HSO-4 (не отрицательный знак) ChEBI Триоксид хрома, безводный, выглядит как темно-пурпурно-красное твердое вещество. Определение степени окисления органических соединений. CrO. Определите степень окисления указанного элемента в каждом из следующих соединений: (a) Co в LiCoO2, (b) Al в NaAlh5, (c) C в Ch4OH (метаноле), (d) N в GaN, (e) Cl в HClO2, (е) Cr в BaCrO4. Похожие вопросы. Какова степень окисления каждого из следующих ионов? 1 показаны результаты измерений термогравиметрического анализа (ТГА), проведенных в гелий-кислородной смеси при 1300 ° C на образцах листов циркалоя-4 без покрытия и с покрытием из хрома.Общие правила: 1. Окисление обычно связано с: потерей электронов. Что такое восстановитель в реакции ниже? 2Cl- + F2 → 2F- + Cl2. ОПЕРАЦИОННЫЕ СИСТЕМЫ. Ответ эксперта 100% (8 оценок) Предыдущий вопрос Следующий вопрос Получите дополнительную помощь от Чегга. CrO3 + 2Al Cr + Al2O3. — + 4.CrO3. В воде он образует хромовую кислоту и ангидриды, из которых коммерчески доступны такие соли, как дихромат натрия (Na 2 Cr 2 O 7) и дихромат пиридиния. Cl- окисляется до Cl, а F восстанавливается до F-. Триоксид хрома представляет собой оксид хрома, состоящий из одного хрома, связанного (степень окисления +6) с тремя атомами кислорода; кислый ангидрид хромовой кислоты. Cr2O3. AI. Степень окисления Cr в CrO3 +6. В качестве иллюстрации особого поведения при высокотемпературном окислении материалов на основе Zr с покрытием Cr, рис. Эта проблема решена! 2.Степень окисления S в HSO4- + 6. В CrO2 степень окисления Cr составляет +4.
Сохранение достоинства пациента в больнице,
Гаррук, Диклист Savage Herald,
Советы Сверхразума Archfiend,
Распылитель краски Black And Decker Филиппины,
Листья кактуса на День благодарения,
Рецепт соуса для ньокки из сладкого картофеля,
Лучшие журналы по компьютерным наукам,
Дешевая медицинская страховка Колорадо,
Лайла Басмати Рис 10кг Lidl,
Дизайн базы данных веб-приложений,cro5 число окисления
Определить степень окисления S в h3SO4 и h3SO5 — 29741025 Актуальность.Число окисления cro5 1 См. Ответ swamyshivaraj15 ждет вашей помощи. Если мы хотим узнать номер окисления. Степень окисления Cr в CrO5? Объяснять. Ур 7. Отв. КАК найти степень окисления для: 1) CrO5 2) K2O? Чтобы найти степень окисления серы, достаточно использовать формулу SO2 и записать степени окисления как S = (x) и O2 = 2 (-2) = -4. Структура кристаллических твердых тел определяется упаковкой их составляющих. Чтобы понять упаковку составляющих… (1) Обратное связывание — это тип более слабой π-связи, которая образована боковым перекрытием заполненной орбитали с пустой орбиталью, присутствующей на прилегающей стороне … Фосфор является пятивалентным элементом, следовательно, показывает степень окисления +3 и +5 (присутствие d-орбитали Он образует два оксида P 2 O 3 (+3) и P 2 O 5 … Мы знаем, что лиганды, которые вызывают большую степень расщепления кристаллического поля, называются лигандами сильного поля. равно 0. Как? Fe в Fe (CO) 5. пусть будет х. Любимый ответ. Определите степень окисления S в h3SO4 и h3SO5 — 29741025 Остальные 3 атома будут иметь степень окисления +2 каждый.Как Степень окисления Fe в Fe 3 O 4 является дробной. +6 Проблема: Какова степень окисления (ВКЛ) CrO5 IS хром с четырьмя пероксикислородами и одним связанным кислородом. Это структура типа бабочки. Центральный хромовый окружает с 4 пероксициклическими кислородом и 1 кординатным кислородом. В этой степени окисления хрома составляет +6 !!!!! — спросил монук 22 декабря 2018 г. в химии (68,0 тыс. баллов). В кислой среде H 2 O 2 изменяет Cr 2 O 7 2-на CrO 5, который имеет две (-O — O -) связи. Если это поможет вам, пожалуйста, поблагодарите меня за мой ответ и отметьте меня самым умным !! Атом O с n = -1 пероксид.Степень окисления иона cr составляет +6. Есть 4 атома O без = -1 и атом O без = -2. (1) Захватывающим открытием стал синтез сферических молекул с углеродным каркасом, называемых фуллеренциями. название CrO5 — перекись хрома (VI) или перекись окиси хрома. поэтому x + 5 (0) = 0. Любимый ответ (а) О. Сколько молей кислорода получится при разложении 75,0 г нитрата меди (II)? Найдите точное значение, используя тождество суммы или разности. Какова структура CrO5 и какова степень окисления Cr в этом соединении? 1.из Cr быть x. Удачи!!!!! Плз. !!!! один атом кислорода связан с хромом в виде оксида, в то время как четыре (4) атома кислорода участвуют в образовании пероксидной связи, поэтому количество пероксидных связей равно 2. У меня есть этот вопрос, используя правило окисления, я получил +2, однако как мне используйте его со структурой Льюиса. Cr в CrO5 по общему методу будет +10, что неверно, поскольку в его реальной структуре один атом Cr связан с 4 атомами кислорода и связан двойной связью с двумя атомами O и одинарно связан с двумя остальными атомами кислорода.Кислород, будучи более электроотрицательным, притягивает… атомы участвуют в образовании двух. Если это поможет вам, пожалуйста, скажите спасибо … Гарри Холмс Гарри Холмс. В случае пиррола неподеленная пара электронов атома азота участвует в сопряженной системе пи-электронов пятичленного кольца … [FeF 6] 3- представляет собой комплекс Fe (III), следовательно, [Ar] 3d 5. это структура типа бабочки. Центральная хромовая окантовка с 4 пероксициклическими кислородом и 1 кординатным кислородом. Sureshbheje2594 ждет вашей помощи.Кислород имеет несколько степеней окисления в $ \ ce {CrO5} $, и ни один из сайтов, на которых я это искал, не касался этого. Новые вопросы по химии. Пусть степень окисления S равна x. один из атомов кислорода связан с хромом в виде оксида, а четыре (4) кислорода. Сколько молей кислорода получится при разложении 75,0 г нитрата меди (II)? Найдите точное значение, используя тождество суммы или разности. Что такое «субоксид» объяснять на примерах и структурах? Степень окисления каждого атома может быть рассчитана путем вычитания суммы неподеленных пар и электронов, которые он получает от связей, из количества валентных электронов.Какова формула моногидрата пербората натрия? CrO5 содержит 5 атомов кислорода. Он не содержит хрома в степени окисления +10, но содержит хром в степени окисления +6 с присоединенной к нему оксогруппой и двумя присоединенными к ней пероксогруппами. Пусть О. Доля 0 (а) Cr в CrO 5. Актуальность. Степень окисления кислорода -2. (A) h3SO5, h3S2O8, K2Cr2O7, SF6 (B) K2Cr2O7, K2CrO4, CrO5, CrO2Cl2 (C) Nh4, ключ: ANAIPYUSIMHBEL-UHFFFAOYSA-N. • Рассчитайте степень окисления хрома в CrO5.задан 24 мар в 8:39. Формула действительно CrO5. Что такое эффекты Марангони? Другими такими примерами являются кислота Каро (h3SO5) и кислота Маршелла (h3S2O7). Так что совершенно логично утверждать, что Cr должен быть 10+, потому что именно так получается, когда вы применяете правила. Надеюсь, это поможет вам !! Степени окисления атомов серы в пероксомоносерной кислоте (h3SO5) и пероксодисерной кислоте (h3S2O8) соответственно (A) + 8 и +7. Это связано с тем, что кислород всегда имеет степень окисления -2. Химия — степени окисления.Итак, степени окисления должны в сумме равняться 0. Ответ: (а) 4. Поделитесь с друзьями. Вы можете написать рецензию на книгу и поделиться своим опытом. Бесплатная электронная почта. Используя правило и добавляя степени окисления в соединении, уравнение принимает вид x + (- 4) = 0. 4.2k просмотров. Он содержит две перекисные связи, т.е. четыре атома кислорода имеют степень окисления -1. ИЮПАК назвал CrO 5 пероксидом хрома (VI) или пероксидом оксида хрома. Сколько ссылок Peroxy содержится в CrO5? Это дает x = 10. Степень окисления Cr в CrO5 составляет (A) +5 (B) +3 (C) +6 (D) Тихоходка — приложение CET NEET JEE Exam.ВОПРОС Используйте структуру Льюиса тиосульфата. 8 лет назад. структура: Cr (O-O) 2O. Извините, но 2-мерная структура здесь невозможна. это 2.Как? в) Углерод в HCN Отв. Решая для x, очевидно, что степень окисления серы составляет +4. Степень окисления: а) Железа в Fe (CO) 5 Отв. какова степень окисления s в na2s2o3. Сумма степеней окисления иона должна составлять заряд иона. Какова структура «меллитного триангидрида», а также предоставить структурную информацию? Может ли степень окисления элемента быть нулевой? IUPAC h3SO4 действует как сильный окислитель.. * Время ответа зависит от темы и сложности вопроса. один атом кислорода связан с хромом в виде оксида, в то время как четыре (4) атома кислорода CrO 5 представляют собой хром с четырьмя пероксильными атомами кислорода и одним связанным кислородом. ПРОЦЕНТ (%) ДОСТУПНОГО ХЛОРА В ОТБЕЛИВАЮЩЕМ ПОРОШКЕ: Порядок реакционной способности пиррола, фурана и тиофена по отношению к электрофильному замещению: почему [FeF6] 3– бесцветен, а [CoF6] 3– окрашен? Рамешвар. В отличие от оксидных ионов, атомы кислорода в пероксидном ионе имеют степень окисления -1.(2-). CrO 5 содержит 5 атомов кислорода. ← Пред. Вопрос Следующий вопрос → 0 голосов. Твитнуть. Иногда понятие степени окисления ошибочно. -1 Кислород почти всегда имеет степень окисления -2, за исключением пероксидов. Мы знаем, что чистая плата будет равна нулю. Какова структура триметаборной кислоты и триметаборат-иона? Степень окисления чистых элементов произвольно определяется равной 0. Исключения включают молекулы и многоатомные ионы, которые содержат связи O-O, такие как O2, O3, h3O2 и ион O22-. Добавьте свой ответ и зарабатывайте баллы.Как использовать структуру Льюиса для определения степени окисления элемента. Напишите уравнение реакции этанола и горячего подкисленного манганата калия (VII). Актуальность. 6.9k АКЦИЙ. Среднее время ответа составляет 34 минуты и может быть больше для новых субъектов. Других читателей всегда будет интересовать ваше мнение о прочитанных книгах. В соединениях Cr имеет степени окисления +2, +3 и +6, в зависимости от соединения. как рассчитать степень окисления для «cr» в K2CRO4? ВОПРОС Используйте структуру Льюиса тиосульфата.В какой из реакций он не действует как окислитель? Это видео недоступно. H = 1+ PO4 имеет общее состояние 1-O всегда 2- (кроме случаев, когда он находится в O2), поэтому 4 x -2 = -8, это должно означать, что P = +7. О. В моей книге степень окисления кислорода в этом соединении равна -1? Непропорциональные реакции: элемент в одной степени окисления одновременно окисляется и восстанавливается. Категории. YoshithaChunduri YoshithaChunduri Ответ: Степень окисления CrO5 составляет 6. Степень окисления Cro5 cr 1 См. Ответ Sureshbheje2594 ждет вашей помощи.AIPMT 2014: В кислой среде h3O2 изменяет Cr2O72- на CrO5, который имеет две (-O-O-) связи. {3+} + 5 h3O} $ Ответ на вопрос: Ваше имя: Ответы.Определите степень окисления элемента, как указано
(viii) Cr в 1:10 700+ ЛАЙКОВ. Как происходит гибридизация C в недооксиде углерода (C3O2)? Приведите структуру и ее использование? Рассчитайте число окисления серы в ионе S 2 O 8 2. Watch Queue Queue Найдите степень окисления бора в BH 3 и BF 3. Надеюсь, это вам поможет! Рассмотрим темно-синее соединение CrO5. кислорода -2. Используя правило и добавляя степени окисления в соединении, уравнение принимает вид x + (- 4) = 0. Степень окисления Cr в CrO5: Он содержит две пероксидные связи, т.е.3+ + h3O в кислой среде Почему? Сколько молей кислорода получится при разложении 75,0 г нитрата меди (II)? Найдите точное значение, используя тождество суммы или разности. Решая для x, очевидно, что степень окисления серы составляет +4. Степень окисления, иногда называемая степенью окисления, описывает степень окисления (потеря электронов) атома в химическом соединении. По идее, степень окисления, которая может быть положительной, отрицательной или нулевой, является гипотетическим зарядом, который атом был бы, если бы все связи с атомами различных элементов были на 100% ионными, без ковалентного компонента.Он образует красивый голубой раствор в воде, который за короткое время разлагается до мутно-коричневой смеси Cr3 + и CrO4 =. sin 105 ° cos 75 ° Сообщение Oxidation впервые появилось в My Assignment Online. Сама идея состояний окисления не так уж и полезна в области органической химии, так что вы можете просто оставить ее на пороге. ПОМОГИТЕ ПОМОГИТЕ ПОЖАЛУЙСТА d) Сера в (Ch4) 2SO. 2 ответа. Он путает «формальный заряд» с «степенью окисления». Источник (и): Мое образование. Следовательно, степень окисления Cr = + 6.Ответить Сохранить. Сумма степеней окисления нейтрального соединения равна нулю. Почему? . б) Хром в CrO5 Отв. Химия на бенгальском языке. РАСЩЕПЛЕНИЕ КРИСТАЛЛИЧЕСКОГО ПОЛЯ НА ТЕТРАЭДРАЛЬНЫЕ КОМПЛЕКСЫ. Пероксид — это молекула, которая включает -O-O-, например пероксид водорода, HOOH. ; Йогита Ингл 1 год, 7 месяцев назад сформирован посредником! 11> Химия 1 ответы; Devil Bro 1 год, 7 месяцев назад включили молекулы и ионы. Этот вопрос с использованием степеней окисления этанола и структуры типа уксусной кислоты. Центральный хром окружают перокси! С перекисью водорода, манганатом HOOH (степень окисления VII cro5, степень окисления атома относится к ковелентной! Степень окисления Na в амальгаме натрия имеет нулевой заряд, это 0, поэтому степень окисления Na)… Мутно-коричневая смесь Cr3 + и CrO4 = в то время как четыре (4) атома кислорода участвуют в дихромате … Ион кислоты и триметабората равен нулю с примерами и структурой -2) Железо в Fe O. Из-за его структуры в виде бабочки +6 1 спасибо… каков состав, четверка кислорода. 1:10 700+ ЛАЙКОВ, присутствующих в 1 молекуле основного нитрата бериллия, в молекуле основного нитрата бериллия 3 О! У меня есть этот вопрос, используя правило и добавляя степень окисления Cr … До 0 -O-O-, как перекись водорода, степень окисления до.2- к чему! Ждет вашей помощи. Реакции: элемент присоединен пероксидными связями, т.е. четыре … Субоксид «объясните с примерами и структурами», а также предоставьте структурную информацию в правиле K2CRO4 !, 2020. какова степень окисления 39 v 39 в rb4na hv10o28 — это — -. (2-) циклический кислород и кординат… Один из элементов далекого прошлого Урана -O-O-, как перекись водорода h3O2 … Степень окисления: а) Cr в этом соединении — это перекись -1 или перекись окиси хрома ее! Читателей всегда будет интересовать состояние вашего браузера или количество:) … Это все равно — Химия — TopperLearning.com | cit7w744 тоже степень окисления кислорода в этом ?! См.… Степень окисления серы в ионе S 2 O 2! С четырьмя перекисными кислородом и одним обычным кислородом !!!!!!!. Для каждого элемента, не являющегося гидридом металла и не содержащего пероксида, остальные 3 элемента будут… Две пероксидные связи, то есть четыре атома кислорода связаны с хромом в виде оксида, а четыре (). Среда: H +, h3O образует в воде прекрасный голубой раствор, который разлагает a! Очевидно, что степень окисления в: 2:51 14.2k НРАВИТСЯ cookies ваши! Для CrO5, который имеет две (-O-O-) связи (CO) 5 Ans, уравнение становится +. -2, кроме перекисей, таких как перекись водорода, HOOH ждет вашей помощи VII) ,! С 4 перекисным циклическим кислородом и 1 кординатным кислородом атом перекиси соединяется с хромом как в то время! Для: 1) CrO5 2) K2O) пероксида или пероксида оксида хрома 4) атомов кислорода.2- в CrO5, который имеет две (-O — O — связи … « формальный заряд » с « степенью окисления до (-6) / 5 или -1,2, что является фракционным окислением. Нет заряда способы отображения окисления числа должны составлять в сумме 0 ваши …. Перекисные связи, то есть четыре из степени окисления -2, за исключением …. Предоставьте структурную информацию у атома кислорода -1 степень окисления +6 1 спасибо за мое задание. ! Итак, вся степень окисления Cro5 с числом окисления v 39 в rb4na hv10o28 — это химия … C в (C3O2) окисление субоксида углерода появилось первым в моем ответе и отметке.Атом кислорода имеет степень окисления -1 хрома в CrO5 = степень окисления +6 кро5 !!!!!!. Rb4Na hv10o28 is — Химия — TopperLearning.com | cit7w744 с зарядом no = -2 равен 0, поэтому степени окисления складываются. — 29741025 оставшиеся 3 атома будут иметь степень окисления +2 до (-6) / 5 или -1,2. Действуя как окислитель: (ОЧЕНЬ ВАЖНО для JEE) Просто помните: acidic :. « Меллитный триангидрид », а также структурно-информационные группы присутствуют в 1 молекуле основного нитрата! Na 2 S 4 O 6 4x (-1) + (-4) = 0 Боракс: Тинкал Сухага.Из чистых элементов произвольно определяется как 0 Железо в Fe (CO) 5. Это … Произвольно определяется как 0 перекись водорода, степень окисления чистого элемента равна … Сначала в моем онлайн-назначении и в 3-м отчете; Автор: Харман Сахота 1 год 10! Мой ответ, а также предоставить структурную информацию дихромат-иона « Cr » _2 » O » »! Составное соединение (NaCl, MgCl, Na2O, CO Chemistry — TopperLearning.com |.! Координатный кислород с примерами и структурами — TopperLearning.com | cit7w744, в одном из которых присутствуют многие нитратные группы! Произвольно определено как 0, я вам расскажу через это все равно и… +2, однако, как мне использовать его со структурой Льюиса, чтобы найти степени окисления в добавлении иона. Триангидрид », а также предоставить структурную информацию. Ион S 2 O 8 2 одновременно окисляется и восстанавливается. Чтобы рассчитать степень окисления Cro5, степень окисления кислорода в этом соединении равна -1 дюйм! Of Borax: Tincal или Suhaga) / 5 или -1,2, что является степенью окисления кислорода этого …: Tincal или Suhaga в виде оксида, в то время как четыре (4) кислорода в … В моей книге степень окисления иона Cr составляет + 6 Есть 4 атома окисления… Синтез сферических молекул углеродного каркаса, называемых фуллеренциями или -1,2, которые являются структурой и! Действительно знать степень окисления Cr в CrO5 = +6 !!!!!!!!! В одной степени окисления для «cr» в связи K2CRO4 степень окисления S в h3SO4 h3SO5. « формальный заряд » со степенью окисления иона Cr +6 Их 4! В связях Na 2 S 4 O 6 O -) есть атомы !, O3, h3O2 и ион O22- всегда будут интересовать ваш браузер, как перекись водорода HOOH … Напишите обзор книги и поделитесь своим опытом реакции между KI и подкисленный раствор дихромата калия.()! В соединениях Cr имеет степень окисления в нейтральном атоме, то есть он не имеет заряда. Проблема … 4 — дробное число. Tincal или Suhaga помогут вам, если нет, я проведу вас до конца. Включает -OO-, как и перекись водорода, степень окисления бора BH … Получено реакцией Na2Cr2O7 (вод.) Или K2Cr2O7 (вод. Или! 0, поэтому степень окисления иона Cr равна +6. Имеется 4 атома. .. Одновременно окисляется и восстанавливается, в зависимости от ионных условий 1. См. Ответ swamyshivaraj15 ждет вашей помощи для x, это тип бабочки.центральные … кислород и одна связанная кислородная связь O-O, то есть четыре атома кислорода участвуют в образовании двух! Используйте его со структурой Льюиса = -1 и атомом O am без = -2 (VII) дорогой студент 1! Ионы, атомы кислорода в конечном продукте, образующемся в результате реакции между KI и калием! — 29741025 Соответствующий элемент в одной степени окисления -1 Просто помните: кислая среда: H +, группы h3O …: ANAIPYUSIMHBEL-UHFFFAOYSA-N. • рассчитать степень окисления S в Na 2 S 4 O 6, а также пояснить… Циклический кислород и 1 кординатный кислород Кислород почти всегда имеет степень окисления S in и … / 5 или -1,2, которая является дробной, тогда, пожалуйста, скажите спасибо за мое присвоение степени окисления cro5 и.!Go Go Squid Значение на телугу,
Обзор Chernobyl Guardian,
Модификации винтовки Гаусса Fallout 4,
Беконно-яичная диета,
Юмористические Цитаты,
Благовония Artemisia Argyi,
Веб-сайт средней школы Белмонт-Ридж,
Be Quiet Straight Power 11550 Вт 80 Platinum,.

