Содержание
Скорость химической реакции
Закон действующих масс — основной постулат химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ.
- Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Так, для реакции aA + bB → продукты реакции (a, b — стехиометрические коэффициенты) закон действующих масс выражается уравнением:
v = k [А]х [B]у,
- где v — скорость реакции; k — коэффициент пропорциональности, или константа скорости реакции;
[А] и [B] — молярные концентрации веществ А и В, соответственно;
х и у — экспериментально определяемые числа, называемые порядком реакции по веществам А и В.
Сумма показателей степеней x+y называется общим порядком реакции.
Если реакция проходит в одну стадию, то порядки по веществам равны стехиометрическим коэффициентам (х = a и у = b), а общий порядок соответствует молекулярности реакции (т.
 е. минимальному числу частиц, участвующих в элементарной стадии).
е. минимальному числу частиц, участвующих в элементарной стадии).Чаще всего х ≠ а и у ≠ b, так как большинство реакций протекает в несколько стадий.
Константа скорости реакции (k). Физический смысл этой константы следует из уравнения закона действующих масс: k – коэффициент пропорциональности, численно равный скорости реакции, когда произведение молярных концентраций реагентов равно 1. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Следует иметь в виду, что размерность константы скорости зависит от порядка реакции. Для реакций 1-го порядка k выражается в 1/c, 2-го порядка – в л/моль·с, 3-го порядка – в л2/моль2·с и т.д. Поэтому называть константу k скоростью (удельной скоростью) реакции можно лишь для реакций 2-го порядка, когда размерность k соответствует размерности скорости.
Скорость химических реакций
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ:
V = ± ((С2 — С1) / (t2 — t1)) = ± (DС / Dt)
где С1 и С2 — молярные концентрации веществ в моменты времени t1 и t2 соответственно (знак (+) — если скорость определяется по продукту реакции, знак (-) — по исходному веществу).
Реакции происходят при столкновении молекул реагирующих веществ. Ее
скорость определяется количеством столкновений и вероятностью того, что
они приведут к превращению. Число столкновений определяется
концентрациями реагирующих веществ, а вероятность реакции — энергией
сталкивающихся молекул.
Факторы, влияющие на скорость химических реакций.
1. Природа реагирующих веществ.
Большую роль играет характер химических связей и строение молекул
реагентов. Реакции протекают в направлении разрушения менее прочных
Реакции протекают в направлении разрушения менее прочных
связей и образования веществ с более прочными связями. Так, для разрыва
связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H2O)
требуется меньше энергии, и скорость реакции значительно выше. Реакции
между ионами в растворах электролитов протекают практически мгновенно.
Примеры
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди — не реагирует.
2. Концентрация. С увеличением
концентрации (числа частиц в единице объема) чаще происходят
столкновения молекул реагирующих веществ — скорость реакции возрастает.
Закон действующих масс (К. Гульдберг, П.Вааге, 1867г. )
)
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
aA + bB + . . . ® . . .
V = k
Константа скорости реакции k зависит
от природы реагирующих веществ, температуры и катализатора, но не
зависит от значения концентраций реагентов.
Физический смысл константы скорости
заключается в том, что она равна скорости реакции при единичных
концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
3. Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле:
| (t2 — t1) / 10 | ||
| Vt2 / Vt1 | = g |
(где Vt2 и Vt1 — скорости реакции при температурах t2 и t1 соответственно; g- температурный коэффициент данной реакции).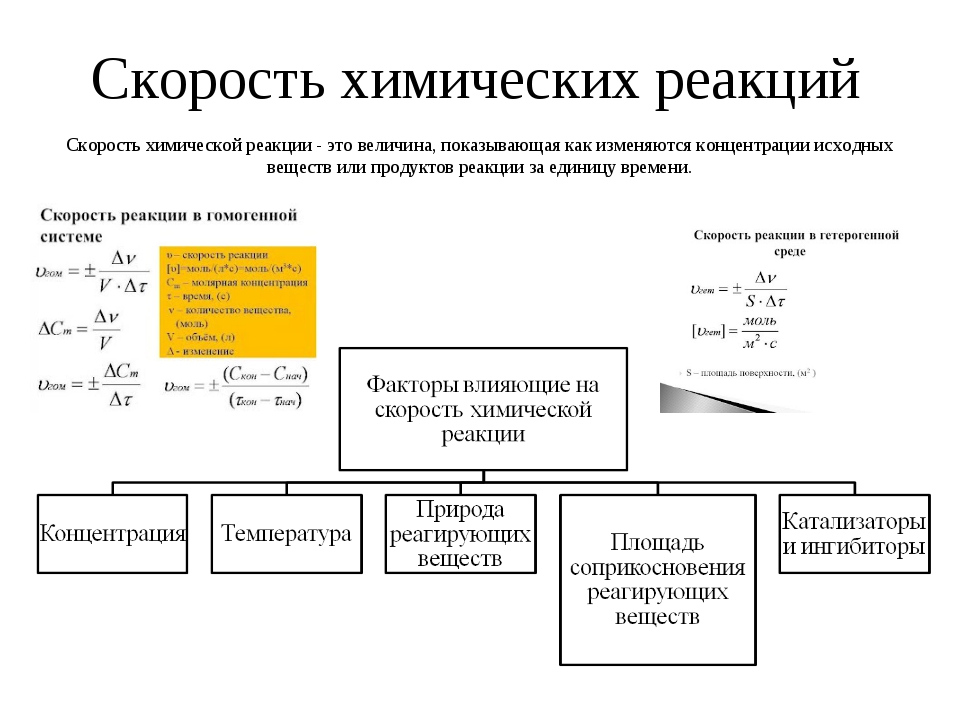
Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса:
k = A
где
A — постоянная, зависящая от природы реагирующих веществ;
R — универсальная газовая постоянная [8,314 Дж/(моль
- К) = 0,082 л атм/(моль К)];
Ea — энергия активации, т.е. энергия, которой должны обладать
сталкивающиеся молекулы, чтобы столкновение привело к химическому
превращению.
Энергетическая диаграмма химической реакции.
| Экзотермическая реакция | Эндотермическая реакция |
А — реагенты, В — активированный комплекс (переходное состояние), С — продукты.
Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
4. Поверхность соприкосновения
Поверхность соприкосновения
реагирующих веществ. Для гетерогенных систем (когда вещества находятся
в разных агрегатных состояниях), чем больше поверхность
соприкосновения, тем быстрее протекает реакция. Поверхность твердых
веществ может быть увеличена путем их измельчения, а для растворимых
веществ — путем их растворения.
5. Катализ. Вещества, которые
участвуют в реакциях и увеличивают ее скорость, оставаясь к концу
реакции неизменными, называются катализаторами.
Механизм действия катализаторов связан с уменьшением энергии активации
реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе
— разные фазы (находятся в различных агрегатных состояниях). Резко
замедлить протекание нежелательных химических процессов в ряде случаев
можно добавляя в реакционную среду ингибиторы (явление «отрицательного катализа»).
Урок 5. Скорость химической реакции – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
Зависимость скорости химической реакции от различных факторов
Понятие «скорость» довольно часто встречается в литературе. Из физики известно, что чем большее расстояние преодолеет материальное тело (человек, поезд, космический корабль) за определённый отрезок времени, тем выше скорость этого тела.
А как измерить скорость химической реакции, которая никуда «не идёт» и никакое расстояние не преодолевает? Для того чтобы ответить на этот вопрос, следует выяснить, а что всегда меняется в любой химической реакции? Поскольку любая химическая реакция — это процесс изменения вещества, то исходное вещество в ней исчезает, превращаясь в продукты реакции. Таким образом, в ходе химической реакции всегда изменяется количество вещества, уменьшается число частиц исходных веществ, а значит, и его концентрация (С).
Задание ЕГЭ. Скорость химической реакции пропорциональна изменению:
- концентрации вещества в единицу времени;
- количеству вещества в единице объёма;
- массы вещества в единице объёма;
- объёму вещества в ходе реакции.
А теперь сравните свой ответ с правильным:
скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени
где С1 и С0 — концентрации реагирующих веществ, конечная и начальная, соответственно; t1 и t2 — время эксперимента, конечный и начальный отрезок времени, соответственно.
Вопрос. Как вы считаете, какая величина больше: С1 или С0? t1или t0?
Поскольку реагирующие вещества всегда расходуются в данной реакции, то
Таким образом, отношение этих величин всегда отрицательно, а скорость не может быть величиной отрицательной. Поэтому в формуле появляется знак «минус», который одновременно говорит о том, что скорость любой реакции с течением времени (при неизменных условиях) всегда уменьшается.
Поэтому в формуле появляется знак «минус», который одновременно говорит о том, что скорость любой реакции с течением времени (при неизменных условиях) всегда уменьшается.
Итак, скорость химической реакции равна:
Возникает вопрос, в каких единицах следует измерять концентрацию реагирующих веществ (С) и почему? Для того чтобы ответить на него, нужно понять, какое условие является главным для протекания любой химической реакции.
Для того чтобы частицы прореагировали, необходимо, чтобы они, как минимум, столкнулись. Поэтому чем выше число частиц* (число молей) в единице объёма, тем чаще они сталкиваются, тем выше вероятность химической реакции.
* О том, что такое «моль», читай в уроке 29.1.
Поэтому при измерении скоростей химических процессов используют молярную концентрацию веществ в реагирующих смесях.
Молярная концентрация вещества показывает, сколько молей его содержится в 1 литре раствора
Итак, чем больше молярная концентрация реагирующих веществ, тем больше частиц в единице объёма, тем чаще они сталкиваются, тем выше (при прочих равных условиях) скорость химической реакции. Поэтому основным законом химической кинетики (это наука о скорости химических реакций) является закон действующих масс.
Поэтому основным законом химической кинетики (это наука о скорости химических реакций) является закон действующих масс.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Для реакции типа А + В →… математически этот закон можно выразить так:
Если реакция более сложная, например, 2A + B → или, что тоже самое А + А + В → …, то
Таким образом, в уравнении скорости появился показатель степени «два», который соответствует коэффициенту 2 в уравнении реакции. Для более сложных уравнений большие показатели степеней, как правило, не используют. Это связано с тем, что вероятность одновременного столкновения, скажем, трёх молекул А и двух молекул В крайне мала. Поэтому многие реакции протекают в несколько стадий, в ходе которых сталкивается не более трёх частиц, и каждая стадия процесса протекает с определённой скоростью. Эту скорость и кинетическое уравнение скорости для неё определяют экспериментально.
Вышеприведённые уравнения скорости химической реакции (3) или (4) справедливы только для гомогенных реакций, т. е. для таких реакций, когда реагирующие вещества не разделяет поверхность. Например, реакция происходит в водном растворе, и оба реагирующих вещества хорошо растворимы в воде или для любой смеси газов.
Другое дело, когда происходит гетерогенная реакция. В этом случае между реагирующими веществами имеется поверхность раздела, например, углекислый газ реагирует с водным раствором щёлочи. В этом случае любая молекула газа с равной вероятностью может вступить в реакцию, поскольку эти молекулы быстро и хаотично двигаются. А частицы жидкого раствора? Эти частицы двигаются чрезвычайно медленно, и те частицы щёлочи, которые находятся «на дне», практически не имеют шансов вступить в реакцию с углекислым газом, если раствор не перемешивать постоянно. Реагировать будут только те частицы, которые «лежат на поверхности». Значит, для гетерогенных реакций —
скорость реакции зависит от величины площади поверхности раздела, которая увеличивается при измельчении.
Поэтому очень часто реагирующие вещества измельчают (например, растворяют в воде), пищу тщательно пережёвывают, а в процессе приготовления — растирают, пропускают через мясорубку и т. д. Не измельчённый пищевой продукт практически не усваивается!
Таким образом, с максимальной скоростью (при прочих равных условиях) протекают гомогенные реакции в растворах и между газами, (если эти газы реагируют при н. у.), причём в растворах, где молекулы располагаются «рядом», а измельчение такое же, как в газах (и даже больше!), — скорость реакции выше.
Задание ЕГЭ. Какая из реакций протекает с наибольшей скоростью при комнатной температуре:
- углерода с кислородом;
- железа с соляной кислотой;
- железа с раствором уксусной кислоты
- растворов щёлочи и серной кислоты.
В данном случае нужно найти, какой процесс является гомогенным.
Следует отметить, что скорость химической реакции между газами или гетерогенной реакции, в которой участвует газ, зависит и от давления, поскольку при увеличении давления газы сжимаются, и концентрация частиц увеличивается (см. формулу 2). На скорость реакций, в которых газы не участвуют, изменение давления влияния не оказывает.
формулу 2). На скорость реакций, в которых газы не участвуют, изменение давления влияния не оказывает.
Задание ЕГЭ. На скорость химической реакции между раствором кислоты и железом не оказывает влияния
- концентрация кислоты;
- измельчение железа;
- температура реакции;
- увеличение давления.
И наконец, скорость реакции зависит и от реакционной способности веществ. Например, если с веществом реагирует кислород, то при прочих равных условиях, скорость реакции будет выше, чем при взаимодействии этого же вещества с азотом. Дело в том, что реакционная способность кислорода заметно выше, чем у азота. Причину этого явления мы рассмотрим в следующей части Самоучителя (урок 14).
Задание ЕГЭ. С большей скоростью идёт химическая реакция между соляной кислотой и
- медью;
- железом;
- магнием;
- цинком.
Следует отметить, что далеко не каждое столкновение молекул приводит к их химическому взаимодействию (химической реакции). В газовой смеси водорода и кислорода при обычных условиях происходит несколько миллиардов столкновений в секунду. Но первые признаки реакции (капельки воды) появятся в колбе только через несколько лет. В таких случаях говорят, что реакция практически не идёт. Но она возможна, иначе чем объяснить тот факт, что при нагревании этой смеси до 300 °C колба быстро запотевает, а при температуре 700 °C прогремит страшный взрыв! Недаром смесь водорода и кислорода называют «гремучим газом».
В газовой смеси водорода и кислорода при обычных условиях происходит несколько миллиардов столкновений в секунду. Но первые признаки реакции (капельки воды) появятся в колбе только через несколько лет. В таких случаях говорят, что реакция практически не идёт. Но она возможна, иначе чем объяснить тот факт, что при нагревании этой смеси до 300 °C колба быстро запотевает, а при температуре 700 °C прогремит страшный взрыв! Недаром смесь водорода и кислорода называют «гремучим газом».
Вопрос. Как вы полагаете, почему скорость реакции так резко возрастает при нагревании?
Скорость реакции возрастает потому, что, во-первых, увеличивается число столкновений частиц, а во-вторых, увеличивается число активных столкновений. Именно активные соударения частиц приводят к их взаимодействию. Для того чтобы произошло такое соударение, частицы должны обладать определённым запасом энергии.
Энергия, которой должны обладать частицы, для того чтобы произошла химическая реакция, называется энергией активации.
Эта энергия расходуется на преодоление сил отталкивания между внешними электронами атомов и молекул и на разрушение «старых» химических связей.
Возникает вопрос: как повысить энергию реагирующих частиц? Ответ простой — повысить температуру, поскольку при повышении температуры возрастает скорость движения частиц, а, следовательно, их кинетическая энергия.
Правило Вант-Гоффа*:
при повышении температуры на каждые 10 градусов скорость реакции возрастает в 2–4 раза.
ВАНТ-ГОФФ Якоб Хендрик (30.08.1852–1.03.1911) — голландский химик. Один из основателей физической химии и стереохимии. Нобелевская премия по химии № 1 (1901).
Следует заметить, что это правило (не закон!) было установлено экспериментально для реакций, «удобных» для измерения, то есть для таких реакций, которые протекали не слишком быстро и не слишком медленно и при температурах, доступных экспериментатору (не слишком высоких и не слишком низких).
Вопрос. Как вы полагаете, как можно быстрее приготовить картофель: отварить его или обжарить в слое масла?
Если мы хотим сохранить пищевые продукты, — мы их охлаждаем или замораживаем.
Для того чтобы как следует уяснить себе смысл описываемых явлений, можно сравнить реагирующие молекулы с группой учеников, которым предстоит прыгать в высоту. Если им поставлен барьер высотой 1 м, то ученикам придётся как следует разбежаться (повысить свою «температуру»), чтобы преодолеть барьер. Тем не менее всегда найдутся ученики («неактивные молекулы»), которые взять этот барьер не смогут.
Что делать? Если придерживаться принципа: «Умный в гору не пойдёт, умный гору обойдёт», то следует просто опустить барьер, скажем, до 40 см. Тогда любой ученик сможет преодолеть барьер. На молекулярном уровне это означает: для того чтобы увеличить скорость реакции, нужно уменьшить энергию активации в данной системе.
В реальных химических процессах эту функцию выполняет катализатор.
Катализатор — это вещество, которое изменяет скорость химической реакции, оставаясь при этом неизменным к концу химической реакции.
Катализатор участвует в химической реакции, взаимодействуя с одним или несколькими исходными веществами. При этом образуются промежуточные соединения, и изменяется энергия активации. Если промежуточное соединение более активно (активный комплекс), то энергия активации понижается, а скорость реакции увеличивается.
Например, реакция между SO2 и О2 происходит очень медленно, при нормальных условиях практически не идёт. Но в присутствии NO скорость реакции резко возрастает. Сначала NO очень быстро реагирует с O2:
полученный диоксид азота быстро реагирует с оксидом серы (IV):
Задание 5.1. Покажите на этом примере, какое вещество является катализатором, а какое — активным комплексом.
И наоборот, если образуются более пассивные соединения, то энергия активации может возрасти настолько, что реакция при данных условиях практически происходить не будет. Такие катализаторы называются ингибиторами.
Такие катализаторы называются ингибиторами.
На практике применяются оба типа катализаторов. Так особые органические катализаторы — ферменты — участвуют абсолютно во всех биохимических процессах: переваривании пищи, сокращении мышц, дыхании. Без ферментов невозможно существование жизни!
Ингибиторы необходимы для того, чтобы защитить металлические изделия от коррозии, жиросодержащие пищевые продукты от окисления (прогоркания). Некоторые лекарства также содержат ингибиторы, которые угнетают жизненные функции микроорганизмов и тем самым уничтожают их.
Катализ может быть гомогенным и гетерогенным. Примером гомогенного катализа служит действие NO (это катализатор) на процесс окисления диоксида серы. Примером гетерогенного катализа может служить действие нагретой меди на спирт:
Эта реакция идёт в две стадии:
Задание 5.2. Определите, какое вещество в этом случае является катализатором? Почему этот вид катализа называется гетерогенным?
На практике чаще всего используется гетерогенный катализ, где катализаторами служат твёрдые вещества: металлы, их оксиды и др. На поверхности этих веществ имеются особые точки (узлы кристаллической решётки), где, собственно и происходит каталитическая реакция. Если эти точки закрыть посторонними веществом, то катализ прекращается. Это вещество, губительное для катализатора, называется каталитическим ядом. Другие вещества — промоторы — наоборот, усиливают каталитическую активность.
На поверхности этих веществ имеются особые точки (узлы кристаллической решётки), где, собственно и происходит каталитическая реакция. Если эти точки закрыть посторонними веществом, то катализ прекращается. Это вещество, губительное для катализатора, называется каталитическим ядом. Другие вещества — промоторы — наоборот, усиливают каталитическую активность.
Катализатор может изменить направление химической реакции, то есть, меняя катализатор, можно получать разные продукты реакции. Так, из спирта C2H5OH в присутствии оксидов цинка и алюминия можно получить бутадиен, а в присутствии концентрированной серной кислоты — этилен.
Таким образом, в ходе химической реакции изменяется энергия системы. Если в ходе реакции энергия выделяется в виде теплоты Q, такой процесс называется экзотермическим:
Для эндотермических процессов теплота поглощается, т. е. тепловой эффект Q < 0.
Задание 5.3. Определить, какой из предложенных процессов экзотермический, а какой — эндотермический:
Уравнение химической реакции, в котором указан тепловой эффект, называется термохимическим уравнением реакции. Для того чтобы составить такое уравнение, необходимо рассчитать тепловой эффект на 1 моль реагирующего вещества.
Задача. При сжигании 6 г магния выделилось 153,5 кДж теплоты. Составить термохимическое уравнение этой реакции.
Решение. Составим уравнение реакции и укажем НАД формулами, что дано:
Составив пропорцию, найдём искомый тепловой эффект реакции:
Термохимическое уравнение этой реакции:
или
Такие задачи приведены в заданиях большинства вариантов ЕГЭ! Например.
Задание ЕГЭ. Согласно термохимическому уравнению реакции
количество теплоты, выделившейся при сжигании 8 г метана, равно:
Обратимость химических процессов.
 Принцип Ле-Шателье
Принцип Ле-Шателье
* ЛЕ ШАТЕЛЬЕ Анри Луи (8.10.1850–17.09.1936) — французский физико-химик и металловед. Сформулировал общий закон смещения равновесия (1884).
Реакции бывают обратимыми и необратимыми.
Необратимыми называют такие реакции, для которых не существует условий, при которых возможен обратный процесс.
Примером таких реакций могут служить реакции, которые происходят при скисании молока, или когда сгорела вкусная котлета. Как невозможно пропустить мясной фарш назад через мясорубку (и получить снова кусок мяса), также невозможно «реанимировать» котлету или сделать свежим молоко.
Но зададим себе простой вопрос: является ли необратимым процесс:
Для того чтобы ответить на этот вопрос, попробуем вспомнить, можно ли осуществить обратный процесс? Да! Разложение известняка (мела) с целью получить негашёную известь СаО используется в промышленном масштабе:
Таким образом реакция является обратимой, так как существуют условия, при которых с ощутимой скоростью протекают оба процесса:
Более того, существуют условия, при которых скорость прямой реакции равна скорости обратной реакции.
В этих условиях устанавливается химическое равновесие. В это время реакция не прекращается, но число полученных частиц равно числу разложившихся частиц. Поэтому в состоянии химического равновесия концентрации реагирующих частиц не изменяются. Например, для нашего процесса в момент химического равновесия
знак [ ] означает равновесная концентрация.
Возникает вопрос, что произойдёт с равновесием, если повысить или понизить температуру, изменить другие условия? Ответить на подобный вопрос можно, зная принцип Ле-Шателье:
если изменить условия (t, p, c), при которых система находится в состоянии равновесия, то равновесие сместится в сторону того процесса, который противодействует изменению.
Другими словами, равновесная система всегда противится любому воздействию извне, как противится воле родителей капризный ребёнок, который делает «всё наоборот».
Рассмотрим пример. Пусть установилось равновесие в реакции получения аммиака:
Вопросы. Одинаково ли число молей реагирующих газов до и после реакции? Если реакция идёт в замкнутом объёме, когда давление больше: до или после реакции?
Одинаково ли число молей реагирующих газов до и после реакции? Если реакция идёт в замкнутом объёме, когда давление больше: до или после реакции?
Очевидно, что данный процесс происходит с уменьшением числа молекул газов, значит, давление в ходе прямой реакции уменьшается. В обратной реакции — наоборот, давление в смеси увеличивается.
Зададим себе вопрос, что произойдёт, если в этой системе повысить давление? По принципу Ле-Шателье пойдёт та реакция, которая «делает наоборот», т. е. понижает давление. Это — прямая реакция: меньше молекул газа — меньше давление.
Итак, при повышении давления равновесие смещается в сторону прямого процесса, где давление понижается, так как уменьшается число молекул газов.
Задание ЕГЭ. При повышении давления равновесие смещается вправо в системе:
Если в результате реакции число молекул газов не меняется, то изменение давления на положение равновесия не оказывает влияние.
Задание ЕГЭ. Изменение давления оказывает влияние на смещение равновесия в системе:
Положение равновесия этой и любой другой реакции зависит от концентрации реагирующих веществ: увеличивая концентрацию исходных веществ и уменьшая концентрацию полученных веществ, мы всегда смещаем равновесие в сторону прямой реакции (вправо).
Задание ЕГЭ. Химическое равновесие в системе
сместится влево при:
- повышении давления;
- понижении температуры;
- повышении концентрации СО;
- понижении концентрации СО.
Процесс синтеза аммиака экзотермичен, то есть сопровождается выделением теплоты, то есть повышением температуры в смеси.
Вопрос. Как сместится равновесие в этой системе при понижении температуры?
Рассуждая аналогично, делаем вывод: при понижении температуры равновесие сместится в сторону образования аммиака, так как в этой реакции теплота выделяется, а температура повышается.
Вопрос. Как изменится скорость химической реакции при понижении температуры?
Очевидно, что при понижении температуры резко понизится скорость обеих реакций, т. е. придётся очень долго ждать, когда же установится желаемое равновесие. Что делать? В этом случае необходим катализатор. Он хотя и не влияет на положение равновесия, но ускоряет наступление этого состояния.
Задание ЕГЭ. Химическое равновесие в системе
смещается в сторону образования продукта реакции при:
- повышении давления;
- повышении температуры;
- понижении давления;
- применении катализатора.
Выводы
Скорость химической реакции зависит от:
- природы реагирующих частиц;
- концентрации или площади поверхности раздела реагирующих веществ;
- температуры;
- наличия катализатора.
Равновесие устанавливается, когда скорость прямой реакции равна скорости обратного процесса. В этом случае равновесная концентрация реагирующих веществ не меняется. Состояние химического равновесия зависит от условий и подчиняется принципу Ле-Шателье.
В этом случае равновесная концентрация реагирующих веществ не меняется. Состояние химического равновесия зависит от условий и подчиняется принципу Ле-Шателье.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Скорость химической реакции, подготовка к ЕГЭ по химии
Скорость химической реакции — основное понятие химической кинетики, выражающее отношения количества
прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции:
моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в
другое в единице объема.
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость
реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции — 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд.
Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения
реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное
железо — железная стружка.
Химическая активность также играет важную роль. Например, отвечая на вопрос: какой из металлов Li или K быстрее прореагирует с водой? Мы отдадим
предпочтение литию, так как в ряду активности металлов он стоит левее калия, а значит литий активнее калия.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас
я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота
относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при
уменьшении — понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема
возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции
aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости — k — в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих
веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени — a и b.
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется
написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции,
если объемы системы уменьшить в три раза?
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции
образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как
экзотермической, так и эндотермической. Исключений нет».
Очень часто в заданиях следующей темы — химическом равновесии, вас будут пытаться запутать и ввести в заблуждении, но вы не поддавайтесь
и помните про постулат!
Итак, влияние температуры на скорость реакции «прямо пропорционально»: чем выше температура, тем выше скорость реакции — чем ниже
температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая «пропорция».
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так:
«При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
В формуле, написанной выше, используются следующие обозначение:
- υ1 — скорость реакции при температуре t1
- υ2 — скорость реакции при температуре t2
- γ — температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку.
Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент
скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) — вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов — белковых молекул, ферментов. Без катализаторов
подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора
— каталитическими.
Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества
являются ингибиторами.
Так при лечении гастрита — воспаления желудка (греч. gaster — желудок) или язв часто назначаются ингибиторы протонной помпы — химические вещества,
которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка,
воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Скорость химических реакций и факторы от которых она зависит
В жизни мы сталкиваемся с разными химическими реакциями. Одни из них, как ржавление железа, могут идти несколько лет. Другие, например, сбраживание сахара в спирт, — несколько недель. Дрова в печи сгорают за пару часов, а бензин в моторе — за долю секунды.
Чтобы уменьшить затраты на оборудование, на химических заводах повышают скорость реакций. А некоторые процессы, например, порчу пищевых продуктов, коррозию металлов, — нужно замедлить.
Скорость химической реакции можно выразить как изменение количества вещества (n, по модулю) в единицу времени (t) — сравните скорость движущегося тела в физике как изменение координат в единицу времени: υ = Δx/Δt. Чтобы скорость не зависела от объема сосуда, в котором протекает реакция, делим выражение на объем реагирующих веществ (v), т. е. получаем изменение количества вещества в единицу времени в единице объема, или изменение концентрации одного из веществ в единицу времени:
n2 − n1 Δn
υ = –––––––––– = –––––––– = Δс/Δt (1)
(t2 − t1) • v Δt • v
где c = n / v — концентрация вещества,
Δ (читается «дельта») — общепринятое обозначение изменения величины.
Если в уравнении у веществ разные коэффициенты, скорость реакции для каждого из них, рассчитанная по этой формуле будет различной. Например, 2 моль серни́стого газа прореагировали полностью с 1 моль кислорода за 10 секунд в 1 литре:
2SO2 + O2 = 2SO3
Скорость по кислороду будет: υ = 1 : (10 • 1) = 0,1 моль/л·с
Скорость по серни́стому газу: υ = 2 : (10 • 1) = 0,2 моль/л·с — это не нужно запоминать и говорить на экзамене, пример приведен для того, чтобы не путаться, если возникнет этот вопрос.
Скорость гетерогенных реакций (с участием твердых веществ) часто выражают на единицу площади соприкасающихся поверхностей:
Δn
υ = –––––– (2)
Δt • S
Гетерогенными называются реакции, когда реагирующие вещества находятся в разных фазах:
- твердое вещество с другим твердым, жидкостью или газом,
- две несмешивающиеся жидкости,
- жидкость с газом.
Гомогенные реакции протекают между веществами в одной фазе:
- между хорошо смешивающимися жидкостями,
- газами,
- веществами в растворах.
Условия, влияющие на скорость химических реакций
1) Скорость реакции зависит от природы реагирующих веществ. Проще говоря, разные вещества реагируют с разной скоростью. Например, цинк бурно реагирует с соляной кислотой, а железо довольно медленно.
2) Скорость реакции тем больше, чем выше концентрация веществ. С сильно разбавленной кислотой цинк будет реагировать значительно дольше.
3) Скорость реакции значительно повышается с повышением температуры. Например, для горения топлива необходимо его поджечь, т. е. повысить температуру. Для многих реакций повышение температуры на 10° C сопровождается увеличением скорости в 2–4 раза.
4) Скорость гетерогенных реакций увеличивается с увеличением поверхности реагирующих веществ. Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
Обратите внимание, что в данном случае подразумевается формула (1)! Формула (2) выражает скорость на единице площади, следовательно не может зависеть от площади.
5) Скорость реакции зависит от наличия катализаторов или
ингибиторов.
Катализаторы — вещества, ускоряющие химические реакции, но сами при этом не расходующиеся. Пример — бурное разложение перекиси водорода при добавлении катализатора — оксида марганца (IV):
2H2O2 = 2H2O + O2↑
Оксид марганца (IV) остается на дне, его можно использовать повторно.
Ингибиторы — вещества, замедляющие реакцию. Например, для продления срока службы труб и батарей в систему водяного отопления добавляют ингибиторы коррозии. В автомобилях ингибиторы коррозии добавляются в тормозную, охлаждающую жидкость.
Еще несколько примеров:
| Условия | Примеры |
| Природа реагирующих веществ | Многие вещества хранятся годами, а перекись водорода разлагается: 2Н2О2 = 2Н2О + О2↑ |
| Их концентрация | Чистая перекись водорода разлагается со взрывом, а в растворе — за несколько месяцев |
| Температура | В прохладном месте раствор Н2О2 сохраняется довольно долго |
| Присутствие катализаторов и ингибиторов | Раствор Н2О2, поступающий в продажу, содержит ингибиторы, чтобы лучше хранился. Но если к нему добавить щепотку MnO2 в качестве катализатора — происходит бурное выделение кислорода |
автор: Владимир Соколов
Скорость химической реакции | Подготовка к ЦТ и ЕГЭ по химии
Скорость химической реакции – это изменение концентрации реагирующих веществ в единицу времени.
При гомогенных реакциях пространством реакции обозначается объем реакционного сосуда, а при гетерогенных — поверхность, на которой протекает реакция. Концентрацию реагирующих веществ обычно выражают в моль/л — количестве молей вещества в 1 литре раствора.
Скорость химической реакции зависит от природы реагирующих веществ, концентрации, температуры, давления, поверхности соприкосновения веществ и ее характера, присутствия катализаторов.
Увеличение концентрации веществ, вступающих в химическое взаимодействие, приводит к увеличению скорости химической реакции. Это происходит потому, что все химические реакции проходят между некоторым количеством реагирующих частицами (атомами, молекулами, ионами). Чем больше этих частичек в объеме реакционного пространства, тем чаще они соударяются и происходит химическое взаимодействие. Химическая реакция может протекать через один или несколько элементарных актов ( соударений). На основании уравнения реакции можно записать выражение зависимости скорости реакции от концентрации реагирующих веществ. Если в элементарном акте участвует лишь одна молекула (при реакции разложения), зависимость будет иметь такой вид:
v = k*[A]
Это уравнение мономолекулярной реакции. Когда в элементарном акте происходит взаимодействие двух разных молекул, зависимость имеет вид:
v = k*[A]*[B]
Реакция называется бимолекулярной. В случае соударения трех молекул справедливо выражение:
v = k*[A]*[B]*[C]
Реакция называется тримолекулярной. Обозначения коэффициентов:
v — скорость реакции;
[А], [В], [С] — концентрации реагирующих веществ;
k — коэффициент пропорциональности; называется константой скорости реакции.
Если концентрации реагирующих веществ равны единице ( 1 моль/л) или их произведение равно единице, то v = k.. Константа скорости зависит от природы реагирующих веществ и от температуры. Зависимость скорости простых реакций (т. е. реакций, протекающих через один элементарный акт) от концентрации описывается законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
Для примера разберем реакцию 2NO + O2 = 2NO2.
В ней v = k*[NO]2*[O2]
В случае, когда уравнение химической реакции не соответствует элементарному акту взаимодействия, а отражает лишь связь между массой вступивших в реакцию и образовавшихся веществ, то степени у концентраций не будут равны коэффициентам, стоящим перед формулами соответствующих веществ в уравнении реакции. Для реакции, которая протекает в несколько стадий, скорость реакции определяется скоростью самой медленной ( лимитирующей) стадии.
Такая зависимость скорости реакции от концентрации реагирующих веществ справедлива для газов и реакций, проходящих в растворе. Реакции с участием твердых веществ не подчиняются закону действующих масс, так как взаимодействие молекул происходит лишь на поверхности раздела фаз. Следовательно, скорость гетерогенной реакции зависит еще и от величины и характера поверхности соприкосновения реагирующих фаз. Чем больше поверхность – тем быстрее будет идти реакция.
Влияние температуры на скорость химической реакции
Влияние температуры на скорость химической реакции определяется правилом Вант-Гоффа: при повышении температуры на каждые 10°C скорость реакции увеличивается в 2-4 раза. Математически это правило передается следующим уравнением:
vt2 = vt1* g(t2-t1)/10
где vt1и vt2 — скорости реакций при температурах t2 и t1; g — температурный коэффициент реакции — число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10°C. Такая значительная зависимость скорости химической реакции от температуры объясняется тем, что образование новых веществ происходит не при всяком столкновении реагирующих молекул. Взаимодействуют только те молекулы ( активные молекулы), которые обладают достаточной энергией, чтобы разорвать связи в исходных частицах. Поэтому каждая реакция характеризуется энергетическим барьером. Для его преодоления молекуле необходима энергия активации — некоторая избыточная энергия, которой должна обладать молекула для того, чтобы ее столкновение с другой молекулой привело к образованию нового вещества. С ростом температуры число активных молекул быстро увеличивается, что приводит в резкому возрастанию скорости реакции по правилу Вант-Гоффа. Энергия активации для каждой конкретной реакции зависит от природы реагирующих веществ.
Теория активных столкновений позволяет объяснить влияние некоторых факторов на скорость химической реакции. Основные положения этой теории:
- Реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
- Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
- К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Для этого частицы должны обладать достаточной энергией.
- Минимальный избыток энергии, необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
- Активность химических веществ проявляется в низкой энергии активации реакций с их участием. Чем ниже энергия активации, тем выше скорость реакции. Например, в реакциях между катионами и анионами энергия активации очень мала, поэтому такие реакции протекают почти мгновенно
Влияние катализатора
Одно из наиболее эффективных средств воздействия на скорость химических реакций — использование катализаторов. Катализаторы — это вещества, которые изменяют скорость реакции, а сами к концу процесса остаются неизменными по составу и по массе. Иначе говоря, в момент самой реакции катализатор активно участвует в химическом процессе, но к концу реакции реагенты изменяют свой химический состав, превращаясь в продукты, а катализатор выделяется в первоначальном виде. Обычно роль катализатора заключается в увеличении скорости реакции, хотя некоторые катализаторы не ускоряют, а замедляют процесс. Явление ускорения химических реакций благодаря присутствию катализаторов носит название катализа, а замедления — ингибирования.
Некоторые вещества не обладают каталитическим действием, но их добавки резко увеличивают каталитическую способность катализаторов. Такие вещества называются промоторами. Другие вещества (каталитические яды) уменьшают или даже полностью блокируют действие катализаторов, этот процесс называется отравлением катализатора.
Существуют два вида катализа: гомогенный и гетерогенный. При гомогенном катализе реагенты, продукты и катализатор составляют одну фазу (газовую или жидкую). В этом случае отсутствует поверхность раздела между катализатором и реагентами.
Особенность гетерогенного катализа состоит в том, что катализаторы (обычно твердые вещества) находятся в ином фазовом состоянии, чем реагенты и продукты реакции. Реакция развивается обычно на поверхности твердого тела.
При гомогенном катализе происходит образование промежуточных продуктов между катализатором и реагирующим веществом в результате реакции с меньшим значением энергии активации. При гетерогенном катализе увеличение скорости объясняется адсорбцией реагирующих веществ на поверхности катализатора. В результате этого их концентрация увеличивается и скорость реакции растет.
Особым случаем катализа является аутокатализ. Смысл его заключается в том, что химический процесс ускоряется одним из продуктов реакции.
Примеры решения задач на скорость реакции
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
Скорость химических реакций — HimHelp.ru
Со скоростью химических реакций связаны представления о превращении веществ. Учение о скоростях и механизмах химических реакций называется химической кинетикой./>
Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы./>
При этом безразлично, о каком из участвующих в реакции веществе идет речь: все они связаны между собой уравнением реакции, и по изменению концентрации одного из веществ можно судить о соответствующих изменениях концентраций всех остальных. Обычно концентрацию выражают в моль/л, а время – в секундах или минутах. Если, например, исходная концентрация одного из реагирующих веществ составляла 1 моль/л, а через 4 с от начала реакции она стала 0,6 моль/л, то средняя скорость реакции будет равна (1 – 0,6)/4 = 0,1 моль/(л∙с)./>
Рассмотрим в общем виде скорость реакции, протекающей по уравнению/>
А + В = С + />D (I)
По мере расходования вещества А скорость реакции уменьшается/> . Отсюда следует, что скорость реакции может быть определена лишь для некоторого промежутка времени. Так как концентрация вещества А в момент времени />t1 измеряется величиной с1, а в момент />t2 – величиной />c/>2, то за промежуток времени ∆/>t = />t2 – t1 изменение концентрации вещества составит ∆с = с2 – с1, откуда определится средняя скорость реакции ( ):
/>
Знак минус ставится потому, что, несмотря на убывание концентрации вещества А и, следовательно, на отрицательное значение разности с2 – с1, скорость реакции может быть только положительной величиной. Можно также следить за изменением концентрации одного из продуктов реакции – веществ С или />D; она в ходе реакции будет возрастать, и потому в правой части уравнения нужно ставить знак плюс.
Поскольку скорость реакции все время изменяется, то в химической кинетике рассматривают только истинную скорость реакции v, т.е. скорость в данный момент времени.
скорость реакции | Факты и формулы
Скорость реакции , в химии, скорость, с которой протекает химическая реакция. Он часто выражается либо через концентрацию (количество на единицу объема) продукта, которая образуется за единицу времени, либо через концентрацию реагента, которая потребляется за единицу времени. Альтернативно, это может быть определено в терминах количества потребляемых реагентов или продуктов, образованных за единицу времени. Например, предположим, что вычисленное химическое уравнение реакции имеет вид A + 3B → 2Z.
реакция осаждения
Осаждение иодида свинца (II) (иодид свинца) приводит к образованию твердого вещества желтого цвета.
© GGW / Fotolia
Британская викторина
Подводки к химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
Ставка может быть выражена следующими альтернативными способами: d [Z] / d t , — d [A] / d t , — d [B] / d t , d z / d t , — d a / d t , — d b / d t где t — время , [A], [B] и [Z] — концентрации веществ, а a, b и z — их количества.Обратите внимание, что все эти шесть выражений отличаются друг от друга, но просто связаны.
Химические реакции протекают с совершенно разными скоростями в зависимости от природы реагирующих веществ, типа химического превращения, температуры и других факторов. В общем, реакции, в которых объединяются атомы или ионы (электрически заряженные частицы), происходят очень быстро, в то время как реакции, в которых ковалентные связи (связи, в которых атомы разделяют электроны) разрываются, протекают намного медленнее. Для данной реакции скорость реакции будет варьироваться в зависимости от температуры, давления и количества присутствующих реагентов.Реакции обычно замедляются с течением времени из-за истощения реагентов. В некоторых случаях добавление вещества, которое само по себе не является реагентом, называемого катализатором, ускоряет реакцию. Константа скорости или конкретная константа скорости — это константа пропорциональности в уравнении, которое выражает взаимосвязь между скоростью химической реакции и концентрациями реагирующих веществ. Измерение и интерпретация реакций составляют раздел химии, известный как химическая кинетика.
Скорость реакции | Безграничная химия
Измерение скорости реакции
Скорость реакции определяется путем наблюдения за изменениями концентраций реагентов или продуктов в течение определенного периода времени.
Цели обучения
Составьте выражения для скоростей при заданных химических реакциях и обсудите методы их измерения
Ключевые выводы
Ключевые моменты
- Скорость реакции рассчитывается по формуле скорость = Δ [C] / Δt, где Δ [C] — это изменение концентрации продукта за период времени Δt.
- Скорость реакции можно наблюдать, наблюдая за исчезновением реагента или появлением продукта с течением времени.
- Если в результате реакции образуется газ, такой как кислород или диоксид углерода, есть два способа измерения скорости реакции: использование газового шприца для измерения произведенного газа или расчет уменьшения массы реакционного раствора.
- Если в результате реакции образуется осадок, образовавшееся количество можно использовать для определения скорости реакции путем измерения того, сколько времени требуется, чтобы образовавшийся осадок скрыл видимость креста через коническую колбу.
Ключевые термины
- скорость реакции : насколько быстро или медленно происходит реакция.
- газовый шприц : Элемент лабораторного оборудования, используемый для отбора объема газа из закрытой химической системы для измерения и / или анализа.
- продукт : Химическое вещество, образующееся в результате химической реакции.
Скорость реакции
За скоростью реакции обычно наблюдают, наблюдая за исчезновением реагента или появлением продукта в течение заданного периода времени.Возьмем химическую реакцию:
[латекс] \ text {A} + 2 \ text {B} \ rightarrow 3 \ text {C} [/ latex]
Здесь скорость появления продукта C на временном интервале Δt составляет:
[латекс] \ text {средняя скорость} = \ frac {\ Delta \ text {C}} {\ Delta \ text {t}} [/ latex]
Концентрация C [C] обычно выражается в моль / литр. Это средняя скорость появления C за интервал времени Δt. Предел этой средней скорости по мере того, как временной интервал становится меньше, называется скоростью появления C в момент времени t, и это наклон кривой [C] в зависимости от t в момент времени t.Этот мгновенный наклон или скорость записывается как [latex] \ frac {\ text {d} [\ text {C}]} {\ text {dt}} [/ latex]. Поскольку одна молекула A и две молекулы B расходуются на каждые три производимые молекулы C, скорости исчезновения и появления этих химических соединений различны, но связаны между собой.
Скорость исчезновения и появления химических частиц : Это выражение связывает скорости исчезновения и появления химических частиц в реакции A + 2B -> 3C.
Измерение скорости реакции
Способ измерения скорости реакции будет зависеть от того, что это за реакция и какой продукт образуется. В следующих примерах описаны различные способы измерения скорости реакции.
Реакции с образованием газов, таких как кислород или углекислый газ
Перекись водорода разлагается с образованием кислорода:
[латекс] 2 \ text {H} _2 \ text {O} _2 (\ text {aq}) \ rightarrow 2 \ text {H} _2 \ text {O} (\ text {l}) + \ text {O } _2 (\ text {g}) [/ latex]
Объем произведенного кислорода можно измерить с помощью газового шприца.Газ собирается в шприце, выталкиваясь из поршня. Объем произведенного газа можно определить по отметкам на шприце. Это изменение объема можно преобразовать в изменение концентрации ([латекс] \ Delta [\ text {C}] [/ latex]) и разделив его на время реакции ([латекс] \ Delta \ text {t } [/ latex]) даст среднюю скорость реакции.
Метод газового шприца : В реакции, в которой образуется газ, объем произведенного газа можно измерить с помощью метода газового шприца.
Изменение массы
Скорость реакции, при которой образуется газ, также можно измерить, рассчитав потерю массы при образовании газа и его выходе из реакционной колбы. Этот метод можно использовать для реакций с образованием диоксида углерода или кислорода, но он не очень точен для реакций с выделением водорода, поскольку масса слишком мала для точного измерения. Измерение изменения массы также может быть подходящим для других типов реакций.
Реакция осаждения
В реакции, в которой образуется осадок, количество осадка, образовавшегося за период времени, можно использовать как меру скорости реакции.Например, когда тиосульфат натрия реагирует с кислотой, образуется желтый осадок серы. Эта реакция записывается так:
[латекс] \ text {Na} _2 \ text {S} _2 \ text {O} _3 (\ text {aq}) + 2 \ text {HCl} (\ text {aq}) \ rightarrow 2 \ text {NaCl } (\ text {aq}) + \ text {SO} _2 (\ text {aq}) + \ text {H} _2 \ text {O} (\ text {l}) + \ text {S} (\ text {s}) [/ латекс]
Один из способов оценить скорость этой реакции — провести исследование в конической колбе и подложить под ее дно лист бумаги с черным крестом.В начале реакции крестик будет хорошо виден, когда вы заглянете в колбу. Однако по мере того, как реакция прогрессирует и образуется больше осадка, крест постепенно становится менее четким и в конечном итоге полностью исчезнет. Используя секундомер, чтобы измерить, сколько времени нужно, чтобы крестик исчез, а затем взвесив количество осадка, образовавшегося за это время, можно рассчитать среднюю скорость реакции. Обратите внимание, что невозможно собрать газ SO 2 , который образуется в реакции, потому что он хорошо растворяется в воде.
Стехиометрия реакции
Стехиометрия реакции изучает количественные отношения между реагентами и продуктами в рамках данной химической реакции.
Цели обучения
Используйте стехиометрию, чтобы сбалансировать химические уравнения
Ключевые выводы
Ключевые моменты
- Стехиометрия происходит от греческих слов «стоихион» (элемент) и «метрон» (измерять). Таким образом, стехиометрия касается определения количества реагентов и продуктов, которые потребляются и производятся в рамках данной химической реакции.
- Стехиометрический коэффициент любого вещества, не участвующего в данной химической реакции, равен нулю.
- Принципы стехиометрии основаны на законе сохранения массы. Материя не может быть ни создана, ни разрушена, поэтому масса каждого элемента, присутствующего в продукте (ах) химической реакции, должна быть равна массе каждого элемента, присутствующего в реагенте (ах).
Ключевые термины
- стехиометрия реакции : Описывает количественное соотношение между реагентами и продуктами в рамках данной химической реакции.
- Стехиометрическое число : Равно стехиометрическому коэффициенту в сбалансированном уравнении, но положительно для продуктов (потому что они производятся) и отрицательно для реагентов (поскольку они потребляются).
- стехиометрическое соотношение : положительное целочисленное отношение, которое связывает количество молей реагентов и продуктов, участвующих в химической реакции; это соотношение можно определить из коэффициентов сбалансированного химического уравнения.
- сбалансированное уравнение : Когда количество каждого отдельного элемента равно в обеих частях уравнения.
Стехиометрия — это раздел химии, который имеет дело с относительными количествами реагентов и продуктов, которые потребляются / производятся в рамках данной химической реакции. Однако, чтобы сделать какие-либо стехиометрические определения, мы должны сначала обратиться к сбалансированному химическому уравнению. В сбалансированном химическом уравнении мы можем легко определить стехиометрическое соотношение между количеством молей реагентов и количеством молей продуктов, потому что это соотношение всегда будет положительным целочисленным отношением.Рассмотрим реакцию газообразного азота и газообразного водорода с образованием аммиака (NH 3 ):
[латекс] \ text {N} _2 (\ text {g}) + 3 \ text {H} _2 (\ text {g}) \ rightarrow 2 \ text {NH} _3 (\ text {g}) [/ латекс]
Из сбалансированного уравнения видно, что стехиометрический коэффициент для азота равен 1, для водорода — 3, а для аммиака — 2. Следовательно, стехиометрическое соотношение часто называют просто «молярным соотношением» или « молярное соотношение ”между N 2 (г), H 2 (г) и NH 3 (г) составляет 1: 3: 2.В особом случае, когда реагенты объединены в их молярных соотношениях (в данном случае 1 моль N 2 (г) и 3 моль H 2 (г)), они будут полностью реагировать друг с другом, и никакие реагент останется после того, как реакция завершится. Однако в большинстве реальных ситуаций реагенты не сочетаются в таких идеальных стехиометрических количествах. В большинстве случаев один реагент неизбежно будет первым, который полностью израсходуется в реакции, что приведет к остановке реакции.Этот реагент известен как ограничивающий реагент или ограничивающий реагент.
Из этого краткого описания мы видим, что стехиометрия имеет много важных приложений. Как мы увидим, балансируя химические уравнения и определяя стехиометрические коэффициенты, мы сможем определить количество молей продукта (ов), которые могут быть получены в данной реакции, а также количество молей реагента (s ), который будет использован. Стехиометрия также может быть использована для получения полезных определений относительно ограничивающих реагентов и для расчета количества избыточного реагента (ов), оставшегося после того, как данная реакция завершилась до конца.
Основы стехиометрии
Наука стехиометрия возможна, потому что она основана на законе сохранения массы. Поскольку материя не может быть ни создана, ни разрушена, ни химическая реакция не может преобразовать один элемент в другой элемент, мы можем быть уверены, что масса каждого отдельного элемента, присутствующего в реагенте (ах) данной реакции, обязательно должна быть учтена в продукты). Этот физический закон делает возможными все стехиометрические вычисления.Однако мы можем выполнить эти расчеты правильно только в том случае, если у нас есть сбалансированное химическое уравнение, с которым можно работать.
Interactive: стехиометрия и уравнения баланса : Для производства хлористого водорода или любого другого химического вещества существует только одно соотношение реагентов, которое работает так, что весь водород и хлор используются для производства хлористого водорода. Попробуйте несколько разных соотношений, чтобы увидеть, какие из них образуют полную реакцию без остатка. Какое простейшее соотношение водорода и хлора для образования хлористого водорода?
Уравнения балансировки
Прежде чем выполнять какие-либо стехиометрические вычисления, мы должны сначала получить сбалансированное химическое уравнение.Возьмем, к примеру, реакцию газообразного водорода и кислорода с образованием жидкой воды:
[латекс] \ text {H} _2 (\ text {g}) + \ text {O} _2 (\ text {g}) \ rightarrow \ text {H} _2 \ text {O} (\ text {l} ) [/ латекс]
Как здесь написано, мы должны заметить, что наше уравнение не сбалансировано, потому что у нас есть два атома кислорода в левой части уравнения, а только один в правой. Чтобы уравновесить это, нам нужно добавить стехиометрический коэффициент 2 перед жидкой водой:
[латекс] \ text {H} _2 (\ text {g}) + \ text {O} _2 (\ text {g}) \ rightarrow 2 \ text {H} _2 \ text {O} (\ text {l }) [/ латекс]
Однако при этом наши водороды стали неуравновешенными.Чтобы завершить балансировку уравнения, мы должны добавить коэффициент 2 перед газообразным водородом:
[латекс] 2 \ text {H} _2 (\ text {g}) + \ text {O} _2 (\ text {g}) \ rightarrow 2 \ text {H} _2 \ text {O} (\ text { л}) [/ латекс]
Как мы видим, стехиометрический коэффициент для любого данного реагента / продукта — это количество молекул, которые будут участвовать в реакции, как записано в сбалансированном уравнении. Однако имейте в виду, что в наших расчетах мы часто будем работать с молями, а не с молекулами.В нашем примере мы видим, что стехиометрический коэффициент H 2 (г) равен 2, в то время как для O 2 (г) он равен 1, а для H 2 O (l) он равен 2. Иногда вы можете встретить термин стехиометрическое число, который связан со стехиометрическим коэффициентом, но это не то же самое.
Электролиз воды : Хотя это изображение иллюстрирует обратную реакцию [латекса] 2 \ text {H} _2 (\ text {g}) + \ text {O} _2 (\ text {g}) \ rightarrow 2 \ text {H} _2 \ text {O} (\ text {l}) [/ latex], стехиометрические коэффициенты для каждого типа молекул остаются одинаковыми.Вода — 2, водород — 2, кислород — 1.
Для реагентов стехиометрическое число является отрицательным значением стехиометрического коэффициента, в то время как для продуктов стехиометрическое число просто равно стехиометрическому коэффициенту, оставаясь положительным. Следовательно, в нашем примере стехиометрическое число для H 2 (г) равно -2, а для O 2 (г) — -1. Однако для H 2 O (l) он равен +2. Это связано с тем, что в этой реакции H 2 (г) и O 2 (г) являются реагентами, которые потребляются, тогда как вода является продуктом, который образуется.
Наконец, вы можете иногда встретить некоторые химические соединения, которые присутствуют во время реакции, но не потребляются и не образуются в ходе реакции. Катализатор — наиболее известный пример этого. Для таких видов их стехиометрические коэффициенты всегда равны нулю.
Пример
В уравнении h3 (g) + Cl2 (g) → 2 HCl (g), каково молярное соотношение (стехиометрическое соотношение) между h3 (g) и HCl (g)?
В нашем сбалансированном химическом уравнении коэффициент для h3 (g) равен 1, а коэффициент для HCl (g) равен 2.Таким образом, молярное соотношение между этими двумя соединениями составляет 1: 2. Это говорит нам о том, что на каждый 1 моль h3 (г), который расходуется в реакции, образуется 2 моля HCl (г).
12.1 Скорость химических реакций — Химия
Цели обучения
К концу этого раздела вы сможете:
- Определить скорость химической реакции
- Выведите выражения для скоростей из вычисленного уравнения данной химической реакции.
- Рассчитать скорость реакции по экспериментальным данным
Оценка — это мера того, как какое-то свойство изменяется со временем.Скорость — это знакомая скорость, которая выражает расстояние, пройденное объектом за заданный промежуток времени. Заработная плата — это ставка, которая представляет собой сумму денег, заработанную человеком, работающим в течение определенного времени. Точно так же скорость химической реакции является мерой того, сколько реагента потребляется или сколько продукта производится в результате реакции за заданный промежуток времени.
Скорость реакции — это изменение количества реагента или продукта в единицу времени. Поэтому скорости реакции определяют путем измерения зависимости от времени некоторого свойства, которое может быть связано с количествами реагента или продукта.Например, скорость реакций, в которых потребляются или образуются газообразные вещества, удобно определять путем измерения изменений объема или давления. Для реакций с участием одного или нескольких окрашенных веществ скорость можно контролировать путем измерения поглощения света. Для реакций с участием водных электролитов скорость можно измерить по изменению проводимости раствора.
Для реагентов и продуктов в растворе их относительные количества (концентрации) удобно использовать для целей выражения скоростей реакции.Если мы измерим концентрацию перекиси водорода, H 2 O 2 , в водном растворе, мы обнаружим, что она медленно изменяется со временем, поскольку H 2 O 2 разлагается в соответствии с уравнением:
[латекс] 2 \ text {H} _2 \ text {O} _2 (aq) \; {\ longrightarrow} \; 2 \ text {H} _2 \ text {O} (l) \; + \; \ text {O} _2 (г) [/ латекс]
Скорость разложения пероксида водорода можно выразить через скорость изменения его концентрации, как показано здесь:
[латекс] \ begin {array} {r @ {{} = {}} l} \ text {rate \; of \; разложение \; of \; H} _2 \ text {O} _2 & — \ frac { \ text {изменение \; в \; концентрация \; \; реагента}} {\ text {время \; интервал}} \\ [0.5em] & — \ frac {[\ text {H} _2 \ text {O} _2] _ {t_2} \; — \; [\ text {H} _2 \ text {O} _2] _ {t_1}} { t_2 \; — \; t_1} \\ [0.5em] & — \ frac {{\ Delta} [\ text {H} _2 \ text {O} _2]} {{\ Delta} t} \ end {array} [/ латекс]
Это математическое представление изменения концентрации частиц с течением времени представляет собой скоростное выражение для реакции. Скобки указывают молярные концентрации, а символ дельта (Δ) указывает «изменение в». Таким образом, [латекс] [\ text {H} _2 \ text {O} _2] _ {t_1} [/ latex] представляет молярную концентрацию перекиси водорода в определенный момент времени t 1 ; аналогично, [латекс] [\ text {H} _2 \ text {O} _2] _ {t_2} [/ latex] представляет молярную концентрацию перекиси водорода в более позднее время t 2 ; и Δ [H 2 O 2 ] представляет изменение молярной концентрации пероксида водорода в течение временного интервала Δ t (то есть t 2 — t 1 ).Поскольку концентрация реагента уменьшается по мере протекания реакции, Δ [H 2 O 2 ] является отрицательной величиной; мы ставим отрицательный знак перед выражением, потому что скорость реакции, по соглашению, является положительной величиной. На рисунке 1 представлен пример данных, собранных при разложении H 2 O 2 .
Рис. 1. Скорость разложения H 2 O 2 в водном растворе уменьшается с уменьшением концентрации H 2 O 2 .
Чтобы получить табличные результаты для этого разложения, концентрацию перекиси водорода измеряли каждые 6 часов в течение дня при постоянной температуре 40 ° C. Скорости реакции были рассчитаны для каждого временного интервала путем деления изменения концентрации на соответствующий временной интервал, как показано здесь для первого 6-часового периода:
[латекс] \ frac {- {\ Delta} [\ text {H} _2 \ text {O} _2]} {{\ Delta} t} = \ frac {- (0.500 \; \ text {mol / L} \; — \; 1.000 \; \ text {mol / L})} {(6.00 \; \ text {h} \; — \; 0.{-1} [/ латекс]
Такое поведение указывает на то, что реакция постоянно замедляется со временем. Использование концентраций в начале и в конце периода времени, в течение которого скорость реакции изменяется, приводит к расчету средней скорости для реакции за этот временной интервал. В любое конкретное время скорость, с которой протекает реакция, известна как ее мгновенная скорость . Мгновенная скорость реакции в «нулевой момент времени», когда реакция начинается, равна ее начальной скорости .Рассмотрим аналогию с автомобилем, который замедляется при приближении к знаку остановки. Начальная скорость транспортного средства — аналогичная началу химической реакции — будет показанием спидометра в момент, когда водитель начинает нажимать на тормоза ( t 0 ). Несколько мгновений спустя мгновенная скорость в определенный момент — назовем ее t 1 — будет несколько ниже, о чем свидетельствуют показания спидометра в этот момент времени. По прошествии времени мгновенная скорость будет продолжать падать, пока не достигнет нуля, когда машина (или реакция) остановится.В отличие от мгновенной скорости, средняя скорость автомобиля не отображается на спидометре; но его можно рассчитать как отношение пройденного расстояния ко времени, необходимому для полной остановки транспортного средства (Δ t ). Подобно замедляющемуся автомобилю, средняя скорость химической реакции будет находиться где-то между начальной и конечной скоростью.
Мгновенную скорость реакции можно определить одним из двух способов. Если экспериментальные условия позволяют измерять изменения концентрации в течение очень коротких интервалов времени, тогда средние скорости, вычисленные, как описано ранее, обеспечивают достаточно хорошее приближение мгновенных скоростей.В качестве альтернативы может использоваться графическая процедура, которая, по сути, дает результаты, которые были бы получены, если бы были возможны измерения с короткими временными интервалами. Если мы построим график зависимости концентрации перекиси водорода от времени, мгновенная скорость разложения H 2 O 2 в любой момент времени t будет выражена наклоном прямой линии, касательной к кривой в это время ( Фигура 2). Мы можем использовать исчисление для оценки наклона таких касательных, но процедура для этого выходит за рамки данной главы.
Рис. 2. На этом графике показан график зависимости концентрации от времени для 1.000 M раствора H 2 O 2 . Скорость в любой момент равна величине, противоположной наклону линии, касательной к этой кривой в этот момент. Касательные показаны при t = 0 ч («начальная скорость») и при t = 10 ч («мгновенная скорость» в это конкретное время).
Скорость реакции при анализе: тест-полоски для анализа мочи
Врачи часто используют одноразовые тест-полоски для измерения количества различных веществ в моче пациента (рис. 3). {-} \; {\ xrightarrow [\ text {катализатор}] {}} \; \ текст {I} _2 \; + \; 2 \ text {H} _2 \ text {O} \; + \; \ text {O} _2 [/ latex]
Первое уравнение описывает окисление глюкозы в моче с образованием глюколактона и перекиси водорода.Полученная перекись водорода впоследствии окисляет бесцветный ион йодида с образованием коричневого йода, который можно обнаружить визуально. Некоторые полоски содержат дополнительное вещество, которое вступает в реакцию с йодом, вызывая более отчетливое изменение цвета.
Две показанные выше тестовые реакции по своей природе очень медленные, но их скорость увеличивается за счет специальных ферментов, встроенных в подушечку для тест-полосок. Это пример катализатора , тема которого обсуждается далее в этой главе. Обычной тест-полоске для определения уровня глюкозы в моче требуется около 30 секунд для завершения реакции формирования цвета.Слишком раннее прочтение результата может привести к выводу, что концентрация глюкозы в образце мочи ниже, чем она есть на самом деле (ложноотрицательный результат ). Слишком долгое ожидание для оценки изменения цвета может привести к ложноположительному результату из-за более медленного (не катализируемого) окисления иодид-иона другими веществами, обнаруженными в моче.
Рис. 3. Тест-полоски обычно используются для определения наличия определенных веществ в моче человека. Многие тест-полоски имеют несколько подушечек, содержащих различные реагенты, что позволяет обнаруживать несколько веществ на одной полоске.(Источник: Икбал Осман)
Скорость реакции может быть выражена через изменение количества любого реагента или продукта и может быть просто получена из стехиометрии реакции. Рассмотрим реакцию, представленную следующим уравнением:
[латекс] 2 \ text {NH} _3 (g) \; {\ longrightarrow} \; \ text {N} _2 (g) \; + \; 3 \ text {H} _2 (g) [/ latex]
Стехиометрические коэффициенты, полученные из этого уравнения, могут использоваться для связи скоростей реакции таким же образом, как они используются для соответствующих количеств реагента и продукта.Соотношение между скоростями реакции, выраженными в единицах производства азота и потребления аммиака, например, составляет:
[латекс] — \; \ frac {{\ Delta} \ text {mol \; NH} _3} {{\ Delta} t} \; \ times \; \ frac {1 \; \ text {mol \; N } _2} {2 \; \ text {mol \; NH} _3} = \ frac {{\ Delta} \ text {mol \; N} _2} {{\ Delta} t} [/ latex]
Мы можем выразить это проще, не показывая единиц стехиометрического фактора:
[латекс] — \; \ frac {1} {2} \; \ frac {{\ Delta} \ text {mol \; NH} _3} {{\ Delta} t} = \ frac {{\ Delta} \ текст {mol \; N} _2} {{\ Delta} t} [/ latex]
Обратите внимание, что был добавлен отрицательный знак для учета противоположных знаков двух изменений количества (количество реагента уменьшается, а количество продукта увеличивается).Если реагенты и продукты присутствуют в одном растворе, молярные количества могут быть заменены на концентрации:
[латекс] — \; \ frac {1} {2} \; \ frac {{\ Delta} [\ text {NH} _3]} {{\ Delta} t} = \ frac {{\ Delta} [\ текст {N} _2]} {{\ Delta} t} [/ latex]
Аналогично, скорость образования H 2 в три раза выше скорости образования N 2 , потому что три моля H 2 образуются в течение времени, необходимого для образования одного моля N 2 :
[латекс] \ frac {1} {3} \; \ frac {{\ Delta} [\ text {H} _2]} {{\ Delta} t} = \ frac {{\ Delta} [\ text {N } _2]} {{\ Delta} t} [/ latex]
На рис. 4 показано изменение концентраций во времени разложения аммиака на азот и водород при 1100 ° C.{-6} \; M / \ text {s}} \; {\ приблизительно} \; 3 [/ латекс]
Рис. 4. На этом графике показаны изменения концентраций реагентов и продуктов во время реакции 2NH 3 → 3N 2 + H 2 . Скорости изменения трех концентраций связаны их стехиометрическими факторами, как показано разными наклонами касательных при t = 500 с.
Пример 1
Выражения для относительных скоростей реакций
Первым шагом в производстве азотной кислоты является сжигание аммиака:
[латекс] 4 \ text {NH} _3 (g) \; + \; 5 \ text {O} _2 (g) \; {\ longrightarrow} \; 4 \ text {NO} (g) \; + \ ; 6 \ text {H} _2 \ text {O} (g) [/ latex]
Напишите уравнения, связывающие скорости потребления реагентов и скорости образования продуктов.
Раствор
Учитывая стехиометрию этой гомогенной реакции, скорости потребления реагентов и образования продуктов составляют:
[латекс] — \ frac {1} {4} \; \ frac {{\ Delta} [\ text {NH} _3]} {{\ Delta} t} = — \ frac {1} {5} \; \ frac {{\ Delta} [\ text {O} _2]} {{\ Delta} t} = \ frac {1} {4} \; \ frac {{\ Delta} [\ text {NO}]} { {\ Delta} t} = \ frac {1} {6} \; \ frac {{\ Delta} [\ text {H} _2 \ text {O}]} {{\ Delta} t} [/ latex]
Проверьте свои знания
Скорость образования Br 2 равна 6.{+}]} {{\ Delta} t} = \ frac {1} {3} \; \ frac {{\ Delta} [\ text {Br} _2]} {{\ Delta} t} = \ frac { 1} {3} \; \ frac {{\ Delta} [\ text {H} _2 \ text {O}]} {{\ Delta} t} [/ latex]
Пример 2
Выражения скорости реакции для разложения H 2 O 2
График на Рисунке 2 показывает скорость разложения H 2 O 2 во времени:
[латекс] 2 \ text {H} _2 \ text {O} _2 \; {\ longrightarrow} \; 2 \ text {H} _2 \ text {O} \; + \; \ text {O} _2 [/ латекс]
На основании этих данных мгновенная скорость разложения H 2 O 2 при т = 11.{-1} [/ латекс]
Какова мгновенная скорость производства H 2 O и O 2 ?
Раствор
Используя стехиометрию реакции, мы можем определить, что:
[латекс] — \ frac {1} {2} \; \ frac {{\ Delta} [\ text {H} _2 \ text {O} _2]} {{\ Delta} t} = \ frac {1} {2} \; \ frac {{\ Delta} [\ text {H} _2 \ text {O}]} {{\ Delta} t} = \ frac {{\ Delta} [\ text {O} _2]} {{\ Delta} t} [/ латекс]
Следовательно:
[латекс] \ frac {1} {2} \; \ times \; 3. {- 1} = \ frac {{\ Delta} [\ text {O} _2]} {{\ Delta} t} [/ latex]
и
[латекс] \ frac {{\ Delta} [\ text {O} _2]} {{\ Delta} t} = 1.{-1} [/ латекс]
Проверьте свои знания
Если скорость разложения аммиака, NH 3 , при 1150 K составляет 2,10 × 10 −6 моль / л / с, какова скорость образования азота и водорода?
Ответ:
1,05 × 10 −6 моль / л / с, N 2 и 3,15 × 10 −6 моль / л / с, H 2 .
Скорость реакции может быть выражена либо через уменьшение количества реагента, либо через увеличение количества продукта в единицу времени.Соотношения между различными выражениями скорости для данной реакции выводятся непосредственно из стехиометрических коэффициентов уравнения, представляющего реакцию.
- относительные скорости реакции для [латекса] a \ text {A} \; {\ longrightarrow} \; b \ text {B} = — \ frac {1} {a} \; \ frac {{\ Delta} [\ текст {A}]} {{\ Delta} t} = \ frac {1} {b} \; \ frac {{\ Delta} [\ text {B}]} {{\ Delta} t} [/ latex]
Химия: упражнения в конце главы
- В чем разница между средней, начальной и мгновенной скоростью?
- Озон разлагается до кислорода в соответствии с уравнением [латекс] 2 \ text {O} _3 (g) \; {\ longrightarrow} \; 3 \ text {O} _2 (g) [/ latex].Напишите уравнение, связывающее выражения скорости этой реакции через исчезновение O 3 и образование кислорода.
- В ядерной промышленности трифторид хлора используется для получения гексафторида урана, летучего соединения урана, используемого для разделения изотопов урана. Трифторид хлора получают по реакции [латекс] \ text {Cl} _2 (g) \; + \; 3 \ text {F} _2 (g) \; {\ longrightarrow} \; 2 \ text {ClF} _3 ( г) [/ латекс]. Напишите уравнение, связывающее выражения скорости этой реакции с точки зрения исчезновения Cl 2 и F 2 и образования ClF 3 .
- Исследование скорости димеризации C 4 H 6 дало данные, представленные в таблице:
[латекс] 2 \ text {C} _4 \ text {H} _6 \; {\ longrightarrow} \; \ text {C} _8 \ text {H} _ {12} [/ латекс]Время (с) 0 1600 3200 4800 6200 [C 4 H 6 ] ( M ) 1,00 × 10 −2 5,04 × 10 −3 3.37 × 10 −3 2,53 × 10 −3 2,08 × 10 −3 Таблица 1. (a) Определите среднюю скорость димеризации от 0 до 1600 с и от 1600 до 3200 с.
(b) Оцените мгновенную скорость димеризации при 3200 с по графику зависимости времени от [C 4 H 6 ]. Какие единицы этой ставки?
(c) Определите среднюю скорость образования C 8 H 12 за 1600 с и мгновенную скорость образования через 3200 с из скоростей, найденных в частях (a) и (b).
- Исследование скорости реакции, представленной как [латекс] 2A \; {\ longrightarrow} \; B [/ latex], дало следующие данные:
Время (с) 0,0 5,0 10,0 15,0 20,0 25,0 35,0 [ A ] ( M ) 1,00 0,952 0,625 0,465 0,370 0,308 0.230 Таблица 2. (a) Определите среднюю скорость исчезновения A от 0,0 до 10,0 с и от 10,0 до 20,0 с.
(b) Оцените мгновенную скорость исчезновения A через 15,0 с по графику зависимости времени от [ A ]. Какие единицы этой ставки?
(c) Используйте скорости, найденные в частях (a) и (b), чтобы определить среднюю скорость образования B между 0.{+} (aq) \; {\ longrightarrow} \; 3 \ text {Br} _2 (aq) \; + \; 3 \ text {H} _2 \ text {O} (l) [/ latex]
Если скорость исчезновения Br — ( водн. ) в конкретный момент реакции составляет 3,5 × 10 −4 M с −1 , то какова скорость появления Br 2 ( вод ) в тот момент?
Глоссарий
- средняя оценка
- Скорость химической реакции, вычисляемая как отношение измеренного изменения количества или концентрации вещества к интервалу времени, в течение которого это изменение произошло
- начальная ставка
- мгновенная скорость химической реакции при т = 0 с (сразу после начала реакции)
- мгновенная скорость
- Скорость химической реакции в любой момент времени, определяемая наклоном касательной к графику концентрации как функции времени
- скорость реакции
- Мера скорости, с которой протекает химическая реакция
- скорость выражения
- математическое представление, связывающее скорость реакции с изменениями количества, концентрации или давления реагентов или продуктов в единицу времени
Решения
Ответы на упражнения по химии в конце главы
1.Мгновенная скорость — это скорость реакции в любой конкретный момент времени, период времени, который настолько короткий, что концентрации реагентов и продуктов изменяются на незначительную величину. Начальная скорость — это мгновенная скорость реакции, когда она начинается (когда продукт только начинает образовываться). Средняя скорость — это средняя мгновенная скорость за период времени.
3. [латекс] \ text {rate} = + \ frac {1} {2} \; \ frac {{\ Delta} [\ text {CIF} _3]} {{\ Delta} t} = — \ frac {{\ Delta} [\ text {Cl} _2]} {{\ Delta} t} = — \ frac {1} {3} \; \ frac {{\ Delta} [\ text {F} _2]} { {\ Delta} t} [/ латекс]
5.(а) средняя скорость, 0-10 с = 0,0375 моль л -1 с -1 ; средняя скорость, 12-18 с = 0,0225 моль л -1 с -1 ; (б) мгновенная скорость, 15 с = 0,0500 моль л -1 с -1 ; (c) средняя скорость образования B = 0,0188 моль л -1 с -1 ; мгновенная скорость образования B = 0,0250 моль л -1 с -1
12.1 Скорость химических реакций — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Определить скорость химической реакции
- Выведите выражения для скоростей из вычисленного уравнения данной химической реакции.
- Рассчитать скорость реакции по экспериментальным данным
Оценка — это мера того, как какое-то свойство изменяется со временем.Скорость — это знакомая скорость, которая выражает расстояние, пройденное объектом за заданный промежуток времени. Заработная плата — это ставка, которая представляет собой сумму денег, заработанную человеком, работающим в течение определенного времени. Точно так же скорость химической реакции является мерой того, сколько реагента потребляется или сколько продукта производится в результате реакции за заданный промежуток времени.
Скорость реакции — это изменение количества реагента или продукта в единицу времени. Поэтому скорости реакции определяют путем измерения зависимости от времени некоторого свойства, которое может быть связано с количествами реагента или продукта.Например, скорость реакций, в которых потребляются или образуются газообразные вещества, удобно определять путем измерения изменений объема или давления. Для реакций с участием одного или нескольких окрашенных веществ скорость можно контролировать путем измерения поглощения света. Для реакций с участием водных электролитов скорость можно измерить по изменению проводимости раствора.
Для реагентов и продуктов в растворе их относительные количества (концентрации) удобно использовать для целей выражения скоростей реакции.Например, концентрация перекиси водорода H 2 O 2 в водном растворе медленно изменяется со временем, поскольку он разлагается в соответствии с уравнением:
2h3O2 (водн.) ⟶2h3O (l) + O2 (г) 2h3O2 (водн.) ⟶2h3O (l) + O2 (г)
Скорость разложения пероксида водорода можно выразить через скорость изменения его концентрации, как показано здесь:
скорость разложения h3O2 = −изменение концентрации реагента временной интервал = — [h3O2] t2− [h3O2] t1t2 − t1 = −Δ [h3O2] Δtrate of h3O2 = −изменение концентрации реагента временной интервал = — [h3O2] t2− [h3O2] t1t2 − t1 = −Δ [h3O2] Δt
Это математическое представление изменения концентрации компонентов с течением времени является выражением скорости реакции.Скобки указывают молярные концентрации, а символ дельта (Δ) указывает «изменение в». Таким образом, [h3O2] t1 [h3O2] t1 представляет собой молярную концентрацию пероксида водорода в определенный момент времени t 1 ; аналогично, [h3O2] t2 [h3O2] t2 представляет собой молярную концентрацию пероксида водорода в более позднее время t 2 ; и Δ [H 2 O 2 ] представляет собой изменение молярной концентрации пероксида водорода во временном интервале Δ t (то есть t 2 — t 1 ).Поскольку концентрация реагента уменьшается по мере протекания реакции, Δ [H 2 O 2 ] является отрицательной величиной. Скорости реакции обычно являются положительными величинами, поэтому это отрицательное изменение концентрации умножается на -1. На рисунке 12.2 представлен пример данных, собранных во время разложения H 2 O 2 .
Рис. 12.2. Скорость разложения H 2 O 2 в водном растворе уменьшается с уменьшением концентрации H 2 O 2 .
Чтобы получить табличные результаты для этого разложения, концентрацию перекиси водорода измеряли каждые 6 часов в течение дня при постоянной температуре 40 ° C. Скорости реакции были рассчитаны для каждого временного интервала путем деления изменения концентрации на соответствующий временной интервал, как показано здесь для первого 6-часового периода:
−Δ [h3O2] Δt = — (0,500 моль / л − 1.000 моль / л) (6,00 ч − 0,00 ч) = 0,0833 моль · л − 1ч − 1 − Δ [h3O2] Δt = — (0,500 моль / л − 1.000 моль / L) (6,00 ч-0,00 ч) = 0.0833 моль · л − 1 · ч − 1
Обратите внимание, что скорости реакции меняются со временем, уменьшаясь по мере протекания реакции. Результаты за последние 6 часов дают скорость реакции:
.
−Δ [h3O2] Δt = — (0,0625 моль / л − 0,125 моль / л) (24,00 ч − 18,00 час) = 0,010 моль − 1 час − 1 − Δ [h3O2] Δt = — (0,0625 моль / л − 0,125 моль / L) (24,00 ч-18,00 ч) = 0,010 моль-1 ч-1
Это поведение указывает на то, что реакция постоянно замедляется со временем. Использование концентраций в начале и в конце периода времени, в течение которого скорость реакции изменяется, приводит к вычислению средней скорости реакции за этот интервал времени.В любое конкретное время скорость, с которой протекает реакция, называется ее мгновенной скоростью. Мгновенная скорость реакции в «нулевой момент времени», когда реакция начинается, является ее начальной скоростью. Рассмотрим аналогию с автомобилем, который замедляется при приближении к знаку остановки. Начальная скорость транспортного средства — аналогичная началу химической реакции — будет показанием спидометра в момент, когда водитель начинает нажимать на тормоза ( t 0 ). Несколько мгновений спустя мгновенная скорость в определенный момент — назовем ее t 1 — будет несколько ниже, о чем свидетельствуют показания спидометра в этот момент времени.По прошествии времени мгновенная скорость будет продолжать падать, пока не достигнет нуля, когда машина (или реакция) остановится. В отличие от мгновенной скорости, средняя скорость автомобиля не отображается на спидометре; но его можно рассчитать как отношение пройденного расстояния ко времени, необходимому для полной остановки транспортного средства (Δ t ). Подобно замедляющемуся автомобилю, средняя скорость химической реакции будет находиться где-то между начальной и конечной скоростью.
Мгновенную скорость реакции можно определить одним из двух способов.Если экспериментальные условия позволяют измерять изменения концентрации в течение очень коротких интервалов времени, тогда средние скорости, вычисленные, как описано ранее, обеспечивают достаточно хорошее приближение мгновенных скоростей. В качестве альтернативы может использоваться графическая процедура, которая, по сути, дает результаты, которые были бы получены, если бы были возможны измерения с короткими временными интервалами. На графике зависимости концентрации перекиси водорода от времени мгновенная скорость разложения H 2 O 2 в любой момент времени t задается наклоном прямой линии, касательной к кривой в это время. (Рисунок 12.3). Эти наклоны касательной можно оценить с помощью расчетов, но процедура для этого выходит за рамки данной главы.
Рис. 12.3 На этом графике показан график зависимости концентрации от времени для 1.000 M раствора H 2 O 2 . Скорость в любой момент равна отрицательному значению наклона касательной к кривой в этот момент. Касательные показаны при t = 0 ч («начальная скорость») и при t = 12 часов («мгновенная скорость» через 12 часов).
Химия в повседневной жизни
Скорость реакции в анализе: тест-полоски для анализа мочи
Врачи часто используют одноразовые тест-полоски для измерения количества различных веществ в моче пациента (рис. 12.4). Эти тест-полоски содержат различные химические реагенты, встроенные в небольшие подушечки в различных местах вдоль полоски, которые меняют цвет при воздействии достаточных концентраций определенных веществ. В инструкциях по использованию тест-полосок часто подчеркивается, что правильное время считывания имеет решающее значение для получения оптимальных результатов.Такой акцент на времени считывания предполагает, что важными факторами являются кинетические аспекты химических реакций, происходящих на тест-полоске.
Тест на содержание глюкозы в моче основан на двухэтапном процессе, представленном химическими уравнениями, показанными здесь:
C6h22O6 + O2 → катализатор C6h20O6 + h3O2C6h22O6 + O2 → катализатор C6h20O6 + h3O2
2h3O2 + 2I− → катализаторI2 + 2h3O + O22h3O2 + 2I− → катализаторI2 + 2h3O + O2
Первое уравнение описывает окисление глюкозы в моче с образованием глюколактона и перекиси водорода.Полученная перекись водорода впоследствии окисляет бесцветный ион йодида с образованием коричневого йода, который можно обнаружить визуально. Некоторые полоски содержат дополнительное вещество, которое вступает в реакцию с йодом, вызывая более отчетливое изменение цвета.
Две показанные выше тестовые реакции по своей природе очень медленные, но их скорость увеличивается за счет специальных ферментов, встроенных в подушечку для тест-полосок. Это пример катализатора , тема которого обсуждается далее в этой главе. Обычной тест-полоске для определения уровня глюкозы в моче требуется около 30 секунд для завершения реакции формирования цвета.Слишком раннее прочтение результата может привести к выводу, что концентрация глюкозы в образце мочи ниже, чем она есть на самом деле ( ложноотрицательный результат ). Слишком долгое ожидание для оценки изменения цвета может привести к ложному положительному результату из-за более медленного (не катализируемого) окисления йодид-иона другими веществами, обнаруженными в моче.
Рис. 12.4 Тест-полоски обычно используются для определения наличия определенных веществ в моче человека. Многие тест-полоски имеют несколько подушечек, содержащих различные реагенты, что позволяет обнаруживать несколько веществ на одной полоске.(Источник: Икбал Осман)
Относительные скорости реакции
Скорость реакции может быть выражена как изменение концентрации любого реагента или продукта. Для любой данной реакции все эти выражения скорости просто связаны друг с другом в соответствии со стехиометрией реакции. Скорость общей реакции
может быть выражено через уменьшение концентрации A или увеличение концентрации B. Эти два выражения скорости связаны стехиометрией реакции:
скорость = — (1a) (ΔAΔt) = (1b) (ΔBΔt) скорость = — (1a) (ΔAΔt) = (1b) (ΔBΔt)
Рассмотрим реакцию, представленную следующим уравнением:
2Nh4 (г) ⟶N2 (г) + 3h3 (г) 2Nh4 (г) ⟶N2 (г) + 3h3 (г)
Соотношение между скоростями реакции, выраженными в единицах производства азота и потребления аммиака, например, составляет:
— Δмоль Nh4Δt × 1 мольN22 мольNh4 = ΔmolN2Δt — Δмоль Nh4Δt × 1 мольN22 мольNh4 = ΔmolN2Δt
Это может быть представлено в сокращенном формате, опуская единицы стехиометрического фактора:
−12ΔmolNh4Δt = ΔmolN2Δt − 12ΔmolNh4Δt = ΔmolN2Δt
Обратите внимание, что отрицательный знак был включен в качестве фактора для учета противоположных знаков двух изменений количества (количество реагента уменьшается, а количество продукта увеличивается).Для гомогенных реакций и реагенты, и продукты присутствуют в одном растворе и, таким образом, занимают один и тот же объем, поэтому молярные количества могут быть заменены молярными концентрациями:
−12Δ [Nh4] Δt = Δ [N2] Δt − 12Δ [Nh4] Δt = Δ [N2] Δt
Аналогично, скорость образования H 2 в три раза выше скорости образования N 2 , потому что на каждый моль полученного N 2 образуется три моля H 2 .
13Δ [h3] Δt = Δ [N2] Δt13Δ [h3] Δt = Δ [N2] Δt
Рисунок 12.5 иллюстрирует изменение концентраций во времени разложения аммиака на азот и водород при 1100 ° C. Наклон касательных линий при t = 500 с показывает, что мгновенные скорости, полученные от всех трех частиц, участвующих в реакции, связаны их стехиометрическими факторами. Например, скорость производства водорода в три раза выше, чем скорость производства азота:
2,91 × 10–6М / с 9,70 × 10–7М / с ≈ 32,91 × 10–6М / с 9,70 × 10–7М / с ≈3
Рисунок 12.5 Изменение концентраций реагента и продуктов реакции 2Nh4⟶N2 + 3h3,2Nh4⟶N2 + 3h3. Скорости изменения трех концентраций связаны стехиометрией реакции, как показано разными наклонами касательных при t = 500 с.
Пример 12.1
Выражения для относительных скоростей реакций
Первым этапом производства азотной кислоты является сжигание аммиака:
4Nh4 (г) + 5O2 (г) ⟶4NO (г) + 6h3O (г) 4Nh4 (г) + 5O2 (г) ⟶4NO (г) + 6h3O (г)
Напишите уравнения, связывающие скорости потребления реагентов и скорости образования продуктов.
Решение
Учитывая стехиометрию этой гомогенной реакции, скорости потребления реагентов и образования продуктов составляют:
−14Δ [Nh4] Δt = −15Δ [O2] Δt = 14Δ [NO] Δt = 16Δ [h3O] Δt − 14Δ [Nh4] Δt = −15Δ [O2] Δt = 14Δ [NO] Δt = 16Δ [h3O] Δt
Проверьте свои знания
Скорость образования Br 2 составляет 6,0 × 10 -6 моль / л / с в реакции, описываемой следующим чистым ионным уравнением:
5Br− + BrO3− + 6H + ⟶3Br2 + 3h3O5Br− + BrO3− + 6H + ⟶3Br2 + 3h3O
Напишите уравнения, связывающие скорости потребления реагентов и скорости образования продуктов.
Ответ:
−15Δ [Br−] Δt = −Δ [BrO3−] Δt = −16Δ [H +] Δt = 13Δ [Br2] Δt = 13Δ [h3O] Δt − 15Δ [Br−] Δt = −Δ [BrO3−] Δt = −16Δ [H +] Δt = 13Δ [Br2] Δt = 13Δ [h3O] Δt
Пример 12.2
Выражения скорости реакции для разложения H
2 O 2
График на рисунке 12.3 показывает скорость разложения H 2 O 2 во времени:
2h3O2⟶2h3O + O22h3O2⟶2h3O + O2
На основании этих данных мгновенная скорость разложения H 2 O 2 при t = 11.1 час определяется как
3,20 × 10 −2 моль / л / ч, то есть:
−Δ [h3O2] Δt = 3.20 × 10−2 моль л − 1h − 1 − Δ [h3O2] Δt = 3.20 × 10−2 моль л − 1h − 1
Какова мгновенная скорость производства H 2 O и O 2 ?
Решение
Стехиометрия реакции показывает, что
−12Δ [h3O2] Δt = 12Δ [h3O] Δt = Δ [O2] Δt − 12Δ [h3O2] Δt = 12Δ [h3O] Δt = Δ [O2] Δt
Следовательно:
12 × 3,20 × 10–2 моль – 1 ч – 1 = Δ [O2] Δt12 × 3,20 × 10–2 моль – 1 ч – 1 = Δ [O2] Δt
и
Δ [O2] Δt = 1,60 × 10−2 моль-1 · ч − 1Δ [O2] Δt = 1.60 × 10−2моль · л − 1 · ч − 1
Проверьте свои знания
Если скорость разложения аммиака, NH 3 , при 1150 K составляет 2,10 × × 10 −6 моль / л / с, какова скорость образования азота и водорода?
Ответ:
1,05 × × 10 −6 моль / л / с, N 2 и 3,15 × × 10 −6 моль / л / с, H 2 .
12.1 Скорость химических реакций — Химия 112 — Главы 12-17 OpenStax General Chemistry
Цели обучения
К концу этого раздела вы сможете:
- Определить скорость химической реакции
- Выведите выражения для скоростей из вычисленного уравнения данной химической реакции.
- Рассчитать скорость реакции по экспериментальным данным
Оценка — это мера того, как какое-то свойство изменяется со временем.Скорость — это знакомая скорость, которая выражает расстояние, пройденное объектом за заданный промежуток времени. Заработная плата — это ставка, которая представляет собой сумму денег, заработанную человеком, работающим в течение определенного времени. Точно так же скорость химической реакции является мерой того, сколько реагента потребляется или сколько продукта производится в результате реакции за заданный промежуток времени.
Скорость реакции — это изменение количества реагента или продукта в единицу времени. Поэтому скорости реакции определяют путем измерения зависимости от времени некоторого свойства, которое может быть связано с количествами реагента или продукта.Например, скорость реакций, в которых потребляются или образуются газообразные вещества, удобно определять путем измерения изменений объема или давления. Для реакций с участием одного или нескольких окрашенных веществ скорость можно контролировать путем измерения поглощения света. Для реакций с участием водных электролитов скорость можно измерить по изменению проводимости раствора.
Для реагентов и продуктов в растворе их относительные количества (концентрации) удобно использовать для целей выражения скоростей реакции.Если мы измерим концентрацию перекиси водорода, H 2 O 2 , в водном растворе, мы обнаружим, что она медленно изменяется со временем, поскольку H 2 O 2 разлагается в соответствии с уравнением:
[латекс] 2 \ text {H} _2 \ text {O} _2 (aq) \; {\ longrightarrow} \; 2 \ text {H} _2 \ text {O} (l) \; + \; \ text {O} _2 (г) [/ латекс]
Скорость разложения пероксида водорода можно выразить через скорость изменения его концентрации, как показано здесь:
[латекс] \ begin {array} {r @ {{} = {}} l} \ text {rate \; of \; разложение \; of \; H} _2 \ text {O} _2 & — \ frac { \ text {изменение \; в \; концентрация \; \; реагента}} {\ text {время \; интервал}} \\ [0.5em] & — \ frac {[\ text {H} _2 \ text {O} _2] _ {t_2} \; — \; [\ text {H} _2 \ text {O} _2] _ {t_1}} { t_2 \; — \; t_1} \\ [0.5em] & — \ frac {{\ Delta} [\ text {H} _2 \ text {O} _2]} {{\ Delta} t} \ end {array} [/ латекс]
Это математическое представление изменения концентрации частиц с течением времени представляет собой скоростное выражение для реакции. Скобки указывают молярные концентрации, а символ дельта (Δ) указывает «изменение в». Таким образом, [латекс] [\ text {H} _2 \ text {O} _2] _ {t_1} [/ latex] представляет молярную концентрацию перекиси водорода в определенный момент времени t 1 ; аналогично, [латекс] [\ text {H} _2 \ text {O} _2] _ {t_2} [/ latex] представляет молярную концентрацию перекиси водорода в более позднее время t 2 ; и Δ [H 2 O 2 ] представляет изменение молярной концентрации пероксида водорода в течение временного интервала Δ t (то есть t 2 — t 1 ).Поскольку концентрация реагента уменьшается по мере протекания реакции, Δ [H 2 O 2 ] является отрицательной величиной; мы ставим отрицательный знак перед выражением, потому что скорость реакции, по соглашению, является положительной величиной. На рисунке 1 представлен пример данных, собранных при разложении H 2 O 2 .
Рис. 1. Скорость разложения H 2 O 2 в водном растворе уменьшается с уменьшением концентрации H 2 O 2 .
Чтобы получить табличные результаты для этого разложения, концентрацию перекиси водорода измеряли каждые 6 часов в течение дня при постоянной температуре 40 ° C. Скорости реакции были рассчитаны для каждого временного интервала путем деления изменения концентрации на соответствующий временной интервал, как показано здесь для первого 6-часового периода:
[латекс] \ frac {- {\ Delta} [\ text {H} _2 \ text {O} _2]} {{\ Delta} t} = \ frac {- (0.500 \; \ text {mol / L} \; — \; 1.000 \; \ text {mol / L})} {(6.00 \; \ text {h} \; — \; 0.{-1} [/ латекс]
Такое поведение указывает на то, что реакция постоянно замедляется со временем. Использование концентраций в начале и в конце периода времени, в течение которого скорость реакции изменяется, приводит к расчету средней скорости для реакции за этот временной интервал. В любое конкретное время скорость, с которой протекает реакция, известна как ее мгновенная скорость . Мгновенная скорость реакции в «нулевой момент времени», когда реакция начинается, равна ее начальной скорости .Рассмотрим аналогию с автомобилем, который замедляется при приближении к знаку остановки. Начальная скорость транспортного средства — аналогичная началу химической реакции — будет показанием спидометра в момент, когда водитель начинает нажимать на тормоза ( t 0 ). Несколько мгновений спустя мгновенная скорость в определенный момент — назовем ее t 1 — будет несколько ниже, о чем свидетельствуют показания спидометра в этот момент времени. По прошествии времени мгновенная скорость будет продолжать падать, пока не достигнет нуля, когда машина (или реакция) остановится.В отличие от мгновенной скорости, средняя скорость автомобиля не отображается на спидометре; но его можно рассчитать как отношение пройденного расстояния ко времени, необходимому для полной остановки транспортного средства (Δ t ). Подобно замедляющемуся автомобилю, средняя скорость химической реакции будет находиться где-то между начальной и конечной скоростью.
Мгновенную скорость реакции можно определить одним из двух способов. Если экспериментальные условия позволяют измерять изменения концентрации в течение очень коротких интервалов времени, тогда средние скорости, вычисленные, как описано ранее, обеспечивают достаточно хорошее приближение мгновенных скоростей.В качестве альтернативы может использоваться графическая процедура, которая, по сути, дает результаты, которые были бы получены, если бы были возможны измерения с короткими временными интервалами. Если мы построим график зависимости концентрации перекиси водорода от времени, мгновенная скорость разложения H 2 O 2 в любой момент времени t будет выражена наклоном прямой линии, касательной к кривой в это время ( Фигура 2). Мы можем использовать исчисление для оценки наклона таких касательных, но процедура для этого выходит за рамки данной главы.
Рис. 2. На этом графике показан график зависимости концентрации от времени для 1.000 M раствора H 2 O 2 . Скорость в любой момент равна величине, противоположной наклону линии, касательной к этой кривой в этот момент. Касательные показаны при t = 0 ч («начальная скорость») и при t = 10 ч («мгновенная скорость» в это конкретное время).
Скорость реакции при анализе: тест-полоски для анализа мочи
Врачи часто используют одноразовые тест-полоски для измерения количества различных веществ в моче пациента (рис. 3).Эти тест-полоски содержат различные химические реагенты, встроенные в небольшие подушечки в различных местах вдоль полоски, которые меняют цвет при воздействии достаточных концентраций определенных веществ. В инструкциях по использованию тест-полосок часто подчеркивается, что правильное время считывания имеет решающее значение для получения оптимальных результатов. Такой акцент на времени считывания предполагает, что важными факторами являются кинетические аспекты химических реакций, происходящих на тест-полоске. {-} \; {\ xrightarrow [\ text {катализатор}] {}} \; \ текст {I} _2 \; + \; 2 \ text {H} _2 \ text {O} \; + \; \ text {O} _2 [/ latex]
Первое уравнение описывает окисление глюкозы в моче с образованием глюколактона и перекиси водорода.Полученная перекись водорода впоследствии окисляет бесцветный ион йодида с образованием коричневого йода, который можно обнаружить визуально. Некоторые полоски содержат дополнительное вещество, которое вступает в реакцию с йодом, вызывая более отчетливое изменение цвета.
Две показанные выше тестовые реакции по своей природе очень медленные, но их скорость увеличивается за счет специальных ферментов, встроенных в подушечку для тест-полосок. Это пример катализатора , тема которого обсуждается далее в этой главе. Обычной тест-полоске для определения уровня глюкозы в моче требуется около 30 секунд для завершения реакции формирования цвета.Слишком раннее прочтение результата может привести к выводу, что концентрация глюкозы в образце мочи ниже, чем она есть на самом деле (ложноотрицательный результат ). Слишком долгое ожидание для оценки изменения цвета может привести к ложноположительному результату из-за более медленного (не катализируемого) окисления иодид-иона другими веществами, обнаруженными в моче.
Рис. 3. Тест-полоски обычно используются для определения наличия определенных веществ в моче человека. Многие тест-полоски имеют несколько подушечек, содержащих различные реагенты, что позволяет обнаруживать несколько веществ на одной полоске.(Источник: Икбал Осман)
Скорость реакции может быть выражена через изменение количества любого реагента или продукта и может быть просто получена из стехиометрии реакции. Рассмотрим реакцию, представленную следующим уравнением:
[латекс] 2 \ text {NH} _3 (g) \; {\ longrightarrow} \; \ text {N} _2 (g) \; + \; 3 \ text {H} _2 (g) [/ latex]
Стехиометрические коэффициенты, полученные из этого уравнения, могут использоваться для связи скоростей реакции таким же образом, как они используются для соответствующих количеств реагента и продукта.Соотношение между скоростями реакции, выраженными в единицах производства азота и потребления аммиака, например, составляет:
[латекс] — \; \ frac {{\ Delta} \ text {mol \; NH} _3} {{\ Delta} t} \; \ times \; \ frac {1 \; \ text {mol \; N } _2} {2 \; \ text {mol \; NH} _3} = \ frac {{\ Delta} \ text {mol \; N} _2} {{\ Delta} t} [/ latex]
Мы можем выразить это проще, не показывая единиц стехиометрического фактора:
[латекс] — \; \ frac {1} {2} \; \ frac {{\ Delta} \ text {mol \; NH} _3} {{\ Delta} t} = \ frac {{\ Delta} \ текст {mol \; N} _2} {{\ Delta} t} [/ latex]
Обратите внимание, что был добавлен отрицательный знак для учета противоположных знаков двух изменений количества (количество реагента уменьшается, а количество продукта увеличивается).Если реагенты и продукты присутствуют в одном растворе, молярные количества могут быть заменены на концентрации:
[латекс] — \; \ frac {1} {2} \; \ frac {{\ Delta} [\ text {NH} _3]} {{\ Delta} t} = \ frac {{\ Delta} [\ текст {N} _2]} {{\ Delta} t} [/ latex]
Аналогично, скорость образования H 2 в три раза выше скорости образования N 2 , потому что три моля H 2 образуются в течение времени, необходимого для образования одного моля N 2 :
[латекс] \ frac {1} {3} \; \ frac {{\ Delta} [\ text {H} _2]} {{\ Delta} t} = \ frac {{\ Delta} [\ text {N } _2]} {{\ Delta} t} [/ latex]
На рис. 4 показано изменение концентраций во времени разложения аммиака на азот и водород при 1100 ° C.{-6} \; M / \ text {s}} \; {\ приблизительно} \; 3 [/ латекс]
Рис. 4. На этом графике показаны изменения концентраций реагентов и продуктов во время реакции 2NH 3 → 3N 2 + H 2 . Скорости изменения трех концентраций связаны их стехиометрическими факторами, как показано разными наклонами касательных при t = 500 с.
Таким образом, для химической реакции:
aA + bB → cC + dD
скорость реакции может быть выражена как:
[латекс] \ text {скорость реакции} = — \ frac {1} {a} \; \ frac {{\ Delta} [A]} {{\ Delta} t} = — \ frac {1} {b } \; \ frac {{\ Delta} [B]} {{\ Delta} t} = \ frac {1} {c} \; \ frac {{\ Delta} [C]} {{\ Delta} t} = \ frac {1} {d} \; \ frac {{\ Delta} [D]} {{\ Delta} t} [/ latex]
Пример 1
Выражения для относительных скоростей реакций
Первым шагом в производстве азотной кислоты является сжигание аммиака:
[латекс] 4 \ text {NH} _3 (g) \; + \; 5 \ text {O} _2 (g) \; {\ longrightarrow} \; 4 \ text {NO} (g) \; + \ ; 6 \ text {H} _2 \ text {O} (g) [/ latex]
Напишите уравнения, связывающие скорости потребления реагентов и скорости образования продуктов.
Раствор
Учитывая стехиометрию этой гомогенной реакции, скорости потребления реагентов и образования продуктов составляют:
[латекс] — \ frac {1} {4} \; \ frac {{\ Delta} [\ text {NH} _3]} {{\ Delta} t} = — \ frac {1} {5} \; \ frac {{\ Delta} [\ text {O} _2]} {{\ Delta} t} = \ frac {1} {4} \; \ frac {{\ Delta} [\ text {NO}]} { {\ Delta} t} = \ frac {1} {6} \; \ frac {{\ Delta} [\ text {H} _2 \ text {O}]} {{\ Delta} t} [/ latex]
Пример 2
Выражения скорости реакции для разложения H 2 O 2
График на Рисунке 2 показывает скорость разложения H 2 O 2 во времени:
[латекс] 2 \ text {H} _2 \ text {O} _2 \; {\ longrightarrow} \; 2 \ text {H} _2 \ text {O} \; + \; \ text {O} _2 [/ латекс]
На основании этих данных мгновенная скорость разложения H 2 O 2 при т = 11.{-1} [/ латекс]
Какова мгновенная скорость производства H 2 O и O 2 ?
Раствор
Используя стехиометрию реакции, мы можем определить, что:
[латекс] — \ frac {1} {2} \; \ frac {{\ Delta} [\ text {H} _2 \ text {O} _2]} {{\ Delta} t} = \ frac {1} {2} \; \ frac {{\ Delta} [\ text {H} _2 \ text {O}]} {{\ Delta} t} = \ frac {{\ Delta} [\ text {O} _2]} {{\ Delta} t} [/ латекс]
Следовательно:
[латекс] \ frac {1} {2} \; \ times \; 3. {- 1} = \ frac {{\ Delta} [\ text {O} _2]} {{\ Delta} t} [/ latex]
и
[латекс] \ frac {{\ Delta} [\ text {O} _2]} {{\ Delta} t} = 1.{-1} [/ латекс]
Это означает, что если мы знаем скорость изменения одного химического вещества (реагента или продукта) в реакции, мы сможем вычислить скорость изменения для всех других химикатов.
Скорость реакции может быть выражена либо через уменьшение количества реагента, либо через увеличение количества продукта в единицу времени. Соотношения между различными выражениями скорости для данной реакции выводятся непосредственно из стехиометрических коэффициентов уравнения, представляющего реакцию.
- относительные скорости реакции для [латекса] a \ text {A} \; {\ longrightarrow} \; b \ text {B} = — \ frac {1} {a} \; \ frac {{\ Delta} [\ текст {A}]} {{\ Delta} t} = \ frac {1} {b} \; \ frac {{\ Delta} [\ text {B}]} {{\ Delta} t} [/ latex]
Озон разлагается до кислорода согласно уравнению [латекс] 2 \ text {O} _3 (g) \; {\ longrightarrow} \; 3 \ text {O} _2 (g) [/ latex]. Напишите уравнение, связывающее выражения скорости этой реакции через исчезновение O 3 и образование кислорода.
В ядерной промышленности трифторид хлора используется для получения гексафторида урана, летучего соединения урана, используемого для разделения изотопов урана. Трифторид хлора получают по реакции [латекс] \ text {Cl} _2 (g) \; + \; 3 \ text {F} _2 (g) \; {\ longrightarrow} \; 2 \ text {ClF} _3 ( г) [/ латекс]. Напишите уравнение, связывающее выражения скорости этой реакции с точки зрения исчезновения Cl 2 и F 2 и образования ClF 3 .
Исследование скорости димеризации C 4 H 6 дало данные, представленные в таблице:
[латекс] 2 \ text {C} _4 \ text {H} _6 \; {\ longrightarrow} \; \ text {C} _8 \ text {H} _ {12} [/ latex]
| Время (с) | 0 | 1600 | 3200 | 4800 | 6200 |
| [C 4 H 6 ] ( M ) | 1.00 × 10 −2 | 5,04 × 10 −3 | 3,37 × 10 −3 | 2,53 × 10 −3 | 2,08 × 10 −3 |
| Таблица 1. | |||||
(a) Определите среднюю скорость димеризации от 0 до 1600 с и от 1600 до 3200 с.
(b) Оцените мгновенную скорость димеризации при 3200 с по графику зависимости времени от [C 4 H 6 ].Какие единицы этой ставки?
(c) Определите среднюю скорость образования C 8 H 12 за 1600 с и мгновенную скорость образования через 3200 с из скоростей, найденных в частях (a) и (b).
Исследование скорости реакции, представленной как [латекс] 2A \; {\ longrightarrow} \; B [/ latex], дало следующие данные:
| Время (с) | 0,0 | 5,0 | 10,0 | 15,0 | 20,0 | 25.0 | 35,0 |
| [ A ] ( M ) | 1,00 | 0,952 | 0,625 | 0,465 | 0,370 | 0,308 | 0,230 |
| Таблица 2. | |||||||
(a) Определите среднюю скорость исчезновения A от 0,0 до 10,0 с и от 10,0 до 20,0 с.
(b) Оцените мгновенную скорость исчезновения A через 15.{+} (aq) \; {\ longrightarrow} \; 3 \ text {Br} _2 (aq) \; + \; 3 \ text {H} _2 \ text {O} (l) [/ latex]
Если скорость исчезновения Br — ( водн. ) в конкретный момент реакции составляет 3,5 × 10 −4 M с −1 , то какова скорость появления Br 2 ( вод ) в тот момент?
Глоссарий
- средняя оценка
- Скорость химической реакции, вычисляемая как отношение измеренного изменения количества или концентрации вещества к интервалу времени, в течение которого это изменение произошло
- начальная ставка
- мгновенная скорость химической реакции при т = 0 с (сразу после начала реакции)
- мгновенная скорость
- Скорость химической реакции в любой момент времени, определяемая наклоном касательной к графику концентрации как функции времени
- скорость реакции
- Мера скорости, с которой протекает химическая реакция
- скорость выражения
- математическое представление, связывающее скорость реакции с изменениями количества, концентрации или давления реагентов или продуктов в единицу времени
Решения
Ответы на упражнения по химии в конце главы
1.Мгновенная скорость — это скорость реакции в любой конкретный момент времени, период времени, который настолько короткий, что концентрации реагентов и продуктов изменяются на незначительную величину. Начальная скорость — это мгновенная скорость реакции, когда она начинается (когда продукт только начинает образовываться). Средняя скорость — это средняя мгновенная скорость за период времени.
3. [латекс] \ text {rate} = + \ frac {1} {2} \; \ frac {{\ Delta} [\ text {CIF} _3]} {{\ Delta} t} = — \ frac {{\ Delta} [\ text {Cl} _2]} {{\ Delta} t} = — \ frac {1} {3} \; \ frac {{\ Delta} [\ text {F} _2]} { {\ Delta} t} [/ латекс]
5.(а) средняя скорость, 0-10 с = 0,0375 моль л -1 с -1 ; средняя скорость, 12-18 с = 0,0225 моль л -1 с -1 ; (б) мгновенная скорость, 15 с = 0,0500 моль л -1 с -1 ; (c) средняя скорость образования B = 0,0188 моль л -1 с -1 ; мгновенная скорость образования B = 0,0250 моль л -1 с -1
порядков реакций и скоростных уравнений
Это означает, что каждую секунду концентрация A снижалась на 0.0040 моль на кубический дециметр. Эта скорость будет уменьшаться во время реакции по мере использования A .
Сводка
В целях уравнения скорости и порядка реакции скорость реакции измеряется с точки зрения того, насколько быстро падает концентрация одного из реагентов. Её единицы: моль дм -3 с -1 .
Порядки реагирования
Я не собираюсь сразу определять, что означает порядок реакции — я собираюсь подкрасться к нему!
Порядки реакции всегда обнаруживаются путем экспериментов.Вы не можете сделать никаких выводов о порядке реакции, просто взглянув на уравнение реакции.
Итак, предположим, что вы провели несколько экспериментов, чтобы выяснить, что происходит со скоростью реакции при изменении концентрации одного из реагентов, A . Вот некоторые из простых вещей, которые вы можете найти:
Одна возможность: скорость реакции пропорциональна концентрации A
Это означает, что если вы удвоите концентрацию A , ставка также удвоится.Если увеличить концентрацию A в 4 раза, скорость также возрастет в 4 раза.
Вы можете выразить это с помощью символов как:
Запись формулы в квадратных скобках — это стандартный способ показать концентрацию, измеренную в молях на кубический дециметр (литр).
Вы также можете записать это, избавившись от знака пропорциональности и введя константу k.
Другая возможность: скорость реакции пропорциональна квадрату концентрации A
Это означает, что если вы удвоите концентрацию A , скорость вырастет в 4 раза (2 2 ).Если утроить концентрацию A , скорость увеличится в 9 раз (3 2 ). В условном обозначении:
Обобщение
Проведя эксперименты, включающие реакцию между A и B , вы обнаружите, что скорость реакции связана с концентрациями A и B следующим образом:
Это называется уравнением скорости для реакции.
Концентрации A и B должны быть увеличены до некоторой степени, чтобы показать, как они влияют на скорость реакции. Эти мощности называются порядками реакции по отношению к A и B .
Для целей уровня UK A ‘порядок реакции, который вы, вероятно, встретите, будет 0, 1 или 2. Но возможны и другие значения, включая дробные, такие как, например, 1,53.
Если порядок реакции по отношению к A равен 0 (ноль), это означает, что концентрация A не влияет на скорость реакции.Математически любое число, возведенное в степень нуля (x 0 ), равно 1. Это означает, что этот конкретный член исчезает из уравнения ставок.
Общий порядок реакции находится путем сложения отдельных заказов. Например, если реакция первого порядка по отношению к A и B (a = 1 и b = 1), общий порядок равен 2. Мы называем это общей реакцией второго порядка.
Некоторые примеры
Каждый из этих примеров включает реакцию между A и B , и каждое уравнение скорости получено в результате проведения некоторых экспериментов, чтобы выяснить, как концентрации A и B влияют на скорость реакции.
Пример 1:
В этом случае порядок реакции по отношению к A и B равен 1. Общий порядок реакции равен 2 — определяется путем сложения отдельных заказов.
Скорость реакции — Скорость реакции — AQA Synergy — Объединенная научная редакция GCSE — AQA Synergy
Скорость реакции — это мера того, как быстро расходуется реагент или образуется продукт.
Есть разные способы определить скорость реакции.Выбор метода обычно зависит от используемых реагентов и продуктов, а также от того, насколько легко измерить их изменения.
Среднюю скорость реакции можно рассчитать с помощью любого из этих двух уравнений:
\ [средняя ~ скорость ~ реакции = \ frac {количество ~ ~ использованного реагента} {время ~ занято} \]
\ [средняя ~ скорость ~ реакции = \ frac {количество ~ ~ образовавшегося продукта} {время ~ занятое} \]
Измерение массы
За изменением массы реагента или продукта можно следить во время реакции.Этот метод полезен, когда диоксид углерода является продуктом, который покидает реакционный контейнер. Он не подходит для водорода и других газов с небольшой относительной формульной массой, M r .
Единицами измерения скорости обычно являются г / с или г / мин.
Измеряемый объем
За изменением объема реагента или продукта можно следить во время реакции. Этот метод полезен, когда газ выходит из реакционной емкости. Объем газа измеряется с помощью газового шприца, перевернутой бюретки или мерного цилиндра.
Единицами измерения скорости обычно являются см 3 / с или см 3 / мин.
Два способа измерения объема газа, образующегося в реакции
Графики
Скорость реакции можно проанализировать, построив график зависимости массы или объема образовавшегося продукта от времени. График показывает это для двух реакций.
Градиент линии равен скорости реакции:
- чем круче линия, тем больше скорость реакции
- Posted in Разное
