Содержание
Закон сохранения массы веществ. Уравнения химических реакций
В течение
тысячелетий люди верили, что вещество может бесследно исчезать, а также
возникать из ничего. Это утверждение подтвердил и такой известный учёный, как
Роберт Бойль.
Бойль проделал
множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз
масса окалины оказывалась больше массы прокаливаемого металла.
Вот что записал
учёный после одного из своих опытов в 1673 году:
«После
двух часов нагревания был открыт запаянный кончик реторты, причём в неё
ворвался с шумом наружный воздух. По нашему наблюдению при этой операции была
прибыль в весе на 8 гранов…»
Русский учёный М.В. Ломоносов предположил, что
чувственный опыт обманывает нас. 5 июля 1748 года он написал в письме Леонарду
Эйлеру:
«Все перемены в натуре случающиеся
такого суть состояния, что сколько чего у одного тела отнимется, столько же
присовокупится к другому. Так, ежели где убудет материи, то умножится в другом
месте; сколько часов положит кто на бдение, столько же сну отнимет. ..»
..»
Лишь в 1756 году Ломоносову удалось проверить
опытным путём теоретически открытый закон сохранения массы вещества при
химических реакциях. Подобно Бойлю русский учёный делал опыт в запаянных
ретортах. Но, в отличие от Бойля,
Ломоносов взвешивал сосуды как до, так и после прокаливания не вскрывая.
«Оными опытами нашлось, что славного
Роберта Бойля мнение ложно, ибо без пропущения внешнего воздуха вес сожжённого
металла остаётся в одной мере…»
Спустя 41 год после опытов Ломоносова французский
учёный Антуан Лоран Лавуазье практически повторил формулировку закона в своём
учебнике.
Современная формулировка закона сохранения массы:
Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
youtube.com/embed/09bFhmNNssY?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
С точки зрения атомно-молекулярного учения закон
объясняется тем, что общее количество атомов в результате не изменятся, а
происходит лишь их перегруппировка.
Закон сохранения массы веществ применяют при составлении уравнений химических реакций. Что такое уравнение реакции и как его составить?
Таким образом, уравнение химической реакции – это условная
запись химической реакции с помощью химических формул и коэффициентов.
Вещества, которые изначально вступили в реакцию, называются исходными веществами.
вещества, образующиеся в результате реакции, называются продуктами реакции.
Тренинг: (выполняя задания, дождитесь, когда картинка меняться не будет)
Урок 11. Формулировка закона сохранения массы и энергии – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 11 «Формулировка закона сохранения массы и энергии» из курса «Химия для чайников» дадим определение закону сохранения массы и закону сохранения энергии, познакомимся с открытием Ломоносова, а также повторим некоторые основы химии из прошлой главы. Этим уроком мы открываем следующий раздел курса, под названием «Закон сохранения массы и энергии». Поэтому, чтобы у вас не возникало вопросов по урокам, обязательно изучите все уроки из первого раздела «Атомы, молекулы и ионы».
Этим уроком мы открываем следующий раздел курса, под названием «Закон сохранения массы и энергии». Поэтому, чтобы у вас не возникало вопросов по урокам, обязательно изучите все уроки из первого раздела «Атомы, молекулы и ионы».
Мысль о том, что все в мире состоит из атомов, зародилась еще до нашей эры. Древнегреческий философ Демокрит полагал, что вся материя состоит из неделимых микрочастиц — атомов, что каждый атом обладает индивидуальными свойствами, что свойства веществ определяются их взаимным расположением относительно друг друга. Таким образом его идеи являются примитивным вариантом того, что изложено в разделе 1 «Атомы, молекулы и ионы». Напрашивается вопрос: почему же тогда древние греки не воспользовались гипотезой Демокрита и не научились получать атомную энергию? Почему прошло еще 2000 лет, прежде чем наука достигла своего современного уровня? Одна из причин заключалась в том, что древние греки понятия не имели о законах сохранения вещества, ну и конечно же о законе сохранения энергии.
Закон сохранения массы и энергии
Великий русский ученый М.В. Ломоносов в 1748 году стал первым, кто осознал, что масса является фундаментальным свойством, сохраняющимся в процессе химических реакций. Он установил закон который гласит, что суммарная масса всех продуктов химического превращения должна точно совпадать с суммарной массой исходных веществ. Помимо суммарной массы веществ, в химических реакциях сохраняется также число атомов каждого сорта независимо от того, в сколь сложных превращениях они участвуют и как переходят из одних молекул в другие.
В химических реакциях должна сохраняться также и энергия. Химически важный вывод из этого закона заключается в том, что поглощение или выделение тепла (теплота реакции) в конкретной химической реакции не зависит от того, каким путем осуществляется реакция — в одну или несколько стадий. Например, тепло, выделяющееся напрямую при сгорании газообразного водорода и графита (одна из форм углерода), должна совпадать с теплом, выделяющимся, когда водород и углерод используются для получения синтетического бензина, а заем этот бензин используется в качестве топлива. Если бы количество тепла, выделяемого в одной из двух описанных выше вариантов реакции, было неодинаковым, можно было бы воспользоваться этим и проводить более эффективную реакцию в одном направлении, а менее эффективную — в обратном. В результате получился бы циклический бестопливный источник тепла, непрерывно дающий даровую энергию. Но это всего лишь мечты о вечном двигателе, создание которого разрушается об незыблемую стену закона сохранения массы и энергии.
Если бы количество тепла, выделяемого в одной из двух описанных выше вариантов реакции, было неодинаковым, можно было бы воспользоваться этим и проводить более эффективную реакцию в одном направлении, а менее эффективную — в обратном. В результате получился бы циклический бестопливный источник тепла, непрерывно дающий даровую энергию. Но это всего лишь мечты о вечном двигателе, создание которого разрушается об незыблемую стену закона сохранения массы и энергии.
Закон сохранения массы: в процессе химической реакции не происходит образования или разрушения атомов.
Закон сохранения энергии: если сумма двух реакций представляет собой новую, третью реакцию, то теплота третьей реакции равна сумме теплот первых двух реакций. Говорят, что тепловые эффекты реакций аддитивны. Более подробно о законе сохранения тепла вы узнаете в конце данной главы, где все станет просто и ясно.
Кстати, в 1756 году Ломоносов экспериментально подтвердил химический закон сохранения массы, путем обжига металлов в запаянных сосудах. Вместо обжига металлов можно в запаянном сосуде сжечь фтор, закон сохранения массы все равно соблюдается:
Вместо обжига металлов можно в запаянном сосуде сжечь фтор, закон сохранения массы все равно соблюдается:
Повторюсь, что не плотность или объем, а именно масса является фундаментальным свойством, сохраняющимся в процессе химических реакций. И как только химики это поняли, они сразу бросились в поиски правильной шкалы атомных масс для каждого элемента. В уроке 3 «Строение молекулы» мы отмечали, что молекулярная масса молекулы вычисляется через сумму всех атомных масс входящих в ее состав атомов. А из урока 5 «Моль и молярная масса» нам известно, что моль любого вещества — это такое его количество, в котором число частиц этого вещества равно 6,022·1023. Масса одного моля вещества в граммах называется молярной массой. Моль и молярная масса являются важнейшими понятиями, без которых невозможно проводить химический расчет.
Моль — это просто средство подсчитывать атомы и молекулы порциями по 6,022·1023. Если известно, что две молекулы газообразного водорода H2 реагируют с одной молекулой газообразного кислорода O2, с образованием двух молекул воды H2O, то можно предсказать, что 2 моля H2, т.е. 4,032 г, будут реагировать с 1 молем O2, т.е. с 31,999 г, с образованием 2 молей H2O, т.е.36,031 г). Контрольное суммирование 4,032+31,999=36,031 подтверждают, что в этой реакции выполняется химический закон сохранения массы.
Если известно, что две молекулы газообразного водорода H2 реагируют с одной молекулой газообразного кислорода O2, с образованием двух молекул воды H2O, то можно предсказать, что 2 моля H2, т.е. 4,032 г, будут реагировать с 1 молем O2, т.е. с 31,999 г, с образованием 2 молей H2O, т.е.36,031 г). Контрольное суммирование 4,032+31,999=36,031 подтверждают, что в этой реакции выполняется химический закон сохранения массы.
Урок 11 «Формулировка закона сохранения массы и энергии» является повторением уже пройденного материала перед погружением в более серьезный раздел химии. Надеюсь вы открыли в этом уроке для себя что-то новое и интересное. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Примеры закона сохранения массы веществ. Закон сохранения массы вещества
Из данного урока вы узнаете, в чем заключается сущность химической реакции с позиции атомно-молекулярной теории. Урок посвящен изучению одного из важнейших законов химии — закона сохранения массы веществ.
Урок посвящен изучению одного из важнейших законов химии — закона сохранения массы веществ.
Тема: Первоначальные химические представления
Урок: Сущность химической реакции. Закон сохранения массы веществ
Вопрос о сущности химического превращения долгое время оставался загадкой для естествоиспытателей. Только с развитием атомно-молекулярной теории стало возможным предположить, как на уровне атомов и молекул происходят химические реакции.
В соответствие с атомно-молекулярной теорией, вещества состоят из молекул, а молекулы – из атомов. В ходе химической реакции атомы, входящие в состав исходных веществ, не исчезают и не появляются новые атомы.
Тогда, мы можем предположить, что в результате химической реакции продукты реакции образуются из атомов, которые ранее входили в состав исходных веществ. Вот модель химической реакции:
Рис. 1. Модель химической реакции с позиции АМТ
Проанализировав данную модель, мы можем выдвинуть гипотезу (научно обоснованное предположение):
Суммарная масса продуктов реакции должна быть равна суммарной массе исходных веществ.
Еще Леонардо да Винчи сказал: «Знания, не проверенные опытом, матерью всякой достоверности, бесплодны и полны ошибок». Значит, гипотеза никогда не станет законом, если ее не подтвердить экспериментально.
Экспериментальный метод в химии начал широко использоваться после исследований Р. Бойля в 17 в. Английский естествоиспытатель прокаливал металлы в незапаянных сосудах – ретортах и обнаружил, что после прокаливания масса металла становилась больше.
Основываясь на этих опытах, он не учитывал роль воздуха и сделал неправильный вывод, что масса веществ в ходе химических реакций изменяется.
М.В. Ломоносов, в отличие от Р. Бойля, прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он доказал, что масса веществ до и после реакции остается неизменной и что при прокаливании к металлу присоединяется воздух (кислород в то время не был еще открыт). Но Ломоносов не опубликовал результаты своих исследований.
В 1774 г. опыты Р. Бойля повторил А. Лавуазье с совершенно такими же результатами, как и Ломоносов. Но он сделал новое, очень важное, наблюдение, а именно, что только часть воздуха запаянной реторты соединилась с металлом и что увеличение веса металла, перешедшего в окалину, равно уменьшению веса воздуха в реторте. Вместе с тем часть металла осталась в свободном виде.
опыты Р. Бойля повторил А. Лавуазье с совершенно такими же результатами, как и Ломоносов. Но он сделал новое, очень важное, наблюдение, а именно, что только часть воздуха запаянной реторты соединилась с металлом и что увеличение веса металла, перешедшего в окалину, равно уменьшению веса воздуха в реторте. Вместе с тем часть металла осталась в свободном виде.
Таким образом, независимо друг от друга, М.В. Ломоносов и А. Лавуазье подтвердили справедливость предположения о сохранении массы веществ в результате химической реакции.
Это предположение стало законом лишь после десятилетнего исследования немецкого химика Г. Ландольта в начале 20 века. Сегодня закон сохранения массы веществ
формулируется так:
Масса веществ, участвующих в реакции, равна массе продуктов реакции
.
Подтвердить правильность закона сохранения массы веществ можно с помощью следующего опыта. В первом сосуде Ландольта подготовим растворы йодида калия и нитрата свинца. Во втором сосуде – пройдет реакция хлорида железа с роданидом калия.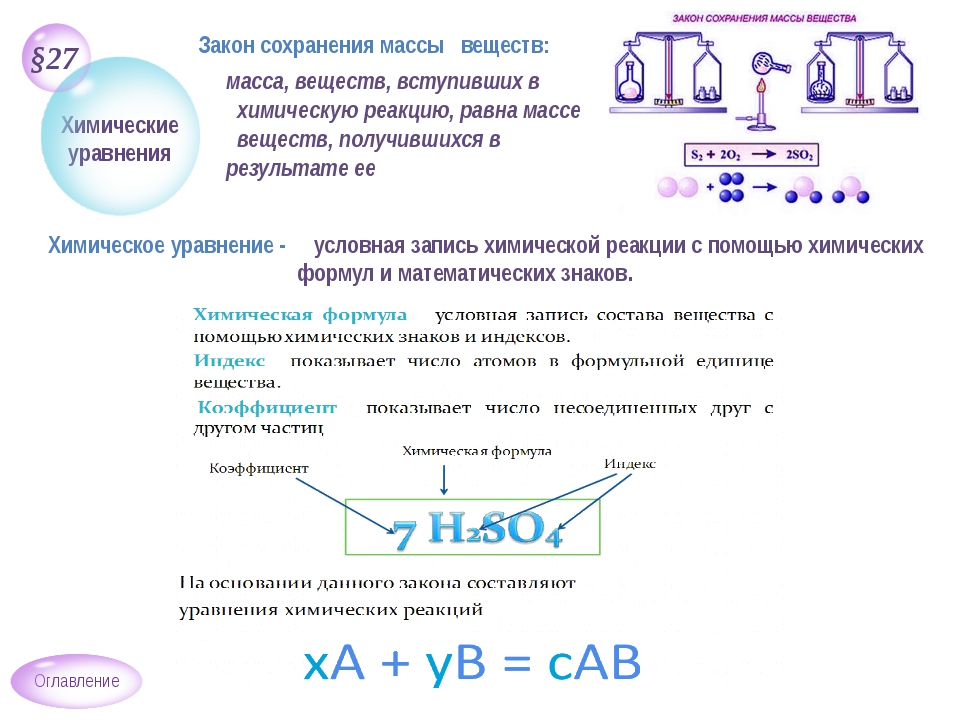 Плотно закрываем пробки. Уравновешиваем чашки весов. Сохранится ли равновесие после окончания реакций? В первом сосуде выпадает желтый осадок йодида свинца, во втором образуется темно-красный роданид трехвалентного железа. В сосудах Ландольта произошли химические реакции: образовались новые вещества. Но равновесие не нарушилось (Рис. 2). Масса исходных веществ всегда равна массе продуктов реакции.
Плотно закрываем пробки. Уравновешиваем чашки весов. Сохранится ли равновесие после окончания реакций? В первом сосуде выпадает желтый осадок йодида свинца, во втором образуется темно-красный роданид трехвалентного железа. В сосудах Ландольта произошли химические реакции: образовались новые вещества. Но равновесие не нарушилось (Рис. 2). Масса исходных веществ всегда равна массе продуктов реакции.
Рис. 2. Эксперимент, подтверждающий правильность закона сохранения массы веществ
Приведем пример еще одного опыта, доказывающего правильность закона сохранения массы веществ в химических реакциях. Внутри колбы при закрытой пробке будет гореть свеча. Уравновесим весы. Подожжем свечу и опустим ее в колбу. Плотно закроем колбу пробкой. Горение свечи – это химический процесс. Израсходовав находящийся в колбе кислород, свеча гаснет, химическая реакция завершается. Но равновесие весов не нарушается: масса продуктов реакции остается такой же, какой была масса исходных веществ (Рис.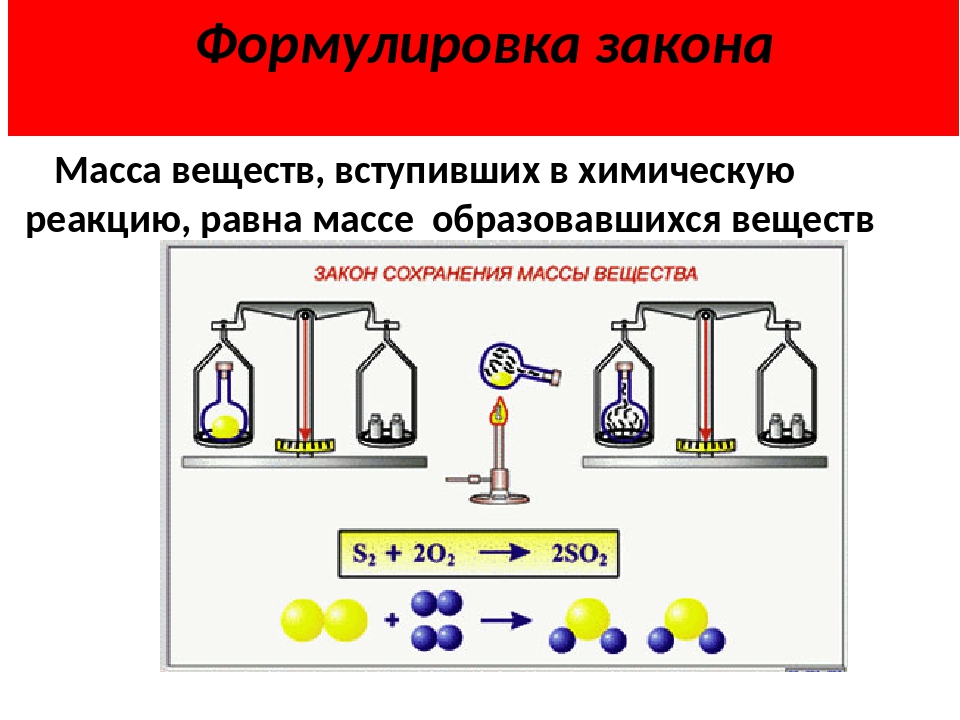 3).
3).
Рис. 3. Эксперимент с горящей свечой в колбе
Открытие закона сохранения массы веществ имело огромное значение для дальнейшего развития химии. На основании закона сохранения массы веществ производят важнейшие расчеты и составляют уравнения химических реакций.
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.15-16)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§6)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009.
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых
образовательных ресурсов ().
2. Электронная
версия журнала «Химия и жизнь» ().
Домашнее задание
с. 16 №№ 3,5
из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Закон сохранения массы веществ один из важнейших законов химии. Его открыл М. В. Ломоносов, а позже экспериментально подтвердил А. Лавуазье. Так в чем же состоит суть этого закона?
История
Закон сохранения массы веществ впервые сформулировал М. В. Ломоносов в 1748 году, а экспериментально подтвердил его на примере обжига металлов в запаянных сосудах в 1756 году. Закон сохранения массы веществ Ломоносов связывал с законом сохранения энергии (количества движения). Он рассматривал эти законы в единстве как всеобщий закон природы.
Он рассматривал эти законы в единстве как всеобщий закон природы.
Рис. 1. М. В. Ломоносов.
Но еще до Ломоносова более 20 веков назад древнегреческий ученый Демокрит предполагал, что все живое и неживое состоит из незримых частиц. позже в XVII веке эти догадки подтвердил Р. Бойль. Он проводил эксперименты с металлом и древесиной и выяснил, что вес металла после нагревания увеличился, а вес золы по сравнению с деревом, наоборот, уменьшился.
Независимо от М. В. Ломоносова закон сохранения массы вещества был установлен в 1789 году французским химиком А. Лавуазье, который показал, что при химических реакциях сохраняется не только общая масса веществ, но и масса каждого из элементов, входящих в состав взаимодействующих веществ.
Взгляды Ломоносова и Лавуазье были подтверждены современной наукой. В 1905 году А. Эйнштейн показал, что между массой тела (m) и его энергией (E) существует связь, выражаемая уравнением:
где c – скорость света в вакууме.
Рис. 2. Альберт Эйнштейн.
2. Альберт Эйнштейн.
Таким образом, закон сохранения массы дает материальную основу для составления уравнений химических реакций.
Суть закона сохранения массы вещества
Закон сохранения массы вещества заключается в следующем: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Рис. 3. Закон сохранения массы вещества.
При написании уравнений химических реакций надо следить за соблюдением этого закона. Число атомов элемента в левой и правой частях реакций должно быть одинаковым, так как атомные частицы в химических превращениях неделимы и никуда не исчезают, а лишь переходят из одного вещества в другое. Сущность химической реакции – разрыв одних связей и образование других связей. Поскольку эти процессы связаны с затратой и получением энергии, то знак равенства в реакциях можно ставить, если учтены энергетические факторы, условия реакции, агрегатные состояния веществ.
Очень часто знак равенства, особенно в неорганических реакциях, ставят и без учета необходимых факторов,производя упрощенную запись.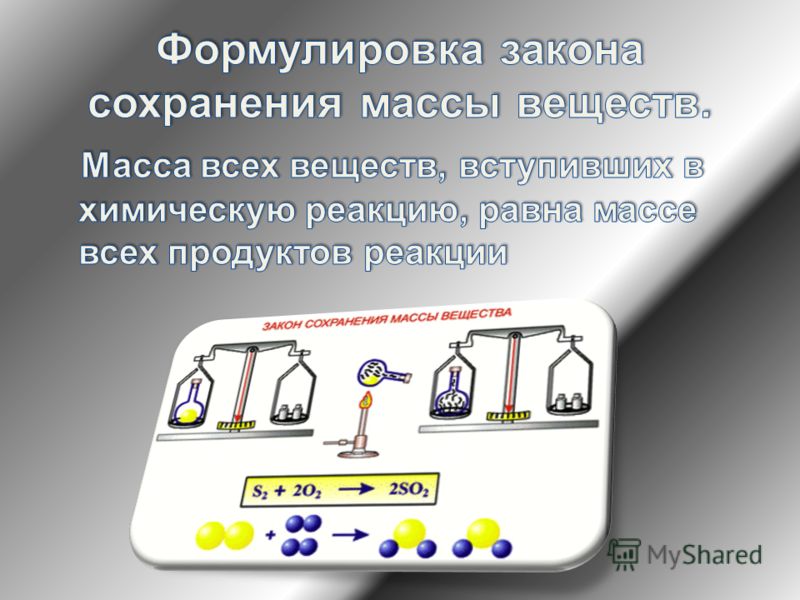 При уравнивании коэффициентов вначале уравнивают число атомов металла, потом неметалла, затем водорода и в конце производят проверку по кислороду.
При уравнивании коэффициентов вначале уравнивают число атомов металла, потом неметалла, затем водорода и в конце производят проверку по кислороду.
Что мы узнали?
Закон сохранения массы вещества изучают в школе по химии 8 класса, так как понимание его сути необходимо для правильного составления уравнений реакций. О том, что любая материя на земле состоит из невидимых частиц предположил еще древнегреческий ученый Демокрит, а его более современные последователи Ломоносов, Лавуазье, Эйнштейн доказали это экспериментально.
В уроке 11 «» из курса «Химия для чайников
» дадим определение закону сохранения массы и закону сохранения энергии, познакомимся с открытием Ломоносова, а также повторим некоторые основы химии из прошлой главы. Этим уроком мы открываем следующий раздел курса, под названием «Закон сохранения массы и энергии». Поэтому, чтобы у вас не возникало вопросов по урокам, обязательно изучите все уроки из первого раздела «Атомы, молекулы и ионы».
Мысль о том, что все в мире состоит из атомов, зародилась еще до нашей эры. Древнегреческий философ Демокрит полагал, что вся материя состоит из неделимых микрочастиц — атомов, что каждый атом обладает индивидуальными свойствами, что свойства веществ определяются их взаимным расположением относительно друг друга. Таким образом его идеи являются примитивным вариантом того, что изложено в разделе 1 «Атомы, молекулы и ионы». Напрашивается вопрос: почему же тогда древние греки не воспользовались гипотезой Демокрита и не научились получать атомную энергию? Почему прошло еще 2000 лет, прежде чем наука достигла своего современного уровня? Одна из причин заключалась в том, что древние греки понятия не имели о законах сохранения вещества
Древнегреческий философ Демокрит полагал, что вся материя состоит из неделимых микрочастиц — атомов, что каждый атом обладает индивидуальными свойствами, что свойства веществ определяются их взаимным расположением относительно друг друга. Таким образом его идеи являются примитивным вариантом того, что изложено в разделе 1 «Атомы, молекулы и ионы». Напрашивается вопрос: почему же тогда древние греки не воспользовались гипотезой Демокрита и не научились получать атомную энергию? Почему прошло еще 2000 лет, прежде чем наука достигла своего современного уровня? Одна из причин заключалась в том, что древние греки понятия не имели о законах сохранения вещества
, ну и конечно же о законе сохранения энергии.
Великий русский ученый М.В. Ломоносов в 1748 году стал первым, кто осознал, что масса является фундаментальным свойством, сохраняющимся в процессе химических реакций. Он установил закон который гласит, что суммарная масса всех продуктов химического превращения должна точно совпадать с суммарной массой исходных веществ. Помимо суммарной массы веществ, в химических реакциях сохраняется также число атомов каждого сорта независимо от того, в сколь сложных превращениях они участвуют и как переходят из одних молекул в другие.
Помимо суммарной массы веществ, в химических реакциях сохраняется также число атомов каждого сорта независимо от того, в сколь сложных превращениях они участвуют и как переходят из одних молекул в другие.
В химических реакциях должна сохраняться также и энергия. Химически важный вывод из этого закона заключается в том, что поглощение или выделение тепла (теплота реакции) в конкретной химической реакции не зависит от того, каким путем осуществляется реакция — в одну или несколько стадий. Например, тепло, выделяющееся напрямую при сгорании газообразного водорода и графита (одна из форм углерода), должна совпадать с теплом, выделяющимся, когда водород и углерод используются для получения синтетического бензина, а заем этот бензин используется в качестве топлива. Если бы количество тепла, выделяемого в одной из двух описанных выше вариантов реакции, было неодинаковым, можно было бы воспользоваться этим и проводить более эффективную реакцию в одном направлении, а менее эффективную — в обратном. В результате получился бы циклический бестопливный источник тепла, непрерывно дающий даровую энергию. Но это всего лишь мечты о вечном двигателе, создание которого разрушается об незыблемую стену закона сохранения массы и энергии.
В результате получился бы циклический бестопливный источник тепла, непрерывно дающий даровую энергию. Но это всего лишь мечты о вечном двигателе, создание которого разрушается об незыблемую стену закона сохранения массы и энергии.
: в процессе химической реакции не происходит образования или разрушения атомов.
Закон сохранения энергии
: если сумма двух реакций представляет собой новую, третью реакцию, то теплота третьей реакции равна сумме теплот первых двух реакций. Говорят, что тепловые эффекты реакций аддитивны. Более подробно о законе сохранения тепла вы узнаете в конце данной главы, где все станет просто и ясно.
Кстати, в 1756 году Ломоносов экспериментально подтвердил химический закон сохранения массы, путем обжига металлов в запаянных сосудах. Вместо обжига металлов можно в запаянном сосуде сжечь фтор, закон сохранения массы все равно соблюдается:
Повторюсь, что не плотность или объем, а именно масса
является фундаментальным свойством, сохраняющимся в процессе химических реакций.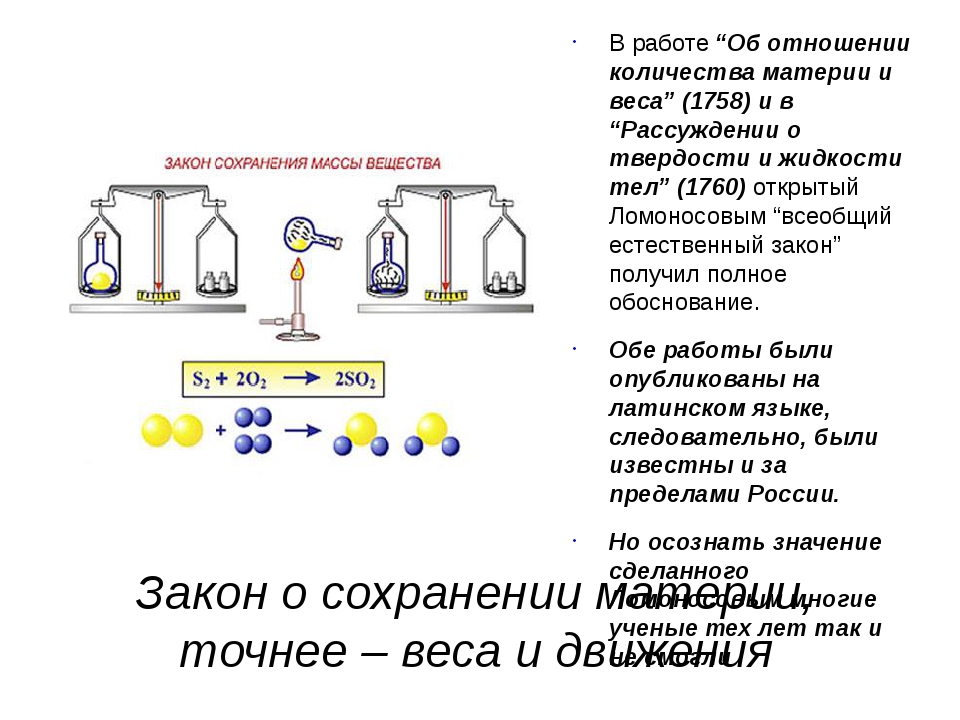 И как только химики это поняли, они сразу бросились в поиски правильной шкалы атомных масс для каждого элемента. В уроке 3 «Строение молекулы» мы отмечали, что молекулярная масса
И как только химики это поняли, они сразу бросились в поиски правильной шкалы атомных масс для каждого элемента. В уроке 3 «Строение молекулы» мы отмечали, что молекулярная масса
молекулы вычисляется через сумму всех атомных масс входящих в ее состав атомов. А из урока 5 «Моль и молярная масса» нам известно, что моль
любого вещества — это такое его количество, в котором число частиц этого вещества равно 6,022·10 23 . Масса одного моля вещества в граммах называется молярной массой
. Моль и молярная масса являются важнейшими понятиями, без которых невозможно проводить химический расчет.
Моль — это просто средство подсчитывать атомы и молекулы порциями по 6,022·10 23 . Если известно, что две молекулы газообразного водорода H 2 реагируют с одной молекулой газообразного кислорода O 2 , с образованием двух молекул воды H 2 O, то можно предсказать, что 2 моля H 2 , т.е. 4,032 г, будут реагировать с 1 молем O 2 , т.е. с 31,999 г, с образованием 2 молей H 2 O, т.е.36,031 г).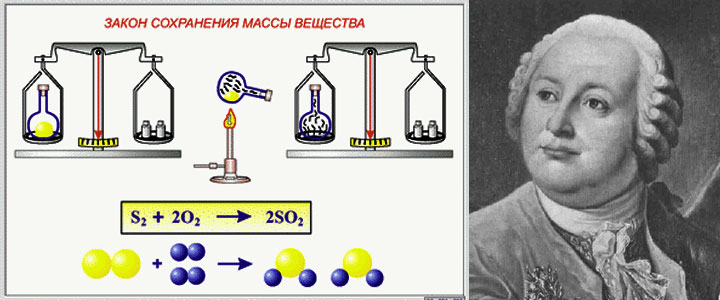 Контрольное суммирование 4,032+31,999=36,031 подтверждают, что в этой реакции выполняется химический закон сохранения массы.
Контрольное суммирование 4,032+31,999=36,031 подтверждают, что в этой реакции выполняется химический закон сохранения массы.
Урок 11 «Формулировка закона сохранения массы и энергии
» является повторением уже пройденного материала перед погружением в более серьезный раздел химии. Надеюсь вы открыли в этом уроке для себя что-то новое и интересное. Если у вас возникли вопросы, пишите их в комментарии.
Урок №14. Закон сохранения массы вещества. Химические уравнения
Закон сохранения массы веществ
Проблемный вопрос:
изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
Чтобы ответить на данный вопрос пронаблюдайте за следующим экспериментом
Видео-эксперимент:
.
Описание эксперимента:
В коническую колбу помесите 2 грамма измельченной меди. Плотно закройте колбу пробкой и взвесьте. Запомните массу колбы. Осторожно нагревайте колбу в течение 5 минут и наблюдайте за происходящими изменениями. Прекратите нагревание, и когда колба охладится, взвесьте её. Сравните массу колбы до нагревания с массой колбы после нагревания.
Прекратите нагревание, и когда колба охладится, взвесьте её. Сравните массу колбы до нагревания с массой колбы после нагревания.
Вывод:
Масса колбы после нагревания не изменилась.
Пронаблюдаем за другими видео-экспериментами:
Вывод:
Масса веществ до и после реакции не изменилась.
Формулировка
закона сохранения массы:
масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка.
Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновение современной химии как точной науки.
Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М. В. Ломоносовым.
В. Ломоносовым.
Французский учёный Антуан Лавуазье в 1789 году окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.
Химические уравнения
Закон сохранения массы веществ применяется при составлении уравнений химических реакций.
Химическое уравнение
– это условная запись химической реакции посредством химических формул и коэффициентов.
Посмотрим видео — эксперимент
:
.
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II
) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических реакциях называются
реагентами.
Новые вещества, образующиеся в результате химической реакции называются
продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe
+
S
=
FeS
Алгоритм составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ
двухатомны –
H
2
;
N
2
;
O
2
;
F
2
;
Cl
2
;
Br
2
;
I
2
. Между реагентами ставим знак «+», а затем стрелку:
P
+
O
2
→
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии).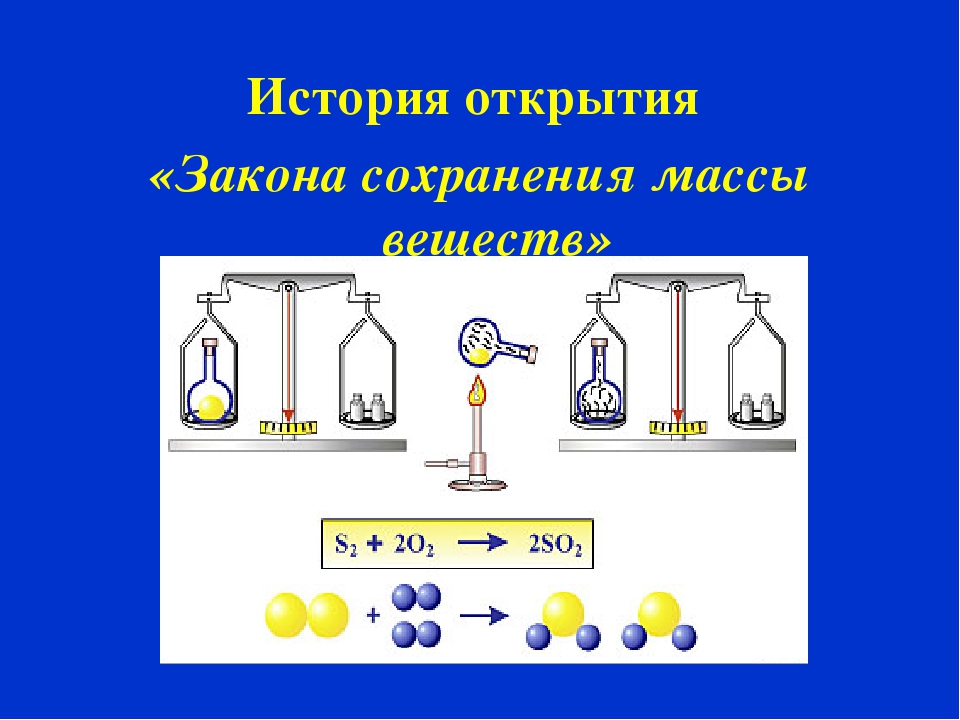 Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O
2
→ P
2
O
5
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
В данном случае это атомы кислорода.
Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:
Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции:
Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом:
Получаем окончательный вид уравнения химической реакции.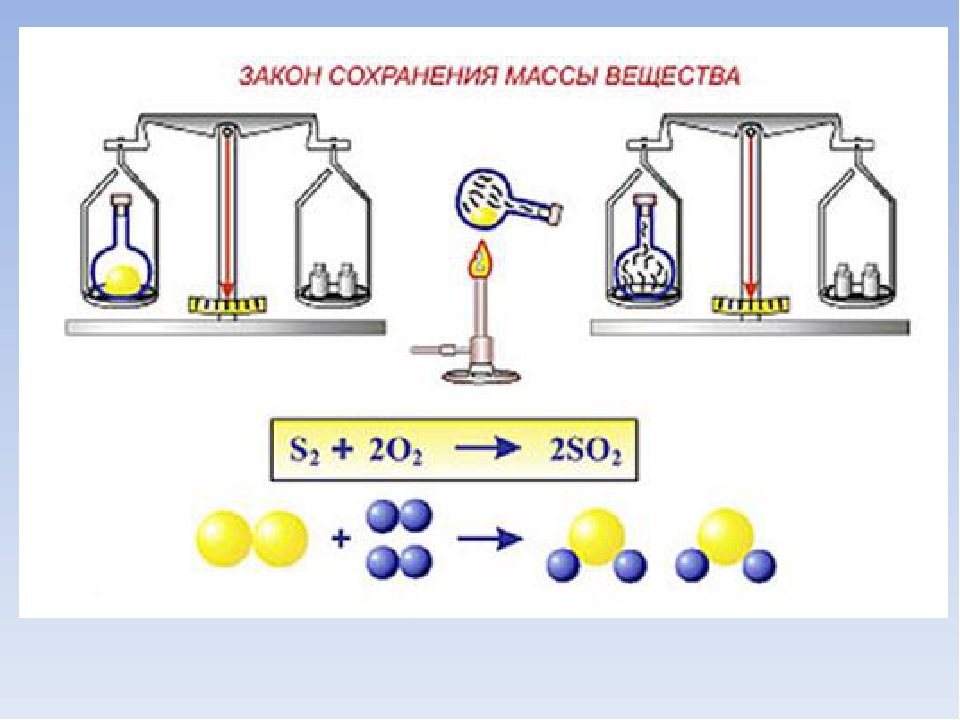 Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен:
Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен:
4
P + 5O
2
= 2P
2
O
5
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1.
Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства:
Zn + O
2
→ ZnO
Fe + Cl
2
→ FeCl
3
Mg + HCl → MgCl
2
+ H
2
Al(OH)
3
→ Al
2
O
3
+ H
2
O
HNO
3
→ H
2
O+NO
2
+O
2
CaO+H
2
O→ Ca(OH)
2
H
2
+Cl
2
→ HCl
KClO
3
→ KClO
4
+KCl
Fe(OH)
2
+H
2
O+O
2
→ Fe(OH)
3
KBr
+
Cl
2
→
KCl
+
Br
2
№2.
Используя алгоритм составления уравнений химических реакций, составьте уравнения реакций взаимодействия между следующими парами веществ:
1) Na и O
2
2) Na и Cl
2
3) Al и S
Конспект урока по химии на тему » Закон сохранения массы веществ.
 Химическое уравнение»
Химическое уравнение»
Цель урока: формирование представлений о химическом уравнении как об условной записи химической реакции, о практическом применении закона сохранения массы веществ.
Задачи урока:
· актуализировать имеющиеся знания, связанные с понятиями «молекула», «атом», «химический элемент», «валентность», «химическая формула», «признаки химической реакции»;
· научить школьников:
-формулировать понятия: химическое уравнение, закон сохранения массы веществ;
-составлять: уравнения химических реакций;
-объяснять: зависимость составления уравнений химических реакций от закона сохранения массы веществ;
-мотивировать обучающихся к изучению темы.
Тип урока: урок открытия новых знаний.
Методы: объяснительно – иллюстративный с элементами беседы; проблемно – поисковый; исследовательский.
Формы: индивидуальная, фронтальная, парная.
Техническое обеспечение: компьютер, проектор, экран, презентация.
План урока:
1. Организационный момент (1 мин).
2. Самоопределение к деятельности (целеполагание)
2.1 Актуализация знаний (5 мин).
3. Учебно-познавательная деятельность (изучение нового содержания) (15 мин)
4. Интеллектуально-преобразовательная деятельность. Диагностика качества освоения темы (15 мин)
5. Домашнее задание (2 мин.)
6. Рефлексивная деятельность (3 мин.)
Тема
Закон сохранения массы веществ. Химические уравнения. Расстановка коэффициентов в химических уравнениях
Основное содержание темы, термины и понятия
Содержание темы предполагает изучение сущности химических уравнений, правил расстановки коэффициентов в уравнениях химических реакций.
Закон сохранения массы веществ. Химические уравнения.
Планируемые результаты
Личностные
– проявление эмоционально-ценностного отношения к учебной проблеме;
– проявление творческого отношения к процессу обучения.
Познавательные:
– умение находить сходство и различие между объектами, обобщать полученную информацию;
– умение вести наблюдение;
– умение прогнозировать ситуацию.
Регулятивные:
– умение выполнять учебное задание в соответствии с целью;
– умение соотносить учебные действия с известными правилами;
– умение выполнять учебное действие в соответствии с планом.
Коммуникативные:
– умение формулировать высказывание;
– умение согласовывать позиции и находить общее решение;
– умение адекватно использовать речевые средства и символы для представления результата.
Предметные
-умение изображать сущность простейших химических реакций с помощью химических уравнений;
– умение составлять уравнения химических реакций.
Этап урока и планируемы результат | Деятельность | Формируемые УУД |
1. организационный момент | Добрый день! Говорят если день начать с улыбки, то есть вероятность того , что он пройдет успешно. Вот и наш урок я предлагаю начать с улыбки. Главное на уроке быть внимательным , активным и находчивым. Обратите внимание на эпиграф к уроку. О чем нам говорит китайская мудрость? ( слайд 1) | личностные -проявление эмоционально-ценностного отношения к учебной проблеме; – проявление творческого отношения к процессу обучения.
|
2. Самоопределение к деятельности (целеполагание) Планируемый результат
-актуализировать имеющиеся знания, связанные с понятиями «молекула», «атом», «химический элемент», «валентность», «химическая формула»; – мотивировать обучающихся к изучению темы.
| Актуализация знаний. 1.Как классифицируются вещества в зависимости от их состава? 2.Дайте определение «Химический элемент» 3.Сформулируйте определения классов веществ, с учетом понятия химический элемент. 4.Чем отражается состав простых и сложных веществ? 5.Что такое химическая формула вещества?
6.С веществами происходят различные изменения- явления. Чем различаются физические и химические явления? 7.Что происходит в ходе химических реакций с молекулами веществ? 8Что происходит с атомами, из которых состоят молекулы реагентов? 9. Каковы признаки химической реакции? 10.Что такое масса?
| Личностные– проявление интереса к поставленной проблеме Коммуникативные развивать монологическую речь, умение выражать свои мысли в соответствии с задачами и условиями коммуникации
|
II этап. Учебно-познавательная деятельность (изучение нового содержания)
Планируемый результат
научить школьников: формулировать понятия: химическое уравнение, закон сохранения массы веществ. составлять: уравнения химических реакций. объяснять: зависимость составления уравнений химических реакций от закона сохранения массы веществ.
| Тема урока (слайд 2)
Как при химических реакциях изменяется масса веществ? Как записать суть происходящей химической реакции? Какова ребята, цель сегодняшнего урока? Учащиеся формулируют цель урока . А каковы задачи? Учащиеся формулируют задачи урока
Для ответа на вопрос – Как при химических реакциях изменяется масса веществ? посмотрим видеоролик эксперимента.( Слайд 3) На основании просмотра вы должны объяснить суть эксперимента ( ролик без звука) Как вы поняли, что произошла химическая реакция? А изменилась ли масса в результате реакции? Какой вывод можно сделать из проведенного эксперимента? Масса веществ, вступивших в реакцию равна массе веществ образовавшихся в результате реакции. Вы только что сформулировали очень важный закон химии – закон сохранения массы веществ. Закон сохранения массы веществ был открыт русским ученым Михаилом Васильевичем Ломоносовым (слайд 4) Согласно закону сохранения массы веществ составляются уравнения химических реакций. Опыт : горение бенгальской свечи. Какое явление вы наблюдали. По каким признакам вы так решили? Как по – другому называется химическое явление. Как нам записать эту химическую реакцию? Выслушиваем предположения учащихся. Бенгальская свеча – это магний горела она в кислороде воздуха, получился оксид магния (Слайд 5) Писать словами неудобно, да и невозможно отразить закон сохранения массы веществ Как же записать уравнение? Разбор уравнения. Формулу получившегося в ходе реакции оксида магния составляем согласно валентности. Могу ли я поставить знак равно? Сколько атомов магния в правой стороне, а сколько в левой? Сколько атомов кислорода в правой стороне, а сколько в левой? Что нужно сделать, чтобы поставить знак равно?
| Регулятивные- Целеполагание как постановка учебной задачи на основе соотнесения того, что уже известно и освоено учащимися и того, что еще неизвестно. умение выполнять учебное задание в соответствии с целью. Прогнозирование – предвосхищение результата и уровня усвоения Коммуникативные – умение выполнять учебные задания в паре, умение адекватно использовать речевые средства для представления результата. Личностные- проявление творческого отношения к процессу обучения.
|
Физминутка | Слайды 6-8
Опыт. После выполнения задания проверка. Как вы поняли, что произошла химическая реакция? Итак ребята, так что же такое химическое уравнение? Ребята , давайте теперь сформулируем определение химического уравнения. слайд ( 10)
|
|
III этап. Интеллектуально-преобразовательная деятельность. Диагностика качества освоения темы Цель – установить степень усвоения темы Предметный: -умение подбирать коэффициенты; – умение составлять уравнения химических реакций.
| Работа с дидактическим материалом (слайд 11) Дидактические материалы. После работы взаимопроверка ( слайд 12) Ребята после взаимопроверки анализируют проверяемую работу, указывают на допущенные ошибки. Ребята , а что нам необходимо сделать чтобы больше не повторять допущенных ошибок? Оценки за урок. | . Личностные: – творческое отношение к процессу выбора и выполнения заданий.
Познавательные: – умение использовать методы наблюдения и прогнозирования для выполнения задания
Регулятивные: – умение выполнять учебное действие в соответствии с планом. умение выполнять задание в соответствии с целью контроль в форме сличения способа действия и его результата с заданным эталоном с целью обнаружения отличий и отклонений от эталона и коррекция результата. Коммуникативные: – умение адекватно использовать речевые и символьные средства для представления результата.
|
IV этап. Рефлексивная деятельность
| Какова цель урока? Достигнута ли цель урока? Ребята отвечают, чему они научились на уроке, используя выражения Я знаю. Я могу.
| Регулятивные –выделение и осознание того, что уже усвоено и что подлежит усвоению, осознание уровня и качества усвоения.
Коммуникативные- умение аргументировать свою точку зрения, умение выражать свои мысли в соответствии с задачами и условиями коммуникации; – владение монологической формой речи в соответствии с нормами родного языка. Личностные Нравственное оценивание усваиваемого материала, способность делать личностный моральный выбор, исходя из социальных ценностей
|
Дом. Задание. | Параграф 19-20 Базовый уровень: с.67 учебника задание 3,5
Повышенный уровень: с. 68 учебника задание 4, 6( Слайд 13)
| Личностные: – творческое отношение к процессу выбора и выполнения заданий.
|
| Итак, сегодня мы узнали, что такое химическое уравнение. На примерах рассмотрели, что нужно для составления химического уравнения. Пока остается неясным, зачем нужны уравнения реакций. Вот мы и обозначили задачу, над которой будем работать на последующих уроках. Урок окончен спасибо за работу. |
|
Закон сохранения массы
ЗАКОН СОХРАНЕНИЯ МАССЫ. Принцип классической механики, устанавливающий, что масса не может создаваться или исчезать, а может только переноситься из одного объема в другой. В метеорологии выражением 3. С. М. является уравнение неразрывности.[ …]
Закон сохранения массы: сумма массы вещества системы и массы эквивалентной энергии, полученной или отданной той же системой, постоянна. Первоначальная формулировка этого закона — масса (вес) веществ до химической реакции равна массе (весу) веществ после химической реакции, а более расширительно — масса поступающего в систему вещества минус масса выходящего из системы вещества равна массе накапливаемого в системе вещества. Если накопления или убывания вещества в системе не наблюдается, она находится в устойчивом, гомеостатическом состоянии. Близкий к этому закон сохранения энергии, или первый принцип (закон, начало) термодинамики, гласит: любые изменения в изолированной системе оставляют ее общую энергию постоянной; или: при всех макроскопических процессах энергия не создается и не исчезает, а лишь переходит из одной формы в другую.[ …]
Действие закона внутреннего динамического равновесия совершенно четко связано с законом однонаправленности потока энергии. Именно ограниченность этого потока и специфические свойства формируют всю массу связей в экосистеме в их разнообразии. Поэтому и соблюдается экологический аналог законов сохранения массы и энергии (разд.[ …]
В соответствии с законом сохранения массы (вещества) при любом физическом или химическом изменении вещество не возникает и не исчезает, но лишь изменяет свое физическое или химическое состояние. За длительное время установились, причем в очень узких диапазонах, значения параметров окружающей среды, при которых существует жизнь. Мы привыкли говорить о потреблении или расходовании ресурсов. Но мы не потребляем вещество, а только временно пользуемся какими-то видами ресурсов Земли, перемещая их, превращая в продукты или полезные товары. Все, что выброшено, остается с нами.[ …]
Данный принцип гармонирует с законом сохранения массы. Так как атомы не возникают, не исчезают и не превращаются один в другой, они могут использоваться бесконечно в самых различных химических соединениях, и запас их практически неограничен. Именно это и происходит в природных экосистемах.[ …]
Уравнение неразрывности, как известно, выражает закон сохранения массы. В нем представлена связь распределения удельного количества движения и изменения плотности жидкости. Получим его применительно к поставленной ранее задаче.[ …]
Действительно, уже 200 лет назад был сформулирован закон сохранения массы, но человек и по сей день действует так, будто масса непрерывно возникает в одном месте и бесследно исчезает в другом.[ …]
Смысл первого принципа очевиден, а смысл второго, выражающего по существу законы сохранения массы и энергии, заключается в том, что необходимо анализировать результаты наших предполагаемых конкретных действий до того, как с их помощью достигнуты желаемые цели. В третьем принципе содержится напоминание о том, насколько взаимосвязаны наша экономическая и социальная деятельность и состояние окружающей среды как элементы одной системы.[ …]
При рассмотрении вопроса с количественной точки зрения исследователи опираются прежде всего на известные законы сохранения массы, количества движения, энергии. Для замыкания системы уравнений используются определенные гипотезы и упрощения. Существующие количественные методы прогноза можно представить в виде табл. 9.1.[ …]
Очевидно, что при любых изменениях состояния потоков в элементе ХТС, ее подсистеме или ХТС в целом должны соблюдаться законы сохранения массы и энергии.[ …]
Принципиальная позиция автора состоит в том, что инженерная и санитарная охрана окружающей среды основаны на фундаментальном законе экологии — законе лимитирующего фактора, значимость которого сопоставима со значимостью таких фундаментальных законов физики, как закон сохранения массы и второе начало термодинамики.[ …]
Закономерности процессов преобразования веществ в пищевых целях в водной, воздушной средах подчиняются фундаментальным законам физики1 — закону сохранения массы и второму началу термодинамики (сохранение энергии).[ …]
Неотложной является задача объединения теплофизического и гидромеханического подходов. Таким образом в модели будут использоваться три закона сохранения: массы, количества движения и энергии. Один из вариантов такого подхода рассматривается далее в разд. 9.2.[ …]
Балансовые уравнения в экологии, описывающие движение потоков биомассы и энергии между основными компонентами наземных систем, опираются на законы сохранения массы и энергии. Схематично потоки массы и энергии изображены на рис. 4.[ …]
В общем случае этот блок модели представляет собой полную систему нестационарных уравнений Навье — Стокса распределения газа в поле силы тяжести, которые отражают закон сохранения массы, импульса и энергии. Приведем общий вид этой системы без комментариев.[ …]
В заключение этого раздела отметим, что справедливость равенств (5.3.5) обеспечивается справедливостью равенств (5.2.5) и (5.3.1). Последнее равенство является прямым следствием уравнения неразрывности (2.5.14) из дискретной модели (см. гл. 2). Этим самым выполнение законов сохранения для дискретных моделей экосистем является следствием требований, сформулированных в виде равенств (5.2.5), и согласованности дискретных моделей экосистем с дискретными моделями гидротермодинамики, для котоых имеет место дискретный аналог закона сохранения массы воды.[ …]
Вопреки всем данным науки некоторые люди свято верят в «безотходное» производство, полагая, что именно так работают экосистемы. То, что это не так, хорошо известно и наглядно иллюстрируется накоплением биогенных геологических пород. Собственно, вся стратисфера планеты пронизана «отходами» биотических процессов. Последние лишь полузамкнуты, иногда в высокой, но не в абсолютной степени. В случае же хозяйственной деятельности существует мало осознаваемый закон неустранимости отходов и ¡или побочных воздействий производства (хозяйства): в любом хозяйственном цикле образующиеся отходы и возникающие побочные эффекты неустранимы, они могут быть лишь переведены из одной физикохимической формы в другую или перемещены в пространстве. Если бы была реальная возможность избавиться от отходов, это было бы нарушением законов сохранения массы и энергии (разд. 3.2.3.). Суммарное количество отходов в виде вещества, энергии и побочных эффектов (изменения динамических качеств природных систем — их устойчивости, надежности и т. п.) фактически постоянно: в производственных циклах меняется лишь место их возникновения, время образования и физико-химическая или биологическая форма. Поэтому закон неустранимости отходов может быть дополнен законом постоянства количества отходов в технологических цепях.[ …]
Не боясь повториться, отметим, что моделирование экосистем больших стратифицированных озер требует применения трехмерных моделей ввиду огромного разнообразия гидрофизических условий в водоеме, связанного именно с большими размерами водоема. Эти модели должны воспроизводить процессы трансформации органического вещества и биогенов, перенос, седиментацию и турбулентную диффузию субстанций. Важным свойством моделей экосистем является выполнение для них закона сохранения веществ при отсутствии источников и стоков или законов изменения, если есть обмен веществом на границах водоема. Выполнение законов сохранения обеспечивается, с одной стороны, согласованностью моделей экосистем с моделями гидродинамики водоема, для которых выполняется закон сохранения массы воды, с другой — соответствующей требованию консервативности конструкцией операторов, описывающих трансформацию органического вещества и биогенов.[ …]
Анализ аварийных и поставарийных ситуаций, связанных с загрязнением окружающей среды (ОС), в значтельной мере опирается на математическое моделирование переноса поллютантов (загрязнителей) в разных естественных средах. Для прогноза поведения поллютантов в ОС в настоящее время привлекают разнообразные модели переноса поллютантов (модели поллютантности). В последние годы все более широкое использование находят аэро- и гидродинамические модели поллютантности, основанные на фундаментальных законах сохранения массы, количества движения и энергии [1-3]. В то же время нельзя не отметить, что подобные модели требуют большого объема исходной информации, значительных затрат машинного времени при проведении расчетов по этим моделям на ЭВМ, однако они не гарантируют высокой точности прогноза.[ …]
Закон сохранения массы веществ. Закон — форма научных знаний | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Тема:
Химические законы и уравнения
Во время химических реакций атомы сохраняются. Происходит лишь их перегруппировка. Поскольку атомы сохраняются, то должна сохраняться и их масса. Для проверки этой гипотезы выполним опыт. Уравновесим весы, на одной чашке которых стоят сосуды с растворами йодида натрия и нитрата свинца (II). После смешивания растворов и образования ярко-желтого осадка весы остались уравновешенными. Итак, наша гипотеза подтвердилась, и можно утверждать, что масса реагентов равна массе продуктов реакции (рис. 15.6).
Очевидно, что на основании одного опыта обобщения делать нельзя. Подобное исследование реакции мела с кислотой приведет нас к другому выводу. Можно предположить, что масса веществ уменьшилась. А вот масса продуктов прокаливания металлов больше массы металлов, взятых для реакции. К такому выводу еще в XVII в. пришел английский ученый Роберт Бойль.
| Рис. 15.6. Масса реагентов (1) равна массе продуктов реакции (2) |
Какая же из этих гипотез является правильной и можно ли это доказать? Как выяснилось, достаточно изменить одно из условий эксперимента. А именно — проводить опыты в закрытых сосудах.
Такой подход позволил М.В. Ломоносову в отчете за 1756 г. записать: «… деланы опыты в заплавленных накрепко стеклянных сосудах, чтобы исследовать, прибывает ли вес металлов от чистого жару. Оными опытами нашлось, что славного Роберта Бойля мнение ложно, ибо без пропущения внешнего воздуха вес сожженного металла остается в одной мере». Однако эти наблюдения не были обнародованы. А. Лавуазье собственноручно выполнил множество опытов по прокаливанию металлов в закрытых сосудах. Также он тщательно проанализировал экспериментальные данные, полученные другими учеными. И на основании этого в 1789 году сформулировал закон сохранения массы.
Современная формулировка закона сохранения массы такая:
Масса реагентов равна массе продуктов реакции.
Закон — форма научных знаний. На конкретных примерах стало понятно, какое значение имеет количественный подход к изучению веществ и явлений. Исследователи на основании выявленных закономерностей формулируют их словесное или математическое выражение — научный закон. Материал с сайта http://worldofschool.ru
Проявления закона сохранения массы ученые наблюдали и исследовали на макроуровне. А теоретическое обоснование выявленных закономерностей связано с процессами, которые происходят между частицами микромира. Ведь при химических реакциях атомы не исчезают и не возникают из ничего. Общее количество атомов в химической реакции не изменяется. Масса каждого атома также остается постоянной. Поэтому и общая масса веществ не изменяется.
Открытие закона сохранения массы способствовало дальнейшему развитию химической науки и производства, пониманию законов природы и связи между ними.
| Рис. 15.9. Ход исследования |
На этой странице материал по темам:
Наблюдение и эксперименты химии
История открытия закона сохранения массы в химии
Состав червя биология 8 класс
Урок 21. закон як форма наукових знань. закон збереження маси
В чем особенность современного подхода к закону сохранения массы
Вопросы по этому материалу:
Сформулируй закон сохранения массы веществ.
Закон сохранения массы. Движение. Теплота
Читайте также
Глава 10 ЗАКОН СОХРАНЕНИЯ ИМПУЛЬСА
Глава 10
ЗАКОН СОХРАНЕНИЯ ИМПУЛЬСА
§ 1. Третий закон Ньютона§ 2. Закон сохранения импульса§3. Импульс все-таки сохраняется§ 4. Импульс и энергия§ 5. Релятивистский импульс§ 1. Третий закон НьютонаВторой закон Ньютона, который связывает ускорение любого тела с действующей на
Сохранение массы
Сохранение массы
При рассмотрении импульса мы имели дело с тремя величинами: скоростью, массой и их произведением, т. е. самим импульсом.С точки зрения сохранения мы рассмотрели две из них: импульс, который сохраняется, и скорость, которая не сохраняется. А что происходит
Несохранение массы
Несохранение массы
Новое представление о строении атома укрепило уверенность физиков в том, что законы сохранения применимы не только к окружающему нас повседневному миру, но и к тому огромному миру, который изучают астрономы. Но справедливы ли законы сохранения в
Закон сохранения массы и энергии
Закон сохранения массы и энергии
В ядерных реакциях изменения энергии столь значительны, что эквивалентностью массы и энергии уже нельзя пренебречь. Если следить за изменением одной только массы, кажется, что закон сохранения нарушается.Чтобы убедиться в этом,
ИСТОРИЯ ПРИНЦИПОВ СОХРАНЕНИЯ
ИСТОРИЯ ПРИНЦИПОВ СОХРАНЕНИЯ
Современный историк механики не случайно начинает свою общую характеристику развития механики в XVII в. со следующего положения: «От ожерелья, надетого на наклонную плоскость, до первой подлинно математической физики мировой системы, через
2.1. Поиск общей причины неудач с ppm. «Закон сохранения силы»
2.1. Поиск общей причины неудач с ppm. «Закон сохранения силы»
Последние два века описанного в гл. 1 периода истории ppm (XVII и XVIII вв.) характерны тем, что многие даже достаточно серьезные ученые верили, в то, что вечный двигатель можно создать. Даже постоянные неудачи
III. Закон взаимосвязи массы и энергии
III. Закон взаимосвязи массы и энергии
1. Формула Эйнштейна.Мы знаем, что существует закон сохранения массы: «Ничто в природе не пропадает бесследно и не создается из ничего, все превращается». С другой стороны, известно, что есть закон сохранения энергии. Энергия
Законы сохранения в СТО
Законы сохранения в СТО
Как выводились законы сохранения и строились сохраняющиеся величины в дорелятивистской механике и электродинамике до появления СТО? Преобразованиями в уравнениях движения частиц, механических систем, уравнений поля выделялись специальные
СОХРАНЕНИЕ МАССЫ И ЭНЕРГИИ
СОХРАНЕНИЕ МАССЫ И ЭНЕРГИИ
1.2. Существуют два принципа, ставшие краеугольными камнями здания современной науки. Первый принцип материя не создается и не уничтожается и лишь переходит из одного вида в другой был высказан в XVIII веке и знаком каждому изучающему химию; он
ЭКВИВАЛЕНТНОСТЬ МАССЫ И ЭНЕРГИИ
ЭКВИВАЛЕНТНОСТЬ МАССЫ И ЭНЕРГИИ
1.4. Один из выводов, полученных на довольно ранней стадии развития теории относительности, состоял в том, что инертная масса движущегося тела увеличивается с возрастанием его скорости. Это означало эквивалентность изменения энергии
IV. Законы сохранения
IV. Законы сохранения
Отдача
Даже тот, кто не был на войне, знает, что при выстреле из орудия его ствол резко отходит назад. При стрельбе из ружья происходит отдача в плечо. Но и не прибегая к огнестрельному оружию, можно ознакомиться с явлением отдачи. Налейте в пробирку
Закон сохранения импульса
Закон сохранения импульса
Произведение массы тела на его скорость называется импульсом тела (другое название – количество движения). Так как скорость – вектор, то и импульс является векторной величиной. Разумеется, направление импульса совпадает с направлением
Закон сохранения механической энергии
Закон сохранения механической энергии
Мы убедились на только что рассмотренных примерах, как полезно знать величину, не изменяющую свое численное значение (сохраняющуюся) при движении.Пока мы знаем такую величину лишь для одного тела. А если в поле тяжести движется
Закон сохранения вращательного момента
Закон сохранения вращательного момента
Если связать два камня веревкой и с силой бросить один из них, то второй камень полетит вдогонку за первым на натянутой веревке. Один камень будет обгонять второй, перемещение вперед будет сопровождаться вращением.Забудем про поле
3.9. Массы и плотности астероидов
3.9. Массы и плотности астероидов
Поскольку энергия, выделяющаяся при столкновении тела с Землей, пропорциональна массе тела, получение оценки массы является необходимым элементом оценивания угрозы со стороны каждого потенциально опасного тела.Масса m, объем v и средняя
Эпилог Конструкция массы
Эпилог
Конструкция массы
Из чего сделан мир?В середине 1930-х мы могли бы сказать, что вся материальная субстанция в мире состоит из химических элементов, а каждый элемент состоит из атомов. Каждый атом, в свою очередь, состоит из ядра, а ядро – из разного числа положительно
Закон сохранения массы: определение, формула, история (с примерами)
Обновлено 22 декабря 2020 г.
Кевин Бек
Один из великих определяющих принципов физики состоит в том, что многие из ее наиболее важных свойств неуклонно подчиняются важный принцип: при легко определяемых условиях они равны сохраняемым , что означает, что общее количество этих количеств, содержащихся в выбранной вами системе, никогда не изменяется.
Четыре общие величины в физике характеризуются применимыми к ним законами сохранения.Это энергии , импульса , момента импульса и массы . Первые три из них являются величинами, часто специфичными для задач механики, но масса универсальна, и открытие — или, так сказать, демонстрация — того, что масса сохраняется, одновременно подтверждая некоторые давние подозрения в мире науки, было жизненно важным для доказательства. .
Закон сохранения массы
Закон сохранения массы гласит, что в замкнутой системе (включая всю вселенную) масса не может быть ни создана, ни уничтожена химическими веществами. или физические изменения.Другими словами, общая масса всегда сохраняется . Дерзкий изречение «Что входит, должно выходить!» кажется буквальным научным трюизмом, поскольку никогда не было доказано, что ничто просто не исчезает без каких-либо физических следов.
Все компоненты всех молекул в каждой клетке кожи, которую вы когда-либо сбрасывали, с их атомами кислорода, водорода, азота, серы и углерода, все еще существуют. Точно так же, как загадочное научно-фантастическое шоу Секретные материалы заявляет об истине, вся масса, которая когда-либо существовала, находится там где-то .«
Вместо этого его можно было бы назвать« законом сохранения материи », потому что в отсутствие гравитации в особо« массивных »объектах нет ничего особенного в мире; подробнее об этом важном различии следует ниже, поскольку его значимость трудно переоценить.
История закона сохранения массы
Открытие закона сохранения массы было сделано в 1789 году французским ученым Антуаном Лавуазье; другие высказывали эту идею и раньше, но Лавуазье был первым, кто ее доказал.
В то время преобладающее в химии представление об атомной теории по-прежнему исходило от древних греков, и благодаря более поздним идеям считалось, что что-то внутри огня (« флогистон ») на самом деле было веществом. . По мнению ученых, это объясняет, почему куча пепла легче того, что было сожжено для образования пепла.
Лавуазье нагрел оксид ртути и отметил, что количество уменьшенного веса химического вещества было равно весу газообразного кислорода, высвободившегося в химической реакции.
Прежде чем химики смогли объяснить массу вещей, которые было трудно отслеживать, таких как водяной пар и следовые газы, они не могли адекватно проверить какие-либо принципы сохранения материи, даже если они подозревали, что такие законы действительно действуют.
В любом случае это привело Лавуазье к утверждению, что материя должна сохраняться в химических реакциях, что означает, что общее количество вещества на каждой стороне химического уравнения одинаково. Это означает, что общее количество атомов (но не обязательно общее количество молекул) в реагентах должно равняться количеству в продуктах, независимо от природы химического изменения.
- « Масса продуктов в химических уравнениях равна массе реагентов » является основой стехиометрии или процесса учета, с помощью которого химические реакции и уравнения математически уравновешиваются с точки зрения массы и количество атомов с каждой стороны.
Обзор сохранения массы
Одна из трудностей, с которыми люди могут столкнуться с законом сохранения массы, состоит в том, что пределы ваших чувств делают некоторые аспекты закона менее интуитивными.
Например, когда вы съедите фунт еды и выпьете фунт жидкости, вы можете весить столько же шесть или около того часов спустя, даже если не пойдете в туалет. Отчасти это связано с тем, что соединения углерода в пище превращаются в углекислый газ (CO 2 ) и постепенно выдыхаются в виде пара (обычно невидимого) при дыхании.
По своей сути, как химическая концепция, закон сохранения массы является неотъемлемой частью понимания физической науки, включая физику. Например, в задаче об импульсе о столкновении мы можем предположить, что полная масса в системе не изменилась с той, которая была до столкновения, до чего-то другого после столкновения, потому что масса, такая как импульс и энергия, сохраняется.
Что еще «сохраняется» в физике?
Закон сохранения энергии гласит, что полная энергия изолированной системы никогда не изменяется, и это можно выразить разными способами. Один из них — KE (кинетическая энергия) + PE (потенциальная энергия) + внутренняя энергия (IE) = константа. Этот закон следует из первого закона термодинамики и гарантирует, что энергия, как и масса, не может быть создана или уничтожена.
- Сумма KE и PE называется механической энергией, и является постоянной в системах, в которых действуют только консервативные силы (то есть, когда энергия не «растрачивается» в виде потерь на трение или тепла).
Импульс (m v ) и угловой момент ( L = m vr ) также сохраняются в физике, и соответствующие законы сильно определяют многое. поведения частиц в классической аналитической механике.
Закон сохранения массы: пример
При нагревании карбоната кальция, или CaCO 3 , образуется соединение кальция с выделением загадочного газа. Допустим, у вас есть 1 кг (1000 г) CaCO 3 , и вы обнаруживаете, что при нагревании остается 560 граммов соединения кальция.
Каков вероятный состав оставшегося химического вещества кальция и какое соединение образовалось в виде газа?
Во-первых, поскольку это, по сути, химическая проблема, вам нужно обратиться к периодической таблице элементов (см. Пример в разделе Ресурсы).
Вам сообщают, что у вас есть первоначальные 1000 г CaCO 3 . Из молекулярных масс составляющих атомов в таблице вы видите, что Ca = 40 г / моль, C = 12 г / моль и O = 16 г / моль, что делает молекулярную массу карбоната кальция в целом 100 г / моль. моль (помните, что в CaCO 3 есть три атома кислорода).Однако у вас есть 1000 г CaCO 3 , что составляет 10 моль вещества.
В этом примере кальций содержит 10 молей атомов Са; поскольку каждый атом Ca составляет 40 г / моль, у вас есть 400 г Ca, которые, как вы можете смело предположить, остались после нагревания CaCO 3 . В этом примере оставшиеся 160 г (560-400) соединения после нагревания представляют 10 моль атомов кислорода. Это должно оставить 440 г массы в виде выделенного газа.
Уравнение должно иметь вид
10 \ text {CaCO} _3 \ implies10 \ text {CaO} + \ text {?}
и знак «?» газ должен содержать углерод и кислород в некоторой комбинации; в нем должно быть 20 молей атомов кислорода — у вас уже есть 10 молей атомов кислорода слева от знака + — и, следовательно, 10 молей атомов углерода.Знак «?» составляет CO 2. (В современном научном мире вы слышали о двуокиси углерода, что делает эту проблему чем-то вроде тривиального упражнения. Но вспомните время, когда даже ученые даже не знали, что находится в «воздухе».)
Эйнштейн и уравнение массы-энергии
Студенты-физики могут быть сбиты с толку знаменитым уравнением сохранения массы-энергии E = mc 2 , постулированным Альбертом Эйнштейном в начале 1900-х гг. если это противоречит закону сохранения массы (или энергии), поскольку, кажется, подразумевает, что масса может быть преобразована в энергию и наоборот.
Ни один закон не нарушен; вместо этого закон утверждает, что масса и энергия на самом деле являются разными формами одного и того же.
Это похоже на их измерение в разных единицах, в зависимости от ситуации.
Масса, энергия и вес в реальном мире
Возможно, вы не можете не подсознательно приравнять массу к весу по причинам, описанным выше: масса — это вес только тогда, когда гравитация находится в смеси, но когда, по вашему опыту, это гравитация , а не (когда вы на Земле, а не в камере с невесомостью)?
Таким образом, трудно представить себе материю как нечто такое, как энергия сама по себе, которая подчиняется определенным фундаментальным законам и принципам.
Также, как энергия может менять форму между кинетическим, потенциальным, электрическим, тепловым и другими типами, материя делает то же самое, хотя различные формы материи называются состояниями : твердое тело, газ, жидкость и плазма.
Если вы сможете отфильтровать то, как ваши собственные органы чувств воспринимают различия в этих величинах, вы сможете понять, что реальных различий в физике немного.
Возможность связать основные концепции вместе в «точных науках» может сначала показаться трудной задачей, но в конце концов это всегда увлекательно и полезно.
Закон сохранения массы — Вычисления в химии — AQA — GCSE Combined Science Revision — AQA Trilogy
Закон сохранения массы гласит, что никакие атомы не теряются или не образуются в химической реакции. Вместо этого атомы соединяются по-разному, образуя продукты. Вот почему в уравнении сбалансированного символа количество атомов каждого элемента одинаково с обеих сторон уравнения.
Поскольку атомы не теряются и не образуются в ходе химической реакции, общая масса продуктов равна общей массе реагентов.Сумма относительных формульных масс реагентов равна сумме относительных формульных масс продуктов.
При реакции меди с кислородом с образованием оксида меди не образуются и не разрушаются атомы.
Расчеты по закону.
Массу одного вещества в реакции можно вычислить, если известны массы других веществ. Например:
1. Карбонат кальция состоит из 28 граммов оксида кальция и 22 граммов диоксида углерода
2.Чтобы узнать количество карбоната кальция, добавьте 28 граммов оксида кальция и 22 грамма диоксида углерода
3. Всего получается 50 граммов карбоната кальция
4. 48 граммов магния и неизвестное количество кислорода. сделать 80 граммов оксида магния
5. Возьмите 80 граммов оксида магния и уберите 48 граммов магния
6. Остается 32 грамма кислорода
Реакции в закрытых системах
Никакие вещества не могут войти или покинуть закрытая система, такая как колба с пробкой.Иногда реакции, происходящие в открытых стаканах, представляют собой закрытые системы, например реакции кислотно-щелочной нейтрализации. Поскольку все реагенты и продукты остаются в стакане, общая масса стакана и веществ в нем остается неизменной во время реакции.
Реакции в незамкнутых системах
Вещества могут входить или выходить из незамкнутой системы. Эти системы включают открытые колбы, кипящие трубы или тигли, через которые газы попадают или уходят. Например:
- карбонат меди при нагревании разлагается с образованием твердого оксида меди, который остается в кипящей трубе, и газообразного диоксида углерода, который уходит
- , магний реагирует с кислородом, полученным из воздуха, с образованием оксида магния
Если газ улетучится, общая масса будет выглядеть так, как если бы она уменьшилась.Если набрать газ, общая масса будет выглядеть так, как если бы она увеличилась. Однако общая масса остается неизменной, если учитывать массу газа.
Рабочий пример
- Вопрос
10,0 г карбоната кальция, CaCO 3 , нагревали в реакции термического разложения. После нагревания осталось 5,60 г твердого вещества. Уравнение ниже представляет реакцию:
CaCO 3 (s) → CaO (s) + CO 2 (g)
Объясните изменение массы.
- Показать ответ
Масса, похоже, уменьшилась из-за того, что один из продуктов, углекислый газ, улетучивается в воздух. Общая масса твердых и газообразных продуктов составит 10,0 г.
3.7: Сохранение массы — Новой Материи нет
Может показаться, что горение разрушает материю, но такое же количество или масса материи все еще существует после костра, как и раньше. Посмотрите на рисунок \ (\ PageIndex {1} \) ниже. Он показывает, что когда дерево горит, оно соединяется с кислородом и превращается не только в золу, но также в углекислый газ и водяной пар.Газы уносятся в воздух, оставляя после себя только пепел. Предположим, вы измерили массу древесины до того, как она сгорела, и массу золы после того, как она сгорела. Также предположим, что вы смогли измерить кислород, используемый огнем, и газы, выделяемые огнем. Что бы вы нашли? Общая масса вещества после пожара будет равна общей массе вещества до пожара.
Закон сохранения массы
Закон сохранения массы был создан в 1789 году французским химиком Антуаном Лавуазье.Закон сохранения массы утверждает, что материя не может быть создана или разрушена в результате химической реакции. Например, когда горит древесина, масса сажи, золы и газов равна исходной массе древесного угля и кислорода, когда они впервые прореагировали. Таким образом, масса продукта равна массе реагента. Реагент — это химическая реакция двух или более элементов с образованием нового вещества, а продукт — это вещество, которое образуется в результате химической реакции (Видео \ (\ PageIndex {1} \)).Материя и соответствующая ей масса не могут быть созданы или разрушены, но могут изменить форму на другие вещества, такие как жидкости, газы и твердые тела.
Видео \ (\ PageIndex {1} \): Это красивая небольшая демонстрация, показывающая сохранение массы в действии.
Если вы станете свидетелем сгорания дотла 300-килограммового дерева, после сожжения останется только пепел, и все они вместе весят 10 кг. Это может заставить вас задуматься, куда делись остальные 290 кг. Недостающие 290 кг были выброшены в атмосферу в виде дыма, поэтому единственное, что вы можете увидеть, — это 10 кг золы.Если вы знаете закон сохранения массы, то вы знаете, что остальные 290 кг должны куда-то уйти, потому что они должны равняться массе дерева до того, как оно сгорело.
Пример \ (\ PageIndex {1} \)
Если нагревание 10,0 граммов карбоната кальция (CaCO 3 ) дает 4,4 г диоксида углерода (CO 2 ) и 5,6 г оксида кальция (CaO), покажите, что эти наблюдения согласуются с законом сохранения массы. .
Решение
\ [\ begin {align *} \ text {Масса реагентов} & = \ text {Масса продуктов} \\ [4pt] 10.0 \, \ text {g of} \ ce {CaCO3} & = 4.4 \, \ text {g of} \ ce {CO2} + 5.6 \, \ text {g of} \ ce {CaO} \\ [4pt] 10.0 \, \ text {г реагента} & = 10.0 \, \ text {г продуктов} \ end {align *} \]
Поскольку масса реагента равна массе продуктов, наблюдения согласуются с законом сохранения массы.
Упражнение \ (\ PageIndex {1} \)
Гидроксид калия (\ (\ ce {KOH} \)) легко реагирует с диоксидом углерода (\ (\ ce {CO2} \)) с образованием карбоната калия (\ (\ ce {K2CO3} \)) и воды (\ ( \ ce {h3O} \)).Сколько граммов карбоната калия получается, если 224,4 г \ (\ ce {KOH} \) вступает в реакцию с 88,0 г \ (\ ce {CO2} \)? В результате реакции также образуется 36,0 г воды.
- Ответ
- 276,4 г карбоната калия
Закон также применим как к химическим, так и к физическим изменениям. Например, если у вас есть кубик льда, который плавится в жидкость, и вы нагреваете эту жидкость, она превращается в газ. Кажется, что он исчез, но все еще там.
Сохранение вещества и массы
Идея этого фокуса исследована через:
Противопоставление взглядов студентов и ученых
Ежедневный опыт студентов
Для многих студентов идея о сохранении материи не является естественной. Они наблюдают, что сахар исчезает при смешивании с водой, большое бревно сгорает до небольшого количества золы, появляются ржавчины автомобилей и большие ямы, вода выкипает, из ниоткуда появляются иней и конденсат, а деревья растут, по-видимому, только из почвы.
Студентам может показаться, что материя исчезает или появляется во время таких процессов, как растворение, горение, испарение, кипение, гниение, дыхание, ржавление, конденсация и рост растений. Невидимые газы участвуют во многих из этих процессов, что приводит ко многим из этих альтернативных концепций студентов.
Исследования: Драйвер (1985), Рассел, Харлен и Ватт (1989)
Студенты также часто верят, что материя обменивается или превращается в энергию (например, они считают, что древесина превращается в тепло во время горения, а пища превращается в энергию, когда мы метаболизируем его), или они путают энергию пищи (указанную на пакетах как килоджоули) с весом перечисленных ингредиентов.Студенты также часто считают, что солнечная энергия превращается в растительную материю в процессе фотосинтеза.
Процесс испарения также может бросить вызов представлениям студентов, поскольку многие студенты считают, что вещества становятся легче, если они переходят в газообразное состояние. Если жидкость испаряется внутри герметичного контейнера, они считают, что общий вес контейнера и жидкости будет уменьшен за счет веса жидкости, поскольку она, по-видимому, исчезла.
Исследование: Stavy (1990)
Хотя на этом уровне большинство студентов будут иметь представление о природе атомов в виде частиц, для многих количество атомов не сохраняется во время химических реакций.Например, кажется, что количество атомов в коре деревьев растет, а их количество падает во время таких процессов, как горение или распад, и увеличивается во время фотосинтеза.
Научная точка зрения
Идея неделимых атомов помогает объяснить сохранение материи. Если количество атомов остается неизменным, независимо от того, как они перестраиваются, то их общий вес остается неизменным.
При всех физических и химических изменениях общее количество атомов остается неизменным, следовательно, когда вещества взаимодействуют друг с другом, объединяются или распадаются, общий вес системы остается неизменным.
Растущие растения получают новый углерод (большую часть своей сухой массы) из углекислого газа, то есть из воздуха. Когда мы худеем с помощью диеты или упражнений, большая часть потери приходится на выдыхание атомов углерода, которые метаболизируются из нашего жира в виде углекислого газа. Когда жидкость испаряется в запечатанном контейнере, вес остается прежним; на частицы газа действует сила тяжести так же, как и на теннисные мячи, и, следовательно, они ударяются о нижнюю поверхность контейнера с большей силой, чем при ударе о верх.
Предсказание Альберта Эйнштейна о том, что масса может быть преобразована в энергию, было экспериментально подтверждено многочисленными ядерными экспериментами. Следствием этого является то, что утверждение «общий вес системы остается неизменным» является более правильным только очень хорошим приближением для всех неядерных изменений.
Критические идеи обучения
В физических и химических изменениях:
- частицы просто не исчезают и не создаются, скорее их расположение меняется
- при любом изменении, связанном с материей, вся материя должна учитываться.Материя не превращается в энергию и не появляется из нее.
- частицы перестраиваются для создания веществ, отличных от исходных.
- нет изменения веса, когда вещества входят и выходят из газового состояния.
Изучите взаимосвязь между идеями сохранения массы в
Карты развития концепции — (Сохранение материи, состояния материи, потока материи в экосистемах)
В вашем обучении сохранению материи и, следовательно, веса, учащихся необходимо поощрять менять свои взгляды с взглядов, основанных на их повседневном опыте, на более широкие. научные взгляды, такие как идея о том, что в мире есть только фиксированное количество частиц, и эти строительные блоки постоянно перестраиваются в новые вещи.
Это сложная абстрактная идея, и мы можем использовать аналогии, чтобы помочь учащимся ее понять. Например: «Это немного похоже на ведро Lego: вы можете строить много разных вещей, но у вас есть только определенное количество частей Lego, из которых можно это делать». Одна из трудностей заключается в том, что закрытые системы, включающие такие изменения, как горение и дыхание, практически невозможно настроить и взвесить в классе. Вы можете экспериментально опровергнуть лишь некоторые из распространенных альтернативных концепций в этой области.
Исследования: Loughran, Milroy, Berry, Gunstone & Mulhall (2001)
Важно обсудить различные ситуации изменений, которые, как представляется, связаны с несохранением материи, и вернуться к этому вопросу в других темах, таких как экосистемы, продукты питания. и диета, и источники энергии. Учащимся следует поощрять делать прогнозы об этих процессах в благоприятной классной среде, где им могут помочь разработать новые теории, критически проанализировать свое понимание и понимание других и сравнить их с научными взглядами, представленными учителем.Легче попытаться исключить альтернативные концепции, которые могут быть сначала проверены экспериментально, а затем студенты придут к пониманию научной модели как той, которая может лучше всего объяснить широкий спектр явлений.
Обсуждение учащимися того, как изменились их взгляды, будет ценным компонентом достижения долгосрочных концептуальных изменений у учащихся и понимания научных объяснений.
Исследования: Лофран, Милрой, Берри, Гунстоун и Малхолл (2001)
Учебная деятельность
Учащиеся должны как обсуждать, так и наблюдать явления, при которых наблюдается явное изменение веса, и им следует искать альтернативные объяснения.
Содействовать осмыслению и разъяснению существующих идей и позволить учащимся увидеть, как изменились их идеи
Попросите учащихся записать и сохранить свои взгляды на ряд ситуаций, например:
- Свежий труп запечатан в герметичное подземелье. 100 лет спустя труп превратился в скелет. Общая масса подземелья, трупа и прочего содержимого увеличивается, уменьшается или остается неизменной? Куда девается плоть?
- Представьте себе горящую кучу дров в запечатанном помещении.Увеличивается ли, уменьшается или остается общая масса помещения и изделий из него? (См. Дерево, растущее в коробке, ниже).
Начать обсуждение через обмен опытом и способствовать размышлению и прояснению существующих идей
Упражнения POE (Predict -Observe-Explain) могут быть полезны как для выявления предшествующих взглядов учащихся, так и для переосмысления этих концепций.
Попросите учащихся предсказать, что произойдет, если материалы (например, стальная вата или магний) будут сожжены.Затем учащиеся должны взвесить материалы до и после сжигания, убедившись, что все продукты горения сохраняются. Обратите внимание, что эти эксперименты не доказывают, что общий вес сохраняется в закрытой системе. В этом случае система открыта, и общий вес стальной ваты / магния увеличивается, поскольку они соединяются с кислородом воздуха. Эти эксперименты убедительно показывают, что при сгорании не всегда теряется вес, и, следовательно, представление о превращении материи в тепло не является жизнеспособным.
Аналогичным образом исследуем, что происходит при испарении. Взвесьте плотно закупоренную колбу, содержащую 1-2 мл ацетона, медленно нагрейте и снова взвесьте. (Студенты часто предсказывают, что вес колбы уменьшился, потому что газы легче жидкостей или молекулы больше не сидят на дне.)
Содействовать размышлению и разъяснению существующих идей
Устные обсуждения (когда учитель откладывает оценку «неправильные» комментарии) могут позволить учащимся рассмотреть и переосмыслить свои взгляды (после просмотра приведенных выше изменений и многих других, которые можно придумать).
Уточняйте и объединяйте идеи для / путем общения с другими
На основе описанных выше заданий небольшие группы учащихся могли бы сделать плакаты и представить их классу, чтобы поделиться своими идеями и объяснениями.
Начать обсуждение посредством обмена опытом и способствовать размышлению и разъяснению существующих идей
Учащийся может взвесить несколько таблеток антацида и небольшую бутылку безалкогольного напитка, наполненную водой, по отдельности, чтобы определить их общий вес.Затем таблетки добавляют в воду, флакон быстро закрывают и повторно взвешивают после того, как таблетки полностью растворятся. Вес «до» и «после» должен быть одинаковым, даже если таблетки полностью исчезли и образовался газ. Предложите студентам обсудить результаты и высказать свое мнение о том, насколько эти результаты согласуются с их взглядами на сохранение материи или оспаривают их.
Содействовать осмыслению и разъяснению существующих идей
Другая проблема, которая проверяет понимание студентами теории сохранения материи, заключается в следующем: внутри большой запечатанной стеклянной коробки много влажной почвы, резервуар для воды с капельным орошением и семя быстрорастущего дерева.Ящик помещается на солнце на год, и внутри ящика растет дерево. Учащимся задают вопрос, будет ли общий вес коробки и ее содержимое увеличиваться, уменьшаться или оставаться неизменными в течение года роста дерева.
| Преподавательская деятельность — Понимание теории сохранения материи | |
|---|---|
Изображение 1 показывает начало дерева как семя. | |
Изображение 2 показывает, что год спустя выросло дерево. |
Еще один вариант, который следует рассмотреть: не открывая коробку, дерево поджигается. После сжигания изменится ли вес ящика? Что произойдет с количеством атомов до и после обоих этих изменений?
Уточняйте и объединяйте идеи для / путем общения с другими
Попросите студентов рассмотреть следующую ситуацию: ваша рука состоит из атомов углерода (содержащихся в молекулах белка). Рассмотрим один из этих атомов углерода, назовем его «Гилберт».Предположим, что миллион лет назад Гилберт был в травинке. Напишите возможную историю Гилберта за последний миллион лет. В своем ответе укажите как можно больше процессов.
Когда вы представляете это задание, предупредите учащихся, что они, вероятно, вернутся к своим предыдущим представлениям. (Очень немногим ученикам удается написать эту историю, не опираясь на свои предыдущие взгляды и не записывая того, что противоречит тому, чему их только что научили. Распространенной ошибкой является возвращение к убеждению, что растения черпают большую часть материала, необходимого для роста, из почвы, причем Гилберта неоднократно возвращали в почву в результате разложения мертвого органического материала, а затем извлекали из почвы другим растением).Для студентов, которые возвращаются с рассказами, демонстрирующими очень мало знаний о том, что они только что узнали, попробуйте объяснить, почему они написали рассказы таким образом.
Поощряйте размышления о том, как изменились идеи учащихся.
Попросите учащихся еще раз взглянуть на свои взгляды на сценарии, связанные с распадом и возгоранием, и подумать, изменили ли они свои взгляды. Если да, спросите их, как бы они изменили свои ответы на ситуации и почему они бы изменили их. (Никогда не оценивайте их первоначальные ответы, но можно оценить рефлексивные ответы во второй раз).
Студенты также могли сформулировать свои собственные гипотезы об изменении веса при сжигании, дыхании и фотосинтезе и провести исследования, чтобы подтвердить или опровергнуть их.
Дополнительные ресурсы
Интерактивные обучающие объекты, связанные с наукой, можно найти на
Страница ресурсов для учителей FUSE.
Чтобы получить доступ к интерактивному объекту обучения ниже, учителя должны войти в FUSE и выполнить поиск по идентификатору учебного ресурса:
- Химические реакции: горение — студенты изучают химические реакции на молекулярном уровне.Они разбивают молекулы кислорода и другого вещества на составляющие их атомы и перестраивают их, чтобы образовать молекулы новых веществ. Например, они исследуют, как метан сгорает в кислороде с образованием углекислого газа и воды. Они также определяют количество молекул каждого вещества, необходимое для баланса химического уравнения.
ID учебного ресурса: HY5GUN
сохранение массы — Студенты | Britannica Kids
Введение
Британская энциклопедия, Inc.
Закон сохранения массы — фундаментальный принцип физики. Согласно этому закону материя не может быть ни создана, ни уничтожена. Другими словами, масса объекта или набора объектов никогда не меняется, независимо от того, как переставлены части. В обычной химической реакции сумма масс реагентов (веществ, претерпевающих изменение) равна сумме масс продуктов (веществ, образующихся в результате реакции). Например, масса древесины и кислорода, который исчезает при сгорании, равна массе водяного пара, углекислого газа, дыма и золы, которые появляются в результате реакции.
Сохранение массы в химических и физических системах
Масса сохраняется в химических реакциях, потому что в реагентах присутствуют те же атомы, что и в продуктах, хотя они сочетаются по-разному. Например, кальций (Ca) может реагировать с кислородом (O 2 ) с образованием сложного оксида кальция (CaO):
2 Ca + O 2 → 2 CaO
Обратите внимание, что реагенты состоят из 2 атомов кальций и 1 молекула кислорода, содержащая 2 атома кислорода.Продукт представляет собой 2 молекулы оксида кальция, каждая из которых состоит из 1 атома кальция и 1 атома кислорода. Число и типы атомов до реакции — 2 атома кальция и 2 атома кислорода — равны числу и типам атомов в продукте — 2 атома кальция и 2 атома кислорода. Атомы расположены в продукте по-разному по сравнению с реагентами, но до и после реакции присутствует одно и то же количество и тип массы.
Британская энциклопедия, Inc.
Масса также сохраняется, когда материя претерпевает физические изменения, такие как изменения состояния.Например, вода состоит из атомов водорода и кислорода с химической формулой H 2 O. Вода может существовать в трех состояниях: твердом (лед), жидком и газообразном (водяной пар или пар). Масса пробы воды останется неизменной независимо от изменения состояния. Если растопить 1 грамм кубиков льда, он произведет 1 грамм жидкой воды и, при повышении температуры, 1 грамм водяного пара:
1 г H 2 O лед = 1 г H 2 O вода = 1g H 2 O пар
Кроме того, количество атомов водорода и кислорода во льду равно количеству атомов водорода и кислорода в жидкой воде и водяном паре.
Сохранение массы живых систем
Encyclopædia Britannica, Inc.
Закон сохранения массы применим и к движению материи через живые системы. По мере того как питательные вещества перемещаются через биосферу, элементы непрерывно переносятся между организмами и окружающей их средой посредством биогеохимических циклов, таких как цикл азота и цикл фосфора.
Движение углерода в углеродном цикле является хорошим примером того, как сохраняется масса в живых системах.Источником углерода, содержащегося в живом веществе, является двуокись углерода, находящаяся в воздухе или растворенная в воде. В земной среде растения используют углекислый газ из воздуха для производства углеводов посредством фотосинтеза. Эти соединения переходят к травоядным — организмам, поедающим растения, — а затем к организмам, поедающим травоядных. Чтобы получить энергию, организмы расщепляют углеводы посредством клеточного дыхания, выделяя углекислый газ обратно в атмосферу. Углерод в отходах животных — и в тканях мертвых организмов — попадает в окружающую среду в результате разложения.Некоторое количество углерода возвращается в атмосферу в виде двуокиси углерода. Однако некоторое количество углерода хранится под землей. Углерод в ископаемом топливе, таком как уголь и нефть, образуется из разложившихся тканей растений и животных, отложившихся миллионы лет назад. Этот углерод возвращается в атмосферу в результате сгорания при сжигании этого топлива. Сгорание также учитывает выбросы углекислого газа при сжигании растительности и при извержении вулканов.
Углерод также перемещается через водные экосистемы, где углекислый газ, растворенный в воде, поглощается водорослями и фитопланктоном для фотосинтеза и возвращается в воду посредством клеточного дыхания.Углерод, отложенный в донных отложениях из разложившихся останков организмов, помогает образовывать минеральные соединения, которые некоторые водные животные, например устрицы, включают в свои раковины.
Углеродный цикл показывает, что одни и те же атомы углерода могут — в течение эонов — неоднократно перемещаться между организмами, атмосферой, почвой и океанами. Углерод, выделяемый животным в виде углекислого газа, может оставаться в атмосфере в течение 5 или 10 лет, прежде чем он будет поглощен другим организмом, или углерод может почти немедленно вернуться обратно в соседнее растение и использоваться во время фотосинтеза.Даже когда организмы умирают, углерод в их тканях не разрушается, хотя он может менять форму, циркулируя в окружающей среде.
Сохранение массы-энергии
Однако закон сохранения массы не всегда верен. Специальная теория относительности Альберта Эйнштейна, представленная в 1905 году, показала, что масса и энергия эквивалентны, поэтому массу можно преобразовать в энергию и наоборот. Некоторое преобразование между массой и энергией происходит как в химических, так и в ядерных реакциях, поэтому продукты обычно имеют меньшую или большую массу, чем реагенты.Разница в массе настолько мала для обычных химических реакций, что закон сохранения массы все еще считается верным. Однако в ядерных реакциях преобразование массы в энергию достаточно существенно, чтобы аннулировать закон. В свете этого открытия закон сохранения массы был объединен с законом сохранения энергии, чтобы создать закон сохранения массы-энергии.
Как научить сохранять массу | CPD
Это вроде очевидно, не правда ли, материю нельзя создавать или разрушать.Сэндвич будет иметь ту же массу, что и его ингредиенты, а разбитый бокал будет весить не больше и не меньше, чем до того, как его уронили. Но помимо очевидного есть ряд интересных наблюдений, которые делают, казалось бы, интуитивный закон сохранения массы не таким интуитивным, в конце концов:
- Именинный торт будет весить меньше, чем его ингредиенты.
- Железная вата увеличивается в массе при горении на воздухе.
- Свеча уменьшается в массе при горении на воздухе.
- Когда сахар растворяется в воде, он исчезает, но масса сохраняется.
- Растения получают большую часть своей массы из невидимого газа.
Что нужно знать студентам
Чтобы помочь студентам ориентироваться в этих наблюдениях, которые, кажется, подрывают закон сохранения массы, давайте немного углубимся в их размышления.
Демонстрация на изображении ниже основана на мысленном эксперименте Джонстона и Скотта (1991). Задача исследует мысли студентов о массовых изменениях при растворении.
Только 40% детей в возрасте 12–13 лет в этом исследовании успешно предсказали сохранение массы при растворении вещества. У некоторых масса уменьшалась при растворении, потому что сахар расщеплялся на более мелкие кусочки. Те, кто предсказывали, что масса увеличится, полагали, что сахар цепляется за частицы воды и поэтому становится тяжелее.
Что интересно в этих объяснениях, так это то, что они основаны на правильной науке. Кристаллы сахара действительно становятся меньше, когда они растворяются в воде, а молекулы сахара цепляются за молекулы воды.Однако эти правильные идеи использовались, чтобы сделать неверные выводы об общем изменении массы. Это произошло потому, что студенты думали об определенных частях системы, например, о кристаллах сахара или только о частицах воды. Вместо этого им нужно было думать о системе в целом.
Идеи для вашего класса
Подобный анализ всей системы может помочь учащимся понять, что происходит, когда кажется, что масса не сохраняется. Термическое разложение карбоната меди (II) является прекрасным примером этого.Студентов часто смущает уменьшение массы при нагревании зеленого порошка CuCO 3 с образованием черного оксида меди (II).
Уравнение 1: CuCO 3 (с) → CuO (с) + CO 2 (г)
Здесь есть два способа помочь студентам. Сначала обсудите, как уравнение соотносится с их практическими наблюдениями. Во-вторых, определите, где находятся всех компонентов системы. В частности, учащимся нужно смотреть за пределы нагреваемой пробирки, чтобы «найти» углекислый газ.
Обсудите уравнение
Химические уравнения могут быть довольно вводящим в заблуждение представлением о том, что происходит в химической реакции. Поэтому вместо того, чтобы начинать с общего уравнения, которое показывает все вещества вместе, разбейте реакцию как минимум на три этапа и представьте их по отдельности, например:
| Реагенты | Продукты | |
|---|---|---|
| В начале: | CuCO 3 (т) | |
| Во время: | CuCO 3 (т) | → CuO (т) + CO 2 (г) |
| В конце: | → CuO (т) + CO 2 (г) |
Теперь ученикам легче увидеть, что реагенты отсутствуют, когда реакция закончилась.Вы можете показать, как атомы перестраиваются, используя цвет, например:
Изучить всю систему
Помогите студентам идентифицировать все компоненты системы как внутри, так и вне пробирки. Предоставьте схему устройства и попросите их указать местонахождение и названия всех веществ. Сделайте это для начала и конца реакции. Вы можете увидеть, как это выглядит, в сопутствующем занятии в классе.
Загрузите это
- Занятие в классе, чтобы помочь студентам визуализировать компоненты реакции с использованием примеров растворения сахара и нагревания карбоната меди в качестве начального слайда (в формате MS Powerpoint или pdf) или рабочего листа (в формате MS Word или pdf) с листом ответов ( в формате MS Word или pdf).
- Некоторые вопросы для размышления (например, MS Powerpoint или pdf), чтобы побудить студентов подумать о том, что происходит во время и после реакции.
Скачать все
Загрузите это
Классные занятия, помогающие учащимся визуализировать компоненты реакции на примерах растворения сахара и нагревания карбоната меди с веб-сайта Education in Chemistry : rsc.li/2BlIRxb
Распространенные заблуждения
Понимание сохранения массы требует понимания теории частиц.Исследование Ванессы Кинд показало, что некоторые студенты думают, что газы не имеют массы и что вещества в твердом состоянии весят больше, чем их жидкая форма, путая плотность с массой. Используйте тщательно структурированные демонстрации, чтобы устранить эти недоразумения, прежде чем вводить химические изменения, которые, как представляется, нарушают закон сохранения массы.
Демо 1: Газы имеют массу
Надуйте два воздушных шара и прикрепите каждый шарик к концам 1-метровой линейки.Уравновесите линейку на опоре. Попросите учащихся предсказать, что произойдет, если вы лопнете один воздушный шарик. Лопните один воздушный шарик и попросите учеников понаблюдать и объяснить. Как вариант, замените воздушные шары пакетами из коричневой бумаги, затем налейте углекислый газ из смеси кислоты и мраморной крошки в один из пакетов и посмотрите, как наклоняется линейка.
Демонстрация 2: В открытых системах материя теряется
Положите немного уксуса и разрыхлителя на цифровые весы. Запишите их массу. Теперь сложите эти два химиката вместе внутри пакета Ziploc, и ученики увидят, что пакет расширяется, но масса остается прежней.
Демонстрация 3: твердые частицы имеют ту же массу, что и жидкие частицы
Запишите массу двух стаканов, один из которых содержит раствор гидроксида натрия, а другой — раствор сульфата меди (II). Теперь слейте их вместе, чтобы образовался синий (твердый) осадок гидроксида меди (II). Поместите обе мензурки обратно на весы. Не показывая учащимся чтения, попросите их предсказать, какой будет новая масса.
Формирующее оценивание
Диагностические вопросы с несколькими вариантами ответов — отличный способ изучить аргументы учащихся, стоящие за их ответами.Ресурсы Best Evidence Science Teaching предоставляют отличную отправную точку для изучения их идей о сохранении массы. Студентам дается вопрос и несколько правдоподобных объяснений наблюдения. Затем они выбирают и обосновывают, с каким объяснением они согласны. Вы также можете предложить учащимся мысленные эксперименты и попросить их дать свои собственные объяснения (см. Ресурс «Вопросы для размышления»).
Если учащиеся нарисуют графики изменения массы во время реакции и расскажут о своих рассуждениях в парах, вы сможете прислушаться к их мнению.Используйте горящую железную вату в воздухе в качестве стимула.
Переход на 14–16
Понимание студентами сохранения массы станет более сложным. Они рассмотрят больше контекстов, например нейтрализацию и электролиз, и посмотрят, как взаимодействуют компоненты системы. Они будут применять идеи сохранения массы к обратимым реакциям. Они будут отслеживать скорость реакции, учитывая, сколько продукта производится (или израсходовано реагентов) за определенный промежуток времени.Это потребует использования более сложных устройств, таких как газовые шприцы или регистраторы данных.
Учащиеся также будут представлять массовые изменения более сложными способами, используя уравнения сбалансированных символов. Эти уравнения помогут студентам развить количественное понимание материи, вычислить относительные массы по формуле и прогнозировать массы образовавшихся продуктов.
Очков на вынос
- Закон сохранения массы гласит, что атомы не создаются и не разрушаются во время реакции, они просто перестраиваются.
- Многие химические реакции, кажется, включают изменение массы, потому что не вся материя учтена.
- Используйте ряд реакций в открытых и закрытых системах, чтобы учащиеся идентифицировали все составные части системы.
- Понимание сохранения массы позволяет понять уравнения баланса и вычислить реакционные массы.
Как закон сохранения материи может объяснить проблемы с эмпирическими формулами
В классе
JChemEd.chem.wisc.edu • Vol. 78 № 8 августа 2001 г. • Журнал химического образования 1051
, выраженная в а.е.м., а также относительная масса одного моля
этого элемента, выраженная в граммах. Предпосылка, которая связывает
атомного и макроскопического уровней, состоит в том, что масса атома
постоянна. Следовательно, если один атом элемента на
вдвое тяжелее атома другого элемента, то 1 моль
атомов первого элемента вдвое тяжелее 1 моль
других атомов.Использование атомных весов с присущими им отношениями
между макро- и атомными уровнями
основывается на идее, что масса атома сохраняется.
На этапах 5 и 6 моли цинка и элементарного йода
в соединении иодида цинка выражаются целыми числами, а
затем записываются в виде нижних индексов в произведении. Это делается путем деления
мольных значений элементов в соединении на
наименьших мольных значений.Эти два шага позволяют индексам
представлять мольное соотношение элементов, составляющих продукт
. Изменение мольного соотношения изменяет химические и
физических свойств реагентов. Мольное соотношение элементов
в соединении равно количеству молей атомов, которые вначале вступают в реакцию. Следовательно, сохраняется сохранение молей
от реагентов до продуктов. Отношение этих нижних значений
пропорционально изменяется от макроскопических значений в терминах
моль до значения, которое отражает атомный уровень.Другими словами,
нецелочисленных мольных значений
заменяются целыми значениями, соответствующими
атомам, например, как видно в продукте из иодида цинка,
ZnI2. Это изменение соответствует не сохранению, а
теории атома. Поскольку материя представляет собой частицы, а не
непрерывных частиц, атомы объединяются как целые единицы, а не как дробные
частей единицы.
Включение консервации в уроки, включающие эмпирические задачи
формулы
Есть несколько способов сделать химические допущения
, которые лежат в основе методов, которые мы используем для решения
задач эмпирических формул, явных для наших студентов.В моих собственных классах
учащимся предоставляется неполная версия таблицы 1
, в которой записаны только процедурные шаги. Работа —
В группах студенты должны сделать предположения, что
соответствуют шагам. Хотя этот подход
формально не оценивался, обсуждение в классе действительно позволяет учащимся
сформулировать свое понимание, а также неправильные представления
теоретических построений.
Можно также использовать ссылки на историю химии,
особенно количественную работу Лавуазье с газами.Например,
Я цитирую Traité Élémentaire de Chimie Лавуазье для моего класса (12):
Мы должны сформулировать это как неоспоримую аксиому, что в
во всех операциях искусства и природы ничего не создается;
равное количество материи существует как до, так и после
эксперимента. … От этого принципа зависит все искусство проведения химических экспериментов
.
Еще один способ подчеркнуть важность сохранения
— просто попросить студентов выполнить лабораторное задание по
по этому предмету.Вопросы, касающиеся сохранения, поместили
во все последующие действия, такие как эмпирическая формула
активность может помочь студентам связать новые химические реакции с
принципами сохранения, обсуждаемыми в этой статье.
Язык, на котором мы описываем химические проблемы
, также может быть способом сформулировать некоторые из предположений
, лежащих в основе этих проблем. Добавляя в уроки «консервационный» словарь
, можно напрямую связать
шагов, связанных с решением задач стехиометрии.Для примера
лексику сохранения можно включить в уроки
, попросив учащихся «сохранить химическое уравнение» вместо
«сбалансировать химическое уравнение». Важная роль сохранения
подчеркнута Бейкером и Пибурном в их книге для учителей естественных наук
, где они пишут (13):
Успех стехиометрии критически зависит от предположения
о равенстве двух сторон химическое
уравнение.К сожалению, многие люди не видят необходимости сохранения количества
, когда думают о химических превращениях
.
Проблемы с ограничением и избытком реагентов
Расчет количества продукта по идентификатору
ограничивающих и избыточных реагентов зависит от первого написания
сбалансированного химического уравнения. Знание эмпирической формулы продукта
позволяет сбалансировать уравнение с коэффициентами
.Манипулирование коэффициентами повторяет наблюдение
о том, что количество атомов каждого реагента поддерживается равным
, они претерпевают химические превращения в продукты. Проще говоря,
количество атомов / элементов на стороне реагента должно равняться
количеству атомов / элементов на стороне продукта. Коэффициенты co-
представляют собой количество в химическом рецепте, когда все
реагентов полностью преобразованы в указанное количество продуктов
.Обычно они выражаются целыми числами, но иногда
дробями.
После завершения сбалансированного химического уравнения можно обсудить
дополнительных шагов с точки зрения консервации.
Например, масса продукта может быть теоретически
рассчитана на основе ограничивающего реагента. По моей оценке, это
,
— самый сложный аспект стехиометрии — где студент
должен определить лимитирующие и избыточные реагенты.Так как же консервация
поддерживает эти сложные шаги? Поддержка взимается по
двумя способами. Во-первых, если мы рассмотрим этот общий тип проблемы стехиометрии
как расширение проблемы прототипной эмпирической формулы
, тогда студенты могут понять, что принципы сохранения
сопровождают и теоретически поддерживают эти дополнительные методы. Это небезосновательно, поскольку выяснение
, сколько продукта теоретически может быть произведено, предполагает
, что идентичность и состав продукта известны.
Второй способ, которым консервация связана со стехи
ометрическими задачами, которые требуют массы продукта, касается
коэффициентов сбалансированного уравнения.
