Содержание
Фотосинтез кратко и понятно
☰
Фотосинтез — это процесс синтеза органических веществ из неорганических за счет энергии света. В подавляющем большинстве случаев фотосинтез осуществляют растения с помощью таких клеточных органелл как хлоропласты, содержащих зеленый пигмент хлорофилл.
Если бы растения не были способны к синтезу органики, то почти всем остальным организмам на Земле нечем было бы питаться, так как животные, грибы и многие бактерии не могут синтезировать органические вещества из неорганических. Они лишь поглощают готовые, расщепляют их на более простые, из которых снова собирают сложные, но уже характерные для своего тела.
Так обстоит дело, если говорить о фотосинтезе и его роли совсем кратко. Чтобы понять фотосинтез, нужно сказать больше: какие конкретно неорганические вещества используются, как происходит синтез?
Для фотосинтеза нужны два неорганических вещества — углекислый газ (CO2) и вода (H2O). Первый поглощается из воздуха надземными частями растений в основном через устьица. Вода — из почвы, откуда доставляется в фотосинтезирующие клетки проводящей системой растений. Также для фотосинтеза нужна энергия фотонов (hν), но их нельзя отнести к веществу.
Первый поглощается из воздуха надземными частями растений в основном через устьица. Вода — из почвы, откуда доставляется в фотосинтезирующие клетки проводящей системой растений. Также для фотосинтеза нужна энергия фотонов (hν), но их нельзя отнести к веществу.
В общей сложности в результате фотосинтеза образуется органическое вещество и кислород (O2). Обычно под органическим веществом чаще всего имеют в виду глюкозу (C6H12O6).
Органические соединения большей частью состоят из атомов углерода, водорода и кислорода. Именно они содержатся в углекислом газе и воде. Однако при фотосинтезе происходит выделение кислорода. Его атомы берутся из воды.
Кратко и обобщенно уравнение реакции фотосинтеза принято записывать так:
6CO2 + 6H2O → C6H12O6 + 6O2
Но это уравнение не отражает сути фотосинтеза, не делает его понятным. Посмотрите, хотя уравнение сбалансированно, в нем общее количество атомов в свободном кислороде 12. Но мы сказали, что они берутся из воды, а там их только 6.
Посмотрите, хотя уравнение сбалансированно, в нем общее количество атомов в свободном кислороде 12. Но мы сказали, что они берутся из воды, а там их только 6.
На самом деле фотосинтез протекает в две фазы. Первая называется световой, вторая — темновой. Такие названия обусловлены тем, что свет нужен только для световой фазы, темновая фаза независима от его наличия, но это не значит, что она идет в темноте. Световая фаза протекает на мембранах тилакоидов хлоропласта, темновая — в строме хлоропласта.
В световую фазу связывания CO2 не происходит. Происходит лишь улавливание солнечной энергии хлорофилльными комплексами, запасание ее в АТФ, использование энергии на восстановление НАДФ до НАДФ*H2. Поток энергии от возбужденного светом хлорофилла обеспечивается электронами, передающимися по электрон-транспортной цепи ферментов, встроенных в мембраны тилакоидов.
Водород для НАДФ берется из воды, которая под действием солнечного света разлагается на атомы кислорода, протоны водорода и электроны. Этот процесс называется фотолизом. Кислород из воды для фотосинтеза не нужен. Атомы кислорода из двух молекул воды соединяются с образованием молекулярного кислорода. Уравнение реакции световой фазы фотосинтеза кратко выглядит так:
Этот процесс называется фотолизом. Кислород из воды для фотосинтеза не нужен. Атомы кислорода из двух молекул воды соединяются с образованием молекулярного кислорода. Уравнение реакции световой фазы фотосинтеза кратко выглядит так:
H2O + (АДФ+Ф) + НАДФ → АТФ + НАДФ*H2 + ½O2
Таким образом, выделение кислорода происходит в световую фазу фотосинтеза. Количество молекул АТФ, синтезированных из АДФ и фосфорной кислоты, приходящихся на фотолиз одной молекулы воды, может быть различным: одна или две.
Итак, из световой фазы в темновую поступают АТФ и НАДФ*H2. Здесь энергия первого и восстановительная сила второго тратятся на связывание углекислого газа. Этот этап фотосинтеза невозможно объяснить просто и кратко, потому что он протекает не так, что шесть молекул CO2 объединяются с водородом, высвобождаемым из молекул НАДФ*H2, и образуется глюкоза:
6CO2 + 6НАДФ*H2 →С6H12O6 + 6НАДФ
(реакция идет с затратой энергии АТФ, которая распадается на АДФ и фосфорную кислоту).
Приведенная реакция – лишь упрощение для облегчения понимания. На самом деле молекулы углекислого газа связываются по одной, присоединяются к уже готовому пятиуглеродному органическому веществу. Образуется неустойчивое шестиуглеродное органическое вещество, которое распадается на трехуглеродные молекулы углевода. Часть этих молекул используется на ресинтез исходного пятиуглеродного вещества для связывания CO2. Такой ресинтез обеспечивается циклом Кальвина. Меньшая часть молекул углевода, включающего три атома углерода, выходит из цикла. Уже из них и других веществ синтезируются все остальные органические вещества (углеводы, жиры, белки).
То есть на самом деле из темновой фазы фотосинтеза выходят трехуглеродные сахара, а не глюкоза.
световая фаза, темновая фаза, фотодыхание, хемосинтез
Фотосинтез – это синтез сложных молекул из более простых под действием фотонов света, в результате которого световая энергия трансформируется в химическую. Продуктами первой фазы фотосинтеза являются НАДФ и АТФ (аденозинтрифосфат) — универсальные источники энергии для всех биохимических реакций, протекающих в живых организмах. Во второй фазе НАДФ и АТФ участвуют в синтезе более стабильных органических молекул, позволяющих хранить энергию (крахмал и ряд других углеводов).
Продуктами первой фазы фотосинтеза являются НАДФ и АТФ (аденозинтрифосфат) — универсальные источники энергии для всех биохимических реакций, протекающих в живых организмах. Во второй фазе НАДФ и АТФ участвуют в синтезе более стабильных органических молекул, позволяющих хранить энергию (крахмал и ряд других углеводов).
Содержание:
Не только растения, но и многие одноклеточные способны к фотосинтезу благодаря специальным органоидам, которые называются хлоропластами. Хлоропласты состоят из двух мембран и стопок (граны), которые содержат диски (тилакоиды). Внутреннее вещество, находящиеся между гранами и мембраной, называется стромой. Фотосинтез делят на две фазы: световую и темновую. Рассмотрим каждую из них.
Строение хлоропласта
Световая фаза
Световая фаза происходит на мембранах тилакоидов, которые содержат хлорофилл. Фотоны света действуют на хлорофилл, возбуждают его и приводят к выделению электронов на мембрану (это первая фотосистема). Когда хлорофилл теряет все свои электроны, фотоны света действуют на воду, вызывая фотолиз воды (это вторая фотосистема). В результате фотолиза протоны водорода накапливаются на внутренней мембране тилакоидов, а из гидроксильных ионов получается кислород. Также важно то, что работа второй фотосистемы восполняет утраченные электроны первой фотосистемы.
В результате фотолиза протоны водорода накапливаются на внутренней мембране тилакоидов, а из гидроксильных ионов получается кислород. Также важно то, что работа второй фотосистемы восполняет утраченные электроны первой фотосистемы.
Когда количество протонов водорода и электронов достигает максимума, запускается специальный переносчик, называемый АТФ-синтаза. АТФ-синтаза выталкивает протоны водорода в строму где их подхватывает НАДФ, который вместе с полученным водородом переходит дальше в темновую фазу. Прохождение протонов водорода через АТФ-синтазу сопровождается фосфорилированием, другими словами — синтезом АТФ из АДФ и фосфата.
Стоит отметить, что обе фотосистемы реагируют на световые волны различной длины. Цель их работы – запастись энергией для синтеза сложных органических молекул из простых неорганических, а именно, запастись АТФ и НАДФ·H2, которые активно используются в темновой фазе.
Темновая фаза
Темная стадия фотосинтеза – сложный процесс, в котором НАДФ·H2 и АТФ используются для производства молекул углеводов (сахаров). В отличие от световой фазы, ее процессы могут происходить как на свету, так и в темноте. Разберемся, как темновая фаза фотосинтеза работает, какие у нее преимущества и почему она важна.
В отличие от световой фазы, ее процессы могут происходить как на свету, так и в темноте. Разберемся, как темновая фаза фотосинтеза работает, какие у нее преимущества и почему она важна.
Темная фаза фотосинтеза происходит внутри органелл хлоропластов и напрямую зависит от продуктов, полученных в световой фазе. Рибулозобисфосфат, присоединяясь к газообразному углекислому газу (CO2) из воздуха, приводит к образованию органических соединений, главным образом углеводов или сахаров, молекулы которых содержат углерод, водород и кислород. Этот цикл трансформации называется циклом Кальвина.
Выделяют три стадии темновой фазы:
- Углеродная фиксация.
- Восстановление.
- Регенерация.
После образования глюкозы происходит последовательность химических реакций, которая приводит к образованию крахмала и ряда других углеводов. С помощью этих продуктов растение производит липиды (жиры) и белки, необходимые для формирования растительной ткани. Полученный крахмал смешивается с водой, содержащейся в листьях, через крошечные трубки в стебле растения транспортируется к корням, где формируются его основные запасы. Также крахмал используется для производства целлюлозы, основного компонента древесины.
Полученный крахмал смешивается с водой, содержащейся в листьях, через крошечные трубки в стебле растения транспортируется к корням, где формируются его основные запасы. Также крахмал используется для производства целлюлозы, основного компонента древесины.
Стоит отметить, что темновая фаза является донором НАДФ+ и АДФ + Ф для световой фазы.
Упрощенная схема фотосинтеза
С3-фотосинтез
Растения, использующие для фиксации углекислого газа из воздуха лишь цикл Кальвина, известны как растения C3. На первом этапе цикла CO2 реагирует с RuBP с образованием двух 3-углеродных молекул 3-фосфоглицериновой кислоты (3-PGA). Отсюда и происходит обозначение C3 для растений, использующих этот цикл.
Весь процесс, от захвата световой энергии до производства сахара, происходит внутри хлоропласта. Световая энергия улавливается нециклическим процессом транспорта электронов, который использует тилакоидные мембраны.
Около 85% видов растений являются растениями С3. Приведем примеры:
Приведем примеры:
- Пшеница
- Рис
- Ячмень
- Овес
- Рожь
- Арахис
- Хлопок
- Сахарная свекла
- Табак
- Шпинат
- Большинство деревьев
- Газонные травы (овсяница и др.)
Главный недостаток С3 фотосинтеза
У растений C3 есть недостаток: в сухих условиях их фотосинтетическая эффективность страдает из-за процесса, называемого фотодыханием. Когда концентрация CO2 в хлоропластах падает ниже уровня 50 частей на миллион, катализатор РуБисКО, который помогает фиксировать углерод, начинает вместо этого фиксировать кислород. Это очень бесполезно расходует энергию, полученную от света, и заставляет РуБисКО работать всего на четверть своей максимальной скорости. В результате резко угнетается синтез органических веществ, рост и развитие растения, а побочный продукт фотосинтеза (кислород) не выбрасывается в атмосферу.
Фотодыхание
Во время дыхания растения потребляют питательные вещества для поддержания метаболизма растительных клеток, в то время как во время фотосинтеза растения создают свою собственную пищу.
Формула фотосинтеза:
Формула дыхания растений:
Растения дышат постоянно, днем и ночью. А фотосинтез происходит только в течение дня, когда есть солнечный свет.
Дыхание – это физический процесс обмена газами между живыми объектами и окружающей средой.
Растения не дышат в самом строгом смысле этого слова, как животные и люди. Во время дыхания и фотосинтеза газы диффузно входят и выходят из растений через маленькие отверстия, называемые устьицами. Устьица расположены на нижней стороне листа. Каждый лист может содержать тысячи таких отверстий.
Так выглядят устьица под микроскопом
Все живые организмы дышат, потому что им нужно получать кислород для осуществления клеточного дыхания, чтобы остаться в живых. Так же и растения должны дышать, чтобы остаться в живых.
Однако, в общем и целом у растений объем выброса кислорода намного превышает объем его поглощения при фотодыхании. За солнечный день один гектар леса выделяет 180-200 кг кислорода, поглощая 120-280 кг углекислого газа.
Газообмен растений в зависимости от освещенности
В зависимости от количества солнечного света растения могут выделять или поглощать кислород и углекислый газ следующим образом.
Темно – имеет место только дыхание. Кислород расходуется, а углекислый газ выделяется.
Тусклый солнечный свет – скорость фотосинтеза равна «частоте» дыхания. Растение потребляет на дыхание весь кислород, который генерирует фотосинтез. В результате газообмен с окружающей средой не происходит.
Яркий солнечный свет – при фотосинтезе используется углекислый газ, и кислорода освобождается намного больше, чем расходуется на дыхание. Лишний кислород выделяется в атмосферу. В дневное время фотосинтез производит кислород и глюкозу быстрее, чем дыхание потребляет его. Фотосинтез также использует углекислый газ быстрее, чем его производит дыхание. Избыток кислорода выделяется в атмосферу, углекислый газ забирается из воздуха, а неиспользованная глюкоза связывается в крахмал, который откладывается в растении для хранения и последующего использования.
С4-фотосинтез
Проблема фотодыхания преодолевается в растениях C4 с помощью двухэтапной стратегии, которая поддерживает высокий уровень CO2 и низкий уровень O2 в хлоропластах, где работает цикл Кальвина. Эта стратегия служит для предотвращения фотодыхания.
Сахарный тростник является лидером в сфере фотосинтеза в нормальных условиях произрастания и является ярким примером растения, использующего фотосинтез C4.
Растения С4 почти никогда не насыщаются светом, а в жарких и сухих условиях значительно превосходят растения С3 по скорости синтеза органических веществ. Они используют двухстадийный процесс, в котором СО2 фиксируется в тонкостенных клетках мезофилла с образованием 4-углеродного промежуточного соединения, обычно малата (яблочной кислоты). 4-углеродная кислота активно перекачивается через клеточную мембрану в толстостенную оболочку, где она расщепляется на CO2 и 3-углеродное соединение.
Этот CO2 затем вступает в цикл Кальвина и вырабатывает G3P, а затем углеводы, которые попадают в клеточную систему обмена энергии.
Преимущество этого двухстадийного процесса состоит в том, что активная закачка углерода в ячейку оболочки пучка и блокирование кислорода создают окружающую среду с 10-120-кратным количеством СО2, доступным для цикла Кальвина, и рубиско оптимально используется, не переходя на связывание кислорода. Высокая концентрация CO2 и отсутствие кислорода означает, что система никогда не испытывает негативных эффектов фотодыхания.
Недостатком фотосинтеза С4 является расход дополнительной энергии АТФ, которая идет на превращение 4-углеродных кислот в 3-углеродные соединения, и обратно. Эта потеря энергии объясняет, почему растения C3 всегда будут превосходить растения C4 по производительности, если им будет достаточно воды и солнца.
Небольшой процент растений С4 включает в себя многие тропические травы и осоки, а также важные продовольственные культуры:
- Кукурузу
- Сорго
- Сахарный тростник
- Просо
Значение фотосинтеза в природе
Растения жизненно важны для существования человека и других животных. Без фотосинтеза у нас не было бы ни кислорода, ни пищи, чтобы элементарно оставаться в живых.
Без фотосинтеза у нас не было бы ни кислорода, ни пищи, чтобы элементарно оставаться в живых.
Жизнь на нашей планете поддерживается в основном благодаря фотосинтезу водорослями и наземными растениями. Это связано с их способностью синтезировать органическое вещество из неорганических веществ почвы, воды и атмосферного углекислого газа, с использованием солнечного света.
Также можем рассматривать растения (наземные и водные) как глобальную фабрику кислорода, который они выбрасывают в виде отходов фотосинтеза, когда производят для себя сахар и прочие углеводы, используя воду с углекислым газом в качестве сырья, а свет – источника энергии.
Хемосинтез
Фотосинтез происходит на суше и на мелководье, где доступен солнечный свет. Но образование моноуглеводов из углекислого газа и воды возможно и без солнечной энергии. И такую возможность используют бактерии.
Хемосинтез – это процесс, при котором пища (глюкоза) производится с использованием химических веществ (вместо солнечного света) в качестве источника энергии. Хемосинтез происходит вокруг гидротермальных источников и метановых утечек в глубоком море, и других теплых местах, где отсутствует солнечный свет.
Хемосинтез происходит вокруг гидротермальных источников и метановых утечек в глубоком море, и других теплых местах, где отсутствует солнечный свет.
Во время хемосинтеза бактерии, живущие на морском дне или внутри животных, используют энергию, запасенную в химических связях сероводорода и метана, для получения глюкозы из воды и углекислого газа (растворенного в морской воде). Как побочные продукты хемосинтеза образуются сера и соединения серы.
Оба процесса, фотосинтез и хемосинтез, сводятся к образованию молекул глюкозы и других простых углеводов из СО2 и Н2О. Но у этих процессов разные источники энергии и побочные продукты (отходы). И это определяет значение растений и бактерий в природе.
Читайте также:
Исследование выявило отличие в мозге убийц
Новое исследование делает существенный шаг вперед в нейро-криминологии, обнаружив, что мозг людей, виновных в убийстве, заметно отличается от мозга других преступников.
Фотосинтез и его фазы (световая и темновая).
 Что происходит в световой фазе фотосинтеза? Световая стадия фотосинтеза
Что происходит в световой фазе фотосинтеза? Световая стадия фотосинтеза
С использованием световой энергии или без нее. Он характерен для растений. Рассмотрим далее, что собой представляют темновая и световая фаза фотосинтеза.
Общие сведения
Органом фотосинтеза у высших растений является лист. В качестве органоидов выступают хлоропласты. В мембранах их тилакоидов присутствуют фотосинтетические пигменты. Ими являются каротиноиды и хлорофиллы. Последние существуют в нескольких видах (а, с, b, d). Главным из них считается а-хлорофилл. В его молекуле выделяется порфириновая «головка» с атомом магния, расположенным в центре, а также фитольный «хвост». Первый элемент представлен в виде плоской структуры. «Головка» является гидрофильной, поэтому располагается на той части мембраны, которая направлена к водной среде. Фитольный «хвост» является гидрофобным. За счет этого он удерживает хлорофилльную молекулу в мембране. Хлорофиллами поглощается сине-фиолетовый и красный свет. Они также отражают зеленый, за счет чего растения имеют характерный для них цвет. В мембранах тилактоидов молекулы хлорофилла организованы в фотосистемы. Для синезеленых водорослей и растений характерны системы 1 и 2. Фотосинтезирующие бактерии имеют только первую. Вторая система может разлагать Н 2 О, выделять кислород.
Они также отражают зеленый, за счет чего растения имеют характерный для них цвет. В мембранах тилактоидов молекулы хлорофилла организованы в фотосистемы. Для синезеленых водорослей и растений характерны системы 1 и 2. Фотосинтезирующие бактерии имеют только первую. Вторая система может разлагать Н 2 О, выделять кислород.
Световая фаза фотосинтеза
Процессы, происходящие в растениях, отличаются сложностью и многоступенчатостью. В частности, выделяют две группы реакций. Ими являются темновая и световая фаза фотосинтеза. Последняя протекает при участии фермента АТФ, белков, переносящих электроны, и хлорофилла. Световая фаза фотосинтеза происходит в мембранах тилактоидов. Хлорофилльные электроны возбуждаются и покидают молекулу. После этого они попадают на внешнюю поверхность мембраны тилактоида. Она, в свою очередь, заряжается отрицательно. После окисления начинается восстановление молекул хлорофилла. Они отбирают электроны у воды, которая присутствует во внутрилакоидном пространстве. Таким образом, световая фаза фотосинтеза протекает в мембране при распаде (фотолизе): Н 2 О + Q света → Н + + ОН —
Таким образом, световая фаза фотосинтеза протекает в мембране при распаде (фотолизе): Н 2 О + Q света → Н + + ОН —
Ионы гидроксила превращаются в реакционноспособные радикалы, отдавая свои электроны:
ОН — → .ОН + е —
ОН-радикалы объединяются и образуют свободный кислород и воду:
4НО. → 2Н 2 О + О 2 .
При этом кислород удаляется в окружающую (внешнюю) среду, а внутри тилактоида идет накопление протонов в особом «резервуаре». В результате там, где протекает световая фаза фотосинтеза, мембрана тилактоида за счет Н + с одной стороны получает положительный заряд. Вместе с этим за счет электронов она заряжается отрицательно.
Фосфирилирование АДФ
Там, где протекает световая фаза фотосинтеза, присутствует разность потенциалов между внутренней и наружной поверхностями мембраны. Когда она достигает 200 мВ, начинается проталкивание протонов сквозь каналы АТФ-синтетазы. Таким образом, световая фаза фотосинтеза происходит в мембране при фосфорилировании АДФ до АТФ. При этом атомарный водород направляется на восстановление особого переносчика никотинамидадениндинуклеотидфосфата НАДФ+ до НАДФ.Н2:
При этом атомарный водород направляется на восстановление особого переносчика никотинамидадениндинуклеотидфосфата НАДФ+ до НАДФ.Н2:
2Н + + 2е — + НАДФ → НАДФ.Н 2
Световая фаза фотосинтеза, таким образом, включает в себя фотолиз воды. Его, в свою очередь, сопровождают три важнейших реакции:
- Синтез АТФ.
- Образование НАДФ.Н 2 .
- Формирование кислорода.
Световая фаза фотосинтеза сопровождается выделением последнего в атмосферу. НАДФ.Н2 и АТФ перемещаются в строму хлоропласта. На этом световая фаза фотосинтеза завершается.
Другая группа реакций
Для темновой фазы фотосинтеза не нужна световая энергия. Она идет в строме хлоропласта. Реакции представлены в виде цепочки последовательно происходящих преобразований поступающего из воздуха углекислого газа. В итоге образуются глюкоза и прочие органические вещества. Первой реакцией является фиксация. В качестве акцептора углекислого газа выступает рибулозобифосфат (пятиуглеродный сахар) РиБФ. Катализатором в реакции является рибулозобифосфат-карбоксилаза (фермент). В результате карбоксилирования РиБФ формируется шестиуглеродное неустойчивое соединение. Оно практически мгновенно распадается на две молекулы ФГК (фосфоглицериновой кислоты). После этого идет цикл реакций, где она через несколько промежуточных продуктов трансформируется в глюкозу. В них используются энергии НАДФ.Н 2 и АТФ, которые были преобразованы, когда шла световая фаза фотосинтеза. Цикл указанных реакций именуется «циклом Кальвина». Его можно представить следующим образом:
Катализатором в реакции является рибулозобифосфат-карбоксилаза (фермент). В результате карбоксилирования РиБФ формируется шестиуглеродное неустойчивое соединение. Оно практически мгновенно распадается на две молекулы ФГК (фосфоглицериновой кислоты). После этого идет цикл реакций, где она через несколько промежуточных продуктов трансформируется в глюкозу. В них используются энергии НАДФ.Н 2 и АТФ, которые были преобразованы, когда шла световая фаза фотосинтеза. Цикл указанных реакций именуется «циклом Кальвина». Его можно представить следующим образом:
6СО 2 + 24Н+ + АТФ → С 6 Н 12 О 6 + 6Н 2 О
Помимо глюкозы, в ходе фотосинтеза образуются прочие мономеры органических (сложных) соединений. К ним, в частности, относят жирные кислоты, глицерин, аминокислоты нуклеотиды.
С3-реакции
Они представляют собой тип фотосинтеза, при котором в качестве первого продукта образуются трехуглеродные соединения. Именно он описан выше как цикл Кальвина. В качестве характерных особенностей С3-фотосинтеза выступают:
- РиБФ является акцептором для углекислого газа.
- Реакция карбоксилирования катализирует РиБФ-карбоксилаза.
- Образуется шестиуглеродное вещество, которое впоследствии распадается на 2 ФГК.
Фосфоглицериновая кислота восстанавливается до ТФ (триозофосфатов). Часть из них направляется на регенерацию рибулозобифосфата, а остальная — превращается в глюкозу.
С4-реакции
Для этого типа фотосинтеза характерно появление четырехуглеродных соединений в качестве первого продукта. В 1965 году было выявлено, что С4-вещества появляются первыми у некоторых растений. Например, это было установлено для проса, сорго, сахарного тростника, кукурузы. Эти культуры стали именовать С4-растениями. В следующем, 1966-м, Слэк и Хэтч (австралийские ученые) выявили, что у них почти полностью отсутствует фотодыхание. Также было установлено, что такие С4 растения намного эффективнее осуществляют поглощение углекислого газа. В результате путь трансформации углерода в таких культурах стали именовать путем Хэтча-Слэка.
Заключение
Значение фотосинтеза очень велико. Благодаря ему из атмосферы ежегодно поглощается углекислый газ в огромных объемах (миллиардами тонн). Вместо него выделяется не меньшее количество кислорода. Фотосинтез выступает в качестве основного источника формирования органических соединений. Кислород участвует в образовании озонового слоя, обеспечивающего защиту живых организмов от воздействия коротковолновой УФ-радиации. В процессе фотосинтеза лист поглощает только 1% всей энергии света, падающего на него. Его продуктивность находится в пределах 1 г органического соединения на 1 кв. м поверхности за час.
Как понятно из названия, фотосинтез по своей сути являет собой природный синтез органических веществ, превращая СО2 из атмосферы и воду в глюкозу и свободный кислород.
При этом необходимо наличие энергии солнечного света.
Химическое уравнение процесса фотосинтеза в общем можно представить в следующем виде:
Фотосинтез имеет две фазы: темную и световую. Химические реакции темной фазы фотосинтеза существенно отличаются от реакций световой фазы, однако темная и световая фаза фотосинтеза зависят друг от друга.
Световая фаза может происходить в листьях растений исключительно при солнечном свете. Для темной же необходимо наличие углекислого газа, именно поэтому растение все время должно поглощать его из атмосферы. Все сравнительные характеристики темной и световой фаз фотосинтеза будут предоставлены ниже. Для этого была создана сравнительная таблица «Фазы фотосинтеза».
Световая фаза фотосинтеза
Основные процессы в световой фазе фотосинтеза происходят в мембранах тилакоидов. В ней участвуют хлорофилл, белки-переносчики электронов, АТФ-синтетаза (фермент, ускоряющий реацию) и солнечный свет.
Далее механизм реакции можно описать так: когда солнечный свет попадает на зеленые листья растений, в их структуре возбуждаются электроны хлорофилла (заряд отрицательный), которые перейдя в активное состояние, покидают молекулу пигмента и оказываются на внешней стороне тилакоида, мембрана которого заряжена также отрицательно. В то же время молекулы хлорофилла окисляются и уже окисленные они восстанавливаются, отбирая таким образом электроны у воды, которая находится в структуре листа.
Этот процесс приводит к тому, что молекулы воды распадаются, а созданные в результате фотолиза воды ионы, отдают свои электроны и превращаются в такие радикалы ОН, которые способны проводить дальнейшие реакции. Далее эти реакционноспособные радикалы ОН объединяются, создавая полноценные молекулы воды и кислород. При этом свободный кислород выходит во внешнюю среду.
В результате всех этих реакций и превращений, мембрана тилакоида листа с одной стороны заряжается положительно (за счет иона Н+), а с другой — отрицательно (за счет электронов). Когда разность между этими зарядами в двух сторонах мембраны достигает больше 200 мВ, протоны проходят через специальные каналы фермента АТФ-синтетазы и за счет этого происходит превращение АДФ до АТФ (в результате процесса фосфорилизации). А атомный водород, который освобождается из воды, восстанавливает специфический переносчик НАДФ+ до НАДФ·Н2. Как видим, в результате световой фазы фотосинтеза происходит три основных процесса:
- синтез АТФ;
- создание НАДФ·Н2;
- образование свободного кислорода.
Последний освобождается в атмосферу, а НАДФ·Н2 и АТФ берут участие в темной фазе фотосинтеза.
Темная фаза фотосинтеза
Темная и световая фазы фотосинтеза характеризуются большими затратами энергии со стороны растения, однако темная фаза протекает быстрее и требует меньше энергии. Для реакций темной фазы не нужен солнечный свет, поэтому они могут происходить и днем и ночью.
Все основные процессы этой фазы протекают в строме хлоропласта растения и являют собой своеобразную цепочку последовательных превращений углекислого газа из атмосферы. Первая реакция в такой цепи – фиксация углекислого газа. Чтобы она проходила более плавно и быстрее, природой был предусмотрен фермент РиБФ-карбоксилаза, который катализирует фиксацию СО2.
Далее происходит целый цикл реакций, завершением которого является преобразование фосфоглицериновой кислоты в глюкозу (природный сахар). Все эти реакции используют энергию АТФ и НАДФ Н2, которые были созданы в световой фазе фотосинтеза. Помимо глюкозы в результате фотосинтеза образуются также и другие вещества. Среди них разные аминокислоты, жирные кислоты, глицерин, а также нуклеотиды.
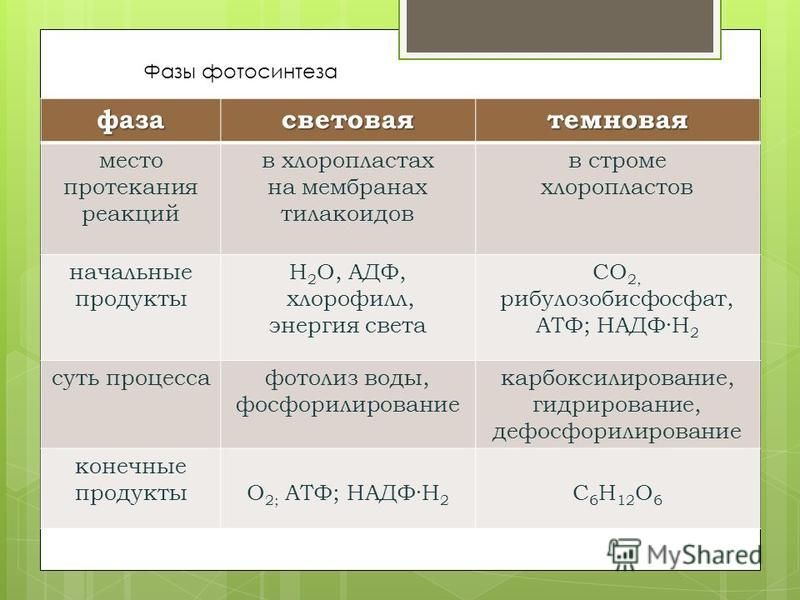
Фазы фотосинтеза: таблица сравнений
| Критерии сравнения | Световая фаза | Темная фаза |
| Солнечный свет | Обязателен | Необязателен |
| Место протекание реакций | Граны хлоропласта | Строма хлоропласта |
| Зависимость от источника энергии | Зависит от солнечного света | Зависит от АТФ и НАДФ Н2, образованных в световой фазе и от количества СО2 из атмосферы |
| Исходные вещества | Хлорофилл, белки-переносчики электронов, АТФ-синтетаза | Углекислый газ |
| Суть фазы и что образуется | Выделяется свободный О2, образуется АТФ и НАДФ Н2 | Образование природного сахара (глюкозы) и поглощение СО2 из атмосферы |
Фотосинтез — видео
Более точно: в темновую фазу происходит связывание углекислого газа (CO 2).
Процесс этот многоступенчатый, в природе существуют два основных пути: C 3 -фотосинтез и C 4 -фотосинтез. Латинская буква C
обозначает атом углерода, цифра после нее — количество атомов углерода в первичном органическом продукте темновой фазы фотосинтеза. Так в случае C 3 -пути первичным продуктом считается трехуглеродная фосфоглицериновая кислота, обозначаемая как ФГК. В случае C 4 -пути первым органическим веществом при связывание углекислого газа является четырехуглеродная щавелевоуксусная кислота (оксалоацетат).
C 3 -фотосинтез также называется циклом Кальвина в честь изучившего его ученого. C 4 -фотосинтез включает в себя цикл Кальвина, однако состоит не только из него и называется циклом Хэтча-Слэка. В умеренных широтах обычны C 3 -растения, в тропических — C 4 .
Темновые реакции фотосинтеза протекают в строме хлоропласта .
Цикл Кальвина
Первой реакцией цикла Кальвина является карбоксилирование рибулозо-1,5-бифосфата (РиБФ).
Карбоксилирование
— это присоединение молекулы CO 2 , в результате чего образуется карбоксильная группа -COOH. РиБФ — это рибоза (пятиуглеродный сахар), у которой к концевым атомам углерода присоединены фосфатные группы (образуемые фосфорной кислотой):
Химическая формула РиБФ
Реакция катализируется ферментом рибулозо-1,5-бифосфат-карбоксилаза-оксигеназа (РуБисКО
). Он может катализировать не только связывание углекислого газа, но и кислорода, о чем говорит слово «оксигеназа» в его названии. Если РуБисКО катализирует реакцию присоединения кислорода к субстрату, то темновая фаза фотосинтеза идет уже не по пути цикла Кальвина, а по пути фотодыхания
, что в принципе является вредным для растения.
Катализ реакции присоединения CO 2 к РиБФ происходит в несколько шагов. В результате образуется неустойчивое шестиуглеродное органическое соединение, которое тут же распадается на две трехуглеродные молекулы фосфоглицериновой кислоты
(ФГК).
Химическая формула фосфоглицериновой кислоты
Далее ФГК за несколько ферментативных реакций, протекающих с затратой энергии АТФ и восстановительной силы НАДФ·H 2 , превращается в фосфоглицериновый альдегид (ФГА), также называемый триозофосфатом
.
Меньшая часть ФГА выходит из цикла Кальвина и используется для синтеза более сложных органических веществ, например глюкозы. Она, в свою очередь, может полимеризоваться до крахмала. Другие вещества (аминокислоты, жирные кислоты) образуются при участии различных исходных веществ. Такие реакции наблюдаются не только в растительных клетках. Поэтому, если рассматривать фотосинтез как уникальное явление содержащих хлорофилл клеток, то он заканчивается синтезом ФГА, а не глюкозы.
Большая часть молекул ФГА остается в цикле Кальвина. С ним происходит ряд превращений, в результате которых ФГА превращается в РиБФ. При этом также используется энергия АТФ. Таким образом, РиБФ регенерируется для связывания новых молекул углекислого газа.
Цикл Хэтча-Слэка
У многих растений жарких мест обитания темновая фаза фотосинтеза несколько сложнее. В процессе эволюции C 4 -фотосинтез возник как более эффективный способ связывания углекислого газа, когда в атмосфере возросло количество кислорода, и РуБисКО стал тратиться на неэффективное фотодыхание.
У C 4 -растений существует два типа фотосинтезирующих клеток. В хлоропластах мезофилла листьев происходит световая фаза фотосинтеза и часть темновой, а именно связывание CO 2 с фосфоенолпируватом
(ФЕП). В результате образуется четырехуглеродная органическая кислота. Далее эта кислота транспортируется в хлоропласты клеток обкладки проводящего пучка. Здесь от нее ферментативно отщепляется молекула CO 2 , которая далее поступает в цикл Кальвина. Оставшаяся после декарбоксилирования трехуглеродная кислота — пировиноградная
— возвращается в клетки мезофилла, где снова превращается в ФЕП.
Хотя цикл Хэтча-Слэка более энергозатратный вариант темновой фазы фотосинтеза, но фермент связывающий CO 2 и ФЕП более эффективный катализатор, чем РуБисКО. Кроме того, он не вступает в реакцию с кислородом. Транспорт CO 2 с помощью органической кислоты в более глубоколежащие клетки, к которым затруднен приток кислорода, приводит к тому, что концентрация углекислого газа здесь увеличивается, и РуБисКО почти не расходуется на связывание молекулярного кислорода.
Фотосинтез
— синтез органических соединений из неорганических за счет энергии света (hv). Суммарное уравнение фотосинтеза:
6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2
Фотосинтез протекает при участии фотосинтезирующих пигментов, обладающих уникальным свойством преобразования энергии солнечного света в энергию химической связи в виде АТФ. Фотосинтезирующие пигменты представляют собой белковоподобные вещества. Наиболее важный из них — пигмент хлорофилл. У эукариот фотосинтезирующие пигменты встроены во внутреннюю мембрану пластид, у прокариот — во впячивания цитоплазматической мембраны.
Строение хлоропласта очень похоже на строение митохондрии. Во внутренней мембране тилакоидов граны содержатся фотосинтетические пигменты, а также белки цепи переноса электронов и молекулы фермента АТФ-синтетазы.
Процесс фотосинтеза состоит из двух фаз: световой и темновой.
Световая фаза
фотосинтеза протекает только на свету в мембране тилакоидов граны. В этой фазе происходит поглощение хлорофиллом квантов света, образование молекулы АТФ и фотолиз воды.
Под действием кванта света (hv) хлорофилл теряет электроны, переходя в возбужденное состояние:
Хл → Хл + e —
Эти электроны передаются переносчиками на наружную, т.е. обращенную к матриксу поверхность мембраны тилакоидов, где накапливаются.
Одновременно внутри тилакоидов происходит фотолиз воды, т.е. ее разложение под действием света
2H 2 O → O 2 +4H + + 4e —
Образующиеся электроны передаются переносчиками к молекулам хлорофилла и восстанавливают их: молекулы хлорофилла возвращаются в стабильное состояние.
Протоны водорода, образовавшиеся при фотолизе воды, накапливаются внутри тилакоида, создавая Н + -резервуар. В результате внутренняя поверхность мембраны тилакоида заряжается положительно (за счет Н +), а наружная — отрицательно (за счет e —). По мере накопления по обе стороны мембраны противоположно заряженных частиц нарастает разность потенциалов. При достижении критической величины разности потенциалов сила электрического поля начинает проталкивать протоны через канал АТФ-синтетазы. Выделяющаяся при этом энергия используется для фосфорилирования молекул АДФ:
АДФ + Ф → АТФ
Образование АТФ в процессе фотосинтеза под действием энергии света называются фотофосфорилированием
.
Ионы водорода, оказавшись на наружной поверхности мембраны тилакоида, встречаются там с электронами и образуют атомарный водород, который связывается с молекулой-переносчиком водорода НАДФ (никотинамидадениндинуклеотидфосфат):
2H + + 4e — + НАДФ + → НАДФ H 2
Таким образом, во время световой фазы фотосинтеза происходят три процесса: образование кислорода вследствие разложения воды, синтез АТФ, образование атомов водорода в форме НАДФ H 2 . Кислород диффундирует в атмосферу, АТФ и НАДФ H 2 участвуют в процессах темновой фазы.
Темновая фаза
фотосинтеза протекает в матриксе хлоропласта как на свету, так и в темноте и представляет собой ряд последовательных преобразований CO 2 , поступающего из воздуха, в цикле Кальвина. Осуществляются реакции темновой фазы за счет энергии АТФ. В цикле Кальвина CO 2 связывается с водородом из НАДФ H 2 с образованием глюкозы.
В процессе фотосинтеза кроме моносахаридов (глюкоза и др.) синтезируются мономеры других органических соединений — аминокислоты, глицерин и жирные кислоты. Таким образом, благодаря фотосинтезу растения обеспечивают себя и все живое на Земле необходимыми органическими веществами и кислородом.
Сравнительная характеристика фотосинтеза и дыхания эукариот приведена в таблице:
| Признак | Фотосинтез | Дыхание |
|---|---|---|
| Уравнение реакции | 6CO 2 + 6H 2 O + Энергия света → C 6 H 12 O 6 + 6O 2 | C 6 H 12 O 6 + 6O 2 → 6H 2 O + Энергия (АТФ) |
| Исходные вещества | Углекислый газ, вода | |
| Продукты реакции | Органические вещества, кислород | Углекислый газ, вода |
| Значение в круговороте веществ | Синтез органических веществ из неорганических | Разложение органических веществ до неорганических |
| Превращение энергии | Превращение энергии света в энергию химических связей органических веществ | Превращение энергии химических связей органических веществ в энергию макроэргических связей АТФ |
| Важнейшие этапы | Световая и темновая фаза (включая цикл Кальвина) | Неполное окисление (гликолиз) и полное окисление (включая цикл Кребса) |
| Место протекания процесса | Хлоропласта | Гиалоплазма (неполное окисление) и митохондрии (полное окисление) |
Каждое живое существо на планете нуждается в пище или энергии, чтобы выжить. Некоторые организмы питаются другими существами, тогда как другие могут производить свои собственные питательные элементы. сами производят продукты питания, глюкозу, в процессе, который называется фотосинтезом.
Фотосинтез и дыхание взаимосвязаны. Результатом фотосинтеза является глюкоза, которая хранится как химическая энергия в . Эта накопленная химическая энергия получается в результате превращения неорганического углерода (углекислого газа) в органический углерод. Процесс дыхания высвобождает накопленную химическую энергию.
Помимо продуктов, которые они производят, растениям также необходим углерод, водород и кислород, чтобы выжить. Вода, поглощенная из почвы, обеспечивает водород и кислород. Во время фотосинтеза, углерод и вода используются для синтеза пищи. Растения также нуждаются в нитратах, чтобы производить аминокислоты (аминокислота — ингредиент для выработки белка). В дополнение к этому, они нуждаются в магнии для производства хлорофилла.
Заметка:
Живые существа, которые зависят от других продуктов питания называются . Травоядные, такие как коровы, а также растения, питающиеся насекомыми, являются примерами гетеротрофов. Живые существа, производящие собственную пищу, называются . Зеленые растения и водоросли — примеры автотрофов.
В этой статье вы узнаете больше о том, как происходит фотосинтез у растений и об необходимы для этого процесса условиях.
Определение фотосинтеза
Фотосинтез — это химический процесс, посредством которого растения, некоторые и водоросли производят глюкозу и кислород из углекислого газа и воды, используя только свет в качестве источника энергии.
Этот процесс чрезвычайно важен для жизни на Земле, поскольку благодаря ему выделяется кислород, от которого зависит вся жизнь.
Зачем растениям нужна глюкоза (пища)?
Подобно людям и другим живым существам, растения также нуждаются в питании для поддержания жизнедеятельности. Значение глюкозы для растений заключается в следующем:
- Глюкоза, полученная в результате фотосинтеза, используется во время дыхания для высвобождения энергии, необходимой растению для других жизненно важных процессов.
- Растительные клетки также превращают часть глюкозы в крахмал, который используют по мере необходимости. По этой причине мертвые растения используются в качестве биомассы, ведь в них хранится химическая энергия.
- Глюкоза также необходима, чтобы производить другие химические вещества, такие как белки, жиры и растительные сахара, необходимые для обеспечения роста и других важных процессов.
Фазы фотосинтеза
Процесс фотосинтеза разделен на две фазы: световую и темновую.
Световая фаза фотосинтеза
Как следует из названия, световые фазы нуждаются в солнечном свете. В светозависимых реакциях энергия солнечного света поглощается хлорофиллом и преобразуется в запасенную химическую энергию в виде молекулы электронного носителя НАДФН (никотинамидадениндинуклеотидфосфат) и молекулы энергии АТФ (аденозинтрифосфат). Световые фазы протекают в тилакоидных мембранах в пределах хлоропласта.
Темновая фаза фотосинтеза или цикл Кальвина
В темновой фазе или цикле Кальвина возбужденные электроны из световой фазы обеспечивают энергию для образования углеводов из молекул углекислого газа. Не зависящие от света фазы иногда называют циклом Кальвина из-за цикличности процесса.
Хотя темновые фазы не используют свет в качестве реагента (и, как результат, могут происходить днем или ночью), им необходимо, чтобы продукты светозависимых реакций функционировали. Независимые от света молекулы зависят от молекул энергоносителей — АТФ и НАДФН — для создания новых молекул углеводов. После передачи энергии молекулы энергоносители возвращаются к световым фазам для получения более энергичных электронов. Кроме того, несколько ферментов темновой фазы активируются с помощью света.
Схема фаз фотосинтеза
Заметка:
Это означает, что темновые фазы не будут продолжаться, если растения будут лишены света слишком долго, так как они используют продукты световых фаз.
Строение листьев растений
Мы не можем полностью изучить фотосинтез, не зная больше о строении листа. Лист адаптирован для того, чтобы играть жизненно важную роль в процессе фотосинтеза.
Внешнее строение листьев
Одной из самых главных особенностей растений является большая площадь поверхности листьев. Большинство зеленых растений имеют широкие, плоские и открытые листья, которые способны захватывать столько солнечной энергии (солнечного света), сколько необходимо для фотосинтеза.
- Центральная жилка и черешок
Центральная жилка и черешок соединяются вместе и являются основанием листа. Черешок располагает лист таким образом, чтобы он получал как можно больше света.
- Листовая пластинка
Простые листья имеют одну листовую пластину, а сложные — несколько. Листовая пластинка — одна из самых главных составляющих листа, которая непосредственно участвует в процессе фотосинтеза.
Сеть жилок в листьях переносит воду от стеблей к листьям. Выделяемая глюкоза также направляется в другие части растения из листьев через жилки. Кроме того, эти части листа поддерживают и удерживают листовую пластину плоской для большего захвата солнечного света. Расположение жилок (жилкование) зависит от вида растения.
- Основание листа
Основанием листа выступает самая нижняя его часть, которая сочленена со стеблем. Зачастую, у основания листа располагается парное количество прилистников.
В зависимости от вида растения, край листа может иметь различную форму, включая: цельнокрайнюю, зубчатую, пильчатую, выемчатую, городчатую и т.п.
- Верхушка листа
Как и край листа, верхушка бывает различной формы, включая: острую, округлую, туповатую, вытянутую, оттянутою и т.д.
Внутреннее строение листьев
Ниже представлена близкая схема внутреннего строения тканей листьев:
Кутикула выступает главным, защитным слоем на поверхности растения. Как правило, она толще на верхней части листа. Кутикула покрыта веществом, похожим на воск, благодаря которому защищает растение от воды.
Эпидермис — слой клеток, который является покровной тканью листа. Его главная функция — защита внутренних тканей листа от обезвоживания, механических повреждений и инфекций. Он также регулирует процесс газообмена и транспирации.
Мезофилл — это основная ткань растения. Здесь происходит процесс фотосинтеза. У большинства растений мезофилл разделен на два слоя: верхний — палисадный и нижний — губчатый.
- Защитные клетки
Защитные клетки — специализированные клетки в эпидермисе листьев, которые используются для контроля газообмена. Они выполняют защитную функцию для устьица. Устьичные поры становятся большими, когда вода есть в свободном доступе, в противном случае, защитные клетки становятся вялыми.
Фотосинтез зависит от проникновения углекислого газа (CO2) из воздуха через устьица в ткани мезофилла. Кислород (O2), полученный как побочный продукт фотосинтеза, выходит из растения через устьица. Когда устьица открытые, вода теряется в результате испарения и должна быть восполнена через поток транспирации, водой, поглощенной корнями. Растения вынуждены уравновешивать количество поглощенного СО2 из воздуха и потерю воды через устьичные поры.
Условия, необходимые для фотосинтеза
Ниже приведены условия, которые необходимы растениям для осуществления процесса фотосинтеза:
- Углекислый газ.
Бесцветный природный газ без запаха, обнаруженный в воздухе и имеет научное обозначение CO2. Он образуется при горении углерода и органических соединений, а также возникает в процессе дыхания. - Вода
. Прозрачное жидкое химическое вещество без запаха и вкуса (в нормальных условиях). - Свет.
Хотя искусственный свет также подходит для растений, естественный солнечный свет, как правило, создает лучшие условия для фотосинтеза, потому что в нем присутствует природное ультрафиолетовое излучение, которое оказывает положительное влияние на растения. - Хлорофилл.
Это зеленый пигмент, найденный в листьях растений. - Питательные вещества и минералы.
Химические вещества и органические соединения, которые корни растений поглощают из почвы.
Что образуется в результате фотосинтеза?
- Глюкоза;
- Кислород.
(Световая энергия показана в скобках, поскольку она не является веществом)
Заметка:
Растения получают CO2 из воздуха через их листья, и воду из почвы через корни. Световая энергия исходит от Солнца. Полученный кислород выделяется в воздух из листьев. Получаемую глюкозу можно превратить в другие вещества, такие как крахмал, который используется как запас энергии.
Если факторы, способствующие фотосинтезу, отсутствуют или присутствуют в недостаточном количестве, это может негативно повлиять на растение. Например, меньшее количество света создает благоприятные условия для насекомых, которые едят листья растения, а недостаток воды замедляет.
Где происходит фотосинтез?
Фотосинтез происходит внутри растительных клеток, в мелких пластидах, называемых хлоропластами. Хлоропласты (в основном встречающиеся в слое мезофилла) содержат зеленое вещество, называемое хлорофиллом. Ниже приведены другие части клетки, которые работают с хлоропластом, чтобы осуществить фотосинтез.
Строение растительной клетки
Функции частей растительной клетки
- :
обеспечивает структурную и механическую поддержку, защищает клетки от , фиксирует и определяет форму клетки, контролирует скорость и направление роста, а также придает форму растениям. - :
обеспечивает платформу для большинства химических процессов, контролируемых ферментами. - :
действует как барьер, контролируя движение веществ в клетку и из нее. - :
как было описано выше, они содержат хлорофилл, зеленое вещество, которое поглощает световую энергию в процессе фотосинтеза. - :
полость внутри клеточной цитоплазмы, которая накапливает воду. - :
содержит генетическую марку (ДНК), которая контролирует деятельность клетки.
Хлорофилл поглощает световую энергию, необходимую для фотосинтеза. Важно отметить, что поглощаются не все цветовые длины волны света. Растения в основном поглощают красную и синюю волны — они не поглощают свет в зеленом диапазоне.
Углекислый газ в процессе фотосинтеза
Растения получают углекислый газ из воздуха через их листья. Углекислый газ просачивается через маленькое отверстие в нижней части листа — устьицу.
Нижняя часть листа имеет свободно расположенные клетки, чтобы углекислый газ достиг других клеток в листьях. Это также позволяет кислороду, образующемуся при фотосинтезе, легко покидать лист.
Углекислый газ присутствует в воздухе, которым мы дышим, в очень низких концентрациях и служит необходимым фактором темновой фазы фотосинтеза.
Свет в процессе фотосинтеза
Лист обычно имеет большую площадь поверхности, поэтому он может поглощать много света. Его верхняя поверхность защищена от потери воды, болезней и воздействия погоды восковым слоем (кутикулой). Верх листа находится там, где падает свет. Этот слой мезофилла называется палисадным. Он приспособлен для поглощения большого количества света, ведь в нем находится много хлоропластов.
В световых фазах, процесс фотосинтеза увеличивается с большим количеством света. Больше молекул хлорофилла ионизируется, и больше генерируется АТФ и НАДФН, если световые фотоны сосредоточены на зеленом листе. Хотя свет чрезвычайно важен в световых фазах, необходимо отметить, что чрезмерное его количество может повредить хлорофилл, и уменьшить процесс фотосинтеза.
Световые фазы не слишком сильно зависят от температуры, воды или углекислого газа, хотя все они нужны для завершения процесса фотосинтеза.
Вода в процессе фотосинтеза
Растения получают воду, необходимую для фотосинтеза через свои корни. Они имеют корневые волоски, которые разрастаются в почве. Корни характеризуются большой площадью поверхности и тонкими стенками, что позволяет воде легко проходить сквозь них.
На изображении представлены растения и их клетки с достаточным количеством воды (слева) и ее нехваткой (справа).
Заметка:
Корневые клетки не содержат хлоропластов, поскольку они, как правило, находятся в темноте и не могут фотосинтезировать.
Если растение не впитывает достаточное количество воды, оно увядает. Без воды, растение будет не способно фотосинтезировать достаточно быстро, и может даже погибнуть.
Какое значение имеет вода для растений?
- Обеспечивает растворенными минералами, которые поддерживают здоровье растений;
- Является средой для транспортировки ;
- Поддерживает устойчивость и прямостояние;
- Охлаждает и насыщает влагой;
- Дает возможность проводить различные химические реакции в растительных клетках.
Значение фотосинтеза в природе
Биохимический процесс фотосинтеза использует энергию солнечного света для преобразования воды и углекислого газа в кислород и глюкозу. Глюкоза используется в качестве строительных блоков в растениях для роста тканей. Таким образом, фотосинтез — это способ, благодаря которому формируются корни, стебли, листья, цветы и плоды. Без процесса фотосинтеза растения не смогут расти или размножаться.
Из-за фотосинтетической способности, растения известны как продуценты и служат основой почти каждой пищевой цепи на Земле. (Водоросли являются эквивалентом растений в ). Вся пища, которую мы едим, происходит от организмов, являющихся фотосинтетиками. Мы питаемся этими растениями напрямую или едим животных, таких как коровы или свиньи, которые потребляют растительную пищу.
- Основа пищевой цепи
Внутри водных систем, растения и водоросли также составляют основу пищевой цепи. Водоросли служат пищей для , которые, в свою очередь, выступают источником питания для более крупных организмов. Без фотосинтеза в водной среде жизнь была бы невозможна.
- Удаление углекислого газа
Фотосинтез превращает углекислый газ в кислород. Во время фотосинтеза углекислый газ из атмосферы поступает в растение, а затем выделяется в виде кислорода. В сегодняшнем мире, где уровни двуокиси углерода растут ужасающими темпами, любой процесс, который устраняет углекислый газ из атмосферы, является экологически важным.
- Круговорот питательных веществ
Растения и другие фотосинтезирующие организмы играют жизненно важную роль в круговороте питательных веществ. Азот в воздухе фиксируется в растительных тканях и становится доступным для создания белков. Микроэлементы, находящиеся в почве, также могут быть включены в растительную ткань и стать доступными для травоядных животных, дальше по пищевой цепи.
- Фотосинтетическая зависимость
Фотосинтез зависит от интенсивности и качества света. На экваторе, где солнечный свет обилен весь год и вода не является ограничивающим фактором, растения имеют высокие темпы роста, и могут стать довольно большими. И наоборот, фотосинтез в более глубоких частях океана встречается реже, поскольку свет не проникает в эти слои, и в результате эта экосистема оказывается более бесплодной.
Биология| Фотосинтез: световая и темновая фаза
Жизнь на Земле возможна благодаря световой, главным образом, солнечной энергии. Эта энергия преобразуется в энергию химических связей органических веществ, образующихся в процессе фотосинтеза.
Фотосинтезом обладают все растения и некоторые прокариоты (фотосинтезирующие бактерии и сине зелёные водоросли). Такие организмы называются фототрофами. Энергию для фотосинтеза даёт свет, который улавливается особыми молекулами –фотосинтетическими пигментами. Поскольку при этом поглощается свет лишь определённой длины волны, часть световых волн не поглощается, а отражается. В зависимости от спектрального состава отражённого света пигменты приобретают окраску – зелёную, жёлтую, красную и др.
Различают три типа фотосинтетических пигментов – хлорофиллы, каротиноиды и фикобилины. Наиболее важным пигментом является хлорофилл. Основой является плоское порфириновое ядро, образованное четырьмя пиррольными кольцами, соединёнными между собой метиловыми мостиками, с атомом магния в центре. Имеются различные хлорофиллы типа- а. У высших растений, зелёных и эвгленовых водорослей имеется хлорофилл-В, который образуется из хлорофилла — А. Бурые и диатомовые водоросли вместо хлорофилла-в содержат хлорофилл-С, а красные водоросли – хлорофилл-Д. Другую группу пигментов образуют каротиноиды, имеющие окраску от жёлтой до красной. Они содержатся во всех окрашенных пластидах (хлоропластах, хромопластах) растений. Причём в зелёных частях растений хлорофилл маскирует каротиноиды, делая их незаметными до наступления холодов. Осенью зелёные пигменты разрушаются и каротиноиды становятся хорошо заметными. Каротиноиды синтезируют фототрофные бактерии и грибы. Фикобилины присутствуют у красных водорослей и цианобактерий.
Световая стадия фотосинтеза
Хлорофиллы и другие пигменты в хлоропластах образуют специфические светособирающие комплексы. Путём электромагнитного резонанса они передают собранную энергию на особые молекулы хлорофилла. Эти молекулы под действием энергии возбуждения отдают электроны молекулам других веществ – переносчикам, а затем отнимают электроны у белков и далее, от воды. Расщепление воды в процессе фотосинтеза называется фотолизом. Это происходит в полостях тилакоидов. Протоны через специальные каналы проходят в строму. При этом выделяется энергия, необходимая для синтеза АТФ:
2Н2О = 4е + 4Н+ + О2
АДФ + Ф = АТФ
Участие энергии света здесь является обязательным условием, поэтому данную стадию называют световой стадией. Кислород, образующийся как побочный продукт выводится наружу и используется клеткой для дыхания.
Темновая стадия фотосинтеза
Следующие реакции протекают в строме хлоропласта. Из углекислого газа и воды происходит образование моносахаридов. Сам по себе данный процесс противоречит законам термодинамики, но поскольку при этом участвуют молекулы АТФ, то за счёт этой энергии синтез глюкозы является реальным процессом. Позже, из её молекул создаются полисахариды – целлюлоза, крахмал и другие сложные органические молекулы. Суммарное уравнение фотосинтеза можно представить в следующем виде:
6СО2 + 6Н2О = С6Н12О6 + 6О2
Особенно много крахмала откладывается в хлоропластах днём при интенсивном течении фотосинтетических процессов, ночью же крахмал расщепляется до растворимых форм и используется растением.
Хотите более подробно разобраться в этой или другой теме по биологии? Записывайтесь на онлайн-уроки к автору этой статьи Владимиру Смирнову.
Статья является выдержкой из труда Владимира Смирнова «Генезис», любое копирование и использование материала обязательно с указанием авторства.
Также предлагаем посмотреть видеоурок о фотосинтезе от нашего ботаника Ирины:
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Фотосинтез. Темновая фаза
Автор статьи Чергинцев Д.А.
В предыдущей статье мы рассмотрели физиологические процессы, происходящие в листе в ходе так называемой световой фазы фотосинтеза, в которой при непосредственном участии квантов солнечного света происходит образование восстановленных соединений (NADPH+H+) и ATP. И ATP и NADPH+H+ будут в дальнейшем использованы в различных процессах и метаболических путях, в основном – при фиксации атмосферного СО2, а так же – в ассимиляции нитрата и аммония из почвы. На рисунке 1 схематично представлена связь между световой и темновой фазами фотосинтеза. Закаченные в тилакоид в точках сопряжения (цитохром b6/f комплекс и марганцевый кластер) протоны подкисляют люмен и вместе с этим происходит подщелачивание стромы хлоропласта. Далее по градиенту концентрации (в сторону меньшей концентрации) протоны выходят через канал, образованный Fo субъединицей АТФ-синтазы и создаваемое протонами механическое вращения Fo передается на статор (F1), где происходит катализ образования ATP. Электроны, выбитые из P700 PSI, восстанавливают ферредоксин, который, в свою очередь, в окислительно-восстановительной реакции, катализируемой ферредоксин-НАДФ+-редуктазой, отдает электроны на NADP+, восстанавливая его до NADPH+H+. Далее ATP и NADPH+H+ поступают в строму и там используются в реакциях, которые мы ниже рассмотрим.
В темновой фазе происходят процессы, напрямую с солнечным светом не связанные, но большинство ключевых ферментов, работающих на этой стадии, активны только на свету. Зависимая от света работа ферментов определяется несколькими регуляторными механизмами: pH стромы, наличие двухвалентных катионов (преимущественно Mg2+), а также и в основном благодаря взаимодействию с тиоредоксином. Тиоредоксины – группа белков, имеющаяся у всех живых организмов, представители которой отвечают за сигнализацию в ответ на изменение окислительно-восстановительного (redox) потенциала клетки. Тиоредоксины имеют довольно специфическую укладку и два расположенных рядом остатка цистеина. В окисленной форме цистеины образуют дисульфидный мостик (Cys-S-S-Cys), в восстановленной – две тиольные (сульфгидрильные) группы (2Cys-SH). Окисляясь или восстанавливаясь сами, тиоредоксины могут, соответственно, восстанавливать или окислять другие субстраты. Восстанавливая дисульфидные связи в других белках, цистеины регулируют их активность и, помимо этого, могут поставлять электроны для различных redox реакций. Восстановление тиоредоксинов может проходить разными способами. В частности, тиоредоксин может восстанавливаться электронами с восстановленного ферредоксина при участии ферредоксин-тиоредоксинредуктазы (см рис. 2). Таким образом, происходит передача прямого сигнала от электрон-транспортной цепи (ЭТЦ) тилакоида к ферментам различных реакций и осуществляется непосредственный контроль последних. Очевидно, что данная система функционирует только при работе ЭТЦ, то есть – на свету. Помимо этого тиоредоксины могут восстанавливаться с помощью тиоредоксинредуктаз, принимая электроны от NADPH+H+.
На рисунке 3 схематично изображены основные участники темновой фазы фотосинтеза, подверженные регуляции с помощью тиоредоксиновой системы, хотя, несомненно, регуляция гораздо более обширная. На свету восстановленный благодаря работе ЭТЦ хлоропласта пул тиоредоксинов активирует работу ферментов, отвечающих за путь фиксации CO2 и синтеза глюкозы, в то время как активность ферментов путей анаэробного дыхания – окисления глюкозы (гликолиз и пентозофосфатный путь), будут ингибирована. В темноте ситуация противоположная: тиоредоксиновый пул весь окислен, восстановить его нечем, ферменты пути фиксации углерода не активируются, зато протекают пути окисления синтезированной ранее на свету глюкозы. Помимо тиоредоксиновой регуляции, как уже было сказано, наблюдается регуляция с помощью pH. Те же ферменты, что активируются днем тиоредоксинами, увеличивают свою активность и благодаря повышенным дневным значениям pH стромы хлоропласта (pH=8.0).
Рис 3. Светозависимая регуляция компонентов темновой фазы фотосинтеза.
Непосредственно фиксация углекислого газа, то есть – превращение углерода из окисленной неорганической формы в восстановленную органическую, происходит в восстановительном пентозофосфатном цикле (пути) или иначе — цикле Кальвина. Допустимое сокращение – ВПФП. Путь, который правильнее называть с учетом всех исследователей циклом Кальвина — Бенсона — Бассама (Calvin–Benson–Basshamcycle, CBB), был открыт с использованием СО2 с изотопом 14C. Стадии цикла были выяснены с помощью анализа последовательности включения 14C в разные углеводные продукты. В 1961 году за открытие цикла трем исследователям была присуждена Нобелевская премия по химии.
Цикл Кальвина состоит из трех стадий: 1) карбоксилирование; 2) восстановление; 3) регенерация.
Стадия карбоксилирования состоит из одной реакции, катализируемой рибулозобисфосфат карбоксилазой-оксигеназой или RuBisCO. Пожалуй, RuBisCO – самый распространенный фермент на Земле и при этом очень древний. Содержание RuBisCO может составлять порядка 50% массы растворимых белков зеленых листьев, при этом концентрация фермента на порядки выше концентрации субстрата – СО2, что абсолютно нехарактерно для ферментативных реакций. У растений, большинства водорослей и фотосинтетических бактерий RuBisCO состоит из 8 больших субъединиц (L, 55 kDa), кодируемых пластидным геномом и 8 малых субъединиц (S, 13 kDa), кодируемых ядерным геномом. Большие субъединицы являются каталитическими, малые – регуляторными, и они не являются необходимыми для самой реакции карбоксилирования. L субъединицы организованы в димеры, при этом активные сайты карбоксилирования образованы аминокислотами обеих частей димера, таким образом, RuBisCO с формулой L8S8 содержит 8 активных сайтов (бывают и другие типы RuBisCO).
Схема строения активного центра RuBisCO представлена на рисунке 4. Для осуществления реакции карбоксилирования рибулозо-1,5-бисфосфата (RuBP) требуется первоначальная активация и самого активного центра (рисунок 5). RuBisCO проявляет активность только в том случае, когда ε-аминогруппа лизина в 201 положении ковалентно связана с СО2. После присоединения СО2, происходит таутомеризация присоединенной группы и образуется карбамат. Заметьте, что данная молекула СО2 не используется для карбокилирования – не включается в углеродные скелеты. Далее в активный центр последовательно заходят ион Mg2+ и RuBP. Mg2+ связывается с карбаматом и активирует его, создавая определенную активную конформацию. Функция карбамата заключается в катализе кето-енольной изомеризации RuBP – происходит депротонирование С3 на RuBP и образование нестабильной ендиольной формы (рисунок 6) с двойной связью между С2 и С3. Далее молекула воды атакует С3, а СО2 — С3 RuBP, разрывается связь между С2 и С3. Таким образом, получаются два трехуглеродных продукта реакции – два 3-фосфоглицерата.
Помимо описанного для активации RuBisCO необходимо взаимодействие с активазой RuBisCO – АТР-зависимым ферментом (т.е. тоже работает только на свету!). В темноте в активном сайте RuBisCO, не образовавшем карбамата, прочно удерживается RuBP, который блокирует работу фермента. Активаза RuBisCO высвобождает RuBP из активного сайта, делая его доступным для образования карбамата.
Более подробный механизм реакций, происходящих в активном сайте RuBisCO, можно посмотреть здесь: https://www.ebi.ac.uk/thornton-srv/m-csa/entry/907/.
На следующей стадии, стадии восстановления, происходят процессы, обратные реакциям гликолиза (рисунок 7): фосфорилирование 3-фосфоглицерата фосфоглицераткиназой до 1,3-дифосфоглицерата и затратой одной молекулы ATP, и дальнейшее восстановление 1,3-дифосфоглицерата ферментом глицеральдегидфосфатдегидрогеназой до глицеральдегид-3-фосфата с использованием в качестве донора электронов NADPH+H+ и выделением свободного фосфата. Затем из глицеральдегид-3-фосфата в равновесной реакции, катализируемой триозофосфатизомеразой образуется дигидроксиацетонфосфат. Использование в реакциях стадии восстановления ATP и NADPH+H+ делает стадию сильно зависимой от энергии, а значит – и от солнечного света.
Образованные восстановленные триозы далее вступают в реакции стадии регенерации. На этой стадии происходят три основных типа реакций – альдолазная, транскетолазная и фосфатазная. Основные процессы схематично изображены на рисунке 8. Сначала в реакции, катализируемой ферментом альдолазой из глицеральдегид-3-фосфата и дигидроксиацетонфосфата образуется фруктозо-1,6-бисфосфат. Альдолазная реакция обратима, в ее механизме в активном центре фермента происходит образование протонированного Шиффового основания между С2 кетозы (дигидроксиацетонфосфата) и ε-аминогруппой остатка лизина, в ходе дальнейшей нуклеофильной реакции с С1 карбонильной группы альдозы (глицеральдегид-3-фосфата) образуется фруктозо-1,6-бисфосфат.
Далее фруктозо-1,6-бисфосфат гидролизуется до фруктозо-6-фосфата. Эту реакцию катализирует фруктозо-1,6-бисфосфатаза, и данная реакция необратима. Необратимость реакции позволяет сделать ее регуляторной для всего цикла.
Далее фруктозо-6-фосфат вступает с глицеральдегид-3 фосфатом в транскетолазную реакцию, в ходе которой на глицеральдегид-3-фосфат переносятся С1-С2 с фруктозо-6-фосфата. В данной реакции участвует кофермент тиаминпирофосфат (TPP), являющийся простетической группой транскетолазы. ТРР, связываясь углеродом тиазольного кольца с С2 атомом кетозы, вызывает расщепление ковалентной связи между С2 и С3 на кетозе и образование карбаниона с отрицательным зарядом на С2, к которому присоединяется С-атом альдегидной группы альдозы (глицеральдегид-3-фосфат), имеющий частичный положительный заряд. В ходе реакции образуются четырехуглеродный сахар эритрозо-4-фосфат и пентоза – ксилулозо-5-фосфат.
Образованный эритрозо-4-фосфат вступает в альдолазную реакцию с дигидроксиацетонфосфатом с образованием седогептулозо-1,7-бисфосфата, который затем гидролизуется до седогептулозо-7-фосфата. Реакция во многом похожа на гидролиз фруктозо-1,6-бисфосфата и так же является необратимой и регуляторной.
В следующей транскетолазной реакции седогептулозо-7-фосфат взаимодействует с глицеральдегид-3-фросфатом с образованием двух пентоз – рибозо-5-фосфата и ксилулозо-5-фосфата.
Итого, получены 3 различные пентозы. В последующих реакциях (рисунок 9) происходит эпимеризация ксилулозо-5-фосфата в рибулозо-5-фосфат под действием фермента рибулозофосфатэпимеразы и изомеризация рибозо-5-фосфата в рибулозо-5-фосфат под действием фермента рибозофосфатизомеразы. Полученные рибулозо-5-фосфаты фосфорилируются по С1 рибулозофосфаткиназой с образованием рибулозо-1,5-бисфосфата (RuBP). Данная реакция необратима. Таким образом, в ходе цикла Кальвина вновь образовался RuBP, который снова может вступать в реакцию карбоксилирования. Помимо этого был зафиксирован СО2.
Если сделать пересчет на три зафиксированных СО2, то есть – на одну синтезированную триозу, то суммарное уравнение ОПФП выглядит следующим образом:
3CO2 + 6NADPH + 6H+ + 9ATP → глицеральдегид-3-фосфат + 6NADP+ + 9ADP + 3H2O + 8Pi
Таким образом, для работы цикла Кальвина требуется соотношение ATP/NADPH+H+ = 1,5. Вспомним снова световую фазу, при нециклическом транспорте электронов на каждый восстановленный NADPH+H+ в люмене хлоропласта становится на 6 протонов больше (2Н+ на PSII, 2Н+ на цитохром-b6/f комплексе и 2H+ — в Q-цикле). АТФ-синтаза хлоропласт содержит 12-14 с-субъединиц, значит, для полного разворота F0 требуется 12-14 протонов и при этом образуется 3 ATP. Простые расчеты дают на этом основании стехиометрию H+/ATP = 4,7 (для 14 с-субъединиц) и ATP/NADPH+H+ = 1.3, что меньше необходимого, то есть ATP находится в недостатке. Для компенсации этого недостатка в ЭТЦ тилакоида идет циклический транспорт электронов вокруг I фотосистемы.
Кроме восстановительного пентозофосфатного пути существует еще и окислительный. Большинство ферментов и реакций этих путей общие и многие реакции являются обратимыми, ОПФП, как и ВПФП проходит в строме хлоропласта. Очевидно, что для нормального функционирования обоих путей и во избежание бессмысленной траты АТP необходимо регулировать активность ферментов, которая осуществляется с помощью тиоредоксиновой системы и изменения рН стромы хлоропласта (рис 10).
Помимо карбоксилазной активности RuBisCO проявляет также и оксигеназную (рисунок 11). В ходе этой реакции в активный центр RuBisCO вместо СО2 приходит О2 и образуются 2-фосфогликолат и только один 3-фосфоглицерат. Даже небольшие концентрации 2-фосфогликолата опасны для растения, вещество оказывает сильное и ингибирующее воздействие на многие системы и реакции. Для устранения последствий карбоксилазной активности RuBisCO в растениях существует целый метаболический путь, называемый фотодыханием, или гликолатный путь (не путать с глиоксилатным!), или С2-фотосинтез. Реакции данного пути требуют консолидированной работы сразу трех органелл – хлоропласта, пероксисомы и митохондрии (рисунок 12, из учебника Страсбургера «Физиология растений»).
Образованный в строме хлоропласта 2-фосфогликолат гидролизуется фосфогликолатфосфатазой и продукт, гликолат, выносится из хлоропласта через интегрированныйво внутреннюю мембрану транспортер и попадает в пероксисому через образованные поринами пор. В пероксисоме гликолат окисляется до глиоксилата гликолатоксидазой. Данная реакция идет в присутствии кислорода, на который через флафинмононуклеотид гликолатоксидазы передаются электроны и образуется H2O2. Н2О2 разлагается каталазой до воды и кислорода, именно поэтому данную реакцию необходимо проводить в пероксисоме. Далее ферментом глутамат-глиоксилатаминотрансферазой осуществляется переаминирование – перенос аминогруппы с глутамата на глиоксилат с образованием 2-оксоглутарата и глицина. В качестве донора аминогруппы может использоваться также аланин, помимо этого реакцию осуществляет и серин-глиоксилатаминотрансфераза (см. далее). Глицин затем поступает через аминокислотный транслокатор в митохондрию, где окисляется мультиферментным комплексом, сходным с пируватдегидрогеназным комплексом цикла Кребса, полное название которого – глициндекарбоксилазосерингидроксиметилтрансферазный комплекс (рисунок 13). В ходе реакций, катализируемых данным комплексом глицин, связываясь с пиридоксалем, образует основание Шиффа (B) и декарбоксилируется, затем остаток глицина передается на липоевую кислоту (C) и дезаминируется, окисляясь до формильного остатка, который связывается с тетрагидрофолатом (D, 1, 2). Восстановленная при этом дигидролипоевая кислота окисляется флафинадениндинуклеотидом (FAD) снова до липоевой кислоты, при этом FADH2 восстанавливает NADP+ (D-E). Формильный остаток с тетрагидрофолата передается на вторую молекулу глицина, образуя серин (А-В).
Таким образом, в ходе данной реакции из двух молекул глицина образуется серин, аммоний, CO2 и NADH+H+. Серин затем транспортируется из митохондрии обратно в пероксисому, гда происходит его дезаминирование серин-глиоксилатаминотрансферазой с образованием гидроксипирувата. Фермент гидроксипируватредуктаза восстанавливает гидроксипируват до глицерата, донором электронов для реакции является NADH+H+, глицерат транспортируется гликолат-глицератным переносчиком в строму хлоропласта и там фосфорилируется глицераткиназой. Итого, имеем регенерированный из 2-фосфогликолата 3-фосфоглицерат.
Аммоний, образованный в ходе дыхания, также переносится в хлоропласт, где с использованием ATP ферментом глутаминсинтетазой осуществляется аминирование глутамита до глутамина, а затем глутаматоксоглутаратаминотрансфераза (ГОГАТ) из глутамина и 2-оксоглутарата при использовании двух восстановленных ферредоксинов (то есть реакция фиксации аммония в листьях тоже светозависима!) в качестве доноров электронов катализирует образование двух глутаматов.
Полученный при декарбоксилировании глицина СО2 может быть снова зафиксирован RuBisCO. Можно привести некоторый подсчет «стоимости» оксигеназной активности RuBisCO. На две пентозы при связывании RuBisCO двух молекул кислорода происходит образование двух 3-фосфоглицератов и двух 2-фосфогликолатов. По стехиометрии фотодыхания на два 2-фосфогликолата образуется один 3-фосфогликолат (два синтезированных глицина превращаются в один серин), при этом тратится 1ATP на фосфорильрование глицерата и 1 АTP + NADPH+H+ (энергетический эквивалент двух ферредоксинов) – при фиксации аммония. При рефиксации выделившегося CO2 в ВПФП образуется 1/3 3-фосфоглицерата с использованием 3 АТР и 2 NADPH+H+ (смотри стехиометрию пути). То есть, из расчета на два акта оксигеназной активности можно получить 2+1+0,33 = 3,33 3-фосфоглицерата. Далее при синтезе из них в ВПФП двух RuBP (учтя, что 3C*3,(3) = 2*5C) используются еще пять ATP и три NADPH+H+. Итого выходит для АТР: 1+1+3+5=10; для NADPH+H+: 1+2+3=6.
Состояние, когда весь фиксируемый CO2 расходуется из-за оксигеназной активности, получило название углекислотной компенсации. Нетрудно догадаться из стехиометрии ВПФП и фотодыхания, что такая ситуация будет наблюдаться при соотношении карбоксилазной и оксигеназной реакций = 1:2.
Возникает резонный вопрос – почему миллиарды лет эволюции не позволили RuBisCO избавиться от оксигеназной активности или существенно ее снизить. Одно из объяснений заключается в том, что RuBisCO, как ферментный комплекс появился задолго (по разным данным — более миллиарда лет) до кислородной катастрофы и эволюционировал в условиях, когда оксигеназная активность не мешала в силу отсутствия субстрата. Несмотря на появление оксигенного фотосинтеза порядка 2,8-2,4 млрд лет назад, кислород в атмосфере стал накапливаться и достигать современного уровня лишь в последние пять-шесть сотен миллионов лет. Возможно, сложность комплекса не позволила ему адаптироваться и уменьшить уровень оксигеназной активности. Другое, более «физиологичное» объяснение наличия у RuBisCO оксигеназной активности – адаптация к аридным местам обитания с избыточной инсоляцией. Живущие в таких условиях растения вынуждены избавляться от избытка энергии и перевосстановленности, образующихся в ходе световых реакций и приводящих к повреждениям клетки. Использовать эту избыточную энергию на фиксацию СО2 невозможно, так как закрыты устьица, чтобы не допустить потерю воды. Поэтому в данном случае затратное фотодыхание служит защитой фотосинтетического аппарата.
Рассмотренные процессы происходят в растениях с так называемым С3 фотосинтезом, по количеству углеродов в первом образованном после фиксации СО2 веществе – 3-фосфоглицерате. Но у растений существуют и другие типы фотосинтеза, их много, если учесть переходные формы. Далее мы рассмотрим некоторые основные.
Концентрация кислорода в современной атмосфере равна 21%, СО2 – порядка 0,035-0,04%. Известно, что с повышением температуры растворимость газов уменьшается, а так как СО2 всего лишь около 350 ppm, в водном растворе СО2 становится очень мало по сравнению с содержанием О2, падает соотношение CO2/O2, что способствует значительному возрастанию оксигеназной активности. Растения научились бороться с этим и выживать в засушливых условиях с повышенной температурой и инсоляцией. Ключевая реакция здесь – первичная фиксация углекислого газа ферментом фосфоенолпируваткарбоксилазой (ФЕП-карбоксилаза, PEPCase).
В одном случае CO2 в форме карбоксильной группы низкомолекулярных органических веществ (малат, оксалоацетат, аспартат) перемещается из клетки первичной фиксации (клетка хлоренхимы мезофилла) в клетку обкладки пучка (рис. 14), где происходит декарбоксилирование и образование СО2. Тут СО2 уже фиксируется с помощью RuBisCO. Данный механизм позволяет создать в области активности RuBisCO условия с повышенной концентрацией СО2, благодаря чему можно если не убрать, то минимизировать оксигеназную реакцию. Схематичный процесс, который называется в честь первооткрывателей циклом Хэтча-Слэка-Карпилова (хотя последнего все забывают), представлен на рисунке 14. Такой фотосинтез называется С4 из-за того, что первоначально при первичной фиксации образуется четырехуглеродное соединение – оксалоацетат.
Листья растений с С4 типом фотосинтеза имеют своеобразную анатомию (рисунок 15), называемую кранц-анатомией (нем. Kranz – венок). Кранц-анатомия и С4 фотосинтез эволюционно возникала независимо во многих таксонах цветковых растений и имеет различное строение в зависимости от типа С4 фотосинтеза и видовой принадлежности самого растения, более того, даже помимо переходных случаев, вроде С3-С4 фотосинтеза, есть данные, что у типичных С3 растений вполне может проходить и С4 фотосинтез.
ФЕП-карбоксилаза катализирует образование оксалоацетата из иона бикарбоната и фосфоенолпирувата. На первой стадии реакции происходит нуклеофильная атака бикарбонатом фосфата фосфоенолпирувата, образуются два промежуточных продукта – фосфокарбонат и енольная форма пирувата. На второй, необратимой стадии, происходит разрыв эфирной связи в фосфокарбонате, выходит из реакции Pi, а CO2 реагирует с енольной формой пирувата с образованием оксалоацетата. У С4 растений ФЕП-карбоксилаза активируется фосфорилированием осуществляемым ферментом киназой ФЕП-карбоксилазы, при этом сама киназа активируется светом, в темноте ФЕП карбоксилаза инактивируется фосфорилазой, гидролизующей присоединенный на свету фосфат. Поэтому данная стадия у С4 растений идет только на свету. У ФЕП-карбоксилазной реакции два больших преимущества: (1) отсутствие оксигеназной активности и (2) использование бикарбоната в качестве
субстрата. Образование HCO3— из СО2 (помимо самопроизвольного) катализируется карбоангидразой. Данный факт позволяет накопить большое количество углерода в форме HCO3-, ведь в равновесии с 8 мкмоль СО2 при 25°С и рН=8 находится 400 мкмоль HCO3-, таким образом, минимизируется проблема малого количества растворенного СО2 при высокой температуре.
Так как в С4 фотосинтезе разные клетки и разные органеллы объединены в один метаболический процесс, необходима система транспортеров для различных переносимых соединений. Например, малат-оксалоацетатный и малат-аспартатный челноки. Во внутренних мембранах митохондрий и пластид располагается транслокатор, обменивающий, например, малат на оксалоацетат и наоборот. Таким образом, данные соединения могут находиться в строме хлоропласта, матриксе митохондрии, выходить оттуда в цитоплазму, по градиенту диффузионного потенциала перемещаться по симпласту между клетками и снова заходить в матрикс митохондрии или строму хлоропласта. Помимо этого, благодаря ферменту малатдегидрогеназе, который осуществляет окисление малата с образованием оксалоацетата и восстановлением NAD(P)H+H+ (существуют изозимы, специфичные как к NAD+, так и к NADP+), а также и обратную реакцию, через мембрану транспортируется и восстановительный эквивалент. Также важным является триозофосфат-3-фосфоглицератный челнок (обмен дигидроксиацетонфосфата и 3-фосфоглицерата), который, помимо восстановительного эквивалента, переносит еще и энергию, которая конвертируется в АТР (рис. 20).
Есть и большое количество других переносчиков, обменивающих аминокислоты, фосфаты, нуклеотиды, ионы и проч.
С4 тип фотосинтеза можно разделить на три основных подтипа (см. рисунки 19,21,22) – NADP+-ME, NAD+-ME и ФЕП-карбоксикиназный. Все они названы по ферменту, который осуществляет декарбоксилирование, соответственно – NADP+-зависимая декарбоксилирующая малатдегидрогеназа или NADP+ -малик-энзим, NAD+ -малик-энзим и ФЕП-карбоксикиназа. Ниже рассмотрим подробнее каждый из типов.
Самым простым, пожалуй, является NADP+-ME тип. Пируват в клетках мезофилла транспортируется в хлоропласт и там в реакции, катализируемой пируватортофосфатдикиназой (PPDK) из него образуется фосфоенолпируват (ФЕП). Субстратами PPDK являются АТР, фосфат и пируват, продуктами реакции – пирофосфат и AMP. Пирофосфат в строме быстро гидролизуется пирофосфатазой до двух фосфатов, что сильно сдвигает реакцию образования ФЕП в сторону продуктов. PPDK активна только на свету, в темноте происходит ее фосфорилирование, причем в данном случае используется не АТР, а ADP, которого как раз много в темноте, а не на свету.
ФЕП далее поступает из хлоропласта в цитоплазму, где происходит карбоксилазная реакция, катализируемая ФЕП-карбоксилазой, которая была описана выше. Образованный в ходе реакции оксалоацетат снова поступает в хлоропласт, где происходит его восстановление до малата NADPH+-зависимой малатдегидрогеназой. Малат выходит из хлоропласта в цитоплазму и по симпласту через плазмодесмы по градиенту концентрации (в зону меньшей концентрации) переносится в цитоплазму клетки обкладки. В клетках обкладки малат поступает в строму хлоропласта, здесь происходит реакция декарбоксилирования ферментом NADP+ -малик-энзимом с образованием пирувата, углекислого газа и восстановленного NADPH+H+. Пируват далее снова выходит из хлоропласта и диффундирует в клетку мезофилла, СО2 используется в карбоксилазной реакции RuBisCO, NADPH+H+ в цикле Кальвина.
У растений с NADP+-ME типом фотосинтеза клетки мезофилла имеют мощно развитую гранальную структуру пластид, а пластиды клеток обкладки, наоборот, агранальные. Возникает проблема – как в агранальных хлоропластах обеспечить энергией и восстановительными эквивалентами протекающий цикл Кальвина. Для решения этой проблемы и испольхуется упомянутый выше триозофосфат-3-фосфоглицератный челнок (рис. 20).
В NAD+-ME типе (рис. 21) в клетках мезофилла происходит переаминирование, катализируемое аспартатаминотрансферазой, полученный в ходе реакции из оксалоацетата аспартат диффундирует в клетку обкладки и там поступает уже не в строму хлоропласта, а в матрикс митохондрии. В митохондрии происходит обратная реакция и снова образуется оксалоацетат, который, как и в предыдущем случае NAD(P)+-зависимой малатдегидрогеназой восстанавливается до малата. Малат декарбоксилируется до пирувата с выделением СО2 и восстановлением NAD+ NAD+-малик-энзимом. Углекислый газ диффундирует в хлоропласт клетки обкладки. Пируват выходит из стромы митохондрии в цитоплазму, и там происходит его аминирование аланинаминотрансферазой. Аланин диффундирует в клетку мезофилла, где снова дезаминируется и превращается в пируват.
Хлоропласты клеток обкладки в растениях с В NAD+-ME типом фотосинтеза имеют гранальную структуру, в то время как клеток мезофилла – наоборот, их структура может быть агранальной.
ФЕП-карбоксикиназный вариант С4 фотосинтеза более сложный. Образованный в ФЕП-карбоксилазной реакции оксалоацетат имеет разную дальнейшую судьбу. Он может, как и в случае NAD+-ME фотосинтеза, преобразуясь в аспартат, поступать в клетки обкладки пучка, а может, как в NADP+-ME типе, поступать снова в хлоропласт мезофилла, превращаться в малат и уже в малат будет диффундировать в клетку обкладки (данная часть на рисунке 22 не показана). Малат далее поступает в митохондрию клетки обкладки, где декарбоксилируется, и дальнейшие реакции повторяют реакции уже NAD+-ME типа фотосинтеза. В том случае, если оксалоацетат превращается в аспартат, аспартат диффундирует в цитоплазму клеток обкладки там дезаминируется аспартатаминтрансферазой, и оксалоацетат вступает в реакцию, катализируемую ФЕП-карбоксикиназой. В ходе этой реакции с использованием АТР оксалоацетат декарбоксилируется и превращается в ФЕП. ФЕП дальше диффундирует обратно в клетки мезофилла, где может снова вступить в карбоксилазную реакцию. Таким образом, в данном типе С4 фотосинтеза сосуществуют две декарбоксилирующие реакции, производящие СО2 для RuBisCO.
С4 тип фотосинтеза происходит в основном у растений, обитающих в климате с повышенной температурой и отчасти с недостатком воды (рис 23). Если брать в рассмотрение только протекающие в процессе фиксации углерода реакции, то можно прийти к выводу, что по сравнению с C3 фотосинтезом С4 довольно расточителен. Действительно, в условиях умеренного климата с относительно стабильным и достаточным увлажнением растения с С3 фотосинтезом имеют преимущество перед С4 растениями, опережая их в скорости накопления биомассы. Но как только растения оказываются в жарком климате, энергетические затраты на дополнительные реакции у С4 растений м перекрываются большим выигрышем в уровне фиксации СО2 и уменьшении оксигеназной активности RuBisCO.
Растения, произрастающие в засушливых с долговременной нехваткой влаги или даже полным отсутствием воды в течение продолжительного времени, развили третий тип фотосинтеза. CAM-фотосинтез (от англ. Crassulacean acid metabolism – метаболизм по типу толстянковых) довольно широко распространен среди высших растений, хоть и был впервые описан на семействе Crassulaceae. САМ фотосинтез, точно так же, как и С4, возникал у разных групп растений неоднократно и независимо друг от друга. Растения с САМ фотосинтезом встречаются и во многих группах – представителей можно встретить среди плауновидных, папоротникообразных, гнетовых, голосеменных и покрытосеменных растений. Точно так же есть растения с переходными типами фотосинтеза, существует много примеров изменения типа фотосинтеза с С3 на САМ у одного растения в зависимости от внешних условий и/или стадии онтогенеза и даже от рассматриваемого органа. САМ фотосинтез в основном выполняет роль физиологической адаптации к недостатку воды, потому встречается не только у пустынных растений, но так же у эпифитов и галофитов. Помимо этого, САМ фотосинтез имеет распространение и среди водных растений (например, Isoetes howellii или Crassula aquatica). Недостатка воды в данном случае растение не испытывает, но сталкивается с недостатком СО2 в силу его низкой концентрации и малой доступности, особенно в кислых водоемах, где равновесие сдвинуто в сторону образования СО2 из растворенного бикарбоната. Такие растения фиксируют СО2 ночью, когда не так высока конкуренция за СО2 с другими фотосинтетиками, населяющими водоем, а также когда эти фотосинтетики не образуют кислород.
САМ фотосинтез с точки зрения биохимии процессов очень похож на С4, основная его особенность в том, что происходит разделение первичной и вторичной фиксации СО2 не в пространстве, а во времени. В данном случае первичная фиксация с помощью ФЕП-карбоксилазы происходит ночью, в вечерние и ранние утренние часы – то есть в то время, когда у растений открыты устьица, а активность RuBisCO наблюдается днем, когда устьица закрыты, чтобы максимально уменьшить испарение воды.
В отличие от С4 типа фотосинтеза, в данном случае ФЕП-карбоксилаза работает не на свету, а ночью и светом наоборот ингибируется. Работа данного варианта фермента контролируется циркадными ритмами на уровне транскрипции киназы ФЕП-карбоксилазы – транскрипты этого фермента накапливаются именно в темное время суток.
Начнем рассмотрение САМ фотосинтеза с процессов, происходящих ночью. В темное время суток крахмал, который накопился в ходе протекания цикла Кальвина на свету, гидролизуется под действием различных ферментов (фосфорилаза и разные амилазы), образованные моно- и дисахариды превращаются в глюкозо-6-фосфат, который затем превращается в триозофосфат (реакции, аналогичные начальным стадиям гликолиза). Триозофосфаты выходят в цитоплазму, где протекают последующие реакции гликолиза, завершающиеся формированием фосфоенолпирувата. ФЕП вступает в реакцию с гидрокарбонатом, катализируюмую ФЕП-карбоксилазой и затем образованный оксалоацетат восстанавливается до малата. Малат (в виде аниона) закачивается в выкуоль. В вакуоль с помощью вакуолярной протонной помпы (ATPase V-типа) закачиваются противоионы – H+. Таким образом, рН вакуоли за ночь очень сильно понижается (вплоть до рН=3), этим обусловлен кислый вкус САМ растений в предрассветные и утренние часы. Энергетически затратная закачка протонов через тонопласт необходима для уменьшения осмотического давления, которое могло бы быть создано малатом калия. Яблочная кислота с обеими протонированными карбоксильными группами создает в три раза меньшее осмотическое давление, чем калиевая соль. Во время всех описанных событий устьица растений остаются открытыми и СО2 свободно диффундирует в межклетники.
Утром на свету ФЕП-карбоксилаза довольно быстро ингибируется, устьица закрываются. При этом малат выходит из вакуоли и декарбоксилируется. Эту реакцию могут осуществлять, в зависимости от конкретного растения, разные декарбоксилирующие ферменты — различные малик-энзимы или ФЕП-карбоксикиназа, декарбоксилирующая синтезированный из малата оксалоацетат. Соответственно типу декарбоксилирующегофермента, дальнейшие процессы происходят либо в митохондриях, либо в хлоропластах. Так или иначе, высвободившийся СО2 поступает в хлоропласт и там связывается RuBisCO. Образованный в ходе цикла Кальвина триозофосфат либо вступает в путь глюконеогенеза и образует в хлоропласте пул крахмала, который будет дальше гидролизоваться ночью для синтеза малата, либо поступает в цитоплазму, где из него синтезируется сахароза, которая отправляется в дальний транспорт по растению.
Биология для студентов — 10. Фотосинтез как сочетание световых и темновых реакций, их взаимосвязь
Фотосинтез — синтез органических веществ из углекислого газа и воды с обязательным использованием энергии света:
6СО2 + 6Н2О + Qсвета → С6Н12О6 + 6О2.
У высших растений органом фотосинтеза является лист, органоидами фотосинтеза — хлоропласты. В мембраны тилакоидов хлоропластов встроены фотосинтетические пигменты: хлорофиллы и каротиноиды. Существует несколько разных типов хлорофилла (a, b, c, d), главным является хлорофилл a. В молекуле хлорофилла можно выделить порфириновую «головку» с атомом магния в центре и фитольный «хвост». Порфириновая «головка» представляет собой плоскую структуру, является гидрофильной и поэтому лежит на той поверхности мембраны, которая обращена к водной среде стромы. Фитольный «хвост» — гидрофобный и за счет этого удерживает молекулу хлорофилла в мембране.
Хлорофиллы поглощают красный и сине-фиолетовый свет, отражают зеленый и поэтому придают растениям характерную зеленую окраску. Молекулы хлорофилла в мембранах тилакоидов организованы в фотосистемы. У растений и синезеленых водорослей имеются фотосистема-1 и фотосистема-2, у фотосинтезирующих бактерий — фотосистема-1. Только фотосистема-2 может разлагать воду с выделением кислорода и отбирать электроны у водорода воды.
Фотосинтез — сложный многоступенчатый процесс; реакции фотосинтеза подразделяют на две группы:
- реакции световой фазы.
- реакции темновой фазы.
Световая фаза осуществляется на мембранах тилакоидов и только при наличии света. Реакции темновой фазы протекают в строме хлоропласта и не требуют света, однако для их прохождения необходимы продукты световой фазы. Поэтому темновая фаза идет практически одновременно со световой.
Световая фаза фотосинтеза. Процессы, протекающие в световой фазе, можно представить следующим образом.
- Пигменты обеих фотосистем поглощают свет, полученная энергия передается в реакционные центры на молекулы хлорофилла а (молекулы-ловушки), которые переходят в возбужденное состояние и отдают электроны переносчикам. Электрон из фотосистемы I транспортируется переносчиками на внешнюю сторону тилакоида. Электрон из фотосистемы II с помощью переносчиков доставляется в фотосистему I и восстанавливает молекулу-ловушку в реакционном центре. Так фотосистема I восстанавливается за счет электронов из фотосистемы II, которая, в свою очередь, получает электроны, как вы уже знаете, за счет фотолиза воды. Кислород, который образуется при фотолизе воды, выделяется из хлоропласта в гиалоплазму клетки, затем в окружающую среду, а протоны (Н+) накапливаются внутри тилакоида.
- Накопление протонов внутри тилакоида ведет к возникновению электрохимического потенциала на его мембране. В мембране тилакоида содержится фермент АТФ-синтетаза. Когда концентрация протонов достигает определенного уровня, они устремляются в строму хлоропласта, проходя через специальные каналы АТФ-синтетазы. При этом АТФ-синтетаза использует энергию движения протонов для синтеза АТ Ф.
- На внешней стороне тилакоида происходит восстановление НАДФ+ за счет присоединения к нему электронов и протонов. НАДФ — никотинамид-адениндинуклеотидфосфат (полное название приводится не для запоминания) — переносчик атомов водорода в процессе фотосинтеза. НАДФ+ + 2ё + 2Н+ ->• НАДФ-Н+Н+.
Таким образом, в ходе световой фазы энергия света поглощается и преобразуется в энергию макроэргических связей АТФ, происходит расщепление воды с выделением кислорода и накопление атомов водорода (в форме НАДФ’Н+Н+). Продуктами световой фазы фотосинтеза являются АТФ, восстановленный НАДФ и кислород. Кислород — побочный продукт фотосинтеза, он выделяется в окружающую среду. АТФ и НАДФ*Н+Н+ используются в темновой фазе фотосинтеза.
Темповая фаза фотосинтеза. Из окружающей среды в хлоропласта поступает углекислый газ, а в строме хлоропластов происходит его восстановление до органических веществ. Это сложный многоступенчатый процесс, который можно выразить общим уравнением:
6С02 + 12НАДФ-Н+Н+ + 18АТФ ->• С6Н1206 + 12НАДФ+ + 18АДФ + 18Н3Р04.
Из приведенного уравнения видно, что для синтеза одной молекулы глюкозы необходимо окислить 12 молекул НДДФ*Н+Н+ (служит источником атомов водорода) и расщепить 18 молекул АТФ (служит источником энергии для синтеза глюкозы). Таким образом, в темновой фазе фотосинтеза энергия макроэргических связей АТФ преобразуется в энергию химических связей органических веществ.
В темновой фазе фотосинтеза, как уже отмечалось ранее, используются продукты световой фазы (НАДФ’Н+Н+и АТФ), поэтому реакции темновой фазы проходят почти одновременно с реакциями световой фазы. Если объединить процессы, протекающие в обеих фазах, исключив все промежуточные стадии и вещества, можно получить суммарное уравнение процесса фотосинтеза:
6С02 + 6Н20-> С6Н1206 + 602.
Фотосинтез фазы световая и темновая
Существуют две фазы процесса фотосинтеза — световая и темновая. [c.210]
Различают две фазы фотосинтеза — световую и темновую . В первой фазе имеет место фотолиз воды с образованием атомов водорода и кислорода [c.321]
Процесс фотосинтеза состоит из двух фаз-световой и темновой [c.687]
Общая характеристика фотосинтеза. Фотосинтез — это совокупность процессов, в ходе которых солнечная энергия запасается в виде химических связей органических соединений, синтезируемых из неорганических веществ. Он состоит из двух фаз световой (фото-физический и фотохимический этапы) и темновой. В ходе световой фазы происходит поглощение солнечной энергии хлорофиллом и передача ее в реакционный центр, где в результате химических реакций, включающих транспорт электронов между различными переносчиками и сопряженного с ним фосфорилирования, образуются восстановительные и энергетические эквиваленты (НАДФН и АТФ). Для протекания световой фазы требуются световая энергия, сборщики световой энергии и вода (или другой источник водорода). Темновая фаза фотосинтеза — это фиксация и восстановление СО2 с образованием углеводов и других конечных продуктов [c.193]
Темновая фаза фотосинтеза (цикл Кальвина) включает в се в качестве основного процесса восстановление углекислоты, по. ченной клеткой из окружающей среды, до углеводородов. Восс новителем здесь служит образованный на световой. ф НАДФ-Нг, причем эта реакция эндотермична, и необходимая для развития энергия поставляется за счет расщепления АТФ. Хар терный тип реакции фиксации СО2 и образования углеводоро можно представить в виде [c.190]
Измеряя квантовый выход, можно установить, что фотосинтез сО стоит из двух фаз световой и темновой. В процессе световой фазы накапливаются АТР и NADPH, во время темновой реакции эти вещества расходуются. [c.701]
Непосредственными источниками энергии в процессе фотосинтеза во время темновой фазы служат 2 вещества — АТФ и НАДФ-Нз. Оба они образуются во время световой фазы за счет энергии солнечных лучей при участии хлорофилла. Доказано, что на каждый эквивалент выделяющегося Ог (т. е. па Ог) возникает 1 молекула АТФ и 1 молекула НАДФ Нз. [c.262]
При фракционировании изолированных хлоропластов было показано, что их общий процесс фотосинтеза может быть экспериментально разделен на световую и темновую фазы. Темновая фаза заключалась в некоторых энзиматических реакциях, которые превращают СОг в углеводы в интактных зеленых клетках. Эти темновые реакции направляются АТФ и НАД, которые образовались во время световой фазы циклического и нециклического фосфорилирования. [c.329]
Здесь следует непременно отметить одно очень важное обстоятельство. Всю последовательность реакций, изображенных на рис. 23-12, мы объединяем под общим названием световые реакции фотосинтеза. Такое определение удобно, поскольку оно вполне четко разграничивает энергогенерирующую фазу фотосинтеза и темновые реакции, обеспечивающие восстановление СОз до глюкозы. Однако название световые реакции не вполне точно. В действительности только для двух этапов этих световых реакций нужен свет, а именно для тех этапов, которые переводят в возбужденное состояние два фотохимических реакционных центра (рис. 23-12). После того как электроны, поглотив световую энергию, перейдут на более высокий энергетический уровень, все остальные этапы фотосинтетического переноса электронов могут уже идти и в темноте. [c.697]
Экспериментальные доказательства реального существования этих двух фаз фотосинтеза были получены в опытах с мигающим светом, которые ставились следующим образом. Между источником света и растением помещали непрозрачный вращающийся диск с вырезанным сектором. Изменяя скорость вращения диска и величину вырезанного сектора, создавали различную длительность и соотношение светового и темпового периодов. Были использованы и другие способы импульсного освещения. Определялась интенсивность фотосинтеза листьев или суспензии клеток хлореллы. Опыты с мигающим светом, проведенные в России (А. А. Рихтер, 1914) и в США (Р. Эмерсон и У. Арнольд, 1932, 1941), показали, что максимальная интенсивность фотосинтеза наблюдается не при непрерывном, а при импульсном освещении (пересчет сделан на время освещения) и особенно в тех случаях, когда продолжительность темновых промежутков составляла 0,04 — 0,06 с (при 25 °С). Оптимальное время световой вспышки оказалось порядка 10 с. Большая эффективность импульсного света доказывает наличие темновых реакций в фотосинтезе, так как темновые (энзиматические) процессы осуществляются более медленно, чем фотохимические. [c.64]
Восприятие растением сезонных изменений с помощью фотопериодизма связано не только с рецепцией световых и темновых сигналов, но и с передачей этих сигналов внутренним биологическим часам, на существование которых указывают легко наблюдаемые циркадные ритмы. Такие ритмы были обнаружены во многих процессах, включая движения листьев, фотосинтез, деление клеток и биолюминесценцию у водорослей, а также в активности некоторых клеточных ферментов. В то время как амплитуда и фаза ритмических колебаний чувствительны к температуре, период в большинстве случаев практически не зависит от нее. Механизм создания периодичности и природа температурной компенсации не ясны, но есть некоторые данные в пользу того, что ритмы связаны с циклическими изменениями в мембранах. [c.387]
Процесс фотосинтеза сводится к двум фазам одна связана с поглощением световой энергии хлорофиллами айв и может протекать только на свету (световая стадия), другая обусловливает восстановление СОг, т. е. синтез углеводов, и происходит без непосредственного участия света (темновая стадия). [c.59]
Согласно приведенным схемам (см. рис. 30, 32), где объединены световая и темновая фазы процесса фотосинтеза в хлоропласте, молекулы фотосистемы П, поглощая квант света, переводят электрон в возбужденное состояние, который и воспринимается пластохиноном Молекулы хлорофилла реакционного центра фотосистемы П вместо утраченного электрона присоединяют электрон молекулы воды или радикала ОН. Пластохинон при участии цитохромов и пластоцианина передает электрон реакционному центру фотосистемы I. Эта фотосистема, также поглощая квант света, отдает возбужденный электрон через катализатор ферредоксин и фермент—ферредоксин-НАДФ-ре-дуктаза НАДФ, который акцептирует иои водорода, образуя НАДФНг — восстановитель с высоким потенциалом. [c.186]
У растений, цианобактерий и прохлофи-тов фотосинтез протекает в 2 фазы световые и темновые реакции. [c.193]
В последнее время опыты с мечеными атомами показали (Кальвин и др.), что фотосинтез является сложным процессом, протекающим в две фазы световую и темновую, и что основным продуктом фотосинтеза является фосфоглицерино-вая кислота. В образовании фосфоглицериновой кислоты участвуют СОз, АТФ и рибулозофосфат. Вначале происходит фосфорилирование рибулозофосфата за счет АТФ под действием фермента фосфорибулокиназы . [c.258]
Наличие в процессе фотосинтеза темновых реакций было подтверждено и работами Блэкмана по действию ограничивающих факторов на фотосинтез ( в1аскшап, 1905). №( показано, что когда интенсивность фотосинтеза больше не увеличивается ни при повышении освещенности, ни при поюшении уровня Og, усиление ее может быть вызвано повышением температуры. Блэкман первый шска-зал предположение о том, что в процессе фотосинтеза кроме световой имеется и темновая независимая от света фаза, которая и была названа «реакцией Блэкмана». [c.12]
Представление об участии в фотосинтезе темновой реакции выдвинул в 1905 г. Блекман. В 1937 г. Мак-Алистер и Майерс отметили, что водоросли продолжают поглощать углекислоту в течение короткого промежутка времени после прекращения освещения. Использование С Ог позволило подтвердить данные Мак-Алистера и Майерс о том, что связывание углекислоты происходит в темноте, непосредственно после периода освещения. Недавно с помощью фракционирования хлоропластов на граны и строму удалось осуществить физическое разделение световой и темновой реакций. Световая фаза была завершена в освещенных хлоропластах (в соответствующей реакционной смеси) в отсутствие углекислоты. При этом выделился кислород и образовались субстратные количества АТФ и НАДФ-Нг- После этого граны удалили центрифугированием. Оставшаяся строма, содержащая полученные в результате предыдущей световой реакции АТФ и НАДФ-Нг, оказалась способной ассимилировать углекислоту в темноте с образованием триозофосфата и фосфатов сахаров. [c.275]
Таким образом, в результате световой фазы фотосинтеза образуется АТФ и НАДФН для использования в ферментативных реакциях темновой фазы. [c.198]
В настоящее время процесс фотосинтеза разделяют на тем-новую и световую фазы. Темновая фаза состоит из реакций, при которых образуются углеводы и некоторые другие соединения из СО2. Синтез этих соединений в темновой фа е происходит с участием АТФ и НАДФ Н2, которые возникают в световой фазе при фотосинтетическом фосфорилировании. Было показано, что количество образующихся АТФ и НАДФ Нг, в результате циклического и нециклического фотофосфорилирования достаточно для восстановления СО2 до уровня углеводов в темповых реакциях без света. [c.136]
В фотохимической фазе фотосинтеза оОразуются сильные окис-лители и восстановители, участвующие в последующих ферментативных реакциях. Предотвращение рекомбинации этих соединений с потерей энергии в виде тепла возможно только при наличии определенной организации, определенной структуры хлоропласта. Прохождение световых и темновых реакций фотосинтеза также связано с определенным расположением участвующих в них систем на соответственных структурах. Поэтому приятно то огромное внимание, которое сейчас уделяется изучению строения хлоропластов и других структурных образований, в которых осуществляется весь процесс фотосинтеза или только часть составляодих его реакций. [c.93]
Важным звеном в цепи доказательств, связывающих световую фазу фотосинтеза с темновой ассимиляцией СОг в хлоропластах, были опыты, показывающие значение циклического и нециклического фотофосфорилирования. Нециклическое фотофосфорилирование дает три продукта световой фазы фотосинтеза Ог, НАДФ-Нг и АТФ. Циклическое фотофосфорилирование дает только АТФ, и участие этой реакции в ассимиляции СОг необходимо только тогда, когда АТФ нециклического фотофосфорилирования недостаточно для ассимиляции СОг до уровня углевода. Таким образом, ассимиляция СОг зависит от должным образом сбалансированного участия обоих видов фотофосфорилирования. [c.329]
Не останавливаясь подробно на световой фазе фотосинтеза [64], исследованной, главным образом, Кэлвиным и др., следует упомянуть, что важнейшими процессами здесь являются поглощение хлорофиллом квантов света и использование их энергии для синтеза богатых энергий пирофосфатных связей (АТФ, НАДФ-Н2) поглощаемая энергия света используется при разложении воды, кислород которой выделяется в виде О 2 как конечный продукт фотосинтеза, а водород используется для восстановления при участии АТФ и НАДФ-Н фосфоглицериновой кислоты на второй, темновой стадии фотосинтеза. [c.204]
Уровень фотосинтетической активности клетки снижается (рис. 2O, кривая 2, рис. За, кривая I). Сравнение газообмена интактных листьев и водорослей с лшинесцентными характеристиками хлорофилла а показало, что в этот мсжиент не изменяется пигментный состав фотосинтетического аппарата, не нарушается поступление энергии от светособирающих пигментов в реакционные центры, не тормозится существенно скорость фотосинтетического электронного транспорта. Однако в это время отказывает один из гомеостатических механизмов фотосинтетического аппарата, регулирующий оптимальное распределение световой энергии между фотосистемами. В результате во время лаг-фазы фотосинтеза тормозится светоиндуцированный структурный переход тилакоидных мембран из «темнового» состояния 1 в «световое» состояние 2. Об этом свидетельствовало уменьшение светозависимого изменения спектров флуоресценции при температуре жидкого азота (рис. За, кривая 2). [c.30]
Световые и темные реакции фотосинтеза. | Питер Майлз
Включая Фотосистемы, I и II.
Фотосинтез — это двухэтапный процесс: световые реакции с использованием фотонов световой энергии для перевода молекул в более высокое энергетическое состояние и темные реакции, которые используют энергию молекул для связывания углекислого газа с 6 углеродными сахарами.
Реакция темноты не обязательно должна происходить в темноте, она также называется независимой от света реакцией.
Эти реакции иногда называют фотосинтезом 1 (свет) и фотосинтезом 2 (темнота), не путать с фотосистемами I и II, см. Ниже.
Фотосинтез — это автотрофный процесс, фундаментальный для всего живого на Земле, преобразовывающий солнечную энергию в химическую энергию, а также сахара или углеводы.
Схематическое изображение хлоропластов. Изображение — Pixy.org Creative Commons.
Фотосинтез происходит в специализированных органеллах клетки, называемых хлоропластами. Хлоропласты содержат пигменты хлорофилла, которые отвечают за зеленый цвет листьев. Свет улавливается и используется для преобразования углекислого газа из атмосферы в сахара для использования растениями.
При фотосинтезе углекислый газ CO2 расщепляется на углерод C и кислород 02. Это происходит в присутствии света одной молекулой CO2, соединяющейся с двумя молекулами воды h3O. Атомы кислорода в воде высвобождаются вместе с одним h3O и углеводом, обычно производятся триозные (3 углерода) сахара.
Изобилие жизни зависит от этой химической реакции:
3 CO2 + 6 h30 + свет -> C3H6O3 + 3 O2 + 3 h30
Углекислый газ + вода + свет -> сахар + кислород + вода
Это также часто пишут так:
6CO2 + 12h30 + свет -> C6h22O6 + 6O2 + 6h3O
Эта реакция происходит в три стадии:
Первая — это поглощение фотонов света молекулами пигмента хлорофилла, при этом энергия света передается в реакционные центры фотосистемы.
На второй стадии электроны высвобождаются при расщеплении воды с образованием протонов и кислорода. Затем электроны переносятся (переносится только энергия, а не электрон) по цепи переноса электронов в тилакоидной мембране хлоропласта. Это производит высокоэнергетические соединения НАДФН из НАДФ + и АТФ из АДФ, готовые к третьей стадии.
Пока что реакции являются световыми реакциями фотосинтеза, поскольку они требуют ввода света и его энергии.
Третья стадия — использование НАДФН и АТФ в фотосинтетическом сокращении углеродного цикла, цикла Кальвина, для ассимиляции СО2 и производства триозных сахаров.Фермент, действующий как катализатор в этой реакции, — Рубиско.
Эта третья стадия может работать со светом или без него и известна как темновая реакция фотосинтеза.
Растения сгруппированы по фотосинтезу C3, C4 или CAM в зависимости от используемых ими фотосинтетических процессов. Растения C3 используют цикл Кальвина, описанный выше, с этими стадиями, происходящими одновременно, и включает в себя многие растения с умеренным климатом. См. Мою статью о C3, C4, CAM Photosynthesis.
Световые реакции фотосинтеза показаны как представление структур, вовлеченных в просвет тилакоида.Изображение — Wikimedia Commons.
Ниже приводится более подробное объяснение двух световых реакций.
Внутри органелл хлоропласта есть отделы, называемые просветом тилакоида.
Мембрана органеллы хлоропласта показана на изображении выше двумя рядами желтых точек.
Фотон света (слева) улавливается антенным комплексом в клетках мезофилла растений и называется фотосистемой 2, здесь обозначен как ФСII.
Световая энергия передается в реакционный центр фотосистемы, это группа белков с парой молекул хлорофилла под названием P680.
В реакционном центре электрон возбуждается световой энергией, и энергия движется вправо на диаграмме вдоль цепи переноса электронов. В конечном итоге это приводит к удалению электрона из молекулы воды, изображенной в левом нижнем углу диаграммы.
Когда два электрона возбуждаются и удаляются из воды, образуются ионы водорода, протоны H + и кислород.
Некоторые из возбужденных электронов передают свою энергию ионам H + в нижней части диаграммы.
В PSI входит другой фотон света, возбуждая электрон до еще более высокого состояния, P700, а затем передает свою энергию молекуле НАДФН, это Фотосистема I.
Нумерация фотосистем II и I является исторической, поскольку фотосистема, которую я открыл и назвал первой. Хотя на диаграмме он показан вторым, на практике они работают одновременно. Фотосистема II имеет оптимальное поглощение света при 680 нм, следовательно, P680, а фотосистема I при 700 нм, P700.
Протоны H + перемещаются через мембрану через белковые ворота, используя энергию PSII, затем эта энергия теряется на АДФ, перезаряжая ее до АТФ. Этот белок называется АТФ-синтазой (синтезирует АТФ).
Схема светоэнергетических реакций фотосинтеза. Изображение — Wikimedia Commons.
На изображении выше фотоны световой энергии вызывают возбуждение электрона в PSII P680, затем он высвобождает эту энергию, перемещаясь по цепи переноса электронов и через мембрану, синтезирующую АТФ, затем электрон становится еще более возбужденным на PSI P700 и высвобождает энергию для образования НАДФН. Это называется Z-диаграммой (Z-образная форма на ее стороне).
Хлорофилл а и хлорофилл b, длины волн света.Изображение — Wikimedia Commons.
Хлорофилл — это пигмент, а основным пигментом, поглощающим свет, является «хлорофилл а», который поглощает синий и красный свет. Другой пигмент хлорофилла, «хлорофилл b», поглощает свет с другими длинами волн, сине-зелеными и желто-оранжевыми, и в реакционном центре передает энергию «хлорофиллу а». Это дает более широкий спектр поглощаемых длин волн света, в основном в диапазоне видимого света.
Для получения дополнительной информации это полезная лекция:
https: // www.khanacademy.org/science/biology/photosynthesis-in-plants/the-calvin-cycle-reactions/v/photosynthesis-calvin-cycle
Ссылка:
Knox, B., Ladiges, P., Evans, B. , Сэйнт Р., (2014). Биология: австралийский фокус (5-е изд.). Новый Южный Уэльс. Австралия: McGraw-Hill Education. Книга.
Реакции на свет и темноту в фотосинтезе
Автор: Кэти З.
Фотосинтез — это процесс, при котором зеленые растения поглощают солнечную энергию с помощью воды и углекислого газа и преобразуют ее в химическую энергию для производства (синтеза) углеводов (в частности, глюкозы) и кислорода.Фотосинтез можно описать следующей формулой:
6CO 2 + 6H 2 O + солнечный свет (световая энергия) → C 6 H 12 O 6 + 6O 2
Если вам нужен более подробный обзор, ознакомьтесь с нашим уроком по фотосинтезу, прежде чем читать дальше.
«Независимые от света» или реакции темноты происходят в строме хлоропластов. Это также известно как цикл Кальвина . Поскольку эти процессы могут происходить только в хлоропласте (пластида, заполненная хлорофиллом в зеленых растениях), фотосинтез может происходить только в зеленых растениях!
Первый общий принцип фотосинтеза состоит в том, что световая энергия солнца преобразуется в химическую энергию и сохраняется в связях глюкозы (углеводного углеводорода) для последующего использования растением и / или организмом, поедающим растение.
Второй общий принцип фотосинтеза заключается в том, что атомы углерода, кислорода и водорода берутся из молекул углекислого газа и воды, расщепляются и превращаются в новые вещества: углеводы (в частности, глюкозу) и газообразный кислород (чтобы мы могли дышать, уф! ). Эта реакция представляет собой перенос вещества: углекислого газа из атмосферы, воды из почвы или атмосферы в сахар в растении и кислород обратно в атмосферу.
Светозависимые реакции
Первая часть процесса происходит в тилакоидах из хлоропластов и представляет собой «светозависимые» реакции: фотосистемы I и II поглощают фотоны солнечного света и обрабатывают их через мембраны тилакоидов одновременно.Фотоны возбуждают электроны в хлорфилле, которые затем движутся по цепи переноса электронов и заставляют НАДФ- соединяться с Н +, образуя НАДФН. В то же время, АДФ (аденозиндифосфат) возник в результате реакции темноты, а третья фосфатная цепь связана с образованием АТФ (аденозинтрифосфат), который затем питает цикл Кальвина. Помните, что АТФ — важный источник всей клеточной энергии.
Теперь мы считаем, что весь кислород, выделяемый при фотосинтезе, поступает из молекул воды, а все атомы кислорода, образующие углеводы, происходят из молекул углекислого газа.Другими словами, во время светозависимой реакции молекула воды распадается, образуя два иона H + и половину молекулы кислорода. Остальную часть молекулы кислорода мы получаем, когда разрушается другая молекула воды.
Темная реакция
Темные реакции также известны как цикл Кальвина, цикл Кальвина-Бенсона и светонезависимые реакции. Дело в том, что они не , а требуют солнечного света для завершения своего процесса.
После того, как АТФ образуется в первой части фотосинтеза, чтобы живые существа могли расти, воспроизводиться и восстанавливать себя, неорганическая форма CO 2 должна превратиться в углевод.Это происходит во время цикла Кальвина в строме (заполненная жидкостью внутренняя часть хлоропласта). АТФ и НАДФН соединяются с CO 2 и водой, образуя конечный продукт — глюкозу. ADP и NADPH + возвращаются в светозависимую сторону, чтобы начать процесс заново.
Помните, что в темное время суток растения не могут осуществлять фотосинтез, поэтому они производят клеточное дыхание в митохондриях, как и все живые организмы.
Словарь
- хлорофилл: зеленый пигмент в растении, который может улавливать фотоны
- хлоропласт: пластида, содержащая хлорофилл
- пластида: органелла в клетке
- rubisco: важный фермент для присоединения CO 2 к 5-углеродному сахару
- устьица: маленькие поры в растительном листе
- строма: внутренняя часть хлоропласта заполнена жидкостью
- тилакоид: небольшой мешочек в хлоропласте, который складывается как монеты
Список литературы
Какова реакция фотосинтеза на свет и темн
Понимать важность и роль хлоропластов, хлорофилла, граны, тилакоидных мембран и стромы в фотосинтезе
Местоположение, значение и механизмы фотосинтеза.Изучите роль хлоропластов, …
Британская энциклопедия, Inc.
Выписка
РАССКАЗЧИК: Перемещение воды от корней к листьям — это проблема, которую наземным растениям пришлось преодолеть. Но есть преимущество у растения, которое отращивает листья на стеблях и высоких ветвях. Свет легче проникает к листьям, что важно для фотосинтеза.
Фотосинтез — это процесс накопления энергии, который важен как для животных, так и для растений.Свободная энергия солнечного света улавливается и хранится в тканях растений в виде сахаров и крахмалов. Расположение листьев на стеблях гарантирует, что растение максимально использует доступный свет.
Ключ к фотосинтезу — это хлоропласт. В средней ткани листа находится большое количество хлоропластов. При слабом освещении они распределяются довольно равномерно. Но яркий свет заставляет их перемещаться в менее открытое положение.
Наиболее заметной характеристикой хлоропластов является их зеленый цвет.Цвет происходит от пигмента под названием хлорофилл, который сконцентрирован в гране.
Мы можем показать, что без хлорофилла фотосинтез невозможен. Сначала отвариваем лист, чтобы закрепить. Затем опускаем в спирт. Кипячение листа и спирта удаляет хлорофилл. Несколько капель йода вскоре приобретут сине-черный цвет, который указывает на то, где в листе присутствует крахмал. Мы видим, что крахмал вырабатывается только в тех частях листа, которые были зелеными, то есть там, где присутствовал хлорофилл.
Химический анализ хлоропластов показывает, что хлорофилл и ряд других соединений систематически организованы в мембранах тилакоидов. Когда свет попадает на мембраны тилакоидов, хлорофилл и другие связанные пигменты окисляются, что вызывает высвобождение электронов. Электронный поток, инициированный этим вводом световой энергии, связан с образованием аденозинтрифосфата или АТФ. Реакция известна как световая реакция фотосинтеза.
Поскольку хлорофилл теряет электроны, их необходимо заменить.Растение делает это, расщепляя молекулы воды и используя электроны из водорода, оставляя кислород в качестве побочного продукта. Когда водные растения, такие как элодея, фотосинтезируют, легко увидеть, как выделяются пузырьки отработанного кислорода.
Молекулы АТФ — это молекулы, запасающие энергию. Они обеспечивают энергию, которая позволяет растению объединять углекислый газ с другими соединениями для производства сахара. Эта активность происходит в строме хлоропласта и не требует света. Поэтому это известно как темная реакция фотосинтеза.
Темные реакции фотосинтеза
Эта страница создана Джимом Бидлаком, Университет Центральной Оклахомы, на основе оригинальной деятельности Бьёрна Виднеса, Норвежский центр научного образования, Като Тандберг, Университет Осло, Венче Эрлиен, Норвежский центр научного образования, Грэм Кент, Грант-колледж, Джойс Диван, Политехнический институт Ренсселера, Джон Кирк, Science Graphics, Родни Бойер, John Wiley & Sons Publishers, Inc., Майк Тайри, Технологический институт штата Вирджиния, и Джон Уайтмарш и Говинджи, Университет Иллинойса в Урбана-Шампейн.
Профиль автора
Это мероприятие прошло экспертную оценку.
Это мероприятие прошло экспертную оценку, в ходе которой представленные мероприятия сравниваются с набором критериев. В коллекцию были добавлены мероприятия, соответствующие этим критериям или отредактированные для соответствия этим критериям. Чтобы узнать больше о критериях обзора, см. [Http://taste.merlot.org/evaluationcriteria.html]. Более подробную информацию о процессе экспертной оценки можно найти на [http: // вкус.merlot.org/peerreviewprocess.html].
Эта страница впервые обнародована: 11 августа 2010 г.
Этот материал был первоначально разработан
Мерло
в рамках сотрудничества с
Педагогическая служба SERC.
Сводка
Рисунки и визуализации используются, чтобы помочь участникам представить себе место и шаги, участвующие в темных реакциях фотосинтеза.
Цели обучения
- Найдите место внутри листа, где происходят темные реакции фотосинтеза.
- Узнайте, каким образом диоксид углерода первоначально соединяется с 3-фосфоглицериновой кислотой с образованием накопленных углеводов.
- Перечислите важность фермента рибулозобифосфаткарбоксилазы / оксигеназы и его вклад в этапы цикла Кальвина.
- Поймите, как темные реакции способствуют накоплению энергии в виде фиксированных углеводов.
Контекст использования
Эта стратегия обучения темновым реакциям фотосинтеза предусматривает одно- или двухчасовую презентацию с рисунками и визуализацией того, как углекислый газ «фиксируется» циклом Кальвина для облегчения накопления энергии в форме углеводов.
Описание и учебные материалы
- Используйте настоящий лист двудольных растений или нарисуйте его изображение на листе бумаги и разрежьте его пополам. Объясните, что световая и темная реакции фотосинтеза происходят внутри специализированных клеток, которые находятся на краю листа и пересекают внутреннюю часть.
- Нарисуйте край листа, показывая несколько слоев клеток внутри, включая верхний эпидермис, паренхиму палисадной, губчатую паренхиму, среднюю жилку с сосудистой тканью и нижний эпидермис см. Http: // www.merlot.org/merlot/viewMaterial.htm?id=281356 для обзора того, где происходят световые реакции в листе, а затем см. http://www.merlot.org/merlot/viewMaterial.htm?id=481172 для получения подробной информации о темные реакции.
- Укажите место фотосинтетических реакций в палисаде и губчатой паренхиме и нарисуйте одну клетку, изобразив несколько хлоропластов в цитоплазме этой клетки. Объясните, что реакции фотосинтеза происходят в хлоропластах.
- Нарисуйте хлоропласт, показывая строму и тилакоиды.Объясните, что темные реакции фотосинтеза происходят внутри стромы http://www.merlot.org/merlot/viewMaterial.htm?id=481172. Некоторые участники могут лучше понять, что хлоропласт «подобен» тарелке со стопкой блинов — блины представляют тилакоиды, а сироп — строму.
- Объясните, что углекислый газ проникает через устьичный аппарат и диффундирует в клетки паренхимы, где он может участвовать в реакциях цикла Кальвина.
- Укажите, что фермент рибулозобисфосфаткарбоксилаза / оксигеназа (RUBISCO) катализирует соединение диоксида углерода с рибулозобисфосфаткарбоксилазой / оксигеназой (RUBISCO) с образованием двух молекул 3-фосфоглицериновой кислоты.
- Укажите, что фотосинтезирующие организмы (как водные, так и наземные) многочисленны на Земле и что этого фермента очень много в растениях, что делает его самым распространенным ферментом на Земле.
- Покажите шаги и попросите участников нарисовать общие шаги цикла Кальвина, см. Http://www.merlot.org/merlot/viewMaterial.htm?id=79769 и, для более подробной информации об отдельных стадиях и задействованных молекулярных структурах, см. http://www.merlot.org/merlot/viewMaterial.htm?id=481167.
- Объясните, что фермент RUBISCO не всегда связывает углекислый газ, и кислород может конкурировать с углекислым газом, что приводит к процессу, называемому фотодыханием. См. Ссылку в последнем разделе на http://www.merlot.org/merlot/viewMaterial.htm?id=80033.
- Кратко объясните, как определенные растения, называемые растениями C-4 (в отличие от растений C-3), имеют фермент фосфоенолпируват (PEP) карбоксилазу, и этот фермент имеет более высокое сродство к диоксиду углерода, что является одной из основных причин, почему Установки C-4 могут быть более эффективными в сухом жарком климате http: // www.merlot.org/merlot/viewMaterial.htm?id=444380.
Вспомогательные файлы:
Учебные заметки и советы
Эта обучающая стратегия предлагает более практический подход к темным реакциям фотосинтеза, который помогает студентам визуализировать, как углекислый газ попадает в лист и преобразуется в запасенную энергию. Обычно студентам требуется две лекции, чтобы полностью понять, когда и как возникают эти реакции. С помощью рисунков и визуализаций клеток листа и происходящих реакций учащиеся получают более практическое представление о том, как происходят эти процессы.Прежде чем приступить к этой теме, участники должны иметь некоторое представление о морфологии растений и клеточной биологии. Обычно есть хорошее понимание того, где происходят реакции, но немного сложнее понять конкретные шаги. Анимации и визуализации этих тем (см. Ссылки и ресурсы ниже), перемежающиеся во время обсуждения, помогают участникам продолжать активно участвовать в процессе обучения.
Оценка
Участники могут быть проверены на понимание этого учебного материала с помощью экзаменов с несколькими вариантами ответов, коротких ответов или сочинений.Несколько примеров вопросов включены в Рабочую таблицу, озаглавленную «Вопросы — Темные реакции фотосинтеза».
Ссылки и ресурсы
Описание MERLOT и ссылка на «Растения C3, C4 и CAM», где представлена информация о фотодыхании и альтернативных путях у растений C4. См. Http://www.merlot.org/merlot/viewMaterial.htm?id=444380
.
Описание MERLOT и ссылка на «Цикл Кальвина (фотосинтез)», который представляет собой сайт, на котором представлена анимированная трехэтапная версия темных реакций фотосинтеза.См. Http://www.merlot.org/merlot/viewMaterial.htm?id=79769
Описание MERLOT и ссылка на «Цикл Кальвина — фотосинтетические реакции углерода», в котором содержатся подробные сведения о каждом из этапов цикла Кальвина, молекулярные структуры и информация об участвующих ферментах. См. Http://www.merlot.org/merlot/viewMaterial.htm?id=481172
.
Описание MERLOT и ссылка на «Темные реакции фотосинтеза», в которых представлена анимация цикла Кальвина, а также детали задействованных молекулярных структур.См. Http://www.merlot.org/merlot/viewMaterial.htm?id=481167
.
Описание MERLOT и ссылка на «Интерактивное анимированное руководство по фотосинтезу», которое включает обзор световых и темных реакций фотосинтеза, а также фотодыхания. См. Http://www.merlot.org/merlot/viewMaterial.htm?id=80033
.
Описание MERLOT и ссылка на «Видео о фотосинтезе», которое предоставляет отличный обзор и руководство о том, где происходит фотосинтез в листе. См. Http: //www.merlot.org / merlot / viewMaterial.htm? id = 281356
Описание MERLOT и ссылка на «Фотосинтетический процесс», которая включает исчерпывающий документ о фотосинтезе и ссылки на все рисунки из оригинальной статьи. См. Http://www.merlot.org/merlot/viewMaterial.htm?id=85664
Скорректированные световые и темные циклы могут оптимизировать фотосинтетическую эффективность при выращивании водорослей в фотобиореакторах
Abstract
Биотопливо из водорослей представляет большой интерес как возобновляемые источники энергии для замены, по крайней мере частично, ископаемого топлива, но все еще необходимы большие исследовательские усилия для оптимизации параметров роста для разработки конкурентоспособных крупномасштабных систем выращивания.Одним из факторов, существенно влияющих на производительность, является доступность света. Световая энергия полностью поддерживает рост водорослей, но при чрезмерном освещении приводит к окислительному стрессу. В этой работе влияние интенсивности света на рост и липидную продуктивность Nannochloropsis salina было исследовано в плоском фотобиореакторе, предназначенном для минимизации самозатенения клеток. Влияние различной интенсивности света изучали как при непрерывном освещении, так и при чередовании световых и темных циклов на различных частотах, которые имитируют изменения освещенности в фотобиореакторе из-за перемешивания.Результаты показывают, что Nannochloropsis может эффективно использовать даже очень интенсивный свет при условии, что темные циклы позволяют повторно окислять переносчики электронов фотосинтетического аппарата. Если чередование света и темноты не является оптимальным, водоросли подвергаются радиационному повреждению, и продуктивность фотосинтеза значительно снижается. Наши результаты показывают, что в фотобиореакторе для выращивания водорослей оптимизация перемешивания имеет важное значение для обеспечения эффективного использования световой энергии водорослями.
Образец цитирования: Сфорца Э., Симионато Д., Джакометти Г.М., Бертукко А., Морозинотто Т. (2012) Регулируемые световые и темные циклы могут оптимизировать фотосинтетическую эффективность при выращивании водорослей в фотобиореакторах. PLoS ONE 7 (6):
e38975.
https://doi.org/10.1371/journal.pone.0038975
Редактор: Эндрю Уэббер, Университет штата Аризона, Соединенные Штаты Америки
Поступила: 17 января 2012 г .; Принята к печати: 14 мая 2012 г .; Опубликован: 20 июня 2012 г.
Авторские права: © 2012 Sforza et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: TM выражает признательность за финансовую поддержку Университета Падуи (грант CPDA089403) и CUIA. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Фотосинтезирующие организмы привлекают все большее внимание в связи с их возможным использованием в производстве биотоплива для частичной замены ископаемого топлива [1] — [5]. Одна из реализуемых в настоящее время возможностей — производство биодизеля из масличных семян, хотя некоторые проблемы все еще остаются открытыми, например, ограниченная урожайность сельскохозяйственных культур и конкуренция с производством продовольствия за пахотные земли [6]. Одна интересная альтернатива — использование некоторых видов водорослей, которые способны накапливать большие количества липидов и, таким образом, могут представлять собой подходящее сырье для производства биодизеля.По оценкам, потенциальная продуктивность этих организмов на площади в десять раз выше, чем у сельскохозяйственных культур, и, таким образом, они являются очень многообещающим источником для производства биомассы в среднесрочной перспективе. Тем не менее, необходимы интенсивные исследования, чтобы в полной мере использовать этот потенциал в крупномасштабных системах культивирования [4], [5], [7].
Водоросли — это группа организмов с очень большой биологической изменчивостью [3]: виды рода Nannochloropsis особенно интересны в этом контексте из-за их способности накапливать большое количество липидов, концентрация которых может достигать 65–70 % от общего сухого веса [8] — [10].Было показано, что такое массовое накопление липидов активируется в ответ на стрессы, такие как азотное или фосфорное голодание или воздействие избыточного света [10] — [14].
Чтобы использовать эти организмы для крупномасштабного производства биотоплива, необходимо детально исследовать, как различные параметры влияют на производительность. Среди нескольких возможностей свет является основным фактором, поскольку он обеспечивает всю энергию, необходимую для поддержания метаболизма, но, если присутствует в избытке, может привести к образованию вредных активных форм кислорода (АФК) и окислительному стрессу [15].
Когда клетки подвергаются воздействию света, один компонент фотосинтетического аппарата, фотосистема II (ФСII), постоянно повреждается и должен постоянно восстанавливаться путем повторного синтеза поврежденных компонентов [16], [17]. Фотосинтезирующие организмы, подвергающиеся воздействию насыщающего света, также могут уменьшить окислительное повреждение за счет теплового рассеивания избыточной энергии [15]. Как ремонт поврежденных фотосистем, так и рассеивание энергии снижают общую эффективность использования света и должны быть сведены к минимуму, если мы хотим добиться более высокой производительности.
Водоросли в фотобиореакторах неизбежно подвергаются воздействию переменного падающего света из-за суточных и сезонных различий в облучении. Виды Nannochloropsis , как было показано, способны расти в большом диапазоне интенсивности освещения, приспосабливаясь к изменяющимся условиям, оптимизируя состав своего фотосинтетического аппарата для облучения [8], [18], [19]. Наблюдаемые реакции на различную интенсивность света включают модуляцию пигментного состава и концентрации ферментов, участвующих в фиксации углерода [19], [20].
Следует также отметить, что культуры водорослей в фотобиореакторах имеют высокую оптическую плотность, что приводит к сильно неоднородному распределению света. Как следствие, открытые на поверхности клетки поглощают большую часть света, оставляя только остаточную часть излучения для клеток под ними, которые, таким образом, ограничены в своем росте. Вместо этого внешние слои легко подвергаются воздействию избыточного света, и они должны термически рассеивать до 80% своих фотонов, чтобы избежать радиационного повреждения. Это значительно снижает эффективность их использования света.Следуя этой идее, было показано, что общая эффективность фотобиореакторов увеличивается, когда световой путь уменьшается, уменьшая неоднородность распределения света [21]. К сожалению, очень короткие световые пути трудно реализовать на крупных предприятиях по практическим и экономическим причинам.
Еще один фактор, который следует учитывать, это то, что клетки в фотобиореакторах быстро перемешиваются и резко переходят от темноты к полному солнечному свету [22]. Циклы перемешивания сильно различаются в зависимости от системы выращивания, и скорость перемешивания в миллисекундной шкале времени может быть достигнута в закрытых трубчатых реакторах или фотобиореакторах на основе оптического волокна благодаря турбулентным завихрениям [22].Напротив, в водоемах с водостоком ламинарные потоки часто влияют на эффективное перемешивание [23].
Было высказано предположение, что чередование светлых и темных периодов способствует эффективности фотосинтеза [23] — [32]. В некоторых случаях была показана возможность достижения интеграции света, что означает, что флуктуирующий свет можно использовать с той же эффективностью, что и непрерывный свет равной средней интенсивности [31]. Однако эксперименты, описанные в литературе, сосредоточены на очень разных диапазонах частот вспышек, от 5 Гц [31] до 1 кГц [27], [33], что затрудняет полное сравнение результатов.Кроме того, в то время как в некоторых экспериментах оценивались эффекты вспышки только на выделение фотосинтетического кислорода [29], [33] — [35], другие оценивали более долгосрочные эффекты, такие как скорость роста [26], [27], [32], которые снова влияли возможность объединения данных.
Эксперименты с фотобиореакторами также предполагают, что скорость перемешивания влияет на продуктивность фотосинтеза и, в частности, что последняя увеличивается с частотой чередования света / темноты [25], [36], [37]. Однако этот вывод не всегда подтверждался, и другие отчеты показывают, что более высокие скорости смешивания не улучшают эффективность фотосинтеза [38], [39], что ясно указывает на необходимость более глубокого понимания влияния световых флуктуаций на продуктивность фотосинтеза.
В данной работе влияние условий освещения на рост и липидную продуктивность Nannochloropsis salina оценивалось в плоском фотобиореакторе, предназначенном для минимизации самозатенения. Водоросли выращивали при различных условиях непрерывного освещения, но также с циклами темноты / света различной интенсивности и частоты, имитируя изменения освещения, происходящие в фотобиореакторе в результате перемешивания. Результаты показали, что при надлежащей оптимизации перемешивания фотобиореактор может использовать даже очень интенсивное облучение с высокой эффективностью.Вместо этого, если чередование темного и светлого не установлено тщательно, импульсный свет может подавить рост.
Результаты
Рост
Nannochloropsis salina на плоской панели при различной интенсивности освещения
Влияние интенсивности света на рост Nannochloropsis salina оценивали в плоском фотобиореакторе, предназначенном для уменьшения влияния самозатенения на наблюдаемые темпы роста и продуктивность (Рисунок S1). Все эксперименты проводились с культурами с низкой оптической плотностью, чтобы дополнительно снизить влияние самозатенения на кинетику роста.CO 2 и азот (в виде нитрата) были предоставлены в избытке, чтобы избежать ограничения роста из-за этих питательных веществ и выявить только эффекты освещения. Рисунок 1 показывает, что интенсивность света, достигающего культуры, сильно влияла как на скорость роста, так и на конечную концентрацию клеток, достигаемую в стационарной фазе. Между 5 и 150 мкЭ · м −2 с −1 скорость роста увеличивалась с увеличением интенсивности света, достигая максимума при 150 µE · м −2 с −1 . Выше этого предела любое увеличение света подавляло.При наиболее интенсивном освещении (350 и 1000 мкЭ · м −2 с −1 ) кривые роста также показали заметную лаг-фазу, которая не проявлялась в других условиях (рис. 1A). Однако через несколько дней клетки Nannochloropsis возобновили рост даже в этих условиях.
Рисунок 1. Рост Nannochloropsis salina при различной интенсивности света в фотобиореакторе с плоским дном.
A) Кинетика роста водорослей, подвергшихся воздействию света различной интенсивности от 5 до 1000 мкЭ · м −2 с −1 .Данные с 5, 50, 120, 150, 250, 350 и 1000 мкЭ · м −2 с −1 показаны голубым, черным, красным, зеленым, темно-синим, розовым и желтым цветом соответственно. B) Параметры роста, определенные по кривым в A, удельная скорость роста (черные квадраты) и концентрация клеток после 8 дней роста (красные кружки). C) Концентрации клеток, указанные в B, нормированные на интенсивность света: это можно использовать в качестве приблизительной оценки продукции биомассы, поскольку не наблюдалось значительного отклонения размера клеток или соотношения DW / клетки.
https://doi.org/10.1371/journal.pone.0038975.g001
Когда продуктивность биомассы, выраженная как конечная концентрация клеток, нормализуется по интенсивности света, четко идентифицируются две отдельные области. Это соотношение является постоянным до 150 мкЭ · м −2 с −1 , что указывает на то, что энергия излучения используется с сопоставимой эффективностью во всех культурах в этом диапазоне. Вместо этого при превышении предела 150 мкЭ · м -2 с -1 соотношение резко уменьшается, показывая, что, хотя клетки все еще способны демонстрировать значительный рост, они используют световую энергию с меньшей эффективностью (рис. 1B).
Влияние импульсного света на рост
Nannochloropsis salina
Как уже отмечалось, водоросли в фотобиореакторе подвергаются естественным изменениям освещенности, но также и циклам темноты / света из-за перемешивания. Соответственно, клетки быстро перемещаются из регионов, где они полностью открыты для солнечного света, в другие, где они находятся практически в темноте. Чтобы понять, как водоросли реагируют на эти условия, клетки Nannochloropsis salina выращивали в прямоугольных циклах свет / темнота для имитации перемешивания.Все эксперименты проводились с получением среднего общего количества фотонов, всегда соответствующего 120 мкЭ · м -2 с -1 непрерывного света, значение выбрано, потому что оно представляет наивысшую интенсивность, при которой рост клеток все еще ограничен светом. Как только средняя интенсивность (I a ) излучаемого света была зафиксирована, можно было оценить влияние других параметров, таких как частота и интенсивность световых импульсов. Как показано в Таблице 1 и схематично на Рисунке S2, использовались вспышки двух разных интенсивностей, 350 и 1200 мкЭ · м -2 с -1 , и, чтобы обеспечить такое же общее количество энергии, свет был направлен на одну треть и одну десятую светового цикла соответственно (скважность (φ) 0.33 и 0,1). В обоих случаях было исследовано влияние разных частот изменения света, соответствующих разной продолжительности светлой и темной фаз (см. Таблицу 1).
При самых сильных вспышках (1200 мкЭ · м −2 с −1 ) выбор частоты световых импульсов оказал огромное влияние на характеристики роста. При 10 Гц скорость роста была такой же, как и у клеток, подвергавшихся постоянному умеренному освещению (120 мкЕ м -2 с -1 , фигура 2А, номенклатура представлена в таблице 1).В этих условиях клетки показали полную интеграцию света, что означает, что они использовали импульсный свет, а также непрерывное освещение [31]. Когда свет подавался импульсами с более низкими частотами, такими как 5 и 1 Гц, рост сильно тормозился, хотя общее количество света и интенсивность импульса были одинаковыми. В случае 1200-1 и 1200-5 Гц рост был даже медленнее, чем при постоянном интенсивном освещении (рис. 2A – C). Продуктивность биомассы, оцениваемая как количество клеток на единицу интенсивности света (рис. 2D), показала, что клетки с частотой 1200-1 и 1200-5 Гц используют свет со значительно меньшей эффективностью, хотя общее количество выделяемой энергии невелико.
Рис. 2. Кинетика роста водорослей в импульсном свете.
A – B) Nannochloropsis кривые роста в импульсном свете различной интенсивности и частоты, 1200 мкЭ · м −2 с −1 (10, 5, 1 Гц, соответственно красным, синим и зеленым, A) и 350 мкЭ · м −2 с −1 (10 и 30 Гц красным и синим, B). Кинетика при 120 мкЕ · м −2 с −1 непрерывный свет, представленный для сравнения (черный). C) Скорость роста (столбцы) и концентрация клеток после 8 дней роста (красные квадраты), экстраполированные из кривых A – B.Значения при 120 и 1000 мкЭ · м −2 с −1 при постоянной освещенности из рисунка 1 приведены для сравнения. D) Концентрация клеток в C, приведенная к интегрированной интенсивности света. 1200-10, 5, 1 Гц и 350-10, 30 Гц представлены темно-синим, розовым, голубым, красным и зеленым цветом соответственно.
https://doi.org/10.1371/journal.pone.0038975.g002
Аналогичные эксперименты были проведены также с 350 мкЭ м −2 с −1 вспышек. В одном случае i.например, при 350-30 Гц значения скорости роста и конечной концентрации клеток снова были эквивалентны непрерывным 120 мкЕ м -2 с -1 , показывая, что клетки достигли световой интеграции. В другом состоянии, то есть при 350-10 Гц, рост был подавлен, подтверждая, что частота смены света имеет огромное влияние на продуктивность биомассы.
Влияние условий освещения на фотосинтетический аппарат
Fv / Fm — полезный параметр для оценки эффективности фотосинтеза у водорослей и растений и, в частности, для выявления фотоингибирования из-за избыточного освещения [40].Fv / Fm отслеживали во всех культурах и клетках, выращенных при разных уровнях непрерывного света до 150 мкЕм -2 с -1 , и все они показали аналогичные значения Fv / Fm, около 0,62 ± 0,02 (рис. 3). При превышении этого предела снижение Fv / Fm коррелировало с увеличением интенсивности света, указывая на то, что клетки подвергались фотоингибированию.
Рис. 3. Зависимость фотосинтетической эффективности (Fv / Fm) от условий освещения.
Значения Fv / Fm в конце экспоненциальной фазы по сравнению между клетками, выращенными при непрерывном освещении разной интенсивности (черные квадраты) и импульсном свете разной интенсивности и частоты, 1200 мкЭ · м −2 с −1 (10, 5, 1 Гц, красные, зеленые и синие кружки), 350 мкЭ м −2 с −1 (10 и 30 Гц, розовые и голубые ромбы).Клетки при 5 мкЕ м -2 с -1 были слишком разбавлены, чтобы обеспечить надежные результаты.
https://doi.org/10.1371/journal.pone.0038975.g003
В экспериментах с импульсным светом Fv / Fm находилось в оптимальном диапазоне в обоих случаях, когда рост был хорошим, 1200 — 10 Гц и 350 — 30 Гц. Вместо этого во всех случаях с нарушением роста также наблюдалось снижение Fv / Fm, что указывает на то, что клетки также подвергались фотоингибированию, хотя они подвергались воздействию небольшого общего количества фотонов.
Нанохлоропсис , как и многие другие водоросли, реагирует на различные условия освещения, модулируя состав своего фотосинтетического аппарата. Эта реакция называется акклиматизацией [19], [41]. Одним из регуляций, обычно наблюдаемых у фотосинтезирующих организмов, подвергающихся воздействию света различной интенсивности, является изменение содержания хлорофилла (Chl) на клетку и соотношения каротиноид (car) / Chl. При избыточном освещении содержание Хл снижается, что снижает эффективность сбора света, и накапливаются каротиноиды, активные в защите от окислительного стресса.Как показано на рисунке 4, постоянный яркий свет снижает содержание Хл на клетку и увеличивает содержание каротиноидов.
Рис. 4. Ответ акклиматизации клеток, выращенных в непрерывном и импульсном свете.
Клетки, выращенные при различной интенсивности света, непрерывном или импульсном, по сравнению с их содержанием Chl на клетку (черный) и соотношением Chl / Car (красный), параметрами, указывающими на активацию реакции акклиматизации к условиям импульсного света.
https://doi.org/10.1371/journal.pone.0038975.g004
Вместо этого, четкие различия в световом ответе наблюдались в клетках при импульсном освещении, которые не накапливали большие количества каротиноидов и даже не увеличивали содержание Хл на клетку. Таким образом, клетки показали особую реакцию по сравнению с теми, которые подвергались одинаковому общему количеству света, но обеспечивались непрерывно. Этот ответ не зависел конкретно от частоты или продолжительности световых импульсов, поскольку подобное содержание пигмента наблюдалось в хорошо растущих клетках и в других, показывающих подавление света, за единственным исключением состояния 350-10 Гц.
Клетки, подвергнутые световому стрессу, накапливают липиды в избытке CO
2 Условия только при постоянном освещении
Было высказано предположение, что интенсивность света влияет на синтез липидов водорослей, а сильное освещение вызывает их накопление [1], [42]. Было обнаружено, что переход от контроля к условиям высокой освещенности усиливает накопление липидов также у видов Nannochloropsis [13], [14], [43].
Чтобы оценить, было ли это также так в испытанных здесь экспериментальных условиях, липидную продуктивность отслеживали во всех культурах (рис. 5).Во всех условиях ограниченного освещения до 150 мкЭ · м −2 с −1 клетки в конце фазы экспоненциального роста имели низкое содержание липидов, около 10% DW, что соответствует основному содержанию клеточных мембран [44] . При облучении более 150 мкЭ · м −2 с −1 содержание липидов увеличивалось, достигая максимума 70 ± 9% при 350 мкЭ · м −2 с −1 . Даже с учетом того, что гравиметрическая оценка содержания липидов, как предполагается, представляет риск завышенной оценки [45], эти данные подтверждают гипотезу о том, что сильное освещение стимулирует биосинтез липидов.
Рисунок 5. Оценка липидной продуктивности.
Зависимость выработки липидов от интенсивности освещения. Значения производительности при постоянном освещении (черные квадраты) по сравнению с показателями при световых вспышках 350 и 1200 мкЭ · м −2 с −1 на различных частотах.
https://doi.org/10.1371/journal.pone.0038975.g005
Интересно отметить, что при выращивании клеток в импульсном свете индукция накопления липидов не наблюдалась ни в одном из тестируемых условий, независимо от того, были ли клетки росли хорошо или нет.
Обсуждение
Влияние световых условий на продуктивность водорослей
Влияние светового излучения на продуктивность Nannochloropsis контролировали в реакторе с плоским слоем, предназначенном для минимизации самозатенения клеток. Поскольку другие основные факторы, влияющие на рост водорослей (азот и CO 2 ), подавались в избытке, эта система считалась оптимальной для выявления влияния освещения на продуктивность водорослей.
Одним из методов проверки правильности этого предположения является сравнение скорости роста и конечной клеточной концентрации.Первый измеряется в первые несколько дней кривой, тогда как концентрация биомассы зависит от того, когда прекращается дупликация клеток. При наличии значительного затенения клеток культуры с высоким освещением должны оказывать положительное влияние в поздней экспоненциальной фазе, достигая более высоких концентраций. Вместо этого на рисунке 1B показано, что скорость роста и конечная концентрация клеток демонстрируют очень похожую зависимость от интенсивности освещения, подтверждая предыдущее предположение, что эффекты затенения минимизированы в этой системе.
Зависимость роста от интенсивности света претерпевала первую фазу, во время которой облучение было ограничивающим, и вторую фазу, в которой свет оказывал тормозящее действие (рис. 1В). Это было ожидаемо, поскольку свет может ограничивать рост, но, если его избыток, приводит к окислительному стрессу [15]. Стоит отметить, что при максимальной тестируемой интенсивности (1000 мкЕ м -2 с -1 ) культуры показали рост, аналогичный таковому при 350 мкЕ м -2 с -1 , что указывает на то, что клетки могут защищают себя от такого сильного избытка света и при этом поддерживают значительное накопление биомассы.
Чтобы продемонстрировать влияние освещения на рост, было интересно проанализировать конечные значения концентрации клеток, нормированные на интенсивность освещения (рис. 1C). Поскольку никаких значительных отклонений в размере или весе клеток не наблюдалось, это соотношение представляет собой оценку продуктивности биомассы культуры. В этом случае, когда свет ограничивает рост, клетки явно используют энергию излучения с очень похожей эффективностью, возможно, с максимальной в этих условиях. Вместо этого после предела 150 мкЭ · м −2 с −1 производительность резко падает.Случай 250 µE m −2 s −1 представляет интерес, поскольку клетки все еще показывают хорошую скорость роста, близкую к значениям, найденным при 120 µE m −2 s −1 . Однако, поскольку световая энергия увеличилась более чем в два раза, эффективность использования света упала более чем на 50%. Реальный крупномасштабный фотобиореактор можно представить как состоящий из перекрытия нескольких из этих слоев: этот результат указывает на то, что когда большинство внешних клеток подвергаются сильному освещению, хотя они и способны справиться с возникающим в результате стрессом, они используют доступную энергию с более низкая эффективность.Это падение производительности большего количества внешних слоев, которые также поглощают большую часть световой энергии, определенно пагубно сказывается на общей производительности фотобиореактора.
Одна стратегия против этого ограничения предложена экспериментами с импульсным светом, которые показали, что даже сильный свет, превышающий точку насыщения фотосинтеза, может эффективно использоваться для роста, о чем свидетельствует тот факт, что клетки одинаково хорошо росли при 120 мкЭ · м −2 с −1 и 1200-10 Гц.Обратите внимание, что при 120 мкЭ · м −2 с −1 свет все еще ограничивает рост, как показано на Рисунке 1B – C, что означает, что при этом оптимальном чередовании света и темноты клетки могут использовать всю энергию импульсного света с той же эффективностью, которую они достигают при непрерывном слабом освещении [25] — [27], [31]. Это ясно показано, если отметить, что количество ячеек на единицу света одинаково при 1200-10, 350-30 Гц и при постоянной низкой освещенности (рис. 2D). Такая высокая эффективность возможна благодаря тому, что фотохимические промежуточные продукты, образующиеся при короткой вспышке интенсивного света, могут дополнительно обрабатываться ферментативными реакциями в течение следующего темного периода, так что клетки выполняют интеграцию полученной световой энергии во времени.
Однако аналогичные эксперименты на разных частотах также показали, что чередование темноты и света может быть вредным, о чем свидетельствует ингибирование роста, наблюдаемое на кривых 1200-1 и -5 Гц. Эти клетки показали снижение значений Fv / Fm, подобное тому, которое наблюдается при постоянном сильном освещении, что указывает на то, что ингибирование роста происходит из-за фотоингибирования. Что еще более важно, когда учитывалось количество клеток на единицу света, клетки, растущие с частотой 1200-1 и −5 Гц, использовали свет с очень низкой эффективностью.Например, в эксперименте 1200-1 Гц продуктивность биомассы была такой же низкой, как в 1000 мкЭ · м -2 с -1 непрерывных световых культур, хотя общая обеспеченная энергия была в 8,3 раза ниже. По-видимому, в этих случаях клетки работают хуже, чем те, которые подвергаются непрерывному свету, что показывает, что чередование света и темноты также может снизить эффективность роста.
В экспериментах с переменным светом следует отметить, что аналогичные результаты были получены со световыми вспышками 1200 и 350 мкЭ · м −2 с −1 , что указывает на то, что интенсивность световых импульсов не имеет большого влияния (рис. 2С).Данные также показывают, что частота сама по себе не является основным параметром, определяющим влияние света. Напротив, условия с наибольшим ростом (1200 мкЭ м −2 с −1 — 10 Гц и 350 мкЭ м −2 с −1 -30 Гц) имеют одинаковую длину фаза освещения, которая, таким образом, оказывает наибольшее влияние на продуктивность биомассы среди рассматриваемых здесь параметров.
Оптимальная длительность световых импульсов оказалась около 10 мс, что согласуется с предполагаемой скоростью обновления PSII в целых клетках [4], [46].Соответственно, после поглощения фотона фотосистемой требуется 1–15 мс для перезагрузки системы, прежде чем она будет готова к приему следующего фотона [22]. Если освещение такое короткое, большинство фотонов используется для фотосинтеза и не приводит к образованию АФК, которые затем вызывают фотоингибирование. Эти результаты показывают, что даже сильный свет не вызывает повреждений, если длится непродолжительное время. И наоборот, более длительная выдержка позволяет генерировать АФК и повреждать, и в этом случае резкие изменения освещенности, которым подвергаются клетки, так же вредны для фотосинтетического аппарата, как и постоянный яркий свет.
Еще одно наблюдение состоит в том, что в условиях импульсного освещения активируется своеобразная реакция акклиматизации. Этот ответ в значительной степени не зависит от частоты или продолжительности световых импульсов, поскольку аналогичное содержание пигмента наблюдалось в хорошо растущих клетках и в других (1200-1 и 1200-5 Гц), а также в тех, которые демонстрировали подавление света, за исключением уровня 350-10 Гц. Эти результаты указывают на особый тип реакции акклиматизации в условиях импульсного света, который не зависит ни от стресса, воспринимаемого клетками, ни от общего количества поглощенного света.Однако это заслуживает дальнейшего изучения.
Эффект света на производство липидов
С точки зрения использования водорослей в качестве сырья для производства биодизеля, рост биомассы необходимо рассматривать вместе с продуктивностью липидов. Взаимосвязь между интенсивностью света и продуктивностью является сложной, и многие параметры влияют на способность водорослей накапливать липиды. Представленные здесь эксперименты с непрерывным освещением показали, что при сильном постоянном освещении стимулируется накопление липидов, о чем также сообщалось ранее [13], [14], [43].Примечательно, что такое большое производство липидов наблюдалось в среде, где азот был обеспечен в избытке и не был вызван недостатком этого питательного вещества. Как показано на рисунке S3, накопление липидов начинается на ранних этапах культивирования, когда азот не может быть истощен, даже если предполагается гораздо более высокое потребление клеток. Этот результат подтверждает, что избыток света может вызывать накопление липидов без прямого или косвенного истощения азота, показывая, что другие сигналы могут вызывать накопление большого количества липидов в N.salina .
В этом контексте следует подчеркнуть основополагающее влияние доступности углекислого газа. Предыдущие результаты на клетках Nannochloropsis , подвергнутых воздействию различной интенсивности излучения с атмосферным CO. 2 показали световой стресс без какой-либо заметной индукции липидов [19]. Напротив, в представленных здесь экспериментах, где углекислый газ поступал извне, избыток света индуцировал накопление липидов. Эти результаты ясно показывают, что легкий стресс сам по себе не индуцирует синтез липидов, который, напротив, является результатом более сложной регуляции.При сильном освещении и ограничении CO 2 эффективность цикла Кальвина-Бенсона, вероятно, ограничена, с последующим накоплением молекул перед фиксацией диоксида углерода. Вместо этого при избытке CO 2 и сильном освещении молекулы после фиксации диоксида углерода с большей вероятностью будут накапливаться, что в конечном итоге запускает биосинтез триацилглицерина.
Эта гипотеза согласуется с данными, полученными с клетками в импульсном свете. Например, клетки, подвергшиеся воздействию 1200-1 Гц, показали световой стресс и ингибировали рост, что, однако, не привело к какому-либо значительному накоплению липидов, подтверждая, что световой стресс сам по себе не вызывает биосинтез липидов, но что его влияние интегрировано с другими метаболическими сигналами. .
Материалы и методы
Условия культивирования
Nannochloropsis salina, от SAG, всегда выращивали в стерильной фильтрованной среде F / 2 [47] с 22 г / л морских солей от SIGMA, 40 мМ TRIS HCl pH 8, обогащение морской воды SIGMA Guillard (f / 2) раствор 1х, модифицированный добавлением неограничивающей концентрации азота (NaNO 3 1,5 г / л). Культуры поддерживали и размножали в той же среде с добавлением 10 г / л растительного агара (Duchefa Biochemie).Эксперименты по выращиванию проводились в плоском аппарате глубиной 0,8 см (Рисунок S1). Предварительные культуры выращивали при 100 мкЕ м -2 с -1 в экспоненциальной фазе, которую разбавляли до оптической плотности (OD) 0,45 при 750 нм. Конечный объем фотобиореактора составлял 150 мл. Постоянное освещение от 5 до 1200 мкЭ · м. −2 с −1 обеспечивалось светодиодным источником света SL 3500 (Photon Systems Instruments). Источник света также был запрограммирован на генерацию прямоугольных импульсов темноты / света с желаемой интенсивностью и частотой (рис. 2).Параметрами, описывающими вспышки, были время вспышки (t f ), время темноты (t d ), рабочий цикл (φ, соответствующий t f / (t f + t d ) [26], [ 32]), интенсивность света вспышки (I 0 ) и интегральная сила света (I a ). В камере для выращивания поддерживалась температура 23 ± 1 ° C. Избыток CO 2 (смешанный при 5% об. / Об. С воздухом) подавали барботированием, что также смешивало ячейки. Среду забуферивали 40 мМ TRIS HCl, pH 8, чтобы избежать изменений из-за избыточного поступления CO 2 .Рост водорослей измеряли по ежедневным изменениям оптической плотности OD 750 (Lambda Bio 40 UV / VIS Spectrometer, Perkin Elmer), а количество клеток контролировали в счетной камере Bürker (HBG, Германия). Удельную скорость роста рассчитывали по наклону логарифмической фазы для количества клеток. Было выполнено не менее четырех повторов всех кривых / экспериментов.
Мониторинг фотосинтетических параметров in vivo. Флуоресценцию хлорофилла определяли in vivo в конце экспоненциальной фазы роста с использованием Dual PAM 100 от WALZ.Параметр Fv / Fm рассчитывали как (Fm-Fo) / Fo [48] после 20 минут адаптации к темноте.
Экстракция и анализ пигментов
Хлорофилл а и общее количество Car экстрагировали в конце экспоненциальной фазы роста из центрифугированных клеток Nannochloropsis 100% N, N’-диметилформамидом в течение не менее 48 часов при 4 ° C в темноте, как в [[ 49]. Концентрации пигментов определяли спектрофотометрически с использованием конкретных коэффициентов экстинкции [50], [51].
Анализ липидов
Содержание липидов обычно контролировали путем измерения флуоресценции клеток, окрашенных Nile Red, после проверки линейной корреляции между сигналом флуоресценции и общим количеством липидов.2 * 10 6 клеток ресуспендировали в 1,9 мл деионизированной стерильной воды с 2,5 мкг / мл NR и инкубировали в течение 10 минут при 37 ° C [52]. Флуоресценцию измеряли на спектрофлуориметре (OLIS DM45) с длиной волны возбуждения 488 нм и эмиссии 580 ± 5 нм [53]. Вычитали сигналы от автофлуоресценции водорослей и только нильского красного. Для проверки линейности сигнала флуоресценции общие липиды экстрагировали из высушенных клеток смесью этанол-гексан (2,5-1 об. / Об.) В качестве растворителя в аппарате Сокслета в течение 10 ч [54], как показано на рисунке S4.Массу липидов измеряли гравиметрически после удаления растворителя в роторном испарителе.
Дополнительная информация
Рисунок S1.
Схема фотобиореактора с плоским слоем. Плоские фотобиореакторы изготовлены из прозрачных материалов (поликарбонат) для максимального использования световой энергии. Рабочий объем составляет 150 мл, и культура перемешивается потоком воздух-CO 2 из разбрызгивателя, размещенного в нижней части панели. Количество CO 2 в воздухе регулируется двумя расходомерами.Поток газа обеспечивает культуру неограниченным содержанием CO 2 . Поток газа для каждого реактора регулируется с помощью подходящих клапанов.
https://doi.org/10.1371/journal.pone.0038975.s001
(TIF)
Рисунок S2.
Условия импульсного освещения, используемые для роста Nannochloropsis salina . Чередующиеся циклы света и темноты были разработаны, чтобы иметь одинаковую интегральную интенсивность света (I a ), соответствующую 120 мкЭ · м −2 с −1 непрерывного света.Были использованы вспышки двух различных интенсивностей, 350 и 1200 мкЭ · м −2 с −1 , с рабочим циклом соответственно 0,33 и 0,1. Изменения света выполнялись с разными частотами, соответственно 10 и 33 Гц с 350 µE m −2 s −1 и 10, 5 и 1 с 1200 µE m −2 s −1 . Эти условия импульсного освещения привели к точной продолжительности вспышек (t f ) и темных (t d ), как показано в таблице 1.
https://doi.org/10.1371/journal.pone.0038975.s002
(TIF)
Вклад авторов
Эксперимент задумал и спроектировал: GMG AB TM. Проведены эксперименты: ES DS. Проанализированы данные: ES DS TM. Предоставленные реагенты / материалы / инструменты анализа: AB GMG. Написал статью: TM ES.
Список литературы
- 1.
Ху К., Зоммерфельд М., Джарвис Э., Гирарди М., Посевиц М. и др. (2008) Триацилглицерины микроводорослей как сырье для производства биотоплива: перспективы и достижения.Завод J 54: 621–639. - 2.
Dismukes GC, Carrieri D, Bennette N, Ananyev GM, Posewitz MC (2008) Водные фототрофы: эффективные альтернативы наземным культурам для биотоплива. Curr Opin Biotechnol 19: 235–240. - 3.
Хэннон М., Гимпель Дж., Тран М., Расала Б., Мэйфилд С. (2010) Биотопливо из водорослей: проблемы и потенциал. Биотопливо 1: 763–784. - 4.
Malcata FX (2011) Микроводоросли и биотопливо: перспективное партнерство? Trends Biotechnol 29: 542–549.S0167–7799 (11) 00094–1 [pii]; 10.1016 / j.tibtech.2011.05.005 [doi]. - 5.
Чисти Ю., Ян Дж.Й. (2011) Энергия водорослей: Текущее состояние и будущие тенденции / Биотопливо из водорослей — Отчет о состоянии. Прикладная энергия 88: 3277–3279. - 6.
Сингх А., Нигам П.С., Мерфи Дж.Д. (2011) Возобновляемое топливо из водорослей: ответ на спорные виды топлива на суше. Биоресурсы Технол 102: 10–16. - 7.
Amaro HM, Guedes AC, Malcata FX (2011) Достижения и перспективы использования микроводорослей для производства биодизеля.Прикладная энергия 88: 3402–3410. - 8.
Boussiba S, Vonshak A, Cohen Z, Avissar Y, Richmond A (1987) Производство липидов и биомассы галотолерантной микроводорослью Nannochloropsis salina . Биомасса 12: 37–47. - 9.
Hodgson PA, Henderson RJ, Sargent JR, Leftley JW (1991) Паттерны изменения класса липидов и жирнокислотного состава Nannochloropsis oculata (Eustigmatophyceae) во время периодического культивирования. Цикл роста. Журнал прикладной психологии 3: 169–181. - 10.
Родольфи Л., Чини З. Г., Басси Н., Падовани Г., Бионди Н. и др. (2009) Микроводоросли для получения масла: отбор штаммов, индукция синтеза липидов и массовое выращивание на открытом воздухе в недорогом фотобиореакторе. Biotechnol Bioeng 102: 100–112. - 11.
Gouveia L, Oliveira AC (2009) Микроводоросли как сырье для производства биотоплива. J Ind Microbiol Biotechnol 36: 269–274. - 12.
Sforza E, Bertucco A, Morosinotto T, Giacometti GM (2012) Фотобиореакторы для роста микроводорослей и производства масла с Nannochloropsis salina: от лабораторных экспериментов до крупномасштабного проектирования.Исследования и разработки в области химической инженерии в прессе. - 13.
Сукеник А., Кармели Ю., Бернер Т. (1989) Регулирование состава жирных кислот по уровню освещенности у эвстигматофита Nannochloropsis sp. Journal of Phycology 25: 686–692. - 14.
Соловченко А., Хозин-Голдберг И., Рехт Л., Буссиба С. (2011) Стресс-индуцированные изменения оптических свойств, содержания пигментов и жирных кислот в Nannochloropsis sp: значение для неразрушающего анализа общих жирных кислот.Mar Biotechnol (NY) 13: 527–535. 10.1007 / s10126-010-9323-x [doi]. - 15.
Ли З, Вакао С., Фишер ББ, Нийоги К.К. (2009) Чувство избытка света и реакция на него. Анну Рев Плант Биол 60: 239–260. - 16.
Мурата Н., Такахаши С., Нишияма Ю., Аллахвердиев С.И. (2007) Фотоингибирование фотосистемы II в условиях стресса окружающей среды. Biochim Biophys Acta 1767: 414–421. - 17.
Nixon PJ, Michoux F, Yu J, Boehm M, Komenda J (2010) Последние достижения в понимании сборки и ремонта фотосистемы II.Энн Бот 106: 1–16. - 18.
Пал Д., Хозин-Голдберг И., Коэн З., Буссиба С. (2011) Влияние света, солености и доступности азота на производство липидов Nannochloropsis sp. Appl Microbiol Biotechnol 90: 1429–1441. - 19.
Simionato D, Sforza E, Corteggiani CE, Bertucco A, Giacometti GM, et al. (2011) Акклимация Nannochloropsis gaditana к различным режимам освещения: Влияние на накопление липидов. Bioresour Technol 102: 6026–6032. - 20.
Фишер Т., Миннаард Дж., Дубинский З. (1996) Фотоакклимация морских водорослей Nannochloropsis sp (эустигматофит): кинетическое исследование. Журнал исследования планктона 18: 1797–1818. - 21.
Ричмонд А., Ченг-Ву З., Зарми Ю. (2003) Эффективное использование сильного света для высокой фотосинтетической продуктивности: взаимосвязь между оптическим путем, оптимальной плотностью популяции и ингибированием роста клеток. Biomol Eng 20: 229–236. - 22.Карвалью А.П., Сильва С.О., Баптиста Дж. М., Малката FX (2011) Требования к свету в фотобиореакторах с микроводорослями: обзор биофотонных аспектов. Appl Microbiol Biotechnol 89: 1275–1288.
- 23.
Grobbelaar JU (2010) Производство биомассы микроводорослей: проблемы и реалии. Photosynth Res 106: 135–144. 10.1007 / s11120-010-9573-5 [doi]. - 24.
Сюэ С., Су З., Конг В. (2011) Рост Spirulina platensis усиливается при прерывистом освещении.J Biotechnol 151: 271–277. S0168-1656 (10) 02063-8 [pii]; 10.1016 / j.jbiotec.2010.12.012 [doi]. - 25.
Гордон Дж. М., Полле Дж. Э. (2007) Сверхвысокая биопродуктивность водорослей. Appl Microbiol Biotechnol 76: 969–975. - 26.
Филлипс Дж., Майерс Дж. (1954) Скорость роста хлореллы в мигающем свете. Физиология растений 29: 152–161. - 27.
Matthijs HC, Balke H, van Hes UM, Kroon BM, Mur LR, et al. (1996) Применение светодиодов в биореакторах: эффекты мигающего света и экономия энергии в культуре водорослей ( Chlorella pyrenoidosa ).Biotechnol Bioeng 50: 98–107. - 28.
Kim ZH, Kim SH, Lee HS, Lee CG (2006) Повышенное производство астаксантина с помощью мигающего света с использованием Haematococcus pluvialis . Ферментные и микробные технологии 39: 414–419. - 29.
Кок Б. (1956) Фотосинтез в мигающем свете. Biochim Biophys Acta 21: 245–258. - 30.
Nedbal L, Tichy V, Xiong FH, Grobbelaar JU (1996) Микроскопические зеленые водоросли и цианобактерии в высокочастотном прерывистом свете.Журнал прикладной психологии 8: 325–333. - 31.
Терри К.Л. (1986) Фотосинтез в модулированном свете: количественная зависимость усиления фотосинтеза от частоты вспышек. Biotechnol Bioeng 28: 988–995. 10.1002 / bit.260280709 [doi]. - 32.
Vejrazka C, Janssen M, Streefland M, Wijffels RH (2011) Фотосинтетическая эффективность Chlamydomonas reinhardtii в мигающем свете. Biotechnol Bioeng. 10.1002 / bit.23270 [doi]. - 33.
Nedbal L, Tichy V, Xiong FH, Grobbelaar JU (1996) Микроскопические зеленые водоросли и цианобактерии в высокочастотном прерывистом свете.Журнал прикладной психологии 8: 325–333. - 34.
Бриндли К., Фернандес Ф. Г., Фернандес-Севилья Дж. М. (2011) Анализ светового режима в непрерывных световых распределениях в фотобиореакторах. Bioresour Technol 102: 3138–3148. S0960–8524 (10) 01744-X [pii]; 10.1016 / j.biortech.2010.10.088 [doi]. - 35.
Grobbelaar JU, Nedbal L, Tichy V (1996) Влияние высокочастотных флуктуаций света / темноты на фотосинтетические характеристики микроводорослей, фотоакклимированных к различной интенсивности света, и последствия для массового культивирования водорослей.Журнал прикладной психологии 8: 335–343. - 36.
Meiser A, Schmid-Staiger U, Trosch W (2004) Оптимизация производства эйкозапентаеновой кислоты с помощью Phaeodactylum tricornutum в реакторе эрлифта с плоской панелью (FPA). Журнал прикладной психологии 16: 215–225. - 37.
Цян Х., Ричмонд А. (1996) Производительность и фотосинтетическая эффективность Spirulina platensis в зависимости от интенсивности света, плотности водорослей и скорости перемешивания в фотобиореакторе с плоской пластиной.Журнал прикладной психологии 8: 139–145. - 38.
Zijffers JWF, Schippers KJ, Zheng K, Janssen M, Tramper J, et al. (2010) Максимальный фотосинтетический выход зеленых микроводорослей в фотобиореакторах. Морская биотехнология 12: 708–718. - 39.
Kliphuis AMJ, de Winter L, Vejrazka C, Martens DE, Janssen M, et al. (2010) Фотосинтетическая эффективность Chlorella sorokiniana в турбулентно перемешанном фотобиореакторе с коротким световым путем. Прогресс биотехнологии 26: 687–696. - 40.
Максвелл К., Джонсон Г. Н. (2000) Флуоресценция хлорофилла — практическое руководство. J Exp Bot 51: 659–668. - 41.
Фальковски П.Г., Ларош Дж. (1991) Акклимация водорослей к спектральному излучению. J Phycol 27: 8–14. - 42.
Damiani MC, Popovich CA, Constenla D, Leonardi PI (2010) Анализ липидов в Haematococcus pluvialis для оценки его потенциального использования в качестве биодизельного сырья. Bioresour Technol 101: 3801–3807. - 43.Фишер Т., Бернер Т., Илуз Д., Дубинский З. (1998) Кинетика фотоакклимационной реакции Nannochloropsis sp. (Eustigmatophyceae): исследование изменений ультраструктуры и плотности PSU. Journal of Phycology 34: 818–824.
- 44.
Су CH, Chien LJ, Gomes J, Lin YS, Yu YK и др. (2011) Факторы, влияющие на накопление липидов Nannochloropsis oculata в двухэтапном процессе культивирования. Журнал прикладной психологии 23: 903–908. - 45.Laurens LM, Quinn M, Van WS, Templeton DW, Wolfrum EJ (2012) Точная и надежная количественная оценка общего топливного потенциала микроводорослей в виде метиловых эфиров жирных кислот путем переэтерификации in situ. Anal Bioanal Chem. 10.1007 / s00216-012-5814-0 [doi].
- 46.
Дубинский З., Фальковски П.Г., Вайман К. (1986) Сбор и использование света фитопланктоном. Физиология растительных клеток 27: 1335–1349. - 47.
Guillard RRL, Ryther JH (1962) Исследования морских планктонных диатомовых водорослей.I. Cyclotella nana Hustedt и Detonula confervagea Cleve. Может J Microbiol 8: 229–239. - 48.
Деммиг-Адамс Б., Адамс В.В., Баркер Д.Х., Логан Б.А., Боулинг Д.Р. и др. (1996) Использование флуоресценции хлорофилла для оценки доли поглощенного света, выделяемого на тепловое рассеяние избыточного возбуждения. Physiologia Plantarum 98: 253–264. - 49.
Моран Р., Порат Д. (1980) Определение хлорофилла в интактных тканях с использованием н, н-диметилформамида.Физиология растений 65: 478–479. - 50.
Porra RJ, Thompson WA, Kriedemann PE (1989) Определение точных коэффициентов экстинкции и одновременных уравнений для анализа хлорофиллов a и b, экстрагированных четырьмя различными растворителями: проверка концентрации стандартов хлорофилла с помощью атомно-абсорбционной спектроскопии. Biochim Biophys Acta 975: 384–394. - 51.
Wellburn AR (1994) Спектральное определение хлорофилла-A и хлорофилла-B, а также общих каротиноидов с использованием различных растворителей с помощью спектрофотометров разного разрешения.Журнал физиологии растений 144: 307–313. - 52.
Chen W, Zhang C, Song L, Sommerfeld M, Hu Q (2009) Высокопроизводительный метод нильского красного для количественного измерения нейтральных липидов в микроводорослях. J Microbiol Methods 77: 41–47. - 53.
Гринспен П., Майер Е.П., Фаулер С.Д. (1985) Нильский красный: селективное флуоресцентное пятно для внутриклеточных липидных капель. J Cell Biol 100: 965–973. - 54.
Молина Г.Е., Роблес М.А., Хименес Г.А., Санчес П.Дж., Гарсия-Камачо Ф. и др.(1994) Сравнение экстракции липидов и жирных кислот из биомассы микроводорослей. J Am Oil Chem Soc 71: 955–959.
Учебное пособие: фотосинтез
Все формы жизни нуждаются в постоянном источнике энергии для выживания. Клетки постоянно находятся в состоянии активности — размножения, роста, обслуживания и ремонта — и для поддержания активности необходим постоянный источник энергии. Пища обеспечивает эту энергию. Пища содержит химические вещества, которые хранят энергию, а клетки расщепляют химические вещества пищи для получения энергии.
По сути, на этой планете есть два типа организмов. АВТОТРОФЫ — это организмы, которые могут производить молекулы пищи из света или других источников энергии. ГЕТЕРОТРОФЫ — это организмы, которые не могут производить себе пищу и поэтому должны есть другие организмы, чтобы остаться в живых. К автотрофам относятся растения — трава, деревья, кустарники, сорняки и водоросли — зеленая слизь, встречающаяся в реках и прудах. К гетеротрофам относятся все животные — змеи, рыбы, сверчки, черви, медузы — и многие микроскопические животные.
В конечном счете, источником всей пищи на этой планете являются автотрофы. Растения используют световую энергию для производства пищевых химикатов, и, таким образом, световая энергия хранится в связях молекул пищи. Растения и животные используют эту накопленную энергию связи в качестве топлива для своих клеток. Если солнце перестанет излучать свет, сначала погибнут автотрофные растения, а затем все гетеротрофные животные. Те животные, которые питались растениями, умрут первыми, а затем хищники, которые поедают животных, питающихся растениями.В конце концов, вся жизнь на планете прекратится.
Таким образом, все, что вы когда-либо делали, стало возможным благодаря захваченной солнечной энергии пищевых химикатов, которые вы употребляли. Процесс производства пищевых химикатов с использованием солнечной энергии — это ФОТОСИНТЕЗ .
По определению, фотосинтез — это: — химические реакции, которые преобразуют лучистую энергию солнечного света в химическую энергию сахаров.
История исследований фотосинтеза
В 1771 году английский ученый по имени Джозеф Пристли обнаружил, что растения и животные дополняют друг друга в воздухе вокруг себя.Он зажег свечу в закрытой банке до тех пор, пока она не перегорит. Если в банке было растение, через несколько дней свеча снова зажглась. Он повторил тот же эксперимент с мышью — мышь с растением в банке будет жить, а мышь в банке одна умрет. Пристли пришел к выводу, что растения восстанавливают воздух, который был «поврежден» свечой или мышью.
История исследований фотосинтеза
В 1779 году голландский врач по имени Ян Ингенхауз обнаружил, что погруженные в воду веточки ивы производят газообразный кислород только в присутствии солнечного света.К 1796 году после дальнейших исследований Ингенхауз смог написать первое уравнение фотосинтеза, которое было:
Энергия света
Свет не может напрямую использоваться в фотосинтезе . Его нельзя напрямую использовать для соединения углекислого газа и воды с образованием сахара и кислородного газа. Сначала он преобразуется в более удобную форму. Свет поглощается в процессе фотосинтеза и временно сохраняется в универсальной молекуле, называемой аденозинтрифосфатом или ATP . Затем можно использовать ATP для объединения углекислого газа и воды с образованием сахара и кислорода.
АТФ
АТФ — это молекула, которая состоит из трех меньших типов молекул: 1) аденин , 2) рибоза , 3) фосфатов . Одна молекула АТФ состоит из одного аденина, одной рибозы и трех фосфатов, связанных вместе. Он изображен ниже. Волнистые линии между фосфатами представляют собой связи с высокой энергией.
Фосфатные связи
Большая часть химической энергии АТФ хранится в связи между 2-м и 3-м фосфатами.Когда энергия АТФ используется для производства глюкозы, третий фосфат отщепляется и присоединяется к другой молекуле, таким образом передавая энергию от АТФ к другой молекуле. Этот перенос фосфата на другую молекулу называется ФОСФОРИЛИРОВАНИЕ . Поскольку АТФ потерял один фосфат, его теперь называют аденозиндифосфатом или АДФ. Он нарисован ниже.
АТФ к АДФ
Фотосинтез должен постоянно производить больше АТФ за счет восстановления молекул АДФ .Он делает это, связывая молекулы фосфата со 2-м фосфатом АДФ, тем самым конвертируя его обратно в АТФ, ИСПОЛЬЗУЯ ЭНЕРГИЮ СВЕТА. После этого АТФ можно будет снова использовать для производства сахара. АТФ участвует в других химических реакциях, таких как дыхание, которые будут рассмотрены в более поздней программе.
Уравнение для фотосинтеза
Фотосинтез преобразует движущуюся лучистую энергию в запасенную энергию химической связи. Ниже приведено химическое уравнение, которое суммирует химические реакции фотосинтеза.Фотосинтез на самом деле намного сложнее, чем то, что представлено уравнением ниже.
Реакция Света и Темноты
Сложный процесс фотосинтеза фактически состоит из ДВУХ взаимосвязанных сложных реакций — реакции СВЕТА и ТЕМНОГО .
В реакциях со светом энергия света преобразуется в химическую энергию АТФ, а вода расщепляется на атомы водорода. Атомы АТФ и водорода поступают в темную реакцию, которая использует их для производства глюкозы из углекислого газа.В конечном итоге световая энергия попадает в глюкозу, но получить ее нелегко.
Зависимость реакции темноты от реакции света
Реакция темноты зависит от реакции света на получение энергии, точно так же, как этот компьютер зависит от электричества. Темновая реакция не обязательно должна происходить в темноте, она просто не может происходить без атомов АТФ и Н, образующихся при световой реакции. Однако световая реакция не может происходить без света. Только при наличии света он производит атомы АТФ и Н.Таким образом, световые реакции действуют как энергетическая установка, питая темные реакции необходимым топливом для производства сахара. Темные реакции служат сахарным заводом, использующим углекислый газ и атомы H в качестве сырья для производства сахара.
Реакции хлоропластов
Фотосинтез происходит внутри хлоропласта. Чтобы быть более конкретным, светлые реакции происходят на поверхности тилакоидных мембран, а темные реакции происходят в стромальной жидкости .Примечание: световая реакция происходит не внутри тилакоида, а только на его поверхности.
Хлорофилл
В хлоропласте содержатся особые пигменты, которые участвуют в фотосинтезе и которые больше нигде в растении не встречаются. (Пигмент — это молекула, имеющая цвет.) Важным пигментом, участвующим в фотосинтезе, является CHLOROPHYLL . Хлорофилл находится только на поверхности тилакоидных мембран и не находится в строме. Участвует в световых реакциях фотосинтеза.
Фотосинтез и свет
Солнечный свет состоит из смеси цветов, поэтому он кажется белым, когда он «струится» через окно. В солнечном свете есть в основном 6 цветов, которые перечислены ниже. Хлорофилл может поглощать только некоторые из этих цветов, например красный, оранжевый, синий и фиолетовый. Он не может поглощать зеленый и желтый. Лист растения кажется зеленым, потому что он преимущественно отражает зеленый цвет для ваших глаз. Если бы хлорофилл поглотил все цвета, он выглядел бы черным, потому что черный — это отсутствие всех цветов.
Поглощение света
Поскольку хлорофилл поглощает красный, оранжевый, синий и фиолетовый свет, он может сохранять эти типы световой энергии в составе химической энергии глюкозного сахара посредством фотосинтеза.
Увеличенный тилакоид
Световые реакции происходят на тилакоидных мембранах . В следующей части программы тилакоидная мембрана увеличена, чтобы можно было увидеть световую реакцию. Увеличение показано ниже.
Электронная накачка
Световые реакции фотосинтеза на самом деле представляют собой систему накачки электронов , расположенную на тилакоидах хлоропласта. Когда частицы света ударяются о молекулу хлорофилла (a или b), электроны отбрасываются и вынуждены перемещаться к другой молекуле. Это буквально создает электрическую цепь, в которой электроны перемещаются, как если бы они были по проводу, но они передаются от одной молекулы к другой.
Световая реакция
Источником электронов являются молекулы воды .Молекулы воды делятся на атомы кислорода, ионы водорода и электроны. Оставшиеся атомы кислорода от расщепления воды образуют отходящий газообразный кислород, ионы водорода используются для производства АТФ, а электроны передаются по «цепи переноса электронов».
Фотосистемы
На самом деле есть две станции накачки электронов, называемые фотосистемами , в световой реакции, которая более эффективна, чем одна.
Ионы водорода
Ионы водорода закачиваются внутрь тилакоидов за счет прохождения электронов .Затем ионы водорода используются для производства АТФ с помощью процесса, называемого хемиосмосом.
NADP
В конце цепи переноса электронов электроны захватываются вместе с ионами водорода специальной молекулой NADP , которая переносит их в темную реакцию.
АНИМАЦИИ СВЕТОВОЙ РЕАКЦИИ
Помните, цель световой реакции состояла в том, чтобы произвести атомы АТФ и H для темной реакции. Электронная накачка световой реакции делает это возможным, закачивая ионы H внутрь тилакоидов, которые используются для производства АТФ, и за счет того, что НАДФ захватывает электроны и ионы H, чтобы перенести их в темную реакцию.
На следующей анимации световая реакция показана в действии. Первый кадр показан ниже.
Авторские права на анимацию принадлежат Стиву Кенстингу, 1989 г., Все права защищены.
Объяснение
Несмотря на то, что световая реакция довольно сложна, продуктами были просто атомы АТФ и H . Атомы H переносятся молекулами NADP, и каждый NADP может нести 2 атома H, представленных NADP-H-H. Молекулы воды расщеплялись на электроны и ионы водорода, которые способствовали выработке АТФ.Атомы H, переносимые НАДФ, в конечном итоге станут частью молекулы глюкозы. Энергия АТФ, образующаяся в световой реакции, на самом деле является поглощенной световой энергией, которая в конечном итоге СОХРАНЯЕТСЯ в молекуле глюкозы.
Цикл Кальвина
Темные реакции часто называют «Циклом Кальвина» в честь ботаника Мелвина Кальвина , открывшего химические реакции, протекающие в темновой реакции. Реакция темноты — это циклическая реакция, в результате которой образуется часть того, что на самом деле использовалось, например, при переработке алюминиевой банки после употребления газировки.
Строма
Темная реакция происходит в строме хлоропласта, который представляет собой жидкость вне тилакоидов. Таким образом, в то время как световая реакция происходит на поверхности тилакоида, темная реакция происходит в жидкости, которая течет по поверхности тилакоида. В темной реакции используются атомы АТФ и H из световой реакции плюс углекислый газ из воздуха.
Подробности реакции в темноте
Реакция в темноте начинается с реакции углекислого газа с молекулой сахара с 5 атомами углерода, называемой RuBP или бифосфатом рибулозы. Это связывание диоксида углерода с другой молекулой называется фиксацией углерода. В результате этой реакции образуются две небольшие 3-углеродные молекулы, называемые PGA или фосфоглицериновой кислотой.
PGA в PGAL (G3P)
Затем 2 молекулы PGA преобразуются в 2 новые молекулы PGAL с использованием атомов АТФ и H из световой реакции.
Использование PGAL
Затем PGAL используется для производства глюкозы, а также для рециркуляции RuBP . Для рециркуляции RuBP также требуется некоторое количество АТФ.Продуктами темновой реакции являются глюкоза и более RuBP, в основном RuBP.
Анимированная темная реакция
На следующей анимации показана темная реакция в действии. Ниже первый кадр анимации.
Авторские права на анимацию принадлежат Стиву Кенстингу, 1989 г., Все права защищены.
Объяснение
Несмотря на то, что темновая реакция довольно сложна, продуктами были просто глюкоза и другие молекулы RuBP .Глюкоза несет в себе: 1) накопленную солнечную энергию от АТФ, 2) H от НАДФ и 3) атомы углерода и кислород углекислого газа. Молекулы RuBP перерабатываются, потому что в противном случае их сложно произвести. Глюкоза, полученная в результате реакции темноты, затем будет использоваться растительной клеткой, которая производит ее в пищу.
Анимация фотосинтеза
В следующей и последней анимации показаны одновременные реакции темноты и света. Показано производство только одной молекулы глюкозы.Анимация сложна из-за множества взаимосвязанных процессов, происходящих одновременно. Попробуйте смотреть только одну часть за раз, чтобы увидеть, что происходит только в этой области. Ниже приведены многие символы, которые используются в анимации для упрощения процесса. Изучите их, прежде чем переходить к просмотру анимации, используя три гиперссылки ниже.
Авторские права на анимацию принадлежат Стиву Кенстингу, 1989 г., Все права защищены.
Объяснение
В предыдущем моделировании исходными реагентами были вода и диоксид углерода.С помощью световой энергии они были преобразованы в кислород и глюкозу, а световая энергия накапливалась в глюкозе. НАДФ и АТФ были необходимы темной реакции для производства сахара.
Вода и реакции фотосинтеза
При производстве одной молекулы глюкозы необходимо использовать более 6 молекул воды. В первом уравнении ниже (показанном ранее в программе) только 6 молекул воды указаны как производящие одну глюкозу. Фактически, 12 молекул воды расщепляются в процессе производства 1 молекулы глюкозы.Оказывается, что темновая реакция производит 6 молекул воды, как это работает (показано в моделировании), так что в целом процесс ИСПОЛЬЗУЕТ только шесть.
Одновременные реакции
Внутри хлоропласта присутствует множество тилакоидов, а также множество ферментов и молекул НАДФ. В результате во всех тилакоидах одновременно происходит множество световых реакций, при этом свет получает хлоропласт. Кроме того, одновременно происходит множество темных реакций с одновременным производством большого количества глюкозы.Даже на одном тилакоиде одновременно может происходить множество световых реакций. Это увеличивает эффективность и продуктивность хлоропласта.
Сводка по растительным клеткам
Глюкоза, производимая хлоропластом, будет диффундировать в цитоплазму растительной клетки и использоваться в качестве топлива или будет отправлена в корни растений для хранения в форме крахмала.
Свет усиливает Тьму
Итак, световая реакция существует только для того, чтобы вызвать темную реакцию, в которой фактически производится сахар.Кислород, образующийся в результате реакции света, выделяется в воздух — весь кислород, которым вы когда-либо дышали, был получен из листьев или водорослей. Весь процесс действительно сложен, и в нем гораздо больше шагов, чем перечислено на самом деле. Ферменты используются для каждой химической реакции, участвующей в процессе.
Регулирование фотосинтетического потока электронов при переходе от темноты к свету за счет взаимодействий ферредоксин: НАДФ (H) оксидоредуктаза
Существенные изменения:
Оба рецензента также пришли к выводу, что существуют существенные проблемы, которые необходимо решить.Некоторые из этих вопросов могут потребовать дополнительной экспериментальной работы, но также возможно, что они могут быть решены путем более тщательного анализа и интерпретации результатов, которые группа уже имеет. Например, можно справиться с критикой рецензента №1 интерпретации сигналов поглощения фотосистемы I путем повторного анализа необработанных данных.
Однако другие проблемы, например статистический анализ на рис. 4, представленный обоими рецензентами, по-видимому, требует дополнительных экспериментальных результатов, и это может задержать повторную отправку.
Мы завершили эту экспериментальную работу, которая представлена на новом Рисунке 4 и в Приложении 1 — Рисунок 1.
Оба рецензента рекомендовали конкретные подходы для наиболее простого решения этих проблем.
Обсуждение должно быть изменено в соответствии с комментариями рецензентов, чтобы лучше отразить сильные и слабые стороны наборов данных и текущее состояние области.
Обсуждение изменено в соответствии с рекомендациями рецензентов.
Хотя и понятно, что заголовок может иметь как можно большее влияние, в нем не следует делать деклараций, которые не подтверждаются самим документом.
Название было изменено, чтобы более конкретно отразить результаты, содержащиеся в статье.
Рецензент №1:
Эта рукопись пересматривает давние и довольно загадочные наблюдения, в которых появляются FNR1 и FNR2, которые могут быть по-разному локализованы рядом с тилакоидной мембраной или в строме, что, возможно, регулирует разделение электронов из фотосистемы I (PSI) на линейные электроны. поток (LEF) и циклический поток электронов (CEF).Что мне нравится в этой работе, так это то, что она критически рассматривает некоторые из прошлых предположений о том, как или даже если произойдет эта локализация, и приходит к провокационному выводу, что большая часть предыдущей работы нуждается в переоценке с важными последствия для ряда моделей, предложенных в литературе. В частности, показано, что ранее предложенные растворимые формы FNR остаются ассоциированными с мембраной, но их локализация в разных тилакоидных доменах варьирует. Затем они выполняют ряд генетических и спектроскопических измерений, которые интерпретируются как подтверждение роли изменений в локализации FNR в регулировании электронного потока.
Хотя некоторые работы кажутся надежными, существуют серьезные экспериментальные проблемы с тремя областями фотосинтетических измерений и их интерпретацией.
Вопросы критической науки:
Интерпретация данных на Рисунке 4, вероятно, будет чрезмерно упрощенной, или, по крайней мере, существует несколько интерпретаций, которые приводят к различным выводам.
Мы благодарим рецензента за то, что он подтолкнул нас к более тщательному анализу. Препараты хлоропластов могут сильно варьироваться в зависимости от условий роста и т. Д.Мы повторили эксперимент несколько раз, даже в разных лабораториях до нашей первой заявки, всегда обнаруживая одни и те же основные тенденции (в основном отсутствие или небольшой вклад медленной фазы в мутанте fnr1). Из-за различий между экспериментами, проводившимися в разные дни и в разных лабораториях, мы выбрали репрезентативный набор данных (с наиболее четким сигналом) для подгонки. Теперь мы повторили эксперимент еще 3-6 раз для каждого генотипа с растениями, выращенными в идентичных условиях, чтобы получить надежные средние значения, и провели статистический анализ, показывающий, что различия между генотипами не случайны.Мы представляем эти данные в виде нового рисунка 4. Некоторые из явлений, которые мы описали в предыдущем сообщении, не видны в отдельных повторностях и, следовательно, не являются статистически значимыми при усреднении. Поэтому они больше не обсуждаются, и в текст были внесены соответствующие поправки.
Тест интерпретирует фазы быстрого и медленного роста как отражающие более быстро или более медленно взаимодействующие пулы FNR / NADPH, как в следующем: «Поэтому мы предполагаем, что медленный компонент отражает перемещение FNR из мест жестко связанных привязок в слабые связи в другом месте на тилакоид.«
Однако это кажется маловероятным, учитывая медленный временной масштаб медленных фаз. Более вероятные объяснения включают следующее:
Мы согласны с тем, что все предложения рецензента возможны и их важно учитывать. Однако в отношении рецензента 1 мы по-прежнему считаем, что наше предложение (в настоящее время) более вероятно по причинам, указанным в ответах на отдельные вопросы ниже. Мы добавили новый раздел (Приложение 1). подробное описание кинетики восстановления НАДФ + для проверки гипотез, представленных рецензентом для объяснения присутствия этих двух фаз.
1) Также возможно, что система является гетерогенной, так что разные субпопуляции хлоропластов или пулы внутри хлоропластов ведут себя по-разному. Например, присутствие фракции сломанных или поврежденных хлоропластов может вызвать медленную фазу восстановления NADP +;
Все препараты хлоропластов по своей природе неоднородны, и мы упоминаем в тексте, что это является причиной не сравнивать общие амплитуды. Мы провели эксперимент с преднамеренно разорванными хлоропластами (Приложение 1 — рис. 1), которые показывают значительно более низкий светозависимый сигнал, больший шум и отсутствие медленной кинетической фазы.Как мы теперь пишем в тексте (Приложение 1), мы думаем, что причина остаточной светозависимой активности заключается в том, что значительная часть хлоропластного НАДФ (H), как полагают, связана с ферментом FNR (Latouche et al., 2000 ), и поэтому может быть эффективно восстановлен даже в разорванной системе хлоропластов. Этот эксперимент действительно устанавливает, что медленная фаза кинетики зависит от интактных хлоропластов.
С другой стороны, мы, безусловно, согласны с автором обзора в том, что разные пулы НАДФ (H) в хлоропластах могут вести себя по-разному.
2) Уменьшение других электронных носителей, включая НАДН, который также будет способствовать синей флуоресценции, или связанный НАД (Ф) Н, который, как сообщается, имеет более высокий выход флуоресценции, чем их свободные формы;
Действительно, связанный с белком НАДФН имеет более высокую флуоресценцию, чем свободный НАДФН в растворе (LNM Duysens, GHM Kronenberg (1957) BBA, 26: 437-438; TG Scott, RD Spencer, NL Leonard, G Weber (1970) JACS, 92: 687-695), и поэтому мы изначально думали, что измеряемая нами медленная фаза может быть связана с медленной ассоциацией НАДФН с ферментами.FNR связывает значительную часть свободного NADP + (Latouche et al., 2000) и, следовательно, может быть, что пониженное содержание FNR у мутанта fnr1 может быть связано со сниженной амплитудой медленной фазы. Однако гетерологичная экспрессия ZmFNR3 в мутанте fnr1 дает Wt-уровни FNR, но все еще не в состоянии восстановить амплитуду этой медленной фазы, указывая тем самым, что ответственна локализация FNR, а не ее изобилие. Это согласуется с выводами Latouche et al. (2000), которые пришли к выводу, что ни связывание белков, ни флавины в ферментах (важное соображение при использовании растений с переменным содержанием FNR) не вносят вклад в светозависимую флуоресценцию НАДФН в изолированных хлоропластах после обширной характеристики метода, как мы сейчас обсуждаем в Приложении 1. .
При проведении этих экспериментов мы предположили незначительный вклад НАДН во флуоресценцию, основываясь на неопределяемых низких уровнях НАДН, о которых сообщалось в освещенных изолированных хлоропластах (Heineke et al., 1991, Plant Physiology 95, 1131). Однако с момента нашего первоначального представления появилось сообщение о том, что на основе экспрессии NADPH и NADH-чувствительных флуоресцентных белков в цитозоле и строме уровни NADH действительно повышаются в строме в начале света (Lim et al., Nat Comm. 11, 3238).Сродство FNR к NAD (H) чрезвычайно низкое (Piubelli et al., 2000), и фермент, способный к светозависимому восстановлению NAD + , еще не идентифицирован. НАДФН-зависимое восстановление NAD + возможно, как предположили Lim et al. (2020), и мы проверили это следующим образом. Доминирующим путем взаимного превращения НАДФН / НАДН является внутренний шаттл ОАА / малат хлоропласта, включающий НАДФ (Н) малатдегидрогеназу и НАД (Н) малатдегидрогеназу (оба присутствуют в хлоропласте, см. Selinsky and Scheibe 2018).Повышение тиоловой активности НАДФ-МДГ в течение того же периода времени, что и развитие медленной фазы, делает это хорошим кандидатом. Поэтому мы повторили наш эксперимент по кинетике NADP (H) с нокаутом Т-ДНК этого фермента (nadp-mdh), пример следа которого показан в Приложении 1 — рис. 1. Если светозависимое восстановление NAD + способствует к флуоресценции, наблюдаемой в наших измерениях, то этот мутант должен демонстрировать значительные отклонения в кинетике, но вместо этого он показывает почти идентичный кинетический паттерн с Wt.Теперь это обсуждается в Приложении 1. По нашему мнению, это означает, что вклад НАДН в светозависимую кинетику в наших препаратах хлоропластов маловероятен.
3) Медленный рост контролируется последующим повторным окислением ранее восстановленного НАДФН. Немедленное усиление флуоресценции действительно согласуется с моделью, в которой локальный пул НАДФН быстро уменьшается при включении света. В этом случае медленный рост может отражать дальнейшее чистое снижение NADPH NADPH, но не из-за низкой доступности FNR / NADP +, а скорее из-за изменений в повторном окислении восстановленного NADPH.В этом случае начальная степень восстановления НАДФН определяется конкуренцией между восстановлением и повторным окислением, а медленный рост вызван либо увеличением восстановления, либо уменьшением повторного окисления. Например, может существовать пул окислителя для НАДФН, который медленно восстанавливается во время медленной фазы. Или локальный запас O2 может быть исчерпан во время медленного нарастания.
Если мы правильно интерпретируем этот комментарий, рецензент предполагает, что медленная фаза на рисунке 4 может быть связана с увеличением скорости восстановления NADP + или снижением скорости окисления NADPH по сравнению с «медленной фазой».В первом случае — это соответствует тому, что мы предлагаем в статье. Теперь мы предлагаем две модели (рисунок 6 — приложение к рисунку 1), показывающие возможные пути изменения активности восстановления NADP + и CEF в соответствии с расположением FNR при переходе от темного к светлому. Мы основываем эти модели на том факте, что медленная фазовая амплитуда коррелирует с генотипами, которые имеют сильное взаимодействие FNR: мембрана, и что у Wt эти взаимодействия, как сообщается, нарушаются на свету (Benz et al., 2009) и при ожидаемых значениях pH в строме на свету (Alte et al., 2010).
Во втором случае, как предполагает рецензент, возможно снижение скорости потребления НАДФН. Мы упоминаем об этом в Приложении 1. В качестве примера рецензент предлагает окисление локализованного пула O 2 . Хотя трудно понять, как это будет коррелировать с тесным связыванием FNR с привязками Tic62 / TROL, мы сочли, что это может быть связано с медленным насыщением восстановления глутатиона (NADPH-зависимой глутатионредуктазой), что косвенно связано с O 2 сокращение.Однако в предыдущей работе мы обнаружили, что при освещении пул глутатиона мутанта fnr1 на самом деле более окислен, чем пул Wt (Kozuleva et al., 2016), что противоречит меньшему вкладу медленной фазы, наблюдаемой в этот мутант показан на рис. 4. Поскольку данные, представленные на рис. 4, представляют собой средние значения повторяющихся измерений на изолированных хлоропластах, маловероятно, что они представляют собой истощение метаболита, приводящее к снижению окисления НАДФН.
Наконец, медленная фаза, наблюдаемая в наших (и других) препаратах хлоропластов, отсутствует в измерениях флуоресценции НАДФН на цианобактериях (Kauny and Setif, 2014).У цианобактерий FNR постоянно связан с тилакоидом с помощью линкерного пептида фикобилисом (Korn et al. 2009, JBC 284, 31789), поэтому перемещение между комплексами / местоположениями маловероятно. Это указывает на то, что медленная фаза восстановления NADP + связана либо со специфическим свойством FNR высших растений (таким как взаимодействие с тросами мембраны Tic62 / TROL и различными другими комплексами), либо со специфическим метаболизмом хлоропластов. Теперь это также обсуждается в Приложении 1. Мы согласны с тем, что наше объяснение того, что медленная фаза может быть вызвана диссоциацией FNR от одного комплекса и воссоединением с другим (как ранее предполагали, среди прочего, Джонсон и Жолио), может оказаться неверным. , но, основываясь на имеющихся данных, это, по нашему мнению, является наиболее вероятным объяснением.
Сложная многофазная кинетика распада в темноте, похоже, согласуется с моделью этого типа. Например, явно есть быстрые фазы распада в fnr1 и fnr1 ZmFNR2, которые не подходят для модели «простой кинетики второго порядка», используемой в рукописи. (Действительно, нет веских оснований для использования простой кинетики второго порядка, которая предполагает, что система однородна, но с ограниченными концентрациями двух субстратов.) Эта простая модель второго порядка не может объяснить фазы быстрого распада (см. Выше).Например, возможно, что очень быстрый процесс повторного окисления привел бы к довольно быстрой фазе распада, которая, даже если бы небольшая по амплитуде, составляла бы большую часть потока. Действительно, кинетика довольно сложна, и поэтому простое поведение второго порядка, вероятно, будет чрезмерным упрощением. Это также может объяснить улучшенные подгонки при модуляции специального члена кооперативности Хилла.
Различия в окислении НАДФН не могли быть четко различимы во всех индивидуальных препаратах хлоропластов, поэтому мы удалили этот анализ и любое его обсуждение из текста.Что касается коэффициента Хилла, мы признаем, что подгонка носит чисто феноменологический характер, и мы не пытаемся подогнать физическую модель к данным — он просто используется для получения некоторой полезной характеристики кинетики. Параметры, вероятно, сами по себе имеют мало физического значения, но в относительном смысле они информативны. Мы выбрали функцию типа Хилла, потому что ни моно-, ни биэкспоненциальные функции не подходят. Добавление дополнительных экспонент, вероятно, улучшило бы соответствие данных, но также могло бы создать опасность чрезмерного соответствия.
«Затем мы определили, что эти различия в кинетике НАДФ (Н) не являются результатом вторичного воздействия на другие компоненты цепи ПЭТ, путем изучения изобилия белков, которые могут влиять на фотосинтетический перенос электронов или баланс НАДФ (H) (Рисунок 4 — Приложение к рисунку 1). ). Мы не обнаружили различий, которые коррелируют с таковыми в кинетике восстановления и окисления НАДФ (H) ».
Это не очень сильный аргумент. Даже при одинаковом содержании активность или расположение других ферментов могут различаться, как следует из других аргументов в рукописи.
Автор обзора прав, могут быть различия в регуляции ПЭТ между генотипами, но установление того, что использованный трансгенный подход не привел к изменениям в изобилии соответствующих белков, является первым шагом к устранению плейотропных эффектов как фактора. Если есть нормативные различия, более вероятно, что они, по крайней мере, являются ответом на различную активность / местоположение FNR (например, окислительно-восстановительное состояние Fd или NADP (H)), которые мы упоминаем в тексте, как указано рецензент.Тем не менее, теперь мы изменили текст, чтобы уточнить, что содержание белка не всегда означает активность.
«В обоих случаях это дает линейную зависимость. Сообщается, что взаимодействия FNR с Tic62 и TROL ослабляются под воздействием света (Alte et al., 2010, 262 Benz et al., 2009)».
Отсутствие статистической обработки в этом наборе данных вызывает беспокойство. На рисунке 4 полосы ошибок, показанные в виде гистограмм, очевидно, связаны не с биологическими или даже техническими повторениями, а с «ошибками подгонки», предположительно из одной кривой.Эта проблема распространяется на рисунок 5, поэтому невозможно сделать вывод, существует ли линейная зависимость или нет. Кажущаяся линейность в основном связана с одной точкой, fnr1, и удаление этой точки предполагает, что взаимосвязь совершенно другая, возможно, экспоненциальный рост или отсутствие статистически значимой взаимосвязи вообще. В целом, хотя мы
Данные по нашим множественным препаратам хлоропластов не были достаточно последовательными, чтобы мы могли сделать такие выводы, и поэтому мы удалили предыдущий рисунок 5 и его обсуждение.
Как описано ранее для хлоропластов гороха 235 (Schreiber and Kluhammer, 2009) и Arabidopsis (Hanke et al., 2008), 9 изолированных хлоропластов обнаруживают отдельные компоненты восстановления NADP + 236.
«Затем мы оценили влияние местоположения FNR на фотосинтетический перенос электронов…»
В этой части текста делается довольно большой скачок в выводах от гипотетической интерпретации кинетики синей флуоресценции до местоположения FNR…
Если рецензенты предполагают, что гипотеза о перемещении FNR в хлоропласте является слишком большим скачком, она ранее была предложена в опубликованной рецензируемой работе (Joliot and Johnson, 2011).Учитывая тему наших исследований, эту опубликованную гипотезу нельзя игнорировать. Это еще более актуально, учитывая корреляцию между флуоресценцией NADP (H) и локализацией FNR, наблюдаемую при анализе растений, используемых в этой работе. Затем гипотеза проверяется в эксперименте, показанном на рисунке 6 в рукописи.
«Чтобы отличить LEF от CEF, мы сравнили освещение белым светом (стимуляция как PSI, так и PSII, и, следовательно, CEF + LEF), с дальним красным светом (только возбуждение PSI и, следовательно, только CEF).”
Это явно неверно. Хотя дальний красный свет предпочтительно возбуждает PSI, он не только возбуждает это, и, таким образом, невозможно приписать весь перенос электронов или связанные сигналы с CEF при дальнем красном свете. Кроме того, предыдущее наблюдение высокого CEF в течение первых 20 секунд освещения при попадании света как на PSI, так и на PSII было связано с метаболическими или физиологическими эффектами индукции последующих метаболических процессов. Совершенно неясно, будет ли то же самое с далеким красным светом или что это будет сравнимо с мутантными линиями.
Мы обращаем внимание обозревателей на рисунок 5 — приложение к рисунку 1, демонстрирующий ту же тенденцию (хотя и с большим разбросом) при использовании DCMU вместо дальнего красного света для дифференциальной стимуляции PSII. Кроме того, как указано в тексте (Материалы и методы и легенда на Рисунке 5), период освещения был не далеким красным светом, а актиничным светом, что гарантирует эквивалентность двух обработок. Дальний красный свет используется только в течение 20 секунд перед измерением ECS.Мы изменили текст, чтобы прояснить это дальше. Мы не предполагаем, что во время 20-секундного освещения индуцируются какие-либо нижестоящие эффекты, функция которых состоит в том, чтобы стимулировать максимальную активность либо обеих фотосистем (актиничный свет), либо предпочтительно стимулировать PSI (дальний красный свет). Ранее было опубликовано, что CEF можно в равной степени оценить с помощью ECS с дальним красным светом (как в нашей работе) или переходными флуоресценциями после освещения (PIFT) (Suorsa et al. (2016). Molecular plant, 9, 271-288) .
«Неожиданно, после адаптации к темноте мутант fnr1, который теоретически имеет более низкую окислительную способность Fd, демонстрирует более низкое акцепторное ограничение, чем другие генотипы».
Есть несколько потенциальных проблем с этими результатами.
Ссылки на методы отсутствуют.
Мы расширили текст в материалах и методах, чтобы объяснить методы более подробно, и сослались на руководство Dual-PAM, из которого берутся все расчеты, а не излагаются сами расчеты.
Преобладающий метод проведения этих типов измерений, вероятно, не будет работать в этих типах мутантов и условиях. Ни текст, ни материалы и методы не предоставляют достаточной информации для определения важных аспектов эксперимента, а также не приводятся репрезентативные следы, поэтому невозможно определить, так ли это.
Мы процитировали источник расчетов и предоставили дополнительную информацию об условиях лечения.Мы обращаем внимание обозревателей на типичные кривые P700, представленные на рисунке 5 — приложение к рисунку 2. Раньше это упоминалось только в подписях к рисункам, но теперь мы также упомянули об этом в материалах и методах, чтобы сделать это более понятным.
Важно показать кинетику сигналов P700, потому что при сильных ограничениях на акцептор PSI сильный импульс актиничного света может привести к быстрому накоплению электронов на акцепторах PSI, не позволяя определить реальную амплитуду Pm или Pm ‘.Во многих случаях применение дальнего красного света сводило к минимуму эту проблему, но в случае fnr1, в котором способность к окислению Fd постоянно мала, вполне вероятно, что это не поможет. Недооценка Pm должна искусственно уменьшать Y (NA).
Мы действительно проверили, что наши данные не были вызваны недооценкой Pm, но не включили эти данные в исходную рукопись. Теперь они представлены в виде таблицы в дополнительном файле 2f и показывают небольшое (но не существенное) уменьшение исходного измерения Pm для мутанта fnr1, указывая на то, что это не является существенной проблемой в наших измерениях.Об этом сейчас упоминается в тексте. Кроме того, следует отметить, что после световой адаптации значение Y (NA) мутанта fnr1 становится значительно выше (около 200%), чем у других генотипов (Рисунок 5), что означает, что более низкое значение, наблюдаемое после адаптации к темноте. это не недооценка.
Лучший способ определить, влияют ли эти проблемы на результаты, — это показать необработанные кривые и посмотреть на переходное поведение сигнала P700 +.
См. Предыдущий комментарий выше относительно рисунка 5 — дополнение к рисунку 2.
«Параметры нефотохимического тушения для PSI были рассчитаны с помощью Y (ND) = 1-P700 red. И Y (NA) = (Pm-Pm ‘) / Pm. Эффективный квантовый выход PSI был рассчитан с помощью Y (I) = 1-Y (ND) -Y (NA). NPQ рассчитывали с помощью программного обеспечения DUAL-PAM-100 ».
Это не параметры «нефотохимического тушения», а относительные изменения окислительно-восстановительных состояний.
Эта опечатка была удалена вместе с этим разделом текста, который был заменен ссылкой.Большое спасибо за то, что обратили на это наше внимание.
«Хлоропласты быстро переключаются между LEF и CEF ..». Одним из лучших примеров высокой скорости переключения между LEF и CEF является Люкер и др., Которые показали, что это действительно быстрое переключение, порядка десятков секунд. Каким образом изменение локализации FNR и его взаимодействия с тилакоидной мембраной может так быстро отреагировать?
Мы думаем, что перемещение FNR определенно не единственный механизм регуляции путей CEF / LEF и, вероятно, не доминирующий, особенно при ярком освещении.Поэтому трудно предположить, какой путь CEF измеряется в работе Luker et al. на основании наших выводов. Тем не менее, мы можем развить предположение, которое мы сделали в ходе обсуждения: взаимодействия FNR с привязками TROL и Tic62 подлежат регуляции pH (Alte et al., 2010), ослабевая по мере повышения pH в строме. Изменение Δ pH при появлении света происходит в масштабе времени в секунды или десятки секунд, обеспечивая возможную подсказку для высвобождения FNR. С точки зрения ассоциации с (предположительно) PSI и антеннами (как показано Marco et al., 2019), о регулировании ничего не известно, но, учитывая невозможность его обнаружения в синих нативных гелях, оно должно быть слабее, чем с TROL или Tic62. В отсутствие других доказательств на сегодняшний день мы предполагаем, что это взаимодействие происходит по умолчанию при выпуске из Tic62 / TROL в масштабе времени в десятки секунд. Мы надеемся изучить это в будущей работе.
Рецензент № 2:
Это сильный вклад, который анализирует корреляцию между распределением только FNR срезов хлоропласта и характеристиками циклического электронного потока.Тема посвящена важному спорному вопросу о том, как циклический транспорт электронов временно активируется и регулируется вниз во время перехода к темному свету — короткий период, когда избыточная световая энергия еще не может быть адекватно использована, потому что время, необходимое для активации реакций связывания углерода цикла Кальвина-Бенсона-Бассема. Значение также связано с тем фактом, что аналогичные регуляторные функции, вероятно, необходимы для защиты и стабилизации фотосинтетического механизма в изменяющихся условиях окружающей среды.Поэтому оцениваю общую значимость этой рукописи как высокую.
С технической точки зрения, это хорошо выполненный набор грамотно подобранных экспериментов. Есть некоторые грамматические проблемы, но в целом рукопись явно написана с интересными обсуждениями. Помимо некоторых пояснений по интерпретации кинетики, я не нахожу серьезных сбоев в этой статье и предлагаю лишь несколько незначительных дополнительных предложений:
Было бы неплохо вкратце определить, что означает коэффициент контроля, поскольку этот аспект метаболической теории не так широко изучен, несмотря на его важность.
Мы включили определение в текст.
Результат седьмой абзац (этот и следующий):
Это обсуждение следует немного переработать, чтобы прояснить. После завершения обсуждения я могу видеть, что им было нужно, но первоначальное описание кинетических особенностей требует уточнения. Позже графическая модель также поможет.
Абзац и часть обсуждения были переписаны, чтобы попытаться улучшить ясность.Мы неохотно включаем модель в качестве основного рисунка, поскольку считаем, что это все еще довольно спекулятивно, но теперь мы представляем две возможные альтернативные графические модели в качестве дополнительного рисунка к рисунку 6 — добавление к рисунку 1.
Рисунок 4 соответствует двум компонентам, но обсуждение, похоже, подразумевает третий последовательный компонент, который необходимо учитывать при подборе. Если сильно связанная форма не просто «менее эффективна», но по существу неактивна, то медленный компонент относится ко времени диффузии и (или высвобождения, предполагая очень быструю диффузию).В этом случае третий компонент может быть практически невидимым, если предложенный диффузионный экскурс завершится гораздо более быстрым процессом. Промежуточные ситуации были бы более сложной ситуацией, и я думаю, что это, вероятно, проявится как более сигмоидальная характеристика медленной фазы, поскольку мобилизованные переходят в более быструю деятельность. Не знаю, имеет ли это смысл, но определенно авторам нужно лучше выражать свои идеи в контексте модели.
Это отличный отзыв, и мы благодарим рецензента за содержательный комментарий.Мы внесли поправки в текст о диссоциации и удалили предположения о слабых ассоциациях из раздела результатов, а теперь включили их в обсуждение, исправив, чтобы попытаться лучше выразить, что i) диссоциация, диффузия и ассоциация, как ожидается, внесут вклад в 3 различных компонента. , ii) один из этих компонентов либо молчит (возможно, из-за инактивации при связывании), либо слишком быстр, чтобы его можно было обнаружить.
Я думаю, что это не изменение эффективности, а наличие двух параллельных реакций с разной эффективностью (см. Выше).
Мы согласны с рецензентом, что это весьма вероятно, и мы изменили текст, чтобы просто указать, что медленно нарастающая фаза кинетики восстановления NADP + (а не какое-либо изменение ферментативной эффективности) находится в том же временном масштабе. Кроме того, эта возможность представлена на Рисунке 6 — дополнении к рисунку 1.
Авторам следует принять во внимание недавнее открытие, что комплекс NADH-1, по-видимому, использует не NADPH, а Fd, что согласуется с их интерпретацией.
Теперь мы включили эту информацию.
[Примечание редакции: до принятия были предложены дальнейшие исправления, как описано ниже.]
Существенные изменения:
Рецензенты сочли, что текущие изменения исправили большинство проблем, в основном за счет устранения некоторых областей чрезмерной интерпретации и сужения фокуса обсуждения. Однако остаются некоторые важные проблемы, особенно в отношении интерпретации кинетики флуоресценции НАДФН.Как было поднято рецензентом №1 в первом обзоре и дополнительно расширено рецензентом №2 во втором обзоре, двухфазные характеристики нарастания флуоресценции могут интерпретироваться по-разному, и этот вопрос не был рассмотрен в пересмотренном тексте, который по-прежнему придерживается чрезмерно упрощенной интерпретации, и в тексте необходимо ввести другие возможные интерпретации, особенно потому, что представленные до сих пор данные не могут их исключить. Рецензент и редактор считают, что признание и полное обсуждение этих возможностей не только важно для науки, но и существенно укрепит статью.
Статья может быть принята для публикации, если это, а также более мелкие вопросы, поднятые рецензентом №2, могут быть решены. В частности, пересмотр должен рассмотреть неточную интерпретацию ссылки Кауни / Сетифа и обсудить возможные альтернативные интерпретации быстрой и медленной фаз кинетики НАДФН.
Это сравнение с цианобактериями больше не проводится. Мы включили новые параграфы, в которых обсуждаются другие интерпретации медленной фазы кинетики НАДФН, в результаты, обсуждение и Приложение.Более того, мы удалили последний абзац Обсуждения, чтобы смягчить аргумент.
Рецензент № 2
По большому счету, вопросы в основном решены, однако остаются некоторые проблемы, касающиеся кинетики флуоресценции НАДФН, особенно их двухфазных характеристик их подъема. Авторы до сих пор не исключили другие процессы, расположенные ниже по потоку, как ответственные за медленную фазу. Это могут быть медленно изменяющиеся и быстрые скорости поглощения окислительно-восстановительного потенциала. Другими словами, это может быть относительно быстрый процесс потребления НАДФН (очень быстрый по сравнению с временными масштабами эксперимента), но их скорость может медленно меняться.Пост аргумента об отсутствии у цианобактерий двухфазности (ссылка Кауни / Сетифа) не точен: хотя у цианобактерий явно разная кинетика и разные формы, более медленные фазы четко видны и фактически коррелируют с такими вещами, как переходы состояний и активация цикл Кальвина. Соответственно, процессы после PSET (но взаимодействующие из-за эффектов обратного распространения), по-видимому, ответственны за эти многосекундные кинетические особенности.
Обсуждение кинетики цианобактериального НАДФ (H) было удалено из текста приложения.
Поскольку существуют неповрежденные хлоропласты, очевидно, что такие эффекты присутствуют в текущих экспериментах. Таким образом, аргумент, основанный на измерении распространенности компонентов цепи переноса электронов, недостаточен, чтобы решительно возражать против доминирования последующих процессов в управлении более медленной фазой. Это необходимо четко сформулировать в тексте основных результатов, а также в ходе обсуждения. Тем не менее, гипотеза о том, что эти фазы объясняются перемещением, также не исключена, и в целом интерпретации, похоже, совпадают.Тем не менее указанная слабость должна умерить силу аргументов.
Мы согласны, и, поразмыслив, это следовало бы более четко изложить в тексте. Мы представили эту возможность в разделе «Результаты» и расширили ее более подробно в обсуждении и в Приложении 1.
https://doi.org/10.7554/eLife.56088.sa2
.
