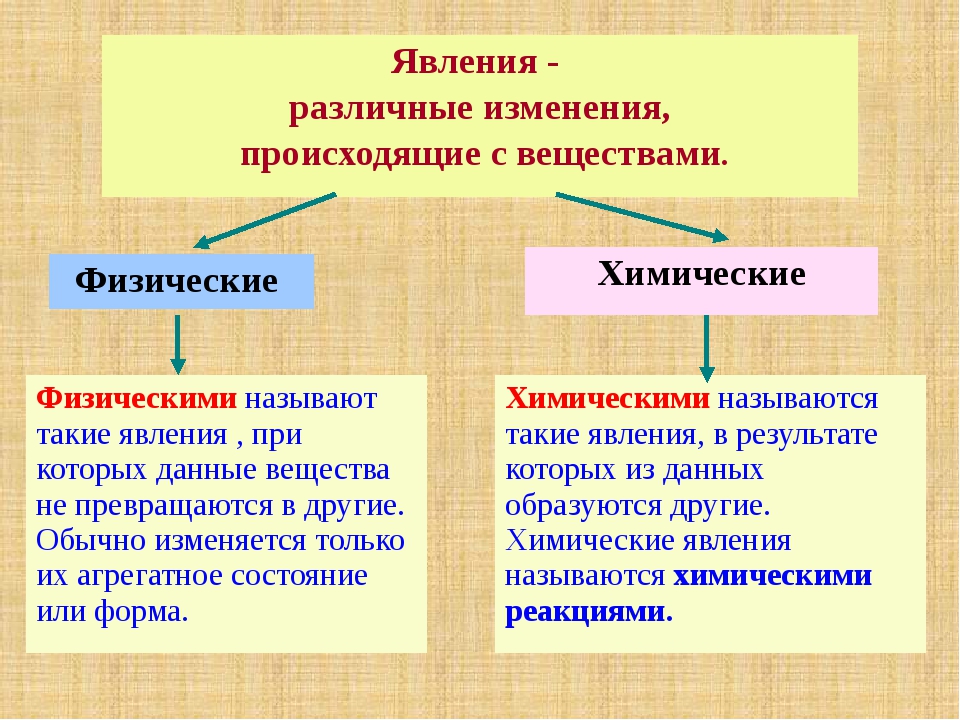
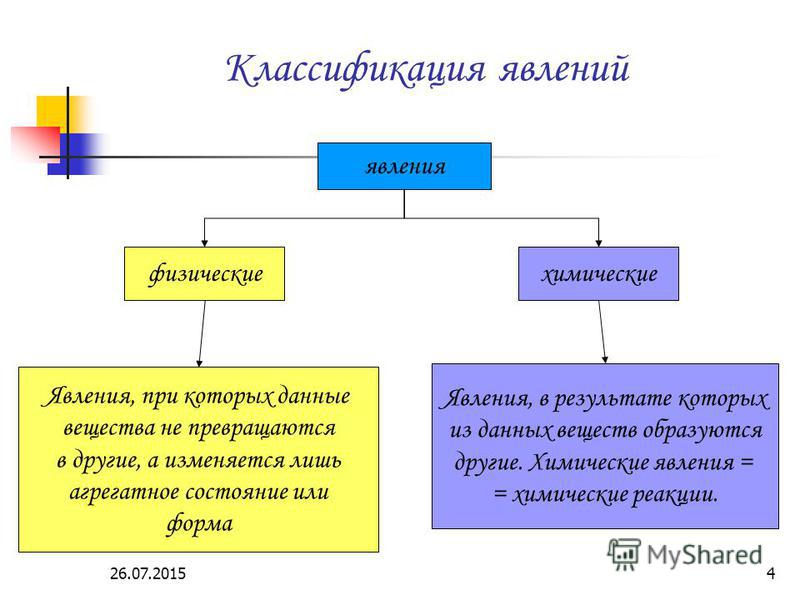
II. Актуализация опорных знаний урока. Проверка опорных знаний, необходимых обучающимся для изучения нового материала | Фронтальная беседа, фронтальный контроль | Активизирует знания, необходимые обучающимся для изучения нового материала. Осуществляет фронтальный контроль: – Какие явления называются физическими? (явления, при которых происходит изменение агрегатного состояние веществ.) – Какие способы разделения смеси можно выбрать для очищения железа, серы, поваренной соли? (соль растворяется в воде, железо можно отделить магнитом.) – На чем основываются способы разделения смесей? (способы разделения смесей основываются на физических свойствах: растворимости в воде, плотности, температуре кипения. Также для разделения веществ используют возгонку и центрифугирование.) – Что изучает химия? (вещества и превращения веществ. | Слушают вопросы учителя. Отвечают на вопросы учителя. Слушают мнения одноклассников | Осуществляют анализ ответов одноклассников. Сравнивают. Строят высказывания, понятные для одноклассников и учителя. Умеют слушать в соответствии с целевой установкой | Вопросы учителя |
III. Мотивация к изучению нового материала. Формулирование темы и целей урока. Обеспечение мотивации и принятия обучающимися цели учебно-познавательной деятельности | Вводная беседа, постановка проблемы.
Записи
Работа | мотивирует обучающихся к определению темы и к постановке познавательной цели урока. озвучивает тему и цель урока. Уточняет понимание обучающимися поставленных целей урока. демонстрирует горение свечи: – К какому типу явлений можно отнести горение свечи? – Объясните свой выбор. Выдвигает проблему: – В чем особенность химических явлений и их отличие от физических явлений? Есть ли характеристики, благодаря которым можно отличать физические и химические явления? | Отвечают на вопросы. Выдвигают предположения. Ставят цели, формулируют тему урока. Разделяются на две группы: одна будет рассуждать, что горение свечи – это физическое явление, другая – что это химическое явление. Слушают мнения одноклассников | Наблюдают. Осуществляют анализ объекта. Устанавливают причинно-следственные связи | Вопросы учителя, устные ответы |
IV. Усвоение новых знаний и способов действий. Обеспечение восприятия, осмысления и первичного запоминания знаний, выявление обучающимися новых знаний. Развитие умения находить ответы на проблемные вопросы. | Вводная беседа.
Записи
Работа | Объясняет новый материал, используя ЭОР и учебник. Формулирует задание: – Пронаблюдайте за явлениями, которые я сейчас вам продемонстрирую. Определите, к каким явлениям они относятся. может использовать видеоопыты из раздела «Физические и химические явления» портала «Единая коллекция цифровых образовательных ресурсов». Организует работу по исследованию проблемной ситуации. Демонстрирует изменение цвета. – Что происходило в пробирке? Какое явления вы сейчас пронаблюдали? (изменение цвета, это химическое явление.) Демонстрирует выделение газа. – Почему это явление относится к химическим? (произошло изменение вещества, поэтому выделяется газ, значит, явление химическое.) Демонстрирует выделение света и тепла (горение свечи). Демонстрирует выпадение осадка. – Выделите, какие признаки сопутствуют химическим реакциям. (Выделение тепла или света, изменение цвета, выделение газа, выделение (растворение) осадка.) – Признаки химических реакций: 1) Выделение (поглощение) тепла или света. 2) Изменение цвета. 3) Выделение газа. 4) Выделение (растворение) осадка. 5) Изменение запаха. – Попробуйте дать определение химическим явлениям. – Химическое явление – это явление, при котором одно вещество превращается в другое | Воспринимают информацию, сообщаемую учителем; работают с материалами ЭОР, учебником; фиксируют в тетрадях новые термины и понятия.
Участвуют в коллективной беседе.
формулируют определение | Устанавливают причинно-следственные связи в изучаемом круге явлений; ищут и отбирают источники необходимой информации, систематизируют информацию | Фронтальный опрос совместно с рассказом учителя |
V. освоение способа действия с полученными знаниями в практической деятельности | Фронтальная беседа | – Из предложенного перечня явлений выберите химические реакции: почернение медной пластинки при нагревании, плавление металла в пламени ацетиленово-кислородной горелки, образование кристаллов соли при упаривании ее раствора, обугливание лучины, скисание молока. (почернение медной пластинки при нагревании, плавление металла в пламени ацетиленово-кислородной горелки, обугливание лучины, скисание молока.) – Поясните, какие признаки подтверждают, что гниение пищевых остатков – химическая реакция. (изменение цвета, выделение тепла.) Контролирует выполнение работы. Осуществляет индивидуальный контроль. Организует коллективную проверку выполнения задания. Устанавливает осознанность восприятия, первичное обобщение, побуждает обучающихся к высказыванию своего мнения. Подводит обучающихся к выводу о химических реакциях, признаках химических реакций. | Решают типовые задания с проговариванием алгоритма вслух. Выбирают из перечня явлений химические реакции | Выполняют задания в соответствии с поставленной целью | Наблюдение. Устные ответы |
VI. Рефлексия учебной деятельности | Фронтальная работа | Акцентирует внимание обучающихся на конечных результатах учебной деятельности на уроке: ‒ Что нового вы узнали на уроке? – Что до сих пор остается непонятным? | Осуществляют самоанализ деятельности | Воспринимают оценку своей работы учителем, товарищами | Устные ответы |
VII. Подведение итогов. Выявление качества и уровня овладения знаниями, обеспечение их коррекции | Закрепляющая беседа | Оценивает работу обучающихся во время урока, комментирует оценки. | Слушают учителя | Формулируют выводы на основе наблюдений, высказывают свое мнение и позицию | Устные ответы |
Домашнее задание | Дает комментарий к домашнему заданию: § 25, задания по рабочей тетради | Записывают задание | Читают задание. Задают уточняющие вопросы | Наблюдение |
Конспект урока по химии 8 класс ФГОС по теме:«Физические и химические явления.Химические реакции »
Урок №6 Дата: химия 8 класс
Тема урока «Физические и химические явления.Химические реакции »
Цель урока: Создание условий для усвоения учащимися знаний о физических и химических явлениях, признаках и условиях протекания химических реакций, учить наблюдать и выполнять химический эксперимент.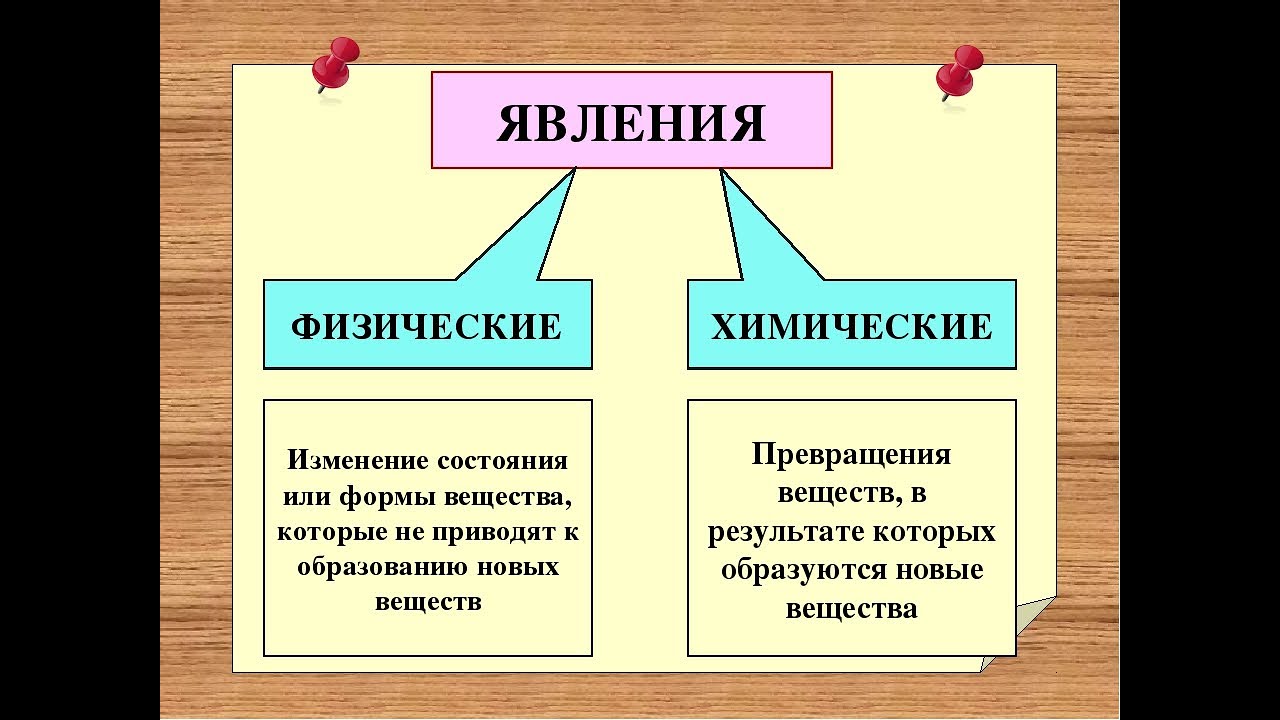
Задачи урока:
Обеспечить достижение предметных результатов обучения
Образовательные задачи.
. Усвоить понятия «физические явления», «химические явления», химическая реакция.
2. Изучить признаки и условия протекания химических реакций.
Сформировать умения:
— Способствовать формированию умений проводить и анализировать лабораторные исследования, вырабатывать практические умения работать с реактивами, оборудованием в соответствии с правилами по технике безопасности.
-Формировать умение наблюдать явления, узнавать их и делать выводы на основе наблюдений;
-Формировать умение проводить эксперимент в целях бережного отношения к здоровью;
-Формировать умение объяснять значение явлений в жизни природы и человека;
Воспитательные задачи.
-Воспитание убеждённости в познаваемости химической составляющей картины мира;
-Формирование эстетического вкуса при наблюдении красоты явлений природы;
-Воспитание бережного отношения к своему здоровью.
Создать условия для:
1. формирования ценностного отношения к исследовательской деятельности как основному способу получения знаний в химии;
2.развития коммуникативных умений;
3. воспитания ответственности и аккуратности при проведении лабораторных опытов;
4.воспитания позитивного отношения к химии;
Развивающие задачи.
Создать условия для развития следующих УУД:
1) Познавательных:
• Общеучебные универсальные действия:
а.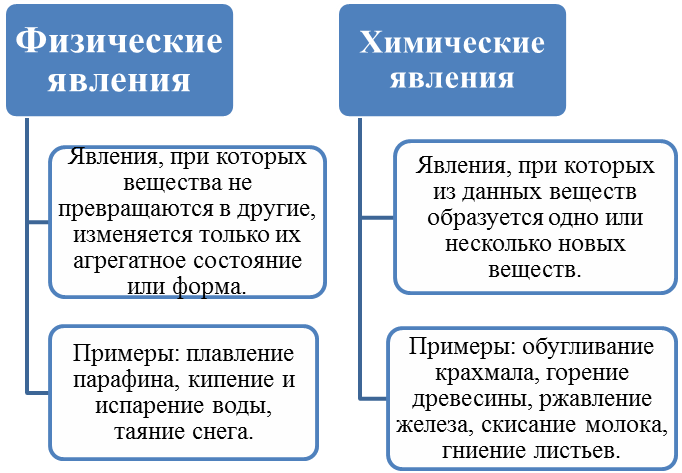 Осознанное и произвольное построение речевого высказывания.
Осознанное и произвольное построение речевого высказывания.
б. Смысловое чтение, определение основной и второстепенной информации.
в. Выбор наиболее эффективных способов решения задач.
г. Рефлексивные УУД (самоконтроль и самооценка).
д. Структурирование знаний.
• Знаково-символические действия: написание уравнений реакций.
• Логические универсальные действия:
а. Анализ объектов с целью выделения признаков, установление причинно-следственных связей.
б. Умение анализировать, строить план исследования, наблюдать и делать выводы на основе эксперимента, делать дедуктивные и индуктивные умозаключения.
в. Умение проводить и описывать эксперимент.
г. Выдвижение гипотез, их обоснование.
• Постановка и решение проблемы.
2) Личностных: самостоятельное создание способов решения проблем поискового характера.
3) Коммуникативных:
а. Умение точно выразить свои мысли, владение диалогической речью,
б.Сотрудничество в группе.
4) Регулятивных.
а. Целеполагание. Планирование (построение плана изучения физических и химических явлений).
б. Контроль в форме сличения результата действия с заданным эталоном.
в. Оценка и саморегуляция.
Критерии достижения цели урока: ученик должен
ЗНАТЬ:
• понятия химические и физические явления, химическая реакция;
• признаки и условия протекания химических реакций;
УМЕТЬ:
• описывать и характеризовать химические и физические явления;
• дифференцировать химические и физические явления;
• наблюдать и сравнивать свойства веществ;
ВЛАДЕТЬ: навыками проведения эксперимента и правилами ТБ;
Планируемые результаты обучения.
Обеспечить достижение метапредметных результатов обучения: создать условия (учебные ситуации) для развития коммуникативных, регулятивных и познавательных УУД.
Обеспечить достижение личностных результатов обучения:
сформировать позитивное эмоциональное отношение обучающихся к изучаемым на уроке химическим явлениям, развитие умения управлять своей познавательной деятельностью, готовности к решению задач на выявление сущности того или иного явления природы
Предметные результаты обучения | Метапредметные результаты обучения |
-Давать определения физических и химических явлений. -описывать самостоятельно проведенные эксперименты, используя для этого язык химии. -уметь описывать и характеризовать физические и химические явления. -наблюдать и сравнивать свойства веществ, — структурировать изученный материал. -планировать и проводить химический эксперимент. -иметь представление о признаках и условиях протекания химических явлений (реакций). | — владеть универсальными способами деятельности: наблюдение, эксперимент, учебное исследование, -использовать универсальные способы деятельности по решению проблемы и основных интеллектуальных операций. -уметь определять средства, необходимые для реализации идей. -уметь определять цели и задачи деятельности, выбирать средства реализации цели и применять их на практике -использовать различные источники для получения химической информации. -развивать способности к наблюдениям, систематизации информации, способности выделять главное существенное |
Оборудование
Для лабораторных опытов: спички, парафиновая свеча, закрепленная на огнеупорной пластине, пробирка с кристаллической содой в штативе для пробирок и флакон с раствором уксусной кислоты (5 – 7%),магниевая лента (стружки), сахарная пудра, конц. серная кислота, раствора глины, раствор медного купороса, раствор щелочи. Лабораторная посуда: колба, ложки для сжигания, воронки химические, фарфоровые ложки-шпатели, бумажные фильтры.
серная кислота, раствора глины, раствор медного купороса, раствор щелочи. Лабораторная посуда: колба, ложки для сжигания, воронки химические, фарфоровые ложки-шпатели, бумажные фильтры.
Маршрутная карта с заданиями, таблицами для внесения наблюдений, сопровождавших лабораторные опыты и для рефлексии.
Тип урока: Урок открытия новых знаний.
ХОД УРОКА
1 этап. Организационный момент.
-Один из героев французского писателя Мольера всю жизнь не знал, что он говорит прозой.Многие, впрочем, и сейчас этого не знают, как не знают и того, что всю жизнь имеют дело с химией.А что такое химия?
2 этап. Актуализация знаний .
-Какие вещества называются чистыми?
-Дайте определение смесям.
-Какими бывают смеси?
-Назовите способы очистки смесей.
Задание: Разделите картинки на две группы. Обоснуйте их распределение (На парты по группам выданы картинки с физическими и химическими явлениями, учащиеся обсуждают наблюдения, делают выводы. )
)
Озвучивается ответ каждой группы.
— Что объединяет все картинки?
Учащиеся: На всех картинках показаны явления.
-Что происходит при различных явлениях?
-Как вы думаете – все ли явления в природе одинаковы, по сути? Поднимите, пожалуйста, руки те, кто считает, что все явления, по сути, сходны или одинаковы, а теперь те, кто считает, что явления отличаются. Кто может объяснить свой выбор? (задание вызывает интеллектуальное затруднение)
Учащиеся сами приходят к выводу:
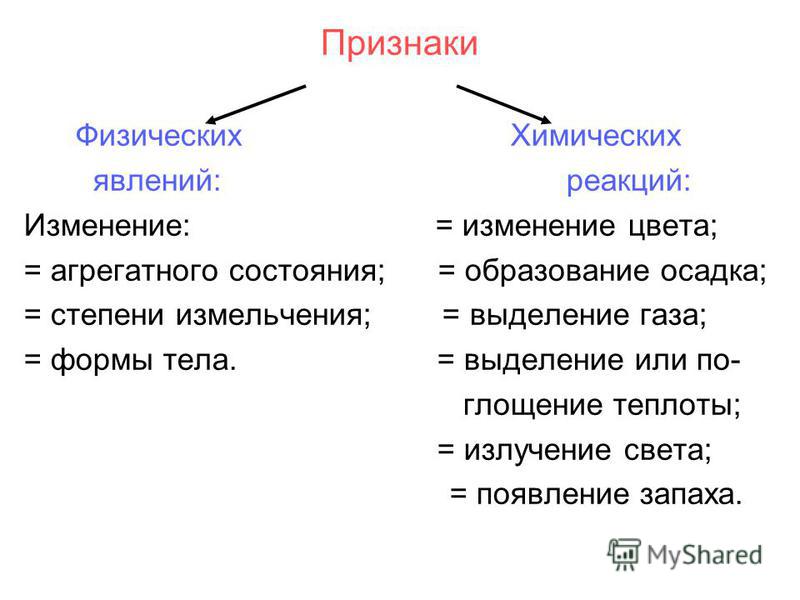
Различают два вида явлений в природе: явления, при которых у веществ изменяется форма, агрегатное состояние или температура. Явления, при которых происходит изменение окраски веществ, выделение газа, образование осадка, выделение тепла.
—. Предложите свою формулировку темы урока, не изменяя содержание.
3 этап. Постановка учебной задачи.
Постановка учебной задачи.
—Как можно сформулировать тему урока?
Тема урока: Физические и химические явления. Химические реакции
—Итак, мы изучаем физические и химические явления.
Давайте теперь на практике попробуем определить, какие явления являются физическими, а какие химическими. (Целеполагание и определение путей достижения цели)
Предположим, вы хотите узнать о физических и химических явлениях абсолютно все.
-Какие цели вы поставите перед собой на этот урок?
-Что вы хотели бы узнать о физических и химических явлениях?Чему научиться?
Варианты ответов учащихся:
1. Изучить понятия «физические«химические» явления (химическая реакция)
2. Изучить признаки и условия протекания химических явлений (реакций)
3. Уметь отличать физические и химические явления (дифференцировать)
Уметь отличать физические и химические явления (дифференцировать)
4. Узнать значение физических и химических явлений
4 этап. Построение проекта выхода из затруднения.
(проектирование) (23 минуты)
Деятельность учителя:
Учитель:
Какими способами будем достигать перечисленные вами цели?
Учащиеся:
Проводить лабораторные опыты. Наблюдать. Делать выводы о «физических «химических» явлениях.
Изучать новые понятия.
Делать схематические рисунки, используя термины.заполнять таблицы.
Находить и анализировать информацию в учебнике и дополнительных источниках.
Сравнивать, дифференцировать физические и химические явления.
Выделять признаки химических явлений
Задавать вопросы учителю.
Размышлять, высказывать предположения.
Учитель:Запишите на полях еще одну цель (цель+) лично для себя. Сегодня эта цель будет связана с вашей работой в группе. Сформулируйте ее сами. «На протяжении урока я…»маршрутная карта задание № 2
Деятельность обучающихся: выполняют эксперименты.Самостоятельно делают выводы о явлениях).Обсуждают результаты наблюдений.
Демонстрационные опыты:
Содержание опыта | Наблюдения, сопровождающие опыт | Вывод о явлении |
Горение магниевой ленты (стружки) | Вспышка света, образование белого дыма (порошка) | химическое |
Растворение сахарной пудры | Образование сиропа | физическое |
Обугливание сахара концентрированной серной кислотой | Появление запаха жженого сахара, почернение сахара и увеличение его объёма (подъём за счёт выделяемого газа) | химическое |
Фильтрование раствора глины | Глина на фильтре, фильтрат бесцветный прозрачный | физическое |
Взаимодействие раствора медного купороса с раствором щелочи | Образование осадка голубого цвета | химическое |
Горение парафиновой свечи | Выделение тепла, света, образование нового вещества с новыми свойствами. | химическое |
Гашение соды уксусом | Образование нового вещества-газа. | химическое |
—По каким признакам вы определяли, какое явление – химическое или физическое происходит?
Ученики высказывают свое мнение. В результате беседы подводится итог – признаки химических реакций (явлений), которые записывается учащимися в рабочую тетрадь по заданиям в маршрутной карте.
Задание индивидуально. Маршрутная карта задание № 4
Используя схему на странице 11 учебника дайте определение:
Физическими явлениями называют-
Химическими явлениями называют-
Дополни схему. Делают записи в тетрадях.
Учащиеся сами называют и записывают признаки химических реакций (явлений).
1. Выделение тепла (иногда света),
2. Изменение окраски,
3. Появление запаха,
4. Образование осадка,
5. Выделение газа.
Выделение газа.
Отвечают на вопросы по маршрутной карте.
Ответь на вопрос: Что происходит при химических реакциях(дают определение)
После ответов на вопросы по маршрутной карте делают выводы:какие же условия должны быть выполнены для того, чтобы началась химическая реакция?
Задание в парах. Маршрутная карта задание №4
— Почему кусковой сахар трудно поджечь, но измельчённый и распылённый в воздухе он сгорает за считанные доли секунды, образуя своеобразный взрыв?
-Произойдет ли разложение сахара, если прекратить его нагревание?
Анализ рисунка маршрутная карта задание №4
Перечисли, условия возникновения и течения химических реакций используя страницу 12 в учебнике.
Сообщение ученика (опережающее д/з):
На протяжении всей жизни мы постоянно сталкиваемся с физическими и химическими явлениями.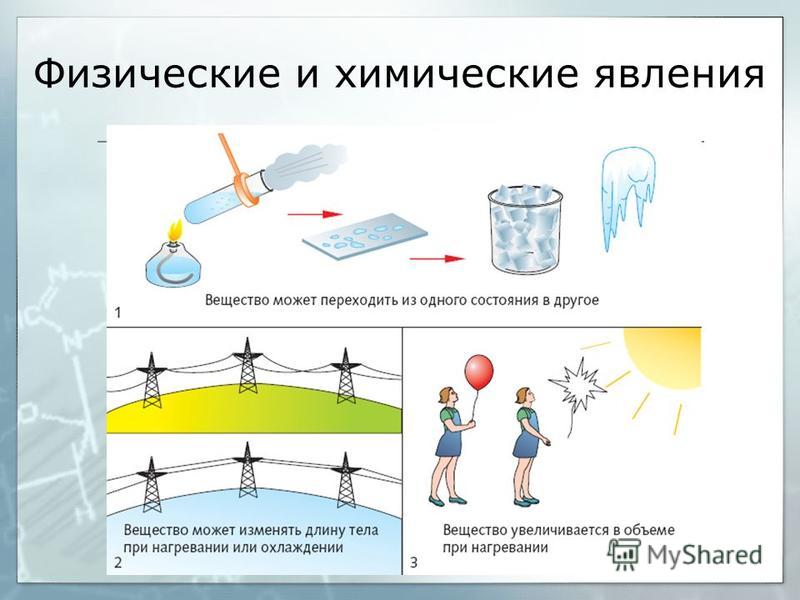 Природные физические явления для нас столь привычны, что мы уже давно не придаём им особого значения. Химические реакции постоянно протекают в нашем организме. Энергия, которая выделяется при химических реакциях, постоянно используется в быту, на производстве, при запуске космических кораблей. Многие материалы, из которых изготовлены окружающие нас вещи, не взяты в природе в готовом виде, а изготовлены с помощью химических реакций.
Природные физические явления для нас столь привычны, что мы уже давно не придаём им особого значения. Химические реакции постоянно протекают в нашем организме. Энергия, которая выделяется при химических реакциях, постоянно используется в быту, на производстве, при запуске космических кораблей. Многие материалы, из которых изготовлены окружающие нас вещи, не взяты в природе в готовом виде, а изготовлены с помощью химических реакций.
Индивидуальное задание. Проверка в парах. Обсуждение в парах.
Используя, страницу учебника №12 заполни таблицу. Маршрутная карта задание № 5
5 этап. Первичное закрепление
Выполните тест
Какое из перечисленных явлений не является физическим?
замерзание воды
плавление алюминия
горение бензина
испарение воды
Какое из перечисленных явлений не является химическим?
ржавление железа
подгорание пищи
горение бензина
испарение воды.
—Чему, как правило, посвящена заключительная часть урока?
Ученики: Проверить, достигнуты ли результаты, и оценить их.
Вернемся к целям урока (записаны на доске). Все ли цели достигнуты теперь? Это результаты нашей совместной работы.
Теперь необходимо оценить качество достижения результатов.
-Самостоятельная работа с самопроверкой по эталону
Маршрутная карта задание № 7
-Проанализируйте результаты проверочной работы. Что выполнено верно? Над чем еще предстоит поработать?
-Какие понятия необходимо повторить? Какие умения отработать еще раз?
Запишите домашнее задание Дифференцированное. (одно из трех заданий по выбору)
Деятельность обучающихся:Маршрутная карта задание № 8
6 этап. Рефлексия деятельности
Учитель:Вспомните весь ход урока, свои мысли, чувства, действия.
– ребята, чему каждый из вас научился на сегодняшнем уроке?
– освоены ли понятия: физическое явление, химическое явление?
– были ли моменты непонимания?
– смогли ли мы их разрешить в ходе разговора?
– что вам понравилось или не понравилось на уроке и почему?
– какой результат вы получили?
Деятельность обучающихся:Маршрутная карта задание № 9
-Сегодня на уроке мы с вами продолжили знакомство с основными понятиями химии. Надеюсь, к данному моменту все справились с задачей, поставленной перед вами в начале урока. Работали все хорошо, если у кого-либо остались ещё вопросы или сомнения есть время их разрешить. Объявляются оценки за работу на уроке, собираются листы с выполненными тестовыми заданиями.
Приложение1. Маршрутная карта.
Разделите картинки на две группы.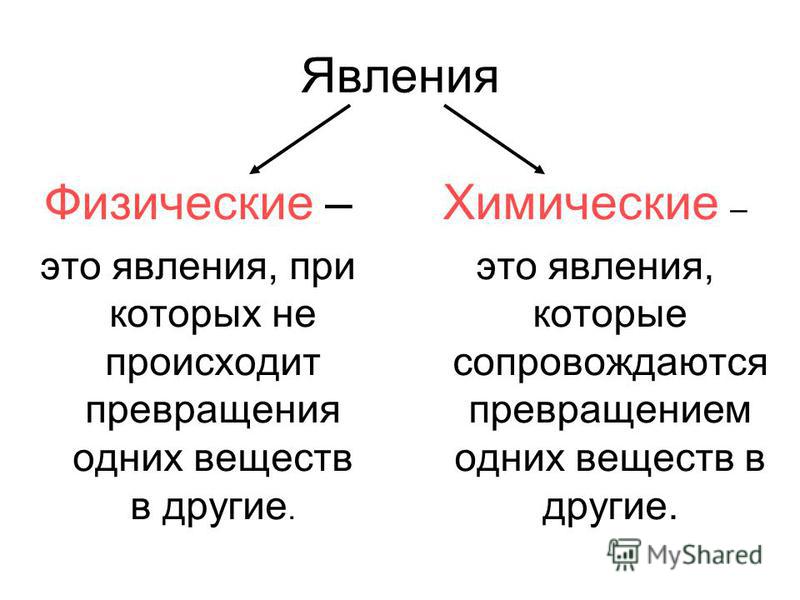 Обоснуйте их распределение.
Обоснуйте их распределение.
1 2
3 4
5 6
87
10
12
13 14
Маршрутная карта
1.Цель урока общая: _________________________________________
2.Цель учащихся личная_______________________________________
Этапы достижения цели:
3. Проведите лабораторные опыты самостоятельно по группам, соблюдая правила охраны труда.
Демонстрационные опыты:
№ п/п | Содержание опыта | Наблюдения, сопровождающие опыт | Вывод о явлении |
1 | Горение магниевой ленты (стружки) | ||
2 | Растворение сахарной пудры | ||
3 | Обугливание сахара конц. | ||
4 | Фильтрование раствора глины | ||
5 | Взаимодействие раствора медного купороса с раствором щелочи | ||
6 | Горение парафиновой свечи | ||
7 | Гашение соды раствором уксуса |
4.Используя схему на странице №11 учебника дайте определение:
Физическими явлениями называют-
Химическими явлениями называют-
Дополни схему. Сделай записи в тетради.
Признаки химических реакций (явлений)
1.
2.
3.
4.
5.
*Ответь на вопрос: Что происходит при химических реакциях-
* Используя, страницу 11 в учебнике ответьте на вопросы: почему кусковой сахар трудно поджечь, но измельчённый и распылённый в воздухе он сгорает за считанные доли секунды, образуя своеобразный взрыв?
*Ответь на вопрос: произойдет ли разложение сахара, если прекратить его нагревание?
*Рассмотри рисунок и проанализируй:
*Перечисли, условия возникновения и течения химических реакций используя страницу 12 в учебнике.
5.Используя страницу учебника №12 заполни таблицу.
Примеры явлений | Значение этих физических и химических явлений |
Физических 1)…………. 2)………….. Химических 1)…………. 2)………….. |
6. Выполни задание. Обменяйтесь тетрадями и проверьте задание друг у друга по образцу.
Какое из перечисленных явлений не является физическим?
замерзание воды
плавление алюминия
горение бензина
испарение воды
Какое из перечисленных явлений не является химическим?
ржавление железа
подгорание пищи
горение бензина
испарение воды.
7.
7.1. Выбрать один правильный ответ из четырёх предложенных.
1. К химическим явлениям относится…
К химическим явлениям относится…
А) сгорание угля
Б) испарение воды
В) образование росы на траве
Г) плавление алюминия
2. К физическим явлениям относится
А) выделение газа при взаимодействии соды с уксусом
Б) испарение уксуса
В) сгорание бензина в двигателе
Г) обугливание древесины
7.2. Верны ли следующие суждения?
А. Помутнение известковой воды при пропускании через неё углекислого газа – это химическое явление.
Б. Химические явления ведут к образованию новых веществ.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
7.3. Установите соответствие между процессом и явлением. Ответ запишите в виде последовательности букв и цифр, например, А1, Б2 и т.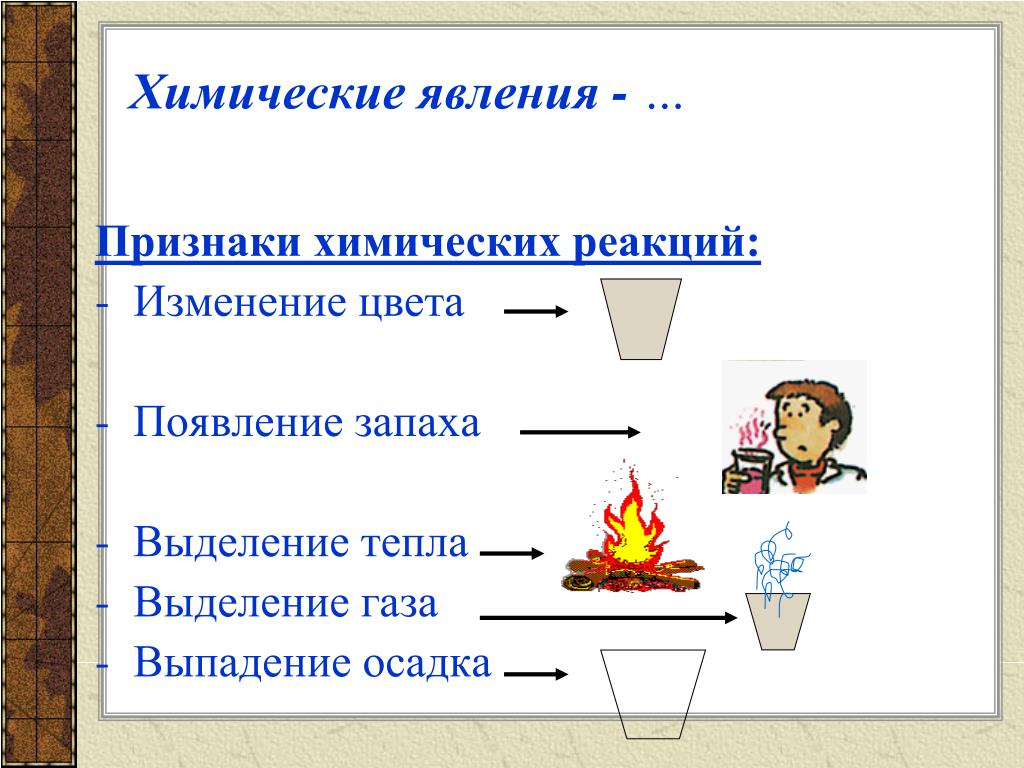 п.
п.
1) замерзание водоёмов зимой
2) изменение окраски листьев деревьев осенью
3) таяние шоколада
4) фотосинтез
А – физические явления Б – химические явления
7.4. ХИМИЧЕСКОЕ ИЛИ ФИЗИЧЕСКОЕ ЯВЛЕНИЕ?
Объясните, почему указанное явление следует отнести к физическим или химическим?
1) Свечение электрической лампочки_______________________________
______________________________________________________________
2) Таяние мороженого__________________________________________
______________________________________________________________
3) Проволока сплющивается от удара с молотком_____________________
______________________________________________________________
4) Горение дров_________________________________________________
_______________________________________________________________
5) Дробление сахара____________________________________________
_____________________________________________________________
6) Почернение медной проволоки ___________________________________
______________________________________________________________
7) Пропускание воды резиновыми сапогами___________________________
7. 5.
5.
Был проведён следующий опыт. Закрыли пробирку пробкой со вставленной в неё трубкой. Опустили конец трубки в стакан с водой. Рукой нагрели пробирку. Объем воздуха в ней увеличился, и часть воздуха из пробирки вышла через трубку, что можно наблюдать благодаря выделению пузырьков воздуха. При охлаждении пробирки объём воздуха уменьшился, и вода вошла в пробирку.
О каком явлении идёт речь? О физическом или химическом. Ответ обоснуйте______________________________________________________
8.домашнее задание (на выбор)
8.1. §3, с.13, упр. 11 – 13.
Изобразить 1 физическое или 1 химическое явление, дать объяснение явления.
8.2.спирт + кислород — вода + углекислый газ
исходные вещества конечные вещества
(реагенты) (продукты реакции)
Объясни суть данной химической реакции :
8. 3. Вследствие фотосинтеза ежегодно из атмосферы поглощается около 300 млрд т углекислого газа, выделяется 200 млрд т кислорода и образуется 150 млрд т органических веществ .Можно ли сказать что в процессе фотосинтеза происходят химические явления(реакции). Обоснуйте свой ответ.
3. Вследствие фотосинтеза ежегодно из атмосферы поглощается около 300 млрд т углекислого газа, выделяется 200 млрд т кислорода и образуется 150 млрд т органических веществ .Можно ли сказать что в процессе фотосинтеза происходят химические явления(реакции). Обоснуйте свой ответ.
8.4. Изучите конспект урока и попытайтесь сами написать по пять физических и химических явлений, используя свой собственный опыт.
8.5.Попытайтесь составить тест по теме “Физические и химические явления”;
9. Продолжить предложение:( на выбор).
сегодня я узнал…
было интересно…
было трудно…
я выполнял задания…
я понял, что…
теперь я могу…
я почувствовал, что…
я приобрел…
я научился…
у меня получилось …
я смог…
я попробую…
меня удивило…
урок дал мне для жизни…
мне захотелось…
Урок «Химические явления»
Урок химии в 8 классе
«Химические явления»
Цель:
способствовать формированию знаний учащихся о химических явлениях;
Задачи:
обучающие: содействовать формированию у учащихся знаний, позволяющих выявить чёткие различия между физическими и химическими явлениями; о признаках и условиях протекания химических реакций;
развивающие: развитие умений проводить и анализировать лабораторные исследования, вырабатывать практические умения работать с реактивами, оборудованием в соответствии с правилами по ТБ. Установление меж предметных связей.
Установление меж предметных связей.
воспитательные: содействовать воспитанию стойкого позитивного интереса к предмету, нравственному, эстетическому воспитанию учащихся.
Тип урока: урок изучения нового материала и первичного закрепления знаний.
Форма урока: беседа с демонстрационными и лабораторными опытами.
Формы организации обучения: сочетание фронтальной, групповой (работа в паре при выполнении лабораторных опытов), индивидуальной работы (при работе с дидактической карточкой).
Оборудование: лабораторное оборудование: комплект хим. посуды (пробирки, хим. стаканы, воронки), спиртовка, разносы, хим. реактивы, свеча, бенгальские огни; инструкционные карты для учащихся, учебник «Химия 8» О.С. Габриелян
Межпредметные связи: физика, биология.
Ход урока
Организационный момент.
Определение темы и целей урока.
Учитель:
— на самом первом уроке химии мы дали определение этой науки. Кто его может вспомнить? (Химия – наука о веществах и их свойствах).
Кто его может вспомнить? (Химия – наука о веществах и их свойствах).
-А какие классы неорганических веществ вы знаете? Назовите их? (Оксиды, основания, кислоты, соли)
Вы знаете вещества, знаете их состав, строение. Но знания будут неполными, если мы не изучим явления происходящие с ними.
На прошлом уроке вы познакомились с физическими явлениями. Но из курса физики вам известно, что с веществами происходят также химические явления.
Это и будет темой нашего урока: Химические явления. Запишите в тетради. (Учащиеся открывают тетради и записывают тему урока).
— Что же нужно узнать и чему научиться на сегодняшнем уроке:
определить- сущность хим. явлений
познакомиться-с видами хим. реакций
выявить- признаки хим. реакций
отметить- условия протекания хим. реакций
Таков план нашего урока.
Актуализация знаний.
Фронтальный опрос:
— Назовите признаки физических явлений. (учащиеся заполняют схему на доске)
Явления
Физические Химические
Это такие явления,
при которых не происходит превращений
одних веществ в другие,
а меняются их агрегатные состояния,
форма и размеры тел.
Назовите способы получения чистых веществ.(учащиеся отвечают: дистилляция или перегонка, кристаллизация, выпаривание, фильтрование, возгонка, отстаивание, центрифугирование)
Проверка Д/З. Упр.4 стр.134. (Предполагаемый ответ: )
Введение новых знаний.
— Начнем знакомство с химическими явлениями.
С ними впервые вы встречались на уроках природоведения.
Записи в тетради: (учащиеся дополняют схему в тетради, учитель на доске)
Явления
Физические Химические
Это такие явления, Это такие явления,
при которых не происходит превращений при которых происходит превращений
одних веществ в другие, одних веществ в другие.
а меняются их агрегатные состояния,
форма и размеры тел.
Химические явления чаще называют химическими реакциями.
— Давайте теперь на конкретных примерах познакомимся с химическими явлениями и постараемся определить их признаки.
Работа в группах (по 4 человека)
У вас на столе лежат конверты с заданиями, вам необходимо их выполнить, соблюдая ТБ, а полученные результаты занести в таблицу
№ | Содержание опыта | Наблюдения, сопровождающие опыт | Вывод о явлении |
1. | Взаимодействие мыльного раствора с раствором уксусной кислоты | Образование хлопьевидного осадка. | Химическое явление. |
2. | Взаимодействие соли аммония и гидроксида натрия. | Появление запаха аммиака. | Химическое явление. |
3. | Взаимодействие раствора соляной кислоты с кусочком мела. | Образование пузырьков газа. | Химическое явление. |
4. | Взаимодействие сырого картофеля с раствором йода | Появление синего цвета на срезе картофеля. | Химическое явление. |
Проверка результатов опытов.
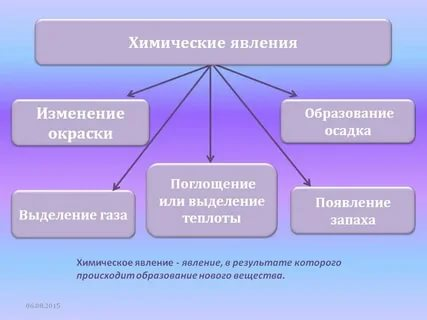
-Определим признаки химических реакций:
Изменение цвета
Появление запаха
Выделение газа
Образование осадка
(Излучение света
Выделение или поглощение теплоты)
— Я вам покажу еще один пример явления: Горение бенгальского огня. Что наблюдаете? (Свечение, выделение теплоты)
Что наблюдаете? (Свечение, выделение теплоты)
-Это признаки реакции горения. (Учащиеся записывают признаки)
— Реакция горения – это частный случай экзотермической реакции. А что это такое? Не знаете? Тогда обратимся к учебнику (п.26). Найдите определение этого понятия и запишем в тетрадь. (Учащиеся работают с учебником и тетрадью)
Реакции, протекающие с выделением теплоты, называют экзотермическими
Реакции, протекающие с поглощением теплоты, называют эндотермическими.
— Вспомним вновь химические явления. Какие условия необходимы, чтобы произошла химическая реакция? (Предположения учеников)
— Запишем в тетрадь: Условия протекания химической реакции
1. Соприкосновение веществ
2. Нагревание
3. Присутствие катализатора
4. Поверхность соприкосновения
4. Закрепление.
— Я читаю отрывки из стихотворений, а вы определяете о каком явлении идет речь: физическом или химическом?
1. Унылая пора! Очей очарованье!
Унылая пора! Очей очарованье!
Приятна мне твоя прощальная краса —
Люблю я пышное природы увяданье.
В багрец и золото одетые леса. (химическое)
(А.С.Пушкин)
2. И трещат сухие сучья,
Разгораясь жарко.
Освящая тьму ночную
Далеко и жарко! (химическое)
(И Суриков.)
3. В декабре, в декабре
Все деревья в серебре.
Нашу речку, словно в сказке
За ночь вымостил мороз… (физическое)
(С.Я.Маршак)
4. А если медь в печи нагреть.
То станет тяжелее медь
С окалиною вместе.
Не верите – так взвесьте… (химическое)
(Е. Ефимовский)
5. Что за звездочки резные
На пальто и на платке?
Все сквозные, вырезные,
А возьмешь – вода в руке? (физическое)
(Е. Благинина)
6. Световых частиц поток
Падает на зеленый листок,
Листок кислород выделяет,
Углекислый газ поглощает. (химическое)
(химическое)
(Из ответа ученика )
7. Когда металл в крутые формы льем,
Мне верится, что оживут в металле
Горячие полдневные поля.
Кипит металл … (физическое)
(А. Кравцов)
— Тест по изученной теме.
Тест по теме “Физические и химические явления»
1 вариант – химические явления
2 вариант – физические явления
А). Растворение сахара в воде
Б). Разложение воды электрическим током на водород и кислород
В). Образование черного налёта на серебряных изделиях
Г). Образование кристалликов соли при выпаривании раствора
2. Из списка условий протекания и признаков химической реакции выберите
1 вариант — признаки реакции
2 вариант – условия протекания
А). Появление запаха
Б). Нагревание
В). Выделение газообразных веществ
Г). Контакт веществ
Д). Изменение цвета
Изменение цвета
Е). Действие электрическим током
Ж). Выпадение или растворение осадка
з). Выделение или поглощение тепла и (или) света
и). Облучение светом
5. Домашнее задание:
Параграф 26, записи в тетради.(задание для всех)
По выбору учащихся: привести примеры химических явлений, которые встречаются в трудовой деятельности ваших родителей, в домашнем хозяйстве.
5. Итог урока.
-О чем мы с вами говорили на сегодняшнем уроке?
— Сумели мы раскрыть на уроке:
— сущность физических и хим. явлений
познакомиться-с видами хим. реакций
выявить- признаки хим. реакций
отметить- условия протекания реакций
— Выставление оценок
Приложения.
№ | Содержание опыта | Наблюдения, сопровождающие опыт | Вывод о явлении |
1. | Взаимодействие мыльного раствора с раствором уксусной кислоты | Образование хлопьевидного осадка. | Химическое явление. |
2. | Взаимодействие соли аммония и гидроксида натрия. | Появление запаха аммиака. | Химическое явление. |
3. | Взаимодействие раствора соляной кислоты с кусочком мела. | Образование пузырьков газа. | Химическое явление. |
4. | Взаимодействие сырого картофеля с раствором йода | Появление синего цвета на срезе картофеля. | Химическое явление. |
Опыт 1. «Взаимодействие мыльного раствора с раствором уксусной кислоты»
«Взаимодействие мыльного раствора с раствором уксусной кислоты»
ТБ: При работе с кислотами необходимо соблюдать осторожность, т.к. это едкие вещества. Все работы проводить над разносами. Растворы веществ наливать в пробирки в небольших количествах: 1 мл соответствует 1 см. Действовать только согласно инструкционной карте.
В пробирку налить 2 мл мыльного раствора, а затем к нему добавить несколько капель уксусной кислоты, результат наблюдения занести в соответствующую графу таблицы.
Опыт 3. «Взаимодействие раствора соляной кислоты с кусочком мела»
ТБ: При работе с кислотами необходимо соблюдать осторожность, т.к. это едкие вещества. Все работы проводить над разносами. Растворы веществ наливать в пробирки в небольших количествах: 1 мл соответствует 1 см.
Действовать только согласно инструкционной карте.
В пробирку налить 2 мл раствора уксусной кислоты, а затем опустить в нее кусочек мела. Наблюдаемый результат занести в графу таблицы.
Опыт 4. «Взаимодействие сырого картофеля с раствором йода»
ТБ: При работе со спиртовой настойкой йода необходимо соблюдать осторожность, т.к. это едкое вещество. Все работы проводить над разносами. Действовать только согласно инструкционной карте.
На свежий срез картофеля капнуть при помощи пипетки капельку раствора йода, наблюдаемый результат занести в таблицу.
Опыт 2. «Взаимодействие соли аммония и гидроксида натрия»
ТБ: При работе со щелочами необходимо соблюдать осторожность, т.к. это едкие вещества. Все работы проводить над разносами. Растворы веществ наливать в пробирки в небольших количествах, по 1 мл, что соответствует 1 см. Действовать только согласно инструкционной карте.
В пробирку налить 1 мл раствора хлорида аммония (Nh5NO3), а затем к нему добавить 1 мл гидроксида натрия (NaOH), результат наблюдения занести в соответствующую графу таблицы.
№ | Содержание опыта | Наблюдения, сопровождающие опыт | Вывод о явлении |
1. | Взаимодействие мыльного раствора с раствором уксусной кислоты |
№ | Содержание опыта | Наблюдения, сопровождающие опыт | Вывод о явлении |
2. | Взаимодействие соли аммония и гидроксида натрия. |
№ | Содержание опыта | Наблюдения, сопровождающие опыт | Вывод о явлении |
3. | Взаимодействие раствора соляной кислоты с кусочком мела. |
№ | Содержание опыта | Наблюдения, сопровождающие опыт | Вывод о явлении |
4. | Взаимодействие сырого картофеля с раствором йода |
Тест по теме “Физические и химические явления»
1 вариант – химические явления
А). Растворение сахара в воде
Б). Разложение воды электрическим током на водород и кислород
В). Образование черного налёта на серебряных изделиях
Г). Образование кристалликов соли при выпаривании раствора
Тест по теме “Физические и химические явления»
2 вариант – физические явления
А). Растворение сахара в воде
Б). Разложение воды электрическим током на водород и кислород
В). Образование черного налёта на серебряных изделиях
Г). Образование кристалликов соли при выпаривании раствора
Из списка условий протекания и признаков химической реакции выберите:
1 вариант — признаки реакции
А).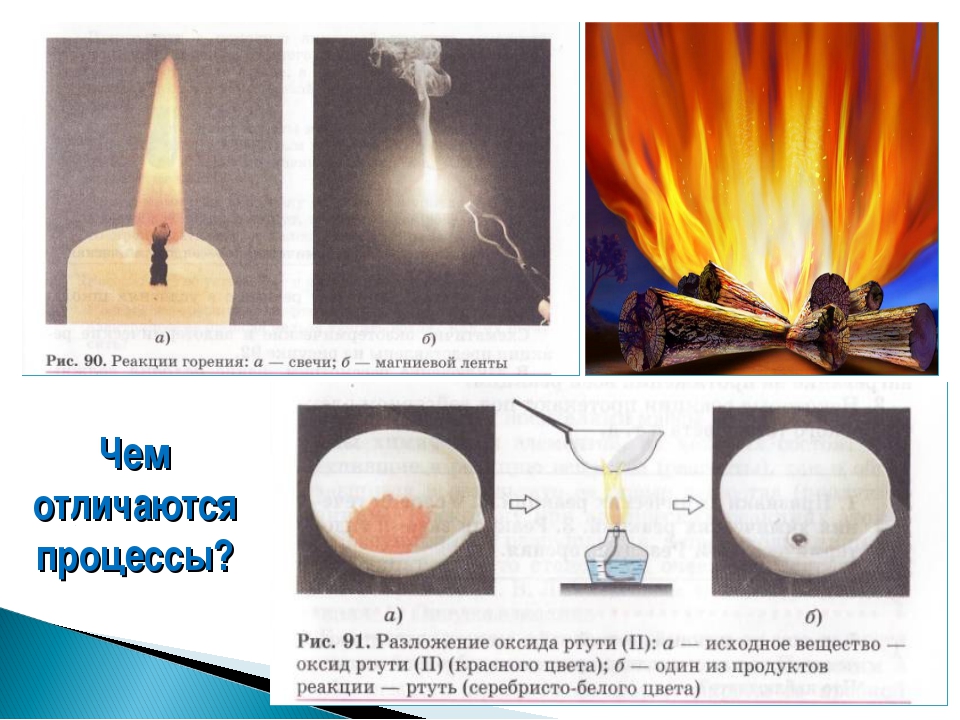 Появление запаха
Появление запаха
Б). Нагревание
В). Выделение газообразных веществ
Г). Контакт веществ
Д). Изменение цвета
Е). Действие электрическим током
Ж). Выпадение или растворение осадка
З). Выделение или поглощение тепла и (или) света
И). Облучение светом
Из списка условий протекания и признаков химической реакции выберите:
2 вариант – условия протекания
А) Появление запаха
Б) Нагревание
В) Выделение газообразных веществ
Г) Контакт веществ
Д) Изменение цвета
Е) Действие электрическим током
Ж) Выпадение или растворение осадка
З) Выделение или поглощение тепла и (или) света
И) Облучение светом.
Физические и химические явления. Лабораторный опыт № 3 «Изучение признаков химических явлений»
КР
Приём «Ключевые слова»
Задание
1. Пользуясь учебником (стр.24) ознакомьтесь с определениями понятий «физическое явление»,
«химическое явление». В чём различие физических и химических явлений?
В чём различие физических и химических явлений?
ФО – словесные комментарии учителя (похвала)
ГР
Приём «Химический эксперимент»
Учитель напоминает учащихся о соблюдении правил техники безопасности при выполнении опытов. Работу оформить на бумаге А3
1 группа
1.Рассмотрите сахар –рафинад.
2.Измельчите рафинад в сахар-песок
3.Растворите измельчённый сахар в воде
Что произошло с сахаром?
К каким явлениям следует отнести изменение сахара при измельчении? Дайте обоснованный ответ
К каким явлениям следует отнести изменение сахара при растворении его в воде? Дайте обоснованный ответ
2 группа
1.Возьмите кусочек парафина от свечи
2. Поместите кусочек парафина в фарфоровую чашку и нагревайте его до расплавления
3.После расплавления, потушите пламя и рассмотрите содержимое фарфоровой чашки
Что произошло с парафином?
К каким явлениям следует отнести изменение парафина при нагревании? Ответ обоснуйте
3 группа
1. Возьмите стеклянную трубку
Возьмите стеклянную трубку
2.Поместите её средней часть в пламя спиртовки.
3. После сильного накаливания попытайтесь осторожно согнуть. Потушите пламя спиртовки
Что произошло со стеклянной трубкой?
К каким явлениям следует отнести изменение стеклянной трубки при нагревании? Ответ обоснуйте
ФО
Взаимооценивание
Приём «Две звезды и одно пожелание»
Физминутка «Движение – жизнь»
ГР
Приём «Лабораторный опыт»
Теперь давайте ознакомимся с химическими явлениями и их признаками. Предлагаю выполнить лабораторный опыт
«Изучение признаков химических явлений»
Учитель напоминает учащимся о соблюдении правил техники безопасности при выполнении опытов
Задание для выполнения
1 группа
Проведите опыт, используя предложенный план действий
Запишите наблюдения
Сделайте вывод о признаках химических явлений
План действий | Наблюдение | Вывод |
Поместите измельчённый сахар в железную ложку и нагрейте |
2 группа
Проведите опыт, используя предложенный план действий
Запишите наблюдения
Сделайте вывод о признаках химических явлений
План действий | Наблюдение | Вывод |
На свежий срез картофеля капните раствор йода |
3группа
1. Проведите опыт, используя предложенный план действий
Проведите опыт, используя предложенный план действий
Запишите наблюдения
Сделайте вывод о признаках химических явлений
План действий | Наблюдение | Вывод |
Налейте в пробирку немного уксусной кислоты и опустите в неё кусочек мела |
Дескриптор
Обучающиеся
— проводят лабораторные опыты согласно предложенному плану действий
— записывают наблюдения;
— формулируют вывод о признаках химических явлений
Каждая группа презентует результаты.
ФО
Самооценивание
Приём «Большой палец»
Классу демонстрируется образец заполненной таблицы, они сравнивают со своей работой.
С помощью приема «Большой палец» исходя из следующих критериев:
— записаны верно наблюдения
— верно записан вывод
Указаны верно наблюдения и вывод – палец вверх
Допущены ошибки либо в наблюдениях, либо неверный вывод – палец вниз
учебник
карточки с заданиями для
сахар –рафинад, вода, стеклянная палочка, химический стакан, ступка и пестик
парафиновая свеча, скальпель, фарфоровая чашка, штатив, спиртовка
стеклянная трубка, спиртовка
стикеры
распечатанные задания для каждой группы
спиртовка, железная ложка,сахар-песок
срез картофеля, раствор йода, пипетка
кусочек мела; пробирка;
уксусная кислота
слайд с заполненной таблицей
Тесты по теме «Физические и химические явления. Роль химии в жизни человека»
Модуль включает 10 тестовых вопросов по теме. В том числе, ученику предлагается распределить явления на физические и химические путем переноса слова под соответствующий рисунок.
В том числе, ученику предлагается распределить явления на физические и химические путем переноса слова под соответствующий рисунок.
Тип:
Контрольный;
версия:
1.0.0.2
от 24.02.2009
Внимание! Для воспроизведения модуля
необходимо установить на компьютере
проигрыватель ресурсов.
Категория пользователей
Обучаемый, Преподаватель
Класс
8
Контактное время
15
минут
Интерактивность
Средняя
Дисциплины
Химия
/ Неорганическая химия
/ Понятия, определения и законы неорганической химии
/ Вещество
/ Физические и химические явления
Статус
Завершенный вариант (готовый, окончательный)
Тип ИР сферы образования
Контрольный модуль
Место издания
Москва
Язык
Русский
Ключевые слова
тест
Автор
Издатель
Правообладатель
Морозов Михаил Николаевич
Марийский государственный технический университет
Марийский государственный технический университет ГОУВПО
ГОУВПО «Марийский государственный технический университет»
Россия, 424000, Республика Марий Эл, Йошкар-Ола, Ленина пл. , 3,
, 3,
Сайт —
http://www.mmlab.ru
Эл. почта —
[email protected]
Федеральное агентство по образованию России
Федеральное агентство по образованию России
Россия, 115998, Москва, Люсиновская ул. , 51
, 51
Характеристики информационного ресурса
Тип используемых данных:
application/xml, image/jpeg, image/png, application/x-shockwave-flash, audio/mpeg, text/html
Объем цифрового ИР
2 112 749 байт
Проигрыватель
OMS-player версии от 1.0
Категория модифицируемости компьютерного ИР
открытый
Признак платности
бесплатный
Наличие ограничений по использованию
есть ограничения
Рубрикация
Ступени
образования
Основное общее образование
Целевое
назначение
Учебное
Тип
ресурса
Открытая образовательная модульная мультимедийная система (ОМС)
Классы общеобразовательной
школы
8
Уровень образовательного
стандарта
Федеральный
Характер
обучения
Базовое
Чем отличаются химические явления от физических
Изменения, происходящие с окружающими нас объектами, классифицируются как химические и физические явления. Чтобы научиться распознавать те и другие, необходимо разобраться в самой их сути.
Чтобы научиться распознавать те и другие, необходимо разобраться в самой их сути.
Определение
Химическими называют явления, приводящие к возникновению абсолютно иных веществ из исходных. Примеры: горение щепки, получение кефира из молока, образование крахмала в растениях.
Физическими называют явления, не затрагивающие молекулярную структуру веществ. Примеры: лепка из пластилина, образование инея, лопается шарик.
к содержанию ↑
Сравнение
Таким образом, решающим критерием становится глубина происходящих изменений. Отличие химических явлений от физических состоит в том, что в первом случае исходные вещества полностью разрушаются, а во втором они остаются сами собой. Иными словами, химические процессы приводят к более кардинальным изменениям, ведь они протекают на молекулярном уровне.
Подобные реакции могут происходить при непосредственном контакте веществ в отсутствие дополнительных факторов, а также под действием электричества, световых волн, при нагревании или участии катализаторов. На выходе получаются вещества с новым составом и свойствами. К примеру, ржавчина, в которую на воздухе под воздействием влаги преобразуется слой железного листа, –это вещество совсем с другими характеристиками, чем само железо.
О том, что произошло химическое превращение, свидетельствуют определенные признаки. В одном случае меняется вкус (как у капусты после квашения), в другом – цвет (посинение крахмального раствора при добавлении в него капли йода), в третьем – выделяется газ (взаимодействие соды и уксуса). Может также образоваться осадок, появиться особый запах или произойти выработка тепла.
В чем разница между химическими и физическими явлениями? В том, что последние, осуществляясь без разрушения молекул, влекут за собой изменения иного характера. Например, наблюдается переход в какое-то другое агрегатное состояние (твердый шоколад в ладони тает). Меняться могут форма (раскатывание теста), размеры (уменьшение длины проводов в мороз), положение в пространстве (падение мяча). Но химический состав во всех случаях остается прежним.
к содержанию ↑
Таблица
| Химические явления | Явления физической природы |
| Разрушение исходных веществ | Молекулярный состав не затрагивается |
| Получение других веществ с присущими им свойствами | В результате новые вещества не образуются |
| Признаки: выработка тепла, выделение газа, появление осадка, изменение таких характеристик, как вкус, цвет, запах | Могут меняться: размеры, форма, положение в пространстве, агрегатное состояние |
Физические и химические явления — Персональный сайт учителя химии Куликовой Надежды Владимировны
III. Тепловой эффект химической реакции
Д.И. Менделеев указывал: важнейшим признаком всех химических реакций является изменение энергии в процессе их протекания.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Выделение или поглощение теплоты в процессе химических реакций обусловлено тем, что энергия затрачивается на процесс разрушения одних веществ (разрушение связей между атомами и молекулами) и выделяется при образовании других веществ (образование связей между атомами и молекулами).
Энергетические изменения проявляются либо в выделении, либо в поглощении теплоты.
Реакции, протекающие с выделением теплоты, называются экзотермическими (от греч. «экзо» — наружу).
Реакции протекающие с поглощением энергии называются эндотермическими (от латинского «эндо» — внутрь).
Чаще всего энергия выделяется или поглощается в виде теплоты (реже — в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Количество теплоты, выделяющееся или поглощающееся при химической реакции, называется тепловым эффектом реакции (Q).
Экзотермическая реакция:
Исходные вещества → продукты реакций + Q кДж
Эндотермическая реакция:
Исходные вещества → продукты реакций — Q кДж
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы.
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект — это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу.
В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии.
Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей — спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы — калории (1 кал = 4,1868 Дж). Энергетическое содержание пищи относят к какой-нибудь массе пищевых продуктов: к 1 г, к 100 г или даже к стандартной упаковке продукта. Например, на этикетке баночки со сгущенным молоком можно прочитать такую надпись: «калорийность 320 ккал/100 г».
Область химии, занимающаяся изучением тепловых эффектов, химических реакций, называетсятермохимией.
Уравнения химических реакций, в которых указан тепловой эффект, называют термохимическими.
Самый быстрый словарь в мире: Vocabulary.com
химическое явление любое природное явление, связанное с химией
физическое явление природное явление, связанное с физическими свойствами материи и энергии
механическое явление физическое явление, связанное с равновесием или движением предметов
оптическое явление физическое явление, связанное со светом или с его участием
электрическое явление физическое явление, связанное с электричеством
Феномен Любое состояние или процесс, известный через органы чувств
природные явления Все неискусственные явления
химический элемент любое из более чем 100 известных веществ (из которых 92 встречаются в природе), которые не могут быть разделены на более простые вещества и которые по отдельности или в комбинации составляют все вещество
психический феномен Явления, которые кажутся противоречащими физическим законам и предполагают возможность причинной связи психическими процессами
органическое явление природное явление с участием живых растений и животных
химическое обозначение обозначение, используемое химиками для выражения технических фактов в химии
процедуры химической защиты, связанные с принятием мер защиты от нападений с использованием химических агентов
процедуры химической защиты, связанные с принятием мер защиты от нападений с использованием химических агентов
химическое машиностроение отрасль машиностроения, которая занимается проектированием, строительством и эксплуатацией установок и оборудования, используемых в промышленных химических процессах
Феномен Тарчанова — изменение электрических свойств кожи в ответ на стресс или тревогу; можно измерить либо путем регистрации электрического сопротивления кожи, либо путем регистрации слабых токов, генерируемых телом
химическая формула Представление вещества с использованием символов для составляющих его элементов
Процесс химического изменения, определяемый составом и структурой веществ
химическая реакция процесс, в котором вещества превращаются в другие
эпифеномен вторичный феномен, являющийся побочным продуктом другого явления
химическая реакция | Определение, уравнения, примеры и типы
Химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов.Вещества — это химические элементы или соединения. Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов.
горение
Полено горело в огне. Сжигание древесины является примером химической реакции, в которой древесина в присутствии тепла и кислорода превращается в углекислый газ, водяной пар и золу.
© chrispecoraro / iStock.com
Популярные вопросы
Каковы основы химических реакций?
- Химическая реакция — это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты.Вещества — это химические элементы или соединения.
- Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современным представлениям о химических реакциях, связи между атомами в реагентах должны быть разорваны, а атомы или части молекул снова собираются в продукты, образуя новые связи. Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше, чем энергия, выделяемая при создании новых связей, и конечным результатом является поглощение энергии.Следовательно, в реакции могут образовываться разные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, разновидностью, которая поставляет электронную пару, и кислотой Льюиса, разновидностью, которая может принимать электронную пару. Аммиак — пример базы Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типам реагентов, по результатам реакции и по механизму реакции.Часто данную реакцию можно разделить на две или даже три категории, включая реакции газообразования и осаждения. Многие реакции производят газ, такой как диоксид углерода, сероводород, аммиак или диоксид серы. Подъем теста для кексов вызван реакцией газообразования между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и реакции окисления-восстановления, которые включают перенос одного или нескольких электронов от восстановителя к окислителю.Примеры классификации по результатам реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перемешиваются и собираются заново при образовании продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и, по сути, самой жизни. Сжигание топлива, плавка чугуна, изготовление стекла и глиняной посуды, пивоварение и изготовление вина и сыра — вот многие примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий.Химические реакции изобилуют геологией Земли, атмосферы и океанов, а также огромным количеством сложных процессов, которые происходят во всех живых системах.
Следует отличать химические реакции от физических изменений. Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. Вне зависимости от физического состояния вода (H 2 O) представляет собой одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода.Однако, если вода в виде льда, жидкости или пара встречает металлический натрий (Na), атомы будут перераспределены, давая новым веществам молекулярный водород (H 2 ) и гидроксид натрия (NaOH). Таким образом, мы знаем, что произошло химическое изменение или реакция.
Тающий лед
Тающий лед, водопад Нижнее Чистилище, на притоке реки Соухеган между Мон-Верноном и Линдборо, Нью-Гэмпшир. Таяние льда — это физическое изменение, а не химическая реакция.
Уэйн Дионн / © Отдел развития туризма и путешествий Нью-Гэмпшира
Исторический обзор
Концепция химической реакции возникла около 250 лет назад.Он возник в ранних экспериментах, в которых вещества классифицировались как элементы и соединения, а также в теориях, объясняющих эти процессы. Разработка концепции химической реакции сыграла первостепенную роль в определении современной химии.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Первые существенные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в XVIII веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли.Особенно заметно влияние французского химика Антуана-Лорана Лавуазье, который подтвердил важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Элементарный трактат по химии ) Лавуазье выделил 33 «элемента» — вещества, не разбитые на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, набранный при окислении элементов, и приписал результат объединению элемента с кислородом.Концепция химических реакций, включающих комбинацию элементов, ясно появилась из его работ, и его подход побудил других исследовать экспериментальную химию как количественную науку.
Другим исторически значимым событием, касающимся химических реакций, было развитие теории атома. В этом большая заслуга английского химика Джона Далтона, который в начале XIX века постулировал свою атомную теорию. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции участвуют в перегруппировке атомов с образованием новых веществ.Такой взгляд на химические реакции точно определяет текущую тему. Теория Дальтона послужила основой для понимания результатов ранних экспериментаторов, включая закон сохранения материи (материя не создается и не разрушается) и закон постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили понятие химических реакций.Сегодня экспериментальная химия предоставляет бесчисленное количество примеров, а теоретическая химия позволяет понять их значение.
Основные понятия химических реакций
При создании нового вещества из других веществ химики говорят, что либо они проводят синтез, либо синтезируют новый материал. Реагенты превращаются в продукты, и этот процесс символизируется химическим уравнением. Например, железо (Fe) и сера (S) объединяются с образованием сульфида железа (FeS).Fe (s) + S (s) → FeS (s) Знак плюс указывает, что железо реагирует с серой. Стрелка означает, что реакция «образует» или «дает» сульфид железа, продукт. Состояние вещества реагентов и продуктов обозначается символами (s) для твердых веществ, (l) для жидкостей и (g) для газов.
углеводородов | Определение, типы и факты
Алканы, углеводороды, в которых все связи одинарные, имеют молекулярные формулы, которые удовлетворяют общему выражению C n H 2 n + 2 (где n — целое число ).Углерод s p 3 гибридизирован (три пары электронов участвуют в связывании, образуя тетраэдрический комплекс), и каждая связь C-C и C-H является сигма-связью ( см. химическая связь) ). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
Метан, этан и пропан — единственные алканы, однозначно определяемые их молекулярной формулой.Для C 4 H 10 два разных алкана удовлетворяют правилам химической связи (а именно, что углерод имеет четыре связи, а водород — одну в нейтральных молекулах). Одно соединение, называемое n -бутан, где префикс n — обозначает нормальный, имеет четыре атома углерода, связанные в непрерывную цепь. Другой, называемый изобутаном, имеет разветвленную цепь.
Различные соединения, имеющие одинаковую молекулярную формулу, называются изомерами. Говорят, что изомеры, которые различаются порядком соединения атомов, имеют различное строение и называются структурными изомерами.(Старое название — структурные изомеры.) Соединения n -бутан и изобутан являются конституциональными изомерами и единственными возможными соединениями для формулы C 4 H 10 . Поскольку изомеры представляют собой разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Нет простой арифметической зависимости между числом атомов углерода в формуле и числом изомеров.Теория графов была использована для расчета количества структурно изомерных алканов, возможных для значений n в C n H 2 n + 2 от 1 до 400. Количество структурных изомеров резко возрастает с увеличением количество атомов углерода увеличивается. Вероятно, не существует верхнего предела возможного количества атомов углерода в углеводородах. Алкан CH 3 (CH 2 ) 388 CH 3 , в котором 390 атомов углерода связаны в непрерывную цепь, был синтезирован в качестве примера так называемого сверхдлинного алкана.Несколько тысяч атомов углерода объединены в молекулы углеводородных полимеров, таких как полиэтилен, полипропилен и полистирол.
| молекулярная формула | количество конституционных изомеров |
|---|---|
| С 3 В 8 | 1 |
| С 4 В 10 | 2 |
| С 5 В 12 | 3 |
| С 6 В 14 | 5 |
| С 7 В 16 | 9 |
| С 8 В 18 | 18 |
| С 9 В 20 | 35 год |
| С 10 В 22 | 75 |
| С 15 В 32 | 4 347 |
| С 20 В 42 | 366 319 |
| С 30 В 62 | 4,111,846,763 |
Необходимость дать каждому соединению уникальное имя требует большего разнообразия терминов, чем доступно с описательными префиксами, такими как n — и iso-.Присвоение названий органическим соединениям упрощается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общая и систематическая. Общие имена возникают по-разному, но имеют общую черту, заключающуюся в отсутствии необходимой связи между именем и структурой. Имя, соответствующее определенной структуре, нужно просто запомнить, как и выучить имя человека. С другой стороны, систематические имена привязаны непосредственно к молекулярной структуре в соответствии с общепринятым набором правил.Наиболее широко используемые стандарты для номенклатуры органических веществ возникли на основе предложений, сделанных группой химиков, собранных для этой цели в Женеве в 1892 году, и регулярно пересматриваются Международным союзом чистой и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения из других семейств рассматриваются как производные алканов путем присоединения функциональных групп к углеродному скелету или иным образом его модификации.
Правила IUPAC присваивают неразветвленным алканам названия в соответствии с числом их атомов углерода. Метан, этан и пропан сохраняются для CH 4 , CH 3 CH 3 и CH 3 CH 2 CH 3 соответственно. Префикс n — не используется для неразветвленных алканов в систематической номенклатуре ИЮПАК; следовательно, CH 3 CH 2 CH 2 CH 3 определяется как бутан, а не n -бутан.Начиная с пятиуглеродных цепей, названия неразветвленных алканов состоят из латинского или греческого корня, соответствующего количеству атомов углерода в цепи, за которым следует суффикс -ан. Группа соединений, таких как неразветвленные алканы, которые отличаются друг от друга последовательным введением групп CH 2 , составляют гомологичный ряд.
| формула алкана | название | формула алкана | название |
|---|---|---|---|
| CH 4 | метан | Канал 3 (Канал 2 ) 6 Канал 3 | октан |
| Канал 3 Канал 3 | этан | Канал 3 (Канал 2 ) 7 Канал 3 | нонан |
| Канал 3 Канал 2 Канал 3 | пропан | Канал 3 (Канал 2 ) 8 Канал 3 | декан |
| Канал 3 Канал 2 Канал 2 Канал 3 | бутан | Канал 3 (Канал 2 ) 13 Канал 3 | пентадекан |
| Канал 3 (Канал 2 ) 3 Канал 3 | пентан | Канал 3 (Канал 2 ) 18 Канал 3 | икозан |
| Канал 3 (Канал 2 ) 4 Канал 3 | гексан | Канал 3 (Канал 2 ) 28 Канал 3 | триаконтан |
| Канал 3 (Канал 2 ) 5 Канал 3 | гептан | Канал 3 (Канал 2 ) 98 Канал 3 | гектан |
Алканы с разветвленными цепями названы на основе названия самой длинной цепи атомов углерода в молекуле, называемой родительской.Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение заместителя CH 3 (метил) в семиуглеродной цепи определяется числом (3-), называемым локантом, полученным путем последовательной нумерации атомов углерода в родительской цепи, начиная с конца, ближайшего к ответвлению. Поэтому соединение называется 3-метилгептаном.
При наличии двух или более идентичных заместителей префиксы репликации (ди-, три-, тетра- и т. Д.) используются вместе с отдельным локатором для каждого заместителя. Различные заместители, такие как этильная (CH 2 CH 3 ) и метильная (―CH 3 ) группы, указаны в алфавитном порядке. При расположении по алфавиту повторяющиеся префиксы игнорируются. В алканах нумерация начинается с конца, ближайшего к заместителю, который появляется первым в цепи, так что углерод, к которому он присоединен, имеет как можно более низкий номер.
Метил и этил являются примерами алкильных групп.Алкильная группа получается из алкана путем удаления одного из его атомов водорода, тем самым оставляя потенциальную точку присоединения. Метил — единственная алкильная группа, производная от метана, а этил — единственная группа из этана. Имеются две C 3 H 7 и четыре C 4 H 9 алкильные группы. Правила ИЮПАК для наименования алканов и алкильных групп охватывают даже очень сложные структуры и регулярно обновляются. Они недвусмысленны в том смысле, что, хотя одно соединение может иметь более одного правильного названия IUPAC, нет никакой возможности, чтобы два разных соединения имели одно и то же имя.
химическая реакция | Определение, уравнения, примеры и типы
Химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов. Вещества — это химические элементы или соединения. Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов.
горение
Полено горело в огне. Сжигание древесины является примером химической реакции, в которой древесина в присутствии тепла и кислорода превращается в углекислый газ, водяной пар и золу.
© chrispecoraro / iStock.com
Популярные вопросы
Каковы основы химических реакций?
- Химическая реакция — это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты. Вещества — это химические элементы или соединения.
- Химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современным представлениям о химических реакциях, связи между атомами в реагентах должны быть разорваны, а атомы или части молекул снова собираются в продукты, образуя новые связи.Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше, чем энергия, выделяемая при создании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться разные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, разновидностью, которая поставляет электронную пару, и кислотой Льюиса, разновидностью, которая может принимать электронную пару.Аммиак — пример базы Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типам реагентов, по результатам реакции и по механизму реакции. Часто данную реакцию можно разделить на две или даже три категории, включая реакции газообразования и осаждения. Многие реакции производят газ, такой как диоксид углерода, сероводород, аммиак или диоксид серы.Подъем теста для кексов вызван реакцией газообразования между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и реакции окисления-восстановления, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результатам реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перемешиваются и собираются заново при образовании продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и, по сути, самой жизни. Сжигание топлива, плавка чугуна, изготовление стекла и глиняной посуды, пивоварение и изготовление вина и сыра — вот многие примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий. Химические реакции изобилуют геологией Земли, атмосферы и океанов, а также огромным количеством сложных процессов, которые происходят во всех живых системах.
Следует отличать химические реакции от физических изменений.Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если происходит физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. Вне зависимости от физического состояния вода (H 2 O) представляет собой одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода. Однако, если вода в виде льда, жидкости или пара встречает металлический натрий (Na), атомы будут перераспределены, давая новым веществам молекулярный водород (H 2 ) и гидроксид натрия (NaOH).Таким образом, мы знаем, что произошло химическое изменение или реакция.
Тающий лед
Тающий лед, водопад Нижнее Чистилище, на притоке реки Соухеган между Мон-Верноном и Линдборо, Нью-Гэмпшир. Таяние льда — это физическое изменение, а не химическая реакция.
Уэйн Дионн / © Отдел развития туризма и путешествий Нью-Гэмпшира
Исторический обзор
Концепция химической реакции возникла около 250 лет назад. Он возник в ранних экспериментах, в которых вещества классифицировались как элементы и соединения, а также в теориях, объясняющих эти процессы.Разработка концепции химической реакции сыграла первостепенную роль в определении современной химии.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Первые существенные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в XVIII веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли. Особенно заметно влияние французского химика Антуана-Лорана Лавуазье, который подтвердил важность количественных измерений химических процессов.В своей книге Traité élémentaire de chimie (1789; Элементарный трактат по химии ) Лавуазье выделил 33 «элемента» — вещества, не разбитые на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, набранный при окислении элементов, и приписал результат объединению элемента с кислородом. Концепция химических реакций, включающих комбинацию элементов, ясно появилась из его работ, и его подход побудил других исследовать экспериментальную химию как количественную науку.
Другим исторически значимым событием, касающимся химических реакций, было развитие теории атома. В этом большая заслуга английского химика Джона Далтона, который в начале XIX века постулировал свою атомную теорию. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции участвуют в перегруппировке атомов с образованием новых веществ. Такой взгляд на химические реакции точно определяет текущую тему.Теория Дальтона послужила основой для понимания результатов ранних экспериментаторов, включая закон сохранения материи (материя не создается и не разрушается) и закон постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили понятие химических реакций. Сегодня экспериментальная химия предоставляет бесчисленное количество примеров, а теоретическая химия позволяет понять их значение.
Основные понятия химических реакций
При создании нового вещества из других веществ химики говорят, что либо они проводят синтез, либо синтезируют новый материал. Реагенты превращаются в продукты, и этот процесс символизируется химическим уравнением. Например, железо (Fe) и сера (S) объединяются с образованием сульфида железа (FeS). Fe (s) + S (s) → FeS (s) Знак плюс указывает, что железо реагирует с серой. Стрелка означает, что реакция «образует» или «дает» сульфид железа, продукт.Состояние вещества реагентов и продуктов обозначается символами (s) для твердых веществ, (l) для жидкостей и (g) для газов.
Обзор химических реакций — Chemistry LibreTexts
Химические реакции — это процессы, посредством которых химические вещества взаимодействуют с образованием новых химических веществ с различным составом. Проще говоря, химическая реакция — это процесс, при котором реагенты превращаются в продукты. То, как реагируют химические вещества, определяется химическими свойствами элемента или соединения — способами, которыми соединение или элемент претерпевает изменения в составе.
Количественное описание реакций
В мире вокруг нас постоянно происходят химические реакции; все, от ржавчины железной ограды до метаболических путей в человеческой клетке, — все это примеры химических реакций. Химия — это попытка классифицировать и лучше понять эти реакции.
Рисунок \ (\ PageIndex {0} \): ржавчина цепи — пример химической реакции.
Химическая реакция обычно представлена химическим уравнением, которое представляет переход от реагентов к продуктам.Левая часть уравнения представляет реагенты, а правая часть — продукты. Типичная химическая реакция записывается со стехиометрическими коэффициентами, которые показывают относительные количества продуктов и реагентов, участвующих в реакции. За каждым соединением следует в скобках примечание о состоянии соединения 2: (l) для жидкости, (s) для твердого тела, (g) для газа. Символ (водный) также обычно используется для обозначения водного раствора, в котором соединения растворены в воде.Реакция может иметь следующий вид:
\ [\ ce {A (aq) + B (g) \ rightarrow C (s) + D (l)} \ nonumber \]
В приведенном выше примере \ (A \) и \ (B \), известные как реагенты, реагировали с образованием продуктов \ (C \) и \ (D \).
Чтобы написать точное химическое уравнение, должны произойти две вещи:
- Каждый продукт и реагент должны быть записаны с использованием его химической формулы, например, \ (H_2 \)
- Количество атомов каждого элемента должно быть одинаковым с обеих сторон уравнения.Коэффициенты используются перед химическими формулами, чтобы помочь сбалансировать количество атомов, например,
.
\ [\ ce {2Mg + O_2 \ rightarrow 2MgO} \ nonumber \]
Пример \ (\ PageIndex {1} \): реакции балансировки
Водород и азот взаимодействуют вместе с образованием газообразного аммиака, запишите химическое уравнение этой реакции.
Решение
Шаг 1: Напишите каждый продукт и реагент, используя его химическую формулу.
\ [\ ce {H_2 + N_2 \ rightarrow NH_3} \ nonumber \]
Шаг 2: Убедитесь, что количество атомов каждого элемента равно с обеих сторон уравнения.
\ [\ ce {3H_2 + N_2 \ rightarrow 2NH_3} \ nonumber \]
Чтобы сбалансировать это уравнение, необходимо использовать коэффициенты. Поскольку в левой части уравнения присутствует только 2 атома азота, к \ (NH_3 \) необходимо добавить коэффициент 2.
Стехиометрия
Коэффициент, который используется для балансировки уравнения, называется стехиометрическим коэффициентом. Коэффициенты говорят нам соотношение каждого элемента в химическом уравнении. Например
\ [\ ce {2Mg + O_2 \ rightarrow 2MgO} \ nonumber \]
означает
- 2 моля MgO производится на каждые 2 моля израсходованного Mg.
- На каждый 1 моль израсходованного O 2 образуется 2 моля MgO.
Когда все реагенты реакции полностью израсходованы, реакция протекает в идеальных стехиометрических пропорциях. Однако часто реакция протекает не в идеальных стехиометрических пропорциях, что приводит к ситуации, когда полностью расходуется один реагент, но остается некоторое количество другого реагента. Реагент, который полностью израсходован, называется ограничивающим реагентом, и он определяет, сколько продуктов будет произведено.
Пример \ (\ PageIndex {2} \): ограничивающий реагент
4,00 г газообразного водорода в смеси с 20,0 г газообразного кислорода. Сколько граммов воды получается?
Решение
\ [n (H_2) = \ dfrac {4g} {(1,008 \ times2) г / моль} = 1,98 моль \]
Теоретически требуется 0,99 моль \ (O_2 \)
n (O 2 ) = n (H 2 ) * (1 моль O 2 /2 моль H 2 ) = 0,99 моль
m (O 2 ) = n (O 2 ) * (16 г / моль * 2) = 31.7 г O 2
Потому что \ (O_2 \) имеет только 20,0 г, что меньше требуемой массы. Это ограничение.
Часто реагенты не реагируют полностью, что приводит к образованию меньшего количества продукта, чем ожидалось. Количество продукта, которое, как ожидается, будет образовано из химического уравнения, называется теоретическим выходом. Количество продукта, которое образуется во время реакции, и есть фактический выход. Для определения процентной доходности:
Процентная доходность = фактическая доходность / теоретическая доходность X 100%
Химические реакции происходят не только в воздухе, но и в растворах.В растворе растворитель — это растворенное соединение, а растворенное вещество — это соединение, в котором растворен растворитель. Молярность раствора — это количество молей растворителя, деленное на количество литров раствора.
\ [\ Molarity = \ dfrac {\ text {количество растворенного вещества (моль)}} {\ text {объем раствора (л)}} \]
\ [\ M = \ dfrac {n} {V} \]
Пример \ (\ PageIndex {3} \): концентрации
100,0 г NaCl растворяют в 50,00 мл воды. Какая молярность раствора?
Решение
а) Найдите количество растворенного вещества в молях.
100,0 г / (22,99 г / моль + 35,45 г / моль) = 1,711 моль
б) Перевести мл в л.
50,00 мл = 0,05000 л
c) Найдите молярность
1,711 моль / 0,05000 л = 34,22 моль / л
Физические изменения во время химических реакций
Физическое изменение — это изменение физических свойств. Физические изменения обычно происходят во время химических реакций, но не меняют природу веществ. Наиболее частыми физическими изменениями во время реакций являются изменение цвета, запаха и выделение газа.Однако при физических изменениях химические реакции могут не произойти.
Типы химических реакций
Осаждение или реакция двойного замещения
Реакция, которая происходит, когда водные растворы анионов (отрицательно заряженные ионы) и катионов (положительно заряженные ионы) объединяются с образованием нерастворимого соединения, известна как осаждение. Нерастворимое твердое вещество называется осадком, а оставшаяся жидкость — супернатантом. См. Рисунок 2.1
Рисунок \ (\ PageIndex {1} \)
Пример из реальной жизни: белый осадок, образовавшийся в результате кислотного дождя на мраморной статуе:
\ [CaCO_3 (вод.) + H_2SO_4 (вод.) \ Стрелка вправо CaSO_4 (s) + H_2O (l) + CO_2 (g) \ nonumber \]
Пример \ (\ PageIndex {4} \): Осадки
Примером реакции осаждения является реакция между нитратом серебра и иодидом натрия.Реакция представлена химическим уравнением:
AgNO 3 (водн.) + NaI (водн.) → AgI (т.) + NaNO 3 (водн.)
Поскольку все вышеперечисленные частицы находятся в водных растворах, они записываются как ионы в форме:
Ag + + NO 3 — (водный) + Na + (водный) + I — (водный) → AgI (s) + Na + (водный) + NO 3 — (водн.)
Ионы, которые появляются по обе стороны уравнения, называются ионами-наблюдателями.Эти ионы не влияют на реакцию и удаляются с обеих сторон уравнения, чтобы получить итоговое ионное уравнение, как написано ниже:
Ag + (водн.) + I — (водн.) → AgI (s)
В этой реакции твердое вещество AgI известно как осадок. Образование осадка — один из многих индикаторов того, что произошла химическая реакция.
Кислотно-основная реакция или реакция нейтрализации
Реакция нейтрализации происходит при смешивании кислоты и основания.Кислота — это вещество, которое производит ионы H + в растворе, тогда как основание — это вещество, которое производит ионы OH — в растворе. Типичная кислотно-основная реакция дает ионное соединение, называемое солью и водой . Типичная кислотно-основная реакция — это реакция между соляной кислотой и гидроксидом натрия. Эта реакция представлена уравнением:
\ [\ ce {HCl (водн.) + NaOH (водн.) \ Rightarrow NaCl (водн.) + H_2O (l)} \ nonumber \]
В этой реакции \ (HCl \) — кислота, \ (NaOH \) — основание, а \ (NaCl \) — соль.Пример из реальной жизни: пищевая сода реагирует с уксусом — это реакция нейтрализации.
Видео : Реакция уксуса и пищевой соды с объяснением
Окислительно-восстановительные (окислительно-восстановительные) реакции
Окислительно-восстановительная реакция происходит, когда степень окисления атомов, участвующих в реакции, изменяется. Окисление — это процесс увеличения степени окисления атома, а восстановление — это процесс уменьшения степени окисления атома.Если степени окисления каких-либо элементов в реакции изменяются, реакция является окислительно-восстановительной реакцией. Атом, который подвергается окислению, называется восстановителем, а атом, который подвергается восстановлению, называется окислителем. Примером окислительно-восстановительной реакции является реакция между газообразным водородом и газообразным фтором:
\ [H_2 (g) + F_2 (g) \ rightarrow 2HF (g) \ label {redox1} \]
В этой реакции водород окисляется со степени окисления от 0 до +1 и, таким образом, является восстановителем.Фтор восстанавливается от 0 до -1 и, таким образом, является окислителем.
Рисунок \ (\ PageIndex {2} \): Рисунок: В окислительно-восстановительной реакции уравнения \ (\ ref {redox1} \) молекула \ (H_2 \) отдает электроны \ (F_2 \), что приводит к двум \ (HF \ ) молекулы
Пример из реальной жизни: срезанная поверхность яблока становится коричневатой после длительного пребывания на воздухе.
Видео: Почему яблоки коричневеют?
Реакция горения
Реакция горения — это тип окислительно-восстановительной реакции, во время которой топливо вступает в реакцию с окислителем, что приводит к выделению энергии в виде тепла.Такие реакции являются экзотермическими, что означает, что во время реакции выделяется энергия. Эндотермическая реакция — это реакция с поглощением тепла. В типичной реакции горения в качестве источника топлива используется углеводород, а в качестве окислителя — газообразный кислород. Продуктами такой реакции будут \ (CO_2 \) и \ (H_2O \).
\ [C_xH_yO_z + O_2 \ rightarrow CO_2 + H_2O \; \; \; \ text {(несимметричный)} \]
Такой реакцией будет горение глюкозы в следующем уравнении
\ [C_6H_ {12} O_6 (s) + 6O_2 (g) \ rightarrow 6CO_2 (g) + 6H_2O (g) \]
Пример из жизни: взрыв; жжение.
Видео : Реакции горения бывают разными. Вот коллекция различных примеров, каждый из которых требует кислорода, энергии активации и, конечно же, топлива
Реакция синтеза
Реакция синтеза происходит, когда одно или несколько соединений объединяются с образованием сложного соединения. Ниже проиллюстрировано простейшее уравнение реакции синтеза.
Примером такой реакции является реакция серебра с газообразным кислородом с образованием оксида серебра:
\ [2Ag (s) + O_2 (g) \ rightarrow 2AgO (s) \]
Пример из реальной жизни: газообразный водород сжигается на воздухе (реагирует с кислородом) с образованием воды:
\ [2H_2 (g) + O_2 (g) \ rightarrow 2H_2O (l) \]
Реакция разложения
Реакция разложения противоположна реакции синтеза.Во время реакции разложения более сложное соединение распадается на несколько более простых соединений. Классическим примером реакции этого типа является разложение перекиси водорода на кислород и газообразный водород:
\ [H_2O_2 (l) \ rightarrow H_2 (g) + O_2 (g) \]
Рисунок \ (\ PageIndex {3} \): молекула AB распадается на A и B
Реакции однократного замещения
Тип окислительно-восстановительной реакции, в которой элемент в соединении заменяется другим элементом.
Пример такой реакции:
\ [Cu (s) + AgNO_3 (водн.) \ Стрелка вправо Ag (s) + Cu (NO_3) _2 (водн.) \]
Это тоже окислительно-восстановительная реакция.
Проблемы
1) C 3 H 6 O 3 + O 2 → CO 2 (г) + H 2 O (г)
а) Что это за реакция?
б) экзотермический или эндотермический? Объяснять.
2) Учитывая окислительно-восстановительную реакцию:
Fe (s) + CuSO 4 (водн.) → FeSO 4 (водн.) + Cu (s)
a) Какой элемент является окислителем, а какой такое восстановитель?
б) Как меняются степени окисления этих веществ?
3) Дано уравнению:
AgNO3 (водн.) + KBr (водн.) → AgBr (s) + KNO 3 (водн.)
a) Какова чистая ионная реакция?
б) Какие виды являются ионами-наблюдателями?
4) 2 HNO 3 (водн.) + Sr (OH) 2 (водн.) → Sr (NO 3 ) 2 (водн.) +2 H 2 O (л)
a Какой вид в этой реакции является кислотой, а какой — основанием?
б) Какого вида соль?
c) Если используются 2 моля HNO3 и 1 моль Sr (OH) 2, получается 0.85 моль Sr (NO3) 2, каков процентный выход (по отношению к молям) Sr (NO3) 2?
5) Определите тип следующих реакций:
a) Al (OH) 3 (водн.) + HCl (водн.) → AlCl 3 (водн.) + H 2 O (l)
b ) MnO 2 + 4H + + 2Cl — → Mn 2 + + 2H 2 O (l) + Cl 2 (g)
c) P 4 (s) + Cl 2 (г) → PCl 3 (л)
г) Ca (т) + 2H 2 O (л) → Ca (OH) 2 (водн.) + H 2 (г )
д) AgNO3 (водн.) + NaCl (водн.) → AgCl (т. Е.) + NaNO 3 (водн.)
Решения
1a) Это реакция горения
1b) Экзотермичность, потому что реакции горения выделяют тепло
2a) Cu — окислитель, Fe — восстановитель
2b) Fe изменяется от 0 до +2, а Cu изменяется от +2 до 0.
3a) Ag + (водн.) + Br — (водн.) → AgBr (s)
3b) Ионы-зрители — это K + и NO 3 —
4a) HNO 3 — кислота, а Sr (OH) 2 — основание
4b) Sr (NO 3 ) 2 — соль
4c) Согласно стехиометрическим коэффициентам теоретический выход Sr (NO 3 ) 2 составляет один моль. Фактический выход составил 0,85 моль.Следовательно, процентная доходность:
.
(0,85 / 1,0) * 100% = 85%
5a) Кислотно-щелочная
5b) Окисление-восстановление
5c) Синтез
5d) Реакция одиночного замещения
5e) Реакция двойного замещения
Устанавливают ли учащиеся связи?
ЦАПАРЛИС
42
концепция субстанции (Ставриду и Соломониду, 1998; Джонсон, 2000). Мы подчеркиваем необходимость
для правильного понимания этой концепции на макроскопическом, экспериментальном уровне.На том же уровне
должно и может быть введено понятие химической реакции (Strong, 1970; De Vos &
Verdonk, 1985). Понятия «субстанция» и «реакция» могут и должны лечь в основу
определения науки химии, которая кажется / необходима для начала курса химии
: изучение веществ и их свойств, с в центре взаимодействия
веществ, которые приводят к образованию других веществ (химические реакции).Следует также иметь в виду, что
, как правило, химические изменения / химические реакции сопровождаются и физическими изменениями
. Наконец, существует ряд процессов и свойств (таких как
изменений состояния / фазы и сольватация), которые «не обладают всеми характеристиками, которые являются центральными для химических систем
», но представляют центральный интерес и для химиков. (Стронг, 1970). Последние
изменений иногда называют «физико-химическими» (см. Также Nelson, 2003).
БЛАГОДАРНОСТИ: Я благодарю двух рецензентов за множество конструктивных и полезных комментариев
, которые способствовали значительному улучшению моей первоначальной рукописи. Я также благодарен
доктору Питеру Г. Нельсону за то, что он прочитал окончательную версию (после рецензирования) статьи и предложил
улучшений. Наконец, я благодарю г-на Спироса Петсиоса за помощь в обработке данных
о физических явлениях.
ПЕРЕПИСКА: Георгиос ЦАПАРЛИС, Университет Янины, химический факультет,
GR-451 10 Янина, Греция; факс: +30 2651 0 98798; электронная почта: gtseper @ cc.uoi.gr
ССЫЛКИ
Abraham, M.R., Grzybowski, E.B., Renner, J.W., & Marek, E.I. (1992). Понимание и
недопонимания восьмиклассниками пяти понятий химии, найденных в учебниках.
Журнал исследований в области преподавания естественных наук, 29, 105–120.
Abraham, M.R., Williamson, V.M., & Westbrook, S.L. (1994). Перекрестное исследование
понимания пяти концепций химии. Журнал исследований в области преподавания естественных наук, 31, 147-
165.
Андерссон Б. (1986). Объяснения учащихся некоторых аспектов химических реакций. Научное образование,
70, 549-563.
Де Вос и Вердонк, A.H. (1985). Новый способ реакции. Журнал химического образования, 62, 238 и
648.
Драйвер Р. (1985). За пределами видимости: Сохранение материи при физико-химическом преобразовании
. В Р. Драйвер, К. Гуэн и А. Тибергин (ред.), Детские идеи в науке.
Милтон Кейнс, Великобритания: Open University Press.
Гарнетт П., Гарнетт П. и Хаклинг М. (1995). Альтернативные концепции студентов по химии:
обзор исследований и их значения для преподавания и обучения. Исследования в области естественнонаучного образования,
25, 69-95.
Генслер, У.Дж. (1970). Физические и химические изменения. Журнал химического образования, 47, 154-155.
Гессе, Дж. И Андерсон, К. (1992). Представление студентов о химических изменениях.Journal of Research in
Science Teaching, 29, 277-299.
Jensen, W.B. (1998). Учебник логики, истории и химии: II. Можем ли мы распутать учебник химии
? Журнал химического образования, 75, 817-828.
Джонсон П. (2000). Развитие понимания учащимися химических изменений: чему мы должны учить
? Химическое образование: исследования и практика в Европе, 1, 77-90.
[htttp: //www.uoi.gr/conf_sem/cerapie]
Джонстон, А.Х. (1991). Думая о мышлении. Международный вестник химического образования,
(36), 7-10.
Джонстон, A.H. (2002). Преподавание химии — логическое или психологическое? Химическое образование:
Исследования и практика в Европе, 1, 9-15. [http://www.uoi.gr/conf_sem/cerapie]
Химическая реакция — определение химии
Химическая реакция — это химическое изменение, в результате которого образуются новые вещества. Химическая реакция может быть представлена химическим уравнением, которое указывает количество и тип каждого атома, а также их организацию в молекулы или ионы.В химическом уравнении символы элементов используются в качестве сокращенного обозначения элементов со стрелками, указывающими направление реакции. Обычная реакция написана с реагентами в левой части уравнения и продуктами в правой части. Состояние вещества может быть указано в скобках (s для твердого вещества, l для жидкости, g для газа, aq для водного раствора). Стрелка реакции может идти слева направо или может быть двойная стрелка, указывающая, что реагенты превращаются в продукты, и некоторые продукты подвергаются обратной реакции с реагентами реформинга.
Хотя в химических реакциях участвуют атомы, обычно только электроны участвуют в разрыве и образовании химических связей. Процессы с участием атомного ядра называются ядерными реакциями.
Вещества, участвующие в химической реакции, называются реагентами. Образующиеся вещества называются продуктами. Продукты имеют свойства, отличные от реагентов.
Также известен как: реакция, химическое изменение
Примеры химических реакций
Химическая реакция H 2 (г) + ½ O 2 (г) → H 2 O (л) описывает образование воды из ее элементов.
Реакция между железом и серой с образованием сульфида железа (II) — это еще одна химическая реакция, представленная химическим уравнением:
8 Fe + S 8 → 8 FeS
Типы химических реакций
Существует бесчисленное множество реакций, но их можно разделить на четыре основные категории:
Реакция синтеза
В реакции синтеза или комбинации два или более реагентов объединяются с образованием более сложного продукта. Общий вид реакции: A + B → AB.
Реакция разложения
Реакция разложения — обратная реакция синтеза.При разложении сложный реагент распадается на более простые продукты. Общая форма реакции разложения: AB → A + B
Реакция однократной замены
В реакции одиночного замещения или одиночного замещения один несоединенный элемент заменяет другой в соединении или обменивается с ним местами. Общая форма реакции одиночного замещения: A + BC → AC + B
Реакция двойной замены
В реакции двойного замещения или двойного замещения анионы и катионы реагентов меняются местами друг с другом, образуя новые соединения.Общая форма реакции двойного замещения: AB + CD → AD + CB.
Поскольку существует так много реакций, есть дополнительные способы их категоризации, но эти другие классы все равно попадают в одну из четырех основных групп. Примеры других классов реакций включают окислительно-восстановительные (окислительно-восстановительные) реакции, кислотно-основные реакции, реакции комплексообразования и реакции осаждения.
Факторы, влияющие на скорость реакции
Скорость или скорость, с которой происходит химическая реакция, зависит от нескольких факторов, в том числе:
- Концентрация реагента
- площадь
- температура
- давление
- Наличие или отсутствие катализаторов
- Наличие света, особенно ультрафиолета
- энергия активации
.

 )
) (плавление воска от температуры – это физическое явление, а горение фитиля свечи – это химическое явление.)
(плавление воска от температуры – это физическое явление, а горение фитиля свечи – это химическое явление.)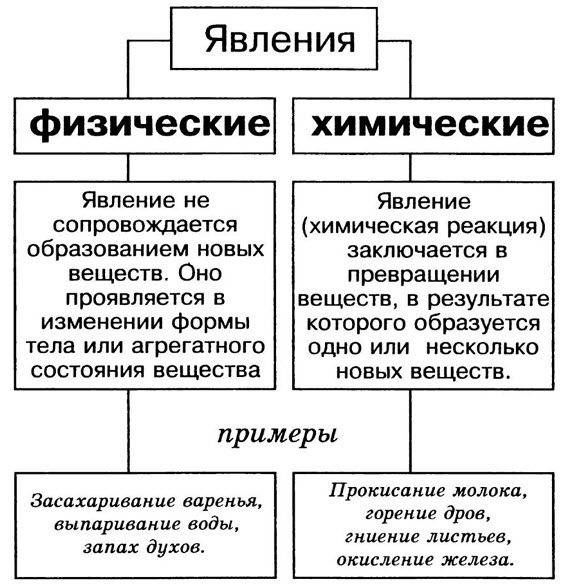 Подведение обучающихся к самостоятельному выводу способа действия с информацией
Подведение обучающихся к самостоятельному выводу способа действия с информацией
 Первичное закрепление изученного материала.
Первичное закрепление изученного материала. Обеспечивает положительную реакцию обучающихся на творчество одноклассников
Обеспечивает положительную реакцию обучающихся на творчество одноклассников  Отмечает степень вовлеченности обучающихся в работу на уроке
Отмечает степень вовлеченности обучающихся в работу на уроке
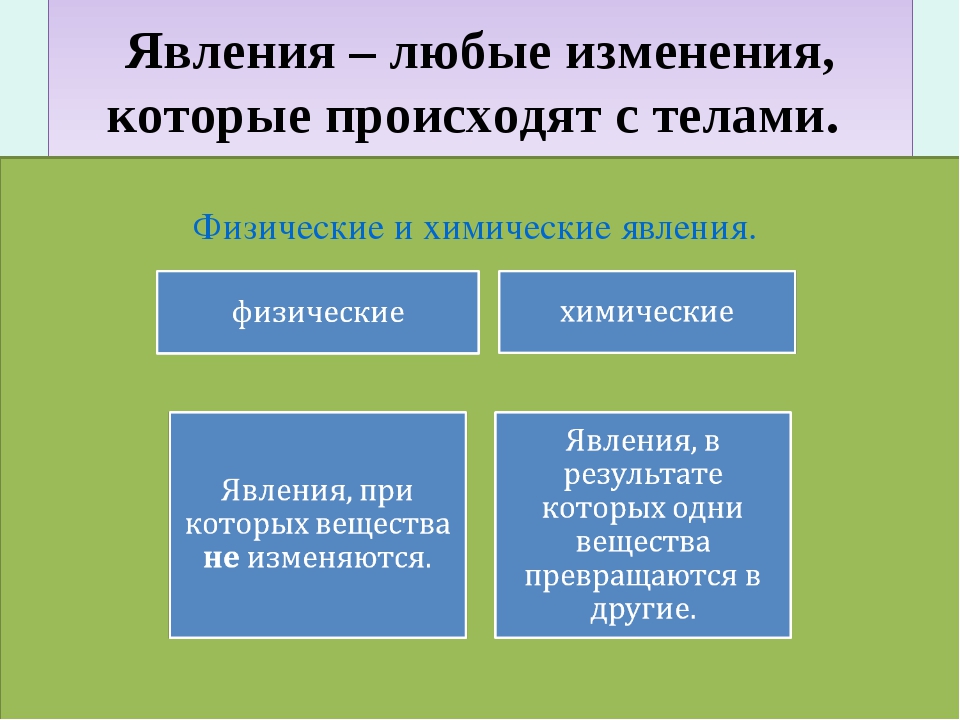
 серной кислотой
серной кислотой