Содержание
Генетические ряды металлов — урок. Химия, 8–9 класс.
Генетический ряд металла состоит из простого вещества, оксида, гидроксида и соли:
металл — основный оксид — основание — соль.
Все металлы можно разделить на две группы: активные и неактивные.
К активным относят металлы, реагирующие с водой при обычных условиях. Это \(10\) металлов: литий, натрий, калий, рубидий, цезий, франций, кальций, стронций, барий, радий. Их оксиды соединяются с водой с образованием растворимых гидроксидов — щелочей.
Остальные металлы менее активны. Их оксиды не реагируют с водой, а основания в воде не растворяются. Поэтому из оксида получить основание можно только через соль. Для неактивных металлов генетический ряд выглядит так:
металл — основный оксид — соль1 — основание — соль2.
1. Генетические ряды активных металлов:
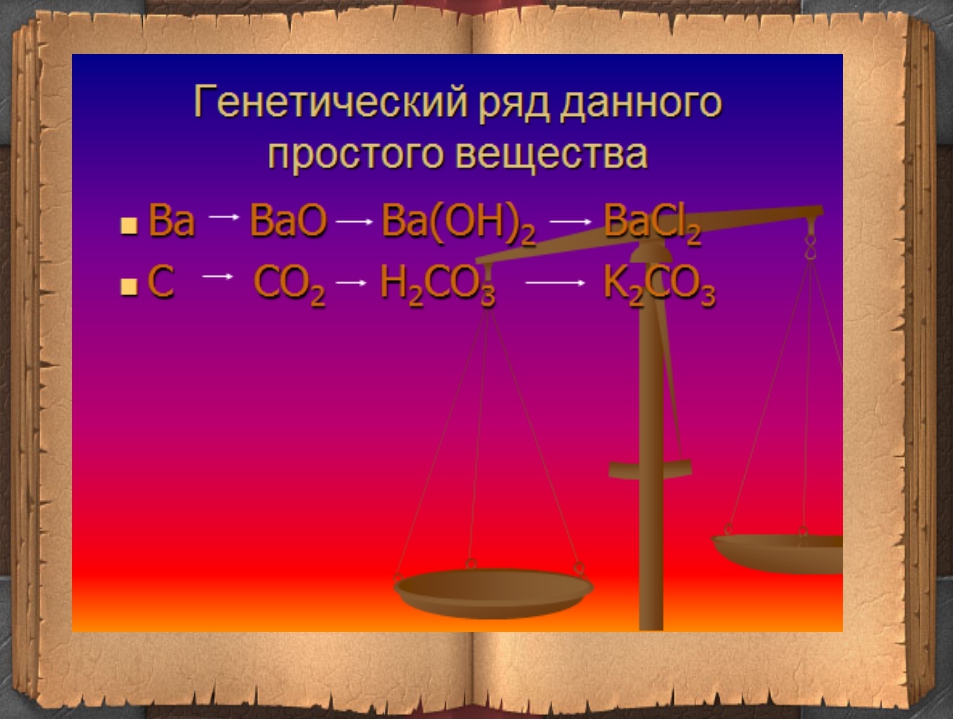
Ряд лития: Li→Li2O→LiOH→Li2SO4.
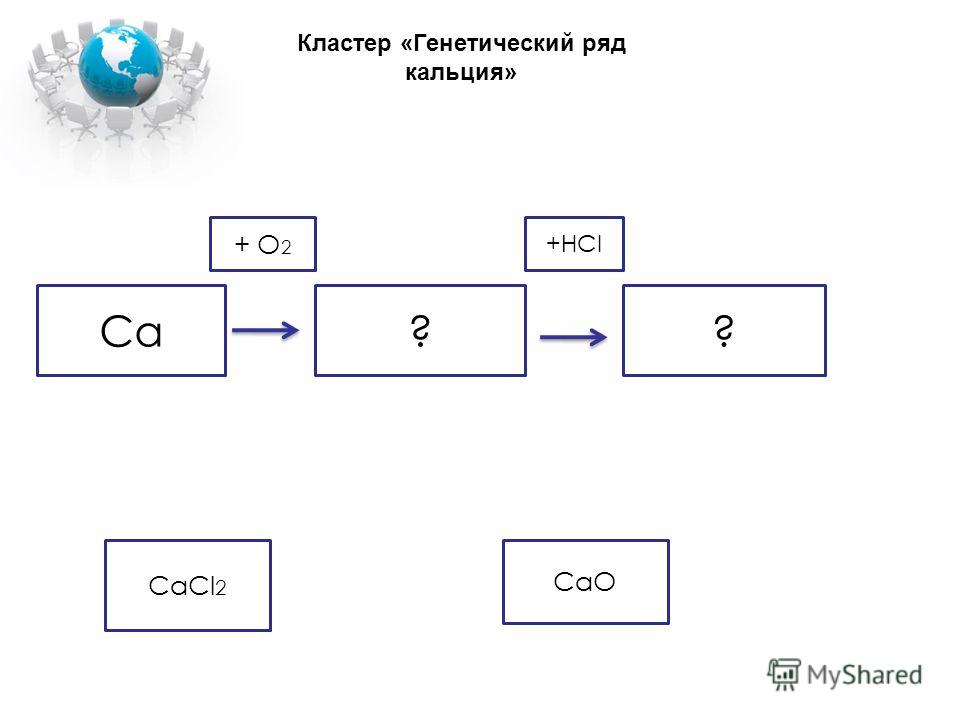
Ряд кальция: Ca→CaO→Ca(OH)2→CaCO3.
Ряд бария: Ba→BaO→Ba(OH)2→Ba3(PO4)2.
Составим уравнения для генетического ряда бария:
2Ba+O2=2BaO,
BaO+h3O=Ba(OH)2,
3Ba(OH)2+2h4PO4=Ba3(PO4)2+6h3O.
Обрати внимание!
Превращение гидроксида бария в фосфат можно осуществить также с помощью кислотного оксида или растворимой соли:
3Ba(OH)2+P2O5=Ba3(PO4)2↓+3h3O,
3Ba(OH)2+2Na3PO4=Ba3(PO4)2↓+6NaOH.
2. Генетические ряды неактивных металлов:
Ряд магния: Mg→MgO→MgCl2→Mg(OH)2→MgSO4.
Ряд железа: Fe→FeO→FeSO4→Fe(OH)2→Fe(NO3)2.
Ряд меди: Cu→CuO→Cu(NO3)2→Cu(OH)2→CuCl2.
Составим уравнения реакций для ряда меди:
2Cu+O2=2CuO,
CuO+2HNO3=Cu(NO3)2+h3O,
Cu(NO3)2+2NaOH=Cu(OH)2+2NaNO3,
Cu(OH)2+2HCl=CuCl2+2h3O.
Обрати внимание!
В ряду неактивного металла получить соль из основания можно только с помощью кислоты.
9 класс. Химия. Повторение. Генетическая связь классов неорганических соединений — Генетическая связь классов неорганических соединений
Комментарии преподавателя
Характеристика основных классов неорганических соединений
Химия – это наука о веществах, их свойствах и превращениях друг в друга.
Рис. 1. Генетическая связь классов неорганических соединений
Все неорганические вещества можно разделить на:
— Простые вещества
— Сложные вещества.
Простые вещества делятся на:
— Металлы
— Неметаллы
Сложные вещества можно разделить на:
— Оксиды
— Основания
— Кислоты
— Соли. См. Рис.1.
Оксиды – это бинарные соединения, состоящее из двух элементов, одним их которых является кислород в степени окисления -2.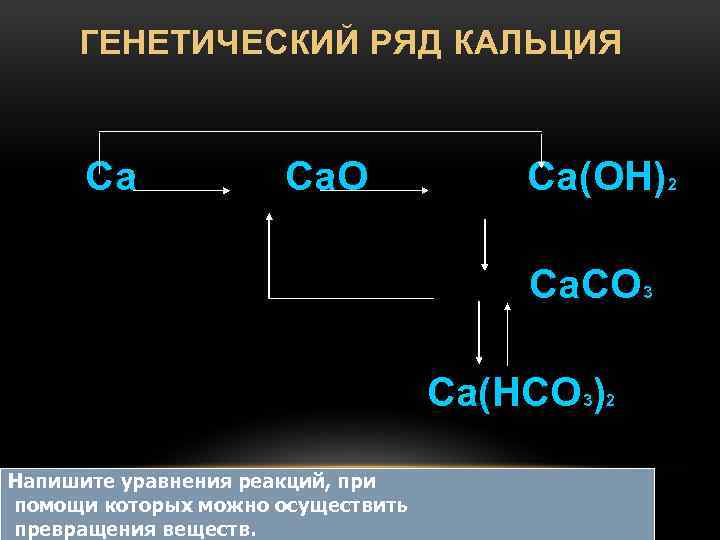 Рис.2.
Рис.2.
Например, оксид кальция: Сa+2О-2,оксид фосфора (V) P2O5., оксид азота (IV) –«лисий хвост»
Рис. 2. Оксиды
Оксиды делятся на:
— Основные
— Кислотные
Основным оксидам соответствуют основания.
Кислотным оксидам соответствуют кислоты.
Соли состоят из катионов металла и анионов кислотного остатка.
Пути генетических связей между веществами
Рис. 3. Пути генетических связей между веществами
Таким образом: из одного класса неорганических соединений можно получить другой класс.
Следовательно, все классы неорганических веществ взаимосвязаны.
Связь классов неорганических соединений часто называют генетической. Рис.3.
Генезис по — гречески означает «происхождение». Т.е. генетическая связь показывает взаимосвязь превращения веществ и их происхождение от единого вещества.
Т.е. генетическая связь показывает взаимосвязь превращения веществ и их происхождение от единого вещества.
Существует два основных пути генетических связей между веществами. Один из них начинается металлом, другой — неметаллом.
Генетический ряд металла показывает:
Металл → Основной оксид → Соль →Основание → Новая соль.
Генетический ряд неметалла отражает такие превращения:
Неметалл→ Кислотный оксид →Кислота →Соль.
Для любого генетического ряда можно написать уравнения реакций, которые показывают превращения одних веществ в другие.
— Для начала, нужно определить к какому классу неорганических соединений относится каждое вещество генетического ряда.
— Подумать, как из вещества, стоящего до стрелочки, получить вещество стоящие после неё.
Пример №1. Генетический ряд металла.
Металл → Основной оксид → Соль →Основание → Новая соль.
Cu → CuO → CuCl2 → Cu(OH)2 → CuSO4
медь оксид хлорид гидроксид сульфат
меди(II) меди(II) меди(II) меди(II)
Ряд начинается простым веществом металлом медью.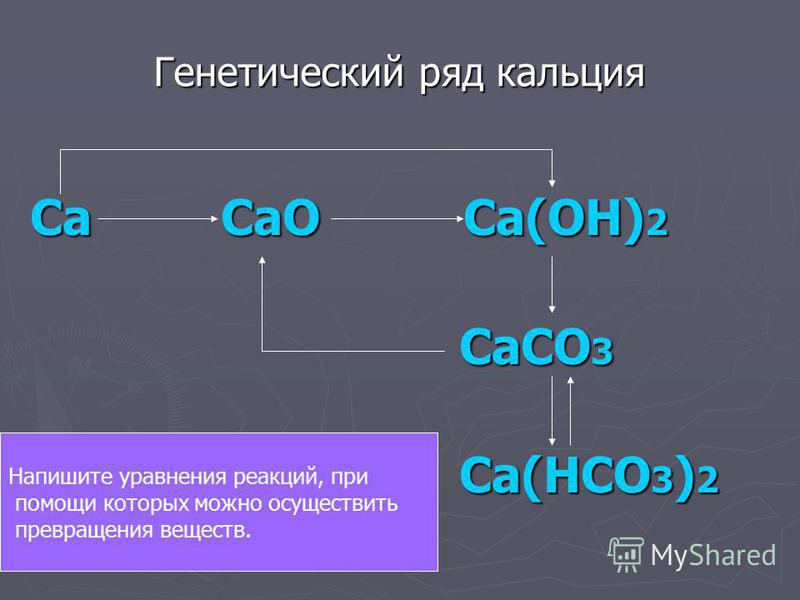 Чтобы осуществить первый переход, нужно сжечь медь в атмосфере кислорода.
Чтобы осуществить первый переход, нужно сжечь медь в атмосфере кислорода.
2Cu +O2 →2CuO
Второй переход: нужно получить соль CuCl2. Она образована соляной кислотой HCl, потому что соли соляной кислоты называются хлориды.
CuO +2 HCl → CuCl2 + h3O
Третий шаг: чтобы получить нерастворимое основание, нужно к растворимой соли прибавить щелочь.
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Чтобы гидроксид меди(II) перевести в сульфат меди(II) прибавим к ней серную кислоту h3SO4.
Cu(OH)2↓ + h3SO4 → CuSO4+ 2h3O
Пример №2. Генетический ряд неметалла.
Неметалл→ Кислотный оксид → Кислота → Соль.
C → CO2 → h3CO3 → CaCO3
Углерод оксид угольная кислота карбонат кальция
углерода(IV)
Ряд начинается простым веществом неметаллом углеродом. Чтобы осуществить первый переход, нужно сжечь углерод в атмосфере кислорода.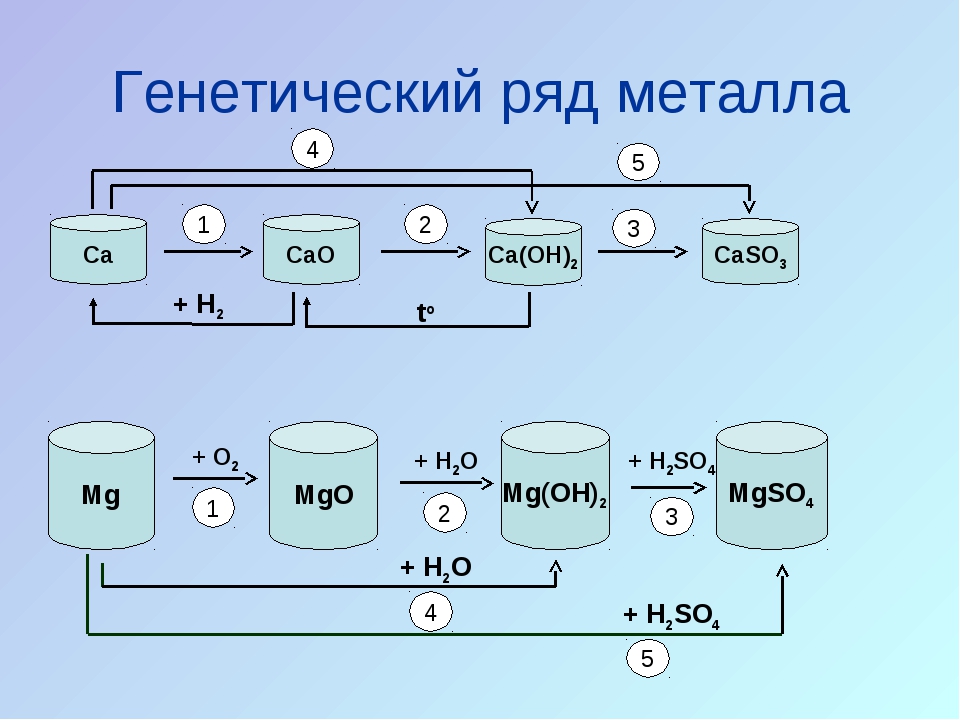
C + O2 → CO2
Если к кислотному оксиду прибавить воду, получится кислота, которая называется угольной.
СO2 + h3O → h3СO3
Чтобы получить соль угольной кислоты – карбонат кальция, нужно к кислоте добавить соединение кальция, например гидроксид кальция Ca(OH)2.
h3СO3 + Ca (OH)2 → CaCO3 + 2h3O
В состав любого генетического ряда входят вещества различных классов неорганических соединений.
Но в эти вещества обязательно входит один и тот же элемент. Зная, химические свойства классов соединений, можно подбирать уравнения реакций, при помощи которых можно осуществить данные превращения. Эти превращения используются и на производстве, для подбора наиболее рациональных методов получения тех или иных веществ.
источник видео — https://www.youtube.com/watch?v=4v2yloM426I
источник презентации — http://ppt4web.ru/khimija/geneticheskaja-svjaz-mezhdu-klassami-neorganicheskikh-veshhestv1.html
Конспект http://interneturok.ru/ru/school/chemistry/9-klass
Кальций, ногти (Calcium, nails; Ca)
Метод определения
Масс-спектрометрия c источником ионов в виде индуктивно связанной плазмы (ИСП-МС).
Исследуемый материал
Ногти
Доступен выезд на дом
Жизненно необходимый (эссенциальный) макроэлемент. Данное исследование входит в состав Профиля:
См. также отдельное исследование:
Для исследования данного микроэлемента в Профилях также принимается другой биоматериал:
Информацию по физиологической роли кальция, основным методам лабораторной оценки состояния кальциевого метаболизма и диагностики патологических состояний, связанных с нарушением метаболизма кальция подробнее, см. тесты: № 37 (кальций сыворотки и плазмы), № 113 (кальций, суточная экскреция с мочой), № 165 (ионизированный кальций плазмы), № 102 (паратгормон), № 171 (кальцитонин), тесты диагностики остеопороза – № 203 (бета-CrossLaps), № 146 (остеокальцин), № 147 ( ДПИД). Кальций (40,08 а.е.м.) — важнейший макроэлемент организма. Он участвует во многих жизненно важных процессах. 99% кальция организма входит в структуру костной ткани, обеспечивая её прочность. Необходимая концентрация кальция в крови поддерживается в жёстких пределах с помощью различных механизмов регуляции процессов метаболизма костной ткани, абсорбции в желудочно-кишечном тракте, реабсорбции в почках. Содержание кальция в волосах и ногтях, в отличие от его содержания в крови, колеблется в широких пределах. Уровень кальция в этих биоматериалах не связан прямо с уровнем потребления кальция. Повышение уровня кальция в волосах может отражать не только его избыточное поступление в организм, но и, напротив, повышенную мобилизацию и потерю кальция из костей (например, при остеопорозе в менопаузе). Снижение уровня кальция в волосах наблюдали в случаях инфарктов миокарда, сопровождающихся повышением кальцификации аорты. У детей в период активного роста, для которого характерно повышенное потребление кальция, его уровень в волосах может снижаться и не показывать корреляции с уровнем его поступления.
Кальций (40,08 а.е.м.) — важнейший макроэлемент организма. Он участвует во многих жизненно важных процессах. 99% кальция организма входит в структуру костной ткани, обеспечивая её прочность. Необходимая концентрация кальция в крови поддерживается в жёстких пределах с помощью различных механизмов регуляции процессов метаболизма костной ткани, абсорбции в желудочно-кишечном тракте, реабсорбции в почках. Содержание кальция в волосах и ногтях, в отличие от его содержания в крови, колеблется в широких пределах. Уровень кальция в этих биоматериалах не связан прямо с уровнем потребления кальция. Повышение уровня кальция в волосах может отражать не только его избыточное поступление в организм, но и, напротив, повышенную мобилизацию и потерю кальция из костей (например, при остеопорозе в менопаузе). Снижение уровня кальция в волосах наблюдали в случаях инфарктов миокарда, сопровождающихся повышением кальцификации аорты. У детей в период активного роста, для которого характерно повышенное потребление кальция, его уровень в волосах может снижаться и не показывать корреляции с уровнем его поступления. Кальциевый обмен и содержание кальция в тканях связаны с метаболизмом других металлов и анионов: фосфора, магния, железа, цинка, кобальта, калия, натрия, тяжелых металлов. Метаболизм кальция изменяется при стрессорных ситуациях, длительном постельном режиме, патологии почек, поджелудочной и щитовидной желёз и при применении лекарственных препаратов.
Кальциевый обмен и содержание кальция в тканях связаны с метаболизмом других металлов и анионов: фосфора, магния, железа, цинка, кобальта, калия, натрия, тяжелых металлов. Метаболизм кальция изменяется при стрессорных ситуациях, длительном постельном режиме, патологии почек, поджелудочной и щитовидной желёз и при применении лекарственных препаратов.
Литература
- Скальный А.В., Рудаков И.А. Биоэлементы в медицине. М., Изд. дом «Оникс 21 век»: Мир, 2004 г., 272 с.
- Оберлис Д., Харланд Б., Скальный А. Биологическая роль макро- и микроэлементов у человека и животных. СПБ., Наука, 2008 г., 544 с.
Урок 24. генетическая связь между основными классаминеорганических соединений. обобщение знаний по теме«основные классы неорганических соединений» — Химия — 8 класс
Урок
Конспект
Дополнительные материалы
Конспект
Генетическая связь между основными классами неорганических соединений. Обобщение знаний по теме «Основные классы неорганических соединений»
Обобщение знаний по теме «Основные классы неорганических соединений»
Изучая разные классы неорганических веществ, мы узнали, что каждый класс со-единений обладает характерными химическими свойствами. Также можно проследить взаимосвязи между веществами разных классов неорганических соединений.
Неметалл фосфор горит в кислороде ослепительным пламенем, в результате обра-зуется окисид фосфора (V): 4P + O2 = 2P2O5.
Растворим оксид фосфора (V) в воде и добавим несколько капель индикатора лак-муса. Оксид фосфора (V) взаимодействует с водой с образованием кислоты: P2O5 + 3h3O = 2h4PO4.
Оксид фосфора (V) – кислотный оксид. К получившемуся раствору кислоты по ка-плям будем приливать раствор гидроксида натрия. Щёлочь нейтрализует получившуюся кислоту. В результате образуются соль и вода: h4PO4 + 3NaOH = Na3PO4 + 3h3O.
У нас получилась цепочка превращений, в которой все вещества относятся к раз-ным классам неорганических соединений, но связаны общим химическим элементом:
P P2O5 h4PO4 Na3PO4
Неметалл кислотный оксид кислота соль
Такую же цепочку можно составить и для типичного металла, например для кальция.
На воздухе кальций горит ослепительным пламенем. В результате образуется оксид кальция: 2Ca + O2 = 2CaO.
Растворим оксид кальция в воде. Прильём несколько капель фенолфталеина. Оксид кальция взаимодействует с водой с образованием щёлочи: CaO + h3O = Ca(OH)2.
Оксид кальция – основный оксид. Прильём к получившемуся раствору несколько капель соляной кислоты. Кислота нейтрализует щёлочь. В результате образуются соль и вода: Ca(OH)2 + 2HCl = CaCl2 + 2h3O
В получившейся цепочке превращений все вещества относятся к разным классам неорганических соединений, но связаны общим химическим элементом – металлом:
Ca CaO Ca(OH)2 CaCl2
металл основный оксид основание (щёлочь) соль
Такую цепочку превращений нельзя составить для металлов, которые образуют не-растворимые основания. Генетический ряд в этом случае будет другим.
Генетический ряд называют рядом превращений. Он характеризует взаимопревра-щения веществ разных классов.
Конспект урока по химии – 9 кл.
 по теме «Соединения щелочноземельных металлов»
по теме «Соединения щелочноземельных металлов»
Джабраилова Х.Д.
Конспект урока по химии – 9 кл.
по теме
«Соединения щелочноземельных металлов»
Цель: Обобщить знания учащихся и сформировать у них полное разностороннее представление
о природных соединениях щелочноземельных металлов, их свойствах, значении в
природе и использовании человеком
Задачи: 1) обучающие: усвоение учащимися представлений о природных соединениях
щелочноземельных металлов, их значении в природе и использовании
человеком;
2) развивающие: развитие умений составлять формулы веществ по их названиям и
давать названия по химическим формулам; записывать уравнения
химических реакций и рассматривать их с точки зрения
ТЭД и ОВР; отработка навыков проведения химического
эксперимента; показать взаимосвязь химии с другими предметами
(биологией, географией, ИЗО) и областями деятельности человека
(медициной, строительством, сельским хозяйством, архитектурой)
3) воспитывающие: патриотическое, эстетическое воспитание, формирование навыков
ЗОЖ (по предупреждению заболеваний опорно-двигательной
системы)
Структура урока:
Организационный момент
Повторение пройденного материала
Изучение нового материала: 1) Генетические ряды щелочноземельных металлов на примере кальция.
 Оксид и гидроксид кальция. Лабораторная работа «Взаимодействие гидроксида кальция с соляной кислотой и сульфатом меди(II)»; 2) Соли щелочноземельных металлов. Лабораторная работа «Ознакомление с образцами природных соединений кальция». Применение солей
Оксид и гидроксид кальция. Лабораторная работа «Взаимодействие гидроксида кальция с соляной кислотой и сульфатом меди(II)»; 2) Соли щелочноземельных металлов. Лабораторная работа «Ознакомление с образцами природных соединений кальция». Применение солейЗакрепление полученных знаний
Домашнее задание
Окончание урока
7. Рефлексия
Ход урока
1. Организационный момент
2. Повторение пройденного материала
Фронтальный опрос:
Где в ПСХЭ находятся щелочноземельные металлы?
Какие элементы относятся к щелочноземельным металлам?
Почему они так называются?
Назовите общую особенность в строении атомов элементов II группы главной подгруппы.
Как строение атомов IIА определяет их свойства?
Как меняются металлические свойства элементов IIА группы с увеличением заряда их ядер?
Каково значение кальция в организме человека?
3. Изучение нового материала
Изучение нового материала
Генетические ряды щелочноземельных металлов на примере кальция.
Оксид и гидроксид кальция
Задание. Заполните таблицу:
? Каким цветом выделены формулы и названия оксидов, гидроксидов, солей?
Задание. Используя формулы соединений кальция, составьте генетический ряд этого металла (работа у доски)
1 2 3
Ответ: Ca → CaO → Ca(OH)2 → CaCO3
Рассмотрим данные переходы:
Ca + O2 → CaO (демонстрация видеоролика) (ОВР у доски)
CaO + H2O → Ca(OH)2 (демонстрация)
Задание. Из предложенного перечня выберите формулы веществ, с которыми может реагировать оксид кальция. Запишите уравнения возможных реакций (самопроверка).
Na, SO2, MgO, HCl, CaCl2, KOH
Ответ: Как основный оксид CaO реагирует с кислотными оксидами и кислотами, образуя соли:
1. СаO + SO2 = CaSO3
СаO + SO2 = CaSO3
2. CaO + 2HCl = CaCl2 +H2O
Применение оксида кальция: используется в нефтеперерабатывающей, нефтехимической (производство присадок и смазок), химической, кожевенной и других отраслях промышленности, в промышленности строительных материалов как вяжущий материал. В пищевой промышленности зарегистрирован в качестве пищевой добавки E529 (регуляторы рН)
Ca(OH)2 + CO2 → CaCO3 (демонстрация биологического опыта «Дыхание») (Качественная реакция)
У травянистых растений газообмен происходит через устьица на листьях и стеблях, у деревьев и кустарников — на стволах через чечевички или трещины
Новые слова: гашёная известь, негашёная известь, гашение, известковая вода, известковое молоко
Задание (работа с текстом учебника): используя текст учебника на странице 63, составьте соответствия
Известковое молоко
Известковая вода
Негашёная известь
Гашение
А. Оксид кальция
Оксид кальция
Б. Оксид магния
В. Гидроксид кальция
Г. Реакция оксида кальция с водой, сопровождающаяся выделением большого количества теплоты
Д. Прозрачный раствор гидроксида кальция
Е. Белая взвесь гидроксида кальция в воде
? С какими веществами ещё может реагировать гидроксид кальция? (с кислотами и солями)
«Взаимодействие гидроксида кальция с соляной кислотой и сульфатом меди(II)»!
Ca(OH)2 + 2HCl→ CaCl2 + 2H2O (ТЭД у доски)
Ca(OH)2 + СuCl2→ CaCl2 + Cu(OH)2 (ТЭД – дома)
Применение гидроксида кальция:
при побелке помещений;
для приготовления известкового строительного раствора и силикатного бетона;
для умягчение воды;
для производства известковых удобрений;
дубление кож;
получение других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот;
в пищевой промышленности зарегистрирован в качестве пищевой добавки E526 (регуляторы рН)
Известковое молоко применяют в сахарной промышленности для очистки свекловичного сока
Задание на дом (дополнительное): Составьте генетический ряд бария
Соли щелочноземельных металлов
? Опишите физические свойства представленных солей
Данные соединение встречаются и в природе в виде минералов
Применение солей:
Задание.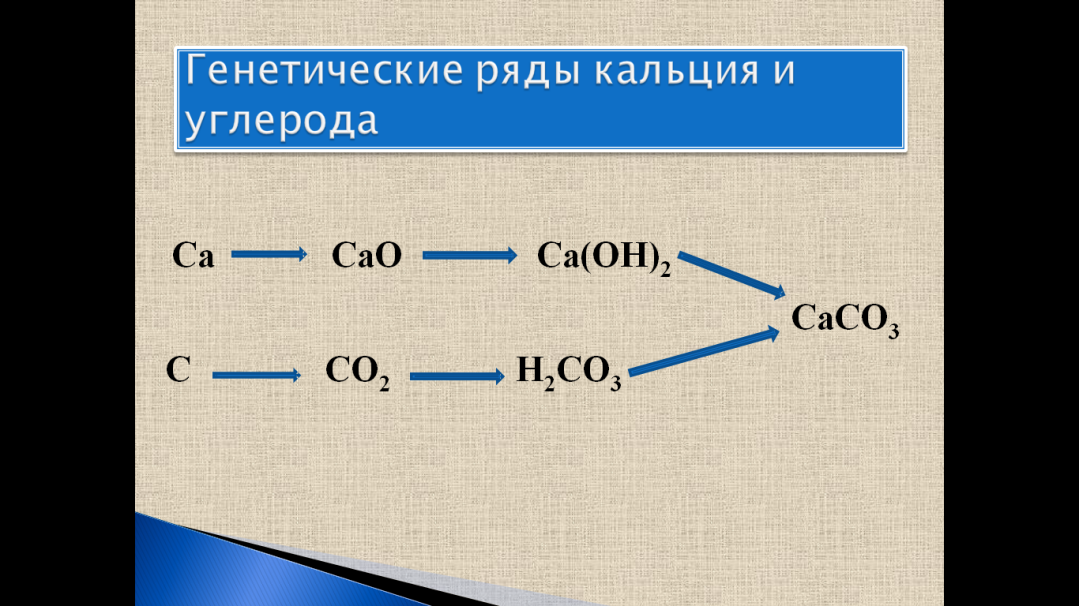 По ходу выступлений заполните таблицу:
По ходу выступлений заполните таблицу:
перламутровых слоёв. Добыча морского жемчуга ведётся главным образом в Красном море и Персидском заливе, а также у берегов Шри-Ланки и Японии. Пресноводный жемчуг добывается в Германии, России, Китае и странах Северной Америки. В настоящее время ведётся не только поиск природного жемчуга, но и выращивание его в промышленных масштабах (особенно в Японии). Внутрь устрицы помещаются бусинки из прессованных раковин, после чего устрицы возвращаются в воду. Через определённое время бусины, покрытые слоями перламутра, извлекаются из устриц. Искусственный жемчуг в последнее время широко используется как популярный компонент для создания бижутерии и украшений своими руками. Современные технологии позволяют создать искусственные жемчужины любых размеров, форм и цветов, при этом стоимость такого жемчуга существенно ниже натурального. История знает много примеров поистине гигантских жемчужин. Однако ни одна из них не дошла до наших дней: жемчужины не живут больше 150—200 лет, после этого срока камень, увы, рассыпается.
Более десяти лет исследований показали, что яичная скорлупа идеальный источник кальция, который легко усваивается организмом.
Готовят скорлупу так. Яйца моют в теплой воде с мылом, хорошо ополаскивают. Белок и желток выливают из яйца, а скорлупу еще раз прополаскивают и на 5 минут помещают в кипящую воду. Скорлупа яиц, сваренных вкрутую чуть менее активна, но зато готова к использованию. Дозировка от 1,5 до 3 г. в зависимости от возраста. Растереть скорлупу в порошок лучше в ступке. Принимать с утренней едой — с творогами или кашей (раздаточный материал).
Закрепление полученных знаний
Тест с взаимопроверкой
Задание: Какие утверждения верны?
Все элементы II группы главной подгруппы относятся к щелочноземельным металлам
Оксид кальция реагирует с кислотными оксидами и кислотами, образуя соли
Негашёная известь – это гидроксид кальция
Помутнение известковой воды вызывает угарный газ
Карбонат и фосфат кальция — это нерастворимые соли
Алебастр – это полуводный гипс
Внутренний скелет характерен для позвоночных животных
В организме человека 98% кальция содержится в костях
Яичная скорлупа образована фосфатом кальция
Природный мел представляет собой остатки раковин древних животных
Домашнее задание
§ 12 стр.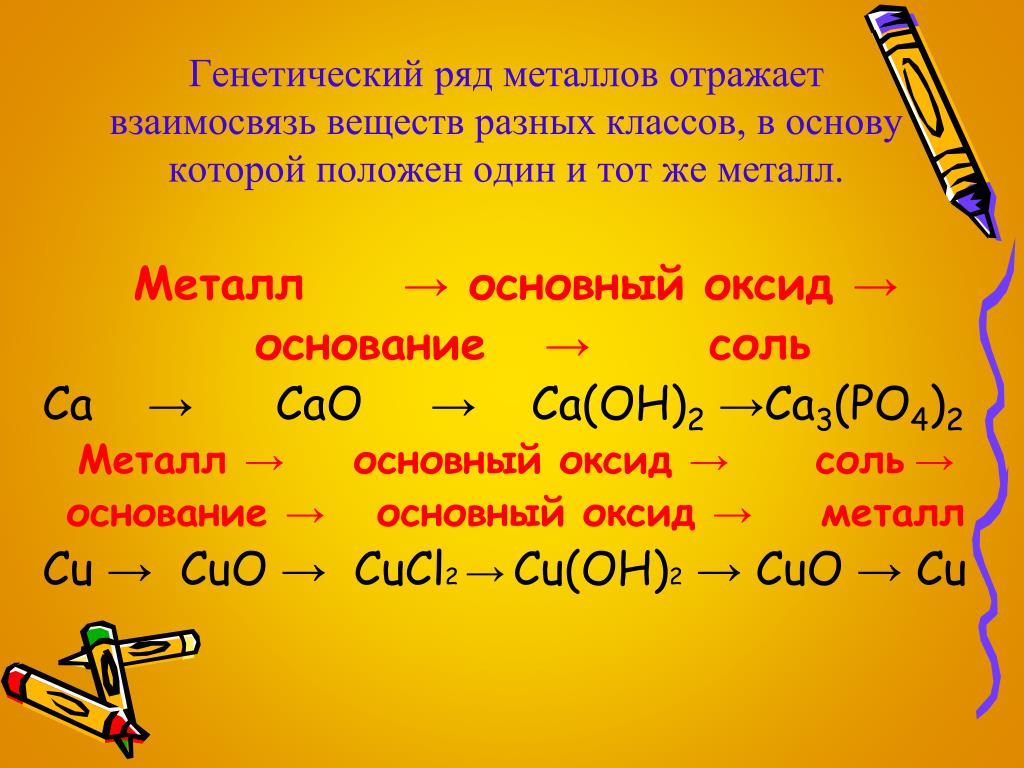 50
50
Взаимосвязь различных классов неорганических веществ / Справочник :: Бингоскул
Как уже известно, существует четыре класса неорганических соединений. К ним относятся оксиды, основания, кислоты и соли. При подробном изучении способов получения каждого класса соединений можно проследить определенную взаимосвязь между всеми классами. Например, из кислот можно получить соли, из оксидов основания и так далее. Такая связь называется генетической.
Следовательно, генетическая связь – это связь между классами неорганических соединений, которая основана на получении веществ одного класса из веществ другого класса, а также их химических свойств.
На основании данной связи составляют генетические ряды, которые включают в себя представителей разных классов, но состоящие из одного элемента.
Генетическую связь можно представить в виде схемы.
Из данной схемы видно, что существует определенная взаимосвязь между классами.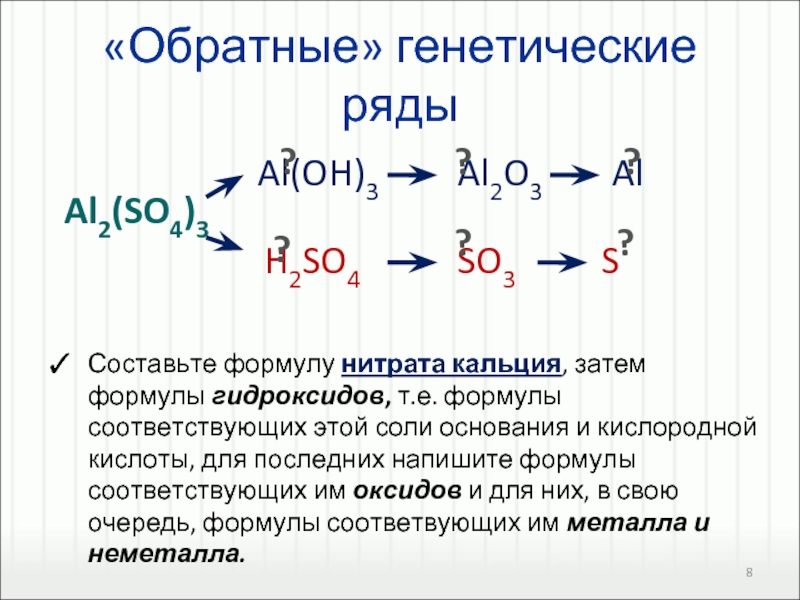 Основополагающими элементами генетического ряда являются либо металл, либо неметалл.
Основополагающими элементами генетического ряда являются либо металл, либо неметалл.
- Для получения оксида необходимо осуществить взаимодействие металла либо неметалла с кислородом.
- При взаимодействии с водой из основного оксида можно получить основание, а из кислотного – кислоту.
- Соль образуется при различных реакциях между всеми классами неорганических соединений. Например, металл + неметалл, основный оксид + кислотный оксид, основание + кислота и так далее.
Можно выделить два типа генетических рядов, которые мы и рассмотрим.
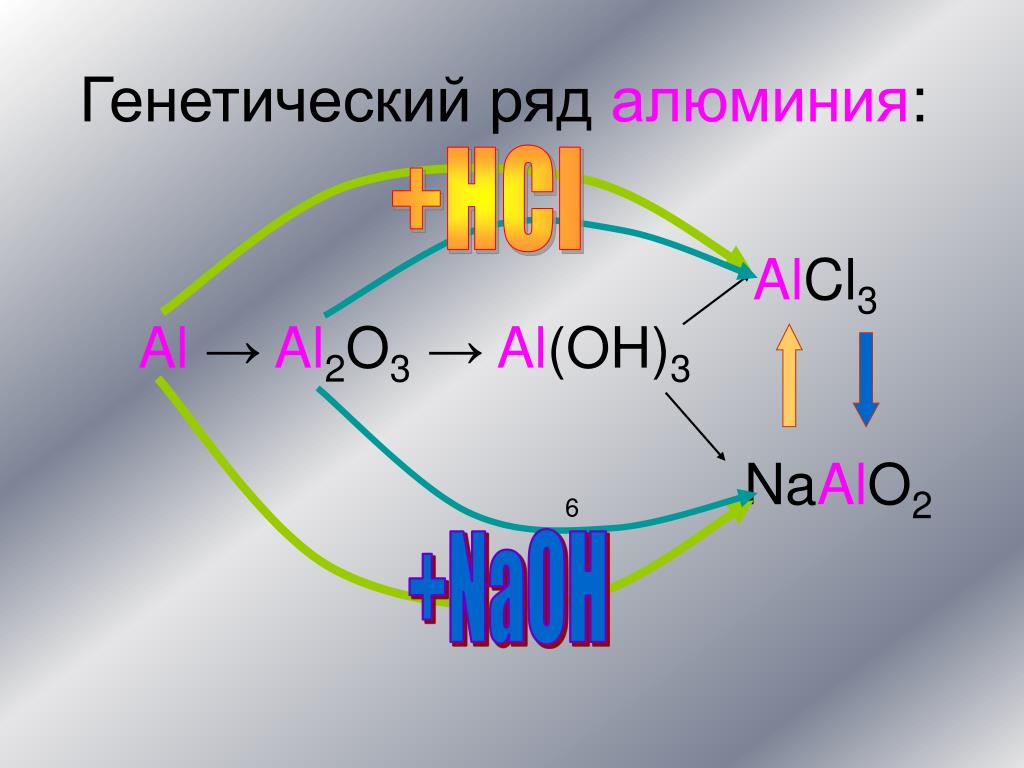
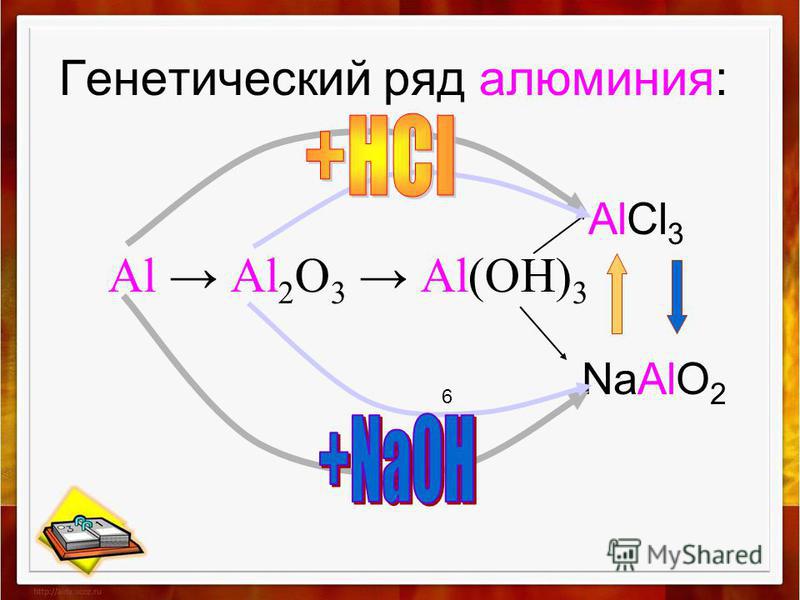
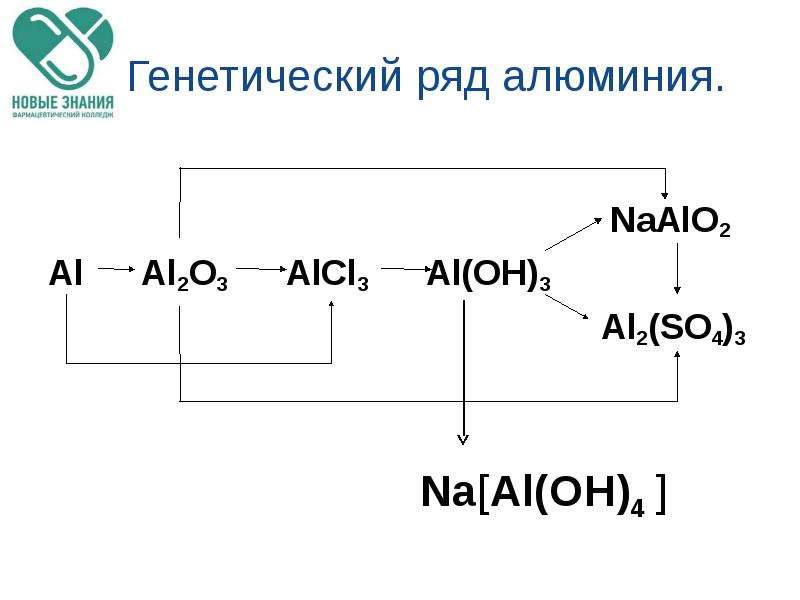
1. Генетический ряд металла
Металл → Основный оксид → Основание → Соль
- Ряд кальция: Ca → CaO → Ca(OH)2 → Ca Cl2;
- Ряд натрия: Na → Na2O → NaOH → Na3PO4;
- Ряд магния: Mg → MgO → Mg(OH)2 → Mg(NO3)2;
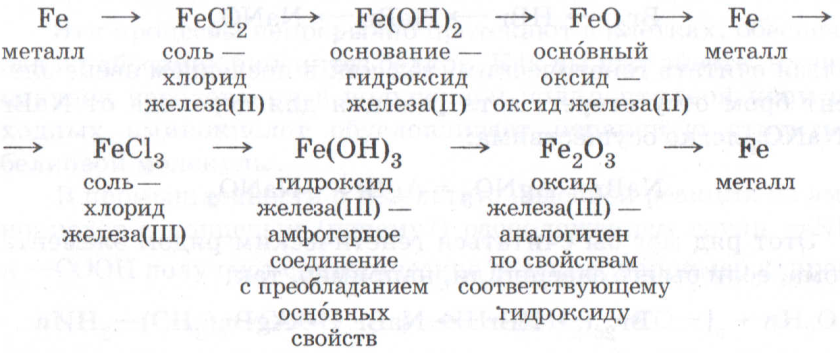
- Ряд железа: Fe → FeO → Fe(OH)2 → FeSO4.
Рассмотрим взаимосвязь в данных рядах на примере магния.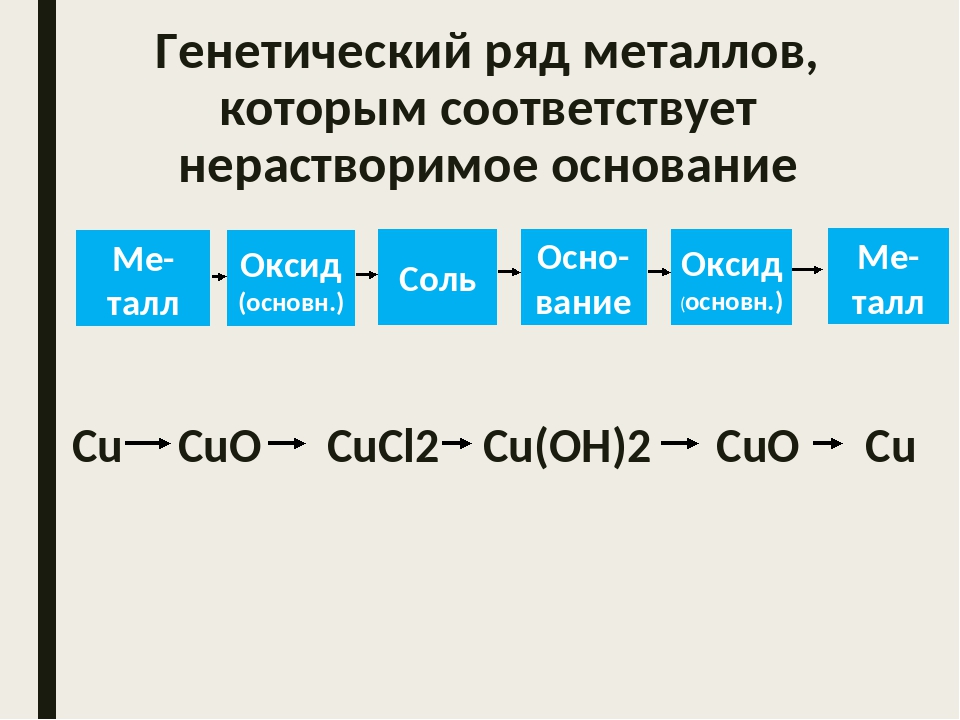
- Для получения оксида магния из чистого металла, осуществим реакцию взаимодействия с кислородом.
Mg + O2 → MgO
- При взаимодействии основного оксида с водой, в частности оксида магния, получим основание – гидроксид магния.
MgO + h3O → Mg(OH)2
- Для получения соли из нерастворимого основания, необходимо добавить кислоту.
Mg(OH)2 + HNO3 → Mg(NO3)2 + H2O
2. Генетический ряд неметалла
Неметалл → Кислотный оксид → Кислота → Соль
- Ряд фосфора: P → P2O5 →H3PO4 → Na3PO4;
- Ряд углерода: C → CO2 → H2CO3 → CaCO3;
- Ряд серы: S → SO2 → H2SO3→ MgSO3;
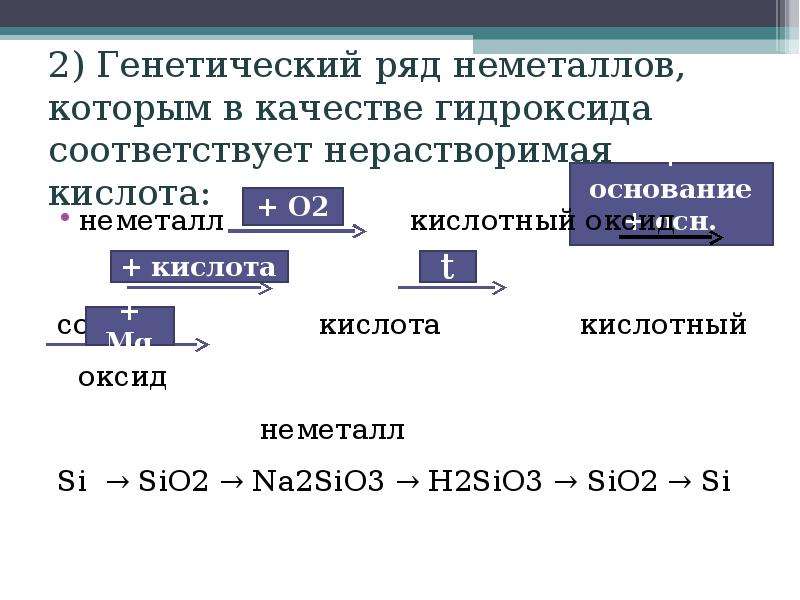
- Ряд кремния: Si → SiO2 → H2SiO3→ K2SiO3.

Рассмотрим взаимосвязь в данных рядах на примере углерода.
- Для получения оксида углерода осуществим реакцию взаимодействия с кислородом – горение. Протекает с выделением энергии.
C + O2 → CO2
- При взаимодействии кислотного оксида с водой, в частности оксида углерода, получим угольную кислоту.
CO + H2O → H2CO3
- Для получения соли из кислоты, необходимо добавить основание.
Ca(OH)2 + H2CO3 → CaCO3↓ + 2H2O
Для составления генетических цепочек необходимо знать химические свойства каждого класса неорганических соединений, а также валентные возможности того элемента, который лежит в основе генетического ряда.
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
Составьте генетический ряд лития, используя схему.
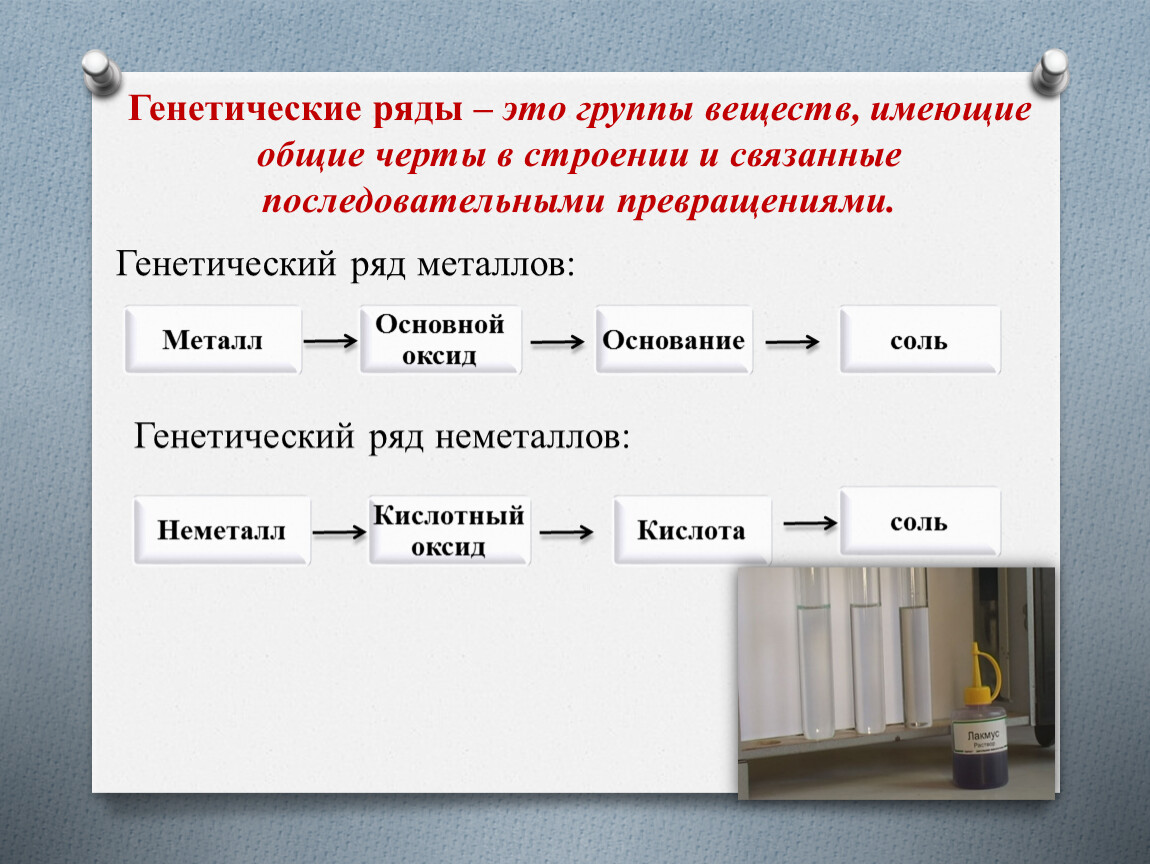 Генетические ряды металлов и их соединений Составить генетический ряд для лития
Генетические ряды металлов и их соединений Составить генетический ряд для лития
Генетической связью между веществами называется такая связь, которая основывается на их взаимопревращениях, она отражает единство происхождения веществ, другими словами – генезис.
Обладая знаниями о классах простых веществ, можно выделить два генетических ряда:
1) Генетический ряд металлов
2) Генетический ряд неметаллов.
Генетический ряд металлов раскрывает взаимосвязанность веществ разных классов, в основу которой положен один и тот же металл.
Генетический ряд металлов бывает двух видов.
1. Генетический ряд металлов, которым в качестве гидроксида соответствует щелочь. Такой ряд может быть представлен подобной цепочкой превращений:
металл → основной оксид → основание (щелочь) → соль
Возьмем для примера генетический ряд кальция:
Ca → CaO → Ca(OH) 2 → Ca 3 (PO 4) 2 .
2. Генетический ряд металлов, которым соответствуют нерастворимые основания. В данном ряде больше генетических связей, т.к. он более полно отражает идею прямых и обратных превращений (взаимных). Такой ряд можно изобразить очередной цепочкой превращений:
В данном ряде больше генетических связей, т.к. он более полно отражает идею прямых и обратных превращений (взаимных). Такой ряд можно изобразить очередной цепочкой превращений:
металл → основной оксид → соль → основание → основной оксид → металл.
Возьмем для примера генетический ряд меди:
Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu.
Генетический ряд неметаллов раскрывает взаимосвязь веществ различных классов, в основе которых лежит один и тот же неметалл.
Давайте выделим еще две разновидности.
1. Генетический ряд неметаллов, которым в качестве гидроксида соответствует растворимая кислота, может быть изображен в виде следующей линии превращений:
неметалл → кислотный оксид → кислота → соль.
Возьмем для примера генетический ряд фосфора:
P → P 2 O 5 → H 3 PO 4 → Ca 3 (PO 4) 2 .
2. Генетический ряд неметаллов, которым соответствует нерастворимая кислота, может быть изображен очередной цепочкой трансформаций:
неметалл → кислотный оксид → соль → кислота → кислотный оксид → неметалл.
Поскольку из рассмотренных нами кислот нерастворимой является исключительно кремниевая кислота, давайте рассмотрим в качестве примера генетический ряд кремния:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si.
Итак, давайте подведем итоги и выделим самую основную информацию.
Целосность и разнообразие химических веществ наиболее выражено изображены в генетической связи веществ, которая раскрывается в генетических рядах. Рассмотрим самые важные признаки генетических рядов:
Генетические ряды – это группа органических соединений, у которых равное число атомов углерода в молекуле, различающихся функциональными группами.
Генетическая связь – более общее понятие, в отличие от генетического ряда, который пусть и является достаточно ярким, но в тоже время частным проявлением данной связи, которая может происходить при любых двусторонних превращениях веществ.
blog.сайт,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
ПОМОГИТЕ ЗАВТРА НАДО) 8 КЛАСС ХИМИЯ, 1) Составьте генетический ряд серы, используя схему: неметалл—-> кислотный
оксид-> кислота →соль.
2) .
Составьте молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме:Na2O->NaOH->NaCl
Na2O->NaOH->Na2SO4
Укажите тип каждой реакции.
3)
Закончите фразу: «Водные растворы диссоциируют на…
помогите плиз хоть с чем-то
Вариант № 1
Часть А. Тестовые задания с выбором одного правильного ответа
1. (2балла). Ряд, в котором представлены формулы веществ каждого из четырех классов неорганических соединений:
А. CuO, CO2, h3SO4, FeS Б. HNO3, h3S, Al2O3, CuCl2 В. P2O5, NaOH, HCl, Na2CO3
2. (2балла). В генетическом ряду CuSO4→X→CuO
Веществом Х является вещество с формулой: А.CuOH Б. Cu(OH)2 В. CuCl2
3. (2балла). Формула гидроксида, соответствующего оксиду серы(VI):
А. h3S Б. h3SO3 В. h3SO4
4. (2балла). Генетическим рядом является ряд, схема которого:
А.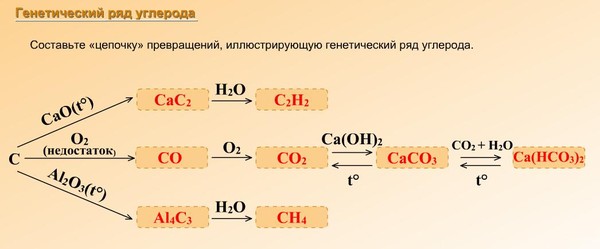 Cu(OH)2→CuO→ Cu Б. FeSO4→Fe(OH)2→ h3O В. SO3→h3SO4→h3
Cu(OH)2→CuO→ Cu Б. FeSO4→Fe(OH)2→ h3O В. SO3→h3SO4→h3
5. (2балла). Гидроксид меди(II) можно получить при взаимодействии веществ, формулы которых: А. Cu и h3O Б. CuO и h3O В. CuCl2 и NaOH
6. (2балла). Пара формул веществ, взаимодействующих друг с другом:
А. Ca(OH)2 и CuO Б. HCl и Hg В. h3SO4 и MgO
7. (2балла). Гидроксид калия вступает в реакцию:
А. с гидроксидом меди(II) Б. с оксидом углерода(IV) В. с оксидом кальция
8. (2балла). В схеме превращений CaO→X Ca(OH)2 →Y CaCl2
вещества Х и Y имеют формулы:
А. X – h3O, Y – HCl Б. X – h3, Y – HNO3 В.X – O2, Y — HCl
9. (2балла). В генетическом ряду Э→Э2О→ЭОН→Э2SО4 Элемент Э – это:
А. Литий Б. Кальций В. Сера
10. (2балла). Ряд формул соединений, в котором каждое из них взаимодействует с водой при обычных условиях:
А. CO2, SO2, SiO2 Б. BaO, P2O5, Li2O В. K2O, CaO, CuO
Часть Б. Задания со свободным ответом
11. (8 баллов). Составьте генетический ряд бария, используя необходимые для этого формулы веществ: Ba(OH)2, h3SO4, CO2, Ba, MgO, BaSO4, BaO
12. (8 баллов). Напишите молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме: P→P2O5→h4PO4→Na3PO4
(8 баллов). Напишите молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме: P→P2O5→h4PO4→Na3PO4
13. (6 баллов) Допишите уравнения реакции:
? + 2HCl→? + ? +СО2
14. (4 балла). Запишите формулы веществ А и В, пропущенных в генетическом ряду: CuSO4→А→В→Cu
ЧАСТЬ А. Тестовые задания с выбором правильного ответа
1/ (2 балла) Ряд, в котором представлены формулы веществ каждого из четырёх классов неорганических соединений:
P2O5, h3SO4, h3SO3, NaOH
SO2, h3SiO3, MgSO4, CuO
CO2, h3S, K2SO3, KOH
2/ (2 балла) В генетическом ряду
Li Li2O X LiCl
веществом Х является вещество с формулой
A) Li B)LiOH C) HCl
3) (2 балла) Формула гидроксида, соответствующего оксиду фосфора (V):
A) HPO2 B) h4PO3 C) h4PO4
4) (2 балла) Генетическим рядом является ряд, схема которого
A) SO3 h3SO4 CaSO4
B) ZnCl2 Zn(OH)2 h3O
C) Al AlCl3 AgCl
5) (2 балла) Хлорид меди (II) можно получить при взаимодействии веществ, формулы которых:
A) Cu + HCl B) CuO + HCl C) CuOH + HCl
6) (2 балла) Пара формул веществ, взаимодействующих друг с другом:
A) Ag + HCl B) SO2 + NaOH C) CuO + NaOH
7) Cоляная кислота вступает в реакцию:
А) с магнием В) с оксидом серы (IV) С) с серебром
8) (2 балла) В схеме превращений:
P P2O5 h4PO4
вещества Х и У имеют формулы:
А) Х – h3O, Y – HCl B) X – O2, Y – h3 C) X – O2, Y – h3O
(2 балла) В генетическом ряду
Э Э2О5 Н3ЭО4 Na3ЭО4
элемент Э – это:
А) калий В) сера С) фосфор
10) (2 балла) Ряд формул соединений, в котором каждое из них взаимодействует с водой при обычных условиях:
A) CO2, Li2O, SO3 B) CuO, P2O5, CaO C) BaO, FeO, ZnO
Часть Б. задание со свободным ответом
задание со свободным ответом
(8 баллов) Составьте генетический ряд бария, используя необходимые для этого формулы веществ: h3O, SO2, Fe2O3, S, CaCO3, h3SO3, K2SO3
(8 баллов) Напишите молекулярные и там, где это имеет место, — ионные уравнения реакций согласно схеме:
Ba BaO Ba(OH)2 BaSO4
Укажите типы реакций по числу и составу исходных веществ и продуктов реакции.
(6 баллов) Допишите уравнения реакций:
Fe(OH)3 + NaOH = ? +
(4 балла) Запишите формулы веществ А и В, пропущенных в генетическом ряду:
Li A B Li3PO4
(4 балла) Допишите уравнение реакций
N2 + ?= N2O3
Повторение. Генетическая связь классов неорганических соединений
Введение
Тема этого урока — «Повторение. Генетическая связь классов неорганических соединений». Вы повторите, как делятся все неорганические вещества, сделаете вывод, как из одного класса неорганических соединений можно получить другой. На основании полученных сведений узнаете, что такое генетическая связь таких классов, два основных пути таких связей.
Тема: Введение
Урок: Повторение. Генетическая связь классов неорганических соединений
Химия — это наука о веществах, их свойствах и превращениях друг в друга.
Рис. 1. Генетическая связь классов неорганических соединений
Все неорганические вещества можно разделить на:
Простые вещества
Сложные вещества.
Простые вещества делятся на:
Металлы
Неметаллы
Сложные вещества можно разделить на:
Основания
Кислоты
Соли. См. Рис.1.
Это бинарные соединения, состоящее из двух элементов, одним их которых является кислород в степени окисления -2. Рис.2.
Например, оксид кальция: Сa +2 О -2 ,оксид фосфора (V) P 2 O 5., оксид азота (IV) -«
лисий хвост»
Рис. 2. Оксиды
Делятся на:
Основные
Кислотные
Основным оксидам
соответствуют основания
.
Кислотным оксидам
соответствуют кислоты
.
Соли
состоят из катионов металла
и анионов кислотного остатка
.
Рис. 3. Пути генетических связей между веществами
Таким образом: из одного класса неорганических соединений можно получить другой класс.
Следовательно, все классы неорганических веществ взаимосвязаны
.
Связь классов
неорганических соединений часто называют генетической.
Рис.3.
Генезис по — гречески означает «происхождение». Т.е. генетическая связь показывает взаимосвязь превращения веществ и их происхождение от единого вещества.
Существует два основных пути генетических связей между веществами. Один из них начинается металлом, другой — неметаллом.
Генетический ряд металла
показывает:
Металл → Основной оксид → Соль →Основание → Новая соль.
Генетический ряд неметалла
отражает такие превращения:
Неметалл→ Кислотный оксид →Кислота →Соль.
Для любого генетического ряда можно написать уравнения реакций, которые показывают превращения одних веществ в другие
.
Для начала, нужно определить к какому классу неорганических соединений относится каждое вещество генетического ряда.
Подумать, как из вещества, стоящего до стрелочки, получить вещество стоящие после неё.
Пример №1. Генетический ряд металла.
Ряд начинается простым веществом металлом медью. Чтобы осуществить первый переход, нужно сжечь медь в атмосфере кислорода.
2Cu +O 2 →2CuO
Второй переход: нужно получить соль CuCl 2. Она образована соляной кислотой HCl, потому что соли соляной кислоты называются хлориды.
CuO +2 HCl → CuCl 2 + H 2 O
Третий шаг: чтобы получить нерастворимое основание, нужно к растворимой соли прибавить щелочь.
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl
Чтобы гидроксид меди(II) перевести в сульфат меди(II) прибавим к ней серную кислоту H 2 SO 4 .
Cu(OH) 2 ↓ + H 2 SO 4 → CuSO 4 + 2H 2 O
Пример №2. Генетический ряд неметалла.
Ряд начинается простым веществом неметаллом углеродом. Чтобы осуществить первый переход, нужно сжечь углерод в атмосфере кислорода.
Чтобы осуществить первый переход, нужно сжечь углерод в атмосфере кислорода.
C + O 2 → CO 2
Если к кислотному оксиду прибавить воду, получится кислота, которая называется угольной.
СO 2 + H 2 O → H 2 СO 3
Чтобы получить соль угольной кислоты — карбонат кальция, нужно к кислоте добавить соединение кальция, например гидроксид кальция Ca(OH) 2 .
H 2 СO 3 + Ca (OH) 2 → CaCO 3 + 2H 2 O
В состав любого генетического ряда входят вещества различных классов неорганических соединений.
Но в эти вещества обязательно входит один и тот же элемент. Зная, химические свойства классов соединений, можно подбирать уравнения реакций, при помощи которых можно осуществить данные превращения. Эти превращения используются и на производстве, для подбора наиболее рациональных методов получения тех или иных веществ.
Вы повторили, как делятся все неорганические вещества, сделали вывод, как из одного класса неорганических соединений можно получить другой. На основании полученных сведений узнали, что такое генетическая связь таких классов, два основных пути таких связей.
1. Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман.М.: Просвещение. 2011 г.176с.:ил.
2. Попель П.П.Химия:8 кл.: учебник для общеобразовательных учебных заведений/П.П. Попель, Л.С.Кривля. -К.: ИЦ «Академия»,2008.-240 с.: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа.:2001. 224с.
1. №№ 10-а,10з (с.112) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман.М.: Просвещение. 2011 г.176с.: ил.
2. Как двумя способами из оксида кальция получить сульфат кальция?
3. Составьте генетический ряд получения из серы сульфата бария. Напишите уравнения реакций.
Каждый такой ряд состоит состоит из металла, его основного оксида, основания и любой соли этого же металла:
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
2Сa + O 2 = 2СaO; 2Mg + O 2 = 2MgO;
Переход от основных оксидов к основаниям в первых двух рядах осуществляется путём известной вам реакции гидратации, например:
СaO + H 2 O = Сa(OH) 2 .
Что касается последних двух рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а уже их – в основания. Поэтому, например, для осуществления перехода от оксида MgO к гидроксиду Mg(OH) 2 используют последовательные реакции:
MgO + H 2 SO 4 = MgSO 4 + H 2 O; MgSO 4 + 2NaOH = Mg(OH) 2 ↓ + Na 2 SO 4 .
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щёлочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей. Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
Генетические ряды неметаллов и их соединений
.
Каждый такой ряд состоит состоит из неметалла, кислотного оксида, соответствующей кислоты и соли, содержащей анионы этой кислоты:
Для перехода от неметаллов к кислотным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
4P + 5O 2 = 2 P 2 O 5 ; Si + O 2 = SiO 2 ;
Переход от кислотных оксидов к кислотам в первых трёх рядах осуществляется путём известной вам реакции гидратации, например:
P 2 O 5 + 3H 2 O = 2 H 3 PO 4 .
Однако, вы знаете, что содержащийся в последнем ряду оксид SiO 2 с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
SiO 2 + 2KOH = K 2 SiO 3 + H 2 O; K 2 SiO 3 + 2HСl = 2KCl + H 2 SiO 3 ↓.
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или с солями.
Следует запомнить:
· Вещества одного и того же генетического ряда друг с другом не реагируют.
· Вещества генетических рядов разных типов реагируют друг с другом. Продуктами таких реакций всегда являются соли (рис. 5):
Рис. 5. Схема взаимосвязи веществ разных генетических рядов.
Эта схема отображает взаимосвязь между различными классами неорганических соединений и объясняет многообразие химических реакций между ними.
Задание по теме:
Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
1. Na → Na 2 O → NaOH → Na 2 CO 3 → Na 2 SO 4 → NaOH;
Na → Na 2 O → NaOH → Na 2 CO 3 → Na 2 SO 4 → NaOH;
2. P → P 2 O 5 → H 3 PO 4 → K 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4 ;
3. Ca → CaO → Ca(OH) 2 → CaCl 2 → CaCO 3 → CaO;
4. S → SO 2 → H 2 SO 3 → K 2 SO 3 → H 2 SO 3 → BaSO 3 ;
5. Zn → ZnO → ZnCl 2 → Zn(OH) 2 → ZnSO 4 → Zn(OH) 2 ;
6. C → CO 2 → H 2 CO 3 → K 2 CO 3 → H 2 CO 3 → CaCO 3 ;
7. Al → Al 2 (SO 4) 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 ;
8. Fe → FeCl 2 →FeSO 4 → Fe(OH) 2 → FeO → Fe 3 (PO 4) 2 ;
9. Si → SiO 2 → H 2 SiO 3 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 ;
10. Mg → MgCl 2 → Mg(OH) 2 → MgSO 4 → MgCO 3 → MgO;
11. K → KOH → K 2 CO 3 → KCl → K 2 SO 4 → KOH;
12. S → SO 2 → CaSO 3 → H 2 SO 3 → SO 2 → Na 2 SO 3 ;
13. S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3 ;
14. Cl 2 → HCl → AlCl 3 → KCl → HCl → H 2 CO 3 → CaCO 3 ;
15. FeO → Fe(OH) 2 → FeSO 4 → FeCl 2 → Fe(OH) 2 → FeO;
16. CO 2 → K 2 CO 3 → CaCO 3 → CO 2 → BaCO 3 → H 2 CO 3 ;
17. K 2 O → K 2 SO 4 → KOH → KCl → K 2 SO 4 → KNO 3 ;
K 2 O → K 2 SO 4 → KOH → KCl → K 2 SO 4 → KNO 3 ;
18. P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → H 3 PO 4 → H 2 SO 3 ;
19. Al 2 O 3 → AlCl 3 → Al(OH) 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3 ;
20. SO 3 → H 2 SO 4 → FeSO 4 → Na 2 SO 4 → NaCl → HCl;
21. KOH → KCl → K 2 SO 4 → KOH → Zn(OH) 2 → ZnO;
22. Fe(OH) 2 → FeCl 2 → Fe(OH) 2 → FeSO 4 → Fe(NO 3) 2 → Fe;
23. Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgSO 4 → Mg(OH) 2 → MgCl 2 ;
24. Al(OH) 3 → Al 2 O 3 → Al(NO 3) 3 → Al 2 (SO 4) 3 → AlCl 3 → Al(OH) 3 ;
25. H 2 SO 4 → MgSO 4 → Na 2 SO 4 → NaOH → NaNO 3 → HNO 3 ;
26. HNO 3 → Ca(NO 3) 2 → CaCO 3 → CaCl 2 → HCl → AlCl 3 ;
27. CuСO 3 → Cu(NO 3) 2 → Cu(OH) 2 → CuO → CuSO 4 → Cu;
28. MgSO 4 → MgCl 2 → Mg(OH) 2 → MgO → Mg(NO 3) 2 → MgCO 3 ;
29. K 2 S → H 2 S → Na 2 S → H 2 S → SO 2 → K 2 SO 3 ;
30. ZnSO 4 → Zn(OH) 2 → ZnCl 2 → HCl → AlCl 3 → Al(OH) 3 ;
31. Na 2 CO 3 → Na 2 SO 4 → NaOH → Cu(OH) 2 → H 2 O → HNO 3 ;
Готовые работы
ДИПЛОМНЫЕ РАБОТЫ
Многое уже позади и теперь ты — выпускник, если, конечно, вовремя напишешь дипломную работу. Но жизнь — такая штука, что только сейчас тебе становится понятно, что, перестав быть студентом, ты потеряешь все студенческие радости, многие из которых, ты так и не попробовал, всё откладывая и откладывая на потом. И теперь, вместо того, чтобы навёрстывать упущенное, ты корпишь над дипломной работой? Есть отличный выход: скачать нужную тебе дипломную работу с нашего сайта — и у тебя мигом появится масса свободного времени!
Но жизнь — такая штука, что только сейчас тебе становится понятно, что, перестав быть студентом, ты потеряешь все студенческие радости, многие из которых, ты так и не попробовал, всё откладывая и откладывая на потом. И теперь, вместо того, чтобы навёрстывать упущенное, ты корпишь над дипломной работой? Есть отличный выход: скачать нужную тебе дипломную работу с нашего сайта — и у тебя мигом появится масса свободного времени!
Дипломные работы успешно защищены в ведущих Университетах РК.
Стоимость работы от 20 000 тенге
КУРСОВЫЕ РАБОТЫ
Курсовой проект — это первая серьезная практическая работа. Именно с написания курсовой начинается подготовка к разработке дипломных проектов. Если студент научиться правильно излагать содержание темы в курсовом проекте и грамотно его оформлять, то в последующем у него не возникнет проблем ни с написанием отчетов, ни с составлением дипломных работ, ни с выполнением других практических заданий. Чтобы оказать помощь студентам в написании этого типа студенческой работы и разъяснить возникающие по ходу ее составления вопросы, собственно говоря, и был создан данный информационный раздел.
Стоимость работы от 2 500 тенге
МАГИСТЕРСКИЕ ДИССЕРТАЦИИ
В настоящее время в высших учебных заведениях Казахстана и стран СНГ очень распространена ступень высшего профессионального образования, которая следует после бакалавриата — магистратура. В магистратуре обучаются с целью получения диплома магистра, признаваемого в большинстве стран мира больше, чем диплом бакалавра, а также признаётся зарубежными работодателями. Итогом обучения в магистратуре является защита магистерской диссертации.
Мы предоставим Вам актуальный аналитический и текстовый материал, в стоимость включены 2 научные статьи и автореферат.
Стоимость работы от 35 000 тенге
ОТЧЕТЫ ПО ПРАКТИКЕ
После прохождения любого типа студенческой практики (учебной, производственной, преддипломной) требуется составить отчёт. Этот документ будет подтверждением практической работы студента и основой формирования оценки за практику. Обычно, чтобы составить отчёт по практике, требуется собрать и проанализировать информацию о предприятии, рассмотреть структуру и распорядок работы организации, в которой проходится практика, составить календарный план и описать свою практическую деятельность.
Мы поможет написать отчёт о прохождении практики с учетом специфики деятельности конкретного предприятия.
кальция | Определение, свойства и соединения
Возникновение, свойства и использование
Кальций не встречается в природе в свободном состоянии, но соединения этого элемента широко распространены. Одно соединение кальция, известь (оксид кальция, CaO) широко использовалось древними. Сам серебристый, довольно мягкий и легкий металл был впервые выделен (1808 г.) сэром Хамфри Дэви после перегонки ртути из амальгамы, образованной электролизом смеси извести и оксида ртути.Название элемента было взято от латинского слова «известь» — calx .
кальцит
Кальцит — наиболее распространенная форма природного карбоната кальция (CaCO 3 ). Это широко распространенный минерал, известный своим красивым развитием и большим разнообразием кристаллов.
Рекламный RF
Кальций составляет 3,64 процента земной коры и 8 процентов коры Луны, а его космическое содержание оценивается в 4,9 × 10 4 атомов (по шкале, где содержание кремния составляет 10 6 атомов). Как кальцит (карбонат кальция), он встречается на Земле в известняке, меле, мраморе, доломите, яичной скорлупе, жемчуге, кораллах, сталактитах, сталагмитах и панцирях многих морских животных. Отложения карбоната кальция растворяются в воде, содержащей диоксид углерода, с образованием бикарбоната кальция, Ca (HCO 3 ) 2 . Этот процесс часто приводит к образованию пещер и может обратить вспять, отложив известняк в виде сталактитов и сталагмитов. Как гидроксилфосфат кальция, он является основным неорганическим компонентом зубов и костей и встречается в виде минерала апатита.Как фторид кальция, он встречается в виде флюорита или плавикового шпата. И как сульфат кальция, он встречается в виде ангидрита. Кальций содержится во многих других минералах, таких как арагонит (разновидность карбоната кальция) и гипс (другая форма сульфата кальция), а также во многих полевых шпатах и цеолитах. Он также содержится в большом количестве силикатов и алюмосиликатов, в солевых отложениях и в природных водах, включая море.
Как кальцит (карбонат кальция), он встречается на Земле в известняке, меле, мраморе, доломите, яичной скорлупе, жемчуге, кораллах, сталактитах, сталагмитах и панцирях многих морских животных. Отложения карбоната кальция растворяются в воде, содержащей диоксид углерода, с образованием бикарбоната кальция, Ca (HCO 3 ) 2 . Этот процесс часто приводит к образованию пещер и может обратить вспять, отложив известняк в виде сталактитов и сталагмитов. Как гидроксилфосфат кальция, он является основным неорганическим компонентом зубов и костей и встречается в виде минерала апатита.Как фторид кальция, он встречается в виде флюорита или плавикового шпата. И как сульфат кальция, он встречается в виде ангидрита. Кальций содержится во многих других минералах, таких как арагонит (разновидность карбоната кальция) и гипс (другая форма сульфата кальция), а также во многих полевых шпатах и цеолитах. Он также содержится в большом количестве силикатов и алюмосиликатов, в солевых отложениях и в природных водах, включая море.
Чистый металлический кальций, который раньше производился электролизом безводного хлорида кальция, в настоящее время производят путем нагревания извести с алюминием.Металл медленно реагирует с кислородом, водяным паром и азотом воздуха с образованием желтого покрытия из оксида, гидроксида и нитрида. Он горит на воздухе или чистом кислороде с образованием оксида и быстро реагирует с теплой водой (и медленнее с холодной водой) с образованием газообразного водорода и гидроксида кальция. При нагревании кальций реагирует с водородом, галогенами, бором, серой, углеродом и фосфором. Хотя кальций выгодно отличается от натрия в качестве восстановителя, он более дорогой и менее реакционноспособный, чем последний.Однако во многих применениях для раскисления, восстановления и дегазации кальций является предпочтительным из-за его более низкой летучести и используется для получения хрома, тория, урана, циркония и других металлов из их оксидов.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Сам металл используется в качестве легирующего агента для алюминия, меди, свинца, магния и других недрагоценных металлов; как раскислитель некоторых жаропрочных сплавов; и как геттер в электронных лампах.Небольшой процент кальция используется во многих сплавах специального назначения. Легированный свинцом (0,04% кальция), например, он используется в качестве оболочки для телефонных кабелей и в качестве сеток для аккумуляторных батарей стационарного типа. При добавлении к сплавам на основе магния в количестве от 0,4 до 1 процента он улучшает устойчивость разрушаемых ортопедических имплантатов к биологическим жидкостям, позволяя тканям полностью зажить до того, как имплантаты потеряют свою структурную целостность.
Кальций природного происхождения состоит из смеси шести изотопов: кальций-40 (96.94 процента), кальций-44 (2,09 процента), кальций-42 (0,65 процента) и, в меньших количествах, кальций-48, кальций-43 и кальций-46. Кальций-48 подвергается двойному бета-распаду с периодом полураспада примерно 4 × 10 19 лет, поэтому он стабилен для всех практических целей. Он особенно богат нейтронами и используется в синтезе новых тяжелых ядер в ускорителях частиц. Радиоактивный изотоп кальция-41 в следовых количествах появляется на Земле в результате естественной бомбардировки кальция-40 нейтронами в космических лучах.
Он особенно богат нейтронами и используется в синтезе новых тяжелых ядер в ускорителях частиц. Радиоактивный изотоп кальция-41 в следовых количествах появляется на Земле в результате естественной бомбардировки кальция-40 нейтронами в космических лучах.
Кальций необходим как для растений, так и для животных и широко используется в качестве преобразователя сигналов, кофактора ферментов и структурных элементов (например, клеточных мембран, костей и зубов). Большое количество живых организмов концентрирует кальций в своих панцирях или скелетах, а у высших животных кальций является наиболее распространенным неорганическим элементом. Многие важные карбонатные и фосфатные отложения обязаны своим происхождением живым организмам.
Человеческое тело на 2 процента состоит из кальция. Основными источниками кальция в рационе человека являются молоко, молочные продукты, рыба и зеленые листовые овощи.Болезнь костей рахит возникает, когда недостаток витамина D ухудшает всасывание кальция из желудочно-кишечного тракта во внеклеточные жидкости. Заболевание особенно поражает младенцев и детей.
Заболевание особенно поражает младенцев и детей.
Эпигенетика и минералы: обзор
- Инга Весселс
Живая справочная работа
Первый онлайн:
Аннотация
Эпигенетика играет решающую роль в регулировании генов и уязвима для экологических проблем, в том числе поставок с факторами питания, такими как минералы.Наблюдение, что функция эпигенетически активных ферментов требует кофакторов, таких как минералы, подтверждает эту гипотезу. Имеются данные, которые показывают прямое и косвенное влияние основных минералов на статус метилирования ДНК, на эпигенетические модификации гистонов и на регуляцию РНК-интерференции. Как и в случае большинства эпигенетически активных факторов, минеральный баланс в основном влияет на генерацию эпигенома во время эмбрионального развития, но изменения могут быть вызваны на протяжении всей жизни как часть пожизненного редактирования эпигенома. Действительно, было высказано предположение, что изменения, вызванные минералами, накапливаются при старении и могут передаваться следующему поколению. В совокупности это предполагает использование минеральных добавок для предотвращения дисплазии, возникающей из-за ошибок в установлении эпигенома или исправления эпигенетических нарушений. Несмотря на огромные успехи, достигнутые в последние годы, литературы о влиянии минералов на эпигеном все еще недостаточно по сравнению с нашими общими знаниями в области пищевой эпигенетики. В этой главе представлен обзор эпигенетической активности кальция, хрома, марганца, магния, железа, селена и цинка и кратко упомянуты данные для молибдена и минеральных смесей.Также будет рассмотрена связь между нарушенным минеральным балансом, эпигенетикой и некоторыми типами заболеваний.
Действительно, было высказано предположение, что изменения, вызванные минералами, накапливаются при старении и могут передаваться следующему поколению. В совокупности это предполагает использование минеральных добавок для предотвращения дисплазии, возникающей из-за ошибок в установлении эпигенома или исправления эпигенетических нарушений. Несмотря на огромные успехи, достигнутые в последние годы, литературы о влиянии минералов на эпигеном все еще недостаточно по сравнению с нашими общими знаниями в области пищевой эпигенетики. В этой главе представлен обзор эпигенетической активности кальция, хрома, марганца, магния, железа, селена и цинка и кратко упомянуты данные для молибдена и минеральных смесей.Также будет рассмотрена связь между нарушенным минеральным балансом, эпигенетикой и некоторыми типами заболеваний.
Ключевые слова
Кальций Хром Марганец Магний Железо Селен Цинк Минеральный баланс Эпигенетика питания Interactome
Список сокращений
- BDNF
Нейротрофический фактор головного мозга
- Гистон
Минеральный анализ тканей волос
- ICP-AES
- Гистон
Атомно-эмиссионная спектроскопия с индуктивно связанной плазмой
Это предварительный просмотр содержания подписки,
войдите в систему
, чтобы проверить доступ.
Ссылки
Akey DL, Li S, Konwerski JR et al (2011) Новая структурная форма в семействе SAM / металл-зависимых ометилтрансфераз: MycE из пути биосинтеза мицинамицина. J Mol Biol 413: 438–450
CrossRefPubMedPubMedCentralGoogle Scholar
Алегрия-Торрес Дж. А., Баккарелли А., Боллати В. (2011) Эпигенетика и образ жизни. Epigenomics 3: 267–277
CrossRefPubMedPubMedCentralGoogle Scholar
Али А.Х., Кондо К., Намура Т. и др. (2011) Аберрантное метилирование ДНК некоторых генов-супрессоров опухолей при раке легких у рабочих, подвергшихся воздействию хроматов.Mol Carcinog 50: 89–99
CrossRefPubMedGoogle Scholar
Aschner JL, Aschner M (2005) Пищевые аспекты гомеостаза марганца. Mol Asp Med 26: 353–362
CrossRefGoogle Scholar
Black RE (2001) Микронутриенты во время беременности. Br J Nutr 85 (Suppl 2): S193 – S197
CrossRefPubMedGoogle Scholar
Brown AS, Susser ES (2008) Дефицит питательных веществ в пренатальном периоде и риск шизофрении у взрослых.
 Schizophr Bull 34: 1054–1063
Schizophr Bull 34: 1054–1063CrossRefPubMedPubMedCentralGoogle Scholar
Brunner C, Wuillemin WA (2010) Железодефицитная анемия и железодефицитная анемия — симптомы и терапия.Ther Umsch 67
Google Scholar
Brunst KJ, Leung YK, Ryan PH et al (2013) Гиперметилирование Forkhead box protein 3 (FOXP3) связано с воздействием выхлопных газов дизельного топлива и риском развития астмы у детей. J Allergy Clin Immunol 131: 592–594
CrossRefPubMedGoogle Scholar
Camaschella C (2013) Железо и гепсидин: история переработки и баланса. Hematol Am Soc Hematol Educ Program 2013: 1–8
Google Scholar
Chen J, Du C, Kang J et al (2008) Cu2 + необходим пирролидин дитиокарбамату для ингибирования ацетилирования гистонов и индукции апоптоза лейкозных клеток человека.Chem Biol Interact 171: 26–36
CrossRefPubMedGoogle Scholar
Chen WY, Mao FC, Liu CH et al (2016) Добавки хрома улучшили постинсультный инфаркт мозга и гипергликемию.
 Metab Brain Dis 31: 289–297
Metab Brain Dis 31: 289–297CrossRefPubMedGoogle Scholar
Червона Ю., Арита А., Коста М. (2012) Канцерогенные металлы и эпигеном: понимание влияния никеля, мышьяка и хрома. Metallomics 4: 619–627
CrossRefPubMedPubMedCentralGoogle Scholar
Кристенсен BC, Marsit CJ (2011) Эпигеномика здоровья окружающей среды.Front Genet 2:84
CrossRefPubMedPubMedCentralGoogle Scholar
Ergaz Z, Guillemin C, Neeman-Azulay M et al (2014) Плацентарный оксидативный стресс и снижение глобального метилирования ДНК у крыс с диабетом Коэна корректируются медью. Toxicol Appl Pharmacol 276: 220–230
CrossRefPubMedGoogle Scholar
Годфри К.М., Баркер Д.Д. (2001) Программирование плода и здоровье взрослых. Public Health Nutr 4: 611–624
CrossRefPubMedGoogle Scholar
Графф Дж., Цай Л.Х. (2013) Ацетилирование гистонов: молекулярная мнемоника хроматина.Nat Rev Neurosci 14: 97–111
CrossRefPubMedGoogle Scholar
He J, Qian X, Carpenter R et al (2013) Репрессия miR-143 опосредует индуцированный Cr (VI) ангиогенез опухоли через IGF-IR / IRS1 / ERK / Путь IL-8.
 Toxicol Sci 134: 26–38
Toxicol Sci 134: 26–38CrossRefPubMedPubMedCentralGoogle Scholar
Ho SM, Johnson A, Tarapore P et al (2012) Эпигенетика окружающей среды и ее влияние на риск заболеваний и результаты для здоровья. ILAR J 53: 289–305
CrossRefPubMedPubMedCentralGoogle Scholar
Jiang X, Tian F, Du Y et al (2008) BHLHB2 контролирует активность промотора 4 Bdnf и возбудимость нейронов.J Neurosci 28: 1118–1130
CrossRefPubMedGoogle Scholar
Kahmann L, Uciechowski P, Warmuth S. et al (2008) Добавление цинка пожилым людям снижает спонтанный выброс воспалительных цитокинов и восстанавливает функции Т-клеток. Rejuvenation Res 11: 227–237
CrossRefPubMedGoogle Scholar
Kambe T, Weaver BP, Andrews GK (2008) Генетика гомеостаза основных металлов во время развития. Genesis 46: 214–228
CrossRefPubMedPubMedCentralGoogle Scholar
Kang J, Lin C, Chen J et al (2004) Медь индуцирует гипоацетилирование гистонов посредством прямого ингибирования активности гистонацетилтрансферазы.
 Chem Biol Interact 148: 115–123
Chem Biol Interact 148: 115–123CrossRefPubMedGoogle Scholar
Kanherkar RR, Bhatia-Dey N, Csoka AB (2014) Эпигенетика на протяжении всей жизни человека. Front Cell Dev Biol 2:49
PubMedPubMedCentralGoogle Scholar
Karavelas T, Mylonas M, Malandrinos G et al (2005) Координационные свойства ионов Cu (II) и Ni (II) по отношению к C-концевому фрагменту пептида -EL. J Inorg Biochem 99: 606–615
CrossRefPubMedGoogle Scholar
Keen CL, Hanna LA, Lanoue L. et al (2003) Последствия дефицита микроэлементов у грызунов для развития: острые и долгосрочные эффекты.J Nutr 133: 1477S – 1480S
PubMedGoogle Scholar
Kessels JE, Wessels I, Haase H et al (2016) Влияние метилирования ДНК на гомеостаз цинка в миелоидных клетках: регуляция транспортеров цинка и цинк-связывающих белков. J Trace Elem Med Biol 37: 125–133
CrossRefPubMedGoogle Scholar
Kim AM, Vogt S, O’Halloran TV et al (2010) Доступность цинка регулирует выход из мейоза в созревающих ооцитах млекопитающих.
 Nat Chem Biol 6: 674–681
Nat Chem Biol 6: 674–681CrossRefPubMedPubMedCentralGoogle Scholar
Клауберт В., Ринк Л. (2015) Цинк как питательный микроэлемент и его профилактическая роль в отношении окислительного повреждения клеток.Food Funct 6: 3195–3204
CrossRefPubMedGoogle Scholar
Комия Ю., Су LT, Чен Х.С. и др. (2014) Магний и эмбриональное развитие. Magnes Res 27: 1–8
PubMedPubMedCentralGoogle Scholar
Kong BY, Bernhardt ML, Kim AM et al (2012). Цинк поддерживает арест профазы I в ооцитах мышей посредством регуляции пути MOS-MAPK. Biol Reprod 87: 11,1–11,12
CrossRefGoogle Scholar
Lou J, Wang Y, Yao C et al (2013) Роль метилирования ДНК в остановке клеточного цикла, индуцированной Cr (VI) в двух клеточных линиях.PLoS One 8: e71031
CrossRefPubMedPubMedCentralGoogle Scholar
Lyko F, Foret S, Kucharski R et al (2010) Эпигеномы медоносных пчел: дифференциальное метилирование ДНК мозга у маток и рабочих. PLoS Biol 8: e1000506
CrossRefPubMedPubMedCentralGoogle Scholar
MacGregor JT (1990) Факторы питания, влияющие на спонтанное повреждение хромосом у человека.
 Prog Clin Biol Res 347: 139–153
Prog Clin Biol Res 347: 139–153PubMedGoogle Scholar
Martinez-Zamudio R, Ha HC (2011) Экологическая эпигенетика при воздействии металлов.Эпигенетика 6: 820–827
CrossRefPubMedPubMedCentralGoogle Scholar
Maywald M, Rink L (2015) Гомеостаз цинка и иммуносенесценция. J Trace Elem Med Biol 29: 24–30
CrossRefPubMedGoogle Scholar
Metes-Kosik N, Luptak I, Dibello PM et al (2012) Как дефицит селена, так и умеренные добавки селена приводят к фиброзу миокарда у мышей за счет воздействия на окислительно-восстановительное метилирование остаток средств. Mol Nutr Food Res 56: 1812–1824
CrossRefPubMedPubMedCentralGoogle Scholar
Нараян В., Равиндра К.С., Ляо С. и др. (2015) Эпигенетическая регуляция экспрессии воспалительных генов в макрофагах с помощью селена.J Nutr Biochem 26: 138–145
CrossRefPubMedGoogle Scholar
Navarro-Alarcon M, Cabrera-Vique C (2008) Селен в пище и организме человека: обзор. Sci Total Environ 400: 115–141
CrossRefPubMedGoogle Scholar
Nepravishta R, Bellomaria A, Polizio F et al (2010) Пептид Reticulon RTN1-C (CT): потенциальная нуклеаза и ингибитор ферментов гистондеацетилазы.
 Biochemistry 49: 252–258
Biochemistry 49: 252–258CrossRefPubMedGoogle Scholar
Ollig J, Kloubert V, Wessels I et al (2016) Параметры, влияющие на цинк в экспериментальных системах in vivo и in vitro.Metals 6
Google Scholar
Pilsner JR, Hall MN, Liu X et al (2011) Связь селена плазмы с мышьяком и геномное метилирование ДНК лейкоцитов в Бангладеш. Environ Health Perspect 119: 113–118
CrossRefPubMedGoogle Scholar
Raynal NJ, Lee JT, Wang Y et al (2016) Нацеливание на передачу сигналов кальция вызывает эпигенетическую реактивацию генов-супрессоров опухолей при раке. Cancer Res 76: 1494–1505
CrossRefPubMedGoogle Scholar
Rosenkranz E, Metz CH, Maywald M. et al (2016) Добавление цинка индуцирует регуляторные Т-клетки путем ингибирования деацетилазы Sirt-1 в смешанных культурах лимфоцитов.Mol Nutr Food Res 60: 661–671
CrossRefPubMedGoogle Scholar
Sharma A, Nguyen H, Geng C et al (2014) Опосредованные кальцием модификации гистонов регулируют альтернативный сплайсинг в кардиомиоцитах.
 Proc Natl Acad Sci U S A 111: E4920 – E4928
Proc Natl Acad Sci U S A 111: E4920 – E4928CrossRefPubMedPubMedCentralGoogle Scholar
Sun Y, Liu C, Liu Y et al (2014) Изменения экспрессии эпигенетических факторов во время индуцированного медью апоптоза в клетках PC12. J Environ Sci Health A Tox Hazard Subst Environ Eng 49: 1023–1028
CrossRefPubMedGoogle Scholar
Sun H, Zhou X, Chen H et al (2009) Модуляция метилирования гистонов и подавление гена MLh2 шестивалентным хромом.Toxicol Appl Pharmacol 237: 258–266
CrossRefPubMedPubMedCentralGoogle Scholar
Sunda WG (2012) Взаимодействие обратной связи между микроэлементами и фитопланктоном в океане. Front Microbiol 3: 204
CrossRefPubMedPubMedCentralGoogle Scholar
Takaya J, Iharada A, Okihana H et al (2013). Бедная кальциевая диета у беременных кормящих крыс индуцирует гипометилирование специфических цитозинов в промоторной дегидрогеназе 11beta-hydroxysteroid-1. печень.Nutr Res 33: 961–970
CrossRefPubMedGoogle Scholar
Тарале П.
 , Чакрабарти Т., Сиванесан С. и др. (2016) Потенциальная роль эпигенетического механизма в нейротоксичности, индуцированной марганцем. Biomed Res Int 2016: 2548792
, Чакрабарти Т., Сиванесан С. и др. (2016) Потенциальная роль эпигенетического механизма в нейротоксичности, индуцированной марганцем. Biomed Res Int 2016: 2548792CrossRefPubMedPubMedCentralGoogle Scholar
Tian X, Diaz FJ (2013) Острый дефицит цинка в пище до зачатия ставит под угрозу эпигенетическое программирование ооцитов и нарушает эмбриональное развитие. Dev Biol 376: 51–61
CrossRefPubMedPubMedCentralGoogle Scholar
Uthus EO, Ross S (2009) Диетический селен (Se) и медь (Cu) взаимодействуют, влияя на метаболизм гомоцистеина у крыс.Biol Trace Elem Res 129: 213–220
CrossRefPubMedGoogle Scholar
Uusi-Rasi K, Karkkainen MU, Lamberg-Allardt CJ (2013) Потребление кальция для поддержания здоровья — систематический обзор. Food Nutr Res 57
Google Scholar
Wallwork JC, Duerre JA (1985) Влияние дефицита цинка на метаболизм метионина, реакции метилирования и синтез белка в изолированной перфузированной печени крысы. J Nutr 115: 252–262
PubMedGoogle Scholar
Ван Л.
 , Шираки А., Итахаши М. и др. (2013) Аберрация в регуляции эпигенетических генов в нейрогенезе гиппокампа из-за воздействия хлорида марганца у мышей в процессе развития.Toxicol Sci 136: 154–165
, Шираки А., Итахаши М. и др. (2013) Аберрация в регуляции эпигенетических генов в нейрогенезе гиппокампа из-за воздействия хлорида марганца у мышей в процессе развития.Toxicol Sci 136: 154–165CrossRefPubMedGoogle Scholar
Ван Дж, Ву З, Ли Д. и др. (2012) Питание, эпигенетика и метаболический синдром. Antioxid Redox Signal 17: 282–301
CrossRefPubMedPubMedCentralGoogle Scholar
Вт DL (2015) Питание, эпигенетика и анализ минералов волосяной ткани (HTMA). Trace Elements Newsl 26: 1–3
Google Scholar
Wessels I (2014) Эпигенетика и дефицит металлов. Curr Nutr Rep 3
Google Scholar
Wessels I.(2015) Гомеостаз металла во время развития, созревания и старения, SFR 16: ISBN 978-0-262-02919-3
Google Scholar
Wessels I, Haase H, Engelhardt G et al (2013) Дефицит цинка вызывает производство провоспалительные цитокины IL-1beta и TNFalpha в промиелоидных клетках через эпигенетические и окислительно-восстановительные механизмы.
 J Nutr Biochem 24: 289–297
J Nutr Biochem 24: 289–297CrossRefPubMedGoogle Scholar
Wild CP (2005) Дополнение генома «экспозомом»: выдающаяся проблема измерения воздействия окружающей среды в молекулярной эпидемиологии.Cancer Epidemiol Biomark Prev 14: 1847–1850
CrossRefGoogle Scholar
Wong CP, Rinaldi NA, Ho E (2015) Дефицит цинка усиливает воспалительный ответ за счет увеличения активации иммунных клеток и индукции деметилирования промотора IL6. Mol Nutr Food Res 59: 991–999
CrossRefPubMedPubMedCentralGoogle Scholar
Wood RJ (2009) Марганец и исход родов. Nutr Rev 67: 416–420
CrossRefPubMedGoogle Scholar
Wright RO, Baccarelli A (2007) Металлы и нейротоксикология.J Nutr 137: 2809–2813
PubMedGoogle Scholar
Xia B, Yang LQ, Huang HY et al (2011) Хром (VI) вызывает подавление биотинидазы в эпителиальных клетках бронхов человека путем модификации ацетилирования гистонов. Toxicol Lett 205: 140–145
CrossRefPubMedGoogle Scholar
Zhang FF, Cardarelli R, Carroll J et al (2011) Физическая активность и глобальное метилирование геномной ДНК в популяции, свободной от рака.
 Эпигенетика 6: 293–299
Эпигенетика 6: 293–299CrossRefPubMedPubMedCentralGoogle Scholar
Житкович А (2011) Хром в питьевой воде: источники, метаболизм и риск рака.Chem Res Toxicol 24: 1617–1629
CrossRefPubMedPubMedCentralGoogle Scholar
Авторы и аффилированные лица
- 1. Институт иммунологии RWTH Больница при Ахенском университете, Аахен, Германия
0 Рождений 9000 9000 Тяжелые металлы. выкидышей и мертворождений из-за отравления тяжелыми металлами в развивающихся странах продолжает расти. В таких странах, как Нигерия, угроза выкидыша не всегда связана с воздействием тяжелых металлов.Это могло быть результатом недостатка доступных научных данных из-за плохой документации и недостаточного санитарного просвещения населения о последствиях этих тяжелых металлов для здоровья матери. Тяжелые металлы, ртуть, свинец и кадмий являются токсичными веществами, которые, как было показано, проникают через плацентарный барьер и накапливаются в тканях плода.
 Методы: Для этого обзора в соответствующих базах данных был проведен поиск оригинальных научных отчетов, и в общей сложности 100 статей были оставлены для анализа. Из этих исследований были извлечены необходимые данные и оценена их методология. Результаты: Выкидыши и мертворождения наблюдались в результате воздействия пяти тяжелых металлов, а именно; ртуть, мышьяк, свинец, хром и кадмий. Эти тяжелые металлы были связаны с увеличением числа выкидышей в развивающихся странах. В Нигерии у женщин, у которых в анамнезе был выкидыш, уровень свинца в крови во время беременности был> 25 мкг / дл, что примерно на 41,61% увеличило частоту выкидышей. Было обнаружено, что уровень кадмия в крови составил 85,96 ± 1,09 мкг / дл с увеличением на 9,50% частоты выкидышей у женщин, подвергшихся воздействию ртути, по сравнению с группой, не подвергавшейся воздействию ртути.Что касается хрома, сообщалось об увеличении на 1,60% частоты выкидышей у женщин, подвергшихся воздействию хрома.
Методы: Для этого обзора в соответствующих базах данных был проведен поиск оригинальных научных отчетов, и в общей сложности 100 статей были оставлены для анализа. Из этих исследований были извлечены необходимые данные и оценена их методология. Результаты: Выкидыши и мертворождения наблюдались в результате воздействия пяти тяжелых металлов, а именно; ртуть, мышьяк, свинец, хром и кадмий. Эти тяжелые металлы были связаны с увеличением числа выкидышей в развивающихся странах. В Нигерии у женщин, у которых в анамнезе был выкидыш, уровень свинца в крови во время беременности был> 25 мкг / дл, что примерно на 41,61% увеличило частоту выкидышей. Было обнаружено, что уровень кадмия в крови составил 85,96 ± 1,09 мкг / дл с увеличением на 9,50% частоты выкидышей у женщин, подвергшихся воздействию ртути, по сравнению с группой, не подвергавшейся воздействию ртути.Что касается хрома, сообщалось об увеличении на 1,60% частоты выкидышей у женщин, подвергшихся воздействию хрома.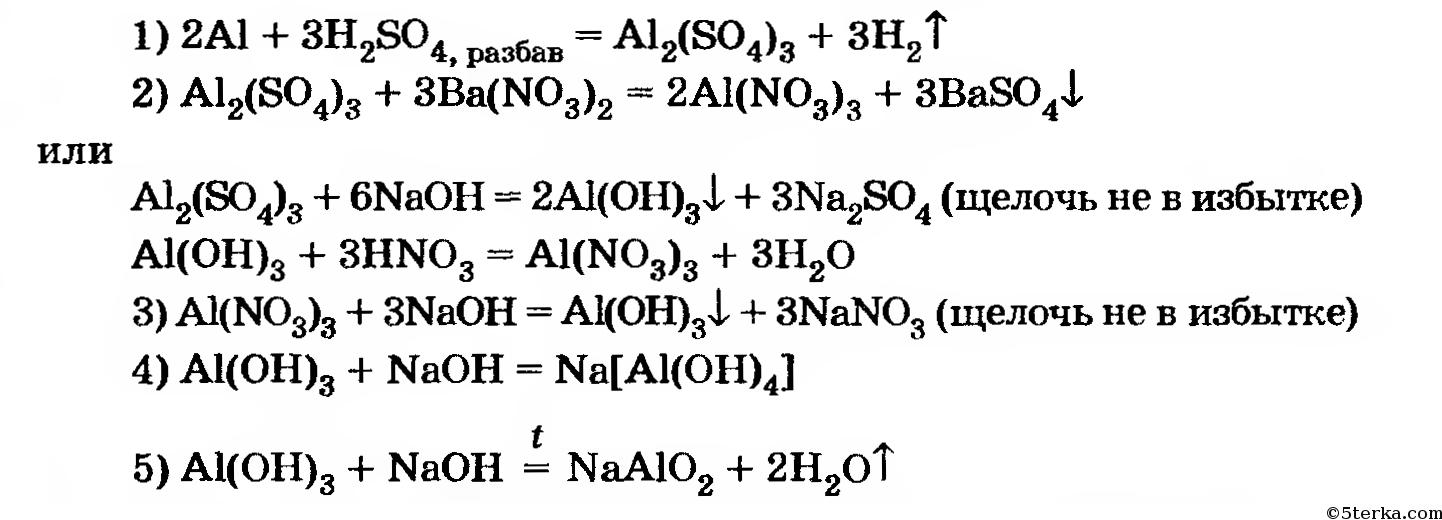 Сообщалось о росте заболеваемости кадмием и мышьяком на 83,93% и 5,88% соответственно. Аналогичные данные были получены для Ямайки (ртуть = 7,29 ± 9,10 мкг / л), Египта (кадмий = 1,17%; свинец = 32,33%). Заключение: Практикующим врачам и токсикологам, занимающимся вопросами здоровья женщин в странах Африки к югу от Сахары, следует подумать о том, могут ли эти тяжелые металлы стать дополнительными биомаркерами при диагностике выкидышей и мертворождений.
Сообщалось о росте заболеваемости кадмием и мышьяком на 83,93% и 5,88% соответственно. Аналогичные данные были получены для Ямайки (ртуть = 7,29 ± 9,10 мкг / л), Египта (кадмий = 1,17%; свинец = 32,33%). Заключение: Практикующим врачам и токсикологам, занимающимся вопросами здоровья женщин в странах Африки к югу от Сахары, следует подумать о том, могут ли эти тяжелые металлы стать дополнительными биомаркерами при диагностике выкидышей и мертворождений.
Ключевые слова
Потенциально токсичные металлы
Здоровье женщин
Самопроизвольные аборты
Общественное здравоохранение
Африка к югу от Сахары
Рекомендуемые статьиЦитирующие статьи (0)
© 2017 Middle East Fertility Society. Производство и хостинг Elsevier B.V.
Рекомендуемые статьи
Цитирующие статьи
CPPD Deposition Disease | UW Orthopaedics and Sports Medicine, Сиэтл
Следите за нашим блогом
http: // плечевой артрит. blogspot.com/
blogspot.com/
Основы болезни отложения cppd
Заболевание, связанное с отложением кристаллов
CPPD (дигидрат пирофосфата кальция), вызывает боль, отек и иногда покраснение и / или жар в одном или нескольких суставах. Это определяется наличием отличительного типа кристаллов: дигидрата пирофосфата кальция (CPPD).
Иногда кристаллы CPPD могут вызывать симптомы, напоминающие ревматоидный артрит и / или остеоартрит. Однако, в отличие от этих других заболеваний, симптомы болезни отложения кристаллов CPPD вызываются крошечными кристаллами CPPD.
Некоторые люди используют другие термины для описания этого состояния. В прошлом многие врачи называли болезнь отложения кристаллов CPPD псевдоподагрой, потому что кристаллы как при подагре, так и при болезни отложения кристаллов CPPD могут вызывать аналогичные симптомы.
Прогноз
Болезнь отложения кристаллов CPPD — это хроническое (длительное) заболевание с повторяющимися обострениями. Это означает, что это может происходить периодически на протяжении всей вашей жизни. У некоторых людей бывает всего один или самое большее несколько приступов за всю жизнь.Хотя лекарства от него пока нет, в большинстве случаев его можно довольно хорошо контролировать с помощью надлежащего лечения.
У некоторых людей бывает всего один или самое большее несколько приступов за всю жизнь.Хотя лекарства от него пока нет, в большинстве случаев его можно довольно хорошо контролировать с помощью надлежащего лечения.
Болезнь отложения кристаллов
CPPD не должна мешать вам продолжать большинство аспектов вашего обычного образа жизни. Поскольку от этого нет лекарства, вам может потребоваться продолжить курс лечения даже в те дни, когда вы чувствуете себя лучше. Если не произошло серьезного повреждения суставов, вы, вероятно, сможете заниматься своими обычными делами с небольшими ограничениями во время обострений.
Заболеваемость
Заболевание отложения кристаллов дигидрата пирофосфата кальция (CPPD) обычно возникает у людей старше 60 лет. Очевидно, некоторые изменения в суставном хряще пожилых людей позволяют или способствуют образованию отложений кристаллов. Он одинаково влияет на мужчин и женщин.
Болезнь отложения кристаллов CPPD может возникнуть у молодых людей, если:
- была травма или операция на суставе или
- есть семейный анамнез заболевания или
- человек болел другими заболеваниями, повышающими предрасположенность к болезни отложения кристаллов CPPD
Причины
Симптомы болезни отложения кристаллов CPPD вызываются двумя процессами:
- наличие крошечных кристаллов CPPD в стыках и
- реакция организма на эти кристаллы.
В здоровом суставе твердый эластичный материал, называемый хрящом, покрывает конец каждой кости. Хрящ действует как амортизатор между костями. Ткань сустава заключена в капсулу. Капсула выстлана тонким материалом, называемым синовиальной оболочкой. Мембрана выпускает скользкую или липкую жидкость, называемую синовиальной жидкостью, в замкнутое пространство сустава. Эта жидкость помогает тканям сустава плавно и легко двигаться (см. Рис. 1).
Кристаллы CPPD, хотя сначала обнаруживаются в суставном хряще, позже могут образовываться в синовиальной оболочке и синовиальной жидкости (см. Рисунок 2).Вероятно, это результат их выхода из хряща. Когда кристаллы присутствуют только в хрящах, они могут не вызывать никаких симптомов. Тело с большей вероятностью отреагирует на кристаллы, выделяемые в суставную жидкость.
Ученые не знают, почему в организме образуются кристаллы CPPD. В некоторых случаях эти кристаллы возникают из-за аномалии хрящевых клеток. В других случаях сначала возникает другое заболевание, такое как остеоартрит, которое приводит к изменению хрящевых клеток или соединительной ткани.
Другие состояния иногда возникают у людей с болезнью отложения кристаллов CPPD и могут вызывать или усугублять симптомы. Если у вас болезнь отложения кристаллов CPPD, вам также следует проверить:
- Гемохроматоз : наследственное заболевание, при котором в организме слишком много железа. Это может привести к диабету или проблемам с печенью и сердцем. Эти проблемы можно предотвратить, если вовремя распознать гемохроматоз.
- Гиперпаратиреоз : Состояние, вызванное сверхактивной или гиперактивной паращитовидной железой, при котором в крови слишком много кальция; это может привести к болезни отложения кристаллов CPPD, а также к проблемам с костями и почками.
- Гипотиреоз : заболевание, вызванное недостаточной активностью щитовидной железы с низким уровнем гормона щитовидной железы; это может привести к сильной усталости, увеличению веса, сухости кожи и чувствительности к холоду.
- Гипомагниемия : Состояние низкого уровня магния в крови.
 Поскольку магний необходим организму для использования пирофосфата, низкие уровни могут привести к болезни отложения кристаллов CPPD.
Поскольку магний необходим организму для использования пирофосфата, низкие уровни могут привести к болезни отложения кристаллов CPPD.
Ваш врач может проверить эти и другие менее известные заболевания.Необходимо учитывать возможность их возникновения, поскольку многие из них легко поддаются лечению. Заболевание отложения кристаллов CPPD иногда может быть важным ключом к обнаружению других излечимых и предотвратимых состояний.
Есть еще одна возможная причина болезни отложения кристаллов CPPD — наследственность / генетическая структура. В некоторых случаях болезнь отложения кристаллов CPPD может передаваться в семьях и может быть более распространенной в некоторых этнических группах. Хотя болезнь отложения кристаллов CPPD вызывается кристаллами, содержащими кальций, она не вызвана употреблением молока или кальцием в вашем рационе.Это не заразно, поэтому вы не можете передать его другим или заразиться от кого-то еще. В некоторых случаях. операция, заболевание или травма сустава могут вызвать приступы боли и отека при заболевании.
Нажмите для увеличения
Рисунок 1 — Здоровый сустав
Увеличить
Рисунок 2 — Увеличенный вид мест отложения
кристаллов CPPD в коленном суставе
Симптомы
Какой бы ни была первоначальная причина, кристаллы CPPD могут вызывать множество различных проблем.
Наиболее драматические симптомы возникают, когда несколько кристаллов вырываются из своего местоположения в хрящевом мениске или синовиальной оболочке и перемещаются в суставную щель. Это движение кристаллов в сустав может вызвать внезапную и сильную боль в суставе, а также покраснение, тепло и отек (воспаление). Воспаление — это один из способов реакции организма на кристаллы CPPD. Он видит в них «захватчиков» и посылает борющиеся с болезнями белые кровяные тельца, чтобы атаковать их.
Эта боль в суставах может длиться несколько дней или недель.Он напоминает приступ подагры (отсюда и старый термин «псевдоподагра»). Это может произойти в любом суставе, но обычно возникает в колене или запястье. Эту форму болезни может сопровождать субфебрильная температура. У многих людей симптомы проходят даже без лечения, а через некоторое время рецидивируют.
Эту форму болезни может сопровождать субфебрильная температура. У многих людей симптомы проходят даже без лечения, а через некоторое время рецидивируют.
Однако чаще кристаллы CPPD создают менее серьезные, но более длительные проблемы. К ним относятся скованность, отек, жар и боль, от которых страдают многие суставы. Это часто случается в коленях, но может также происходить в запястьях, суставах, бедрах, плечах, локтях, лодыжках или пальцах ног.Боль не внезапная; вместо этого он развивается в течение длительного периода времени и может длиться многие недели или месяцы. Боль может усиливаться, чем больше вы двигаете суставами.
Со временем любая форма заболевания может повредить хрящ и / или мениск колена. Когда это происходит, кости трутся друг о друга и вызывают ощущение царапины и боль при использовании сустава.
У вас может быть только один из этих шаблонов или оба. В любом случае у вас могут быть периоды, когда ваши симптомы хуже, чем в другое время.У вас также могут быть периоды без каких-либо симптомов.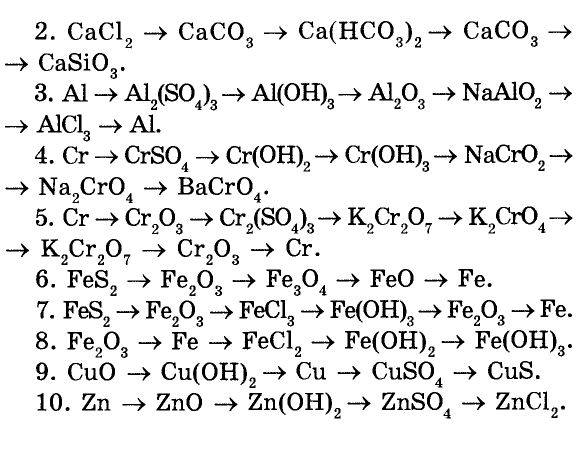
Поскольку болезнь отложения кристаллов CPPD часто развивается через много времени, у некоторых людей симптомы отсутствуют, даже если повреждение суставов уже медленно проявляется. Признаки кристаллов CPPD часто можно увидеть на рентгеновских снимках до появления симптомов.
Заболевания с похожими симптомами
Симптомы болезни отложения кристаллов CPPD аналогичны симптомам других болезней, таких как:
- Подагра вызывает внезапные приступы боли в суставах из-за другого типа кристаллов.Чаще всего это происходит у основания большого пальца ноги, но может произойти где угодно.
- Ревматоидный артрит вызывает хронический отек, жар, утреннюю скованность и боль в суставах, а также может поражать другие ткани. В большинстве случаев задействованы руки и пальцы.
- Остеоартрит вызывает боль в суставах и отек из-за повреждения хряща в суставе.
Лечение
Если у вас есть болезнь отложения CPPD, ваша программа лечения будет зависеть от того, насколько серьезно ваше заболевание, какой у вас тип симптомов и есть ли у вас другое заболевание или форма артрита наряду с болезнью отложения кристаллов CPPD.
Цели лечения — облегчить боль, поддержать полную подвижность суставов и мышечную силу, а также держать воспаление под контролем.
Программа лечения может включать сочетание аспирации суставов, периодических инъекций кортикостероидов в пораженные суставы, приема лекарств, отдыха, физических упражнений и защиты суставов. Некоторым людям с болезнью отложений CPPD может потребоваться операция.
Физические упражнения и терапия
Упражнения помогают укрепить мышцы вокруг суставов, помогают поддерживать полную подвижность и использование суставов, а также поддерживать ваше тело в хорошей физической форме.
Упражнения на диапазон движений особенно полезны в периоды активной болезни отложения кристаллов CPPD. Это легкие упражнения, выполняемые без отягощения и предназначенные для сохранения подвижности сустава. Больной сустав следует осторожно перемещать по всему доступному диапазону движений каждый день, уделяя особое внимание концу движения, когда подвижность часто сначала теряется. Применение тепла или холода до или после тренировки может повысить ваш комфорт и повысить эффективность этих упражнений.Ежедневно выполняйте упражнения на диапазон движений, чтобы поддерживать или восстанавливать движения после консультации с врачом.
Применение тепла или холода до или после тренировки может повысить ваш комфорт и повысить эффективность этих упражнений.Ежедневно выполняйте упражнения на диапазон движений, чтобы поддерживать или восстанавливать движения после консультации с врачом.
В периоды, когда болезнь отложения кристаллов CPPD не активна, можно выполнять укрепляющие упражнения, чтобы обеспечить максимальную функцию и стабильность ваших суставов. Этим упражнениям должен обучать физиотерапевт или терапевт или врач, предпочтительно тот, кто знаком с болезнью отложения кристаллов CPPD.
Ходьба, езда на велосипеде и водные упражнения часто рекомендуются людям с болезнью отложения кристаллов CPPD.
Во время водных упражнений плавучесть воды обычно защищает суставы от быстрых или напряженных движений. Ваш врач или физиотерапевт может помочь вам спланировать программу упражнений и объяснить конкретные виды упражнений, которые следует выполнять во время обострения и ремиссии болезни.
Во время внезапного приступа воспаления из-за болезни отложения кристаллов CPPD вам может потребоваться отдых для больного сустава (суставов).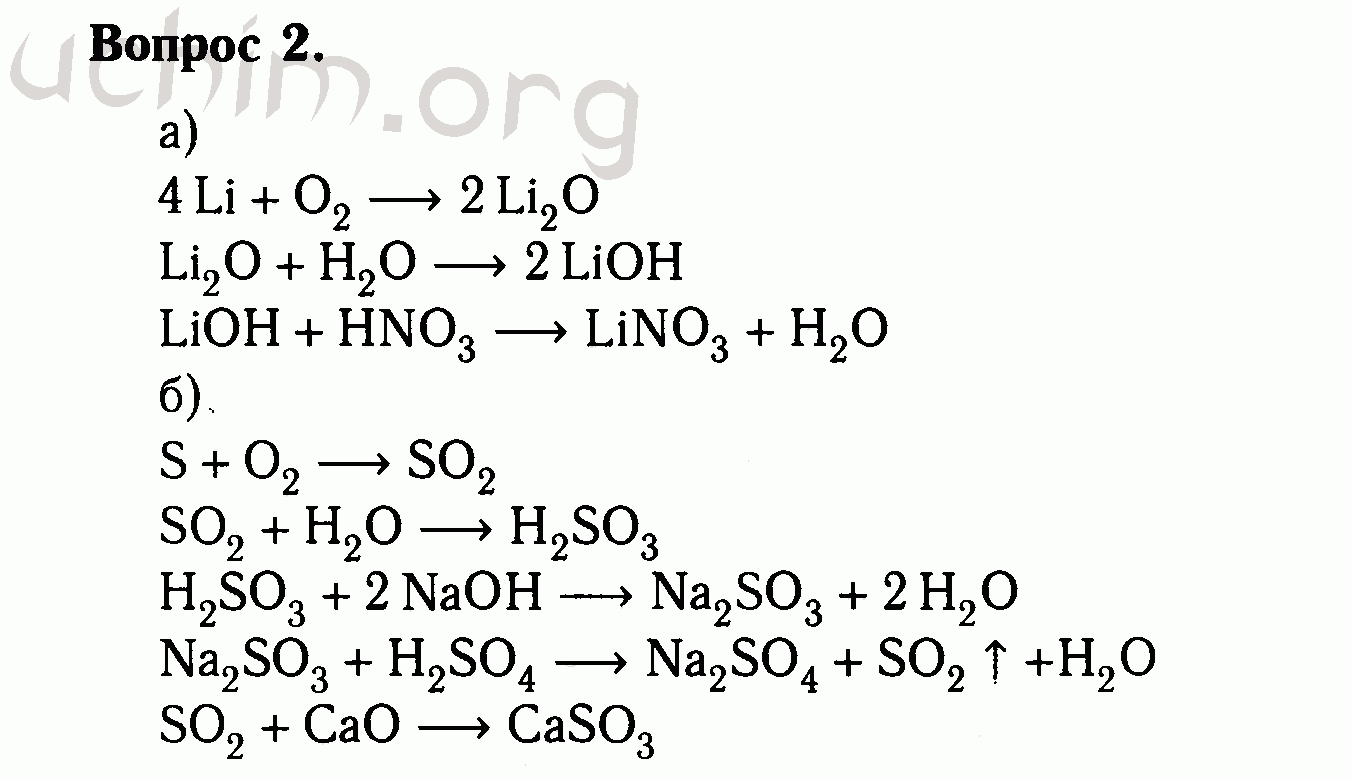 Иногда шины рекомендуются для отдыха и защиты сустава (суставов).Шины, трости и другие устройства для защиты суставов могут быть установлены физиотерапевтами или эрготерапевтами.
Иногда шины рекомендуются для отдыха и защиты сустава (суставов).Шины, трости и другие устройства для защиты суставов могут быть установлены физиотерапевтами или эрготерапевтами.
Лекарства
Некоторые лекарства используются для кратковременного облегчения боли. Другие используются для долгосрочного контроля над болезнью. Чаще всего используются нестероидные противовоспалительные препараты (НПВП). НПВП уменьшают боль в суставах и отечность и обычно снимают симптомы в течение 3-10 дней. НПВП могут вызывать легкое расстройство желудка у многих людей. По этой причине врачи часто рекомендуют принимать эти препараты с жидкостями (например, водой или молоком) и во время еды.Если вы принимаете НПВП, посоветуйтесь со своим врачом о том, как лучше всего принимать лекарство и как он или она хочет контролировать его использование.
Кортикостероиды — это синтетическая форма естественного гормона организма кортизона. Их можно вводить непосредственно в больной сустав или принимать в форме таблеток в течение нескольких дней, чтобы облегчить боль и отек при приступе. Эти препараты могут быть очень полезными, но могут вызывать серьезные побочные эффекты. Было показано, что колхицин умеренно эффективен при предотвращении боли в суставах и отеках, а также при лечении внезапных приступов боли.Храните колхицин и другие лекарства в недоступном для детей месте.
Эти препараты могут быть очень полезными, но могут вызывать серьезные побочные эффекты. Было показано, что колхицин умеренно эффективен при предотвращении боли в суставах и отеках, а также при лечении внезапных приступов боли.Храните колхицин и другие лекарства в недоступном для детей месте.
По мере улучшения симптомов врач может снизить дозу лекарства. Некоторые люди смогут прекратить прием всех лекарств, в то время как другим придется продолжать прием некоторых лекарств, чтобы держать болезнь под контролем. Никогда не прекращайте прием лекарства (даже если вы чувствуете себя лучше), не посоветовавшись с врачом.
В настоящее время лекарств для удаления кристаллов нет. Те лекарства, которые сейчас доступны, только снимают симптомы.
Примечание о недоказанных средствах: остерегайтесь всего, что называется «быстрым лечением», например лекарств, витаминов и минералов или устройств. Эти продукты не лечат болезнь отложения кристаллов CPPD; они стоят вам только денег.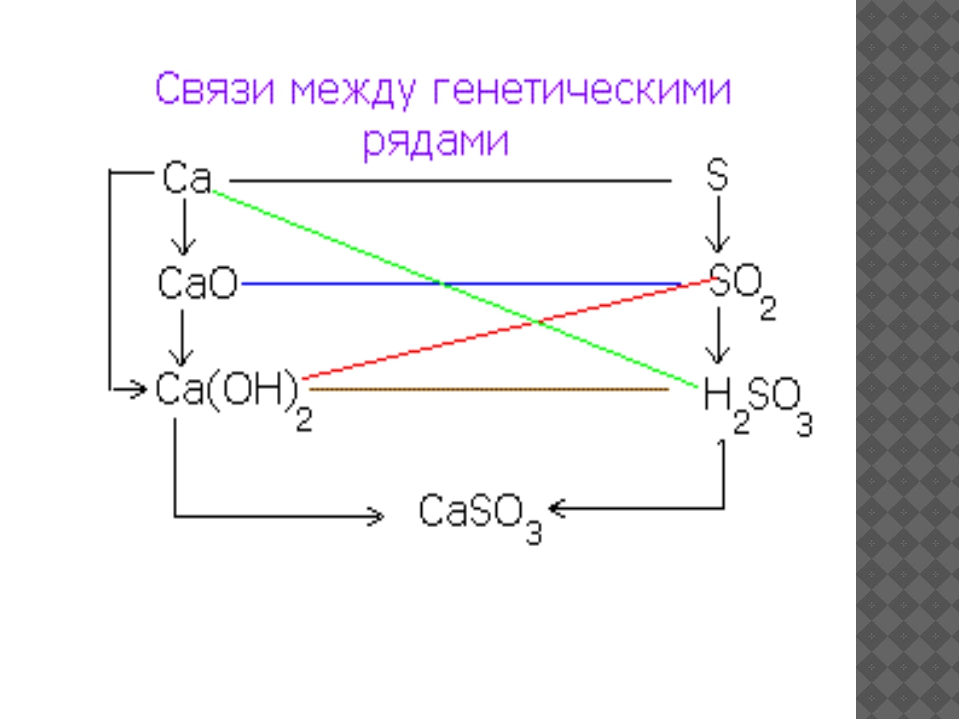 Некоторые из них могут быть вредными или мешать вам получать надлежащий уход. Внимательно следуйте советам врача и обсудите любые другие формы лечения, которые вы планируете.
Некоторые из них могут быть вредными или мешать вам получать надлежащий уход. Внимательно следуйте советам врача и обсудите любые другие формы лечения, которые вы планируете.
Хирургия
У некоторых пациентов операция может использоваться для уменьшения боли и улучшения подвижности в суставе, который сильно поврежден или нестабилен.Некоторые суставы можно частично восстановить, удалив кристаллы CPPD или фрагменты хряща с помощью артроскопа (небольшой телескоп, который смотрит в сустав). Некоторые суставы, особенно тазобедренные или коленные, можно заменить искусственными суставами из пластика и металла.
Аспирация сустава
Совместная аспирация — это процесс удаления некоторого количества жидкости из больного сустава (суставов). Это не только помогает вашему врачу определить, есть ли у вас заболевание, но также удаляет многие кристаллы CPPD, которые вызывают боль и отек.Удаление кристаллов также может улучшить действие лекарств.
Кредиты
Некоторые из этих материалов также могут быть доступны в брошюре Arthritis Foundation.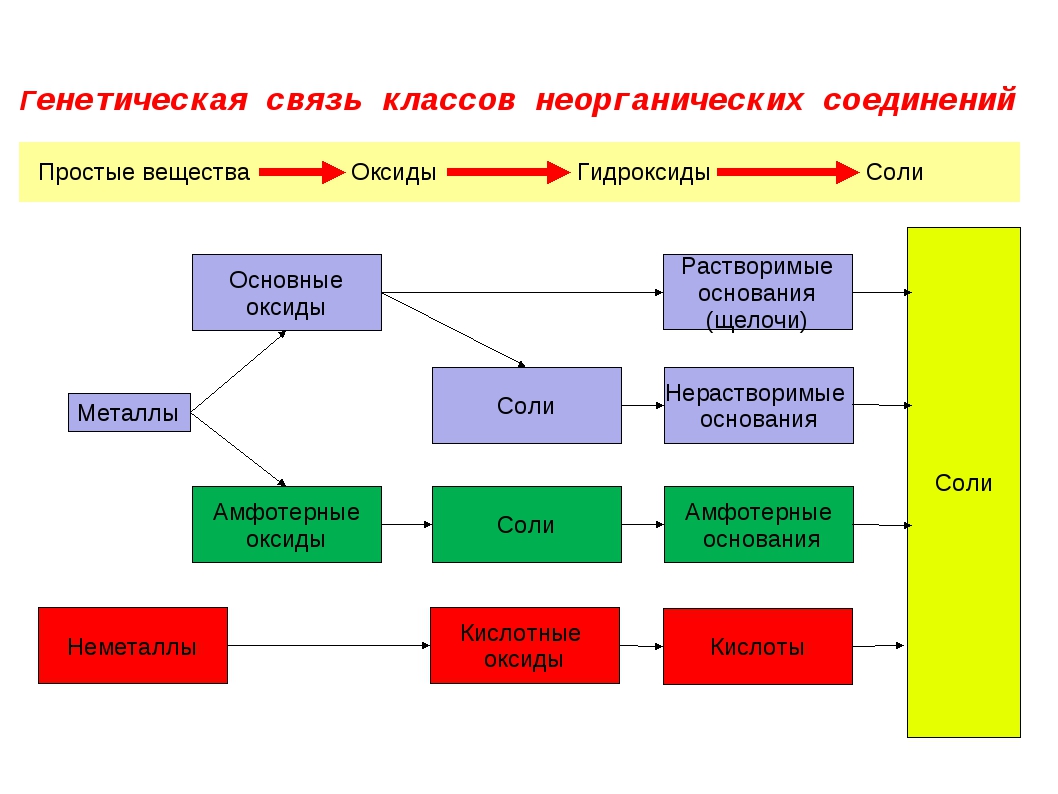
Адаптировано из брошюры, первоначально подготовленной для Фонда артрита Х. Ральфом Шумахером, доктором медицины, Питером Хассельбахером, доктором медицины. Этот материал защищен авторским правом.
Исследование состояния
Исследователи продолжают узнавать больше об этой болезни и о том, как она влияет на организм. Они определили другие типы кристаллов в суставах, которые могут вызывать некоторые заболевания, похожие на болезнь отложения кристаллов CPPD.Они также изучают взаимосвязь между болезнью отложения кристаллов CPPD и другими заболеваниями. Они пытаются узнать, как предотвратить образование кристаллов и как ускорить их удаление. Эта работа может привести к новым тестам или методам лечения этого состояния.
Hydroxyapatite :: общие сведения, применение и применение
1. G. Wei, P.X. Ма, «Структура и свойства каркасов из композита наногидроксиапатит / полимер для инженерии костной ткани». Биоматериалы, 25 (19), стр.4749 (2004).
2. S.J. Калита, А. Бхардвадж, Х.А. Бхатт, «Нанокристаллическая керамика из фосфата кальция в биомедицинской инженерии», Материаловедение и инженерия: C, 27 (3), p. 441 (2007).
3. N.Y. Mostafa, P.W. Браун, «Компьютерное моделирование стехиометрического гидроксиапатита: структура и замещения», Журнал физики и химии твердых тел, 68 (3), с. 431 (2007).
4. С. Тейшейра, М.А. Родригес, П. Пена, А. Х. Де Аза, А. Х., С. Де Аза, М. П. Ферраз, Ф.Дж. Монтейро, «Физические характеристики пористых каркасов из гидроксиапатита для тканевой инженерии», Материаловедение и инженерия: C, 29 (5), стр.1510 (2009).
5. Л. Гуо, М. Хуанг, X. Чжан, «Влияние температуры спекания на структуру гидроксиапатита, изученное методом Ритвельда», Журнал материаловедения: материалы в медицине, 14 (9), стр. 817 (2003).
6. Н. Кантария, С. Найк, С. Апте, М. Хеур, С. Хеур, Б. Кале, «Нано-гидроксиапатит и его современные применения», J Dent Res Sci Develop., 1 (1), p. .15 (2014).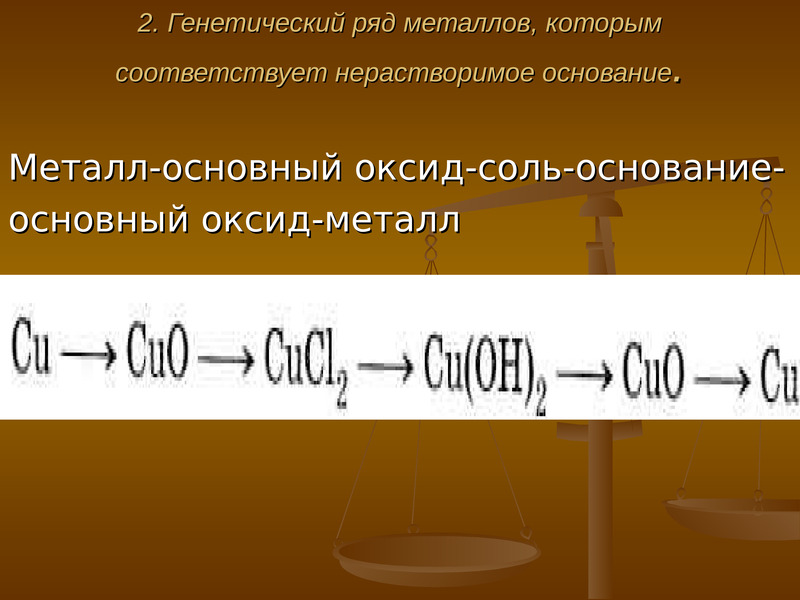
7. М. Эппле, «Обзор потенциальных рисков для здоровья, связанных с наноскопическим фосфатом кальция», Acta Biomaterialia, 77, с.1, (2018).
8. К. Охта, Х. Кавамата, Т. Ишизаки, Р. Хейман, «Окклюзия дентинных канальцев нано-гидроксиапатитом», J Dental Res., 86 (A), (2007).
9. P. Tschoppe, D.L. Зандим, П. Мартус, А. Кильбасса, «Реминерализация эмали и дентина зубными пастами с наногидроксиапатитом», Стоматологический журнал, 39 (6), стр. 430, (2011).
10. Л. Ли, Х. Пан, Дж. Тао, X. Сюй, К. Мао, X. Гу, Р. Тан, «Ремонт эмали с использованием наночастиц гидроксиапатита в качестве строительных блоков», Journal of Materials Chemistry, 18 (34), с.4079 (2008).
11. М. Ханниг, К. Ханниг, «Наноматериалы в профилактической стоматологии», Nat Nanotechnol, 5 (8), с. 565 (2010).
12. М. Наср-Исфахани, С. Фекри, «Наноструктурные композитные фильтры на границе раздела оксид алюминия / TiO2 / гидроксиапатита как эффективные фотокатализаторы для очистки воздуха», Reac Kinet Mech Cat. , 107 (1), с. 89 (2012).
, 107 (1), с. 89 (2012).
13. К. Панди, Н. Вишванатан, «Синтез альгинатного биоинкапсулированного наногидроксиапатитового композита для селективной сорбции фторида», Углеводные полимеры, 112, с.662 (2014).
14. К. Окумура, Ю. Кобаяши, Р. Хираока, Дж. Л. Дюбуа, Дж. Ф. Дево, «Процесс приготовления катализатора, используемого при производстве акролеина и / или акриловой кислоты, и способ получения акролеина и / или акриловой кислоты реакцией дегидратации глицерин »Патент WO2013008279 A1.
15. A. Mekki-Berrada, S. Bennici, J.P. Gillet, J.L. Couturier, J.L. Dubois, A. Auroux, «Метиловые эфиры жирных кислот в нитрилы: кислотно-основные свойства для улучшенных катализаторов», Journal of Catalysis 306, p.30 (2013).
16. Д. Стошич, С. Бенничи, С. Сиротин, К. Кале, JL Couturier, JL Dubois, A. Travert, A. Auroux «Дегидратация глицерина на фосфатно-кальциевых катализаторах: влияние кислотно-основных свойств на каталитические характеристики» , Applied Catalysis A: General, 447-448 p. 124 (2012).
124 (2012).
17. А. Потти, А. Ксенополус, «Удаление белковых агрегатов из биофармацевтических препаратов с использованием солей фосфата кальция», Патент США 2011/0301333.
Болезнь Вильсона — NORD (Национальная организация редких заболеваний)
УЧЕБНИКИ
Brewer GJ.Болезнь Вильсона. В: Справочник НОРД по редким заболеваниям. Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс; 2003: 506.
Брюэр Г.Дж. Болезнь Вильсона: Руководство клинициста по распознаванию, диагностике и лечению. Kluwer Academic Publishing; Бостон, 2001.
Брюэр Дж. Дж. Болезнь Вильсона для пациента и семьи: Руководство пациента по болезни Вильсона и часто задаваемые вопросы о меди. Кслибрис, Филадельфия; 2001.
Щильский М.Л. Болезнь Вильсона. В кн .: Болезни печени.Филадельфия, Пенсильвания: Липпинкотт-Рэйвен; 1999: 1091-1106.
Beers MH, Berkow R., eds. Руководство Merck, 17-е изд. Станция Уайтхаус, Нью-Джерси: Исследовательские лаборатории Мерк; 1999: 56-8.
Кански JJ., Изд. Клиническая офтальмология, 4-е изд. Воберн, Массачусетс: Баттерворт-Хайнеманн; 1999: 142.
Fauci AS, et al., Eds. Принципы внутренней медицины Харрисона, 14-е изд. Нью-Йорк, штат Нью-Йорк: McGraw-Hill, Inc; 1998: 2166-69.
Adams, RD, et al., Eds. Принципы неврологии. 6-е изд. Нью-Йорк, штат Нью-Йорк: McGraw-Hill, Companies; 1997: 969-71.
Bennett JC, Plum F., eds. Сесил Учебник медицины. 20-е изд. Филадельфия, Пенсильвания: W.B. Saunders Co; 1996: 1131-2.
Щильский МЛ. Болезнь Вильсона — генетическая основа токсичности меди и естественная история. В кн .: Семинары по болезням печени. Нью-Йорк, штат Нью-Йорк: Thieme Medical Publishers, Inc .: 1996: 83-95.
Behrman RE, изд. Учебник педиатрии Нельсона, 15-е изд. Филадельфия, Пенсильвания: W.B. Компания Сондерс; 1996: 1139-40.
Scriver CR, et al., Eds. Метаболические и молекулярные основы наследственных заболеваний.7-е изд. Нью-Йорк, штат Нью-Йорк; McGraw-Hill Companies, Inc; 1995: 2217-23.
Menkes JH., Au., Pine JW, et al., Eds. Учебник детской неврологии, 5-е изд. Балтимор, Мэриленд: Уильямс и Уилкинс; 1995: 118-25.
Leevy CM, et al., Eds. Заболевания печени и желчевыводящих путей: стандартизация номенклатуры, диагностических критериев и прогноза. Нью-Йорк, Нью-Йорк: Raven Press; 1994: 112-3.
СТАТЬИ В ЖУРНАЛЕ
Abuduxikuer K, Wang JS. Монотерапия цинком у китайских детей с предсимптоматической болезнью Вильсона: единый центр, ретроспективное исследование.PLoS ONE 9 (1): 2014. e86168. https://doi.org/10.1371/journal.pone.0086168
Брюэр, Дж. Дж. Лечение болезни Вильсона: наши пациенты заслуживают лучшего. Мнение эксперта по орфанным препаратам 2014; 2: 12.
Эль-Юссеф М., болезнь Вильсона. Mayo Clin Proc. 2003; 78: 1126-36.
Ferenci P, et al., Диагностика и фенотипическая классификация болезни Вильсона. Liver Int. 2003; 23: 139-42.
Pellecchia MT, et al., Клиническая картина и лечение болезни Вильсона: опыт одного центра.Eur Neurol. 2003; 50: 48-52.
Брюэр Г.Дж. и др., Лечение болезни Вильсона тетратиомолибдатом аммония: III. Первоначальная терапия в общей сложности 55 пациентов с неврологическими нарушениями и последующее лечение цинком. Arch Neurol. 2003; 60: 379-85.
Бэкон Б.Р. и др., Новые знания о генетическом патогенезе гемохроматоза и болезни Вильсона. Adv Intern Med. 1999; 44: 91-116.
Sturniolo GC, et al., Цинковая терапия увеличивает концентрацию металлотионеина и железа в двенадцатиперстной кишке у пациентов с болезнью Вильсона.Am J Gastroenterol. 1999; 94: 334-38.
Шефер М. и др., Гепатоцит-специфическая локализация и медьзависимый транспорт белка болезни Вильсона в печени. 1999; 276: 639-46.
Брюэр Г.Дж. и др., Лечение болезни Вильсона цинком: XV. Долгосрочные контрольные исследования. J Lab Clin Med. 1998; 132: 264-78.
Брюер Дж. Дж. И др., Лечение болезни Вильсона тетратиомолибдатом аммония. Arch Neurol. 1996; 53: 1017-25.
Демиркиран М. и др., Неврологическая картина болезни Вильсона без колец Кайзера-Флейшера.Неврология. 1996; 46: 1040-3.
Scheinberg IH, et al., Лечение неврологических проявлений болезни Вильсона. Arch Neurol. 1995; 52: 339-40.
Шильский М.Л. и др., Трансплантация печени при болезни Вильсона: показания и исход. Гепатология. 1994; 19: 583-7.
Yarse JC и др., Болезнь Вильсона: текущее состояние. Am J Med. 1992; 92: 643-54.
Брюер Г.Дж. и др., Начальная терапия пациентов с болезнью Вильсона тетратиомолибдатом. Arch Neurol. 1991; 48: 42-7.
Танканов Р.М., Патофизиология и лечение болезни Вильсона. Clin Pharm. 1991; 10: 839-49.
Шильский М.Л. и др., Прогноз хронического активного гепатита Вильсона. Гастроэнтерология. 1991; 100: 762-7.
Woods SE, болезнь Вильсона. Семейный врач. 1989; 40: 171-8.
ИНТЕРНЕТ
Менделирующее наследование онлайн в человеке (OMIM). Университет Джона Хопкинса. Болезнь Вильсона. Запись №: 277900. Последнее изменение 09.07.2016. Доступно по адресу: http://omim.org/entry/277900.По состоянию на 7 марта 2018 г.
методов генетического тестирования | Лабораторные тесты онлайн
Рем, Х.Л. (апрель 2013 г.). Секвенирование, ориентированное на заболевание: краеугольный камень клиники. Природа Обзоры Генетики. Доступно на сайте https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3786217/. По состоянию на октябрь 2018 г.
Кацанис, С. Х. и Кацанис Н. (июнь 2013 г.). Молекулярно-генетическое тестирование и будущее клинической геномики. Национальный обзор генетики. Доступно на сайте https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4461364/. По состоянию на октябрь 2017 г. Behjati, S. and Tarpey P.S. (2013 декабрь). Что такое секвенирование следующего поколения? Архив болезней детства. Доступно на сайте https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3841808/. По состоянию на октябрь 2018 г.
Шен Т. и др. (17 июня 2015 г.). Клинические применения секвенирования следующего поколения при раке: от панелей до экзомов и геномов. Границы генетики. Доступно на сайте https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4469892/.По состоянию на октябрь 2018 г.
Мойнихан Т. (30 июня 2015 г.). Профилирование экспрессии генов при раке груди: что это такое? Клиника Майо. Доступно на сайте https://www.mayoclinic.org/diseases-conditions/breast-cancer/expert-answers/gene-expression-profiling/faq-20058144. По состоянию на октябрь 2018 г.
(27 августа 2015 г.). Технология микрочипов ДНК. Национальный институт исследования генома человека. Доступно на сайте https://www.genome.gov/10000533/dna-microarray-technology/. По состоянию на октябрь 2018 г.
(обновлено 18 декабря 2015 г.).Секвенирование ДНК. Национальный институт исследования генома человека. Доступно в Интернете по адресу https://www.genome.gov/10001177/dna-sequencing-fact-sheet/. По состоянию на октябрь 2018 г.
Беновиц, С. (29 марта 2016 г.). Новое исследование бросает вызов золотому стандарту проверки результатов секвенирования ДНК. Национальный институт исследования генома человека. Доступно в Интернете по адресу https://www.genome.gov/27564480/2016-news-feature-new-study-challenges-gold-standard-for-validating-dna-sequencing-results/. По состоянию на октябрь 2018 г.
Гамильтон, А.и другие. (2016 10 мая). Соответствие между секвенированием всего экзома и клиническим секвенированием по Сэнгеру: значение для ухода за пациентами. Молекулярная генетика и геномная медицина. Доступно в Интернете по адресу http://onlinelibrary.wiley.com/doi/10.1002/mgg3.223/full. По состоянию на октябрь 2018 г.
Sabour L., et al. (2017 апрель). Клинические применения секвенирования нового поколения в диагностике рака. Патология и онкологические исследования. Доступно на сайте https://link.springer.com/article/10.1007/s12253-016-0124-z.По состоянию на октябрь 2018 г.
(© 2017). Что такое диагностическое тестирование? Гены в жизни. Доступно в Интернете по адресу http://www.genesinlife.org/testing-services/testing-genetic-conditions/diagnostic-testing. По состоянию на октябрь 2018 г.
(© 2017). Что такое генотипирование и профили экспрессии? Генотипирование и Институт медицинских исследований Кориелла. Доступно в Интернете по адресу https://www.coriell.org/research-services/genotyping-microarray/what-is-genotyping-and-expression-profiling. По состоянию на октябрь 2018 г.
(27 августа 2015 г.) Национальный исследовательский институт генома человека, ДНК-микрочип. Доступно на сайте https://www.genome.gov/10000533/dna-microarray-technology/ По состоянию на октябрь 2018 г.
.
