Содержание
Название кислот и солей таблица. Кислоты: классификация и химические свойства
Кислотами
называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла и кислотный остаток.
По наличию или отсутствию кислорода в молекуле кислоты делятся на кислородсодержащие
(H 2 SO 4 серная кислота, H 2 SO 3 сернистая кислота, HNO 3 азотная кислота, H 3 PO 4 фосфорная кислота, H 2 CO 3 угольная кислота, H 2 SiO 3 кремниевая кислота) и бескислородные
(HF фтороводородная кислота, HCl хлороводородная кислота (соляная кислота), HBr бромоводородная кислота, HI иодоводородная кислота, H 2 S сероводородная кислота).
В зависимости от числа атомов водорода в молекуле кислоты кислоты бывают одноосновные (с 1 атомом Н), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н).
Например, азотная кислота HNO 3 одноосновная, так как в молекуле её один атом водорода, серная кислота H 2 SO 4 –
двухосновная и т. д.
д.
Неорганических соединений, содержащих четыре атома водорода, способных замещаться на металл, очень мало.
Часть молекулы кислоты без водорода называется кислотным остатком.
Кислотные остатки
могут состоять из одного атома (-Cl, -Br, -I) – это простые кислотные остатки, а могут – из группы атомов (-SO 3, -PO 4, -SiO 3) – это сложные остатки.
В водных растворах при реакциях обмена и замещения кислотные остатки не разрушаются:
H 2 SO 4 + CuCl 2 → CuSO 4 + 2 HCl
Слово ангидрид
означает безводный, то есть кислота без воды. Например,
H 2 SO 4 – H 2 O → SO 3 . Бескислородные кислоты ангидридов не имеют.
Своё название кислоты получают от названия образующего кислоту элемента (кислотообразователя) с прибавлением окончаний «ная» и реже «вая»: H 2 SO 4 – серная; H 2 SO 3 – угольная; H 2 SiO 3 – кремниевая и т.д.
Элемент может образовать несколько кислородных кислот. В таком случае указанные окончания в названии кислот будут тогда, когда элемент проявляет высшую валентность (в молекуле кислоты большое содержание атомов кислорода). Если элемент проявляет низшую валентность, окончание в названии кислоты будет «истая»: HNO 3 – азотная, HNO 2 – азотистая.
Если элемент проявляет низшую валентность, окончание в названии кислоты будет «истая»: HNO 3 – азотная, HNO 2 – азотистая.
Кислоты можно получать растворением ангидридов в воде.
В случае, если ангидриды в воде не растворимы, кислоту можно получить действием другой более сильной кислоты на соль необходимой кислоты. Этот способ характерен как для кислородных так и бескислородных кислот. Бескислородные кислоты получают так же прямым синтезом из водорода и неметалла с последующим растворением полученного соединения в воде:
H 2 + Cl 2 → 2 HCl;
H 2 + S → H 2 S.
Растворы полученных газообразных веществ HCl и H 2 S и являются кислотами.
При обычных условиях кислоты бывают как в жидком, так и в твёрдом состоянии.
Химические свойства кислот
Растворыв кислот действуют на индикаторы.
Все кислоты (кроме кремниевой) хорошо растворяются в воде. Специальные вещества – индикаторы позволяют определить присутствие кислоты.
Индикаторы – это вещества сложного строения.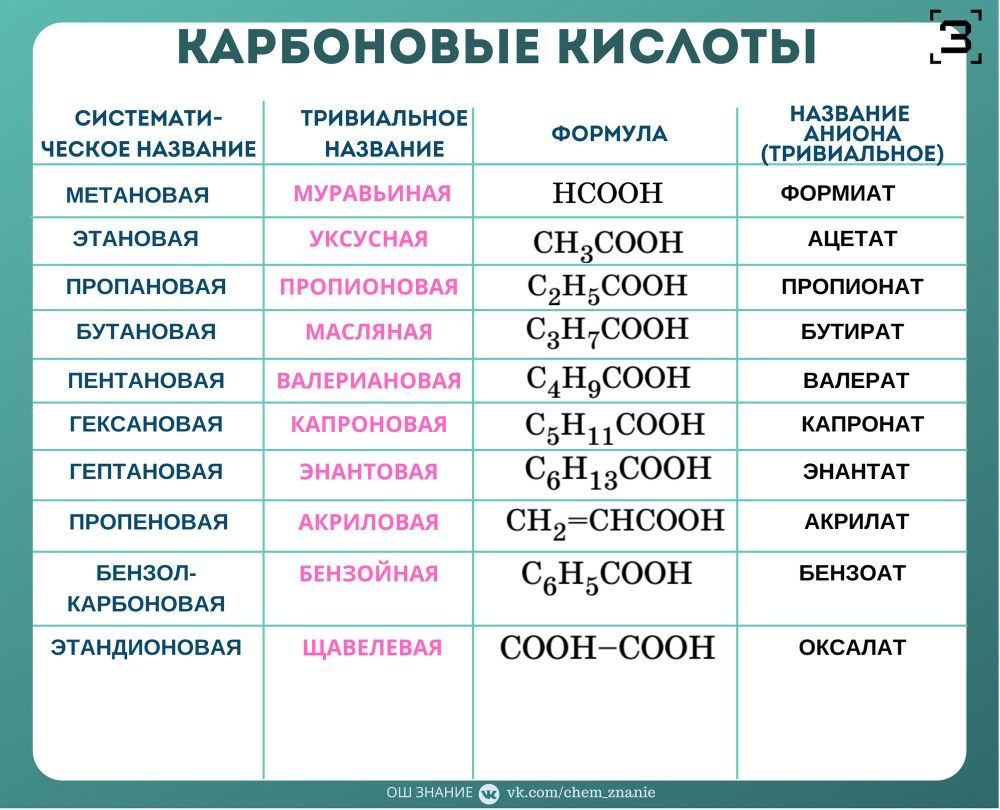 Они меняют свою окраску в зависимоти от взаимодействия с разными химическими веществами. В нейтральных растворах — они имеют одну окраску, в растворах оснований – другую. При взаимодействии с кислотой они меняют свою окраску: индикатор метиловый оранжевый окрашивается в красный цвет, индикатор лакмус – тоже в красный цвет.
Они меняют свою окраску в зависимоти от взаимодействия с разными химическими веществами. В нейтральных растворах — они имеют одну окраску, в растворах оснований – другую. При взаимодействии с кислотой они меняют свою окраску: индикатор метиловый оранжевый окрашивается в красный цвет, индикатор лакмус – тоже в красный цвет.
Взаимодействуют с основаниями
с образованием воды и соли, в которой содержится неизменный кислотный остаток (реакция нейтрализации):
H 2 SO 4 + Ca(OH) 2 → CaSO 4 + 2 H 2 O.
Взаимодействуют с основанными оксидами
с образованием воды и соли (реакция нейтрализации). Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации:
H 3 PO 4 + Fe 2 O 3 → 2 FePO 4 + 3 H 2 O.
Взаимодействуют с металлами.
Для взаимодействия кислот с металлами должны выполнятся некоторые условия:
1. металл должен быть достаточно активным по отношению к кислотам (в ряду активности металлов он должен располагаться до водорода). Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами;
Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами;
2. кислота должна быть достаточно сильной (то есть способной отдавать ионы водорода H +).
При протекании химических реакций кислоты с металлами образуется соль и выделяется водород (кроме взаимодействия металлов с азотной и концентрированной серной кислотами,):
Zn + 2HCl → ZnCl 2 + H 2 ;
Cu + 4HNO 3 → CuNO 3 + 2 NO 2 + 2 H 2 O.
Остались вопросы? Хотите знать больше о кислотах?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Кислоты
— сложные вещества, состоящие из одного или
нескольких атомов водорода, способных замещаться на атома металлов, и кислотных
остатков.
Классификация
кислот
1.
По числу атомов водорода:
число атомов водорода (n
) определяет основность кислот:
n
= 1 одноосновная
n
= 2 двухосновная
n
= 3 трехосновная
2.
По составу:
а) Таблица кислород содержащих кислот, кислотных остатков и
соответствующих кислотных оксидов:
Кислота (Н | Кислотный остаток | Соответствующий кислотный оксид |
H 2 SO 4 | SO 4 (II) | SO |
HNO 3 | NO 3 (I) | N 2 O 5 |
HMnO 4 | MnO 4 (I) | Mn 2 O 7 |
H 2 SO 3 | SO 3 (II) | SO 2 |
H 3 PO 4 | PO 4 (III) | P 2 O 5 |
HNO 2 | NO 2 (I) | N 2 O 3 |
H 2 CO 3 | CO 3 (II) | CO |
H 2 SiO 3 | SiO 3 (II) | SiO 2 |
НСlO хлорноватистая | СlO | С |
НСlO 2 хлористая | СlO 2 хлорит | С |
НСlO | СlO | С |
НСlO | СlO 4 | С |
б) Таблица бескислородных кислот
Кислота (Н n | Кислотный остаток (А) |
HCl | Cl |
H | S |
HBr бромоводородная | Br |
HI | I |
HF фтороводородная,плавиковая | F |
Физические
свойства кислот
Многие кислоты,
например серная, азотная, соляная – это бесцветные жидкости. известны также
известны также
твёрдые кислоты: ортофосфорная, метафосфорная
HPO
3
,
борная
H
3
BO
3
.
Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая
H
2
SiO
3
.
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый
вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и
т.д.
Способы
получения кислот
бескислородные | кислородсодержащие |
HCl, HBr, HI, HF, | HNO |
ПОЛУЧЕНИЕ | |
1. Прямое взаимодействие неметаллов H | 1. Кислотный оксид + вода = кислота SO |
2. 2 NaCl (тв | |
Химические
свойства кислот
1. Изменяют окраску индикаторов
Название индикатора | Нейтральная среда | Кислая среда |
Лакмус | Фиолетовый | Красный |
Фенолфталеин | Бесцветный | Бесцветный |
Метилоранж | Оранжевый | Красный |
Универсальная индикаторная бумага | Оранжевая | Красная |
2. Реагируют с металлами в ряду активности до
Реагируют с металлами в ряду активности до
H
2
(искл.
HNO
3
–азотная кислота)
Видео «Взаимодействие кислот с металлами»
Ме + КИСЛОТА =СОЛЬ +
H
2
(р. замещения)
Zn
+ 2
HCl
=
ZnCl
2
+
H
2
3. С основными (амфотерными) оксидами
– оксидами металлов
Видео «Взаимодействие оксидов металлов с кислотами»
Ме х О у + КИСЛОТА=
СОЛЬ + Н 2 О
(р. обмена)
4. Реагируют с основаниями
– реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+
H
2
O
(р. обмена)
H
3
PO
4
+ 3
NaOH
=
Na
3
PO
4
+ 3
H
2
O
5. Реагируют с солями слабых, летучих кислот —
если образуется кислота,
выпадающая в осадок или выделяется газ:
2 NaCl (тв
.) + H 2 SO 4 (конц
.) = Na 2 SO 4 + 2HCl
(
р
.
обмена
)
Видео «Взаимодействие кислот с солями»
6. Разложение кислородсодержащих кислот при нагревании
(искл.
H
2
SO
4
;
H
3
PO
4
)
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р.
разложения)
Запомните!
Неустойчивые
кислоты (угольная и сернистая) – разлагаются на газ и воду
:
H 2 CO 3 ↔
H 2 O + CO 2
H 2 SO 3
↔ H 2 O + SO 2
Сероводородная кислота в продуктах
выделяется в виде газа:
СаS + 2HCl = H 2 S
+ Ca
Cl 2
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Распределите химические формулы кислот в таблицу. Дайте им названия:
LiOH
, Mn
2 O
7 , CaO
, Na
3 PO
4 , H
2 S
, MnO
, Fe
(OH
) 3 , Cr
2 O
3 ,HI
,
HClO
4
,
HBr
,
CaCl
2 , Na
2 O
, HCl
,
H
2
SO
4
,
HNO
3
,
HMnO
4
,
Ca
(OH
) 2 , SiO
2 , Кислоты
Бес-кисло-
родные
Кислород- содержащие
растворимые
нераст-воримые
одно-
основные
двух-основные
трёх-основные
№2.
Составьте уравнения реакций:
Ca
+ HCl
Na
+ H 2 SO 4
Al
+ H 2 S
Ca
+ H 3 PO 4
Назовите продукты реакции.
№3.
Составьте уравнения реакций, назовите продукты:
Na 2 O + H 2 CO 3
ZnO + HCl
CaO + HNO 3
Fe 2 O 3
+ H 2 SO 4
№4.
Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
KOH + HNO 3
NaOH + H 2 SO 3
Ca(OH) 2 + H 2 S
Al(OH) 3 + HF
HCl + Na 2 SiO 3
H 2 SO 4
+ K 2 CO 3
HNO
3 + CaCO
3
Назовите
продукты реакции.
ТРЕНАЖЁРЫ
Тренажёр №1. «Формулы и названия кислот»
Тренажёр №2. » Установление соответствия:
формула кислоты — формула оксида»
Техника безопасности — Оказание первой помощи при
попадании кислот на кожу
Техника безопасности —
Называются
вещества, диссоциирующие в растворах с образованием ионов водорода.
Кислоты
классифицируются
по их силе, по основности и по наличию или отсутствию кислорода в
составе
кислоты.
По силе
кислоты делятся
на сильные и слабые.
Важнейшие сильные кислоты — азотная
HNO
3
,
серная
H
2
SO
4
, и соляная
HCl
.
По наличию
кислорода
различают
кислородсодержащие кислоты
(HNO
3
,
H
3
PO
4
и т.п.) и
бескислородные кислоты (HCl
,
H
2
S
,
HCN
и т.п.).
По основности
, т.е. по числу
атомов водорода в
молекуле кислоты, способных замещаться атомами металла с образованием
соли,
кислоты подразделяются на одноосновные (например,
HNO
3
,
HCl
),
двухосновные (H
2
S
,
H
2
SO
4
), трехосновные (H
3
PO
4
) и т. д.
Названия
бескислородных
кислот производятся от названия неметалла с прибавлением окончания
-водородная:
HCl
—
хлороводородная кислота,
H
2
S
е —
селеноводородная кислота,
HCN
—
циановодородная кислота.
Названия
кислородсодержащих
кислот также образуются от русского названия соответствующего элемента
с
добавлением слова «кислота». При этом название
кислоты, в которой элемент
находится в высшей степени окисления , оканчивается на
«ная» или «овая»,
например,
H
2
SO
4
—
серная кислота,
HClO
4
— хлорная кислота,
H
3
AsO
4
—
мышьяковая кислота. С понижением степени окисления
С понижением степени окисления
кислотообразующего элемента окончания изменяются в следующей
последовательности: «оватая» (HClO
3
—
хлорноватая кислота), «истая» (HClO
2
—
хлористая кислота), «оватистая» (H
О
Cl
—
хлорноватистая кислота). Если
элемент образует кислоты, находясь только в двух степенях окисления, то
название кислоты, отвечающее низшей степени окисления элемента,
получает
окончание «истая» (HNO
3
—
азотная кислота,
HNO
2
—
азотистая кислота).
Таблица
— Важнейшие кислоты и их соли
Кислота | Названия | |
Название | Формула | |
Азотная | HNO 3 | Нитраты |
Азотистая | HNO 2 | Нитриты |
Борная | H 3 BO 3 | Бораты |
Бромоводородная | Бромиды | |
Иодоводородная | Иодиды | |
Кремниевая | H 2 SiO 3 | Силикаты |
Марганцовая | HMnO 4 | Перманганаты |
Метафосфорная | HPO 3 | Метафосфаты |
Мышьяковая | H 3 AsO 4 | Арсенаты |
Мышьяковистая | H 3 AsO 3 | Арсениты |
Ортофосфорная | H 3 PO 4 | Ортофосфаты |
Дифосфорная | H 4 P 2 O 7 | Дифосфаты |
Дихромовая | H 2 Cr 2 O 7 | Дихроматы |
Серная | H 2 SO 4 | Сульфаты |
Сернистая | H 2 SO 3 | Сульфиты |
Угольная | H 2 CO 3 | Карбонаты |
Фосфористая | H 3 PO 3 | Фосфиты |
Фтороводородная | Фториды | |
Хлороводородная | Хлориды | |
Хлорная | HClO 4 | Перхлораты |
Хлорноватая | HClO 3 | Хлораты |
Хлорноватистая | HClO | Гипохлориты |
Хромовая | H 2 CrO 4 | Хроматы |
Циановодородная | Цианиды | |
Получение
кислот
1.
Бескислородные кислоты
могут быть получены при непосредственном соединении неметаллов с
водородом:
H 2
+ Cl 2 → 2HCl,
H 2
+ S H 2 S.
2.
Кислородсодержащие
кислоты нередко могут быть получены при непосредственном соединении
кислотных
оксидов с водой:
SO 3
+ H 2 O = H 2 SO 4 ,
CO 2
+ H 2 O = H 2 CO 3 ,
P
2
O
5
+
H
2
O
= 2
HPO
3
.
3. Как
бескислородные,
так и кислородсодержащие кислоты можно получить по реакциям обмена
между солями
и другими кислотами:
BaBr 2
+ H 2 SO 4 = BaSO 4
+ 2HBr,
CuSO 4
+ H 2 S = H 2 SO 4
+ CuS,
CaCO 3
+ 2HBr = CaBr 2 + CO 2
+ H 2 O.
4. В ряде
случаев для
получения кислот могут быть использованы окислительно-восстановительные
реакции:
H 2 O 2
+ SO 2 = H 2 SO 4 ,
3P
+ 5HNO 3 + 2H 2 O = 3H 3 PO 4
+ 5NO
.
Химические
свойства кислот
1. Наиболее
характерное
химическое свойство кислот — их способность реагировать с
основаниями (а также
с основными и амфотерными оксидами) с образованием солей, например:
H 2 SO 4
+ 2NaOH = Na 2 SO 4 + 2H 2 O,
2HNO 3
+ FeO = Fe(NO 3) 2 + H 2 O,
2
HCl
+
ZnO
=
ZnCl
2
+
H
2
O
.
2. Способность
взаимодействовать с некоторыми металлами, стоящими в ряду напряжения до
водорода, с выделением водорода:
Zn
+ 2HCl = ZnCl 2 + H 2
,
2Al
+ 6HCl = 2AlCl 3 + 3H 2
.
3. С солями,
если
образуется малорастворимая соль или летучее вещество:
H 2 SO 4
+ BaCl 2 = BaSO 4
↓
+ 2HCl,
2HCl
+ Na 2 CO 3 = 2NaCl + H 2 O
+ CO 2
,
2KHCO 3
+ H 2 SO 4 = K 2 SO 4
+2SO 2
+ 2H 2 O.
Заметим, что
многоосновные кислоты диссоциируют ступенчато, причем легкость
диссоциации по
каждой из ступеней падает, поэтому для многоосновных кислот вместо
средних
солей часто образуются кислые (в случае избытка реагирующей кислоты):
Na 2 S
+ H 3 PO 4 = Na 2 HPO 4
+ H 2 S
,
NaOH
+ H 3 PO 4 = NaH 2 PO 4
+ H 2 O.
4. Частным
случаем
кислотно-основного взаимодействия являются реакции кислот с
индикаторами,
приводящие к изменению окраски, что издавна используется для
качественного
обнаружения кислот в растворах. Так, лакмус изменяет цвет в кислой
среде на
красный.
5. При
нагревании
кислородсодержащие кислоты разлагаются на оксид и воду (лучше в
присутствии
водоотнимающего
P
2
O
5
):
H 2 SO 4
= H 2 O + SO 3 ,
H 2 SiO 3
= H 2 O + SiO 2 .
М.В. Андрюxoва, Л.Н. Бopoдина
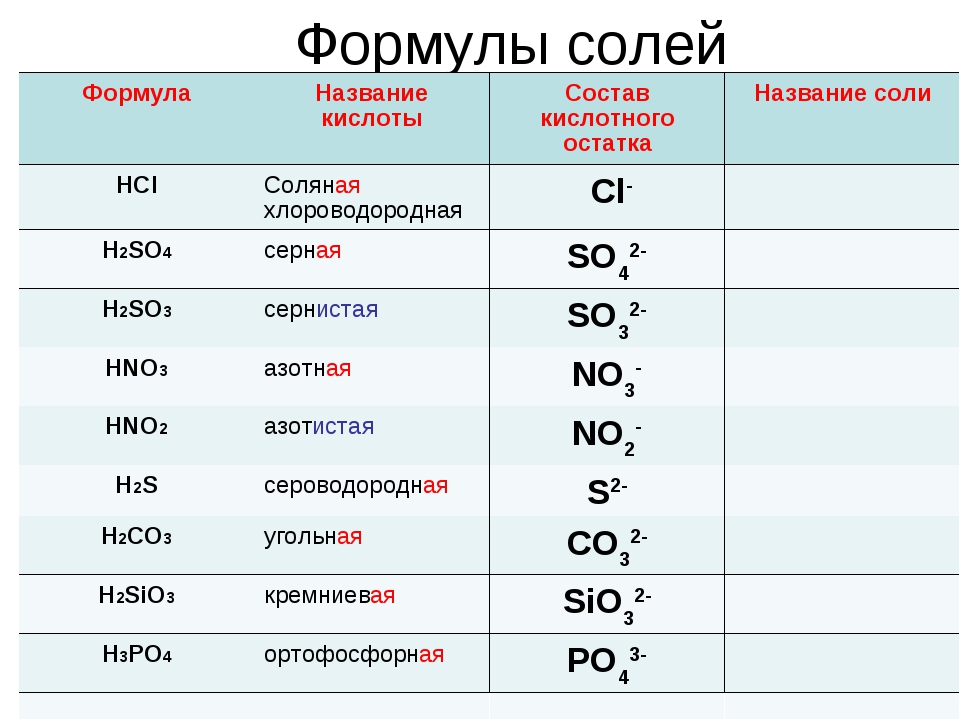
| Формулы кислот | Названия кислот | Названия соответствующих солей |
| HClO 4 | хлорная | перхлораты |
| HClO 3 | хлорноватая | хлораты |
| HClO 2 | хлористая | хлориты |
| HClO | хлорноватистая | гипохлориты |
| H 5 IO 6 | иодная | периодаты |
| HIO 3 | иодноватая | иодаты |
| H 2 SO 4 | серная | сульфаты |
| H 2 SO 3 | сернистая | сульфиты |
| H 2 S 2 O 3 | тиосерная | тиосульфаты |
| H 2 S 4 O 6 | тетратионовая | тетратионаты |
| HNO 3 | азотная | нитраты |
| HNO 2 | азотистая | нитриты |
| H 3 PO 4 | ортофосфорная | ортофосфаты |
| HPO 3 | метафосфорная | метафосфаты |
| H 3 PO 3 | фосфористая | фосфиты |
| H 3 PO 2 | фосфорноватистая | гипофосфиты |
| H 2 CO 3 | угольная | карбонаты |
| H 2 SiO 3 | кремниевая | силикаты |
| HMnO 4 | марганцовая | перманганаты |
| H 2 MnO 4 | марганцовистая | манганаты |
| H 2 CrO 4 | хромовая | хроматы |
| H 2 Cr 2 O 7 | дихромовая | дихроматы |
| HF | фтороводородная (плавиковая) | фториды |
| HCl | хлороводородная (соляная) | хлориды |
| HBr | бромоводородная | бромиды |
| HI | иодоводородная | иодиды |
| H 2 S | сероводородная | сульфиды |
| HCN | циановодородная | цианиды |
| HOCN | циановая | цианаты |
Напомню кратко на конкретных примерах, как следует правильно называть соли.
Пример 1
. Соль K 2 SO 4 образована остатком серной кислоты (SO 4) и металлом К. Соли серной кислоты называются сульфатами. K 2 SO 4 — сульфат калия.
Пример 2
. FeCl 3 — в состав соли входит железо и остаток соляной кислоты (Cl). Название соли: хлорид железа (III). Обратите внимание: в данном случае мы не только должны назвать металл, но и указать его валентность (III). В прошлом примере в этом не было необходимости, т. к. валентность натрия постоянна.
Важно: в названии соли следует указывать валентность металла только в том случае, если данный металл имеет переменную валентность!
Пример 3
. Ba(ClO) 2 — в состав соли входит барий и остаток хлорноватистой кислоты (ClO). Название соли: гипохлорит бария. Валентность металла Ва во всех его соединениях равна двум, указывать ее не нужно.
Пример 4
. (NH 4) 2 Cr 2 O 7 . Группа NH 4 называется аммоний, валентность этой группы постоянна. Название соли: дихромат (бихромат) аммония.
В приведенных выше примерах нам встретились только т. н. средние или нормальные соли. Кислые, основные, двойные и комплексные соли, соли органических кислот здесь обсуждаться не будут.
н. средние или нормальные соли. Кислые, основные, двойные и комплексные соли, соли органических кислот здесь обсуждаться не будут.
Если вас интересует не только номенклатура солей, но и методы их получения и химические свойства, рекомендую обратиться к соответствующим разделам справочника по химии: «
Названия | ||
Метаалюминиевая | Метаалюминат | |
Метамышьяковая | Метаарсенат | |
Ортомышьяковая | Ортоарсенат | |
Метамышьяковистая | Метаарсенит | |
Ортомышьяковистая | Ортоарсенит | |
Метаборная | Метаборат | |
Ортоборная | Ортоборат | |
Четырехборная | Тетраборат | |
Бромоводород | ||
Бромноватистая | Гипобромит | |
Бромноватая | ||
Муравьиная | ||
Уксусная | ||
Циановодород | ||
Угольная | Карбонат | |
Щавелевая | ||
Хлороводород | ||
Хлорноватистая | Гипохлорит | |
Хлористая | ||
Хлорноватая | ||
Перхлорат | ||
Метахромистая | Метахромит | |
Хромовая | ||
Двухромовая | Дихромат | |
Иодоводород | ||
Иодноватистая | Гипоиодит | |
Иодноватая | ||
Периодат | ||
Марганцовая | Перманганат | |
Марганцовистая | Манганат | |
Молибденовая | Молибдат | |
Азидоводород | ||
Азотистая | ||
Метафосфорная | Метафосфат | |
Ортофосфорная | Ортофосфат | |
Двуфосфорная(пирофосфорная) | Дифосфат | |
Фосфористая | ||
Фосфорноватистая | Гипофосфит | |
Сероводород | ||
Родановодород | ||
Сернистая | ||
Тиосерная | Тиосульфат | |
Двусерная | Дисульфат | |
Пероксодвусерная | Пероксодисульфат | |
Селеноводород | ||
Селенистая | ||
Селеновая | ||
Кремниевая | ||
Ванадиевая | ||
Вольфрамовая | вольфрамат | |
Соли
–
вещества, которые
можно рассматривать как продукт замещения
атомов водорода в кислоте атомами
металлов или группой атомов. Различают
Различают
5 типов солей:
средние (нормальные),
кислые, основные, двойные, комплексные,
отличающиеся характером образующихся
при диссоциации ионов.
1.Средние соли
являются продуктами
полного замещения атомов водорода в
молекуле
кислоты. Состав соли: катион
– ион металла, анион – ион кислотного
остатка.Nа 2 СО 3 — карбонат
натрия
Na 3 РО 4 —
фосфат натрия
Nа 3 РО 4
= 3Nа + + РО 4 3-
катион
анион
2.Кислые соли
– продукты неполного
замещения атомов водорода в молекуле
кислоты. В состав аниона входят атомы
водорода.
NаН 2 РО 4
=Nа + + Н 2 РО 4 —
Дигидрофосфат катион анион
Кислые соли дают только многоосновные
кислоты, при недостаточном количестве
взятого основания.
Н 2 SO 4 +NaOH=NaHSO 4 +H 2 O
гидросульфат
При добавлении избытка щелочи кислая
соль может быть переведена в среднюю
NaHSO 4 +NaOH=Na 2 SO 4 +H 2 O
3.Основные соли
– продукты
неполного замещения гидроксид-ионов в
основании на кислотный остаток. В состав
В состав
катиона входит гидроксогруппа.
CuOHCl=CuOH +
+Cl —
гидроксохлорид катион анион
Основные соли могут быть образованы
только многокислотными основаниями
(основаниями, содержащими несколько
гидроксильных групп), при взаимодействии
их с кислотами.
Cu(OH) 2 +HCl=CuOHCl+H 2 O
Перевести основную соль в среднюю можно,
действуя на нее кислотой:
CuOHCl+HCl=CuCl 2 +H 2 O
4.Двойные соли
– в их состав
входят катионы нескольких металлов и
анионы одной кислоты
KAl(SO 4) 2
= K +
+ Al 3+
+ 2SO 4 2-
сульфат калия-алюминия
Характерными свойствами
всех
рассмотренных типов солей являются:
реакции обмена с кислотами, щелочами
и друг с другом.
Для наименования солей
пользуются
русской и международной номенклатурой.
Русское наименование соли составляется
из названия кислоты и названия металла:
СаСО 3 – углекислый кальций.
Для кислых солей вводится добавка
«кислый»: Са(НСО 3) 2 – кислый
углекислый кальций. Для названия основных
Для названия основных
солей добавка «основная»: (СuOH) 2 SO 4 – основная сернокислая медь.
Наибольшее распространение получила
международная номенклатура. Название
соли по этой номенклатуре состоит из
названия аниона и названия катиона:
KNO 3 – нитрат калия.
Если металл имеет разную валентность
в соединении, то ее указывают в скобках:FeSO 4 –сульфат железа
(Ш).
Для солей кислородосодержащих кислот
в названии вводят суффикс «ат», если
кислотообразующий элемент проявляет
высшую валентность: KNO 3 – нитрат калия; суффикс «ит», если
кислотообразующий элемент проявляет
низшую валентность:KNO 2 – нитрит калия. В тех случаях, когда
кислотообразующий элемент образует
кислоты более чем в двух валентных
состояниях, всегда применяют суффикс
«ат». При этом если он проявляет высшую
валентность, добавляют префикс «пер».
Например:KClO 4 –
перхлорат калия. Если кислотообразующий
элемент образует низшую валентность,
применяют суффикс «ит», с добавлением
префикса «гипо». Например:KClO– гипохлорит калия.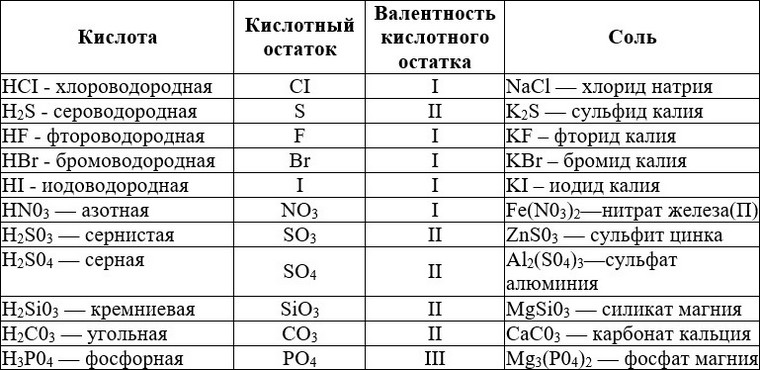 Для солей, образованных
Для солей, образованных
кислотами, содержащими разное количество
воды, добавляются префиксы «мета» и
«орто». Например:NaPO 3 – метафосфат натрия (соль метафосфорной
кислоты),Na 3 PO 4 – ортофосфат натрия (соль ортофосфорной
кислоты). В названии кислой соли вводят
приставку «гидро». Например:Na 2 HPO 4 – гидрофосфат натрия (если в анионе
один атом водорода) и приставку «гидро»
с греческим числительным (если атомов
водорода больше одного) –NaH 2 PO 4 – дигидрофосфат натрия. В названия
основных солей вводится приставка
«гидроксо». Например:FeOHCl– хлорид гидроксожелеза (П).
5.Комплексные соли
– соединения,
образующие при диссоциации комплексные
ионы (заряженные комплексы). При записи
комплексные ионы принято заключать в
квадратные скобки. Например:
Ag(NH 3) 2
Cl = Ag(NH 3) 2 +
+ Cl —
K 2 PtCl 6
= 2K +
+ PtCl 6 2-
Cогласно представлениям,
предложенным А.Вернером, в комплексном
соединении различают внутреннюю и
внешнюю сферы. Так, например, в рассмотренных
комплексных соединениях внутреннюю
сферу составляют комплексные ионыAg(NH 3) 2 + иPtCl 6 2- ,
а внешнюю сферу соответственноCl — и К + . Центральный атом или ион
Центральный атом или ион
внутренней сферы называется
комплексообразователем. В предложенных
соединениях этоAg +1 иPt +4 . Координированные
вокруг комплексообразователя молекулы
или ионы противоположного знака –
лиганды. В рассматриваемых соединениях
это 2NH 3 0 и
6Cl — . Число лигандов
комплексного иона определяет его
координационное число. В предложенных
соединениях оно соответственно равно
2 и 6.
По знаку электрического заряда
различают комплексы
1.Катионные
(координация вокруг
положительного иона нейтральных
молекул):
Zn +2 (NH 3 0) 4 Cl 2 -1 ; Al +3 (H 2 O 0) 6
Cl 3 -1
2.Анионные
(координация
вокруг комплексообразователя в
положительной степени окисления лиганд,
имеющих отрицательную степень окисления):
K 2 +1 Be +2 F 4 -1 ; К 3 +1 Fe +3 (CN -1) 6
3.Нейтральные комплексы
–
комплексные соединения без внешней
сферыPt + (NH 3 0) 2 Cl 2 — 0 .
В отличие от соединений с анионными и
катионными комплексами, нейтральные
комплексы не являются электролитами.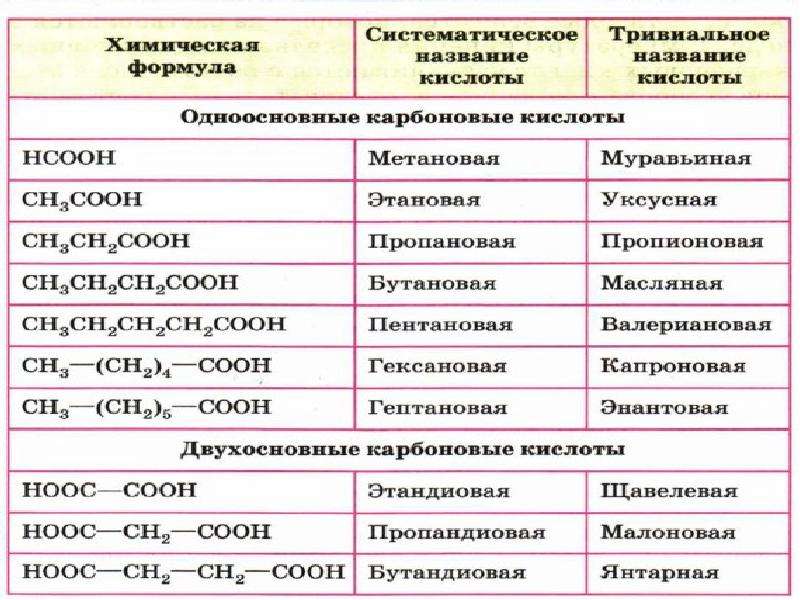
Диссоциация комплексных соединений
на внутреннюю и внешнюю сферы называетсяпервичной
. Протекает она почти
нацело по типу сильных электролитов.
Zn (NH 3) 4 Cl 2
→ Zn
(NH 3) 4
+2 +
2Cl ─
К 3 Fe(CN) 6 → 3 К + +Fe(CN) 6 3 ─
Комплексный ион (заряженный комплекс)
в комплексном соединении образует
внутреннюю координационную сферу,
остальные ионы составляют внешнюю
сферу.
В комплексном соединении K 3
комплексный ион 3- ,
состоящий из комплексообразователя –
ионаFe 3+ и лигандов
– ионовCN ─ , является
внутренней сферой соединения, а ионы
К + образуют внешнюю сферу.
Лиганды, находящиеся во внутренней
сфере комплекса связаны комплексообразователем
значительно прочнее и их отщепление
при диссоциации проходит лишь в
незначительной степени. Обратимая
диссоциация внутренней сферы комплексного
соединения носит название вторичной
.
Fe(CN) 6 3 ─ Fe 3+ + 6CN ─
Вторичная диссоциация комплекса
протекает по типу слабых электролитов.
Алгебраическая сумма зарядов частиц,
образующихся при диссоциации комплексного
иона, равна заряду комплекса.
Названия комплексных соединений,
так же как и названия обычных веществ,
образуются из русских названий катионов
и латинских названий анионов; так же
как и в обычных веществах, в комплексных
соединениях первым называется анион.
Если анион является комплексным, его
название образуется из названия лигандов
с окончанием “о” (Сl — — хлоро, ОН — — гидроксо и т.п.) и
латинского названия комплексообразователя
с суффиксом “ат”; число лигандов как
обычно указывается соответствующим
числительным. Если комплексообразователь
является элементом, способным проявлять
переменную степень окисления, численное
значение степени окисления, как и в
названиях обычных соединений, указывается
римской цифрой в круглых скобках
Пример:Названия комплексных
соединений с комплексным анионом.
K 3
– гексацианоферрат (III)
калия
Комплексные катионы в подавляющем
большинстве случаев в качестве лигандов
содержат нейтральные молекулы воды
Н 2 О, называемые “аква”, или аммиакаNH 3 , называемые
“аммин”. В первом случае комплексные
В первом случае комплексные
катионы называются аквакомплексами,
во втором – аммиакатами. Название
комплексного катиона состоит из названия
лигандов с указанием их количества и
русского названия комплексообразователя
с обозначенным значением его степени
окисления, если это необходимо.
Пример: Названия комплексных соединений
с комплексным катионом.
Cl 2 – хлорид
тетрамминцинка
Комплексы, несмотря на их устойчивость,
могут разрушаться в реакциях, при которых
происходит связывание лигандов в ещё
более устойчивые слабодиссоциирущие
соединения.
Пример: Разрушение гидроксокомплекса
кислотой вследствие образования
слабодиссоциируюших молекул Н 2 О.
K 2 + 2H 2 SO 4 =
K 2 SO 4 + ZnSO 4 + 2H 2 O.
Название
комплексного соединения
начинают с
указания состава внутренней сферы,
потом называют центральный атом и
степень его окисления.
Во внутренней сфере сначала называют
анионы, прибавляя к латинскому названию
окончание «о».
F -1 – фторо Сl — — хлороCN — — цианоSO 2 -2 –сульфито
ОН — — гидроксоNO 2 — — нитрито и т. д.
д.
Затем называют нейтральные лиганды:
NH 3 – аммин Н 2 О
– аква
Число лигандов отмечают греческими
числительными:
I– моно (как правило не
указывается), 2 – ди, 3 – три, 4 – тетра,
5 – пента, 6 –гекса. Далее переходят
к названию центральатома
(комплексообразователя). При этом
учитывают следующее:
Если комплексообразователь входит в
состав катиона, то используют русское
название элемента и в скобках указывают
римскими цифрами степень его окисления;
Если комплексообразователь входит в
состав аниона, то употребляют латинское
название элемента, перед ним указывают
степень его окисления, а в конце прибавляют
окончание – «ат».
После обозначения внутренней сферы
указывают катионы или анионы, находящиеся
во внешней сфере.
При образовании названия комплексного
соединения надо помнить, что лиганды,
входящие в его состав могут быть
смешанными: электронейтральные молекулы
и заряженные ионы; или заряженные ионы
разных видов.
Ag +1 NH 3 2 Cl– хлорид диамин-серебра
(I)
K 3 Fe +3 CN 6 - гексациано (Ш) феррат калия
NH 4 2 Pt +4 OH 2 Cl 4 – дигидроксотетрахлоро (IV)
платинат аммония
Pt +2 NH 3 2 Cl 2 -1 о —
диамминодихлорид-платина х)
Х) в нейтральных комплексах название
комплексообразователя даётся в
именительном падеже
§ 52.
 Названия кислот
Названия кислот
§ 52. Названия кислот
Латинские названия кислот выражаются существительным acidum, i n(кислота) и согласованным с ним прилагательным. Кислоты бывают кислородные и бескислородные.
В названиях кислородных кислот прилагательные образуются путем присоединения к основе названия кислотообразующего элемента суффикса, который характеризует степень окисления.
Максимальная степень окисления — суффикс —ic+ окончание —um (в русской номенклатуре -ная или -овая, -евая):
H2SO4 — acidum sulfuricum — серная кислота
HNO3 — acidum nitricum — азотная кислота
H3AsO4 — acidum arsenicicum — мышьяковая кислота
Низкая степень окисления — суффикс —os+ окончание —um (в русской номенклатуре -истая):
H2SO3 — acidum sulfurosum — сернистая кислота
HNO2 — acidum nitrosum — азотистая кислота
H2AsO3 — acidum arsenicosum — мышьяковистая кислота
Схема образования названий кислородных кислот
|
основа названия кислотообразу-ющего элемента
|
суффикс -ic- (> окисл.
суффикс — os- (< окисл.)
|
окончание
-um
|
По такой же схеме образуются тривиальные названия органических кислот:
уксусная кислота – acidum acetĭcum
лимонная кислота – acidum citrĭcum
В названиях азотсодержащих кислот употребляется только часть основы существительного Nitrogenium – nitr-: азотная кислота — acidum nitricum.
В названия кислот, не содержащих кислород, прилагательные образуются с помощью приставки hydro— и суффикса —ic+ окончание —um:
НСl — acidum hydrochloricum — хлористоводородная (соляная) кислота
HCN — acidum hydrocyanicum — цианистоводородная (синильная) кислота
Схема образования названий кислот, не содержащих кислород
|
приставка
hydro-
|
основа названия кислотообразующего элемента
|
суффикс
-ic-
|
окончание
-um
|
Названия некоторых кислот
|
acĭdum
|
acetĭcum
|
— уксусная кислота
|
|
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
-//-
|
acetylsalicylĭcum
ascorbinĭcum
benzoĭcum
borĭcum
citrĭcum
carbolĭcum
carbonĭcum
formicĭcum
folĭcum
glutaminĭcum
lactĭcum
nicotinĭcum
salicylĭcum
tartarĭcum
arsenicĭcum
arsenicōsum
nitrĭcum
nitrōsum
sulfurĭcum
sulfurōsum
hydrochlorĭcum
hydrobromĭcum
hydroiodĭcum
|
— ацетилсалициловая кислота
— аскорбиновая кислота
— бензойная кислота
— борная кислота
— лимонная кислота
— карболовая кислота
— угольная кислота
— муравьиная кислота
— фолиевая кислота
— глутаминовая кислота
— молочная кислота
— никотиновая кислота
— салициловая кислота
— винная или виннокаменная кислота
— мышьяковая кислота
— мышьяковистая кислота
— азотная кислота
— азотистая кислота
— серная кислота
— сернистая кислота
— хлористоводородная (соляная) кислота
— бромистоводородная кислота
— йодистоводородная кислота
|
15.
 Кислоты.Бескислородные и кислородные кислоты. Номенклатура (название кислот). Химические свойства кислот.
Кислоты.Бескислородные и кислородные кислоты. Номенклатура (название кислот). Химические свойства кислот.
Кислотами называются сложные вещества,
в состав молекул которых входят атомы
водорода, способные замещаться или
обмениваться на атомы металла и кислотный
остаток.
По наличию или отсутствию кислорода в
молекуле кислоты делятся на
кислородсодержащие (h3SO4 серная кислота,
h3SO3 сернистая кислота, HNO3 азотная кислота,
h4PO4 фосфорная кислота, h3CO3 угольная
кислота, h3SiO3 кремниевая кислота) и
бескислородные (HF фтороводородная
кислота, HCl хлороводородная кислота
(соляная кислота), HBr бромоводородная
кислота, HI иодоводородная кислота, h3S
сероводородная кислота).
В зависимости от числа атомов водорода
в молекуле кислоты кислоты бывают
одноосновные (с 1 атомом Н), двухосновные
(с 2 атомами Н) и трехосновные (с 3 атомами
Н). Например, азотная кислота HNO3
Например, азотная кислота HNO3
одноосновная, так как в молекуле её один
атом водорода, серная кислота h3SO4 –
Химические свойства кислот
Растворыв кислот действуют на индикаторы.
Все кислоты (кроме кремниевой) хорошо
растворяются в воде. Специальные
вещества – индикаторы позволяют
определить присутствие кислоты.
Взаимодействуют с основаниями с
образованием воды и соли, в которой
содержится неизменный кислотный остаток
(реакция нейтрализации):
h3SO4 + Ca(OH)2 → CaSO4 + 2 h3O.
Взаимодействуют с основанными оксидами
с образованием воды и соли (реакция
нейтрализации). Соль содержит кислотный
остаток той кислоты, которая использовалась
в реакции нейтрализации:
h4PO4 + Fe2O3 → 2 FePO4 + 3 h3O. двухосновная.
Взаимодействуют с металлами. Для
взаимодействия кислот с металлами
должны выполнятся некоторые условия:
1. металл должен быть достаточно активным
по отношению к кислотам (в ряду активности
металлов он должен располагаться до
водорода). Чем левее находится металл
Чем левее находится металл
в ряду активности, тем интенсивнее он
взаимодействует с кислотами;
2. кислота должна быть достаточно сильной
(то есть способной отдавать ионы водорода
H+).
При протекании химических реакций
кислоты с металлами образуется соль и
выделяется водород (кроме взаимодействия
металлов с азотной и концентрированной
серной кислотами,):
Zn + 2HCl → ZnCl2 + h3↑;
Cu + 4HNO3 → CuNO3 + 2 NO2 + 2 h3O.
16. Соли как продукты взаимодействия кислот и оснований. Типы солей: средние (нормальные), кислые, основные, оксосоли, двойные, комплексные соли. Номенклатура солей. Химические свойства солей.
Соли— это класс химических соединений,
состоящих из ионов металла и ионов
кислотного остатка.
Средние,
или нормальные, соли— это продукты
полного замещения атомов водорода в
кислоте на металл.
Именно с этими солями вы уже знакомы и
знаете их номенклатуру. Например:
Кислые
соли— это продукты неполного замещения
атомов водорода в кислоте на металл.
К кислым солям относят, например, питьевую
соду, которая состоит из катиона металла
и кислотного однозарядного остатка
НСО3. Для кислой кальциевой соли формула
записывается так: Са(НСО3)2.
Названия этих солей складываются из
названий солей с прибавлением слова
гидро, например:
Na2С03
— карбонат натрия, СuSO4 — сульфат меди
(II) и т. д.
Диссоциируют
такие соли на катионы металла и анионы
кислотного остатка
Основные
соли— это продукты неполного замещения
гидроксогрупп в основании на кислотный
остаток.
Например, к таким солям относится
знаменитый малахит (СиОН)2 С03, о котором
вы читали в сказах И. Бажова. Он состоит
нз двух основных катионов СиОН и
двухзарядного аниона кислотного остатка
СО 2- 3.
Катион СuОН+ имеет заряд +1, поэтому в
молекуле два таких катиона и один
двухзарядный анион СО объединены в
электронейтральную соль.
Названия таких солей будут такими же,
как и у нормальных солей, но с прибавлением
слова гидроксо-, например (СuОН)2 СО3 —
гидроксокарбонат меди (II) или АlOНСl2 —
гидроксохлорид алюминия. Подавляющее
Подавляющее
большинство основных солей нерастворимы
или малорастворимы.
Кислоты в лаборатории — правила работы c кислотами в обзорной статье Глювекс
Кислоты часто используются в большинстве химических лабораторий. Прежде чем покупать, хранить, использовать и утилизировать кислоты, важно изучить их свойства, риски и правила работы с кислотами в лаборатории.
Свойства
|
Кислотность
|
Химическая формула
|
Молекулярный вес по формуле соединения
|
Удельная плотность
|
Концентрированная кислота
| |
|
Массовая доля кислоты (в %)
|
Молярность
| ||||
|
Уксусная кислота
|
HC2h4O2
|
60,05
|
1,05
|
99,8
|
17,4
|
|
Соляная кислота
|
HCL
|
36,46
|
1,19
|
37,2
|
12,1
|
|
Азотная кислота
|
HNO3
|
63,02
|
1,42
|
69,5
|
15,8
|
|
Фосфорная кислота
|
h4PO4
|
98,00
|
1,70
|
86
|
14,8
|
|
Серная кислота
|
h3SO4
|
98,08
|
1,84
|
96
|
18,0
|
Меры предосторожности
Концентрированные кислоты оказывают сильное разъедающее воздействие на все ткани организма, в особенности на глаза и кожу. Концентрированные кислоты очень токсичны из-за своей чрезвычайно высокой коррозионной активности. Соляная и уксусная кислоты также токсичны при вдыхании. Другие факторы риска перечислены в этом обзоре. При работе с концентрированными кислотами в лаборатории или растворами всегда носите закрытые очки для защиты от агрессивных жидкостей, химически стойкие перчатки и химически стойкий фартук. Пожалуйста, ознакомьтесь с действующими паспортами безопасности материалов, чтобы узнать подробную информацию о технике безопасности, правилах обращения и утилизации.
Концентрированные кислоты очень токсичны из-за своей чрезвычайно высокой коррозионной активности. Соляная и уксусная кислоты также токсичны при вдыхании. Другие факторы риска перечислены в этом обзоре. При работе с концентрированными кислотами в лаборатории или растворами всегда носите закрытые очки для защиты от агрессивных жидкостей, химически стойкие перчатки и химически стойкий фартук. Пожалуйста, ознакомьтесь с действующими паспортами безопасности материалов, чтобы узнать подробную информацию о технике безопасности, правилах обращения и утилизации.
Покупка
Покупайте, по возможности, разбавленные кислоты для лаборатории. По сравнению с концентрированными кислотами, разбавленные кислотные растворы проще и безопаснее в использовании, хранении и обращении. При работе с растворами вы не потеряете драгоценное время на подготовку.
Покупайте кислоту всегда в небольших количествах. В этом случае кислота не испортится раньше времени, а сам процесс хранения и обработки станет более безопасным и легким. Разлив кислоты в количестве 100 мл ликвидировать намного легче, чем в объеме 2,5 л.
Разлив кислоты в количестве 100 мл ликвидировать намного легче, чем в объеме 2,5 л.
Всегда покупайте концентрированные кислоты в стеклянных бутылках с защитным ПВХ-покрытием. При падении такие бутылки не разобьются, а кислота из них не выльется. ПВХ создает своеобразную пластиковую защитную оболочку, что значительно уменьшает риск разлива и повреждения. ПВХ-покрытие может со временем обесцвечиваться, особенно если подвергается воздействию паров соляной кислоты. Это изменение цвета не влияет на ПВХ-покрытие или качество кислоты внутри бутылки.
Условия хранения
Храните все кислоты в специальном шкафу для сильнодействующих веществ или кислот. Самые лучшие шкафы для хранения кислот в лаборатории изготавливают из дерева, потому что металлические шкафы быстро корродируют под воздействием кислотных паров. Деревянные шкафы обеспечивают безопасное и надежное хранение кислот на протяжении многих лет. Шкаф должен находиться в закрываемом на ключ складе химических реагентов.![]() В противном случае сам шкаф должен закрываться на замок.
В противном случае сам шкаф должен закрываться на замок.
Разрешается хранить кислоты и основания все вместе в одном шкафу для агрессивных веществ. При этом на бутылках может образоваться налет из хлорида аммония под воздействием паров соляной кислоты и аммиака. Промойте шкаф и бутылки при помощи тринатрийфосфата или другого сильного растворителя, чтобы удалить белую пленку.
Если у вас нет специального шкафа для хранения кислот, храните концентрированную кислоту в кубических контейнерах. Такие кубы обеспечивают надежное хранение кислот в лаборатории за счет дополнительной защитной оболочки.
Прежде чем поместить подготовленные растворы кислот на хранение, промаркируйте их с указанием как минимум следующей информации: название кислоты, концентрация кислоты, предупреждение об опасности или о вредном воздействии на организм человека, дата.
Техника безопасности при работе с кислотами
Всегда закрывайте бутылки с концентрированной кислотой крышками с соответствующей цветовой маркировкой. Никогда не используйте эти крышки на других бутылках. Цветовая маркировка является дополнительной мерой безопасности и позволяет идентифицировать концентрированные кислоты в тех случаях, когда этикетка была удалена или повреждена.
Никогда не используйте эти крышки на других бутылках. Цветовая маркировка является дополнительной мерой безопасности и позволяет идентифицировать концентрированные кислоты в тех случаях, когда этикетка была удалена или повреждена.
Если при работе с кислотой в лаборатории крышка на бутылке треснула или потеряла изначальный цвет, замените крышку на новую с соответствующей цветовой маркировкой.
Учитывая то, что концентрированная соляная кислота постоянно испаряется, при хранении следует предусмотреть отвод возникающих паров. Эти пары являются главным виновником повреждений на вашем складе химических реагентов, вызванных коррозией. Хранение соляной кислоты в деревянном шкафу для кислот является обязательным требованием. Пары соляной кислоты быстро разъедают металлические шкафы.
Азотная кислота является сильным окислителем. Концентрированную азотную кислоту следует хранить в отдельном непроницаемом для жидкостей отсеке внутри шкафа для кислот. Если смешать азотную кислоту с горючим органическим соединением, например, уксусной кислотой, то тепла, образовавшегося от реакций окисления и нейтрализации, будет достаточно для воспламенения этого соединения. Азотная кислота также способна медленно разрушать красную пластиковую крышку бутылки. Азотная кислота может также со временем желтеть вследствие выделения диоксида азота под действием света.
Азотная кислота также способна медленно разрушать красную пластиковую крышку бутылки. Азотная кислота может также со временем желтеть вследствие выделения диоксида азота под действием света.
Ледяная уксусная кислота является горючей жидкостью. Ледяную уксусную кислоту следует хранить в шкафу для кислот, в месте, защищенном от возможного контакта с азотной кислотой. Ледяная уксусная кислота замерзает при температуре +16,6 ° C. Кислота может кристаллизоваться на холодном складе. Если это произошло, дайте бутылке нагреться до температуры окружающей среды (+25 °C).
Концентрированная серная кислота является сильным обезвоживающим агентом. Сильной способностью поглощать воду объясняется и обугливание многих органических веществ, например, сахара, древесины, бумаги, при действии на них концентрированной серной кислоты. Если серная кислота приобрела коричневый цвет, значит, скорее всего, она была загрязнена органическими веществами и больше уже не является чистой.
Концентрированная фосфорная кислота имеет температуру плавления, близкую к температуре окружающей среды, и также может кристаллизоваться на холодном складе. Фосфорная кислота гигроскопична и имеет свойство впитывать влагу из воздуха. Храните емкости с фосфорной кислотой плотно закрытыми.
Фосфорная кислота гигроскопична и имеет свойство впитывать влагу из воздуха. Храните емкости с фосфорной кислотой плотно закрытыми.
Транспортировка
Вторичная защитная оболочка имеет решающее значение для предотвращения крупных разливов или аварий при транспортировке кислот. Храните кислоты в бутылках с ПВХ-покрытием или на небьющихся держателях для бутылок.
Возьмите себе за правило проверять наличие трещин на бутылке с кислотой, прежде чем прикасаться к ней или брать ее. Проверьте также, не пролилась ли кислота на ручку или бутылку.
Носите 2,5-литровые бутылки с кислотой, взявшись одной рукой за дно бутылки, а другой рукой обхватив горлышко или углубление для пальцев. В этом случае вы будете держать бутылку ближе к телу, и опасность разбить или повредить бутылку при контакте с острыми предметами, например, при ударе об угол стола, будет снижена.
При транспортировке кислот из одной лаборатории в другую или из кладовой (склада) в лабораторию, следует использовать пластиковые или резиновые защитные держатели для бутылок.
Если вы используете тележку для перевозки опасных химических веществ (например, кислот), поместите совместимые химические вещества во вторичный защитный контейнер, изготовленный из небьющихся материалов, например, в пластиковый лоток. Тележка должна иметь защитное ограждение, чтобы не допустить соскальзывания пластиковых лотков или бутылок.
Если опасные химические вещества перемещаются с одного этажа на другой, используйте, по возможности, лифт. И даже несмотря на то, что несчастные случаи в лифтах происходят редко, соблюдайте необходимую предосторожность. Если утечка материала в лифте все же произойдет, последствия для пассажиров, находящихся в кабине лифта, могут оказаться весьма плачевными.
Подготовка раствора
- Добавьте необходимое количество кислоты — примерно 2/3 от заданного количества дистиллированной или деионизированной воды.
- Всегда добавляйте кислоту в воду! Работая с кислотами в лаборатории, никогда не добавляйте воду в концентрированные кислоты.
 Кислота может начать разбрызгиваться с выделением кислотных паров.
Кислота может начать разбрызгиваться с выделением кислотных паров. - Всегда используйте посуду из боросиликатного стекла.
- Перемешайте раствор.
- Как только раствор остынет до температуры окружающей среды, разбавьте его водой до нужного объема.
- Используйте мерную лабораторную колбу, чтобы точно определить необходимое количество.
- При разбавлении серной кислоты, поместите боросиликатный стакан или колбу в ледяную ванну. Не забывайте о том, что разбавление серной кислоты всегда сопровождается выделением большого количества тепла. Пластиковые контейнеры под воздействием тепла могут расплавиться, а стеклянная посуда, изготовленная не из боросиликатного стекла, может треснуть.
Использование и дозирование кислот
Перед каждым использованием любого опасного материала в лаборатории следует внимательно ознакомиться с паспортом безопасности материала.
Разливайте кислоты из небольших бутылок, чтобы ограничить возможные утечки и испарения.
При дозировании кислот, используйте лабораторные коврики и/или пластиковые лотки для сбора случайно пролившейся кислоты.
Дозирование кислот, особенно соляной, азотной и уксусной, производите в функционирующем вытяжном шкафу.
В процессе лабораторных работ установите бутылку с кислотой на центральную площадку дозирования и поставьте градуированный цилиндр или контрольную пробирку в зону дозирования. Это поможет минимизировать разливы и несчастные случаи, а также ограничить количество кислоты, возвращаемой обратно на лабораторный стенд.
Вылейте необходимое для эксперимента количество кислоты из бутылки с реактивом. Запрещается помещать химические вещества обратно в бутылку с реактивом.
Держите наготове материалы для ликвидации разливов кислот при работе с ними.
Кислоты являются химически агрессивными веществами и разъедают большинство тканей, в результате чего на одежде образуются небольшие дырки. Этот процесс происходит не сразу, а в течение нескольких часов и может не проявляться до тех пор, пока одежда не будет постирана.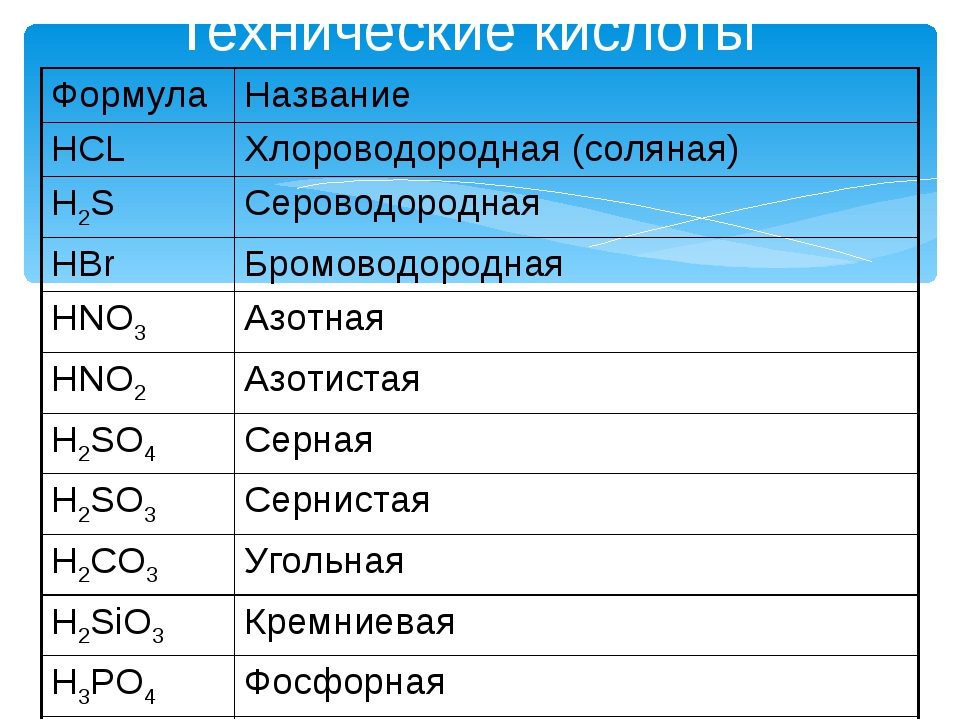 При работе с кислотами всегда носите химически стойкий фартук или лабораторный халат.
При работе с кислотами всегда носите химически стойкий фартук или лабораторный халат.
Средства индивидуальной защиты и инструкции по технике безопасности
Перчатки из нитрильного каучука устойчивы к воздействию кислот и являются оптимальным средством защиты при работе с концентрированными кислотами. Однако любые полимерные или виниловые перчатки способны обеспечить некоторую защиту от случайных брызг, небольших разливов, которые могут возникнуть при использовании или дозировании кислот.
Средства для аварийного промывания глаз должны быть доступны в любом кабинете или лаборатории, в которых проводятся работы с кислотами или растворами кислот. Средство для аварийного промывания глаз должно обеспечивать промывку обоих глаз и подачу чистой питьевой воды как минимум в течение 15-20 минут.
При работе с кислотами в лаборатории или кислотными растворами следует носить закрытые очки для защиты от агрессивных жидкостей. Защитные очки не являются надлежащим средством индивидуальной защиты.
Следует обеспечить надлежащую вентиляцию при работе с соляной, азотной или уксусной кислотами.
Прежде чем работать с кислотами или кислотными растворами, убедитесь в наличии подходящих материалов и средств для ликвидации разливов (песок, абсорбент и нейтрализующий агент).
Меры по оказанию первой помощи
- Всегда обращайтесь за профессиональной медицинской помощью, если вы подверглись воздействию любого опасного химического вещества, особенно концентрированных кислот в лаборатории.
- При любом химическом воздействии на ткани тела или глаза лучше всего немедленно промыть их водой.
- Если кислота попала в глаза, промывайте глаза в течение как минимум 15-20 минут, воспользовавшись средством аварийного промывания глаз. Держите веки открытыми, чтобы тщательно промыть глаза.
- Если кислота попала на открытые участки кожи, промывайте их водой не менее 15-20 минут.
- Если брызги кислоты попали на одежду, сразу же снимите ее, не допуская проникновение кислоты через одежду и контакта с кожей.
 Если брызги кислоты попали на кожу и одежду, немедленно промойте пораженные участки водой (аварийный душ идеально подходит для этих целей), после чего снимите загрязненную одежду. Не ограничивайте себя в средствах защиты перед потенциальной опасностью химических ожогов.
Если брызги кислоты попали на кожу и одежду, немедленно промойте пораженные участки водой (аварийный душ идеально подходит для этих целей), после чего снимите загрязненную одежду. Не ограничивайте себя в средствах защиты перед потенциальной опасностью химических ожогов. - При попадании кислоты в желудок, первое, что нужно предпринять, — это попытаться разбавить кислоту в желудке и предотвратить дальнейшие травмы, вызванные рвотой. Если пострадавший находится в сознании, немедленно попросите его прополоскать рот водой. Попросите пострадавшего выпить одну или две чашки воды или молока. Можно также дать пострадавшему антациды, т. е. препараты для нейтрализации желудочной кислоты. Не вызывайте рвоту, не пытайтесь нейтрализовать кислоту сильным основанием и не давайте пострадавшему бикарбонат натрия или газированные напитки. Позвоните в скорую помощь и следуйте их указаниям.
Комплексное оснащение химических лабораторий
Компания Gluvex выполняет проектирование и комплексное оснащение химических лабораторий всеми видами качественного лабораторного оборудования. Возможно расширение функционала текущих отделений или организация новых. Гарантируется полное соответствие всем нормативно-правовым актам страны клиента и международным стандартам GLP, ISO/IEC 17025, ISO 15189, ISO 7218-2015 и другим.
Возможно расширение функционала текущих отделений или организация новых. Гарантируется полное соответствие всем нормативно-правовым актам страны клиента и международным стандартам GLP, ISO/IEC 17025, ISO 15189, ISO 7218-2015 и другим.
Ваши преимущества с Gluvex:
- Грамотная разработка проектной документации.
- Тесное сотрудничество с клиентом и его подрядчиками.
- Создание лабораторий «под ключ».
- Возможность интеграции в существующую среду.
- Оснащение ведущим европейским оборудованием.
- Доставка в любой регион РФ.
- Установка, наладка и калибровка всех устройств.
- Оптимизация под бюджет клиента без потери качества.
- Последовательное обучение персонала.
- Гарантия и фирменный сервис.
- Расходные материалы всегда в наличии.
- Быстрая поставка запасных частей.
- Своевременные консультации и техническая поддержка.
Специалисты Gluvex уверенно решают задачи любой сложности.
Свяжитесь с нами по телефону +7 (499) 270-16-62 и убедитесь в этом!
классификация, свойства, получение и применение In-chemistry.ru
Кислоты (неорганические, минеральные) — это сложные соединения состоящие из катиона водорода (H+) и аниона кислотного остатка(SO32-, SO42-, NO3— и т.д).
Кислотам дали такое название не просто так. Большинство из них имеют кислый вкус. С некоторыми из них знаком каждый из вас. Это, например, уксусная кислота, которая есть в каждом доме, аскорбиновая кислота (она же витамин C), лимонная кислота и т.д. Но не стоит все кислоты пробовать на вкус. Кислоты являются очень едкими веществами. Даже всем нам привычная и известная аскорбиновая кислота в большой концентрации будет вредна нашему организму. А от более сильных кислот — серной, соляной и даже уксусной — можно получить очень сильные ожоги, вплоть до летального исхода. Поэтому при работе с кислотами нужно быть осторожными, а также соблюдать технику безопасности!!!
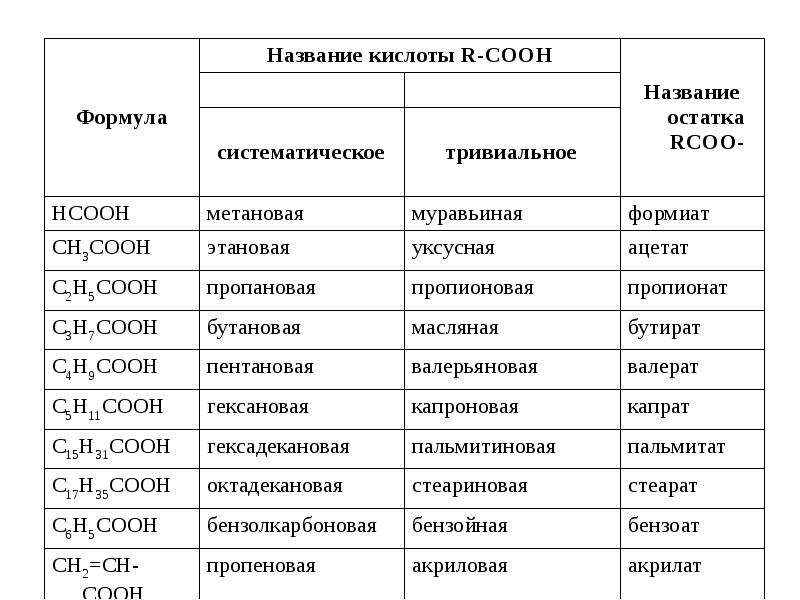
Таблица названий некоторых кислот и их солей
| Название кислоты | Формула | Название соли |
|---|---|---|
| Серная | H2SO4 | Сульфат |
| Сернистая | H2SO3 | Сульфит |
| Сероводородная | H2S | Сульфид |
| Соляная (хлористоводородная) | HCl | Хлорид |
| Фтороводородная (плавиковая) | HF | Фторид |
| Бромоводородная | HBr | Бромид |
| Йодоводородная | HI | Йодид |
| Азотная | HNO3 | Нитрат |
| Азотистая | HNO2 | Нитрит |
| Ортофософорная | H3PO4 | Фосфат |
| Угольная | H2CO3 | Карбонат |
| Кремниевая | H2SiO3 | Силикат |
| Уксусная | CH3COOH | Ацетат |
Классификация кислот
| По содержанию кислорода | |
|---|---|
| Кислородсодержащие (H2SO4) | Бескислородные (HCl) |
| По количеству содержащихся катионов водорода (H+) | ||
|---|---|---|
| Одноосновные (HCl) | Двухосновные (H2SO4) | Трёхосновные (H3PO4) |
Понятие «одноосновная кислота» произошло по причине того, что для нейтрализации одной молекулы одноосновной кислоты нам понадобится одна молекула основания. для двухосновной — соответственно две молекулы и т. д.
| По растворимости (в воде) | |
|---|---|
| Растворимые (HCl) | Нерастворимые (H2SiO3) |
| По силе (степени диссоциации) | |
|---|---|
| Сильные (H2SO4) | Слабые (CH3COOH) |
| По летучести | |
|---|---|
| Летучие (H2S) | Нелетучие (H2SO4) |
| По устойчивости | |
|---|---|
| Устойчивые (H2SO4) | Неустойчивые (H2CO3) |
Свойства кислот
Изменение цвета индикаторов в кислой среде
| Индикатор | Нейтральная среда | Кислая среда |
|---|---|---|
| Метилоранж | оранжевый | красный |
| Лакмус | фиолетовый | красный |
| Фенолфталеин | бесцветный | бесцветный |
| Бромтимоловый синий | зеленый | желтый |
| бромкрезоловый зеленый | синий | желтый |
Химические свойства кислот
- Взаимодействие с металлами (в ряду активности находящихся до водорода), протекает с выделением газообразного водорода и образованием солей:
H2SO4 + 2Na → Na2SO4 + H2↑
Металлы, находящиеся в ряду активности после водорода, не вступают в реакцию с кислотой (кроме концентрированной серной кислоты).
Азотная и концентрированная серная кислоты проявляют свойства окислителей, и продукты реакций будут зависеть от концентрации, температуры и природы восстановителя.
- Взаимодействуют с оксидами основных и амфотерных металлов с образованием солей и воды:
H2SO4 + MgO → MgSO4 + H2O
- С основаниями, с образованием солей и воды (так называемая реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + H2O
- Кислоты могут взаимодействовать с солями, если в результате реакции будет образовываться нерастворимая соль, или выделяться газ:
H2SO4 + K2CO3 → K2SO4 + H2O + CO2↑
- Сильные кислоты могут вытеснять из солей более слабые кислоты:
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Получение кислот
- Взаимодействие кислотного оксида с водой:
H2O + SO3 →H2SO4
- Взаимодействие водорода и неметалла:
H2 + Cl2 → 2HCl
- Вытеснение слабой кислоты из солей, более сильной кислотой:
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Применение кислот
В настоящее время, минеральные и органические кислоты находят множество сфер применения.
Серная кислота (H2SO4), находит широкое применение в химической технологии, для производства лакокрасочных материалов, производстве минеральных удобрений, в пищевой промышленности (пищевая добавка Е513), в качестве электролита в производстве аккумуляторных батарей.
Раствор двухромовокислого калия в серной кислоте (хромовая смесь) используются в лабораториях для мытья химической посуды. Являясь сильным окислителем, хромка позволяет отмывать посуду от следов загрязнений органическими веществами. Так же, хромовая смесь используется в органическом синтезе.
Борная кислота (H3BO3) используется в медицине как антисептик, в качестве флюса при пайке металлов, как борсодержащее удобрение, в домашнем хозяйстве используется как средство от тараканов.
Широко известны в домашнем использовании при выпечке уксусная и лимонная кислоты. Также в быту их используют для удаления накипи.
Знакомая всем с детства аскорбиновая кислота, более известная в народе как витамин С, применяется при лечении простудных заболеваний.
Азотная кислота (HNO3) находит применение при производстве взрывчатых веществ, при производстве минеральных азотсодержащих удобрений (аммиачная, калиевая селитра), в производстве лекарственных средств (нитроглицерин).
классификация, номенклатура, физические и химические свойства
Из материалов урока Вы познакомитесь с разными способами классификации кислот, расширите свои знания о физических и химических свойствах кислот.
I. Посмотрите видео-презентацию
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
Состав кислот отражен в их названии. Например, у бескислородных кислот название всегда включает название элемента и слово «водородная»:
HCl – хлороводородная, h3S – сероводородная.
Названия кислородсодержащих кислот тоже подчиняются определенным правилам. К названию химического элемента прибавляется суффикс н или ов(ев) и окончание –ая, если число атомов кислорода в молекуле кислоты наибольшее:
H2SO4 — серная
HNO3 – азотная
H2SiO3 — кремниевая
Если в молекуле кислоты число атомов кислорода меньше максимального, то часто в названии используют суффикс ист:
H2SO3 – сернистая
HNO2 – азотистая
Это интересно
Всегда ли кислоты называли кислотами?
Названия неорганических кислот долгое время никак не были связаны с присущим им кислым вкусом. Так, серную кислоту называли купоросным маслом или купоросным спиртом, хлороводородную (соляную) кислоту — соляным спиртом или кислым спиртом, азотную кислоту — селитряной дымистой водкой или крепкой водкой; смесь азотной и хлороводородной кислот называли царской водкой. Названия эти пришли из языка алхимиков и не отражали особенностей строения кислот.
II. Классификация кислот
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
2. По составу:
а) Таблица кислород содержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
|
Кислота (НnА)
|
Кислотный остаток (А)
|
Соответствующий кислотный оксид
|
|
HClO4 хлорная
|
ClO4 (I) перхлорат
|
Cl2O7 оксид хлора (VII )
|
|
H2SO4 серная
|
SO4 (II) сульфат
|
SO3 оксид серы (VI ), серный ангидрид
|
|
HNO3 азотная
|
NO3 (I) нитрат
|
N2O5 оксид азота ( V )
|
|
HMnO4 марганцовая
|
MnO4 (I) перманганат
|
Mn2O7 оксид марганца (VII )
|
|
H2SO3 сернистая
|
SO3 (II) сульфит
|
SO2 оксид серы (IV )
|
|
H3PO4 ортофосфорная
|
PO4 (III) ортофосфат
|
P2O5 оксид фосфора (V )
|
|
HNO2 азотистая
|
NO2 (I) нитрит
|
N2O3 оксид азота (III )
|
|
H2CO3 угольная
|
CO3 (II) карбонат
|
CO2 оксид углерода ( IV), углекислый газ
|
|
H2SiO3 кремниевая
|
SiO3 (II) силикат
|
SiO2 оксид кремния (IV)
|
б) Таблица бескислородных кислот
|
Кислота (НnА)
|
Кислотный остаток (А)
|
|
HCl соляная, хлороводородная
|
Cl (I) хлорид
|
|
H2S сероводородная
|
S(II) сульфид
|
|
HBr бромоводородная
|
Br (I) бромид
|
|
HI йодоводородная
|
I(I) йодид
|
|
HF фтороводородная, плавиковая
|
F(I) фторид
|
III. Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
H2SO3 HClO4 HNO3
IV. Способы получения кислот
|
Бескислородные
|
Кислородсодержащие
|
|
HCl, HBr, HI, HF, H2S
|
HNO3, H2SO4 и другие
|
|
ПОЛУЧЕНИЕ
| |
|
1. Прямое взаимодействие неметаллов
H2 + Cl2 = 2 HCl
|
1. Кислотный оксид + вода = кислота
SO3 + H2O = H2SO4
|
|
2. Реакция обмена между солью и менее летучей кислотой
2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl
| |
V. Химические свойства кислот
1. Изменяют окраску индикаторов
|
Название индикатора
|
Нейтральная среда
|
Кислая среда
|
|
Лакмус
|
Фиолетовый
|
Красный
|
|
Фенолфталеин
|
Бесцветный
|
Бесцветный
|
|
Метилоранж
|
Оранжевый
|
Красный
|
|
Универсальная индикаторная бумага
|
Оранжевая
|
Красная
|
2.Реагируют с металлами в ряду активности до H2 (искл. HNO3 –азотная кислота)
Видео: «Взаимодействие кислот с металлами»
Ме + КИСЛОТА =СОЛЬ + H2↑ (р. замещения)
Zn + 2 HCl = ZnCl2 + H2
3. С основными (амфотерными) оксидами – оксидами металлов
Видео: «Взаимодействие оксидов металлов с кислотами»
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
CuO + H2SO4 = Cu SO4 + H2O
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
H3PO4 + 3NaOH = Na3PO4 + 3H2O
5. Реагируют с солями слабых, летучих кислот — если образуется кислота, выпадающая в осадок или выделяется газ:
2NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl↑ ( р. обмена)
|
Сила кислот убывает в ряду:
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2>H2CO3 > H2S > H2SiO3 .
Каждая предыдущая кислота может вытеснить из соли последующую
|
Видео: «Взаимодействие кислот с солями»
6. Разложение кислородсодержащих кислот при нагревании ( искл. H2SO4; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду:
H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
Сероводородная кислота в продуктах выделяется в виде газа: СаS + 2HCl = H2S↑ + CaCl2
Видео: «Химические свойства соляной кислоты»
VI. Значение кислот
Роль кислот в нашей жизни трудно не заметить. Во-первых, в желудочном соке человека и животных содержится слабый раствор соляной кислоты. Муравьиная кислота, которая относится к группе органических кислот, содержится в жидкости, выделяемой муравьями, и ожог от крапивы обусловлен действием на кожу именно этой кислоты.
Рис. 1. Кислоты в природе (в лимонном соке содержится лимонная кислота; в жидкости, выделяемой муравьями – муравьиная кислота)
На этикетке многих газированных фруктовых напитков написано, что в их состав входит фосфорная кислота. Азотная кислота используется в производстве минеральных удобрений и взрывчатых веществ. Серную кислоту применяют в производстве аккумуляторных батарей.
VII. Техника безопасности приработе с кислотами
Анимация: Оказание первой помощи при попадании кислот на кожу
Анимация: Правила техники безопасности при работе с кислотами
Анимация: Правило разбавления концентрированной серной кислоты водой
VIII. Задания для закрепления
Задание №1. Распределите химические формулы кислот в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI, HClO4, HBr, CaCl2, Na2O, HCl, H2SO4, HNO3, HMnO4, Ca(OH)2, SiO2, H2SO3, Zn(OH)2, H3PO4, HF, HNO2,H2CO3, N2O, NaNO3, H2S, H2SiO3
|
Кислоты
| ||||||
|
Бескислородные
|
Кислородосодержащие
|
Растворимые
|
Нерастворимые
|
Одноосновные
|
Двухосновные
|
Трёхосновные
|
Задание №2. Составьте уравнения реакций:
Ca + HCl =
Na + H2SO4 =
Al + H2S =
Ca + H3PO4 =
Назовите продукты реакции.
Задание №3. Составьте уравнения реакций, назовите продукты:
Na2O + H2CO3 =
ZnO + HCl =
CaO + HNO3 =
Fe2O3 + H2SO4 =
Задание №4. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
KOH + HNO3 =
NaOH + H2SO3 =
Ca(OH)2 + H2S =
Al(OH)3 + HF =
HCl + Na2SiO3 =
H2SO4 + K2CO3 =
HNO3 + CaCO3 =
Назовите продукты реакции.
IX. Тренажеры
Тренажёр №1. «Формулы и названия кислот»
Тренажёр №2. » Установление соответствия: формула кислоты — формула оксида»
Тренажёр №3. «Действие кислот на индикаторы»
Тренажёр №4. «Классификация кислот по наличию кислорода в кислотном остатке»
Тренажёр №5. «Классификация кислот по основности»
Тренажёр №6. «Классификация кислот по растворимости в воде»
Тренажёр №7. «Классификация кислот по стабильности»
Интерактивное задание LearningApps.org по теме: “Химические свойства кислот и оснований”
Выполните тест
Выполните итоговый контроль по теме: “Кислоты”
ЦОРы
Видео-презентация: “Кислоты”
Видео-опыт: «Действие кислот на индикаторы»
Видео-опыт: «Взаимодействие кислот с металлами»
Видео-опыт: «Взаимодействие оксидов металлов с кислотами»
Практическая работа: «Реакция обмена между оксидом меди (II) и серной кислотой»
Видео-опыт: «Реакция нейтрализации»
Видео-опыт: «Взаимодействие кислот с солями»
Видео-опыт: «Химические свойства соляной кислоты»
Анимация: “Оказание первой помощи при попадании кислот на кожу”
Анимация: “Правила техники безопасности при работе с кислотами”
Анимация: “Правило разбавления концентрированной серной кислоты водой”
Урок 20. получение и химические свойства кислот — Химия — 8 класс
Урок
Конспект
Дополнительные материалы
Конспект
Получение и химические свойства кислот
Эти химические вещества являются одним из главных классов неорганических соединений. Получили они своё название из-за вкуса. Эти соединения являются одними из самых реакционноспособных веществ. Это кислоты.
Способы получения кислот зависят от их состава.
Бескислородные кислоты получаются при взаимодействии простых веществ: h3 + Cl2 = 2HCl.
Кислородосодержащие кислоты получаются при взаимодействии кислотных оксидов с водой: SO3 + h3O = h3SO4.
При взаимодействии солей с кислотами получается другая кислота и другая соль: 2NaNO3 + h3SO4 = 2HNO3 + Na2SO4
Чтобы узнать, что в результате реакции образовалась кислота, необходимо использовать знания о химических свойствах кислот. Кислоты изменяют окраску индикаторов лакмуса и метилоранжа: лакмус становится красным, а метилоранж – розовым.
Кислоты могут взаимодействовать с металлами. Возможность протекания химической реакции зависит от положения металла в электрохимическом ряду напряжения металлов. Металлы, стоящие до водорода в ряду активности металлов, вытесняют водород из кислот. Реакция между металлом и кислотой протекает с образованием соли и водорода.
Fe + 2HCl = FeCl2 + h3↑
Чтобы получить соли металлов, стоящих после водорода, используем другие свойства кислот. Кислоты взаимодействуют с оксидами металлов. Реакция между основным оксидом и кислотой протекает с образованием соли и воды.
MgO + h3SO4 = MgSO4 + h3O
Кислоты и основания могут нейтрализовать друг друга с образованием соли и воды.
HCl + NaOH = NaCl + h3O
Другие общие свойства кислот, а также их специфические свойства будут рассмотрены в ходе дальнейшего изучения химии.
3.6b: Присвоение названий кислотам и основаниям
Целью обучения этого модуля является определение и обозначение некоторых распространенных кислот и оснований.
Для наших целей в этом месте текста мы можем определить кислоту как вещество, по крайней мере, с одним атомом водорода, которое может диссоциировать с образованием аниона и иона H + (протона) в водном растворе, тем самым образуя кислый раствор. Мы можем определить основания как соединения, которые производят гидроксид-ионы (OH — ) и катион при растворении в воде, образуя, таким образом, щелочной раствор.Растворы, которые не являются ни щелочными, ни кислыми, являются нейтральными. Мы обсудим химию кислот и оснований более подробно позже, но в этом разделе мы опишем номенклатуру обычных кислот и определим некоторые важные основания, чтобы вы могли узнать их в будущих обсуждениях. Чистые кислоты и основания и их концентрированные водные растворы обычно встречаются в лаборатории. Обычно они очень едкие, поэтому с ними нужно обращаться осторожно.
Кислоты
Названия кислот различаются между (1) кислотами, в которых ион H + присоединен к атому кислорода многоатомного аниона (они называются оксокислотами, или иногда оксикислотами), и (2) кислотами, в которых ион H + Ион прикреплен к какому-то другому элементу.В последнем случае название кислоты начинается с гидро- и заканчивается на -ic, с корнем названия другого элемента или иона между ними. Напомним, что название аниона, производного от этой кислоты, всегда оканчивается на -ид. Таким образом, газообразный хлористый водород (HCl) растворяется в воде с образованием соляной кислоты (которая содержит ионы H + и Cl —), газ цианистого водорода (HCN) образует синильную кислоту (которая содержит H + и CN — ). ионы) и т. д. (Таблица 2.8). Примеры такого типа кислоты встречаются часто и очень важны. Например, ваш желудок содержит разбавленный раствор соляной кислоты, который помогает переваривать пищу. Когда механизмы, препятствующие перевариванию желудка, срабатывают, кислота разрушает слизистую оболочку желудка и образуется язва.
| Обратите внимание на узор |
|---|
| Кислоты различаются по тому, присоединен ли ион H + к атому кислорода многоатомного аниона или к какому-либо другому элементу. |
Таблица 2.8 Некоторые распространенные кислоты, не содержащие кислород
| Формула | Название в водном растворе | Название газообразных веществ |
|---|---|---|
| ВЧ | плавиковая кислота | фтороводород |
| HCl | соляная кислота | хлористый водород |
| HBr | бромистоводородная кислота | бромистый водород |
| HI | иодистоводородная кислота | йодистый водород |
| HCN | синильная кислота | цианистый водород |
| H 2 S | Кислота сероводородная | сероводород |
Если кислота содержит один или несколько ионов H + , прикрепленных к кислороду, это производное одного из обычных оксоанионов, такого как сульфат (SO 4 2-) или нитрат (NO 3 — ).Эти кислоты содержат столько ионов H +, сколько необходимо для уравновешивания отрицательного заряда аниона, в результате чего образуются нейтральные частицы, такие как H 2 SO 4 и HNO 3 .
Названия кислот образованы от названий анионов в соответствии со следующими правилами:
- Если название аниона оканчивается на -ат, то название кислоты оканчивается на -ик. Например, поскольку NO 3 — — это нитрат-ион, HNO 3 — это азотная кислота.Аналогично, ClO 4 — — это перхлорат-ион, поэтому HClO 4 — это хлорная кислота. Двумя важными кислотами являются серная кислота (H 2 SO 4 ) из сульфат-иона (SO 4 2-) и фосфорная кислота (H 3 PO 4 ) из фосфат-иона (PO ). 4 3-). Эти два названия используют небольшой вариант корня названия аниона: сульфат становится серным, а фосфат становится фосфорным.
- Если название аниона оканчивается на -ite, то название кислоты оканчивается на -ous.Например, OCl — — это ион гипохлорита, а HOCl — хлорноватистая кислота; NO 2 — — нитрит-ион, а HNO 2 — азотистая кислота; и SO 3 2- представляет собой сульфит-ион, а H 2 SO 3 представляет собой сернистую кислоту. Используются одни и те же корни независимо от того, заканчивается ли название кислоты на -ic или -ous; таким образом, сульфит становится сернистым.
Взаимосвязь между названиями оксокислот и исходных оксоанионов проиллюстрирована на рисунке 2.20, а некоторые распространенные оксокислоты представлены в таблице 2.9.
Рисунок 2.20 Связь между названиями оксокислот и названиями родительских оксоанионов
Таблица 2.9 Некоторые распространенные оксокислоты
| Формула | Имя |
|---|---|
| \ (HNO_2 \) | азотистая кислота |
| \ (HNO_3 \) | азотная кислота |
| \ (H_2SO_3 \) | сернистая кислота |
| \ (H_2SO_4 \) | серная кислота |
| \ (H_3PO_4 \) | фосфорная кислота |
| \ (H_2CO_3 \) | угольная кислота |
| \ (HClO \) | хлорноватистая кислота |
| \ (HClO_2 \) | хлорноватистая кислота |
| \ (HClO_3 \) | хлорная кислота |
| \ (HClO_4 \) | хлорная кислота |
Пример 11 |
|---|
Назовите и дайте формулу каждой кислоты. а. кислота, образующаяся при добавлении протона к иону гипобромита (OBr — ) г. кислота, образованная добавлением двух протонов к селенат-иону (SeO 4 2-) Дано : анион Запрошено : исходная кислота Стратегия : См. Таблицу 2.8 «Некоторые распространенные кислоты, не содержащие кислород» и Таблицу 2.9 «Некоторые распространенные оксокислоты», чтобы найти название кислоты.Если кислоты нет в списке, воспользуйтесь приведенными ранее рекомендациями. Решение : Ни один из видов не указан в таблице 2.8 «Некоторые распространенные кислоты, не содержащие кислород» или в таблице 2.9 «Некоторые распространенные оксокислоты», поэтому мы должны использовать информацию, приведенную ранее, чтобы получить название кислоты из названия многоатомного аниона. а. Название аниона, гипобромит, оканчивается на -ит, поэтому название исходной кислоты оканчивается на -ит. Таким образом, кислота представляет собой гипобромистую кислоту (HOBr). г. Селенат заканчивается на -ate, поэтому название исходной кислоты заканчивается на -ic. Следовательно, кислота представляет собой селеновую кислоту (H 2 SeO 4 ). Упражнение Назовите и дайте формулу каждой кислоты. а. кислота, образованная добавлением протона к пербромат-иону (BrO 4 — ) г. кислота, образованная добавлением трех протонов к иону арсенита (AsO 3 3-) Ответ : а.надбромовая кислота; HBrO 4 г. мышьяковистая кислота; H 3 AsO 3 |
Многие органические соединения содержат карбонильную группу, в которой имеется двойная связь углерод-кислород. В карбоновых кислотах группа –ОН ковалентно связана с атомом углерода карбонильной группы. Их общая формула — RCO 2 H, иногда обозначаемая как RCOOH:
.
, где R может быть алкильной группой, арильной группой или атомом водорода.Простейшим примером HCO 2 H является муравьиная кислота, названная так потому, что она содержится в выделениях жалящих муравьев (от латинского formica, что означает «муравей»). Другой пример — уксусная кислота (CH 3 CO 2 H), которая содержится в уксусе. Как и многие кислоты, карбоновые кислоты имеют резкий запах. Например, масляная кислота (CH 3 CH 2 CH 2 CO 2 H) отвечает за запах прогорклого масла, а характерный запах кислого молока и рвоты возникает из-за молочной кислоты [CH 3 CH (OH) CO 2 H].Некоторые распространенные карбоновые кислоты показаны на рис. 2.21.
Рисунок 2.21 Некоторые общие карбоновые кислоты
Хотя карбоновые кислоты являются ковалентными соединениями, когда они растворяются в воде, они диссоциируют с образованием ионов H + (как и любая другая кислота) и ионов RCO 2 — . Обратите внимание, что только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + . Напротив, атом водорода, присоединенный к атому кислорода спирта, не диссоциирует с образованием иона H + , когда спирт растворяется в воде.Причины разницы в поведении карбоновых кислот и спиртов будут обсуждаться в главе 8 «Ионная связь в сравнении с ковалентной связью».
Обратите внимание на узор
Только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + .
Базы
Мы представим более исчерпывающие определения оснований в следующих главах, но фактически каждое основание, с которым вы столкнетесь, будет ионным соединением, таким как гидроксид натрия (NaOH) и гидроксид бария [Ba (OH) 2 ], которые содержат гидроксид-ион и катион металла.Они имеют общую формулу M (OH) n. Важно понимать, что спирты с общей формулой ROH являются ковалентными соединениями, а не ионными соединениями; следовательно, они не диссоциируют в воде с образованием основного раствора (содержащего ионы OH — ). Когда основание вступает в реакцию с любой из рассмотренных нами кислот, оно принимает протон (H + ). Например, гидроксид-ион (OH — ) принимает протон с образованием H 2 O. Таким образом, основания также называют акцепторами протонов.
Концентрированные водные растворы аммиака (NH 3 ) содержат значительные количества гидроксид-иона, хотя растворенное вещество не является в первую очередь гидроксидом аммония (NH 4 OH), как часто указывается на этикетке. Таким образом, водный раствор аммиака также является обычным основанием. Замена атома водорода Nh4 на алкильную группу приводит к амину (RNH 2 ), который также является основанием. Амины имеют резкий запах — например, метиламин (CH 3 NH 2 ) является одним из соединений, вызывающих неприятный запах, связанный с испорченной рыбой.На физиологическое значение аминов указывает слово «витамин», которое происходит от словосочетания «жизненно важные амины». Это слово было придумано для описания пищевых веществ, которые были эффективны при предотвращении цинги, рахита и других заболеваний, потому что эти вещества считались аминами. Впоследствии было подтверждено, что некоторые витамины являются аминами.
Обратите внимание на узор
Гидроксиды металлов (MOH) дают ионы OH — и являются основаниями, спирты (ROH) не образуют ионы OH — или H + и являются нейтральными, а карбоновые кислоты (RCO 2 H) дают H + ионов и кислоты.
Сводка
Обычные кислоты и производные от них многоатомные анионы имеют свои собственные названия и правила номенклатуры. Номенклатура кислот различает оксикислоты, в которых ион H + присоединен к атому кислорода многоатомного иона, и кислоты, в которых ион H + присоединен к другому элементу. Карбоновые кислоты — важный класс органических кислот. Аммиак является важным основанием, как и его органические производные амины.
Ключевые вынос
Обычные кислоты и производные от них многоатомные анионы имеют свои собственные названия и правила номенклатуры.
| Концептуальные проблемы |
|---|
1. Назовите каждую кислоту. а. HCl г. HBrO 3 г. HNO 3 г. H 2 SO 4 e. HIO 3 |
2. Назовите каждую кислоту.
а. HBr
г. H 2 SO 3
г.HClO 3
г. HCN
e. H 3 PO 4
3. Назовите водную кислоту, соответствующую каждому газу.
а. бромистый водород
г. цианистый водород
г. йодистый водород
4. Для каждой структурной формулы напишите сокращенную формулу и название соединения.
а.
г.
5.Для каждой структурной формулы напишите сокращенную формулу и название соединения.
а.
г.
6. Когда каждое соединение добавляется в воду, является ли полученный раствор кислотным, нейтральным или основным?
а. Канал 3 Канал 2 ОН
г. Мг (ОН) 2
г. C 6 H 5 CO 2 H
г. LiOH
e. C 3 H 7 CO 2 H
ф.H 2 SO 4
7. Изобразите структуру простейшего примера каждого типа соединения.
а. алкан
г. алкен
г. алкин
г. ароматический углеводород
e. алкоголь
ф. карбоновая кислота
г. амин
ч. циклоалкан
8. Определите класс органических соединений, представленных каждым соединением.
а.
г. Канал 3 Канал 2 ОН
г. HC≡CH
г.
e. C 3 H 7 NH 2
ф. CH 3 CH = CHCH 2 CH 3
г.
ч.
9. Определите класс органических соединений, представленных каждым соединением.
а.
г.
г.
г.
e.
ф. CH 3 CCH
г.
ч.
| Числовые задачи |
|---|
1. Напишите формулы для каждого соединения. а. хлорноватистая кислота г. пербромовая кислота г. бромистоводородная кислота г. сернистая кислота e. пербромат натрия |
2.Напишите формулу для каждого соединения.
а. йодистоводородная кислота
г. сероводород
c фосфористая кислота
г. хлорная кислота
e. гипобромит кальция
3. Назовите каждое соединение.
а. HBr
г. H 2 SO 3
г. HCN
г. HClO 4
e. NaHSO 4
4.Назовите каждое соединение.
а. H 2 SO 4
г. HNO 2
г. К 2 HPO 4
г. H 3 PO 3
e. Ca (H 2 PO 4 ) 2 · H 2 O
Авторы и авторство
Полный список кислот — EndMemo
Полный список неорганических кислот
Формула
Название кислоты
Название соли
Формула
Название кислоты
Название соли
h3SO3
Серная кислота
Сульфит
h3SO4
Серная кислота
Сульфат
h3SO2
Гипосерная кислота
Гипосульфит
h3SO5
Персерная кислота
Персульфат
h3S2O7
Пиросерная кислота
Пиросульфат
h3S2O5
Сернистая кислота
Дисульфит
h3S2O4
Дитионовая кислота
Дитионит
h3S4O6
Тетратионовая кислота
Тетратионат
h3S2O2
Тиосерная кислота
Тиосульфит
h3S
Сероводородная кислота
Гидросульфат
h3S2O8
Пероксидисерная кислота
Пероксидисульфат
HClO4
Хлорная кислота
Перхлорат
HCl
Соляная кислота
Гидрохлорат
HClO
Хлорноватистая кислота
Гипохлорит
HClO2
Хлористая кислота
Хлорит
HClO3
Хлорная кислота
Хлорат
HNO
Азотистая кислота
Гипонитрит
HNO2
Азотистая кислота
Нитрит
HNO3
Азотная кислота
Нитрат
HNO4
Азотная кислота
Пернитрат
h3CO2
Углеродистая кислота
Карбонит
h3CO3
Угольная кислота
Карбонат
h3CO
Гипоуглеродистая кислота
Гипокарбонит
h3CO4
Перкарбоновая кислота
Перкарбонат
h3C2O4
Щавелевая кислота
Оксалат
Ch4COOH
Уксусная кислота
Ацетат
h4PO4
Фосфорная кислота
Фосфат
h4PO3
Фосфорная кислота
Фосфит
h4PO2
Гипофосфатная кислота
Гипофосфит
h4PO5
Перфосфорная кислота
Перфосфат
h5P2O6
Гипофосфорная кислота
Гипофосфат
h5P2O7
Пирофосфорная кислота
Пирофосфат
h4P
Фосфорная кислота
Гидрофосфат
HBr
Бромоводородная кислота
Гидробромат
HBrO2
Бромистая кислота
Бромит
HBrO3
Бромная кислота
Бромат
HBrO
Бромистоводородная кислота
Гипобромит
HIO
Гипойодистая кислота
Гипойодит
HIO2
Йодистая кислота
Йодит
HIO3
Йодная кислота
Йодат
HIO4
Периодическая кислота
Периодат
HI
Иодоводородная кислота
Гидроиодат
HFO2
Фтористая кислота
Флюорит
HFO3
Плавиковая кислота
Фторат
HFO
Гипофтористая кислота
Гипофторит
HFO4
Пефтористая кислота
Перфторат
HF
Плавиковая кислота
Фтористоводородная кислота
h3CrO4
Хромовая кислота
Хромат
h3CrO3
Хромовая кислота
Хромит
h3CrO2
Гипохромная кислота
Гипохромит
h3CrO5
Перхромовая кислота
Перхромат
h3Se
Гидроселеновая кислота
Гидроселенат
h3SeO4
Селеновая кислота
Селенат
h3SeO3
Селеновая кислота
Селенит
HN3
Азотная кислота
Гидронитрат
h4BO3
Борная кислота
Борат
h3MoO4
Молибденовая кислота
Молибдат
h5XeO6
Перксеновая кислота
Перксенат
h3SiF6
Кремнефтористоводородная кислота
Кремнийфторант
H6TeO6
Теллуровая кислота
Теллурат
h3TeO3
Теллуристая кислота
Теллурит
h3WO4
Вольфрамовая кислота
Вольфрамат
h3XeO4
Ксеновая кислота
Ксенат
C6H8O7
Лимонная кислота
Цитрат
HCOOH
Муравьиная кислота
Формиат
h5Sb2O7
Пироантимоновая кислота
Пироантимонат
HMnO4
Пермангановая кислота
Перманганат
h3MnO4
Марганцевая кислота
Манганат
HSbO3
Сурьма
Сурьма
h4SbO3
Антимонитовая кислота
Антимонит
h3SiO3
Кремниевая кислота
Силикат
h3TiO3
Титановая кислота
Титанат
h4AsO4
Мышьяковая кислота
Арсенат
HTcO4
Пертехнетическая кислота
Пертехнетат
h4As
Мышьяковистая кислота
Гидроарсенат
h3Cr2O7
Дихромовая кислота
Дихромат
h3B4O7
Тетраборная кислота
Тетраборат
h3SnO3
Метастановая кислота
Метастаннат
h3C2O2
Гипооксалиновая кислота
Гипооксалит
h4 [F3 (CN) 6]
Феррициановая кислота
Феррицианат
HCNO
Циановая кислота
Цианат
h3SiO2
Кремнистая кислота
Силицит
HCN
Синильная кислота
Гидроцианат
HSCN
Тиоциановая кислота
Тиоцианат
h3UO4
Урановая кислота
Уранат
h3U2O7
Диурановая кислота
Диуранат
Список общих органических кислот
Формула
Название кислоты
Название соли
Формула
Название кислоты
Название соли
Ch3 (COOH) 2
Малоновая кислота
Малонат
h3C6H6O7
Лимонная кислота
Цитрат
h3C4h5O6
Винная кислота
Тартартат
HC5H8NO4
Глутаминовая кислота
Глутамат
h3C8h5O4
Фталевая кислота
Фталат
h3C9h24O4
Азелаиновая кислота
Азелат
HC4h4N2O3
Барбитуровая кислота
Барбитурат
HC14h21O3
Бензиловая кислота
Бензилат
C9H8O2
Коричная кислота
Корица
C4h5O4
Фумаровая кислота
Фумарат
C5H8O4
Глутаровая кислота
Глутарат
C6h22O7
Глюконовая кислота
Глюконат
C5h21COOH
Гексановая кислота
Гексаноат
HC3H5O3
Молочная кислота
Лактат
h3C4h5O5
Яблочная кислота
Малат
HC18h43O2
Олеиновая кислота
Олеат
C19h29N7O6
Фолиевая кислота
Фолат
HC2COOH
Пропиоловая кислота
Пропиолат
Ch4Ch3COOH
Пропионовая кислота
Пропионат
C19h24O3
Розоловая кислота
C17h45COOH
Стеариновая кислота
Стеарат
C76H53O46
Дубильная кислота
Таннат
C2HF3O2
Трифторуксусная кислота
h3C5h3N4O3
Мочевая кислота
Ураты
HC6H7O6
Аскорбиновая кислота
Аскорбат
HC7H5O5
Галловая кислота
Галлат
HC9H7O4
Ацетилсалициловая кислота
Ch4COOH
Уксусная кислота
Ацетат
Стандартный список сильных кислот и оснований
Изучение химии включает изучение кислот и оснований.Если вы посещаете урок химии, вам, вероятно, нужно будет запомнить сильные кислоты и основания. Используйте этот список сильных кислот и оснований как инструмент, который поможет вам узнать названия и химический состав каждой из них.
Список сильных кислот
Сильные кислоты не названы так, потому что они более сильные, чем другие кислоты. Сильная кислота растворяется в воде. Термин сильный в названии относится к способности кислоты выделять молекулы водорода (H + ), что позволяет ей ионизироваться при помещении в раствор воды.Слабые кислоты не обладают этой способностью. Есть семь сильных кислот.
Сильная кислота | Химический состав |
хлорноватая кислота | HClO 3 | бромистоводородная кислота 000 0 | соляная кислота | HCl |
иодистоводородная кислота | HI |
азотная кислота | HNO 3 | HClO 4 |
серная кислота | H 2 SO 4 |
Все эти высококоррозионные вещества могут выделять опасные пары и вызывать чрезвычайно болезненные ожоги.С этими веществами необходимо обращаться с особой осторожностью.
Как запомнить сильные кислоты
Запоминание списка веществ может быть сложной задачей. Попробуйте эту комбинацию мнемонического устройства в сочетании с фрагментированием, чтобы сохранить в памяти список из семи сильных кислот.
Мнемонический прибор сильных кислот
Используйте фразу «Химия иногда требует подготовки, помогите! ”, чтобы начать запоминать семь сильных кислот.
- c hemistry — c хлорная кислота
- n eeds — n итриновая кислота
- p репарация — p эхлорная кислота
29 s
0 sur h elp — h ydro acid
Добавьте приведенный ниже совет по фрагментам, чтобы завершить запоминание сильных кислот, так как некоторые элементы начинаются с одного и того же префикса.
Разделение на части и мнемоника
В списке сильных кислот три h слов, каждое из которых начинается с префикса hydro . Соедините эти три слова вместе и выучите фразу «раньше в классе » , чтобы лучше их запомнить. Эта фраза основана на букве, следующей сразу за гидро в остальных сильных кислотах.
Чтобы вспомнить кислоты, начинающиеся с буквы h, спросите себя: « Когда понадобится h elp?» Ответ:
- b efore — hydro b romic
- i n — hydro i odic
- c lass — Hydro c
04 hloric Примеры для каждого
04 hloric Кислота
Если вы хотите узнать больше о сильных кислотах, чем просто их название и их химический состав, вы можете найти эти примеры интересных и информативных способов использования каждой из них.
- хлорная кислота — производство хлоридных солей, производство спичек, производство взрывчатых веществ
- бромистоводородная кислота — промышленные чистящие средства, литографическая печать, гравировка
- соляная кислота — желудочная кислота (способствует пищеварению), производство фейерверков, аккумулятор производство
- иодоводородная кислота — производство уксусной кислоты, дезинфекция медицинских инструментов, промышленный восстановитель
- азотная кислота — производство взрывчатых веществ, нитрат аммония (удобрения), производство полиуретана
- хлорная кислота — отделение натрия от калия, ракета производство топлива, производство взрывчатых веществ
- серная кислота — ингредиент очистителя канализации, очистка сточных вод, производство стали
Каждая из этих кислот может использоваться многими способами, помимо примеров, приведенных выше.Большинство их приложений используются для промышленных и научных лабораторий.
Список сильных оснований
Подобно сильным кислотам, сильных оснований также полностью растворяются в воде, в отличие от слабых оснований, которые не растворяются. Сильные основания выделяют ионы гидроксида (OH-) и поглощают молекулы водорода (H +). Есть восемь сильных баз.
Сильное основание
Химический состав
гидроксид бария
Ba (OH) 2
гидроксид кальция
0 Ca OH)
2
гидроксид цезия
CsOH
гидроксид лития
LiOH
гидроксид калия
гидроксид калия
гидроксид рубидия
RbOH
гидроксид натрия
NaOH
гидроксид стронция
Sr (OH) 2
При работе с этими веществами следует соблюдать особую осторожность.Они очень едкие и могут вызвать чрезвычайно опасные химические ожоги.
Как запоминать сильные основы
Чтобы помочь запомнить и вспомнить восемь сильных оснований, попробуйте следующий мнемонический прием. Обратите внимание, что он включает в себя слова base, и strong , поэтому фразу должно быть легко связать с тем, что она представляет.
- b ases — b arium
- ca n — ca lcium
- ce обязательно — ce sium
- l
2 lithium hydroxide лизинг — p гидроксид калия
- r eally — r гидроксид убидия
- so mething — so dium hydroxide
- st rong гидроксид — st ron есть две сильные основы, которые начинаются с одной и той же буквы, соответствующее слово в мнемонике начинается с первых двух букв или соответствующего слова, чтобы сделать инструмент запоминания максимально полезным.
Примеры использования каждой сильной базы
Вам интересно, как можно использовать сильные базы? Откройте для себя несколько примеров практического применения каждого из них.
- гидроксид бария — производство стекла, смазочные добавки, производство пестицидов
- гидроксид кальция — стоматологические пломбы, пищевая промышленность (травильная известь), очистка сточных вод
- гидроксид цезия — аккумуляторные батареи, производство металлов, радиоактивные отходы очистка
- гидроксид лития — литий-ионные батареи, производство смазок (смазок), производство мыла
- гидроксид калия — осушитель, моющий ингредиент, производство жидких удобрений
- гидроксид рубидия — электрические аккумуляторные батареи, кристаллы рубидия производство, очистка сточных вод
- гидроксид натрия — щелок, ингредиент для очистки канализации, ингредиент для очистки духовки
- гидроксид стронция — производство консистентной смазки, производство мыла, извлечение сахара из свеклы
Сильные основания имеют много применений помимо перечисленных примероввыше.Эти вещества находят множество применений в промышленных и научных целях.
Развивайте свои знания в области химии
Теперь, когда у вас есть списки сильных кислот и оснований, а также общая информация и устройства, которые помогут вам их запомнить, самое время узнать больше о химии. Начните с изучения распространенных примеров баз в повседневной жизни.
Номенклатура
Номенклатура
Номенклатура
Задолго до того, как химики узнали формулы химических соединений, они разработали систему
из номенклатуры , которая дала каждому соединению уникальное имя.Сегодня мы часто используем химические
формулы, такие как NaCl, C 12 H 22 O 11 и Co (NH 3 ) 6 (ClO 4 ) 3 ,
для описания химических соединений. Но нам по-прежнему нужны уникальные имена, которые однозначно идентифицируют
каждое соединение.Общие названия
Некоторые соединения были известны так долго, что систематическая номенклатура не может
конкурировать с общепринятыми именами.Примеры соединений, для которых общие названия
используются вода (H 2 O), аммиак (NH 3 ) и метан (CH 4 ).Обозначение ионных соединений
(Металлы с неметаллами)
Названия ионных соединений записываются путем перечисления названия положительного иона.
за которым следует название отрицательного иона.NaCl натрия хлорид (NH 4 ) 2 SO 4 сульфат аммония NaHCO 3 бикарбонат натрия Поэтому нам нужен ряд правил, позволяющих однозначно называть положительные и
отрицательные ионы, прежде чем мы сможем назвать соли, которые эти ионы образуют.Обозначение положительных ионов
Одноатомные положительные ионы имеют название элемента, из которого они образованы.
Na + натрия Zn 2+ цинк Ca 2+ кальций H + водород К + калий Sr 2+ стронций Некоторые металлы образуют положительные ионы в более чем одной степени окисления.Один из самых ранних
В методах различения этих ионов используются суффиксы -ous и -ic .
добавлен к латинскому названию элемента для обозначения более низкой и высокой степени окисления,
соответственно.Fe 2+ черный Fe 3+ железо Sn 2+ олово Sn 4+ станник Cu + Медь Cu 2+ медь Химики теперь используют более простой метод, в котором заряд на ионе обозначается значком
Римская цифра в скобках сразу после названия элемента.Fe 2+ железо (II) Fe 3+ железо (III) Sn 2+ олово (II) Sn 4+ олово (IV) Cu + медь (I) Cu 2+ медь (II) Многоатомные положительные ионы часто имеют общие названия, оканчивающиеся на суффикс -onium .
H 3 O + гидроксоний NH 4 + аммоний Именование отрицательных ионов
Отрицательные ионы, состоящие из одного атома, именуются добавлением суффикса -ide
к основе имени элемента.Ф — фторид О 2- оксид Класс — хлорид S 2- сульфид Br — бромид N 3- нитрид I — йодид П 3- фосфид H — гидрид С 4- карбид Общие многоатомные отрицательные ионы
-1 иона HCO 3 — бикарбонат HSO 4 — гидросульфат (бисульфат) CH 3 CO 2 — ацетат ClO 4 — перхлорат НЕТ 3 — нитрат ClO 3 — хлорат НЕТ 2 — нитрит ClO 2 — хлорит MnO 4 — перманганат ClO — гипохлорит CN — цианид ОН — гидроксид -2 иона CO 3 2- карбонат О 2 2- перекись СО 4 2- сульфат CrO 4 2- хромат СО 3 2- сульфит Cr 2 O 7 2- дихромат S 2 O 3 2- тиосульфат HPO 4 2- гидрофосфат -3 иона PO 4 3- фосфат AsO 4 3- арсенат BO 3 3- борат Обозначение многоатомных ионов
На первый взгляд, номенклатура многоатомных отрицательных ионов в таблице выше
кажется безнадежным.Однако есть несколько общих правил, которые могут навести порядок в
этот кажущийся хаос.Название иона обычно заканчивается на -ite или -ate . — участок
окончание указывает на низкую степень окисления. Таким образом, ион NO 2 — является
нитрит-ион.Окончание -ate указывает на высокую степень окисления. НО 3 —
ion, например, является ионом нитрата.Префикс hypo — используется для обозначения самой низкой степени окисления. ClO-
ион, например, представляет собой ион гипохлорита.Префикс на — (как в гипер-) используется для обозначения очень высокой степени окисления.
государственный. Таким образом, ион ClO 4 — является перхлорат-ионом.Есть лишь несколько исключений из этих обобщений.
Названия гидроксида (OH —), цианида (CN —) и пероксида (O 2 2-)
ионы, например, имеют окончание -ид , потому что когда-то считалось
одноатомные ионы.Практическая задача 5 Кость и зубная эмаль в вашем теле
содержат ионные соединения, такие как фосфат кальция и гидроксиапатит. Предсказать формулу
фосфата кальция, который содержит ионы Ca 2+ и PO 4 3- .
Вычислите значение x , если формула гидроксиапатита: Ca x (PO 4 ) 3 (OH).Нажмите здесь, чтобы
проверьте свой ответ на практическую задачу 5Обозначение простых ковалентных соединений
(Неметаллы с неметаллами)
Степени окисления также играют важную роль в названии простых ковалентных соединений. В
имя атома в положительной степени окисления указывается первым.Суффикс -ide
затем добавляется к основанию имени атома в отрицательной степени окисления.HCl хлористый водород НЕТ оксид азота BrCl хлорид брома Как правило, химики пишут формулы, в которых элемент в положительной степени окисления
сначала пишется, а затем идут элементы с отрицательной степенью окисления.Число атомов элемента в простых ковалентных соединениях указывается добавлением
один из следующих греческих префиксов к имени элемента.1 моно — 6 гекса- 2 ди- 7 гепта- 3 три- 8 окт. 4 тетра- 9 нона- 5 пента- 10 дека Префикс моно — используется редко из-за избыточности.Главное исключение
к этому правилу относится окись углерода (СО).Обозначение кислот
Простые ковалентные соединения, содержащие водород, такие как HCl, HBr и HCN, часто
растворяются в воде с образованием кислот. Эти решения названы добавлением префикса hydro —
к названию соединения, а затем заменив суффикс -ide на -ic . Для
например, хлористый водород (HCl) растворяется в воде с образованием соляной кислоты; водород
бромид (HBr) образует бромистоводородную кислоту; а цианистый водород (HCN) образует синильную кислоту.Многие из богатых кислородом многоатомных отрицательных ионов в таблице 2.1 образуют кислоты, названные
путем замены суффикса — ate на -ic и суффикса -ite на -ous .Кислоты, содержащие ионы, оканчивающиеся на ide часто
статьсоляная кислота Класс — хлорид HCl соляная кислота Ф — фторид HF плавиковая кислота S 2- сульфид H 2 S Кислота сероводородная Кислоты, содержащие ионы, оканчивающиеся на , обычно съедали
стать-кислота CH 3 CO2 — ацетат CH 3 CO 2 H уксусная кислота CO 3 2- карбонат H 2 CO 3 угольная кислота BO 3 3- борат H 3 BO 3 борная кислота НЕТ 3 — нитрат HNO 3 азотная кислота СО 4 2- сульфат H 2 SO 4 серная кислота ClO 4 — перхлорат HClO 4 хлорная кислота PO 4 3- фосфат H 3 PO 4 фосфорная кислота MnO 4 — перманганат HMnO 4 Пермангановая кислота CrO 4 2- хромат H 2 CrO 4 хромовая кислота ClO 3 — хлорат HClO 3 хлорная кислота Кислоты, содержащие ионы, оканчивающиеся на ите обычно
стать-кислотный ClO 2 — хлорит HClO 2 хлорноватистая кислота НЕТ 2 — нитрит HNO 2 азотистая кислота СО 3 2- сульфит H 2 SO 3 сернистая кислота ClO — гипохлорит HClO хлорноватистая кислота Сложные кислоты можно назвать, указав присутствие кислого водорода следующим образом.
NaHCO 3 гидрокарбонат натрия (также известный как бикарбонат натрия) NaHSO 3 гидросульфит натрия (также известный как бисульфит натрия) KH 2 PO 4 дигидрофосфат калия карбоновая кислота | Структура, свойства, формула, использование и факты
Карбоновая кислота , любой из класса органических соединений, в которых атом углерода (C) связан с атомом кислорода (O) двойной связью и с гидроксильной группой (OH) одинарной связью.Четвертая связь связывает атом углерода с атомом водорода (H) или с некоторой другой одновалентной объединяющей группой. Карбоксильная (СООН) группа названа так из-за онильной группы карб (С = О) и гидр оксильной группы .
окисление спиртов
Спирты могут окисляться с образованием альдегидов, кетонов и карбоновых кислот. Окисление органических соединений обычно увеличивает количество связей углерода с кислородом и может уменьшить количество связей с водородом.
Британская энциклопедия, Inc.
Основной химической характеристикой карбоновых кислот является их кислотность. Как правило, они более кислые, чем другие органические соединения, содержащие гидроксильные группы, но обычно слабее, чем известные минеральные кислоты (например, соляная кислота, HCl, серная кислота, H 2 SO 4 и т. Д.).
Карбоновые кислоты широко встречаются в природе. Жирные кислоты являются компонентами глицеридов, которые, в свою очередь, являются компонентами жира. Гидроксильные кислоты, такие как молочная кислота (содержится в кисломолочных продуктах) и лимонная кислота (содержится в цитрусовых), а также многие кетокислоты являются важными продуктами метаболизма, которые существуют в большинстве живых клеток.Белки состоят из аминокислот, которые также содержат карбоксильные группы.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчасСоединения, в которых OH карбоксильной группы заменен некоторыми другими группами, называются производными карбоновых кислот, наиболее важными из которых являются ацилгалогениды, ангидриды кислот, сложные эфиры и амиды.
Производные карбоновых кислот имеют множество применений. Например, в дополнение к использованию в качестве дезинфицирующего средства муравьиная кислота, простейшая карбоновая кислота, используется при обработке текстиля и в качестве кислотного восстановителя.Уксусная кислота широко используется в производстве целлюлозных пластиков и сложных эфиров. Аспирин, сложный эфир салициловой кислоты, получают из уксусной кислоты. Пальмитиновая кислота и стеариновая кислота важны для производства мыла, косметики, фармацевтических препаратов, свечей и защитных покрытий. Стеариновая кислота также используется в производстве резины. Акриловая кислота используется в виде сложного эфира при производстве полимеров (длинноцепочечных молекул), известных как акрилаты. Метакриловая кислота служит сложным эфиром и полимеризуется с образованием люцита.Олеиновая кислота используется в производстве мыла, моющих средств и текстильных изделий.
таблетки аспирина
таблетки аспирина.
© Джеймс Стюарт Гриффит / Shutterstock.com
Номенклатура карбоновых кислот и их солей
Название карбоновой кислоты по ИЮПАК происходит от названия самой длинной углеродной цепи, содержащей карбоксильную группу, путем удаления последнего -e из название исходного алкана и добавление суффикса -oic, за которым следует слово «кислота». Цепь пронумерована, начиная с углерода карбоксильной группы.Поскольку считается, что углерод карбоксильной группы представляет собой углерод 1, нет необходимости давать ему номер. Например, соединение CH 3 CH 2 COOH имеет три атома углерода и называется пропановой кислотой от пропана, названия трехуглеродной цепи, с добавлением суффикса -ойной кислоты для этого класса соединений. . Если карбоновая кислота содержит двойную связь углерод-углерод, окончание меняется с -ановой кислоты на -еноевую кислоту, чтобы указать на наличие двойной связи, и число используется для обозначения местоположения двойной связи.
Большинство простых карбоновых кислот, вместо того, чтобы называться их названиями IUPAC, чаще упоминаются общими названиями, которые старше их систематических названий. Большинство простых карбоновых кислот изначально были выделены из биологических источников; поскольку их структурные формулы часто были неизвестны во время изоляции, им были даны имена, которые обычно происходили от названий источников. Например, CH 3 CH 2 CH 2 COOH, масляная кислота, впервые полученная из масла, была названа в честь латинского butyrum , что означает «масло.«Кислоты, содержащие нечетное число атомов углерода больше девяти, обычно не имеют общих названий. Причина в том, что длинноцепочечные карбоновые кислоты были первоначально выделены из жиров (которые представляют собой сложные эфиры карбоновых кислот), и, как правило, эти жиры содержат карбоновые кислоты только с четным числом атомов углерода (потому что процесс, с помощью которого живые организмы синтезируют такие жирные кислоты, вызывает молекулы вместе в двухуглеродные части).
При использовании общепринятых названий заместители в углеводородной цепи обозначаются греческими буквами, а не числами, и счет начинается не с углерода карбоксильной группы, а с соседнего углерода.Например, общее название следующего соединения γ-аминомасляной кислоты, сокращенно ГАМК. Его название по ИЮПАК — 4-аминобутановая кислота. ГАМК является тормозным нейромедиатором в центральной нервной системе человека.
Соли карбоновых кислот имеют такое же название, как и соли неорганических соединений; сначала называют катион, а затем анион, как в хлориде натрия. Для карбоновых кислот название аниона получено путем замены оканчивающейся -oic acid в названии IUPAC или -ic acid в общепринятом названии на -ate.Некоторыми примерами являются ацетат натрия, CH 3 COONa; формиат аммония, HCOONH 4 ; и бутаноат калия (бутират калия), CH 3 CH 2 CH 2 COOK.
Химическая номенклатура
Химическая номенклатура — слишком большая тема для всестороннего рассмотрения, и было бы бесполезным отвлечением пытаться сделать это в начальном курсе; большинство студентов-химиков подбирают химические названия и правила, регулирующие их, по ходу дела.
Но мы вряд ли можем говорить о химии, не упомянув химических веществ, у каждого из которых есть имена — а часто и несколько! Все, что мы попытаемся сделать здесь, — это рассказать о том, что вам нужно знать, чтобы разобраться в химии на первом курсе.
Для тех из вас, кто планирует заниматься химией, самое интересное будет позже!1 Игра в названия химии
Существует более 100 миллионов названных химических веществ.Кто придумал названия всем этим химическим веществам? Есть ли опасность, что у нас закончатся новые имена? Ответ на последний вопрос — «нет», для простых
причина в том, что подавляющее большинство имен не «придумано»; существуют тщательно продуманные правила присвоения химическим веществам названий на основе их структуры. Это систематических имен ; они могут быть немного
тяжеловесны, но они однозначно идентифицируют данное вещество. Правила для этих имен определяются международным органом.Но чтобы упростить индексацию и идентификацию, каждый
известное химическое вещество имеет собственный числовой «личный идентификатор», известный как регистрационный номер CAS. Ежедневно выдается около 15 000 новых номеров.Общеупотребительные и систематические наименования
Регистрационные номера
CAS являются важными инструментами для навигации по лесу множественных названий для данного вещества. Например, этанол , CH 3 CH 2 OH, также известен как этиловый спирт, зерновой спирт, абсолютный
спирт, гидроксиэтилен и этилгидрат — но каждый имеет один и тот же регистрационный номер 64-17-5.По состоянию на июнь 2015 г. единственным веществом с наибольшим количеством синонимов является обычный пластик полиэтилен ; в нем 9 409 наименований!
Многие химические вещества настолько вошли в нашу жизнь, что мы знаем их по знакомым названиям, как и другие наши друзья. У данного вещества может быть несколько общих или тривиальных названий ; обычный тростниковый сахар, например, более формально
известная как «сахароза», но просьба о ней за обеденным столом под этим именем, вероятно, будет препятствием для разговора, и я даже не осмелюсь предсказать результат, если вы попытаетесь использовать ее систематическое название в том же контексте:«пожалуйста, передайте α-D-глюкопиранозил- (1,2) — β-D-фруктофуранозид!»
Но «сахароза» будет вполне уместным, если вам нужно отличить этот конкретный сахар от сотен других названных сахаров.Единственное место, где вы можете встретить систематическое название, подобное довольно громоздкому, упомянутому здесь, — это когда
ссылка (в печати или в компьютерной базе данных) на сахар, не имеющий общего названия.Химические вещества были частью ткани цивилизации и культуры на протяжении тысячелетий, и современная химия сохраняет значительную часть этого древнего багажа в форме терминов, скрытые культурные и исторические связи которых добавляют
цвет и интерес к предмету.Многие распространенные химические названия дошли до нас только после удивительно долгих путешествий во времени и месте, как показывают следующие два примера:–
У большинства людей название аммиак (NH 3 ) ассоциируется с газом, имеющим резкий запах; систематическое название «тригидрид азота» (которое редко используется) подскажет вам его формулу.Что он не скажет вам, так это то, что дым
при горении верблюжий навоз (основное топливо Северной Африки) конденсируется на прохладных поверхностях с образованием кристаллического осадка. Древние римляне впервые заметили это на стенах и потолке храма, построенного египтянами богу Солнца.
Амон в Фивах, и они назвали этот материал сали аммиак, что означает «соль Амона». В 1774 году Джозеф Пристли (первооткрыватель кислорода) обнаружил, что при нагревании соляного аммиака выделяется газ с резким запахом, который у T.Бергман назвал «аммиак»
восемь лет спустя.Арабская алхимия дала нам ряд химических терминов; например, спирт , как полагают, происходит от арабского al-khwl или al-ghawl , чье первоначальное значение было металлическим порошком, используемым для затемнения женщин.
веки ( kohl ).Алкоголь вошел в английский язык в 17 веке в значении «сублимированная субстанция», затем стал «чистым духом» чего-либо и стал ассоциироваться с «винным спиртом» только в 1753 году. Наконец, в 1852 году он стал
часть химической номенклатуры, обозначающая класс органических соединений. Но все еще общепринято называть конкретное вещество CH 3 CH 2 OH «спиртом».
а не его систематическое название этанол .Обычной практикой среди химиков является использование наиболее распространенных химических названий всякий раз, когда это возможно, особенно в устной или неформальной письменной коммуникации. Для многих простейших соединений (в том числе для большинства из них,
будут встречаться в течение первого года обучения), систематическое и общеупотребительное названия совпадают, но там, где есть различие и если это позволяет контекст, обычно предпочтительнее общее название.Некоторые имена встречаются чаще, чем другие
Многие из «распространенных» имен, на которые мы ссылаемся в этом уроке, известны и используются в основном научным сообществом. Химические вещества, которые используются дома, в искусстве или в промышленности, получили традиционные или «популярные» названия, которые
до сих пор широко используются. Многие, например, упомянутый выше салиновый аммиак, могут рассказать увлекательные истории. Вот краткий пример некоторых других традиционных имен:Более обширный список общепринятых и торговых наименований можно найти здесь
народное название химическое наименование формула бура декагидрат тетрабората натрия Na 2 B 4 O 7 · 10h3O каломель хлорид ртути (I) Hg 2 Класс 2 молоко магнезиальное гидроксид магния мг (OH) 2 соляная кислота соляная кислота HCl (водн.) Купорос серная кислота H 2 SO 4 селитра натрия нитрат NaNO 3 гашеная известь кальция гидроксид Са (ОН) 2 Минералы
Минералы — это твердые материалы, встречающиеся в земле, которые классифицируются и называются в соответствии с их составом (который часто изменяется в непрерывном диапазоне) и расположением
атомы в их кристаллических решетках.Существует около 4000 названных минералов. Многие из них названы в честь мест, людей или собственности и чаще всего заканчиваются на — ите . См. Здесь для обширного списка.Фирменные наименования
Химия — крупная отрасль промышленности, поэтому неудивительно, что многие вещества продаются под торговыми марками. Это особенно характерно для фармацевтической промышленности, которая использует компьютеры для производства имен, которые, как они надеются, будут отличать
новый продукт от конкурентов.Возможно, самым известным из них является аспирин, название которого было придумано немецкой компанией Bayer в 1899 году.
правительство США после Первой мировой войны, и больше не является охраняемым товарным знаком в этой стране.Несколько интересных имен
Тем, кто не думает, что у химиков есть чувство юмора, стоит заглянуть на этот сайт профессора Пола Мэя из Бристольского университета в Великобритании:
Молекулы с глупыми или необычными названиями
… что особенно понравится подросткам всех возрастов.
2 Имена и символы стихий
Наименование химических веществ начинается с наименований элементов . Первооткрыватель элемента традиционно имел право дать ему имя, и в этих именах можно найти интересную человеческую и культурную историю,
многие из которых относятся к свойствам элемента или к географическому местоположению.Лишь некоторые из недавно открытых (и искусственно созданных) элементов названы в честь людей.имя элемента символ Латинское название сурьма Сб стибий медь Cu медь золото Au золотой утюг Fe железо свинец Пб отвес ртуть рт. Ст. гидраргирум калий К калий натрий Na натрий банка Sn олова Некоторые элементы на самом деле не были «открыты», но были известны с древних времен; многие из них имеют символы, образованные от латинских названий элементов.Предполагается, что вы должны знать девять элементов, символы латинского происхождения которых вы должны знать.
Какое самое старое упоминание об определенном элементе? Один из кандидатов — древняя еврейская легенда об уничтожении Содома и Гоморры серой (серой).
как записано в Бытие 19:24: « И пролил Господь дождь на Содом и Гоморру серой и пламенем от Господа с неба. »Семь металлов, известных с древности на 140 языках
Многие из этих имен связаны с историей и традициями.Например, латинское название ртути,
Hydrargyrum означает «водное серебро» или ртуть. Название «шарлатан» в применении к некомпетентному врачу является искажением фламандского слова «ртуть» и происходит от использования соединений ртути в
Медицина 17 века. Название «Меркурий» имеет алхимическое происхождение и, конечно же, происходит от имени греческого бога, в честь которого названа планета; Загадочные свойства элемента, в то же время металлические, текучие и испаряемые, предполагают одного и того же посланника с крылатыми ногами, который кружит по небу близко к солнцу.Откуда произошли названия других химических элементов ? Узнайте из Списка этимологий названий химических элементов в Википедии.
Названия элементов на других языках
Элемент, известный нам как стронций , называется Stroncij на хорватском, Stroncijum на курдском, Estroncio на испанском и istiruntiyum на арабском.Если такие драгоценные камни вас очаровывают, взгляните на Elementymology & Elements Multidict, в котором рассказывается о происхождении названий элементов не только на английском, но и на английском языке.
разные языки.Информацию об именах элементов на китайском, японском, корейском и вьетнамском языках см. На этой странице в Википедии.
Отличное руководство по химической номенклатуре можно найти на этой странице Shodor.
видеороликов по основной химической номенклатуре
3 Наименования бинарных молекул
Дополнительную помощь по номенклатуре см. В разделе видео внизу этой страницы.
Система, используемая для обозначения химических веществ, зависит от природы молекулярных единиц, составляющих соединение. Обычно это либо ионы, либо молекулы; к каждому применяются разные правила.В этом разделе мы обсудим простейший двоичный
(двухатомные) молекулы.Цифры в именах
Часто бывает необходимо различать соединения, в которых одни и те же элементы присутствуют в разных пропорциях; угарный газ CO и углекислый газ CO 2 знакомы
каждому. Химики, возможно, надеясь, что это узаконит их как ученых, используют греческие (иногда латинские) префиксы для обозначения чисел в именах; вы будете часто сталкиваться с ними, и вы должны их знать:Иногда вы будете видеть такие названия, как ди водород и ди хлор, используемые для различения общих форм этих элементов (H 2 , Cl 2 ) от
атомы, имеющие одно и то же имя, когда это требуется для ясности.1/2 1 2 3 4 5 6 7 8 9 10 пол моно di три тетра пента гекса гепта окта нона дека Примеры:
Из этих примеров будет очевидно, что химики имеют обыкновение допускать некоторые вольности, применяя строгие числовые префиксы к более широко известным веществам.
Бинарные соединения неметаллов
Эти двухэлементные соединения обычно довольно легко назвать, потому что большинство из них следуют систематическому правилу добавления суффикса -ide к корневому имени второго элемента, которое обычно является более «отрицательным». Несколько таких
примеры показаны выше.Но, как отмечалось выше, есть несколько важных исключений, в которых общий или q H 2 O ( вода , а не оксид дигидрогена) /
- H 2 O 2 ( перекись водорода , не диоксид водорода)
- H 2 S ( сероводород , не сероводород)
- NH 3 ( аммиак , не тригидрид азота)
- NO ( оксид азота , не оксид азота)
- N 2 O ( закись азота , не закись азота)
- CH 4 ( метан , не тетрагидрид углерода)
4 Обозначение химических ионов
Ион — это электрически заряженный атом или молекула, то есть такая, в которой число электронов отличается от числа ядерных протонов.Многие простые соединения можно рассматривать, по крайней мере формально, как производимые
вверх пары ионов с противоположными знаками заряда.Катионы
Положительные ионы, также известные как катионы , в основном состоят из металлических элементов, которые просто принимают название самого элемента.
кальций натрия магний кадмий калий Ca 2+ Na + мг 2+ Кд 2+ К + Единственными важными неметаллическими катионами, о которых вам нужно знать, являются
водород гидроксоний аммоний H + H 3 O + NH 4 + (Позже, когда вы изучите кислоты и основания, вы узнаете, что первые два представляют собой одни и те же химические соединения.)
Многовалентные катионы
Некоторые из металлических ионов многовалентны , что означает, что они могут обладать более чем одним электрическим зарядом. Для них существуют систематические имена, использующие римские цифры, и гораздо более старые и менее громоздкие общие имена, которые в основном
Используйте латинские названия элементов, используя окончания — ous и — ic для обозначения более низкого и высокого заряда соответственно.(В случаях, когда возможно более двух значений начисления, используются систематические названия.)
Единственное, что вам нужно знать в этом курсе:Cu + Cu 2+ Fe 2+ Fe 3+ * рт. Ст. 2 2+ рт. Ст. 2+ Sn 2+ Sn 4+ медь (I) медь (II) железо (II) железо (III) ртуть (I) ртуть (II) олово (II) олово (IV) медь медь черный железо ртуть ртуть олово станник * Ион ртути представляет собой уникальный двойной катион , который иногда неправильно представляется как Hg + .
Анионы
Неметаллические элементы обычно образуют отрицательных ионов ( анионов ). Имена одноатомных анионов заканчиваются суффиксом -ide :
.
Класс — S 2– O 2– С 4– I — H – хлорид сульфид оксид карбид йодид гидрид Существует ряд важных многоатомных анионов, которые для целей наименования можно разделить на несколько категорий.Некоторые следуют схеме для одноатомных анионов:
ОН — CN — О 2 — гидроксид цианид перекись Оксианионы
Наиболее распространенные кислородсодержащие анионы ( оксианионов ) имеют названия, оканчивающиеся на -ate , но если существует вариант, содержащий небольшое количество атомов кислорода, он принимает суффикс -ite .
CO 3 2– НЕТ 3 — НЕТ 2 — СО 4 2– СО 3 2– PO 4 3– карбонат нитрат нитрит сульфат сульфит фосфат Вышеупомянутые ионы (за исключением нитрата) также могут объединяться с H + с образованием «кислотных» форм, имеющих меньший отрицательный заряд.По довольно неясным историческим причинам некоторые из них имеют общие названия, начинающиеся с -bi , что, хотя
официально не рекомендуется, до сих пор широко используются:ион систематическое наименование общее название HCO 3 — гидрокарбонат бикарбонат HSO 4 — сероводород бисульфат HSO 3 — гидросульфит бисульфит Хлор и, в меньшей степени, бром и йод, образуют более обширную серию оксианионов, для которой требуется несколько более сложное соглашение об именах:
ClO — ClO 2 — ClO 3 — ClO 4 — гипохлорит хлорит хлорат перхлорат 5 Названия соединений на основе ионов
Эти соединения формально являются производными положительных ионов ( катионов ) и отрицательных ионов ( анионов ) в соотношении, которое дает электрически нейтральную единицу.
Соли
Соли, из которых обычная «соль» (хлорид натрия) является наиболее распространенным примером, все являются твердыми веществами при обычных условиях. Небольшое их количество (например, NaCl) действительно сохраняет свои составляющие ионы и правильно называется «ионными твердыми веществами». Во многих
Однако в некоторых случаях ионы теряют свой электрически заряженный характер и образуют в значительной степени неионогенные твердые вещества, такие как CuCl 2 , описанный здесь. Термин «твердые вещества на основе ионов» охватывает
оба этих класса соединений.Большинство катионов и анионов, описанных выше, могут объединяться с образованием твердых соединений, которые обычно известны как соли . Главное требование состоит в том, что полученное соединение должно быть электрически нейтральным: таким образом, ионы Ca 2+ и Br — объединяются только в соотношении 1: 2 с образованием бромида кальция CaBr 2 . Поскольку никакая другая простейшая формула невозможна, нет необходимости называть ее «дибромид кальция».
Поскольку некоторые металлические элементы образуют катионы, имеющие разные положительные заряды, названия ионных соединений, производных от этих элементов, должны содержать некоторое указание заряда катиона. В более старом методе используются суффиксы -ous и
-ic для обозначения более низкого и высокого заряда соответственно. В случае железа и меди используются латинские названия элементов: железо , медь .Эта система до сих пор широко используется, хотя она была официально заменена более точной, хотя и немного громоздкой стандартной системой, в которой катионный заряд (фактически, степень окисления) указывается римскими цифрами.
после символа катиона.В обеих системах название аниона оканчивается на — ide .формула систематическое название общее название CuCl хлорид меди (I) хлорид меди CuCl 2 хлорид меди (II) хлорид меди Hg 2 Класс хлорид ртути (I) хлорид ртути HgO оксид ртути (II) оксид ртути FeS сульфид железа (II) сульфид железа Fe 2 S 3 сульфид железа (III) сульфид железа Кислоты
Большинство кислот можно рассматривать как комбинацию иона водорода H + с анионом; название аниона отражено в названии кислоты.Обратите внимание, в случае оксикислот, как суффиксы анионов -ate и -ite становятся -ic и -ous , соответственно, в названии кислоты. Да, у химии грамматика очень похожа на грамматику любого другого языка — и довольно много в ней неправильных!
анион название аниона кислота название кислоты Класс — хлорид-ион HCl соляная кислота CO 3 2– карбонат-ион H 2 CO 3 угольная кислота НЕТ 2 — нитрит-ион HNO 2 азотистая кислота НЕТ 3 — нитрат-ион HNO 3 азотная кислота СО 3 2– сульфит-ион H 2 SO 3 сернистая кислота СО 4 2– сульфат-ион H 2 SO 4 серная кислота CH 3 COO — ацетат-ион CH 3 COOH уксусная кислота 6 Наименование органических соединений
Поскольку органические (углеродные) соединения составляют подавляющее большинство всех известных химических веществ, номенклатура органических веществ сама по себе является огромным предметом.Мы представляем здесь только самую основную часть, которую вам нужно знать на первом курсе химии —
гораздо больше ожидает тех из вас, кому позже предстоит испытать удовольствие от курса органической химии.Указание длины углеродной цепи
Простейшие органические соединения состоят из прямых цепочек атомов углерода, названных с помощью префиксов, обозначающих количество атомов углерода в цепи. Используя соглашение C n для обозначения прямой цепи из n атомов (даже не спрашивайте о разветвленных цепях!), Префиксы для длин цепей от 1 до 10 приведены здесь:
С 1 С 2 С 3 С 4 С 5 С 6 С 7 С 8 С 9 С 10 мет- eth- проп- а — пент- шестнадцатеричный — гепт- окт — без дека — Как видите, в цепочках от C 5 и далее используются префиксы греческих номеров, так что здесь у вас не будет много нового для изучения.Простейшими из этих соединений являются углеводороды, имеющие общую формулу C n H 2 n +2 .
В целом они известны как алканов , и все их названия объединяют соответствующий числовой префикс с окончанием -ane :.
СН 4 C 2 H 6 C 3 H 8 С 8 В 18 С C – C C – C – C C – C – C – C – C – C – C – C метан этан пропан октановое число Все атомы углерода должны иметь четыре связи; обратите внимание на общепринятое правило не показывать атомы водорода явно.
Функциональные группы
Путем замены одного или нескольких атомов водорода углеродной цепи соответствующей функциональной группой можно получить различные классы соединений. Для максимальной простоты мы приводим примеры только для алканов с прямой цепью.
с одним заместителем. Отметим также, что в цепях C 3 и выше заместитель может находиться более чем в одном месте, что приводит к появлению множества изомеров .Спирты: гидроксильная группа
формула общее название систематическое название СН 3 ОН спирт метиловый метанол Канал 3 Канал 2 ОН спирт этиловый этанол C 8 H 15 OH октиловый спирт октанол Кислоты: карбоксильная группа
формула общее название систематическое название HCOOH муравьиная кислота метановая кислота CH 3 COOH уксусная кислота этановая кислота C 4 H 9 COOH масляная кислота бутановая кислота Еще несколько…
класс , пример имя> амин метиламин CH 3 NH 2 кетон ацетон (диметилкетон) CH 3 -CO-CH 3 эфир диэтиловый эфир C 2 H 5 -O-C 2 H 5 видео по номенклатуре органической продукции
Что вы должны уметь
Различные инструкторы устанавливают самые разные требования к химической номенклатуре.Следующие, вероятно, наиболее часто ожидаемые:
- Вы должны знать названия и символы по крайней мере первых двадцати элементов, а также всех групп галогенов и благородных газов (группы 17-18).
- Назовите любую бинарную молекулу, используя стандартные префиксы от 1 до 10.
- Все часто встречающиеся ионы.
- Соли и другие соединения на основе ионов, включая перечисленные здесь кислоты.На некоторых курсах вам не нужно будет знать -ous / -ic названий солей меди, железа и т. Д., Но на других вам понадобится.
- Узнайте у своего инструктора, какие органические соединения вы должны уметь называть.
Концептуальная карта
Общие и торговые наименования химических веществ
Общепринятое наименование Химическое название Формула Спирт, дерево метанол, метиловый спирт CH 3 OH Спирт зерновой Этанол или этиловый спирт C 2 H 5 OH Спирт, растирание 2-пропанол, пропиловый спирт,
изопропиловый спиртСпирт Спирт этиловый Алка Зельцер бикарбонат натрия Квасцы Калий сульфат алюминия
додекагидратГлинозем Оксид алюминия Al 2 O 3 Alundum Плавленый оксид алюминия Антифриз Этиленгликоль Антиперсперант Хлоргидрат алюминия Царская водка 1: 3 смесь азотной и
соляная кислотаHNO 3 + HCl Аспирин Ацетилсалициловая кислота Пищевая сода натрия гидрокарбонат NaHCO 3 Разрыхлитель бикарбонат натрия Банановое масло Амилацетат Барыта Оксид бария Баритов Сульфат бария Аккумуляторная кислота Серная кислота Бокситы Гидратированный оксид алюминия Бензол Бензол Отбеливатель (прачечная) Гипохлорит натрия NaClO Обесцвечивающий порошок Гипохлорит хлорида кальция Синий витрол Сульфат меди (II) CuSO 4 * 5H 2 O Bluestone Пентагидрат сульфата меди II CuSO 3 * 5H 2 O Борная кислота Борная кислота Borax Декагидрат тетрабората натрия Na 2 B 4 O 7 * 10H 2 O Латунь Сплав меди и цинка Сера Сера S Бронза Сплав меди и олова Каламин Карбонат цинка Кальцит Карбонат кальция Калгон гексаметафосфат кальция Каломель Хлорид ртути Карболовая кислота Фенол Тетрахлорметан Тетрахлорметан CCl 4 Карборунд Карбид кремния Каустическая сода Натрия гидроксид Мел Карбонат кальция Селитра Чили Нитрат натрия Хлороформ Трихлорметан CHCl 3 Хлорокс Гипохлорная кислота Желтый хром Хромат свинца Киноварь Сульфид ртути II HgS Клубная газировка Угольная кислота Коппера Гидратированный сульфат железа Коррозионный сублимат Хлорид ртути Винный камень Гидротартрат калия KHC 4 H 4 O 6 ДДТ Дихлордифенилтрихлорэтан декстроза Глюкоза Алмаз Углерод C Доломит Карбонат кальция и магния CaCO 3 * MgCO 3 Драно натрия гидроксид Средство для очистки духового шкафа натрия гидроксид Яичная скорлупа Карбонат кальция Английская соль Гептагидрат сульфата магния MgSO 4 * 7H 2 O Эфир Этиловый эфир Ex-lax Фенолфталеин Компонент удобрения Аммиачная селитра Флуростан Фторид олова Золото дураков Пирит железный Формалин 40% раствор формальдегида Фреон (хладагент) Дихлордифторметан CCl 2 F 2 Галена Сульфид цинка Галена Сульфид свинца II PbS Глауберова соль Гидратированный сульфат натрия Глицерин Глицерин Зерновой спирт Этанол или этиловый спирт C 2 H 5 OH Графит Углерод C Купорос зеленый Гидратированный сульфат железа Гипс дигидрат сульфата кальция CaSO 4 * 2H 2 O Тяжелая вода Оксид дейтерия Гипо Пентагидрат тиосульфата натрия Na 2 S 2 O 3 * 5H 2 O Кусок льда Хлорид кальция Инвертный сахар Смесь глюкозы и фруктозы Веселящий газ Оксид диазота N 2 O Левулоза Фруктоза Лайм Оксид кальция CaO Известняк Карбонат кальция CaCO 3 Жидкая бумага диоксид титана Соль облегченная Калия хлорид Горит Окись свинца Литопон Смесь сульфида цинка и
сульфат барияПечень серы Сульфид калия LOX Кислород жидкий Лунный каустик Нитрат серебра Щелочь Натрия гидроксид NaOH Магнезия Оксид магния Мрамор Карбонат кальция CaCO 3 Маргарин Частично насыщенные жирные кислоты Марш газ Метан МЭК Метилэтилкетон CH 3 COC 2 H 5 Микрокосмическая соль Натрий-аммоний гидратированный
гидрофосфатМолочный сахар Лактоза Молоко магнезиальное Гидроксид магния Mg (OH) 2 Известковое молоко Гидроксид кальция Соль Мора Гидратированный двухвалентный аммоний
сульфатШарики мотылька Нафталин Сообщение натрия гидроглутамат Соляная кислота Кислота соляная HCl Nutrasweet Аспартам Масло горького миндаля Бензальдегид Купоросное масло Серная кислота (конц.) H 2 SO 4 Масло мирбена Нитробензол Купоросное масло Кислота серная концентрированная Масло зимнее зеленое метилсалицилат Олеум Дымящая серная кислота Парижский зеленый Двойная соль ацетата меди и
арсенит медиPerier Угольная кислота Олово Сплав олова, сурьмы, меди,
и свинецФосген Карбонилхлорид Фотографическая гипо Тиосульфат натрия Пикриновая кислота Тринитрофенол Гипс Гидроксид кальция Штукатурка Парижская полугидрат сульфата кальция CaSO 4 * (1/2) H 2 O Калий Карбонат калия K 2 CO 3 Прусский синий Ферроцианид железа Пирит (золото дураков) Дисульфид железа FeS 2 Кварц Диоксид кремния SiO 2 Известь негашеная Оксид кальция Ртуть Меркурий Hg Рошельская соль Тартрат калия и натрия Ролаидс дигидроксиалюминий натрий
карбонатРуж Оксид железа Медицинский спирт 2-пропанол, пропиловый спирт,
изопропиловый спиртнашатырный спирт Хлорид аммония NH 4 Cl Сода содовая Карбонат натрия гидратированный нашатырный спирт Хлорид аммония Соль столовая Натрия хлорид NaCl Соль, легкая Калия хлорид Селитра Нитрат калия KNO 3 Песок Диоксид кремния SiO 2 Сани-промывка Бисульфат натрия Обертка Saran Поли-1,1-дихлорэтилен Кремнезем Диоксид кремния Гашеная известь Гидроксид кальция Ca (OH) 2 Нюхательные соли Карбонат аммония Кальцинированная сода (стиральная сода) Карбонат натрия Припой Сплав олова и сурьмы Сахар Сахароза Сахар столовый Сахароза C 12 H 22 O 11 Сахар свинца Гидратированный ацетат свинца Лосьон для загара Парааминобензойная кислота Тефлон Полимер тетрафторэтилена TNT Тринитротолуол Толуол Толуол ТСП (Tri) фосфат натрия Na 3 PO 4 Tums Карбонат кальция Синий Тернбулла Феррицианид железа Тайленол Ацетоминофен Уксус Уксусная кислота, этановая кислота Витамин C Аскорбиновая кислота Сода стиральная декагидрат карбоната натрия NaCO 3 * 10H 2 O Сода стиральная Карбонат натрия гидратированный Устройство для смягчения воды Гидроксид бария Белый свинец Карбонат свинца основной Windex Аммиак Древесный спирт Метиловый спирт, метанол CH 3 OH Смесь цинка Сульфид цинка .

 Реакция обмена между солью и менее
Реакция обмена между солью и менее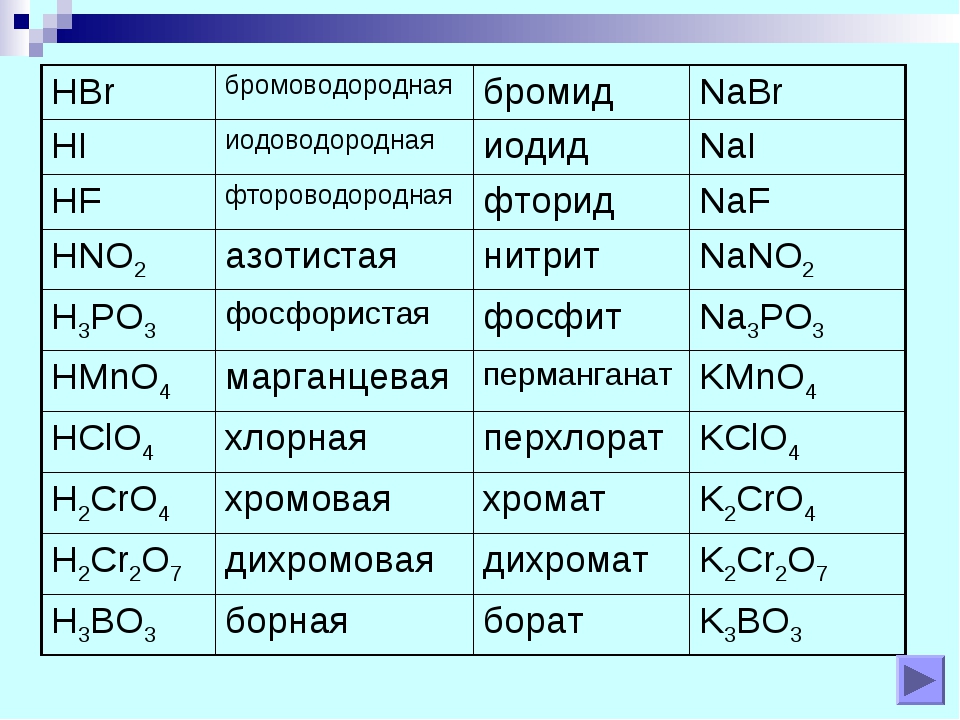 )
) Кислота может начать разбрызгиваться с выделением кислотных паров.
Кислота может начать разбрызгиваться с выделением кислотных паров.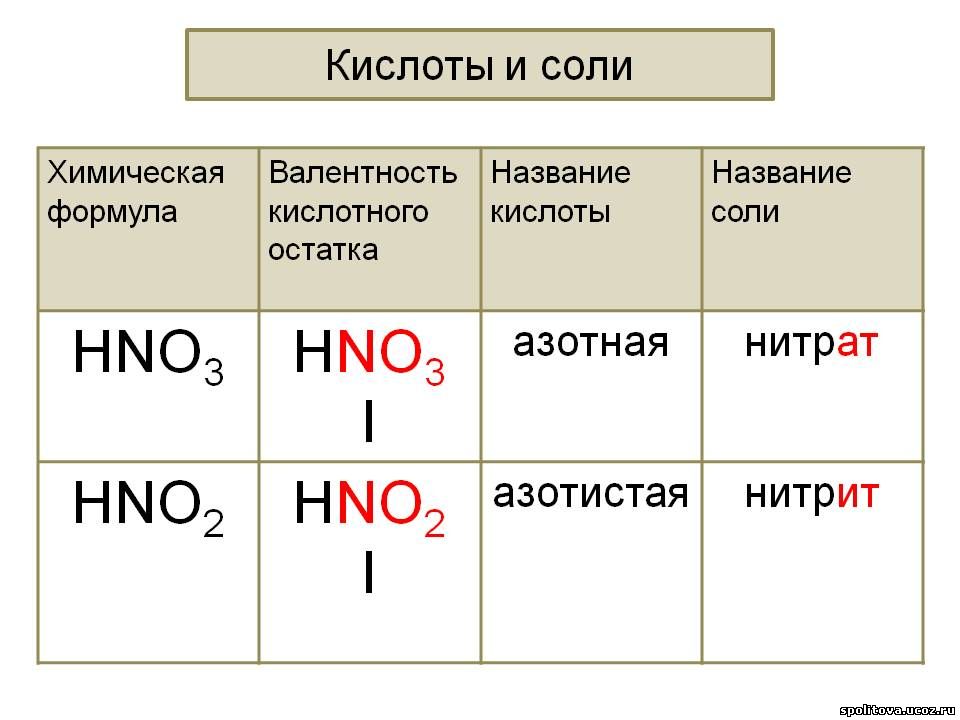 Свяжитесь с нами по телефону +7 (499) 270-16-62 и убедитесь в этом!
Свяжитесь с нами по телефону +7 (499) 270-16-62 и убедитесь в этом!