Содержание
Кислоты: химические свойства и получение
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н+ (или Н3О+).
По растворимости в воде кислоты можно поделить на растворимые и нерастворимые. Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые). Подробно про классификацию кислот можно прочитать здесь.
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
Например, оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4
При этом оксид кремния (IV) с водой не реагирует:
SiO2 + H2O ≠
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
Например, хлор реагирует с водородом:
H20 + Cl20 → 2H+Cl—
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз раствора сульфата меди (II):
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + H2O + CO2
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
P + 5HNO3 → H3PO4 + 5NO2 + H2O
1. В водных растворах кислоты диссоциируют на катионы водорода Н+ и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
Например, соляная кислота диссоциирует почти полностью:
HCl → H+ + Cl–
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O+ + Cl–
Многоосновные кислоты диссоциируют cтупенчато.
Например, сернистая кислота диссоциирует в две ступени:
H2SO3 ↔ H+ + HSO3–
HSO3– ↔ H+ + SO32–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
3. Кислоты реагируют с основаниями и основными оксидами.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
Например, гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
Cu(OH)2 + 2HBr → CuBr2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
Cu(OH)2 + H2SiO3 ≠
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
Например, уксусная кислота взаимодействует с гидроксидом алюминия:
3CH3COOH + Al(OH)3 → (CH3COO)3Al + 3H2O
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например, йодоводород можно окислить хлоридом меди (II):
4HI— + 2Cu+2 Cl2 → 4HCl + 2Cu+I + I20
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит. Такие реакции протекают по механизму ионного обмена.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Например, соляная кислота взаимодействует с нитратом серебра в растворе:
Ag+NO3— + H+Cl— → Ag+Cl—↓ + H+NO3—
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей.
При этом более сильные кислоты вытесняют менее сильные кислоты из солей.
Например, карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
CaCO3 + 2HCl → CaCl2 + H2O + CO2
5. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
Например, гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример: гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
H3PO4 + K2HPO4 → 2KH2PO4
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Более сильные кислоты также вытесняют менее сильные из солей.
Например, гидроксокарбонат меди (II) растворяется в серной кислоте:
2H2SO4 + (CuOH)2CO3 → 2CuSO4 + 3H2O + CO2
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например, гидроксохлорид алюминия взаимодействует с соляной кислотой:
Al(OH)Cl2 + HCl → AlCl3 + H2O
6. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Например, железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe + 2H+Cl → Fe+2Cl2 + H20
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т. к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
7. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
2HNO2 → NO + H2O + NO2
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
H2SiO3 → H2O + SiO2
2HI → H2 + I2
Азотная кислота HNO3 разлагается при нагревании или на свету:
4HNO3 → O2 + 2H2O + 4NO2
Химические свойства кислот.
 8-й класс
8-й класс
Цели урока:
- Образовательные:
- познакомить учащихся с классификацией кислот;
- изучить химические свойства кислот.
- Развивающие:
- развивать практические навыки;
- учить анализировать полученную информацию;
- развивать логическое мышление путем сравнения, обобщения, систематизации;
- учить выделять причинно-следственные связи.
- Воспитательные
- развивать интерес к предмету;
- развивать взаимосвязь между предметами;
- развивать знания о применении химии в быту;
- учить аккуратности при выполнении химических опытов.
Оборудование:
- мультимедийная презентация (ПК, проектор)
- штатив для пробирок, пробирки, спиртовка, спички, держатель для пробирок, химические стаканы, белый экран для демонстрации опытов
Реактивы:
- Индикаторы: лакмус, метилоранж, фенолфталеин
- Кислоты: соляная и серная
- Металлы: цинк, железо, медь.

- Оксид меди (II)
- Гидроксид натрия
- Соли: сульфат меди (II), хлорид бария, карбонат натрия
План урока:
1. Организационный момент (1-2 мин.)
2. Актуализация знаний учащихся (3 мин.)
3. Изучение нового материала (30 мин.)
4. Закрепление (8 мин.)
5. Домашнее задание (2 мин.)
ХОД УРОКА
I. Организационный момент
II. Актуализация знаний учащихся
Учитель: В этом учебном году вы приступили к изучению новой для вас науки. Как известно, химия – наука о веществах. Какие классы веществ вам известны? (Металлы, неметаллы, оксиды, основания, кислоты, соли)
На экране изображен ряд неорганических веществ. Из данного перечня выберите формулы только кислот. (Слайд 1 – Соляная, серная, кремниевая кислоты)
– На основании представленных формул и ранее изученного материала дайте определение этому классу веществ. (Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.)
(Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.)
– Сегодня на уроке мы попробуем обобщить уже имеющиеся знания о кислотах и познакомимся с химическими свойствами кислот. (Слайд 2)
III. Изучение нового материала
– Итак, тема урока: Химические свойства кислот (запись в тетрадях и на доске).
У каждого из вас на партах имеется схема, где представлена система координат. (Приложение 1). На одной из осей К0 отмечены основные пункты, по которым мы будем рассматривать класс кислоты. Первый пункт нашего плана Состав. Давайте на оси К1 отметим известную нам информацию.
На оси К2 отметим известные нам классификации кислот. Давайте обратимся к слайду (слайд 4): Чем различаются кислоты, записанные в правом и левом столбиках? Что лежит в основе классификации? (наличием кислорода)
(Слайд 5) Чем различаются кислоты на этом слайде? Что лежит в основе классификации? (количеством атомов водорода)
(Слайд 6) Кислоты по растворимости в воде также делятся на растворимые и нерастворимые. Назовите примеры кислот, используя таблицу растворимости.
Назовите примеры кислот, используя таблицу растворимости.
(Слайд 7) Кислоты делятся на стабильные и нестабильные. Как вы думаете, что значит нестабильные кислоты?( кислоты, способные разлагаться)
Перейдем к оси К3 – Физические свойства кислот. Какие физические свойства кислот вам известны?(кислый вкус, агрегатное состояние, цвет)
На оси К4 будем отмечать характерные для кислот химические свойства.
Одним из общих химических свойств кислот является действие их на индикаторы. Что такое индикаторы? (Вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной) Какие индикаторы вам известны? (Лакмус, метилоранж, фенолфталеин). (Слайд 9). Посмотрим демонстрационный опыт: в трех химических стаканах находится соляная кислота. Прильем в стаканы индикаторы? Как изменилась окраска растворов? (При добавлении лакмуса и метилоранжа растворы приобрели красную окраску, в случае фенолфталеина видимых изменений не было). Какой вывод можно сделать? (Кислоты можно обнаружить только с помощью лакмуса и фенолфталеина)
Какой вывод можно сделать? (Кислоты можно обнаружить только с помощью лакмуса и фенолфталеина)
Задание. На столах вам выданы 3 пронумерованные пробирки, в которых находятся вода, серная кислота и гидроксид натрия. Определите, в какой пробирке находится то или иное вещество. (Работа в парах).
– Кислоты вступают в ряд химических реакций (Слайд 10), взаимодействуют с металлами, оксидами металлов, основаниями и солями. Обратите внимание, что во всех случаях основным продуктом реакции будет соль.
1. Взаимодействие кислот с металлами. В три пробирки поместите соответственно цинк, железо, медь. Прилейте одинаковое количество соляной кислоты. Что наблюдаете? (В случае цинка – быстрое выделение пузырьков газа, в случае железа – менее интенсивное выделение газа, в случае меди признаки реакции отсутствуют). Какой вывод можно сделать? (Не все металлы реагируют с кислотами). Практическим путем учеными было выяснено, какие металлы вытесняют водород из растворов кислот. Таким образом был составлен ряд Н. Н. Бекетова, который сейчас называют электрохимический ряд напряжения металлов. Если металл находится до водорода, то он реагирует с кислотами, если после, то – нет. Запишите соответствующие уравнения реакций:
Таким образом был составлен ряд Н. Н. Бекетова, который сейчас называют электрохимический ряд напряжения металлов. Если металл находится до водорода, то он реагирует с кислотами, если после, то – нет. Запишите соответствующие уравнения реакций:
Zn + 2HCl = ZnCl2 + H2↑ (реакция замещения)
Fe + 2HCl = FeCl2 + H2↑ (реакция замещения)
Cu + HCl ≠
2. Взаимодействие кислот с оксидами металлов. В сухую пробирку поместите небольшое количество оксида меди (II), прилейте 2 мл серной кислоты. Осторожно нагрейте пробирку, соблюдая правила техники безопасности. Что наблюдаете? (После реакции раствор стал голубого цвета). Составьте уравнение реакции. Какие вещества образуются в результате реакции?
CuO + H2SO4 = CuSO4 + H2O (реакция обмена)
3. Взаимодействие кислот с основаниями. На каждом столе в штативе для пробирок имеется свежеприготовленный гидроксид меди(II) синего цвета. Прилейте раствор кислоты до полного растворения осадка. Напишите уравнение химической реакции.
Взаимодействие кислот с основаниями. На каждом столе в штативе для пробирок имеется свежеприготовленный гидроксид меди(II) синего цвета. Прилейте раствор кислоты до полного растворения осадка. Напишите уравнение химической реакции.
Cu(OH)2 + 2HCl = CuCl2 + 2H2O (реакция обмена)
4. Взаимодействие кислот с солями. В две пробирки прилейте соответственно растворы хлорида бария и карбоната натрия. Прилейте в обе пробирки серную кислоту. Что наблюдаете? (Выпадения осадка белого цвета; выделение пузырьков газа). Напишите уравнение химической реакции.
BaCl2 + H2SO4 = BaSO4 + 2HCl (реакция обмена)
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ (реакция обмена
Для написания уравнений реакций кислот с солями следует пользоваться рядом вытеснения кислот, в котором каждая предыдущая может вытеснить из соли последующую. (Приложение 2)
(Приложение 2)
На схеме найдем ось К5. Давайте подумаем, где в жизни мы встречаемся с кислотами?
В желудочном соке животных организмов присутствует соляная кислота.
Действие кислот на наш организм:
1) Кислоты уничтожают болезнетворные и гнилостные микробы, поэтому влияют на наш иммунитет (особенно аскорбиновая кислота). Кроме того, именно это свойство позволяет их использовать как консерванты (при мариновании продуктов). Вы все прекрасно знаете, что кислые ягоды не портятся значительно дольше, чем сладкие.
2) Кислоты способствуют расщеплению жиров, тем самым улучшают переваривание пищи.
3) Возбуждают аппетит, обостряют осязание.
Немало кислот в нашей пище. Фрукты, молочные продукты, соусы, приправы, лекарства поставляют целый букет кислот: яблочную, щавелевую, лимонную, молочную и др.
Уксусная и лимонная кислота применяется для удаления пятен от ржавчины на хлопчатобумажных, льняных и шерстяных белых тканях. 1 чайная ложка на 1 стакан воды, подогреть до кипения и ткань с пятном несколько раз окунуть в раствор или пятно протереть раствором, а затем кислоту тщательно смыть водой, лучше с добавлением несколько капель нашатырного спирта – для нейтрализации кислоты. (Приложение 3)
IV. Закрепление
Задание: составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. Из букв, соответствующих правильным ответам, вы составите название одного из элементов четвертого периода таблицы Д.И. Менделеева.
| 1) SiО2 | А |
2) LiОН | К |
3) Ва (NО3)2 | А |
4) НСI | С |
5) К2О | Л |
6) К2SiО3 | И |
7) Н NО3 | О |
8) Fе(ОН)3 | Й |
V. Домашнее задание:
Домашнее задание:
§38(по учебнику Габриеляна О.С.), выучить таблицу,
На оценку стр. 214:
- «3» – упр 1, 2
- «4» – упр 1, 2, 4
- «5» – упр 1, 2, 4, 5
6. Итоги урока
7. Оценки за урок
Список используемой литературы:
- CD-ROM «Химия.8 класс» (Электронный ресурс) – М. «Просвещение»,2004.Габриелян О.С. Настольная книга учителя. Химия. 8 класс. М.: Дрофа, 2003
- Маркина И.В. Современный урок химии. Ярославль. Академия развития. 2008
- Правила техники безопасности при работе с кислотами. Анимация. http://files.school-collection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de-0800200c9a66/ch08_20_05.swf
- http://www.logosib.ru/him/HCl.jpg
- http://forexaw.com/TERMs/Metal121313/img73211_4-1_Himicheskie_svoystva_zolota-rastvoryi.jpg
Урок №48.
 Химические свойства кислот
Химические свойства кислот
Химические свойства кислот
1. Изменяют окраску индикаторов
Видео «Действие кислот на индикаторы»
Название индикатора | Нейтральная среда | Кислая среда |
Лакмус | Фиолетовый | Красный |
Фенолфталеин | Бесцветный | Бесцветный |
Метилоранж | Оранжевый | Красный |
Универсальная индикаторная бумага | Оранжевая | Красная |
2.Реагируют с металлами в ряду активности до H2
(искл. HNO3 –азотная кислота)
HNO3 –азотная кислота)
Видео «Взаимодействие кислот с металлами»
Ме + КИСЛОТА =СОЛЬ + H2↑ (р. замещения)
Zn + 2 HCl = ZnCl2 + H2
3. С основными (амфотерными) оксидами – оксидами металлов
Видео «Взаимодействие оксидов металлов с кислотами»
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
CuO + H2SO4 = Cu SO4 + H2O
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
H3PO4 + 3NaOH = Na3PO4 + 3H2O
5. Реагируют с солями слабых, летучих кислот — если образуется кислота, выпадающая в осадок или выделяется газ:
Реагируют с солями слабых, летучих кислот — если образуется кислота, выпадающая в осадок или выделяется газ:
2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl↑ ( р. обмена)
Сила кислот убывает в ряду: HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3 . Каждая предыдущая кислота может вытеснить из соли последующую |
Видео «Взаимодействие кислот с солями»
6. Разложение кислородсодержащих кислот при нагревании
( искл. H2SO4 ; H3PO4 )
H2SO4 ; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду:
H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
Сероводородная кислота в продуктах выделяется в виде газа:
СаS + 2HCl = H2S↑ + CaCl2
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Составьте уравнения реакций:
Ca + HCl
Na + H2SO4
Al + H2S
Ca + H3PO4
Назовите продукты реакции.
№2. Составьте уравнения реакций, назовите продукты:
Na2O + H2CO3
ZnO + HCl
CaO + HNO3
Fe2O3 + H2SO4
№3.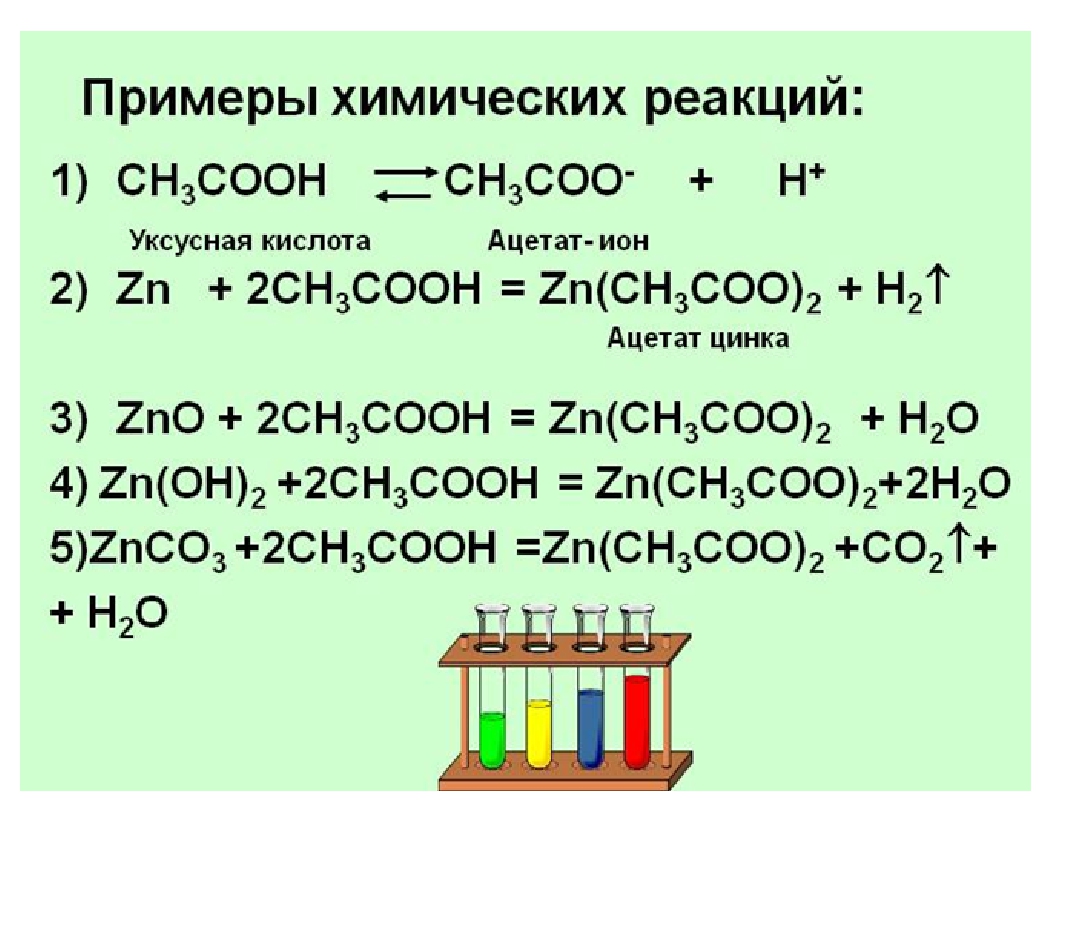 Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
KOH + HNO3
NaOH + H2SO3
Ca(OH)2 + H2S
Al(OH)3 + HF
HCl + Na2SiO3
H2SO4 + K2CO3
HNO3 + CaCO3
Назовите продукты реакции.
Тренируемся по свойствам кислот
ЕГЭ. Химические свойства кислот
Химические свойства кислот
1. Сила кислот уменьшается в ряду:
HI → HClO4 → HBr → HCl → H2SO4 → H2SeO4 → HNO3 → HClO3 → HIO3 →
H2SO3 → HClO2 → H3PO4 → HF → HNO2 → CH3COOH → H2CO3 → H2S → H2SiO3.
Некоторые реакции, подтверждающие ряд кислот:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O т. е. H2CO3 слабее, чем HCl
е. H2CO3 слабее, чем HCl
K2CO3 + SO2 → K2SO3 + CO2 т.е. H2CO3 слабее, чем H2SO3
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O т.е. H2CO3 слабее, чем CH3COOH
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3 т.е. H2SiO3 слабее, чем H2CO3
3H2SO4 + 2K3PO4 → 3K2SO4 + 2H3PO4 т.е. H3PO4 слабее, чем H2SO4
Во всех этих реакциях образуются либо осадок, либо (более) слабая кислота.
Если осадка не образуется и обе кислоты сильные (т. е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
NaCl(тв.) + H2SO4(к) → NHSO4 + HCl
NaNO3(тв.) + H2SO4(к) → NaHSO4 + HNO3
Аналогичным образом можно получить и слабую плавиковую кислоту:
KF(тв.) + H2SO4(к) → KHSO4 + HF
HBr и HI (они также являются летучими) таким образом получать не удается, так как они окисляются концентрированной серной кислотой:
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
2. Летучесть кислот
Летучесть кислот
Следующие кислоты являются летучими: HNO3, HF, HCl, HBr, HI, H2S, H2Se.
Остальные кислоты являются нелетучими.
3. Сила кислот (способность к диссоциации)
Сильные: HNO3, H2SO4, HCl, HBr, HI, HClO4, HClO3.
Слабые (все остальные): HF, H2CO3, H2SO3, HNO2, H3PO4, H2S, H2SiO3, все органические кислоты и другие.
4. Растворимость кислот в воде
Нерастворимыми кислотами являются: H2SiO3 и все высшие жирные кислоты, т.е. кислоты, содержащие 10 атомов углерода и больше. Например, C17H35COOH (стеариновая кислота).
5. Термическое разложение кислот
При нагревании разлагаются следующие кислоты:
H2CO3 → CO2 + H2O
H2SO3 → SO2 + H2O
4HNO3 → 4NO2 + O2 + 2H2O
H2SiO3 → SiO2 + H2O
Неустойчивыми являются H2CO3 и H2SO3.
6. Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2HCl + Mg(OH)2 → MgCl2 + 2H2O
Эти реакции идут, только если образующаяся соль существует в водном растворе, т.е. в таблице растворимости не должен стоять прочерк:
H2S + Al(OH)3 → реакция не идет, т.к. Al2S3 в водной среде разлагается (по сути, идет обратная реакция)
H2S + Cr(OH)3 → реакция не идет по той же причине.
Особенность кремниевой кислоты: из оснований она реагирует только с щелочами:
H2SiO3 + 2NaOH → Na2SiO3 + 2H2O
H2SiO3 + Cu(OH)2 → реакция не идет
H2SiO3 + Al(OH)3 → реакция не идет.
7. Взаимодействие с солями
Взаимодействие с солями
Реакции с солями идут, если выделяется газ, выпадает осадок или образуется более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
8. Взаимодействие кислот-неокислителей с металлами
Металлы, стоящие в ряду активности металлов до водорода, взаимодействуют с кислотами-неокислителями с выделением водорода:
H2SO4(р) + Zn → ZnSO4 + H2
6HCl + 2Fe → 2FeCl3 + 3H2
Cu + HCl → реакция не идет.
9. Взаимодействие кислот-окислителей (H2SO4(к), HNO3(к) и HNO3(р)) с простыми и сложными веществами
9.1) Серная кислота
9. 2) Азотная кислота
2) Азотная кислота
Свойства кислот, получение кислот
Свойства кислот
Кислоты — это сложные химические вещества, которые содержат атомы водорода, способные замещаться на атомы металлов и образовывать соли.
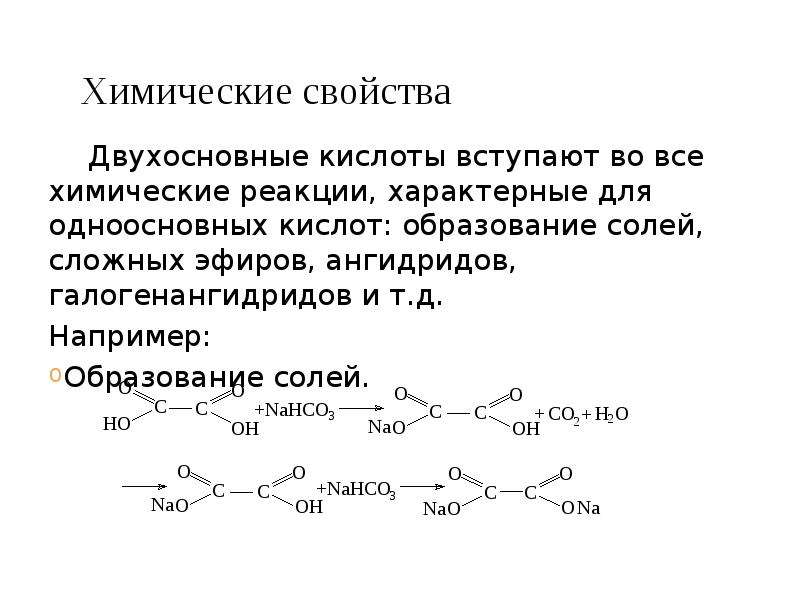
Кислоты различаются по основности: Основность определяется количеством атомов водорода, входящим в их состав. Например, серная — H2SO4 — двухосновная, так как в её состав входит 2 атома водорода.
Кислоты разделяют также на кислородосодержащие и не содержащие кислород. Например, соляная — HCl — не содержит атомов кислорода, а H2СO3 — угольная — содержит 3 атома кислорода и является кислородосодержащей.
Теперь разберём подробнее свойства кислот и их химическое взаимодействие c простыми и сложными веществами.
Основные химические свойства кислот:
— взаимодействие с металлами:
H2SO4 +Zn → ZnSO4 + H2 — Образуется соль и выделяется водород
В зависимости от концентрации самой кислоты получаются различные продукты химической реакции.
Например,
2H2SO4 + Cu → CuSO4 + SO2 +2H2O — в этом случае серная кислота — концентрированная. Разбавленная — на медь (Cu) никак не действует.
— взаимодействие с основными оксидами и амфотерными оксидами:
CuO + H2SO4 → CuSO4 + H2O — образуется соль и вода;
SnO + HCl → SnCl2 + H2O (оксид олова — SnO — амфотерный оксид)
— взаимодействие с основаниями и щелочами:
HCl + KOH → KCl + H2O — эту реакцию ещё называют реакцией нейтрализации — образуется соль и вода;
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
— взаимодействие с солью:
При химических реакциях кислот с солью обязательно надо учитывать основные признаки химических реакций, а именно, химическая реакция пройдёт, если будет выделяться газ, выпадет осадок, и т. д.
д.
N2CO3 + 2HCl → 2NaCl + CO2 + H2O — выделяется углекислый газ CO2. Конечно, если говорить точно, то образуется слабая угольная кислота (H2CO3), которая сразу же распадается на углекислый газ и воду.
При этих реакциях образуется соль и другая кислота (более слабая, чем та, которая вступала в реакцию).
Теперь рассмотрим основным способы получения кислот
Получение кислот
Получение кислот производят с помощью следующих химических реакций:
— при взаимодействии кислотных оксидов с водой:
SO3 + H2O → H2SO4;
CO2 + H2O → H2CO3;
— при взаимодействии кислоты с солью:
NaCl + H2SO4(конц. ) → HCl + Na2SO4 — при этой химической реакции образуется новая более слабая кислота (более слабая, чем серная, но тоже сильная) и другая соль;
) → HCl + Na2SO4 — при этой химической реакции образуется новая более слабая кислота (более слабая, чем серная, но тоже сильная) и другая соль;
— при взаимодействии неметаллов с водородом с последующим растворением их в воде:
H2 + Cl2 → HCl (Надо помнить, что само по себе данное химическое соединение — газ хлороводород HCl кислотой не является. Для её образования необходимо полученный газ HCl растворить в воде). Аналогичным образом поступают с газом сероводородом:
H2 + S → H2S;
— при окислении некоторых простых веществ:
P + 5HNO3 +2H2O → 3H3PO4 + 5NO (в этой химической реакции происходит окисление фосфора (P) азотной кислотой (HNO3) до ортофосфорной кислоты (H3PO4) с выделением оксида азота (NO)
100 ballov.
 kz образовательный портал для подготовки к ЕНТ и КТА
kz образовательный портал для подготовки к ЕНТ и КТА
В 2021 году казахстанские школьники будут сдавать по-новому Единое национальное тестирование. Помимо того, что главный школьный экзамен будет проходить электронно, выпускникам предоставят возможность испытать свою удачу дважды. Корреспондент zakon.kz побеседовал с вице-министром образования и науки Мирасом Дауленовым и узнал, к чему готовиться будущим абитуриентам.
— О переводе ЕНТ на электронный формат говорилось не раз. И вот, с 2021 года тестирование начнут проводить по-новому. Мирас Мухтарович, расскажите, как это будет?
— По содержанию все остается по-прежнему, но меняется формат. Если раньше школьник садился за парту и ему выдавали бумажный вариант книжки и лист ответа, то теперь тест будут сдавать за компьютером в электронном формате. У каждого выпускника будет свое место, огороженное оргстеклом.
Зарегистрироваться можно будет электронно на сайте Национального центра тестирования. Но, удобство в том, что школьник сам сможет выбрать дату, время и место сдачи тестирования.
Но, удобство в том, что школьник сам сможет выбрать дату, время и место сдачи тестирования.
Кроме того, в этом году ЕНТ для претендующих на грант будет длиться три месяца, и в течение 100 дней сдать его можно будет два раза.
— Расскажите поподробнее?
— В марте пройдет тестирование для желающих поступить на платной основе, а для претендующих на грант мы ввели новые правила. Школьник, чтобы поступить на грант, по желанию может сдать ЕНТ два раза в апреле, мае или в июне, а наилучший результат отправить на конкурс. Но есть ограничение — два раза в один день сдавать тест нельзя. К примеру, если ты сдал ЕНТ в апреле, то потом повторно можно пересдать его через несколько дней или в мае, июне. Мы рекомендуем все-таки брать небольшой перерыв, чтобы еще лучше подготовиться. Но в любом случае это выбор школьника.
— Система оценивания останется прежней?
— Количество предметов остается прежним — три обязательных предмета и два на выбор. Если в бумажном формате закрашенный вариант ответа уже нельзя было исправить, то в электронном формате школьник сможет вернуться к вопросу и поменять ответ, но до того, как завершил тест.
Если в бумажном формате закрашенный вариант ответа уже нельзя было исправить, то в электронном формате школьник сможет вернуться к вопросу и поменять ответ, но до того, как завершил тест.
Самое главное — результаты теста можно будет получить сразу же после нажатия кнопки «завершить тестирование». Раньше уходило очень много времени на проверку ответов, дети и родители переживали, ждали вечера, чтобы узнать результат. Сейчас мы все автоматизировали и набранное количество баллов будет выведено на экран сразу же после завершения тестирования.
Максимальное количество баллов остается прежним — 140.
— А апелляция?
— Если сдающий не будет согласен с какими-то вопросами, посчитает их некорректными, то он сразу же на месте сможет подать заявку на апелляцию. Не нужно будет ждать следующего дня, идти в центр тестирования, вуз или школу, все это будет электронно.
— С учетом того, что школьникам не придется вручную закрашивать листы ответов, будет ли изменено время сдачи тестирования?
— Мы решили оставить прежнее время — 240 минут. Но теперь, как вы отметили, школьникам не нужно будет тратить час на то, чтобы правильно закрасить лист ответов, они спокойно смогут использовать это время на решение задач.
Но теперь, как вы отметили, школьникам не нужно будет тратить час на то, чтобы правильно закрасить лист ответов, они спокойно смогут использовать это время на решение задач.
— Не секрет, что в некоторых селах и отдаленных населенных пунктах не хватает компьютеров. Как сельские школьники будут сдавать ЕНТ по новому формату?
— Задача в том, чтобы правильно выбрать время и дату тестирования. Центры тестирования есть во всех регионах, в Нур-Султане, Алматы и Шымкенте их несколько. Школьники, проживающие в отдаленных населенных пунктах, как и раньше смогут приехать в город, где есть эти центры, и сдать тестирование.
— На сколько процентов будет обновлена база вопросов?
— База вопросов ежегодно обновляется как минимум на 30%. В этом году мы добавили контекстные задания, то что школьники всегда просили. Мы уделили большое внимание истории Казахстана и всемирной истории — исключили практически все даты. Для нас главное не зазубривание дат, а понимание значения исторических событий. Но по каждому предмету будут контекстные вопросы.
Но по каждому предмету будут контекстные вопросы.
— По вашему мнению система справится с возможными хакерскими атаками, взломами?
— Информационная безопасность — это первостепенный и приоритетный вопрос. Центральный аппарат всей системы находится в Нур-Султане. Связь с региональными центрами сдачи ЕНТ проводится по закрытому VPN-каналу. Коды правильных ответов только в Национальном центре тестирования.
Кроме того, дополнительно через ГТС КНБ (Государственная техническая служба) все тесты проходят проверку на предмет возможного вмешательства. Здесь все не просто, это специальные защищенные каналы связи.
— А что с санитарными требованиями? Нужно ли будет школьникам сдавать ПЦР-тест перед ЕНТ?
— ПЦР-тест сдавать не нужно будет. Требование по маскам будет. При необходимости Центр национального тестирования будет выдавать маски школьникам во время сдачи ЕНТ. И, конечно же, будем измерять температуру. Социальная дистанция будет соблюдаться в каждой аудитории.
— Сколько человек будет сидеть в одной аудитории?
— Участники ЕНТ не за семь дней будут сдавать тестирование, как это было раньше, а в течение трех месяцев. Поэтому по заполняемости аудитории вопросов не будет.
— Будут ли ужесточены требования по дисциплине, запрещенным предметам?
— Мы уделяем большое внимание академической честности. На входе в центры тестирования, как и в предыдущие годы, будут стоять металлоискатели. Перечень запрещенных предметов остается прежним — телефоны, шпаргалки и прочее. Но, помимо фронтальной камеры, которая будет транслировать происходящее в аудитории, над каждым столом будет установлена еще одна камера. Она же будет использоваться в качестве идентификации школьника — как Face ID. Сел, зарегистрировался и приступил к заданиям. Мы применеям систему прокторинга.
Понятно, что каждое движение абитуриента нам будет видно. Если во время сдачи ЕНТ обнаружим, что сдающий использовал телефон или шпаргалку, то тестирование автоматически будет прекращено, система отключится.
— А наблюдатели будут присутствовать во время сдачи тестирования?
— Когда в бумажном формате проводили ЕНТ, мы привлекали очень много дежурных. В одной аудитории было по 3-4 человека. При электронной сдаче такого не будет, максимум один наблюдатель, потому что все будет видно по камерам.
— По вашим наблюдениям школьники стали меньше использовать запрещенные предметы, к примеру, пользоваться телефонами?
— Практика показывает, что школьники стали ответственнее относиться к ЕНТ. Если в 2019 году на 120 тыс. школьников мы изъяли 120 тыс. запрещенных предметов, по сути у каждого сдающего был телефон. То в прошлом году мы на 120 тыс. школьников обнаружили всего 2,5 тыс. телефонов, и у всех были аннулированы результаты.
Напомню, что в 2020 году мы также начали использовать систему искусственного интеллекта. Это анализ видеозаписей, который проводится после тестирования. Так, в прошлом году 100 абитуриентов лишились грантов за то, что во время сдачи ЕНТ использовали запрещенные предметы.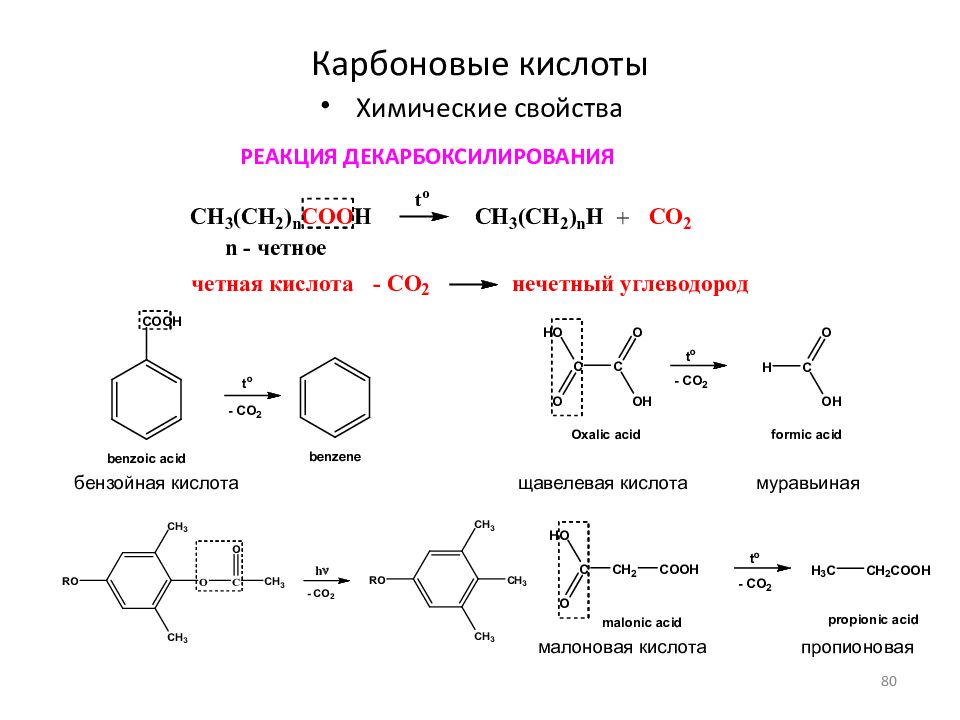
— Сколько средств выделено на проведение ЕНТ в этом году?
Если раньше на ЕНТ требовалось 1,5 млрд тенге из-за распечатки книжек и листов ответов, то сейчас расходы значительно сокращены за счет перехода на электронный формат. Они будут, но несущественные.
— Все-таки почему именно в 2021 году было принято решение проводить ЕНТ в электронном формате. Это как-то связано с пандемией?
— Это не связано с пандемией. Просто нужно переходить на качественно новый уровень. Мы апробировали данный формат на педагогах школ, вы знаете, что они сдают квалификационный тест, на магистрантах, так почему бы не использовать этот же формат при сдаче ЕНТ. Тем более, что это удобно, и для школьников теперь будет много плюсов.
Химия
КИСЛОТЫ
Оглавление:
1. Определение
2. Классификация
3. Электролитическая
диссоциация
4. Получение
Получение
5. Важнейшие химические
свойства
6. Специфические свойства
7. Задания
8. Ответы
|
Кислоты –
|
КЛАССИФИКАЦИЯ
1. По числу атомов водорода, способных
замещаться на атомы металлов кислоты разделяют на одноосновные,
двухосновные и трёхосновные.
2. По наличию или отсутствию атомов кислорода
в молекуле различают бескислородные и кислородсодержащие кислоты.
Существуют и другие способы классификации кислот.
По силе (по степени диссоциации)
1.
Сильные
(α
=100 %)
2.
Слабые
(α
< 100 %)
HCl,
HNO3, H2SO4
H2S, HNO2, H2CO3
По растворимости
1. Растворимые 2. Нерастворимые
HCl,
HNO3
H2SiO3,
H2MoO4
По
стабильности
1. Стабильные 2. Нестабильные
HCl,
HF, H2SO4 ,
HNO3,
H2SO3,
H2SiO3,
H2CO3
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Растворимые кислоты при растворении в воде
диссоциируют на катионы водорода и анионы кислотных остатков.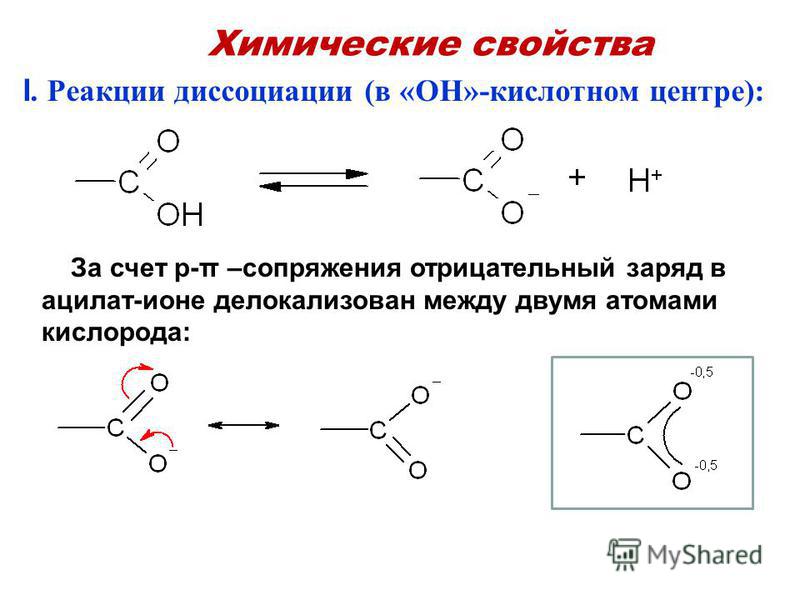
HCl →
H+ + Cl—
Диссоциация многоосновных кислот протекает ступенчато.
H2SO4 → H+
+ HSO4—
HSO4—↔ H+ + SO42—
ВАЖНЕЙШИЕ СПОСОБЫ ПОЛУЧЕНИЯ
1. Галоген + водород = галогеноводород
(растворением галогеноводорода в воде получают соответственную
галогеноводородную кислоту.)
H2 +Cl2 = 2HCl
2. Кислотный оксид + вода = кислота
SO3 + H2O = H2SO4
3. Кислота + соль = другая кислота + другая соль
(для этой реакции используют более сильную кислоту)
AgNO3 + HCl = AgCl + HNO3
BaCl2 + H2SO4
= BaSO4 + 2HCl
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
1. Реакция нейтрализации: кислота + основание =
Реакция нейтрализации: кислота + основание =
соль + вода
H2SO4
+ 2NaOH = Na2SO4
+ 2H2O
При неполной нейтрализации многоосновной кислоты основанием
получают кислую соль:
H2SO4
+ NaOH = NaHSO4
+ H2O
При неполной нейтрализации многокислотного основания кислотой
получают основную соль:
Zn(OH)2
+ HCl = ZnOHCl +
H2O
2. Кислота + металл = соль + водород
(кислоты кроме
HNO3 иH2SO4(конц.);
металлы кроме стоящих в электрохимическом ряду напряжений металлов
правее водорода)
Zn + 2HCl
= ZnCl2 + H2↑
3. Кислота + основный (амфотерный) оксид = соль
+ вода
3H2SO4+Al2O3=Al2(SO4)3+
3H2O
4. Кислота + соль = другая кислота + другая соль
Кислота + соль = другая кислота + другая соль
(для этой реакции используют более сильную кислоту)
AgNO3 + HCl = AgCl + HNO3
BaCl2 +
H2SO4
= BaSO4 + 2HCl
5. Кислоты (благодаря диссоциации на ионы) изменяют
окраску индикаторов:
Лакмус: синий → розовый;
Метилоранж оранжевый → красный
СПЕЦИФИЧЕСКИЕ СВОЙСТВА КИСЛОТ
1. Реакции азотной кислоты и концентрированной
серной кислоты с металлами.
При реакциях металлов с азотной кислотой различных
концентраций и с концентрированной серной кислотой не выделяется
водород. Вместо водорода ( в зависимости от кислоты) образуются
различные соединения серы или азота и вода. Схемы этих химических
реакций можно записать следующим образом:
Me + HNO3 = MeNO3 + X + H2O,
где X= NH4NO3; N2; N2O
; NO ; NO2;
Me +
H2SO4(конц. )
)
= MeSO4 + X + H2O,
где X= H2S ; S
; SO2
Образующиеся продукты «Х» зависят от концентрации кислоты и
активности металла. См. таблицу:
| Кислота/ Металл |
Li; Na; K; Mg; Ca;Ba |
Аl*; Zn; Fe*; Ni;
|
Cu; Ag ; Hg |
Au; Pt; Ta |
| HNO3
(конц.) |
N2O |
NO2 |
NO2 |
Не реагируют |
HNO3(разб. ) )
|
Nh4 ( NH4NO3 ) |
NO; NO2 ;N2 ; NH3(
|
NO |
Не реагируют |
| H2SO4
(конц.) |
S ,
|
S ,
|
SO2 |
Не реагируют |
Fe*, Аl*
с концентрированной азотной кислотой и холодной концентрированной серной
кислотой не реагируют, поэтому данные кислоты можно перевозить в
алюминиевых и стальных цистернах. .
.
Например:
а) с азотной кислотой
10 HNO3(конц.) + 8Na = 8Na NO3 + N2O +
5H2O
4 H NO3(конц.) + Zn = Zn(NO3)2 + 2NO2
+ 2H2O
4 H NO3(конц.) + Cu =
Cu(NO3)2 + 2NO2
+ 2H2O
8 HNO3(разб.) + 3Cu = 3Cu(NO3)2 + 2NO +
4H2O
36 H NO3(разб.) + 10Fe = 10Fe(NO3)3 +
3N2 + 18H2O
9 HNO3(разб.) + 8Na = 8Na NO3 + NH3 +
3H2O
б) с концентрированной серной кислотой
Zn + 2H2SO4(конц.)
= ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(конц.)
= 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(конц. )
)
= 3ZnSO4 + S + 4H2O
Сu +
2H2SO4(конц.)
= Сu SO4
+ SO2 + 2H2O
в) смесь, состоящая из одной части
концентрированной азотной кислоты и трёх частей концентрированной
азотной кислоты растворяет золото. Такая смесь называется царской
водкой.
Au + HNO3 + 4HCl
= H[AuCl4] + NO + 2H2O
2. Азотная кислота и концентрированная серная
кислота как сильные окислители могут реагировать с неметаллами.
3P + 5HNO3 + 2H2O
=
3H3PO4 + 5NO
S + 2НNO3
=
H2SO4 +
2NO
C + 2H2SO4(конц.)
=
CO2 + 2SO2 + 2H2O
S + 2Н2SO4(конц. )= 3SO2
)= 3SO2
+ 2Н2О
3. Специфические свойства кислот зависят от
входящего в состав кислоты аниона.
Ag+ +
Cl— = AgCl↓
белый творожистый осадок
Ba2+ +
SO42- =
BaSO4↓ белый мелкокристаллический
осадок
3Ag+ +
PO43- =
Ag3PO4↓
жёлтый осадок
2H+ +
S2- = H2S↑
газ с неприятным запахом тухлых яиц
4. Нестабильные
кислоты разлагаются.
H2SO3 и
H2CO3
в свободном виде не
существуют, разлагаются:
H2SO3 =
H2O
+ SO2↑ газ с резким запахом
H2CO3 =
H2O
+ CO2↑ газ без запаха
H2SiO3
— нерастворимая кислота. Разлагается при нагревании.
Разлагается при нагревании.
H2SiO3 =
H2O
+ SiO2
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
кислоты, назовите их, определите тип.
1) HNO2 2)
Li2O 3) H2S 4) CuSO4
5) P2O5 6) Al(OH)3 7) HCl 8) H2SO4
Задание 2. С какими из перечисленных веществ
может реагировать а) HCl б)
H2SO4(раствор)
1)Na2O 2)SO3
3)H2O 4) AgNO3 5)HNO3 6)Na2SO4
7)BaCl2 8)Mg 9)Cu 10) NaOH
ОТВЕТЫ.
Наверх
реакций кислот: металлы, карбонаты и гидроксиды — научный класс [Видео 2021]
Первая группа реакций, которые мы обсудим, — это сочетание металла и кислоты. Общая реакция приводит к соли и газообразному водороду. Не все металлы реагируют таким образом, но многие реагируют.
Для каждого типа реакции будет показано сбалансированное уравнение, которое означает, что количество атомов на стороне реагента (левая сторона стрелки) равно количеству атомов на стороне продукта (правая сторона стрелки).Также будет показано полное ионное уравнение, которое показывает ионы (или заряженные атомы) в водном растворе (когда материал растворен в воде).
Реакция магния с соляной кислотой дает хлорид магния (соль) и газообразный водород.
Вычисленное уравнение выглядит следующим образом:
Mg (s) + 2HCl (aq) -> MgCl2 (aq) + h3 (g)
Вы заметите буквы в скобках рядом с символами элемента. Это просто показывает состояние, в котором находится элемент:
- (s) означает твердый
- (л) означает жидкость
- (водн.) Означает водный
- (г) означает газ
Когда происходит эта реакция, газообразный водород образует пузырьки, а в результате реакции выделяется тепло.Эта реакция известна как реакция однократного вытеснения , потому что магний вытесняет (и заменяет) другой элемент (водород).
Теперь давайте проверим ионное уравнение. Иногда используется чистое ионное уравнение, и это означает, что ионы, одинаковые с обеих сторон, будут вычеркнуты. Здесь мы просто представим полное уравнение:
Mg (s) + 2H + (aq) + 2Cl- (aq) -> Mg + 2 (aq) + 2Cl- (aq) + h3 (g)
Для В нашем втором примере давайте посмотрим, что происходит, когда железо смешивается с серной кислотой.Здесь железа и серной кислоты дают сульфат железа (соль) и газообразный водород. Взгляните на вычисленное уравнение:
Fe (s) + h3 SO4 (водн.) -> Fe SO4 (водн.) + H3 (g)
И снова образуются пузырьки из газообразного водорода, и в результате реакции выделяется тепло. Как и первая реакция, это реакция однократного замещения (железо вытесняет водород).
И ионное уравнение:
Fe (т. Е.) + 2H + (водн.) + SO4-2 (водн.) -> Fe + 2 (водн. Карбонаты
Перейдем к кислотам и карбонатам.Карбонат заряжен отрицательно и содержит углерод, связанный с тремя атомами кислорода. Общая реакция приводит к образованию соли, углекислого газа и воды.
Реакции между карбонатами и кислотами называются реакциями нейтрализации , потому что кислота нейтрализуется. Другими словами, кислота и основание (карбонат) нейтрализуются, или их pH приближается к 7.
Если вы когда-либо принимали Тумс для борьбы с кислотой желудка, вы испытали эту реакцию на собственном опыте.Тумс содержит карбонат, который нейтрализует кислоту в желудке. А если вы отрыгиваете, угадайте, почему? Да, в результате реакции образуется газ, и это вызывает у вас отрыжку.
Рассмотрим другой пример. Когда карбонат магния реагирует с соляной кислотой , образуется хлорид (соль) магния, вода и диоксид углерода. Сбалансированное уравнение:
MgCO3 (s) + 2HCl (aq) -> MgCl2 (aq) + h3 O (l) + CO2 (g)
Как и в других реакциях, пузырьки образуются (на этот раз из-за углерода диоксид) и выделяется тепло.
Ионное уравнение:
MgCO3 (s) + 2H + (aq) + 2Cl- (aq) -> Mg + 2 (aq) + 2Cl- (aq) + h3 O (l) + CO2 (g)
Теперь давайте посмотрим на карбонат цинка и азотная кислота , которые объединяются с образованием нитрата (соли) цинка, воды и диоксида углерода. Вычисленное уравнение:
ZnCO3 (s) + 2HNO3 (водный) -> Zn (NO3) 2 (водный) + h3 O (l) + CO2 (g)
И вы догадались, поскольку при этом образуется газ ( углекислый газ) появляются пузырьки. И, как и другие реакции, выделяется тепло.
Ионное уравнение:
ZnCO3 (т.
Кислоты и гидроксиды
Последняя группа, на которой мы остановимся, — это реакции с кислотой и гидроксидом. Гидроксид заряжен отрицательно и содержит атомы водорода и кислорода. Подобно карбонатным и кислотным реакциям, это реакции нейтрализации. Гидроксиды являются основаниями. Типичная реакция приводит к образованию соли и воды.
Первая реакция, которую мы рассмотрим, — это реакция соляной кислоты и гидроксида натрия , в результате которой образуются хлорид натрия (соль) и вода.
Вычисленное уравнение:
HCl (водный) + NaOH (водный) -> NaCl (водный) + h3 O (l)
Вы можете заметить, что газы не образуются, следовательно, нет пузырьков. Однако тепло все равно выделяется.
И ионное уравнение:
H + (водн.) + Cl- (водн.) + Na + (водн.) + OH- (водн.) -> Na + (водн.) + Cl- (водн.) + H3 O (l)
В этой конечной реакции гидроксид калия и азотная кислота образуют нитрат калия (соль) и воду. Вычисленное уравнение:
KOH (водн.) + HNO3 (водн.) -> KNO3 (водн.) + H3 O (l)
Как и при другой реакции с гидроксидом, пузырьки не образуются; однако он нагреется.
И ионное уравнение:
K + (водн.) + OH- (водн.) + H + (водн.) + NO 3 — (водн.) -> K + (водн.) + NO 3 — (водн.) + H3 O ( l)
Краткое изложение урока
Ого, реакции было много! Звезды наших реакций были кислот или веществами с pH менее 7. Мы реагировали с кислотами с металлами, карбонатами и гидроксидами. Карбонаты представляют собой атомы углерода, присоединенные к трем атомам кислорода, а гидроксидов состоят из кислорода и водорода вместе взятых.Карбонаты и гидроксиды — это оснований или веществ с pH выше 7.
| Реакция | Пример | Результаты | Тип |
|---|---|---|---|
| Кислота и металл | Соляная кислота и магний | Соль и газообразный водород | Одинарный рабочий объем |
| Кислота и карбонаты | Соляная кислота и карбонат магния | Соль, диоксид углерода и вода | Нейтрализация |
| Кислота и гидроксиды | Азотная кислота и гидроксид калия | Соль и вода | Нейтрализация |
Типы химических реакций, определения и примеры
Типы химических реакций
Большинство курсов химии или естествознания требуют, чтобы вы знали имена многих
типы химических реакций и задайте экзаменационные вопросы по этой теме.Какие именно типы
реакции зависит от вашего курса. Здесь я покажу вам, как распознать
о вещах, о которых они могут вас спросить. Для именованного типа
реакции, он должен точно соответствовать описанию для этого типа — он должен иметь
только упомянутые реагенты и образуют только продукты (и все
продукты) даны. Если есть лишний продукт или реагент, или один из них
отсутствует, значит, это не тот тип реакции. Это так просто.Это популярные экзаменационные вопросы, поэтому стоит изучить определения.
очень осторожно. Если химическая реакция не соответствует всему определению, это
не такая реакция. (Но некоторые реакции могут соответствовать более чем одному типу.)
Наслаждайтесь этим уроком по химии — надеюсь, он поможет с домашним заданием по химии.
проблемы.
Основные виды химических реакций
Окисление и восстановление
Реакция, при которой одно химическое вещество окисляется, а другое восстанавливается.
Проще говоря, одно вещество получает кислород (или теряет водород), а другое
теряет кислород (или получает водород). Это объясняется более подробно в
уроки по этой теме на Главном
Страница науки, которую вам следует прочитать следующей, особенно если вы находитесь на
продвинутый курс, который использует определение усиления / потерь электронов. Но вот
пара примеров, которые помогут вам. Примеров такого типа много.
реакции на всех курсах химии.Железо и кислород —> оксид железа, где железо окисляется
4Fe + 3O 2 —> 2Fe 2 O 3Этанол и кислород —> этановая кислота, где этанол окисляется
CH 3 CH 2 OH + [O] —> CH 3 COOH
([O] означает некоторые другие химические вещества кислород)В начало
Кислота — Основание
Реакция между кислотой и основанием с образованием соли и воды в качестве единственного
продукты.Соляная кислота и гидроксид натрия —> хлорид натрия и вода
HCl + NaOH —> NaCl + H 2 OСерная кислота и гидроксид калия —> Сульфат калия и вода
H 2 SO 4 + 2KOH —> K 2 SO 4 + 2H 2 OАзотная кислота и гидроксид кальция —> нитрат кальция и вода
2HNO 3 + Ca (OH) 2 —> Ca (NO 3 ) 2
+ 2H 2 OЭтановая кислота и гидроксид натрия —> этаноат натрия и вода
(Уксусная кислота и гидроксид натрия —> ацетат натрия и вода, используя
старые названия)
CH 3 COOH + NaOH —> NaOOCCH 3 + H 2 OЭто одна из первых названных реакций, которые упоминаются в большинстве курсов химии.
но у него есть простая вариация, описанная ниже.(Если вы не уверены в том, что такое кислота, а что — основание, посетите
Кислоты и основания Стр.)В начало
Кислота — оксид металла
Реакция между кислотой и оксидом металла с образованием соли и воды в виде
единственные продукты.Это частный пример кислотно-основной реакции.
Соляная кислота и оксид железа —> хлорид железа и вода
6HCl + Fe 2 O 3 —> 2FeCl 3 + 3H 2 OСерная кислота и оксид меди —> сульфат меди и вода
H 2 SO 4 + CuO —> CuSO 4 + H 2 OОксиды металлов также являются основаниями.Водорастворимые образуют гидроксиды металлов в
решения, которые лежат в основе в предыдущем примере.В начало
Кислота — Металл
Реакция между кислотой и металлом с образованием соли металла и водорода
как единственные продукты.Соляная кислота и цинк —> хлорид цинка и водород
2HCl + Zn —> ZnCl 2 + H 2Серная кислота + магний —> сульфат магния и водород
H 2 SO 4 + Mg —> MgSO 4 + H 2Этановая кислота и кальций —> этаноат кальция и водород
(Уксусная кислота и кальций —> ацетат кальция и водород, используя
старые названия)
2CH 3 COOH + Ca —> Ca (OOCCH 3 ) 2 + H 2В начало
Кислота — Карбонат
Реакция между кислотой и карбонатом с образованием соли, диоксида углерода
и вода как единственные продукты.Азотная кислота и карбонат натрия —> нитрат натрия и диоксид углерода
и вода
2HNO 3 + Na 2 CO 3 —> 2NaNO 3
+ CO 2 + H 2 OСерная кислота и карбонат кальция —> сульфат кальция и углерод
диоксид и вода
H 2 SO 4 + CaCO 3 —> CaSO 4 +
CO 2 + H 2 OСоляная кислота и карбонат кальция —> хлорид кальция и углерод
диоксид и вода
2HCl + CaCO 3 —> CaCl 2 + CO 2 + H 2 OВ начало
Этерификация
Реакция с образованием сложного эфира.
Обычно это реакция между органической кислотой и спиртом с образованием
сложный эфир и вода как единственные продукты.
В некоторых более продвинутых курсах он включает реакцию между хлорангидридом
и спирт с образованием сложного эфира и газообразный HCl в качестве единственных продуктов.
Чтобы помочь вам проследить за происходящим, я закрасил часть молекулы спирта.
красный, чтобы было легче отслеживать.Этанол и этановая кислота —> этилэтаноат и вода
(или этанол и уксусная кислота —> этилацетат и вода, если использовать старые
вылепленные имена более 30 лет назад)
CH 3 CH 2 OH + CH 3 COOH
—> Канал 3 Канал 2 OOCCH 3
+ H 2 OМетанол и пропановая кислота —> метилпропаноат и вода
CH 3 OH + CH 3 CH 2 COOH
—> Канал 3 OOCCH 2 Канал 3
+ H 2 OИ более продвинутые примеры.
Метанол и бутаноилхлорид —> метилбутаноат и хлористый водород
CH 3 OH + CH 3 CH 2 CH 2 COCl
—> Канал 3 OOCCH 2 Канал 2 Канал 3
+ HClМетанол и этаноилхлорид —> метилэтаноат и хлористый водород
CH 3 OH + CH 3 COCl —>
CH 3 OOCCH 3 + HClВ начало
Гидролиз
Реакция, в которой вода является одним из реагентов, а большая молекула
разделен на две более мелкие молекулы, одна из которых содержит водород из воды
а другой имеет группу ОН из воды.Наличие воды в качестве растворителя НЕ приводит к реакционному гидролизу.
Гидролиз — это на самом деле особый вид замещения.
реакция.Трихлорид фосфора и вода —> фосфористая кислота и хлористый водород
PCl 3 + 3H 2 O —> H 3 PO 3 + 3HCl
(структура H 3 PO 3 фактически является P (OH) 3
)Метилпропаноат + вода —> метанол и пропановая кислота
CH 3 OOCCH 2 CH 3 + H 2 O —> CH 3 OH
+ CH 3 CH 2 COOH
Этот пример является обратным предыдущей этерификации.
реакция, и обычно проводится в присутствии калия или натрия.
гидроксид, который затем реагирует с образовавшейся кислотой с образованием соли кислоты.Этаноилхлорид и вода —> этановая кислота и хлористый водород
CH 3 COCl + H 2 O —> CH 3 COOH + HClВ начало
Гидрирование
Реакция, при которой водород добавляется через двойную связь или даже тройную связь.
связь.Этен и водород —> этан
CH 2 = CH 2 + H 2 —> CH 3 CH 3Бутен и водород —> бутан
CH 2 = CHCH 2 CH 3 + H 2 —> CH 3 CH 2 CH 2 CH 3Пропин и водород —> пропен
CH 3 C = CH + H 2 —> CH 3 CH = CH 2
Добавление большего количества водорода в конечном итоге приведет к образованию пропана, CH 3 Канал 2 Канал 3Реакции гидрирования обычно включают катализатор.Никель Ренея, платина
или палладий будет катализировать приведенные выше примеры.В начало
Замена
Реакция, при которой одна небольшая группа в молекуле заменяется другой небольшой.
группа.На самом деле это целый набор связанных типов реакций, многие из которых
имеют собственное особое название. Эти реакции очень полезны для создания новых
химикатыЭтанол и соляная кислота —> хлорэтан и вода
(Или этиловый спирт и соляная кислота —> этилхлорид и вода,
используя старые названия)
CH 3 CH 2 OH + HCl —> CH 3 CH 2 Cl + H 2 OБромэтан и гидроксид натрия —> этанол и бромид натрия
(Или этилбромид и гидроксид натрия —> этиловый спирт и бромид натрия
используя старые названия)
CH 3 CH 2 Br + NaOH —> CH 3 CH 2 OH
+ NaBrРеакция на замену временами может сбивать с толку, а иногда и сбивать с толку.
похоже, тоже идут в обратном направлении.Это зависит от того, какие еще химические вещества присутствуют.
в то же время, чтобы помочь им идти так, как мы хотим. Если вы написали
первый пример в обратном направлении, это будет гидролиз
реакция.
т.е. CH 3 CH 2 Cl + H 2 O —> CH 3 CH 2 OH
+ HCl
Часто мы используем большой избыток химиката, поставляющего входящую группу в
заставить реакцию идти так, как мы хотим. Поэтому мы использовали бы концентрированную HCl.
чтобы заставить первый пример идти так, как мы хотим.Если бы мы начали с
хлорэтан и добавлено много воды, HCl образуется в реакции гидролиза
будет очень разбавленным, поэтому первая реакция будет подавлена и не произойдет.
Не волнуйтесь, если сначала это покажется немного запутанным, всем это покажется сложным
для начала, особенно если Ле
Принцип Шателье не является частью их курса — обычно он не входит в их состав.
из самых первых курсов, преподаваемых в школах.В начало
GCSE Chemistry — Acids Page
GCSE Chemistry — Acids Page
Вернуться наверх
Кислоты — Введение
Кислоты — это группа соединений, которые обладают очень специфическими свойствами.Все они имеют как минимум один атом водорода как часть молекулы. Именно этот атом водорода играет главную роль в его реакциях.
Сила кислоты определяется ее значением pH. Это расшифровывается как «за водород» — скандинавский термин, означающий концентрацию водорода. Чем больше ионов водорода выделяет кислота, тем ниже значение pH, поэтому кислоты имеют значения pH от -1 до 7.
Кислоты реагируют с металлами, такими как магний и цинк, с карбонатными соединениями и основаниями, такими как оксиды и гидроксиды.
Видео о периодической таблице: соляная кислота I Периодическая таблица видео: соляная кислота II
Периодическая таблица Менделеева: серная кислота
Видео из таблицы Менделеева: Царская водка
Вернуться наверх
Лист экспериментов по реакции металлов с разбавленной соляной кислотой.
Реакция металлов с кислотами намного интенсивнее, чем соответствующая реакция с водой. Так же, как и при реакции с водой, выделяется газообразный водород.Также образуется соль, то есть комбинация двух ионов; Конкретная образующаяся соль зависит от кислоты, используемой в реакции.
Три распространенных лабораторных кислоты — это соляная кислота (HCl), азотная кислота (HNO 3 ) и серная кислота (H 2 SO 4 ). Соли, образованные этими кислотами, представляют собой хлорид, нитрат и сульфат соответственно. Во время реакции атомы водорода заменяются ионами металлов с образованием соли.
Общие словесные уравнения —
металл + соляная кислота → хлорид металла + газообразный водород
металл + азотная кислота → нитрат металла + газообразный водород
металл + серная кислота → сульфат металла + газообразный водород
Примерные формулы уравнений —
Mg (т.) + 2HCl (водн.) → MgCl 2 (водн.) + H 2 (г)
Zn (т.) + 2HNO 3 (водн.) → Zn (NO 3 ) 2 (водн.) + H 2 (г)
2Na (т) + H 2 SO 4 (водн.) → Na 2 SO 4 (водн.) + H 2 (г)
Вернуться наверх
Кислоты — Реакция с карбонатами
Реакция карбонатов с кислотами очень похожа на их реакцию с металлами.Образуется та же соль, что и при реакции с металлом; однако вместо выделения газообразного водорода образуются вода и газообразный диоксид углерода.
Углекислый газ можно проверить путем барботирования полученного газа через известковую воду, разбавленный раствор гидроксида кальция. Если известковая вода становится молочной, т. Е. Образует белый осадок, то образуется двуокись углерода.
Общие словесные уравнения —
карбонат металла + соляная кислота → хлорид металла + вода + диоксид углерода
карбонат металла + азотная кислота → нитрат металла + вода + диоксид углерода
карбонат металла + серная кислота → сульфат металла + вода + диоксид углерода
Примерные формулы уравнений —
MgCO 3 (т) + 2HCl (водн.) → MgCl 2 (водн.) + H 2 O (л) + CO 2 (г)
ZnCO 3 (с) + 2HNO 3 (водн.) → Zn (NO 3 ) 2 (водн.) + H 2 O (л) + CO 2 (г)
Na 2 CO 3 (с) + H 2 SO 4 (водн.) → Na 2 SO 4 (водн.) + H 2 O (л) + CO 2 (г)
Вернуться наверх
Кислоты — реакция с основаниями
Основания — это соединения, которые реагируют с кислотами с образованием только соли и воды.И оксидные, и гидроксидные соединения можно классифицировать как основания, хотя не все возможные оксиды и гидроксиды будут реагировать с кислотами. Например, оксид железа (III) (ржавчина) не вступает в реакцию с кислотами.
В этих реакциях не образуются газы, и поэтому единственный способ увидеть ход любой реакции — это заметить растворение твердого вещества в кислоте.
Общие словесные уравнения —
оксид металла + соляная кислота → хлорид металла + вода
оксид металла + азотная кислота → нитрат металла + вода
оксид металла + серная кислота → сульфат металла + вода
гидроксид металла + соляная кислота → хлорид металла + вода
гидроксид металла + азотная кислота → нитрат металла + вода
гидроксид металла + серная кислота → сульфат металла + вода
Примерные формулы уравнений —
MgO (т.) + 2HCl (водн.) → MgCl 2 (водн.) + H 2 O (л)
2NaOH (водн.) + H 2 SO 4 (водн.) → Na 2 SO 4 (водн.) + 2H 2 O (л)
Вернуться наверх
Кислоты — скорость реакции
Экспериментальный лист для измерения скорости реакции между HCl и CaCO 3 .
Скорость, с которой происходит химическая реакция, называется ее скоростью. Некоторые химические реакции происходят очень медленно, например, химическое выветривание горных пород и ржавление железа. Некоторые реакции происходят очень быстро, например, реакция металлов с кислотами и химическими взрывчатыми веществами, такими как тротил.
За скоростью реакции можно следить, измеряя скорость образования одного из продуктов или скорость потребления одного из реагентов.
Кинетическая теория —
Расположение частиц в твердых телах, жидкостях и газах напрямую влияет на скорость протекания реакции.
На диаграммах выше видно, что в твердом теле частицы расположены очень близко друг к другу и движение чрезвычайно ограничено, разрешена только молекулярная вибрация. Это приводит к очень медленным реакциям, но хорошей теплопроводности.
В жидкости частицы обладают большей свободой, однако между частицами все еще существует притяжение, удерживающее их близко друг к другу.
В газе частицы разнесены друг от друга с очень небольшим притяжением между частицами, если оно вообще существует.Движение не ограничено, поэтому реакции с участием газов обычно происходят очень быстро.
Теория столкновений —
Одна из самых важных частей химической реакции — это столкновение молекул реагента друг с другом. Без этого первоначального столкновения химическая реакция не произойдет. Следует отметить, что помимо столкновения молекулы должны обладать достаточной энергией для того, чтобы реакция действительно произошла, поэтому не все столкновения приведут к положительной реакции и образованию продукта.
Любое изменение условий реакции, которое влияет на эффективность столкновения между молекулами, напрямую влияет на скорость. Например, если концентрация реагентов, то есть количество молекул в данном объеме, увеличивается, будет больше столкновений, и, следовательно, скорость увеличится. При реакции между газами увеличение давления заставит больше молекул в меньший объем, поэтому количество столкновений и скорость увеличатся.
Для твердого реагента очень важным фактором является доступная площадь поверхности.Если твердое вещество измельчено в мелкий порошок, его площадь поверхности будет очень большой, и, следовательно, большее количество молекул может столкнуться друг с другом, и скорость реакции увеличится.
Последний важный фактор, влияющий на скорость реакции, — это используемая температура. Чем выше температура, при которой проводится реакция, тем больше энергии будут иметь молекулы и тем быстрее они будут двигаться. Следовательно, будут более частые столкновения и более эффективные столкновения, и скорость будет увеличиваться.
Оцените графики —
Путем определения концентрации реагента или продукта в определенные моменты времени во время реакции можно построить графики данных. Они должны иметь форму:
| за потерю реагента | для формирования изделия |
Скорость реакции — это просто абсолютная величина градиента этих линий.
Вернуться наверх
написано доктором Ричардом Кларксоном: © Суббота, 1 ноября 1997 г.
обновлено: воскресенье, 15 -е июля 2012 г.
почта: chemistryrules
Создано с помощью,
Давайте узнаем о кислотах и щелочах
кислотный : прилагательное для материалов, содержащих кислоту. Эти материалы часто способны разъедать некоторые минералы, такие как карбонат, или в первую очередь предотвращать их образование.
подкисление : процесс, снижающий pH раствора. Когда углекислый газ растворяется в воде, он запускает химические реакции, в результате которых образуется угольная кислота.
атом : основная единица химического элемента. Атомы состоят из плотного ядра, которое содержит положительно заряженные протоны и незаряженные нейтроны. Ядро вращается вокруг облака отрицательно заряженных электронов.
отбеливатель : Разбавленная форма жидкости, гипохлорита натрия, которая используется в домашних условиях для осветления и осветления тканей, удаления пятен или уничтожения микробов.Или это может означать постоянное осветление чего-либо, например: постоянное пребывание на солнце осветляет большую часть насыщенного цвета из оконных штор.
углерод : химический элемент с атомным номером 6. Это физическая основа всей жизни на Земле. Углерод существует в свободном виде в виде графита и алмаза. Это важная часть угля, известняка и нефти, и она способна к самосвязыванию химически, образуя огромное количество химически, биологически и коммерчески важных молекул.(в исследованиях климата) Термин «углерод» иногда используется почти взаимозаменяемо с диоксидом углерода, чтобы обозначить потенциальное воздействие, которое какое-либо действие, продукт, политика или процесс может оказать на долгосрочное потепление атмосферы.
диоксид углерода : (или CO 2 ) Бесцветный газ без запаха, вырабатываемый всеми животными, когда вдыхаемый ими кислород вступает в реакцию с богатой углеродом пищей, которую они съели. Углекислый газ также выделяется при горении органических веществ (включая ископаемое топливо, такое как нефть или газ).Двуокись углерода действует как парниковый газ, удерживая тепло в атмосфере Земли. Растения превращают углекислый газ в кислород во время фотосинтеза — процесса, который они используют для приготовления пищи.
химический : Вещество, состоящее из двух или более атомов, которые объединяются (связываются) в фиксированной пропорции и структуре. Например, вода — это химическое вещество, которое образуется, когда два атома водорода связываются с одним атомом кислорода. Его химическая формула — H 2 O. Химический также может быть прилагательным для описания свойств материалов, которые являются результатом различных реакций между различными соединениями.
химическая реакция : Процесс, который включает перегруппировку молекул или структуры вещества в противоположность изменению физической формы (например, от твердого тела к газу).
химия : Область науки, изучающая состав, структуру и свойства веществ и способы их взаимодействия. Ученые используют эти знания для изучения незнакомых веществ, для воспроизведения больших количеств полезных веществ или для конструирования и создания новых полезных веществ.(о соединениях) Химия также используется как термин для обозначения рецепта соединения, способа его получения или некоторых его свойств. Люди, работающие в этой области, известны как химики. (в социальных науках) Термин, обозначающий способность людей сотрудничать, ладить и получать удовольствие от общества друг друга.
какао : порошок, полученный из твердых веществ (не жиров) бобов, которые растут на растении Theobroma cacao , также известном как дерево какао. Какао — это также название горячего напитка, приготовленного из какао-порошка (а иногда и других материалов), смешанного с водой или молоком.
соединение : (часто используется как синоним химического) Соединение — это вещество, образующееся, когда два или более химических элемента объединяются (связываются) в фиксированных пропорциях. Например, вода — это соединение, состоящее из двух атомов водорода, связанных с одним атомом кислорода. Его химический символ — H 2 O.
.
показатель степени : Число, показанное в виде надстрочного индекса (крошечное число в правом верхнем углу некоторого другого «основного» числа или математического выражения). Показатель степени определяет, сколько раз это базовое число или выражение должно быть умножено само на себя.
окаменелости : Любые сохранившиеся останки или следы древней жизни. Существует много различных типов окаменелостей: кости и другие части тела динозавров называются «окаменелостями». Такие вещи, как следы, называются «окаменелостями». Даже образцы фекалий динозавров являются окаменелостями. Процесс образования окаменелостей называется окаменелостью.
ископаемое топливо : Любое топливо — такое как уголь, нефть (сырая нефть) или природный газ — которое образовалось на Земле за миллионы лет из разложившихся останков бактерий, растений или животных.
водород : самый легкий элемент во Вселенной. Как газ, он бесцветен, не имеет запаха и легко воспламеняется. Это неотъемлемая часть многих видов топлива, жиров и химикатов, из которых состоят живые ткани. Он состоит из одного протона (который служит его ядром), на орбите которого движется один электрон.
ion : (прил. Ионизированный) Атом или молекула с электрическим зарядом из-за потери или усиления одного или нескольких электронов. В ионизированном газе или плазме все электроны отделены от своих родительских атомов.
Логарифм : Степень (или экспонента), до которой нужно возвести одно основное число — умножить само на себя — для получения другого числа. Например, в системе с основанием 10 10 нужно умножить на 10, чтобы получить 100. Таким образом, логарифм 100 в системе с основанием 10 равен 2. В системе с основанием 10 логарифм 1000 будет равен 3, а логарифм 10 000 будет 4 и так далее.
молекула : электрически нейтральная группа атомов, представляющая минимально возможное количество химического соединения.Молекулы могут состоять из атомов одного или разных типов. Например, кислород в воздухе состоит из двух атомов кислорода (O 2 ), а вода состоит из двух атомов водорода и одного атома кислорода (H 2 O).
моллюски : беспозвоночные животные с мягким телом, которые обычно живут в воде и имеют твердую защитную оболочку. Примеры включают улиток, моллюсков (например, моллюсков и устриц), слизней, осьминогов и кальмаров.
кислород : газ, составляющий около 21 процента атмосферы Земли.Все животные и многие микроорганизмы нуждаются в кислороде для своего роста (и обмена веществ).
частица : Минутное количество чего-то.
pH : показатель кислотности или щелочности раствора. PH 7 абсолютно нейтрален. Кислоты имеют pH ниже 7; чем дальше от 7, тем сильнее кислота. Щелочные растворы, называемые основаниями, имеют pH выше 7; опять же, чем дальше выше 7, тем сильнее база.
протон : субатомная частица, которая является одним из основных строительных блоков атомов, составляющих материю.Протоны принадлежат к семейству частиц, известных как адроны.
лосось : популярная промысловая рыба, которая, как правило, живет большую часть своей жизни в океане, а затем входит в прибрежные реки (и пресные воды) для размножения и откладывания яиц.
море : океан (или регион, являющийся частью океана). В отличие от озер и ручьев, морская или океанская вода соленая.
акулы : Семейство примитивных рыб, скелеты которых состоят из хрящей, а не костей. Как скаты и скаты, они принадлежат к группе, известной как эластожаберные.Тогда они, как правило, медленно растут и созревают, и у них мало молодых. Одни откладывают яйца, другие рожают живых детенышей.
оболочка : Обычно твердое защитное внешнее покрытие чего-либо. Он может покрывать моллюсков или ракообразных (например, мидию или краб), птичье яйцо или другую относительно мягкую ткань, требующую защиты (например, древесный орех или арахис). (в боеприпасах) Разрывная пуля, бомба, граната или другой снаряд.
раствор : жидкость, в которой одно химическое вещество растворено в другом.
вкус : одно из основных свойств, которое тело использует для ощущения окружающей среды, особенно пищи, с помощью рецепторов (вкусовых сосочков) на языке (и некоторых других органах).
Каковы химические свойства кислоты?
Каковы химические свойства кислоты?
Химические свойства кислот:
- Кислоты реагируют с реакционноспособными металлами .
- Кислота + металл → соль + водород
- Медь и серебро не реагируют с разбавленной кислотой.
- Кислоты реагируют с основаниями .
- Кислота + основание → соль + вода
- Кислоты реагируют с карбонатами.
- Кислота + карбонат → соль + вода + диоксид углерода
Люди тоже спрашивают
Для изучения химических реакций кислот опыт
Цель: Изучение химических реакций кислот.
Материалы: 2 моль дм -3 соляная кислота, 2 моль дм -3 этановая кислота, магний, карбонат меди (II), оксид железа (III), известковая вода, деревянная шина и фильтровальная бумага.
Аппарат: Пробирки, подающая трубка, шпатель, держатель для пробирок, горелка Бунзена, пробка, чашка для испарения и фильтровальная воронка.
Мера безопасности: Кислоты едкие. Надевайте защитные очки.
А. Реакции кислот с основаниями
Процедура:
- Около 5 см 3 разбавленной соляной кислоты наливают в пробирку.
- Кислота нагревается легким пламенем.
- Порошок оксида железа (III) постепенно добавляют к горячей кислоте при перемешивании.
- Любые происходящие изменения наблюдаются и регистрируются.
- Непрореагировавший оксид железа (III) удаляют фильтрованием.
- Фильтрат упаривают в чаше для выпаривания до тех пор, пока не останется одна треть первоначального объема.
- Горячему раствору дают остыть для образования кристаллов.
- Образовавшиеся кристаллы удаляют фильтрованием и сушат, зажимая кристаллы между листами фильтровальной бумаги.
- Отмечаются и записываются особенности кристаллов.
- Шаги с 1 по 9 повторяются с использованием разбавленной этановой кислоты для замены разбавленной соляной кислоты.
Наблюдения:
| Кислота | Наблюдение |
| Кислота соляная | Красновато-коричневое твердое вещество растворяется с образованием коричневого раствора. Получаются красновато-коричневые кристаллы. |
| этановая кислота | Красновато-коричневое твердое вещество растворяется с образованием коричневого раствора.Получаются красновато-коричневые кристаллы. |
Обсуждение:
- Оксид железа (III) является примером основания.
- Реагирует с кислотами с образованием солей и воды.
- Кристаллы представляют собой хлорид железа (III) и этаноат железа (III).
- Соли железа (III) растворяются в воде с образованием коричневых растворов.
Б. Реакции кислот с металлами
Процедура:
- Около 5 см 3 разбавленной соляной кислоты наливают в пробирку.
- К кислоте добавляется один полный шпатель порошка магния.
- К горловине пробирки подводят зажженную деревянную шину, чтобы зажечь выделившийся газ.
- Все наблюдения записываются.
- Непрореагировавший магний отфильтровывают.
- Фильтрат упаривают до тех пор, пока не останется одна треть первоначального объема.
- Горячему раствору дают остыть для образования кристаллов.
- Образовавшиеся кристаллы удаляют фильтрованием и сушат, зажимая кристаллы между листами фильтровальной бумаги.
- Отмечаются и записываются особенности кристаллов.
- Шаги с 1 по 9 повторяются с использованием разбавленной этановой кислоты для замены разбавленной соляной кислоты.
Наблюдения:
| Кислота | Наблюдение |
| Кислота соляная | Серое твердое вещество растворяется с образованием бесцветного раствора. Выделяется бесцветный газ, который горит с хлопком. Получаются белые кристаллы. |
| этановая кислота | Серое твердое вещество растворяется с образованием бесцветного раствора. Выделяется бесцветный газ, который горит с хлопком. Получаются белые кристаллы. |
Обсуждение:
- Магний — химически активный металл.
- Реактивные металлы реагируют с кислотами с образованием солей и водорода. Металлы, не вступающие в реакцию, такие как медь и серебро, не вступают в реакцию с разбавленными кислотами.
- Выделившийся газообразный водород можно идентифицировать с помощью деревянной шины с подсветкой.Газообразный водород горит с хлопком.
- Белые кристаллы представляют собой хлорид магния и этаноат магния. Они растворяются в воде с образованием бесцветных растворов.
C. Реакции кислот с карбонатами металлов
Процедура:
- Около 5 см 3 разбавленной соляной кислоты наливают в пробирку.
- К кислоте добавляют одну лопатку порошка карбоната меди (II).
- Пробирка быстро закрывается пробкой, снабженной подающей трубкой, погруженной в известковую воду.
- Любое происходящее изменение записывается.
- Непрореагировавший карбонат меди (II) отфильтровывают.
- Фильтрат упаривают до тех пор, пока не останется одна треть первоначального объема.
- Горячему раствору дают остыть для образования кристаллов.
- Образовавшиеся кристаллы удаляют фильтрованием и сушат, зажимая кристаллы между листами фильтровальной бумаги.
- Отмечаются и записываются особенности кристаллов.
- Шаги с 1 по 9 повторяются с использованием разбавленной этановой кислоты для замены разбавленной соляной кислоты.
Наблюдательный пункт:
| Кислота | Наблюдение |
| Кислота соляная | Зеленое твердое вещество растворяется с выделением газа с образованием синего раствора. Вырабатывается бесцветный газ, который превращает известковую воду в молочную. Получаются синие кристаллы. |
| этановая кислота | Зеленое твердое вещество растворяется с выделением газа с образованием синего раствора. Вырабатывается бесцветный газ, который превращает известковую воду в молочную.Получаются синие кристаллы. |
Обсуждение:
- Карбонат меди (II) — карбонат металла.
- Реагирует с кислотами с образованием солей, воды и углекислого газа.
- Соли меди (II) кристаллизуются в виде голубых кристаллов и растворяются в воде с образованием голубых растворов.
- Когда в известковую воду барботируют углекислый газ, образуется белый осадок карбоната кальция. Белый осадок делает известковую воду молочной.
Заключение:
- Кислота реагирует с основанием с образованием соли и воды.
- Кислота реагирует с химически активным металлом с образованием соли и газообразного водорода.
- Кислота реагирует с карбонатом металла с образованием соли, воды и углекислого газа.
Химические свойства щелочей
- Щелочи реагируют с кислотами .
- Щелочь + кислота → соль + вода
- Щелочь нейтрализует кислоты.
- Щелочи реагируют с металлами ионы .
- Щелочь + ион металла → гидроксид металла
- Большинство гидроксидов металлов нерастворимы в воде и выпадают в осадок.
- Ионы переходных металлов образуют окрашенные выделения.
Учебник по химии с уравнениями из основных слов и кислот
Сноски:
(1) В этом руководстве мы будем использовать определение кислот и оснований Аррениуса.
Кислоты включают: неорганические кислоты, такие как разбавленная серная кислота, соляная кислота и азотная кислота, и органические кислоты, такие как уксусная кислота, содержащиеся в уксусе.
Основания также включают водные растворы аммиака, называемые гидроксидом аммония.
(2) Температура закипания воды зависит от того, где вы находитесь.
Если вы окажетесь в месте, где атмосферное давление составляет 1 атмосферу, вода закипит при 100 ° C.
Если вы находитесь над уровнем моря, поднимаетесь на холм или в гору, температура кипения воды будет ниже 100 ° C.
Если вы снизите давление воздуха в достаточной степени, например, в откачанном колпаке, вы сможете вскипятить воду комнатной температуры!
(3) Мы могли бы провести несколько тестов с солью, чтобы определить, из чего она состоит:
(i) Испытание на пламя: идентифицирует металл по цвету пламени.
(ii) Тесты на растворимость: идентифицирует анион путем осаждения нерастворимого твердого вещества:
(a) Добавьте нитрат бария: если образуется осадок, раствор соли содержит сульфат.
(b) Если в (a) не образуется осадка, добавьте раствор нитрата серебра, если образуется осадок, раствор соли содержит хлорид.
(4) Некоторые металлы, например железо, могут образовывать ионы с разными положительными зарядами. Железо может образовывать ионы с зарядом 1+, 2+ или 3+.
Таким образом, катионы железа называются: железо (1+), железо (2+) и железо (3+).
Название соли, образованной этими катионами, должно включать название металла И его заряд: хлорид железа (1+), хлорид железа (2+), хлорид железа (3+).
Железо также может образовывать ковалентные соединения.
В этом случае нет катиона, нет положительного заряда, но мы можем назначить неформальный заряд на основе его степени окисления (которая затем называется степенью окисления или степенью окисления).Когда мы это делаем, мы используем римские цифры, чтобы указать степень окисления металла.
Для железа степени окисления — железо (I), железо (II) и железо (III).
Номенклатура неорганической химии: Рекомендации ИЮПАК 2005 («Красная книга») для наименования солей (бинарных неорганических ионных соединений) рекомендует использовать номер заряда (1+, 2+, 3+) вместо степени окисления ( I, II, III).
Введение в кислотно-основные реакции — мастер органической химии
Продолжая 4 основных класса реакций, с которыми вы сталкиваетесь в Организации 1, давайте рассмотрим первую из этих четырех: кислотно-основные реакции.Здесь основное внимание уделяется не тому, чтобы сначала понять , почему вещи происходят именно так, а это придет позже. Первоначальная цель — уметь распознавать , что происходит в .
Так же, как когда вы впервые читаете роман или смотрите фильм, ваша основная цель, вероятно, просто следить за сюжетом. Как только вы поймете сюжет фильма, вы сможете начать более глубокий анализ персонажей, обстановки, смысла фильма и так далее.
Великую речь Курта Воннегута о сюжетах в романах можно применить и к органической химии.[См. Ниже]
«График» химической реакции в основном анализирует, какие связи разрываются и какие образуются. Итак, давайте посмотрим на следующие четыре реакции. Прежде чем вы это сделаете, предполагается, что вы знакомы с диаграммами линий связи и «скрытыми» атомами водорода — если вам нужно освежиться, это видео может оказаться полезным. Также предполагается, что вы знаете, что реагентов — это структуры слева от (или выше) стрелки реакции, а продуктов — это структуры справа от стрелки реакции.
Вы заметите, что на поверхности они могут сильно отличаться — все эти разные структуры! — , но основной сюжет каждой реакции тот же . Мы разрываем связь H- (атом) и формируем связь H- (атом). В то же время мы также соединяем двух «оставшихся» партнеров, чтобы сформировать соль , состоящую из двух противоположно заряженных ионов.
Давайте рассмотрим последнюю реакцию более подробно. Здесь мы разрываем связь C-H и (ионную) связь Na-Nh3 и формируем связь N-H, а также (ионную) связь C-Na.
В этой реакции есть четыре «участника» — как в каждой кислотно-основной реакции — и у нас есть названия для всех из них.
Реагентом, в котором разрывается связь с H, является кислота .
Реагент, в котором образуется связь с H, представляет собой основание
Продукт, образующийся при разрыве связи с H , называется основанием конъюгата .
Продукт, образующийся при образовании связи с H , называется конъюгированной кислотой .
Мы также можем провести обратную предыдущую реакцию. Посмотри на это внимательно. Мы все еще разрываем связь с H и формируем связь с H, но мы все поменяли местами. Мы разрушаем N-H и C-Na и формируем N-Na и C-H. Это все еще кислотно-основная реакция.
Есть только одна вещь — эксперимент говорит нам, что эта реакция не происходит в сколько-нибудь заметной степени.
Один из способов объединения «прямой» и «обратной» реакций — использовать стрелку равновесия.Если мы нарисуем это таким образом, то другой способ сделать то же самое заключается в том, что равновесие благоприятствует продукту справа.
Интересно! Значит, не все кислотно-основные реакции одинаково вероятны. Это вызывает несколько вопросов.
- Почему одни кислотно-основные реакции работают, а другие нет?
- Какие факторы определяют силу кислот и щелочей?
- Как мы можем определить равновесие кислотно-основной реакции?
Когда вы научитесь распознавать кислотно-основные реакции, мы сможем начать думать об ответах на эти типы вопросов.Мы также можем начать думать о зарядах (или частичных зарядах) на каждом реагенте, а затем начать изображать , куда уходят электроны.
