Содержание
Тема урока: « Свойства концентрированной азотной кислоты» | План-конспект занятия по химии (9 класс) на тему:
Открытый урок по химии в 9 классе. Подготовила учитель химии Федорова О.В.
Тема урока: « Свойства концентрированной азотной кислоты» (слайд 1)
Цель урока: продолжить изучение азотной кислоты, рассмотреть химические свойства концентрированной азотной кислоты (слайд 4).
Задачи: (слайд 5)
Образовательные:
1) расширить представления учащихся об азотной кислоте;
2) продолжить формирование умений записывать уравнения реакций, характеризующих свойства азотной кислоты.
Развивающие:
1) способствовать продолжению развития устойчивого интереса к химической науке;
2) применять полученные знания на практике и оценивать результаты выполненных действий;
3) совершенствовать умения обобщать и делать выводы.
Воспитательные:
1)воспитывать положительное отношение к знаниям, инициативность, способность преодолевать трудности для достижения цели;
2)формировать у каждого учащегося умения работать в группах, навыки взаимопроверки и взаимоконтроля.
Тип урока: урок совершенствования знаний, умений и навыков.
Методы обучения: частично – поисковый, наглядный, интерактивный.
Формы организации познавательной деятельности: групповая, индивидуальная, фронтальная.
Этапы урока.
I Организационный этап
1. Приветствие
2. Проверка подготовленности учащихся к учебному занятию
3. Организация внимания
II Актуализация опорных знаний учащихся ( блиц – опрос по вопросам изученных тем). Учащиеся класса отвечают на вопросы блиц – опроса в своих тетрадях, затем меняются тетрадями, сверяют ответы с правильными ответами, представленными учителем (Помощник № 1), используя шкалу оценивания, выставляют оценку друг другу.
Блиц – опрос (слайд 2)
1. Степень окисления атома азота в азотной кислоте —
2. Валентность атома азота в азотной кислоте –
3. В молекуле азотной кислоты связь –
4. 3 – 10% — раствор аммиака называется –
5. Аммиак при нормальных условиях – это …
Аммиак при нормальных условиях – это …
6. Ион аммония образуется по … механизму.
7. Оксид азота (II) является – … оксидом.
8. При окислении оксида азота (II) образуется …
9. Оксид азота (IV) – это …
10. Оксид азота (IV) является – … оксидом.
Помощник № 1 (слайд 3)
Шкала оценивания: каждый правильный ответ оценивается в – 0.5 балла.
1. Степень окисления атома азота в азотной кислоте — + 5.
2. Валентность атома азота в азотной кислоте – IV.
3. В молекуле азотной кислоты связь – ковалентная полярная.
4. 3 – 10% — раствор аммиака называется – нашатырным спиртом.
5. Аммиак при нормальных условиях – это бесцветный газ с характерным запахом.
6. Ион аммония образуется по донорно — акцепторному механизму.
7. Оксид азота (II) является – несолеобразующим оксидом.
8. При окислении оксида азота (II) образуется оксид азота(IV).
9. Оксид азота (IV) – это бурый ядовитый газ с характерным удушливым запахом.
10. Оксид азота (IV) является – кислотным оксидом.
III Мотивация учебной деятельности учащихся (постановка целей и задач урока)
1.Скажите, пожалуйста, различаются ли растворы кислот по концентрации?
Ответы учащихся: да, растворы бывают разбавленные и концентрированные.
2.Отличаются ли химические свойства разбавленных и концентрированных растворов сильных неорганических кислот?
Ответы учащихся: да, отличаются.
3.На прошлом уроке мы изучили химические свойства разбавленной азотной кислоты. Как вы считаете, что мы будем сегодня изучать?
Ответы учащихся: химические свойства концентрированной азотной кислоты. Учащиеся записывают тему и цель урока.
IV Совершенствование знаний, умений и навыков
Свойства концентрированной азотной кислоты (слайд 6)
1. Разложение при нагревании и под действием света
4HNO3(конц.)= 4NO2 + O2 + 2h3O
Чем > t и чем > c (HNO3), тем быстрее идет разложение. Концентрированная азотная кислота всегда окрашена в желтоватый цвет, т. к. в ней растворен оксид азота(IV).
к. в ней растворен оксид азота(IV).
2. Окислительные свойства концентрированной азотной кислоты:
( слайд 7)
а) окисление неметаллов
При 3) – NO , при > c (HNO3) – NO2 .
S + 2HNO3 (40%) = h3SO4 + 2NO↑
S + 6HNO3 (60%) = h3SO4 + 6NO2↑ + 2h3O
3P + 5HNO3(30%) + 2h3O = 3h4PO4 + 5NO↑
P + 5HNO3(60%) = h4PO4 + 5NO2↑ + h3O
Тлеющий уголек, погруженный в концентрированную азотную кислоту, не только не гаснет, а ярко разгорается, разлагая кислоту с образованием NO2.
C +4HNO3(конц.) = CO2 + 2h3O + 4NO2
б) окисление сложных веществ ( слайд 8)
Иногда при окислении выделяется так много тепла, что окисляющееся вещество загорается само собой, без предварительного подогревания.
Например: скипидар, бумага, солома, древесные опилки в концентрированной азотной кислоте самовоспламеняются.
3.Взаимодействие с белками.
При взаимодействии концентрированной азотной кислоты с белками образуются вещества ярко – желтого цвета.
При работе с концентрированной азотной кислотой необходимо соблюдать крайнюю осторожность: не допускать ее попадания на кожу и одежду! В случае попадания кислоты на кожу смыть большим количеством проточной воды и обработать 2 % раствором соды.
4. Взаимодействие с металлами ( слайд 9)
а) с щелочными и щелочно – земельными металлами образуется
Me(NO3)n + N2O + h3O ,например:
4Ca + 10HNO3(конц.) = 4Ca(NO3)2 + N2O +5 h3O;
б) с Fe,Cr,Al,Au,Pt,Ta, Rh,Ir не взаимодействует;
в) с другими тяжелыми металлами образуется
Me(NO3)n + NO2 + h3O, например:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2h3O.
V Физкультминутка (слайд 10)
Чтобы голова не болела,
Ей вращаем вправо-влево. (Вращение головой)
А теперь руками крутим –
И для них разминка будет. ( Вращение прямых рук вперед и назад)
Тянем наши ручки к небу,
В стороны разводим. (Потягивания – руки вверх и в стороны)
Повороты вправо-влево
Плавно производим.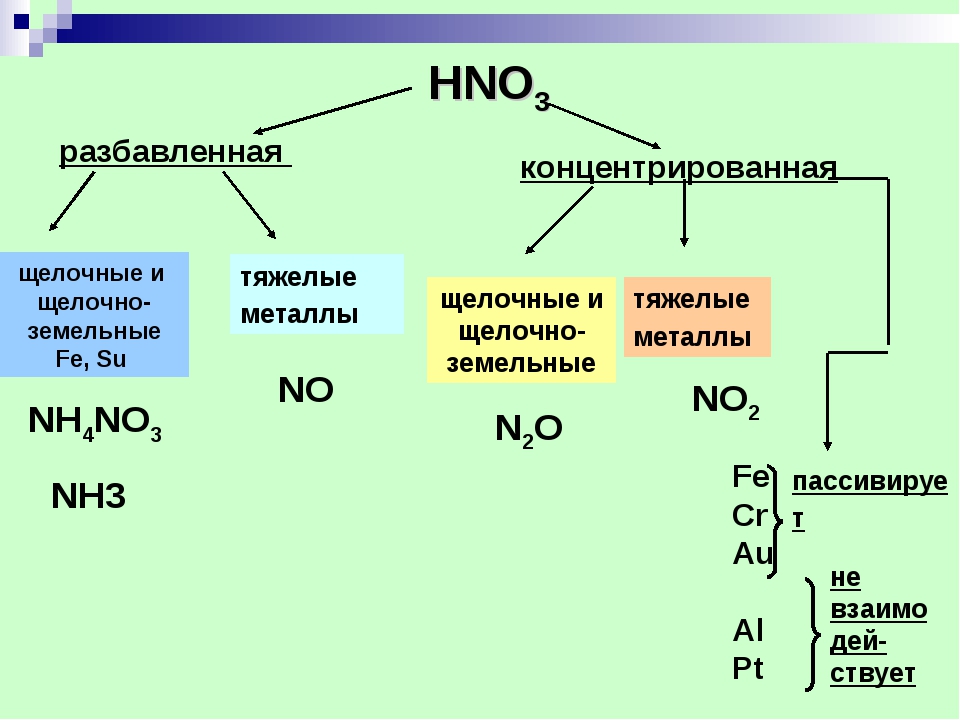 (Повороты туловища влево и вправо)
(Повороты туловища влево и вправо)
Наклоняемся легко,
Достаем руками пол. ( Наклоны вперед)
Потянули плечи, спинки,
А теперь конец разминке. (Дети садятся)
VI Первичное закрепление
Составьте уравнения реакций между концентрированной азотной кислотой и следующими металлами: Ba и Co. Уравнения реакций рассмотрите как ОВР.
Двое учащихся одновременно выполняют задание у доски(индивидуальная работа учащихся).
а) 4Ba0 + 10HN+5O3(конц.) = 4Ba+2(NO3)2 + N+12O + 5h3O
Ba0 – 2е – Ba+2 , 2, окисляется, восстановитель
N+5 + 4е – N+1 ,1 , восстанавливается, окислитель
б) Co0 + 4HN+5O3(конц.) = Co+2(NO3)2 +2 N+4O2 +2h3O
Co0 — 2е – Co+2 , 1 , окисляется, восстановитель
N+5 + 1е – N+4 , 2 , восстанавливается, окислитель
VII Обобщающее закрепление ( слайд 11)
Существует общая закономерность при взаимодействии азотной кислоты с металлами: чем больше разбавлена кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации увеличение активности
кислоты металла
Предлагаю вам обобщенную схему « Взаимодействие азотной кислоты с металлами» (слайд 12)
Самостоятельная работа учащихся.
Используя предложенную схему выполните упр 5 на стр. 96 учебника.
Сверьте правильность выполнения задания с помощником № 2.
Помощник № 2 (слайд 13)
а)3Ag 0+4HN+5O3(разб.) =3Ag+NO3 + N+2O + 2h3O
Ag0 -1e –Ag+ , 3 , окисляется, восстановитель
N+5 +3e – N+2, 1 , восстанавливается, окислитель
б)Ag0 +2HN+5O3(конц.) =Ag+NO3 + N+4O2 +h3O
Ag0 -1e – Ag+ ,1 , окисляется, восстановитель
N+5 +1e – N+4 , 1 , восстанавливается, окислитель
Самостоятельно определите процент успешности выполнения задания.
VII Домашнее задание (слайд 14)
Изучите материал § 27 учебника, выполните тестовые задания в конце параграфа. Используя электронное приложение, ознакомьтесь с видеофрагментами к параграфу.
VIII Рефлексия (слайд 15)
1. На уроке вы узнали что-то новое?
2. Вы поняли новую тему?
3. На все возникшие у вас вопросы вы получили ответы?
4. По новой теме вам нужна дополнительная консультация?
5. На уроке вы поработали добросовестно?
Взаимодействие азотной кислоты с металлами ( слайд 12)
N2O
Щелочные,
щелочно-земельные
металлы
NO2
Al, Cr, Fe
Остальные металлы
Концентрированная При любых условиях |
Разбавленная |
N2O Активные металлы
Малоактивные металлы Pt, Rh, Ir, Ta, Au
NO
Сильно разбавленная,
активные металлы
N2O, N2, Nh4
Тест на свойства азотной кислоты, нитратов и соединений фосфора.

Задание №1
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой при нагревании.
1) золото
2) серебро
3) азот
4) железо
5) аргон
Решение
Задание №2
Из приведенного списка простых веществ выберите два таких, которые не взаимодействуют с концентрированной азотной кислотой при нагревании.
1) медь
2) сера
3) хлор
4) фосфор
5) платина
Решение
Задание №3
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой только при нагревании.
- 1. Al
- 2. Fe
- 3. Ne
- 4. Cu
- 5. Zn
Решение
Задание №4
Из приведенного списка простых веществ выберите два таких, которые не взаимодействуют с концентрированной азотной кислотой без нагревания.
- 1. Cr
- 2. Cu
- 3. Al
- 4.
 Mn
Mn - 5. Cl2
Решение
Задание №5
Из приведенного списка простых веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой при нагревании.
- 1. S
- 2. P
- 3. N2
- 4. Au
- 5. Pt
Решение
Задание №6
Из приведенного списка сложных веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой при нагревании.
- 1. H2O
- 2. H2S
- 3. NO2
- 4. ZnS
- 5. Fe(NO3)3
Решение
Задание №7
Из приведенного списка сложных веществ выберите два таких, которые не взаимодействуют с концентрированной азотной кислотой при нагревании.
- 1. Cu2O
- 2. CuO
- 3. CO2
- 4. SO3
- 5. FeO
Решение
Задание №8
Из приведенного списка сложных веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой при нагревании.
1) нитрат меди(II)
2) нитрат железа(II)
3) нитрат железа(III)
4) нитрат аммония
5) нитрит калия
Решение
Задание №9
Из приведенного списка сложных веществ выберите два таких, которые не взаимодействуют с концентрированной азотной кислотой при нагревании.
- 1. CuS
- 2. CuSO4
- 3. Na2SO3
- 4. KHSO4
- 5. FeS2
Решение
Задание №10
Из приведенного списка сложных веществ выберите два таких, которые взаимодействуют с концентрированной азотной кислотой при нагревании.
- 1. PH3
- 2. P2O3
- 3. H3PO4
- 4. H2SO4
- 5. NO2
Решение
Задание №11
Из приведенного списка веществ выберите два таких, которые могут образоваться при взаимодействии азотной кислоты с различными восстановителями.
- 1.
 NO
NO - 2. O2
- 3. H2
- 4. NO2
- 5. NH3
Решение
Задание №12
Из приведенного списка веществ выберите два таких, которые не могут образоваться при взаимодействии азотной кислоты с различными восстановителями.
- 1. H2
- 2. NH4NO3
- 3. NO2
- 4. NO
- 5. O2
Решение
Задание №13
Из приведенного списка веществ выберите два таких, которые могут взаимодействовать с расплавом нитрата калия.
1) сера
2) азот
3) кислород
4) углерод
5) фторид натрия
Решение
Задание №14
Из приведенного списка веществ выберите два таких, которые не могут взаимодействовать с расплавом нитрата калия.
1) кислород
2) оксид хрома(III)
3) оксид азота(IV)
4) оксид марганца(IV)
5) сера
Решение
Задание №15
Из приведенного списка веществ выберите два таких, которые могут взаимодействовать с расплавом нитрата калия.
1) аргон
2) оксид хрома(III)
3) азот
4) хлор
5) фосфор
Решение
Задание №16
Из приведенного списка веществ выберите те, которые образуются при разложении нитрата калия. Число верных ответов может быть любым.
1) кислород
2) оксид металла
3) металл
4) оксид азота(IV)
5) оксид азота(I)
6) вода
7) соль
Решение
Задание №17
Нитрат алюминия прокалили.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
Задание №18
Нитрат аммония прокалили.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: NH4NO3 = N2O + 2H2O
Задание №19
Нитрат серебра прокалили.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2AgNO3 = 2Ag + 2NO2 + O2
Задание №20
Из приведенного списка веществ выберите те, которые образуются при разложении нитрата железа(III). Число верных ответов может оказаться любым.
1) кислород
2) оксид металла
3) металл
4) соль
5) оксид азота(I)
6) вода
7) оксид азота(IV)
Решение
Задание №21
Из приведенного перечня выберите пару реагентов, между которыми возможна реакция.
1) разбавленная азотная кислота + медь
2) концентрированная азотная кислота + платина
3) разбавленная азотная кислота + хлор
4) концентрированная азотная кислота + бром
5) разбавленная азотная кислота + азот
Впишите в поле ответа уравнение данной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
Задание №22
Из приведенного перечня выберите пару реагентов, между которыми возможна реакция.
1) нитрат калия + сульфат калия (раствор)
2) нитрат калия + хлорид меди(II) (раствор)
3) нитрат натрия + сера (расплав)
4) нитрат натрия + углерод (раствор)
5) нитрат рубидия + кислород (расплав)
Решение
Ответ: 2NaNO3 + S = 2NaNO2 + SO2
Задание №23
Из приведенного списка пар реагентов выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции с коэффициентами. Если взаимодействие невозможно ни где, то запишите в ответ (-).
- 1. CuCl2 + HNO3(разб.)
- 2. CuSO4 + HNO3(разб.)
- 3. CuS + HNO3(конц.)
- 4. Cu(NO3)2 + HNO3(разб.
 )
) - 5. CuBr2 + HNO3(разб.)
Решение
Ответ: CuS + 8HNO3(конц) = CuSO4 + 8NO2 + 4H2O
Задание №24
Из приведенного перечня выберите пару реагентов, между которыми возможна химическая реакция.
1) нитрат меди + сульфат калия (раствор)
2) нитрат аммония + хлорид калия (раствор)
3) нитрат натрия + оксид хрома(III) + едкий натр (расплав)
4) нитрат натрия + железная окалина (раствор)
5) нитрат рубидия + гашеная известь (расплав)
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3NaNO3 + Cr2O3 + 4NaOH = 2Na2CrO4 + 3NaNO2 + 2H2O
Задание №25
Железо растворили в горячей концентрированной азотной кислоте.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O
Задание №26
Медь растворили в разбавленной азотной кислоте.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Задание №27
Медь растворили в концентрированной азотной кислоте.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Задание №28
Запишите уравнение реакции термического разложения нитрата магния.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2Mg(NO3)2 = 2MgO + 4NO2 + O2
Задание №29
Серу растворили в концентрированной азотной кислоте.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
Задание №30
К раствору, содержащему нитрат натрия и гидроксид натрия добавили металлический алюминий. Наблюдали образование газа с резким запахом.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3NaNO3 + 8Al + 5NaOH + 18H2O = 8Na[Al(OH)4] + 3NH3
Задание №31
Фосфор растворили в концентрированной азотной кислоте.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: P + 5HNO3 = H3PO4 + 5NO2 + H2O
Задание №32
Смесь порошков оксида хрома (III), гидроксида калия и нитрата калия подвергли совместному прокаливанию.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3KNO3 + Cr2O3 + 4KOH = 2K2CrO4 + 3KNO2 + 2H2O
Задание №33
В расплавленный нитрат калия поместили уголь.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2KNO3 + C = 2KNO2 + CO2
Задание №34
Магний растворили в очень разбавленной азотной кислоте. При протекании этой реакции газ не выделялся.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
Задание №35
Вычислите массу твердого остатка, полученного при разложении 188 г нитрата меди, если в процессе выделилось 5,6 л кислорода. Ответ укажите в граммах и округлите до целых.
Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №36
Рассчитайте объем газов, образовавшихся при разложении 85 г нитрата серебра. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №37
При внесении 20 г смеси песка и медных опилок в 75%-ный раствор азотной кислоты выделилось 8,96 л бурого газа. Определите массовую долю песка в исходной смеси. Ответ укажите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №38
Навеску смеси нитратов серебра и меди прокалили до постоянной массы. Полученный твердый остаток может прореагировать с 365 г 10%-ного раствора соляной кислоты. Определите массу исходной смеси, если массовая доля нитрата серебра в ней составляла 20%. Ответ укажите в граммах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №39
Электролиз 100 г раствора нитрата серебра проводили до тех пор, пока не прекратилось образование металла на катоде. Рассчитайте массовую долю соли в исходном растворе, если на аноде выделилось 224 мл газа. Ответ укажите в процентах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №40
Из приведенного списка соединений выберите те, в которых фосфор проявляет степень окисления -3. Число верных ответов может быть любым.
- 1. PCl3
- 2. H3PO3
- 3. PH3
- 4. POCl3
- 5. K3P
Решение
Задание №41
Из приведенного списка соединений выберите те, в которых фосфор проявляет степень окисления +1. Число верных ответов может быть любым.
- 1. P4
- 2. Mg3P2
- 3. H3PO2
- 4. KH2PO4
- 5.
 KH2PO2
KH2PO2
Решение
Задание №42
Из приведенного списка соединений выберите те, в которых фосфор проявляет степень окисления +3. Число верных ответов может быть любым.
- 1. H3PO3
- 2. PCl5
- 3. P2O5
- 4. PH3
- 5. AlP
Решение
Задание №43
Из приведенного списка соединений выберите те, в которых фосфор проявляет степень окисления +5. Число верных ответов может быть любым.
- 1. HPO3
- 2. H3PO3
- 3. H4P2O7
- 4. Ca3(PO4)2
- 5. POCl3
Решение
Задание №44
Из приведенного списка соединений выберите те, в которых фосфор проявляет высшую и низшую степень окисления соответственно.
- 1. PH3
- 2. P2O3
- 3. HPO3
- 4.
 K2HPO3
K2HPO3 - 5. PBr3
Решение
Задание №45
Из приведенного списка простых веществ выберите два таких, c которыми взаимодействует фосфор.
1) золото
2) калий
3) азот
4) хлор
5) водород
Решение
Задание №46
Из приведенного списка простых веществ выберите два таких, c которыми не взаимодействует фосфор.
1) бром
2) медь
3) фтор
4) сера
5) графит
Решение
Задание №47
Из приведенного списка простых веществ выберите два таких, c которыми взаимодействует фосфор.
1) литий
2) кислород
3) азот
4) серебро
5) водород
Решение
Задание №48
Из приведенного списка простых веществ выберите два таких, c которыми не взаимодействует фосфор.
1) кальций
2) барий
3) железо
4) хлор
5) аргон
Решение
Задание №49
Из приведенного списка простых веществ выберите два таких, c которыми взаимодействует фосфор.
1) кислород
2) иод
3) азот
4) свинец
5) водород
Решение
Задание №50
Из приведенного списка сложных веществ выберите два таких, c которыми взаимодействует фосфор.
1) гидроксид калия
2) гидроксид алюминия
3) гидроксид меди
4) гидроксид бария
5) гидроксид бериллия
Решение
Задание №51
Из приведенного списка сложных веществ выберите два таких, c которыми не взаимодействует фосфор.
- 1. HCl
- 2. HBr
- 3. HNO3
- 4. H2SO4
- 5. NaOH
Решение
Задание №52
Из приведенного списка сложных веществ выберите два таких, c которыми взаимодействует фосфор.
- 1. HF
- 2. NaF
- 3. HNO3
- 4. KCl
- 5. H2SO4
Решение
Задание №53
Из приведенного списка сложных веществ выберите два таких, c которыми не взаимодействует фосфор.
- 1. Zn(OH)2
- 2. Ba(OH)2
- 3. Be(OH)2
- 4. Sr(OH)2
- 5. Ca(OH)2
Решение
Задание №54
Из приведенного списка сложных веществ выберите два таких, c которыми взаимодействует фосфор.
1) вода
2) соляная кислота
3) едкий натр
4) серная кислота
5) кремниевая кислота
Решение
Задание №55
Из приведенного перечня выберите пару реагентов, между которыми возможна реакция.
1) фосфор + кальций
2) фосфор + аргон
3) фосфор + азот
4) фосфор + серебро
5) фосфор + водород
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ: 2P + 3Ca = Ca3P2
Задание №56
Из приведенного перечня выберите пару реагентов, между которыми возможна реакция.
1) фосфин + гашеная известь
2) фосфин + пирит
3) фосфин + поташ
4) фосфин + сероводород
5) фосфин + кислород
В поле ответа введите уравнение этой реакции, используя в качестве разделителя левой и правой части знак равенства.
Решение
Ответ: 2PH3 + 4O2 = P2O5 + 3H2O
Задание №57
Из приведенного перечня выберите пару реагентов, между которыми возможна реакция.
1) оксид фосфора(V) + хлор
2) оксид фосфора(V) + кислород
3) оксид фосфора(III) + кислород
4) оксид фосфора(III) + водород
5) оксид фосфора(V) + хлороводород
В поле ответа введите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: P2O3 + O2 = P2O5
Задание №58
Установите соответствие между названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) фосфор Б) азотная кислота В) фосфат натрия | 1) сера, гидроксид калия, нитрат железа(II) 2) водород, нитрат свинца, сульфат цинка 3) натрий, кислород, сера 4) фосфорная кислота, нитрат серебра, серная кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №59
Установите соответствие между названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) фосфин Б) нитрат бария В) бромид фосфора(V) | 1) HNO3(конц.), O2, H2O2 2) Zn, H2, N2 3) Cl2, H2O, KOH 4) K2SO4, K3PO4, AgF |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №60
Установите соответствие между названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) оксид фосфора (III) Б) гидрокарбонат аммония В) фосфат натрия | 1) HI, O2, H2O2 2) NaH2PO4, HNO3, AgNO3 3) KOH, Ca(OH)2, HCl 4) H2SO4(конц. |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №61
Установите соответствие между названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) P2O3 Б) H3PO4 В) Cu(NO3)2 | 1) HNO3, O2, H2O 2) H2S, Fe, KI 3) Ca3(PO4)2, KOH, Ba(OH)2 4) KHSO4, K3PO4, KF |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №62
Установите соответствие между названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) нитрат свинца Б) фосфор В) фосфат натрия | 1) HNO3, O2, Cl2 2) H2S, Fe, KI 3) CaO, RbOH, Ba(OH)2 4) H2SO4, H3PO4, LiNO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Задание №63
Вычислите объем фосфина, который необходим для получения 49 г фосфорной кислоты при действии концентрированной азотной кислоты. Ответ укажите в литрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №64
Определите массу осадка, который выпадет при добавлении 8,2 г фосфата натрия в избыток раствора хлорида кальция. Ответ укажите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №65
Навеску фосфора массой 31 г сожгли в некотором количестве кислорода. В результате была получена смесь из двух сложных веществ, которую затем растворили в воде. Определите массовую долю оксида фосфора(V) в продуктах сгорания фосфора, если полученный раствор может полностью обесцветить 63,2 г 5% раствора перманганата калия, подкисленного серной кислотой. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №66
Смесь порошков карбоната калия и карбоната серебра массой 20 г растворили в необходимом количестве азотной кислоты. При добавлении к полученному раствору избытка фосфата натрия выпало 4,19 г осадка. Определите массовую долю карбоната калия в изначальной смеси. Ответ укажите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №67
Вычислите массу фосфора, которую можно получить при взаимодействии 31 г фосфата кальция с избытком угля и песка.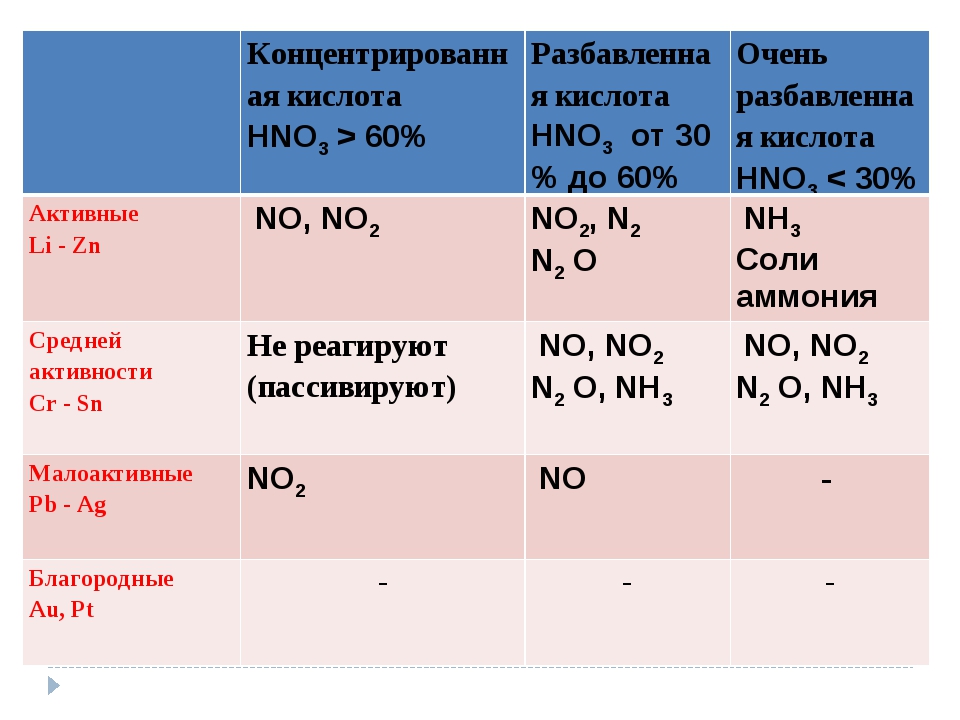 Ответ укажите в граммах и округлите до десятых.
Ответ укажите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №68
Образец фосфида натрия массой 10 г полностью гидролизовали. Рассчитайте объем кислорода, необходимый для полного окисления газообразного продукта реакции. Ответ укажите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №69
Навеску фосфора полностью окислили избытком азотной кислоты. Вычислите массу навески, если для поглощения газообразных продуктов реакции потребовалось 20 мл 10% раствора гидроксида натрия (плотность 1,1 г/мл). Ответ приведите в миллиграммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №70
Рассчитайте объем сернистого газа, который можно получить при окислении концентрированной серной кислотой 11,2 л фосфина. Ответ укажите в литрах и округлите с точностью до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №71
Вычислите массу 20% раствора гидроксида калия, необходимую для полной нейтрализации продуктов гидролиза 41,7 г хлорида фосфора(V). Ответ укажите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №72
Смесь песка и порошка магния массой 10 г нагрели с избытком фосфора. Полученную смесь обработали водой, при этом выделилось 1,12 л газа. Вычислите массовую долю песка в исходной смеси. Ответ укажите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Задание №73
Запишите уравнение взаимодействия гидрофосфата натрия с гидроксидом натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na2HPO4 + NaOH = Na3PO4 + H2O
Задание №74
Фосфид кальция обработали избытком раствора соляной кислоты.
В поле ответа введите уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Ca3P2 + 6HCl = 3CaCl2 + 2PH3
Задание №75
Запишите уравнение взаимодействия фосфата натрия с дигидрофосфатом натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na3PO4 + NaH2PO4 = 2Na2HPO4
Задание №76
Запишите уравнение взаимодействия фосфата натрия с дигидрофосфатом натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na3PO4 + NaH2PO4 = 2Na2HPO4
Задание №77
Запишите уравнение взаимодействия фосфорной кислоты с гидрофосфатом натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Na2HPO4 + H3PO4 = 2NaH2PO4
Задание №78
Запишите уравнение взаимодействия большого избытка фосфорной кислоты с гидроксидом натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: NaOH + H3PO4 = NaH2PO4 + H2O
Задание №79
Запишите уравнение взаимодействия фосфорной кислоты с избытком гидроксида натрия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3NaOH + H3PO4 = Na3PO4 + 3H2O
Задание №80
Запишите уравнение взаимодействия фосфида магния с водой.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3
Задание №81
Запишите уравнение взаимодействия фосфора с кальцием.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 3Ca + 2P = Ca3P2
Задание №82
Запишите уравнение взаимодействия хлорида фосфора(V) с избытком водного раствора гидроксида калия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: PCl5 + 8KOH = K3PO4 + 5KCl + 4H2O
Задание №83
Запишите уравнение взаимодействия хлорида фосфора(V) с водой.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: PCl5 + 4H2O = H3PO4 + 5HCl
Задание №84
Запишите уравнение взаимодействия фосфора с недостатком брома.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2P + 3Br2 = 2PBr3
Задание №85
Запишите уравнение взаимодействия фосфора с концентрированной серной кислотой.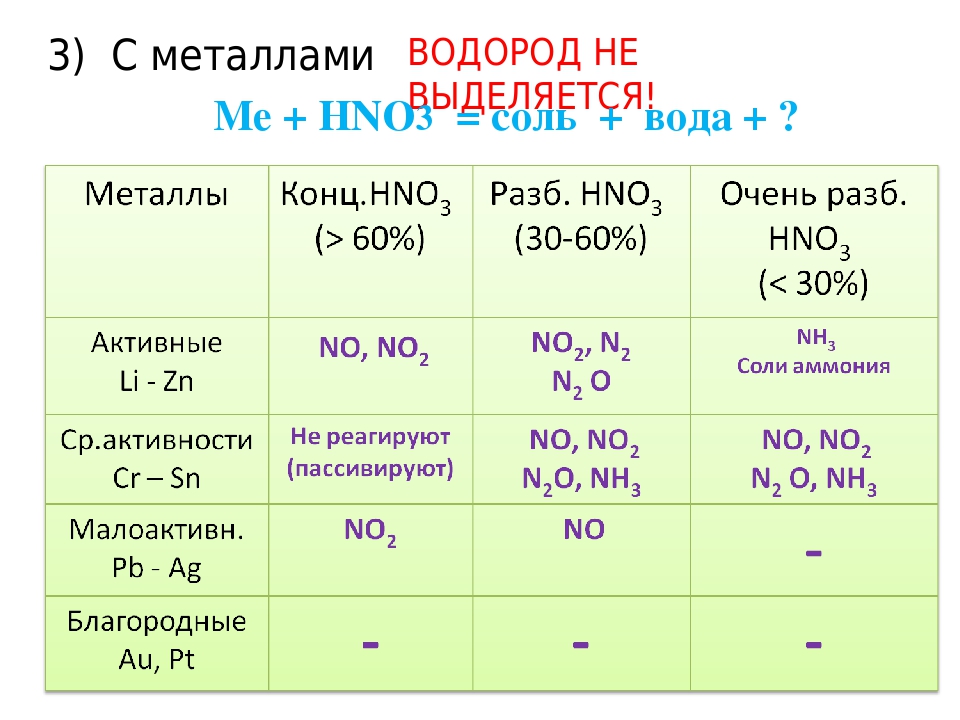
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
Задание №86
Запишите уравнение взаимодействия фосфора с концентрированной азотной кислотой.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: P + 5HNO3 = H3PO4 + 5NO2 + H2O
Задание №87
Запишите уравнение взаимодействия фосфора с концентрированным раствором гидроксида калия.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 4P + 3KOH + 3H2O = 3KH2PO2 + PH3
Задание №88
Запишите уравнение взаимодействия фосфина с избытком хлора в водной среде.
Используйте в качестве разделителя левой и правой частей знак равенства.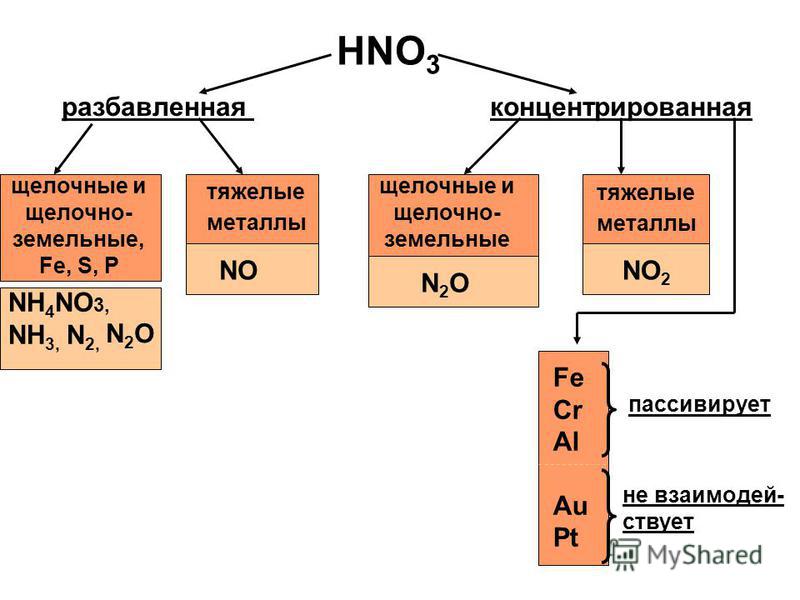
Решение
Ответ: PH3 + 4Cl2 + 4H2O = H3PO4 + 8HCl
Задание №89
Запишите уравнение взаимодействия фосфина с концентрированной серной кислотой.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
Задание №90
Запишите уравнение взаимодействия фосфина с концентрированной азотной кислотой.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
Задание №91
Запишите уравнение взаимодействия фосфина с перекисью водорода.
Используйте в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: PH3 + 4H2O2 = H3PO4 + 4H2O
Задание №92
Фосфин пропустили через водный раствор, содержащий перманганат калия и серную кислоту.
Впишите в поле ответа уравнение осуществленной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: 5PH3 + 8KMnO4 + 12H2SO4 = 5H3PO4 + 4K2SO4 + 8MnSO4 + 12H2O
Задание №93
Фосфат кальция совместно прокалили с песком и коксом.
Впишите в поле ответа уравнение осуществленной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Решение
Ответ: Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO
Азотная кислота химические свойства | Дистанционные уроки
19-Окт-2012 | комментария 4 | Лолита Окольнова
— сильный окислитель.
Это сильная кислота. Бесцветная, концентрированная азотная кислота на воздухе дымит. Очень быстро становится коричневого (бурого) цвета из-за реакции разложения:
Очень быстро становится коричневого (бурого) цвета из-за реакции разложения:
4HNO3 = 4NO2 + 2h3O + O2
Очень рекомендую почитать лекцию ПОДГРУППА АЗОТА — тогда многие химические свойства азотной кислоты будут более понятны.
Почему? Да потому что азот N проявляет в этом соединении степень окисления +5, что соответствует номеру его группы. Т.е. сам азот N может только понизит свою степень окисления — восстановиться. Значит, по химическим свойствам азотная кислота — сильный окислитель.
S + HNO3 = NO2 + SO2 + h3O
окислитель N(+5) +1e(-) = N(+4) — восстановление
восстановитель S(0) -4e(-) =S(+4) — окисление
S +4 HNO3 = 4NO2 + SO2 + 2h3O
Это просто один из примеров таких реакций. Продукт реакции — оксид азота (IV) — NO2, не единственно возможный, есть еще варианты, и их образование подчиняется определенным правилам.
Химические свойства азотной кислоты
Правила взаимодействия азотной кислоты и металлов
1 правило — правило концентрации
Концентрированная азотная кислота восстанавливается до оксида азота (IV) — NO2
Zn + 4HNO3 (конц) = Zn(NO3)2 + 2NO2 + 2h3O
Разбавленная азотная кислота восстанавливается до оксида азота (II) — NO
3Zn + 8HNO3 (разб) = 3Zn(NO3)2 + 2NO + 4h3O
2 правило — правило металла
Смотрим ряд активности металлов!
- С золотом (Au) и платиной (Pt)азотная кислота не реагирует ни при каких условиях.
- Азотная кислота и металлы, стоящие в ряду напряжений после водорода — применимо правило 1 — правило концентрации:
Сu + 4HNO3 (конц) = Cu(NO3)2 + 2NO2 + 2h3O
3Cu + 8HNO3 (разб) = 3Cu(NO3)2 + 2NO + 4h3O - Азотная кислота и металлы, стоящие в ряду напряжений до водорода: вариантов продуктов немало, есть закономерность:
Все реакции азотной кислоты — окислителя ( с металлами и неметаллами) изучаем ЗДЕСЬ!
Соли азотной кислоты
(нитраты)
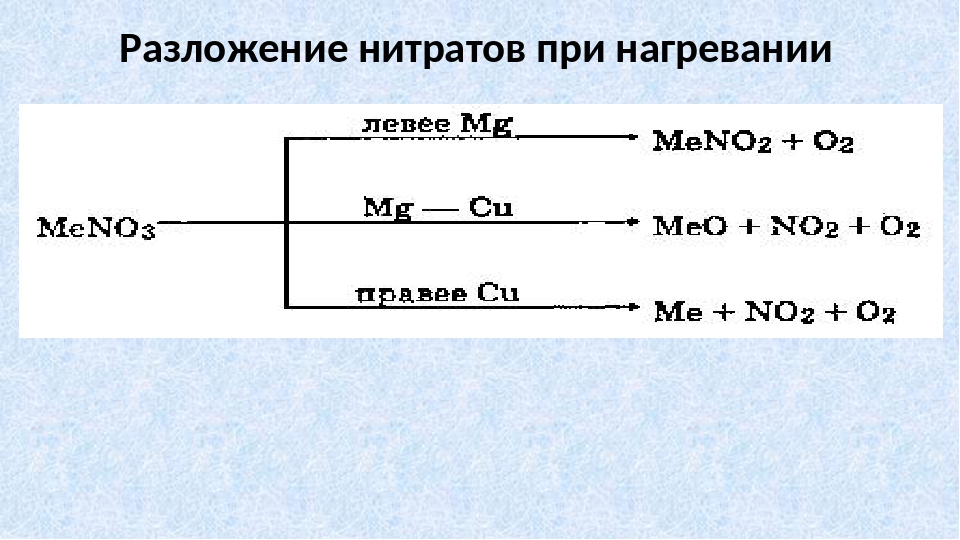
Здесь мы рассмотрим вопрос реакций разложения нитратов
- Разложение нитратов металлов, стоящих в ряду напряжений ДО МАГНИЯ — до нитритов:
2KNO3 = 2KNO2 + O2
- Разложение нитратов металлов, стоящих в ряду напряжений ДО МАГНИЯ — до нитритов:
- Разложение нитратов металлов правее магния ( и после водорода) и до меди (Сu) — на соответствующий оксид металла и оксид азота (IV) NO2:
2Сu(NO3)2 = 2CuO + 4NO2 + O2
- Разложение нитратов металлов правее магния ( и после водорода) и до меди (Сu) — на соответствующий оксид металла и оксид азота (IV) NO2:
- Разложение нитратов металлов правее ртути — до металла:
2AgNO3 =2 Ag + 2NO2 + O2
- Разложение нитратов металлов правее ртути — до металла:
- Нитрат аммония разлагается до образования оксида азота(I) — N2O:
Nh5NO3 = N2O + 2h3O
На нитрат-ионы NO3(-) нет качественных реакций — все соли азотной кислоты очень хорошо растворимы в воде.
Еще на эту тему:
Обсуждение: «Азотная кислота химические свойства»
(Правила комментирования)
Азотная кислота концентрирование — Справочник химика 21
Азотная кислота, концентрированная и разбавленная (1 I). [c.104]
Многие химические свойства циклоалканов напоминают свойства алканов. Они вступают в реакции замещения, наиример с галогенами, нитруются азотной кислотой. Концентрированная серная кислота практически не растворяет циклоалканы (С5 и выше), олеум и хлорсульфоновая кис [оты реагируют с ними е выделением ЗОг. Циклопропан энергично реагирует с концентрированной серной кислотой по следующее реакции [c.138]
Азотная кислота, концентрированная. [c.108]
Опыт 7. Медь, стружка. Олово. Азотная кислота, концентрированная. Аммиак, концентрированный раствор. Железные гвозди. Сульфат меди, 0,5 н. раствор. [c.311]
Железные гвозди. Сульфат меди, 0,5 н. раствор. [c.311]
По физико-химическим свойствам перфторуглероды отличаются рядом особенностей и прежде всего чрезвычайно высокой химической и термической стабильностью. Они не взаимодействуют при комнатной температуре с такими сильными окислителями, как азотная кислота, концентрированная серная кислота, хромовая кислота и др. Они не взаимодействуют с натрием до температуры 350 С. Фторуглероды устойчивы к взаимодействию кислорода, не горят и не разлагаются до температур 400—500° С. Термическая стабильность фторуглеродов выше, чем полисилоксанов. Высокая термическая стойкость и химическая инертность фторуглеродов объясняются большей прочностью связи углерода с фтором, чем углерода с водородом. [c.152]
Азотная кислота, концентрированная, 0,1 М раствор. [c.335]
Опыт 4, Сероводородная вода. Бромная вода. Йодная вода. Раствор перекиси водорода. Азотная кислота, концентрированная. [c.311]
[c.311]
Сопоставить поведение Аз, 8Ь и В1 по отношению к азотной кислоте — концентрированной и разбавленной. Написать уравнения реакций. [c.203]
Не рекомендуется применять армированные пластики при работе с концентрированной азотной кислотой, концентрированным каустиком, ароматическими растворителями. [c.225]
Опыт 5. Кислотно-основные свойства оксидов. Исследуйте отношение ХпО, СбО и НдО к воде, разбавленной азотной кислоте, концентрированному раствору щелочи. Сделайте вывод о кислотно-основных свойствах оксидов. [c.171]
Взаимодействие с концентрированной азотной кислотой. Концентрированная азотная кислота, в отличие от разбавленной, обычно восстанавливается до диоксида азота [c.333]
Дм работы требуется. Прибор по рис. 69. — Войлочный или суконный круг. — Трубка паяльная. — Воронка. — Штатив с пробирками. — Уголь кусковой. — Двуокись свинца. Смесь угля с окисью свинца 1 1. — Смесь угля с двуокисью олова 1 1. — Цинк гранулированный. — Хлорид олова (IV). — Азотная кислота концентрированная и 2 и. раствор. — Серная кислота, 2 н. раствор. — Соляная кислота концентрированная и 2 н. раствор. — Едкий натр, 2 н. раствор. — Едкое кали, 2 и. раствор. — Хлорид олова (II), 0,5 н. раствор. — Нитрат свинца, 0,5 н. раствор. — Ацетат свинца, 0,5 н. раствор. — Нитрат висмута, 0,5 н. раствор. — Иодид калия, 0,5 н. раствор. — Полисульфид аммония, [c.240]
Опыт 3. Гвозди (размером больше длины пробирки). Азотная кислота, концентрированная. Щипцы. Стаканы. Серная кислота, 2 н. раствор. [c.308]
В четыре пробирки, содержащие соответственно разбавленную серную кислоту, очень разбавленную азотную кислоту, концентрированный раствор хлорида аммония и концентрированный раствор щелочи, вносят немного порошкообразного алюминия. Укажите, в каких пробирках будет происходить реакция а) с выделением осадка, б) с выделением газа, в) с образованием алюминийсодержащих катионов, г) с образованием алюминийсодержащих анионов, д) с образованием алюминийсодержащих молекул [c.76]
Окислители — кислород, галогены, азотная кислота, концентрированная серная кислота, двуокись свинца, двуокись марганца, перманганат калия, бихромат калия, озон, гипохлорит натрия ЫаСЮ, хлорат калия КСЮз, УаОа, N 203, КВгОд, ионы благородных металлов. [c.198]
Легче происходит растворение в разведенной азотной кислоте, концентрированная же азотная кислота его пассивирует. [c.369]
Для работы требуется. Штатив с пробирками. — Цилиндр мерный емк. 10 мл. — Чашка фарфоровая. — Палочка стеклянная. — Ацетат аммония. — Карбонат калия. — Сульфид железа. — Сульфид меди. — Сульфид цинка. — Хлорид марганца. — Хлорид натрия. — Фосфат натрия. — Азотная кислота концентрированная.—Серная кислота концентрированная. — Хлорид стронция, насыщенный раствор. — Сульфат кальция, насыщенный раствор. — Хлорид кальция, насыщенный раствор. — Ацетат серебра, насыщенный раствор. — Сульфат стронция, насыщенный раствор. — Нитрат серебра, 20%-ный раствор. — Ацетат натрия, 20%-ный раствор. —Аммиак, 10%-ный раствор. —Серная кислота (1 6). — Едкий натр, 2 н. раствор. — Фосфат натрия, 1 н. раствор. — Соляная кислота, 2 н. раствор. — Хлорид железа (III), 0,5 н. раствор. — Сульфид натрия, 0,5 н. раствор. — Сульфат натрия, 1 н. раствор. — Сульфат цинка, [c.133]
Медь, серебро и золото в ряду напряжений располагаются ниже водорода их электродные потенциалы имеют положительное значение, поэтому они не окисляются ионами водорода, но могут быть окислены (кроме золота) кислотами, кислотные остатки которых обладают высокой окислительной способностью (концентрированная и разбавленная азотная кислота, концентрированная серная кислота и т. д.). В этих реакциях кислоты выполняют роль и окислителя, и среды. [c.190]
Для работы требуется Аккумулятор на 6—8 вольт. — Амперметр на 5 ампер. — Вольтметр на 5 вольт. — Секундомер. — Реостат ползунковый. — Ключ электрический.— Медная пластинка 2 мм, 2 шт. — Провода электрические. — Штатив с пробирками. — Воронка. — Стакан химический 300 мл. — Щипцы тигельные. — Медные стружки. — Медная проволока. — Нихромов я проволока. — Медная сетка, свернутая в трубочку. — Бумага лакмусовая. — Бумага крахмальная. — Бумага наждачная. — Бумага фильтровальная. — Жидкость Фелинга (растворы i и i ). — Азотная кислота концентрированная. — Серная кислота, 2 н. раствор.—Азотная кислота (1 1) и 15%-ный раствор.—Соляная кислота концентрированная, 2 н. раствор и 6%-ный раетвор. — Нитрат серебра, 1%-ный раствор. — Нитрат серебра, 0,1 н. раствор. — Аммиак, 10%-ный рас- [c.193]
Для работы требу тся Приборы (см. рис. 73 и 74). — Штатив с пробирка ми. — Тигельные щипцы. — Крышка от фарфорового тигля. — Кристаллиза тор большой. — Стаканы емк. 100 или 150 и ЙО мл. — Цилиндр мерный емк 50 мл. — Цилиндр со стеклом. — Колбы емк. 100 мл. 4 шт. — Колба мерная емк 100 мл. — Колбы конические емк. 100 мл, 3 шт. — Пипетка емк. 10 мл. — Шпа тель стеклянный. — Газоотводная трубка с пробкой для собирания газов над водой. — Ванна стеклянная. — Бумага (листы 7X7 см). — Лучины. — Вата. — Хлорид аммония. — Гидроокись кальция. — Цинк гранулированный. — Фосфор красный. — Соляная кислота концентрированная. — Азотная кислота концентрированная. — Серная кислота (1 5). — Хлорид аммония, насыщенный раствор. — Нитрит натрия, насыщенный раствор. — Соляная кислота, 0,4 н. титрованный раствор. — Едкое кали, 2 н. раствор. — Аммиак, 25%-ный и 2 н. растворы. — Арсенат натрия, 0,5 н. раствор. — Сульфат цинка, 0,5 н. раствор. — Сульфат никеля, 0,5 н. раствор. — Нитрат серебра, 1%-ный раствор. — Сульфат гидразина, 3%-ный раствор. — Хлорид гидроксиламина, 3%-ный раствор. — Жидкость Фелинга, растворы I и И (см. раб. 21, стр. 194). — Растворы метилового оранжевого и фенолфталеина. [c.254]
Для работы требуется Колба емк. 50 мл с пробкой, воронкой и газоотводной трубкой. — Аппарат Киппа для получения сероводорода. — Штатив с пробирками. — Стакан емк. 500 мл. — Стакан емк. 100 мл. — Трубка стеклянная 0 см с пробкой. —Ступка фарфоровая. —Тигель фарфоровый с крышкой. — Щипцы тигельные. — Цилиндр мерный емк. 100 мл. — Воронка. — Нож. — Трубка паяльная. — Держатель для пробирок. — Асбест. — Бумага фильтровальная. — Бумага свинцовая. — Сульфат натрия безводный. — Уголь в порошке. — Уголь (кокс) кусковой. — Сера в кусках. — Сера в порошке. — Железные пластинки. — Сернистое железо.—Смесь цинковой пыли с серой. — Азотная кислота концентрированная. — Серная кислота, 2 н. и 4 н. растворы. — Аммиак, 10%-ный раствор. — Соляная кислота, 2 н. раствор. — Едкое кали, 2 н. раствор. — Хлорид олова (П), 0,5 н. раствор. — Сульфид аммония, 2 н. раствор. — Сульфид натрия, 2 н. раствор. — Хлорид сурьмы, 0,5 и. раствор. — Хлорид меди, 0,5 н. раствор. — Хлорид цинка. — Хлорид марганца, 0,5 и. раствор. — Хлорид бария, 2 н. раствор. — Теллурит калия, 2%-ный раствор. — Сернистая кислота, насыщенный раствор. — Селенистая кислота, 10%-ный раствор.— Раствор лакмуса нейтральный. — Спирт этиловый. — Ксилол. — Сероводородная вода. [c.278]
Для работы требуется-. Штатив с пробирками. — Тигель фарфоровый. — Стекло часовое. — Пипетка. — Палочка стеклянная. — Лучины. — Вата гигроскопическая. — Бумага лакмусовая. — Двуокись свинца. — Сурик свинцовый. — Перманганат калия. Бертолетова соль. — Двуокись марганца прокаленная. — Едкое кали. — Сульфит натрия. — Азотная кислота концентрирован-яая. — Серная кислота концентрированная. — Серная кислота, 2 н. раствор. — Перманганат калия, 0,05 н. раствор. — Хлорид аммония, 10%-ный раствор. — Аммиак, 10%-ный раствор. — Едкий натр, 30%-ный и 2 н. раствор. — Сернистая кислота, насыщенный раствор. — Сульфат марганца, 1 н. раствор. — Сульфат железа (И), I н. раствор. —Сульфид аммония, 2 н. раствор. —Спирт этиловый. — Сероводородная вода. — Хлорная вода. — Бромная вода. [c.319]
Оборудование и реактивы. Низкий цилиндр диаметром 15— 20 см, фарфоровая чашка, пипетка, щипцы дымящая азотная кислота, концентрированная серная кислота, скипидар. [c.68]
Азотная кислота концентрированная. . …………….0,05 [c.207]
Оборудование и реактивы. Два демонстрационных бокала, стеклянные палочки, золотая фольга, дымящая азотная кислота, концентрированная соляная кислота, концентрированный раствор хлорида натрия. [c.144]
Но с металлами азотная кислота реагирует иначе, чем другие кислоты. При взаимодействии азотной кислоты водород не выделяется. Восстанавливается в ней азот за счет понижения окислительного числа с 5 до низшего значения, вплоть до 3 —. Если азотная кислота концентрированная, то, независимо от восстановителя, азот восстанавливается до того или иного низшего положительного по знаку значения окислительного числа, и вместо водорода образуются двуокись или окись азота — N4+022- N2+02-, Если же кислота сильно разбавленная, а металл химически активный, то азот восстанавливается до окислительного числа О, т. е. выделяется свободный азот N2, или 3—. В этом последнем случае азот переходит в аммиак N Hз+, который с избытком кислоты образует нитрат аммония. [c.55]
Пластические массы на основе политетрафторэтилена получили название фторопласты-4 (в США—тефлон). Они отличаются высокой термической устойчивостью от —183 С до +300 С и высокой химической стойкостью. На фторопласт-4 не действуют горячая дымящая азотная кислота, концентрированная серная кислота, расплавленный едкий натр. Лишь расплавленный металлический натрий постепенно разрушает его. [c.119]
Серная кислота, концентрированная Азотная кислота, концентрированная Едкий натр Уксусный ангидрид Перманганат калия Соляная кислота, концентрированная Этиловый спирт [c.800]
Из металлов подгруппы цинка ртуть наименее активна вследствие высокой энергии ионизации ее атомов (см. табл. 34). Соляная и разбавленная серная кислота, а также щелочи не дейстиуют на ртуть. Легко растворяется ртуть в азотной кислоте. Концентрированная серная кислота растворяет ртуть ири нагревании. [c.626]
Вода при обычной температуре на олово не действует. Свинец под действием воды, особенно при высокой температуре, постепеи-ио окисляется, так как вода растворяет заш.итпую оксидную пленку. С разбавленными кислотами олово реагирует медленно, лучше с соляной кислотой. Свинец способен. реагировать со многими кислотами, по их действие часто ослабляется из-за образования иа поверхности свинца нерастворимых пленок — сульфатной, хлорид-пой и других легко реагирует свинец с разбавленной азотной кислотой, поскольку нитрат свинца хорошо растворнм и, следовательно, защитную пленку не образует. Олово и свинец окисляются концентрированной азотной кислотой. Концентрированная серная кислота прн иагреваиии окисляет олово, восстанавливаясь при этом до оксида серы (IV) [c.341]
Азотная кислота — сильный окислитель. Металлы, за исключением Р1, РЬ, 1г, Аи, переводятся концентрированной азотной кислотой в соответствующие оксиды. Если последние растворимы в азотной кислоте, то образуются нитраты. Железо хорошо растворяется в разбавленной азотной кислоте. Концентрированная азотная кислота образует на поверхности железа тонкий, но плотный слой нерастворимого в концентрированной кислоте оксида, защищающего металл от дальнейшего разъедания. Эта способность железа пассивироваться используется для защиты его от коррозии. Концентрированную азотную кислоту (особенно с добавлением 10% Н2504) перевозят обычно в стальных цистернах. Многие органические вещества (в частности животные и растительные ткани) при действии НМОз разрушаются, а некоторые из них от соприкосновения с очень концентрированной кислотой могут воспламеняться. В лабораторной практике обычно применяется азотная кислота, [c.99]
Реактивы, посуда. Нитрат ртути Hg2(N03)2 2Н2О (кр.). Хлорид натрия Na l (кр.). Нитрат желеэа(1И) Fe(N03)3 — 5%-й раствор. Азотная кислота -концентрированная (р = 1,40). Ртуть Hg (металл). Тиоцианат калия KS N - [c.88]
Некоторые металлы, например сурьма и олово, при действии на них азотной кислоты — концентрированной или умеренно концентрированной — окисляются с образованием малорастворимых в воде гидратных форм высших оксидов, имеющих слабо выраженный кислотный характер. Так, сурьма образует ЗЬаОв-д НдО, а олово — р-оловянную кислоту НгЗпОз. [c.187]
Опыт 2. MnSOi или Мп(ЫОэ)а, 0,5 н. раствор. Двуокись свинца или сурик. Азотная кислота, концентрированная. [c.313]
Для работы требуется. Штатив с пробирками. — Стружка медная. — Гвозди железные. — Перманганат калия кристаллический. — Азотная кислота концентрированная. — Соляная кислота концентрированная. — Сульфат меди, 0,5 н. раствор. — Иодид калия, 0,5 и. раствор.— Серная кислота, 2 н. раствор. — Нитрит калия, 1 н. раствор. — Едкий натр, 2 н. раствор. — Хлорид марганца, 0,5 н. раствор. — Перманганат калия, 0,05 н. раствор. — Метахромит натрия, 0,1 н. раствор. —- Бихромат калия, 0.3 н. раствор. — Иодат калия, 0,2 н. раствор. — Сульфит калия, 0,5 н. раствор. — Крахмальный раствор. — Хлорная вода. — Бромная вода. — Сероводородная вода. — Бумага наждачная. [c.151]
Для работы требуется Прибор (см. рис. 52, пробирка прибора имеет отверстие в дне). — Прибор (см. рис. 54). — Газометр с кислородом. — Аппарат Киппа. — Барометр. — Термометр комнатный. — Линейка металлическая. — клянка промывная. — Штатив с пробирками. — Ложечки для сжигания, 2 шт.— Цилиидрм стеклянные, 2 шт. — Цилиндр мерный емк. 250 мл. — Пробка с газоотводной трубкой. — Стекла к цилиндрам, 2 шт. — Воронка. — Ванна стеклянная. — Лучины..— Хлорат калия. — Двуокись марганца. — Перманганат калия. — Персульфат аммония. — Цинк, гранулированный. — Уголь кусковой. — Сера кусковая. — Эфир серный.—Азотная кислота концентрированная.— Серная кислота разбавленная (1 6). — Перманганат калия, 0,1 н. раствор. — Иодид калия, 0,5 н. раствор. — Ацетат свинца, 0,5 н. раствор. — Едкий натр, 2 н. раствор. — Сульфид натрия, 1 н. раствор. — Хлорид марганца, 0,5 н. раствор. — Раствор индиго или индиго красного. — Вата. [c.157]
Для работы требуется Коническая пробирка с пробкой и термометром. — Пробирка тугоплавкая. — Штатив с пробирками. — Щипцы тигельные.— Поднос или кюветы. — Тигель фарфоровый с крышкой. — 7 реугсмьник фарфоровый. — Стаканы емк. 200 мл и л. — Конус асбестовый. — Мешалка стеклянная.— Палочка стеклянная.—Индиговая или кобальтовая призма. — Лучины. — Бумага фильтровальная. — Проволока платиновая. — Ртуть (в специальной капельнице). — Цинк. — Амальгама натрия. — Окись цинка. — Окись кадмия. — Окись ртути. — Иодид ртути (П). — Азотная кислота концентрированная. — Серная кислота концентрированная и 2 н. раствор. — Перманганат калия, 0,05 н. раствор. — Соляная кислота, 2 н. раствор. — Едкий натр, 30%-ный и 2 н. раствор. — Аммиак, 10%-ный раствор. — Едкое кали, 20%-иый раствор. — Сульфат стронция, насыщенный раствор. — Карбонат натрия, 2 и. раствор. — [c.215]
Для работы требуется Воронка для горячего фильтрования.— Прибор для фильтрования при уменьшенном давлении. — Стакан емк. 50 мл. — Стакан емк. 00мл. — Цилиндр мерный емк. 50 мд. — Воронка. — Чашка фарфоровая.— Ступка фарфоровая. — Штатив с пробирками. — Ванна стеклянная.—Стекло часовое. — Палочки стеклянные, 2 шт. — Проволока платиновая. — Ножницы. — Пластинка алюминиевая. — Бумага наждачная. — Бумага лакмусовая. — Бумага куркумовая. — Бумага свинцовая. — Бумага фильтровальная. —Кусочки белой ткани. — Асбест листовой. — Алюминий, стружка. — Алюминиевая пыль. — Магний, лента. — Цинк гранулированный. — Сера порошком. — Бура безводная. — Азотная кислота концентрированная. — Серная кислота концентрированная.— Соляная кислота концентрированная. — Едкий натр, 30%-ный раствор и 2 н. раствор. — Аммиак, 10%-ный раствор. — Нитрат ртути (11), [c.223]
РеОз — кислотообразующий оксид железной кислоты Н2ре04, которая в свободном виде не получена. Соли этой кислоты — ферраты — сильные окислители. Пленка РеОд образуется при пассивировании железа в азотной кислоте (концентрированная с добавкой NaNOj). [c.369]
Высокая стойкость к тепловому старению, исключительная стойкость к действию разнообразных растворителей, гугасел и топлив при повышенных температурах являются характерной особенностью фторсодержащих каучуков. Вулканизаты фторкаучуков обладают высоким сопротивлением истиранию и стойкостью к агрессивным средам —щелочам, сильным окислителям (дымящей серной кислоте, азотной кислоте, концентрированной перекиси водорода, озону). [c.115]
Азотная кислота — конспект — Химия
2 Содержание: 1. Историческая справка 2. Распространенность в природе 3. Атом и молекула 4. Физические и химические свойства 5. Получение и применение 6. Азотная кислота 7. Окислительные свойства азотной кислоты 8. Нитраты 9.Промышленное получение азотной кислоты 10. Круговорот азота в природе 3 6 более устойчивы оксигалогениды азота — NOF, NOCI, NOBr, NO2F и NO2CI. С серой также не происходит непосредственного соединения азота; азотистая сера N4S4 получается в результате реакции жидкой серы с аммиаком. При взаимодействии раскаленного кокса с азотом образуется циан (СN)2. Нагреванием азота с ацетиленом С2Н2 до 15000С может быть получен цианистый водород HCN. Взаимодействие азота с металлами при высоких температурах приводит к образованию нитридов (например, Mg3N2 ). При действии на обычный азот электрических разрядов или при разложении нитридов бора, титана, магния и кальция, а также при электрических разрядах в воздухе может образоваться активный азот, представляющий собой смесь молекул и атомов азота, обладающих повышенным запасом энергии. В отличие от молекулярного, активный азот весьма энергично взаимодействует с кислородом, водородом, парами серы, фосфором и некоторыми металлами. Азот входит в состав очень многих важнейших органических соединений ( амины, аминокислоты, нитросоединения и др. ). 5. Получение и применение. В лаборатории азот легко может быть получен при нагревании концентрированного нитрита аммония: Nh5NO2 N2 + 2h3O. Технический способ получения азота основан на разделении предварительно сжиженного воздуха, который затем подвергается разгонке. Основная часть добываемого свободного азота используется для промышленного производства аммиака, который затем в значительных количествах перерабатывается на азотную кислоту, удобрения, взрывчатые вещества и т. д. Помимо прямого синтеза аммиака из элементов, промышленное значение для связывания азота воздуха имеет разработанный в 1905 цианамидный метод, основанный на том, что при 10000С карбид кальция (получаемый накаливанием смеси известии угля в электрической печи) реагирует со свободным азотом: CaC2 + N2 CaCN2 + C. Образующийся цианамид кальция при действии перегретого водяного пара разлагается с выделением аммиака: CaCN2 + 3h3O CaCO3 + 2Nh4. Cвободный азот применяют во многих отраслях промышленности: как инертную среду при разнообразных химических и металлургических процессах, для заполнения свободного пространства в ртутных термометрах, при перекачке горючих жидкостей и т. д. Жидкий азот находит применение в различных холодильных установках. Его хранят и транспортируют в стальных сосудах Дьюара, газообразный азот в сжатом виде — в баллонах. Широко применяют многие соединения азота. Производство связанного азота стало усиленно развиваться после 1-й мировой войны и сейчас достигло огромных масштабов. 6. Азотная кислота. Чистая азотная кислота HNO —бесцвет ная жидкость плотностью 1,51 г/см при — 42 °С застывающая в прозрачную кристаллическую массу. На воздухе она, подобно кон центрированной соляной кислоте, «дымит», так как пары ее обра зуют с ‘влагой воздуха мелкие капельки тумана, Азотная кислота не отличается прочностью, Уже под влиянием света она постепенно разлагается: 7 Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску. Азотная кислота принадлежит к числу наиболее сильных кис лот; в разбавленных растворах она полностью распадается на ионы Н и- NO . 7. Окислительные свойства азотной кислоты. Характерным свойством азотной кислоты является ее ярко выраженная окислительная способность. Азотная кислота—один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор — в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO , ярко разгорается. Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы—в оксиды. Концентрированная HNO пассивирует некоторые металлы. Еще Ломоносов открыл, что железо, легко растворяющееся в разбавленной азотной кислоте, не растворяется в холодной концентрированной HNO . Позже было установлено, что аналогичное действие азотная кислота оказывает на хром и алюминий. Эти металлы переходят под действием концентрированной азотной кислоты в пассивное состояние. Степень окисленности азота в азотной кислоте равна 4-5. Выступая в качестве окислителя, НNО может восстанавливаться до различных продуктов: Какое из этих веществ образуется, т. е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрации HNO , тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется . При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется NO. В случае более активных ме таллов — железа, цинка, — образуется . Сильно разбавленная азотная кислота взаимодействует с активными металлами——цинком, магнием, алюминием—с образованием иона аммония, даю щего с кислотой нитрат аммония. Обычно одновременно образуют ся несколько продуктов. Для иллюстрации приведем схемы реакций окисления некото рых металлов азотной кислотой; 8 При действии азотной кислоты на металлы водород, как пра вило, не выделяется. При окислении неметаллов концентрированная азотная кисло та, как и в случае металлов, восстанавливается до , например Более разбавленная кислота обычно восстанавливается до NO, например: Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительно-восстановительные реакции, идущие с участием , протекают сложно. Смесь, состоящая из 1 объема азотной и 3—4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов»—золото. Дей ствие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота(III), или хлорида нитрозила, : Хлорид нитрозила является промежуточным продуктом реакции и разлагается: Хлор в момент выделения состоит из атомов, что и обусловли вает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно сле дующим уравнениям. С избытком соляной кислоты хлорид золота(III) и хлорид пла тины (IV) образуют комплексные соединения На многие органические вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами . Этот про цесс называется нитрованием и имеет большое значение в органической химии.
Азотная кислота: свойства и все характеристики
Характеристики и физические свойства азотной кислоты
На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары её образуют с влагой воздуха мелкие капельки тумана.
Азотная кислота не отличается прочностью. Уже под влияние света она постепенно разлагается:
4HNO3 = 4NO2↑ + O2↑ + 2H2O.
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Рис. 1. Строение молекулы азотной кислоты.
Таблица 1. Физические свойства азотной кислоты.
|
Молекулярная формула
|
HNO3
|
|
Молярная масса, г/моль
|
63
|
|
Плотность, г/см3
|
1,513
|
|
Температура плавления, oС
|
-41,59
|
|
Температура кипения, oС
|
82,6
|
|
Растворимость в воде, г/100мл
|
смешивается
|
Получение азотной кислоты
Азотная кислота образуется в результате действия окислителей на азотистую кислоту:
5HNO2 + 2KMnO4 + 3H2SO4 = 5HNO3 + 2MnSO4 + K2SO4 + 3H2O.
Безводная азотная кислота может быть получена перегонкой при пониженном давлении концентрированного раствора азотной кислоты в присутствии P4O10 или H2SO4 в полностью стеклянном оборудовании без смазки в темноте.
Промышленный процесс производства азотной кислоты основан на каталитическом окислении аммиака над нагретой платиной:
NH3 + 2O2 = HNO3 + H2O.
Химические свойства азотной кислоты
Азотная кислоты принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью диссоциирует на ионы. Её соли носят название нитраты.
HNO3↔H+ + NO3—.
Характерным свойством азотной кислоты является её ярко выраженная окислительная способность. Азотная кислота – один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор – в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO3, ярко разгорается.
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы – в оксиды.
Концентрированная азотная кислота пассивирует некоторые металлы.
При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется диоксид азота. В случае более активных металлов – железа, цинка – образуется оксид диазота. Сильно разбавленная азотная кислота взаимодействует с активными металлами – цинком, магнием, алюминием – с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Cu + HNO3 (conc) = Cu(NO3)2 + NO2↑ + H2O;
Cu + HNO3 (dilute) = Cu(NO3)2 + NO↑ + H2O;
Mg + HNO3 (dilute) = Mg(NO3)2 + N2O↑ + H2O;
Zn + HNO3 (highly dilute) = Zn(NO3)2 + NH4NO3 + H2O.
При действии азотной кислоты на металлы водород, как правило, не выделяется.
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
Смесь, состоящая из 1 объема азотной и 3-4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов» — золото. Действие её объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила, NOCl:
HNO3 + 3HCl = Cl2 + 2H2O + NOCl.
Применение азотной кислоты
Азотная кислота – одно из важнейших соединений азота: в больших количествах она расходуется в производстве азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
Примеры решения задач
Сравните химические свойства серной и азотной кислот
Сходства в свойствах серной и азотной кислот.
Концентрированные серная и азотная кислоты являются сильными окислителями. В азотной кислоте окислителем служит азот в степени окисления +5, в серной кислоте – сера в степени окисления +6:
| Cu + 2H2SO4(конц.) ⟶ CuSO4 + SO2↑ + 2H2O | ||
| S+6 + 2ē ⟶ S+4 | 1 | окислитель (восстановление) |
| Cu0 — 2ē ⟶ Cu+2 | 1 | восстановитель (окисление) |
| Cu + 4HNO3(конц.) ⟶ Cu(NO3)2 + 2NO2↑ + 2H2O | ||
| N+5 + 1ē ⟶ N+4 | 2 | окислитель (восстановление) |
| Cu0 — 2ē ⟶ Cu+2 | 1 | восстановитель (окисление) |
Различие в свойствах серной и азотной кислот.
Разбавленная серная кислота реагирует с металлами с выделением водорода, то есть окислителем служит водород в степени окисления +1:
| Mg + H2SO4 ⟶ MgSO4 + H2↑ | ||
| 2H+ + 2ē ⟶ H20 | 1 | окислитель (восстановление) |
| Mg0 — 2ē ⟶ Cu+2 | 1 | восстановитель (окисление) |
В разбавленной азотной кислоте окислителем является азот в степени окисления +5, состав продуктов реакции зависит от концентрации кислоты.
Если массовая доля кислоты 10%:
| 5Mg + 12HNO3 ⟶ 5Mg(NO3)2 + N2↑ + 6H2O | ||
| N+5 + 10ē ⟶ N20 | 1 | окислитель (восстановление) |
| Mg0 — 2ē ⟶ Mg+2 | 5 | восстановитель (окисление) |
Если массовая доля кислоты 2-3%:
| 4Mg + 10HNO3 ⟶ 4Mg(NO3)2 + NH4NO3 + 3H2O | ||
| N+5 + 8ē ⟶ N-3 | 1 | окислитель (восстановление) |
| Mg0 — 2ē ⟶ Mg+2 | 4 | восстановитель (окисление) |
gomolog.ru1https://gomolog.ru/reshebniki/11-klass/rudzitis-i-feldman-2019/39/zadanie-1.html
Формула азотной кислоты — использование, свойства, структура и формула азотной кислоты
Формула и структура: Химическая формула азотной кислоты — HNO 3 . Его молекулярная формула записывается как NHO 3 , а его молярная масса составляет 63,01 г / моль. Химическая структура азотной кислоты показана ниже с ее резонансными формами:
Молекула HNO 3 плоская, с азотом, присоединенным к трем атомам кислорода, один из которых удерживает протон.Две связи N-O эквивалентны и демонстрируют резонанс с характером двойной связи.
Приготовление: Азотную кислоту получают реакцией диоксида азота (NO 2 ) с водой.
3 NO 2 + H 2 O → 2 HNO 3 + NO
Побочный продукт оксида азота (NO) обычно снова окисляется кислородом воздуха с образованием дополнительного исходного материала диоксида азота.
Промышленное производство азотной кислоты осуществляется путем окисления безводного аммиака до оксида азота в присутствии платинового катализатора при высокой температуре (процесс Оствальда).
Физические свойства: Азотная кислота — жидкость с едким, резким и удушающим запахом. Доступны разные концентрации азотной кислоты, они бесцветные, желтые или красные соответственно. Промышленный сорт составляет около 68% в воде, коммерческий сорт составляет от 52% до 68%, дымящаяся азотная кислота составляет 86% или выше, а концентрации выше 95% называются белой или красной дымящей азотной кислотой.
Химические свойства: Азотная кислота — сильная монопротонная кислота. Он легко образует твердые гидраты, такие как моногидрат (HNO 3 · H 2 O) и тригидрат (HNO 3 · 3H 2 O).Азотная кислота может разлагаться под действием тепла или света, как показано ниже:
4 HNO 3 → 2 H 2 O + 4 NO 2 + O 2 .
Это мощный окислитель, бурно реагирующий со многими неметаллическими соединениями. Он также реагирует с металлами, растворяя их, образуя оксиды металлов и т. Д.
Применение: Азотная кислота широко используется для производства удобрений, таких как нитрат аммония, и полимеров (например, нейлона). Это отличный нитрующий агент (вводит нитрогруппу) в сочетании с серной кислотой.Он также используется в качестве окислителя в жидкостных ракетах.
Опасность для здоровья / воздействие на здоровье: Азотная кислота — это едкая кислота, которая может вызвать серьезные ожоги кожи. Являясь сильной кислотой и окислителем, он может полностью разлагать ткани. Даже разбавленные формы могут вызвать ожоги и окрашивать кожу в желтый цвет, вступая в реакцию с белками кожи. Едкий дым также очень раздражает и повреждает глаза, горло и слизистые оболочки.
Страница не найдена | MIT
Перейти к содержанию ↓
- Образование
- Исследовать
- Инновации
- Прием + помощь
- Студенческая жизнь
- Новости
- Выпускников
- О MIT
- Подробнее ↓
- Прием + помощь
- Студенческая жизнь
- Новости
- Выпускников
- О MIT
Меню ↓
Поиск
Меню
Ой, похоже, мы не смогли найти то, что вы искали!
Попробуйте поискать что-нибудь еще!
Что вы ищете?
Увидеть больше результатов
Предложения или отзывы?
Азотная кислота — обзор
6.1 Введение
История : Азотная кислота была известна алхимикам еще в средние века. Однако только в 12 веке его приготовление было описано в «De Inventioni Veritatis». Азотная кислота была получена перегонкой смеси, состоящей из 1 г купороса кипариса (CuSO 4 · 5H 2 O), 1,5 г нитрата калия KNO 3 и 0,25 г квасцов калия (KAl (SO 4 ) 2 · 12H 2 O). Он был снова описан Альбертом Великим в 13 веке и Рамоном Луллем, который приготовил его путем нагревания селитры и глины и назвал его «eau forte» (аква фортис).Несколько веков спустя, в 1776 году, Лавуазье показал, что он содержит кислород. Кавендиш в 1785 году смог произвести его с помощью электрического разряда во влажном воздухе, доказав, что он содержит азот и кислород. Наконец, полный состав был определен Гей-Люссаком и Бетолле в 1816 году. Фактическое использование расширилось только после того, как серная кислота стала коммерческой.
Производство : Промышленный процесс, разработанный Глаубером в 1698 году, использовался веками. Он состоял из перегонки смеси нитрата калия (KNO 3 ) и серной кислоты (H 2 SO 4 ).Нитрат калия был заменен NaNO 3 (чилийская селитра) во время Великой войны. Хотя он был получен из NO, полученного при сжигании на воздухе, текущий метод, основанный на каталитическом окислении аммиака, был запатентован в 1902 году Вильхемом Оствальдом. Азотную кислоту необходимо беречь от света и тепла, поскольку NO 2 выделяет газы, которые придают ей желтый цвет. Основными мировыми производителями являются Германия, Франция, Великобритания, Бельгия, Канада и Испания (Ortuño, 1999).
Использует : В 2013 году на удобрения было использовано 80% от общего количества произведенной азотной кислоты.Среди них 96% составила нитрат аммония. Использование неудобрений составляет около 20%. Основные продукты — нитробензол (3,6%), динитротолуол (2,8%), адипиновая кислота (2,7%) и нитрохлорбензолы (1,8%). Общая мировая добыча составляет около 55 млн т / год. На рис. 6.1 представлены основные продукты, полученные из азотной кислоты (Clarke and Mazzafro, 1993).
Рисунок 6.1. Основные продукты из азотной кислоты.
Азотная кислота | 7697-37-2
Азотная кислота Химические свойства, использование, производство
Описание
Азотная кислота — это бесцветная коррозионная жидкость, которая является наиболее распространенной азотной кислотой.Его использовали сотни лет. Азотная кислота — это минеральная кислота, которую называли спиртом селитры и аквафортиса, что означает крепкая вода.
Дымящаяся азотная кислота названа из-за паров, выделяемых кислотой, когда она соединяется с влажным воздухом. Дымящаяся азотная кислота имеет высокую концентрацию и обозначается либо красной дымящей азотной кислотой, либо белой дымящей азотной кислотой. Красная дымящая азотная кислота, как следует из названия, при контакте с воздухом выделяет красновато-коричневый дым. Цвет происходит от диоксида азота, который выделяется при контакте с воздухом.Концентрация азотной кислоты в красной дымящей азотной кислоте составляет примерно 85% или больше, при этом присутствует значительное количество растворенного диоксида азота. Белая дымящаяся азотная кислота — это высококонцентрированная безводная азотная кислота с концентрацией 98–99%; оставшиеся 1-2% — это вода и диоксид азота. Основная часть азотной кислоты товарного качества имеет концентрацию от 50% до 70%.
Химические свойства
Азотная кислота, HN03, является сильным пожароопасным окислителем. Это бесцветная или желтоватая жидкость, которая смешивается с водой и кипит при 86 ℃ (187 ℉).Азотная кислота, также известная как aqua fortis, используется для химического синтеза, производства взрывчатых веществ и удобрений, а также в металлургии, травлении, гравировке и флотации руды.
Химические свойства
Азотная кислота представляет собой дымящееся вещество от бесцветного до светло-коричневого.
жидкость с едким удушающим запахом. Дымящийся азотный
кислота — дымящаяся жидкость красноватого цвета. Дым во влажном воздухе. Часто
используется в водном растворе. Дымящаяся азотная кислота концентрируется
азотная кислота, содержащая растворенный диоксид азота.Азотная кислота — это раствор диоксида азота NO2 в воде.
а так называемая дымящая азотная кислота содержит избыток NO2
и имеет цвет от желтого до коричневато-красного.
Физические свойства
Бесцветная жидкость; сильная коррозия; показатель преломления 1,397 при 16,5 ° C; плотность 1,503 г / л; замерзает при –42 ° C; кипит при 83 ° С; полностью смешивается с водой; образует постоянно кипящий азеотроп с водой при 68,8 мас.% азотной кислоты; азеотроп имеет плотность 1,41 г / мл и кипит при 121 ° C.
История
Азотная кислота была известна алхимикам в древности. Кавендиш в 1784 году синтезировал кислоту, приложив электрическую искру к влажному воздуху. Ранее в 1776 году Лавуазье определил, что кислота содержит кислород. В 1798 году Милнер получил азотную кислоту из аммиака вместе с оксидами азота путем окисления паров аммиака над раскаленным диоксидом марганца. В 1816 году Гей-Люссак и Бертолле установили его состав.
Азотная кислота — одно из важнейших промышленных химикатов в мире.В наибольшей степени он используется в производстве удобрений для производства различных нитратных удобрений. Такие удобрения включают нитраты аммония, натрия, калия и кальция. Другие основные области применения азотной кислоты — это производство нитратов и нитрогаников для использования во взрывчатых веществах, порохе и фейерверках. Нитрат аммония, нитроглицерин, нитроцеллюлоза и тринитротолуолы являются примерами таких взрывчатых веществ, а нитраты бария и стронция используются в фейерверках. АЗОТНАЯ КИСЛОТА 635 Другое важное применение — производство циклогексанона, сырья для адипиновой кислоты и капролактама для производства нейлона.
Азотная кислота — обычный лабораторный реактив. Он также является одним из наиболее часто используемых окислителей, применяемых в нескольких органических и неорганических синтезах. Некоторые виды синтетического применения азотной кислоты включают производство диазокрасителей, лаков, лаков, пластмасс, полиуретанов и моющих средств. Другие области применения — травление металлов, экстракция руды, травление нержавеющей стали, ракетное топливо, обработка ядерного топлива, в качестве растворителя в царской водке, для разложения проб при анализе металлов методами AA или ICP, а также при подготовке аналитических стандартов.
Концентрированная азотная кислота, используемая в торговле, не является 100% чистой азотной кислотой. Это смесь с постоянным кипением, содержащая 68% кислоты.
использует
Азотная кислота — важный исходный материал для производства удобрений и химикатов. Разбавленная азотная кислота используется для растворения и травления металлов.
использует
Азотная кислота — важный материал для производства взрывчатых веществ. Концентрированная азотная кислота, обычно смешанная с серной кислотой (смешанная кислота), используется для нитрования органических соединений.Лист технических данных
использует
Эта тяжелая, прозрачная или слегка желтоватая жидкость очень ядовита.
и вызывает сильные ожоги при контакте с кожей. Это было сделано
путем перегонки нитрата щелочного металла в сочетании с
серная кислота. Комбинация азотной и серной кислот была
используется для преобразования простого хлопка в нитрат целлюлозы. Азотная кислота
был использован в процессе мокрой пластины в качестве добавки к проявителям сульфата железа, чтобы обеспечить более белый цвет изображения для амбротипов.
и ферротипы.Он также был добавлен для снижения pH
серебряная ванна для коллодиевых пластин. Добавление кислоты в серебряную ванну
сделали коллодиевые пластины менее чувствительными к свету,
положительный эффект уменьшения возникновения тумана не-изображения.
использует
В основном азотная кислота используется для производства удобрений, причем для этой цели используется примерно три четверти азотной кислоты. Аммиачная селитра является предпочтительным азотным удобрением из-за простоты производства, экономики и высокого содержания азота, составляющего 35%.Азотная кислота также может использоваться для подкисления фосфоритов с целью производства азотно-фосфорных удобрений. Азотная кислота является сильным окислителем, что делает ее полезной во взрывчатых веществах и в качестве ракетного топлива.
Азотная кислота используется для нитрования множества других соединений с целью получения нитратов. Азотная кислота используется для производства адипиновой кислоты (C6h5O10), которая используется в производстве нейлона (см. Нейлон).
Азотная кислота также используется для окисления, нитрования и в качестве катализатора в многочисленных реакциях.Соли азотной кислоты все вместе называются нитратами, которые растворимы в воде. Азотная кислота используется в производстве многих товаров, таких как красители, фармацевтические препараты и синтетические ткани, а также в различных процессах, включая печать.
Азотная кислота широко используется в металлургической промышленности. Азотная кислота используется для травления стальных и латунных поверхностей при обработке металлов.
использует
Азотная кислота (HNO3) — важная промышленная кислота, используемая для изменения или производства многих продуктов.
такие как удобрения и взрывчатые вещества.Он реагирует с аммиаком с образованием нитрата аммония,
важный коммерческий химикат.
использует
Азотная кислота — одно из наиболее широко используемых в промышленности химических веществ. Он используется в производстве удобрений, взрывчатых веществ, красителей, синтетических волокон и многих неорганических и органических нитратов; и как обычный лабораторный реактив ..
Определение
азотная кислота: бесцветная коррозионно-ядовитая жидкость, HNO3; р. д. 1,50; т. Пл. –42 ° С; б.п. 83 ° С. Азотная кислота может быть получена в лаборатории путем дистилляции смеси щелочно-нитрата и концентрированной серной кислоты.Промышленное производство осуществляется путем окисления монооксида азота аммония, его окисления до диоксида азота и реакции диоксида азота с водой с образованием азотной кислоты и монооксида азота (который рециркулируется). Первая реакция (NH 3 в NO) катализируется платина или платина / родий в виде тонкой проволочной сетки. Окисление NO и абсорбция NO 2 с образованием продукта некаталитичны и протекают с высокими выходами, но обе реакции являются медленными и протекают второго порядка.Повышение давления снижает селективность реакции, и поэтому требуются довольно большие газопоглощающие колонны. На практике абсорбирующая кислота охлаждается до температуры около 2 ° C и производится коммерческая « концентрированная азотная кислота » с концентрацией около 67%. водный раствор) и разбавленные растворы ведут себя так же, как и другие минеральные кислоты. Концентрированная триновая кислота ниобия является сильным окислителем.
Большинство металлов растворяются с образованием нитратов, но с выделением оксидов азота.Концентрированная азотная кислота также реагирует с несколькими неметаллами с образованием оксокислоты или оксида. Азотная кислота обычно хранится в темно-коричневых бутылях из-за фотолитического разложения до четырехокиси азота. См. Также нитрование.
Методы производства
Азотную кислоту можно получить несколькими способами. В лаборатории его готовят путем перегонки раствора нитрата калия в концентрированной серной кислоте, содержащего равные количества (по весу) каждого из них.
KNO3 + h3SO4 → KHSO4 + HNO3
Азотная кислота разлагается до диоксида азота.Поэтому температуру нужно поддерживать как можно ниже. Во время приготовления азотная кислота конденсируется в виде дымящейся жидкости. Чистую кислоту можно получить, когда ее собирают при –42 ° C, точке замерзания. Когда азотная кислота собирается путем конденсации при комнатной температуре, она может частично разлагаться до пентаоксида азота, N2O5, который испаряется во влажном воздухе. Ранние коммерческие процессы основывались на реакции чилийской селитры (NaNO3) с серной кислотой. Концентрированная азотная кислота была получена перегонкой реакционной смеси.
Азотная кислота также может быть получена путем быстрого прохождения воздуха через электрическую дугу 636 NITRIC ACIDarc. Метод основан на первом препарате Кавендиша азотной кислоты. В этом методе азот и кислород сначала объединяются с образованием оксида азота. Смесь газообразных продуктов, обычно содержащая около 2% оксида азота, объединяется с избытком кислорода с образованием диоксида азота и пятиокиси азота. При растворении этих газов в воде образуется азотная кислота. Однако этот процесс дорог и непригоден для коммерческого применения.
В настоящее время азотная кислота производится исключительно каталитическим окислением аммиака. Платина или платино-родий является эффективным катализатором этого окисления (процесс Оствальда). Три основных этапа в таком процессе окисления аммиака: (1) окисление аммиака с образованием оксида азота:
4Nh4 + 5O2 → 4NO + 6h3O
Вышеупомянутая реакция протекает быстро и почти полностью переходит в сторону продукта. (2) окисление оксида азота с образованием диоксида азота:
2НО + O2 → 2НО 2
Вышеупомянутая реакция также является быстрой и почти полностью завершается при температуре ниже 150 ° C.(3) растворение диоксида азота в воде:
3NO2 + h3O → 2HNO3 + NO
Эта реакция является умеренно экзотермической, выделяя 32,4 ккал / моль.
Было предложено несколько механизмов абсорбции диоксида азота в воде. Двуокись азота легко димеризуется до четырехокиси N2O4 при низких температурах и повышении давления.
2NO2 ↔ N2O4? Hrxn = –13,7 ккал / моль
Поглощение четырехокиси в воде также может образовывать азотную кислоту и оксид азота:
3N2O4 + 2h3O → 4HNO3 + 2NO
В последние годы произошло несколько изменений в конструкции установки и условиях процесса окисления аммиака.Эти изменения более или менее основаны на рабочих давлениях и температурах, снижении выбросов NOx и других экологических нормах, а также на желаемой производственной мощности завода.
Азотная кислота, получаемая при стандартном окислении аммиака, обычно представляет собой водный раствор от 50 до 70 мас.%. Чистая азотная кислота 98-99% может быть получена либо экстрактивной дистилляцией, либо прямыми процессами сильной азотной кислоты (DSN). В методе перегонки концентрированная азотная кислота 50-70% перегоняется с 93% -ной серной кислотой в паровой колонне.Серная кислота действует как дегидратирующий агент. Пары дистиллированной азотной кислоты конденсируются в чистую азотную кислоту, в то время как серная кислота, поглощающая воду из 50-70% -ной азотной кислоты, теряет свою прочность примерно до 70% и собирается на дне. 70% серная кислота снова концентрируется до 93% АЗОТНОЙ КИСЛОТЫ 637 для повторного использования путем удаления воды в концентраторе серной кислоты.
В процессе DSN четырехокись азота N2O4, полученная при окислении аммиака, абсорбируется концентрированной азотной кислотой в присутствии воздуха или кислорода с образованием чистой азотной кислоты.В качестве альтернативы, N2O4 может быть отделен от газообразных продуктов процесса окисления аммиака охлаждением, а затем обработан разбавленной азотной кислотой в воздухе или кислороде.
Общее описание
Азотная кислота представляет собой жидкость от бесцветной до желтого или красного цвета, иногда выделяющую красновато-коричневые пары с удушающим запахом. Азотная кислота растворяется в воде с выделением тепла. Азотная кислота вызывает коррозию металлов и тканей. Азотная кислота ускоряет горение горючих материалов, а азотная кислота может даже вызвать возгорание при контакте с горючим материалом.Азотная кислота полностью растворима в воде и может бурно реагировать при контакте с водой с выделением тепла, дыма и разбрызгивания. Продолжительное воздействие низких концентраций или кратковременное воздействие высоких концентраций может привести к неблагоприятным последствиям для здоровья. Плотность 10,4 фунта / галлон.
Реакции воздуха и воды
Пары в воздухе. Полностью растворим в воде с выделением тепла. Реагирует бурно с водой с выделением тепла, дыма и разбрызгивания.
Профиль реактивности
Азотная кислота; воспламеняется при контакте со спиртами, аминами, аммиаком, алкилами бериллия, боранами, дицианогеном, гидразинами, углеводородами, водородом, нитроалканами, порошкообразными металлами, силанами или тиолами [Bretherick 1979.с.174]. Реакция мелкодисперсной сурьмы и азотной кислоты может быть бурной [Pascal 10: 504. 1931-34]. Пентафторид брома бурно реагирует с сильной азотной кислотой и сильной серной кислотой [Mellor 2, Supp. 1: 172. 1956]. Эксперименты показывают, что смеси, содержащие более 50% азотной кислоты по весу в уксусном ангидриде, могут действовать как детонирующие взрывчатые вещества [BCISC 42: 2. 1971]. Травильный агент, состоящий из равных частей ацетона, азотной кислоты и 75% уксусной кислоты, взорвался через 4 часа после приготовления и помещения азотной кислоты в закрытую бутыль.Это похоже на рецептуру для получения тетранитрометана, чувствительного взрывчатого вещества [Chem. Англ. News 38: 56. 1960]. Фосфин сильно разлагается концентрированной азотной кислотой, и возникает пламя. При попадании теплой дымящейся азотной кислоты в емкость с газообразным фосфином возникает взрыв [Един. Рой. Soc. 13:88. 1835]. При контакте азотной кислоты с треххлористым фосфором происходит взрыв [Comp. Ренд. 28:86]. Реакция азида натрия и сильной азотной кислоты является энергичной [Mellor 8, Supp 2: 315.1967]. Реагирует бурно с водой с выделением тепла, дыма и разбрызгивания.
Опасность
Поскольку азотная кислота является сильным окислителем, она может вступать в бурную реакцию с мощными восстановителями. Многие реакции нитрования органических веществ приводят к образованию взрывоопасных продуктов. Чистая азотная кислота оказывает сильное разъедающее действие на кожу, вызывая серьезные травмы. Концентрированная кислота (68,8 мас.%) Умеренно разъедает кожу. Кислота может разлагаться при нагревании или фотохимически с выделением токсичного газообразного диоксида азота.
Опасность для здоровья
Азотная кислота — это едкое вещество, вызывающее желтые ожоги кожи. Он разъедает ткани тела, превращая сложные белки в желтое вещество, называемое ксантопротеиновой кислотой (Meyer 1989). Проглатывание кислоты может вызвать жжение и разъедание рта и желудка. Доза 5–10 мл может быть смертельной для человека.
Хроническое воздействие паров и тумана азотной кислоты может вызвать бронхит и химический пневмонит (Fairhall 1957). Он выделяет NO2, высокотоксичный газ, образующийся при его разложении в присутствии света.Азотная кислота менее агрессивна, чем серная кислота. Его испарения и туман могут разъедать зубы.
Пожарная опасность
Негорючее вещество, само по себе не горит, но может разлагаться при нагревании с образованием едких и / или токсичных паров. Пары могут накапливаться в замкнутых пространствах (подвал, цистерны, хопперы / цистерны и т. Д.). Вещество вступает в реакцию с водой (в некоторых случаях бурно), выделяя коррозионные и / или токсичные газы и сточные воды. При контакте с металлами может выделяться легковоспламеняющийся водород. Контейнеры могут взорваться при нагревании или при загрязнении водой.
Воспламеняемость и взрывоопасность
Взрывоопасность Не горючее вещество, а сильный окислитель. Связаться с легко
окисляемые материалы, в том числе многие органические вещества, могут привести к пожару или
взрывы.
Использование в сельском хозяйстве
Азотная кислота (HNO) — это минеральная кислота, которая сочетается с
металлы или щелочи с образованием нитратов. Это можно сделать
синтетически, пропуская аммиак и воздух через металлический
катализатор.
Азотная кислота используется при производстве аммония.
нитрат для взрывчатых веществ и удобрений.Два других типа
азотная кислота — красная дымящая азотная кислота и белая дымящая
азотная кислота. Белая дымящаяся азотная кислота содержит более 97,5% азотной кислоты, менее 2% воды и менее
более 0,5% оксидов азота. Красная дымящая азотная кислота
содержит более 86% азотной кислоты, от 6 до 15% оксидов
азот и менее 5% воды. Используется как ракетное топливо.
и нитрующий агент. Важный производственный процесс для
производство азотной кислоты подробно описаны в разделе
Процессы производства азотной кислоты.
Процессы производства азотной кислоты 2
Используется около 75% производимой в мире азотной кислоты.
для производства удобрений (и около 15% для взрывчатых веществ).
Оставшаяся кислота используется в производстве синтетических волокон,
красители и пластик.
Азотная кислота может быть получена путем (а) подкисления
натуральный нитрат натрия с серной кислотой, (б) прямой
синтез из азота и кислорода, и (c) окисление
аммиак.
Азотная кислота — сильная кислота и мощный окислитель.
агент.Кислота азотная концентрированная при перегонке при
атмосферное давление начинает закипать при 78,2 ℃, но
со временем разлагается с образованием 68% азотной кислоты с
точка кипения 120,5 ℃. Стандартный предел хлора составляет
менее 5 ppmw и азотистой кислоты (HNO 2 ) менее
чем 5 ppmw. Безводная азотная кислота не существует в
жидкая форма.
Безводный аммиак и платиновый катализатор являются
требуется для производства азотной кислоты. Оксиды
азот, который используется в производстве азотной кислоты,
закись азота (N 2 O), оксид азота (NO), диоксид азота
(NO 2 ) и тетроксид диазота (N 2 O 4 ).Смесь
оксиды азота, обычно NO и NO 2 , обычно
именуется NO x .
Производство слабой азотной кислоты состоит из
следующие три стадии: (а) каталитическое окисление аммиака до оксида азота, (б) окисление оксида азота до азота I
диоксида азота, и (c) кислотное поглощение диоксида азота в
вода.
Характеристики абсорбера улучшены за счет высокой
давление и низкая температура, а также высокое содержание кислорода
в газовой фазе. Однако в конвертере аммиака
окислению аммиака способствует низкое давление.
Способы производства: многие процессы для
производство азотной кислоты. Они не отличаются
в фундаментальных принципах, но прежде всего в деталях дизайна
завода, условия эксплуатации для размера завода, стоимость
соображения, касающиеся сырья, энергии и
монтаж.
Производство азотной кислоты окислением
аммиак проходит следующие стадии или единицы: (а)
подготовка-испарение аммиака, перегрев и
фильтрация безводного аммиака, (б) технологический воздух
подготовка, включающая предварительный нагрев, фильтрацию и
сжатие, (в) каталитическое окисление аммиака, (г)
охлаждение продуктов реакции различными средами, такими как
как технологический воздух, котловая вода, остаточный газ и т. д., (д) окисление
от оксида азота до высших оксидов, (е) оксидов азота
абсорбция водой с образованием азотной кислоты, (ж) кислотное отбеливание
с помощью дополнительного воздуха или других средств, (h) очистка хвостовых газов до
уменьшить загрязнение воздуха и повысить общую эффективность
установки, (i) рекуперация энергии от нагретого и
сжатые технологические газы и (i) восстановление катализатора
платина.
Безводный аммиак и используемый технологический воздух
не должно содержать ни масла, ни катализатора
яды, чтобы избежать загрязнения испарителя и катализатора
экраны.Отношение аммиака к воздуху и расход
каждый компонент должен тщательно контролироваться, чтобы гарантировать
максимальная эффективность преобразования, предотвращение взрыва
и максимизация выпуска завода.
Обычным катализатором, используемым в процессе, является платинородий.
марля или сетка. Это не только способствует реакции, но и
также соответствует другим рабочим критериям, таким как
противодействовать жесткой коррозионной и окислительной атмосфере,
и т. д. Обычное процентное содержание родия в катализаторе находится в
диапазон от 4 до 10%. Для достижения более высокой эффективности и
меньшие потери платины, используются трикотажные сетки.Решетки из хромоникелевого сплава используются для поддержки мелких
экраны.
Платиновые катализаторы могут быть отравлены такими элементами
как As, Bi, P, Pb, S, Si и Sn. Эти элементы приводят к
образование неактивных соединений в проводах и, следовательно,
снизить каталитическую активность. В некоторых случаях
временное загрязнение следами Cr, Ni или Fe
снижает эффективность преобразования, которая часто может быть
восстанавливается обработкой соляной кислотой.
Промышленное использование
Азотная кислота, также называемая аквафортисом и азотовой кислотой, представляет собой дымящуюся жидкость от бесцветной до красноватого цвета с составом HNO 3 , имеющую широкий спектр применения для травления металлов, травления и производства нитроцеллюлозы, пластмасс, красителей и взрывчатых веществ.Он имеет удельный вес 1,502 (95% кислоты) и температуру кипения 86 ° C, и он растворим в воде. Его пары вызывают удушье, и он очень едкий и едкий. Дымящаяся азотная кислота — это любой водный раствор, содержащий более 86% кислоты и имеющий удельный вес выше 1,480. Азотная кислота образуется под действием серной кислоты на нитрат натрия и конденсацией паров. Он также производится из аммиака путем каталитического окисления или из оксида азота, получаемого из воздуха.
Профиль безопасности
Яд при вдыхании.А
разъедающий раздражитель кожи, глаз и слизистых оболочек
мембраны. Очень опасная пожарная опасность
и очень мощный окислитель. Может реагировать
взрывоопасно со многими восстановителями. Wdl
реагировать с водой или паром с выделением тепла
а также токсичные, едкие и легковоспламеняющиеся пары. При нагревании до разложения выделяет
высокотоксичные пары NOx. Смотрите также
АЗОТНАЯ КИСЛОТА.
Возможное воздействие
Азотная кислота — вторая по важности
промышленная кислота и ее производство представляет собой шестой
крупнейшая химическая промышленность США.Азотная кислота — это
используется в химикатах, взрывчатых веществах, удобрениях, травлении стали;
очистка металла. Наибольшее использование азотной кислоты в производстве
удобрений. Почти 15% продукции идет
в производство взрывчатых веществ, а оставшиеся
10% распределяется между различными применениями, такими как травление,
яркое погружение; гальваника, фотогравировка, изготовление
ракетного топлива; и производство пестицидов.
Канцерогенность
Азотная кислота не была мутагенной в ограниченном количестве.
исследования.4 Нет информации о
канцерогенные свойства азотной кислоты, но
связь между заболеваемостью гортани
рак и воздействие кислотных туманов было
указано 4
склад
При обращении следует надевать защитные очки и резиновые перчатки.
эту кислоту и емкости с азотной кислотой следует хранить в хорошо вентилируемом месте, отдельно
из органических веществ и других горючих материалов.
Доставка
UN2031 Кислота азотная, кроме красной дымящей, с
.70% азотная кислота или азотная кислота, кроме красной дымящей,
с содержанием азотной кислоты не менее 65%, но не 70%, класс опасности:
8; Этикетки: 8-Коррозийный материал, 5.1-Окислитель. UN2032
Азотная кислота, красный дымящийся, класс опасности: 8; Ярлыки:
8-Коррозийный материал, 5.1-Окислитель, 6.1-Ядовитый материал.
Вдыхание, опасная зона B. UN2031 Азотная кислота, кроме
красный дымящийся, с 20% и < 65% азотной кислоты или Nitric
кислота, кроме красной дымящей, с содержанием азотной кислоты не более 20%,
Класс опасности: 8; Этикетки: 8-Коррозийный материал.
Методы очистки
Кислота получается бесцветной (ок.92%) прямой перегонкой дымящейся HNO3 при пониженном давлении и температуре 40-50 ° С с утечкой воздуха в верхней части ректификационной колонны. Храните в эксикаторе в холодильнике. Не содержащую нитритов HNO3 можно получить вакуумной перегонкой из мочевины. [Ward et al. Inorg Synth III 13 1950, Kaplan & Schechter Inorg Synth IV 53 1953.]
Несовместимость
Сильный окислитель и сильная кислота. Реагирует
бурно с горючими веществами и восстановителями; карбиды,
сероводород, скипидар, древесный уголь, спирт, порошок
металлы; сильные основания.Тепло вызывает разложение с образованием
оксиды азота. Агрессивно в отношении некоторых пластиков. Разъедает металлы.
Вывоз мусора
Добавляется кальцинированная сода-гашеная известь.
образовывать нейтральный раствор нитратов натрия и кальция.
Этот раствор может быть удален после разбавления
вода. Кроме того, азотная кислота может быть восстановлена и повторно использована в
в некоторых случаях как с растворами для формования акрилового волокна. Проконсультируйтесь
с природоохранными агентствами для получения рекомендаций по
приемлемые методы утилизации. Генераторы отходов, содержащие
этот загрязнитель (≥100 кг / мес) должен соответствовать правилам EPA, регулирующим хранение, транспортировку, обработку,
и удаление отходов.
Продукты и сырье для получения азотной кислоты
Сырье
Препараты
МОНОГИДРАТ БОРАТА СВИНЦА (II)
ПИРИДИН-2-СУЛЬФОНОВАЯ КИСЛОТА
3,5-ДИНИТРО-4-ГИДРОКСИБЕНЗАЛЬДЕГИД
2-НИТРОТИОФЕН-4-КАРБОКСАЛЬДЕГИД
1,3-Диметил-8-нитро-1H-пурин-2,6 (3H, 9H) -дион, 97%
Гексагидрат нитрата лантана (III)
5-амино-2,4,6-трийод-N-метилизофталаминовая кислота
КАДМИЯ НИТРАТА ТЕТРАГИДРАТ
5-Метилизоксазол-3-карбоновая кислота
2-НИТРОМЕЗИТИЛЕН
ФЛАВИАНОВАЯ КИСЛОТА
2-МЕТИЛ-5-НИТРО-ПИРИМИДИН-4,6-ДИОЛ
5-хлор-2-гидрокси-3-нитропиридин
РЕАГЕНТ НЕССЛЕРА
3-нитробензонитрил
2-нитротиофен
4-ацетамидо-3-нитробензойная кислота
6-НИТРОПИПЕРОНАЛ
РТУТНЫЙ ХЛОРИД
ФЕНИЛМЕРКУРИЙ НИТРАТ
10-нитроантрон
Нитрогумат натрия
2,6-диметил-3-нитропиридин
РТУТНЫЙ НИТРАТ
2-гидрокси-5-нитроникотиновая кислота
5-НИТРОБАРБИТУРОВАЯ КИСЛОТА
3-МЕТИЛПИРАЗИН-2-КАРБОКСИЛОВАЯ КИСЛОТА
2-ГИДРОКСИ-3,5-ДИНИТРОПИРИДИН
Йодид ртути
4,5-DIPHENYLIMIDAZOLE
2-этил-5-нитробензоламин
3,3′-ДИНИТРОБЕНЗОФЕНОН
Мезаконовая кислота
бромид ртути
Диэтилнитромалонат
Нитрат кадмия
2,4-дихлор-5-нитробензалегид
катализаторы гидроочистки (серия РН)
ТЕТРАНИТРОМЕТАН
Метил 3-нитробензоат
Состав паров кипящих растворов азотной кислоты (Технический отчет)
Крукс, Р.К., Уилсон, Р. К., Берсе, А. Э. и Филберт, мл., Р. Б. Состав паров кипящих растворов азотной кислоты . США: Н. П., 1955.
Интернет. DOI: 10,2172 / 4368595.
Крукс, Р. К., Уилсон, Р. К., Берс, А. Э. и Филберт, мл., Р. Б. Состав паров кипящих растворов азотной кислоты . Соединенные Штаты. https://doi.org/10.2172/4368595
Крукс, Р. К., Уилсон, Р. К., Берс, А. Э. и Филберт, мл., Р. Б. Вт.
«Состав паров кипящих растворов азотной кислоты». Соединенные Штаты. https://doi.org/10.2172/4368595. https://www.osti.gov/servlets/purl/4368595.
@article {osti_4368595,
title = {Состав паров кипящих растворов азотной кислоты},
author = {Крукс, Р.К. и Уилсон, Р. К., Берсе, А. Э. и Филберт, мл., Р. Б.},
abstractNote = {Состав паров водных растворов азотной кислоты, кипящих при общем давлении 200 мм рт. ст., установлен для растворов, содержащих от 0 до 67,5 тв / л азотной кислоты. Характеристики летучести низких концентраций хлорида в том же диапазоне концентраций азотной кислоты были измерены в растворах, кипящих при 200 мм рт. Оцениваются эффекты концентрации хлоридов и давления кипения.Описан спектрофотометрический метод определения хлоридов в растворах азотной кислоты.},
doi = {10.2172 / 4368595},
url = {https://www.osti.gov/biblio/4368595},
журнал = {},
номер =,
объем =,
place = {United States},
год = {1955},
месяц = {2}
}
неорганическая химия — Какой окислитель лучше: концентрированная азотная кислота или разбавленная азотная кислота?
Я думаю, что ваши задания для уравнений необходимо внимательно изучить.\ circ _ {\ text {rxn}} $ значения в обоих условиях).
Поздний выпуск:
Я старался избегать критики литературных ценностей по этой теме, но мой ответ пока вызвал вопросы у заинтересованных людей. Таким образом, я постараюсь сделать все возможное, чтобы справиться с этим как можно более деликатно.
Насколько мне известно, не должно быть вопроса о том, конц. $ \ ce {HNO3} $ — лучший окислитель, чем разбавленный $ \ ce {HNO3} $. Окислительным реагентом здесь является ион $ \ ce {NO3 -} $, как мои уравнения описаны выше.Например, любой ион $ \ ce {NO3 -} $ (скажем, $ \ ce {KNO3} $) будет окислять $ \ ce {Cu} $ в кислой среде (скажем, $ \ ce {HCl} $). Используя разбавленный или концентрированный $ \ ce {HNO3} $, мы удобно обеспечиваем как ионы $ \ ce {NO3 -} $, так и $ \ ce {h4O +} $ для нашей окислительно-восстановительной реакции. Эта реакция во многом зависит от условий реакции. Я думаю, что никто не знает точного процесса, но все строят предположения по результатам. \ circ_f = \ pu {+9.\ circ_f = \ pu {+90,25 кДж / моль} $).
Вопрос 2: Почему изменяется степень окисления $ \ ce {N} $ на -1 в концентрированном растворе по сравнению с -3 в разбавленном растворе?
Ответ: Посмотрите на последнюю серию реакций с участием $ \ ce {N2O4} $, приведенную в моем первоначальном ответе. Возможное изменение степени окисления $ \ ce {N} $ одинаково в обоих случаях. Эта реакция не просто вопрос силы. Я не думаю, что кто-то еще детально изучал этот процесс. Я хотел бы подчеркнуть свою точку зрения, указав некоторые известные окислительно-восстановительные процессы $ \ ce {NO3 -} $.\ circ = \ pu {0,957 В}
\ end {align} $$
Оба процесса находятся в относительно схожих условиях (скажем, $ \ pu {2M} $ vs $ \ pu {3M} ~ \ ce {HNO3} $). В процессе (1) степень окисления $ \ ce {N} $ изменяется с +5 до +3, в то время как в (2) она была от +5 до +2. Какой процесс преобладает, когда они подвергаются окислению в соответствующем количестве $ \ ce {Cu} $?
Медный пенни с концентрированной азотной кислотой
В результате реакции образуется красно-коричневый газообразный диоксид азота и горячий концентрированный раствор нитрата меди (II), который имеет синий цвет.По мере испарения воды и охлаждения раствора начинают формироваться кристаллы Cu (NO 3 ) 2 ( s ).
Cu ( с ) + 4HNO 3 ( водн. ) → Cu (NO 3 ) 2 ( водн. ) + 2NO 2 ( г ) + 2H 2 O ( л )
Следующее — из статьи Ричарда Раметта (1), в которой содержится цитата Иры Ремсена о действии азотной кислоты на медь.
Читая учебник химии, я наткнулся на утверждение: «азотная кислота действует на медь.«Я устал читать такие абсурдные вещи, и я решил посмотреть, что это означает. Медь была мне более или менее знакома, потому что в то время использовались медные центы. Я видел бутылку с надписью« азотная кислота »на столе в кабинете врача. где я тогда «делал время». Я не знал его особенностей, но дух приключений был на мне. Имея азотную кислоту и медь, мне нужно было только узнать, что означают слова «действует на». Затем утверждение «азотная кислота» действие кислоты на медь «было бы чем-то большим, чем просто словами.Все было по-прежнему. Ради познания я даже был готов пожертвовать одним из немногих медных центов, которыми тогда владел. Я положил одну из них на стол, открыл бутылку с надписью «азотная кислота», вылил немного жидкости на медь и приготовился к наблюдению. Но что это было за чудесное, что я увидел? Цент уже был изменен, и это тоже была не маленькая сдача. Зеленовато-синяя жидкость вспенилась и кипела над центом и над столом. Воздух в окрестностях спектакля стал темно-красным.Поднялось большое цветное облако. Это облако было неприятным и удушающим. Как мне это остановить? Я попытался избавиться от неприятного беспорядка, подняв его и выбросив в окно. Я узнал еще один факт. Азотная кислота действует не только на медь, но и на пальцы. Боль привела к еще одному непреднамеренному эксперименту. Я провел пальцами по брюкам, и был обнаружен еще один факт. Азотная кислота действует на брюки. Принимая все во внимание, это был самый впечатляющий эксперимент и, возможно, самый дорогостоящий эксперимент, который я когда-либо проводил.

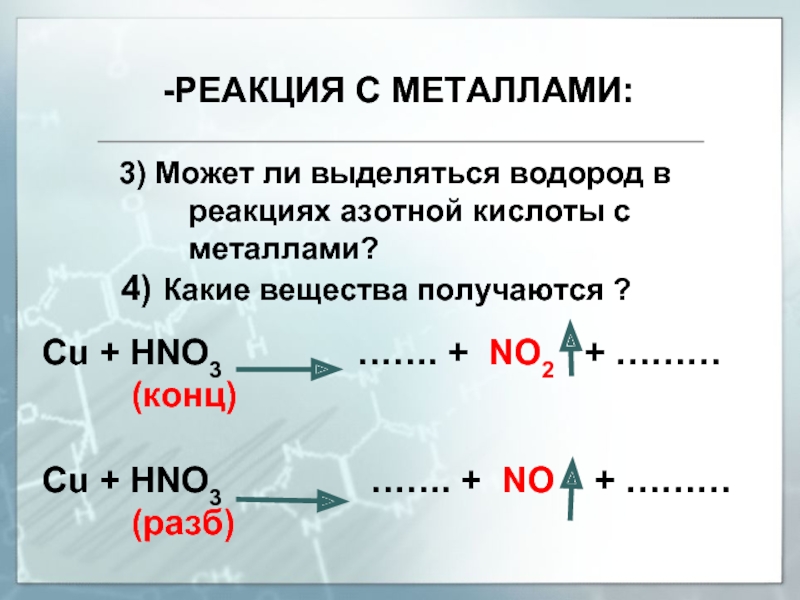 ), HNO3(конц.), O2
), HNO3(конц.), O2