Содержание
Урок 16. Кислоты и основания – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 16 «Кислоты и основания» из курса «Химия для чайников» дадим определение кислотам и основаниям, рассмотрим процесс их диссоциации в водном растворе и различия слабых кислот и оснований от сильных. Кроме того, вы узнаете самые распространенные кислоты и основания. Основы химии, которые вы должны знать перед прочтением данного урока, содержатся в уроке 9 «Ионы в водном растворе».
Что такое кислота и основание?
Для тех, кто только к нам присоединился напоминаю, что ионы — это все те же атомы веществ, просто с бОльшим или меньшим количеством электронов относительно числа протонов. Для кислот и оснований наиболее популярны следующие определения:
Кислота — это вещество, которое при добавлении к воде повышает концентрацию ионов водорода [H+].
Основание — это вещество, которое при добавлении к воде повышает концентрацию гидроксидных ионов [OH—].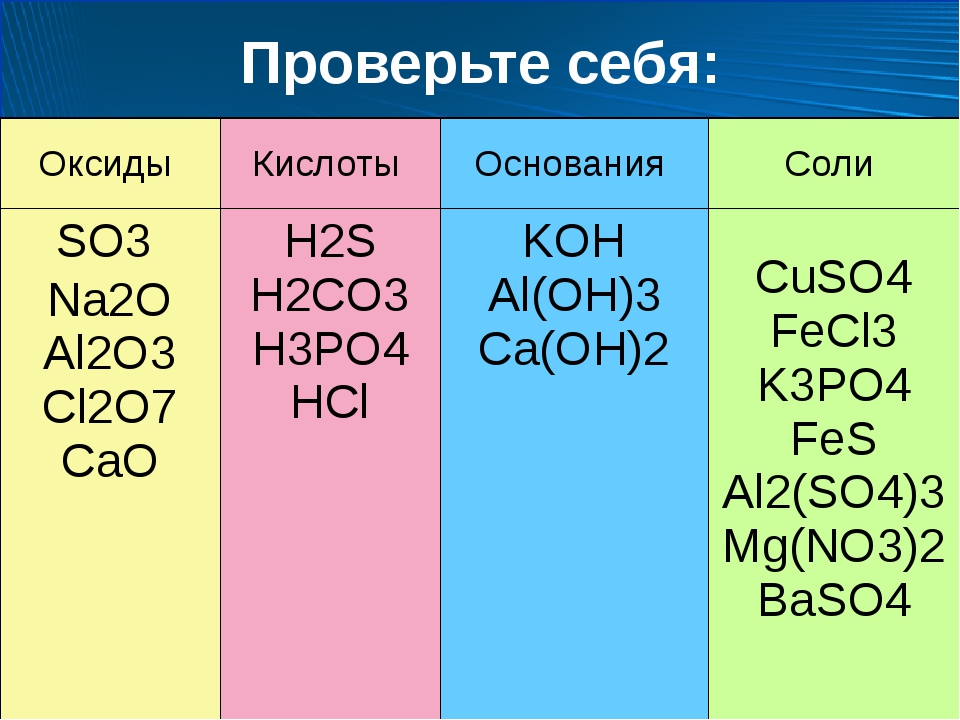 Забегая вперед, скажу, что основанием также называют вещество, которое забирает ионы водорода [H+].
Забегая вперед, скажу, что основанием также называют вещество, которое забирает ионы водорода [H+].
Если данные определения вам не понятны, то скорее всего вам нужно вспомнить, что такое простые и сложные ионы. Дальше все будет проще, ведь сложные лишь определения!
Диссоциация кислот
Диссоциация кислот, от HF до HNO3, в водном растворе сопровождается высвобождением одного протона, т.е иона водорода H+.
- HNO3 → H+(водн.) + NO3—(водн.)
В дальнейшем не будем указывать сокращение (водн.), означающее что ион гидратирован, поскольку в водном растворе любой ион гидратирован. Кислоты H2CO3, H2SO3 и H2SO4 диссоциируют в водном растворе с высвобождением двух протонов. Это происходит не в одну, а в две стадии:
- H2CO3 → H+ + HCO3— → 2H+ + CO—
- H2SO3 → H+ + HSO3— → 2H+ + SO—
- H2SO4 → H+ + HSO4— → 2H+ + SO42-
Угольная кислота дает протоны в раствор только частично, так помимо смеси HCO3— и CO— ионов в водном растворе присутствует немного недиссоциированной угольной к-ты. Зато серная кислота полностью высвобождает первый из двух ионов H+, поэтому она считается сильной кислотой. Самые распространенные сильные кислоты — это хлористоводородная и азотная, а распространенная слабая кислота — фосфорная кислота.
Зато серная кислота полностью высвобождает первый из двух ионов H+, поэтому она считается сильной кислотой. Самые распространенные сильные кислоты — это хлористоводородная и азотная, а распространенная слабая кислота — фосфорная кислота.
Каждая фосфорсодержащая кислота высвобождает в водном растворе три протона, и соответственно осуществляется это в 3 стадии:
- H3PO4 → H+ + H2PO4— → 2H+ + HPO42- → 3H+ + PO43-
Органические кислоты, такие как уксусная и муравьиная кислота, дают H+ из своих карбоксигрупп –COOH.
- CH3 –COOH → CH3 –COO— + H+
Диссоциация оснований
Диссоциация оснований, содержащие OH-группы (гидроксигруппы), например LiOH или Ca(OH)2, дает в водный раствор гидроксидные ионы OH—:
- LiOH → Li+ + OH—
- Ca(OH)2 → Ca2+ + 2OH—
Хотя у аммиака отсутствуют OH— ионы, тем не менее NH3 является основанием, поскольку он образует гидроксидные ионы при реакции с молекулами воды:
- NH3 + H2O → NH4+ + OH—
Надеюсь урок 16 «Кислоты и основания» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Что такое органические кислоты? — ivtherapy
Органические кислоты — это химические соединения, которые выделяются с мочой млекопитающих и являются продуктами метаболизма. Метаболизм — это сумма химических реакций в живых существах, с помощью которых организм строит новые молекулы и расщепляет молекулы, чтобы удалить продукты жизнедеятельности и выработать энергию. Органические кислоты — это вещества, в которых всегда присутствуют углерод и водород, но которые также могут содержать элементы кислорода, азота, серы и фосфора.
Каждая органическая кислота имеет одно или несколько сопряженных оснований, названных суффиксом –ат. Таким образом, конъюгированным основанием молочной кислоты является лактат. Часто при обсуждении физиологии и биохимии название органической кислоты и ее конъюгированного (ых) основания (й) используются взаимозаменяемо, например, лактат или молочная кислота. Наиболее распространенными химическими группами, связанными с органическими кислотами, являются карбоновые кислоты, которые присутствуют в форме конъюгированного основания при нейтральном pH, 7,0, pH внутри большинства живых клеток. Органические кислоты с одной карбоновой кислотой имеют одно сопряженное основание, в то время как некоторые органические кислоты могут иметь две или три карбоновых кислоты и два или три сопряженных основания.
Наиболее распространенными химическими группами, связанными с органическими кислотами, являются карбоновые кислоты, которые присутствуют в форме конъюгированного основания при нейтральном pH, 7,0, pH внутри большинства живых клеток. Органические кислоты с одной карбоновой кислотой имеют одно сопряженное основание, в то время как некоторые органические кислоты могут иметь две или три карбоновых кислоты и два или три сопряженных основания.
Как измеряются органические кислоты по медицинским причинам?
Почти все органические кислоты измеряются с помощью комбинации газовой или жидкостной хроматографии, связанной с масс-спектрометрией. Органические кислоты чаще всего анализируются в моче, потому что они не реабсорбируются в почечных канальцах после клубочковой фильтрации. Таким образом, органические кислоты в моче часто присутствуют в концентрации, в 100 раз превышающей их концентрацию в сыворотке крови, и поэтому легче обнаруживаются в моче. Вот почему органические кислоты редко тестируются в крови или сыворотке.
Как используется тест на органические кислоты для лечения заболеваний?
Многие генетические нарушения вызваны недостаточной выработкой соответствующего фермента, который реагирует медленнее, чем в норме, что приводит к накоплению промежуточного продукта метаболизма (соответствующей органической кислоты). Органические ацидемии — это нарушения промежуточного метаболизма, которые приводят к накоплению токсичных соединений, которые нарушают многочисленные внутриклеточные биохимические пути, включая катаболизм глюкозы (гликолиз), синтез глюкозы (глюконеогенез), метаболизм аминокислот и аммиака, метаболизм пуринов и пиримидинов, а также метаболизм жиров. Накопление органической кислоты в клетках и жидкостях (плазме, спинномозговой жидкости или моче) приводит к заболеванию, называемому органической ацидемией или органической ацидурией.
Клинические проявления органических ацидемий широко варьируются и могут включать неспособность к развитию, нарушения интеллектуального развития, гипо- или гипергликемию, энцефалопатию, летаргию, гиперактивность, судороги, дерматит, дисморфические черты лица, микроцефалию, макроцефалию, анемию и/или иммунодефицит с частыми инфекциями; кетоз и / или лактоацидоз, нарушение слуха, речи или зрения, периферическуя невропатию, внезапную остановку сердечно-сосудистой системы, тошноту, кому. Многие органические ацидемии связаны с незначительным или заметным повышением уровня аммиака в плазме. Некоторые органические ацидемии могут быть хроническими и проявляться в первые несколько дней жизни. В других случаях, таких как дефицит ацил-дегидрогеназы со средней длиной цепи, ребенок может казаться совершенно нормальным до потенциально фатального эпизода остановки сердца и дыхания.
Многие органические ацидемии связаны с незначительным или заметным повышением уровня аммиака в плазме. Некоторые органические ацидемии могут быть хроническими и проявляться в первые несколько дней жизни. В других случаях, таких как дефицит ацил-дегидрогеназы со средней длиной цепи, ребенок может казаться совершенно нормальным до потенциально фатального эпизода остановки сердца и дыхания.
Негенетические факторы также могут изменять метаболизм человека. Токсичные количества препарата ацетаминофен и другие токсичные химические вещества истощают количество ключевого антиоксиданта человеческого организма — глутатиона, который помогает организму выводить токсины. Это приводит к перепроизводству органической кислоты пироглутаминовой кислоты. Опухоли надпочечников (феохромоцитомы) могут вызывать гиперпродукцию нейромедиатора адреналина, что приводит к заметномую увеличению его метаболита, ваниллилминдальной кислоты. Генетические заболевания митохондрий, источника энергии клетки, а также токсичные химические вещества, нарушающие функцию митохондрий, вызывают повышение уровня янтарной кислоты. Янтарная кислота является ключевым промежуточным звеном как цикла Кребса, так и цепи переноса электронов, которая генерирует аденозинтрифосфат (АТФ), который служит «валютой» большинства энергетических транзакций организма.
Янтарная кислота является ключевым промежуточным звеном как цикла Кребса, так и цепи переноса электронов, которая генерирует аденозинтрифосфат (АТФ), который служит «валютой» большинства энергетических транзакций организма.
Ряд органических кислот прямо или косвенно указывает на дефицит важнейших витаминов, таких как витамин B12, пантотеновая кислота, биотин и другие. Одно из наиболее важных применений теста на органические кислоты — это индикатор дисбактериоза, аномального разрастания дрожжей и бактерий в кишечном тракте. Некоторые из этих бактериальных побочных продуктов из кишечника попадают в кровоток и негативно влияют на метаболизм нейротрансмиттеров, таких как дофамин.
Тест на органические кислоты (метаболический профиль)
Тест на органические кислоты – это исчерпывающий метаболический скрининг общего состояния здоровья пациента, который включает более 70 показателей. Он обеспечивает точную оценку состояния кишечной флоры — наличие дрожжей и патогенных бактерий. Аномально высокие уровни этих микроорганизмов могут вызывать или усугублять нарушения поведения, гиперактивность, двигательные нарушения, повышенную утомляемость и нарушение иммуннитета. Тест на органические кислоты также включает маркеры уровней витаминов и минералов, окислительного стресса, уровней нейромедиаторов и оксалатов, уровень которых прямо коррелирует с возникновением многих метаболических и неврологических нарушений.
Аномально высокие уровни этих микроорганизмов могут вызывать или усугублять нарушения поведения, гиперактивность, двигательные нарушения, повышенную утомляемость и нарушение иммуннитета. Тест на органические кислоты также включает маркеры уровней витаминов и минералов, окислительного стресса, уровней нейромедиаторов и оксалатов, уровень которых прямо коррелирует с возникновением многих метаболических и неврологических нарушений.
18.09.2020
Химики синтезировали молекулу с рекордной любовью к протонам
Изменения на масс-спектре в процессе отщепления протонов от молекулы бензола основанием
Berwyck L. J. Poad et al. / Chemical Science, 2016
Австралийские химики получили вещество с самым высоким сродством к протону из всех известных. Им оказался дианион диэтинилбензола в газовой фазе. Он «обошел» на несколько процентов предыдущих рекордсменов: анион окиси лития (LiO—) и метанид-анион (CH3—). Авторы продемонстрировали силу супероснования, отщепив с его помощью атом водорода от молекулы бензола. Исследование опубликовано в журнале Chemical Science, кратко о нем сообщает блог Королевского химического общества.
Им оказался дианион диэтинилбензола в газовой фазе. Он «обошел» на несколько процентов предыдущих рекордсменов: анион окиси лития (LiO—) и метанид-анион (CH3—). Авторы продемонстрировали силу супероснования, отщепив с его помощью атом водорода от молекулы бензола. Исследование опубликовано в журнале Chemical Science, кратко о нем сообщает блог Королевского химического общества.
Основание и кислота — важнейшие понятия в химии. Согласно одной из теорий кислот и оснований (Бренстеда—Лоури) под основанием понимают частицу (нейтральную молекулу, анион), которая способна отщеплять протон (положительно заряженный атом водорода) от кислоты. Типичные основания можно получить, растворив в воде щелочь, например, NaOH. Образовавшиеся после диссоциации гидроксид-анионы легко отщепляют протоны от кислот, образуя воду. Такой же процесс можно провести и в газовой фазе — с тем же результатом.
Силу основания можно сравнивать разными способами. Традиционно это делается с помощью констант основности — они показывают как хорошо вещество отщепляет протоны от выбранной кислоты, например, воды. Но в газовой фазе необходимо использовать другой показатель — сродство к протону. Он показывает как много энергии выделяется при реакции основания с протоном. Чем сильнее основание, тем больше энергии выделяется.
Но в газовой фазе необходимо использовать другой показатель — сродство к протону. Он показывает как много энергии выделяется при реакции основания с протоном. Чем сильнее основание, тем больше энергии выделяется.
В число самых сильных оснований входят гидрид анион (продукт отщепления протона от молекулы водорода) и метанид (отщепление протона от метана). Последний сохранял статус самого сильно основания из полученных человеком вплоть до 2008 года. Затем химики синтезировали анион оксида лития LiO—. Это соединение оказалось рекордсменом сродства к протону — при реакции присоединения выделяется около 1782 килождоулей на моль. Вещество, полученное авторами новой работы увеличивает рекордную планку на 60 килоджоулей на моль.
Процессы, происходящие в масс-спектрометре
Berwyck L. J. Poad et al. / Chemical Science, 2016
Орто-диэтинилбензол представляет собой молекулу бензола, к которой присоединены два остатка ацетилена. Для синтеза его аниона авторы использовали электроспрей ионизацию более сложной молекулы, в которой к ацетиленовым фрагментам дополнительно были присоединены остатки карбоновой кислоты (-COOH). На первой стадии вещество в форме дианиона карбоновой кислоты переводилось в газовую фазу под действием сильного электрического поля. Затем из-за столкновений со специально введенными в прибор атомами гелия происходило двухстадийное отщепление молекул CO2. В результате этого образовывались целевые молекулы. Их фиксировали с помощью масс-спектрометрии.
Для синтеза его аниона авторы использовали электроспрей ионизацию более сложной молекулы, в которой к ацетиленовым фрагментам дополнительно были присоединены остатки карбоновой кислоты (-COOH). На первой стадии вещество в форме дианиона карбоновой кислоты переводилось в газовую фазу под действием сильного электрического поля. Затем из-за столкновений со специально введенными в прибор атомами гелия происходило двухстадийное отщепление молекул CO2. В результате этого образовывались целевые молекулы. Их фиксировали с помощью масс-спектрометрии.
Для того чтобы проверить экспериментально силу основания химики добавили к анионам диэтинилбензола бензол. Последний представляет собой чрезвычайно слабую кислоту, не отдающую свои протоны привычным основаниям. Как правило для этого требуются такие вещества как бутиллитий. Проанализировав изменения, происходившие с масс-спектром после впрыскивания бензола, ученые подтвердили, что новое вещество способно «отбирать» у ароматической молекулы протоны. С водородом и метаном аналогичные реакции запустить не удалось.
С водородом и метаном аналогичные реакции запустить не удалось.
Сила основания была установлена с помощью квантово-химических расчетов. Авторы выполнили сходные расчеты для сильнейших оснований и обнаружили, что дианион орто-диэтинилбензола обладает сродством к протону на несколько десятков килоджоулей большим, чем у аниона оксида лития. Интересно, что смена расположения ацетиленовых фрагментов резко снижала сродство.
Как отмечают ученые, заметно, что чем больше «лишних» электронов находится у молекулы, тем выше ее основность. Это предлагает возможный путь для поиска сильных оснований, однако у него есть и обратная сторона. Многочисленные заряды дестабилизируют молекулу из-за электростатического отталкивания.
Владимир Королёв
Ксено-нуклеиновые кислоты — синтетические конкуренты ДНК | Научные открытия и технические новинки из Германии | DW
На прошедшей в Лондоне 6-й международной конференции по синтетической биологии подавляющее большинство докладов и сообщений были посвящены тем или иным модификациям молекулы ДНК. Что вполне естественно: ведь главная задача этого совсем еще молодого направления генной инженерии состоит в проектировании и создании новых, не встречающихся в живой природе биологических систем, а молекулы ДНК являются, как известно, носителями наследственной информации, основой всей жизни на Земле. Поэтому внимание ученых, работающих в области синтетической биологии, приковано к ДНК. Именно на ее основе они конструируют новые гены.
Что вполне естественно: ведь главная задача этого совсем еще молодого направления генной инженерии состоит в проектировании и создании новых, не встречающихся в живой природе биологических систем, а молекулы ДНК являются, как известно, носителями наследственной информации, основой всей жизни на Земле. Поэтому внимание ученых, работающих в области синтетической биологии, приковано к ДНК. Именно на ее основе они конструируют новые гены.
Пока, правда, исследователи заняты, в основном, тем, что придают новые или изменяют имеющиеся функции организмов, давно существующих в природе и развившихся естественным путем, однако в будущем они намерены синтезировать и невиданные прежде искусственные организмы, способные к самостоятельной жизнедеятельности, включая воспроизводство, и обладающие строго определенными, заранее заданными свойствами. В процессе создания таких программируемых организмов наука должна прийти к более глубокому пониманию феномена биологической жизни как таковой: ведь сегодня ученые лишь разбирают живой организм на составные части, а впредь начнут собирать их из атомов и молекул.
Впрочем, уже, можно сказать, начали: в 2010 году знаменитому американскому генетику Крейгу Вентеру (Craig Venter) и его коллегам удалось создать первую в мире искусственно синтезированную бактерию.
Британцы пошли другим путем
Так вот, хотя основные доклады на лондонской конференции касались ДНК, ничуть не меньший интерес вызвало сообщение группы британских исследователей, пошедших другим путем. Они синтезировали иные носители наследственной информации, отличные от молекул ДНК, хотя и похожие на них.
Собственно, молекула ДНК послужила разработчикам основой. Руководитель группы — Филипп Холлигер (Philipp Holliger), научный сотрудник Лаборатории синтетической биологии в Кембридже, говорит: «Мы создали несколько аналогов ДНК и назвали их ксено-нуклеиновыми кислотами — от греческого слова «ксенос», то есть чужой, чуждый, инородный. Мы модифицировали, так сказать, остов нормальной молекулы ДНК. Она, как известно, имеет структуру двойной спирали. Если представить себе эту двойную спираль в виде закрученной лестницы, то мы изменили не поперечные перекладины, не соединенные попарно водородными связями азотистые основания, а продольные опоры между ними. Там расположены сахара, которые вместе с фосфатами образуют остов молекулы, связывают нуклеотиды внутри каждой цепи».
Там расположены сахара, которые вместе с фосфатами образуют остов молекулы, связывают нуклеотиды внутри каждой цепи».
Азотистые основания — те же, сахара — другие
Таким образом, все четыре азотистых основания, присущих ДНК — аденин, гуанин, тимин и цитозин, — сохранились неизменными. А вот вместо типичной для ДНК дезоксирибозы британские исследователи встроили в молекулы своих ксено-нуклеиновых кислот другие сахара — в частности, арабинозу и циклогексенил.
С химической точки зрения это было относительно несложно. Но носитель наследственной информации способен выполнять эту свою функцию только в том случае, если он поддается прочтению и копированию. Поскольку же природные ферменты могут выполнять эти операции лишь применительно к молекулам ДНК, Филиппу Холлигеру и его коллегам пришлось синтезировать и соответствующие искусственные ферменты. Ученый говорит: «Нам нужен был один фермент, способный считывать молекулу ксено-нуклеиновой кислоты, и другой фермент, способный ее воспроизводить. Такое преобразование должно было работать в обе стороны: от ДНК к ксено-НК и от ксено-НК к ДНК».
Такое преобразование должно было работать в обе стороны: от ДНК к ксено-НК и от ксено-НК к ДНК».
Ксено-нуклеиновые кислоты могут заинтересовать медиков
Все исследования в сфере синтетической биологии относятся пока к разряду фундаментальных исследований, но некоторые варианты практического применения молекул ксено-нуклеиновых кислот просматриваются уже сейчас. Пусть их производство обходится намного дороже, чем производство ДНК, зато эти альтернативные носители информации гораздо прочнее и, судя по всему, могут сохраняться в неизменном виде тысячелетиями. Ведь в природе просто не существует ферментов, способных их расщепить.
Причем такую прочность эти молекулы демонстрируют не только в стерильной лабораторной посуде, но и в живых организмах, в теле животных и человека, что делает их чрезвычайно интересными для медиков. Филипп Холлигер говорит: «Некоторые из ксено-нуклеиновых кислот настолько чужеродны для организма человека, что они в нем либо вообще не расщепляются, либо расщепляются чрезвычайно медленно. Поэтому любые искусственно синтезированные биологически активные вещества на основе таких кислот могут сохраняться в организме гораздо дольше, чем природные субстанции. Это открывает интересные перспективы в деле создания новых биомолекулярных лекарственных препаратов».
Поэтому любые искусственно синтезированные биологически активные вещества на основе таких кислот могут сохраняться в организме гораздо дольше, чем природные субстанции. Это открывает интересные перспективы в деле создания новых биомолекулярных лекарственных препаратов».
Внеземные цифилизации могут изрядно удивить человечество
Впрочем, по мнению ученого, его работа отвечает и на сугубо философский вопрос, касающийся зарождения и развития жизни на Земле: «Является ли ДНК той единственной молекулой, на основе которой могла возникнуть жизнь? Или это случайность? То есть просто в какой-то момент эволюция сделала свой выбор, и он стал окончательным? Похоже, что это именно так. Жизнь в той форме, какую мы знаем, базируется на ДНК, но если мы ищем внеземные цивилизации, то должны ясно понимать, что они могут быть основаны на иных носителях наследственной информации. Это могут быть нуклеиновые кислоты вроде тех, что мы создали искусственно, а, может, и нечто более экзотическое и чужеродное».
Кислота и основание
Кислота и основание
Вопросы могут быть классифицированы по-разному. Кислоты и основания
являются еще одним способом классификации веществ. Большинство
реакций, происходящих в водных растворах, происходят в кислых или
щелочных средах. Определения кислот и оснований даны Аррениусом и
Бронстедом. Они определяют кислоты и основания по-разному. Теперь мы
рассмотрим эти определения по одному.
1) Определение Аррениуса:
Аррениус определяет кислоты как «в водных растворах вещества,
которые дают ион H+, называются кислотами». Примерами
кислот являются;
HCl(aq) → H+(aq) + Cl—
HNO3(aq) → H+(aq) + NO3—(aq)
H3PO4(aq) → 3H+(aq) + PO4-3(aq)
H2SO4(aq) → 2H+(aq) + SO4-2(aq)
Как видно из примеров, кислоты превращают ион H+ в
раствор. Напротив, некоторые из кислот, таких как SO2,
P2O5, SO3, не содержат атома H,
но их растворы с водой проявляют кислотные свойства. Решения этих
Решения этих
вопросов с водой становится;
SO2(g) + H2O(l) → H2SO3(aq)
CO2(g) + H2O(l) → H2CO3(aq)
P2O5(s) + 3H2O(l) → 2H3PO4(aq)
Эти неметаллические оксиды называются «безводными кислотами».
Аррениус определяет основания как «в водных растворах вещества,
которые дают OH— ион, называются основаниями». Примеры
оснований:
KOH(s) → K+(aq) + OH—(aq)
Ba(OH)2(s) → Ba+2(aq) + 2OH—(aq)
NaOH(s) → Na+(aq) + OH—(aq)
Ca(OH)2(s) → Ca+2(aq) + 2OH—(aq)
Как видно из примеров, основания дают ион OH— раствора
в раствор. Напротив, некоторые из оснований, такие как Nh4, MgO,
CaO, не содержат иона OH—, но их растворы с водой
содержат ион OH—, и они проявляют основные свойства.
Посмотрите на эти примеры, приведенные ниже;
NH3(aq) + H2O(l) → NH4+(aq)
+ OH-(aq)
K2O(s) + H2O(l) → 2K+(aq) + 2OH—(aq)
MgO(s) + H2O(l) → Mg+2(aq) + 2OH—(aq)
Эти вопросы называются «безводными основаниями».
2) Определение Бренстеда-Лоури:
В определении Аррениуса есть некоторые ограничения. Например, это не
может объяснить безводные кислоты и основания. Таким образом,
Бренстед-Лоури приводит другое определение кислот и оснований. Они
определяют кислоты и основания как;
«Кислоты — это вещества, которые отдают H+, а основания —
вещества, которые принимают ион H+».
HCl(g) + NH3(g) → NH4+(s) + Cl—(s)
В этой реакции HCl отдает ион H+, поэтому он является
кислотой, а NH3 принимает ион H+, он
является основанием.
CO3-2 + H2O → HCO3—
+ OH—
В этой реакции одна кислота и одно основание реагируют с
образованием другой кислоты и основания. Кислота H2O
отдает ион H+ и становится основанием OH—,
основание CO3 принимает ион H+ и становится
кислотой HCO3. OH— представляет собой
сопряженное основание H2O, а HCO3—
представляет собой сопряженную кислоту CO3-2.
Список, приведенный ниже, показывает некоторые общие кислотные и
основные конъюгаты;
Пример: согласно определению Бренстеда-Лоури,
какие из следующих утверждений верны для следующей реакции.
HCO3— + HSO4— → H2CO3
+ SO4-2
I. Кислотные свойства HSO4— иона выше,
чем кислотные свойства HCO3—
II. Ион SO4-2 проявляет как кислотные,
Ион SO4-2 проявляет как кислотные,
так и основные свойства.
III. Кислотные свойства H2CO3 выше, чем
у HSO4— иона.
Решение:
В данной реакции HSO4— и H2CO3
являются кислотой, а HCO3— и SO4-2
являются основаниями. Поскольку ион HSO4—
превращает ион H+ в HCO3—, его
кислотные свойства высоки. I. правда.
Кислоты должны иметь ион H+ в своей структуре, чтобы
стать кислотой Бренстеда-Лоури. Поскольку в SO4-2
нет иона H+, он не ведет себя как кислота. II. ложно
Третье утверждение может быть верным или ложным, мы не можем
сказать, что это правда, глядя на эту реакцию.
Пример: Какие из следующих пар являются
кислотой в данной реакции?
H2PO4— + HSO3—
↔ HPO4— + H2SO3
I. H2PO4—
H2PO4—
и H2SO3
II. HSO3— и H2SO3
III. HSO3— и HPO4—
IV. H2PO4—
и HPO4—
Решение:
H2PO4— дарит H+ и
становится HPO4—, поэтому он проявляет
кислотные свойства.
H2SO3 отдает H+ и становится HSO3—,
поэтому он проявляет кислотные свойства.
Пара дана во I. правда.
Кислота
и основание экзамены и решение проблем
|
|
Диета при подагре — Новая Больница
Подагра – это тяжелое системное заболевание, которое без лечения прогрессирует, приводит к тяжелым осложнениям, инвалидизации либо летальному исходу. Подагра характеризуется повышенным уровнем мочевой кислоты в крови. Вследствие этого образуются отложения кристаллов моноурата натрия в мягких тканях, в суставах и вокруг них с образованием тофусов (подагрических узлов).
Лечение подагры комплексное:
- медикаментозная терапия
- обязательное соблюдение диетотерапии.
Диета основана на исключении алкоголя, ограничении продуктов, содержащих животный белок, исключении сладких газированных напитков, жирной, жареной и копченой еды. Рацион должен быть сбалансирован растительными и молочными продуктами.
Плюсы диеты
Мочевая кислота образуется при расщеплении пуринов. Пуриновые основания содержатся в еде, поэтому при лечении подагры важен рацион больного и соблюдение диетотерапии. Диетотерапия позволяет исключить продукты, которые содержат пурины, и снизить уровень мочевой кислоты.
Диетотерапия позволяет исключить продукты, которые содержат пурины, и снизить уровень мочевой кислоты.
Во время соблюдения диеты уменьшается количество болевых приступов, снижается воспалительный процесс, уменьшается отечность суставов и мягких тканей. Рацион сбалансирован продуктами с высокой калорийностью, не вызывает чувство сильного голода. С помощью диеты снижается риск осложнений и образования тофусов.
Минусы диеты
Для того чтобы заболевание не прогрессировало диетотерапия должна быть пожизненная. Алкоголь и продукты животного происхождения должны быть сведены к минимуму в рационе или исключены из пищевого рациона. Наполнить рацион белком можно за счет белковых продуктов растительного происхождения.
Таблица продуктов
| Вид продукта | Продукты |
| Хлебобулочные изделия | Черный, белый хлеб, хлебцы рисовые, гречневые, ржаные, выпечка из бездрожжевого теста. |
| Мясо, рыба | Не более 3-х раз в неделю (150 г порция). Кролик, индейка, курица, рыба нежирных сортов, морепродукты – мидии, кальмары. |
| Молочные продукты | Молоко, кефир не более 2% жирности, сыр до 45 % жирности, йогурт без добавок, сметана до 15% жирности, сливочное масло 82 % жирности. |
| Сладости | Белковые десерты – безе. Желе, мармелад, пастила, зефир классический без добавок, варенье домашнего изготовления, джем. |
| Крупы | Гречиха, рисовая, пшено, пшенная, киноа, булгур, кус-кус. Исключить бобовые – кукурузная. |
| Яйца | Куриные, перепелиные – не более 2 штук в день. |
| Масла | Растительные – оливковое, ореховое, льняное, шиповника, кокосовое. Сливочное органическое, 82 % жирности. |
| Фрукты, ягоды | Сухофрукты разрешены все, кроме изюма. Цитрусовые: апельсины, лимоны, мандарины, помело. Абрикосы, клубника, малина, груши. Цитрусовые: апельсины, лимоны, мандарины, помело. Абрикосы, клубника, малина, груши. |
| Овощи | Картофель, морковь, огурцы, помидоры, кабачки, баклажаны, свекла, укроп, лук, чеснок, капуста белокочанная, тыква, патиссон. |
Орехи, семена | Орехи разрешены все, кроме арахиса. Арахис может быть поражен плесенью. |
Напитки | Чай зеленый, травяной, с куркумой, можно лимон добавлять в чай. Соки из разрешенных овощей и фруктов, морсы домашние, квас домашнего приготовления, минеральная вода щелочная. |
Меню на неделю
Понедельник
- Завтрак – омлет, приготовленный в духовке или на пару, можно добавить 50 мл молока + пару кусочков хлеба, 150 г овощного салата.
- Обед – суп минестроне (овощной), 130 г рыбы не жирных сортов, приготовленной на пару или сваренной.

- Ужин – тушеное овощное соте с кабачками и баклажанами 300 г, кусочек хлеба.
Вторник
- Завтрак – каша булгур или овсяная с фруктами или сухофруктами.
- Обед – плов из дикого риса и куриного филе без зажарки.
- Ужин – овощное соте с картофелем и нежирным сыром, запечённое в духовке, кусочек хлеба.
Среда
- Завтрак – йогурт с фруктами и орехами.
- Обед – крем-суп из тыквы, кабачка и картофеля, котлеты из нута, к супу можно добавить 2 чайные ложки тыквенных или льняных семечек.
- Ужин – тушеная капуста с томатами, луком и индейкой.
Четверг
- Завтрак – булгур или рисовая каша, можно варить на воде или вода + молоко, ягоды или сухофрукты.
- Обед – лобио из фасоли, овощной салат.
- Ужин – плов из булгура или дикого риса с куриной грудкой и овощами.
Пятница
- Завтрак – творог или сырники, запечённые в духовке, фрукты, 1 чайная ложка кунжута, сметана 1 столовая ложка.

- Обед – паста из твердых сортов пшеницы с морепродуктами, овощной соус.
- Ужин – гречневая крупа с рыбой, запечённой в духовке.
Суббота
- Завтрак – пшеничная каша на смеси воды и молока, сухофрукты.
- Обед – крем-суп из овощей, добавить семя льна или тыквенные семечки, кусочек хлеба или хлебец.
- Ужин – овощное соте, морепродукты, отваренное яйцо.
Воскресенье
- Завтрак – йогурт с фруктами, орехами.
- Обед – перлотто с овощами и сыром.
- Ужин – тушеная капуста с овощами и тефтелями из мяса индейки.
Результаты
У больного подагрой, который соблюдает диетическое питание, период ремиссии намного дольше, чем у того, кто питается без соблюдения диеты. Диета снижает интенсивность боли, воспаление. При сбалансированном диетическом питании врач может контролировать уровень мочевой кислоты в организме больного.
Цели диетического питания
Цель диетического питания при заболевании – ограничить употребление продуктов, которые содержат пуриновые основания, и усилить выведение почками мочевой кислоты.
Лечебная диета при данной патологии
Лечебная диета направлена на снижение употребления белковых продуктов животного происхождения. Разрешенное количество – до 1 г на 1 кг массы тела. Обязательно необходимо соблюдать водный баланс, количество выпитой жидкости – до 2-х литров в день. В качестве жидкости можно употреблять отвар шиповника, морс, воду с лимоном, минеральную щелочную воду. Щелочная вода предупреждает возникновение нефролитиаза. Ограничивается потребление соли, т.к. она задерживает жидкость в организме и нарушает лимфодренаж.
Диетотерапия при подагре направлена на исключение продуктов, которые богаты пуринами.
Продукты, которые должны быть исключены:
- наваристые мясные, рыбные бульоны;
- дрожжевые хлебобулочные изделия;
- бобовые;
- рыба жирных сортов, шпроты, сардины, щука;
- субпродукты;
- сало, смалец;
- белые грибы, шампиньоны;
- сладости – торты, пирожные, конфеты, шоколад;
- зелень – шпинат, щавель, ревень;
- овощи – спаржа, цветная капуста, редис, редька;
- фрукты – инжир;
- крупы – рис белый очищенный;
- колбасные изделия, копчености;
- дрожжевые продукты.

Мясо употреблять рекомендуют в вареном виде, т.к. пуриновые основания остаются в бульоне.
Необходимо исключить или ограничить потребление кофе, крепкого чая, пряностей, копченостей, жирной еды, алкоголь.
Особенности питания и его принципы
Питание должно быть сбалансированным и наполнено продуктами, бедными пуринами. Разрешенные продукты:
- яйца;
- молочные продукты;
- овощи;
- фрукты;
- орехи;
- мед;
- крупы;
- мясо и рыба нежирных сортов до 300 г в неделю.
Специфика питания при ожирении
При ожирении обязательно должно быть скорректировано питание. Снижение массы тела – это первоочередная цель. Диета позволяет снизить вес и уменьшить проявление подагры и подагрических приступов. При ожирении назначают диету по Певзнеру, стол № 6.
Разгрузочные дни при подагре
При соблюдении диетотерапии нет необходимости проводить разгрузочные дни. Полное голодание запрещено при подагре, т.к. оно усугубляет течение болезни.
Полное голодание запрещено при подагре, т.к. оно усугубляет течение болезни.
Рецепты блюд для больного
Диета содержит большое количество продуктов, из которых можно приготовить различные блюда по сезону. Нужно разнообразить рацион новыми блюдами.
Цельнозерновые булочки
Ингредиенты на 4-5 штук: 100 г овсяных отрубей, 100 г цельнозерновой муки, 200 мл кефира, 1 чайная ложка оливкового масла, 1 чайная ложка разрыхлителя, соль, травы (по вкусу).
Рецепт приготовления:
- 1. Смешать овсяные отруби с кефиром, дать постоять 15-20 минут.
- 2. Смешать муку с разрыхлителем.
- 3. Перемешать с отрубями, муку вводить постепенно и перемешивать.
- 4. Тесто вымесить, оно должно быть эластичным и мягким.
- 5. Добавить масло, соль, травы. Снова вымесить.
- 6. Сформировать булочки и отправить в духовку на 30 мин 180 градусов. Если выпекаете булочки на пергаменте, то пергамент нужно смазать сливочным маслом.

Овсяное печенье
Ингредиенты: овсяные хлопья – 200 г, йогурт несладкий – 300 г, яблоки – 2 шт., сухофрукты – 50 г, корица по вкусу.
Рецепт приготовления:
- 1. Овсяные хлопья залить йогуртом и перемешать. Оставить ненадолго для набухания (20 минут).
- 2. Яблоко без кожуры натереть на крупной терке, сухофрукты измельчить ножом.
- 3. Смешать яблоко, сухофрукты, корицу, хлопья.
- 4. Сформировать печенье в виде небольших шариков и выложить на пергамент для выпечки. Выпекать при 180 градусах в течение 40 минут.
Стоимость услуг
Способы оплаты: оплата наличными средствами; оплата пластиковыми банковскими картами МИР, VISA, MastercardWorldwide
Разъяснение баз данных ACID и BASE
Когда дело доходит до баз данных NoSQL, модели согласованности данных иногда могут сильно отличаться от моделей, используемых в реляционных базах данных (а также сильно отличаться от других хранилищ NoSQL).
Две наиболее распространенные модели согласованности известны под аббревиатурами ACID и BASE. Хотя они часто соперничают друг с другом в битве за окончательную победу (пожалуйста, снимите видео), обе модели согласованности имеют свои преимущества — и недостатки — и ни одна из них не всегда идеально подходит.
Давайте подробнее рассмотрим компромиссы обеих моделей согласованности базы данных.
В этой серии блогов Graph Databases for Beginners я расскажу вам об основах графической технологии, предполагая, что у вас мало (или совсем нет) знаний в этой области. В последние недели мы обсуждали, почему технологии графов — это будущее, почему связанные данные имеют значение, основы (и подводные камни) моделирования данных, почему важен язык запросов к базе данных, различия между императивными и декларативными языками запросов, прогнозное моделирование с использованием графов. теория, основы алгоритмов поиска по графам и зачем нам базы данных NoSQL.
На этой неделе мы подробнее рассмотрим ключевые различия между моделями согласованности баз данных ACID и BASE и их компромиссы для ваших транзакций с данными.
Модель согласованности ACID
Многие разработчики знакомы с транзакциями ACID по работе с реляционными базами данных. Таким образом, модель согласованности ACID какое-то время была нормой.
Ключевой гарантией ACID является то, что он обеспечивает безопасную среду для работы с вашими данными. Акроним ACID означает:
Atomic .
- Все операции в транзакции выполнены успешно или каждая операция откатывается.
Согласованный
- По завершении транзакции база данных структурно исправна.
Изолированный
- Транзакции не конкурируют друг с другом. Спорный доступ к данным контролируется базой данных, поэтому транзакции выполняются последовательно.
Долговечный
- Результаты применения транзакции постоянны, даже при наличии сбоев.
Свойства ACID означают, что после завершения транзакции ее данные согласованы (технический жаргон: согласованность записи) и стабильны на диске, что может включать в себя несколько отдельных участков памяти.
Согласованность записи — прекрасная вещь для разработчиков приложений, но она также требует сложной блокировки, которая обычно является тяжелым шаблоном для большинства случаев использования.
Когда дело доходит до технологий NoSQL, большинство графовых баз данных (включая Neo4j) используют модель согласованности ACID для обеспечения безопасности и согласованного хранения данных.
Модель согласованности BASE
Для многих доменов и вариантов использования транзакции ACID гораздо более пессимистичны (т. Е. Их больше беспокоит безопасность данных), чем того требует домен.
В мире баз данных NoSQL транзакции ACID менее популярны, поскольку некоторые базы данных ослабили требования к немедленной согласованности, свежести и точности данных, чтобы получить другие преимущества, такие как масштабирование и устойчивость.
(Примечательно, что RavenDB на базе .NET превзошла тенденцию среди агрегированных хранилищ в поддержке транзакций ACID.)
Вот как расшифровывается аббревиатура BASE:
Базовая доступность
- База данных работает большую часть времени.

Мягкое состояние
- Хранилища не обязательно должны быть согласованными по записи, равно как и разные реплики не должны быть взаимно согласованными все время.
Окончательная согласованность
- Магазины демонстрируют постоянство на более позднем этапе (например,г., лениво во время чтения).
Свойства BASE намного слабее, чем гарантирует ACID, но нет прямого однозначного соответствия между двумя моделями согласованности (момент, который, вероятно, нельзя переоценить).
Хранилище данных BASE оценивает доступность (поскольку это важно для масштабирования), но не обеспечивает гарантированной согласованности реплицированных данных во время записи. В целом, модель согласованности BASE обеспечивает менее строгую гарантию, чем ACID: данные будут согласованы в будущем либо во время чтения (например,g., Riak) или всегда будет согласованным, но только для некоторых обработанных прошлых снимков (например, Datomic).
Модель согласованности BASE в основном используется агрегатными хранилищами, включая семейство столбцов, хранилища «ключ-значение» и хранилища документов.
Выбор компромиссов между ACID и BASE
Нет правильного ответа на вопрос, нужна ли вашему приложению модель согласованности ACID или BASE. Разработчики и архитекторы данных должны выбирать компромиссы согласованности данных в каждом конкретном случае, а не только на основе тенденций или модели, которая использовалась ранее.
Учитывая слабую согласованность BASE, разработчикам необходимо быть более осведомленными и точными в отношении согласованных данных, если они выбирают хранилище BASE для своего приложения. Важно быть знакомым с БАЗОВЫМ поведением выбранного вами совокупного магазина и работать в рамках этих ограничений.
С другой стороны, планирование ограничений BASE иногда может быть серьезным недостатком по сравнению с простотой транзакций ACID. База данных полностью ACID идеально подходит для случаев использования, когда важны надежность и согласованность данных (банковское дело, кто-нибудь?).
В ближайшие недели мы более подробно рассмотрим особенности ACID / BASE, когда речь идет об агрегированных хранилищах и других графических технологиях.
Не ограничивайтесь основами:
Получите копию книги O’Reilly Graph Databases и начните использовать графическую технологию для решения реальных задач.
Получить книгу
Познакомьтесь с остальной частью серии «Графические базы данных для начинающих»:
Концентрации кислоты и основания | Протокол
Кислоты и основания
Кислота Аррениуса образует ионы водорода при растворении в воде:
HA + H 2 O → H + (водн.) + A — (водн.)
Здесь HA — недиссоциированная кислота, H + — катион водорода, а A — — сольватированный анион, называемый сопряженным основанием.Основание Аррениуса производит ионы гидроксида при растворении в воде:
BOH + H 2 O → B + (водн. ) + OH — (водн.)
) + OH — (водн.)
Здесь BOH — недиссоциированное основание, OH — — ион гидроксида, а B + — сольватированный катион, называемый сопряженной кислотой. Конъюгированное основание образуется, когда кислота теряет ион водорода и имеет потенциал для получения водорода. То же самое следует и для конъюгированной кислоты, которая образуется, когда основание теряет гидроксильную группу и имеет потенциал для ее восстановления.У каждой кислоты есть сопряженное основание, и у каждого основания есть сопряженная кислота.
pH
pH — это степень кислотности раствора и мера количества ионов водорода в растворе. Шкала pH логарифмическая и изменяется от 0 до 14; водные растворы с pH ниже 7 описываются как кислые, а водные растворы с pH выше 7 описываются как щелочные или основные. Растворы с pH 7 считаются нейтральными.
pH раствора равен отрицательному десятичному логарифму концентрации ионов водорода в растворе.
Вода сильно взаимодействует с ионом водорода, потому что его сильный положительный заряд притягивает отрицательный полюс окружающих молекул воды. Фактически, они настолько сильно взаимодействуют, что образуют ковалентную связь и катион H 3 O + , называемый гидроксонием. Приведенное выше уравнение переписано, чтобы отразить это.
Для простоты мы будем ссылаться на концентрацию ионов водорода вместо ионов гидроксония при обсуждении pH. Чем ниже значение pH раствора, тем больше в нем ионов водорода и, соответственно, более кислый раствор.Например, pH 1 мМ серной кислоты составляет 2,75, тогда как pH 1 мМ соляной кислоты равен 3,01. Концентрация ионов водорода в растворе серной кислоты рассчитывается как 1 × 10 -2,75 , тогда как концентрация ионов водорода в растворе соляной кислоты составляет 1 × 10 -3,01 . Таким образом, в серной кислоте больше ионов водорода, и она более кислая. Помните, что даже несмотря на то, что pH двух растворов может отличаться всего на половину значения pH, из-за логарифмической природы шкалы pH, количество водорода сильно варьируется.
Сила кислот и оснований
Сила кислоты зависит от электроотрицательности сопряженного основания и полярности кислого водорода. Следовательно, сила относится к тому, насколько легко катион водорода (H + ) отделяется от аниона. Сильные кислоты и основания полностью диссоциируют в водных растворах, тогда как слабые кислоты и основания диссоциируют только частично на их сопряженные ионы.
Константа диссоциации, K a , представляет силу кислоты.K a рассчитывается с использованием концентраций недиссоциированной кислоты HA и концентраций катионов водорода и конъюгированного основания A —. Более высокие значения K a представляют более сильные кислоты, тогда как меньшие значения K a представляют более слабые кислоты.
K a численно очень мало, и часто указывается в форме pK a , которая является отрицательной десятичной логарифмической базой для K a . Более низкие значения pK a соответствуют более сильной кислоте, тогда как более высокие значения pK a соответствуют более слабой кислоте.
Некоторые кислоты диссоциируют только один ион водорода и, следовательно, имеют значение pK , равное . Эти кислоты называют монопротонными. Однако некоторые кислоты могут диссоциировать более одного иона водорода и называются полипротонными. Эти кислоты имеют значение pK и для каждой диссоциации иона водорода.
pK a также можно использовать для расчета равновесного pH кислотно-щелочной реакции, как показано в уравнении Хендерсона-Хассельбаха.
Уравнение Хендерсона-Хассельбаха используется для расчета pH, если известны концентрации конъюгированного основания и слабой кислоты, или для расчета pK a , если известны pH и концентрации.
Титрование
Кислотно-основные реакции количественно изучены с помощью титрования. В эксперименте по титрованию раствор известной концентрации, называемый стандартным раствором, используется для определения концентрации другого раствора. Для кислотно-основного титрования стандартизованный раствор основания медленно добавляют к кислоте неизвестной концентрации (или кислота добавляется к основанию). Кислотно-основная реакция — это реакция нейтрализации, при которой образуется соль и вода. Когда моли ионов водорода в кислоте равны молям гидроксильных ионов, добавленных из основания, раствор достигает нейтрального pH.
Для проведения кислотно-основного титрования стандартизованное основание медленно добавляют в колбу с неизвестной кислотой с помощью бюретки, которая позволяет измерять объем и добавлять по каплям основание. PH раствора тщательно контролируется на протяжении титрования с помощью индикатора pH, добавляемого к кислоте. Обычно используется фенолфталеин, поскольку раствор остается бесцветным до тех пор, пока он не станет основным и не станет светло-розовым.
По мере приближения титрования к точке эквивалентности, когда количество молей ионов водорода равно количеству добавленных гидроксильных ионов, индикатор pH временно меняет цвет из-за избытка гидроксильных ионов.Когда колба покачивается, кислая окраска индикатора pH возвращается. Титрование завершено и достигло своей конечной точки, когда крошечный избыток гидроксильных ионов навсегда изменит цвет индикатора до его основного цвета.
Кривая титрования представляет собой график зависимости pH раствора от объема добавленного стандартизованного основания. Точка эквивалентности находится в точке перегиба кривой и рассчитывается как вторая производная кривой титрования.
Если кислота является полипротонной, у нее будет несколько точек эквивалентности, по одной для каждой диссоциации иона водорода.PH на полпути к точке эквивалентности для монопротоновых кислот или между точками эквивалентности в случае полипротонных кислот равен pK a кислоты.
Список литературы
- Коц, Дж. К., Трейхель-младший, П. М., Таунсенд, Дж. Р. (2012). Химия и химическая реакционная способность. Белмонт, Калифорния: Брукс / Коул, Cengage Learning.
- Зильберберг, М. (2009). Химия: молекулярная природа материи и изменений. Бостон, Массачусетс: Макгроу-Хилл.
- Харрис, округ Колумбия (2015). Количественный химический анализ. Нью-Йорк, Нью-Йорк: W.H. Фримен и компания.
Кислота и основания
Кислота и основания
Кислотно-основные концепции
кислоты
и базы впервые характеризовались
вкус и другие простые свойства: кислоты кислые, а щелочи — кислые.
Горький. Есть три описания (концепции):
Аррениус :
— кислоты увеличивают концентрацию H +
ионов (протонов) и оснований увеличивают
концентрация ионов OH — (гидроксид) в
решение.В воде ионы H + гидратированы и являются
часто обозначается как ион H 3 O + (гидроксоний).
Недостатки: не может использоваться для
неводные фазы или структурные различия. Для
Например, следующая кислотно-основная реакция не может быть
описано с использованием определений Аррениуса:
HCl ( г ) + NH 3 ( г )
-> NH 4 Cl ( с )
Брнстед – Лоури :
— кислота является донором протона и основанием
является акцептором протона .
Пример :
| кислотное основание |
A сопряженная пара кислота-основание
состоит из двух частиц в кислотно-основной реакции, один
кислота и одно основание, которые отличаются потерей или усилением протона .
амфипротические виды
— это разновидность, которая может действовать как кислота или основание (она может
потерять или получить протон) , в зависимости от другого реагента.Для
Например, HCO 3 — действует как кислота в
присутствие OH — , но в качестве основания в присутствии HF.
Анионы с ионизируемыми атомами водорода, такие как HCO 3 — ,
и некоторые растворители, такие как вода, являются амфипротонными.
Идентификация
Кислотные и основные виды In
в следующих уравнениях обозначьте каждый вид кислотой или основанием.
Покажите сопряженную кислотно-основную пар.
(a) HCO 3 — ( водн. )
+ HF ( вод. ) -> H 2 CO 3 ( вод. )
+ Факс — ( водн. )
(b) HCO 3 — ( водн. )
+ OH — ( вод. ) -> CO 3 2- (
11 )
+ H 2 O ( л )
Проблема
Стратегия Начиная с
Кислота Бренстеда – Лоури является донором протонов, а основанием является
акцептор протонов.Изучите каждое уравнение, чтобы найти донора протонов.
с каждой стороны. Затем пометьте кислоты и основания.
В реакции а) H 2 CO 3
и HCO 3 — представляют собой пару конъюгированных кислотных оснований,
как и HF и F — .
В реакции б) HCO 3 — и CO 3 2-
представляют собой пару конъюгированных кислотных оснований, как и H 2 O и OH —
Недостатки: не может
может использоваться для кислотно-основной реакции без протона.Для
Например:
Na 2 O ( s )
+ SO 3 ( г ) -> Na 2 SO 4 ( с
Льюис :
— кислота — акцептор электронной пары ,
а база — донор электронной пары .
Образование комплексных ионов
также можно рассматривать как кислотно-основные реакции Льюиса. Обычно, когда это
не подчеркивается, кислотно-основное описание рассматривается с точки зрения
Брнстед – Лоури. Кислоты и основания Льюиса, на
с другой стороны, обозначаются как кислота Льюиса или кислота Льюиса
база.
Идентификация
Кислота Льюиса и основные виды В следующих реакциях определите
Кислота Льюиса и основание Lewis .
(а) Ag + + 2NH 3
-> Ag (NH 3 ) 2 +
(б) B (OH) 3 + H 2 O
-> B (OH) 4 — + H +
Проблема
Стратегия Напишите
уравнения с использованием электронно-точечных формул Льюиса.Затем определите
акцептор электронной пары, или кислота Льюиса, и электронная пара
донор, или база Льюиса.
Кислотно-щелочная прочность
Сильный
Кислоты Бренстеда-Лоури легко ионизируются, высвобождая ионы H + .
Как определено для электролитов, сильные кислоты и основания ионизируются почти полностью.
в воде. Сочетание молекулярной структуры и индивидуальной связи
полярность
определяет силу кислоты или основания.Кислотно-основная реакция обычно идет в
направление более слабой кислоты.
| HCl ( водн. ) + H 2 O ( л ) -> Cl — ( водн. ) + H 3 O + ( водн. ) |
| сильнее сильнее слабее слабее кислота основная основная кислота |
А
сильная кислота реагирует с водой с образованием сильной кислоты и слабой
база.Пары кислоты и основания на противоположных сторонах уравнения
называются сопряженными кислотно-основными
пары.
Распознавание сильных и слабых кислот помогает предсказать,
Произойдет кислотно-основная реакция. Важно понимать, что
термины более сильный и более слабый используются здесь только в
сравнительный смысл. Ион H 3 O + является
относительно сильная кислота.
| ||||||||
Пример: Для
после реакции решите, какие виды (реагенты или продукты)
благоприятствуют завершению реакции.
SO 4 2- ( водн. )
+ HCN ( вод. ) -> HSO 4 — ( вод. )
+ CN — ( водн. )
Используйте таблицу для сравнения относительной силы
кислоты и основания.если ты
сравните относительную силу двух кислот HCN и HSO 4 — ,
вы видите, что HCN слабее. Или сравнивая базы SO 4 2-
и CN — , вы видите, что SO 4 2- — это
слабее. Следовательно, реакция обычно идет справа налево.
| SO 4 2- ( водн. ) + HCN ( вод. ) <- HSO 4 — ( вод. ) + CN — ( водн. ) |
| слабее слабее сильнее сильнее основная кислота кислотная основа |
Заключение:
реагенты предпочтительны.
Самоионизация воды
Хотя вода считается неэлектролитом, она ионизирует
немного по реакции:
H 2 O ( л )
+ H 2 O ( l ) -> H 3 O + ( aq
+ OH — ( водн. )
степень ионизации может быть выражена как равновесие
константа:
Уравнение можно переписать
как K w , константа ионного произведения для
вода:
[H 2 O] 2 K c
= [H 3 O + ] [OH — ]
= K w = 1.0 Х 10 -14
при 25C
В
чистая вода присутствуют как ионы H + , так и ионы OH —
в равной концентрации. От K w = 1 x 10 -14 ,
отсюда следует, что [H + ] = [OH — ] = 1,0 x 10 -7 M в чистой воде. Если концентрация H +
увеличивается с добавлением кислоты Бренстеда, концентрация
из OH — должно уменьшиться для поддержания K w
и наоборот.
Мера
кислотность раствора часто выражается в единицах pH. pH составляет
рассчитано из концентрации H +
как
pH = -log [H + ]
где [H + ]
находится в моляре. Нейтральный раствор будет иметь pH 7, кислый
растворы будут иметь pH ниже 7, а основные растворы будут иметь
pH выше 7.
Мы можем суммировать [H + ] и [OH — ] для водных
решения:
Базовый: [H + ] <
1.0 X 10 -7 [OH — ]
> 1,0 X 10 -7 pH> 7
Нейтральный: [H + ] = [OH — ]
= 1.0 X 10 -7 pH ~ 7
Кислый: [H + ]>
1,0 X 10 -7 [OH — ]
<1.0 Х 10 -7
pH <7
Мы также можем
определите pOH как
pOH = -log [OH — ] и p K w
как p K w = -log K w
= -log 1,00 x 10 -14 = 14.00 при 25 o C.
pH и pOH связаны с K w следующим образом: pH + pOH = 14,00
Обычно измеряют pH раствора.
с помощью pH-метра или индикатора
решения.
Молекулярная структура и кислота
Прочность
Сила кислоты зависит от
насколько легко протон H + теряется или удаляется из
Связь H –– X в кислотных формах.Следующие факторы
важно при определении относительной силы кислоты: сила
Связь H –– X, прочность связи H –– O в H 3 O + ,
и степень, в которой сопряженное основание, X — , кислоты гидратировано в воде.
Одним из определяющих факторов является
полярность связи, к которой присоединен атом H. H
атом должен иметь положительный частичный заряд:
Чем более поляризована связь в
в этом направлении, тем легче удаляется протон и
большая сила кислоты.Второй фактор, определяющий кислотность
сила — это сила связи , то есть как
крепко держится протон. Это, в свою очередь, зависит от размера
атом X. Чем больше атом X, тем слабее связь и тем больше
сила кислоты.
1) При спуске колонны
элементов периодической таблицы, размер атома X увеличивается,
H ___ Прочность связи X уменьшается, и
сила бинарной кислоты увеличивается. Вы можете предсказать
следующий порядок концентрации кислоты в группе :
HF
2) Пересечение ряда
элементов таблицы Менделеева электроотрицательность увеличивается,
H ___ Полярность связи X увеличивается, и
сила кислоты увеличивается. Например, бинарные кислоты
последние два элемента второго периода равны H 2 O
и ВЧ.Кислотная сила
H 2 O
3) Оксокислоты — электроотрицательность. An
оксокислота имеет структуру
H –– O –– Y ––
Кислый атом H всегда
присоединен к атому O, который, в свою очередь, присоединен к атому Y.
Другие группы, такие как атомы O или O –– H
группы, также могут быть присоединены к Y.Полярность связи преобладает в
определение относительной силы оксокислот. Это в свою очередь,
зависит от электроотрицательности атома Y. Если
электроотрицательность атома Y большая, связь H ___ O
относительно полярен, а сила кислоты велика. Для серии
оксокислот той же структуры, различающихся только атомом Y,
сила кислоты увеличивается с увеличением электроотрицательности Y:
HIO
Оксокислоты хлора обеспечивают
другой пример, когда степень окисления (и, следовательно,
электроотрицательность) Cl увеличивается с каждым дополнительным атомом O.В результате атом H становится более кислым. Кислотные силы
увеличивается в следующем порядке:
HClO
4) Полипротонные кислоты. Для
Например, H 2 SO 4 ионизируется, теряя протон
дать HSO 4 — , который, в свою очередь, ионизируется до
дать SO 4 2-.HSO 4 — банка
теряют протон, поэтому он кислый. Однако из-за отрицательного
заряд иона, который имеет тенденцию притягивать протоны, его кислота
сила снижена по сравнению с незаряженными видами. Это,
кислоты с концентрацией порядка
HSO 4 —
Это показывает, что кислота
сила полипротонной кислоты и ее анионов уменьшается с
возрастающий отрицательный заряд
Кислотно-основные растворы
Описание
Чем отличаются сильная и слабая кислоты? Используйте лабораторные инструменты на своем компьютере, чтобы узнать! Окуните бумагу или зонд в раствор для измерения pH или вставьте электроды для измерения проводимости.Затем посмотрите, как концентрация и сила влияют на pH. Может ли слабый кислотный раствор иметь такой же pH, как и сильный кислотный раствор?
Примеры целей обучения
- При наличии кислот или оснований с одинаковой концентрацией продемонстрировать понимание силы кислоты и основания путем: 1. соотнесения силы кислоты или основания со степенью ее диссоциации в воде; 2. определения всех молекул и ионов, которые являются присутствует в данном кислотном или основном растворе.3. Сравнение относительных концентраций молекул и ионов в слабых и сильных кислотных (или основных) растворах. 4. Описание сходства и различий между сильными кислотами и слабыми кислотами или сильными основаниями и слабыми основаниями.
- Продемонстрировать понимание концентрации раствора с помощью: 1. Описания сходств и различий между концентрированными и разбавленными растворами. 2. Сравнение концентраций всех молекул и ионов в концентрированных и разбавленных растворах той или иной кислоты или основания.
- Используйте силу кислоты или основания и концентрацию его раствора, чтобы: 1. Описать словами и рисунками (графики или молекулярные рисунки), что это означает, если у вас есть: Концентрированный раствор слабой кислоты (или основание) или концентрированный раствор сильной кислоты (или основания) или другие комбинации. 2. Изучите различные комбинации силы / концентрации, которые приводят к одинаковым значениям pH.
- Опишите, как обычные инструменты (pH-метр, проводимость, pH-бумага) помогают определить, является ли раствор кислотным или основным, сильным или слабым, концентрированным или разбавленным.
Версия 1.2.24
HTML5 sims могут работать на iPad и Chromebook, а также в системах ПК, Mac и Linux в современных веб-браузерах. Если у вас возникли проблемы с использованием симулятора HTML5 на поддерживаемой платформе, отключите все расширения браузера.
iPad:
iOS 12+ Safari
iPad-совместимые sim-карты
Android:
Официально не поддерживается. Если вы используете симуляторы HTML5 на Android, мы рекомендуем использовать последнюю версию Google Chrome.
Chromebook:
Последняя версия Google Chrome
Симуляторы HTML5 и Flash PhET поддерживаются на всех устройствах Chromebook.
SIM-карты, совместимые с Chromebook
Системы Windows:
Microsoft Edge, последняя версия Firefox, последняя версия Google Chrome.
Системы Macintosh:
macOS 10.13+, Safari 13+, последняя версия Chrome.
Системы Linux:
Официально не поддерживается. Пожалуйста, свяжитесь с phethelp @ colorado.edu с проблемами устранения неполадок.
Кислоты и Основания — Уроки Wyzant
Что такое кислота или основание?
Согласно определению Сванте Аррениуса (Швеция) в 1884 году, кислота
— это материал, который может выделять протон или ион водорода (H
+ ). Хлороводород в водном растворе ионизирует
и превращается в ионы водорода и ионы хлора. В этом случае основание,
или щелочь, представляет собой материал, который может отдавать гидроксид-ион (OH — ).
Гидроксид натрия в водном растворе превращается в ионы натрия и ионы гидроксида. К
году определение Томаса Лоури (Англия) и Дж. Брэнстед (Дания)
работая независимо в 1923 году, кислота — это материал, который отдает протон
, а основание — это материал, который может принимать протон. Ошибался ли Аррениус? $ | 😎
Нет. Определение Аррениуса хорошо подходит для ограниченного использования. Мы собираемся
использовать определения Аррениуса большую часть времени. Определение
Лоури-Брэнстеда шире, включая некоторые идеи, которые поначалу могут не казаться кислотными и
основными типами взаимодействия.Каждую диссоциацию иона, в которой участвует ион водорода или гидроксид-ион
, можно рассматривать как кислотно-щелочную реакцию. Как и в случае с определением Аррениуса
, все известные нам вещества, которые мы называем кислотами, также являются кислотами
в модели Лоури-Бренстеда. Группа G.N. Идея Льюиса (1923) о кислотах и основаниях
шире, чем модель Лоури-Бренстеда. Определения Льюиса таковы: кислоты
являются акцепторами электронных пар, а основания — донорами электронных пар.
Мы можем рассмотреть ту же идею в стиле Лоури — Бренстеда.
Каждая ионизируемая пара имеет протонный донор и протонный акцептор. Кислоты
спарены с основаниями. Один может принять протон, а другой — отдать протон. Каждая кислота
имеет доступный протон (ионизируемый водород) и другую часть, называемую
, сопряженное основание . (Слово «конъюгат» просто
означает, что оно «сочетается» с другой частью.) Когда кислота ионизируется, ион водорода представляет собой кислоту
, а остальная часть исходной кислоты является конъюгированным основанием. Азотная кислота, HNO
3 ,
диссоциирует (расщепляется) на ион водорода и ион нитрата.Водород
почти сразу присоединяется к молекуле воды, образуя ион гидроксония. Ион нитрата
является сопряженным основанием иона водорода. Во второй части реакции вода
является основанием (потому что она может принимать протон), а ион гидроксония является сопряженной с ней кислотой.
| HNO 3 | + | H 2 O | ===> | (НЕТ 3 ) — | + | (H 3 O) + |
| КИСЛОТА | ОСНОВАНИЕ | СОЕДИНИТЕЛЬ ОСНОВАНИЕ | КОНЬЮГАТ КИСЛОТА |
Химики или тексты по химии часто используют ион водорода, H +
, чтобы показать ион водорода, выделяющийся в водный раствор.В каком-то смысле не может быть иона водорода или протона без
ничего другого. Большинство атомов водорода — это только один протон и один электрон.
Если вы удалите электрон, чтобы сделать его ионом, останется только протон.
Протоны просто не существуют обнаженными, как в водном растворе. Помните, что вода
— очень полярный материал. Имеется сильный частичный отрицательный заряд
на стороне атома кислорода и сильный частичный положительный заряд
на стороне водорода.Любой свободный ион водорода, имеющий положительный заряд,
быстро оказался бы рядом с кислородом молекулы воды. На близком расстоянии от притяжения заряда
ион водорода найдет пару (на выбор из двух пар) из
неподеленных электронов вокруг кислорода, которые будут способны заполнить его внешнюю оболочку.
Каждый ион водорода объединяется с молекулой воды, образуя ион гидроксония ,
(H 3 O) +
31 действительное разновидности, которые действуют как кислота.Ион гидроксида в растворе не соединяет
с молекулой воды подобным образом. Когда мы пишем реакции кислот и оснований, обычно удобнее всего игнорировать ион гидроксония
в пользу записи только иона водорода
, H + .
Свойства кислот
Для свойств кислот и оснований мы будем использовать определения Аррениуса.
Кислоты выделяют ионы водорода в водный (водный) раствор .Обычно вы видите формулу кислоты с ионизируемым водородом в начале, такой как HCl, соляная кислота или H (C 2 H 3 O 2 ), уксусная кислота.
Кислоты нейтрализуют основания в реакции нейтрализации . Кислота и основание объединяются, образуя соль
и воду.Соль — это любое ионное соединение, которое может быть образовано анионом кислоты и катионом основания. Ион водорода кислоты и ион гидроксида основания (
) объединяются с образованием воды.
Кислоты разъедают активные металлы . Даже золото, наименее активный металл, подвергается воздействию кислоты,
смеси кислот, называемой «царская водка» или «королевская жидкость». Когда кислота реагирует
с металлом, она дает соединение с катионом металла. и анион кислоты и газообразный водород
.
Кислоты превращают синюю лакмусовую бумажку в красную . Лакмус является одним из большого количества органических соединений
, которые меняют цвет, когда раствор меняет кислотность в определенной точке
. Лакмус — самый старый из известных индикаторов pH. Он красный в кислоте и синий в основе
. Фраза «лакмусовая бумажка» указывает на то, что лакмусовая бумажка существует в английском языке уже давно. Лакмус не меняет цвет точно в нейтральной точке
между кислотой и основанием, но очень близко к ней.Лакмусовая бумага №
часто пропитывается на бумагу для получения «лакмусовой бумаги».
Кислота кисловатая . ДЕГУСТАЦИЯ ЛАБОРАТОРНЫХ КИСЛОТ НЕ РАЗРЕШАЕТСЯ НИКАКОЙ ШКОЛЕЙ. Слово «sauer» на немецком языке
означает «кислота» и произносится почти так же, как «кислый» на английском языке.
(Квашеная капуста — это квашеная капуста, капуста, консервированная в собственной ферментированной молочной кислоте.
http://en.wikipedia.org/wiki/Sauerkraut
http://www.wildfermentation.com/resources.php?page=sauerkraut)
Желудочная кислота —
соляная кислота.Хотя дегустация желудочной кислоты неприятна, она имеет кислый привкус кислоты
. Уксусная кислота — это кислотный ингредиент уксуса. Цитрусовые фрукты, такие как лимоны, грейпфрут
, апельсины и лаймы, содержат лимонную кислоту в соке. Простокваша, сметана, йогурт
, кимчи и творог содержат молочную кислоту от ферментации сахара-лактозы.
Свойства баз
Основания выделяют гидроксид-ион в водный раствор . (Или, в модели Лоури-Бренстеда,
вызывает высвобождение иона гидроксида в водный раствор, принимая ион водорода в воду.)
Основания нейтрализуют кислоты в реакции нейтрализации . Слово — реакция:
Кислота плюс основание образует воду плюс соль .
Где «Y» — анион кислоты «HY», «X» — катион основания
«XOH», «XY» — соль в продукте, реакция будет следующей: HY + XOH === > HOH + XY
Основания денатурируют белок . Этим объясняется ощущение «скользкости» на руках
при контакте с основанием.Крепкие базы
, которые хорошо растворяются в воде, такие как натрий или калий
, очень опасны, потому что большая часть структурного материала
человека состоит из белка. Серьезных повреждений плоти можно избежать, если бережно использовать
прочных оснований.
База превращает красную лакмусовую бумажку в синюю . Это не означает, что лакмус является единственным кислотно-основным индикатором
, но скорее всего, это самый старый индикатор.
Основы горькие .Есть очень мало пищевых продуктов, которые являются щелочными, но те, что
, имеют горький вкус. Еще важнее позаботиться о дегустационных основах. И снова НЕТ
ШКОЛА РАЗРЕШАЕТ ДЕГУСТАЦИЮ ЛАБОРАТОРНЫХ ХИМИКАТОВ. Дегустация основ более опасна, чем дегустация кислот
из-за свойства более сильных оснований денатурировать белок.
Сильные кислоты и сильные основания
Обычными кислотами, ионизированными почти на сто процентов, являются: 1
HNO 3 — азотная кислота
HCl 1 — соляная кислота
H
2
HClO 4 — хлорная кислота
HBr 1 — 1 — — йодистоводородная кислота
Кислоты в этом коротком списке называются сильными кислотами , потому что
кислотность раствора зависит от концентрации ионизированных
атомов водорода.Соляная кислота — это соляная кислота промышленного класса, которая часто используется для отделки бетона. Менее концентрированная соляная кислота содержится в желудке человека.
Сильные кислоты полностью ионизируются в воде. Вы вряд ли увидите много HBr или HI в лаборатории, потому что они на
дорогие. Вы вряд ли увидите хлорную кислоту в школьных условиях, потому что она может взорваться, если с ней не обращаться осторожно. Другие кислоты не полностью ионизированы и существуют в основном в неионизированной форме.
Неполностью ионизированные кислоты называются слабыми кислотами , потому что в растворе имеется меньшая концентрация ионизированного водорода
. Не путайте терминологию
с концентрацией кислот. Различия в концентрации
всей кислоты будут обозначены как разбавленная или концентрированная .
В списке сильных кислот серная кислота — единственная, которая имеет вид
дипротонная , потому что она имеет два ионизируемых атома водорода по формуле
(или два моля ионизируемого водорода на моль кислоты).(Серная кислота ионизируется в два этапа.
В первый раз ион водорода отделяется от серной кислоты, он действует как сильная кислота.
Во второй раз, когда водород отделяется от сульфат-иона, он действует как слабая кислота.)
других кислот в списке — это монопротонные , содержащие только один ионизируемый протон
на формулу. Фосфорная кислота, H 3 PO 4 ,
— слабая кислота. Фосфорная кислота имеет три иона водорода, доступных для ионизации и потери в виде протона,
, и поэтому фосфорная кислота — это трипротонная .Мы называем любую кислоту с двумя или более
ионизируемыми атомами водорода полипротонными .
Точно так же есть краткий список сильных оснований, которые полностью ионизируются до
гидроксид-ионов и сопряженной кислоты. Все основания металлов группы I и группы II
, за исключением бериллия, являются сильными основаниями . Опять же, как и сильные кислоты, сильные основания полностью ионизируются в водном растворе. Гидроксиды лития, рубидия и цезия не часто используются в лаборатории, потому что они дороги.Основания металлов группы II, магния, кальция
, бария и стронция сильны, но все эти основания имеют несколько ограниченную растворимость
. Гидроксид бария обладает достаточно высокой растворимостью, чтобы на самом деле назвать его единственным двухосновным сильным основанием
. Гидроксид магния имеет особенно низкую растворимость. Гидроксиды калия и натрия
имеют общее название щелок . Содовый щелок
(NaOH) и калийный щелок (КОН) — общие названия, позволяющие различать эти два соединения.
LiOH 1 — гидроксид лития
NaOH 1 — гидроксид натрия
KOH 1 — гидроксид калия
RbOH 8 гидроокись C
RbOH 8 1 — гидроксид цезия
(Mg (OH) 2 — гидроксид магния)
(Ca (OH) 2 — гидроксид кальция)
(Sr (OH) 2 — гидроксид стронция)
Ba (OH) 2 — гидроксид бария
Все основные металлы группы I — одноосновные .Основания металлов группы
II — все двухосновные . Гидроксид алюминия,
Al (OH) 3 — трехосновный .
Любой материал с двумя или более ионизируемыми гидроксильными группами будет называться многоосновным .
Большинство щелочных органических соединений (и некоторые неорганические материалы) имеют аминогруппу
— (NH 2 ), а не ионизируемую гидроксильную группу
.Аминогруппа притягивает протон (ион водорода) и превращается в — (NH 3
) + .
(тире перед (NH 3 ) +
или (NH 2 ) указывает на один связывающий электрон
, так что он связан с чем-то иначе ковалентной связью.) Согласно определению Лоури-Бренстеда
, аминогруппа определенно действует как основание, и эффект удаления ионов водорода из
молекул воды такой же, как и при добавлении гидроксид-ионов в раствор.
Запомните сильные кислоты и сильные основания. Все остальные кислоты или основания слабые.
Растворимость и диссоциация
Теперь, после рассмотрения оснований металлов II группы, самое время подумать о кислотности
раствора и растворимости соединения. Гидроксиды кальция и магния
используются в антацидах , материалах, используемых для борьбы с кислотностью желудочно-кишечного тракта
. Как такое может быть, если это сильные базы? Чтобы действовать как основа, материал
должен быть растворен.Почти все эти растворенные основания диссоциированы или ионизированы
, но низкая растворимость этих оснований делает их безопасными для проглатывания. Кислота или основание
должны сначала раствориться, прежде чем они смогут диссоциировать (распасться) или ионизироваться (стать парой из
ионов).
Важно отметить, что тот факт, что соединение имеет водород или группу -ОН, такую как
, часть структуры не означает, что оно может быть кислотой или основанием. Водород метана
, CH 4 , все очень ковалентно
присоединены к атому углерода, и водороды не ионизируются, поэтому метан не является кислотой..
Глицерин (или глицерин) имеет в своей структуре три группы -ОН, но группы -ОН не разделяются
как ион, поэтому глицерин не является основанием.
Это спиртовые группы -ОН, присоединенные к атому углерода. НАЛИЧИЕ ГИДРОКСИДА
ИЛИ ВОДОРОДА В КАЧЕСТВЕ ИОНА ЗАВИСИТ ОТ ЧЕМ ОН ПРИСОЕДИНЯЕТСЯ.
Химическое уравнение диссоциации азотной кислоты:
Для сильных кислот и сильных оснований уравнение полностью направо.
— это не исходная кислота или основание, а только ионы материала, не связанные друг с другом
в воде.
Обзор pH
pH — это просто простой способ выразить кислотность или щелочность водного раствора
. PH раствора — это отрицательный логарифм концентрации ионов водорода.
Концентрация иона водорода обратно пропорциональна концентрации гидроксид-иона
, и два из них, умноженные вместе, дают число 1 E-14. Это немного странно, что произведение (результат умножения) молярной концентрации
ионов водорода и гидроксида всегда почти точно равно E-14, но это так.Таблица
ниже показывает взаимосвязь между этими измерениями в целых числах.
комментариев | [H + ] | pH | pOH | [OH — ] |
| очень низко | E-14 | 14 | 0 | E-0 |
| E-13 | 13 | 1 | E-1 | |
| основание | E-12 | 12 | 2 | E-2 |
| E-11 | 11 | 3 | E-3 | |
| слегка базовый | E-10 | 10 | 4 | E-4 |
| E-9 | 9 | 5 | E-5 | |
| E-8 | 8 | 6 | E-6 | |
| НЕЙТРАЛЬНО | E-7 | 7 | 7 | E-7 |
| E-6 | 6 | 8 | E-8 | |
| E-5 | 5 | 9 | E-9 | |
| слабокислый | E-4 | 4 | 10 | E-10 |
| E-3 | 3 | 11 | E-11 | |
| кислота | E-2 | 2 | 12 | E-12 |
| E-1 | 1 | 13 | E-13 | |
| очень кислая | E-0 | 0 | 14 | E-14 |
Блок pH
pH-бокс — это устройство для самоистязания, подобное термочувствительному шкафу.В каждом поле все четыре измерения представляют собой
различных способов выражения в точности одного и того же состояния. КВт воды, константа диссоциации
, является натуральным числом, удивительно близким к 1 E-14. То есть
, когда вы умножаете концентрацию ионов водорода [H + ] на концентрацию гидроксид-иона
[(OH) — ] в чистой воде при температуре, близкой к комнатной, число
равно 1 E-14. Если вы знаете [(OH) — ], вы знаете
[H + ] и наоборот.
Эти два измерения имеют разную шкалу, но это два разных измерения
одного и того же объекта. PH — это просто отрицательный логарифм
[H + ], а pOH равен
только отрицательный логарифм [(OH) — ].
Последний этап шкалы — это соотношение между pH и pOH, и это
— самый простой из них. pH + pOH = 14, потому что это экспоненциальная форма уравнения
кВт.
Самая сложная часть работы с pH-боксом — это «перебор чисел».«На научном калькуляторе
математика проще. Только мазохист может подумать о том, чтобы попытаться произвести вычисления вручную с
журнальной таблицей. Из-за большого количества различий между ручными калькуляторами существует предел
на количество help Chemtutor может дать вам работу с калькулятором, но есть несколько советов
, которые мы можем вам дать.
Научный калькулятор для использования с блоком pH
Калькулятор может быть довольно сложным в вычислениях с помощью шкалы pH.
Давайте рассмотрим пример использования коробки.Таблица pH перед полем pH
упрощает целочисленные вычисления pH, но калькулятор больше всего необходим для
нецелочисленных pH. Лучший способ понять это — взять калькулятор и пошагово выполнять вычисления на своей машине. Между калькуляторами есть некоторые большие различия, поэтому привыкните к своему собственному калькулятору, прежде чем пытаться использовать чей-то другой.
[H + ] = 2,75 E-6
Начните с [H + ] = 2.75 E-6.
Ввод 2 . 7 5 E +/- 6 . Чтобы получить значение pH
, введите «log» (а не ln , натуральный логарифм). На дисплее отображается
-5,5607. Значение pH является отрицательным логарифмом, поэтому оно составляет 5,5607, округленное до 5,6, но при
вы оставляете -5,5607 на дисплее, чтобы продолжить обход.
pH = 5,5607
Punch + 1 4 = , чтобы добавить 14 к отрицательному значению pH.
Это даст вам pOH 8,4393.
рОН = 8,4393
Нажмите кнопку «поменять знак», +/- . Это изменит 8.4393
на -8.4393. Нам нужно получить антилогарифм -8,4393, а эта функция
не одинакова на многих калькуляторах. Вы можете найти 2nd или INV или
shift или любую другую кнопку, которую нужно нажать перед журналом. Моя зеркальная фотокамера TI-30 имеет на кнопке
ИНВ. Нажмите INV, а затем «log», чтобы получить [OH — ].На вашем дисплее
может отображаться число, например: 0,000,000,004. Что ты сделал не так?
Правильный ответ: 3,6364 E-9.
[OH — ] = 3,6364 E-9
Почему дисплей вам врет? Это не так.
Числа те же, но ваш калькулятор показал вам длинную форму
(потому что она МОЖЕТ), которая представляет собой большое количество нулей, занимающих место, и одну значащую цифру
. Калькулятор фактически имеет это число в своей памяти
до восьми, десяти или шестнадцати цифр, но он решил показать вам только одну значащую цифру
.Вы можете увидеть другие цифры на дисплее, умножив
на E6 (1 E6) или E9 (1 E9), но если вы хотите продолжать обходить рамку,
вам нужно разделить на такое же число (с таким количеством значащих цифр, как
), чтобы вернуть [OH — ]. Или вы можете сохранить номер [OH — ]
, прежде чем взглянуть на него. На вашем калькуляторе должна быть кнопка с надписью
STO или M + или M1, которая сохранит ваш номер в памяти. Сделайте это, прежде чем
заглянет в номер.Чтобы вернуть этот сохраненный номер, вы нажимаете RCL или M-. Чтобы
вернуться к исходному [H + ], пробейте
в: 1 E +/- 1 4 ˜ RCL 16 = Вы должны увидеть на дисплее свой старый добрый [H +
] 2,75 E-6.
[H + ] = 2,75 E-6
А теперь для практики, обойдите поле pH другим способом.
Правила:
- Чтобы получить pH из [H + ]
или получить pOH из [OH — ], используйте отрицательные значения журнала. - Чтобы перейти от [OH — ] к pOH или от
[H + ] к pH, используйте антилогарифм отрицательного числа. - Чтобы перейти с [H + ]
на [OH — ] или обратно, сначала введите Kw, 1E-14 и разделите на
, которое вы уезжаете. - Чтобы перейти от pH к pOH или обратно, вычтите полученное число
из 14.
Знание в расчетах шкалы pH требует практики. Вы можете выполнить свои собственные упражнения
и проверить свои ответы, обойдя поле pH и вернувшись к
с тем же числом, а затем перейдя в другую сторону вокруг окна pH. Расчеты шкалы pH могут быть очень полезны для решения многих задач
в этом кислотно-щелочном разделе.
Слабые кислоты и слабые основания
Мы можем записать химическое уравнение диссоциации слабой кислоты, используя «A — »
для представления конъюгированного основания, как;
И аналогично, мы можем записать химическое уравнение для диссоциации слабого основания,
, используя «X + » для обозначения конъюгированной кислоты, как;
Равновесное выражение для диссоциации слабой кислоты:
На языке выражение равновесия читается; «Константа диссоциации кислоты
равна концентрации ионов водорода, умноженной на концентрацию конъюгированного основания кислоты
, деленную на концентрацию неионизированной кислоты.«
Точно так же выражение равновесия для слабого основания гласит: «Константа диссоциации
основания равна концентрации гидроксид-ионов, умноженной на концентрацию конъюгата
кислоты, деленную на концентрацию неионизированного основания».
k A кислоты или k B
основания являются свойствами этой кислоты или основания при данной температуре. Температура при
, при которой указаны эти константы диссоциации, обычно близка к комнатной.
Выражения равновесия относятся к одноосновным кислотам или одноосновным щелочам или первой
диссоциации полипротонной кислоты или многоосновной щелочи. Фосфорная кислота (H 3 PO 4 ) является хорошим примером полипротонной кислоты. При полной ионизации моль фосфорной кислоты даст три иона водорода и один фосфат-ион, но ионы водорода отрываются по одному за время
при разных pH и с разными k A ‘s.
| H 3 PO 4 ===> (H 2 PO 4 900 + | первая ионизация | к A = 6,92 E-3 |
| (H 2 PO 4 ) — ===> (HPO 4 ) 7 7 + H + | вторая ионизация | к A = 6.17 E-8 |
| (HPO 4 ) 2 — ===> (PO 4 ) 8 — 9181 H + | третья ионизация | к A = 2,09 E-12 |
Любая кислота с более чем одним ионизируемым водородом или любое основание с более чем одним ионизируемым гидроксидом
обычно будет отделяться ступенчато, как фосфорная кислота.
Коробка pKa
pK кислоты — очень полезное число
, как вы увидите в математических расчетах ниже. PK A
— отрицательный логарифм k A , pK B
— отрицательный логарифм k B , и pK A
плюс pK B равны четырнадцати.Коробка k A
такая же, как и коробка pH, но замените k A
на [H + ], pK A
для pH, k B для [OH —],
и pK B для pOH.
pH сильных кислот и оснований
Сильные кислоты и основания полностью ионизируют весь растворенный материал.
Концентрация монопротоновой кислоты равна концентрации
иона водорода. Концентрация одноосновной щелочи равна концентрации гидроксид-иона
. Фактическая концентрация иона водорода
(или гидроксид-иона) в чистой воде порядка концентрации
моль E-7, поэтому любая концентрация сильной кислоты или основания сверх моляра E-5
полностью поглощает сравнительно небольшое количество ион от ионизации воды.
Что такое pH 0.0850 M HNO 3 ? Азотная кислота
— это сильная монопротонная кислота. [HNO 3 ] = [H + ] и pH = — log [H + ], так
, pH = — log (0,085 ) = 1,07 Всего одна ступенька шкалы pH.
Что такое pH 0,00765 КОН? Гидроксид калия — одноосновное сильное основание. [KOH] =
[OH — ] и pOH = — log [OH — ] и pH = 14 — pOH Или вы можете обойти поле pH вокруг
другим способом.POH = 2,12 и pH = 11,88.
Слабые кислоты
Следующие таблицы опубликованы здесь для вашего удобства при решении рабочих задач, а
— для просмотра примеров слабых кислот и оснований. Вам не нужно запоминать имена, формулы
или числа, связанные с этими материалами.
| КИСЛОТА | ФОРМУЛА | к A | пк A |
| уксусная кислота | H (C 2 H 3 O 2 ) | 1.74 E-5 | 4,76 |
| аскорбиновая кислота (1) | H 2 (C 6 H 6 O 1 6)| 7,94 E-5 | 4,10 | |
| аскорбиновая кислота (2) | (HC 6 H 6 O 6 ) — | 1.62 E-12 | 11,79 |
| борная кислота (1) | H 3 BO 3 | 5,37 E-10 | 9,27 |
| борная кислота (2) | (H 2 BO 3 ) — | 1,8 E-13 | 12,7 |
| борная кислота (3) | (HBO 3 ) = | 1.6 E-14 | 13,8 |
| бутановая кислота | H (C 4 H 7 O 2 ) | 1,48 E-5 | 4,83 |
| угольная кислота (1) | H 2 CO 3 | 4,47 Е-7 | 6.35 |
| угольная кислота (2) | (HCO 3 ) — | 4,68 E-11 | 10,33 |
| хромовая кислота (1) | H 2 CrO 4 | 1,82 E-1 | 0,74 |
| хромовая кислота (2) | (HCrO 4 ) — | 3.24 E-7 | 6,49 |
| лимонная кислота (1) | H 3 (C 6 H 5 9018 9187 9018 9187 9018 9187 9018 9187 9018 ) | 7,24 E-4 | 3,14 |
| лимонная кислота (2) | (H 2 C 6 H 5 O 7)| 1.70 E-5 | 4,77 | |
| лимонная кислота (3) | (HC 6 H 5 O 7 ) = | 4,07 E-7 | 6,39 |
| муравьиная кислота | H (CHO 2 ) | 1,78 E-4 | 3,75 |
| гептановая кислота | H (C 7 H 13 O 2 ) | 1.29 E-5 | 4,89 |
| гексановая кислота | H (C 6 H 11 O 2 ) | 1,41 E-5 | 4,84 |
| синильная кислота | HCN | 6,17 E-10 | 9,21 |
| плавиковая кислота | HF | 6.31 E-4 | 3.20 |
| молочная кислота | H (C 3 H 5 O 3 ) | 8,32 Е-4 | 3,08 |
| азотистая кислота | HNO 2 | 5,62 E-4 | 3,25 |
| октановая кислота | H (C 8 H 15 O 2 ) | 1.29 E-4 | 4,89 |
| щавелевая кислота (1) | H 2 (C 2 0 4 ) | 5,89 E-2 | 1,23 |
| щавелевая кислота (2) | (HC 2 O 4 ) — | 6.46 E-5 | 4,19 |
| пентановая кислота | H (C 5 H 9 O 2 ) | 3,31 E-5 | 4,84 |
| фосфорная кислота (1) | H 3 PO 4 | 6,92 E-3 | 2.16 |
| фосфорная кислота (2) | (H 2 PO 4 ) — | 6,17 E-8 | 7,21 |
| фосфорная кислота (3) | (HPO 4 ) = | 2,09 E-12 | 12,32 |
| пропановая кислота | H (C 3 H 5 O 2 ) | 1.38 E-5 | 4,86 |
| серная кислота (2) | (HSO 4 ) — | 1.05 E-2 | 1,98 |
| сернистая кислота (1) | H 2 SO 3 | 1,41 E-2 | 1,85 |
| сернистая кислота (2) | (HSO 3 ) — | 6.31 E-8 | 7,20 |
| мочевая кислота | H (C 5 H 3 N 4 O | 1,29 Е-4 | 3,89 | |
Органические кислоты в приведенной выше таблице обозначены как кислота с сопряженным основанием
, что отличается от стандартного обозначения.Обратите внимание, что первая ионизация серной кислоты
— это сильная кислота, поэтому ее нет в этой таблице. Аскорбиновая кислота
— это витамин С. Некоторые из кислот в таблице не очень растворимы, например, мочевая кислота
.
Органическая кислота обычно имеет группу — COOH. Форма этой группы больше похожа;
Между углеродом и одиночным кислородом существует двойная связь. Имеется
одинарная связь с спиртовой группой (-ОН). Есть еще одна связь с центральным углеродом
, которая обычно присоединена к другому углероду.Водород спиртовой группы
— это водород, который имеет тенденцию ионизироваться вдали от группы,
оставляя ион (-COO) — на конце кислоты.
Обратите внимание на набор органических кислот, которые начинаются с муравьиной кислоты. Муравьиная кислота
имеет водород, присоединенный к атому углерода в группе органической кислоты. Уксусная кислота
имеет группу (-CH 3 ), присоединенную на
к атому углерода в группе органической кислоты. Линия атомов углерода становится длиннее
для следующих кислот.В этом списке нет разветвленных цепей атомов углерода или каких-либо
двойных или тройных связей между атомами углерода органических кислот.
Физиологические органические кислоты (органические кислоты, которые содержатся в
живых существах) имеют четное количество атомов углерода. Гексановая, октановая и декановая кислоты (C-6,
, C-8 и C-10 кислоты) названы в честь коз, что даст вам представление о запахе этих соединений
.
Название, наиболее используемое для органической кислоты, в этой таблице выделено жирным шрифтом.
| НАЗВАНИЕ СИСТЕМЫ | КОЛИЧЕСТВО УГЛЕРОДА | ОБЩЕЕ НАЗВАНИЕ |
| метановая кислота | 1 углерод | муравьиная кислота |
| этановая кислота | 2 атома углерода | уксусная кислота |
| пропановая кислота | 3 атома углерода | пропионовая кислота |
| бутановая кислота | 4 атома углерода | масляная кислота |
| пентановая кислота | 5 атомов углерода | валериановая кислота |
| гексановая кислота | 6 атомов углерода | капроновая кислота |
| гептановая кислота | 7 атомов углерода | энантовая кислота |
| октановая кислота | 8 атомов углерода | каприловая кислота |
| нонановая кислота | 9 атомов углерода | пеларгоновая кислота |
| декановая кислота | 10 атомов углерода | каприновая кислота |
| СЛЕДУЮЩИЕ «ЖИРНЫЕ КИСЛОТЫ» | ||
| додекановая кислота | 12 атомов углерода | лауриновая кислота |
| тетрадекановая кислота | 14 атомов углерода | миристиновая кислота |
| гексадекановая кислота | 16 атомов углерода | пальмитиновая кислота |
| октадекановая кислота | 18 атомов углерода | стеариновая кислота |
| эйкозановая кислота | 20 атомов углерода | арахидовый |
| тетракозановая кислота | 24 атома углерода | лигноцериновый |
Ниже приведены некоторые из молекулярных формул некоторых органических кислот в форме стержня и символа
.Ионизируемый водород выделен синим цветом.
Органические кислоты с прямым углеродом с четными цепями от двенадцати до двадцати —
четыре называются жирными кислотами . Вы можете видеть, что
pK A очень близки для всех подобных органических кислот.
Муравьиная и уксусная кислоты растворимы в воде. По мере увеличения длины углеродной цепи до
молекула становится все менее и менее растворимой в воде. Начиная с пропановой кислоты
, даже при увеличении количества атомов углерода,
pK A не сильно меняются.
Слабые базы
Многие материалы являются слабыми основаниями из-за присутствия аминогруппы
— (NH 2 ), присоединенной к органическому соединению. Азот
имеет пять электронов во внешней оболочке. Три сольных электрона могут участвовать (
) в (ковалентных) связях с азотом. Неразделенная пара электронов может быть подарена атомом азота
для образования полной ковалентной связи с материалом
, в котором отсутствует пара электронов. Определение
Льюиса наиболее четко показывает, что донор пары электронов (атом N) — это основание
, а все, что присоединяется к азоту, принимая положение
ковалентного присоединения к азоту, является кислотой.
| ОСНОВАНИЕ | ФОРМУЛА | к B | пк B |
| аланин | C 3 H 5 O 2 NH 1 1 9018 2 9018| 7.41 E-5 | 4,13 | |
| аммиак (вода) | NH 3 (NH 4 OH) | 1,78 E-5 | 4,75 |
| диметиламин | (CH 3 ) 2 NH | 4,79 E-4 | 3,32 |
| этиламин | C 2 H 5 NH 2 | 5.01 E-4 | 3,30 |
| глицин | C 2 H 3 O 2 NH 1 9018 2 9018| 6,03 Е-5 | 4,22 | |
| гидразин | N 2 H 4 | 1.26 E-6 | 5,90 |
| метиламин | CH 3 NH 2 | 4,27 E-4 | 3,37 |
| триметиламин | (CH 3 ) 3 N | 6.31 E-5 | 4,20 |
Аланин и глицин — это аминокислоты, два из примерно двадцати типов
строительных блоков белка.Каждая аминокислота имеет как амино (основание), так и
кислотный конец. Перечислены только номера конца аминогруппы (стороны основания)
.
Правило 5%
Измерение и расчет pH не так точны, как некоторые другие из
химических мер из-за разницы температур, присутствующих других ионов, чистоты
растворенных веществ, изменений концентрации из-за испарения и т. Д. Измерение
pH в медицине, для Экземпляр должен иметь температуру 37 градусов Цельсия. Может быть
машин, которые заявляют, что измеряют pH с точностью до сотых или тысячных долей единицы pH,
, но стандарт, который калибрует машину, может немного отличаться.Изменение концентрации ионов водорода на
на пять процентов не изменит pH более чем на
на несколько сотых единицы pH. Вы попробуете на калькуляторе. Введите число,
скажем 0,001 и наберите журнал . Теперь введите число 95% или 105% от первого числа
(в данном случае 0,00105 или 0,00095) и введите журнал . Насколько отличается
pH? Наши ответы в отношении pH будут округляться до ближайшей десятой единицы pH,
, поэтому концентрация ионов водорода должна быть только в пределах 5% от точного числа
.Это «правило пяти процентов».
Как вы помните, мы упоминали, что концентрация сильной кислоты
равна концентрации ионов водорода. Это не совсем так.
В любом водном растворе кислоты есть еще один источник ионов водорода —
вода . Только вода имеет концентрацию ионов водорода E-7
молярных. Допустим, у вас есть раствор E-5 M HCl. Концентрация ионов водорода в кислоте составляет E-5, поэтому вклад ионизации воды составляет лишь сотую часть от количества иона водорода из кислоты.Вы могли бы приблизить реальную концентрацию ионов водорода
лучше, найдя концентрацию гидроксид-иона в растворе с концентрацией водородных ионов E-5
, а затем найдя добавленную концентрацию ионов водорода
из-за диссоциации воды от этого. Общая концентрация
иона водорода будет даже дальше от того, чтобы иметь какой-либо значительный вклад иона водорода из
ионизации воды. Имеет ли значение в этом случае ионизация воды в
? Конечно нет.Разница
между двумя числами намного меньше пяти процентов. Вот очевидная ситуация, когда вы,
, можете использовать более простое приближение концентрации ионов водорода, чтобы найти значение pH
. Бывают случаи, когда более простое приближение оказывается недостаточно точным.
Бывают случаи, когда вы сомневаетесь, и вам нужно работать ОБОИМИ способами, чтобы показать, можете ли вы использовать упрощенный метод.
Другой способ сформулировать правило пяти процентов: если у вас
есть упрощенный способ решения для концентрации ионов водорода, который
даст вам ответ, который вы можете показать, будет в пределах 5% от более точного способа вычисления
, вы можете использовать более простой метод.
pH слабых кислот и оснований
Слабые кислоты и основания не сильно ионизируются, поэтому [H + ]
или [(OH) — ] должны быть рассчитаны с помощью выражения равновесия.
Это было бы легко узнать точно, за исключением того, что [HA] не всегда равно
концентрации растворенного вещества, которое фактически попало в раствор. Более точным способом выражения равновесия
было бы включение в знаменатель
идеи о том, что [HA] на самом деле представляет собой концентрацию растворенного вещества
, первоначально помещенного в раствор, за вычетом количества этого растворенного вещества, которое ионизировалось.Мы
могли бы представить количество, которое ионизировалось либо [A — ]
, либо [H + ],
, поэтому знаменатель должен быть либо [HA] — [A — ] или [HA] —
[H + ]. Давайте использовать второй вариант
в качестве альтернативного знаменателя, потому что мы хотим найти концентрацию ионов водорода. Согласно правилу
5%, [HA] = [HA] — [H + ]
, только если концентрация ионов водорода составляет менее пяти процентов от общей концентрации растворенных веществ
.Так обстоит дело с большинством слабых кислот. Единственное исключение
— это когда самая сильная из слабых кислот находится в наиболее разбавленных растворах.
Если у вас более сильная слабая кислота (с высоким k A ),
вам следует проверить, находится ли [H + ] около 5% от общая концентрация растворенных веществ
. Если это так, вам придется использовать альтернативный знаменатель
в уравнении и решить его для [H + ] с помощью квадратного уравнения
.
Небеса предостерегают от необходимости использовать квадратное уравнение. (Я бы предпочел поцеловать
БОЛЬШОГО аллигатора.) Намного проще, если [H + ]
будет меньше пяти процентов [HA]. Расчет pH
ОЧЕНЬ слабых кислот, таких как борная кислота, всегда требует использования квадратного уравнения, но давайте избегать этого в основном курсе.
Если в растворе есть только вода и слабая кислота, каждый моль кислоты
диссоциирует только на один моль ионов водорода и только на один моль сопряженных основных ионов
.[H + ]
= [A — ]! Так;
и решение для [H + ] 2 ,
, извлекая квадратный корень из обеих частей, получаем [H + ].
После определения концентрации ионов водорода можно переходить в любое место на поле pH.
Та же идея касается слабого основания как единственного материала в водном растворе.Начнем с
, равновесное выражение и сопряженный ион кислоты равен концентрации гидроксида
. Вы начнете с базового выражения равновесия:>
и решите относительно [OH — ], чтобы получить;
И снова в поле pH для всего, что вам нужно.
Буферы и pH буферов
Буфер — это раствор, устойчивый к изменениям pH. Буфер состоит из слабой кислоты
и растворимой соли, содержащей сопряженное основание слабой кислоты
или слабого основания и растворимую соль, содержащую сопряженную кислоту слабого основания
.Некоторые примеры пар буферных материалов:
уксусная кислота и ацетат натрия, H (C 2 H 3 O 2 ) и Na (C 2 H 3 O 2 )
плавиковая кислота и фторид калия, HF и KF
угольная кислота и бикарбонат натрия, H 2 CO 3 и NaHCO 3
гидроксид аммония и нитрат аммония, NH 4 OH и NH 4 NO 3
азотистая кислота и нитрит лития, HNO 2 и LiNO 2
Рассмотрим приведенные выше пары.Есть четыре кислотных буфера и один щелочной буфер. Все кислоты содержат водород, который является однократно ионизируемым, а его сопряженное основание, такое как HF, обратимо ионизируется до H + и F —. HF — слабая кислота, а фторид-ион — сопряженное основание. Иногда мы говорим, что KF является сопряженным основанием, но идентичность аниона в конъюгате НЕ ВАЖНА, за исключением случаев, когда мы взвешиваем соединение для включения в буфер. В базовом буфере конъюгатом является анион, в данном случае аммоний.
Чтобы объяснить, как работает буфер, давайте воспользуемся примером кислотного буфера. Слабая кислота буфера в растворе в воде будет более кислой, чем буфер. Основание конъюгата в одном только буфере в воде было бы более щелочным, но оба могут существовать ВМЕСТЕ, в растворе, не нейтрализуя друг друга. Буферная пара не может взаимодействовать друг с другом, потому что у них есть общий ион, конъюгат. Когда к буферному раствору добавляется больше (более сильного) основания, часть кислоты нейтрализуется, образуя больше конъюгированного основания.Когда (более сильная) кислота добавляется к буферу, она нейтрализует основание конъюгата, образуя больше слабой кислоты. Пока есть как слабая кислота, так и сопряженное основание, буфер все еще работает, и pH не очень далеко от pKA кислоты.
Буфер наиболее эффективен в растворах с pH равным или близким к pKA
слабой кислоты. (Или растворы pOH на уровне pKB слабого основания или близком к нему.)
Наибольшая буферная емкость доступна, когда концентрация слабой кислоты
или основания близка к концентрации конъюгированного иона и когда концентрация
обоих составляет величайший.Одномолярный буфер, когда обе части буфера являются одномолярными, имеет вдвое большую буферную способность, чем полумолярный буфер.
Какая польза от буфера для биологических систем? Живые существа нуждаются в очень близком гомеостазе, постоянной температуре, осмотическом давлении, pH и т. Д., Чтобы оставаться в живых. Если у человека слишком много кислоты, это состояние называется ацидозом. Если слишком много основания, алкалоз. Любое из этих состояний опасно для жизни. В организме есть несколько буферных систем, фосфатная система, карбонатная система и белковая система.Основные неорганические системы, фосфат и карбонат, зависят от концентраций фосфат-бифосфат или карбонат-бикарбонат. (Концентрация углекислого газа в крови является частью карбонатной системы.) Белковая система зависит от слабых кислотных и основных групп вне белков, в основном глобулярных белков в крови.
Если подумать задом наперед, если вам нужен буфер с определенным pH ниже
7, выберите слабую кислоту, которая имеет pK A
, близкое к этому pH, и сопряженное основание для этого.
Мы можем снова начать с равновесного выражения ионизации
слабой кислоты или слабого основания;
В буферных растворах концентрация иона водорода ([H + ]) составляет , а не , равное
концентрации конъюгированного иона ([A — ]). Концентрация конъюгированного иона из
диссоциации кислоты в значительной степени незначительна, поэтому мы можем рассчитать, как будто весь конъюгированный ион
происходит из соли. Если растворимая соль имеет только один моль иона конъюгата
на моль соли, концентрация иона конъюгата будет такой же, как
, как концентрация соли.
Вход в поле pH снова — это концентрация ионов водорода. Решите
для концентрации ионов водорода, если вам это нужно, pH раствора,
pOH или концентрации гидроксид-иона.
Уравнение Хендерсона-Хассельбаха (H-H) может несколько сбивать с толку, но это
не более чем отрицательный логарифм приведенного выше уравнения, равновесного выражения
, решенного для концентрации ионов водорода. Если вы знаете
уравнение равновесия, знаете, как решить уравнение равновесия для концентрации ионов водорода
, и знаете, как преобразовать концентрацию иона водорода
в pH, вы его освоили.Если вам действительно нужно уравнение H-H
для теста, лучше всего убедиться, что вы получаете его правильно, выведя
из выражения равновесия.
-log [H + ] = pH
-logk A = pK A
-log (1 / [A — ]) = + log [A — ]
-log ([HA]) = -log [HA]
По компоненту, возьмите отрицательный логарифм выражения равновесия
и измените умножение на сложение.(Теперь это бревна.) Получается:
pH = pK A +
log [A — ] — log [HA], что то же самое, что;
pH = pK A — log ([HA] / [A — ]
), обычным способом вы видите уравнение H-H.
Есть четыре совершенно правильных способа написать уравнение HH. Их:
Эквимолярный буфер — это буфер, в котором концентрация
слабой кислоты (или основания) совпадает с концентрацией иона конъюгата.
Это может показаться вам не особенно важным, но есть несколько
важных идей, которые можно легко увидеть из него. Начните с выражения равновесия ионизации
и отмените [HA] с помощью [A — ]. Это показывает
, что в эквимолярном буфере k A
= [H + ].
Это показывает, как работает буфер. Когда кислота или основание добавляются к буферному раствору,
равновесие буфера будет меняться [HA] с [A — ], чтобы прийти к новому равновесию
.Когда это произойдет, концентрация ионов водорода
изменится гораздо меньше, чем если бы кислота или основание были добавлены к небуферизованному раствору
.
Теперь давайте проделаем аналогичный трюк с уравнением HH. Если [HA] = [A — ],
, член [HA] / [A — ] = 1 и log 1 = 0, поэтому pH =
pK A .
Это указывает на то, что в эквимолярном буфере pH = pK A
и что ОТНОШЕНИЕ [HA] к [A — ] будет определять pH раствора
.Чем дальше соотношение становится от единицы к единице, тем больше pH
от pK A . Буфер имеет
наибольшую буферную способность на pK A
слабой кислоты (или основания). Чем выше концентрация как слабой кислоты
, так и ее конъюгированного иона, тем больше доступна буферная способность.
Титрование
Слово «титрование» рифмуется со словом « плотная нация .«Медицинское использование этого слова немного отличается, но в химии титрование относится к широко используемому методу определения концентрации неизвестной жидкости
путем сравнения ее с известной жидкостью (или известной массой твердого вещества в растворе). Кислотно-основное титрование хорошо, если
учитывается при изучении метода, но есть больше применений для этого метода
Измерение оксалат-иона с использованием перманганата калия в теплой кислотной среде
является хорошим примером окислительно-восстановительного титрования.Титрование по Мору — это определение
концентрации хлорида с использованием известного раствора нитрата серебра и бихромата натрия
в качестве индикатора.
Измеренное количество неизвестного материала в колбе с индикатором обычно составляет
в сочетании с известным материалом из бюретки (рифмуется со словом «вилка»). На бюретке
указывается объем жидкости шкалой с нулем вверху и (обычно) 50 миллилитрами
внизу. Бюретка имеет в нижней части
клапан определенного типа, который может распределять содержащуюся жидкость.
Нет необходимости начинать титрование при известном уровне жидкости в бюретке
на нулевой отметке, но уровень должен находиться в пределах той части бюретки, на которой отмечена отметка
. Бюретка слева показывает около 1,7 мл желтой жидкости в
it, потому что дно мениска находится между отметками 1 и 2 мл и ближе к отметке
2 мл. Большинство лабораторных бюреток можно прочитать с точностью до одной сотой от
миллилитра. (Рисунок слева немного грубоват.Большинство бюреток показывают десять
делений миллилитра, и вы можете интерполировать между отметками.) На бюретке
считывают, находясь на уровне глаз до дна мениска (кривая в жидкости
) и сравнивая нижнюю часть мениска с следы на стекле.
Показания бюретки снимаются до и в конце титрования. Используемое количество известной концентрационной жидкости
представляет собой разницу между начальным и конечным показаниями бюретки
.
Конечная точка титрования обычно отображается с помощью какого-либо индикатора.
A pH-индикатор представляет собой материал, обычно органический краситель, который имеет один цвет выше
, характерного pH, и другой цвет, ниже этого pH. Есть много материалов, которые могут служить индикаторами pH, каждый из которых имеет свой диапазон pH, при котором он меняет цвет. У некоторых наблюдается более чем одно изменение цвета на
при различных значениях pH. Лакмус и фенолфталеин — это
общих индикаторов pH. Лакмус красный для кислоты (ниже pH 4,7) и синий для основания (pH выше 8,1).
Phenolphthalein (Второй «ph» молчит, а «а» и оба «е» — длинные, если это поможет.)
является прозрачным по кислоте (ниже pH 8,4) и розово-пурпурным по основанию (выше pH 9,9). Эти диапазоны
могут показаться большими, но около точки эквивалентности , точки, в которой материалы
равны, наблюдается большое изменение pH. Точка эквивалентности может не наступить при pH 7, нейтральном pH
, поэтому необходимо выбрать соответствующий индикатор pH для типа кислоты и основания
, подлежащих титрованию.
Объем материала неизвестной концентрации известен по тому, сколько его помещают в реакционный сосуд
.Концентрация стандарта известна, а его объем известен как
из измерения жидкости, используемой при титровании.
Если у вас одноосновное основание и одноосновная кислота, формулу титрования можно упростить до:
если C A =
концентрация кислоты и C B =
концентрация основания и V A = = 900 объем раствора кислоты и V B =
объем основания, тогда
В некоторых учебниках для обозначения концентрации в молярных единицах используется символ «M», поэтому формула будет отображаться как M A V A =
M B V B .
Соли
A соль представляет собой комбинацию аниона (- ион) и катиона (ион
+). Другой способ представить себе соль — это комбинация аниона определенной кислоты
в сочетании с катионом определенного основания. Нейтрализация
гидроксида калия соляной кислотой дает воду и соль
хлорида калия. В твердой соли ионы удерживаются вместе разностью зарядов. Твердые соли
обычно образуют кристаллы, иногда включая определенные молярные количества воды,
, называемые вода гидратации в кристалл.Если соль растворяется в водном растворе
, она обычно диссоциирует (распадается) на анионы и катионы
, составляющие соль.
Соли, растворенные в воде, не могут иметь нейтральный pH. Поваренная соль NaCl имеет нейтральный pH в воде
, но пищевая сода NaHCO 3 очень щелочная при растворении в воде. Возьмите чайную ложку пищевой соды, намочите ее и полностью вымойте руки. (Пищевая сода
— действительно прекрасный материал для мытья рук!) Есть намек на скользкость основ на ваших руках
, который должен был появиться из-за пищевой соды.
Как можно предсказать pH растворенной в воде соли? Фактический pH будет зависеть от типа аниона и катиона, растворимости соли, температуры
раствора и концентрации соли, если она меньше насыщенной.
Вот общие правила:
Соли, состоящие из аниона сильной кислоты и катиона сильного основания
, будут нейтральными солями, то есть водный раствор с этой солью будет иметь pH
, равный семи. (Пример — хлорид натрия)
Соли, состоящие из аниона сильной кислоты и катиона слабого основания
, будут кислыми солями, то есть водный раствор с этой солью будет иметь pH
менее семи.(Пример — хлорид аммония)
Соли, состоящие из аниона слабой кислоты и сильного основания, будут
солью щелочного металла. PH раствора будет больше семи. (Пример — бикарбонат натрия)
Может быть немного сложнее определить pH раствора соли, если соль
состоит из аниона слабой кислоты и катиона слабого основания. Обычно
основным определяющим фактором является то, является ли слабая кислота слабее, чем слабое основание,
, но это не всегда так.Для целей раздела обзора
вы можете сказать, что pH «слабо-слабой» соли является неопределенным.
Проблемы титрования и pH
СЛЕДУЮЩИЕ СОЛИ В ВОДНОМ РАСТВОРЕ БУДУТ ИМЕТЬ pH 7, <7 (менее 7),> 7 (более
, чем 7) ИЛИ НЕОПРЕДЕЛЕННЫЙ (I). ДЛЯ КАЖДОГО ПРОГНОЗИРУЙТЕ pH РЕШЕНИЯ.
| 1. Na 2 CO 3 | 2.FeCl 3 | 3. KNO 3 | 4. NH 4 C 2 H 3 9187 9187 918 918 31 918 31 918 31 918 31 918 31 918 31 918 31 |
| 5.ЗнСО 4 | 6. Ba (НЕТ 3 ) 2 | 7. | 8. CaBr 2 |
НАЙДИТЕ pH СЛЕДУЮЩИХ РЕШЕНИЙ. Найдите kA, pKA,
kB и pKB в таблицах
выше.
| 9.0,0115 М HCl | 10. 0,0815 М NaOH | 11. 0,00372 M Ba (OH) 2 | |
| 12. 0,12 M HC 2 H 3 O 1 | 13. 1,35 E-5 H 3 BO 3 | 14.0,255 M NH 4 OH | |
| 15. 0,578 M H 3 PO 4 | 16. 0,16 М HCl и 0,072 М фосфорная кислота. | ||
| 17. 1,25 М уксусная кислота и 0,75 М ацетат калия. | |||
| 18.0,788 М молочной кислоты и 1,27 М лактата кальция. | |||
| 19. 0,590 М гидроксид аммония и 1,57 М хлорид аммония. | |||
| 20. Объясните, как приготовить 5 л 0,15 М буфера уксусная кислота-ацетат натрия при pH 5,00, если у вас есть 1,00 молярная уксусная кислота и кристаллический ацетат натрия. | |||
СЛЕДУЮЩИЕ ПРОБЛЕМЫ ТИТРАЦИИ. ПРЕДПОЛАГАЙТЕ, ЧТО ИНДИКАТОР pH БУДЕТ ПРАВИЛЬНЫМ, ЧТОБЫ БАЛАНСИРОВАТЬ КОЛИЧЕСТВО КИСЛОТЫ И ОСНОВАНИЯ
.НЕКОТОРЫЕ ТИТРАЦИИ НЕ ЯВЛЯЮТСЯ КИСЛОТНЫМИ — ТИТРАЦИИ НА ОСНОВЕ
. СНОВА ПРИНИМАЕМСЯ, ЕСТЬ ИНДИКАТОР, КОТОРЫЙ УКАЗЫВАЕТ, КОГДА СОБИРАЕТСЯ СУММА МОЛЯРОВ
.
21. 23,45 мл 0,275 М гидроксида натрия использовали для титрования против 1 мл уксусной кислоты.
Какова была концентрация уксусной кислоты в M?
22. 17,05 мл 0,247 М гидроксида бария использовали для титрования против 10 мл азотной кислоты
. Какова была концентрация азотной кислоты в M?
23. 35,79 мл 0.275 М гидроксид натрия использовали для титрования против 15 мл серной кислоты
. Какова была концентрация серной кислоты в M?
24. 24,92 мл 0,00199 М нитрата серебра использовали для титрования против 5 мл раствора хлорида натрия
. Какая была концентрация NaCl?
ОТВЕТЫ НА ПРОБЛЕМЫ
| 1.> 7 | 2. <7 | 3. 7 | 4. I | 5.<7 |
| 6. 7 | 7.> 7 | 8,7 | 9. 1,9 | 10. 12.9 |
| 11,9 | 12. 2,8 | 13,6,8 | 14. 11,3 | 15. 1,2 |
| 16. 0,8 | 17. 4.5 | 18.3,6 | 19. 8,8 | |
| 20. Взвесьте 39,1 г ацетата натрия, отмерьте 274 мл 1,00 молярной уксусной кислоты и поместите в 5-литровую мерную колбу . Растворите, затем заполните мерную колбу дистиллированной водой до линии и перемешайте. | ||||
| 21. 1,29 M | 22. 0,842 M | 23. 0,328 M | 24.9.92 Э-3 М | |
Кислоты и основания
Для наших целей в этом месте текста мы можем определить вещество acidA по крайней мере с одним атомом водорода, которое может диссоциировать с образованием аниона и иона H + (протона) в водном растворе, тем самым образование кислого раствора. как вещество, имеющее по крайней мере один атом водорода, который может диссоциировать с образованием аниона и иона H + (протон) в водном растворе, тем самым образуя кислотный раствор . Мы можем определить основания: вещество, которое при растворении в водном растворе образует один или несколько гидроксид-ионов (OH-) и катион, образуя, таким образом, основной раствор.как соединения, которые при растворении в воде производят ионы гидроксида (OH — ) и катион, образуя, таким образом, основной раствор . Растворы, которые не являются ни щелочными, ни кислыми, являются нейтральными . Мы обсудим химию кислот и оснований более подробно в главе 4 «Реакции в водном растворе», главе 8 «Ионная и ковалентная связь» и главе 16 «Водные кислотно-основные равновесия», но в этом разделе мы описываем номенклатуру обычных кислот и определите некоторые важные основания, чтобы вы могли распознать их в будущих обсуждениях.Чистые кислоты и основания и их концентрированные водные растворы обычно встречаются в лаборатории. Обычно они очень едкие, поэтому с ними нужно обращаться осторожно.
Кислоты
Названия кислот различаются между (1) кислотами, в которых ион H + присоединен к атому кислорода многоатомного аниона (они называются оксокислотами, кислотой, в которой диссоциируемый ион H + присоединен к атому кислорода многоатомного аниона). анион., или иногда оксикислоты () и (2) кислоты, в которых ион H + присоединен к какому-либо другому элементу.В последнем случае название кислоты начинается с hydro — и заканчивается — ic , с корнем названия другого элемента или иона между ними. Напомним, что название аниона, производного от этой кислоты, всегда заканчивается на — ide . Таким образом, газообразный хлористый водород (HCl) растворяется в воде с образованием соляной кислоты (которая содержит ионы H + и Cl —), газ цианистого водорода (HCN) образует синильную кислоту (которая содержит H + и CN —). ионы) и т. д. (Таблица 2.8 «Некоторые распространенные кислоты, не содержащие кислород»). Примеры такого типа кислоты встречаются часто и очень важны. Например, ваш желудок содержит разбавленный раствор соляной кислоты, который помогает переваривать пищу. Когда механизмы, препятствующие перевариванию желудка, не работают, кислота разрушает слизистую оболочку желудка и образуется язва.
Обратите внимание на узор
Кислоты различаются по тому, присоединен ли ион H + к атому кислорода многоатомного аниона или к какому-либо другому элементу.
Таблица 2.8 Некоторые распространенные кислоты, не содержащие кислород
| Формула | Название в водном растворе | Название газообразных видов |
|---|---|---|
| HF | плавиковая кислота | фтороводород |
| HCl | соляная кислота | хлористый водород |
| HBr | бромистоводородная кислота | бромистый водород |
| HI | иодистоводородная кислота | иодистого водорода |
| HCN | синильная кислота | цианистый водород |
| H 2 S | сероводородная кислота | сероводород |
Если кислота содержит один или несколько ионов H + , прикрепленных к кислороду, это производное одного из обычных оксоанионов, такого как сульфат (SO 4 2-) или нитрат (NO 3 — ).Эти кислоты содержат столько ионов H + , сколько необходимо для уравновешивания отрицательного заряда аниона, в результате чего образуются нейтральные частицы, такие как H 2 SO 4 и HNO 3 .
Названия кислот образованы от названий анионов в соответствии со следующими правилами:
- Если название аниона оканчивается на — ate , то название кислоты оканчивается на — ic . Например, поскольку NO 3 — — это нитрат-ион, HNO 3 — азотная кислота.Аналогично, ClO 4 — — это перхлорат-ион, поэтому HClO 4 — это хлорная кислота. Двумя важными кислотами являются серная кислота (H 2 SO 4 ) из сульфат-иона (SO 4 2-) и фосфорная кислота (H 3 PO 4 ) из фосфат-иона (PO 4 3-). В этих двух названиях используется небольшой вариант корня имени аниона: sulf ate становится sulf ic, а phosph ate становится phosphor ic.
- Если название аниона оканчивается на — ite , то название кислоты оканчивается на — ous . Например, OCl — — это ион гипохлорита, а HOCl — хлорноватистая кислота; NO 2 — — ион нитрита, а HNO 2 — азотистая кислота; и SO 3 2- представляет собой сульфит-ион, а H 2 SO 3 представляет собой сернистую кислоту. Одинаковые корни используются независимо от того, заканчивается ли название кислоты на — ic или — ous ; таким образом, сульфит становится сернистым .
Взаимосвязь между названиями оксокислот и исходными оксоанионами проиллюстрирована на рисунке 2.20 «Взаимосвязь между названиями оксокислот и именами исходных оксоанионов», а некоторые распространенные оксокислоты представлены в таблице 2.9 «Некоторые общие оксоанионы» .
Рисунок 2.20 Связь между названиями оксокислот и названиями родительских оксоанионов
Таблица 2.9 Некоторые распространенные оксокислоты
| Формула | Имя |
|---|---|
| HNO 2 | азотистая кислота |
| HNO 3 | азотная кислота |
| H 2 SO 3 | сернистая кислота |
| H 2 SO 4 | серная кислота |
| H 3 PO 4 | фосфорная кислота |
| H 2 CO 3 | угольная кислота |
| HClO | хлорноватистая кислота |
| HClO 2 | хлорноватистая кислота |
| HClO 3 | хлорная кислота |
| HClO 4 | хлорная кислота |
Пример 11
Назовите и дайте формулу каждой кислоты.
- кислота, образованная присоединением протона к гипобромит-иону (OBr — )
- кислота, образованная присоединением двух протонов к селенат-иону (SeO 4 2-)
Дано: анион
Запрошено: исходная кислота
Стратегия:
См. Таблицу 2.8 «Некоторые распространенные кислоты, не содержащие кислород» и Таблицу 2.9 «Некоторые обычные оксикислоты», чтобы узнать название кислоты. Если кислоты нет в списке, воспользуйтесь приведенными ранее рекомендациями.
Решение:
Ни один из видов не указан в Таблице 2.8 «Некоторые распространенные кислоты, не содержащие кислород» или Таблице 2.9 «Некоторые распространенные оксокислоты», поэтому мы должны использовать информацию, приведенную ранее, чтобы получить название кислоты из названия многоатомного аниона.
- Название аниона, гипобромит , оканчивается на — ите , поэтому название исходной кислоты оканчивается на — ous .Таким образом, кислота представляет собой гипобромистую кислоту (HOBr).
- Selenate оканчивается на — ate , поэтому название исходной кислоты оканчивается на — ic . Таким образом, кислота представляет собой селеновую кислоту (H 2 SeO 4 ).
Упражнение
Назовите и дайте формулу каждой кислоты.
- кислота, образованная добавлением протона к пербромат-иону (BrO 4 —)
- кислота, образованная присоединением трех протонов к иону арсенита (AsO 3 3-)
Ответ:
- пербромовая кислота; HBrO 4
- мышьяковистая кислота; H 3 AsO 3
Многие органические соединения содержат карбонильную группу: Атом углерода, связанный двойной связью с атомом кислорода.Это характерная особенность многих органических соединений, в том числе карбоновых кислот, в которых имеется двойная связь углерод-кислород. В карбоновых кислотах: органическое соединение, которое содержит группу -OH, ковалентно связанную с атомом углерода карбонильной группы. Общая формула карбоновой кислоты — RCO2H. В воде карбоновая кислота диссоциирует с образованием кислого раствора. Группа –ОН ковалентно связана с атомом углерода карбонильной группы. Их общая формула — RCO 2 H, иногда обозначаемая как RCOOH:
.
, где R может быть алкильной группой, арильной группой или атомом водорода.Простейший пример, HCO 2 H, представляет собой муравьиную кислоту , названную так потому, что она содержится в выделениях жалящих муравьев (от латинского formica , что означает «муравей»). Другой пример — уксусная кислота (CH 3 CO 2 H), которая содержится в уксусе. Как и многие кислоты, карбоновые кислоты имеют резкий запах. Например, масляная кислота (CH 3 CH 2 CH 2 CO 2 H) отвечает за запах прогорклого масла, а характерный запах кислого молока и рвоты обусловлен молочной кислотой [CH 3 CH (OH) CO 2 H].Некоторые распространенные карбоновые кислоты показаны на Рисунке 2.21 «Некоторые общие карбоновые кислоты».
Рисунок 2.21 Некоторые общие карбоновые кислоты
Хотя карбоновые кислоты являются ковалентными соединениями, когда они растворяются в воде, они диссоциируют с образованием ионов H + (как и любая другая кислота) и ионов RCO 2 —. Обратите внимание, что только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + .Напротив, атом водорода, присоединенный к атому кислорода спирта, не диссоциирует , а не с образованием иона H + , когда спирт растворяется в воде. Причины разницы в поведении карбоновых кислот и спиртов будут обсуждаться в главе 8 «Ионная связь в сравнении с ковалентной связью».
Обратите внимание на узор
Только водород, присоединенный к атому кислорода группы CO 2 , диссоциирует с образованием иона H + .
Базы
Мы представим более подробные определения оснований в следующих главах, но фактически каждое основание, с которым вы столкнетесь, будет ионным соединением, таким как гидроксид натрия (NaOH) и гидроксид бария [Ba (OH) 2 ], которые содержат ион гидроксида и катион металла. Они имеют общую формулу M (OH) n . Важно понимать, что спирты с общей формулой ROH являются ковалентными соединениями, а не ионными соединениями; следовательно, они не , а диссоциируют в воде с образованием основного раствора (содержащего ионы OH — ).Когда основание вступает в реакцию с любой из рассмотренных кислот, оно принимает протон (H + ). Например, гидроксид-ион (OH — ) принимает протон с образованием H 2 O. Таким образом, основания также называют акцепторами протонов .
Концентрированные водные растворы аммиака (NH 3 ) содержат значительные количества гидроксид-иона, хотя растворенное вещество представляет собой , а не , в основном гидроксид аммония (NH 4 OH), как часто указывается на этикетке.Таким образом, водный раствор аммиака также является обычным основанием. Замена атома водорода NH 3 на алкильную группу приводит к органическому соединению amineAn, имеющему общую формулу RNh3, где R представляет собой алкильную группу. Амины, как и аммиак, являются основаниями. (RNH 2 ), которая также является базой. Амины имеют резкий запах — например, метиламин (CH 3 NH 2 ) является одним из соединений, ответственных за неприятный запах, связанный с испорченной рыбой. На физиологическое значение аминов указывает слово витамин , которое происходит от словосочетания жизненно важные амины .Это слово было придумано для описания пищевых веществ, которые были эффективны при предотвращении цинги, рахита и других заболеваний, потому что эти вещества считались аминами. Впоследствии было подтверждено, что некоторые витамины являются аминами.
Обратите внимание на узор
Гидроксиды металлов (MOH) дают ионы OH — и являются основаниями, спирты (ROH) не дают ионов OH — или H + и являются нейтральными, а карбоновые кислоты (RCO 2 H) дают H + ионов и кислоты.
Сводка
Общие кислоты и производные от них многоатомные анионы имеют свои собственные названия и правила номенклатуры. Номенклатура кислот различается между оксокислотами , в которых ион H + присоединен к атому кислорода многоатомного иона, и кислотами, в которых ион H + присоединен к другому элементу. Карбоновые кислоты — важный класс органических кислот.Аммиак является важным основанием , как и его органические производные, амины .
Ключевые вынос
- Обычные кислоты и производные от них многоатомные анионы имеют свои собственные названия и правила номенклатуры.
Концептуальные проблемы
Назовите каждую кислоту.
- HCl
- HBrO 3
- HNO 3
- H 2 SO 4
- HIO 3
Назовите каждую кислоту.
- HBr
- H 2 SO 3
- HClO 3
- HCN
- H 3 PO 4
Назовите водную кислоту, соответствующую каждому газу.
- бромистый водород
- цианистый водород
- йодистый водород
Для каждой структурной формулы запишите сокращенную формулу и название соединения.
Для каждой структурной формулы запишите сокращенную формулу и название соединения.
Когда каждое соединение добавляется в воду, является ли полученный раствор кислотным, нейтральным или основным?
- Канал 3 Канал 2 ОН
- Мг (OH) 2
- C 6 H 5 CO 2 H
- LiOH
- C 3 H 7 CO 2 H
- H 2 SO 4
Нарисуйте простейшую структуру каждого типа соединения.
- алкан
- алкен
- алкин
- ароматический углеводород
- алкоголь
- карбоновая кислота
- амин
- циклоалкан
Укажите класс органических соединений, представленных каждым соединением.
- СН 3 СН 2 ОН
- HC≡CH
- C 3 H 7 NH 2
- CH 3 CH = CHCH 2 CH 3
Укажите класс органических соединений, представленных каждым соединением.
- CH 3 C≡CH
Числовые задачи
Напишите формулы для каждого соединения.
- кислота хлорноватистая
- пербромовая кислота
- бромистоводородная кислота
- сернистая кислота
- пербромат натрия
Напишите формулы для каждого соединения.
- иодоводородная кислота
- сероводород
- фосфорная кислота
- хлорная кислота
- гипобромит кальция
Назовите каждое соединение.
- HBr
- H 2 SO 3
- HCN
- HClO 4
- NaHSO 4
Назовите каждое соединение.
- H 2 SO 4
- HNO 2
- К 2 HPO 4
- H 3 PO 3
- Ca (H 2 PO 4 ) 2 · H 2 O
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.

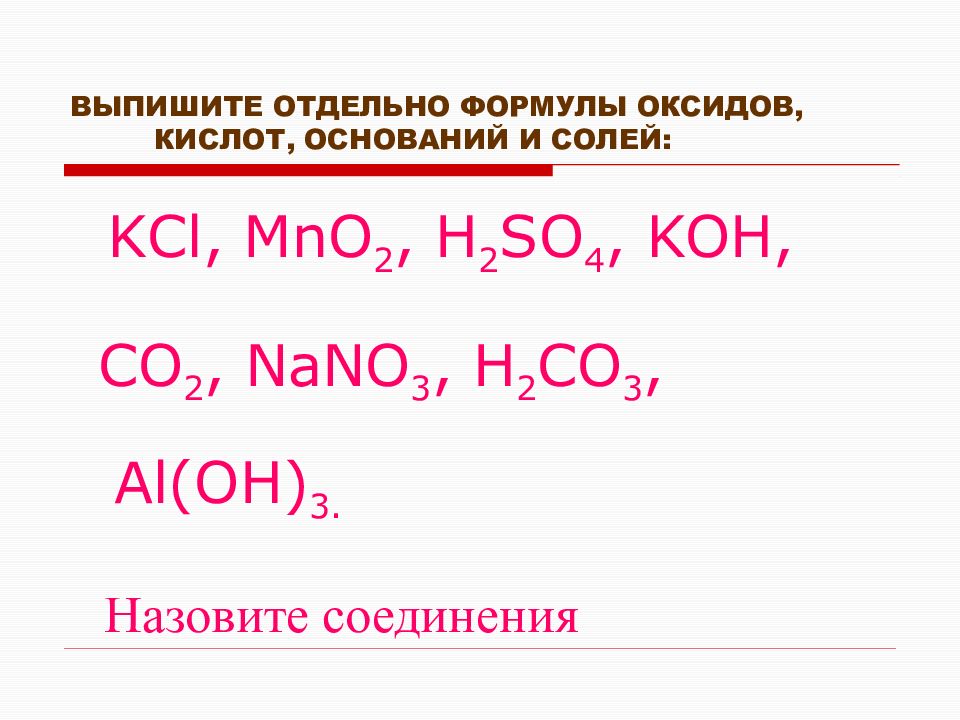 Т. Жуков «Химия 8-9 класс»
Т. Жуков «Химия 8-9 класс»

