Содержание
ОГЭ. Химические свойства оксидов
Правило 9. Химические свойства оксидов
Взаимодействие оксидов с водой
| Правило | Комментарий |
|---|---|
| Основный оксид + H2O → Основание |
Реакция идет, если образуется растворимое основание, а также Ca(OH)2:
CaO + H2O → Ca(OH)2
MgO + H2O → Реакция не идет, так как Mg(OH)2 нерастворим
|
| Амфотерный оксид + H2O → реакция не идет | Амфотерные оксиды, также как и амфотерные гидроксиды, с водой не взаимодействуют |
| Кислотный оксид + H2O → Кислота |
Все реакции идут за исключением SiO2 (кварц, песок):
SiO2 + H2O → реакция не идет
|
Взаимодействие оксидов друг с другом
1. Оксиды одного типа друг с другом не взаимодействуют:
Na2O + CaO → реакция не идет
CO2 + SO3 → реакция не идет
2. Как правило, оксиды разных типов взаимодействуют друг с другом:
Na2O + SO3 → Na2SO4
CaO + CO2 → CaCO3
Na2O + ZnO → Na2ZnO2
Взаимодействие оксидов с кислотами
1. Основные и амфотерные оксиды взаимодействуют с кислотами:
Na2O + HNO3 → NaNO3 + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Исключением является очень слабая нерастворимая (мета)кремниевая кислота H2SiO3. Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
CuO + H2SiO3 → реакция не идет.
2. Кислотные оксиды не вступают в реакции ионного обмена с кислотами, но возможны некоторые окислительно-восстановительные реакции:
SO2 + 2H2S → 3S + 2H2O
SO3 + H2S → SO2 + H2O
Взаимодействие оксидов с основаниями
1. Основные оксиды с щелочами и нерастворимыми основаниями НЕ взаимодействуют.
2. Кислотные оксиды взаимодействуют с основаниями с образованием солей:
SiO2 + 2NaOH → Na2SiO3 +H2O
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3 (если CO2 в избытке, образуется кислая соль)
Рассмотрим подобнее реакцию:
SO3 + 2NaOH → Na2SO4 + H2O
Чтобы правильно написать эту реакцию, нужно вспомнить кислоту, которая соответствует оксиду SO3. Этой кислотой является H2SO4 (так как степени оксиления серы в оксиде SO3 и кислоте H2SO4 совпадают). Далее берем кислотный остаток серной кислоты (SO42–) и соединяем его с металлом, получаем Na2SO4. Также выделяется вода, так как ионы водорода также присутствуют в реакции.
Этой кислотой является H2SO4 (так как степени оксиления серы в оксиде SO3 и кислоте H2SO4 совпадают). Далее берем кислотный остаток серной кислоты (SO42–) и соединяем его с металлом, получаем Na2SO4. Также выделяется вода, так как ионы водорода также присутствуют в реакции.
3. Амфотерные оксиды взаимодействуют с щелочами (т.е. только с растворимыми основаниями) с образованием солей или комплексных соединений:
а) Реакциях с растворами щелочей:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
б) Сплавление с твердыми щелочами:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
(кислота: H2ZnO2)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
(кислота: H2BeO2)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (алюминат натрия)
(кислота: HAlO2)
Взаимодействие оксидов с солями
1. Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
SiO2 + CaCO3 → CaSiO3 + CO2
SiO2 + Na2CO3 → Na2SiO3 + CO2
P2O5 + 3CaCO3 → Ca3(PO4)2 + 3CO2
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
ZnO + 2KHCO3 → K2ZnO2 + 2CO2 + H2O
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
SiO2 + K2SO3 → K2SiO3 + SO2
ZnO + Na2SO3 → Na2ZnO2 + SO2
Если оба оксида являются газообразными, то выделяется тот, который соответствует более слабой кислоте:
K2CO3 + SO2 → K2SO3 + CO2 (H2CO3 слабее и менее устойчива, чем H2SO3)
CaO + NaNO3 → реакция не идет, так как более летучий оксид не образуется.
2. Растворенный в воде CO2 растворяет нерастворимые в воде карбонаты (с образованием растворимых в воде гидрокарбонатов):
CO2 + H2O + CaCO3 → Ca(HCO3)2
CO2 + H2O + MgCO3 → Mg(HCO3)2
В тестовых заданиях такие реакции могут быть записаны как:
MgCO3 + CO2 (р-р), т.е. используется раствор с углекислым газом и, следовательно, в реакцию необходимо добавить воду.
Это один из способов получения кислых солей.
Восстановление слабых металлов и металлов средней активности из их оксидов возможно с помощью водорода, углерода, угарного газа или более активного металла (все реакции проводятся при нагревании):
1. Реакции с CO, C и H2:
CuO + C → Cu + CO
CuO + CO → Cu + CO2
CuO + H2 → Cu + H2O
ZnO + C → Zn + CO
ZnO + CO → Zn + CO2
ZnO + H2 → Zn + H2O
FeO + C → Fe + CO
FeO + CО → Fe + CO2
FeO + H2 → Fe + H2O
Fe2O3 + 3C → 2Fe + 3CO
Fe2O3 + 3CО → 2Fe + 3CO2
Fe2O3 + 3H2 → 2Fe + 3H2O
2. Восстановление оксидов слабых металлов более активным металлом:
Восстановление оксидов слабых металлов более активным металлом:
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3.
Конспект на тему «Химические свойства оксидов»
1. Основные оксиды, образованные щелочными и щелочноземельными металлами, взаимодействуют с водой, образуя растворимое в воде основание — щёлочи.
Основной оксид + вода → основание
Например, при взаимодействии оксида кальция с водой, образуется гидроксид кальция:
CaO+h3O→Ca(OH)2
2. Основные оксиды взаимодействуют с кислотами, образуя соль и воду.
Основной оксид + кислота → соль + вода
Например, при взаимодействии оксида меди с серной кислотой, образуется сульфат меди и вода:
CuO+h3SO4→CuSO4+h3O
3. Основные оксиды могут взаимодействовать с оксидами, принадлежащими к другим классам, образуя соли.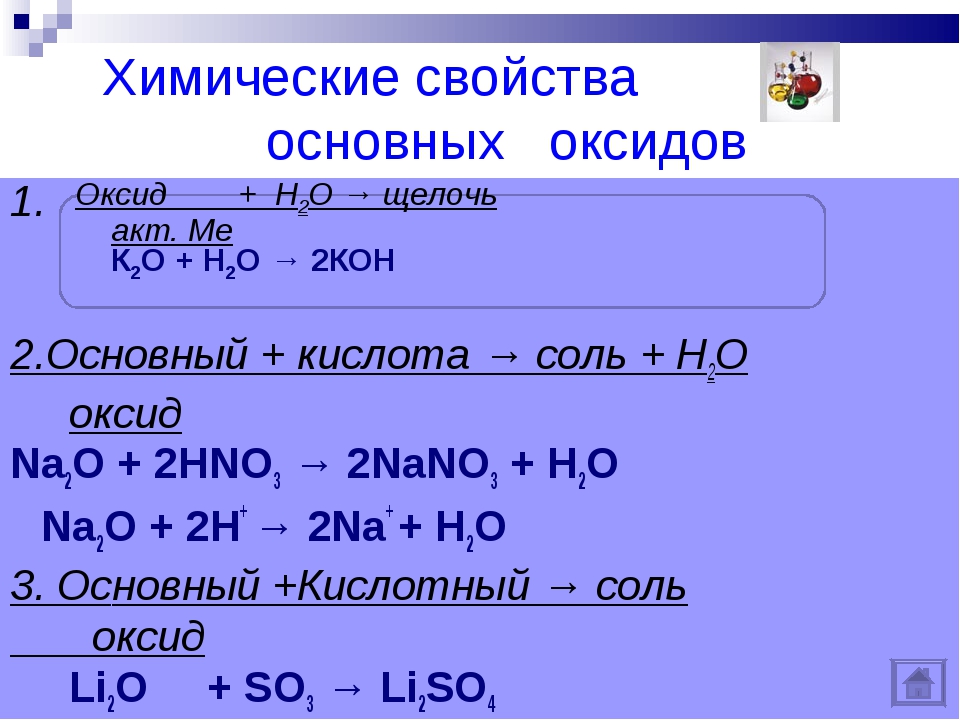
Основной оксид + кислотный оксид → соль
Например, при взаимодействии оксида магния с углекислым газом, образуется карбонат магния:MgO+CO2→MgCO3
Химические свойства кислотных оксидов
1. Кислотные оксиды могут взаимодействовать с водой, образуя кислоты.
Кислотный оксид + вода → кислота
Например, при взаимодействии оксида серы(VI) с водой образуется серная кислота:
SO3+h3O→h3SO4
Обрати внимание!
Оксид кремния SiO2 с водой не реагирует.
2. Кислотные оксиды взаимодействуют со щёлочами, образуя соль и воду.
Кислотный оксид + основание → соль + вода
Например, при взаимодействии оксида серы(IV) с гидроксидом натрия, образуется сульфит натрия и вода:
SO2+2NaOH→Na2SO3+h3O
3. Кислотные оксиды могут реагировать с основными оксидами, образуя соли.
Кислотный оксид + основный оксид → соль
Например, при взаимодействии оксида углерода(IV) с оксидом кальция, образуется карбонат кальция:
CO2+CaO→CaCO3
Химические свойства амфотерных оксидов
1. Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом, проявляют свойства, характерные для основных оксидов. Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду.
Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом, проявляют свойства, характерные для основных оксидов. Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду.
Например, при взаимодействии оксида цинка с соляной кислотой, образуется хлорид цинка и вода: ZnO+2HCl→ZnCl2+h3O
2. Амфотерные оксиды при взаимодействии со щёлочью или с оксидом щелочного или щелочноземельного металла, проявляют кислотные свойства. При сплавлении их со щёлочами протекает химическая реакция, в результате которой образуется соль и вода.
Например, при сплавлении оксида цинка с гидроксидом калия, образуется цинкат калия и вода:
ZnO+2KOH→K2ZnO2+h3O
Если же с гидроксидом калия сплавить оксид алюминия, кроме воды, образуется алюминат калия: Al2O3+2KOH→2KAlO2+h3O
Химические свойства оксидов — Справочник химика 21
В табл. 13—16 приведены способы получения и химические свойства оксидов, гидроксидов, кислот и солей. [c.34]
[c.34]
Химические свойства оксидов и гидроксидов зависят как от положения соответствующего элемента в периодической системе химических элементов Д. И. Менделеева, так и от его степени окисления. Вам уже известно, что в группах сверху вниз увеличиваются атомные радиусы элементов и, следовательно, возрастают металлические свойства. Особенно это характерно для элементов главных подгрупп. В том же направлении усиливаются основные свойства оксидов и гидроксидов соответству-ЮШ.ИХ элементов. В этом можно убедиться при сравнении свойств элементов, их оксидов и гидроксидов, отраженных в таблице 19. [c.116]
Здесь рассматриваются некоторые общие свойства металлов и химические свойства оксидов и пероксидов. (на примере ряда металлов главных подгрупп периодической системы элементов Д. И. Менделеейа). Соединения металлов с серой, галогенами и другими неметаллами, а также некоторые способы получения металлов были представлены в других разделах книги. [c.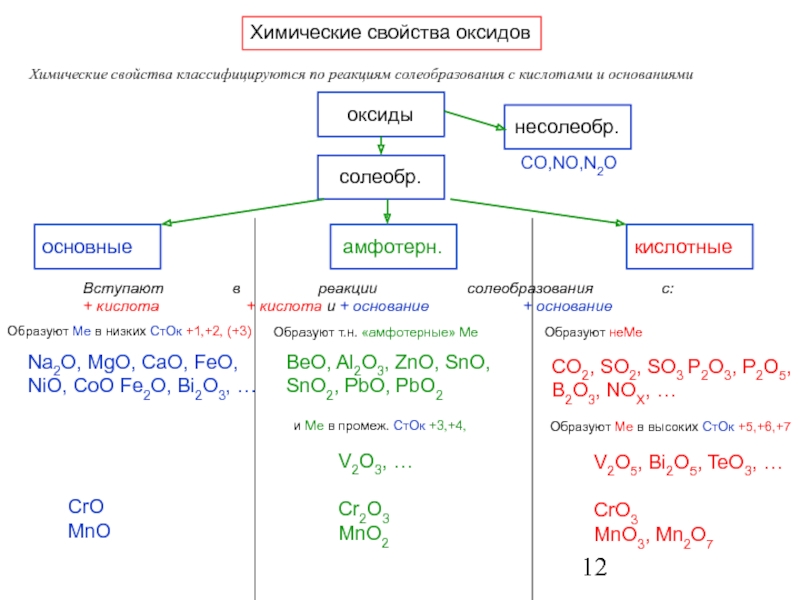 165]
165]
Промотирование оксида алюминия фтором. Изучению физических и химических свойств оксида алюминия посвящены многочисленные исследования. Используемый при синтезе катализатора изомеризации у-оксид алюминия получается при дегидратации гидроксида типа бемит и рассматривается как дефектная шпинель, имеющая плотно упакованную решетку из кислородных ионов и ионов алюминия с координационными [c.43]
Как изменяются физические и химические свойства оксидов элементов главной подгруппы IV группы с увеличением порядкового номера элемента Обратите внимание на их агрегатные состояния, плотность, термическую устойчивость, отношение к воде. 0 5-72. Какие из оксидов элементов главной подгруппы IV группы периодической системы реагируют со щелочами и кислотами Напишите уравнения реакций. [c.42]
Элементы П1А-группы. Общая электронная конфигурация, электроотрицательность, степени окисления. Изменение химических свойств оксидов и гидроксидов элементов при увеличении порядкового номера. Бор как неметалл. Оксид и гидроксид бора. Бура. Распространение в природе. [c.176]
Бор как неметалл. Оксид и гидроксид бора. Бура. Распространение в природе. [c.176]
Опишите физические и химические свойства оксида фосфора (V). [c.122]
Как изменяются химические свойства оксидов различных элементов, принадлежащих к одному периоду, при переходе слева направо вдоль периода [c.324]
По химическим свойствам оксиды разделяют на кислотные, основные, амфотерные и несолеобразующие. К амфотерным оксидам относят те оксиды, которые могут проявлять свойства как основных, так и кислотных оксидов. К несолеобразующим относится, [c.150]
Но химическим свойствам оксид азота(II) относится к числу безразличных оксидов, так как не образует никакой кислоты. [c.408]
Химические свойства оксидов см. раздел 7.2. в части I и табл. 1. [c.296]
Как изменяются химические свойства оксидов и гидроксидов железа, кобальта и никеля в степени окисления ( + 11) Подтвер >кдает ли найденная Вами тенденция изменения свойств в ряду Ре—Со—N1 необходимость перестановки положений N1″ и Со в Периодической системе элементов (атомная масса никеля меньше, чем у кобальта), проведенной Д. И. Менделеевым [c.143]
И. Менделеевым [c.143]
Рассмотрите проявление диагональной периодичности литий->магний на примерах получения и химических свойств оксидов, нитридов, гидридов, гидроксидов, карбонатов, фторидов, ортофосфатов, перхлоратов. [c.255]
Физические и химические свойства. Оксид серы (IV), или сернистый газ, ЗОг — бесцветный тяжелый газ с резким удушливым запахом. [c.191]
Химические свойства оксидов азота [c.301]
Химические свойства оксидов [c.14]
Различные модификации и разновидности оксида алюминия широко применяются для приготовления катализаторов [1271. Используемый в качестве носителя бифункциональны.х катализаторов риформинга, промотированный хлором или фтором ok hj алюминия играет важную роль в катализе, поскольку на нем протекают кис-лотно-каталнзируемые реакции. Поэтому большое значение имеют физико-химические свойства оксида алюминия, а также содержание в нем примесей. Регулированиесвойств окснда алюминия достигается за счет изменения методов и условий синтеза исходной гидроокиси и ее последующей обработки (промывки, формовки, сушки и прокаливания). [c.63]
Регулированиесвойств окснда алюминия достигается за счет изменения методов и условий синтеза исходной гидроокиси и ее последующей обработки (промывки, формовки, сушки и прокаливания). [c.63]
Какие химические свойства оксидов азота проявляются в этих реакциях [c.92]
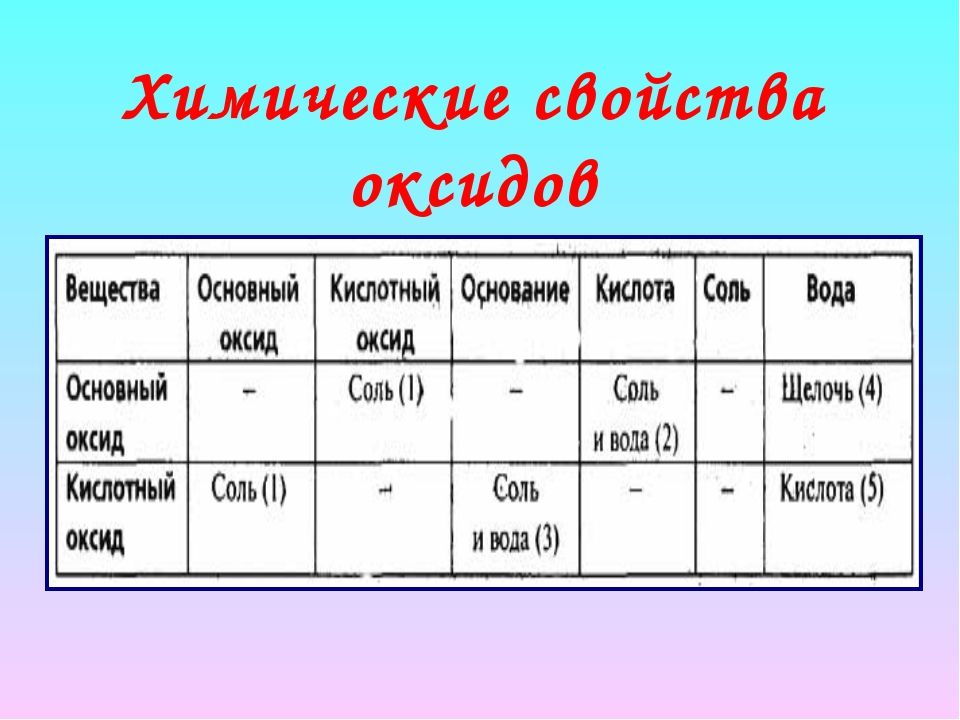
Химические свойства оксидов характеризуются отношением их к кислотам, основаниям и воде. [c.28]
П. Каковы физические и химические свойства оксидов углерода [c.416]
По химическим свойствам оксиды делятся на три группы основные, кислотные и амфотерные. [c.124]
Углерод, его аллотропные формы, химические свойства. Оксиды углерода (II) и (IV), их хшшческие свойства. Угольная кислота и ее соли. [c.155]
Химические свойства. Важнейшие химические свойства оксидов обусловливаются их отношением к кислотам и основаниям. [c. 125]
125]
Рассмотрите элементы второго короткого периода (Na- l) с учетом их электронного строения, способности к образованию связей, а также химических свойств оксидов и гидридов. [c.548]
Влияние оксидов азота на коррозию металлов. Имеются ограниченные данные о влиянии оксидов азота на скорость коррозии металлов в атмосферных условиях. Вместе с тем химические свойства оксидов азота в известном смысле аналогичны свойствам сернистого газа. [c.63]
Получение и химические свойства оксидов, оснований, кислот н солей [c.66]
Химические свойства. Оксиды энергично реагируют с водой, образуя щелочи [c.182]
Химические свойства. Оксиды Нд обладают основными свойствами 7пО, СёО — амфотерные оксиды. При взаимодействии ЭО с кислотами образуются устойчивые аквакомплексы типа [Э(ОН2)4] + и [Э (ОН2)б] + для [c.416]
Химические свойства оксидов -металлов зависят от степени окисления металла. По существу, лишь один СггОз является пассивирующим оксидом при высоких температурах. [c.361]
По существу, лишь один СггОз является пассивирующим оксидом при высоких температурах. [c.361]
По химическим свойствам оксиды разделяются на следующие типы [c.4]
Химические свойства. Оксиды М , Са, 5г, Ва — основного характера, ВеО проявляет амфотерные свойства. Химическая активность ЭО увеличивается в ряду ВеО— ВаО. Оксиды, кроме ВеО, реагируют с водой МдО реагирует частично с горячей водой [c.196]
По химическим свойствам оксид кремния (IV) 810о относится к кислотным оксидам. При сплавлении его с твердыми щелочами, основными окс1 дами и карбонатами образу отся солп кремниевой кислоты [c.141]
Химические свойства. Оксиды Xe(Vl, VHI)—неустойчивые соединения, разлагаются уже при комнатной температуре, особенно легко Хе04 [c.394]
Химические свойства оксидов А1, Оа, 1п и Т1 постепенно изменяются с увеличением главного квантового числа п. А1зОз — типичный амфотерный оксид, образующий два типа солей [c. 409]
409]
По химическим свойствам оксид кремния (IV) SiOa относится к к слотным оксидам. При сплавлении его с твердыми щелочами, основными оксидами и карбонатами образуются соли кремниевой кислоты [c.216]
В чем различие химических свойств оксидов углерода (II) и (IV) Чем это вызвано Привехцгге соответствующие уравнения реакций. [c.79]
Химические свойства оксидов отражаются в их клас-С11([>нкацни, приведенной на рнс. 2.2 (в скобках даны примеры каждою шпа). [c.19]
Физические и химические свойства оксидов?
РЕШЕНИЕ
Физические и химические свойства оксидов очень отличаются. При комнатной температуре большинство оксидов являются твердыми веществами, например, меди (II) оксид CuO черного цвета, кальций оксид CaO белого цвета, хром (III) оксид Cr2O3 темно-зеленого цвета. Некоторые оксиды являются жидкостями, например, водород оксид (вода h3O и Cl2O7 являются бесцветными жидкостями, а некоторые — газообразными веществами, например карбон (IV) оксид CO2 является газом без цвета, а азот (IV) оксид NO2 являются бурым газом. Некоторые оксиды являются веществами с молекулярным строением, другие имеют ионную строение
Некоторые оксиды являются веществами с молекулярным строением, другие имеют ионную строение
Физические и химические свойства оксидов
Физические и химические свойства оксидов очень отличаются. При комнатной температуре большинство оксидов являются твердыми веществами, например, меди (II) оксид CuO черного цвета, кальций оксид CaO белого цвета, хром (III) оксид Cr2O3 темно-зеленого цвета. Некоторые оксиды являются жидкостями, например, водород оксид (вода h3O и Cl2O7 являются бесцветными жидкостями, а некоторые — газообразными веществами, например карбон (IV) оксид CO2 является газом без цвета, а азот (IV) оксид NO2 являются бурым газом. Некоторые оксиды являются веществами с молекулярным строением, другие имеют ионную строение.
Основные и кислотные оксиды проявляют разные свойства. Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами. С водой непосредственно реагируют оксиды щелочных металлов (оксиды лития, натрия, калия, рубидия и цезия и окислы щелочноземельных металлов (оксиды кальция, стронция и бария. Рассмотрим примеры уравнений типовых химических реакций, которые подтвержт указанные свойства основных оксидов.
Рассмотрим примеры уравнений типовых химических реакций, которые подтвержт указанные свойства основных оксидов.
1. Взаимодействие основного оксида с кислотным оксидом с образованием соли
CaO + SiO2 CaSiO3
2. Взаимодействие основного оксида с амфотерными оксидом с образованием соли
Na2O + Al2O3 2NaAlO2
3. Взаимодействие основного оксида с водой с образованием основания:
BaO + h3O = Ba (OH) 2
4. Взаимодействие основного оксида с кислотой с образованием соли и воды:
MgO + 2HCl = MgCl2 + h3O
Кислотные оксиды могут вступать в реакции с основными и амфотерными оксидами, с растворимыми в воде основаниями (щелочами. Многие кислотных оксидов взаимодействуют с водой (исключением является кремний (IV) оксид SiO2. Рассмотрим примеры уравнений типовых химических реакций, которые подтвержт указанные свойства кислотных оксидов.
1. Взаимодействие кислотного оксида с основным оксидом с образованием соли
CO2 + Na2O = Na2CO3
2. Взаимодействие кислотного оксида с амфотерными оксидом с образованием соли
SO3 + ZnO = ZnSO4
3. Взаимодействие кислотного оксида с водой с образованием кислоты:
Взаимодействие кислотного оксида с водой с образованием кислоты:
P2O5 + 3h3O = 2h4PO4
4. Взаимодействие кислотного оксида со щелочью с образованием соли и воды:
SO2 + 2KOH = K2SO3 + h3O
Амфотерными оксидам присущи свойства как основных, так и кислотных оксидов. То есть они могут реагировать как с кислотными, так и с основными оксидами с образованием солей. Кроме того, амфотерные оксиды могут взаимодействовать как с кислотами, так и со щелочами с образованием солей и воды. Например:
ZnO + h3SO4 = ZnSO4 + h3O
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Оксид алюминия | Сульфат алюминия
Оксид алюминия — это обычное встречающееся в природе соединение, которое используется в различных отраслях промышленности, особенно в производстве алюминия. Используется в производстве промышленной керамики. Его наиболее распространенная кристаллическая форма, корунд, также имеет несколько разновидностей ювелирного качества.
Химические свойства
Существует множество различных форм оксида алюминия, включая как кристаллические, так и некристаллические формы.Химическая формула оксида алюминия — Al₂O₃. Это электрический изолятор, что означает, что он не проводит электричество, а также имеет относительно высокую теплопроводность. Кроме того, в кристаллической форме, корунд, его твердость делает его пригодным в качестве абразива. Высокая температура плавления оксида алюминия делает его хорошим огнеупорным материалом для футеровки высокотемпературных устройств, таких как обжиговые печи, печи, мусоросжигательные печи, реакторы различных типов и тигли.
Кроме того, в кристаллической форме, корунд, его твердость делает его пригодным в качестве абразива. Высокая температура плавления оксида алюминия делает его хорошим огнеупорным материалом для футеровки высокотемпературных устройств, таких как обжиговые печи, печи, мусоросжигательные печи, реакторы различных типов и тигли.
Использование в производстве алюминия
Чаще всего оксид алюминия используется в производстве металлического алюминия.Металлический алюминий реагирует с кислородом, что может вызвать коррозию. Однако, когда алюминий связывается с кислородом с образованием оксида алюминия, он создает тонкое покрытие, которое защищает его от окисления. Это предохраняет алюминий от коррозии и потери прочности. Толщина и другие свойства оксидного слоя могут быть изменены с помощью процесса анодирования. Оксид алюминия также является продуктом процесса плавки алюминия.
Корунд Драгоценные камни
Наиболее распространенной кристаллической формой оксида алюминия является корунд.И рубины, и сапфиры представляют собой корунды ювелирного качества. Своей отличительной окраской они обязаны следам примесей. Рубины получают свой темно-красный цвет и лазерные свойства из-за следов хрома. Сапфиры бывают разных цветов, которые происходят из других примесей, таких как железо и титан. Твердость различных видов корунда делает их пригодными для использования в качестве абразивов и компонентов в режущих инструментах.
Применение в керамике
Оксид алюминия, также называемый оксидом алюминия, используется в инженерной керамике.Он твердый и износостойкий, устойчив к воздействию кислот и щелочей, обладает высокой прочностью и жесткостью, а также хорошей теплопроводностью, что делает его ценным при производстве различных керамических изделий. К ним относятся такие вещи, как высокотемпературные электрические изоляторы и изоляторы напряжения, детали контрольно-измерительных приборов для машин для термических испытаний, уплотнительные кольца, газовые лазерные трубки и другое лабораторное оборудование. Оксид алюминия также используется в производстве баллистической брони.
Другое применение
Поскольку оксид алюминия является довольно инертным химически, белым и относительно нетоксичным, он служит наполнителем в пластмассах.Это также частый ингредиент солнцезащитного крема. Из-за своей твердости и прочности он используется как абразив, в том числе в наждачной бумаге, и как менее дорогой заменитель промышленных алмазов. Некоторые комплекты для полировки CD и DVD содержат оксид алюминия. Те же качества делают его хорошим ингредиентом зубной пасты. Стоматологи используют оксид алюминия в качестве полирующего средства для удаления зубных пятен.
Оксид алюминия используется для различных целей. Самый важный из них — производство металлического алюминия, но, конечно, не единственный.Хотя вы можете этого не знать, рубины и сапфиры состоят из оксида алюминия, что делает его очень ценным элементом!
Формула оксида алюминия
Al2O3
Свойства оксида алюминия
Молярная масса: 101,96 г · моль -1
Точка плавления: 2,072 ° C (3762 ° F; 2345 K)
Точка кипения: 2,977 ° C (5,391 ° F; 3250 K)
Плотность: 3,95–4,1 г / см3
Оксид алюминия: свойства, производство и применение
Глинозем , широко известный как оксид алюминия (Al 2 O 3 ) , представляет собой инертный белый аморфный материал без запаха, часто используемый в промышленной керамике.Благодаря своим выдающимся свойствам, оксид алюминия способствовал значительному увеличению продолжительности жизни и улучшению общества. Он широко используется в медицине и современной войне [1].
Оксид алюминия — это термически нестабильное и нерастворимое соединение, которое встречается в природе в различных минералах, таких как корунд , кристаллический вариант оксида и боксит , который считается его основной алюминиевой рудой [1].
Здесь вы узнаете о:
- Какие основные свойства оксида алюминия
- Как получают оксид алюминия
- Основные области применения оксида алюминия
Свойства оксида алюминия
Благодаря своим превосходным механическим, химическим и термическим свойствам оксид алюминия отличается от многих сопоставимых материалов, предлагая равные или лучшие решения для недорогого производства и производства.
Его производительность зависит от следующих свойств [1], [2], [3]:
Как производится оксид алюминия?
Оксид алюминия часто получают по процессу Байера, который означает рафинирование бокситов для получения глинозема. Следующее обратимое химическое уравнение описывает основы процесса Байера:
Этот процесс начинается с сушки измельченного и промытого боксита, обычно содержащего 30–55% Al2O3 [4]. Боксит растворяется в каустической соде с образованием суспензии, нагретой до температуры примерно 230–520 ° F (110–270 ° C).Затем эту смесь фильтруют для удаления остатков, называемых примесями «красного шлама».
Отфильтрованный раствор оксида алюминия (гидроксид алюминия) затем переносится или перекачивается в резервуары-осадители, где он охлаждается и начинает засеивать. Эти зародыши стимулируют процесс осаждения, позволяя формировать твердые кристаллы гидроксида алюминия. Весь гидроксид алюминия, который оседает на дне резервуара, удаляется.
Оставшийся едкий натр вымывается из гидроксида алюминия, который проходит различные уровни фильтрации.Наконец, его нагревают, чтобы полностью удалить лишнюю воду. После прохождения стадии охлаждения получается мелкодисперсный белый порошок [5].
Процесс Байера представлен на Рисунке 1, где показаны все этапы и то, что происходит на каждом этапе.
Рис. 1. Процесс Байера в его современной форме (2017 г.), поскольку этапы удаления кремнезема и оксалата добавлены к исходному процессу Байера 1892 года. Воспроизведено с рис. 3.1 (стр. 51) исх. 1.
Применение оксида алюминия
Большая часть производимого оксида алюминия используется для образования металлического алюминия .Кислород обычно катализирует коррозию в реакции с металлическим алюминием. Однако при связывании с кислородом с образованием оксида алюминия образуется защитное покрытие, предотвращающее дальнейшее окисление. Это добавляет прочности и делает материал менее уязвимым к порче [6].
Отрасли, в которых используется оксид алюминия:
Медицинская промышленность
Благодаря твердости, биоинертности и химическим свойствам оксида алюминия он является предпочтительным материалом для опор при замене тазобедренного сустава, например, протезов, бионических имплантатов, заменителей глазных протезов, тканевых усилителей, зубных коронок, абатментов, мостовидных протезов и других зубных имплантатов.Он также используется в лабораторном оборудовании и инструментах, таких как тигли, печи и другое лабораторное оборудование [1].
Военное и защитное снаряжение
Прочность и легкость оксида алюминия способствуют совершенствованию бронежилетов, таких как нагрудники, а также брони транспортных средств и самолетов, которая является ее крупнейшим рынком сбыта. Оксид алюминия также используется в пуленепробиваемых окнах и баллистике из синтетического сапфира [1].
Электротехническая и электронная промышленность
Его высокие температуры плавления и кипения, в дополнение к его превосходным термоустойчивым свойствам, делают оксид алюминия желательным при производстве высокотемпературной изоляции для печей и электрических изоляторов.Пленки из оксида алюминия также являются жизненно важными компонентами в производстве микрочипов. Некоторые из других его применений включают изоляторы свечей зажигания, микроэлектрические подложки и изолирующие радиаторы [1].
Ювелирная промышленность
Оксид алюминия — ценный элемент при образовании рубинов и сапфиров. Его кристаллическая форма, корунд, является основным элементом для этих драгоценных камней. Рубины обязаны своим темно-красным цветом примесям хрома, в то время как сапфиры получают свой вариант цвета из-за следов железа и титана [6].
Промышленное применение
Поскольку оксид алюминия химически инертен, он используется в качестве наполнителя в пластмассах, кирпиче и другой тяжелой глиняной посуде, например в печах. Из-за своей чрезвычайной прочности и твердости его часто используют в качестве абразива для наждачной бумаги. Это также экономичный заменитель промышленных алмазов [6].
Оксиды алюминия также используются для производства таких компонентов трубопроводов, как колена, тройники, прямые трубы, гидроциклоны, редукторы, сопла и клапаны.Другие области применения включают производство различных обрабатывающих инструментов, режущих инструментов, кожухов для термопар, износостойких рабочих колес насосов и перегородок [1].
[1] A.J. Ruys, Alumina Ceramics: Biomedical and Clinical Applications , UK: Woodhead Publishing, 2018.
[2] CeramTec, Самый известный оксидный керамический материал , CeramTec, Германия, nd, дата обращения: 28 октября 2019 г. [онлайн] Доступно: https://www.ceramtec.com/ceramic-materials / оксид алюминия / #
[3] American Elements, Оксид алюминия , American Elements, США, n.d., дата обращения: 28 октября 2019 г. [Онлайн] Доступно: https://www.americanelements.com/aluminium-oxide-1344-28-1
[4] Guichon Valves, Alumina — Процесс производства глинозема , Guichon Valves, Франция, nd, дата обращения: 28 октября 2019 г. [онлайн] Доступно: https://guichon-valves.com/faqs/alumina -производство-процесс-оксида алюминия /
[5] «Алюминий», дата обращения: 28 октября 2019 г. [Онлайн] Доступно: http://www.madehow.com/Volume-5/Aluminium.html
[6] «Оксид алюминия», n.d., дата обращения: 28 октября 2019 г. [Онлайн] Доступно: https://aluminumsulfate.net/aluminium-oxide
Физические характеристики оксида алюминия
Оксид алюминия представляет собой соединение, состоящее из алюминия и кислорода. Несмотря на металлическое название, он считается керамическим. Его промышленное использование включает определенные типы освещения, такие как натриевые лампы, а развивающаяся нанотехнологическая промышленность использует оксид алюминия в качестве проводника электричества в микроскопических схемах. Оксид алюминия может быть сформирован в волокна тоньше человеческого волоса, что также делает их полезными для фильтрации ДНК.
Общие свойства
Оксид алюминия представляет собой белое порошкообразное вещество без запаха. Он не токсичен, но пыль оксида алюминия, переносимая по воздуху, может представлять опасность на производстве, поэтому при длительном воздействии рекомендуется носить маски. Оксид алюминия очень тяжелый; куб из оксида алюминия со стороной 1 метр весит около 7200 фунтов.
Промышленные свойства
Из компаунда оксида алюминия можно производить механическую обработку или формование в твердые, износостойкие материалы, подходящие для использования в различных промышленных целях.К ним относятся направляющие для проводов, уплотнения для машин, измерительные приборы и высокотемпературные электрические изоляторы.
Химические свойства
Оксид алюминия не растворяется в воде и имеет очень высокую температуру плавления — 2000 ° C или около 3600 F. Его температура кипения чрезвычайно высока — 5400 F. Химическая формула объединяет два атома алюминия с тремя атомами кислорода, который выражается как Al2O3. Это электрический резистор, в отличие от своего родственника из алюминия. Уровень сопротивления меняется в зависимости от чистоты материала.Оксид алюминия не реагирует легко с большинством материалов, но он очень реактивен по отношению к трифториду хлора и оксиду этилена. Смешивание оксида алюминия с любым из этих химикатов вызывает пожар.
Механические свойства
Оксид алюминия — очень твердый материал, почти до уровня алмазов, поэтому он обладает превосходными износостойкими свойствами. Он обладает высокой коррозионной стойкостью и высокой температурной стабильностью, низким тепловым расширением и благоприятным соотношением жесткости к массе. Поскольку оксид алюминия имеет отличный электрический резистор, он часто используется в конденсаторах в качестве диэлектрика, поскольку часть, удерживающая заряды в устройстве, разделена.
Оксид меди (II) | AMERICAN ELEMENTS ®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Оксид меди (II)
Номер продукта: Все применимые коды продуктов American Elements, например CU2-OX-02
, CU2-OX-03
, CU2-OX-04
, CU2-OX-05
Номер CAS: 1317-38-0
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Лос-Анджелес, Калифорния
Тел .: +1 310-208-0551
Факс: +1 310-208-0351
Телефон экстренной связи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТЕЙ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
GHS07
Acute Tox. 4 h402 Вредно при проглатывании.
Классификация в соответствии с Директивой 67/548 / EEC или Директивой 1999/45 / EC
Xn; Вреден для здоровья
R22: Вреден при проглатывании.
N; Опасно для окружающей среды
R50 / 53: Очень токсичен для водных организмов, может оказывать долгосрочное вредное воздействие на водную среду.
Информация об особых опасностях для человека и окружающей среды:
Н / Д
Опасности, не классифицированные иным образом
Данные отсутствуют
Элементы маркировки
Маркировка в соответствии с Постановлением (ЕС) № 1272/2008
Вещество классифицируется и маркируется в соответствии с постановлением CLP .
Пиктограммы, обозначающие опасности
GHS07
Сигнальное слово: Предупреждение
Краткая характеристика опасности
h402 Вредно при проглатывании.
Меры предосторожности
P264 После работы тщательно вымыть.
P270 Не ешьте, не пейте и не курите при использовании этого продукта.
P301 + P312 ПРИ ПРОГЛАТЫВАНИИ: Обратиться в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР / к врачу /…/ при плохом самочувствии.
P330 Прополоскать рот.
P501 Утилизировать содержимое / контейнер в соответствии с местными / региональными / национальными / международными правилами.
Классификация WHMIS
Не контролируется
Система классификации
Рейтинги HMIS (шкала 0-4)
(Система идентификации опасных материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКТИВНОСТЬ
2
0
0
Здоровье (острые эффекты) = 2
Воспламеняемость = 0
Физическая опасность = 0
Другие опасности
Результаты оценки PBT и vPvB
PBT: N / A
vPvB: N / A
РАЗДЕЛ 3.СОСТАВ / ИНФОРМАЦИЯ ОБ ИНГРЕДИЕНТАХ
Вещества
Номер CAS / Название вещества:
1317-38-0 Оксид меди (II)
Идентификационный номер (а):
Номер ЕС: 215-269-1
РАЗДЕЛ 4. ПЕРВЫЙ МЕРЫ ПОМОЩИ
Описание мер первой помощи
При вдыхании:
Обеспечить пациента свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь за медицинской помощью.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь за медицинской помощью.
При попадании в глаза:
Промыть открытый глаз под проточной водой в течение нескольких минут. Проконсультируйтесь с врачом.
При проглатывании:
Обратитесь за медицинской помощью.
Информация для врача
Наиболее важные симптомы и воздействия, как острые, так и замедленные
Данные отсутствуют
Указание на необходимость немедленной медицинской помощи и специального лечения
Данные отсутствуют
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие средства пожаротушения
Продукт не горюч.Примите меры пожаротушения, которые подходят для окружающего пожара.
Особые опасности, исходящие от вещества или смеси
При попадании этого продукта в огонь могут образоваться следующие вещества:
Пары оксида металла
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Надеть полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры личной безопасности, защитное снаряжение и порядок действий в чрезвычайной ситуации
Используйте средства индивидуальной защиты.Не подпускайте к себе незащищенных людей.
Обеспечьте соответствующую вентиляцию.
Меры по защите окружающей среды:
Не допускайте попадания материала в окружающую среду без официального разрешения.
Не допускайте попадания продукта в канализацию, канализацию или другие водоемы.
Не допускайте попадания материала в землю или почву.
Методы и материалы для локализации и очистки:
Утилизировать зараженный материал как отходы в соответствии с разделом 13.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для получения информации о безопасном обращении.
См. Раздел 8 для получения информации о средствах индивидуальной защиты.
Информацию об утилизации см. В Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Хранить контейнер плотно закрытым.
Хранить в сухом прохладном месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров:
Продукт негорючий
Условия безопасного хранения с учетом несовместимости
Требования, предъявляемые к складским помещениям и таре:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от окислителей.
Хранить вдали от алюминия и алюминиевых сплавов.
Хранить вдали от металлических порошков.
Хранить вдали от магния / магниевых сплавов.
Хранить вдали от щелочных металлов.
Дополнительная информация об условиях хранения:
Держать емкость плотно закрытой.
Хранить в прохладных, сухих условиях в хорошо закрытых емкостях.
Конечное использование
Нет данных
РАЗДЕЛ 8.КОНТРОЛЬ ВОЗДЕЙСТВИЯ / ИНДИВИДУАЛЬНАЯ ЗАЩИТА
Дополнительная информация о конструкции технических систем:
Правильно работающий вытяжной шкаф для химических веществ, предназначенный для опасных химикатов и имеющий среднюю скорость движения не менее 100 футов в минуту.
Параметры контроля
Компоненты с предельными значениями, требующие контроля на рабочем месте:
Нет.
Дополнительная информация: Нет данных
Средства контроля за опасным воздействием
Средства индивидуальной защиты
Соблюдайте стандартные правила защиты и гигиены при обращении с химическими веществами.
Хранить вдали от продуктов питания, напитков и кормов.
Немедленно снимите всю грязную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Поддерживайте эргономичную рабочую среду.
Дыхательное оборудование:
При высоких концентрациях используйте подходящий респиратор.
Рекомендуемое фильтрующее устройство для краткосрочного использования:
Используйте респиратор с картриджами типа N95 (США) или PE (EN 143) в качестве резервного средства технического контроля. Следует провести оценку рисков, чтобы определить, подходят ли респираторы для очистки воздуха.Используйте только оборудование, проверенное и одобренное соответствующими государственными стандартами.
Защита рук: Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Материал перчаток
Нитрилкаучук, NBR
Время проницаемости материала перчаток (в минутах): Данные отсутствуют
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9.ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физических и химических свойствах
Внешний вид:
Форма: Различные формы (порошок / хлопья / кристаллы / шарики и т. Д.)
Цвет: Черный
Запах: Без запаха
Порог запаха: Нет данных.
pH: нет данных
Точка плавления / интервал плавления: 1326 ° C (2419 ° F)
Точка кипения / интервал кипения: данные отсутствуют
Температура сублимации / начало: данные отсутствуют
Воспламеняемость (твердое тело, газ): нет данных имеется в наличии.
Температура возгорания: данные отсутствуют
Температура разложения: данные отсутствуют
Самовоспламенение: данные отсутствуют.
Взрывоопасность: данные отсутствуют.
Пределы взрываемости:
Нижний: данные отсутствуют
Верхние: данные отсутствуют
Давление пара:
НЕТ
Плотность при 20 ° C (68 ° F): 6,3-6,49 г / см 3 (52,574-54,159 фунтов) / гал)
Относительная плотность: Нет данных.
Плотность пара: N / A
Скорость испарения: N / A
Растворимость в воде (H 2 O): Нерастворимый
Коэффициент распределения (н-октанол / вода): данные отсутствуют.
Вязкость:
Динамическая: нет
Кинематическая: нет
Другая информация
Нет данных
РАЗДЕЛ 10.СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Данные отсутствуют
Химическая стабильность
Стабилен при рекомендуемых условиях хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит при использовании и хранении в соответствии со спецификациями.
Возможность опасных реакций
Об опасных реакциях не известно
Условия, которых следует избегать
Данные отсутствуют
Несовместимые материалы:
Окислители
Порошки металлов
Щелочные металлы
Алюминий / алюминиевые сплавы.
Магний / сплавы магния
Опасные продукты разложения:
Дым оксида металла
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Вредно при проглатывании.
Реестр токсических эффектов химических веществ (RTECS) содержит данные об острой токсичности этого вещества.
Значения LD / LC50, имеющие отношение к классификации: LD50 при пероральном приеме 470 мг / кг (крыса)
Раздражение или разъедание кожи: Может вызывать раздражение
Раздражение или разъедание глаз: Может вызывать раздражение
Сенсибилизация: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевой клетки:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о мутациях этого вещества.
Канцерогенность:
EPA-D: Канцерогенность для человека не поддается классификации: неадекватные доказательства канцерогенности для человека и животных или данные отсутствуют.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая системная токсичность, поражающая отдельные органы-мишени — многократное воздействие: Эффекты неизвестны.
Специфическая системная токсичность, поражающая отдельные органы-мишени — однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о токсичности при множественных дозах этого вещества.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Водная токсичность:
Данные отсутствуют
Стойкость и разлагаемость
Нет данных имеется
Потенциал биоаккумуляции
Данные отсутствуют
Подвижность в почве
Данные отсутствуют
Экотоксические эффекты:
Примечание:
Очень токсично для водных организмов
Дополнительная экологическая информация:
Не допускать попадания материала в окружающую среду без официальных разрешений.
Не допускайте попадания неразбавленного продукта или больших количеств продукта в грунтовые воды, водоемы или канализацию.
Также ядовит для рыб и планктона в водоемах.
Может вызывать длительные вредные последствия для водных организмов.
Избегать попадания в окружающую среду.
Очень токсичен для водных организмов
Результаты оценки PBT и vPvB
PBT: N / A
vPvB: N / A
Другие побочные эффекты
Данные отсутствуют
РАЗДЕЛ 13. УТИЛИЗАЦИЯ
Рекомендации Методы обработки отходов
Проконсультироваться официальные правила для обеспечения надлежащей утилизации.
Неочищенная тара:
Рекомендация:
Утилизация должна производиться в соответствии с официальными предписаниями.
РАЗДЕЛ 14. ТРАНСПОРТНАЯ ИНФОРМАЦИЯ
Номер ООН
DOT, IMDG, IATA
UN3077
Собственное транспортное наименование ООН
DOT
Вещества, опасные для окружающей среды, твердые, н.у.к. (Оксид меди (II))
IMDG, IATA
ВЕЩЕСТВО, ОПАСНОЕ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ, ТВЕРДОЕ, Н.У.К. (Оксид меди (II))
Класс (ы) опасности при транспортировке
DOT, IMDG
Class
9 Прочие опасные вещества и предметы.
Этикетка
9
Класс
9 (M7) Прочие опасные вещества и изделия
Этикетка
9
IATA
Класс
9 Прочие опасные вещества и изделия.
Этикетка
9
Группа упаковки
DOT, IMDG, IATA
III
Опасности для окружающей среды:
Специальная маркировка (ADR):
Символ (рыба и дерево)
Специальная маркировка (IATA):
Символ (рыба и дерево)
Особые меры предосторожности для пользователя
Предупреждение: Прочие опасные вещества и предметы
Номер EMS:
FA, SF
Транспортировка навалом согласно Приложению II MARPOL73 / 78 и Кодексу IBC
N / A
Транспортировка / Дополнительная информация:
DOT
Морской загрязнитель ( DOT):
№
Типовой регламент ООН:
UN3077, Вещества твердые, опасные для окружающей среды, n.Операционные системы. (Оксид меди (II)), 9, III
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Нормы / законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в США. Агентство по защите закона о контроле за токсичными веществами Перечень химических веществ.
Все компоненты этого продукта занесены в Канадский список веществ, предназначенных для домашнего использования (DSL).
SARA Раздел 313 (списки конкретных токсичных химикатов)
1317-38-0 Оксид меди (II)
Предложение 65 Калифорнии
Предложение 65 — Химические вещества, вызывающие рак
Вещество не указано.
Предложение 65 — Токсичность для развития
Вещество не указано.
Предложение 65 — Токсичность для развития, женщины
Вещество не указано.
Предложение 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Для использования только технически квалифицированными специалистами.
Другие постановления, ограничения и запретительные постановления
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (EC) № 1907/2006.
Вещества нет в списке.
Должны соблюдаться условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещества нет в списке.
Приложение XIV Правил REACH (требуется разрешение на использование)
Вещество не указано.
REACH — Предварительно зарегистрированные вещества
Вещество внесено в список.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16.ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Вышеприведенная информация считается правильной, но не претендует на исчерпывающий характер и должна использоваться только в качестве руководства. Информация в этом документе основана на текущем уровне наших знаний и применима к продукту с учетом соответствующих мер безопасности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом.Дополнительные условия продажи см. На обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 AMERICAN ELEMENTS. ЛИЦЕНЗИОННЫМ ДАННЫМ РАЗРЕШЕНО ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННЫХ КОПИЙ БУМАГИ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Поэтапное восстановление оксида графена (GO) и его влияние на химические и коллоидные свойства
Гейм А. К. и Новоселов К. С. Возникновение графена. Nat Mater 6 , 183–191 (2007).
Артикул
PubMed
ОБЪЯВЛЕНИЯ
CAS
Google Scholar
Такур, С. и Карак, Н. Альтернативные методы и природные реагенты для восстановления оксида графена: обзор. Углерод 94 , 224–242, https://doi.org/10.1016/j.carbon.2015.06.030 (2015).
Артикул
CAS
Google Scholar
Чуа, К. и Пумера, М. Химическое восстановление оксида графена: точка зрения синтетической химии. Обзоры химического общества 43 , 291–312, https: // doi.org / 10.1039 / C3CS60303B (2014 г.).
Артикул
PubMed
CAS
Google Scholar
Веласко-Сото, М.А. и др. . Селективное манипулирование запрещенной зоной оксида графена путем его восстановления мягкими реагентами. Углерод 93 , 967–973, https://doi.org/10.1016/j.carbon.2015.06.013 (2015).
Артикул
CAS
Google Scholar
Кониос Д., Стилианакис М. М., Стратакис Э. и Кимакис Э. Дисперсионные свойства оксида графена и восстановленного оксида графена. Journal of Colloid and Interface Science 430 , 108–112, https://doi.org/10.1016/j.jcis.2014.05.033 (2014).
Артикул
PubMed
ОБЪЯВЛЕНИЯ
CAS
Google Scholar
Choi, J. et al. . Контролируемый уровень окисления восстановленных оксидов графена и его влияние на термоэлектрические свойства. Макромолекулярные исследования 22 , 1104–1108, https://doi.org/10.1007/s13233-014-2160-4 (2014).
Артикул
CAS
Google Scholar
Парк С. и Руофф Р. С. Химические методы производства графенов. Нат Нано 4 , 217–224 (2009).
Артикул
CAS
Google Scholar
Mei, X. & Ouyang, J.Сверхбыстрое восстановление оксида графена цинковым порошком при помощи ультразвука при комнатной температуре. Углерод 49 , 5389–5397, https://doi.org/10.1016/j.carbon.2011.08.019 (2011).
Артикул
CAS
Google Scholar
Hua, Z. et al. . Агрегация и повторное суспендирование оксида графена в смоделированных природных поверхностных водных средах. Загрязнение окружающей среды 205 , 161–169, https: // doi.org / 10.1016 / j.envpol.2015.05.039 (2015).
Артикул
PubMed
CAS
Google Scholar
Wu, L. et al. . Кинетика агрегации оксидов графена в водных растворах: эксперименты, механизмы и моделирование. Langmuir 29 , 15174–15181, https://doi.org/10.1021/la404134x (2013).
Артикул
PubMed
CAS
Google Scholar
Doğan, H. Ö., Ekinci, D. & Demir, Ü. Получение изображений в атомном масштабе и спектроскопические характеристики электрохимически восстановленного оксида графена. Surface Science 611 , 54–59, https://doi.org/10.1016/j.susc.2013.01.014 (2013).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google Scholar
Де Силва, К. К., Хуанг, Х. Х., Джоши, Р. К. и Йошимура, М. Химическое восстановление оксида графена с использованием зеленых восстановителей. Углерод 119 , 190–199, https://doi.org/10.1016/j.carbon.2017.04.025 (2017).
Артикул
CAS
Google Scholar
Чоудхури, И., Дач, М. К., Мансукхани, Н. Д., Херсам, М. К. и Бушард, Д. Коллоидные свойства и стабильность наноматериалов оксида графена в водной среде. Наука об окружающей среде и технологии 47 , 6288–6296, https://doi.org/10.1021/es400483k (2013).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google Scholar
Гударзи М. М. Коллоидная стабильность оксида графена: агрегация в двух измерениях. Langmuir 32 , 5058–5068, https://doi.org/10.1021/acs.langmuir.6b01012 (2016).
Артикул
PubMed
CAS
Google Scholar
Han, S. et al. . Непрерывные иерархические гибридные пленки углеродных нанотрубок / восстановленного оксида графена для суперконденсаторов. Electrochimica Acta 225 , 566–573, https://doi.org/10.1016/j.electacta.2016.12.159 (2017).
Артикул
CAS
Google Scholar
Du, R. et al. . Управляемый синтез трехмерных сеток из восстановленного оксида графена для применения в электроде суперконденсатора. Алмаз и сопутствующие материалы 70 , 186–193, https://doi.org/10.1016/j.diamond.2016.11.003 (2016).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google Scholar
Маткар А. и др. . Контролируемое ступенчатое уменьшение и изменение ширины запрещенной зоны оксида графена. The Journal of Physical Chemistry Letters 3 , 986–991, https://doi.org/10.1021/jz300096t (2012).
Артикул
PubMed
CAS
Google Scholar
Теофил Н.И Джеонг, Х. К. Электрохимические свойства композита поливинилового спирта и оксида графена для применения в суперконденсаторах. Chemical Physics Letters 669 , 125–129, https://doi.org/10.1016/j.cplett.2016.12.029 (2017).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google Scholar
Пумера М. Электрохимия графена, оксида графена и других графеноидов: Обзор. Electrochemistry Communications 36 , 14–18, https: // doi.org / 10.1016 / j.elecom.2013.08.028 (2013).
Артикул
CAS
Google Scholar
Паредес, Дж. И., Вильяр-Родил, С., Мартинес-Алонсо, А. и Таскон, Дж. М. Д. Дисперсии оксида графена в органических растворителях. Langmuir 24 , 10560–10564, https://doi.org/10.1021/la801744a (2008).
Артикул
PubMed
CAS
Google Scholar
То, С. Ю., Ло, К. С., Камарудин, С. К. и Дауд, В. Р. В. Производство графена электрохимическим восстановлением оксида графена: синтез и характеристика. Chemical Engineering Journal 251 , 422–434, https://doi.org/10.1016/j.cej.2014.04.004 (2014).
Артикул
CAS
Google Scholar
Чжао, Дж., Лю, Ф., Ван, З., Цао, X. и Син, Б. Гетероагрегация оксида графена с минералами в водной фазе. Наука об окружающей среде и технологии 49 , 2849–2857, https://doi.org/10.1021/es505605w (2015).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google Scholar
Jang, G.G. et al. . Эффект размера частиц в пористых пленочных электродах из модифицированного лигандом графена для улучшения характеристик суперконденсатора. Углерод 119 , 296–304, https://doi.org/10.1016/j.carbon.2017.04.023 (2017).
Артикул
CAS
Google Scholar
Pei, S. & Cheng, H.-M. Восстановление оксида графена. Углерод 50 , 3210–3228, https://doi.org/10.1016/j.carbon.2011.11.010 (2012).
Артикул
CAS
Google Scholar
Пэн В., Ли, Х., Лю, Ю. и Сонг, С. Обзор адсорбции ионов тяжелых металлов из воды оксидом графена и его композитами. Журнал молекулярных жидкостей 230 , 496–504, https://doi.org/10.1016/j.molliq.2017.01.064 (2017).
Артикул
CAS
Google Scholar
Дай, Дж., Ван, Г., Ма, Л. и Ву, К. Исследование поверхностных энергий и диспергируемости оксида графена и его производных. Журнал материаловедения 50 , 3895–3907, https://doi.org/10.1007/s10853-015-8934-z (2015).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google Scholar
Хонг, Б. Дж., Комптон, О. К., Ан, З., Эриазичи, И., Нгуен, С. Т. Успешная стабилизация оксида графена в растворах электролитов: усиление биофункциональности и клеточного поглощения. ACS Nano 6 , 63–73, https://doi.org/10.1021/nn202355p (2012).
Артикул
PubMed
CAS
Google Scholar
Кавинкумар, Т. и Маниваннан, С. Синтез, характеристика и газочувствительные свойства композита из многослойных углеродных нанотрубок из оксида графена. Журнал материаловедения и технологий 32 , 626–632, https://doi.org/10.1016/j.jmst.2016.03.017 (2016).
Артикул
Google Scholar
Конкена Б. и Васудеван С. Понимание водной дисперсности оксида графена и восстановленного оксида графена с помощью измерений pKa. The Journal of Physical Chemistry Letters 3 , 867–872, https://doi.org/10.1021/jz300236w (2012).
Артикул
PubMed
CAS
Google Scholar
Jiao, T. et al. . Композитный гидрогель на основе восстановленного оксида графена, содержащий наночастицы серебра, как высокоэффективные катализаторы-красители для очистки сточных вод. Scientific Reports 5 , 11873, https://doi.org/10.1038/srep11873 (2015).
Артикул
PubMed
ОБЪЯВЛЕНИЯ
CAS
PubMed Central
Google Scholar
Zhang, H., Wang, S., Lin, Y., Feng, M. & Wu, Q. Стабильность, теплопроводность и реологические свойства контролируемых наножидкостей с дисперсией восстановленного оксида графена. Прикладная теплотехника 119 , 132–139, https://doi.org/10.1016/j.applthermaleng.2017.03.064 (2017).
Артикул
CAS
Google Scholar
Чжао, Дж., Ван, З., Уайт, Дж. К. и Син, Б. Графен в водной среде: адсорбция, дисперсия, токсичность и трансформация. Наука об окружающей среде и технологии 48 , 9995–10009, https://doi.org/10.1021/es5022679 (2014).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google Scholar
Liu, X. T. et al. . Токсичность многостенных углеродных нанотрубок, оксида графена и восстановленного оксида графена для эмбрионов рыбок данио. Биомедицинские науки и науки об окружающей среде 27 , 676–683, https://doi.org/10.3967/bes2014.103 (2014).
PubMed
CAS
Статья
Google Scholar
Yousefi, M. et al. . Антибактериальная активность оксида графена как нового оружейного наноматериала для борьбы с бактериями с множественной лекарственной устойчивостью. Материаловедение и инженерия: C 74 , 568–581, https://doi.org/10.1016/j.msec.2016.12.125 (2017).
Артикул
CAS
Google Scholar
Хан, М. В. и О’Мелиа, К. Р. Осаждение и повторный унос броуновских частиц в пористой среде в неблагоприятных химических условиях: некоторые концепции и применения. Наука об окружающей среде и технологии 38 , 210–220, https://doi.org/10.1021/es030416n (2004).
Артикул
ОБЪЯВЛЕНИЯ
CAS
Google Scholar
Ntim, S. A., Sae-Khow, O., Desai, C., Witzmann, F. A. & Mitra, S. Зависимая от размера водная дисперсность карбоксилированных многостенных углеродных нанотрубок. Журнал экологического мониторинга: JEM 14 , 2772–2779, https://doi.org/10.1039/c2em30405h (2012).
Артикул
PubMed
CAS
Google Scholar
Qiao, S.-J., Xu, X.-N., Qiu, Y., Xiao, H.-C. & А Чжу, Ю.-Ф. Одновременное восстановление и функционализация оксида графена 4-гидразинобензолсульфоновой кислотой для полимерных нанокомпозитов. Наноматериалы 6 (2), 29 (2016).
Артикул
CAS
PubMed Central
Google Scholar
Станкович, С. и др. . Синтез нанолистов на основе графена путем химического восстановления расслоенного оксида графита.

 д.
д. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.