Содержание
Исследователи научили нейросеть принимать во внимание химические уравнения для создания новых лекарств и материалов
Группа ученых из Казанского федерального университета, МГУ, Университета Страсбурга (Франция) и университета Хоккайдо (Япония) объединила методы машинного обучения и химические уравнения. Это нужно для более точного предсказания характеристик молекул, что используется при компьютерном дизайне новых лекарств или материалов. Результаты работы опубликованы в Journal of Chemical Information and Modeling. Исследование является первым результатом проекта в рамках Президентской программы исследовательских проектов Российского научного фонда.
Методы машинного обучения и искусственного интеллекта все шире применяются в дизайне лекарств и материалов, медицинской и технической диагностике. Эти методы способны извлекать закономерности на основе множества данных, а потому могут находить сложные и неочевидные взаимосвязи между переменными. С другой стороны, полученные зависимости, построенные на ограниченной выборке, не всегда выявляют фундаментальные законы природы. В результате страдают точность вычислений и качество предсказания на новых данных. В то же время в химии часто известны физические или эмпирические законы, связывающие те или иные характеристики молекул или реакций.
В результате страдают точность вычислений и качество предсказания на новых данных. В то же время в химии часто известны физические или эмпирические законы, связывающие те или иные характеристики молекул или реакций.
Интернациональный коллектив ученых из Казани, Москвы, Страсбурга и Хоккайдо предложил способ, который позволяет методам машинного обучения использовать фундаментальные химические законы при предсказании свойств молекул. Исследователи рассмотрели проблему прогнозирования характеристик таутомерного равновесия, то есть способности молекул превращаться из одной формы (таутомера) в другую за счет перехода протона с одного атома на другой. Таутомерия — явление обратимой изомерии, когда несколько веществ имеют одинаковый качественный и количественный состав, но отличаются расположением некоторых групп и связей. Она является одним из важнейших явлений в органической химии. Кроме того, таутомерия — ключевой фактор, влияющий на появление мутаций, а также функционирование нуклеиновых кислот, белков и сахаров.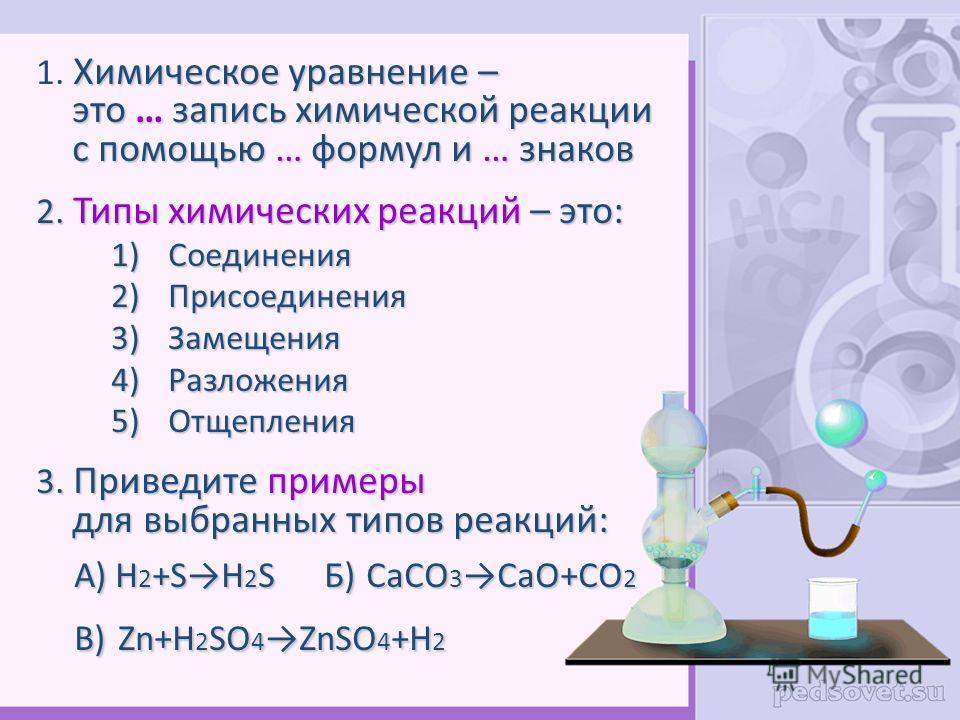 По этой причине важно учитывать таутомерные превращения при регистрации новых соединений, компьютерном дизайне новых лекарств и поиске молекул с заданными свойствами.
По этой причине важно учитывать таутомерные превращения при регистрации новых соединений, компьютерном дизайне новых лекарств и поиске молекул с заданными свойствами.
Известно, что характеристики (например, константа таутомерного равновесия) процесса перехода одной таутомерной формы в другую связаны с кислотностью молекул. Соответствующее уравнение, открытое советским химиком М. И. Кабачником, используется почти во всех хемоинформатических инструментах предсказания константы таутомерного равновесия. Ранее авторы статьи показали, что качество таких расчетов достаточно низкое. Проблема применения уравнения заключается в том, что некоторых таутомеров в равновесии очень мало, и определить их кислотность невозможно. Вероятность ошибки при ее предсказании высока, и получаются неверные результаты.
«Мы пришли к выводу, что нужно создать модель, которая умела бы принимать во внимание уравнение Кабачника и обучалась одновременно на данных по таутомерии и кислотности», — рассказывает руководитель проекта Тимур Маджидов, кандидат химических наук, старший научный сотрудник Казанского федерального университета.
В работе были рассмотрены два варианта действий. В первом случае использовали множественную линейную регрессию, то есть считали, что зависимость кислотности от структуры можно описать линейным законом. Во втором случае для предсказания кислотности использовали нелинейные уравнения, которые в качестве решения предлагали нейронные сети. Обе модели учатся прогнозировать таутомерию с использованием уравнения Кабачника. Оказалось, что если обучать модель только на данных по кислотности, то качество предсказания константы таутомерного равновесия хуже, чем при ее предсказании случайным образом. Результаты изменились, когда ученые объединили подходы. Точность получившейся сопряженной модели совпадает с таковой у лучших моделей, способных, однако, предсказывать только одно свойство. Более того, она работает в случае кислотности таутомерных форм, которых в растворе содержится очень мало, и делает это почти так же хорошо, как и для «обычных» молекул.
Итог исследования — создание вычислительной модели, которая обеспечила более точное нахождение константы кислотности и таутомерии. Авторами была предложена концепция сопряженных моделей QSPR (количественной взаимосвязи структуры и свойств) для одновременного предсказания нескольких функционально связанных характеристик. Подобные модели в будущем позволят осуществлять более точный прогноз физико-химических свойств соединений и параметров химических реакций, а также помогут в поиске новых лекарственных препаратов.
Авторами была предложена концепция сопряженных моделей QSPR (количественной взаимосвязи структуры и свойств) для одновременного предсказания нескольких функционально связанных характеристик. Подобные модели в будущем позволят осуществлять более точный прогноз физико-химических свойств соединений и параметров химических реакций, а также помогут в поиске новых лекарственных препаратов.
Урок 11. Химические уравнения – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 11 «Химические уравнения» из курса «Химия для чайников» мы узнаем кем и когда был открыт закон сохранения массы веществ; познакомимся с химическими уравнениями и научимся правильно расставлять в них коэффициенты.
До сих пор при рассмотрении химических реакций мы обращали внимание на их качественную сторону, т. е. на то, как и при каких условиях исходные вещества превращаются в продукты реакций. Но в химических явлениях существует и другая сторона — количественная.
Закон сохранения массы веществ
Изменяется ли масса веществ, вступивших в химическую реакцию? В поиске ответа на этот вопрос английский ученый Р. Бойль еще в XVII в. провел множество опытов по прокаливанию свинца в запаянных сосудах. После окончания опытов он вскрывал сосуды и взвешивал продукты реакции. В результате Бойль пришел к выводу, что масса вещества после реакции больше массы исходного металла. Он объяснил это присоединением к металлу некой «огненной материи».
Опыты Р. Бойля по прокаливанию металлов повторил русский ученый М. В. Ломоносов в 1748 г. Прокаливание железа он проводил в специальной колбе (реторте) (рис. 56), которая была герметически запаяна. В отличие от Бойля после реакции он оставлял реторту запаянной. Взвешивание реторты после реакции показало, что ее масса не изменилась. Это свидетельствовало о том, что, хотя между металлом и веществом, содержащемся в воздухе, произошла химическая реакция, сумма масс исходных веществ равна массе продукта реакции.
М. В. Ломоносов сделал вывод: «Все перемены, в натуре случающиеся, суть такого состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому, так ежели где убудет несколько материи, то умножится в другом месте».
В 1789 г. французский химик А. Лавуазье доказал, что прокаливание металлов — это процесс их взаимодействия с одной из составных частей воздуха — кислородом. На основе работ М. В. Ломоносова и А. Лавуазье был сформулирован закон сохранения массы веществ в химических реакциях.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
При химических реакциях атомы не исчезают бесследно и не возникают из ничего. Их число остается неизменным. А так как они имеют постоянную массу, то и масса образованных ими веществ также остается постоянной.
Закон сохранения массы веществ можно проверить экспериментально. Для этого используют прибор, показанный на рисунке 57, а, б. Главная его часть — двухколенная пробирка. В одно колено нальем известковую воду, во второе — раствор медного купороса. Уравновесим прибор на весах, а затем смешаем оба раствора в одном колене. При этом мы увидим, что выпадает голубой осадок нового вещества. Образование осадка подтверждает, что произошла химическая реакция. Масса прибора при этом остается прежней. Это означает, что в результате химической реакции масса веществ не изменяется.
Главная его часть — двухколенная пробирка. В одно колено нальем известковую воду, во второе — раствор медного купороса. Уравновесим прибор на весах, а затем смешаем оба раствора в одном колене. При этом мы увидим, что выпадает голубой осадок нового вещества. Образование осадка подтверждает, что произошла химическая реакция. Масса прибора при этом остается прежней. Это означает, что в результате химической реакции масса веществ не изменяется.
Закон важен для правильного понимания всего совершающегося в природе: ничто не может исчезнуть бесследно и возникнуть из ничего.
Химические уравнения
Химические реакции можно изобразить, используя химический язык формул. Химические элементы обозначают химическими символами, состав веществ записывают при помощи химических формул, химические реакции выражают при помощи химических уравнений, т. е. так же, как из букв составляются слова, из слов — предложения.
Уравнение химической реакции (химическое уравнение) — это условная запись реакции при помощи химических формул и знаков «+» и «=».
Закон сохранения массы веществ в химических реакциях должен соблюдаться и при составлении уравнений химических реакций. Как и в математических уравнениях, в уравнениях химических реакций имеется левая часть (где записываются формулы исходных веществ) и правая часть (где записываются формулы продуктов реакции). Например (рис. 58):
При написании уравнений химических реакций знак «+» (плюс) соединяет формулы веществ в левой и правой частях уравнения. Так как масса веществ до реакции равна массе образовавшихся веществ, используется знак «=» (равно), который связывает левую и правую части уравнения. Для уравнивания числа атомов в левой и правой частях уравнения используются числа перед формулами веществ. Эти числа называются коэффициентами химических уравнений и показывают число молекул или формульных единиц. Поскольку 1 моль любого вещества состоит из одинакового числа структурных единиц (6,02*1023), то коэффициенты показывают и химические количества каждого из веществ:
При написании химических уравнений применяют также и специальные знаки, например знак «↓», обозначающий, что вещество образует осадок:
знак «↑», обозначающий, что вещество выделяется в виде газа (рис. 59):
59):
Часто в уравнениях химических реакций над знаком «=» указывают условия их протекания: нагревание (t), облучение светом (hν), электрический ток (↯) и др.
Краткие выводы урока:
- В химических реакциях соблюдается закон сохранения массы веществ: масса исходных веществ равна массе продуктов реакции.
- Сущность химической реакции состоит в перегруппировке атомов, из которых состояли исходные вещества, с образованием новых веществ.
- Число атомов каждого химического элемента до реакции должно быть равно их числу после реакции.
- Химическое уравнение — условная запись реакции при помощи химических формул и специальных знаков.
Надеюсь урок 11 «Химические уравнения» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Химические уравнения
На
основании закона сохранения массы веществ составляют уравнения химических
реакций.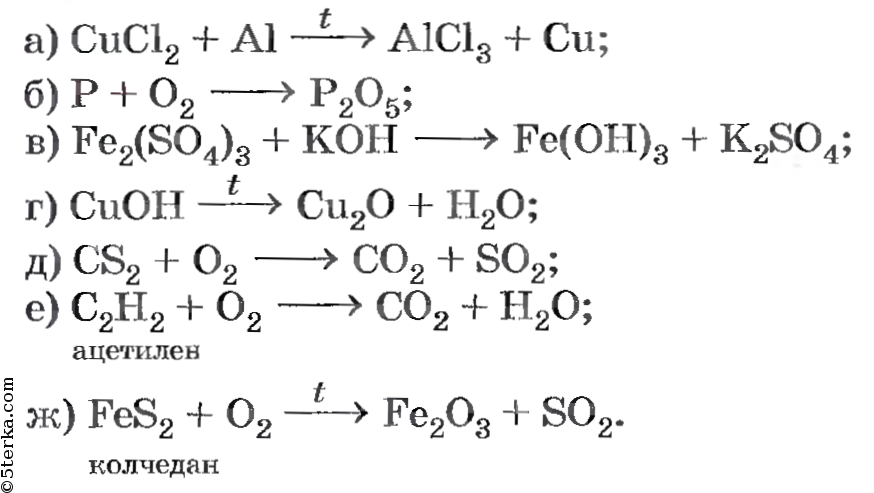 Химическое уравнение – условная запись
Химическое уравнение – условная запись
химической реакции с помощью химических формул и знаков.
В
левой части уравнения записывают формулы или формулу веществ,
которые вступили в химическую реакцию. Их называют исходными веществами,
между ними знак «плюс», в правой части уравнения записывают формулы или
формулу продуктов реакции, т.е. веществ, которые образуются в результате
реакции, между ними тоже ставят знак «плюс», а между левой и правой частью
уравнения ставят стрелку.
Химическую
реакцию можно изобразить молекулярным уравнением. Т.е. молекулярное
уравнение – это уравнение, в котором исходные вещества и продукты реакции
записаны в виде молекул. Если в результате реакции образуется осадок, то
возле него справа ставят стрелку, направленную вниз (↓), а если
выделяется газ, то возле него справа ставят стрелку, направленную вверх
(↑).
После
записи схемы уравнения находят коэффициенты,
т. е. цифры, стоящие перед формулами веществ, чтобы число атомов до и после
е. цифры, стоящие перед формулами веществ, чтобы число атомов до и после
реакции было одинаковым.
Например,
запишем уравнение реакции водорода с кислородом. Вначале укажем формулы
веществ, вступивших в химическую реакцию – это водород (Н2) и
кислород (О2), между ними ставим знак «плюс», в результате реакции
образуется вода – Н2О. Между веществами левой и правой части ставим
стрелку. Посмотрим, сколько атомов водорода в левой и правой части. Получается
два атома водорода до и после реакции, а кислорода до реакции 2 атома, после
реакции – один атом. Поэтому в правой части уравнения перед формулой воды
ставим коэффициент 2. Но теперь в правой части уравнения стало 4 атома
водорода, а в левой только 2. Чтобы уровнять число атомов водорода, необходимо
в левой части уравнения перед водородом поставить коэффициент 2. Т.к. мы
уровняли число всех атомов в левой и правой части уравнения, то теперь ставим
не стрелку, а знак равенства.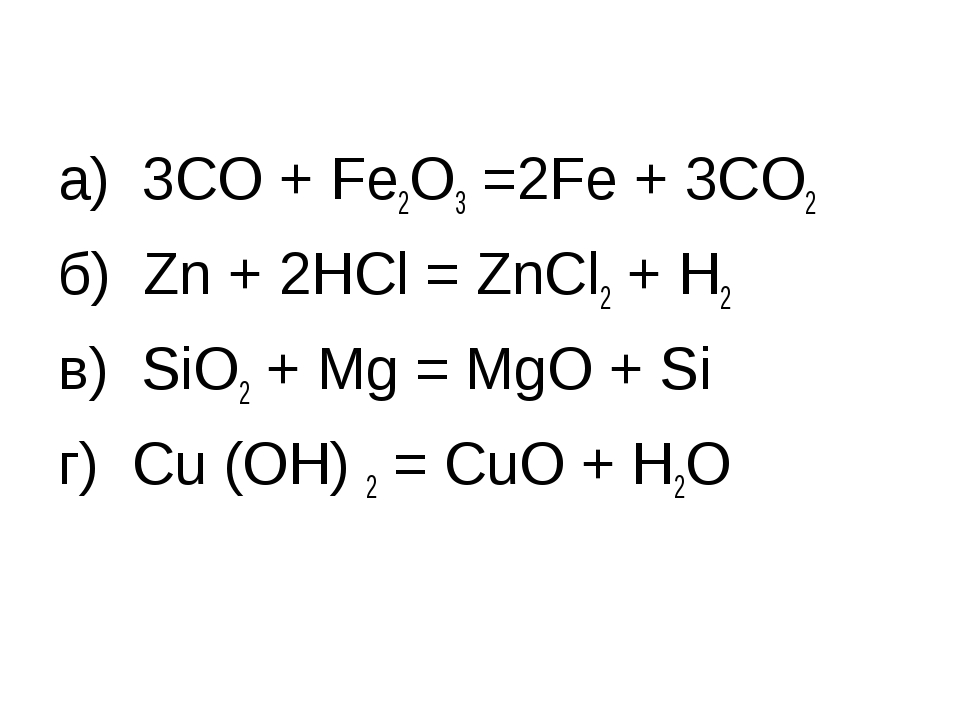
Для
правильного подбора коэффициентов в уравнении реакции следует выполнять
некоторые условия:
·
Перед
формулой простого вещества можно записывать дробный коэффициент.
Например, в реакции горения бутана:
С4Н10
+ О2 → СО2 + Н2О. Перед формулой СО2
ставим коэффициент 4, т.к. в реакцию вступает 4 атома углерода, перед формулой воды
ставим коэффициент 5, т.к. в реакцию вступает 10 атомов водорода. В результате
реакции образуется 13 атомов кислорода, а до реакции 2 атома, значит перед
формулой кислорода необходимо поставить коэффициент 6,5. А так как, коэффициент
показывает не только число атомов, но и молекул, то следует удвоить коэффициент
в уравнении. Получается, уравнение будет иметь вид: 2С4Н10
+ 13О2 → 8СО2 + 10Н2О.
·
Если
в схеме реакции есть соль, то сначала уравнивают число ионов, образующих
соль. Например, в результате реакции фосфорной кислоты и гидроксида кальция
Например, в результате реакции фосфорной кислоты и гидроксида кальция
образуется соль – фосфат кальция и вода.
Н3РО4
+ Са(ОН)2 → Са3(РО4)2 + Н2О.
Эта соль состоит из фосфат-ионов с зарядом 3- и ионов кальция с зарядом 2+.
Уравняем их число, записав перед формулой фосфорной кислоты коэффициент 2, а
перед формулой гидроксида кальция – коэффициент 3.
·
Если
в схеме реакции есть атомы водорода и кислорода, то сначала уравниваются
атомы водорода, а только потом кислорода. Из предыдущей схемы видно, что в
левой части уравнения 12 атомов водорода, в правой – только 2, значит, перед
формулой воды необходимо поставить коэффициент 6. Подсчитаем число атомов
кислорода. До реакции их 14, после реакции тоже 14. Поэтому можно вместо
стрелки поставить знак равенства.
·
Если
в схеме реакции имеется несколько формул солей, то начинать уравнивание
следует с ионов, входящих в состав соли, содержащей большее их число.
Например, в реакции нитрата бария и сульфата алюминия образуется две соли –
сульфат бария и нитрат алюминия. Наибольшее число ионов содержит соль – нитрат
алюминия, поэтому сначала нужно уравнять ионы, которыми образована эта соль,
т.е. ионы алюминия и нитрат-ионы. Ba(NO3)2
+ Al2(SO4)3
→ BaSO4
+ Al(NO3)3.
У алюминия заряд 3+, у нитрат-ионов – 1-. Поэтому в левой части уравнения
перед формулой Ba(NO3)2
ставим коэффициент 3. Перед формулой Al2(SO4)3
нужно поставить коэффициент 1, но он не ставится. Уравниваем остальные
ионы. Ионов бария до реакции 3, после реакции 1, поэтому перед формулой BaSO4
ставим коэффициент 3, нитрат-ионов до реакции 6, поэтому в правой части
уравнения перед Al(NO3)3
ставим коэффициент 2. Число атомов алюминия до и после реакции одинаково, т. е.
е.
2. Ионов бария и сульфат-ионов до реакции и после реакции одинаково – по 3.
·
Если
число атомов какого-то элемента в одной части схемы уравнения четное, а в
другой нечетное, то необходимо перед формулой с нечетным числом атомов
поставить коэффициент 2, а затем уровнять число всех атомов. Например,
расставим коэффициенты в реакции алюминия с кислородом. Al
+ O2 → Al2O3.
В результате реакции образуется оксид алюминия – Al2O3.
Число атомов кислорода до реакции четное, т.е. равно двум, а после реакции
нечетное – 3. Поэтому перед формулой оксида алюминия ставим коэффициент 2. В
результате у нас стало 6 атомов кислорода после реакции, значит, в левой части
уравнения перед формулой кислорода ставим коэффициент 3. Начинаем уравнивать
число атомов алюминия до и после реакции. До реакции 1 атом, после реакции – 4.
Следовательно, в левой части уравнения перед формулой алюминия ставим
коэффициент 4. Теперь число атомов каждого химического элемента в левой и
Теперь число атомов каждого химического элемента в левой и
правой части схемы уравнения одинаково, и стрелку следует заменить знаком
равенства.
Уравнения химические — Справочник химика 21
В случае химической реакции закон сохранения массы принимает иную характерную форму ему подчиняются не компоненты, а химические элементы или, возможно, отдельные радикалы. Вместо суммы чисел молей отдельных компонентов неизменной остается сумма чисел атомов отдельных элементов. Этот факт выражается с помощью уравнения химической реакции. Обычная общая форма этого уравнения [c.47]
Индексы кИ относятся соответственно к конечным и начальным продуктам реакции индексы, —ко всем участникам реакции к. и v —коэффициенты стехиометрического уравнения химической реакции. [c.72]
Приведем пример одного из важных дополнений. В 1923 г. американский химик Джильберт Ньютон Льюис (1875—1946) в классической книге по термодинамике ввел понятие активность. Активность вещества не то же самое, что его концентрация, но связана с ней. Уравнения химической термодинамики можно сделать более точными в более широких пределах, если заменить концентрацию на активность. [c.114]
В 1923 г. американский химик Джильберт Ньютон Льюис (1875—1946) в классической книге по термодинамике ввел понятие активность. Активность вещества не то же самое, что его концентрация, но связана с ней. Уравнения химической термодинамики можно сделать более точными в более широких пределах, если заменить концентрацию на активность. [c.114]
Возвращаясь к теории Лэнгмюра, отметим, что в большинстве гетерогенных реакций, представляющих интерес, участвуют газообразные реагенты, поэтому дальнейшее обсуждение будет ограничено газовыми реакциями. Процесс хемосорбции может быть представлен как реакция между адсорбатом (О) и активным участком на поверхности (а) и описан уравнением, подобным уравнению химической реакции [c.208]
Химико-технологические расчеты в производстве минеральных удобрении основаны иа балансовых уравнениях химических реакций обменного разложения или окислительпо-восстаповительных гетерогенных некаталитических процессов.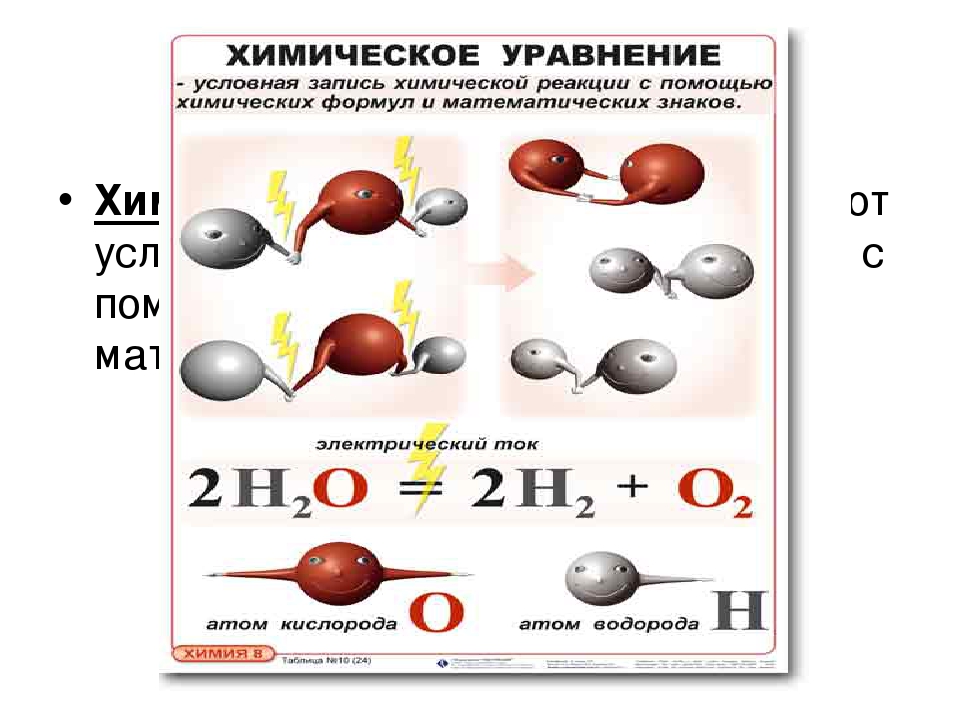 В производстве фосфорной кислоты степень разложе1Н1я фосфата серион кислотой характеризуется коэффициентом разложения [c.172]
В производстве фосфорной кислоты степень разложе1Н1я фосфата серион кислотой характеризуется коэффициентом разложения [c.172]
Остановимся на размерности и физическом смысле констант в формулах (Х,4), (X, 5) и (Х,6). Так как константы входят сомножителями с удельной энергией в безразмерные показатели степеней, то размерность их обратна размерности и/У, т. е. существенно отлична от размерности констант скоростей в обычных уравнениях химической кинетики. Так. если и У выражено в киловатт-часах на кубический метр газа, приведенного к нормальным условиям, размерность /г,- будет выражена в кубических метрах на киловатт-час. [c.247]
Стехиометрическое уравнение химической реакции показывает, в каких соотношениях вещества вступают во взаимодействие. Однако оказывается, что очень редко реакция протекает по схеме [c.35]
Уравнения химических реакций с указанием теплового эффекта [c.160]
Сравнивая математические операции, выполняемые при комбинировании уравнений химических реакций, а также и соответствующих величин А 2, можно заметить, что эти операции совершенно идентичны. Следовательно, для того чтобы рассчитать свободную энергию какой-либо химической реакции, необходимо подобрать две или большее количество таких химических реакций (с известными значениями А 2), из которых посредством простых арифметических действий можно было бы скомбинировать уравнение интересующей нас химической реакции. [c.117]
Следовательно, для того чтобы рассчитать свободную энергию какой-либо химической реакции, необходимо подобрать две или большее количество таких химических реакций (с известными значениями А 2), из которых посредством простых арифметических действий можно было бы скомбинировать уравнение интересующей нас химической реакции. [c.117]
К правой части стехиометрического уравнения химической реакции прибавляют член, показывающий разность между внутренними энергиями (или энтальпиями) исходных веществ и продуктов реакции, т. е. убыль внутренней энергии (энтальпии) системы. Если эта убыль положительна, то при реакции теплота выдел яется, если убыль отрицательна, то теплота поглощается извне. Уравнения, записанные таким образом, называются термохимическими. [c.58]
Ядерные реакции коренным образом отличаются от химических реакций, при которых атомные ядра остаются неизменными, а в процессе принимают участие лишь внешние электроны атомов. Тем не менее к ядериым превращениям могут быть приложены закономерности и уравнения химической термодинамики, так как термодинамика в своей основе не связана с определенными представлениями о структуре и свойствах отдельных частиц. Закономерности химической термодинамики поэтому приложимы к превращениям веществ, взаимодействующих в стехиометрических количествах, хотя бы эти превращения не имели химического характера. [c.343]
Закономерности химической термодинамики поэтому приложимы к превращениям веществ, взаимодействующих в стехиометрических количествах, хотя бы эти превращения не имели химического характера. [c.343]
Определение Д 2 посредством комбинирования уравнений химических реакций [c.116]
Здесь мы познакомим читателя с косвенным методом онределения величины Д2, основанном на комбинировании уравнений химических реакций и их свободных энергий. [c.116]
В уравнении химической реакции каждая формула изображает один моль соответствующего вещества. Поэтому, зная мольные массы участвующих в реакции веществ, молуравнению реакции найти соотношение между массами веществ, вступающих в реакцию н образующихся в результате ее протекания. Если в реакции участвуют вещества в газообразном состоянии, то уравнение реакции позволяет найти их объемные отношения. [c.25]
Определение посредством комбинирования уравнений химических реакций, для которых Д 2 определена одним из первых двух методов. [c.102]
[c.102]
Приняв в этом случае, что при дегидрировании х молей циклогексана образуется, в соответствии с уравнением химической реакции, х мо- [c.137]
Напишем теперь уравнения химических реакций образования ацети фена и бензола из элементов в развернутом виде [c.116]
Сложив приведенные выше уравнения химических реакций, получаем [c.118]
Теоретическое количество кислорода, как следует из уравнений химических реакций окисления (горения) 1 кг топлива, определяется из следующего выражения [c.93]
Для того чтобы получить уравнение закона действия масс, представим уравнение химической реакции в общем виде [c.174]
Вот это утверждение уже представляет собой уравнение химической реакции меди с кислородом, приводящей к получению оксида меди(1). Числа, 2 и 4, помещенные перед символами или формулами, называются стехиомет-рическими коэффициентами. Для проверки подсчитаем атомы каждого элемента в обеих частях уравнения [c.107]
Для проверки подсчитаем атомы каждого элемента в обеих частях уравнения [c.107]
Тем не менее, при образовании фосгена дело обстоит совсем не так. В этом случае уравнение химической реакции запишется [c.30]
Уравнение химической реакции показывает, что для сгорания каждого моля метана требуется два моля газообразного кислорода, т. е. в нашем случае нужно 2 40,6 моль О2, или [c.370]
Стехиометрическое уравнение химической реакции можно записать в общем виде [c.12]
Сокращенное ионное уравнение Химическое уравнение, содержащее только ионы, непосредственно участвующие в обменной реакции в растворе [c.547]
Рассмотрим реакцию, в которой вещества А и В при взаимодействии образ уют С. Уравнение химической реакции пе записываем, поскольку ОНО является очень простым. Пусть в любой момент времени в системе заданной массы и объема V при- [c.26]
Составить основное уравнение химической реакции. [c.208]
[c.208]
Что означает слово полное в полном уравнении химической реакции Каким образом полное уравнение реакции иллюстрирует закон сохранения массы [c.102]
Закон Гесса позноляет вычислять тепловые эффекты, оперируя с уравнениями химических реакций так же, как и с обычными алгебраическими уравнениями. [c.53]
Во всех уравнениях химической кинетики фигурируют концентрации реагирующих веществ. В термодинамике же константа равновесия иеидеальной системы выражается через активности. Это обстоятельство необходимо учитывать, если в кинетическое уравнение входит константа равновесия. Правда, при реакциях в газовой фазе и между нейтральными молекулами в растворе в этом нет практической необходимости, но при рассмотрении реакций между заряженными частицами подобное пренебрежение может явиться источником существенных ошибок. [c.290]
Ниже приведены вопросы о кислороде во вдыхаемом и выдыхаемом воздухе и о сгорарии глюкозы в организме. На все из них можно ответить, используя гонятия, которые вы уже изучали (моли и молярные соотношения, следуьзщие из уравнений химических реакций). Для иллюстрации рассмотрим, как отвечать на вопросы этого упражнения. [c.369]
На все из них можно ответить, используя гонятия, которые вы уже изучали (моли и молярные соотношения, следуьзщие из уравнений химических реакций). Для иллюстрации рассмотрим, как отвечать на вопросы этого упражнения. [c.369]
Подставляя в уравнение химического раннонесня для данной реакции [c.259]
Через электролитическую ячейку, содержащую расплавленный Zn lj, в течение определенного времени пропускают ток силой 3,0 А. При этом на катоде выделяется 24,5 г металлического Zn. Запишите уравнение химической реакции на катоде. Составьте уравнение реакции, протекающей на аноде. Сколько времени должен продолжаться указанный процесс Какая масса газообразного хлора выделится при этом на аноде [c.61]
Таким образом, для неразветвленных цепей остаются справедливыми обычные уравнения химической кинетики с константой скорости, увеличенной в v раз. Из выражения (XIV, 37) видно, что все те воздействия, которые вызывают образование свободных радикалов, т, е. увеличивают скорость зарождения цепей (малые добавки веществ, способных образовывать свободные радикалы, действие света, ионизи- [c.352]
увеличивают скорость зарождения цепей (малые добавки веществ, способных образовывать свободные радикалы, действие света, ионизи- [c.352]
Как видно из уравнений химических реакций, для превращения 1 кмоля С в СО2 требуется 1 кмолъ О2 и нри этом получается [c.91]
Важно отметить, что численное значение константы скорости зависит от реагента или продукта, выбранного при определении порядка реакции. Например, если стехиометричеокое уравнение химической реакции имеет вид [c.28]
Отсюда следует, что любой элемент жидкости или газа, движущийся в одном из кольцевых каналов, ведет себя совершенно так же, как в реакторе периодического действия. Степень превращения, достигаемая внутри такого элемента, может быть, следовательно, получена интегрированием обычных уравнений химической кинетики. Однако для нахождения средней степени превращения на выходе из реактора необохдимо осуществить [c.66]
Урок химии в 8 классе по теме «Химические уравнения.
 Типы химических реакций».
Типы химических реакций».
Урок химии в 8 классе по теме «Химические уравнения. Типы химических реакций».
Тип урока –изучение нового материала.
Тема. Химические уравнения. Типы химических реакций.
Цели.
1. Закрепить знания о законе сохранения массы веществ и на его основе объяснить, что такое «химическая реакция»; правила составления реакций. Познакомить с классификацией реакций.
2. Развивать умения писать уравнения химических реакций, определять тип реакции и правильно расставлять коэффициенты в уравнениях.
3. Развивать познавательный интерес к теме и к предмету, повышать творческую активность.
4. Вырабатывать умения логически рассуждать и грамотно выражать свои мысли.
Методы. Беседа, рассказ, демонстрация опытов, работа в тетради, в рабочей тетради.
Оборудование: реактивы-магниевая лента, Fe и CuSO4, пробирки, спички, спички, скрепка (Fe).
Ход урока.
I. Организационный момент.
II. Повторение.
Учитель. Здравствуйте, ребята! Мы с вами начали в 8 классе изучать химию. Без нее прожить нельзя! И это действительно так, без нее никуда. Это наука – волшебница. Химия нас кормит, одевает, обувает, наконец, предоставляет блага, без которых немыслимо наше общество. Каждый человек, каждый из вас, сам того не подозревая, ежедневно осуществляет химические реакции, даже не выходя из дома: намыливая руки, зажигая спички и газ, приготавливая пищу. Да и сам человеческий организм – большая химическая фабрика, в которой происходит множество химических реакций. Переваривание пищи. Сидение волос. Старение организма. Вокруг нас химические реакции – горение дров, горение бензина, скисание молока, квашение капусты, порча продуктов, гниение листьев. Что такое химическая реакция?
Тема нашего урока- «Химические уравнения. Типы химических реакций». Мы должны научиться писать химические уравнения, правильно проставлять коэффициенты и узнать, какие типы реакций существуют. К изучению данной темы, мы провели большую подготовительную работу: изучали химические элементы, валентность, научились составлять формулы. Давайте вспомним наиболее важные моменты.
Типы химических реакций». Мы должны научиться писать химические уравнения, правильно проставлять коэффициенты и узнать, какие типы реакций существуют. К изучению данной темы, мы провели большую подготовительную работу: изучали химические элементы, валентность, научились составлять формулы. Давайте вспомним наиболее важные моменты.
Вопросы.
— По составу все вещества делятся на какие группы?
— Приведите примеры простых веществ.
— Какое вещество называется простым?
— Приведите примеры сложных веществ.
— Какие вещества называются сложными?
— Что такое химическая формула?
— Под диктовку на доске пишутся формулы: AL2O3, CuO, H20. Дайте названия.
— На доске написаны формулы веществ. Ученик правильно произносит.
— Составить формулу оксида Fe(III). Составить формулу соединения Na с S.
Молодцы! Последний вопрос, который нам необходим для составления уравнений – это знание закона сохранения массы веществ. Дайте формулировку закона.
Дайте формулировку закона.
III. Новая тема.
Все химические реакции мы можем записать с помощью уравнений. Что это такое?
1) Химическим уравнением называют условную запись химической реакции с помощью химических знаков и формул.
2) Демонстрация опытов.
а) Горение магния.
— При горении Mg взаимодействует с каким веществом?
— Какое вещество образуется?
2Mg+ O2 = 2MgO
Начинаем уравнивать количество атомов. Надо начать с того элемента, чьих атомов больше вступает в реакцию. Количество атомов до реакции и после должно быть равно. (Дети читают уравнение вслух).
Эта реакция лежит в основе фейерверков, бенгальских огней.
б) Горение Cu.
2Cu+ O2 = 2CuO (оксид меди).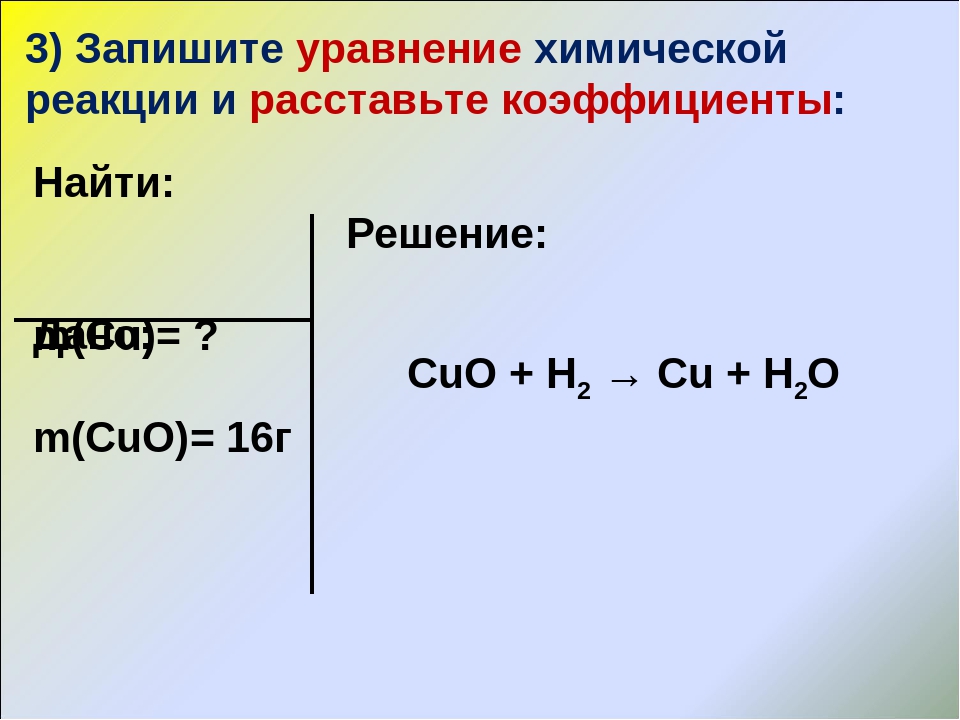 Реакция соединения.
Реакция соединения.
(Проверяем. Читаем вслух).
в) Горение фосфора.
4P+ 5O2 = 2P2O5 (оксид фосфора). Реакция соединения.
(Проверяем. Читаем вслух).
3). Эти три реакции относятся к одному типу реакции. Что общего? Что происходит в этих реакциях?
Это реакции соединения (определение читаем из учебника).
4). Реакции разложения. Что происходит в ходе этих реакций?
2H2O = 2H2 + O2
(Определение – из учебника).
5). Реакции замещения.
Это реакции между простым и сложным веществом.
Демонстрация опыта.
Fe + CuSO4 = FeSO4 + Cu
(Определение – из учебника).
IV. Закрепление.
Закрепление.
1). Каждую химическую реакцию мы можем записать в виде уравнения.
— Что называется химическим уравнением?
— Каким правилом мы должны пользоваться при расстановке коэффициентов?
— Дать определения реакциям: соединения, разложения, замещения.
2). Выполняется упражнение на расстановку коэффициентов в уравнениях реакций и на определение типа реакции.
V. Домашнее задание: п.27 (1), 30, упражнения в тетради.
Автор: Фаттахова Оксана Владимировна
МБОУ «Гимназия № 22», г. Нижнекамск, Республика Татарстан
Химические уравнения Составление химического уравнения.
Химическое уравнение представляет собой запись реакции с помощью символов элементов и формул соединений, принимающих в ней участие. Относительные количества реагентов и продуктов, выраженные в молях, указываются численными коэффициентами в полном (сбалансированном) уравнении реакции. Эти коэффициенты иногда называют стехиометрическими коэффициентами. В настоящее время наблюдается все возрастающая тенденция включать в химические уравнения указания физического состояния реагентов и продуктов. Это делается с помощью следующих обозначений: (газ) или (г.) означает газообразное состояние, (ж.)-жидкость, (тв.) — твердое вещество, (водн.)-водный раствор.
Относительные количества реагентов и продуктов, выраженные в молях, указываются численными коэффициентами в полном (сбалансированном) уравнении реакции. Эти коэффициенты иногда называют стехиометрическими коэффициентами. В настоящее время наблюдается все возрастающая тенденция включать в химические уравнения указания физического состояния реагентов и продуктов. Это делается с помощью следующих обозначений: (газ) или (г.) означает газообразное состояние, (ж.)-жидкость, (тв.) — твердое вещество, (водн.)-водный раствор.
Химическое уравнение может быть составлено на основе экспериментально установленного знания реагентов и продуктов изучаемой реакции, а также путем измерения относительных количеств каждого реагента и продукта, которые принимают участие в реакции.
Составление химического уравнения
Составление полного химического уравнения включает следующие четыре стадии. 1-я стадия. Запись реакции в словесном выражении. Например,
Магний + диоксид углерода = оксид магния + углерод
2-я стадия. Замена словесных названий формулами реагентов и продуктов. Mg + CO2 =MgO + С
Замена словесных названий формулами реагентов и продуктов. Mg + CO2 =MgO + С
3-я стадия. Балансировка уравнения (определение его коэффициентов) 2Mg + CO2 = 2MgO + С
Такое уравнение называется сбалансированным или стехиометрическим. Необходимость сбалансировать уравнение диктуется тем, что в любой реакции должен выполняться закон сохранения материи. Применительно к реакции, рассматриваемой нами в качестве примера, это означает, что в ней не может ни образоваться, ни исчезнуть ни один атом магния, углерода или кислорода. Другими словами, число атомов каждого элемента в левой и правой частях химического уравнения должно быть одинаково.
4-я стадия. Указание физического состояния каждого участника реакции. 2Mg(TB.) + CO2 (г.) =2MgO(TB.) + С(тв.)
Оглавление:
история 91-летнего японского «виновника войны»
16 августа, «Жэньминь жибао» онлайн — Японский остров Окуносима во время Второй мировой войны отнюдь не славился тем, что он был домом для многочисленных кроликов, как он известен сейчас, в то время Окуносима был «островом ядовитых газов», поскольку именно оттуда поставлялось большинство химического оружия для японской армии в период агрессивной войны против Китая.
Тогда взрослых японцев отправляли на поле войны, производством ядовитых газов занимались дети. Японские войска отправили на этот остров детей в возрасте 10 с лишним лет, чтобы они работали над изготовлением ядовитых газов. Согласно статистическим данным, в то время на Окуносиме работало около 7 тыс. детей, одним из них был Фудзимото Ясума (Fujimoto Yasuma).
Фудзимото Ясума: Это остров Окуносима, вы должны здесь учиться и изготавливать ядовитый газ. Это первая фраза, которую сказал нам учитель.
Японцу Фудзимото Ясума 91 год. В 1941 году происходивший из бедной семьи Фудзимото узнал, что на острове Окуносима построили завод, где можно учиться и зарабатывать деньги, он подал заявку, чтобы поехать туда. Однако, поскольку в то время японский военный штаб держал в строгой тайне производство ядовитых газов, никто не знал о конкретной деятельности завода. Фудзимото понял, что это был непростой завод только в тот день, когда он прибыл на остров.
Фудзимото Ясума: Прибыв на остров Окуносима, я почувствовал сильный запах газа. Я почувствовал боль в носу, горле и глазах. Тогда я понял, что это непростой завод, а завод по производству ядовитых газов.
Я почувствовал боль в носу, горле и глазах. Тогда я понял, что это непростой завод, а завод по производству ядовитых газов.
Фудзимото был распределен в цех по изготовлению люизита. Люизит – боевое отравляющее вещество кожно-нарывного действия, оно вместе с горчичным газом использовалось японской армией на полях сражений в Китае. Тысячи китайцев пострадали и погибли от использования этих отправляющих веществ японскими войсками.
«Победить войну в Китае с помощью ядовитых газов» — именно этим лозунгом подбадривали в работе Фудзимото и других подростков милитаристского государства, считавшие, что станут «героями», которые помогли Японии одержать победу.
Фудзимото Ясума: «Можно сделать все, что угодно ради императора, можно сделать все, что угодно для захвата Китая», даже производить ядовитый газ. Под влиянием идеологии милитаризма я стал подростком милитаристского государства.
Хотя японская армия и предоставила работникам средства защиты, избежать повреждений, причиненных утечкой ядовитых газов все же, не удалось. По воспоминаниям Фудзимото, в цехе постоянно были люди, которые обжигались ядовитыми газами. Ближе к концу войны работы становилось больше, учащались и несчастные случаи. В настоящее время Фудзимото и многие другие японцы, которые работали с ним на острове Окуносима, страдают бронхиальными заболеваниями, более того, их центральная нервная система подверглась трудно излечимым повреждениям.
По воспоминаниям Фудзимото, в цехе постоянно были люди, которые обжигались ядовитыми газами. Ближе к концу войны работы становилось больше, учащались и несчастные случаи. В настоящее время Фудзимото и многие другие японцы, которые работали с ним на острове Окуносима, страдают бронхиальными заболеваниями, более того, их центральная нервная система подверглась трудно излечимым повреждениям.
Фудзимото Ясума: Это ядовитый порошок, если человек вдохнет 0.5 граммов этого порошка, то он умрет. Тогда, на заводе, в процессе производства этот порошок был повсюду. Я каждый день дышал этим ядовитым газом.
После войны Фудзимото был вынужден подписать «клятвенное соглашение», по которому он гарантировал не раскрывать секреты «острова ядовитых газов». В 90-х годах прошлого века этот пожилой человек увидел в телевизоре фрагмент о том, что был найден ресивер для ядовитого газа, который использовался японской армией в агрессивной войне против Китая. Фудзимото с гневом сказал своим родным, что именно этот газ производился на острове Окуносима. Фудзимото, который молчал долгое время, инициативно начал предоставлять исторические доказательства деятельности, которая имела место на «острове ядовитых газов». Он неоднократно приезжал в Китай и приносил свои извинения китайскому народу.
Фудзимото, который молчал долгое время, инициативно начал предоставлять исторические доказательства деятельности, которая имела место на «острове ядовитых газов». Он неоднократно приезжал в Китай и приносил свои извинения китайскому народу.
Фудзимото Ясума: Когда я ездил в Китай, китайские пострадавшие говорили мне, что я тоже пострадавший, я вынужден был делать ядовитый газ, однако, я считаю, что я вредитель. Китайский народ пострадал в войне из-за Японии, японцы убивали китайцев, используя ядовитый газ, Япония непременно должна извиниться за свои действия.
В ходе интервью Фудзимото время от времени воспроизводил химические уравнения, которые использовались при производстве ядовитых газов. За каждым уравнением скрываются его мучительные воспоминания об острове ядовитых газов, а также бесчисленные человеческие жизни, которые были уничтожены химической войной японской армии. За прошедшие 20 с лишним лет этот пожилой человек рассказывал о том, что он делал при каждом удобном случае.
Фудзимото Ясума: Производитель ядовитого газа – преступник. Если я забуду доказательства преступлений, я не смогу давать показания. Я никогда не забуду те химические уравнения.
3.1: Химические уравнения — Chemistry LibreTexts
Цели обучения
- Для описания химической реакции.
- Для расчета количества соединений, производимых или потребляемых в химической реакции
Что происходит с материей, когда она претерпевает химические изменения? Закон сохранения массы гласит, что « Атомы не создаются и не разрушаются во время какой-либо химической реакции ». Таким образом, после реакции присутствует тот же набор атомов, что и до реакции.Изменения, которые происходят во время реакции, включают только перегруппировку атомов. В этом разделе мы обсудим стехиометрию («измерение элементов»).
Химические уравнения
Как показано на рисунке \ (\ PageIndex {1} \), приложение небольшого количества тепла к груде оранжевого порошка дихромата аммония приводит к бурной реакции, известной как вулкан дихромата аммония.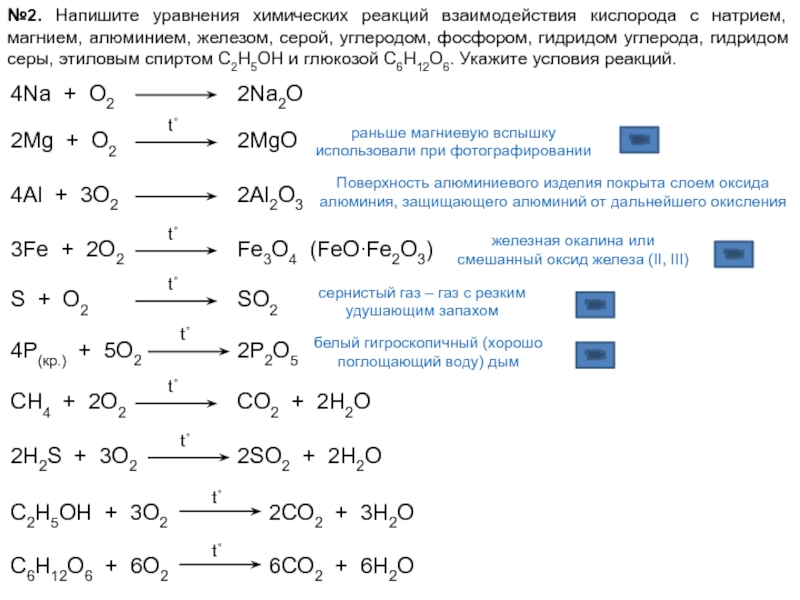 Тепло, свет и газ образуются в виде большого ворса пушистого зеленого оксида хрома (III).Эта реакция описывается химическим уравнением, выражением, которое определяет идентичность и количество веществ в химической реакции.
Тепло, свет и газ образуются в виде большого ворса пушистого зеленого оксида хрома (III).Эта реакция описывается химическим уравнением, выражением, которое определяет идентичность и количество веществ в химической реакции.
Рисунок \ (\ PageIndex {1} \): Вулкан из дихромата аммония: изменение во время химической реакции. Исходный материал — твердый дихромат аммония. Химическая реакция превращает его в твердый оксид хрома (III), на котором изображена часть его цепочечной структуры, газообразный азот и водяной пар (кроме того, выделяется энергия в виде тепла и света).Во время реакции распределение атомов меняется, но количество атомов каждого элемента не меняется. Поскольку номера каждого типа атомов одинаковы в реагентах и продуктах, химическое уравнение сбалансировано. (CC BY-SA 3.0; Микк Михкель Ваабель через Википедию). Смотрите видео здесь: www.youtube.com/watch?v=CW4hN0dYnkM
Химические реакции представлены на бумаге химическими уравнениями . Например, газообразный водород (H 2 ) может реагировать (гореть) с газообразным кислородом (O 2 ) с образованием воды (H 2 O). Химическое уравнение для этой реакции записывается как:
Химическое уравнение для этой реакции записывается как:
\ [\ ce {2H_2 + O_2 \ rightarrow 2H_2O} \]
Химические формулы и другие символы используются для обозначения исходных материалов или реагентов, которые по соглашению записываются в левой части уравнения, и конечных соединений или продуктов, которые записываются справа. Стрелка указывает от реагента к продуктам. Химическая реакция вулкана из дихромата аммония на рисунке \ (\ PageIndex {1} \) составляет
.
\ [\ underbrace {\ ce {(NH_4) _2Cr_2O_7}} _ {реагент} \ rightarrow \ underbrace {\ ce {Cr_2O_3 + N_2 + 4H_2O}} _ {продукты} \ label {3.1.1} \]
Стрелка читается как «уступает» или «реагирует на форму». Уравнение \ (\ ref {3.1.1} \) указывает, что дихромат аммония (реагент) дает оксид хрома (III), азот и воду (продукты). Уравнение этой реакции еще более информативно, если записать его следующим образом:
\ [\ ce {(Nh5) 2Cr2O7 (s) \ rightarrow Cr2O3 (s) + N2 (g) + 4h3O (g)} \ label {3. 1.2} \]
1.2} \]
Уравнение \ (\ ref {3.1.2} \) идентично уравнению \ (\ ref {3.1.1} \) за исключением добавления сокращений в скобках для обозначения физического состояния каждого вида.Сокращения: (s) для твердого вещества, (l) для жидкости, (g) для газа и (aq) для водного раствора, раствора вещества в воде.
В соответствии с законом сохранения массы, числа каждого типа атомов одинаковы по обе стороны от уравнений \ (\ ref {3.1.1} \) и \ (\ ref {3.1.2} \). Каждая сторона реакции имеет два атома хрома, семь атомов кислорода, два атома азота и восемь атомов водорода.
В сбалансированном химическом уравнении номера каждого типа атомов и общий заряд одинаковы с обеих сторон.Уравнения \ (\ ref {3.1.1} \) и \ (\ ref {3.1.2} \) являются сбалансированными химическими уравнениями. С каждой стороны уравнения различается то, как атомы расположены, чтобы образовывать молекулы или ионы. Химическая реакция представляет собой изменение распределения атомов, но не количества атомов. В этой реакции, как и в большинстве химических реакций, разрываются связи в реагентах (здесь связи Cr – O и N – H), и образуются новые связи для создания продуктов (здесь связи O – H и N≡N). . Если числа каждого типа атомов различны по обе стороны химического уравнения, тогда уравнение неуравновешено и не может правильно описать, что происходит во время реакции.Чтобы продолжить, сначала необходимо сбалансировать уравнение.
В этой реакции, как и в большинстве химических реакций, разрываются связи в реагентах (здесь связи Cr – O и N – H), и образуются новые связи для создания продуктов (здесь связи O – H и N≡N). . Если числа каждого типа атомов различны по обе стороны химического уравнения, тогда уравнение неуравновешено и не может правильно описать, что происходит во время реакции.Чтобы продолжить, сначала необходимо сбалансировать уравнение.
Химическая реакция изменяет только распределение атомов, но не количество атомов.
Уравновешивание простых химических уравнений
Когда химик сталкивается с новой реакцией, на ней обычно нет этикетки, которая показывает сбалансированное химическое уравнение. Вместо этого химик должен идентифицировать реагенты и продукты, а затем записать их в форме химического уравнения, которое может быть сбалансировано, а может и не быть сбалансировано, как было написано вначале.Рассмотрим, например, сгорание н-гептана (\ (C_7H_ {16} \)), важного компонента бензина:
\ [\ ce {C_7H_ {16} (l) + O_2 (g) \ rightarrow CO_2 (g) + H_2O (g)} \ label {3. 1.3} \]
1.3} \]
Полное сгорание любого углеводорода с достаточным количеством кислорода всегда дает диоксид углерода и воду.
Рисунок \ (\ PageIndex {2} \): Пример реакции горения. Воск в свече представляет собой высокомолекулярный углеводород, который в реакции горения выделяет газообразный диоксид углерода и водяной пар (Уравнение \ (\ ref {3.1.3} \)).
Уравнение \ (\ ref {3.1.3} \) не сбалансировано: номера каждого типа атомов на стороне реагента уравнения (7 атомов углерода, 16 атомов водорода и 2 атома кислорода) не совпадают с количество атомов каждого типа на стороне продукта (1 атом углерода, 2 атома водорода и 3 атома кислорода). Следовательно, коэффициенты реагентов и продуктов должны быть скорректированы так, чтобы получить одинаковое количество атомов каждого типа по обеим сторонам уравнения. Поскольку идентичности реагентов и продуктов фиксированы, уравнение не может быть сбалансировано путем изменения индексов реагентов или продуктов.Это изменит химическую идентичность описываемых видов, как показано на рисунке \ (\ PageIndex {3} \).
Рисунок \ (\ PageIndex {3} \): Уравнения балансировки. Вы не можете изменить индексы в химической формуле, чтобы сбалансировать химическое уравнение; вы можете изменить только коэффициенты. Изменение индексов изменяет соотношение атомов в молекуле и получаемые в результате химические свойства. Например, вода (H 2 O) и перекись водорода (H 2 O 2 ) являются химически разными веществами.H 2 O 2 разлагается на газ H 2 O и газ O 2 при контакте с металлической платиной, тогда как между водой и платиной такая реакция не происходит.
Самым простым и наиболее полезным методом уравновешивания химических уравнений является «проверка», более известная как метод проб и ошибок. Ниже приводится эффективный подход к уравновешиванию химического уравнения с использованием этого метода.
Шаги по уравновешиванию химического уравнения
- Определите наиболее сложное вещество.
- Начиная с этого вещества, выберите элемент, который присутствует только в одном реагенте и одном продукте, если это возможно.
 Отрегулируйте коэффициенты, чтобы получить одинаковое количество атомов этого элемента с обеих сторон.
Отрегулируйте коэффициенты, чтобы получить одинаковое количество атомов этого элемента с обеих сторон. - Уравновешивает многоатомные ионы (если есть) как единое целое.
- Уравновесить оставшиеся атомы, обычно заканчивая наименее сложным веществом и при необходимости используя дробные коэффициенты. Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов.
- Проверьте свою работу, подсчитав количество атомов каждого вида по обе стороны уравнения, чтобы убедиться, что химическое уравнение сбалансировано.
Пример \ (\ PageIndex {1A} \): Горение гептана
Чтобы продемонстрировать этот подход, давайте возьмем в качестве примера сжигание н-гептана (уравнение \ (\ ref {3.1.3} \)).
- Определить наиболее сложное вещество . Самая сложная субстанция — это вещество с наибольшим числом различных атомов, то есть \ (\ ce {C_7H_ {16}} \).
 Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества.
Сначала предположим, что окончательное сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. - Настройте коэффициенты . Попробуйте отрегулировать коэффициенты молекул на другой стороне уравнения, чтобы получить одинаковое количество атомов с обеих сторон. Поскольку одна молекула н-гептана содержит 7 атомов углерода, нам нужно 7 молекул CO 2 , каждая из которых содержит 1 атом углерода, с правой стороны:
\ [\ ce {C_7H_ {16} + O_2 \ rightarrow 7CO_2 + H_2O} \ label {3.1.4} \]
- Баланс многоатомных ионов как единое целое . В этой реакции не рассматриваются многоатомные ионы.
- Сбалансируйте оставшиеся атомы . Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 молекул h3O, каждая из которых содержит 2 атома водорода, с правой стороны: \ [\ ce {C_7H_ {16} + O_2 \ rightarrow 7CO_2 + 8H_2O} \ label {3.
 1.5} \] Атомы углерода и водорода теперь уравновешены, но у нас есть 22 атома кислорода справа и только 2 атома кислорода слева.Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \ [\ ce {C_7H_ {16} (l) + 11O_2 (g) \ rightarrow 7CO_2 (g ) + 8H_2O (г)} \ label {3.1.6} \]
1.5} \] Атомы углерода и водорода теперь уравновешены, но у нас есть 22 атома кислорода справа и только 2 атома кислорода слева.Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \ [\ ce {C_7H_ {16} (l) + 11O_2 (g) \ rightarrow 7CO_2 (g ) + 8H_2O (г)} \ label {3.1.6} \] - Проверь свою работу . Уравнение теперь сбалансировано, и дробных коэффициентов нет: с каждой стороны по 7 атомов углерода, 16 атомов водорода и 22 атома кислорода. Всегда проверяйте, сбалансировано ли химическое уравнение. Предположение, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу самого сложного вещества, не всегда верно, но это хорошее место для начала.
Пример \ (\ PageIndex {1B} \): сжигание изооктана
Рассмотрим, например, аналогичную реакцию, горение изооктана (\ (\ ce {C8h28} \)). Поскольку при сгорании любого углеводорода с кислородом образуется диоксид углерода и вода, несбалансированное химическое уравнение выглядит следующим образом:
\ [\ ce {C_8H_ {18} (l) + O_2 (g) \ rightarrow CO_2 (g) + H_2O (g)} \ label {3. 1.7} \]
1.7} \]
- Определить наиболее сложное вещество . Начните процесс балансировки, предположив, что окончательное сбалансированное химическое уравнение содержит одну молекулу изооктана.
- Настройте коэффициенты . Первый элемент, который появляется в реагентах только один раз, — это углерод: 8 атомов углерода в изооктане означает, что в продуктах должно быть 8 молекул CO 2 : \ [\ ce {C_8H_ {18} + O_2 \ rightarrow 8CO_2 + H_2O} \ label {3.1.8} \]
- Баланс многоатомных ионов как единое целое . Этот шаг не применяется к этому уравнению.
- Сбалансируйте оставшиеся атомы . Восемнадцать атомов водорода в изооктане означает, что в продуктах должно быть 9 молекул H 2 O: \ [\ ce {C_8H_ {18} + O_2 \ rightarrow 8CO_2 + 9H_2O} \ label {3.1.9} \] Атомы углерода и водорода теперь уравновешены, но у нас есть 25 атомов кислорода справа и только 2 атома кислорода слева.
 Мы можем сбалансировать наименее сложное вещество, O 2 , но поскольку на молекулу O 2 приходится 2 атома кислорода, мы должны использовать дробный коэффициент (25/2), чтобы сбалансировать атомы кислорода: \ [\ ce {C_8H_ {18} + 25/2 O_2 \ rightarrow 8CO_2 + 9H_2O} \ label {3.1.10} \] Уравнение \ (\ ref {3.1.10} \) теперь сбалансировано, но мы обычно пишем уравнения с целочисленными коэффициентами.Мы можем исключить дробный коэффициент, умножив все коэффициенты с обеих сторон химического уравнения на 2: \ [\ ce {2C_8H_ {18} (l) + 25O_2 (g) \ rightarrow 16CO_2 (g) + 18H_2O (g)} \ этикетка {3.11} \]
Мы можем сбалансировать наименее сложное вещество, O 2 , но поскольку на молекулу O 2 приходится 2 атома кислорода, мы должны использовать дробный коэффициент (25/2), чтобы сбалансировать атомы кислорода: \ [\ ce {C_8H_ {18} + 25/2 O_2 \ rightarrow 8CO_2 + 9H_2O} \ label {3.1.10} \] Уравнение \ (\ ref {3.1.10} \) теперь сбалансировано, но мы обычно пишем уравнения с целочисленными коэффициентами.Мы можем исключить дробный коэффициент, умножив все коэффициенты с обеих сторон химического уравнения на 2: \ [\ ce {2C_8H_ {18} (l) + 25O_2 (g) \ rightarrow 16CO_2 (g) + 18H_2O (g)} \ этикетка {3.11} \] - Проверь свою работу . Сбалансированное химическое уравнение имеет 16 атомов углерода, 36 атомов водорода и 50 атомов кислорода с каждой стороны.
Балансировка уравнений требует от вас некоторой практики, а также некоторого здравого смысла. Если вы обнаружите, что используете очень большие коэффициенты или безуспешно потратили несколько минут, вернитесь и убедитесь, что вы правильно написали формулы реагентов и продуктов.
Пример \ (\ PageIndex {1C} \): Гидроксиапатит
Реакция минерального гидроксиапатита (\ (\ ce {Ca5 (PO4) 3 (OH)} \)) с фосфорной кислотой и водой дает \ (\ ce {Ca (h3PO4) 2 • h3O} \) (дигидрофосфат кальция моногидрат). Напишите и сбалансируйте уравнение этой реакции.
Гидроксиапатит (\ (\ ce (Ca5 (PO4) 3 (OH)} \)) кристалл
Дано : реагенты и продукт
Запрошенный : вычисленное химическое уравнение
Стратегия :
- Определите продукт и реагенты, а затем запишите несбалансированное химическое уравнение.
- Следуйте инструкциям по уравновешиванию химического уравнения.
Решение :
A Сначала мы должны идентифицировать продукт и реагенты и написать уравнение реакции. В задаче приведены формулы для гидроксиапатита и моногидрата дигидрофосфата кальция (напомним, что фосфорная кислота — H 3 PO 4 ). Исходное (несбалансированное) уравнение выглядит следующим образом:
Исходное (несбалансированное) уравнение выглядит следующим образом:
\ [\ ce {Ca5 (PO4) 3 (OH) (s) + H_3PO4 (вод.) + H_2O _ {(l)} \ rightarrow Ca (H_2PO_4) _2 \ cdot H_2O _ {(s)}} \]
1. B Определите наиболее сложное вещество . Мы начинаем с предположения, что только одна молекула или формульная единица наиболее сложного вещества, \ (\ ce {Ca5 (PO4) 3 (OH)} \), появляется в сбалансированном химическом уравнении.
2. Настройте коэффициенты . Поскольку кальций присутствует только в одном реагенте и одном продукте, мы начнем с него. Одна формульная единица \ (\ ce {Ca5 (PO4) 3 (OH)} \) содержит 5 атомов кальция, поэтому нам нужно 5 Ca (H 2 PO 4 ) 2 • H 2 O на правая сторона:
\ [\ ce {Ca5 (PO4) 3 (OH) + h4PO4 + h3O \ rightarrow 5Ca (h3PO4) 2 \ cdot h3O} \]
3. Уравновесить многоатомные ионы как единое целое . Обычно легче сбалансировать уравнение, если мы признаем, что определенные комбинации атомов встречаются с обеих сторон. В этом уравнении многоатомный фосфат-ион (PO 4 3-) появляется в трех местах. В H 3 PO 4 ион фосфата объединяется с тремя ионами H + с образованием фосфорной кислоты (H 3 PO 4 ), тогда как в Ca (H 2 PO 4 ) 2 • H 2 O он объединяется с двумя ионами H + с образованием дигидрофосфатного иона.Таким образом, легче сбалансировать PO 4 как единицу, чем считать отдельные атомы фосфора и кислорода. На правой стороне 10 штук PO 4 , а на левой — всего 4. Самый простой способ уравновесить единицы PO 4 — поставить коэффициент 7 перед H 3 PO 4 :
В этом уравнении многоатомный фосфат-ион (PO 4 3-) появляется в трех местах. В H 3 PO 4 ион фосфата объединяется с тремя ионами H + с образованием фосфорной кислоты (H 3 PO 4 ), тогда как в Ca (H 2 PO 4 ) 2 • H 2 O он объединяется с двумя ионами H + с образованием дигидрофосфатного иона.Таким образом, легче сбалансировать PO 4 как единицу, чем считать отдельные атомы фосфора и кислорода. На правой стороне 10 штук PO 4 , а на левой — всего 4. Самый простой способ уравновесить единицы PO 4 — поставить коэффициент 7 перед H 3 PO 4 :
\ [\ ce {Ca_5 (PO_4) _3 (OH) + 7H_3PO_4 + H_2O \ rightarrow 5Ca (H_2PO_4) _2 \ cdot H_2O} \]
Хотя OH — также является многоатомным ионом, он не появляется с обеих сторон уравнения.Таким образом, кислород и водород необходимо уравновешивать отдельно.
4. Уравновесить остальные атомы . Теперь у нас 30 атомов водорода справа и только 24 слева. Мы можем уравновесить атомы водорода, используя наименее сложное вещество, H 2 O, поместив коэффициент 4 перед H 2 O с левой стороны, что в сумме даст 4 H 2 O молекул:
\ [\ ce {Ca_5 (PO_4) _3 (OH) (s) + 7H_3PO_4 (aq) + 4H_2O (l) \ rightarrow 5Ca (H_2PO_4) _2 \ cdot H_2O (s)} \]
Уравнение теперь сбалансировано.Несмотря на то, что мы явно не сбалансировали атомы кислорода, на каждой стороне находится 41 атом кислорода.
5. Проверьте свою работу . Обе части уравнения содержат 5 атомов кальция, 10 атомов фосфора, 30 атомов водорода и 41 атом кислорода.
Упражнение \ (\ PageIndex {1} \): Ферментация
Ферментация — это биохимический процесс, который позволяет дрожжевым клеткам жить в отсутствие кислорода. Люди веками использовали его для производства вина и пива, а также для выращивания хлеба. При ферментации сахара, такие как глюкоза, превращаются в этанол (\ (CH_3CH_2OH \) и диоксид углерода \ (CO_2 \). Напишите сбалансированную химическую реакцию ферментации глюкозы.
При ферментации сахара, такие как глюкоза, превращаются в этанол (\ (CH_3CH_2OH \) и диоксид углерода \ (CO_2 \). Напишите сбалансированную химическую реакцию ферментации глюкозы.
Коммерческое использование ферментации . (а) Чаны для пивоварен используются для приготовления пива. (б) Ферментация глюкозы дрожжевыми клетками — это реакция, которая делает возможным производство пива.
- Ответ
\ [C_6H_ {12} O_6 (s) \ rightarrow 2C_2H_5OH (l) + 2CO_2 (g) \ nonumber \]
Интерпретация химических уравнений
Помимо предоставления качественной информации об идентичности и физическом состоянии реагентов и продуктов, сбалансированное химическое уравнение предоставляет количественную информацию.В частности, он дает относительные количества реагентов и продуктов, потребляемых или производимых в реакции. Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении является коэффициентом этого вещества (например, 4 предшествующих H 2 O в уравнении \ (\ ref {3.1.1} \ )). Если перед видом не указан коэффициент, предполагается, что коэффициент равен 1. Как показано на рисунке \ (\ PageIndex {4} \), коэффициенты позволяют использовать уравнение \ (\ ref {3.1.1} \). интерпретируется любым из следующих способов:
- Два иона NH 4 + и один ион Cr 2 O 7 2- выход иона 1 формульная единица Cr 2 O 3 , 1 молекула N 2 и 4 H 2 Молекулы О.
- Один моль (NH 4 ) 2 Cr 2 O 7 дает 1 моль Cr 2 O 3 , 1 моль N 2 и 4 моль H 2 О.
- Масса 252 г (NH 4 ) 2 Cr 2 O 7 дает 152 г Cr 2 O 3 , 28 г N 2 и 72 г H 2 О.
- Всего 6,022 × 10 23 формульных единиц (NH 4 ) 2 Cr 2 O 7 дает 6.022 × 10 23 формульные единицы Cr 2 O 3 , 6.022 × 10 23 молекулы N 2 и 24,09 × 10 23 молекулы H 2 O.
Рисунок \ (\ PageIndex {4} \): Взаимосвязи между молями, массами и формульными единицами соединений в сбалансированной химической реакции для вулкана дихромата аммония
уравнение, использующее понятия моля, молярной или формульной массы и числа Авогадро.Отношение количества молей одного вещества к количеству молей другого называется мольным соотношением. Например, мольное отношение \ (H_2O \) к \ (N_2 \) в уравнении \ (\ ref {3.1.1} \) составляет 4: 1. Общая масса реагентов равна общей массе продуктов, как предсказывает закон сохранения массы Дальтона:
\ [252 \; г \; \ текст {из} \; \ ce {(NH_4) _2Cr_2O_7} \]
выход
\ [152 + 28 + 72 = 252 \; грамм \; \ text {товаров.} \]
Химическое уравнение, однако, не показывает скорость реакции (быстро, медленно или совсем) или выделяется ли энергия в виде тепла или света.Эти вопросы более подробно рассматриваются в следующих главах.
Важная химическая реакция была проанализирована Антуаном Лавуазье, французским химиком 18-го века, который интересовался химией живых организмов, а также простыми химическими системами. В классической серии экспериментов он измерил углекислый газ и тепло, выделяемое морской свинкой во время дыхания, в котором органические соединения используются в качестве топлива для производства энергии, углекислого газа и воды. Лавуазье обнаружил, что соотношение выделяемого тепла и выдыхаемого углекислого газа было аналогично соотношению, наблюдаемому при реакции древесного угля с кислородом воздуха с образованием двуокиси углерода — процесс, который химики называют горением.Основываясь на этих экспериментах, он предположил, что «Дыхание — это горение, правда, медленное, но в остальном оно совершенно похоже на горение древесного угля». Лавуазье был прав, хотя органические соединения, потребляемые при дыхании, существенно отличаются от тех, что содержатся в древесном угле. Одним из важнейших видов топлива в организме человека является глюкоза (\ (C_6H_ {12} O_6 \)), которая фактически является единственным топливом, используемым в мозгу. Таким образом, горение и дыхание являются примерами химических реакций.
Пример \ (\ PageIndex {2} \): Горение глюкозы
Сбалансированное химическое уравнение горения глюкозы в лаборатории (или в мозге) имеет следующий вид:
\ [\ ce {C_6H_ {12} O6 (s) + 6O2 (g) \ rightarrow 6CO2 (g) + 6h3O (l)} \]
Постройте таблицу, показывающую, как интерпретировать информацию в этом уравнении в терминах
- одиночная молекула глюкозы.
- моль реактивов и продуктов.
- граммов реагентов и продуктов представлены 1 моль глюкозы.
- чисел молекул реагентов и продуктов, представленных 1 моль глюкозы.
Горение кубика сахара, состоящего из сахарозы, с аналогичной реакцией на горение глюкозы. из Википедии.
Дано : вычисленное химическое уравнение
Запрошено : отношения молекул, молей и масс
Стратегия :
- Используйте коэффициенты из сбалансированного химического уравнения, чтобы определить как молекулярные, так и мольные отношения.
- Используйте молярные массы реагентов и продуктов для перевода из молей в граммы.
- Используйте число Авогадро для перевода молей в количество молекул.
Решение :
Это уравнение сбалансировано, как написано: каждая сторона имеет 6 атомов углерода, 18 атомов кислорода и 12 атомов водорода. Таким образом, мы можем использовать коэффициенты напрямую, чтобы получить желаемую информацию.
- Одна молекула глюкозы реагирует с 6 молекулами O 2 с образованием 6 молекул CO 2 и 6 молекул H 2 O.
- Один моль глюкозы реагирует с 6 моль O 2 с образованием 6 моль CO 2 и 6 моль H 2 O.
- Чтобы интерпретировать уравнение в терминах масс реагентов и продуктов, нам нужны их молярные массы и мольные отношения из части b. Молярные массы в граммах на моль следующие: глюкоза 180,16; О 2 , 31,9988; CO 2 , 44,010; и H 2 O, 18.015.
\ [\ begin {align *} \ text {масса реагентов} & = \ text {масса продуктов} \\ [4pt] g \, глюкоза + g \, O_2 & = g \, CO_2 + g \, H_2O \ end {align *} \]
\ [1 \, моль \, глюкоза \ влево ({180.16 \, g \ over 1 \, mol \, глюкоза} \ right) + 6 \, mol \, O_2 \ left ({31.9988 \, g \ over 1 \, mol \, O_2} \ right) \]
\ [= 6 \, моль \, CO_2 \ влево ({44.010 \, g \ over 1 \, mol \, CO_2} \ right) + 6 \, mol \, H_2O \ left ({18.015 \, g \ over 1 \, mol \, H_2O} \ right) \]
\ [372,15 \, г = 372,15 \, г \]
C Один моль глюкозы содержит число Авогадро (6,022 × 10 23 ) молекул глюкозы. Таким образом, 6,022 × 10 23 молекулы глюкозы реагируют с (6 × 6.022 × 10 23 ) = 3,613 × 10 24 молекул кислорода, чтобы получить (6 × 6,022 × 10 23 ) = 3,613 × 10 24 молекулы каждая из CO 2 и H 2 O.
В табличной форме:
| \ (C_6H_ {12} O_ {6 \; (s)} \) | + | \ (6O_ {2 \; (g)} \) | → | \ (6CO_ {2 \; (g)} \) | \ (6H_2O _ {(l)} \) | ||
|---|---|---|---|---|---|---|---|
| а. | 1 молекула | 6 молекул | 6 молекул | 6 молекул | |||
| б. | 1 моль | 6 моль | 6 моль | 6 моль | |||
| с. | 180,16 г | 191,9928 г | 264,06 г | 108,09 г | |||
| г. | 6.022 × 10 23 молекулы | 3,613 × 10 24 молекулы | 3,613 × 10 24 молекулы | 3.613 × 10 24 молекула |
Упражнение \ (\ PageIndex {2} \): взрыв нитрата аммония
Аммиачная селитра — обычное удобрение, но при неправильных условиях может быть опасным. В 1947 году корабль, загруженный нитратом аммония, загорелся при разгрузке и взорвался, разрушив город Техас-Сити, штат Техас.
Нитрат аммония может быть опасным. На этом аэрофотоснимке Техас-Сити, штат Техас, показаны разрушения, вызванные взрывом корабля с нитратом аммония 16 апреля 1947 года.Для просмотра видео щелкните здесь.
Взрыв возник в результате реакции:
\ [2NH_4NO_ {3 \; (s)} \ rightarrow 2N_ {2 \; (g)} + 4H_2O _ {(g)} + O_ {2 \; (g)} \]
Создайте таблицу, показывающую, как интерпретировать информацию в уравнении в терминах
- отдельных молекул и ионов.
- моль реактивов и продуктов.
- граммов реагентов и продуктов с учетом 2 моль нитрата аммония.
- чисел молекул или формульных единиц реагентов и продуктов на 2 моля нитрата аммония.
Ответ :
| \ (2NH_4NO_ {3 \; (s)} \) | → | \ (2N_ {2 \; (g)} \) | + | \ (4H_2O _ {(g)} \) | + | \ (O_ {2 \; (g)} \) | |
|---|---|---|---|---|---|---|---|
| а. | 2NH 4 + иона и 2NO 3 — иона | 2 молекулы | 4 молекулы | 1 молекула | |||
| б. | 2 моль | 2 моль | 4 моль | 1 моль | |||
| с. | 160,0864 г | 56,0268 г | 72,0608 г | 31,9988 г | |||
| г. | 1,204 × 10 24 формульные единицы | 1.204 × 10 24 молекулы | 2.409 × 10 24 молекулы | 6.022 × 10 23 молекулы |
Сводка
Химическая реакция описывается химическим уравнением, которое определяет идентичность и количество реагентов и продуктов.В химической реакции одно или несколько веществ превращаются в новые вещества. Химическая реакция описывается химическим уравнением , выражением, которое определяет идентичность и количество веществ, участвующих в реакции. Химическое уравнение показывает исходное соединение (я) — реагенты , — слева и конечное соединение (я) — продукты — справа, разделенные стрелкой. В сбалансированном химическом уравнении количество атомов каждого элемента и общий заряд одинаковы с обеих сторон уравнения.Число атомов, молекул или формульных единиц реагента или продукта в сбалансированном химическом уравнении — это коэффициент для этого вида. Мольное соотношение двух веществ в химической реакции — это соотношение их коэффициентов в сбалансированном химическом уравнении.
11: Химическое уравнение — Chemistry LibreTexts
Цели обучения
- Определите химическое уравнение .
- Определяет составные части химического уравнения.
Химическая реакция выражает химическое изменение. Например, одним из химических свойств водорода является то, что он реагирует с кислородом с образованием воды. Мы можем написать это так:
\ [\ text {водород реагирует с кислородом, образуя воду} \ nonumber \]
Мы можем представить это химическое изменение более кратко:
\ [\ text {водород} + \ text {кислород} → \ text {вода} \ nonumber \]
, где знак + означает, что два вещества химически взаимодействуют друг с другом, а символ → означает, что происходит химическая реакция.Но вещества также могут быть представлены химическими формулами. Помня, что водород и кислород существуют в виде двухатомных молекул, мы можем переписать наше химическое изменение как:
\ [\ ce {H_2 + O_2 → H_2O} \ nonumber \]
Это пример химического уравнения, которое является кратким представлением химической реакции . Исходные вещества называются реагентами , а конечные вещества называются продуктами .
К сожалению, это также неполное химическое уравнение .Закон сохранения материи гласит, что материя не может быть создана или уничтожена. В химических уравнениях количество атомов каждого элемента в реагентах должно быть таким же, как количество атомов каждого элемента в продуктах. Если мы посчитаем количество атомов водорода в реагентах и продуктах, мы найдем два атома водорода. Но если мы посчитаем количество атомов кислорода в реагентах и продуктах, мы обнаружим, что в реагентах есть два атома кислорода, но только один атом кислорода в продуктах.
Что мы можем сделать? Можно ли изменить индексы в формуле для воды так, чтобы в ней было два атома кислорода? Нет, вы, , не можете изменять формулы отдельных веществ, потому что химическая формула данного вещества характерна для этого вещества. Однако то, что вы можете сделать, , — это изменить количество молекул, которые вступают в реакцию или образуются. Мы делаем это по одному элементу за раз, переходя от одной стороны реакции к другой, изменяя количество молекул вещества до тех пор, пока все элементы не будут иметь одинаковое количество атомов с каждой стороны.
Чтобы использовать два атома кислорода в качестве реагентов, предположим, что у нас есть две молекулы воды в качестве продуктов:
\ [\ ce {H_2 + O_2 → 2H_2O} \ nonumber \]
Число 2 перед формулой для воды называется коэффициентом . Теперь в реагентах такое же количество атомов кислорода, как и в продукте. Но чтобы удовлетворить потребность в одинаковом количестве атомов кислорода на обеих сторонах реакции, мы также изменили количество атомов водорода на стороне продукта, поэтому количество атомов водорода больше не равно.Нет проблем, просто вернитесь к реакционной стороне уравнения и добавьте коэффициент перед H 2 . Действующий коэффициент 2:
.
\ [\ ce {2H_2 + O_2 → 2H_2O} \ nonumber \]
Теперь в реагентах есть четыре атома водорода, а также четыре атома водорода в продукте. В реагентах есть два атома кислорода, а в продукте — два атома кислорода. Закон сохранения вещества соблюден. Когда реагенты и продукты химического уравнения имеют одинаковое количество атомов всех присутствующих элементов, мы говорим, что уравнение сбалансировано .Все правильные химические уравнения сбалансированы. Если перед веществом не написан коэффициент, предполагается, что он равен 1. Кроме того, принято использовать все целые числа при балансировании химических уравнений. Иногда это заставляет нас делать немного больше «туда-сюда» при балансировании химического уравнения.
Пример \ (\ PageIndex {1} \)
Напишите и уравновесите химические уравнения для каждой данной химической реакции.
- Водород и хлор реагируют с образованием \ (\ ce {HCl} \)
- Этан, \ (\ ce {C2H6} \), реагирует с кислородом с образованием диоксида углерода и воды.
.
Решение
- Давайте начнем с простого написания химического уравнения в терминах формул веществ, помня, что и элементарный водород, и хлор двухатомны: \ [\ ce {h3 + Cl2 → HCl} \ nonumber \ nonumber \]
В реагентах есть два атома водорода и два атома хлора, а в продукте — по одному на каждый атом. Мы можем исправить это, включив коэффициент 2 на стороне продукта:
\ [\ ce {h3 + Cl2 → 2HCl} \ nonumber \ nonumber \]
Теперь есть два атома водорода и два атома хлора по обе стороны химического уравнения, так что оно уравновешено.
- Начните с написания химического уравнения в терминах используемых веществ: \ [\ ce {C2H6 + O2 → CO2 + h3O} \ nonumber \ nonumber \]
У нас два атома углерода слева, поэтому нам нужны две молекулы диоксида углерода на стороне продукта, чтобы на каждой стороне было по два атома углерода; этот элемент сбалансирован. У нас есть шесть атомов водорода в реагентах, поэтому нам нужно шесть атомов водорода в продуктах. Мы можем получить это, имея три молекулы воды:
\ [\ ce {C2H6 + O2 → 2CO2 + 3h3O} \ nonumber \ nonumber \]
Теперь у нас есть семь атомов кислорода в продуктах (четыре из CO 2 и три из H 2 O).Это означает, что нам нужно семь атомов кислорода в реагентах. Однако, поскольку кислород — двухатомная молекула, мы можем получить только четное количество атомов кислорода за один раз. Мы можем добиться этого, умножив другие коэффициенты на 2:
.
\ [\ ce {2C2H6 + O2 → 4CO2 + 6h3O} \ nonumber \ nonumber \]Умножая все остальное на 2, мы не разбалансируем другие элементы, и теперь мы получаем четное число атомов кислорода в произведении — 14. Мы можем получить 14 атомов кислорода на стороне реагента, имея 7 молекул кислорода:
\ [\ ce {2C2H6 + 7O2 → 4CO2 + 6h3O} \ nonumber \ nonumber \]
Для проверки пересчитайте все, чтобы определить, что каждая сторона имеет одинаковое количество атомов каждого элемента.Это химическое уравнение теперь сбалансировано.
Упражнение \ (\ PageIndex {1} \)
Напишите и уравновесите химическое уравнение, которое представляет реакцию азота и водорода с образованием аммиака, NH 3 .
- Ответ
\ [\ ce {N2 + 3h3 → 2Nh4 \ nonumber \ nonumber \]
Многие химические уравнения также включают метки фаз для веществ: (s) для твердого вещества, (ℓ) для жидкости, (g) для газа и (aq) для водного (т.е.{\ circ} C} {\ rightarrow} \ ce {Na2CO3 (s) + CO2 (г) + h3O (l)} \ nonumber \]
Основные выводы
- Химическое уравнение — это краткое описание химической реакции.
- Правильные химические уравнения сбалансированы.
Что такое химические уравнения?
Химическое уравнение — это то, с чем вы будете сталкиваться каждый день в химии. Это письменное представление с использованием чисел и символов процесса, происходящего во время химической реакции.
Как написать химическое уравнение
В химическом уравнении слева от стрелки указаны реагенты, а справа — продукты химической реакции. Головка стрелки обычно указывает вправо или в сторону произведения уравнения, хотя некоторые уравнения могут указывать на равновесие, при котором реакция протекает одновременно в обоих направлениях.
Элементы в уравнении обозначаются их символами. Коэффициенты рядом с символами указывают стехиометрические числа.Нижние индексы используются для обозначения количества атомов элемента, присутствующего в химическом веществе.
Пример химического уравнения можно увидеть при горении метана:
CH
4 + 2 О
2 → CO
2 + 2 ч
2 O
Участники химической реакции: символы элементов
Вам нужно знать символы элементов, чтобы понять, что происходит в химической реакции.В этой реакции C — углерод, H — водород и O — кислород.
Левая часть уравнения: Реагенты
Реагентами этой химической реакции являются метан и кислород: CH 4 и O 2 .
Правая часть уравнения: продукты
Продуктами этой реакции являются диоксид углерода и вода: CO 2 и H 2 O.
Направление реакции: стрелка
Принято размещать реагенты в левой части химического уравнения, а продукты — в правой.Стрелка между реагентами и продуктами должна указывать слева направо или, если реакция протекает в обоих направлениях, указывать в обоих направлениях (это обычное дело). Если ваша стрелка указывает справа налево, рекомендуется переписать уравнение обычным способом.
Уравновешивание массы и заряда
Химические уравнения могут быть как несбалансированными, так и сбалансированными. Несбалансированное уравнение перечисляет реагенты и продукты, но не соотношение между ними. Сбалансированное химическое уравнение имеет одинаковое количество и типы атомов по обе стороны стрелки.Если присутствуют ионы, сумма положительных и отрицательных зарядов по обе стороны стрелки также одинакова.
Обозначение состояния вещества
Обычно состояние вещества в химическом уравнении указывают с помощью скобок и сокращения сразу после химической формулы. Это можно увидеть в следующем уравнении:
2 ч
2 (г) + O
2 (г) → 2 ч
2 O (л)
Водород и кислород обозначены (g), что означает, что они газы.Вода обозначена (l), что означает, что это жидкость. Другой символ, который вы можете увидеть, — это (aq), что означает, что химическое вещество находится в воде или водном растворе. Символ (aq) — это своего рода сокращенное обозначение водных растворов, поэтому воду не нужно включать в уравнение. Это особенно часто случается, когда в растворе присутствуют ионы.
химических уравнений (предыдущая версия) | Химия
Доступна обновленная версия модуля «Химические уравнения».Для просмотра перейдите сюда.
Химические реакции происходят повсюду вокруг нас: когда мы зажигаем спичку, заводим машину, ужинаем или выгуливаем собаку. Химическая реакция — это процесс, с помощью которого вещества связываются (или разрывают связи) и при этом либо выделяют, либо потребляют энергию (см. Наш модуль «Химические реакции»). Химическое уравнение — это сокращение, которое ученые используют для описания химической реакции. В качестве примера возьмем реакцию водорода с кислородом с образованием воды.Если бы у нас был контейнер с газообразным водородом и мы сожгли бы его в присутствии кислорода, два газа вступили бы в реакцию вместе, высвобождая энергию, с образованием воды. Чтобы написать химическое уравнение для этой реакции, мы поместим реагирующие вещества (реагенты) в левую часть уравнения со стрелкой, указывающей на вещества, образующиеся в правой части уравнения (продукты). Учитывая эту информацию, можно предположить, что уравнение этой реакции записано:
Знак плюс в левой части уравнения означает, что взаимодействуют водород (H) и кислород (O) .К сожалению, с этим химическим уравнением связаны две проблемы. Во-первых, поскольку атомы любят иметь полные валентные оболочки, одиночные атомы H или O встречаются редко. В природе и водород, и кислород находятся в виде двухатомных молекул, H 2 и O 2 соответственно (при образовании двухатомных молекул атомы разделяют электроны и завершают свои валентные оболочки). Следовательно, газообразный водород состоит из молекул H 2 ; газообразный кислород состоит из O 2 . Исправив наше уравнение, мы получим:
Но у нас все еще есть одна проблема.Как написано, это уравнение говорит нам, что одна молекула водорода (с двумя атомами H) реагирует с одной молекулой кислорода (двумя атомами O) с образованием одной молекулы воды (с двумя атомами H и одним атомом O). Другими словами, кажется, что мы потеряли один атом кислорода по пути!
Балансирующие уравнения
Чтобы правильно написать химическое уравнение, количество атомов в левой части химического уравнения должно быть точно сбалансировано с атомами в правой части уравнения.Как это произошло? На самом деле, атом кислорода, который мы «потеряли», вступает в реакцию со второй молекулой водорода, образуя вторую молекулу воды. Во время реакции связи H-H и O-O разрываются, и связи H-O образуются в молекулах воды, как показано в моделировании ниже.
Следовательно, записывается уравнение:
При написании химических уравнений число перед символом молекулы (называемое коэффициентом) указывает количество молекул, участвующих в реакции.Если перед молекулой не появляется никакого коэффициента, мы интерпретируем это как единицу.
Чтобы написать правильное химическое уравнение, мы должны уравновесить все атомы на левой стороне реакции с атомами на правой стороне. Давайте посмотрим на другой пример. Если вы используете газовую плиту для приготовления обеда, скорее всего, ваша плита работает на природном газе, в основном на метане. Метан (CH 4 ) — это молекула, содержащая четыре атома водорода, связанных с одним атомом углерода.Когда вы зажигаете печь, вы доставляете энергию активации, чтобы начать реакцию метана с кислородом в воздухе. Во время этой реакции химические связи разрываются и реформируются, и образуются продукты, содержащие углекислый газ и водяной пар (и, конечно, свет и тепло, которые вы видите как пламя). Неуравновешенное химическое уравнение будет записано:
| CH 4 (метан) + O 2 (кислород) | → | CO 2 (диоксид углерода) + H 2 O (вода) |
Посмотрите на реакцию атом за атомом.В левой части уравнения мы находим один атом углерода и один — справа.
| С | H 4 | + | О 2 | → | С | О 2 | + | H 2 | О |
| ↑ | 1 углерод | ↑ | 1 углерод |
Далее мы переходим к водороду: в левой части уравнения четыре атома водорода, а в правой — только два.
| С | H 4 | + | О 2 | → | С | О 2 | + | H 2 | О |
| ↑ | 4 водород | ↑ | 2 водород |
Следовательно, мы должны уравновесить атомы H, добавив коэффициент «2» перед молекулой воды (вы можете изменять только коэффициенты в химическом уравнении, но не индексы).Складывая этот коэффициент, получаем:
| С | H 4 | + | О 2 | → | С | О 2 | + | 2H 2 | O |
| ↑ | 4 водород | ↑ | 4 водород |
Это уравнение говорит о том, что две молекулы воды
производятся на каждую израсходованную молекулу метана.Двигаясь дальше
к атомам кислорода, мы находим два в левой части уравнения, но
всего четыре с правой стороны (два от молекулы CO 2 и по одному от каждой
две молекулы воды H 2 O).
| С | H 4 | + | О 2 | → | С | О 2 | + | 2H 2 | О |
| ↑ | 2 кислорода | ↑ | 4 кислорода |
Чтобы сбалансировать химическое уравнение, мы должны добавить коэффициент «2» в
перед молекулой кислорода в левой части уравнения, показывая
что две молекулы кислорода расходуются на каждую молекулу метана, которая
ожоги.
| С | H 4 | + | 2O 2 | → | С | О 2 | + | 2H 2 | О |
| ↑ | 4 кислорода | ↑ | 4 кислорода |
Контрольная точка понимания
В обеих частях сбалансированного уравнения одинаковое количество _____.
Закон определенных пропорций Дальтона
Закон определенных пропорций Дальтона справедлив для всех химических реакций (см. Наши «Ранние идеи о материи: от Демокрита к модулю Дальтона»). По сути, этот закон гласит, что химическая реакция всегда протекает в соответствии с соотношением, определяемым сбалансированным химическим уравнением. Таким образом, вы можете интерпретировать приведенное выше сбалансированное уравнение метана как чтение: «одна часть метана реагирует с двумя частями кислорода с образованием одной части диоксида углерода и двух частей воды.«Это соотношение всегда остается неизменным. Например, если мы начнем с двух частей метана, то мы потребляем четыре части O 2 и сгенерируем две части CO 2 и четыре части H 2 O. Если мы начнем с избыток любого из реагентов (например, пять частей кислорода, когда доступна только одна часть метана), избыток реагента не будет израсходован:
| С | H 4 | + | 5O 2 | → | С | О 2 | + | 2H 2 | + | 0 | + | 3O 2 |
| Избыточные реагенты не расходуются. | ||||||||||||
В примере, показанном выше, нужно было добавить 3O 2 справа
часть уравнения, чтобы уравновесить его и показать, что избыток кислорода не
расходуется во время реакции. В этом примере метан называется
предельный
Реактив .
Хотя мы обсуждали уравнения баланса в терминах числа атомов и молекул, имейте в виду, что мы никогда не говорим об одном атоме (или молекуле), когда используем химические уравнения.Это потому, что отдельные атомы (и молекулы) настолько крошечные, что их трудно изолировать. Химические уравнения обсуждаются в зависимости от количества молей используемых или произведенных реагентов и продуктов (см. Наш модуль «Моль»). Поскольку моль относится к стандартному числу атомов (или молекул), этот термин можно просто подставить в химические уравнения. Таким образом, приведенное выше сбалансированное уравнение для метана также можно интерпретировать как следующее: «один моль метана реагирует с двумя молями кислорода, образуя один моль диоксида углерода и два моля воды.«
Контрольная точка понимания
Закон определенных пропорций Дальтона гласит, что в химических реакциях
Сохранение материи
Закон сохранения материи гласит, что материя не теряется и не приобретается в традиционных химических реакциях; он просто меняет форму. Таким образом, если у нас есть определенное количество атомов элемента в левой части уравнения, мы должны иметь такое же количество в правой части.Это означает, что масса также сохраняется во время химической реакции. Реакция воды, например:
Общая масса реагентов, 36,04 г, в точности равна общей массе продуктов, 36,04 г (если вы не уверены в этих молекулярных массах, вам следует просмотреть урок «Крот»). . Это верно для всех сбалансированных химических уравнений.
Сводка
Когда ученые хотят описать химическую реакцию письменно, они используют точные химические уравнения.Этот модуль, третий из серии, посвященной химическим реакциям, объясняет химические уравнения в пошаговом процессе. Модуль показывает, как химические уравнения сбалансированы в контексте химических изменений, происходящих во время реакции. Представлен Закон сохранения материи.
Химическое уравнение
4.1 Химическое уравнение
Цели обучения
- Определите химическое уравнение .
- Определяет составные части химического уравнения.
Химическая реакция выражает химическое изменение. Например, одним из химических свойств водорода является то, что он реагирует с кислородом с образованием воды. Мы можем написать это так:
водород реагирует с кислородом с образованием воды
Мы можем представить это химическое изменение более кратко как
водород + кислород → вода
, где знак + означает, что два вещества химически взаимодействуют друг с другом, а символ → означает, что происходит химическая реакция.Но вещества также могут быть представлены химическими формулами. Помня, что водород и кислород существуют в виде двухатомных молекул, мы можем переписать наше химическое изменение как
H 2 + O 2 → H 2 O
Это пример химического уравнения — краткий способ представления химической реакции., Который является кратким способом представления химической реакции. Исходные вещества называются реагентами, исходным веществом в химическом уравнении, а конечные вещества называются продуктами конечного вещества в химическом уравнении..
К сожалению, это также неполное химическое уравнение . Закон сохранения материи гласит, что материя не может быть создана или уничтожена. В химических уравнениях количество атомов каждого элемента в реагентах должно быть таким же, как количество атомов каждого элемента в продуктах. Если мы посчитаем количество атомов водорода в реагентах и продуктах, мы найдем два атома водорода. Но если мы посчитаем количество атомов кислорода в реагентах и продуктах, мы обнаружим, что в реагентах есть два атома кислорода, но только один атом кислорода в продуктах.
Что мы можем сделать? Можно ли изменить индексы в формуле для воды так, чтобы в ней было два атома кислорода? Нет; вы, , не можете изменять формулы отдельных веществ, потому что химическая формула данного вещества характерна для этого вещества. Однако то, что вы можете сделать, , — это изменить количество молекул, которые вступают в реакцию или образуются. Мы делаем это по одному элементу за раз, переходя от одной стороны реакции к другой, изменяя количество молекул вещества до тех пор, пока все элементы не будут иметь одинаковое количество атомов с каждой стороны.
Чтобы использовать два атома кислорода в качестве реагентов, предположим, что у нас есть две молекулы воды в качестве продуктов:
H 2 + O 2 → 2 H 2 O
Число 2 перед формулой для воды называется коэффициентом. Число в химическом уравнении, указывающее более чем на одну молекулу вещества. Теперь в реагентах содержится такое же количество атомов кислорода, как и в продукте. Но чтобы удовлетворить потребность в одинаковом количестве атомов кислорода на обеих сторонах реакции, мы также изменили количество атомов водорода на стороне продукта, поэтому количество атомов водорода больше не равно.Нет проблем — просто вернитесь к реакционной стороне уравнения и добавьте коэффициент перед H 2 . Действующий коэффициент 2:
.
2H 2 + O 2 → 2H 2 O
Теперь в реагентах есть четыре атома водорода, а также четыре атома водорода в продукте. В реагентах есть два атома кислорода, а в продукте — два атома кислорода. Закон сохранения вещества соблюден. Когда реагенты и продукты химического уравнения имеют одинаковое количество атомов всех присутствующих элементов, мы говорим, что уравнение сбалансировано — состояние, когда реагенты и продукты химического уравнения имеют одинаковое количество атомов всех присутствующих элементов.. Все правильные химические уравнения сбалансированы. Если перед веществом не написан коэффициент, предполагается, что он равен 1. Кроме того, принято использовать все целые числа при балансировании химических уравнений. Иногда это заставляет нас делать немного больше «туда-сюда» при балансировании химического уравнения.
Пример 1
Напишите и уравновесите химические уравнения для каждой данной химической реакции.
- Водород и хлор реагируют с образованием HCl.
- Этан, C 2 H 6 , реагирует с кислородом с образованием диоксида углерода и воды.
Решение
Давайте начнем с простого написания химического уравнения в терминах формул веществ, помня, что и элементарный водород, и хлор двухатомны:
H 2 + Cl 2 → HCl
В реагентах есть два атома водорода и два атома хлора, а в продукте — по одному на каждый атом.Мы можем исправить это, включив коэффициент 2 на стороне продукта:
H 2 + Cl 2 → 2HCl
Теперь есть два атома водорода и два атома хлора по обе стороны химического уравнения, так что оно уравновешено.
Начните с написания химического уравнения в терминах используемых веществ:
C 2 H 6 + O 2 → CO 2 + H 2 O
У нас два атома углерода слева, поэтому нам нужны две молекулы диоксида углерода на стороне продукта, чтобы на каждой стороне было по два атома углерода; этот элемент сбалансирован.У нас есть шесть атомов водорода в реагентах, поэтому нам нужно шесть атомов водорода в продуктах. Мы можем получить это, имея три молекулы воды:
C 2 H 6 + O 2 → 2CO 2 + 3H 2 O
Теперь у нас есть семь атомов кислорода в продуктах (четыре из CO 2 и три из H 2 O). Это означает, что нам нужно семь атомов кислорода в реагентах. Однако, поскольку кислород — двухатомная молекула, мы можем получить только четное количество атомов кислорода за один раз.Мы можем добиться этого, умножив другие коэффициенты на 2:
.
2C 2 H 6 + O 2 → 4CO 2 + 6H 2 OУмножая все остальное на 2, мы не выводим из равновесия другие элементы, и теперь мы получаем четное число атомов кислорода в произведении — 14. Мы можем получить 14 атомов кислорода на стороне реагента, имея 7 молекул кислорода:
2C 2 H 6 + 7O 2 → 4CO 2 + 6H 2 O
Для проверки пересчитайте все, чтобы определить, что каждая сторона имеет одинаковое количество атомов каждого элемента.Это химическое уравнение теперь сбалансировано.
Проверьте себя
Напишите и уравновесите химическое уравнение, которое представляет реакцию азота и водорода с образованием аммиака, NH 3 .
Ответ
N 2 + 3H 2 → 2NH 3
Многие химические уравнения также включают метки фаз для веществ: (s) для твердого вещества, (ℓ) для жидкости, (g) для газа и (aq) для водного (т.е.э., растворенный в воде). Над стрелкой также могут быть указаны особые условия, например температура. Например,
2NaHCO3 (т) → 200 ° C Na2CO3 (т) + CO2 (г) + h3O (ℓ)
Основные выводы
- Химическое уравнение — это краткое описание химической реакции.
- Правильные химические уравнения сбалансированы.
Упражнения
Из утверждения «азот и водород реагируют с образованием аммиака» определите реагенты и продукты.
Из заявления «металлический натрий реагирует с водой с образованием гидроксида натрия и водорода» укажите реагенты и продукты.
Из заявления «гидроксид магния реагирует с азотной кислотой с образованием нитрата магния и воды» укажите реагенты и продукты.
Из утверждения «пропан реагирует с кислородом с образованием диоксида углерода и воды» укажите реагенты и продукты.
Напишите и уравновесите химическое уравнение, описанное в упражнении 1.
Напишите и уравновесите химическое уравнение, описанное в упражнении 2.
Напишите и уравновесите химическое уравнение, описанное в упражнении 3.
Напишите и уравновесите химическое уравнение, описанное в упражнении 4. Формула для пропана: C 3 H 8 .
Остаток: ___NaClO 3 → ___NaCl + ___O 2
Остаток: ___N 2 + ___H 2 → ___N 2 H 4
Остаток: ___Al + ___O 2 → ___Al 2 O 3
Остаток: ___C 2 H 4 + ___O 2 → ___CO 2 + ___H 2 O
Как бы вы написали сбалансированное химическое уравнение в упражнении 10, если бы все вещества были газами?
Как бы вы записали сбалансированное химическое уравнение в упражнении 12, если бы все вещества, кроме воды, были газами, а сама вода была жидкостью?
ответы
реактивов: азот и водород; продукт: аммиак
реактивы: гидроксид магния и азотная кислота; продукция: нитрат магния и вода
Mg (OH) 2 + 2HNO 3 → Mg (NO 3 ) 2 + 2H 2 O
2NaClO 3 → 2NaCl + 3O 2
N 2 (г) + 3H 2 (г) → 2NH 3 (г)
| ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
Химические уравнения и реакции
Химические уравнения и реакции
An
интерактивный обзор к предстоящему экзамену!
*** Любой текст
написанные розовым цветом ссылки на дополнительную информацию и мероприятия.***
*** Любой текст
написано желтым, требует от вас использования раздаточного материала в Интернете. ***
A химическая реакция процесс
в котором атомы, присутствующие в исходных веществах, перестраиваются, давая новые
химические комбинации, присутствующие в веществах, образованных в результате реакции. Эти исходные вещества химического
реакции называются реагентами , а новые вещества, которые
Результат называется товаров .
Вокруг химические реакции, |
наблюдаемый
Признаки химической реакции могут включать:
НО
ПОМНИТЬ!!!
Единственный способ
быть абсолютно уверенным, что произошла химическая реакция
через химическое
анализ продукции! Мы не могли бы
уметь наблюдать один из вышеперечисленных индикаторов
*** Помните наш
невидимая реакция кислоты / основания ??? ***
~ ХИМИЧЕСКИЕ УРАВНЕНИЯ ~
Химический
реакцию можно точно суммировать с
правильно написано химическое
уравнение .
Правильно написано
химическое уравнение дает информацию о реагентах, продуктах,
межмолекулярные отношения между реагентами и продуктами, и
родинка крота
между реагентами и
продукты.
*** Что такое
три части информации, что химическое уравнение
НЕ
предоставить? ***
С тех пор
еще так много информации можно получить из химического уравнения,
нам нужно стать
знатоки их выписывания!
Но только что
является ли правильно написанным химическим уравнением?
Правильно написанное уравнение — это химическое уравнение, которое
1. представляет известные факты | Все реагенты и продукты идентифицированы Идентификация с помощью химического анализа в лаборатории |
2. содержит | |
3. и | Одинаковое количество атомов каждого элемента появляется на |
Чтобы убедиться, что
химическое уравнение подчиняется закону сохранения массы,
ты должен быть уверен
что уравнение сбалансировано.Практикуйте свои навыки балансировки с помощью CHEMBALANCER.
Запишите свой
ответы на прилагаемый интернет-раздаточный материал.
*** Каким образом
ты делаешь ??? ***
Хорошо, ну а теперь
что мы рассмотрели химические уравнения, давайте посмотрим, сможем ли мы
применяют эти концепции
в ОБЗОР МИНИ !!!
Направления: Запишите и сбалансируйте правильный химикат
уравнения для следующих
реакций на
сопроводительный раздаточный материал.(Не забудьте указать состояние
в скобках.)
1. Когда натрий твердый
Нитрат нагревается, он разлагается с образованием твердого нитрита натрия и газообразного кислорода.
2. При твердом фосфате кальция
и водный раствор серной кислоты реагируют, водная фосфорная кислота и твердое вещество
сульфат кальция.
3. Водный раствор
хлорид аммония и гидроксид бария нагревают, и соединения реагируют на
выделяют газообразный аммиак.Хлорид бария
раствор и вода также являются продуктами.
4. Газообразный аммиак реагирует.
с газообразным кислородом с получением газообразного азота и воды.
5. Медь (II)
оксид кипятят в водном растворе
серная кислота с образованием сульфата меди (II) и воды.
~ 5 ОСНОВНОЙ ХИМИЧЕСКИЙ ВЕЩЕСТВО
РЕАКЦИИ ~
Мы можем классифицировать химические реакции
в зависимости от способа, которым атомы или
молекул реагентов образуют новые
группировки.Многие химические реакции можно отнести к
как принадлежащие к одной из пяти основных групп.
1. РЕАКЦИИ СИНТЕЗА
Также известна как реакция композиции, синтез
реакция — реакция, в которой два или более веществ
объединить, чтобы сформировать новое соединение.
Представлен генеральным
уравнение:
A + X AX
где A и X могут быть
элементы или соединения, а AX представляет собой соединение.
Примеры реакций синтеза
включают:
Синтез
натрия хлорид
Na (т) + Cl ( г)
Синтез оксида магния
мг (т) + O 2 ( г)
Синтез воды
H 2 ( г) + O 2 (г)
2.РЕАКЦИЯ РАЗЛОЖЕНИЯ
Реакция разложения обратная
реакции синтеза и представляет собой реакцию, в которой одно соединение подвергается
реакция, которая производит два или более простых вещества.
Представлен генеральным
уравнение:
ТОПОР А + Х
где AX —
соединение и и A и X могут быть
элементы или соединения.
Большинство реакций разложения требует
размещать только когда энергия в виде
электричество или
добавлено тепло.
Примеры разложения
реакции включают:
Разложение
вода
H 2 O ( л)
Разложение карбоната свинца (II)
PbCO 3 (с)
Разложение йодида натрия
NaI (т)
3. РЕАКЦИИ ОДНОЗАМЕНЫ
А
реакция одиночного замещения или реакция замещения — это реакция, в которой
один элемент заменяет аналогичный элемент в составе.
Это
представлен общим уравнением:
A + BX AX + B
или
Y + BX BY + X
, где A, B, X и Y — элементы, а AX, BX и BY —
соединения.
Многие
реакции однократного замещения протекают в воде, и по сравнению с обоими
реакции синтеза и разложения, количество энергии, необходимое для
реакция одиночного замещения меньше.
Примеры
реакции однократного замещения включают:
Реакция термитов
Al (т)
+ Fe 2 O 3 (с)
Реакция твердого кальция и воды
Ca (с) + H 2 O ( л)
Реакция твердого лития и газообразного хлора
Li (т)
+ Cl 2 ( г)
4.ДВОЙНЫЕ РЕАКЦИИ
Двойной
реакция замещения — это реакция, в которой ионы двух соединений обмениваются
помещается в водный раствор с образованием двух новых соединений.
Один из новых составов
эта форма обычно представляет собой осадок, нерастворимый газ, который пузырится из
раствор или молекулярное соединение (обычно вода).
Другой
образующееся соединение обычно растворимо и остается в растворе.
Двойная замена
реакции представлены общим уравнением:
AX + BY AY + BX
где A, X, B и Y в реагентах представляют собой
ионы и продукты AY и BX представляют собой ионные или молекулярные соединения.
Примеры
реакции двойного замещения включают:
Реакции
нитрат серебра с хлоридом натрия и нитрат серебра с иодидом натрия
AgNO 3 ( водн.) + NaCl (водн.)
AgNO 3 ( водн.) + NaI (водн.)
Реакция серной кислоты и гидроксида натрия
H 2 SO 4 ( водн. ) + NaOH (водн.)
*** Есть два особых случая, которым присвоены конкретные имена
их.***
1.
Когда реакция идет между двумя ионными
соединений, и они образуют осадок, эта реакция также называется осаждением . Первое
приведенные выше примеры показывают реакции осаждения.
2.
Когда реакция происходит между кислотой ( любым соединением, которое образует ионы водорода ) и основанием ( любым соединением, которое
образует гидроксид-ионы ), вода образуется как один
продуктов.Это называется нейтрализацией . Пример
реакция нейтрализации наблюдается в приведенной выше реакции между серной кислотой и
гидроксид натрия.
5. РЕАКЦИИ ГОРЕНИЯ
A горение
реакция — реакция, в которой вещество соединяется с кислородом
и выделяет большое количество энергии в виде тепла и света.
Примеры
реакции горения включают:
Три баллона H 2 и один из H 2 / O 2
смесь
H 2 ( г) + O 2 (г)
Сжигание метана (углеводорода)
CH 4 ( г) + O 2 (г)
Сжигание гексана (углеводорода)
C 6 H 14 ( л) + O 2 (г)
*** Обычно
реакции горения происходят, когда углеводороды реагируют с кислородом с образованием углерода
диоксид и вода, и будет иметь общее уравнение
C x H y + O 2 CO 2 + H 2 O
, где x представляет собой количество атомов углерода, а y — число
.
атомов водорода в углеводороде
Углеводороды
класс соединений, которые в основном состоят из водорода и углерода.***
*** ВЫ
СМОТРЕТЬ ВСЕ МИНИ-ФИЛЬМЫ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ПРОДАЖИ
ПРИМЕР КАЖДОГО ТИПА РЕАКЦИИ ??? ***
Другой
раздел рассмотрен Пора еще раз ОБЗОР МИНИ !!!
Направления: Запишите или заполните и сбалансируйте каждое
следующих уравнений и
идентифицировать каждый как
синтез, разложение, однократное замещение, двойное замещение или сжигание
1.C 3 H 8 ( г)
+ O 2 (г)
2. Твердый натрий прореагировал
с водой образует водный гидроксид натрия и водород
газ.
3.
CaCO 3 (т)
4. AgNO 3 ( водн.) + KI (водн.)
5. Водородный газ реагирует
с газообразным йодом с образованием газообразного йодистого водорода.
~ СЕРИЯ ДЕЯТЕЛЬНОСТИ ~
Возможно размещение металлов в
порядок их химической реактивности и тем самым установить ряд активности
металлов.Серия занятий помогает
предсказать, будут ли реакции однократного замещения металлов ионами металлов
и металлов с водой и кислотами.
Активность серии Металлы Li руб. K Может реагировать с холодным h3O Ba и кислоты, заменяющие Sr водород Ca Na мг Al Mn Может реагировать с паром Zn и кислоты, заменяющие Cr водород. Fe Кд Co Ni Может реагировать с кислотами, Sn замена водорода. Пб H 2 Сб Реагировать с кислородом, Bi образует оксиды. Cu Hg Ag Достаточно инертный. Pt Только форма оксидов Au косвенно. Активность галогена Факс 2 Класс 2 Br 2 Я 2
| Некоторые
реакции синтеза металлов с кислородом также протекают тем легче, чем выше
чем активнее металл, тем сильнее он удерживает кислород в оксиде и
наиболее активные металлы вряд ли останутся несоединенными с другими веществами Элементы в верхней части серии никогда не встречаются бесплатно в
Таким образом, серия действий полезна |
Заключительный участок
просмотрел последний ОБЗОР MINI !!!
Направления: Используя ряд действий, спрогнозируйте
будет ли каждая из следующих реакций
встречается , и напишите
сбалансированные уравнения, которые вы предсказываете.
Если вы предсказываете, что этого не произойдет, просто напишите NR (если нет
реакция).
1. Pb (с) + ZnCl (с)
2. Класс 2 ( г)
+ KBr (водн.)
3. Al (s)
+ Pb (NO 3 ) 2 (водн.)
4. Cu (т)
+ FeSO 4 ( водн.)
5. Ni (s)
+ O 2 ( г)
Ну вот и завершаем интернет-обзор!
Сопровождающий
Раздаточный материал с интернет-обзором необходимо сдать в день экзамена!
И не забывай
усердно готовиться к экзамену. Пройдите тест, домашние задания и
раздаточный материал для обзора! И приходи в класс
с любыми вопросами
вы могли бы еще
имеют!
С УЧЕБНОЙ ЗАЧЕМ !!!
.
