Содержание
Урок 5. классификация химических реакций — Химия — 11 класс
Химия, 11 класс
Урок № 5. Классификация химических реакций
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению способов классификации химических реакций и системам классификации химических реакций.
Глоссарий
Гетерогенные реакции – реакции, в которых реагенты и продукты реакции находятся в разных фазах, при этом реакция протекает на границе раздела фаз.
Гомогенные реакции – реакции, в которых реагенты и продукты реакции находятся в одной фазе.
Катализатор – вещество, увеличивающее скорость химической реакции, но само при этом остающееся неизменным.
Необратимые реакции – реакции, протекающие в одном направлении до полного превращения реагирующих веществ в продукты реакции.
Обратимые реакции – реакции, протекающие одновременно в прямом и обратном направлениях в одних и тех же условиях.
Окислительно-восстановительные реакции (ОВР) – реакции, сопровождающиеся изменением степеней окисления элементов.
Реакции замещения – реакции между простыми и сложными веществами, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Реакции обмена – реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями.
Реакции разложения – реакции, при которых из одного сложного вещества образуется несколько новых веществ.
Реакции соединения – реакции, в результате которых из двух или нескольких исходных веществ образуется одно сложное вещество.
Химическая реакция (химическое превращение) – процесс, в котором одно или несколько веществ превращаются в другие вещества.
Экзотермическая реакция – реакция, сопровождающаяся выделением энергии (тепла).
Эндотермическая реакция – реакция, сопровождающаяся поглощением энергии (тепла).
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Химическая реакция – это процесс, в котором одно или несколько веществ превращаются в другие вещества. Выбирая определённые критерии, которые лягут в основу нашего описания, мы можем классифицировать и описать любую химическую реакцию с разных «точек зрения».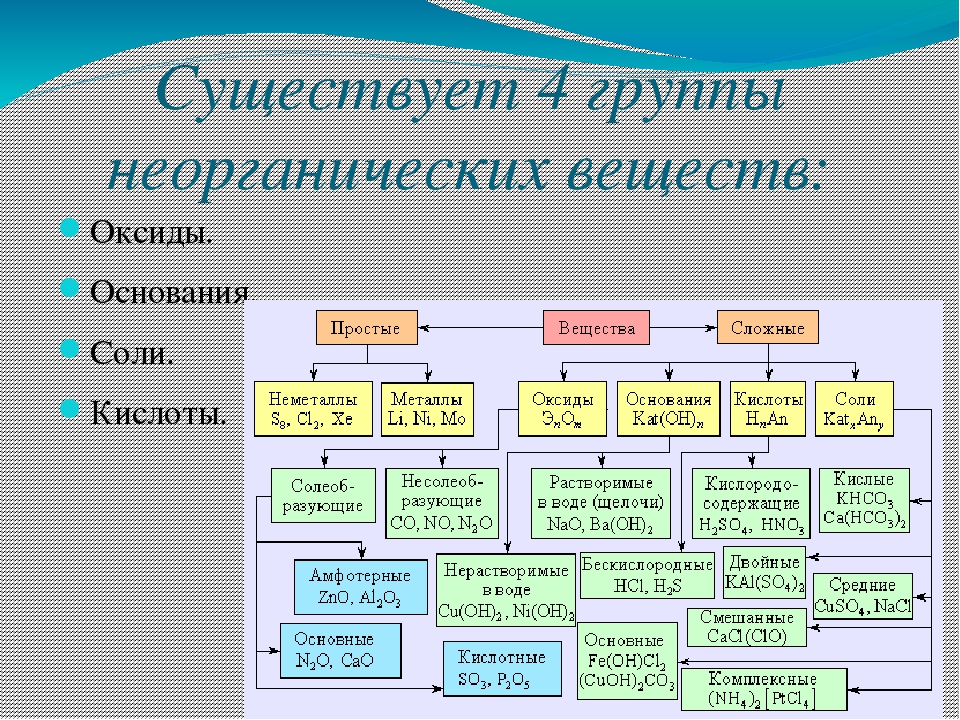
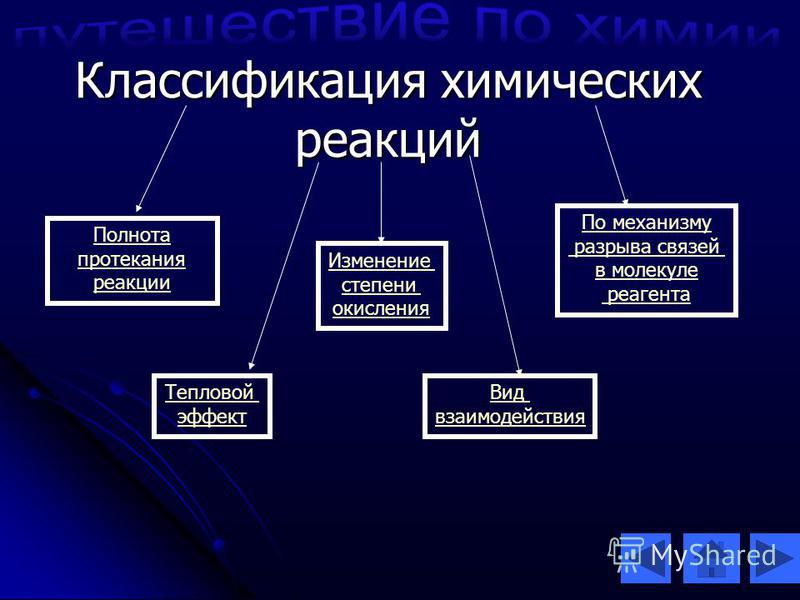
Рассмотрим, какие критерии могут лежать в основе разных классификаций химических реакций.
Первый критерий – число и состав реагирующих и образующихся веществ. Мы можем выделить реакции: соединения, разложения, замещения и обмена. Кроме этого, нам могут встретиться реакции, в ходе которых изменение состава веществ не происходит. Примерами таких реакций будут превращения одних аллотропных модификаций в другие, а также реакции изомеризации.
Если в основу классификации мы положим изменение степени окисления атомов элементов, то все реакции разделятся на две категории: окислительно-восстановительные и реакции, при которых изменение степени окисления не происходит.
В зависимости от использования катализатора, реакции могут являться каталитическими либо некаталитическими.
Если нас заинтересует смещение химического равновесия во время химического превращения, тогда мы увидим, что некоторые реакции окажутся обратимыми, а некоторые будут проходить до конца полностью и безвозвратно – необратимо.
По фазовому составу можно разделить реакции на гомогенные, при которых реагенты и продукты находятся в одной фазе, и гетерогенные, в которых реагенты и продукты находятся в разных фазах, а реакции происходят на границе раздела фаз.
Также реакции можно различить по виду энергии, которая их инициирует: таким образом реакции могут быть радиационные, фотохимические, термохимические и электрохимические.
В зависимости от теплового эффекта можно выделить реакции экзотермические, в ходе которых тепло выделяется, и эндотермические, при которых происходит поглощение тепла.
В заключение, можно посмотреть на реакции с точки зрения их механизма и тогда большинство реакций можно будет разделить на те, которые проходят по радикальному механизму, и те, что проходят по ионному.
Химические реакции следует отличать от ядерных. В результате химических реакций общее число атомов каждого химического элемента и его изотопный состав не меняются. Ядерные же реакции – это процесс превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами.
Ядерные же реакции – это процесс превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами.
Как мы видим, классификация химических реакций многопланова, то есть в ее основу положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Для примера рассмотрим реакцию разложения осадка гидроксида меди (II) с образованием оксида меди (II) и воды.
Cu(OH)2 → CuO + H2O
По количеству и характеру реагентов и продуктов эта реакция относится к типу реакций разложения – из одного сложного вещества мы получаем два новых сложных. В ходе реакции степени окисления атомов элементов остаются прежними, значит, это превращение относится к реакциям без изменения степеней окисления. Для осуществления такой реакции нам не требуется катализатор, поэтому это будет превращением некаталитическим. При разложении нерастворимого гидроксида меди (II) мы получаем нерастворимый в воде оксид меди (II), поэтому, если мы попробуем провести реакцию между оксидом меди (II) и водой, у нас ничего не выйдет. Значит, реакция разложения гидроксида меди (II) является необратимой. В качестве реагента выступает твердое вещество, а в качестве продуктов – твердый оксид меди (II) и водяной пар, поэтому по фазовому составу такая реакция является гетерогенной. Реакция разложения гидроксида меди (II) начинается при его нагревании, температура превращения составляет около 80 °С. Значит, по виду энергии, инициирующей реакцию, эта реакция является термохимической. Для «запуска» этой реакции требуется нагревание, следовательно, теплота, которую мы подводим извне, будет поглощаться и полученная энергия будет расходоваться на перестройку структуры. Такая реакция относится к эндотермическим.
Значит, реакция разложения гидроксида меди (II) является необратимой. В качестве реагента выступает твердое вещество, а в качестве продуктов – твердый оксид меди (II) и водяной пар, поэтому по фазовому составу такая реакция является гетерогенной. Реакция разложения гидроксида меди (II) начинается при его нагревании, температура превращения составляет около 80 °С. Значит, по виду энергии, инициирующей реакцию, эта реакция является термохимической. Для «запуска» этой реакции требуется нагревание, следовательно, теплота, которую мы подводим извне, будет поглощаться и полученная энергия будет расходоваться на перестройку структуры. Такая реакция относится к эндотермическим.
В итоге мы видим, что любая химическая реакция может быть одновременно и полно охарактеризована по различным критериям.
Классификация химических реакций разнообразна. Такой комплексный подход позволяет рассмотреть и изучить каждое превращение со всех возможных сторон и понять его максимально полно.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
Пример 1.
Введите формулу недостающего продукта реакции.
CH3COOH + Ca(OH)2 → … + H2O.
Решение
Мы видим, что первое вещество в этой реакции – это уксусная кислота, а второе – гидроксид кальция. Вспоминаем, что реакция между кислотой и основанием – это реакция нейтрализации. Продуктами подобных реакций являются соль и вода. Вода уже записана в правой части уравнения, остается вписать туда формулу соль. Это должна быть кальциевая соль уксусной кислоты – ацетат кальция. Ацетат-ион одновалентен, а ион кальция – двухвалентен, следовательно, на каждый ион кальция приходится два ацетат-иона. Его формула (CH3COO)2Ca. Записываем формулу на место пропуска.
Пример 2.
К каким типам реакций относится промышленный синтез аммиака?
- Реакция соединения
- Реакция обмена
- Электрохимическая реакция
- Радиохимическая реакция
- Гомогенная реакция
- Каталитическая реакция
Решение.
Реакция синтеза аммиака: N2 + H2 → NH3
Два простых вещества реагируют друг с другом с образованием сложного вещества. Следовательно, по определению, такая реакция будет реакцией соединения. Значит, «обмен» можно смело вычеркивать. Реакция синтеза аммиака происходит при высокой температуре и очень высоком давлении в присутствии катализатора. Выходит, что по типу энергии, инициирующей реакцию, эта реакция будет термохимической. Такого варианта у нас нет, значит оба предложенных варианта не подходит (электрохимическая и радиохимическая). Мы сказали, что для реакции требуется катализатор, поэтому эта реакция является каталитической. Все три вещества – азот, водород и аммиак – являются газообразными веществами, значит, реакция относится к типу гомогенных.
Классификация химических реакций в неорганической и органической химии | ЕГЭ по химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.}2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат.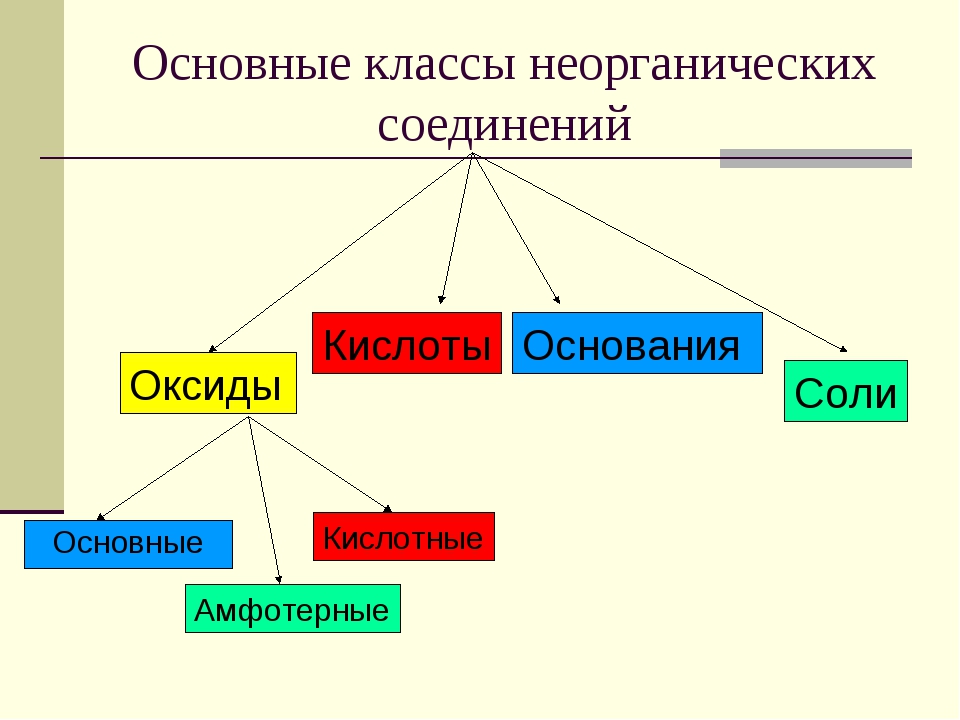 ,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
3) реакция крекинга (расщепления) пропана:
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑. $
$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).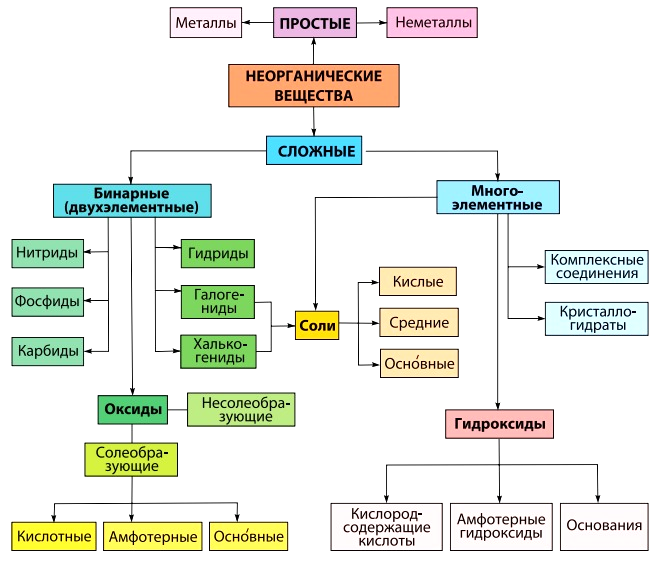 {-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{\text»уксусный альдегид»}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{\text»этиловый спирт»}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{\text»уксусный альдегид»}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{\text»этиловый спирт»}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92. 3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Классификация химических реактивов по степени чистоты по различным стандартам
1. Классификация химических реактивов, принятая в РФ в соответствии ГОСТ 13867-68.
1.2. Классификация химических реактивов, принятая в других странах.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Требования к качеству химических реактивов, выпускаемых в РФ, определяются Государственными Стандартами (ГОСТ) или Техническими Условиями (ТУ) — ГОСТ 13867-68 — Продукты химические. Обозначение чистоты.
http://www.gostedu.ru/43109.html.
Государственная Фармакопея Российской Федерации XI издание «Испытания на чистоту и допустимые пределы примесей».
2. Классификация химических реактивов, принятая в других странах.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Reagent A.C.S. — реагент высокого качества для лабораторного использования, в соответствии с требованиями Американского химического общества.
USP (Фармакопея США) — вещества, изготовленные в соответствии с действующими правилами производства и удовлетворяющие требованиям Фармакопеи США.
BP (Фармакопея Британская) — вещества, изготовленные в соответствии с действующими правилами производства и удовлетворяющие требованиям Фармакопеи Британской.
DAB (Фармакопея Германии) — вещества, изготовленные в соответствии с действующими правилами производства и удовлетворяющие требованиям Фармакопеи Германии.
Ph. Eur (Фармакопея Европейская) — вещества, изготовленные в соответствии с действующими правилами производства и удовлетворяющие требованиям Фармакопеи Европейской.
HAB (Фармакопея Немецкая Гомеопатическая) — вещества, изготовленные в соответствии с действующими правилами производства и удовлетворяющие требованиям Фармакопеи Немецкой.
Guaranteed Reagent (Гарантированный реагент) — реагент для использования в аналитической химии, который отвечает требованиям Американского химического общества или превосходит их.
AR (Аналитический реагент) — стандартная классификация аналитических реагентов Маллинкродта, подходящих для лабораторного и общего использования. Если реагент также отвечает требованиям Комиссии Американского химического общества по аналитическим реагентам, он будет отмечен как реагент AR.
Первичный стандарт (Primary Standard) — аналитический реагент исключительной частоты, изготовленный специально для стандартизированных волюметрических растворов и приготовления эталонных образцов.
Reagent (Реагент) — высочайшее качество, коммерчески доступное для данного химического вещества. Американское химическое общество официально не устанавливало спецификаций для данного материала.
Американское химическое общество официально не устанавливало спецификаций для данного материала.
OR (Органические реагенты) — органические реагенты, которые подходят для проведения исследований.
Purified (Очищенное вещество) — химическое вещество высокого качества, в ситуации, когда официальных стандартов нет. Эта классификация обычно применяется только к неорганическим химическим веществам.
Practical (Вещество, пригодное для практического использования) — химическое вещество хорошего качества, в ситуации, когда официальных стандартов нет. Пригодно для использования в задачах общего назначения. Органические вещества этого класса могут содержать небольшое количество изомеров промежуточных форм.
LabGrade (Лабораторное вещество) — растворители, пригодные для использования в гистологии и общем лабораторном использовании.
USP/GenAR — химические вещества, изготовленные в соответствии с c GMP и удовлетворяющие применимым требованиям 1995 USP 23, Европейской Фармакопеи (Ph.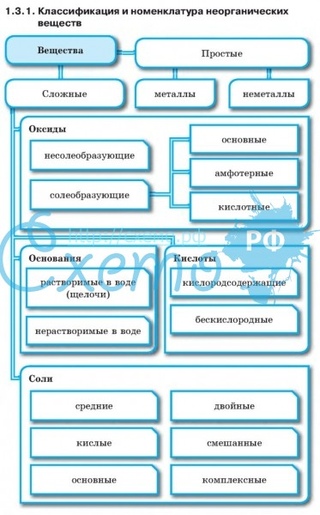 Eur.EP) и Британской Фармакопеи (BP), а также прошедших эндотоксинное тестирование (LAL) при необходимости.
Eur.EP) и Британской Фармакопеи (BP), а также прошедших эндотоксинное тестирование (LAL) при необходимости.
NF — химические вещества, соответствующие требованиям Национального Фармакологического Справочника.
FCC — продукты, соответствующие требованиям Кодекса пищевых химикатов.
Химически чистое вещество (CP) — вещества, чистота которых позволяет использовать их в общих ситуациях.
Technical (Вещество, пригодное для технических целей) — вещество, подходящее для общего промышленного применения.
Стандартные растворы.
Standardized Solintions (Стандартизированные растворы) — Растворы приготовлены из исходных материалов, которые отвечают требованиям Американского химического общества или превосходят их. В случае, если этих требований не установлено, используются химические компоненты высочайшей очистки из других возможных. Все водные растворы приготавливаются с использованием деионизированной воды высокой очистки, отвечающей требованиям классификации реагентов ASTM типа 1. Эти растворы стандартизированы в соответствии со стандартами NIST или первичными стандартами. (Только из растворов, изготовленных из компонентов классификации «Реагент»).
Эти растворы стандартизированы в соответствии со стандартами NIST или первичными стандартами. (Только из растворов, изготовленных из компонентов классификации «Реагент»).
StandARd — Растворы, приготовленные с использованием титрации и стандартов атомической абсорбции. Эти растворы пригодны для использования в методах ACS, USP и NF и общего применения в лаборатории.
Acculute — Стандартные волюметрические концентраты растворов, упакованные в ампулы или запечатанные бутылки.
Дополнительно к вышеуказанным квалификациям химических реактивов по степени чистоты некоторые производители используют индивидуальные обозначения:
MP Biomedicals:
UP (Ultra-Pure) — очень чистый, реальная чистота зависит от вещества.
C (Compendial) — соответствует фармакопейной статье.
PanReac Applichem:
BioChemica — реагенты для университетов и исследовании и разработке в биохимии, молекулярной биологии и биотехнологической индустрии.
Chemicals — реагенты для качественного контроля в фармацевтическом и пищевом производстве, экологических лабораторий и химической промышленности в целом.
Microbiology product — реагенты для экологических анализов воды, воздуха и поверхности, также для пищевой, фармацевтической и косметической промышленности.
Excipients — сырьё для фармацевтической, пищевой, биофармацевтической, ветеринарной и косметической промышленности.
Классификация химических реакций, с примерами
Наиболее часто под химическими реакциями
понимают процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются с помощью химических уравнений, содержащих формулы исходных веществ и продуктов реакции. Согласно закону сохранения массы,
число атомов каждого элемента в левой и правой частях химического уравнения одинаково. Обычно формулы исходных веществ записывают в левой части уравнения,
а формулы продуктов – в правой.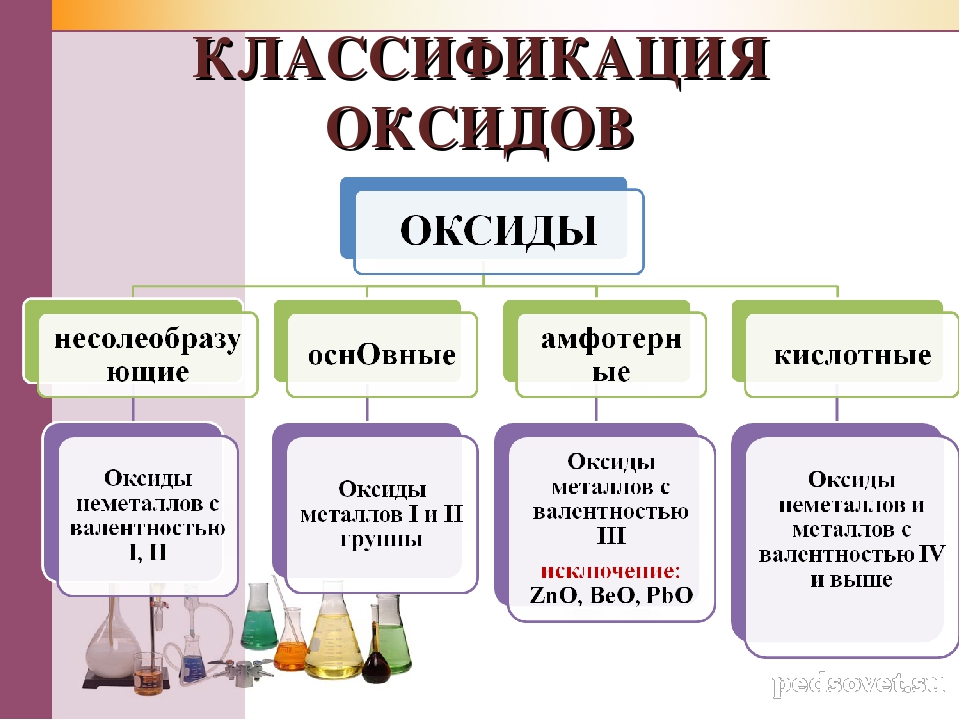 Равенство числа атомов каждого элемента в левой и правой частях уравнения достигается расстановкой перед формулами веществ
Равенство числа атомов каждого элемента в левой и правой частях уравнения достигается расстановкой перед формулами веществ
целочисленных стехиометрических коэффициентов.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции: температура, давление, излучение и т.д., что указывается
соответствующим символом над (или «под») знаком равенства.
Все химические реакции могут быть сгруппированы в несколько классов, которым присущи определенные признаки.
Классификация химических реакций по числу и составу исходных и образующихся веществ
Согласно этой классификации, химические реакции подразделяются на реакции соединения, разложения, замещения, обмена.
В результате реакций соединения из двух или более (сложных или простых) веществ образуется одно новое вещество. В общем виде уравнение такой
химической реакции будет выглядеть следующим образом:
A + B (+D) = C
Например:
СаСО3 + СО2 + Н2О = Са(НСО3)2
SO3 + H2O = H2SO4
2Mg + O2 = 2MgO.
2FеСl2 + Сl2 = 2FеСl3
Реакции соединения в большинстве случаев экзотермические, т.е. протекают с выделением тепла. Если в реакции участвуют простые вещества, то такие реакции
чаще всего являются окислительно-восстановительными (ОВР), т.е. протекают с изменением степеней окисления элементов. Однозначно сказать будет ли реакция
соединения между сложными веществами относиться к ОВР нельзя.
Реакции, в результате которых из одного сложного вещества образуется несколько других новых веществ (сложных или простых) относят к реакциям разложения. В общем виде уравнение химической реакции разложения будет выглядеть следующим образом:
A= B+ C + D
Например:
CaCO3CaO + CO2 ↑ (1)
2H2O =2H2 ↑+ O2↑ (2)
CuSO4 × 5H2O = CuSO4 + 5H2O (3)
Cu(OH)2 = CuO + H2O (4)
H2SiO3 = SiO2 + H2O (5)
2SO3 =2SO2 + O2 ↑ (6)
(NH4)2Cr2O7 = Cr2O3 + N2↑ +4H2O (7)
Большинство реакций разложения протекает при нагревании (1,4,5). Возможно разложение под действием электрического тока (2). Разложение кристаллогидратов,
Возможно разложение под действием электрического тока (2). Разложение кристаллогидратов,
кислот, оснований и солей кислородсодержащих кислот (1, 3, 4, 5, 7) протекает без изменения степеней окисления элементов, т.е. эти реакции не относятся к
ОВР. К ОВР реакциям разложения относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления (6).
Реакции разложения встречаются и в органической химии, но под другими названиями — крекинг (8), дегидрирование (9):
С18H38 = С9H18 + С9H20 (8)
C4H10 = C4H6 + 2H2 ↑ (9)
При реакциях замещения простое вещество взаимодействует со сложным, образуя новое простое и новое сложное вещество. В общем виде уравнение
химической реакции замещения будет выглядеть следующим образом:
A + BC = AB + C
Например:
2Аl + Fe2O3 = 2Fе + Аl2О3 (1)
Zn + 2НСl = ZnСl2 + Н2 (2)
2КВr + Сl2 = 2КСl + Вr2 (3)
2КСlO3 + l2 = 2KlO3 + Сl2 (4)
СаСО3+ SiO2 = СаSiO3 + СО2 (5)
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5 (6)
СН4 + Сl2 = СН3Сl + НСl (7)
Реакции замещения в своем большинстве являются окислительно-восстановительными (1 – 4, 7). Примеры реакций разложения, в которых не происходит изменения
Примеры реакций разложения, в которых не происходит изменения
степеней окисления немногочисленны (5, 6).
Реакциями обмена
называют реакции, протекающие между сложными веществами, при которых они обмениваются своими составными частями. Обычно этот термин применяют для реакций с
участием ионов, находящихся в водном растворе. В общем виде уравнение химической реакции обмена будет выглядеть следующим образом:
АВ + СD = АD + СВ
Например:
CuO + 2HCl = CuCl2 + H2O (1)
NaOH + HCl = NaCl + H2O (2)
NаНСО3 + НСl = NаСl + Н2О + СО2↑ (3)
AgNО3 + КВr = АgВr ↓ + КNО3 (4)
СrСl3 + ЗNаОН = Сr(ОН)3 ↓+ ЗNаСl (5)
Реакции обмена не являются окислительно-восстановительными. Частный случай этих реакций обмена -реакции нейтрализации (реакции взаимодействия кислот со
Частный случай этих реакций обмена -реакции нейтрализации (реакции взаимодействия кислот со
щелочами) (2). Реакции обмена протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного вещества (3), осадка
(4, 5) или малодиссоциирующего соединения, чаще всего воды (1, 2).
Классификация химических реакций по изменениям степеней окисления
В зависимости от изменения степеней окисления элементов, входящих в состав реагентов и продуктов реакции все химические реакции подразделяются на
окислительно-восстановительные (1, 2) и, протекающие без изменения степени окисления (3, 4).
2Mg + CO2 = 2MgO + C (1)
Mg0 – 2e = Mg2+ (восстановитель)
С4+ + 4e = C0 (окислитель)
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O (2)
Fe2+ -e = Fe3+ (восстановитель)
N5+ +3e = N2+ (окислитель)
AgNO3 +HCl = AgCl ↓ + HNO3 (3)
Ca(OH)2 + H2SO4 = CaSO4 ↓ + H2O (4)
Классификация химических реакций по тепловому эффекту
В зависимости от того, выделяется ли или поглощается тепло (энергия) в ходе реакции, все химические реакции условно разделяют на экзо – (1, 2) и
эндотермические (3), соответственно. Количество тепла (энергии), выделившееся или поглотившееся в ходе реакции называют тепловым эффектом реакции. Если в
Количество тепла (энергии), выделившееся или поглотившееся в ходе реакции называют тепловым эффектом реакции. Если в
уравнении указано количество выделившейся или поглощенной теплоты, то такие уравнения называются термохимическими.
N2 + 3H2 = 2NH3 +46,2 кДж (1)
2Mg + O2 = 2MgO + 602, 5 кДж (2)
N2 + O2 = 2NO – 90,4 кДж (3)
Классификация химических реакций по направлению протекания реакции
По направлению протекания реакции различают обратимые (химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в
которых они получены, с образованием исходных веществ) и необратимые (химические процессы, продукты которых не способны реагировать друг с другом с
образованием исходных веществ).
Для обратимых реакций уравнение в общем виде принято записывать следующим образом:
А + В ↔ АВ
Например:
СН3СООН + С2Н5ОН↔ Н3СООС2Н5+ Н2О
Примерами необратимых реакций может служить следующие реакции:
2КСlО3 → 2КСl + ЗО2↑
С6Н12О6 + 6О2 → 6СО2↑+ 6Н2О
Свидетельством необратимости реакции может служить выделение в качестве продуктов реакции газообразного вещества, осадка или малодиссоциирующего
соединения, чаще всего воды.
Классификация химических реакций по наличию катализатора
С этой точи зрения выделяют каталитические и некаталитические реакции.
Катализатором называют вещество, ускоряющее ход химической реакции. Реакции, протекающие с участием катализаторов, называются каталитическими. Протекание
некоторых реакций вообще невозможно без присутствия катализатора:
2H2O2 = 2H2O + O2 ↑ (катализатор MnO2)
Нередко один из продуктов реакции служит катализатором, ускоряющим эту реакцию (автокаталитические реакции):
MeO+ 2HF = MeF2 + H2O, где Ме – металл.
Примеры решения задач
| 21 мая 2020 г. | |||
| Органические вещества. Кислородосодержащие соединения | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
Органические вещества. Углеводороды Углеводороды | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| 15 мая 2020 г. | |||
| Итоговая видеоконсультация по химии | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| 12 мая 2020 г. | |||
| Генетическая связь между классами неорганических соединений | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Кислоты неорганические и органические | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
5 мая 2020 г.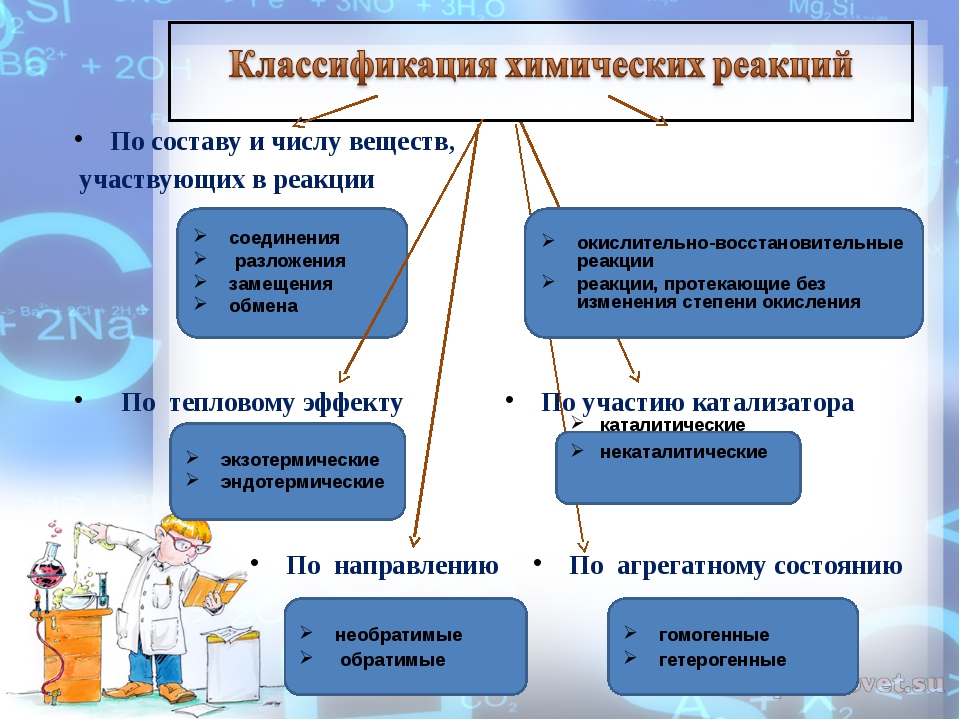 | |||
| Электролиз растворов и расплавов. Применение электролиза в промышленности | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Неметаллы | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| 29 апреля 2020 г. | |||
| Урок 1. Обобщение знаний. Виды химических связей и типы кристаллических решеток | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Урок 2. Обобщение знаний. Электроотрицательность. Степень окисления | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Окислительно-восстановительные реакции в природе, производственных процессах и жизнедеятельности организмов | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Свойства простых веществ – металлов главных и побочных подгрупп | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
6 апреля 2020 г. | |||
| Свойства, получение и применение углерода. Синтез-газ как основа современной промышленности | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Общая характеристика элементов IVА-группы | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Периодическая система химических элементов Д.И. Менделеева. Строение атома и вещества. | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
|
1. 
|
Оксиды
|
1 |
|
2. |
Основания
|
1 |
|
3. 
|
Соли
|
1 |
|
4. |
Классификация веществ
|
2 |
|
5. 
|
Допиши термины
|
2 |
|
6. |
Распредели вещества по классам
|
3 |
|
7. 
|
Свойства простых веществ
|
3 |
|
8. |
Ряд веществ
|
3 |
|
9. 
|
Определи металл
|
4 |
Согласование классификации и маркировки химических веществ — Глава 19. Экологически безопасное управление использованием токсичных химических веществ, включая предотвращение незаконного международного оборота токсичных и опасных продуктов — Повестка дня на XXI век — Конвенции и соглашения
Повестка дня на XXI век
Принята Конференцией ООН по окружающей среде и развитию, Рио-де-Жанейро, 3–14 июня 1992 года
Раздел II.
 Сохранение и рациональное использование ресурсов в целях развития
Сохранение и рациональное использование ресурсов в целях развития
Глава 19. Экологически безопасное управление использованием токсичных химических веществ, включая предотвращение незаконного международного оборота токсичных и опасных продуктов
Программные области
В. Согласование классификации и маркировки химических веществ
Основа для деятельности
19.24. Надлежащая маркировка химических веществ и распространение документов с данными о безопасности, таких, как МКХБ (международные карточки химической безопасности), и аналогичных печатных материалов на основе оценки их опасности для здоровья людей и окружающей среды являются наиболее простым и эффективным путем для указания того, каким образом можно безопасно обращаться с химическими веществами и использовать их.
19.25. Для безопасной перевозки опасных грузов, включая химические вещества, в настоящее время используется комплексная схема, разработанная в рамках системы Организации Объединенных Наций. В этой схеме в основном учитываются наиболее серьезные опасности, связанные с химическими веществами.
19.26. На мировом уровне пока еще отсутствуют согласованные системы классификации опасностей и маркировки, способствующие безопасному применению химических веществ, в частности, на производстве или в быту и т.д. Классификация химических веществ может использоваться для различных целей и имеет особо важное значение для создания систем маркировки. Опираясь на результаты текущей работы, необходимо разработать согласованные системы классификации опасностей и маркировки.
Цели
19.27. К 2000 году, по возможности, следует создать согласованную на международном уровне классификацию опасностей и совместимую систему маркировки, включающую материалы с данными о безопасности и понятные обозначения.
Деятельность
а) Вопросы управления
19.28. Правительствам, действуя в сотрудничестве с соответствующими международными организациями и промышленностью, когда это представляется целесообразным, следует приступить к осуществлению проекта в целях определения и разработки согласованной классификации и совместимой системы маркировки для химических веществ для ее использования на всех языках Организации Объединенных Наций, включая необходимые пиктограммы. Такая система маркировки не должна приводить к установлению неоправданных барьеров в торговле. Эта новая система должна в максимально возможной степени основываться на существующих системах; ее следует разрабатывать поэтапно, помня о необходимости обеспечения ее совместимости с маркировкой, используемой в различных областях.
b) Данные и информация
19.29. Международным органам, в том числе МПХБ (ЮНЕП, МОТ и ВОЗ), ФАО, Международной морской организации (ИМО), Комитету экспертов Организации Объединенных Наций по перевозке опасных грузов и ОЭСР, в сотрудничестве с региональными и национальными органами, имеющими действующие системы классификации и маркировки и другие системы распространения информации, следует создать координационную группу для:
a) оценки и, при необходимости, изучения существующих систем классификации опасностей и информирования о них в интересах выработки общих принципов создания системы, согласованной на международном уровне;
b) разработки и осуществления плана работ по созданию системы классификации опасностей, согласованной на международном уровне. В этом плане должны быть описаны задачи, которые надлежит выполнить, установлены сроки для их выполнения и распределены поручения между членами координационной группы;
c) разработки согласованной системы классификации опасностей;
d) подготовки предложений по стандартизации терминологии и обозначений, указывающих на характер опасности, для совершенствования мер по снижению опасности химических веществ и упрощения международной торговли и облегчения процедуры перевода соответствующей информации на язык конечного пользователя;
e) разработки согласованной системы маркировки.
Средства осуществления
а) Финансирование и исчисление расходов
19.30. Секретариат Конференции включил расходы на техническую помощь, связанные с этой программой, в смету приведенную в программной области Е. По его оценке, среднегодовая общая сумма расходов (1993–2000 годы) на укрепление международных организаций составит около 3 млн. долл. США, предоставляемых международным сообществом безвозмездно или на льготных условиях. Эта смета расходов носит лишь ориентировочный и приближенный характер и еще не рассматривалась правительствами. Фактический объем расходов и условия финансирования, в том числе любые нельготные условия, будут зависеть, помимо прочего, от конкретных стратегий и программ, решение об осуществлении которых будет принято правительствами.
b) Развитие людских ресурсов
19.31. Правительствам, учреждениям и неправительственным организациям в сотрудничестве с соответствующими организациями и программами Организации Объединенных Наций следует начать проведение учебных курсов и информационных кампаний для облегчения понимания и использования новой согласованной классификации и совместимой системы маркировки химических веществ.
с) Создание потенциала
19.32. При укреплении национального потенциала в управлении использованием химических веществ, включая разработку и внедрение новых систем классификации и маркировки и переход на эти системы, необходимо следить за тем, чтобы при этом не создавались торговые барьеры, и в полной мере учитывать тот факт, что значительное число стран, особенно развивающихся, имеют ограниченные возможности и ресурсы для внедрения таких систем.
1.2: Классификация веществ — Chemistry LibreTexts
Химики изучают структуру, физические свойства и химические свойства материальных веществ. Они состоят из материи , то есть всего, что занимает пространство и имеет массу. Золото и иридий важны, как арахис, люди и почтовые марки. Дым, смог и веселящий газ — это материя. Однако энергия, свет и звук не имеют значения; идеи и эмоции тоже не имеют значения.
Масса объекта — это количество вещества, которое он содержит.Не путайте массу объекта с массой , которая является силой, вызванной гравитационным притяжением, действующим на объект. Масса — это фундаментальное свойство объекта, которое не зависит от его местоположения. С физической точки зрения масса объекта прямо пропорциональна силе, необходимой для изменения его скорости или направления. Более подробное обсуждение различий между весом и массой и единиц, используемых для их измерения, включено в Основные навыки 1 (Раздел 1.9). С другой стороны, вес зависит от местоположения объекта. Астронавт, масса которого составляет 95 кг, весит около 210 фунтов на Земле, но только около 35 фунтов на Луне, потому что гравитационная сила, которую он или она испытывает на Луне, примерно в шесть раз меньше силы, испытываемой на Земле. Для практических целей в лабораториях вес и масса часто используются как взаимозаменяемые. Поскольку считается, что сила тяжести одинакова на всей поверхности Земли, 2,2 фунта (вес) равны 1,0 кг (масса), независимо от местоположения лаборатории на Земле.
В нормальных условиях существует три различных состояния материи: твердые тела, жидкости и газы. Твердые тела относительно жесткие, имеют фиксированные формы и объемы. Скала, например, твердое тело. Напротив, жидкости имеют фиксированные объемы, но текут, принимая форму своих емкостей, таких как напиток в банке. Газы , такие как воздух в автомобильной шине, не имеют ни фиксированных форм, ни фиксированных объемов и расширяются, чтобы полностью заполнить свои емкости.В то время как объем газов сильно зависит от их температуры и давления (величина силы, приложенной к данной области), объемы жидкостей и твердых тел практически не зависят от температуры и давления. Материя может часто переходить из одного физического состояния в другое в процессе, называемом физическим изменением . Например, жидкая вода может быть нагрета с образованием газа, называемого паром, или пар может быть охлажден с образованием жидкой воды. Однако такие изменения состояния не влияют на химический состав вещества.
Рисунок \ (\ PageIndex {1} \): Три состояния материи. Твердые тела имеют определенную форму и объем. Жидкости имеют фиксированный объем, но текут, принимая форму своих емкостей. Газы полностью заполняют свои емкости, независимо от объема. Рисунок использован с разрешения Википедии
Чистые вещества и смеси
Чистое химическое вещество — это любое вещество, имеющее фиксированный химический состав и характерные свойства. Кислород, например, представляет собой чистое химическое вещество, бесцветный газ без запаха при 25 ° C.Очень немногие образцы материи состоят из чистых веществ; вместо этого большинство из них представляют собой смеси, которые представляют собой комбинации двух или более чистых веществ в различных пропорциях, в которых отдельные вещества сохраняют свою идентичность. Воздух, водопроводная вода, молоко, голубой сыр, хлеб и грязь — все это смеси. Если все части материала находятся в одинаковом состоянии, не имеют видимых границ и однородны по всей поверхности, тогда материал гомогенный . Примерами однородных смесей являются воздух, которым мы дышим, и вода из-под крана, которую мы пьем.Однородные смеси еще называют растворами. Таким образом, воздух представляет собой раствор азота, кислорода, водяного пара, углекислого газа и некоторых других газов; водопроводная вода — это раствор небольших количеств нескольких веществ в воде. Однако конкретные составы обоих этих растворов не фиксированы, а зависят как от источника, так и от местоположения; например, состав водопроводной воды в Бойсе, штат Айдахо, отличается от состава водопроводной воды в Буффало, штат Нью-Йорк. Хотя большинство растворов, с которыми мы сталкиваемся, являются жидкими, растворы также могут быть твердыми.Серое вещество, которое до сих пор используется некоторыми стоматологами для пломбирования зубных полостей, представляет собой сложный твердый раствор, который содержит 50% ртути и 50% порошка, который в основном содержит серебро, олово и медь, а также небольшое количество цинка и ртути. Твердые растворы двух или более металлов обычно называют сплавами.
Если состав материала не полностью однороден, то он будет неоднородным (например, тесто для печенья с шоколадной крошкой, сыр с плесенью и грязь). Смеси, которые кажутся однородными, после микроскопического исследования часто оказываются неоднородными.Молоко, например, кажется однородным, но при исследовании под микроскопом ясно, что оно состоит из крошечных шариков жира и белка, диспергированных в воде. Компоненты гетерогенных смесей обычно можно разделить простыми способами. Смеси твердого вещества и жидкости, такие как песок в воде или чайные листья в чае, легко отделяются фильтрацией, которая заключается в пропускании смеси через барьер, такой как сетчатый фильтр, с отверстиями или порами, которые меньше твердых частиц. В принципе, смеси двух или более твердых веществ, таких как сахар и соль, можно разделить с помощью микроскопического исследования и сортировки.Однако обычно требуются более сложные операции, например, при отделении золотых самородков от речного гравия путем промывки. Сначала отфильтровывают твердый материал из речной воды; затем твердые частицы отделяются путем инспекции. Если золото внедрено в горную породу, его, возможно, придется изолировать химическими методами.
Рисунок \ (\ PageIndex {2} \): неоднородная смесь. Под микроскопом цельное молоко на самом деле представляет собой гетерогенную смесь, состоящую из глобул жира и белка, диспергированных в воде. Рисунок использован с разрешения Wikipedia.
Гомогенные смеси (растворы) могут быть разделены на составляющие вещества с помощью физических процессов, которые зависят от различий в некоторых физических свойствах, таких как различия в их точках кипения.Двумя из этих методов разделения являются дистилляция и кристаллизация. Дистилляция использует разницу в летучести, меру того, насколько легко вещество превращается в газ при заданной температуре. Простой дистилляционный аппарат для разделения смеси веществ, хотя бы одно из которых является жидкостью. Наиболее летучий компонент закипает первым и конденсируется обратно в жидкость в конденсаторе с водяным охлаждением, из которого он перетекает в приемную колбу. Если раствор соли и воды перегоняется, например, более летучий компонент, чистая вода, собирается в приемной колбе, а соль остается в перегонной колбе.
Рисунок \ (\ PageIndex {3} \): Дистилляция раствора поваренной соли в воде. Раствор соли в воде нагревают в перегонной колбе до кипения. Образующийся пар обогащается более летучим компонентом (водой), который конденсируется в жидкость в холодном конденсаторе и затем собирается в приемной колбе.
Смеси двух или более жидкостей с разными температурами кипения можно разделить с помощью более сложного дистилляционного аппарата. Одним из примеров является переработка сырой нефти в ряд полезных продуктов: авиационное топливо, бензин, керосин, дизельное топливо и смазочные масла (в приблизительном порядке уменьшения летучести).Другой пример — перегонка спиртных напитков, таких как бренди или виски. (Эта относительно простая процедура вызвала немало головной боли у федеральных властей в 1920-х годах, в эпоху сухого закона, когда нелегальные кадры распространились в отдаленных регионах США!)
Кристаллизация разделяет смеси на основе различий в растворимости, показателе того, сколько твердого вещества остается растворенным в данном количестве указанной жидкости. Большинство веществ более растворимы при более высоких температурах, поэтому смесь двух или более веществ можно растворить при повышенной температуре, а затем дать ей медленно остыть.В качестве альтернативы жидкости, называемой растворителем, можно дать испариться. В любом случае наименее растворимое из растворенных веществ, то, которое с наименьшей вероятностью останется в растворе, обычно сначала образует кристаллы, и эти кристаллы можно удалить из оставшегося раствора фильтрацией.
Рисунок \ (\ PageIndex {4} \): Кристаллизация ацетата натрия из концентрированного раствора ацетата натрия в воде. Добавление небольшого «затравочного» кристалла (а) заставляет соединение образовывать белые кристаллы, которые растут и в конечном итоге занимают большую часть колбы.Видео можно найти здесь: www.youtube.com/watch?v=BLq5NibwV5g
Большинство смесей можно разделить на чистые вещества, которые могут быть элементами или соединениями. Элемент , такой как серый металлический натрий, представляет собой вещество, которое не может быть разбито на более простые химическими изменениями; соединение , такое как белый кристаллический хлорид натрия, содержит два или более элемента и имеет химические и физические свойства, которые обычно отличаются от свойств элементов, из которых оно состоит.За некоторыми исключениями, конкретное соединение имеет одинаковый элементный состав (одни и те же элементы в одинаковых пропорциях) независимо от его источника или истории. Химический состав вещества изменяется в процессе, называемом химическим изменением . Превращение двух или более элементов, таких как натрий и хлор, в химическое соединение, хлорид натрия, является примером химического изменения, часто называемого химической реакцией. В настоящее время известно около 118 элементов, но из этих 118 элементов получены миллионы химических соединений.Известные элементы перечислены в периодической таблице.
Рисунок \ (\ PageIndex {5} \): Разложение воды на водород и кислород путем электролиза. Вода — это химическое соединение; водород и кислород — элементы.
В общем, обратный химический процесс расщепляет соединения на элементы. Например, вода (соединение) может быть разложена на водород и кислород (оба элемента) с помощью процесса, называемого электролизом. При электролизе электричество обеспечивает энергию, необходимую для разделения соединения на составляющие элементы (Рисунок \ (\ PageIndex {5} \)).Подобный метод широко используется для получения чистого алюминия, элемента, из его руд, которые представляют собой смеси соединений. Поскольку для электролиза требуется много энергии, затраты на электроэнергию, безусловно, являются самыми большими затратами при производстве чистого алюминия. Таким образом, переработка алюминия экономична и экологически безопасна.
Общая организация вещества и методы, используемые для разделения смесей, суммированы на рисунке \ (\ PageIndex {6} \).
Рисунок \ (\ PageIndex {6} \): Взаимосвязь между типами материи и методами, используемыми для разделения смесей
Пример \ (\ PageIndex {1} \)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- фильтрованный чай
- свежевыжатый апельсиновый сок
- компакт-диск
- оксид алюминия, белый порошок с соотношением атомов алюминия и кислорода 2: 3
- селен
Дано : химическое вещество
Запрошено : его классификация
Стратегия:
- Определите, является ли вещество химически чистым. Если оно чистое, это либо элемент, либо соединение.Если вещество можно разделить на элементы, это соединение.
- Если вещество не является химически чистым, это либо гетерогенная смесь, либо гомогенная смесь. Если его состав однороден во всем, это однородная смесь.
Решение
- A Чай представляет собой раствор соединений в воде, поэтому он не является химически чистым. Обычно его отделяют от чайных листьев фильтрацией. B Поскольку состав раствора однороден, это однородная смесь.
- A Апельсиновый сок содержит твердые частицы (мякоть), а также жидкость; он не является химически чистым. Б. Апельсиновый сок является неоднородной смесью, поскольку его состав неоднороден.
- A Компакт-диск — это твердый материал, содержащий более одного элемента, с видимыми по краям участками разного состава. Следовательно, компакт-диск не является химически чистым. B Области разного состава указывают на то, что компакт-диск представляет собой неоднородную смесь.
- A Оксид алюминия представляет собой одно химически чистое соединение.
- A Селен — один из известных элементов.
Упражнение \ (\ PageIndex {1} \)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- белое вино
- ртуть
- Заправка для салата в стиле ранчо
- сахар столовый (сахароза)
- Ответ A
раствор
- Ответ Б
элемент
- Ответ C
гетерогенная смесь
- Ответ D
соединение
Сводка
Вещество можно классифицировать по физическим и химическим свойствам.Материя — это все, что занимает пространство и имеет массу. Три состояния вещества — твердое, жидкое и газообразное. Физическое изменение включает в себя преобразование вещества из одного состояния в другое без изменения его химического состава. Большая часть вещества состоит из смесей чистых веществ, которые могут быть однородными (однородными по составу) или неоднородными (разные области обладают разным составом и свойствами). Чистые вещества могут быть как химическими соединениями, так и элементами. Соединения можно разделить на элементы с помощью химических реакций, но элементы нельзя разделить на более простые вещества химическими методами.Свойства веществ можно разделить на физические или химические. Ученые могут наблюдать физические свойства без изменения состава вещества, тогда как химические свойства описывают склонность вещества претерпевать химические изменения (химические реакции), которые изменяют его химический состав. Физические свойства могут быть интенсивными или обширными. Интенсивные свойства одинаковы для всех образцов; не зависят от размера выборки; и включают, например, цвет, физическое состояние и точки плавления и кипения.Обширные свойства зависят от количества материала и включают массу и объем. Соотношение двух экстенсивных свойств, массы и объема, является важным интенсивным свойством, называемым плотностью.
Авторы и авторство
Классификация веществ (элементы, соединения, смеси) — Введение в химию
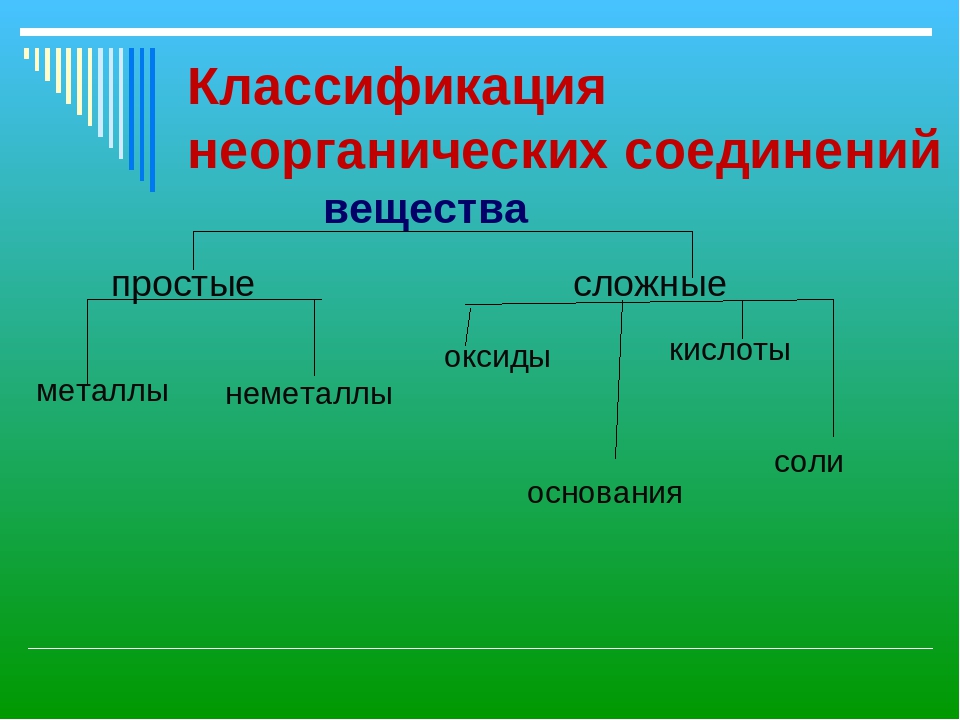
Вещества и смеси
Вещества состоят из чистых элементов или химически связанных элементов, тогда как смеси состоят из несвязанных веществ.
ЦЕЛИ ОБУЧЕНИЯ
Отличать химические вещества от смесей.
КЛЮЧЕВЫЕ ВХОДЫ
Ключевые моменты
- Вещество можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разбиваются на элементы и соединения. Смеси — это физически комбинированные структуры, которые можно разделить на их исходные компоненты.
- Химическое вещество состоит из одного типа атомов или молекул.
- Смесь состоит из различных типов атомов или молекул, которые не связаны химически.
- Гетерогенная смесь — это смесь двух или более химических веществ, в которой можно визуально различить различные компоненты.
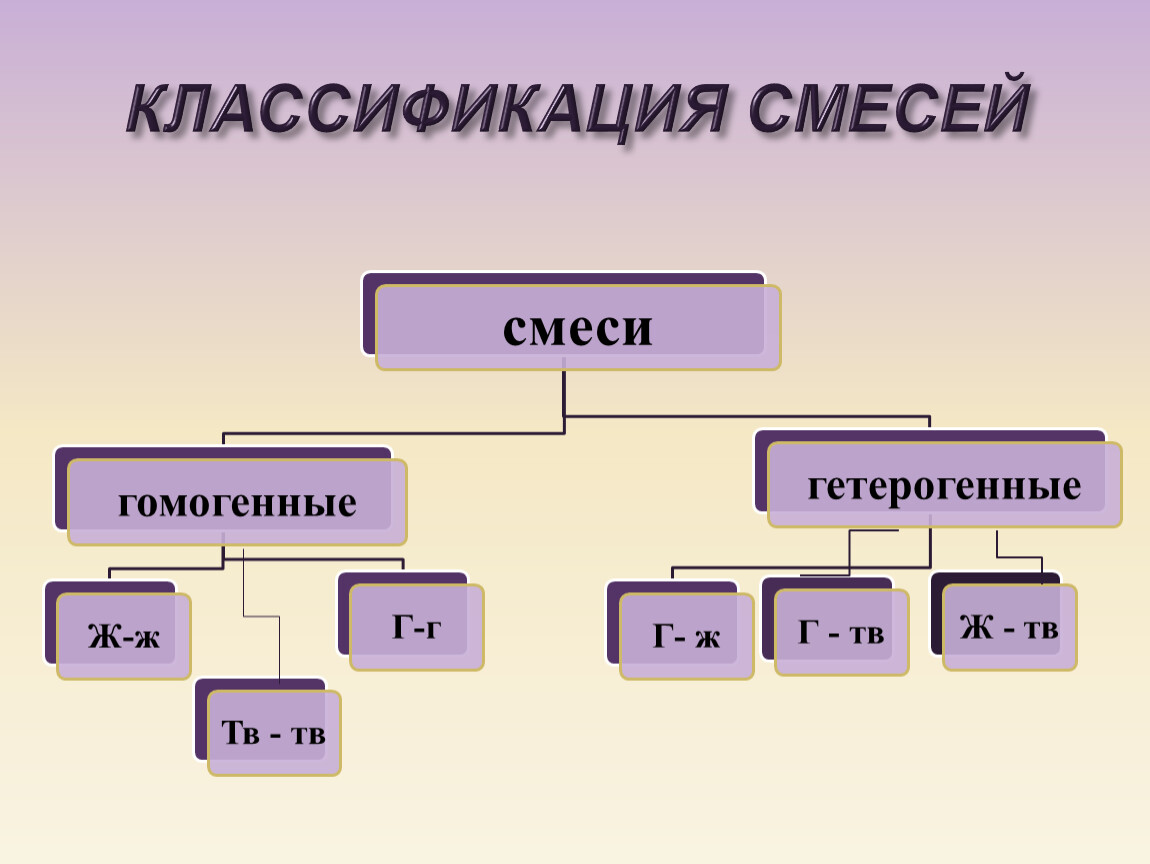
- Гомогенная смесь — это смесь, состав которой однороден, и каждая часть раствора имеет одинаковые свойства.
- Существуют различные методы разделения для разделения веществ, включая дистилляцию, фильтрацию, выпаривание и хроматографию. Для этого разделения вещество может находиться в одной или двух разных фазах.
Ключевые термины
- смесь : То, что состоит из различных, несвязанных элементов или молекул.
- элемент : химическое вещество, которое состоит из определенного типа атома и не может быть расщеплено или преобразовано с помощью химической реакции.
- вещество : форма вещества, имеющая постоянный химический состав и характерные свойства. Он состоит из одного типа атома или молекулы.
Вещества химические
В химии химическое вещество — это форма вещества, имеющая постоянный химический состав и характерные свойства.Его нельзя разделить на компоненты без разрыва химических связей. Химические вещества могут быть твердыми, жидкостями, газами или плазмой. Изменения температуры или давления могут вызывать переход веществ между различными фазами вещества.
Элемент — это химическое вещество, состоящее из определенного типа атома и, следовательно, не может быть расщеплено или преобразовано в результате химической реакции в другой элемент. Все атомы элемента имеют одинаковое количество протонов, хотя они могут иметь разное количество нейтронов и электронов.
Чистое химическое соединение — это химическое вещество, состоящее из определенного набора молекул или ионов, которые химически связаны. Два или более элемента, объединенных в одно вещество в результате химической реакции, например вода, образуют химическое соединение. Все соединения являются веществами, но не все вещества являются соединениями. Химическое соединение может быть либо атомами, связанными вместе в молекулы, либо кристаллами, в которых атомы, молекулы или ионы образуют кристаллическую решетку. Соединения, состоящие в основном из атомов углерода и водорода, называются органическими соединениями, а все остальные — неорганическими соединениями.Соединения, содержащие связи между углеродом и металлом, называются металлоорганическими соединениями.
Химические вещества часто называют «чистыми», чтобы отличить их от смесей. Типичный пример химического вещества — чистая вода; он всегда имеет одни и те же свойства и одинаковое отношение водорода к кислороду, независимо от того, извлечен ли он из реки или изготовлен в лаборатории. Другие химические вещества, обычно встречающиеся в чистом виде, — это алмаз (углерод), золото, поваренная соль (хлорид натрия) и рафинированный сахар (сахароза).Простые или кажущиеся чистыми вещества, встречающиеся в природе, на самом деле могут быть смесями химических веществ. Например, водопроводная вода может содержать небольшие количества растворенного хлорида натрия и соединений, содержащих железо, кальций и многие другие химические вещества. Чистая дистиллированная вода — это вещество, а морская вода, поскольку она содержит ионы и сложные молекулы, представляет собой смесь.
Химические смеси
Смесь — это система материалов, состоящая из двух или более различных веществ, которые смешаны, но не соединены химически.Под смесью понимается физическая комбинация двух или более веществ, в которой сохраняются идентичности отдельных веществ. Смеси имеют форму сплавов, растворов, суспензий и коллоидов.
Встречающиеся в природе кристаллы серы: Сера встречается в природе в виде элементарной серы, сульфидов, сульфатных минералов и сероводорода. Это месторождение полезных ископаемых состоит из смеси веществ.
Гетерогенные смеси
Гетерогенная смесь — это смесь двух или более химических веществ (элементов или соединений), различные компоненты которой можно визуально различить и легко разделить физическими средствами.Примеры включают:
- смеси песка и воды
- Смеси песчано-железной стружки
- конгломерат породы
- вода и масло
- салат
- трейл микс
- Смесь золотого порошка и серебряного порошка
https://lab.concord.org/embeddable.html#interactives/sam/intermolecular-attractions/3-1-oil-and-water.json
Interactive: Oil and Water : исследуйте взаимодействия, которые вызывают воду и масло отделить от смеси.
Гомогенные смеси
Гомогенная смесь — это смесь двух или более химических веществ (элементов или соединений), различные компоненты которой невозможно различить визуально. Часто разделение компонентов гомогенной смеси является более сложной задачей, чем разделение компонентов гетерогенной смеси.
Различие между гомогенными и гетерогенными смесями зависит от масштаба отбора проб. В достаточно малом масштабе любую смесь можно назвать гетерогенной, потому что образец может быть размером с одну молекулу.На практике, если интересующие свойства одинаковы, независимо от того, сколько смеси взято, смесь является однородной.
Физические свойства смеси, такие как температура плавления, могут отличаться от свойств ее отдельных компонентов. Некоторые смеси можно разделить на компоненты физическими (механическими или термическими) способами.
Classification Matter (3 части): Введение в классификацию вещества как вещества или смеси веществ.Смеси описываются как гетерогенные или гомогенные. Описаны три распространенных метода разделения.
Элементы и соединения
Элемент — это материал, состоящий из одного типа атомов, в то время как соединение состоит из двух или более типов атомов.
ЦЕЛИ ОБУЧЕНИЯ
Различайте элементы и соединения и исследуйте методы разделения.
КЛЮЧЕВЫЕ ВХОДЫ
Ключевые моменты
- Элементы — это простейшие законченные химические вещества.Каждый элемент соответствует одной записи в периодической таблице. Элемент — это материал, состоящий из одного типа атомов. Каждый тип атома содержит одинаковое количество протонов.
- Химические связи соединяют элементы вместе, образуя более сложные молекулы, называемые соединениями. Соединение состоит из двух или более типов элементов, удерживаемых вместе ковалентными или ионными связями.
- Элементы не могут быть разделены на более мелкие части без большого количества энергии. Соединения, с другой стороны, могут быть разорваны с помощью практического количества энергии, например тепла от огня.
- Вещество можно разделить на две категории: чистые вещества и смеси. Чистые вещества далее разбиваются на элементы и соединения. Смеси представляют собой физически комбинированные структуры, которые можно снова разделить на их исходные компоненты.
Ключевые термины
- элемент : Любое из простейших химических веществ, которое нельзя изменить с помощью химической реакции или каких-либо химических средств. Состоит из атомов, имеющих одинаковое количество протонов.
- химическая связь : Любая из нескольких сил притяжения, которые служат для связывания атомов вместе с образованием молекул.
- соединение : Вещество, состоящее из двух или более элементов. Состоит из фиксированного соотношения химически связанных атомов. Обладает уникальными свойствами, которые отличаются от свойств отдельных его элементов.
Элементы
Химический элемент — это чистое вещество, состоящее из одного типа атомов. У каждого атома есть атомный номер, который представляет количество протонов, находящихся в ядре одного атома этого элемента.Периодическая таблица элементов упорядочена по возрастанию атомного номера.
Химические элементы делятся на металлы, металлоиды и неметаллы. Металлы, обычно встречающиеся в левой части периодической таблицы, — это
.
- часто токопроводящие
- податливый
- блестящий
- иногда магнитный
Алюминий, железо, медь, золото, ртуть и свинец являются металлами.
В отличие от неметаллов, найденных в правой части таблицы Менделеева (справа от лестницы),
- обычно непроводящий
- не податливый
- тусклый (не блестящий)
- немагнитный
Примеры элементарных неметаллов включают углерод и кислород.
Металлоиды обладают некоторыми характеристиками металлов и некоторыми характеристиками неметаллов. Кремний и мышьяк — металлоиды.
По состоянию на ноябрь 2011 г. было идентифицировано 118 элементов (самым последним из них был идентифицирован ununseptium в 2010 г.). Из этих 118 известных элементов только первые 98 встречаются в природе на Земле. Элементы, которые не встречаются в природе на Земле, являются синтетическими продуктами ядерных реакций, созданных человеком. 80 из 98 встречающихся в природе элементов стабильны; остальные радиоактивны, что означает, что они распадаются на более легкие элементы в течение времени от долей секунды до миллиардов лет.
Водород и гелий — самые распространенные элементы во Вселенной. Однако железо является самым распространенным элементом (по массе) в составе Земли, а кислород — наиболее распространенным элементом в слое земной коры.
Хотя вся известная химическая материя состоит из этих элементов, сама химическая материя составляет лишь около 15% материи во Вселенной. Остальное — темная материя, загадочная субстанция, не состоящая из химических элементов.Темной материи не хватает протонов, нейтронов или электронов.
Соединения
Чистые образцы изолированных элементов редко встречаются в природе. В то время как 98 природных элементов были идентифицированы в образцах минералов из земной коры, лишь небольшая часть из них может быть обнаружена как узнаваемые, относительно чистые минералы. Среди наиболее распространенных таких «самородных элементов» — медь, серебро, золото и сера. Углерод также обычно встречается в форме угля, графита и алмазов.Благородные газы (например, неон) и благородные металлы (например, ртуть) также можно найти в их чистых, несвязанных формах в природе. Тем не менее, большинство этих элементов находится в смесях.
Когда два различных элемента химически объединены, то есть между их атомами образуются химические связи, результат называется химическим соединением. Большинство элементов на Земле связываются с другими элементами, образуя химические соединения, такие как натрий (Na) и хлорид (Cl), которые вместе образуют поваренную соль (NaCl). Вода — еще один пример химического соединения.Два или более компонентов соединения можно разделить с помощью химических реакций.
Химические соединения имеют уникальную и определенную структуру, которая состоит из фиксированного соотношения атомов, удерживаемых вместе в определенном пространственном расположении химическими связями. Химические соединения могут быть
- молекулярные соединения, удерживаемые вместе ковалентными связями
- соли, удерживаемые ионными связями
- интерметаллические соединения, удерживаемые металлическими связями
- комплексов, скрепленных координатными ковалентными связями
Чистые химические элементы не считаются химическими соединениями, даже если они состоят из двухатомных или многоатомных молекул (молекул, содержащих только несколько атомов одного элемента, например H 2 или S 8 ).
ЛИЦЕНЗИИ И АТРИБУЦИИ
CC ЛИЦЕНЗИОННЫЙ КОНТЕНТ, ПРЕДЫДУЩИЙ РАЗДЕЛ
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, СПЕЦИАЛЬНАЯ АТРИБУЦИЯ
химическое соединение | Определение, примеры и типы
Химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
молекула метана
Метан, в котором четыре атома водорода связаны с одним атомом углерода, является примером основного химического соединения.На структуру химических соединений влияют сложные факторы, такие как валентные углы и длина связи.
Британская энциклопедия, Inc.
Британская викторина
Типы химических реакций
Можете ли вы определить, какой тип химической реакции показан? Проверьте свои знания с помощью этой викторины!
Вся материя Вселенной состоит из атомов более чем 100 различных химических элементов, которые встречаются как в чистом виде, так и в сочетании в химических соединениях.Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы углерода отличаются от атомов железа, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, происходящих либо от текущего имени элемента, либо от его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно.Символ железа — Fe, от оригинального латинского названия ferrum . Фундаментальный принцип химической науки состоит в том, что атомы различных элементов могут объединяться друг с другом, образуя химические соединения. Например, метан, который образован из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит отдельные молекулы CH 4 . Формула соединения, например CH 4 , указывает типы присутствующих атомов, с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не записывается).
молекула воды
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Один атом кислорода содержит шесть электронов в своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется.
Encyclopædia Britannica, Inc.
Изучите магнитоподобную ионную связь, образующуюся при передаче электронов от одного атома к другому
Ионы — атомы с положительным или отрицательным суммарным зарядом — связываются вместе, образуя ионные соединения.
Encyclopædia Britannica, Inc. См. Все видео для этой статьи
Посмотрите, как работают молекулярные связи, когда два атома водорода соединяются с атомом серы, образуя сероводород
Молекулярные соединения образуются при образовании молекул, таких как молекулы метана или воды , соединяйтесь вместе, деля электроны.
Encyclopædia Britannica, Inc. См. Все видео по этой статье
Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O.Хлорид натрия — это химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионов хлора с отрицательным зарядом (Cl — ). ( См. Ниже Тенденции в химических свойствах элементов для обсуждения процесса превращения незаряженных атомов в ионы [i.е., виды с положительным или отрицательным суммарным зарядом].) Упомянутые выше вещества представляют собой два основных типа химических соединений: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. С другой стороны, хлорид натрия содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются в тысячи слов, атомы элементов могут объединяться различными способами, образуя бесчисленное множество соединений. .На самом деле известны миллионы химических соединений, и еще многие миллионы возможны, но еще не открыты и не синтезированы. Большинство веществ, встречающихся в природе, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества могут быть разделены на составляющие их соединения физическими методами, которые не меняют способ агрегирования атомов в соединениях. Соединения можно разбить на составные элементы путем химических изменений.Химическое изменение (то есть химическая реакция) — это изменение, при котором изменяется организация атомов. Пример химической реакции — горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в способе связывания атомов углерода, водорода и кислорода. в соединениях.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Химические соединения обладают поразительным набором характеристик. При обычных температурах и давлениях некоторые из них являются твердыми телами, некоторые — жидкостями, а некоторые — газами. Цвета различных составных частей совпадают с цветами радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.Чтобы понять это огромное разнообразие, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также подразделяются на органические и неорганические. Органические соединения ( см. Ниже Органические соединения), названные так потому, что многие из них были первоначально изолированы от живых организмов, обычно содержат цепи или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений.Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. Ниже Неорганические соединения).
ртуть (Hg)
Ртуть (химический символ: Hg) — единственный металлический элемент, который находится в жидком состоянии при комнатной температуре.
© marcel / Fotolia
В рамках широкой классификации органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат ионы O 2- или атомы кислорода, гидриды содержат ионы H — или атомы водорода, сульфиды содержат ионы S 2- и т. Д.Подклассы органических соединений включают спирты (содержащие группу OH), карбоновые кислоты (характеризующиеся группой COOH), амины (содержащие группу NH 2 ) и так далее.
Различные способности различных атомов объединяться с образованием соединений лучше всего можно понять с помощью периодической таблицы. Периодическая таблица Менделеева была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития химии было обнаружено, что элементы можно сгруппировать в соответствии с их химической реакционной способностью.Элементы с подобными свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. По мере раскрытия деталей атомной структуры стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента ( см. Атом ). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его внешней оболочке. Такие электроны называются валентными электронами.
Таблица Менделеева
Периодическая таблица элементов.
Encyclopædia Britannica, Inc.
Например, атомы элементов в группе 1 периодической таблицы все имеют один валентный электрон, атомы элементов в группе 2 имеют два валентных электрона и так далее, до группы 18 , элементы которого содержат восемь валентных электронов. Самое простое и самое важное правило для предсказания того, как атомы образуют соединения, состоит в том, что атомы имеют тенденцию объединяться таким образом, чтобы они могли либо опустошить свою валентную оболочку, либо завершить ее (т.е., заполните его), в большинстве случаев всего с восемью электронами. Элементы в левой части периодической таблицы имеют тенденцию терять свои валентные электроны в химических реакциях. Натрий (в Группе 1), например, имеет тенденцию терять свой одинокий валентный электрон с образованием иона с зарядом +1. Каждый атом натрия имеет 11 электронов ( e — ), каждый с зарядом -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает общий заряд +1: Na → Na + + e — .Калий, расположенный непосредственно под натрием в группе 1, также образует +1 ион (K + ) в своих реакциях, как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы имеют тенденцию вступать в реакции, так что они получают (или разделяют) достаточно электронов, чтобы заполнить свою валентную оболочку. Например, кислород в Группе 16 имеет шесть валентных электронов и, следовательно, ему нужно еще два электрона, чтобы завершить его внешнюю оболочку. Кислород достигает этой договоренности, реагируя с элементами, которые могут терять или делиться электронами.Атом кислорода, например, может реагировать с атомом магния (Mg) (в Группе 2), принимая два валентных электрона магния, образуя ионы Mg 2+ и O 2-. (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2-.) Получающийся в результате Mg 2+ и O 2- затем объединяют в соотношении 1: 1 с получением ионного соединения MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, у него нет чистого заряда, потому что он содержит равное количество ионов Mg 2+ и O 2-.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксид кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы в данной группе имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное разделение элементов — на металлы, которые составляют большинство элементов, и неметаллы.Типичными физическими свойствами металлов являются блестящий внешний вид, пластичность (способность растираться в тонкий лист), пластичность (способность вытягиваться в проволоку), а также эффективная теплопроводность и электрическая проводимость. Самым важным химическим свойством металлов является тенденция отдавать электроны с образованием положительных ионов. Например, медь (Cu) — типичный металл. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко превращаться в изделия различной формы, такие как трубы для систем водоснабжения.Медь содержится во многих ионных соединениях в форме иона Cu + или Cu 2+ .
Металлические элементы находятся слева и в центре таблицы Менделеева. Металлы групп 1 и 2 называются типичными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Неметаллы, которых относительно мало, находятся в верхнем правом углу таблицы Менделеева, за исключением водорода, единственного неметаллического члена Группы 1.У неметаллов отсутствуют физические свойства, характерные для металлов. В химических реакциях с металлами неметаллы приобретают электроны с образованием отрицательных ионов. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор — это типичный неметалл. При обычных температурах элементарный хлор содержит молекулы Cl 2 и реагирует с другими неметаллами с образованием таких молекул, как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl — .
Разделение элементов на металлы и неметаллы является приблизительным. Некоторые элементы вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Классификация элементов и соединений
3.4: Классификация элементов и соединений
Чистые вещества состоят только из одного типа материи.Чистое вещество может быть элементом или соединением. Элемент состоит только из одного типа атомов, в то время как соединение состоит из двух или более типов атомов, скрепленных химической связью. Элементы классифицируются как атомарные или молекулярные в зависимости от природы их основных единиц.
Соединения — это чистые вещества, состоящие из двух или более элементов в фиксированных, определенных пропорциях. Соединения классифицируются как ионные или молекулярные (ковалентные) в зависимости от присутствующих в них связей.
Молекулярные соединения
Молекулярные соединения (или ковалентные соединения) образуются, когда два или более разных неметаллических атома обмениваются электронами с образованием ковалентных связей.Базовыми единицами молекулярных соединений являются дискретные нейтральные молекулы, состоящие из различных составляющих атомов. Например, молекулярное соединение монооксида углерода состоит из молекул CO, содержащих ковалентно связанные атомы углерода и кислорода. Точно так же метанол содержит молекулы CH 3 OH в качестве основных единиц, составляющих один атом углерода, один атом кислорода и четыре атома водорода, все из которых ковалентно связаны.
Молекулярные соединения можно идентифицировать по их физическим свойствам.В нормальных условиях молекулярные соединения часто существуют в виде газов, низкокипящих жидкостей и легкоплавких твердых веществ, хотя существуют исключения.
Ионные соединения
Когда элемент, состоящий из атомов, которые легко теряют электроны (металл), реагирует с элементом, состоящим из атомов, которые легко приобретают электроны (неметалл), обычно происходит перенос электронов с образованием ионов. Соединение, образованное этим переносом, стабилизируется электростатическим притяжением (ионными связями) между ионами противоположного заряда, присутствующими в соединении.Например, когда каждый атом натрия в образце металлического натрия (группа 1) отдает один электрон для образования катиона натрия, Na + , и каждый атом хлора в образце газообразного хлора (группа 17) принимает один электрон на образуют хлорид-анион, Cl —, полученное соединение, NaCl, состоит из ионов натрия и хлорид-ионов в соотношении один ион Na + на каждый ион Cl —.
Соединение, содержащее ионы и удерживаемое ионными связями, называется ионным соединением.Ионные соединения — это твердые вещества, которые обычно плавятся при высоких температурах и кипят при еще более высоких температурах. В твердой форме ионное соединение не является электропроводным, потому что его ионы не могут течь. Однако в расплавленном состоянии он может проводить электричество, потому что его ионы могут свободно перемещаться через жидкость.
В каждом ионном соединении общее количество положительных зарядов катионов равно общему количеству отрицательных зарядов анионов. Таким образом, ионные соединения в целом электрически нейтральны, даже если они содержат положительные и отрицательные ионы.
Многие ионные соединения содержат многоатомные ионы в виде катиона, аниона или того и другого. Как и простые ионные соединения, эти соединения также должны быть электрически нейтральными, поэтому их формулы можно предсказать, рассматривая многоатомные ионы как дискретные единицы. Мы используем круглые скобки в формуле для обозначения группы атомов, которые ведут себя как единое целое. Например, формула фосфата кальция, одного из минералов в наших костях, — Ca 3 (PO 4 ) 2 . Эта формула показывает, что есть три иона кальция (Ca 2+ ) на каждые две фосфатные (PO 4 ) 3- группы.Группы (PO 4 ) 3- представляют собой дискретные единицы, каждая из которых состоит из одного атома фосфора и четырех атомов кислорода и имеет общий заряд 3−. Соединение электрически нейтрально, и его формула показывает общее количество трех атомов Ca, двух P и восьми атомов O.
Этот текст адаптирован из Openstax, Chemistry 2e, раздел 2.6: Молекулярные и ионные соединения.
Различные виды химии — химия и биохимия
По сути, химия — это изучение материи и изменений.Способы, которыми химики изучают материю и изменения, и типы изучаемых систем сильно различаются. Традиционно химия подразделяется на пять основных дисциплин: органическая, аналитическая, физическая, неорганическая, и биохимия. За последние несколько лет начали появляться дополнительные концентрации, включая ядерную химию, химию полимеров, биофизическую химию, биоорганическую химию, химию окружающей среды и т. Д. Все эти области химии в некоторой степени рассматриваются в наших классах здесь, в UWL, а также в рамках исследовательских интересов нашего факультета на химическом факультете.Следующие ниже описания пяти основных субдисциплин были написаны несколькими преподавателями в их области знаний. Все наши преподаватели будут рады подробно рассказать и / или обсудить другие аспекты химии, которые не описаны ниже!
Органическая Органическая химия — это раздел химии, который включает изучение молекул жизни. В основном это касается изучения структуры и поведения этих молекул, которые состоят только из нескольких различных типов атомов: углерода, водорода, кислорода, азота и некоторых других.Эти атомы используются для создания молекул, необходимых всем растениям и животным для их выживания. Традиционные химики-органики озабочены синтезом новых молекул и разработкой новых реакций, которые могут сделать эти синтезы более эффективными. Типы молекул, которые синтезируют химики-органики, включают полезные вещества, такие как лекарства, ароматизаторы, консерванты, ароматизаторы, пластмассы (полимеры) и сельскохозяйственные химикаты (удобрения и пестициды), а также иногда включают необычные молекулы, встречающиеся в природе, или молекулы, которые могут просто создать проблему для делать.Кроме того, понимание органической химии необходимо для изучения биохимии и молекулярной биологии, потому что биомолекулы, такие как белки, сахара, жиры и нуклеиновые кислоты (ДНК и РНК), являются органическими молекулами, хотя и очень большими. Студенты, специализирующиеся на органической химии, обычно продолжают работать в фармацевтических, пищевых или полимерных компаниях, проводят исследования или преподают в области органической химии, продолжают медицинскую карьеру или могут искать другие связанные с этим возможности работы.
Вернуться к началу
Аналитическая Аналитическая химия — это наука об идентификации и количественном определении материалов в смеси.Химики-аналитики могут изобретать процедуры анализа, а также использовать или изменять существующие. Они также контролируют, проводят и интерпретируют анализ. Студенты, специализирующиеся на аналитической химии, часто продолжают работать в лабораториях судебной экспертизы, экологических или фармацевтических компаниях, работают, управляют и / или разрабатывают процедуры обеспечения качества, проводят исследования или преподают в колледжах и университетах.
Вернуться к началу
Физика Физическая химия — это изучение фундаментальных физических принципов, которые определяют поведение атомов, молекул и других химических систем.Физические химики изучают широкий круг вопросов, таких как скорости реакций (кинетика), способ взаимодействия света и вещества (спектроскопия), расположение электронов в атомах и молекулах (квантовая механика), а также стабильность и реакционная способность различных соединений. и процессы (термодинамика). Во всех этих случаях физико-химики пытаются понять, что происходит на атомном уровне и почему. Студенты, которые концентрируются на физической химии, могут продолжить карьеру в промышленности, исследованиях или преподавании.Многие современные исследования в области физической химии в промышленности и академических кругах сочетают в себе методы и идеи из нескольких областей. Например, некоторые химики применяют методы физической химии для исследования механизмов органических реакций (какие происходят столкновения и перегруппировки связей, насколько они быстры, сколько этапов и т. Д.) — этот тип исследования называется физической органической химией. Другие применяют физические методы для изучения биологических систем (почему белки складываются в те формы, которые они имеют, как структура связана с функцией, что заставляет нерв работать и т. Д.) — это биофизическая химия. Третьи могут использовать физические методы для характеристики полимеров или изучения систем окружающей среды.
Вернуться к началу
Неорганическая Неорганическая химия обычно считается областью химии, которая не имеет отношения к углероду. Однако углерод играет очень важную роль во многих неорганических соединениях, и существует целая область исследований, известная как металлоорганическая химия, которая действительно представляет собой гибрид традиционных дисциплин органической и неорганической химии.Некоторые области неорганической химии, которые особенно важны, — это катализ, химия материалов и биоинорганическая химия. Катализаторы — это химические соединения, которые увеличивают скорость реакции, не расходясь, и обычно основаны на переходных металлах (обычно) металлоорганических комплексах переходных металлов). Это чрезвычайно важная область для промышленности, и многие из химиков, которые будут идентифицированы как неорганические или металлоорганические химики работают в этой области. Химия материалов — это область, связанная с разработкой и синтезом материалов, которые позволяют продвигать технологии практически во всех сферах жизни общества.Часто химики-неорганики, работающие в этой области, занимаются синтезом и характеристикой соединений в твердом состоянии или неорганических полимеров, таких как силиконы. Химики-биоинорганики изучают функцию металлосодержащих соединений в живых организмах. Студенты, специализирующиеся на неорганической химии, часто продолжают работать в промышленности в области полимеров или материаловедения, проводят исследования или преподают в области неорганической химии или ищут другие связанные с этим рабочие места.
Вернуться к началу
Биохимия Биохимия — это исследование химических принципов, лежащих в основе основных биологических систем.По сути, биохимические исследования направлены на определение связи между структурой и функцией биологических макромолекул. В частности, биохимические исследования обеспечили более полное понимание регенеративной медицины, инфекционных заболеваний, трансплантации органов / тканей, клинической диагностики и генетических заболеваний. Студенты, специализирующиеся на биохимии, продолжают делать чрезвычайно успешную карьеру в медицине, исследованиях и бизнесе. Некоторые студенты могут поступать в профессиональные школы сразу после получения степени бакалавра, в то время как другие могут поступать в академические или правительственные исследовательские учреждения.Некоторые студенты также объединяют свои знания в области биохимии в рамках степени магистра делового администрирования (MBA). Совместное изучение биохимии и бизнеса дает этим студентам уникальную возможность лучше сопоставить затраты и размер прибыли при производстве биохимических продуктов. Для получения информации о специальности «Биохимия» щелкните здесь.
Вернуться к началу
Графика Легенда:
Органическая химия : Восстановление камфоры боргидридом натрия.
Аналитическая химия : Масс-спектр диэтиламина.
Физическая химия : Иллюстрация момента инерции молекулы, такой как этан.
Неорганическая химия : Рентгеновская кристаллическая структура нового твердого неорганического соединения, синтезированного исследовательской группой доктора Роба Макгаффа.
Биохимия : схематический чертеж, показывающий структурные элементы домена I лактатдегидрогеназы
Функциональная классификация запаха с помощью подхода медицинской химии
Реферат
Решающим фактором для любой гипотезы о кодировании запаха является классификация и прогнозирование сенсорных качеств в химических соединениях .Взаимосвязь между качеством восприятия и молекулярной структурой занимала обонятельных ученых на протяжении всего 20 века, но детали механизма остаются неуловимыми. Молекулы запаха обычно представляют собой органические соединения с низкой молекулярной массой, которые могут быть алифатическими или ароматическими, могут быть насыщенными или ненасыщенными и могут иметь различные функциональные полярные группы. Однако многие молекулы, соответствующие этим характеристикам, не имеют запаха. Один из подходов, который недавно использовался для решения этой проблемы, заключался в применении стратегий машинного обучения к большому набору запахов и классификаторов людей в попытке найти общие и уникальные химические свойства, которые могли бы предсказать запах химического вещества.Мы используем альтернативный метод, который больше полагается на биологические реакции обонятельных сенсорных нейронов, а затем применяет принципы медицинской химии, метод, широко используемый при открытии лекарств. Мы демонстрируем эффективность этой стратегии с помощью классификации сложных эфиров, важных отдушек для создания вкуса вина. Наши результаты показывают, что вычислительные подходы, которые не учитывают биологические реакции, страдают как от ложноположительных, так и от ложноотрицательных результатов и не могут предоставить значимые механистические данные.Однако два подхода, используемые в тандеме, могут разрешить многие парадоксы в восприятии запахов.
ВВЕДЕНИЕ
Практически невозможно предсказать, будет ли данная молекула иметь запах и каков ее запах, исходя только из химической структуры. Хотя все молекулы запаха обычно представляют собой органические соединения с низкой молекулярной массой, они могут быть алифатическими или ароматическими, могут быть насыщенными или ненасыщенными и могут иметь любую из нескольких полярных функциональных групп. Однако есть много молекул, которые соответствуют этим характеристикам, но, тем не менее, не имеют запаха для людей и других животных.Основная трудность заключается в определении категорий запаха. Без однозначных и измеримых категорий практически невозможно построить какой-либо набор взаимосвязей между запахом и структурой. Существующие категории построены на основе консенсуса между наблюдателями, но эти дескрипторы, как правило, в основном субъективны, а не универсальны. В 1988 г. Частретт и его коллеги ( 1 ) изучили коллекцию из 2500 описаний запахов ( 2 ) и пришли к выводу, что только 3% дескрипторов привели к плодотворной взаимосвязи запах-структура.В 1985 году попытка Дравниекса ( 3 ) закончилась более чем 100 дескрипторами для описания 144 запахов. Некоторые из этих дескрипторов были использованы в недавней попытке применить алгоритмы машинного обучения в конкурсе программистов, чтобы найти корреляции между физико-химическими свойствами более 400 одорантов и их запахом, по оценке людей ( 4 ). Однако это было выполнено с ограниченным количеством дескрипторов восприятия, включая неоднозначные ярлыки, такие как «пекарня» или «химическое вещество», и другие очень специфические типы, такие как «чеснок» или «рыбный», которые испытуемые были вынуждены использовать. для классификации.Конкретные химические структурные характеристики были получены из набора из более чем 4000 химических характеристик, предоставленных химической базой данных DRAGON. Как можно было представить с такой большой базой данных, многие химические классификаторы в ДРАКОНЕ имеют неясные химические свойства, относящиеся к физической и органической химии. Хотя программы-победители показали смешанную удачу в прогнозировании качества запаха по скрытому набору данных, даже правильные корреляции не обеспечивали никакой рациональной схемы классификации или какого-либо биологического механизма обнаружения и распознавания.Возможно, это неудивительно, потому что химические системы имеют тенденцию сильно влиять на структуры и качества, которые были бы важны для химика-синтетика, разрабатывающего или анализирующего путь реакции. Однако нет никаких оснований полагать априори, что эти же особенности могут представлять интерес для биологического рецептора. В предыдущем исследовании мы уже показали, что биологические реакции являются лучшим предиктором химического обнаружения, чем химические дескрипторы ( 5 ). В качестве альтернативы использованию субъективных дескрипторов от людей мы обратились к обонятельным сенсорным нейронам мыши (OSN), где мы можем считывать активность рецепторов с помощью сигнала кальция.Мы также смогли расширить и подтвердить наши результаты в экспериментах с мышью и, наконец, на человеческой панели, не требуя использования дескрипторов.
Кроме того, вместо того, чтобы пытаться выбрать «разнообразную» панель одорантов, основываясь исключительно на разнообразии их физико-химических структур, которые могут иметь небольшое биологическое значение и могут вообще не быть биологически разнообразными, в нашем исследовании использовались хорошо зарекомендовавшие себя методы из фармацевтическая химия. Dunkel et al. ( 6 ) предположил, что, хотя обонятельная система способна реагировать на широкий спектр химических веществ, лучшими лигандами будут те, которые имеют поведенческое и эволюционное значение.Таким образом, они сосредоточились на пищевых ароматизаторах и выявили, что 230 «ключевых пищевых запахов» из 10 000 идентифицированных ароматических соединений были необходимы и достаточны для воссоздания большинства представлений о еде и напитках. Эти результаты упрощают картину запахов на два порядка ( 6 ). Воспользовавшись этим упрощенным ландшафтом, Краутвурст и его коллеги ( 7 ) сумели идентифицировать высокочувствительные рецепторы для двух ключевых пищевых запахов, обнаруженных в красном вине и луке, которые активируют широко настроенные человеческие рецепторы OR1A1 и OR2M3, соответственно.Эти исследования дают дополнительное обоснование для использования меньшего набора одорантов, выбранных из-за их экологических или других соответствующих свойств ( 4 , 7 ).
Поэтому для данного исследования мы выбрали сложные эфиры. Применяя подход, основанный на медицинской химии, мы использовали ряд родственных соединений медиальных и концевых сложных эфиров для поиска рационального набора параметров для понимания того, почему родственные химические соединения могут восприниматься как разные или похожие на основе их свойств биологической активации.Медицинская химия делает упор на биологические функции, а не на химические свойства, исследуя влияние тонких изменений химических структур в молекулах на их мишени (то есть рецепторы). В случае используемых здесь сложных эфиров положение эфирного кислорода и длины углеродной цепи по обе стороны от эфирного кислорода или карбонильной группы варьировались, и мы исследовали обратные сложные эфиры каждого соединения — сложные эфиры, в которых атомы кислорода простого эфира и карбонила переносятся по сравнению с исходным соединением (рис.1). Сегодня знание сложных эфиров и их реакционной способности занимает центральное место в науке о продуктах питания. Поскольку официальный термин для сложных эфиров был введен в 1850 г. Л. Гмелином (который также ввел термин для кетонов в 1848 г.), сложные эфиры стали наиболее широко используемыми соединениями в ароматизаторах и химии ароматизаторов. В частности, сложные эфиры играют важную роль в производстве вина, где они не только отвечают за его фруктовые нотки, но и снижают его кислотность ( 8 , 9 ). Сложные эфиры также представляют собой ядро половых феромонов многочисленных насекомых-вредителей сельскохозяйственных культур ( 10 , 11 ).Поскольку эти половые феромоны часто могут очень тонко различаться между разными видами, понимание того, какие особенности действительно имеют отношение к их различению, может привести к лучшему пониманию видообразования этих насекомых и проложить путь к стратегиям защиты растений, основанным на антагонистах или агонистах половых феромонов ( 12 ). Поэтому мы выбрали молекулу сложного эфира в качестве модельного лиганда для ее широкого обнаружения и распознавания в обонятельных системах у эволюционно далеких видов.Наши результаты показывают, что, хотя классический подход, ориентированный на химию, не может предсказать сходство запахов, подход, основанный на медицинской химии и биологии, предлагает более точную стратегию для понимания различения запахов через молекулярные структуры.
Рис. 1. Манипуляции с эфирными группами.
Эти структуры показывают отношения между одорантами нашей панели. Все пахучие вещества этой панели имеют основную цепь длиной девять атомов. ( A ) [1] и [2] — терминальные обратные сложные эфиры.Их эфирный кислород и карбонил взаимно перемещаются, так что карбонил теперь находится там, где раньше был эфирный кислород. У них обоих есть одно шестиуглеродное неполярное «плечо» и терминальная полярная группа. ( B ) [5] и [6] являются средними обратными сложными эфирами. Их эфирный кислород и карбонил взаимно транспонированы. У них обоих есть два неполярных «плеча» углеродной цепи и центральная полярная группа. ( C ) [3] представляет сдвиг двухуглеродного терминала к медиальной сложноэфирной группе по сравнению с [1]. ( D ) Кетон [4] представляет собой замещение O → C по сравнению с обоими [5] и [3]. ( E ) [3] и [1] имеют эфирный кислород, расположенный в одном и том же относительном положении их основной цепи, но представляют собой симметричное смещение карбонила вокруг этого эфирного кислорода. ( F ) [5] и [3] имеют свои карбонилы, расположенные в одном и том же относительном положении вдоль их основной цепи, но представляют собой симметричное смещение их эфирного кислорода вокруг этого карбонила.
РЕЗУЛЬТАТЫ
Ответы диссоциированных OSN на сложные эфиры
Мы использовали OSN, диссоциированные от мышей, сконструированные для экспрессии GCaMP6f под промотором обонятельного маркерного белка (OMP) для мониторинга активности клеток при воздействии соединений запаха. В этом случае мы были заинтересованы в понимании особенностей близкородственных сложноэфирных соединений, которые позволяли их обнаруживать и различать с помощью пахучих рецепторов (OR). Поскольку зрелые OSN, экспрессирующие OMP, экспрессируют только один OR ( 13 ), мы можем использовать активность отдельных клеток в качестве заместителя для активации специфических рецепторов (рис.2А).
Рис. 2 Ответы диссоциированных OSN на эфирные отдушки.
( A ) В общей сложности 872 из 4523 жизнеспособных OSN ответили по крайней мере на один одорант, что привело к 58 различным образцам бинарного ответа (перечислены слева). Цифры в крайнем правом столбце показывают, как часто наблюдалась та или иная реакция. Зеленая рамка обозначает активацию OSN соответствующим одорантом. ( B ) Двумерное (2D) представление тестируемых одорантов.( C ) Коактивация OSN, отвечающих на каждый из пяти сложных эфиров, нанесена на график в соответствии со смещением сложноэфирной группы вдоль углеродной цепи первичного одоранта (числа над каждым графиком). Обратные сложные эфиры, обозначенные фиолетовой полосой, показали самые высокие уровни коактивации как для средних, так и для концевых сложных эфиров, хотя концевые сложные эфиры представляют собой замещение четырех атомов углерода. Значения парной коактивации представлены на рис. S1. Примеры трасс отклика OSN на Ca 2+ представлены на рис.S4.
Наша панель состояла из гексилацетата [1] и следующих производных: метилгептаноат [2] , этилгексаноат [3] , бутилбутират [5] и пропилпентаноат [6]. Каждое соединение представляет собой смещение по углеродной цепи молекулы эфирного кислорода, карбонильной группы или всей сложноэфирной функциональной группы (рис. 1). Кетон, 4-нонанон [4] , был добавлен в эту панель в качестве постороннего химического вещества.Всего 872 OSN продемонстрировали кальциевый ответ по крайней мере на один одорант из этой панели из приблизительно 4500 протестированных OSN. При консервативной бинарной оценке ответов наблюдали 58 различных паттернов активности, что указывает на то, что в обнаружении этой панели было задействовано не менее 58 различных OR (рис. 2A). Из них 31 образец был представлен меньшим количеством ячеек на штуку, в том числе 13 образцов наблюдались только в одной ячейке (рис. S4).
Из 872 ответивших OSN 68.3% ответили на [1] , 66,3% на [2] , 54% на [3] , 44,2% на [5] и 40,6% на [6]. Более высокие уровни активации, наблюдаемые в [1] и [2] , указывают на то, что концевые сложные эфиры, независимо от их ориентации, являются предпочтительными лигандами в репертуаре OR. В общей сложности 246 из 872 OSN (28,2%) ответили на все одоранты в панели, включая кетон [4] , что свидетельствует о значительной степени перекрестной активации этих одорантов (рис.2 и 3). Удивительно, но одорант кетона [4] смог активировать почти 74% OSN, отвечающих на [1] , хотя он представляет собой двухуглеродное смещение карбонила от терминала к медиальному и замещение кислород / углерод. . Более того, [4] активировал более 82% OSN, которые отвечали на медиальные эфиры [3] , [5] или [6] (Рис. 2 и Рис. S1). Сложный эфир [5] , который можно рассматривать как C → O аналог кетона [4] , активирован 44.2% OSN, наравне с ester [6] , но явно меньше, чем [4] , который активирует 67,5% OSN. Это было первым признаком того, что кислород эфира и, в частности, его расположение относительно карбонила, оказали влияние на распознавание запаха. Дальнейшее подтверждение пришло из открытия, что в [1] и [3] , которые сохраняют расположение эфирного кислорода, но где карбонил меняет стороны, было только 62,2% совместного распознавания для этого теперь более медиального сложного эфира.Это приводит к гипотезе о том, что кислород простого эфира, хотя и вносит лишь слабый вклад в образование водородных связей, тем не менее придает сложному эфиру своего рода «ориентацию считывания», когда сложный эфир находится на конце. Соответственно, мы сосредоточились на ряде дополнительных химических манипуляций, включая тактику медицинской химии по обращению эфира (соединения [1] и [2] , и [5] и [6] ), которые создает выраженное изменение идентичности спирта и кислотной ветви соединения, но сохраняет положение полярной группы (рис.1). Хотя эфирный кислород действительно меняет положение при этой манипуляции, карбонил также сдвигается, и комбинация изменений может, таким образом, компенсировать друг друга.
Рис. 3 Иерархический кластерный анализ протестированных сложных эфиров.
( A ) Одоранты сгруппированы в соответствии с химическим сходством, согласно оценке по 1666 молекулярным дескрипторам, загруженным через приложение e-Dragon. Обратите внимание, что в этой кластеризации на химической основе основным делением является функциональная группа (то есть сложный эфир или кетон). C обозначает коэффициент кофенетической корреляции. ( B ) Одоранты сгруппированы в соответствии со сходством биологической реакции на основе кальциевой визуализации диссоциированных OSN (данные, показанные на фиг. 2). В этой классификации, ориентированной на биологию, относительное положение функциональной группы (то есть медиальной или конечной) выступает в качестве основного организационного признака классификации. Ближайшие пахучие вещества, по-видимому, представляют собой обратные сложные эфиры как в медиальном, так и в терминальном кластерах. Все расстояния в дендрограммах евклидовы.См. «Материалы и методы» для получения подробной информации о создании дендрограммы. Представлены 20 лучших дескрипторов e-Dragon, которые лучше всего воспроизводят ответы OSN на сложные эфиры ( [1] , [2] , [3] , [5] и [6] ). в таблице S1.
Как и ожидалось из медицинской химии, OSN, реагирующие на данный сложный эфир, по-видимому, лучше переносят обратный эфир, чем любое другое замещение. Действительно, всего 85,6% OSN, отвечающих на терминальный эфир [1] , были коактивированы его обратным эфиром [2] (рис.2C и рис. S2). Это также верно для OSN, отвечающих на медиальный эфир [5] , который показывает 81,5% коактивации при заражении его обратным эфиром [6] (фиг. 2C и 3). Для сравнения, [2] представляет собой одноуглеродное смещение сложноэфирной группы от медиального к концевому участку вдоль «основной цепи» [3] (рис. 1 и рис. S2B). Этот одноуглеродный сдвиг аналогичен сдвигу, вызванному замещением сложного эфира на обратный сложный эфир. Однако [2] показывает уменьшение коактивации OSN, отвечающих на [3] до 61.9% (рис. S1). Затем мы рассмотрели «перенос» эфира по основной цепи пахучих веществ. Хотя наша панель ограничивает возможные сочетания, мы отметили, что существует устойчивая тенденция к тому, что терминальные сложные эфиры являются лучшими активаторами, чем медиальные эфиры (рис. 2). Только 50% OSN, отвечающих на [1] , были коактивированы [5] (рис. S2A), что представляет собой двухуглеродное смещение терминальной группы сложного эфира по сравнению с [1]. Более того, когда OSN, отвечающие на [1] , подвергались сомнению с помощью [6] , который представлял смещение трех атомов углерода от терминального к медиальному направлению сложноэфирной группы, уровень коактивации составлял только 46.5% (рис. 1 и 2В). Карбонилы одорантов [3] и [5] расположены на одинаковом расстоянии от их конца, но их эфирный кислород расположен по разные стороны от этого карбонила. Тем не менее, 82% OSN, ответивших на [5] , также показали ответ на [3]. Эти результаты неожиданно показывают, что кислород простого эфира, вероятно, не является ключевым признаком связывания медиальных сложных эфиров с их рецептором, и вместо этого предполагают, что относительное расположение карбонила от конца может быть ключевым признаком связывания сложных эфиров с их родственными OR.Взаимная активность также наблюдалась в парах одорантов, и эти уровни представлены на рис. S1.
Классификация одорантов по химическому составу или по откликам OSN
Затем мы сравнили классификацию наших эфирных одорантов, используя как традиционный химический подход, так и биологический подход, основанный на медицинской химии. Для химико-ориентированного подхода мы использовали программное обеспечение e-Dragon для получения 1666 молекулярных дескрипторов для каждого одоранта и построили дендрограмму сходства (рис.3А). С помощью этого метода разделение нашей панели одорантов сначала было обусловлено их функциональной группой, при этом кетон [4] , как и ожидалось, образует один кластер, а эфирный одорант объединяется во второй кластер. В последней группе уровень сегрегации, по-видимому, основан на сравнительной длине плеч, что приводит к более асимметричным или симметричным сложным эфирам (хотя все они имеют одинаковую ширину от конца до конца). «Асимметричный» концевой эфир [1] отделился от остальных молекул, которые образовали группу внутри кластера «сложного эфира с симметричными рукавами», в котором [5] и [3] , по-видимому, являются ближайшими молекулами. .
Для классификации, ориентированной на биологию, образцы ответов 872 отзывчивых OSN были использованы в качестве основы для иерархического кластерного анализа, который привел к совершенно другой дендрограмме сходства (рис. 3B). Примечательно, что концевой эфир [1] и его обратный эфир [2] были сгруппированы в одном кластере и отделены от других пахучих веществ панели. Что еще более удивительно, [4] со своей кетонной группой не представляет собой внешнюю группу, а встроен в кластер «симметричных одорантов», включая [3] , [5] и [6] ]. Внутри этого кластера, в отличие от того, что наблюдается в традиционной химии, [5] оказался ближе к своему обратному эфиру [6] , чем к [3]. Эти результаты предполагают, что относительное положение карбонильной группы является ключевым компонентом, который приводит к распознаванию одоранта его рецептором, а не функциональной группой (то есть кетон по сравнению с эфиром), как предсказывает традиционная химия.
Наконец, в попытке переконструировать биологические данные в базу данных химических дескрипторов, мы рассчитали и сравнили матрицу расстояний каждого молекулярного дескриптора, предоставленного e-Dragon, с нашей биологической классификацией, используя их коэффициент корреляции Спирмена (таблица S1 ).Удивительно, хотя этот метод позволил идентифицировать несколько молекулярных дескрипторов, имитирующих биологически ориентированную классификацию пяти сложных эфиров нашей панели, не было обнаружено никаких дескрипторов, которые повторяли бы кластеризацию кетона [4] с медиальными сложными эфирами, как наблюдалось с классификацией, полученной на основе кальциевых ответов OSN. Таким образом, мы решили исключить [4] из этого «обратного» анализа, и только тогда мы смогли идентифицировать первые 20 молекулярных дескрипторов, которые лучше всего качественно моделировали биологически ориентированную классификацию медиальных сложных эфиров [3] , [5] и [6] и сложные эфиры [1] и [2] (таблица S1).
Поведенческая реакция мышей на сложные эфиры
Хотя данные OSN убедительно указывают на альтернативную систему классификации запаховых стимулов, основанную на биологии, уместно спросить, отражается ли эта классификация в поведенческих реакциях на запахи. Чтобы определить это, мы использовали тест привыкания-прекращения обитания на нескольких когортах мышей с одной и той же панелью запахов, представленных парами. Этот тест показывает, воспринимаются ли два запаха одинаковыми или разными по качеству (рис.4). Сначала животному предъявляется единый запах для нескольких последовательных испытаний, пока животное не перестанет реагировать на запах, что указывает на то, что оно привыкло. Затем появляется второй запах. Если этот запах имеет такое же или почти такое же восприятие, как привычный запах, то мышь проигнорирует его. Если он имеет другое качество (то есть новое качество восприятия), то мышь будет обращать на него внимание. По этим данным мы можем оценить «перцептивное сходство» между нашими одорантами и сравнить его с дендрограммами, полученными на основе химии или биологии выше.
Рис. 4. Обонятельный тест привыкания-утраты жизни.
Гистограммы показывают среднее время исследования обоняния (в секундах) у мышей во время повторяющихся 2-минутных воздействий пар запахов или диметилсульфоксида (ДМСО) (растворитель). Мыши, которые привыкли к терминальному эфиру [1] , остались приученными к его обратному эфиру [2] ( A ), но не привыкли к среднему эфиру [5] ( B ) и кетону [4 ] ( C ).Точно так же мыши, которые привыкли к среднему сложному эфиру [5] , остались приученными к его обратному эфиру [6] ( D ), но лишились жизни к среднему эфиру [3] ( E ) и кетону . [4] ( F ). Обратите внимание, что это поведение повторяет классификацию сложного эфира, полученную из реакции диссоциированного OSN на рис. 3. Поведенческие данные были проанализированы с использованием теста дисперсии (ANOVA) с последующим апостериорным парным тестом t (* P <0 .05 и ** P <0,005, парный апостериорный тест t ). n.s., не имеет значения. Планки погрешностей указывают на SEM. Каждую пару сложных эфиров тестировали от 9 до 12 животных.
Примечательно, что в ходе этих поведенческих экспериментов было получено несколько результатов. Во-первых, кетон [4] был выделен как из медиального эфира [5] , так и из концевого эфира [1] (фиг. 4, C и F). Этот результат показывает, что [4] представляет собой истинное соединение аутсайдера среди нашей группы.Мыши также легко отличили [1] от [5] (рис. 4B). Эти результаты могли быть предсказаны как по химическим, так и по биологическим классификациям. Однако, согласно традиционной классификации, основанной на химии, [5] следует воспринимать как более похожее на [3] , чем на [6] , но наши тестовые мыши оказались неспособны различить [5] от его обратного эфира [6] (рис. 4D), хотя они отличали его от [3] (рис.4E). Точно так же и вопреки предсказанию классификации, основанной на химии, мыши не отличали [1] от его обратного эфира [2] (фиг. 4A). Однако эти результаты согласуются с биологической классификацией с использованием ответов OSN.
Распознавание эфиров людьми
Эти результаты показали, что было бы интересно посмотреть, будут ли люди классифицировать эти одоранты с учетом химии или биологии. Чтобы сравнить результаты на людях с тестом обонятельной дискриминации мышей, проведенным при 30 мкМ, мы проверили группу из 11 человек (восемь женщин и три мужчины) с семью растворами, состоящими из 30 мкМ растворов одорантов [1] , [ 2] , [3] , [5] и [6] , пустая проба (без запаха) и второй раствор [1]. Мы попросили их сгруппировать образцы запахов во многие группы, которые они считали похожими (рис. 5A). Обратите внимание, что мы не запрашивали словесное описание запахов и не предоставляли их. Испытуемых просили только различать запахи похожие или разные. Неудивительно, что между испытуемыми были существенные различия в классификации, но каждый испытуемый демонстрировал значительную последовательность в своих группах в течение трех итераций эксперимента (рис. S3). На основе кластеризованных данных мы построили дендрограммы на основе ощущаемого сходства запахов.Наши люди, как и мыши, воспринимают медиальные эфиры [5] и [6] как наиболее похожие, но, в отличие от мышей, классифицируют их как более близкие к [2] , чем к [3]. Люди также сгруппировали [1] с [3] , а не [2]. Концентрация одоранта 30 мкМ казалась слишком слабой для того, чтобы люди могли четко отличить контрольный раствор от холостого раствора. Тем не менее, пустой раствор был правильно идентифицирован в 27–36% случаев за три повторения, в то время как уровень вероятности составляет 15% (рис.S3).
Рис. 5. Тесты на обонятельную дискриминацию человека.
( A ) 3D-изображения тестируемых одорантов. ( B ) Одоранты сгруппированы по сходству на основе восприятия 11 людьми 30 мкМ растворов одоранта в течение трех итераций. Все расстояния в дендрограммах евклидовы. См. «Материалы и методы» для получения подробной информации о создании дендрограммы. Два реверсивных медиальных эфира [5] и [6] группировались вместе чаще, чем два раствора одоранта, содержащие [1] (результаты итераций представлены на рис.S3). ( C ) Гистограммы представляют процент правильной идентификации испытуемыми людьми различных 3 мМ раствора одоранта [x] [то есть [2] , [3] , [5] или пустой (Blk)] из двух идентичных 3 мМ одорантов, содержащих [1] ; уровень шанса (33%) показан красной пунктирной линией. n = 13 добровольцев. ( D ) Гистограммы представляют собой процент правильной идентификации, сделанной людьми для различных 3 мМ раствора одоранта [x] (то есть [2] , [3] , [5] ) или пустой) из двух идентичных 3 мМ одорантов, содержащих [1] ; уровень шанса (33%) показан красной пунктирной линией. n = 14 предметов.
Чтобы подтвердить эти результаты, мы предложили испытуемым пройти еще более простой обонятельный тест — одно и то же против различий. Мы также решили увеличить концентрацию одоранта до 3 мМ для этого второго эксперимента, чтобы посмотреть, изменит ли увеличение концентрации восприятие запаха людьми. В этом случае каждому испытуемому давали три флакона с раствором, содержащим два идентичных 3 мМ раствора одоранта (либо [5] , либо [1] ) и 3 мМ раствор одоранта другого одоранта ( [2] , [3] , [6] или пробел) и попросили идентифицировать другой одорант.Как и в первом тесте, испытуемых не спрашивали и не давали дескрипторов. Примечательно, что эта 100-кратная разница в концентрации не изменила общую классификацию одорантов людьми, за исключением лучшего различения холостого опыта. Различенные одоранты в концентрации 30 мкМ все еще различались при 3 мМ, тогда как неразличимые одоранты в концентрации 30 мкМ оставались неразличимыми при 3 мМ. Субъекты отличали пустой флакон от флаконов, содержащих [5] или [1] более чем в 70% случаев, и флаконы, содержащие [2] из [1] дубликатов в 66% испытаний ( Инжир.5С). При тестировании с [5] в качестве дубликата испытуемые смогли отличить его от образца [2] или [3] примерно на уровне 55–60%, но смогли определить только запах [6] отличается в 28% случаев, что ниже даже уровня вероятности в 33% (рис. 5D). Результаты интересны тем, что люди распознают эти запахи иначе, чем предсказания, сделанные с помощью классификации, основанной на химии, но также отличаются от распознавания мыши.Это дополнительно подтверждает модель, согласно которой качество запаха определяется как рецепторами, так и химией, и будет различаться в зависимости от репертуара рецепторов, которыми обладает распознающий организм.
ОБСУЖДЕНИЕ
Широко признано, что периферическая обонятельная дискриминация работает через взаимный комбинаторный код, в котором одно химическое вещество может быть обнаружено разными OR, а одно OR может обнаруживать группу различных, предположительно связанных химических веществ ( 14 , 15 ).Кроме того, аксоны всех OSN, экспрессирующих конкретный OR, проецируются в один и тот же клубок в обонятельной луковице, что позволяет предположить обозначенную в виде линии «карту запаха» ( 16 , 17 ), которая зависит от диапазона молекулярной восприимчивости каждого из них. рецептор ( 18 ). Обычно то, что подразумевается под молекулярным диапазоном восприимчивости рецептора, определяется в терминах химических категорий — рецептор чувствителен к альдегидам или кетонам, к ароматическим кольцам или длине цепи и т. Д. Однако эти диапазоны восприятия часто выходят за пределы явно определенных химических веществ. категории.Таким образом, понимание обонятельного кода требует правильного набора предположений о связи между химической структурой и качеством запаха. В настоящее время в этой области в основном используются химические данные и психофизические описания запаховых качеств ( 4 ). Решающая роль биологии, рецепторов запаха, либо не учитывается, либо считается нейтральной. Таким образом, исторически и в настоящее время предпринимались многочисленные попытки классифицировать запахи по химической структуре и качеству восприятия, а затем искать отношения, которые будут описывать различные наборы запахов ( 19 ).Тем не менее, из-за этих схем в этой области остается множество парадоксов. Например, восприятие мускусного запаха может быть создано любой из нескольких молекул, которые имеют небольшую общую химическую структуру ( 20 , 21 ).
Существуют тысячи химических дескрипторов, которые были разработаны за десятилетия исследований в области аналитической химии ( 22 ). Однако все эти дескрипторы могут описывать молекулы, которые с одинаковой вероятностью имеют запах или нет.Безусловно, существуют грубые практические правила — алифатические альдегиды обычно имеют фруктовый запах, если они также имеют определенную минимальную длину цепи, — но ни одно из них не является неизменно надежным. Химические свойства не приводят к какому-либо биологическому механизму, который подсказывает, почему альдегиды иногда бывают фруктовыми. Казалось бы, единственное надежное определение запаха — рабочее: запахи — это молекулы, которые связываются с рецепторами запахов и активируют их. Хотя на первый взгляд это может показаться тривиальным определением, его можно использовать для разработки метода классификации запахов, который является гораздо более эмпирическим и менее теоретическим, чем более распространенные схемы, сочетающие химические дескрипторы с субъективными суждениями.
Именно такое упражнение было недавно опубликовано как соревнование между группами программистов, которым была предоставлена большая база данных, содержащая психофизические данные от многих субъектов, протестированных на большом массиве запахов. Применяя алгоритмы машинного обучения к данным, одна или несколько групп пришли к программам, которые могли предсказывать химические атрибуты для 8 из 19 дескрипторов. В некоторых случаях требовалось более 100 химических характеристик (из более чем 4000 базы данных) для прогнозирования некоторых качеств запаха ( 4 ).Большинство из этих особенностей были бы неизвестны всем, кроме специализированного химика-органика или физического химика, и не могли бы дать интуитивного представления о том, почему и как они могут быть важны для активации рецепторов. Примечательно, что от людей требовалось классифицировать запахи в соответствии с заранее определенным набором дескрипторов, все из которых имеют неизвестное и, возможно, своеобразное психологическое значение. Хотя это впечатляющее достижение для скрининга больших наборов молекул на предмет потенциального запаха, оно дает мало или совсем не дает механистического понимания обнаружения или распознавания запаха.Это также привело к большому количеству как ложных срабатываний, так и ложноотрицательных результатов.
Дополнительная проблема возникает из-за необоснованных предположений, сделанных при создании панелей запаха, предназначенных для отражения разнообразия. Хотя они могут отражать химическое разнообразие, на самом деле они могут не отражать биологически разнообразное пространство запахов. Например, включение в панель альдегидов, спиртов и кислот, как это часто делается, не обязательно гарантирует разнообразие, потому что существует множество рецепторов, которые не различают эти химические функциональные группы ( 23 ).Еще одним следствием этой зависимости от химической структуры является то, что это легко приведет к неверным моделям того, как качество запаха или восприятие могут возникать в мозгу. Например, классическая химическая классификация не смогла предсказать, что наше соединение [1] и его обратный эфир [2] будут иметь подобные представления. В свою очередь, медиальные эфиры [5] и [3] , хотя и являются ближайшими молекулами нашей панели в соответствии с классической химической классификацией, легко распознавались мышами и людьми в поведенческих тестах.Примечательно, что наши психофизические тесты не требовали, чтобы люди (или, конечно, мыши) производили классификацию восприятия — просто распознавание сходства или различия.
Таким образом, мы предполагаем, что для понимания правил классификации запахов в биологических системах требуется подход, сочетающий химические свойства с биологической функцией. В фармацевтической промышленности это часто достигается применением медицинской химии. Медицинская химия вносит различные изменения в известные молекулы и анализирует их биологическое воздействие на клетки, системы или организмы.Он ищет биоизостеры, молекулы, которые имеют сходные биологические функции независимо от их химического сходства или различия (то есть стереоизомеры) ( 24 ). Этот подход, в частности, показал интересные результаты в разработке параферомонов для нарушения коммуникации насекомых в целях защиты растений ( 12 , 25 ). Сочетание химии с биологической направленностью позволяет классифицировать запахи физиологически значимым образом, что является отражением работы биологической системы.Это позволяет нам идентифицировать важные химические характеристики, имеющие биологическое значение, которые не всегда могут быть наиболее заметными химическими характеристиками.
В текущем примере химии сложных эфиров, представленном здесь, мы обнаруживаем, что существует сильная связь между сложными эфирами и кетонами, которая не предсказывается химическим анализом. Этот неожиданный результат привел нас к предположению, что критической особенностью различения сложноэфирных молекул является не сложноэфирная группа, а, скорее, положение карбонильной группы.Вместо этого эфирный кислород сложноэфирной группы, по-видимому, обеспечивает направленную рамку считывания для молекулы. Кроме того, мы обнаружили, что сложный эфир и его обратный эфир хорошо переносятся OR. Этот результат является неожиданным, поскольку превращение сложного эфира в его обратный эфир представляет собой заметное изменение по стандартной схеме химической классификации. В известном примере 1980-х годов использование наркоманами МФТП (1-метил-4-фенил-1,2,3,6-тетрагидропиридина), обратного эфира меперидина, вместо меперидина, привело к развитию Болезнь паркинсона у потребителей ( 26 , 27 ).Это было связано с тем, что обратный сложный эфир не мог связываться и должным образом метаболизироваться решающим ферментом. В этом случае и во многих других фармакологических случаях различают сложный эфир и обратный эфир. Однако это верно не во всех случаях и, конечно, не в случае обоняния.
Использование этого подхода особенно приятно, потому что данные о поведении мыши и человека, которые не основываются на субъективных дескрипторах запаха, подтверждают данные о клетках, тем самым предполагая, что восприятие может быть связано с молекулярными особенностями, если их учитывать. с помощью биологического анализа.В этом исследовании и в предыдущих работах ( 5 , 28 — 30 ) подчеркивалось, что слишком сильная зависимость от химических анализов может иногда приводить к серьезным просчетам в отношении различения и восприятия обоняния. Эти просчеты невозможно преодолеть простым применением машинного обучения к большим, но идиосинкратически сконструированным базам данных. Они с большей вероятностью усугубят проблемы. С другой стороны, включение биологических данных в наборы данных значительно повышает ценность использования подходов к большим данным.
МАТЕРИАЛЫ И МЕТОДЫ
Химические вещества
Пахучие вещества панели были образованы вокруг одоранта свинца, гексилацетата [1] , и состояли из гексилацетата [1] , метилгептаноата [2] , этил гексаноат [3] , 4-нонанон [4] , бутилбутират [5] и пропилпентаноат [6]. Все одорантов были приобретены у Sigma-Aldrich, за исключением [6] , который был приобретен у Chem Service Inc.Исходные вещества одоранта были приготовлены в> 99% ДМСО (Sigma-Aldrich) и разбавлены свежеприготовленным раствором Рингера до конечной концентрации 30 мкМ непосредственно перед экспериментами. Размерные представления (2D и 3D) молекулы были получены с использованием бесплатного программного обеспечения Molinspiration Cheminformatics (www.molinspiration.com).
Сбор животных и тканей
Все процедуры с животными соответствовали руководящим принципам по уходу и использованию животных Колумбийского университета, а также были рассмотрены и одобрены Комитетом по уходу за животными и их использованию.Мыши GCaMP6f, управляемые OMP-Cre, использованные в этой работе, были получены путем скрещивания линии OMP-Cre (# 006668, лаборатория Джексона) с линией B6; 129S-Gt (ROSA) 26Sortm95.1 (CAG-GCaMP6f) Hze / J (# 024105, Лаборатория Джексона). У этих сложных мутантных мышей экспрессия генетически кодируемого кальциевого сенсора GCaMP6f была ограничена зрелыми OSN. Все мыши были выращены и содержались в отделении для животных. OSN были выделены от 5-8-недельных мышей-самцов GCaMP6f, управляемых OMP-Cre, с генотипом OMP-Cre +/- GCaMP6f — / — .Мышам вводили передозировку анестетиками [кетамин (90 мг -1 , внутрибрюшинно) и ксилазин (10 мг -1 , внутрибрюшинно)] и декапитировали. Голову разрезали сагиттально и удалили перегородку, чтобы обнажить медиальную поверхность обонятельного эпителия и носовых раковин. Обонятельный эпителий и носовые раковины вскрывали и собирали в двухвалентном растворе Рингера [145 мМ NaCl, 5,6 мМ KCl, 10 мМ Hepes, 10 мМ глюкозы и 4 мМ EGTA (pH 7,4)]. Ткань инкубировали при 37 ° C в течение 45 минут в 5 мл безвалентного раствора Рингера, содержащего коллагеназу (0.5 мг / мл -1 ), бычий сывороточный альбумин (5 мг / мл -1 ; Sigma-Aldrich), диспаза (5 ед / мл -1 ; Roche) и дезоксирибонуклеаза II (50 мг / мл -1 ; Сигма-Олдрич). Затем ткань переносили в чистую пробирку с питательной средой и промывали. OSN диссоциировали, постукивая по пробирке, содержащей ткань. OSN (объем 50 мкл) разделяли на четыре покровных стекла, покрытых конканавалином (10 мг мл -1 ; Sigma-Aldrich) и помещали в чашки Петри диаметром 35 мм.После того, как клетки успели осесть в течение 20 минут, в каждую чашку добавляли 2 мл культуральной среды, и чашки помещали при 37 ° C как минимум на 1 час. Культуральная среда состояла из DMEM (среда Игла, модифицированная Дульбекко) / F12 (Gibco BRL) с добавлением 10% фетальной бычьей сыворотки, 1 × инсулин-трансферрин-селен (Gibco BRL), пенициллин (100 Ед мл -1 ) и стрептомицин ( 100 мг / мл -1 ; Gibco BRL) и 100 мМ аскорбиновой кислоты (Sigma-Aldrich).
Кальций-визуализация для записи
После промывания свежим раствором Рингера покровные стекла помещали в записывающую камеру.Визуализацию проводили при комнатной температуре на инвертированном флуоресцентном микроскопе (IMT-Olympus), оборудованном камерой SIT (C10600, Hamamatsu Photonics), источником света Lambda XL (Sutter Instrument) и устройством смены оптических фильтров Lamba-10B (Sutter Instrument). . Используя систему ВЭЖХ 1260 Infinity (Agilent Technologies), диссоциированные OSN стимулировали одорантами в случайном порядке. Последняя стимуляция 10 мкМ раствором форсколина (Sigma-Aldrich) была проведена для оценки жизнеспособности OSN.Записи производились при возбуждении 490 нм и эмиссии 520 нм. Изображения снимались каждые 4 с, между стимуляциями была 4-минутная задержка. Затем изображения были рассчитаны с использованием программного обеспечения MetaMorph Premier (Molecular Devices LLC), и клетки были подсчитаны вручную. Клетки, демонстрирующие увеличение интенсивности не менее чем на 10% с амплитудой Δ F / F 0 между 8 и 12 кадрами после инъекции одоранта, считались чувствительными клетками.
Анализ данных записи изображений кальция
Всего через бесплатное приложение e-Dragon (www.vcclab.org/) ( 31 ). Нормализованные дескрипторы использовались для вычисления евклидовых расстояний и создания дендрограмм на основе кратчайшего евклидова расстояния с использованием MATLAB (MathWorks). Параметры всех 1666 дескрипторов были оценены z перед кластеризацией. Мы не исключали вручную какие-либо значения и не обрабатывали категориальные / непрерывные значения по-разному. Ответы нейронов на пахучие вещества при визуализации кальция были преобразованы в матрицу m * n bool, где «m» — это количество нейронов, реагирующих по крайней мере на одно химическое вещество, а «n» — количество используемых химикатов; «1» означает «ответ», а «0» означает «нет ответа».Эта матрица использовалась для расчета евклидовых расстояний и создания дендрограмм запахов с помощью MATLAB. Для сравнения тепловых карт одоранта «Ответ» и «Нет ответа» с использованием StatView (Институт SAS) было проведено сравнение Кокрановского Q-теста с последующими апостериорными тестами Макнемара. Затем была рассчитана ранговая корреляция Спирмена между матрицей расстояний каждого молекулярного дескриптора и матрицей расстояний активности OSN для определения дескрипторов, которые лучше повторяют классификацию, основанную на ответах OSN.
Поведенческий тест привыкания-исчезновения
Сходства в качестве воспринимаемого запаха среди группы одорантов оценивали с помощью обонятельного теста привыкания-исчезновения на мышах. За 30 минут до эксперимента самцов мышей OMP-Cre +/- GCaMP6f — / — в возрасте от 5 до 8 недель по отдельности помещали в вытяжку в пустой клетке для мышей, содержащей ватный тампон, смоченный в растворе ДМСО / Рингера. (1: 1000). Затем каждое животное стимулировали три раза подряд в течение 2 минут раствором ДМСО / Рингера, смоченным ватным тампоном, в качестве отрицательного контроля.Затем они получили три последовательных презентации ватного тампона, пропитанного первым одорантом с концентрацией 30 мкМ. Каждая презентация длилась 2 минуты с интервалом в 1 минуту между презентациями. После 1-минутного отдыха животным аналогичным образом трижды предъявляли второй запах. После последнего 1-минутного перерыва в качестве положительного контроля вводили 30 мкМ раствор 2-ацетилтиазола при однократной 2-минутной стимуляции. Суммарное время обнюхивания ватной палочки регистрировали с помощью бесшумных часов.Статистическое сравнение ANOVA с последующим апостериорным парным тестом t было выполнено для результатов с использованием StatView. Каждую мышь использовали только один раз с одним и тем же одорантом. Мыши, которые не смогли обнаружить первую стимуляцию запахом или которые ответили на отрицательный контроль, были исключены из дальнейшего анализа.
Обонятельное восприятие эфиров человеком
Эксперименты на человеке были проведены в Корнельском университете под руководством Т.А. и рассмотрен и одобрен институциональным наблюдательным советом.В первом эксперименте 11 человек были представлены три итерации семи растворов, состоящих из 30 мкМ растворов одорантов [1] , [2] , [3] , [5] и [ 6] , бланк (без запаха) и второй раствор [1]. [4] , «внешний» кетон, не использовался в этих тестах из-за возможных неблагоприятных воздействий на людей. Семь решений были представлены двойным слепым методом. Испытуемых попросили сгруппировать эти решения в соответствии с их предполагаемым сходством / различием.У испытуемых не спрашивали дескрипторы и не давали их. Не было ограничений на количество раз или продолжительность времени, в течение которого испытуемые могли чувствовать запахи. Ответы на пахучие вещества были преобразованы в матрицу m * n bool, где «m» — это количество групп, воспринимаемых испытуемыми, а «n» — количество использованных химикатов; «1» означает «похожий», а «0» означает «другой». Эта матрица использовалась для расчета евклидовых расстояний и создания дендрограмм запахов с помощью MATLAB. Подопытная группа состояла из восьми женщин и трех мужчин в возрасте от 18 до 52 лет (средний возраст 29 лет.4 года).
Во втором эксперименте — одна и та же задача по сравнению с другой — испытуемым дали три флакона, содержащие два идентичных 3 мМ раствора одоранта (либо [5] , либо [1] ) и 3 мМ раствор одоранта другого одоранта. ( [2] , [3] , [6] или пробел), снова представленный в программе двойным слепым методом. Их попросили идентифицировать разные одоранты. Как и в первом тесте, испытуемых не спрашивали и не давали дескрипторов.Группа людей состояла из восьми женщин и шести мужчин в возрасте от 18 до 68 лет (средний возраст 32,3 года). Был рассчитан процент правильной идентификации одоранта для каждой пары одорантов и сопоставлен с уровнем вероятности.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
Дополнительные материалы к этой статье доступны по адресу http://advances.sciencemag.org/cgi/content/full/4/2/eaao6086/DC1
рис. S1. Таблица коактивации OSN.
рис. S2. Диаграмма Венна, отображающая перекрывающуюся активацию OSN сложными эфирами.
рис. S3. Повторения тестов на обонятельную дискриминацию человека.
рис. S4. Примеры ответов OSN Ca 2+ на панель с запахом.
таблица S1. Топ-20 дескрипторов e-Dragon, описывающих расстояния между эфирами.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial, которая разрешает использование, распространение и воспроизведение на любом носителе, при условии, что конечное использование будет , а не для коммерческих целей и при условии, что оригинальная работа правильно цитируется.
ССЫЛКИ И ПРИМЕЧАНИЯ
- ↵
- ↵
S. Arctander, Духи и ароматизаторы природного происхождения (Arctander, 1960).
- ↵
A. Dravnieks, Атлас характеристик запахов (ASTM International, 1985), 354 стр.
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
J Чжан, У. Б. Уокер, Г. Ван, Прием феромонов у бабочек: от молекул к поведению, in Progress in Molecular Biology and Translational Science , R.Glatz, Ed. (Academic Press, 2015), т. 130. С. 109–128.
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
А. Тромелин, Прогнозирование восприятия с использованием моделей структура – активность, в Вкус: от еды к поведению , Wellbeing and Health , P. Etiévant, E. Guichard, C. Salles, A. Voilley, Eds. (Woodhead Publishing, 2016), стр. 181–200.
- ↵
- ↵
- ↵
р.Todeschini, V. Consonni, Справочник молекулярных дескрипторов (Wiley-VCH, 2000).
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
Благодарности: Мы благодарим A.-S. Барвич за исторические материалы и редакционные предложения; К. Марго за комментарии по химии; Р. Хассуна за статистические советы; и К. Чжан, Д. Ципенюк и К. Алтомаре за техническую помощь.Мы также благодарим волонтеров, принявших участие в тестах на распознавание запахов. Финансирование: Это исследование было поддержано Национальным институтом глухоты и других коммуникативных расстройств (R01DC013553). Вклад авторов: С.Ф. задумал и руководил проектом. E.P. и З.П. разработал эксперименты. E.P. и N.T провели эксперименты и проанализировали результаты. Т.А. руководил обонятельным тестом человека. L.X. помог с химической классификацией и анализами.D.-J.Z. разработал и поддерживал линию мышей с L.X. E.P. и С.Ф. написал рукопись. Все авторы доработали рукопись. Конкурирующие интересы: S.F. поддерживает консультационные отношения с Firmenich Inc. Все остальные авторы заявляют, что у них нет конкурирующих интересов. Доступность данных и материалов: Все данные, необходимые для оценки выводов в статье, представлены в документе и / или дополнительных материалах.

 Цвет полосы на упаковке — светло-коричневый.
Цвет полосы на упаковке — светло-коричневый.
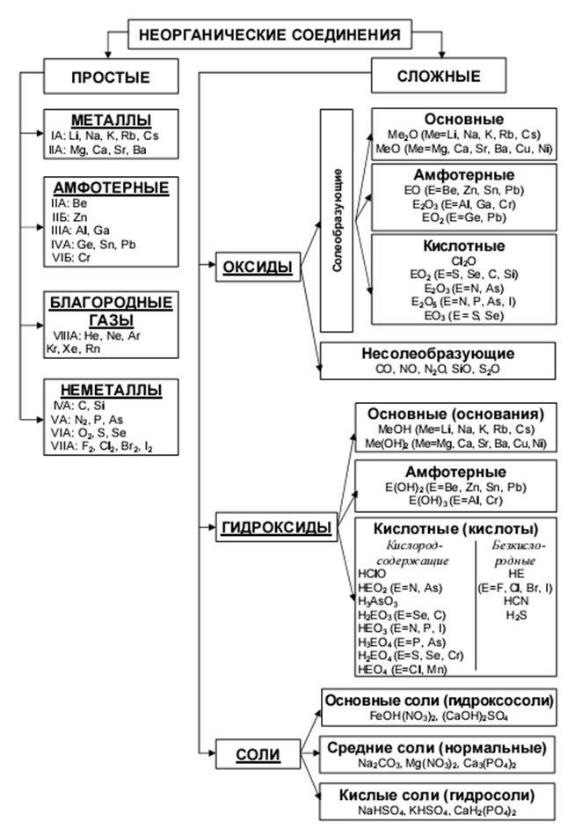 Цвет полосы на упаковке — синий.
Цвет полосы на упаковке — синий.