Содержание
Методическая разработка «Алгоритм решения превращений по химии»
Методические рекомендации решения «цепочек» превращения по химии.
В заданиях ля школьников по химии на любом этапе обучения и для любой параллели всегда имеются задания со схемами последовательных превращений одних веществ в другие, которые характеризуют связь между основными классами органических и неорганических веществ. Многостадийную схему превращения одних веществ в другие в определенной последовательности часто называют «цепочкой». Для выполнения этих заданий необходимо знать основные классы неорганических и органических соединений, номенклатуру, химические свойства, в том числе продукты термического разложения веществ, механизмы реакций.
«Цепочки» – это оптимальный способ проверить большой объем знаний (практически по всем разделам общей, неорганической и органической химии) в одной задаче.
Для того, чтобы успешно решать цепочки химических превращений из одного вещества в другое, необходимо изучить свойства веществ, их взаимодействия и особенности каждого класса соединений. Среди качественных задач решение цепочек веществ встречаются чаще всего.
Среди качественных задач решение цепочек веществ встречаются чаще всего.
Алгоритм решения «цепочки»:
1.Внимательно прочитайте условие задачи. Если необходимо, можете сделать это не один раз.
Напишите уравнения, с помощью которых можно получить следующие превращения:
Al → → Al2O3 → Al(OH)3 → K[AL(OH)4] → AlCl3 → Al(NO3)3 → AlPO4.
Для каждого превращения составьте уравнения реакций. Если переход в одну стадия невозможен, составьте два и более уравнений реакций.
2.Выпишите цепочку отдельно, из условия задачи. Вы можете пронумеровать количество реакций и ли веществ для удобства. Помните, что каждое следующее вещество является исходным для последующего. Определите к какому классу веществ относиться каждый член цепочки. Под первым номером стоит металл алюминий. исходным продуктом реакции должна стать соль. По свойствам металла, соль получается при взаимодействии с кислотой. В данном случае с азотной кислотой. Проанализируйте возможна ли эта реакция. Составьте схему уравнения, расставьте коэффициенты. Первое превращение готова. Далее следуйте шаг за шагом, постепенно продвигаясь к последнему веществу, фосфату алюминия.
Первое превращение готова. Далее следуйте шаг за шагом, постепенно продвигаясь к последнему веществу, фосфату алюминия.
3.Проверьте себя еще раз. Пробегитесь взглядом по уравнениям реакций, проверьте везде ли стоят нужные коэффициенты. Не забудьте правильно оформить уравнения реакций.
Решение
1.Al + 6HNO3(конц.) => Al(NO3)3 + 3NO2 + 3h3O
2.4Al(NO3)3 => 2AL2O3 + 12NO2 + 3O2
3.Al2O3 + 3h3SO4 => Al2(SO4)3 + 3h3O
Al2(SO4)3 + 6NaOH => 2Al(OH)3 + 3Na2SO4
4.Al(OH)3 +KOH => K[Al(OH)4]
5.K[Al(OH)4] + 4HCl => KCl + AlCl3 + 4h3O
6.AlCl3 + 3AgNO3 => Al(NO3)3 + 3AgCl
7.Al(NO3)3 + K3PO4 => AlPO4 + 3KNO3
Решите «цепочки» самостоятельно:
Ca → CaO → Ca(OH)2 →CaCl2
NaOH
Na2O Na2CO3
NaNO3
Mg→MgO→Mg(OH)2→MgCl2
K2O→ KOH→K2SO4
KNO3
S →SO2 → H2SO3
Na2SO3
Cu→CuO→CuCl2→Cu(OH)2→CuO
Ba Ba(NO3)2 Ba(OH)2 BaO
Zn ZnO Zn(OH)2 ZnSO4
Cu CuO Cu(OH)2 CuO
Fe FeCl2 Fe (OH)2 FeO
Ca CaSO4 Ca(OH)2 CaO
Si SiO2 H2SiO3 K2SiO3
N2 N2O5 HNO3 NaNO3
O2 H2O H2 HCl
H2 H2O Ca(OH)2 CaO
Fe FeO Fe(OH)2 FeCl2
Ca CaO Ca(OH)2 Ca(NO3)2
K K2O KOH K2SO4
Na Na2O NaOH Na2СО3
P P2O5 H3PO4 Na3PO4
Mg MgO Mg(OH)2 MgSO4
Ba BaO Ba(OH)2 BaCl2
Ca → CaO → Ca(OH)2 →Ca(NO3)2
Cu(OH)2 → CuO → CuCl2→ Cu(OH)2
S → SO2 → H2SO3 → CaSO3
Fe(OH)3 → Fe2O3 → Fe2(SO4)3 → Fe(OH)3
P → P2O5 → H3PO4 → Na3PO4
H2O → O2 → CO2 → CaCO3
Fe(OH)2 → FeO → Fe → FeCl2
C → CO2 → Na2CO3 → H2CO3
▶▷▶▷ осуществите превращения по схеме укажите типы реакций
▶▷▶▷ осуществите превращения по схеме укажите типы реакций
| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 05-04-2019 |
осуществите превращения по схеме укажите типы реакций — Осуществите превращения по схеме, укажите типы реакций znanijacomtask16879745 Cached Осуществите превращения по схеме, укажите типы реакций , назовите вещества 1AlAl2O3AlCl3Al(OH)3Al2O3 2 Осуществите превращения по схеме, укажите типы реакций shkolnikucomhimiyatask2611754html Cached Осуществите превращения по схеме, укажите типы реакций , назовите вещества 1AlAl2O3AlCl3Al(OH)3Al2O3 2 PP2O5h4PO4Na3PO4Ca3(PO4)2 3 Осуществите превращения по схеме , укажите типы реакций shkolnikucomhimiyatask2592333html Cached Осуществите превращения по схеме , укажите типы реакций , назовите вещества : 1) c—ch5—co2—h3co3 Помогите, кому не трудно! Осуществите превращения по схеме znanijacomtask16904794 Cached Помогите, кому не трудно! Осуществите превращения по схеме, укажите типы реакций , Осуществите цепочку химических превращений, составив wwwv-gdzcomhimiya5-9osyshestvite-cepochky Cached Cоставьте уравнения реакций , с помощью которых можно осуществить превращения по схеме : Fe — FeSO4 — Fe(OH)2 — FeO; 2) Запишите уравнения реакций для переходов: Fe — FeCL3 — Fe(OH)3 — Fe2O3 Осуществите превращения по схеме, укажите тип химической himianeznakaruanswer3577147_osusestvite Cached Осуществите превращения по схеме , укажите тип химической реакции карбид кальция ацетилен этан этилен 10-11 класс Урок 2 Основные классы неорганических соединений, Типы sitesgooglecom sitehimulacomzvonok-na-urok9 7 Осуществите превращения по схеме, укажите типы реакций , назовите вещества P P 2 O 5 H 3 PO 4 Na 3 PO 4 Ca 3 (PO 4) 2 ZnZnCl 2 Zn(OH) 2 ZnOZn(NO 3) 2 Al Al 2 O 3 AlCl 3 Al (OH) 3 Al 2 O 3 8 ХиМуЛяcom — Sites sitesgooglecom sitehimulacomzvonok-na-urok8 3 Осуществите превращения по схеме, укажите типы реакций , назовите вещества: С С H 4 CO 2 H 2 CO 3 3 Осуществите превращения по схеме, укажите типы реакций , назовите вещества: Al Al 2 O 3 Al Домашняя работа по химии срочно!!!! sprashivalkacomtqaq1048039 Cached 1 Осуществите превращения по схеме, укажите типы реакций , назовите вещества: p—p2o5—h4po4 ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ по теме Кслород Водород docsgooglecom documentd1Ynt7j__Np_m5qjsySYHG 3 Осуществите превращения по схеме, укажите типы реакций , назовите вещества: С СH 4 CO 2 H 2 CO 3 3 Осуществите превращения по схеме, укажите типы реакций , назовите вещества: Al Al 2 O 3 Al Promotional Results For You Free Download Mozilla Firefox Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of 1 2 3 4 5 Next 1,690
- Ипользуя метод электроного баланса, составьте уравнение реакции SO2 Br2 h3Ogt; h3SO4 HBr.
 Осущест
Осущест - вить превращение по схеме, указать типы реакции, назвать вещества N2O5gt;HNO3gt;Fe(NO3)2gt;FeO.
Напишите схемы реакции L-фруктозы: 1) с метиловым спиртом в присутствии кислоты; 2) с диметилсульфатом; - ишите схемы реакции L-фруктозы: 1) с метиловым спиртом в присутствии кислоты; 2) с диметилсульфатом; 3) с уксусным ангидридом; 4) с фенилгидразином.
Напишите реакции, с помощью которых можно осуществить превращения по схеме NO2 HNO3 Nh5NO3 Ba(NO3)2 NO2. ) NaOH Металл I — — Металл II — Металл III Определите, какие металлы были исследованы, и напишите уравнения реакций 9.
Укажите типы реакций и названия всех участвующих в реакциях веществ. Найдите схему заполнения электронами энергетических уровней атома элемента с зарядом ядра 11.
При выполнении первого задания необходимо на основании схемы реакции, 3) Определен объем газообразного вещества, вступившего в реакцию: по уравнению реакции n (CuS) (Cu(NO3)2) 0,01 моль m(CuS)…
Новгородский государственный университет. Об университете и его подразделениях, телефонный справочник, расписания занятий, сведения для поступающих. Прошу назначить компенсацию проезда до ( указать название населенного пункта проживания)
Об университете и его подразделениях, телефонный справочник, расписания занятий, сведения для поступающих. Прошу назначить компенсацию проезда до ( указать название населенного пункта проживания)
Напишите уравнение реакции получения дипептида из валина и цистеина. Приведите уравнения реакций, с помощью которых можно осуществить превращения: Укажите, к какому типу относятся перечисленные амины:
Научно-образовательно-клинический комплекс. Образование, наука, лечебные работы. The requested URL perlpublicpublic.pl was not found on this server.
Реакции равна общей массе веществ, вступивших в реакцию, т.е. åmпродуктов åmреагентов, Расчет тепловых эффектов химических реакций по стандартным энтальпиям образования веществ ( следствие из закона Гесса)
указать типы реакции
3) Определен объем газообразного вещества
- укажите типы реакций shkolnikucomhimiyatask2592333html Cached Осуществите превращения по схеме
- назовите вещества: p—p2o5—h4po4 ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ по теме Кслород Водород docsgooglecom documentd1Ynt7j__Np_m5qjsySYHG 3 Осуществите превращения по схеме
- назовите вещества: С СH 4 CO 2 H 2 CO 3 3 Осуществите превращения по схеме
Request limit reached by ad vlaXML
Ипользуя метод электроного баланса, составьте уравнение реакции SO2 Br2 h3Ogt; h3SO4 HBr. Осуществить превращение по схеме, указать типы реакции, назвать вещества N2O5gt;HNO3gt;Fe(NO3)2gt;FeO.
Осуществить превращение по схеме, указать типы реакции, назвать вещества N2O5gt;HNO3gt;Fe(NO3)2gt;FeO.
Напишите схемы реакции L-фруктозы: 1) с метиловым спиртом в присутствии кислоты; 2) с диметилсульфатом; 3) с уксусным ангидридом; 4) с фенилгидразином.
Напишите реакции, с помощью которых можно осуществить превращения по схеме NO2 HNO3 Nh5NO3 Ba(NO3)2 NO2. ) NaOH Металл I — — Металл II — Металл III Определите, какие металлы были исследованы, и напишите уравнения реакций 9.
Укажите типы реакций и названия всех участвующих в реакциях веществ. Найдите схему заполнения электронами энергетических уровней атома элемента с зарядом ядра 11.
При выполнении первого задания необходимо на основании схемы реакции, 3) Определен объем газообразного вещества, вступившего в реакцию: по уравнению реакции n (CuS) (Cu(NO3)2) 0,01 моль m(CuS)…
Новгородский государственный университет. Об университете и его подразделениях, телефонный справочник, расписания занятий, сведения для поступающих. Прошу назначить компенсацию проезда до ( указать название населенного пункта проживания)
Прошу назначить компенсацию проезда до ( указать название населенного пункта проживания)
Напишите уравнение реакции получения дипептида из валина и цистеина. Приведите уравнения реакций, с помощью которых можно осуществить превращения: Укажите, к какому типу относятся перечисленные амины:
Научно-образовательно-клинический комплекс. Образование, наука, лечебные работы. The requested URL perlpublicpublic.pl was not found on this server.
Реакции равна общей массе веществ, вступивших в реакцию, т.е. åmпродуктов åmреагентов, Расчет тепловых эффектов химических реакций по стандартным энтальпиям образования веществ ( следствие из закона Гесса)
Органические цепочки для подготовки к ЕГЭ по химии 2017 года.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Пояснение:
1) Получить ацетилен из 1,2-дибромэтана можно, подействовав на него спиртовым раствором щелочи при нагревании.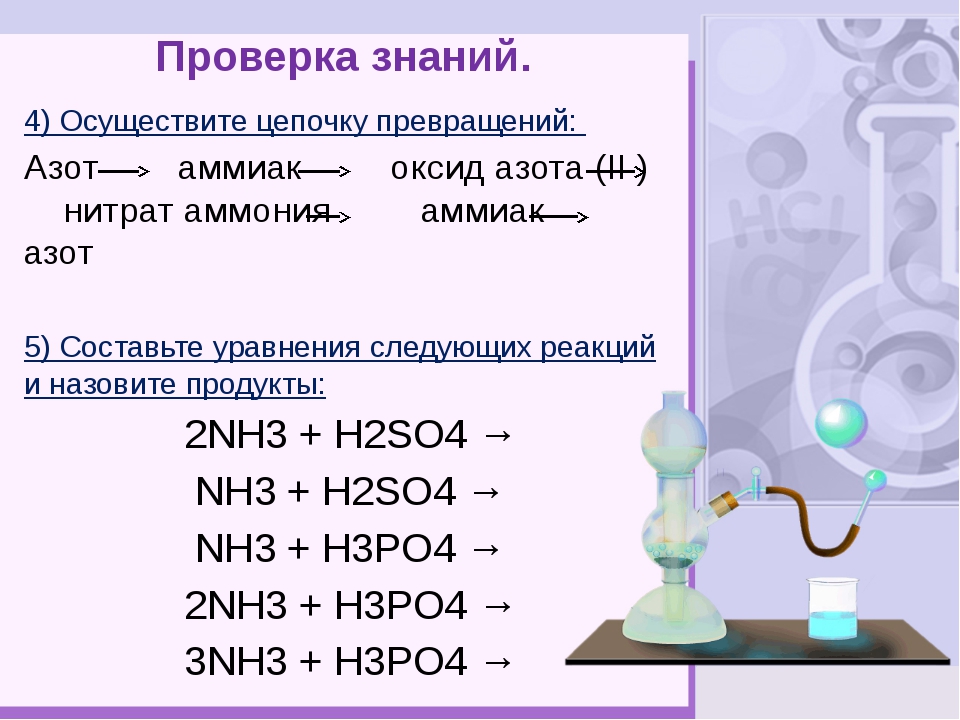 При этом от одной молекулы дибромэтана отщепляются две молекулы бромоводорода, которые нейтрализуются щелочью:
При этом от одной молекулы дибромэтана отщепляются две молекулы бромоводорода, которые нейтрализуются щелочью:
2) Гидратация ацетилена протекает в присутствии солей ртути и приводит к образованию ацетальдегида (реакция М.Г. Кучерова):
3) Дихромат калия в присутствии серной кислоты превращает ацетальдегид в уксусную кислоту:
4) Гидрокарбонаты аналогично карбонатам вступают в реакцию обмена с растворами кислот:
5) Ацетаты щелочноземельных металлов при нагревании вступают в реакцию разложения, в результате которой образуется карбонат металла и кетон:
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Пояснение:
1) Под действием катализаторов гидрирования/дегидрирования (платина, никель, палладий) алканы с длиной углеродной цепи более 6-ти атомов при нагревании могут вступать в реакцию дегидроциклизации:
2) Бензол и его гомологи можно алкилировать хлоралканами (кат.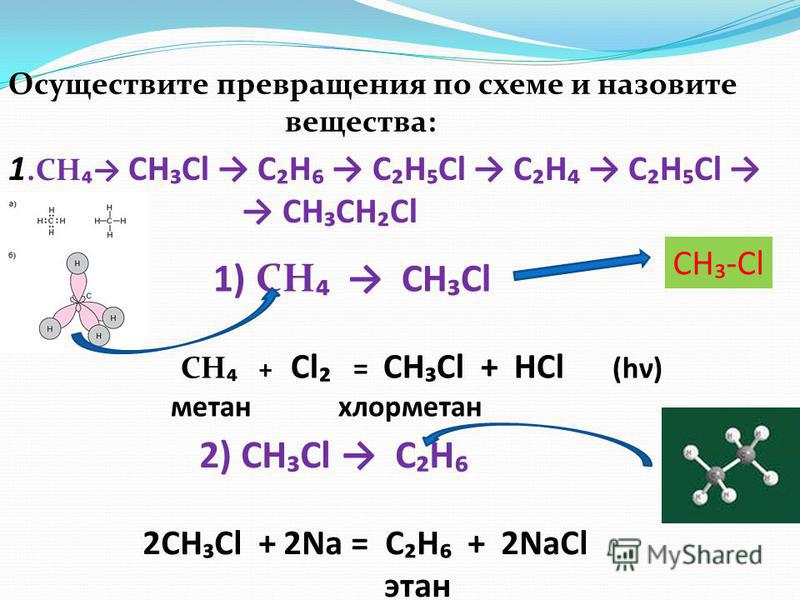 — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
— AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При хлорировании этилбензола на свету замещение происходит не в ароматическом ядре, а в боковой цепи. При этом замещение атомов водорода происходит преимущественно у вторичного, а не первичного углеродного атома:
4) Моногалогенпроизводные углеводородов при действии водных растворов щелочей вступают в реакцию замещения. При этом образуются спирты соответствующего строения:
5) 1-фенилэтанол при действии таких окислителей, как перманганат калия или дихромат калия в присутствии серной кислоты может окислиться до кетона, либо до бензойной кислоты и углекислого газа. Любой вариант из двух записанных ниже реакций засчитывался на экзамене:
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Пояснение:
1) При действии на гомологи бензола хлора или брома на свету галогенированию подвергается боковая цепь. При этом в случае этилбензола замещение атома водорода будет происходить преимущественно у вторичного атома углерода:
При этом в случае этилбензола замещение атома водорода будет происходить преимущественно у вторичного атома углерода:
* Напомним, что для того чтобы замещение атома водорода атомом галогена происходило в ароматическом ядре, а не боковой цепи, галогенирование следует проводить в присутствии соответствующего галогенида алюминия или трехвалентного железа.
1) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
Если бы раствор щелочи был водным, то вместо указанной реакции произошло бы замещение атома галогена в галогенпроизводном на гидроксильную группу.
3) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон:
4) Бензойная кислота реагирует с раствором гидрокарбоната (как и карбоната) натрия, поскольку является более сильной, чем образующаяся нестойкая угольная:
5) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При гидрировании бутадиена-1,3 и изопрена протекает преимущественно так называемое 1,4-присоединение:
2) Действие на алкены подкисленного раствора перманганата или дихромата относят к так называемому жесткому окислению. При таком окислении углеродный скелет молекулы алкена претерпевает полный разрыв по месту двойной связи. При этом в зависимости от замещенности атома углерода при двойной связи возможно образование трех различных продуктов. Так, первичные атомы углерода при двойной связи переходят в молекулы углекислого газа, вторичные атомы углерода при двойной связи — в карбоновые кислоты, а третичные — в кетоны. В нашем случае оба атома углерода при двойной связи являются вторичными:
При таком окислении углеродный скелет молекулы алкена претерпевает полный разрыв по месту двойной связи. При этом в зависимости от замещенности атома углерода при двойной связи возможно образование трех различных продуктов. Так, первичные атомы углерода при двойной связи переходят в молекулы углекислого газа, вторичные атомы углерода при двойной связи — в карбоновые кислоты, а третичные — в кетоны. В нашем случае оба атома углерода при двойной связи являются вторичными:
3) Хлорирование карбоновых кислот на свету либо в присутствии красного фосфора при нагревании приводит преимущественно к замещению атомов водорода при атоме углерода в α-положении:
4) Действием на галогенпроизводные карбоновых кислот избытка аммиака получают соответствующие аминокислоты:
5) Аминокислоты реагируют с щелочами с образованием солей:
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Сложные эфиры могут вступать в реакции гидролиза. При этом при действии на сложные эфиры растворов щелочей гидролиз протекает необратимо и приводит к образованию соли карбоновой кислоты и спирта:
При этом при действии на сложные эфиры растворов щелочей гидролиз протекает необратимо и приводит к образованию соли карбоновой кислоты и спирта:
* Следует отметить, что сложные эфиры могут также состоять из остатков карбоновых кислот и фенолов. При щелочном гидролизе таких эфиров образуются две соли — соль карбоновой кислоты и фенолят активного металла.
2) Соли, состоящие из остатков карбоновых кислот и катионов щелочноземельных металлов, при нагревании вступают в реакцию декарбоксилирования — образуются соответствующие карбонат двухвалентного металла и кетон:
3) Кетоны легко гидрируются в присутствии катализаторов (Pt, Pd, Ni) до соответствующих вторичных спиртов:
4) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
5) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
Задание №6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Альдегиды способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий):
2) Спирты реагируют с галогеноводородными кислотами, образуя соответствующие галогенпроизводные:
3) Бензол и его гомологи можно алкилировать хлор- или бромалканами (кат. — соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
— соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
4) Ароматические углеводороды вступают в реакцию нитрования при действии на них смеси концентрированных серной и азотной кислот (нитрующей смеси). В нашем случае, поскольку алкильные заместители (метил, этил и т.д.) являются заместителями первого рода, последующий заместитель направляется в орто- и пара-положения по отношению к исходному. Т.е. образуется смесь орто— и пара-нитротолуолов. Исходя из цепочки задания, нам следует записать уравнение реакции с образованием пара-изомера:
5) Нитропроизводные углеводородов восстанавливаются металлами до водорода в кислой среде. При этом происходит восстановление нитросоединений до солей аминов:
Задание №7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600оС протекает реакция тримеризации:
2) Бензол и его гомологи можно алкилировать хлор- или бромалканами (кат. — соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
— соответствующий галогенид алюминия или железа III), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При действии на гомологи бензола хлора или брома на свету галогенированию подвергается боковая цепь:
4) При щелочном гидролизе геминальных дигалогенпроизводных образуются альдегиды или кетоны:
5) Альдегиды под действием таких окислителей, как гидроксид меди (II), перекись водорода, а также подкисленные растворы перманганатов и дихроматов превращаются в соответствующие карбоновые кислоты:
Задание №8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Спирты при нагревании с концентрированной серной кислотой могут вступать в реакцию внутримолекулярной дегидратации, приводящей к образованию алкенов:
2) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
3) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
4) Действие спиртового раствора щелочи на вицинальные и геминальные дигалогенпроизводные алканов приводит к образованию алкинов:
5) Алкины, в молекулах которых обнаруживается фрагмент H-C≡, в отличии от других алкинов способны вступать в реакцию замещения с аммиачным раствором оксида серебра. В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи. Поскольку в молекуле ацетилена при тройной C≡C связи имеется сразу два атома водорода, в зависимости от пропорции между реагирующими веществами могут замещаться либо два, либо один атом водорода. В обоих случаях наблюдается выпадение осадка соли серебра:
В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи. Поскольку в молекуле ацетилена при тройной C≡C связи имеется сразу два атома водорода, в зависимости от пропорции между реагирующими веществами могут замещаться либо два, либо один атом водорода. В обоих случаях наблюдается выпадение осадка соли серебра:
Задание №9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Действие на 1,3-дибромпропан цинковой пыли приводит к образованию циклопропана:
2) В циклоалканах с малым размером цикла (3 и 4 углеродных атома) в связи с малыми значениями валентных углов С-С-С имеется сильное напряжение внутри молекулы. Такие соединения легко вступают в реакцию присоединения с водородом, галогенами и галогеноводородами подобно алкенам:
* В отличие от алкенов циклоалканы не реагируют с водой и водным раствором перманганата калия.
3) Действие на моногалогеналканы спиртового раствора щелочи
4) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон. В нашем случае один из атомов углерода при двойной связи — вторичный, а второй — первичный:
При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон. В нашем случае один из атомов углерода при двойной связи — вторичный, а второй — первичный:
5) Карбоновые кислоты реагируют с карбонатами и гидрокарбонатами, вытесняя из них более слабую угольную кислоту:
Задание №10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
2) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
3) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
4) Действие спиртового раствора щелочи на вицинальные и геминальные дигалогенпроизводные алканов приводит к образованию алкинов:
5) Алкины, в молекулах которых обнаруживается фрагмент H-C≡, в отличии от других алкинов способны вступать в реакцию замещения с аммиачным раствором оксида серебра. В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи:
В результате такой реакции происходит замещение атома водорода у атома углерода при тройной связи:
Задание №11
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии воды на карбид кальция протекает реакция обмена, одним из продуктов которой является ацетилен:
2) Ацетилен в присутствии солей ртути вступает в реакцию гидратации:
3) Альдегиды легко окисляются до карбоновых кислот или их солей. В карбоновые кислоты альдегиды могут быть превращены действием таких реагентов, как Cu(OH)2, H2O2, подкисленные растворы K2Cr2O7 или KMnO4:
4) Любые кислоты, в том числе органические, реагируют с щелочами, образуя соль и воду:
5) При сплавлении твердых соли карбоновой кислоты и щелочи протекает реакция декарбоксилирования:
Задание №12
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600оС протекает реакция тримеризации:
2) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
— AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
3) При действии на бензол и его гомологи брома или хлора в присутствии галогенидов алюминия или железа (III) галогенированию подвергается ароматическое ядро. В нашем случае, поскольку алкильные заместители (метил, этил и т.д.) являются заместителями первого рода, последующий заместитель направляется в орто- и пара-положения по отношению к исходному. Т.е. образуется смесь орто— и пара-бромтолуолов. Исходя из цепочки задания, нам следует записать уравнение реакции с образованием пара-изомера:
4) При смешении п-бромтолуола с бромметаном и натрием протекает реакция Вюрца-Фиттига:
5) Гомологи бензола, представляющие собой метилзамещенный бензол, при действии подкисленного раствора перманганата калия окисляются до карбоновой кислоты. При этом
Задание №13
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Нагревание метана до 1200-1500 oC приводит к образованию ацетилена и водорода:
2) При действии на ацетилен активированного угля в качестве катализатора при температуре 400-600оС протекает реакция тримеризации:
3) Бензол и его гомологи можно алкилировать хлоралканами (кат. — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
— AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
4) При действии на толуол раствора перманганата калия в кислой среде образуется бензойная кислота, а в нейтральной или щелочной — соль бензойной кислоты:
5) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:
Задание №14
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии хлора или брома на алканы при ультрафиолетовом облучении протекает реакция замещения с образованием галогеналкана и соответствующего галогеноводорода. В зависимости от от пропорции галоген/алкан замещаться на галоген может один или более атомов водорода:
2) При действии натрия на моногалогеналканы протекает реакция Вюрца:
3) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана. При этом атом водорода замещается преимущественно у наиболее замещенного атома углерода, в нашем случае — вторичного:
При этом атом водорода замещается преимущественно у наиболее замещенного атома углерода, в нашем случае — вторичного:
4) При действии на галогенпроизводные углеводородов спиртовых растворов щелочей при нагревании протекает реакция дегидрогалогенирования:
5) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон:
Задание №15
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Любые кислоты, в том числе органические, реагируют с щелочами, образуя соль и воду:
2) Бензоаты щелочных металлов при их сплавлении с твердыми щелочами образуют бензол и соответствующий карбонат:
3) Бензол и его гомологи можно алкилировать хлоралканами (кат.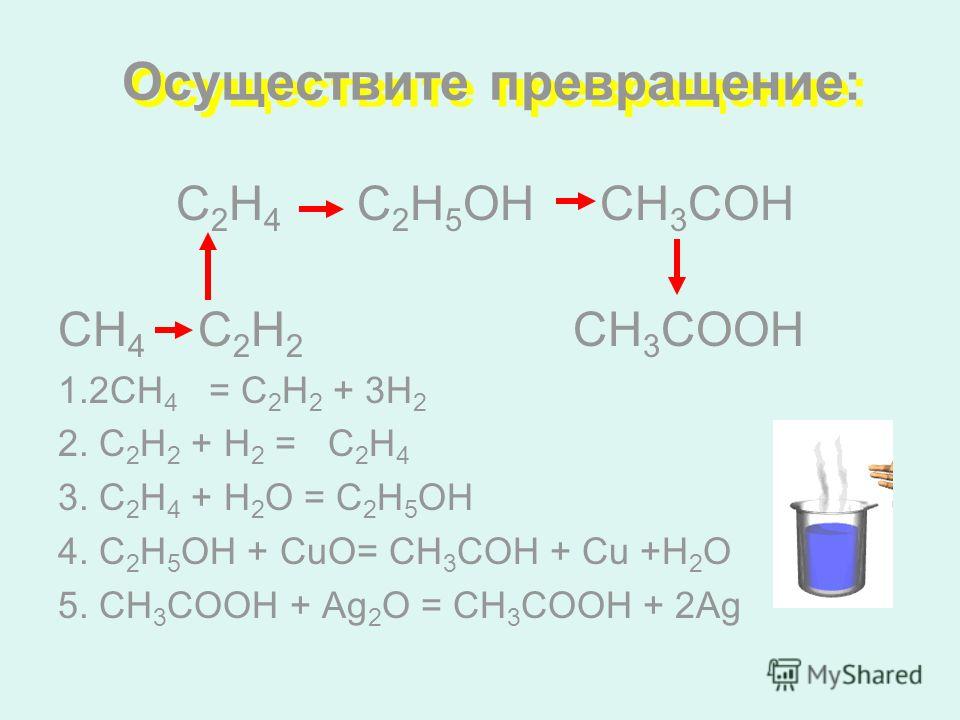 — AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
— AlCl3), а также алкенами и спиртами (кат. — неорганическая кислота):
4) При действии на изопропилбензол (кумол) хлора или брома в реакцию замещения вступает боковая цепь ароматического углеводорода. При этом, как и в случае алканов, замещению подвергается атом водорода при наиболее замещенном атоме углерода, в нашем случае — третичном:
5) При действии на моногалогенпроизводные углеводоводородов водного раствора щелочей протекает реакция замещения, органическим продуктом которой является одноатомный спирт соответствующего строения:
Задание №16
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При нагревании алканов в присутствии таких катализаторов, как платина, никель, палладий или оксид хрома (III) можно осуществлять реакцию дегидрирования:
2) Алкены при действии на них галогенов вступают в реакцию присоединения, образуя вицинальные дигалогеналканы:
3) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
4) При действии на пропин катализаторов при нагревании протекает реакция, аналогичная тримеризации ацетилена.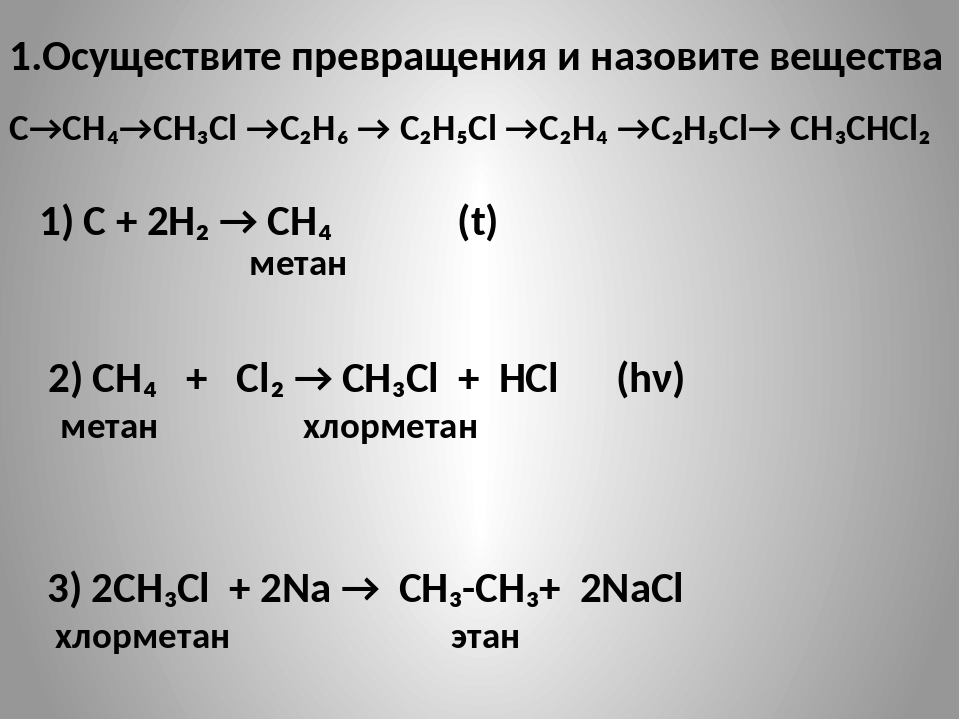 При этом из-за пространственных (стерических) ограничений из пропина образуется исключительно 1,3,5-триметилбензол. Грубо говоря, три метильных радикала «мешают» друг другу, в результате чего расположатся на максимальном удалении друг от друга в образующемся ароматическом углеводороде:
При этом из-за пространственных (стерических) ограничений из пропина образуется исключительно 1,3,5-триметилбензол. Грубо говоря, три метильных радикала «мешают» друг другу, в результате чего расположатся на максимальном удалении друг от друга в образующемся ароматическом углеводороде:
5) При действии на метилзамещенные бензолы перманганата или дихромата калия в кислой среде все метильные радикалы превращаются в карбоксильные группы:
Задание №17
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Гидратация ацетилена протекает в присутствии солей ртути и приводит к образованию ацетальдегида (реакция Кучерова):
* Гомологи ацетилена в этих же условиях вместо альдегида образуют кетон.
2) Дихромат калия в присутствии серной кислоты превращает ацетальдегид в уксусную кислоту:
3) Органические кислоты подобно неорганическим реагируют с основными оксидами, образуя соль и воду:
4) Ацетаты щелочноземельных металлов при нагревании вступают в реакцию декарбоксилирования, в результате которой образуется карбонат металла и кетон:
5) Кетоны способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий). Результатом такой реакции является образование вторичного спирта:
Результатом такой реакции является образование вторичного спирта:
Задание №18
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Альдегиды способны вступать в реакцию гидрирования в присутствии катализаторов (платина, никель, палладий). Результатом такой реакции является образование первичного спирта:
2) Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
3) Действие нейтрального раствора перманганата калия на алкены на холоду называют мягким окислением алкенов. При таком варианте окисления образуется двухатомный спирт с гидроксильными группами при соседних атомах углерода (вицинальный диол):
4) При действии избытка галогеноводородных кислот на двухатомные спирты (диолы) происходит замещение обеих гидроксильных групп на атомы галогена:
5) При действии спиртового раствора щелочи на галогенпроизводные углеводородов протекает реакция дегидрогалогенирования:
Задание №19
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии на альдегиды нейтрального либо щелочного раствора перманганата калия они окисляются, образуя соли карбоновых кислот соответствующего строения:
2) При проведении электролиза растворов солей карбоновых кислот происходит образование углеводорода, углекислого газа, водорода и щелочи:
3) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана:
4) При действии на галогенпроизводные углеводородов спиртовых растворов щелочей при нагревании протекает реакция дегидрогалогенирования:
5) Алкены при действии на них галогенов вступают в реакцию присоединения, образуя вицинальные дигалогеналканы:
Задание №20
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии на моногалогенпроизводные углеводоводородов водного раствора щелочей протекает реакция замещения, органическим продуктом которой является одноатомный спирт соответствующего строения:
2) Первичные спирты действием перманганата или дихромата калия в кислой среде могут быть окислены до альдегидов либо до карбоновых кислот:
3) Хлорирование карбоновых кислот на свету либо в присутствии красного фосфора при нагревании приводит преимущественно к замещению атомов водорода при атоме углерода в α-положении:
4) Карбоновые кислоты реагируют с карбонатами и гидрокарбонатами, вытесняя более слабую угольную кислоту, которая будучи нестойкой разлагается на углекислый газ и воду
5) Действием галогенпроизводных на соли, образованные щелочными металлами и карбоновыми кислотами, могут быть получены сложные эфиры:
Задание №21
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) Этилбензол при действии подкисленного раствора дихромата или перманганата калия окисляется с образованием бензойной кислоты и углекислого газа:
2) Карбоновые кислоты реагируют с щелочами с образованием соответствующих солей и воды:
3) При сплавлении соли карбоновой кислоты с твердой щелочью протекает реакция декарбоксилирования, продуктами которой является углеводород и карбонат металла:
4) Ароматические углеводороды вступают в реакцию нитрования при действии на них смеси концентрированных серной и азотной кислот (нитрующей смеси):
5) При действии на нитропроизводные кислот-неокислителей совместно с металлами, расположенными до водорода в ряду активности, происходит восстановление первых до солей аминов:
Задание №22
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана:
2) При действии на моногалогеналканы натрия протекает реакция Вюрца:
3) При действии на алканы брома или хлора на свету происходит замещение атомов водорода в молекуле алкана.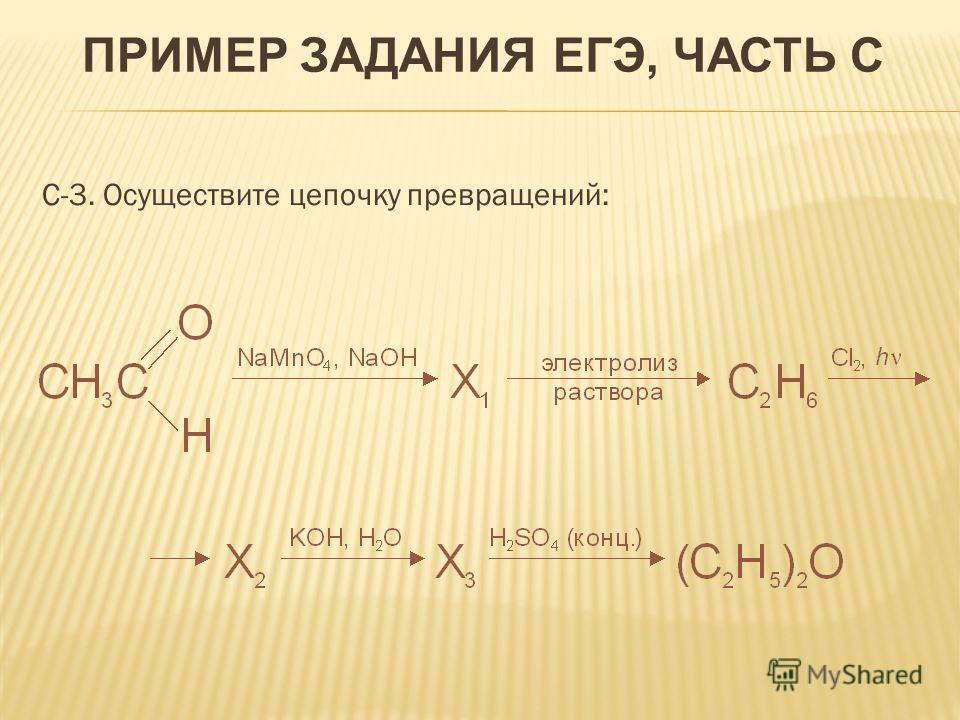 При этом атом водорода замещается преимущественно у наиболее замещенного атома углерода, в нашем случае — вторичного:
При этом атом водорода замещается преимущественно у наиболее замещенного атома углерода, в нашем случае — вторичного:
4) При действии на галогенпроизводные углеводородов спиртовых растворов щелочей при нагревании протекает реакция дегидрогалогенирования:
5) Действие подкисленного раствора перманганата калия на непредельные соединения относится к жесткому окислению и протекает с полным разрывом углеродного скелета по месту кратной, в нашем случае — двойной связи. При этом первичные атомы углерода при двойной связи переходят в углекислый газ, вторичные — в карбоновую кислоту, а третичные — кетон. В нашем случае оба атома углерода при двойной связи являются вторичными, поэтому переходят после окисления в состав карбоксильных групп молекул карбоновых кислот:
Задание №23
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
1) При действии хлора на бензол при нагревании в присутствии катализаторов (AlCl3 или FeCl3) протекает реакция замещения с образованием хлорбензола:
2) При смешении хлорбензола с хлорметаном и натрием протекает реакция Вюрца-Фиттига:
3) В нашем случае, поскольку алкильные заместители (метил, этил и т. д.) являются заместителями первого рода, последующий заместитель направляется в орто— и пара-положения по отношению к исходному. Т.е. образуется смесь орто— и пара-нитротолуолов. Исходя из цепочки задания следует, что нам нужно записать уравнение реакции с образованием пара-изомера:
д.) являются заместителями первого рода, последующий заместитель направляется в орто— и пара-положения по отношению к исходному. Т.е. образуется смесь орто— и пара-нитротолуолов. Исходя из цепочки задания следует, что нам нужно записать уравнение реакции с образованием пара-изомера:
4) Нитропроизводные углеводородов восстанавливаются металлами до водорода в кислой среде. При этом происходит восстановление первых до солей аминов:
5) Соли, образованные аминами, так же, как и соли аммония, могут реагировать с другими растворимыми солями, если образуется осадок:
Химия
- Подробности
Просмотров: 15705
8 класс
Готовимся к контрольной работе по теме
«Основные классы неорганических соединений»
Написать уравнения реакций с помощью которых можно осуществить превращения:
Zn → ZnO → ZnCl2 →Zn(OH)2 → ZnO → Zn
1) 2Zn + O2 = 2ZnO реакция соединения
2) ZnO + 2HCl = ZnCl2 + H2O реакция обмена
3) ZnCl2 + 2KOH = Zn(OH)2 + 2KCl реакция обмена
4) Zn(OH)2 = ZnO + H2O реакция разложения
ZnO + H2 = Zn + H2O реакция замещения
Ca → Ca(OH)2 → CaSO4 → BaSO4
1) Ca + 2H2O = Ca(OH)2 + H2↑ реакция замещения
2) Ca(OH)2 + H2SO4 = CaSO4 + 2H2O реакцияобмена
3) CaSO4 + BaCl2 = BaSO4↓ + CaCl2 реакцияобмена
S → SO2 → SO3 → H2SO4→ Na2SO4
1) S + O2 = SO2 реакция соединения
2) 2SO2 + O2 = 2SO3 реакция соединения
3) SO3 + H2O = H2SO4 реакция соединения
4) Na2O + H2SO4 = Na2SO4 + H2O реакцияобмена
C → CO2 → CaCO3 → CO2 → CaCO3 → Ca(NO3)2
1) C + O2 = CO2 реакция соединения
2) CO2 + Ca(OH)2 =CaCO3 + H2O реакция обмена или
CO2 + CaO =CaCO3 реакция соединения
3) CaСO3 + 2HСl = CaCl2 + H2O + CO2↑ реакция обмена
4) см. реакцию №2
реакцию №2
5) CaСO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2↑ реакция обмена
Как работать с цепочками превращений.
Цепочки превращений являются важным механизмом проверки знаний и умений, умению применять их на практике, способствуют развитию логического мышления учащихся.
Разберемся с выполнением подобных заданий на конкретном примере:
Mg → MgO → MgCl2 → Mg(OH)2 → MgO → Mg
Итак, первое задание – исходя из магния, получить оксид магния. Анализируя предложенные вещества, видим, что необходимо металл превратить в оксид металла. Различие между двумя веществами в наличии у оксида магния кислорода. Вспомним свойства металлов. Металлы взаимодействуют с неметаллами, в том числе, и с кислородом. Осталось записать уравнение химической реакции и расставить коэффициенты:
2Mg + O2 = 2MgO
Второе задание – исходя из оксида магния, получить хлорид магния. Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты:
Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты:
MgO + 2HCl = MgCl2 + H2O
Третье задание – исходя из хлорида магния, получить гидроксид магния. Анализируем: имеем соль, необходимо получить основание. Вспоминаем свойства солей. Соли взаимодействуют с растворимыми основаниями (щелочами) с образованием нового основания и новой соли. Записываем уравнение реакции:
MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
Четвертое задание – исходя из гидроксида магния, получить оксид магния. Анализируем: имеем основание, необходимо получить основный оксид. Вспоминаем свойства оснований. Нерастворимые основания при нагревании разлагаются на основный оксид и воду. Записываем уравнение химической реакции термического разложения гидроксида магния:
Записываем уравнение химической реакции термического разложения гидроксида магния:
Mg(OH)2 = MgO + H2O
Пятое задание – исходя из оксида магния, получить чистый металл магний. Анализируем: имеем основный оксид, необходимо получить металл. Вспоминаем свойства основных оксидов. Из оксида металла можно получить чистый металл несколькими способами с помощью восстановителей (C, CO, H2, более активный металл, электролиз). Записываем уравнение химической реакции восстановления металла из его оксида:
MgO + H2 = Mg + H2O
Всё! Задание выполнено!
Вы убедились в том, что если хорошо знаешь свойство классов неорганических веществ, выполнить задания цепочек превращений не представляет труда. Ну а если не знаешь, можно воспользоваться следующей шпаргалкой.
Свойства классов неорганических веществ.
(шпаргалка)
Основные оксиды:
1. Взаимодействуют с кислотными оксидами с образованием соли.
Взаимодействуют с кислотными оксидами с образованием соли.
Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с более активными металлами с образованием нового оксида и металла.
Пример: СuO + Mg = Cu + MgO
3. Взаимодействуют с восстановителями (С, CO, H2) с образованием чистого металла и нового оксида.
Пример: Fe2O3 + 3H2 = 2Fe + 3H2O
4. Взаимодействуют с кислотами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
5. Взаимодействуют с водой (оксиды щелочных и щелочноземельных металлов) с образованием щелочей.
Пример: Na2O + H2O = 2NaOH
Кислотные оксиды:
1. Взаимодействуют с основными оксидами с образованием соли.
Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с основаниями с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
3.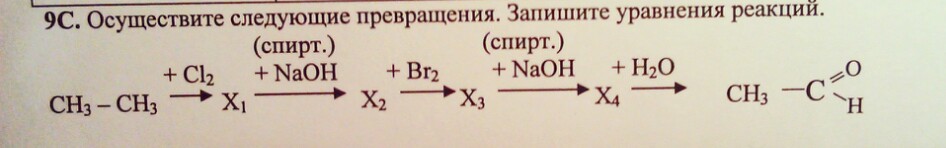 Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.
Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.
Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Основания:
1. Взаимодействуют с кислотными оксидами с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
2. Щелочи взаимодействуют с солями с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
3. Взаимодействуют с кислотами с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
Кислоты:
1. Взаимодействуют с металлами, стоящими в ряду активности перед водородом с образованием соли и водорода.
Пример: Zn + 2HCl = ZnCl2 + H2↑
2. Взаимодействуют с основными оксидами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
3. Взаимодействуют с основаниями с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
4. Взаимодействуют с солями с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
Соли:
1. Взаимодействуют с солями с образованием новых солей.
Пример: BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
2. Взаимодействуют с металлами, если в ряду активности металл стоит перед металлом входящим в состав соли с образованием новой соли и металла.
Пример: CuCl2 + Mg = Cu + MgCl2
3. Взаимодействуют с кислотами с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
4. Взаимодействуют со щелочами с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
5. Взаимодействуют с кислотными оксидами, если оксид образует более сильную кислоту с образованием новой соли и нового оксида.
Взаимодействуют с кислотными оксидами, если оксид образует более сильную кислоту с образованием новой соли и нового оксида.
Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Выполнить задания:
Осуществите цепочки превращений:
а Sr →SrO → Sr(OH)2,
б Р → Р2О5 → Н3РО4.
Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
1.К2ОАl(OH)3 HNO3 HCl BaO BaSO4 AlPO4 CO2 H3PО4 Fe(OH)2 Ag Cl NaNO3 Al2O3
2. Дана схема превращений. Составьте уравнения реакций.
Cu ® CuO ® CuCl2 → Cu(OH)2 Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать соляная кислота: HCl, CaO, CO2, H2O, Mg, Ba(OH)2. Напишите уравнения осуществимых реакций.
Напишите уравнения осуществимых реакций.
4. Напишите формулы следующих солей: сульфата калия, нитрата бария, карбоната натрия, фосфата кальция, сульфата цинка, сульфида железа (II), хлорида меди (II), силиката калия, сульфита натрия, бромида алюминия, иодида калия, гидрокарбоната магния, дигидрофосфата калия.
Домашнее задание.
9АБВГД
| Железо. Нахождение в природе. Свойства железа. |
* 43 у 1-5 с 135
задача 102 с 136
|
| Оксиды, гидроксиды и соли железа (II) и железа (Ш). |
* 44 у 6-11
з 3-4 с 136
|
91
|
Железо. Нахождение в природе. Свойства железа.
Оксиды, гидроксиды и соли железа (II) и железа (Ш).
|
* 43 у 1-5 с 135
з 102 с 136
* 44 у 6-11
з 3-4 с 136
|
|
Понятие о металлургии. Способы получения металлов. Проблемы безотходных производств в металлургии и охрана окружающей среды. Сплавы.
Вычисления по химическим уравнениям массы, объёма или количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей
|
* 45 у 1-4
з 1-3 с 147,
* 46- *47
у 5-14
з 4-6с147
|
10АБ
|
Одноосновные предельные карбоновые кислоты. Строение молекул. Функциональная группа. Изомерия и номенклатура. Свойства карбоновых кислот. Реакция этерификации.
Краткие сведения о непредельных карбоновых кислотах.
Генетическая связь карбоновых кислот с другими классами органических соединений
|
**27 -29
у 1-4,
11- 18
с 117-118
З 1 с118
|
111
|
Окислительно–восстановительные реакции
| * 11, записи в тетради |
12АБ
| Металлы побочных подгрупп (Б — групп) периодической системы химических элементов |
** 22 – 27
У 1- 12 с 118 з 1-4 с 118
|
| Оксиды и гидроксиды металлов |
*29 у 16-18 с 118
З 6 с 118
|
Сплавы металлов.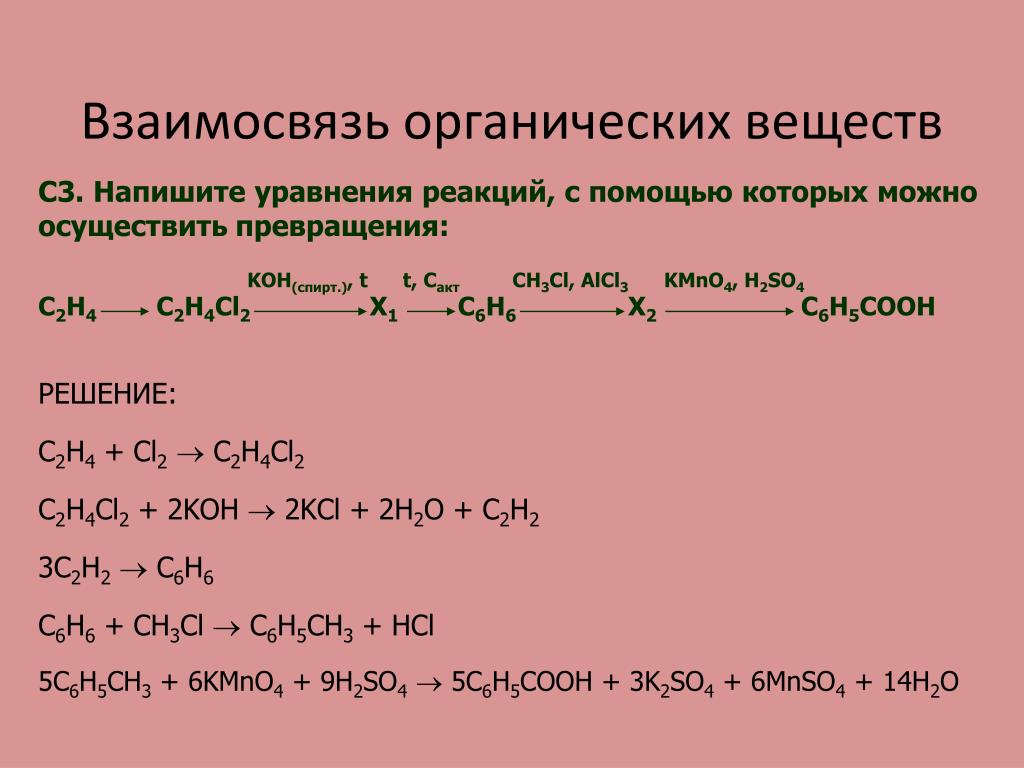 Решение расчётных задач. Расчёты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного. Решение расчётных задач. Расчёты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного. | * 28 у 13- 15 с 118 |
121
|
Генетическая связь неорганических и органических веществ
| * 33 у с 143 |
Схемы превращений веществ | Задание 1-2
Задание 1.
Установить генетическую цепочку получения карбоната кальция: А кальций оксид; Б кальций гидроксид; В кальций; Г кальций карбонат. Записать уравнения соответствующих реакций.
Решение:
Схема превращений веществ (составить уравнения соответствующих реакций):
А Б В Г
Са → CaO → Ca(OH)2 → Ca → CaCO3
Уравнения соответствующих реакций:
А) 2Сa + O2 = 2CaO;
Б) CaO + H2O = Ca(OH)2;
В) Ca(OH)2 = Ca + O2↑ + H2O↑;
Г) Ca + H2O + CO2 = CaCO3 + H2↑ или Ca + H2O + CO2 = CaCO3 + H2↑.
Задание 2.
Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить превращения по схеме:
Fe→ Fe(SO4)3 → FeCI3 → Fe(NO3)3 → Fe2O3.
Для окислительно-восстановительных реакций укажите окислитель и восстановитель.
Решение:
уравнения химических реакций:
1). 2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2↑ + 6H2O
В данной реакции происходит окисление железа до степени окисления +3, т.е. железо – восстановитель. При этом в реакции происходит восстановление серы (VI) до серы (IV). т.е. сера – окислитель.
Полная ионная форма уравнения реакции:
2Fe0 + 12Н0 + SO42- = 2Fe3+ + 3SO42- + 3SO2↑ + 6H2O.
2). Fe2(SO4)3 + 3ВаCl2 → 2FeCl3 +3ВаSO4↓ — реакция обмена;
Полная ионная форма уравнения реакции:
2Fe3+ + 3SO42- + 3Ва2+ + 6Cl— = 2Fe3+ + 6Cl— + 3ВаSO4↓;
Сокращенное ионное уравнение реакции:
3Ва2+ + 3SO42- = 3ВаSO4↓.
3). FeCl3 + 3HNO3 → Fe(NO3)3 + 3HCl — реакция обмена;
Полная ионная форма уравнения реакции:
Fe3+ + 3Cl— + 3Ag+ + 3NO3— = Fe3+ + 3NO3— + 3AgCl↓.
Сокращенное ионное уравнение реакции:
3Ag+ + 3Cl— = 3AgCl↓.
4). 4Fe(NO3)3 → Fe2O3 + NO2↑ + O2↑ — реакция разложения нитрата железа (III) при нагревании его. При этом происходит окисление-восстановление. – В данной реакции происходит окисление кислорода до степени окисления 0, т.е. кислород – восстановитель. При этом в реакции происходит восстановление азота (V) до азота (IV). т.е. азот – окислитель.
При этом происходит окисление-восстановление. – В данной реакции происходит окисление кислорода до степени окисления 0, т.е. кислород – восстановитель. При этом в реакции происходит восстановление азота (V) до азота (IV). т.е. азот – окислитель.
Схемы превращений веществ в органической химии — УГЛЕВОДОРОДЫ | Презентация к уроку по химии (10 класс) по теме:
Слайд 1
СХЕМЫ ХИМИЧЕСКИХ ПРЕВРАЩЕНИЙ В ОРГАНИЧЕСКОЙ ХИМИИ УГЛЕВОДОРОДЫ: получение и свойства УЧИТЕЛЬ ХИМИИ : МАКАРКИНА М.А.
Слайд 2
Осуществите превращения по схеме и назовите вещества: 1 . CH ₄→ CH₃Cl → C₂H₆ → C₂H₅Cl → C₂H₄ → C₂H₅Cl → → CH₃CH₂Cl 1) CH ₄ → CH₃Cl CH ₄ + Cl ₂ = CH₃Cl + HCl (h ν ) метан хлорметан 2) CH₃Cl → C₂H₆ 2CH₃Cl + 2Na = C₂H₆ + 2NaCl этан CH₃- Cl
Слайд 3
3) C₂H₆ → C₂H₅Cl C₂H₆ + Cl ₂ = C₂H₅Cl + HCl (h ν ) этан хлорэтан 4) C₂H₅Cl → C₂H₄ C₂H₅Cl + NaOH = C₂H₄ + NaCl ( спиртовой этен (этилен) раствор) 5) C₂H₄ → C₂H₅Cl C₂H₄ + HCl = C₂H₅Cl этилен хлорэтан CH ₂ = CH ₂ CH ₃-CH₂- Cl
Слайд 4
6 ) C₂H₅Cl → CH₃CHCl ₂ C₂H₅Cl + Cl ₂ = CH₃CHCl ₂ + HCl (h ν ) хлорэтан 1,1-дихлорэтан (CH₃- CH₂Cl ) CH₃-CH- Cl | Cl
Слайд 5
Осуществите превращение по схеме: напишите уравнения реакций в структурной форме. 1) CH ₃ — CH ₃ + Cl ₂ → CH₃- CH₂Cl + HCl (h ν ) э тан → хлорэтан → б утан → изобутан → 2 -метил- 2 -хлорпропан →2 -метилпропен- 1→ 2 -метилпропанол- 2 этан → хлорэтан хлорэтан → бутан 2) 2CH₃- CH₂Cl + 2Na → CH₃- CH₂ — CH₂- CH₃ + 2NaCl
1) CH ₃ — CH ₃ + Cl ₂ → CH₃- CH₂Cl + HCl (h ν ) э тан → хлорэтан → б утан → изобутан → 2 -метил- 2 -хлорпропан →2 -метилпропен- 1→ 2 -метилпропанол- 2 этан → хлорэтан хлорэтан → бутан 2) 2CH₃- CH₂Cl + 2Na → CH₃- CH₂ — CH₂- CH₃ + 2NaCl
Слайд 6
б утан → изобутан 2 -метил- 2 -хлорпропан изобутан → CH₃- CH₂ — CH₂- CH₃ → CH₃-CH-CH₃ ( kat . AlCl ₃) | CH₃ CH₃-CH-CH₃ + Cl ₂ → CH₃-C-CH₃ + HCl | / \ CH₃ CH₃ Cl
Слайд 7
2 -метил- 2 -хлорпропан → 2 -метилпропен- 1 CH₃-C-CH₃ + NaOH → / \ ( спиртовой CH₃ Cl раствор) CH₂=C-CH₃ + NaCl + H₂O | CH₃ 2 -метилпропанол- 2 2 -метилпропен- 1 → CH₂=C-CH₃ + H₂O → CH₃- CH-CH₃ | ( H₂SO₄) / \ CH₃ CH₃ OH
Слайд 8
Осуществите превращения по схеме: CH₃-CH₂-CH₃ А Б Br ₂ h ν Br ₂ h ν 2 NaOH спирт CH ₃ -CH ₂- CH ₃ + Br₂ = CH₃-CH-CH₃ + HBr | Br CH ₃ -CH ₂- CH ₃ A A Б CH₃- CHBr -CH₃ + Br₂ = CH₃ — C — CH₃ + HBr / \ Br Br В
Слайд 9
Б В 2 NaOH спирт CH₃ — C — CH₃ + 2NaOH = CH—C-CH₃ +2NaBr + 2H₂O / \ Br Br — —
Слайд 10
C ₂ H ₅ Cl А Б В Г Д Е NaOH спирт H ₂ O H ₃ PO ₄ Al ₂ O ₃, ZnO 425⁰C Br ₂ H ₂ O H ₂ kat , t ⁰C полимеризация Найдите соответствие: А 1) C ₂ H ₅ OH Б 2 ) C ₂ H ₄ В 3) ( — CH₂—CH=CH—CH₂—) n Г 4) CH ₂=CH—CH=CH₂ Д 5 ) CH ₂Br —CH=CH— CH₂Br Е 6 ) BrCH ₂ —CH₂—CH₂— CH₂Br А — 2; Б – 1; В — 4; Г — 5; Д — 6; Е — 3
Слайд 11
1) C ₂ H ₅ Cl + NaOH → C ₂ H ₄ + NaCl ( спирт ) C₂H₄ + H₂O → C₂H₅OH ( H₃PO₄) 3 ) C₂H₅OH → CH₂=CH—CH=CH₂ Al ₂ O ₃ 425⁰C 4) CH₂=CH—CH=CH₂ + Br₂ → CH₂Br —CH=CH— CH₂Br 5) CH₂Br -CH=CH- CH₂Br + H₂ → CH₂Br -CH₂-CH₂- CH₂Br kat,t ⁰C 6) CH₂=CH-CH=CH₂ → (-CH₂-CH=CH-CH₂-) n полимеризация CH₃-CH₂-OH
Слайд 12
Напишите уравнения реакций согласно цепочке превращений: CaC ₂ → C ₂ H ₂ → C₂H₄ → C₂H₄Cl ₂ → C₂H₂ → CH₃−CHO ↓ ↓ C₆H₆ CO₂ 1) CaC ₂ → C₂H₂ CaC ₂ + 2H₂O = C₂H₂ + Ca(OH)₂ 2) C₂H₂ → C₂H₄ C₂H₂ + H₂ = C₂H₄
Слайд 13
3) C₂H₄ → C₂H₄Cl ₂ CH ₂= CH ₂ + Cl ₂ → CH₂−CH₂ | | Cl Cl 4) C₂H₄Cl ₂ → C₂H₂ условия: NaOH ( спирт . р-р ) C ₂ H ₄ Cl ₂ + 2NaOH → 2NaCl + 2H₂O + C₂H₂ C₂H₂ → CH₃−C=O | H C ₂ H ₂ + H ₂ O → CH₃−CHO ( kat ) 6) CH₃− CHO → CO₂ CH ₃−CHO + 3O₂ → 2CO₂ + 2H₂O
р-р ) C ₂ H ₄ Cl ₂ + 2NaOH → 2NaCl + 2H₂O + C₂H₂ C₂H₂ → CH₃−C=O | H C ₂ H ₂ + H ₂ O → CH₃−CHO ( kat ) 6) CH₃− CHO → CO₂ CH ₃−CHO + 3O₂ → 2CO₂ + 2H₂O
Слайд 14
СПАСИБО ЗА ВНИМАНИЕ 3C₂H₂ → C₆H₆ условия: t⁰C , kat .
Осуществить цепочку превращений | Дистанционные уроки
22-Авг-2012 | комментариев 9 | Лолита Окольнова
Допустим, нам в задании С3 ЕГЭ по химии дана такая цепочка превращений:
Какой вообще алгоритм действий при решении таких задач?
- Определяем класс исходного вещества. С2H5OH — классический предельный одноатомный спирт.
- Определяем условия реакции.Нам дана серная кислота и реакция происходит при нагревании. В Органической химии сочетание h3SO4/t означает дегидратацию.
Дегидратация — реакция отщепления воды от молекул органических соединений
Но все дело в том, что в данном случае у нас возможны 2 варианта: образование простого эфира — межмолекулярная дегидратация или образование алкена — внутримолекулярная дегидратация.
- По следующей реакции определяем исходное вещество Х1 подвергается слабому окислению. Слабому, т.к. выбраны достаточно мягкие условия — водная среда (h3O) и низкая температура).Простые эфиры не окисляются, а вот алкены очень даже хорошо вступают в реакции такого рода, следовательно, в первая реакция у нас была внутримолекулярная дегидратация:
Полученное вещество — этилен — вещество с двойной связью (алкен)
Сh3=Ch3
В теперь внимание!!! При окислении в зависимости от условий реакции алкены дают разные продукты!
Обратите внимание на эти реакции. Зазубривать их не надо, надо запомнить логику:
— при мягком окислении образуется диол -двухатомный спирт;
— при более жестком окислении рвется двойная связь и образуется кислота;
— совсем жесткое окисление — это горение.
Спирты, как и остальные органические соединения, при горении образуют углекислый газ (СO2) и воду (h3O).
В нашем случае окисление прошло в мягких условиях, поэтому образовался этандиол или этиленгликоль — двухатомный спирт.
Х2 — 1,2-этандиол, или этиленгликоль
- Взаимодействие с избытком HBr. Взаимодействие спиртов с галогеноводородами дает галогеналканы. Но здесь не просто взаимодействие, а взаимодействие с ИЗБЫТКОМ. Это означает, что обе группы -ОН будут заменены на Br:Х3 — 1,2-дибромэтан.
- В следующей реакции продуктом является этин или ацетилен. Алкины содержат меньше атомов водорода, поэтому такая реакция будет называться дегидрирование.
Дегидрирование —реакция отщепления водорода
У нас еще уходит Br, поэтому такая реакция — это дегидрогалогенирование.
Алкины — вещества с тройной связью. Условия реакции — KOH в спиртовом растворе (Y). Именно в спиртовом, т.к. в водном растворе будет происходить совершенно другая реакция — присутствие -OH-групп здесь крайне нежелательно!
Ну и чтобы написать последнюю реакцию, нам надо определить вещество C2h5O. По реакции Кучерова это ацетальдегид
Вот примеры олимпиадных заданий (2015 г)
В первой цепочке начало — классический способ получения метана:
4Al + 3C -> Al4C3 карбид алюминия
Al4C3 + 12h3O -> 4Al(OH)4 + 3Ch5 Х1 = метан
Хлорирование метана ( 1 моль) на свету — т.е. образуется монохлорпроизводное:
Ch5 + Cl2 -> Ch4Cl + HCl X2 = хлорметан
Чтобы получить этан, нужно провести реакцию Вюрца:
2Ch4Cl + 2Na -> C2H6 + 2NaCl
При нагревании и действии катализатора обычно происходит дегидрирование — из алканов образуются алкены:
C2H6 -> C2h5 + h3 X3 = этилен
Это же вещество — начало второй цепочки првращений
А = этилен
C2h5 + h3O -> C2H5OH Б = этанол
2C2H5OH -> C2H5-O-C2H5 + h3O C = диэтиловый эфир
Еще на эту тему:
Обсуждение: «Осуществить цепочку превращений»
(Правила комментирования)
Как бы вы провели следующую трансформацию? Расскажите, какие реагенты вы бы использовали в каждом конкретном случае.

Рассчитайте E °, G ° и K при 25 ° C для реакции 3Mn2 + (водн.) + 2MnO4 (водн.) + 2h3O5MnO2 (s) + 4H + (водн.)
Химия: принципы и реакции
66. Прочтите коробка под названием «Что если. . . Сложность из простоты ». Объясните комментарий в следующем ca …
Chemistry In Focus
Наиболее частыми исключениями из правила октетов являются соединения или ионы с центральными атомами, имеющими более восьми эл…
Химия: первый подход к атомам
Для каждого из следующих углеродных скелетов укажите количество атомов углерода в самой длинной непрерывной цепи: a ….
Химия сегодня: общие, органические и биохимические
7,54 CO, CO2, Ch4OH и CO32, все содержат углерод-кислородные связи. Нарисуйте структуры Льюиса для этих молекул …
Химия для студентов инженерных специальностей
Элементарный бор получают в одном промышленном процессе путем нагревания триоксида дибора с металлическим магнием, также пр…
Введение в химию: основа
Когда дипротоновая кислота, h3A, титруется NaOH, протоны дипротоновой кислоты обычно удаляются при . ..
..
Химия
30. Что обычно используется для ацетон?
Chemistry In Focus
Можете ли вы оценить r для сферической гармоники Y22? Почему или почему нет?
Physical Chemistry
Образец h3C2O4.2h3O массой 3,35 г нагревают для удаления вод гидратации (обозначены отдельно в…
Химия для студентов инженерных специальностей
Вы соблюдаете диету, которая требует употребления не более 1200 кал / день. Что это за энергия в джоулях?
Химия и химическая реакционная способность
Двумя наиболее реактивными группами элементов являются галогены и щелочные металлы. Чем они отличаются по …
Химия
Йод — голубовато-черное твердое вещество. При нагревании образует пар фиолетового цвета. Твердое вещество плавится при 236 ° F. Что такое …
Общая химия — Отдельная книга (список курсов MindTap)
Случай 2 1.У этого пациента наблюдались как обструктивные, так и рестриктивные заболевания легких. Во время первой части . ..
..
Сердечно-легочная анатомия и физиология
Влияние диеты на уровень липопротеинов (мг / дл) цис-жирных кислот транс-жирных кислот Насыщенные жиры Оптимальный уровень ЛПНП …
Биология: динамическая наука ( Список курсов MindTap)
Что такое окислительно-восстановительная реакция?
Биология: единство и разнообразие жизни (Список курсов MindTap)
Длина и ширина прямоугольной комнаты измеряются равными 3.9550.005 м и 3.0500.005 м. Вычислить площадь …
Колледж физики
Для изменения веса необходимы усилия во всех следующих областях: a. режимы питания, физическая активность и …
Питание: концепции и противоречия — Отдельная книга (список курсов MindTap)
Используйте второй закон термодинамики, чтобы объяснить, почему мы можем использовать масло только один раз в качестве топлива, или, другими словами, почему …
Наука об окружающей среде (Список курсов MindTap)
Определите максимальное количество водородных связей, которые могут образовываться между молекулой этанола и a. другой этанол m …
другой этанол m …
Общая, органическая и биологическая химия
Какие два чувства дают нам больше всего информации об окружающей среде?
Введение в физику
Ваш самолет прибывает в Лондон, и пилот сообщает вам, что температура составляет 30 ° C. Если вы наденете …
Inquiry into Physics
Тип скрещивания, описанный в вопросе 2, — это (а) крест F2 (б) дигибридный крест (в) тестовый крест (г) двухпозиционный. ..
Биология (список курсов MindTap)
Потребление питательных веществ из пищи, потребление калорий и жировые отложения влияют на фертильность, прежде всего, изменяя окружающую среду…
Питание на протяжении всего жизненного цикла (Список курсов MindTap)
Перечислите основные типы мембран в организме.
Биология человека (Список курсов MindTap)
Как вы оцениваете точность или обоснованность методов дополнительной и альтернативной медицины?
Understanding Nutrition (Список курсов MindTap)
H сравнивает разрешающую способность телескопа 5-rn на горе Паломар недалеко от Сан-Диего с разрешающей способностью 2. 5-r …
5-r …
Horizons: Exploring the Universe (MindTap Course List) )
Липопротеиновые частицы представляют собой относительно большие сферические скопления молекул белка и липидов (см. Рис. 3).14 tha …
БИОЛОГИЯ: КОНЦЕПЦИИ + ПРИМЕНЕНИЕ (LOOSELEAF)
Не имея современных часов, первые экспериментаторы иногда измеряли временные интервалы с помощью своего пульса. Почему это было …
College Physics
Ной — бывший поздний недоношенный мужчина, родившийся на 36 неделе беременности. Он весил 2000 г и был мал для беременности …
Питание на протяжении всего жизненного цикла
Что такое бедность и каковы три ее вредных воздействия на окружающую среду и здоровье? Примерно какой процент-го…
Наука об окружающей среде (Список курсов MindTap)
Задача 12-10 Выполните эти реакции. Ch4 (a) Ch4CCH = Ch3 + Br2CHjCli ch4
Введение в общую, органическую и биохимию
Беременным женщинам не рекомендуется есть определенные виды рыбы, поскольку FDA и EPA обнаружили неприемлемость . ..
..
Питание
Ответы на все проблемы в конце этой книги. Подробные решения доступны в Студенческих решениях …
Биохимия
Оцените количество атомов в 1 см5 твердого тела.(Обратите внимание, что диаметр атома составляет около 1010 м.)
Колледж физики
Что такое популяционная генетика?
Человеческая наследственность: принципы и проблемы (список курсов MindTap)
РИСУНОК 8.24 Исследование глобальных температур в течение 4 лет до и после крупных извержений вулканов дает …
Основы физической географии
ОТРАЖАТЬ И ПРИМЕНИТЬ Определить процессивность и указать важность этой концепции в репликации ДНК.
Биохимия
Показатель преломления фиолетового света в кремнеземистом стекле составляет нВ, а для красного света — nR.Что такое …
Физика для ученых и инженеров
Почему в США прекращено использование МТБЭ в качестве добавки к бензину?
Органическая и биологическая химия
В большинстве __________, мужчины и женщины сотрудничают в уходе за молодыми. а. млекопитающие b. птицы c. насекомые d. all of t …
а. млекопитающие b. птицы c. насекомые d. all of t …
Биология: единство и разнообразие жизни (список курсов MindTap)
На рисунке P10.18 показана трансмиссия велосипеда с колесами диаметром 67,3 см и педалями 17.5 см l …
Физика для ученых и инженеров, Обновление технологий (коды доступа не включены)
Что такое электролит? Как экспериментально отличить слабый электролит от сильного электролита …
Химия и химическая реактивность
Уравновесите следующие уравнения, для которых уже написаны правильные химические формулы. Мы предоставили …
Введение в химию: подход к активному обучению
Несколько сульфонилмочевины, класс соединений, содержащих RSO2NHCONHR, являются полезными лекарствами в качестве перорально активной замены…
Organic Chemistry
Неудержимое пианино стартует из состояния покоя и скользит вниз по холму без трения 20,0 длиной 5,00 м. а. Нарисуйте бесплатный …
Физика для ученых и инженеров: основы и связи
В 1983 году Соединенные Штаты начали чеканить монету из цинка, плакированного медью, а не из чистой меди. Th …
Th …
Физика для ученых и инженеров с современной физикой
На каких средних расстояниях от Солнца вы ожидаете найти промежутки Кирквуда, где указан период обращения звезды…
Основы астрономии (Список курсов MindTap)
Сколько лет Земле? Откуда нам знать?
Океанография: приглашение к морской науке, отрывная версия
Ретросинтез Учебник по органической химии
В органической химии синтез и ретросинтез идут рука об руку.
Хотя нет четкого различия, мне нравится думать о синтезе как о перспективном мышлении и ретросинтезе, как о , обратном .
Синтез — это тема, которая обычно вводится в Органическую химию 1 сразу после изучения реакций алкинов.Вы будете использовать его снова и снова по мере того, как будет накапливаться количество реакций, которые вы выучите.
Вот почему важно просмотреть прошлые темы , прежде чем переходить к следующей главе. Во время изучения новых тем вас могут попросить выполнить ретросинтез, который включает получение пяти различных реакций из пяти разных глав.
Давайте вернемся…
Retro = Backwards
Synthesis = Процесс объединения более простых реакций с образованием химического соединения / молекулы.
В вашем курсе органической химии это представлено в форме сложной молекулы, которую затем просят синтезировать из заданной исходной молекулы или набора условий реакции.
-> Вам могут дать конкретный реагент и попросить синтезировать продукт.
Например:
«Синтезировать транс-3,4-дибромгексан из этина».
-> Вас могут попросить синтезировать продукт с учетом набора неопределенных или конкретных условий реакции.
Например:
«Синтезировать 2-бутанон с использованием любых неорганических реагентов.Используйте 2 углеродных алкилгалогенида в качестве единственного источника углерода ».
Встречали ли вы похожие вопросы в своем домашнем задании, тестах или практических экзаменах?
Как вы думаете?
Многие студенты будут смотреть на процесс и запаниковать;
И в упомянутой панике начал рисовать все, что приходит в голову, без четкого процесса или представления о том, куда они направляются.
Мне нравится систематически подходить к проблемам.
Мне нравится планировать свои шаги и точно знать, что мне делать.
И что еще более важно, я верю, что этот процесс снова и снова поможет мне получать правильные результаты.
Как можно быстрее!
Чем более систематизирован ваш подход, тем больше вероятность, что вы уловите каждый компонент реакции. Следовательно, тем меньше вероятность, что вы что-то пропустите.
Это ключ. Получите все компоненты и сведите к минимуму потерянные баллы на экзамене.
Прежде чем углубляться в проблемы, вам нужно знать, куда вы собираетесь.
Вы должны убедиться, что в конечном итоге ваши действия окупятся и вы получите желаемый продукт.
- Что то же самое?
- Что изменилось?
- Как я могу добиться этой разницы?
Что такое же?
Прежде чем добавлять новые группы в молекулу, вы хотите увидеть, с чем уже можно работать.
Мы будем использовать анализ, описанный в руководстве по синтезу, при анализе того, что присутствует в реагенте.
ПОДСЧИТАЙТЕ ВАШИ УГЛЕРОДА !!!
(очень многие теряют очки из-за отсутствия счета.)
Сколько атомов углерода присутствует в реагенте и продукте ?
Это поможет вам определить реакции удлинения или расщепления цепи.
Найдите
неуглеродных атома и функциональных группы .
Что еще находится в молекуле в реагенте и продукте?
Найдите
место реакционной способности молекулы.
Реакционная способность молекулы относится к расположению реакционноспособных атомов или функциональных групп.
Например, 2-хлорпропан обладает реакционной способностью по отношению ко второму углероду. Cl — хорошая уходящая группа. Это позволяет провести ряд реакций:
- Исключение для создания пи-связи (E1 или E2)
- Замена, чтобы дать нам другую функциональную группу в виде поступающего нуклеофила (SN1 или SN2)
- Мы можем превратить Cl в смесь Гриньяра для сверхреактивного металлоорганического соединения
- И многое другое…
Это ваша подсказка относительно ГДЕ начать реакцию.
Сравните каждую из этих характеристик с конечным продуктом.
Обратите внимание на все, что изменяет , потому что наша цель при проведении ретросинтеза будет именно такой: выяснение КАК выполнять эти преобразования, что подводит меня к вопросу 2.
Что отличается?
- Если число атомов углерода изменилось, на сколько?
- Сколько атомов углерода было добавлено или удалено?
- Если функциональные группы или реакционная способность изменились , что было заменено и чем?
- Сколько новых групп было добавлено?
После того, как мы определили, что одинаково, а что отличается, мы задаем самый важный вопрос:
КАК я могу осуществить это преобразование?
Это вопрос из двух частей.
1) Для кратких задач синтеза ответ прост.
Какая ОДНА реакция превратит исходную молекулу x в продукт y ?
Например, от 2-йодпропана до пропена.
Что то же самое?
И реагент, и продукт имеют три атома углерода.
Что изменилось?
Реагент имеет галоген на углероде №2.
Продукт имеет пи-связь между бывшим углеродом 2 и углеродом 3.
Как я могу выполнить это преобразование?
Удалите галоген, используя сильное основание для реакции E2 или даже слабое основание и нагрейте для реакции E1.Оба предоставят один и тот же продукт.
Подсказка: в случае сомнений выберите E2 вместо E1. При правильных условиях он быстрее, точнее и имеет меньшую конкуренцию (E1 против SN1). Вы также можете управлять выбором продукта для формирования более (Зайцев) или менее замещенной (Big Bulky Base) пи-облигации.
2) Но ваш профессор, скорее всего, не даст вам такого простого одношагового преобразования для ретросинтеза.
Давайте поднимем его на ступеньку выше.
Например, вас просят преобразовать 2-хлорбутан в 1-бутанол.
Все еще относительно простое преобразование, но мы больше не рассматриваем простую одностадийную реакцию.
Применяется тот же набор вопросов, которые по-прежнему помогут вам перейти к продукту.
Что то же самое?
Всего в реагенте и продукте четыре атома углерода.
У нас есть одна функциональная группа в реагенте и продукте.
Чем отличается?
Реагент содержит галоген; в продукте есть спирт.
Реакционная способность молекулы изменилась с углерода №2 на углерод №1.
Какие реакции я знаю, чтобы провести это преобразование?
Внезапно ответ становится не таким однозначным, но все же возможно.
В предыдущем примере мы смогли быстро ответить на этот вопрос.
ОДНА единственная реакция превратила нашу исходную молекулу в желаемый продукт.
Здесь не так уж и много!
Вот где проявляется истинная сила ретросинтетического анализа.
Давайте разберемся.
У нас есть хлор в исходной молекуле и спирт в продукте.
Хотя нам ДЕЙСТВИТЕЛЬНО известна реакция превращения Cl в OH (SN2), это произойдет на том же углероде. Нам нужен ОН на другом углероде.
Итак, давайте сделаем шаг вперед, или лучше сказать, сделаем шаг назад .
Ретросинтез — это обратное мышление, поэтому давайте начнем с продукта.
Если продукт представляет собой спирт на первичном углероде, то какая реакция, которую я знаю, даст МНЕ спирт на первичном углероде?
«Первичный против вторичного» сообщает мне «Антимарковниковский спирт», который говорит мне, что мне нужно провести реакцию присоединения алкена в условиях «Антимарковникова».
Вернемся к продукту на шаг назад. Мне нужен алкен.
Пока не беспокойтесь о реагентах. Гораздо проще продумать молекулы сначала , а затем вернуться и заполнить недостающие реагенты, как описано в руководстве по синтезу.
Теперь мы относимся к алкену как к нашему новому продукту и снова задаем тот же вопрос.
Сравнение реагента с алкеном,
Знаю ли я о реакции, которая либо осуществит это преобразование, либо приблизит меня?
Абсолютно да, простая реакция удаления, как мы видели выше.
Однако на этот раз мы не можем просто использовать сильное основание, потому что пи-связь будет благоприятствовать более замещенному и продукту Зайцева 2-бутену.
Вместо этого нам нужна реакция отщепления, которая заставит пи-связь образоваться на менее замещенном первичном и вторичном углероде.
Какой реагент будет выполнять это «антизайцевское» или устранение Хоффмана?
Нам нужна «тройная В» или большая объемная основа
Трет-бутоксид
Но давайте не будем сейчас беспокоиться о трет-бутоксиде, вместо этого давайте просто признаем тот факт, что мы МОЖЕМ реагировать с 2-хлорбутаном с образованием 1-бутена и провести это преобразование.
После того, как все ваши промежуточные соединения перейдут от продукта к реагенту, быстро проследите последовательность от реагента к продукту, чтобы убедиться, что он выглядит правильно и имеет смысл.
А теперь спросите себя:
Какой реагент будет выполнять каждое преобразование?
Задайте себе этот вопрос по очереди, задавая условия реакции и завершая последовательность ретросинтеза.
Начнем с вторичного галогена и образуем менее замещенную пи-связь.
Это требует сильного основания трет-бутоксида, как мы уже намекали выше.
В то время как некоторые профессора примут это как есть, другие потребуют полного набора условий.
Давайте используем трет-бутоксид калия, растворенный в его собственном конъюгированном спирте, трет-бутаноле, и нагреем, чтобы помочь осуществить эту реакцию. Напомним, что реакции E2 предпочитают тепло. Теперь, когда у нас есть асимметричный алкен, нам нужна реакция присоединения алкена, которая позволит спирту присоединиться к первичному углероду или антимарковниковской позиции.
Окисление гидроборированием должно сразу прийти в голову.
Добавим Bh4, THF в NaOH и h3O2.
И вот, пошаговая трансформация с использованием реагентов.
Синтез + ретросинтетический анализ.
Начните с назад думайте, когда можете.
Вы знаете выражение «ретроспективный взгляд — 20/20»?
Вот на что мы рассчитываем.
Глядя на свой продукт и не забывая только о своем реагенте, вы можете задать очень, очень важный вопрос:
Как выглядела эта молекула всего за ОДИН шаг до того, как я смог образовать функциональную группу x?
Эта форма ретросинтетического анализа поможет вам быстро идентифицировать одно промежуточное соединение за раз, вплоть до вашей исходной молекулы.
Давайте попробуем что-нибудь посложнее.
Допустим, вас попросили начать с бензола для синтеза 2-нитробензойной кислоты.
Что то же самое?
Реагент и продукт имеют бензольное кольцо.
Чем отличается?
Продукт представляет собой дизамещенный бензол . Заместители находятся в орто-соотношении.
Мы добавили карбоновую кислоту и нитрогруппу.
Какие реакции я знаю для проведения этих преобразований?
Учитывая, что у нас происходит более одной реакции, всегда обращайте внимание на то, как реакции влияют друг на друга.
Мы можем добавить карбоновую кислоту путем алкилирования Фриделя-Крафтса с последующим окислением.
Мы можем добавить нитрогруппу с помощью EAS Nitration.
НО, вот с чем следует быть осторожным:
Группы орто друг к другу.
Как NO2, так и карбоновая кислота являются группами, дезактивирующими EAS, с метауправляющими эффектами.
Давайте подумаем, прежде чем мы начнем реагировать.
Если карбоновая кислота происходит в результате алкилирования FC, алкильная группа до окисления является орто / пара-директором.
Это хорошо.
Но как мы можем гарантировать, что мы закончим с положением ortho , а не para ?
Нам нужна еще одна реакция, которая не проявляется в продукте.
Нам нужна блокирующая группа в пара-положении, чтобы гарантировать, что орто — единственная доступная группа.
Все эти мысли должны быстро пролететь у вас в голове. Пока нет необходимости записывать реакции, хотя я люблю отмечать молекулы как «заметку для себя».’
Теперь, когда мы знаем, куда мы идем, ретросинтез завершен, и мы можем напрямую перенести эту реакцию от реагента к продукту.
Начнем с алкилирования Фриделя Крафтса. Размер вашей углеродной цепи не имеет значения, поскольку окисление боковой цепи отсекает лишние атомы углерода.
Давайте возьмем этилхлорид в FeCl3 и получим этилбензол:
Теперь у нас есть орто-парадиректор, поэтому давайте добавим блокирующую группу .
Сульфирование EAS приведет к добавлению объемного SO3H в пара-положении.
При заблокированном параграфе мы можем провести еще одну реакцию, имея в виду следующее:
- Этил по-прежнему является орто / пара директором, но пара заблокирована!
- Сера является частично положительной и метауправляющей группой.
ОБЕ группы направляют атом углерода №2 рядом с этильной группой, что нам и нужно.
Затем мы проводим нитрование EAS, переводя нитрогруппу в орто-этил и мета в сульфат.
Разбавленная кислота затем удалит блокирующую группу из пара-положения, оставив мета-нитрогруппу с этильной группой.
Здесь многие студенты теряют баллы.
Они так взволнованы тем, что думали обо всем этом, что забывают, что это нежелательный продукт.
ВСЕГДА возвращайтесь к исходному вопросу, чтобы убедиться, что вы ничего не забыли.
Что мы забыли?
Этил не является нашей целью.
Нам нужна карбоновая кислота.
Введите перманганат калия со способностью окисления боковой цепи, превращая бензильную позицию в карбоновую кислоту для нашего конечного продукта.
После этого выполните всю последовательность, чтобы убедиться, что все ваши реагенты и промежуточные продукты работают вместе и имеют смысл, и мы закончили.
Те же самые мысли могут быть применены к любой задаче ретросинтеза от двух до 100 шагов и более. Хорошо, возможно, я преувеличиваю, ваш профессор, надеюсь, ограничит ваши проблемы ретросинтеза тремя-семью шагами.
Теперь, когда у вас есть основы подхода к ретросинтезу, вам понадобится прочная основа.Я рекомендую вернуться, чтобы просмотреть все ключевые реакции, затронутые в вашем семестре, чтобы они были свежими и готовы к использованию по мере необходимости.
Используйте мой Syllabus Companion, чтобы быстро найти учебные пособия, видео и шпаргалки по типичным реакциям органической химии.
Я хотел бы услышать от вас
Чувствуете ли вы себя лучше в отношении ретросинтеза и оставаясь на правильном пути к полной признательности по каждой проблеме? Позвольте мне знать в комментариях ниже.
Addgene: Протокол — бактериальная трансформация
Если вас не волнует эффективность трансформации (например, когда у вас есть пробирка с плазмидной ДНК и вам просто нужно трансформировать бактерии, чтобы вырастить больше плазмиды), вы можете сэкономить много времени, сократив или пропустив многие этапы и у вас по-прежнему будет достаточно колоний для вашего следующего шага.Помните, что каждый из этих ярлыков снижает эффективность преобразования, поэтому, когда требуется более высокая эффективность, следуйте полному протоколу.
Химически компетентные клетки быстры и просты в использовании, но менее эффективны при захвате плазмид большего размера. Если вам нужно трансформировать большие плазмиды, рекомендуется использовать электрокомпетентные клетки.Вместо того, чтобы полагаться на тепловой шок, заставляющий клетки поглощать ДНК, к смеси клетка / ДНК прикладывается электромагнитное поле, чтобы вызвать проницаемость мембраны. Для этого вам понадобится электропоратор и соответствующие кюветы. Следуйте инструкциям производителя для каждого.
Убедитесь, что вы высеваете на чашку с агаром LB Agar, содержащую правильный антибиотик.Ген устойчивости вашей плазмиды должен соответствовать антибиотику на планшете. Вы также должны добавить положительный контроль (многие компании включают плазмиду положительного контроля со своими компетентными клетками), чтобы убедиться, что ваша процедура трансформации работает.
Хотя это может показаться нелогичным, вы часто получите более высокую эффективность трансформации с меньшим количеством ДНК, особенно при использовании высококомпетентных клеток.Если вы использовали 100–1000 нг тотальной ДНК для лигирования, вы часто получите больше колоний, если будете использовать 1 мкл в разведении 1: 5 или 1:10, а не 1 мкл напрямую.
сложных вопросов и ответов по органической химии
Этот набор сложных вопросов и ответов по органической химии посвящен «Реагентам в органической химии».
1. Что является подходящим катализатором для осуществления приведенного ниже превращения?
a) BF 3 . Et 2 0
b) NaOEt
c) вольфрамовая лампа
d) дибензоилпероксид
Посмотреть ответ
Ответ: a
Пояснение: BF 3 увеличивает электрофильность карбонильного углерода, из-за чего сера атакует карбонильный углерод.
2. Что из перечисленного даст эффективное восстановление 3-гексина до транс-3-гексена?
a) H 2 / катализатор Линдлара
b) Na / liq. NH 3
c) Fe / NaCl
d) DIBAL
Посмотреть ответ
Ответ: b
Пояснение: Na / liq. NH 3 даст эффективное сокращение в следующем случае:
3. Какой из реагентов даст эффективное преобразование данных соединений?
a) CH 2 N 2
b) CH 3 Li
c) (CH 3 ) 2 CuLi
d) Ph 3 P = CH 2
Посмотреть ответ
Ответ: d
Пояснение: Ph 3 P = CH 2 даст наиболее эффективное превращение кетона в алкен (реакция Виттига).Реакция Виттига — популярный метод синтеза алкена из кетонов и альдегидов. Реагент Виттига обычно может переносить карбонильные соединения, содержащие несколько видов функциональных групп, таких как ОН, OR, ароматические нитро- и даже сложноэфирные группы.
4. Какой самый мягкий восстанавливающий агент восстанавливает только карбонильную группу в присутствии нитро, карбоксильных, двойной связи и сложноэфирных групп?
a) LiAIH 4
b) Na-NH 3
c) NaBH 4
d) H 2 -Ni
Посмотреть ответ
Ответ: c
Пояснение: NaBH 4 является мягким агент для этого преобразования.Он очень эффективен для восстановления альдегидов и кетонов до спиртов. Сам по себе он обычно не восстанавливает сложные эфиры, карбоновые кислоты или амиды (хотя он восстанавливает ацилхлориды до спиртов).
5. Каким будет продукт для данного реагента и реагентов?
a)
b)
c)
d)
Просмотреть ответ
Ответ: c
Пояснение: LiAlH 4 восстановит двойную связь до одинарной связи и альдегидную группу до спирта.
6.Какая правильная комбинация реагентов может быть использована после преобразования?
a) (i) CH 3 — MgBr, затем H + (ii) H 2 S0 4 / ∆ (iii) NH 2 — NH 2 / KOH
b) (i ) (CH 3 ) 2 CuLi, затем H + (ii) NaBH 4 EtOH (iii) H 2 S0 4 / ∆
c) (i) CH 3 — Li, затем H + (ii) PCC / ∆
d) (i) NaBH 4 ∙ CeCl 3 затем H + (ii) MnO 2 (iii) CH 3 — Li
Просмотреть ответ
Ответ: c
Объяснение: Здесь CH 3 будет атаковать при C = O, и дегидратация пройдет, и снова вода будет атаковать в мета-положении как нуклеофил на кольце.PCC превратит -OH в = O.
7. Как ацетофенон может быть превращен в фенол реакцией?
a) m-CPBA с последующим катализируемым основанием гидролизом
b) конц. HN0 3
c) йод и NaOH
d) Синглетный кислород с последующим продуктом катализируемого основанием продукта гидролиза
Посмотреть ответ
Ответ: a
Пояснение:
m-CPBA может превращать кетон в амид, а после гидролиза сложного эфира он восстанавливается до фенола.
8. Как мы можем получить RR ’R” OH под действием избытка подходящего реактива Гриньяра на какой из следующих реагентов?
a) нитрил или альдегид
b) сложный эфир или спирт
c) альдегид или кетон
d) кетон или сложный эфир
Посмотреть ответ
Ответ: a
Пояснение: Получение спирта 3 o из кетона и сложного эфира действием избытка подходящего реактива Гриньяра проводят, как показано ниже:
9.Что используется для выполнения следующего преобразования?
a) гидроборирование с последующим окислением Джонса
b) Окисление Ваккера с последующей реакцией галоформы
c) определение оксимеркурации с последующим окислением Джонса
d) озонолиз с последующей реакцией галоформы
Посмотреть ответ
Ответ: b
Пояснение: Превращение концевого или 1,2-дизамещенного алкена в кетон под действием каталитического палладия (II), воды и сооксиданта. Из-за легкости, с которой могут быть получены концевые алкены, и универсальности метилкетоновой группы, устанавливаемой в результате реакции, окисление Ваккера широко применялось в органическом синтезе.Затем следует галоформная реакция.
10. Сколько изомеров C 4 H 8 O при взаимодействии с CH 3 MgBr с последующим подкислением до спирта (учитывайте только карбонильные изомеры и включая стереоизомеры)?
a) 2
b) 3
c) 4
d) 5
Просмотреть ответ
Ответ: a
Пояснение:
Sanfoundry Global Education & Learning Series — Органическая химия.
Чтобы практиковать сложные вопросы и ответы по всем областям органической химии, представляет собой полный набор из 1000+ вопросов и ответов с множественным выбором .
Примите участие в конкурсе сертификации Sanfoundry, чтобы получить бесплатную Почетную грамоту. Присоединяйтесь к нашим социальным сетям ниже и будьте в курсе последних конкурсов, видео, стажировок и вакансий!
насадок по химическому преобразованию | NEB
Насадки для химического преобразования | NEB
Принимать файлы cookie
Мы используем файлы cookie, чтобы понять, как вы используете наш сайт, и улучшить общее впечатление пользователя. Это включает в себя персонализацию контента и рекламы. Чтобы узнать больше и управлять файлами cookie, обратитесь к нашему Заявлению о файлах cookie .
Эффективность трансформации определяется как количество колониеобразующих единиц (КОЕ), которые могут быть получены при трансформации 1 мкг плазмиды в данный объем компетентных клеток. Этот термин несколько вводит в заблуждение, поскольку 1 мкг плазмиды на самом деле редко трансформируется. Вместо этого эффективность обычно рассчитывается путем трансформации 100 мкг-1 нг высокоочищенной сверхспиральной плазмиды в идеальных условиях. Уравнение для расчета эффективности трансформации (TE): TE = Колонии / мкг / разведение.Расчеты эффективности можно использовать для сравнения клеток или лигирования. Мы перечислили наши рекомендуемые протоколы и советы, которые помогут достичь максимальных результатов.
Рекомендуемые протоколы
Протокол высокоэффективного преобразования
- Разморозьте клетки в одноразовых пробирках для трансформации на льду в течение 10 минут. Пробирки на 200 мкл разморозьте на льду, пока не исчезнут последние кристаллы льда. Осторожно перемешайте и аккуратно внесите пипеткой 50 мкл клеток в пробирку для трансформации на льду.
- Добавить 1 мкг-100 нг плазмидной ДНК (1-5 мкл) к клеткам и перемешать без встряхивания.
- Поместите на лед на 30 минут.
- Тепловой шок при 42 ° C в течение 30 секунд. *
- Поместите на лед на 5 минут.
- Добавьте 950 мкл SOC комнатной температуры. При использовании компетентных клеток NEB 10-beta или NEB Stable E.coli добавьте 950 мкл среды NEB 10-beta / Stable Outgrowth Medium.
- Поместите при 37 ° C на 60 минут. Энергично встряхните (250 об / мин) или поверните.
- Перемешайте клетки без встряхивания и выполните несколько 10-кратных серийных разведений в SOC. При использовании NEB 10-beta или NEB Stable E.coli , выполните серийные разведения, используя вместо этого среду NEB 10-beta / Stable Outgrowth Medium.
- Распределите 50–100 мкл каждого разведения на предварительно нагретые планшеты для отбора проб и инкубируйте при 37 ° C или в соответствии с рекомендациями.
* Ровно 10 секунд для BL21 (NEB # C2530)
5-минутный протокол преобразования
Результат только 10% эффективности по сравнению с вышеуказанным протоколом.
- Размораживайте клетки в руке.
- Добавить 1 мкг-100 нг плазмидной ДНК (1-5 мкл) к клеткам и перемешать без встряхивания.
- Поместите на лед на 2 минуты.
- Тепловой шок при 42 ° C в течение 30 секунд.
- Поместите на лед на 2 минуты.
- Добавьте 950 мкл SOC комнатной температуры. При использовании компетентных клеток NEB 10-beta или NEB Stable E.coli добавьте 950 мкл среды NEB 10-beta / Stable Outgrowth Medium. Немедленно распределите 50-100 мкл на планшете для отбора и инкубируйте в течение ночи при 37-42 ° C. ПРИМЕЧАНИЕ. Для выбора с использованием антибиотиков, отличных от ампициллина, может потребоваться некоторый рост перед посевом.
Советы по трансформации
Размораживание
- Клетки лучше всего размораживать на льду.
- ДНК следует добавлять, как только исчезнет последний след льда в пробирке.
- Клетки можно разморозить вручную, но нагревание выше 0 ° C снижает эффективность.
Инкубация ДНК с клетками на льду
- Инкубируйте на льду 30 минут. Ожидайте двукратной потери TE на каждые 10 минут сокращения этого шага.
Тепловой шок
- Температура и время зависят от объема трансформации и емкости.Обычно рекомендуется 30 секунд при 42 ° C, за исключением случая использования BL21 (NEB # C2530), для которого требуется ровно 10 секунд.
Нарост
- Рост при 37 ° C в течение 1 часа лучше всего подходит для восстановления клеток и выражения устойчивости к антибиотикам.
Ожидайте двукратной потери TE за каждые 15 минут сокращения этого шага. - SOC и NEB 10-beta / Stable Outgrowth Medium дают в 2 раза более высокое TE, чем среда LB.
- Инкубация при встряхивании или вращении пробирки дает в 2 раза более высокое значение ТЕ.
Покрытие
- Селекционные планшеты можно использовать в тепле или холода, влажном или сухом без значительного воздействия на ТЕ.
- Теплые сухие чашки легче разложить и позволяют максимально быстро образовывать колонии.
ДНК
- ДНК для трансформации необходимо очистить и ресуспендировать в воде или буфере ТЕ.
- Можно использовать до 10 мкл ДНК из смеси для лигирования с потерей эффективности только в 2 раза.
- Чтобы максимально увеличить количество трансформантов, следует проводить очистку на спин-колонке или экстракцию фенолом / хлороформом и осаждение этанолом.
- Оптимальное количество ДНК ниже общепринятого. При использовании чистого pUC19 с суперспиральной структурой эффективность трансформации достигает максимума в диапазоне 100 пг-1 нг. Однако общее количество колоний, которые можно получить в результате одной реакции трансформации, увеличивается примерно до 100 нг.
Загрязнения ДНК, которых следует избегать
| Загрязнение | Метод удаления |
| Моющие средства | Этаноловый осадок |
| Фенол | Экстракт с хлороформом и осадком этанола |
| Этанол или изопропанол | Сухой осадок перед ресуспендированием |
| ПЭГ * | Очистка на колонке или фенол / хлороформный экстракт и осадок этанолом |
| ДНК-связывающие белки * (например,г., лигаза) | Очистка на колонке или фенол / хлороформный экстракт и осадок этанолом |
* В идеале ДНК для трансформации следует очищать и ресуспендировать в воде или ТЕ. Однако можно использовать до 10 мкл ДНК непосредственно из смеси для лигирования с двукратной потерей эффективности трансформации. Если необходимо увеличить количество трансформантов (например, библиотеки), следует добавить стадию очистки, либо спин-колонку, либо экстракцию фенолом / хлороформом и осаждение этанолом.
Сессия истекла
Вы бездействовали более 20 минут, в целях безопасности вы вышли из системы. Пожалуйста, войдите снова, чтобы продолжить сеанс.
Войти
Организация изменена
Ваш профиль привязан к учреждению, пожалуйста, войдите еще раз, чтобы завершить обновление вашего профиля.
Войти
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
(334aa) Настраивающие катализаторы для эффективного химического и энергетического преобразования
Активность металлов платиновой группы поставила большинство этих катализаторов намного выше других типов металлических катализаторов, частота смены циклов обычно ставила их на вершину вулканических кривых большинства химических реакций.Однако его самая большая привлекательность является также причиной отсутствия практичности; две из самых больших проблем, связанных с металлами платиновой группы, включают отсутствие контроля селективности и восприимчивость к ядам 1 . Гидродеоксигенация (HDO) является ключевым химическим процессом в продвижении большего количества био-производного сырья в промышленности, янтарная кислота — через HDO- была выделена как потенциальная альтернатива малеиновому ангидриду для производства 1,4-бутандиола, гамма-бутиролактона и тетрагидрофуран.Однако повышение качества этих карбоновых кислот оказывается проблематичным по сравнению с предпочтительными катализаторами (благородными металлами) из-за отсутствия контроля селективности. Эти активные катализаторы облегчают множество нежелательных реакций, таких как гидрогенолиз, декарбонилирование, декарбоксилирование и метанирование, которые все приводят к множеству малоценных продуктов 2 . Широко сообщается, что добавление оксофильных «промоторных металлов», таких как Sn, можно использовать для настройки селективности по благородным металлам во время HDO карбоновых кислот 3 ; однако их механизм действия плохо изучен.Другой распространенной проблемой как при повышении качества, так и при извлечении энергии (топливные элементы) из карбоновых кислот является образование монооксида углерода, который имеет тенденцию снижать скорость реакции. Новый подход был выдвинут на передний план в работе современных катализаторов, динамический катализ. Это включает использование внешних стимулов для колебания между энергетическим состоянием 4 ; эти различные состояния будут манипулировать шагами, определяющими скорость (rds) в механизме реакции, подпрыгивание между различными rds потенциально может работать с большей скоростью, чем работа в статическом состоянии.В этом плакате мы используем два разных подхода для решения практических ограничений металлов платиновой группы.
Во-первых, мы используем HDO пропионовой кислоты в качестве модельной системы для контроля селективности катализаторов Pt на носителе. Хотя HDO янтарной кислоты может быть более практичным в промышленных условиях, более простая молекула идеально подходит для фундаментального исследования, поскольку она улавливает весь необходимый химический состав без переполнения потока продукта. Мы проанализируем активность HDO над монометаллической Pt, используя экспериментальные и вычислительные методы, обеспечивая макроскопическое понимание путей реакции и основных ингибиторов селективности HDO.Это должно сыграть решающую роль в понимании того, как добавление оксофильного промотора Sn может внутренне настраивать каталитическую активность в сторону более высоких выходов продуктов HDO.
Во-вторых, мы исследуем влияние динамического катализа на окисление карбоновых кислот с помощью электрических полей. Окисление муравьиной кислоты будет использоваться в качестве модельной реакции для производства диоксида углерода, это обычная реакция в топливных элементах. Колебание между различными приложенными потенциалами позволит нам наблюдать эту концепцию экспериментально и степень, в которой увеличение скорости может быть достигнуто с использованием потенциодинамического подхода, а также преодолеть препятствие, связанное с ингибированием продукта.
Научные интересы
Кислородсодержащие соединения стали краеугольным камнем современного промышленного ландшафта, находясь на переднем крае хранения энергии, а также химического производства. Распространение современного катализа равносильно эффективному осуществлению этих химических процессов для удовлетворения социальных потребностей. Поскольку существует множество аспектов химического процесса, которые могут быть одобрены, существует также множество подходов, которые можно использовать для решения текущих проблем, а в некоторых случаях — сочетание подходов.Биметаллические катализаторы продемонстрировали свою стойкость к ингибированию продукта за счет образования оксигенированных продуктов по сравнению с типичными нежелательными, которые могут образовываться на высокоактивных катализаторах. 3 : нежелательные соединения включают монооксид углерода, диоксид углерода и алканы / алкены. Динамический катализ недавно был выдвинут на передний план как средство увеличения частоты переключения каталитического нейтрализатора за счет переключения между состояниями каталитической энергии. Теоретические и экспериментальные исследования показали, что скорости реакции на порядок выше во время динамической работы по сравнению со статической работой 4-5 .В ходе теоретических исследований также сообщалось, что динамический катализ также обладает способностью настраивать селективность путей путем изменения амплитуды и частоты стимулов, способствующих динамическому действию 6 . Мои исследовательские интересы включают использование благоприятных свойств биметаллических катализаторов наряду с огромным потенциалом динамического катализа для настройки селективности при одновременном увеличении скорости реакций с участием сильно кислородсодержащих соединений.В прошлом проводились исследования, которые неосознанно продемонстрировали, что эта идея правдоподобна в экспериментальной обстановке 7-8 , однако без подхода к концепции с конкретной целью раскрытия ее тайны будут пробелы в общем понимании, которое будет замедлить его путь к приложениям реального мира. Эти исследовательские интересы могут найти применение во многих различных отраслях промышленности, таких как добыча энергии, переработка биомассы и фармацевтика; изысканное решение часто встречающейся проблемы.
Список литературы
- Gurbuz, E .; Bond, J. Q .; Dumesic, J. A; Роман-Лешков, Ю. 261-288. Эльзевир, 2013.
- Lugo-José ©, Y. K .; Monnier, J. R .; Williams, T. C. Appl. Катал. A: Общий 469, 410-418. 2014.
- Вардон Д. Р., Бекхэм Г. Т. и др. ACS Catal. 7, 9. 2017.
- M. Alexander, A .; Омар А., А .; Пол Д. Принципы динамического гетерогенного катализа: поверхностный резонанс и частотный отклик. 2019.
- Гописингх, Джошуа; Арда, Мэтью; Шетти, Маниш; Берк, Шон; Дауэнхауэр, Пол; Абдельрахман, Омар (2020): Резонансное окисление муравьиной кислоты с помощью динамической электрокаталитической модуляции.


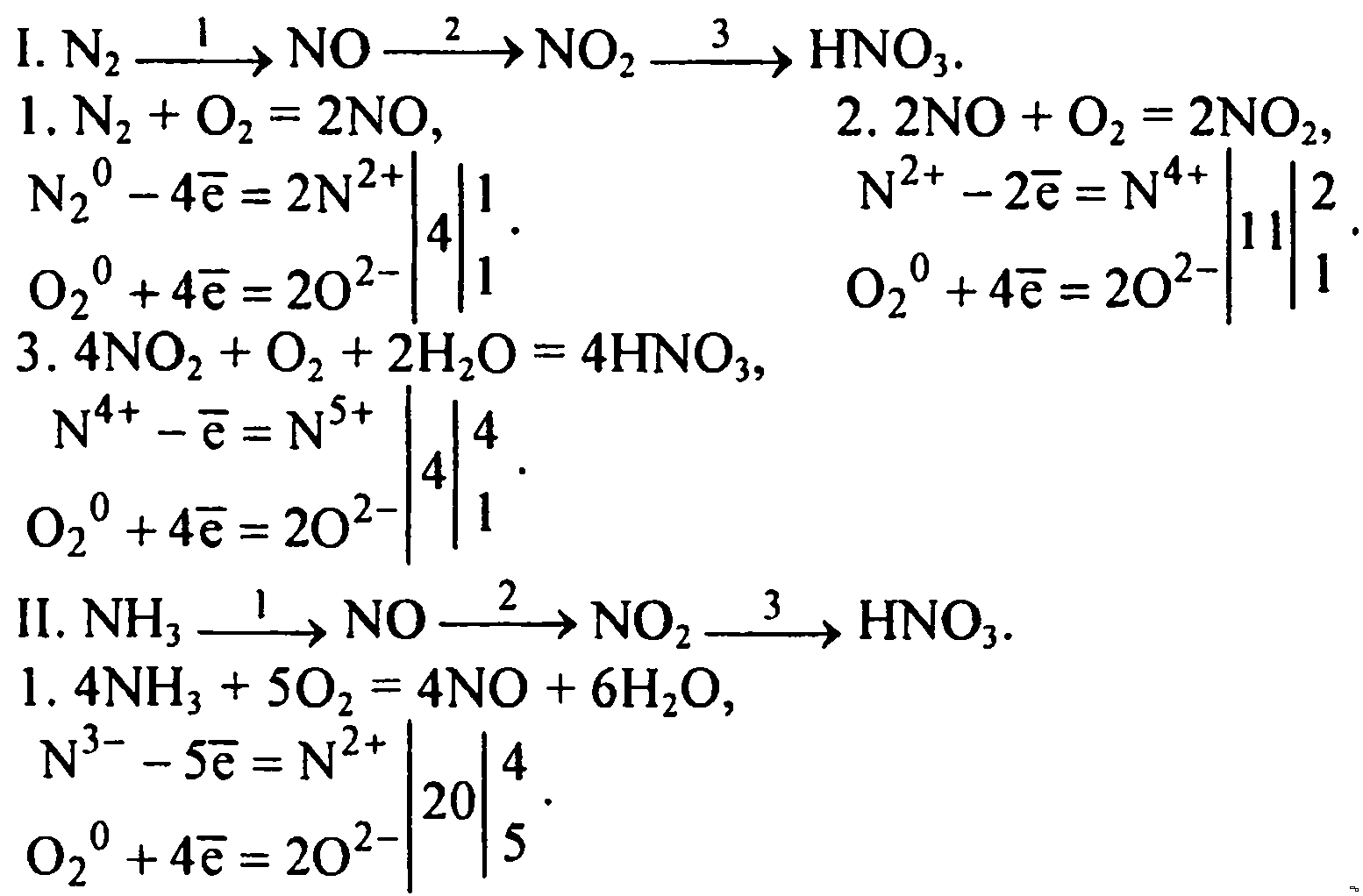 Получение карбоновых кислот и применение.
Получение карбоновых кислот и применение.