Содержание
Селективные изобретения и Роспатент как жупел нагнетаемых страстей вокруг патентования химических соединений
В.Ю. Джермакян,
кандидат технических наук,
Советник, Юридическая фирма «Городисский и Партнеры»
«Журнал Суда по интеллектуальным правам», № 16, июнь 2017 г., с 36-47
На сайте Журнала Суда по интеллектуальным правам опубликована статья А.В. Михайлова (далее — оппонент) «Миф о мифе, или Рождение селективных изобретений из пены бумажной», в которой оппонент излагает свое видение в оценке патентоспособности «селективных» изобретений и утверждает, что авторами1 «вольно или невольно умалчивается о существовании особого подхода к оценке новизны химических соединений, предусмотренной последним абзацем п. 24.5.2(4) Административного регламента». Следующее утверждение приводим полностью:
«Упорство, с которым авторы [2, 3]2 игнорируют существование данной нормы, может создать у читателей представление о том, что известное химическое соединение не может быть повторно запатентовано. Этот неверный вывод служит основой для заявления о том, что никакой проблемы селективных изобретений не существует, а, следовательно, действующее регулирование не нуждается в каком-либо пересмотре».
Этот неверный вывод служит основой для заявления о том, что никакой проблемы селективных изобретений не существует, а, следовательно, действующее регулирование не нуждается в каком-либо пересмотре».
Из этого следует, что оппонент убежден в том, что существование нормы административного регламента Роспатента позволяет повторно запатентовать известное химическое соединение (выделено автором – В.Д.)
Этот же тезис был неоднократно повторен оппонентом на форуме3 ЮрКлуба, но несмотря на многочисленные настойчивые просьбы подтвердить сказанное реальными примерами выданных патентов РФ или патентов Евразийской патентной организации, далее — ЕАПВ на идентичные селективные изобретения оппонент так и не представил ни одного примера, когда известное ранее запатентованное химическое соединение было повторно запатентовано4 с тождественным ранее предоставленному объемом прав, исходя якобы из действующей нормы правила 24.5.2(4) Административного регламента.
Настораживает, когда российское нормативное регулирование5 в области патентного права, используемое Роспатентом многие годы, подвергается сегодня жесткой критике с приписыванием ему всех смертных грехов в области охраны химических соединений, именуемых в частных случаях «селективными изобретениями», не предоставляя при этом ни одного примера из реальных дел, рассмотренных в Палате по патентным спорам Роспатента или в судах, подтверждающих данный, практически обвинительный тезис. Целесообразнее напомнить читателям предысторию публикаций по рассматриваемому вопросу и дать пояснения к выдвинутым6 тезисам.
В Журнале Суда по интеллектуальным правам была опубликована статья7 «Селективное» изобретение: самостоятельный вид или заимствованное условное обозначение изобретений, создаваемых научным методом селекции?», в которой было отмечено:
…«Селективное изобретение» не является понятием, определяющим некий самостоятельный вид химического изобретения, а представляет собой заимствованное из немецкой практики и широко разошедшееся по миру условное обозначение (термин) изобретений, получаемых научным методом селекции, направленным на получение новых объектов в среде им подобных, но обладающих новыми полезными свойствами.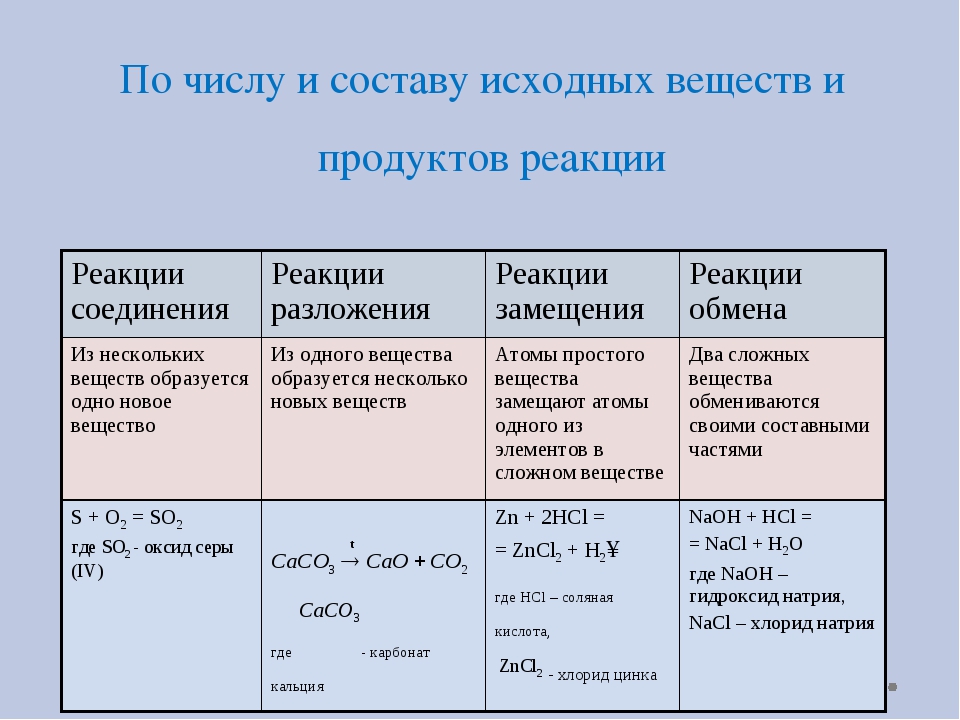
Селективное изобретение относится к химическому соединению (или нескольким соединениям), которые уже входят в известную обширную группу, объединяющую подобные химические соединения, хотя и является новым как таковое. Известность этой группы, охватывающей значительное число структурно родственных химических соединений, не говорит о том, что в нее не будут входить и вновь создаваемые соединения, имеющие общие, но не тождественные признаки химического соединения.
Вторым заблуждением является толкование термина «селективное изобретение» как известного и выбранного из ряда уже ранее запатентованных альтернативных химических соединений, объединенных в структурную группу, именуемую формулой Маркуша, но проявляющего свойства, ранее неизвестные для перечисленных известных альтернативных вариантов соединений.
Тем самым создается и распространяется в различных публикациях, например [9], ошибочная иллюзия того, что селективное изобретение якобы может не отвечать условию патентоспособности «новизна», но тем не менее при выявлении (установлении) нового свойства этого будет достаточно для признания Роспатентом патентоспособности такого изобретения.
Однако это совершенно не соответствует действительности, и оценка новизны конкретного химического соединения по всей совокупности характеризующих его признаков (структура, наличие конкретных заместителей в определенных положениях и взаимное расположение групп и атомов в молекуле) обязательно предшествует принятию во внимание нового свойства этого конкретного соединения, которое относится к техническому результату и служит всего лишь одним из сопутствующих условий признания патентоспособности, но не единственным и самодостаточным.
Рассматриваемое в новой заявке частное (индивидуальное) химическое соединение, хотя и подпадает под общую родовую группу химических соединений, но должно являться тем частным вариантом, который ранее не был раскрыт в уровне техники, т.е. он был не известен (на это прямо указывают нормативные правовые акты, которыми руководствуется Роспатент). В этой ситуации действует стандартный для патентного права принцип: известность общего не порочит новизны частного, и так называемое селективное изобретение, если оно соответствует ВСЕМ условиям патентоспособности (новизна конкретного химического соединения, соответствие его изобретательскому уровню и промышленной применимости), охраняется патентами во всех известных нам странах». (выделено автором, — В.Д.).
(выделено автором, — В.Д.).
Такова фабула моей статьи, на которую последовал ответ оппонента, а до того на форуме ЮрКлуба была развернута присущая таким интернет ресурсам «баталия»8.
В разделе 2. Системные проблемы российского патентного законодательства оппонент пишет:
2) закон9 устанавливает ограничение срока действия исключительных прав 20-25 лет, но в то же время допускает при определенных условиях получение патента на полностью идентичный продукт или способ при выявлении у него ранее неизвестных (но имманентно присущих) особенностей или свойств (селективные изобретения)» (выделено автором, – В.Д.).
Именно этот основной тезис оппонента является ложным по своей сути, т.к. российское законодательство любого уровня не допускало и не допускает получение патента на, словами оппонента, «полностью идентичный продукт или способ».
Если заявленный продукт или способ как изобретения «полностью идентичны» ранее известным, это означает, что они не имеют новизны.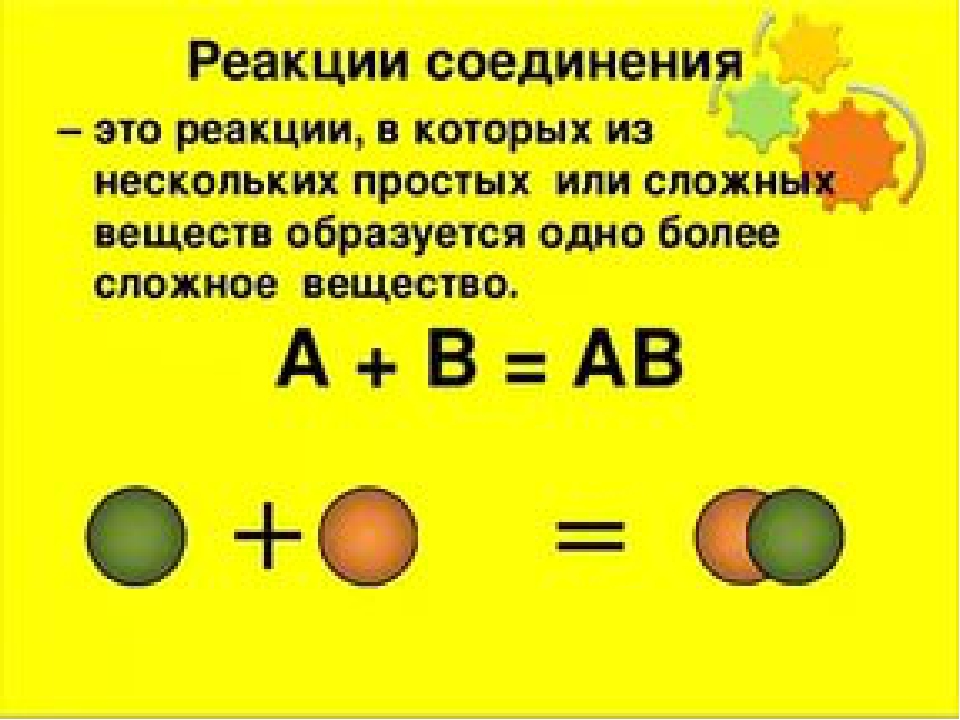 Иначе толковать словосочетания «полностью идентичный» в контексте новизны изобретения невозможно. И как их условно ни называй (селективными, с имманентными признаками и т.п.), — патент на такое известное, т.е. не новое, изобретение получить нельзя в силу нормы по ст. 1350 ГК РФ, согласно которой «Изобретению предоставляется правовая охрана, если оно является новым, имеет изобретательский уровень и промышленно применимо».
Иначе толковать словосочетания «полностью идентичный» в контексте новизны изобретения невозможно. И как их условно ни называй (селективными, с имманентными признаками и т.п.), — патент на такое известное, т.е. не новое, изобретение получить нельзя в силу нормы по ст. 1350 ГК РФ, согласно которой «Изобретению предоставляется правовая охрана, если оно является новым, имеет изобретательский уровень и промышленно применимо».
Раздел 5.3.2. статьи оппонента озаглавлен следующим образом:
«При переходе в общественное достояние более раннего патента на идентичное селективное изобретение более поздний патент действует только применительно к тому назначению, которое связано с вновь открытыми свойствами вещества, даже если такое ограничение не содержится в формуле изобретения более позднего патента». (выделено автором, — В.Д.)
В приведенном названии раздела оппонент опять утверждает об идентичности селективного изобретения, и далее пишет: «Вкупе с положениями законодательства о селективном изобретении это приводит к тому, что становится возможным получить два (или больше) патента с разными датами на одно и то же химическое соединение, если в позднем патенте (в описании, а не в формуле) указано на новую активность известного химического соединения». (выделено автором, — В.Д.).
(выделено автором, — В.Д.).
В сноске к законодательству10 оппонент поясняет:
«Эти положения позволяют получить патент на соединение, которое является частным случаем ранее известной группы соединений, если у него (соединения) выявлены какие-то новые в качественном или количественном отношении свойства».
Во-первых, законодательство не позволяет получить два и более патента с разными датами на одно и то же химическое соединение, а как рассматривается новизна химических соединений и являются ли они «одними и теми же», — можно ознакомиться в деле о возражении11 против выдачи патента Российской Федерации на изобретение № 2114838 «Триазольные производные, фармацевтическая композиция и промежуточные продукты» (Решение от 21 ноября 2016 г. Суда по интеллектуальным правам, дело СИП-295/2016). Заслуживает особого внимания содержание приведенного в судебном решении экспертного заключения РАН, утвержденного бюро Экспертного совета РАН (протокол от 8 ноября 2016 г. № 04-16).
№ 04-16).
Во-вторых, нормативные акты не позволяют получить патент на известное химическое соединение (известное как таковое), если оно действительно является частным случаем ранее известной группы химических соединений.
Иерархическая классификационная подчиненность химических соединений не говорит о том, что все соединения, входящие в эту иерархическую группу, уже известны как таковые. Группа соединений по той или иной химической классификации может быть общая, а входить в нее может множество соединений, как уже известных, так и вновь создаваемых. Это аксиома.
Оппонент, выступая во второй статье с критикой, решил отступиться от своих ранее высказанных представлений о «селективных изобретениях».
Еще раз напомним ранее высказанное оппонентом: «Закон устанавливает ограничение срока действия исключительных прав 20-25 лет, но в то же время допускает при определенных условиях получение патента на полностью идентичный продукт или способ при выявлении у него ранее неизвестных (но имманентно присущих) особенностей или свойств (селективные изобретения)» (выделено автором, — В. Д.)
Д.)
Теперь оппонент во второй статье12, пишет:
«Содержание понятия “селективное изобретение” в разных юрисдикциях и работах различных специалистов сильно различается. Поэтому, во избежание терминологических разногласий, важно сразу определить, что именно вкладывается в понятие “селективное изобретение”».
Во-первых, никто ранее не мешал оппоненту определиться, что именно вкладывается им в понятие «селективное изобретение», а во-вторых, «разные юрисдикции» не имеют никакого отношения к критике административного регламента Роспатента и практики выдачи патентов на не новые, но «селективные изобретения».
В моей первой статье приведены ссылки на ответы в отношении «селективных изобретений из разных стран, и практически все «разные юрисдикции» повторили13 однозначно: «селективное изобретение» как и любое иное изобретение, должно отвечать всем условиям патентоспособности, т.е. «новизна» для них является обязательным условием.
Возможно, что ведомство совершило ошибку, проглядев ссылку в известном уровне техники, выдав второй патент на идентичное изобретение; но такой патент легко аннулируется14 в апелляционной инстанции как не соответствующий новизне.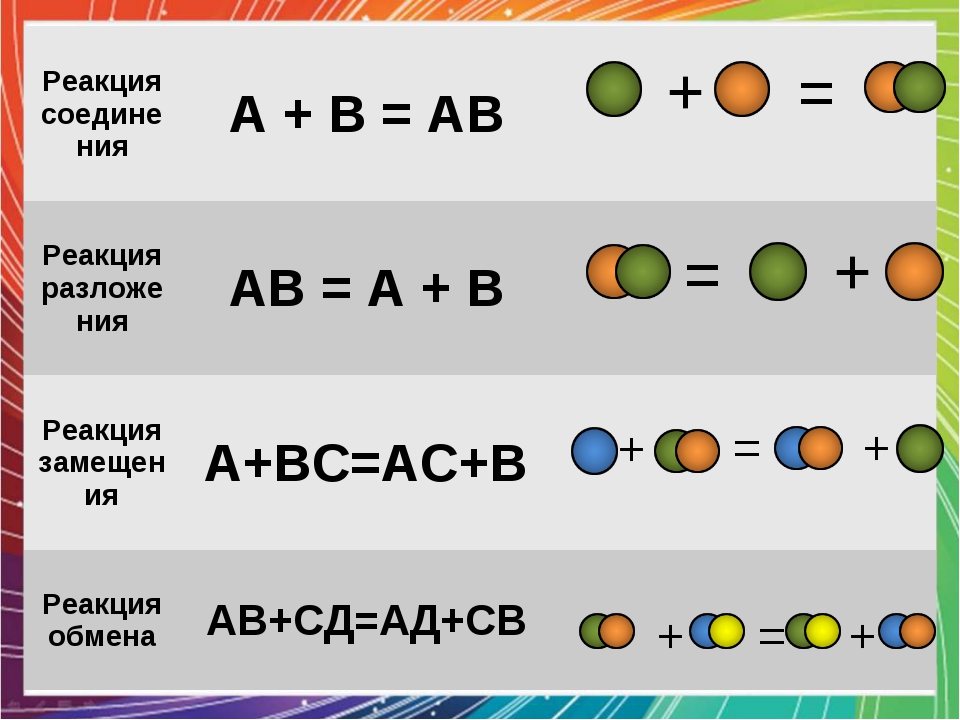 Ничего неординарного в этом нет, и такая процедура присуща патентным законодательствам всех стран.
Ничего неординарного в этом нет, и такая процедура присуща патентным законодательствам всех стран.
Но обратимся теперь к предлагаемой оппонентом квалификации «селективных изобретений»:
«В настоящей статье селективными изобретениями будут называться такие, которые представляют собой выбор какого-либо конкретного химического соединения, из источника, в котором все его признаки полностью раскрыты, но соединение представлено в одном ряду с множеством других аналогичных соединений. Под полным раскрытием подразумевается, что соединение из источника полностью совпадает с таковым по селективному изобретению, а не отличается от него какими-то дополнительными признаками. Это важное уточнение исключает из дискуссии похожие ситуации. Например, к селективным изобретениям мы не относим ситуацию с патентами на клопидогрел, приведенную в статье [2]15, так как из одного патента был известен клопидогрел-молекула, а из другого — клопидогрел в кристаллической форме. В более раннем патенте какие-либо кристаллические формы не были упомянуты. Это само по себе исключает ситуацию выбора конкретного варианта из числа известных вариантов, что и отличает селективные изобретения от всех прочих. Не удивительно, что изобретение по второму патенту было признано новым. К описанному в [2] случаю применяются самые обычные подходы к оценке новизны и изобретательского уровня, а упоминание правоприменителем «селективных изобретений» в данном случае представляется некорректным. Поэтому далее мы будем говорить только о ситуациях, когда имеет место полное совпадение признаков селективного изобретения с признаками одного из конкретных вариантов из более ранней публикации.
Это само по себе исключает ситуацию выбора конкретного варианта из числа известных вариантов, что и отличает селективные изобретения от всех прочих. Не удивительно, что изобретение по второму патенту было признано новым. К описанному в [2] случаю применяются самые обычные подходы к оценке новизны и изобретательского уровня, а упоминание правоприменителем «селективных изобретений» в данном случае представляется некорректным. Поэтому далее мы будем говорить только о ситуациях, когда имеет место полное совпадение признаков селективного изобретения с признаками одного из конкретных вариантов из более ранней публикации.
Для простоты мы воздержимся от рассмотрения сложных ситуаций, когда нельзя однозначно сказать, был ли в ранее опубликованном источнике раскрыт какой-то конкретный вариант или нет — ввиду неопределенности формулировок. Например, если в источнике раскрыт «фенил, замещенный алкилом», нельзя с полной уверенностью сказать, что в данном случае речь идет о «фениле, замещенном н-октилом», поскольку понятие «алкил» настолько неопределенное, что охватывает бесчисленное количество конкретных вариантов.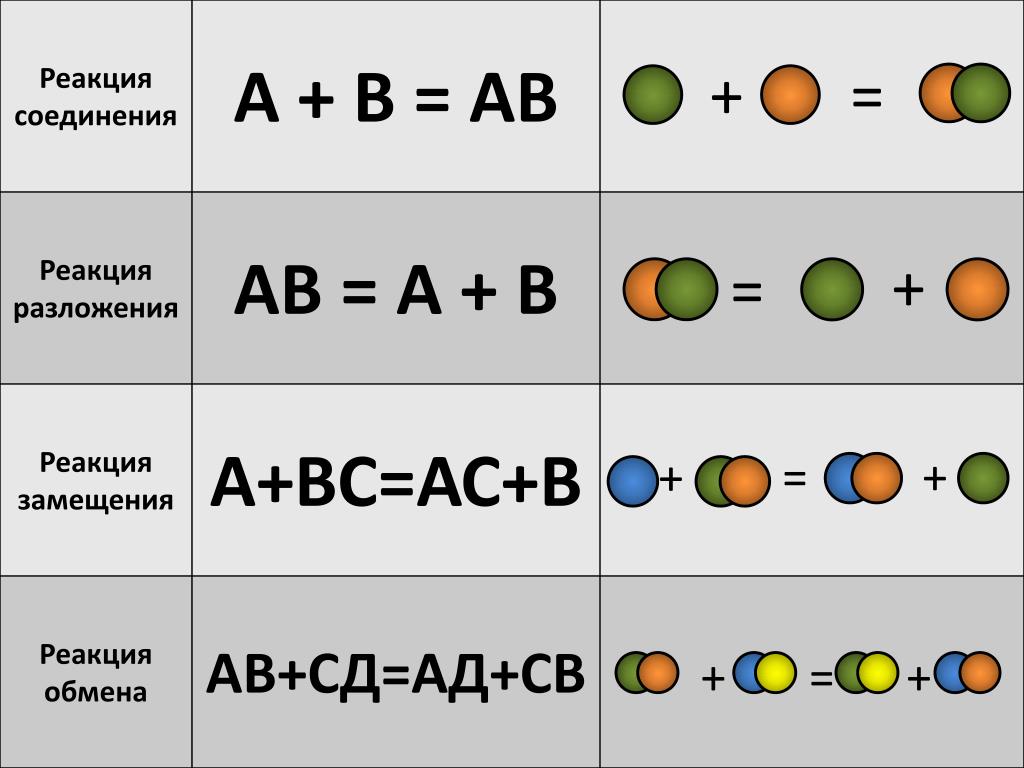 Мы же будем рассматривать ситуации, при которых количество конкретных вариантов пусть и велико, но все же ограничено, и все они могут быть выведены специалистом из имеющихся структурных формул.
Мы же будем рассматривать ситуации, при которых количество конкретных вариантов пусть и велико, но все же ограничено, и все они могут быть выведены специалистом из имеющихся структурных формул.
Эти уточнения позволят нам избежать дискуссии о соотношении особых подходов к селективным изобретениям и общего для всех видов изобретений подхода, согласно которому источник, содержащий более общее раскрытие, не противопоставляется по заявке, на охрану какого-то частного варианта, который хотя и охватывается общим раскрытием, но содержит дополнительные (видовые) признаки, не упомянутые в общем раскрытии. Применительно к таким ситуациям можно полностью согласиться с утверждением: «Рассматриваемое в новой заявке частное (индивидуальное) химическое соединение, хотя и подпадает под общую родовую группу химических соединений, но должно являться тем частным вариантом, который ранее не был раскрыт в уровне техники, т.е. он был не известен (на это прямо указывают нормативные правовые акты, которыми руководствуется Роспатент).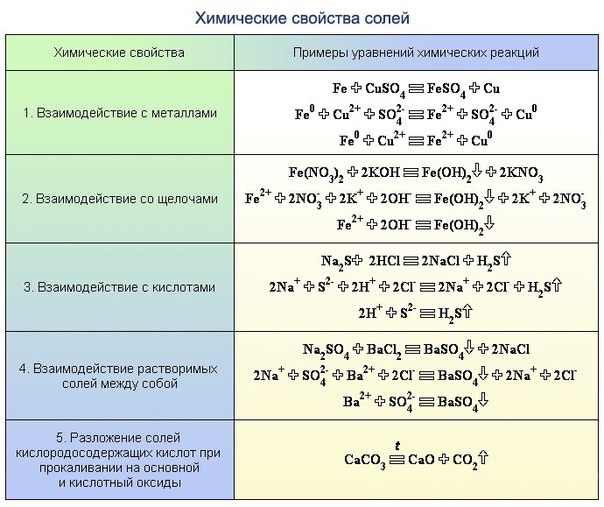 В этой ситуации действует стандартный для патентного права принцип: известность общего не порочит новизны частного, и так называемое селективное изобретение, если оно соответствует ВСЕМ условиям патентоспособности (новизна конкретного химического соединения, соответствие его изобретательскому уровню и промышленной применимости), охраняется патентами во всех известных нам странах» [2].» (курсивом выделена цитата из ранней статьи автора, – В.Д.)
В этой ситуации действует стандартный для патентного права принцип: известность общего не порочит новизны частного, и так называемое селективное изобретение, если оно соответствует ВСЕМ условиям патентоспособности (новизна конкретного химического соединения, соответствие его изобретательскому уровню и промышленной применимости), охраняется патентами во всех известных нам странах» [2].» (курсивом выделена цитата из ранней статьи автора, – В.Д.)
Оппонент подчеркивает: «Поэтому далее мы будем говорить только о ситуациях, когда имеет место полное совпадение признаков селективного изобретения с признаками одного из конкретных вариантов из более ранней публикации».
Однако, если «имеет место полное совпадение признаков селективного изобретения с признаками одного из конкретных вариантов из более ранней публикации», то в таком случае имеет место отсутствие новизны изобретения; и никаких дискуссий об этом никто не ведет; и Роспатент не предусматривает нормативными документами возможности выдач патентов на такие изобретения «с полным совпадением признаков».
В своей публикации подчеркивал: «… Оценка новизны конкретного химического соединения по всей совокупности характеризующих его признаков (структура, наличие конкретных заместителей в определенных положениях и взаимное расположение групп и атомов в молекуле), обязательно предшествует принятию во внимание нового свойства этого конкретного соединения, которое (свойство), относящееся к техническому результату, служит всего лишь одним из сопутствующих условий признания патентоспособности, но не единственным и самодостаточным».
Оппонент вложил в предложенное им понятие селективного изобретения на уже упоминавшемся ресурсе16 ЮрКлуба следующим образом:
«Я уже ответил, что рассматриваемые патенты к тому случаю селективных изобретений, который меня интересует (чистые молекулы, без кристаллов, солей и прочей озеленительной дребедени) не относятся. Это типичные второсортные патенты, какая-никакая новизна в них есть, поэтому говорить о выборе одного или нескольких конкретных технических решений из большого ряда известных технических решений не приходится».
Вряд ли имеет смысл останавливаться на таких сентенциях и квалификации изобретений как «прочей озеленительной дребедени». Ну, интересуют оппонента только те селективные изобретения, которые «с чистыми молекулами, но без кристаллов, солей и прочей озеленительной дребедени», и пусть интересуют, но это не имеет никакого отношения к критике нормативной базы Роспатента. Если оппонент хочет ограничить отнесение к селективным изобретениям в области химических соединений только теми из них, которые он обозначает «чистыми молекулами», так это его личное мнение, и больше ничего. Но я уже приводил ссылки в первой статье на решения Роспатента (ППС), а сейчас и на далее указанное решение Суда по интеллектуальным правам, содержащее заключение специалистов РАН, которые не рассматривают химические соединения только по признакам «чистых молекул». Такой подход не имеет под собой абсолютно никакого научного обоснования.
Оппонент пишет: «Следует отметить, что на момент выдачи патента № 2195446 в законодательстве отсутствовали какие-либо нормы о новизне или изобретательском уровне селективных изобретений».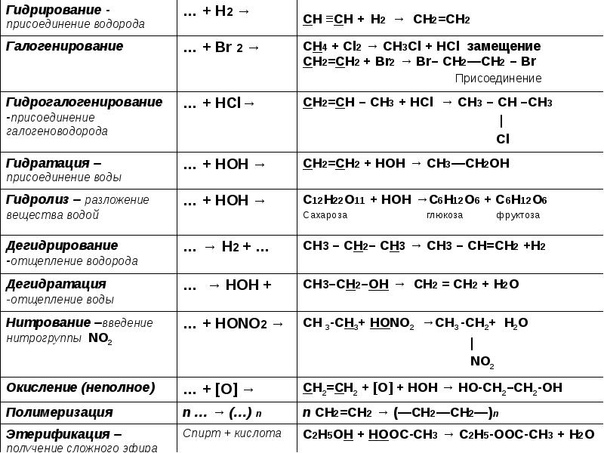 Но это опять же не соответствует действительности по той причине, что «селективные изобретения» никогда не рассматривались в отрыве от общих для всех изобретений условий патентоспособности, и как некие особые объекты, требующие своего, сугубо специфического правового регулирования в отрыве или даже в противовес общим нормам.
Но это опять же не соответствует действительности по той причине, что «селективные изобретения» никогда не рассматривались в отрыве от общих для всех изобретений условий патентоспособности, и как некие особые объекты, требующие своего, сугубо специфического правового регулирования в отрыве или даже в противовес общим нормам.
Условно названное «селективное изобретение» должно отвечать условиям новизны, изобретательского уровня и промышленной применимости. Когда в качестве «селективного изобретения» рассматривается именно индивидуальное химическое соединение, то если оно получено впервые, это уже означает, что оно новое. Если ранее описанное всеми конкретными признаками индивидуальное химическое соединение просто воспроизведено и именно с теми же известными признаками, то оно не считается новым со всеми вытекающими из этого последствиями при решении вопроса о выборе объекта патентования.
Далее оппонент рассматривает пример соединения, входящего, как он считает, в предложенную им классификацию «селективных изобретений», говоря его словами, с «чистыми молекулами»:
«Данное соединение является выбором конкретного варианта из числа описанных посредством общей структурной формулы в патенте РФ № 2147574 (который действовал с 21 августа 1992 г. по 22 августа 2017 г.) и № 2195446 (действует до 24 октября 2020 г.). Общий срок патентной охраны цинакалцета указанными патентами составляет 28 лет. Оба патента наряду с другими соединениями охраняют цинакалцет и при этом не отличаются даже в части назначения или биологической активности. Это возможно благодаря тому, что закон не требует указывать назначение или активность химического соединения в независимом пункте формулы изобретения (что также является особенностью изобретений в области химии)».
по 22 августа 2017 г.) и № 2195446 (действует до 24 октября 2020 г.). Общий срок патентной охраны цинакалцета указанными патентами составляет 28 лет. Оба патента наряду с другими соединениями охраняют цинакалцет и при этом не отличаются даже в части назначения или биологической активности. Это возможно благодаря тому, что закон не требует указывать назначение или активность химического соединения в независимом пункте формулы изобретения (что также является особенностью изобретений в области химии)».
Мнение оппонента о том, что патенты из приведенного им примера не отличаются один от другого, не подкреплены фактическим рассмотрением спора в Роспатенте или суде. Обратим внимание лишь на то, что патент № 2195446 продлен до 2020 г. и действует до сих пор. Если в этом патенте позже приводится одно и то же химическое соединение, которое уже было полностью раскрыто по всем признакам в раннем патенте, всегда можно подать возражение в Палату по патентным спорам Роспатента.
До тех пор пока такого рассмотрения не было, говорить о том, что в данных патентах «запатентовано одно и то же химическое соединение», некорректно.
Оппонент процитировал ранее действовавшие Рекомендации17:
«1.9.1.9. Изобретение, относящееся к индивидуальному химическому соединению с установленной структурой, удовлетворяет условию новизны, если эта структура не известна из уровня техники. Однако, если структура известна, но в источнике информации (например, научном или научно-популярном журнале или патенте), в котором она приведена, отсутствуют сведения о способе получения соединения, данные его структурного анализа, сведения о физико-химических или иных свойствах, изобретение также удовлетворяет условию новизны».
А далее оппонент отметил:
«Но именно с Рекомендаций18 данный сомнительный подход начал широко применяться Роспатентом. Этот подход к новизне был узаконен лишь спустя 10 лет, в 2009 г., в момент принятия Административного регламента, где в п. 24.5.2(4) говорится:
«(4) Изобретение признается известным из уровня техники и не соответствующим условию новизны, если в уровне техники раскрыто средство, которому присущи все признаки изобретения, выраженного формулой, предложенной заявителем <…>
Химическое соединение, подпадающее под общую структурную формулу группы известных соединений, признается новым, если оно не раскрыто как таковое и отсутствуют какие-либо сведения относительно исходных соединений, способа его получения или его свойств».
Отсюда ясно, что общая структурная формула — это не частная структурная формула варианта химического соединения как такового, и никаких сомнений в признании такого варианта соединения новым нет.
Точно так же и с той же логикой об известности общей структурной формулы как якобы порочащей новизну частного конкретного соединения, подпадающего под эту общую структурную формулу, думали лица, безуспешно пытавшиеся четырежды аннулировать патент № 2114838. В конечном итоге Суд по интеллектуальным правам 21 ноября 2016 г. принял решение (дело СИП-295/201619) об отказе в удовлетворении иска, направленного против решения Роспатента, сохранившего действительность патента. В решении суда цитируется экспертное заключение, подготовленное Российской академией наук, в которую обратился суд за получением разъяснений специалистов по вопросам, относящимся к индивидуальным химическим соединениям из сравниваемых патентов.
Данное заключение специалистов РАН показывает, в чем могут усматриваться характеристики (признаки) индивидуальных химических соединений, определяющих их как новые.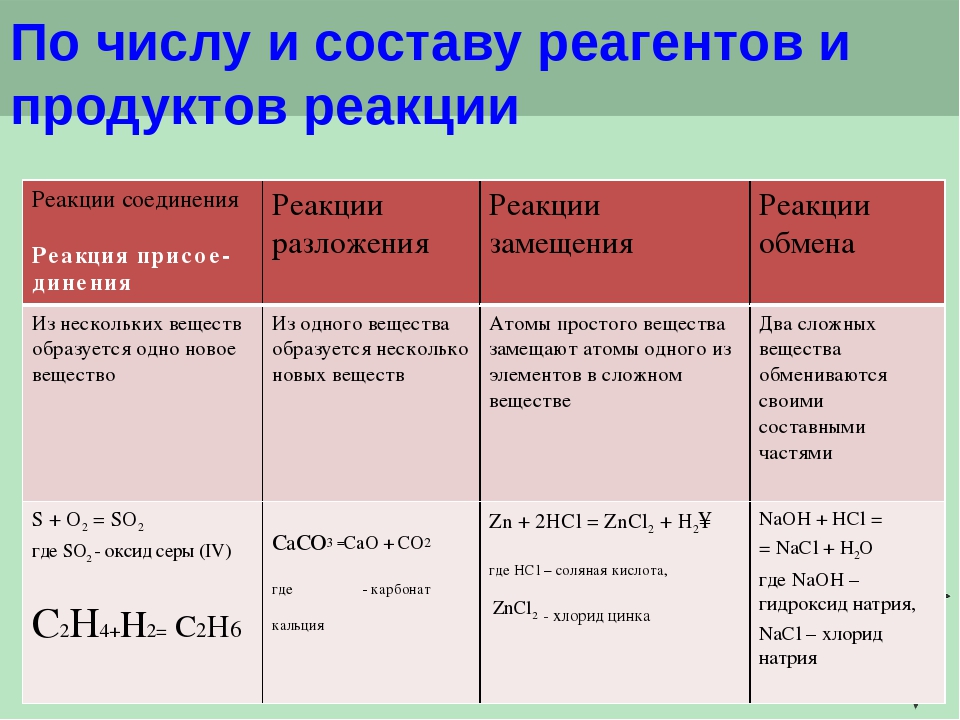 Приведем выписку из утвержденного экспертного заключения, процитированного в судебном решении:
Приведем выписку из утвержденного экспертного заключения, процитированного в судебном решении:
[1. Охарактеризовано ли в патенте Российской Федерации №2095358; европейской патентной заявке ЕР №89307920.2; патенте Союза Советских Социалистических Республик № 1836366, хотя бы одно индивидуальное химическое соединение, входящее в группу соединений, охарактеризованных общей формулой 1 в независимом пункте 1 патента Российской Федерации № 2114838, или соединение зависимого пункта 10, или вся группа соединений в целом, в том виде как она охарактеризована в пункте 1 формулы изобретения патента Российской Федерации № 2114838, структурной формулой и/или химическим названием, и/или физико-химическими данными и/или данными по активности? При ответе на вопросы, поставленные судом с целью правильного рассмотрения настоящего дела, просьба ссылаться на открытые источники информации, опубликованные не позднее даты подачи заявки на изобретение – 02.02.1990.
Ответ
В европейской патентной заявке ЕР № 89307920.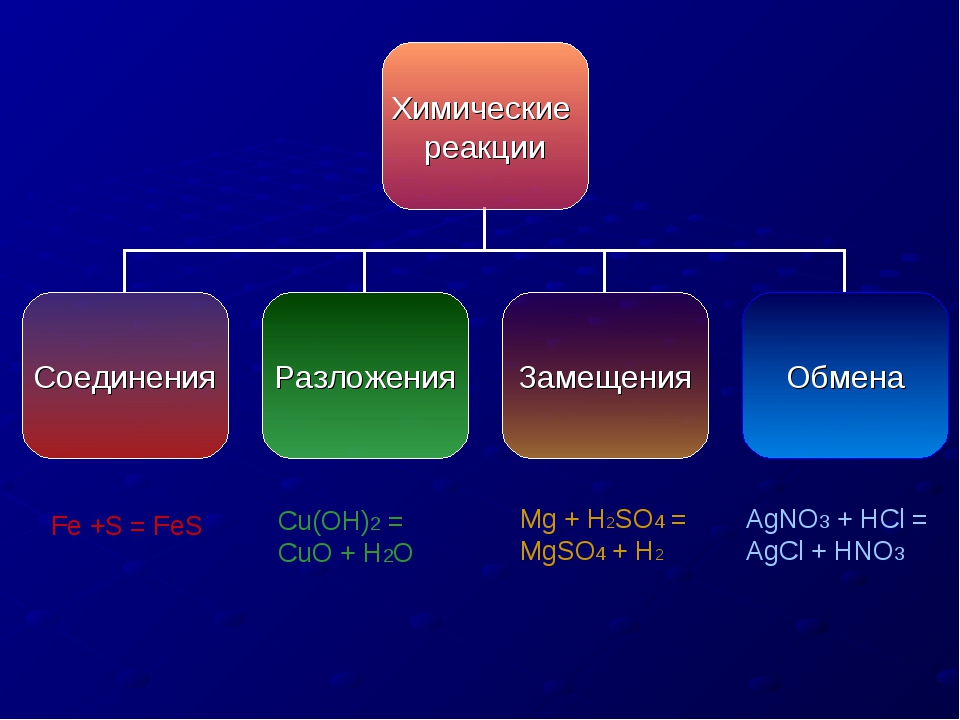 2, патенте Российской Федерации № 2095358 и патенте Союза Советских Социалистических Республик № 1836366 формулы изобретения включают соединения, удовлетворяющие общей формуле 1 патента Российской Федерации № 2114838, однако, ни одно индивидуальное химическое соединение, удовлетворяющее общей формуле 1 патента РФ № 2114838, в европейской патентной заявке ЕР № 89307920.2, патенте РФ № 2095358 и патенте СССР № 1836366 не охарактеризовано и не включено в список примеров. Ключевым отличием соединений, охарактеризованных в примерах заявки ЕР № 89307920.2, является отсутствие галогенного заместителя в шестичленном гетероцикле, в то время как для соединений патента РФ № 2114838 наличие такого заместителя(-ей) является обязательным и зафиксировано в орто-положении по отношению к основной части молекулы (положение обозначено в общей формуле 1 независимого пункта 1 патента РФ № 2114838 буквой Y). В примере 24 патента РФ № 2095358 и примере 10 патента СССР № 1836366 охарактеризовано соединение 3-(6-хлор-4-пиримидинил)-2-(2,4-дифторфенил)-1-(1Н-1,2,4-триазол-1-ил-бутан)-2-ол, галогенный заместитель в котором находится в положении 6, вследствие чего это соединение не удовлетворяет общей формуле 1 независимого пункта 1 патента РФ № 2114838.
2, патенте Российской Федерации № 2095358 и патенте Союза Советских Социалистических Республик № 1836366 формулы изобретения включают соединения, удовлетворяющие общей формуле 1 патента Российской Федерации № 2114838, однако, ни одно индивидуальное химическое соединение, удовлетворяющее общей формуле 1 патента РФ № 2114838, в европейской патентной заявке ЕР № 89307920.2, патенте РФ № 2095358 и патенте СССР № 1836366 не охарактеризовано и не включено в список примеров. Ключевым отличием соединений, охарактеризованных в примерах заявки ЕР № 89307920.2, является отсутствие галогенного заместителя в шестичленном гетероцикле, в то время как для соединений патента РФ № 2114838 наличие такого заместителя(-ей) является обязательным и зафиксировано в орто-положении по отношению к основной части молекулы (положение обозначено в общей формуле 1 независимого пункта 1 патента РФ № 2114838 буквой Y). В примере 24 патента РФ № 2095358 и примере 10 патента СССР № 1836366 охарактеризовано соединение 3-(6-хлор-4-пиримидинил)-2-(2,4-дифторфенил)-1-(1Н-1,2,4-триазол-1-ил-бутан)-2-ол, галогенный заместитель в котором находится в положении 6, вследствие чего это соединение не удовлетворяет общей формуле 1 независимого пункта 1 патента РФ № 2114838. Структурные формулы, химические названия, физико-химические характеристики или данные по активности соединений, охарактеризованных в патенте РФ № 2114838, отсутствуют в патентной заявке ЕР № 89307920.2, патенте РФ № 2095358 и патенте СССР № 1836366.»]
Структурные формулы, химические названия, физико-химические характеристики или данные по активности соединений, охарактеризованных в патенте РФ № 2114838, отсутствуют в патентной заявке ЕР № 89307920.2, патенте РФ № 2095358 и патенте СССР № 1836366.»]
Как говорится, комментарии излишни.
Далее в статье оппонент, как минимум, в двух абзацах статьи, нагнетает, а иначе не сказать, обстановку в отношении якобы имеющей место негативной практике Роспатента при выдаче патентов на «селективные изобретения»:
— «…Однако для целей настоящей статьи мы хотели бы привести именно этот пример, так как он лучше всего иллюстрирует обсуждаемую проблему: в отличие от периода до 2009 г., когда выдачу патента № 2195446 можно было бы назвать ошибкой, с момента вступления в силу Административного регламента правовое регулирование никак не препятствует регистрации подобных изобретений. Мы видим в этом серьезную угрозу, которой могут воспользоваться не вполне добросовестные заявители из-за рубежа и России»;
— «На протяжении 10 лет патенты на селективные изобретения в области химии выдавались вопреки общей норме п. 19.5.2 Правил-93 и всех последующих Правил о том, что заявленное изобретение не считается новым, если все его признаки раскрыты в том или ином источнике, являющемся частью уровня техники». (выделено автором, — В.Д.)
19.5.2 Правил-93 и всех последующих Правил о том, что заявленное изобретение не считается новым, если все его признаки раскрыты в том или ином источнике, являющемся частью уровня техники». (выделено автором, — В.Д.)
Ни одного реального патента, выданного вопреки общей норме, оппонент так и не привел, несмотря на многократные обращения на названном форуме ЮрКлуба, хотя казалось, если такие патенты выдавались аж целых 10 лет, так их должен быть не один десяток, если не сотни.
Я не проводил анализ всего российского, да и евразийского, патентных фондов, и не искал в них «селективных изобретений». Для меня это бессмысленное занятие, но провел анализ тех патентов, которые оспаривались20 в Палате по патентным спорам Роспатента, в тексте решений по которым хотя бы упоминалось словосочетание – «селективное изобретение». Их оказалось всего шесть: №2114838, 2137766, 2143804, 2132134, 2132134, 2047607. Все названные патенты в результате оспаривания патентоспособности признаны Роспатентом патентоспособными и действительными.
Поиск проводился с момента публикаций решений Роспатента (ППС) и по правовой базе. Полученные данные говорят сами за себя.
Оппонент удивленно высказывает:
«…Ведь все высказанное им в отношении селективных изобретений связано с тем, что в [5] он позволил себе упомянуть о п. 24.5.2 (4) Административного регламента, который хотя и устранил указанную ошибку Роспатента, но ввиду своей крайней неудачности привел к появлению угрозы повторной защиты одного и того же соединения. Еще большее недоумение вызывает тот факт, что вся критика тезиса об опасности повторной защиты в области химии сводится либо к отрицанию, либо к затушевыванию самого факта существования указанной нормы».
Полученные сведения об отсутствии реально выданных и успешно оспоренных патентах не подтверждают мнения оппонента о существовании нормативно обусловленной угрозы повторной защиты одного и того же химического соединения.
Еще раз подчеркну, что изобретение, как бы его ни называли, не будет запатентовано21, если оно не отвечает условию патентоспособности – новизна. Оно не будет также запатентовано, если не соответствует изобретательскому уровню или промышленной применимости, но мы в статье не рассматриваем эти ситуации, т.к. оппонент все время говорит об «идентичности» старого и нового изобретений, т.е. ставит под сомнение толкование условия новизны изобретения.
Оно не будет также запатентовано, если не соответствует изобретательскому уровню или промышленной применимости, но мы в статье не рассматриваем эти ситуации, т.к. оппонент все время говорит об «идентичности» старого и нового изобретений, т.е. ставит под сомнение толкование условия новизны изобретения.
Оппонент ошибается, когда в двух процитированных ниже абзацах интерпретирует содержание противопоставляемых документов:
—
[Итак, новизна химического соединения будет признана согласно п. 24.5.2 (4) даже в том случае, когда все его признаки раскрыты в уровне техники, но по каким-то причинам не приведены «сведения о [его] физико-химических или иных свойствах».]
—
[Вразрез с европейской практикой согласно действующей норме пункта 24.5.2 (4) Административного регламента, соединение будет признано новым и тогда, когда оно является выбором из одного списка, и даже тогда, когда оно прямо упомянуто и индивидуализировано в уровне техники, но не приведены его физико-химические данные, температура плавления и т. п.]
п.]
Реально в п. 24.5.2 (4) написано все совершенно наоборот (цитирую):
«Изобретение признается известным из уровня техники и не соответствующим условию новизны, если в уровне техники раскрыто средство, которому присущи все признаки изобретения, выраженного формулой, предложенной заявителем.
Химическое соединение, подпадающее под общую структурную формулу группы известных соединений, признается новым, если оно не раскрыто как таковое и отсутствуют какие-либо сведения относительно исходных соединений, способа его получения или его свойств».
Таким образом, химическое соединение, хотя и подпадающее под общую структурную формулу, признается новым, если оно не раскрыто как таковое, т.е. не раскрыты все его признаки, о которых говорится в первом абзаце данного правила, и только после этого говорится о том, что при этом учитывается также отсутствие сведений о свойствах и т. п. Никакого самостоятельного значения вне учета других, указанных в норме условий, отсутствие сведений о свойствах (при оценке новизны самого химического соединения) не имеет.
п. Никакого самостоятельного значения вне учета других, указанных в норме условий, отсутствие сведений о свойствах (при оценке новизны самого химического соединения) не имеет.
Когда все признаки химического соединения (как и любого иного изобретения) раскрыты в уровне техники, то уже не приходиться говорить о новизне самого химического соединения как объекта патентования, т.к. ее (новизны) просто нет.
Если химическое соединение известно по признакам (как таковое), то оно не может быть само вновь запатентовано как химическое соединение. При установлении ранее не известных свойств известного химического соединения патентуется не химическое соединение как таковое, а его применение по определенному и новому для данных соединений назначению22, что никак не может быть приравнено по объему прав к патентованию непосредственного химического соединения как такового.
Обвинения о якобы принятой в России нормативной базе, способствующей выдаче патентов на изобретения в области химических соединений, не соответствующие новизне, должны быть подтверждены не ссылками на мнения и публикации различных специалистов, пугающих население по принципу «пробирки Коллина Пауэла»23, а ссылками и анализом судебных столкновений по реальным патентам РФ и ЕАПВ24 на «селективные изобретения».
Оппонент также пишет: «Европейское регулирование, на которое обычно ссылаются отечественные специалисты, не признаёт соединение, подпадающее под ранее известную общую структурную формулу новым лишь на том основании, что оно не поименовано и не приведены его физико-химические данные. Более того, согласно уже упомянутой монографии [10] ЕПВ может применять и более жесткие подходы, нежели принцип двух списков: «Если заявлена группа соединений, описанная общей структурной формулой, которая включает хотя бы одно известное соединение [под известностью, как следует из контекста, понимается в том числе раскрытие в виде общей структурной формулы, если при этом раскрыты способы, которыми могут быть получены конкретные соединения по структурной формуле. — Прим. А.М.], такое изобретение не признается новым».
Но и это искажение толкования реального правила ЕПВ. Если убрать из текста правила ЕПВ неправильный ее комментарий оппонентом, то получим: «Если заявлена группа соединений, описанная общей структурной формулой, которая включает хотя бы одно известное соединение, такое изобретение не признается новым».
Сказано совершенно верно, т.к. речь идет в этом правиле о ситуации, когда в группу соединений по общей структурной формуле включено хотя бы одно, но уже известное соединение. Это тот самый случай, когда мы говорили о тех формулах, которые включают множество альтернативных вариантов, и когда новизна такого объекта в виде множества альтернатив не признается при известности хотя бы одной из них. Но ведь оппонент исказил данное содержание, написав, что под известностью понимается в том числе раскрытие в виде общей структурной формулы, если при этом раскрыты способы, которыми могут быть получены конкретные соединения по структурной формуле (выделено автором, — В.Д.).
Если раскрыт способ, информация из которого неизбежно ведет к признакам конкретного соединения с присущими только ему признаками, — это одно; но раскрытие способа в объеме, не свидетельствующем о возможности получения конкретного соединения, — это другое. Неспроста в упомянутом правиле ЕПВ способ вообще не упоминается как некое основание для отрицания новизны конкретного химического соединения при известности общей структурной формулы.
Далее, рассуждая на тему «селективных изобретений», оппонент пишет: «Пожалуй, российское законодательство в этом смысле является самым мягким в мире по отношению к селективным изобретениям, и нам следует задуматься о соблюдении баланса частных и публичных интересов».
Полагаю, что прежде чем оценивать «мягкость» российского законодательства, лучше задуматься о действительном его содержании, тем более когда оппонент позиционирует себя в статье не только как патентный поверенный РФ и ЕАПВ, но и как независимый патентный специалист в области фармацевтики.
Не буду отвечать на вопросы оппонента, которые порождены статьями и иными публикациями других специалистов. И не потому, что на них нет ответа, а потому, что они сами, если посчитают нужным, могут ответить, но на критику по публикации, в которой я являюсь одним из авторов, бесспорно отвечу.
Оппонент пишет:
[И что заставило моего уважаемого оппонента В.Ю. Джермакяна отступиться от собственного вывода [10]:
«Отечественную практику проверки соответствия изобретения, относящегося к органическим соединениям, охарактеризованным при помощи формулы Маркуша, отличают излишне строгие требования к информации об известных веществах, которая должна содержаться в противопоставленном документе. Фактически соединение признается известным, только если описана конкретная методика его получения или физико-химические константы. При противопоставлении патентных документов российские эксперты должны учитывать только соединения, для которых приведены примеры получения или применения».]
Фактически соединение признается известным, только если описана конкретная методика его получения или физико-химические константы. При противопоставлении патентных документов российские эксперты должны учитывать только соединения, для которых приведены примеры получения или применения».]
Нет с моей стороны никакого отступления. В цитате из публикации25 написано, что при противопоставлении должны учитываться только те соединения, для которых приведены примеры получения или применения, а приведение конкретной методики получения химического соединения или приведение его физико-химических констант является излишним.
Нужно понимать, что «пример получения» приводится тогда, когда патентуется непосредственно новое химическое соединение и нужно показать принципиальную возможность его получения, а «пример применения» приводится в ситуации, когда патентуется не соединение как таковое без указания назначения, а когда патентуется его применение по определенному назначению или когда патентуется соединение с указанием конкретного назначения, возможность достижения которого подтверждается примерами в отношении осуществления назначения и/или достижения свойств. При этом совершенно не исключено предоставление в одной заявке разных примеров, качественная составляющая которых определяется разновидностями патентуемых в одной заявке групп изобретений.
При этом совершенно не исключено предоставление в одной заявке разных примеров, качественная составляющая которых определяется разновидностями патентуемых в одной заявке групп изобретений.
Как правило, заявитель не заинтересован раскрывать конкретную методику получения химического соединения, особенно тогда, когда конкретная методика является секретом производства, если речь идет о патентовании самого соединения.
Поэтому мы в статье с соавторами уже писали о том, что заявитель должен показать пример получения соединения или пример применения, а не конкретную методику его получения и т.п.
Именно в требовании раскрытия конкретной методики получения химического соединения усматривалась нами излишняя строгость отечественного законодательства. Когда объектом патентования является химическое соединение, по нашему мнению, является достаточным предоставление примера получения самого химического соединения или примера его применения, в зависимости от испрашиваемого объема прав, а не предоставление в обязательном порядке конкретных методик и физико-химических констант.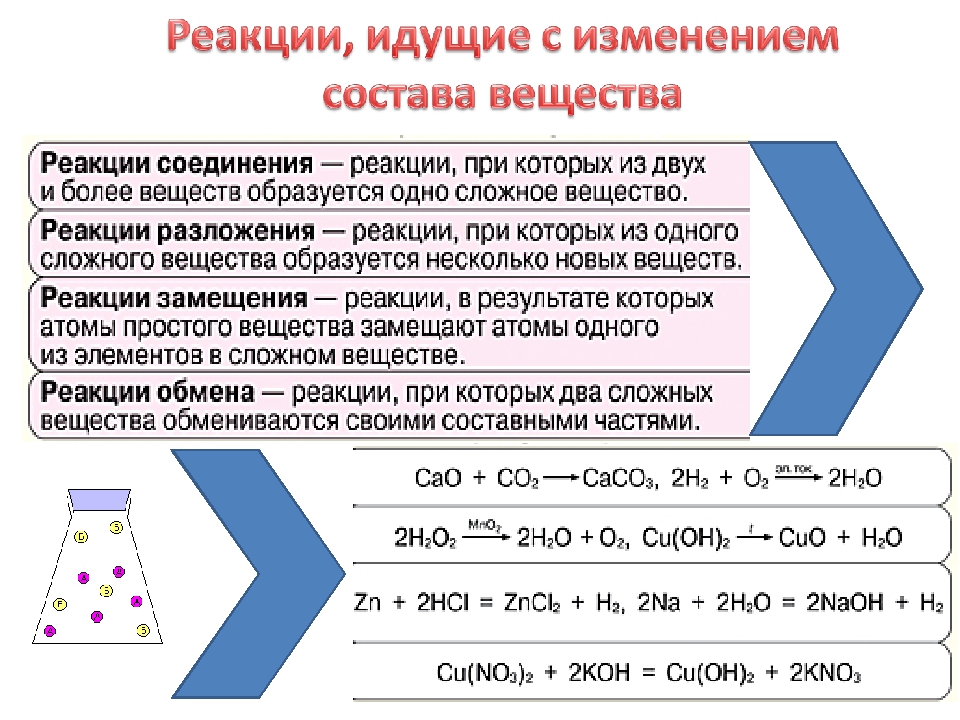
Вряд ли профессиональному сообществу нужно показывать разницу между конкретной методикой получения химического соединения и примером его получения, сведения из которого должны быть достаточными для подтверждения промышленной применимости заявляемого химического соединения; но эти сведения могут быть не достаточными для описания конкретной методики его получения.
В конце своей статьи оппонент в разделе 8. Предложения пишет:
«Подводя итог, отметим, что хотя масштаб проблемы, то есть количество ошибочно выданных (в период до вступления в силу Административного регламента) патентов на селективные изобретения в области химии трудно оценить, мы хотели бы призвать ведомство исправить допущенные ошибки и привести нормы о селективных изобретениях в области химии в соответствие с мировой практикой или хотя бы с тем подходом, который Роспатент уже применяет при проверке промышленной применимости химических соединений, заявленных с помощью формулы Маркуша» (выделено автором, — В.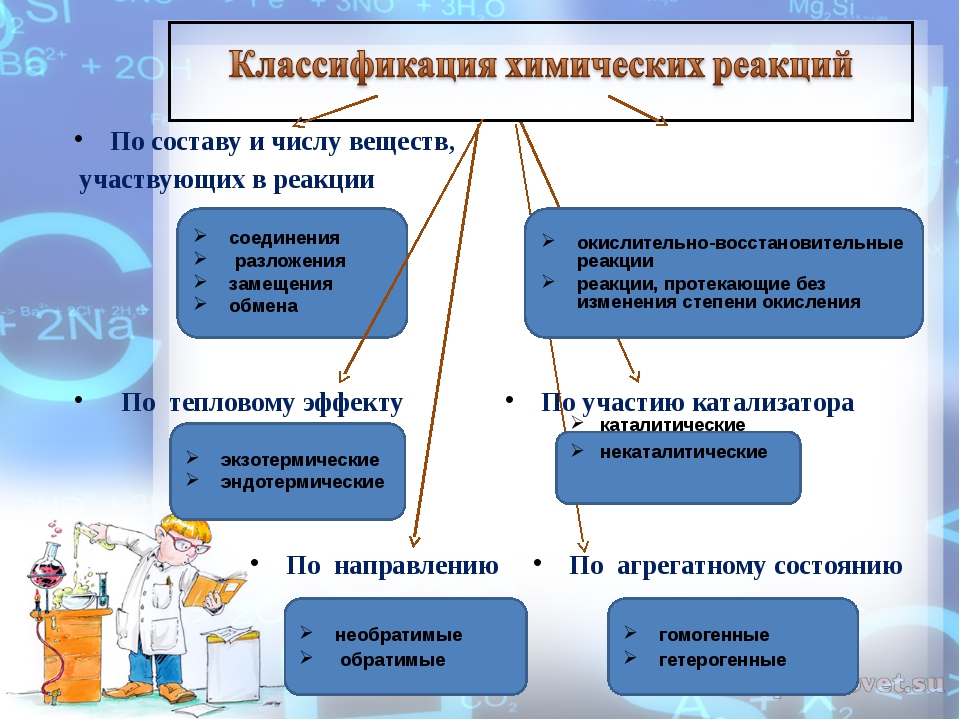 Д.).
Д.).
По сути, оппонент без каких-либо доказательств обвинил Роспатент прямым текстом в том, что он якобы выдал ошибочно столько патентов на селективные изобретения;, что трудно оценить масштаб созданной тем самым проблемы в государстве; и призвал Роспатент исправить якобы допущенные ошибки.
Ничем иным, кроме как жупелом нагнетаемых страстей вокруг Роспатента при патентовании химических соединений, назвать такое нельзя.
1В число которых вхожу и я.
2 В указанных сносках [2] и [3] названы следующие статьи:Джермакян В.Ю.. Селективное изобретение: самостоятельный вид или заимствованное условное обозначение изобретений, создаваемых научным методом селекции? // Он-лайн ресурс http://ipcmagazine.ru/patent-law/selective-invention-an-independent-type-or-symbol-borrowed-inventions-created-by-scientific-selection-method. Мещеряков В.А. Кризис российского патентного права в области фармацевтики? // Журнал Суда по интеллектуальным правам. 2016 г. № 13. С. 30-38..
№ 13. С. 30-38..
3 http://forum.yurclub.ru/index.php?showtopic=319566.
4Действующими российскими или евразийскими патентами.
5Мы не будет акцентировать внимание на евразийском законодательстве, не отличающемся по сути в рассматриваемой части от российского.
6Затронем только основные моменты разногласий, т.к. в статье представлены самые разные вопросы из проблем в патентном праве, и отвечать на все не имеет смысла во избежание неточностей по сути выдвинутых в адрес Роспатента замечаний.
7 http://ipcmagazine.ru/patent-law/selective-invention-an-independent-type-or-symbol-borrowed-inventions-created-by-scientific-selection-method.
8 http://forum.yurclub.ru/index.php?showtopic=319566.
9Имеется в виду российское законодательство.
10«Законодательства о селективном изобретении» вообще не существует, примем его за жаргонное выражение.
11Четвертое по счету.
12 Михайлов А. Миф о мифе, или Рождение селективных изобретений из пены бумажной, Журнал Суда по интеллектуальным правам, http://ipcmagazine. ru/patent-law/the-myth-of-the-myth-or-the-birth-of-selective-inventions-of-paper-foam.
ru/patent-law/the-myth-of-the-myth-or-the-birth-of-selective-inventions-of-paper-foam.
13В статье приведены ответы национальных групп при обсуждении в AIPPI в 2009 г.
14Ситуации такие встречаются весьма редко.
15 [2]- Джермакян В.Ю. «Селективное» изобретение: самостоятельный вид или заимствованное условное обозначение изобретений, создаваемых научным методом селекции?»Журнал Суда по интеллектуальным правам, М., 2016, http://ipcmagazine.ru/patent-law/selective-invention-an-independent-type-or-symbol-borrowed-inventions-created-by-scientific-selection-method.
16 http://forum.yurclub.ru/index.php?showtopic=319566.
17Рекомендации по вопросам экспертизы заявок на изобретения и полезные модели (с изменениями на 30 ноября 2009 г.) (утратили силу на основании приказа Роспатента от 20января 2010 г. N 4), утв. в соответствии с Приказом Роспатента от 31 марта 2004 г. N 43.
18Корчагин А.Д., Березкин В.В., Добрынин О.В., Рябова М.В. Рекомендации по вопросам экспертизы заявок на изобретения и полезные модели // ИНИЦ Роспатента.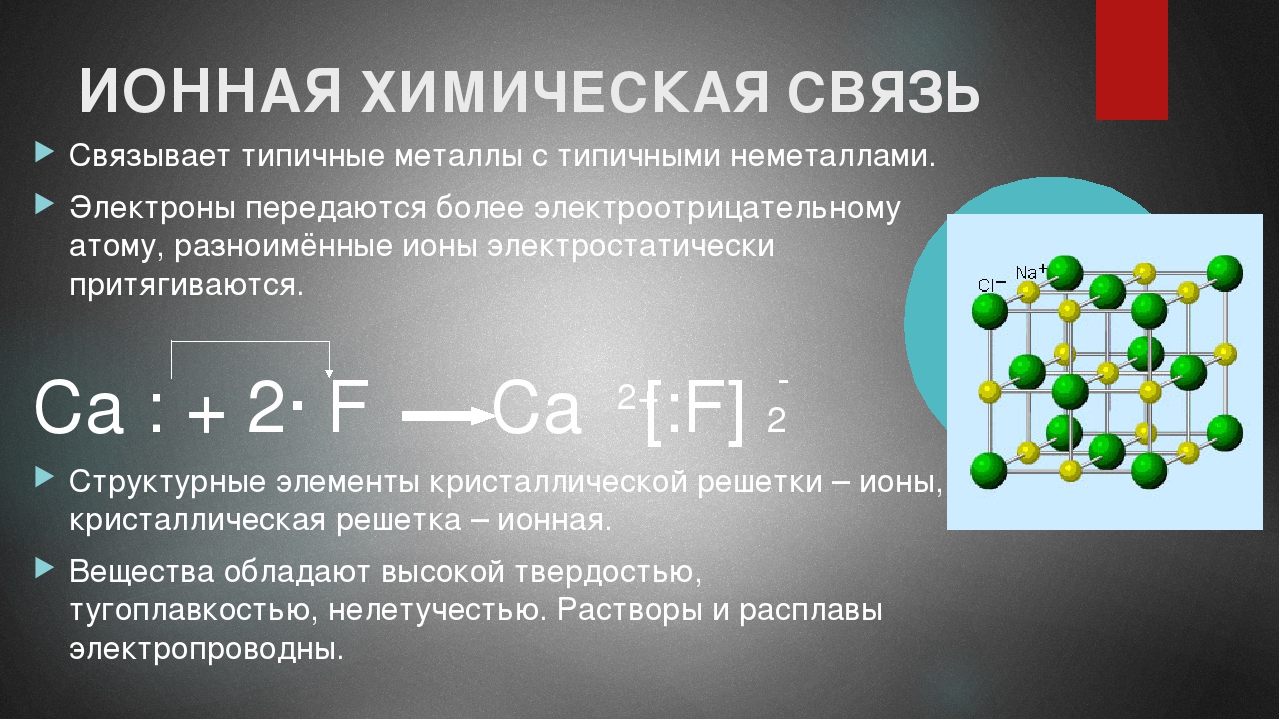 Москва. 1999.
Москва. 1999.
1921 апреля 2017 г. Суд по интеллектуальным правам кассационной инстанции оставил решение суда первой инстанции без изменения, а кассационную жалобу — без удовлетворения.
20Если они оспаривались, значит именно их можно рассматривать как репрезентативные.
21Ошибки в выдаче патентов на изобретения, которые не отвечают новизне, не рассматриваются, т.к. они выданы вопреки нормативным документам, а не благодаря им. Аннулировать их при отсутствии новизны не представляет труда.
22См.: Веселицкая И.А. Селективные изобретения/ Патентный поверенный, М. 2005. № 5.
23Оправдывал, махая пробиркой, вторжение США в Ирак.
24Нормативная база ЕАПВ в отношении патентования индивидуальных химических соединений ничем по существу не отличается от российской.
25 Лубяко Е.Н., Полякова А.А., Уткина Е.А., Джермакян В.Ю. Особенности определения патентоспособности изобретений, относящихся к органическим соединениям, М., ИНИЦ Роспатента, 2004.
Типы химических реакций в органической химии
При протекании химических реакций происходит разрыв одних и возникновение других связей. Химические реакции условно делят на органические и неорганические. Органическими реакциям принято считать реакции, в которых, по крайней мере, одно из реагирующих веществ является органическим соединением, изменяющим свою молекулярную структуру в процессе реакции. Отличием органических реакций от неорганических является то, что, как правило, в них участвуют молекулы. Скорость таких реакции низка, а выход продукта обычно составляет всего лишь 50-80 %. Для повышения скорости реакции применяют катализаторы, повышают температуру или давление. Далее рассмотрим типы химических реакций в органической химии.
Химические реакции условно делят на органические и неорганические. Органическими реакциям принято считать реакции, в которых, по крайней мере, одно из реагирующих веществ является органическим соединением, изменяющим свою молекулярную структуру в процессе реакции. Отличием органических реакций от неорганических является то, что, как правило, в них участвуют молекулы. Скорость таких реакции низка, а выход продукта обычно составляет всего лишь 50-80 %. Для повышения скорости реакции применяют катализаторы, повышают температуру или давление. Далее рассмотрим типы химических реакций в органической химии.
Классификация по характеру химических превращений
- Реакции замещения
- Реакции присоединения
- Реакция элиминирования (отщепления)
- Реакция изомеризации и перегруппировка
- Реакции окисления
- Реакции конденсации и поликонденсации
- Реакции разложения
Реакции замещения
В ходе реакций замещения один атом или группа атомов в начальной молекуле замещается на иные атомы или группы атомов, образуя новую молекулу. Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:
Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:
Реакции присоединения
При протекании реакций присоединения из двух или более молекул веществ образуется одна молекула нового соединения. Такие реакции характерны для ненасыщенных соединений. Различают реакции гидрирования (восстановления), галогенирования, гидрогалогенирования, гидратации, полимеризации и т.п:
- Гидрирование – присоединение молекулы водорода:
- Галогенирование — присоединение молекулы галогена:
- Гидрогалогенирование — присоединение молекулы галогенводорода:
- Гидратация — присоединение молекулы воды:
- Полимеризация – образование высокомолекулярного соединения посредством многократного присоединения низкомолекулярного соединения, например:
Реакция элиминирования (отщепления)
В результате реакций отщепления органические молекулы теряют атомы или группы атомов, и образуется новое вещество, содержащее одну или несколько кратных связей. К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
- Дегидрирование – отщепления молекулы водорода:
- Дегидратация – отщепление молекулы воды:
- Дегидрогалогенирования – отщепления молекулы галогеноводородов:
Реакции изомеризации и перегруппировка
В ходе таких реакций происходит внутримолекулярная перестройка, т.е. переход атомов или групп атомов с одного участка молекулы в другое без изменения молекулярной формулы вещества, участвующего в реакции, например:
Реакции окисления
В результате воздействия окисляющего реагента происходит повышение степени окисления углерода в органическом атоме, молекуле или ионе процесс за счет отдачи электронов, вследствие чего образуется новое соединение:
Реакции конденсации и поликонденсации
Заключаются во взаимодействии нескольких (двух и более) органических соединений с образованием новых С-С связей и низкомолекулярного соединения:
Поликонденсация – образование молекулы полимера из мономеров, содержащих функциональные группы с выделением низкомолекулярного соединения. В отличие от реакции полимеризации, в результате которых образуется полимер, имеющий состав, аналогичный мономеру, в результате реакций поликонденсации состав образованного полимера отличается от его мономера:
В отличие от реакции полимеризации, в результате которых образуется полимер, имеющий состав, аналогичный мономеру, в результате реакций поликонденсации состав образованного полимера отличается от его мономера:
Реакции разложения
Это процесс расщепления сложного органического соединения на менее сложные или простые вещества:
С18H38 → С9H18 + С9H20
Классификация химических реакций по механизмам
Протекание реакций с разрывом ковалентных связей в органических соединениях возможно по двум механизмам (т.е. пути, приводящему к разрыву старой связи и образованию новой) – гетеролитическому (ионному) и гомолитическому (радикальному).
Гетеролитический (ионный) механизм
В реакциях, протекающих по гетеролитическому механизму образуются промежуточные частицы ионного типа с заряженным атомом углерода. Частицы, несущие положительный заряд называются карбкатионы, отрицательный – карбанионы. При этом происходит не разрыв общей электронной пары, а ее переход к одному из атомов, с образованием иона:
При этом происходит не разрыв общей электронной пары, а ее переход к одному из атомов, с образованием иона:
Склонность к гетеролитическому разрыву проявляют сильно полярные, например Н–O, С–О и легко поляризуемые, например С–Вr, С–I связи.
Реакции, протекающие по гетеролитическому механизму делят на нуклеофильные и электрофильные реакции. Реагент, располагающий электронной парой для образования связи называют нуклеофильным или электронодонорным. Например, HO—,RO—, Cl—, RCOO—, CN—, R—, NH2, H2O, NH3, C2H5OH, алкены, арены.
Реагент, имеющий незаполненную электронную оболочку и способные присоединить пару электронов в процессе образования новой связи.называют электрофильным реагентам относятся следующие катионы: Н+, R3C+, AlCl3, ZnCl2, SO3, BF3, R-Cl, R2C=O
Реакции нуклеофильного замещения
Характерны для алкил- и арилгалогенидов:
Реакции нуклеофильного присоединения
Реакции электрофильного замещения
Реакции электрофильного присоединения
Гомолитический (радикальный механизм)
В реакциях, протекающих по гомолитическому (радикальному) механизму на первой стадии происходит разрыв ковалентной связи с образованием радикалов. Далее образовавшийся свободный радикал выступает в качестве атакующего реагента. Разрыв связи по радикальному механизму свойственен для неполярных или малополярных ковалентных связей (С–С, N–N, С–Н).
Далее образовавшийся свободный радикал выступает в качестве атакующего реагента. Разрыв связи по радикальному механизму свойственен для неполярных или малополярных ковалентных связей (С–С, N–N, С–Н).
Различают реакции радикального замещения и радикального присоединения
Реакции радикального замещения
Характерны для алканов
Реакции радикального присоединения
Характерны для алкенов и алкинов
Таким образом, мы рассмотрели основные типы химических реакций в органической химии
Ионные и ковалентные соединения.
Соединения двух элементов, расположенных в противоположных концах одного (или разных) периодов, имеют преимущественно ионный характер связи, но по мере сближения элементов в пределах периода ионный характер их соединений уменьшается, а ковалентный характер-увеличивается. В большинстве случаев нельзя сказать, что соединение является полностью (или чисто) ионным либо полностью (или чисто) ковалентным. Однако можно утверждать, что некоторые соединения являются преимущественно ионными, а другие соединения преимущественно ковалентными.
Однако можно утверждать, что некоторые соединения являются преимущественно ионными, а другие соединения преимущественно ковалентными.
Хорошими примерами сказанного являются хлориды и оксиды. Хлориды и оксиды элементов, расположенных в левой части периодической таблицы, как правило, имеют преимущественно ионный характер, а хлориды и оксиды элементов из правой части периодической таблицы являются преимущественно ковалентными соединениями. Хлориды и оксиды промежуточных элементов имеют смешанный характер связи-ионный с большой степенью ковалентности. В табл. 2.3 и 2.4 приведены примеры соединений, которые обычно рассматриваются как ионные и соответственно ковалентные.
Таблица 2.3. Примеры ионных соединений Таблица 2.4. Примеры ковалентных соединений
Электроны, участвующие в образовании металлической связи, являются внешними, или валентными, электронами атомов металла. Эти валентные электроны уже не принадлежат каждый определенному атому металла, а делокализованы между положительными ионами. Делокализованные внутри металла электроны не располагаются парами на связывающих орбиталях между соседними ионами, а находятся на гигантских орбиталях, которые простираются по всей кристаллической решетке. Эти орбитали футшируются по энергии в отдельные зоны. В пределах одной зоны имеется множество орбиталей с разными энергетическими уровнями; соседние энергетические уровни имеют почти одинаковую энергию. Валентные электроны металлов, принадлежащих к I группе периодической системы, частично заполняют самую низкую энергетическую зону. Она называется s-зоной. Металлы II группы имеют полностью заполненную s-зону. После того как одна зона заполнена, электроны начинают заполнять следующую, более высокую по энергии зону (рис. 2.14).
Делокализованные внутри металла электроны не располагаются парами на связывающих орбиталях между соседними ионами, а находятся на гигантских орбиталях, которые простираются по всей кристаллической решетке. Эти орбитали футшируются по энергии в отдельные зоны. В пределах одной зоны имеется множество орбиталей с разными энергетическими уровнями; соседние энергетические уровни имеют почти одинаковую энергию. Валентные электроны металлов, принадлежащих к I группе периодической системы, частично заполняют самую низкую энергетическую зону. Она называется s-зоной. Металлы II группы имеют полностью заполненную s-зону. После того как одна зона заполнена, электроны начинают заполнять следующую, более высокую по энергии зону (рис. 2.14).
Оглавление:
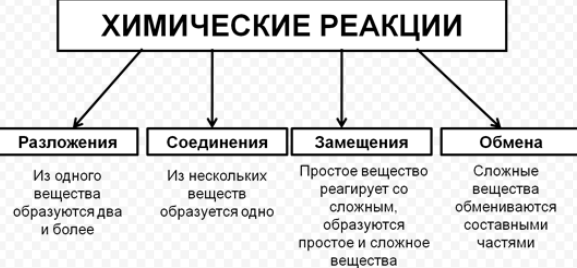
Классификация химических реакций в неорганической и органической химии
Чтобы поделиться, нажимайте
1) Первый признак классификации – по изменению степени окисления элементов, образующих реагенты и продукты.
а) окислительно-восстановительные
+2 +5 +3 +6 +4
FeS2 + 18HNO3 = Fe(NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
б) без изменения степени окисления
CaO + 2HCl = CaCl2 + H2O
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
2) Химические реакции классифицируются по характеру процесса, т.е по числу и составу реагентов и продуктов.
-реакции соединения или присоединения в органической химии.
Для того чтобы вступить в реакцию присоединения, органическая молекула должна иметь кратную связь (или цикл), эта молекула будет главной (субстрат). Молекула попроще (часто неорганическое вещество, реагент) присоединяется по месту разрыва кратной связи или раскрытия цикла.
NH3 + HCl = NH4Cl
CaO + CO2 = CaCO3
-реакции разложения.
Реакции разложения можно рассматривать как процессы, обратные соединению.
C2H5Br = C2H4 + HBr
Hg(NO3)2 = Hg + 2NO2 + O2
– реакции замещения.
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
Zn + CuSO4 = Cu + ZnSO4
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
– обмена (в том числе и нейтрализации).
CaO + 2HCl = CaCl2 + H2O
KCl + AgNO3 = AgCl¯ + KNO3
3) По возможности протекать в обратном направлении – обратимые и необратимые.
4) По типу разрыва связей – гомолитические (равный разрыв, каждый атом по 1 электрону получает) и гетеролитический (неравный разрыв – одному достается пара электронов)
5) По тепловому эффекту
экзотермические (выделение тепла) и эндотермические (поглощение тепла). Реакции соединения как правило будут реакциями экзотермическими, а реакции разложения — эндотермическими. Редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + О2 → 2NO – Q
6) По фазе
а) Гомогенные (однородные вещества, в одной фазе, например г-г, реакции в растворах)
б) Гетерогенные (г-ж, г-тв, ж-тв, реакции между несмешивающимися жидкостями)
7) По использованию катализатора. Катализатор – вещество ускоряющее химическую реакцию.
Катализатор – вещество ускоряющее химическую реакцию.
а) каталитические (в том числе и ферментативные) – без использование катализатора практически не идут.
б) некаталитические.
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков, сведения о которых приведены в таблице ниже.
Необратимыми называют реакции, протекающие только в прямом направлении, в результате которых образуются продукты, не взаимодействующие между собой. К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
HCl + NaOH = NaCl + h3O
2Ca + O2 = 2CaO
BaBr2 + Na2SO 4 = BaSO4↓ + 2NaBr
Обратимыми называют химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями. При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
N2 +3H2↔2NH3
По типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы.
Гетеролитическими называют реакции, протекающие через образование ионных частиц — катионов и анионов.
Радикальными (цепными) называют химические реакции с участием радикалов, например:
CH4 + Cl2hv →CH3Cl + HCl
Ионными называют химические реакции, протекающие с участием ионов, например:
KCl + AgNO3 = KNO3 + AgCl↓
Электрофильными называют гетеролитические реакции органических соединений с электрофилами — частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
C6H6 + Cl2 FeCl3→ C 6 H 5 Cl + HCl
H2C =CH2 + Br2 → BrCH2 –CH2Br
Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами — частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения, например:
CH3Br + NaOH → CH3OH + NaBr
CH3C(O)H + C2H5OH → CH3CH(OC2H5)2 + H2O
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии (теплосодержания) ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH < 0.
Эндотермическими называют химические реакции, идущие с поглощением теплоты.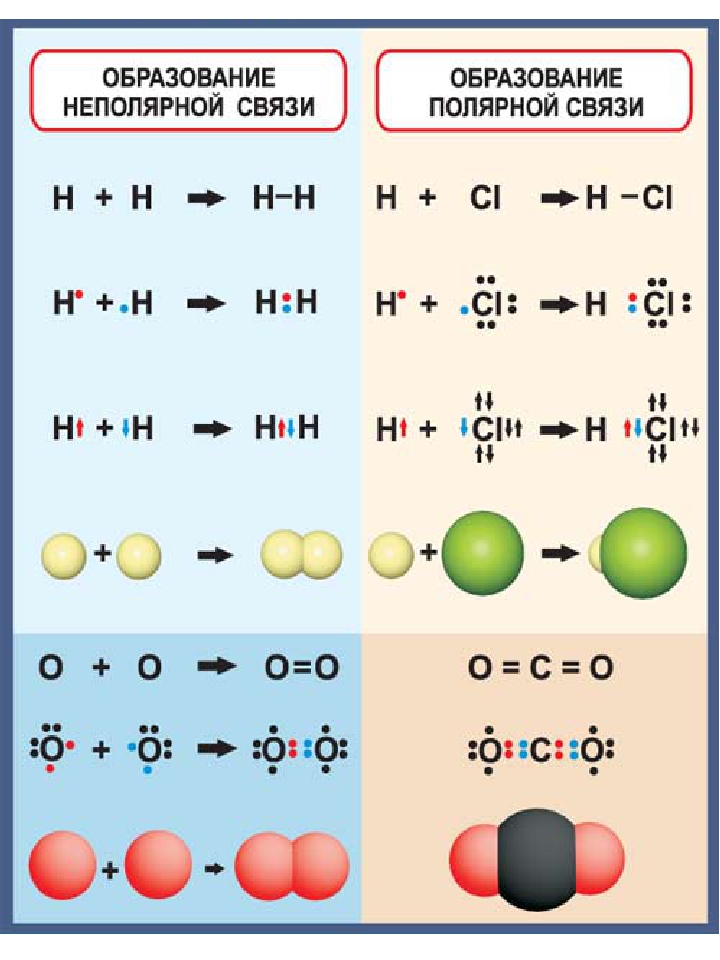 Для эндотермических реакций Q < 0, а ΔH > 0.
Для эндотермических реакций Q < 0, а ΔH > 0.
Гомогенными называют реакции, протекающие в однородной среде.
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
Каталитические реакции протекают только в присутствии катализатора. Некаталитические реакции идут в отсутствие катализатора.
Классификация органических реакций приведена в таблице:
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
Примеры химических связей
21 декабря 2018
Химическая связь – это взаимодействие атомов, возникающее в молекуле вещества. Она обусловлена обменом электронами. Всего существует четыре основных вида связи (иногда называют и число пять, так как один из видов подразделяется на два других).
Содержание
1. Ковалентная связь
2. Ионная связь
3. Водородная связь
4. Металлическая связь
5. Заключение
Заключение
Ковалентная связь
При таком типе связи атомы имеют одну или несколько общих пар электронов. Такая связь возможна только между атомами неметаллов, так как металлы не могут приобретать электроны (в случае ковалентной связи все атомы одновременно и принимают несколько электронов). Существует два типа ковалентной связи:
Ковалентная неполярная связь. Характерна для веществ, чьи молекулы состоят из двух одинаковых атомов – например, газов кислорода O2 или азота N2.
•• ••
O (::) O
•• ••
Обычно при графическом изображении ковалентной связи электроны отмечают точками и изображают попарно по сторонам от символа элемента. Общие пары указывают крупными скобками.
Ковалентная полярная связь объединяет атомы с разной электроотрицательностью, один из которых притягивает общие электронные пары сильнее, чем другой.
 В качестве примера можно рассмотреть бинарное соединение хлора и водорода (газ хлороводород, соляная кислота):
В качестве примера можно рассмотреть бинарное соединение хлора и водорода (газ хлороводород, соляная кислота):
•• ••
H • + • Cl : –> H (:) Cl :
•• ••
Проще всего определить ковалентную связь выяснив типы веществ. Ковалентная неполярная связь всегда возникает только между атомами одного элемента-неметалла, а полярная – между двумя или несколькими неметаллами с разной электроотрицательностью.
Ионная связь
Ионная связь соединяет ионы нескольких элементов, один из которых отдает электроны другому, который, в свою очередь, их принимает. Как и в любом типе связи, в итоге на высшем уровне каждого атома должно остаться максимально возможное число электронов (для большинства элементов это 8, для водорода– 2). Для примера можно графически записать связь в молекуле бинарного веществе NaCl, хлорида натрия. Ниже представлена схема и рассуждения, подтверждающие ионную связь в этой молекуле:
- Электронная конфигурация натрия: 1s²2s²2p⁶3s¹
Электронная конфигурация хлора: 1s²2s²2p⁶3s²3p⁵
Исходя из этого, на третьем уровне натрия есть один электрон, а на третьем уровне хлора – 7. Очевидно, что натрий отдает один электрон хлору, и таким образом на верхнем уровне у обоих атомов остается по 8 электронов (верхним уровнем иона натрия становится второй).
Очевидно, что натрий отдает один электрон хлору, и таким образом на верхнем уровне у обоих атомов остается по 8 электронов (верхним уровнем иона натрия становится второй).
- Na⁰ – 1e –> Na¹⁺
Cl⁰ + 1e –> Cl¹⁻
NaCl –> Na⁺Cl⁻
Ионный тип связи характерен для солей (например, упоминавшийся выше NaCl – это поваренная соль). Также указанием на ионную связь с большой вероятностью может служить бинарное соединение из атомов металла и неметалла.
Водородная связь
Водородная связь (по-другому ее называют H-связью) возникает между атомами водорода и более электроотрицательного элемента. Такой тип связи возникает спонтанно, из-за того, что один из атомов способен притягивать к себе электроны сильнее, чем другой. Стандартная схема водородной связи состоит из двух атомов электроотрицательных элементов и атома водорода между ними. Например, так выглядит водородная связь в h3O – воде:
O – H – O
Помимо этого, в формировании водородной связи электростатические взаимодействия. Этот тип связи не всегда относят к химическим из-за того, что он крайне непрочен. Стандартной формы записи у водородной связи нет.
Этот тип связи не всегда относят к химическим из-за того, что он крайне непрочен. Стандартной формы записи у водородной связи нет.
Металлическая связь
В предыдущих пунктах металлы упоминались только в контексте ионной связи, где они могут быть частью бинарного соединения. Но многие элементы-металлы могут образовывать и простые вещества. Несмотря на то, что большинство таких веществ состоят из одного атома и молекул там нет, атомы металлов образуют металлическую решётку. Именно она обеспечивает определенные свойства металлов: например, высокую способность проводить электрический ток. Внутри такой решётки одинаковые атомы теряют электроны и становятся положительно заряженными ионами – катионами. Освобождающиеся при этом свободные (металлические) электроны перемещаются внутри решётки. Вместе они образуют то, что называется “электронным газом”.
Такой же тип связи характерен и для сплавов.
Графически металлическую связь часто изображают как двухмерную или трехмерную решетку с одинаковыми катионами в узлах. Электроны же обозначают небольшими точками или общим заштрихованным контуром.
Электроны же обозначают небольшими точками или общим заштрихованным контуром.
Заключение
Всего существует четыре вида связи. Каждый из них определяется тем, что происходит с валентными электронами в молекуле. Выяснить тип связи поможет вид вещества (простое, бинарное соединение, сложное), электроотрицательность, а также то, являются ли химические элементы, входящие в него, металлами или неметаллами. Часть связей имеет форму графической записи.
Источник
Reaxys — база данных издательства Elsevier
Главная >> Все ресурсы >> Reaxys
База данных по химическим наукам Reaxys от компании Elsevier с модулем Reaxys Medicinal Chemistry
Структурно-химическая база данный Reaxys включает в себя структурную базу данных химических соединений и их экспериментальных свойств, реферативную базу журнальных и патентных публикаций, базу химических реакций с функцией построения плана синтеза. Reaxys специально разработан для научно-исследовательских организаций химического профиля для решения практических задач, связанных с разработкой новых материалов, новых технологий. Извлеченные экспериментальные свойства химических соединений в Reaxys покрывают более 130 предметных областей, включая хроматографические, спектральные, электрохимические, магнитные, физические, оптические, термодинамические и кристаллические свойства, информацию о природных объектах и использовании соединений.
Reaxys специально разработан для научно-исследовательских организаций химического профиля для решения практических задач, связанных с разработкой новых материалов, новых технологий. Извлеченные экспериментальные свойства химических соединений в Reaxys покрывают более 130 предметных областей, включая хроматографические, спектральные, электрохимические, магнитные, физические, оптические, термодинамические и кристаллические свойства, информацию о природных объектах и использовании соединений.
Периодические издания в Reaxys проиндексированы с использованием индексных терминов ведущих междисциплинарных баз: Compendex© — технология и инженерия, Embase© — биомедицина и фармакология, Medline© — науки о жизни, Geobase© — геонауки и окружающая среда, Reaxys© — химические науки.
Модуль биологически активных соединений, биологических мишеней, фармакологических свойств химических соединений Reaxys Medicinal Chemistry является крупнейшей в мире базой данных в своем роде и предназначен специально для научно-исследовательских организаций, связанных с разработкой новых фармацевтических препаратов.
Содержание Reaxys и Reaxys Medicinal Chemistry:
• Более 118 млн химических соединений
• Более 49 млн химических реакций
• Более 500 млн записей экспериментальных свойств
• Более 37 млн записей экспериментальных свойств биологической активности
• Более 1,5 млн биологических мишеней
• Более 59 млн документов покрывают более 16000 периодических изданий
• Патенты 7 ведущих патентных ведомств
Функциональные возможности:
• Поиск химических соединений по одному или части, или комбинации следующих параметров: название, структурная формула, CAS#, брутто формула, свойства, автор публикации, фармакологическая мишень и др.
• Возможность для каждого соединения в пару кликов увидеть его экспериментальные свойства, химические реакции, литературу, патенты, данные о биологической активности и др.
• Поиск химических реакций по одному или нескольким, или части следующих параметров: название, графическое изображение, растворитель, температура, выход, экспериментальная методика и др.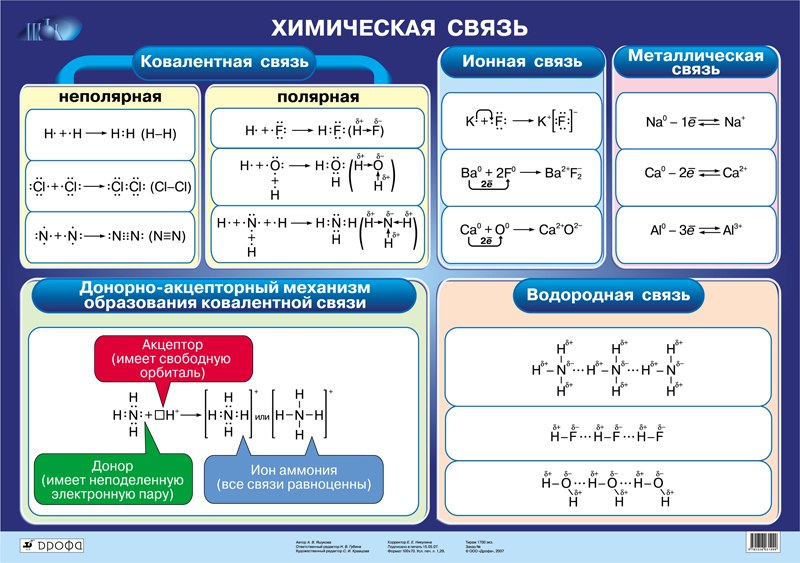
• Быстрое построение «тепловой карты» биологической активности в виде таблицы с разными активностями для разных соединений, например, имеющих сходную структуру или название, действующих на заданные мишени
• Построение плана синтеза заданного соединения и поиск информации о коммерческой доступности
• Фильтрация и анализ результатов поиска по структуре, свойствам, литературным источникам, индексным терминам и другим параметрам
Полезные ссылки:
Краткое руководство пользователя Reaxys с модулем RMC (на русском языке)
Руководство по использованию Reaxys, Reaxys Medicinal Chemistry и примеры решения конкретных задач (на английском языке)
Образование легколетучих хлорорганических соединений при первичной перегонке нефти в результате разложения химических реагентов, содержащих соли четвертичных аммониевых соединений
PROНЕФТЬ. Профессионально о нефти. – 2019 — № 4(14). – С. 63-69
Профессионально о нефти. – 2019 — № 4(14). – С. 63-69
УДК 547- 302+543.05+543.5+66 1.7+553.982
А.В. Синёв, Т.В. Девяшин
ООО «Газпромнефть-Приразломное»
А.М. Кунакова, к.х.н., Л.Р. Сайфутдинова, к.х.н., Ф.Г. Усманова, к.х.н.
Научно-Технический Центр «Газпром нефти» (ООО «Газпромнефть НТЦ»)
А.Н. Крикун, к.т.н., А.Е. Лестев, к.и.н.
АНО «ГЦСС «Нефтепромхим»
Электронные адреса: [email protected]
Ключевые слова: хлорорганические соединения (ХОС), легколетучие ХОС (ЛХОС), четвертичные аммониевые соединения (ЧАС), нафта, товарная нефть, нефтепромысловые химические реагенты
Исследования, результаты которых представлены в статье, посвящены выявлению летучих хлорорганических соединений (ЛХОС) в нафте и химических реагентах и обусловлены ужесточением требований к качеству товарной нефти в соответствии с Техническим регламентом Евразийского экономического союза «О безопасности нефти, подготовленной к транспортировке и (или) использованию». Практическая значимость работы заключается в снижении риска образования ЛХОС в товарной нефти за счет использования химических реагентов. В результате проведенных исследований было обнаружено образование ЛХОС (так называемых «вторичных хлорорганических соединений») за счет разложения солей четвертичных аммониевых оснований, содержащихся в некоторых нефтепромысловых химических реагентах.
Практическая значимость работы заключается в снижении риска образования ЛХОС в товарной нефти за счет использования химических реагентов. В результате проведенных исследований было обнаружено образование ЛХОС (так называемых «вторичных хлорорганических соединений») за счет разложения солей четвертичных аммониевых оснований, содержащихся в некоторых нефтепромысловых химических реагентах.
PRONEFT». Professional’no o nefti, 2019, no. 4(14), pp. 63-69
A.V. Sinev, T.V. Devyashin
Gazpromneft-Prirazlomnoe LLC, RF, Saint-Petersburg
A.M. Kunakova, L.R. Sayfutdinova, F.G. Usmanova
Gazpromneft NTC LLC, RF, Saint-Petersburg
A.N. Krikun, A.E. Lestev
NDCS Neftepromсhim, RF, Kazan
E-mail: [email protected], [email protected], [email protected]
Keywords: organochlorine compounds, volatile organochlorine compounds, salts of quaternary ammonium compounds, naphtha, marketable oil, oilfield chemicals
Research, the results of which are presented in the article, are devoted to the detection of LHOS in naphtha and chemical reagents and are due to stricter requirements for the quality of marketable oil in accordance with the Technical Regulation of the Eurasian Economic Union On the Safety of Oil Prepared for Transportation and (or) TR EAEU 045/2017. The practical significance of the work is to reduce the risk of the formation of volatile organochlorine compounds in marketable oil due to the use of chemicals. As a result of the studies, the formation of volatile organochlorine compounds (the so-called secondary organochlorine compounds) was discovered due to the decomposition of salts of Quaternary ammonium bases contained in some oilfield chemicals.
The practical significance of the work is to reduce the risk of the formation of volatile organochlorine compounds in marketable oil due to the use of chemicals. As a result of the studies, the formation of volatile organochlorine compounds (the so-called secondary organochlorine compounds) was discovered due to the decomposition of salts of Quaternary ammonium bases contained in some oilfield chemicals.
DOI: 10.24887/2587-7399-2019-4-63-69
Хлорорганические соединения (ХОС) пред- ставляют собой соединения, в которых один или более атомов водорода замещены ато- мами хлора. ХОС можно описать общей фор- мулой RCl, где R – углеводородный ра- дикал, Cl – атом хлора, соединенные кова- лентной связью. ХОС хорошо растворимы в органических растворителях, маслах и жирах. Легколетучие ХОС (ЛХОС) представляют собой группу ХОС, температура кипения кото- рых ниже 204 °С.
В Европе и России разработка способов и методов укрепления грунтов искусственными вяжущими была начата в конце ХIX века после изобретения технологии производства цемента. В 20-х годах ХХ века в России академиками СССР М.М. Филатовым, В.В. Охотиным, П.А. Замятченским, П.А. Ребиндером, Н.Н. Ивановым, А.Я. Тулаевым, В.М. Безруком и другими учеными впервые были выполнены научно обоснованные работы по укреплению грунтов искусственными вяжущими [1, 2]. Согласно ГОСТ Р 52247-2004 «Нефть. Методы
В 20-х годах ХХ века в России академиками СССР М.М. Филатовым, В.В. Охотиным, П.А. Замятченским, П.А. Ребиндером, Н.Н. Ивановым, А.Я. Тулаевым, В.М. Безруком и другими учеными впервые были выполнены научно обоснованные работы по укреплению грунтов искусственными вяжущими [1, 2]. Согласно ГОСТ Р 52247-2004 «Нефть. Методы
Согласно ГОСТ Р 52247-2004 «Нефть. Методы определения хлорорганических соединений» нефть, поставляемая на нефтеперерабаты- вающие предприятия и экспортируемая за рубеж, должна отвечать ряду требований к показателям, характерузующим физико-хи- мические свойства (качество) нефти: плот- ность, содержание механических примесей, воды, хлористых солей, сероводорода и мер- каптанов, давление насыщенных паров. Кроме опеределения физико-химических ха- рактеристик, ГОСТ предписывает обязатель- ное определение содержания в нефти ХОС, для которых установлена норма в нефтяной фракции, выкипающей до 204 °С – не более 10 мг/дм3 (ppm).
Главным предназначением укрепленных грунтов (УГ) является замена привозных каменных материалов при строительстве дорожных одежд, укреплении обочин и откосов. Это связано прежде всего с отсутствием каменных материалов на 80 % площади территории России. До конца 80-х годов ХХ века в СССР было построено около 60 тыс. км дорог с применением УГ, из них 35 тыс. км в Западной Сибири [3]. На первом этапе в 1955–1970 гг. материал использовался в строительстве автомобильных дорог при освоении целинных и залежных земель Казахстана и юга Западной Сибири, на втором этапе с 1962 г. до конца 90-х годов ХХ века – для создания транспортной сети при обустройстве нефтяных и газовых месторождений Западной Сибири.
Это связано прежде всего с отсутствием каменных материалов на 80 % площади территории России. До конца 80-х годов ХХ века в СССР было построено около 60 тыс. км дорог с применением УГ, из них 35 тыс. км в Западной Сибири [3]. На первом этапе в 1955–1970 гг. материал использовался в строительстве автомобильных дорог при освоении целинных и залежных земель Казахстана и юга Западной Сибири, на втором этапе с 1962 г. до конца 90-х годов ХХ века – для создания транспортной сети при обустройстве нефтяных и газовых месторождений Западной Сибири.
Действующий нормативный уровень свойств УГ не позволяет реализовать технологию их применения в сборных конструкциях и изделиях, поскольку максимально допустимый предел прочности при сжатии составлял 6 МПа, предел прочности при изгибе – 0,4 МПа. Кроме того, способы производства УГ и конструкций исключают круглогодичное производство работ на территории России, кроме регионов с благоприятными климатическими условиями (юг страны). Область применения УГ сужают также требования к дорожным конструкциям, которые не допускают использования УГ в ответственных элементах. В результате многочисленных исследований в конце ХХ века СоюзДорНИИ и ТюмИСИ были получены новые способы и методы укрепления грунтов, которые показали высокую эффективность их применения в конструкциях автомобильных дорогах и аэродромов [4]. Под руководством А.В. Линцера разработаны теоретические и практические основы индустриального производства дорожных конструкций из пропарочного и автоклавного цементогрунта. Предложены новые количественные и качественные критерии оценки свойств УГ, технологические и материаловедческие основы их промышленного применения на базе новейших достижений в области строительных материалов с учетом их специфики, а также способы получения оптимального по структуре и свойствам ИКМ. Полученный высокопрочный УГ на основе цемента имеет следующие свойства: расход вяжущего составляет 14–25 %, число пластичности – менее 7, модуль упругости Еу – от 5000 до 10000 МПа, прочность при сжатии Rсж – от 10 до 50 МПа, прочность на растяжение при изгибе Rизг – от 3,0 до 8,0 МПа.
В результате многочисленных исследований в конце ХХ века СоюзДорНИИ и ТюмИСИ были получены новые способы и методы укрепления грунтов, которые показали высокую эффективность их применения в конструкциях автомобильных дорогах и аэродромов [4]. Под руководством А.В. Линцера разработаны теоретические и практические основы индустриального производства дорожных конструкций из пропарочного и автоклавного цементогрунта. Предложены новые количественные и качественные критерии оценки свойств УГ, технологические и материаловедческие основы их промышленного применения на базе новейших достижений в области строительных материалов с учетом их специфики, а также способы получения оптимального по структуре и свойствам ИКМ. Полученный высокопрочный УГ на основе цемента имеет следующие свойства: расход вяжущего составляет 14–25 %, число пластичности – менее 7, модуль упругости Еу – от 5000 до 10000 МПа, прочность при сжатии Rсж – от 10 до 50 МПа, прочность на растяжение при изгибе Rизг – от 3,0 до 8,0 МПа.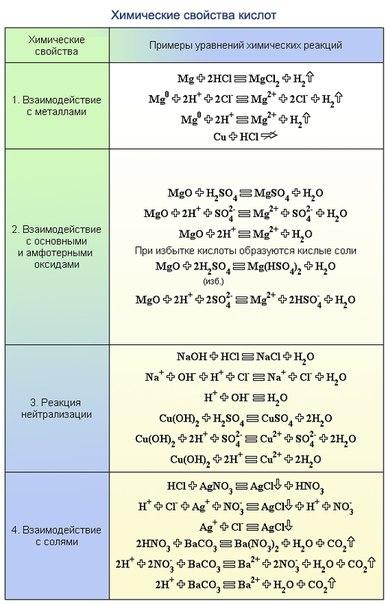 Это позволяет изготавливать дорожные плиты, блоки, панели, водопропускные кольца, ограждающие элементы и другие конструкции без использования привозных каменных материалов. Под воздействием электронагрева или перегретого пара цементогрунтовая смесь в формах преобразуется в готовые изделия в течение 15–20 ч.
Это позволяет изготавливать дорожные плиты, блоки, панели, водопропускные кольца, ограждающие элементы и другие конструкции без использования привозных каменных материалов. Под воздействием электронагрева или перегретого пара цементогрунтовая смесь в формах преобразуется в готовые изделия в течение 15–20 ч.
Из содержащихся в нефти соединений хлора именно ХОС создают наибольшие проблемы, так как являются дополнительным к неорганическим хлоридам (в ряде случаев весьма значительным) источником возникновения хлористоводородной коррозии установок переработки нефти
Из содержащихся в нефти соединений хлора именно ХОС создают наибольшие проблемы, так как являются дополнительным к неорганическим хлоридам (в ряде случаев весьма значительным) источником возникновения хлористоводородной коррозии установок переработки нефти. При переработке нефти в условиях высоких температур ХОС разрушаются с образованием коррозионного хлористого водорода и более легких «осколков», распределяющихся по фракциям нефти. Хлористый водород при отсутствии конденсационной воды не проявляет высокой коррозионной активности. В условиях конденсации паров воды, т.е. при температурах 70-130 °С (в зависимости от давления) хлористый водород образует соляную кислоту HCl, которая вызывает интенсивную электрохимическую коррозию металлов, особенно углеродистых и низколегированных сталей.
Хлористый водород при отсутствии конденсационной воды не проявляет высокой коррозионной активности. В условиях конденсации паров воды, т.е. при температурах 70-130 °С (в зависимости от давления) хлористый водород образует соляную кислоту HCl, которая вызывает интенсивную электрохимическую коррозию металлов, особенно углеродистых и низколегированных сталей.
Наибольшая активность ХОС наблюдается на установках предварительной гидроочистки сырья, дизельного топлива, газофракционирования и риформинга. Пределы выкипания ХОС в основном совпадают с пределами выкипания бензиновых фракций, поэтому основной ущерб наносится установкам каталитического риформинга из-за высокой скорости коррозии, обусловленной образованием HCl и частичной дезактивацией катализаторов. Одним из источников загрязнения нефти и нефтепродуктов могут быть химические продукты, содержащие ЛХОС либо в качестве составляющего компонента, либо в виде примеси, оставшейся в них в результате нарушения технологии их получения. Согласно данным, представленным в работе [1], ХОС наиболее часто в значительных количествах обнаруживаются в органических растворителях (например, толуоле), в гидрофобизаторах на основе N-алкилдиметилбензиламмония хлорида, смазочных добавках для буровых растворов на основе отработанных масел, а также в кислотах, являющихся отходами химического производства, в технологических процессах которого присутствуют ХОС.
Согласно данным, представленным в работе [1], ХОС наиболее часто в значительных количествах обнаруживаются в органических растворителях (например, толуоле), в гидрофобизаторах на основе N-алкилдиметилбензиламмония хлорида, смазочных добавках для буровых растворов на основе отработанных масел, а также в кислотах, являющихся отходами химического производства, в технологических процессах которого присутствуют ХОС.
В небольших количествах ЛХОС встречается в ингибиторах коррозии, бактерицидах, ингибиторах комплексного действия, содержащих соли четвертичных аммониевых соединений (ЧАС). Так, АНО ГЦСС «Нефтепромхим» ежегодно выявляет более 500 химических реагентов, содержащих в своем составе ЛХОС [1].
Известно, что в сырую нефть ХОС попадают с закачиваемыми в скважину реагентами, представляющими собой композиции из тяжелых органических жидкостей и комплексообразующих соединений [2], применяющихся в качестве жидкостей глушения, для воздействия на призабойную зону нефтяного пласта с целью растворения асфальтосмолопарафиновых отложений (АСПО), а также для удаления карбонатных отложений при использовании промывочной жидкости для бурения скважин, содержащей в качестве утяжелителя фтортрихлорметан (хладон 11). В июле 2019 г. вступил в действие Технический регламент Евразийского экономического союза «О безопасности нефти, подготовленной к транспортировке и (или) использованию» ТР ЕАЭС 045/2017, в котором ужесточились требования EАЭC к содержанию органических хлоридов в товарной нефти: для фракции, выкипающей до температуры 204 °С – не более 6 ppm, что с учетом доли отгона фракции (в среднем 12–19 %) в пересчете на нефть дает норматив не более 0,8–1,2 ppm (ГОСТ Р 51858- 2002 «Нефть. Общие технические условия»). Кроме того, введено требование о недопустимости применения при добыче, подготовке и транспортировке нефти химических реагентов, содержащих ХОС.
В июле 2019 г. вступил в действие Технический регламент Евразийского экономического союза «О безопасности нефти, подготовленной к транспортировке и (или) использованию» ТР ЕАЭС 045/2017, в котором ужесточились требования EАЭC к содержанию органических хлоридов в товарной нефти: для фракции, выкипающей до температуры 204 °С – не более 6 ppm, что с учетом доли отгона фракции (в среднем 12–19 %) в пересчете на нефть дает норматив не более 0,8–1,2 ppm (ГОСТ Р 51858- 2002 «Нефть. Общие технические условия»). Кроме того, введено требование о недопустимости применения при добыче, подготовке и транспортировке нефти химических реагентов, содержащих ХОС.
На объектах ООО «Газпром нефть шельф» требование о недопустимости содержания ЛХОС в нефти было введено в действие в 2018 г. В связи с этим для определения степени влияния химических реагентов, используемых при добыче и подготовке нефти на МЛСП «Приразломная», Научно-Технический Центр «Газпром нефти» и АНО «ГЦСС «Нефтепромхим» провели исследования нефти, пластовой воды с применяемыми химическими реагентами с целью определения наличия в них ЛХОС, а также возможности их образования во время производственных процессов. Практическая значимость работы заключалась в снижении риска образования ЛХОС в товарной нефти из-за применения химических реагентов.
Проведены хромато-масс-спектрометрические исследования проб ингибиторов коррозии и АСПО на приборе Shimadzu GCMSQP2010Ultra. Результаты исследований (хроматограммы) для пробы 1 представлены на рис. 1 и в табл. 1, для пробы 2 – на рис. 2 и в табл. 2. Идентификация компонентов проводилась с использованием библиотеки масс-спектров. В обеих исследуемых пробах химических реагентов были обнаружены хлорорганические компоненты. В пробе 1 ингибитора коррозии выявлены соединения: C7H7Cl, C11h33Cl, C18h41ClO, в пробе 2 ингибитора АСПО – C7H7Cl, C11h33Cl, C14h39Cl. В связи с тем, что температура кипения веществ C11h33Cl, C14h39Cl, C18h41ClO превышает 204 °С, данные соединения были исключены из дальнейшего исследования, поскольку они, являясь ХОС, не относятся к легколетучим. Для подтверждения данного факта образец ингибитора АСПО (проба 2) был добавлен в сырую нефть в рабочей концентрации 150 мг/дм3, далее нефть была подвергнута перегонке в соответствии с ГОСТ Р 52247-2004 для получения нафты. В полученной нафте проведено определение содержания органически связанного хлора методами рентгенофлуо ресцентной спектрометрии (метод В ГОСТ Р 52247-2004) и газовой хроматографии (ГХ) (Свидетельство об аттестации МИ № 01.00257-2013/17506-17 от 13.12.17 г.; ФР.1.31.2018.29025) [3]. Обоими методами получено сопоставимое содержание органически связанного хлора в нафте: соответственно 2,8 ppm и 3,0 ppm. При этом следует отметить, что допустимая воспроизводимость метода В не должна превышать 2,0 ppm. Полученная разница результатов по двум разным методам составляет 0,2 ppm, что на порядок меньше даже допустимых расхождений результатов по методу В.
Таким образом, результаты обнаружения бензилхлорида методом ГХ следует признать достоверными. При этом в нафте был определен только бензилхлорид C7H7Cl. Проведенный эксперимент подтверждает отнесение C7H7Cl к ЛХОС и отсутствие перехода C11h33Cl, C14h39Cl, C18h41ClO в нафту. На рис. 3 представлен спектр бензилхлорида. При проведении анализов проб нефти с химическими реагентами на наличие ХОС методом газовой хроматографии [3] в составе одной из проб был обнаружен бензилхлорид C7H7Cl. Концентрация бензилхлорида в пересчете на реагент составила порядка 70 000 ppm. На данном этапе исследований было сделано предположение, что большое количество бензилхлорида C7H7Cl в пробах может быть вызвано как наличием самого вещества в химическом продукте, так и термической деструкцией ЧАС (алкилдиметилбензиламмоний хлорида) в ходе испытаний с образованием вторичного ХОС – бензилхлорида. Для определения источника ЛХОС в пробах химических реагентов были проведены дополнительные исследования на газовом хроматографе с детектором электронного захвата. На хроматограммах также наблюдались пики бензилхлорида. Поскольку наблюдаемая картина в пробах ингибитора коррозии и ингибитора АСПО аналогична, то в дальнейшем для иллюстрации приводятся хроматограммы только ингибитора АСПО (проба 2) (рис. 4).
Была проведена экстракция указанных химических реагентов смесью изооктана с водой в соотношениях (1:1:1). На полученных хроматограммах пики бензилхлорида не наблюдаются (рис. 5). Это свидетельствует, с одной стороны, о переходе ЧАС в водную фазу, с другой – о том, что обнаруженный ранее во время испытаний методами В (ГОСТ Р 52247- 2004), хромато-масс-спектрометрии и ГХ без предварительной пробоподготовки) бензилхлорид появлялся в результате термической деструкции ЧАС.
Соли ЧАС представляют собой органические производные иона аммония Nh5+, в котором атомы водорода полностью или частично замещены органическими радикалами [R4-nNHn] +An- , где анион An- – остаток органической или неорганической кислоты, n = 0–3. В ЧАС атом хлора находится не в ковалентном, а в ионном состоянии. Соли ЧАС являются компонентами ингибиторов коррозии и характеризуются функциональной группой (положительно заряженный атом азота) и липофильным остатком. Адсорбционно активная функциональная группа взаимодействует с поверхностью металла, адсорбируется на ней благодаря донорно-акцепторным и/или водородным связям, а липофильный фрагмент захватывает углеводороды нефти, создавая физический барьер между металлом и агрессивной средой [4]. Соли ЧАС обладают ингибирующими, эмульгирующими и бактерицидными свойствами [4]. Наиболее часто применяется соединение алкилдиметилбензиламмоний хлорид, который сам по себе не является ЛХОС, так как в этом случае нет связи C-Cl (признак хлорорганического соединения), а есть ионная связь R-Nh5 +Cl- . Однако соединения этого класса могут быть термически неустойчивыми и подвергаться деструкции при нагревании до температуры 204 оС с образованием бензилхлорида, который относится к классу ЛХОС. ГОСТ Р 52247-2004 регламентирует методы определения ЛХОС применительно к нефти, а не к химическим реагентам, и предусматривает обязательную стадию отгонки фракции нефти. Именно на этой стадии и происходит деструкция ЧАС с образованием бензилхлорида.
Подобное поведение ЧАС было выявлено в АНО «ГЦСС «Нефтепромхим» в 2006 г. при исследований ряда реагентов, имеющих в своем составе ЧАС. Образующийся в результате термического разложения ЧАС бензилхлорид выявляется любым методом, предлагаемым в ГОСТ Р 52247-2004. При прямом хроматографировании подобных химических реагентов на хроматограмме присутствует пик, характерный по времени удерживания для бензилхлорида, который также является следствием разрушения ЧАС в условиях хроматографирования (температура испарителя 220 оС). Однако, если подобный химический реагент подвергнуть экстракции подходящим органическим растворителем, то на хроматограмме экстракта данный пик не регистрируется. Это свидетельствует о том, что изначально бензилхлорид в химическом продукте отсутствует и не появляется в результате термического разрушения ЧАС, так как ЧАС в данном случае остается в водной (полярной) фазе. В случае, когда бензилхлорид изначально присутствует в химическом реагенте, при экстракции как неполярное соединение он переходит в неполярную фазу – органический растворитель. Как правило, соли четвертичных аммониевых оснований являются водорастворимыми и на стадии первичной подготовки(обезвоживания и обессоливания) нефти переходят из органической (нефтяной, неполярной) фазы в более полярную фазу – воду, т.е. нахождение их в нефти после первичной подготовки в больших количествах маловероятно. На практике подача химически реагентов, содержащих ЧАС, в сырую нефть перед процессом обезвоживания и обессоливания не должно влиять на повышение содержания ЛХОС в товарной нефти, либо это влияние может быть незначительным (вследствие неполного перехода ЧАС из нефтяной в водную фазу). Подача химических реагентов, содержащих ЧАС, в товарную нефть будет приводить к повышению содержания ЛХОС в процессе разделения последней на фракции на НПЗ.
Одним из источников загрязнения нефти и нефтепродуктов могут быть химические продукты, содержащие ЛХОС либо в качестве составляющего компонента, либо в виде примеси, оставшейся в них в результате нарушения технологии их получения
Поскольку наличие ЧАС в ингибиторах АСПО не является характерным, был проведен анализ технологического регламента объекта, на котором планировалось применение химического реагента.
При анализе Технологического регламента выяснилось, что ингибитор АСПО применяется для снижения рисков образования органических отложений и предотвращения их накопления в системе подготовки и транспорта нефти. Реагент подается на устье добывающих скважин, далее на вход в процесс подготовки нефти и выход нефти из стриппинг колонны перед погрузкой в танкер. Таким образом, ингибитор АСПО, содержащий ЧАС, в соответствии с Технологическим регламентом должен был дозироваться в уже подготовленную нефть. В этом случае водорастворимые ЧАС не могут перераспределиться и остаются в товарной нефти, впоследствии разлагаясь с образованием ЛХОС – бензилхлорида, что определяется по методикам ASTM D4929 и ГОСТ Р 52247-2004. Для определения количества ЛХОС, образующегося в результате разложения ЧАС, образец ингибитора АСПО (проба 2) был добавлен в сырую нефть в концентрации 150 мг/дм3. Образец нефти с химическим реагентом был подвержен перегонке в соответствии с ГОСТ Р 52247-2004, выход нафты (фракции, выкипающей до температуры 204 °С) составил 15,5 %. В отогнанной фракции нафты было проведено определение содержания ЛХОС – обнаружен бензилхлорид в количестве 10,7 ppm, что в пересчете на органически связанный хлор составляет 3,0 ppm1. Аналогично был проведен эксперимент с химическим реагентом, не содержащим ЧАС и ЛХОС. Образец ингибитора солеотложений добавили в сырую нефть в концентрации 20 мг/дм3. Образец нефти с химическим реагентом подвергли перегонке в соответствии с ГОСТ Р 52247-2004, выход нафты (фракции, выкипающей до температуры 204 °С) составил 15,5 %. Проведенные исследования отогнанной фракции нафты на содержание ЛХОС выявили их отсутствие.
*Хроматографический метод предусматривает определение целого хлорорганического соединения, имеющего углеводородную часть, связанную с ионами хлора. Для расчета непосредственно органически связанного хлора, нормируемого по ГОСТ Р 51858-2002, используется расчетный метод. Пример. Молекулярная формула бензилхлорида имеет вид C6H5-Ch3-Cl. Молекулярная масса данного соединения составляет: (12⋅6+1⋅5+12+1⋅2+35,5) = 126,5 г/моль. Поскольку в 126,5 г бензилхлорида содержится 35,5 г хлора, коэффициент перевода данного хлорорганического соединения на органически связанный хлор k = 35,5:126,5 = 0,28. Хроматографический метод анализа основан на том, что по каждому индивидуальному хлорорганическому соединению строится градуировочный график зависимости аналитического сигнала (площадь пика) от массовой концентрации растворов ЛХОС, приготовленных из стандартных образцов. Таким образом, непосредственно определяется индивидуальное содержание ХОС, затем путем пересчета найденное содержание ЛХОС переводится в содержание органически связанного хлора, в соответствии с ГОСТ Р 52247-2004. Пример. Найдено 10,7 ppm бензилхлорида, тогда содержание органически связанного хлора составит 10,7 ppm⋅0,28 = 2,996 ppm. Округляем до одного знака после запятой и получаем 3,0 ppm органически связанного хлора.
1. Обнаруженные в ингибиторе АСПО (проба 2) методом газовой хроматографии ХОС (C11h33Cl, C12h35Cl, C14h39Cl, C18h41ClO) не были выявлены после перегонки по методу В (ГОСТ Р 55247-2004) в нафте, содержащей тот же самый реагент. Это свидетельствует о том, что данные вещества, являясь ХОС, не относятся к легколетучим.
2. Проведенные исследования ХОС в нефти, в которую был добавлен ингибитор АСПО (содержащий ХОС) концентрацией 150 мг/дм3, методами рентгенофлоуресцентной спектрометрии и ГХ позволили получить сопоставимые количества органически связанного хлора в нафте: по методу В (ГОСТ Р 52247-2004) – 2,8 ppm, по методу ГХ – 3,0 ppm.
3. При анализе химических реагентов (проба 2) на содержание органических хлоридов методами, предусмотренными ASTM D4929 и ГОСТ Р 52247-2004, наблюдается разложение ЧАС с образованием ЛХОС при отгонке нафты.
4. Для предотвращения попадания ЛХОС в подготовленную или товарную нефть не рекомендуется добавлять в нее ингибиторы парафиноотложений, депрессорные присадки и иные химические реагенты, содержащие соли ЧАС, способствующие образованию ЛХОС.
5. На МЛСП изменена процедура входного контроля, добавлены исследования по определению содержания ЛХОС и солей ЧАС (способных образовывать ЛХОС) в реагентах с целью предотвращения попадания ХОС в товарную нефть.
6. При анализе химических реагентов на содержание органических хлоридов методами, предусмотренными ASTM D4929 и ГОСТ Р 52247, необходимо учитывать возможность разложения ЧАС с образованием ЛХОС при отгонке нефти.
7. Вопрос полноты перехода ЧАС из органической (нефтяной, неполярной) фазы в более полярную фазу – воду на стадии первичной подготовки (обезвоживания и обессоливания) нефти требует дополнительного изучения.
8. Необходимо проведение дополнительных исследований с целью изучения возможных реакций в нефти с участием ХОС и влияния тяжелых ХОС на процессы нефтепереработки и качество нефтепродуктов.
1. Крикун Н.Г. Утраченный контроль. Проблемы применения химпродуктов в нефтяной отрасли России // ТехНАДЗОР. – 2012. — № 8(69). – С. 40–41.
2. Охлопков А.С. Свойства товарной сырой нефти, позволяющие идентифицировать источник нефтяного загрязнения окружающей природной среды : дис. …канд. хим. наук. – Нижний Новгород, 2015. – 130 с
3. ASTM D4929. Standard Test Method for Determination of Organic Chloride Content in Crude Oil. ФР.1.31.2018.29025 «Химические продукты. Определение массовой доли легколетучих хлорорганических соединений хроматографическим методом. Методика (метод) измерений».
4. Угрюмов О.В., Ившин Я.В. Азотфосфорсодержащие ингибиторы коррозии нефтепромыслового оборудования. – Казань: КГУ, 2009. – 213 с.
Reference
1. Krikun N.G., Lost control. Problems of chemical products in the Russian oil industry (In Russ.), TekhNADZOR, 2012, no. 8(69), pp. 40–41.
2. Okhlopkov A.S., Svoystva tovarnoy syroy nefti, pozvolyayushchie identifitsirovat’ istochnik neftyanogo zagryazneniya okruzhayushchey prirodnoy sredy (Properties of commercial crude oil, allowing to identify the source of oil pollution of the environment): thesis of candidate of chemical science, Nizhniy Novgorod, 2015
3. ASTM D4929, Standard test method for determination of organic chloride content in crude oil.
4. Ugryumov O.V., Ivshin Ya.V., Azotfosforsoderzhashchie ingibitory korrozii neftepromyslovogo oborudovaniya (Nitrogen phosphorus inhibitors of oilfield equipment corrosion), Kazan’: Publ. of KSU, 2009, 213 p
Примеры соединений
Примеры соединений — Пероксид водорода
Химическая формула соединения воды — H 2 O, что указывает на то, что 2 атома водорода соединяются с 1 атомом кислорода, см. Химические формулы. Но если добавить еще один атом кислорода, будет создано новое соединение, называемое перекисью водорода — H 2 O 2 , что указывает на то, что 2 атома водорода объединяются с 2 атомами кислорода и создают соединение перекиси водорода.
Примеры соединений — соль
Соль — это соединение, потому что оно состоит из более чем одного элемента. Химическая формула хлорида натрия (соли) — NaCl, что указывает на то, что 1 атом натрия соединяется с 1 атомом хлора.
Примеры соединений
Примеры соединений — общие соединения
Существуют миллионы соединений. В следующих примерах соединений показаны некоторые из наиболее распространенных соединений и их химические формулы или уравнения.
Примеры соединений | ||||
| Примеры формул для соединений | Примеры названий общих соединений | |||
H 2 O | Вода | |||
C 6 H 12 O 6 | Глюкоза | |||
| C 2 H 6 O | Спирт | |||
NaCl | Соль | |||
| Этанол | ||||
| C 2 H 4 O 2 | Уксус | |||
NH 3 | Аммиак | Аммиак | 2 H 4 O 2 | Уксусная кислота |
C 4 H 10 | Бутан | |||
H 2 SO 4 | Серная кислота | |||
CH 4 | Метан | Сахароза | ||
C 3 H 8 | Пропан | |||
| CO61 3 | Пищевая сода | |||
N 2 O | Азот | |||
C 6 H 8 O 7 | лимонная кислота | C 8 H 18 | Октан | |
C 10 9 0007 H 16 O | Camphor | |||
| Примеры формул для соединений | Примеры названий общих соединений | |||
Примеры соединений | ||||
Примеры соединений
В приведенных выше примерах соединений подробно описаны общие химические формулы.
Примеры соединений — карта элементов!
Для получения дополнительной информации об элементах, представленных в Периодической таблице, пожалуйста, обратитесь к нашей обширной карте элементов!
Определение соединений и примеры — Биологический онлайн-словарь
Определение
существительное
множественное число: соединения
соединение, ˈkɒmpaʊnd
( общее ) Материал, состоящий из двух или более частей или элементов
( биохимия ) Вещество, состоящее из атомов или ионов двух или более элементов, которые химически связаны вместе, e.грамм. углекислый газ , вещество, состоящее из углерода и двух атомов кислорода
прилагательное
( зоология ) Состоит из отдельных особей, которые связаны, образуя колонию, например, коралл
( ботаника ) Состоит из одинаковых частей, которые объединяются в единое целое, как сложный плод , который развился из нескольких завязей, или составной лист , состоящий из листочков
Детали
Химическое соединение
Химическое соединение относится к веществу , состоящему из из двух или более элементов , которые химически связаны между собой .
Вещество относится к тому, что имеет определенный химический состав и особые свойства и состоит из элементов в сочетании с другими или такими же элементами. Все соединения являются веществами, но не все вещества являются соединениями, поскольку чистые элементы также являются химическими веществами.
Химический элемент, в свою очередь, определяется как чистое вещество, состоящее только из одного типа атомов. В элементе будут атомы с одинаковым числом протонов.
Элементы образуют соединение. Два или более элемента, которые удерживаются вместе химической связью, образуют соединение.Например, комбинация элементов натрия и хлора приводит к образованию хлорида натрия (поваренная соль). Таким образом, вещество, состоящее только из одного типа элементов, является не химическим соединением, а аллотропом элемента. Например, алмаз — это чистый элемент, состоящий из атомов углерода, расположенных в кристалле.
Многие элементы, встречающиеся в природе на Земле, химически соединены. Примерами общих соединений, имеющих решающее значение для жизни, являются вода, хлорид натрия и углекислый газ.Процессы, которые, как полагают, изначально породили природные элементы, — это нуклеосинтез во время Большого взрыва, звездный нуклеосинтез, взрывной нуклеосинтез в сверхновых и расщепление космических лучей.
Химическая формула используется для обозначения пропорций атомов, составляющих химическое соединение. Символ указывает составной элемент, тогда как нижние индексы указывают, сколько атомов этого элемента составляют соединение. Химический состав соединения можно изменить, подвергнув его химической реакции.
Химическая связь — это сила притяжения, удерживающая атомы вместе. Существует четыре основных типа химических связей: (1) ионная связь, (2) ковалентная связь, (3) водородная связь и (4) металлическая связь.
Ионная связь — это химическая связь, при которой происходит полный перенос электрона от одного атома к другому. Это электростатическое притяжение между противоположно заряженными ионами, то есть катионом и анионом. Катион представляет собой положительно заряженный ион, тогда как анион представляет собой отрицательно заряженный ион.Соединение, образованное элементами, удерживаемыми ионной связью (ами), упоминается как ионное соединение . Хлорид натрия является примером ионного соединения, в котором катион Na + и анион Cl — удерживаются вместе ионной связью. Ионное соединение, содержащее ионы водорода (H + ), классифицируется как кислота . И наоборот, ионное соединение, содержащее гидроксид (OH —) или оксид (O 2-), классифицируется как основание .Ионное соединение, образованное кислотно-основными реакциями без этих ионов, называется солью .
Ковалентная связь представляет собой тип химической связи, в которой электроны разделяются между атомами. Например, молекула воды имеет два атома водорода и центральный атом кислорода, удерживаемые вместе двумя ковалентными связями; каждый атом водорода разделяет пару электронов с атомом кислорода. Ковалентная связь может быть одинарной , двойной или тройной .Одинарная связь (-) — это когда атомы разделяют два электрона. Обычно это сигма (σ) связь. Двойная связь (=) — это разделение четырех электронов между двумя химическими элементами. Обычно он состоит из более сильной связи σ и более слабой связи pi (π). Когда ковалентная связь включает шесть электронов между двумя атомами, это тройная связь. Тройная связь (≡) обычно имеет одну σ-связь и две π-связи. Одинарная связь является самой слабой из трех, поскольку существует только одна связь, соединяющая два атома вместе.
Водородная связь представляет собой низкоэнергетическую электростатическую связь, в которой водород служит мостиком между двумя атомами. Он образуется, когда слегка положительный атом водорода полярной ковалентной связи образует электростатическую связь с более электроотрицательным атомом полярной ковалентной связи в той же или другой молекуле. Как следует из названия, он включает атом водорода, который притягивается к электроотрицательным атомам, например. кислород, фтор, азот полярной ковалентной связи в той же или другой молекуле.Водородная связь — слабая химическая связь, но относительно обычна в организмах. Он отвечает за вторичные и третичные структуры нуклеиновых кислот и белков. ДНК, например, имеет двойную спиральную структуру, которая в значительной степени обусловлена водородными связями между парными азотистыми основаниями.
Металлическая связь — это электростатическая сила между электронами проводимости и положительно заряженными ионами металлов. Интерметаллические соединения удерживаются вместе металлическими связями.
Органические vs.Неорганическое
Органическое соединение — это тип соединения, содержащего атом углерода. Неорганическое соединение представляет собой тип соединения, в котором отсутствуют атомы углерода, или когда оно присутствует, оно ионно связано с другими атомами. Живые существа описываются как органических , поскольку они состоят из органических соединений. Примерами органических соединений являются углеводы, липиды, белки и нуклеиновые кислоты. Поскольку они состоят из соединений на основе углерода, они распадаются на более мелкие и простые соединения в результате разложения, когда они умирают.Живые организмы также выделяют или выделяют материал, который считается органическим материалом. Органическое вещество живых существ становится частью окружающей среды. Таким образом, в экосистеме много органических веществ, например почвенная экосистема. Органическое вещество перемещается в почву или в основной поток воды, где затем служит источником питания для живых организмов.
Другие биологические определения
В общем, соединение относится к материалу, состоящему из двух или более частей.Например, составной лист — это лист, состоящий из листочков. Сложный плод — это плод, который развивается из нескольких завязей. Таким образом, соединение в ботаническом контексте описывает структуру растения, состоящую из схожих частей, которые объединяются в единое целое.
Дополнительный
Этимология
- Латинский: com («вместе»)
- Латинский: ponere («положить»)
Производные термины
Дополнительная литература
Сравнить
См. Также
© Biology Online.Контент предоставлен и модерируется онлайн-редакторами биологии
Соединения: факты (Science Trek: Общественное телевидение Айдахо)
Атомы и элементы: строительные блоки всего
Все, что занимает место в нашем мире, — материя. Наука об изучении материи называется химией. Вся материя состоит из крошечных частиц, называемых атомами. Атомы составляют воздух, воду, ваше тело, вашу одежду, пищу, которую вы едите, и стул, на котором вы сидите.Но вы не видите атомов. Они настолько крошечные, что в точке в конце этого предложения есть миллиарды атомов. Есть разные типы атомов, и они особым образом подходят друг к другу, чтобы образовать всю материю в мире.
Все атомы состоят из еще более мелких частиц, называемых протонами, нейтронами и электронами. Протоны и нейтроны собираются вместе в ядре или центре атома, в то время как электроны вращаются вокруг ядра.
Все во вселенной состоит из элементов.Мы знаем о 92 элементах, встречающихся в природе, но еще несколько были созданы учеными, всего их 118. Элемент — это чистое вещество, состоящее из одного типа атомов. Например, золото — это элемент, состоящий из атомов золота. Кислород — это элемент, состоящий из атомов кислорода. Периодическая таблица элементов используется для организации элементов по их атомным номерам или количеству протонов в ядре. Например, у кислорода 8 протонов, поэтому его атомный номер равен 8. Химические символы обозначают каждый элемент.Из таблицы Менделеева вы можете узнать гораздо больше об атомах и элементах.
Соединения
Когда два или более атома соединяются вместе, мы называем это молекулой. Когда два или более атомов различных элементов соединяются вместе, мы называем это соединением. Все соединения являются молекулами, но не все молекулы являются соединениями. Это потому, что молекула может состоять из двух атомов одного типа, например, когда два атома кислорода соединяются вместе, образуя молекулу кислорода.Однако все соединения состоят из двух или более различных типов атомов.
Элементы редко встречаются в чистом виде; соединения встречаются гораздо чаще. Существует чуть более 100 различных видов атомов, но существуют миллионы различных видов веществ, состоящих из разных типов молекул. Вероятно, все, что вы видите вокруг себя, представляет собой какое-то соединение. Когда атомы разных видов объединяются в соединение, создается новое вещество. Новые соединения не обладают такими же физическими или химическими характеристиками, как исходные элементы.У них есть собственная новая жизнь.
Соединения записываются с формулами, показывающими, какие элементы из таблицы Менделеева объединены. Одно очень знакомое соединение — это вода. Когда два атома водорода (h3) соединяются с одним атомом кислорода (O), образуется соединение h3O, известное нам как вода. Все молекулы воды имеют одинаковую комбинацию атомов. Вода — это не водород или кислород. Нельзя подлить атомы кислорода и водорода в огонь и рассчитывать на его тушение. Но когда они связаны вместе как молекулы воды, они ведут себя как вода.Соединение — это совершенно новое вещество со своими собственными свойствами.
Из одних и тех же элементов можно составлять самые разные соединения. Если вы возьмете эти два атома водорода и соедините их с двумя атомами кислорода (вместо одного), вы получите не воду, а h3O2, совершенно другое соединение, называемое перекисью водорода — вы бы не захотели его пить!
- Есть много других соединений, которые вам уже знакомы:
- Когда один атом натрия (Na) соединяется с одним атомом хлора (Cl), образуется соединение NaCl, которое мы знаем как соль.
- Каждый раз, когда вы выдыхаете, ваше дыхание содержит CO2, соединение одного атома углерода (C) и двух атомов кислорода (O2), которое мы называем углекислым газом.
- Иногда более двух элементов составляют соединение. Молекула сахара (глюкоза) представляет собой соединение из 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода, записанное как C6h22O6. Эти конкретные атомы в этих точных числах составляют молекулу сахара.
- Когда четыре различных типа атомов (натрий, водород, углерод и кислород) соединяются определенным образом, мы получаем NaHCO3, который вы знаете как пищевую соду.Если бы эти атомы соединить по-другому, это не была бы пищевая сода.
Химические связи
Как образуются эти соединения? Что удерживает атомы в молекуле вместе? Ответ заключается в том, что соединения образуются, когда элементы соединяются и удерживаются вместе сильными силами, называемыми химическими связями. Эти связи включают электроны, которые вращаются вокруг ядра атома. Электроны расположены на энергетических уровнях, которые находятся на определенных расстояниях от ядра, называемых оболочками.Каждая из этих оболочек может нести определенное количество электронов (например, 2 в первой оболочке, 8 во второй и т. Д.). Атомы хотят, чтобы их оболочки были заполнены таким количеством электронов, которое они могут нести, и когда их крайний край оболочка не заполнена, атомы пытаются соединиться с другими атомами, отдавая или получая электроны. Атомы с почти пустой внешней оболочкой захотят отдать электроны, в то время как атомы с почти полной внешней оболочкой захотят получить электроны, чтобы заполнить ее.
Есть два основных типа связей, которые удерживают вместе большинство соединений.Ионные связи образуются, когда один атом отдает или передает электрон другому, чтобы у обоих была полноценная внешняя оболочка. При этом атомы связаны и образуют соединение. Ковалентные связи разделяют электроны между атомами, чтобы заполнить их электронные оболочки. В этом соединении молекулы удерживаются вместе за счет притяжения между ядром и общими электронами.
Составы и смеси
Часто вещества могут объединяться, не образуя соединения.Чтобы создать соединение, должна произойти химическая реакция, при которой образуются связи и создается совершенно новое вещество. Без этой химической реакции объединенные вещества могут образовывать смесь.
Компоненты смеси сохраняют свои первоначальные свойства и легко разделяются. Например, смесь фруктов в салате можно разделить на группы разных фруктов. Соль и воду можно смешать в смеси, но вода остается водой, а соль остается солью.Чтобы разделить два компонента, воду можно выпарить, чтобы можно было собрать соль. Песок и воду можно отделить с помощью фильтра. Океан, камни, кровь и даже воздух, которым мы дышим, представляют собой смеси, а не составные части.
С другой стороны, компоненты в соединении не могут быть разделены физическими средствами. Узнайте больше о соединениях и смесях.
Физические и химические изменения
Физические изменения не разрушают соединения.Физические изменения влияют на размер, форму или состояние вещества, но не на химические свойства. Вы можете изменить состояние материи, но состав не изменится. Если вы оставите кубик льда на солнце, он растает и превратится в жидкую воду, но в любом из этих состояний он по-прежнему состоит из молекул воды. Вы можете применить физическую силу к твердому стеклу и разбить его, но молекулы, из которых состоит стекло, останутся.
Химические изменения в соединениях происходят при создании или разрушении химических связей.Затем меняется молекулярная структура; формируются новые молекулы и создается новое вещество. Часто тепло используется для начала химического изменения, например, при выпечке торта. Другой пример химической реакции — ржавчина металлического мусорного бака. Ржавчина происходит из-за того, что железо (Fe) в металле соединяется с кислородом (O2) воздуха. Создаются и разрушаются химические связи, в результате чего образуется оксид железа (Fe2O3), который мы называем ржавчиной.
Разорвать химические связи непросто, но это можно сделать в химических реакциях, используя энергию для разрыва связей.Например, электрический ток, проходящий через воду, может вызвать химическое изменение, которое расщепляет воду на водород и кислород. Когда химик смешивает разные соединения в химической реакции, соединения могут объединяться в одно соединение или превращаться в несколько новых соединений. Некоторые из признаков химической реакции — изменение температуры, образование газа или изменение цвета.
Именование соединений
У ученых есть особый способ наименования соединений.Есть несколько сложных правил, но давайте остановимся на простых. Для молекул с двумя элементами составное имя состоит из двух слов: имени первого элемента и имени второго элемента, изменяющего окончание на «ide». Например, если кислород является вторым элементом в соединении, он становится «оксидом». Если хлор является вторым элементом, он становится «хлоридом».
Если один из элементов имеет более одного атома, вы добавляете префикс в начало имени элемента в зависимости от количества атомов.Если есть два атома, вы добавляете «ди» в начале. Если их три, вы добавляете «три» в начале. Если их четыре, вы добавляете «тетра».
Соединение, состоящее из одного атома натрия и одного атома хлора, называется хлоридом натрия.
(1) Натрий и (1) Хлор = Хлорид натрия (NaCl)
Соединение одного атома магния и одного атома серы (MgS) называется сульфидом магния.
(1) Магний и (1) Сера = сульфид магния (MgS)
Соединение, состоящее из одного атома углерода и двух атомов кислорода, называется диоксидом углерода.
(1) Углерод + (2) Кислород = Двуокись углерода (CO2)
Соединение, состоящее из одного атома углерода и четырех атомов хлора, называется четыреххлористым углеродом. (1) Углерод + (4) Хлор = Четыреххлористый углерод (CCl4)
Немного попрактиковавшись, вы скоро заговорите на «языке» химических соединений!
молекул и соединений
Когда атомы объединяются, образуя ионные или ковалентные связи, они образуют устойчивые ассоциации, которые изменяют свойства каждого атома в отдельности.Эти новые молекулы демонстрируют уникальные эмерджентные свойства. Молекула существует, когда два или более атома соединяются, образуя химические связи. Одиночная молекула может иметь размер всего два атома, как кислород, которым мы дышим, или целых 5 секстиллионов (5 с 21 нулем после них!) Атомов углерода, как алмаз в 1⁄2 карата в обручальном кольце.
Когда атомы по крайней мере двух разных элементов объединяются, чтобы образовать химические связи, эти молекулы можно назвать соединениями. Хлорид натрия (NaCl) — классический пример ионного соединения или соединения, образованного ионными связями.Воду (H 2 O) часто называют молекулярным соединением, но также называют ковалентным соединением, потому что это соединение, образованное ковалентными связями. Хотя это и менее распространено, некоторые учебники биологии называют молекулярные соединения молекулами и не включают ионные соединения в термин «молекула». Для ясности мы будем использовать более общее определение молекулы, которое включает всех типов соединений, а также молекул, образованных атомами одного элемента, таких как примеры молекулярного кислорода и молекулярного углерода (алмазы).
Все молекулы можно записать в виде списка атомов, их образующих. Мы пишем NaCl, чтобы представить молекулярную формулу поваренной соли, которая образована ионной связью между натрием (Na) и хлором (Cl). Молекулярные формулы также используются для ковалентных молекул, таких как вода (H 2 O). Когда в одной молекуле содержится более одного атома определенного элемента, мы используем нижний индекс справа от символа атома, чтобы указать, сколько атомов этого элемента присутствует в каждой молекуле.Например, молекулярная формула воды (H 2 O) указывает, что в каждой отдельной молекуле есть два атома водорода и один атом кислорода. Как показывает этот пример, атомы в молекулярной формуле не всегда записываются в порядке их связей. Структурная формула воды — H-O-H, но когда мы пишем молекулярную формулу, мы объединяем атомы водорода в один список, H 2 O, для простоты.
Молекула или соединение?
Это задание проверяет вашу способность определять, представляет ли молекулярная формула молекулу, ионное соединение или ковалентное соединение.
Молекулярные и структурные формулы
В этом упражнении вы сопоставите молекулярный форум молекулы с соответствующей структурной формулой.
молекул, соединений и смесей — кинетическая теория
Непрофессионалы иногда используют соединения и смеси как синонимы.
Хотя термины частично совпадают, технически они не совпадают.
Соединения — это два или более элемента, химически соединенных в определенных весовых пропорциях.
Смеси — это два или более вещества , не соединенные химически.
Читайте дальше, чтобы получить более подробное объяснение свойств соединений и смесей.
Основы — Молекулы, смеси и соединения
Вселенная состоит из атомов , крошечных строительных блоков материи.
Этот экран компьютера состоит из атомов, как и ваши глаза, остальная часть вашего тела и пол под вами!
За последние 110 лет ученые обнаружили, что сами атомы состоят из более мелких частиц.У атома есть центральное ядро, состоящее из протонов и нейтронов, окруженное электронами.
Эти детали настолько малы, что ученые их не видят. Они «видны» только по поведению атома. На случай, если вы запутались, электронные микроскопы позволяют ученым «видеть» сильно увеличенные изображения некоторых атомов, но не более мелкие частицы, образующие атом.
Элементы — это простейшие в природе вещества, которые нельзя разбить на более мелкие части обычными химическими средствами.Они содержат только атомы одного типа, обладающие идентичными химическими свойствами. Есть как минимум 90 элементов природного происхождения, а также элементы, созданные руками человека. Если вы посмотрите на периодическую таблицу, вы увидите названия каждого из этих элементов и некоторые их свойства (например, массу или тяжесть атома).
Молекулы и соединения
Когда атомы разных элементов объединяются в группы, они образуют молекул . Атомы в молекулах связываются химически, что означает, что атомы не могут быть снова разделены физическими средствами, такими как фильтрация.Молекула имеет свойства, отличные от элементов, из которых она была сделана. Молекула воды — это не три отдельных атома, два водорода (H) и один кислород (O), но на самом деле это уникальная молекула H 2 O.
Подобно элементам, состоящим из атомов одного сорта, соединения состоят из молекул одного сорта. Элементы могут быть объединены примерно в 2 миллиона различных соединений!
Знаете ли вы, что яичная скорлупа состоит из соединения карбоната кальция? А лимонная кислота, которая содержится в апельсинах и других цитрусовых, представляет собой соединение атомов углерода, водорода и кислорода.Вашим детям может быть полезно провести научно-исследовательский проект по поиску других распространенных соединений в вашем доме. Выдвигайте гипотезы и проводите исследования, используя справочник по химии, веб-сайт или учебник, чтобы найти ответы.
Углерод — это наиболее распространенный элемент, содержащийся в соединениях. Соединение, содержащее углерод, называется органическим соединением .
Смеси — Немного того и другого
Все вещества можно разделить на две категории: чистые вещества и смеси.
Чистое вещество состоит из одного элемента или соединения. Железо состоит только из атомов железа (Fe); Поваренная соль образована только молекулами хлорида натрия (NaCl).
Смесь , однако, состоит из различных соединений и / или элементов. Когда соль добавляется в воду для получения соленой воды, она превращается в смесь. Молекулы соли и воды не объединяются, чтобы сформировать новые молекулы, а только «смешиваются» вместе, сохраняя при этом свою идентичность. Воздух также представляет собой смесь, содержащую необходимое количество азота, кислорода и других газов для жизни на Земле.
Смеси различаются по составу. Гомогенные (равномерно распределенные) смеси двух или более химических веществ называются растворами. Соленая вода — это раствор, а итальянская заправка — нет (потому что ингредиенты не растворяются полностью).
Смеси металлов называются сплавами (бронза — сплав меди и олова)
Вещества, составляющие смесь, можно разделить физическими средствами, поскольку они имеют разные физические свойства (например, разные точки плавления) и не связаны химически.
Смесь можно разделить на части различными способами, в том числе декантацией (дать песку в смеси воды и песка осесть, а затем слить воду, например), фильтрованием и испарением .
Для фильтрации можно использовать кухонную воронку и кофейный фильтр, а для испарения использовать солнечный свет или слабый нагрев. Попробуйте эти методы на соленой воде и смеси песка и воды, чтобы увидеть, как они работают, и сравнить результаты.
Испарение подходит как для соленой воды, так и для песка и водных растворов, но фильтрация не работает для соленой воды.
Можете ли вы вспомнить другие примеры, где метод разделения будет работать для одной смеси, а не для другой? Еще можно попробовать лимонный сок, смесь воды и лимонной кислоты; как вы думаете, что происходит, когда его варят? Вода испаряется и в конечном итоге не оставляет ничего, кроме кристаллов лимонной кислоты.
Химическое вещество под любым другим названием…
Химическая формула молекулы дает нам ее атомный номер.То есть он сообщает нам, какие элементы содержатся внутри и в какой пропорции.
Например, знаете ли вы, сколько атомов в молекуле AlSO 4 (сульфат алюминия)? Есть один алюминий (Al), одна сера (S) и четыре кислорода (O). Ответ — шесть атомов.
Какая формула хлорида аммония? Поскольку он содержит один азот (N), четыре водорода (H) и один хлор (Cl), химическая формула — NH 4 Cl. Чтобы познакомить ваших детей с периодической таблицей и сокращениями элементов, ответьте на подобные вопросы в игру.Определите количество атомов для CaOH 2 , FeCl 2 , K 3 FeCN 6 и химические формулы для соединения с двумя атомами натрия, одного кальция и трех атомов кислорода и соединения с одним железом. и три атома хлора.
Вы когда-нибудь задумывались, как назвать химическое соединение, например CaOH 2 ? Есть несколько общих правил, которые могут вам помочь. Начнем с имени первого атома Ca. Это элемент кальций. Затем возьмите следующий атом и замените окончание на «ide.Кислород (O) становится «оксидом».
Однако, как и во многих правилах, есть исключения! В этом случае первая часть имени последнего атома, водорода (H), добавляется так, что правильное химическое название — гидроксид кальция. Вот что ваши дети должны уметь вычислить с помощью простой таблицы Менделеева: каково химическое название NaCl?
Префиксы
, часть, добавляемая в начало слова, также могут помочь вам понять имена и формулы. Mono означает один, di означает два.Таким образом, соединение с двумя одинаковыми молекулами (представленное нижним индексом 2 ) будет иметь «ди» перед названием молекулы. Как бы вы позвонили на CO 2 ? Сколько атомов кислорода в окиси углерода? Какова химическая формула дигидрида дикарбона?
A моль — мера химических веществ. В одном моль содержится 602 300 миллионов триллионов (6,023 x 10 23 ) атомов или молекул. Моль любых двух элементов имеет разную массу, но одинаковое количество частиц.Если вы посмотрите на золото (Au) в периодической таблице, вы увидите, что его атомная масса 107,9. Чтобы отмерить один моль, вы должны взвесить 107,9 грамма золота. С другой стороны, атомная масса натрия (Na) составляет 23,0, так что один моль составляет 23 грамма натрия. И золото, и натрий имеют одинаковое количество частиц в одном моль, хотя: 6.023 x 10 23 .
Двигаясь дальше — кинетическая теория и изменения
Кинетическая теория материи утверждает, что атомы и молекулы находятся в постоянном движении и что чем выше температура вокруг них, тем больше будет их скорость.
Другими словами, повышенная тепловая энергия заставит атомы и молекулы двигаться быстрее. Это связано с состояниями или фазами материи. В твердой фазе атомы и молекулы расположены близко друг к другу и колеблются в случайных направлениях. В жидкой фазе они движутся и сталкиваются друг с другом. Затем, в фазе , газ, , они движутся намного быстрее и расширяются, или расширяются, . Энергия необходима для фазового перехода, часто в виде тепловой энергии.
Чтобы показать детям, как это работает, проведите эксперимент. Попробуйте заварить чай, используя для сравнения кружку с горячей и холодной водой. Основываясь на том, что было сказано в предыдущем абзаце о кинетической теории и движении молекул, будет ли горячая или холодная вода лучше всего работать для смешивания молекул чая?
Молекулы горячей воды сталкиваются с чаем гораздо быстрее, быстрее перемешивая молекулы. Вы можете попробовать это и с другими веществами: например, с пищевыми красителями, солью и сахаром.Кипящая вода лучше подходит для смешивания веществ, чем горячая вода из-под крана, или они такие же? Обратите внимание своих маленьких детей на пар, исходящий от кипящей воды — это результат того, что молекулы воды достигают точки кипения и превращаются из жидкости в газ.
Когда твердое вещество достигает точки плавления , оно становится жидкостью. Мы видим это, когда твердый лед тает в жидкую воду. Затем, когда жидкость достаточно нагревается, она достигает точки кипения и переходит из жидкой фазы в газовую.Точки плавления и кипения различаются в зависимости от свойств элементов, образующих молекулы. Вода имеет низкую температуру плавления (32 ° F), но у многих элементов она намного выше. Температура плавления железа составляет 2777 ° F!
Химическое изменение влияет на тип атомов в молекуле; физическое изменение , с другой стороны, не меняет атомный состав молекулы. Когда вы берете лист бумаги и подносите конец к огню, в результате получается сгоревшая бумага — это химическое изменение.Бумага не может стать «недожженной». Однако, когда вы намочите простой лист бумаги, изменение будет физическим. Вы можете просушить бумагу, часто не оставляя больших повреждений — вода испарится. Посмотрите, могут ли ваши дети определить каждое из этих изменений как химическое (необратимое) или физическое (обратимое): ржавчина гвоздя, замерзание сока в эскимо, горение дров в огне и смешивание сахара с водой.
Связи соединяют вместе разные атомы или молекулы. У атомов есть «оболочки» из электронов вокруг них, которые притягивают другие атомы — когда внешняя оболочка имеет неполное число электронов, она будет притягивать еще один неполный атом.Ковалентная связь возникает, когда атомы разделяют электроны. Вода (H 2 O) имеет очень прочные ковалентные связи между атомами водорода и кислорода. Соединение с ковалентными связями обычно не проводит электричество при растворении в воде. (100% чистая вода не проводит электричество.)
Ионные связи обычно образуются между соединениями металлов и неметаллов. Катион — это атом, потерявший электрон и имеющий положительный заряд; Анион — это атом, который получил электрон и имеет отрицательный заряд.Когда ионное соединение растворяется в воде, вода проводит электричество.
В реакции исходные связи между атомами разрушаются, и атомы образуют новые связи. Энергия используется для разрыва старых связей, а энергия (обычно в виде тепла) выделяется или поглощается по мере образования новых связей.
экзотермические реакции выделяют тепло, тогда как эндотермические реакции забирают тепло. Учтите это, когда в следующий раз будете печь торт. Тесто для пирога на самом деле не пирог, но когда оно нагревается в духовке, происходит эндотермическая химическая реакция и образуются новые связи, в результате чего образуется соединение из муки, сахара, масла, яиц, соли и всего остального, что составляет пирог.
Реакции окисления происходят, когда химическое вещество отдает электроны другому веществу. Возгорание является примером этого. Бензин содержит углерод и водород, которые при горении «окисляются» с образованием воды (H 2 O) и диоксида углерода (CO 2 ). Коррозия — это еще одна реакция окисления, происходящая при контакте металла с кислородом. В результате реакции на поверхности металла образуется соединение, называемое оксидом. Ржавчина (оксид железа) является типичным примером этого.
В реакции восстановления одно химическое вещество получает электроны от другого вещества. Примером этого является фотосинтез растений: клетки растений используют энергию солнца для превращения воды и углекислого газа в глюкозу и кислород.
Попробуйте эти проекты, в которых используются соединения и смеси:
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Марка 7A
марка 7Б
Класс 7 (вместе A и B)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
марка 8А
марка 8Б
Оценка 8 (вместе A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
марка 9А
марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 4A
марка 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (комбинированные A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6А
Марка 6Б
Оценка 6 (комбинированные A и B)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий.Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственным ограничением является то, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного знака)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
11 соединений, которые мы используем в повседневной жизни — StudiousGuy
Есть несколько соединений, которые мы все используем в повседневной жизни, которые стали неотъемлемой частью нашего роста и выживания.Мы сталкиваемся с этими соединениями в нашей повседневной жизни; в еде, которую мы едим, в воде, которую мы пьем, и в воздухе, которым мы дышим.
« Соединение — это вещество, которое образуется в результате комбинации двух или более химических элементов, удерживаемых вместе сильной силой между ними». Давайте проверим некоторые соединения, которые мы используем в повседневной жизни ».
1. Вода
Химическая формула : h3O
Почти ни одно живое существо не может выжить без воды.Вода есть повсюду на нашей планете. Это причина того, что у нас есть органическая жизнь на Земле. Молекула воды состоит из одного атома кислорода в сочетании с двумя атомами водорода. Мы используем воду днем и ночью; в питьевой, кулинарии, бытовых нуждах, промышленности и сельском хозяйстве. Помимо этого общего использования воды, вы, возможно, будете удивлены, узнав, что вода играет важную роль в извержениях вулканов. Помимо множества ужасающих историй об извержениях вулканов, они на самом деле очень полезны для нас; поскольку они обеспечивают питательными веществами окружающую среду, содержащую ценные минералы, полезные для растений.Следовательно, вода — самое важное соединение в нашей жизни.
2. Столовая соль
Химическая формула : NaCl
Мы можем найти соль практически на каждом обеденном столе, как основной ингредиент, который можно использовать множеством разумных способов, помимо приправы пищи, и который также считается одним из самых эффективных консервантов. Несмотря на обычное бытовое использование соли, она также используется в качестве средства для борьбы с обледенением. Он снижает температуру замерзания воды и предотвращает ее замерзание.Поваренная соль — это химическое соединение, состоящее из одного атома натрия и одного атома хлора, удерживаемых ионной связью. Почти 96-99% поваренной соли составляет NaCl, остальные 1-4% — это примеси или другие химические соединения, добавленные к ней.
3. Сахароза (сахар)
Химическая формула: C12h32O11
Сахароза — это обычный сахар, который снова является основным ингредиентом в выпечке и кулинарии. Помимо использования сахарозы в различных десертах и напитках, они широко используются в фармацевтической промышленности, где они действуют как добавка в лекарственные препараты (которые имеют ужасный вкус), чтобы сделать их более вкусными.Сахароза производится естественным путем на растениях, из которых рафинируется столовый сахар. Он состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода, скрепленных гликозидной связью.
4. Мыло
Химическая формула: RCOO — Na, где R представляет собой длинную цепочку атомов углерода в диапазоне от 16 до 18.
Мы все начинаем свой распорядок дня после хорошей ванны. Помимо этого обычного туалетного мыла, есть также мыло, содержащее глицерин, которое может помочь людям с дерматологическими проблемами, такими как экзема.Мыло — это комплексное ионное соединение, состоящее из длинной цепи ионов углерода, кислорода и натрия, удерживаемых ионными связями.
5. Зубная паста
Химическая формула : CaCO3 или NaF
Чистить зубы — это первое, что приходит в голову после пробуждения. У нас есть широкий выбор зубных паст, доступных на рынке; например, средство против кариеса, дополнительное отбеливание, чувствительность и многое другое. Зубная паста не только делает ваши зубы белыми, ее также можно использовать в различных средствах, например: для устранения потертостей и очистки контейнеров, таких как термосы и детские бутылочки.Это основное соединение, которое уменьшает количество бактерий, присутствующих во рту.
6. Разрыхлитель
Химическая формула : NaHCO3 (бикарбонат-ион натрия)
Разрыхлитель — это соединение, состоящее из ионов натрия, водорода и карбоната. Его используют в выпечке тортов и десертов. Он также используется для нейтрализации кислотности желудка. Более того, его можно использовать как натуральный дезодорант.
7. Ополаскиватель для полости рта
Химическая формула : h3O2 (перекись водорода)
Ополаскиватель для полости рта — это антисептический раствор, который используется для снижения антибактериальной нагрузки в полости рта.Перекись водорода используется для уничтожения бактерий, успокаивает кровоточащие десны, боль в горле и как отбеливатель для зубов. Наряду с этим он широко используется в таких отраслях, как электронная промышленность, где он используется в качестве окислителя и чистящего средства в процессе производства полупроводников и печатных плат.
8. Средство для снятия лака
Химическая формула: Ch4COCh4 (ацетон)
Средство для снятия лака — широко используемое косметическое средство, которое встречается на туалетных столиках большинства женщин.Он разрушает лак для ногтей, поэтому его легко удалить ватным тампоном или тканью. Он широко используется, поскольку легко смешивается с водой и быстро испаряется на воздухе. Ацетон не только удаляет лак с ногтей, но также помогает удалить смолу, масло и другие липкие вещества с сырых тканей, таких как хлопок или шелк. Его химическое название — ацетон или пропанол, это бесцветная жидкость.
9. Уксус
Химическая формула: Ch4COOH (этановая кислота / уксусная кислота)
Уксус — это химическое соединение, состоящее из карбоновой кислоты.Он широко используется в качестве консерванта, приправы к еде и салату. Он также используется для очистки. Те, кто заботится о красоте, могут также найти это химическое вещество полезным, поскольку оно также используется в педикюре.
