Содержание
Формулы для решения задач по химии
от 01.01.2017 года
Настоящее пользовательское (лицензионное) соглашение (далее – «Соглашение»)
заключается между Обществом с ограниченной ответственностью «АЛЕКТА» (далее –
«Лицензиар»), и Пользователем (физическим лицом, выступающем в роли конечного
потребителя Продукта) совместно именуемые «Стороны».
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно
представляет собой публичную оферту и, после его принятия Вами, образует соглашение
между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в
тексте Соглашения.
Принимая настоящее Соглашение, Вы соглашаетесь с положениями, принципами, а
также соответствующими условиями лицензионного соглашения, изложенными ниже.
1. ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
1.1. Программный продукт — экземпляры программы для ЭВМ «ХиШник», состоящей
из Серверной части (свидетельство о государственной регистрации базы данных
№2014621526) и Клиентского приложения (свидетельство о государственной
регистрации программы для ЭВМ № 2014661592), права на использование которой
предоставляются в соответствии с настоящим Соглашением.
1.2. Серверная часть — часть Программного продукта, размещенная в сети Интернет и
используемая для хранения данных в базе данных Лицензиара под наименованием
«ХиШник» (далее также – «база данных»), а также для хранения, обработки,
передачи данных Пользователя между базой данных и клиентским приложением.
1.3. Клиентское приложение — часть Программного продукта, устанавливаемая на
компьютер Пользователя или на мобильное устройство Пользователя и
позволяющая получить доступ к базе данных Лицензиара, а также данным
Пользователя, хранящимся в памяти сервера Лицензиара.
1.4. Пользовательское (лицензионное) соглашение – текст настоящего Соглашения со
всеми дополнениями, изменениями, приложениями к нему, размещенный на сайте
Лицензиара и доступный в сети интернет по адресу: http://www.hishnik-school.ru
1.5. Заключение Пользовательского (лицензионного) соглашения (акцепт
публичной оферты) — полное и безоговорочное принятие условий настоящего
Соглашения Пользователем путем совершения Пользователем одного (или
нескольких) из следующих действий:
прохождение регистрации и (или) авторизации на Сайте Лицензиара в
установленном им порядке;
внесение платежа за предоставление права на использование Программного
продукта;
начало использования Пользователем Программного продукта в любой иной
форме.
1.6. Лицензиар — сторона в настоящем Соглашении, обладающая исключительным
правом на Программный продукт и предоставляющая по настоящему Соглашению
Пользователю право использования Программного продукта, в пределах и
способами, указанными в настоящем Соглашении.
1.7. Пользователь — физическое лицо, которое устанавливает на компьютер или
мобильное устройство Клиентское приложение и использует его.
1.8. Неисключительная лицензия — лицензионный договор, предусматривающий
предоставление права использования Программного продукта с сохранением за
Лицензиаром права заключения лицензионного договора с другими лицами.
1.9. Роль – набор функций, которые доступны в Программном продукте Пользователю.
Настоящим Соглашением предусмотрены следующие роли:
1.9.1. Администратор — сотрудник образовательного учреждения,
осуществляющий регистрацию и предоставление доступа к Программному
продукту Пользователям – участникам образовательного процесса в
образовательном учреждении.
1.9.2. Преподаватель – сотрудник образовательного учреждения, организующий
и осуществляющий образовательный процесс посредством использования
функций Программного продукта.
1.9.3. Репетитор – преподаватель, дающий частные уроки, может проводить как
индивидуальные, так и групповые занятия посредством использования
функций Системы вне рамок Образовательного учреждения.
1.9.4. Учащийся – обучающийся в Образовательном учреждении и (или) вне его,
получающий и проверяющий свои знания посредством Системы.
1.10. Профиль — запись в базе данных, содержащая идентифицирующие сведения о
Пользователе и его роли.
1.11. Демонстрационный режим – режим использования Программного продукта для
целей ознакомления с его функциональными возможностями.
1.12. Продуктивный режим – режим использования Программного продукта для целей
применения в образовательном процессе.
1.13. Регистрационный ключ — набор цифр и букв, посредством которого Пользователь
получает право использования Программного продукта в Продуктивном режиме с
полным доступом к Серверной части.
1.14. Логин – уникальный идентификатор Пользователя в базе данных.
1.15. Пароль – набор цифр и букв, посредством которого и совместно с Логином
Пользователь получает доступ в Клиентское приложение Программного продукта.
1.16. Интернет сайт Лицензиара — http://www.hishnik-school.ru.
1.17. Контент — все объекты, размещенные на Сайте и в Программном продукте, в том
числе элементы дизайна, текст, графические изображения, иллюстрации, видео,
скрипты, программы, музыка, звуки и другие объекты и их подборки.
2. ПРЕДМЕТ СОГЛАШЕНИЯ
2.1. Лицензиар предоставляет Пользователю право использования Программного
продукта «ХиШник» на условиях простой (неисключительной) лицензии в пределах
и способами, указанными в настоящем Соглашении, а Пользователь обязуется
уплатить Лицензиару вознаграждение за предоставление права использования
Программного продукта в соответствии с условиями настоящего Соглашения.
2.2. Лицензиар гарантирует, что он является правообладателем исключительных прав на
Программный продукт и имеет права на заключение Соглашения. Лицензиару в
настоящий момент в соответствии с тем знанием, которым он обладает, не известны
права третьих лиц, нарушаемые данным Соглашением.
2.3. Пользователь не вправе полностью или частично предоставлять (передавать) права
третьим лицам, полученные им по Соглашению, в том числе продавать,
тиражировать, копировать Программный продукт, предоставлять доступ третьим
лицам, отчуждать иным образом, в т.ч. безвозмездно, без получения на все
вышеперечисленные действия предварительного письменного согласия Лицензиара.
2.4. Соглашение предоставляет Пользователю право использования Программного
продукта с сохранением за Лицензиаром права выдачи лицензий другим лицам.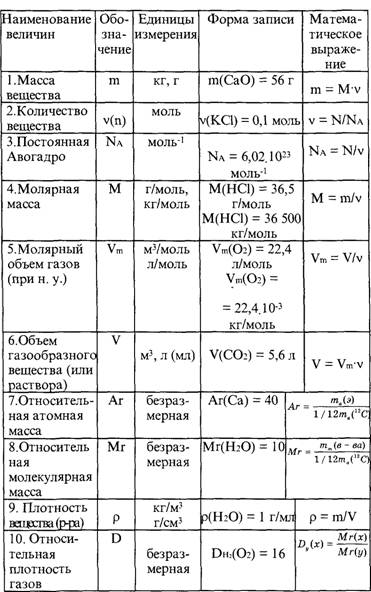
Пользователь может использовать экземпляр Программного продукта только в
пределах тех прав и теми способами, которые предусмотрены Соглашением.
Предоставляемое Пользователю Лицензиаром право на использование
Программного продукта действует в течение срока действия Соглашения.
2.5. Программный продукт «ХиШник», состоящий из Серверной части и Клиентского
приложения, представляет собой программу для ЭВМ, предназначенную для
осуществления образовательного процесса.
2.6. Право использования Программного продукта (неисключительная лицензия),
предоставляемое Пользователю в соответствии с настоящим Соглашением,
включает право на использование Программного продукта в двух режимах:
2.6.1. Демонстрационный режим, ограниченный правом установки на компьютер
или мобильное устройство, запуска, настройки Клиентского приложения и
ограниченного доступа к Серверной части, для целей ознакомления с
функциональными возможностями Программного продукта.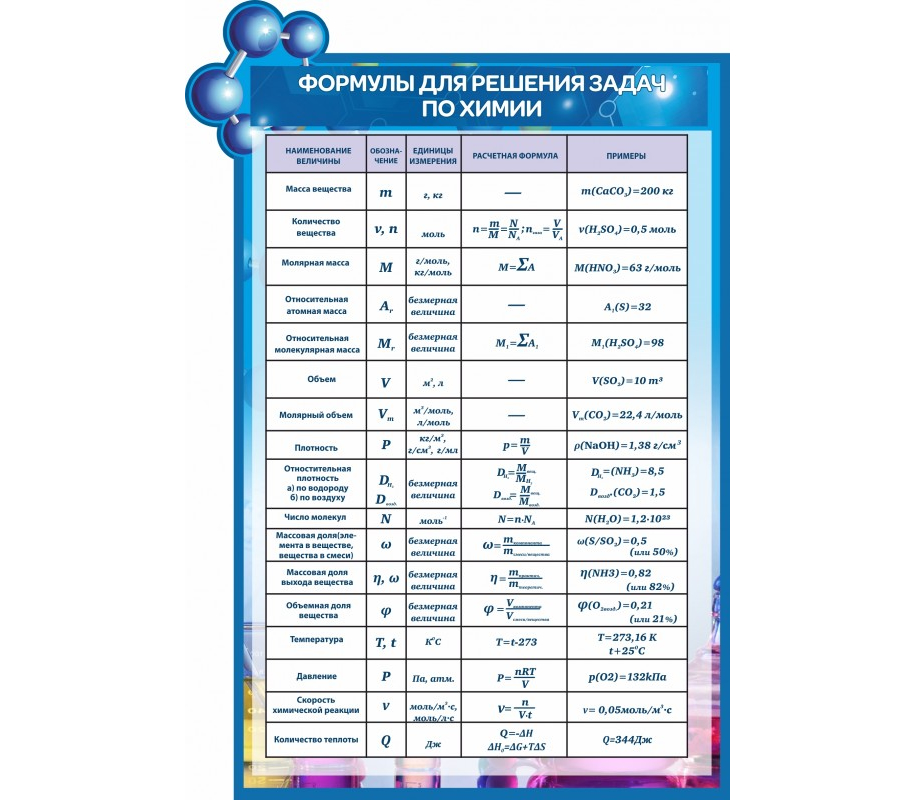
2.6.2. Продуктивный режим, ограниченный правом установки на компьютер или
мобильное устройство, запуска, настройки Клиентского приложения и
полного доступа к Серверной части, для целей применения Программного
продукта в образовательном процессе.
2.7. Право использования Программного продукта предоставляется:
2.7.1. В демонстрационном режиме — с момента установки Клиентского приложения
на компьютер или мобильное устройство.
2.7.2. В продуктивном режиме — с момента поступления денежных средств на счет
Лицензиара.
2.8. Права на использование Программного продукта считаются предоставленными
Пользователю:
2.8.1. В демонстрационном режиме — в момент установки Клиентского приложения
на компьютер или мобильное устройство.
2.8.2. В продуктивном режиме — в момент направления Пользователю на
электронную почту письма с регистрационным ключом.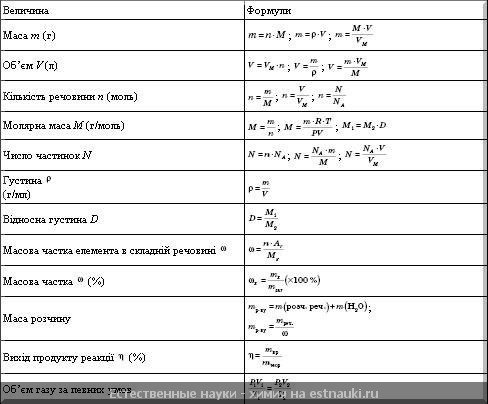
2.9. Право использования Программного продукта предоставляется как на территории
Российской Федерации, так и на территории всех иных стран мира, если не
противоречит национальному законодательству этих стран.
2.10. Требования к компьютерам (оборудованию), необходимому для функционирования
Клиентского приложения размещены в сети Интернет на сайте Лицензиара.
3. СТОИМОСТЬ И ПОРЯДОК ОПЛАТЫ
3.1. Размер вознаграждения Лицензиара за предоставление Пользователю прав на
продуктивное использование Программного продукта размещен на Сайте
Лицензиара.
3.2. Вознаграждение Лицензиара за предоставление прав продуктивного использования
Программного продукта не облагаются НДС на основании подпункта 26 пункта 2
статьи 149 Налогового кодекса РФ.
3.3. Оплата предоставленных прав за продуктивное использование Программного
продукта по настоящему Соглашению производится Пользователем в форме
ежегодных платежей.
3.4. Способ оплаты по Соглашению: безналичное перечисление Пользователем
денежных средств в валюте Российской Федерации (рубль) на расчетный счет
Лицензиара способами, обозначенными на Сайте Лицензиара. При этом обязанность
Пользователя в части оплаты вознаграждения по Соглашению считается
исполненной со дня зачисления денежных средств банком на счет Лицензиара.
3.5. Лицензиар имеет право на одностороннее изменение условий и размера
вознаграждения по настоящему Соглашению. Актуальный размер вознаграждения
публикуется на Сайте Лицензиара.
4. СРОК ДЕЙСТВИЯ СОГЛАШЕНИЯ
4.1. Настоящее Соглашение вступает в силу с момента его заключения в соответствии с
п.2.7.
4.2. Срок предоставления права продуктивного использования Программного продукта в
соответствии с Соглашением составляет 1 (Один) год с момента авторизации
Пользователя посредством Регистрационного ключа.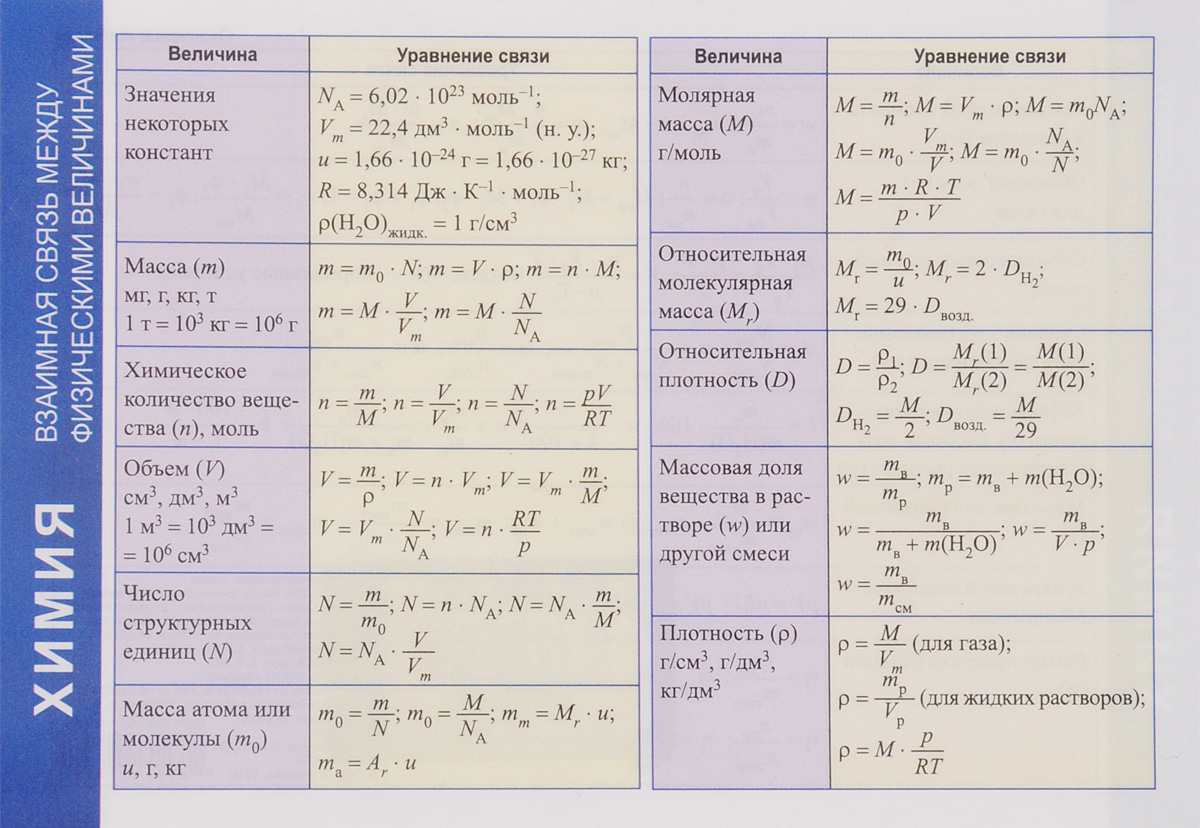 Соглашение считается
Соглашение считается
заключенным на тех же условиях на новый срок, равный 1 (Одному) году, при
условии осуществления Пользователем полной оплаты за продление права
продуктивного использования Программного продукта. Количество пролонгаций не
ограничивается.
4.3. Предоставление права демонстрационного использования Программного продукта
не ограничен по сроку.
4.4. Расторжение настоящего Соглашения возможно в соответствии с условиями,
указанным в действующем законодательстве РФ.
5. ПРАВА И ОБЯЗАННОСТИ СТОРОН
5.1. Пользователь обязуется:
5.1.1. Соблюдать права Лицензиара на Программный продукт и не использовать
Программный продукт иными способами кроме тех, что предусмотрены
настоящим Соглашением.
5.1.2. Не предпринимать попыток получения исходного кода Программного
продукта для дальнейшего его использования, а также не извлекать материалы
базы данных.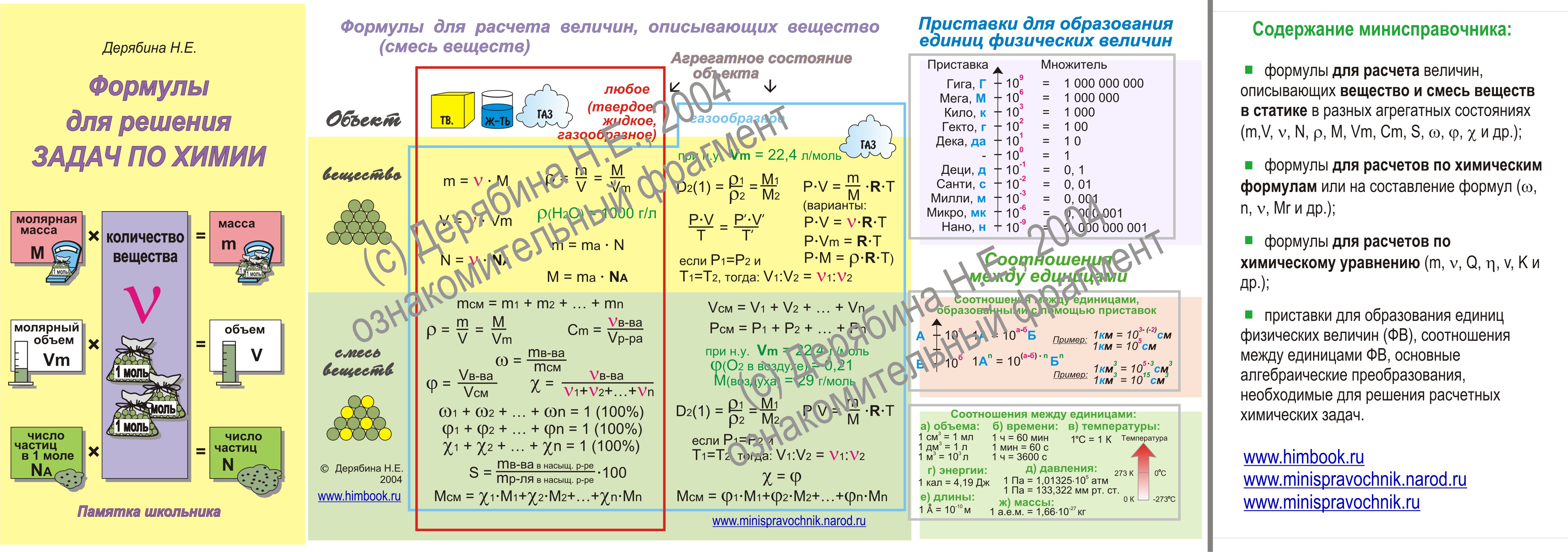
5.1.3. Своевременно уплачивать Лицензиару вознаграждение за предоставление
Пользователю права продуктивного использования Программного продукта в
порядке и сроки, установленные настоящим Соглашением.
5.1.4. Указывать достоверную информацию, в том числе свой адрес электронной
почты и иные данные, запрашиваемые Лицензиаром. При этом в случае
указания Пользователем недостоверной информации, все возможные риски,
которые могут возникнуть в связи с выполнением настоящего Соглашения,
Пользователь принимает на себя.
5.1.5. Строго придерживаться и не нарушать условий Соглашения, а также
обеспечить конфиденциальность коммерческой и технической информации
Лицензиара.
5.1.6. Не устанавливать Программный продукт на компьютерах (оборудованиях), не
соответствующих техническим требованиям для функционирования
Программного продукта.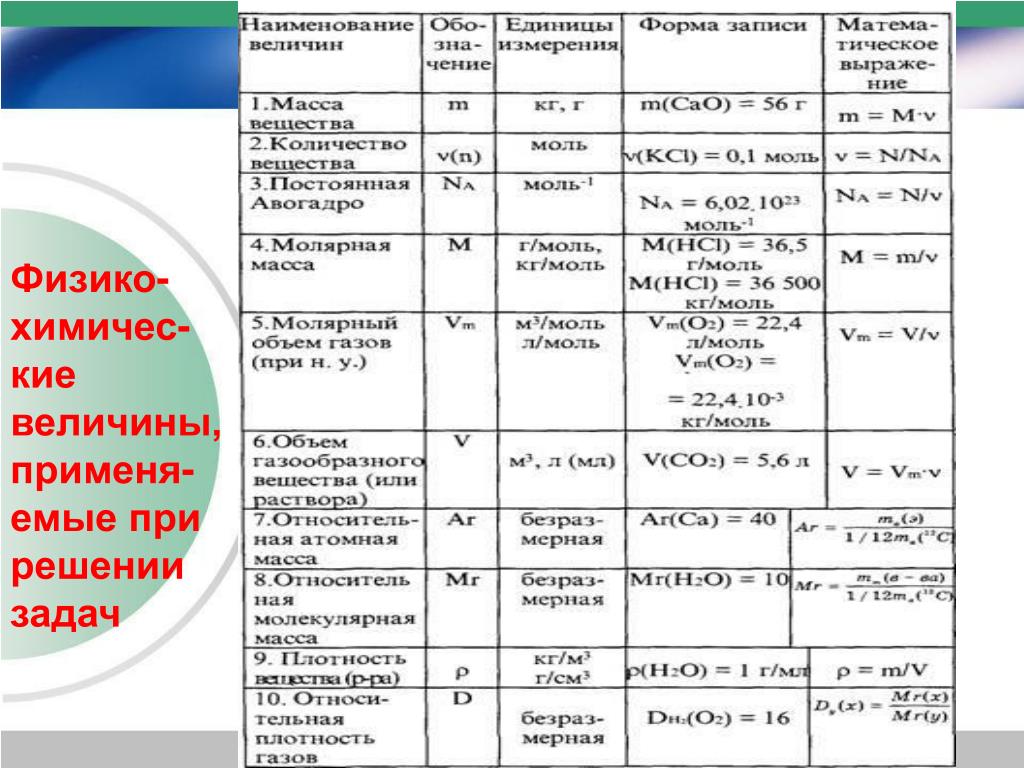
5.1.7. Заботиться о том, чтобы права Лицензиара на Программный продукт не были
нарушены третьими лицами на территории действия настоящего Соглашения,
и обязан сообщить Лицензиару обо всех ставших ему известными
нарушениях.
5.2. Пользователь вправе:
5.2.1. Использовать Программный продукт только посредством установки (записи)
Клиентского приложения Программного продукта на компьютер или
мобильное устройство и его настройки для осуществления ознакомительного
или образовательного процесса с помощью базы данных.
5.2.2. Использовать Программный продукт для любых целей Пользователя, за
исключением ограничений, определенных Соглашением.
5.3. Лицензиар обязуется:
5.3.1. Обеспечить технические условия функционирования Серверной части и
Клиентского приложения для использования Программного продукта
Пользователем, в том числе обеспечить возможность получения и/или
предоставить дистрибутив (установочные файлы) Клиентского приложения, с
помощью которого осуществляется использование Программного продукта.
5.3.2. Защищать данные Пользователя, которые стали известны Лицензиару в связи
с исполнением Сторонами своих обязательств в соответствии с настоящим
Соглашением.
5.3.3. Уведомлять Пользователя о невозможности использования Программного
продукта в связи с выполнением сервисных работ не менее чем за 48 (Сорок
восемь) часов путем отправки сообщения на электронную почту, указанную
при регистрации.
5.3.4. Воздерживаться от каких-либо действий, способных затруднить
осуществление Пользователя предоставленного ему права использования
Программного продукта в установленных Соглашением пределах.
5.3.5. Предоставлять новые версии (обновления) Программного продукта путем их
размещения в сети Интернет на сайте Лицензиара либо в системе Google Play
с возможностью скачивания.
5. 3.6. Информировать Пользователя о новых версиях (обновлениях) Программного
3.6. Информировать Пользователя о новых версиях (обновлениях) Программного
продукта, посредством направления уведомления на адрес электронной почты
Пользователя, указанный при регистрации и (или) авторизации на Сайте
Лицензиара.
5.3.7. Обеспечивать круглосуточный прием обращений в Службу поддержки по
адресу электронной почты: [email protected].
5.3.8. Осуществлять обработку поступивших обращений и консультации через
Службу поддержки, в период с 5:00 до 14:00 по московскому времени с
понедельника по пятницу, за исключением выходных и праздничных дней.
5.4. Лицензиар вправе:
5.4.1. Производить сервисные работы, которые могут повлечь перерывы в работе
Клиентского приложения.
5.4.2. В случае нарушения Пользователем условий (способов) использования прав
на Программный продукт в соответствии с настоящим Соглашением, лишить
Пользователя лицензии на использование прав на Программный продукт
путем закрытия доступа к Программному продукту.
5.4.3. Изменять в одностороннем порядке условия настоящего Соглашения в
установленном порядке.
5.4.4. Отказаться в одностороннем порядке от исполнения Соглашения в порядке,
предусмотренном применимым правом и/или настоящим Соглашением;
5.4.5. Осуществлять иные права, предусмотренные применимым правом, а также
настоящим Соглашением.
6. ПОРЯДОК ИСПОЛЬЗОВАНИЯ ПРОГРАММНОГО ПРОДУКТА
6.1. Пользователю для использования Программного продукта предлагается установить
(записать в память ЭВМ) и запустить Клиентское приложение Лицензиара,
экземпляр которого скачивается Пользователем самостоятельно одним из
следующих способов:
в сети Интернет на сайте Лицензиара;
в системе Google Play;
с флэш-накопителя, предоставленного Лицензиаром (опция).
6.2. После установки (записи в память ЭВМ) и запуска Клиентского приложения
Лицензиара Пользователю предоставляется право использования Программного
продукта в Демонстрационном режиме.
6.3. Для использования Программного продукта в Продуктивном режиме Пользователю
необходимо в Клиентском приложении ввести Регистрационный ключ, который
Лицензиар направляет Пользователю на адрес электронной почты, указанный на
Сайте Лицензиара в запросе на предоставление доступа. Пользователь
самостоятельно осуществляет использование Программного продукта путем запуска
и настройки Клиентского приложения.
6.4. Программный продукт предоставляется Пользователю по принципу «as is» («как
есть»), что подразумевает: Пользователю известны важнейшие функциональные
свойства продукта, в отношении которого предоставляются права на использование,
Пользователь несет риск соответствия Программного продукта его желаниям и
потребностям, а также риск соответствия условий и объема предоставляемых прав
своим желаниям и потребностям. Лицензиар не несет ответственность за какие-либо
Лицензиар не несет ответственность за какие-либо
убытки или ущерб, независимо от причин их возникновения (включая особый,
случайный или косвенный ущерб; убытки, связанные с недополученной прибылью,
прерыванием коммерческой или производственной деятельности, утратой деловой
информации, небрежностью, или какие-либо иные убытки), возникшие вследствие
использования или невозможности использования Программного продукта.
6.5. Программный продукт предназначен для личных, образовательных и иных не
связанных с осуществлением предпринимательской деятельности нужд физических
лиц. Использование Программного продукта в коммерческих целях не допускается.
7. ОТВЕТСТВЕННОСТЬ СТОРОН
7.1. За невыполнение или ненадлежащее выполнение обязательств по настоящему
Соглашению Стороны несут ответственность в соответствии с действующим
законодательством, если иное не установлено Соглашением.
7.2. Стороны освобождаются от ответственности за неисполнение (ненадлежащее
исполнение) Соглашения, если такое неисполнение (ненадлежащее исполнение)
явилось следствием действий обстоятельств непреодолимой силы, наступление
которых Стороны не могли предвидеть и предотвратить. Сторона, для которой
надлежащее исполнение обязательства стало невозможным ввиду действия
обстоятельств непреодолимой силы, обязана незамедлительно уведомить об этом
другую Сторону. Стороны вправе ссылаться на действия обстоятельств
непреодолимой силы лишь при условии, что они сделали все возможное в целях
предотвращения и/или минимизации негативных последствий действия указанных
обстоятельств.
7.3. Лицензиар не гарантирует абсолютную бесперебойность использования
Программного продукта и не дает гарантию того, что произведенные третьими
лицами программы для ЭВМ или любые другие средства, используемые при работе
Программного продукта, абсолютно защищены от компьютерных вирусов и других
вредоносных компонентов. Лицензиар обязуется осуществить все разумные меры
Лицензиар обязуется осуществить все разумные меры
для защиты информации Пользователя и обеспечения бесперебойного
использования Программного продукта.
7.4. Пользователь самостоятельно отвечает за содержание информации, передаваемой им
или иным лицом по сети Интернет и хранимой в памяти сервера Лицензиара, в том
числе за ее достоверность и правомерность ее хранения и распространения.
7.5. В случае привлечения Лицензиара к ответственности или наложения на него
взыскания в связи с допущенными Пользователем нарушениями прав третьих лиц, а
равно установленных законодательством запретов или ограничений, Пользователь
обязан в полном объеме возместить убытки Лицензиара.
7.6. В случае нарушения Пользователем условий и ограничений настоящего
Соглашения, он является нарушителем исключительного права на Программный
продукт. За нарушение авторских прав на Программный продукт Пользователь несет
За нарушение авторских прав на Программный продукт Пользователь несет
ответственность в соответствии с законодательством Российской Федерации.
7.7. Совокупная кумулятивная ответственность Лицензиара перед Пользователем в
отношении требований любого рода, возникающих из настоящего Соглашения, не
будет превышать сумму вознаграждения по данному Соглашению, фактически
выплаченного Пользователем за Программный продукт, в отношении которого
возникло требование, в течение 12 (двенадцати) месяцев, предшествующих
возникновению требования. Вышеуказанные ограничения ответственности
применяются даже в том случае, если с помощью вышеуказанного способа защиты
права не удается добиться его основной цели.
8. ПЕРСОНАЛЬНЫЕ ДАННЫЕ
8.1. Информация, предоставленная Пользователем является конфиденциальной.
8. 2. Предоставляя свои персональные данные Лицензиару, Пользователь соглашается на
2. Предоставляя свои персональные данные Лицензиару, Пользователь соглашается на
их обработку, как с использованием средств автоматизации, так и без использования
средств автоматизации, в частности сбор, хранение, передачу третьим лицам и
использование информации Лицензиаром в целях исполнения обязательств перед
Пользователем в соответствии с настоящим Соглашением; получения
Пользователем персонализированной рекламы; проверки, исследования и анализа
данных, позволяющих поддерживать и улучшать Программный продукт.
8.3. Лицензиар обязуется не разглашать полученную от Пользователя информацию. Не
считается нарушением предоставление Лицензиаром информации, в том числе
персональные данные Пользователя третьим лицам, действующим на основании
договора с Лицензиаром, в целях исполнения настоящего Соглашения.
8.4. Не считается нарушением обязательств по неразглашению информации
Не считается нарушением обязательств по неразглашению информации
предоставленной Пользователем, в том числе персональные данные Пользователя, в
целях обеспечения соблюдения требований действующего законодательства
Российской Федерации (в том числе в целях предупреждения и/или пресечения
незаконных и/или противоправных действий Пользователей).
8.5. Пользователь не имеет права передавать свои Логин и Пароль третьим лицам.
8.6. Пользователь обязуется обеспечивать конфиденциальность своего Логина и Пароля
и несет ответственность за использование Логина и Пароля третьими лицами. Ни
при каких обстоятельствах Лицензиар не несет ответственность за использование
третьими лицами Логина и пароля Пользователя.
8.7. В случае несанкционированного доступа к логину и паролю и/или персональной
странице Пользователя, или распространения логина и пароля Пользователь обязан
незамедлительно сообщить об этом Лицензиару посредством заполнения формы
обратной связи, представленной на Сайте.
8.8. Лицензиар не несет ответственности за использование кем бы то ни было
общедоступных персональных данных Пользователей.
9. ИСКЛЮЧИТЕЛЬНЫЕ ПРАВА НА КОНТЕНТ
9.1. Все объекты, размещенные на Сайте и в Программном продукте, в том числе
элементы дизайна, текст, графические изображения, иллюстрации, видео, скрипты,
программы, музыка, звуки и другие объекты и их подборки (далее — Контент),
являются объектами исключительных прав Лицензиара, все права на эти объекты
защищены.
9.2. Кроме случаев, установленных настоящим Соглашением, а также действующим
законодательством Российской Федерации, Контент не может быть скопирован
(воспроизведен), переработан, распространен, отображен во фрейме, опубликован,
скачан, передан, продан или иным способом использован целиком или по частям без
предварительного разрешения правообладателя, кроме случаев, когда
правообладатель явным образом выразил свое согласие на свободное использование
Контента любым лицом.
9.3. Использование Пользователем Контента, доступ к которому получен исключительно
для личного некоммерческого использования, допускается при условии сохранения
всех знаков авторства или других уведомлений об авторстве, сохранения имени
автора в неизменном виде, сохранении произведения в неизменном виде.
9.4. Любое использование Контента, кроме разрешенного в настоящем Соглашении или
в случае явно выраженного согласия правообладателя на такое использование, без
предварительного письменного разрешения правообладателя, категорически
запрещено.
10. ПРОЧИЕ УСЛОВИЯ
10.1. Все споры и разногласия, возникающие в связи с исполнением и (или) толкованием
настоящего Соглашения, разрешаются Сторонами путем переговоров. При
невозможности урегулирования Сторонами возникших разногласий путем
переговоров, спор подлежит разрешению в арбитражном суде по месту нахождения
ответчика с обязательным соблюдением претензионного порядка урегулирования
споров и разногласий. Срок ответа на претензию 30 (тридцать) календарных дней с
Срок ответа на претензию 30 (тридцать) календарных дней с
момента ее поступления в письменной форме или в электронном виде.
10.2. Ни одно из положений настоящего Соглашения не является и не может
рассматриваться как передача (отчуждение) исключительных прав на
интеллектуальную собственность Лицензиара.
10.3. В случае поступления от Пользователя замечаний к Программному продукту,
предоставляемому в рамках настоящего Соглашения, такие замечания подлежат
рассмотрению Лицензиаром по его желанию и необязательны для учета.
10.4. Условия настоящего Соглашения распространяются на последующие версии
Программного продукта, которые являются его обновлениями. Заключения иных
соглашений в отношении обновлений Программного продукта не требуется.
10.5. Во всем ином, что не предусмотрено настоящим Соглашением, Стороны
руководствуются действующим законодательством РФ.
11. АДРЕС, РЕКВИЗИТЫ ЛИЦЕНЗИАРА
ООО «АЛЕКТА»
Юридический адрес: 630090, г. Новосибирск, Проспект академика Лаврентьева 2/2.
Почтовый адрес: 630090, г. Новосибирск, Проспект академика Лаврентьева 2/2.
ОГРН 1025403657135
ИНН 5408128408
КПП 540801001
ОКВЭД 72.19, 62.01, 62.02, 68.20.2;
ОКПО 26335100;
ОКАТО 50401384000;
ОКФС 16;
ОКОПФ 65.
E-mail: [email protected]
Основные Химические формулы для решения задач.
| № | Количественные характеристики вещества | Обозначение | Единицы измерения | Формула для расчета |
|---|---|---|---|---|
| 1 | Плотность вещества | ρ | кг/м³ | ρ = m / V(Массу делим на объем вещества) |
| 2 | Относительная атомная масса элемента | Аr | — | Ar = ma / u см.  в периодической система химических элементов в периодической система химических элементов |
| 3 | Атомная единица массы | u а.е.м. | кг | u = 1/12 * ma (12C) const = 1.66*10-27 |
| 4 | Масса атома (абсолютная) | ma | кг | ma = Ar * u |
| 5 | Относительная молекулярная (формульная) масса вещества | Mr | — | Mr (AxBy)=m(AB) / u Mr(AxBy)=x*Ar(A) + y*Ar(B) |
| 6 | Масса молекулы (формульной единицы) | m M | кг | mM = Mr*u |
| 7 | Количество вещества | n | моль | n=m/M n=N/NA n=V/VM |
| 8 | Молярная масса (масса 1 моль вещества) | M | г/моль | M=m/n M=Mr M=Ar (для простых веществ) |
| 9 | Масса вещества | m | г (кг) | m=M*n m=ρ*V |
| 10 | Число структурных единиц | N | атомов, молекул, ионов, частиц, формульных единиц (Ф. Е.) Е.) | N=NA*n |
| 11 | Молярный объем — число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н.у.) | VM | л/моль | const=22,4 |
| 12 | Объем газа при н.у. | V | л | V=VM*n V=m/ρ |
| 13 | Постоянная Авогадро | NA | частиц/моль | const=6,02*1023 |
| 14 | Массовая доля вещества (омега) | ωЭ/В | % | ωЭ/В = (Ar(э) * k) / Mr(В) |
| Формула | Название кислоты | Формула кислотного остатка | Название кислотного остатка |
|---|---|---|---|
| HF | Фтороводород, плавиковая | F— | Фторид |
| HCl | Хлороводород, соляная | Cl— | Хлорид |
| HBr | Бромоводород | Br— | Бромид |
| HI | Йодоводород | I— | Йодид |
| h3S | Сероводород | S2- | Сульфид |
| HCN | Циановодородная | CN— | Цианид |
| HNO2 | Азотистая | NO2— | Нитрит |
| HNO3 | Азотная | NO3— | Нитрат |
| h4PO4 | Ортофосфорная | PO43- | Фосфат |
| h4AsO4 | Мышьяковая | AsO43- | Арсенат |
| h3SO3 | Сернистая | SO32- | Сульфит |
| h3SO4 | Серная | SO42- | Сульфат |
| h3CO3 | Угольная | CO32- | Карбонат |
| h3SiO3 | Кремниевая | SiO32- | Силикат |
| h3CrO4 | Хромовая | CrO42- | Хромат |
| h3Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HMnO4 | Марганцовая | MnO4— | Перманганат |
| HClO | Хлорноватистая | ClO— | Гипохлорит |
| HClO2 | Хлористая | ClO2— | Хлорит |
| HClO3 | Хлорноватая | ClO3— | Хлорат |
| HClO4 | Хлорная | ClO4— | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO— | Формиат |
| Ch4COOH | Этановая, уксусная | Ch4COO— | Ацетат |
| h4C2O4 | Этандиовая, щавелевая | C2O42- | Оксалат |
Нажмите на картинку для увеличения
Формулы для решения задач по химии ЕГЭ 2021 / Блог / Справочник :: Бингоскул
Формулы для расчета:
- v — количества моль, моль
- m — масса, г
- M — молярная масса, г/моль
- C — концентрация, моль/л
- N — количество атомов, молекул
- NA — число Авогадро
- V — объем, л
- Vm — молярный объем = 22,4 л/моль
- p — плотность
- D — относительная плотность
Число Авогадро NA
1 моль = 6,02 · 1023 частиц
Закон Авогадро: 1 моль идеального газа при нормальных условиях имеет один и тот же объём Vm = 22,413 996(39) л
Количество вещества n (моль) |
|
| Масса вещества m (г) | |
| Объем вещества V(л) |
|
| Масса |
|
| Количество вещества |
|
| Объем |
|
| Число частиц |
|
| Молярный объем |
|
| Молярная масса | |
| Относительная молекулярная масса |
|
Решай с ответами:
Решение сложных задач на нахождение формулы вещества
Фреоны
Задача.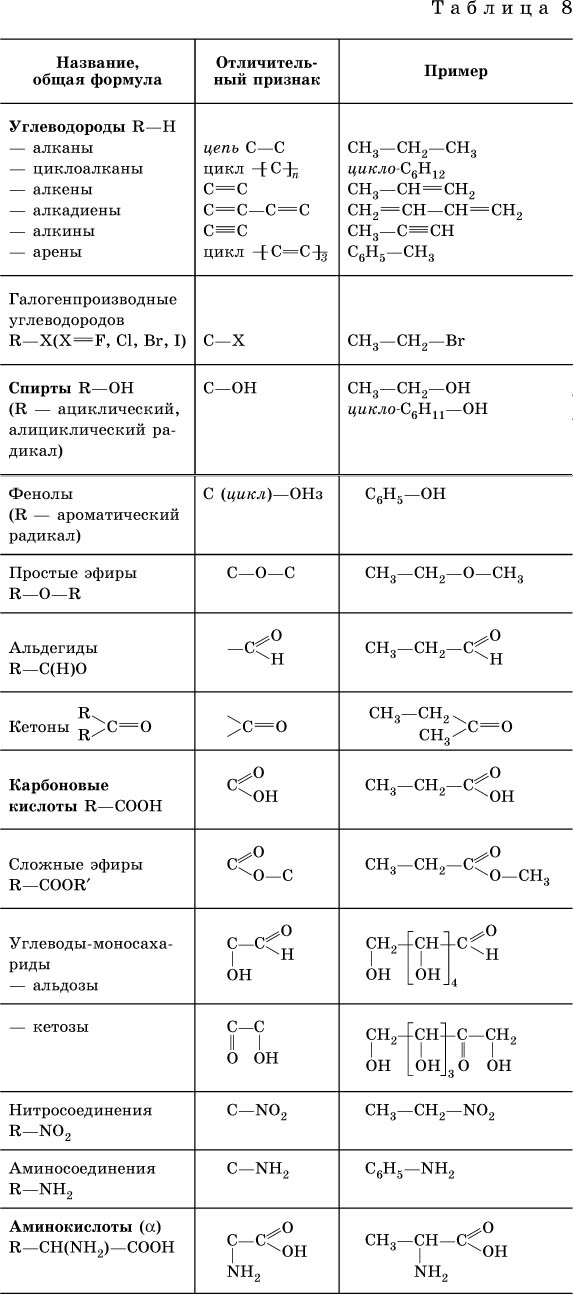 В мастерской по ремонту холодильников и климатического оборудования отклеились этикетки от 5 баллонов с хранившимися в них фреонами (техническое название группы насыщенных алифатических галогенсодержащих углеводородов, применяемых в качестве хладагентов). Этикетки содержали следующие надписи: R-12, R-23, R-32, R-41, R-161. Для установления формул фреонов были проведены исследования. При сжигании фреона 1 образовалось 2,24 л СО2 и 4 г HF. Фреон 2 не горит (ω(C) = 9,92%; D(H2) = 60,5). У фреона 3 (ω(F) = 39,58%, ω(Н) = 10,42%). При взаимодействии фреона 4 с натрием образовался этан и фторид натрия. При щелочном гидролизе фреона 5 образовались две соли: формиат натрия (ω(C) = 17,65%; ω(О) = 47,06%) и фторид натрия. Установите структурные формулы указанных фреонов и дайте им химические названия, установите соответствие между кодом фреона и его формулой.
В мастерской по ремонту холодильников и климатического оборудования отклеились этикетки от 5 баллонов с хранившимися в них фреонами (техническое название группы насыщенных алифатических галогенсодержащих углеводородов, применяемых в качестве хладагентов). Этикетки содержали следующие надписи: R-12, R-23, R-32, R-41, R-161. Для установления формул фреонов были проведены исследования. При сжигании фреона 1 образовалось 2,24 л СО2 и 4 г HF. Фреон 2 не горит (ω(C) = 9,92%; D(H2) = 60,5). У фреона 3 (ω(F) = 39,58%, ω(Н) = 10,42%). При взаимодействии фреона 4 с натрием образовался этан и фторид натрия. При щелочном гидролизе фреона 5 образовались две соли: формиат натрия (ω(C) = 17,65%; ω(О) = 47,06%) и фторид натрия. Установите структурные формулы указанных фреонов и дайте им химические названия, установите соответствие между кодом фреона и его формулой.
Данная задача предназначена для десятиклассников, которые еще не освоили курс кислородсодержащих органических соединений, поэтому даны массовые доли.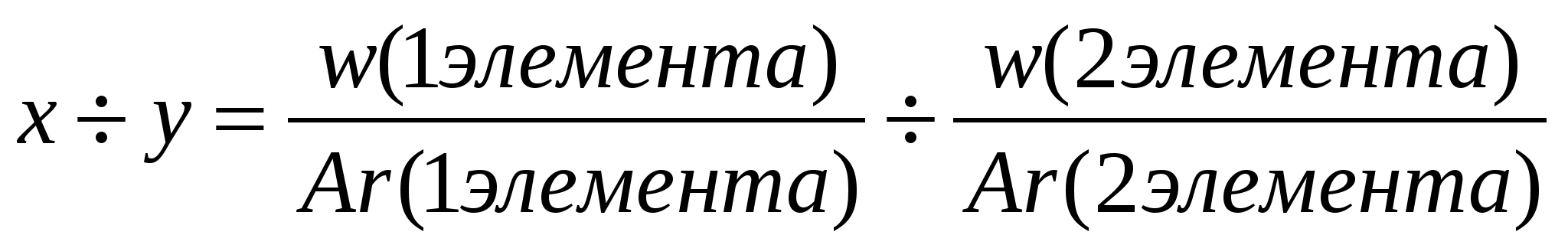
1. Начнем с фреона № 1. При его сжигании образовалось 2,24 л углекислого газа. Найдем количество углекислого газа. Делим его объем на молярный объем и получаем 0,1 моль. Соответственно, атомов углерода тоже 0,1 моль, поскольку в каждой молекуле углекислого газа содержится один атом углерода.
Информацию по водороду возьмем из фтороводорода. Найдем количество фтороводорода. Поскольку дана его масса, мы должны поделить массу (4 г) на молярную массу. Молекула фтороводорода состоит из атома фтора и атома водорода. Масса атома фтора 19, у водорода масса 1, значит, молярная масса 20. И мы получаем 0,2 моль.
Следовательно, H = 0,2 и F = 0,2. Формула вещества, фреона № 1: CH2F2 (на один атом углерода приходится два атома водорода и два атома фтора).
2. Узнаем, что скрывается под фреоном № 2. Известно, что он не горит, и дана его плотность по водороду. Это относительная плотность, которая показывает, во сколько раз молярная масса вещества больше молярной массы (в данном случае) водорода. Молярная масса фреона № 2 равна 121 г/моль.
Молярная масса фреона № 2 равна 121 г/моль.
Сколько атомов углерода во фреоне № 2? Для подсчета используем массовую долю углерода. Масса углерода равна: молярную массу умножить на массовую долю. Получаем 12. Значит, в данной молекуле фреона № 2 содержится только один атом углерода.
Нарисуем этот атом углерода. У него имеется четыре связи, поскольку в органической химии углерод четырехвалентный. Попробуем определить атомы, исходя из того, что в сумме один атом углерода и все остальные атомы должны равняться молярной массе (равной молекулярной) 121. Попробуем рассчитать. Если это четыре атома фтора, то получается мало. А если это четыре атома хлора, то много. Возьмем нечто среднее: половина — атомы фтора и половина — атомы хлора. Единица в показателе 121 говорит о том, что имеются нечетные значения. Молярная масса хлора 35,5. Для того чтобы получить целое численное значение, вероятно, нужны два атома хлора.
121 – 71 – 12 = 38 (ровно на два атома фтора)
3. Перейдем к фреону № 3. Нам дана массовая доля фтора: 39,58. Дана массовая дола водорода: 10,42. Поскольку это органическое вещество, должен быть и углерод — попробуем его найти.
Перейдем к фреону № 3. Нам дана массовая доля фтора: 39,58. Дана массовая дола водорода: 10,42. Поскольку это органическое вещество, должен быть и углерод — попробуем его найти.
100 – 39,58 – 10,42 = 50
Проверим вариант, что там только хлор и нет других атомов. Предположим, что там всего один атом углерода (его масса будет равна 12). Посчитаем, какая масса при этом будет приходиться, например, на атом фтора.
12 ∙ 39,58 : 50 = 9,5
Как указано в периодической системе Менделеева, атомная масса фтора — 19. Ровно половина одного атома фтора — 9,5, так что в составе этой молекулы не может быть один атом углерода, их должно быть как минимум два. Следовательно, на углерод приходиться масса 24, на фтор — 19. Какая масса в данном случае приходится на водород? По сути, должно оставаться пять атомов водорода.
24 ∙ 10,42 : 50 = 5
Поскольку у нас один атом фтора, пять атомов водорода и два атома углерода, мы имеем дело с фторэтаном.
4. Что касается фреона № 4, то в реакции с натрием образовались этан и фторид натрия. Это реакция Вюрца — Фиттига. Мы имеем исходное вещество фторметан, которое реагирует с натрием, и образуются этан и фторид натрия.
5. Переходим к фреону № 5. Формиат натрия образуется при гидролизе трифторметана. Получается формиат натрия, фторид натрия и две молекулы воды.
Посмотрев в справочную информацию, вы можете соотнести с кодами каждый из найденных фреонов.
Изучение фреонов очень интересно. Каждый тип холодильного оборудования требует особую марку фреона. Сегодня холодильное оборудование часто заполняют и углеводородами, поскольку, как известно, фреоны способствуют разрушению озонового слоя Земли. Но на сегодняшний день полного отказа от фреонов еще не произошло.
Химия. 10 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии, изложенный в учебниках «Химия. 8 класс» и «Химия. 9 класс» данного авторскогo коллектива. Предназначен для изучения химии на углубленном уровне. Учебник соответствует федеральному государственному образовательному стандарту среднего общeгo образования.
М. В. Ломоносова и продолжает курс химии, изложенный в учебниках «Химия. 8 класс» и «Химия. 9 класс» данного авторскогo коллектива. Предназначен для изучения химии на углубленном уровне. Учебник соответствует федеральному государственному образовательному стандарту среднего общeгo образования.
Купить
Вильгельм Рудольф Фиттиг
Задача. Вещество, открытое в 1862 году немецким ученым Вильгельмом Рудольфом Фиттигом, представляет собой бесцветные кристаллы (tпл = +690С). Они широко применяются в качестве пищевой добавки для сохранения товарного вида фруктов (например, цитрусовых) путем нанесения на кожуру плода. Для установления состава вещество массой 15,4 г сожгли, образовалось 26,88 л (н.у.) углекислого газа и 9 г воды. Установите структурную формулу, если известно, что оно может подвергаться каталитическому галогенированию. Составьте уравнение этого вещества с избытком водорода на платиновом катализаторе при повышенном давлении.
Похожую задачу часто можно встретить на ЕГЭ.
Начнем с определения молекулярной формулы вещества, то есть узнаем состав этой молекулы. Найдем количество углекислого газа, а оно равно количеству углерода. Разделим объем на молярный объем. Поскольку условия нормальные, молярный объем для газообразного вещества составляет около 22,4 л/моль.
26,88 л : 22,4 л/моль = 1,2 моль
Поскольку воды 9 г, а молярная масса воды 18 г, следовательно, воды 0,5 моль, а водорода 1 моль. Как такое может быть? В одной молекуле воды содержится целых два атома водорода. Но нам не сказано: соединение ли углеводородом? содержит ли кислород? Мы должны проверить наличие кислорода и найти массу углерода и водорода.
1,2 моль ∙ 12 = 14,4 г
Сумма углерода и водорода: 14,4 + 1 = 15,4. Следовательно, в составе неизвестного вещества нет кислорода.
Молярное соотношение показывает, что формула вещества С12H10. Почему не С6H5? Потому что в углеводородах никогда не бывает нечетного числа атомов водорода. Радикал С6H5 в химии называется фенилом. Иными словами, мы имеем соединение, которое называется в химии дифенил. На это также указывают химические свойства дифенила, и он является разрешенной пищевой добавкой. В магазинах можно встретить, например, апельсины, покрытые белым веществом — это и есть дифенил. Иногда его применяют в изрядном количестве, поэтому нужно тщательно мыть фрукты.
Составим уравнение реакции с избытком водорода. Очень просто посчитать, сколько атомов водорода потребуется на реакцию с дифенилом. Мы видим шесть двойных связей. Следовательно, на одну двойную связь нужна одна молекула водорода, а на шесть двойных связей — шесть молекул водорода при исчерпывающем гидрировании. Конечно, на platinum-катализаторе, потому что соединение ароматическое и требует преодоления достаточно высокого энергетического барьера. Мы получаем соединение, которое нельзя назвать никак иначе, кроме как дициклогексил.
Соединение дифенил и было открыто Рудольфом Фиттигом в 1862 году с температурой плавления 69°С.
Желеобразующая жидкость
Задача. Некоторая нерастворимая в воде жидкость при хранении на воздухе способна уплотняться, превращаясь в желе. Химик отобрал, отмерив, некоторый объем этой жидкости и установил, что при действии избытка раствора брома в четыреххлористом углероде образовалось 26,4 г дибромида. А при действии раствора хлора на такой же объем этой жидкости образовалось 17,5 г дихлорида. Определите структурную формулу этой жидкости, если известно, что в ее состав входят только атомы водорода и углерода. Составьте уравнение реакции полимеризации этой жидкости.
Обозначим неизвестную жидкость-углеводород через формулу CXHY. О какой реакции идет речь: замещения или присоединения? Поскольку реакция протекает при обычных условиях, значит, речь идет о реакции присоединения.
Для решения данной задачи нужно применить прием, известный в учебной химии как прием вычитания массы. Представим, что жидкости у нас ровно 1 моль. В этом случае разница между массой дибромида и дихлорида будет разницей между массой брома и хлора.
Молекула брома имеет массу 160, а молекула хлора — 71. Получаем 89. То есть если бы вещества у нас было 1 моль, то разница составила бы 89 г. Вычислим разницу массы дибромида и дихлорида:
26,4 – 17,5 = 8,9
Искомого вещества 0,1 моль.
Теперь установим формулу. Обратимся к молекулярной записи. На углеводородную часть приходится 104. Сколько там может быть углеродов и водородов? Если углеродов 8 (что подходит), тогда на углероды приходится 96 и на водороды — 8.
Формула углеводорода C8H8.
Разберемся, о каком углеводороде идет речь. Обратим внимание, что соединение непредельное, но оно способно присоединить только одну молекулу брома или одну молекулу хрома. Значит, исходя из малого числа атомов водорода по отношению к атомам углерода, скорее всего, это соединение есть не что иное, как производное бензола, то есть ароматическое соединение. В бензоле шесть атомов углерода и пять атомов водорода в остатке. У нас получается кетастирол.
Чтобы не было полимеризации, обычно в тот стирол, который можно купить в магазине, добавляют стабилизатор.
Уравнение полимеризации. Из n молекул стирола получается полимер, состоящий из n фрагментов.
Полистирол — это, например, одноразовая посуда. Она наносит существенный вред окружающей среде, и сейчас идет речь о том, чтобы ее запретить.
Что ещё почитать?
Отдушка для мыла
Задача. Некоторое легкоплавкое вещество, обладающее приятным запахом, используют в качестве ингибитора полимеризации, в качестве отдушки для мыла. При сжигании этого вещества массой 8,4 г получили 11,2 л (н.у.) углекислого газа, 7,2 г воды. Установите структурную формулу неизвестного соединения, если известно, что оно не реагирует с бромной водой, но реагирует с водородом в присутствии катализатора. Известно, что это соединение может быть получено в результате прокаливания кальциевой соли органической кислоты. Составьте уравнение соответствующей химической реакции.
По данным задачи, углекислый газ составляет 0,1 моль, соответственно, столько же и углерода. Поскольку воды 7,2 г, что в молях 0,4, то водорода 0,8. Проверим на наличие кислорода. Масса углерода 6, масса водорода – 0,8. Поскольку общая масса сожженного вещества составляет 8,4, то на кислород приходится масса 1,6 (в молях 0,1). Получается молекулярная формула C5H8O.
Перейдем к структурой формуле вещества. Вещество не реагирует с бромной водой — из этого можно делать вывод, что нет кратных соединений (то есть двойных, тройных углерод-углеродных связей). Но вещество реагирует с водородом в присутствии катализатора. Исходя из условий, скорее всего, речь идет о двухосновной кислоте. В результате прокаливания, нагревания (в пределах 200–250°С) отщепляется карбонат кальция и образуется кетон циклопентанон.
Циклопентанон как раз используют в качестве отдушки для мыла.
Ошибка А. М. Бутлерова
Задача. Установите структурную формулу альдегида, в определении которой немного ошибся великий А. М. Бутлеров, если известно, что в результате взаимодействия 100 г 0,9%-го раствора этого вещества с избытком раствора перманганата калия образуется осадок массой 3,48 г. Составьте уравнение реакции этого альдегида с раствором перманганата калия.
Все великие химики ошибались, в том числе и А. М. Бутлеров.
Для начала вспомним, как альдегиды взаимодействуют с перманганатом калия. Мы не знаем, о каком альдегиде идет речь. Допустим, у него была одна альдегидная группа (хотя, если в соединении две альдегидные группы, он все равно будет альдегидом). Возьмем также перманганат калия и мысленно нагреем. Мы получаем калиевую соль некой карбоновой кислоты, оксид марганца (IV) и гидроксид калия. Степень окисления углерода в альдегидной группе была +1, а стала +3. Получается, что углерод альдегид потерял два электрона. Марганец был +7, стал +4? значит, он принял три электрона. Так мы определили ключевые коэффициенты. Проблема состоит в том, что калия всего два атома. Можно сказать, что две молекулы были в форме соли, а одна молекула в форме кислоты. Поскольку гидроксида калия 3, мы видим, что его не хватает — вместо него будет вода.
После составления уравнения найдем массу альдегида и массу осадка. Но осадок — это, разумеется, оксид марганца (IV).
Поскольку у нас 100 г 0,2%-го раствора и на 1% приходится 1 г, масса альдегида 0,9 г. Чтобы найти количество оксида марганца, 3,48 разделим на молярную масса оксида марганца — 87. Получаем 0,04 моль. В соответствии с этим уравнением альдегида у нас должно быть больше в полтора раза: 0,06 моль.
Найдем молярную массу альдегида.
Где вы видели альдегид с молярной массой 15? Только на атом кислорода приходится 16. Значит, что либо альдегид содержал две альдегидные группы, либо это был формальдегид. Если бы он содержал две альдегидные группы, он бы отдал не два, а четыре электрона. Столько же отдал бы и формальдегид. Перманганат калия принимал бы три электрона. У оксида марганца (IV) было бы 4 моль. В этом случае оксида марганца 0,4 моль, а альдегида 0,3 моль.
Тогда
Следовательно, искомый альдегид — формальдегид. CH2O.
А. М. Бутлеров изначально определил формулу как C2H4O2.
Химия. 11 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии для старшей школы, изложенный в учебнике «Химия. Углубленный уровень. 10 класс» данного авторского коллектива. Учебник предназначен для изучения химии на углублённом уровне. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
…ловая кислота
Задача. На полке в химической лаборатории стояла склянка с полустертой надписью. Единственное, что можно было разобрать: «…ловая кислота». Для установления состава кислоты провели ряд экспериментов. Для полной нейтрализации раствора, содержащего 0,36 г этой кислоты, понадобилось 50 мл 0,1-молярного раствора гидроксида натрия. Такая же навеска кислоты смогла обесцветить V = 80 мл (ω = 1%, ρ ≈ 1 г/мл) бромной воды. Восстановите надпись на склянке.
Обозначим формулу кислоты (будем считать, что она монокарбоновая). Если она одноосновная, то реакция идет один к одному. Найдем количество гидроксида натрия: 50 миллилитров 0,1-молярного раствора. У нас раствор, в одном литре которого содержится 0,1 моль вещества. Поскольку 50 мл — это в 20 раз меньше, то 0,1 разделим на 20. Получаем 0,005 гидроксида натрия. Столько же и карбоновой кислоты.
Отсюда легко находим молекулярную массу карбоновой кислоты.
На карбоксильную группу приходится 45. Значит, на углеводородную часть приходится 27. В них поместятся два атома углерода и три атома водорода. Искомая кислота — акриловая.
Электроны
Задача. 0,800000 кг вещества содержит 0,2743 г электронов. Установите формулу вещества, если известно, что масса электрона равна 0,0005486 а.е.м.
Начнем с количества электронов. Масса электронов у нас известна и молярная масса тоже.
Число протонов равно количеству электронов:
Отсюда находим массу, которая приходится на нейтроны (поскольку с точки зрения школьной химии любое число состоит из протонов, нейтронов и электронов). Обычно мы пренебрегаем массой электронов, но в данной задаче ей пренебрегать не нужно.
Получается интересное вещество. Обычно в атомах число нейтронов либо равно числу протонов, либо больше. В данном веществе протоны преобладают. Скорее всего, мы имеем дело с водородным соединением. Найдем соотношение между числом протонов и числом нейтронов.
Если мы переберем водородные соединения элементов второго периода, то для метана получим, что в составе метана протонов буде 10, а нейтронов — 6.
Поделив 10 на 6, получаем 1,67. Следовательно, искомым соединением был родоначальник предельных углеводородов, первый член гомологического ряда — метан.
#ADVERTISING_INSERT#
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 440 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 г\моль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=m\M
n=V\22.4 (л\моль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (л\моль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем \ массу \ кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.
Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: «Основные формулы для решения задач по химии»
(Правила комментирования)
Решение задач
ХИМИЯ
Предлагаем цикл занятий “Развивай навыки решения задач по химии” (программа 12.5 ч , 5 дней) для учеников 8-9 классов. К курсу также могут присоединиться ученики 10-12-х классов, которые хотят улучшить свои знания основ химии.
Достаточно часто решение задач по химии доставляет определенные сложности. Почему? У каждого будет свой ответ. Мы в свою очередь на дополнительных занятиях по химии освоим алгоритмы решения задач, которые помогут справиться не только с задачами уровня основной школы, но и сформируют базовые навыки для решения задач уровня средней школы. Во время занятий поможем систематизировать алгоритмы решения задач таким образом, чтобы в процессе решения можно было легко выбрать наиболее подходящие формулы и путь решения.
Наша цель, чтобы в результате данных занятий участники приобрели следующие навыки и умения:
- научились правильно определять заданные величины в заданиях и таблицах данных;
- научились использовать и преобразовывать формулы в соответствии с условиями задач;
- определять свой путь решения задачи;
- выбрать соответствующие формулы в комплексных задачах;
- правильно составлять химические формулы по названиям;
- правильно составлять уравнения реакций;
- проверять правильность составленного уравнения реакций;
- находить взаимосвязь уравнений реакций с расчетами.
Темы занятий:
- Количество вещества. Молярная масса. Молярный объем. Число Авогадро. Число атомов и молекул.
- Уравнения реакций. Степени окисления. Индексы. Коэффициенты. Цепи реакций.
- Задачи с уравнениями реакций. Молярное соотношение. Преобладание реагентов.
- Задачи, в вычисление которых используют растворы. Молярная масса. Молярная концентрация. Кристаллогидраты. Смешивание растворов.
- Комбинированные задачи с уравнениями реакций и растворами.
ЗАПИСАТЬСЯ
ФИЗИКА
Предлагаем цикл занятий “Развивай навыки решения задач по физике” (программа 12.5 ч , 5 дней) для учеников 8-9 классов. К курсу также могут присоединиться ученики 10-12-х классов, которые хотят улучшить свои знания основ физики.
Достаточно часто решение задач по физике доставляет определенные сложности. Почему? У каждого будет свой ответ. Мы в свою очередь на дополнительных занятиях по физике освоим алгоритмы решения задач, которые помогут справиться не только с задачами уровня основной школы, но и сформируют базовые навыки для решения задач уровня средней школы. Во время занятий поможем систематизировать алгоритмы решения задач таким образом, чтобы в процессе решения можно было легко выбрать наиболее подходящий путь решения и формулы.
Цель команды нашей школы, чтобы в результате этих занятий участники приобрели следующие навыки и умения:
- правильно определить заданные величины и задании и в таблицах данных;
- использовать и преобразовывать формулы в соответствии с условиями задач;
- объединить несколько формул решений в одно;
- определить свой путь решения задачи;
- преобразовывать и анализировать единицы измерения;
- вычислить и преобразовать числа в нормальную форму;
- оценить достоверность полученного ответа;
- отобразить в задании происходящие процессы и развить воображение.
Темы занятий:
- Механика (скорость, ускорение, сила, гравитация)
- Энергия (потенциальная и кинетическая энергия, теплота, сохранение энергии)
- Волны (свет, звук)
- Электричество (Закон Ома, электрические цепи, мощность)
- Комбинированные задачи (в которых объединены несколько тем по физике)
ЗАПИСАТЬСЯ
ОПЛАТА И ДРУГАЯ ВАЖНАЯ ИНФОРМАЦИЯ
Занятия будут проходить 1 раз в неделю, 5 раз.
Длительность одного занятия — 2,5 часа (включен перерыв — 15 минут).
В каждом занятии 20% времени предусмотрено на разъяснение теории и 80% времени на практическое решение задач.
Количество участников: до 16 учеников
Взять с собой: тетрадь для записей, ручка, калькулятор.
Занятия будут проходить удаленно через платформу Google Classroom
Включенные в программу задачи дифференцированы по нескольким уровням сложности, начиная с базового и вплоть до уровня олимпиадных задач. Таким образом каждый участник приобретет новые знания и навыки независимо от уровня знаний на начало занятий. Занятие проводит учитель с ассистентом, чтобы была возможность при решении задач уделить каждому участнику индивидуальное внимание и обеспечить максимально эффективные процесс обучения. Уровень освоения материала будет оцениваться с помощью теста в конце каждого занятия. По окончанию всего цикла занятий будет проведен завершающий тест для закрепления и проверки приобретенных знаний и навыков.
Цена: 75 Eur за всю программу (5 раз), 20 Eur за отдельное занятие (отдельно можно посещать только темы 1, 2, 3, 4 занятия).
Оплатить занятия следует до начала первого занятия по Счету, который будет вам выставлен и выслан после заполнения заявки — анкеты.
ЗАПИСАТЬСЯ
ДАТЫ БЛИЖАЙШИХ КУРСОВ
ДРУГИЕ КУРСЫ:
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Олимпиада по химии 2020-21 • Формула Единства
К участию в олимпиаде приглашаются российские школьники 8–11 классов. Участие в олимпиаде бесплатное. Призёры олимпиады получают право на льготную путёвку в образовательные лагеря «Формула Единства».
Организатор олимпиады
Санкт-Петербургский Химико-Фармацевтический Университет.
Контакты оргкомитета олимпиады
Официальные документы
Текущий статус: Подведены итоги заключительного этапа. Информация о церемонии награждения будет позднее.
Хронология событий
Все новости олимпиады будут публиковаться ниже от более новых к более старым.
В соответствии с Порядком проведения олимпиад школьников, утверждённым Приказом Минобрнауки России от 4 апреля 2014 г. №267, здесь опубликованы олимпиадные работы победителей и призёров олимпиады «Формула Единства» / «Третье тысячелетие» по химии 2020/21 г.
Уважаемые участники!
Публикуем окончательные результаты официальных участников заключительного этапа
Границы дипломов были установлены следующие:
| 8 класс | 9 класс | 10 класс | 11 класс | |
| I диплом | 80 | 95 | 80 | 75 |
| II диплом | 60 | 70 | 70 | 70 |
| III диплом | 50 | 60 | 65 | 60 |
Информация относительно призов будет направлена на почту.
Внеконкурсным участникам для получения своего балла необходимо зарегистрироваться в системе с указанием своего кода.
Уважаемые участники!
Публикуем предварительные результаты и решения задач заключительного этапа:
Не позднее 23:59 6 апреля по московскому времени участники могут запросить работу и/или подать апелляцию (запрос на пересмотр решения определённой задачи). Для этого нужно прислать письмо на адрес жюри olimp.[email protected]formulo.org, указав в теме письма номер класса. В тексте письма напишите «Запрос работы» или «Апелляция по задаче №…», укажите свои фамилию и имя. Обратите внимание, что в результате апелляции баллы за решение могут как увеличиться, так и снизиться.
Если Вы обнаружили, что результаты участника заключительного этапа отсутствуют или есть ошибка в персональных данных, просим безотлагательно сообщить об этом в жюри.
Решение о присуждении дипломов будет принято при подведении окончательных итогов (7 апреля).
Внеконкурсные участники должны зарегистрироваться в системе до 7 апреля с указанием своего кода.
Участники заключительного этапа олимпиады по химии имеют возможность выбрать площадку в следующих населённых пунктах: Ангарск, Бавлы, Брянск, Волгоград, Вологда, Волжский, Воронеж, Геленджик, Глазов, Дербент, Екатеринбург, Иваново, Казань, Калининград, Киров, Краснодар, Красноярск, Липецк, Магнитогорск, Мезень, Москва, Невинномысск, Нижний Новгород, Новосибирск, Ростов-на-Дону, Санкт-Петербург, Саранск, Симферополь, Томск, Тула, Уфа, Ухта, Хабаровск, Челябинск, Череповец, Ярославль.
Для выбора площадки в личном кабинете нужно найти олимпиаду «Химия 2020–21» в таблице олимпиад и нажать зелёную кнопку «Открыть» под словами «Заключительный этап». Обратите внимание, что время проведения на выбранной площадке может быть нестандартным (время в информационной системе указывается московское.)
Площадка в любом случае должна быть выбрана не позднее 11 марта.
При возникновении любых сложностей предлагаем обращаться в оргкомитет по адресу olimp.[email protected]formulo.org.
Публикуем полный список участников, приглашенных на заключительный этап, который состоится 13 марта на многочисленных региональных площадках (как правило, в 11:00 по местному времени). Информация о площадках проведения будет опубликована в ближайшие дни.
Уважаемые участники второго отборочного этапа!
Жюри завершило проверку поступивших работ. С набранными баллами Вы можете ознакомиться в личном кабинете в Информационной системе. Там же указано, набран у Вас проходной балл для участия в заключительном этапе или нет. Ниже прикреплены решения и критерии:
Уважаемые участники олимпиады, их родители, учителя и руководители кружков! Публикуем полный протокол первого отборочного этапа.
Благодаря поддержке нескольких компаний — доноров Фонда Эйлера Оргкомитет олимпиады объявляет о призах для победителей и призёров олимпиады «Формула Единства» / «Третье тысячелетие» по химии.
Участники, награждаемые дипломом I степени, получат (на выбор) бесплатную путёвку на одну из смен лагеря «Формула Единства» в 2021 г. или сертификат на приобретение продукции в магазинах bookvoed.ru/ozon.ru номиналом 10 000 р.
Участники, награждаемые дипломом II/III степени, получат (на выбор) скидку в размере 50/30 % на путёвку в лагерь «Формула Единства» или сертификат номиналом 5000/3000 р.
Перед Вами задачи дополнительного отборочного этапа химической олимпиады «Формула Единства» / «Третье тысячелетие». Принять в нём участие могут все желающие российские школьники 8–11 классов.
Помните, что решение задачи должно включать не только правильный ответ, но и полное обоснование этого ответа. Мы будем рады, если в олимпиаде примут участие Ваши друзья, которым нравится химия. Однако работы с признаками списывания и «коллективного творчества» рассматриваться не будут.
Условия задач в работу переписывать не нужно. Работа должна быть оформлена на русском языке.
Напоминаем, что если у Вас набран проходной балл в первом отборочном этапе, то Вы приглашены СРАЗУ на заключительный этап, который состоится 13 марта 2021 года на региональных площадках.
Порядок участия в олимпиаде
Для участия в олимпиаде необходимо в срок до 14 февраля 2021 г. включительно подготовить файлы с решениями задач (каждая задача — отдельный файл), зарегистрироваться в нашей информационной системе и отправить файлы через личный кабинет:
Загрузить можно как текстовые файлы (в форматах TXT, DOC, DOCX или PDF), сканы бумажных работ (в форматах JPG и PNG), архивы в формате ZIP. На каждую задачу разрешено прикрепить ровно 1 файл. В файлах с решениями задач не должны указываться фамилия, имя и другие личные данные участника!
Вопросы?
Все вопросы Оргкомитету по условиям задач и о порядке проведения Олимпиады можно задать по электронной почте olimp.[email protected]formulo.org или по телефону +7 (953) 345–85–17.
Вопросы по работе информационной системы можно задать по электронной почте [email protected]formulo.org.
В связи с малым количеством участников отборочного этапа было принято решение о проведении дополнительного тура олимпиады по химии.
Второй отборочный этап будет проходить 1.02.21 — 14.02.21. К участию приглашаются все желающие школьники 8–11 классов. Для этого необходимо зарегистрироваться в информационной системе и загрузить решения в период проведения этапа. Задания будут доступны с 1 февраля.
Уважаемые участники первого отборочного этапа по химии этого года! Вы можете ознакомиться со своими результатами в информационной системе. Если у Вас набран проходной балл, то Вы приглашены СРАЗУ на заключительный этап, который состоится 13 марта 2021 года на региональных площадках.
Если Вы не набрали проходного балла, то Вы можете поучаствовать во втором отборочном этапе олимпиады по химии, и, в случае успешного прохождения, мы Вас пригласим на заключительный этап.
Уважаемые участники отборочного этапа!
Жюри завершило проверку поступивших работ. С набранными баллами вы можете ознакомиться в личном кабинете в Информационной системе. Ниже прикреплены решения и критерии:
Окончательное решение по итогам этапа будет опубликовано в ближайшие несколько дней.
Перед Вами задачи отборочного этапа второй химической олимпиады «Формула Единства» / «Третье тысячелетие».
Помните, что решение задачи должно включать не только правильный ответ, но и полное обоснование этого ответа. Мы будем рады, если в олимпиаде примут участие Ваши друзья, которым нравится химия. Однако работы с признаками списывания и «коллективного творчества» рассматриваться не будут.
Условия задач в работу переписывать не нужно. Работа должна быть оформлена на русском языке. Использование других языков должно быть заранее согласовано с организаторами.
Призёры первой химической олимпиады «Формула Единства» / «Третье тысячелетие» 2019/20 г. будут приглашены непосредственно на заключительный этап.
Порядок участия в олимпиаде
Для участия в олимпиаде необходимо в срок до 10 декабря 2020 г. включительно подготовить файлы с решениями задач (каждая задача — отдельный файл), зарегистрироваться в нашей информационной системе и отправить файлы через личный кабинет:
Загрузить можно как текстовые файлы (в форматах TXT, DOC, DOCX или PDF), сканы бумажных работ (в форматах JPG и PNG), архивы в формате ZIP. На каждую задачу разрешено прикрепить ровно 1 файл. В файлах с решениями задач не должны указываться фамилия, имя и другие личные данные участника!
Обращаем внимание, что наша информационная система была запущена всего несколько месяцев назад, и все участники должны регистрироваться заново (прежняя регистрация на других площадках не действует).
Вопросы?
Все вопросы Оргкомитету по условиям задач и о порядке проведения Олимпиады можно задать по электронной почте olimp.[email protected]formulo.org или по телефону +7 (953) 345–85–17.
Вопросы по работе информационной системы можно задать по электронной почте [email protected]formulo.org.
Коллекция из 62 химических калькуляторов и утилит
В вашем браузере отключен JavaScript.
Вам необходимо включить его, чтобы использовать наши калькуляторы на основе JavasSript.
Содержание
Обзор
Химия — это наука о материи: о ее составе, свойствах, изменениях, которые приводят к ее образованию, и способах ее взаимодействия с другими веществами в окружающей среде. Мы начинаем со строительных блоков материи — электронов, нейтронов и протонов — и строим атомы и ионы, которые затем образуют молекулы и ионные соединения, которые могут реагировать, создавая известный нам материальный мир.Тщательное исследование свойств и тенденций этих материальных образований способствует лучшему пониманию возможностей материального мира.
Этот сборник химических калькуляторов, разбитых на различные фундаментальные концепции, представляет собой хороший обзор вводной химии, но также содержит некоторые инструменты для более высокого уровня усилий по таким темам, как квантовые числа и продвинутая стехиометрия.
Кислотно-основные реакции
- Калькулятор pH WebQC — нужно знать pKa раствора? Или, может быть, даже просто pH? Посетите эту страницу, чтобы узнать обо всех ваших потребностях в кислотно-щелочной реакции.
- EasyCalculation Neutralization Reaction — Есть два способа проверить вашу работу: сдать ее и надеяться на лучшее или использовать этот сайт. Это так же просто, как нажмите, подключите и проверьте!
- Meracalculator Neutralization Reactions — Отлично подходит при работе с реакциями нейтрализации кислот и оснований, возвращайтесь к «нормальному состоянию» с помощью этого простого в использовании инструмента для решения проблем.
Буферы
- Рецепты буфера PFG — этот простой инструмент дает быстрые и точные ответы, а также дает возможность распечатать результаты и сохранить рецепт для дальнейшего использования.
- Wiley Buffers — Очень простой сайт без рекламы для расчета буфера.
- Science Gateway Общие реагенты и буферы — нужно знать массу или объем буферов? Как насчет объема буфера, необходимого для разбавления раствора? Щелкните здесь также, чтобы просмотреть список общих реагентов.
Катализ
- Энергия активации — Вам нужно знать энергию активации реакции в Дж / моль, а не в британских тепловых единицах / фунт-моль? Просто подключите и выпейте здесь свои ответы на энергию активации, чтобы быстро и удобно проводить вычисления.
Химическое равновесие
- Onlinesciencetools Химическое равновесие — склоните чашу весов в правильном направлении с помощью этих простых в использовании равновесных весов. Просто вставьте свои фигуры в отведенные места, и ваши формулы всегда будут выровнены.
- Tutorvista Equilibrium Constant — Найдите константу равновесия для любого уравнения с помощью этого простого в использовании онлайн-уравнения. Просто введите значения равновесия и нажмите «рассчитать константу равновесия».”
- Colorado State Equilibria — более продвинутый и точный онлайн-источник для подсчета равновесий.
Эмпирические и молекулярные формулы
Электрохимия
- Калькулятор электрической движущей силы — Определите движущую силу любой электрохимической реакции с помощью этого простого в использовании инструмента.
- Calctool.org Nernst Solver — Вам нужно знать фактический или стандартный обратимый потенциал уравнения Нернста? Введите свои данные в текстовые поля и начните получать ответы.
- TutorVista Nernst Equation — Найдите редукционный потенциал уравнения, используя это простое уравнение Нернста. Заполните отведенные текстовые поля своими фигурами и позвольте ему сделать все остальное.
Электролиз
Электронные квантовые числа
Газовые законы (идеальный закон, закон Далтона и Грэма)
- AJ Design Формулы и уравнения закона идеального газа — Решаете ли вы для плотности, давления, температуры или объема с помощью закона идеального газа,
- WebQC Ideal Gas Law — идеальное место для любого химика, студента или любого другого специалиста, чтобы получить быстрый доступ к множеству уравнений и простому в использовании расчету.
- EasyCalculation Закон идеального газа — Просто введите цифры, которые вы знаете из уравнений закона идеального газа, а все остальное сделает easycalculation.com.
- Mera Закон Дальтона — Если вам нужно знать парциальные давления уравнения, то meracalculator.com — это то, что вам нужно. Этот сайт использует закон Далтона для вычисления этих значений парциального давления за вас.
- 1728 Закон диффузии Грэма. Это отличное место для изучения закона диффузии уравнений Грэма.Удобные, точные результаты.
Калькулятор
Ионные / ковалентные связи
Ионы и молекулы
- Цифровое ионное уравнение — Вы знаете название молекулы, но не знаете, из чего она состоит? Просто введите название, и этот инструмент предоставит вам молярную массу и эмпирическую формулу молекулы.
- Shodor Polyatomic Ion — Если вы знаете эмпирическую формулу иона или молекулы, то можете узнать ее название. Отлично подходит для тех, кто плохо знаком с ионами и молекулами или если вы просто хотите перепроверить свою работу.
- Mera Calculator Polyatomic Ion — Простой, но эффективный, этот калькулятор позволяет ввести положительные и отрицательные ионы из эмпирической формулы, а затем выдает название молекулы.
Кинетика
Масс-спектрометрия
Ядерный распад
Реакции окисления-восстановления
- TutorVista Число окисления — Введите желаемую химическую формулу, и этот полезный онлайн-инструмент выдаст число окисления-восстановления за секунды.
- Shodor Redox Reactions — Для более глубокого изучения окислительно-восстановительных реакций ознакомьтесь с этим отличным инструментом для решения проблем «plug and chug».
- — просто введите химическую формулу, и вы сразу же получите числа реакций окисления-восстановления и структурную диаграмму.
Вольфрамовое число окисления
Процентный состав
Значимые цифры
- Значимые цифры — Не сбавляйте скорость из-за длинных рукописных формул.Вставьте здесь свои уравнения или числа, чтобы быстро и надежно подсчитать значимые числа.
- Ostermiller Значительные цифры — Значительные цифры сбивают вас с толку? Щелкните здесь и введите свои числа, чтобы получить правильное количество значащих цифр для любого числа, а также определить наименее значащий десятичный разделитель.
- для химиков — Хотите перепроверить количество значащих цифр? Просто введите свои числа, чтобы получить точные значащие цифры.
- CalculatorSoup Significant Figures — Этот инструмент, содержащий подробные сведения об определении значащих цифр, также помогает научить вас округлять (и может проверить вашу работу).
- TutorCircle Significant Figures — Обширный список примеров и инструкций по значимым цифрам, со счетчиком сигнатур, так что вы даже можете проверить свою работу.
Счетчик значащих цифр
Концентрация раствора
Стехиометрия раствора (моли, титрование и расчеты молярности)
- Endmemo Chemical Mole Grams — Введите здесь химические формулы, чтобы вычислить количество молей или граммов в химической формуле.
- AJ Design Формулы и уравнения закона идеального газа — Используйте этот онлайн-вычислитель чисел для решения уравнений и формул закона идеального газа с использованием давления, объема и температуры.
- Lenntech Molecular Weights — Рассчитайте среднюю молекулярную массу (MW) по молекулярной формуле или по одному из двух списков распространенных органических соединений или элементов периодической таблицы.
- Stoichiometry Tool — Введите ваши сбалансированные химические уравнения (при необходимости используйте Chemical Equation Balancer!), Чтобы получить стехиометрию каждого уравнения.
- OST Стехиометрия — с широким диапазоном входных параметров и опций для типа газа, а также выхода, этот инструмент незаменим для ваших расчетов стехиометрии.
- Стехиометрия реакции — задайте реакцию и выберите, хотите ли вы рассчитать реагент или продукт.
- Концентрация раствора с помощью титрования — онлайн-инструмент для титрования образцов с учетом концентрации стандарта, объема титранта, необходимого для титрования стандарта и образца.
- GraphPad Molarity — Масса, объем и концентрация: учитывая два, легко вычислить другое или разбавить исходный раствор.
- Molaritycalculator.com — позволяя рассчитывать массу, объем или концентрацию в зависимости от того, какие два из них известны, на этой странице также есть подробные объяснения различных способов выполнения этих расчетов вручную.
- Sigma-Aldrich Mass Molarity — Рассчитайте массу, необходимую для молярного раствора определенной концентрации и объема.
Дополнительные инструменты
Список общих уравнений
Периодическая таблица
- Интерактивная таблица Менделеева — Нужна справочная информация, пока вы делаете домашнее задание по химии, или, может быть, вы просто хотите узнать больше об элементах? В таком случае эта интерактивная таблица Менделеева идеально подходит для обычного браузера или подготовки к тестам.
Основные единицы измерения (метрическая система / СИ)
- UCDavis Единицы СИ — Вам нужно знать, какую единицу измерения использовать для этого уравнения плотности? Может быть, вам нужно освежить свои префиксы измерений? Как бы то ни было, этот список единиц СИ является удобной справочной информацией.
В вашем браузере отключен JavaScript.
Вам необходимо включить его, чтобы использовать наши калькуляторы на основе JavasSript.
1.8: Решение химических проблем — Chemistry LibreTexts
Цели обучения
- Объясните подход размерного анализа (метка фактора) к математическим вычислениям, связанным с величинами.
- Опишите, как использовать анализ размеров для выполнения преобразования единиц для данного свойства и вычислений, включающих два или более свойств.
- Преобразование между тремя основными единицами измерения температуры: Фаренгейтом, Цельсием и Кельвином.
Часто бывает так, что интересующее количество может быть нелегко (или даже возможно) измерить напрямую, но вместо этого оно должно быть вычислено на основе других непосредственно измеряемых свойств и соответствующих математических соотношений. Например, рассмотрите возможность измерения средней скорости спортсмена, бегущего на спринт. Обычно это выполняется путем измерения времени , необходимого спортсмену для пробега от стартовой линии до финишной линии, и расстояния между этими двумя линиями, а затем вычисления скорости из уравнения, которое связывает эти три свойства:
\ [\ mathrm {speed = \ dfrac {distance} {time}} \]
Спринтер олимпийского качества может пробежать 100 м примерно за 10 с, что соответствует средней скорости
\ [\ mathrm {\ dfrac {100 \: m} {10 \: s} = 10 \: m / s} \]
Обратите внимание, что эта простая арифметика включает деление чисел каждой измеренной величины, чтобы получить число вычисленной величины (100/10 = 10) и аналогичным образом деление единиц каждой измеренной величины, чтобы получить единицу вычисленной величины (m / с = м / с).Теперь рассмотрите возможность использования этого же соотношения для прогнозирования времени, необходимого человеку, бегущему с этой скоростью, для преодоления расстояния 25 м. Используется такое же соотношение между тремя свойствами, но в этом случае предоставляются две величины: скорость (10 м / с) и расстояние (25 м). Чтобы получить искомое свойство, время, уравнение необходимо переставить соответствующим образом:
\ [\ mathrm {time = \ dfrac {distance} {speed}} \]
Время может быть вычислено как:
\ [\ mathrm {\ dfrac {25 \: m} {10 \: m / s} = 2.5 \: s} \]
И снова арифметика с числами (25/10 = 2,5) сопровождалась той же арифметикой по единицам измерения (м / м / с = с), давая число и единицу результата, 2,5 с. Обратите внимание, что, как и в случае с числами, когда единица делится на идентичную единицу (в данном случае м / м), результатом становится «1» — или, как обычно выражается, единицы «отменяются».
Эти расчеты являются примерами универсального математического подхода, известного как размерный анализ (или метод метки факторов). Анализ размеров основан на этой предпосылке: единицы величин должны подвергаться тем же математическим операциям, что и соответствующие числа .Этот метод может применяться к вычислениям, начиная от простого преобразования единиц измерения и заканчивая более сложными, многоэтапными вычислениями, включающими несколько различных величин.
Коэффициенты преобразования и размерный анализ
Отношение двух эквивалентных величин, выраженных в разных единицах измерения, может использоваться в качестве коэффициента преобразования единиц. Например, длины 2,54 см и 1 дюйм эквивалентны (по определению), и поэтому коэффициент преобразования единиц может быть получен из соотношения,
\ [\ mathrm {\ dfrac {2.54 \: cm} {1 \: дюйм} \ 🙁 2.54 \: cm = 1 \: дюйм) \: или \: 2.54 \: \ dfrac {cm} {дюйм}} \]
Несколько других часто используемых коэффициентов пересчета приведены в таблице \ (\ PageIndex {1} \).
| Длина | Объем | Масса |
|---|---|---|
| 1 м = 1,0936 ярда | 1 л = 1,0567 кварты | 1 кг = 2.2046 фунтов |
| 1 дюйм = 2,54 см (точно) | 1 кварт = 0,94635 л | 1 фунт = 453,59 г |
| 1 км = 0,62137 миль | 1 фут 3 = 28,317 л | 1 (экирдупуа) унция = 28,349 г |
| 1 миля = 1609,3 м | 1 столовая ложка = 14,787 мл | 1 (тройская) унция = 31,103 г |
Когда мы умножаем величину (например, расстояние в дюймах) на соответствующий коэффициент преобразования единиц, мы преобразуем количество в эквивалентное значение с различными единицами измерения (например, расстояние в сантиметрах).Например, вертикальный прыжок баскетболиста на 34 дюйма можно преобразовать в сантиметры следующим образом:
\ [\ mathrm {34 \: \ cancel {in.} \ Times \ dfrac {2.54 \: cm} {1 \: \ cancel {in.}} = 86 \: cm} \]
Поскольку эта простая арифметика включает в себя величин , предпосылка размерного анализа требует, чтобы мы умножали как чисел, так и единицы . Числа этих двух величин умножаются, чтобы получить номер количества продукта, 86, тогда как единицы умножаются, чтобы получить
.
\ [\ mathrm {\ dfrac {дюйм.\ times cm} {дюймы}}. \]
Как и в случае с числами, соотношение одинаковых единиц численно равно единице,
\ [\ mathrm {\ dfrac {дюйм} {дюйм} = 1} \]
, и таким образом единичный продукт упрощается до см . (Когда идентичные единицы делятся, чтобы получить коэффициент 1, они называются «отменяющими».) Используя анализ размеров, мы можем определить, что коэффициент преобразования единиц был установлен правильно, проверив, чтобы подтвердить, что исходная единица будет отменена, и результат будет содержать искомую (преобразованную) единицу.
Пример \ (\ PageIndex {1} \): использование коэффициента преобразования единиц
Масса соревновательного фрисби 125 г. Преобразуйте его массу в унции, используя коэффициент преобразования единиц, полученный из соотношения 1 унция = 28,349 г (Таблица \ (\ PageIndex {1} \)).
Решение
Если у нас есть коэффициент преобразования, мы можем определить массу в килограммах, используя уравнение, подобное тому, которое используется для преобразования длины из дюймов в сантиметры.
\ [x \: \ mathrm {oz = 125 \: g \ times unit \: conversion \: factor} \ nonumber \]
Мы записываем коэффициент преобразования единиц в двух формах:
\ [\ mathrm {\ dfrac {1 \: oz} {28.349 \: g} \: и \: \ dfrac {28.349 \: g} {1 \: oz}} \ nonumber \]
Правильный коэффициент преобразования единиц — это соотношение, которое отменяет единицы граммов и оставляет унции.
\ [\ begin {align *}
x \: \ ce {oz} & = \ mathrm {125 \: \ cancel {g} \ times \ dfrac {1 \: oz} {28.349 \: \ cancel {g} }} \\
& = \ mathrm {\ left (\ dfrac {125} {28.349} \ right) \: oz} \\
& = \ mathrm {4.41 \: oz \: (три \: значащие \: цифры )}
\ end {align *} \]
Упражнение \ (\ PageIndex {1} \)
Преобразует объем 9.345 кварты в литры.
- Ответ
8,844 л
Помимо простых преобразований единиц, метод меток факторов может использоваться для решения более сложных задач, связанных с вычислениями. Независимо от деталей, основной подход один и тот же — все факторы , участвующие в расчетах, должны быть соответствующим образом ориентированы, чтобы гарантировать, что их метки (единицы) будут соответствующим образом отменены и / или объединены, чтобы дать желаемую единицу в результате. .Вот почему он называется методом факторной метки. По мере продолжения изучения химии вы столкнетесь с множеством возможностей применить этот подход.
Пример \ (\ PageIndex {2} \): вычисление величин по результатам измерений
Какова плотность обычного антифриза в г / мл? Образец антифриза объемом 4,00 кварты весит
фунта.
Решение
Поскольку \ (\ mathrm {density = \ dfrac {mass} {volume}} \), нам нужно разделить массу в граммах на объем в миллилитрах.3 \: mL} = 1.11 \: г / мл} \ nonumber \]
В качестве альтернативы расчет можно настроить таким образом, чтобы последовательно использовать три коэффициента преобразования единиц измерения, как показано ниже:
\ [\ mathrm {\ dfrac {9.26 \: \ cancel {lb}} {4.00 \: \ cancel {qt}} \ times \ dfrac {453.59 \: g} {1 \: \ cancel {lb}} \ times \ dfrac {1.0567 \: \ cancel {qt}} {1 \: \ cancel {L}} \ times \ dfrac {1 \: \ cancel {L}} {1000 \: mL} = 1.11 \: г / мл} \ nonumber \]
Упражнение \ (\ PageIndex {2} \)
Каков объем в литрах 1000 унций, если 1 л = 1.{-2} \: L} \)
Пример \ (\ PageIndex {3} \): вычисление величин по результатам измерений
На пути из Филадельфии в Атланту, расстояние около 1250 км, Lamborghini Aventador Roadster 2014 года использует 213 л бензина.
- Какая (средняя) экономия топлива в милях на галлон была у Roadster во время этой поездки?
- Если бензин стоит 3,80 доллара за галлон, какова стоимость топлива для этой поездки?
Решение
(a) Сначала мы конвертируем расстояние из километров в мили:
\ [\ mathrm {1250 \: км \ раз \ dfrac {0.62137 \: mi} {1 \: km} = 777 \: mi} \ nonumber \]
, а затем переведите объем из литров в галлоны:
\ [\ mathrm {213 \: \ cancel {L} \ times \ dfrac {1.0567 \: \ cancel {qt}} {1 \: \ cancel {L}} \ times \ dfrac {1 \: gal} {4 \: \ cancel {qt}} = 56.3 \: gal} \ nonumber \]
Затем,
\ [\ mathrm {(средний) \: пробег = \ dfrac {777 \: mi} {56,3 \: гал} = 13,8 \: миль / галлон = 13,8 \: миль на галлон} \ nonumber \]
В качестве альтернативы расчет можно настроить таким образом, чтобы все коэффициенты пересчета использовались последовательно, как показано ниже:
\ [\ mathrm {\ dfrac {1250 \: \ cancel {km}} {213 \: \ cancel {L}} \ times \ dfrac {0.62137 \: mi} {1 \: \ cancel {km}} \ times \ dfrac {1 \: \ cancel {L}} {1.0567 \: \ cancel {qt}} \ times \ dfrac {4 \: \ cancel { qt}} {1 \: gal} = 13,8 \: миль на галлон} \ nonumber \]
(b) Используя ранее рассчитанный объем в галлонах, находим:
\ [\ mathrm {56.3 \: gal \ times \ dfrac {$ 3.80} {1 \: gal} = $ 214} \ nonumber \]
Упражнение \ (\ PageIndex {3} \)
Toyota Prius Hybrid использует 59,7 л бензина для поездки из Сан-Франциско в Сиэтл на расстояние 1300 км (две значащие цифры).
- Какую (среднюю) экономию топлива в милях на галлон получил Prius во время этой поездки?
- Если бензин стоит 3 доллара.90 за галлон, какова была стоимость топлива в этой поездке?
- Ответьте на
51 миль на галлон
- Ответ б
$ 62
Преобразование единиц температуры
Мы используем слово температура для обозначения жара или холода вещества. Один из способов измерить изменение температуры — это использовать тот факт, что большинство веществ расширяются при повышении их температуры и сжимаются при понижении температуры.Ртуть или спирт в обычном стеклянном термометре изменяют свой объем при изменении температуры. Поскольку объем жидкости изменяется больше, чем объем стекла, мы можем видеть, как жидкость расширяется, когда становится теплее, и сжимается, когда становится холоднее.
Чтобы разметить шкалу на термометре, нам понадобится набор справочных значений: два из наиболее часто используемых — это температура замерзания и кипения воды при заданном атмосферном давлении. По шкале Цельсия 0 ° C определяется как температура замерзания воды и 100 ° C как температура кипения воды.Пространство между двумя температурами разделено на 100 равных интервалов, которые мы называем градусами. По шкале Фаренгейта точка замерзания воды определяется как 32 ° F, а температура кипения — как 212 ° F. Пространство между этими двумя точками на термометре Фаренгейта разделено на 180 равных частей (градусов).
Определение температурных шкал Цельсия и Фаренгейта, как описано в предыдущем абзаце, приводит к немного более сложной взаимосвязи между значениями температуры на этих двух шкалах, чем для разных единиц измерения для других свойств.Большинство единиц измерения для данного свойства прямо пропорциональны друг другу (y = mx). На примере знакомых единиц длины:
\ [\ mathrm {length \: in \: ft = \ left (\ dfrac {1 \: ft} {12 \: in.} \ Right) \ times length \: in \: inch} \]
где
- y = длина в футах,
- x = длина в дюймах и
- коэффициент пропорциональности m является коэффициентом преобразования.
Температурные шкалы Цельсия и Фаренгейта, однако, не имеют общей нулевой точки, поэтому связь между этими двумя шкалами является линейной, а не пропорциональной (\ (y = mx + b \)).Следовательно, преобразование температуры из одной из этих шкал в другую требует большего, чем простое умножение на коэффициент преобразования m, это также должно учитывать различия в нулевых точках шкалы (\ (b \)). \ circ F} +32)} \]
Как упоминалось ранее в этой главе, единицей измерения температуры в системе СИ является кельвин (K).В отличие от шкал Цельсия и Фаренгейта шкала Кельвина представляет собой шкалу абсолютных температур, в которой 0 (ноль) К соответствует самой низкой температуре, которая теоретически может быть достигнута. Открытие в начале 19 века взаимосвязи между объемом газа и температурой предполагало, что объем газа будет равен нулю при -273,15 ° C. В 1848 году британский физик Уильям Томпсон, который позже принял титул лорда Кельвина, предложил шкалу абсолютных температур, основанную на этой концепции (дальнейшее рассмотрение этой темы дается в главе этого текста, посвященной газам).\ circ C} = T _ {\ ce K} -273,15 \]
Значение 273,15 в этих уравнениях было определено экспериментально, поэтому оно неточно. На рисунке \ (\ PageIndex {1} \) показано соотношение между тремя температурными шкалами. Напомним, что мы не используем знак градуса с температурами по шкале Кельвина. \ circ C} +273.2 \, K \ hspace {20px} (две \: значащие \: цифры)} \ nonumber \]
Упражнение \ (\ PageIndex {5} \)
Преобразование 50 ° F в ° C и К.
- Ответ
10 ° С, 280 К
Сводка
Измерения производятся с использованием различных единиц. Часто бывает полезно или необходимо преобразовать измеренную величину из одной единицы в другую. Эти преобразования выполняются с использованием коэффициентов преобразования единиц, которые получаются с помощью простых приложений математического подхода, называемого методом меток факторов или анализом размеров.\ circ C} = \ ce K-273.15 \)
Глоссарий
- анализ размеров
- (также метод метки факторов) универсальный математический подход, который может применяться к вычислениям, начиная от простого преобразования единиц измерения и заканчивая более сложными многоэтапными вычислениями с использованием нескольких различных величин
- по Фаренгейту
- единица температуры; вода замерзает при 32 ° F и закипает при 212 ° F по этой шкале
- коэффициент преобразования
- соотношение эквивалентных величин, выраженных в разных единицах; используется для преобразования одной единицы в другую
Авторы и авторство
Решение проблем в химии Учебник
Ключевые концепции
Есть 5 шагов к решению задач по химии (1) , которые можно представить как набор светофоров:
| 1: | СТОП! | S проблема времени. | ↓ | СТОП | ← | 5: | СТОП! | S tate solution or S tart еще раз |
|---|---|---|---|---|---|---|---|---|
| 2: | ПАУЗА! | P план ремонта ремонт. | ↓ | ПАУЗА | ↑ | 4: | ПАУЗА! | P на достоверность. |
| 3: | GO! | G o с планом игры. | → | GO | ↑ |
AUS-e-TUTE называет это подходом к решению проблем Sto P Go P S :
| Шаг 1: | Sto p, чтобы сформулировать проблему и извлечь все данные из вопроса. |
|---|---|
| Шаг 2: | P поможет подготовить ваш план игры, ваш подход к решению проблемы. |
| Шаг 3: | Go сделай это! Следуйте инструкциям вашего плана игры. |
| Шаг 4: | P позволяет задуматься о том, разумно ли ваше решение проблемы. Проверьте правильность примененных вами научных принципов. Проверить правильность формул, расчетов, единиц измерения и т. Д. |
| Шаг 5: | S верх. Довольны вашим решением? Назовите решение! Не устраивает ваше решение? Снова начните процесс решения проблемы с шага 1. |
Здесь вы найдете одностраничный шаблон (pdf), который можно использовать для решения проблем.
Все учебные пособия AUS-e-TUTE используют эту эвристическую «временную» процедуру для решения проблем.
Это руководство намного длиннее, чем нам хотелось бы, но это потому, что мы собираемся сосредоточиться на некоторых проблемах, поднятых экзаменаторами (экзаменаторами) в их отчетах о внешних экзаменах.
Итак, прежде чем вы начнете, вы можете пойти в ванную, взять что-нибудь попить и / или поесть и получить дополнительную подушку для своего стула….
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
СТОП! Сформулируйте проблему
Цель этого первого шага — разобрать вопрос, чтобы вы могли ясно видеть:
- что вас просит сделать вопрос
- какие научные принципы необходимо применять
- какая информация была предоставлена вам в вопросе
Шаг 1. Внимательно прочтите вопрос.
Шаг 2. Подчеркните слова или фразы в вопросе, которые говорят вам, что вас просят сделать.
| Ключевое слово | Значение |
|---|---|
| счет | укажите причины этого или сообщите об этом |
| анализировать | определить компоненты в этом и отношения между этими компонентами |
| применить | использовать информацию, данную в данной конкретной ситуации |
| оценка | оцените стоимость этого |
| оценить | оценить ценность этого |
| оценить | выносит суждение об этом на основании его ценности, качества, результата, результата или размера |
| рассчитать | определить значение для этого на основе данных |
| уточнить | сделайте это ясным или простым |
| классифицировать | упорядочить данные по группам, категориям или классам |
| сравнить | показать, как эти вещи одинаковы или разные |
| конструкция | создать или построить вещь или набор аргументов |
| контраст | показывают, чем все отличается, или как одно противоположно другому |
| критически | проанализируйте и оцените это на предмет степени точности и глубины понимания, то есть определите компоненты и взаимосвязь между ними, а затем сделайте суждение. |
| вывести | сделать выводы по этому поводу |
| определить | указать значение этого и определить его основные компоненты |
| продемонстрировать | покажите это на примере |
| описать | дать характеристики и особенности этого |
| обсудить | выявить проблемы и дать ключевые аргументы за и против этого |
| различить | обратите внимание на различия между этими вещами |
| оценить | сделать суждение об этом на основе определенных критериев или определить стоимость этого |
| изучить | запросить |
| объяснить | связывает причину и следствие, проясняет взаимосвязь между вещами, объясняет причины, почему и как это так |
| исследовать | внимательно посмотрите на предоставленную информацию, чтобы что-то обнаружить |
| экстракт | из предоставленной информации выберите соответствующие и / или соответствующие данные |
| экстраполировать | сделать вывод об этом из того, что известно |
| идентифицировать | узнайте и назовите это |
| интерпретировать | извлечь смысл из этого |
| расследовать | планировать, исследовать и делать выводы об этом |
| по ширине | поддержать аргумент или вывод, указав причины |
| организовать | использовать разные фрагменты информации для создания единого целого |
| контур | приведите основные характеристики этого, набросайте в общих чертах |
| прогноз | предположить, что может произойти на основании предоставленной информации |
| предложить | выдвинул на рассмотрение пример, точку зрения, идею, аргумент, предложение и т. Д. |
| отзыв | представить запомненные идеи, факты, опыт |
| признать | определить по знаниям, опыту или характеру |
| рекомендовать | аргументы в пользу этого |
| пересчет | пересказать серию событий |
| выбрать | тщательно выбирайте что-то, отдавая предпочтение другому |
| подвести итог | кратко укажите соответствующие подробности |
| синтезировать | объединить различные фрагменты данных в единое целое |
Шаг 3. Запишите, что вас просят сделать в вопросе, то есть сформулируйте проблему.
Используйте ключевое слово в начале утверждения.
Пример: Вычислить молей газа.
Пример: Объясните , почему скорость реакции увеличивается.
Шаг 4. Выделите ключевых слов, которые указывают на научные принципы, которые вам нужно будет применить.
| Слово / фраза | Научный принцип (тип проблемы) |
|---|---|
| кислота | Определение (Аррениус? Бронстед-Лоури? Льюис? Монопротический? Дипротический? Трипротический? Полипротический?)? Нейтрализация? Титрование? Расчет pH / pOH / концентрации? Равновесие? Буфер? Скорость реакции? Кислотный дождь? |
| активность | Activity Series? Тенденция периодической таблицы? |
| аммиак | Структура / внутримолекулярные силы (связывание)? Межмолекулярные силы? Газ (стехиометрия? Газовые законы?)? Процесс Габера (равновесие? Скорость реакции? Катализаторы? Уравнение? Стехиометрия?)? |
| основание | Определение (Аррениус? Бронстед-Лоури?), Нейтрализация? Титрование? Расчет pH / pOH / концентрации? Равновесие? Буфер? Скорость реакции? |
| связка | Внутримолекулярные силы (ковалентные? Ионные? Металлические?)? Межмолекулярные силы (дисперсионные силы? Диполь-дипольные взаимодействия? Водородная связь?)? |
| буфер | Равновесие? Кислотно-щелочная? Теория Бронстеда-Лоури? Сила кислот / оснований? |
| катализатор | Скорость реакции? Изменение энтальпии? Энергетический профиль? Использование? Фермент? |
| хроматография | Тип (бумага? Тонкий слой? Газ? Высокоэффективная жидкость?)? Расчет (коэффициент замедления? Время удерживания? Концентрация?)? |
| горение | Органическая химия (написать уравнение? Полное / неполное?)? Энтальпия (Расчет теплоты сгорания? Энергетический профиль? Закон Гесса?)? Калориметрия? Топливо (эффективность сгорания? Факторы, влияющие на?) |
| концентрация | Тип раствора (водный раствор? Газовая смесь? И т. Д.)? Стехиометрия (расчет)? Преобразование единиц измерения? Разбавление? |
| конъюгат | Теория Бренстеда-Лоури? Сила кислот / оснований? |
| цикл | Тип (углерод? Азот?)? Стехиометрия (расчет)? Химическое уравнение? Равновесие? Скорость реакции? |
| моющее средство | Структура (анионная, катионная, нейтральная)? Очистка (мицеллы? Межмолекулярные силы? Поверхностное натяжение?)? |
| рабочий объем | Уравнение реакции вытеснения? Серия мероприятий? Расчет электродного потенциала (ЭДС)? |
| электролизный / электролитический | Электролитическая ячейка? Уравнение окислительно-восстановительной реакции? Расчет электродного потенциала (ЭДС)? Применение (зарядка аккумуляторов? Гальваника? Извлечение / рафинирование металлов?)? |
| электрофорез | Техника? Разделение аминокислот? ДНК? |
| энтальпия | Расчет стохиометрии? Закон Гесса? Энергетический профиль? Жар реакции? Жар нейтрализации? Теплота раствора? Теплота сгорания? Теплота образования? Связанная энергия? Скрытая теплота? Калориметрия? Равновесие? Скорость реакции? |
| равновесие | Принцип Ле Шателье? Расчет / с использованием константы равновесия (K)? Расчет / использование коэффициента реакции (Q)? Кислота (K a )? База (K b )? Вода (K aw )? Осадок (K sp )? Применение (кровь? Процесс Хабера? Контактный процесс? Процесс Solvay?)? |
| формула | Органический (молекулярная формула? 2-мерная структурная формула? 3-мерная структурная формула? Сжатая (полу) структурная формула? Скелетная формула?)? Соль? Переходный Металлический Комплекс? |
| газ | Закон Гей-Люссака? Принцип Авогадро? Закон Бойля? Закон Чарльза? Комбинированное газовое уравнение? Закон об идеальном газе? Кинетическая теория газов? Закон частичных давлений Дальтона? Законы Грэма излияния и диффузии? |
| теплица | Эффект? Газы (тип «стехиометрических» уравнений?) |
| период полураспада | Ядерный распад? Скорость реакции? |
| изотоп | Атомная теория? Ядерный распад? Относительная атомная масса? Масс-спектроскопия? Период полураспада? Свойства / использование? Стабильность? |
| масса | Стехиометрия (расчет?)? Преобразование единиц измерения? Относительная атомная масса? Молярная масса? Молекулярная масса? Формула массы? Изотопная масса? Масс-спектроскопия? |
| металл | Периодическая таблица Тенденции? Реакции? Стехиометрия? Металлическое соединение? Серия мероприятий? Извлечение металлов из руд? Свойства / использование? |
| молярность | Стехиометрия (расчет)? Тип реакции (кислотно-щелочной? Окислительно-восстановительный? Металл + кислота? Вытеснение? Горение? Синтез и т. Д?)? Написать химическое уравнение? Разбавление? |
| моль | Стехиометрия (расчет)? Газ? Твердый? Жидкость? Решение? Тип реакции (кислотно-щелочное? Вытеснение? Окислительно-восстановительный? Синтез? Горение? И т. Д.)? Ограничение количества реагента / реагента в избытке? |
| наименование | Органическая номенклатура (IUPAC? Common?), Бинарное неорганическое соединение или соль? Переходный Металлический Комплекс? |
| нейтрализация | Теория Аррениуса? Теория Бронстеда-Лоури? Перенос протонов? Титрование? Соль (pH? Концентрация? Идентичность?)? |
| ядерный распад | Написать уравнение? Расчет (период полураспада? Масса? Процент?) Изотопов? Излучение (альфа?, Бета?, Гамма?)? |
| окисление | Органическая химия (напишите уравнение? Окислители?)? Электрохимия (степень окисления? Написать полууравнение? Окислитель?) |
| озон | Структура? Озоновый слой? Истощение озонового слоя? Стехиометрия (расчет)? Химическое уравнение? |
| полимер | Имя / Структура? Типа (добавление / конденсация?)? Примеры? |
| осадок | Уравнение (молекулярное? Ионное? Чистое ионное?)? Стехиометрия (расчет?)? Правила растворимости? Продукт растворимости (K sp )? Гравиметрический анализ? Межмолекулярные силы? |
| оценка | Теория столкновений? Распределение кинетической энергии? Закон о ставке? Равновесие? Энтальпия / энергия? |
| редокс | Состояние окисления? Реакция окисления? Редукционная реакция? Полуравнение? Уравнение окислительно-восстановительного потенциала? Электродные потенциалы (ЭДС)? Гальванический элемент? Электролитическая ячейка? Законы электролиза Фарадея? Гальваника (электроосаждение)? Добыча металла из руды? Титрование? |
| редуктор | Органическая химия (напишите уравнение? Восстанавливающий агент?)? Электрохимия (степень окисления? Полууравнение? Восстановитель?) |
| соль | Реакция нейтрализации? Бинарная неорганическая номенклатура? Металл + кислота? Карбонат + кислота? Теория Аррениуса? Теория Бронстеда-Лоури? Титрование? |
| мыло | Синтез / структура (омыление)? Очистка (мицеллы? Межмолекулярные силы? Поверхностное натяжение?)? |
| спектроскопия | Тип (масса? Атомная абсорбция? Излучение? Инфракрасное? УФ-видимое? 1 H? 13 C?)? Качественный? Количественный? |
| серная кислота | Стехиометрия? Кислотная сила? Нейтрализация? Реакция обезвоживания? Окисляющая кислота? Контактный процесс (равновесие? Скорость реакции? Катализаторы? Стехиометрия?) |
| поверхность | Адгезия? Сплоченность? Поверхностное натяжение? Смачивание? Капиллярное действие? Межмолекулярные силы? Моющее средство? Мыло? Катализ (скорость реакции? Изменение энтальфии?)? |
| раствор | Расчет стехиометрии (концентрация, разведение)? Коллигативные свойства растворов (понижение точки замерзания, повышение температуры кипения, понижение давления пара, осмотическое давление)? |
| растворимость | Правила растворимости? Осадки? Межмолекулярные силы? Энергия решетки? Стехиометрия (расчет)? Продукт растворимости (K sp )? Равновесие? Скорость реакции? Решение? |
| титрование | Тип (прямое кислотно-основное? Обратное титрование? Окислительно-восстановительный? Комплексометрический? Кондуктометрический?)? Техника? Стехиометрия (расчет)? Нейтрализация? Показатель? Кривая титрования? |
| объем | Твердый? Жидкость? Газ? Решение? Преобразование единиц измерения? Плотность? |
| вода | Равновесие (K w )? Водные растворы (стехиометрия? Уравнения? Реакции?)? Анализ? Очищение? Поверхностное натяжение? Смачивание? Структура / внутримолекулярные силы (связь)? Межмолекулярные силы? |
| выход | Расчет стехиометрии? Равновесие против скорости реакции? |
Под вашей формулировкой проблемы напишите краткую заметку, в которой сообщается, какой научный принцип (выделен) вы будете применять.
Начните заметку со слов вроде «Использовать …» или «Применить ….»
Шаг 5. Извлеките всю информацию, данные, приведенные в вопросе, и запишите их в виде списка под своим примечанием о применимых научных принципах.
При необходимости укажите единицы измерения.
Шаг 6. Где необходимо, запишите символ для фрагмента данных рядом с ним в списке.
| Некоторые примеры | |||
|---|---|---|---|
| количество | символ | кол-во | условное обозначение |
| число Авогадро | N A | моль | n |
| изменение: макроскопическое | Δ | давление | -П, |
| изменение: бесконечно малое | δ | коэффициент реакции | Q |
| концентрация (молярность) | с | коэффициент замедления | R f |
| энтальпия | H | время удерживания | R т |
| константа равновесия | К | удельная теплоемкость | C г |
| постоянная Фарадея | F | стандартный потенциал электрода | E o |
| период полураспада | т 1/2 | температура | т |
| постоянная идеального газа | R | раз | т |
| масса | м | том | В |
| молярная масса | M | ||
ПАУЗА! Подготовьте план игры
После выполнения вышеуказанного шага СТОП у вас должна появиться страница, которая выглядит как на диаграмме ниже:
| Проблема:………… Применить …………….. Данные |
Цель этого шага — подготовить план игры, которому вы можете следовать, чтобы решить проблему.
План может быть набором пронумерованных шагов или блок-схемой, но это должно быть то, чему вы можете следовать последовательно.
Шаг 1: Под списком данных, которые вы уже записали, запишите список шагов , скажем, 10 шагов, оставляя достаточно места между каждым из них:
| Проблема:………… Применить …………….. Данные |
Шаг 1 Шаг 2 Шаг 3 и т. Д. |
Вы всегда можете добавить дополнительные шаги позже, если вам нужно, или проигнорировать те, которые вы не используете.
Шаг 2: Подумайте о том, как ваше неизвестное (то, что вам нужно найти) связано с информацией, полученной вами в соответствии с научными принципами, которые вы выбрали.
От того, как неизвестное связано с известными, указанными в вопросе, будет зависеть, что вы напишете рядом с каждым числом в вашем списке шагов.
- Что вам нужно сделать в первую очередь?
Вам нужно написать химическое уравнение? Сделайте этот шаг 1.
Пример: Шаг 1: напишите сбалансированное химическое уравнение реакции между X и Y с образованием Z - Что вам нужно делать дальше?
Вам нужно найти стехиометрическое (мольное) соотношение? Сделайте этот шаг 2.
Пример: Шаг 2: найдите n (x): n (z), используя сбалансированное химическое уравнение. - Что вам нужно делать дальше?
Вам нужно рассчитать количество молей реагента? Сделайте этот шаг 3.
Пример: Шаг 3: вычислить n (X) - Что вам нужно делать дальше?
Нужно ли использовать мольное соотношение для расчета количества молей образовавшегося продукта? Сделайте этот шаг 4.
Пример: Шаг 4: используйте мольное отношение для вычисления n (Z) - Что вам нужно делать дальше?
Вам нужно рассчитать массу продукта? Сделайте этот шаг 5.
Пример: Шаг 5: вычислить m (Z) в граммах - Позволяет ли этот последний шаг решить проблему? Если да, то у вас есть основа для вашего плана!
Шаг 3: Прочтите свои шаги и решите, нужно ли вам использовать формулу (уравнение) , и запишите это как часть этого шага:
| Шаг 1: | запишите вычисленное химическое уравнение реакции между X и Y с образованием Z |
| Шаг 2: | найдите n (x): n (z), используя вычисленное химическое уравнение |
| Шаг 3: | вычислить n (X) n (X) = c (X) x V (X) |
| Шаг 4: | использовать мольное соотношение для расчета n (Z) |
| Шаг 5: | вычислить m (Z) в граммах м (Z) = n (Z) x M (Z) |
Шаг 4: Прочитайте ваши шаги еще раз и поместите информацию , которую вам дали , под заголовком для соответствующего шага.
| Шаг 1: | запишите вычисленное химическое уравнение реакции между X и Y с образованием Z |
| Шаг 2: | найдите n (x): n (z), используя вычисленное химическое уравнение |
| Шаг 3: | вычислить n (X) п (Х) = с (Х) х V (Х) c (X) = 0,010 моль л -1 В (Х) = 25.0 мл |
| Шаг 4: | использовать мольное соотношение для расчета n (Z) |
| Шаг 5: | вычислить m (Z) в граммах м (Z) = n (Z) x M (Z) |
Шаг 5: Прочтите шаги еще раз. Вам нужно сделать какие-либо предположения , чтобы решить проблему? Если да, запишите их на этом этапе:
| Шаг 1: | запишите вычисленное химическое уравнение реакции между X и Y с образованием Z |
| Шаг 2: | найдите n (x): n (z), используя вычисленное химическое уравнение |
| Шаг 3: | вычислить n (X) п (Х) = с (Х) х V (Х) с (Х) = 0.010 моль л -1 V (X) = 25,0 мл |
| Шаг 4: | использовать мольное соотношение для расчета n (Z) предполагаем, что реакция завершается |
| Шаг 5: | вычислить m (Z) в граммах м (Z) = n (Z) x M (Z) |
Шаг 6: Нужна ли вам дополнительная информация ? , например, нужно ли вам использовать Периодическую таблицу для определения относительных атомных масс? Или вам нужно использовать таблицу данных, чтобы найти физическую / химическую константу? Если да, запишите это в соответствующий шаг:
| Шаг 1: | запишите вычисленное химическое уравнение реакции между X и Y с образованием Z |
| Шаг 2: | найдите n (x): n (z), используя вычисленное химическое уравнение |
| Шаг 3: | вычислить n (X) п (Х) = с (Х) х V (Х) с (Х) = 0.010 моль л -1 V (X) = 25,0 мл |
| Шаг 4: | использовать мольное соотношение для расчета n (Z) предположим, что реакция завершится |
| Шаг 5: | вычислить m (Z) в граммах используйте таблицу Менделеева для определения относительных атомных масс элементов, составляющих соединение Z рассчитать M (Z), используя относительные атомные массы м (Z) = n (Z) x M (Z) |
Шаг 7: Вам нужно преобразовать единиц в , чтобы все используемые вами единицы были согласованы? Например, вам нужно преобразовать объем в мл в объем в л? Если да, добавьте это к соответствующему шагу:
| Шаг 1: | запишите вычисленное химическое уравнение реакции между X и Y с образованием Z |
| Шаг 2: | найдите n (x): n (z), используя вычисленное химическое уравнение |
| Шаг 3: | вычислить n (X) п (Х) = с (Х) х V (Х) с (Х) = 0.010 моль л -1 V (X) = 25,0 мл |
| Шаг 4: | использовать мольное соотношение для расчета n (Z) предположим, что реакция завершится |
| Шаг 5: | вычислить m (Z) в граммах используйте Периодическую таблицу, чтобы найти относительные атомные массы элементов, составляющих соединение Z рассчитать M (Z), используя относительные атомные массы м (Z) = n (Z) x M (Z) |
Шаг 8: Прочтите шаги еще раз.Переходит ли шаг 1 логически к шагу 2, затем к шагу 3 и т. Д.?
Если кажется, что все это имеет смысл, то пора реализовать план игры!
GO! с планом игры
Если вы подготовили хороший план игры, описанный выше, все, что вам нужно сделать, это следовать каждому шагу, который вы написали.
Если вы обнаружите, что в вашем плане игры есть пробелы, то есть вещи, которые вам нужны, но не включены, пора сделать паузу! и внимательно прочитайте каждый шаг в своем плане игры, внося при необходимости любые дополнения, ПРЕЖДЕ, чем вы продолжите реализацию плана игры.
Подставляйте значения в уравнения по мере продвижения, шаг за шагом, и вычисляйте каждое значение по мере его появления.
Когда вы завершите последний шаг своего плана игры, вы должны искать решение проблемы.
На этом этапе важно сделать ПАУЗУ! и вдумайтесь!
ПАУЗА! Обдумайте правдоподобность своего решения
Прежде чем вы назовете эту проблему «завершенной» и перейдете к следующей проблеме, подумайте о своем решении в связи с заданным вопросом.
Шаг 1: Вы действительно ответили на заданный вопрос?
Прежде чем вы рассмеетесь, я должен сказать вам, что одна из многих жалоб, которые есть у маркеров жалоб на студенческие экзаменационные работы, заключается в том, что студенты НЕ ответили на заданный вопрос … так что давайте продолжим …
Прочтите вопрос еще раз.
Прочтите свое решение.
Дает ли ваше решение ответ на заданный вопрос?
Проверьте это, задав себе следующий вопрос: «Если бы я дал свое решение проблемы кому-то, кто не читал проблему, могли бы они угадать, какой вопрос был задан?»
Если ваше решение действительно ответит на вопрос… отличная работа!
Но если этого не произойдет … ОСТАНОВИТЕСЬ прямо здесь! Вернитесь к началу процесса решения проблемы!
Шаг 2: Разумно ли ваше решение?
Одна из наиболее распространенных ошибок, которые студенты делают при сдаче экзаменационных работ, заключается в том, что они неправильно или пренебрегают преобразованием единиц измерения, что приводит к отклонению ответа на несколько порядков (множитель 10).
Вы можете проверить, кажется ли ваше решение разумным во многих отношениях, вот несколько:
- Получите цифру о парке мячей и посмотрите, как она соотносится с вашим ответом.
То есть округлите все числа, которые вы используете, в большую или меньшую сторону до ближайших 5 или 10, например, 0,89, потому что 1, 22,76 станет 20 и т. Д., А затем используйте эти округленные числа для быстрых вычислений в уме, просто чтобы проверить что вы не на порядки.
Если вы в конечном итоге получите число мячей, равное 50, а решение, которое вы тщательно рассчитали, было 64,71, вы выглядите хорошо, но если ваше тщательно рассчитанное решение было 0,6471, это указывает на то, что где-то что-то ужасно не так, поэтому пора ОСТАНОВИТЬ и вернитесь к началу процесса решения проблемы. - Должно быть число больше или меньше заданного?
Если вопрос касается, например, разбавления раствора, то концентрация раствора после разбавления будет меньше, чем концентрация раствора до его разбавления.
Если ваш ответ дает концентрацию разбавленного раствора выше, чем исходный раствор, ОСТАНОВИТЕСЬ и вернитесь к началу процесса решения проблемы.Если реакция выделяет энергию (экзотермическая), температура реакционной смеси должна повыситься, если ваш ответ показывает падение температуры, вам нужно ОСТАНОВИТЬ и вернуться к началу процесса решения проблемы.
Точно так же, если температура реакционной смеси увеличилась, поскольку реакция выделяла тепло, но ваш ответ дает положительное (а не отрицательное) значение для изменения энтальпии, вам нужно ОСТАНОВИТЬ и вернуться к началу решения проблемы. процесс.
- Вернитесь назад, используя свой ответ, чтобы вычислить одну из известных величин, указанных в вопросе (или используйте все известные величины и ваше значение для неизвестного, чтобы вычислить значение константы в уравнении) и т. Д.
Шаг 3: Убедитесь, что все данные, которые вы использовали, верны.
Да, это еще одна распространенная ошибка экзаменационных работ.
Проверьте, например, формулу ионов; сульфат — SO 4 2-, сульфит — SO 3 2- , сульфид — S 2-
Убедитесь, что химические уравнения правильно сбалансированы.
Убедитесь, что вы использовали правильное стехиометрическое (мольное) соотношение.
Убедитесь, что вы использовали правильную формулу (уравнение) при каждом расчете.
Если вы изменили формулу, убедитесь, что вы сделали это правильно, например, если c = n / V, то V = n / c
Убедитесь, что вы использовали правильные единицы измерения и что все используемые единицы согласованы.
Убедитесь, что у вас есть соответствующее количество значащих цифр, например, если вам дали pH = 1,32, концентрация ионов водорода НЕ будет 0,047863!
Шаг 4: Проверьте правописание!
Есть некоторые орфографические ошибки, которые, вероятно, не будут волновать экзаменаторов, например, там / их / они, где / носят и т. Д.
Но некоторые орфографические ошибки, например, алкан / алкен / алкин (например, огромная разница в реакционной способности, во-первых!), Гарантированно лишат вас баллов.
Шаг 5: Убедитесь, что научные принципы, которые вы применили, действительны для этой проблемы.
Это также означает проверку любых предположений, которые вы могли сделать.
Если вы проверили все вышеперечисленное, то пора ….
СТОП!
Если после выполнения шага ПАУЗА для размышления, описанного выше, все выглядело хорошо, значит, проблема решена.
Запишите свое решение проблемы.
Прекратите работу над этой проблемой.
Если, однако, есть некоторые сомнения в ценности или качестве вашего ответа после прохождения вышеуказанных проверок, вам следует ОСТАНОВИТЬ здесь и начать процесс решения проблемы снова, с самого начала, с шага 1.
Сноски:
(1) Этот подход основан на подходе Поли к решению задач в математике, который я всегда считаю «оружием деконструкции математики», но это хороший общий подход к решению задач.
Polya, G. Как решить ; 2 д изд .; Издательство Принстонского университета: Принстон, Нью-Джерси, 1985.
Онлайн-решение задач химии | Домашнее задание по химии
Если эти странные уравнения, которые учитель химии записывает на классной доске, сводят вас с ума, не нужно мучить себя. Благодаря цифровому и технологическому прогрессу вы можете найти решение химических проблем для любого случая. Вот некоторые из них, которые вы можете использовать.
- Chem Wiz
- Калькулятор pH
- Балансировка химических уравнений
- Калькулятор кротов
- Калькулятор периодов полураспада (реакция второго порядка)
- Номенклатура
- Калькулятор химических реакций
- Калькулятор молярности Philip Harris
- Калькулятор химических реакций
- Балансир реакции
- Калькулятор частотного коэффициента
- Поиск элементов
- Generador de Estructuras de Lewis ITPA
- Калькулятор периодов полураспада (реакция нулевого порядка)
- Калькулятор pH
- Виджет VSEPR
- Калькулятор электронной конфигурации
- Оксид
- Фазовая диаграмма
- Химическая формула
- Элементы периодической таблицы
- Калькулятор валентности оболочки
- Химическая структура
- Калькулятор температуры воспламенения
- Найти и преобразовать массу по формуле грамма
- Этикетки NFPA для химических веществ
- Структура Льюиса
- Калькулятор периодов полураспада (реакция первого порядка)
- Идентификатор соединения
- Генератор трехмерной химической структуры
- Закон об идеальном газе
- Создатель молекулярной структуры
- Ящик для химикатов
- Калькулятор решений
- JOULES в eV
- Онлайн-решение проблем
- градусов
- Калькулятор молярной массы
- Таблица реактивов Свойства II
- Калькулятор плотности воды
- Конвертер молей
- Калькулятор массового дефекта
- Определение постоянной скорости
- Поиск структуры Льюиса
- Калькулятор таблицы реагентов — настольный гаджет
- Поиск элемента
- Калькулятор pH для слабых кислот
10 лучших справочных приложений по химии
Химия — молярная масса Это приложение предназначено как для iPhone, так и для iPad |
Химическая формула Практика бесплатно Это приложение предназначено как для iPhone, так и для iPad |
Химия и периодическая таблица Это приложение предназначено как для iPhone, так и для iPad |
Основы органической химии Это приложение предназначено как для iPhone, так и для iPad |
Банк тестов по органической химии Lite Это приложение предназначено как для iPhone, так и для iPad |
Решение задач по химии для всех студентов-химиков
Когда вам нужно рассчитать молярную массу или уравновесить химическое уравнение, вы можете рассчитывать на решение химических задач, которое поможет вам.Этот инструмент достаточно всеобъемлющий. Это полезно для любого студента, независимо от типа и уровня курса химии, который он или она изучает. Если вам сложно что-то понять, решатель проблем поможет вам в процессе обучения. Если у вас есть опыт и навыки, это позволит вам сэкономить массу времени при выполнении домашней работы. Инструмент интуитивно понятен и очень прост в использовании.
Домашнее задание по химии поможет получить хорошие оценки
Химия — это раздел науки, который учит студентов, как вещества ведут себя и взаимодействуют друг с другом.Это очень интересный предмет, который расширяет знания учащихся об элементах и принципах, регулирующих эти элементы. Но та же химия оказывается сложной задачей для многих студентов, которые не могут запомнить формулы и уравнения, необходимые для понимания предмета. Это факт, что студенты должны запоминать множество формул и свойств веществ и газов, помимо запоминания того, как они реагируют с другими веществами и газами. Именно эти знания пригодятся при поиске ответов на домашние задания по химии, которые дают учителя в школе.Для таких студентов, которые боятся химии, особенно формул этого предмета, становится важным организовать домашнее задание по химии, чтобы иметь возможность выполнять свои задания.
Вам действительно нужна помощь, если вы не запомнили символы и значения
Если вы оказались одним из тысяч студентов, которые боятся химии из-за имен, символов и формул, которые вам нужно запомнить, чтобы решать задачи, вы повезло. Теперь вы можете получать домашние задания по химии, сидя дома, и то же самое с помощью всего лишь нескольких щелчков мышью на компьютере.Да, существует множество порталов, на которых можно найти ответы на домашние задания по химии учащимся, которые не могут выполнять задания, данные им учителями в школе. Конечно, вы платите небольшую сумму за такую услугу, но представьте себе комфорт и удобство, связанные с такой услугой.
Держитесь подальше от бесплатных онлайн-ресурсов
Если вас интересует программа для решения проблем химии , но вам трудно запомнить символы, валентности, свойства и характеристики различных веществ, лучший способ действий для вас — зарегистрироваться на веб-сайте или у онлайн-преподавателя, который может решить ваши проблемы в кратчайшие сроки.Хотя есть также репетиторы и веб-сайты, которые бесплатно предоставляют домашние задания по химии, вам лучше работать с веб-сайтами, которые взимают небольшую плату за свои услуги. Это связано с тем, что вы можете застрять в критический момент и не получить ответ на опубликованную вами проблему в случае бесплатного обслуживания. Это может нарушить ваши расчеты и снизить ваши оценки на выпускном экзамене. Чтобы избежать всего этого и получить быструю и эффективную помощь с домашним заданием по химии, выбирайте онлайн-справку с умом.
Есть несколько веб-сайтов, на которых работают лучшие из имеющихся специалистов в области химии.Эти эксперты остаются в распоряжении веб-сайта и в короткие сроки отвечают на вопросы зарегистрированных студентов. Из обзоров этих сайтов нужно убедиться в эффективности решателя домашних заданий по химии. Многие веб-сайты утверждают, что взломали вопросы из сотен учебников по химии. Вам нужно выбрать компанию с лучшими отзывами студентов. Если вы проведете небольшое исследование, прежде чем закончить онлайн-справку, вам никогда не придется беспокоиться о том, «как делать домашнее задание по химии» дома, не получив помощи от родителей, братьев и сестер.
Молекулярная формула и пример простейшей формулы Задача
Молекулярная формула соединения перечисляет все элементы и количество атомов каждого элемента, которые фактически составляют соединение. Самая простая формула аналогична, когда все элементы перечислены, но числа соответствуют соотношениям между элементами. Этот рабочий пример задачи демонстрирует, как использовать простейшую формулу соединения и его молекулярную массу, чтобы найти молекулярную формулу.
Молекулярная формула из задачи простейшей формулы
Простейшая формула витамина C: C 3 H 4 O 3 .Экспериментальные данные показывают, что молекулярная масса витамина С составляет около 180. Какова молекулярная формула витамина С?
Решение
Сначала вычислите сумму атомных масс для C 3 H 4 O 3 . Найдите атомные массы для элементов из Периодической таблицы. Найдено, что атомные массы равны:
H составляет 1,01
C составляет 12,01
O составляет 16,00
Подставляя эти числа, сумма атомных масс для C 3 H 4 O 3 составляет:
3 ( 12.0) + 4 (1,0) + 3 (16,0) = 88,0
Это означает, что формульная масса витамина С равна 88,0. Сравните формулу массы (88,0) с приблизительной молекулярной массой (180). Молекулярная масса в два раза превышает формульную массу (180/88 = 2,0), поэтому простейшую формулу нужно умножить на 2, чтобы получить молекулярную формулу:
молекулярная формула витамин C = 2 x C 3 H 4 O 3 = C 6 H 8 O 6
Ответ
C 6 H 8 O 6
Советы по устранению рабочих проблем
Приблизительной молекулярной массы обычно достаточно для определения формулы массы, но расчеты, как правило, не работают «даже», как в этом примере.Вы ищете ближайшее целое число, которое нужно умножить на формулу массы, чтобы получить молекулярную массу.
Если вы видите, что соотношение между формульной массой и молекулярной массой составляет 2,5, возможно, вы смотрите на соотношение 2 или 3, но более вероятно, что вам придется умножить формулу массы на 5. Часто в процессе проб и ошибок получение правильного ответа. Хорошая идея — проверить свой ответ, выполнив математические вычисления (иногда более чем одним способом), чтобы увидеть, какое значение ближе всего.
Если вы используете экспериментальные данные, в расчете молекулярной массы будет некоторая ошибка.Обычно соединения, назначаемые в лабораторных условиях, будут иметь отношения 2 или 3, а не большие числа, такие как 5, 6, 8 или 10 (хотя эти значения также возможны, особенно в лаборатории колледжа или в реальных условиях).
Стоит отметить, что хотя химические задачи решаются с использованием молекулярных и простейших формул, реальные соединения не всегда подчиняются правилам. Атомы могут иметь общие электроны, например, в соотношении 1,5. Однако при выполнении домашних заданий по химии используйте целые числа!
Определение молекулярной формулы по простейшей формуле
Формульная задача
Простейшая формула бутана — это C2H5, а его молекулярная масса составляет около 60.Какова молекулярная формула бутана?
Решение
Сначала вычислите сумму атомных масс для C2H5. Найдите атомные массы для элементов из Периодической таблицы. Атомные массы оказываются равными:
H составляет 1,01
C составляет 12,01
Подставляя эти числа, сумма атомных масс для C2H5 составляет:
2 (12,0) + 5 (1,0) = 29,0
Это означает, что формула массы бутана 29,0. Сравните формулу массы (29,0) с приблизительной молекулярной массой (60). Молекулярная масса практически вдвое превышает формульную массу (60/29 = 2.1), поэтому простейшую формулу нужно умножить на 2, чтобы получить молекулярную формулу:
молекулярная формула бутана = 2 x C2H5 = C4h20
Ответ
Молекулярная формула бутана — C4h20.
Chemistry Step-by-Step Solutions: Химические реакции — Блог Wolfram
Если вы изучаете химию или изучаете дисциплину, требующую обязательных курсов по химии, то вы знаете, насколько дорогими могут быть необходимые учебники. Чтобы бороться с этим, сообщество химического образования разработало открытые образовательные ресурсы, чтобы предоставить бесплатные учебники химии.Однако, хотя бесплатные учебники хранят деньги в вашем кошельке, в них нет руководств по решению всех домашних задач.
К счастью, функция «Пошаговые решения» в Wolfram | Alpha вас поддержала! Независимо от того, учитесь ли вы удаленно или сотрудничаете с помощью видеоконференцсвязи, Wolfram | Alpha поможет вам изучить и применить фреймворки для решения химических задач. Пошаговые решения содержат пошаговые руководства по решениям, которые можно просматривать по очереди или все сразу.Руководства не только оттачивают эффективное решение проблем, но и способствуют более глубокому изучению концепций, которые все еще могут быть неясными.
В течение следующих нескольких недель мы будем изучать некоторые популярные темы, с которыми учащиеся средних школ, старшеклассников и колледжей сталкиваются на курсах химии и выпускных экзаменах: химические реакции, структура и связывание, химические растворы и, наконец, квантовая химия. Прочтите, например, о проблемах химических реакций и их пошаговых решениях!
Балансировка химических уравнений
Фундаментальный аспект химии — уравновешивание химических уравнений.Если химические уравнения — это язык, на котором выражаются химические процессы, то уравновешивающие химические уравнения — это соответствующая грамматика. Пошаговое решение проведет вас через надежный алгебраический подход к определению стехиометрических коэффициентов.
Пример проблемы
Напишите сбалансированное уравнение реакции меди с азотной кислотой с образованием нитрата меди, оксида азота и воды.
Пошаговое решение
Для этого класса задач просто введите «баланс медь + азотная кислота -> нитрат меди + диоксид азота + вода».
Масса
После уравновешивания соответствующих химических уравнений следующим шагом в планировании лабораторного эксперимента является вычисление количества каждого реагента, которое необходимо отмерить. Для этого нужна молярная масса каждого реагента. Доступны пошаговые решения для молекулярной массы и относительной молекулярной массы в дополнение к молярной массе. Во всех случаях общая структура для решения этих типов проблем предоставляется на этапе «Планирование». Предоставляется подробная информация о том, какую формулу использовать и как собрать необходимую информацию.
Пример проблемы
Рассчитайте молярную массу сульфата серебра Ag 2 SO 4 .
Пошаговое решение
В этом случае просто введите «молярная масса сульфата серебра».
Массовый состав
Один из способов анализа отдельных химических веществ — вычисление и сравнение массовых и атомных процентов. Пошаговое решение обеспечивает общую основу для решения этого класса проблем на этапе «Планирование». Приведены подробные сведения о соответствующих уравнениях, а также о том, как вычислить необходимые промежуточные значения.Способы, которыми вы можете проверить свою работу во время расчетов, также доступны с помощью кнопок «Показать промежуточные шаги».
Пример проблемы
Антигемофильный фактор — коагулянт с формулой C 11794 H 18314 N 3220 O 355 S 83 . Каков его процентный состав?
Пошаговое решение
Для ответа просто введите «элементный состав антигемофильного фактора».
Химическая конверсия
Химические превращения возникают почти в каждом домашнем задании по химии или в каждой исследовательской задаче.Таким образом, доступны пошаговые решения для преобразования между молями, массой, объемом, молекулами и атомами. Предоставляется преобразование единиц измерения и подробный анализ размеров.
Пример проблемы
Сколько атомов в пяти миллилитрах 1,5 мМ раствора гидроксида магния?
Пошаговое решение
Чтобы решить эту проблему, просто введите «преобразовать 5 мл 1,5 мМ гидроксида магния в атомы».
Стехиометрия
После проведения химической реакции часто хочется узнать, как протекает реакция, вычисляя выходы реакции.Доступны пошаговые решения для расчета количества необходимых реагентов и теоретического выхода в дополнение к процентному выходу. Подробно объясняется использование стехиометрических факторов для получения желаемых значений.
Пример проблемы
При взаимодействии 1,274 грамма сульфата меди с избытком металлического цинка было получено 0,392 грамма металлической меди в соответствии со следующим уравнением: CuSO 4 (водн.) + Zn (s) & xrarr; Cu (s) + ZnSO 4 (водн.). Какой процент доходности?
Пошаговое решение
Чтобы найти процентный выход, просто добавьте значения массы к соответствующим химическим соединениям и запросите стехиометрию: «1.274 г CuSO4 + Zn -> 0,392 г Cu + ZnSO4 стехиометрия ».
Задачи
Проверьте свои навыки решения проблем с химическими реакциями, используя описанные инструменты Wolfram | Alpha для решения этих словесных задач. Ответы будут предоставлены в следующем сообщении блога этой серии.
- Вычислите молекулярную массу ацетаминофена. Является ли элемент с наибольшим количеством атомов элементом с наибольшим массовым процентом?
- Каков предельный реагент и теоретический выход, когда 24.8 граммов белого фосфора и 0,200 моль кислорода реагируют с образованием 10,0 граммов пятиокиси фосфора?
и больше химии в будущем
Готовитесь ли вы к предстоящим выпускным экзаменам, решаете ли вы домашнее задание или просто хотите освежиться, химические реакции — одна из многих тем по химии, охватываемых базой знаний Wolfram | Alpha. На следующей неделе мы рассмотрим пошаговые инструкции для химических растворов, затем структуру и связывание, а затем квантовую химию. Если у вас есть предложения по другому пошаговому содержанию (по химии или другим предметам), сообщите нам об этом! Вы можете связаться с нами, оставив комментарий ниже или отправив отзыв внизу любой страницы запроса Wolfram | Alpha.
Арифметика химических формул
1 Как читать и писать формулы
Формула соединения определяет количество атомов каждого типа, присутствующих в одной молекулярной единице соединения. Поскольку каждое уникальное химическое вещество имеет определенный состав, каждое такое вещество должно быть описано с помощью
химическая формула.
Пример задачи 1: запись молекулярной формулы
Хорошо известный спирт этанол состоит из молекул, содержащих два атома углерода, пять атомов водорода и один атом кислорода.Какова его молекулярная формула?
Решение: Просто напишите символ каждого элемента, за которым следует нижний индекс, указывающий количество атомов, если их больше одного. Таким образом: C 2 H 5 O
Обратите внимание, что:
- Число атомов каждого элемента записывается в нижнем индексе;
- Когда присутствует только один атом элемента, нижний индекс опускается.
- В случае органических (углеродсодержащих) соединений в формуле принято помещать символы элементов C, H, (и, если есть,) O, N в указанном порядке.
Формулы элементов
Символ элемента — это одно- или двухбуквенная комбинация, которая представляет атом определенного элемента, например Au (золото) или O (кислород).Символ может использоваться как аббревиатура для имени элемента (это
проще написать «Mb» вместо «молибден»!) В более формальном химическом использовании символ элемента может также означать один атом или, в зависимости от контекста, один моль (число Авогадро) атомов элемента .
Различные молекулярные формы одного и того же элемента (например, O 2 и O 3 ) называются аллотропами .
Некоторые из неметаллических элементов существуют в форме молекул, содержащих два или более атомов элемента. Эти молекулы описываются формулами , такими как N 2 , S 6 и P 4 . Некоторые из этих элементов
может образовывать более одного вида молекул; наиболее известным примером этого является кислород, который может существовать как O 2 (обычная форма, составляющая 21% молекул в воздухе), а также как O 3 , нестабильный и очень реактивный
Молекула, известная как озон .Углеродные молекулы в форме футбольного мяча, которые иногда называют бакиболлы , имеют формулу C 60 .
Формулы ионов
Ионы — это атомы или молекулы, несущие электрический заряд. Эти заряды представлены в ионных формулах в виде верхних индексов. Таким образом:
| Класс — | хлорид-ион, с одним отрицательным зарядом на атом |
| S 2– | сульфид-ион несет два отрицательных заряда |
| HCO 3 2– | ион гидрокарбоната («бикарбонат») — молекулярный ион |
| NH 4 + | ион аммония |
Обратите внимание, что количество зарядов (в единицах заряда электрона) всегда должно предшествовать положительному или отрицательному знаку, но это число опускается, если заряд равен ± 1.
Формулы расширенных твердых тел и минералов
В твердом CdCl 2 атомы Cl и Cd организованы в бесконечно протяженные листы. Каждый атом окружен шестью атомами противоположного типа, поэтому можно произвольно выбрать любую единицу CdCl 2 в качестве «молекулярной единицы». Одна такая единица обозначена двумя связями красного цвета на диаграмме, но она не составляет дискретную «молекулу» CdCl 2 .
Многие на первый взгляд «простые» твердые тела существуют только в виде ионных твердых частиц (например, NaCl) или в виде протяженных твердых частиц (например, CuCl 2 ), в которых нет дискретных молекул.
можно идентифицировать. Формулы, которые мы пишем для этих соединений, просто выражают относительные числа различных типов атомов в соединении в наименьших возможных целых числах. Они идентичны эмпирическим или «простейшим»
формулы, которые мы обсудим далее.
Многие минералы и большинство горных пород содержат различные соотношения определенных элементов и могут быть точно охарактеризованы только на структурном уровне. Поскольку это обычно не чистые вещества, «формулы», обычно используемые для их описания
имеют ограниченное значение.
Например, оливин обыкновенной породы, который можно рассматривать как твердый раствор Mg 2 SiO 4 и Fe 2 SiO 4 , может быть представлен как (Mg, Fe) 2 SiO 4 .Это означает, что отношение
содержание металлов в SiO 4 постоянно, и что магний обычно присутствует в большем количестве, чем железо.
Эмпирические «простейшие» формулы
Эмпирические формулы дают относительных номеров различных элементов в образце соединения, выраженных в наименьших возможных целых числах.Термин эмпирический относится к тому факту, что формулы такого рода
определяются экспериментально; такие формулы также обычно называют простейшими формулами .
Пример задачи 2: Простейшая формула из молекулярной формулы
Глюкоза («топливо», на котором работает ваше тело) состоит из молекулярных единиц, имеющих формулу C 6 H 12 O 6 .Какая эмпирическая формула глюкозы?
Раствор: Молекула глюкозы содержит в два раза больше атомов водорода, чем углерод или кислород, поэтому мы разделим на 6, чтобы получить CH 2 O .
Примечание: эта простейшая формула, которая применяется ко всем 6-углеродным сахарам, указывает на то, что эти соединения «состоят» из углерода и воды, что объясняет, почему сахара известны как углеводов .
Некоторые твердые соединения не существуют в виде дискретных молекулярных единиц, а построены в виде протяженных двух- или трехмерных решеток атомов или ионов. Составы таких соединений обычно описываются их простейшими формулами. в
очень распространенный случай ионных твердых частиц , такая формула также выражает минимальное количество положительных и отрицательных ионов, необходимых для создания электрически нейтрального элемента, как в NaCl или CuCl 2 .
Пример проблемы 3: Молекулярная формула для ионных зарядов
a) Напишите формулу бромида трехвалентного железа, учитывая, что ион трехвалентного железа (III) — это Fe 3+ , а ион бромида несет единственный отрицательный заряд.
b) Напишите формулу сульфида висмута, образующегося при соединении ионов Bi 3+ и S 2– .
Решение:
a) Три иона Br — необходимы для уравновешивания трех положительных зарядов Fe 3+ , отсюда формула FeBr 3 .
b) Единственный способ получить равное количество противоположных зарядов — иметь по шесть зарядов каждого, поэтому формула будет Bi 2 S 3 .
Какие формулы
не говорят нам
Формулы, которые мы обычно пишем, не передают никакой информации о структуре соединения — то есть о порядке, в котором атомы связаны химическими связями или расположены в трехмерном пространстве.Это ограничение
особенно важно для органических соединений, в которых сотни, если не тысячи различных молекул могут иметь одну и ту же эмпирическую формулу.
Соединения этанола и диметилового эфира имеют простейшую формулу C 2 H 6 O. Структурные формулы показывают совершенно разную природу этих двух молекул:
Формулы могут быть составлены для передачи структурной информации
Часто бывает полезно писать формулы таким образом, чтобы передать хотя бы некоторую информацию о структуре соединения.Например, формула твердого вещества (NH 4 ) 2 CO 3 сразу идентифицируется.
как карбонат аммония и по существу соединение ионов аммония и карбоната в соотношении 2: 1, тогда как простейший или эмпирическая формула N 2 H 8 CO 3 скрывает эту информацию.
Точно так же различие между этанолом и диметиловым эфиром можно провести, записав формулы как C 2 H 5 OH и CH 3 –O – CH 3 соответственно.Хотя ни одна из этих формул не указывает
структуры, любой, кто изучал органическую химию, может их вычислить и сразу же распознает группу –OH (гидроксил), которая является определяющей характеристикой большого класса известных органических соединений
как спиртов . Атом –O–, связывающий два атома углерода, также является определяющей чертой простых эфиров .
2 Формулы подразумевают молярные массы
Несколько связанных терминов используются для выражения массы одного моля вещества.
- Молекулярный вес Это аналог атомного веса: это относительный вес одной формульной единицы соединения по шкале углерода-12. Молекулярная масса определяется сложением атомных масс всех атомов.
присутствует в формульной единице. Молекулярные веса, как и атомные веса, безразмерны; т.е. у них нет единиц. - Формула веса То же, что и молекулярная масса.Этот термин иногда используется в связи с ионными твердыми телами и другими веществами, в которых отсутствуют дискретные молекулы.
- Молярная масса Масса (в граммах, килограммах или любой другой единице массы) одного моля частиц или формульных единиц. Выраженная в граммах молярная масса численно совпадает с молекулярной массой, но должна сопровождаться
единицей массы.
Пример задачи 4: Формула веса и молярной массы
a) Рассчитайте формульную массу хлорида меди (II), CuCl 2 .
b) Как бы вы выразили это же количество как молярной массы ?
Решение:
a) Атомные массы Cu и Cl равны соответственно 63,55 и 35,45; сумма каждого атомного веса, умноженная на количество атомов каждого типа в формульной единице, дает 63,55 + 2 (25,35) = 134,45 .
б) Масса одного моля атомов Cu и Cl соответственно равна 63.55 г и 35,45 г; масса одного моля CuCl 2 единиц равна (63,55 г) + 2 (25,35 г) = 134,45 г .
Мольные отношения и мольные доли из формул
Информация, содержащаяся в формулах, может использоваться для сравнения составов родственных соединений, как в следующем примере:
Пример задачи 5: расчет мольного отношения
Отношение водорода к углероду часто представляет интерес при сравнении различных видов топлива.Рассчитайте эти отношения для метанола (CH 3 OH) и этанола (C 2 H 5 OH).
Раствор: отношения H: C для двух спиртов составляют 4: 1 = 4,0 для метанола и 6: 2 (3,0) для этанола.
Или же иногда используют мольные доли, чтобы выразить то же самое. Мольная доля элемента M в соединении — это просто количество атомов M, деленное на общее количество атомов в формульной единице.
Пример задачи 6: мольная доля и молярный процент
Рассчитайте мольную долю и молярный процент углерода в этаноле (C 2 H 5 OH).
Раствор: Формульная единица содержит девять атомов, два из которых являются углеродом. Мольная доля углерода в соединении составляет 2/9 = 0,22. Таким образом, 22 процента атомов в этаноле составляют углерод.
Процентный состав и элементные массы из формул
Поскольку формула соединения выражает соотношение количества составляющих его атомов, формула также передает информацию об относительных массах элементов, которые оно содержит.Но для того, чтобы установить эту связь, нам нужно знать
относительные массы различных элементов.
Пример задачи 7: масса каждого элемента в данной массе соединения
Найдите массы углерода, водорода и кислорода в одном моль этанола (C 2 H 5 OH).
Решение: Используя атомные массы (молярные массы) этих трех элементов, мы имеем
углерод: (2 моль) (12.0 г моль –1 ) = 24 г водорода C
: (6 моль) (1,01 г моль –1 ) = 6 г кислорода H
: (1 моль) (16,0 г моль –1 ) = 16 г O
массовая доля элемента в соединении — это просто отношение массы этого элемента к массе всей формульной единицы. Массовые доли всегда находятся в диапазоне от 0 до 1, но часто выражаются в процентах.
Пример задачи 8: массовая доля и массовый процент элемента в соединении
Найдите массовую долю и массовый процент кислорода в этаноле (C 2 H 5 OH)
Решение: Используя информацию, полученную в предыдущем примере, молярная масса этанола составляет (24 + 6 + 16) г моль –1 = 46 г моль –1 .Из них 16 г приходится на кислород, поэтому его массовая доля
в соединении составляет (16 г) / (46 г) = 0,35, что соответствует 35%.
Нахождение процентного состава соединения по его формуле — это фундаментальный расчет, который вы должны освоить; техника в точности такая, как показано выше. Определение массовой доли часто является первым шагом в решении связанных
видов проблем:
Пример задачи 9: масса элемента в данной массе соединения
Сколько тонн калия содержится в 10 тоннах KCl?
Раствор: Массовая доля K в KCl составляет 39.1 / 74,6 = 0,524; 10 тонн KCl содержат (39,1 / 74,6) × 10 тонн K, или 5,24 тонны K. (Атомный вес: K = 39,1, Cl = 35,5.)
Обратите внимание, что нет необходимости явно иметь дело с молями, что потребовало бы преобразования тонн в кг.
Pro blem Пример 10: масса соединения, содержащего заданную массу элемента
Сколько граммов KCl будет содержать 10 г калия?
Раствор: Массовое отношение KCl / K составляет 74.6 ÷ 39,1; 10 г калия будет присутствовать в (74,6 / 39,1) × 10 граммах KCl, или 19 граммов .
Массовые отношения двух элементов в соединении могут быть найдены непосредственно из мольных соотношений, выраженных в формулах.
Пример задачи 11: Массовое соотношение элементов из формулы
Расплавленный хлорид магния (MgCl 2 ) может быть разложен на элементы, пропуская через него электрический ток.Сколько кг хлора будет выделено при образовании 2,5 кг магния? (Mg = 24,3, Cl = 35,5)
Раствор: Раствор : массовое отношение Cl / Mg составляет (35,5 × 2) / 24,3 или 2,9; таким образом, 2,9 кг хлора будет производиться на каждый кг Mg, или (2,9 × 2,5) = 7,2 кг хлора для 2,5 кг Mg
(обратите внимание, что нет необходимости знать формулу элементарного хлора (Cl 2 ), чтобы решить эту проблему.)
3 Простейшие формулы из экспериментальных данных
Как было объяснено выше, простейшая формула ( эмпирическая формула ) — это формула, в которой относительные числа различных элементов выражены в наименьших возможных целых числах.Хлорид алюминия, например, существует
в виде структурных единиц, имеющих состав Al 2 Cl 6 ; Простейшая формула этого вещества — AlCl 3 .
Простейшие формулы из атомных соотношений
Некоторые методы анализа предоставляют информацию об относительном количестве различных типов атомов в соединении.
Процесс определения формулы соединения на основе анализа его состава зависит от вашей способности распознавать десятичные эквиваленты обычных целочисленных соотношений, таких как 2: 3, 3: 2, 4: 5 и т. Д.
Пример задачи 12: Простейшая формула из мольного отношения
Анализ соединения алюминия показал, что 1,7 моль Al объединяется с 5,1 моль хлора. Напишите простейшую формулу этого соединения.
Раствор: Формула Al 1,7 Cl 5,1 выражает относительные количества молей двух элементов в соединении. Его можно преобразовать в простейшую формулу, разделив оба нижних индекса на меньшие.
один, давая AlCl 3 .
Простейшие формулы из массового состава
Чаще обнаруживается, что произвольная масса соединения содержит определенные массы его элементов.Их необходимо преобразовать в моли, чтобы найти формулу.
Пример задачи 13: Простейшая формула для масс сгорания
Когда 10,0 г определенного органического соединения, содержащего только C, H и O, подвергаются сгоранию в присутствии избытка O 2 , образуется 9,56 г CO 2 и 3,92 г H 2 O. Найдите простейшую формулу
это вещество.
Решение: Начните с вычисления молей двух продуктов сгорания:
CO
2 : (9.56 г) / (44 г моль –1 ) = 0,217 моль
H
2 O: (3,92 г) / (18 г моль –1 ) = 0,218 моль (с содержанием 2 × 0,218 моль = 0,436 моль водорода)
Теперь мы можем записать предварительную формулу соединения как C .217 H .436 O x , оставив значение x для определения. Самый простой способ сделать это — вычислить разницу
между 10.0 г массы неизвестного соединения и общая масса углерода плюс водород в продуктах сгорания. Последние величины рассчитываются следующим образом: C: (0,217 моль × 12 г моль –1 ) = 2,60 г;
H: (0,436 моль × 1,01 г моль –1 ) = 0,440 г. Масса кислорода в соединении составляет
(10,0 г) — (0,440 + 2,60) г = 6,96 г, что соответствует (6,96 г / 16 г моль –1 ) =
,435 моль. Подставляя это количество в предварительную формулу, получаем C ,217 H ,436 O .435 . С учетом экспериментальной ошибки и ошибки округления это сокращается до CH 2 O 2 .
Комментарий: Эта задача может сначала показаться очень сложной, но на самом деле это просто комбинация ряда почти тривиально простых вычислений, выполняемых в логической последовательности. Ваша способность построить эту последовательность
является неотъемлемой частью решения практических задач такого рода.стоит потратить время на самостоятельную работу над этим упражнением, возможно, начиная с 5,0 г соединения, что даст пропорционально меньшее количество
количество продуктов.
Пример задачи 14: Простейшая формула на основе масс элементов
Образец соединения алюминия массой 4,67 г содержит 0,945 г Al и 3,72 г Cl. Найдите простейшую формулу этого соединения.Атомный вес: Al = 27,0, Cl = 35,45.
Раствор: Образец содержит (0,945 г) / (27,0 г моль –1 ) = 0,035 моль алюминия и (3,72 г) (35,45) = 0,105 моль хлора. Формула Al .035 Cl .105 выражает относительные числа
молей двух элементов в соединении. Его можно преобразовать в простейшую формулу, разделив оба нижних индекса на меньший, что даст AlCl 3 .
Простейшие формулы из соотношений масс
Состав бинарного (двухэлементного) соединения иногда выражают через массовое отношение. Самый простой подход здесь — рассматривать числа, выражающие отношение, как массы, таким образом превращая проблему в тот вид, который описывается немедленно.
выше.
Пример задачи 15: Простейшая формула из отношения масс элементов
Соединение, состоящее только из углерода и кислорода, содержит эти два элемента в массовом соотношении C: H, равном 0.375. Найдите простейшую формулу.
Раствор: Выразите это соотношение как 0,375 г C на 1,00 г O.
моль углерода: (0,375 г) / (12 г / моль) = 0,03125 моль C;
моль кислорода: (1,00 г) / (16 г / моль) = 0,0625 моль O
мольное отношение C / O = 0,03125 / 0,0625 = 0,5;
это соответствует формуле C 0,5 O, которую мы выражаем целыми числами
как CO 2 .
Простейшие формулы процентного состава
Массовый состав соединения чаще всего выражается в массовых процентах (граммы на 100 граммов соединения). Первый шаг — снова преобразовать их в относительное количество молей каждого элемента в фиксированной массе соединения.
Хотя эта фиксированная масса совершенно произвольна (в 100 граммах нет ничего особенного!), Соотношение и мольных количеств различных элементов не является произвольным: эти отношения должны быть выражены в виде целых чисел, поскольку они
представляют собой отношения целых чисел атомов.
Пример задачи 16: Простейшая формула из массового процента
Найдите простейшую формулу соединения, имеющего следующий массовый процентный состав. В скобках указаны атомные веса.
36,4% Mn (54,9), 21,2% S (32,06), 42,4% O (16,0)
Раствор: В 100 г этого соединения содержится:
Mn: (36.4 г) / (54,9 г моль –1 ) = 0,663 моль
S: (21,2 г) / (32,06 г моль –1 ) = 0,660 моль
O: (42,4 г) / (16,0 г моль — 1 ) = 2,65 моль
Формула Mn .663 S .660 O 2,65 выражает относительные количества молей трех элементов в соединении. Его можно преобразовать в простейшую формулу, разделив все индексы на наименьшие.
один, давая Mn 1.00 S 1,00 O 4,01 который мы записываем как MnSO 4 .
Примечание: поскольку экспериментально определенные массы подвержены небольшим ошибкам, обычно необходимо пренебречь небольшими отклонениями от целых значений.
Пример задачи 17: Простейшая формула из массового процента
Найдите простейшую формулу соединения, имеющего следующий массовый процентный состав.В скобках указаны атомные веса.
27,6% Mn (54,9), 24,2% S (32,06), 48,2% O (16,0)
Раствор: Предварительная формула на основе 100 г этого соединения может быть записана как
Mn (27,6 / 54,9) S (24,2 / 32,06) O (42,4 / 16,0) или Mn .503 S .754 O 3,01
Если разделить на наименьший индекс, получим Mn 1 S 1.5 О 6 . Изучение этой формулы предполагает, что умножение каждого нижнего индекса на 2 дает целочисленную формулу Mn 2 S 3 O 12 .
4 Подробнее об элементном анализе
Элементный анализ в лаборатории
Одна из самых фундаментальных операций в химии состоит из разложения соединения на его элементы (процесс, известного как анализ ) и последующего определения простейшей формулы из относительных количеств каждого типа атомов.
присутствует в соединении.Только в очень немногих случаях целесообразно проводить такой процесс напрямую: таким образом, нагревание сульфида ртути (II) приводит к его прямому разложению: 2 HgS → 2Hg + O 2 . Аналогично электролизу
воды образует газы H 2 и O 2 в объемном соотношении 2: 1.
Однако большинство элементных анализов необходимо проводить косвенно. Наиболее широко используемым из этих методов традиционно был анализ горения органических соединений.Неизвестный углеводород C a H b O c можно охарактеризовать, нагревая его в потоке кислорода так, чтобы он полностью разложился на газообразный CO 2 и H 2 O. Эти газы проходят через трубки содержащие вещества, избирательно поглощающие каждый газ.
Путем тщательного взвешивания каждой трубки до и после процесса сгорания можно рассчитать значения a и b для углерода и водорода, соответственно.Индекс c для кислорода находится путем вычитания рассчитанного
массы углерода и водорода из исходного образца.
Справа: иллюстрация из книги Марка Бишопа Введение в химию: онлайн-учебник .
Эта страница также содержит подробные примеры эмпирических
формулы расчетов.
← С 1970-х годов стало возможным проводить анализ горения с помощью автоматизированного оборудования.Также можно определить азот и серу.
Для анализа соединений, содержащих элементы, отличные от C, H и O, в настоящее время широко используются спектроскопические методы, основанные на атомной абсорбции и атомной абсорбции с индуктивно связанной плазмой.
Весы аналитические
Измерения массы или веса долгое время были основным инструментом для количественного понимания химических изменений.Весы и весы используются в коммерческих и фармацевтических целях с начала регистрации
истории, но этим устройствам не хватало точности 0,001 г, необходимой для количественного химического и элементного анализа, проводимого в лабораторном масштабе.
Классические равноручные аналитические весы и набор калиброванных гирь
Лишь в середине 18 века шотландский химик Джозеф Блэк изобрел аналитические весы с равным плечом .Ключевой особенностью этого изобретения было
легкая, жесткая балка, опирающаяся на острие опоры; дополнительные лезвия поддерживали чаши весов. Лезвия лезвий значительно уменьшили трение, которое ограничивало чувствительность предыдущих моделей; это не случайно, что
Примерно в это же время начались точные измерения сочетания весов и атомных весов.
Аналитические весы
помещены в стеклянный корпус, чтобы избежать помех от воздушных потоков, а калиброванные гири обрабатываются пинцетом, чтобы предотвратить адсорбцию влаги или масел с обнаженных пальцев.
Любой, кто был зачислен на курс общей химии в колледж вплоть до 1960-х годов, вспомнит обучение (и скуку), связанное с этими устройствами. Они могут считываться с точностью до 1 миллиграмма и позволяют делать оценки до ± 0,1 мг. Позже технический
Доработки добавили магнитное демпфирование качания балки, тормоза панорамирования и встроенные наборы грузов, управляемые ручками. Самые лучшие весы исследовательского класса достигли точности 0,001 мг.
Начиная с 1970-х годов, электронных весов получили широкое распространение, особенно популярны были весы с одной чашей весов.Весы с одной чашкой избавляют от необходимости сравнивать вес образца с весом калиброванных гирь.
Добавление образца в чашу вызывает смещение тензодатчика , который генерирует компенсирующее электромагнитное поле достаточной величины, чтобы поднять чашу в исходное положение. Ток, необходимый для выполнения
это воспринимается и преобразуется в измерение веса. Лучшие электронные весы исследовательского класса могут показывать до 1 микрограмма, но 0.

 4 (л/моль)
4 (л/моль)