Содержание
Тест,тест,тест,тест,тест — Docsity
1. Немолекулярное строение имеет: 1) фуллерен, 2) алмаз, 3) вода, 4) углекислый газ. 2. Немолекулярное строение имеет: 1) железо, 2) водород, 3) кислород, 4) угарный газ. 3. Ионную кристаллическую решетку имеет: 1) бромид калия, 2) бром, 3) калий, 4) бромоводород. 4. Молекулярную кристаллическую решетку имеет: 1) литий, 2) оксид натрия, 3) красный фосфор, 4) белый фосфор. 5. Молекулярную кристаллическую решетку имеет: 1) фторид серы (VI),VI),), 2) сульфид натрия, 3) графит, 4) натрий. 6. Молекулярное строение имеет: 1) йод, 2) йодид калия, 3) гидроксид калия, 4) гидроксид алюминия. 7. Немолекулярное строение имеет: 1) йод, 2) хлорид йода, 3) гидроксид калия, 4) уксусная кислота. 8. Немолекулярное строение имеет: 1) цинк, 2) муравьиная кислота, 3) фтороводород, 4) кислород. 9. Молекулярную кристаллическую решетку в твердом состоянии имеет: 1) иодид бария, 2) гидроксид бария, 3) барий, 4) йод. 10. Ионную кристаллическую решетку имеет: 1) фтор, 2) фтороводород, 3) гидрид натрия, 4) хлорид титана(VI),I),V). 11. Молекулярное строение имеет: 1) оксид кремния(VI),I),V), 2) нитрат бария, 3) хлорид натрия, 4) оксид углерода(VI),I),I),). 12. Молекулярную кристаллическую решетку имеют: 1) h3O, CuO, 2) CuO, K2S, 3) K2S, h3SO4, 4) h3SO4, O2. 13. Атомную кристаллическую решетку имеет: 1) графит, 2) железо, 3) карбонат кальция, 4) азотная кислота. 14. Ионную кристаллическую решетку имеет: 1) фторид кальция, 2) оксид кремния, 3) алмаз, 4) медь. 15. Вещество, имеющее низкую температуру плавления, возгоняющееся при нагревании, неэлектропроводное – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную. 16. Твердое, хрупкое вещество, расплав которого проводит электрический ток – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную 17. Вещество, имеющее высокую электропроводность, ковкое, пластичное, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную. 18. Тугоплавкое хрупкое вещество, нерастворимое в воде, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную 19.
11. Молекулярное строение имеет: 1) оксид кремния(VI),I),V), 2) нитрат бария, 3) хлорид натрия, 4) оксид углерода(VI),I),I),). 12. Молекулярную кристаллическую решетку имеют: 1) h3O, CuO, 2) CuO, K2S, 3) K2S, h3SO4, 4) h3SO4, O2. 13. Атомную кристаллическую решетку имеет: 1) графит, 2) железо, 3) карбонат кальция, 4) азотная кислота. 14. Ионную кристаллическую решетку имеет: 1) фторид кальция, 2) оксид кремния, 3) алмаз, 4) медь. 15. Вещество, имеющее низкую температуру плавления, возгоняющееся при нагревании, неэлектропроводное – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную. 16. Твердое, хрупкое вещество, расплав которого проводит электрический ток – имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную 17. Вещество, имеющее высокую электропроводность, ковкое, пластичное, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную. 18. Тугоплавкое хрупкое вещество, нерастворимое в воде, имеет кристаллическую решетку: 1) ионную, 2) металлическую, 3) молекулярную, 4) атомную 19. Атом является структурной единицей в кристаллической решетке: 1) фосфорной кислоты, 2) белого фосфора, 3) кремнезема, 4) хлорида аммония. 20. В кристалле вольфрама частицы связаны металлической связью, поэтому вольфрам: 1) тугоплавок, 2) химически стоек, 3) электропроводен, 4) имеет высокую плотность. 21. Ионный тип кристаллической решетки характерен для: 1) кислот, 2) металлов, 3) неметаллов, 4) солей. 22. Из молекул состоит каждое из веществ: 1) поваренная соль и кислород, 2) оксид магния и хлороводород, 3) вода и хлор, 4) алмаз и сода. 23. Атомную кристаллическую решетку имеет каждое из веществ: 1) алмаз и графит, 2) аммиак и йод, 3) озон и кислород, 4) вода и мел. 24. Ионную кристаллическую решетку имеет каждое из веществ: 1) серная кислота и оксид углерода(VI),I),V), 2) гидроксид натрия и хлорид калия, 3) карбонат кальция и хлороводород, 4) оксид кремния и гидроксид меди(VI),I),I),). 25. Верны ли следующие суждения о типах кристаллических решеток веществ в твердом состоянии? А) этанол имеет ионную кристаллическую решетку.
Атом является структурной единицей в кристаллической решетке: 1) фосфорной кислоты, 2) белого фосфора, 3) кремнезема, 4) хлорида аммония. 20. В кристалле вольфрама частицы связаны металлической связью, поэтому вольфрам: 1) тугоплавок, 2) химически стоек, 3) электропроводен, 4) имеет высокую плотность. 21. Ионный тип кристаллической решетки характерен для: 1) кислот, 2) металлов, 3) неметаллов, 4) солей. 22. Из молекул состоит каждое из веществ: 1) поваренная соль и кислород, 2) оксид магния и хлороводород, 3) вода и хлор, 4) алмаз и сода. 23. Атомную кристаллическую решетку имеет каждое из веществ: 1) алмаз и графит, 2) аммиак и йод, 3) озон и кислород, 4) вода и мел. 24. Ионную кристаллическую решетку имеет каждое из веществ: 1) серная кислота и оксид углерода(VI),I),V), 2) гидроксид натрия и хлорид калия, 3) карбонат кальция и хлороводород, 4) оксид кремния и гидроксид меди(VI),I),I),). 25. Верны ли следующие суждения о типах кристаллических решеток веществ в твердом состоянии? А) этанол имеет ионную кристаллическую решетку. Б) йод имеет молекулярную кристаллическую решетку. 1) верно только А, 2) верно только Б, 3) верны оба суждения, 4) оба суждения неверны. 26. Какие свойства характерны для вещества с атомной кристаллической решеткой? 1) нерастворимость в воде и тугоплавкость, 2) хрупкость и легкоплавкость, 3) растворимость в воде и летучесть, 4) хорошая тепло- и электропроводность. 27. В твердых веществах молекулярного строения химическая связь: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная 28. В твердых веществах атомного строения химическая связь между атомами: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная 29. Некоторое вещество тугоплавко и не проводит электрический ток ни в твердом виде, ни в расплаве. Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. 30. Некоторое вещество тугоплавко и не проводит электрический ток в твердом виде, но его водный раствор обладает электрической проводимостью. Какую кристаллическую решетку имеет это вещество? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую.
Б) йод имеет молекулярную кристаллическую решетку. 1) верно только А, 2) верно только Б, 3) верны оба суждения, 4) оба суждения неверны. 26. Какие свойства характерны для вещества с атомной кристаллической решеткой? 1) нерастворимость в воде и тугоплавкость, 2) хрупкость и легкоплавкость, 3) растворимость в воде и летучесть, 4) хорошая тепло- и электропроводность. 27. В твердых веществах молекулярного строения химическая связь: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная 28. В твердых веществах атомного строения химическая связь между атомами: 1) ковалентная, 2) металлическая, 3) ионная, 4) водородная 29. Некоторое вещество тугоплавко и не проводит электрический ток ни в твердом виде, ни в расплаве. Какую кристаллическую решетку оно имеет? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. 30. Некоторое вещество тугоплавко и не проводит электрический ток в твердом виде, но его водный раствор обладает электрической проводимостью. Какую кристаллическую решетку имеет это вещество? 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. 31. Выберите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку: 1) С (VI),графит), 2) SiO2, 3) SiC, 4) CO2 32. Выберите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) SiO2, 2) Sih5, 3) O2, 4) Na. 33. Выберите вещество, которое в твердом состоянии имеет ионную кристаллическую решетку: 1) N2O5, 2) HNO3, 3) Nh5NO3, 4) Nh4. 34. Какое свойство характерно для веществ с атомной кристаллической решеткой? 1) высокая плотность, 2) тугоплавкость, 3) хорошая растворимость в воде, 4) электропроводность. 35. Один и тот же тип решетки в кристаллическом состоянии имеют: 1) хлор и водород, 2) вода и алюминий, 3) поваренная соль и серная кислота, 4) кремнезем и гидроксид натрия. 36. Запахом обладают вещества, имеющие кристаллическую решетку: 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. 37. Молекулярную решетку в кристаллическом состоянии имеет: 1) хлорид натрия, 2) хлор, 3) натрий, 4) гидроксид натрия. 38. Хлорид-ионы отсутствую в кристаллах: 1) хлорида натрия, 2) хлорида кальция, 3) хлорида фосфора(VI),V), 4) хлорида цезия.
31. Выберите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку: 1) С (VI),графит), 2) SiO2, 3) SiC, 4) CO2 32. Выберите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) SiO2, 2) Sih5, 3) O2, 4) Na. 33. Выберите вещество, которое в твердом состоянии имеет ионную кристаллическую решетку: 1) N2O5, 2) HNO3, 3) Nh5NO3, 4) Nh4. 34. Какое свойство характерно для веществ с атомной кристаллической решеткой? 1) высокая плотность, 2) тугоплавкость, 3) хорошая растворимость в воде, 4) электропроводность. 35. Один и тот же тип решетки в кристаллическом состоянии имеют: 1) хлор и водород, 2) вода и алюминий, 3) поваренная соль и серная кислота, 4) кремнезем и гидроксид натрия. 36. Запахом обладают вещества, имеющие кристаллическую решетку: 1) атомную, 2) молекулярную, 3) ионную, 4) металлическую. 37. Молекулярную решетку в кристаллическом состоянии имеет: 1) хлорид натрия, 2) хлор, 3) натрий, 4) гидроксид натрия. 38. Хлорид-ионы отсутствую в кристаллах: 1) хлорида натрия, 2) хлорида кальция, 3) хлорида фосфора(VI),V), 4) хлорида цезия. 39. Ионную кристаллическую решетку в кристаллическом состоянии имеет: 1) бром, 2) вода, 3) серная кислота, 4) карбонат натрия. 40. Металлическую кристаллическую решетку имеет: 1) Nh4, 2) AlCl3, 3) Cu3Al, 4) CuO.
39. Ионную кристаллическую решетку в кристаллическом состоянии имеет: 1) бром, 2) вода, 3) серная кислота, 4) карбонат натрия. 40. Металлическую кристаллическую решетку имеет: 1) Nh4, 2) AlCl3, 3) Cu3Al, 4) CuO.
[PDF] Тест А6 Зависимость свойств веществ от их состава и строения.
Download Тест А6 Зависимость свойств веществ от их состава и строения….
Тест А6 Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения. 1. Кристаллическая решетка хлорида кальция 1) ионная 2)молекулярная 3) металлическая 4) атомная 2. Молекулярное строение имеет 1) ртуть 2) бром 3) гидроксид натрия 4) сульфат калия 3. Атом является структурной частицей в кристаллической решетке 1) метана 2) водорода 3) кислорода 4) кремния 4. Вещества, обладающие твёрдостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку: 1) молекулярную 2) атомную 3) ионную 4) металлическую 5. Молекулярную кристаллическую решетку имеет 1) НВr 2) K2О 3) ВаО 4) КСl 6. Вещества с атомной кристаллической решеткой 1) очень твёрдые и тугоплавкие 2) хрупкие и легкоплавкие 3) проводят электрический ток в растворах 4) проводят электрический ток в расплавах. 7. Молекулярную кристаллическую решетку имеет 1) Са3Р2 2) СО2 3) SO2 4) АlF3 8. Ионную кристаллическую решетку имеет каждое из веществ, расположенных в ряду 1) натрий, хлорид натрия, гидрид натрия 2) кальций, оксид кальция, карбонат кальция 3) бромид натрия, сульфат калия, хлорид железа (II) 4) фосфат магния, хлорид калия, оксид фосфора (V) 9. Кристаллическая решетка графита 1) ионная 2) молекулярная 3) атомная 4) металлическая 10. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку 1) молекулярную 2) ионную 3) атомную 4) металлическую 11. Молекулярную кристаллическую решетку имеет 1) кремний 2) оксид углерода(IV) 3) диоксид кремния 4) нитрат аммония 12. Кристаллическая решетка галогенов 1) атомная 2) ионная 3) молекулярная 4) металлическая 13.
Вещества с атомной кристаллической решеткой 1) очень твёрдые и тугоплавкие 2) хрупкие и легкоплавкие 3) проводят электрический ток в растворах 4) проводят электрический ток в расплавах. 7. Молекулярную кристаллическую решетку имеет 1) Са3Р2 2) СО2 3) SO2 4) АlF3 8. Ионную кристаллическую решетку имеет каждое из веществ, расположенных в ряду 1) натрий, хлорид натрия, гидрид натрия 2) кальций, оксид кальция, карбонат кальция 3) бромид натрия, сульфат калия, хлорид железа (II) 4) фосфат магния, хлорид калия, оксид фосфора (V) 9. Кристаллическая решетка графита 1) ионная 2) молекулярная 3) атомная 4) металлическая 10. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку 1) молекулярную 2) ионную 3) атомную 4) металлическую 11. Молекулярную кристаллическую решетку имеет 1) кремний 2) оксид углерода(IV) 3) диоксид кремния 4) нитрат аммония 12. Кристаллическая решетка галогенов 1) атомная 2) ионная 3) молекулярная 4) металлическая 13.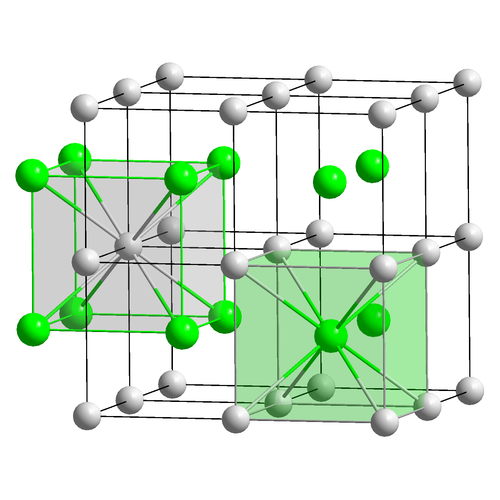 К веществам с атомной кристаллической решеткой относятся 1) натрий, фтор, оксид серы (IV) 2) свинец, азотная кислота, оксид магния 3) бор, алмаз, карбид кремния 4) хлорид калия, белый фосфор, йод 14. Молекулярное строение имеет 1) цинк 2) нитрат бария 3) гидроксид калия 4) бромоводород 15. Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку 1) металлическую 2) молекулярную 3) атомную 4) ионную 16. Ионы являются структурными частицами 1) кислорода 2) воды 3) оксида углерода (IV) 4) хлорида натрия 17. Немолекулярное строение имеют все неметаллы группы 1) углерод, бор, кремний 3) кислород, сера, азот 2) фтор, бром, иод 4) хлор, фосфор, селен 18. Кристаллическую структуру, подобную структуре алмаза, имеет 1) кремнезем 2) оксид натрия 3) оксид углерода (II) 4) белый фосфор Р4 19. Атом является структурной частицей в кристаллической решетке 1) метана 2) водорода 3) кислорода 4) кремния 20. Молекулярную кристаллическую решетку имеет каждое из двух веществ 1) графит и алмаз 2) кремний и йод 3) хлор и оксид углерода(IV) 4) хлорид бария и оксид бария 21.
К веществам с атомной кристаллической решеткой относятся 1) натрий, фтор, оксид серы (IV) 2) свинец, азотная кислота, оксид магния 3) бор, алмаз, карбид кремния 4) хлорид калия, белый фосфор, йод 14. Молекулярное строение имеет 1) цинк 2) нитрат бария 3) гидроксид калия 4) бромоводород 15. Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку 1) металлическую 2) молекулярную 3) атомную 4) ионную 16. Ионы являются структурными частицами 1) кислорода 2) воды 3) оксида углерода (IV) 4) хлорида натрия 17. Немолекулярное строение имеют все неметаллы группы 1) углерод, бор, кремний 3) кислород, сера, азот 2) фтор, бром, иод 4) хлор, фосфор, селен 18. Кристаллическую структуру, подобную структуре алмаза, имеет 1) кремнезем 2) оксид натрия 3) оксид углерода (II) 4) белый фосфор Р4 19. Атом является структурной частицей в кристаллической решетке 1) метана 2) водорода 3) кислорода 4) кремния 20. Молекулярную кристаллическую решетку имеет каждое из двух веществ 1) графит и алмаз 2) кремний и йод 3) хлор и оксид углерода(IV) 4) хлорид бария и оксид бария 21. Атомную кристаллическую решетку имеет каждое из двух веществ 1) оксид кремния (IV) и оксид углерода (IV) 2) графит и кремний
Атомную кристаллическую решетку имеет каждое из двух веществ 1) оксид кремния (IV) и оксид углерода (IV) 2) графит и кремний
3) хлорид калия и фторид натрия 4) хлор и йод 22. Молекулярное строение имеет 1) натрий 2) фруктоза 3) фосфат натрия 4) оксид натрия 23. Молекулярная кристаллическая решетка характерна для каждого из веществ, расположенных в ряду 1) хлорид калия, азот, метан 2) иод, диоксид углерода, озон 3) алюминий, бром, алмаз 4) водород, сульфат магния, оксид железа (III) 24. Оксид кремния тугоплавок, нерастворим в воде. Его кристаллическая решётка 1) атомная 2) молекулярная 3) ионная 4) металлическая 25. В зависимости от характера частиц, образующих кристалл, и от природы сил взаимодействия между ними различают четыре типа кристаллических решеток: 1) ионные, атомные, молекулярные и металлические 2) ионные, ковалентные, атомные и молекулярные 3) металлические, ковалентные, атомные и молекулярные 4) ионные, кубические, треугольные и слоистые 26. Кристаллическая решетка льда: 1) атомная 2) молекулярная 3) ионная 4) металлическая 27. Укажите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку. 1) графит 2) натрий 3) гидроксид натрия 4) водород 28. Укажите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) хлороводород 2) хлор 3) оксид кремния (IV) 4) оксид кальция 29. Для твердых веществ с металлической кристаллической решеткой характерна высокая… 1) растворимость в воде 2) электроотрицательность атомов 3) летучесть 4) электропроводность 30. Кристаллическое вещество образовано частицами Na+ и ОН-. К какому типу принадлежит кристаллическая решетка этого вещества? 1) атомная 2) молекулярная 3) ионная 4) металлическая 31. Немолекулярное строение имеет каждое из двух веществ: 1) S8 и O2 2) Fe и NaCl 3) CO и Mg 4) Na2CO3 и I2 32. Веществом молекулярного строения является 1) озон 2) оксид бария 3) графит 4) сульфид калия 33. Атомная кристаллическая решетка у простого вещества: 1) алмаз 2) медь 3) фтор 4) олово 34. Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для 1) алмаза 2) поваренной соли 3) кремния 4) азота 35.
Укажите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку. 1) графит 2) натрий 3) гидроксид натрия 4) водород 28. Укажите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) хлороводород 2) хлор 3) оксид кремния (IV) 4) оксид кальция 29. Для твердых веществ с металлической кристаллической решеткой характерна высокая… 1) растворимость в воде 2) электроотрицательность атомов 3) летучесть 4) электропроводность 30. Кристаллическое вещество образовано частицами Na+ и ОН-. К какому типу принадлежит кристаллическая решетка этого вещества? 1) атомная 2) молекулярная 3) ионная 4) металлическая 31. Немолекулярное строение имеет каждое из двух веществ: 1) S8 и O2 2) Fe и NaCl 3) CO и Mg 4) Na2CO3 и I2 32. Веществом молекулярного строения является 1) озон 2) оксид бария 3) графит 4) сульфид калия 33. Атомная кристаллическая решетка у простого вещества: 1) алмаз 2) медь 3) фтор 4) олово 34. Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для 1) алмаза 2) поваренной соли 3) кремния 4) азота 35. Ионную кристаллическую решетку имеет 1) вода 2) фторид натрия 3) серебро 4) бром 36. Простые вещества, имеющие одинаковый тип кристаллической решетки, образованы элементами 1) малых периодов 3) побочных подгрупп 2) главных подгрупп 4) больших периодов 37. Кристаллическую структуру, подобную структуре алмаза, имеет: 1) кремнезем SiO2 2) оксид натрия Na2O 3) оксид углерода(II) CO 4) белый фосфор Р4 38. Фосфин РН3 — это газ. Его кристаллическая решётка 1) атомная 2) молекулярная 3) ионная 4) металлическая 39. Из молекул состоят кристаллы. 1) сахара 2) соли 3) алмаза 4) серебра 40. Из разноимённо заряженных ионов состоят кристаллы 1) сахара 2) гидроксида натрия 3) алмаза 4) серебра 41. Какие частицы образуют кристалл нитрата натрия? 1) атомы Nа, N и О 3) ионы Nа+, NO3+ 5+ 22) ионы Nа , N ,О 4) молекулы NаNО3 42. Оцените правильность суждений о связи между строением и свойствами вещества.
Ионную кристаллическую решетку имеет 1) вода 2) фторид натрия 3) серебро 4) бром 36. Простые вещества, имеющие одинаковый тип кристаллической решетки, образованы элементами 1) малых периодов 3) побочных подгрупп 2) главных подгрупп 4) больших периодов 37. Кристаллическую структуру, подобную структуре алмаза, имеет: 1) кремнезем SiO2 2) оксид натрия Na2O 3) оксид углерода(II) CO 4) белый фосфор Р4 38. Фосфин РН3 — это газ. Его кристаллическая решётка 1) атомная 2) молекулярная 3) ионная 4) металлическая 39. Из молекул состоят кристаллы. 1) сахара 2) соли 3) алмаза 4) серебра 40. Из разноимённо заряженных ионов состоят кристаллы 1) сахара 2) гидроксида натрия 3) алмаза 4) серебра 41. Какие частицы образуют кристалл нитрата натрия? 1) атомы Nа, N и О 3) ионы Nа+, NO3+ 5+ 22) ионы Nа , N ,О 4) молекулы NаNО3 42. Оцените правильность суждений о связи между строением и свойствами вещества.
А. Среди веществ молекулярного строения есть газообразные, жидкие и твёрдые при обычных условиях. Б. Вещества с атомной кристаллической решеткой при обычных условиях твёрдые. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 43. Оцените правильность суждений о связи между строением и свойствами вещества: А. Если между частицами в кристалле прочная химическая связь, то вещество тугоплавко. Б. Все твёрдые вещества имеют немолекулярное строение 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 44. Какие из приведенных утверждений верны: А. Вещества с молекулярной решеткой имеют низкие температуры плавления и низкую электропроводность. Б. Вещества с атомной решеткой пластичны и обладают высокой электропроводностью. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 45. Установите соответствие между веществом и типом его кристаллической решетки. ВЕЩЕСТВО ТИП КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ 1) поваренная соль А) молекулярная 2) серебро Б) ионная 3) углекислый газ В) атомная 4) графит Г) металлическая 5) глюкоза 46.
Б. Вещества с атомной кристаллической решеткой при обычных условиях твёрдые. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 43. Оцените правильность суждений о связи между строением и свойствами вещества: А. Если между частицами в кристалле прочная химическая связь, то вещество тугоплавко. Б. Все твёрдые вещества имеют немолекулярное строение 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 44. Какие из приведенных утверждений верны: А. Вещества с молекулярной решеткой имеют низкие температуры плавления и низкую электропроводность. Б. Вещества с атомной решеткой пластичны и обладают высокой электропроводностью. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 45. Установите соответствие между веществом и типом его кристаллической решетки. ВЕЩЕСТВО ТИП КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ 1) поваренная соль А) молекулярная 2) серебро Б) ионная 3) углекислый газ В) атомная 4) графит Г) металлическая 5) глюкоза 46. Установите соответствие между типом кристаллической решетки и свойствами веществ. ТИП КРИСТАЛЛИЧЕСКОЙ СВОЙСТВА ВЕЩЕСТВ РЕШЕТКИ A) ионная 1) твердые, тугоплавкие, не растворяются в воде Б) металлическая 2) хрупкие, легкоплавкие, не проводят электрический ток В) атомная 3) пластичные, имеют различные температуры плавления, проводят электрический ток Г) молекулярная 4) твердые, тугоплавкие, хорошо растворяются в воде 47. Укажите ряд, характеризующийся уменьшением длины химической связи 1) SiCl4, MgCl2, AlCl3, NaCl 2) NaCl, MgCl2, SiCl4, AlCl3 3) NaCl, SiCl4, MgCl2, AlCl3 4) NaCl, MgCl2, AlCl3, SiCl4 48. Оцените правильность суждений о связи между строением и свойствами вещества. А. Если между частицами в кристалле прочная химическая связь, то вещество легко испаряется. Б. Все газы имеют молекулярное строение. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
Установите соответствие между типом кристаллической решетки и свойствами веществ. ТИП КРИСТАЛЛИЧЕСКОЙ СВОЙСТВА ВЕЩЕСТВ РЕШЕТКИ A) ионная 1) твердые, тугоплавкие, не растворяются в воде Б) металлическая 2) хрупкие, легкоплавкие, не проводят электрический ток В) атомная 3) пластичные, имеют различные температуры плавления, проводят электрический ток Г) молекулярная 4) твердые, тугоплавкие, хорошо растворяются в воде 47. Укажите ряд, характеризующийся уменьшением длины химической связи 1) SiCl4, MgCl2, AlCl3, NaCl 2) NaCl, MgCl2, SiCl4, AlCl3 3) NaCl, SiCl4, MgCl2, AlCl3 4) NaCl, MgCl2, AlCl3, SiCl4 48. Оцените правильность суждений о связи между строением и свойствами вещества. А. Если между частицами в кристалле прочная химическая связь, то вещество легко испаряется. Б. Все газы имеют молекулярное строение. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
ПОМОГИТЕ ПЛИЗ 1. Молекулярную кристаллическую решетку в твёрдом состоянии имеет
1) ацетат
1. Молекулярную кристаллическую решетку в твёрдом состоянии имеет
Молекулярную кристаллическую решетку в твёрдом состоянии имеет
1) ацетат железа (III)
2) глюкоза
3) оксид натрия
4) иодид натрия
2. Ионную кристаллическую решетку в твёрдом состоянии имеет
1) ацетат железа (III)
2) глюкоза
3) этиловый спирт
4) хлорэтан
3. Гомологом ацетальдегида является вещество состава
1) C2H6O
2) C3H6O2
3) C4H8O
4) C5h22O
4. Из предложенного перечня выберите два вещества, которые
являются структурными изомерами бутена-1.
1) бутан
2) циклобутан
3) бутин-2
4) бутадиен-1,3
5) метилпропен
5. В результате реакции присоединения хлороводорода к 2-метилбутену-2 преимущественно образуется
1) 2-метил-2-хлорбутан
2) 3-метил-2-хлорбутан
3) 2-метил-2,3-дихлорбутан
4) 2-метил-1-хлорбутан
6. Из предложенного перечня выберите два вещества, при взаимодействии которых с раствором перманганата калия будет наблюдаться изменение окраски раствора.
1) циклогексан
2) бензол
3) толуол
4) пропан
5) пропилен
6. В отличие от пропанола-1, фенол вступает в реакцию с
В отличие от пропанола-1, фенол вступает в реакцию с
1) уксусной кислотой
2) кислородом
3) оксидом серебра
4) хлоридом железа (III)
7. Верны ли следующие суждения о свойствах альдегидов?
А. Формальдегид реагирует с водородом.
Б. При взаимодействии этаналя с гидроксидом меди (II) образуется уксусная кислота.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
8. Из предложенного перечня выберите два вещества, с которыми реагирует формальдегид.
1) Cu
2) N2
3) h3
4) Ag2 O (в растворе Nh4)
5) Ch4OCh4
9. Диэтиловый эфир в одну стадию получают из
1) этилового спирта
2) 1,2-дихлорэтана
3) Этаналя
4) этановой кислоты
10. Метиламин реагирует с
1) метаном
2) хлоридом натрия
3) иодметаном
4) гидроксидом натрия
Строение вещества
Тренировочные тесты ЕГЭ по химии
Вещества молекулярного и немолекулярного строения. Типы кристаллических решёток. Зависимость свойств веществ от их состава и строения.
Типы кристаллических решёток. Зависимость свойств веществ от их состава и строения.
1. Молекулярное строение имеет
1) С12 2) СаО 3) ZnCl2 4) NaBr
2. Кристаллическая решетка хлорида кальция
1) металлическая
2) молекулярная
3) ионная
4) атомная
3. Кристаллическая решетка твердого оксида углерода (IV)
1) ионная
2) молекулярная
3) металлическая
4) атомная
4. Молекулярную кристаллическую решетку имеет
1) CaF2 2) СО2 3) SiO2 4) A1F3
5. Немолекулярное строение имеет
1) Н2О 2) H2SO4 3) SiО2 4) СО2
6. Молекулярное строение имеет
Молекулярное строение имеет
1) алмаз
2) азот
3) кремний
4) поваренная соль
7. Немолекулярное строение имеет
1) азот 2) графит 3) аммиак 4) кислород
8. Наибольшую температуру плавления имеет
1) водород
2) кислород
3) оксид углерода (IV)
4) оксид кремния (IV)
9. Ионное строение имеет
1) оксид бора
2) оксид углерода (IV)
3) оксид серы (VI)
4) оксид магния
10. Вещества с металлической кристаллической решеткой
1) хрупкие, легкоплавкие
2) проводят электрический ток, пластичные
3) обладают низкой тепло- и электропроводностью
4) обладают хорошими оптическими свойствами
11. Немолекулярное строение имеет каждое из двух веществ:
1) СО2иСl2 2) Fe и NaCl 3) СО и Mg 4) Na2CO3 и I2 (тв)
12. Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку
Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку
1) металлическую
2) молекулярную
3) атомную
4) ионную
13. Молекулярную кристаллическую решетку имеет
1) кремний
2) оксид углерода (IV)
3) оксид кремния
4) нитрат аммония
14. Молекулярная кристаллическая решетка характерна для каждого из веществ, расположенных в ряду:
1) хлорид калия, азот, метан
2) иод, диоксид углерода, гелий
3) алюминий, бром, алмаз
4) водород, сульфат магния, оксид железа (Ш)
15. Ионную кристаллическую решетку имеет каждое из веществ, расположенных в ряду:
1) натрий, хлорид натрия, гидрид натрия
2) кальций, оксид кальция, карбонат кальция
3) бромид натрия, сульфат калия, хлорид железа (II)
4) фосфат магния, хлорид калия, оксид фосфора (V)
16. Молекулярное строение имеет
Молекулярное строение имеет
1) СO2 2) КВг 3) MgSО4 4) SiO2
17. Ионы являются структурными частицами
1) кислорода
2) воды
3) оксида углерода (IV)
4) хлорида натрия
18. Металлическую кристаллическую решетку имеет
1) малахит
2) бронза
3) кремнезем
4) графит
19. Кристаллическая решетка брома
1) молекулярная
2) металлическая
3) ионная
4) атомная
20. Верны ли следующие суждения о зависимости свойств веществ от особенностей их кристаллической решетки?
А. Расплавы веществ с ионной кристаллической решеткой проводят электрический ток.
Б. Алмаз и кварц имеют атомную кристаллическую решетку.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
21. Немолекулярное строение имеет
Немолекулярное строение имеет
1) | H2O | 2) | NH3 | 3) | SiO2 | 4) | CO2 |
22. Ионы являются структурной единицей для каждого из двух веществ:
1) СН4 и I2 2) SO, и Н2О 3) Сl2 и NH3 4) LiF и KCl
23. Молекулярное строение имеет каждое из двух веществ:
1) NН4С1 и CH3NH3
2) Na2CO3 и HNO3
3) C2H5OH и СН4
4} H2S и CH3COONa
24. Молекулярную кристаллическую решетку имеет
Молекулярную кристаллическую решетку имеет
1) фторид кальция
2) бромид алюминия
3) сероводород
4) хлорид меди (П)
25. Молекулярное строение имеет
1) С2Н5ОН 2) А1 3) Fe2(SO4)3 4) КСЮ3
26. Вещества только немолекулярного строения приведены в ряду
1) S8, O2(г), лед
2) Fe, NaCl (тв), алмаз
3) СО2 (г), N2 (г), А1
4) графит, Na2CO3 (тв), I2
27. Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для
1) | алмаза |
2) | поваренной соли |
3) | кремния |
4) | азота |
28. Кристаллическая решетка хлорида кальция
Кристаллическая решетка хлорида кальция
1) | ионная |
2) | молекулярная |
3) | металлическая |
4) | атомная |
29. Кристаллическая решетка льда
1) | ионная |
2) | молекулярная |
3) | металлическая |
4) | атомная |
30. Молекулярную кристаллическую решетку имеет
Молекулярную кристаллическую решетку имеет
1) | CaF2 | 2) | SO2 | 3) | SiO2 | 4) | AlF3 |
31. Простые вещества, имеющие одинаковый тип кристаллической решетки, образованы элементами
1) | малых периодов |
2) | побочных подгрупп |
3) | главных подгрупп |
4) | больших периодов |
Ответы: 1-1, 2-3, 3-2, 4-2, 5-3, 6-2, 7-2, 8-4, 9-4, 10-2, 11-2, 12-4, 13-2, 14-2, 15-3, 16-1, 17-4, 18-2, 19-1, 20-3, 21-3, 22-4, 23-3, 24-3, 25-1, 26-2, 27-4, 28-1, 29-2, 30-2, 31-3
Вещества молекулярного и немолекулярного строения.
 Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.Кристаллическая решетка твердого хлороводорода:
1) атомная
2) молекулярная
3) ионная
4) металлическая
2.В твердых веществах молекулярного строения химическая связь между молекулами
1) ковалентная
2) металлическая
3) ионная
4) ван-дер-ваальсова или водородная
3.Хлорид бария имеет кристаллическую решётку
1) атомную
2) металлическую
3) ионную
4) молекулярную
4.Веществом молекулярного строения является
1) озон
2) оксид бария
3) графит
4) сульфид калия
5.Ионное строение имеет
1) оксид бора
2) оксид углерода (II)
3) оксид серы (IV)
4) оксид бария
6. Атомную кристаллическую решетку имеет
Атомную кристаллическую решетку имеет
1) хлороводород
2) вода
3) поваренная соль
4) кремнезем
7.Молекулярное строение имеет каждое из двух веществ:
1)
2)
3)
4)
8.Немолекулярное строение имеет каждое из двух веществ:
1)
2)
3)
4)
9.Бром в твердом состоянии имеет кристаллическую решётку
1) молекулярную
2) металлическую
3) ионную
4) атомную
10.Молекулярное строение имеет
1) хлорид бария
2) оксид калия
3) хлорид аммония
4) аммиак
11.К веществам молекулярного строения не относится
1) хлороводород
2) оксид серы (IV)
3) иод
4) ацетат калия
12.К веществам с молекулярным строением относятся
1) графит и оксид углерода (IV)
2) вода и оксид углерода (II)
3) кремний и оксид железа (III)
4) серная кислота и оксид кремния (IV)
13. Веществом молекулярного строения является
Веществом молекулярного строения является
1)
2)
3)
4)
14.У веществ с низкой температурой плавления кристаллическая решетка
1) атомная
2) ионная
3) молекулярная
4) металлическая
15.Молекулярное строение имеет
1) цинк
2) нитрат бария
3) гидроксид калия
4) сероводород
16.Оксид серы (IV) в кристаллическом состоянии имеет кристаллическую решётку
1) ионную
2) металлическую
3) молекулярную
4) атомную
17.Ионную кристаллическую решётку имеет
1) хлор
2) хлорид цезия
3) хлорид фосфора (III)
4) оксид углерода (II)
18.Кристаллическая решётка кремния
1) атомная
2) молекулярная
3) ионная
4) металлическая
19.Вещества с атомной кристаллическои решёткой
1) очень твердые и тугоплавкие
2) хрупкие и легкоплавкие
3) проводят электрический ток в растворах
4) проводят электрический ток в расплавах
20.Атомную кристаллическую решётку имеет
1) иод
2) лёд
3) поваренная соль
4) кремнезем
21.Фторид цезия имеет кристаллическую решетку
1) атомную
2) молекулярную
3) металлическую
4) ионную
22.Кристаллическая решётка хлорида лития
1) металлическая
2) молекулярная
3) ионная
4) атомная
23.Какой тип кристаллической решётки имеют вещества с высокой электропроводностью и пластичностью?
1) атомная 2) ионная 3) молекулярная 4) металлическая
24.Веществом молекулярного строения является
1)
2)
3)
4)
25.Иодид кальция имеет кристаллическую решётку
1) атомную 2) металлическую 3) ионную 4) молекулярную
26.К веществам молекулярного строения не относится
1) хлор
2) оксид серы (IV)
3) йод
4) бромид калия
27.У твёрдых веществ с высокой электропроводностью и пластичностью кристаллическая решётка
1) атомная
2) ионная
3) металлическая
4) молекулярная
28.Веществом молекулярного строения является
1)
2)
3)
4)
29.Ионное строение имеет
1) оксид кремния 2) оксид фосфора (V)
3) оксид азота (II) 4) оксид лития
30.Молекулярное строение имеет каждое из двух веществ:
1)
2)
3)
4)
31.К веществам с молекулярным строением относятся
1) алмаз и оксид натрия 2) аммиак и оксид серы (IV)
3) йод и хлорид бария 4) фосфорная кислота и кремний
32.Веществом молекулярного строения является
1) иод 2) оксид кремния 3) марганец 4) хлорид кальция
33.У какого вещества в узлах кристаллической решетки находятся молекулы?
1) Na2O2
2) SO3
3) SiO2
4) Na2SO4
Дата добавления: 2015-10-23; просмотров: 315 | Нарушение авторских прав
mybiblioteka.su — 2015-2021 год. (0.011 сек.)
Тест на химические связи и типы строения веществ (кристаллические решетки).
Задание №1
Из предложенного перечня веществ выберите два таких, в которых имеет место ионная связь
- 1. HClO3
- 2. HClO4
- 3. NH4Cl
- 4. Ca(ClO2)2
- 5. Cl2O7
Решение
Задание №2
Из предложенного перечня выберите два соединения, в которых тип химической связи такой же, как в молекуле фтора.
1) кислород
2) оксид азота (II)
3) бромоводород
4) иодид натрия
5) алмаз
Решение
Задание №3
Из предложенного перечня выберите два вещества, между молекулами которых образуются водородные связи.
- 1. C2H6
- 2. C2H5OH
- 3. H2O
- 4. CH3OCH3
- 5. CH3COCH3
Решение
Задание №4
Из предложенного перечня выберите два соединения с ионной химической связью.
- 1. PCl3
- 2. CO2
- 3. NaCl
- 4. H2S
- 5. MgO
Решение
Задание №5
Из предложенного перечня выберите два вещества с одинаковым типом строения.
1) вода
2) алмаз
3) кварц
4) поваренная соль
5) золото
Решение
Задание №6
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная связь, образованная по донорно-акцепторному механизму
- 1. CH3NH2
- 2. CCl4
- 3. NH4Cl
- 4. CH3NH3Br
- 5. SO2Cl2
Решение
Задание №7
Из предложенного перечня выберите два соединения, которые имеют молекулярную кристаллическую решетку.
- 1. Cs2O
- 2. I2
- 3. KBr
- 4. NaI
- 5. HCl
Решение
Задание №8
Из предложенного перечня выберите два вещества немолекулярного строения.
1) фтор
2) кислород
3) белый фосфор
4) бор
5) кремний
Решение
Задание №9
Из предложенного перечня выберите два соединения с наиболее прочными химическими связями.
- 1. Cl2
- 2. Br2
- 3. O2
- 4. I2
- 5. N2
Решение
Задание №10
Из предложенного перечня выберите два соединения, в молекулах которых ковалентная связь образована одной общей электронной парой.
- 1. N2
- 2. Cl2
- 3. NO
- 4. HBr
- 5. O2
Решение
Задание №11
Из предложенного перечня выберите два вещества, в которых имеет место ковалентная связь, образованная по донорно-акцепторному механизму.
- 1. NH4NO3
- 2. NH3
- 3. NaAlO2
- 4. K[Al(OH)4]
- 5. HCl
Решение
Задание №12
Из предложенного перечня выберите два вещества с наиболее полярными связями.
- 1. HCl
- 2. HF
- 3. H2O
- 4. H2S
- 5. HI
Решение
Задание №13
Из предложенного перечня выберите два вещества, в которых имеются и ковалентные полярные, и ионные связи.
- 1. NaCl
- 2. NaNO3
- 3. Na2SO4
- 4. Na
- 5. H2SO4
Решение
Задание №14
Из предложенного перечня выберите два вещества с ионной связью.
1) кислород
2) вода
3) оксид углерода (IV)
4) хлорид натрия
5) оксид кальция
Решение
Задание №15
Из предложенного перечня выберите два вещества с таким же типом кристаллической решетки, как у алмаза.
1) кремнезем SiO2
2) оксид натрия Na2O
3) угарный газ CO
4) белый фосфор P4
5) кремний Si
Решение
Задание №16
Из предложенного перечня выберите два вещества с ионной связью.
- 1. NH4Cl
- 2. HCOONa
- 3. NH3
- 4. HCOOH
- 5. CO
Решение
Задание №17
Из предложенного перечня выберите два вещества с наибольшей длиной химической связи в молекуле.
- 1. HF
- 2. HCl
- 3. HBr
- 4. HI
- 5. H2O
Решение
Задание №18
Из предложенного перечня выберите два вещества с наиболее полярными связями
- 1. HI
- 2. H2O
- 3. HBr
- 4. H2S
- 5. NH3
Решение
Задание №19
Из предложенного перечня выберите два вещества с атомной кристаллической решеткой.
- 1. Cl2
- 2. B
- 3. Cu
- 4. Si
- 5. P4
Решение
Задание №20
Из предложенного перечня выберите два вещества, с наиболее прочными ковалентными связями
- 1. F2
- 2. I2
- 3. Br2
- 4. O2
- 5. Cl2
Решение
Задание №21
Из предложенного перечня выберите два вещества, в молекулах которых есть ковалентная неполярная связь.
1) гидроксид натрия
2) вода
3) метанол
4) этан
5) пероксид водорода
Решение
Задание №22
Из предложенного перечня веществ выберите два вещества, которые имеют молекулярную кристаллическую решётку.
- 1. CO2
- 2. SiO2
- 3. NH3
- 4. NaH
- 5. PbO2
Решение
Задание №23
Из предложенного перечня веществ выберите два вещества, для каждого из которых характерно наличие водородной связи между молекулами.
- 1. H2
- 2. NH3
- 3. C6H6
- 4. CH3OH
- 5. C6H5CH3
Решение
Задание №24
Из предложенного перечня веществ выберите два вещества, которые имеют атомную кристаллическую решётку.
1) белый фосфор
2) сера
3) графит
4) кремний
5) натрий
Решение
Задание №25
Из предложенного перечня веществ выберите два соединения, в которых как минимум одна из ковалентных связей образована по донорно-акцепторному механизму.
- 1. LiOH
- 2. Li3P
- 3. (NH4)2HPO4
- 4. NH4F
- 5. H3PO3
Решение
Задание №26
Из предложенного перечня веществ выберите два соединения, в которых присутствует ковалентная полярная химическая связь.
1) оксид кремния
2) оксид лития
3) хлорид лития
4) силикат лития
5) кремний
Решение
Задание №27
Из предложенного перечня веществ выберите два вещества, в которых присутствует ионная химическая связь.
- 1. H2SO4
- 2. KNO3
- 3. PCl3
- 4. KCl
- 5. H3BO3
Решение
Задание №28
Из предложенного перечня веществ выберите два соединения, в которых присутствует ионная связь.
1) хлороводород
2) хлорид натрия
3) оксид серы(IV)
4) аммиак
5) оксид натрия
Решение
Задание №29
Из предложенного перечня веществ выберите два соединения, в которых присутствует ковалентная неполярная связь.
1) аммиак
2) иод
3) кислород
4) вода
5) метан
Решение
Задание №30
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная неполярная связь
1) метан
2) хлор
3) серная кислота
4) аммиак
5) йод
Решение
Задание №31
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная полярная связь
- 1. Na2O
- 2. P2O5
- 3. Na
- 4. S8
- 5. HCl
Решение
Задание №32
Из предложенного перечня веществ выберите два таких, которые в твердом состоянии имеют ионную кристаллическую решетку:
1) фосфорная кислота
2) оксид серы (VI)
3) сухой лед
4) оксид рубидия
5) нитрат цезия
Решение
Задание №33
Из предложенного перечня веществ выберите два таких, которые в твердом состоянии имеют молекулярную кристаллическую решетку:
- 1. BaO
- 2. CaI2
- 3. CO
- 4. F2
- 5. C(алмаз)
Решение
Задание №34
Из предложенного перечня веществ выберите два, в которых присутствует ковалентная неполярная связь
1) азот
2) аммиак
3) вода
4) хлор
5) бромоводород
Решение
Задание №35
Из предложенного перечня веществ выберите два таких, в которых имеет место ионная связь:
1) оксид калия
2) оксид фосфора (III)
3) вода
4) йодоводород
5) фторид бария
Решение
Задание №36
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная неполярная связь
1) пероксид водорода
2) вода
3) хлор
4) углекислый газ
5) оксид лития
Решение
Задание №37
Из предложенного перечня веществ выберите два таких, в которых присутствует ионная связь:
- 1. NH4NO3
- 2. SrBr2
- 3. H2
- 4. H3PO4
- 5. N2O
Решение
Задание №38
Из предложенного перечня веществ выберите два таких, в которых присутствует ковалентная неполярная связь
- 1. Al
- 2. P4
- 3. NaH
- 4. этан
- 5. Fe2O3
Решение
Задание №39
Из предложенного перечня веществ выберите два таких, в которых присутствует ионная связь
- 1. Ca
- 2. P4
- 3. NaH
- 4. этан
- 5. Cs2O
Решение
Задание №40
Из предложенного перечня веществ, выберите два таких, строение которых относится к одному типу:
- 1. Cl2
- 2. Fe
- 3. B
- 4. Si
- 5. NaCl
Решение
Задание №41
Из предложенного перечня веществ выберите два таких, которые имеют молекулярное строение:
- 1. NH3
- 2. PCl5
- 3. CaSO4
- 4. RbH
- 5. C(графит)
Решение
Задание №42
Из предложенного перечня веществ выберите два таких, которые имеют ионную кристаллическую решетку
1) фторид стронция
2) уксусная кислота
3) сероводород
4) кремнезем
5) оксид лития
Решение
Задание №43
Из предложенного перечня веществ выберите два таких, в которых имеет место ионная связь
1) гидрид рубидия
2) нитрат аммония
3) бор
4) вода
5) кремний
Решение
Задание №44
Из предложенного перечня веществ выберите два таких, которые в твердом состоянии имеют атомную кристаллическую решетку
1) хлорид кремния (IV)
2) карбид кремния (IV)
3) хлор
4) кремний
5) белый фосфор
Решение
Задание №45
Из предложенного перечня веществ выберите два с ионной кристаллической решеткой в твердом состоянии
1) хлорид брома (I)
2) хлорид натрия
3) оксид серы (IV)
4) бор
5) йодид рубидия
Решение
Задание №46
Из предложенного перечня веществ выберите два таких, в которых имеет место ионная химическая связь
- 1. SiC
- 2. Cs2O
- 3. [CH3NH3]Cl
- 4. CH3COOH
- 5. H2SO4
Решение
Задание №47
Из предложенного перечня веществ выберите два таких, которые имеют атомную кристаллическую решетку
1) хром
2) кремний
3) железо
4) кремнезем
5) сухой лед
Решение
Задание №48
Из предложенного перечня веществ выберите два с атомной кристаллической решеткой
1) бор
2) аммиак
3) бром
4) фосфат аммония
5) кварц
Решение
Задание №49
Из предложенного перечня веществ выберите два таких, которые имеют ионную кристаллическую решетку
1) фторид лития
2) нитрат аммония
3) хлорид кремния (IV)
4) сероводород
5) азотная кислота
Решение
Задание №50
Из предложенного перечня веществ выберите два таких, которые имеют молекулярную кристаллическую решетку
1) графит
2) угарный газ
3) метанол
4) карбид кремния
5) хлорид аммония
Решение
Задание №51
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная полярная связь
1) пероксид водорода
2) бром
3) бромид кальция
4) азотная кислота
5) марганец
Решение
Задание №53
Из предложенного перечня видов химических связей выберите два таких, которые присутствуют в гидрофосфате аммония
1) водородная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
5) ионная
Решение
Задание №54
Из предложенного перечня веществ выберите два с немолекулярным строением
1) железо
2) хлор
3) углерод (графит)
4) белый фосфор
5) бром
Решение
Задание №55
Из предложенного перечня веществ выберите два таких, для которых характерен одинаковый тип связи:
- 1. SiO2
- 2. Mn
- 3. NH3
- 4. B
- 5. NaCl
Решение
Задание №56
Из предложенного перечня веществ выберите два таких, которые имеют ионную кристаллическую решетку
- 1. (NH4)2SO4
- 2. CH3NH2
- 3. NH3
- 4. N2
- 5. CH3NH3Cl
Решение
Задание №57
Из предложенного перечня веществ выберите два с молекулярным строением
1) кремний
2) водород
3) литий
4) йод
5) марганец
Решение
Задание №58
Из предложенного перечня веществ выберите два таких, которые имеют ионное строение
1) оксид кремния
2) хлорид калия
3) оксид азота (II)
4) оксид лития
5) оксид фосфора (III)
Решение
Задание №59
Из предложенного перечня веществ выберите два таких, которые имеют молекулярное строение
- 1. CH3COOH
- 2. SiC
- 3. SiCl4
- 4. CH3OK
- 5. HCOONH4
Решение
Задание №60
Из предложенного перечня соединений выберите два таких, в которых присутствуют как ковалентные, так и ионные связи
- 1. H2SO4
- 2. HCl
- 3. (NH4)2HPO4
- 4. Ca(NO3)2
- 5. Na2S
Решение
Задание №61
Из предложенного перечня веществ выберите два таких, которые имеют молекулярное строение
1) сухой лед
2) бор
3) йод
4) карборунд
5) бромид аммония
Решение
Задание №62
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная полярная связь:
1) фторид калия
2) фтороводородная кислота
3) литий
4) оксид углерода (IV)
5) йод
Решение
Задание №63
Из предложенного перечня видов химической связи выберите две, которые характерны для воды:
1) ионная
2) водородная
3) ковалентная неполярная
4) ковалентная полярная
5) металлическая
Решение
Задание №64
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная неполярная связь
1) пероксид водорода
2) бром
3) бромид кальция
4) азотная кислота
5) марганец
Решение
Задание №65
Из предложенного перечня веществ выберите два таких, в которых имеет место ковалентная полярная связь
1) хром
2) водород
3) пероксид водорода
4) бромид стронция
5) серная кислота
Решение
Задание №66
Из предложенного перечня видов химической связи выберите две, характерные для хлорида аммония:
1) водородная
2) ионная
3) ковалентная полярная
4) ковалентная неполярная
5) металлическая
Решение
Задание №67
Из предложенного перечня соединений выберите два таких, в которых присутствует ковалентная связь, образованная по донорно-акцепторному механизму:
- 1. NH4Cl
- 2. Al2O3
- 3. Na[Al(OH)4]
- 4. NH3
- 5. SO2Cl2
Решение
Задание №68
Из предложенного перечня соединений выберите два таких, в которых присутствует ковалентная связь, образованная по донорно-акцепторному механизму:
- 1. H2O2
- 2. CH3NH3Cl
- 3. Ca(H2PO4)2
- 4. PCl5
- 5. NH4HSO4
Решение
Задание №69
Из предложенного перечня соединений выберите два таких, в которых присутствует ковалентная связь, образованная по донорно-акцепторному механизму:
- 1. CH3COOK
- 2. CH3NH2
- 3. K2[Zn(OH)4]
- 4. CH3NH3Br
- 5. NH2CH2CH2Cl
Решение
Задание №70
Из предложенного перечня соединений выберите два таких, в молекулах которых связь между атомами наиболее полярная:
- 1. HCl
- 2. HI
- 3. HF
- 4. H2S
- 5. H2O
Решение
Задание №71
Из предложенного перечня соединений выберите два таких, в молекулах которых связь между атомами наиболее полярная
- 1. H2Se
- 2. PH3
- 3. HF
- 4. H2S
- 5. H2O
Решение
Задание №72
Из предложенного перечня соединений выберите два таких, в молекулах которых связь между атомами наиболее прочная
- 1. Br2
- 2. O2
- 3. N2
- 4. Cl2
- 5. I2
Решение
Задание №73
Из предложенного перечня веществ выберите два вещества немолекулярного строения
1) карборунд
2) фтороводород
3) йод
4) кремний
5) аммиак
Решение
Задание №74
Из предложенного перечня соединений выберите два таких, в которых присутствует водородная связь:
- 1. CH3COOH
- 2. KH
- 3. HF
- 4. H2S
- 5. NaOH
Решение
Задание №75
Из предложенного перечня соединений выберите два таких, в которых присутствует водородная связь:
- 1. C2H6
- 2. NH4Cl
- 3. NH3
- 4. HCl
- 5. H2O
Решение
Задание №76
Из предложенного перечня соединений выберите два таких, в которых присутствует водородная связь:
- 1. PH3
- 2. C2H5OH
- 3. HI
- 4. H2
- 5. CH3NH2
Решение
Задание №77
Из предложенного перечня соединений выберите два таких, в которых присутствует ковалентная связь, образованная по донорно-акцепторному механизму:
- 1. N2O3
- 2. Al2O3
- 3. CH3NH3Cl
- 4. NH3
- 5. NH4NO3
Решение
Задание №78
Из предложенного перечня соединений выберите два с одинаковым типом химической связи:
1) фтор
2) алмаз
3) хлороводород
4) хлорид калия
5) марганец
Решение
Задание №79
Из предложенного перечня химических веществ выберите два таких, в которых присутствует ковалентная неполярная связь:
1) вода
2) пероксид водорода
3) метан
4) этан
5) марганец
Решение
Задание №80
Из предложенного перечня химических веществ выберите два таких, которые имеют наибольшие температуры плавления:
- 1. NaCl
- 2. SiO2
- 3. P4
- 4. C(алмаз)
- 5. SO2
Решение
Задание №81
Из предложенного перечня веществ выберите два таких, водные растворы или расплавы которых проводят электрический ток:
- 1. SiO2
- 2. NaCl
- 3. P4
- 4. Si
- 5. KOH
Решение
Задание №82
Из предложенного перечня химических веществ выберите два таких, которые имеют наиболее низкие температуры кипения:
1) бор
2) кислород
3) хлорид калия
4) железо
5) хлорид кремния (IV)
Решение
Задание №83
Из предложенного перечня водородных соединений выберите два, с наибольшими температурами кипения:
- 1. NH3
- 2. KH
- 3. PH3
- 4. CaH2
- 5. H2S
Решение
Задание №84
Из предложенного перечня соединений кремния выберите два с наиболее низкими температурами кипения:
- 1. SiH4
- 2. SiO2
- 3. SiCl4
- 4. SiC
- 5. Si
Решение
Задание №85
Из предложенного перечня соединений выберите два, в которых есть как ковалентные полярные, так и ионные связи
1) пероксид водорода
2) серная кислота
3) нитрат натрия
4) бромид аммония
5) карборунд
Решение
Задание №86
Из предложенного перечня веществ выберите два таких, в которых присутствует водородная связь:
- 1. SiH4
- 2. PH3
- 3. NH3
- 4. H2S
- 5. H2O
Решение
Задание №87
Из предложенного перечня выберите веществ выберите два вещества немолекулярного строения
1) белый фосфор
2) хром
3) азот
4) кремний
5) водород
Решение
Задание №88
Из предложенного перечня соединений выберите два с наиболее прочными связями
1) азот
2) хлор
3) кислород
4) йод
5) бром
Решение
Задание №89
Из предложенного перечня выберите два вещества с наиболее полярными связями
- 1. H2O
- 2. NH3
- 3. PH3
- 4. H2Se
- 5. HF
Решение
Задание №90
Из предложенного перечня соединений выберите два с типом химической связи как в алмазе:
- 1. SiO2
- 2. HF
- 3. C(графит)
- 4. Cl2
- 5. PCl3
Решение
Задание №91
Из предложенного перечня соединений выберите два таких, в которых есть ковалентная неполярная связь
- 1. Li
- 2. CO2
- 3. H2O2
- 4. Cr
- 5. C2H4
Решение
Задание №92
Из предложенного перечня соединений выберите два, в молекулах которых есть пи-связи
- 1. NH3
- 2. SO2
- 3. Cl2
- 4. CH4
- 5. SO3
Решение
Задание №93
Из предложенного перечня характеристик выберите две, справедливые для веществ с молекулярным строением:
1) тугоплавкость
2) легкоплавкость
3) прочность в твердом состоянии
4) хрупкость в твердом состоянии
5) исключительно твердое агрегатное состояние в обычных условиях
Решение
Задание №94
Из предложенного перечня соединений выберите два таких, в которых прочность связи в молекуле наименьшая:
- 1. HF
- 2. HCl
- 3. HI
- 4. HBr
- 5. N2
Решение
Задание №95
Из предложенного перечня характеристик выберите две, не относящиеся к веществам с ионным строением:
1) высокая электропроводность расплавов и водных растворов
2) в таких веществах может иметь место ковалентная связь
3) в обычных условиях являются твердыми
4) газообразное или жидкое состояние в обычных условиях
5) в таких веществах не бывает никаких химических связей кроме ионных
Решение
Задание №96
Из предложенного перечня характеристик выберите две, чаще всего справедливые для веществ с металлической структурной решеткой
1) низкая электропроводность
2) высокая электропроводность
3) высокая пластичность
4) газообразное состояние в обычных условиях
5) ковалентный тип связи между атомами
Решение
Задание №97
Из предложенного перечня соединений выберите два таких, в которых присутствует ковалентная неполярная связь
1) хром
2) этан
3) марганец
4) хлор
5) серная кислота
Решение
Ответ: 24
Задание №98
Из предложенного перечня веществ, выберите два с таким же типом химической связи как у кремния:
- 1. Cl2
- 2. SiC
- 3. SiCl4
- 4. H2
- 5. Fe
Решение
Задание №99
Из предложенного перечня соединений выберите два таких, в которых есть водородная связь
- 1. NH3
- 2. H2S
- 3. CH3CH2NH2
- 4. HCl
- 5. HI
Решение
Задание №100
Из предложенного перечня водородных соединений выберите два с наиболее низкими температурами плавления
- 1. AlH3
- 2. NH3
- 3. CaH2
- 4. H2Se
- 5. KH
Решение
Задания для подготовки. 1. Задание 5 № 64. Кристаллическая решетка твердого хлороводорода
1. Задание 5 № 64. Кристаллическая решетка твердого хлороводорода:
1) атомная
2) молекулярная
3) ионная
4) металлическая
2. Задание 5 № 107. В твердых веществах молекулярного строения химическая связь между молекулами
1) ковалентная
2) металлическая
3) ионная
4) ван-дер-ваальсова или водородная
3. Задание 5 № 193. Хлорид бария имеет кристаллическую решётку
1) атомную
2) металлическую
3) ионную
4) молекулярную
4. Задание 5 № 236. Веществом молекулярного строения является
1) озон
2) оксид бария
3) графит
4) сульфид калия
5. Задание 5 № 279. Ионное строение имеет
1) оксид бора
2) оксид углерода (II)
3) оксид серы (IV)
4) оксид бария
6. Задание 5 № 322. Атомную кристаллическую решетку имеет
1) хлороводород
2) вода
3) поваренная соль
4) кремнезем
7. Задание 5 № 365. Молекулярное строение имеет каждое из двух веществ:
1)
2)
3)
4)
8. Задание 5 № 408. Немолекулярное строение имеет каждое из двух веществ:
1)
2)
3)
4)
9. Задание 5 № 451. Бром в твердом состоянии имеет кристаллическую решётку
1) молекулярную
2) металлическую
3) ионную
4) атомную
10. Задание 5 № 494. Молекулярное строение имеет
1) хлорид бария
2) оксид калия
3) хлорид аммония
4) аммиак
11. Задание 5 № 537. К веществам молекулярного строения не относится
1) хлороводород
2) оксид серы (IV)
3) иод
4) ацетат калия
12. Задание 5 № 580. К веществам с молекулярным строением относятся
1) графит и оксид углерода (IV)
2) вода и оксид углерода (II)
3) кремний и оксид железа (III)
4) серная кислота и оксид кремния (IV)
13. Задание 5 № 623. Веществом молекулярного строения является
1)
2)
3)
4)
14. Задание 5 № 666. У веществ с низкой температурой плавления кристаллическая решетка
1) атомная
2) ионная
3) молекулярная
4) металлическая
15. Задание 5 № 709. Молекулярное строение имеет
1) цинк
2) нитрат бария
3) гидроксид калия
4) сероводород
16. Задание 5 № 752. Оксид серы (IV) в кристаллическом состоянии имеет кристаллическую решётку
1) ионную
2) металлическую
3) молекулярную
4) атомную
17. Задание 5 № 795. Ионную кристаллическую решётку имеет
1) хлор
2) хлорид цезия
3) хлорид фосфора (III)
4) оксид углерода (II)
18. Задание 5 № 838. Кристаллическая решётка кремния
1) атомная
2) молекулярная
3) ионная
4) металлическая
19. Задание 5 № 881. Вещества с атомной кристаллическои решёткой
1) очень твердые и тугоплавкие
2) хрупкие и легкоплавкие
3) проводят электрический ток в растворах
4) проводят электрический ток в расплавах
20. Задание 5 № 924. Атомную кристаллическую решётку имеет
1) иод
2) лёд
3) поваренная соль
4) кремнезем
21. Задание 5 № 967. Фторид цезия имеет кристаллическую решетку
1) атомную
2) молекулярную
3) металлическую
4) ионную
22. Задание 5 № 1010. Кристаллическая решётка хлорида лития
1) металлическая
2) молекулярная
3) ионная
4) атомная
23. Задание 5 № 1053. Какой тип кристаллической решётки имеют вещества с высокой электропроводностью и пластичностью?
1) атомная
2) ионная
3) молекулярная
4) металлическая
24. Задание 5 № 1096. Веществом молекулярного строения является
1)
2)
3)
4)
25. Задание 5 № 1139. Иодид кальция имеет кристаллическую решётку
1) атомную
2) металлическую
3) ионную
4) молекулярную
26. Задание 5 № 1182. К веществам молекулярного строения не относится
1) хлор
2) оксид серы (IV)
3) йод
4) бромид калия
27. Задание 5 № 1225. У твёрдых веществ с высокой электропроводностью и пластичностью кристаллическая решётка
1) атомная
2) ионная
3) металлическая
4) молекулярная
28. Задание 5 № 1268. Веществом молекулярного строения является
1)
2)
3)
4)
29. Задание 5 № 1311. Ионное строение имеет
1) оксид кремния
2) оксид фосфора (V)
3) оксид азота (II)
4) оксид лития
30. Задание 5 № 1354. Молекулярное строение имеет каждое из двух веществ:
1)
2)
3)
4)
31. Задание 5 № 1397. К веществам с молекулярным строением относятся
1) алмаз и оксид натрия
2) аммиак и оксид серы (IV)
3) йод и хлорид бария
4) фосфорная кислота и кремний
32. Задание 5 № 1440. Веществом молекулярного строения является
1) иод
2) оксид кремния
3) марганец
4) хлорид кальция
33. Задание 5 № 1985. У какого вещества в узлах кристаллической решетки находятся молекулы?
1) Na2O2
2) SO3
3) SiO2
4) Na2SO4
типов кристаллов | Безграничная химия
Ионные кристаллы
Ионы в ионных кристаллах связаны друг с другом электростатическим притяжением.
Цели обучения
Опишите, как ионы образуют ионные кристаллы.
Основные выводы
Ключевые моменты
- Ионы, связанные электростатическим притяжением, образуют ионные кристаллы. Их расположение варьируется в зависимости от размеров ионов или отношения радиусов (отношения радиусов положительного иона к отрицательному).Простая кубическая кристаллическая решетка имеет ионы, равномерно распределенные в трехмерном пространстве под углом 90 °.
- Стабильность ионных твердых тел зависит от энергии решетки, которая выделяется в виде тепла, когда два иона объединяются в твердое тело. Энергия решетки — это сумма всех взаимодействий внутри кристалла.
- Свойства ионных кристаллов отражают сильные взаимодействия, существующие между ионами. Они очень плохо проводят электричество, сильно поглощают инфракрасное излучение и легко раскалываются.Эти твердые вещества обычно довольно твердые и имеют высокие температуры плавления.
Ключевые термины
- энергия решетки : энергия, необходимая для разделения ионов твердого ионного тела (особенно кристалла) на бесконечное расстояние.
- кристаллическая решетка : регулярное трехмерное геометрическое расположение атомов, молекул или ионов в кристалле.
- ионный кристалл : класс кристаллов, состоящих из решетки ионов, удерживаемых вместе за счет электростатических взаимодействий; они демонстрируют сильное поглощение инфракрасного излучения и имеют плоскости, вдоль которых они легко раскалываются.
Кристаллическая форма ионных соединений
Ионный кристалл состоит из ионов, связанных вместе электростатическим притяжением. Расположение ионов в правильной геометрической структуре называется кристаллической решеткой. Примерами таких кристаллов являются галогениды щелочных металлов, которые включают:
- фторид калия (KF)
- хлорид калия (KCl)
- бромид калия (KBr)
- йодид калия (KI)
- фторид натрия (NaF)
- Другие комбинации ионов натрия, цезия, рубидия или лития с ионами фтора, бромида, хлорида или иодида
Эти твердые вещества, как правило, довольно твердые и имеют высокие температуры плавления, что отражает сильные взаимодействия между ионами с противоположным зарядом.Точное расположение ионов в решетке зависит от размера ионов в кристалле.
Пример использования: NaCl
Свойства NaCl отражают сильные взаимодействия, существующие между ионами. Это хороший проводник электричества в расплавленном состоянии (расплавленное состояние), но очень плохой в твердом состоянии. При плавлении подвижные ионы переносят заряд через жидкость. Кристаллы NaCl характеризуются сильным поглощением инфракрасного (ИК) излучения и имеют плоскости, вдоль которых они легко раскалываются.Структурно каждый ион в хлориде натрия окружен шестью соседними ионами с противоположным зарядом. Полученная кристаллическая решетка относится к типу, известному как «простая кубическая», что означает, что точки решетки равномерно разнесены во всех трех измерениях, а все углы ячеек равны 90 °.
Кристаллическая структура NaCl : Сферы представляют собой ионы Na + и Cl-. Каждый ион окружен шестью другими ионами противоположного заряда, поэтому NaCl описывается как имеющий (6,6) координацию.
Как может один ион натрия, окруженный шестью ионами хлора (или наоборот) соответствовать простейшей (эмпирической) формуле NaCl? Ответ заключается в том, что каждый из этих шести ионов хлора находится в центре своего собственного октаэдра, вершины которого определяются шестью соседними ионами натрия.Может показаться, что это соответствует Na 6 Cl 6 , но обратите внимание, что центральный ион натрия, показанный на диаграмме, может претендовать только на одну шестую долю каждого из своих соседних хлорид-иона. Таким образом, формула NaCl не просто простейшая формула, а правильно отражает стехиометрию соединения 1: 1. Как и во всех ионных структурах, здесь нет различимых «молекулярных» единиц, соответствующих простейшей формуле NaCl. Хлорид натрия, как практически все соли, представляет собой более энергетически предпочтительную конфигурацию натрия и хлора, чем элементы по отдельности.
Галит : Галит, или каменная соль, представляет собой минеральную форму хлорида натрия. Галит образует кубические кристаллы. Он встречается в минералах эвапоритов, образовавшихся в результате высыхания замкнутых озер и морей. Этот снимок был сделан в Величке, Польша, одной из старейших соляных шахт в мире.
Энергия образования ионных солей
Поскольку ионные соли имеют более низкую энергетическую конфигурацию, чем их отдельные элементы, реакции , образующие ионных твердых частиц, имеют тенденцию к высвобождению энергии.Например, когда натрий и хлор реагируют с образованием хлорида натрия:
Na (тв.) + ½Cl 2 (г) → NaCl (тв.) + 404 кДж
Выделение 404 кДж энергии показывает, что образование твердого хлорида натрия является экзотермическим. Согласно второму закону термодинамики, высвобождаемая энергия распространяется в окружающую среду и, следовательно, не может вызвать обратную реакцию. Эта необратимость является основной причиной того, что хлорид натрия более стабилен, чем входящие в его состав элементы.
Энергия решетки
Когда ионы натрия и хлорида реагируют с образованием NaCl, выделяется 787 кДж / моль энергии:
Na + (г) + Cl — (г) → NaCl (т) + 787 кДж
Эта большая величина возникает из-за силы кулоновской силы между ионами противоположного заряда. Эта энергия является одним из определений энергии решетки: энергия, выделяемая, когда ионное твердое вещество образуется из газообразных ионов, связывающихся вместе. Обратите внимание, что фактическое значение изменения энтальпии (ΔH o ) отрицательно (-787 кДж / моль).
Экзотермичность таких реакций приводит к стабильности ионных твердых веществ. То есть энергия необходима, чтобы разбить ионное твердое тело на составляющие элементы. (Это не следует путать с диссоциацией ионов соединения в растворе. Это другой процесс.) Эта эндотермическая реакция дает начало другому определению энергии решетки: энергии, которая должна быть затрачена на разложение ионного твердого вещества на газообразное. ионы.
Энергия решетки, в основном из-за кулоновского притяжения между каждым ионом и его ближайшими соседями (шесть в случае NaCl), на самом деле является суммой всех взаимодействий внутри кристалла.Энергии решетки нельзя измерить напрямую, но их можно оценить по энергиям других процессов.
Плотно упакованные конструкции
Наиболее энергетически стабильным расположением твердых тел, состоящих из идентичных молекулярных единиц, обычно являются те, в которых имеется минимум пустого пространства. Они известны как плотноупакованные структуры и бывают нескольких видов.
В ионных твердых телах даже простейшей стехиометрии 1: 1 положительные и отрицательные ионы обычно настолько различаются по размеру, что упаковка часто оказывается гораздо менее эффективной.Это может привести к тому, что твердое тело примет геометрию решетки, отличную от той, которая проиллюстрирована выше для NaCl.
Рассмотрим структуру хлорида цезия CsCl. Радиус иона Cs + составляет 168 пм (по сравнению с 98 пм для Na + ) и никак не может поместиться в октаэдрическое отверстие простой кубической решетки хлорид-ионов (ионный радиус 181 пм). Поэтому решетка CsCl имеет другое устройство.
Структура CsCl : В CsCl ионы металлов смещены в центр каждого кубического элемента решетки иона Cl ––.Каждый ион цезия имеет восемь ближайших соседних ионов хлорида, в то время как каждый ион хлорида также окружен восемью ионами цезия в координации (8,8).
Два типа решеток, примером которых являются NaCl и CsCl, встречаются в большом количестве других ионных твердых веществ 1: 1, и эти названия используются в общем для описания структур этих других соединений. Существует много других фундаментальных структур решетки (не все кубические), но двух описанных здесь достаточно, чтобы проиллюстрировать то, что отношение радиусов (отношение радиусов положительного иона к отрицательному) играет важную роль в структурах простые ионные твердые тела.
Ковалентные кристаллы
Атомы в ковалентных твердых телах ковалентно связаны со своими соседями, создавая, по сути, одну гигантскую молекулу.
Цели обучения
Обсудить свойства ковалентных кристаллов или сетчатых тел
Основные выводы
Ключевые моменты
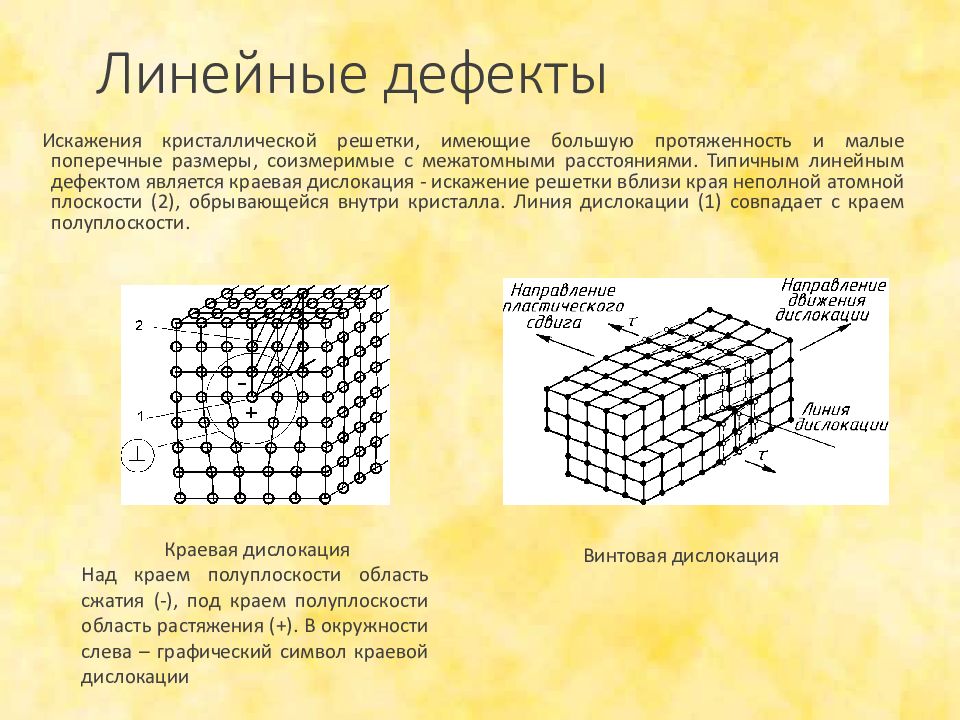
- Ковалентные (или сетчатые) твердые тела представляют собой соединения с расширенной решеткой, в которых каждый атом ковалентно связан со своими ближайшими соседями. Поскольку нет делокализованных электронов, ковалентные твердые тела не проводят электричество.
- Перестройка или разрыв ковалентных связей требует большого количества энергии; поэтому ковалентные твердые вещества имеют высокие температуры плавления.
- Ковалентные связи чрезвычайно прочные, поэтому ковалентные твердые вещества очень твердые. Обычно ковалентные твердые вещества нерастворимы из-за сложности сольватации очень больших молекул.
- Алмаз — самый твердый из известных материалов, а кубический нитрид бора (BN) — второй по твердости. Карбид кремния (SiC) очень сложен по структуре и имеет не менее 70 кристаллических форм.
Ключевые термины
- твердое тело ковалентной сети : твердое тело, образованное, когда атомы ковалентно связаны в непрерывную протяженную сеть.
- ковалентная связь : Тип химической связи, при которой два атома соединяются друг с другом за счет совместного использования двух или более электронов.
- алмаз : мерцающий стеклоподобный минерал, представляющий собой аллотроп углерода, в котором каждый атом углерода связан с четырьмя другими атомами с тетраэдрической геометрией.
- карбид : соединение, состоящее из углерода и менее электроотрицательного элемента.
- аллотроп : Другая форма элемента в его естественном состоянии. Например, кислород содержится преимущественно в двух формах: O2 и O3 (озон).
Твердые тела ковалентной сети
Ковалентная связь — это химическая связь, которая включает обмен парами электронов между атомами. Это совместное использование приводит к стабильному балансу сил притяжения и отталкивания между этими атомами.Ковалентные твердые вещества представляют собой класс соединений с расширенной решеткой, в которых каждый атом ковалентно связан со своими ближайшими соседями. Это означает, что, по сути, весь кристалл представляет собой одну гигантскую молекулу. Чрезвычайно сильные связывающие силы, которые соединяют все соседние атомы, объясняют чрезвычайную твердость этих твердых тел. Их нельзя сломать или истереть без разрыва большого количества ковалентных химических связей. Точно так же ковалентное твердое тело не может «плавиться» в обычном смысле слова, поскольку весь кристалл представляет собой одну гигантскую молекулу.При нагревании до очень высоких температур эти твердые вещества обычно разлагаются на элементы.
Еще одним свойством твердых тел с ковалентной сеткой является плохая электропроводность, поскольку в них нет делокализованных электронов. В расплавленном состоянии, в отличие от ионных соединений, вещество все еще не может проводить электричество, поскольку макромолекула состоит из незаряженных атомов, а не из ионов. (Это также противоречит большинству форм металлических связей.)
Пример использования: аллотропы углерода
Графит — это аллотроп углерода.В этом аллотропе каждый атом углерода образует три ковалентные связи, оставляя один электрон на каждой внешней орбитали делокализованным, создавая множество «свободных электронов» в каждой плоскости углерода. Это придает графиту электропроводность. Его точка плавления высока из-за большого количества энергии, необходимой для перестройки ковалентных связей. Это также довольно сложно из-за сильной ковалентной связи по всей решетке. Однако из-за плоских связей между атомами углерода слои в графите могут легко перемещаться, поэтому вещество становится пластичным.Это объясняет использование графита в карандашах, где слои углерода «проливаются» на бумагу («грифель» карандаша обычно представляет собой смесь графита и глины и был изобретен для этого использования в 1795 году). Графит обычно нерастворим в каком-либо растворителе из-за сложности сольватации очень больших молекул.
Алмаз и графит: два аллотропа углерода : Эти два аллотропа углерода представляют собой твердые тела с ковалентной сеткой, которые различаются геометрией связи атомов углерода. В алмазе связь происходит в тетраэдрической геометрии, в то время как в графите атомы углерода связаны друг с другом в тригональной плоскости.Это различие объясняет совершенно разные внешний вид и свойства этих двух форм углерода.
Алмаз также представляет собой аллотроп углерода. Алмаз — самый твердый из известных материалов, определяющий верхний предел шкалы от 1 до 10, известной как шкала твердости Мооса. Алмаз нельзя расплавить; выше 1700 ° C он превращается в графит, более стабильную форму углерода. Элементарная ячейка алмаза имеет гранецентрированную кубическую форму и содержит восемь атомов углерода.
Другие примеры
Нитрид бора (BN) похож на углерод, потому что он существует как алмазоподобный кубический полиморф, а также в гексагональной форме, подобной графиту.
Гексагональный нитрид бора : Гексагональный нитрид бора, двумерный материал, по структуре подобен графиту.
Кубический нитрид бора — второй по твердости материал после алмаза, он используется в промышленных абразивах и режущих инструментах.
Кубический нитрид бора : Кубический нитрид бора имеет кристаллическую структуру, которую можно построить, заменяя каждые два атома углерода в алмазе одним атомом бора и одним атомом азота.Кубический нитрид бора — второй по твердости материал после алмаза.
В последнее время интерес к нитриду бора был сосредоточен на его углеродоподобной способности образовывать нанотрубки и связанные с ними наноструктуры.
Карбид кремния (SiC) также известен как карборунд. Его структура очень похожа на структуру алмаза, где каждый второй углерод заменен кремнием. Карбид кремния существует примерно в 250 кристаллических формах. Он используется в основном в синтетической форме, потому что в природе встречается крайне редко. Он содержится в метеорите определенного типа, который, как считается, произошел за пределами нашей солнечной системы.Первые светодиоды, использованные в высокоэффективном освещении, были основаны на SiC.
При нагревании при атмосферном давлении он разлагается при 2700 ° C, но никогда не наблюдалось плавления. Конструктивно карбид кремния очень сложен; идентифицировано по крайней мере 70 кристаллических форм. Его чрезвычайная твердость и простота синтеза привели к разнообразным применениям — в режущих инструментах и абразивных материалах, высокотемпературных полупроводниках и других высокотемпературных приложениях, производстве специальных сталей и ювелирных изделий и многого другого.Карбид вольфрама (WC), вероятно, является наиболее широко распространенным ковалентным твердым телом из-за его использования в твердосплавных режущих инструментах и в качестве материала, используемого для изготовления вращающихся шариков в шариковых ручках. Он имеет высокую температуру плавления (2870 ° C) и структуру, аналогичную структуре алмаза, но немного менее твердую. Во многих случаях он заключен в более мягкую матрицу из кобальта или покрыт соединениями титана.
Карбид кремния : Карбид кремния — чрезвычайно редкий минерал и в природе чаще всего встречается в определенных типах метеоритов.
Молекулярные кристаллы
Молекулы, удерживаемые силами Ван-дер-Ваальса, образуют молекулярные твердые тела.
Цели обучения
Обсудите свойства молекулярных кристаллов.
Основные выводы
Ключевые моменты
- Молекулярное твердое тело состоит из молекул, удерживаемых вместе силами Ван-дер-Ваальса. Его свойства продиктованы слабой природой этих межмолекулярных сил. Молекулярные твердые вещества мягкие, часто летучие, имеют низкие температуры плавления и являются электрическими изоляторами.
- Классы молекулярных твердых веществ включают органические соединения, состоящие из углерода и водорода, фуллеренов, галогенов (F, Cl и т. Д.), Халькогенов (O, S и т. Д.) И пниктогенов (N, P и т. Д.).
- Более крупные молекулы менее летучие и имеют более высокие температуры плавления, поскольку их дисперсионные силы увеличиваются с увеличением числа атомов. Уменьшение связывания внешних электронов с ядром также увеличивает ван-дер-ваальсовы взаимодействия атома из-за его повышенной поляризуемости.
Ключевые термины
- межмолекулярная сила : любое из взаимодействий притяжения, которое происходит между атомами или молекулами в образце вещества.
- Сила Ван-дер-Ваальса : Силы притяжения между молекулами (или между частями одной и той же молекулы). К ним относятся взаимодействия между частичными зарядами (водородные связи и диполь-дипольные взаимодействия) и более слабые силы лондонской дисперсии.
- молекулярное твердое тело : твердое тело, состоящее из молекул, удерживаемых вместе межмолекулярными силами Ван-дер-Ваальса.
- легирование : Преднамеренное введение примесей в образец вещества с целью изменения его электрических свойств.
Природа межмолекулярных сил
Напомним, что молекула определяется как дискретная совокупность атомов, достаточно прочно связанных вместе направленными ковалентными силами, позволяющими ей сохранять свою индивидуальность при растворении, плавлении или испарении вещества. Два слова, выделенные курсивом в предыдущем предложении, очень важны. Ковалентная связь подразумевает, что силы, действующие между атомами в пределах молекулы ( внутри молекулы ), намного сильнее, чем силы, действующие между молекулами ( между молекулами ). Направленное свойство ковалентной связи придает каждой молекуле отличительную форму, которая влияет на ряд его свойств.
Жидкости и твердые вещества, состоящие из молекул, удерживаются вместе ван-дер-ваальсовыми (или межмолекулярными) силами, и многие из их свойств отражают это слабое связывание. Молекулярные твердые вещества имеют тенденцию быть мягкими или деформируемыми, имеют низкие температуры плавления и часто достаточно летучие, чтобы испаряться непосредственно в газовую фазу. Последнее свойство часто придает таким твердым веществам характерный запах. В то время как характерная температура плавления металлов и ионных твердых частиц составляет ~ 1000 ° C, большинство молекулярных твердых веществ плавятся значительно ниже ~ 300 ° C.Таким образом, многие соответствующие вещества являются жидкими (вода) или газообразными (кислород) при комнатной температуре.
Молекулярные твердые вещества также имеют относительно низкую плотность и твердость. Вовлеченные элементы легкие, а межмолекулярные связи относительно длинные и, следовательно, слабые. Из-за нейтральности заряда составляющих молекул и из-за большого расстояния между ними молекулярные твердые тела являются электрическими изоляторами.
Поскольку дисперсионные силы и другие силы Ван-дер-Ваальса увеличиваются с увеличением количества атомов, большие молекулы, как правило, менее летучие и имеют более высокие температуры плавления, чем меньшие.Кроме того, при движении вниз по столбцу в периодической таблице внешние электроны более слабо связаны с ядром, увеличивая поляризуемость атома и, следовательно, его склонность к взаимодействиям типа Ван-дер-Ваальса. Этот эффект особенно очевиден при повышении температуры кипения последовательно более тяжелых элементов из благородных газов.
Интерактивное: заряженные и нейтральные атомы : В этой модели показаны два вида сил притяжения: кулоновские силы (притяжение между ионами) и силы Ван-дер-Ваальса (дополнительная сила притяжения между всеми атомами).Какие паттерны образуются с заряженными и нейтральными атомами? Как изменение притяжения Ван-дер-Ваальса или зарядки атомов влияет на температуру плавления и кипения вещества?
Пример использования: Phosphorus
Термин «молекулярное твердое вещество» может относиться не к определенному химическому составу, а к определенной форме материала. Например, твердый фосфор может кристаллизоваться в различных аллотропах, называемых «белым», «красным» и «черным» фосфором.
- Белый фосфор образует молекулярные кристаллы, состоящие из тетраэдрических молекул P 4 .Молекулярный твердый белый фосфор имеет относительно низкую плотность 1,82 г / см 3 и температуру плавления 44,1 ° C; это мягкий материал, который можно разрезать ножом.
- Нагревание при атмосферном давлении до 250 ° C или воздействие солнечного света превращает белый фосфор в красный фосфор, в котором тетраэдры P 4 больше не изолированы, а связаны ковалентными связями в полимероподобные цепи.
- При нагревании белого фосфора под высоким давлением (ГПа) он превращается в черный фосфор, который имеет слоистую графитоподобную структуру.
Когда белый фосфор превращается в ковалентный красный фосфор, плотность увеличивается до 2,2–2,4 г / см. 3 , а температура плавления — до 590 ° C; когда белый фосфор превращается в (также ковалентный) черный фосфор, плотность становится 2,69–3,8 г / см 3 с температурой плавления ~ 200 ° C.
И красный, и черный фосфор значительно тверже белого фосфора. Хотя белый фосфор является изолятором, черный аллотроп, состоящий из слоев, простирающихся по всему кристаллу, действительно проводит электричество.Структурные переходы в фосфоре обратимы: при высвобождении высокого давления черный фосфор постепенно превращается в красный аллотроп, а путем испарения красного фосфора при 490 ° C в инертной атмосфере и конденсации пара ковалентный красный фосфор может снова превратиться в белый молекулярное твердое вещество.
Точно так же желтый мышьяк представляет собой твердое молекулярное вещество, состоящее из звеньев As 4 ; он метастабилен и постепенно превращается в серый мышьяк при нагревании или освещении.Каждая из определенных форм серы и селена состоит из звеньев S 8 или Se 8 и в условиях окружающей среды является твердым молекулярным веществом. Однако они могут превращаться в ковалентные аллотропы, имеющие атомные цепи, простирающиеся по всему кристаллу.
Классы молекулярных твердых тел
Подавляющее большинство молекулярных твердых веществ можно отнести к органическим соединениям, содержащим углерод и водород, таким как углеводороды (C n H m ). Другой важный класс — сферические молекулы, состоящие из разного числа атомов углерода, называемые фуллеренами.Менее многочисленными, но отличительными молекулярными твердыми веществами являются галогены (например, Cl 2 ) и их соединения с водородом (например, HCl), а также легкие халькогены (например, O 2 ) и пниктогены (например, N 2 ). ).
Проводимость молекулярных твердых тел может быть вызвана «легированием» фуллеренов (например, C 60 ). Его твердая форма является изолятором, потому что все валентные электроны атомов углерода участвуют в ковалентных связях внутри отдельных молекул углерода. Однако вставка (интеркалирование) атомов щелочного металла между молекулами фуллерена дает дополнительные электроны, которые могут легко ионизироваться атомами металла и делать материал проводящим и даже сверхпроводящим.
Кристаллы фуллерена : Твердый фуллерен является изолятором, но он может стать сверхпроводником, если интеркалирующие ионы металла вставлены между молекулами фуллерена (C 60 ).
Металлические кристаллы
Металлические кристаллы удерживаются вместе металлическими связями, электростатическим взаимодействием между катионами и делокализованными электронами.
Цели обучения
Опишите металлические кристаллы.
Основные выводы
Ключевые моменты
- Атомы в металлах теряют электроны с образованием катионов.Делокализованные электроны окружают ионы. Металлические связи (электростатические взаимодействия между ионами и электронным облаком) удерживают металлическое твердое тело вместе. Атомы расположены в виде плотно упакованных сфер.
- Поскольку внешние электроны атомов металлов делокализованы и очень подвижны, металлы обладают электрической и теплопроводностью. Модель свободных электронов может использоваться для расчета электропроводности, а также вклада электронов в теплоемкость и теплопроводность металлов.
- Металлы пластичны или способны к пластической деформации. Закон Гука описывает обратимую упругую деформацию металлов, в которой напряжение линейно пропорционально деформации. Силы, превышающие предел упругости, или нагрев могут вызвать необратимую деформацию объекта.
- В общем, металлы плотнее неметаллов. Это связано с плотно упакованной кристаллической решеткой металлической структуры. Чем больше количество делокализованных электронов, тем прочнее металлические связи.
Ключевые термины
- металлическая связь : химическая связь, в которой подвижные электроны распределены между многими ядрами; это приводит к электрической проводимости.
- металл : Любой из ряда химических элементов в периодической таблице, которые образуют металлическую связь с атомами других металлов. Обычно он блестящий, податливый и проводник тепла и электричества.
Металлические свойства
В металле атомы легко теряют электроны с образованием положительных ионов (катионов).Эти ионы окружены делокализованными электронами, которые отвечают за проводимость. Образовавшееся твердое тело удерживается вместе за счет электростатических взаимодействий между ионами и электронным облаком. Эти взаимодействия называются металлическими связями. Металлическое соединение определяет многие физические свойства металлов, такие как прочность, пластичность, пластичность, тепловая и электрическая проводимость, непрозрачность и блеск.
Металлическая связь : Слабосвязанные и подвижные электроны окружают положительные ядра атомов металлов.
Металлическую связь, понимаемую как разделение «свободных» электронов между решеткой положительно заряженных ионов (катионов), иногда сравнивают со связью расплавленных солей; однако эта упрощенная точка зрения верна для очень небольшого числа металлов. С квантово-механической точки зрения, проводящие электроны распределяют свою плотность одинаково по всем атомам, которые функционируют как нейтральные (незаряженные) объекты.
Атомы в металлах расположены в виде плотно упакованных сфер, и особенно распространены две модели упаковки: объемноцентрированная кубическая, в которой каждый металл окружен восемью эквивалентными металлами, и гранецентрированная кубическая, в которой металлы окружены шестью соседними атомы.Некоторые металлы принимают обе структуры в зависимости от температуры.
Металлы в целом обладают высокой электропроводностью, высокой теплопроводностью и высокой плотностью. Как правило, они деформируются (податливы) под действием напряжения без скалывания. Некоторые металлы (щелочные и щелочноземельные металлы) имеют низкую плотность, низкую твердость и низкие температуры плавления. По оптическим свойствам металлы непрозрачны, блестят и блестят.
Точка плавления и прочность
Прочность металла определяется электростатическим притяжением между решеткой положительных ионов и «морем» валентных электронов, в которое они погружены.Чем больше ядерный заряд (атомный номер) атомного ядра и чем меньше размер атома, тем сильнее это притяжение. В целом переходные металлы с их d-электронами валентного уровня сильнее и имеют более высокие температуры плавления:
- Fe, 1539 ° С
- Re, 3180 ° С
- Os, 2727 ° С
- Вт, 3380 ° С.
Большинство металлов имеют более высокую плотность, чем большинство неметаллов. Тем не менее, плотность металлов сильно различается.Литий (Li) — наименее плотный твердый элемент, а осмий (Os) — самый плотный. Металлы групп IA и IIA называются легкими металлами, потому что они являются исключениями из этого обобщения. Высокая плотность большинства металлов обусловлена плотноупакованной кристаллической решеткой металлической структуры.
Электропроводность: почему металлы являются хорошими проводниками?
Чтобы вещество проводило электричество, оно должно содержать заряженные частицы (носители заряда), которые достаточно подвижны, чтобы двигаться в ответ на приложенное электрическое поле.В случае ионных соединений в водных растворах эту функцию выполняют сами ионы. То же самое верно и для ионных соединений при плавлении. Ионные твердые тела содержат те же носители заряда, но, поскольку они зафиксированы на месте, эти твердые тела являются изоляторами.
В металлах носителями заряда являются электроны, и поскольку они свободно перемещаются через решетку, металлы обладают высокой проводимостью. Очень малая масса и инерция электронов позволяют им проводить высокочастотные переменные токи, чего не могут делать растворы электролитов.
Электропроводность, а также вклад электронов в теплоемкость и теплопроводность металлов можно рассчитать по модели свободных электронов , которая не учитывает детальную структуру ионной решетки , а не .
Механические свойства
Механические свойства металлов включают ковкость и пластичность, что означает способность к пластической деформации. Обратимая упругая деформация в металлах может быть описана законом Гука для восстанавливающих сил, в котором напряжение линейно пропорционально деформации.Приложенное тепло или силы, превышающие предел упругости, могут вызвать необратимую деформацию объекта, известную как пластическая деформация или пластичность.
Металлические твердые тела известны и ценятся за эти качества, которые проистекают из ненаправленной природы притяжения между атомными ядрами и морем электронов. Связь внутри ионных или ковалентных твердых тел может быть более прочной, но она также является направленной, что делает эти твердые тела хрупкими и подверженными разрушению, например, при ударе молотком.Напротив, металл с большей вероятностью будет просто деформирован или помят.
Хотя металлы имеют черный цвет из-за их способности одинаково поглощать все длины волн, золото (Au) имеет характерный цвет. Согласно специальной теории относительности, увеличенная масса электронов внутренней оболочки с очень высоким импульсом заставляет орбитали сжиматься. Поскольку внешние электроны менее подвержены влиянию, поглощение синего света увеличивается, что приводит к усиленному отражению желтого и красного света.
Золото : Золото — благородный металл; он устойчив к коррозии и окислению.
ионных кристаллов | Введение в химию
Цель обучения
- Опишите, как ионы образуют ионные кристаллы.
Ключевые моменты
- Ионы, связанные электростатическим притяжением, образуют ионные кристаллы. Их расположение варьируется в зависимости от размеров ионов или отношения радиусов (отношения радиусов положительного иона к отрицательному). Простая кубическая кристаллическая решетка имеет ионы, равномерно распределенные в трехмерном пространстве под углом 90 °.
- Стабильность ионных твердых тел зависит от энергии решетки, которая выделяется в виде тепла, когда два иона объединяются в твердое тело. Энергия решетки — это сумма всех взаимодействий внутри кристалла.
- Свойства ионных кристаллов отражают сильные взаимодействия, существующие между ионами. Они очень плохо проводят электричество, сильно поглощают инфракрасное излучение и легко раскалываются. Эти твердые вещества обычно довольно твердые и имеют высокие температуры плавления.
Условия
- ионный кристалл Класс кристаллов, состоящих из решетки ионов, удерживаемых вместе за счет электростатических взаимодействий; они демонстрируют сильное поглощение инфракрасного излучения и имеют плоскости, вдоль которых они легко раскалываются.
- кристаллическая решетка: Регулярное трехмерное геометрическое расположение атомов, молекул или ионов в кристалле.
- энергия решетки Энергия, необходимая для разделения ионов твердого ионного тела (особенно кристалла) на бесконечное расстояние друг от друга.
Кристаллическая форма ионных соединений
Ионный кристалл состоит из ионов, связанных вместе электростатическим притяжением. Расположение ионов в правильной геометрической структуре называется кристаллической решеткой. Примерами таких кристаллов являются галогениды щелочных металлов, которые включают:
- фторид калия (KF)
- хлорид калия (KCl)
- бромид калия (KBr)
- йодид калия (KI)
- фторид натрия (NaF)
- Другие комбинации ионов натрия, цезия, рубидия или лития с ионами фтора, бромида, хлорида или иодида
Эти твердые вещества, как правило, довольно твердые и имеют высокие температуры плавления, что отражает сильные взаимодействия между ионами с противоположным зарядом.Точное расположение ионов в решетке зависит от размера ионов в кристалле.
Пример использования: NaCl
Свойства NaCl отражают сильные взаимодействия, существующие между ионами. Это хороший проводник электричества в расплавленном состоянии (расплавленное состояние), но очень плохой в твердом состоянии. При плавлении подвижные ионы переносят заряд через жидкость. Кристаллы NaCl характеризуются сильным поглощением инфракрасного (ИК) излучения и имеют плоскости, вдоль которых они легко раскалываются.Структурно каждый ион в хлориде натрия окружен шестью соседними ионами с противоположным зарядом. Полученная кристаллическая решетка относится к типу, известному как «простая кубическая», что означает, что точки решетки равномерно разнесены во всех трех измерениях, а все углы ячеек равны 90 °.
Кристаллическая структура NaCl Сферы представляют собой ионы Na + и Cl-. Каждый ион окружен шестью другими ионами противоположного заряда, поэтому NaCl описывается как имеющий (6,6) координацию.
Как может один ион натрия, окруженный шестью ионами хлора (или наоборот) соответствовать простейшей (эмпирической) формуле NaCl? Ответ заключается в том, что каждый из этих шести ионов хлора находится в центре своего собственного октаэдра, вершины которого определяются шестью соседними ионами натрия.Может показаться, что это соответствует Na 6 Cl 6 , но обратите внимание, что центральный ион натрия, показанный на диаграмме, может претендовать только на одну шестую долю каждого из своих соседних хлорид-иона. Таким образом, формула NaCl не просто простейшая формула, а правильно отражает стехиометрию соединения 1: 1. Как и во всех ионных структурах, здесь нет различимых «молекулярных» единиц, соответствующих простейшей формуле NaCl. Хлорид натрия, как практически все соли, представляет собой более энергетически предпочтительную конфигурацию натрия и хлора, чем элементы по отдельности.
Галит Галит, или каменная соль, представляет собой минеральную форму хлорида натрия. Галит образует кубические кристаллы. Он встречается в минералах эвапоритов, образовавшихся в результате высыхания замкнутых озер и морей. Этот снимок был сделан в Величке, Польша, одной из старейших соляных шахт в мире.
Энергия образования ионных солей
Поскольку ионные соли имеют более низкую энергетическую конфигурацию, чем их отдельные элементы, реакции , образующие ионных твердых частиц, имеют тенденцию к высвобождению энергии.Например, когда натрий и хлор реагируют с образованием хлорида натрия:
Na (тв.) + ½Cl 2 (г) → NaCl (тв.) + 404 кДж
Выделение 404 кДж энергии показывает, что образование твердого хлорида натрия является экзотермическим. Согласно второму закону термодинамики, высвобождаемая энергия распространяется в окружающую среду и, следовательно, не может вызвать обратную реакцию. Эта необратимость является основной причиной того, что хлорид натрия более стабилен, чем входящие в его состав элементы.
Энергия решетки
Когда ионы натрия и хлорида реагируют с образованием NaCl, выделяется 787 кДж / моль энергии:
Na + (г) + Cl — (г) → NaCl (т) + 787 кДж
Эта большая величина возникает из-за силы кулоновской силы между ионами противоположного заряда. Эта энергия является одним из определений энергии решетки: энергия, выделяемая, когда ионное твердое вещество образуется из газообразных ионов, связывающихся вместе. Обратите внимание, что фактическое значение изменения энтальпии (ΔH o ) отрицательно (-787 кДж / моль).
Экзотермичность таких реакций приводит к стабильности ионных твердых веществ. То есть энергия необходима, чтобы разбить ионное твердое тело на составляющие элементы. (Это не следует путать с диссоциацией ионов соединения в растворе. Это другой процесс.) Эта эндотермическая реакция дает начало другому определению энергии решетки: энергии, которая должна быть затрачена на разложение ионного твердого вещества на газообразное. ионы.
Энергия решетки, в основном из-за кулоновского притяжения между каждым ионом и его ближайшими соседями (шесть в случае NaCl), на самом деле является суммой всех взаимодействий внутри кристалла.Энергии решетки нельзя измерить напрямую, но их можно оценить по энергиям других процессов.
Плотноупакованные конструкции
Наиболее энергетически стабильным расположением твердых тел, состоящих из идентичных молекулярных единиц, обычно являются те, в которых имеется минимум пустого пространства. Они известны как плотноупакованные структуры и бывают нескольких видов.
В ионных твердых телах даже простейшей стехиометрии 1: 1 положительные и отрицательные ионы обычно настолько различаются по размеру, что упаковка часто оказывается гораздо менее эффективной.Это может привести к тому, что твердое тело примет геометрию решетки, отличную от той, которая проиллюстрирована выше для NaCl.
Рассмотрим структуру хлорида цезия CsCl. Радиус иона Cs + составляет 168 пм (по сравнению с 98 пм для Na + ) и никак не может поместиться в октаэдрическое отверстие простой кубической решетки хлорид-ионов (ионный радиус 181 пм). Поэтому решетка CsCl имеет другое устройство.
Структура CsCl В CsCl ионы металлов смещены в центр каждого кубического элемента решетки иона Cl ––.Каждый ион цезия имеет восемь ближайших соседних ионов хлорида, в то время как каждый ион хлорида также окружен восемью ионами цезия в координации (8,8).
Два типа решеток, примером которых являются NaCl и CsCl, встречаются в большом количестве других ионных твердых веществ 1: 1, и эти названия используются в общем для описания структур этих других соединений. Существует много других фундаментальных структур решетки (не все кубические), но двух описанных здесь достаточно, чтобы проиллюстрировать то, что отношение радиусов (отношение радиусов положительного иона к отрицательному) играет важную роль в структурах простые ионные твердые тела.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
10.6 Структуры решеток в кристаллических твердых телах — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Опишите расположение атомов и ионов в кристаллических структурах
- Вычислить ионные радиусы, используя размеры элементарной ячейки
- Объяснить использование измерений дифракции рентгеновских лучей для определения кристаллических структур
Более 90% твердых веществ природного и антропогенного происхождения являются кристаллическими.Большинство твердых веществ образуются с регулярным расположением своих частиц, потому что общее притягивающее взаимодействие между частицами максимизируется, а общая межмолекулярная энергия сводится к минимуму, когда частицы упаковываются наиболее эффективным образом. Регулярное расположение на атомном уровне часто отражается на макроскопическом уровне. В этом модуле мы исследуем некоторые детали структур металлических и ионных кристаллических твердых тел и узнаем, как эти структуры определяются экспериментально.
Структуры металлов
Мы начнем обсуждение кристаллических твердых тел с рассмотрения элементарных металлов, которые относительно просты, поскольку каждый содержит только один тип атомов. Чистый металл — это кристаллическое твердое тело, атомы которого плотно упакованы в повторяющийся узор. Некоторые свойства металлов в целом, такие как их пластичность и пластичность, во многом обусловлены наличием одинаковых атомов, расположенных в правильном порядке. Различные свойства одного металла по сравнению с другим частично зависят от размеров их атомов и особенностей их пространственного расположения.В следующих разделах мы исследуем сходства и различия четырех наиболее распространенных геометрических форм металлических кристаллов.
Элементарные ячейки металлов
Структуру кристаллического твердого вещества, будь то металл или нет, лучше всего описать, рассматривая его простейшую повторяющуюся единицу, которая упоминается как его элементарная ячейка. Элементарная ячейка состоит из узлов решетки, которые представляют расположение атомов или ионов. Вся структура состоит из этой элементарной ячейки, повторяющейся в трех измерениях, как показано на рисунке 10.46.
Рис. 10.46. Элементарная ячейка показывает расположение точек решетки, повторяющихся во всех направлениях.
Давайте начнем наше исследование структуры кристаллической решетки и элементарных ячеек с самой простой структуры и самой простой элементарной ячейки. Чтобы визуализировать это, представьте, что вы берете большое количество одинаковых сфер, таких как теннисные мячи, и равномерно размещаете их в контейнере. Самый простой способ сделать это — создать слои, в которых сферы в одном слое находятся прямо над сферами в слое ниже, как показано на рисунке 10.47. Такое расположение называется простой кубической структурой, а элементарная ячейка называется простой кубической элементарной ячейкой или примитивной кубической элементарной ячейкой.
Рис. 10.47 Когда атомы металла расположены сферами в одном слое непосредственно над или под сферами в другом слое, структура решетки называется простой кубической. Обратите внимание, что сферы соприкасаются.
В простой кубической структуре сферы не упакованы так плотно, как могли бы, и они «заполняют» только около 52% объема контейнера.Это относительно неэффективное устройство, и только один металл (полоний, Po) кристаллизуется в простой кубической структуре. Как показано на рис. 10.48, твердое тело с таким расположением состоит из плоскостей (или слоев), в которых каждый атом контактирует только с четырьмя ближайшими соседями в своем слое; один атом прямо над ним в верхнем слое; и один атом прямо под ним в слое ниже. Число других частиц, с которыми контактирует каждая частица в кристаллическом твердом теле, известно как ее координационное число.Следовательно, для атома полония в простом кубическом массиве координационное число равно шести.
Рис. 10.48. Атом в структуре простой кубической решетки контактирует с шестью другими атомами, поэтому его координационное число равно шести.
В простой кубической решетке элементарная ячейка, повторяющаяся во всех направлениях, представляет собой куб, определяемый центрами восьми атомов, как показано на рис. 10.49. Атомы в соседних углах этой элементарной ячейки контактируют друг с другом, поэтому длина края этой ячейки равна двум атомным радиусам или одному атомному диаметру.Кубическая элементарная ячейка содержит только те части этих атомов, которые находятся в ней. Поскольку атом в углу простой кубической элементарной ячейки состоит в общей сложности из восьми элементарных ячеек, только одна восьмая этого атома находится в конкретной элементарной ячейке. А поскольку каждая простая кубическая элементарная ячейка имеет по одному атому в каждом из восьми «углов», в одной простой кубической элементарной ячейке содержится 8 × 18 = 18 × 18 = 1 атом.
Рис. 10.49. Простая элементарная ячейка кубической решетки содержит одну восьмую атома в каждом из восьми углов, так что всего она содержит один атом.
Пример 10.14
Расчет атомного радиуса и плотности металлов, часть 1
Длина ребра элементарной ячейки альфа-полония составляет 336 мкм.
(а) Определите радиус атома полония.
(b) Определите плотность альфа-полония.
Решение
Альфа-полоний кристаллизуется в простой кубической элементарной ячейке:
(a) Два соседних атома По контактируют друг с другом, поэтому длина края этой ячейки равна двум атомным радиусам По: l = 2 r .Следовательно, радиус Po равен r = l2 = 336 pm2 = 168 pm. R = l2 = 336 pm2 = 168 pm.
(b) Плотность определяется как плотность = масса-объем. Плотность = масса-объем. Плотность полония можно определить, определив плотность его элементарной ячейки (масса, содержащаяся в элементарной ячейке, деленная на объем элементарной ячейки). Поскольку элементарная ячейка По содержит одну восьмую атома По в каждом из восьми углов, элементарная ячейка содержит один атом По.
Массу элементарной ячейки По можно найти по формуле:
1 элементарная ячейка Po × 1 атом Po 1 элементарная ячейка Po × 1 моль Po6.022 × 1023 атомов Po × 208,998 г1 моль Po = 3,47 × 10−22g1 элементарная ячейка Po × 1 атом Po1 элементарная ячейка Po × 1 моль Po6,022 × 1023 атомов Po × 208,998 г1 моль Po = 3,47 × 10−22 г
Объем элементарной ячейки По можно найти по:
V = l3 = (336 × 10−10 см) 3 = 3,79 × 10−23 см3 V = l3 = (336 × 10−10 см) 3 = 3,79 × 10−23 см3
(Обратите внимание, что длина края была преобразована из pm в см, чтобы получить обычные единицы объема для плотности.)
Следовательно, плотность Po = 3,471 × 10–22 г3,79 × 10–23 см3 = 9,16 г / см3 Po = 3,471 × 10–22 г3,79 × 10–23 см3 = 9,16 г / см3
Проверьте свои знания
Длина края элементарной ячейки для никеля равна 0.3524 нм. Плотность Ni 8,90 г / см 3 . Кристаллизуется ли никель в виде простой кубической структуры? Объяснять.
Ответ:
Нет. Если бы Ni был простым кубическим, его плотность была бы определена как:
1 атом Ni × 1 моль Ni6,022 × 1023 атомов Ni × 58,693 г 1 моль Ni = 9,746 × 10–23 г 1 атом Ni × 1 моль Ni6,022 × 1023 атомов Ni × 58,693 г 1 моль Ni = 9,746 × 10–23 г
V = l3 = (3,524 × 10−8 см) 3 = 4,376 × 10−23 см3 V = l3 = (3,524 × 10−8 см) 3 = 4,376 × 10−23 см3
Тогда плотность Ni будет = 9,746 × 10–23 г4,376 × 10–23 см3 = 2,23 г / см3 = 9.746 × 10-23 г 4.376 × 10-23 см3 = 2,23 г / см3
Поскольку фактическая плотность Ni не близка к этой, Ni не образует простой кубической структуры.
Большинство металлических кристаллов являются одним из четырех основных типов элементарных ячеек. А пока мы сосредоточимся на трех кубических элементарных ячейках: простой кубической (которые мы уже видели), объемно-центрированной кубической элементарной ячейке и гранецентрированной кубической элементарной ячейке — все они показаны на рис. 10.50. (Обратите внимание, что на самом деле существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего 14 различных типов элементарных ячеек.Мы оставляем более сложные геометрические формы на потом в этом модуле.)
Рис. 10.50 Кубические элементарные ячейки металлов показывают (на верхних рисунках) расположение узлов решетки и (на нижних рисунках) атомов металла, расположенных в элементарной ячейке.
Некоторые металлы кристаллизуются в виде кубической элементарной ячейки с атомами во всех углах и атомом в центре, как показано на рис. 10.51. Это называется объемно-центрированным кубическим (ОЦК) твердым телом. Атомы в углах элементарной ячейки ОЦК не контактируют друг с другом, а контактируют с атомом в центре.Элементарная ячейка ОЦК содержит два атома: по одной восьмой атома в каждом из восьми углов (8 × 18 = 1 (8 × 18 = 1 атом от углов) плюс один атом от центра. Любой атом в этой структуре касается четыре атома в слое над ним и четыре атома в слое под ним. Таким образом, атом в структуре ОЦК имеет координационное число 8.
Рис. 10.51. В объемно-центрированной кубической структуре атомы в определенном слое не касаются друг друга. Каждый атом касается четырех атомов в слое выше и четырех атомов в слое ниже.
Атомы в структурах ОЦК упакованы гораздо эффективнее, чем в простой кубической структуре, занимая около 68% от общего объема. Изоморфные металлы со структурой BCC включают K, Ba, Cr, Mo, W и Fe при комнатной температуре. (Элементы или соединения, которые кристаллизуются с одинаковой структурой, считаются изоморфными.)
Многие другие металлы, такие как алюминий, медь и свинец, кристаллизуются в структуре, которая имеет кубическую элементарную ячейку с атомами во всех углах и в центре каждой грани, как показано на рисунке 10.52. Такое расположение называется гранецентрированным кубическим (ГЦК) твердым телом. Элементарная ячейка FCC содержит четыре атома: по одной восьмой атома в каждом из восьми углов (8 × 18 = 1 (8 × 18 = 1 атом от углов) и по половине атома на каждой из шести граней. (6 × 12 = 3 (6 × 12 = 3 атома от граней). Атомы в углах касаются атомов в центрах соседних граней вдоль диагоналей граней куба. Поскольку атомы находятся в одинаковых точках решетки, у них идентичная среда.
Рисунок 10.52 Гранецентрированное кубическое твердое тело имеет атомы по углам и, как следует из названия, в центрах граней его элементарных ячеек.
Атомы в системе ГЦК упакованы как можно ближе друг к другу, причем атомы занимают 74% объема. Эта структура также называется кубической плотнейшей упаковкой (CCP). В CCP есть три повторяющихся слоя гексагонально расположенных атомов. Каждый атом контактирует с шестью атомами в собственном слое, с тремя в слое выше и с тремя в слое ниже. В этом расположении каждый атом касается 12 ближайших соседей и, следовательно, имеет координационное число 12.Тот факт, что механизмы FCC и CCP эквивалентны, может быть не сразу очевиден, но почему они на самом деле являются одной и той же структурой, показано на рисунке 10.53.
Рис. 10.53 Компоновка CCP состоит из трех повторяющихся слоев (ABCABC…) гексагонально расположенных атомов. Атомы в структуре CCP имеют координационное число 12, потому что они контактируют с шестью атомами в своем слое, плюс три атома в слое выше и три атома в слое ниже. Поворачивая перспективу, мы видим, что структура CCP имеет элементарную ячейку с гранью, содержащей атом из слоя A в одном углу, атомы из слоя B по диагонали (в двух углах и в середине лица) и атом из слоя C в оставшемся углу.Это то же самое, что и гранецентрированное кубическое расположение.
Поскольку более тесная упаковка максимизирует общее притяжение между атомами и минимизирует общую межмолекулярную энергию, атомы в большинстве металлов упаковываются таким образом. Мы находим два типа плотнейшей упаковки в простых металлических кристаллических структурах: CCP, с которой мы уже сталкивались, и гексагональная плотнейшая упаковка (HCP), показанная на рис. 10.54. Оба состоят из повторяющихся слоев гексагонально расположенных атомов. В обоих типах второй слой (B) помещается на первый слой (A), так что каждый атом во втором слое контактирует с тремя атомами в первом слое.Третий слой размещается одним из двух способов. В HCP атомы в третьем слое находятся непосредственно над атомами в первом слое (т.е. третий слой также относится к типу A), а наложение состоит из чередующихся плотноупакованных слоев типа A и типа B (то есть ABABAB). В CCP атомы в третьем слое не находятся над атомами в любом из первых двух слоев (т. Е. Третий слой относится к типу C), а наложение состоит из чередующихся плотноупакованных слоев типа A, типа B и типа C ( т.е. ABCABCABC ⋯). Около двух третей всех металлов кристаллизуются в виде плотноупакованных массивов с координационным числом 12.Металлы, которые кристаллизуются в структуре HCP, включают Cd, Co, Li, Mg, Na и Zn, а металлы, которые кристаллизуются в структуре CCP, включают Ag, Al, Ca, Cu, Ni, Pb и Pt.
Рис. 10.54. В обоих типах плотнейшей упаковки атомы упакованы максимально компактно. Гексагональная плотнейшая упаковка состоит из двух чередующихся слоев (ABABAB…). Плотнейшая кубическая упаковка состоит из трех чередующихся слоев (ABCABCABC…).
Пример 10.15
Расчет атомного радиуса и плотности металлов, часть 2
Кальций кристаллизуется в кубической гранецентрированной структуре.Длина ребра его элементарной ячейки составляет 558,8 пм.
(а) Каков атомный радиус Са в этой структуре?
(b) Рассчитайте плотность Ca.
Решение
(a) В структуре ГЦК атомы Са контактируют друг с другом по диагонали грани, поэтому длина диагонали равна четырем атомным радиусам Са (d = 4 r ). Два смежных ребра и диагональ грани образуют прямоугольный треугольник, длина каждой стороны которого равна 558,8 пм, а длина гипотенузы равна четырем атомным радиусам Са:
а2 + а2 = d2⟶ (558.8pm) 2+ (558,5pm) 2 = (4r) 2a2 + a2 = d2⟶ (558,8pm) 2+ (558,5pm) 2 = (4r) 2
Решение этого дает r = (558,8 пм) 2+ (558,5 пм) 216 = 197,6 пм для радиуса Са. R = (558,8 пм) 2+ (558,5 пм) 216 = 197,6 пм для радиуса Са.
(b) Плотность определяется как плотность = масса-объем. Плотность = масса-объем. Плотность кальция можно определить, определив плотность его элементарной ячейки: например, массу, содержащуюся в элементарной ячейке, деленную на объем элементарной ячейки. Гранецентрированная элементарная ячейка Са имеет одну восьмую атома на каждом из восьми углов (8 × 18 = 1 (8 × 18 = 1 атом) и половина атома на каждой из шести граней 6 × 12 = 36 × 12 = 3 атома), всего четыре атома в элементарной ячейке.
Массу элементарной ячейки можно найти по:
1 элементарная ячейка Ca × 4 атома Ca 1 элементарная ячейка Ca × 1 моль Ca6,022 × 1023 атомов Ca × 40,078 г 1 моль Ca = 2,662 × 10−22 г 1 элементарная ячейка Ca × 4 атома Ca 1 элементарная ячейка Ca × 1 моль Ca6,022 × 1023 атомов Ca × 40,078 г 1 моль Ca = 2,662 × 10−22 г
Объем элементарной ячейки Са можно определить по:
V = a3 = (558,8 × 10−10 см) 3 = 1,745 × 10−22 см3 V = a3 = (558,8 × 10−10 см) 3 = 1,745 × 10−22 см3
(Обратите внимание, что длина края была преобразована из pm в см, чтобы получить обычные единицы объема для плотности.)
Тогда плотность Ca = 2.662 × 10–22 г 1,745 × 10–22 см3 = 1,53 г / см3 Ca = 2,662 × 10–22 г 1,745 × 10–22 см3 = 1,53 г / см3
Проверьте свои знания
Серебро кристаллизуется в структуре FCC. Длина ребра его элементарной ячейки 409 мкм.
(а) Каков атомный радиус Ag в этой структуре?
(б) Рассчитайте плотность Ag.
Ответ:
(а) 144 вечера; (б) 10,5 г / см 3
В общем, элементарная ячейка определяется длиной трех осей ( a , b и c ) и углами ( α , β и γ ) между ними, как проиллюстрировано на рисунке 10.55. Оси определяются как длины между точками пространственной решетки. Следовательно, оси элементарной ячейки соединяют точки с идентичной средой.
Рис. 10.55 Элементарная ячейка определяется длиной трех ее осей ( a , b и c ) и углами ( α , β и γ ) между осями.
Существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего четырнадцать различных элементарных ячеек, которые имеют форму, показанную на рисунке 10.56.
Рис. 10.56. Существует семь различных систем решеток и 14 различных элементарных ячеек.
Структуры ионных кристаллов
Ионные кристаллы состоят из двух или более различных типов ионов, которые обычно имеют разные размеры. Упаковка этих ионов в кристаллическую структуру более сложна, чем упаковка атомов металла того же размера.
Большинство одноатомных ионов ведут себя как заряженные сферы, и их притяжение для ионов противоположного заряда одинаково во всех направлениях.Следовательно, стабильные структуры для ионных соединений возникают (1), когда ионы одного заряда окружены как можно большим количеством ионов противоположного заряда, и (2) когда катионы и анионы контактируют друг с другом. Структуры определяются двумя основными факторами: относительными размерами ионов и соотношением количества положительных и отрицательных ионов в соединении.
В простых ионных структурах мы обычно находим анионы, которые обычно больше, чем катионы, расположенные в виде плотноупакованного массива.(Как было замечено ранее, дополнительные электроны, притянутые к одному и тому же ядру, делают анионы крупнее, а меньшее количество электронов, притягиваемых к тому же ядру, делает катионы меньше по сравнению с атомами, из которых они образованы.) Более мелкие катионы обычно занимают один из двух типов дырок ( или пустоты), оставшиеся между анионами. Меньшее из отверстий находится между тремя анионами в одной плоскости и одним анионом в соседней плоскости. Четыре аниона, окружающие это отверстие, расположены по углам тетраэдра, поэтому отверстие называется тетраэдрическим отверстием.Дыра большего размера находится в центре шести анионов (три в одном слое и три в соседнем слое), расположенных в углах октаэдра; это называется октаэдрическим отверстием. На рисунке 10.57 показаны оба этих типа отверстий.
Рис. 10.57. Катионы могут занимать два типа дырок между анионами: октаэдрические дырки и тетраэдрические дырки.
В зависимости от относительных размеров катионов и анионов, катионы ионного соединения могут занимать тетраэдрические или октаэдрические отверстия, как показано на рисунке 10.58. Относительно небольшие катионы занимают тетраэдрические отверстия, а более крупные катионы занимают октаэдрические отверстия. Если катионы слишком велики, чтобы поместиться в октаэдрические отверстия, анионы могут принять более открытую структуру, такую как простой кубический массив. Тогда более крупные катионы могут занять большие кубические отверстия, что стало возможным благодаря более открытому пространству.
Рис. 10.58 Размер катиона и форма отверстия, занимаемого соединением, напрямую связаны.
Есть две тетраэдрические дырки для каждого аниона в массиве анионов HCP или CCP.Соединение, которое кристаллизуется в виде плотноупакованного массива анионов с катионами в тетраэдрических отверстиях, может иметь максимальное соотношение катион: анион 2: 1; все тетраэдрические отверстия заполнены при этом соотношении. Примеры включают Li 2 O, Na 2 O, Li 2 S и Na 2 S. Соединения с соотношением менее 2: 1 также могут кристаллизоваться в виде плотноупакованного массива анионов с катионами. в тетраэдрических отверстиях, если подходят ионные размеры. Однако в этих соединениях часть тетраэдрических дырок остается вакантной.
Пример 10.16
Заполнение четырехгранных отверстий
Сульфид цинка является важным промышленным источником цинка, а также используется в качестве белого пигмента в красках. Сульфид цинка кристаллизуется с ионами цинка, занимающими половину тетраэдрических отверстий в плотноупакованном массиве сульфид-ионов. Какая формула сульфида цинка?
Решение
Поскольку на каждый анион (сульфид-ион) приходится две тетраэдрических дырки, и половина этих дырок занята ионами цинка, должно быть 12 × 2,12 × 2, или 1 ион цинка на сульфидный ион.Таким образом, формула ZnS.
Проверьте свои знания
Селенид лития можно описать как плотноупакованный массив селенид-ионов с ионами лития во всех тетраэдрических дырках. Какая у него формула селенида лития?
Отношение октаэдрических дырок к анионам в структуре HCP или CCP составляет 1: 1. Таким образом, соединения с катионами в октаэдрических дырках в плотноупакованном массиве анионов могут иметь максимальное соотношение катион: анион 1: 1. Например, в NiO, MnS, NaCl и KH все октаэдрические отверстия заполнены.Отношения менее 1: 1 наблюдаются, когда некоторые из октаэдрических отверстий остаются пустыми.
Пример 10.17
Стехиометрия ионных соединений
Сапфир — это оксид алюминия. Оксид алюминия кристаллизуется с ионами алюминия в двух третях октаэдрических дырок в плотноупакованном массиве оксидных ионов. Какая формула у оксида алюминия?
Решение
Поскольку на каждый анион (оксидный ион) приходится одна октаэдрическая дырка и только две трети этих дырок заняты, отношение алюминия к кислороду должно составлять 2323: 1, что дает Al2 / 3O.Al2 / 3O. Простейшее целочисленное отношение 2: 3, поэтому формула Al 2 O 3 .
Проверьте свои знания
Белый пигмент оксида титана кристаллизуется с ионами титана в половине октаэдрических отверстий в плотноупакованном массиве оксидных ионов. Какая формула оксида титана?
В простом кубическом массиве анионов есть одно кубическое отверстие, которое может быть занято катионом для каждого аниона в массиве. В CsCl и других соединениях с такой же структурой все кубические дырки заняты.Половина кубических дырок занята в SrH 2 , UO 2 , SrCl 2 и CaF 2 .
Различные типы ионных соединений часто кристаллизуются в одной и той же структуре, если относительные размеры их ионов и их стехиометрия (две основные характеристики, определяющие структуру) схожи.
Элементарные ячейки ионных соединений
Многие ионные соединения кристаллизуются с кубическими элементарными ячейками, и мы будем использовать эти соединения, чтобы описать общие особенности ионных структур.
Когда ионное соединение состоит из катионов и анионов одинакового размера в соотношении 1: 1, оно обычно образует простую кубическую структуру. Примером этого является хлорид цезия, CsCl (проиллюстрированный на рисунке 10.59), причем Cs + и Cl — имеют радиусы 174 мкм и 181 мкм соответственно. Мы можем представить это как ионы хлорида, образующие простую кубическую элементарную ячейку с ионом цезия в центре; или в виде ионов цезия, образующих элементарную ячейку с ионом хлорида в центре; или в виде простых кубических элементарных ячеек, образованных ионами Cs + , перекрывающих элементарные ячейки, образованные ионами Cl — .Ионы цезия и ионы хлора соприкасаются по диагоналям тела элементарных ячеек. Один ион цезия и один ион хлорида присутствуют в элементарной ячейке, что дает стехиометрию 1: 1, требуемую формулой для хлорида цезия. Обратите внимание, что в центре ячейки нет точки решетки, и CsCl не является структурой BCC, потому что ион цезия не идентичен иону хлорида.
Рис. 10.59. Ионные соединения с катионами и анионами аналогичного размера, такие как CsCl, обычно образуют простую кубическую структуру.Их можно описать элементарными ячейками с катионами по углам или анионами по углам.
Мы сказали, что расположение точек решетки произвольно. Это иллюстрируется альтернативным описанием структуры CsCl, в которой узлы решетки расположены в центрах ионов цезия. В этом описании ионы цезия расположены в точках решетки в углах ячейки, а ион хлора расположен в центре ячейки. Две элементарные ячейки разные, но они описывают идентичные структуры.
Когда ионное соединение состоит из катионов и анионов в соотношении 1: 1, которые значительно различаются по размеру, оно обычно кристаллизуется с помощью элементарной ячейки FCC, как показано на рисунке 10.60. Примером этого является хлорид натрия, NaCl, причем Na + и Cl — имеют радиусы 102 и 181 мкм соответственно. Мы можем представить это как ионы хлора, образующие ячейку FCC, причем ионы натрия расположены в октаэдрических отверстиях в середине краев ячейки и в центре ячейки.Ионы натрия и хлора соприкасаются друг с другом по краям ячейки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1: 1, требуемую формулой NaCl.
Рис. 10.60 Ионные соединения с анионами, которые намного крупнее катионов, например NaCl, обычно образуют структуру ГЦК. Их можно описать элементарными ячейками ГЦК с катионами в октаэдрических дырках.
Кубическая форма сульфида цинка, цинковая обманка, также кристаллизуется в элементарной ячейке FCC, как показано на рисунке 10.61. Эта структура содержит ионы сульфида в узлах решетки ГЦК-решетки. (Расположение сульфид-ионов идентично расположению хлорид-ионов в хлориде натрия.) Радиус иона цинка составляет всего около 40% от радиуса сульфид-иона, поэтому эти маленькие ионы Zn 2+ расположены в чередование четырехгранных отверстий, то есть в одной половине четырехгранных отверстий. В элементарной ячейке четыре иона цинка и четыре иона сульфида, что дает эмпирическую формулу ZnS.
Рисунок 10.61 ZnS, сульфид цинка (или цинковая обманка) образует элементарную ячейку ГЦК с ионами сульфида в узлах решетки и ионами цинка гораздо меньшего размера, занимающими половину тетраэдрических отверстий в структуре.
Элементарная ячейка с фторидом кальция, подобная той, что показана на рисунке 10.62, также является элементарной ячейкой FCC, но в этом случае катионы расположены в узлах решетки; эквивалентные ионы кальция расположены в узлах решетки ГЦК-решетки. Все тетраэдрические позиции в массиве ГЦК ионов кальция заняты ионами фтора.В элементарной ячейке четыре иона кальция и восемь ионов фтора, что дает соотношение кальций: фтор 1: 2 в соответствии с химической формулой CaF 2 . Внимательное изучение рисунка 10.62 покажет простой кубический массив ионов фтора с ионами кальция в одной половине кубических дырок. Структуру нельзя описать в терминах пространственной решетки точек на фторид-ионах, потому что не все фторид-ионы имеют одинаковое окружение. Ориентация четырех ионов кальция относительно ионов фтора различается.
Рис. 10.62 Фторид кальция, CaF 2 , образует элементарную ячейку ГЦК с ионами кальция (зеленый) в узлах решетки и ионами фтора (красный), занимающими все тетраэдрические узлы между ними.
Расчет ионных радиусов
Если мы знаем длину края элементарной ячейки ионного соединения и положение ионов в ячейке, мы можем вычислить ионные радиусы для ионов в соединении, если мы сделаем предположения об индивидуальных формах ионов и контактах.
Пример 10.18
Расчет ионных радиусов
Длина края элементарной ячейки LiCl (NaCl-подобная структура, ГЦК) составляет 0,514 нм или 5,14 Å. Предполагая, что ион лития достаточно мал, чтобы ионы хлора контактировали, как показано на рисунке 10.60, рассчитайте ионный радиус для иона хлорида.
Примечание. Единица измерения длины, Å, часто используется для представления размеров в атомном масштабе и эквивалентна 10 −10 м.
Решение
На лицевой стороне элементарной ячейки LiCl ионы хлора контактируют друг с другом по диагонали грани:
Нарисовав прямоугольный треугольник на поверхности элементарной ячейки, мы видим, что длина диагонали равна четырем радиусам хлорида (один радиус от каждого углового хлорида и один диаметр, равный двум радиусам, от иона хлорида в центре). грани), поэтому d = 4 r .Из теоремы Пифагора имеем:
, что дает:
(0,514 нм) 2+ (0,514 нм) 2 = (4r) 2 = 16r2 (0,514 нм) 2+ (0,514 нм) 2 = (4r) 2 = 16r2
Решение этого дает:
r = (0,514 нм) 2+ (0,514 нм) 216 = 0,182 нм (1,82 Å) для радиуса Cl-. r = (0,514 нм) 2+ (0,514 нм) 216 = 0,182 нм (1,82 Å) для Cl- радиус.
Проверьте свои знания
Длина ребра элементарной ячейки KCl (NaCl-подобная структура, ГЦК) составляет 6,28 Å. Предполагая, что анион-катионный контакт проходит по краю ячейки, рассчитайте радиус иона калия. Радиус хлорид-иона равен 1.82 Å.
Ответ:
Радиус иона калия 1,33 Å.
Важно понимать, что значения ионных радиусов, рассчитанные на основе длин краев элементарных ячеек, зависят от множества предположений, таких как идеальная сферическая форма для ионов, которые в лучшем случае являются приблизительными. Следовательно, такие расчетные значения сами по себе являются приблизительными, и сравнения нельзя зайти слишком далеко. Тем не менее, этот метод оказался полезным для расчета ионных радиусов на основе экспериментальных измерений, таких как рентгеновские кристаллографические определения.
Рентгеновская кристаллография
Размер элементарной ячейки и расположение атомов в кристалле могут быть определены из измерений дифракции рентгеновских лучей на кристалле, называемой рентгеновской кристаллографией. Дифракция — это изменение направления движения электромагнитной волны, когда она встречает физический барьер, размеры которого сопоставимы с размерами длины волны света. Рентгеновские лучи — это электромагнитное излучение с длиной волны, равной расстоянию между соседними атомами в кристаллах (порядка нескольких Å).
Когда пучок монохроматических рентгеновских лучей попадает на кристалл, его лучи рассеиваются во всех направлениях атомами внутри кристалла. Когда рассеянные волны, распространяющиеся в одном направлении, сталкиваются друг с другом, они претерпевают интерференцию , процесс, при котором волны объединяются, приводя к увеличению или уменьшению амплитуды (интенсивности) в зависимости от степени, в которой максимумы объединяющихся волн находятся разделены (см. рисунок 10.63).
Рис. 10.63 Световые волны, занимающие одно и то же пространство, испытывают интерференцию, объединяясь, давая волны большей (а) или меньшей (б) интенсивности, в зависимости от разделения их максимумов и минимумов.
Когда рентгеновские лучи определенной длины волны, λ , рассеиваются атомами в соседних кристаллических плоскостях, разделенных расстоянием, d , они могут претерпевать конструктивную интерференцию, когда разница между расстояниями, пройденными двумя волнами до их комбинация представляет собой целочисленный коэффициент длины волны n . Это условие выполняется, когда угол дифрагированного луча, θ , связан с длиной волны и межатомным расстоянием уравнением:
Это соотношение известно как уравнение Брэгга в честь У.Х. Брэгг, английский физик, первым объяснивший это явление. На рисунке 10.64 показаны два примера дифрагированных волн от одних и тех же двух плоскостей кристалла. На рисунке слева изображены волны, дифрагированные под углом Брэгга, приводящие к конструктивной интерференции, а на рисунке справа показаны дифракция и другой угол, который не удовлетворяет условию Брэгга, что приводит к деструктивной интерференции.
Рис. 10.64. Дифракция рентгеновских лучей, рассеянных атомами внутри кристалла, позволяет определить расстояние между атомами.Верхнее изображение показывает конструктивную интерференцию между двумя рассеянными волнами и результирующей дифрагированной волной высокой интенсивности. На нижнем изображении показаны деструктивная интерференция и дифрагированная волна низкой интенсивности.
Ссылка на обучение
Посетите этот сайт для получения дополнительных сведений об уравнении Брэгга и симуляторе, который позволяет исследовать влияние каждой переменной на интенсивность дифрагированной волны.
Рентгеновский дифрактометр, такой как изображенный на рисунке 10.65, может использоваться для измерения углов, под которыми дифрагируют рентгеновские лучи при взаимодействии с кристаллом, как описано ранее. Из таких измерений можно использовать уравнение Брэгга для вычисления расстояний между атомами, как показано в следующем примере упражнения.
Рис. 10.65. (A) В дифрактометре пучок рентгеновских лучей попадает на кристаллический материал, создавая (b) картину дифракции рентгеновских лучей, которая может быть проанализирована для определения кристаллической структуры.
Пример 10.19
Использование уравнения Брэгга
В дифрактометре рентгеновские лучи с длиной волны 0.1315 нм были использованы для получения дифракционной картины для меди. Дифракция первого порядка ( n = 1) произошла под углом θ = 25,25 °. Определите расстояние между дифрагирующими плоскостями в меди.
Решение
Расстояние между плоскостями находится путем решения уравнения Брэгга: nλ = 2 d sin θ для d .
Это дает: d = nλ2sinθ = 1 (0,1315 нм) 2sin (25,25 °) = 0,154 нм d = nλ2sinθ = 1 (0,1315 нм) 2sin (25,25 °) = 0,154 нм
Проверьте свои знания
Кристалл с расстоянием между плоскостями 0.394 нм дифрагирует рентгеновские лучи с длиной волны 0,147 нм. Каков угол дифракции первого порядка?
Портрет химика
Рентгеновский кристаллограф Розалинд Франклин
Открытие структуры ДНК в 1953 году Фрэнсисом Криком и Джеймсом Уотсоном — одно из величайших достижений в истории науки. Они были удостоены Нобелевской премии по физиологии и медицине 1962 года вместе с Морисом Уилкинсом, предоставившим экспериментальное доказательство структуры ДНК. Британский химик Розалинд Франклин внесла неоценимый вклад в это грандиозное достижение своей работой по измерению рентгеновских дифракционных изображений ДНК.В начале своей карьеры исследования Франклин структуры углей оказались полезными для британских военных действий. В начале 1950-х годов Франклин и докторант Реймонд Гослинг переключили свое внимание на биологические системы и обнаружили, что ДНК состоит из двух форм: длинного тонкого волокна, образующегося при намокании (тип «B»), и короткого широкого волокна, образующегося при сушке ( наберите «А»). Ее рентгеновские дифракционные изображения ДНК (рис. 10.66) предоставили важную информацию, которая позволила Уотсону и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры.Франклин также провел новаторское исследование вирусов и РНК, содержащей их генетическую информацию, обнаружив новую информацию, которая радикально изменила совокупность знаний в этой области. После развития рака яичников Франклин продолжала работать до своей смерти в 1958 году в возрасте 37 лет. Среди множества посмертных признаний ее работы, Чикагская медицинская школа Финчского университета медицинских наук изменила свое название на Университет медицины и науки Розалинды Франклин в 2004 году. , и приняла изображение ее знаменитого рентгеновского дифракционного изображения ДНК в качестве официального логотипа университета.
Рис. 10.66 На этом рисунке показано изображение дифракции рентгеновских лучей, подобное тому, которое Франклин нашла в своем исследовании. (кредит: Национальный институт здоровья)
9.2: Ионная связь и энергия решетки
Навыки для развития
- Для описания характеристик ионной связи.
- Для количественного описания энергетических факторов, участвующих в образовании ионной связи.
Ионы — это электрически заряженные атомы или молекулы. Катионы, заряжены положительно, а анионы , заряжены отрицательно. Ионы образуются, когда атомы приобретают или теряют валентные электроны. Поскольку электроны заряжены отрицательно, атом, потерявший один или несколько электронов, станет заряженным положительно; атом, который получает один или несколько электронов, становится отрицательно заряженным. Ионная связь — это притяжение между положительно и отрицательно заряженными ионами. Эти противоположно заряженные ионы притягиваются друг к другу, образуя ионные сети, или решеток, .Электростатика объясняет, почему это происходит: противоположные заряды притягиваются, а одинаковые — отталкиваются. Когда многие ионы притягиваются друг к другу, они образуют большие упорядоченные кристаллические решетки, в которых каждый ион окружен ионами противоположного заряда. Обычно, когда металлы реагируют с неметаллами, электроны передаются от металлов к неметаллам. Металлы образуют положительно заряженные ионы, а неметаллы образуют отрицательно заряженные ионы.
Свойства ионных соединений вытекают из упорядоченной структуры кристаллической решетки прочно связанных заряженных частиц, из которых они состоят.Ионные соединения имеют тенденцию иметь высокие температуры плавления и кипения, потому что притяжение между ионами в решетке очень сильное. Выдвижение ионов из решетки разрушает структуру, поэтому ионные соединения имеют тенденцию быть хрупкими, а не податливыми. Ионные соединения не проводят электричество в твердом состоянии, потому что ионы не могут свободно перемещаться по решетке; однако, когда ионные соединения растворены, они могут диссоциировать на отдельные ионы, которые свободно перемещаются через раствор и, следовательно, хорошо проводят электричество.
Создание ионных связей
Ионные связи образуются при химической реакции металлов и неметаллов. По определению, металл относительно стабилен, если он теряет электроны, образуя полную валентную оболочку, и становится положительно заряженным. Точно так же неметалл становится стабильным, приобретая электроны, чтобы заполнить свою валентную оболочку и стать отрицательно заряженным. Когда металлы и неметаллы вступают в реакцию, металлы теряют электроны, передавая их неметаллам, которые их приобретают. Следовательно, образуются ионы, которые мгновенно притягиваются друг к другу — ионная связь.В общем ионном соединении положительные и отрицательные заряды должны быть сбалансированы, потому что электроны не могут быть созданы или уничтожены, а только перенесены. Таким образом, общее количество электронов, потерянных катионными частицами, должно равняться общему количеству электронов, приобретенных анионными частицами.
Ионные соединения удерживаются вместе за счет электростатических сил, которые в классической физике описываются законом Кулона . Согласно этому закону, энергия электростатического притяжения (\ (E \)) между двумя заряженными частицами пропорциональна величине зарядов (\ (Q) 1 \) и \ (Q_2 \)) и обратно пропорциональна величине заряда. межъядерное расстояние между частицами (\ (r \)):
\ [E \ propto \ dfrac {Q_ {1} Q_ {2}} {r} \ label {Eq1a} \]
Энергия притяжения (\ (E \)) — это тип потенциальной энергии , так как она основана на положении заряженных частиц относительно друг друга.Если две частицы имеют противоположные заряды (как в ионных соединениях), значение (\ (E \)) будет отрицательным, что означает, что энергия высвобождается за счет сближения частиц, то есть частицы естественным образом притягиваются друг с другом. Согласно закону Кулона, чем больше величина зарядов на каждой частице, тем сильнее будет притяжение. Так, например, Mg 2 + и O 2- будут иметь более сильное притяжение, чем Na + и Cl —, из-за большего заряда.Кроме того, чем ближе друг к другу заряды, тем сильнее притяжение. Следовательно, ионы меньшего размера также образуют более сильные ионные связи.
В ионной решетке одновременно взаимодействуют более двух заряженных частиц, высвобождая количество энергии, известное как энергия решетки . Энергия решетки не совсем такая, как предсказывается законом Кулона, но применяются те же общие принципы электростатического притяжения. В ионном соединении значение энергии решетки соответствует силе ионной связи.
Пример \ (\ PageIndex {1} \): хлорид натрия
Например, в реакции Na (натрия) и Cl (хлора) каждый атом Cl отнимает один электрон от атома Na. Следовательно, каждый Na становится катионом Na + , а каждый атом Cl становится анионом Cl —. Из-за их противоположных зарядов они притягиваются друг к другу, образуя ионную решетку. Формула (отношение положительных и отрицательных ионов) в решетке \ (\ ce {NaCl} \).
\ [\ ce {2Na (s) + Cl2 (g) \ rightarrow 2NaCl (s)} \ nonumber \]
Эти ионы расположены в твердом \ (\ ce {NaCl} \) в регулярном трехмерном расположении (или решетке):
Решетка NaCl.(слева) трехмерная структура и (справа) простой двухмерный срез через решетку. Изображения использованы с разрешения Википедии и Майка Блабера.
Хлор имеет высокое сродство к электронам, а натрий — низкую энергию ионизации. Таким образом, хлор получает электрон от атома натрия. Это можно представить с помощью точечных символов Льюиса, показывающих валентные электроны в каждом атоме (здесь мы будем рассматривать один атом хлора, а не Cl 2 ):
Изогнутая стрелка указывает на перенос электрона от натрия к хлору с образованием иона металла Na + и иона хлорида Cl — .Каждый ион теперь имеет полную валентную оболочку из восьми электронов:
Электронная конфигурация ионов
Если ионная связь становится сильнее для соединений с более высокозарядными ионами, почему натрий теряет только один электрон, образуя Na + , а не, скажем, Na 2+ ? Число электронов, передаваемых между ионами, зависит не только от энергии, выделяемой при образовании решетки, но и от энергии, необходимой для отрыва электронов от одного атома и добавления их к другому.Другими словами, энергия решетки, высвобождаемая при образовании ионного соединения, должна быть сбалансирована с требуемой энергией ионизации и сродством к электрону при образовании ионов. Поскольку ион Na + имеет электронную конфигурацию благородного газа, удаление следующего электрона из этого стабильного расположения потребует больше энергии, чем выделяется во время образования решетки (натрий I 2 = 4560 кДж / моль). Таким образом, натрий присутствует в ионных соединениях как Na + , а не Na 2+ .Точно так же добавление электрона для заполнения валентной оболочки (и достижения электронной конфигурации благородного газа) экзотермично или лишь слегка эндотермично. Чтобы добавить дополнительный электрон в новую подоболочку , требуется огромная энергия — больше, чем энергия решетки. Таким образом, мы находим Cl — в ионных соединениях, но не Cl 2 — . Как правило, элементы основной группы образуют ионы только с ближайшей электронной конфигурацией благородного газа — в противном случае энергии решетки было бы недостаточно для компенсации энергии ионизации / сродства к электрону
Типичные значения энергии решетки могут компенсировать такие большие значения, как I 3 для валентных электронов (т.е.е. может оторвать до 3 валентных электронов от катионов). Поскольку для большинства переходных металлов требуется удаление более 3 электронов для достижения сердцевины из благородного газа, они не встречаются в ионных соединениях с сердцевиной из благородного газа. Переходный металл всегда сначала теряет электроны из подоболочки более высокой «s», а затем теряет электроны из нижней подоболочки «d». (Оставшиеся электроны в незаполненной d подоболочке являются причиной ярких цветов, наблюдаемых во многих соединениях переходных металлов!) Например, ионы железа , а не образуют ядро благородного газа:
- Fe: [Ar] 4s 2 3d 6
- Fe 2+ : [Ar] 3d 6
- Fe 3+ : [Ar] 3d 5
Некоторые ионы металлов могут образовывать ядро псевдо благородного газа (и быть бесцветными), например:
- Ag: [Kr] 5s 1 4d 10 Ag + [Kr] 4d 10 Соединение: AgCl
- Cd: [Kr] 5s 2 4d 10 Cd 2+ [Kr] 4d 10 Соединение: CdS
Примечание: атомы серебра и кадмия потеряли 5s-электроны при достижении ионного состояния.Помните, что атомы всегда сначала теряли электроны из подоболочки с наибольшим квантовым числом n (то есть за 5 секунд до 4d).
Когда положительный ион формируется из атома, электронов всегда теряются первыми из подоболочки с наибольшим главным квантовым числом.
Многоатомные ионы
Не все ионные соединения образуются только из двух элементов. Существует много многоатомных ионов , в которых два или более атома связаны ковалентными связями.Они образуют стабильную группу, несущую заряд (положительный или отрицательный). Группа атомов в целом действует как заряженная разновидность, образуя ионное соединение с противоположно заряженным ионом. Многоатомные ионы могут быть как положительными, так и отрицательными, например:
- NH 4 + (аммоний) = катион
- SO 4 2- (сульфат) = анион
Принципы ионной связи с многоатомными ионами такие же, как и с одноатомными ионами.Противоположно заряженные ионы объединяются, образуя кристаллическую решетку, высвобождая энергию решетки. В зависимости от формы и заряда многоатомных ионов эти соединения могут образовывать кристаллические решетки с интересными и сложными структурами.
Энергетика образования ионных связей
Ионные связи образуются, когда положительно и отрицательно заряженные ионы притягиваются электростатическими силами. Рассмотрим одну пару ионов, один катион и один анион. Насколько сильной будет сила их притяжения? Мы можем переписать закон Кулона (Equation \ ref {Eq1a}) количественно для любых двух заряженных частиц:
\ [E = k \ dfrac {Q_ {1} Q_ {2}} {r} \ label {Eq1b} \]
, где заряд каждого иона представлен символом \ ( Q \) , а межъядерное расстояние между частицами представлено символом (\ (r \)).Константа пропорциональности k равна 2,31 × 10 −28 Дж · м. Это значение \ ( k \) включает заряд одного электрона (1,6022 × 10 −19 Кл) для каждого иона. Уравнение также можно записать, используя заряд каждого иона, выраженный в кулонах (Кл), включенный в константу. В этом случае константа пропорциональности k равна 8,999 × 109 Дж · м / C 2 . В приведенном примере Q 1 = +1 (1,6022 × 10 −19 C) и Q 2 = −1 (1.6022 × 10 −19 С). Если \ (Q_1 \) и \ (Q_2 \) имеют противоположные знаки (как в \ (\ ce {NaCl} \), например, где Q 1 равно +1 для Na + и Q 2 равно -1 для Cl — ), тогда E отрицательно, что означает, что энергия выделяется , когда противоположно заряженные ионы сближаются с бесконечного расстояния, чтобы сформировать изолированную ионную пару.
Энергия всегда высвобождается при образовании связи и, соответственно, всегда требуется энергия для разрыва связи.
Как показано зеленой кривой в нижней половине рисунка \ (\ PageIndex {1} \), максимальная энергия будет выделяться, когда ионы бесконечно близки друг к другу, при r = 0. Поскольку ионы занимают пространство и имеют структуру с положительным ядром, окруженным электронами, однако они не могут быть бесконечно близко друг к другу. На очень коротких расстояниях отталкивающие электрон-электронные взаимодействия между электронами на соседних ионах становятся сильнее, чем притягивающие взаимодействия между ионами с противоположными зарядами, как показано красной кривой в верхней половине рисунка \ (\ PageIndex {1} \).Полная энергия системы — это баланс между притягивающим и отталкивающим взаимодействиями. Пурпурная кривая на рисунке \ (\ PageIndex {1} \) показывает, что полная энергия системы достигает минимума при r 0 , точке, где электростатическое отталкивание и притяжение точно уравновешены. Это расстояние такое же, как экспериментально измеренное расстояние соединения .
Рисунок \ (\ PageIndex {1} \): График потенциальной энергии в зависимости от межъядерного расстояния для взаимодействия между газообразным ионом Na + и газообразным ионом Cl — .{23} \; \ cancel {ion \; пара} / моль \ вправо) = — 589 \; кДж / моль \ label {Eq3} \]
Это энергия, выделяемая при образовании 1 моль газообразных ионных пар, не , когда 1 моль положительных и отрицательных ионов конденсируется с образованием кристаллической решетки. Из-за дальнодействующих взаимодействий в структуре решетки эта энергия не соответствует непосредственно энергии решетки кристаллического твердого тела. Однако большое отрицательное значение указывает на то, что объединение положительных и отрицательных ионов энергетически очень выгодно, независимо от того, образуется ли ионная пара или кристаллическая решетка.
| Соединение | Энергия решетки (кДж / моль) |
|---|---|
| LiF | 1024 |
| LiI | 744 |
| NaF | 911 |
| NaCl | 788 |
| NaI | 693 |
| KF | 815 |
| KBr | 682 |
| КИ | 641 |
| MgF 2 | 2910 |
| SrCl 2 | 2130 |
| MgO | 3938 |
Подытожим важные моменты, касающиеся ионной связи:
- При r 0 ионы более стабильны (имеют более низкую потенциальную энергию), чем они находятся на бесконечном межъядерном расстоянии.Когда противоположно заряженные ионы собираются вместе от r = ∞ до r = r 0 , энергия системы понижается (энергия высвобождается).
- Из-за низкой потенциальной энергии при r 0 системе необходимо добавить энергию для разделения ионов. Необходимое количество энергии — это энергия связи.
- Энергия системы достигает минимума на определенном межъядерном расстоянии (расстояние связи).
Пример \ (\ PageIndex {2} \): LiF
Рассчитайте количество энергии, выделяющейся при образовании 1 моль газообразных ионных пар Li + F — из разделенных ионов.Наблюдаемое межъядерное расстояние в газовой фазе составляет 156 пм.
Дано: катион и анион, количество и межъядерное расстояние
Запрошено: энергия, выделяемая при образовании пар газообразных ионов
Стратегия:
Подставьте соответствующие значения в уравнение \ (\ ref {Eq1b} \), чтобы получить энергию, выделяемую при образовании единственной ионной пары, а затем умножьте это значение на число Авогадро, чтобы получить энергию, выделяемую на моль.{23} \ cancel {\ text {ion pair}} / моль \ right) \\ [5pt] & −891 \; кДж / моль \ end {align *} \]
Поскольку Li + и F – меньше, чем Na + и Cl – (см. Раздел 7.3), межъядерное расстояние в LiF короче, чем в NaCl. Следовательно, в соответствии с уравнением \ (\ ref {Eq1b} \), при образовании 1 моль газообразных ионных пар Li + F — (-891 кДж / моль) выделяется гораздо больше энергии, чем когда 1 моль образуются газообразные ионные пары Na + Cl — (-589 кДж / моль).
Упражнение \ (\ PageIndex {2} \): оксид магния
Рассчитайте количество энергии, выделяющейся при образовании 1 моль газообразных ионных пар \ (\ ce {MgO} \) из разделенных ионов. Межъядерное расстояние в газовой фазе составляет 175 пм.
- Ответ
−3180 кДж / моль = −3,18 × 10 3 кДж / моль
Сводка
Ионные соединения образуются, когда электроны переносятся между атомами или группами атомов с образованием заряженных ионов, которые затем образуют структуру кристаллической решетки из-за электростатического притяжения.Образование ионных соединений обычно чрезвычайно экзотермично . Сила электростатического притяжения между ионами с противоположными зарядами прямо пропорциональна величине зарядов на ионах и обратно пропорциональна межъядерному расстоянию. Полная энергия системы представляет собой баланс между отталкивающими взаимодействиями между электронами на соседних ионах и притягивающими взаимодействиями между ионами с противоположными зарядами.
Решетчатые структуры в кристаллических твердых телах — химия
Более 90% природных и искусственных твердых тел являются кристаллическими.Большинство твердых веществ образуются с регулярным расположением своих частиц, потому что общее притягивающее взаимодействие между частицами максимизируется, а общая межмолекулярная энергия сводится к минимуму, когда частицы упаковываются наиболее эффективным образом. Регулярное расположение на атомном уровне часто отражается на макроскопическом уровне. В этом модуле мы исследуем некоторые детали структур металлических и ионных кристаллических твердых тел и узнаем, как эти структуры определяются экспериментально.
Мы начнем обсуждение кристаллических твердых тел с рассмотрения элементарных металлов, которые относительно просты, поскольку каждый содержит только один тип атомов. Чистый металл — это кристаллическое твердое тело, атомы которого плотно упакованы в повторяющийся узор. Некоторые свойства металлов в целом, такие как их пластичность и пластичность, во многом обусловлены наличием одинаковых атомов, расположенных в правильном порядке. Различные свойства одного металла по сравнению с другим частично зависят от размеров их атомов и особенностей их пространственного расположения.В следующих разделах мы исследуем сходства и различия четырех наиболее распространенных геометрических форм металлических кристаллов.
Структуру кристаллического твердого вещества, будь то металл или нет, лучше всего описать, рассматривая его простейшую повторяющуюся единицу, которая упоминается как его элементарная ячейка. Элементарная ячейка состоит из узлов решетки, которые представляют расположение атомов или ионов. Вся структура состоит из этой элементарной ячейки, повторяющейся в трех измерениях, как показано в [ссылка].
Элементарная ячейка показывает расположение точек решетки, повторяющихся во всех направлениях.
Давайте начнем наше исследование структуры кристаллической решетки и элементарных ячеек с самой простой структуры и самой простой элементарной ячейки. Чтобы визуализировать это, представьте, что вы берете большое количество одинаковых сфер, таких как теннисные мячи, и равномерно размещаете их в контейнере. Самый простой способ сделать это — создать слои, в которых сферы в одном слое находятся прямо над сферами в слое ниже, как показано в [ссылка].Такое расположение называется простой кубической структурой, а элементарная ячейка называется простой кубической элементарной ячейкой или примитивной кубической элементарной ячейкой.
Когда атомы металла расположены сферами в одном слое непосредственно над или под сферами в другом слое, структура решетки называется простой кубической. Обратите внимание, что сферы соприкасаются.
В простой кубической структуре сферы не упакованы так плотно, как могли бы, и они «заполняют» только около 52% объема контейнера.Это относительно неэффективное устройство, и только один металл (полоний, Po) кристаллизуется в простой кубической структуре. Как показано в [ссылка], твердое тело с таким расположением состоит из плоскостей (или слоев), в которых каждый атом контактирует только с четырьмя ближайшими соседями в своем слое; один атом прямо над ним в верхнем слое; и один атом прямо под ним в слое ниже. Число других частиц, с которыми контактирует каждая частица в кристаллическом твердом теле, известно как ее координационное число.Следовательно, для атома полония в простом кубическом массиве координационное число равно шести.
Атом в структуре простой кубической решетки контактирует с шестью другими атомами, поэтому его координационное число равно шести.
В простой кубической решетке элементарная ячейка, повторяющаяся во всех направлениях, представляет собой куб, определяемый центрами восьми атомов, как показано в [ссылка]. Атомы в соседних углах этой элементарной ячейки контактируют друг с другом, поэтому длина края этой ячейки равна двум атомным радиусам или одному атомному диаметру.Кубическая элементарная ячейка содержит только те части этих атомов, которые находятся в ней. Поскольку атом в углу простой кубической элементарной ячейки состоит в общей сложности из восьми элементарных ячеек, только одна восьмая этого атома находится в конкретной элементарной ячейке. А поскольку каждая простая кубическая элементарная ячейка имеет по одному атому в каждом из восьми «углов», существует \ (8 \ phantom {\ rule {0.2em} {0ex}} × \ phantom {\ rule {0.2em} {0ex} } \ frac {1} {8} \ phantom {\ rule {0.2em} {0ex}} = 1 \) атом внутри одной простой кубической элементарной ячейки.
Простая элементарная ячейка кубической решетки содержит одну восьмую атома в каждом из восьми углов, так что всего она содержит один атом.
Расчет атомного радиуса и плотности металлов, часть 1
Длина края элементарной ячейки альфа-полония составляет 336 мкм.
(а) Определите радиус атома полония.
(b) Определите плотность альфа-полония.
Раствор
Альфа-полоний кристаллизуется в простой кубической элементарной ячейке:
(a) Два соседних атома По контактируют друг с другом, поэтому длина края этой ячейки равна двум атомным радиусам По: l = 2 r .Следовательно, радиус Po равен \ (r \ phantom {\ rule {0.2em} {0ex}} = \ phantom {\ rule {0.2em} {0ex}} \ frac {\ text {l}} {2} \ фантом {\ rule {0.2em} {0ex}} = \ phantom {\ rule {0.2em} {0ex}} \ frac {\ text {336 pm}} {2} \ phantom {\ rule {0.2em} {0ex }} = \ text {168 pm}. \)
(b) Плотность определяется как \ (\ text {density} \ phantom {\ rule {0.2em} {0ex}} = \ phantom {\ rule {0.2em} {0ex}} \ frac {\ text {mass} } {\ text {volume}}. \) Плотность полония можно найти, определив плотность его элементарной ячейки (масса, содержащаяся в элементарной ячейке, деленная на объем элементарной ячейки).{3} \)
Поскольку фактическая плотность Ni не близка к этой, Ni не образует простой кубической структуры.
Большинство металлических кристаллов являются одним из четырех основных типов элементарных ячеек. А пока мы сосредоточимся на трех кубических элементарных ячейках: простой кубической (которую мы уже видели), объемно-центрированной кубической элементарной ячейке и кубической элементарной ячейке с гранецентрированной структурой — все они проиллюстрированы в [ссылка]. (Обратите внимание, что на самом деле существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего 14 различных типов элементарных ячеек.Мы оставляем более сложные геометрические формы на потом в этом модуле.)
Кубические элементарные ячейки металлов показывают (на верхних рисунках) расположение узлов решетки и (на нижних рисунках) атомов металлов, расположенных в элементарной ячейке.
Некоторые металлы кристаллизуются в виде кубической элементарной ячейки с атомами во всех углах и атомом в центре, как показано в [ссылка]. Это называется объемно-центрированным кубическим (ОЦК) твердым телом. Атомы в углах элементарной ячейки ОЦК не контактируют друг с другом, а контактируют с атомом в центре.Элементарная ячейка BCC содержит два атома: по одной восьмой атома в каждом из восьми углов \ (\ left (8 \ phantom {\ rule {0.2em} {0ex}} × \ phantom {\ rule {0.2em} { 0ex}} \ frac {1} {8} \ phantom {\ rule {0.2em} {0ex}} = \ phantom {\ rule {0.2em} {0ex}} 1 \) атом из углов) плюс один атом из центр. Любой атом в этой структуре касается четырех атомов в слое над ним и четырех атомов в слое под ним. Таким образом, атом в структуре ОЦК имеет координационное число восемь.
В объемно-центрированной кубической структуре атомы в определенном слое не касаются друг друга.Каждый атом касается четырех атомов в слое выше и четырех атомов в слое ниже.
Атомы в структурах ОЦК упакованы гораздо эффективнее, чем в простой кубической структуре, занимая около 68% от общего объема. Изоморфные металлы со структурой BCC включают K, Ba, Cr, Mo, W и Fe при комнатной температуре. (Элементы или соединения, которые кристаллизуются с одинаковой структурой, считаются изоморфными.)
Многие другие металлы, такие как алюминий, медь и свинец, кристаллизуются в структуре, которая имеет кубическую элементарную ячейку с атомами во всех углах и в центре каждой грани, как показано в [ссылка].Такое расположение называется гранецентрированным кубическим (ГЦК) твердым телом. Элементарная ячейка FCC содержит четыре атома: по одной восьмой атома в каждом из восьми углов \ (\ left (8 \ phantom {\ rule {0.2em} {0ex}} × \ phantom {\ rule {0.2em} { 0ex}} \ frac {1} {8} \ phantom {\ rule {0.2em} {0ex}} = 1 \) атом из углов) и по половине атома на каждой из шести граней \ (\ left (6 \ phantom {\ rule {0.2em} {0ex}} × \ phantom {\ rule {0.2em} {0ex}} \ frac {1} {2} \ phantom {\ rule {0.2em} {0ex}} = 3 \) атомов с граней). Атомы в углах касаются атомов в центрах соседних граней по диагоналям граней куба.Поскольку атомы находятся в идентичных узлах решетки, они имеют идентичное окружение.
Гранецентрированное кубическое твердое тело имеет атомы по углам и, как следует из названия, в центрах граней его элементарных ячеек.
Атомы в системе ГЦК упакованы как можно ближе друг к другу, причем атомы занимают 74% объема. Эта структура также называется кубической плотнейшей упаковкой (CCP). В CCP есть три повторяющихся слоя гексагонально расположенных атомов. Каждый атом контактирует с шестью атомами в собственном слое, с тремя в слое выше и с тремя в слое ниже.В этом расположении каждый атом касается 12 ближайших соседей и, следовательно, имеет координационное число 12. Тот факт, что устройства FCC и CCP эквивалентны, может быть не сразу очевиден, но почему они на самом деле имеют одинаковую структуру, показано в [ссылка].
Компоновка CCP состоит из трех повторяющихся слоев (ABCABC…) гексагонально расположенных атомов. Атомы в структуре CCP имеют координационное число 12, потому что они контактируют с шестью атомами в своем слое, плюс три атома в слое выше и три атома в слое ниже.Поворачивая перспективу, мы видим, что структура CCP имеет элементарную ячейку с гранью, содержащей атом из слоя A в одном углу, атомы из слоя B по диагонали (в двух углах и в середине лица) и атом из слоя C в оставшемся углу. Это то же самое, что и гранецентрированное кубическое расположение.
Поскольку более тесная упаковка максимизирует общее притяжение между атомами и минимизирует общую межмолекулярную энергию, атомы в большинстве металлов упаковываются таким образом.Мы находим два типа плотнейшей упаковки в простых металлических кристаллических структурах: CCP, с которой мы уже сталкивались, и гексагональная плотнейшая упаковка (HCP), показанная в [link]. Оба состоят из повторяющихся слоев гексагонально расположенных атомов. В обоих типах второй слой (B) помещается на первый слой (A), так что каждый атом во втором слое контактирует с тремя атомами в первом слое. Третий слой размещается одним из двух способов. В HCP атомы в третьем слое находятся непосредственно над атомами в первом слое (т.е.е., третий слой также относится к типу A), а наложение состоит из чередующихся плотно упакованных слоев типа A и типа B (то есть ABABAB). В CCP атомы в третьем слое не находятся над атомами в любом из первых двух слоев (т. Е. Третий слой относится к типу C), а наложение состоит из чередующихся плотноупакованных слоев типа A, типа B и типа C ( т.е. ABCABCABC ⋯). Около двух третей всех металлов кристаллизуются в плотноупакованных массивах с координационным числом 12. Металлы, которые кристаллизуются в структуре HCP, включают Cd, Co, Li, Mg, Na и Zn, а металлы, которые кристаллизуются в структуре CCP, включают Ag , Al, Ca, Cu, Ni, Pb и Pt.
В обоих типах плотнейшей упаковки атомы упакованы максимально компактно. Гексагональная плотнейшая упаковка состоит из двух чередующихся слоев (ABABAB…). Плотнейшая кубическая упаковка состоит из трех чередующихся слоев (ABCABCABC…).
Расчет атомного радиуса и плотности металлов, часть 2
Кальций кристаллизуется в гранецентрированной кубической структуре. Длина ребра его элементарной ячейки составляет 558,8 пм.
(а) Каков атомный радиус Са в этой структуре?
(b) Рассчитайте плотность Ca.{2}} {16}} \ phantom {\ rule {0.2em} {0ex}} = \ text {197,6 pmg для радиуса Ca}. \)
(b) Плотность определяется как \ (\ text {density} \ phantom {\ rule {0.2em} {0ex}} = \ phantom {\ rule {0.2em} {0ex}} \ frac {\ text {mass} } {\ text {volume}}. \) Плотность кальция можно найти, определив плотность его элементарной ячейки: например, массу, содержащуюся в элементарной ячейке, деленную на объем элементарной ячейки. Гранецентрированная элементарная ячейка Са содержит по одной восьмой атома в каждом из восьми углов \ (\ left (8 \ phantom {\ rule {0.2em} {0ex}} × \ phantom {\ rule {0.2em} {0ex}} \ frac {1} {8} \ phantom {\ rule {0.2em} {0ex}} = 1 \) атом) и одно- половина атома на каждой из шести граней \ (6 \ phantom {\ rule {0.2em} {0ex}} × \ phantom {\ rule {0.2em} {0ex}} \ frac {1} {2} \ phantom {\ rule {0.2em} {0ex}} = 3 \) атомы), всего четыре атома в элементарной ячейке.
Массу элементарной ячейки можно найти по:
\ (\ text {элементарная ячейка 1 Ca} \ phantom {\ rule {0.2em} {0ex}} × \ phantom {\ rule {0.2em} {0ex}} \ frac {\ text {4 атома Ca}} { \ text {Элементарная ячейка 1 Ca}} \ phantom {\ rule {0.{3} \)
Проверьте свои знания
Серебро кристаллизуется в структуре FCC. Длина ребра его элементарной ячейки 409 мкм.
(а) Каков атомный радиус Ag в этой структуре?
(б) Рассчитайте плотность Ag.
Ответ:
(а) 144 вечера; (б) 10,5 г / см 3
В общем, элементарная ячейка определяется длиной трех осей ( a , b и c ) и углами ( α , β и γ ) между ними, как проиллюстрировано в [ссылка].Оси определяются как длины между точками пространственной решетки. Следовательно, оси элементарной ячейки соединяют точки с идентичной средой.
Элементарная ячейка определяется длиной трех ее осей ( a , b и c ) и углами ( α , β и γ ) между осями.
Существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего четырнадцать различных элементарных ячеек, формы которых показаны в [ссылка].
Существует семь различных систем решеток и 14 различных элементарных ячеек.
Ионные кристаллы состоят из двух или более различных типов ионов, которые обычно имеют разные размеры. Упаковка этих ионов в кристаллическую структуру более сложна, чем упаковка атомов металла того же размера.
Большинство одноатомных ионов ведут себя как заряженные сферы, и их притяжение для ионов противоположного заряда одинаково во всех направлениях. Следовательно, стабильные структуры для ионных соединений возникают (1), когда ионы одного заряда окружены как можно большим количеством ионов противоположного заряда, и (2) когда катионы и анионы контактируют друг с другом.Структуры определяются двумя основными факторами: относительными размерами ионов и соотношением количества положительных и отрицательных ионов в соединении.
В простых ионных структурах мы обычно находим анионы, которые обычно больше, чем катионы, расположенные в виде плотноупакованного массива. (Как было замечено ранее, дополнительные электроны, притянутые к одному и тому же ядру, делают анионы больше, а меньшее количество электронов, притягиваемых к тому же ядру, делает катионы меньше по сравнению с атомами, из которых они образованы.Катионы меньшего размера обычно занимают один из двух типов отверстий (или пустот), оставшихся между анионами. Меньшее из отверстий находится между тремя анионами в одной плоскости и одним анионом в соседней плоскости. Четыре аниона, окружающие это отверстие, расположены по углам тетраэдра, поэтому отверстие называется тетраэдрическим отверстием. Дыра большего размера находится в центре шести анионов (три в одном слое и три в соседнем слое), расположенных в углах октаэдра; это называется октаэдрическим отверстием.[ссылка] иллюстрирует оба этих типа отверстий.
Катионы могут занимать два типа дырок между анионами: октаэдрические дырки и тетраэдрические дырки.
В зависимости от относительных размеров катионов и анионов, катионы ионного соединения могут занимать тетраэдрические или октаэдрические отверстия, как показано в [ссылка]. Относительно небольшие катионы занимают тетраэдрические отверстия, а более крупные — октаэдрические. Если катионы слишком велики, чтобы поместиться в октаэдрические отверстия, анионы могут принять более открытую структуру, такую как простой кубический массив.Тогда более крупные катионы могут занять большие кубические отверстия, что стало возможным благодаря более открытому пространству.
Размер катиона и форма отверстия, занимаемого соединением, напрямую связаны.
Есть две тетраэдрические дырки для каждого аниона в массиве анионов HCP или CCP. Соединение, которое кристаллизуется в виде плотноупакованного массива анионов с катионами в тетраэдрических отверстиях, может иметь максимальное соотношение катион: анион 2: 1; все тетраэдрические отверстия заполнены при этом соотношении.Примеры включают Li 2 O, Na 2 O, Li 2 S и Na 2 S. Соединения с соотношением менее 2: 1 также могут кристаллизоваться в виде плотноупакованного массива анионов с катионами. в тетраэдрических отверстиях, если подходят ионные размеры. Однако в этих соединениях часть тетраэдрических дырок остается вакантной.
Заполнение четырехгранных отверстий
Сульфид цинка является важным промышленным источником цинка, а также используется в качестве белого пигмента в красках. Сульфид цинка кристаллизуется с ионами цинка, занимающими половину тетраэдрических отверстий в плотноупакованном массиве сульфид-ионов.Какая формула сульфида цинка?
Решение
Поскольку на каждый анион (сульфид-ион) приходится две тетраэдрических дырки, и половина этих дырок занята ионами цинка, должно быть \ (\ frac {1} {2} \ phantom {\ rule {0.4em} {0ex}} × \ phantom {\ rule {0.2em} {0ex}} 2, \) или 1, ион цинка на ион сульфида. Таким образом, формула ZnS.
Проверьте свои знания
Селенид лития можно описать как плотноупакованный массив ионов селенида с ионами лития во всех тетраэдрических отверстиях. Какая у него формула селенида лития?
Отношение октаэдрических дырок к анионам в структуре HCP или CCP составляет 1: 1.Таким образом, соединения с катионами в октаэдрических дырках в плотноупакованном массиве анионов могут иметь максимальное соотношение катион: анион 1: 1. Например, в NiO, MnS, NaCl и KH все октаэдрические отверстия заполнены. Отношения менее 1: 1 наблюдаются, когда некоторые из октаэдрических отверстий остаются пустыми.
Стехиометрия ионных соединений
Сапфир — оксид алюминия. Оксид алюминия кристаллизуется с ионами алюминия в двух третях октаэдрических дырок в плотноупакованном массиве оксидных ионов.Какая формула у оксида алюминия?
Решение
Поскольку на каждый анион (оксидный ион) приходится одна октаэдрическая дырка и только две трети этих дырок заняты, отношение алюминия к кислороду должно быть \ (\ frac {2} {3} \): 1, что даст \ ({\ text {Al}} _ {2 \ text {/} 3} \ text {O}. \) Простейшее целочисленное соотношение равно 2: 3, поэтому формула будет Al 2 O 3 .
Проверьте свои знания
Белый пигмент оксида титана кристаллизуется с ионами титана в половине октаэдрических отверстий в плотноупакованном массиве оксидных ионов.Какая формула оксида титана?
В простом кубическом массиве анионов есть одно кубическое отверстие, которое может быть занято катионом для каждого аниона в массиве. В CsCl и других соединениях с такой же структурой все кубические дырки заняты. Половина кубических дырок занята в SrH 2 , UO 2 , SrCl 2 и CaF 2 .
Различные типы ионных соединений часто кристаллизуются в одной и той же структуре, если относительные размеры их ионов и их стехиометрия (две основные характеристики, определяющие структуру) схожи.
Многие ионные соединения кристаллизуются с кубическими элементарными ячейками, и мы будем использовать эти соединения, чтобы описать общие особенности ионных структур.
Когда ионное соединение состоит из катионов и анионов одинакового размера в соотношении 1: 1, оно обычно образует простую кубическую структуру. Примером этого является хлорид цезия, CsCl (проиллюстрирован в [ссылка]), при этом Cs + и Cl — имеют радиусы 174 и 181 мкм соответственно. Мы можем представить это как ионы хлорида, образующие простую кубическую элементарную ячейку с ионом цезия в центре; или в виде ионов цезия, образующих элементарную ячейку с ионом хлорида в центре; или в виде простых кубических элементарных ячеек, образованных ионами Cs + , перекрывающих элементарные ячейки, образованные ионами Cl — .Ионы цезия и ионы хлора соприкасаются по диагоналям тела элементарных ячеек. Один ион цезия и один ион хлорида присутствуют в элементарной ячейке, что дает стехиометрию 1: 1, требуемую формулой для хлорида цезия. Обратите внимание, что в центре ячейки нет точки решетки, и CsCl не является структурой BCC, потому что ион цезия не идентичен иону хлорида.
Ионные соединения с катионами и анионами аналогичного размера, такие как CsCl, обычно образуют простую кубическую структуру. Их можно описать элементарными ячейками с катионами по углам или анионами по углам.
Мы сказали, что расположение точек решетки произвольно. Это иллюстрируется альтернативным описанием структуры CsCl, в которой узлы решетки расположены в центрах ионов цезия. В этом описании ионы цезия расположены в точках решетки в углах ячейки, а ион хлора расположен в центре ячейки. Две элементарные ячейки разные, но они описывают идентичные структуры.
Когда ионное соединение состоит из катионов и анионов в соотношении 1: 1, которые значительно различаются по размеру, оно обычно кристаллизуется с помощью элементарной ячейки FCC, как показано в [ссылка].Примером этого является хлорид натрия, NaCl, причем Na + и Cl — имеют радиусы 102 и 181 мкм соответственно. Мы можем представить это как ионы хлора, образующие ячейку FCC, причем ионы натрия расположены в октаэдрических отверстиях в середине краев ячейки и в центре ячейки. Ионы натрия и хлора соприкасаются друг с другом по краям ячейки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1: 1, требуемую формулой NaCl.
Ионные соединения с анионами, которые намного крупнее катионов, например NaCl, обычно образуют структуру ГЦК. Их можно описать элементарными ячейками ГЦК с катионами в октаэдрических дырках.
Кубическая форма сульфида цинка, цинковая обманка, также кристаллизуется в элементарной ячейке FCC, как показано в [ссылка]. Эта структура содержит ионы сульфида в узлах решетки ГЦК-решетки. (Расположение сульфид-ионов идентично расположению хлорид-ионов в хлориде натрия.) Радиус иона цинка составляет всего около 40% от радиуса сульфид-иона, поэтому эти маленькие ионы Zn 2+ расположены в чередующихся тетраэдрических дырках, то есть в одной половине тетраэдрических дырок. В элементарной ячейке четыре иона цинка и четыре иона сульфида, что дает эмпирическую формулу ZnS.
ZnS, сульфид цинка (или цинковая обманка) образует элементарную ячейку ГЦК с ионами сульфида в узлах решетки и ионами цинка гораздо меньшего размера, занимающими половину тетраэдрических отверстий в структуре.
Элементарная ячейка с фторидом кальция, подобная той, что показана на [ссылка], также является элементарной ячейкой FCC, но в этом случае катионы расположены в узлах решетки; эквивалентные ионы кальция расположены в узлах решетки ГЦК-решетки. Все тетраэдрические позиции в массиве ГЦК ионов кальция заняты ионами фтора. В элементарной ячейке четыре иона кальция и восемь ионов фтора, что дает соотношение кальций: фтор 1: 2 в соответствии с химической формулой CaF 2 .Внимательное изучение [ссылка] покажет простой кубический массив ионов фтора с ионами кальция в одной половине кубических дырок. Структуру нельзя описать в терминах пространственной решетки точек на фторид-ионах, потому что не все фторид-ионы имеют одинаковое окружение. Ориентация четырех ионов кальция относительно ионов фтора различается.
Фторид кальция, CaF 2 , образует элементарную ячейку ГЦК с ионами кальция (зеленый) в узлах решетки и ионами фтора (красный), занимающими все тетраэдрические узлы между ними.
Размер элементарной ячейки и расположение атомов в кристалле могут быть определены из измерений дифракции рентгеновских лучей на кристалле, называемой рентгеновской кристаллографией. Дифракция — это изменение направления движения электромагнитной волны, когда она встречает физический барьер, размеры которого сопоставимы с размерами длины волны света. Рентгеновские лучи — это электромагнитное излучение с длиной волны, равной расстоянию между соседними атомами в кристаллах (порядка нескольких Å).
Когда пучок монохроматических рентгеновских лучей попадает на кристалл, его лучи рассеиваются во всех направлениях атомами внутри кристалла. Когда рассеянные волны, распространяющиеся в одном направлении, сталкиваются друг с другом, они претерпевают интерференцию , процесс, при котором волны объединяются, приводя к увеличению или уменьшению амплитуды (интенсивности) в зависимости от степени, в которой максимумы объединяющихся волн находятся разделенные (см. [ссылка]).
Световые волны, занимающие одно и то же пространство, испытывают интерференцию, объединяясь, давая волны большей (а) или меньшей (б) интенсивности, в зависимости от разделения их максимумов и минимумов.
Когда рентгеновские лучи определенной длины волны, λ , рассеиваются атомами в соседних кристаллических плоскостях, разделенных расстоянием, d , они могут претерпевать конструктивную интерференцию, когда разница между расстояниями, пройденными двумя волнами до их комбинация представляет собой целочисленный коэффициент длины волны n . Это условие выполняется, когда угол дифрагированного луча, θ , связан с длиной волны и межатомным расстоянием уравнением:
\ (п \ lambda = 2d \ phantom {\ rule {0.2em} {0ex}} \ text {sin} \ phantom {\ rule {0.2em} {0ex}} \ theta \)
Это соотношение известно как уравнение Брэгга в честь У. Х. Брэгга, английского физика, который первым объяснил это явление. [ссылка] иллюстрирует два примера дифрагированных волн от одних и тех же двух плоскостей кристалла. На рисунке слева изображены волны, дифрагированные под углом Брэгга, приводящие к конструктивной интерференции, а на рисунке справа показаны дифракция и другой угол, который не удовлетворяет условию Брэгга, что приводит к деструктивной интерференции.
Дифракция рентгеновских лучей, рассеянных атомами внутри кристалла, позволяет определить расстояние между атомами. Верхнее изображение показывает конструктивную интерференцию между двумя рассеянными волнами и результирующей дифрагированной волной высокой интенсивности. На нижнем изображении показаны деструктивная интерференция и дифрагированная волна низкой интенсивности.
Посетите этот сайт для получения дополнительных сведений об уравнении Брэгга и симуляторе, который позволяет исследовать влияние каждой переменной на интенсивность дифрагированной волны.
Рентгеновский дифрактометр, такой как тот, что показан в [ссылка], может использоваться для измерения углов, под которыми рентгеновские лучи дифрагируют при взаимодействии с кристаллом, как описано ранее. Из таких измерений можно использовать уравнение Брэгга для вычисления расстояний между атомами, как показано в следующем примере упражнения.
(a) В дифрактометре луч рентгеновских лучей попадает на кристаллический материал, создавая (b) картину дифракции рентгеновских лучей, которая может быть проанализирована для определения кристаллической структуры.
Использование уравнения Брэгга
В дифрактометре рентгеновские лучи с длиной волны 0,1315 нм использовались для создания дифракционной картины для меди. Дифракция первого порядка ( n = 1) произошла под углом θ = 25,25 °. Определите расстояние между дифрагирующими плоскостями в меди.
Решение
Расстояние между плоскостями находится путем решения уравнения Брэгга, nλ = 2 d sin θ для d .
Это дает: \ (d \ phantom {\ rule {0.2em} {0ex}} = \ phantom {\ rule {0.2em} {0ex}} \ frac {n \ lambda} {2 \ phantom {\ rule {0.2 em} {0ex}} \ text {sin} \ phantom {\ rule {0.2em} {0ex}} \ theta} \ phantom {\ rule {0.2em} {0ex}} = \ phantom {\ rule {0.2em} {0ex}} \ frac {1 \ left (0,1315 \ phantom {\ rule {0.2em} {0ex}} \ text {nm} \ right)} {2 \ phantom {\ rule {0.2em} {0ex}} \ текст {sin} \ phantom {\ rule {0.2em} {0ex}} \ left (25.25 \ text {°} \ right)} \ phantom {\ rule {0.2em} {0ex}} = \ text {0,154 нм} \)
Check Your Learning
Кристалл с расстоянием между плоскостями, равным 0.394 нм дифрагирует рентгеновские лучи с длиной волны 0,147 нм. Каков угол дифракции первого порядка?
Рентгеновский кристаллограф Розалинд Франклин
Открытие структуры ДНК в 1953 году Фрэнсисом Криком и Джеймсом Уотсоном — одно из величайших достижений в истории науки. Они были удостоены Нобелевской премии по физиологии и медицине 1962 года вместе с Морисом Уилкинсом, предоставившим экспериментальное доказательство структуры ДНК. Британский химик Розалинд Франклин внесла неоценимый вклад в это грандиозное достижение своей работой по измерению рентгеновских дифракционных изображений ДНК.В начале своей карьеры исследования Франклин структуры углей оказались полезными для британских военных действий. В начале 1950-х годов Франклин и докторант Реймонд Гослинг переключили свое внимание на биологические системы и обнаружили, что ДНК состоит из двух форм: длинного тонкого волокна, образующегося при намокании (тип «B»), и короткого широкого волокна, образующегося при сушке ( наберите «А»). Ее рентгеновские дифракционные изображения ДНК ([ссылка]) предоставили важную информацию, которая позволила Уотсону и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры.Франклин также провел новаторское исследование вирусов и РНК, содержащей их генетическую информацию, обнаружив новую информацию, которая радикально изменила совокупность знаний в этой области. После развития рака яичников Франклин продолжала работать до своей смерти в 1958 году в возрасте 37 лет. Среди множества посмертных признаний ее работы, Чикагская медицинская школа Финчского университета медицинских наук изменила свое название на Университет медицины и науки Розалинды Франклин в 2004 году. , и приняла изображение ее знаменитого рентгеновского дифракционного изображения ДНК в качестве официального логотипа университета.
На этой иллюстрации показано изображение дифракции рентгеновских лучей, подобное тому, которое Франклин нашла в своем исследовании. (кредит: Национальный институт здоровья)
Ионная решетка — Ионные соединения — AQA — GCSE Combined Science Revision — AQA Trilogy
Ионное соединение — это гигантская структура ионов. Ионы имеют регулярное повторяющееся расположение, называемое ионной решеткой. Решетка образуется из-за того, что ионы притягиваются друг к другу и образуют регулярный узор с противоположно заряженными ионами рядом друг с другом.
Двумерная модель заполнения пространства для ионной решетки в хлориде натрия Трехмерная модель заполнения пространства для ионной решетки в хлориде натрия
Помните, что структура решетки гигантская — например, одна крупинка соли может содержать 1,2 × 10 18 (1,200,000,000,000,000,000) ионов. Расположение решетки продолжается в трех измерениях. Вот почему твердые ионные соединения образуют кристаллы правильной формы.
Трехмерная модель шарика и палки для ионной решетки в хлориде натрия
Ионная связь
Ионная решетка удерживается вместе за счет сильных электростатических сил притяжения между противоположно заряженными ионами.Силы действуют в решетке во всех направлениях. Это называется ионной связью.
Представление ионных соединений
Различные типы моделей используются для представления гигантских ионных структур. У каждого есть свои преимущества и недостатки. Например:
- двумерная модель, заполняющая пространство, четко показывает расположение ионов в одном слое, но не показывает, как расположен следующий слой ионов
- трехмерная модель шара и ручки показывает расположение ионов в большей части кристалла, но использование стержней для связей вводит в заблуждение, потому что силы притяжения между ионами фактически действуют во всех направлениях
- трехмерная модель также вводит в заблуждение, потому что она показывает много свободного пространства между ионами, которого нет
Свойства твердых тел
Свойства твердых тел
Свойства твердых тел
Как вы должны помнить из кинетической молекулярной теории, молекулы в твердых телах движутся не так, как в жидкостях или газах.Твердые молекулы просто вибрируют и вращаются на месте, а не перемещаются. Твердые тела обычно удерживаются вместе ионной или прочной ковалентной связью, а силы притяжения между атомами, ионами или молекулами в твердых телах очень сильны. Фактически, эти силы настолько сильны, что частицы в твердом теле удерживаются в фиксированных положениях и имеют очень небольшую свободу движения. Твердые тела имеют определенные формы и объемы и никак не сжимаются.
Есть две основные категории твердых тел — кристаллические твердые вещества и аморфные твердые вещества. Кристаллические твердые тела — это те, в которых атомы, ионы или молекулы, составляющие твердое тело, существуют в регулярном, четко определенном порядке. Наименьший повторяющийся узор кристаллических твердых тел известен как элементарная ячейка , , а элементарные ячейки подобны кирпичам в стене — все они идентичны и повторяются. Другой основной тип твердых тел называется аморфными. Аморфные твердые тела не имеют особого порядка в своей структуре. Хотя их молекулы расположены близко друг к другу и имеют небольшую свободу передвижения, они не расположены в правильном порядке, как в кристаллических твердых телах.Распространенными примерами твердого тела этого типа являются стекло и пластмассы.
Есть четыре типа твердых кристаллических веществ:
Ионные твердые тела — Состоят из положительных и отрицательных ионов и удерживаются вместе за счет электростатического притяжения. Они характеризуются очень высокими температурами плавления и хрупкостью, а в твердом состоянии являются плохими проводниками. Примером ионного твердого вещества является поваренная соль NaCl.
Молекулярные твердые тела — Состоят из атомов или молекул, удерживаемых вместе лондонскими силами дисперсии, диполь-дипольными силами или водородными связями.Отличаются низкими температурами плавления и гибкостью, имеют плохую проводимость. Примером твердого молекулярного вещества является сахароза.
Твердые тела с ковалентной сеткой (также называемые атомными) — Состоят из атомов, связанных ковалентными связями; межмолекулярные силы также являются ковалентными связями. Характеризуется очень твердым материалом с очень высокими температурами плавления и плохой проводимостью. Примерами твердого тела этого типа являются алмаз, графит и фуллерены. Как вы можете видеть ниже, графит имеет только двумерную гексагональную структуру и поэтому не тверд, как алмаз.Листы графита удерживаются вместе только слабыми лондонскими силами!
Металлические твердые тела — Состоят из атомов металлов, скрепленных металлическими связями. Характеризуется высокой температурой плавления, может варьироваться от мягкого и податливого до очень твердого, и являются хорошими проводниками электричества.
КРИСТАЛЛИЧЕСКИЕ СТРУКТУРЫ С КУБИЧЕСКИМИ ЯЧЕЙКАМИ (Из https://eee.uci.edu/programs/gchem/RDGcrystalstruct.pdf)
Кристаллические твердые тела представляют собой трехмерную совокупность отдельных атомов, ионов или целых молекул, организованных в повторяющихся узоры.Эти атомы, ионы или молекулы называются точками решетки и обычно визуализируются в виде круглых сфер. Двумерные слои твердого тела создаются путем упаковки точечных «сфер» решетки в квадратные или закрытые упакованные массивы. (См. ниже).
Рисунок 1: Два возможных расположения идентичных атомов в двумерной структуре
При наложении двухмерных слоев друг на друга создается трехмерная структура точек решетки, представленная элементарной ячейкой.Элементарная ячейка — это наименьший набор узлов решетки, которые можно повторить для создания кристаллического твердого тела. Твердое тело можно представить как результат сложения большого количества элементарных ячеек вместе. Элементарная ячейка твердого тела определяется типом слоя (квадратный или плотноупакованный), способом размещения каждого последующего слоя на слое ниже и координационным числом для каждой точки решетки (количеством «сфер», соприкасающихся с « сфера »интереса.)
Примитивная (простая) кубическая структура
Размещение второго слоя квадратной матрицы непосредственно над первым слоем квадратной матрицы формирует «простую кубическую» структуру.Простой «кубический» вид полученной элементарной ячейки (рис. 3а) является основой для названия этой трехмерной структуры. Такое расположение упаковки часто обозначается как «AA …», буквы обозначают повторяющийся порядок слоев, начиная с нижнего слоя. Координационное число каждой точки решетки равно шести. Это становится очевидным при осмотре части соседней элементарной ячейки (рис. 3b). Элементарная ячейка на рисунке 3а, кажется, содержит восемь угловых сфер, однако общее количество сфер в элементарной ячейке равно 1 (фактически только 1/8 каждой сферы находится внутри элементарной ячейки).Остальные 7/8 каждой угловой сферы находятся в 7 смежных элементарных ячейках.
Значительное пространство, показанное между сферами на рис. 3b, вводит в заблуждение: точки решетки в твердых телах соприкасаются, как показано на рис. 3c. Например, расстояние между центрами двух соседних атомов металла равно сумме их радиусов. Снова обратитесь к рисунку 3b и представьте, что соседние атомы соприкасаются. Тогда край элементарной ячейки равен 2r (где r = радиус атома или иона), а значение диагонали грани как функция от r можно найти, применив теорему Пифагора (a 2 + b 2 = c 2 ) в прямоугольный треугольник, образованный двумя ребрами и диагональю грани (рисунок 4a).Повторное применение теоремы к другому прямоугольному треугольнику, созданному ребром, диагональю грани и диагональю тела, позволяет определить диагональ тела как функцию от r (рис. 4b).
Немногие металлы принимают простую кубическую структуру из-за неэффективного использования пространства. Плотность кристаллического твердого вещества связана с его «процентной эффективностью упаковки». Эффективность упаковки простой кубической структуры составляет всего около 52%. (48% — пустое место!)
Объемно-центрированная кубическая (ОЦК) структура
Более эффективно упакованная кубическая структура — это «объемно-центрированная кубическая» (ОЦК).Первый слой квадратного массива слегка расширен во всех направлениях. Затем второй слой сдвигается так, чтобы его сферы прижались к пространствам первого слоя (рис. 5а, б). Этот повторяющийся порядок слоев часто обозначается как «ABA …». Как и на рисунке 3b, значительное пространство, показанное между сферами на рисунке 5b, вводит в заблуждение: сферы плотно упакованы в твердые тела с ОЦК и касаются друг друга по диагонали тела. Эффективность упаковки ОЦК-структуры составляет около 68%. Координационное число атома в структуре ОЦК равно восьми.Сколько всего атомов в элементарной ячейке для ОЦК-структуры? Проведите диагональную линию, соединяющую три атома, отмеченные знаком «x» на рисунке 5b. Предполагая, что атомы, помеченные «x», имеют одинаковый размер, плотно упакованы и соприкасаются, каково значение диагонали этого тела в зависимости от радиуса r? Найдите край и объем ячейки как функцию от r.
Cubic Closest Packed (ccp)
Кубическая структура с максимальной плотностью упаковки (ccp) создается путем наслоения плотно упакованных массивов.Сферы второго слоя прижимаются к половине пространств первого слоя. Сферы третьего слоя непосредственно перекрывают другую половину пространств первого слоя, при этом располагаясь в половине пространств второго слоя. Порядок повторения слоев — «ABC …» (Рисунки 6 и 7). Координационное число атома в структуре ccp равно двенадцати (шесть ближайших соседей плюс три атома в слоях выше и ниже), а эффективность упаковки составляет 74%.
Рисунок 6: Наслоение плотно упакованного массива.1-й и 3-й слои представлены светом
сферы; 2-й слой, темные шары. Сферы 2-го слоя приживаются в пространствах 1-го
г.
слой, отмеченный знаком «x». Сферы 3-го слоя прижимаются к пространствам 2-го слоя
.
непосредственно перекрывайте пространства, отмеченные знаком «·» в 1-м слое.
Рис. 7a и 7b: два вида кубической плотно упакованной структуры
Если кубическая плотноупакованная структура повернута на 45 °, можно увидеть элементарную ячейку гранецентрированного куба (ГЦК) (рис. 8).Элементарная ячейка ГЦК содержит 8 угловых атомов и атом на каждой грани. Лицевые атомы являются общими с соседней элементарной ячейкой, поэтому каждая элементарная ячейка содержит ½ граневого атома. Атомы гранецентрированной кубической (ГЦК) элементарной ячейки соприкасаются по диагонали грани (рис. 9). Каковы край, диагональ грани, диагональ тела и объем гранецентрированной кубической элементарной ячейки в зависимости от радиуса?
Рисунок 8: Гранецентрированная кубическая элементарная ячейка нарисована путем разрезания диагональной плоскости через
.
компоновка упаковки ABCA структуры ccp.В элементарной ячейке 4 атома (1/8 от
каждый угловой атом и ½ каждого лицевого атома).
Рисунок 9a: Модель заполнения пространства ГЦК. Рис. 9b: Лицо ГЦК. Диагональ лица = 4р.
Ionic Solids
В ионных соединениях более крупные ионы становятся точечными «сферами» решетки, которые составляют основу элементарной ячейки. Ионы меньшего размера «прижимаются» к углублениям («дырам») между ионами большего размера. Есть три типа отверстий: «кубические», «октаэдрические» и «четырехгранные».Кубические и октаэдрические отверстия встречаются в структурах квадратного массива; тетраэдрические и октаэдрические дырки появляются в плотноупакованных структурах массива (рис. 10). Какой ион обычно больше — катион или анион? Как можно использовать таблицу Менделеева для предсказания размера ионов? Какое координационное число иона в тетраэдрической дырке? восьмигранная дыра? кубическая дыра?
Рис. 10. Отверстия в ионных кристаллах больше похожи на «ямочки» или «впадины» между
.
плотно упакованные ионы.Маленькие ионы могут помещаться в эти отверстия и окружены более крупными ионами
противоположного заряда.
Тип дырки, образующейся в ионном твердом теле, в значительной степени зависит от отношения радиуса меньшего иона к радиусу большего иона (r меньше / r больше ). (Таблица 1).
Эмпирическая формула ионного твердого вещества
Эмпирическую формулу ионного твердого вещества можно определить двумя способами: 1) из числа каждого иона, содержащегося в одной элементарной ячейке 2) из отношения координационных чисел катионов и анионы в твердом теле.
Пример: Найдите эмпирическую формулу для ионного соединения, показанного на рисунках 11 и 12.
Первый метод: При использовании первого метода помните, что большинство атомов в элементарной ячейке используются совместно с другими ячейками. В таблице 2 перечислены типы атомов и доли, содержащиеся в элементарной ячейке. Определяется количество каждого иона в элементарной ячейке: 1/8 каждого из 8 угловых ионов X и 1/4 каждого из 12 краевых ионов Y находятся в одной элементарной ячейке.Следовательно, ячейка содержит 1 ион X (8/8 = 1) на каждые 3 иона Y (12/4 = 3), что дает эмпирическую формулу XY3. Что такое катион? анион? Что стоит на первом месте при написании формулы ионных твердых веществ?
Второй метод: Второй метод менее надежен и требует исследования кристаллической структуры для определения количества катионов, окружающих анион, и наоборот. Структура должна быть расширена, чтобы включить больше элементарных ячеек.На рис. 12 показано то же твердое тело на рис. 11, расширенное до четырех соседних элементарных ячеек. Исследование структуры показывает, что есть 2 иона X, координированных с каждым ионом Y, и 6 ионов Y, окружающих каждый ион X. (Чтобы увидеть шестой ион Y, необходимо проецировать дополнительную элементарную ячейку перед страницей). Отношение 2 к 6 дает ту же эмпирическую формулу XY3.
Резюме:
Простой куб: 1 общий атом на ячейку (1/8 каждого угла) | Телоцентрированный кубик: 2 атома на ячейку (1 в центре и 1/8 для каждого угла) | Кубик с центрированной гранью: 4 атома на ячейку |
|---|
.
