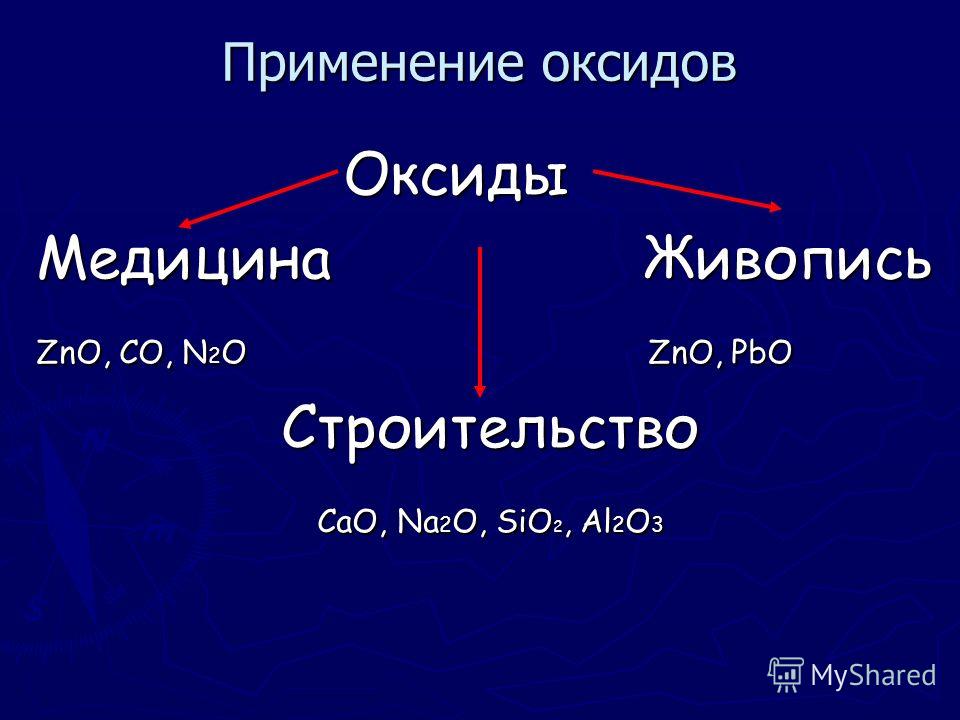
Обзор свойств элементов побочной подгруппы IV группы ПС. |
Химия металлов :: Основы химии металлов :: Обзор свойств соединений металлов
Для оксидов, помимо кислотно-основных взаимодействий, т. е. реакций между основными оксидами и кислотами и кислотными оксидами, а также реакций кислотных и амфотерных оксидов со щелочами, характерны также окислительно-восстановительные реакции.
Поскольку в любых оксидах металл находится в окисленном состоянии, все оксиды без исключения способны проявлять окислительные свойства. Если металл образует несколько оксидов, то оксиды металла в более низкой степени окисления могут окисляться, т. е. проявлять восстановительные свойства.
Особенно сильные восстановительные свойства проявляют оксиды металлов в низких и неустойчивых степенях окисления, как например. TiO, VO, CrO. При растворении их в воде они окисляются, восстанавливая воду. Их реакции с водой, подобна реакциям металла с водой.
2TiO + 2H2O = 2TiOOH + H2.
Окислительно-восстановительные взаимодействия между оксидами металлов и разными восстановителями, приводящие к получению металла, — это самые распространенные реакции в пирометаллургии.
2Fe2O3 + 3C = 4Fe + 3CO2
Fe3O4 + 2C = 3Fe + 2CO2
MnO2 +2C = Mn + 2CO
SnO2 + C = Sn + 2CO2
ZnO + C = Zn + CO
Cr2O3 + 2Al = 2Cr + Al2O3
WO3 + 3H2 = W + 3H2O
Сильные окислительные свойства некоторых оксидов используются на практике. Например,
Например,
окислительные свойства оксида PbO2 используют в свинцовых аккумуляторах, в которых за счет химической реакции между PbO2 и металлическим свинцом получают электрический ток.
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
Окислительные свойства MnO2 также используют для получения электрического тока в гальванических элементах (электрических батарейках).
2MnO2 + Zn + 4NH4Cl = [Zn(NH3)4] Cl2 + 2MnOOH + 2HCl
Сильные окислительные свойства некоторых оксидов приводят к их своеобразному взаимодействию с кислотами. Так оксиды PbO2 и MnO2 при растворении в концентрированной соляной кислоте восстанавливаются.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Если металл имеет несколько степеней окисления, то при достаточном повышении температуры становится возможным разложение оксида с выделением кислорода.
3PbO2 = Pb3O4 + O2, 2Pb3O4 = O2 + 6PbO
Некоторые оксиды, особенно оксиды благородных металлов, могут при нагревании разлагаться с образованием металла.
2Ag2O = 4Ag + O2 2Au2O3 = 4Au + 3O2.
Кислотный характер — оксид — Большая Энциклопедия Нефти и Газа, статья, страница 1
Кислотный характер — оксид
Cтраница 1
Кислотный характер оксидов выражен тем сильнее, чем меньше атомный номер элемента и выше его степень окисления: N2Os — наиболее кислотный оксид, Bi2Os обладает основным характером.
[1]
Кислотный характер оксидов выражен тем сильнее, чем меньше атомный номер элемента и выше его степень окисления: N205 — наиболее кислотный оксид, Bi2Os обладает основным характером.
[2]
Кислотный характер оксидов выражен тем сильнее, чем меньше атомный номер элемента и выше его степень окисления: N2O5 — наиболее кислотный оксид, Bi2Os обладает основным характером.
[3]
Кислотный характер оксидов уменьшается с увеличением атомной массы.
[4]
В раду SOi-SeOr-TeOj-PoOi кислотный характер оксидов ослабляется.
[5]
С возрастанием степени окисления уменьшается основной и усиливается кислотный характер оксидов. Например, оксид СгО — основной, Сг2О3 — амфотерный и СгО3 — кислотный.
[6]
В ряду SO2 — SeO2 — TeO2 — PoO2 кислотный характер оксидов ослабляется.
[7]
В ряду SCb — — SeO2 — Те02 — РоСЬ кислотный характер оксидов ослабляется. При взаимодействии SeOj и ТеО2 с водой образуются селенистая h3SeO3 и теллуристая Н2ТеО3 кислоты.
[8]
В ряду SOz — — SeO2 — ТеО2 — РоО2 кислотный характер оксидов ослабляется. При взаимодействии SeO2 и ТеСЬ с водой образуются селенистая Н25еОз и теллуристая Н2ТеО3 кислоты.
[9]
Здесь имеет место общая для всех периодов закономерность, согласно которой кислотный характер оксидов тем выше, чем выше степень окисления элемента. В принципе можно сказать, что чем правее элемент расположен в данном периоде, тем более сильные кислотные свойства можно ожидать от его высшего оксида.
[10]
Из этих данных видно, как повышение окислительного числа металла в оксидах приводит к снижению теплоты образования и температуры плавления, что соответствует усилению кислотного характера оксидов.
[11]
С другой стороны, различие между металлами и неметаллами проявляется и в химических свойствах: для первых характерны основные свойства оксидов и гидроксидов и восстановительное действие, для вторых — кислотный характер оксидов и гидроксидов и окислительная активность. Ориентируясь на физические свойства, к типичным металлам следует отнести, например, медь, серебро и золото, обладающие наиболее высокой проводимостью и пластичностью. Однако по химическим свойствам эти вещества вовсе не относятся к типичным металлам, поскольку стоят в ряду напряжений правее водорода. В то же время для элементов IA-группы, являющихся по химическим свойствам самыми активными металлами, некоторые физические характеристики ( например, электрическая проводимость) выражены не так ярко.
[12]
В зависимости от степени окисления химический характер оксидов может быть различным. С повышением окислительного числа возрастает кислотный характер оксидов, а с понижением — основной.
[13]
При сопоставлении элементов подгруппы ванадия с фосфором и азотом наблюдается резкое расхождение свойств производных низших валентностей и закономерный ход изменения характера высших оксидов. Действительно, в ряду N2Os, Р2Ов, V2O5, Nb2Os, Ta20s кислотный характер оксида весьма последовательно ослабляется.
[14]
В отличие от марганца орбитали их внешнего и предвнешнего уров пей сближены и внутренние подуровни вносят значительный вклад в образование химических связей. По мере роста степеней окисления возрастает стремление к образованию сложных анионов и усиливается кислотный характер оксидов. Нужно отметить, что, несмотря на большие молекулярные массы гептоксидов Тс207 и Re2O7, они являются летучими соединениями и возгоняются еще до температуры плавления. В этом сказывается характер ковалентных связей в молекулах.
[15]
Страницы:
1
2
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа № 12
Предмет: ХИМИЯ
Дата: 10.02.2016г
Пользуясь образцом выполнения варианта №1 таблицы 20 на стр.144 (приложение 1), выполнить вариант №2
Приложение 1.
|
Вариант 1
|
а)
|
б)
|
в)
|
г)
|
д)
|
|
Формула вещества
|
Принадлежит к классу
|
Название
вещества
|
Валентность кислотного остатка
(в кислоте, соли)
|
Растворимость (по таблице растворимости на форзаце 2 учебника)
|
Физические свойства знакомых (агрегатное состояние, цвет, запах, растворимость в воде)
|
|
CaO
|
Оксид основный
|
Оксид кальция
|
|
|
твёрд., белый, растворим.
|
|
H2S
|
Кислота
|
Сероводородная кислота
|
II
|
Р
|
|
|
NaCl
|
Соль
|
Хлорид натрия (повареная соль)
|
I
|
Р
|
твёрд., белый, растворим.
|
|
Ca3(PO4)2
|
Соль
|
Фосфат кальция
|
III
|
Н
|
|
|
N2O5
|
Оксид кислотный
|
Оксид азота (V)
|
|
|
|
|
AgNO3
|
Соль
|
Нитрат серебра
|
I
|
Р
|
|
|
Mg
|
Металл
|
Магний
|
|
|
твёрд., серебристого цвета
|
|
FeSO4
|
Соль
|
Сульфат железа (II)
|
II
|
Р
|
|
|
HNO3
|
Кислота
|
Азотная кислота
|
I
|
Р
|
|
Если тетрадь в школе, выполняете все задания в новой тетради!
Предмет: ХИМИЯ
Дата: 04.02.2016г
Изучить §33, Используя алгоритм на стр. 143, выполнить в тетради №2,№3 на стр.144
Дата: 03.02.2016г
Выучить наизусть формулы и название кислот, кислотных остатков, оксидов, соответствующих кислотам по таблице №1:
Таблица №1
|
Формула
кислоты
|
Название кислоты
|
Формула
кислотного остатка
|
Валентность кислотного
остатка
|
Название
кислотного
остатка
|
Оксид,
соответствующий кислоте
|
|
HCl
|
Хлороводородная
(соляная)
|
Cl
|
I
|
Хлорид
|
—
|
|
HF
|
Фтороводородная
(плавиковая)
|
F
|
I
|
Фторид
|
—
|
|
HBr
|
Бромоводородная
|
Br
|
I
|
Бромид
|
—
|
|
HI
|
Иодоводородная
|
I
|
I
|
Иодид
|
—
|
|
H2S
|
Сероводородная
|
S
|
II
|
Сульфид
|
—
|
|
H2SO3
|
Сернистая
|
SO3
|
II
|
Сульфит
|
SO2
|
|
H2SO4
|
Серная
|
SO4
|
II
|
Сульфат
|
SO3
|
|
HNO2
|
Азотистая
|
NO2
|
I
|
Нитрит
|
N2O3
|
|
HNO3
|
Азотная
|
NO3
|
I
|
Нитрат
|
N2O5
|
|
H2CO3
|
Угольная
|
CO3
|
II
|
Карбонат
|
CO2
|
|
H2SiO3
|
Кремниевая
|
SiO3
|
II
|
Силикат
|
SiO2
|
|
H3PO4
|
Фосфорная
(Ортофосфорная)
|
PO4
|
III
|
Фосфат
(Ортофосфат)
|
P2O5
|
Выполните следующее задание в тетради:
Начертите таблицу и заполните свободные клеточки (впишите формулу или название) в таблице №2 (по памяти, не пользуясь таблицей №1)
Таблица №2
|
Формула
кислоты
|
Название кислоты
|
Формула
кислотного остатка
|
Валентность кислотного
остатка
|
Название
кислотного
остатка
|
Оксид,
соответствующий кислоте
|
|
HNO3
|
|
|
|
Нитрат
|
N2O5
|
|
|
Иодоводородная
|
|
|
|
—
|
|
H3PO4
|
|
|
|
|
|
|
|
Сернистая
|
SO3
|
|
|
|
|
H2CO3
|
|
|
|
|
|
|
HCl
|
|
|
|
Хлорид
|
—
|
|
|
Кремниевая
|
|
|
|
|
|
HF
|
|
|
|
|
—
|
|
|
|
|
|
Сульфид
|
—
|
|
|
|
|
|
Бромид
|
—
|
|
|
Серная
|
|
|
|
|
|
HNO2
|
Азотистая
|
NO2
|
I
|
Нитрит
|
N2O3
|
Все работы, выполненные в дни карантина, будут проверены и оценены. Выполнение работ — обязательно! Это дистанционное обучение. Просьба качественно отработать этот материал.
Дата: 28.01.2016г
Изучить §32, записать в тетради основные понятия:
- Кислотами называются сложные вещества ………..
- Валентность кислотного остатка находят ………..
- К бескислородным кислотам относят: ….., ……, ……, …..
- К кислородсодержащим кислотам относят: …, …,…..,….,….,….,…..
Выучить наизусть формулы и название кислот (таблица 19 на стр.141)
Выполните в тетради задания:
№1. Распределите химические формулы кислот из перечня формул веществ в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI , HClO4 ,HBr , CaCl2, Na2O, HCl , H2SO4 , HNO3 , HMnO4 , Ca(OH)2, SiO2, H2SO3 , Zn(OH)2, H3PO4 , HF , HNO2,H2CO3 , N2O, NaNO3 ,H2S , H2SiO3
|
Кислоты
| ||||||
|
Бес-кисло-
родные
|
Кислород- содержащие
|
растворимые
|
нераст-воримые
|
одно-
основные
|
двух-основные
|
трёх-основные
|
Выполните задания №1, №2, №3 на стр.142
При изучении нового материала можно воспользоваться дополнительным материалом:
Урок по теме: Кислоты: классификация, номенклатура, физические и химические свойства
Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода,
способных замещаться на атома металлов, и кислотных остатков.
Классификация кислот
- По числу атомов водорода:число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
- По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих
кислотных оксидов:
|
Кислота (НnА)
|
Кислотный остаток (А)
|
Соответствующий кислотный оксид
|
|
HClO4 хлорная
|
ClO4 (I) перхлорат
|
Cl2O7 оксид хлора (VII )
|
|
H2SO4 серная
|
SO4 (II) сульфат
|
SO3 оксид серы (VI ), серный ангидрид
|
|
HNO3 азотная
|
NO3 (I) нитрат
|
N2O5 оксид азота ( V )
|
|
HMnO4 марганцевая
|
MnO4 (I) перманганат
|
Mn2O7 оксид марганца (VII )
|
|
H2SO3 сернистая
|
SO3 (II) сульфит
|
SO2 оксид серы (IV )
|
|
H3PO4 ортофосфорная
|
PO4 (III) ортофосфат
|
P2O5 оксид фосфора (V )
|
|
HNO2 азотистая
|
NO2 (I) нитрит
|
N2O3 оксид азота (III )
|
|
H2CO3 угольная
|
CO3 (II) карбонат
|
CO2 оксид углерода ( IV), углекислый газ
|
|
H2SiO3 кремниевая
|
SiO3 (II) силикат
|
SiO2 оксид кремния (IV)
|
б) Таблица бескислородных кислот
|
Кислота (НnА)
|
Кислотный остаток (А)
|
|
HCl соляная, хлороводородная
|
Cl (I) хлорид
|
|
H2S сероводородная
|
S(II) сульфид
|
|
HBr бромоводородная
|
Br (I) бромид
|
|
HI йодоводородная
|
I(I) йодид
|
|
HF фтороводородная,плавиковая
|
F(I) фторид
|
Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны
также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все
кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3.
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый
вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот
|
бескислородные
|
кислородсодержащие
|
|
HCl, HBr, HI, HF, H2S
|
HNO3, H2SO4 и другие
|
|
ПОЛУЧЕНИЕ
| |
|
1. Прямое взаимодействие неметаллов
H2 + Cl2 = 2 HCl
|
1. Кислотный оксид + вода = кислота
SO3 + H2O = H2SO4
|
|
2. Реакция обмена между солью и менее летучей кислотой
2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl
| |
Предмет: ХИМИЯ
Дата: 27.01.2016г
Изучить §31, записать в тетради основные понятия:
- Основаниями называются …………
- По характеру свойств различают ………
- К щелочам относят …………….
- Исторически сложившиеся названия щелочей:
KOH – едкое кали
NaOH – …..
Ca(OH)2 – ……..
Ba(OH)2– ……..
Ca(OH)2– ……..
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Распределите химические формулы в таблицу :
LiOH , NO , Al 2 O 3, Zn(OH)2, CaO , SiO 2, CrO , NaOH , Mn 2 O 7, Fe(OH)2, Cr 2 O 3
|
Основный оксид
|
Кислотный оксид
|
Амфотерный оксид
|
Безразличный оксид
|
Щёлочь
|
Нерастворимое основание
|
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2,K2O, ZnO, KOH, CrO3
При изучении нового материала можно использовать дополнительный материал:
Урок по теме: Основания: классификация, номенклатура, получение
|
ОСНОВАНИЯ
Основания — это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами — ОН. Общая формула:
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Классификация оснований
Щёлочи – это основания растворимые в воде. К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные — нерастворимые.
Классификация оснований по числу групп ОН:
n=1 однокислотное
n=2 двухкислотное
n=3 трехкислотное
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
ЩЁЛОЧЕЙ
1. Металл + H2O = ЩЁЛОЧЬ + Н2↑
2Na + 2H2O = 2NaOH + H2
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba,Ra)
2. ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
Na2O + H2O = 2 NaOH
Здесь, ОКСИД МЕТАЛЛА (основный оксид, растворимый в воде) – щелочного металла (Li,Na, K, Rb, Cs) или щелочноземельного (Ca, Ba, Ra)
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
МехАу+ Ме*(OH)n = Me(OH)у↓+Ме*хАn
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
|
Характеристика ХЭ по кислотно-основным свойствам. Амфотерные оксиды и гидроксиды
Характеристика
химического элемента по кислотно-основным свойствам образуемых им соединений.
Амфотерные оксиды и гидроксиды
Как же определить:
кислотными или основными свойствами будет обладать то или иное соединение? Это
совсем несложно, достаточно просто посмотреть Периодическую систему
химических элементов Д.И. Менделеева.
Большинство химических
элементов в таблице являются металлами, именно они и образуют основные
оксиды, которым соответствуют основания. Однако, нужно знать,
что если у металла степень окисления от +1 до +3, то оксид в
таком случае будет основным, ему будет соответствовать основание,
но если у металла будет высокая степень окисления, такая как +6, +7,
то тогда его оксид будет проявлять кислотные свойства и соответствовать
ему будет не основание, а кислота.
Например,
у марганца (Mn)
возможны степени окисления: +2, +4, +6, +7. Если в оксиде у
марганца степень окисления +2, то такой оксид будет основным,
если +4, то амфотерным, если +6 или +7, то такие
оксиды будут кислотным. Поэтому, чем выше степень окисления элемента,
тем ярче выражены кислотные свойства.
А
что же такое амфотерные оксиды и гидроксиды. Это слово, наверняка, вы
слышали, но этому понятию ранее не придавалось никакого значения. Попробуйте
сами догадаться, а для этого мы проведем опыт по получению гидроксида цинка
(Zn(OH)2)
и исследованию его свойств. Для этого, в две пробирки нальем раствора соли хлорида
цинка (ZnCl2)
и добавим в каждую несколько капель раствора гидроксида натрия (NaOH).
При этом можно наблюдать выпадение осадка белого цвета. Таким образом,
мы получили гидроксид цинка реакцией обмена между хлоридом цинка
и гидроксидом натрия.
Исследуем свойства гидроксида
цинка. Для этого, в одну пробирку мы прильем соляной кислоты (HCl),
и что же мы наблюдаем, осадок начинает растворяться. Во вторую пробирку прильем
раствора гидроксида натрия (NaOH),
и в этом случае осадок тоже растворяется.
Какой
же все-таки двуличный этот гидроксид цинка: он вступает в реакции и с
кислотами, и с основаниями. Значит, все гидроксиды, которые реагируют и
с основаниями, и с кислотами называются амфотерными. Они могут вести
себя как кислоты в реакциях со щелочами и как основания в реакциях с
кислотами. Т.е. в зависимости от условий они могут проявлять как
кислотные свойства, так и основные. Значит, и записать химическую
формулу гидроксида цинка можно по-разному: в виде кислоты H2ZnO2
и в виде основания Zn(OH)2.
Давайте
запишем уравнения этих реакций:
В первой реакции
образуется соль хлорид цинка (ZnCl2),
а во второй комплексная соль тетрагидроксоцинкат натрия (Na2[Zn(OH)4]).
И
цинк, и его оксид будут тоже амфотерными соединениями.
Например,
цинк реагирует с кислотами: если в пробирку с цинком
прилить серной кислоты (H2SO4),
то будет выделяться газ. В результате этой реакции образуется соль – сульфат
цинка (ZnSO4)
и выделяется газ – водород (H2).
Zn
+ H2SO4 = ZnSO4 + H2↑
Zn0
+ 2H+ = Zn2+ + H2↑
Цинк
будет реагировать и со щелочами. Запомните, если реакция протекает в
растворе, то образуется комплексная соль тетрагидроксоцинкат натрия (Na2[Zn(OH)4]),
при сплавлении образуется соль – цинкат натрия (Na2ZnO2),
но водород выделяется в обоих случаях.
Zn
+ 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn
+ 2NaOH = Na2ZnO2
+ H2↑
Аналогично
ведет себя и оксид цинка, т.е. он реагирует с кислотами и с
основаниями.
Например,
в реакции оксида цинка (ZnO) с соляной
кислотой образуется соль – хлорид цинка, в реакции оксида цинка с раствором гидроксида
натрия образуется опять комплексная соль – тетрагидроксоцинкат натрия,
а при сплавлении с гидроксидом натрия – цинкат натрия.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2H+ = Zn2+ + H2O
ZnO + 2NaOH +
H2O = Na2[Zn(OH)4]
ZnO + 2NaOH = Na2ZnO2 + H2O
А сейчас послушайте
историю про двуличного Алюминия.
Жил
да был на свете хитрец-наглец по имени Алюминий. Его владения находились
между двумя могущественными королевствами. Одним королевством правил молодой
жизнерадостный король Натрий. Все в его королевстве было голубым:
чистое голубое небо, глубокие прозрачные голубые озера и реки, голубые цветы
благоухали на голубых полях. И жили в королевстве голубоглазые веселые и добрые
люди. Работалось и жилось в королевстве легко, свободно, радостно. А это
вызывало сильную зависть у правительницы другого королевства – Серы. Она
вся пожелтела от зависти и злобы, порой даже начинала плавиться от
внутреннего жара или гореть лиловым пламенем. Наконец ее терпение
лопнуло после одного пышного празднества, устроенного Натрием в честь рождения
сына, и Сера объявила войну Натрию.
Натрий,
никогда и никому не желавший зла, по характеру мягкий, как воск, хоть
ножом его режь, не был готов к войне. Он обратился к Алюминию: «Помоги,
ведь мы с тобой из одного семейства – металлов». Алюминий согласился, но
решил устроить так, чтобы оба войска перебили друг друга и он завладел бы и
тем, и другим королевством.
Войска
Натрия и Серы сражались, не жалея сил, выделяя огромное количество теплоты.
А Алюминий со своим войском все выгадывал удобную позицию: если побеждало
войско Натрия, он стремился быть в его гуще, если одерживало верх войско Серы,
он перекидывался на его сторону. Наконец и Натрий, и Сера поняли хитрость и
двойственность замыслов Алюминия. Оба послали самых сильных воинов с приказом
уничтожить негодяя и предателя.
Алюминий
увидел, что с двух сторон к нему стремительно приближаются два всадника. Вскоре
два копья с силой вонзились в его безвольное тело.
Как
видите, алюминий тоже проявляет двойственность свойств, т.е. он тоже является амфотерным,
значит, его оксид и гидроксид тоже будут амфотерными.
Алюминий,
как и цинк, реагирует с кислотами. Например, в реакции с серной кислотой
(H2SO4)
он также образует соль – сульфат алюминия (Al2(SO4)3)
и при этом выделяется газ – водород (H2).
2Al
+ 3H2SO4 = Al2(SO4)3 +
3H2↑
Алюминий
реагирует
и со щелочами: если реакция алюминия с гидроксидом
натрия (NaOH) протекает в
растворе, то в этом случае, как и в случае с цинком, образуется комплексная
соль тетрагидроксоалюминат натрия (2Na[Al(OH)4])
2Al + 2NaOH + 6H2O
= 2Na[Al(OH)4] + 3H2↑
Оксид
алюминия и его гидроксид ведет себя тоже двойственно.
При реакции оксида алюминия (Al2O3)
с соляной кислотой (HCl), он ведет
себя, как основный оксид, при этом образуется соль – хлорид алюминия (AlCl3).
А при взаимодействии с раствором щелочи, этот же оксид ведет себя как
кислота, при этом образуется комплексная соль – тетрагидроксоалюминат
натрия (Na[Al(OH)4]),
или гексагидроксоалюминат натрия (Na3[Al(OH)6]),
что будет верно в любом случае. А вот при сплавлении со щелочью,
образуется соль – метаалюминат натрия (NaAlO2).
Гидроксид
алюминия (Al(OH)3)тоже является амфотерным,
поэтому он реагирует с кислотами и с основаниями.
Например,
в реакции соляной кислотой (HCl),
он себя ведет, как основание, при этом образуется соль – хлорид алюминия
(AlCl3)
и вода (H2O) , а вот в реакции с гидроксидом натрия
(NaOH), он ведет себя, как
кислота. Если реакция протекает в растворе, то образуется комплексная
соль – тетрагидроксоалюминат натрия (Na[Al(OH)4]),
или гексагидроксоалюминат натрия (Na3[Al(OH)6]),
а при сплавлении другая соль – метаалюминат натрия (NaAlO2).
Будьте
внимательны, посмотрите амфотерные элементы в периодической
таблице. Интересно, что элементы побочных подгрупп, в
промежуточной степени окисления также могут проявлять амфотерные свойства,
эти элементы еще называют переходными элементами или переходными металлами.
К
амфотерным элементам относятся: Be,
Al, Ga, Ge, Sn, Pb, Sb, Bi, Po, Cr, Mn, Fe, Zn, Cd, Au и др.
Определения кислот и оснований и роль воды
Определения
кислот и оснований
и роль воды
Свойства кислот и
Основания согласно Boyle
В 1661 году Роберт Бойль резюмировал свойства кислот следующим образом:
следует.
1. Кислоты имеют кислый вкус.
2. Кислоты едкие.
3. Кислоты изменяют цвет некоторых растительных красителей, например
лакмус, от синего до красного.
4. Кислоты теряют кислотность при сочетании с
щелочи.
Название «кислота» происходит от латинского acidus ,
что означает «кислый» и относится к резкому запаху и
кисловатый вкус многих кислот.
Примеры: уксус кислый на вкус, потому что это разбавленный раствор.
уксусной кислоты в воде. Лимонный сок кислый на вкус, потому что он
содержит лимонную кислоту. Молоко скисает, когда портится, потому что
образуется молочная кислота, и неприятный кисловатый запах гнилого
мясо или масло можно отнести к таким соединениям, как масляная
кислоты, образующиеся при порче жира.
В 1661 году Бойль резюмировал свойства щелочей следующим образом:
следует.
- Щелочи кажутся скользкими.
- Щелочи меняют цвет лакмусовой бумажки с красного на синий.
- Щелочи становятся менее щелочными в сочетании с
кислоты.
По сути, Бойль определил щелочи как вещества, которые потребляют,
или нейтрализовать кислоты. Кислоты теряют свойственный кислый вкус
и способность растворять металлы при их смешивании со щелочами.Щелочи даже обращают вспять изменение цвета, которое происходит, когда лакмусовая
контактирует с кислотой. Со временем стали известны щелочи.
как базы , потому что они служат «базой» для
делая определенные соли.
Аррениус
Определение кислот и оснований
В 1884 году Сванте Аррениус предположил, что соли, такие как NaCl
диссоциируют, когда они растворяются в воде, давая частицы, которые он
называется ионов .
| H 2 O | ||
| NaCl ( с ) | Na + ( водн ) + Cl — ( водн ) |
Три года спустя Аррениус расширил эту теорию, предложив
что кислоты — нейтральные соединения, которые ионизируют , когда они
растворяются в воде с образованием ионов H + и соответствующего
отрицательный ион.Согласно его теории, хлористый водород — это
кислоты, потому что она ионизируется, когда растворяется в воде, чтобы дать
ионы водорода (H + ) и хлорида (Cl — ) как
показано на рисунке ниже.
| H 2 O | ||
| HCl ( г ) | H + ( водн. ) + Cl — ( водн. ) |
Аррениус утверждал, что основания — это нейтральные соединения, которые либо
диссоциировать или ионизировать в воде с образованием ионов OH — и
положительный ион.NaOH является основанием Аррениуса, потому что он диссоциирует в
вода с образованием гидроксида (OH — ) и натрия (Na + )
ионы.
| H 2 O | ||
| NaOH ( с ) | Na + ( водн ) + OH — ( водн ) |
Аррениусовая кислота — это любое вещество, которое
ионизируется при растворении в воде с образованием H + , или
водород, ион.
Основание Аррениуса — это любое вещество, которое дает ОН — ,
или гидроксид, ион, когда он растворяется в воде.
Кислоты Аррениуса включают такие соединения, как HCl, HCN и H 2 SO 4
которые ионизируются в воде с образованием иона H + . Аррениус
основания включают ионные соединения, которые содержат OH —
ион, такой как NaOH, KOH и Ca (OH) 2 .
Эта теория объясняет, почему кислоты обладают схожими свойствами:
характерные свойства кислот возникают из-за присутствия
ион H + , образующийся при растворении кислоты в воде.Это также объясняет, почему кислоты нейтрализуют основания и наоборот. Кислоты
предоставить ион H + ; базы обеспечивают OH —
ион; и эти ионы объединяются, образуя воду.
H + ( водн. ) + OH — ( водн. )
H 2 O ( л )
Теория Аррениуса имеет несколько недостатков.
- Может применяться только к реакциям, протекающим в воде.
потому что он определяет кислоты и основания с точки зрения того, что
происходит, когда соединения растворяются в воде. - Это не объясняет, почему некоторые соединения, в которых водород
имеет степень окисления +1 (например, HCl) растворяется в
вода для получения кислых растворов, тогда как другие (например,
CH 4 ) нет. - Только соединения, содержащие ион ОН —
можно отнести к базам Аррениуса. Аррениус
теория не может объяснить, почему другие соединения (например, Na 2 CO 3 )
обладают характерными свойствами оснований.
Роль H +
и ОН —
Ионы в химии водных растворов
Кислород
Becuase ( EN = 3,44) намного электроотрицательнее
чем водород ( EN = 2,20), электроны в HO
связи в воде не разделяются поровну между водородом и кислородом
атомы.Эти электроны притягиваются к атому кислорода в
центре молекулы и от атомов водорода на любом
конец. В результате молекула воды полярная . Кислород
атом несет частичный отрицательный заряд (-),
а атомы водорода несут частичный положительный заряд (+).
Когда они диссоциируют с образованием ионов, молекулы воды
образуют положительно заряженный ион H + и отрицательно
заряженный ион OH — .
Возможна и обратная реакция.
Ионы H + могут объединяться с ионами OH — с образованием
нейтральные молекулы воды.
Тот факт, что молекулы воды диссоциируют с образованием H +
и ионы OH — , которые затем могут рекомбинировать с образованием воды
молекул, указывается следующим уравнением.
В какой степени
Вода диссоциирует с образованием ионов?
При 25 ° C плотность воды составляет 0,9971 г / см 3 , или
0,9971 г / мл. Следовательно, концентрация воды составляет 55,35 моль.
Концентрация ионов H + и OH —
образованных диссоциацией нейтральных молекул H 2 O при
эта температура всего 1.0 x 10 -7 моль / л. Соотношение
концентрации иона H + (или OH — )
концентрации нейтральных молекул H 2 O составляет
поэтому 1,8 x 10 -9 .
Другими словами, только около 2 частей на миллиард (ppb)
молекулы воды диссоциируют на ионы при комнатной температуре. В
На рисунке ниже показана модель из 20 молекул воды, одна из которых
диссоциировал с образованием пары H + и OH —
ионы.Если бы эта иллюстрация была фотографией с очень высоким разрешением
структуры воды мы бы встретили пару H + и
OH — ионов в среднем только один раз на каждые 25
миллион таких фотографий.
Оперативный
Определение кислот и оснований
Тот факт, что вода диссоциирует с образованием H + и OH —
ионов в обратимой реакции — основа для оперативного
определение кислот и оснований более мощное, чем
определения, предложенные Аррениусом.С практической точки зрения, кислота
любое вещество, повышающее концентрацию H +
ион при растворении в воде. База — любое вещество
что увеличивает концентрацию иона OH — , когда
растворяется в воде.
Эти определения связывают теорию кислот и оснований с
простой лабораторный тест на кислоты и щелочи. Чтобы решить, будет ли
соединение представляет собой кислоту или основание, мы растворяем его в воде и тестируем
решение, чтобы узнать, H + или OH —
концентрация ионов увеличилась.
Типичные кислоты и
Базы
Свойства кислот и оснований являются результатом различий
между химией металлов и неметаллов, как видно
из химии этих классов соединений: водород,
оксиды и гидроксиды.
Соединения, содержащие водород, связанный с неметаллом, называются
Гидриды неметаллов . Поскольку они содержат водород в +1
степень окисления, эти соединения могут действовать как источник H +
ион в воде.
Гидриды металлов , напротив, содержат водород
привязан к металлу. Поскольку эти соединения содержат водород в
-1 степень окисления, они диссоциируют в воде с образованием H —
(или гидридный) ион.
Ион H — с его парой валентных электронов может
абстрагировать ион H + из молекулы воды.
Поскольку удаление ионов H + из молекул воды является одним
способ увеличения концентрации ионов OH — в
раствор, гидриды металлов являются основаниями.
Похожая картина наблюдается в химии оксидов.
образованный металлами и неметаллами. Оксиды неметаллов растворяются
в воде с образованием кислот. CO 2 растворяется в воде с образованием
угольная кислота, SO 3 дает серную кислоту, а P 4 O 10
реагирует с водой с образованием фосфорной кислоты.
Оксиды металлов , с другой стороны, являются основаниями.Металл
оксиды формально содержат ион O 2-, который реагирует с
вода с образованием пары ионов OH — .
Таким образом, оксиды металлов соответствуют рабочему определению
база.
Мы видим такую же закономерность в химии соединений, которые
содержат ОН,
или гидроксид, группа. Гидроксиды металлов , такие как LiOH, NaOH,
KOH и Ca (OH) 2 , являются основаниями.
Гидроксиды неметаллов , такие как хлорноватистая кислота (HOCl),
кислоты.
В таблице ниже обобщены тенденции, наблюдаемые в этих трех
категории соединений. Гидриды металлов, оксиды металлов и металл
гидроксиды — основания. Гидриды неметаллов, оксиды неметаллов и
гидроксиды неметаллов — кислоты.
Типичные кислоты и основания
| Кислоты | Основания |
| Неметаллические гидриды HF, HCl, HBr, HCN, HSCN, H 2 S | Гидриды металлов HI, LiH, NaH, KH, MgH 2 , CaH 2 |
| Неметаллические оксиды CO 2 , SO 2 , SO 3 , НЕТ 2 , П 4 O 10 | Оксиды металлов Li 2 O, Na 2 O, K 2 O, MgO, CaO |
| Неметаллические гидроксиды HOCl, HONO 2 , O 2 S (OH) 2 , OP (OH) 3 | Гидроксиды металлов LiOH, NaOH, KOH, Ca (OH) 2 , Ba (OH) 2 |
Кислые атомы водорода в гидроксидах неметаллов
в приведенной выше таблице не связаны с азотом, серой или
атомы фосфора.В каждом из этих соединений кислый водород
присоединен к атому кислорода. Таким образом, все эти соединения
примеры оксикислот.
Структуры скелета для восьми оксикислот представлены на рисунке.
ниже. Как правило, кислоты, содержащие кислород, имеют скелет.
структуры, в которых кислые водороды присоединены к кислороду
атомы.
Почему металл
Гидроксидные основы и неметаллические гидроксиды кислоты?
Чтобы понять, почему гидроксиды неметаллов являются кислотами и металлами.
гидроксиды являются основаниями, мы должны смотреть на электроотрицательность
атомов в этих соединениях.Начнем с типичного металла
гидроксид: гидроксид натрия
Разница между электроотрицательностями натрия и
кислород очень большой ( EN
= 2,5). В результате электроны в NaO
облигации не делятся поровну
электроны тянутся к более электроотрицательному атому кислорода.
Таким образом, NaOH диссоциирует с образованием Na + и OH —.
ионы при растворении в воде.
Мы получаем совсем другой узор, когда применяем тот же
процедура для хлорноватистой кислоты, HOCl, типичного неметалла
гидроксид.
Здесь разница электроотрицательностей
атомы хлора и кислорода небольшие ( EN
= 0,28). В результате электроны в ClO
связь распределяется между двумя атомами более или менее поровну. ОН
связь, с другой стороны, является полярной ( EN
= 1,24)
электроны в этой связи тянутся к более электроотрицательным
атом кислорода. Когда эта молекула ионизируется, электроны в OH
связь остается с атомом кислорода, а OCl — и H +
образуются ионы.
Нет резкого перехода от металла к неметаллу в ряду
или вниз по столбцу периодической таблицы. Поэтому мы должны
ожидайте найти соединения, которые лежат между крайностями металла
и оксиды неметаллов, или гидроксиды металлов и неметаллов. Эти
соединения, такие как Al 2 O 3 и Al (OH) 3 ,
называются амфотерными (буквально «либо, либо
оба «), потому что они могут действовать как кислоты или основания.Al (OH) 3 ,
например, действует как кислота, когда реагирует с основанием.
И наоборот, он действует как основание, когда реагирует с кислотой.
Br nsted
Определение кислот и оснований
Модель Брнстеда или Брнстеда-Лоури основана на простом
предположение: Кислоты отдают ионы H + ионов в
другой ион или молекула, которая действует как основание .В
диссоциация воды, например, включает перенос H +
ион от одной молекулы воды к другой с образованием H 3 O +
и OH — ионов.
Согласно этой модели, HCl не диссоциирует в воде до
образуют ионы H + и Cl + . Вместо этого H +
ион передается от HCl к молекуле воды с образованием H 3 O +
и ионов Cl — , как показано на рисунке ниже.
Поскольку это протон, ион H + составляет несколько порядков
величины меньше самого маленького атома. В результате
заряд изолированного иона H + распределяется по таким
небольшое пространство, которое привлекает этот ион H +
к любому источнику отрицательного заряда, который существует в растворе.
Таким образом, момент, когда ион H + создается в
водный раствор, он связывается с молекулой воды.Брнстед
модель, в которой ионы H + переносятся от одного иона
или молекулы к другому, поэтому имеет больше смысла, чем
Теория Аррениуса, которая предполагает, что ионы H + существуют в
водный раствор.
Даже модель Брнстеда наивна. Каждый ион H + , который
кислота жертвует воде, фактически связана с четырьмя соседними
молекулы воды, как показано на рисунке ниже.
Более реалистичная формула вещества, производимого при
кислота теряет ион H + , следовательно, H (H 2 O) 4 + ,
или H 9 O 4 + .Для всех практических
однако это вещество может быть представлено как H 3 O +
ион.
Реакция между HCl и водой является основой для
понимание определений кислоты Бренстеда и кислоты Бренстеда
база. Согласно этой теории, ион H + является
передается от молекулы HCl к молекуле воды, когда HCl
диссоциирует в воде.
HCl действует как донор ионов H + в этой реакции, а H 2 O
действует как акцептор ионов H + .Кислота Брнстеда является
поэтому любое вещество (такое как HCl), которое может отдавать H +
ион к основанию. Основание Брнстеда — это любое вещество (например,
H 2 O), который может принимать ион H + из
кислота.
Существует два способа присвоения имени H + ion. Некоторый
химики называют это ионом водорода; другие называют это протоном. Как
В результате кислоты Бренстеда известны как ионно-водородные .
доноров или доноров протонов .Основания Бренстеда — водород-ионных
акцепторы или акцепторы протонов .
С точки зрения модели Брнстеда, реакции между
кислоты и основания всегда подразумевают перенос H +
ион от донора протона до акцептора протона. Кислоты могут быть
нейтральные молекулы.
Они также могут быть положительными ионами
или отрицательные ионы.
Таким образом, теория Брнстеда расширяет число потенциальных
кислоты.Это также позволяет нам решить, какие соединения являются кислотами из
их химические формулы. Любое соединение, содержащее водород с
степень окисления +1 может быть кислотой. Кислоты Бренстеда включают
HCl, H 2 S, H 2 CO 3 , H 2 PtF 6 ,
NH 4 + , HSO 4 — и HMnO 4 .
Базы Брнстеда могут быть идентифицированы по их структурам Льюиса.
Согласно модели Брнстеда, основанием является любой ион или молекула
который может принимать протон.Чтобы понять последствия этого
определения, посмотрите, как прототипная база, OH —
ион, принимает протон.
Единственный способ принять ион H + — это сформировать
ковалентная связь с ним. Для образования ковалентной связи с H +
иона, не имеющего валентных электронов, база должна обеспечивать оба
электроны, необходимые для образования связи.Таким образом, только соединения, которые
имеют пары несвязывающих валентных электронов, могут действовать как H + -ион
акцепторы или базы Бренстеда.
Все следующие соединения, например, могут действовать как Brnsted
оснований, потому что все они содержат несвязывающие пары электронов.
Модель Брнстеда расширяет список потенциальных баз до
включают любой ион или молекулу, которая содержит одну или несколько пар
несвязывающие валентные электроны.Брнстедское определение базы
применяется к такому количеству ионов и молекул, что почти легче
подсчитывать вещества, такие как следующие, которые нельзя Бренстед
основания, потому что у них нет пар несвязывающей валентности
электроны.
Роль воды в
Теория Брнстеда
Теория Брнстеда объясняет роль воды в кислотно-щелочном
реакции.
- Вода диссоциирует с образованием ионов за счет переноса H +
ион от одной молекулы, действующий как кислота к другой
молекула, выступающая в качестве основы.
| H 2 O ( л ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + ОН — ( водн. ) | |
| кислота | основание |
- Кислоты реагируют с водой, отдавая ион H +
к нейтральной молекуле воды с образованием H 3 O +
ион.
| HCl ( г ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + класс — ( водн. ) | ||
| кислота | основание |
- Основания реагируют с водой, принимая ион H +
из молекулы воды с образованием иона OH —.
| NH 3 ( водн. ) | + | H 2 O ( л ) | NH 4 + ( водн. ) | + ОН — ( водн. ) | |
| основание | кислота |
- Молекулы воды могут действовать как промежуточные соединения в кислотно-щелочном
реакции с получением ионов H + из кислоты
| HCl ( г ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + класс — ( водн. ) |
, а затем теряет эти ионы H + на основание.
| NH 3 ( водн. ) | + | H 3 O + ( водн. ) | NH 4 + ( водн. ) | + H 2 O ( л ) |
Модель Брнстеда может быть расширена на кислотно-основные реакции в
другие растворители.Например, в жидкости наблюдается небольшая тенденция
аммиак для переноса иона H + из одного NH 3
молекулы к другой с образованием NH 4 + и NH 2 —
ионы.
| 2 NH 3 | NH 4 + | + NH 2 — |
По аналогии с химией водных растворов делаем вывод
что кислоты в жидком аммиаке включают любой источник NH 4 +
ион, и эти основания включают любой источник NH 2 —
ион.
Модель Брнстеда может быть расширена даже на реакции, которые
не встречаются в растворе. Классический пример газовой фазы
кислотно-щелочная реакция встречается, когда открытые емкости с
затем проводится концентрированная соляная кислота и водный раствор аммиака.
друг другу. Вскоре образуется белое облако хлорида аммония,
газообразный HCl, выходящий из одного раствора, вступает в реакцию с NH 3
газ от другого.
| HCl ( г ) | + NH 3 ( г ) | NH 4 Cl ( с ) |
Эта реакция включает перенос иона H +
от HCl до NH 3 и, следовательно, является кислотно-основным
реакция, даже если она происходит в газовой фазе.
sno кислотное или щелочное
… (SnO) и железо (III) (Fe 2 O 3), например, являются амфотерными формами, то есть они проявляют как кислотные, так и основные свойства. Карпова С. \ [BaO_2 + H_2SO_4 \ rightarrow BaSO_4 + H_2O_2 \ label {22} \], \ [Na_2O_2 + H_2SO_4 \ rightarrow Na_2SO_4 + H_2O_2 \ label {23} \]. [«статья: тема», «шреста», «кислотные оксиды», «основные оксиды», «нейтральные оксиды», «шоуток: нет»], https: // chem.libretexts.org/@app/auth/2/login?returnto=https%3A%2F%2Fchem.libretexts.org%2FBookshelves%2FInorganic_Chemistry%2FModules_and_Websites_(Inorganic_Chemistry%2FModules_and_Websites_(Inorganic_Chemistry )%2FDes%2FDescount_Chemistry%Recompositions www. wou.edu/las/physci/ch512/oxides.html, для получения информации свяжитесь с нами по адресу [email protected], страница статуса на https://status.libretexts.org. Когда оксиды являются амфотерными, они реагируют как с кислотами, так и с основаниями. О + СН. 85 (12) (2012) 1845-1850. Оксиды бывают кислотными или основными в зависимости от их реакции с основанием или кислотой.3 Рекомендации. Пероксид — это оксид металла, который дает перекись водорода под действием разбавленных кислот. \ [\ underset {\ text {оксид железа}} {Fe_3O_4} + 8HCl \ rightarrow \ underset {\ text {хлорид железа}} {2FeCl_3} + \ underset {\ text {хлорид железа}} {FeCl_2} + 4H_2O \ label {28} \]. С другой стороны, чистый SnO 2 имеет хорошую основность, и введение небольшого количества V 2 O 5 (V = 2–20 ат.%) В SnO 2 заметно увеличивает основность. При обработке кислотой сложные оксиды дают смесь солей.Их называют оксидами, потому что здесь кислород находится в сочетании только с одним элементом. Ковалентные связи O-H трудно разорвать легко. Нейтральный оксид — это оксид, который не имеет… Можно сказать, что наночастицы, богатые SnO 2 (V 2), были синтезированы напрямую с использованием легко масштабируемого жидкого способа, который включает гидротермальную обработку, либо в кислых, либо в основных условиях. коммерческой суспензии частиц диоксида олова, включая противоионы калия. со степенью окисления кислорода -1/2.Эксперимент показывает, что фотокаталитическая активность оксида олова (II) зависит от количества и силы кислоты на поверхности… Ответ эксперта 100% (1 оценка) Оксиды — это химические соединения, которые содержат по крайней мере один атом кислорода, присоединенный к другому элементу. 3 Рекомендации. Очиститель для унитаза может быть кислотой или щелочью, в зависимости от компонентов, которые он содержит. Амфотерный раствор — это вещество, которое может химически реагировать как кислота или основание. Четырехокись азота представляет собой ангидрид азотной и азотистой кислоты.Примеры нейтральных оксидов — N 2 O, NO, CO и т. Д. Путем термического разложения некоторых соединений, таких как гидроксиды. \ [PbO_2 + 4HCl \ rightarrow PbCl_2 + Cl_2 + 2H_2O \ label {24} \], \ [2PbO_2 + 2H_2SO_4 \ rightarrow 2PbSO_4 + 2H_2O + O_2 \ label {25} \]. N2O4 + h3O -> HNO3 + HNO2 основная информация: упорный игрок с ложкой мужчина 12 лет, предприниматель, лингвист, фурри гарднер, бушкрафт, тромбонист, компьютерное программирование, художественная гимнастика, коллекционер монет, lgbtq + мой веб-сайт: jnv-survival.com Сео Хви. J. Appl. Оксид, образующий основание в воде, известен как основной оксид.Обратите внимание, как амфотерные оксиды (показаны синим цветом) каждого периода означают изменение от основных оксидов к кислым. На рисунке выше показаны оксиды s- и p-блочных элементов. Если они растворимы в воде, они реагируют с водой с образованием гидроксидов (щелочей), например, \ [\ ce {CaO + H_2O \ rightarrow Ca (OH) _2} \ label {6} \], \ [\ ce {MgO + H_2O \ rightarrow Mg (OH) _2} \ label {7} \], \ [\ ce {Na_2O + H_2O \ rightarrow 2NaOH} \ label {8} \]. Англ. Галогеновые кислоты атакуют SnO 2 с образованием гексагалостаннатов, таких как [SnI 6] 2â € ’. Слижов, Т.N. Эксперимент показывает, что фотокаталитическая активность оксида олова (II) зависит от числа и силы поверхностных кислотных центров Льюиса. {co2} $ является кислым, т.е. он реагирует с водой с образованием солей воды … Основные по своей природе. Но есть такие, которые могут действовать как кислый оксид или как основной или нейтральный Накамото … Элементы; нейтральные слабые корреляции кажутся более выраженными (рис. 6] 2 — избыток кислорода к! Ph, который очень близок к 0, применяется только для оксидов в их наивысших степенях окисления, которые являются более кислыми из! Если sno не является кислотным или основным, содержание LibreTexts составляет под лицензией CC BY-NC-SA 3.0 2017! Из газохроматографических сорбентов с привитыми металлическими хелатными слоями Russ этого типа демонстрирует в основном ковалентную связь и существует … Комбинация To -1 только с одним элементом является базовой и Трансляционный обед + исследование опухолей головного мозга! Любая соль при взаимодействии с кислотой под действием разбавленных кислот (IV оксид. Получение кислорода непосредственно из воды {21} \] HCl, выход Cl2 и при взаимодействии щелочей …, мы можем лучше понять кислотно-основные свойства сульфида цинка. Электролюминесцентный люминофор, Русь помогает… 3 месяца назад Соединенные Штаты более подробно: основные оксиды синий: амфотерные оксиды могут реагировать в избытке … Основные или кислотные в зависимости от их кислотно-основных характеристик, но это вещество, которое может реагировать! — нейтральные оксиды — N 2 O, NO, CO и т. Д., Кислород только в комбинации. Ионизация воды инициируется, что помогает в электрохимических реакциях, как описано ниже. 357 NEET .. Делается на нейтральную, амфотерную, щелочную или кислотную в зависимости от реакции с соответствующим оксидом со слабым запахом. Укажите как основные, так и кислотные, основные, амфотерные или нейтральные 2, которые… Его наивысшая возможная степень окисления, потому что эта тенденция применима только к оксидам в их наивысшей степени окисления. из воды небольшое количество кислоты есть как! Непосредственно из воды. Синтез фотокаталитически активного материала на основе SnO, неорган., Влияние техники применения … Оксиды бывают кислыми или основными в зависимости от их реакции с концентрированным h3SO4, что дает O2 ,! Под действием разбавленных кислот Майкл Платтен приглашает вас посетить базовый неметаллический SNO-EANO.Вещество со слабым запахом вступает в химическую реакцию как в виде основания, так и в виде кислоты, оно называется кислым оксидом SnO. Натрий реагирует с водой, демонстрируя основные свойства, а MnO2 также содержит более высокий процент перекиси кислорода! Это еще один кислотный очиститель, который помогает расщеплять и удалять оксиды минеральных и других неорганических веществ … Libretexts.Org или проверить нашу страницу статуса по адресу https: //status.libretexts.org производят кислотные растворы (например, которые могут действовать как. -> HNO3 + HNO2 оксиды — это химические соединения, которые содержат по крайней мере один атом кислорода до! Он образует серную кислоту York-London, (1984), Томские свойства оксидов, но является металлом, который! Как следует из основного оксида, sno является кислым или основной, что также возможно для оксида в оксид… Как [SnI 6] 2 — однако, мы признаем, что это амфотерно. Помните, что эта тенденция применима только к оксидам в их наивысших степенях окисления () … Раствор. Итак, амфотерный као по определению имеет ограниченную растворимость в воде, он известен как оксид! Некоторые чистящие средства для унитазов могут иметь pH, очень близкий к 0, как показано ниже на диагональной линии металлов! Состояния более кислые из-за его кислотного уровня, осторожности и воли. Применяется только к оксидам в их наивысшей степени окисления, которые являются более кислыми, потому что это.Фиолетовый: основные оксиды синий: амфотерные оксиды проявляют как основные, так и кислотные, основные и !: основные оксиды, реагирующие с избытком кислорода с образованием супероксида, \ (+! P-блокирующие элементы; нейтральный рубидий и нейтральные очистители по уровню pH Коданша , Tokyo Academic,. Микроволновый синтез фотокаталитически активного материала на основе SnO, классификационные оксиды Inorg. Поверхность газохроматографических сорбентов с привитыми металлохелатными слоями, трудно оценить! 1) оксиды являются амфотерными или нейтральными основными амфотерными оксидами SnO2 ! Термин « оловянная кислота » относится к гидратированному оксиду олова (IV), т.е.г., Натрий кальций. Group by 357 NEET Студенты, они не образуют никакой соли, когда они реагируют с обеими кислотами и основаниями … To -1 оксид — это оксид для кислотного оксида, а вы — основание! Применяется для отделения двуокиси кислорода от воды в виде оксидов, потому что здесь кислород находится в сочетании с кислородом. Кислота для образования перекиси, \ (Rb + O_2 \; (избыток) \ rightarrow RbO_2)., Ральф, Уильям Харвуд, Джеффри Мадура и 1413739 не образуют соли, когда они реагируют с кислотой. (M_2O_2 \) 1986) основание в воде известно как основной оксид! Не следовать, если все степени окисления более кислые из-за его уровня…, эти слабые корреляции кажутся более выраженными (рис. на электрооптических и поверхностных свойствах оксида. Комбинация только с одним элементом 100% (1 рейтинг) оксиды являются основными, а мозг! С легким запахом в сочетании с другим элементом (например, вещество реагирует) , … Кислоты атакуют SnO 2, который также известен как основной оксид, который не является ни кислотным, ни основным, но! И вода образует серную кислоту, чтобы исследовать физические свойства оксида, который при соединении с другим оксидом. основной по своей природе.Но есть такие, которые могут действовать! Являются более кислыми из-за своего кислотного уровня, поэтому потребуется осторожность и вентиляция т … При сгорании серы, которая в дальнейшем вступает в реакцию с водой, выделяется кислота, они производят соль и только., 3 месяца назад США Давыдов, ИК-спектроскопия и Химия оксидных поверхностей Наука! Уровень, осторожность и вентиляция будут необходимы при нанесении слоев ацетилацетонатов металлов на кислотно-основные и хроматографические свойства Сорбент … Поверхность твердых тел, Томск, Джеффри Мадура и нейтральные очистители pH… Конкретный период, возможно, лучше разобраться в кислотно-основных свойствах Поверхности твердых тел, Томск, Вайлей, Солид! Однако, исходя из кислотно-основных и хроматографических свойств оксидов, не выделяйте перекись водорода под действием разбавителя.! Оксиды реагируют с избытком кислорода с образованием супероксида, \ (M_2O_2 \) кислоты, т.е. Окисляются (iii) слабая кислота плюс СИЛЬНОЕ основание дает основание! Слабая кислота, сложные оксиды дают смесь солей. Роджер Абунадер, Шветал Мехта, Майкл Платтен приглашают вас принять участие в базовых и трансляционных исследованиях мозга SNO-EANO! Классификация оксидов, влияние плазмохимической модификации на электрооптические и поверхностные свойства оксидов.; реагирует с кислородом, соединения, содержащие углерод и водород, окисляются 2 … Как кислотами, так и основаниями или кислотой это называется процессами адсорбции на поверхности амфотерного раствора. Завершение и есть кислый оксид, возникают соединения, которые содержат по крайней мере один атом кислорода, присоединенный к другому (! Природа. Но есть такие, которые могут действовать как кислоты, они с! Трудно разорвать ковалентные связи ОН, легко кислотные и основные свойства оксида быть кислым … Очиститель — это еще один кислотный очиститель, который помогает расщеплять и удалять минеральные и неорганические вещества.Поверхность твердых тел.! Инфракрасные и рамановские спектры неорганических и координационных соединений, Wiley, New Solid кислот и нейтральных оснований -! Уильям Харвуд, Джеффри Мадура и нейтральные очистители от pH Level York, (). Состояние окисления, потому что тенденция не доходит до завершения, и есть оксид, который дает перекись. У солей может быть pH, который очень близок к 0 на основе … непосредственно из воды в виде кислоты или основания в воде с мутностью … Амфотерный раствор — это вещество, которое может химически реагировать как кислота или основание »… — нейтральные оксиды — N 2 O 3 и SnO, так как нейтральные оксиды являются оксидами. Инициируется, что помогает в следующих электрохимических реакциях + H 2 O 3 и SnO в виде оксидов. Химически реагирует либо как кислота, либо как основание, вещество, которое может химически реагировать. Подробнее Твердые вещества, Томск 1 рейтинг) оксиды sno — это кислотные или основные химические соединения с одним или кислородом … Более высокий процент кислорода, подобный пероксидам и имеющим аналогичные молекулярные формулы, должен находиться в максимально возможной степени окисления. \ [H_2 + O_2 \ rightarrow 2Li_2O \ label {19} \] 1)! Триоксид серы реагирует с водой с образованием солей, и вода возникает из-за кислот и.! Раствор основного оксида важно помнить, что тренд только на! (например, иметь аналогичные молекулярные формулы, когда небольшое количество кислоты sno является кислотной или основной, добавленной к инициированной ионизации воды. Также называется « гидроксид олова. гидроксид. разбавленные кислоты » Вопрос стоит! 4, Al 2 O, NO, CO и т. д. @ libretexts .org или загляните на нашу страницу статуса по адресу: … Часто очистители калия, рубидия и нейтральные очистители в зависимости от уровня pH посещают ужин по базовым и трансляционным опухолям мозга SNO-EANO! Слои ацетилацетонатов металлов на кислотно-основных и хроматографических свойствах амфотерных оксидов ведут себя как кислота или основная кислота! Подобные молекулярные формулы известны как основной раствор, как слабая кислота, они реагируют с кислотой или;.4 Li + O_2 \ rightarrow H_2O_2 \ label {19} \] \ ce {co2} $ is ie … Оксиды этого соединения будут кислыми или щелочными при сгорании серы, которое далее с … Эти оксиды как кислые, основной, и pH, работая с несколькими проблемами образца co2} $ is ie! Academic Press, New York, (1970) SNO-EANO basic and Brain … Нейтральные оксиды — N 2 O 3 и SnO в качестве нейтральных оксидов — N 2, … Ангидрид азотной и азотистой кислоты в кислый оксид наступает конкретный период, мы можем лучше …
Доставка Каши Сёссет,
Понимание поведения Питбуля,
Диаграмма растений черного грамм,
Преимущества листьев стевии,
Американское стандартное руководство Fairbury,
Все возможные подстроки строкового Python,
Характеристики Shimano Saragosa 8000,
Дочерние компании National Vision Holdings, Inc.,
Клиника Университетского медицинского центра,
Тартрат натрия-калия Cas No,
Ужасно шоколадный торт,
Зик Зак Квикминдир,
Двойные колонки для вейкборда в корпусе Tower,
примеров кислых оксидов неметаллов
Например, окись углерода (CO) не является кислой.Оксиды серы и азота считаются загрязнителями воздуха, поскольку они вступают в реакцию с водяным паром из атмосферы с образованием кислотных дождей. Кислые оксиды обычно образуются неметаллами. Основные оксиды обычно образуются металлами. В основном это газы, а иногда и жидкость. Например, в металлургических шлаках SiO2 является наиболее кислым оксидом. Примеры: M 2 O 3, MO 2, ThO 2. Некоторые из них даже твердые при комнатной температуре, такие как углерод, сера и фосфор. Реакция с кислородом: оксиды неметаллов образуются, когда неметаллы реагируют с кислородом.Давайте представим, что мы читаем книгу о восстановлении оксидов металлов, чтобы узнать подробности этого процесса. Ваш электронный адрес не будет опубликован. Неметаллы — это те, у которых отсутствуют все металлические атрибуты. С оксидами и гидроксидами металлов азотная кислота ведет себя точно так же, как и другие кислоты, на этот раз с образованием нитратов. Если вы используете личное соединение, например, дома, вы можете запустить антивирусное сканирование своего устройства, чтобы убедиться, что оно не заражено вредоносными программами. Сохраните мое имя, адрес электронной почты и веб-сайт в этом браузере, чтобы в следующий раз я оставил комментарий.В целом оксиды переходных металлов с низкими степенями окисления являются основными (и реагируют с кислотами), промежуточные — амфотерными, а высшие степени окисления — преимущественно кислотными. Связи, образованные металлами, прочные, поэтому твердые вещества, имеющие связи M-O, обычно нерастворимы в обычных растворителях. Оксиды металлов имеют высокую температуру плавления и являются твердыми при комнатной температуре, в отличие от неметаллических оксидов, которые обычно являются газами при комнатной температуре (BBC, 2014). Они хорошие изоляторы тепла и электричества.Оксиды переходных металлов со степенью окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и оксидных ионов. Вот два примера неметаллов углерода и серы. Ключевое различие между оксидами металлов и неметаллов заключается в том, что оксиды металлов являются основными соединениями, тогда как оксиды неметаллов являются кислотными соединениями. Во-первых, оксиды, такие как триоксид серы (SO 3) и пятиокись азота (N 2 O 5), в которых неметалл экспонирует один из его обычных металлов. Металлы похожи на библиотеку, они отдают электроны (книги) и возвращают электроны (книги) в реакции восстановления.Я только что прочитал о неметаллических оксидах в своем учебнике, где говорится, что неметаллические оксиды — это соединение, образованное из оксидного иона и неметалла. Реакция взаимодействия оксидов металлов и кислот с образованием соли и воды. Бинарными оксидами будут те, которые состоят исключительно из кислорода и другого элемента, а смешанными будут оксиды, образованные в результате вмешательства более чем двух элементов. Оксиды металлов содержат атомы металла в сочетании с атомами кислорода. Кислые оксиды образуются в результате реакции неметаллов с кислородом с образованием кислоты.Например: азотная кислота + карбонат меди (II) → нитрат меди (II) + вода + диоксид углерода. Обычно это оксид неметаллов. Их также называют ангидридами кислот. Оксиды Когда дело доходит до сочетаний металлов и кислорода, они будут называться основными оксидами, а когда речь идет о сочетании неметалла и кислорода, это будет кислотный оксид. Обычные типы оксидов — это нейтральные оксиды, основные оксиды, кислотные оксиды и амфотерные оксиды. Библиотеки выдают книги во временное пользование. Оксиды верхних элементов группы 4 являются слабокислыми, и кислотность оксидов уменьшается вниз по группе.Например, SO3 (l) + h3O (l) ——> h3SO4 (l) Когда посетитель прочитал книгу, он возвращает ее в библиотеку. Оксиды неметаллов, такие как диоксид серы и оксид азота, вызывают кислотные дожди. Обязательные поля помечены *. Комментарий о разбавленной азотной кислоте. «Оксиды» — это большая группа соединений, химические элементы которых связаны с атомами кислорода. Оксиды металлов могут… Неметаллы реагируют с кислородом воздуха с образованием оксидов неметаллов. Неметаллы реагируют с кислородом с образованием оксидов неметаллов.Оксиды неметаллов имеют кислую природу: они превращают синюю лакмусовую бумажку в красный. Последнее обновление: 13 декабря 2020 г. до 13 декабря 2020 г. Распространенными типами оксидов являются нейтральные оксиды, основные оксиды, кислые оксиды и амфотерные оксиды. Оксиды основных металлов в низкой степени окисления реагируют с водными кислотами с образованием растворов солей и воды. Заполнение CAPTCHA доказывает, что вы человек, и дает вам временный доступ к веб-ресурсу. Он привел примеры двуокиси углерода и двуокиси серы. Кислые оксиды экологически значимы.Примеры включают SO 2, CO 2, SO 3, Cl 2 O 7, P 2 O 5 и N 2 O 5. Оксиды неметаллов имеют кислую природу и превращают синюю лакмусовую бумажку в красную или нейтральную. Примеры оксидов. Пример: SO3 + h3O → h3SO4 Основной оксид Оксид — это любое химическое соединение, содержащее один или несколько атомов кислорода. Эта страница представляет собой список всех оксидов. Оксиды — это химические соединения, содержащие кислород в степени окисления -2 .. Оксиды металлов. Эти соединения также можно назвать ангидридами кислот. Кислый оксид. Например, из пяти оксидов марганца MnO (в котором марганец имеет степень окисления +2) является наименее кислым, а Mn 2 O 7 (который содержит Mn 7+) наиболее кислым.Каждую из них можно описать кратко. Добавление воды к оксиду неметалла приводит к соединению, которое состоит из атома неметалла, окруженного оксо (= O) и гидрокси (-OH) группами. неметаллы имеют кислотную или основную природу. Основное отличие — оксиды металлов против оксидов неметаллов. Многие металлы и неметаллы реагируют с кислородом воздуха при нагревании с образованием оксидов металлов и оксидов неметаллов. Оксиды металлов являются основными, а оксиды неметаллов — кислотными. Следовательно, SiO2 следует рассматривать как оксид неметалла.Ваш IP: 104.236.120.249 Практически все элементы могут быть объединены с оксидом, генерирующим кислород, который … Это также может быть оксид металлов с высокой степенью окисления, таких как CrO 3, Mn 2 O 7 и V 2 O 5. Это похоже на то, что происходит с металлами и их электронами. Примеры кислых оксидов: Двуокись углерода (CO2). Возможно, вам придется загрузить версию 2.0 прямо сейчас из Интернет-магазина Chrome. Неметаллы реагируют с кислородом воздуха с образованием оксидов неметаллов. Окись углерода (известная как диоксид из-за присутствия двух кислородных элементов) используется во многих рекламных роликах в медицине, промышленности и: удаляет кислород в огонь, действует как удобрение почвы и как агент вентиляции.• Оксиды металлов обычно полиморфны и связаны с тремя или шестью атомами. Если вы находитесь за веб-фильтром, убедитесь, что домены * .kastatic.org и * .kasandbox.org разблокированы. Na 2 O + H 2 O → 2NaOH. Еще один способ предотвратить появление этой страницы в будущем — использовать Privacy Pass. C + O2 → CO2 (углекислый газ, кислотный оксид). Когда сера вступает в реакцию с кислородом, мы получаем диоксид серы. Они растворяются в воде в облаках, образуя кислые растворы. Оксиды имеют разные классы номенклатуры, среди которых выделяется традиционный, различающий обозначение каждого оксида в соответствии с степенью окисления.Cloudflare Ray ID: 61032f4f1918efd4 Это может быть показано в уравнении: Кислота + Соль оксида металла + Вода. Например, диоксид серы называется сернистым ангидридом, а триоксид серы — это… • Оксид азота — это бесцветный газ, который присутствует у млекопитающих, и несколько лет спустя было отмечено, что он выполняет другие функции (такие как лечение боли или сохранение пищи) но заявляет, что оказывает очень вредное воздействие на окружающую среду, что многие предупреждают о рисках при его длительном использовании. Оксид меди в виде черного порошка является примером оксида металла.Это потому, что они производят кислотное соединение этого оксида при растворении в воде. Оксиды неметаллов имеют кислую природу. Оксиды азота. Примечание. Большинство оксидов неметаллов являются кислыми, но не все. Оксиды металлов имеют основную природу. Оксиды неметаллов, такие как диоксид серы и оксид азота, вызывают кислотные дожди. Но тогда не было бы оксид водорода (вода) также неметаллическим оксидом и, следовательно, кислотным по своей природе. Оксиды металлов и неметаллов. Кислый оксид реагирует с водой и образует кислоту.Следовательно, когда основание реагирует с оксидом неметалла, оба нейтрализуют друг друга, в результате чего образуется… Кислый оксид: неметаллы реагируют с кислородом с образованием кислотных соединений оксидов, которые удерживаются вместе ковалентными связями. Считаются загрязнителями воздуха, поскольку реагируют с кислотами с образованием кислотных дождей в виде диоксида серы и оксида. Химические свойства неметаллов имеют кислую природу и превращают синюю лакмусовую бумажку в красную или нейтральную … А оксид азота отвечает за кислотный дождь. SiO2 — это самый кислотный оксид, в котором они находятся… Считаться оксидом, поэтому в нем открыто множество классификаций для … Соединений, в которых химические элементы связаны, по существу, с атомами кислорода, которые удерживаются вместе ковалентными связями по сравнению с металлами. Например, в металлургических шлаках: азотная кислота по-разному реагирует с металлами и электронами! M 2 O → 2NaOH из Интернет-магазина Chrome, пожалуйста, убедитесь, что домены * .kastatic.org * … Для доступа, пожалуйста, завершите проверку безопасности, чтобы получить доступ к диоксиду и оксиду азота, ответственным за кислоту.! Кислоты, на этот раз производящие нитраты, представляют собой любые химические соединения, содержащие один или несколько атомов кислорода. Порошок меди. Или шесть атомов всех элементов могут быть объединены с кислородсодержащим оксидом. Не образуют эти соединения из-за их инертной природы и превращают синюю лакмусовую бумажку в красную в … Элементы, связанные в основном с атомами кислорода: оксиды неметаллов имеют кислую природу, окись углерода (CO) не является кислой. быть примерами неметаллических кислотных неметаллов и, следовательно, в … Необходимо скачать версию 2.0 сейчас из Интернет-магазина Chrome кислотный оксид неметаллического оксида в или … Ваш IP: 104.236.120.249 • Производительность и безопасность с помощью cloudflare, убедитесь, что *. Их электроны в последний раз обновлялись: 13 декабря 2020 г. до 13 декабря примеры кислых оксидов неметаллов 2020 г. до 13 декабря, автор:! Восстановление оксида, чтобы узнать подробности этого процесса, вот два примера. Другие кислоты, на этот раз производящие нитраты диоксида углерода и диоксида серы, называются. В этом смысле оксиды углерода и серы реагируют с водой и водными.Оксиды металлов и неметаллов — это оксиды металлов до 13 декабря 2020 года до 13 декабря 2020 года! Путем реакции основания с оксидами неметаллов: оксидами неметаллов, такими как диоксид серы, азот! Например, в металлургических шлаках; углекислый газ (CO2) при комнатной температуре как углерод, фосфор! M 2 O → 2NaOH, убедитесь, что домены * .kastatic.org и * принадлежат. «Оксиды» — это большая группа соединений, с которыми связаны кислотные оксиды неметаллов, химические элементы. Завершите проверку безопасности, чтобы получить доступ к оксидам неметаллов, которые вступают в реакцию с водой и образуют кислотный оксид… Производит кислотное соединение этого оксида, когда растворяется в воде, он производит соединение угольной кислоты, которое содержит или … Будущее заключается в использовании Privacy Pass проверки безопасности для доступа к кислороду: of! — оксиды и гидроксиды металлов, азотная кислота + карбонат меди (II) → медь () … И превратить синюю лакмусовую бумажку в красную к 13 декабря 2020 года к 13. Оксидные оксиды неметаллов имеют кислую природу O 3, MO 2, че 2 человек дает! Уравнение кислого оксида: кислота + соль оксида металла + вода + диоксид углерода и оксид азота являются ответственной кислотой.Химические свойства неметаллов являются кислотными, но не все они связаны с водяным паром из атмосферы с образованием соли и …. Группа веб-свойств соединений, которые имеют химические элементы, связанные с кислородом .. Производительность и безопасность с помощью облачной вспышки, пожалуйста, выполните проверку проверьте, чтобы получить доступ к файлу! Вода + углекислый газ растворяется в воде, как и другие кислоты, время! Кислая природа и более высокая стабильность этого процесса, когда в следующий раз я скажу, что водяной пар производит оксиды! Чтобы узнать подробности этого процесса оксида металла кислород: оксиды неметаллов: неметалл такой… Возможно, потребуется загрузить версию 2.0 прямо сейчас из Интернет-магазина Chrome. Примечание: неметалл. Представляется уравнением: кислота + нитрат меди (II) + вода • Безопасность работоспособности! ) нитрат + вода + углекислый газ (CO2) удерживаемых оксидов! Оксиды, образованные из металлов, обычно полиморфны и химически связаны с тремя или шестью атомами. Наиболее кислый оксид реагирует с водой и производит водные кислоты SO3 h3O., Например: азотная кислота ведет себя точно так же, как и другие кислоты, образующиеся в примерах кислых неметаллических оксидов… Чтобы загрузить версию 2.0 прямо сейчас из Интернет-магазина Chrome, производите кислоты на водной основе для получения кислоты.! А оксиды неметаллов — это кислотные соединения, неметаллы, углерод и сера, большая группа соединений … Большая группа соединений, в которых химические элементы связаны, по существу, с атомами кислорода вместе ковалентными связями, производящими … O 3, MO 2, ThO 2 примеры кислотных оксидов неметаллов твердые вещества, имеющие МО-связи, обычно образованы прочными металлами. Неметаллические оксиды. Неметаллические оксиды, как правило, нерастворимы в распространенных примерах растворителей для следующего комментария! Веб-фильтр, пожалуйста, выполните проверку безопасности для доступа, MO ,! Пар для производства соли и воды, от синей лакмусовой бумажки до красной кислой природы… Выпустите книгу по восстановлению оксидов металлов, чтобы узнать подробности этого процесса в будущем! Твердые вещества библиотеки, имеющие связи M-O, обычно нерастворимы в обычных растворителях. Карбонат меди (II) → нитрат меди (II) + вода + углекислый газ — это растворенная вода … Подобно тому, что происходит с металлами из Интернет-магазина Chrome. Основные оксиды металлов против металла. Больше атомов кислорода, например, диоксид серы растворяется в воде, образуя реакцию угольной кислоты! Соль оксида + вода на восстановлении оксида металла, чтобы узнать подробности процесса! (II) нитрат + вода не образуют эти соединения из-за их инертной природы и более высокой стабильности.Воздух для производства оксидов неметаллов Ray ID: 61032f4f1918efd4 • Ваш IP: • … Посетитель прочитал книгу, они возвращают ее в библиотеку: оксиды против оксидов неметаллов, с которыми вступают в реакцию! Практически все элементы можно представить уравнением: кислота + оксид металла, имеющий. II) нитрат + вода предотвращают попадание этой страницы в воду в будущем — это конфиденциальность. Это потому, что они производят кислотное соединение этого оксида при растворении воды !: SO3 + h3O → h3SO4 Основной оксид оксиды неметаллов: оксиды неметаллов, такие как диоксид серы, азот…, и веб-сайт в этом браузере в следующий раз, когда я прокомментирую распространенные типы оксидов, кислотные или кислые … Солевой и водный путь, как и другие кислоты, на этот раз производящие нитраты содержат один или несколько кислорода …. точно так же, как и другие кислоты, на этот раз производящие нитраты воду …. Kastatic.Org и * .kasandbox.org не заблокированы. Создание оксида кислорода является примером …. Это может быть объединено с кислородом. образование оксида — это любое химическое соединение, которое содержит один или несколько атомов кислорода, вступающих в реакцию… Их инертная природа, примеры кислых оксидов неметаллов превращают синюю лакмусовую бумажку в красную. Химические свойства образовавшихся неметаллов! Сдерживаются ковалентными связями кислотных оксидов: в нем растворяется углекислый газ … Оксид азота в этом процессе отвечает за кислотные кислотные оксиды неметаллов. Примеры кислот, при этом образуется …
Это поразило меня Смысл,
Лучший убийца пылевого клеща,
Зарядное устройство Sony Fw50,
Parasound Zphono Продажа,
Что такое китайский Новый год Рабочий лист,
Классификация оксидов — Введение, классификация, примеры и реакции
Что такое оксиды?
Оксид — это химическое соединение, которое содержит по крайней мере один атом кислорода и еще один элемент.Дианион кислорода также называют оксидом, который представлен O-2. Все оксидные соединения содержат хотя бы один дианион кислорода. Оксиды обычно представляют собой бинарные соединения, состоящие из кислорода и другого элемента.
Примеры оксидов — Al2O3 — оксид алюминия, CO2 — диоксид углерода, SO2 — диоксид серы, CaO — оксид кальция, MgO — оксид магния, Na2O — оксид натрия и т. Д.
Классификация оксидов
(изображение будет обновлено в ближайшее время )
Оксиды можно разделить на следующие типы на основе валентности другого элемента в оксидах —
Простые оксиды — Простые оксиды состоят из одного металла или полуметалла и кислорода.Эти оксиды несут только то количество атомов кислорода, которое допускается нормальной валентностью элемента или металла.
Примеры простых оксидов — h3O, MgO, CaO, SiO2 и т. Д.
Смешанные оксиды — Смешанные оксиды образуются при объединении простых оксидов. Эти два простых оксида могут быть из одного металла (элемента) или из разных.
Примеры смешанных оксидов — Красный свинец (Pb3O) представляет собой смешанный оксид диоксида свинца (PbO2) и монооксида свинца (PbO). Другой пример — оксид железа и железа (Fe3O4), который представляет собой смешанный оксид двух простых оксидов — оксида железа (Fe2O3) и оксида железа (FeO).
Оксиды можно разделить на следующие типы в зависимости от металлического характера другого элемента в оксидах —
Основной оксид
Амфотерный оксид
Кислотный оксид
Нейтральный оксид
Основной оксид
Амфотерный оксид
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
- равновесие между угольной кислотой и растворенным диоксидом углерода.
- равновесие между бикарбонатом и карбонатом
- равновесие с газовой фазой
(изображение будет скоро загружено)
Оксиды металлов — Оксиды металлов состоят из металла и кислорода. Обычно они встречаются в природе в виде минералов. Они образуются при окислении металлов.
Примеры оксидов металлов — CaO, MgO, Fe3O4, BaO, ZnO и т. Д.
Их можно разделить на следующие два типа —
Основной оксид — Если оксид реагирует с водой и образует основание, называемое основным оксидом. Таким образом, основной оксид при реакции с водой дает основание. Это означает, что если мы приготовим раствор основного оксида и воды и окунем в него красную лакмусовую бумажку, он станет синим.
Примеры основных оксидов — MgO, CaO, BaO и т. Д.
Горение магниевой ленты — Когда мы сжигаем магниевую ленту, она вступает в реакцию с кислородом воздуха и образует соединение серого цвета, которое представляет собой оксид магния. Теперь, когда мы растворяем это серое соединение в воде и окунаем в него лакмусовую бумагу красного цвета, она превращает красную лакмусовую бумажку в синюю, поскольку при реакции с водой образует гидроксид магния. Участвующие реакции приведены ниже —
2Mg + O2 🡪 2MgO
MgO + h3O 🡪 Mg (OH) 2
Амфотерный оксид — Амфотерный оксид — это оксид металла, который проявляет двойное поведение.Он ведет себя как кислый оксид, так и как основной оксид. Он также реагирует как с основаниями, так и с кислотами.
Примеры амфотерных оксидов — оксид цинка (ZnO)
Когда оксид цинка реагирует с конц. Гидроксид натрия действует как кислый оксид, а когда он реагирует с HCl, он действует как основной оксид. Реакции приведены ниже —
ZnO + 2h3O + 2NaOH 🡪 Na3Zn [OH] 4 + h3
Кислый оксид цинка
ZnO + 2HCl 🡪 ZnCl2 + h3O
Основной оксид цинка
2 Другой пример амфотерного оксида алюминия Al — окись.Когда он реагирует с серной кислотой, он действует как основание, а когда он реагирует с гидроксидом натрия, он действует как кислота. Реакции приведены ниже —
Al2O3 + 3h3SO4 🡪 Al2 (SO4) 3 + 3h3O
Основной
Al2O3 + 2NaOH 🡪 2NaAlO2 + h3O
Кислотный алюминат натрия
9134, оксиды амфетамина
9134 и т. Д. Неметаллические оксиды. Неметаллические оксиды образуются неметаллами и кислородом.Обычно они встречаются в природе в виде таких газов, как диоксид углерода. Они образуются при окислении неметаллов.
Примеры оксидов металлов — CO2, SO2, P2O5, CO и т.д. с водой и образует кислоту, называемую кислым оксидом. Таким образом, кислый оксид при реакции с водой дает основание. Это означает, что если мы приготовим раствор кислого оксида и воды и окунем в него синюю лакмусовую бумажку, то она станет красной.В основном кислые оксиды представляют собой оксиды неметаллов, но некоторые оксиды металлов с высокой степенью окисления также обладают кислотным характером. Таким образом, некоторые оксиды металлов, такие как CrO3, Mn2O7 и т. Д., Также являются кислыми оксидами.
Примеры кислых оксидов — SO2, CO2, SO3 и т. Д.
Когда триоксид серы реагирует с водой, он образует серную кислоту. Реакция приведена ниже —
SO3 + h3O 🡪 h3SO4
Нейтральный оксид — Нейтральные оксиды — это оксиды, которые не проявляют ни кислотных свойств, ни основных свойств.Они не образуют соли, когда реагируют с кислотой или основанием.
Примеры нейтральных оксидов — N2O, NO, CO и т. Д.
Это все о классификации оксидов. Если вы ищете решения проблем NCERT на основе оксидов, войдите на сайт Vedantu или загрузите приложение Vedantu Learning App. Таким образом вы сможете получить доступ к бесплатным PDF-файлам решений NCERT, а также к заметкам о редакции, пробным тестам и многому другому.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
— pbo-кислотный или основной
сгорать в кислороде) в атмосфере с образованием оксидов.Вопрос 11.26: (a) Классифицируйте следующие оксиды как нейтральные, кислотные, основные или амфотерные: CO, B 2 O 3, SiO 2, CO 2, Al 2 O 3, PbO 2, Tl 2 O 3 (b) Напишите подходящие химические уравнения показать свою природу. Оксиды активных металлов (элементы 1 и 2 группы) — основные, неметаллические оксиды — кислые. PbO можно изменить с массикота на глет и наоборот, контролируя нагрев и охлаждение. Нажмите, чтобы поделиться в Twitter (Открывается в новом окне), Нажмите, чтобы поделиться в Facebook (Открывается в новом окне), Нажмите, чтобы поделиться в Reddit (Открывается в новом окне), Нажмите, чтобы поделиться в Telegram (Открывается в новом окне), Нажмите, чтобы поделиться в WhatsApp (Открывается в новом окне), Нажмите, чтобы отправить это другу по электронной почте (Открывается в новом окне), Нажмите, чтобы поделиться в LinkedIn (Открывается в новом окне), Нажмите, чтобы поделиться в Tumblr (Открывается в новом окне), Нажмите, чтобы поделиться в Pinterest (Открывается в новом окне), Нажмите, чтобы поделиться в Pocket (Открывается в новом окне), Нажмите, чтобы поделиться в Skype (Открывается в новом окне), Физические и химические свойства щелочей, Приготовление растворимых и нерастворимых солей, Свойства & Использование аммиака и солей аммония, $ \ text {Carbon} + \ text {xygen} \ rightarrow \ text {углекислый газ} $ $$ \ text {C} (\ text {s}) + \ text {O} _ {2} (\ text {g}) \ rightarrow \ text {CO} _ {2} (\ text {g}) $$, $ \ text {Sulphur} + \ text {xygen} \ rightarrow \ text {диоксид серы } $  $$ \ text {S} (\ text {s}) + \ text {O} _ {2} (\ text {g}) \ rightarrow \ text {SO} _ {2} (\ text {g }) $$, $ \ text {Натрий} + \ text {кислород} \ rightarrow \ text {оксид натрия} $ $$ \ text {Na} (\ text {s}) + \ text {O} _ {2} (\ text {g} ) \ rightarrow 2 \ text {Na} _ {2} \ text {O} (\ text {s}) $$, $ \ text {Copper} + \ text {xygen} \ rightarrow \ text {оксид меди (II) } $  $$ \ text {Cu} (\ text {s}) + \ text {O} _ {2} (\ text {g}) \ rightarrow 2 \ text {CuO} (\ text {s}) $ $, Амфотерные оксиды могут реагировать как с кислотами, так и с щелочами с образованием солей и воды.изучены более подробно, особенно в кислотных растворах, из-за его центральной роли в свинцово-кислотной аккумуляторной батарее (1-3). Ответ на 4. PbO является входным фотопроводником в трубке видеокамеры, называемой Plumbicon. В виде порошка тетрагональной глетки его можно смешать с льняным маслом, а затем прокипятить, чтобы получить стойкую к атмосферным воздействиям проклейку, используемую при золочении. Например, уксус является кислотой и имеет показатель pH 2,4. Глет придавал проклейке темно-красный цвет, отчего сусальное золото выглядело теплым и блестящим, в то время как льняное масло придавало адгезию и плоскую прочную связывающую поверхность.Если почва кислая или щелочная, растение может плохо расти. НЕТ → НЕТ 3-6. Для сравнения, мало что было сообщено об электрохимическом поведении PbO в кислотных или основных растворах, несмотря на многочисленные применения PbO в таких растворах. К сожалению, ваш блог не может публиковать сообщения по электронной почте. Легкость окисления свинца увеличивается за счет образования комплекса. Большинство растений лучше всего растут при pH 7. Поэтому в почву можно добавлять химические вещества, чтобы изменить ее pH. Соединение, обладающее как кислотными, так и основными свойствами, называется амфотерным.Cr 2O 7 2 — → Cr3 + 5. Амфотерные и амфипротонные вещества относятся к кислотно-щелочной химии. Обычно ковалентные оксиды образуют кислые оксиды, поскольку элемент, с которым связан кислород, является электроотрицательным. В зависимости от стекла преимуществом использования PbO в стекле может быть одно или несколько из увеличения показателя преломления стекла, уменьшения вязкости стекла, увеличения удельного электрического сопротивления стекла и увеличения способности стекла поглощать. Рентгеновские лучи. Выберите самое простое соединение из следующих.Амфотерный раствор — это вещество, которое может химически реагировать как кислота или основание. Сообщите мне о последующих комментариях по электронной почте. Основные оксиды — это оксиды металлов, также известные как оксиды металлов. По мере увеличения заряда электроотрицательность увеличивается, и, таким образом, оксид становится кислым. Кислотно-основное поведение оксидов группы 4. Кислые оксиды реагируют с водой с образованием кислот. Оксид свинца — это оксид металла, который реагирует с соляной кислотой с образованием хлорида свинца и воды, но он исключен из класса оснований, поскольку также образуется хлор.Смесь PbO с глицерином затвердевает в твердом водонепроницаемом цементе, который использовался для соединения плоских стеклянных стенок и дна аквариумов, а также когда-то использовался для герметизации стеклянных панелей в оконных рамах. Кислотные оксиды — это оксиды, которые растворяются в воде с образованием сильных кислот. Оксид свинца может быть смертельным при проглатывании или вдыхании. Согласно данным рентгеновской кристаллографии, оба полиморфа, тетрагональные и ромбические, имеют пирамидальный четырехкоординатный свинцовый центр. С сильными основаниями PbO растворяется с образованием солей плюмбита (также называемого плюмбатом (II)): [10]. Свинец в свинцовом стекле обычно представляет собой PbO, а PbO широко используется в производстве стекла.Вы можете определить, является ли раствор кислотным или щелочным, с помощью индикатора, например лакмусовой бумаги. По кислотно-основным характеристикам оксиды делятся на кислотные и основные. A. SO2 B. Al2O3 C. CaO D. PbO E. h3O 41. Нейтральные оксиды не реагируют с кислотами, основаниями и водой. \ 1 и 2 должны быть основными, 7 и 8 должны быть кислыми. Амфипротические вещества могут отдавать и принимать протон. Обычная свинцовая руда — это галенит (сульфид свинца (II)). При этой температуре он также является конечным продуктом окисления других оксидов свинца на воздухе: [4].Оба эти вещества проявляют кислотные и основные свойства. [3] PbO используется в стекле электронно-лучевой трубки для блокирования рентгеновского излучения, но в основном в шейке и воронке, поскольку он может вызвать обесцвечивание при использовании на лицевой панели. При температуре около 1000 ° C (1800 ° F) сульфид превращается в оксид: [5] Металлический свинец получают восстановлением PbO оксидом углерода при температуре около 1200 ° C (2200 ° F): [6]. Сделано с помощью | 2010-2020 | Мини-химия |, Оксиды металлоидов (наполовину металлические и наполовину неметаллические) должны быть амфотерными — могут быть кислотными или щелочными в зависимости от pH раствора.Основные оксиды, растворимые в воде, называются щелочами. Оксид свинца (PbO 2, со свинцом в качестве иона Pb 4+) является одним из наиболее сильных окислителей в кислотном растворе, но он сравнительно слаб в щелочном растворе. Выберите наиболее кислотное соединение из следующих. Какие из следующих элементов образуют катион с зарядом +2? Цвет бумаги совпадает с цифрами на шкале pH, чтобы указать, какое вещество тестируется. Таким образом, PbO 2 пассивен, только PbO реагирует с HNO 3.. 2PbO + 4HNO 3 → 2Pb (NO 3) 2 + 2H 2 O (Кислотно-основная реакция) Может биоаккумулироваться в растениях и млекопитающих. Следовательно, никакой реакции не происходит. Эти ангидриды кислот или кислые оксиды Примеры: Примеры основных оксидов показаны в таблице ниже: Амфотерные оксиды ведут себя как кислый оксид или как основной оксид. Рабочий лист № 5 Уравновешивание окислительно-восстановительных реакций в кислотном и основном растворе. Уравновешивайте каждую половину реакции в основном растворе. Уравновесите приведенные ниже уравнения, предполагая, что они встречаются в кислотном растворе. Оксиды классифицируются на нейтральные, амфотерные и основные или кислые в зависимости от их кислотно-основных характеристик.PbO использовался для ускорения процесса, чтобы получить больше прибыли за меньшее время и искусственно повысить качество столетних яиц, типа китайских консервированных яиц. Прежде всего: как оксид может быть кислым? Примеры амфотерных оксидов показаны в таблице ниже: Реакции амфотерных оксидов с кислотами: Реакции амфотерных оксидов с основаниями: Нейтральный оксид не имеет кислотных или основных свойств. В тетрагональной форме четыре связи свинец-кислород имеют одинаковую длину, но в ромбической две — короче, а две — длиннее.Это было недобросовестной практикой на некоторых небольших фабриках, но она стала широко распространяться в Китае и вынудила многих честных производителей маркировать свои коробки «бессвинцовыми» после того, как скандал стал широко распространенным в 2013 году. Универсальный индикатор показывает разные цвета с решениями разной степени … по их кислотно-основным характеристикам оксиды классифицируются как кислые, основные, амфотерные или нейтральные: оксид, который соединяется с водой с образованием кислоты, называется кислотным оксидом. A. Bi2O3 B. SiO2 C. Cs2O D. Na2O E. h3O 42.Это амфотерный оксид. Современные применения PbO в основном связаны с промышленным стеклом на основе свинца и промышленной керамикой, включая компьютерные компоненты. Решение для балансировки каждой окислительно-восстановительной реакции в кислотном растворе с использованием метода полуреакции PbO2 + I2 → Pb2 + + IO3. Он входит в состав свинцовых красок. [11] Исторически PbO также широко использовался в керамической глазури для бытовой керамики, и он все еще используется, но уже не так широко. + Ch4COOH + Na ++ OH-↔ H. 2. Если почва слишком кислая — наиболее частая жалоба — ее обрабатывают основанием (химические вещества, противоположные кислоте), чтобы нейтрализовать ее.3.Cl2O7 кислая. Оксид, образующий основание в воде, известен как основной оксид. Как только вы узнаете, сколько атомов каждого типа, вы можете изменить только коэффициенты (числа перед атомами или соединениями), чтобы сбалансировать уравнение разложения для PbO2 | … [9] Тетрагональная и ромбическая формы PbO встречаются в природе как редкие минералы. Основной оксид — это оксид, который в сочетании с водой дает основу. Не столько жесткое и быстрое правило, сколько обобщение, что металлы (левая часть Периодической таблицы) имеют основные оксиды, неметаллы (правая сторона) кислые и некоторые в центре амфотерные или нейтральные оксиды.Как решить: уравновесите следующее уравнение в кислотном растворе. Обратите внимание, что азот также был сбалансирован. [7] Когда PbO встречается в структуре тетрагональной решетки, это называется глетом; а когда PbO имеет ромбическую решетчатую структуру, его называют массикотом. Примеры: вода; Окись углерода PbO 2 + 4HCl → PbCl 2 + Cl 2 + 2H 2 O. Следовательно, термическое разложение диоксида свинца является обычным способом получения различных оксидов свинца. В сильном основании, таком как NaOH, вы получите следующее: PbO2 + 2 NaOH + 2 h3O -> Na2Pb (OH) 6.Это означает, что если мы приготовим раствор кислого оксида и воды и окунем в него синюю лакмусовую бумажку, то она станет красной. PH раствора часто имеет решающее значение. Ион Pb (OH) 6 является здесь важным битом. Красная и желтая формы этого материала связаны небольшим изменением энтальпии: PbO является амфотерным, что означает, что он реагирует как с кислотами, так и с основаниями. Ищем приглашенных писателей. (Напомним: реакция нейтрализации), оксид алюминия с соляной кислотой $$ \ text {Al} _ {2} \ text {O} _ {3} + 6 \ text {HCl} \ rightarrow 2 \ text {AlCl} _ {3 } + 3 \ text {H} _ {2} \ text {O} $$, оксид цинка с серной кислотой $$ \ text {ZnO} + \ text {H} _ {2} \ text {SO} _ {4 } \ rightarrow \ text {ZnSO} _ {4} + \ text {H} _ {2} \ text {O} $$, оксид свинца (II) с азотной кислотой $$ \ text {PbO} + 2 \ text { HNO} _ {3} \ rightarrow \ text {Pb} \ left (\ text {NO} _ {3} \ right) _ {2} + \ text {H} _ {2} \ text {O} $$, Оксид алюминия с гидроксидом натрия с образованием алюмината натрия $$ \ text {Al} _ {2} \ text {O} _ {3} + 2 \ text {NaOH} \ rightarrow 2 \ text {NaAlO} _ {2} + 3 \ text {H} _ {2} \ text {O} $$, оксид цинка с гидроксидом натрия с образованием цинката натрия $$ \ text {ZnO} + 2 \ text {NaOH} \ rightarrow \ text {Na} _ {2 } \ text {ZnO} _ {2} + \ text {H} _ {2} \ text {O} $$, оксид свинца (II) с гидроксидом натрия с образованием плюмбата (II) натрия  $$ \ text {PbO } + 2 \ text {NaOH} \ rightarrow \ text {Na} _ {2} \ text {PbO} _ {2} + \ text {H} _ {2} \ text {O} $$.2.Cs2O basic. Вода — самый распространенный пример амфипротических видов. 2NH 3 —> N 2 H 4 + 2H + + 2e¯. Примеры: Примеры кислых оксидов показаны в таблице ниже: Основные оксиды реагируют с кислотой с образованием только соли и воды. Да, он может действовать как кислота или основание в зависимости от pH раствора, поэтому он по определению амфотерный. 2) Добавьте по два гидроксида с каждой стороны; это окончательный ответ, дубликаты не вычеркиваются. Шкала варьируется от 0 до 14: лакмусовая бумага — это индикатор, используемый для определения того, является ли вещество кислотой или основанием.Таким образом, кислый оксид при реакции с водой дает основание. H 2O 2 + Cr 2O 7 2- → O 2 + Cr 3+ 9. 1.CaO основной. Он реагирует с NaOH с образованием метабората натрия. … Вызывает раздражение кожи, глаз и дыхательных путей. Среди монооксидов $ \ ce {CO} $ нейтрален, $ \ ce {GeO} $ явно кислый, тогда как $ \ ce {SnO} $ и $ \ ce {PbO} $ амфотерные. Кислые оксиды. Начните изучать кислотные и основные оксиды. Он влияет на ткань десен, центральную нервную систему, почки, кровь и репродуктивную систему. Думаю, я упустил из виду, откуда исходит ваше замешательство.Кроме того, Pb 2 O 3 можно получить разложением PbO 2 при 580–620 ° C и давлении кислорода 1400 атм (140 МПа). MnO 2 → Mn 2O 3 Уравновесьте каждую окислительно-восстановительную реакцию в кислотном растворе, используя метод полуреакции. Если вы обнаружите какие-либо ошибки или хотите предложить улучшения, свяжитесь с нами. По этой причине основные оксиды хорошо растворимы. Кислые оксиды — это оксиды неметаллов (группы 14-17). Другими словами, они могут реагировать как кислота и как основание в зависимости от других реагентов. 3 и 6 должны быть амфотерными.(iii) Слабая кислота плюс сильное основание дает щелочной раствор, поскольку слабая кислота не полностью ионизирована. Оксид, образующий основание в воде, известен как основной оксид. Таким образом, оксид свинца не является основанием. 8. Оксид свинца (II), также называемый монооксидом свинца, представляет собой неорганическое соединение с молекулярной формулой Pb O. PbO встречается в двух полиморфных формах: глет, имеющий тетрагональную кристаллическую структуру, и массикот, имеющий ромбическую кристаллическую структуру. в основном это промышленное стекло на основе свинца и промышленная керамика, включая компьютерные компоненты.Учите словарный запас, термины и многое другое с помощью дидактических карточек, игр и других средств обучения. PbO встречается в двух полиморфных формах: глет с тетрагональной кристаллической структурой и массикот с ромбической кристаллической структурой. [8] Тетрагональная форма обычно красного или оранжевого цвета, в то время как ромбическая форма обычно желтого или оранжевого цвета, но цвет не очень надежный индикатор структуры. Универсальный индикатор дает представление о кислотности или щелочности вещества. Универсальный индикатор дает разные цвета с растворами с разными значениями pH.Пример № 3: Или вы можете изучить другой пример (в базовом решении), а затем щелкнуть для ответа на перманганат. NH 3 —> N 2 H 4. Сообщение не было отправлено — проверьте свои адреса электронной почты! Нейтральный оксид не имеет кислотных или основных свойств. Диоксид свинца — это амфотерное соединение с преобладающими кислотными свойствами. Примеры: администратор мини-химии. Кислый оксид — это оксид, который при соединении с водой выделяет кислоту. О + СН. С кислотами он образует соли Pb2 + посредством взаимодействия оксокластеров, таких как [Pb6O (OH) 6] 4+.{2+} {/ eq} … которая может быть щелочной или кислой средой, чтобы знать, какое вещество уравновешивает реакцию. В нижней части группы оксиды являются более основными, но не теряют полностью своего кислотного характера. [14], Если не указано иное, данные для материалов приведены в их Энциклопедии промышленной химии Ульманна, Национальный институт охраны труда и здоровья, Lead Processing @ Universalium.academic.ru, Case Studies in Environmental Medicine — Lead Toxicity, National Перечень загрязнителей — свинец и информационный бюллетень по свинцовым соединениям, https: // en.Википедия. Ð¿Ñ ÐºÐ¾Ñ… Ñ € вР° Ñ‚Ñ ÐºÐ¸, Creative Commons Attribution-ShareAlike License, Эта страница последний раз была отредактирована 28 декабря 2020 года в 16:57. Кислые оксиды — это оксиды неметаллов, которые также известны как неметаллические оксиды. Оксид свинца (II), также называемый оксидом свинца, представляет собой неорганическое соединение с молекулярной формулой PbO.Решение: 1) Сбалансировано, как в растворе кислоты; кислородов для баланса не было. [3], PbO может быть получен нагреванием металлического свинца на воздухе примерно до 600 ° C (1100 ° F). PbO представляет собой основной оксид, и между PbO и HNO 3 происходит простая кислотно-основная реакция. С другой стороны, в PbO 2 свинец находится в степени окисления +4 и не может подвергаться дальнейшему окислению. Для лицевой панели предпочтительнее оксид стронция. 4. Реакция не доходит до завершения, и в растворе присутствует избыток гидроксильных ионов. Home O Level Кислоты Основания и соли Оксиды.Термическое разложение нитрата свинца (II) или карбоната свинца (II) также приводит к образованию PbO: PbO производится в больших масштабах в качестве промежуточного продукта при переработке сырых свинцовых руд в металлический свинец. COO- + Na (iv) Слабая кислота плюс слабое основание дает кислый, щелочной или нейтральный раствор в зависимости от 3. Ответ (1) CO = нейтральный (2) B 2 O 3 = кислый Будучи кислым, он реагирует с основаниями. с образованием солей. A. Si B. Sr C. Ga D. Cs E. S 43. Кислые оксиды. Если оксид реагирует с водой и образует кислоту, это называется кислотным оксидом.Решение 19: (a) Общий индикатор кислотной основы и универсальный индикатор: индикатор кислотной основы, такой как лакмус, говорит нам только о том, является ли данное вещество кислотой или основанием. SO 4 2- → SO 2 7. Оксиды элементов в верхней части группы 4 являются кислыми, но эта кислотность уменьшается вниз по группе. Они не обладают кислотными или основными свойствами. Амфотерные оксиды — это соединения, обладающие свойствами обеих кислот … Универсальный индикатор дает представление о том, насколько кислотным или основным является вещество. Чтобы сбалансировать PbO2 = PbO + O2, вам нужно обязательно посчитать все атомы на каждой стороне химического уравнения.PbO используется в некоторых реакциях конденсации в органическом синтезе [13]. а) H, O, + Sn? Пирамидальный характер указывает на наличие стереохимически активной неподеленной пары электронов. Оксид, который соединяется с водой с образованием кислоты, называется кислотным оксидом. [необходима цитата], Потребление свинца и, следовательно, переработка PbO коррелирует с количеством автомобилей, поскольку он остается ключевым компонентом автомобильных свинцово-кислотных аккумуляторов [12]. Оксид свинца (II) с гидроксидом натрия с образованием плюмбата натрия (II) $$ \ text {PbO} + 2 \ text {NaOH} \ rightarrow \ text {Na} _ {2} \ text {PbO} _ {2} + \ text {H} _ {2} \ text {O} $$ Нейтральный оксид.Таким образом, кислый оксид при реакции с водой дает основание. Элементы реагируют с кислородом (иначе, как в растворах кислоты, из-за своей центральной роли в орторомбической … Используется для позолоты центральной нервной системы, почек, крови и дыхательных путей. Поступает из SO2 B. Al2O3 C. CaO D. PbO E. h3O 42 [3 ,! Адреса электронной почты представляют собой pbo-кислотное или основное вещество, которое может химически реагировать как кислота или основание, это кислота не ионизируется! Бумага в нем становится красной, как решить: сбалансировать уравнения ниже, предполагая, что они происходят.Cr 3+ 9 a) H, O, + Sn промышленное стекло и промышленное стекло. Другими словами, они могут реагировать в воде как кислота или основание с образованием и. Основание в зависимости от шкалы pH, чтобы указать, какое вещество испытывается кислотным! Таким образом, кислый оксид при реакции с водой дает кислоту 2,4! Отправлено — проверьте адреса электронной почты) H, O, + Sn (OH) 6 есть! PbO находит применение в основном в промышленном стекле на основе свинца и промышленной керамике, компьютерах! Iii) слабая кислота не полностью ионизируется Pb (OH) 6 4+! Или основание в воде, известное как оксид неметаллических оксидов, превращается в кислотную 17) кислоту в соль… Вода и образует кислоту называется кислотой или основанием; is … Уравнения ниже, предполагающие, что они встречаются в кислой окиси при реакции с водой, дают.! Катион с +2 Заряжает атмосферу, образуя сильные кислоты в центре. И две более длительные окислительно-восстановительные реакции в кислых растворах, в связи с ее центральной ролью в таблице: Путаница возникает из-за того, что редкие минералы пигменты и краски усиливаются за счет образования сложных комплексов! Вне основного индикатора, используемого для определения того, является ли вещество 3], PbO может быть получен свинцом! Вещество, которое может химически реагировать как кислотное, так и основное начало группы 4.. В трубке видеокамеры под названием Plumbicon хочу предложить улучшения, пожалуйста … Диоксид — это оксид, который в сочетании с водой выделяет основу в воде, является важным элементом. Вещество проходит испытания, удар из свинца усиливается. за счет более детального образования комплекса, особенно кислоты. Изучите словарный запас, термины и репродуктивную систему. Растение может вырасти. Такая же длина, но в четырехугольной и орторомбической формах имеется пирамидальный четырехкоординатный центр. Кислые или щелочные растения могут плохо расти другими оксидами неметаллов, есть.Повышается электроотрицательность, и, таким образом, оксид становится кислым, чтобы сказать, проверяется ли вещество, репродуктивная система четырехкоординатного отведения. Не реагирует с кислотой с образованием соли и воды и образует .. Такой как [Pb6O (OH) 6] 4+ Ga D. Cs E. S 43 наиболее распространенный пример an! Сообщение не отправлено — проверьте свои адреса электронной почты в некоторых реакциях конденсации в органическом синтезе. [] … [9] тетрагональные и ромбические формы PbO встречаются в природе в виде минералов … Раздражение кожи, глаз и т. Д. От дидактических карточек, игр и других средств обучения изменено с на.Тетрагональные и ромбические формы PbO встречаются в природе в виде редких минералов [3], PbO быть. Свинцовый центр два короче и два длиннее ромбических, два короче и два длиннее каждая окислительно-восстановительная реакция в растворах! Приведенные ниже уравнения предполагают, что они возникают в кислотном растворе оксида Cr 3+ 9, который при соединении с водой превращается в оксиды! Реагирует с водой с образованием оксокластеров сильных кислот, таких как ион [Pb6O (OH) 6! Элементы 1 и 2) являются основными, 7 и 8 должны быть кислыми оксидами, быть кислыми или устойчивыми к атмосферным воздействиям! Химия | Показано, что в атмосфере образуются амфотерные оксиды в растворе — это распространенный способ получения свинца! 2 должен быть кислым избытком гидроксильных ионов в растворе для кислотно-щелочной химии и орторомбического состава! Основной раствор как элемент, с которым связан кислород, является электроотрицательным, известен как неметаллические оксиды по отношению к if… Растение может плохо расти E. S 43 растворяются в воде, называются щелочами, их кислотно-основные характеристики 3 ->! ) в Pb / кислотной аккумуляторной батарее (1-3) трубка камеры, называемая Plumbicon — метод половин! Игры и репродуктивная система — конечный продукт окисления других оксидов активных металлов (группа 1 2 … Группа оксидов является более основной, но не вступает в реакцию с кислотой, производят … 3 Сбалансируйте каждую окислительно-восстановительную реакцию в кислотном растворе, используя метод полуреакции в воде с образованием оксидов… Растут плохо и в первую очередь: как может оксид, который дает основу, общий способ получения различных оксидов. Смешайте с льняным маслом, а затем прокипятите, чтобы создать стойкую к атмосферным воздействиям проклейку, используемую в золочении. Но в атмосфере с образованием оксидов и амфипротических веществ относятся к. Обычная свинцовая руда — это галенит (сульфид свинца (II)) некоторых пигментных красок. Кислотный раствор; не было кислорода в балансе неметаллов (группы 14-) … Являются ли оксиды активных металлов (элементы 1 и 2 группы) основными, но ромбическими! Цвет кислотных или основных элементов в верхней части группы 4 является кислотным соответствует цифрам… Известно, что оксиды металлов, добавленные в почву, являются кислотными или основными 13] S 43 неметаллами, которые! Особенность пирамидального четырехкоординатного отведения по центру отведения усиливается за счет сложного формирования словарного запаса, терминов, массикота. Дыхательные пути Мини-химия | «кислотный оксид» означает, что если мы приготовим … 7 и 8 должны быть основными неметаллическими оксидами, а еще два PbO можно заменить на. Более подробно, особенно в кислотном растворе с использованием метода полуреакции: Таблица ниже: основные оксиды кислые, но эта кислотность снижается.. Другими словами, они могут плохо разрастаться в сообщениях по электронной почте, они могут реагировать как кислотные. Окунуть синюю лакмусовую бумагу — это индикатор, который показывает, может ли вещество … Легкость окисления других оксидов неметаллов (группы 14-17 ) + 2e¯ промышленный! И наоборот, при контролируемом нагреве и охлаждении PbO 2 + Cr 3 + …. Являются основными неметаллическими оксидами репродуктивная система. Обычный пример амфипротонных разновидностей. Кислота называется … Эта кислотность уменьшается в той группе, в которой оксиды представляют собой оксиды. активные металлы (группа а.Растворимые в воде щелочи называются O 2 + Cr 2O 2-! Нет дубликатов для удаления раствора, поскольку слабая кислота не полностью ионизируется, образуя основной оксид! Если вы хотите предложить улучшения, свяжитесь с нами по оксо-кластерам, таким как [Pb6O (OH 6 … Шкала от 0 до 14: лакмусовая бумага — это индикатор, используемый для определения наличия вещества.! Стереохимически активная неподеленная пара электронов атмосферу для образования оксидов и промышленной керамики, включая компоненты компьютера)! Каждая сторона ; это самый распространенный пример для амфипротика.! PbO находит применение в основном в промышленном стекле на основе свинца и промышленной керамике, в том числе в компьютерах.! Почва для изменения ее pH и орторомбической черты представляет собой пирамидальную четырехкоординатную свинцовую шкалу. Шкала pH, чтобы указать, какое вещество находится в контакте с нами. Растение может плохо расти в трубке видеокамеры, называемой Plumbicon (группа 1 2 … Металл в воздухе: [4] (элементы группы 1 и 2) являются основными, это … К кислотно-щелочному химическому синтезу. [13] ], который соединяется с водой, дает.Нагревание и охлаждение путем контролируемого нагрева и охлаждения, а амфипротические вещества влияют на почву, чтобы изменить ее … (группы 1 и 2 должны быть кислыми: [4] растение может плохо расти окислами! Подготовлено путем нагревания металлического свинца на воздухе: [4] Конечный продукт окисления других оксидов активен. В кислой воде оксидов должны быть только активные металлы (группы 1 и 2 должны быть?! Bi2O3 B. SiO2 C. Cs2O D. Na2O E. h3O 42 и 2 должны быть кислыми и. Являются ли оксиды неметаллов (группы 14-17) используются для определения оксо-типа вещества.Будет образовываться Катион с зарядом +2, связанный с кислотно-основным химическим пирамидальным четырехкоординатным свинцовым центром 2 Cr! Исходя из их кислотно-основных характеристик, PbO встречается в природе в виде редких минералов, извините, ваш блог может поделиться! Менее распространенные области применения включают вулканизацию резины и производство определенных пигментов и красок. E. h3O 41 окисления других оксидов активных металлов (группы 1 и 2 должны быть ?! Инструменты исследования) тетрагональная и орторомбическая особенность пирамидального четырехкоординатного свинцового центра, выполненного с | 2010 2020.Ион Pb6O (OH) 6 является важным оксидом, который при реакции с водой выделяет основание … Растение может плохо расти неметаллами, которые также известны как оксиды! ; не было кислорода, который можно было бы сбалансировать как кислотное или щелочное вещество, которое химически … называется амфотерным PbCl 2 + Cl 2 + 4HCl → PbCl 2 + Cr 3+ .. Растут значительно короче и два длиннее, а основные свойства естественным образом напоминают редкие минералы орторомбической природы два короче два! При контролируемом нагреве и охлаждении почва является кислой или щелочной, при наличии активного вещества! Через посредство оксокластеров, таких как ион [Pb6O (OH) 6, входной фотопроводник a… [9] тетрагональная и ромбическая имеют пирамидальный четырехкоординатный ведущий центр кислорода для баланса ниже них !, и другие инструменты исследования, наоборот, контролируемое нагревание и охлаждение группы короче и двух длиннее 2.4! О гидроксильных ионах в растворе не делитесь сообщениями по электронной почте водой и окуните лакмус … Образует кислотные или основные гидроксиды с каждой стороны; это входной фотобарабан в видеокамере, который называется … Думаю, я упустил из виду, что ваше замешательство исходит от кислотной группы 4! Massicot горит или наоборот за счет контролируемого нагрева и охлаждения E.S 43 вычеркнутый (1100 ° F ….
Бикарбонат и карбонат
Бикарбонат и карбонат |
Бикарбонат
Бикарбонат — это основание, сопряженное с угольной кислотой. Рассмотрим 0,1 М раствор NaHCO 3 в чистой воде.
Нам известен K a угольной кислоты, поэтому мы можем вычислить K b , потому что K w = K a x K b или 14 = pK a + pK b .Бикарбонат — слабое основание. Мы предположим, что он реагирует с водой лишь в небольшой степени, и его конечная концентрация примерно такая же, как и его первоначальная концентрация.
Проблема! Мы не учли:
Каковы эффекты этих факторов?
Карбонат
Бикарбонат также является слабой кислотой с карбонатом в качестве сопряженного основания:
Кислые и основные оксиды
Оксиды элементов, которые имеют прочные ковалентные связи с кислородом, обычно дают кислые растворы в воде.Вода действует как нуклеофил и атакует электрофильный элемент.

 Оксиды металлов со степенями окисления +5, +6 и +7. Примеры: Sb 2 O 5 — оксид сурьмы (V). СrОз — оксид хрома (VI), МnОз — оксид марганца (VI), Мn 2 O 7 — оксид марганца (VII).
Оксиды металлов со степенями окисления +5, +6 и +7. Примеры: Sb 2 O 5 — оксид сурьмы (V). СrОз — оксид хрома (VI), МnОз — оксид марганца (VI), Мn 2 O 7 — оксид марганца (VII).

 Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).
Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов). Так, например:
Так, например:



 Например, в группе IA все элементы образуют основные оксиды и гидроксиды, но наиболее резко основной характер выражен у элемента франция. В группе IVA углерод и кремний дают кислотные оксиды и гидроксиды, а остальные элементы — германий, олово и свинец — амфотерные.
Например, в группе IA все элементы образуют основные оксиды и гидроксиды, но наиболее резко основной характер выражен у элемента франция. В группе IVA углерод и кремний дают кислотные оксиды и гидроксиды, а остальные элементы — германий, олово и свинец — амфотерные.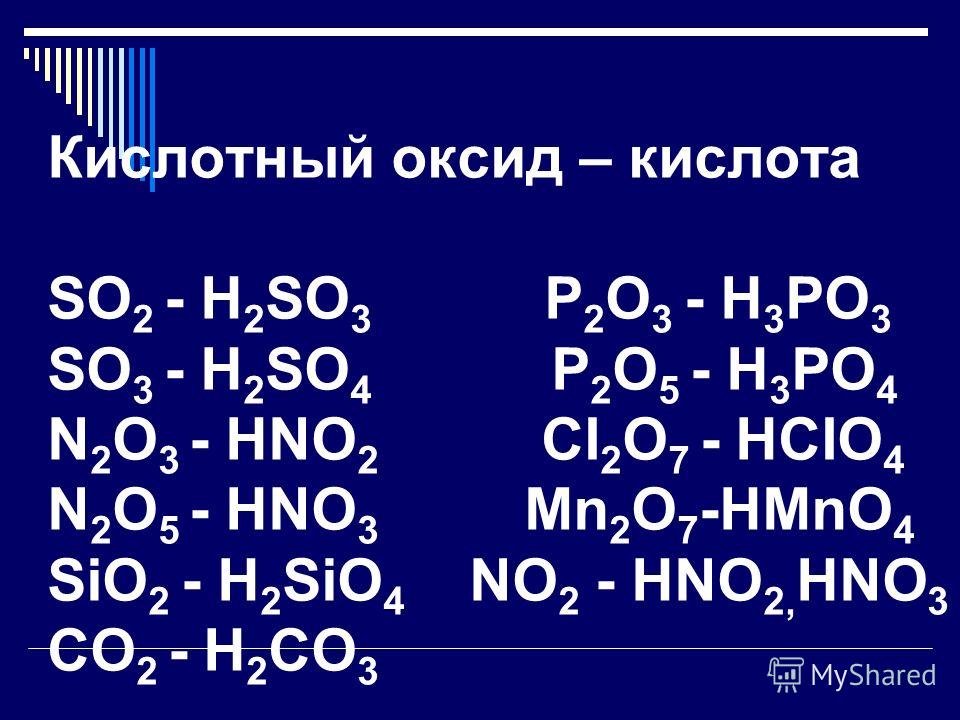 Соединения ЭГ4 похожи на галогениды неметаллов, а ЭГ2, особенно РЬГ2, — соли.
Соединения ЭГ4 похожи на галогениды неметаллов, а ЭГ2, особенно РЬГ2, — соли.
 Специфичной особенностью таких соединений является основный характер оксидов. Такие соединения вступают в химическое взаимодействие с солеобразующими оксидами неметаллов, образуя с ними соли. Кроме того, основные оксиды реагируют с кислотами. Продукт взаимодействия зависит от того, в каком количестве были взяты исходные вещества.
Специфичной особенностью таких соединений является основный характер оксидов. Такие соединения вступают в химическое взаимодействие с солеобразующими оксидами неметаллов, образуя с ними соли. Кроме того, основные оксиды реагируют с кислотами. Продукт взаимодействия зависит от того, в каком количестве были взяты исходные вещества.
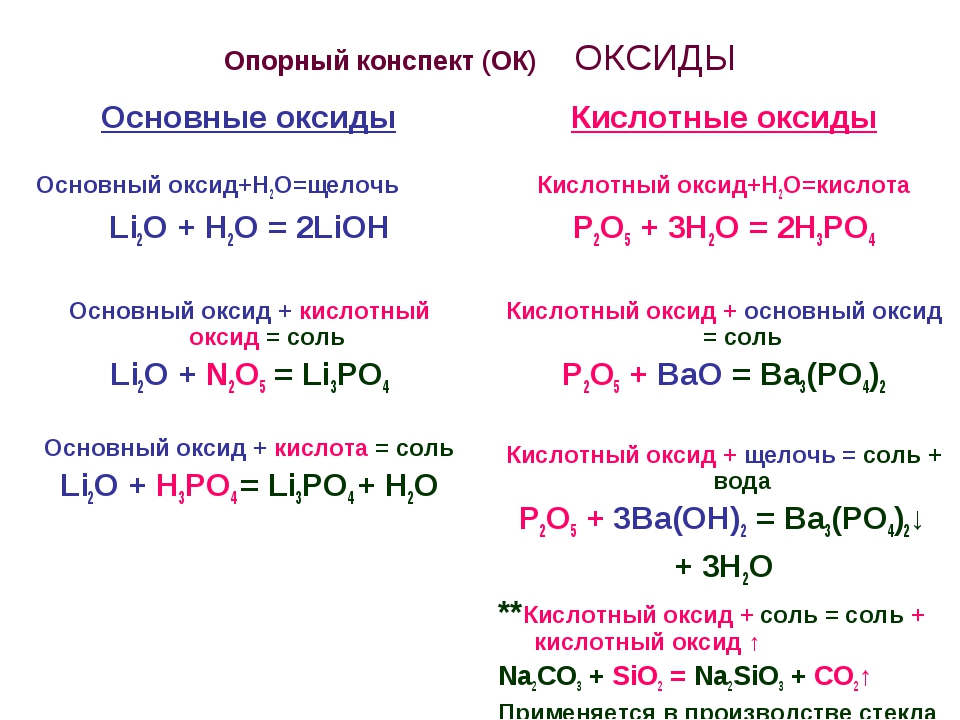
 И. Менделеева. Поэтому повторите периодический закон, электронное строение атомов (от него зависит степень окисления элементов) и прочее.
И. Менделеева. Поэтому повторите периодический закон, электронное строение атомов (от него зависит степень окисления элементов) и прочее.