Содержание
Растворимость газов в воде ⇆ Растворенные газы в воде
Растворимость газов в воде. Растворенные газы в воде и их коэффициенты растворимости.
Нам известно, что многие газы могут растворяться в воде. К примеру, рыбы, как и множество других водных обитателей, дышат растворенным в воде кислородом. Морские водоросли особенно активно разрастаются в прибрежных зонах, насыщенных растворенным в воде углекислым газом, который необходим для протекания фотосинтеза. Взгляните на газы, растворимые в воде. В таблице приведен коэффициент рсрастворимости Растворенный в воде газ присутствует в жизни практически какждого из нас, ведь сложно найти человека, который откажется от охлажденного газированного напитка, в котором любезно растворили CO2. Подобных глобальных примеров растворения газа в воде очень много, как и газов, которые немедленно начнут растворятся в воде при контакте с ней.
Таблица №1 «Коэффициенты растворимости газов в воде»
|
|
Растворимость – это такой баланс, при котором количество растворенного газа пропорционально парциальному давлению в газообразной фазе над поверхностью воды. Если нам известно атмосферное давление и соответствующая концентрация газа, то можно вычислить максимальную концентрацию растворенного в воде газа, умножив значение парциального давления газа на расчетный коэффициент растворимости из таблици №1.
Пример №1 «Колличественная оценка содержания кислорода и азота, растворенных в воде»:
Классический пример, когда атмосферный воздух вступает с водой в реакцию, сопровождающуюся растворением основных его компоенетов.
1. Подсчитываем кислород O2: концентрация 20.9 объемн. % кислорода с атмосферным давлением 1000 мбар (750 мм. ртутного столба) создают парциальное давление 0.209 бар (0.0209 МПа), таким образом, получаем числовое значение:
ртутного столба) создают парциальное давление 0.209 бар (0.0209 МПа), таким образом, получаем числовое значение:
0.031 x 0.209 = 0.00648 литра или 6.5 мл кислорода O2 растворены в 1 литре воды.
2. Подсчитываем азот N2: при создаваемом парциальном давление 0.791 бар N2) азот растворяется хуже кислорода, выражение:
0.016 x 0.791 = 0.01266 л или 12.7 мл. азота N2 содеожится в 1 л. воды.
Мы только что получили данные по составу и насущению кислродом большиснва пресных водемво и рек россиии.
Пример №2 «Расчет содержания растворенного углекислого газа в газированной воде»:
Газировка производится посредством растворения в воде CO2 под давлением около 2 бара (0,2 МПа).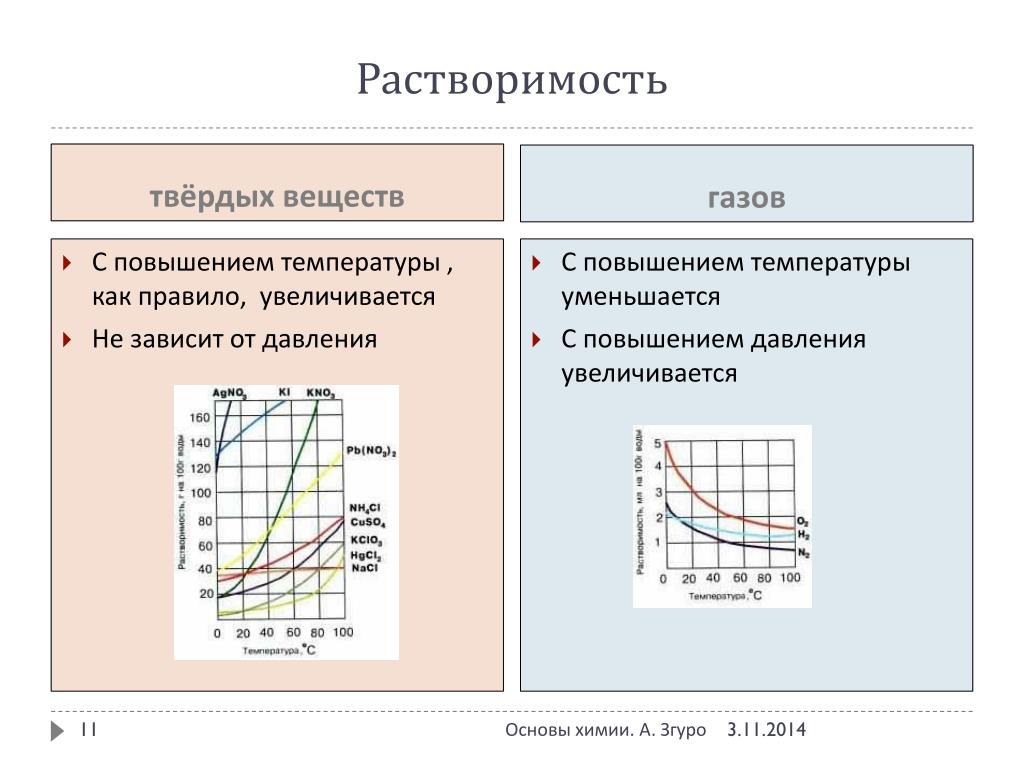 Этих данных достаточно, что бы вычислить содержание CO2 в заданной жидкости, принятой за минеральную воду.
Этих данных достаточно, что бы вычислить содержание CO2 в заданной жидкости, принятой за минеральную воду.
0.879 x 2 = 1.75 л CO2 растворенны в 1 литре газированной воды.
Как вы могли заметить, из таблицы и примеров, некоторые газы растворяются в воде очень быстро и эффективно. Именно поэтому в качестве мер безопасности широко распространено использование водяных распылителей, создание “водяных завес”, например, для снижения угрозы здоровью при выбросах значительных объемов аммиака, HCl и других токсичных газов.
Помните, что растворимость во многом зависит от температуры. Чем выше температура воды, тем меньше газа можно в ней растворить. По этой причине для растворения загрязняющих газов в воздухе их пропускают сквозь холодную техническую воду, Нагревание такого раствора с газами, сопровождается десорбцией и высвобождением всех растворенных газообразных компонентов до полного испарения основы (воды). Обладая подобной информацией, проектировщики систем безопасности выбирают наиболее подходящие для комплектации модели приборов, обозначая на схеме их предварительные места установки и требуемое количество.
Обладая подобной информацией, проектировщики систем безопасности выбирают наиболее подходящие для комплектации модели приборов, обозначая на схеме их предварительные места установки и требуемое количество.
Отсюда вывод: избегайте условий образования конденсата при монтаже датчиков! Влага внутри прибора коварна даже в небольших малозметных колличествах. Применяйте специальные аксессуары и опции для дополнительной защиты газоанализатора от внешних воздействий — брызгозащитные комлекты, антибликовые козырьки, термокожухи, модули защиты от насекомых и т.д.
Сульфат кальция — это
Сульфа́т ка́льция (CaSO4) — неорганическое соединение, кальциевая соль серной кислоты.
Находится в природе в виде дигидрата CaSO4 ∙ 2H2O (гипс, селенит) и в безводном состоянии — ангидрит.
Безводный сульфат кальция — бесцветные кристаллы при нормальных условиях — с ромбической кристаллической решёткой, плотность 2,96 г/см³, температура плавления 1450 °C. При повышенных температурах (свыше 1200 °C) может существовать в виде стабильной кубической модификации или двух метастабильных α- и β-гексагональных модификаций. Очень медленно присоединяет воду, гидратируясь до кристаллогидрата с 1/2 или 2 молекулами воды на 1 молекулу сульфата, соответственно CaSO4 · 0,5H2О и CaSO4 · 2H2О. В воде растворим незначительно. Растворимость падает с повышением температуры: если при 20 °C она составляет 0,2036 г/100 г воды, то вблизи точки кипения воды (100 °C) снижается до 0,067 г сульфата на 100 г воды. Растворённый в природной воде сульфат кальция является одним из факторов, определяющих жёсткость воды.
При повышенных температурах (свыше 1200 °C) может существовать в виде стабильной кубической модификации или двух метастабильных α- и β-гексагональных модификаций. Очень медленно присоединяет воду, гидратируясь до кристаллогидрата с 1/2 или 2 молекулами воды на 1 молекулу сульфата, соответственно CaSO4 · 0,5H2О и CaSO4 · 2H2О. В воде растворим незначительно. Растворимость падает с повышением температуры: если при 20 °C она составляет 0,2036 г/100 г воды, то вблизи точки кипения воды (100 °C) снижается до 0,067 г сульфата на 100 г воды. Растворённый в природной воде сульфат кальция является одним из факторов, определяющих жёсткость воды.
В индустриальных масштабах добывают в составе природных минералов, например гипса, селенита или алебастра или получают синтетическим путём — сплавлением CaCl2 с K2SO4.
В аналитической химии может быть получен воздействием серной кислоты на оксид, карбонат, оксалат или ацетат кальция.
Образуется в результате окисления сульфида кальция при нагреве до 700—800 °C по реакции CaS + 2O2 = CaSO4.
При повышении температуры, но не более чем до 180 °C двуводный сульфат кальция теряет часть воды, переходя в полуводный — так называемый «жжёный гипс», пригодный для дальнейшего применения как вяжущее вещество. При дальнейшем нагреве до 220 °C гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Если обжиг вести при температуре выше 220 °C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при смешивании с водой (это вещество нередко называют «мёртвый гипс»). При дальнейшем нагревании до 900—1200 °C можно получить «гидравлический гипс», который после охлаждения вновь обретает свойства связываться с водой. Первый способ частичной дегидратиции применяют в промышленных условиях для получения полугидрата сульфата кальция (жжёного гипса, алебастра) CaSO4 ∙ 0,5H2O, нагревая дигидрат примерно до 140 °C, уравнение реакции: CaSO4 · 2H2О = CaSO4 · 0,5H2О + 1,5H2О. Значительные объёмы полученного таким путём алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.» [1] .
Значительные объёмы полученного таким путём алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.» [1] .
Регистрационный номер CAS:
- ангидрат 7778-18-9 [2] ;
- полугидрат 10034-76-1 [3] ;
- двугидрат 10101-41-4 [4] .
Применение
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.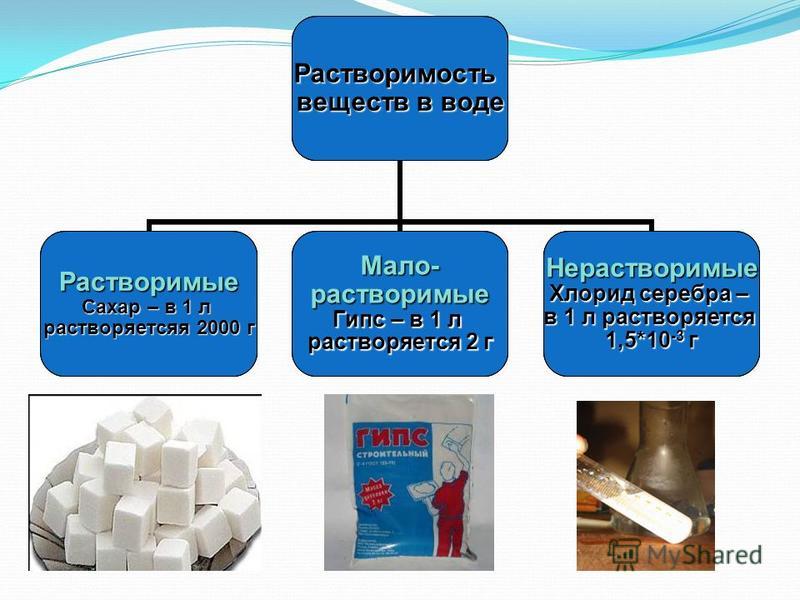
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite, состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении тофу.
Источник:
http://dic.academic.ru/dic.nsf/ruwiki/94813
Сульфат кальция
Сульфат кальция широко распространен в природе в виде дигидрата — гипса (селепит) СаSO4∙2Н2O и в безводном состоянии в виде ангидрита (карстонит, муриацит).
В питьевой воде сульфат кальция нередко содержится в растворенном состоянии и обусловливает поэтому постоянную или неустранимую жесткость воды (т. е. ту жесткость, которая не исчезает после кипячения).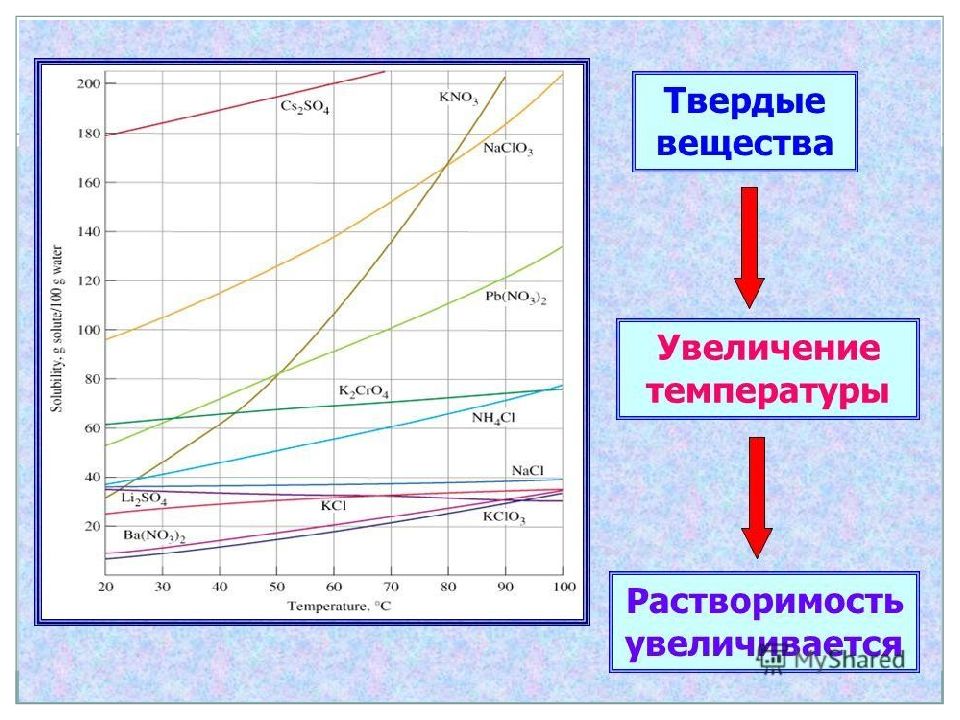 Однако растворимость сульфата кальция в воде все же невелика. При 18 °С она составляет 202 мг в 100 г воды и лишь незначительно изменяется с температурой. Кривая его растворимости имеет плоский максимум между 30 и 40 °С. Присутствие других сульфатов понижает растворимость СаSO4, однако наличие в воде других солей, а также кислот, не исключая и серной кислоты, наоборот, довольно значительно повышает растворимость сульфата кальция. С серной кислотой СаSO4 довольно легко образует растворимые в воде продукты присоединения, например СаSO4∙Н2SO4 и СаSO4∙3Н2SO4, которые были выделены в свободном состоянии. С сульфатами щелочных металлов СаSO4 образует труднорастворимые двойные соли, встречающиеся также в природе, например глауберит Na2SO4∙СаSO4 и сингенит К2SO4∙СаSO4∙Н2О.
Однако растворимость сульфата кальция в воде все же невелика. При 18 °С она составляет 202 мг в 100 г воды и лишь незначительно изменяется с температурой. Кривая его растворимости имеет плоский максимум между 30 и 40 °С. Присутствие других сульфатов понижает растворимость СаSO4, однако наличие в воде других солей, а также кислот, не исключая и серной кислоты, наоборот, довольно значительно повышает растворимость сульфата кальция. С серной кислотой СаSO4 довольно легко образует растворимые в воде продукты присоединения, например СаSO4∙Н2SO4 и СаSO4∙3Н2SO4, которые были выделены в свободном состоянии. С сульфатами щелочных металлов СаSO4 образует труднорастворимые двойные соли, встречающиеся также в природе, например глауберит Na2SO4∙СаSO4 и сингенит К2SO4∙СаSO4∙Н2О.
Из водных растворов при температуре ниже 66 ºC сульфат кальция всегда кристаллизуется в виде дигидрата СаSO4∙2Н2O (гипс), образующего шестигранные моноклинные призмы удельного веса 2,32. Кристаллы гипса имеют заметную склонность к образованию двойников (в форме ласточкиного хвоста). Гипс распространен в природе в очень больших количествах; иногда встречаются большие, красивые, правильные кристаллы, а чаще — порода, состоящая из мелких и мельчайших кристаллов и имеющая волокнистое, зернистое или совершенно плотное строение. Гипсовые породы встречаются во всех геологических формациях, но главным образом они распространены в пермской формации или диасе, в триасе и четвертичной формации, иногда образуя мощные залегания и штоки. Гипс легко отличить, по его незначительной твердости (1,5-2) и прекрасно выраженной способности раскалываться (спайности). Подобно всем минералам, кристаллизующимся в моноклинной системе, он обладает двойным лучепреломлением. Разновидностями гипса являются мариенелос, или фрауенглас, и алебастр. Последний очень похож на белый мрамор, но вследствие незначительной теплопроводности не дает при прикосновении, подобно мрамору, ощущения холода. Чистый гипс бесцветен, или, если он представляет кристаллический агрегат, имеет болый цвет.
Кристаллы гипса имеют заметную склонность к образованию двойников (в форме ласточкиного хвоста). Гипс распространен в природе в очень больших количествах; иногда встречаются большие, красивые, правильные кристаллы, а чаще — порода, состоящая из мелких и мельчайших кристаллов и имеющая волокнистое, зернистое или совершенно плотное строение. Гипсовые породы встречаются во всех геологических формациях, но главным образом они распространены в пермской формации или диасе, в триасе и четвертичной формации, иногда образуя мощные залегания и штоки. Гипс легко отличить, по его незначительной твердости (1,5-2) и прекрасно выраженной способности раскалываться (спайности). Подобно всем минералам, кристаллизующимся в моноклинной системе, он обладает двойным лучепреломлением. Разновидностями гипса являются мариенелос, или фрауенглас, и алебастр. Последний очень похож на белый мрамор, но вследствие незначительной теплопроводности не дает при прикосновении, подобно мрамору, ощущения холода. Чистый гипс бесцветен, или, если он представляет кристаллический агрегат, имеет болый цвет. Различные примеси иногда сообщают ему серую, желтоватую, коричневатую или красноватую, а иногда даже почти черную окраску.
Различные примеси иногда сообщают ему серую, желтоватую, коричневатую или красноватую, а иногда даже почти черную окраску.
При нагревании до 100 °С гипс отщепляет 3/4 своей кристаллизационной воды и переходит в метастабильный семигидрат (полугидрат) СаSO4∙1/2Н2О. При обычной температуре последний снова поглощает воду с заметным разогреванием. Если его замесить с водой в виде жидкого теста, то он довольно скоро застывает, образуя твердую массу, состоящую из тонковолокнистых, переплетенных между собой кристаллов гипса. На этом свойстве основано применение гипса в строительном деле, а также при изготовлении скульптур (для отливок). Применяемый в этих случаях жженый гипс («штукатурный») обычно содержит еще меньше воды, чем полугидрат; однако он не должен быть полностью обезвожен. Если гипс настолько сильно обжечь, что он отдаст всю воду, то он теряет способность в дальнейшем «схватываться», т. е. присоединять воду. Таной гипс называют «пережженым». Природный безводный сульфат кальция — ангидрит — также не способен «схватываться». Однако при очень длительном выдерживании в присутствии воды ангидрит все-таки переходит в гипс. Значительная часть встречающегося в природе гипса образовалась таким путем. Иногда, наоборот, природный ангидрит образуется из гипса. Из подлых растворов ангидрит кристаллизуется при температуре выше 66 ºС. Однако если раствор содержит одновременно и другие соли, то ангидрит может выделяться и при значительно более низких температурах. Так, из раствора, который одновременно насыщеп хлористым натрием, сульфат кальция выделяется в виде ацгидрита уже выше 30 °С. Кроме ангидрита, существует еще одна модификация безводного сульфата кальция. Она растворима лучше, чем ангидрит, и поэтому неустойчива.
Однако при очень длительном выдерживании в присутствии воды ангидрит все-таки переходит в гипс. Значительная часть встречающегося в природе гипса образовалась таким путем. Иногда, наоборот, природный ангидрит образуется из гипса. Из подлых растворов ангидрит кристаллизуется при температуре выше 66 ºС. Однако если раствор содержит одновременно и другие соли, то ангидрит может выделяться и при значительно более низких температурах. Так, из раствора, который одновременно насыщеп хлористым натрием, сульфат кальция выделяется в виде ацгидрита уже выше 30 °С. Кроме ангидрита, существует еще одна модификация безводного сульфата кальция. Она растворима лучше, чем ангидрит, и поэтому неустойчива.
Природный ангидрит встречается в виде прослоек в залежах каменной соли, а иногда составляет промежуточный слой между залежами каменной соли и калийных солей. Он чрезвычайно распространен и встречается почти в каждой геологической формации, большей частью в смеси с гипсом, который образовался из него. Ангидрит кристаллизуется в ромбической системе, хорошо раскалывается, однако не в такой степени, как гипс. Он превосходит гипс по твердости (3-3,5) и плотности. Его удельный вес равен 2,8-3. В чистом состоянии он бесцветен, однако нередко бывает окрашен примесями в синеватый, синевато-серый и другие цвета.
Ангидрит кристаллизуется в ромбической системе, хорошо раскалывается, однако не в такой степени, как гипс. Он превосходит гипс по твердости (3-3,5) и плотности. Его удельный вес равен 2,8-3. В чистом состоянии он бесцветен, однако нередко бывает окрашен примесями в синеватый, синевато-серый и другие цвета.
Если гипс или ангидрит нагреть выше 1000 °С, то они начинают выделять трехокись серы. Получающийся продукт (твердый раствор СаО в СаSO4) отличается способностью поглощать воду; при замешивании с небольшим количеством воды он скорее, чем раствор из извести и песка, образует очень твердую, плотную массу, устойчивую к выветриванию. На этом свойстве основано использование гипса, обожженного при высоких температурах (1300 °C), для изготовления цементирующих растворов (гипс для строительных растворов, гипс для затирки каменных полов) которые были известны еще древним египтянам. Кроме того, «штукатурный гипс» широко применяют для изготовления форм для керамических изделий, а именно для литья фарфора (для чего он осабенно удобен благодаря своей пористости). Тонко размолотый необожженный гипс служит добавкой к минеральным краскам (в обойном производстве и в бумажной промышленности).
Тонко размолотый необожженный гипс служит добавкой к минеральным краскам (в обойном производстве и в бумажной промышленности).
Применение
Природный ангидрит применяют в производстве вяжущих материалов. Сульфат кальция применяют для изготовления фигур, слепков, как строительный материал (гипс) и в медицине (кальций). Из гипса изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др. Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Алебастр при смешении с водой твердеет, образуя дигидрат и широко используется в строительстве. Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объема. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.
Дополнительно
Находится в природе в виде дигидрата CaSO4 ∙ 2h3O (гипс, селенит) и в безводном состоянии — ангидрит.
Безводный сульфат кальция — бесцветные кристаллы, плотность 2,96 г/см³, температура плавления 1450 °C. Очень медленно присоединяет воду. В воде растворим незначительно. При повышении температуры до 220°C двуводный гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Однако если обжиг вести при температуре вышЕ-220°C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при затворении водой. В промышленных условиях также получают полугидрат сульфата кальция (алебастр)CaSO4 ∙ 0,5h3O путем нагревания дигидрата примерно до 140°C, по уравнению реакции: CaSO4·2h3О = CaSO4·0,5h3О + 1,5h3О.
Не нашли что искали? Вы можете оставить заявку, в форме обратной связи.
Источник:
http://himiya.gosstandart.info/slozhnye-veshchestva/soli/sulfat-kalciya/
Сульфат кальция (Е516)
Сульфат кальция на самом деле очень известное и широко распространенное вещество, наиболее известное в народе, как гипс. По достоинству вяжущие свойства этого продукта изначально оценили врачи, и только в прошлом столетии он нашел применение в пищевой промышленности, как пищевая добавка, маркируемая знаком Е516.
По достоинству вяжущие свойства этого продукта изначально оценили врачи, и только в прошлом столетии он нашел применение в пищевой промышленности, как пищевая добавка, маркируемая знаком Е516.
Как же используется сульфат кальция в изготовлении продуктов? Какие последствия влечет за собой его употребление? Где еще используется данная добавка? Все это можно узнать, прочитав следующую статью.
Свойства сульфата кальция и основные характеристики
К другим наименованиям такой пищевой добавки относятся: гипс, кальций сернокислый, ангидрит, селенит, Calcium sulfate, Е516. На французском языке его название звучит, как sulfate de calcium, а на немецком – calciumsulfat.
- Свойства сульфата кальция и основные характеристики
- Основные производители и стандартная упаковка сульфата кальция
- Применение в разных сферах
- Полезные и вредные свойства добавки Е516
- В заключение
Это вещество замечательным образом соединяет в себе свойства стабилизатора и эмульгатора. В природе также существует его аналог – серной кислоты кальциевая соль. В естественной среде сульфат кальция формируется из обезвоженных гипсовых отложений, содержится в гипсе и селените, как дигидрат. Жесткость водопроводной воды напрямую связана с концентрацией в ней сульфата калия.
В природе также существует его аналог – серной кислоты кальциевая соль. В естественной среде сульфат кальция формируется из обезвоженных гипсовых отложений, содержится в гипсе и селените, как дигидрат. Жесткость водопроводной воды напрямую связана с концентрацией в ней сульфата калия.
В промышленных масштабах такую добавку получают путем сплавления сульфата калия с хлоридом кальция. В результате такой реакции выпадает осадок, который и является сульфатом кальция.
По внешнему виду это вещество более всего напоминает белый или слегка желтоватый кристаллический порошок горьковато-соленого вкуса и без запаха. Его химический состав включает в себя сернокислый кальций и различные примеси: фториды, селен и другие. Молекулярную формулу вещества можно обозначить в виде: CaSO4.
Этот пищевой эмульгатор практически не растворяется в воде и абсолютно не растворим в этиловом спирте. Однако обладает хорошей растворимостью в глицерине, кислой среде и солях аммония.
Данная пищевая добавка является влаговпитывающим веществом. Она способна поглощать до семи процентов воды от общей массы. Плавится при очень высоких температурах, гигроскопична.
Она способна поглощать до семи процентов воды от общей массы. Плавится при очень высоких температурах, гигроскопична.
Основные производители и стандартная упаковка сульфата кальция
В Российской Федерации такую добавку производит только одно предприятие, которое находится в Удмуртии в городе Глазов – Чепецкий механический завод.
Основными ведущими мировыми производителями сульфата кальция являются:
- компания Bassermann minerals GmbH & Co.KG, зарегистрированная в Германии;
- корпорация Dr. Paul Lohmann GmbH KG, также находящаяся в Германии;
- польская компания «Alwernia» Spółka Akcyjna.
Самым главным поставщиком данного вещества на мировой рынок является Китай. Эта прерогатива полностью принадлежит корпорации Foodchem International Corporation.
Наиболее приемлемыми стандартными упаковками для такого вещества считаются контейнеры «биг бэг» мягкие, полипропиленовые мешки, бумажные многослойные пакеты, картонно-навивные барабаны.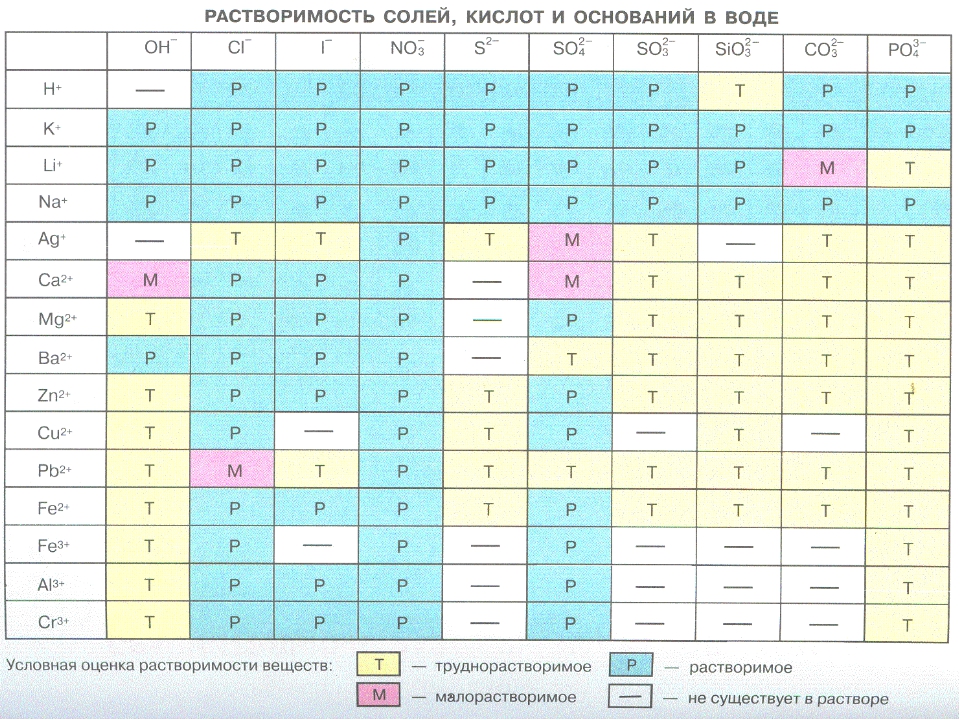 Помимо этого, пищевая добавка Е516 предварительно герметично зашивается в полиэтиленовые пакеты.
Помимо этого, пищевая добавка Е516 предварительно герметично зашивается в полиэтиленовые пакеты.
Применение в разных сферах
Наиболее распространенными областями применения сульфата кальция являются пищевая отрасль, медицина и косметологическая промышленность.
В сфере приготовления продуктов питания эта пищевая добавка используется как самостоятельное вещество или в совокупности с другими эмульгаторами и стабилизаторами.
Высокая влаговпитывающая способность сульфата кальция обеспечивает ему широкое применение при сушке грибов и овощей, при изготовлении различных пряностей, молока, соусов и других изделий.
Такую пищевую добавку используют в различных целях:
- для улучшения структуры растительной ткани, большей сохранности полезных веществ, а также повышения термостойких свойств применяется для консервирования томатов;
- для регулирования кислотности в виноградном сусле применяют французские виноделы при изготовлении вин;
- для улучшения текстуры и качества сгустка используется для приготовления тофу, домашнего сыра и творога;
- для нормализации pH уровня в солодовом заторе при изготовлении пива;
- в качестве питательного вещества для различных микроорганизмов в производстве хлебопекарных дрожжей;
- для повышения пластичности теста и его эластичности, улучшения качества муки и защите ее от порчи применяется в изготовлении хлебобулочных изделий;
- для связывания компонентов при производстве замороженных продуктов из рыбы.

К тому же данное вещество часто применяется в диетологии в качестве заменителя соли.
В медицинской сфере сернокислый кальций используют для изготовления хирургических фиксирующих повязок. В недалеком прошлом это был единственный материал, который использовался для оттисков зубов в стоматологической практике.
Широко распространен сульфат кальция в косметологической промышленности. Его применяют в качестве одного из компонентов для приготовления альгинатных масок с морскими водорослями.
Вещество разводят в воде, наносят на лицо, а после снимают также, как и резиновую маску. Благодаря своим пластифицирующим свойствам сульфат кальция способствует быстрому застыванию такой маски.
При совмещении порошка сернокислого кальция с водой, получают вязкую гомогенную субстанцию, которую наносят на лицо и тело, получая так называемую питательную термическую маску.
После застывания полученная смесь имеет свойство нагреваться, что способствует лучшему раскрытию пор и ускорению проникновения необходимых веществ в клетки кожи. Можно найти данное вещество в декоративной косметике в качестве матирующего компонента, а также в скрабах, где он популярен как абразив.
Можно найти данное вещество в декоративной косметике в качестве матирующего компонента, а также в скрабах, где он популярен как абразив.
Сульфат кальция считается повсеместно разрешенным продуктом, максимальная суточная доза его не регламентируется.
Полезные и вредные свойства добавки Е516
Пищевая добавка Е516 является легкоусвояемой и абсолютно безопасной для организма человека. Часто его применяют при нехватке кальция, для его скорейшего пополнения. Однако при этом следует учитывать, что кальций способен усваиваться только в компании с другими веществами – особенно с витамином D. Продукты питания содержат в себе небольшое количество такой добавки.
Сульфат кальция, полученный путем химического синтеза, может содержать в себе некоторое количество примесей, которые могут нанести организму вред, особенно принятые в завышенных дозировках.
Поэтому таким продуктом лучше не злоупотреблять. Тем более, что переизбыток кальция также небезопасен для здоровья человека, как и его нехватка.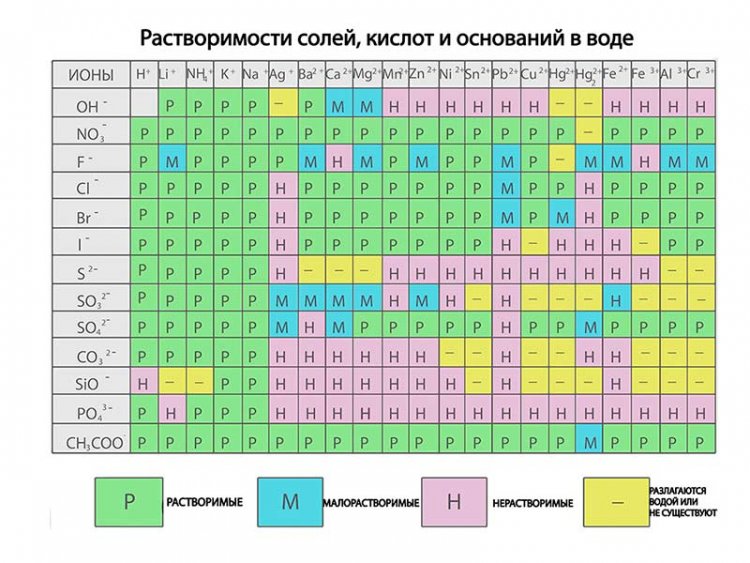 В итоге это может привести к гиперкальциемии, которая повлечет за собой негативные и неприятные последствия.
В итоге это может привести к гиперкальциемии, которая повлечет за собой негативные и неприятные последствия.
- Почему нельзя самостоятельно садиться на диету
- 21 совет, как не купить несвежий продукт
- Как сохранить свежесть овощей и фруктов: простые уловки
- Чем перебить тягу к сладкому: 7 неожиданных продуктов
- Ученые заявили, что молодость можно продлить
В заключение
Сульфат кальция является абсолютно безопасной пищевой добавкой для здоровья человека, а потому ее применение даже в пищевой отрасли одобрено и разрешено во всех странах мира.
Благодаря своим стабилизирующим и эмульгирующим, а также высоким влаговпитывающим свойствам, кальций сернокислый широко применяется в медицине и в косметологической промышленности.
Благодаря ему, можно значительно повысить уровень кальция в организме, однако использовать его необходимо только в совокупности с витаминами, потому что в чистом виде он не усваивается организмом человека.
Источник:
http://foodandhealth.ru/dobavki/sulfat-kalciya-e516/
Сульфат кальция
Сульфат кальция (кальциевая соль серной кислоты) – неорганическое соединение, представленное бесцветными или светло-желтыми кристаллами без четко выраженного запаха с ромбическим строением решетки. Вещество не растворяется в этаноле. Растворимость сульфата кальция в воде незначительна и она только падает с повышением ее температуры.
В природе содержание сульфата кальция определяет естественную жесткость воды.
В окружающей среде сульфат кальция представлен дигидратом (гипсом, селенитом). В безводном состоянии – минералом ангидритом, образующимся в осадочных толщах в результате естественного обезвоживания отложений гипса. Перед применением сырье очищается от посторонних примесей (стронция, силикатов) и прокаливается при температуре 110 градусов Цельсия, чтобы обеспечить освобождение гипса от воды. В итоге получается гемигидрат, который иначе называется «парижским пластырем».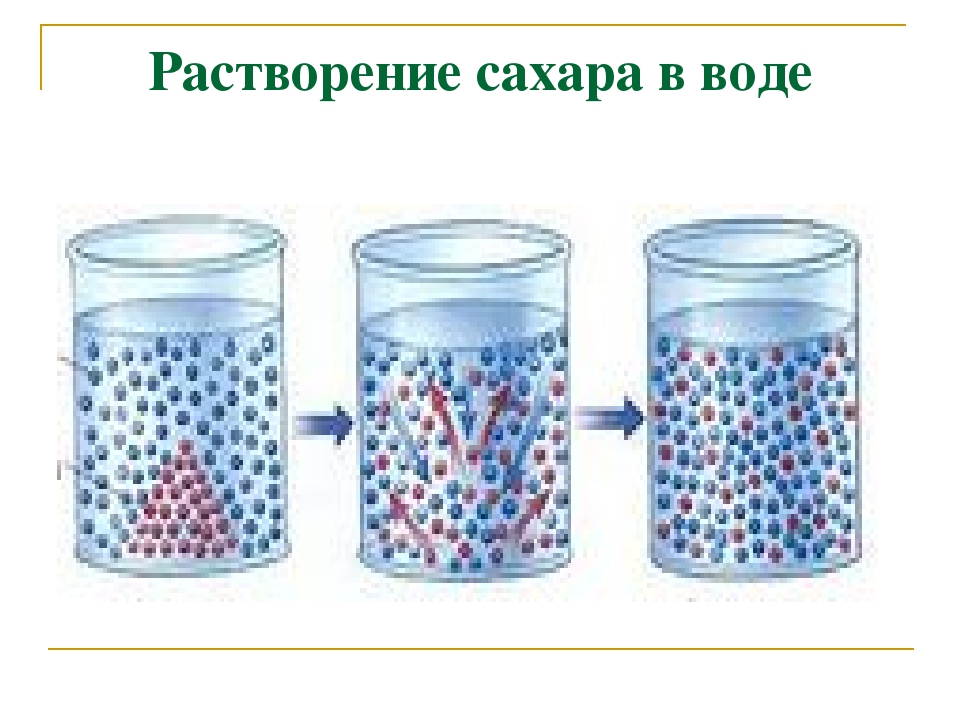
Получение сульфата кальция в промышленных масштабах осуществляется с помощью добычи вещества, находящегося в составе природных минералов (селенита, гипса, алебастра).
Также получение сульфата кальция может происходить синтетическим путем – реакцией сплавления CaCl2(хлористого кальция) с K2SO4 (сульфатом калия).
Химическая формула вещества – CaSO4.
Зарегистрирован в качестве пищевой добавки Е516.
Применение сульфата кальция
Минерал, состоящий из дигидрата сульфата кальция (гипса) имеет длительную историю своего применения: первые упоминания относительно использования вещества датируются 1961 годом в области клинического применения. В те годы материал использовался при восстановлении различных повреждений кости туберкулезного и травматического происхождения. По сообщениям специалистов, сульфат кальция полностью резорбировался уже через пять недель.
Материал действительно обладает способностью к полному рассасыванию в естественных условиях, благодаря чему с успехом используется в стоматологии, имплантологии, ортопедии.
В пищевой индустрии сульфат кальция применяется в качестве добавки-эмульгатора (вещества, обеспечивающего создание эмульсий из других заведомо не смешивающихся жидкостей), отвердителя, осушителя, улучшителя хлеба и муки, коагулянта. Используется в производстве сыра тофу, пива, кондитерских изделий, биологически активных добавок, консервированных овощей, вина (для подкисления сусла). Зачастую сульфат кальция добавляют в пищевые продукты в качестве заменителя соли.
Помимо пищевой промышленности сульфат кальция используется в медицине, строительстве. Созданные искусственным образом кристаллы сернокислого кальция, легированные марганцем и самарием, применяются как термолюминесцентный материал.
Влияние на здоровье
По результатам многочисленных исследований и наблюдений пищевая добавка сульфат кальция был признан безвредным и разрешенным к употреблению, как в пищевых, так и в медицинских целях. Максимально допустимая норма потребления сульфата кальция также не установлена.
Источник:
http://www.neboleem.net/sulfat-kalcija.php
Сульфат кальция – удобрение, применяемое в различных отраслях
Удобрение, применяемое в различных отраслях
Сульфат кальция – это кальциевая соль серной кислоты, на вид – это бесцветные кристаллы. В природе встречается в виде дигидрата. Впервые его начали применять в 60-х годах прошлого века для восстановления костных повреждений. Имеет свойство полностью рассасываться через 5 недель. В соединении с водой сульфат кальция имеет свойство застывать.
Применяется в медицине (для гипсов), строительстве изготавливают сухую штукатурку, элементы декора. В пищевой промышленности – это добавка эмульгатор. Он улучшает качество мучных изделий, может служить подкислителем для сусла в виноделии.
В качестве удобрения широко используется и в сельском хозяйстве.
Известные факты, что почва – важный инструмент для работника сельского хозяйства. Азот является главным фактором урожая. Его действие зависит от наличия серы. Удобряя почву, мы не только подкармливаем растение, но и заботимся о плодородности почвы.
Удобряя почву, мы не только подкармливаем растение, но и заботимся о плодородности почвы.
Нехватка серы в почве приводит к слабому урожаю, понижению сопротивления растений, понижает содержание жиров, простого сахара, вызывает концентрацию нитратов в растениях.
Сера влияет на состояние азота, увеличивает количество урожая, повышает устойчивость растений к болезням, а также устойчивость растений к засухе, жаре.
Кальций способствуют развитию, укрепляет и развивает корневую систему, повышает выносливость растений, активизирует энзимы, противодействует органическим кислотам.
Сульфат кальций удобрение обладает рядом полезных свойств:
- не окисляет почву;
- постепенно растворяется;
- легко усваивается;
- нейтрализует токсичный алюминий;
- улучшает физические свойства почвы;
- понижает уровень соли в почве.
Главной идеей удобрения почвы – оптимизировать этот процесс (ограничить в почве химические соединения), забота о ее состоянии, предотвращение истощения, экономное использование средств защиты.
Используют это удобрение перед посевной, его смешивают с почвой. В вегетационный период растения удобряют перед формированием стебля, зерновые культуры перед кущением. Озимые следует удобрять осенью, чтобы было время для его растворения. Возможно добавлять его в вегетационный период. Весеннее удобрение почвы осуществляют перед посевом и в период вегетации.
Хранить удобрение сульфат кальция нужно согласно инструкции по эксплуатации. На земле в поле лучше прикрывать пленкой. Хотя под воздействием влаги может взяться комками, а верхний слой взяться коркой, но от этого оно не потеряет своих химических свойств. Если храните не прикрытым, то лучше его перед использованием перемешать.
Источник:
http://topxlist.ru/sulfat-kaltsiya-udobrenie-primenyaemoe-v-razlichnyih-otraslyah/
Свойство воды и растворимость веществ в ней
В обычной неассоциированной жидкости, например в такой, как бензин, молекулы свободного скользят одна вокруг другой. В воде же они скорее катятся, чем скользят. Молекулы воды, как известно, соединены между собой водородными связями, поэтому прежде чем произойдет какое-либо смещение, нужно разорвать хотя бы одну из этих связей. Эта особенность и определяет вязкость воды.
В воде же они скорее катятся, чем скользят. Молекулы воды, как известно, соединены между собой водородными связями, поэтому прежде чем произойдет какое-либо смещение, нужно разорвать хотя бы одну из этих связей. Эта особенность и определяет вязкость воды.
Диэлектрической постоянной воды называется ее способность нейтрализовать притяжение, существующее между электрическими зарядами. Растворение твердых веществ в воде — сложный процесс, который обусловливается взаимодействием частиц растворенного вещества и частиц воды.
При изучении строения веществ с помощью рентгеновских лучей было установлено, что большинство твердых тел имеет кристаллическое строение, т. е. частицы вещества расположены в пространстве в определенном порядке. Частицы одних веществ расположены так, будто бы они находятся в углах крошечного куба, частицы других — в углах, центре и в середине сторон тетраэдра, призмы, пирамиды и пр. Каждая из этих форм является мельчайшей ячейкой более крупных кристаллов аналогичной формы. У одних веществ в узлах их кристаллической решетки находятся молекулы (у большинства органических соединений), у других (например, у неорганических солей) — ионы, т. е. частицы, состоящие из одного или нескольких атомов, имеющих положительные или отрицательные заряды. Силами, удерживающими ионы в определенном, ориентированном в пространстве порядке кристаллической решетки, являются силы электростатического притяжения разноименно заряженных ионов, составляющих кристаллическую решетку.
У одних веществ в узлах их кристаллической решетки находятся молекулы (у большинства органических соединений), у других (например, у неорганических солей) — ионы, т. е. частицы, состоящие из одного или нескольких атомов, имеющих положительные или отрицательные заряды. Силами, удерживающими ионы в определенном, ориентированном в пространстве порядке кристаллической решетки, являются силы электростатического притяжения разноименно заряженных ионов, составляющих кристаллическую решетку.
Если, например, растворить в воде хлористый натрий, то положительно заряженные ионы натрия и отрицательно заряженные ионы хлора будут отталкиваться друг от друга.
Это отталкивание происходит потому, что у воды высокая диэлектрическая постоянная, т. е. выше, чем у любой другой жидкости. Она уменьшает силу взаимного притяжения между противоположно заряженными ионами в 100 раз. Причину сильно нейтрализующего действия воды нужно искать в расположении ее молекул. Водородный атом в них не делит поровну свой электрон с тем атомом кислорода, к которому он прикреплен.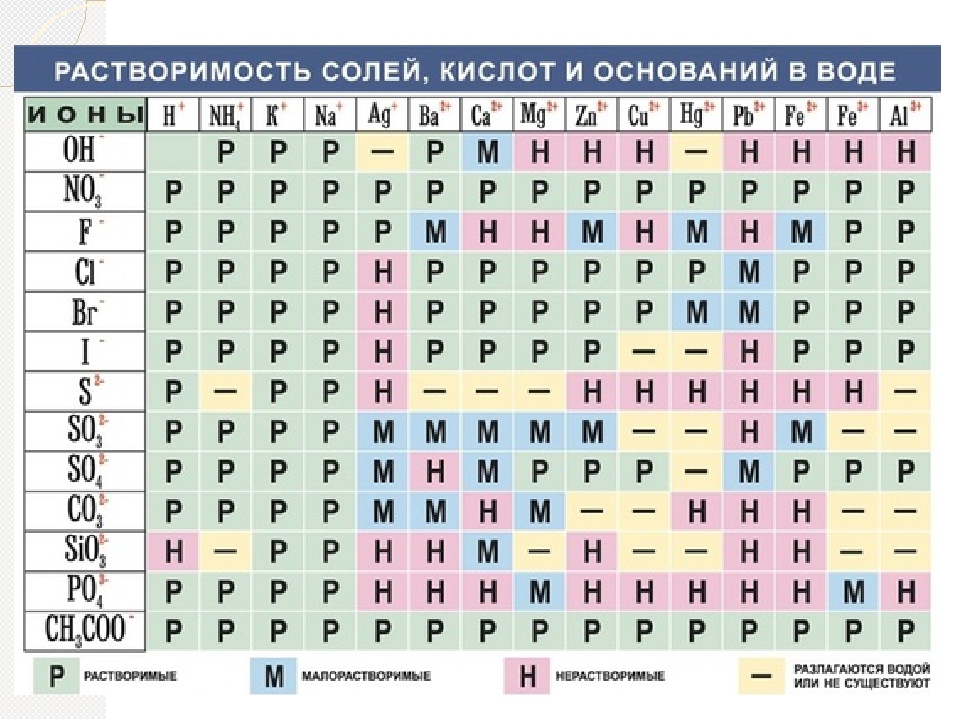 Этот электрон всегда ближе к кислороду, чем к водороду. Поэтому водородные атомы заряжены положительно, а кислородные — отрицательно.
Этот электрон всегда ближе к кислороду, чем к водороду. Поэтому водородные атомы заряжены положительно, а кислородные — отрицательно.
Когда какое-либо вещество, растворяясь, распадается на ионы, кислородные атомы притягиваются к положительным ионам, а водородные — к отрицательным. Молекулы воды, окружающие положительный ион, направляют к нему свои кислородные атомы, а молекулы, которые окружают отрицательный ион, устремляются к нему своими атомами водорода. Таким образом молекулы воды образуют как бы решетку, которая отделяет ионы друг от друга и нейтрализует их притяжение (рис. 12). Чтобы оторвать друг от друга ионы, находящиеся в кристаллической решетке, и перевести их в раствор, необходимо преодолеть силу притяжения этой решетки. При растворении солей такой силой является притяжение ионов решетки молекулами воды, характеризуемое так называемой энергией гидратации. Если при этом энергия гидратации по сравнению с энергией кристаллической решетки будет достаточно велика, то ионы будут отрываться от последней и перейдут в раствор.
Взаимосвязь между молекулами воды и ионами, оторванными от решетки, в растворе не только не ослабевает, а становится еще теснее.
Рис. 12. Разрушение ионной решетки кристалла NaCl полярными молекулами воды при растворении.
Как уже отмечалось, в растворе ионы окружаются и разобщаются молекулами воды, которые, ориентируясь на них своими противоположными по заряду частями, образуют так называемую гидратную оболочку (рис. 13). Величина этой оболочки различна у разных ионов и зависит от заряда иона, его размера и, кроме того, от концентрации ионов в растворе.
В продолжение нескольких лет физико-химики изучали воду в основном как растворитель электролитов. В результате получено много сведений об электролитах, но очень мало о самой воде. Как ни странно, но только в последние годы появились работы, посвященные изучению отношения воды к веществам, которые в ней практически не растворяются.
Наблюдалось немало поразительных явлений. Например, однажды труба, по которой шел природный газ при t = 19°С, оказалась забитой, мокрым снегом с водой. Стало ясным, что дело здесь не в температуре, а в других свойствах воды. Возник ряд вопросов: почему вода замерзла при столь высокой температуре, как вода могла соединиться с веществами, которые в ней нерастворимы.
Стало ясным, что дело здесь не в температуре, а в других свойствах воды. Возник ряд вопросов: почему вода замерзла при столь высокой температуре, как вода могла соединиться с веществами, которые в ней нерастворимы.
Эта тайна еще не была раскрыта, когда обнаружилось, что даже такие благородные газы, как аргон и ксенон, которые не вступают ни в какие химические реакции, могут связываться с водой, образуя некоторое подобие соединений.
Рис. 13. Разъединение ионов Na+ и С1— полярными молекулами воды, образующими вокруг них гидратную оболочку.
Интересные результаты по растворимости в воде метана были получены в Иллинойсе. Молекулы метана не образуют ионов в воде и не воспринимают водородных связей; притяжение между ними и молекулами воды очень слабое. Однако метан все же, хотя и плохо, растворяется в воде, и его диссоциированные молекулы образуют с ней соединения — гидраты, в которых несколько молекул воды присоединены к одной молекуле метана.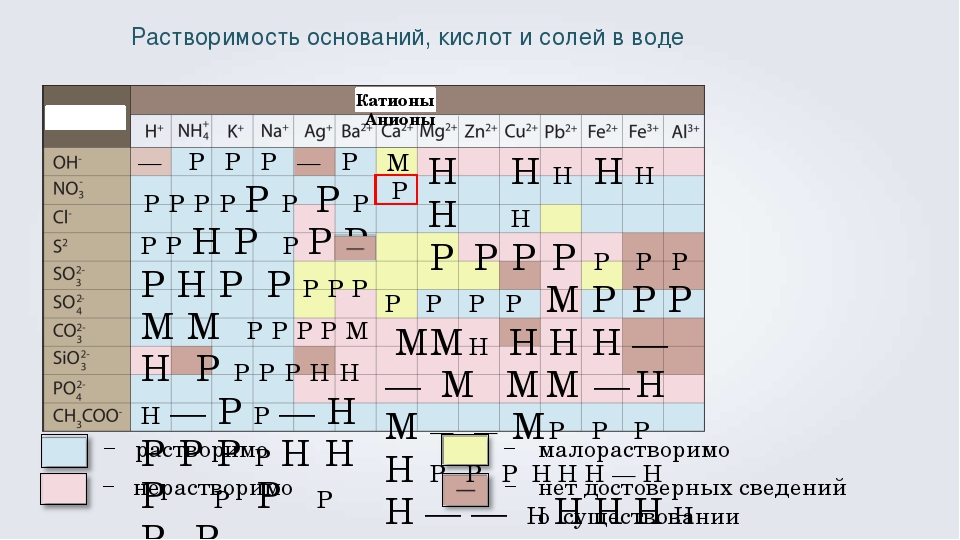 При этой реакции высвобождается в 10 раз больше тепла, чем при растворении метана в гексане (метан растворяется в гексане лучше, чем в воде).
При этой реакции высвобождается в 10 раз больше тепла, чем при растворении метана в гексане (метан растворяется в гексане лучше, чем в воде).
Факт растворения метана в воде представляет большой интерес. Ведь по объему молекула метана вдвое больше молекулы воды. Чтобы метан растворился в воде, между ее молекулами должны образоваться довольно большие «дырки». Для этого требуется значительная затрата энергии, большая чем для испарения воды (примерно 10 000 калорий на каждый моль). Откуда же появляется столько энергии? Силы притяжения между молекулами метана и воды слишком слабы, они не могут дать столько энергии. Поэтому существует другая возможность: структура поды изменяется в присутствии метана. Предположим, что молекула растворенного метана окружена оболочкой из 10-20 молекул воды. При образовании таких ассоциаций молекул выделяется теплота. В пространстве, занятом молекулой метана, исчезают силы взаимного притяжения между молекулами воды, а значит, и внутреннее давление. В таких условиях, как мы видели, вода замерзает при температуре выше нуля.
Вот почему молекулы, находящиеся в промежутке между метаном и водой, могут кристаллизоваться, что и произошло в описанном выше случае. Замороженные гидраты могут поглощаться раствором и выделяться из него. Эта теория известна как теория айсбергов. Практически, как показывают исследования, все непроводящие вещества, которые подвергались испытанию, образуют устойчивые кристаллические гидраты. В то же время у электролитов такая тенденция выражена слабо. Все это ведет к совершенно новому пониманию растворимости.
Считалось, что растворение электролитов происходит в результате действия сил притяжения. Теперь же доказано, что растворение неэлектролитов происходит не благодаря силам притяжения между этими веществами и водой, а в результате недостаточного притяжения между ними. Вещества, не распадающиеся на ионы, соединяются с водой, так как они устраняют внутреннее давление и тем самым способствуют появлению кристаллических образований.
Чтобы лучше понять образование таких гидратов, целесообразно рассмотреть их молекулярную структуру.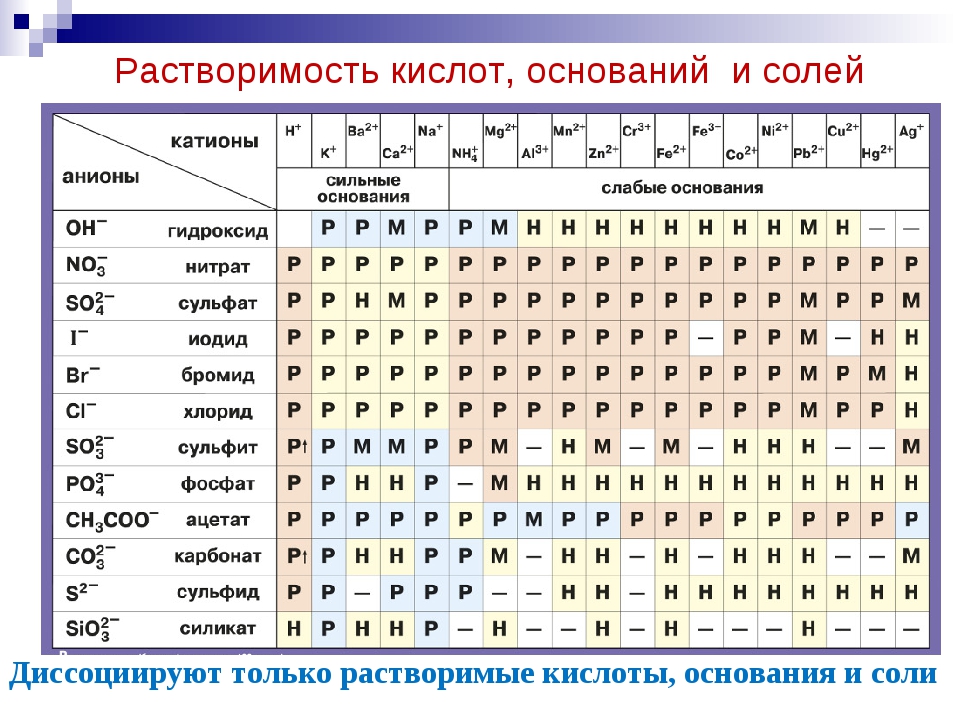
Доказано, что образующиеся гидраты имеют кубическую структуру (решетку) в отличие от гексагональной структуры льда. Дальнейшие работы исследователей показали что гидрат может иметь две кубические решетки: в одной из них промежутки между молекулами равны 12, в другой — 17 А. В меньшей решетке 46 молекул воды, в большей 136. Дырки молекул газа в меньшей решетке имеют 12-14 граней, а в большей — 12-16, к тому же они разнятся по своим размерам и заполняются молекулами различной величины, причем могут быть заполнены не все дырки. Такая модель с большой степенью точности объясняет действительное строение гидратов.
Роль таких гидратов в жизненных процессах трудно переоценить. Эти процессы происходят в основном в промежутках между молекулами воды и протеина. Вода при этом имеет сильную тенденцию к кристаллизации, так как в протеиновой молекуле содержится много неионных, или неполярных, групп. Всякий такой гидрат образуется при меньшей плотности, чем лед, поэтому его образование может вести к значительному разрушительному расширению.
Итак, вода — это своеобразное и сложное вещество с определенными и разнообразными химическими свойствами. Она имеет стройную и в то же время меняющуюся физическую структуру.
Развитие всей живой и в значительной части неживой природы неразрывно связано с характерными особенностями воды.
Растворимость в воде — Справочник химика 21
В табл. 78 приводятся данные о растворимости некоторых изомерных амиловых спиртов в воде, а также о растворимости воды в этих спиртах [200]. Легче всего растворяются в воде третичные изомеры, которые растворяют вместе с тем и наибольшее количество воды. Три вторичных спирта растворяются легче, чем четыре первичных. Растворимость вторичных изомеров тем больше, чем ближе гидроксильная группа к середине цепи молекулы. Наиболее растворимые в воде спирты вместе с тем лучше всего растворяют воду. С повышением температуры растворимость спиртов в воде снижается, но растворимость воды в спиртах увеличивается. Исключением из этого правила является третичный изомер. [c.222]
Исключением из этого правила является третичный изомер. [c.222]
В зависимости от концентрации едкого натра эта реакция протекает с различной скоростью, причем образуются легко растворимые в воде соли сульфокислот и поваренная соль [c.383]
Аскорбиновая кислота — самый нестойкий из всех витаминов. Под действием тепла она быстро разлагается, так что в хорощо проваренных продуктах ее остается очень немного. Кроме того, она растворима в воде. (Из всех витаминов, о которых мы до сих пор говорили, аскорбиновая кислота — первый водорастворимый вита- [c.191]
Также легко реагируют с окисью этилена меркаптаны. Так, додецил-меркаптан с 5 молями окиси этилена в присутствии метилата натрия образует растворимый в воде продукт, обладающий хорошими капиллярными свойствами. [c.194]
Чистый 100%-ный хлоргидрин представляет собой бесцветную, хорошо растворимую в воде жидкость, кипящую при 128,7° (760 мм рт.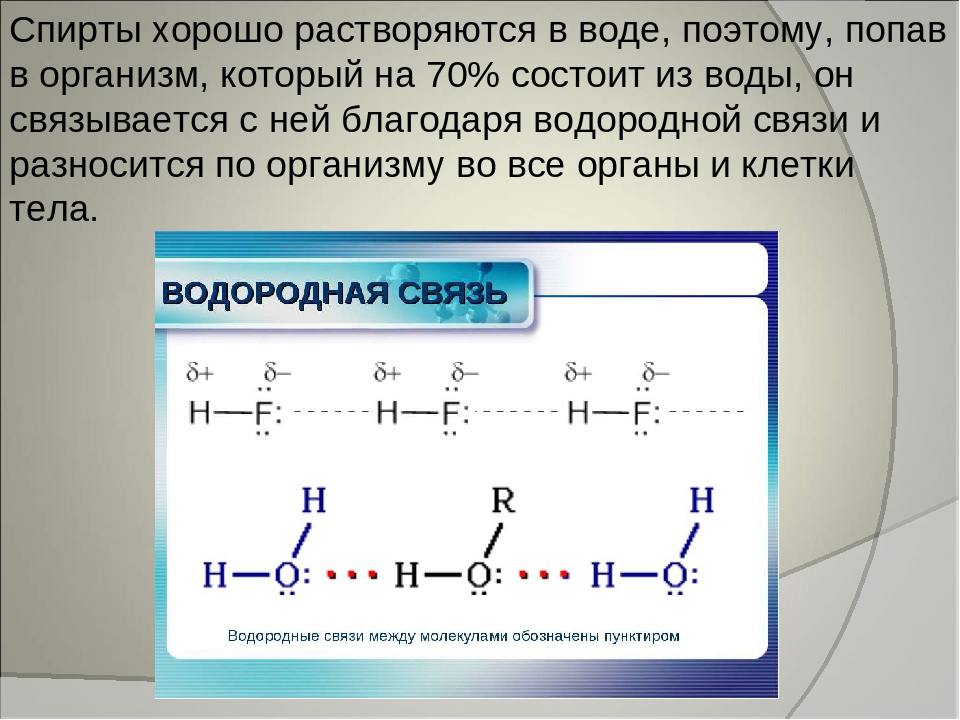 ст.). Простейший способ его получения заключается в том, что газообразные окись [c.183]
ст.). Простейший способ его получения заключается в том, что газообразные окись [c.183]
В качестве катализаторов при получении галоидалкилов из спиртов применяют концентрированную серную кислоту, хлористый магний или хлористый цинк. Можно применять также хлористое железо и другие не растворимые в воде хлориды многовалентных металлов от хрома до висмута, как, например, олова или меди. [c.193]
Если, -наоборот, подкислять раствор щелочной соли иитропарафина, го происходит постепенное превращение ациформы в нейтральную форму. Этот процесс, как показал А. Голлеман [14], можно проследить измерением проводймости раствора. Псевдокислота ие дает цветной реакции с хлорным железом, тогда как ациформа вызывает тотчас же коричнево-красное окрашивание, характерное для энольной формы. Ациформа значительно лучше растворима в воде, чем нейтральная форма, и при прибавлении щелочей тотчас же растворяется в воде, так как при этом происходит моментальная реакция нейтрализации, не требующая перегруппировки. Ациформа нитропарафинов быстро присоединяет бром, В то время как псевдоформа реагирует только медленно. [c.268]
Ациформа нитропарафинов быстро присоединяет бром, В то время как псевдоформа реагирует только медленно. [c.268]
Соли высокомолекулярных сульфокислот, получаемые в результате сульфохлорирования парафиновых углеводородов и щелочного омыления сульфохлоридов, гигроскопичны, т. е., находясь на воздухе, они поглощают влагу и постепенно растекаются, превращаясь в продукты, похожие на консистентные смазки. Соли сульфокислот, получаемые из. высокомолекулярных парафиновых углеводородов, обладают также прекрасной растворимостью в воде. Исследование растворимости и гигроскопичности химически индивидуальных синтетически полученных натриевых солей изомерных сульфокислот позволяет установить следующее. [c.414]
Амины, полученные восстановлением продуктов нитрования без предварительного отделения нейтрального масла, могут быть легко от него освобождены это достигается обработкой аминов рассчитанным количеотвом соляаой или серной кислоты и извлечением полученных солей аминов разбавленным метанолом при встряхивании.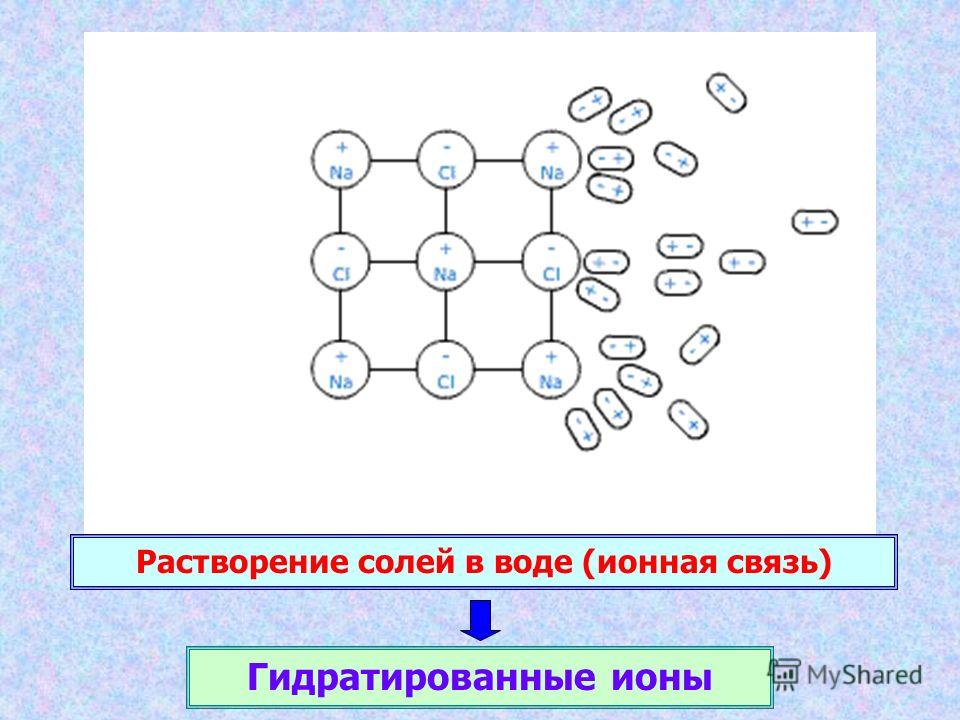 Избыток минеральной кислоты вызывает выделение солей аминов из водных растворов в виде масел. Эти масла растворимы в углеводородах и эмульгируют их при прибавлении воды. Соли аминов с органическими кислотами также растворимы в воде при избытке кислоты. Высокомолекулярные амины могут быть превращены в алкилированные аминокислоты действием хлоркарбоновых кислот. Особенно просто получают алкиламиноуксусные кислоты. В виде натриевых солей при подходящей длине алкильной группы они обладают прекрасными моющими свойствами [c.346]
Избыток минеральной кислоты вызывает выделение солей аминов из водных растворов в виде масел. Эти масла растворимы в углеводородах и эмульгируют их при прибавлении воды. Соли аминов с органическими кислотами также растворимы в воде при избытке кислоты. Высокомолекулярные амины могут быть превращены в алкилированные аминокислоты действием хлоркарбоновых кислот. Особенно просто получают алкиламиноуксусные кислоты. В виде натриевых солей при подходящей длине алкильной группы они обладают прекрасными моющими свойствами [c.346]
При действии на сульфамиды смеси формальдегида с бисульфитом образуются растворимые в воде соединения по реакции [c.141]
Сырой формальдегидпый раствор содержит около 20—25% формальдегида, от 10 до 20% летучих кислородсодержащих соединений, как ацетальдегид, ацетали, метиловый спирт, ацетон, а также высокомолекулярные, растворимые в воде оксндаты, как гликоль, глиоксаль и т. п. От летучих соединений раствор освобождается нагревом под давлением порядка 0,7 ат (рис. 87). Остаток продувают паром под давлением около 3 ат, при этом [c.154]
87). Остаток продувают паром под давлением около 3 ат, при этом [c.154]
Триэтиленгликолъ. Трпэтиленгликоль представляет собой бесцветную, легко растворимую в воде, вязкую жидкость. Он применяется в качестве тормозной жидкости, для осушки газов, особенно природного нефтяного газа [261, и служит для дезинфекции воздуха в больницах, театрах, концертных залах и т. п., так как уже в малых концентрациях обладает сильным стерилизующим действием [27]. Эфиры триэтиленгликоля и монокарбоно-вых кислот являются превосходными пластификаторами. Известны 2-этил-масляный эфир триэтиленгликоля под названием флексол ЗОН и смесь эфиров триэтиленгликоля и смеси жирных кислот с 6—10 атомами С из кокосового масла под названием пластификатора ЗС. На рис. 114 приведены основные направления использования триэтиленгликоля. [c.190]
Марка полигликоля Средиий молекулярный нес Удельный вес 20/20 Температура замерзания, °С Растворимость в воде, % Температура вспышки, С pfi 5%-1ЮГ0 водного растьора [c.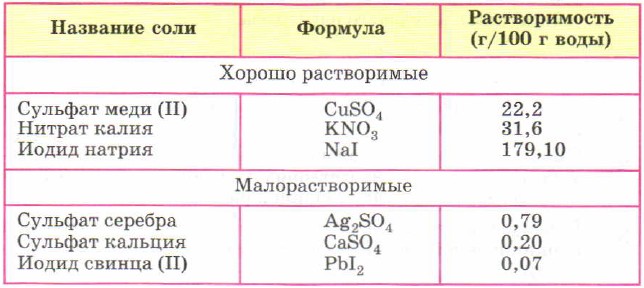 191]
191]
Сырье для лаков метилцеллюлоза, желатина, декстрин, белок. Красители все красители растворимы в воде. [c.324]
Перевод молекулы высокомолекулярного алифатического углеводорода в раствор можно осуществить введением в ее состав различных гидрофильных групп. Чаще всего это достигают следующими путями вводят карбоксильную группу и нейтрализуют ее едкой щелочью (мыла) или нитруют углеводород далее нитросоединение восстанавливают в амин и получают солянокислый амин вводят гидроксильную группу и при взаимодействии ее с хлорсульфоновой кислотой получают алкилсульфаты или при взаимодействии с окисью этилена — растворимый в воде эфир алкилнолигликоля наконец, введение гидрофильной группы осуществляют действием серной кислоты на высокомолекулярные олефины или сульфохлорированием и омылением сульфохлоридной группы в сульфонатную [c.408]
Вы знаете, что если положить в воду, например, соль или сахар, они растворятся и как будто исчезнут. При этом происходит вот что твердые частицы соли или сахара распадаются на отдельные молекулы (или части молекул — ионы), которые потом полностью перемешиваются с водой. Поэтому говорят, что соль и сахар растворимы в воде. [c.32]
При этом происходит вот что твердые частицы соли или сахара распадаются на отдельные молекулы (или части молекул — ионы), которые потом полностью перемешиваются с водой. Поэтому говорят, что соль и сахар растворимы в воде. [c.32]
Ненасыщенные сульфоны гидрированием могут быть превращены в насыщенные соединения, растворимые в воде и являющиеся одновременно селективными растворителями [c.258]
Олеиловый спирт с 15 молями окиси этилена образует растворимый в воде полигликолевый эфир, 30%-ный раствор которого под названием лео-нил О применяется для мойки шерсти. Продукт оксиэтилирования стеарило-вого спирта 20 молями окиси этилена под названием эмульфор С применяется для изготовления эмульсий для промывки шерстяной пряжи. [c.193]
Натриевые соли сульфиновых кислот легко растворимы в воде. По своим капиллярно-активным свойствам натриевые соли сульфиновых кислот высокомолекулярных парафиновых углеводородов в ряде [c. 388]
388]
Авторы далее указывают, что при обработке этого продукта водным раствором едкой щелочи получается многоатомный спирт, который содержит большое число гидроксильных групп, поэтому он становится растворимым в воде. [c.358]
Под смачивающим действием понимают способность какого-нибудь растворимого в воде капиллярно-активного вещества ускорять проникновение в хлопчатобумажную ткань воды в результате снижения ее поверхностного натяжения. Эта способность характеризуется концентрацией смачивающего вещества в г/л воды, при которой специальный хлопчатобумажный лоскут диаметром примерно 30 мм тонет в растворе за 120 сек. Если такой хлопчатобумажный лоскут положить на поверхность дистиллированной воды, то часто приходится ждать часами пока он потонет. [c.410]
При взаимодействии алифатических сульфохлоридов с фенолами по типу реакции Шоттен-Баумана получают не растворимые в воде соединения. [c.384]
Первичные и вторичные нитропарафины образуют со щелочами растворимые в воде соли, тогда как третичные нитропарафины со щелочами не реагируют. Благодаря этому свойству можно отделить первичные и вторичные нитропарафины от третичных. [c.267]
Благодаря этому свойству можно отделить первичные и вторичные нитропарафины от третичных. [c.267]
Вторым независимым процессом депТм яриаации при коррозии в оредах с растворимой в воде СО2 является деполяризация свободными ионами гидроксония по схеме . - [c.11]
В результате омыления сульфсхлоридов раствором едкого натра они превращаются в натриевые соли сульфокислот й стано-вятсз растворимыми в воде и могут быть отделены от нейтрального масла [c.376]
Если же для реакции брать фенолы, содержащие сульфогруппы или карбоксильные группы, то получают продукты, растворимые в воде, или щелочи [c.384]
Если высокомолекулярный углеводород (в результате введения в состав его гидрофильной группы, придающей ему растворимость в воде) перевести в водный раствор, то в зависимости от величины мо екулы исходного углеводорода и характера гидрофильной группы раствор в большей или меньшей мере приобретает капиллярно-активные свойства. Это значит в таком растворе значительно снижается поверхностное натяжение воды, что внешне проявляется в сильном ценообразовании. [c.408]
Это значит в таком растворе значительно снижается поверхностное натяжение воды, что внешне проявляется в сильном ценообразовании. [c.408]
Полигликоли. Гликоли еще более высокого молекулярного веса, чем триэтиленгликолъ, представляют собой или бесцветные жидкости или соединения парафинообразного вида. Они растворимы в воде и могут применяться в качестве смазочных масел, в косметической и фармацевтической промышленности и как вспомогательные материалы в текстильной и бумажной промышленности. [c.191]
Соотношение количеств трех этаноламинов в продуктах реакции зависит от молярного отношения окиси этилена к аммиаку [30]. При большом избытке аммиака в продуктах реакции преобладает моноэтаноламин. Разделение трех этаноламинов производится перегонкой и ректификацией. Все они легко растворимы в воде. Их важнейшие физические свойства приведены в табл. 82. [c.194]
Наиболее важными в промышленном отношении путями переработки высокомолекулярных парафиновых сульфохлоридов до сих пор являются омыление щелочами с образованием растворимых в воде солей сульфокислот, обладающих прекрасными смачивающими, моющими и эмульгирующими свойствами далее получение эфиров при взаимодействии фенолов с алифатическими спиртами с образованием лрильных или алкильных эфиров сульфокислот, являющихся очень хо- [c.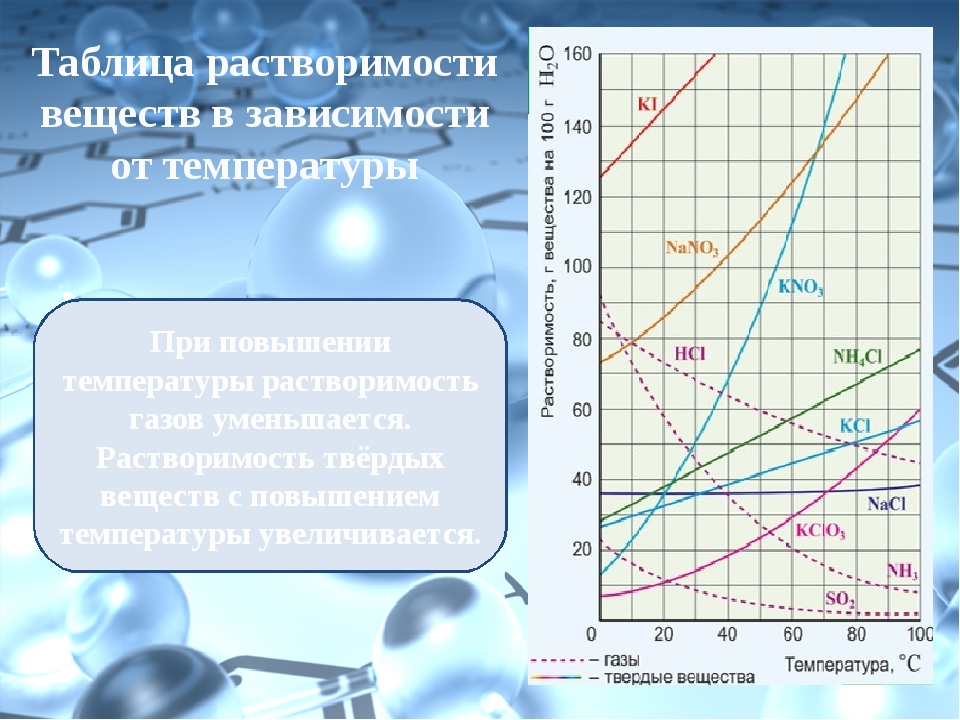 407]
407]
Не растворимые в воде ариловые эфиры алкилсульфокислот представляют собой масла, являющиеся прекрасными растворителями для различных синтетических продуктов (пластмасс), как, например, в большом количестве для игелита. При достаточной длине алкильной цепи, обеспечивающей малую летучесть эфира, их можно с успехом применять в качестве пластификатора вместо трикрезилфосфата и других веществ. [c.384]
Для сульфохлорирования в промышленном масштабе, как это было детально рассмотрено выше, можно применять только продукты синтеза по Фишеру и Тропшу, т. е. когазины I и II и их фракции. Наибольший интерес до сих пор представляет сульфохлорирование когазина II (смесь углеводородов с пределами выкипания 230—320°), так как из сульфохлоридов с этой величиной молекулы при омылении щелочами получают растворимые в воде соли сульфокислот, которые обладают очень хорошими смачивающими и моющими свойствами и которые в широких масштабах используют в качестве сырья для производства моющих веществ..jpg.7c6732d7dd929c1bbec35c4ee7b548b4.jpg) [c.399]
[c.399]
Сульфохлорид перерабатывают в смеси с нейтральным маслом и только 1П0сле этого отделяют последнее. Это возможно, если после переработки продукт реакции становится растворимым в воде или же с таким трудом подвергается омылению, что нейтральное масло может быть удалено перегонкой с острым водяным паром, а при известных условиях в вакууме. [c.404]
Растворимые в воде или в щелочах продукты реакции высокомолекулярных сульфохлоридов с фенол- или нафтолсульфокислотами или карбоновыми кислотами можно применять в качестве эмульгаторов или заменителей мыла. [c.384]
Общая химия (1987) — [
c.76
,
c.453
]
Справочник азотчика (1987) — [
c.0
]
Производство хлора, каустической соды и неорганических хлорпродуктов (1974) — [
c.28
,
c. 339
339
]
Справочник азотчика Том 1 (1967) — [
c.60
,
c.61
,
c.296
,
c.297
]
Идентификация органических соединений (1983) — [
c.120
]
Справочник химика Том 3 Изд.2 (1965) — [
c.0
,
c.316
,
c.319
]
Справочник инженера — химика том первый (1969) — [
c.384
,
c.389
]
Справочник по аналитической химии (1979) — [
c.68
]
Справочник по аналитической химии (1975) — [
c.70
]
Аналитическая химия никеля (1966) — [
c.21
,
c.22
]
Справочник по английской химии (1965) — [
c.70
]
Краткий инженерный справочник по технологии неорганических веществ (1968) — [
c.0
]
Производство хлора и каустической соды (1966) — [
c.241
]
Справочник азотчика Издание 2 (1986) — [
c.32
,
c.33
]
Справочник по аналитической химии Издание 4 (1971) — [
c.70
]
Технология соды (1975) — [
c.205
,
c.269
]
Справочник сернокислотчика 1952 (1952) — [
c.58
,
c.102
]
Справочник сернокислотчика Издание 2 1971 (1971) — [
c.13
,
c.14
,
c.50
,
c.74
,
c.141
]
Очистка технических газов (1969) — [
c.63
,
c.75
,
c.91
,
c.92
]
Краткий справочник по минеральным удобрениям (1977) — [
c.0
]
Систематический качественный анализ органических соединений (1950) — [
c.69
]
Справочник по производству хлора каустической соды и основных хлорпродуктов (1976) — [
c.0
]
Инженерный справочник по технологии неорганических веществ Графики и номограммы Издание 2 (1975) — [
c.0
]
Краткий справочник химика Издание 4 (1955) — [
c.34
,
c.57
,
c.121
,
c.260
,
c.333
]
Основы общей химии Т 1 (1965) — [
c.165
]
Справочник азотчика Т 1 (1967) — [
c.60
,
c.61
,
c.296
,
c.297
]
Справочник по разделению газовых смесей (1953) — [
c.193
,
c.194
,
c.195
,
c.196
,
c.200
,
c.201
]
Справочник химика Том 3 Издание 2 (1964) — [
c.0
]
Основы общей химии том №1 (1965) — [
c.165
]
Справочник химика Изд.2 Том 3 (1964) — [
c.0
,
c.316
,
c.319
]
Химия окружающей среды (1982) — [
c.0
]
Растворимость некоторых газов в воде (аргона, метана, этилена, этанола, углекислого газа, диоксида углерода, хлорина, водорода, сероводорода , гелия, азота, аммиака, кислорода, диоксида серы).
Растворимость некоторых газов в воде (аргона, метана, этилена, этанола, углекислого газа, диоксида углерода, хлорина, водорода, сероводорода , гелия, азота, аммиака, кислорода, диоксида серы).
Зависимость растворимости в воде при давлении в одну атмосферу (101.325 кПа) и разных значениях температур показана на графиках ниже:
Растворимость Аргона -Ar- в воде (г газа на кг воды).
Растворимость Метана -CH4— в воде (г газа на кг воды).
Растворимость Этилена -C2H4— в воде (г газа на кг воды).
Растворимость Этанола -C2H6— в воде (г газа на кг воды).
Растворимость Монооксида углерода (Углекислого газа) -CO- в воде (г газа на кг воды).
Растворимость Диоксида углерода -CO2— в воде (г газа на кг воды).
Растворимость Хлорина -Cl2— в воде (г газа на кг воды).
Растворимость Водорода -H2— в воде (г газа на кг воды).
Растворимость Сероводорода -H2S- в воде (г газа на кг воды).
Растворимость Гелия -He- в воде (г газа на кг воды).
Растворимость Азота -N2— в воде (г газа на кг воды).
Растворимость Аммиака -NH3— в воде (г газа на кг воды).
Растворимость Кислорода -O2— в воде (г газа на кг воды).
Растворимость Диоксида серы -SO2— в воде (г газа на кг воды).
Экспериментирование . Растворимость в воде | План-конспект занятия (подготовительная группа) на тему:
КОНСПЕКТ
непосредственной образовательной деятельности воспитателя с детьми подготовительной группы по экспериментированию воспитателя группы № 6 ГБДОУ детсад № 97 Бурлаковой Елены Семеновны
Цель образовательной деятельности : дать детям знания о растворимых и нерастворимых в воде веществах, дать начальное понятие о химической реакции (превращение одних веществ в другие) развивать у детей логическое мышление, память, внимание, познакомить с нетрадиционными методами художественно — продуктивной деятельности
Интеграция образовательных областей: речевое развитие, художественно – эстетическое развитие, физическое развитие
Развивающая среда: Четыре пластиковых стаканчика с питьевой водой, емкость с лимонной кислотой (порошок), краски, кисточка, пластиковая ложка, емкость с жидким мылом, маленький стаканчик на каждого ребенка, емкость с содой, емкость с песком, емкость с глиной, емкость с солью, емкость с сахаром на двух детей ( на парту), листы бумаги (две половинки альбомного листа на каждого ребенка), утюг, раствор уксуса .банка с игрушечными овощами у воспитателя.
Содержание образовательной деятельности.
Вводная часть Дети сидят за партами. Перед ними стаканчики с водой и различные материалы (смотри «Развивающая среда») Спрашивает детей, какие свойства воды им известны (нет вкуса, цвета, запаха) Дети рассматривают, нюхают, пробуют воду Воспитатель сообщает детям, что сегодня пойдет речь о растворимости воды ,рассказывает о понятии « раствор»,говорит, что в результате растворения не появляется новое вещество.
1 Растворение соли и сахарного песка Воспитатель задает детям вопросы о растворимости соли и сахарного песка, предлагает растворить ложечку соли и сахара в воде (каждое вещество в отдельном стакане) Дети проводят опыт Выясняется, что соль и сахар растворились в воде без остатка и теперь, чтобы узнать , где какой раствор ,необходимо его попробовать, что дети и делают.
2 Растворение уксуса Воспитатель рассказывает детям, что уксусная кислота (уксус) очень хорошо растворяется в воде, говорит, что это широко используется в домашних заготовках. Воспитатель демонстрирует детям стеклянную баночку с водой с игрушечными овощами. Наливает в баночку уксус, который растворяется в воде, цвет воды не меняется Дети отмечают, что опять изменился только вкус воды. но пробовать в данном случае не безопасно
3 Растворение глины и песка Воспитатель задает детям вопросы о растворимости песка и глины. Дети предполагают возможный результат, затем растворяют песок и глину в стаканчиках с соленой и сладкой водой, убеждаются в том, что глина и песок не растворяются в воде Воспитатель предлагает пофантазировать ,что было бы, если бы песок растворялся в воде (его бы не было бы в нашей песочнице после первого дождя)
4 Физминутка Рыбки плавали, ныряли в чистой голубой воде (соответствующие движения руками) То сожмутся (сжимаем руки в кулаки),разожмутся(разжимаем кулаки),то зароются в песке (круговые движения руками)
5 Растворение мыла в воде Воспитатель предлагает детям подумать о растворимости мыла и других моющих средств в воде дети рассуждают о том, как происходит процессы умывания, мытья посуды, стирки белья Дети приходят к выводу, что все моющие средства растворяются в воде После этого дети растворяют жидкое мыло в воде (третий стаканчик) и получают мыльный раствор
6 Растворение краски в воде,рисование мыльной водой Воспитатель предлагает детям вспомнить ,растворяется или нет в воде краска, дети регулярно проводят такой опыт ,когда рисуют красками и моют кисточку в стакане Воспитатель предлагает добавить краску в мыльный раствор и попробовать нарисовать красивые цветы Получаются неяркие в отличии от нарисованных красками изображения цветов .
7 Физминутка Воспитатель предлагает детям отдохнуть и поиграть в игру на внимание Он называет разные части тела, показывает их , дети повторяют. Затем воспитатель называет одну часть тела, показывает другую(специально путает детей) ,дети должны показать, то ,что воспитатель называет
8 Растворение лимонной кислоты в воде,рисование лимонной кислотой Воспитатель рассказывает детям о тайных невидимых чернилах, которыми можно писать секретные письма Увидеть, что написано можно только после того, как прогладишь бумагу очень горячим утюгом Воспитатель предлагает детям взять одну ложку лимонной кислоты9предварительно обсуждает с детьми, будет ли кислота растворяться в воде), добавить туда две ложки воды и написать на листе бумаги свое имя Дети отдают свои работы помощнику воспитателя, который проглаживает их горячим утюгом (работы должны предварительно высохнуть)
9 Химическая реакция Соединение лимонной кислоты исоды в водном растворе Воспитатель рассказывает детям, что при растворении в воде не получается новых веществ .можно выпарить воду и получить опять соль, например А вот если соединить лимонную кислоту и соду в воде, получатся новые вещества, одно из них – углекислый газ Дети проводят такой опыт(добавляют воду из 4 го стаканчика), получают «лимонад»
10 Мыльный фонтан В конце занятия воспитатель предлагает детям добавить в « лимонад» мыльный цветной раствор . Содержимое выливается из стаканчика, получается мыльный фонтан
Воспитатель демонстрирует детям мыльный фонтан в пластиковой бутылке, добавляя еще и раствор уксуса Фонтан получается более мощным, так как у бутылки узкое горлышко и содержимое более интенсивно выливается из бутылки ,чем из стакана
Воспитатель хвалит детей, предлагает вспомнить, что нового мы узнали сегодня ,предлагает поиграть в дидактическую игру Воспитатель называет различные вещества, если они растворяются в воде, дети хлопают в ладоши, если нет, то прячут руки за спину Воспитатель предлагает детям проверить свои знания в компьютерной игре « Растворение в воде» на интерактивном столе в вечернее время
Растворяющая способность воды
Способность воды растворять минеральные и органические вещества (минерализоваться) имеет чрезвычайно важное геологическое и гидрогеологическое значение.
Растворимость различных соединений в воде весьма разнообразна. Наиболее растворимы некоторые хлористые, азотнокислые и углекислые соли калия, натрия и хлористый магний. Максимальная насыщенность воды этими солями может достигнуть 50% по весу. Мало растворимы (средняя растворимость) сернокислые и еще менее углекислые соли кальция и магния. Их растворимость колеблется в пределах 0,10—0,001%. Наконец, силикаты и некоторые другие минеральные соединения растворимы в столь малом количестве, что практически их растворимость может быть принята равной нулю. Растворимость солей нарастает с повышением температуры (имеются редкие исключения из этого правила) (см. рис. 13). Растворимость газов при этом условии падает. Природная вода всегда минерализована.
Следует отметить, что нахождение в растворе некоторых веществ может либо способствовать, либо препятствовать растворению других. Так, например, если в воде уже имеется в растворе углекислота, то растворимость в такой воде углекислой извести (известняка, мела) повышается почти втрое, а растворимость сернокислого кальция не изменяется. Наличие NaCl повышает растворимость CaS04 в воде почти вчетверо, а наличие сернокислого магния понижает растворимость его до нуля. В природной воде редко встречаются предельные насыщения солями и газами.
Растворенные в воде С02 или соли типа R2C03 способствуют разложению алюмосиликатов
K2OAl2036Si02 + C02+10Н20 = К2С03 + 4Si(OH)4 + 2H2ОAl2032Si02.
Ортоклаз Каолин
Растворимость солей в воде (кг/л воды)
Соли | Температура, °C | |
0 | 100 | |
КС1 | 0,29 | 0,60 |
NaCl | 0,35 | 0,40 |
K2S04 | 0,10 | 0,26 |
Na2S04 | 0,05 | 0,42 (50°—0,50) |
KN03 | 0,13 | 2,36 |
СаСОз | 0,00018 | — |
FeC03 | 0,0007 | — |
MnC03 | 0,0005 | — |
CaS04 | 0,0019 | 0,0017 (40°—0,00) |
FeS04 | 0,6 | 3,30 |
Mg(OH)2 | 0,0002 | Нерастворимые |
MgS04 | 0,27 | 0,74 |
MgC03 | 0,0001 | 0,001 |
BaC03 | 0,00007 | 0,00006 |
BaS04 | 0,000002 |
|
Растворимость газов в воде (см
3/мл воды)
Температура, °C | N | H | О | Воздух | H2CО3 | СО2 | H2S | NH3 |
0 | 0,20 | 0,019 | 0,041 | 25 | 1,20 | 32 | 4,37 | 1,049 |
10 | 0,16 | 0,019 | 0,032 | 20 | 1,18 | 26 | 3,59 | 0,812 |
20 | 0,14 | 0,019 | 0,028 | 17 | 0,90 | 23 | 2,90 | 0,654 |
Растворенный в воде воздух богаче кислородом, чем воздух атмосферы. В его составе 33,7% кислорода и 66% азота.
Растворимость — обзор | Темы ScienceDirect
КОЭФФИЦИЕНТЫ РАСТВОРИМОСТИ
Растворимость твердых веществ описывается в терминах данного числа молей или миллимолей растворенного вещества, которое растворяется в 1 литре растворителя, но для газов на практике это намного проще выразить. количество с точки зрения его объема, как в предыдущих примерах. Объем газа, однако, имеет точное значение только в том случае, если указаны давление и температура, а для научной работы объем газа обычно корректируется до s.т. п. Поэтому физики используют коэффициент растворимости, известный как коэффициент растворимости Бунзена, который использует такую поправку.
Коэффициент растворимости Бунзена — это объем газа, скорректированный до s.t.p., который растворяется в одной единице объема жидкости при соответствующей температуре, где парциальное давление газа над жидкостью составляет одно стандартное атмосферное давление.
Коэффициент Бунзена обычно приводится в научных таблицах и учебниках, но в анестезиологической практике предпочтительным является другой коэффициент растворимости.Это известно как коэффициент растворимости Оствальда.
Коэффициент растворимости Оствальда — это объем газа, который растворяется в одной единице объема жидкости при данной температуре.
В данном случае объем газа не корректируется по стандартной температуре и давлению, а вместо этого измеряется при известных температуре и давлении.
Практическое преимущество коэффициента растворимости Оствальда заключается в том, что он не зависит от давления.
Рисунок 6.6 иллюстрирует эту независимость от давления. Слева находится давление азота 100 кПа (1 бар) над поверхностью 1 литра воды. Азот в объеме 0,016 литра при таком давлении растворяется в воде. Справа давление азота над водой составляет 200 кПа (2 бара). Посмотрим, что происходит. Согласно закону Генри количество растворенного газа пропорционально давлению, поэтому в воде справа в два раза больше азота, т.е.е. 0,032 литра при давлении 100 кПа. Но если бы этот объем был измерен при атмосферном давлении 2 бара, он был бы уменьшен вдвое, то есть до 0,016 литра (закон Бойля). Следовательно, объем растворенного азота, измеренный при атмосферном давлении, остается постоянным, даже несмотря на то, что парциальное давление азота удваивается, а количество молекул азота в растворе также удваивается. Следовательно, коэффициент растворимости Оствальда не нужно определять в терминах давления, поскольку давление не изменяет объем, который растворяется, при условии, что объем измеряется при давлении окружающей среды.
Рисунок 6.6. На рисунке показано, что коэффициент растворимости Оствальда не зависит от давления.
Растворимость
Растворимость
Почему некоторые твердые вещества растворяются в воде?
Сахар, который мы используем для подслащивания кофе или чая, представляет собой твердое молекулярное вещество , в котором
отдельные молекулы удерживаются вместе относительно слабыми межмолекулярными силами. Когда
сахар растворяется в воде, слабые связи между отдельными молекулами сахарозы
сломаны, и эти молекулы C 12 H 22 O 11 высвобождаются в
решение.
Требуется энергия, чтобы разорвать связи между C 12 H 22 O 11
молекулы сахарозы. Также требуется энергия, чтобы разорвать водородные связи в воде, которые должны
быть нарушенным, чтобы вставить одну из этих молекул сахарозы в раствор. Сахар растворяется в
вода, потому что энергия выделяется, когда образуются слабополярные молекулы сахарозы
межмолекулярные связи с полярными молекулами воды. Слабые связи, которые образуются между
растворенное вещество и растворитель компенсируют энергию, необходимую для разрушения структуры обоих
чистое растворенное вещество и растворитель.В случае сахара и воды этот процесс работает так
хорошо, что в литре воды можно растворить до 1800 граммов сахарозы.
Ионные твердые частицы (или соли) содержат положительные и отрицательные ионы, которые удерживаются
вместе из-за сильной силы притяжения между частицами с противоположными зарядами. Когда
одно из этих твердых веществ растворяется в воде, ионы, образующие твердое вещество, выделяются в
раствор, где они становятся связанными с полярными молекулами растворителя.
| H 2 O | ||||
| NaCl ( с ) | Na + ( водн. ) | + | Класс — ( водн. ) |
В целом можно предположить, что соли диссоциируют на свои ионы, когда они растворяются в
вода.Ионные соединения растворяются в воде, если энергия выделяется при взаимодействии ионов
с молекулами воды компенсирует энергию, необходимую для разрыва ионных связей в
твердое тело и энергия, необходимая для разделения молекул воды, чтобы ионы могли быть
вставлен в раствор.
Равновесие растворимости
Обсуждения равновесия растворимости основаны на следующем предположении: Когда
твердые вещества растворяются в воде, они диссоциируют с образованием элементарных частиц, из которых они
сформированы .Таким образом, твердые молекулярные частицы диссоциируют с образованием отдельных молекул
| H 2 O | ||
| C 12 H 22 O 11 ( с ) | C 12 H 22 O 11 ( водн. ) |
и ионные твердые частицы диссоциируют с образованием растворов положительных и отрицательных ионов, которые они
содержать.
| H 2 O | ||||
| NaCl ( с ) | Na + ( водн. ) | + | Класс — ( водн. ) |
При первом добавлении соли она быстро растворяется и диссоциирует. Проводимость
поэтому раствор сначала быстро увеличивается.
| растворить | ||||
| NaCl ( с ) | Na + ( водн. ) | + | Класс — ( водн. ) | |
| диссоциировать |
Концентрации этих ионов вскоре становятся достаточно большими, чтобы обратная реакция
начинает конкурировать с прямой реакцией, что приводит к снижению скорости при
которые входят в раствор ионы Na + и Cl — .
| сотрудник | ||||
| Na + ( водн. ) | + | Класс — ( водн. ) | NaCl ( с ) | |
| осадок |
Со временем концентрации ионов Na + и Cl — становятся большими.
достаточно, чтобы скорость, с которой происходит осаждение, точно уравновешивала скорость, с которой NaCl
растворяется.Как только это произойдет, концентрация этих ионов не изменится.
время, и реакция находится в равновесии. Когда эта система достигает равновесия, она называется
насыщенный раствор , потому что он содержит максимальную концентрацию ионов, которая
может существовать в равновесии с твердой солью. Количество соли, которое необходимо добавить в
данный объем растворителя для образования насыщенного раствора называется растворимостью
соль.
Нормы растворимости
Существует ряд закономерностей в данных, полученных при измерении растворимости
разные соли.Эти шаблоны составляют основу правил, изложенных в таблице ниже.
которые могут помочь в прогнозировании растворения данной соли в воде. Эти правила
основаны на следующих определениях терминов растворимый , нерастворимый и слегка
растворимый .
- Соль растворима, если она растворяется в воде с образованием раствора с концентрацией
не менее 0,1 моль на литр при комнатной температуре. - Соль нерастворима, если концентрация водного раствора меньше 0.001 м при
комнатная температура. - Труднорастворимые соли дают растворы, которые находятся между этими крайностями.
Правила растворимости ионных соединений в воде
Растворимые соли
1. Ионы Na + , K + и NH 4 + образуют растворимых
соли .Таким образом, NaCl, KNO 3 , (NH 4 ) 2 SO 4 , Na 2 S,
и (NH 4 ) 2 CO 3 растворимы.2. Ион нитрата (NO 3 — ) образует растворимых солей . Таким образом,
Cu (NO 3 ) 2 и Fe (NO 3 ) 3 растворимы.3. Хлорид (Cl — ), бромид (Br — ) и йодид (I — )
ионы обычно образуют растворимых солей .Исключения из этого правила включают соли Pb 2+ ,
Ионы Hg 2 2+ , Ag + и Cu + . ZnCl 2 является
растворим, а CuBr — нет.4. Ион сульфата (SO 4 2- ) обычно образует растворимых солей .
Исключения включают BaSO 4 , SrSO 4 и PbSO 4 , которые являются
нерастворимые и Ag 2 SO 4 , CaSO 4 и Hg 2 SO 4 ,
которые мало растворимы.Нерастворимые соли
1. Сульфиды (S 2- ) обычно нерастворимы . Исключения включают Na 2 S,
K 2 S, (NH 4 ) 2 S, MgS, CaS, SrS и BaS.2. Оксиды (O 2- ) обычно нерастворимы . Исключения включают Na 2 O,
K 2 O, SrO и BaO, которые растворимы, и CaO, которые растворимы слабо.3. Гидроксиды (OH — ) обычно нерастворимы . Исключения включают NaOH,
KOH, Sr (OH) 2 и Ba (OH) 2 , которые растворимы, и Ca (OH) 2 ,
который мало растворим.4. Хроматы (CrO 4 2- ) обычно нерастворимы . Исключения
включают Na 2 CrO 4 , K 2 CrO 4 , (NH 4 ) 2 CrO 4 ,
и MgCrO 4 .5. Фосфаты (PO 4 3- ) и карбонаты (CO 3 2- )
обычно нерастворимы . Исключения включают соли Na + , K + ,
и ионов NH 4 + .
От чего зависит растворимость материала?
Полный вопрос: каковы условия растворимости в воде и растворим ли CH 3 NHCH 3 в воде?
Я расширю исходный вопрос и объясню концепцию растворимости в целом:
Если подумать, для любого материала в мире должен быть хотя бы один химикат, в котором он растворяется идеальным образом и в любом соотношении, которое мы выберем, и это… это химическое вещество само по себе.
Вода, конечно, растворяется в воде, соевое масло растворяется в соевом масле, парафин в парафине, ртуть в ртути и так далее. Это кажется очень очевидным, но этот факт дает начало концепции «подобное растворяется в подобном», что означает, что если материал лучше всего растворить в себе, он, скорее всего, растворился бы в подобном материале. Сходство относится к химическим свойствам материала — особенно к свойствам химических связей между атомами.
Следовательно, металлы растворяются в металлах, полярные соединения растворяются в полярных растворителях, неполярные соединения растворяются в неполярных растворителях, соединения, содержащие водородные связи, растворяются в растворителях, содержащих водородные связи, и так далее.Например: обычная поваренная соль (NaCl), которая является ионным / полярным соединением, растворяется в воде, которая является полярной, но не в кулинарном масле, неполярном соединении. С другой стороны, другие виды масла растворимы в кулинарном масле, а вода — нет.
В процессе производства алюминия оксид алюминия (Al 2 O 3 , ионное соединение) растворяется в расплавленном криолите (Na 3 AlF 6 , другое ионное соединение). Ртуть, металл, находящийся в жидком состоянии при комнатной температуре, может растворять медь и золото, другие типы металлов.
Меркурий (заимствовано из Википедии)
Конечно, с молекулами, которые образуют разные типы связей, дела обстоят сложнее. Например, спирты содержат полярную область, которая образует водородные связи (-ОН) и неполярную углеродную основу. Следовательно, растворимость спиртов в воде определяется длиной неполярной углеродной основной цепи — чем она длиннее, тем менее растворим спирт. Питьевой алкоголь (этанол) содержит короткую основную цепь из 2 атомов углерода и поэтому растворяется в воде в любом соотношении.Напротив, пантенол (также известный как провитамин B5 , ингредиент многих шампуней) содержит основную цепь из 5 атомов углерода и, таким образом, лишь частично растворяется в воде, в то время как спирты с более длинной основной цепью из 20 атомов углерода. , практически не растворимы в воде.
Вы конкретно спросили о растворимости метиламина (CH 3 NHCH 3 (. Это полярная молекула, не имеющая длинных углеродных цепей. Азотно-водородная группа позволяет образовывать водородные связи с водой, поэтому метиламин довольно хорошо растворяется в воде.
Доктор Ави Сайг
Институт естественных наук Дэвидсона
Научный институт Вейцмана
Примечание для читателя
Если вы сочтете эти объяснения недостаточно ясными или у вас есть дополнительные вопросы по этой теме, напишите об этом на нашем форуме, и мы ответим на ваши комментарии. Ваши предложения и конструктивная критика всегда приветствуются.
Наука о растворимости: много ли слишком много?
Ключевые концепции
Химия
Собственность материи
Решения
Растворимость
Введение
Вы когда-нибудь добавляли в чай ложку сахара и задавались вопросом, почему он исчез? Куда оно делось? На самом деле сахар не исчез — он превратился из твердой формы в растворенную в процессе, называемом химическим растворением.В результате получается чайно-сахарный раствор, в котором отдельные молекулы сахара равномерно распределяются в чае. Но что произойдет, если вы увеличите количество сахара, которое добавляете в чай? Он все еще растворяется? В этом упражнении вы узнаете, сколько соединения слишком много для растворения.
Предпосылки
Химия изучает материю и то, как она ведет себя и взаимодействует с другими видами материи. Все вокруг нас состоит из материи, и вы можете исследовать ее свойства, используя обычные химические вещества в вашем доме.Его поведение называется свойством материи. Одно важное свойство называется растворимостью. Мы думаем о растворимости, когда растворяем что-то в воде или другой жидкости. Если химическое вещество растворяется в воде, оно растворяется или исчезает, когда вы добавляете его в воду. Если он нерастворим или нерастворим, он не растворяется, и вы все равно будете видеть, как он плавает в жидкости или на дне контейнера.
Когда вы растворяете растворимое химическое вещество в воде, вы делаете раствор.В раствор добавляемое вами химическое вещество называется растворенным веществом, а жидкость, в которой он растворяется, называется растворителем. Растворимость соединения зависит от его физических и химических свойств. Чтобы химическое вещество могло растворяться, оно должно взаимодействовать с растворителем. В процессе химического растворения связи, которые удерживают растворенное вещество, должны быть разорваны, и должны образоваться новые связи между растворенным веществом и растворителем. Например, при добавлении сахара в воду молекулы воды (растворителя) притягиваются к молекулам сахара (растворенного вещества).Когда притяжение становится достаточно большим, вода может втягивать отдельные молекулы сахара из объемных кристаллов сахара в раствор. Обычно количество энергии, необходимое для разрыва и образования этих связей, определяет, является ли соединение растворимым или нет.
Обычно количество химического вещества, которое вы можете растворить в определенном растворителе, ограничено. В какой-то момент раствор становится насыщенным. Это означает, что если вы добавите больше соединения, оно больше не будет растворяться и останется твердым.Это количество зависит от молекулярных взаимодействий между растворенным веществом и растворителем. В этом упражнении вы исследуете, сколько различных соединений вы можете растворить в воде. Как вы думаете, в чем разница между сахаром и солью?
Материалы
- Дистиллированная вода
- Мерная чашка для измерения миллилитров
- Восемь стаканов или чашек по восемь унций каждая
- Четыре ложки
- Мерная ложка
- Английская соль (150 грамм)
- Соль поваренная (50 грамм)
- Сахар столовый (тростниковый сахар, 250 грамм)
- Пищевая сода (20 грамм)
- Весы для измерения в граммах
- Маркер
- Малярная лента
- Бумага
- Ручка
- Термометр (опция)
Препарат
- Используя маркер и малярную ленту, отметьте две чашки для каждого соединения: «поваренная соль», «столовый сахар», «пищевая сода» и «английская соль.”
- В одну чашку для поваренной соли отмерьте 50 граммов соли.
- В одну столовую чашку для сахара отмерьте 250 граммов сахара.
- В одну чашку для пищевой соды отмерьте 20 граммов пищевой соды.
- В одну чашку для английской соли отмерьте 150 граммов английской соли.
- Для каждой чашки взвесьте ее и запишите массу (вес).
- Добавьте 100 миллилитров дистиллированной воды в каждую чашку. Используйте мерную чашку, чтобы убедиться, что в каждой чашке одинаковое количество воды.Вода должна быть комнатной температуры и одинаковой для всех чашек. Вы можете использовать термометр, чтобы убедиться в этом.
Процедура
- Возьмите обе чашки с поваренной солью, которые вы пометили. С помощью мерной ложки осторожно добавьте одну чайную ложку поваренной соли на 100 миллилитров дистиллированной воды.
- Перемешайте чистой ложкой, пока вся соль не растворится. Что вы замечаете, когда добавляете в воду соль?
- Продолжайте добавлять одну чайную ложку соли в воду и каждый раз помешивать, пока соль не перестанет растворяться. Что происходит, если соль больше не растворяется?
- Повторите эти шаги с обеими чашками с надписью «Английская соль». В какой момент раствор английской соли становится насыщенным?
- Повторите действия с пищевой содой. Сколько чайных ложек пищевой соды можно растворить в воде?
- Повторите шаги с сахаром. Вы добавляли больше или меньше сахара по сравнению с другими соединениями?
- Поместите каждую из чашек с оставшимися твердыми частицами на весы и запишите массу (вес) каждой из них. Сколько каждого вещества вы употребляли?
- Вычтите измеренную массу из начальной массы (см. Раздел «Приготовление») для каждого соединения. Что разница в массе говорит вам о растворимости каждого из соединений? Какое соединение наиболее или наименее растворимо в дистиллированной воде?
- Extra: Изменится ли растворимость при использовании другого растворителя? Повторите тест, но вместо дистиллированной воды используйте медицинский спирт, растительное масло или жидкость для снятия лака в качестве растворителя. Как это повлияет на ваши результаты?
- Extra: Можете ли вы найти другие вещества или химические вещества, которые можно растворить в дистиллированной воде? Как их растворимость соотносится с растворимостью соединений, которые вы тестировали?
- Extra: Растворимость соединений также сильно зависит от температуры растворителя. Как вы думаете, можно ли растворить больше соли или сахара в горячей или холодной воде? Протестируйте, чтобы узнать!
Наблюдения и результаты
Все ли ваши протестированные соединения растворялись в дистиллированной воде? Должны были — но в разной степени.Вода в целом является очень хорошим растворителем и способна растворять множество различных соединений. Это потому, что он может взаимодействовать с множеством разных молекул. Вы должны были заметить, что сахар имеет самую высокую растворимость из всех протестированных соединений (около 200 граммов на 100 миллилитров воды), за ним следуют английская соль (около 115 граммов / 100 миллилитров), поваренная соль (около 35 граммов / 100 миллилитров) и пищевая сода ( почти 10 грамм / 100 миллилитров).
Это связано с тем, что каждое из этих соединений имеет разные химические и физические свойства, основанные на их различной молекулярной структуре.Все они состоят из разных химических элементов и образованы разными типами связей. В зависимости от этой структуры молекулам воды более или менее трудно разорвать эти связи и образовать новые с молекулами растворенного вещества, чтобы растворить их в растворе.
Очистка
Вы можете утилизировать любой из ваших растворов в раковине. После этого дайте воде течь некоторое время, чтобы правильно промыть раковину. Утилизируйте все оставшиеся твердые частицы в обычном мусоре.Вымойте руки водой с мылом.
Больше для изучения
Насыщенные растворы: Измерение растворимости, от приятелей науки
Соляная наука: как разделить растворимые растворы, от Scientific American
Наука о растворимости: Как вырастить лучшие кристаллы, от Scientific American
Science Activity для всех возрастов !, от Science Buddies
Это мероприятие предоставлено вам в сотрудничестве с Science Buddies
Границы | Водорастворимые и нерастворимые полимеры, наночастицы, нанокомпозиты и гибриды, способные удалять из воды опасные неорганические загрязнители
Введение
В настоящее время применяется несколько методов экстракции для удаления загрязняющих веществ из природной воды или сточных вод.Эти методы в основном представляют собой жидкостно-жидкостную экстракцию, адсорбцию, осаждение и другие, которые основаны на распределении двух фаз (Sincero and Sincero, 2002; Stuetz and Stephenson, 2009). Среди них наиболее развиты мембранные и адсорбционные процессы, в которых в основном используются полимерные материалы.
Различные водорастворимые полимеры коммерчески доступны или могут быть получены синтетическим путем. Обычно функциональные полимеры можно получить аддитивной полимеризацией посредством свободнорадикальной полимеризации (Rivas et al., 2003) или с помощью методов, которые обеспечивают больший контроль над молекулярной структурой, таких как радикальная полимеризация с переносом атома (ATRP) (Matyjaszewski et al., 2000; Li et al., 2005). Функциональный полимер можно идентифицировать как соединение, которое имеет функциональные группы (например, карбоновую кислоту, гидроксильные или аминогруппы), или как полимер, выполняющий определенную функцию (Rivas et al., 2011).
Функциональные полимеры могут содержать одну или несколько координационных групп, ионизируемых групп или групп с постоянным зарядом в основной цепи или боковой цепи.Те полимеры, которые содержат исключительно группы, которые образуют комплексы с металлами, такие как карбоновые кислоты, амины, амиды, аминокислоты, спирты, пиридины и другие, называются полихелатогенами (Rivas et al., 2003). Гибкость этих функциональных групп для взаимодействия с ионами металлов может быть обеспечена путем добавления спейсерных групп или увеличения расстояния функциональной группы от основной цепи. Точно так же водорастворимые полимеры могут быть гомо- или сополимерами, где при соответствующем выборе сомономеров такие свойства, как растворимость, сорбционная способность ионов металлов и селективность, могут быть улучшены или контролироваться (Rivas et al., 2011).
Затем удаление ионов металлов или металлоидов из водных источников может быть достигнуто с помощью водорастворимых полимеров, используемых в сочетании с ультрафильтрационными мембранами в методике, называемой удерживанием на основе жидкой фазы на основе полимера (LPR), которая будет описана в этом обзоре.
Водорастворимые полимеры можно превратить в нерастворимые соединения, задав точку сшивания, таким образом соединяя полимерные цепи, ведущие к полимерным смолам (см. Рисунок 1). На протяжении десятилетий было продемонстрировано, что органические смолы являются важным материалом для удержания частиц посредством ионного обмена.Некоторыми преимуществами являются механическая и химическая стабильность, высокая обменная емкость и возможность выбора лигандной группы (Загородний, 2007).
Рисунок 1 . Схема строения различных материалов на основе полимеров для адсорбционных процессов.
Полимерные матрицы смол могут быть синтетическими или биополимерными. Аналогично водорастворимым полимерам, для их использования в области удаления загрязняющих веществ тяжелых металлов из водных источников полимер должен обладать ионизируемыми группами, которые позволяют взаимодействовать с ионными частицами за счет электростатических сил или групп, способных образовывать хелат, устанавливающий координационные связи с металл.В этих случаях обычно используются полимеры, которые имеют группы, такие как сульфоновые кислоты, карбоновые кислоты, аммоний и амин, или хелатирующие агенты, такие как иминодиуксусная кислота, N-метил-D-глюкамин, амидоксим, аминофосфоновые кислоты, тиомочевина и 2- пиколиламин (Da̧Browski et al., 2004; Zagorodni, 2007; Alexandratos, 2009). Включение в полимерную матрицу части различной химической природы, например, неорганической природы, может привести к получению композиционного материала, который может проявлять новые свойства и функции.
Композиционный материал — это материал, состоящий из двух фаз разной химической природы (органической, металлической или керамической), где фаза в большей пропорции является матрицей, а наполнитель соответствует фазе в самой низкой пропорции. Когда частицы наполнителя находятся в нанометровом масштабе, то есть от 1 до 100 нм, по крайней мере, в одном измерении, полученный материал называется нанокомпозитом. Под гибридным материалом понимается материал, в котором органическая фаза (полимер) и неорганическая (например,g., оксид) смешиваются на молекулярном уровне и соответствует соединению с высокой гомогенностью, где неорганическую фазу часто получают in-situ из неорганических предшественников с помощью золь-гель процесса. Нанокомпозит характеризуется тем, что массив имеет разбросанные дискретные структурные единицы (см. Рисунок 1). IUPAC определяет гибридный материал как материал, состоящий из однородной смеси неорганических компонентов, органических компонентов или обоих типов компонентов (IUPAC, 1997). Между тем, нанокомпозит определяется как композит, в котором по крайней мере один из фазовых доменов имеет по крайней мере один размер порядка нанометров (IUPAC, 1997).Несмотря на эти различия, существует нечеткий предел определений, и разные авторы используют термины «нанокомпозит» и «гибрид» как синонимы.
Наночастицы, полимерные нанокомпозиты и гибриды для сорбции ионов металлов
Наночастицы
Благодаря достижениям в области нанонауки и нанотехнологий за последние несколько десятилетий были разработаны наночастицы различной химической природы, формы, функциональности и т. Д. Наночастицы на основе углерода (углеродные нанотрубки, графен и оксид графена), наночастицы на основе металлов и оксидов металлов (Ag , Au, Fe, TiO 2 , SiO 2 , Fe 2 O 3 , ZrO 2 , ZnO и т. Д.) и слоистые силикаты (монтмориллонит, вермикулит, каолин и др.) получили огромное развитие благодаря своим исключительным свойствам в наномасштабе (Spitalsky et al., 2010; Rhim et al., 2013; Hu et al., 2014; Liu et al. ., 2014; Kotal, Bhowmick, 2015). Наноматериалы, которые будут использоваться в качестве адсорбентов, интересны тем, что они обладают большой удельной площадью, высокой реакционной способностью, быстрой кинетикой и удельным сродством к различным загрязняющим веществам (Zhang et al., 2016). Например, углеродные нанотрубки (УНТ) состоят из листов графена, свернутых в трубчатую форму, и в соответствии с синтетическим методом могут быть получены одностенные углеродные нанотрубки (ОСУНТ) или многослойные углеродные нанотрубки (МУНТ) (Spitalsky et al., 2010). УНТ известны своими исключительными механическими и электрическими свойствами, а также высокой химической и термической стабильностью. Чтобы использовать в качестве сорбента ионов металлов, графеновые слои должны быть окислены для введения кислородсодержащих функциональных групп, которые увеличивают сорбционную емкость углеродного материала, и, таким образом, УНТ были изучены на предмет их способности адсорбировать Cu (II). , Pb (II), Cd (II), Co (II), Cu (II), Zn (II), Mn (II), Ni (II) и Hg (II) (Li et al., 2003; Chen and Wang, 2006; Stafiej and Pyrzynska, 2007).Кроме того, функционализированные УНТ были синтезированы для повышения сорбционной способности или для обеспечения селективности адсорбции, например, соединения на основе амина могут быть прикреплены к поверхности нанотрубок для сорбции Cu (II) и Pb (II) (Zang et al. , 2009; Vuković et al., 2011; Chen et al., 2017; Singha Deb et al., 2017), и соединение на основе тиола может быть использовано для сорбции Hg (II) из-за высокого сродства ртути к сере. соединения (Bandaru et al., 2013; Hadavifar et al., 2014; Singha Deb et al., 2017). Между тем, среди прочих также могут быть использованы другие фрагменты, такие как иминодиуксусные группы (Cui et al., 2012), гуминовая кислота (Côa et al., 2017) и циклодекстрины (Hu et al., 2010). С другой стороны, графен состоит из одного слоя углерода, расположенного гексагонально, что обеспечивает исключительную теплопроводность и электрическую проводимость благодаря π-связям. Эти характеристики поверхности не способствуют удержанию ионов металлов на ее поверхности. Однако окисление до оксида графена (GO) и добавление кислородсодержащих функциональных групп к поверхности приводит к получению материала с высокой удельной площадью с возможностью адсорбции ионов металлов.Таким образом, GO был использован для адсорбции ионов металлов, таких как Cu (II), Cd (II) и Ni (II) (Tan et al., 2015), а также U (VI) (Wang et al. ., 2016). Аналогично функционализации УНТ поверхность GO была модифицирована с помощью ЭДТА для сорбции Pb (II) (Madadrang et al., 2012) или поли (амидоамина) для Cu (II), (Zn (II), Pb ( II), сорбция Fe (III) и Cr (III) (Yuan et al., 2013).
Использование оксидов металлов в процессах адсорбции привлекательно из-за их амфотерного характера вместе с их свойствами на наноразмерном уровне (большая площадь поверхности и высокая активность за счет эффекта размерного квантования) (см. Таблицу 1).Материалы, которые становятся привлекательными наноматериалами для очистки сточных вод, включают оксиды железа, оксиды алюминия, оксиды марганца, оксиды титана, оксиды магния и оксиды церия, которые являются наиболее изученными материалами (Hua et al., 2012). Железо — элемент в большом количестве на Земле, и при его легком извлечении можно получить недорогие адсорбенты оксида железа. Гетит (α-FeOOH) (Триведи и др., 2001; Gerth, 2005; Xu et al., 2006; Брюммер и др., 2013), гематит (α-Fe 2 O 3 ) (Jeon et al. ., 2004; Grover et al., 2012; Ahmed et al., 2013) и маггемита (γ-Fe 2 O 3 ) (Ahmadi et al., 2014; Chávez-Guajardo et al., 2015; Madrakian et al., 2015; Rajput et al. , 2017) являются примерами оксидов железа, используемых для сорбции ионов металлов.
Несмотря на выгодные свойства наноматериалов, их применение в крупномасштабных процессах адсорбции сталкивается с рядом препятствий, особенно в проточных системах, таких как колонна с неподвижным слоем или реактивный барьер (Zhang et al., 2016). Присущая им склонность к агломерации, возможное выщелачивание наночастиц в очищенных стоках, их отделение от очищенной воды и перепады давления — технические проблемы, которые трудно преодолеть. Эффективным решением этих технических проблем является иммобилизация наноматериала на более крупных частицах, таких как активированный уголь, частицы кремнезема и полимеры (Zhao et al., 2011).
Синтез нанокомпозитов и гибридов
Причиной смешивания соединений различной химической природы является синергизм, который может быть получен от веществ с разными свойствами (например,g., полимер и оксид металла) только в одном материале. Во-первых, включение неорганического нанонаполнителя (или наночастиц на основе углерода) в полимерную матрицу обеспечивает улучшение механических и термических свойств материала, или добавление наночастиц (например, УНТ, графена и т. Д.) Придает ему электрическую проводимость. полимер (Spitalsky et al., 2010; Kotal, Bhowmick, 2015). Для процессов адсорбции включение наночастиц в полимерную сетку может не только увеличить механическую прочность (или термическую прочность) и помочь преодолеть неблагоприятные характеристики в крупном масштабе, но также добавить новые центры адсорбции (Sarkar et al., 2011; Чжао и др., 2011). Кроме того, синтез полимера может быть адаптирован для регулирования пористости, химического состава поверхности, активных центров адсорбции, набухания и механических свойств. Следовательно, свойства полимера как адсорбента наряду с характеристиками наночастиц приводят к созданию новых композиционных материалов с превосходными характеристиками для очистки воды.
Синтез нанокомпозитных материалов может осуществляться различными способами, например: интеркалированием расплава, интеркалированием раствора и полимеризацией in-situ (Павлиду и Папаспириды, 2008).При интеркалировании расплава, хотя он считается экологически безопасным по сравнению с другими методами синтеза, условия обработки, такие как модификация используемых частиц наполнителя и добавок, улучшающих совместимость, играют важную роль в получении нанокомпозита с надлежащей дисперсией наночастиц. Однако этот процесс полезен для синтеза полиолефинового нанокомпозита, но для полимера, имеющего функциональные группы для процесса адсорбции, он может проявлять деструкцию и побочные реакции из-за температуры и сил сдвига во время смешивания.Кроме того, интеркаляция в растворе требует солюбилизации полимера и диспергирования наночастиц в подходящем растворителе. Перемешивание смеси способствует внедрению полимера между наночастицами, улучшая дисперсию и распределение наполнителя, а затем полимерный нанокомпозит получается путем удаления растворителя. Эта стратегия кажется более подходящей для получения нанокомпозита из-за более мягких условий по сравнению с интеркаляцией при плавлении; однако этот метод (вместе с интеркаляцией расплава) не позволяет получить сетчатый полимер, который обеспечивает стабилизацию композита в процессе сорбции.Методика полимеризации на месте имеет несколько преимуществ по сравнению с другими стратегиями, поскольку позволяет получать термопласты и термореактивные полимерные нанокомпозиты. Кроме того, полимеризация in-situ обеспечивает большую гибкость в синтезе, тем самым позволяя модифицировать наночастицы на поверхности соединениями, которые способствуют диспергированию или функционализации поверхности, среди прочего, для проведения реакций во время полимеризации.Кроме того, с помощью этого метода можно достичь более высокой дисперсии наночастиц и обеспечить образование сшитого полимера, вмещающего наночастицы в полимерной сети.
Получение гибридного материала, как правило, требует in-situ образования его компонентов (особенно неорганической фазы), тогда как полимер органической фазы происходит из мономеров, а неорганическая фаза может быть получена из предшественника через золь- гелевый процесс.
Золь-гель процесс происходит в более мягких экспериментальных условиях по сравнению с другими неорганическими материалами в твердом состоянии, полученным при высоких температурах; однако полученные неорганические твердые вещества обычно являются аморфными, а кристаллические фазы различимы в микроскопическом масштабе.Таким образом, золь-гель процесс становится жизнеспособной альтернативой сочетанию с полимерным материалом (Wen and Wilkes, 1996). Золь-гель процесс химически связан с поликонденсацией, в результате чего образуется трехмерная сеть, полученная в результате реакций конденсации небольших молекул. Процесс начинается с гидролиза алкоксида металла с образованием гидроксильных групп, а затем происходит конденсация гидроксильных групп с образованием трехмерной сетки и образованием остаточной алкоксидной группы.Обычно неорганические предшественники представляют собой тип M (OR) n, где M представляет собой элемент типа Si, Ti, Zr, Al, B и т.д., а R представляет собой алкильную группу (C x H 2x − 1 ). Структура и морфология образовавшейся неорганической сетки зависит от нескольких переменных, таких как природа катализатора, алкоксид, кислотность, реакционная способность металла или металлоида и т. Д. Мягкие условия реакции, которые требуются в золь-геле. Процесс вместе с широким спектром совместимых растворителей позволяет реакции полимеризации происходить до, во время или после золь-гель процесса.Таким образом, гибрид может быть получен путем i) пропитки неорганического предшественника в ранее синтезированном полимере, (ii) пропитки мономеров (или форполимеров, или полимеров) неорганическим соединением и последующей полимеризации, и (iii) посредством полимеризации реакция и одновременный золь-гель процесс (Kickelbick, 2007). В случае стратегий (i) и (ii) совместимость между фазами имеет решающее значение для достижения смеси на молекулярном уровне, и по этой причине взаимодействие оксид-полимер должно быть как можно более похожим на взаимодействия между полимерно-полимерные и оксидные.С этой целью исходные материалы могут быть функционализированы для облегчения взаимодействия между фазами с использованием реакционноспособных и инертных связующих агентов.
Сорбция ионов металлов
Полимерная матрица нанокомпозита и гибрида может содержать катионные, анионные или хелатные группы в основной цепи, и в зависимости от них нанокомпозит будет анионно-катионным ионообменником. За исключением хелатных групп, эти функции не являются специфическими для адсорбции ионов металлов, и их основная роль в нанокомпозите заключается в обеспечении доступа к ионам путем их перемещения в полимер посредством принципа исключения Доннана (Cumbal and SenGupta, 2005).Кроме того, в зависимости от природы наночастиц, соединение может проявлять специфическую сорбцию по отношению к ионам металлов за счет электростатических или лигандных взаимодействий. Полимерные носители, часто используемые для изготовления этих композитов, представляют собой сшитые полистиролом полимеры с фиксированными катионными или анионными зарядами (ионообменные смолы) с макропористой структурой, которые имеются в продаже.
Глины соответствуют типу нанонаполнителя, который широко используется и широко изучается для получения нанокомпозитов полимер-глина из-за резких изменений в таких свойствах, как механические, барьерные и воспламеняющиеся свойства полимеров.Эти соединения представляют собой естественные ионообменные материалы, которые могут быть анионами или катионообменниками, такими как двухслойный гидроксид или монтмориллонит, соответственно, а затем, помимо их усиливающих свойств, глины могут быть компонентом полимерного адсорбента для удаления Cu (II ), Pb (II) и Cd (II) (Say et al., 2006; Kaşgöz et al., 2008; Urbano and Rivas, 2012, 2014), а также оксианионы, такие как Cr (VI) (Pandey and Mishra, 2011) или As (V) (Urbano et al., 2012a, b). В этом случае добавление глин может улучшить не только сорбционные свойства полимера, но также увеличить способность к набуханию, способствуя проникновению загрязняющих веществ в полимерную сетку и механической стабильности сорбента (Zhang et al., 2005; Zheng et al., 2007).
Нанокомпозит полимер-оксид железа — один из наиболее изученных материалов для захвата ионов металлов. Оксид железа (нано) частицы считаются эффективным недорогим адсорбентом и геохимически важными из-за их взаимодействия с оксианионами и катионами (Zhang et al., 2016). Zhang et al. недавно приготовленный гидрогель на основе наночастиц водного оксида железа (HFO), впитанных в пористый поли (трансаконитовая кислота / 2-гидроксиэтилакрилат) с помощью метода осаждения на месте для сорбции Pb (II), Cu (II) ), Cd (II) и Ni (II) (Zhang, Li, 2017).В этом случае вклад наночастиц HFO заключался в увеличении сорбционной способности полимера за счет образования комплексов внутренней сферы с катионами металлов. Растворы четвертичных, тройных и бинарных ионов показали, что система проявляет большее сродство к Pb (II), а механизм сорбции — хемосорбция (Zhang and Li, 2017). Магнитная сепарация — один из многообещающих методов очистки окружающей среды, и, следовательно, введение магнитного оксида железа приводит к получению адсорбентов, способных отделяться от смеси с помощью магнитных сил.Таким образом, несколько полимерных матриц, включая синтетические и биополимеры, включают магнитный оксид железа для удаления Pb (II), Cd (II), Hg (II), Cu (II), Ni (II) и Co (II). (Zhou et al., 2009; Monier et al., 2010; Fan et al., 2013; Sekhavat Pour, Ghaemy, 2016). Загрязняющие оксианионы, такие как арсенат, арсенит, хромат и ванадат, среди прочего, адсорбируются на поверхностях (гидр) оксидов металлов, образуя стабильные монодентатные или бидентатные комплексы внутренней сферы посредством обмена лигандом с группами OH — или OH 2 (Христовски и Марковский, 2017).Среди оксианионных загрязнителей наибольшую токсичность проявляет мышьяк (органические и неорганические соединения), и его восстановление с помощью методов адсорбции и ионного обмена широко изучено. В частности, монодентатные комплексы арсенат-железо (гидр) оксид демонстрируют энергии Гиббса в диапазоне от -23 до -38 кДж / моль, тогда как у бидентатных комплексов диапазон от -11 до -55 кДж / моль, и это стабильное взаимодействие было использовано для мышьяка устранение загрязнения (Фаррелл и Чаудхари, 2013). Фактически, для сорбции мышьяка коммерчески доступны различные адсорбенты на основе (гидра) оксида железа (например,g., Bayoxide, GEH-102, NXT-2 и т. д.) (см. рисунок 2). Включение наночастиц (гидр) оксида железа в анионообменные смолы, содержащие четвертичные аммониевые группы (N + R 4 ), позволяет объединить преимущества обоих материалов; наночастицы обеспечивают стабильное взаимодействие с частицами арсенита и арсената, большую удельную поверхность и селективность, в то время как полимер обеспечивает доступ мышьяка к полимеру, ионообменное взаимодействие с арсенатом, лучшие гидравлические характеристики и т. д.Наночастицы гидратированного оксида железа (HFO) были успешно включены в катионные и анионные ионообменные смолы (DeMarco et al., 2003; Cumbal and SenGupta, 2005; Vatutsina et al., 2007; Iesan et al., 2008), демонстрируя, что анионный композитный адсорбент обеспечивает значительно более высокую способность удаления арсената по сравнению с катионитом (Cumbal and SenGupta, 2005). Ли и др. изучили эффект ограничения размера поровой структуры хозяина на адсорбцию As (V) наночастицами HFO, внедренными в анионообменные смолы (Li et al., 2016). Основные выводы заключались в том, что диаметр наночастиц уменьшался с уменьшением среднего размера пор сетчатого полимера, и это привело к увеличению сорбционной способности и лучшим характеристикам в экспериментах с колоннами с неподвижным слоем.
Рисунок 2 . Схема взаимодействия оксианионов мышьяка с поверхностью оксида металла. (A) комплексов внутренней сферы, (B) комплексов внешней сферы.
Другими оксидными наночастицами, недавно изученными на предмет их способности удерживать неорганические загрязнители, является оксид циркония.Таким образом, наночастицы ZrO 2 были диспергированы в катионообменных смолах (сульфированные) и успешно использованы для сорбции Pb (II), демонстрируя повышенную сорбционную способность по сравнению с ненагруженной смолой, а роль сульфонатных групп увеличивала диспергирование наночастиц ZrO 2 вместе с способствованием диффузии ионов Pb (II) (Zhang et al., 2013a). Точно так же сорбция ионов Cd (II) усиливается за счет включения фосфата циркония в сильный катионообменник (Jia et al., 2009). Совсем недавно была изучена способность (гидр) оксида циркония к сорбции мышьяка (Hristovski et al., 2008; Hang et al., 2012; Cui et al., 2013). Считается, что взаимодействие мышьяка с оксидом циркония более стабильно, чем наблюдаемое для оксида железа (Pan et al., 2014). Как правило, получение нанокомпозита полимер-цирконий (гидр) оксид состоит из загрузки неорганического прекурсора оксихлорида циркония (ZrOCl 2 · 8H 2 O) в полимер с последующей обработкой щелочным раствором для получения гидроксида циркония. и затем нагревание с образованием гидратированного оксида циркония.Наночастицы полимер-оксид циркония успешно применялись для сорбции As (V), As (III), Cr (VI) и фторида (Kosmulski, 2002; Mandal et al., 2013; Pan et al., 2013, 2014 ; Padungthon et al., 2014; Hua et al., 2017). Кроме того, были получены нанокомпозиты оксида титана (Borai et al., 2015; Urbano et al., 2015; Mahmoud et al., 2017) и оксида алюминия (Onnby et al., 2012; Praipipat et al., 2017). используются в качестве адсорбентов.
Гибридные материалы, в которых органическая и неорганическая фазы тщательно смешаны, могут быть получены для удаления ионов металлов.Недавно был получен гибрид катионного полимера и водного оксида циркония (Pérez et al., 2016; Toledo et al., 2018). Гибрид продемонстрировал способность непосредственно удерживать арсенит и арсенат, а сорбция различными видами мышьяка модулировалась путем изменения неорганико-полимерного состава в материале. Другой подобный гибрид был получен с использованием оксигидроксида алюминия в качестве неорганической части (Pérez et al., 2016). С другой стороны, оксианионы Cr (VI) эффективно удалялись из водного раствора с использованием адсорбента на основе желатина и кремнезема, полученного золь-гель процессом (Thakur and Chauhan, 2014).Донг и др. приготовили гибридный сорбет для удаления Cu (II) с использованием диангидрида пиромеллитовой кислоты (PMDA) и N- [3- (триметоксисилил) пропил] этилендиамина (TMSPEDA) в золь-гель реакции. Полученный гибрид проявляет способность к обмену анионов и катионов (Dong et al., 2011). Аналогичным образом сорбцию Cu (II) проводили новыми гибридными адсорбентами, содержащими тиоловые группы. Гибрид синтезировали золь-гель реакцией 3-меркаптопропилтриметоксисилана в присутствии поли (этиленгликоля) с последующим сшиванием ацетальдегидом (Zhang et al., 2013б). Одновременный процесс радикальной полимеризации / золь-гель для получения гибрида на основе сополимера поли [акриловая кислота- co -3- (триметоксисилил) пропилметакрилат] –оксида алюминия был получен для Ni (II), Cu (II), Cd ( II) и сорбция Pb (II). Синтезированный гибрид имел различное содержание 3- (триметоксисилил) пропилметакрилатекомономера, который, в свою очередь, действовал как связывающий агент, и только изменение этого соединения изменило сорбционные характеристики гибрида (Campos et al., 2015).Сорбция редкоземельных металлов, таких как La (III), Nd (III), Eu (III), Dy (III) и Lu (III) на гибридном материале, была исследована Roosen et al. Гибрид состоял из хитон-кремнеземных фрагментов и дополнительно функционализирован этилендиаминтетрауксусной кислотой (EDTA), а также диэтилентриаминпентауксусной кислотой (DTPA) (Roosen et al., 2014). Интересно отметить, что порядок сродства между ионами металлов следует тому же порядку, что соответствует константам стабильности между ионами лантаноидов и неиммобилизованным DTPA (Roosen et al., 2014).
Во-первых, мы предполагаем, что будущие направления исследований в области композитных адсорбирующих соединений должны быть сосредоточены на получении материалов с высокой удельной поверхностью, чтобы обеспечить большую площадь контакта между адсорбентом и загрязняющим веществом. Кроме того, для синтеза более стабильных композитов (механических и химических) в процессе адсорбции большее значение имеет взаимодействие между органическими и неорганическими фазами. Установив прочные связи на границе раздела органических и неорганических веществ, можно избежать потери некоторых компонентов и, как следствие, ухудшения рабочих характеристик.Во-вторых, с коммерческой точки зрения, исследования композитных адсорбентов должны быть направлены на их производство в более крупных масштабах, конкурентоспособных по сорбционной способности и эксплуатационным затратам. В настоящее время алюминий-диоксид кремния и соединение на основе железа (в качестве неорганического адсорбента) и ионообменные смолы (в качестве органических адсорбентов) широко доступны на рынке благодаря своей высокой сорбционной способности и низкой стоимости эксплуатации. Хотя некоторые составы композитных адсорбентов успешно вышли на рынок (Lewatit, Ferrix), в целом сложность этих композитных систем увеличивает стоимость, делая их менее привлекательными с точки зрения их появления на рынке.В этом смысле разработка высокоселективных адсорбентов, новой архитектуры, высокой стабильности или материалов со значительным улучшением характеристик по сравнению с существующими адсорбентами может найти нишу для своей разработки и в конечном итоге достичь их маркетинга.
Водорастворимые функциональные полимеры и мембраны: метод LPR
Метод LPR легко позволяет разделить несколько частиц (ионы металлов, металлоиды и органические загрязнители), которые связаны с водорастворимыми полимерами.В литературе сообщалось о многих применениях водорастворимых полимеров для селективного отделения или концентрирования различных ионов металлов из воды. Мембрана ультрафильтрации является наиболее подходящим фильтром для исследований LPR, и было опубликовано огромное количество данных (Sánchez and Rivas, 2011).
Большим преимуществом LPR является удержание неорганических частиц в однородной среде, что в значительной степени позволяет избежать явлений массопереноса или явлений диффузии, которые присутствуют в гетерогенной системе.Для исследований LPR полимер с высокой молекулярной массой (более 100 кДа) взаимодействует с анионами, а ультрафильтрационная мембрана удерживает новый полимер-анион. Обычно в качестве ультрафильтрационных мембран используют поли (эфирсульфон) или регенерированную целлюлозу с исключительной молекулярной массой 10 кДа, что намного ниже молекулярной массы полимера. Метод промывки аналогичен периодической системе. На ячейку наносится уникальное соотношение полимер: раствор аниона, и она промывается при постоянном объеме бидистиллированной водой при определенном pH.Процесс разделения оценивается как процент удаления [R (%)] по сравнению с коэффициентом фильтрации (Z). Коэффициент фильтрации определяется как отношение объема фильтрата (V f ) к объему ячейки (V o ) (Sánchez and Rivas, 2011).
Удаление катионов металлов
Научное сообщество заинтересовано в поиске новых методов производства качественной воды с использованием недорогих, простых в использовании и более эффективных технологий по сравнению с традиционной обработкой, такой как коагуляция и флокуляция, химическое осаждение, электрохимическая обработка, адсорбция и ионный обмен. (Асман, 2009; Chen et al., 2009; Дула, 2009; Нансеу-Нджики и др., 2009; Дуан и др., 2010; Jiang et al., 2010). Образование координационной связи или ионной связи может быть результатом взаимодействий между функциональным полимером и ионами металлов в растворе. Однако следует учитывать и более слабые взаимодействия (Rivas et al., 2011). По характеру взаимодействия полимер – ион металла можно разделить на две группы. Первая группа включает природу полимера, а вторая группа включает природу водной среды (Rivas et al., 2011).
Метод LPR с поли (2-акриламидо-2-метилпропансульфонатом натрия) (PAMPS) в качестве сорбента использовался для удаления ионов тяжелых металлов из воды. Результаты показали высокое удерживание ионов различных металлов (Rivas et al., 2001). Несмотря на эти хорошие результаты, селективность метода можно улучшить. Альтернативой для улучшения этих результатов является использование сополимера на основе AMPS с неионным мономером с более высокой тенденцией координировать один из нескольких ионов металла в растворе (Valle et al., 2015). В другом исследовании PAMPS, PVP, смесь гомополимеров и поли (VP- co -AMPS) были изучены сравнительно как сорбенты Cu (II), Cd (II) и Ni (II) методом LPR ( Валле и др., 2015).
PAMPS представляет собой гомополимер, который демонстрирует самую высокую удерживающую способность (около 60%) Cu (II), Cd (II) и Ni (II) при pH 3,2 и 5,7. Такое поведение можно объяснить электростатическим взаимодействием ионов металлов с сульфонатными группами, расположенными во внешнем положении спиральной структуры PAMPS (Liekens et al., 1997). Кроме того, сворачивание линейных полимеров с группами AMPS в своей структуре позволяет избежать электростатического отталкивания между сульфонатными группами, способствующего доступности ионов металлов (Fisher et al., 1977).
(% R) PAMPS был аналогичным при обоих значениях pH (3,2 и 5,7), что указывает на то, что протоны среды не мешают удалению металла. В исследованном диапазоне pH поведение PAMPS согласуется с pK a = 1,5, сообщенным для групп сульфоновой кислоты (Cavus and Gurdag, 2009).При обоих значениях pH профили удерживания медленно уменьшаются в зависимости от объема фильтрата. Для сравнения ПВП и ПАМПС проявляли различное поведение по отношению к ионам металлов. ПВП содержат электронодонорную амидную функциональную группу, которая действует как лиганд при комплексообразовании с ионами металлов (Valle et al., 2015). ПВП не содержит ионизируемых групп, и это позволяет в значительной степени сворачивать макромолекулярные цепи, что снижает доступ ионов металлов к ПВП по сравнению с PAMPS. Также вероятно, что амидная группа PVP может образовывать комплекс более чем с одним ионом металла, тогда как сульфонатные группы PAMPS могут образовывать комплекс с одним ионом металла.Результаты экспериментов показали, что удерживание Ni (II) достигается избирательно по сравнению с нулевым удерживанием Cu (II) и Cd (II) при обоих значениях pH с использованием PVP при pH 3,2 и 5,7. Такое поведение предполагает более адаптируемую макромолекулярную конформацию ПВП для взаимодействия с ионами никеля, вероятно, из-за его меньшего ионного радиуса по сравнению с Cd (II) и Cu (II) (Valle et al., 2015).
Сополимер по сравнению с гомополимерами показал другое поведение по отношению к ионам металлов. PAMPS продемонстрировал высокую удерживающую способность всех ионов металлов при обоих значениях pH, в то время как PVP продемонстрировал избирательное удерживание ионов никеля.С другой стороны, удерживающая способность сополимера была ниже по сравнению с PAMPS. Однако сополимер показал заметную селективность по отношению к ионам никеля, и удерживание Cu 2+ и Cd (II) увеличилось по сравнению с ПВП. Смесь ПАМПС и ПВП в растворе неэффективна для удержания исследуемых ионов металлов (Valle et al., 2015). Приготовление сополимеров может быть эффективным вариантом для регулирования селективности и максимальной удерживающей способности.
Водорастворимый полиэтиленимин [P (EI)] был изучен как сорбент для ионов металлов в водных растворах с использованием метода LPR.Метод LPR был выполнен с использованием раствора, содержащего смесь катионов металлов, таких как Cu (II), Cd (II), Co (II), Ni (II), Zn (II), Pb (II) и Cr (III). ). Удаление ионов металлов изучали в основном в зависимости от pH. Известно, что полиамины, такие как поли (этиленимин) P (EI), являются подходящими макромолекулярными лигандами для комплексообразования-ультрафильтрации ионов металлов. В целом, pH оказывает заметное влияние на удаление ионов металлов, показывая, что, когда pH увеличивается, способность удерживать ионы металлов также увеличивается (Rivas et al., 2012). Результаты взаимодействия полимера и иона металла для P (EI) были следующими: при pH 3 P (EI) проявлял селективность только для Cu (II), достигая удерживания 74%. При pH 5 удаление всех ионов металлов улучшилось, особенно в случае Cu (II), которое достигло 100%. При pH 7 удерживающие способности для всех ионов металлов были максимальными (Cd (II) 99%, Zn 2+ 98%, Cu (II) 100%, Co (II) 98% и Ni (II). 100%), за исключением Pb (II) и Cr (III), которые не удерживались. P (EI) показал самую высокую способность удерживать металл при более высоких значениях pH, когда функциональные группы могли бы легче координировать и удалять ионы металлов.Cu (II), Cd (II), Co (II), Ni (II) и Zn (II) имеют одинаковые ионные радиусы и незаполненные d -орбитали, которые необходимы для образования связи с амином полимеров. Однако Pb (II) и Cr (III) имеют более стабильную электронную структуру, предотвращающую образование комплексов (Rivas et al., 2012). Адекватный выбор водорастворимых полимеров и предыдущая оптимизация среды (pH, концентрация и ионная сила) могут иметь решающее значение для достижения селективности по отношению к катионам металлов, присутствующим в водных растворах.
Удаление мышьяка
Мышьяк присутствует в воде в основном в виде арсената [As (V)] и ионов арсенита [As (III)], которые связаны с мышьяковой кислотой (H 3 AsO 4 ) и мышьяковистой кислотой (H 3 AsO 3 ) соответственно. Концентрации, формы и относительные соотношения как As (V), так и As (III) в воде значительно различаются в зависимости, главным образом, от изменений pH и окислительного потенциала.
Водорастворимые полимеры, содержащие четвертичные аммониевые группы, были исследованы в сочетании с ультрафильтрационными мембранами в качестве сорбентов мышьяка.Такие полимеры, как хлорид поли [2- (акрилоилокси) этил] триметиламмония [P (ClAETA)] и хлорид поли (ар-винилбензил) триметиламмония [P (ClVBTA)], были приготовлены и использованы в методике LPR для удаления мышьяка. В целом, P (ClVBTA) и P (ClAETA) показали более высокую удерживающую способность к компонентам As (V) при значениях pH 8 и 6 по сравнению с 4. При щелочном pH в растворе преобладают двухвалентные частицы HAsO42-, которые легко удерживаются полимерами. (Санчес и Ривас, 2011). Кроме того, были изучены различные молярные отношения полимер: As (V) (31: 1, 20: 1, 10: 1, 6: 1 и 3: 1).В этом эксперименте использовалось постоянное количество полимера (7 × 10 -5 моль) при pH 8 или 6 (Sánchez and Rivas, 2011). Результаты удаления As (V) с помощью P (ClVBTA) и P (ClAETA) методом промывки представлены в таблице 2. Результаты показали, что удерживание As (V) ограничено концентрацией полимера, когда концентрация мышьяка . Если рассматривать два разных порядка величины (2 × 10 -4 и 7 × 10 -5 моль полимера) в отдельных экспериментах, типичное молярное соотношение полимер: 20: 1 было более эффективным.Примечательно, что высокая эффективность поликатиона сохраняется постоянной при рекуперации компонентов As (V) даже при значительно более высоких концентрациях мышьяка.
Таблица 2 . Влияние молярного отношения полимер: As (V) на удерживание As (V) для двух полимеров при pH 8 и коэффициенте фильтрации Z = 10.
Комплексы поликатион-полианион в водном растворе для удаления мышьяка
Исследования по использованию водорастворимых сополимеров, содержащих анионные и катионные центры, были выполнены для удержания As (V) из воды.Поли [(3-метакрилоиламин) пропил) триметиламмонийхлорид-соакриловая кислота] [P (ClMPTA- co -AA)] получали в различных молярных соотношениях катион: анион (1: 1, 1: 2, 2: 1. , и 4: 1). В этом исследовании удерживание мышьяка зависело в основном от таких факторов, как pH, концентрация полимера и состав сополимера (Rivas et al., 2006). Характеристики поликатионных и полианионных цепей в сополимере были изучены в отношении удерживания мышьяка в зависимости от pH (см. Рисунок 3). Когда сополимер, полученный при молярном соотношении 1: 1, использовали в LPR, сополимер теряет свою способность связывать As (V) независимо от pH.Согласно литературным данным, поликатион подвесного типа может образовывать эквимолярный комплекс с полианионом. Вероятно, это связано с взаимодействием карбоксилатных групп P (AA) с четвертичными аммониевыми группами P (ClMPTA) (Rivas et al., 2006). P (AA) представляет собой полимер с протонодонорными свойствами, однако в этом случае его комплексообразование с катионными полиэлектролитами зависит от состава каждого звена в сополимере, а также от pH водного раствора.
Рисунок 3 .Профиль удерживания As (V) поли [(3-метакрилоиламин) пропил) триметиламмонийхлорид- со -акриловой кислотой] [P (ClMPTA- со -AA)] при различных молярных соотношениях мономеров (a) 1: 1, (B) 1: 2, (C) 2: 1 и (D) 4: 1. Количество полимера составляет 0,2 ммоль, а абсолютное количество ионов As (V) составляет 0,01 ммоль. По материалам Rivas et al. (2006), Ривас и Агирре (2007).
В целом, P (AA) увеличивал свою диссоциацию в присутствии P (ClMPTA).Диссоциация P (AA) подавляется при pH 4 (ниже pKa = 5,6). Водородные и ковалентные связи между катионными и анионными полиэлектролитами препятствуют удерживанию анионов мышьяка. Это происходит из-за комплексообразования между мономерными звеньями, и поэтому удерживание арсената равно нулю.
При pH 6 P (AA) диссоциирует и образует карбоксилат-анион и, следовательно, способен вызывать комплексообразование. Однако реакционная способность анионных полимерных цепей, покрытых катионными полимерными цепями, может считаться выше, чем у свободной цепи.Вероятно, это связано с изменениями конформации, диссоциации и микроокружения в домене полимерной цепи (Rivas et al., 2006). Однако некоторые из катионных групп являются свободными и могут связываться с арсенатом раствора, когда состав сополимера не является эквимолярным. Этот эффект выше, когда соотношение поликатион: полианион> 1, когда значительная часть групп аммония может свободно взаимодействовать и удалять арсенат-анионы (см. Рисунок 3).
При pH 8 удерживание ионов арсената увеличивается для обоих сополимеров без эквимолярного соотношения.Наблюдается, что когда количество четвертичных аммониевых групп увеличивается в сополимерах (4: 1), достигается повышенное удерживание мышьяка, аналогичное удерживанию чистого P (ClMPTA). Было обнаружено, что эффективность чистого P (AA) в удерживании анионов арсената незначительна, независимо от pH (Rivas et al., 2006).
Полимерно-металлический комплекс для удаления мышьяка
В последнее время разработка новых водорастворимых полимеров и их использование в сочетании с ультрафильтрацией через мембраны считается одним из наиболее перспективных методов обогащения и отделения ионов от водного раствора.С другой стороны, улавливание мышьяка из водных сред важно из-за его высокой токсичности и воздействия на окружающую среду (Sánchez et al., 2015). Кроме того, для рекуперации мышьяка из загрязненной среды были разработаны новые методы идентификации и определения различных форм мышьяка с целью повышения уровня чувствительности, скорости и эффективности измерений (Thotiyl et al., 2012). В этом контексте нашей целью было получить водорастворимые полимеры, такие как некатионная система, которая проявляется через сложную реакцию металлического активного центра с токсичными частицами для восстановления.По этой причине были приготовлены водорастворимые комплексы соли олова (II) в матрице поли (акриловой кислоты), ПАК. Добавленное содержание олова составляло 3, 5, 10 и 20 мас.%. Соль олова-металла включается в ПАК для удаления As (III) из водного раствора (Rivas and Aguirre, 2007). Sn (II) может координироваться как 2-4 карбоксилатные группы в структуре, обычно бидентатной, но они не симметричны. Инфракрасная спектроскопия показала симметричные валентные колебания ν sym (COO — ) при 1405 см −1 и асимметричные валентные колебания ν asym (COO — ) при 1600 см −1 , содержащие некоторое количество свободного карбоксилата COO — .Полосы при 777 и 540 см -1 подтверждали связь Sn-O (Rivas, Aguirre, 2007).
Исследования селективности проводили до pH 4, 6 и 8 с использованием молярных соотношений полимер: As (20: 1), (100: 1), (200: 1), (400: 1) и (600: 1).
Удерживание арсенита P (AA) незначительно, независимо от pH. Однако поли (AA) -Sn обладает сорбционными свойствами As (III), подтверждая, что способность к взаимодействию и удалению зависит от концентрации соли олова, pH раствора и мольного отношения полимер-As (III) (Rivas and Aguirre, 2007).
При pH 8 обнаруживается, что анион-диссоциированная соль As (III) находится в равновесии с одновалентными анионами (H 2 AsO3-). При использовании поли (AA) -Sn (10 мас.% Теоретического содержания олова) 90% удерживаемого As (III) получают при Sn-As (III) 20: 1 и поли (AA) -Sn: As (III). Мольное соотношение 400: 1 (Rivas and Aguirre, 2007).
Поведение различных комплексов металл-полимер (3, 5, 10 и 20 мас.% Олова) представлено на рисунке 4. Эксперименты проводились с (20: 1), (100: 1), (200 мас.%). : 1), (400: 1) и (600: 1) молярные отношения поли (AA) -Sn: As (III) при pH 8.
Рис. 4. (A) Значения удерживания для As (III) при различных полимерах: мольное соотношение As (III) и содержание олова для Z = 10 и pH 8. (B) Значения удерживания для As (III) ) и As (V) для Z = 10, мольное соотношение (400: 1) при различных значениях pH. По материалам Rivas et al. (2006), Ривас и Агирре (2007).
При содержании олова 3 мас.% Степень удерживания была незначительной. При более высоком содержании олова (5, 10 и 20 мас.%) Удерживание As (III) было улучшено при мольном соотношении поли (AA) -Sn: As (III) (600: 1) и (400: 1). .Кроме того, более высокое удерживание As (III) удваивается при увеличении содержания олова (Rivas and Aguirre, 2007).
Более высокая способность удаления As (III) (до 90%) указывает на то, что виды арсенита сильно ограничены при щелочном pH, например, когда использовалось 400: 1 при содержании олова 10 и 20 мас.%.
Частичное окисление As (III) до As (V), вероятно, связано с более высоким содержанием олова в полимере. Однако, учитывая состав мышьяка, большая часть остается в виде As (III) со следами As (V), менее 10 мас.% В растворе фильтрата (Rivas and Aguirre, 2007).
Способность полимера связывать арсенит обусловлена комплексами металл-полимер.
pH среды может влиять на конформацию полимера. При более высоком значении pH ПАК депротонируется и из-за электростатического отталкивания заряженных карбоксилатных групп и ионов металлов связываются либо с одной, либо с двумя соседними группами. При pH 4,8 цепи PAA могут сокращаться, и ионы металлов могут образовывать комплексы с 2-4 группами карбоновых кислот (Rivas and Aguirre, 2007).
Параллельные эссе LPR с As (V) по комплексам металл-полимер олова показали аналогичный профиль удерживания с As (III).На рисунке 4 показано удаление As (III) и As (V) с помощью LPR. Показатель R (%) мышьяка показал, что наилучшие характеристики обнаруживаются при содержании олова 10 и 20 мас.% Для обоих видов мышьяка с максимальным удерживанием при pH 8 и 4 (Rivas and Aguirre, 2007).
Будущие тенденции, касающиеся техники LPR, связаны с развитием гибридных методов. Эти методы включают использование LPR в качестве предварительной или последующей обработки в комбинированных методах, таких как химическое или электрохимическое окисление / восстановление в сочетании с ультрафильтрацией с использованием водорастворимых полимеров (Arar et al., 2014; Санчес и др., 2015, 2017; Chou et al., 2018). Кроме того, фотокатализ использовался в сочетании с LPR для повышения способности удаления мышьяка (Yuksel et al., 2014; Molinari and Argurio, 2017).
В одном исследовании было предложено химическое восстановление для извлечения меди из ретентата, полученного методом LPR. Были изучены три различных полимера (PSS, PAA и PEI), чтобы изучить их влияние на удаление меди в LPR и на извлечение меди путем химического восстановления при различных условиях pH (Chou et al., 2018). Эффективность удаления меди при pH 3 была различной и составляла 60, 75 и 90% для PAA, PSS и PEI соответственно. После этого химическое восстановление привело к полному извлечению меди из раствора, содержащего ПСС. Эффективность извлечения меди составляла более 95% для раствора ПАК со значениями pH от 3 до 9 при времени реакции 1 час. Для PEI эффективность извлечения составляла от 20 до 96% и зависела от pH. Результаты показали, что можно удалить и сконцентрировать медь из водного раствора с помощью LPR с различными водорастворимыми полимерами, а затем химически восстановить медь для получения оксида меди во всех образцах (Chou et al., 2018).
В другом примере электрохимическое окисление As (III) до As (V) проводили с помощью металлических электродов в присутствии водорастворимых полимеров, а затем применяли ультрафильтрацию для удаления общего As (V) из водного раствора (Arar et al. ., 2014). В ходе исследования поли [глицидилметакрилат N-метил-D-глюкамин], P (GMA-NMG), был синтезирован и очищен с помощью ультрафильтрационных мембран. Впоследствии он был использован для удаления мышьяка путем сочетания процессов электроокисления (ЭО) и LPR.На первом этапе полный ЭО от As (III) до As (V) выполняли с помощью платинового сетчатого электрода, модифицированного стекловидным углеродом, и за ходом электролиза следили с помощью аналитических электродов. После окисления As (III) до As (V) LPR проводили методом промывки с использованием мембраны из регенерированной целлюлозы и давлением 1 бар. Результаты показали, что при использовании P (GMA-NMG) в качестве фонового электролита во время полного ЭО от As (III) до As (V) с последующим разделением LPR, почти 80% As (V) было удалено при pH 10 (Arar et al. al., 2014).
Метод LPR также использовался для удаления ионов Cr (VI) из водного раствора с использованием водорастворимого поли (диаллилдиметиламмонийхлорида), PDDA и последующего электрохимического восстановления Cr (VI) до Cr (III) (Sánchez et al. , 2017). Метод обогащения LPR использовали для определения максимальной удерживающей способности полимера, а высвобождение Cr (VI) и регенерацию полимера анализировали с помощью процесса сорбции-десорбции. Затем был проведен электроанализ Cr (VI) с помощью линейной вольтамперометрии и полного электролиза при контролируемом потенциале в кислой среде и в присутствии PDDA.Максимальная удерживающая способность PDDA составляла 33 мг Cr / г полимера при pH 9. Результаты с использованием процесса сорбции-десорбции показали, что этот PDDA может высвобождать Cr (VI) и регенерировать. Наконец, электролиз Cr (VI) до Cr (III) был успешно проведен в присутствии PDDA (Sánchez et al., 2017).
С другой стороны, фотокатализ и LPR были объединены для окисления As (III) до As (V), а затем удалены с помощью LPR (Yuksel et al., 2014; Molinari and Argurio, 2017). Фотокаталитическое окисление As (III) проводили с использованием TiO 2 в УФ-А свете.Окисление As (III) достигало 100% после 30 мин освещения УФ-А светом. Водорастворимый полимер, содержащий четвертичные аммониевые группы, использовали в качестве экстрагирующего реагента в процессе LPR. Удаление мышьяка водорастворимым полимером было достигнуто с выходом 99% при молярном соотношении полимер: As (V) 20: 1 при значении pH 9. Результаты показывают, что сочетание этих методов очень полезно для потенциальных применения, связанные с очисткой сточных вод, загрязненных As (III) (Yuksel et al., 2014).
Выводы
Водорастворимые и нерастворимые полимеры — универсальные материалы для обеззараживания воды. Полимерные нанокомпозиты, сочетающие в себе различные свойства неорганических соединений и полимеров, могут не только улучшать физические свойства (например, механическую стабильность), но также добавление наночастиц может обеспечивать новые функциональные возможности, такие как магнитные характеристики, полезные для облегчения разделения, или новые поверхности взаимодействия, повышающие эффективность и селективность адсорбции.Кроме того, полимерная матрица позволяет преодолевать эксплуатационные препятствия, которые наночастицы проявляют как адсорбирующие материалы. Точно так же получение гибридного композита, в котором полимерные цепи и оксид оксидной сетки смешаны на молекулярном уровне, представляет собой новые материалы, которые можно использовать в процессах адсорбции.
С другой стороны, для обеззараживания воды также можно использовать несшитый полимер или растворимые полимеры. В этом случае структуры полимеров могут быть гомополимерами или сополимерами, и такие переменные, как pH и концентрация, влияют не только на взаимодействие с ионами металлов, но и на конформацию полимерных цепей в растворе.Сильное взаимодействие полимер-металл приведет к образованию макромолекулярного агрегата, который можно использовать в технике LPR.
Авторские взносы
JS обновил литературу и написал о водорастворимых полимерах и мембранах для удаления токсичных ионов. БУ обновил литературу и писал о нанокомпозитах. BR организовал всю рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарят FONDECYT (грант № 1150510). BF Urbano благодарит FONDEF IDeA (грант № ID15i10211), FONDECYT (грант № 1171082) и Университет Консепсьона (грант VRID-Enlace № 216.024.040-1.0). JS благодаря DICYT от USACH (грант № 021741SP).
Список литературы
Ахмади А., Хайдарзаде С., Мохтари А. Р., Дарезерешки Е. и Харуни Х. А. (2014). Оптимизация удаления тяжелых металлов из водных растворов наночастицами маггемита (γ-Fe 2 O 3 ) с использованием методологии поверхности отклика. J. Geochem. Explor. 147, 151–158. DOI: 10.1016 / j.gexplo.2014.10.005
CrossRef Полный текст | Google Scholar
Ахмед, М.А., Али, С.М., Эль-Дек, С.И., и Галал, А. (2013). Наночастицы магнетит-гематита, полученные экологически чистыми методами для удаления ионов тяжелых металлов из воды. Mater. Sci. Англ. B Solid State Mater. Adv. Tech. 178, 744–751. DOI: 10.1016 / j.mseb.2013.03.011
CrossRef Полный текст | Google Scholar
Александратос, С.Д. (2009). Ионообменные смолы: ретроспектива исследований промышленной и инженерной химии. Ind. Eng. Chem. Res. 48, 388–398. DOI: 10.1021 / ie801242v
CrossRef Полный текст | Google Scholar
Арар, О., Кабай, Н., Санчес, Дж., Ривас, Б. Л., Бриджак, М., и Пенья, К. (2014). Удаление мышьяка из воды путем сочетания электроокисления и ультрафильтрации, усиленной полимером. Environ. Прог. Поддерживать. Энергия 33, 918–924. DOI: 10.1002 / ep.11876
CrossRef Полный текст | Google Scholar
Асман, Г.(2009). Использование мембран поли (метилметакрилат-со-метакриловая кислота) в ультрафильтрации водных растворов Fe3 + путем образования комплекса с поливинилпирролидоном и декстраном. Sep. Sci. Technol. 44, 1164–1180. DOI: 10.1080 / 014963909148
CrossRef Полный текст | Google Scholar
Бандару Н. М., Рета Н., Далал Х., Эллис А. В., Шаптер Дж. И Фолькер Н. Х. (2013). Повышенная адсорбция ионов ртути на одностенных углеродных нанотрубках, дериватизированных тиолами. J. Hazard. Матер. 261, 534–541. DOI: 10.1016 / j.jhazmat.2013.07.076
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бораи, Э. Х., Бреки, М. М. Э., Сайед, М. С., и Або-Али, М. М. (2015). Синтез, характеристика и применение нанокомпозитов оксида титана для удаления радиоактивных ионов цезия, кобальта и европия. J. Colloid Interface Sci. 450, 17–25. DOI: 10.1016 / j.jcis.2015.02.062
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брюммер, Г.В., Барроу, Н. Дж., И Фишер, Л. (2013). Влияние пористости гетита на сорбцию шести ионов тяжелых металлов. евро. J. Почвоведение. 64, 805–813. DOI: 10.1111 / ejss.12091
CrossRef Полный текст | Google Scholar
Кампос, К. Х., Торрес, К. К., Урбано, Б. Ф., и Ривас, Б. Л. (2015). Влияние связующего агента на свойства взаимопроникающих гибридов поли (акриловая кислота) –Al2O3 и сорбцию ионов металлов. Polym. Int. 64, 595–604. DOI: 10.1002 / пи.4829
CrossRef Полный текст | Google Scholar
Кавус, С., Гурдаг, Г. (2009). Неконкурентное удаление ионов тяжелых металлов из водных растворов гидрогелем поли [2- (акриламидо) -2-метил-1-пропансульфоновой кислоты и итаконовой кислоты]. Ind. Eng. Chem. Res. 48, 2652–2658. DOI: 10.1021 / ie801449k
CrossRef Полный текст | Google Scholar
Чавес-Гуахардо, А. Э., Медина-Ллама, Дж. К., Макейра, Л., Андраде, К. А. С., Алвес, К. Г. Б., и Де Мело, К.П. (2015). Эффективное удаление ионов Cr (VI) и Cu (II) из водных сред с использованием магнитных нанокомпозитов полипиррол / маггемит и полианилин / маггемит. Chem. Англ. J. 281, 826–836. DOI: 10.1016 / j.cej.2015.07.008
CrossRef Полный текст | Google Scholar
Chen, C., and Wang, X. (2006). Адсорбция Ni (II) из водного раствора окисленными многослойными углеродными нанотрубками. Ind. Eng. Chem. Res. 45, 9144–9149. DOI: 10.1021 / ie060791z
CrossRef Полный текст | Google Scholar
Чен, Н., Дэн, Дж., Цзяо, Ф. П., Цзян, X. Y., Хао, X., и Ю, Дж. Г. (2017). Приготовление углеродных нанотрубок, функционализированных триэтаноламином, для водного удаления Pb (II). Десалин. Водное лечение. 71, 191–200. DOI: 10.5004 / dwt.2017.20551
CrossRef Полный текст | Google Scholar
Чен, К., Ло, З., Хиллс, К., Сюэ, Г., и Тайрер, М. (2009). Осаждение тяжелых металлов из сточных вод с использованием моделированного дымового газа: последовательное добавление летучей золы, извести и диоксида углерода. Water Res. 43, 2605–2614. DOI: 10.1016 / j.watres.2009.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chou, Y.-H., Choo, K.-H., Chen, S.-S., Yu, J.-H., Peng, C.-Y., and Li, C.-W. (2018). Извлечение меди с помощью ультрафильтрации, усиленной полиэлектролитом, с последующим химическим восстановлением на основе дитионита: влияние pH раствора и типа полиэлектролита. Сентябрь Purif. Tech. 198, 113–120. DOI: 10.1016 / j.seppur.2017.02.008
CrossRef Полный текст | Google Scholar
Côa, F., Штраус, М., Клементе, З., Родригес Нето, Л. Л., Лопес, Дж. Р., Аленкар, Р. С. и др. (2017). Покрытие углеродных нанотрубок гуминовой кислотой экологически чистым механохимическим методом: применение для удаления ионов Cu (II) из воды и водной экотоксичности. Sci. Total Environ. 607–608, 1479–1486. DOI: 10.1016 / j.scitotenv.2017.07.045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цуй, Х., Су, Й., Ли, К., Гао, С., и Шан, Дж. К. (2013). Исключительная эффективность удаления мышьяка (III, V) высокопористыми наноструктурированными сферами ZrO 2 для реакторов с неподвижным слоем слоя и полномасштабное моделирование системы. Water Res. 47, 6258–6268. DOI: 10.1016 / j.watres.2013.07.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цуй, Ю., Ху, З. Дж., Янг, Дж. Х. и Гао, Х. У. (2012). Новые многослойные углеродные нанотрубки, привитые фенилиминодиуксусной кислотой, для твердофазной экстракции ионов железа, меди и свинца из водной среды. Microchim. Acta 176, 359–366. DOI: 10.1007 / s00604-011-0725-x
CrossRef Полный текст | Google Scholar
Кумбал, Л., и СенГупта, А.К. (2005). Удаление мышьяка с использованием наночастиц гидратированного оксида железа (III) на полимерной основе: роль мембранного эффекта доннана. Environ. Sci. Technol. 39, 6508–6515. DOI: 10.1021 / es050175e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Да̧Бровски, А., Хубицки, З., Подкосцельни, П., и Робенс, Э. (2004). Селективное удаление ионов тяжелых металлов из вод и промышленных сточных вод ионообменным методом. Химия 56, 91–106.DOI: 10.1016 / j.chemosphere.2004.03.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Демарко, М. Дж., Сенгупта, А. К., и Гринлиф, Дж. Э. (2003). Удаление мышьяка с помощью гибридного полимерного / неорганического сорбента. Water Res. 37, 164–176. DOI: 10.1016 / S0043-1354 (02) 00238-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Донг, К., Лю, Дж., Сун, Л., и Шао, Г. (2011). Новые цвиттерионные неорганические органические гибриды: синтез гибридных адсорбентов и их применение для удаления Cu 2+ . J. Hazard. Матер. 186, 1335–1342. DOI: 10.1016 / j.jhazmat.2010.12.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дула, М. К. (2009). Одновременное удаление Cu, Mn и Zn из питьевой воды с использованием клиноптилолита и его Fe-модифицированной формы. Water Res. 43, 3659–3672. DOI: 10.1016 / j.watres.2009.05.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дуань, Дж., Лу, К., Чен, Р., Дуань, Ю., Ван, Л., Гао, Л. и др. (2010). Синтез нового флокулянта на основе сшитого ксантогената Konjac глюкоманнан-привит-полиакриламид-натрий и его применение для удаления иона Cu 2+ . Carbohydr. Polym. 80, 436–441. DOI: 10.1016 / j.carbpol.2009.11.046
CrossRef Полный текст | Google Scholar
Фан, Л., Ло, К., Сун, М., Ли, X., и Цю, Х. (2013). Высокоселективная адсорбция ионов свинца вододиспергируемыми магнитными композитами хитозан / оксид графена. Colloids Surf. B Биоинтерфейсы 103, 523–529. DOI: 10.1016 / j.colsurfb.2012.11.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фиерро, Дж. Л. Г. (2005). Оксиды металлов: химия и применение . Бока-Ратон, Флорида: CRC Press.
Google Scholar
Фишер, Л. В., Сочор, А. Р., Тан, Дж. С. (1977). Цепные характеристики полимеров поли (2-акриламидо-2-метилпропансульфоната). 1. Исследования светорассеяния и характеристической вязкости. Макромолекулы 10, 949–954. DOI: 10.1021 / ma60059a012
CrossRef Полный текст | Google Scholar
Герт, Дж. (2005). Влияние модификации кристаллов на связывание следов металлов и арсената гетитом. J. Почвенные отложения 5, 30–36. DOI: 10.1065 / jss2005.01.126
CrossRef Полный текст | Google Scholar
Гровер В. А., Ху Дж., Энгейтс К. Э. и Шипли Х. Дж. (2012). Адсорбция и десорбция двухвалентных металлов на наночастицах гематита. Environ. Toxicol. Chem. 31, 86–92. DOI: 10.1002 / etc.712
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хадавифар М., Бахрамифар Н., Юнеси Х. и Ли К. (2014). Адсорбция ионов ртути из синтетических и реальных водных растворов сточных вод функционализированными многостенными углеродными нанотрубками с аминогруппами и тиолированными группами. Chem. Англ. J. 237, 217–228. DOI: 10.1016 / j.cej.2013.10.014
CrossRef Полный текст | Google Scholar
Ханг, С., Ли, К., Гао, С., и Шан, Дж. К. (2012). Адсорбция As (III) и As (V) наночастицами водного оксида циркония, синтезированных гидротермальным способом с последующей термообработкой. Ind. Eng. Chem. Res. 51, 353–361. DOI: 10.1021 / ie202260g
CrossRef Полный текст | Google Scholar
Христовски, К. Д., Марковски, Дж. (2017). Разработка сорбентов на основе оксидов металлов (гидратов) для удаления арсената и аналогичных примесей, содержащих слабокислые оксианионы: критический обзор с акцентом на факторы, определяющие процессы сорбции Sci. Total Environ. 598, 258–271. DOI: 10.1016 / j.scitotenv.2017.04.108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Христовски, К. Д., Вестерхофф, П. К., Криттенден, Дж. К., и Олсон, Л. В. (2008). Удаление арсената наноструктурированными сферами ZrO2. Environ. Sci. Technol. 42, 3786–3790. DOI: 10.1021 / es702952p
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ху, Дж., Шао, Д., Чен, К., Шэн, Г., Ли, Дж., Wang, X., et al. (2010). Плазма-индуцированная прививка циклодекстрина на многослойные углеродные нанотрубки / оксиды железа для нанесения адсорбента. J. Phys. Chem. B 114, 6779–6785. DOI: 10.1021 / jp4k
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ху К., Кулкарни Д. Д., Чой И. и Цукрук В. В. (2014). Нанокомпозиты графен-полимер для структурных и функциональных приложений. Прог. Polym. Sci. 39, 1934–1972. DOI: 10.1016 / j.progpolymsci.2014.03.001
CrossRef Полный текст | Google Scholar
Hua, M., Yang, B., Shan, C., Zhang, W., He, S., Lv, L., et al. (2017). Одновременное удаление As (V) и Cr (VI) из воды макропористым анионитом, нанесенным наноразмерным композитом на основе водного оксида железа. Химия 171, 126–133. DOI: 10.1016 / j.chemosphere.2016.12.051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hua, M., Zhang, S., Pan, B., Zhang, W., Lv, L., и Zhang, Q.(2012). Удаление тяжелых металлов из воды / сточных вод наноразмерными оксидами металлов: обзор. J. Hazard. Матер. 211, 317–331. DOI: 10.1016 / j.jhazmat.2011.10.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Исан, К. М., Капат, К., Рута, Ф., и Удреа, И. (2008). Оценка нового материала гибридного типа неорганического / органического полимера в процессе удаления мышьяка из питьевой воды. Water Res. 42, 4327–4333. DOI: 10.1016 / j.watres.2008.06.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ИЮПАК (1997). Сборник химической терминологии. Оксфорд: Научные публикации Блэквелла.
Чон Б. Х., Демпси Б. А., Бургос В. Д., Ройер Р. А. и Роден Э. Э. (2004). Моделирование кинетики сорбции ионов двухвалентных металлов гематитом. Water Res. 38, 2499–2504. DOI: 10.1016 / j.watres.2004.03.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзя, К., Пан, Б., Львов, Л., Чжан, К., Ван, X., Пан, Б., и др. (2009). Пропитка наночастиц фосфата титана на пористом катионите для более эффективного удаления свинца из воды. J. Colloid Interface Sci. 331, 453–457. DOI: 10.1016 / j.jcis.2008.11.068
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Jiang, M.-Q., Jin, X.-Y., Lu, X.-Q., and Chen, Z.-L. (2010). Адсорбция Pb (II), Cd (II), Ni (II) и Cu (II) на природной каолинитовой глине. Опреснение 252, 33–39.DOI: 10.1016 / j.desal.2009.11.005
CrossRef Полный текст | Google Scholar
Kaşgöz, H., Durmuş, A., and Kaşgöz, A. (2008). Улучшенные набухающие и адсорбционные свойства нанокомпозитов AAm-AMPSNa / глинистый гидрогель для удаления ионов тяжелых металлов. Polym. Adv. Technol. 19, 213–220. DOI: 10.1002 / pat.999
CrossRef Полный текст | Google Scholar
Кикельбик, Г. (ред.). (2007). Гибридные материалы: синтез, характеристика и применение. Вайнхайм: Wiley-Vch Verlag GmbH & Co.
Google Scholar
Космульский, М. (2002). Значимость разницы в точке нулевого заряда между рутилом и анатазом. Adv. Коллоидный интерфейс Sci. 99, 255–264. DOI: 10.1016 / S0001-8686 (02) 00080-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Космульский, М. (2011). Зависимость от pH и точки нулевого заряда: обновление версии . J. Colloid Interface Sci. 353, 1–15. DOI: 10.1016 / j.jcis.2010.08.023
CrossRef Полный текст
Котал М., Бховмик А. К. (2015). Полимерные нанокомпозиты из модифицированных глин: последние достижения и проблемы. Прог. Polym. Sci. 51, 127–187. DOI: 10.1016 / j.progpolymsci.2015.10.001
CrossRef Полный текст | Google Scholar
Ли, Х., Шан, К., Чжан, Ю., Цай, Дж., Чжан, В., и Пань, Б. (2016). Адсорбция арсената наночастицами водного оксида железа, внедренными в сшитый анионообменник: влияние структуры поры хозяина. ACS Appl. Матер. Интерфейсы 8, 3012–3020. DOI: 10.1021 / acsami.5b09832
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Дж., Сяо, Х., Ким, Ю. С., и Лоу, Т. Л. (2005). Синтез водорастворимых катионных полимеров звездообразной структуры на основе циклодекстринового ядра посредством ATRP. J. Polym. Sci. Полим. Chem. 43, 6345–6354. DOI: 10.1002 / pola.21058
CrossRef Полный текст | Google Scholar
Ли, Ю. Х., Дин, Дж., Луан, З., Di, Z., Zhu, Y., Xu, C., et al. (2003). Конкурентная адсорбция ионов Pb 2+ , Cu 2+ и Cd 2+ из водных растворов многослойными углеродными нанотрубками. Карбон Нью-Йорк 41, 2787–2792. DOI: 10.1016 / S0008-6223 (03) 00392-0
CrossRef Полный текст | Google Scholar
Ликенс, С., Нейтс, Дж., Дегрев, Б., и Де Клерк, Э. (1997). Полимеры сульфоновой кислоты PAMPS [поли (2-акриламидо-2-метил-1-пропансульфоновая кислота)] и родственные аналоги являются сильнодействующими ингибиторами ангиогенеза. Онкол. Res. Featur. Доклиническая клиника. Cancer Ther. 9, 173–181.
PubMed Аннотация | Google Scholar
Лю М., Цзя З., Цзя Д. и Чжоу К. (2014). Недавний прогресс в исследованиях галлуазитных нанотрубок и полимерного нанокомпозита. Прог. Polym. Sci. 39, 1498–1525. DOI: 10.1016 / j.progpolymsci.2014.04.004
CrossRef Полный текст | Google Scholar
Мададранг, К. Дж., Ким, Х. Ю., Гао, Г., Ван, Н., Чжу, Дж., Фэн, Х. и др. (2012). Адсорбционные свойства оксида ЭДТА-графена при удалении Pb (II). ACS Appl. Матер. Интерфейсы 4, 1186–1193. DOI: 10,1021 / am201645g
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мадракян Т., Афхами А., Задпур Б. и Ахмади М. (2015). Новые синтетические наночастицы маггемита, модифицированные гомополимером меркаптоэтиламино, для эффективного удаления некоторых ионов тяжелых металлов из водного раствора. J. Indus. Англ. Chem. 21, 1160–1166. DOI: 10.1016 / j.jiec.2014.05.029
CrossRef Полный текст | Google Scholar
Махмуд, М.Э., Али, С. А. А., Нассар, А. М. Г., Элвешахи, С. М. Т., и Ахмед, С. Б. (2017). Иммобилизация нанослоев хитозана на поверхности оксида нанотитана как новый нанокомпозит для эффективного удаления La (III) из воды. Внутр. J. Biol. Макромол. 101, 230–240. DOI: 10.1016 / j.ijbiomac.2017.03.049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мандал, С., Саху, М. К., и Патель, Р. К. (2013). Адсорбционные исследования удаления мышьяка (III) из воды гибридным материалом на основе полиакриламида циркония (ZrPACM-43). Водные ресурсы. Инд. 4, 51–67. DOI: 10.1016 / j.wri.2013.09.003
CrossRef Полный текст | Google Scholar
Matyjaszewski, K., Gaynor, S. G., Qiu, J., Beers, K., Coca, S., Davis, K., et al. (2000). «Получение четко определенных водорастворимых-набухающих (Со) полимеров радикальной полимеризацией с переносом атома», в Associative Polymers in A Water Media , ed J. Edward Glass (Вашингтон, Вашингтон: Американское химическое общество), 52–71.
Молинари Р. и Аргурио П.(2017). Удаление мышьяка из воды путем сочетания процессов фотокатализа и комплексообразования-ультрафильтрации: предварительное исследование. Water Res. 109, 327–336. DOI: 10.1016 / j.watres.2016.11.054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Монье, М., Аяд, Д. М., Вей, Ю., и Сархан, А. А. (2010). Адсорбция ионов Cu (II), Co (II) и Ni (II) модифицированной магнитной хитозановой хелатирующей смолой. J. Hazard. Матер. 177, 962–970. DOI: 10.1016 / j.jhazmat.2010.01.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нансеу-Нджики, К. П., Чаманго, С. Р., Нгом, П. К., Дарчен, А., и Нгамени, Э. (2009). Удаление ртути (II) из воды электрокоагуляцией с использованием алюминиевых и железных электродов. J. Hazard. Матер. 168, 1430–1436. DOI: 10.1016 / j.jhazmat.2009.03.042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оннби, Л., Пакаде, В., Маттиассон, Б., и Кирсебом, Х. (2012).Полимерные композитные адсорбенты, использующие частицы полимеров с молекулярной печатью или наночастиц оксида алюминия для очистки воды, загрязненной мышьяком. Water Res. 46, 4111–4120. DOI: 10.1016 / j.watres.2012.05.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Падунгтон, С., Ли, Дж., Герман, М., и Сенгупта, А. К. (2014). Гибридный анионообменник с диспергированными наночастицами оксида циркония: прочный и многоразовый фторид-селективный сорбент. Environ.Англ. Sci. 31, 360–372. DOI: 10.1089 / ees.2013.0412
CrossRef Полный текст | Google Scholar
Пан Б., Ли З., Чжан Ю., Сюй Дж., Чен Л., Донг Х. и др. (2014). Кислотостойкий и органический наногидратированный гибридный адсорбент оксида циркония (HZO) / полистирола для удаления мышьяка из воды. Chem. Англ. J. 248, 290–296. DOI: 10.1016 / j.cej.2014.02.093
CrossRef Полный текст | Google Scholar
Пан Б., Сюй Дж., Ву Б., Ли З. и Лю X.(2013). Повышенное удаление фторида с помощью полистирольного анионита, нанесенного на наночастицы водного оксида циркония. Environ. Sci. Technol. 47, 9347–9354. DOI: 10.1021 / es401710q
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пандей С., Мишра С. Б. (2011). Органико-неорганический гибрид бионанокомпозитов хитозан / органоглина для поглощения шестивалентного хрома. J. Colloid Interface Sci. 361, 509–520. DOI: 10.1016 / j.jcis.2011.05.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Павлиду, С.и Папаспиридес, К. Д. (2008). Обзор полимерно-слоистых силикатных нанокомпозитов. Прог. Polym. Sci. 33, 1119–1198. DOI: 10.1016 / j.progpolymsci.2008.07.008
CrossRef Полный текст | Google Scholar
Перес, Дж., Толедо, Л., Кампос, К. Х., Ривас, Б. Л., Яньес, Дж., И Урбано, Б. Ф. (2016). Органико-неорганические взаимопроникающие гибриды на основе катионного полимера и водного оксида циркония для удаления арсената и арсенита. Chem. Англ. J. 287, 744–754.DOI: 10.1016 / j.cej.2015.11.051
CrossRef Полный текст | Google Scholar
Перес, Дж., Толедо, Л., Кампос, К. Х., Янез, Дж., Ривас, Б. Л., и Урбано, Б. Ф. (2016). Сорбция мышьяка на гибридном сорбенте оксигидроксид алюминия-поли [(4-винилбензил) триметиламмонийхлорид]. RSC Adv. 6, 28379–28387. DOI: 10.1039 / C6RA01230B
CrossRef Полный текст | Google Scholar
Praipipat, P., El-Moselhy, M. M., Khuanmar, K., Weerayutsil, P., Nguyen, T.Т., и Падунгтон, С. (2017). Усиленное дефторирование с использованием многоразовых сильнокислотных катионитов в форме Al3 + (SAC-Al), содержащих наночастицы гидратированного оксида Al (III). Chem. Англ. J. 314, 192–201. DOI: 10.1016 / j.cej.2016.12.122
CrossRef Полный текст | Google Scholar
Раджпут С., Сингх Л. П., Питтман К. У. мл. И Мохан Д. (2017). Очистка воды от свинца (Pb 2+ ) и меди (Cu2 +) с использованием суперпарамагнитных наночастиц маггемита (γ-Fe2O3), синтезированных методом пламенного пиролиза (FSP). J. Colloid Interface Sci. 492, 176–190. DOI: 10.1016 / j.jcis.2016.11.095
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Rhim, J.-W., Park, H.-M., and Ha, C.-S. (2013). Бионанокомпозиты для упаковки пищевых продуктов. Прог. Polym. Sci. 38, 1629–1652. DOI: 10.1016 / j.progpolymsci.2013.05.008
CrossRef Полный текст | Google Scholar
Ривас, Б. Л., и Агирре, М. Д. К. (2007). Удерживающие свойства арсенита водорастворимых металл-полимеров. J. Appl. Polym. Sci. 106, 1889–1894. DOI: 10.1002 / app.26737
CrossRef Полный текст | Google Scholar
Ривас, Б. Л., Агирре, М. Д. К., и Перейра, Э. (2006). Удерживающие свойства арсенат-анионов водорастворимых полимеров с помощью метода удерживания на основе жидкофазного полимера. J. Appl. Polym. Sci. 102, 2677–2684. DOI: 10.1002 / app.24093
CrossRef Полный текст | Google Scholar
Ривас, Б. Л., Хубе, С., Санчес, Дж., И Перейра, Э.(2012). Хелатирующие водорастворимые полимеры, связанные с ультрафильтрационными мембранами для удаления ионов металлов. Polym. Бык . 69, 881–898. DOI: 10.1007 / s00289-012-0785-z
CrossRef Полный текст | Google Scholar
Ривас, Б. Л., Перейра, Э. Д., и Морено-Виллослада, И. (2003). Взаимодействие водорастворимого полимера с ионами металлов. Прог. Polym. Sci. 28, 173–208. DOI: 10.1016 / S0079-6700 (02) 00028-X
CrossRef Полный текст | Google Scholar
Ривас, Б.Л., Перейра, Э. Д., Паленсия, М., и Санчес, Дж. (2011). Водорастворимые функциональные полимеры в сочетании с мембранами для удаления загрязняющих ионов из водных растворов. Прог. Polym. Sci. 36, 294–322. DOI: 10.1016 / j.progpolymsci.2010.11.001
CrossRef Полный текст | Google Scholar
Ривас, Б. Л., Пули, С. А., Луна, М., и Гекелер, К. Э. (2001). Синтез водорастворимых полимеров, содержащих фрагменты сульфоновой кислоты и амина, для восстановления ионов металлов с помощью ультрафильтрации. J. Appl. Polym. Sci. 82, 22–30. DOI: 10.1002 / app.1819
CrossRef Полный текст | Google Scholar
Рузен, Дж., Спурен, Дж., И Биннеманс, К. (2014). Адсорбционные характеристики функционализированных гибридных материалов хитозан-диоксид кремния по отношению к редкоземельным элементам. J. Mater. Chem. А 2, 19415–19426. DOI: 10.1039 / C4TA04518A
CrossRef Полный текст | Google Scholar
Санчес Дж., Баттер Б., Басаез Л., Ривас Б. Л. и Оттакам Тотийл М. (2017). Эффективное удаление Cr (VI) ультрафильтрацией с использованием полиэлектролитов и последующим электрохимическим восстановлением до Cr (III). J. Chilean Chem. Soc. 62, 3647–3652. DOI: 10.4067 / s0717-97072017000303647
CrossRef Полный текст | Google Scholar
Санчес, Дж., Баттер, Б., Ривас, Б. Л., Басаес, Л., и Сантандер, П. (2015). Электрохимическое окисление и удаление мышьяка с использованием водорастворимых полимеров. J. Appl. Электрохим. 45, 151–159. DOI: 10.1007 / s10800-014-0785-9
CrossRef Полный текст | Google Scholar
Санчес Дж. И Ривас Б. Л. (2011). Удержание арсената из водного раствора гидрофильными полимерами через ультрафильтрационные мембраны. Опреснение 270, 57–63. DOI: 10.1016 / j.desal.2010.11.021
CrossRef Полный текст | Google Scholar
Саркар С., Чаттерджи П. К., Кумбал Л. Х. и Сенгупта А. К. (2011). Нанокомпозиты на основе гибридного ионообменника: сорбция и зондирование для экологических приложений. Chem. Англ. J. 166, 923–931. DOI: 10.1016 / j.cej.2010.11.075
CrossRef Полный текст | Google Scholar
Сэй Р., Бирлик Э., Денизли А. и Эрсез А. (2006).Удаление ионов тяжелых металлов с помощью композитов полимер / органосмектит, закрепленных дитиокарбаматом. Прил. Clay Sci. 31, 298–305. DOI: 10.1016 / j.clay.2005.10.006
CrossRef Полный текст | Google Scholar
Сехават Пур, З., Гэми, М. (2016). Получение нанокомпозита поли (виниловый спирт) / сополимер акриламида и винилимидазола / γ-Fe2O3 полу-IPN и их применение для удаления ионов тяжелых металлов из воды. Polym. Adv. Technol. 27, 1557–1568. DOI: 10.1002 / pat.3830
CrossRef Полный текст | Google Scholar
Sincero, A. P., and Sincero, G.A. (2002). Физико-химическая очистка воды и сточных вод. Лондон: CRC Press.
Google Scholar
Сингха Деб, А. К., Двиведи, В., Дасгупта, К., Мушараф Али, С., и Шеной, К. Т. (2017). Новые функционализированные амидоамином многостенные углеродные нанотрубки для удаления ионов ртути (II) из сточных вод: комбинированный экспериментальный подход и теоретический подход с функционалом плотности. Chem. Англ. J. 313, 899–911. DOI: 10.1016 / j.cej.2016.10.126
CrossRef Полный текст | Google Scholar
Спитальский, З., Тасис, Д., Папагелис, К., Галиотис, К. (2010). Композиты углеродные нанотрубки – полимеры: химия, обработка, механические и электрические свойства. Прог. Polym. Sci. 35, 357–401. DOI: 10.1016 / j.progpolymsci.2009.09.003
CrossRef Полный текст | Google Scholar
Стафей А. и Пыжинска К. (2007). Адсорбция ионов тяжелых металлов углеродными нанотрубками. Сентябрь Purif. Tech. 58, 49–52. DOI: 10.1016 / j.seppur.2007.07.008
CrossRef Полный текст | Google Scholar
Стуэц, Р. М., и Стефенсон, Т. (2009). Принципы процессов очистки воды и сточных вод. Норвич: Издательство Ива.
Google Scholar
Tan, P., Sun, J., Hu, Y., Fang, Z., Bi, Q., Chen, Y., et al. (2015). Адсорбция Cu 2+ , Cd 2+ и Ni 2+ из водных растворов одиночных металлов на мембранах из оксида графена. J. Hazard. Матер. 297, 251–260. DOI: 10.1016 / j.jhazmat.2015.04.068
CrossRef Полный текст | Google Scholar
Такур, С.С., Чаухан, Г.С. (2014). Гибридные материалы на основе желатина и диоксида кремния как эффективные кандидаты для удаления хрома (Vi) из водных растворов. Ind. Eng. Chem. Res. 53, 4838–4849. DOI: 10.1021 / ie401997g
CrossRef Полный текст | Google Scholar
Thotiyl, M. M. O., Basit, H., Sánchez, J. A., Goyer, C., Coche-Guerente, L., Dumy, P., et al. (2012). Многослойные сборки наночастиц полиэлектролит-золото для электрокаталитического окисления и обнаружения мышьяка (III). J. Colloid Interface Sci. 383, 130–139. DOI: 10.1016 / j.jcis.2012.06.033
CrossRef Полный текст | Google Scholar
Толедо, Л., Елинек, Л., Гордятская, Ю., Кампос, К., и Урбано, Б. Ф. (2018). Синтез гибридной микросхемы из бутоксида циркония и ионно-неионного сополимера. Colloid Surf. А 546, 91–98.DOI: 10.1016 / j.colsurfa.2018.03.012
CrossRef Полный текст | Google Scholar
Триведи, П., Акс, Л., и Дайер, Дж. (2001). Адсорбция ионов металлов на гетите: одиночные адсорбаты и конкурентные системы. Colloids Surf. Physicochem. Англ. Аспекты 191, 107–121. DOI: 10.1016 / S0927-7757 (01) 00768-3
CrossRef Полный текст | Google Scholar
Урбано, Б. Ф., и Ривас, Б. Л. (2014). Сорбционные свойства хелатирующей нанокомпозитной смолы полимер – глина на основе иминодиуксусной кислоты и монтмориллонита: водопоглощение, поглощение ионов металлов, селективность и кинетика. J. Chem. Tech. Биотех. 89, 249–258. DOI: 10.1002 / jctb.4109
CrossRef Полный текст | Google Scholar
Урбано, Б. Ф., Ривас, Б. Л., Мартинес, Ф., и Александратос, С. Д. (2012b). Нерастворимая в воде нанокомпозитная ионообменная смола полимер-глина на основе нанокомпозитной ионообменной смолы N-метил-d полимер-глина на основе лигандных групп N-метил-dglucamine для удаления мышьяка. Реактивная функция. Polym. 72, 642–649. DOI: 10.1016 / j.reactfunctpolym.2012.06.008
CrossRef Полный текст | Google Scholar
Урбано, Б.Ф., Вилленас И., Ривас Б. Л. и Кампос К. Х. (2015). Катионный полимер-нанокомпозитный сорбент TiO2 для удаления арсената. Chem. Англ. J. 268, 362–370. DOI: 10.1016 / j.cej.2015.01.068
CrossRef Полный текст | Google Scholar
Урбано Б. и Ривас Б. Л. (2012). Ионообменные смолы полимер-глина поли (4-стиролсульфонат) и поли (2-акриламидогликолевая кислота) с улучшенными механическими свойствами и удерживанием ионов металлов. Polym. Int. 61, 23–29.DOI: 10.1002 / pi.3178
CrossRef Полный текст | Google Scholar
Урбано Б., Ривас Б. Л., Мартинес Ф. и Александратос С. Д. (2012a). Равновесное и кинетическое исследование сорбции мышьяка водонерастворимой нанокомпозитной смолой поли [N- (4-винилбензил) -N-метил-D-глюкамин] -монтмориллонита. Chem. Англ. J. 193– 194, 21–30. DOI: 10.1016 / j.cej.2012.03.065
CrossRef Полный текст | Google Scholar
Валле, Х., Санчес, Дж., И Ривас, Б. Л. (2015).Поли (N-винилпирролидон-со-2-акриламидо-2-метилпропансульфонат натрия): синтез, характеристика и его потенциальное применение для удаления ионов металлов из водного раствора. J. Appl. Polym. Sci. 132, 41272. doi: 10.1002 / app.41272
CrossRef Полный текст | Google Scholar
Ватуцина О. М., Солдатов В. С., Соколова В. И., Йоханн Дж., Биссен М. и Вайссенбахер А. (2007). Новый гибридный (полимерный / неорганический) волокнистый сорбент для удаления мышьяка из питьевой воды. Реактивная функция. Polym. 67, 184–201. DOI: 10.1016 / j.reactfunctpolym.2006.10.009
CrossRef Полный текст | Google Scholar
Вукович, Г. Д., Маринкович, А. Д., Шкапин, С. Д., Ристич, М. Т., Алексич, Р., Перич-Груич, А. А. и др. (2011). Удаление свинца из воды с помощью модифицированных аминогруппами многостенных углеродных нанотрубок. Chem. Англ. J. 173, 855–865. DOI: 10.1016 / j.cej.2011.08.036
CrossRef Полный текст | Google Scholar
Ван, X., Фан, Q., Yu, S., Chen, Z., Ai, Y., Sun, Y., et al. (2016). Высокая сорбция U (VI) на оксидах графена исследована серийными экспериментальными и теоретическими расчетами. Chem. Англ. J. 287, 448–455. DOI: 10.1016 / j.cej.2015.11.066
CrossRef Полный текст | Google Scholar
Вен, Дж., И Уилкс, Г. Л. (1996). Органические / неорганические гибридные сетевые материалы на основе золь-гель подхода. Chem. Матер. 8, 1667–1681. DOI: 10,1021 / см 9601143
CrossRef Полный текст | Google Scholar
Сюй, Ю., Акс, Л., Йи, Н., и Дайер, Дж. А. (2006). Бидентатное комплексообразование, моделирующее адсорбцию тяжелых металлов и конкуренцию на гетите. Environ. Sci. Tech. 40, 2213–2218. DOI: 10.1021 / es051916e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Юань, Ю., Чжан, Г., Ли, Ю., Чжан, Г., Чжан, Ф., и Фань, X. (2013). Оксид графена, модифицированный поли (амидоамином), как эффективный адсорбент ионов тяжелых металлов. Polym. Chem. 4, 2164–2167. DOI: 10.1039 / c3py21128b
CrossRef Полный текст | Google Scholar
Юксель, С., Ривас, Б. Л., Санчес, Дж., Мансилла, Х. Д., Яньес, Дж., Кочифас, П. и др. (2014). Водорастворимый полимер и фотокатализ для удаления мышьяка. J. Appl. Polym. Sci . 131, 40871. DOI: 10.1002 / APP.40871
CrossRef Полный текст | Google Scholar
Загородний А.А. (2007). Свойства и применение ионообменных материалов. Амстердам: Elsevier BV.
Google Scholar
Zang, Z., Hu, Z., Li, Z., He, Q., и Chang, X. (2009). Синтез, характеристика и применение модифицированных этилендиамином многослойных углеродных нанотрубок для селективной твердофазной экстракции и концентрирования ионов металлов. J. Hazard. Матер. 172, 958–963. DOI: 10.1016 / j.jhazmat.2009.07.078
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан Дж., Чен Х. и Ван А. (2005). Исследование суперабсорбирующего композита. III. свеллиновые свойства композита полиакриламид / аттапульгит на основе подкисленного аттапульгита и органо-аттапульгита. евро. Polym. J . 41, 2434–2442. DOI: 10.1016 / j.eurpolymj.2005.03.022
CrossRef Полный текст | Google Scholar
Чжан, К., Ду, К., Хуа, М., Цзяо, Т., Гао, Ф., и Пан, Б. (2013a). Усиление сорбции ионов свинца из воды нанокомпозитами из наноразмерного оксида циркония на основе полистирола. Environ. Sci. Technol. 47, 6536–6544. DOI: 10.1021 / es400919t
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан Ю. и Ли З. (2017). Удаление тяжелых металлов с использованием наноразмерного водного оксида железа на гидрогелевой основе: синтез, характеристика и механизм. Sci. Total Environ. 580, 776–786. DOI: 10.1016 / j.scitotenv.2016.12.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, Ю., Ван, X., Лю, Дж., И Ву, Л. (2013b). Удаление меди (Cu 2+ ) из воды с использованием новых гибридных адсорбентов: кинетика и изотермы. J. Chem. Англ. Данные 58, 1141–1150. DOI: 10.1021 / je301168m
CrossRef Полный текст | Google Scholar
Zhang, Y., Wu, B., Xu, H., Liu, H., Wang, M., He, Y., et al. (2016).Очистка воды и сточных вод с использованием наноматериалов. NanoImpact 3, 22–39. DOI: 10.1016 / j.impact.2016.09.004
CrossRef Полный текст | Google Scholar
Чжао, X., Lv, L., Pan, B., Zhang, W., Zhang, S., и Zhang, Q. (2011). Нанокомпозиты на полимерной основе для экологического применения: обзор. Chem. Англ. J. 170, 381–394. DOI: 10.1016 / j.cej.2011.02.071
CrossRef Полный текст | Google Scholar
Чжэн, Ю., Ли, П., Чжан, Дж., и Ван, А. (2007). Исследование суперабсорбирующего композита XVI. Синтез, характеристика и поведение при набухании поли (акрилата натрия) / вермикулита суперабсорбирующих композитов. евро. Polym. J. 43, 1691–1698. DOI: 10.1016 / j.eurpolymj.2007.02.023
CrossRef Полный текст | Google Scholar
Чжоу, Л., Ван, Ю., Лю, З., и Хуанг, К. (2009). Характеристики равновесия, кинетические исследования адсорбции ионов Hg (II), Cu (II) и Ni (II) магнитными микросферами хитозана, модифицированными тиомочевиной. J. Hazard. Матер. 161, 995–1002. DOI: 10.1016 / j.jhazmat.2008.04.078
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Растворимость ионных соединений | Протокол
4.7: Растворимость ионных соединений
Растворимость — это мера максимального количества растворенного вещества, которое может быть растворено в данном количестве растворителя при данной температуре и давлении. Растворимость обычно измеряется молярностью ( M ) или молями на литр (моль / л).Соединение называется растворимым, если оно растворяется в воде.
Когда растворимые соли растворяются в воде, ионы твердого вещества разделяются и равномерно диспергируются по всему раствору; этот процесс представляет собой физическое изменение, известное как диссоциация. Хлорид калия (KCl) является примером растворимой соли. Когда твердый KCl добавляется в воду, положительный (водородный) конец полярных молекул воды притягивается к отрицательным ионам хлора, а отрицательный (кислородный) конец воды притягивается к положительным ионам калия.Молекулы воды окружают отдельные ионы K + и Cl —, уменьшая сильные силы, связывающие ионы вместе, и позволяя им переходить в раствор в виде сольватированных ионов.
Другим примером растворимой соли является нитрат серебра AgNO 3 , который растворяется в воде в виде ионов Ag + и NO 3 —. Нитрат, NO 3 —, представляет собой многоатомный ион, и в растворе он остается неизменным как единое целое. В отличие от одноатомных ионов (K + , Cl — , Ag + ), которые содержат только один атом, многоатомные ионы представляют собой группу атомов, несущих заряд (NO 3 — , SO 4 2-, NH 4 + ).Они остаются такими в растворе и не расщепляются на отдельные атомы.
Соединение считается нерастворимым, если оно не растворяется в воде. Однако в действительности «нерастворимые» соединения растворяются до некоторой степени, то есть менее 0,01 М.
В случае нерастворимых солей сильные межионные силы, связывающие ионы в твердом теле, сильнее ионно-дипольных сил между отдельными ионами и молекулами воды. В результате ионы остаются нетронутыми и не разделяются. Таким образом, большая часть соединения остается нерастворенной в воде.Хлорид серебра (AgCl) является примером нерастворимой соли. Молекулы воды не могут преодолеть сильные межионные силы, которые связывают ионы Ag + и Cl — вместе; следовательно, твердое вещество остается нерастворенным.
Правила растворимости
Растворимость ионных соединений в воде зависит от типа ионов (катион и анион), образующих соединения. Например, AgNO 3 растворим в воде, а AgCl не растворим в воде. Растворимость соли можно предсказать, следуя набору эмпирических правил (перечисленных ниже), разработанных на основе наблюдений за многими ионными соединениями.
i) Растворимы соединения, содержащие ионы аммония (NH 4 + ) и катионы щелочных металлов.
ii) Все нитраты и ацетаты всегда растворимы.
iii) Хлоридные, бромидные и йодидные соединения растворимы, за исключением серебра, свинца и ртути (I)
iv) Все сульфатные соли растворимы, за исключением их солей с серебром, свинцом, ртутью (I), барием, стронций и кальций
v) Все карбонаты, сульфиты и фосфаты нерастворимы, за исключением их солей с катионами аммония и щелочных металлов.
vi) Сульфиды и гидроксиды всех солей нерастворимы, за исключением их солей с катионами щелочных металлов, ионом аммония и ионами кальция, стронция и бария.
vii) Все оксидсодержащие соединения нерастворимы, за исключением их соединений с катионами кальция, бария и щелочных металлов.
Этот текст адаптирован из OpenStax Chemistry 2e, раздел 11.2: Электролиты.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.

 и является основным критерием оценки растворимости.
и является основным критерием оценки растворимости.