Содержание
Кристаллические решетки ионные — Справочник химика 21
Чем отличаются вещества с кристаллической решеткой ионного типа от веществ с кристаллической решеткой молекулярного типа (примеры) [c.50]
Энергия кристаллической решетки ионного кристалла может быть вычислена независимым путем, если известны радиусы ионов. Для бинарного кристалла АВ эта величина рассчитывается по формуле [c.213]
Напомним, что, согласно изложенному в разд. 7.3, ч. 1, анионы, как правило, имеют большие радиусы, чем катионы. Поэтому можно представить себе кристаллическую решетку ионного вещества в виде плотноупакованной анионной структуры, в которой тот или иной тип дырок занят катионами. Относительные размеры катионов и анионов определяют тип дырок, занимаемых катионами. Наиболее устойчивая структура достигается при максимальном числе контактов между катионами и анионами, что соответствует наибольшей суммарной величине сил электростатического притяжения между противоположно заряженными ионами в кристаллической решетке ионного вешества.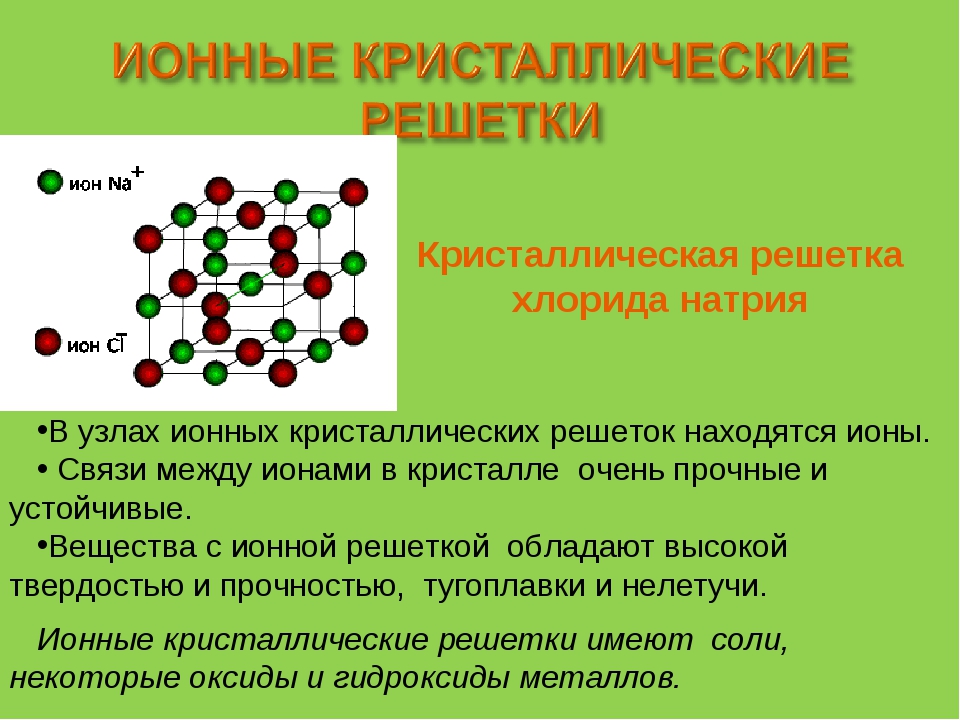 Однако устойчивая структура не может существовать при наличии прямых контактов между анионами, которые привели бы к появлению слишком больших электростатических сил отталкивания. Рассмотрим подробнее различные возможности на примере ситуации, когда небольшие катионы в точности заполняют тетраэдрические дырки, образованные плотноупакованным расположением анионов. Как было указано, такая ситуация возникает при условии, что отношение радиусов катиона и аниона rJr равно 0,225. При таком условии катион касается четырех окружающих его анионов. Теперь посмотрим, что произойдет, если размер катиона начнет увеличиваться, так что станет выполняться условие rJr > 0,225. В таком случае анионы раздвигаются, что уменьшает дестабилизующие контакты между ними, тогда как стабилизующие структуру катионно-анионные контакты сохраняются. Однако, когда отношение радиусов достигает значения 0,414, положение катиона в тетраэдрической дырке перестает быть устойчивым. Более устойчивым положением для катиона становится октаэдрическая дырка, находясь в которой он обеспечивает большее число [c.
Однако устойчивая структура не может существовать при наличии прямых контактов между анионами, которые привели бы к появлению слишком больших электростатических сил отталкивания. Рассмотрим подробнее различные возможности на примере ситуации, когда небольшие катионы в точности заполняют тетраэдрические дырки, образованные плотноупакованным расположением анионов. Как было указано, такая ситуация возникает при условии, что отношение радиусов катиона и аниона rJr равно 0,225. При таком условии катион касается четырех окружающих его анионов. Теперь посмотрим, что произойдет, если размер катиона начнет увеличиваться, так что станет выполняться условие rJr > 0,225. В таком случае анионы раздвигаются, что уменьшает дестабилизующие контакты между ними, тогда как стабилизующие структуру катионно-анионные контакты сохраняются. Однако, когда отношение радиусов достигает значения 0,414, положение катиона в тетраэдрической дырке перестает быть устойчивым. Более устойчивым положением для катиона становится октаэдрическая дырка, находясь в которой он обеспечивает большее число [c. 352]
352]
Экспериментально определить энергию кристаллической решетки ионного соединения очень сложно. Ее можно вычислить посредством термодинамического цикла (цикл Борна — Габера), воспользовавшись другими известными энтальпиями превращений, которым может подвергаться исследуемое ионное соединение. [c.214]
Объяснение. Как известно, кристаллы сильно полярных солей состоят из ионов, которые образуют так называемую кристаллическую решетку. Ионы в такой решетке связаны между собой электростатическими силами притяжения. Силы взаимодействия в ионных кристаллах весьма значительны. В твердом виде ионные кристаллы не проводят электрический ток, так как в них электроны прочно удерживаются в атомных орбитах отдельных ионов. В расплавленном состоянии кристаллические вешества проводят электрический ток, причем электропроводность осуществляется за счет переноса ионов. [c.68]
Возможность образования ионной атмосферы вытекает из статистической теории электролитов. Распределение ионов в растворе следует рассматривать как промежуточное между беспорядочным распределением молекул в жидкости и упорядоченным распределением частиц в кристаллической решетке. Ионы в растворе в каждый данный момент времени распределены не хаотически, а в некоторой степени упорядоченно благодаря кулоновскому притяжению зарядов противоположного знака. В каждый момент времени вокруг любого из ионов формируется оболочка из ионов противоположного заряда — ионная атмосфера (рис. 6.1,а). [c.286]
Распределение ионов в растворе следует рассматривать как промежуточное между беспорядочным распределением молекул в жидкости и упорядоченным распределением частиц в кристаллической решетке. Ионы в растворе в каждый данный момент времени распределены не хаотически, а в некоторой степени упорядоченно благодаря кулоновскому притяжению зарядов противоположного знака. В каждый момент времени вокруг любого из ионов формируется оболочка из ионов противоположного заряда — ионная атмосфера (рис. 6.1,а). [c.286]
Расчет энергии кристаллической решетки ионного кристалла. [c.14]
Твердые растворы металлов также обладают свойствами, качественно напоминающими свойства индивидуальных металлов, но количественно отличающимися от них и зависящими от состава растворов, который может изменяться в довольно широких пределах. Среди компонентов твердого раствора различают металл—растворитель и растворенный металл. Растворителем считается металл, который сохраняет свою кристаллическую решетку при образовании раствора и содержание которого в растворе должно быть не менее определенного значения. Ионы растворяемого металла постепенно замещают в кристаллической решетке ионы металла—растворителя (растворы замещения) или же располагаются между ионами металла—растворителя (растворы внедрения). Содержание растворенного металла в твердом растворе может быть не больше определенной величины. В случае, когда различные металлы с близкими кристаллическими решетками способны образовать твердые растворы в любых количественных соотношениях, уже нет возможности отличать растворенный металл от металла—растворителя, а приходится считать, что металлы взаимно растворяют друг друга. [c.32]
Ионы растворяемого металла постепенно замещают в кристаллической решетке ионы металла—растворителя (растворы замещения) или же располагаются между ионами металла—растворителя (растворы внедрения). Содержание растворенного металла в твердом растворе может быть не больше определенной величины. В случае, когда различные металлы с близкими кристаллическими решетками способны образовать твердые растворы в любых количественных соотношениях, уже нет возможности отличать растворенный металл от металла—растворителя, а приходится считать, что металлы взаимно растворяют друг друга. [c.32]
Если бы поляризационные взаимодействия между ионами отсутствовали, тип кристаллической решетки ионного соединения определялся бы только числом структурных единиц и их размерами (XII 2). Однако поляризационные явления играют важную роль при образовании кристаллов и иногда сильно влияют на тип образуемой кристаллизующимся веществом решетки. [c.425]
Есть ли различие в протекании процесса растворения веществ с кристаллическими решетками ионного и молекулярного типа [c.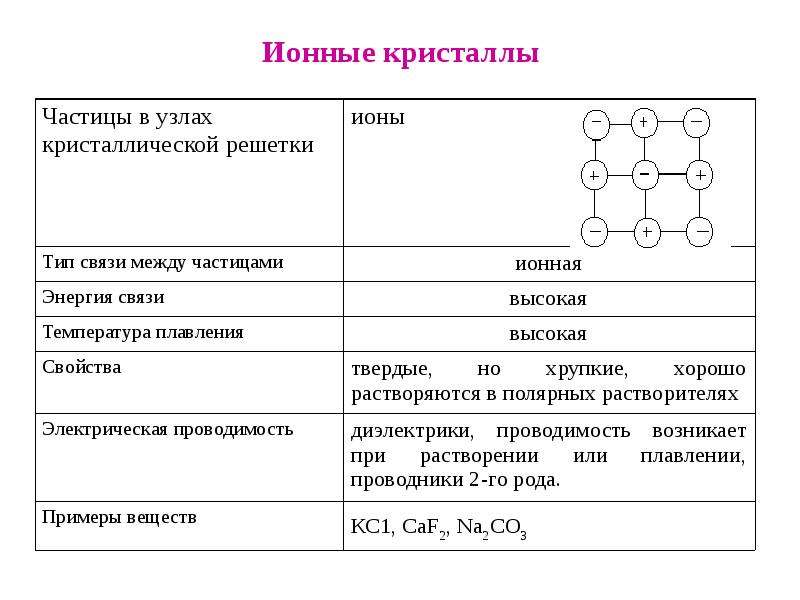 51]
51]
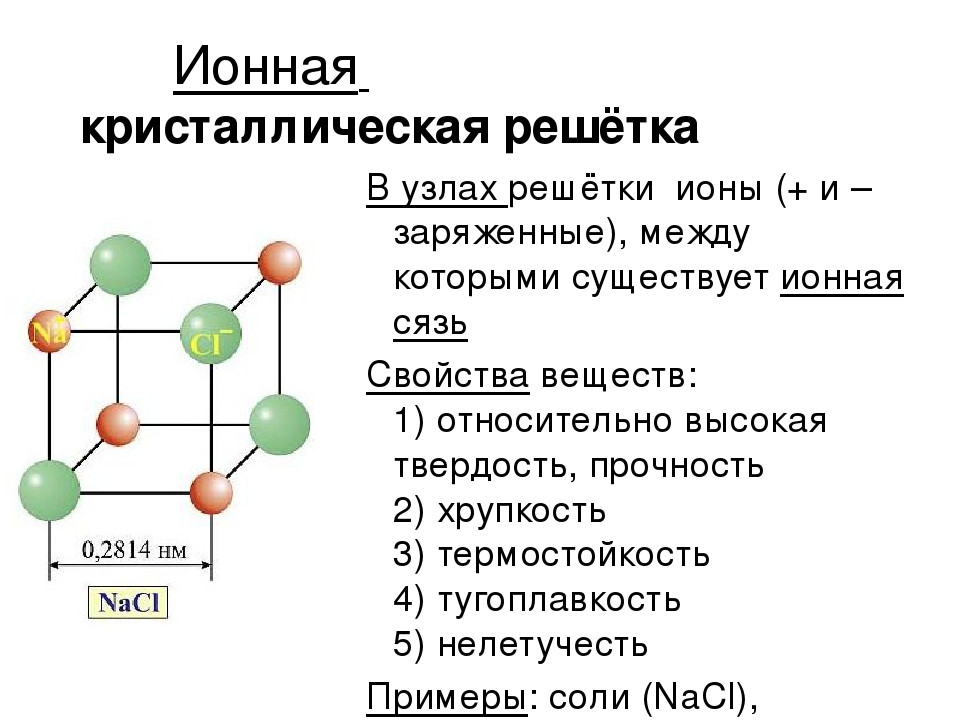
Во-вторых, большинство химических сложных веществ состоит не из молекул, а из ионов. Ионными соединениями являются все соли, а также солеобразные соединения (см. 6.10). Составными частями таких соединений являются одноэлементные или многоэлементные ионы, соединенные между собой (в кристаллической решетке) ионной связью. [c.25]
Гетерогенные высокодисперсные коллоидные системы в большинстве случаев существуют в виде дисперсий трехмерных и двухмерных структур как аморфных (включая жидкости), так и относящихся к различным кристаллическим решеткам — ионной, атомной, молекулярной или металлической. Дисперсионной средой обычно является нерастворяющая жидкость, реже газы. Наличие высокоразвитой поверхности раздела — наиболее характерная черта, общая для всех коллоидных систем этого рода. [c.23]
Гидроксиды Э(0Н)2 — белые порошкообразные вещества (кристаллическая решетка ионная) Они могут быть получены в безводном состоянии и в виде кристаллогидратов с 1, 2, 3, 8 молекулами воды Растворимость в воде относительно невелика и увеличивается при переходе от Ве(ОН)г к Ва(ОН)г Некоторые свойства гидроксидов элементов группы ПА приведены ниже [c.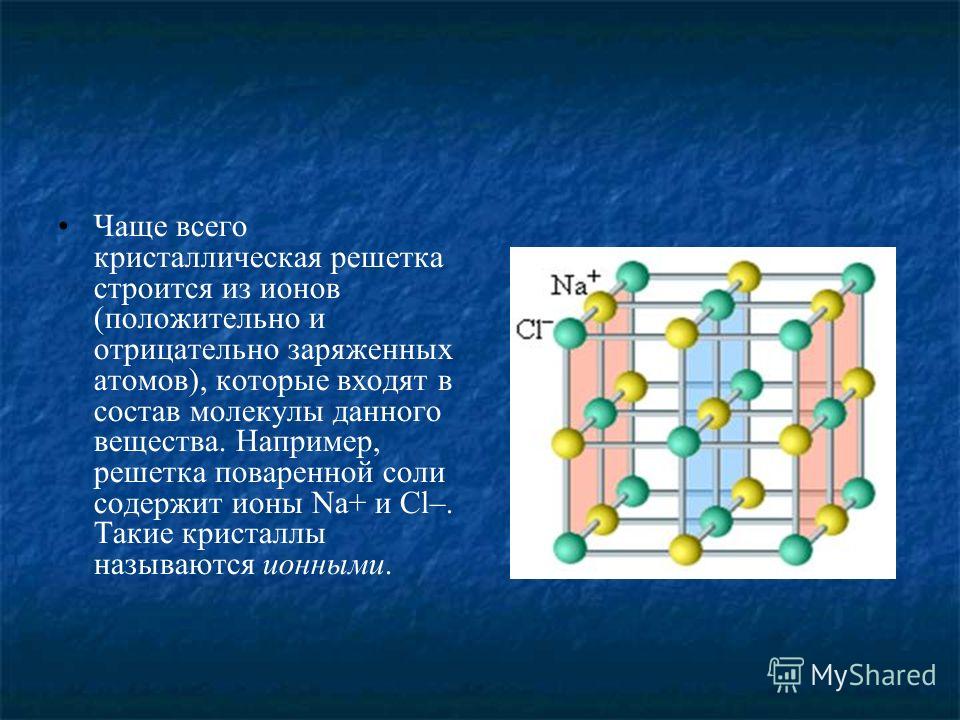 198]
198]
К сильным электролитам относят вещества, которые полностью диссоциированы и не образуют ионных пар, т. е. агрегатов из противоположно заряженных ионов, которые в целом не несут электрического заряда. В твердом состоянии сильные электролиты образуют кристаллическую решетку ионного типа. Подобных веществ сравнительно немного. К ним относятся минеральные соли щелочных и щелочно-земельных металлов, галогениды, перхлораты и нитраты некоторых переходных металлов. Минеральные кислоты и щелочи являются сильными электролитами только в достаточно разбавленных водных растворах. В концентрированных же растворах они диссоциированы не полностью. [c.43]
Общее название веществ, обладающих способностью люминесцировать — люминофоры. Так же называются неорганические люминофоры. Сложные неорганические кристаллические люминофоры с дефектной структурой, вызванной внедрением в их кристаллическую решетку ионов тяжелых металлов (активаторов), называют кристаллофосфорами.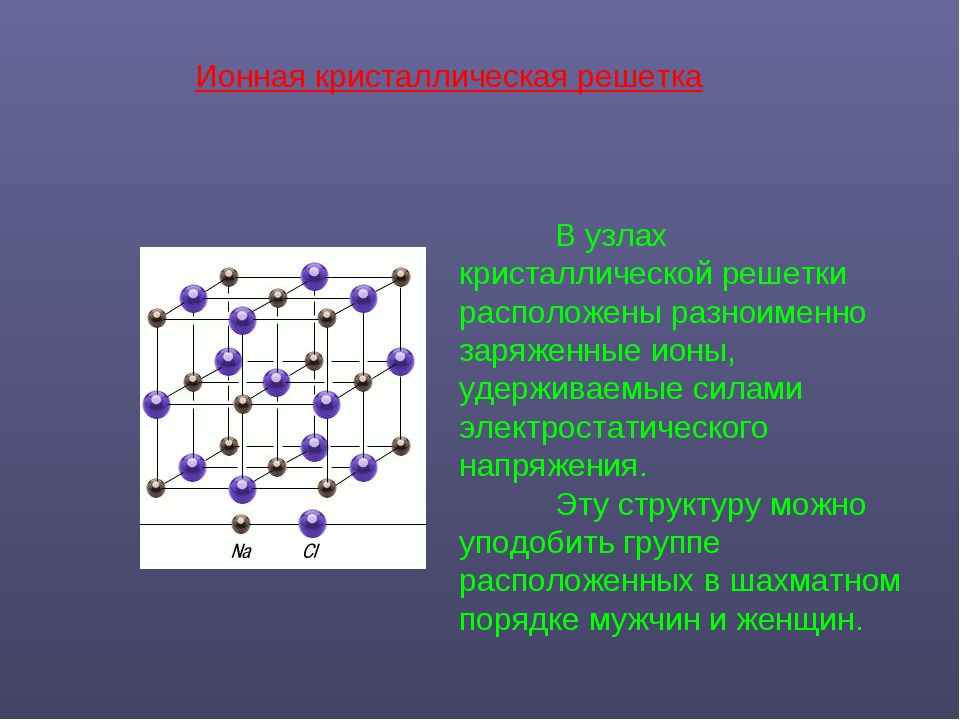 Органические люминофоры принято называть органолюминофорами. [c.498]
Органические люминофоры принято называть органолюминофорами. [c.498]
Заряд ионов. Электрический заряд ионов (обозначаемый в формулах арабской цифрой с последующим знаком + или — ) определяет, в каком соотношении эти ионы находятся в кристаллической решетке ионного соеди-нения. [c.157]
Для энергии кристаллической решетки ионного кристалла Л. Полинг [ ] дает следующую формулу [c.99]
Можно, до известной степени, провести параллели между силами сцепления и силами, которые удерживают в кристаллической решетке ионы гетерополярных и молекулы гомеополярных веществ. Эти силы находятся в тесной связи со строением решетки. От них зависит величина теплоты плавления и температуры плавления. Эти величины [c.202]
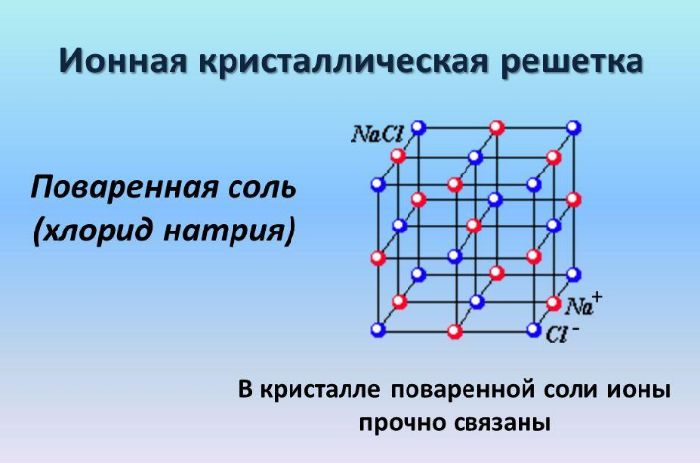
Кристаллическую решетку ионного соединения можно рассматривать как бесконечное повторение минимального трехмерного участка (параллелепипеда), называемого элементарной ячейкой. В соответствии с симметрией элементарной ячейки кристаллическую решетку относят к одной из кристаллических систем (сингоний) кубической, тетрагональной, гексагональной, тригональной, орторомбической, моноклинной и триклинной (в порядке убывания симметрии). Нена-сыщаемость и ненаправленность ионной связи приводят в большинстве ионных кристаллов к образованию структур так называемых плотнейших упаковок. Это кубические решетки типов Na I и s l (рис. 60), сфалерита (ZnS) и флюорита (СаРг), гексагональные типа ZnO и др. [c.129]
В соответствии с симметрией элементарной ячейки кристаллическую решетку относят к одной из кристаллических систем (сингоний) кубической, тетрагональной, гексагональной, тригональной, орторомбической, моноклинной и триклинной (в порядке убывания симметрии). Нена-сыщаемость и ненаправленность ионной связи приводят в большинстве ионных кристаллов к образованию структур так называемых плотнейших упаковок. Это кубические решетки типов Na I и s l (рис. 60), сфалерита (ZnS) и флюорита (СаРг), гексагональные типа ZnO и др. [c.129]
Энергией кристаллической решетки ионного соединения, ЛЯкр, называют то количество энергии, которое требуется для удаления 1 моль ионов из решетки на расстояние, при котором силы взаимодействия между ионами бесконечно малы. Например, для кристалла Na l стандартная энергия кристаллической решетки равна [c.213]
Простые соли — соединения типичных металлических элементов с окислительными элементами (оксоидами). Связь между атомами в молекулах простых солей, находящихся в газовом состоянии, преимущественно ионная, по крайней мере для типичных случаев (т. е. для соединений наиболее активных, например щелочных, металлов с активными оксоидами, например галогенами). Простые соли характеризуются кристаллическими решетками ионного типа, а в жидком состоянии — ионной электропроводностью. Несомненно, что к классу простых солей должны быть отнесены оксиды и нитриды активных металлов, поскольку они характеризуются теми же типичными для солей признаками гидриды наиболее активных (например, щелочных) металлов также являются простыми солями, обладая всеми их признаками. Характерной химической функцией простых солей является их способность бьта донорами положительно и отрицательно заряженных элементарных ионов, сочетаниями которых они являются. [c.51]
е. для соединений наиболее активных, например щелочных, металлов с активными оксоидами, например галогенами). Простые соли характеризуются кристаллическими решетками ионного типа, а в жидком состоянии — ионной электропроводностью. Несомненно, что к классу простых солей должны быть отнесены оксиды и нитриды активных металлов, поскольку они характеризуются теми же типичными для солей признаками гидриды наиболее активных (например, щелочных) металлов также являются простыми солями, обладая всеми их признаками. Характерной химической функцией простых солей является их способность бьта донорами положительно и отрицательно заряженных элементарных ионов, сочетаниями которых они являются. [c.51]
Кристаллические решетки ионных соединений. Решетку можно рассматривать как бесконечное новторение минимального трехмерного участка (пареллелепипеда), называемого элементарной ячейкой. В соответствии с симметрией элементарной ячейки кристаллическую решетку относят к одной из семи кристаллических систем (сингоний) кубической, тетрагональной, гексагональной, тригональной, орторомбической, моноклинной и триклинной (в порядке убывания симметрии).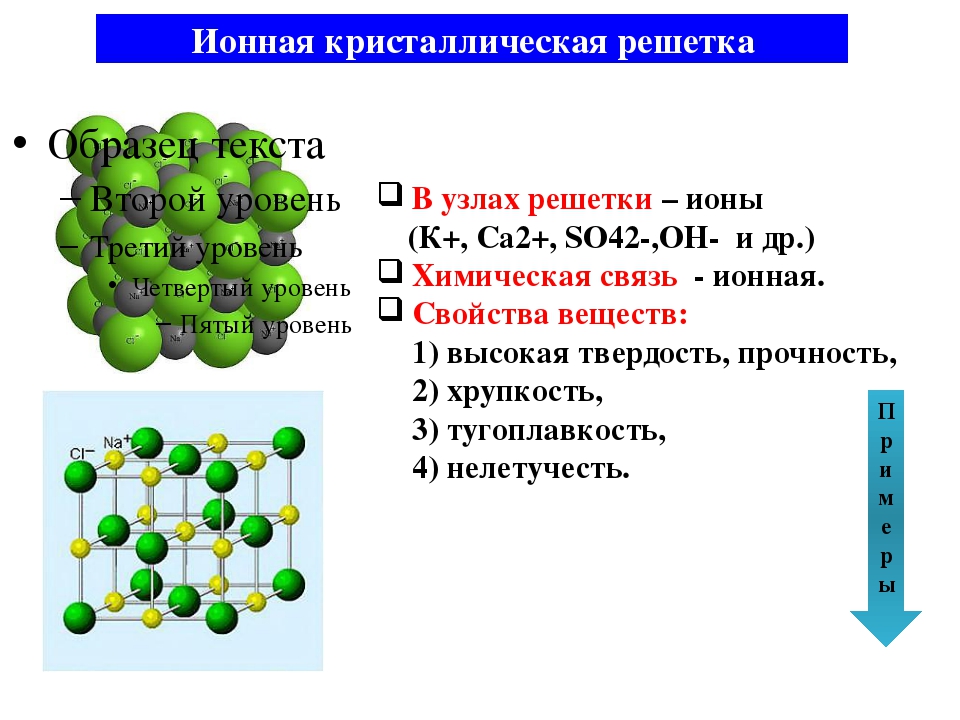 [c.167]
[c.167]
Ионы [РЮ1б]2″ занимают углы кубической, центрированной в гранях, кристаллической решетки. Ионы К составляют куб. [c.135]
Упругость кристаллических твердых тел обусловлена тем, что небольшое увеличение (при приложении виешних сил) нормальных для данного вещества расстояний между молекулами (или ионами, если кристаллическая решетка ионная) сопровождается работой против сил кристаллической реиштки (и вообще межмолекулярных сил). Именно эти силы и стремятся после снятия нагрузки вернуть молекулы (ионы) в их нормальное положение. [c.321]
Оксид титана(1У) TIO2 может существовать в виде бесцветных кристаллов трех модификаций — рутил, анатаз и брукит. Все его модификации образуют очень прочные кристаллические решетки ионного типа. Он медленно растворяется только в концентрированной серной кислоте, образуя оксосульфат (сульфат титанила) [c.345]
При соприкосновении СдЗ с водой происходит удаление из его кристаллической решетки ионов кальция и образование пористого модифицированного слоя на поверхности минерала за счет стягивания — возникновение промежуточного продукта гидратации. Судя по кривой pH, насыщение дисперсионной среды щелочными ионами достигается к 3 ч от начала гидратации, после чего остается практически постоянным [341. По ИК-спектрам идентифицирован СдЗ и доказано наличие конденсации тетраэдров и образование слоистых гидросиликатов. При гидратации наблюдается увеличение активности и величин поверхности трехкальциевого силиката и его новообразований, доказываемое ростом теплового эффекта при смачивании образцов водой. Аномально высокое значение теплоты смачивания исходного СдЗ водой обусловлено частичным растворением вяжущего, поверхностными ионообменными реакциями и другими факторами. Об этом свидетельствует малый тепловой эффект при смачивании бензолом, в то время как для гидрати- [c.236]
Судя по кривой pH, насыщение дисперсионной среды щелочными ионами достигается к 3 ч от начала гидратации, после чего остается практически постоянным [341. По ИК-спектрам идентифицирован СдЗ и доказано наличие конденсации тетраэдров и образование слоистых гидросиликатов. При гидратации наблюдается увеличение активности и величин поверхности трехкальциевого силиката и его новообразований, доказываемое ростом теплового эффекта при смачивании образцов водой. Аномально высокое значение теплоты смачивания исходного СдЗ водой обусловлено частичным растворением вяжущего, поверхностными ионообменными реакциями и другими факторами. Об этом свидетельствует малый тепловой эффект при смачивании бензолом, в то время как для гидрати- [c.236]
Наиболее простыми кристаллическими решетками ионного типа являются решетки ЫаС1 и СзС1, рассмотренные нами ранее (см. рис. 6-2). Однако в кристаллах веществ, содержащих комплексные ионы, структура элементарных ячеек может быть очень сложной. [c.107]
[c.107]
На рис. 5 схематически изображен кусок меди. Здесь атомы не имеют одного электрона. Объединяясь в кристаллическую решетку, атомы теряют свой самый удагген-ный электрон (слабее всех связанный). Этот электрон становится свободным. Таким образом, создается кристаллическая решетка ионов и электронный газ. При отсутствии электрического поля имеется только тепловое поле. [c.17]
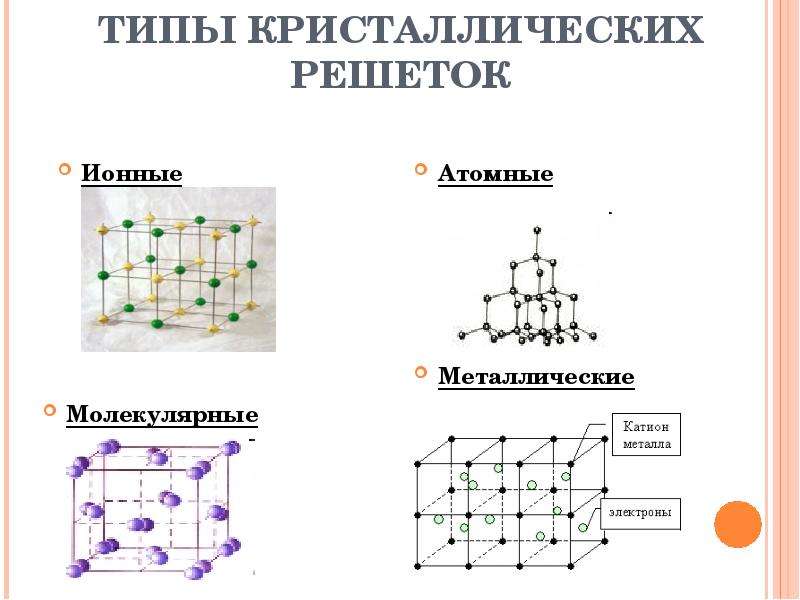
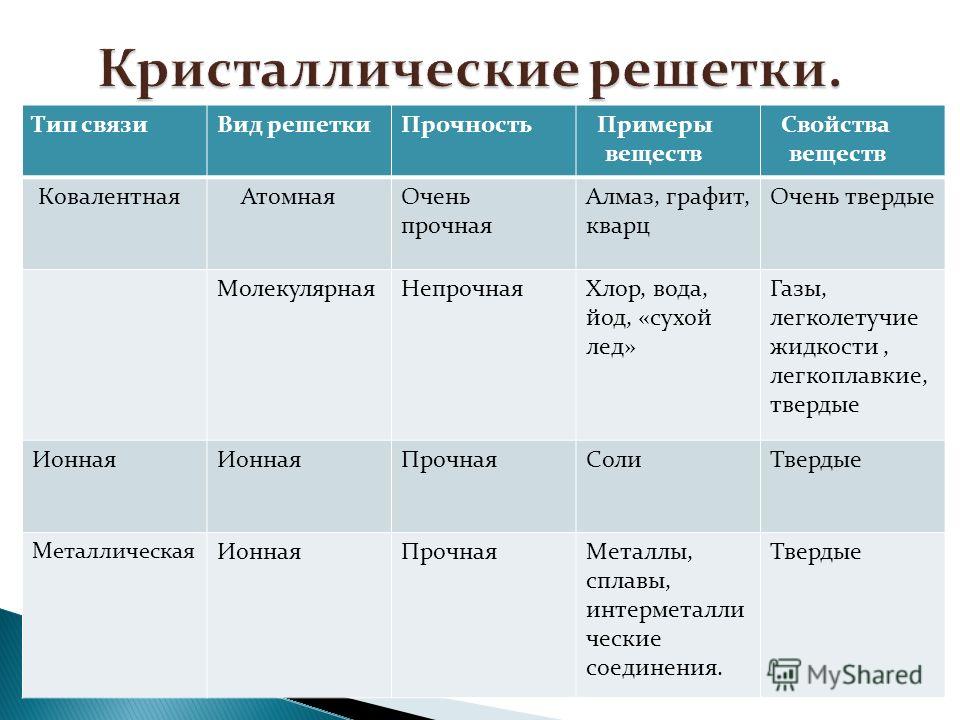
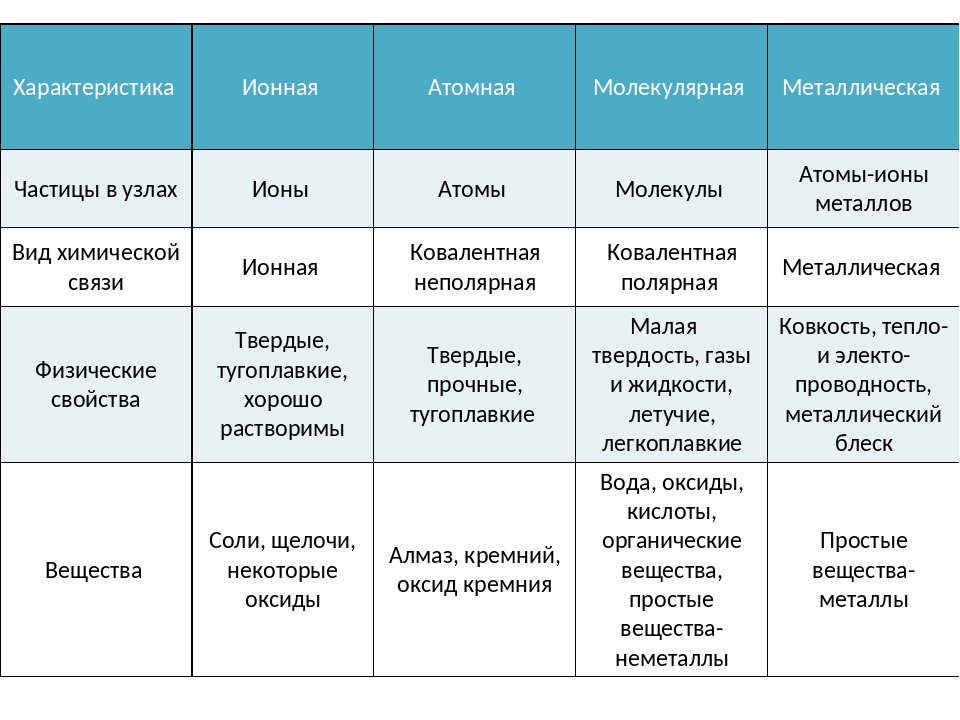
Учащимся предлагают выполнить задания после краткого напоминания учителем, какие существуют виды химической связи (ионная, ковалентная полярная, ковалентная неполярная, металлическая), какого типа кристаллические решетки (ионная, атомная, молекулярная, металлическая) образуют вещества при затвердевании. Чтобы возбудить интерес учащихся к выполнению работы, учитель предлагает учащимся попытаться самостоятельно определить, какие виды связи имеются между химическими элементами в тех или ииых указанных веществах, какого типа кристаллические решетки имеют указ. .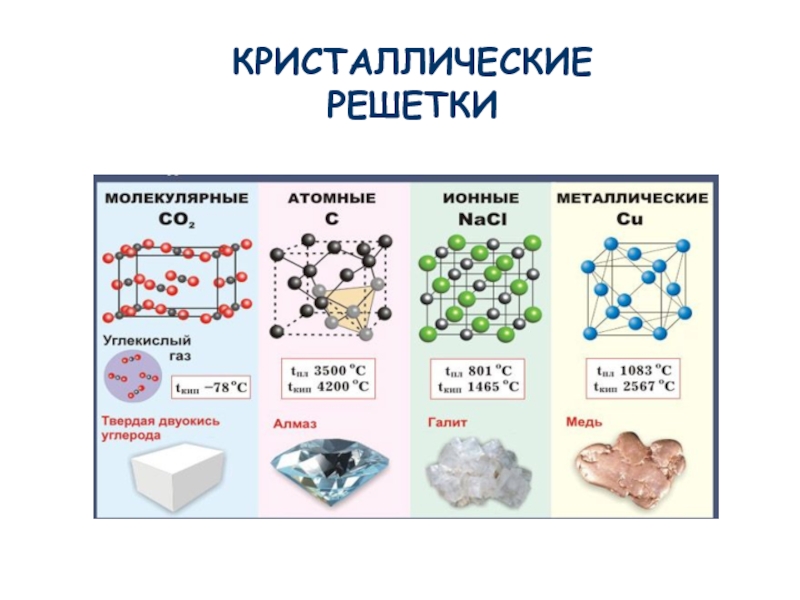 н-иые твердые вещества. [c.121]
н-иые твердые вещества. [c.121]
В кристаллах ионного типа, например, галите Na l, флюорите СаРг, кварце ЗЮг, положительно заряженные атомы (катионы) отдают электроны из наружной электронной оболочки, а отрицательно заряженные (анионы) принимают их. Вследствие этого число положительных зарядов соответствует числу отрицательных. Длина связи между катионом и анионом приблизительно равна сумме их радиуса действия. Энергия кристалла (так часто называют энергию кристаллической решетки) ионного типа пропорциональна числу структурных единиц 2/п, слагающих кристалл (на это число ионов распадается молекула), валентности ионов Zi и Z2 и обратно пропорциональна радиусам действия атомов гк — катиона и га — аниона. [c.16]
В(. граиваюгииеся из газовой фазы в кристаллическую решетку ионы кислорода коицентри[)уются вблизи поверхности кристалла N 0, а затем часть пикеля диффундирует к повер, ности, чтобы сбалансировать избыточный. электрический заряд. При эго.м в объеме кристалла возникают вакансии. Черный оксид нтн сля проводит электрический тoк 1ак как электроны. могут легко переходить от к N1 + [c.82]
При эго.м в объеме кристалла возникают вакансии. Черный оксид нтн сля проводит электрический тoк 1ак как электроны. могут легко переходить от к N1 + [c.82]
Из фторобериллатов наиболее важны соединения состава М2 Вер4(1М11Вер4) и М ВеРз. Фторобериллаты — комплексы, содержащие в кристаллической решетке ион Вер42 с тетраэдрической конфигурацией ионов фтора. [c.26]
Жан Дюран, пропустив сухой ацетилен над нагретым до 450 °С порошком бериллия, получил черные кристаллы карбида бериллия другого состава — ВеСд. Впрочем, черный цвет скорее всего был вызван примесью углерода, который одновременно выделялся при термическом разложении ацетилена. Позже установили, что карбид Лебо содержит в кристаллической решетке ионы Ве и С , а карбид Дюрана — ионы Ве и С . Как эти карбиды будут реагировать с водой [c.158]
В табл. 6.1 с)пммированы результаты современных исследований природы окраски кристаллов кварца. Коричневые синтетические камни, напоминающие природный цитрин, были получены добавлением в гидротермальный раствор соединений железа, причем затравочные пластины вырезались в специально выбранных направлениях. Предполагают, что коричневая окраска обусловлена или вхождением в кристаллическую решетку ионов трехвалентного железа, или тонко-дисперсньоми силикатами железа, присутствующими в виде очень мелких частичек внутри кристалла кварца. Зеленые камни получают нагреванием коричневых разновидностей для восстановления трехвалентного железа до двухвалентного опять же или в кристаллической решетке, нлн в тонкоднсперсных частичках. Прн радиоактивном облучении (например, когда в качестве источника излучения используют кобальт-60) кварц приобретает фиолетовую окраску, характерную [c.111]
Предполагают, что коричневая окраска обусловлена или вхождением в кристаллическую решетку ионов трехвалентного железа, или тонко-дисперсньоми силикатами железа, присутствующими в виде очень мелких частичек внутри кристалла кварца. Зеленые камни получают нагреванием коричневых разновидностей для восстановления трехвалентного железа до двухвалентного опять же или в кристаллической решетке, нлн в тонкоднсперсных частичках. Прн радиоактивном облучении (например, когда в качестве источника излучения используют кобальт-60) кварц приобретает фиолетовую окраску, характерную [c.111]
Французский химик Поль Лебо в 1895 г впервые получил карбид бериллия при взаимодействии оксида бериллия с углем Лебо спрессо вал из смеси ВеО и С таблетки и нагрел их в атмосфере водорода при 1900 °С По окончании реакции образовались красивые кирпично-крас ные кристаллы B g Позднее, в 1924 г, другой французский химик — Жан Дюран, пропустив сухой ацетилен над нагретым до 450 °С порош ком бериллия, получил черные кристаллы карбида бериллия другого состава — Be g Впрочем, черный цвет скорее всего был вызван при месью углерода, который одновременно выделялся при термическом разложении ацетилена Позже установили, что карбид Лебо содержит в кристаллической решетке ионы Ве и а карбид Дюрана — ионы Ве и С Как эти карбиды будут реагировать с водой [c.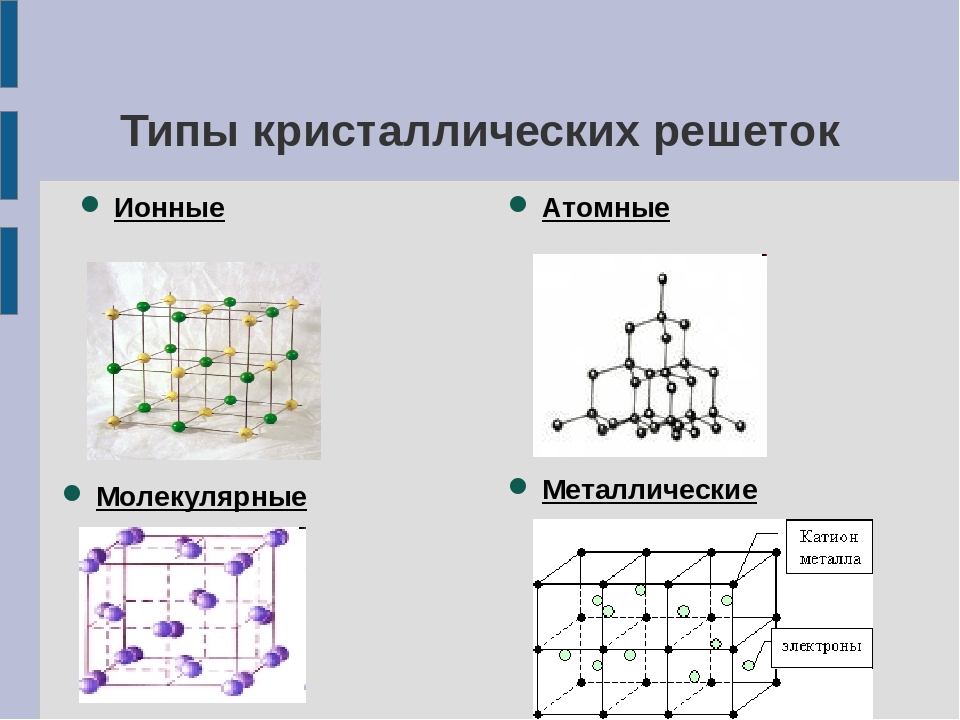 158]
158]
Ионные реакции (см. 7.6), как следует из их названия, протекают при участии ионов, причем такие ионы должны быть более или менее подвижными. Ионные реакции ие могут протекать между связанными ионами, которые на ходятся в узлах кристаллической решетки ионных соединений. Свободные, т. е. достаточно подвижные ионы, необходимые для проведения ионных реакций, появляются только в расплавах или в растворах вследствие электролиТи ческой диссоциации расплавленных или растворенных вешеств. [c.166]
Механизм процесса появления свободных ионов в растворе несколько иной, что обусловлено другой причиной разрыва связей в кристаллической решетке ионных соединений. Разрушение ионной решетки происходит под воздействием растворителя, например воды. Полярныг молекулы воды (см. 6.7) настолько понижают силы электростатического притяжения между ионами в решетке, что ионы становятся свободными и переходят в раствор. Таким образом, процесс растворения в воде ионных веществ обязательно сопровождается распадом иа составляющие их ионы.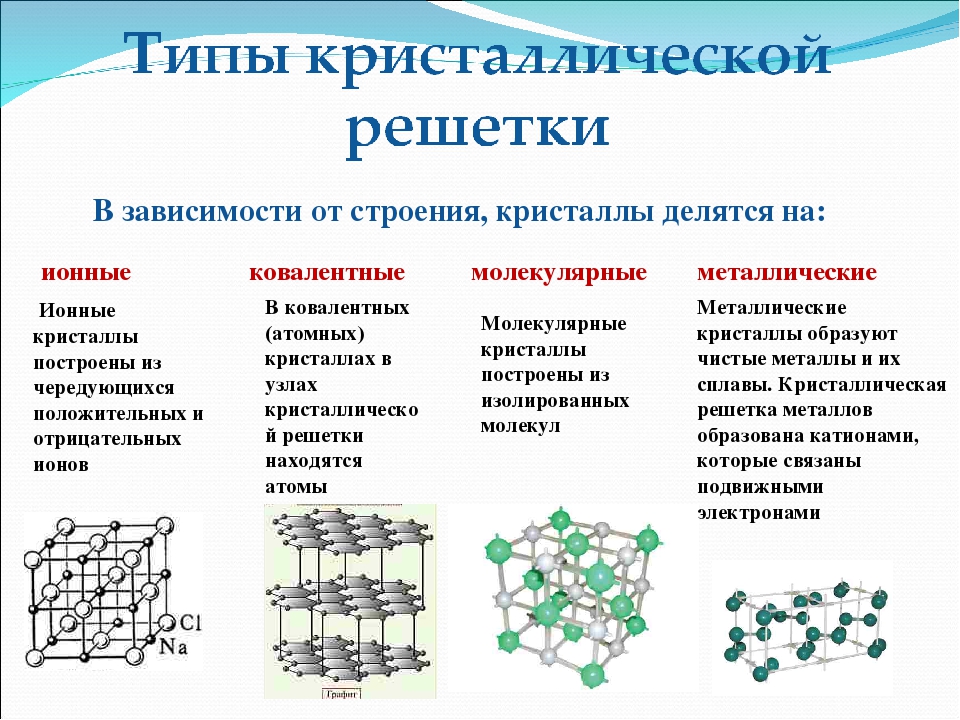 Получающиеся растворы также обладают электропроводимостью. [c.166]
Получающиеся растворы также обладают электропроводимостью. [c.166]
Органические производные природных глин-бентонитов обладают высокой селективностью при отделении ароматических УВ от алифатических. Бентонитовая глина относится к группе монтморил-лонитовых, содержит в кристаллической решетке ионы, способные замещаться. Эти глины с успехом могут применяться для разделения м- и -ксилолов (отношение удерживаемых объемов разделяемых компонентов в этом случае составляет 1,26—1,40). [c.233]
Зависимость свойств веществ от их состава. Строение вещества. Типы кристаллических решеток. Ионные кристаллические решетки
Урок открытых мыслей
Цели
. Образовательная – закрепить и
углубить знания учащихся по теории химического
строения, ее основным положениям.
Воспитательная
– содействовать
формированию причинно-следственных связей и
отношений.
Развивающая
– развитие мыслительных
умений, способности переносить знания и умения в
новые ситуации.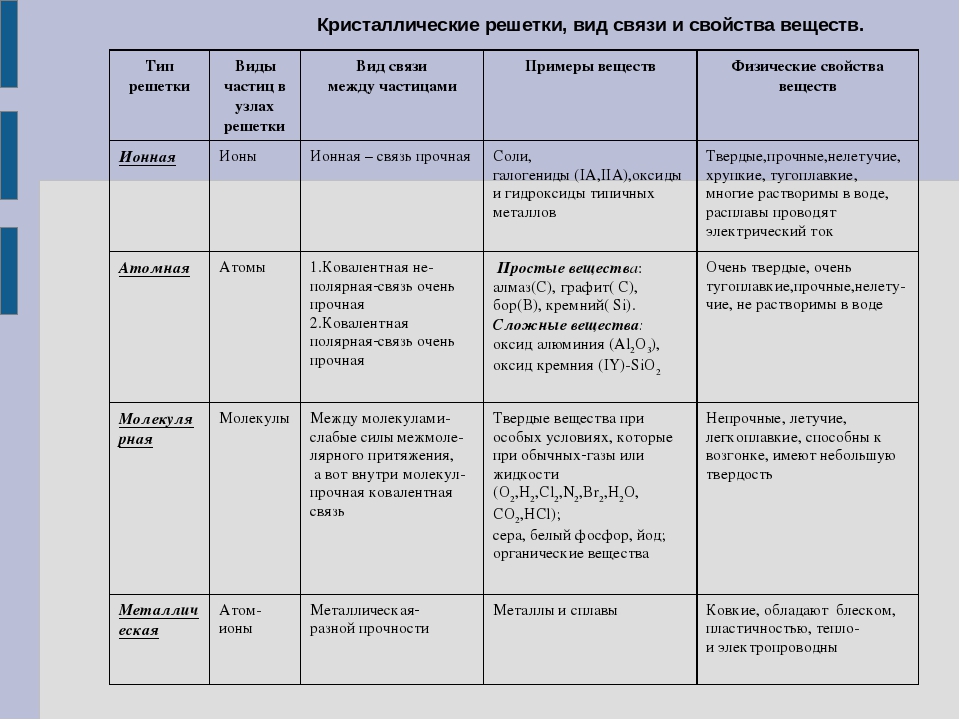
Оборудование и реактивы.
Набор
шаростержневых моделей; образцы натурального и
синтетического каучука, диэтиловый эфир,
бутанол, этанол, фенол, литий, натрий, раствор
лакмуса, бромная вода, муравьиная и уксусная
кислоты.
Девиз
. «Всякое вещество – от самого
простого до самого сложного – имеет три
различные, но взаимосвязанные стороны –
свойство, состав, строение»
(В.М.Кедров).
ХОД УРОКА
Что включает в себя понятие «зависимость»?
(Узнать мнение учащихся).
На доске написать определение: «Зависимость –
1) отношение одного явления к другому как
следствие к причине;
2) подчиненность другим при отсутствии
самостоятельности, свободы» (словарь
С.И.Ожегова).
Цели урока определим совместно, составив схему:
Мотивационно-ориентационный блок
Интеллектуальная разминка
Определите верность приведенных ниже суждений,
подтвердите ваши ответы примерами.
Теорию химического строения открыл
Д. И.Менделеев.
И.Менделеев.
Ответ
. А.М.Бутлеров, 1861 г.
Валентность углерода в органических
соединениях может быть II и IV.
Ответ
. Валентность углерода – чаще
всего IV.
Атомы, образующие молекулы органических
веществ, связаны беспорядочно, без учета
валентности.
Ответ
. Атомы в молекулах связаны в
определенной последовательности согласно их
валентности.
Свойства веществ не зависят от строения
молекул.
Ответ
. Бутлеров в теории химического
строения утверждал, что свойства органических
соединений определяются составом и строением их
молекул.
Операционно-исполнительный блок
Фактор пространственного строения
Что вам известно о пространственном строении
молекул алканов и алкенов?
Ответ
. В алканах при каждом углероде
– четыре соседних атома, которые располагаются в
вершинах тетраэдра. Сам углерод находится в
центре тетраэдра. Тип гибридизации атома
углерода – sp 3
, углы между связями
(Н–С–С, Н–С–Н, С–С–С) — 109°28″.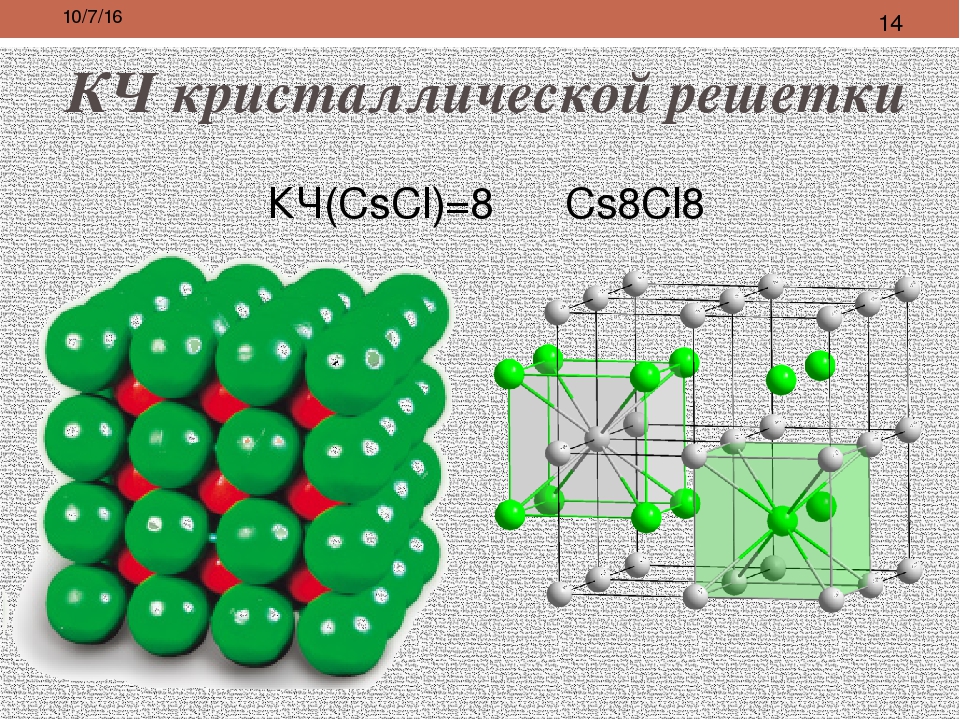 Строение
Строение
углеродной цепи – зигзагообразное.
В алкенах два атома углерода, связанных двойной
связью, и четыре атома при них с одинарными
связями находятся в одной плоскости. Тип
гибридизации атомов – sp 2
, углы между связями
(Н–С=С, C–С=С) — 120°.
Вспомните, в чем отличие пространственного
строения молекул натурального каучука и
синтетического.
Ответ
. Натуральный каучук – линейный
полимер изопрена – имеет строение цис
-1,4-полиизопрена.
Синтетический каучук может иметь строение транс
-1,4-полиизопрена.
Одинакова ли эластичность этих каучуков?
Ответ
. Цисформа более эластична, чем
трансформа. Молекулы натурального каучука
длиннее и более упруго закручены (сначала в
спираль, а потом в клубок), чем молекулы
синтетического каучука.
Крахмал (С 5 Н 10 О 5) m –
белый аморфный порошок, а целлюлоза (С 5 Н 10 О 5) n
– волокнистое вещество.
В чем причина такого различия?
Ответ
. Крахмал – полимер -глюкозы,
Крахмал – полимер -глюкозы,
тогда как целлюлоза – полимер-глюкозы.
Отличаются ли химические свойства крахмала и
целлюлозы?
Ответ
. Крахмал + I 2 синий р-р,
целлюлоза + HNO 3
нитроцеллюлоза.
Вывод
. От пространственного строения
зависят как физические, так и химические
свойства.
Фактор химического строения
Что является главной идеей теории
химического строения?
Ответ
. Химическое строение отражает
зависимость свойств веществ от порядка
соединения атомов и их взаимодействия.
Определите, что общего у веществ:
Ответ
. Состав.
Сравните физические свойства данных веществ.
В чем вы видите причину такого отличия?
На основании распределения электронной
плотности химической связи определите, какая
молекула более полярна? С чем это связано?
Ответ
. –ОН
водородную связь.
Демонстрационный эксперимент
Вывод
. Реакционная способность спирта
Реакционная способность спирта
определяется взаимным влиянием атомов в
молекуле.
Фактор электронного строения
В чем заключается сущность взаимного влияния
атомов?
Ответ
. Взаимное влияние состоит во
взаимодействии электронных структур атомов, что
приводит к смещению электронной плотности
химических связей.
Лабораторная работа
Учитель
. На ваших столах стоят
наборы для лабораторной работы. Выполните
задание и докажите экспериментально зависимость
свойств веществ от электронного строения. Работа
в парах. Строго соблюдайте правила техники
безопасности.
Вариант I
. Проведите исследование
химических свойств этанола и фенола. Докажите
зависимость их реакционной способности от
электронного строения. Используйте реагенты –
металлический литий и бромную воду. Составьте
уравнения возможных реакций. Покажите смещение
электронной плотности химической связи в
молекулах.
Вариант II
. Поясните сущность взаимного
влияния карбоксильной группы –СООН и
заместителя при карбонильном углероде в
молекулах карбоновых кислот.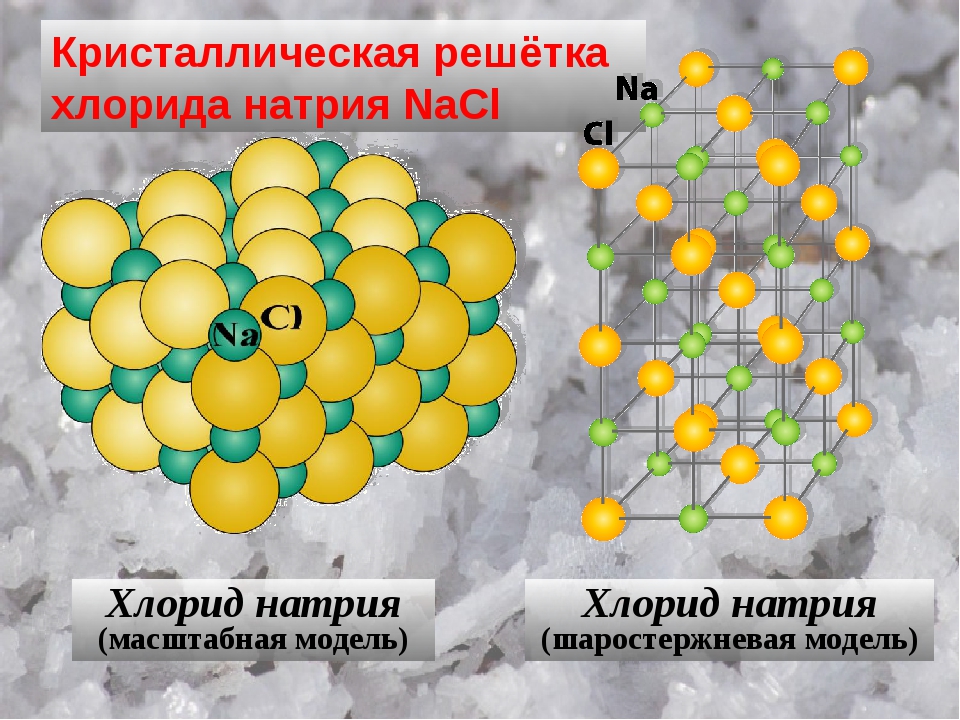 Рассмотрите на
Рассмотрите на
примере муравьиной и уксусной кислот.
Используйте раствор лакмуса и литий. Составьте
уравнения реакций. Покажите смещение
электронной плотности химической связи в
молекулах.
Вывод
. Химические свойства зависят от
взаимного влияния атомов.
Итоговый контроль знаний
Учитель
. Подведем итог нашего урока.
Мы с вами подтвердили, что свойства веществ
зависят от пространственного химического и
электронного строения.
1. Формулы НСООН, С 6 Н 5 ОН и C 4 H 9 COОН
запишите в порядке возрастания кислотных
свойств веществ.
2. Расположите формулы СН 3 СООН, С 3 Н 7 СООН,
СН 3 ОН, ClCH 2 СООН в порядке убывания
кислотных свойств веществ.
3. У какого альдегида:
более активная альдегидная группа? Почему?
Оцените свою работу на уроке.
Л.А.ЕРЕМИНА,
учитель химии школы № 24
(г. Абакан, Хакасия)
Тест А6
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки.
Тип кристаллической решетки.
Зависимость свойств веществ от их состава и строения.
1. Кристаллическая решетка хлорида кальция
1) ионная 2)молекулярная 3) металлическая
4) атомная
2. Молекулярное строение имеет
1) ртуть
2) бром
3) гидроксид натрия
4) сульфат калия
3. Атом является структурной частицей в кристаллической решетке
1) метана 2) водорода 3) кислорода 4) кремния
4. Вещества, обладающие твёрдостью, тугоплавкостью, хорошей растворимостью в воде, как
правило, имеют кристаллическую решетку:
1) молекулярную
2) атомную
3) ионную
4) металлическую
5. Молекулярную кристаллическую решетку имеет
1) НВr
2) K2О
3) ВаО
4) КСl
6. Вещества с атомной кристаллической решеткой
1) очень твёрдые и тугоплавкие
2) хрупкие и легкоплавкие
3) проводят электрический ток в растворах
4) проводят электрический ток в расплавах.
7. Молекулярную кристаллическую решетку имеет
1) Са3Р2
2) СО2
3) SO2
4) АlF3
8. Ионную кристаллическую решетку имеет каждое из веществ, расположенных в ряду
1) натрий, хлорид натрия, гидрид натрия
2) кальций, оксид кальция, карбонат кальция
3) бромид натрия, сульфат калия, хлорид железа (II)
4) фосфат магния, хлорид калия, оксид фосфора (V)
9. Кристаллическая решетка графита
Кристаллическая решетка графита
1) ионная
2) молекулярная
3) атомная 4) металлическая
10. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как
правило, имеют кристаллическую решетку
1) молекулярную 2) ионную 3) атомную 4) металлическую
11. Молекулярную кристаллическую решетку имеет
1) кремний
2) оксид углерода(IV) 3) диоксид кремния
4) нитрат аммония
12. Кристаллическая решетка галогенов
1) атомная
2) ионная
3) молекулярная 4) металлическая
13. К веществам с атомной кристаллической решеткой относятся
1) натрий, фтор, оксид серы (IV)
2) свинец, азотная кислота, оксид магния
3) бор, алмаз, карбид кремния
4) хлорид калия, белый фосфор, йод
14. Молекулярное строение имеет
1) цинк
2) нитрат бария
3) гидроксид калия
4) бромоводород
15. Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят
электрический ток, имеют кристаллическую решетку
1) металлическую
2) молекулярную 3) атомную 4) ионную
16. Ионы являются структурными частицами
1) кислорода
2) воды
3) оксида углерода (IV)
4) хлорида натрия
17. Немолекулярное строение имеют все неметаллы группы
Немолекулярное строение имеют все неметаллы группы
1) углерод, бор, кремний
3) кислород, сера, азот
2) фтор, бром, иод
4) хлор, фосфор, селен
18. Кристаллическую структуру, подобную структуре алмаза, имеет
1) кремнезем 2) оксид натрия
3) оксид углерода (II) 4) белый фосфор Р4
19. Атом является структурной частицей в кристаллической решетке
1) метана 2) водорода
3) кислорода
4) кремния
20. Молекулярную кристаллическую решетку имеет каждое из двух веществ
1) графит и алмаз
2) кремний и йод
3) хлор и оксид углерода(IV)
4) хлорид бария и оксид бария
21. Атомную кристаллическую решетку имеет каждое из двух веществ
1) оксид кремния (IV) и оксид углерода (IV)
2) графит и кремний
3) хлорид калия и фторид натрия
4) хлор и йод
22. Молекулярное строение имеет
1) натрий
2) фруктоза
3) фосфат натрия
4) оксид натрия
23. Молекулярная кристаллическая решетка характерна для каждого из веществ, расположенных в
ряду
1) хлорид калия, азот, метан
2) иод, диоксид углерода, озон
3) алюминий, бром, алмаз
4) водород, сульфат магния, оксид железа (III)
24. Оксид кремния тугоплавок, нерастворим в воде. Его кристаллическая решётка 1) атомная 2) молекулярная
Оксид кремния тугоплавок, нерастворим в воде. Его кристаллическая решётка 1) атомная 2) молекулярная
3) ионная 4) металлическая
25. В зависимости от характера частиц, образующих кристалл, и от природы сил взаимодействия
между ними различают четыре типа кристаллических решеток:
1) ионные, атомные, молекулярные и металлические
2) ионные, ковалентные, атомные и молекулярные
3) металлические, ковалентные, атомные и молекулярные
4) ионные, кубические, треугольные и слоистые
26. Кристаллическая решетка льда:
1) атомная
2) молекулярная 3) ионная
4) металлическая
27. Укажите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку.
1) графит
2) натрий
3) гидроксид натрия
4) водород
28. Укажите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку:
1) хлороводород 2) хлор
3) оксид кремния (IV)
4) оксид кальция
29. Для твердых веществ с металлической кристаллической решеткой характерна высокая…
1) растворимость в воде
2) электроотрицательность атомов
3) летучесть
4) электропроводность
30. Кристаллическое вещество образовано частицами Na+ и ОН-. К какому типу принадлежит
Кристаллическое вещество образовано частицами Na+ и ОН-. К какому типу принадлежит
кристаллическая решетка этого вещества?
1) атомная
2) молекулярная
3) ионная
4) металлическая
31. Немолекулярное строение имеет каждое из двух веществ:
1) S8 и O2
2) Fe и NaCl
3) CO и Mg 4) Na2CO3 и I2
32. Веществом молекулярного строения является
1) озон
2) оксид бария
3) графит
4) сульфид калия
33. Атомная кристаллическая решетка у простого вещества:
1) алмаз 2) медь 3) фтор 4) олово
34. Утверждение о том, что структурной частицей данного вещества является молекула, справедливо
только для
1) алмаза 2) поваренной соли
3) кремния 4) азота
35. Ионную кристаллическую решетку имеет
1) вода
2) фторид натрия
3) серебро
4) бром
36. Простые вещества, имеющие одинаковый тип кристаллической решетки, образованы элементами
1) малых периодов
3) побочных подгрупп
2) главных подгрупп
4) больших периодов
37. Кристаллическую структуру, подобную структуре алмаза, имеет:
1) кремнезем SiO2
2) оксид натрия Na2O
3) оксид углерода(II) CO 4) белый фосфор Р4
38. Фосфин РН3 — это газ. Его кристаллическая решётка
Фосфин РН3 — это газ. Его кристаллическая решётка
1) атомная
2) молекулярная
3) ионная
4) металлическая
39. Из молекул состоят кристаллы.
1) сахара 2) соли
3) алмаза
4) серебра
40. Из разноимённо заряженных ионов состоят кристаллы
1) сахара 2) гидроксида натрия 3) алмаза 4) серебра
41. Какие частицы образуют кристалл нитрата натрия?
1) атомы Nа, N и О
3) ионы Nа+, NO3+
5+ 22) ионы Nа, N ,О
4) молекулы NаNО3
42. Оцените правильность суждений о связи между строением и свойствами вещества.
А. Среди веществ молекулярного строения есть газообразные, жидкие и твёрдые при обычных
условиях.
Б. Вещества с атомной кристаллической решеткой при обычных условиях твёрдые.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
43. Оцените правильность суждений о связи между строением и свойствами вещества:
А. Если между частицами в кристалле прочная химическая связь, то вещество тугоплавко.
Б. Все твёрдые вещества имеют немолекулярное строение
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
44. Какие из приведенных утверждений верны:
Какие из приведенных утверждений верны:
А. Вещества с молекулярной решеткой имеют низкие температуры плавления и низкую
электропроводность.
Б. Вещества с атомной решеткой пластичны и обладают высокой электропроводностью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
45. Установите соответствие между веществом и типом его кристаллической решетки.
ВЕЩЕСТВО
ТИП КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
1) поваренная соль
А) молекулярная
2) серебро
Б) ионная
3) углекислый газ
В) атомная
4) графит
Г) металлическая
5) глюкоза
46. Установите соответствие между типом кристаллической решетки и свойствами веществ.
ТИП КРИСТАЛЛИЧЕСКОЙ
СВОЙСТВА ВЕЩЕСТВ
РЕШЕТКИ
A) ионная
1) твердые, тугоплавкие, не растворяются в воде
Б) металлическая
2) хрупкие, легкоплавкие, не проводят электрический
ток
В) атомная
3) пластичные, имеют различные температуры
плавления, проводят электрический ток
Г) молекулярная
4) твердые, тугоплавкие, хорошо растворяются в воде
47. Укажите ряд, характеризующийся уменьшением длины химической связи
1) SiCl4, MgCl2, AlCl3, NaCl
2) NaCl, MgCl2, SiCl4, AlCl3
3) NaCl, SiCl4, MgCl2, AlCl3
4) NaCl, MgCl2, AlCl3, SiCl4
48. Оцените правильность суждений о связи между строением и свойствами вещества.
Оцените правильность суждений о связи между строением и свойствами вещества.
А. Если между частицами в кристалле прочная химическая связь, то вещество легко испаряется.
Б. Все газы имеют молекулярное строение.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Лекция 7
Зависимость свойств веществ от их
строения. Химическая связь. Основные
виды химической связи.
Рассматриваемые вопросы:
1. Уровни организации вещества. Иерархия структуры.
2. Вещества молекулярного и немолекулярного строения.
3.
4. Причины возникновения химической связи.
5. Ковалентная связь: механизмы образования, способы
перекрывания атомных орбиталей, полярность, дипольный момент
молекулы.
6. Ионная связь.
7. Сравнение ковалентной полярной и ионной связи.
8. Сравнение свойств веществ с ковалентными полярными и
ионными связями.
9. Металлическая связь.
10. Межмолекулярные взаимодействия.
 )
)
Что надо знать о каждом веществе?
Формула (из чего состоит)
Структура (как устроено)
Физические свойства
Химические свойства
Способы получения
(лаб. и промышл.)
6. Практическое применение
1.
2.
3.
4.
5.
Все вещества
состоят из
атомов, но не
все – из
молекул.
Атом
Молекула
У всех веществ
Только у веществ
молекулярного
строения
Наноуровень
У всех веществ
Объемный (макро)
уровень
У всех веществ
Все 4 уровня – объект изучения химии
и немолекулярного строения
Вещества Молекулярного
строения
Немолекулярного
строения
Состоят из молекул
Состоят из атомов
или ионов
h3O, CO2, HNO3, C60,
почти все орг. вещества
Алмаз, графит, SiO2,
металлы, соли
Формула отражает
состав молекулы
Формула отражает состав
формульной единицы
Хлорид натрия
Формульная единица NaCl
Диоксид кремния
Формульная единица SiO2
Минералогический музей имени Ферсмана находится возле входа в Нескучный сад.
Адрес: Москва, Ленинский проспект, дом 18, корпус 2.
пропеллан
C5H6
коронен
(супербензол)
C24h22
кавитанд
C36h42O8
катенан
Разнообразие химических структур.катенан
Разнообразие химических структур.лист Мебиуса
Молекула Молекула – устойчивая система, состоящая из нескольких
атомных ядер и электронов.
Атомы объединяются в молекулы путем образования
химических связей.
Главная движущая сила образования молекулы из
атомов – уменьшение общей энергии.
Молекулы имеют геометрическую форму, характеризующуюся
расстояниями между ядрами и углами между связями.
образования химической связи
между частицами вещества –
уменьшение общей энергии
системы.
связи:
1.Ионная
2.Ковалентная
3.Металлическая
Основные межмолекулярные
взаимодействия:
1. Водородные связи
Водородные связи
2.Ван-дер-Ваальсовы связи
Если связь образуют атомы с резко различающимися
значениями электроотрицательности (ΔОЭО ≥ 1,7),
общая электронная пара практически полностью
смещается в сторону более электроотрицательного
атома.
Na Cl
ОЭО 0,9 3,16
∆ 2,26
+Na
Анион
:ClКатион
Химическая связь между ионами, возникающая за
счет их электростатического притяжения,
называется ионной.
Кулоновский потенциал сферически
симметричен, направлен во все стороны,
поэтому ионная связь ненаправлена.
Кулоновский потенциал не имеет
ограничений на количество
присоединяемых противоионов —
следовательно, ионная связь
ненасыщаема.
Соединения с ионным типом связи
твердые, хорошо растворимые в
полярных растворителях, имеют высокие
температуры плавления и кипения.
Кривая I: притяжение ионов, если
бы они представляли собой
точечные заряды.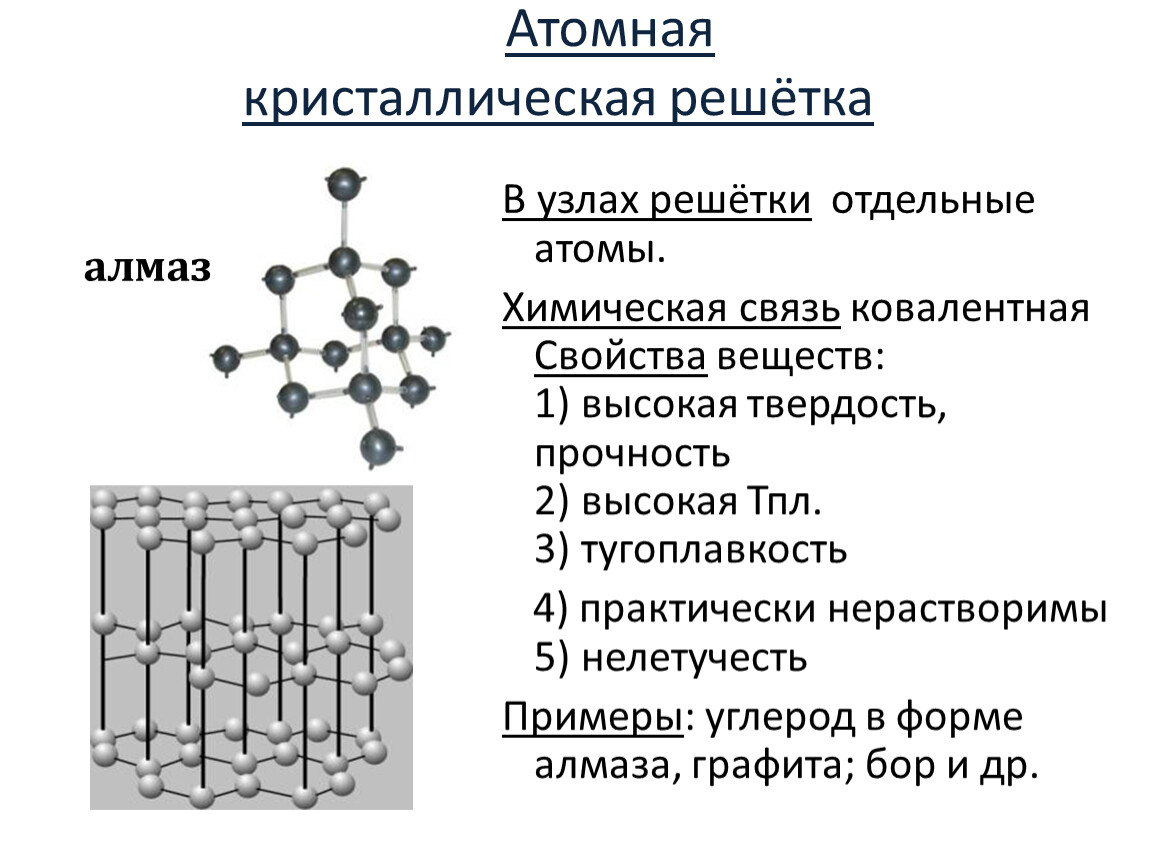
Кривая II: отталкивание ядер в
случае сильного сближения ионов.
Кривая III: минимум энергии Е0 на
кривой соответствует
равновесному состоянию ионной
пары, при котором силы
притяжения электронов к ядрам
скомпенсированы силами
отталкивания ядер между собой на
расстоянии r0,
Химическую связь в молекулах можно описать с
позиций двух методов:
— метода валентных связей, МВС
— метода молекулярных орбиталей, ММО
Теория Гейтлера-Лондона
Основные положения метода ВС:
1. Связь образуют два электрона с противоположными
спинами, при этом происходит перекрывание волновых
функций и увеличивается электронная плотность между
ядрами.
2. Связь локализована в направлении максимального
перекрывания Ψ-функций электронов. Чем сильнее
перекрывание, тем прочнее связь.
dсв — длина
связи;
Есв — энергия
связи.
Н· + ·Н → Н:Н
При сближении двух атомов
возникают силы притяжения и
отталкивания:
1) притяжения: «электрон-ядро»
соседних атомов;
2) отталкивания: «ядро-ядро»,
«электрон-электрон» соседних
атомов.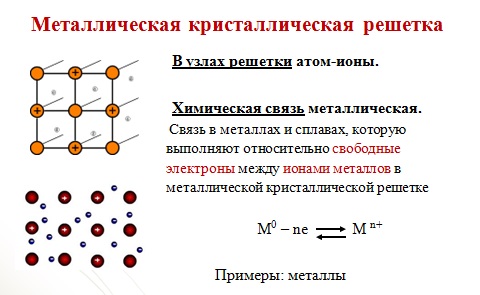
Молекулярное
двухэлектронное облако,
обладающее максимальной
электронной плотностью.
электронными парами, называется ковалентной.
Общая электронная пара может образоваться двумя
способами:
1) в результате объединения двух непарных электронов:
2) в результате обобществления неподеленной
электронной пары одного атома (донора) и пустой
орбитали другого (акцептора).
Два механизма образования ковалентной связи:
обменный и донорно-акцепторный.
плотности связи происходит по линии,
соединяющей центры атомов (ядра), то такое
перекрывание называется σ-связью:
образовании ковалентной связи
Если образование максимальной электронной
плотности связи происходит по обе стороны
линии, соединяющей центры атомов (ядра), то
такое перекрывание называется π-связью:
1) Если связь образуют одинаковые атомы,
двухэлектронное облако связи распределяется в
пространстве симметрично между их ядрами — такая
связь называется неполярной: h3, Cl2, N2.
2) если связь образуют разные атомы, облако связи
смещено в сторону более электроотрицательного атома
— такая связь называется полярной: HCl, Nh4, CO2.
Дипольный момент связи
Диполь
H+δCl-δ или H+0,18Cl-0,18
Где ±δ — эффективный
заряд атома, доля
абсолютного заряда
электрона.
+δ
-δ
Не путать со степенью окисления!
l
Произведение эффективного заряда на длину диполя
называется электрическим моментом диполя: μ = δl
Это векторная величина: направлен от положительного
заряда к отрицательному.
Дипольный момент молекулы
Дипольный момент молекулы равен сумме
векторов дипольных моментов связей с учетом
неподеленных электронных пар.
Единицей измерения дипольного момента
является Дебай: 1D = 3,3·10-30 Кл·м.
Дипольный момент молекулы
В произведении μ = δl обе величины разнонаправлены.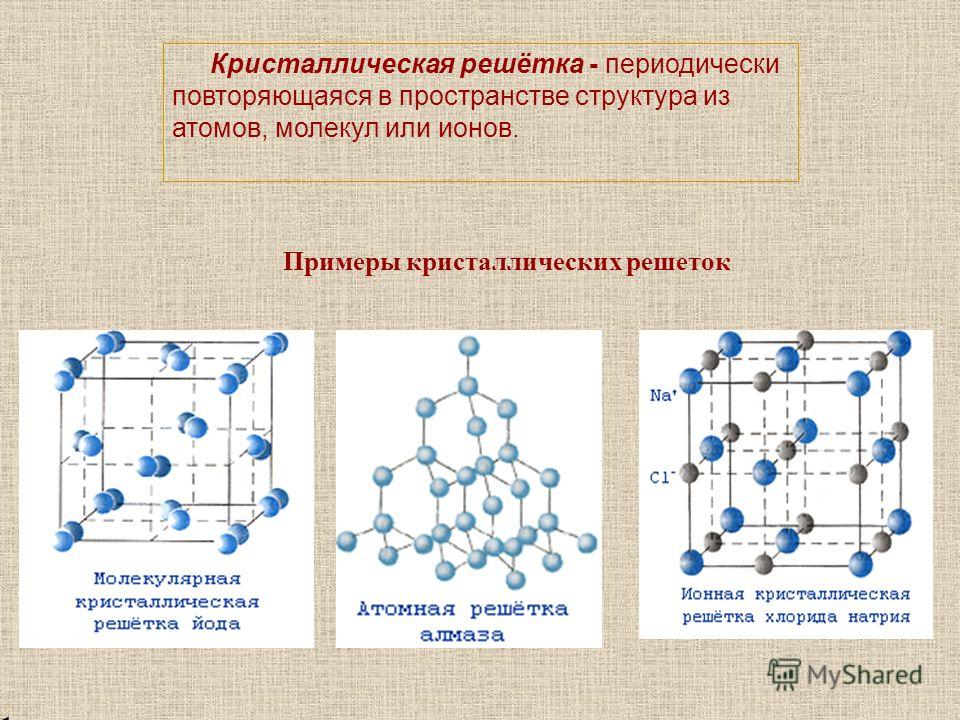
Поэтому надо внимательно отслеживать причину
изменения μ.
Например,
CsF
CsCl
24
31
δ «проиграл» l
CsI
HF
HCl
HBr
HI
37
5,73
3,24
2,97
1,14
наоборот
Дипольный момент молекулы
Может ли молекула быть неполярной, если
все связи в ней полярные?
Молекулы типа АВ всегда полярны.
Молекулы типа АВ2 могут быть и полярными, и
неполярными…
Н2О
О
Н
СО2
μ>0
Н
О
С
μ=0
О
Молекулы, состоящие из трех атомов и более
(АВ2, АВ3, АВ4, АВ5, АВ6) ,
могут быть неполярными, если они симметричны.
На что влияет наличие дипольного момента
молекулы?
Имеются межмолекулярные взаимодействия, а,
следовательно, увеличиваются плотность вещества,
t°плавления и t°кипения.
Общее: образование общей
электронной пары.
Отличие: степень
смещения общей
электронной пары
(поляризация связи).
Ионную связь следует рассматривать как крайний
случай ковалентной полярной связи.
полярной связей
Ковалентная связь: насыщена и направлена
Насыщаемость (максимальная валентность) —
определяется способностью атома образовывать
ограниченное количество связей (с учетом обоих
механизмов образования).
Направление связи задает валентный угол, зависящий от
типа гибридизации орбиталей центрального атома.
Ионная связь: ненасыщена и ненаправлена.
полярной связей
Направленность связи задают валентные углы.
Валентные углы определяют экспериментально или
предсказывают на основе теории гибридизации
атомных орбиталей Л. Поллинга либо теории
Гиллеспи.
Подробно об этом на семинарах.
ковалентными связями
Ковалентные связи
Атомные кристаллы
Между атомами
в самом кристалле
Высокая твердость
высокие tºплав, tºкип
плохие тепло- и
электропроводность
Молекулярные кристаллы
Между атомами
в молекуле
Умеренная мягкость
достаточно низкие
tºплав, tºкип
плохие тепло- и
Электропроводность
Нерастворимы в воде
ковалентными связями
Молекулярный кристалл
Температура плавления 112,85 °С
ковалентными связями
Атомный ковалентный кристалл
Температура плавления ≈ 3700 °С
ковалентными связями
Ионные связи
между ионами
в кристалле
твердость и хрупкость
высокая температура плавления
плохие тепло- и электропроводность
Растворимы в воде
ковалентными связями
Ионный кристалл
Температура плавления ≈ 800 °С
Металлическая связь осуществляется электронами,
принадлежащими всем атомам одновременно.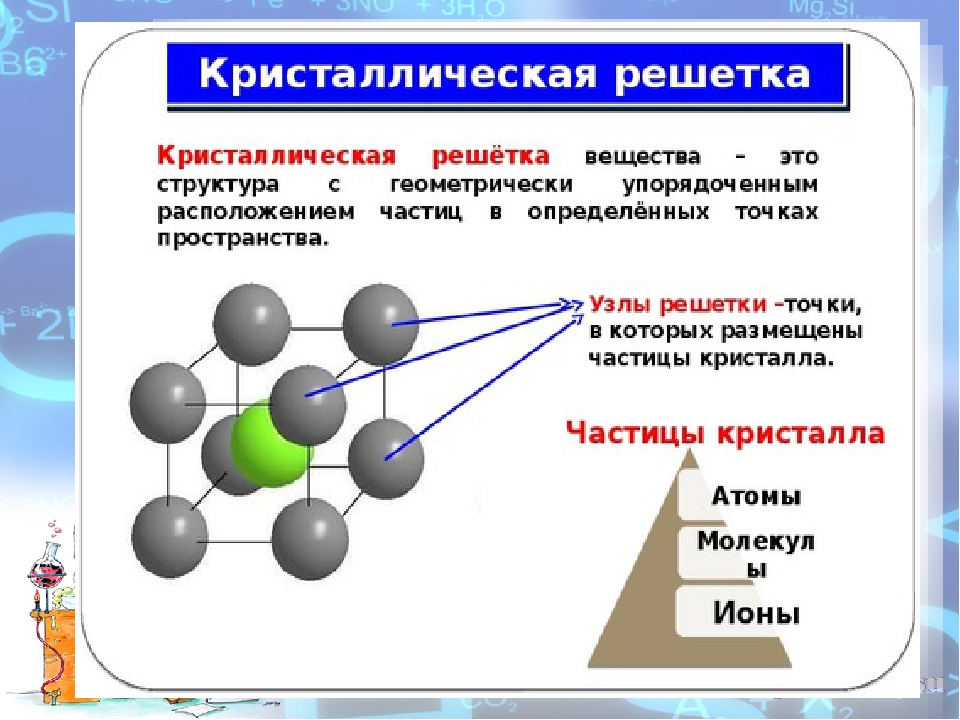
Электронная плотность
делокализована «электронный газ».
Характерный
металлический блеск
Пластичность
Ковкость
Высокие тепло- и
электропроводность
Температуры плавления
очень разные.
1. Водородная связь
Притяжение между атомом водорода (+) одной
молекулы и атомом F, O, N (–) другой молекулы
F
F
H
H
H
H
F
F
O
h4C
H
F
C
H
Полимер
(HF)n
O
C
O
H
Ch4
Димер
уксусной кислоты
O
Водородные связи слабы индивидуально,
но сильны коллективно
2. Водородная связь в ДНК
Межмолекулярные связи. 3. Водородные связи в воде
жидкая вода
лед
4. Образование водородных связей в
воде
жидкая вода
превращение
воды в лед
5. Ван-дер-ваальсовы связи
Даже если между молекулами нет водородных связей,
молекулы всегда притягиваются друг к другу.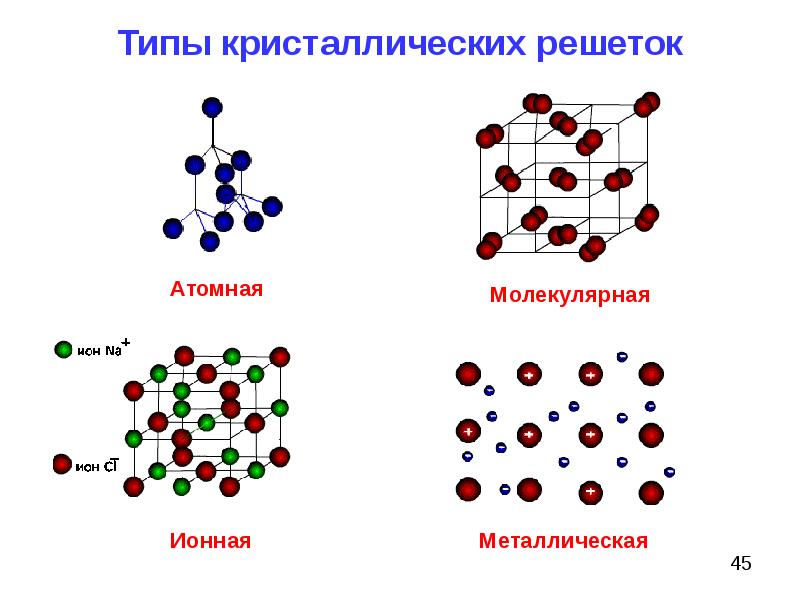
Притяжение между молекулярными диполями называют вандер-ваальсовой связью.
В-д-в притяжение тем сильнее, чем больше:
1) полярность; 2) размер молекул.
Пример: метан (Ch5) – газ, бензол (C6H6) – жидкость
Одна из самых слабых в-д-в связей – между молекулами
h3 (т. пл. –259 оС, т. кип. –253 оС).
Взаимодействие между молекулами во много раз слабее связи между атомами:
Eков(Cl–Cl) = 244 кДж/моль, Eвдв(Cl2–Cl2) = 25 кДж/моль
но именно оно обеспечивает существование жидкого и твердого состояния вещества
химического факультета МГУ им. Ломоносова
Еремина Вадима Владимировича
Спасибо
за внимание!
Современное учение о свойствах органических является развитием идеи А. М. Бутлерова о зависимости от его строения. Выражающая строение дает представление о всем многообразии , хотя предсказания на не являются следствием строгих математических законов, а носят лишь качественный характер и предоставляют еще многое на долю таланта и интуиции химика-экспериментатора.
Характеристики физических свойств соединений часто выражают как сумму нескольких слагаемых, относящихся к соответствующих элементов, которые входят в состав данного соединения. Применение таких аддитивных схем
для нахождения какой-либо физико-химической характеристики соединения по формуле его строения равносильно, следовательно, предположению, что элемента, входя в состав различных соединений, вносит всегда одну и ту же долю такой характеристики.
В простейших случаях это предположение в отношении оказывается очень близким к истине (аддитивны, например, величины молекулярных объемов и
Лекция 7 Зависимость свойств веществ от их строения. Химическая связь. Основные виды химической связи. Рассматриваемые вопросы: 1. Уровни организации вещества. Иерархия структуры. 2. Вещества молекулярного и немолекулярного строения. 3. Разнообразие химических структур. 4. Причины возникновения химической связи. 5. Ковалентная связь: механизмы образования, способы перекрывания атомных орбиталей, полярность, дипольный момент молекулы.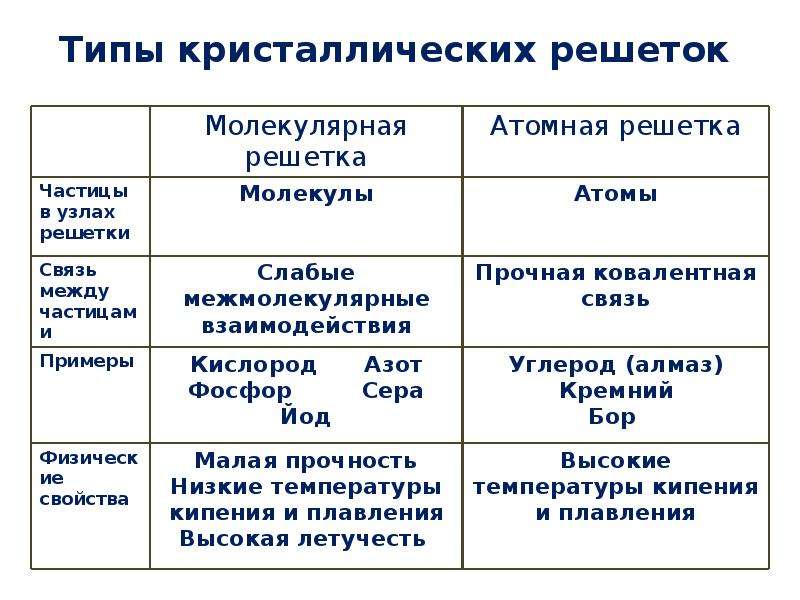 6. Ионная связь. 7. Сравнение ковалентной полярной и ионной связи. 8. Сравнение свойств веществ с ковалентными полярными и ионными связями. 9. Металлическая связь. 10. Межмолекулярные взаимодействия.
6. Ионная связь. 7. Сравнение ковалентной полярной и ионной связи. 8. Сравнение свойств веществ с ковалентными полярными и ионными связями. 9. Металлическая связь. 10. Межмолекулярные взаимодействия.
Вещество (более 70 млн.) Что надо знать о каждом веществе? 1. 2. 3. 4. 5. Формула (из чего состоит) Структура (как устроено) Физические свойства Химические свойства Способы получения (лаб. и промышл.) 6. Практическое применение
Иерархия структуры вещества Все вещества состоят из атомов, но не все – из молекул. Атом Молекула У всех веществ Только у веществ молекулярного строения Наноуровень У всех веществ Объемный (макро) уровень У всех веществ Все 4 уровня – объект изучения химии
Вещества Молекулярного строения Немолекулярного строения Состоят из молекул Состоят из атомов или ионов H 2 O, CO 2, HNO 3, C 60, почти все орг. вещества Алмаз, графит, Si. O 2, металлы, соли Формула отражает состав молекулы Формула отражает состав формульной единицы
Вещества Диоксид кремния Формульная единица Si. O 2 Минералогический музей имени Ферсмана находится возле входа в Нескучный сад. Адрес: Москва, Ленинский проспект, дом 18, корпус 2.
O 2 Минералогический музей имени Ферсмана находится возле входа в Нескучный сад. Адрес: Москва, Ленинский проспект, дом 18, корпус 2.
Разнообразие химических структур. пропеллан C 5 H 6 коронен (супербензол) C 24 H 12 кавитанд C 36 H 32 O 8
Молекула – устойчивая система, состоящая из нескольких атомных ядер и электронов. Атомы объединяются в молекулы путем образования химических связей. Главная движущая сила образования молекулы из атомов – уменьшение общей энергии. Молекулы имеют геометрическую форму, характеризующуюся расстояниями между ядрами и углами между связями.
Основные типы химической связи: 1. Ионная 2. Ковалентная 3. Металлическая Основные межмолекулярные взаимодействия: 1. Водородные связи 2. Ван-дер-Ваальсовы связи
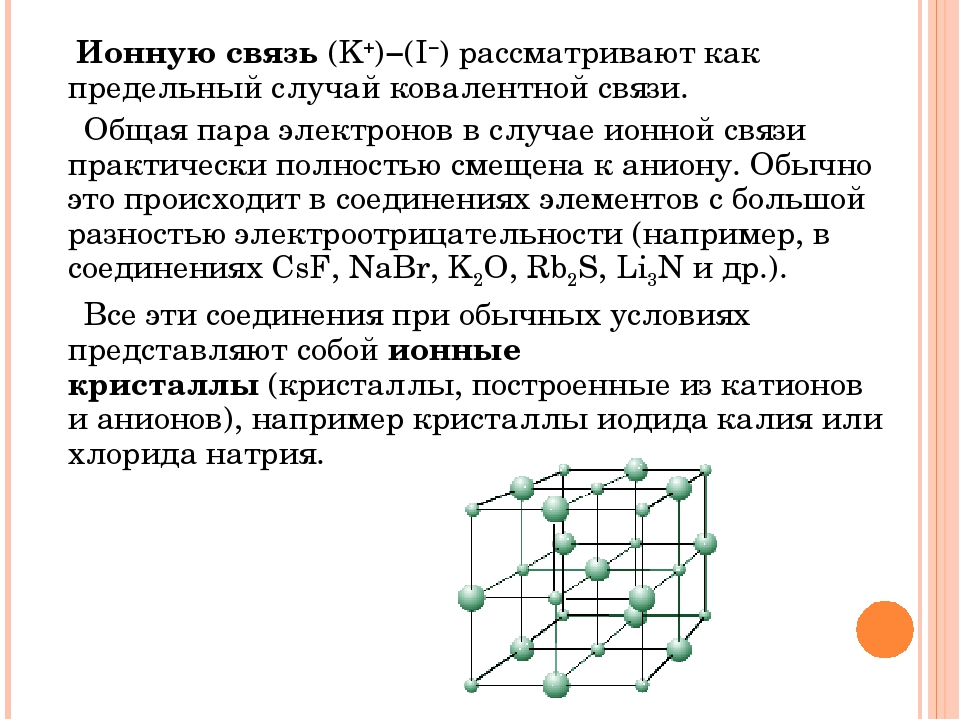
Ионная связь Если связь образуют атомы с резко различающимися значениями электроотрицательности (ΔОЭО ≥ 1, 7), общая электронная пара практически полностью смещается в сторону более электроотрицательного атома. Na Cl ОЭО 0, 9 3, 16 ∆ 2, 26 +Na Анион: Cl. Катион Химическая связь между ионами, возникающая за счет их электростатического притяжения, называется ионной.
Ионная связь Кулоновский потенциал сферически симметричен, направлен во все стороны, поэтому ионная связь ненаправлена. Кулоновский потенциал не имеет ограничений на количество присоединяемых противоионов — следовательно, ионная связь ненасыщаема.
Ионная связь Соединения с ионным типом связи твердые, хорошо растворимые в полярных растворителях, имеют высокие температуры плавления и кипения.
Ионная связь Кривая I: притяжение ионов, если бы они представляли собой точечные заряды. Кривая II: отталкивание ядер в случае сильного сближения ионов. Кривая III: минимум энергии Е 0 на кривой соответствует равновесному состоянию ионной пары, при котором силы притяжения электронов к ядрам скомпенсированы силами отталкивания ядер между собой на расстоянии r 0,
Химическая связь в молекулах Химическую связь в молекулах можно описать с позиций двух методов: — метода валентных связей, МВС — метода молекулярных орбиталей, ММО
Метод валентных связей Теория Гейтлера-Лондона Основные положения метода ВС: 1. Связь образуют два электрона с противоположными спинами, при этом происходит перекрывание волновых функций и увеличивается электронная плотность между ядрами. 2. Связь локализована в направлении максимального перекрывания Ψ-функций электронов. Чем сильнее перекрывание, тем прочнее связь.
Образование молекулы водорода: Н· + ·Н → Н: Н При сближении двух атомов возникают силы притяжения и отталкивания: 1) притяжения: «электрон-ядро» соседних атомов; 2) отталкивания: «ядро-ядро» , «электрон-электрон» соседних атомов.
Химическая связь, осуществляемая общими электронными парами, называется ковалентной. Общая электронная пара может образоваться двумя способами: 1) в результате объединения двух непарных электронов: 2) в результате обобществления неподеленной электронной пары одного атома (донора) и пустой орбитали другого (акцептора). Два механизма образования ковалентной связи: обменный и донорно-акцепторный.
Способы перекрывания атомных орбиталей при образовании ковалентной связи Если образование максимальной электронной плотности связи происходит по линии, соединяющей центры атомов (ядра), то такое перекрывание называется σ-связью:
Способы перекрывания атомных орбиталей при образовании ковалентной связи Если образование максимальной электронной плотности связи происходит по обе стороны линии, соединяющей центры атомов (ядра), то такое перекрывание называется π-связью:
Полярная и неполярная ковалентная связь 1) Если связь образуют одинаковые атомы, двухэлектронное облако связи распределяется в пространстве симметрично между их ядрами — такая связь называется неполярной: H 2, Cl 2, N 2. 2) если связь образуют разные атомы, облако связи смещено в сторону более электроотрицательного атома — такая связь называется полярной: HCl, NH 3, CO 2.
Полярная ковалентная связь Дипольный момент связи Диполь H+δCl-δ или H+0, 18 Cl-0, 18 +δ -δ Где ±δ — эффективный заряд атома, доля абсолютного заряда электрона. Не путать со степенью окисления! l Произведение эффективного заряда на длину диполя называется электрическим моментом диполя: μ = δl Это векторная величина: направлен от положительного заряда к отрицательному.
Полярная ковалентная связь Дипольный момент молекулы равен сумме векторов дипольных моментов связей с учетом неподеленных электронных пар. Единицей измерения дипольного момента является Дебай: 1 D = 3, 3· 10 -30 Кл·м.
Полярная ковалентная связь Дипольный момент молекулы В произведении μ = δl обе величины разнонаправлены. Поэтому надо внимательно отслеживать причину изменения μ. Например, Cs. F Cs. Cl 24 31 δ «проиграл» l Cs. I HF HCl HBr HI 37 5, 73 3, 24 2, 97 1, 14 наоборот
Полярная ковалентная связь Дипольный момент молекулы Может ли молекула быть неполярной, если все связи в ней полярные? Молекулы типа АВ всегда полярны. Молекулы типа АВ 2 могут быть и полярными, и неполярными. . . Н 2 О О Н СО 2 μ>0 Н О С μ=0 О
Полярная ковалентная связь Молекулы, состоящие из трех атомов и более (АВ 2, АВ 3, АВ 4, АВ 5, АВ 6) , могут быть неполярными, если они симметричны. На что влияет наличие дипольного момента молекулы? Имеются межмолекулярные взаимодействия, а, следовательно, увеличиваются плотность вещества, t°плавления и t°кипения.
Сравнение ионной и ковалентной полярной связей Общее: образование общей электронной пары. Отличие: степень смещения общей электронной пары (поляризация связи). Ионную связь следует рассматривать как крайний случай ковалентной полярной связи.
Сравнение характеристик ионной и ковалентной полярной связей Ковалентная связь: насыщена и направлена Насыщаемость (максимальная валентность) — определяется способностью атома образовывать ограниченное количество связей (с учетом обоих механизмов образования). Направление связи задает валентный угол, зависящий от типа гибридизации орбиталей центрального атома. Ионная связь: ненасыщена и ненаправлена.
Сравнение характеристик ионной и ковалентной полярной связей Направленность связи задают валентные углы. Валентные углы определяют экспериментально или предсказывают на основе теории гибридизации атомных орбиталей Л. Поллинга либо теории Гиллеспи. Подробно об этом на семинарах.
Сравнение свойств веществ с ионными и ковалентными связями Ковалентные связи Атомные кристаллы Между атомами в самом кристалле Высокая твердость высокие tºплав, tºкип плохие тепло- и электропроводность Молекулярные кристаллы Между атомами в молекуле Умеренная мягкость достаточно низкие tº плав, tºкип плохие тепло- и Электропроводность Нерастворимы в воде
Сравнение свойств веществ с ионными и ковалентными связями Атомный ковалентный кристалл Температура плавления ≈ 3700 °С
Сравнение свойств веществ с ионными и ковалентными связями Ионные связи между ионами в кристалле твердость и хрупкость высокая температура плавления плохие тепло- и электропроводность Растворимы в воде
Металлическая связь осуществляется электронами, принадлежащими всем атомам одновременно. Электронная плотность делокализована «электронный газ» . Характерный металлический блеск Пластичность Ковкость Высокие тепло- и электропроводность Температуры плавления очень разные.
Межмолекулярные связи. 1. Водородная связь Притяжение между атомом водорода (+) одной молекулы и атомом F, O, N (–) другой молекулы Полимер (HF)n Димер уксусной кислоты Водородные связи слабы индивидуально, но сильны коллективно
Межмолекулярные связи. 5. Ван-дер-ваальсовы связи Даже если между молекулами нет водородных связей, молекулы всегда притягиваются друг к другу. Притяжение между молекулярными диполями называют вандер-ваальсовой связью. В-д-в притяжение тем сильнее, чем больше: 1) полярность; 2) размер молекул. Пример: метан (CH 4) – газ, бензол (C 6 H 6) – жидкость Одна из самых слабых в-д-в связей – между молекулами H 2 (т. пл. – 259 о. С, т. кип. – 253 о. С). Взаимодействие между молекулами во много раз слабее связи между атомами: Eков(Cl–Cl) = 244 к. Дж/моль, Eвдв(Cl 2–Cl 2) = 25 к. Дж/моль но именно обеспечивает существование жидкого и твердого состояния вещества
В лекции использованы материалы профессора химического факультета МГУ им. Ломоносова Еремина Вадима Владимировича Спасибо за внимание!
приведите пример с ионной типом кристаллическая решетки и укажите её физические свойства???
1.Який газ при згоранні утворює білий густий дим і краплі води2. Яка речовина при згоранні утворює газ з різким запахом і газ від якого мутніє вапняка
…
вода?СРОЧНО БУДЛАСОНЬКА
химия 7 класс разбор элементов 5, 10, 16 и 20
Помогите!!!!!Дано:m розчину=150 гW речовини=15%m (h3O)=50 г———————-m (нового розчину)-?W речовини-?
Дослідження достовірності реклами з погляду хімії
ВІДПОВІДЬ
Реклама стала невід’ємним атрибутом нашого життя. Іноді вона допомагає зорієнтуватися у рі
…
зноманітті товарів, вибрати найбільш підходящий для нас, але іноді і шкодить, особливо малоосвіченим людям, обіцяючи «чудеса». Численні рекламні ролики стверджують, що до складу хорошої зубної пасти обов’язково має бути включений фтор. Попри те, що фторид — природна речовина, він є токсичним для людини, набагато більшим токсином, ніж свинець. Кількість фториду в одному тюбику зубної пасти середнього розміру досить для того, щоб убити маленьку дитину, якщо використати увесь тюбик за один раз. Фторид — це нейротоксин, який погіршує пам’ять і послабляє розумові здібності. Пасти, які були найширше розрекламовані («Colgate», «Blend — a — med»), мають в собі найбільший вміст фтору. Люди стали купувати ці зубні пасти не тому що їх користь доведена, а тому що багаторазово повторена брехня(у вигляді реклами ) стала сприйматися багатьма людьми як правда.
Рослинна олія Особлива позначка на пляшках з соняшниковою олією — «без холестерину» — повинна спонукати громадян, яких хвилює це питання, купувати саме це масло.
Далеко не всі знають про те, що холестерину немає і не може бути ні в одній пляшці олії будь-якої марки. Холестерин — це природний жирний спирт, що міститься строго в тваринних організмах. І писати на пляшках з маслом «без холестерину», все одно що писати «без хліба» — його там немає і так. Вітамін Е, який теж виступає в комунікації як конкурентна перевага, навпаки, невід’ємна частина соняшникової олії.
Пральні порошки Останній писк моди у галузі створення композицій для прання — введення в порошки ферментів (чомусь званих ензимами). Ці речовини досить успішно справляються з біологічними забрудненнями типу плям від яєць, крові, вина і т. д. Порошки з ферментами можуть знадобитися при пранні, наприклад, скатертин або дитячих речей.
Але! Ферменти не витримують температуру понад 50 градусів, так що при пранні постільної білизни з кип’ятінням порошок з ферментами використовувати безглуздо. Тим більше, що їх присутність зазвичай помітно здорожує порошок. Ступінь забрудненості речей, склад і колір їх тканин, а також наявність плям на них, є одними з головних критеріїв у виборі прального порошку
Колаген і еластин в кремі повернуть молодість шкіри. Гірка правда полягає в тому, що скільки не втирай колаген шкіри, зморшок від цього менше не стане. Молекули еластину і колагену занадто великі, щоб проникнути через верхній шар шкіри. Це просто неможливо з точки зору медицини. Крім того, використання крему з колагеном може негативно позначитися на вашій шкірі. Адже, як уже говорилося, колаген не може проникнути в шкіру, тому він буде просто закупорювати пори, а це призводить до самі знаєте чого. Втім, з допомогою колагену можна тимчасово позбутися від зморшок — знову ж, якщо зробити ін’єкцію.
Креми на основі плаценти дуже ефективні Омолоджуючу дію плаценти було відкрито ще в минулому столітті. В результаті експериментів з’ясувалося, що секрет її впливу — стероїдних гормонах, які, проникаючи в шкіру, справді омолоджують її. Але (і це важливо) незабаром після цього виявилося, що у плаценти є безліч побічних ефектів: зокрема вона змінює гормональний фон, що вже не дуже здорово. Тому вчені спробували прибрати з гормони плаценти. Тобто саме те, що омолоджує шкіру. Втім, у більшості випадків, коли вам намагаються продати крем з плацентою, там немає навіть такої плаценти.
висновок
Дослідивши рекламу товарів, яку ми часто бачимо на екранах наших телевізорів та чуємо по звукових трансляторах, я дійшла до висновку, що не завжди та інформація яка озвучується або написана на етикетках відповідає дійсності . Отже, щоб не впасти в халепу, потрібно не довіряти рекламі а більш ретельно вивчати інформацію яка зазначена на етикетці оскільки лише від нас самих залежить наше здоров’я.
m (h3O)=222гW речовини=15%m розчину?
фізичні властивості атомів
Напишите уравнение реакций по схеме KCIO3-O2-P2O3-P2O5-h4PO4
складіть формулу неорганічних сполук
№1Выбери правильное утверждение.
Щелочные металлы:
образуют кислоты
реагируют с водой с образованием щёлочи и водорода
реагируют с металлами
не реагир
…
уют с кислородом
№2
В ряду элементов Na,Mg,Al,Si,P,S,Cl металлические свойства простых веществ:
не изменяются
ослабевают
усиливаются
№3
Расположи химические элементы по возрастанию относительной атомной массы:
1 — Mg; 2 — S; 3 — Cl; 4 — Al.
Ответ запиши в виде последовательности цифр. Например: 1432.
№4
Выбери современную формулировку Периодического закона:
свойства простых веществ, а также состав и свойства соединений элементов находятся в периодической зависимости от величины их относительных атомных масс
периодичность изменения свойств обозначает, что через определённое число элементов свойства повторяются
свойства химических элементов, а также состав и свойства их соединений находятся в периодической зависимости от зарядов атомных ядер
№5
Установи соответствие между химическим элементом и его высшей валентностью в кислородном соединении.
1 — Cl; 2 — Li; 3 — Mg; 4 — B.
а) I; б) II; в) III; г) IV; д) V; ж) VI; з) VII.
Запиши ответ в виде последовательности цифр и букв, например: 1а2б3ж4г.
№6
Отметь общие формулы, которые соотвествуют высшему оксиду и водородному соединению элемента № 6:
R2O5
RO2
R2O3
R2O
Rh5
Rh4
Rh3
RH
№7
Укажи порядковый номер и название химического элемента, расположенного в пятом периоде, IIIB группе Периодической системы.
Запиши номер и название через запятую и пробел. Например: 6, углерод.
Ответ: №
.
№8
Какой из указанных химических элементов относится к главной подгруппе: цинк, медь, цирконий, магний?
В ответе укажи символ этого химического элемента: например, Rb.
№9
Какой из указанных химических элементов находится в побочной подгруппе: рубидий, олово, титан, бериллий?
В ответе укажи символ этого химического элемента: например, Au.
№10
Какое число элементов образует третий период Периодической системы:
12
2
8
32
18
№11
Номер группы не совпадает с высшей валентностью для элемента:
Mo
Fr
Cu
Ge
№12
Выбери химический элемент, высшая валентность которого равна IV:
молибден, цирконий, астат, висмут.
№13
Выбери верные утверждения:
все элементы в Периодической таблице разделены на периоды
в каждом периоде происходит ослабление неметаллических свойств
номер периода показывает высшую валентность элементов
высшая валентность золота не совпадает с номером группы, в которой оно находится
№14
Установи соответствие между химическим элементом и семейством элементов, к которому он принадлежит:
1. F А. щелочные металлы
2. Ra Б. щелочноземельные металлы
3. Rb В. инертные газы
4. Kr Г. галогены
Запиши ответ в виде сочетания букв и цифр без пробелов: например, А1Б2В3Г4.
Ответ:
Na2O + MgS = Na2S + MgO написати окисно-відновне рівняння
Физические и электрические свойства ионных кристаллов Текст научной статьи по специальности «Физика»
ИЗВЕСТИЯ
ТОМСКОГО ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ ПОЛИТЕХНИЧЕСКОГО Той 83 ИНСТИТУТА имени С. М. КИРОВА 1956 г.
ФИЗИЧЕСКИЕ 1 ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ИОННЫХ
КРИСТАЛЛОВ А. А. ВОРОБЬЕВ и Е. К. ЗАВАДОВСКАЯ
Введение
В настоящее, время в физике диэлектриков и физике твердого тела в более широком смысле рассматривается несколько отдельных, не связанных друг с другом учений: учение о диэлектрической поляризации и диэлектрическом коэффициенте, ионной проводимости, диэлектрических потерях, электронной проводимости, электрической прочности и пробое, механической прочности и механическом разрушении, упругих и тепловых свойствах и другие.
За длительное время как в учебной, так и научной литературе вырабатывался вышеуказанный подход к изолированной трактовке этих вопросов. Нужно отдать справедливость педагогам, разработавшим методику раздельного изложения этих вопросов. Сейчас только человек, не искушенный в физике диэлектриков и электроматериаловедении, может поставить себе такой вопрос, почему все эги свойства единого рассматриваются в отдельности, где же единство всех этих свойств объекта нашего изучения—диэлектрика.
Изолированное изучение отдельных свойств материалов уводит некоторых исследователей далеко от сущности изучаемого, приводит к попыткам оторвать эти свойства от самого объекта изучения и взаимосвязанности свойств объекта.
Общим в методике и физике при изложении явления ионной проводимости, или диэлектрических потерь, или электронной проводимости является игнорирование основной структуры и состава диэлектрика. Общим в методике объяснения перечисленных свойств является также отыскание возможных вторичных процессов и исключение из рассмотрения самого изучаемого тела и закономерных в данных условиях процессов в нем.
Изучение первичных явлений в однородном диэлектрике обычно заменяется изучением вторичных процессов в нем или свойств недоброкачественного материала.
Признаком хорошего тона в науке о диэлектриках считалось умение ■объяснить наблюдаемые явления ролью примесей, дефектов и нарушениями основной структуры.
Основная структура и химический состав материала не учитывались при изучении свойств диэлектриков и процессов в них, исключая явления диэлектрической поляризации. Ионная проводимость диэлектриков объясняется освобождением слабо связанных ионов примесей и их последующими перемещениями по дефектным узлам решетки. Высоковольтная поляризация диэлектрика, играющая значительную роль в теории ионной проводимости, представляется вторичным явлением и связана с ионами примесей. Объяснение диэлектрических потерь исходит из наличия в диэлектрике дефектов и примесей. В оенэвном потери объясняются колебаниями ионов примесей в потенциальной яме дефектного участка решетки.
‘перспективным. Оно позволяет улучшить данный диэлектрик, но не всегда приводит к установлению основной закономерности, определяющей связь между свойствами диэлектриков, его составом и структурой, не позволяет улучшать и конструировать диэлектрики с заранее заданными свойствами.ртдддаой.,,
В процессе наших исследований по теории диэлектриков мы поздно •ознакомились с работами акад. А. Е. Ферсмана по геохимии и обнаружили параллелизм в некоторых наших разработках и заключениях.
Известно, что термическая и механическая прочность природных группировок атомов в газообразном, жидком и твердом состояниях связаны как между собой, так и с периодическим строением самого атома. Следствием пдмшдичаосет—строения атомов является периодичность свойств вещества: -коэффициента расширения и сжимаемости, коэффициента связи, атомной тея-лоемкостиг точки плавления и кипения, теплот плавления к кипения и т. д.
‘ПрОЧНоЪть~еЖ1аги*~0Лё1иентов обусловливается сочетанием отдельных атомов в разные системы молекул и твердые кристаллические решетки. Акад. А. Е. Ферсман приводит ряд эмпирических правил, — устанавливающих связь между температурой плавления (термическим разрушением) элементов, их соединений с их периодическими свойствами, энергией решетки, плотностью •упаковки и другими. Приведем некоторые следствия из этой теории, необходимые для последующего описания явлений в диэлектриках,
Ход процессов образования химических соединений и кристаллизации термодинамически направлен в сторону уменьшения свободной энергии (уде: .личения энтропии) системы.
Устойчивость, прочность кристалла зависят от величины сил, действующих между его частицами, и определяемой ими потенциальной энергии кристаллической решетки. Под действием внешних условий при нагревании, механическом воздействии, действии внешнего электрического поля энергия взаимодействия между частицами может быть преодолена, и решетка разрушена. Это наблюдается при плавлении, механическом и электрическом раз-\ рушении. Величина энергии, необходимая для разделения кристаллической решетки на отдельные ионы и удаление их друг от друга на бесконечно большое расстояние при температуре абсолютного нуля, или энергия, выделяемая при образовании решетки из свободных ноков, называется энер-I гией решётки!™»
Следует думать, что энергия кристаллической решетки однозначно определяет ее устойчивость и различные свойства. Величина энергии решетки является важным показателем энергетического уровня системы.
Энергия решетки есть важнейшее слагаемое теплового эффекта в уравнении химической реакции. Энергия кристаллической решетки в общем виде .может быть определена на основании теории кристаллической решетки при учете сил притяжения и отталкивания, действующих между катионом и анионом, и дается формулой в виде:
. «‘-1 , (1) а о пг
где А—-постоянная Маделунга, зависящая от симметрии решетки; ~Ша и Шв — валентности входящих в решетку ионов;
ао — кратчайшее расстояние между центрами разноименно заряженных ионов в решетке; п 1 — показатель степени в выражении сил отталкивания, определяемый из сжимаемости кристаллов.
Термохимически энергия решетки определяется из кругового процесса Борна-Габера по формуле:
+ —Е)+С}, (2>
где С? — тепловой эффект реакции, £/—суммарная энергия решетки, /—полная энергия ионизации металла, Е — сродство электрона к аниону, а— теплота сублимации, О — теплота диссоциации.
Энергия решетки может быть рассчитана в больших калориях на один моль вещества ккал!моль или электронвольтах на пару ионов (одну молекулу) или в других единицах.
Для энергии кристаллической решетки типа МаС1 Борном получена формула:
з
О = 545 УЩ~ккал’моль, (3)
где р — плотность вещества и М — его молекулярный вес. Выражение энергии решетки для кристаллов других типов получается тоже в виде (3), но с другими коэффициентами.
В случае бинарных соединений типа Ат Вт А. Ф. Капустинский для расчета энергии решеток с координационным числом 6 приводит следующую упрощенную формулу:
Нл+Кв
где а — число катионов, Ь — число анионов, 1Уа и ^/в — валентности аниона и катиона,
Щ— Ел+Кв—радиусы соответственных ионов для структуры решетки типа каменной соли.
Приближенная формула (4) не учитывает некоторые величины, входящие в точное выражение, например, коэффициент „расшатывания», различие радиусов ионов для разных типов кристаллических структур и координационных чисел, не учитывает поправки на поляризацию.
Ионные решетки имеют большое значение энергии решетки и как следствие этого большую термическую и механическую стойкость. Гомеополяр-ные решетки состоят из прочных обособленных молекул, слабо связанных друг с другом. Следствием этого является их слабая термическая и механическая стойкость, несмотря на более высокое значение энергии решетки, чем для ионных решеток.
В случае однородной кристаллической структуры ее механическая прочность будет связана с энергией решетки. В остальных случаях, например, в случае слоистых структур (слюда, графит, углекислота в твердом состоянии) разрушение решетки будет идти по ослабленным местам вдоль слоев, и соответствия между полным значением энергии решетки и ее прочностью уже не будет. Нужно заметить, что если между механической прочностью структуры и энергией решетки намечена какая-то логическая связь, то численных соотношений между этими величинами пока нет.
Поляни для кристаллов дает формулу, связывающую величину поверхностной энергии о и прочность Z в виде
о =- . ап , (о}
2 Е
где щ—междуатомное расстояние и Е—модуль упругости.
По акад. А. Е. Ферсману наиболее прочные (твердые) структуры должны получаться при образовании соединений из четырехвалентных элементов, например: С—С—И; С—М0. Оксиды элементов второй группы таблицы Менделеева Ве, 1\%, Са, 2п, Бг, Ва, имеющие высокое значение энергии решетки, теплоты образования, температуры плавления, должны также иметь высокие электрические и механические свойства.
Акад. А. Е. Ферсман, изучавший термическую и механическую стойкость кристаллических решеток, сделал интересные выводы. Энергия связи элементов в металле находится в зависимости от величины энергии решетки и. Полное соответствие следует ожидать лишь для координационных ионных решеток, где нет геометрически и физически замкнутых образований, кроме самих ионов или атомов.
Иначе обстоит дело в решетках с закрытой связью или слоистых решетках, где силы сцепления распределены неравномерно и где имеются большие силы связи внутри молекулы и очень слабая связь между отдельными молекулами. В этом случае при большой суммарной величине энергии решетки связь между молекулами слаба; вследствие этого вещество имеет малую твердость и летучесть.
Таким образом, большая величина энергии решетки (У предполагает высокую прочность лишь для соединений гетерополярного координационного типа, и обратно: прочность, стойкость, трудная летучесть, диссоциация, твердость зависят не только от ¿/, но и от типа решетки и ее геометрических особенностей—таков общий вывод акад. А. Е. Ферсмана.
Итак, наука уже показала, что многие свойства материалов закономерно связаны с энергией решетки, ее типом и геометрическими особенностями. Надо полагать, что электрические свойства материалов не должны быть исключением из этого правила. Эти закономерности нужно установить. Если исключить из рассмотрения тип решетки и ее геометрические особенности, то есть рассмотреть решетку одного типа, то тогда свойства материала будут однозначно связаны с энергией кристаХлической решетки.
Мы это попробовали сделать с кристаллами щелочно-галоидных солей, имеющими решетку типа каменной соли. Сопоставили их электрические свойства с энергией решетки и постоянной решетки, связанной с энергией решетки формулой А. Ф. Капустинского.
Современная теория кристаллической решетки и известные экспериментальные результаты содержат необходимые данные для сопоставления электрических свойств ионных решеток с их энергетическими и структурными характеристиками.
Зависимость физических свойств кристаллов типа каменном соли от энергии решетки
Физико-химические свойства химических соединений изменяются закономерно при изменении их состава. Это является следствием закономерного изменения свойств самих элементов.
Температура плавления элементов в таблице Менделеева изменяется закономерно. Она увеличивается с валентностью и уменьшается с атомным объемом. Температура плавления связана со структурой решетки, с плотностью упаковки. Эмпирически установлено, что для элементов, кристаллизующихся в кубе с центрированными гранями, температура плавления примерно пропорциональна корню квадратному из атомного веса, а для элементов, кристаллизующихся в решетке типа центрированного куба, температура плавления пропорциональна -корню кубическому из атомного веса. При прочих равных условиях температура плавления или кипения химического соединения должна понижаться*с увеличением радиуса ионов и, следовательно, постоянной решетки вещества. При этом также уменьшается механиче-
екая прочность и твердость, а растворимость соединения увеличивается. Для температуры плавления химических соединений Фридрих и Ситтинг установили следующие закономерности.
1. Нет резкого различия между температурой плавления атомных и ионных решеток. Это является следствием отсутствия резкого различия в значениях энергий этих решеток.
2, Температура плавления изменяется в основном в прямой зависимости от валентности элементов соединения и, в меньшей степени,—в обратной зависимости от атомного объема. Температура плавления бинарных ■соединений примерно выражается формулой:
Тпл ю
ГП 2, /’:
(6)
где и Z■l — валентности и К — атомный радиус.
3. Явление поляризации атомов в соединении понижает температуру плавления. Температура плавления в значительной степени зависит от расстояния между атомами или ионами, входящими в соединение.
I,, Эта же закономерность наблюдается и для изменения электрической прочности, что установлено нами. С увеличением поляризуемости уменьшается электрическая прочность кристаллов солей щелочно-галоидного ряда. С повышением температуры плавления кристаллов одновременно возрастает их электрическая прочность.
4. Роль анионов больше, чем роль катионов при их морфотропическом «замещении.
и
1000 I
300
«00
600
50 О
1 у 1 / у Не Г | | 1 1 !
с X А» У 1
у/ / ш
Я 63 ЯВЗг исе/
и _/ и/’
эв
6.5
7,5
У.5
ю.5 а. о
Фиг. 1. Зависимость между энергией решетки и температурой плавления Тпл «С для кристаллов щелочио-галоидвых солей.
Для электрической прочности кристаллов щелочно-галоидных солей это правило также имеет место, на что было указано А. Хиппелем и А. А. Воробьевым.
5. Температура плавления вещества растет для более симметрично построенных молекул. Такие ряды известны, например, в органической химии, где иногда четные члены гомологического ряда обладают более высокой температурой плавления, чем промежуточные нечетные.
Так, в ряде кислот—щавелевой, янтарной и т. д. четному числу групп ъН2 отвечает повышенная температура плавления.
Зависимость температуры плавления кристаллов щелочно-галоидных
солеи от энергии решетки, представленная на фиг
находится в согласии
приведенными выше
положениями. Между температурой плавления гало-
идного соединения металла и его энергией решетки получена приблизительная линейная зависимость.
С увеличением энергии решетки химического соединения его термическая прочность, характеризуемая температурой плавленая, возрастает. При уменьшении масштаба линии на фиг. 1 могут слиться в одну. В этом случае зависимость температуры плавления щелочно-галоидных соединений от энергии решетки получается почти линейной. .
Фиг. 2. Зависимость между объемом молекулы и энергией решетки для кристаллов щелочно-галоидных солей.
Теоретически следует, что в простой зависимости от энергии решетки .должны быть тепловые эффекты, сопровождающие физические и химические процессы. Экспериментальные данные показывают, что с уменьшением энергии ¡решетки щелочно-галоидных соединений уменьшается скрытая теплота плав-
Фиг. 3. Зависимость удельного веса кристаллов щелочно-галоидных солей от энергии решетки.
.ления, температура испарения и скрытая теплота испарения, а также и теплота сублимации химических соединений в твердом состоянии, теплосодержание, теплоемкость и др. Теплоемкость, в свою очередь, связана с другими «физическими величинами, что и определит их связь с энергией решетки.
о
На фиг. 2 представлено изменение объема молекулы в А3 щелочно-га-лоидных соединений по данным рентгеновского анализа и величины энергии решетки для кристаллов щелочно-галоидных соединений типа каменной соли.
На фиг. 3 изображена зависимость удельного веса кристаллов щелочно-галоидных солей от энергии решетки. С увеличением энергии решетки имеется общая тенденция к возрастанию удельного веса кристаллов. При замещении галоида от фтора к иоду удельный вес кристаллов соединений возрастает.
Замещение металла при неизменном галоиде сопровождается изменением удельного веса кристалла. Это видно на фиг. 3, где изображено изменение плотности кристаллов щелочно-галоидных солей при изменении энергии решетки. С увеличением энергии решетки удельный вес кристаллов имеет тенденцию к уменьшению.
На фиг. 4 изображено изменение коэффициента сжатия для кристаллов-щелочно-галоидных солей при изменении их состава. Наибольшей сжимаемостью обладают соединения с меньшей энергией решетки, большей поляризуемостью и с наименьшей концентрацией ионов в единице объема.
Зависимость поляризационных свойств молекул и кристаллов, щелочно-галоидных соединений от энергии решетки
На фиг. 5 построена зависимость между числом ионов п в 1 смг и постоянной решетки для кристаллов щелочно-галоидных солей. Величина п определена из условия:
где N — 6,06.1023, р — удельный вес, Аг и А., — атомные веса ионов.
С увеличением постоянной решетки концентрация ионов в решетке непрерывно уменьшается. С увеличением постоянной решетки уменьшается энергия решетки, поэтому концентрация ионов в кристаллах щелочно-галоидных соединений будет возрастать с увеличением энергии решетки.
На фиг. 6 и 7 изображено изменение концентрации ионов в решетке при замещении катиона или аниона. Эти результаты показывают раздельно роль катиона и аниона и находятся в согласии с результатами, представленными на фиг. 5. Замещение катиона и аниона вызывает изменение кон-
V,:> ЗД %5 ¡(¿¡О Ш,5 /1,0 !1илек
Фиг. 4. Зависимость коэффициента сжатия кристаллов щелочно-галоидных солей от энергии решетки.
центрации ионов в кристалле, причем влияние того и другого на измене’ ние концентрации приблизительно одинаково.
Л-/О’
330
290 250 2Щ по
¡30 90 50
и> \ { 1 !
\ 1 \ !
\
\ V
‘V л шсе
¥авг
ксе^ 1 … щ т «о
2,2
г, б
3,0
3,4
3,8
Ю см
Фиг. 5. Зависимость между числом ионов в 1 с.и3 для кристаллов щелочно-галоидных солей и постоянной решетки.
Тессман, Кан и Шокли, пользуясь показателем преломления п для кри сталлов, с помощью выражения
— 3 Ут п2— 1
О. т — —
4″ п2 + 2
где Vт — объем молекулы, определили величины электронной поляризуе мости ат щелочных и галоидных ионов и молекул.
П:/0 230
п-ю
330
20
Фиг. 6. Изменение числа ионов п в 1 см3 при замещении аниона в кристаллах щелочно-галоидных солей.
Фиг. 7. Изменение числа ионов п .в 1 см? при замещении катиона в кристаллах щелочно-галоидных солей.
Пользуясь значениями ат, они определили также поляризуемость других галоидосодержащих соединений как сумму электронных поляризаций их ионов. «
Показатель преломления света в этих исследованиях измерялся для монохроматических линий спектра натрия на кристаллах значительных размеров. Величина коэффициента преломления для л = со определялась путем .экстраполяции.
На фиг. 8 изображена зависимость между электронной поляризуемостью молекул ат и величиной энергии решетки. Поляризуемость молекулы зависит -от природы катиона и аниона; она уменьшается последовательно при замене № на К, На, У. Для анионов электронная поляризуемость уменьшается .при замене Л на Вг, С1 и Р. Фтористый рубидий, кристаллизующийся в решетке типа хлористого цезия, не составляет исключения в этом ряду.
\
\
\
ийи ~-
\
V!
38
6 0
6.5
V
8,5
90
полек
‘0,0 ¡05
Фиг.радиусами.
На фиг. 9 и 10 представлена зависимость показателя преломления
о
определенного при л = со и Хд = 5893 А от энергии решетки. Из фиг. 9 и 10 видно, что показатель преломления света в кристаллах щелочно-гало-идных соединений возрастает ори последовательной замене металлов от КЬ к Ы и последовательно уменьшается при замене галоидов от Л к Р. Такие же результаты получены при измерениях показателя преломления света линий С и Р спектра натрия.
На фиг. .11 изображена зависимость между энергией решетки и рефракцией, взятой как сумма рефракции аниона и катиона. В согласии с предыдущим наблюдается уменьшение рефракции с увеличением энергии решетки, рассчитанной на пару ионов. Эта зависимость позволяет видеть отдельно влияние изменения рефракции аниона и катиона на величину энергии решетки. —< щ, то получается формула для молекулярной рефракции МЯ-, с показателем преломления п при данной частоте V:
Ж Би,
где
•молекулярный вес и
ё,-
■ плотность вещества.
/ ш
/
/ ‘N,10 / /
РЛ» У К
щ ——‘»л’ сег
ЯШ’
1 А’; ми?
6.0 6,5 70 7.3 «.О 8.5 9.0 5.5 1-0,0 ИЛ» цо
Фиг. модем.
Фиг. 11. Зависимость между суммой рефракций аниона-К А и рефракцией катиона Ик и энергией решетки для кристаллов щелочно-галоидных еолей-.
Молекулярная рефракция является аддитивным свойством вещества с ясно выраженной зависимостью от его молекулярного строения, например, присутствия диполей. Вследствие этого молекулярную рефракцию можно вычислять из атомных констант. Появляющиеся при этом отступления объясняются особенностями структуры вещества.
Благодаря взаимодействию между а!омами, в молекуле происходит внутримолекулярная поляризация, вообще различная в зависимости от химического состава. Внутримолекулярная поляризация возрастает с плотностью упаковки в соединении. Известно, что с возрастанием напряженности поля смещение зарядов становится меньше, чем это соответствует коэффициенту упругой связи для поляризуемости в слабых полях. Подобно этому и поляризация ионов в соединении под действием поля падающей электромагнитной волны становится более слабой вследствие внутримолекулярной поляризации. Таким образом, внутримолекулярная поляризация снижает молекулярную рефракцию. Следовательно, при аддитивном расчете молекулярной рефракции не учитывается влияние: а) внутримолекулярной поляризации и б) междумолекулярной поляризации, которая, как правило, слабее первой.
В кристаллах щелоч н о- г а л о и дн ы х соединений имеет место деформация электронных орбит ионов.
Рефракция измеряет смещение электронных оболочек, то есть электронную поляризуемость в ионах или молекулах. Силовое поле соседнего иона может изменить электронную поляризуемость. Фаянс в 1923 г. показал, что в ионных соединениях вследствие влияния полей соседних ионов, рефракция молекулы обычно неравна сумме рефракций ионов, образующих это соединение и отличается от нее на величину: ДК = Нд -г- К я — Р/И. Величина отклонения ДИ может быть и положительной, и отрицательной, и равной нулю. Для галоидово-дородов ДК изменяется от 0,6 до 5,5. Это указывает на то, что поляризуемость молекулы галоидоводородов меньше, чем поляризуемость ионов.
На фиг. 12 представлено изменение молекулярной рефракции для твердых солей щелочно-галоидных металлов.
Положительное поле катионов будет укреплять электронные оболочки соседних анионов; последние своим отрицательным полем, наоборот, будут уменьшать прочность связи электронов с ядром катиона.
Из фиг. 12 видно, что ДЯ > 0 почти для всех солей. Отсюда следует, что действие катионов на анионы сильнее, чем обратное. Укрепляющее влияние катиона возрастает с уменьшением его размеров. Еще большее деформирующее действие будут оказывать многовалентные ионы. Изменение поляризации ионов в кристаллической решетке влияет на энергию, которую нужно затратить для разрушения решетки при плавлении, сублимации, растворении, электролизе и проч.
Предполагая, что действующее поле в диэлектрике равняется среднему макроскопическому, получают простое выражение, связывающее диэлектрический коэффициент с его электронной составляющей и с поляризуемостью лонного смещения в виде:
•Фиг. 12. Изменение молекулярной рефракции для твердых солей ще-лочво-галоидных соединений.
•« -I- 4~ п а,
(Ю)
где п число пар ионов в 1 см». Полагая, что внутреннее поле отличается
4
от среднего макроскопического на —-— тг/, где 1 — электрический момент
3
единицы объема диэлектрика, получим, что величина диэлектрического коэффициента е ионных кристаллов связана с поляризуемостью ионов условием:
Р:
1
4~
. 9
N (аа + сс2 -}-
(11)
где и а2—электронные поляризуемости ионов, а/—ионная поляризуемость, равная а/ =
2<г2 К
где К — коэффициент упругой связи ионов, N—число ионов в 1 см».
Величина электронной поляризуемости Рэ представляется формулой:
Рэ
Установлено, что электронная поляризация ионных кристаллов зависит от поляризуемости отдельных ионов, из которых построен кристалл, и от числа ионов в единице его объема. Электронная поляризация зависит от отношения электронной поляризуемости иона к кубу его радиуса.
На фиг. 13 представлена зависимость электронной составляющей диэлектрического коэффициента кристаллов щелочно-галоидных солей от энергии решетки. С увеличением энергии решетки и прочности соединения уменьшается электронная составляющая диэлектрического коэффициента.
Фиг. 13. Зависимость электронной составляющей диэлектрического коэффициента от энергии решетки для кристаллов ще-лочно-галоидных солей.
3,0 2,8 2, Б 2,4 2.2
4 6
6 1
у л 2вг
1 ! !
Шт«* 1 К&г
Ибсе< 1 ла ¿г Г- У
| № \ У
1 Па с
КО № 160 Ш0 Ш 220 240 260
С увеличением постоянной решетки, а следовательно, и радиусов ионов, ее составляющих, растет величина диэлектрического коэффициента. Увеличение диэлектрического коэффициента определяется возрастанием поляризуемости галоида. Замещение одного металла другим в ряду щелочно-галоидных соединений так же сопровождается изменением диэлектрического коэффициента. Например, при замещении натрия калием, несмотря на значитель-
мое увеличение поляризуемости иона, диэлектрический коэффициент молекулы все же уменьшается. Уменьшение диэлектрического коэффициента соединения является следствием увеличения радиуса иона и уменьшения их числа в единице объема. Поляризуемость, связанная с ионным смещением «/, рассчитанная на пару ионов в гетерополярной решетке, получается равной’
«г =—-
0,56
а„л
(Щ
1)
(12 )
где а() — постоянная решетки и п, > 1—показатель степени в уравнении сил отталкивания за счет взаимодействия электронных оболочек. 1,0 ¿р %о 9,5 що щв и,а тлея
Фиг. 14. Зависимость между ионной составляющей диэлектрического коэффициента и энергией решетки.
Согласно условию (12), диэлектрический коэффициент должен возрастать пропорционально ионной поляризуемости и, следовательно, а0:!.
На фиг. 14 изображена зависимость составляющей диэлектрического коэффициента за счет смещения ионов от величины энергии решетки. С увеличением постоянной решетки, а следовательно, и уменьшением энергии решетки, ионная составляющая диэлектрического коэффициента уменьшается.
£
да
9
8
7
б
5
„ эв
46,0■ 45 7,0 7,5 8,0 3,5 9,0 9,5 10,0 ¡0,5 11,о»
Фиг. 15. Зависимость диэлектрического коэффициента от энергии, решетки для кристаллов щелочно-галоидных солей.
Несмотря на увеличение поляризуемости ионов при возрастании расстояния между ними, которое должно было бы сопровождаться увеличением диэлектрического коэффициента (фиг. 14), наблюдается его уменьшение. Это увеличение ионной составляющей диэлектрического коэффициента с увеличением энергии решетки объясняется возрастанием концентрации ионов с увеличением энергии решетки кристаллов щ е л о ч н о — г а л о и д н ы к солей, отмеченное ранее.
На фиг. 15 изображена зависимость диэлектрического коэффициента от величины энергии решетки. С увеличением энергии решетки диэлектрический коэффициент возрастает. Эти графики повторяют ход зависимости ионной составляющей диэлектрического коэффициента, которая определяет величину диэлектрического коэффициента ионных кристаллов.
Зависимость ионной проводимости кристаллов щелочно-галоидных селей от постоянной решетки и энергии решетки
Зависимость электропроводности от температуры описывается двухчленной формулой типа:
_ Л-
а^А.основной структуры.
С увеличением энергии решетки высокотемпературная энергия активации и, сохраняет почти постоянное значение, изменяясь в пределах 10-;- 15% при замещении галоида или металла. Низкотемпературная энергия активации при увеличении энергии решетки почти в два раза возрастает. Значительные изменения наблюдаются как при замещении галоида, так и металла.
Особенно сильное изменение низкотемпературной энергии активации происходит при замещении ионов с большей поляризуемостью (ионы Л, Вг). Так как величина энергии активации определяет ионную электропроводность кристаллов, то можно сделать вывод, что электропроводность закономерно связана с энергией кристаллической решетки.
Зависимость диэлектрических потерь в кристаллах щелочно-галоидных солей от их состава и других свойств
Благодаря работам К. А. Водопьянова в Сибирском физико-техническом институте и его учеников, значительно повышена точность измерения угла диэлектрических потерь и получена возможность измерять в десять раз меньшую его величину. Вследствие этого оказалось возможным измерение угла диэлектрических потерь в кристаллах и установление связи его с другими физико-химическими характеристиками кристалла.
2. Изв. ТПИ, т. 83.
Из фиг. 16 следует, что находится в прямой зависимости от высоты потенциального барьера, разделяющего частицы решетки.,С уменьшением энергии активации возрастает. Величина энергии активации зависит от энергии решетки. С увеличением энергии решетки и укреплением всей структуры уменьшается (фиг. 17). Отсюда очевидной является связь с величиной постоянной решетки, энергией сублимации, теплотой образова-{ температурой плавления.
Разница между тепловой и электрической; формой пробоя, вероятно,, имеет место в способе передачи энергии от электрического поля диэлектрику и развития в нем канала пробоя.
При электрической форме пробоя энергия поля передается кристаллической решетке при помощи электронного тока, а при тепловой форме пробоя в передаче энергии решетки существенную роль играет ионный ток.
Заключение
Физические и электрические характеристики ионных кристаллов закономерно связаны с их химическим составом и структурой. Связь между различными характеристиками кристаллов щелочно-галоидиых солей выявляется при сопоставлении их с энергией решетки и постоянной решетки.
Сказанное выше об определяющей роли состава и химической структуры диэлектрика на его электрические свойства не исключает, а предполагает влияние на характеристики кристаллов дефектов в них и нарушений структуры. Можно считать, что в определенных условиях эксперимента какие-то свойства кристалла будут определяться нарушениями структуры или примесями. Это обстоятельство открывает большие возможности регулирования; свойств и характеристик материалов. Для этого необхлдимо установить законы протекания физических процессов в основной структуре и при ее нарушениях примесями и дефектами.
В приведенных рассуждениях показано, что термическая, механическая и электрическая прочность диэлектриков возрастают с увеличением энергии-решетки кристаллов типа каменной соли.
Кристаллическая решетка типа каменной соли является наиболее устойчивой и наиболее распространенной в геохимии. Этот тип решетки позволяет получать весьма компактную и симметричную упаковку ионов.
Вообще энергия гомополярных решеток несколько больше энергии re-терополярных, так как поляризация увеличивает связь и п является дополнительный член в выражении энергии решетки. Несмотря на увеличение-энергии решетки, в молекулярных решетках наблюдается понижение механической и термической прочности вследствие ослабления связи между отдельными молекулами.
В кристаллической решетке возможно замещение одних ионов другими со сходными объемами. Возможно и замещение одних ионов ионами другой-валентности при условии одновременного изменения валентности и радиуса ионов и сохранения постоянным их отношения. В случае изоморфного замещения процесс будет идти в сторону уменьшения энергии системы, увеличения энтропии и увеличения энергии решеток. Известно, что в случае сплавов элементов энергия решеток обычно увеличивается по сравнению с энергией чистых металлов. Замещение атомов вертикальных групп, вышестоящих в таблице Менделеева, нижележащими ионами с меньшими ионизационными потенциалами сопровождается уменьшением энергии соединения системы. Поэтому, замещая Са, Sr или tía, мы должны каждый раз ожидать меньшей устойчивости новой сис емы.
По мере усложнения явления в диэлектрике оно оказывается связанным, со все большим числом других величин. Если поляризуемость отдельного иона определяется валентностью и радиусом иона, то поляризуемость пары ионов уже определяется и расстоянием между ними. Поляризуемость единицы объема будет связана помимо указанных величин еще с концентрацией ионов и энергией взаимодействия их друг с другом и так далее.
Такая величина, как tg8 или электрическая прочность кристаллов, уже оказывается связанной с большим числом других характеристик кристалла. Некоторые из этих связей являются определяющими явление, другие — только в какой-то мере влияющими на него. Представляет практический, инте-
ионная, атомная и молекулярная. Зависимость свойств веществ от типа кристаллической решётки
Конспект урока по химии в 8 классе.
Тема урока: «Кристаллические решётки: ионная, атомная и молекулярная. Зависимость свойств веществ от типа кристаллической решётки».
Цель:изучение типов кристаллических решеток
Задачи:
познакомить с понятиями «аморфного» и «кристаллического» веществ, выявить зависимость свойств веществ от типов «кристаллических решеток», химической связи и строения атомов; научить определять тип кристаллической решетки и физические свойства по ним;
продолжить развитие интеллектуальных умений критического мышления (поиск, анализ, осмысление, синтез, оценка и применение информации), развивать интерес к предмету, расширять кругозор учащихся;
формирование коммуникативных и информационных компетенций.
Оборудование:
Мультимедийное: проектор, компьютеры для обучающихся , презентация выполненная в программеPowerPoint, тесты созданные в программе Stimulator;
Вещества: шоколад, алмаз, горный хрусталь, жевательная резинка, поваренная соль, пластилин, стекло, сера
Ход урока
Здравствуйте, садитесь. Звучит музыка.
I.Фронтальный опрос
Вступление учителя. Как разнообразен мир музыки, так разнообразен и мир веществ. Нас удивляет блеск различных металлов, разнообразие природных минералов. Мы уже не можем обойтись без современных сплавов, пластмасс. А нужные лекарства спасают жизнь. Нас окружает огромное количество веществ
2. Беседа по вопросам:
В каких агрегатных состояниях находятся соли, воды, кислорода, песка, железа – эти соединения в обычных условиях?
А может одно вещество находиться в разных агрегатных состояниях? Приведите пример
Как вы думаете, почему вещества при одинаковых условиях находятся в разных агрегатных состояниях?
Найдите ошибки в тексте и исправьте их .
1. Все вещества с немолекулярным строением имеют низкие температуры кипения и плавления. (высокие)
2.Вещества, имеющие мельчайшие частицы ионы и атомы имеют молекулярное строение. (немолекулярное строение)
3. Размеры атома составляют 10м.
Распределите вещества в две группы: 1. молекулярного и
2. немолекулярного строения : азот, вода, хлорид калия, водород, этиловый спирт, железо
Изучение нового материала
АКТУАЛИЗАЦИЯ
Практическая часть. Рассмотрим некоторые твердые вещества, которые на столе Шоколад, алмаз, горный хрусталь, жевательная резинка, поваренная соль, пластилин, стекло, сера. Распределите вещества на две группы.
Объясните по какому признаку вы их распределяли..
Учащиеся определяют
I группа: нет определенной температуры плавления, размягчаются постепенно и переходят в текучее состояние
II группа: имеют определенную температуру плавления, правильное расположение частиц из которых они построены.
Вывод учителя: Вспомните, что часто людей, у которых нет своей определенной позиции, которым «все-равно» называют аморфными. И наши вещества, у которых нет определенной температуры плавления, называют аморфными. Напротив, соль NaCl, оксид кремния, сульфат меди –кристаллические вещества. Для них характерны четкие температуры плавления, правильные геометрические формы, симметрия.
Что бы выяснить отличие аморфных и кристаллических веществ, их свойства (прикрепляются опорные слова «свойства веществ»), мы заглянем внутрь этих веществ. И неслучайно, эпиграфом нашего урока являются слова русского философа Н.А. Бердяева «Познать сущее нельзя извне, можно только изнутри». Запишите тему урока.
Озвучиваются цели урока.
Определение понятий «аморфные вещества» и «кристаллические вещества» (слайд 7)
Понятие «Кристаллическая решетка» (слайд 8)
Кристаллические вещества характеризуются правильным расположением частиц, из которых они построены: атомов, молекул или ионов. Эти частицы расположены в строго определенных точках пространства – называемых узлами. Если соединить узлы прямыми линиями, то образуется пространственный каркас – кристаллическая решетка.
Дополнение: Интересно, что слово «krystallos» (греч.) первоначально обозначало обычный лед, а в дальнейшем — горный хрусталь
Виды кристаллической решетки.
Вопрос: Какие частицы могут стоять в узлах решетки? (ионы, атомы, молекулы)
Отсюда и название кристаллических решеток: ионная, молекулярная, атомная, а еще металлическая. Изучать особенности каждого типа кристаллической решетки вы будите в группах. Вам необходимо будет на листах ответить на вопросы:
Виды частиц в узлах решетки?
Вид связи между частицами?
Какие вещества могут иметь ионную кристаллическую решетку? Примеры
Какими физ. свойствами будут обладать такие вещества?
Выступление групп.
Закон постоянства вещества (слайд)
Остался еще один момент урока – закон постоянства состава вещества, которому подчиняются вещества с молекулярным строением.
Этот закон открыт французским химиком Ж.Л.Прустом.
Его формулировка такова:
вещества молекулярного строения имеют постоянный состав независимо от способа их получения.
Н-р: вода – не зависимо от того как ее получают, в каком агрегатном состоянии она находится, состав ее не меняется – Н2О
Для веществ с ионным строением закон Пруста не всегда выполняется.
6. Подведение итогов
Вопросы:
Сделайте вывод, от чего зависят свойства веществ? (от типа кр. решеток). Опорные слова прикрепляются к доске.
От чего зависит тип кристаллической решетки? (от типа связи) Опорные слова прикрепляются к доске.
От чего зависит тип связи? (от строения атома) Опорные слова прикрепляются к доске.
Подведение итогов по опорным словам.
ИТОГ: Мы заглянули внутрь вещей. Рассмотрели кристаллические решетки
А теперь ответим на вопрос, который был задан в начале урока.
Почему у стекла все кусочки разной формы, а у сульфата меди сходны по форме? Почему вещества при одинаковых условиях находятся в разных агрегатных состояниях?
ЗАКРЕПЛЕНИЕ
. Выполнение тестов
В узлах кристаллической решетки меди находятся
1) Атомы 2) ионы 3) молекулы 4) атомы и ионы
2. В узлах кристаллической решетки алмаза находятся
1) Атомы 2) ионы 3) молекулы 4) атомы и ионы
3. Ионную кристаллическую решетку имеет вещество:
1) KBr 2) Br 3) HBr 4) Br2O5
4. Наиболее высокую температуру плавления имеет вещество:
1) H2O 2) SO3 3) KBr 4) Cl2
5. Кристаллическая решетка хлорида натрия NaCl:
1) атомная 2) молекулярная 3) металлическая 4) ионная
6. Какие из приведенных утверждений верны?
А. Вещества с молекулярной решеткой имеют низкие температуры плавления.
Б. Большинство веществ с металлической решеткой обладают
электропроводимостью.
1) верно только А 2) верно только Б 3) верны А и Б 4) оба неверны
7. Вещества с атомной кристаллической решеткой
1) очень твердые и тугоплавкие 2) хрупкие 3) легкоплавкие
4) проводят электрический ток
8. В каком ряду перечислены вещества, имеющие ионную кристаллическуюрешетку?
1) KBr; O2; CO2 2) FeCl3; BaS; NaI 3) SiO2; CuBr2; 4) HCl; KF; H2O
Задание. По формуле приведенных веществ: Na2O,C2H2,Si,AL – определите тип кристаллической решетки каждого соединения и на основе этого предположите физические свойства каждого из четырех веществ.
Дополнительно:AlCI3,H2S,O3
IV. РЕФЛЕКСИЯ
Прочитайте цель занятия. Достигли вы цели? С какими новыми понятиями вы познакомились на уроке? С какими трудностями вы столкнулись?
Запишите домашнее задание. §.8 выучить основные понятия отв. на вопр.3 с. 32 и тестовые задания.
И чтобы поставить точку в нашем уроке у нас есть черный ящик. Отгадайте, какое вещество находится в нем. Это вещество не имеет определенной температуры плавления. Если его держать в руках, оно сначала размягчается, затем становится жидким. Вещество имеет сладкий вкус, коричневый цвет..
Она растает на руках.
И след оставит на губах. И сладкий вкус её загадка
Зовут её все…(шоколадка)
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/217989-konspekt-uroka-po-himii-po-temekristallichesk
Соединения с молекулярной кристаллической решеткой. Типы кристаллических решеток
Твердые вещества существуют в кристаллическом и аморфном состоянии и преимущественно имеют кристаллическое строение. Оно отличается правильным местоположением частиц в точно определенных точках, характеризуется периодической повторяемостью в объемном, Если мысленно соединить эти точки прямыми — получим пространственный каркас, который и называют кристаллической решеткой. Понятие «кристаллическая решетка» относится к геометрическому образу, который описывает трехмерную периодичность в размещении молекул (атомов, ионов) в кристаллическом пространстве.
Точки расположения частиц называются узлами решетки. Внутри каркаса действуют межузловые связи. Вид частиц и характер связи между ними: молекулы, атомы, ионы — определяют Всего выделяют четыре таких типа: ионные, атомные, молекулярные и металлические.
Если в узлах решетки расположены ионы (частицы с отрицательным или положительным зарядом), то это ионная кристаллическая решетка, характеризующаяся одноименными связями.
Эти связи весьма прочны и стабильны. Поэтому вещества с таким типом строения обладают достаточно высокой твердостью и плотностью, нелетучи и тугоплавки. При низких температурах они проявляют себя как диэлектрики. Однако при плавлении таких соединений нарушается геометрически правильная ионная кристаллическая решетка (расположение ионов) и уменьшаются прочностные связи.
При температуре, близкой к температуре плавления, кристаллы с ионной связью уже способны проводить электрический ток. Такие соединения легко растворимы в воде и других жидкостях, которые состоят из полярных молекул.
Ионная кристаллическая решетка свойственна всем веществам с ионным типом связи — соли, гидроксиды металлов, бинарные соединения металлов с неметаллами. не имеет направленности в пространстве, потому что каждый ион связан сразу с несколькими противоионами, сила взаимодействия которых зависит от расстояния между ними (закон Кулона). Ионно-связанные соединения имеют немолекулярное строение, они представляют собой твердые вещества с ионными решетками, высокой полярностью, высокими температурами плавления и кипения, в водных растворах являющиеся электропроводными. Соединений с ионными связями в чистом виде практически не встречается.
Ионная кристаллическая решетка присуща некоторым гидроксидам и оксидам типичных металлов, солям, т.е. веществам с ионной
Кроме ионной связи в кристаллах бывает металлическая, молекулярная и ковалентная связь.
Кристаллы, имеющие ковалентную связь, являются полупроводниками или диэлектриками. Типовыми примерами атомных кристаллов служат алмаз, кремний и германий.
Алмаз — это минерал, аллотропная кубическая модификация (форма) углерода. Кристаллическая решетка алмаза — атомная, весьма сложная. В узлах такой решетки находятся атомы, соединенные между собой крайне прочными ковалентными связями. Алмаз состоит из отдельных атомов углерода, расположенных по одному в центре тетраэдра, вершинами которого являются четыре ближайших атома. Такая решетка характеризуется гранецентрированной кубической что обусловливает максимальную твердость алмаза и довольно высокую температуру плавления. В решетке алмаза отсутствуют молекулы — и кристалл можно рассматривать как одну внушительную молекулу.
Помимо этого, свойственна кремнию, твердому бору, германию и соединениям отдельных элементов с кремнием и углеродом (кремнезем, кварц, слюда, речной песок, карборунд). Вообще же представителей с атомной решеткой относительно немного.
Большинство твердых веществ имеют кристаллическую структуру
, в которой частицы, из которых она «построена» находятся в определенном порядке, создавая тем самым кристаллическую решетку
. Она строится из повторяющихся одинаковых структурных единиц — элементарных ячеек
, которая связывается с соседними ячейками, образуя дополнительные узлы. В результате существует 14 различных кристаллических решеток.
Типы кристаллических решеток.
В зависимости от частиц, которые стоят в узлах решетки, различают:
- металлическую кристаллическую решетку;
- ионную кристаллическую решетку;
- молекулярную кристаллическую решетку;
- макромолекулярную (атомную) кристаллическую решетку.
Металлическая связь в кристаллических решетках.
Ионные кристаллы обладают повышенной хрупкостью, т.к. сдвиг в решетке кристалла (даже незначительный) приводит к тому, что одноименно заряженные ионы начинают отталкиваться друг от друга, и связи рвутся, образуются трещины и расколы.
Молекулярная связь кристаллических решеток.
Основная особенность межмолекулярной связи заключается в ее «слабости» (ван-дер-ваальсовые, водородные).
Это структура льда. Каждая молекула воды связана водородными связями с 4-мя окружающими ее молекулами, в результате структура имеет тетраэдрический характер.
Водородная связь объясняет высокую температуру кипения, плавления и малую плотность;
Макромолекулярная связь кристаллических решеток.
В узлах кристаллической решетки находятся атомы. Эти кристаллы разделяются на 3 вида:
- каркасные;
- цепочечные;
- слоистые структуры.
Каркасной структурой
обладает алмаз — одно их самых твердых веществ в природе. Атом углерода образует 4 одинаковые ковалентные связи, что говорит о форме правильного тетраэдра (sp
3
— гибридизация). Каждый атом имеет неподеленную пару электронов, которые также могут связываться с соседними атомами. В результате чего образуется трехмерная решетка, в узлах которой только атомы углерода.
Энергии для разрушения такой структуры требуется очень много, температура плавления таких соединений высока (у алмаза она составляет 3500°С).
Слоистые структуры
говорят о наличии ковалентных связях внутри каждого слоя и слабых ван-дер-ваальсовых — между слоями.
Рассмотрим пример: графит. Каждый атом углерода находится в sp
2
—
гибридизации. 4-ый неспаренный электрон образует ван-дер-ваальсовую связь между слоями. Поэтому 4ый слой очень подвижен:
Связи слабые, поэтому их легко разорвать, что можно наблюдать у карандаша — «пишущее свойство» — 4ый слой остается на бумаге.
Графит — отличный проводник электрического тока (электроны способны перемещаться вдоль плоскости слоя).
Цепочечными структурами
обладают оксиды (например, SO
3
), который кристаллизуется в виде блестящих иголок, полимеры, некоторые аморфные вещества, силикаты (асбест).
Поговорим о твердых телах. Твердые тела можно разделить на две большие группы: аморфные
и кристаллические
. Разделять мы их будем по принципу есть порядок или нет.
В аморфных веществах
молекулы располагаются хаотично. В их пространственном расположении нет никаких закономерностей. По сути, аморфные вещества – это очень вязкие жидкости, настолько вязкие, что твердые.
Отсюда и название: «а-» – отрицательная частица, «morphe» – форма. К аморфным веществам относятся: стекла, смолы, воск, парафин, мыло.
Отсутствие порядка в расположении частиц обусловливает физические свойства аморфных тел: они не имеют фиксированных температур плавления
. По мере нагревания их вязкость постепенно снижается, и они также постепенно переходят в жидкое состояние.
В противоположность аморфным веществам существуют кристаллические. Частицы кристаллического вещества пространственно упорядочены. Это правильная структура пространственного расположения частиц в кристаллическом веществе называется кристаллической решеткой
.
В отличии от аморфных тел, кристаллические вещества
имеют фиксированные температуры плавления.
В зависимости от того какие частицы находятся в узлах решетки
, и от того какие связи удерживают их различают: молекулярную
, атомную
, ионную
и металлическую
решетки.
Для чего принципиально важно знать, какая у вещества кристаллическая решетка? Что она определяет? Все. Структура определяет, как химические и физические свойства вещества
.
Самый простой пример: ДНК. У всех организмов на земле она построена из одинакового набора структурных компонентов: нуклеотидов четырех видов. А какое многообразие жизни. Это все определяется структурой: порядком, в котором эти нуклеотиды расположены.
Молекулярная кристаллическая решетка.
Типичный пример вода – в твердом состоянии (лед). В узлах решетки находятся целые молекулы. И удерживают их вместе межмолекулярные взаимодействия
: водородные связи, силы Ван-дер-Ваальса.
Связи эти слабые, поэтому молекулярная решетка – самая непрочная
, температура плавления таких веществ низкая.
Хороший диагностический признак: если вещество имеет при нормальных условиях жидкое или газообразное состояние и/или имеет запах – то скорее всего у этого вещества молекулярная кристаллическая решетка. Ведь жидкое и газообразное состояния – это следствие того, что молекулы на поверхности кристалла плохо держатся (связи то слабые). И их «сдувает». Это свойство называется летучестью. А сдутые молекулы, диффундируя в воздухе доходят до наших органов обоняния, что субъективно ощущается как запах.
Молекулярную кристаллическую решетку имеют:
- Некоторые простые вещества неметаллов: I 2 , P, S (то есть все неметаллы, у которых не атомная решетка).
- Почти все органические вещества (кроме солей
). - И как уже говорилось ранее, вещества при нормальных условиях жидкие, либо газообразные (будучи замороженными) и/или имеющие запах (NH 3 , O 2 , H 2 O, кислоты, CO 2).
Атомная кристаллическая решетка.
В узлах атомной кристаллической решетки, в отличие от молекулярной, располагаются отдельные атомы
. Получается, что удерживают решетку ковалентные связи (ведь именно они связывают нейтральные атомы).
Классический пример – эталон прочности твердости – алмаз (по химической природе – это простое вещество углерод). Связи: ковалентные неполярные
, так как решетку образуют только атомы углерода.
А вот, например, в кристалле кварца (химическая формула которого SiO 2) есть атомы Si и O. Поэтому связи ковалентные полярные
.
Физические свойства веществ с атомной кристаллической решеткой:
- прочность, твердость
- высокие температуры плавления (тугоплавкость)
- нелетучие вещества
- нерастворимы (ни в воде, ни в других растворителях)
Все эти свойства обусловлены прочностью ковалентных связей.
Веществ в атомной кристаллической решеткой немного. Особой закономерности нет, поэтому их нужно просто запомнить:
- Аллотропные модификации углерода (C): алмаз, графит.
- Бор (B), кремний (Si), германий (Ge).
- Только две аллотропные модификации фосфора имеют атомную кристаллическую решетку: красный фосфор и черный фосфор. (у белого фосфора – молекулярная кристаллическая решетка).
- SiC – карборунд (карбид кремния).
- BN – нитрид бора.
- Кремнезем, горный хрусталь, кварц, речной песок – все эти вещества имеют состав SiO 2 .
- Корунд, рубин, сапфир – у этих веществ состав Al 2 O 3 .
Наверняка возникает вопрос: С – это и алмаз, и графит. Но они же совершенно разные: графит непрозрачный, пачкает, проводит электрический ток, а алмаз прозрачный, не пачкает и ток не проводит. Отличаются они структурой.
И то, и то – атомная решетка, но разная. Поэтому и свойства разные.
Ионная кристаллическая решетка.
Классический пример: поваренная соль: NaCl. В узлах решетки располагаются отдельные ионы
: Na + и Cl – . Удерживает решетку электростатические силы притяжения между ионами («плюс» притягивается к «минусу»), то есть ионная связь
.
Ионные кристаллические решетки довольно прочные, но хрупкие, температуры плавления таких веществ довольно высокие (выше, чем у представителей металлической, но ниже чем у веществ с атомной решеткой). Многие растворимы в воде.
С определением ионной кристаллической решетки, как правило, проблем не возникает: там, где ионная связь – там ионная кристаллическая решетка. Это: все соли
, оксиды металлов
, щелочи
(и другие основные гидроксиды).
Металлическая кристаллическая решетка.
Металлическая решетка реализуется в простых веществах металлах
. Ранее мы говорили, что все великолепие металлической связи можно понять лишь вместе с металлической кристаллической решеткой. Час настал.
Главное свойство металлов: электроны на внешнем энергетическом уровне
плохо удерживаются, поэтому легко отдаются. Потеряв электрон металл превращается в положительно заряженный ион – катион:
Na 0 – 1e → Na +
В металлической кристаллической решетке постоянно протекают процессы отдачи, и присоединения электронов: от атома металла в одном узле решетки отрывается электрон. Образуется катион. Оторвавшийся электрон притягивается другим катионом (или этим же): вновь образуется нейтральный атом.
В узлах металлической кристаллической решетки находятся как нейтральные атомы, так и катионы металла. А между узлами путешествуют свободные электроны:
Эти свободные электроны называются электронным газом. Именно они обусловливают физические свойства простых веществ металлов:
- тепло- и электропроводность
- металлический блеск
- ковкость, пластичность
Это и есть металлическая связь: катионы металлов притягиваются к нейтральным атомам и все это «склеивают» склеивают свободные электроны.
Как определить тип кристаллической решетки.
P.
S.
Есть кое-что в школьной программе и программе ЕГЭ по этой теме то, с чем мы не совсем согласны. А именно: обобщение, о том, что любая связь металл-неметалл – это ионная связь. Это допущение, намеренно сделано, видимо, для упрощения программы. Но это ведет к искажению. Граница между ионной и ковалентной связью условная. У каждой связи есть свой процент «ионности» и «ковалентности». Связь с малоактивным металлом имеет малый процент «ионности», она больше похожа на ковалентную. Но по программе ЕГЭ, она «округляется» в сторону ионной. Это порождает, порой абсурдные вещи. Например, Al 2 O 3 – вещество с атомной кристаллической решеткой. О какой ионности здесь может идти речь. Только ковалентная связь может удерживать таким образом атомы. Но по стандарту «металл-неметалл» мы квалифицируем эту связь как ионную. И получается противоречие: решетка атомная, а связь ионная. Вот к чему приводит, излишнее упрощение.
Молекулярное и немолекулярное строение веществ. Строение вещества
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного
и немолекулярного строения
. Вещества, состоящие из молекул, называются молекулярными веществами
. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам
относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них есть металлы и неметаллы. К веществам немолекулярного строения
относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K 2 SO 4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества
имеют высокие температуры плавления и кипения.
Твердые вещества: аморфные и кристаллические
Твердые вещества делятся на кристаллические и аморфные
.
Аморфные вещества
не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества
характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки. В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионными называют кристаллические решетки
, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl — , так и сложные SO 4 2- , OH — . Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na + и отрицательных Cl — , образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Кристаллическая решетка — а) и аморфная решетка — б).
Кристаллическая решетка — а) и аморфная решетка — б).
Атомные кристаллические решетки
Атомными
называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями
. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода. Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки
Молекулярными
называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными (HCl, H 2 O), и неполярными (N 2 , O 2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения
. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Молекулярная кристаллическая решетка(углекислый газ)
Металлические кристаллические решетки
Вещества с металлической связью
имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы
(то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Шпаргалки
Как мы уже знаем, вещество может существовать в трех агрегатных состояниях: газообразном
, твердом
и жидком
. Кислород, который при обычных условиях находится в газообразном состоянии, при температуре -194° С преобразуется в жидкость голубоватого цвета, а при температуре -218,8° С превращается в снегообразную массу с кристаллами синего цвета.
Температурный интервал существования вещества в твердом состоянии определяется температурами кипения и плавления. Твердые вещества бывают кристаллическими
и аморфными
.
У аморфных веществ
нет фиксированной температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние. В таком состоянии, например, находятся различные смолы, пластилин.
Кристаллические вещества
отличаются закономерным расположением частиц, из которых они состоят: атомов, молекул и ионов, – в строго определенных точках пространства. Когда эти точки соединяются прямыми линиями, создается пространственный каркас, его называют кристаллической решеткой. Точки, в которых находятся частицы кристалла, называют узлами решетки.
В узлах воображаемой нами решетки могут находиться ионы, атомы и молекулы. Эти частицы совершают колебательные движения. Когда температура увеличивается, размах этих колебаний тоже возрастает, что приводит к тепловому расширению тел.
В зависимости от разновидности частиц, находящихся в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные
, атомные
, молекулярные
и металлические
.
Ионными
называют такие кристаллические решетки, в узлах которых расположены ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т.е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Атомными
кристаллическими решетками называют такие кристаллические решетки, в узлах которых находятся отдельные атомы. В подобных решетках атомы соединяются между собой очень крепкими ковалентными связями. К примеру, алмаз – одно из аллотропных видоизменений углерода.
Вещества с атомной кристаллической решеткой не сильно распространены в природе. К ним относятся кристаллический бор, кремний и германий, а также сложные вещества, например такие, в составе которых есть оксид кремния (IV) – SiO 2: кремнезем, кварц, песок, горный хрусталь.
Подавляющее большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (у алмаза она превышает 3500° С), такие вещества прочны и тверды, практически не растворимы.
Молекулярными
называют такие кристаллические решетки, в узлах которых расположены молекулы. Химические связи в этих молекулах могут быть также, как полярными (HCl, H 2 0), так и неполярными (N 2 , O 3). И хотя атомы внутри молекукл связаны очень крепкими ковалентными связями, между самими молекулами действует слабые силы межмолекулярного притяжения. Именно поэтому вещества с молекулярными кристаллическими решетками характеризуются малой твердостью, низкой температурой плавления, летучестью.
Примерами таких веществ могут послужить твердая вода – лед, твердый оксид углерода (IV) – «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно – (благородные газы), двух – (H 2 , O 2 , CL 2 , N 2 , I 2), трех – (O 3), четырех – (P 4), восьмиатомными (S 8) молекулами. Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
blog.сайт,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Подписаться на еженедельную рассылку izhneftyanic.ru
100 ballov.kz образовательный портал для подготовки к ЕНТ и КТА
В 2021 году казахстанские школьники будут сдавать по-новому Единое национальное тестирование. Помимо того, что главный школьный экзамен будет проходить электронно, выпускникам предоставят возможность испытать свою удачу дважды. Корреспондент zakon.kz побеседовал с вице-министром образования и науки Мирасом Дауленовым и узнал, к чему готовиться будущим абитуриентам.
— О переводе ЕНТ на электронный формат говорилось не раз. И вот, с 2021 года тестирование начнут проводить по-новому. Мирас Мухтарович, расскажите, как это будет?
— По содержанию все остается по-прежнему, но меняется формат. Если раньше школьник садился за парту и ему выдавали бумажный вариант книжки и лист ответа, то теперь тест будут сдавать за компьютером в электронном формате. У каждого выпускника будет свое место, огороженное оргстеклом.
Зарегистрироваться можно будет электронно на сайте Национального центра тестирования. Но, удобство в том, что школьник сам сможет выбрать дату, время и место сдачи тестирования.
Кроме того, в этом году ЕНТ для претендующих на грант будет длиться три месяца, и в течение 100 дней сдать его можно будет два раза.
— Расскажите поподробнее?
— В марте пройдет тестирование для желающих поступить на платной основе, а для претендующих на грант мы ввели новые правила. Школьник, чтобы поступить на грант, по желанию может сдать ЕНТ два раза в апреле, мае или в июне, а наилучший результат отправить на конкурс. Но есть ограничение — два раза в один день сдавать тест нельзя. К примеру, если ты сдал ЕНТ в апреле, то потом повторно можно пересдать его через несколько дней или в мае, июне. Мы рекомендуем все-таки брать небольшой перерыв, чтобы еще лучше подготовиться. Но в любом случае это выбор школьника.
— Система оценивания останется прежней?
— Количество предметов остается прежним — три обязательных предмета и два на выбор. Если в бумажном формате закрашенный вариант ответа уже нельзя было исправить, то в электронном формате школьник сможет вернуться к вопросу и поменять ответ, но до того, как завершил тест.
Самое главное — результаты теста можно будет получить сразу же после нажатия кнопки «завершить тестирование». Раньше уходило очень много времени на проверку ответов, дети и родители переживали, ждали вечера, чтобы узнать результат. Сейчас мы все автоматизировали и набранное количество баллов будет выведено на экран сразу же после завершения тестирования.
Максимальное количество баллов остается прежним — 140.
— А апелляция?
— Если сдающий не будет согласен с какими-то вопросами, посчитает их некорректными, то он сразу же на месте сможет подать заявку на апелляцию. Не нужно будет ждать следующего дня, идти в центр тестирования, вуз или школу, все это будет электронно.
— С учетом того, что школьникам не придется вручную закрашивать листы ответов, будет ли изменено время сдачи тестирования?
— Мы решили оставить прежнее время — 240 минут. Но теперь, как вы отметили, школьникам не нужно будет тратить час на то, чтобы правильно закрасить лист ответов, они спокойно смогут использовать это время на решение задач.
— Не секрет, что в некоторых селах и отдаленных населенных пунктах не хватает компьютеров. Как сельские школьники будут сдавать ЕНТ по новому формату?
— Задача в том, чтобы правильно выбрать время и дату тестирования. Центры тестирования есть во всех регионах, в Нур-Султане, Алматы и Шымкенте их несколько. Школьники, проживающие в отдаленных населенных пунктах, как и раньше смогут приехать в город, где есть эти центры, и сдать тестирование.
— На сколько процентов будет обновлена база вопросов?
— База вопросов ежегодно обновляется как минимум на 30%. В этом году мы добавили контекстные задания, то что школьники всегда просили. Мы уделили большое внимание истории Казахстана и всемирной истории — исключили практически все даты. Для нас главное не зазубривание дат, а понимание значения исторических событий. Но по каждому предмету будут контекстные вопросы.
— По вашему мнению система справится с возможными хакерскими атаками, взломами?
— Информационная безопасность — это первостепенный и приоритетный вопрос. Центральный аппарат всей системы находится в Нур-Султане. Связь с региональными центрами сдачи ЕНТ проводится по закрытому VPN-каналу. Коды правильных ответов только в Национальном центре тестирования.
Кроме того, дополнительно через ГТС КНБ (Государственная техническая служба) все тесты проходят проверку на предмет возможного вмешательства. Здесь все не просто, это специальные защищенные каналы связи.
— А что с санитарными требованиями? Нужно ли будет школьникам сдавать ПЦР-тест перед ЕНТ?
— ПЦР-тест сдавать не нужно будет. Требование по маскам будет. При необходимости Центр национального тестирования будет выдавать маски школьникам во время сдачи ЕНТ. И, конечно же, будем измерять температуру. Социальная дистанция будет соблюдаться в каждой аудитории.
— Сколько человек будет сидеть в одной аудитории?
— Участники ЕНТ не за семь дней будут сдавать тестирование, как это было раньше, а в течение трех месяцев. Поэтому по заполняемости аудитории вопросов не будет.
— Будут ли ужесточены требования по дисциплине, запрещенным предметам?
— Мы уделяем большое внимание академической честности. На входе в центры тестирования, как и в предыдущие годы, будут стоять металлоискатели. Перечень запрещенных предметов остается прежним — телефоны, шпаргалки и прочее. Но, помимо фронтальной камеры, которая будет транслировать происходящее в аудитории, над каждым столом будет установлена еще одна камера. Она же будет использоваться в качестве идентификации школьника — как Face ID. Сел, зарегистрировался и приступил к заданиям. Мы применеям систему прокторинга.
Понятно, что каждое движение абитуриента нам будет видно. Если во время сдачи ЕНТ обнаружим, что сдающий использовал телефон или шпаргалку, то тестирование автоматически будет прекращено, система отключится.
— А наблюдатели будут присутствовать во время сдачи тестирования?
— Когда в бумажном формате проводили ЕНТ, мы привлекали очень много дежурных. В одной аудитории было по 3-4 человека. При электронной сдаче такого не будет, максимум один наблюдатель, потому что все будет видно по камерам.
— По вашим наблюдениям школьники стали меньше использовать запрещенные предметы, к примеру, пользоваться телефонами?
— Практика показывает, что школьники стали ответственнее относиться к ЕНТ. Если в 2019 году на 120 тыс. школьников мы изъяли 120 тыс. запрещенных предметов, по сути у каждого сдающего был телефон. То в прошлом году мы на 120 тыс. школьников обнаружили всего 2,5 тыс. телефонов, и у всех были аннулированы результаты.
Напомню, что в 2020 году мы также начали использовать систему искусственного интеллекта. Это анализ видеозаписей, который проводится после тестирования. Так, в прошлом году 100 абитуриентов лишились грантов за то, что во время сдачи ЕНТ использовали запрещенные предметы.
— Сколько средств выделено на проведение ЕНТ в этом году?
Если раньше на ЕНТ требовалось 1,5 млрд тенге из-за распечатки книжек и листов ответов, то сейчас расходы значительно сокращены за счет перехода на электронный формат. Они будут, но несущественные.
— Все-таки почему именно в 2021 году было принято решение проводить ЕНТ в электронном формате. Это как-то связано с пандемией?
— Это не связано с пандемией. Просто нужно переходить на качественно новый уровень. Мы апробировали данный формат на педагогах школ, вы знаете, что они сдают квалификационный тест, на магистрантах, так почему бы не использовать этот же формат при сдаче ЕНТ. Тем более, что это удобно, и для школьников теперь будет много плюсов.
9.2: Ионная связь и энергия решетки
Навыки для развития
- Для описания характеристик ионной связи.
- Для количественного описания энергетических факторов, участвующих в образовании ионной связи.
Ионы — это электрически заряженные атомы или молекулы. Катионы заряжены положительно, а анионы заряжены отрицательно. Ионы образуются, когда атомы приобретают или теряют валентные электроны.Поскольку электроны заряжены отрицательно, атом, потерявший один или несколько электронов, станет заряженным положительно; атом, который получает один или несколько электронов, становится отрицательно заряженным. Ионная связь — это притяжение между положительно и отрицательно заряженными ионами. Эти противоположно заряженные ионы притягиваются друг к другу, образуя ионные сети, или решетки , . Электростатика объясняет, почему это происходит: противоположные заряды притягиваются, а одинаковые — отталкиваются. Когда многие ионы притягиваются друг к другу, они образуют большие упорядоченные кристаллические решетки, в которых каждый ион окружен ионами противоположного заряда.Обычно, когда металлы реагируют с неметаллами, электроны передаются от металлов к неметаллам. Металлы образуют положительно заряженные ионы, а неметаллы образуют отрицательно заряженные ионы.
Свойства ионных соединений вытекают из упорядоченной структуры кристаллической решетки прочно связанных заряженных частиц, из которых они состоят. Ионные соединения имеют тенденцию к высоким температурам плавления и кипения, потому что притяжение между ионами в решетке очень сильное. Выдвижение ионов из решетки разрушает структуру, поэтому ионные соединения имеют тенденцию быть хрупкими, а не податливыми.Ионные соединения не проводят электричество в твердом состоянии, потому что ионы не могут свободно перемещаться по решетке; однако, когда ионные соединения растворены, они могут диссоциировать на отдельные ионы, которые свободно перемещаются через раствор и, следовательно, хорошо проводят электричество.
Создание ионных связей
Ионные связи образуются при химической реакции металлов и неметаллов. По определению, металл относительно стабилен, если он теряет электроны, образуя полную валентную оболочку, и становится положительно заряженным.Точно так же неметалл становится стабильным, приобретая электроны, чтобы заполнить свою валентную оболочку и стать отрицательно заряженным. Когда металлы и неметаллы реагируют, металлы теряют электроны, передавая их неметаллам, которые их приобретают. Следовательно, образуются ионы, которые мгновенно притягиваются друг к другу — ионная связь. В общем ионном соединении положительные и отрицательные заряды должны быть сбалансированы, потому что электроны не могут быть созданы или уничтожены, а только перенесены. Таким образом, общее количество электронов, потерянных катионными частицами, должно равняться общему количеству электронов, приобретенных анионными частицами.
Ионные соединения удерживаются вместе за счет электростатических сил, которые в классической физике описываются законом Кулона . Согласно этому закону, энергия электростатического притяжения (\ (E \)) между двумя заряженными частицами пропорциональна величине зарядов (\ (Q) 1 \) и \ (Q_2 \)) и обратно пропорциональна величине заряда. межъядерное расстояние между частицами (\ (r \)):
\ [E \ propto \ dfrac {Q_ {1} Q_ {2}} {r} \ label {Eq1a} \]
Энергия притяжения (\ (E \)) является разновидностью потенциальной энергии , так как она основана на положении заряженных частиц относительно друг друга.Если две частицы имеют противоположные заряды (как в ионных соединениях), значение (\ (E \)) будет отрицательным, что означает, что энергия высвобождается за счет сближения частиц, то есть частицы естественным образом притягиваются друг с другом. Согласно закону Кулона, чем больше величина зарядов на каждой частице, тем сильнее будет притяжение. Так, например, Mg 2 + и O 2- будут иметь более сильное притяжение, чем Na + и Cl —, из-за большего заряда.Кроме того, чем ближе друг к другу заряды, тем сильнее притяжение. Следовательно, ионы меньшего размера также образуют более сильные ионные связи.
В ионной решетке одновременно взаимодействуют более двух заряженных частиц, высвобождая количество энергии, известное как энергия решетки . Энергия решетки не совсем такая, как предсказывается законом Кулона, но применяются те же общие принципы электростатического притяжения. В ионном соединении значение энергии решетки соответствует силе ионной связи.
Пример \ (\ PageIndex {1} \): хлорид натрия
Например, в реакции Na (натрия) и Cl (хлора) каждый атом Cl отнимает один электрон от атома Na. Следовательно, каждый Na становится катионом Na + , а каждый атом Cl становится анионом Cl —. Из-за их противоположных зарядов они притягиваются друг к другу, образуя ионную решетку. Формула (отношение положительных и отрицательных ионов) в решетке \ (\ ce {NaCl} \).
\ [\ ce {2Na (s) + Cl2 (g) \ rightarrow 2NaCl (s)} \ nonumber \]
Эти ионы расположены в твердом \ (\ ce {NaCl} \) в регулярном трехмерном расположении (или решетке):
Решетка NaCl.(слева) трехмерная структура и (справа) простой двухмерный срез через решетку. Изображения использованы с разрешения Википедии и Майка Блабера.
Хлор имеет высокое сродство к электронам, а натрий — низкую энергию ионизации. Таким образом, хлор получает электрон от атома натрия. Это можно представить с помощью точечных символов Льюиса, показывающих валентные электроны в каждом атоме (здесь мы будем рассматривать один атом хлора, а не Cl 2 ):
Изогнутая стрелка указывает на перенос электрона от натрия к хлору с образованием иона металла Na + и иона хлорида Cl — .Каждый ион теперь имеет полную валентную оболочку из восьми электронов:
Электронная конфигурация ионов
Если ионная связь усиливается для соединений с более высокозарядными ионами, почему натрий теряет только один электрон, образуя Na + , а не, скажем, Na 2+ ? Число электронов, передаваемых между ионами, зависит не только от энергии, выделяемой при образовании решетки, но также от энергии, необходимой для отрыва электронов от одного атома и добавления их к другому.Другими словами, энергия решетки, высвобождаемая при образовании ионного соединения, должна быть сбалансирована с требуемой энергией ионизации и сродством к электрону при образовании ионов. Поскольку ион Na + имеет электронную конфигурацию благородного газа, удаление следующего электрона из этого стабильного расположения потребует больше энергии, чем выделяется во время образования решетки (натрий I 2 = 4560 кДж / моль). Таким образом, натрий присутствует в ионных соединениях в виде Na + , а не Na 2+ .Точно так же добавление электрона для заполнения валентной оболочки (и достижения электронной конфигурации благородного газа) экзотермично или лишь слегка эндотермично. Чтобы добавить дополнительный электрон в новую подоболочку , требуется огромная энергия — больше, чем энергия решетки. Таким образом, мы находим Cl — в ионных соединениях, но не Cl 2 — . Как правило, элементы основной группы образуют ионы только с ближайшей электронной конфигурацией благородного газа — в противном случае энергии решетки было бы недостаточно для компенсации энергии ионизации / сродства к электрону
Типичные значения энергии решетки могут компенсировать такие большие значения, как I 3 для валентных электронов (т.е.е. может оторвать до 3 валентных электронов от катионов). Поскольку для большинства переходных металлов требуется удаление более 3 электронов для достижения сердцевины из благородного газа, они не встречаются в ионных соединениях с сердцевиной из благородного газа. Переходный металл всегда сначала теряет электроны из подоболочки более высокой «s», а затем теряет электроны из нижней подоболочки «d». (Оставшиеся электроны в незаполненной d подоболочке являются причиной ярких цветов, наблюдаемых во многих соединениях переходных металлов!) Например, ионы железа , а не образуют ядро благородного газа:
- Fe: [Ar] 4s 2 3d 6
- Fe 2+ : [Ar] 3d 6
- Fe 3+ : [Ar] 3d 5
Некоторые ионы металлов могут образовывать ядро псевдо благородного газа (и быть бесцветными), например:
- Ag: [Kr] 5s 1 4d 10 Ag + [Kr] 4d 10 Соединение: AgCl
- Cd: [Kr] 5s 2 4d 10 Cd 2+ [Kr] 4d 10 Соединение: CdS
Примечание. Атомы серебра и кадмия потеряли 5s электронов при достижении ионного состояния.Помните, что атомы всегда сначала теряли электроны из подоболочки с наибольшим квантовым числом n (то есть за 5 секунд до 4d).
Когда из атома образуется положительный ион, всегда теряет электронов первыми из подоболочки с наибольшим главным квантовым числом.
Многоатомные ионы
Не все ионные соединения образуются только из двух элементов. Существует много многоатомных ионов , в которых два или более атома связаны ковалентными связями.Они образуют стабильную группу, несущую заряд (положительный или отрицательный). Группа атомов в целом действует как заряженная разновидность, образуя ионное соединение с противоположно заряженным ионом. Многоатомные ионы могут быть как положительными, так и отрицательными, например:
- NH 4 + (аммоний) = катион
- SO 4 2- (сульфат) = анион
Принципы ионной связи с многоатомными ионами такие же, как и с одноатомными ионами.Противоположно заряженные ионы объединяются, образуя кристаллическую решетку, высвобождая энергию решетки. В зависимости от формы и заряда многоатомных ионов эти соединения могут образовывать кристаллические решетки с интересными и сложными структурами.
Энергетика образования ионных связей
Ионные связи образуются, когда положительно и отрицательно заряженные ионы притягиваются электростатическими силами. Рассмотрим одну пару ионов, один катион и один анион. Насколько сильной будет сила их притяжения? Мы можем переписать закон Кулона (Equation \ ref {Eq1a}) количественно для любых двух заряженных частиц:
\ [E = k \ dfrac {Q_ {1} Q_ {2}} {r} \ label {Eq1b} \]
, где заряд каждого иона представлен символом \ ( Q \) , а межъядерное расстояние между частицами представлено символом (\ (r \)).Константа пропорциональности k равна 2,31 × 10 −28 Дж · м. Это значение \ ( k \) включает заряд одного электрона (1,6022 × 10 −19 Кл) для каждого иона. Уравнение также можно записать, используя заряд каждого иона, выраженный в кулонах (Кл), включенный в константу. В этом случае константа пропорциональности k равна 8,999 × 109 Дж · м / C 2 . В приведенном примере Q 1 = +1 (1,6022 × 10 −19 C) и Q 2 = −1 (1.6022 × 10 −19 С). Если \ (Q_1 \) и \ (Q_2 \) имеют противоположные знаки (как в \ (\ ce {NaCl} \), например, где Q 1 равно +1 для Na + и Q 2 равно -1 для Cl — ), тогда E отрицательно, что означает, что энергия выделяется , когда противоположно заряженные ионы сближаются с бесконечного расстояния, чтобы сформировать изолированную ионную пару.
Энергия всегда высвобождается при образовании связи и, соответственно, всегда требуется энергия для разрыва связи.
Как показано зеленой кривой в нижней половине рисунка \ (\ PageIndex {1} \), максимальная энергия будет выделяться, когда ионы бесконечно близки друг к другу, при r = 0. Поскольку ионы занимают пространство и имеют структуру с положительным ядром, окруженным электронами, однако они не могут быть бесконечно близко друг к другу. На очень коротких расстояниях отталкивающие электрон-электронные взаимодействия между электронами на соседних ионах становятся сильнее, чем притягивающие взаимодействия между ионами с противоположными зарядами, как показано красной кривой в верхней половине рисунка \ (\ PageIndex {1} \).Полная энергия системы — это баланс между притягивающим и отталкивающим взаимодействиями. Пурпурная кривая на рисунке \ (\ PageIndex {1} \) показывает, что полная энергия системы достигает минимума при r 0 , точке, где электростатическое отталкивание и притяжение точно уравновешены. Это расстояние такое же, как экспериментально измеренное расстояние соединения .
Рисунок \ (\ PageIndex {1} \): График потенциальной энергии в зависимости от межъядерного расстояния для взаимодействия между газообразным ионом Na + и газообразным ионом Cl — .{23} \; \ cancel {ion \; пара} / моль \ вправо) = — 589 \; кДж / моль \ label {Eq3} \]
Это энергия, выделяемая при образовании 1 моль газообразных ионных пар, , а не , когда 1 моль положительных и отрицательных ионов конденсируется с образованием кристаллической решетки. Из-за дальнодействующих взаимодействий в структуре решетки эта энергия не соответствует непосредственно энергии решетки кристаллического твердого тела. Однако большое отрицательное значение указывает на то, что объединение положительных и отрицательных ионов энергетически очень выгодно, независимо от того, образуется ли ионная пара или кристаллическая решетка.
| Соединение | Энергия решетки (кДж / моль) |
|---|---|
| LiF | 1024 |
| LiI | 744 |
| NaF | 911 |
| NaCl | 788 |
| NaI | 693 |
| KF | 815 |
| KBr | 682 |
| КИ | 641 |
| MgF 2 | 2910 |
| SrCl 2 | 2130 |
| MgO | 3938 |
Мы суммируем важные моменты, касающиеся ионной связи:
- При r 0 ионы более стабильны (имеют более низкую потенциальную энергию), чем они находятся на бесконечном межъядерном расстоянии.Когда противоположно заряженные ионы собираются вместе от r = ∞ до r = r 0 , энергия системы понижается (энергия высвобождается).
- Из-за низкой потенциальной энергии при r 0 системе необходимо добавить энергию для разделения ионов. Необходимое количество энергии — это энергия связи.
- Энергия системы достигает минимума на определенном межъядерном расстоянии (расстояние связи).
Пример \ (\ PageIndex {2} \): LiF
Рассчитайте количество энергии, выделяющейся при образовании 1 моль газообразных ионных пар Li + F — из разделенных ионов.Наблюдаемое межъядерное расстояние в газовой фазе составляет 156 пм.
Дано: катион и анион, количество и межъядерное расстояние
Запрошено: энергия, выделяемая при образовании пар газообразных ионов
Стратегия:
Подставьте соответствующие значения в уравнение \ (\ ref {Eq1b} \), чтобы получить энергию, выделяемую при образовании единственной ионной пары, а затем умножьте это значение на число Авогадро, чтобы получить энергию, выделяемую на моль.{23} \ cancel {\ text {ion pair}} / моль \ right) \\ [5pt] & −891 \; кДж / моль \ end {align *} \]
Поскольку Li + и F — меньше, чем Na + и Cl — (см. Раздел 7.3), межъядерное расстояние в LiF короче, чем в NaCl. Следовательно, в соответствии с уравнением \ (\ ref {Eq1b} \), при образовании 1 моль газообразных ионных пар Li + F — (-891 кДж / моль) выделяется гораздо больше энергии, чем при образовании 1 моль газообразных пар ионов Li + F — (-891 кДж / моль). образуются газообразные ионные пары Na + Cl — (-589 кДж / моль).
Упражнение \ (\ PageIndex {2} \): оксид магния
Рассчитайте количество энергии, выделяющейся при образовании 1 моль газообразных ионных пар \ (\ ce {MgO} \) из разделенных ионов. Межъядерное расстояние в газовой фазе составляет 175 пм.
- Ответ
−3180 кДж / моль = −3,18 × 10 3 кДж / моль
Сводка
Ионные соединения образуются, когда электроны переносятся между атомами или группами атомов с образованием заряженных ионов, которые затем образуют структуру кристаллической решетки из-за электростатического притяжения.Образование ионных соединений обычно чрезвычайно экзотермично . Сила электростатического притяжения между ионами с противоположными зарядами прямо пропорциональна величине зарядов на ионах и обратно пропорциональна межъядерному расстоянию. Полная энергия системы представляет собой баланс между отталкивающими взаимодействиями между электронами на соседних ионах и притягивающими взаимодействиями между ионами с противоположными зарядами.
8.9. Физические свойства ионных соединений
- Последнее обновление
- Сохранить как PDF
- Ионные соединения имеют высокие температуры плавления.
- Ионные соединения твердые и хрупкие.
- Растворы ионных соединений и расплавленных ионных соединений проводят электричество, а твердые вещества — нет.
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
- Ионные соединения образуются, когда атомы соединяются друг с другом ионными связями.
- Ионная связь — это самый прочный тип химической связи, который приводит к характерным свойствам.
- Один атом в связи имеет частичный положительный заряд, а другой атом имеет частичный отрицательный заряд.Эта разница в электроотрицательности делает связь полярной, поэтому некоторые соединения полярны.
- Но полярные соединения часто растворяются в воде. Это делает ионные соединения хорошими электролитами.
- Из-за прочности ионной связи ионные соединения имеют высокие температуры плавления и кипения, а также высокие энтальпии плавления и испарения.
- Они образуют кристаллы.
Ионные соединения образуют кристаллические решетки, а не аморфные твердые тела. Хотя молекулярные соединения образуют кристаллы, они часто принимают другие формы, плюс молекулярные кристаллы обычно мягче, чем ионные кристаллы. На атомном уровне ионный кристалл представляет собой регулярную структуру, в которой катион и анион чередуются друг с другом и образуют трехмерную структуру, основанную в основном на меньшем ионе, равномерно заполняющем промежутки между большим ионом. - Они имеют высокие температуры плавления и кипения.
Высокие температуры необходимы для преодоления притяжения между положительными и отрицательными ионами в ионных соединениях. Следовательно, требуется много энергии, чтобы расплавить ионные соединения или вызвать их кипение. - Они имеют более высокие энтальпии плавления и испарения, чем молекулярные соединения.
Так же, как ионные соединения имеют высокие температуры плавления и кипения, они обычно имеют энтальпии плавления и испарения, которые могут быть в 10-100 раз выше, чем у большинства молекулярных соединений.Энтальпия плавления — это количество тепла, необходимое для плавления одного моля твердого вещества при постоянном давлении. Энтальпия испарения — это тепло, необходимое для испарения одного моля жидкого соединения при постоянном давлении. - Они твердые и хрупкие.
Ионные кристаллы являются твердыми, потому что положительные и отрицательные ионы сильно притягиваются друг к другу и их трудно разделить, однако при приложении давления к ионному кристаллу ионы с одинаковым зарядом могут быть сближены друг с другом.Электростатического отталкивания может быть достаточно, чтобы расколоть кристалл, поэтому ионные твердые частицы также являются хрупкими. - Они проводят электричество, когда растворяются в воде.
Когда ионные соединения растворяются в воде, диссоциированные ионы могут проводить электрический заряд через раствор. Расплавленные ионные соединения (расплавленные соли) также проводят электричество. - Хорошие изоляторы.
Хотя они проводят в расплавленном виде или в водном растворе, твердые ионные частицы не очень хорошо проводят электричество, потому что ионы так прочно связаны друг с другом. - Ashcroft, Neil W .; Мермин, Н. Дэвид (1977). Физика твердого тела (27-е изд.). Нью-Йорк: Холт, Райнхарт и Уинстон. ISBN 978-0-03-083993-1.
- Brown, Theodore L .; LeMay, H. Eugene, Jr; Bursten, Bruce E .; Лэнфорд, Стивен; Сагатис, Далиус; Даффи, Нил (2009). Химия: центральная наука: широкая перспектива (2-е изд.). Frenchs Forest, N.S.W .: Pearson Australia. ISBN 978-1-4425-1147-7.
- Все ионные соединения имеют очень похожую структуру
и поэтому очень похожие свойства. - Диаграмма справа типична для
гигантская ионно-кристаллическая структура ионных соединений, таких как хлорид натрия и
оксид магния. - Твердые ионные соединения состоят из гигантской решетки
плотно упакованных ионов, которые все вместе образуют кристалл. Ты можешь
см. диаграмму хлорида натрия справа, есть один положительный ион, который
один отрицательный ион, дающий эмпирическую формулу NaCl. - Ионы (+) и (-) удерживаются вместе за счет
электростатическое притяжение. - То же для KCl, MgO, CaO
- Модель с мячом и клюшкой показана на диаграмме справа.Обратите внимание, что
тонкие линии НЕ являются связями, они просто указывают на геометрию кристалла
состав. Электростатическая сила притяжения действует во ВСЕХ направлениях, и это
что такое ионная связь. - На этой схеме не показаны электронные
детали ионов, и не указывает на относительный размер ионов
(регулируется пространством, занимаемым электронными облаками),
что он ясно показывает, так это то, где расположены центры ионов в
кристаллическая решетка — трехмерное пространственное расположение ионов относительно
друг с другом. - чередует положительные и отрицательные ионы в
ионные твердые тела расположены упорядоченным или регулярным образом в
гигантская структура ионной решетки , например, показано справа. - Ионная связь — это сильное электрическое притяжение между
противоположно заряженные положительные и отрицательные ионы
рядом друг с другом в решетке, поэтому электростатическая сила притяжения в
ионные соединения действуют в всех направлениях . - Ионная связь распространяется по всему кристаллу
во всех направлениях. - Соли и оксиды металлов
являются типичными ионными соединениями. - Это сильная сила сцепления между
противоположно заряженные ионы делают структуру твердой (если хрупкой) и имеют
высокоплавкие и
очень высокие точки кипения ,
так они не очень летучие! - Относительно большое количество энергии требуется для
плавить или кипятить ионные соединения для уменьшения / преодоления сильных сил связывания.- Чем больше требуется энергии, тем выше температура плавления
и температура кипения, поэтому большинство ионных соединений плавятся и кипят только при относительно высоких
температуры — прямое следствие сильной химической связи в ионных
соединения. - Изменения энергии для физических изменений состояния
плавления и кипения ряда веществ с различными связями сравниваются в разделе
Заметки по энергетике.
- Чем больше требуется энергии, тем выше температура плавления
- Чем больше заряд на ионах, тем сильнее
связывающее притяжение e.грамм. оксид магния Mg 2+ O 2
имеет гораздо более высокую температуру плавления, чем хлорид натрия Na + Cl .- Ионы оксида магния имеют двойную
заряжен, поэтому электростатическое притяжение намного больше (на самом деле это примерно 4x
как сильная сила притяжения).- Как и в этом случае, ионы в
оксид магния меньше, чем ионы в хлориде натрия, поэтому ионы в
оксид магния может упаковываться ближе друг к другу, что также увеличивает привлекательный
сила сцепления.
- Как и в этом случае, ионы в
- Этот двойной эффект приводит к гораздо более сильному
ионная связь в оксиде магния, поэтому гораздо большая тепловая кинетическая энергия, т.е.
требуется гораздо большая температура, чтобы ослабить гигантскую ионную решетку и расплавить
кристаллы оксида магния по сравнению с хлоридом натрия. - Простое экспериментальное доказательство хлорида натрия
плавится при 801 o C, тогда как оксид магния плавится намного выше при 2852 o C.
- Ионы оксида магния имеют двойную
- В отличие от ковалентных молекул, ВСЕ ионные соединения представляют собой твердые кристаллические вещества
при комнатной температуре. - Они твердые, но хрупкие ,
при напряжении связи разрываются по плоскостям ионов, которые отталкиваются.- Они НЕ податливы, как металлы.
- Многие ионные соединения растворимы в воде,
но не все, поэтому не делайте этого предположения.- Соли могут растворяться в воде, потому что ионы могут
разделяются и становятся окруженными молекулами воды, которые слабо связываются с ионами
(см. диаграммы ниже). - Это уменьшает силы притяжения между
ионы, препятствующие существованию кристаллической структуры. - Выпаривание воды из солевого раствора приведет к
в конечном итоге позволить ионной кристаллической решетке реформироваться.
- Соли могут растворяться в воде, потому что ионы могут
- Твердые кристаллы НЕ проводят электричество
потому что ионы не могут перемещаться, чтобы проводить электрический ток.- Однако, если ионное соединение расплавлено или
растворяется в воде , жидкость или раствор теперь будут проводить электричество. - Это потому, что
ионных частиц теперь могут свободно перемещаться и переносить электрический ток в
расплав соли или раствор соли в водном растворе (см. диаграммы
ниже).- Электрический ток — это поток заряженных частиц.
(ионы или электроны). - Это электрическая проводимость по этим
Условия свидетельствует о существовании ионов в этом типе соединений.
- Электрический ток — это поток заряженных частиц.
Нужна диаграмма для отображения проводимости —
простая принципиальная схема аккумуляторная колба электроды раствор«Продвинутая» картина частиц натрия
растворение хлоридов в водеНО, на самом деле их было бы не так много
пространство между молекулами H 2 O…(частичные электрические заряды δ + и δ
предназначены только для студентов продвинутого уровня A)==>
твердый хлорид натрия ==> расплавленный натрий
хлорид (от фиксированных ионов к свободно движущимся) - Однако, если ионное соединение расплавлено или
- Ионное твердое тело состоит из положительных ионов (катионов) и отрицательных ионов (анионов), удерживаемых вместе электростатическими силами в жестком массиве или решетке.
- Ионная связь относится к электростатическому притяжению между катионами и анионами.
- Физические свойства ионных соединений:
⚛ Высокая температура плавления и высокая температура кипения
⚛ Ионные твердые тела не проводят электричество (они изоляторы).
⚛ Когда расплавленные (жидкие) ионные соединения проводят электричество.
⚛ При растворении в воде с образованием водного раствора ионные соединения проводят электричество.
⚛ Жесткий
⚛ Хрупкий
- Заряд на ионах.
- Размер ионов.
- Катионы (положительные ионы) движутся к катоду
M + (л) + e — → M (л)
- Анионы (отрицательные ионы) движутся к аноду
X — (л) → X + e —
- Ионная связь является результатом чистого кулоновского притяжения положительно и отрицательно заряженных анионов, упакованных вместе в регулярную кристаллическую решетку.
- Кулоновская сила пропорциональна заряду, поэтому более высокие заряды приводят к более сильным взаимодействиям.
- Кулоновская сила обратно пропорциональна (квадрату) расстояния, поэтому ионы меньшего размера, которые могут упаковываться более близко друг к другу, будут иметь более сильные взаимодействия.
- Пример: Что из следующего будет иметь более экзотермическую энергию решетки, NaF или KBr?
- NaF будет иметь более экзотермическую энергию решетки (-922 кДж / моль против -688 кДж / моль), потому что он состоит из более мелких ионов, которые могут более плотно упаковываться вместе.
- В ионных соединениях электроны прочно удерживаются ионами, и ионы не могут двигаться поступательно друг относительно друга.
- Это объясняет многие свойства ионных твердых тел.Они твердые и хрупкие, они не податливы или пластичны (т.е. не могут быть сформированы без трещин / разломов) и не проводят электричество.
- Металлическое соединение описывает решетку положительно заряженных ионов, окруженную подвижным «морем» валентных электронов. В отличие от ионной связи, валентные орбитали делокализованы по всей решетке металла, электроны могут свободно перемещаться и не связаны с отдельными катионами.
- Модель «свободных валентных электронов» объясняет несколько свойств металлов: они проводят электричество, пластичны и пластичны (их форма может изменяться без разрушения) и не летучие.
- Как упоминалось выше, именно они, наблюдаемые в твердом состоянии соединения, определяют свойства твердых тел.
- Твердые вещества:
- Состоит из неметаллов, ковалентно связанных друг с другом.
- Состоят из отдельных молекул ковалентно связанных атомов, которые притягиваются друг к другу относительно слабыми (лондонскими и дипольными) силами
- Обычно имеют низкие температуры плавления и кипения.
- Электроны прочно связаны четко определенными связями, поэтому они не проводят электричество в твердом состоянии или в растворе.
- Примеры: CO 2 , I 2 , S 8
- Ионные твердые вещества:
- имеют низкое давление пара (сильное кулоновское притяжение между ионами)
- хрупкие и не деформируются (ионы в решетке не могут скользить друг по другу)
- Твердые тела не проводят электричество (электроны прочно связаны с ионами)
- В водном растворе или при плавлении в жидкость ионные соединения действительно проводят электричество (ионы теперь могут свободно перемещаться).Это часто является отличительной чертой ионного твердого вещества.
- Обычно растворяется в полярных растворителях и не растворяется в неполярных растворителях.
- Примеры: NaCl, Fe 2 O 3
- Металлические вещества:
- Хорошо проводят тепло и электричество (электроны делокализованы и могут свободно перемещаться)
- Податливы и пластичны (катионы более свободно перемещаются относительно друг друга, чем в ионных твердых телах)
- Блестящие («блестящие») и хорошо проводят тепло.
- Примеры: все чистые металлы: Na, Fe, Al, Au, Ag …
- Металлы также могут существовать в виде смесей, называемых сплавами , где атомы либо замещают атомы металла в решетке, либо заполняют пустые пространства в решетке. Различные атомы в металлической решетке могут изменять свойства чистого металла.
- Примеры: Атомы углерода (около 2%), смешанные с железом, образуют сталь, которая намного прочнее (менее пластична), чем чистое железо. Латунь — еще один сплав, состоящий из 70% меди и 30% цинка.
- Сеть Ковалентные твердые тела образуют большие 2D или 3D сети ковалентно связанных атомов.
- Они образованы только неметаллами, которые могут образовывать ковалентные связи
- Поскольку все атомы связаны ковалентной связью, они имеют чрезвычайно высокие температуры плавления.
- Ковалентные твердые тела с трехмерной сеткой чрезвычайно твердые и хрупкие. (например, алмаз)
- Двумерные сетчатые ковалентные твердые тела имеют слои, которые могут легче скользить друг мимо друга (например,грамм. графит)
- Примеры: алмаз, графит (оба углерода), диоксид кремния, карбид кремния.
- Вопрос об образце: Неизвестное вещество представляет собой бесцветное кристаллическое твердое вещество.
Регулярное и упорядоченное расположение ионов в кристаллической решетке отвечает за различные формы этих кристаллов, в то время как ионы переходных металлов порождают цвета. \ text {o} \ text {C} \).
Разрушение
Ионные соединения обычно твердые, но хрупкие. Почему? Требуется большое количество механической силы, такой как удар по кристаллу молотком, чтобы заставить один слой ионов сместиться относительно своего соседа. Однако, когда это происходит, он сближает ионы с одинаковым зарядом (см. Ниже). Силы отталкивания между одноименно заряженными ионами вызывают разрушение кристалла. Когда ионный кристалл ломается, он имеет тенденцию делать это по гладким плоскостям из-за правильного расположения ионов.
Рисунок \ (\ PageIndex {2} \): (A) Кристалл хлорида натрия показан в двух измерениях. (B) При ударе молотка отрицательно заряженные ионы хлорида прижимаются друг к другу, и сила отталкивания заставляет кристалл расколоться.
Электропроводность
Еще одним характерным свойством ионных соединений является их электропроводность . На рисунке ниже показаны три эксперимента, в которых два электрода, подключенные к лампочке, помещаются в химические стаканы, содержащие три разных вещества.
Рисунок \ (\ PageIndex {3} \): (A) Дистиллированная вода не проводит электричество. (B) Твердое ионное соединение также не проводит. (C) Водный раствор ионного соединения хорошо проводит электричество.
В первом стакане дистиллированная вода не проводит ток, потому что вода представляет собой молекулярное соединение. Во втором стакане твердый хлорид натрия также не проводит ток. Несмотря на то, что она является ионной и, следовательно, состоит из заряженных частиц, твердая кристаллическая решетка не позволяет ионам перемещаться между электродами.Подвижные заряженные частицы необходимы для замыкания цепи и зажигания лампочки. В третьем стакане \ (\ ce {NaCl} \) растворяется в дистиллированной воде. Теперь кристаллическая решетка разрушена, и отдельные положительные и отрицательные ионы могут двигаться. Катионы перемещаются к одному электроду, а анионы перемещаются к другому, позволяя течь электричеству (см. Рисунок ниже). Плавление ионного соединения также освобождает ионы для проведения тока. Ионные соединения проводят электрический ток при плавлении или растворении в воде.-} \) ионы мигрируют к положительному электроду.
Сводка
Авторы и авторство
Объяснение свойств ионных соединений
Ионные соединения содержат ионные связи.Ионная связь образуется, когда существует большая разница в электроотрицательности между элементами, участвующими в связи. Чем больше разница, тем сильнее притяжение между положительным ионом (катионом) и отрицательным ионом (анионом).
Свойства ионного соединения
Свойства, разделяемые ионными соединениями
Свойства ионных соединений зависят от того, насколько сильно положительные и отрицательные ионы притягиваются друг к другу в ионной связи.Знаменитые соединения также обладают следующими свойствами:
Пример обычного домохозяйства
Знакомым примером ионного соединения является поваренная соль или хлорид натрия. Соль имеет высокую температуру плавления 800ºC. В то время как кристалл соли является электрическим изолятором, солевые растворы (соль, растворенная в воде) легко проводят электричество. Расплавленная соль также является проводником. Если вы посмотрите на кристаллы соли через увеличительное стекло, вы увидите правильную кубическую структуру, образованную кристаллической решеткой. Кристаллы соли твердые, но хрупкие — кристалл легко раздавить.Хотя растворенная соль имеет узнаваемый аромат, вы не чувствуете запаха твердой соли, потому что она имеет низкое давление пара.
Напротив, сахар — ковалентное соединение. У него более низкая температура плавления, чем у соли. Он растворяется в воде, но не распадается на ионы, поэтому его раствор не проводит электричество. Сахар образует кристаллы, но вы можете почувствовать его сладость, потому что он имеет относительно высокое давление пара.
Источники
Гигантские ионные структуры — Структуры и свойства — Редакция GCSE Chemistry (Single Science) — WJEC
Ионы в соединении, таком как хлорид натрия, расположены в гигантской ионной структуре (также известной как гигантская ионная решетка).Такое регулярное расположение приводит к образованию кристалла.
На схеме показана часть кристаллической решетки хлорида натрия:
Положительно заряженные ионы Na + , отрицательно заряженные ионы Cl — ионы
Этот рисунок повторяется во всех направлениях, давая гигантскую трехмерную структуру решетки в хлориде натрия. кристаллы.
Из-за сильных электростатических сил между ними требуется много энергии, чтобы разделить положительные и отрицательные ионы в кристаллической решетке.Это означает, что ионные соединения имеют высокие температуры плавления и кипения .
Твердые ионные соединения не проводят электричество , потому что ионы прочно удерживаются на месте. Ионы не могут двигаться, проводя электрический ток. Но когда ионное соединение плавится, заряженные ионы могут свободно перемещаться. Следовательно, расплавленные ионные соединения действительно проводят электричество .
Когда кристалл ионного соединения растворяется в воде, ионы разделяются. Опять же, ионы могут свободно перемещаться — поэтому раствор ионного соединения в воде также проводит электричество .
Ионные решетки
Противоположно заряженные ионы в гигантской ионной решетке удерживаются вместе сильными ионными связями (электростатические силы притяжения) в огромной трехмерной структуре.
Взгляните на этот пример — это кристаллическая решетка хлорида натрия.
Подобные диаграммы лучше всего рисовать, начиная с одного типа иона (например, Na + ), а затем прослеживая каждую линию от этого иона ко всем соседним ионам и превращая их в другой тип иона (например, Cl — ).Ни одна линия не должна соединять одинаковые ионы.
Объяснение точек плавления [Только для более высокого уровня]
Требуется много энергии, чтобы преодолеть сильные электростатические силы притяжения между противоположно заряженными ионами, поэтому ионные соединения имеют высокие точки плавления и кипения . Однако некоторые из них имеют более высокие температуры плавления, чем другие.
Чем больше заряд на ионах, тем сильнее силы, удерживающие их вместе. Хлорид натрия состоит из ионов Na + и ионов Cl — и имеет температуру плавления 801 ° C.Оксид магния состоит из ионов с двумя зарядами (Mg 2+ и O 2–) и поэтому имеет гораздо более высокую температуру плавления — 2 852 ° C.
| . 2к. Описание и объяснение свойств ионного С использованием описанных моделей ионной связи Док The Точечные и кросс-схемы подходят для демонстрации электронных Двумерная диаграмма ионов дает ограниченное представление о том, как
Что
НАЧАЛО СТРАНИЦЫ | |
Физические свойства ионных соединений Учебное пособие по химии
Ключевые понятия
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Физические свойства ионных соединений: высокая температура плавления
Ионные соединения имеют высокие температуры плавления.
Электростатическое притяжение (ионная связь) между катионами и анионами сильно.
Требуется много энергии, чтобы преодолеть это притяжение, чтобы ионы могли двигаться более свободно и образовывать жидкость.
Факторы, влияющие на температуру плавления ионного соединения:
(i) Заряд ионами
В общем, чем больше заряд, тем больше электростатическое притяжение, чем сильнее ионная связь, тем выше температура плавления.
В таблице ниже сравниваются температура плавления и заряды ионов для двух ионных соединений, хлорида натрия (NaCl) и оксида магния (MgO).
| Ионное соединение | Температура плавления (° C) | Катионный заряд | Заряд аниона |
|---|---|---|---|
| NaCl (Na + Cl — ) | 801 | +1 | -1 |
| MgO (Mg 2+ O 2- ) | 2800 | +2 | -2 |
MgO имеет более высокую температуру плавления, чем NaCl, потому что 2 электрона передаются от магния к кислороду с образованием MgO, в то время как только 1 электрон передается от натрия к хлору с образованием NaCl.
(ii) Размер ионов.
Ионы меньшего размера могут упаковываться ближе друг к другу, чем ионы большего размера, поэтому электростатическое притяжение больше, ионная связь сильнее, температура плавления выше.
Температура плавления фторидов щелочных металлов группы 1 сравнивается с ионным радиусом катиона в таблице ниже.
| Ионное соединение | Температура плавления (° C) | Радиус катиона (пм) | ||
|---|---|---|---|---|
| NaF | 992 | выше M.С. | 99 | меньший радиус |
| KF | 857 | ↑ | 136 | ↓ |
| руб. | 775 | ↑ | 148 | ↓ |
| CSF | 683 | нижний M.С. | 169 | больший радиус |
По мере того, как радиус катионов увеличивается вниз по группе 1 от Na + до Cs + , температуры плавления фторидов снижаются.
Физические свойства ионных соединений: проводимость
Для того чтобы вещество проводило электричество, оно должно содержать подвижные частицы, способные нести заряд.
| Ионное твердое вещество | Ионная жидкость | Водный раствор | |
|---|---|---|---|
| Подвижность ионов | очень плохо | хорошо | хорошо |
| Электропроводность | очень плохо | хорошо | хорошо |
Твердые ионные соединения не проводят электричество, потому что ионы (заряженные частицы) заключены в жесткую решетку или массив.
Ионы не могут выйти из решетки, поэтому твердое тело не может проводить электричество.
При нагревании твердое ионное вещество плавится с образованием жидкости или расплавленного ионного соединения.
Ионы в расплавленном или жидком ионном соединении могут свободно выходить из структуры решетки.
Когда электрический ток проходит через расплавленное ионное соединение:
Когда твердое ионное вещество растворяется в воде с образованием водного раствора:
MX (водн.) → M + (водн.) + X — (водн.)
ионы высвобождаются из структуры решетки и могут свободно перемещаться, поэтому раствор проводит электричество так же, как расплавленное (жидкое) ионное соединение.
Физические свойства ионных соединений: хрупкость
Ионные твердые вещества хрупкие.
Когда к ионной решетке прикладывается напряжение, слои слегка сдвигаются.
Слои расположены так, что каждый катион окружен анионами в решетке.
Если слои сдвигаются, то ионы с одинаковым зарядом сблизятся.
ионов одного заряда будут отталкиваться друг от друга, поэтому структура решетки распадается на более мелкие части.
