Содержание
Валентность бария (Ba), формулы и примеры
Общие сведения о валентности бария
В виде простого вещества барий – серебристо-белый металл, который на воздухе покрывается желтоватой пленкой продуктов взаимодействия с составными частями воздуха. Барий по твердости напоминает свинец. Плотность 3,76 г/см3. Температура плавления 727oС, кипения 1640oС.Имеет объемно центрированную кристаллическую решетку.
Валентность бария в соединениях
Барий – пятьдесят шестой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в шестом периоде в IIA группе. В ядре атома бария содержится 56 протонов и 81 нейтрон (массовое число равно 137). В атоме бария есть шесть энергетических уровней, на которых находятся 56 электронов (рис. 1).
Рис. 1. Строение атома бария.
Электронная формула атома бария в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s24p64d105s25p66s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Для атома бария характерно наличие возбужденного состояний из-за того, что орбитали 6p-подуровня являются вакантными. Электроны 6s-подуровня распариваются и занимают свободную орбиталь 6p -подуровня:
Наличие двух неспаренных электронов в возбужденном состоянии свидетельствует о том, что барий проявляет в своих соединениях валентность II(BaO, Ba(OH)2, BaSO4, Ba(NO3)2 и др.) (постоянная валентность).
Примеры решения задач
|
Понравился сайт? Расскажи друзьям! |
| ||
Барий валентность — Справочник химика 21
Атомы кислорода соединяются не менее чем с двумя различными атомами.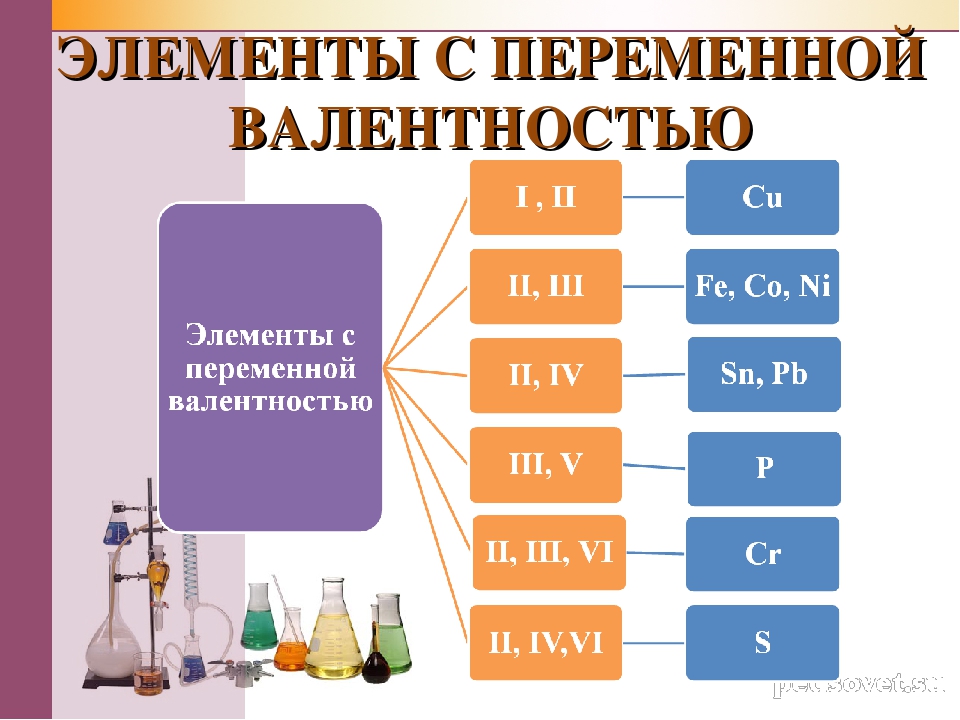 Так же ведут себя кальций, сера, магний и барий. У этих элементов валентность два, У азота, фосфора, алюминия и золота валентность три. Железо может иметь валентность два или три. В принципе вопрос о валентности оказался не столь простым, каким представлялось вначале, но даже такой простейший вариант этой теории позволил сделать важные выводы. [c.81]
Так же ведут себя кальций, сера, магний и барий. У этих элементов валентность два, У азота, фосфора, алюминия и золота валентность три. Железо может иметь валентность два или три. В принципе вопрос о валентности оказался не столь простым, каким представлялось вначале, но даже такой простейший вариант этой теории позволил сделать важные выводы. [c.81]
Под толщиной двойного электрического слоя следует понимать расстояние между поверхностью твердого тела, на котором адсорбированы ионы одного знака, и центром тяжести ионов другого знака, находящихся во внешнем слое. На толщину двойного электрического слоя оказывают влияние различные факторы, в частности свойства твердого тела, концентрация электролитов, валентность ионов, наличие поверхностно-активных веществ. Так, толщина двойного электрического слоя уменьшается с увеличением концентрации электролита при этом концентрации одновалентного иона калия, двухвалентного иона бария и трехвалентного иона алюминия, производящие одинаковое действие, приблизительно относятся как 800 25 1.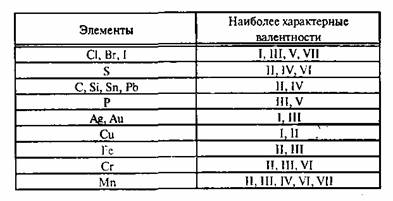 [c.192]
[c.192]
Естественно, закономерности в свойствах различных веществ или в параметрах различных реакций должны быть более простыми, если при сопоставлении ограничиться веществами, близкими между собой по химическому составу и строению. Условимся называть однотипными соединения, обладающие аналогичной формулой и различающиеся только одним элементом, причем эти элементы должны быть аналогами (т. е. принадлежать к одной подгруппе периодической системы) и находиться в одинаковом валентном состоянин. Однотипными можно считать, например, карбонаты щелочно-земельных металлов. Можно пользоваться понятием о различной степени однотипности. Так, карбонаты кальция, стронция и бария являются более однотипными между собой, а карбонаты магния и тем более бериллия менее подобны им по термодинамическим свойствам, в соответствии с большим отличием строения электронной оболочки их катионов. [c.291]
На основании полученных данных автор [202] делает предположение о существовании связи между валентностью катиона, его размерами п влиянием на каталитическую активность алюмосиликатного катализатора. Действительно, одновалентные катионы неактивны, двухвалентные обладают некоторой активностью, возрастающей по мере уменьшения радиуса катиона (от бария к магнию), трех- и четырехвалентные катионы активны так же, как и Н+. [c.156]
Действительно, одновалентные катионы неактивны, двухвалентные обладают некоторой активностью, возрастающей по мере уменьшения радиуса катиона (от бария к магнию), трех- и четырехвалентные катионы активны так же, как и Н+. [c.156]
К 20 мл 0,2 М раствора соли неизвестного металла добавили избыток раствора хлористого бария. В результате реакции в осадок выпадает 2,796 г сульфата бария. Определите валентность неизвестного металла. [c.30]
Неметаллические свойства водорода выражены довольно слабо, поэтому только наиболее активные металлы — литий, калий, натрий, кальций, барий — образуют сравнительно непрочные гидриды состава LiH, КН и СаН-з, ВаНа, в которых формальная валентность водорода равна —1. Гидриды щелочных и щелочноземельных металлов обладают солеобразной природой и представляют собой твердые кристаллические вещества. Они легко разлагаются водой и кислотами с выделением [c.116]
Степень окисления (электровалентность) характеризует заряд ионов данного химического элемента в данном соединении.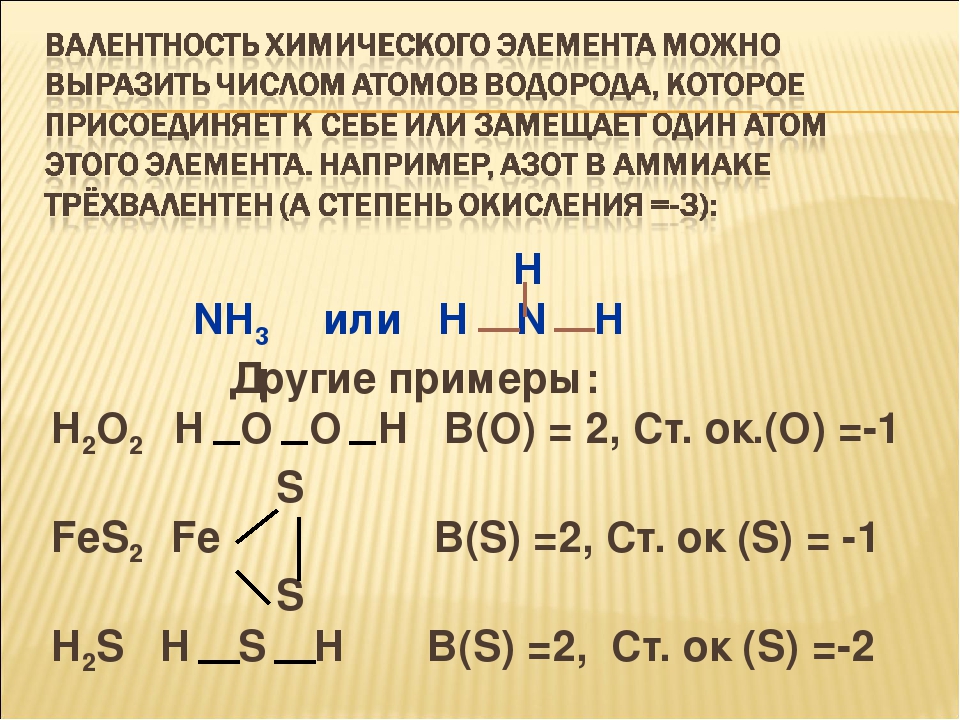 Число отдаваемых электронов определяет положительную валентность, число присоединяемых электронов — отрицательную валентность. Например, в соединениях ВаСЬ и КагО барий проявляет положительную электровалентность (2+), натрий — (I» ). хлор имеет отрицательную валентность (1 ), кислород — (2-). [c.77]
Число отдаваемых электронов определяет положительную валентность, число присоединяемых электронов — отрицательную валентность. Например, в соединениях ВаСЬ и КагО барий проявляет положительную электровалентность (2+), натрий — (I» ). хлор имеет отрицательную валентность (1 ), кислород — (2-). [c.77]
Считая очень важным уточнение атомного веса и валентности церия, Менделеев экспериментально определил его теплоемкость. Лучшие куски (3,5 г), прокаленные в струе водорода, дали для церия теплоемкость… около 0,05 как и следовало ожидать по атомному весу Се=138 [18, с. 64]. Одновременно Менделеев определил теплоемкость бария, которая оказалась сходной с теплоемкостью церия. Это подтвердило правильность принятого для Се и Ва атомного веса, а также правомерность использованной для этой цели методики эксперимента. [c.85]
В подгруппе щелочноземельных металлов (максимальная валентность центрального атома 2) оксид и гидроксид бериллия амфотерны (малый радиус), магния — слабые основания, кальция, стронция, бария и радия — сильные основания. [c.98]
[c.98]
Атомы кальция, стронция и бария, обладая электронной конфигурацией Зр 4 , 4р 55 и 5р 6 , имеют несколько меньший второй ионизационный потенциал по сравнению с Al,Mg,Be. При формировании кристалла оба валентных 5-электрона делокализуются. Возникшие ионы имеют заполненные р-оболочки, что способствует образованию объемно-центрированной решетки. Плавление кальция, стронция и бария не сопровождается изменением расположения ионов, тип их упаковки напоминает распределение атомов щелочных металлов. Свинец (конф. [c.176]
Радий (1Кп]75 ) является гомологом щелочно-земельных металлов и ближайшим аналогом бария. Металлический радий впервые был получен электролизом расплава КаСЬ. Его получают также разложением азида Ка (N3)2 в вакууме при 180—250 °С. В компактном виде радий — серебристо-белый металл с плотностью 6,0 г/см и с температурой плавления около 960 С. В отличие от диамагнитного бария радий слабо парамагнитен (более легкий переход 1р для валентного электрона). [c.431]
[c.431]
К первой группе относятся элементы, атомы которых проявляют постоянную валентность. Например, водород, щелочные металлы (литий, натрий, калий, рубидий, цезий, франций) всегда одновалентны кислород, щелочноземельные металлы (кальций, стронций, барий, радий) всегда двухвалентны алюминий всегда трехвалентен. [c.26]
Кальций Са, стронций 8г, барий Ва и радий Ка в отличие от ранее рассмотренных элементов имеют относительно большие атомные радиусы и низкие значения потенциалов ионизации. Поэтому в условиях химического взаимодействия кальций и его аналоги легко теряют валентные электроны и образуют простые ионы Поскольку ионы имеют электронную конфигурацию и большие размеры (т.е. слабо поляризуют), комплексные ионы с неорганическими лигандами у элементов подгруппы кальция неустойчивы. [c.521]
Некоторые редкоземельные элементы проявляют валентность, отличную от трех. Четырехвалентный церий во всех своих соединениях весьма напоминает торий. Другие редкоземельные элементы (Рг, ТЬ н, возможно, N 5 проявляют валентность, равную четырем, только в окислах. Некоторые другие редкоземельные элементы (Ей, УЬ и с трудом 5т) могут быть восстановлены до двухвалентных (синтез 19). В двухвалентном состоянии они похожи на барий и стронций. [c.34]
Четырехвалентный церий во всех своих соединениях весьма напоминает торий. Другие редкоземельные элементы (Рг, ТЬ н, возможно, N 5 проявляют валентность, равную четырем, только в окислах. Некоторые другие редкоземельные элементы (Ей, УЬ и с трудом 5т) могут быть восстановлены до двухвалентных (синтез 19). В двухвалентном состоянии они похожи на барий и стронций. [c.34]
Элементы бериллий Ве, магний М , кальций Са, стронций 8г, барий Ва и радий Ка составляют ПА-группу Периодической системы Д.И.Менделеева. Элементы кальций, стронций, барий и радий имеют групповое название — щелочноземельные металлы. Валентный уровень атомов элементов ПА-группы содержит по два электрона п8 У, характерная степень окисления этих элементов -(-П. Металлические свойства элементов ПА-группы выражены несколько слабее, чем у элементов 1А-группы. [c.114]
На рис 6.11 представлен типичный ИК-спектр в области валентных колебаний ОН-групп цеолита V, содержащего двухвалентный катион [77]. Для всех изученных цеолитов полоса поглощения при 3747 см является характеристической. Гидроксильные группы в цеолитах X с двухвалентными катионами отличаются от гидроксильных групп в цеолитах с одновалентными катионами. Исключение составляет только бариевая форма барий ведет [c.474]
Для всех изученных цеолитов полоса поглощения при 3747 см является характеристической. Гидроксильные группы в цеолитах X с двухвалентными катионами отличаются от гидроксильных групп в цеолитах с одновалентными катионами. Исключение составляет только бариевая форма барий ведет [c.474]
После того как порядковый номер элементов достигает 57, энергия 4/-орбиталей становится достаточно низкой, чтобы они могли использоваться для заселения электронами в атомах. Таким образом, после бария в шестом периоде начинается последовательное заселение электронами 4/-орбиталей, которое происходит у атомов 14 лантаноидных металлов. Подобно этому, в седьмом периоде после 2 = 89, когда 5/- и 6 -орбитали приобретают практически одинаковую энергию, возникает 14 актиноидных металлов, в атомах которых происходит последовательное заселение электронами 5/-орбиталей. Электронные конфигурации атомов, принадлежащих этим двум рядам внутренних переходных металлов, показаны на рис. 9-3. Как и при заселении -орбиталей у переходных металлов, заселение /-орбиталей также сопровождается отклонениями от строгой закономерности, причем такие отклонения чаще встречаются у актиноидов, чем у лантаноидов. Но и в этом случае достаточно запомнить лищь общую закономерность, отложив обсуждение отклонений от нее на более позднее время. (Укажем только, что поскольку первый элемент в каждом из рядов /-элементов- Ьа и Ас-имеет валентную конфигурацию вместо /, то иногда считается, что эти ряды начинаются с Се и ТЬ, как это указано, например, в таблице периодической системы, помещенной на внутренней стороне обложки этой книги.) [c.451]
Но и в этом случае достаточно запомнить лищь общую закономерность, отложив обсуждение отклонений от нее на более позднее время. (Укажем только, что поскольку первый элемент в каждом из рядов /-элементов- Ьа и Ас-имеет валентную конфигурацию вместо /, то иногда считается, что эти ряды начинаются с Се и ТЬ, как это указано, например, в таблице периодической системы, помещенной на внутренней стороне обложки этой книги.) [c.451]
В качестве противодымных присадок к топливам рекомендованы гидразин, а также соли его и растворимых в нефтепродуктах алкилзамещенных бензолсульфокислот, комплексы норборна-диенов с солями металлов переменной валентности, ацетилацето-наты железа, кобальта и меди, а также ферроцен и карбонилы железа. С целью снижения дымности выхлопных газов дизельных двигателей предлагается вводить в топливо растворимые в нем органические соли щелочноземельных металлов, а также сульфонаты кальция, бария или магния в виде растворов в легком бензине [15, с. 341]. Добавление к дизельному топливу дидецилсульфо- [c.280]
Добавление к дизельному топливу дидецилсульфо- [c.280]
Аналогия в свойствах элементов и соединений, как отмечал еще Д. И. Менделеев, наблюдается не только в пределах групп или периодов, но и при движении по диагонали. Развивая идеи Д. И. Менделеева, А. Е. Ферсман писал, что поскольку радиусы ионов при движении по горизонтали периодической системы вправо уменьшаются, а при движении сверху вниз увеличиваются, то диагональ будет соединять ионы примерно одинаковой величины, но разной валентности. Отсюда он сделал вывод, что ионы, встречающиеся по диагонали, могут замещать друг друга в соединениях. Этот вывод чрезвычайно важен и для аналитической химии, особенно при рассмотрении вопросов соосаждения и сокристаллнзации. Оказалось, например, что Еи + (радиус иона 0,124 нм) со-осаждается с Ва304 (радиус иона бария 0,143 нм), и это может быть использовано для выделения европия. Рассматривая элементы центра периодической системы, И. П. Алимарин отмечал, что аналогия действительно наблюдается не только по горизонтали 2г — МЬ — Мо или Н1 — Та — но и по диагонали Т1 — ЫЬ -—W. Сходство химико-аналитических свойств элементов имеет свои положительные и отрицательные стороны. Определение близких по свойствам элементов прн совместном присутствии является сложной аналитической задачей именно из-за близости их химико-аналитических свойств. Например, спектрофотометрическому определению ниобия с тиоцианатом мешают Мо, Ш, Т1 и другие элементы, а определению его с пероксидом водорода мешают Т1 и . Для анализа таких смесей используются самые небольшие различия в свойствах элементов. [c.15]
Сходство химико-аналитических свойств элементов имеет свои положительные и отрицательные стороны. Определение близких по свойствам элементов прн совместном присутствии является сложной аналитической задачей именно из-за близости их химико-аналитических свойств. Например, спектрофотометрическому определению ниобия с тиоцианатом мешают Мо, Ш, Т1 и другие элементы, а определению его с пероксидом водорода мешают Т1 и . Для анализа таких смесей используются самые небольшие различия в свойствах элементов. [c.15]
А-группу периодической системы элементов Менделеева составляют литий, натрий, калий, рубидий, цезий и франций. У атомов этих элементов на наружном уровне электронной оболочки находится по одному з-электрону. Ими начинаются 2—7-й периоды системы Менделеева. Бериллий, магний, кальций, стронций, барий и радий образуют ИА-группу. У атомов этих элементов на наружном уровне электронной оболочки содержится по два з-электрона. Таким образом, в атомах элементов этих групп валентными являются только 5-элек-троны. [c.33]
[c.33]
Пятый период системы элементов начинается с рубидия. При этом снова при незаполненных 4й- и 4/-обо-лочках начинает заполняться 5з-уровень, Оболочка Ай начинает заполняться после стронция в атоме иттрия, подобно тому как З -оболочка начинала заполняться в скандии. Завершается заполнение 4й-состояний в палладии Рс1 (1) (2) (3) (45)2(4р) (4й) , и пятый период заканчивается ксеноном Хе (1) (2) (3) (45)2(4р) (4й ) ° 55)2 (5р) . Валентный электрон цезия, оставляя пустыми оболочки 41 и 5 , занимает состояние 6з и, таким образом, начинает шестой период. После бария Ва(1)(2)(3) (48)2(4р) (4й ) °(55)2(5р) (2 )2 начинает заполняться оболочка М в атоме следующего элемента лантана Ьа(1)(2)(3)(45)2(4р)б(4 ) (58)2(5р)б(5 )Мб5)2. Таким образом, лантан трехвалентен. В следующих за ним не продолжается заполнение 5с/-оболочки, а начинает заполняться забытая оболочка 4/. На этой оболочке всего может разместиться 14 электронов [2 (2-3-1-1)]. В результате ее заполнение завершается на лютеции Ьи(1)(2)(3)(4)(58)2(5р)б(5 ) (б5)2. Эти 14 элементов весьма близки по своим свойствам к лантану. Их называют лантанидами, или редкоземельными. [c.318]
Эти 14 элементов весьма близки по своим свойствам к лантану. Их называют лантанидами, или редкоземельными. [c.318]
Последний щелочный элемент (франций) начинает седьмой период. Этот элемент не представлен в природе и был искусственно синтезирован. Валентный электрон этого элемента находится в 75-состоянии. Седьмой элемент заполняется подобно шестому. Внешние оболочки бария и актиния подобны таковым бария (радия) и лантана (актиния). Соответственно лантанидам существует четырнадцать актинидов, завершаемых 103 элементом — лауренсием. Электронные оболочки синтезированного в СССР 104 элемента подобны оболочке гафния, а оболочка 106 элемента, также синтезированного в СССР, подобна оболочке вольфрама. В последнее время в СССР был синтезирован 107 элемент. Седьмой период должен завершиться на 118 элементе, который должен быть аналогом радона. [c.319]
У атома цезия начинает заполняться б5-состояние, а у атома бария это заполнение завершается. У следующего за барием лантана начинает заполняться 5 -оболочка. Таким образом, у этих атомов оказываются незаполненными не только предыдущий (пятый) этаж , но и в четвертом остаются свободными 14 мест 4/-ячеек, И вот после лантана начинают заполняться эти далеко находящиеся от внешних электронных оболочек орбиты. Естественно, что элементы, в которых происходит заполнение /-ячеек, по своим свойствам весьма близки к лантану. Они также трех-валентны. Эти элементы носят название лантонидов, или редких земель. Остановимся кратко на все возрастающем применении редких земель. [c.588]
У следующего за барием лантана начинает заполняться 5 -оболочка. Таким образом, у этих атомов оказываются незаполненными не только предыдущий (пятый) этаж , но и в четвертом остаются свободными 14 мест 4/-ячеек, И вот после лантана начинают заполняться эти далеко находящиеся от внешних электронных оболочек орбиты. Естественно, что элементы, в которых происходит заполнение /-ячеек, по своим свойствам весьма близки к лантану. Они также трех-валентны. Эти элементы носят название лантонидов, или редких земель. Остановимся кратко на все возрастающем применении редких земель. [c.588]
Металлы второй группы периодической системы — бериллий, магний, кальций, стронций, барий и радий — называют щелочноземельными металлами. Некоторые свойства этих элементов приведены в табл. 18.2. Щелочноземельные металлы обладают значительно большей твердостью и меньшей реакционной способностью, чем щелочные металлы, поскольку имеют вдвое больше валентных электронов. Соединения щелочноземельных элементов аналогичны по своему составу все они образуют окислы МО, гидроокиси М(0Н)2, карбонаты МСОз, сульфаты MSO4 и другие соединения (М=Ве, Mg, Са, Sr, Ва и Ra). [c.521]
[c.521]
Пиккар также считал формулу (I) мало вероятной, гак как при образовании перекиси бария из ВаО и Ог в случае формулы (I) должен происходить разрыв одной валентной связи кислородной молекулы [c.125]
Цеолиты — алюмосиликаты, содержаш,ие в своем составе окислы щелочных и щелочноземельных металлов, отличающиеся строго регулярной структурой пор, которые в обычных температурных условиях заполнены молекулами воды. Эта вода, названная цеолитной, при нагреве выделяется, цеолиты кипят , отсюда н произошло сочетание двух греческих слоев цео и лит , т. е. кипящие камни . Термин цеолиты введен в минералогию свыше 200 лет назад шведским ученым Кронштедом. Свойства природных цеолитов изучены и систематизированы в трудах академиков Ферсмана [25] и Вернадского [26]. Общая химическая формула цеолитов Ме2/ 0-АЬОд-жЗЮо-г/НзО, где Ме — катион щелочного металла, а/г — его валентность. В природе в качестве катионов обычно в состав цеолитов входят натрий, калшг, кальций, ре-,ке барий, стронций и магний. Кристаллическая структура цеолитов образована тетраэдрами 8164 и АЮ4. Катионы компенсируют избыточный отрицательный заряд анионной части алюмосиликатного скелета цеолита. [c.105]
Кристаллическая структура цеолитов образована тетраэдрами 8164 и АЮ4. Катионы компенсируют избыточный отрицательный заряд анионной части алюмосиликатного скелета цеолита. [c.105]
При прибавлении поливалентных катионов (А » «. Са , Ba » ) картина резко меняется с ростом концентрации катиона в смеси и повыщением его валентности оптическая плотность )аствора К-4 увеличива ется. 1ри дальнейшем пов ыше-нии количества ионов электролита оптическая плотность раствора уменьшается, что связано с седимен-тационным выпадением ско-агулированных (агрегированных) частиц полимера и повышением плотности осадка (рис. 24), Можно полагать, что катионы участвуют в образовании поперечных связей между макромолекулами полимера. Из рис. 24 видно, что исследуемый раствор полимера имеет максимальную оптическую плотность при прибавлении 400 1600 и 4000 миллиграмм-ионов алюминия, бария и кальция на [c.50]
Поскольку давление О2 над eOj очень низкое (10 бар при 800°С), то восстановление СеОг в ejOa проводят при высокой температуре сильными газообразными восстановителями, Восстаиовление протекает через ряд промежуточных соединений оо смешанной валентностью Се(1П, IV), имеющих интенсивную сине-чериую окраску. [c.1180]
[c.1180]
По.тюжительная эмпирическая константа В зависит от свойств данного электролита и имеет величину того же норядка, что и (А). Электропроводность сильных 1,1-валентных электролитов можно, как правило, выражать с помощью этого уравнения вплоть до концентрацци, равной 0,1 н., с точностью до величины ошибки опыта. Интересно отметить, что электропроводность растворов хлористого калия при малых концентрациях не подчиняется уравнению Шидловского. Электропроводность электролитов, состоящих 1ГЗ ионов с высокой валентностью, не может быть выражена этим уравнением, но ИЗ рис. 13 видно, что график зависимости Л° от концентрации допускает удовлетворительную экстраполяцию данных для хлористых бария и лантана. Этот рисунок иллюстрирует также небольшое,хотя и поддающееся измерению, отклонение величин Л° для хлористого калия от линейной зависимости, выражаемой уравнением (12). Почти линейный характер отдельных участков кривых объясняется наличием перегиба этих кривых. При больших концентрациях кривые сильно изгибаются вниз. С помощью этих кривых можно довольно точно вычислять Л° несмотря на то, что при самых малых концентрациях отклонения от линейной зависимости весьма значительны. Для электро.т[итов, состоящих из ионов более высокой валентности, например для желеяистосинеродистого калия и сернокислого цинка, экстраполяция практически невозможна. Из рис. 14 видно, что кривые электропроводностей растворов этих солей при приближении к оси ординат резко изгибаются. [c.153]
С помощью этих кривых можно довольно точно вычислять Л° несмотря на то, что при самых малых концентрациях отклонения от линейной зависимости весьма значительны. Для электро.т[итов, состоящих из ионов более высокой валентности, например для желеяистосинеродистого калия и сернокислого цинка, экстраполяция практически невозможна. Из рис. 14 видно, что кривые электропроводностей растворов этих солей при приближении к оси ординат резко изгибаются. [c.153]
Гексаферрит бария с примесями титана позволит создать материал для сверхбыстрой памяти | Новости
Ученые из МФТИ объединили оптический и акустический подходы и обнаружили, что добавление титана в гексаферрит бария позволяет создать особую подструктуру в кристаллической решетке. Новый материал может быть использован для создания сверхбыстрой компьютерной памяти. Результаты опубликованы в журнале Scientific Reports.
Мультиферроики — это материалы, обладающие одновременно несколькими упорядочениями. Например, они могут одновременно быть сегнетоэлектриками (обладать в определенном диапазоне температур спонтанной поляризацией) и ферромагнетиками (ниже определенной температуры становиться намагниченным в отсутствии внешнего магнитного поля).
Исследователи изучают фундаментальные свойства мультиферроиков, чтобы получать материалы с заданными свойствами или изменять эти свойства направленным образом. Мультиферроики находят применение в технологиях сверхбыстрой магнитной памяти, терагерцовой телекоммуникации или антирадарных покрытиях.
Объединив оптический (терагерцовую спектроскопию) и акустический (исследование поглощения и скорости ультразвука) экспериментальные методы с целью подробнее «рассмотреть» гексаферрит бария с примесью титана, ученые зафиксировали интересные особенности в поведении материала.
Найдено объяснение необычному поведению одновременно оптических и акустических свойств исследуемого материала. Оказалось, что при добавлении титана в гексаферрите бария изменяется характер подрешетки ионов железа. Атомы примеси заставляют часть атомов железа менять свою степень окисления и образовывать подструктуру в основной решетке — так называемую ян-теллеровскую подрешетку.
При добавлении в гексаферрит бария титан становится на место некоторых атомов железа.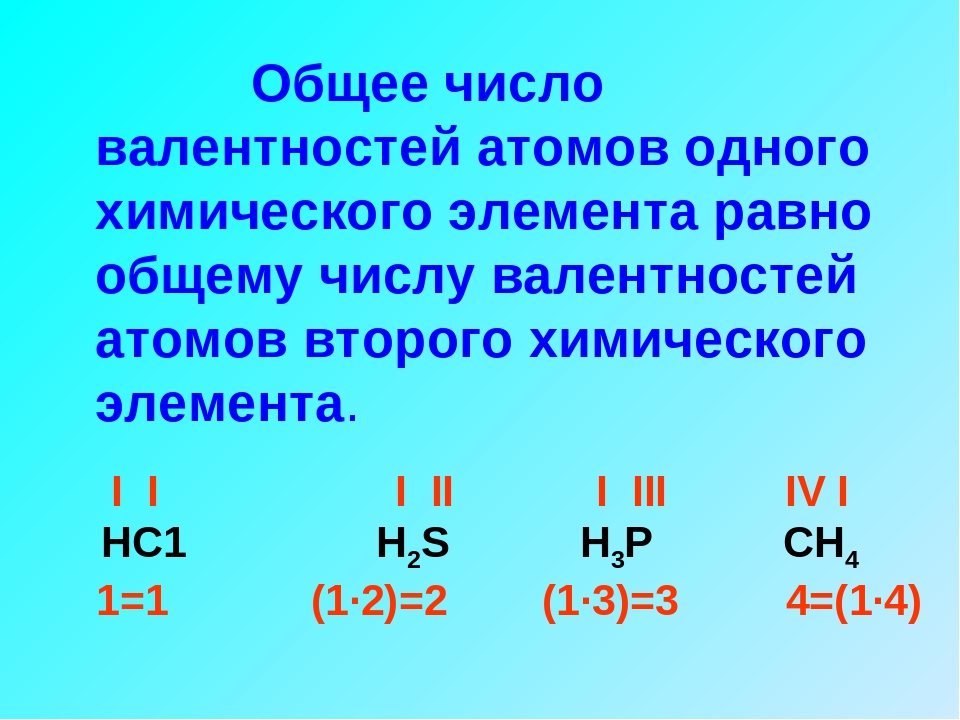 При этом атом титана и атом железа находятся в разных валентных состояниях: титан четырехвалентный, а железо трехвалентное. Валентность отражается и на электрическом заряде ионов в кристалле, и на их размере.
При этом атом титана и атом железа находятся в разных валентных состояниях: титан четырехвалентный, а железо трехвалентное. Валентность отражается и на электрическом заряде ионов в кристалле, и на их размере.
Когда четырехвалентный ион титана замещает трехвалентный ион железа, возникает искажение решетки и нарушается электронейтральность. Электронейтральность должна поддерживаться — это фундаментальное правило. Поэтому часть соседей титана — трехвалентных ионов железа — переходят в двухвалентное состояние, чтобы компенсировать возникший заряд.
Наличие подрешетки Яна — Теллера ведет к появлению необычных свойств кристалла. Например, возникает возможность воздействовать на магнитные подсистемы с помощью электрического поля, скажем, с помощью Т-лучей перемагничивать биты сверхбыстрой компьютерной памяти.
Вы можете подписаться на нашу страницу в LinkedIn!
Валентность бария
Валентность бария.
Валентность бария:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность бария равна II. Барий проявляет постоянную валентность.
| Валентность бария в соединениях | |
| II | Ba(OH)2, BaTe, BaO |
Все свойства атома бария
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности
68
химический элемент Барий Barium — «Химическая продукция»
Что такое
Барий, barium, характеристики, свойства
Барий — это химический элемент Ba элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56. Обозначается символом Ba (лат. Barium). Простое вещество барий — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
Барий класс химических элементов
Элемент Ba — относится к группе, классу хим элементов (элемент главной подгруппы второй группы, шестого периода, с атомным номером 56)
Элемент Ba свойство химического элемента Барий Barium
Основные характеристики и свойства элемента Ba…, его параметры.
формула химического элемента Барий Barium
Химическая формула Барийа:
Атомы Барий Barium химических элементов
Атомы Barium хим. элемента
Barium Барий ядро строение
Строение ядра химического элемента Barium — Ba,
История открытия Барий Barium
Открытие элемента Barium —
Барий был открыт в виде оксида BaO в 1774 году Карлом Шееле и Юханом Ганом. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
Происхождение названия
Своё название получил от др.-греч. βαρύς — «тяжёлый».
Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/л. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (BaSO 4 ) и витерит (BaCO 3 ).
Редкие минералы бария:
- цельзиан
- бариевый полевой шпат (алюмосиликат бария),
- гиалофан (смешанный алюмосиликат бария и калия),
- нитробарит (нитрат бария) и пр.
Типы месторождений
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит , галенит , сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно.
Изотопы
Природный барий состоит из смеси семи стабильных изотопов:130 Ba, 132 Ba, 134 Ba, 135 Ba, 136 Ba, 137 Ba, 138 Ba. Последний является самым распространённым (71,66 %). Известны и радиоактивные изотопы бария, наиболее важным из которых является 140 Ba. Он образуется при делении ядер урана , тория и плутония .
Получение
Основное сырьё для получения бария — баритовый концентрат (80—95 % BaSO 4 ), который, в свою очередь, получают флотацией барита . Сульфат бария в дальнейшем восстанавливают коксом или природным газом :
- BaSO4+4C→BaS+4CO {\\displaystyle {\\mathsf {BaSO_{4}+4C\\rightarrow BaS+4CO}}}
- BaSO4+2Ch5→BaS+2C+4h3O {\\displaystyle {\\mathsf {BaSO_{4}+2CH_{4}\\rightarrow BaS+2C+4H_{2}O}}}
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH) 2 или под действием CO 2 превращают в нерастворимый карбонат бария BaCO 3 , который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH) 2 и свыше 1000 °C для BaCO 3 ):
Получают металлический барий электролизом безводного расплава хлорида бария:
Физические свойства
Барий — серебристо-белый ковкий металл . При резком ударе раскалывается. Существуют две аллотропные модификации бария: до 375 °C устойчив α-Ba с кубической объёмно-центрированной решёткой (а = 0,501 нм), выше устойчив β-Ba.
Твёрдость по шкале Мооса 1,25.
Хранят металлический барий в керосине или под слоем парафина .
Химические свойства
Барий — щёлочноземельный металл . На воздухе барий быстро окисляется, образуя смесь оксида бария BaO и нитрида бария Ba 3 N2 , а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН) 2 :
- Ba+2h3O→Ba(OH)2+h3↑ {\\displaystyle {\\mathsf {Ba+2H_{2}O\\rightarrow Ba(OH)_{2}+H_{2}\\uparrow }}}
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO 4 , сульфит бария BaSO 3 , карбонат бария BaCO 3 , фосфат бария Ba 3 (PO 4 )2 . Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде. Растворимые соли бария позволяют определить наличие в растворе серной кислоты и её растворимых солей по выпадению белого осадка сульфата бария, нерастворимого в воде и кислотах.
Легко вступает в реакцию с галогенами, образуя галогениды .
При нагревании с водородом образует гидрид бария BaH 2 , который, в свою очередь, с гидридом лития LiH даёт комплекс Li[BaH 3 ].
Реагирует при нагревании с аммиаком :
- 6Ba+2Nh4→3Bah3+Ba3N2 {\\displaystyle {\\mathsf {6Ba+2NH_{3}\\rightarrow 3BaH_{2}+Ba_{3}N_{2}}}}
Нитрид бария Ba 3 N2 при нагревании взаимодействует с CO , образуя цианид :
- Ba3N2+2CO→Ba(CN)2+2BaO {\\displaystyle {\\mathsf {Ba_{3}N_{2}+2CO\\rightarrow Ba(CN)_{2}+2BaO}}}
С жидким аммиаком даёт тёмно-синий раствор, из которого можно выделить аммиакат [Ba(NH 3 )6 ], имеющий золотистый блеск и легко разлагающийся с отщеплением NH 3 . В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
- [Ba(Nh4)6]→Ba(Nh3)2+4Nh4+h3 {\\displaystyle {\\mathsf {[Ba(NH_{3})_{6}]\\rightarrow Ba(NH_{2})_{2}+4NH_{3}+H_{2}}}}
Карбид бария BaC 2 может быть получен при нагревании в дуговой печи BaO с углём.
С фосфором образует фосфид Ba 3 P2 .
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария BaSO 4 , отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок родизоната бария . Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора.
Соединения бария окрашивают пламя в желто-зелёный цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO 4 или BaCrO 4 .
Применение Бария
Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя ( геттера ) в высоковакуумных электронных приборах.
Оксид бария , в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов , а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей .
Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зелёный огонь).
Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов применяется для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространённых типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, ВаО — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется также и фосфат бария.
Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
Применение в медицине
Сульфат бария , нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта.
Биологическая роль и токсичность
Биологическая роль бария изучена недостаточно. В число жизненно важных микроэлементов он не входит.
Все растворимые в воде соединения бария высокотоксичны. Вследствие хорошей растворимости в воде из солей бария опасен хлорид, а также нитрат, нитрит, фторид, иодид, бромид, сульфид, хлорат и перхлорат. Хорошо растворимые в воде соли бария быстро резорбируются в кишечнике. Смерть может наступить уже через несколько часов от паралича сердца.
Симптомы острого отравления солями бария: слюнотечение, жжение во рту и пищеводе. Боли в желудке, колики, тошнота, рвота, понос, повышенное кровяное давление, твёрдый неправильный пульс, судороги, позже возможны и параличи, синюшность лица и конечностей (конечности холодные), обильный холодный пот, мышечная слабость, в особенности конечностей, доходящая до того, что отравленный не может кивнуть головой. Расстройство походки, а также речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум в ушах, расстройство зрения.
В случае тяжёлого отравления смерть наступает внезапно или в течение одних суток. Тяжёлые отравления наступают при приёме внутрь 0,2—0,5 г солей бария, смертельная доза 0,8—0,9 г.
Оказании первой помощи
Для оказании первой помощи необходимо промыть желудок 1 % раствором сульфата натрия или магния.
Клизмы из 10 % растворов тех же солей. Приём внутрь раствора тех же солей (20,0 частей соли на 150,0 частей воды) по столовой ложке каждые 5 мин. Рвотные средства для удаления из желудка образовавшегося нерастворимого сульфата бария. Внутривенно 10—20 мл 3 % раствора сульфата натрия. Подкожно — камфора, кофеин, лобелин — по показаниям. Тепло на ноги. Внутрь слизистые супы и молоко.
Барий Barium происхождение названия
Откуда произошло название Barium …
Распространённость Барий Barium
Как любой хим. элемент имеет свою распространенность в природе, Ba …
Получение Барий Barium
Barium — получение элемента
Физические свойства Барий Barium
Основные свойства Barium
Изотопы Barium Барий
Наличие и определение изотопов Barium
Ba свойства изотопов Барий Barium
…
Химические свойства Барий Barium
Определение химических свойств Barium
Меры предосторожности Барий Barium
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Barium
Стоимость Барий Barium
Рыночная стоимость Ba, цена Барий Barium Цены на металлический барий в слитках чистотой 99,9 % колеблются около 30 долларов за 1 кг.
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент Ba
Карбонат бария, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Сульфит бария
| Сульфит бария | |
|---|---|
| Систематическое наименование | Сульфит бария |
| Традиционные названия | Сернистокислый барий |
| Хим. формула | BaSO3 |
| Рац. формула | BaSO3 |
| Состояние | белые кристаллы |
| Молярная масса | 217,40 г/моль |
| Плотность | 4.44 г/см³ |
| Энтальпия | |
| • образования | -1172 кДж/моль |
| Растворимость | |
| • в воде | 0,019720; 0,0017780 г/100 мл |
| Рег. номер CAS | 7787-39-5 |
| PubChem | 516931 |
| Рег. номер EINECS | 232-112-2 |
| SMILES | |
| InChI |
1S/Ba.h3O3S/c;1-4(2)3/h;(h3,1,2,3)/q+2;/p-2 ARSLNKYOPNUFFY-UHFFFAOYSA-L |
| ChemSpider | 450991 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфит бария — неорганическое соединение, соль металла бария и сернистой кислоты с формулой BaSO3, белые кристаллы, не растворяется в воде.
Получение
- Пропускание диоксида серы через суспензию карбоната или гидроксид бария:
- BaCO3 + SO2 → BaSO3 + CO2↑
- Ba(OH)2 + SO2 → BaSO3 + H2O
Физические свойства
Сульфит бария образует белые кристаллы, плотностью в 4,44 г/см³.
Не растворяется в воде.
Химические свойства
- Диспропорционирует при нагревании без доступа воздуха:
- 4BaSO3 →T BaS + 3BaSO4
- Окисляется при нагревании на воздухе:
- 2BaSO3 + O2 →T 2BaSO4
- Реагирует с сильными кислотами:
- BaSO3 + 2HCl → BaCl2 + SO2↑ + H2O
Соединения бария
- Барий (Ba)
- Азид бария (Ba(N3)2) Тринидрид бария
- Амид бария (Ba(NH2)2) Амид бария
- Арсенид бария (Ba3As2) Барий мышьяковистый
- Аурат бария (Ba[AuO2]2) Аурат бария
- Ацетат бария (Ba(CH3COO)2) Барий уксуснокислый
- Бромат бария (Ba(BrO3)2) Барий бромноватокислый
- Бромид бария (BaBr2) Барий бромистый
- Вольфрамат бария (BaWO4) Барий вольфрамовокислый
- Гексаборид бария (BaB6) Барий бористый
- Гексацианоферрат II бария (Ba2[Fe(CN)6]) Гексацианоферроат бария
- Гидрид бария (BaH2) Барий водородистый
- Гидроксид бария (Ba(OH)2) Едкий барий
- Гидросульфид бария (Ba(HS)2) Сернистый барий кислый
- Гидрофосфат бария (BaHPO4) Фосфорнокислый барий кислый
- Гипонитрит бария (BaN2O2) Барий азотноватистокислый
- Дигидрофосфат бария (Ba(H2PO4)2) Барий фосфорнокислый однозамещённый
- Дитионат бария (BaS2O6) Барий дитионовокислый
- Йодат бария (Ba(IO3)2) Барий йодноватокислый
- Йодид бария (BaI2) Барий йодистый
- Карбид бария (BaC2) Барий углеродистый
- Карбонат бария (BaCO3) Барий углекислый
- Манганат бария (BaMnO4) Барий марганцовистокислый
- Молибдат бария (BaMoO4) Барий молибденовокислый
- Нитрат бария (Ba(NO3)2) Барий азотнокислый
- Нитрид бария (Ba3N2) Барий азотистый
- Нитрит бария (Ba(NO2)2) Барий азотистокислый
- Оксалат бария (BaC2O4) Барий щавелевокислый
- Оксид бария (BaO) Барий окись
- Оксид иттрия-бария-меди (YBa2Cu3O7−x) YBCO
- Перманганат бария (Ba(MnO4)2) Барий марганцовокислый
- Пероксид бария (BaO2) Перекись бария
- Пероксодисульфат бария (BaS2O6(O2)) Барий надсернокислый
- Перхлорат бария (Ba(ClO4)2) Барий хлорнокислый
- Пирофосфат бария (Ba2P2O7) Барий фосфорнокислый пиро
- Селенат бария (BaSeO4) Барий селеновокислый
- Селенид бария (BaSe) Барий селенистый
- Силикат бария (BaSiO3) Барий кремнекислый
- Сульфат бария (BaSO4) Барий сернокислый
- Сульфид бария (BaS) Барий сернистый
- Сульфит бария (BaSO3) Барий сернистокислый
- Тиосульфат бария (BaSO3S) Гипосульфит бария
- Тиоцианат бария (Ba(SCN)2) Барий роданистый
- Титанат бария (BaTiO3) Барий титановокислый
- Формиат бария (C2H2BaO4) Барий муравьинокислый
- Фосфат бария (Ba3(PO4)2) Барий фосфорнокислый
- Фосфид бария (Ba3P2) Барий фосфористый
- Фторид бария (BaF2) Барий фтористый
- Хлорат бария (Ba(ClO3)2) Барий хлорноватокислый
- Хлорид бария (BaCl2) Барий хлористый
- Хромат бария (BaCrO4) Барий хромовокислый
- Цианид бария (Ba(CN)2) Барий цианистый
- Цирконат бария (BaZrO3) Барий цирконивокислый
Сколько валентных электронов у бария?
Электронные конфигурации на уровнях атомной энергии
Этот урок объяснит, что делают электроны внутри атома.Настройтесь, чтобы узнать, как мы указываем, где они расположены, и как это описание местоположения поможет нам предсказать свойства элемента.
Возможно, вы знакомы с ролью электронов в электрических устройствах, но знаете ли вы, что электроны также определяют химическую реакционную способность всего, что вас окружает?
Что такое валентные электроны? — Урок для детей
Электроны валентности похожи на указания в наборе Lego.В этом уроке мы узнаем, что такое валентные электроны и почему ученым нужно знать количество валентных электронов в атоме.
Электронные конфигурации на s, p и d орбиталях
Вас смущают длинные списки, которые начинаются с единиц и, кажется, продолжаются бесконечно? Не волнуйтесь, этот урок электронной конфигурации поможет вам быстро понять, как описать размещение электронов.
Основные свойства химических реакций
Узнайте, как насчет различных компонентов химической реакции и как эти компоненты функционируют.Используйте этот урок, чтобы понять основные свойства различных видов химических реакций.
The Element Neon: история, факты и применение
Неоновые вывески были культовыми в Америке с 1920-х годов и до сих пор распространены.В этом уроке мы узнаем, как был открыт неон и почему он так важен для нас.
Механизмы реакции и шаг, определяющий скорость
В этом уроке исследуется, что такое механизм реакции и как он соотносится со скоростью реакции.Вы узнаете, как точно определить этап определения тарифа, и узнаете, как написать закон скорости, основанный на этапе определения тарифа.
Электроотрицательность: определение и тенденции
Притяжение электронов разное в зависимости от элемента.Эта степень притяжения измеряется электроотрицательностью элемента. В этом уроке мы обсудим электроотрицательность, ее тенденции в периодической таблице и связи.
Урок с таблицей Менделеева для детей: структура и применение
В этом уроке мы обсудим устройство и структуру периодической таблицы Менделеева, а также некоторые способы ее использования.Мы посмотрим, как упорядочены элементы и что нам говорят строка и столбец, в которых находится элемент.
Как соединения и молекулы состоят из элементов
Знаете ли вы, что элементы чем-то похожи на людей и имеют разные личности? Некоторым элементам нравится, когда их оставляют в покое.Другие предпочитают проводить время с друзьями. Мы обсудим, как элементы образуют молекулы и соединения и как их можно классифицировать.
Настройтесь на этот урок, чтобы узнать, что важно в материи.Что такое атом? И чем атомы, составляющие элементы периодической таблицы, отличаются друг от друга?
Химические связи: ионные и ковалентные
Атомы составляют все на Земле, а химические связи — это то, что удерживает эти атомы вместе.В этом уроке мы обсудим два очень важных типа химических связей: ковалентную и ионную.
Метод вытеснения воды и расчет плотности
Измерение объема и плотности объектов неправильной формы может быть затруднено.Но есть способ сделать это, совсем не требующий больших усилий. Фактически, все, что вам нужно, — это немного воды, весы и калькулятор, которые вам помогут.
Гликоген: определение, хранение и разложение
Углеводы — важный источник энергии для человеческого организма.Тем не менее, когда мы потребляем слишком много этого топлива, у нас должен быть способ хранить излишки, как вы узнаете из этого урока.
Эффективный ядерный заряд и периодические тенденции
В этом видеоуроке будет описан эффективный ядерный заряд и его роль в объяснении периодических тенденций.В частности, мы научимся прогнозировать тенденции изменения радиуса атома и энергии ионизации, используя наши знания о защите и эффективном ядерном заряде.
Измерения и неопределенность в науке
В этом уроке вы откроете для себя важность точности и аккуратности в науке, одновременно научившись проводить измерения.Кроме того, вы поймете, как выполнять вычисления с измерениями, сохраняющими точность и ограничивающими неопределенность.
Валентный электрон: определение, конфигурация и пример
Электроны — неотъемлемая часть атома.В отличие от протонов и нейтронов валентные электроны принимают участие в возбуждении химической реакции. Узнайте, как определить количество валентных электронов любого элемента в этом уроке.
Атомный номер и массовое число
Атомы — это основные строительные блоки всего, что вас окружает.Чтобы действительно понять, как атомы объединяются в молекулы, необходимо знать их структуру. В этом уроке мы рассмотрим атомы, чтобы увидеть, что на самом деле входит в состав этих маленьких строительных блоков материи.
WebElements Periodic Table »Барий» Свойства свободных атомов
Атомы бария имеют 56 электронов, а структура оболочки — 2.8.18.18.8.2.
Электронная конфигурация основного состояния газообразного нейтрального бария в основном состоянии — это [ Xe ]. 6s 2 , а символ термина — это 1 S 0 .
Схематическая электронная конфигурация бария.
Оболочечная структура Косселя бария.
Атомный спектр
Представление атомного спектра бария.
Энергии ионизации и сродство к электрону
Электронное сродство бария составляет 13,95 кДж / моль ‑1 . Энергии ионизации бария приведены ниже.
Энергии ионизации бария.
Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды «Клементи-Раймонди», Z eff . Для получения более подробной информации и графиков в различных форматах перейдите по гиперссылкам.
| 1с | 54,89 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 41,25 | 2п | 51,81 | ||||
| 3с | 37.16 | 3-пол. | 37,32 | 3д | 42.02 | ||
| 4с | 27,92 | 4 пол. | 26,80 | 4д | 23,78 | 4f | (нет данных) |
| 5s | 16,62 | 5 пол | 14,80 | 5d | (нет данных) | ||
| 6s | 7,58 | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальный | эВ [ссылка на литературу] | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| K | 1s | 37441 [1] | ||||||||||||||||||||||||||
| L I | 2s | 5989 [1] | ||||||||||||||||||||||||||
| L II 2 | 1/2 1 II 2 | 5624 [1] | ||||||||||||||||||||||||||
| L III | 2p 3/2 | 5247 [1] | ||||||||||||||||||||||||||
| M I | 3s | 1293 [2, значения получены из справочного материала 1] | ||||||||||||||||||||||||||
| M II | 3p 1/2 | 1137 [2, значения получены из справочного материала 1] | ||||||||||||||||||||||||||
| M III | 3p 3/2 | 1063 [2, значения получено из ссылки 1] | ||||||||||||||||||||||||||
| M IV | 3d 3/2 | 795.7 [3] | ||||||||||||||||||||||||||
| M V | 3d 5/2 | 780,5 [2] | ||||||||||||||||||||||||||
| N I | 4s | 253,5 [3] | N | 4p 1/2 | 192 [1] | N III | 4p 3/2 | 178,6 [3] | N IV | 4d | 4d / 2 | 92,6 [3] | N V | 4d 5/2 | 89.9 [3] | N VI | 4f 5/2 | — | N VII | 4f 7/2 | — | 1 O 1 5s | 30,3 [3] | O II | 5p 1/2 | 17 [3] | O III | 5p 3/12 14,812 | [3] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электрона.Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- Д.Р. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, «Энергии связи на уровне ядра в металлах», J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
ионов — Химическая формула для хлорида бария
иона — Химическая формула для хлорида бария — Chemistry Stack Exchange
Сеть обмена стеков
Сеть Stack Exchange состоит из 176 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.
Посетить Stack Exchange
0
+0
- Авторизоваться
Зарегистрироваться
Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, преподавателей, преподавателей и студентов в области химии.Регистрация займет всего минуту.
Зарегистрируйтесь, чтобы присоединиться к этому сообществу
Кто угодно может задать вопрос
Кто угодно может ответить
Лучшие ответы голосуются и поднимаются наверх
Спросил
Просмотрено
13к раз
$ \ begingroup $
Хлорид бария представлен как $ \ ce {BaCl2} $.
Поскольку хлор представляет собой двухатомную молекулу, его следует обозначать как $ \ ce {Cl2} $.
Формулируя, получаем
\ begin {array} {| c: cc |} \ hline
\ small \ rm Элемент & \ ce {Ba} & \ ce {Cl2} \\
\ small \ rm Валентность & 2 & 1 \\\ hline
\ end {array}
Пересекая валентности бария и хлора, мы получаем $ \ ce {Ba (Cl2) 2} $ — в отличие от принятой формулы $ \ ce {BaCl2} $. Как это так?
М.А.
9,8101818 золотых знаков6262 серебряных знака8787 бронзовых знаков
Создан 19 июн.
Хороший парень, хороший парень
10311 золотой знак11 серебряный знак22 бронзовых знака
$ \ endgroup $
5
$ \ begingroup $
Составной хлорид бария — это не то же самое, что барий и хлор, смешанные вместе.-} $$, который в твердом состоянии образует ионную решетку. Поскольку эта решетка имеет общий нейтральный заряд, ее ионные заряды должны уравновешиваться с целыми коэффициентами.
Как ни странно, эти коэффициенты равны $ 1 $ и $ 2 $ для $ 2 + $ и $ 1- $ соответственно, поэтому они применяются к ионам, несущим эти заряды. Таким образом: $$ \ ce {Ba1Cl2} $$ или проще и прямо: $$ \ ce {BaCl2} $$
Создан 19 июн.
NijNij
1112 серебряных знаков1818 бронзовых знаков
$ \ endgroup $
1
$ \ begingroup $
Когда хлор находится в свободном состоянии, он является двухатомным.2 +} $. Барий отдает один электрон атому хлора, а другой электрон другому атому хлора, так как валентность хлора равна 1, поэтому это $ \ ce {BaCl2} $.
Создан 19 июн.
Матикс
3311 серебряный знак88 бронзовых знаков
$ \ endgroup $
Chemistry Stack Exchange лучше всего работает с включенным JavaScript
Ваша конфиденциальность
Нажимая «Принять все файлы cookie», вы соглашаетесь, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой в отношении файлов cookie.
Принимать все файлы cookie
Настроить параметры
Какова формула и валентность бария? — AnswersToAll
Какова формула и валентность бария?
Валентные электроны — это электроны, находящиеся во внешней оболочке атома.Валентные электроны могут легко реагировать с электронами во внешней оболочке другого атома. Валентность бария и хлорида равна 2 и 1 соответственно. Итак, Итак, химическая формула — BaCl2.
Почему валентность магния равна 2?
Магний имеет валентность 2+, потому что электронная конфигурация Mg [2,8,2]. Ближайшим к магнию благородным газом является неон с электронной конфигурацией [2,8], для достижения этой стабильной электронной конфигурации Mg может потерять 2 валентных электрона, следовательно, его валентность равна 2+.
Сколько валентных электронов существует в o2?
шесть валентных электронов
Почему возникает переменная валентность?
Некоторые элементы обладают переменной валентностью из-за различной электронной конфигурации. Атом элемента может иногда терять больше электронов, чем присутствует в его валентной оболочке, то есть потерять из предпоследней оболочки и, следовательно, проявлять более 1 или переменную валентность.
Какой металл не имеет переменной валентности?
Элементы группы 2 (Ba) не обладают переменной валентностью….
Какова переменная валентность серебра?
В сульфате железа [II] или сульфате железа, то есть FeSO4, валентность железа равна двум … Имеют ли некоторые элементы переменную валентность?
| Элемент | Серебро |
|---|---|
| Символ | Ag |
| Валентность | 1, 2 |
| Ионы | Ag1 + Ag2 + |
| Номенклатура | Серебро [I] или Аргентное серебро [II] или Аргентинское |
Имеет ли алюминий переменную валентность?
Мы можем определить переменную валентность как явление, которое обычно встречается в переходных элементах.В оксиде железа (II) степень окисления / валентность железа составляет +2, а в оксиде железа (III) степень окисления / валентность железа составляет +3. Мы можем назвать переменную валентность. Алюминий не относится к переходному элементу.
Имеет ли хром переменную валентность?
Хром — это переходный элемент (металл), поэтому он может проявлять переменную валентность. Следовательно, валентности хрома могут быть приняты равными 2 и 3, как в случае железа, которое также является переходным металлом.
Имеет ли серебро переменную валентность?
Некоторые элементы обладают переменной валентностью из-за различной электронной конфигурации.серебро может иногда терять больше электронов, чем присутствует в его валентной оболочке, то есть потеря из предпоследней оболочки и, следовательно, проявляет более 1 или переменную валентность.
|
Барий в Периодической таблице | Сетевые объяснения
Барий:
Определите: Барий является щелочноземельным металлом, занимающим место 5 -го числа в группе щелочноземельных металлов.Он показывает мягкую блестящую структуру. Барий является химически активным металлом. Он токсичен по своей природе и легко растворяется в воде и кислоте. Барий содержится в земной коре в комбинированном виде. Металлический барий, содержащийся в земной коре в барите и витеритовой руде.
Открытие: барий открыт в 1808 году ученым Хамфри Дэви
Происхождение названия:. Название Барий происходит от греческого слова «Барыс», значение которого — Тяжелый.
Физические свойства:
Атомный символ: Барий обозначается символом Ba
Атомный номер: Атомный номер бария 56
В барии присутствует 56 протонов и 56 электронов.
Атомный вес / масса:
Атомный вес бария 137,33 а.е.
В барии присутствует 56 протонов и 81 нейтрон
Позиция: Барий находится в периодической таблице в столбце 2 (группа) и периоде 6 (строке)
Блок : барий находится в блоке s
Цвет: Барий показать серебристый цвет.
Природа: Барий в твердой форме встречается в природе
Точка кипения: Точка кипения бария 1845 0 C
Точка плавления: Точка плавления бария 727 0 C
Изотопы:
Барий показать 7 стабильных изотопов
130 Ba: атомный вес этого изотопа 129.9 Amu
В этом изотопе присутствует 56 протонов, 56 электронов и 74 нейтрона
Присутствует 0.1% в природе
132 Ba: атомный вес этого изотопа 131,9 Amu
В этом изотопе присутствует 56 протонов, 56 электронов и 76 нейтронов
В природе присутствует 0,1%
134 Ba: атомный вес этого изотопа 133,9 Amu
В этом изотопе присутствует 56 протонов, 56 электронов и 78 нейтронов
В природе присутствует 2,4%
135 Ba: Атомный вес этого изотопа 134,9 Amu
В этом изотопе присутствует 56 протонов, 56 электронов и 79 нейтронов
Присутствует 6.5% в природе
136 Ba: Атомный вес этого изотопа 135,9 Amu
В этом изотопе присутствует 56 протонов, 56 электронов и 80 нейтронов
В природе присутствует на 7,8%
137 Ba: Атомный вес этого изотопа 136,9 Amu
В этом изотопе присутствует 56 протонов, 56 электронов и 81 нейтрон
В природе присутствует на 11,2%
138 Ba: Атомный вес этого изотопа 137,9 Amu
В этом изотопе присутствует 56 протонов, 56 электронов и 82 нейтрона
Присутствует 71.9% в природе
Химические свойства:
Электронная конфигурация
Электронная конфигурация бария [Xe] 6S 2
Электронная конфигурация корпуса 2,8,18,18,8,2
Электронная структура
Валентность: Валентность бария 2
Атомный радиус: Атомный радиус бария 268 мкм
Реакционная способность: : барий реагирует с водой и воздухом
Использует:
Использование карбонатной формы в ядах для крыс
Использование нитратов в фейерверках дает зеленый цвет
Барий используется в буровом растворе в нефтяных и газовых скважинах
Используется в производстве красок и стекла
Барий также используется для изготовления кирпича, плитки и резины.
Барий используется в бумажной и резиновой промышленности
Барий используется для изготовления белого пигмента
Барий в основном используется в электродах свечей зажигания
Он также используется в вакуумных трубках в качестве осушителя и удаляющего кислород
Использование оксидной формы для покрытия электрода в люминесцентной лампе
Вопрос и ответ:
Q1. Определить барий
Q2. Кто открыл барий?
Q2. Физические свойства бария
Q4.Напишите атомный символ бария.
Q5. Напишите атомный номер бария.
Q6. На каком блоке присутствует элемент бария?
Q7. Какого цвета барий?
Q8. Какова точка кипения бария?
Q9. Какова точка плавления бария?
Q10. Напишите изотопы бария.
Q11. Показать электронную конфигурацию бария.
Q12. Напишите электронную структуру бария.
Q13. Что такое валентность бария?
Q14.Напишите использование элемента бария.
валентность свинца
Свинец имеет 4 валентных электрона. ВСТУПЛЕНИЕ. Валентные электроны — это те электроны, которые находятся во внешней оболочке, окружающей атомное ядро. Какому элементу, кроме водорода, нужна 2 валентность … Какова формула для определения количества … Сколько валентных электронов у азота? Валентные электроны — это электроны, которые расположены в самых отдаленных… Наши специалисты могут ответить на ваши сложные домашние задания и учебные вопросы.Авторские права © 2020 Multiply Media, LLC. Однако некоторые металлы теряют электроны из оболочки рядом с валентной оболочкой. 1 0. subhojit.dhar. Сколько лет было королеве Елизавете 2, когда она стала королевой? Также встречается в пироморфите, буланжерите и церусситовых рудах. Но оксид свинца обычно образуется при соотношении PbO и PB02 2: 1. Сколько валентных электронов у германия? В сульфате железа [III] или сульфате железа, то есть Fe 2 (SO 4) 3, валентность железа равна трем. Это определяется на основе количества электронов, которые будут добавлены, потеряны или разделены, если он вступит в реакцию с другими атомами.Электроны расположены вокруг ядра атома. Регистрация не требуется! Большинство элементов d-блока (переходные металлы) имеют переменную валентность. отвечать! Использование свинца: используется в припое, защите от излучения, в батареях и боеприпасах. Соединение, в котором металл имеет более высокую валентность, называется «-иком», в то время как соединение, в котором металл имеет более низкую валентность, называется «… Протоны и нейтроны составляют ядро, а электроны находятся вне ядра. Мировое производство свинца составляет около 2 800 000 тонн в год.У крыс после применения соединений свинца в течение 12 дней общее количество свинца в моче значительно увеличилось до 146,0+ или — 6,4 нг (стандартное отклонение) для стеарата свинца, 123,1+ или — 7,2 нг для сульфата свинца, 115,9+ или — 5,3 нг для оксид свинца, 47,8 + или — 6,9 нг для свинцового порошка и 10,3 нг для… © Copyright 2003-2020 Study.com. Регистрация не требуется! Это тяжелый металл, более плотный, чем большинство обычных материалов. отведение валентности = +4. Нужно ли охлаждать тыквенный пирог? Валентность — это взаимосвязь строительных единиц в сетчатых каркасах.Валентность или число валентности — это мера количества химических связей, образованных атомами данного элемента. Валентность для некоторых общих элементов и соединений. Дизайн более высокой валентности в COF из одиночных органических линкеров. По словам исследователей, антигены с низкой валентностью действительно приводят к… Основные районы добычи полезных ископаемых находятся в США, Австралии, Мексике, Германии и Франции. Вся группа имеет валентность 4, то есть диоксиды являются стабильными и знакомыми соединениями. Как долго Маргарет Тэтчер была премьер-министром? Когда у Элизабет Беркли появилась щель между передними зубами? Как бы вы описали одержимость zi dima? Наконец, формат, который помогает вам запоминать и понимать.Свинец помещен в группу 14 или p-блок и период 6 периодической таблицы элементов. «Валентность имеет значение, но вам не нужна валентность 1000, введенная в вашу вакцину, чтобы она изменила ситуацию», — сказал профессор LJI Шейн Кротти, который вместе с профессором Уильямом Шифом из Scripps Research руководил новым исследованием. Мы показываем, что разнообразие КОФ можно увеличить… Вы абсолютно правы. Просматривайте или ищите тысячи страниц или создайте свою собственную страницу с помощью простого мастера. Следовательно, валентность хлора равна 1.Таким образом, валентность Na и Al равна 1 и 3 соответственно. — Определение и уравнение, серия Activity: прогнозирование продуктов реакций одинарного смещения, электронная орбиталь: определение, оболочки и формы, репрезентативные элементы периодической таблицы: определение и обзор, состояния вещества: твердые тела, жидкости, газы и плазма, CLEP Natural Науки: Учебное пособие и подготовка к экзаменам, Наука о жизни в средней школе: обучающее решение, Холт Макдугал, Современная химия: Справка по онлайн-учебнику, Праксис Химия (5245): Практическое и учебное пособие, Химия в колледже: Справочный ресурс для домашних заданий, Подтест II по химии CSET (218 ): Практическое и учебное пособие, Общий вступительный экзамен ISEB для 13+ География: Учебное пособие и подготовка к экзаменам, Holt Science Spectrum — Физические науки с наукой о Земле и космосе: Справка по онлайн-учебникам, Биологические и биомедицинские науки, Кулинарное искусство и личный просмотр или поиск на тысячах страниц или создайте свою собственную страницу с помощью простого мастера.Какие недостатки у первичной группы? Все права защищены. Изучите факты Таблицы общих ионов с валентностью, используя простой интерактивный процесс (флэшкарта, сопоставление или множественный выбор). Наконец, формат, который помогает вам запоминать и понимать. Следовательно, валентный электрон в хлоре равен 7, и ему нужно получить 1 электрон с внешней орбиты, чтобы достичь октета. Электроны, доступные для связывания, называются. Когда органная музыка стала ассоциироваться с бейсболом? Если удалить протон и электрон, может… Где в атоме расположены валентные электроны? Валентность также известна как степень окисления. Кто развил идею электронных оболочек? Уровень 6. PbO = оксид свинца. Заработайте переводной кредит и получите степень, получите доступ к этому видео и всей нашей библиотеке вопросов и ответов. Валентность свинца равна 2. Как долго продержатся следы на Луне? (A) Линкеры BPA (от BPA-1 до 5) объединяют … приводят к обширному пространству структуры MOF (7). Если валентность кислорода равна 2, определите валентности других элементов, присутствующих в следующих оксидах: a) оксид натрия (Na2O), оксид цинка (Zno), оксид свинца (PbO), оксид алюминия (Al2O3) и оксид кальция ( CaO) Вам понадобится валентность, когда вы узнаете, как были получены формулы для кислот и оснований.В H 2 O объединяющая способность кислорода в два раза выше, чем у водорода. Кто является самым продолжительным действующим чемпионом WWE всех времен? Посмотрите на химию свинцово-кислотной батареи. Валентные электроны имеют решающее значение, потому что они дают глубокое понимание химических свойств элемента: является ли он электроотрицательным или электроположительным по природе, или они указывают порядок связи в химическом соединении — количество связей, которые могут быть образованы между двумя атомами. Валентность описывает, насколько легко атом или радикал могут сочетаться с другими химическими соединениями.Изучите факты Таблицы общих ионов с валентностью, используя простой интерактивный процесс (флэшкарта, сопоставление или множественный выбор). Обычно металлы отдают электроны из своей валентной оболочки, образуя положительно заряженные ионы. Свинец — это химический элемент с символом Pb (от латинского plumbum) и атомным номером 82. Определение валентности: свойство атомов или групп, равное количеству атомов водорода, которые атом или … | Значение, произношение, переводы и примеры Валентность элемента всегда целое число.Станьте участником Study.com, чтобы разблокировать это Электроны расположены вокруг ядра атома. Сколько валентных электронов у свинца? В отличие от этого, строительные единицы в COF, за некоторыми исключениями (8), были полностью основаны на валентности 3 и 4, и нет никаких сообщений о каких-либо в. Число отражает, сколько электронов в атоме … В этой статье рассматривается Рентгеновская абсорбционная спектроскопия на L-краях таллия и свинца и меди K 610 F. Studer et al. Валентность (валентность) (… Свинец Pb 2 4 Platinum Pt www.vaxasoftware.com. В теории мотивации ожидания есть три компонента и взаимосвязи. отведение валентности = +2. 1 десятилетие назад. gold — valce elctrons = 5 valecy = 3. silver — символ siver — это Ag, и его валентность равна 1 и 3. свинец — валентность = 2. соединение не имеет валентности, НО это элемент, который имеет валентность, когда мы пишем любой любой элемент благодаря своей валентности он называется ионным. Свинец мягкий и податливый, а также имеет относительно низкую температуру плавления. В свежем виде свинец серебристый с оттенком синего; при контакте с воздухом он тускнеет до тускло-серого цвета.Электронные конфигурации на уровнях атомной энергии, что такое валентные электроны? Даже римляне знали об отравлении свинцом — доктор Корнелиус Цельс предупреждал о вреде свинцового белила, используемого в красках и косметике, а инженер Витрувий рекомендовал глиняные трубы вместо свинцовых. Услуги, валентные электроны и уровни энергии атомов элементов, Working Scholars®: бесплатный колледж в сообществе. Насколько высоки члены довоенной дамы? Оценка теории ожидаемой валентности Врума.Таким образом, металлы, такие как свинец, олово, медь, ртуть, железо и т. Д., Обладают переменной валентностью. Некоторые элементы демонстрируют более одной валентности, которая называется переменной валентностью. Источники свинца: чаще всего встречается в рудах, называемых галенитом. Plumbous имеет валентность +2. Показано, что чистый купрат свинца проявляет состояние Pb (II), тогда как три замещенных свинцом купрата таллия характеризуются только Pb (IV). Материалы на этом сайте не могут быть воспроизведены, распространены, переданы, кэшированы или использованы иным образом без предварительного письменного разрешения Multiply.(Источник :exfear) Примеры валентности на основе химической формулы аммиак (NH 3) Мы знаем, что валентность — это способность атома соединяться с определенным числом атомов другого элемента. Почему библиотеки не пахнут книжными магазинами? И если вы хотите иметь валентность Plumbic: +4 .. 🙂 .. Надеюсь, это поможет !! Хотя известно, что металлоорганические каркасы (MOF) имеют валентности от 3 до 24, ковалентные органические каркасы (COF) ограничены более низкими валентностями 3 и 4, в основном из-за сильной зависимости органической химии от sp 2 и sp 3. гибридизация.[Углерод не может сместить электроны с S-орбитали на P-орбиталь, потому что существует значительная разница в энергии, в отличие от свинца.] Все четыре соединения демонстрируют для меди структуру, характерную для 3d 9 и 3 d 10 L (L: дырка лиганда) конфигурации со смещением края из-за наличия дополнительных кислородных р-дырок, вносимых легированием. Состояние окисления и валентность являются одними из самых фундаментальных свойств элементов и могут быть изучены с помощью электронных конфигураций. — Урок для детей, Валентный электрон: определение, конфигурация и пример, правило октетов и структуры атомов Льюиса, энергия ионизации: тенденции среди групп и периодов периодической таблицы, Периодическая таблица: свойства групп и периодов, определение наклона для положения против.Временные графики, Ионные соединения: образование, энергия решетки и свойства, что такое уровень энергии атома? Оксид свинца (PbO) -ат: в молекуле есть 3 или более типа атомов, и 1 тип — кислород: карбонат кальция (CaCO 3) ТАБЛИЦА ЗНАЧЕНИЙ. Первый компонент — это взаимосвязь эффект-исполнение; именно здесь сотрудник понимает, что приложенные усилия приведут к производительности. Сколько валентных электронов у бария? Свинец повреждает мозг и почки, он может вызвать анемию и форму подагры с печальным названием сатурнианской подагры.www.goodscience.com.au Валентность общих одноатомных и многоатомных ионов Положительные ионы Отрицательные ионы +1 +2 +3 +4 –1 –2 –3 Одноатомные ионы H + водород PbO2 = диоксид свинца. Кто является актрисой в рекламе Saint Agur? Таким образом, удвоение количества кислорода, которое соединяется с 1 атомом элементов, также называется валентностью. Конфигурация валентных электронов Pb — [Xe] 4f14 5d10 6s2 6p2, или 2, 8, 18, 32, 18, 4 электрона на оболочку. В сульфате железа [II] или сульфате железа, то есть FeSO 4, валентность железа равна двум.Концепция валентности была разработана во второй половине 19 века и помогла успешно объяснить молекулярную структуру неорганических и органических соединений. Межгосударственная форма налога с продаж подоходный налог? Повышенная аффинность связывания и валентность фрагментов рекомбинантных антител приводят к улучшенному нацеливанию на опухолевый ангиогенез. Вити Ф (1), Тарли Л., Джованнони Л., Зарди Л., Нери Д. Информация об авторе: (1) Institut für Molekularbiologie und Biophysik, ETH Hönggerberg, Zürich, Switzerland. ! Слова валентность и валентность имеют в химии два связанных значения.Создать учетную запись. Свинец также имеет степень окисления +4. У него четыре валентных электрона во внешней оболочке. Свинец всегда называют отвесным. Pb3O4 = тетраоксид свинца или 2 PbO — PbO2: сложив эти формулы, вы получите Pb3O4. / Состояния валентности Pb, TI и Cu в сверхпроводящих купратах: край купрата свинца, PbZSr2Cao, 5Yo, 5Cu308, и трех соединений таллия, замещенных свинцом, (T1o.5Pbo.s) SrzCu05 (1201), (Tlo.5Pbo.s) SrzCaCuzO, (1212) и (Tlo.5Pbo.s) SrzCaZCu309 (1223)… — ой, я ошибался.Где я могу найти схему реле предохранителей для vw vanagon 1990 года выпуска или любого другого vw vanagon по этому вопросу? Некоторые элементы обладают более чем одной валентностью, то есть имеют переменную валентность. Валентность — заряд иона или радикала, потерявшего или получившего электроны; Обратите внимание, что металлы легко теряют электроны и превращаются в положительные ионы.
