Содержание
Реакция кислоты с солью происходит если.mp4
Здравствуйте,
мои Дорогие!!!!
Реакция кислоты с солью происходит если…
Одна из тем, из главной темы «Определение возможности
осуществления химических реакций».
Урок – 7
Правило 9
Реакция кислоты с солью происходит, если исходная
кислота растворима, а один из продуктов — слабый электролит, при
условии, что реагирующая кислота расположена в ряду вытеснения кислот левее
кислоты, которой образована соль:
Ряд активности кислот
HNO3
H2SO4 HCL
H2SO3 H2CO3 CH3COOH H2S H2SiO3
H3PO4
Каждая последующая кислота вытесняет
предыдущую из её солей
Сила кислот уменьшается, гидролиз средних солей по аниону
усиливается
Исключения
Существуют химические реакции, которые не подчиняются
этому общему правилу.
1. Исключения из правила. Кислоты H3PO4,HCL и
HNO3
(стоят в ряду кислот вместе) вытесняют друг друга из растворимых солей
только в тех случаях, когда образуется слабый электролит.
2. . Исключения из правила. Сероводородная кислота реагирует с солями
кислот, стоящих левее в ряду активности металлов, если соли образованы
металлами: Cu,
Pb, Hg, Ag, так как сульфиды этих
металлов не реагируют с растворами кислот.
Если металл другой, то реакция не пойдет, так как
сульфиды других металлов реагируют с растворами кислот, например:
З. . Исключения из
правила. Соляная кислота
вытесняет серную кислоту только из сульфата серебра, так как при этом
образуется менее растворимый (чем ) хлорид серебра
Рассмотрим задания
Задание 21
1. Определите можно ли провести реакцию между веществами, формулы
Определите можно ли провести реакцию между веществами, формулы
которых: Na2S и HCL
2.Вспомните условия, при котором возможна реакция соли с кислотой
Кислота
+ соль → новая
соль + новая кислота
Кислота растворима Хотя бы один из продуктов слабый
электролит
Na2S + HCL → NaCl + H2S
Растворима растворима Слабый электролит
4. Вспомните ряд вытеснения кислот и сравните исходную
кислоту с кислотой, которой образована соль.
Ряд активности кислот
HNO3
H2SO4 HCL
H2SO3 H2CO3 H2S H2SiO3
H3PO4
Сила кислот уменьшается с лева на право,
гидролиз средних солей по аниону усиливается
Каждая последующая кислота вытесняет
предыдущую из её солей
Посмотрите
исключения из правил (выше по тексту)
6. Сделайте вывод о возможности проведения реакции.
Сделайте вывод о возможности проведения реакции.
Реакция между веществами, формула которых: Na2S и HCL осуществима, так как выполняются все
условия. Данная реакция не относится к исключениям из правил
Задание 21
1. Определите можно ли провести реакцию между веществами, формулы
которых: Na2SO4 + H3PO4 →
2.Вспомните условия, при котором возможна реакция соли с кислотой
Кислота + соль → новая соль + новая кислота.
Кислота растворима Хотя бы один из продуктов слабый
электролит
Na2SO4 + H3PO4 → Na3PO4 + H2SO4
растворима
растворима
растворима растворима
Сильные электролиты
реакция не протекает
Смотрите таблицу растворимости (выше по тексту)
Вывод: Ряд
вытеснения смотреть не требуется, так как в этом случае образуются сильные электролиты, значит, вывод
можно сделать сразу: реакция не идёт (не выполняется одно из условий).
Задание 23
- Определите можно ли
провести реакцию между веществами,
формулы которых: CuSO4 и H2S - Вспомните условия, при
котором возможна реакция соли с
кислотой
Кислота + соль → новая соль + новая кислота.
Кислота растворима Хотя бы один из продуктов слабый
электролит
3. Определите растворимость исходной кислоты по таблице
растворимости
CuSO4 + H2S → CuS +
H2SO4
Растворима Нерастворима, Сильный электролит
слабый
электролит
4. Вспомните ряд вытеснения кислот и сравните исходную
кислоту с кислотой, которой образована соль.
Ряд активности кислот
HNO3
H2SO4 HCL
H2SO3 H2CO3 H2S H2SiO3
H3PO4
Сила кислот уменьшается с лева на право,
гидролиз средних солей по аниону усиливается
Каждая последующая кислота вытесняет
предыдущую из её солей
H2S Стоит правее H2SO4, поэтому не
должна вытеснять её из соли.
Посмотрите
исключения из правил (выше по тексту)
Донная реакция: CuSO4 + H2S относится к исключениям из правил.
6. Сделайте вывод о возможности проведения реакции.
Реакция между веществами, формулы которых CuSO4 и H2S осуществима, так как
образуется соль CuS
– более слабый электролит, чем H2S
Литература:
Химия. Гимназия на дому. А.Е.Савельев
Химия
СОЛИ
Оглавление:
1. Определение
2. Классификация
3. Электролитическая
диссоциация
4. Получение
5. Важнейшие химические
свойства
6. Специфические свойства
7. Задания
8. Ответы
|
|
КЛАССИФИКАЦИЯ
По химическому составу соли классифицируют
на
средние, кислые, основные и двойные.
Отдельным типом солей являются комплексные соли
(соли с комплексными катионами или анионами) . В формулах этих солей
комплексный ион заключён в квадратные скобки.
Комплексные ионы
— это сложные ионы, состоящие из ионов элемента (комплексообразователя)
и связанных с ним нескольких молекул или ионов (лигандов).
Примеры комплексных
солей приведены ниже.
а) С комплексным анионом:
K2[PtCl]4
— тетрахлороплатинат(II)
калия,
K2[PtCl]6
— гексахлороплатинат(IV)
калия,
К3[Fe(CN)6]
— гексацианоферрат(III)
калия.
б) С комплексным катионом:
[Cr(NH3)6]Cl3
— хлорид гексаамминхрома (III),
[Ag(NH3)2]Cl
— хлорид диамминсеребра (I)
[Cu(NH3)4]SO4
— сульфат тетраамминмеди
(II)
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Растворимые соли при растворении в воде
диссоциируют на катионы металлов и анионы кислотных остатков.
NaCl → Na+ +
Cl—
K2SO4 → 2K+
+ SO42-
Al(NO3)3 → Al3+ + 3NO3—
ВАЖНЕЙШИЕ
СПОСОБЫ ПОЛУЧЕНИЯ СОЛЕЙ
1. Металл + неметалл = соль
2Fe + 3Cl2
= 2FeCl3
2. Металл + кислота = соль + водород
Металл + кислота = соль + водород
Zn + 2HCl
= ZnCl2 + H2↑
3. Металл + соль = другой металл + другая соль
(согласно электрохимическому ряду напряжений металлов)
Fe + CuSO4 = Cu + FeSO4
4. Кислота + основный (амфотерный) оксид = соль
+ вода
3H2SO4+Al2O3=Al2(SO4)3+
3H2O
5. Кислота + основание = соль + вода
H2SO4
+ 2NaOH = Na2SO4
+ 2H2O
При неполной нейтрализации многоосновной кислоты основанием
получают кислую соль:
H2SO4
+ NaOH = NaHSO4
+ H2O
При неполной нейтрализации многокислотного основания кислотой
получают основную соль:
Zn(OH)2
+ HCl = ZnOHCl +
H2O
6. Кислота + соль = другая кислота + другая соль
Кислота + соль = другая кислота + другая соль
(для этой реакции используют более сильную кислоту)
AgNO3 + HCl = AgCl + HNO3
BaCl2 + H2SO4
= BaSO4 + 2HCl
7. Основный (амфотерный) оксид + кислота = соль
+ вода
CaO + 2HCl = CaCl2 +H2O
8. Основный оксид + кислотный оксид = соль
Li2O+CO2 = Li2CO3
9. Кислотный оксид + основание = соль + вода
SO3 + 2NaOH = Na2SO4
+ H2O
10. Щёлочь + соль = основание + другая соль
CuSO4 + 2NaOH
= Cu(OH)2
+ Na2SO4
11. Реакция обмена между солями: соль(1) + соль
(2) = соль(3) + соль(4)
NaCl + AgNO3 =Na NO3
+ AgCl
12. Кислые соли могут быть получены
действием избытка кислоты на средние соли и оксиды:
Na2SO4
+ H2SO4
= 2NaHSO4
Li2O
+ 2H2SO4
= 2LiHSO4 + H2O
13. Основные соли получают при осторожном
Основные соли получают при осторожном
добавлении небольших количеств щелочей к растворам средних солей:
AlCl3 + 2NaOH = Al(OH)2Cl +
2NaCl
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
1. Соль + щёлочь = другая соль + другое
основание
CuCl2 + 2KOH = 2KCl + Cu(OH)2
2. Соль + кислота = другая соль + другая кислота
BaCl2 +
H2SO4
= BaSO4 + 2HCl
3. Соль(1) + соль (2) = Соль(3) + соль(4)
Na2SO4 + BaCl2
=2NaCl + BaSO4
4. Соль + металл = другая соль + другой металл
(согласно электрохимическому ряду напряжений металлов)
Zn + Pb(NO3)2
= Pb + Zn(NO3)2
5. Некоторые соли разлагаются при нагревании
CaCO3 = CaO + CO2
KNO3 = KNO2
+ O2
СПЕЦИФИЧЕСКИЕ ХИМИЧЕСКИЕ
СВОЙСТВА
Специфические химические свойства солей зависят от
того, какой катион и какой анион образуют данную соль.
|
|
|
|
Ag+
Cu2+
Ba2+
Fe3+
Al3+
Ca2+
|
Ag+
Ba2+
2H+
2H+
3Ag+
2H+
|
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
Из приведённого перечня выберите
соли, назовите их, определите тип.
1) КNO2
2)
LiOH 3) CaS 4) CuSO4 5) P2O5
6) Al(OH)2Cl 7) NaHSO3 8) H2SO4
Задание 2. С какими из перечисленных веществ
может реагировать а) BaCl2 б)
CuSO4 в)
Na2CO3?
1)Na2O 2)HCl 3)H2O 4) AgNO3 5)HNO3
6)Na2SO4 7)BaCl2 8)Fe
9)Cu(OH)2 10) NaOH
ОТВЕТЫ.
Наверх
Химические свойства солей: средних, кислых, основных, комплексных.
Химические свойства средних солей
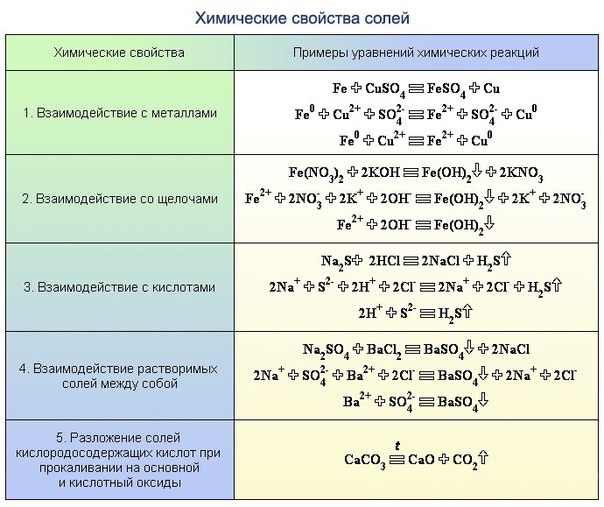
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли.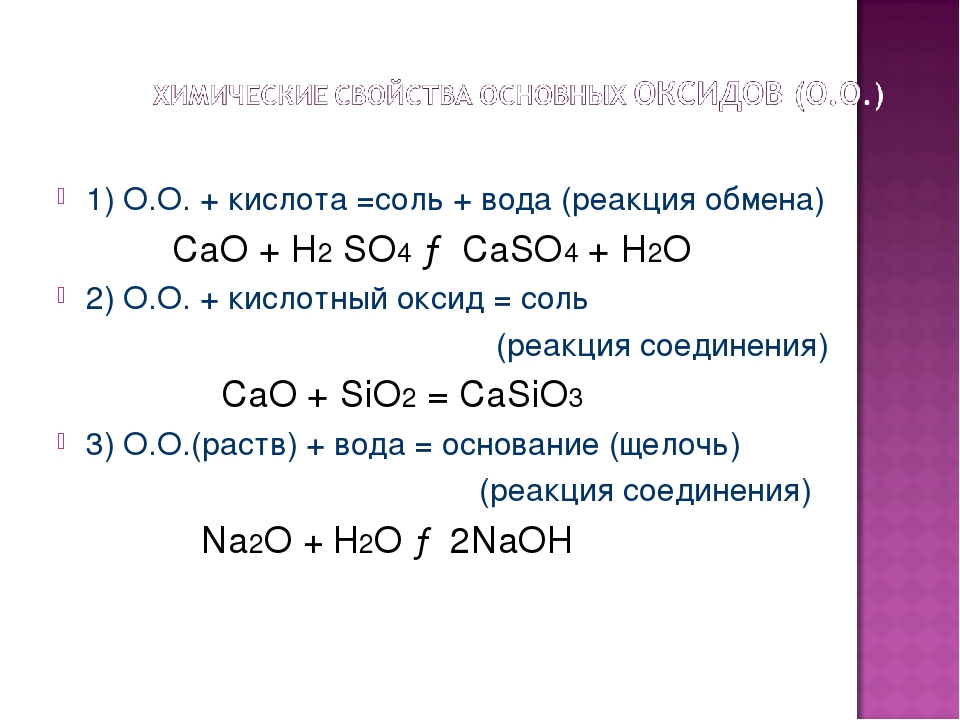 Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.

Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т. е.:
е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу сопропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Соли: химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например, оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
SO3 + Na2O → Na2SO4
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например, гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например, гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
H3PO4 + KOH → KH2PO4 + H2O
H3PO4 + 2KOH → K2HPO4 + 2H2O
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например, гидроксид меди (II) реагирует с серной кислотой:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например, гидроксид цинка (II) реагирует с соляной кислотой:
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например, аммиак реагирует с соляной кислотой:
NH3 + HCl → NH4Cl
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например, соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например, гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
2NaOH + CO2 → Na2CO3 + H2O
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например, при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например, гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
Cu(OH)2 + CO2 ≠
Cu(OH)2 + SO3 → CuSO4 + H2O
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + 2H2O + CO2
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например, кислород окисляет сульфит натрия до сульфата натрия:
2Na2SO3 + O2 → 2Na2SO4
7. Еще один способ получения солей — взаимодействие металлов с неметаллами. Таким способом можно получить только соли бескислородных кислот.
Таким способом можно получить только соли бескислородных кислот.
Например, сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах. Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например, железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например, хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
1. В водных растворах соли диссоциируют на катионы металлов Ме+ и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
В водных растворах соли диссоциируют на катионы металлов Ме+ и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например, хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca2+ + 2Cl–
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например, гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na+ + HCO3–
HCO3– → H+ + CO32–
Основные соли также диссоциируют ступенчато.
Например, гидроксокарбонат меди (II) диссоциирует в две ступени:
(CuOH)2CO3 → 2CuOH+ + CO32–
CuOH+ → Cu2+ + OH–
Двойные соли диссоциируют в одну ступень.
Например, сульфат алюминия-калия диссоциирует в одну ступень:
KAl(SO4)2 → K+ + Al3+ + 2SO42–
Смешанные соли диссоциируют также одноступенчато.
Например, хлорид-гипохлорид кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca2+ + Cl— + ClO–
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например, тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
K[Al(OH)4] → K+ + [Al(OH)4]–
2. Соли взаимодействуют с кислотными и амфотерными оксидами. При этом менее летучие оксиды вытесняют более летучие при сплавлении.
Соли взаимодействуют с кислотными и амфотерными оксидами. При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например, карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
K2CO3 + SiO2 → K2SiO3 + CO2↑
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
K2CO3 + Al2O3 → 2KAlO2 + CO2↑
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например, сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
CuSO4 + 2KOH → Cu(OH)2 + K2SO4
Хлорид аммония взаимодействует с гидроксидом натрия:
(NH4)2SO4 + 2KOH → 2NH3↑ + 2H2O + K2SO4
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например, гидрокарбонат калия взаимодействует с гидроксидом калия:
KHCO3 + KOH → K3CO3 + H2O
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например, сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
CuSO4 + BaCl2 → BaSO4↓+ CuCl2
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например, гидрокарбонат калия взаимодействует с гидросульфатом калия:
KHSO4 + KHCO3 = H2O + CO2↑ + K2SO4
Некоторые кислые соли могут реагировать со своими средними солями.
Например, фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
K3PO4 + KH2PO4 = 2K2HPO4
6. Cоли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например, железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Соль1 + металл1 = соль2 + металл2
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например, при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например, нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
Cu(NO3)2, (расплав) + Fe ≠
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
Pb(NO3)2 + Zn = Pb + Zn (NO3)2
7. Некоторые соли при нагревании разлагаются.
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2→ N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
2AgNO3 → 2Ag +2NO2 + O2
- Галогениды серебра (кроме AgF):
2AgCl → 2Ag + Cl2
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
К ним относятся:
- Карбонаты и гидрокарбонаты:
MgСO3 → MgO + СО2
2NaНСО3 → Na2СО3 + СО2 + Н2О
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
NH4Cl → NH3+ HCl
(NH4)2CO3 → 2NH3+ CO2 + H2O
(NH4)2SO4→ NH4HSO4+ NH3
7. Соли проявляют восстановительные свойства. Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например, йодид калия окисляется хлоридом меди (II):
4KI— + 2Cu+2 Cl2 → 4KCl + 2Cu+l + I20
8. Соли проявляют и окислительные свойства. Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Опыты по химии. Соли | Подготовка к ЦТ и ЕГЭ по химии
Чтобы поделиться, нажимайте
Взаимодействие кислот с солями
Если соединить растворы соли и кислоты в одном сосуде – происходит обмен ионами. Приведем примеры таких реакций. При соединении раствора хлорида бария с серной кислотой образуется нерастворимая соль — сульфат бария.
Приведем примеры таких реакций. При соединении раствора хлорида бария с серной кислотой образуется нерастворимая соль — сульфат бария.
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Мрамор (карбонат кальция) взаимодействует с соляной кислотой.
CaCO3 + 2HCl = CaCl2 + CO2 ↑ +H2O
Реакция обмена происходит, так как выделяется летучее соединение – углекислый газ.
В результате обмена ионами образуется нестойкая угольная кислота, которая распадается на углекислый газ и воду. Реакция между солью и кислотой происходит тогда, когда может образоваться осадок или выделиться газ.
Оборудование: пробирка, штатив для пробирок.
Техника безопасности. Следует соблюдать правила работы с растворами кислот. Избегать попадания кислот и и хлорида бария на кожу и слизистые оболочки.
Следует соблюдать правила работы с растворами кислот. Избегать попадания кислот и и хлорида бария на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Взаимодействие металлов с солями
Активные металлы вытесняют из солей менее активные (металлы расположены в порядке убывания активности в ряду напряжений).
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Проведем опыт с раствором сульфата меди (II) CuSO4. В одну колбу с раствором положим кусочки цинка Zn, в другую – стальные кнопки (сталь – сплав на основе железа Fe). Что произойдет через несколько часов? Растворы изменили цвет — значит, сульфата меди там больше не осталось. Активные металлы ‑ цинк и железо заместили медь в сульфате и образовали соли. Цинк и железо окислились, а медь восстановилась.
Цинк и железо окислились, а медь восстановилась.
CuSO4 + Zn = Zn SO4 + Cu
CuSO4 + Fe = Fe SO4 + Cu
В одной колбе медь выделилась на кнопках, в другой – на кусочках цинка. В колбах были разные металлы, поэтому и осадок меди выглядит по-разному. На цинке медь выделилась в виде рыхлой бурой массы. На железных кнопках осадок меди ‑ более плотный, розового цвета.
Оборудование: колбы.
Техника безопасности. Необходимо осторожное обращение с солями меди. Остерегаться попадания солей меди на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Образование и разрушение кристаллогидратов
Кристаллогидраты – вещества, в состав которых входит кристаллизационная вода. Например, медный купорос CuSO4•5H2O ‑ пятиводный сульфат меди. Медный купорос – голубого цвета. При нагревании большинство кристаллогидратов теряют кристаллизационную воду, превращаясь в безводные вещества. При этом часто происходит изменение цвета веществ. Измельчим купорос и прокалим его. Медный купорос постепенно теряет воду, превращаясь в белый порошок сульфата меди.
Например, медный купорос CuSO4•5H2O ‑ пятиводный сульфат меди. Медный купорос – голубого цвета. При нагревании большинство кристаллогидратов теряют кристаллизационную воду, превращаясь в безводные вещества. При этом часто происходит изменение цвета веществ. Измельчим купорос и прокалим его. Медный купорос постепенно теряет воду, превращаясь в белый порошок сульфата меди.
CuSO4•5H2O = CuSO4 + 5H2O
При добавлении воды происходит обратный процесс: безводный белый сульфат меди превращается в кристаллогидрат –голубой медный купорос.
CuSO4 + 5H2O = CuSO4•5H2O
Вновь образовался кристаллогидрат ‑ пятиводный сульфат меди.
Оборудование: спиртовка, фарфоровая чашка, ступка фарфоровая, шпатель, штатив, стеклянная палочка, химический стакан, вода, пипетка.
Техника безопасности. Следует соблюдать правила работы с нагревательными приборами. Не допускать попадания солей меди на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Лимонная кислота, соль — Справочник химика 21
Кровь, взятая из организма, не свертывается, если прибавить к ней лимонную кислоту, соли щавелевой кислоты или другие соли, которые осаждают ионы кальция. [c.253]
Хорошие результаты дает применение органических кислот, особенно многоосновных (например, лимонная кислота). Соли этих кислот пригодны для добавки в смолу перед обезвоживанием [c. 283]
283]
Для регулировки pH жидкостей тела используются химические буферы. Буферный раствор содержит относительно высокую концентрацию слабой кислоты и ее соли. Например, буферная комбинация лимонной кислоты и ее соли часто используется в коммерческих пищевых продуктах. [c.459]
Кислотная промывка. Для удаления из нефтепроводов нерастворимых солей железа, образовавшихся после кислотной очистки и предотвращения образования гидроокиси железа, при последующей нейтрализации сразу же после кислотной очистки через нефтепроводы прокачивали 320 м 0,1 %-го раствора лимонной кислоты. [c.158]
В 10 мл горячей воды растворите 4 г лимонной кислоты и внесите в раствор 1,7 г бромата калия. После полного растворения соли Б этот раствор прилейте раствор соли церия и перемешайте. [c.315]
Растворите в одной пробирке несколько кристалликов лимонной кислоты (48), в другой — виннокаменной кислоты (66). Нейтрализуйте (по лакмусу) кислоты 10%-ным NH OH (3), затем добавьте немного раствора хлорида кальция (37). В пробирке с виннокаменной кислотой вьшадает осадок тартрата кальция, вторую пробирку с раствором нейтрализованной лимонной кислоты кипятят 2—3 мин при кипячении выпадает осадок. Различная растворимость кальциевых солей позволяет различить виннокаменную и лимонную кислоты. Уравнения проведенных реакций запишите в тетрадь. [c.75]
Нейтрализуйте (по лакмусу) кислоты 10%-ным NH OH (3), затем добавьте немного раствора хлорида кальция (37). В пробирке с виннокаменной кислотой вьшадает осадок тартрата кальция, вторую пробирку с раствором нейтрализованной лимонной кислоты кипятят 2—3 мин при кипячении выпадает осадок. Различная растворимость кальциевых солей позволяет различить виннокаменную и лимонную кислоты. Уравнения проведенных реакций запишите в тетрадь. [c.75]
Для работы требуется-. Штатив с пробирками.— Тигель фарфоровый.— Термометр Ассмана. — Коническая колба емк. 50 мл. — Капельница с водой. — Коллекционный набор солей всех лантанидов. — Нитрат неодима, кристаллический. — Двуокись церия. — Двуокись свинца. — Сульфат калия, кристаллический. — Катионит КУ-2 или СБС в Н-форме. — Азотная кислота 1 2 и 2 и. раствор. — Соляная кислота, 2 и. раствор. — Лимонная кислота, 5% раствор. — Щавелевая кислота, 2 н. раствор. — Едкое кали, 2 н. раствор. — Карбонат натрия, 2 н. раствор.—Сульфат церия (П1), 5% раствор. —Иодат калия, 5% раствор. — Фторид калия, 5% раствор. — Перманганат калия, 0,5 и. раствор. — Сульфат аммония, 40% раствор. — Перекись водорода, 3% и 10% растворы. — Церий металлический (или мишметалл) порошком. [c.336]
—Иодат калия, 5% раствор. — Фторид калия, 5% раствор. — Перманганат калия, 0,5 и. раствор. — Сульфат аммония, 40% раствор. — Перекись водорода, 3% и 10% растворы. — Церий металлический (или мишметалл) порошком. [c.336]
Получение гидроокиси. В две пробирки налить по 1 мл раствора соли церия (П1) и добавить в одну 3 мл раствора лимонной кислоты, а в другую — 3 мл воды. Прилить в обе пробирки по 1 мл раствора едкого кали. В какой из пробирок не образуется осадка и почему Составить уравнение реакции комплексообразования иона лантанида с лимонной кислотой. Какого цвета получился осадок в другой пробирке Уравнение реакции. Половину раствора с осадком перелить в другую пробирку и прилить немного раствора перекиси водорода. Почему осадок желтеет Составить уравнение реакции. Обратить внимание, что в другой пробирке осадок постепенно желтеет за счет окисления Се(ОН)з в Се(0Н)4-Уравнение реакции. [c.336]
В коническую колбу налить 10 мл воды и 1 мл раствора соли церия. Перемешать раствор, отлить 2 мл его в пробирку и установить присутствие трехвалентного церия. В колбу всыпать 1 а катионита и в течение 3—5 мин взбалтывать содержимое колбы. Слить небольшой объем раствора из колбы в пробирку и установить присутствие в нем ионов церия. Слить с катионита весь раствор, промыть катионит водой и влить в него 10 мл 5% -ного раствора лимонной кислоты. Содержимое колбы изредка встряхивать. Установить, содержатся ли в растворе ионы церия. Дать объяснение всему проделанному опыту. [c.338]
Перемешать раствор, отлить 2 мл его в пробирку и установить присутствие трехвалентного церия. В колбу всыпать 1 а катионита и в течение 3—5 мин взбалтывать содержимое колбы. Слить небольшой объем раствора из колбы в пробирку и установить присутствие в нем ионов церия. Слить с катионита весь раствор, промыть катионит водой и влить в него 10 мл 5% -ного раствора лимонной кислоты. Содержимое колбы изредка встряхивать. Установить, содержатся ли в растворе ионы церия. Дать объяснение всему проделанному опыту. [c.338]
Средняя кальциевая соль лимонной кислоты малорастворима в горячей воде, но хорошо растворяется в холодной иоде, что попользуется па практике. [c.475]
Алюминий цитрат Лимонной кислоты алюминиевая соль [c.18]
Дицианоаурат калия KlAu( N),l Лимонная кислота Соль никеля (в пересчете на металл) [c.193]
Органические кислоты и их соли муравьиная НСООН пропионовая СНз—СНг—СООН лимонная кислота. Соли м) равьиной кислоты применяются в качестве вкусовых вещест (солезаменители). Пропионовая кислота используется в конД терской и хлебобулочной промышленности. Лимонная кислот, в маргариновой продукции. [c.84]
Соли м) равьиной кислоты применяются в качестве вкусовых вещест (солезаменители). Пропионовая кислота используется в конД терской и хлебобулочной промышленности. Лимонная кислот, в маргариновой продукции. [c.84]
В работе [40] описаны результаты использования в растворах кобальтирования солей янтарной и лимонной кислот. Соли янтарной кислоты, выполняющие функции буфера, экзальтанта (ускорителя) и комплексообразующего агента, более эффектив- [c.180]
Объемный метод определения никеля титрованием его раствором ди-метилглиокснма с применением в качестве индикатора диметилглиоксим-ной бумаги совмещает, по-видимому, точность весового диметилглиоксим-ного метода с быстротой цианидного метода. Раствор подготовляют к анализу так же, как и для определения никеля весовым диметилглиокспмным методом. Медь предварительно удаляют осаждением ее электролизом, металлическим цинком или алюминием, сероводородом или тиосульфатом. Железо окисляют до трехвалентного состояния перекисью водорода или персульфатом аммония и затем связывают в комплексное соединение. Для последней цели можно применять винную кислоту, лимонную кислоту, соли этих кислот, фториды и пирофосфат натрия. При добавлении фторида натрия выпадает бесцветный осадок, который не мешает последующему титрованию. [c.427]
Для- химического нанесения железа в литературе описывается несколько составов. Для железнения приводится раствор, содержащий 30 г[л водорастворимой соли железа 10 г/л гипофосфита буферную добавку и комплексообразователь — щавелевую или лимонную кислоту (соль) 25—100 г/л сегнетовой соли. Процесс проводится в щелочной среде при 50°С [88]. [c.184]
В случаях, когда содержание СО2 в исследуемом газе менее 1%, следует пользоваться методом титрования, состоящим в том, что отмеренный объем газа пропускают через известный объем Ва(0Н)2 определенного титра. Гидрат окиси бария связывает СО2 в нерастворимую соль ВаСОз. а непрореагировавший избыток Ва(ОН)а оттитровывают раствором щавелевой или лимонной кислоты в присутствии фенолфталеина. [c.827]
Существует процесс защитно-декоративной обработки алюминия под названием эматалирование. Он отличается от способа оксидирования главным образом тем, что обработку ведут в менее агрессивных электролитах, содержащих щавелевую, борную, лимонную кислоты низкой концентравдш и щавелевокислые соли титана, при 40—60 °С. Получаемые пленки имеют молочный оттенок и хорошо окрашиваются. [c.456]
Определение кобальта. Используют метод дифференциального потенциометрического титрования растнором красной кровяной соли КзРе(СЫ) . Отбирают 20—50 см исследуемо1о раствора, добавляют 100 см воды, 10 см 10 %-го Nh5 I, 30 см 25 %-го аммиака и 10 см 30 %-й лимонной кислоты. В стакан с приготовленным раствором помещают два платиновых электрода, из которых один заключен в чрубку с открытым концом. Электроды подключают к милливольтметру, например типа рН-340. Титрование ведут прн перемешивании раствора магнитной мешалкой. Конец титрования определяют по скачку потенциала, Ко щентрацию (г/дм ) кобальта рассчитывают по формуле [c.131]
Один из наиболее важных способов классификации веществ в химии заключается в установлении у них кислотных или основных свойств. Еще в начале развития экспериментальной химии было замечено, что некоторые вещества, называемые ки лoтa /lи, имеют кислый вкус и способны растворять активные металлы, например цинк. Кроме того, под действием кислот некоторые красители растительного происхождения принимают характерную окраску например, лакмус, который получают из лишайников (сложное растение, состоящее из водорослей и грибков), при взаимодействии с кислотами приобретает красную окраску. Подобно кислотам, у оснований тоже имеется целый ряд характерных свойств, по которым можно отличить эти вещества. Но если кислоты имеют кислый вкус (кислый вкус лимонов обусловлен присутствием в их соке лимонной кислоты), то основания имеют характерный горький вкус. Кроме того, основания кажутся скользкими на ощупь. Подобно кислотам, основания также изменяют окраску лакмуса, но если кислоты делают лакмус красным, то основания делают его синим. При взаимодействии оснований со многими солями металлов в растворе из раствора выпадает осадок. [c.68]
Подготовка опыта не сложна, но сам процесс имеет сложный характер . Бромат калия окисляет лимонную кислоту в кислой среде в присутствии соли церия в аце-тондикарбоновую кислоту [c.60]
Выполнение. Раствор лимонной кислоты нагреть примерно до 40— 50° С, а затем высыпать навеску бромата калия и размешать палочкой После растворения КВгОз стакан поставить на лист белой бумаги и внести приготовленную заранее навеску соли церия, а также несколько миллилитров разбавленной серной кислоты. Сразу же начинает происходить чередование цветов желтый — бес1Цветнь[й-)-желтый и т. д. Длится это всего 1—2 мин. Если чередование цветов будет происходить не четко, нужно слегка подогреть раствор. [c.61]
Сурьмяноокисный электрод позволяет определять pH в интервале от 2 до 12 включительно, однако он недостаточно точен. Обычная точность его показаний 0,1 —0,2 единицы pH. Сурьмяный электрод нельзя употреблять, если в растворе имеются соли металлов, более благородных, чем сурьма, например Си, В1, НЬ, 5п, Ag и др., так как эти металлы могут контактно выделяться на поверхности сурьмы. Соли сернистой кислоты, сероводород Н2О2, СгОз и другие окислители и восстановители влияют на показания сурьмяноокисного электрода. Так же влияют некоторые органические вещества (например, лимонная кислота). [c.189]
Ионнообменная хроматография. Метод состоит из двух последовательных операций 1) поглощение катионов из раствора в колонке, наполненной кусочками смолы, предварительно переведенной в Н» -, NHt-, Си +- или форму по мере продвижения раствора по колонке вниз катионы лантаноидов обмениваются с катионами смолы и сорбируются на поверхности по определенным зонам (в каждой из сорбционных зон содержится катион определенного лантаноида) 2) элюирование (вымывание) катионов лантаноидов растворами (элюентами) веществ, образующих комплексные соединения. При элюировании катионы лантаноидов вымываются в определенной последовательности. В качестве комплексообразующих веществ используются лимонная кислота, натриевые или аммонийные соли органических кислот — нитрилтриуксусиой (трилон А), этилендиаминтетрауксусной (трилон Б) и др. Вымывание производится элюентами с определенной концентрацией и при оптимальных значениях pH. [c.279]
Янтарная кислота [(СН2С00Н)а] присутствует в свободном виде как в растениях, так и в животных. Она содержится также в окаменевшей смоле — янтаре. Ее соли участвуют в важном метаболическом цикле лимонной кислоты (цикле Кребса)— наиболее известном биохимическом цикле, заверш аю-щем окислительное расщепление белков, липидов и сахаридов с помощью ацетилкофермента А на диоксид углерода. В этом цикле участвуют также следующие кислоты [c.183]
Лимонная кислота в большом количестве содержится в плодах цитрусовых, вырабатывается с помощью микроорганизмов, например Aspergillus niger, на растворе сахарозы (патоки). Она используется в пищевой промышленности (при производстве фруктовых сиропов и различных напитков) соли лимонной кислоты применяются в гематологии (препятствуют свертыванию крови) и в пищевой промышленности. [c.184]
Лимонная кислота широко распространена в природе, особенно в фруктовых соках. Лимонный сок служит источником промышленного получения лимонной кислоты путем экстракции. Лимонная кислота может дать несколько рядов солей и сложных эфиров, отличающихся положением реагирующей карбоксильной группы. Обладает характерными свойствами а-гидроксикислот, давая комплексы с ионом железа(III), ионом меди(II) (реактив Бенедикта, разд. 7.1.4,Г), превращается в сеответст- [c.240]
Реакция с ртутью(И). Цитрат-ион (и сама лимонная кислота) при взаимодействии с катионами р1ути(П) в сернокислой среде в присутствии перманганата калия образу ет белый осадок соли ртути(П) ацетондикарбоновой кислоты [c.476]
Число молекул кристаллизационной воды различно (от 3 до 5). Первыми комплексообразователями, которые были использованы в полупромышленных масштабах для разделения РЗЭ, были лимонная кислота и ее соли. Лимонная кислота с РЗЭ способна образовывать комплексные соединения разного состава. Средние из них наиболее устойчивы в водных растворах существуют комплексы [ЬпС112] » (где си — С6Н5О7). Устойчивость лимоннокислых комплексов возрас- [c.68]
Элюирование лимонной кислотой. Применявшиеся вначале для разделения малых количеств РЗЭ 5%-ные растворы лимонной кислоты при pH 3 для разделения больших количеств РЗЭ оказались неприемлемыми, так как большая часть вводимой кислоты (90—95%) расходовалась непроизводительно в связи с небольшой устойчивостью комплексов. Концентрация РЗЭ в выходящих из колонок растворах (элюатах) не превышала 1 г/л. Применение растворов лимонной кислоты и ее натриевых и аммониевых солей с pH 5—8 и концентрацией 0,1 % дало возможность повысить степень использования комплексообразователя и увеличить концентрацию РЗЭ в элюатах. Разделение производилось на катионитах в ЫН4″ — и Н -формах. Процесс схематично можно представить следующим образом [87]. При пропускании раствора через сорбционную колонку со смолой в ЫН4 -форме сорби- [c.119]
Разделение при этом незначительное из-за небольшой разницы в сорбционной способности ионов РЗЭ. При промывании колонки раствором лимонной кислоты (или ее соли) образуются комплексы РЗЭ, вымывающиеся во вторую колонку, заполненную смолой в Н- -форме. В указанных условиях разделения преобладает комплекс [Ln itJ -[87, 87] [c.120]
Раствор перекиси водорода не должен содержать других перекисей, например пербораюн или п ркярбодатов. При титровании первые капли раствора перманганата калия обесцвечиваются медленно. Затем реакция идет достаточно быстро до конечной точки титрования. Это, как и в случае перманганатометрического титрования щавелевой кислоты, объясняется постепенным накоплением в растворе марганца (И), ускоряющего реакцию. Поэтому перед титрованием полезно внести в колбу для титрования немного соли марганца (П). Для повышения устойчивости перекиси водорода в раствор вводят ацетанилид, мочевую кислоту, лимонную кислоту, салициловую кислоту и другие вещества, которые тоже окисляются перманганатом калия. Поэтому результаты титрования перекиси водорода завышены. Если добавлена мочевина, то она не мешает титрованию. В присутствии стабилизаторов перекись водорода рекомендуется определять иодометрическим методом ( 144). [c.402]
Состав одного из заменителей сахара (подсластителя) 25% натриевой соли сахарина. 67,5 /о пищевой соды и 1,5% лимонной кислоты. 96,67 г этой смеси заменяют 10 кг сахара. Вычислите, сколько подсластителя нужно взять на 1 стакан чая и какова будет в не.м концентрация каждого компонента. Оцените кислотность (pH) раствора чая, если для угольной кислоты /С, = 4,5 10 Kj = 4,8 10 «, а для лимонной кислоты НООССН,—НОССООН—НООССН, -= 7,4 10 = 2,2 10 5 = 4,0 ю К = 1,0 10 6. Мож но ли пользоваться подсластителем при повышенной или пониженной кислотности желудочного сока Кому рекомендуется использовать в пищу заменители сахара Объясните также, почему лимонной кислоты сильно отличается от остальных. [c.413]
Сурьмяный электрод нельзя употреблять, если в растворе имеются соли металлов более благородных, чем сурьма, например, Си, В1, РЬ, 5п, Ад и др., так как эти металлы могут контактно выделяться на поверхности сурьмы. Соли сернистой кислоты, сероводород, Н2О2, СгОз и другие окислители и некоторые восстановители влияют на показания сурьмяноокисного электрода. Так же влияют некоторые органические вещества (например, лимонная кислота). [c.198]
С соответствующими солями щелочных металлов и аммония соли трехвалентного железа часто образуют двойные соединения, примером которых могут служить железные квасцы общей формулы M[Pe(S04)2] I2h3O. Особенно характерно комплексообразование для солей многих слабых кислот. Например, от H N производится комплексная железосинеродистая кислота— Нз[Ре(СЫ)б], из солей которой наиболее обычен хорошо растворимый в воде феррицианид калия — Кз[Ре(СЫ)б] ( красная кровяная соль ). Легко образуются также растворимые в воде комплексные соединения трехвалентного железа и многих органических вещесте. На этом основано, в частности, применение лимонной кислоты для удаления с материи пятен от ржавчины. [c.441]
В полярографическом анализе для переведения определяемых катионов в комплексные соединения пользуются различными веществами. Из неорганических лигандов чаще всего применяют водный раствор аммиака или пиридин (часто в смеси с их хлоридами), гидроксиды щелочных металлов, роданиды, иодиды, цианиды. Применяют и многие органические вещества винную и лимонную кислоты, этиленди-амин, триэтаноламин, этилендиаминтетрауксусную кислоту и ее соли (ЭДТА) и др. [c.505]
Аммоний цитрат Лимонной кислоты триаммонийная соль [c.38]
Аммоний гидроцитрат Лимонной кислоты диаммонийная соль [c.38]
Кислоти, основания, соли основные свойства
|
Кислоты
H2SO4 — серная (сульфаты)
HCl — соляная (хлориды)
HNO3 — азотная (нитраты)
H3PO4 — фосфорная (Фосфаты)
H2SO3 -сернистая (сульфиты)
H2S — сероводород (сульфиды)
H2CO3 — угольная (карбонаты)
H2SiO3 — кремниевая (силикаты)
|
Основания
NaOH — гидроксид натрия
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Ba(OH)2 — гидроксид бария
Mg(OH)2 — гидроксид магния
Cu(OH)2 — гидроксид меди (II)
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Al(OH)3 — гидроксид алюминия
|
Соли
CuSO4 — сульфат меди (II)
NaCl — хлориднатрия
Fe(NO3)3 — нитрат железа (III)
Ba3(PO4)3 -фосфат бария
MgSO3 — сульфит магния
FeS -сульфид железа (II)
CaCO3 -карбонат кальция
K2SiO3 -силикат калия
Al2(SO4)3 -сульфат алюминия
|
1. Кислоты реагируют
- с металлами, стоящими в ряду активностм левее водорода с выделением водорода (кроме азотной и концентрированной серной)
- с основными оксидами с образованием соли и воды
- с основаниями с образованием соли и воды
- с солями, образованными более слабыми кислотами с выпадением осадка или выделением газа
2. Азотная кислота реагирует со всеми металлами, кроме Au, Pt, Al, Fe, при этом водород не выделяется, а образуются различные соединения азота (NH4NO3, N2, N2O, NO, NO2) в зависимости от концентрации кислоты и активности металла.
3. Концентрированная серная кислота реагирует со всеми металлами, кроме Au, Pt, Al, Fe, при этом водород не выделяется, а выделяются различные соединения серы (H2S, S, SO2) в зависимости от активности металла.
4. Вытеснительный ряд кислот (по убыванию):
H2SO4 —> HCl и HNO3 —> H3PO4 —> H2SO3 —> H2S —> H2CO3 —> H2SiO3
5. Кислоты (кроме нерастворимой в воде кремниевой кислоты) изменяют окраску индикаторов: фиолетовый лакмус в кислотах краснеет, оранжевый метилоранж становится розовым.
6. Щелочи реагируют с кремнием, галогенами, кислотами, кислотными и амфотерными оксидами, амфотерными металлами и растворимыми солями, если выпадает осадок или выделяется газ аммиак.
7. Щелочи при нагревании не разлагаются, изменяют окраску индикаторов: фиолетовый лакмус в щелочах синеет, оранжевый метилоранж становится желтым, бесцветный фенолфталеин становится малиновым.
8. Нерастворимые основания реагируют с кислотами и разлагаются при нагревании на оксид металла и воду.
9. Амфотерные основания реагируют с кислотами, щелочами и разлагаются при нагревании.
10. Соли реагируют
-
со щелочами (если выпадает осадок или выделяется газ аммиак)
-
с кислотами, более сильными, чем та, которой образована соль
-
с другими растворимыми солями (если выпадает осадок)
-
с металлами (более активные вытесняют менее активные)
-
с галогенами (более активные галогены вытесняют менее активные и серу)
11. Нитраты разлагаются с выделением кислорода:
-
если металл стоит до Mg, образуется нитрит + кислород
-
если металл от Mg до Cu, образуется оксид металла + NO2 + O2
-
если металл стоит после Cu, образуется металл + NO2 + O2
-
нитрат аммония разлагается на N2O и H2O
12. Карбонаты щелочных металлов не разлагаются при нагревании
13. Карбонаты металлов II группы разлагаются на оксид металла и углекислый газ
Давайте порассуждаем вместе
1. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) Na2CO3 + HCl
1) NaCl + CO2 + H2O
Б) Na2CO3 + CO2 + H2O
2) NaHCO3 + HCl
В) Na2CO3 + CaCl2
3) NaOH + NaHCO3
4) NaHCO3
5) NaCl + CaCO3
Ответ:
т.к. Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Na2CO3 + CO2 + H2O = NaHCO3
Na2CO3 + CaCl2 = 2NaCl + CaCO3
2. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) H2SO4 + MgO
1) MgSO4 + H2O
Б) H2SO4 + Mg(OH)2
2) MgSO4 + H2
В) Mg + H2S
3) MgS + H2O
4) MgH2 + S
5) MgS + H2
Ответ:
т.к. H2SO4 + MgO = MgSO4 + H2O
H2SO4 + Mg(OH)2 = MgSO4 + 2H2O
Mg + H2S = MgS + H2
3. Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества
Продукты реакции
А) Al2O3 + NaOH
1) NaAlO2 + H2O
Б) Al2O3 + HCl
2) NaH2AlO3
В) Na2SO3 + CaCl2
3) AlCl3 + H2O
4) AlCl3 + H2
5) NaCl + CaSO3
Ответ:
т.к. Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Na2SO3 + CaCl2 = 2NaCl + CaSO3
Реакция кислот — Кислоты, основания и соли — (CCEA) — GCSE Chemistry (Single Science) Revision — CCEA
1. Кислотные реакции с металлами
Кислоты реагируют с металлами с образованием соли и водорода.
кислота + металл → соль + водород
Пример:
соляная кислота + магний → хлорид магния + водород
2HCl (водный) + Mg (s) → MgCl 2 (водный) + H 2 (g)
Наблюдения: серый твердый магний исчезает, образуется бесцветный раствор, выделяется тепло, пузыри.
Водород в этих реакциях можно проверить. Тест для водорода :
- наложите светящуюся шину
- результаты хлопка
2. Кислотные реакции с основаниями
Кислоты реагируют с основаниями с образованием соли и воды.
кислота + основание → соль + вода
Пример:
серная кислота + оксид меди (II) → сульфат меди (II) + вода
H 2 SO 4 (водный) + CuO (s) → CuSO 4 (водн.) + H 2 O (l)
Наблюдения: черный твердый оксид меди (II) исчезает, образуется голубой раствор.
3. Кислотные реакции с карбонатами и гидрокарбонатами
Кислоты реагируют с карбонатами и гидрокарбонатами металлов одинаковым образом. Эти реакции производят соль, воду и углекислый газ.
кислота + карбонат → соль + вода + диоксид углерода
или
кислота + гидрокарбонат → соль + вода + диоксид углерода
Пример — карбонат:
соляная кислота + карбонат меди (II) → хлорид меди (II) + вода + диоксид углерода
2HCl (водн.) + CuCO 3 (с) → CuCl 2 (водн.) + H 2 O (л) + CO 2 (г)
Наблюдения: зеленый твердый карбонат меди (II) исчезает, образуется голубой раствор, выделяется тепло, пузыри.
Пример — гидрокарбонат:
соляная кислота + гидрокарбонат натрия → хлорид натрия + вода + диоксид углерода
HCl (водный) + NaHCO 3 (с) → NaCl (водный) + H 2 O (л ) + CO 2 (г)
Наблюдения: твердый белый гидрокарбонат натрия исчезает, образуется бесцветный раствор, пузырьки.
Газообразный диоксид углерода, образующийся в этих реакциях, можно проверить. Тест на диоксид углерода :
- пузырьковый газ в бесцветной известковой воде (раствор гидроксида кальция)
- раствор изменится с бесцветного на молочный, если газ представляет собой диоксид углерода
4.Кислотные реакции с аммиаком
Кислоты реагируют с аммиаком с образованием соли.
кислота + аммиак → соль аммония
Пример:
серная кислота + аммиак → сульфат аммония
H 2 SO 4 (водн.) + 2NH 3 (г) → (NH 4 ) 2 SO 4 (водн.)
Неорганическая химия — синтез HCl из серной кислоты и натриевой соли
В идеале это реакция. Реально есть несколько лежачих полицейских.
Во-первых, это происходит поэтапно, с кислой солью бисульфата натрия в качестве промежуточного продукта. Первый этап происходит при комнатной температуре между равными пропорциями соли и серной кислоты. Вторая стадия требует температуры 200 * C (что, в свою очередь, требует безводных концентраций кислоты и сухой соли) и дополнительного эквивалента соли, которая реагирует с бисульфатом.
Вы сказали, что использовали избыток серной кислоты; если это так, вы прореагируете со всей солью, но в колбе останется бисульфат натрия, а не сульфат натрия.Поскольку вас интересует получаемый газ HCl, а не сульфатная соль, это не имеет большого значения, но я просто хотел, чтобы вы ясно дали понять, что один моль серной кислоты на два моля соли вам не поможет. ожидаемые 2 моля HCl, если вы не нагреваете «безводную» комбинацию реагентов.
Во-вторых, если в реакции слишком много воды, HCl не будет пузыриться; он с радостью перейдет в раствор. Итак, рекомендуется сухая соль и 10M или более высокая концентрация серной кислоты (как в видео Николау на YouTube, 18M достаточно сильна, чтобы выполнять эту работу, и они производят и продают ее с концентрацией до 98%).Если вы застряли с 1M, вы можете нагреть колбу до кипения, что испарит немного воды и увеличивает концентрацию кислоты, высвобождая газ HCl (серная кислота не будет кипеть ниже 300 * C, поэтому вы можете перегонять HCl. так, пока вы не выйдете из воды и столбик термометра не начнет подниматься).
После этих шагов и барботирования полученного газа через воду, вы определенно должны производить соляную кислоту. Очевидно, что его молярная сила (и, следовательно, его способность реагировать с исследуемыми материалами, как было также указано Николо) будет зависеть от относительных пропорций и количества реагентов, объема вашей воды в ловушке и того, сколько газа фактически поглощается вода.
Кислотно-основные свойства солей | Безграничная химия
Соли, из которых производятся базовые растворы
При растворении в воде основной соли образуется раствор с pH более 7,0.
Цели обучения
Отличить основные соли от неосновных солей
Основные выводы
Ключевые моменты
- В кислотно-основной химии соли — это ионные соединения, образующиеся в результате реакции нейтрализации кислоты и основания.
- Основные соли содержат сопряженное основание слабой кислоты, поэтому, когда они растворяются в воде, они реагируют с водой с образованием раствора с pH более 7,0.
Ключевые термины
- основная соль : продукт нейтрализации сильного основания и слабой кислоты; его анион является сопряженным основанием слабой кислоты
В кислотно-основной химии соль определяется как ионное соединение, которое образуется в результате реакции нейтрализации между кислотой и основанием.Таким образом, соли состоят из катионов (положительно заряженных ионов) и анионов (отрицательных ионов), и в их несольватированных твердых формах они электрически нейтральны (без чистого заряда). Ионы компонента в соли могут быть неорганическими; примеры включают хлорид (Cl —), органический ацетат (CH 3 COO —) и одноатомный фторид (F —), а также многоатомные ионы, такие как сульфат (SO 4 2− ).
Реакция основной соли в воде
Существует несколько разновидностей солей, и в этом разделе мы рассмотрим основные соли.- (\ text {aq}) [/ latex]
Поскольку он способен депротонировать воду и давать щелочной раствор, бикарбонат натрия является основной солью.
Другие примеры основных солей включают:
- Карбонат кальция (CaCO 3 )
- Ацетат натрия (NaOOCCH 3 )
- Цианид калия (KCN)
- Сульфид натрия (Na 2 S)
Обратите внимание, что для всех этих примеров анион является сопряженным основанием слабой кислоты (угольная кислота, бисульфат (вторая стадия диссоциации серной кислоты), уксусная кислота, синильная кислота, сероводород).
Конъюгированные основы слабых и сильных кислот
Имейте в виду, что соль будет основной, только если она содержит сопряженное основание слабой кислоты . Например, хлорид натрия содержит хлорид (Cl — ), который является сопряженным основанием HCl. Но поскольку HCl — сильная кислота, ион Cl — не является основным в растворе и не способен депротонировать воду.
Бикарбонат натрия : Поскольку бикарбонат-ион является сопряженным основанием с угольной кислотой, слабая кислота, бикарбонат натрия будет давать щелочной раствор в воде.
Соли, образующие кислотные растворы
При растворении в воде кислые соли образуют растворы с pH менее 7,0.
Цели обучения
Объясните образование кислотных солей и их влияние на pH раствора.
Основные выводы
Ключевые моменты
- Кислотные соли содержат гидролизуемый протон в катионе, анионе или обоих; например, соль бисульфата аммония (NH 4 HSO 4 ) содержит кислый протон как в катионе, так и в анионе.
- Чтобы определить кислотность / щелочность гидролизуемого аниона, сравните значения K a и K b для иона; если K a > K b , ион является кислым; если K b > K a , ион является основным.
Ключевые термины
- кислая соль : соль, дающая раствор с pH менее 7,0
- гидролизуемый : способный диссоциировать в воде
Соли с гидролизуемым катионом
При растворении в воде кислые соли образуют растворы с pH менее 7.0. Это происходит либо из-за присутствия катиона металла, который действует как кислота Льюиса (что будет обсуждаться позже), либо, что довольно часто, из-за гидролизуемого протона в катионе или анионе. Соли с кислотными протонами в катионе чаще всего представляют собой соли аммония или органические соединения, содержащие протонированную аминогруппу. Примеры включают:
- аммоний (NH 4 + )
- метиламмоний (CH 3 NH 3 + )
- этиламмоний (CH 3 CH 2 NH 3 + )
- анилиний (C 6 H 6 NH 2 + )
Примером кислой соли является соль, содержащая любой из этих катионов с нейтральным основанием, например хлорид аммония (NH 4 Cl).
Соли с гидролизуемыми протонами в анионе
Кислотные соли также могут содержать кислотный протон в анионе. Примеры анионов с кислотным протоном включают:
- бисульфат (HSO 4 —)
- дигидроцитрат (H 2 C 6 H 5 O 7 —)
- биоксалат (HO 2 C 2 O —)
Каждый из этих анионов содержит протон, который слабо диссоциирует в воде.Следовательно, соли, содержащие эти анионы, такие как бисульфат калия, будут давать слабокислые растворы в воде.
Определение кислотности или щелочности гидролизуемого иона
Из предыдущей концепции мы знаем, что соли, содержащие ион бикарбоната (HCO 3 –), являются основными, тогда как соли, содержащие ион бисульфата (HSO 4 –), являются кислыми. Мы определяем, является ли гидролизуемый ион кислотным или основным, сравнивая значения K a и K b для иона; если K a > K b , ион будет кислым, тогда как если K b > K a , ион будет основным.
Хлорид анилиния : Хлорид анилиния является примером кислой соли. Группа NH 3+ содержит кислотный протон, способный диссоциировать в растворе; следовательно, раствор хлорида анилиния в чистой воде будет иметь pH менее 7.
Обзор кислотно-основных свойств соли
Некоторые соли, такие как бикарбонат аммония (NH 4 HCO 3 ), содержат катионы и анионы, которые могут подвергаться гидролизу.
Цели обучения
Предскажите pH раствора соли, содержащей катионы и анионы, оба из которых участвуют в гидролизе.
Основные выводы
Ключевые моменты
- Основные соли образуются в результате нейтрализации сильного основания слабой кислотой.
- Кислотные соли образуются в результате нейтрализации сильной кислоты слабым основанием.
- Для солей, в которых и катион, и анион способны к гидролизу, сравните значения K a и K b , чтобы определить результирующий pH раствора.
Ключевые термины
- реакция нейтрализации : реакция между кислотой и основанием, в которой образуются вода и соль
- гидролиз : реакция с водой, в которой разрываются химические связи
- соль : в кислотно-основной химии, один из продуктов реакции нейтрализации
Резюме кислых и основных солей
Как мы уже обсуждали, соли могут образовывать кислые или основные растворы, если их катионы и / или анионы гидролизуются (способны реагировать в воде).Основные соли образуются в результате нейтрализации сильного основания и слабой кислоты; например, реакция гидроксида натрия (сильное основание) с уксусной кислотой (слабая кислота) даст воду и ацетат натрия. Ацетат натрия — основная соль; Ион ацетата способен депротонировать воду, тем самым повышая pH раствора.
Кислотные соли противоположны основным солям; они образуются в реакции нейтрализации между сильной кислотой и слабым основанием. — ( \ text {aq}) [/ latex]
Однако, как мы уже обсуждали, ион аммония действует в растворе как слабая кислота, а ион бикарбоната действует как слабое основание.{-8} [/ латекс]
Поскольку оба иона могут гидролизоваться, будет ли раствор бикарбоната аммония кислотным или основным? Мы можем определить ответ, сравнив значения K a и K b для каждого иона. В этом случае значение K b для бикарбоната больше, чем значение K a для аммония. Следовательно, бикарбонат немного более щелочной, чем аммоний кислый, а раствор бикарбоната аммония в чистой воде будет слабощелочным (pH> 7.0). Таким образом, если соль содержит два иона, которые гидролизуются, сравните их значения K a и K b :
- Если K a > K b , раствор будет слабокислым.
- Если K b > K a , решение будет немного простым.
Гидролиз солей : В этом видео рассматривается гидролиз кислой соли, основной соли и соли, в которой оба иона гидролизуются.
Использование химических реакций для получения соли
Нейтрализация
Реакция между кислотой и основанием называется нейтрализацией. Именно так работают лекарства от расстройства желудка — они содержат химические вещества, которые реагируют и нейтрализуют избыток желудочной кислоты. Промышленность использует этот же метод для производства широкого спектра солей и продуктов.
Вот как работает нейтрализация:
Кислые растворы содержат ионы водорода (H + ).
Щелочные растворы содержат ионы гидроксида (OH — ).
Вот слово уравнение реакции между кислотой и щелочью:
Кислота + щелочь → соль + вода
Ионное уравнение для всех реакций нейтрализации:
H + (водн.) + OH — (водн.) → H 2 O (л)
Тип соли, образующейся во время реакции, зависит от используемых кислоты и щелочи.
Кислоты, щелочи и соли, которые они производят
При нейтрализации соляной кислоты образуются хлоридные соли.
Соляная кислота + гидроксид натрия → хлорид натрия + вода
При нейтрализации азотной кислоты образуются нитратные соли.
Азотная кислота + гидроксид калия → нитрат калия + вода.
При нейтрализации серной кислоты образуются сульфатные соли.
Серная кислота + гидроксид натрия → сульфат натрия + вода.
Изготовление солей из оксидов металлов
Оксиды металлов также могут использоваться в качестве оснований и вступать в реакцию с кислотами с образованием солей и воды.
Вот словесное уравнение реакции между кислотой и металлическим основанием:
Оксид металла + кислота → соль + вода
Например:
Оксид меди (CuO) + соляная кислота (2HCl) → хлорид меди (CuCl 2 ) + вода (H 2 0)
В то время как достаточно химически активные металлы могут реагировать с кислотами с образованием соли и водорода, соли очень инертных металлов, таких как медь, не могут быть получены таким образом, потому что эти металлы не реагируют с кислотами.
И соли очень реакционноспособных металлов, таких как натрий, не могут быть получены таким способом, потому что реакция между металлом и кислотой слишком интенсивна, чтобы ее можно было проводить безопасно.
Получение соли из реакции осаждения
Некоторые нерастворимые соли могут быть получены в результате реакции между двумя растворами. Сульфат бария — нерастворимая соль. Это может быть получено реакцией между растворами хлорида бария и сульфата натрия.
Например:
Хлорид бария + сульфат натрия → сульфат бария + хлорид натрия
Реакции осаждения могут использоваться для удаления нежелательных ионов из растворов. Этот метод используется для очистки питьевой воды и сточных вод.
Изготовление солей из карбонатов металлов
Кислоты можно нейтрализовать карбонатами металлов с образованием солей. Большинство карбонатов металлов нерастворимы, поэтому они являются основаниями, но не щелочами.
Когда кислоты нейтрализуются карбонатами металлов, образуются соль, вода и диоксид углерода. Это означает, что такие породы, как известняк, содержащие карбонатные соединения, повреждаются кислотными дождями.
Вот слово уравнение реакции:
Карбонат металла + кислота → соль + вода + диоксид углерода
7.-] \]
\ [pH = 12,77 \]
Кислотно-основные реакции | Типы реакций
13.2 Кислотно-основные реакции (ESBQY)
Реакция между кислотой и основанием известна как реакция нейтрализации . Часто при взаимодействии кислоты и основания образуются соль и вода. Мы рассмотрим несколько примеров кислотно-основных реакций.
В химии слово соль не означает белое вещество, которым вы посыпаете пищу (это белое вещество является солью, но не единственной солью).{-} \) ионы. Соль все еще образуется как единственный продукт, но вода не образуется.
Важно понимать, насколько полезны эти реакции нейтрализации. Ниже приведены несколько примеров:
Бытовое использование
Оксид кальция (\ (\ text {CaO} \)) — это основа (все оксиды металлов являются основаниями), которую наносят на слишком кислую почву. Порошковый известняк \ ((\ text {CaCO} _ {3}) \) также можно использовать, но его действие намного медленнее и менее эффективно.Эти вещества могут также использоваться в больших количествах в сельском хозяйстве и в реках.
Известняк (белый камень или карбонат кальция) используется в выгребных ямах (или длинных отстойниках). Известняк — это основа, которая помогает нейтрализовать кислотные отходы.
Биологические применения
Кислоты в желудке (например, соляная кислота) играют важную роль в переваривании пищи. Однако, когда у человека язва желудка или когда в желудке слишком много кислоты, эти кислоты могут вызвать сильную боль. Антациды используются для нейтрализации кислот, чтобы они не горели так сильно. Антациды — это основания, нейтрализующие кислоту. Примерами антацидов являются гидроксид алюминия, гидроксид магния («молоко магнезии») и бикарбонат натрия («бикарбонат соды»). Антациды также можно использовать для снятия изжоги.
Промышленное использование
Основной гидроксид кальция (известковая вода) может использоваться для поглощения вредного кислого \ (\ text {SO} _ {2} \) газа, который выделяется на электростанциях и при сжигании ископаемого топлива.
Укусы пчел являются кислыми и имеют pH от \ (\ text {5} \) до \ (\ text {5,5} \). Их можно успокоить, используя такие вещества, как бикарбонат соды и молоко магнезии. Обе основы помогают нейтрализовать кислотный укус пчелы и немного уменьшить зуд!
Кислотно-основные реакции
Цель
Для исследования кислотно-основных реакций.
Аппаратура и материалы
- Мерная колба
- колбы конические
- раствор гидроксида натрия
- раствор соляной кислоты
- пипетка
- индикатор
Метод
Используйте пипетку, чтобы добавить \ (\ text {20} \) \ (\ text {ml} \) раствор гидроксида натрия в мерную колбу.Долить до отметки водой и хорошо взболтать.
Отмерьте \ (\ text {20} \) \ (\ text {ml} \) раствор гидроксида натрия в коническую колбу. Добавьте несколько капель индикатора.
Медленно добавьте \ (\ text {10} \) \ (\ text {ml} \) соляной кислоты. Если есть изменение цвета, остановитесь. Если нет, добавьте еще \ (\ text {5} \) \ (\ text {ml} \). Продолжайте добавлять \ (\ text {5} \) \ (\ text {ml} \) приращения, пока не заметите изменение цвета.
Наблюдения
Раствор меняет цвет после добавления заданного количества соляной кислоты.
В приведенном выше эксперименте вы использовали индикатор, чтобы увидеть, когда кислота нейтрализует основание. Индикаторы — это химические соединения, которые меняют цвет в зависимости от того, находятся они в кислоте или в основе.
Включен рекомендуемый эксперимент для неформальной оценки по обнаружению природных индикаторов. Учащиеся могут протестировать множество разноцветных растений, чтобы увидеть, что происходит с каждым растением при смешивании с кислотой или основанием.Основная идея состоит в том, чтобы учащиеся извлекли цвет из растения путем кипячения растительного вещества, а затем сливают жидкость. Для таких веществ, как порошок карри, учащиеся могут растворить его в воде, а для чая они могут заварить чашку чая, а затем вынуть пакетик перед тестом. Затем полученную жидкость можно протестировать, чтобы увидеть, является ли она индикатором. Альтернативой смешиванию кислоты или основания с жидкостью является замачивание полоски бумаги в жидкости, а затем нанесение капли кислоты или основания на бумагу.В эксперименте ниже также рассматриваются некоторые другие вещества, такие как разрыхлитель, ванильная эссенция и лук. Разрыхлитель шипит в кислотах, но не в щелочах. Лук и ванильная эссенция теряют свой характерный запах в основном растворе.
Важно, чтобы учащиеся не клали лицо или нос прямо над стаканом или в него, когда нюхали лук и ванильную эссенцию. Они должны держать стакан в одной руке, а другой рукой доносить (т. Е. Махать рукой взад и вперед) запах в сторону своего лица.
Кислоты и щелочи едкие и могут вызвать серьезные ожоги, поэтому с ними нужно обращаться осторожно.
Индикаторы
Цель
Чтобы определить, какие растения и продукты питания могут выступать в качестве индикаторов.
Аппаратура и материалы
- Возможные индикаторы: краснокочанная капуста, свекла, ягоды (например, шелковица), порошок карри, красный виноград, лук, чай (ройбуш или обычный), разрыхлитель, ванильная эссенция
- кислоты (например, уксус, соляная кислота), основания (напр.грамм. аммиак (во многих бытовых чистящих средствах)) до испытания
- Стаканы
Метод
Возьмите небольшое количество первого возможного индикатора (не используйте лук, ванильную эссенцию и разрыхлитель). Варить вещество до тех пор, пока вода не изменит цвет.
Отфильтруйте полученный раствор в стакан, стараясь не попасть в стакан. (Также можно вылить воду через дуршлаг или сито.)
Вылейте половину полученного окрашенного раствора во второй стакан.
Поместите один стакан на лист бумаги формата А4 с надписью «кислоты». Поместите другой стакан на лист бумаги с надписью «основы».
Повторите со всеми другими возможными индикаторами (кроме лука, ванильной эссенции и разрыхлителя).
Во все мензурки на листе с кислотой осторожно налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты.Запишите свои наблюдения.
Во все мензурки на листе основы осторожно налейте \ (\ text {5} \) \ (\ text {ml} \) основы. Запишите свои наблюдения.
Если у вас более одной кислоты или основания, вам нужно будет повторить вышеуказанные шаги, чтобы получить свежие индикаторные образцы для вашей второй кислоты или основания. Или вы можете использовать меньше полученного окрашенного раствора для каждой кислоты и основания, которые вы хотите проверить.
Обратите внимание на запах лука и ванильной эссенции.Поместите небольшой кусочек лука в стакан. Это для тестирования с кислотой. Налейте \ (\ text {5} \) \ (\ text {ml} \) кислоты. Помашите рукой над стаканом, чтобы выдувать воздух к носу. Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.
Поместите небольшой кусочек лука в стакан. Это для тестирования с базой. Залейте \ (\ text {5} \) \ (\ text {ml} \) основы. Помашите рукой над стаканом, чтобы выдувать воздух к носу.Что вы замечаете в запахе лука? Повторите то же самое с ванильной эссенцией.
Наконец, поместите в стакан чайную ложку разрыхлителя. Осторожно налейте в стакан \ (\ text {5} \) \ (\ text {ml} \) кислоты. Запишите свои наблюдения. Повторите, используя базу.
Наблюдения
Вещество | Цвет | Результаты с кислотой | Капуста | С основанием |
Свекла | ||||
Ягоды | ||||
Карри порошок | ||||
Лук | ||||
Ванильная эссенция | ||||
Разрыхлитель | 8 8 | 8 8 присутствие кислоты или основания.Разрыхлитель шипит, когда находится в растворе кислоты, но реакции не наблюдается, когда он находится в растворе основания. Находясь в основе, эссенция ванили и лук должны потерять свой характерный запах. |

