Содержание
Азотная кислота и нитраты
Азотная кислота
Молекулярная формула: HNO3, B(N) = IV, С.О. (N) = +5
Атом азота образует 3 связи с атомами кислорода по обменному механизму и 1 связь — по донорно-акцепторному механизму.
Физические свойства
Безводная HNO3 при обычной температуре — бесцветная летучая жидкость со специфическим запахом (т. кип. 82,6’С).
Концентрированная «дымящая» HNO3 имеет красный или желтый цвет, так как разлагается с выделением NO2. Азотная кислота смешивается с водой в любых соотношениях.
Способы получения
I. Промышленный — 3-стадийный синтез по схеме: NH3 → NO → NO2 → HNO3
1 стадия: 4NH3 + 5O2 = 4NO + 6H2O
2 стадия: 2NO + O2 = 2NO2
3 стадия: 4NO2 + O2 + 2H2O = 4HNO3
II. Лабораторный — длительное нагревание селитры с конц. H2SO4:
H2SO4:
2NaNO3(тв.) +H2SO4(конц.) = 2HNO3 + Na2SO4
Ba(NO3)2(тв) +H2SO4(конц.) = 2HNO3 + BaSO4
Химические свойства
HNO3 → H+ + NO3—
HNO3 — очень реакционноспособное вещество. В химических реакциях проявляет себя как сильная кислота и как сильный окислитель.
HNO3 взаимодействует:
а) с оксидами металлов 2HNO3 + CuO = Cu(NO3)2 + H2O
б) с основаниями и амфотерными гидроксидами 2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O
в) с солями слабых кислот 2HNO3 + СaСO3 = Ca(NO3)2 + СO2↑ + H2O
г) с аммиаком HNO3 + NH3 = NH4NO3
1. При взаимодействии HNO3 с металлами практически никогда не выделяется Н2, так как ионы H+ кислоты не участвуют в окислении металлов.
При взаимодействии HNO3 с металлами практически никогда не выделяется Н2, так как ионы H+ кислоты не участвуют в окислении металлов.
2. Вместо ионов H+ окисляющее действие оказывают анионы NO3—.
3. HNO3 способна растворять не только металлы, расположенные в ряду активности левее водорода, но и малоактивные металлы — Си, Аg, Нg. В смеси с HCl растворяет также Au, Pt.
I. Окисление металлов:
Взаимодействие HNO3: а) с Me низкой и средней активности: 4HNO3(конц.) + Сu = 2NO2↑ + Cu(NO3)2 + 2H2O
8HNO3(разб.) + ЗСu = 2NO↑ + 3Cu(NO3)2 + 4H2O
б) с активными Me: 10HNO3(разб.) + 4Zn = N2O + 4Zn(NO3)2 + 5H2O
в) с щелочными и щелочноземельными Me:
10HNO3(оч. разб.) + 4Са = NH4NO3 + 4Ca(NO3)2 + 3H2O
Очень концентрированная HNO3 при обычной температуре не растворяет некоторые металлы, в том числе Fe, Al, Cr.
II. Окисление неметаллов:
HNO3 окисляет Р, S, С до их высших С.О., сама при этом восстанавливается до NO (HNO3 разб.) или до NO2 (HNO3 конц ).
5HNO3 + Р = 5NO2↑ + H3PO4 + H2O
2HNO3 + S = 2NO↑ + H2SO4
III. Окисление сложных веществ:
Особенно важными являются реакции окисления сульфидов некоторых Me, которые не растворяются в других кислотах. Примеры:
8HNO3 + PbS = 8NO2↑ + PbSO4 + 4H2O
22HNO3 + ЗСu2S = 10NO↑ + 6Cu(NO3)2 + 3H2SO4 + 8H2O
R-Н + НО-NO2 → R-NO2 + H2O
Примеры:
С2Н6 + HNO3 → C2H5NO2 + H2O нитроэтан
С6Н5СН3 + 3HNO3 → С6Н2(NO2)3СН3 + ЗH2O тринитротолуол
С6Н5ОН + 3HNO3 → С6Н5(NO2)3OH + ЗH2O тринитрофенол
R-ОН + НO-NO2 → R-O-NO2 + H2O
Примеры:
С3Н5(ОН)3 + 3HNO3 → С3Н5(ONO2)3 + ЗH2O тринитрат глицерина
При хранении на свету, и особенно при нагревании, молекулы HNO3 разлагаются за счет внутримолекулярного окисления-восстановления:
4HNO3 = 4NO2↑ + O2↑ + 2H2O
Выделяется красно-бурый ядовитый газ NO2, который усиливает агрессивно-окислительные свойства HNO3
Соли азотной кислоты — нитраты Me(NO
3)n
Нитраты — бесцветные кристаллические вещества, хорошо растворяются в воде. Имеют химические свойства, характерные для типичных солей.
Имеют химические свойства, характерные для типичных солей.
Отличительные особенности:
1) окислительно-восстановительное разложение при нагревании;
2) сильные окислительные свойства расплавленных нитратов щелочных металлов.
1. Разложение нитратов щелочных и щелочноземельных металлов:
Me(NO3)n → Me(NO2)n + O2↑
2. Разложение нитратов металлов, стоящих в ряду активности металлов от Mg до Cu:
Me(NO3)n → МеxОy + NO2↑ + O2
3. Разложение нитратов металлов, стоящих в ряду активности металлов превее Cu :
Me(NO3)n → Ме + NO2↑ + O2
Примеры типичных реакций:
1) 2NaNO3 = 2NaNO2 + O2↑
2) 2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
3) 2AgNO3 = 2Ag + 2NO2↑ + O2↑
В водных растворах нитраты, в противоположность HNO3, почти не проявляют окислительной активности.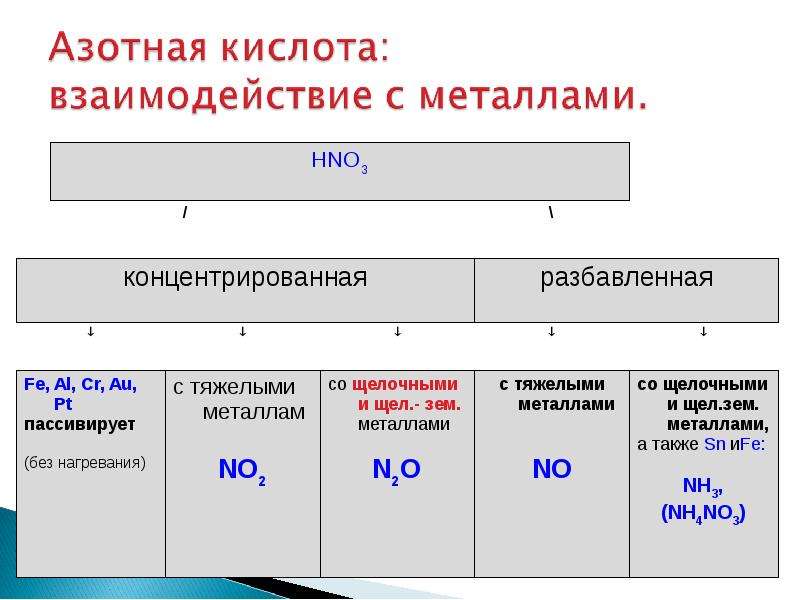 Однако расплавы нитратов щелочных металлов и аммония (селитр) являются сильными окислителями, поскольку разлагаются с выделением активного кислорода.
Однако расплавы нитратов щелочных металлов и аммония (селитр) являются сильными окислителями, поскольку разлагаются с выделением активного кислорода.
Уксусная кислота+Азотная кислота+Молочная кислота+Щавелевая кислота+ Нитрат меди инструкция по применению, цена, аналоги, показания, совместимость, отзывы
пр-т. Ленина, д.2 (1)
ул. Батумская, д.1А (1)
Батумская, д.1А (1)
ул. Бекетова, д.66 (1)
ул. Белинского, д.118/29 (1)
ул. Большая Покровская, д.29 (1)
Большая Покровская, д.29 (1)
ул. Васенко, д.3 (1)
ул. Верхне-Печерская, д.14, корп.1 (1)
ул. Ефремова, д.16 (1)
Ефремова, д.16 (1)
ул. Звездинка, д.3А (1)
ул. Карла Маркса, д.47 (1)
ул. Касьянова, д.1 (1)
Касьянова, д.1 (1)
ул. Коминтерна, д.160 (1)
ул. Львовская, д.3 (1)
ул. Планетная, д.36 (1)
Планетная, д.36 (1)
ул. Родионова, д.165, корп.10 (1)
ул. Сергея Есенина, д.32 (1)
ул. Снежная, д.25А (1)
Снежная, д.25А (1)
ул. Телеграфная, д.3 (1)
ул. Чаадаева, д.28 (1)
ш. Казанское, д.5 (1)
Казанское, д.5 (1)
ш. Московское, д.126 (1)
ш. Московское, д.191 (1)
РазвернутьСвернуть
Нитраты в воде – это опасно?
Нитраты — это ионы с одним зарядом (NO3), соли азотной кислоты. Ранее было распространено известное многим специалистам и работникам сельского хозяйства название «селитра». Это вещество является эффективным и сравнительно недорогим удобрением, поэтому широко используется и в наши дни, несмотря на потенциальную опасность для здоровья человека.
Ранее было распространено известное многим специалистам и работникам сельского хозяйства название «селитра». Это вещество является эффективным и сравнительно недорогим удобрением, поэтому широко используется и в наши дни, несмотря на потенциальную опасность для здоровья человека.
Также нитраты являются конечным продуктом распада азотсодержащих белковых соединений, источниками которых могут быть трупы животных, моча, фекалии, бытовые отходы.
Наличие нитратов в воде говорит о естественном самоочищении водоема. В чистой природной воде содержание нитратов не превышает 1-2 мг/л. Однако нужно помнить, что широкое использование нитратных удобрений приводит к загрязнению воды нитратами через почву.
Санитарными правилами установлена норма содержания нитратов в питьевой воде – 45 мг/л.
Нитраты могут оказывать негативное влияние на организм человека и домашних животных:
1. Способствуют образованию опасного вещества в крови — метгемоглобина, который приводит к кислородному голоданию. Если показатель метгемоглобина составляет 15 %, это проявляется быстрой утомляемостью, вялостью и головокружением. Увеличение метгемоглобина до 60 % приводит к летальному исходу.
Если показатель метгемоглобина составляет 15 %, это проявляется быстрой утомляемостью, вялостью и головокружением. Увеличение метгемоглобина до 60 % приводит к летальному исходу.
2. Снижение уровня гемоглобина может привести к ухудшению работы сердечной и сосудистой системы, закупорке сосудов и капилляров, инсульту.
3. Кислородная недостаточность вызывает сильные головные боли, мигрени, обмороки и тошноту.
4. Превышение концентрации нитратов в воде становится причиной отравления, нарушения работы желудочно-кишечного тракта, выделительной и эндокринной системы, разрушения зубной эмали и появления кариеса.
5. Опасно давать воду, перенасыщенную нитратами, домашним животным. Ведь подобная жидкость не проходит термической обработки, поэтому может привести к серьезным нарушениям в работе внутренних органов животных.
Самые популярные методы очистки воды от нитратов:
1. с помощью установок обратного осмоса
с помощью установок обратного осмоса
Очистка воды от нитратов обратным осмосом – более надежный, но сложный вариант.
Суть его заключается в следующем:
— вода под давлением подается на полупроницаемую мембрану. Нитраты и другие примеси задерживаются мембраной, а к потребителю поступает очищенная вода. Степень извлечения примесей определяется селективностью мембраны, иногда удаление нитратов может достигать 96%.Немаловажное преимущество метода обратного осмоса состоит в том, что качество очистки остается стабильным даже при значительном изменении состава исходной воды. Также установки обратного осмоса будут справляться с задачами по очистке воды от большого спектра химических и бактериологических загрязнений.
Специалисты рекомендуют метод качественной водоочистки обратным осмосом даже для частных домов
2. специальными фильтрами с анионообменными смолами
Метод использования анионообменных смол относительно недорог и эффективен, но имеет свои особенности и ограничения:
-ионообменные нитратселективные смолы эффективно удаляют нитрат-ионы. Физическая суть данного метода сводится к замещению нитрат-ионов аниона смолы, как правило, хлорид-иона. Из этого следуют особенности и ограничения при использовании данного метода. Ионообменная смола характеризуется определенной емкостью – тем количеством анионов, которое она может на себя принять, обеспечивая необходимую степень очистки воды. При насыщении смолы задерживаемыми ионами производится регенерация смолы солевым раствором.
Нитрат кислоты — Справочник химика 21
При исходной удельной активности 10 —10- кюри л и сложном химическом составе сбросов нитраты, кислоты, сульфаты, хлориды, фосфаты, керосиновый контакт и др. — с общим содержанием солей 2—5 г л коэффициенты очистки на стадии упаривания достигают Ю — 10 что позволяет получать воду, очищенную до санитарных норм. За узлом выпаривания иногда предусматривается контрольный узел ионного обмена, который включается в работу при содержании радиоизотопов в конденсате после выпарки выше ПДК. [c.485]
[c.485]
В этой связи следует остановиться на получении из природного газа чистого водорода — промышленном процессе, применяемом в широких масштабах, так как водород потребляется для получения аммиака и его производных (мировое производство аммиака составило в 1957 г. около 8,7 млн. т [22]). Этим процессом нефтехимическая промышленность объединяется с большой промышленностью неорганической химии (аммиак, азотная кислота, нитраты). [c.29]
Для приготовления катализатора кобальт, окись тория и окись магния загружают в мешалку и растворяют в таком количестве разбавленной азотной кислоты, чтобы полученный раствор содержал 40— 50 г/л кобальта. При этом может быть использован также раствор нитрата кобальта, как это делается при переработке отработанного катализатора. Концентрация кобальта в таком растворе должна соответствовать примерно 40 г/л. [c.84]
Железо-ториевый шлам перерабатывают следующим образом шлам обрабатывают раствором сериой кислоты и хлористого калия, причем образуется труднорастворимая двойная соль —сульфат тория и калия, а железо и алюминий переходят в раствор. Чтобы полностью очистить эту двойную соль, содержащую еще некоторое количество железа, к отфильтрованному осадку приливают раствор соды. При этом образуется двойная растворимая соль — карбонат тория и натрия, а железо выпадает в осадок. Торий затем осаждается из двойной соли в виде карбоната серной кислотой. Осадок растворяют в азотной кислоте и переводят в нитрат тория. [c.85]
Чтобы полностью очистить эту двойную соль, содержащую еще некоторое количество железа, к отфильтрованному осадку приливают раствор соды. При этом образуется двойная растворимая соль — карбонат тория и натрия, а железо выпадает в осадок. Торий затем осаждается из двойной соли в виде карбоната серной кислотой. Осадок растворяют в азотной кислоте и переводят в нитрат тория. [c.85]
И здесь углеводород подают через нагретые до определенной температуры пары азотной кислоты. Смесь паров поступает в реакционную трубку, которая также помешена в легкоплавкую солевую баню из эвтектической смеси нитрита натрия и нитрата калия, нагретую до 420°. Этан подают таким образом, чтобы при установившейся температуре не обнаруживалась двуокись азота в отходящих газах. Для этого сначала повышают скорость пропускания газа до тех пор, пока в отходя- щих газах не будет обнаружено в заметных количествах двуокиси азота. Затем скорость газа снижают до заметного появления паров коричневого цвета. [c.288]
[c.288]
Для этого достаточно прибавить к азотной кислоте всего 3 г/л нитрата калия. [c.290]
Сколько нитрата натрия необходимо для получения 1 т 80%-ного раствора азотной кислоты [c.165]
Определить массу нитрата аммония, полученного прп взаимодействии избытка аммиака с 50%-ным раствором азотной кислоты массой 25 т. [c.180]
На одном из предприятий производства синильной кислоты произошел взрыв выхлопных газов в трубопроводе, в котором образовались нитрит и нитрат аммония — вещества, самопроизвольно разлагающиеся со взрывом при нагреве в присутствии инициатора. [c.77]
Получение нитрата аммония в лаборатории. Главные исходные вещества — водный раствор аммиака, азотная кислота. [c.52]
Промышленные производства нитрата аммония полагались на исключении исходных веществ, возможности получения которых очень ограничены (аммиак с газового завода, натриевая селитра), и замене их основными исходными веществами, запасы которых практически неограничены (кислород, азот и вода), а также на нахождении такого решения, при котором используется теплота, выделяющаяся при проведении экзотермической реакции взаимодействия аммиака с азотной кислотой, для упаривания раствора нитрата аммония. [c.53]
[c.53]
Выше упоминалось, что одной из проблем технологии получения нитрата аммония является осушествление реакции взаимодействия аммиака с азотной кислотой в условиях, дающих возможность использовать выделяющуюся теплоту нейтрализации. [c.56]
Лабораторный метод получения нитрата аммония из аммиака и азотной кислоты лежит в основе промышленных решений. В рассматриваемом случае проблема сводится к нахождению экономичных методов промышленного производства аммиака и азотной кислоты. [c.59]
Вторым направлением получения пикриновой кислоты является реакция оксинитрования бензола. В присутствии нитрата ртути нитрование бензола идет с образованием желтого нитрофенолята нитрата ртути. Дальнейшее нитрование дает пикриновую кислоту [c.554]
Концентрация исходной кислоты, % (масс.) Флегмовое число Отношение нитрат кислота Число теоретшескнх тарелок в колонне Тепло, подводимое в кубе, кДж/кг [c. 129]
129]
Согласно одному из существующих подходов, реакции между кислотами и основаниями в расплавах солей, в состав которых входят оксианионы, рассматривают как реакции между донорами и акцепторами оксид-иона [227]. Так, в расплавах щелочных нитратов кислоты S202- и Сг 02,- генерируют N0 путем связывания 02 [c.153]
Устойчивость окраски определяется соотношением мелщу количеством реактива, нитратов, кислоты и воды в реакционной смеси. [c.38]
Отработанный катализатор содержит около 40% парафина. Его экстрагируют из катализатора тяжелым бензином непосредственно в реакторе до остаточного содержания 1—5%. Получаемый при этом парафин имеет особенно, большой молекулярный вес. Далее катализатор растворяют в концентрированной азотной кислоте. При этом кобальт, магний и торий переходят в раствор и отделяется еще некоторое количество парафина. Последний и остающийся нерастворенным кизельгур отделяют, промывают, а полученный раствор нитрата кобальта осторожным осаждением содой освобождают от железа и тория. Осаждение ведется при 50°, карбонаты железа и тория выпадают из раствора при значении рН = 5,5. Торий затем извлекают из осадка. В растворе нитрата кобальта, полученном после осаждения и фильтрования, содержатся кальций и магний, которые прибавлением раствора фтористого натрия переводят в осадок СаРг — MgF2 и удаляют фильтрованием. [c.85]
Осаждение ведется при 50°, карбонаты железа и тория выпадают из раствора при значении рН = 5,5. Торий затем извлекают из осадка. В растворе нитрата кобальта, полученном после осаждения и фильтрования, содержатся кальций и магний, которые прибавлением раствора фтористого натрия переводят в осадок СаРг — MgF2 и удаляют фильтрованием. [c.85]
Перед началом реакции солевая баня, заполненная эвтетикой из нитрита натрия и нитрата калия, подогревают до 4,20°. Углеводород пропускают через нагретую до 108° и поддерживаемую на постоянном уровне 65%-ную азотную кислоту со скоростью 150 л1час (скорость газа измеряется реометром). При это.м углеводород увлекает с собой столько паров азотной кислоты, что образуется смесь, содержащая углеводород и азотную кислоту в молярном соотношении 2 1. [c.279]
Нагретый предварительно до 500—700° метан пропускается в резервуар, через который проходит трубка из платины или из покрытой платиной стали небольшого диаметра через эту трубку подается водная (35—40%-ная) азотная кислота, нагреваемая здесь горячим метаном. Затем метан, увлекая пары азотной кислоты, которые выходят из трубки, образует смесь в отношении 10 1 эта смесь паров пропускается через змеевик из стекла пайрекс, который находится в расплавленной солевой бане из смеси нитрита калия и нитрата натрия и нагревается приблизительно до 460°. Затем пары попадают в конденсатор и отделитель (абшайдер), где собираются жидкие продукты — нитрометан и азотная кислота, которые могут быть слиты, а газообразные продукты, главным образом непрореагировавший метан и азот, либо выпускаются на воздух, либо могут быть возвращены в процесс. [c.288]
Затем метан, увлекая пары азотной кислоты, которые выходят из трубки, образует смесь в отношении 10 1 эта смесь паров пропускается через змеевик из стекла пайрекс, который находится в расплавленной солевой бане из смеси нитрита калия и нитрата натрия и нагревается приблизительно до 460°. Затем пары попадают в конденсатор и отделитель (абшайдер), где собираются жидкие продукты — нитрометан и азотная кислота, которые могут быть слиты, а газообразные продукты, главным образом непрореагировавший метан и азот, либо выпускаются на воздух, либо могут быть возвращены в процесс. [c.288]
Е. Ходж и Л. Свэллен [97] нашли, что можно исключить это нежелательное каталитическое действие, если к азотной кислоте прибавить небольшое количество нитратов калия или натрия. Образующаяся солевая пленка прекращает каталитический эффект и побочного процесса окисления не происходит. [c.290]
Для избежания двухфазной системы пробовали найти растворители, способны частично растворять углеводород и азотную кислоту. Для этой цели применялись ледяная уксусная кислота, ацетилнитрат, этил-нитрат и т. п., не говоря уже о взрывоопасности, которая появляется при применении этих растворителей необходимо указать на дальнейшее изменение этих веществ под влиянием азотной кислоты, так как она в условиях нитрования вызывает со временем изменение почти всех веществ. Даже уксусная кислота, которая является наиболее удовлетворительным растворителем из найденных до сих пор, также подвергается воздействию азотной кислоты в области температур, необходимых для нитрования. Кроме того, как установил Хэсс с сотрудниками [130], применение уксусной кислоты более благоприятствует окислению углеводородов, чем их нитрованию. [c.304]
Для этой цели применялись ледяная уксусная кислота, ацетилнитрат, этил-нитрат и т. п., не говоря уже о взрывоопасности, которая появляется при применении этих растворителей необходимо указать на дальнейшее изменение этих веществ под влиянием азотной кислоты, так как она в условиях нитрования вызывает со временем изменение почти всех веществ. Даже уксусная кислота, которая является наиболее удовлетворительным растворителем из найденных до сих пор, также подвергается воздействию азотной кислоты в области температур, необходимых для нитрования. Кроме того, как установил Хэсс с сотрудниками [130], применение уксусной кислоты более благоприятствует окислению углеводородов, чем их нитрованию. [c.304]
Тетранитрометаи на пр1актике получают не прямым нитрованием. В промышленности его получают действием высококонцентрированной азотной кислоты на ангидрид уксусной кислоты или ацетилен. При этом работают в присутствии катализатора — нитрата ртути — и получают сначала нитрогЬорм, который нитруют дальше до образования тетранитрометана [200]. [c.340]
[c.340]
Если озониды (особенно озониды высших олефинов) ввести при 90—95° в щелочную суспензию окиси серебра и затем выдержать при этой температуре некоторое время, выход карбоновых кислот достигает почти 100%. При подкислении азотной кислотой не растворимые в воде карбоновые кислоты выделяются в виде маслянистого слоя, а образовавшееся серебро и оставша.яся окись переходят в раствор. Раствор нитрата серебра снова переводят щелочью в окись серебра [56]. [c.552]
По отношению к С1 такому условию удовлетворяет краситель флуоресцеин — слабая кислота, применяемая в качестве индикатора при титровании хлоридов нитратом серебра. Анион этой кислоты адсорбируется в точке эквивалентности осадком Ag l, который окрашивается в красный цвет. [c.328]
Изучение зависимости коэффициентов активности, а также ак-т1шностей от состава раствора привело Льюиса к установлению ряда важных эмпирических закономерностей и правил. В частности, было найдено, что в области низких концентраций средние коэффициенты активности электролита определяются зарядами образующихся ионов и не зависят от других их свойств. Так, наиример, в этих условиях средние коэффициенты активности бромида к лия, нитрата натрия и соляной кислоты одинаковы. Далее было-установлено, что средние коэффициен»Ы активности для очень разбавленных растворов зависят от общей концентрации всех присутствующих электролитов и зарядов их ионов, но не от химической природы электролитов. В связи с этим Льюис и Рендалл ввели понятие ионной силы растворов /, которая определяется как полусумма произведений концентраций понов на квадраты их зарядов [c.81]
Так, наиример, в этих условиях средние коэффициенты активности бромида к лия, нитрата натрия и соляной кислоты одинаковы. Далее было-установлено, что средние коэффициен»Ы активности для очень разбавленных растворов зависят от общей концентрации всех присутствующих электролитов и зарядов их ионов, но не от химической природы электролитов. В связи с этим Льюис и Рендалл ввели понятие ионной силы растворов /, которая определяется как полусумма произведений концентраций понов на квадраты их зарядов [c.81]
Какую массу аммиака и 45%-ной азотной кислоты иеоб.чодимо взять для получения нитрата аммония массой 1 т, если принять, что в нроизводственных условиях потери аммиака составляют 2,5 кг, а НМОз — 7,5 кг на [c.180]
Ха])актерным свойством пероксидных соединений, как простых, так и комплексных, является способность образовывать пероксид водорода при взаимодействии с разбавленными раствора.ми кислот а также выделять кислород при термическом разложении или дейст ВИИ воды и других химических агентов. Другие неорганические соеди нения, которые могут быть источником кислорода, как, например нитраты, хлораты, перхлораты, перманганаты и некоторые оксиды не выделяют пероксид водорода при действии воды. Кислород они выдел5ют только при нагревании и в присутствии катализаторов. [c.317]
Другие неорганические соеди нения, которые могут быть источником кислорода, как, например нитраты, хлораты, перхлораты, перманганаты и некоторые оксиды не выделяют пероксид водорода при действии воды. Кислород они выдел5ют только при нагревании и в присутствии катализаторов. [c.317]
Собственная ионизация жидкого HNO3 незначительна. С водой HNOg смешивается в любых отношениях. Его растворы — сильная кислота, называемая азотной. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитрат натрия. Промышленное производство HNOg осуществляется по стадиям скисление HgN в N0 кислородом воздуха на платиновом катализаторе [c.356]
Большинство производных РЬ (II) — кристаллические вещества. За исключением нитрата РЬ(ЫОз)2 и ацетата РЬ(СНзСОО)2, они плохо растворимы (РЬНа12) или почти нерастворимы (РЬЗО , РЬСгО , РЬСОз) в воде. Этим, в частности, объясняется устойчивость свинца к действию большинства кислот. [c.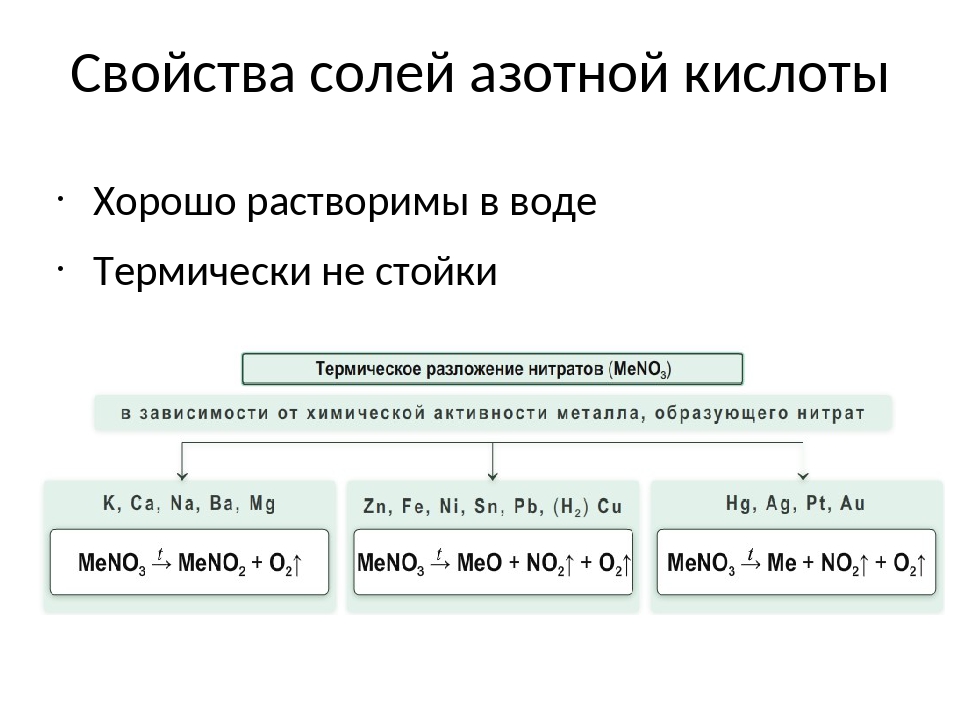 430]
430]
Оксид и гидроксид никеля (И) зеленого цвета. Получают NiO термическим разложением гидроксида, карбоната или нитрата b i (И). Гидроксид Ni(OH)o, образуется при действии щелочей на растворы соединений N1 (II) в виде объемистого зеленого геля, ко-тэрый при стоянии постепенно кристаллизуется. NiO и Ni(0H)2 в вэде не растворяются, но взаимодействуют с кислотами. [c.612]
Фирмой Дюпон (Канада) для производства полупродуктов получения найлона — адипиновой кислоты и гексаметилен-диамина— разработан новый процесс очистки концентрированных сточных вод, богатых азотсодержащими соединениями, путем биологической нитрификации — деиитрификациц. В разработанном процессе предусматривается сочетание аэробного и анаэробного окисления. Нитрификация протекает в аэробных условиях в присутствии диоксида углерода, причем аминный и аммиачный азот биоокисляется до нитритов и нитратов. Денитрификация протекает в анаэробных условиях в среде биораз-лагаемого продукта (обычно метанола). При этом нитраты восстанавливаются до нитритов и в конечном счете до газообразного азота. Поступающие на очистку стоки имеют следующую характеристику содержание общего органического углерода — 3000 мг/л NO2 , N0 3, Nh5+ в пересчете на азот соответственно 800, 90 и 230 мг/л органического азота в пересчете на азот —240 мг/л, БПК —6000 мг/л. Процесс позволяет удалять 98% органических веществ и 80—90% общего азота сточных вод. [c.105]
При этом нитраты восстанавливаются до нитритов и в конечном счете до газообразного азота. Поступающие на очистку стоки имеют следующую характеристику содержание общего органического углерода — 3000 мг/л NO2 , N0 3, Nh5+ в пересчете на азот соответственно 800, 90 и 230 мг/л органического азота в пересчете на азот —240 мг/л, БПК —6000 мг/л. Процесс позволяет удалять 98% органических веществ и 80—90% общего азота сточных вод. [c.105]
Каков будет тепловой эффект при получении твердого нитрата аммония Nh5N03 из газообразного аммиака и разбавленной азотной кислоты. [c.155]
В 67-процентную азотную кислоту пропускают газообразный аммиак, причем образуется нитрат аммония. Достаточно ли будет теплоты реакции, чтобы испарить всю имеющуюся в реакционном аппарате воду, т. е. чтобы получить твердый Nh5NO3. При этом принять, что вся теплота реакции расходуется на испарение НгО. [c.155]
Накопление непрореагировавшей азотной кислоты в нитрато-рах при нарушениях установленного режима дозировки компонентов и определенных условиях может вызвать бурное неуправляемое течение реакции и как следствие этого разрыв аппарата или выброс реакционной массы из него.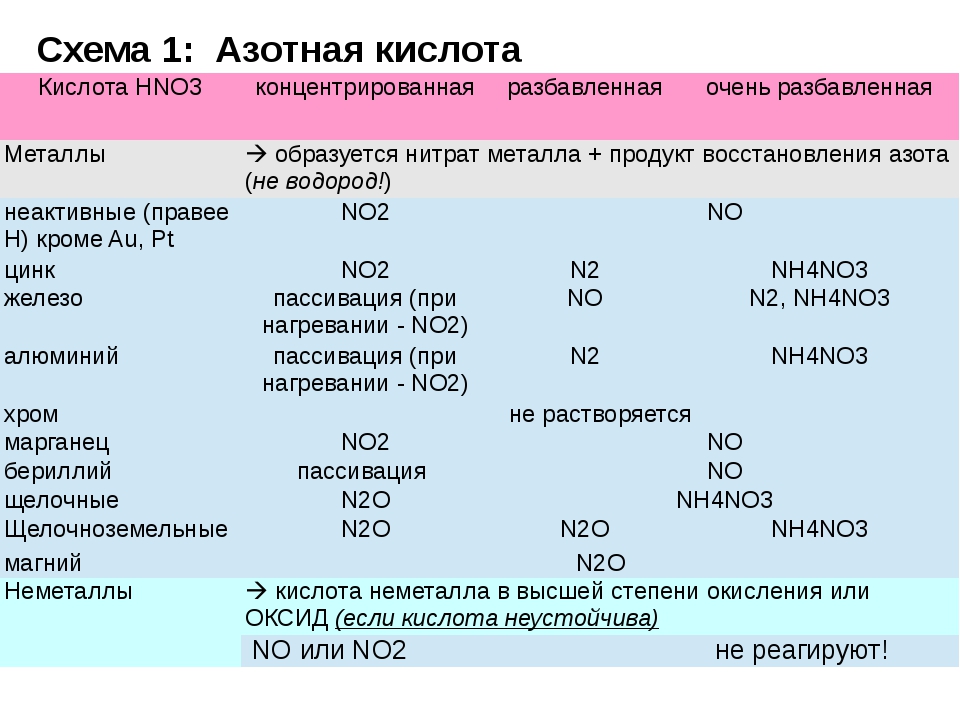 Прекращение размешивания реакционной массы приводит к неравномерному распределению реагирующих компонентов по фазам, сопровождающемуся местными перегревами и неуправляемой реакцией. Неуправляемая реакция может возникнуть также при повыщении температуры, вызванном недостаточным охлаждением реакционной массы. [c.118]
Прекращение размешивания реакционной массы приводит к неравномерному распределению реагирующих компонентов по фазам, сопровождающемуся местными перегревами и неуправляемой реакцией. Неуправляемая реакция может возникнуть также при повыщении температуры, вызванном недостаточным охлаждением реакционной массы. [c.118]
КОН —59% AljOg, обработанных азотной кислотой или раствором нитрата аммония [63]. Оуэн также употреблял катализатор с содержанием 18% СгаОд, улучшив избирательность ого с 76 до 80% при глубине конверсии 35—40%, нанося СгдОд только на наружьрую поверхность таблеток окиси алюминия [57]. [c.196]
Этот самый старый и самый общий метод применяется для получения нитропроизводных, которые во многих случаях трудно или даже невозможно получить другими методами, как, например, пОлинитропарафинов, нитроолефинов, нитроспиртов и нитрокетонов. Метод В. Мейера дает смесь нитропроизводных и изомерных им нитратов. Он никогда не имел промышленного значения. Более поздняя работа (1929) показала [521, что обычно бромистые алкилы дают более высокие выходы двух изомерных производных нитросоединений и эфиров азотистой кислоты при этом образуется большее количество нитросоединений, чем из применявшихся ранее иодистых алкилов. Например, м-гептилбромид давал выход 94,3% двух изомеров, из которых 71,0% составляло нитропроизводное. Недавно (1947 г.) при получении 2-нитрооктана отмечено образование 2-октил- [c.78]
Более поздняя работа (1929) показала [521, что обычно бромистые алкилы дают более высокие выходы двух изомерных производных нитросоединений и эфиров азотистой кислоты при этом образуется большее количество нитросоединений, чем из применявшихся ранее иодистых алкилов. Например, м-гептилбромид давал выход 94,3% двух изомеров, из которых 71,0% составляло нитропроизводное. Недавно (1947 г.) при получении 2-нитрооктана отмечено образование 2-октил- [c.78]
В инертных растворителях реакция идет при температуре ниже 0°, при этом образуются циклоалкилиитраты с выходом бО—65%, нитро-производные с выходом 10—15% и карбоновые кислоты с выходом 10— 15%. При болоо высокой температуре в кипящем четыреххлористом углероде циклогексан дает 39% нитроциклогексана и 41% циклогексил-нитрата [57]. [c.80]
При дальнейш зм изучении этой реакции на основании нитрования м-гептана и 2,7-диметилоктана азотной кислотой был сделан вывод, что в отсутствии NOg нитрование совсем не идет.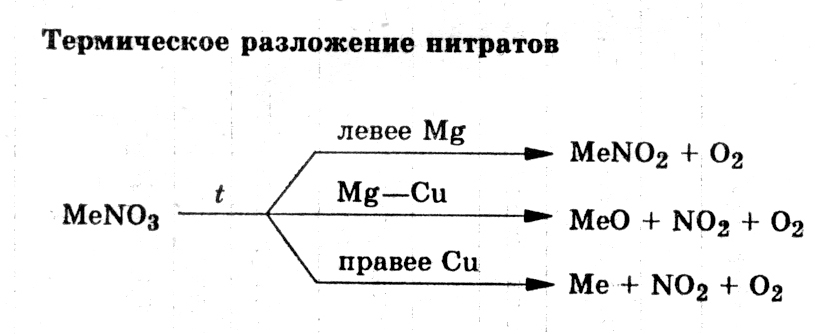 Так, например, октан совершенно не реагировал ири стоянии в течение 50 дней с концентрированной азотной кислотой (плотность 1,42), содержавшей следы нитрата мочевины для поглощения присутствующего NOg [56]. [c.80]
Так, например, октан совершенно не реагировал ири стоянии в течение 50 дней с концентрированной азотной кислотой (плотность 1,42), содержавшей следы нитрата мочевины для поглощения присутствующего NOg [56]. [c.80]
Теоретически вычисленное содержание серы в этом соединении 24,2%, но практически такое количество, если и получается, то очень редко. Диазоаминобензол, нитрат лития, гидроперекись mpem-бутила являются катализаторами этой реакции получаемый продукт содержит до 20% серы. Реакция имеет ограничивающие пределы температуры и обычно проводится ири температурах от —10° до 4-15°. Продукты, содержащие до 5 % серы, эластичны, при более высоком содержании серы получаются роговидные продукты, продукты же с наибольшим количеством серы твердые и хрупкие. Они обычно нерастворимы и растворяются только в концентрированной серной кислоте. При выдавливании раствора каучука и гидроперекиси в раствор двуокиси серы можно получить волокно [38]. [c.224]
Ароматические нитросоединения нолучаются обычно прямым нитрованием соответствующих соединений. Ароматические нитросоединения применяются в больших количествах как красители и взрывчатые вещества, а также в парфюмерной промышленности. Они используются также в качестве растворителей и химических реагентов. Нитрогруппа может действовать как хромофорная группа в красителях, особенно если имеется несколько нитрогрупн и они располагаются в кольце таким образом, что становятся частью сложной сопряженной системы. Значительно чаще нитрогруппа используется как исходная группа для получения соответствующего анилина в результате применения восстановления в довольно мягких условиях. Использование нитросоединений в промышленности взрывчатых веществ направлено в первую очередь на военные цели. Промышленное производство взрывчатых веществ основано больше на нитроглицерине, т. е. на сложном эфире азотной кислоты, чем на истинных нитросоединениях. Некоторым, весьма существенным исключением являются нитрокарбонитратные пороха, содержащие нитрат аммония и незначительные количества тринитротолуола или динитротолуола.
Ароматические нитросоединения применяются в больших количествах как красители и взрывчатые вещества, а также в парфюмерной промышленности. Они используются также в качестве растворителей и химических реагентов. Нитрогруппа может действовать как хромофорная группа в красителях, особенно если имеется несколько нитрогрупн и они располагаются в кольце таким образом, что становятся частью сложной сопряженной системы. Значительно чаще нитрогруппа используется как исходная группа для получения соответствующего анилина в результате применения восстановления в довольно мягких условиях. Использование нитросоединений в промышленности взрывчатых веществ направлено в первую очередь на военные цели. Промышленное производство взрывчатых веществ основано больше на нитроглицерине, т. е. на сложном эфире азотной кислоты, чем на истинных нитросоединениях. Некоторым, весьма существенным исключением являются нитрокарбонитратные пороха, содержащие нитрат аммония и незначительные количества тринитротолуола или динитротолуола. В парфюмерной промышленности нитросоединения используются в качестве синтетических мускусов. Большая группа производных полинитро-/к/)т-бутилбензола обладает запахом, напоминающим мускус. [c.543]
В парфюмерной промышленности нитросоединения используются в качестве синтетических мускусов. Большая группа производных полинитро-/к/)т-бутилбензола обладает запахом, напоминающим мускус. [c.543]
Внимательное рассмотрение спектра комбинационного рассеяния света привело к выводу, что линия 1400 см должна быть приписана иону N0+. Этот ион имеет 16 молекулярных электронов, и, следовательно, надо было бы ожидать, что он является линейным с единственной частотой колебания, большей 1320 смГ . Кроме того, одна линия должна быть сильно поляризована эта поляризация наблюдалась экспериментально для линии 1400 см . Линия 1050 смГ приписывается иону нитрата или иону бисульфата в присутствии серной кислоты. Следовало бы ожидать, что ионы нитрата или бисульфата должны были бы присутствовать, по-видимому, в количестве, пропорциональном таковому иона нитрониума, согласно следующим уравнениям [c.558]
Соли азотной кислоты — нитраты
Азотная кислота – одноосновная, образует один ряд солей – нитраты состава:
Нитраты калия, натрия, кальция и аммония называют селитрами. Например, селитры: KNO3 – нитрат калия (индийская селитра), NаNО3 – нитрат натрия (чилийская селитра), Са(NО3)2 – нитрат кальция (норвежская селитра), NH4NO3 – нитрат аммония (аммиачная или аммонийная селитра, ее месторождений в природе нет). Германская промышленность считается первой в мире, получившей соль NH4NO3из азота N2воздуха и водорода воды, пригодную для питания растений.
Например, селитры: KNO3 – нитрат калия (индийская селитра), NаNО3 – нитрат натрия (чилийская селитра), Са(NО3)2 – нитрат кальция (норвежская селитра), NH4NO3 – нитрат аммония (аммиачная или аммонийная селитра, ее месторождений в природе нет). Германская промышленность считается первой в мире, получившей соль NH4NO3из азота N2воздуха и водорода воды, пригодную для питания растений.
Физические свойства
Нитраты – вещества с преимущественно ионным типом кристаллических решёток. При обычных условиях это твёрдые кристаллические вещества, все нитраты хорошо растворимы в воде, сильные электролиты.
Получение нитратов
Нитраты образуются при взаимодействии:
1) Металл + Азотная кислота
Cu + 4HNO3(k) = Cu(NO3)2 + 2NO2↑ + 2H2O
2) Основный оксид + Азотная кислота
CuO + 2HNO3 = Cu(NO3)2 + H2O
3) Основание + Азотная кислота
HNO3 + NaOH = NaNO3 + H2O
4) Аммиак + Азотная кислота
NH3 + HNO3 = NH4NO3
5) Соль слабой кислоты + Азотная кислота
2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2 ↑
6) Оксид азота (IV) + щёлочь
2NO2 + NaOH = NaNO2 + NaNO3 + H2O
в присутствии кислорода —
4NO2 + O2 + 4NaOH = 4NaNO3 + 2H2O
Химические свойства нитратов
I. Общие с другими солями
Общие с другими солями
1) C металлами
Металл, стоящий в ряду активности левее, вытесняет последующие из их солей:
Cu(NO3)2 + Zn = Cu + Zn(NO3)2
2) С кислотами
AgNO3 + HCl = AgCl↓ + HNO3
3) Со щелочами
Cu(NO3)2 + 2NaOH = Cu(OH)2 ↓ + 2NaNO3
4) C cолями
2AgNO3 + BaCl2 = Ba(NO3)2 + 2AgCl↓
II. Специфические
Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода. Характер других продуктов реакции зависит от положения металла, образующего нитрат, в электрохимическом ряду напряжений:
1) Нитраты щелочных (исключение — нитрат лития) и щелочноземельных металлов разлагаются до нитритов:
2NaNO3 = 2NaNO2 + O2↑
2) Нитраты менее активных металлов от Mg до Cu включительно и нитрат лития разлагаются до оксидов:
2Mg(NO3)2 = 2MgO + 4NO2↑ + O2↑
2Cu(NO3)2 =2CuO + 4NO2 ↑+ O2↑
3) Нитраты наименее активных металлов (правее меди) разлагаются до металлов:
Hg(NO3)2 = Hg + 2NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2 ↑+ O2↑
4) Нитрат и нитрит аммония:
Нитрат аммония разлагается в зависимости от температуры так:
NH4NO3 = N2O ↑+ 2H2O (190-245°C)
2NH4NO3 = N2↑ + 2NO + 4H2O (250-300°C)
2NH4NO3 = 2N2 ↑+ O2 + 4H2O (выше 300°C)
Нитрит аммония:
NH4NO2 = N2 ↑+ 2H2O
Исключения:
4LiNO3 = 2Li2O + 4NO2 + O2
Mn(NO3)2=MnO2 + 2NO2
4Fe(NO3)2=2Fe2O3 + 8NO2 + O2
404 — Документ не найден
Документ не найден.
Пожалуйста, воспользуйтесь поиском или нижним меню.
Обжимные фитинги
муфты, штуцера, адаптеры, уголки, кресты, тройники
Резьбовые фитинги
ниппели, муфты, тройники..
Приварные фитинги
VCR, VCO, БРС
Фитинги
Запорная арматура
Игольчатые вентили
Шаровые краны
Мембранные клапаны
Сильфонные вентили
Манометрические вентили
Клапаны
Баллонные
Общепромышленные
Высокоточные
До себя
Для чистых сред
Двухступенчатые
Регуляторы давления
Фильтры и фильтрующие элементы
фильтры финишной очистки
Промышленные фильтры
Микронные фильтры
Фильтры
Калиброванные бесшовные трубки
Инструмент для труб
полимерные трубки
зажимы и крепления для труб
гибкие рукава
Зажимы, трубы, рукава и аксессуары
Изделия собственного производства
газоразрядные рампы
атмосферные испарители
газовые шкафы
устройства отбора пробы
Изделия
Поточные нагреватели жидкостей и газов
Нагреватели
Расходомеры
Ротаметры
Средства контроля расхода
Уровнемеры
Смотровые стёкла
Средства измерения уровня
Манометры
Преобразователи давления
Реле давления
Разделительные мембраны
Средства измерения давления
Средства измерения температуры
Анализаторы газов
Алюминиевые газовые баллоны:
— Одногорловые
— Двугорловые
Баллоны и Сосуды
Кабельные вводы
Нитрат натрия: свойства и применение соли.
 Справка
Справка
Нитрат натрия применяют как удобрение. Он является компонентом жидких солевых хладагентов, закалочных ванн в металлообрабатывающей промышленности, теплоаккумулирующих составов, используется как окислитель во взрывчатых веществах, ракетных топливах, пиротехнических составах. Он применяется в производстве стекла и солей натрия, в пищевой промышленности.
Нитрат натрия широко используется в медицине, как сосудорасширяющее средство, бронхолитическое, он снимает спазмы кишечника, используется как слабительное и как антидот при отравлении цианидами.
В пищевой промышленности нитрат натрия широко используется для окраски и как консервант, и обозначен как пищевая добавка Е251.
В виде пищевой добавки, Е251 действует как антибактериальное средство, препятствующее росту Clostridium botulinum – возбудителя ботулизма, тяжелой пищевой интоксикации вызываемой ботулинистическим токсином и приводящего к поражению нервной системы.
В то же время нитрат натрия считается ядовитым токсичным веществом, особенно для млекопитающих. При дозировке 180 миллиграмм на килограмм веса погибает более 50% крыс.
При дозировке 180 миллиграмм на килограмм веса погибает более 50% крыс.
При исследованиях Е251 было установлено, что при нагреве свыше 120°C он образует канцерогены и тяжелые металлы. Следовательно, при употреблении продуктов питания с содержанием нитрата натрия, подвергшимся тепловой обработке, возникает потенциальная вероятность возникновения раковых изменений в организме.
Всемирная организация здравоохранения (ВОЗ) называет допустимой суточной дозой 3,7 мг нитратов на 1 кг массы тела. Имеются в виду именно азотная часть соли: 250 мг нитратов, безопасных для условного едока массой в 70 кг, эквивалентны, например, 350 мг нитрата натрия. В разных странах представления о допустимой дозе нитратов отличается: в Германии это 50‑100 мг в сутки, в США – 400‑500 мг, в большинстве стран СНГ – 300‑320 мг.
Главной причиной связанных с нитратами физиологических проблем являются метаболиты нитратов — нитриты. Нитриты, взаимодействуя с гемоглобином, образуют метгемоглобин, который не способен переносить кислород, что приводит к кислородному голоданию.
Метгемоглобин содержится в крови человека и в обычном состоянии – около 2% метгемоглобина. Симптомы острого отравления возникают при повышении содержания метгемоглобина до 30%, при 50% метгемоглобина может наступить смерть.
Нитраты превращаются в нитриты благодаря деятельности микроорганизмов, преимущественно обитающих в толстом кишечнике.
Кроме участия в образовании метгемоглобина, нитриты опасны тем, что в желудочно‑кишечном тракте человека могут соединяться с аминами и амидами любых белковых продуктов и образовывать канцерогенные нитрозамины и нитрозамиды.
Нитрат натрия в больших дозах может вызвать отравление.
Симптомы отравления: боль в животе, посинение губ или ногтей, посинение кожи, судороги, диарея, головокружение, головная боль, затрудненное дыхание.
Материал подготовлен на основе информации открытых источников
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Нитратов и синильной кислоты в кормах
Автор: T.L. Провин и Дж. Л. Питт
Когда нитраты и синильная кислота накапливаются в кормах, корм может быть небезопасным для потребления животным.
Нитраты
Накопление нитратов
Аммонийный азот является предпочтительной формой азота для роста растений, но нитратный азот — это форма, которую в первую очередь усваивают растения. Даже при внесении удобрений на основе аммония и мочевины большая часть азота, поглощаемого растениями, находится в нитратной форме, поскольку почвенные микроорганизмы быстро превращают аммонийный азот в нитратный азот (см. Публикацию Техасской службы поддержки AgriLife Extension E-59, «Что происходит с азотом в Почвы? »).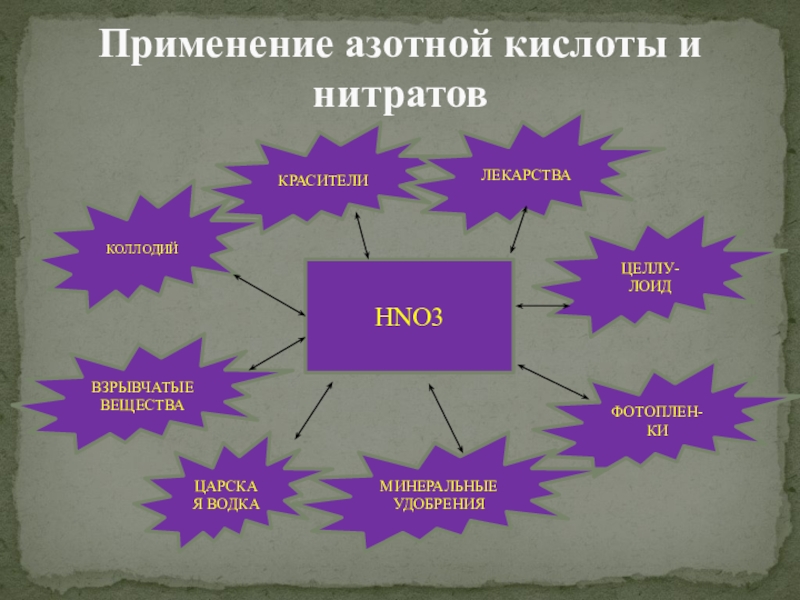 Нитраты чрезвычайно растворимы в воде и легко усваиваются корнями растений вместе с почвенной влагой.
Нитраты чрезвычайно растворимы в воде и легко усваиваются корнями растений вместе с почвенной влагой.
Обычно растения восстанавливают нитраты до ионов аммония, а затем усваивают их до аминокислот и других белков. Этот процесс, называемый нитратредуктазой, происходит в корнях некоторых трав, таких как бермудская трава, и в листьях, стеблях и стеблях таких растений, как кукуруза или сорго. Когда растения подвергаются стрессу (например, из-за засухи), этот процесс замедляется или останавливается, позволяя накапливаться нитратам.Вот некоторые условия, вызывающие накопление нитратов:
- При высокой температуре и достаточной влажности растения могут подвергаться процессу, называемому фотодыханием. Фотодыхание производит углекислый газ, а не ассимилирует углерод в строительные блоки энергии (например, сахара, углеводы и т. Д.). Это может привести к накоплению нитратов.
- Когда почва содержит нитратный азот, но мало почвенной влаги, нитраты сильно концентрируются в воде, которую поглощают растения.
 У растений не хватает воды для продолжения роста и накапливаются нитраты.
У растений не хватает воды для продолжения роста и накапливаются нитраты. - Повреждение гербицидом может ограничить преобразование и усвоение нитратов в растениях. После внесения гербицидов проверьте поле, особенно его края, на предмет наличия кормовых растений, пораженных нецелевым сносом гербицидов. Для значительного снижения уровня нитратов в растениях необходимо от трех до пяти дней активного роста.
Нитраты часто накапливаются до токсичных уровней в следующих растениях:
Хотя эти растения с наибольшей вероятностью накапливают нитраты, нитраты в некоторой степени присутствуют во всех кормах, включая бермудские травы.Нитраты нелетучие и остаются в незащищенных растениях после срезки, обработки и тюкования. Нитраты растворимы в тканях растений и будут вымываться из растений во время продолжительных дождей. Однако выветривание значительно снижает пищевую ценность тюков сена, поэтому это не лучший способ управлять нитратами. Кроме того, движение выщелоченных нитратов внутри обветренного тюка может ограничивать использование корма.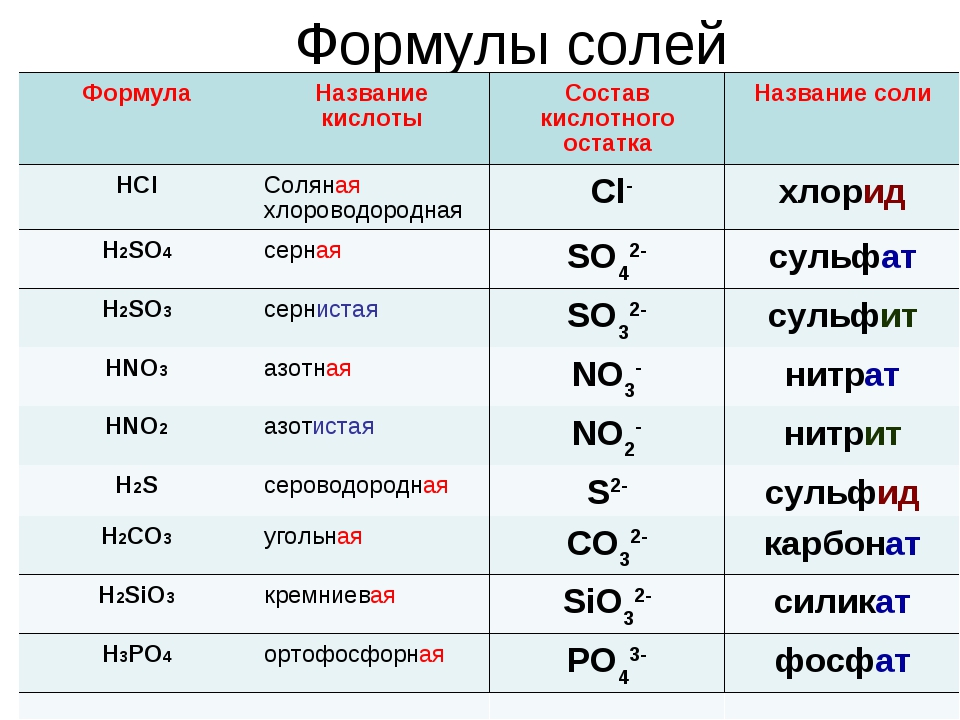
Исследования, проведенные Техасской ветеринарно-медицинской диагностической лабораторией (TVMDL) Техасского университета A&M, показали, что корм, содержащий 1 процент нитрата (по сухому веществу), безопасен для здоровых жвачных животных.Корм с более высоким процентом нитратов можно использовать, если его измельчить и смешать с кормом без нитратов, чтобы снизить общий уровень нитратов до менее 1 процента (по сухому веществу). Корм, содержащий от 0,5 до 1 процента нитратов, не следует давать ослабленному рогатому скоту, если это не одобрено ветеринаром. Уровень нитратов в 1 процент, установленный TVMDL, значительно выше, чем уровни, предложенные другими южными университетами. Этот уровень предполагает, что крупный рогатый скот здоров, хорошо подготовлен и получает высокоэнергетическую диету.
У здорового крупного рогатого скота нитраты, потребляемые с обычными кормами, превращаются в рубце в белок: нитрат → нитрит → аммиак → аминокислоты → белки
Симптомы отравления нитратами
Если корм содержит слишком много нитратов, животные не могут завершить переработку, и уровень нитритов накапливается. Нитрит адсорбируется непосредственно в кровоток через стенку рубца, где он соединяется с гемоглобином с образованием метгемоглобина. Гемоглобин переносит кислород в кровь, а метгемоглобин — нет.Образование метгемоглобина может привести к смерти животного от удушья или недостатка кислорода. Кровь животного становится коричневой, а не ярко-красной. Моногастрики (например, лошади, мулы, свиньи и т. Д.) Менее чувствительны к токсичности нитратов, чем жвачные животные. Кондиционирование животного влияет на его способность усваивать или переносить нитраты, поэтому проконсультируйтесь с ветеринаром перед кормлением кормами, содержащими нитраты.
Нитрит адсорбируется непосредственно в кровоток через стенку рубца, где он соединяется с гемоглобином с образованием метгемоглобина. Гемоглобин переносит кислород в кровь, а метгемоглобин — нет.Образование метгемоглобина может привести к смерти животного от удушья или недостатка кислорода. Кровь животного становится коричневой, а не ярко-красной. Моногастрики (например, лошади, мулы, свиньи и т. Д.) Менее чувствительны к токсичности нитратов, чем жвачные животные. Кондиционирование животного влияет на его способность усваивать или переносить нитраты, поэтому проконсультируйтесь с ветеринаром перед кормлением кормами, содержащими нитраты.
Отбор проб на нитраты
Наибольшее накопление нитратов происходит в нижнем стебле, а наименьшее — в листьях.Вид кормов и метод выпаса определяют, как следует отбирать пробы растений для анализа кормов.
Если практикуется ограниченный выпас и корм состоит из традиционных трав, мелких зерен или бобовых, для отбора пробы удалите только верхние от одной трети до половины растения. Это те части растений, которые будут потреблять животные. При ограниченном выпасе кукурузы, сорго, сорго-суданграсса и подобных кормов отбирайте только листья растений.
Это те части растений, которые будут потреблять животные. При ограниченном выпасе кукурузы, сорго, сорго-суданграсса и подобных кормов отбирайте только листья растений.
При использовании ротационного выпаса или системы выпаса на одном поле оправдан более консервативный подход к отбору проб, поскольку домашний скот будет потреблять не только листья и верхние части растений, но и стебли (которые содержат больше нитратов).Возьмите от одной трети до половины традиционных трав, мелких зерен и бобовых для анализа на нитраты, а нижнюю треть — стеблей кукурузы, сорго и стеблей сорго-суданграсса.
Для отбора проб кормов на корню создайте составную пробу из частей растений, взятых как минимум с 10–15 участков с одинаковыми условиями плодородия и влажности. Не смешивайте растения с «хороших» и «плохих» участков поля. Создайте разные составные образцы для этих областей. Отправьте образцы в лабораторию в чистых бумажных мешках.Не используйте пластиковые пакеты, так как высокое содержание влаги вызовет плесень, что затрудняет анализ нитратов.
Для отбора пробы фуража в тюках возьмите репрезентативные пробы керна с помощью зонда для тюков. Это единственный метод отбора проб, который позволяет адекватно оценить средний уровень нитратов в тюке, но этот метод нельзя использовать для отбора проб грубостебельных кормов, таких как кукуруза, сорго, сорго-суданграсс или аналогичные растения, если тюк не будет измельчен до его кормят.Чтобы взять образец корма с грубыми стеблями, разделите тюк и соберите нижние стебли отдельных растений, чтобы убедиться, что анализ выявит максимально возможный уровень нитратов. Это защитит от робких животных, потребляющих слишком много нитратов (в нижних стеблях), потому что листья и более вкусные верхние стебли были съедены первыми животными в тюке.
Тестирование нитратов
Для кормов, выращиваемых в условиях, описанных выше, надлежащие методы управления включают тестирование на нитраты.Тестирование можно проводить как в полевых условиях, так и в лаборатории. Полевые методы включают качественные методы точечной окраски и некоторые количественные методы, в которых используются колориметры и нитратные электроды. Однако полевые методы следует рассматривать только как качественные инструменты, потому что трудно получить однородные образцы, а тесты недостаточно точны, чтобы использовать результаты для смешивания кормов.
Одним из быстрых тестов является точечный тест на дифениламин. Лаборатория испытаний почвы, воды и кормов Texas AgriLife Extension уже давно изготавливает эти наборы для быстрого тестирования для анализа нитратов растений, но из-за того, что наборы содержат серную кислоту, их доставка стала затруднительной.Лаборатория изучает альтернативные методы быстрого тестирования. Тест на дифениламин состоит из соли дифениламина (0,1 г), растворенной в серной кислоте (30 мл-36 н.). Одна капля этого кислотного реагента помещается на свежеотрезанный стебель растения. Если сразу (в первые 5 секунд) появляется темно-синий цвет, значит, присутствует нитрат. Если нет немедленного изменения цвета, значит, нитратов нет; однако темный цвет (коричневый / черный) в конечном итоге разовьется, если реагент остается на растительной ткани в течение длительного времени.Темный цвет вызван кислотной карамелизацией растительных сахаров и углеводов. На рисунках ниже показаны результаты спот-теста нитратов.
Полевой тест дифениламина показывает только наличие или отсутствие нитрата. Он не определяет фактическую концентрацию нитратов и, как и любой другой метод полевых испытаний, должен использоваться только в качестве инструмента скрининга. Любой положительный результат выборочного теста должен сопровождаться лабораторным анализом для количественной оценки. Полевые испытания могут помочь вам быстро оценить, какая высота стебля безопасна для выпаса.Большинство методов полевых испытаний работают только на влажных растениях со стеблями, достаточно толстыми, чтобы их можно было расколоть и нанести тестовый реагент. Сушеные растения, сено, силос, мелкостебельные травы и аналогичные материалы должны быть испытаны в лаборатории.
Устный перевод лабораторных отчетов
Содержание нитратов может быть выражено как фактические значения нитрата (% NO3) или нитрата-N (% NO3-N). Лаборатория испытаний почвы, воды и кормов Texas AgriLife Extension сообщает о содержании нитратов в кормах как о фактических нитратах. В соответствии с отраслевым стандартом содержание нитратов в кормах выражается в процентах нитратов, что отличается от результатов анализа нитратов растений.Нитраты растений выражаются в миллионных долях нитрата-N. Чтобы преобразовать уровни нитратов-N в фактические нитраты, умножьте их на 4,42. Некоторые лаборатории могут давать отчеты в частях на миллион (ppm). Чтобы преобразовать ppm в проценты, разделите на 10 000. Изучите метод отчетности лаборатории, которую вы используете, чтобы избежать путаницы, которая может привести к тому, что вы скармливаете скоту токсичный уровень нитратов.
Управление нитратами
Наилучший способ обработки кормов, содержащих нитраты, зависит от типа корма и метода сбора урожая.Все описанные здесь системы управления следует использовать вместе с надлежащим отбором проб и анализом.
Обработка кормов на корню:
- Во-первых, внимательно определите уровень нитратов в различных частях растения. Позвольте животным пастись от одной трети до половины травы, бобовых или листьев кормов с крупными стеблями, если уровень нитратов в этих частях растения безопасен. Внимательно следите за выпасом и убирайте домашний скот, когда съедается безопасная часть корма.
- Контролируйте уровни нитратов в нижней трети или половине растения или на грубых стеблях, если домашний скот должен быть выпущен в поле с сомнительным или потенциально токсичным уровнем нитратов.Как правило, уровень нитратов в кормах значительно снижается через 3-5 дней после достаточного количества осадков.
- Третья практика управления — скашивание корма на сено, обработка поля и тюк. Это не снизит уровень нитратов, но тюки можно измельчить и смешать с кормами без нитратов, чтобы сохранить более высокую общую протеиновую и энергетическую ценность.
- Корм можно собирать и силосовать. В процессе силосования нитраты превращаются в летучие оксиды азота, также называемые «газами силоса».«Эти газы очень токсичны, и рабочие должны проявлять особую осторожность при входе в силосные ямы и бункеры, где силосуются корма, загрязненные нитратами. Обычной практикой безопасности является удаление брезента с части силоса за день или два, прежде чем убирать силос из этой части ямы.
Обработка тюкованного сена:
- Существует меньше возможностей для обработки тюкованных кормов, содержащих нитраты. Самый безопасный метод — измельчить тюки и тщательно перемешать их с сеном, не содержащим нитратов.В смеси должно быть достаточно хорошего корма, чтобы снизить уровень нитратов до менее 1 процента. Лучше всего смешивать одинаковые типы кормов, чтобы корм имел однородный гранулометрический состав. Оптимальный размер определяется размером стержня; в общем, чем меньше, тем лучше. Горсть измельченных и комбикормов должна содержать части всех частей растений из всех используемых в смеси кормов. Единый размер поможет ограничить выборочное кормление скота. Этот метод измельчения и смешивания не следует использовать для кормов, содержащих более 2 шт.5 процентов нитратов.
- Если уровень нитратов превышает 2,5 процента или нет возможности измельчить и перемешать фураж, не используйте тюкованный фураж в качестве корма для скота или подстилки.
Синильная кислота
В нормальных условиях, когда эти растения активно растут и здоровы, они содержат низкий уровень синильной кислоты, потому что соединение со временем распадается, тем самым устраняя токсичные скопления. В отличие от нитрата, синильная кислота может присутствовать некоторое время, а затем выделяться из растений, правильно обработанных для сена.
Накопление синильной кислоты может произойти при:
- Плохие условия выращивания мешают нормальному развитию стеблей.
- Недавняя уборка сена или выпас сена вызывают медленный и задержанный рост новых тканей растений.
- Азотные удобрения используются чрезмерно, или имеется другое плодородие почвы или дисбаланс питательных веществ.
- После продолжительной засухи у растений появляются новые побеги.
- Растения повреждены гербицидами, морозом, градом или другими событиями.
Симптомы отравления синильной кислотой
Перечисленные выше растения в процессе роста вырабатывают цианогенные глюкозиды (синильную кислоту). Глюкозиды — это соединения сахара, которые разрушаются в рубце, освобождая цианид от сахара и образуя синильную кислоту. Синильная кислота (HCN) широко известна как цианид. HCN соединяется с гемоглобином с образованием цианоглобина, который не переносит кислород. У домашнего скота, отравленного цианидом, наблюдается респираторный стресс, аналогичный тому, который вызывается отравлением нитратами.Анализ крови позволяет быстро отличить отравление нитратами и синильной кислотой. Если синильная кислота является токсичным агентом, кровь будет вишнево-красной, в отличие от шоколадно-коричневой крови, наблюдаемой при отравлении нитратами. Лошади, свиньи и другие нежвачные животные меньше страдают от синильной кислоты, потому что их желудки превращают синильную кислоту в менее токсичную муравьиную кислоту и хлорид аммония.
Отравление синильной кислотой можно эффективно лечить, если лечение проводится сразу после появления первых симптомов отравления.Двумя распространенными методами лечения являются внутривенные инъекции (125–250 мл) 1,2% нитрата натрия или 7,4% тиосульфата натрия. Перед назначением лечения нитратом натрия ветеринар должен убедиться, что симптомы вызваны синильной кислотой, а не нитратом.
Отбор проб синильной кислоты
Синильная кислота накапливается в основном в листьях, с наибольшими концентрациями в новообразованиях. Концентрация в листьях во много раз выше, чем в стеблях. Поскольку домашний скот обычно ест листья перед стеблями, образцы, взятые для анализа синильной кислоты, должны в основном состоять из листьев.Это особенно верно при отборе проб на полях, где разрешено пасти скоту. Если выпас ограничен, крупный рогатый скот, вероятно, не будет есть стебли.
В отличие от нитратов, синильная кислота может улетучиваться из срезанных / собранных кормов. Количество улетучивания образцов можно уменьшить, поместив образцы в герметичные пластиковые пакеты или стеклянные банки перед отправкой в лабораторию. При заполнении мешка или банки оставьте от 25 до 50 процентов свободного пространства.
Чтобы попробовать корма на корню, выборочно удалите новейшие верхние листья с 10–12 растений на разных участках поля.Пробы в местах, где наиболее вероятно возникновение проблем с синильной кислотой (рассмотрите общие причины). Поместите листья в герметичный контейнер, поместите контейнер на лед (но не замораживайте) и немедленно отправьте в испытательную лабораторию.
Для отбора пробы кормов в тюках используйте зонд для тюков. Образцы, просто взятые с внешней стороны тюков, могут не дать точных результатов из-за улетучивания. Поместите одну сердцевину тюка в герметичную пинтовую банку. Более подробные инструкции по отбору и транспортировке проб для анализа синильной кислоты можно получить в TVDML.
Испытательная лаборатория может оценить концентрацию синильной кислоты как качественно, так и количественно. Некоторые ссылки предполагают, что 250 ppm HCN — это безопасный уровень. Однако крайняя изменчивость методов отбора проб и транспортировки синильной кислоты, а также быстрые изменения полей ограничивают ценность количественного результата. Обычно достаточно простого качественного анализа, чтобы показать, присутствует ли синильная кислота. Если корм действительно содержит синильную кислоту, скот не должен потреблять ее до тех пор, пока уровень не упадет до такой степени, что ее уже нельзя будет обнаружить.
Управление синильной кислотой
Тип корма и метод сбора урожая определяют лучшие методы управления.
- Из кормов на корню, у которых положительный результат теста на синильную кислоту, и которые будут выпасаться, следует отбирать пробы каждые 3-4 дня. При частом отборе проб корм можно выпасать, как только он станет безопасным и до того, как его питательная ценность упадет больше, чем необходимо.
- Корма на корню можно измельчать зеленью и силосовать. Синильная кислота ферментативно превращается в свободный цианид, который улетучивается при удалении силоса.Еще одним преимуществом систем измельчения / силоса является то, что действие синильной кислоты ослабляется, когда домашний скот не может выбирать только листья.
- Корма на корню также могут быть разрезаны, обработаны в полевых условиях и упакованы в тюки. Как и для всех упакованных в тюки кормов, требуется надлежащий отбор проб с помощью датчика тюков. Образцы тюков следует отбирать повторно до тех пор, пока синильная кислота не перестанет обнаруживаться. Тюки можно сделать еще безопаснее, измельчив их, чтобы объединить листья и стебли.
Загрузите версию для печати: Нитраты и синильная кислота в кормах
У вас есть вопросы или вам нужно связаться со специалистом?
Свяжитесь с офисом вашего округа
Нитратных солей — Alfa Aesar
Нитрат алюминия гидрат, Puratronic®, 99.999% (металлы без ртути)
Нонагидрат нитрата алюминия, 98%
Нонагидрат нитрата алюминия, ACS, 98.0-102,0%
Нонагидрат нитрата алюминия, с низким содержанием ртути, Puratronic®, 99,999% (мет.
Аммиачная селитра, ACS, 95% мин.
Аммиачная селитра, Puratronic®, 99.999% (металлы)
Нитрат бария, 99%
Нитрат бария, 99.95% (металлы)
Нитрат бария, Puratronic®, 99,999% (мет.)
Оксид нитрата гидроксида висмута, Bi 2 O 3 79% мин.
Гидрат нитрата висмута (III), Puratronic®, 99.999% (металлы)
Пентагидрат нитрата висмута (III), 98%
Пентагидрат нитрата висмута (III), ACS, не менее 98%
Моногидрат субнитрата висмута, 98 +%
Тетрагидрат нитрата кадмия, 98.5% мин.
ВНИМАНИЕ. Рак — https://www.p65warnings.ca.gov/
Кадмий нитрат тетрагидрат, 99.9% (мет. Мет.)
ВНИМАНИЕ. Рак — https://www.p65warnings.ca.gov/
Тетрагидрат нитрата кадмия, Puratronic®, 99.999% (мет.)
ВНИМАНИЕ. Рак — https: // www.p65warnings.ca.gov/
Нитрат кальция гидрат, Puratronic®, 99,995% (мет.)
Гидрат нитрата кальция, Puratronic®, 99.9995% (мет. Мет.)
Тетрагидрат нитрата кальция, 97 +%
Тетрагидрат нитрата кальция, 99.98% (металлы)
Тетрагидрат аммиачной селитры церия (III), класс реагента
Гексагидрат нитрата церия (III), REacton®, 99.5% (REO)
Гексагидрат нитрата церия (III), REacton®, 99,99% (REO)
Гидрат нитрата церия (III), REacton®, 99.998% (мет. Мет.)
Церий (IV) аммиачная селитра, 98 +%
Церий (IV) аммиачная селитра, ACS, 98.5% мин.
Нитрат церия (IV) и аммония, REacton®, 99,5% (REO)
Нитрат цезия, 99.999% (металлы)
Нитрат цезия 99,99% (мет. Мет.)
Нонагидрат нитрата хрома (III), 98.5%
Нонагидрат нитрата хрома (III), не менее 99,99% (мет.
Гексагидрат нитрата кобальта (II), 97.7% мин.
Гексагидрат нитрата кобальта (II), ACS, 98,0-102,0%
Гексагидрат нитрата кобальта (II), Puratronic®, 99.999% (металлы)
Полу (пентагидрат) нитрата меди (II), 98%
Полу (пентагидрат) нитрата меди (II), ACS, 98.0-102,0%
Нитрат меди (II) гидрат, Puratronic®, 99,999% (мет. Ед.)
Пентагидрат нитрата диспрозия (III), 99.9% (REO)
Пентагидрат нитрата диспрозия (III), REacton®, 99,99% (REO)
Гидрат нитрата эрбия (III), 99.9% (REO)
Пентагидрат нитрата эрбия (III), REacton®, 99,99% (REO)
Гексагидрат нитрата европия (III), REacton®, 99.9% (REO)
Нитрат гидрат европия (III), REacton®, 99,99% (REO)
Гидрат нитрата гадолиния (III), 99.9% (REO)
Гидрат нитрата гадолиния (III), REacton®, 99,99% (REO)
Гидрат нитрата галлия (III), 99.9% (металлы)
Нитрат галлия (III) гидрат, Puratronic®, 99.999% (мет. Ед.)
Раствор нитрата галлия (III), Ga 9-10% по массе
Пентагидрат нитрата гольмия (III), REacton®, 99.9% (REO)
Азотная кислота и нитрат аммония
Азотная кислота — очень важное химическое вещество: из нее делают взрывчатые вещества, В промышленности азотная кислота производится путем проведения двух химических реакций. : 1.в первую очередь аммиак реагирует с кислородом воздуха 2. аммиак и кислород проходят через горячий катализатор из платины 3. в этой первой реакции образуется горячий оксид азота Вторая химическая реакция использует окись азота для производства азотной кислоты: 4. Охлаждение окиси азота 5. При охлаждении реагирует с кислородом воздуха с образованием диоксида азота 6. Затем диоксид азота вступает в реакцию с водой и кислородом с образованием азотной кислоты Азотная кислота — это молекула, состоящая из пяти атомов: трех атомов кислорода; один атом азота; а также химическое уравнение для азотной кислоты: HNO 3 |
Теперь впишите эти недостающие слова …
Чтобы получить азотную кислоту, необходимо провести химические реакции. Первая реакция
это когда реагирует с кислородом. Используется катализатор из
и образуется моноксидный газ.
Затем окись азота реагирует с кислородом и водой с образованием кислоты.
У вас были попытки исправить это
Если азотная кислота смешивается с аммиаком, образуется химическое вещество под названием нитрат аммония . Аммиачная селитра используется в качестве удобрения для роста сельскохозяйственных культур — это очень полезно для фермеров, которые могут выращивать Нитрат аммония часто сокращенно называют NITRAM. Удобрение Nitram также может создавать проблемы. Удобрения также могут вызывать засорение рек слизистыми зелеными растениями, называемыми водорослями. |
Теперь ответьте на эти вопросы…
Сколько реакций нужно произвести, чтобы получить азотную кислоту?
1234
Что аммиак реагирует с кислородом?
азот, кислород, оксид азота, оксид углерода,
Какой тип катализатора используется?
платина, золото, серебро, серебро
Какая температура у катализатора?
комнатная температура очень горячая температура очень холодная
Окись азота реагирует с водой и кислородом, что дает?
Азотная кислота Закись азота Серная кислота Хлороводородная кислота
Если смешать азотную кислоту с аммиаком, что получится?
нитрат серебра, азотистая кислота, сульфат аммония, нитрат аммония
Каково краткое название нитрата аммония?
аммобобнитрамнитро
Каково основное использование нитрата аммония?
краска для домаудобрениябоевой корм дезодорант
Удобрения помогают тому, что растет?
овечья вьющаяся шерсть, ногти для ног
Удобрения могут вызвать рост в реках?
большая рыба, помидоры, креветки
Вы набрали 10 баллов в этом тесте
Тест на снижение содержания нитратов
— Гонорея
Среди человека Neisseria и родственных видов трех видов — N.mucosa , M. catarrhalis и K. denitrificans снижают содержание нитратов. Тест восстановления нитратов является критическим тестом для различения между N. gonorrhoeae и K. denitrificans , особенно когда штаммы K. denitrificans оказываются грамотрицательными диплококками в окрашенных мазках.
Принцип
Виды бактерий можно дифференцировать на основе их способности восстанавливать нитраты до нитритов или азотистых газов.Среди Neisseriaceae человеческого происхождения штаммы Neisseria mucosa , Moraxella catarrhalis и Kingella denitrificans снижают содержание нитратов. Штаммы M. catarrhalis и K. denitrificans были ошибочно идентифицированы как N. gonorrhoeae . Тест на восстановление нитратов позволяет дифференцировать эти виды, которые являются нитрат-положительными, и N. gonorrhoeae (нитрат-отрицательными). У некоторых видов снижение содержания нитратов может сопровождаться анаэробным дыханием.
Биохимический путь восстановления нитратов показан на рисунке 1. Нитрат восстанавливается до нитрита, который затем может быть восстановлен до оксида азота, закиси азота или азота (рисунок 1).
Рисунок l. Путь восстановления нитратов.
Тест восстановления нитратов основан на обнаружении нитритов в среде после инкубации с организмом. Если нитрит присутствует в среде, он будет реагировать с сульфаниловой кислотой (нитратный реагент A) с образованием бесцветного комплекса (нитрит-сульфаниловая кислота).Этот комплекс затем будет давать красный осадок (пронтозил), когда затем в тест добавляется нитратный реагент B (альфа-нафтиламин), как показано на рисунке 2.
Рисунок 2. Схематическое изображение обнаружения нитрита в среде.
Красный цвет в среде будет только тогда, когда в среде присутствует нитрит. Отсутствие красного цвета в среде после добавления сульфаниловой кислоты и альфа-нафтиламина означает только то, что в среде нет нитрита. Этому наблюдению может быть два объяснения.
- Нитрат, возможно, не был уменьшен; штамм нитратотрицательный.
- Нитрат мог быть восстановлен до нитрита, который затем был полностью восстановлен до оксида азота, закиси азота или азота, которые не будут реагировать с реагентами, которые реагируют с нитритом; штамм нитрат-положительный.
Любая тестовая среда, дающая отрицательный результат после добавления нитратных реагентов, должна быть дополнительно протестирована, чтобы определить, какая из двух интерпретаций является точной.
Успешный тест на снижение содержания нитратов зависит от выполнения теста в правильных условиях.
- Реакция будет происходить лучше всего, если основная среда поддерживает рост организма . Однако, хотя некоторые виды Neisseria плохо растут в бульонной среде, тест восстановления нитратов может быть успешно проведен в среде, которая не поддерживает рост, путем сильного инокуляции среды для обеспечения достаточного количества предварительно сформированного фермента для протекания реакции.
- Нитратная реакция происходит только в анаэробных условиях . Нитратсодержащая среда распределяется в пробирки для получения низкого отношения площади поверхности к глубине, которое ограничивает диффузию кислорода в среду, например, 5 мл среды распределяется в пробирке диаметром 13 мм. Neisseria и родственные виды используют кислород в среде и быстро создают анаэробные условия, которые идеально подходят для восстановления нитратов.
Тест восстановления нитратов проводят в среде, содержащей 0.2% нитрат калия. В среду интенсивно засевают чистую культуру подозреваемого организма и инкубируют при температуре от 35 ° C до 36,5 ° C в течение 48 часов. в инкубаторе с добавлением углекислого газа или без него.
Восстановление нитратов обнаруживается с помощью реагентов Грисса Ллосвея, сульфаниловой кислоты и альфа-нафтиламина. Сульфаниловая кислота (нитратный реагент A) добавляется к инкубационной смеси и образует комплекс (нитрит-сульфаниловая кислота) с любым нитритом, присутствующим в среде. Когда альфа-нафтиламин (нитратный реагент B) добавляется в инкубируемую среду, образуется красный осадок (пронтозил) с любым комплексом нитрит-сульфаниловая кислота, присутствующим в среде.
Организм может быть зарегистрирован как нитрат-положительный, если в среде появляется красный цвет после добавления нитратных реагентов A и B в среду , что указывает на то, что организм восстановил нитрат до нитрита.
Отсутствие красного цвета после добавления обоих реагентов автоматически не означает, что организм не может восстанавливать нитраты . Штаммы могли восстановить нитрат до нитрита, а затем полностью восстановить нитрит до азотистых газов, которые не обнаруживаются при добавлении нитратных реагентов A и B в среду.Если среда не меняет цвет после добавления сульфаниловой кислоты и альфа-нафтиламина, в инкубируемую среду добавляют небольшое количество («острие ножа») цинковой пыли. Цинковая пыль будет катализировать химическое восстановление нитрата до нитрита. Таким образом, если нитрат не был восстановлен организмами, то есть они являются нитрат-отрицательными, он будет восстановлен цинковой пылью, и в течение 15 минут в инкубируемой среде разовьется красный цвет. Если после добавления цинковой пыли в инкубируемой среде не появляется окраска, это означает, что организмы не только восстановили нитрат до нитрита, но и восстановили нитрит до азотистых газов; эти организмы также нитрат-положительны.
Хотя нитратная среда поставляется с перевернутыми трубками Дарема для обнаружения добычи газа, добыча газа не регистрируется для видов Neisseria . Хотя некоторые вещества могут восстанавливать нитраты, а не нитриты, до азотистых газов, газ может не накапливаться в трубке. Накопление газа зависит от скорости его добычи. Когда газ выделяется очень медленно, он может растворяться в среде и не накапливаться в трубке Дарема.
Требования к образцам
Оптимальный образец: Чистая культура подозрительного грамотрицательного оксидазоположительного диплококка ( Neisseria spp.или M. catarrhalis ) на шоколадном агаре, инкубированном в атмосфере, обогащенной диоксидом углерода, при температуре от 35 ° C до 36,5 ° C в течение 18-24 часов.
Неприемлемый образец: Культуры изолятов на шоколадном агаре, инкубированные в атмосфере, обогащенной диоксидом углерода, при температуре от 35 ° C до 36,5 ° C в течение более 24 часов.
Компрометирующие факторы, влияющие на результаты испытаний:
- Тестовая среда должна быть засеяна достаточно сильно, чтобы могла происходить реакция с предварительно сформированными ферментами.Недостаточный посевной материал может не позволить организмам использовать кислород для создания анаэробных условий, в которых может происходить восстановление нитратов.
- Слишком много цинковой пыли, добавленной в инкубируемую пробирку, может привести к очень быстрому восстановлению нитратов, помимо нитрита, до азотистых газов, так что нитрит не будет обнаружен.
Стабильность образца: Обнаружение восстановления нитратов для Neisseria и родственных видов зависит от присутствия предварительно сформированных ферментов.
- Тесты следует проводить только с посевным материалом, собранным из 24-часовых культур.
- Нитратная среда должна быть засеяна в течение 30 мин. удаления культуры из инкубатора; длительное воздействие на культуру при комнатной температуре может привести к снижению активности ферментов.
Среда / Реагенты
Среда: Нитратный бульон (инфузионный бульон, содержащий 0,2% нитрата калия)
Сердечный настой (Difco), 25,0 г
Нитрат калия, 2,0 г
Дистиллированная вода, 1000,0 мл
- Растворите ингредиенты в дистиллированной воде; довести раствор до pH 7.0.
- Распределите аликвоты бульона по 5 мл в пробирки размером 16 x 100 мм с газовыми вставками (пробирки Durham, 6 x 50 мм).
- Автоклав на 15 мин при 121 ° C.
Храните среду при температуре от 4 ° C до 10 ° C (в холодильнике) до использования. Перед посевом нагрейте среду до комнатной температуры.
Реагенты: Раствор сульфаниловой кислоты (нитратный реагент A): 0,8% в 5N уксусной кислоте
Химическое название: 4-аминобензолсульфоновая кислота
Храните нитратный реагент A при температуре от 15 ° C до 30 ° C (комнатная температура) до 3 месяцев, в темноте.Реагенты можно хранить в таре из темно-коричневого стекла; бутылки можно обернуть алюминиевой фольгой для обеспечения темноты.
Раствор альфа-нафтиламина (нитратный реагент B): 0,6% в 5N уксусной кислоте
Химическое название: N, N-диметил-1 нафтиламин
Храните нитратный реагент B при температуре от 2 до 8 ° C (в холодильнике) до 3 месяцев в темный. Реагенты можно хранить в таре из темно-коричневого стекла; бутылки можно обернуть алюминиевой фольгой для обеспечения темноты.
Цинковый порошок, чистота реагента: Хранить при комнатной температуре (от 15 ° C до 30 ° C)
Предупреждение: Уксусная кислота вызывает коррозию.Контакт с кожей может вызвать волдыри и ожоги. В случае контакта немедленно промыть глаза и кожу большим количеством воды (не менее 15 мин.)
Контроль качества / Процедура испытаний
Штаммы контроля качества:
- Нитратредуктаза-положительный контроль: Kingella denitrificans , CDC 10 236
- Нитратредуктаза-отрицательный контроль: Neisseria gonorrhoeae , ATCC 43069
Штаммы QC хранятся при -70 ° C в растворе трипсинового соевого бульона, содержащего 20% глицерина.Реакцию контрольных штаммов следует подтверждать во время приготовления замороженных запасов. Штаммы QC могут храниться при -70 ° C до 2 лет.
Процедура:
Штаммы
QC тестируются так же, как и клинические изоляты. Штаммы QC следует пересеять по крайней мере один раз после первоначальной культуры из замороженного образца перед проведением теста. Клинические изоляты можно пересеять из селективной среды или очищенных субкультур. Убедитесь, что культуры чистые.
- Разморозьте флаконы с контрольными штаммами, хранящиеся при -70 ° C.
- Нанесите штрихи на чашки с шоколадным агаром или агаром для ГХ с добавками для выделения. Инкубируйте при температуре от 35 ° C до 36,5 ° C в атмосфере, обогащенной диоксидом углерода, в течение 18–24 часов.
С помощью стерильного тампона приготовьте тяжелую суспензию хорошо изолированных колоний из чистой культуры изолята, инкубированной на шоколадной среде при температуре от 35 ° C до 36,5 ° C в атмосфере, обогащенной диоксидом углерода, в течение 18–24 часов. Засейте тестовую среду, чтобы получить сильную мутность.
Примечание: штаммов N. gonorrhoeae и некоторых других Neisseria spp. не может расти в этой среде. Таким образом, реакция может зависеть от предварительно образованного фермента.
- Инкубируйте инокулированную среду и пробирку с неинокулированной контрольной средой при температуре от 35 ° C до 36,5 ° C в атмосфере, обогащенной диоксидом углерода, в течение 48 часов.
Через 48 ч. После инкубации добавьте с помощью пипеток Пастера 5 капель реагента №A, а затем по 5 капель реагента №B в каждую пробирку.Хорошо встряхните пробирку для смешивания реагентов со средой.
Проверьте суспензию на розово-красный цвет, который должен проявиться в течение нескольких минут, если среда еще теплая. Реакция может занять немного больше времени, если среда на момент добавления реагентов холодная.
Если суспензия становится розово-красной перед добавлением порошка Zn, реакция положительна и испытание завершено. Не выполнять шаг 4.
Реакции, наблюдаемые с неинокулированной контрольной средой, а также с нитрат-отрицательными и нитрат-положительными изолятами, показаны на рисунках 3, 4 и 5 соответственно.
Если суспензия бесцветная после добавления реагентов A и B, добавьте в среду небольшое количество (от 4 до 5 мг; «острый острие ножа») цинковой пыли. Энергично встряхните пробирку и дайте ей постоять при комнатной температуре 10-15 мин.
Если среда остается бесцветной после добавления порошка Zn, результат теста положительный.
Если среда становится розовой после добавления порошка Zn, результат отрицательный.- Считайте и запишите результаты.
Рисунок 3. Реакция , наблюдаемая с незасеянной нитратной средой.
Рисунок 4. Реакция , наблюдаемая с нитрат-отрицательными видами.
Рисунок 5. Реакции, наблюдаемые с нитрат-положительными видами.
График контроля качества:
- Тест контроля качества нитратредуктазы проводится каждый день, когда тестируются клинические изоляты.
Проблемы и решения
Тест на восстановление нитратов может дать ложноотрицательные или ложноположительные результаты, если среда не получена точно или тест не выполнен точно. Реакция в этом тесте зависит от ряда факторов.
- Отсутствие розового цвета в контрольной пробирке неинокулированной среды после добавления цинковой пыли может быть связано (1) с средой, не содержащей нитрат, или (2) с добавлением слишком большого количества цинковой пыли, которая катализирует восстановление нитрата. помимо нитритов до азотистых газов.Самое простое решение — получить больше нитратной среды, убедившись, что нитрат был добавлен в базовую среду. В качестве альтернативы инокулируйте среду штаммом положительного контроля, но проверьте реакцию после более короткого времени инкубации; штаммы N. mucosa будут давать положительную нитритную реакцию через несколько часов инкубации. Если подтверждено, что среда содержит нитраты, повторите тест, пока не определите правильное количество цинковой пыли для добавления. Очень важно узнать, сколько цинковой пыли добавить в тест.Добавление слишком большого количества цинковой пыли может привести к ложноположительному результату.
- Если после добавления в среду нитратных реагентов A и B в неинокулированной контрольной среде обнаруживается розовый цвет, среда загрязнена нитритом. Единственное решение — получить новую партию среды, не загрязненной нитритами.
- В среде, содержащей нитрат, неспособность положительного контрольного штамма Kingella denitrificans дать положительную реакцию будет происходить только в том случае, если штамм не K.Ашхабад . Еще раз проверьте идентичность положительного контрольного штамма. Выберите новую культуру контрольного штамма и повторите тест. Аналогично, если положительный тест на нитратредуктазу получен с отрицательным контрольным штаммом N. gonorrhoeae , либо отрицательный контрольный штамм не является N. gonorrhoeae , либо культура загрязнена нитрат-положительным организмом. Еще раз проверьте чистоту и идентичность эталонного штамма гонококков. Повторите тест с чистой культурой подтвержденной культуры N.Гигантская .
- Реакция восстановления нитратов указывает на способность организмов восстанавливать нитраты, реакция, которая происходит только в анаэробных условиях; реакция не произойдет, если организмы будут получать постоянный кислород. Таким образом, реакция может не происходить в неподвижных культурах (особенно медленнорастущих видов), в которых среда распределена мелкими слоями, которые позволяют кислороду диффундировать в среду. Чтобы определить, присутствует ли в среде кислород, можно добавить в среду каплю оксидазного реагента.Если среда становится пурпурной, среда содержит кислород и реакция восстановления нитратов может не произойти. Если среда остается бесцветной, значит, она не содержит кислорода и может быть проведен тест на восстановление нитратов. Было отмечено, что клеток N. gonorrhoeae быстро потребляют кислород, если в среду инокулируют достаточное количество клеток. Если реактив оксидазы добавлен примерно после 1-2 часов инкубации, среда останется прозрачной. Поскольку реагент оксидазы убивает гонококки, присутствующие в среде, среда будет постепенно становиться фиолетовой, начиная с верха пробирки, по мере того, как кислород диффундирует в среду.Если среда распределяется в трубках, размеры которых отличаются от предложенных выше, убедитесь, что отношение площади поверхности к глубине, по крайней мере, равно или меньше предложенных выше. Если диаметр трубки, в которую распределяется среда, больше, чем описанный выше, используйте больший объем среды для поддержания того же отношения площади поверхности к глубине.
Реакция восстановления нитрата может не произойти, если среда, в которой проводится тест, не позволяет нормальному росту организма.Однако испытание можно проводить в среде, которая не поддерживает рост организмов, если посевной материал достаточно плотный, чтобы предварительно сформированные ферменты могли исчерпать существующий запас кислорода и восстановить нитрат с большей скоростью, чем та, с которой кислород диффундирует в Средняя.
Примечание: Чтобы проверить, что кислород был удален из среды, добавьте 2–3 капли реагента оксидазы в дубликат засеянной среды. Если кислород был должным образом удален из среды, реагент оксидазы не станет пурпурным сразу.Если среда содержит растворенный кислород, реагент оксидазы станет пурпурным. Также обратите внимание, что тест на восстановление нитратов можно проводить в среде, в которую был добавлен оксидазный реагент.
- При добавлении Реагента А в тестовую среду нитрит, образующийся в результате восстановления нитрата, образует комплекс с сульфаниловой кислотой, в результате чего образуется красный осадок с альфа-нафтиламином в Реагенте B. тестовая среда показывает, что нитрит присутствует в результате восстановления нитрата.Однако отсутствие красного цвета после добавления реагентов A и B не обязательно означает, что нитрат не восстановился. Отсутствие красного цвета может означать (1) то, что нитрат не восстановился, или (2) что нитрит, образовавшийся в результате восстановления нитрата, сам был восстановлен до азотистых газов. Чтобы определить, снизился ли уровень нитрита, поместите небольшое количество цинковой пыли в инкубационную смесь, если она бесцветная после добавления реагентов A и B.Цинковая пыль катализирует восстановление нитрата до нитрита; красный цвет должен развиться в среде, которая все еще содержит невосстановленный нитрат. Однако важно не добавлять слишком много цинковой пыли; избыток цинковой пыли будет катализировать восстановление нитрита, образующегося из этого нитрата, что приведет к бесцветной среде и неправильной интерпретации теста как положительного (ложноположительный результат).
- Положительный тест на нитратредуктазу получен с отрицательным контрольным штаммом N.gonorrhoeae , после добавления цинковой пыли указывает на то, что содержание нитрата снизилось до уровня, превышающего нитрит, вероятно, из-за добавления слишком большого количества цинковой пыли в испытание. Повторите тест, убедившись, что добавлено очень мало цинковой пыли. Розовый цвет, указывающий на то, что организм не восстановил нитрат, может занять от 10 до 15 минут. развивать. Не добавляйте цинковую пыль! Подождите, пока цвет проявится. Если в течение 30 минут цвет не изменился, расценивайте тест как положительный.
Ограничения теста
Если испытание выполнено правильно и штаммы для контроля качества дают соответствующие результаты, ограничений для этого испытания быть не должно.Необходимо следить за тем, чтобы все компоненты теста выполнялись должным образом.
Невозможно определить род или вид только на основании теста на снижение содержания нитратов.
Результаты, интерпретация и отчетность
Изоляты могут быть зарегистрированы как Нитрат-положительные , если нитрит (розовый цвет) обнаруживается в инокулированной среде после добавления реагентов A и B или , если после добавления цинковой пыли в среде не обнаруживается окраска.
Изоляты могут быть указаны как Нитрат-отрицательные , если нитрит не обнаружен (без изменения цвета) после добавления реагентов A и B, или , если после добавления цинковой пыли в инокулированную среду появляется розовый цвет.
Библиография
Knapp JS, Clark VL. Анаэробный рост Neisseria gonorrhoeae в сочетании с восстановлением нитрита. Инфекция Иммун 1984; 46: 176-181.
Скерман ВБД. 1967. С. 218 — 220.Руководство по определению родов бактерий. Компания Williams & Wilkins Co., Балтимор, Мэриленд.
Снижение риска отравления нитратами и синильной кислотой у домашнего скота
Фотография предоставлена: Джессика Уильямсон
Однолетние растения теплого сезона — широко используемый и отличный способ обеспечить корм скоту в летние месяцы, когда многолетние растения в прохладное время года замедляют свой рост — или во время «летнего спада». В большинстве случаев от этих однолетников теплого сезона можно получить более одного выпаса или урожая, если после сбора урожая или выпаса внесите азотные удобрения, чтобы стимулировать отрастание, позволяя корму хорошо расти в более прохладные осенние дни.
Нитратное отравление
Во время нехватки воды или засухи, или в результате чрезмерного внесения азотных удобрений, нитраты и нитриты накапливаются в нижней части корма в большей степени, чем обычно присутствуют в корме, и могут быть токсичным при чрезмерном потреблении жвачным скотом. Единственный способ определить чрезмерное содержание нитратов в кормах — это провести анализ нитратов.
На диаграмме показаны различные уровни нитратов и потенциальная токсичность для крупного рогатого скота.
| Нитратный азот (NO 3 -N) (ppm по сухому веществу) | Рекомендации |
|---|---|
| <1000 | Безопасно для кормления в большинстве условий |
| 1000-1,700 ввести в рацион. Накормите немного концентратом. Проверьте все корма и воду. Разбавьте NO 3 -N до содержания 900 ppm в сухом веществе общего рациона. Ограничьте размер разового приема пищи. | |
| 1,700-2,300 | Возможна острая токсичность.Кормите сбалансированным рационом с включенным концентратом. Разбавьте NO 3 -N до содержания 900 ppm в сухом веществе общего рациона. Ограничьте размер разового приема пищи. |
Источник: Adams, et al. 1992. Профилактика и контроль токсичности нитратов у крупного рогатого скота. Информационный бюллетень о расширении штата Пенсильвания.
1 Взято из: От урожая к корму: Понимание управления силосом, К. Джонс, А.Дж. Хайнрихс, Г. Рот, В.А. Ишлер. Кафедры зоотехники и растениеводства Пенсильванского государственного университета.
Для кормов с известным высоким уровнем нитратов существует несколько методов управления, которые помогут предотвратить токсичность. Отсрочка сбора урожая до тех пор, пока не пройдут стрессовые условия, поможет снизить уровень нитратов в культуре. Избыток нитратов обычно накапливается у основания растения; Таким образом, измельчение или скашивание корма намного выше, чем обычно, поможет снизить количество собираемых нитратов. Также было показано, что силосование корма снижает уровень нитратов наполовину во время завершения процесса ферментации.Обертывание тюкованного корма или упаковка в бункер и удаление кислорода, чтобы могло произойти брожение, — отличный способ снизить уровень нитратов.
Всегда рекомендуется не кормить скот токсичными кормами; однако, к сожалению, иногда значительная часть запаса корма будет иметь высокое накопление нитратов, что считается необходимым из-за нехватки нетоксичных кормов на ферме. Если известно, что в кормах уровень нитратов выше идеального, разбавление корма путем включения в рацион корма с низким содержанием нитратов снизит общее потребление нитратов животным.Медленное внесение токсичного корма поможет приспособить животных к уровню нитратов, а также к частому кормлению небольшими порциями, а не одним большим кормлением.
Более подробная информация и информация об отравлении нитратами у домашнего скота доступна в этом информационном бюллетене Университета Арканзаса или в этой публикации штата Пенсильвания по управлению силосом.
Отравление синильной кислотой
Цианогенное соединение обычно содержится в разновидностях сорго в связанной нетоксичной форме, называемой дуррином; однако после сильного мороза или другого источника повреждения растения соединение, также присутствующее в этих кормах, называемое эмульсией, вступает в реакцию с дуррином и «высвобождает» его, вызывая внутри растения высокотоксичное, чрезвычайно ядовитое цианогенное соединение.Концентрация всего 0,1 процента или более сухой ткани считается опасной и может привести к гибели домашнего скота.
Все виды сорго содержат синильную кислоту в вегетативной части растения. Сорго, трава ягненка и шаттеркан содержат наибольшее количество синильной кислоты. Суданграсс содержит примерно на 40 процентов меньше синильной кислоты, чем другие сорго; однако гибрид сорго x суданграсс содержит более высокий уровень токсичного соединения, чем один только суданграсс. Усовершенствования в генетическом развитии кормов теперь позволяют возможности для посадки сортов сорго, которые содержат более низкие уровни синильной кислоты, что помогает снизить риск отравления синильной кислотой у домашнего скота.
Еще один вариант заделки летних ежегодных пастбищ или сенокосов при одновременном снижении риска отравления синильной кислотой — это использование проса жемчужного и лисохвоста, которые не содержат токсичных уровней синильной кислоты даже после сильных морозов. Поэтому его можно пасти в любое время.
Как правило, наибольшие уровни синильной кислоты можно найти в более лиственных частях растения. После смертельного мороза токсическая синильная кислота не начинает снижаться до тех пор, пока листья не отмернут.На всякий случай подождите не менее 7-10 дней после сильного мороза, чтобы пастись или нарезать зеленый корм. Если фураж отрастает после неубивающего мороза, не пасите и не кормите его до тех пор, пока отрастание не достигнет минимум 2 футов в высоту или 2 недель, так как отрастание, вероятно, будет содержать высокие, очень токсичные уровни синильной кислоты.
Высокие нормы удобрений и засуха также могут вызывать высокие уровни накопления синильной кислоты в этих кормах даже за несколько месяцев до смертельных морозов; поэтому следует соблюдать меры предосторожности и в этих условиях.Силосование этих кормов помогает снизить риск токсичных уровней синильной кислоты, поскольку некоторые из токсичных компонентов улетучиваются во время процесса ферментации в виде газа. В качестве меры предосторожности не следует подкармливать силос из сорго раньше, чем через 3-4 недели после сбора урожая.
Если желательно измельчение силоса, производитель должен подождать 5-7 дней после заморозков перед уборкой урожая. Эти корма с риском высокого уровня цианида во время измельчения должны быть силосованы как минимум за 8 недель до кормления и должны быть проанализированы перед кормлением, чтобы убедиться, что токсичные соединения были снижены до безопасного уровня для потребления.
Станция очистки бытовых стоков — одна из немногих, нацеленных на повторное использование воды. С г. , он способен удалять углеродистые вещества и материалы на основе азота […] embraer.com.br | A Estao de Tratamento de Efluentes Domsticos uma das nicas que visa ao reuso da gua ,tendo em vista que a referida estao, devido […] sua conceptpo, Congue fazer a remoo de matria carboncia, материал com base […] embraer.com.br |
Рефлектометры Merck RQeasy: […] проще, быстрее и экономичнее для быстрого доступа на месте […] merck-chemicals.com | Ос рефлектометр RQeasy da Merck so mais simples, […] rpidos e com melhor custo-benecio paraterminao […] merck-chemicals.com.br |
3.2.2. общий растворимый азот за исключением […] нитратного азота по […] определяется, как описано в методе 2.1 eur-lex.europa.eu | 3.2.2. общий раствор азото, пример азото […] ntrico, por digesto […] соответствует методу 2.1 eur-lex.europa.eu |
| боеприпасы ni u m нитрат ( f er tiliser) гексамин ni tr i 9027 9027 9027 o ta s si u m нитрат eur-lex.europa.eu | Nitrato de amni o (adubo) Hexamina eur-lex.europa.eu |
можно выполнить, предварительно растворив […] , такой как трибутилфосфат. eur-lex.europa.eu | r io e m cido ntrico e extr ain do o nitrato d e u run ilo p ur ificado [utilizando] um solvente como o fosfato de tributilo. eur-lex.europa.eu |
При соблюдении условий, установленных компетентными органами, в данную подсубпозицию включается соль, денатурированная или неденатурированная, предназначенная для целей […] для изготовления […] сульфатов натрия, […] карбонаты натрия, гидроксид натрия, хлорат натрия, перхлорат натрия и металлический натрий. eur-lex.europa.eu | Inclui-se designadamente nesta subposio, desde queisfaa as condies definedadas pelas autoridades comptentes, o sal, mesmo […] desnaturado, destinado […] де SDIO, сульфатос, […] carbonatos, hidrxido, clorato e perclorato de sdio, bem como do sdio metlico. eur-lex.europa.eu |
4. ацетилен, пропан, жидкий кислород, дифторамин (HNF […] к п. 8) eur-lex.europa.eu | 4. Ацетилено, пропано, оксигнио lquido, […] (от 5 до 8) eur-lex.europa.eu |
8226 Humistar — Humifirst совместим с удобрениями и […] агрохимических продуктов обычно […] несовместимы с органическими материалами. tradecorp.com.es | 8226 O Humistar — Humitec compatvel com a maioria dos Ferizantes e produtos fitossanitrios […] normalmente utilizados, exceto […] com a matria orgnica. tradecorp.com.es |
Антидемпинговые меры […] europa.eu | Медидас антидемпинговый […] |
8226 Humical совместим с удобрениями и агрохимическими продуктами обычно […] tradecorp.com.es | 8226 O Humical compatvel com a maioria dos Ferizantes e […] produtos fitossanitrios normalmente utilizados, exceto […] tradecorp.com.es |
Примечание: см. Военный номер […] eur-lex.europa.eu | Примечание: Ver Lista de Material de Guerra № […] eur-lex.europa.eu |
| (b) смесь нитрата аммония или других неорганических нитратов с другими горючими веществами, не являющимися взрывчатыми ингредиентами. eur-lex.europa.eu | б) Quer por uma mistura de nitrato de amnio ou outros nitratos inorgnicos com outras matrias combustveis no explosivas. eur-lex.europa.eu |
| патроны ni u m нитрат ( t ec hnical) hydrochl или i tr ометан натрия […] хлорат eur-lex.europa.eu | Nitrato de am nio ( t cn ic o) c ido clordrico Nit Clo romet … an на SDIO eur-lex.europa.eu |
Все мы знаем, какой следующий скандал […] овощей. europarl.europa.eu | Todos sabemos que o prximo escndalo ser o da […] europarl.europa.eu |
записей […] следующие europarl.europa.eu | As entradas r elati vas ao «nitrato d e a mn io» s o subitudas por europarl.europa.eu |
| боеприпасы ni u m нитрат , w hi ch используется […] в основном в качестве удобрения. europa.eu | nitrato d e am nio, ut ilizado Principalmente […] como adubo. europa.eu |
Совместим с […] fertinagro.com | Compatvel com outros […] fertinagro.com |
введение новых обозначенных веществ в […] масло, в дополнение к расширенному списку канцерогенов игаот.pt | Знакомство с новыми подразделами […] e gasleos, e alargamento da lista dos carcinogneos igaot.pt |
Производители на Филиппинах обнаружили, что несколько сортов манго […] цветет в течение нескольких недель после […] при условии, что деревья обрабатываются после созревания последнего смыва. anancy.org | Nas Filipinas, os fruticultores descobriram que vrias cultivares de mangueira […] florescem dentro de poucas semanas aps […] листовая, semper que as rvores […] sejam tratadas depois de amadurecer o ltimo fluxo. anancy.org |
Быстрая потеря веса приводит к преходящему […] brazilmedicaltourism.com | A rpida perda de peso leva a uma aumento […] brazilmedicaltourism.com |
| В качестве альтернативы нижняя часть цилиндра будет погружена в дождевую среду с дорожной солью / acid и в нагретый или охлажденный воздух. eur-lex.europa.eu | A seco inferior imersa alternadamente num ambiente de estrada com sal e de chuva cida e num ambiente de ar aquecido e arrefecido. eur-lex.europa.eu |
| Хотя potas si u m нитрат h a s был меньше […] эффективен в других странах и на других плодовых культурах (и других сортах манго), […] его способность вызывать цветение в настоящее время широко признана. anancy.org | E m bor a o nitrato pot ss ico f os se menos […] eficaz em outros pases e em outras culturas fruteiras (ассим como em outras cultivares […] da mangueira), актуальный, или потенциально подходящий для растительного покрова. anancy.org |
Стальные маслосъемные кольца из трех частей […] , а их […] по требуемому применению и долговечности. mahle-hirschvogel.com.br | Anis de trs peas em ao para motores Otto so produzidos, podendo […] aplicao e durabilidade solicitada. mahle-hirschvogel.com.br |
Добавьте 25 мл воды и 25 мл […] перемешать и подождать, пока не прекратится закипание. eur-lex.europa.eu | Juntar s ucessivamente 25 мл de gua e […] e deixar que acabe a efervescncia. eur-lex.europa.eu |
Я, например, не понимаю, почему Совет отказывается от […] europarl.europa.eu | No percebo, por exemplo, por que razo se recusa o Conselho a […] europarl.europa.eu |
| Химические вещества и металлы-сук h a s нитрат , p es тициды и свинец, […] на высоком уровне может нанести вред здоровью. dettol.co.uk | Qumicos e me tais — c om o o nitrato, pe st icid as e o chumbo […] — em nveis elevados, podem danificar a sade. деттол.пт |
Хотя их много […] способ — регулярно менять часть воды. faq.thekrib.com | Embora haja vrios processos de […] o de mudar regularmente uma parte da gua. faq.thekrib.com |
Текст, одобренный Советом, который основан на компромиссе с председательством, следует за просьбой французской делегации о том, чтобы предложение было […] расширен за счет включения […] 30 человек погибли и 2 400 получили ранения. europa.eu | O texto aprovado pelo Conselho, que baseado num compromisso da Presidncia, d seguimento a um pedido da Delegao Francesa de alargar a proposta por […] , включая […] da fbrica qumica […] AZF Provocou a morte de trinta pessoas e causou 2400 feridos. europa.eu |
Главный недостаток этого […] из почвы, чем обычно. eur-lex.europa.eu | Основное преимущество индикации факта [. |
